アリールオキシアニリドイメージング剤
本発明は、インビボイメージングのために適した新規放射性標識アリールオキシアニリン誘導体を提供する。既知のアリールオキシアニリン誘導体系インビボイメージング剤に比べて、本発明のインビボイメージング剤はインビボイメージングのために一層良好な性質を有する。本発明のインビボイメージング剤は、被験体への投与後における良好な脳内取込み及びインビボ動力学と共に、末梢ベンゾジアゼピンレセプター(PBR)に対する良好な結合性を示す。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、インビボイメージング、特に末梢ベンゾジアゼピンレセプター(PBR)のインビボイメージングに関する。ナノモル親和性をもってPBRに結合し、投与後には脳内への良好な取込みを示し、PBRへの良好な選択的結合を示すアリールオキシアニリド系インビボイメージング剤が提供される。本発明はまた、本発明のインビボイメージング剤の合成において有用な前駆体化合物、並びに前記前駆体化合物の使用を含む前記インビボイメージング剤の合成方法及び前記方法を実施するためのキットも提供する。インビボイメージング剤の自動化合成のためのカセットも提供される。加えて本発明は、本発明のインビボイメージング剤を含む放射性医薬組成物並びに前記インビボイメージング剤の使用方法も提供する。
【背景技術】
【0002】
末梢ベンゾジアゼピンレセプター(PBR)は、主として末梢組織及びグリア細胞に局在することが知られているが、その生理学的機能はまだ明確に解明されていない。細胞レベル以下では、PBRはミトコンドリア外膜上に局在することが知られていて、これはミトコンドリア機能の調節及び免疫系において役割を果たす可能性を表している。さらに、PBRが細胞増殖、ステロイド生成、カルシウム流れ及び細胞呼吸に関係することも仮定されてきた。PBRは、急性及び慢性ストレス、不安、うつ病、パーキンソン病、アルツハイマー病、脳損傷、癌(Gavish et al, Pharm Rev 1999;51:629)、ハンチントン病(Messmer and Reynolds, Neurosci Lett 1998;241:53−6)、喘息(Pelaia et al, Gen Pharmacol 1997;28(4):495−8)、慢性関節リウマチ(Bribes et al, Eur J Pharmacol 2002;452(1):111−22)、アテローム性動脈硬化症(Davies et al, J Nucl Med 2004;45:1898−1907)及び多発性硬化症(Banati et al, Brain 2000;123:2321)を始めとする各種の状態と関連していた。PBRはニューロパシー性疼痛にも関連する可能性があり、Tsuda et alはニューロパシー性疼痛をもった被験者で小グリア細胞の活性化を観察している(TINS 2005;28(2):101−7)。
【0003】
PBR選択性リガンド(R)−[11C]PK11195を用いる陽電子放出断層撮影(PET)イメージングは、中枢神経系(CNS)炎症の包括的指標を提供する。(R)−[11C]PK11195の使用の成功にもかかわらず、それには制約がある。それは、高いタンパク質結合性及び低特異的乃至非特異的結合性を有することが知られている。その放射性標識代謝産物の役割は知られておらず、結合の定量化には複雑なモデル化が要求される。PBRに対して高い親和性及び選択性を有することでCNSにおけるPBR測定の向上を可能にする化合物を得るための努力が行われてきた。
【0004】
PBRに対する高い親和性並びに中枢ベンゾジアゼピンレセプター(CBR)に比べてPBRに対する高い選択性を有するアリールオキシアニリン誘導体が提唱された(Chaki et al, Eur J Pharmacol 1999;371:197−204)。[11C]−DAA1106及び[18F]−FE−DAA1106は、これらのアリールオキシアニリン化合物に基づくPET放射性リガンドである。これらのPET放射性リガンドは米国特許第6870069号に教示され、ヒトにおいて研究されてきた(Ikomo et al, J Cereb Blood Flow Metab 2007;27:173−84及びFujimura et al, J Nuc Med 2006;47:43−50)。別の放射性フッ素化DAA1106誘導体は国際公開第2007/074383号に教示されている。別の11C標識DAA1106誘導体は国際公開第2007/036785号に教示されている。放射性ヨウ素化DAA1106は、欧州特許出願公開第1854781号に記載され、またZhang et al(J Med Chem 2007;50:848−55)によって記載されている。[11C]−DAA1106、[18F]−FE−DAA1106及び[123I]−DAA1106の化学構造は下記の通りである。
【0005】
【化1】

しかし、これらの化合物の動力学的性質はインビボイメージングのために理想的でない結果、定量的研究に対するその適用は制限されると考えられる。
【0006】
さらに最近に至り、PBR06として知られる化合物が、上述の化合物に比べてインビボイメージングのために改善された性質を有することが報告された。この化合物の構造は下記の通りである。
【0007】
【化2】

末梢において極めて急速に代謝されるものの、PBR06の代謝産物は血液脳関門を通過しない(Briard et al, J Med Chem 2009;52:688−699)。以前の化合物とは対照的に、脳から生じる信号のほぼ全部がインタクトなPBR06に由来している。これは、脳内におけるPBRの濃度を正確に測定することを可能にする。したがって、PBR06は有望なインビボイメージング剤と見なされる。
【0008】
しかし、本明細書中に示されるように、バックグラウンド組織(即ち、線条体)と比較した、相対的に高いPBR発現を有する組織(即ち、嗅球)中へのPBR06取込み量の比はインビボイメージングのために最適とはいえない。また、脳内におけるインタクトな化合物の割合を向上させる余地も存在している。
【0009】
したがって、PBR06に比べてインビボイメージングのために改善された性質(即ち、PBR発現組織における高い特異的取込み及び/又は脳内におけるインタクトな化合物の高い割合)を有する代替インビボイメージング剤に対するニーズが存在している。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】米国特許第6870069号
【特許文献2】欧州特許出願公開第1854781号
【特許文献3】国際公開第2007/074383号
【特許文献4】国際公開第2007/036785号
【非特許文献】
【0011】
【非特許文献1】Chaki et al, Eur J Pharmacol 1999; 371: 197-204
【非特許文献2】Ikomo et al, J Cereb Blood Flow Metab 2007; 27: 173-84
【非特許文献3】Fujimura et al, J Nuc Med 2006; 47: 43-50
【非特許文献4】Zhang et al, J Med Chem 2007; 50: 848-55
【非特許文献5】Briard et al, J Med Chem 2009; 52: 688-699
【発明の概要】
【課題を解決するための手段】
【0012】
本発明は、インビボイメージングのために適した新規放射性標識アリールオキシアニリン誘導体を提供する。既知のアリールオキシアニリン誘導体系インビボイメージング剤に比べて、本発明のインビボイメージング剤はインビボイメージングのために一層良好な性質を有する。本発明のインビボイメージング剤は、良好な脳内取込み及び好ましいインビボ動力学を有すると共に、末梢ベンゾジアゼピンレセプター(PBR)に対する改善された特異的結合を示す。
【図面の簡単な説明】
【0013】
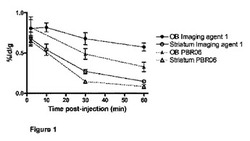
【図1】図1は、嗅球(OB)へのPBR06及びインビボイメージング剤1の取込み比を線条体への取込み比と比較して示している。
【図2】図2は、嗅球(OB)へのPBR06及びインビボイメージング剤2の取込み比を線条体への取込み比と比較して示している。
【図3】図3は、嗅球(OB)へのPBR06及びインビボイメージング剤3の取込み比を線条体への取込み比と比較して示している。
【発明を実施するための形態】
【0014】
イメージング剤
一態様では、本発明は次の式Iのインビボイメージング剤を提供する。
【0015】
【化3】

式中、
A1は−CR1R2−(CH2)n−(式中、R1及びR2は水素、フルオロ及びC1-3アルキルから独立に選択され、nは0、1又は2である。)であり、
A2は−CH2−、−O−又は−O−CH2−であり、或いは
−A1−A2は−CH=CH−である。
【0016】
本発明の文脈中における「インビボイメージング剤」とは、インビボイメージングのために適した放射性標識化合物をいう。本明細書中で使用する「インビボイメージング」という用語は、被験体の内部構造の全部又は一部の画像を非侵襲的に生成する技法をいう。かかるインビボイメージング方法の例は、単光子放出コンピューター断層撮影法(SPECT)及び陽電子放出断層撮影法(PET)である。
【0017】
特記しない限り、単独で又は組み合わせて使用される「アルキル」という用語は、好ましくは1〜3の炭素原子を含む直鎖又は枝分れアルキル基を意味する。かかる基の例には、メチル、エチル及びプロピルがある。
【0018】
本発明のインビボイメージング剤の例を幾つか挙げると下記の通りである。
【0019】
【化4】

式IのA1は、好ましくは−CR1R2−(CH2)n−であり、最も好ましくは−(CH2)m−(式中、mは1、2又は3であり、特に好ましくは1又は2である。)である。式IのA2は、好ましくは−CH2−又は−O−である。特に好ましくは、−A1−A2は−CH2−CH2−、−CH2−O−及び−CH2−CH2−O−から選択される。本発明の好ましいインビボイメージング剤はインビボイメージング剤1〜4であり、最も好ましくはインビボイメージング剤1〜3であり、特に好ましくはインビボイメージング剤1及び2であり、最も特に好ましくはインビボイメージング剤1である。
【0020】
実施例11は、本発明のインビボイメージング剤をPBR06と比較するために使用したラット体内分布モデルを記載している。OB:線条体取込み量をPBR06と比較して評価したところ、インビボイメージング剤1は線条体に比べてOB中に比較的多く取り込まれ(本件の図1参照)、インビボイメージング剤2及び3はPBR06と同等である(図2及び図3参照)ことが明らかになった。OBはラット脳の他の領域に比べて高いレベルのPBRを発現することが知られているので(“Handbook of Substance Abuse”by Tarter, Ammerman and Ott;Springer 1998:398−99を参照されたい)、OB:線条体比は試験化合物取込みの特異性の尺度である。
【0021】
実施例12は、注射から60分後におけるラット脳内のインタクトな試験インビボイメージング剤の量を評価するために使用したアッセイを記載している。インビボイメージング剤1〜4は、PBR06と同じ好ましい代謝プロファイルを示した。即ち、注射から60分後における脳内の高率の放射能はインタクトな試験化合物であることがわかった。インビボイメージング剤1及び2は、PBR06に比べ、注射から60分後において脳内に一層高率のインタクトな化合物を有することがわかった。
【0022】
本発明のインビボイメージング剤は、既知のかかる薬剤に比べて、PBRのインビボイメージングのための優れた性質を有することが本明細書中に示される。
【0023】
製造方法
さらに別の態様では、本発明は、本明細書中に記載したインビボイメージング剤の製造方法であって、18Fの適当な供給源を次の式IIの前駆体化合物と反応させる段階を含む方法を提供する。
【0024】
【化5】

式中、A1及びA2は式Iのインビボイメージング剤に関して本明細書中に好適なもの及び好ましいものとして定義した通りであり、LGは脱離基である。
【0025】
「前駆体化合物」は、好都合な化学形態の18Fとの化学反応が部位特異的に起こり、最小数の段階(理想的にはただ1つの段階)で反応を実施でき、かつ格別の精製の必要なしに(理想的にはいかなる追加の精製も必要なしに)所望のインビボイメージング剤が得られるように設計された、インビボイメージング剤の非放射性誘導体からなる。かかる前駆体化合物は合成品であり、良好な化学純度で簡便に得ることができる。
【0026】
「18Fの適当な供給源」という用語は、18Fが共有結合することで所望のインビボイメージング剤を生成するようにして前駆体化合物の置換基と反応し得る化学形態の18Fを意味する。
【0027】
概して言えば、前駆体化合物を前記18Fの適当な供給源と「反応」させる段階は、できるだけ高い放射化学収率(RCY)で所望のインビボイメージング剤を生成するのに適した反応条件下で2種の反応体を合わせることを含んでいる。幾つかの一層詳細な経路を以下の実験セクションに示す。
【0028】
「脱離基」という用語は、ヘテロリティック結合開裂において1対の電子と共に分子から脱離し、通常は求核基で置き換えられる原子又は原子団をいう。脱離基は陰イオン又は中性分子であり得る。好ましい脱離基(LG)は下記に記載する。
【0029】
Okubo et al(2004 Bioorg.Med.Chem.;12:423−38)は、非放射性アリールオキシアニリド化合物を得るための方法を記載している。アリールオキシアニリド化合物を得るための合成スキームはまた、Briard et al(J.Med.Chem.2008;51:17−31)、Wilson et al(Nuc.Med.Biol.2008;35:305−14)、及びZhang et al(J.Med.Chem.2007;50:848−55)によっても記載されている。これらの先行技術方法は、式IIの前駆体化合物を得るために容易に適合させることができる。
【0030】
下記のスキーム1は、非放射性標準、及び本発明のインビボイメージング剤を製造するのに適した前駆体化合物を得るための一般反応スキームである。
【0031】
【化6】

上記反応スキーム中、LGは本明細書中で定義される脱離基であり、R*は上記式I及び式IIの両方に含まれるようなA環を含む縮合二環式環構造を表している。商業的に入手可能な2−ニトロビフェニルエーテル(a)中のニトロ基を水素化によって還元することで、対応するアニリン(b)が得られる。芳香族アルデヒド(c)での還元アルキル化によってベンジルアミン(d)が得られる。適当なアセチル(e)と反応させれば、所望の非放射性標準及び前駆体化合物が得られる。
【0032】
18Fによる標識は、式IIの前駆体化合物からの脱離基LGの求核置換によって達成できる。好ましい脱離基(LG)には、クロリド、ブロミド、ヨージド、トシレート、メシレート及びトリフレートがあり、ブロミド及びトシレートが最も好ましい。式IIの前駆体化合物は、18Fの適当な供給源を[18F]−フッ化物イオンとする一段階で標識できる。放射性フッ素化反応用の[18F]−フッ化物イオン(18F-)は、通常は核反応18O(p,n)18Fから水溶液として得られ、次いでカチオン対イオンの添加及びそれに続く水の除去によって反応性にされる。好適なカチオン性対イオンは、無水反応溶媒中において、18F-の溶解性を維持するのに十分な溶解度を有するべきである。したがって、使用されてきた対イオンには、ルビジウム又はセシウムのような大きいが軟らかい金属イオン、Kryptofix(商標)のようなクリプタンドと錯体化したカリウム、或いはテトラアルキルアンモニウム塩がある。好ましい対イオンは、無水溶媒中での溶解性が良く、18F-の反応性を向上させることから、Kryptofix(商標)のようなクリプタンドと錯体化したカリウムである。好ましい対イオンは、無水溶媒中での溶解性が良く、18F-の反応性を向上させることから、Kryptofix(商標)のようなクリプタンドと錯体化したカリウムである。
【0033】
放射性フッ素化が特定の部位で起こることを保証するため、前駆体化合物は選択的に化学保護することが必要となる場合がある。保護基は上記に記載されている。
【0034】
前駆体化合物は、理想的には無菌で非発熱性の形態で供給される。したがってそれは、インビボイメージング剤を哺乳動物への投与に適した生体適合性キャリヤーと共に含む医薬組成物の製造のために使用できる。前駆体化合物はまた、かかる医薬組成物を製造するためのキット中に一成分として含めるためにも適している。
【0035】
好ましい実施形態では、前駆体化合物はキット又は自動化合成装置で使用するように設計されたカセットの一部として溶液状態で供給される。これらの態様は、本発明の追加の態様に関連して以下に一層詳しく論議される。
【0036】
別の好ましい実施形態では、前駆体化合物は固相に結合されている。前駆体化合物は、好ましくは固体担体マトリックスに共有結合した状態で供給される。このようにすれば、所望の生成物は溶液状態で生成される一方、出発原料及び不純物は固相に結合したままに保たれる。かかる系の例としては、18F−フッ化物による固相求電子フッ素化用の前駆体化合物が国際公開第03/002489号に記載されており、18F−フッ化物による固相求核フッ素化用の前駆体化合物が国際公開第03/002157号に記載されている。
【0037】
好ましくは、本発明の方法は実施の容易性のために自動化される。
【0038】
前駆体化合物
本発明の方法に関連して上記に好適なもの及び好ましいものとして記載された前駆体化合物は、それ自体が本発明の追加の態様をなしている。
【0039】
放射性医薬組成物
さらに別の態様では、本発明は「放射性医薬組成物」を提供し、これは本発明のインビボイメージング剤を哺乳動物への投与に適した形態の生体適合性キャリヤーと共に含んでいる。
【0040】
「生体適合性キャリヤー」は、放射性医薬組成物が生理学的に認容され得るようにして(即ち、毒性又は過度の不快感なしに哺乳動物体に投与できるようにして)インビボイメージング剤を懸濁又は溶解するための流体(特に液体)である。生体適合性キャリヤーは、好適には、無菌のパイロジェンフリー注射用水、(有利には注射用の最終生成物が等張性又は非低張性になるように平衡させ得る)食塩水のような水溶液、或いは1種以上の張度調整物質(例えば、血漿陽イオンと生体適合性対イオンとの塩)、糖(例えば、グルコース又はスクロース)、糖アルコール(例えば、ソルビトール又はマンニトール)、グリコール(例えば、グリセロール)又は他の非イオン性ポリオール物質(例えば、ポリエチレングリコール、プロピレングリコールなど)の水溶液のような注射可能なキャリヤー液体である。生体適合性キャリヤーはまた、エタノールのような生体適合性有機溶媒を含んでいてもよい。かかる有機溶媒は、親油性の高い化合物又は配合物を可溶化するために有用である。好ましくは、生体適合性キャリヤーはパイロジェンフリー注射用水、等張食塩水又はエタノール水溶液である。静脈内注射用生体適合性キャリヤーのpHは好適には4.0〜10.5の範囲内にある。
【0041】
本発明の放射性医薬組成物中に含まれる場合におけるインビボイメージング剤の好適な実施形態及び好ましい実施形態は、上記に記載した通りである。
【0042】
かかる放射性医薬組成物は非経口的に(即ち、注射によって)投与でき、最も好ましくは水溶液である。かかる組成物は、緩衝剤、薬学的に許容される可溶化剤(例えば、シクロデキストリン或いはPluronic、Tween又はリン脂質のような界面活性剤)、薬学的に許容される安定剤又は酸化防止剤(例えば、アスコルビン酸、ゲンチジン酸又はp−アミノ安息香酸)のような追加成分を任意に含み得る。本発明のインビボイメージング剤が放射性医薬組成物として提供される場合、前記インビボイメージング剤の製造方法はさらに、放射性医薬組成物を得るために必要な段階(例えば、有機溶媒の除去、生体適合性緩衝剤及び任意の追加成分の添加)を含むことができる。
非経口的投与のためには、放射性医薬組成物が無菌性かつ無発熱原性であることを保証するための手段を講じることも必要である。
【0043】
キット及びカセット
好ましい実施形態では、本発明のインビボイメージング剤の製造方法は、キット又は自動化合成装置に挿入し得るカセットを用いて実施できる。これらのキット及びカセットはまた、本発明の追加の態様をなしており、本明細書中に定義された本発明の放射性医薬組成物の製造のため特に好都合である。
【0044】
本発明のキットは、本発明の前駆体化合物を密封容器内に含んでいる。「密封容器」は、好ましくは、注射器による溶液の追加及び抜取りを許しながら、無菌保全性及び/又は放射能安全性の維持、さらに任意には不活性ヘッドスペースガス(例えば、窒素又はアルゴン)の維持を可能にする。好ましい密封容器は、気密クロージャーを(通例はアルミニウムからなる)オーバーシールと共にクリンプ加工した隔壁密封バイアルである。かかる密封容器は、例えばヘッドスペースガスの変更又は溶液のガス抜きのために所望される場合、クロージャーが真空に耐え得るという追加の利点を有している。
【0045】
本発明のキット中に使用する場合、前駆体化合物の好適な実施形態及び好ましい実施形態は、本明細書中に既に記載した通りである。
【0046】
キット中に使用するための前駆体化合物を無菌製造条件下で使用すれば、所望の無菌で非発熱性の材料を得ることができる。別法として、前駆体化合物を非無菌条件下で使用し、続いて例えばγ線照射、オートクレーブ処理、乾熱又は(例えば、エチレンオキシドによる)化学処理を用いる終末滅菌を施すこともできる。好ましくは、前駆体化合物は無菌で非発熱性の形態で供給される。最も好ましくは、無菌で非発熱性の前駆体化合物は上述のような密封容器に入れて供給される。
【0047】
好ましくは、試験間での汚染の可能性を最小限に抑えると共に無菌性及び品質保証を確実にするため、キットのすべての構成要素が使い捨てである。
【0048】
別の態様では、本発明は、本発明のインビボイメージング剤を合成するため適宜に改造された自動化合成装置に挿入し得るカセットを提供する。現在、特に[18F]−ラジオトレーサーはしばしば自動化放射合成装置で簡便に製造されている。かかる装置には、Tracerlab(商標)及びFastlab(商標)(いずれもGE Healthcare社から入手可能)を始めとするいくつかの市販例が存在している。放射化学は、カセットを装置に取り付けることにより、自動化合成装置上で実施される。普通、カセットは流体通路、反応器、及び試薬バイアル並びに放射合成後の清掃段階で使用される任意の固相抽出カートリッジを受け入れるためのポートを含んでいる。
【0049】
本発明のインビボイメージング剤の自動化合成のためのカセットは、
(i)本明細書中に定義した前駆体化合物を含む容器、及び
(ii)本明細書中に定義したような18Fの適当な供給源を用いて容器を溶出するための手段
を含んでいる。
【0050】
かかるカセットはさらに、
(iii)過剰の18Fを除去するためのイオン交換カートリッジ、及び任意には
(iv)得られた放射性標識生成物を脱保護して本明細書中に定義したインビボイメージング剤を生成するためのカートリッジ
を含むことができる。
【0051】
自動化合成のために必要な試薬、溶媒及び他の消耗品もまた、濃度、体積、送出時間などに関する最終ユーザーの要求条件を満たすように自動化合成装置を運転させるソフトウェアを保持したコンパクトディスクのようなデータ媒体と共に含めることができる。
【0052】
使用方法
さらに別の態様では、本発明は、被験体におけるPBR発現の分布及び/又は程度を決定するためのインビボイメージング方法であって、
(i)本明細書中に定義したインビボイメージング剤を前記被験体に投与する段階、
(ii)前記インビボイメージング剤を前記被験体内のPBRに結合させる段階、
(iii)前記インビボイメージング剤の18Fから放出される信号をインビボイメージング技法によって検出する段階、
(iv)前記信号の位置及び/又は量を表す画像を生成する段階、並びに
(v)前記被験体におけるPBR発現の分布及び程度を決定する段階であって、前記発現は前記18Fから放出される前記信号と直接に相関している段階
を含むインビボイメージング方法を提供する。
【0053】
本発明のインビボイメージング方法に関しては、インビボイメージング剤の好適な態様及び好ましい態様は本明細書中において前記に定義した通りである。
【0054】
インビボイメージング剤を「投与する」段階は、好ましくは非経口的に実施され、最も好ましくは静脈内に実施される。静脈内経路は、インビボイメージング剤を被験体の身体全域に送達するため、したがって血液脳関門(BBB)を横切って前記被験体で発現されたPBRに接触させるための最も効率的な方法である。本発明のインビボイメージング剤は、好ましくは本明細書中に定義された本発明の医薬組成物として投与される。別の実施形態では、投与段階はインビボイメージング方法自体に先立って実施される予備段階としても理解できる結果、段階(i)はインビボイメージング剤を予め投与した被験体を用意する段階として定義できる。
【0055】
投与段階後かつ検出段階前に、インビボイメージング剤をPBRに結合させる。例えば、被験体がインタクトな哺乳動物である場合、インビボイメージング剤は哺乳動物の身体を通って動的に移動し、体内の様々な組織に接触する。ひとたびインビボイメージング剤がPBRに接触すれば、特異的な相互作用が起こる結果、PBRをもった組織からのインビボイメージング剤のクリアランスは、PBRをもたない組織又はPBRの少ない組織よりも長い時間がかかる。一定の時点に達すれば、PBRをもった組織に結合したインビボイメージング剤とPBRをもたない組織又はPBRの少ない組織に結合したインビボイメージング剤との比の結果として、PBRに特異的に結合したインビボイメージング剤の検出が可能となる。理想的には、この比は2:1以上である。
【0056】
本発明の方法の「検出」段階は、18Fから放出される信号を、陽電子放出断層撮影(PET)検出器によって検出することを含んでいる。この検出段階はまた、信号データの取得として理解することもできる。
【0057】
本発明の方法の「生成」段階は、取得された信号データに再構築アルゴリズムを適用してデータセットを得るコンピューターによって実施される。次いで、このデータセットを操作することで、前記18Fから放出される信号の位置及び/又は量を示す画像が生成される。放出される信号はPBRの発現と直接に相関する結果、生成された画像を評価することで「決定」段階を行うことができる。
【0058】
本発明の「被験体」は、任意のヒト又は動物被験体であり得る。好ましくは、本発明の被験体は哺乳動物である。最も好ましくは、前記被験体はインタクトな哺乳動物生体である。特に好ましい実施形態では、本発明の被験体はヒトである。本インビボイメージング方法は、健常被験体或いはPBRの異常発現に関連する病的状態(「PBR状態」)を有することが知られ又は疑われる被験体においてPBRを検査するために使用できる。本発明のインビボイメージング剤は、中枢神経系(CNS)におけるPBR発現のインビボイメージングに特に適している。
【0059】
別の実施形態では、本発明のインビボイメージング方法は前記被験体に関する治療計画の進行中に繰り返して実施することができ、前記計画はPBR状態と戦うための薬物の投与を含んでいる。例えば、本発明のインビボイメージング方法は、PBR状態と戦うための薬物による治療前、治療中及び治療後に実施できる。このようにすれば、前記治療の効果を経時的にモニターすることができる。この実施形態のためにはPETイメージングが特に適している。PETは優れた感度及び分解能を有する結果、病変部における比較的小さい変化でも経時的に観察でき、これは治療モニタリングのために有利である。PETスキャナーは、日常的にピコモル範囲内の放射能濃度を測定している。現在、マイクロPETスキャナーは約1mmの空間分解能に接近しているが、臨床スキャナーは約4〜5mmである。
【0060】
好ましくは、前記方法はPBR状態を有することが知られ又は疑われる被験体のインビボイメージングに関し、したがって前記状態の診断方法の一部として有用である。したがって、本発明のインビボイメージング方法は、前記被験体がPBR状態に罹患しているか否かを診断するためにPBR発現の分布及び程度を帰因させる追加段階(vi)を含み得る。インビボイメージングが役に立つかかるPBR状態の例には、神経炎症が存在するパーキンソン病、多発性硬化症、アルツハイマー病及びハンチントン病のような神経疾患がある。本発明の化合物によるイメージングが有用であり得る他のPBR状態には、ニューロパシー性疼痛、関節炎、喘息、アテローム性動脈硬化症、特に限定されないが結腸直腸癌及び乳癌を含む一連の悪性疾患、並びに特に限定されないが双極性障害、統合失調症、不安及び外傷後ストレス障害を含む一連の気分障害がある。
【0061】
別の態様では、本発明は、本明細書中に好適なもの及び好ましいものとして定義したインビボイメージング方法で使用するための、本明細書中に定義したインビボイメージング剤を提供する。
【0062】
さらに別の態様では、本発明は、本明細書中に好適なもの及び好ましいものとして定義したインビボイメージング方法で使用するための本明細書中に定義した放射性医薬組成物を製造するための、本明細書中に定義したインビボイメージング剤を提供する。
【実施例】
【0063】
以下、一連の非限定的な実施例によって本発明を例示する。
【0064】
実施例の簡単な説明
実施例1は、インビボイメージング剤1用の直接標識前駆体化合物の合成法を記載している。
【0065】
実施例2は、インビボイメージング剤2用の直接標識前駆体化合物の合成法を記載している。
【0066】
実施例3は、インビボイメージング剤3用の直接標識前駆体化合物の合成法を記載している。
【0067】
実施例4は、インビボイメージング剤4用の直接標識前駆体化合物の合成法を記載している。
【0068】
実施例5は、インビボイメージング剤1〜4を得るために使用した放射性フッ素化方法を記載している。
【0069】
実施例6は、インビボイメージング剤1に対する非放射性標準の合成法を記載している。
【0070】
実施例7は、インビボイメージング剤2に対する非放射性標準の合成法を記載している。
【0071】
実施例8は、インビボイメージング剤3に対する非放射性標準の合成法を記載している。
【0072】
実施例9は、インビボイメージング剤4に対する非放射性標準の合成法を記載している。
【0073】
実施例10は、PBRに対する本発明のイメージング剤の非放射性標準の親和性を評価するために使用したインビトロアッセイを記載している。
【0074】
実施例11は、静脈内投与後における本発明のイメージング剤の体内分布を測定するために使用した動物モデルを記載している。
【0075】
実施例12は、静脈内投与後における本発明のイメージング剤の代謝を評価するために使用したアッセイを記載している。
【0076】
実施例中で使用される略語のリスト
℃ 摂氏度
aq 水性
BGO ゲルマニウム酸ビスマス
DCM ジクロロメタン
DMF ジメチルホルムアミド
DMSO ジメチルスルホキシド
EtOAc 酢酸エチル
g グラム
h 時間
Ki 半最大阻害のために必要な化合物の濃度
MBq メガベクレル
mg ミリグラム
min 分
ml ミリリットル
mM ミリモル濃度
mmol ミリモル
n 実験回数
NMR 核磁気共鳴
PBR 末梢ベンゾジアゼピンレセプター
rpm 毎分回転数
TEA トリエチルアミン
TLC 薄層クロマトグラフィー
Tris トリス(ヒドロキシメチル)アミノメタン
UV 紫外
実施例1:インビボイメージング剤1用の直接標識前駆体の合成
実施例1(i):2−アミノジフェニルエーテル
【0077】
【化7】

メタノール(250ml)中の2−ニトロジフェニルエーテル(16g、74mmol)を木炭上のパラジウム(1.6g)と共に水素雰囲気下で20〜50℃で30分間振盪した。急速な水素の吸収があり、20〜50℃の検出可能な発熱の結果として温度が急速に上昇し、次いで低下した。温度が50℃を超えて上昇するのを抑えるため、振盪を短時間停止した。次いで、反応物をセライトで濾過し、高真空中で濃縮することで、2−アミノジフェニルエーテルを油状物(13.5g、72.9mmol、98%)として得たが、これは静置後に結晶化して淡黄色の固体を与えた。
【0078】
1H NMR(CDCl3)300MHz δ3.82(2H,brm,NH2),6.7−7.1(7H,m,ArH)7.33(2H,m,ArH)。
【0079】
13C NMR(CDCl3)75MHz δ116.41,117.03,118.70(2C),120.22,122.57,124.85,129.65(2C),138.70,142.97,157.43。
【0080】
実施例1(ii):N−(2,3−ジヒドロベンゾフラン−7−イルメチル)−N−(2−フェノキシフェニル)アミン
【0081】
【化8】

2−アミノジフェニルエーテル(1g、5.4mmol)を2,3−ジヒドロベンゾフラン−7−カルバルデヒド(1g、7.02mmol)及びトルエン(10ml)で処理し、激しく撹拌しながら窒素雰囲気下で4時間加熱還流した。溶液は黄色で均質になった。次いで、反応物を真空中で濃縮してトルエンを除去し、0℃に冷却し、メタノール(15ml)で希釈、水素化ホウ素ナトリウム(612mg、16mmol)を少量ずつ20分かけて添加して処理した。次いで、反応物を室温まで放温し、さらに30分間撹拌した。2N塩酸(5ml)を添加し、反応物をさらに30分間撹拌した。次いで、反応物を真空中で濃縮してガム状物にし、10%炭酸カリウム水溶液(50ml)を添加した。次いで、酢酸エチル(50ml)中への抽出によって生成物を回収し、抽出液を硫酸マグネシウム上で乾燥し、真空中で濃縮してガム状物にした。ガム状物を、ペトロール中10〜30%酢酸エチルの勾配を用いて120gのシリカカラム上でクロマトグラフィー処理した。主たる急速流出画分であるN−(2,3−ジヒドロベンゾフラン−7−イルメチル)−N−(2−フェノキシフェニル)アミンをガム状物(1.2824g、4.04mmol、74.9%)として集めたが、これは静置後に結晶化した。
【0082】
1H NMR CDCl3 300MHz,δ3.19(2H,t,CH2Ph),4.35(2H,s,CH2N)4.51(2H,t,CH2O)4.87(1H,brs,NH),6.6,−7.31(12H,mArH)。
【0083】
13C NMR CDCl3,75MHz δ29.69,42.63,71.11,112.01,116.82,117.27,119.34,120.31,122.48,123.64,126.96,129.55,140.50,143.07,157.71,157.83。
【0084】
実施例1(iii):2−ブロモ−N−(2,3−ジヒドロフラン−7−イルメチル)−N−(2−フェノキシフェニル)アセトアミド
【0085】
【化9】

ジクロロメタン(10ml)中のN−(2,3−ジヒドロベンゾフラン−7−イルメチル)−N−(2−フェノキシフェニル)アミン(0.5g、1.57mmol)を0℃に冷却し、ブロモアセチルクロリド(272mg、1.73mmol)及びトリエチルアミン(175mg、1.73mmol)で処理し、窒素雰囲気下で1時間撹拌した。反応物をジクロロメタン(50ml)で希釈し、5N塩酸(20ml)で洗浄してトリエチルアミンを除去し、炭酸カリウム水溶液(20ml)で洗浄して過剰のブロモアセチルクロリドを除去した。有機層を分離し、硫酸マグネシウム上で乾燥し、高真空中で濃縮して2−ブロモ−N−(2,3−ジヒドロフラン−7−イルメチル)−N−(2−フェノキシフェニル)アセトアミド(661mg、1.51mmol、96%)を得た。
【0086】
1H NMR(CDCl3)300MHz,δ3.06(2H,m,CH2Ph),3.8(2H,d,dCH2O),4.2−4.4(2H,d,q,CH2Br)4.7,(1H,d,CHN),5.12,(1H,d,CHN),6.62−7.32(12H,m,ArH)。
【0087】
13C NMR(CDCl3)75MHz δ27.81,29.68,46.78,70.89,118.04,119.36,120.26,123.06,124.13,124.17,129.82,153.48,155.59,158.55,166.64。
【0088】
実施例2:インビボイメージング剤2用の直接標識前駆体の合成
実施例2(i):N−(ベンゾ[1,3]ジオキソール−4−イルメチル)−N−(2−フェニルオキシ−フェニル)アミン
【0089】
【化10】

2−フェノキシ−フェニルアミン(410mg、2.22mmol)と2,3−(メチレンジオキシ)ベンズアルデヒド(500mg、3.33mmol)との混合物を窒素下において90℃で2時間加熱した。反応物を0℃に冷却し、MeOH(4mL)を添加し、続いてNaBH4(253mg、6.70mmol)を少量ずつ20分かけて添加した。混合物を室温で24時間撹拌した。ギ酸(0.4mL)を添加し、混合物を15分間撹拌した。溶媒を真空中で除去し、残留物を飽和NaHCO3水溶液(50mL)で奪活し、DCM(2×30mL)で抽出し、MgSO4上で乾燥し、濾過し、真空中で溶媒を除去した。粗物質を石油スピリット(A)及び酢酸エチル(B)で溶出するシリカゲルクロマトグラフィー(5%B、80g、4.0CV、60mL/分)によって精製することで、360mg(51%)のN−(ベンゾ[1,3]ジオキソール−4−イルメチル)−N−(2−フェニルオキシ−フェニル)アミンを白色固体として得た。
【0090】
1H NMR(300MHz,CDCl3)δ4.35(2H,d,J=5.2Hz,ArCH2),4.66(1H,s,NH),5.88(2H,s,OCH2O),6.60−7.10(10H,m,ArH),7.24−7.34(2H,m,ArH)。
【0091】
実施例2(ii):N−(ベンゾ[1,3]ジオキソール−4−イルメチル)−2−ブロモ−N−(2−フェニルオキシ−フェニル)アセトアミド
【0092】
【化11】

N−(ベンゾ[1,3]ジオキソール−4−イルメチル)−N−(2−フェニルオキシ−フェニル)アミン(0.18g、0.58mmol)をDCM(4mL)に溶解した溶液に、トリエチルアミン(0.24g、2.32mmol、0.32mL)を添加した。反応物を0℃に冷却し、ブロモアセチルクロリド(0.18g、1.16mmol、0.10mL)を添加した。混合物を室温で2時間撹拌した。LC−MSは、出発原料及び生成物(1:1)を示した。さらに、トリエチルアミン(0.24g、2.32mmol、0.32mL)及びブロモアセチルクロリド(0.18g、1.16mmol、0.10mL)を添加し、室温で2時間撹拌した。溶媒を真空中で除去し、残留物を水(10mL)で奪活し、DCM(2×20mL)で抽出し、MgSO4上で乾燥し、濾過し、真空中で溶媒を除去した。粗物質をDCM(A)及びMeOH(B)で溶出するシリカゲルクロマトグラフィー(1%B、80g、2CV、60mL/分)によって精製した。不純な生成物をDCM(A)及びEtOAc(B)で溶出するシリカゲルクロマトグラフィー(1〜5%B、80g、4.5CV、60mL/分)によってさらに精製することで、120mg(47%)のN−(ベンゾ[1,3]ジオキソール−4−イルメチル)−2−ブロモ−N−(2−フェニルオキシ−フェニル)アセトアミドを無色油状物として得た。
【0093】
1H NMR(300MHz,CDCl3)δ3.76(1H,d,J=11Hz,BrCH),3.82(1H,d,J=11Hz,BrCH),4.72(1H,d,J=14Hz,ArCH),5.13(1H,d,J=14Hz,ArCH),5.63(1H,d,J=1Hz,OCHO),5.79(1H,d,J=1Hz,OCHO),6.65−7.40(12H,m,ArH)。
【0094】
LC−MS:C22H18BrNO4に関するm/z計算値,440.3;実測値,441.9(M+H)+。
【0095】
実施例3:インビボイメージング剤3用の直接標識前駆体の合成
実施例3(i):N−(2,3−ジヒドロベンゾ[1,4]ジオキシニル−5−イルメチル)−N−(2−フェノキシフェニル)アミン
【0096】
【化12】

2−アミノジフェニルエーテル(1g、5.4mmol)を2,3−ジヒドロベンゾ[1,4]ジオキシニル−5−アルデヒド(885mg、5.4mmol)及びトルエン(10ml)で処理し、激しく撹拌しながら窒素雰囲気下で4時間加熱還流した。溶液は黄色で均質になった。次いで、反応物を真空中で濃縮してトルエンを除去し、0℃に冷却し、メタノール(25ml)で希釈、絶えず撹拌しながら水素化ホウ素ナトリウム(1g、ペレット)で処理した。次いで、反応物を一晩かけて室温まで放温したところ、白色の結晶質固体が析出した。濾過によって集めた固体は、N−(2,3−ジヒドロベンゾ[1,4]ジオキシニル−5−イルメチル)−N−(2−フェノキシフェニル)アミン(1.128g、3.56mmol、66%)であった。
【0097】
1H NM RCDCl3 300MHz,δ4.16,(4H,s,CH2−Ox2),4.35(2H,d,CH2N),4.68(1H,t,NH),6.6−7.1(10H,mArH),7.29,(2H,t,ArH)。
【0098】
13C NMR CDCl3,75MHz,δ42.6,64.06,64.21,112.18,116.25,117.09,119.57,120.62,120.79,124.97,128.00,129.58,140.55,141.00,142.97,143.33,157.78。
【0099】
実施例3(ii):N−(2,3−ジヒドロベンゾ[1,4]ジオキシニル−5−イルメチル)−2−ブロモ−N−(2−フェノキシフェニル)アセトアミド
【0100】
【化13】

ジクロロメタン(20ml)中のN−(2,3−ジヒドロベンゾ[1,4]ジオキシン−5−イルメチル)−N−(2−フェノキシフェニル)アミン(純粋)(0.5g、1.5mmol)を、ブロモアセチルクロリド(259mg、1.65mmol)及びトリエチルアミン(168mg、1.65mmol)により0℃で1時間処理した。次いで、反応物をジクロロメタン(50ml)で希釈し、2N塩酸(20ml)で洗浄してトリエチルアミンを除去し、10%炭酸カリウム水溶液で洗浄して過剰のブロモアセチルクロリドを除去した。有機層を分離し、硫酸マグネシウム上で乾燥し、高真空中で濃縮して2−ブロモ−N−(2,3−ジヒドロベンゾ[1,4]ジオキシニル−5−イルメチル)−N−(2−フェノキシフェニル)アセトアミド(637mg、1.40mmol、93%)を得た。
【0101】
1H NMR CDCl3,300MHz,δ3.77(2H,dd,CH2Br),3.85−4.2(4H,m,CH20x2),4.75 and 5.15(1H,d,together CH2N),6.65−7.4(12H,m,ArH)。
【0102】
13C NMR CDCl3 75MHz,δ27.77,46.08,63.95,64.02,116.68,119.39,120.66,122.97,123.00,124.78,124.28,124.70,129.50,129.90,130.40,131.00141.98,143.16,153.58,155.50,166.53。
【0103】
実施例4:インビボイメージング剤4用の直接標識前駆体の合成
実施例4(i):N−(2,2−ジメチル−2,3−ジヒドロベンゾフラン−7−イルメチル)−N−(2−フェノキシフェニル)アミン
【0104】
【化14】

2−フェノキシ−フェニルアミン(350mg、1.89mmol)と2,2−ジメチル−2,3−ジヒドロ−1−ベンゾフラン−7−カルバルデヒド(500mg、2.83mmol)との混合物を窒素下において90℃で2時間加熱した。反応物を0℃に冷却し、MeOH(4mL)を添加し、続いてNaBH4(216mg、5.70mmol)を少量ずつ20分かけて添加した。混合物を室温で24時間撹拌した。ギ酸(0.4mL)を添加し、混合物を15分間撹拌した。溶媒を真空中で除去し、残留物を飽和NaHCO3水溶液(50mL)で奪活し、DCM(2×30mL)で抽出し、MgSO4上で乾燥し、濾過し、真空中で溶媒を除去した。粗物質を石油スピリット(A)及び酢酸エチル(B)で溶出するシリカゲルクロマトグラフィー(5〜10%B、80g、3CV、60mL/分)によって精製することで、560mg(86%)のN−(2,2−ジメチル−2,3−ジヒドロベンゾフラン−7−イルメチル)−N−(2−フェノキシフェニル)アミンを無色油状物として得た。
【0105】
1H NMR(300MHz,CDCl3)δ1.43(6H,s,C(CH3)2),2.98(2H,s,ArCH2),4.32(2H,s,NCH2),4.79(1H,s,NH),6.60−7.10(10H,m,ArH),7.30(2H,m,ArH)。
【0106】
実施例4(ii):2−ブロモ−N−(2,2−ジメチル−2,3−ジヒドロベンゾフラン−7−イルメチル)−N−(2−フェノキシフェニル)アセトアミド
【0107】
【化15】

N−(2,2−ジメチル−2,3−ジヒドロベンゾフラン−7−イルメチル)−N−(2−フェノキシフェニル)アミン(0.20g、0.58mmol)をDCM(2mL)に溶解した溶液に、トリエチルアミン(0.24g、2.32mmol、0.32mL)を添加した。反応物を0℃に冷却し、ブロモアセチルクロリド(0.18g、1.16mmol、0.10mL)を添加した。混合物を室温で2時間撹拌した。LC−MSは、出発原料及び生成物(1:1)を示した。さらに、トリエチルアミン(0.24g、2.32mmol、0.32mL)及びブロモアセチルクロリド(0.18g、1.16mmol、0.10mL)を添加し、室温で2時間撹拌した。溶媒を真空中で除去し、残留物を水(10mL)で奪活し、DCM(2×20mL)で抽出し、MgSO4上で乾燥し、濾過し、真空中で溶媒を除去した。粗物質を石油スピリット(A)及びEtOAc(B)で溶出するシリカゲルクロマトグラフィー(30%B、80g、2.5CV、60mL/分)によって精製した。不純な生成物をDCM(A)及びEtOAc(B)で溶出するシリカゲルクロマトグラフィー(1〜5%B、80g、5CV、60mL/分)によってさらに精製することで、170mg(63%)の2−ブロモ−N−(2,2−ジメチル−2,3−ジヒドロベンゾフラン−7−イルメチル)−N−(2−フェノキシフェニル)アセトアミドを無色油状物として得た。
【0108】
1H NMR(300MHz,CDCl3)δ1.14(3H,s,CH3),1.31(3H,s,CH3),2.83(1H,d,J=15Hz,ArCH),2.90(1H,d,J=15Hz,ArCH),3.74(1H,d,J=11Hz,BrCH),3.80(1H,d,J=11Hz,BrCH),4.59(1H,d,J=14Hz,NCH),5.22(1H,d,J=14Hz,NCH),6.65−7.40(12H,m,ArH)。
【0109】
LC−MS:C25H24BrNO3に関するm/z計算値,466.4;実測値,467.9(M+H)+。
【0110】
実施例5:インビボイメージング剤1〜4を得るための実施例1〜4の前駆体化合物の放射性フッ素化
5(i):[18F]フッ化物イオンの乾燥
15μlの水中に供給された18F−フッ化物イオンに、さらに200μlの水を添加し、COC容器内にフッ化物イオンを吸引した。0.5mlのアセトニトリル及び0.1M炭酸水素カリウム溶液(50μl、5×10-6モル)に溶解したKryptofix(2mg、5.3×10-6モル)の存在下で、18F−フッ化物イオンを窒素流下において110℃で30分間乾燥した(長いタップを開いた場合には、0.3L/分で約20分間、続いて0.1L/分で乾燥した)。スプラッシングの危険がもはや無くなったら流量を0.5L/分に高め(約10分間)、次いで室温に冷却した。
【0111】
5(ii):放射性フッ素化
段階5(i)で得られた乾燥残留物に、1mlのアセトニトリルに溶解した0.7mgの特定前駆体化合物を添加し、反応物を密封系中において100℃で10分間加熱した。冷却後、反応混合物をN46バイアルに移し、COCバイアルを1.5mlの水で洗浄した。洗液を同じガラスバイアルに移した。(全量が約2.5mlである)調製物を分取HPLC上に引き取り、HPLCカットを約15mlの水で希釈した後、(2.5mlのエタノール及び5mlの水でプレコンディショニングを施した)Sep−Pak tC18 light上に装填した。次いで、Sep−Pakを0.5mlのエタノールで溶出し(P6バイアル中に集めた)、続いて4.6mlのダルベッコリン酸緩衝食塩水で溶出した(同じP6バイアル中に集めた)。HPLCによってRCPを測定した。
【0112】
実施例6:インビボイメージング剤1に対する非放射性標準の合成
実施例6(i):N−(2,3−ジヒドロベンゾフラン−7−イルメチル)−2−フルオロ−N−(2−フェノキシフェニル)アセトアミド
【0113】
【化16】

DCM(20ml)中のN−(2,3−ジヒドロベンゾフラン−7−イルメチル)−N−(2−フェノキシフェニル)アミン(0.5g、1.78mmol)を、フルオロアセチルクロリド(199mg、1.96mmol)及びTEA(199mg、1.96mmol)により0℃で1時間処理した。次いで、反応物をDCM(50ml)で希釈し、2N塩酸(20ml)で洗浄してTEAを除去し、10%炭酸カリウム水溶液で洗浄してフルオロアセチルクロリドを除去した。有機層を分離し、硫酸マグネシウム上で乾燥し、高真空中で濃縮してN−(2,3−ジヒドロベンゾフラン−7−イルメチル)−2−フルオロ−N−(2−フェノキシフェニル)アセトアミド(455mg、1.61mmol、91%)を得た。
【0114】
1H NMR CDCl3中,300mHz,δ2.9−3.13(2H,m,CH2Ph),4.22 and 4.38(1H,q,together CH2O),4.7 and 4.9(1H,q,together CH2F),4.8 and 5.1(1H,d,together CH2N),6.63−7.5(12H,m,ArH)。
【0115】
13C NMR CDCl3中,75MHz,δ26.73,43,31,68.03,77.00,114.00,115.00116.39,117.32,120.23,121.34,124.00,126.36,126.94,127.45,150.84,152.58,155.76,164.11,164.38。
【0116】
実施例7:インビボイメージング剤2に対する非放射性標準の合成
実施例7(i):N−(ベンゾ[1,3]ジオキソール−4−イルメチル)−2−フルオロ−N−(2−フェニルオキシ−フェニル)アセトアミド
【0117】
【化17】

N−(ベンゾ[1,3]ジオキソール−4−イルメチル)−N−(2−フェニルオキシ−フェニル)アミン(0.16g、0.50mmol)をDCM(2mL)に溶解した溶液に、TEA(0.20g、2.00mmol、0.28mL)を添加した。反応物を0℃に冷却し、フルオロアセチルクロリド(0.10g、1.00mmol、0.07mL)を添加した。混合物を室温で1時間撹拌した。溶媒を真空中で除去し、残留物を水(10mL)で奪活し、DCM(2×20mL)で抽出し、MgSO4上で乾燥し、濾過し、真空中で溶媒を除去した。粗物質をDCM(A)及びMeOH(B)で溶出するシリカゲルクロマトグラフィー(1〜5%B、80g、4.0CV、60mL/分)によって精製することで、120mg(47%)のN−(ベンゾ[1,3]ジオキソール−4−イルメチル)−2−フルオロ−N−(2−フェニルオキシ−フェニル)アセトアミドを黄色油状物として得た。構造は下記のNMRによって確認された。
【0118】
1H NMR(300MHz,CDCl3)δ4.67(1H,d,J=2Hz,FCH),4.83(1H,d,J=2Hz,FCH),4.74(1H,d,J=14Hz,ArCH),5.12(1H,d,J=14Hz,ArCH),5.63(1H,d,J=1Hz,OCHO),5.79(1H,d,J=1Hz,OCHO),6.66−6.88(6H,m,ArH),6.96−7.06(2H,m,ArH),7.12−7.38(4H,m,ArH)。
【0119】
19F NMR(282MHz,CDCl3)δ−226.8,−227.0,−227.2。
【0120】
LC−MS:C22H18FNO4に関するm/z計算値,379.4;実測値,380.1(M+H)+。
【0121】
実施例8:インビボイメージング剤3に対する非放射性標準の合成
実施例8(i):2−フルオロ−N−(2,3−ジヒドロベンゾ[1,4]ジオキシニル−5−イルメチル)−N−(2−フェノキシフェニル)アセトアミド
【0122】
【化18】

DCM(20ml)中のN−(2,3−ジヒドロベンゾ[1,4]ジオキシニル−5−イルメチル)−N−(2−フェノキシフェニル)アミン(0.5g、1.5mmol)を、フルオロアセチルクロリド(168mg、1.65mmol)及びTEA(168mg、1.65mmol)により0℃で1時間処理した。次いで、反応物をDCM(50ml)で希釈し、2N塩酸(20ml)及び10%炭酸カリウム水溶液で洗浄した。有機層を分離し、硫酸マグネシウム上で乾燥し、高真空中で濃縮してガム状物にした。ガム状物を、ペトロール中15〜40%酢酸エチルの勾配を用いて120gのシリカカラム上でクロマトグラフィー処理した。主画分を集めることで、2−フルオロ−N−(2,3−ジヒドロベンゾ[1,4]ジオキシニル−5−イルメチル)−N−(2−フェノキシフェニル)アセトアミド(0.538g、1.43mmol、95%)を得た。
【0123】
1H NMR CDCl3中,300MHz,δ3.8−4.1(4H,M,CH2Ox2),4.65 and 4.81(1H,d,d,together CH2F),4.8 and 5.1(1H,d,d,together CH2N),6.6−7.4,(12Hm,ArH)。
【0124】
13C NMR CDCl3中,75MHz,δ45.2,63.72,63.83,77.41,79.75,116.58,119.16,120.41,122.98,123.00,124.16,124.30,129.00,129.74,130.00,141.91,143.05,153.71,155.23,166.49,166.75。
【0125】
実施例9:インビボイメージング剤4に対する非放射性標準の合成
実施例9(i):N−(2,2−ジメチル−2,3−ジヒドロベンゾフラン−7−イルメチル)−2−フルオロ−N−(2−フェノキシフェニル)アセトアミド
【0126】
【化19】

N−(2,2−ジメチル−2,3−ジヒドロベンゾフラン−7−イルメチル)−N−(2−フェノキシフェニル)アミン(0.20g、0.58mmol)をDCM(2mL)に溶解した溶液に、TEA(0.24g、2.32mmol、0.32mL)を添加した。反応物を0℃に冷却し、フルオロアセチルクロリド(0.11g、1.16mmol、0.08mL)を添加した。混合物を室温で1時間撹拌した。溶媒を真空中で除去し、残留物を水(10mL)で奪活し、DCM(2×20mL)で抽出し、MgSO4上で乾燥し、濾過し、真空中で溶媒を除去した。粗物質をDCM(A)及びMeOH(B)で溶出するシリカゲルクロマトグラフィー(1%B、80g、2CV、60mL/分)によって精製することで、170mg(72%)のN−(2,2−ジメチル−2,3−ジヒドロベンゾフラン−7−イルメチル)−2−フルオロ−N−(2−フェノキシフェニル)アセトアミドを淡黄色油状物として得た。
1H NMR(300MHz,CDCl3)δ1.12(3H,s,CH3),1.30(3H,s,CH3),2.83(1H,d,J=15Hz,ArCH),2.90(1H,d,J=15Hz,ArCH),4.58(1H,d,J=14Hz,NCH),4.65(1H,s,FCH),4.81(1H,s,FCH),5.22(1H,d,J=14Hz,NCH),6.65−7.40(12H,m,ArH)。
【0127】
19F NMR(282MHz,CDCl3)δ−226.6,−226.8,−227.0。
【0128】
LC−MS:C25H24FNO3に関するm/z計算値,405.5;実測値,406.1(M+H)+。
【0129】
実施例10:インビトロ効力アッセイ
Le Fur et al(Life Sci.1983;USA 33:449−57)の方法を改変した方法を用いて、PBRに対する親和性のスクリーニングを行った。試験した化合物は、PBR06及びインビボイメージング剤1〜4であった。
【0130】
(1%DMSOを含む50mMトリス−HCl、pH7.4、10mM MgCl2に溶解した)各試験化合物を、ウィスター系ラットの心臓PBRとの結合に関して0.3nM[3H]PK−11195と競合させた。反応は50mMトリス−HCl、pH7.4、10mM MgCl2中において25℃で15分間実施した。
【0131】
各試験化合物のスクリーニングは、推定Kiの周辺の300倍の濃度範囲にわたる6種の濃度で行った。PBR06及びインビボイメージング剤1〜4に関するKi値は、それぞれ0.28nM、0.31nM、2.03nM、1.14nM及び2.66nMであることが判明した。
【0132】
実施例11:インビボ体内分布方法
(Briard et al,J Med Chem 2009;52:688−699に従って合成した)PBR06及びインビボイメージング剤1〜3をインビボ体内分布モデルで試験し、それぞれの体内分布を比較した。
【0133】
成体雄ウィスター系ラット(200〜300g)に、側尾静脈を通して1〜3MBqの試験化合物を注射した。注射から2分後、10分後、30分後又は60分後(n=3)に、ラットを安楽死させ、γ線カウンター上での放射能測定のために組織又は体液の試料を採取した。
【0134】
図1〜3は、OBへのPBR06及びそれぞれインビボイメージング剤1〜3の取込み比を線条体への取込み比と比較して示している。
【0135】
実施例12:代謝アッセイ
試験インビボイメージング剤の注射から60分後に、成体雄ウィスター系ラット(200〜300g)から脳組織試料を採取した。次いで、これらの試料を溶剤抽出(下記参照)によって処理することで、HPLCへの導入前に18F標識母体を18F標識代謝産物と共に抽出した。
【0136】
(小脳+橋・延髄を除いた)脳を10mlの氷冷アセトニトリルと共に(5000rpmで5分間)ホモジナイズすることで、すべての18F標識化学種を抽出した。次いで、得られた上澄み液を(40℃での回転蒸発によって)蒸発乾固し、2.5mlの移動相中に濃縮し、濾過し、1mlをHPLCに注入した。
【0137】
18F分析用のHPLC装置を二重BGO放射線&UV検出器に連結した。7.8×300mm、10μm、125Åの寸法を有するμBondapak C18分取カラムを使用した。30〜40%の水及び60〜70%のアセトニトリルを用いるイソクラティック溶出系を使用した。流量は3ml/分であった。各試験インビボイメージング剤ごとに水性相/有機相比を変化させることで、10分±2分又はその付近の保持時間で母体ピークを得た。
【0138】
注射から60分後において、インタクトな試験化合物を表す脳内放射能の百分率は、PBR06及びインタクトイメージング剤1〜3についてそれぞれ90%、93%、92%及び82%であった。
【技術分野】
【0001】
本発明は、インビボイメージング、特に末梢ベンゾジアゼピンレセプター(PBR)のインビボイメージングに関する。ナノモル親和性をもってPBRに結合し、投与後には脳内への良好な取込みを示し、PBRへの良好な選択的結合を示すアリールオキシアニリド系インビボイメージング剤が提供される。本発明はまた、本発明のインビボイメージング剤の合成において有用な前駆体化合物、並びに前記前駆体化合物の使用を含む前記インビボイメージング剤の合成方法及び前記方法を実施するためのキットも提供する。インビボイメージング剤の自動化合成のためのカセットも提供される。加えて本発明は、本発明のインビボイメージング剤を含む放射性医薬組成物並びに前記インビボイメージング剤の使用方法も提供する。
【背景技術】
【0002】
末梢ベンゾジアゼピンレセプター(PBR)は、主として末梢組織及びグリア細胞に局在することが知られているが、その生理学的機能はまだ明確に解明されていない。細胞レベル以下では、PBRはミトコンドリア外膜上に局在することが知られていて、これはミトコンドリア機能の調節及び免疫系において役割を果たす可能性を表している。さらに、PBRが細胞増殖、ステロイド生成、カルシウム流れ及び細胞呼吸に関係することも仮定されてきた。PBRは、急性及び慢性ストレス、不安、うつ病、パーキンソン病、アルツハイマー病、脳損傷、癌(Gavish et al, Pharm Rev 1999;51:629)、ハンチントン病(Messmer and Reynolds, Neurosci Lett 1998;241:53−6)、喘息(Pelaia et al, Gen Pharmacol 1997;28(4):495−8)、慢性関節リウマチ(Bribes et al, Eur J Pharmacol 2002;452(1):111−22)、アテローム性動脈硬化症(Davies et al, J Nucl Med 2004;45:1898−1907)及び多発性硬化症(Banati et al, Brain 2000;123:2321)を始めとする各種の状態と関連していた。PBRはニューロパシー性疼痛にも関連する可能性があり、Tsuda et alはニューロパシー性疼痛をもった被験者で小グリア細胞の活性化を観察している(TINS 2005;28(2):101−7)。
【0003】
PBR選択性リガンド(R)−[11C]PK11195を用いる陽電子放出断層撮影(PET)イメージングは、中枢神経系(CNS)炎症の包括的指標を提供する。(R)−[11C]PK11195の使用の成功にもかかわらず、それには制約がある。それは、高いタンパク質結合性及び低特異的乃至非特異的結合性を有することが知られている。その放射性標識代謝産物の役割は知られておらず、結合の定量化には複雑なモデル化が要求される。PBRに対して高い親和性及び選択性を有することでCNSにおけるPBR測定の向上を可能にする化合物を得るための努力が行われてきた。
【0004】
PBRに対する高い親和性並びに中枢ベンゾジアゼピンレセプター(CBR)に比べてPBRに対する高い選択性を有するアリールオキシアニリン誘導体が提唱された(Chaki et al, Eur J Pharmacol 1999;371:197−204)。[11C]−DAA1106及び[18F]−FE−DAA1106は、これらのアリールオキシアニリン化合物に基づくPET放射性リガンドである。これらのPET放射性リガンドは米国特許第6870069号に教示され、ヒトにおいて研究されてきた(Ikomo et al, J Cereb Blood Flow Metab 2007;27:173−84及びFujimura et al, J Nuc Med 2006;47:43−50)。別の放射性フッ素化DAA1106誘導体は国際公開第2007/074383号に教示されている。別の11C標識DAA1106誘導体は国際公開第2007/036785号に教示されている。放射性ヨウ素化DAA1106は、欧州特許出願公開第1854781号に記載され、またZhang et al(J Med Chem 2007;50:848−55)によって記載されている。[11C]−DAA1106、[18F]−FE−DAA1106及び[123I]−DAA1106の化学構造は下記の通りである。
【0005】
【化1】

しかし、これらの化合物の動力学的性質はインビボイメージングのために理想的でない結果、定量的研究に対するその適用は制限されると考えられる。
【0006】
さらに最近に至り、PBR06として知られる化合物が、上述の化合物に比べてインビボイメージングのために改善された性質を有することが報告された。この化合物の構造は下記の通りである。
【0007】
【化2】

末梢において極めて急速に代謝されるものの、PBR06の代謝産物は血液脳関門を通過しない(Briard et al, J Med Chem 2009;52:688−699)。以前の化合物とは対照的に、脳から生じる信号のほぼ全部がインタクトなPBR06に由来している。これは、脳内におけるPBRの濃度を正確に測定することを可能にする。したがって、PBR06は有望なインビボイメージング剤と見なされる。
【0008】
しかし、本明細書中に示されるように、バックグラウンド組織(即ち、線条体)と比較した、相対的に高いPBR発現を有する組織(即ち、嗅球)中へのPBR06取込み量の比はインビボイメージングのために最適とはいえない。また、脳内におけるインタクトな化合物の割合を向上させる余地も存在している。
【0009】
したがって、PBR06に比べてインビボイメージングのために改善された性質(即ち、PBR発現組織における高い特異的取込み及び/又は脳内におけるインタクトな化合物の高い割合)を有する代替インビボイメージング剤に対するニーズが存在している。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】米国特許第6870069号
【特許文献2】欧州特許出願公開第1854781号
【特許文献3】国際公開第2007/074383号
【特許文献4】国際公開第2007/036785号
【非特許文献】
【0011】
【非特許文献1】Chaki et al, Eur J Pharmacol 1999; 371: 197-204
【非特許文献2】Ikomo et al, J Cereb Blood Flow Metab 2007; 27: 173-84
【非特許文献3】Fujimura et al, J Nuc Med 2006; 47: 43-50
【非特許文献4】Zhang et al, J Med Chem 2007; 50: 848-55
【非特許文献5】Briard et al, J Med Chem 2009; 52: 688-699
【発明の概要】
【課題を解決するための手段】
【0012】
本発明は、インビボイメージングのために適した新規放射性標識アリールオキシアニリン誘導体を提供する。既知のアリールオキシアニリン誘導体系インビボイメージング剤に比べて、本発明のインビボイメージング剤はインビボイメージングのために一層良好な性質を有する。本発明のインビボイメージング剤は、良好な脳内取込み及び好ましいインビボ動力学を有すると共に、末梢ベンゾジアゼピンレセプター(PBR)に対する改善された特異的結合を示す。
【図面の簡単な説明】
【0013】
【図1】図1は、嗅球(OB)へのPBR06及びインビボイメージング剤1の取込み比を線条体への取込み比と比較して示している。
【図2】図2は、嗅球(OB)へのPBR06及びインビボイメージング剤2の取込み比を線条体への取込み比と比較して示している。
【図3】図3は、嗅球(OB)へのPBR06及びインビボイメージング剤3の取込み比を線条体への取込み比と比較して示している。
【発明を実施するための形態】
【0014】
イメージング剤
一態様では、本発明は次の式Iのインビボイメージング剤を提供する。
【0015】
【化3】

式中、
A1は−CR1R2−(CH2)n−(式中、R1及びR2は水素、フルオロ及びC1-3アルキルから独立に選択され、nは0、1又は2である。)であり、
A2は−CH2−、−O−又は−O−CH2−であり、或いは
−A1−A2は−CH=CH−である。
【0016】
本発明の文脈中における「インビボイメージング剤」とは、インビボイメージングのために適した放射性標識化合物をいう。本明細書中で使用する「インビボイメージング」という用語は、被験体の内部構造の全部又は一部の画像を非侵襲的に生成する技法をいう。かかるインビボイメージング方法の例は、単光子放出コンピューター断層撮影法(SPECT)及び陽電子放出断層撮影法(PET)である。
【0017】
特記しない限り、単独で又は組み合わせて使用される「アルキル」という用語は、好ましくは1〜3の炭素原子を含む直鎖又は枝分れアルキル基を意味する。かかる基の例には、メチル、エチル及びプロピルがある。
【0018】
本発明のインビボイメージング剤の例を幾つか挙げると下記の通りである。
【0019】
【化4】

式IのA1は、好ましくは−CR1R2−(CH2)n−であり、最も好ましくは−(CH2)m−(式中、mは1、2又は3であり、特に好ましくは1又は2である。)である。式IのA2は、好ましくは−CH2−又は−O−である。特に好ましくは、−A1−A2は−CH2−CH2−、−CH2−O−及び−CH2−CH2−O−から選択される。本発明の好ましいインビボイメージング剤はインビボイメージング剤1〜4であり、最も好ましくはインビボイメージング剤1〜3であり、特に好ましくはインビボイメージング剤1及び2であり、最も特に好ましくはインビボイメージング剤1である。
【0020】
実施例11は、本発明のインビボイメージング剤をPBR06と比較するために使用したラット体内分布モデルを記載している。OB:線条体取込み量をPBR06と比較して評価したところ、インビボイメージング剤1は線条体に比べてOB中に比較的多く取り込まれ(本件の図1参照)、インビボイメージング剤2及び3はPBR06と同等である(図2及び図3参照)ことが明らかになった。OBはラット脳の他の領域に比べて高いレベルのPBRを発現することが知られているので(“Handbook of Substance Abuse”by Tarter, Ammerman and Ott;Springer 1998:398−99を参照されたい)、OB:線条体比は試験化合物取込みの特異性の尺度である。
【0021】
実施例12は、注射から60分後におけるラット脳内のインタクトな試験インビボイメージング剤の量を評価するために使用したアッセイを記載している。インビボイメージング剤1〜4は、PBR06と同じ好ましい代謝プロファイルを示した。即ち、注射から60分後における脳内の高率の放射能はインタクトな試験化合物であることがわかった。インビボイメージング剤1及び2は、PBR06に比べ、注射から60分後において脳内に一層高率のインタクトな化合物を有することがわかった。
【0022】
本発明のインビボイメージング剤は、既知のかかる薬剤に比べて、PBRのインビボイメージングのための優れた性質を有することが本明細書中に示される。
【0023】
製造方法
さらに別の態様では、本発明は、本明細書中に記載したインビボイメージング剤の製造方法であって、18Fの適当な供給源を次の式IIの前駆体化合物と反応させる段階を含む方法を提供する。
【0024】
【化5】

式中、A1及びA2は式Iのインビボイメージング剤に関して本明細書中に好適なもの及び好ましいものとして定義した通りであり、LGは脱離基である。
【0025】
「前駆体化合物」は、好都合な化学形態の18Fとの化学反応が部位特異的に起こり、最小数の段階(理想的にはただ1つの段階)で反応を実施でき、かつ格別の精製の必要なしに(理想的にはいかなる追加の精製も必要なしに)所望のインビボイメージング剤が得られるように設計された、インビボイメージング剤の非放射性誘導体からなる。かかる前駆体化合物は合成品であり、良好な化学純度で簡便に得ることができる。
【0026】
「18Fの適当な供給源」という用語は、18Fが共有結合することで所望のインビボイメージング剤を生成するようにして前駆体化合物の置換基と反応し得る化学形態の18Fを意味する。
【0027】
概して言えば、前駆体化合物を前記18Fの適当な供給源と「反応」させる段階は、できるだけ高い放射化学収率(RCY)で所望のインビボイメージング剤を生成するのに適した反応条件下で2種の反応体を合わせることを含んでいる。幾つかの一層詳細な経路を以下の実験セクションに示す。
【0028】
「脱離基」という用語は、ヘテロリティック結合開裂において1対の電子と共に分子から脱離し、通常は求核基で置き換えられる原子又は原子団をいう。脱離基は陰イオン又は中性分子であり得る。好ましい脱離基(LG)は下記に記載する。
【0029】
Okubo et al(2004 Bioorg.Med.Chem.;12:423−38)は、非放射性アリールオキシアニリド化合物を得るための方法を記載している。アリールオキシアニリド化合物を得るための合成スキームはまた、Briard et al(J.Med.Chem.2008;51:17−31)、Wilson et al(Nuc.Med.Biol.2008;35:305−14)、及びZhang et al(J.Med.Chem.2007;50:848−55)によっても記載されている。これらの先行技術方法は、式IIの前駆体化合物を得るために容易に適合させることができる。
【0030】
下記のスキーム1は、非放射性標準、及び本発明のインビボイメージング剤を製造するのに適した前駆体化合物を得るための一般反応スキームである。
【0031】
【化6】

上記反応スキーム中、LGは本明細書中で定義される脱離基であり、R*は上記式I及び式IIの両方に含まれるようなA環を含む縮合二環式環構造を表している。商業的に入手可能な2−ニトロビフェニルエーテル(a)中のニトロ基を水素化によって還元することで、対応するアニリン(b)が得られる。芳香族アルデヒド(c)での還元アルキル化によってベンジルアミン(d)が得られる。適当なアセチル(e)と反応させれば、所望の非放射性標準及び前駆体化合物が得られる。
【0032】
18Fによる標識は、式IIの前駆体化合物からの脱離基LGの求核置換によって達成できる。好ましい脱離基(LG)には、クロリド、ブロミド、ヨージド、トシレート、メシレート及びトリフレートがあり、ブロミド及びトシレートが最も好ましい。式IIの前駆体化合物は、18Fの適当な供給源を[18F]−フッ化物イオンとする一段階で標識できる。放射性フッ素化反応用の[18F]−フッ化物イオン(18F-)は、通常は核反応18O(p,n)18Fから水溶液として得られ、次いでカチオン対イオンの添加及びそれに続く水の除去によって反応性にされる。好適なカチオン性対イオンは、無水反応溶媒中において、18F-の溶解性を維持するのに十分な溶解度を有するべきである。したがって、使用されてきた対イオンには、ルビジウム又はセシウムのような大きいが軟らかい金属イオン、Kryptofix(商標)のようなクリプタンドと錯体化したカリウム、或いはテトラアルキルアンモニウム塩がある。好ましい対イオンは、無水溶媒中での溶解性が良く、18F-の反応性を向上させることから、Kryptofix(商標)のようなクリプタンドと錯体化したカリウムである。好ましい対イオンは、無水溶媒中での溶解性が良く、18F-の反応性を向上させることから、Kryptofix(商標)のようなクリプタンドと錯体化したカリウムである。
【0033】
放射性フッ素化が特定の部位で起こることを保証するため、前駆体化合物は選択的に化学保護することが必要となる場合がある。保護基は上記に記載されている。
【0034】
前駆体化合物は、理想的には無菌で非発熱性の形態で供給される。したがってそれは、インビボイメージング剤を哺乳動物への投与に適した生体適合性キャリヤーと共に含む医薬組成物の製造のために使用できる。前駆体化合物はまた、かかる医薬組成物を製造するためのキット中に一成分として含めるためにも適している。
【0035】
好ましい実施形態では、前駆体化合物はキット又は自動化合成装置で使用するように設計されたカセットの一部として溶液状態で供給される。これらの態様は、本発明の追加の態様に関連して以下に一層詳しく論議される。
【0036】
別の好ましい実施形態では、前駆体化合物は固相に結合されている。前駆体化合物は、好ましくは固体担体マトリックスに共有結合した状態で供給される。このようにすれば、所望の生成物は溶液状態で生成される一方、出発原料及び不純物は固相に結合したままに保たれる。かかる系の例としては、18F−フッ化物による固相求電子フッ素化用の前駆体化合物が国際公開第03/002489号に記載されており、18F−フッ化物による固相求核フッ素化用の前駆体化合物が国際公開第03/002157号に記載されている。
【0037】
好ましくは、本発明の方法は実施の容易性のために自動化される。
【0038】
前駆体化合物
本発明の方法に関連して上記に好適なもの及び好ましいものとして記載された前駆体化合物は、それ自体が本発明の追加の態様をなしている。
【0039】
放射性医薬組成物
さらに別の態様では、本発明は「放射性医薬組成物」を提供し、これは本発明のインビボイメージング剤を哺乳動物への投与に適した形態の生体適合性キャリヤーと共に含んでいる。
【0040】
「生体適合性キャリヤー」は、放射性医薬組成物が生理学的に認容され得るようにして(即ち、毒性又は過度の不快感なしに哺乳動物体に投与できるようにして)インビボイメージング剤を懸濁又は溶解するための流体(特に液体)である。生体適合性キャリヤーは、好適には、無菌のパイロジェンフリー注射用水、(有利には注射用の最終生成物が等張性又は非低張性になるように平衡させ得る)食塩水のような水溶液、或いは1種以上の張度調整物質(例えば、血漿陽イオンと生体適合性対イオンとの塩)、糖(例えば、グルコース又はスクロース)、糖アルコール(例えば、ソルビトール又はマンニトール)、グリコール(例えば、グリセロール)又は他の非イオン性ポリオール物質(例えば、ポリエチレングリコール、プロピレングリコールなど)の水溶液のような注射可能なキャリヤー液体である。生体適合性キャリヤーはまた、エタノールのような生体適合性有機溶媒を含んでいてもよい。かかる有機溶媒は、親油性の高い化合物又は配合物を可溶化するために有用である。好ましくは、生体適合性キャリヤーはパイロジェンフリー注射用水、等張食塩水又はエタノール水溶液である。静脈内注射用生体適合性キャリヤーのpHは好適には4.0〜10.5の範囲内にある。
【0041】
本発明の放射性医薬組成物中に含まれる場合におけるインビボイメージング剤の好適な実施形態及び好ましい実施形態は、上記に記載した通りである。
【0042】
かかる放射性医薬組成物は非経口的に(即ち、注射によって)投与でき、最も好ましくは水溶液である。かかる組成物は、緩衝剤、薬学的に許容される可溶化剤(例えば、シクロデキストリン或いはPluronic、Tween又はリン脂質のような界面活性剤)、薬学的に許容される安定剤又は酸化防止剤(例えば、アスコルビン酸、ゲンチジン酸又はp−アミノ安息香酸)のような追加成分を任意に含み得る。本発明のインビボイメージング剤が放射性医薬組成物として提供される場合、前記インビボイメージング剤の製造方法はさらに、放射性医薬組成物を得るために必要な段階(例えば、有機溶媒の除去、生体適合性緩衝剤及び任意の追加成分の添加)を含むことができる。
非経口的投与のためには、放射性医薬組成物が無菌性かつ無発熱原性であることを保証するための手段を講じることも必要である。
【0043】
キット及びカセット
好ましい実施形態では、本発明のインビボイメージング剤の製造方法は、キット又は自動化合成装置に挿入し得るカセットを用いて実施できる。これらのキット及びカセットはまた、本発明の追加の態様をなしており、本明細書中に定義された本発明の放射性医薬組成物の製造のため特に好都合である。
【0044】
本発明のキットは、本発明の前駆体化合物を密封容器内に含んでいる。「密封容器」は、好ましくは、注射器による溶液の追加及び抜取りを許しながら、無菌保全性及び/又は放射能安全性の維持、さらに任意には不活性ヘッドスペースガス(例えば、窒素又はアルゴン)の維持を可能にする。好ましい密封容器は、気密クロージャーを(通例はアルミニウムからなる)オーバーシールと共にクリンプ加工した隔壁密封バイアルである。かかる密封容器は、例えばヘッドスペースガスの変更又は溶液のガス抜きのために所望される場合、クロージャーが真空に耐え得るという追加の利点を有している。
【0045】
本発明のキット中に使用する場合、前駆体化合物の好適な実施形態及び好ましい実施形態は、本明細書中に既に記載した通りである。
【0046】
キット中に使用するための前駆体化合物を無菌製造条件下で使用すれば、所望の無菌で非発熱性の材料を得ることができる。別法として、前駆体化合物を非無菌条件下で使用し、続いて例えばγ線照射、オートクレーブ処理、乾熱又は(例えば、エチレンオキシドによる)化学処理を用いる終末滅菌を施すこともできる。好ましくは、前駆体化合物は無菌で非発熱性の形態で供給される。最も好ましくは、無菌で非発熱性の前駆体化合物は上述のような密封容器に入れて供給される。
【0047】
好ましくは、試験間での汚染の可能性を最小限に抑えると共に無菌性及び品質保証を確実にするため、キットのすべての構成要素が使い捨てである。
【0048】
別の態様では、本発明は、本発明のインビボイメージング剤を合成するため適宜に改造された自動化合成装置に挿入し得るカセットを提供する。現在、特に[18F]−ラジオトレーサーはしばしば自動化放射合成装置で簡便に製造されている。かかる装置には、Tracerlab(商標)及びFastlab(商標)(いずれもGE Healthcare社から入手可能)を始めとするいくつかの市販例が存在している。放射化学は、カセットを装置に取り付けることにより、自動化合成装置上で実施される。普通、カセットは流体通路、反応器、及び試薬バイアル並びに放射合成後の清掃段階で使用される任意の固相抽出カートリッジを受け入れるためのポートを含んでいる。
【0049】
本発明のインビボイメージング剤の自動化合成のためのカセットは、
(i)本明細書中に定義した前駆体化合物を含む容器、及び
(ii)本明細書中に定義したような18Fの適当な供給源を用いて容器を溶出するための手段
を含んでいる。
【0050】
かかるカセットはさらに、
(iii)過剰の18Fを除去するためのイオン交換カートリッジ、及び任意には
(iv)得られた放射性標識生成物を脱保護して本明細書中に定義したインビボイメージング剤を生成するためのカートリッジ
を含むことができる。
【0051】
自動化合成のために必要な試薬、溶媒及び他の消耗品もまた、濃度、体積、送出時間などに関する最終ユーザーの要求条件を満たすように自動化合成装置を運転させるソフトウェアを保持したコンパクトディスクのようなデータ媒体と共に含めることができる。
【0052】
使用方法
さらに別の態様では、本発明は、被験体におけるPBR発現の分布及び/又は程度を決定するためのインビボイメージング方法であって、
(i)本明細書中に定義したインビボイメージング剤を前記被験体に投与する段階、
(ii)前記インビボイメージング剤を前記被験体内のPBRに結合させる段階、
(iii)前記インビボイメージング剤の18Fから放出される信号をインビボイメージング技法によって検出する段階、
(iv)前記信号の位置及び/又は量を表す画像を生成する段階、並びに
(v)前記被験体におけるPBR発現の分布及び程度を決定する段階であって、前記発現は前記18Fから放出される前記信号と直接に相関している段階
を含むインビボイメージング方法を提供する。
【0053】
本発明のインビボイメージング方法に関しては、インビボイメージング剤の好適な態様及び好ましい態様は本明細書中において前記に定義した通りである。
【0054】
インビボイメージング剤を「投与する」段階は、好ましくは非経口的に実施され、最も好ましくは静脈内に実施される。静脈内経路は、インビボイメージング剤を被験体の身体全域に送達するため、したがって血液脳関門(BBB)を横切って前記被験体で発現されたPBRに接触させるための最も効率的な方法である。本発明のインビボイメージング剤は、好ましくは本明細書中に定義された本発明の医薬組成物として投与される。別の実施形態では、投与段階はインビボイメージング方法自体に先立って実施される予備段階としても理解できる結果、段階(i)はインビボイメージング剤を予め投与した被験体を用意する段階として定義できる。
【0055】
投与段階後かつ検出段階前に、インビボイメージング剤をPBRに結合させる。例えば、被験体がインタクトな哺乳動物である場合、インビボイメージング剤は哺乳動物の身体を通って動的に移動し、体内の様々な組織に接触する。ひとたびインビボイメージング剤がPBRに接触すれば、特異的な相互作用が起こる結果、PBRをもった組織からのインビボイメージング剤のクリアランスは、PBRをもたない組織又はPBRの少ない組織よりも長い時間がかかる。一定の時点に達すれば、PBRをもった組織に結合したインビボイメージング剤とPBRをもたない組織又はPBRの少ない組織に結合したインビボイメージング剤との比の結果として、PBRに特異的に結合したインビボイメージング剤の検出が可能となる。理想的には、この比は2:1以上である。
【0056】
本発明の方法の「検出」段階は、18Fから放出される信号を、陽電子放出断層撮影(PET)検出器によって検出することを含んでいる。この検出段階はまた、信号データの取得として理解することもできる。
【0057】
本発明の方法の「生成」段階は、取得された信号データに再構築アルゴリズムを適用してデータセットを得るコンピューターによって実施される。次いで、このデータセットを操作することで、前記18Fから放出される信号の位置及び/又は量を示す画像が生成される。放出される信号はPBRの発現と直接に相関する結果、生成された画像を評価することで「決定」段階を行うことができる。
【0058】
本発明の「被験体」は、任意のヒト又は動物被験体であり得る。好ましくは、本発明の被験体は哺乳動物である。最も好ましくは、前記被験体はインタクトな哺乳動物生体である。特に好ましい実施形態では、本発明の被験体はヒトである。本インビボイメージング方法は、健常被験体或いはPBRの異常発現に関連する病的状態(「PBR状態」)を有することが知られ又は疑われる被験体においてPBRを検査するために使用できる。本発明のインビボイメージング剤は、中枢神経系(CNS)におけるPBR発現のインビボイメージングに特に適している。
【0059】
別の実施形態では、本発明のインビボイメージング方法は前記被験体に関する治療計画の進行中に繰り返して実施することができ、前記計画はPBR状態と戦うための薬物の投与を含んでいる。例えば、本発明のインビボイメージング方法は、PBR状態と戦うための薬物による治療前、治療中及び治療後に実施できる。このようにすれば、前記治療の効果を経時的にモニターすることができる。この実施形態のためにはPETイメージングが特に適している。PETは優れた感度及び分解能を有する結果、病変部における比較的小さい変化でも経時的に観察でき、これは治療モニタリングのために有利である。PETスキャナーは、日常的にピコモル範囲内の放射能濃度を測定している。現在、マイクロPETスキャナーは約1mmの空間分解能に接近しているが、臨床スキャナーは約4〜5mmである。
【0060】
好ましくは、前記方法はPBR状態を有することが知られ又は疑われる被験体のインビボイメージングに関し、したがって前記状態の診断方法の一部として有用である。したがって、本発明のインビボイメージング方法は、前記被験体がPBR状態に罹患しているか否かを診断するためにPBR発現の分布及び程度を帰因させる追加段階(vi)を含み得る。インビボイメージングが役に立つかかるPBR状態の例には、神経炎症が存在するパーキンソン病、多発性硬化症、アルツハイマー病及びハンチントン病のような神経疾患がある。本発明の化合物によるイメージングが有用であり得る他のPBR状態には、ニューロパシー性疼痛、関節炎、喘息、アテローム性動脈硬化症、特に限定されないが結腸直腸癌及び乳癌を含む一連の悪性疾患、並びに特に限定されないが双極性障害、統合失調症、不安及び外傷後ストレス障害を含む一連の気分障害がある。
【0061】
別の態様では、本発明は、本明細書中に好適なもの及び好ましいものとして定義したインビボイメージング方法で使用するための、本明細書中に定義したインビボイメージング剤を提供する。
【0062】
さらに別の態様では、本発明は、本明細書中に好適なもの及び好ましいものとして定義したインビボイメージング方法で使用するための本明細書中に定義した放射性医薬組成物を製造するための、本明細書中に定義したインビボイメージング剤を提供する。
【実施例】
【0063】
以下、一連の非限定的な実施例によって本発明を例示する。
【0064】
実施例の簡単な説明
実施例1は、インビボイメージング剤1用の直接標識前駆体化合物の合成法を記載している。
【0065】
実施例2は、インビボイメージング剤2用の直接標識前駆体化合物の合成法を記載している。
【0066】
実施例3は、インビボイメージング剤3用の直接標識前駆体化合物の合成法を記載している。
【0067】
実施例4は、インビボイメージング剤4用の直接標識前駆体化合物の合成法を記載している。
【0068】
実施例5は、インビボイメージング剤1〜4を得るために使用した放射性フッ素化方法を記載している。
【0069】
実施例6は、インビボイメージング剤1に対する非放射性標準の合成法を記載している。
【0070】
実施例7は、インビボイメージング剤2に対する非放射性標準の合成法を記載している。
【0071】
実施例8は、インビボイメージング剤3に対する非放射性標準の合成法を記載している。
【0072】
実施例9は、インビボイメージング剤4に対する非放射性標準の合成法を記載している。
【0073】
実施例10は、PBRに対する本発明のイメージング剤の非放射性標準の親和性を評価するために使用したインビトロアッセイを記載している。
【0074】
実施例11は、静脈内投与後における本発明のイメージング剤の体内分布を測定するために使用した動物モデルを記載している。
【0075】
実施例12は、静脈内投与後における本発明のイメージング剤の代謝を評価するために使用したアッセイを記載している。
【0076】
実施例中で使用される略語のリスト
℃ 摂氏度
aq 水性
BGO ゲルマニウム酸ビスマス
DCM ジクロロメタン
DMF ジメチルホルムアミド
DMSO ジメチルスルホキシド
EtOAc 酢酸エチル
g グラム
h 時間
Ki 半最大阻害のために必要な化合物の濃度
MBq メガベクレル
mg ミリグラム
min 分
ml ミリリットル
mM ミリモル濃度
mmol ミリモル
n 実験回数
NMR 核磁気共鳴
PBR 末梢ベンゾジアゼピンレセプター
rpm 毎分回転数
TEA トリエチルアミン
TLC 薄層クロマトグラフィー
Tris トリス(ヒドロキシメチル)アミノメタン
UV 紫外
実施例1:インビボイメージング剤1用の直接標識前駆体の合成
実施例1(i):2−アミノジフェニルエーテル
【0077】
【化7】

メタノール(250ml)中の2−ニトロジフェニルエーテル(16g、74mmol)を木炭上のパラジウム(1.6g)と共に水素雰囲気下で20〜50℃で30分間振盪した。急速な水素の吸収があり、20〜50℃の検出可能な発熱の結果として温度が急速に上昇し、次いで低下した。温度が50℃を超えて上昇するのを抑えるため、振盪を短時間停止した。次いで、反応物をセライトで濾過し、高真空中で濃縮することで、2−アミノジフェニルエーテルを油状物(13.5g、72.9mmol、98%)として得たが、これは静置後に結晶化して淡黄色の固体を与えた。
【0078】
1H NMR(CDCl3)300MHz δ3.82(2H,brm,NH2),6.7−7.1(7H,m,ArH)7.33(2H,m,ArH)。
【0079】
13C NMR(CDCl3)75MHz δ116.41,117.03,118.70(2C),120.22,122.57,124.85,129.65(2C),138.70,142.97,157.43。
【0080】
実施例1(ii):N−(2,3−ジヒドロベンゾフラン−7−イルメチル)−N−(2−フェノキシフェニル)アミン
【0081】
【化8】

2−アミノジフェニルエーテル(1g、5.4mmol)を2,3−ジヒドロベンゾフラン−7−カルバルデヒド(1g、7.02mmol)及びトルエン(10ml)で処理し、激しく撹拌しながら窒素雰囲気下で4時間加熱還流した。溶液は黄色で均質になった。次いで、反応物を真空中で濃縮してトルエンを除去し、0℃に冷却し、メタノール(15ml)で希釈、水素化ホウ素ナトリウム(612mg、16mmol)を少量ずつ20分かけて添加して処理した。次いで、反応物を室温まで放温し、さらに30分間撹拌した。2N塩酸(5ml)を添加し、反応物をさらに30分間撹拌した。次いで、反応物を真空中で濃縮してガム状物にし、10%炭酸カリウム水溶液(50ml)を添加した。次いで、酢酸エチル(50ml)中への抽出によって生成物を回収し、抽出液を硫酸マグネシウム上で乾燥し、真空中で濃縮してガム状物にした。ガム状物を、ペトロール中10〜30%酢酸エチルの勾配を用いて120gのシリカカラム上でクロマトグラフィー処理した。主たる急速流出画分であるN−(2,3−ジヒドロベンゾフラン−7−イルメチル)−N−(2−フェノキシフェニル)アミンをガム状物(1.2824g、4.04mmol、74.9%)として集めたが、これは静置後に結晶化した。
【0082】
1H NMR CDCl3 300MHz,δ3.19(2H,t,CH2Ph),4.35(2H,s,CH2N)4.51(2H,t,CH2O)4.87(1H,brs,NH),6.6,−7.31(12H,mArH)。
【0083】
13C NMR CDCl3,75MHz δ29.69,42.63,71.11,112.01,116.82,117.27,119.34,120.31,122.48,123.64,126.96,129.55,140.50,143.07,157.71,157.83。
【0084】
実施例1(iii):2−ブロモ−N−(2,3−ジヒドロフラン−7−イルメチル)−N−(2−フェノキシフェニル)アセトアミド
【0085】
【化9】

ジクロロメタン(10ml)中のN−(2,3−ジヒドロベンゾフラン−7−イルメチル)−N−(2−フェノキシフェニル)アミン(0.5g、1.57mmol)を0℃に冷却し、ブロモアセチルクロリド(272mg、1.73mmol)及びトリエチルアミン(175mg、1.73mmol)で処理し、窒素雰囲気下で1時間撹拌した。反応物をジクロロメタン(50ml)で希釈し、5N塩酸(20ml)で洗浄してトリエチルアミンを除去し、炭酸カリウム水溶液(20ml)で洗浄して過剰のブロモアセチルクロリドを除去した。有機層を分離し、硫酸マグネシウム上で乾燥し、高真空中で濃縮して2−ブロモ−N−(2,3−ジヒドロフラン−7−イルメチル)−N−(2−フェノキシフェニル)アセトアミド(661mg、1.51mmol、96%)を得た。
【0086】
1H NMR(CDCl3)300MHz,δ3.06(2H,m,CH2Ph),3.8(2H,d,dCH2O),4.2−4.4(2H,d,q,CH2Br)4.7,(1H,d,CHN),5.12,(1H,d,CHN),6.62−7.32(12H,m,ArH)。
【0087】
13C NMR(CDCl3)75MHz δ27.81,29.68,46.78,70.89,118.04,119.36,120.26,123.06,124.13,124.17,129.82,153.48,155.59,158.55,166.64。
【0088】
実施例2:インビボイメージング剤2用の直接標識前駆体の合成
実施例2(i):N−(ベンゾ[1,3]ジオキソール−4−イルメチル)−N−(2−フェニルオキシ−フェニル)アミン
【0089】
【化10】

2−フェノキシ−フェニルアミン(410mg、2.22mmol)と2,3−(メチレンジオキシ)ベンズアルデヒド(500mg、3.33mmol)との混合物を窒素下において90℃で2時間加熱した。反応物を0℃に冷却し、MeOH(4mL)を添加し、続いてNaBH4(253mg、6.70mmol)を少量ずつ20分かけて添加した。混合物を室温で24時間撹拌した。ギ酸(0.4mL)を添加し、混合物を15分間撹拌した。溶媒を真空中で除去し、残留物を飽和NaHCO3水溶液(50mL)で奪活し、DCM(2×30mL)で抽出し、MgSO4上で乾燥し、濾過し、真空中で溶媒を除去した。粗物質を石油スピリット(A)及び酢酸エチル(B)で溶出するシリカゲルクロマトグラフィー(5%B、80g、4.0CV、60mL/分)によって精製することで、360mg(51%)のN−(ベンゾ[1,3]ジオキソール−4−イルメチル)−N−(2−フェニルオキシ−フェニル)アミンを白色固体として得た。
【0090】
1H NMR(300MHz,CDCl3)δ4.35(2H,d,J=5.2Hz,ArCH2),4.66(1H,s,NH),5.88(2H,s,OCH2O),6.60−7.10(10H,m,ArH),7.24−7.34(2H,m,ArH)。
【0091】
実施例2(ii):N−(ベンゾ[1,3]ジオキソール−4−イルメチル)−2−ブロモ−N−(2−フェニルオキシ−フェニル)アセトアミド
【0092】
【化11】

N−(ベンゾ[1,3]ジオキソール−4−イルメチル)−N−(2−フェニルオキシ−フェニル)アミン(0.18g、0.58mmol)をDCM(4mL)に溶解した溶液に、トリエチルアミン(0.24g、2.32mmol、0.32mL)を添加した。反応物を0℃に冷却し、ブロモアセチルクロリド(0.18g、1.16mmol、0.10mL)を添加した。混合物を室温で2時間撹拌した。LC−MSは、出発原料及び生成物(1:1)を示した。さらに、トリエチルアミン(0.24g、2.32mmol、0.32mL)及びブロモアセチルクロリド(0.18g、1.16mmol、0.10mL)を添加し、室温で2時間撹拌した。溶媒を真空中で除去し、残留物を水(10mL)で奪活し、DCM(2×20mL)で抽出し、MgSO4上で乾燥し、濾過し、真空中で溶媒を除去した。粗物質をDCM(A)及びMeOH(B)で溶出するシリカゲルクロマトグラフィー(1%B、80g、2CV、60mL/分)によって精製した。不純な生成物をDCM(A)及びEtOAc(B)で溶出するシリカゲルクロマトグラフィー(1〜5%B、80g、4.5CV、60mL/分)によってさらに精製することで、120mg(47%)のN−(ベンゾ[1,3]ジオキソール−4−イルメチル)−2−ブロモ−N−(2−フェニルオキシ−フェニル)アセトアミドを無色油状物として得た。
【0093】
1H NMR(300MHz,CDCl3)δ3.76(1H,d,J=11Hz,BrCH),3.82(1H,d,J=11Hz,BrCH),4.72(1H,d,J=14Hz,ArCH),5.13(1H,d,J=14Hz,ArCH),5.63(1H,d,J=1Hz,OCHO),5.79(1H,d,J=1Hz,OCHO),6.65−7.40(12H,m,ArH)。
【0094】
LC−MS:C22H18BrNO4に関するm/z計算値,440.3;実測値,441.9(M+H)+。
【0095】
実施例3:インビボイメージング剤3用の直接標識前駆体の合成
実施例3(i):N−(2,3−ジヒドロベンゾ[1,4]ジオキシニル−5−イルメチル)−N−(2−フェノキシフェニル)アミン
【0096】
【化12】

2−アミノジフェニルエーテル(1g、5.4mmol)を2,3−ジヒドロベンゾ[1,4]ジオキシニル−5−アルデヒド(885mg、5.4mmol)及びトルエン(10ml)で処理し、激しく撹拌しながら窒素雰囲気下で4時間加熱還流した。溶液は黄色で均質になった。次いで、反応物を真空中で濃縮してトルエンを除去し、0℃に冷却し、メタノール(25ml)で希釈、絶えず撹拌しながら水素化ホウ素ナトリウム(1g、ペレット)で処理した。次いで、反応物を一晩かけて室温まで放温したところ、白色の結晶質固体が析出した。濾過によって集めた固体は、N−(2,3−ジヒドロベンゾ[1,4]ジオキシニル−5−イルメチル)−N−(2−フェノキシフェニル)アミン(1.128g、3.56mmol、66%)であった。
【0097】
1H NM RCDCl3 300MHz,δ4.16,(4H,s,CH2−Ox2),4.35(2H,d,CH2N),4.68(1H,t,NH),6.6−7.1(10H,mArH),7.29,(2H,t,ArH)。
【0098】
13C NMR CDCl3,75MHz,δ42.6,64.06,64.21,112.18,116.25,117.09,119.57,120.62,120.79,124.97,128.00,129.58,140.55,141.00,142.97,143.33,157.78。
【0099】
実施例3(ii):N−(2,3−ジヒドロベンゾ[1,4]ジオキシニル−5−イルメチル)−2−ブロモ−N−(2−フェノキシフェニル)アセトアミド
【0100】
【化13】

ジクロロメタン(20ml)中のN−(2,3−ジヒドロベンゾ[1,4]ジオキシン−5−イルメチル)−N−(2−フェノキシフェニル)アミン(純粋)(0.5g、1.5mmol)を、ブロモアセチルクロリド(259mg、1.65mmol)及びトリエチルアミン(168mg、1.65mmol)により0℃で1時間処理した。次いで、反応物をジクロロメタン(50ml)で希釈し、2N塩酸(20ml)で洗浄してトリエチルアミンを除去し、10%炭酸カリウム水溶液で洗浄して過剰のブロモアセチルクロリドを除去した。有機層を分離し、硫酸マグネシウム上で乾燥し、高真空中で濃縮して2−ブロモ−N−(2,3−ジヒドロベンゾ[1,4]ジオキシニル−5−イルメチル)−N−(2−フェノキシフェニル)アセトアミド(637mg、1.40mmol、93%)を得た。
【0101】
1H NMR CDCl3,300MHz,δ3.77(2H,dd,CH2Br),3.85−4.2(4H,m,CH20x2),4.75 and 5.15(1H,d,together CH2N),6.65−7.4(12H,m,ArH)。
【0102】
13C NMR CDCl3 75MHz,δ27.77,46.08,63.95,64.02,116.68,119.39,120.66,122.97,123.00,124.78,124.28,124.70,129.50,129.90,130.40,131.00141.98,143.16,153.58,155.50,166.53。
【0103】
実施例4:インビボイメージング剤4用の直接標識前駆体の合成
実施例4(i):N−(2,2−ジメチル−2,3−ジヒドロベンゾフラン−7−イルメチル)−N−(2−フェノキシフェニル)アミン
【0104】
【化14】

2−フェノキシ−フェニルアミン(350mg、1.89mmol)と2,2−ジメチル−2,3−ジヒドロ−1−ベンゾフラン−7−カルバルデヒド(500mg、2.83mmol)との混合物を窒素下において90℃で2時間加熱した。反応物を0℃に冷却し、MeOH(4mL)を添加し、続いてNaBH4(216mg、5.70mmol)を少量ずつ20分かけて添加した。混合物を室温で24時間撹拌した。ギ酸(0.4mL)を添加し、混合物を15分間撹拌した。溶媒を真空中で除去し、残留物を飽和NaHCO3水溶液(50mL)で奪活し、DCM(2×30mL)で抽出し、MgSO4上で乾燥し、濾過し、真空中で溶媒を除去した。粗物質を石油スピリット(A)及び酢酸エチル(B)で溶出するシリカゲルクロマトグラフィー(5〜10%B、80g、3CV、60mL/分)によって精製することで、560mg(86%)のN−(2,2−ジメチル−2,3−ジヒドロベンゾフラン−7−イルメチル)−N−(2−フェノキシフェニル)アミンを無色油状物として得た。
【0105】
1H NMR(300MHz,CDCl3)δ1.43(6H,s,C(CH3)2),2.98(2H,s,ArCH2),4.32(2H,s,NCH2),4.79(1H,s,NH),6.60−7.10(10H,m,ArH),7.30(2H,m,ArH)。
【0106】
実施例4(ii):2−ブロモ−N−(2,2−ジメチル−2,3−ジヒドロベンゾフラン−7−イルメチル)−N−(2−フェノキシフェニル)アセトアミド
【0107】
【化15】

N−(2,2−ジメチル−2,3−ジヒドロベンゾフラン−7−イルメチル)−N−(2−フェノキシフェニル)アミン(0.20g、0.58mmol)をDCM(2mL)に溶解した溶液に、トリエチルアミン(0.24g、2.32mmol、0.32mL)を添加した。反応物を0℃に冷却し、ブロモアセチルクロリド(0.18g、1.16mmol、0.10mL)を添加した。混合物を室温で2時間撹拌した。LC−MSは、出発原料及び生成物(1:1)を示した。さらに、トリエチルアミン(0.24g、2.32mmol、0.32mL)及びブロモアセチルクロリド(0.18g、1.16mmol、0.10mL)を添加し、室温で2時間撹拌した。溶媒を真空中で除去し、残留物を水(10mL)で奪活し、DCM(2×20mL)で抽出し、MgSO4上で乾燥し、濾過し、真空中で溶媒を除去した。粗物質を石油スピリット(A)及びEtOAc(B)で溶出するシリカゲルクロマトグラフィー(30%B、80g、2.5CV、60mL/分)によって精製した。不純な生成物をDCM(A)及びEtOAc(B)で溶出するシリカゲルクロマトグラフィー(1〜5%B、80g、5CV、60mL/分)によってさらに精製することで、170mg(63%)の2−ブロモ−N−(2,2−ジメチル−2,3−ジヒドロベンゾフラン−7−イルメチル)−N−(2−フェノキシフェニル)アセトアミドを無色油状物として得た。
【0108】
1H NMR(300MHz,CDCl3)δ1.14(3H,s,CH3),1.31(3H,s,CH3),2.83(1H,d,J=15Hz,ArCH),2.90(1H,d,J=15Hz,ArCH),3.74(1H,d,J=11Hz,BrCH),3.80(1H,d,J=11Hz,BrCH),4.59(1H,d,J=14Hz,NCH),5.22(1H,d,J=14Hz,NCH),6.65−7.40(12H,m,ArH)。
【0109】
LC−MS:C25H24BrNO3に関するm/z計算値,466.4;実測値,467.9(M+H)+。
【0110】
実施例5:インビボイメージング剤1〜4を得るための実施例1〜4の前駆体化合物の放射性フッ素化
5(i):[18F]フッ化物イオンの乾燥
15μlの水中に供給された18F−フッ化物イオンに、さらに200μlの水を添加し、COC容器内にフッ化物イオンを吸引した。0.5mlのアセトニトリル及び0.1M炭酸水素カリウム溶液(50μl、5×10-6モル)に溶解したKryptofix(2mg、5.3×10-6モル)の存在下で、18F−フッ化物イオンを窒素流下において110℃で30分間乾燥した(長いタップを開いた場合には、0.3L/分で約20分間、続いて0.1L/分で乾燥した)。スプラッシングの危険がもはや無くなったら流量を0.5L/分に高め(約10分間)、次いで室温に冷却した。
【0111】
5(ii):放射性フッ素化
段階5(i)で得られた乾燥残留物に、1mlのアセトニトリルに溶解した0.7mgの特定前駆体化合物を添加し、反応物を密封系中において100℃で10分間加熱した。冷却後、反応混合物をN46バイアルに移し、COCバイアルを1.5mlの水で洗浄した。洗液を同じガラスバイアルに移した。(全量が約2.5mlである)調製物を分取HPLC上に引き取り、HPLCカットを約15mlの水で希釈した後、(2.5mlのエタノール及び5mlの水でプレコンディショニングを施した)Sep−Pak tC18 light上に装填した。次いで、Sep−Pakを0.5mlのエタノールで溶出し(P6バイアル中に集めた)、続いて4.6mlのダルベッコリン酸緩衝食塩水で溶出した(同じP6バイアル中に集めた)。HPLCによってRCPを測定した。
【0112】
実施例6:インビボイメージング剤1に対する非放射性標準の合成
実施例6(i):N−(2,3−ジヒドロベンゾフラン−7−イルメチル)−2−フルオロ−N−(2−フェノキシフェニル)アセトアミド
【0113】
【化16】

DCM(20ml)中のN−(2,3−ジヒドロベンゾフラン−7−イルメチル)−N−(2−フェノキシフェニル)アミン(0.5g、1.78mmol)を、フルオロアセチルクロリド(199mg、1.96mmol)及びTEA(199mg、1.96mmol)により0℃で1時間処理した。次いで、反応物をDCM(50ml)で希釈し、2N塩酸(20ml)で洗浄してTEAを除去し、10%炭酸カリウム水溶液で洗浄してフルオロアセチルクロリドを除去した。有機層を分離し、硫酸マグネシウム上で乾燥し、高真空中で濃縮してN−(2,3−ジヒドロベンゾフラン−7−イルメチル)−2−フルオロ−N−(2−フェノキシフェニル)アセトアミド(455mg、1.61mmol、91%)を得た。
【0114】
1H NMR CDCl3中,300mHz,δ2.9−3.13(2H,m,CH2Ph),4.22 and 4.38(1H,q,together CH2O),4.7 and 4.9(1H,q,together CH2F),4.8 and 5.1(1H,d,together CH2N),6.63−7.5(12H,m,ArH)。
【0115】
13C NMR CDCl3中,75MHz,δ26.73,43,31,68.03,77.00,114.00,115.00116.39,117.32,120.23,121.34,124.00,126.36,126.94,127.45,150.84,152.58,155.76,164.11,164.38。
【0116】
実施例7:インビボイメージング剤2に対する非放射性標準の合成
実施例7(i):N−(ベンゾ[1,3]ジオキソール−4−イルメチル)−2−フルオロ−N−(2−フェニルオキシ−フェニル)アセトアミド
【0117】
【化17】

N−(ベンゾ[1,3]ジオキソール−4−イルメチル)−N−(2−フェニルオキシ−フェニル)アミン(0.16g、0.50mmol)をDCM(2mL)に溶解した溶液に、TEA(0.20g、2.00mmol、0.28mL)を添加した。反応物を0℃に冷却し、フルオロアセチルクロリド(0.10g、1.00mmol、0.07mL)を添加した。混合物を室温で1時間撹拌した。溶媒を真空中で除去し、残留物を水(10mL)で奪活し、DCM(2×20mL)で抽出し、MgSO4上で乾燥し、濾過し、真空中で溶媒を除去した。粗物質をDCM(A)及びMeOH(B)で溶出するシリカゲルクロマトグラフィー(1〜5%B、80g、4.0CV、60mL/分)によって精製することで、120mg(47%)のN−(ベンゾ[1,3]ジオキソール−4−イルメチル)−2−フルオロ−N−(2−フェニルオキシ−フェニル)アセトアミドを黄色油状物として得た。構造は下記のNMRによって確認された。
【0118】
1H NMR(300MHz,CDCl3)δ4.67(1H,d,J=2Hz,FCH),4.83(1H,d,J=2Hz,FCH),4.74(1H,d,J=14Hz,ArCH),5.12(1H,d,J=14Hz,ArCH),5.63(1H,d,J=1Hz,OCHO),5.79(1H,d,J=1Hz,OCHO),6.66−6.88(6H,m,ArH),6.96−7.06(2H,m,ArH),7.12−7.38(4H,m,ArH)。
【0119】
19F NMR(282MHz,CDCl3)δ−226.8,−227.0,−227.2。
【0120】
LC−MS:C22H18FNO4に関するm/z計算値,379.4;実測値,380.1(M+H)+。
【0121】
実施例8:インビボイメージング剤3に対する非放射性標準の合成
実施例8(i):2−フルオロ−N−(2,3−ジヒドロベンゾ[1,4]ジオキシニル−5−イルメチル)−N−(2−フェノキシフェニル)アセトアミド
【0122】
【化18】

DCM(20ml)中のN−(2,3−ジヒドロベンゾ[1,4]ジオキシニル−5−イルメチル)−N−(2−フェノキシフェニル)アミン(0.5g、1.5mmol)を、フルオロアセチルクロリド(168mg、1.65mmol)及びTEA(168mg、1.65mmol)により0℃で1時間処理した。次いで、反応物をDCM(50ml)で希釈し、2N塩酸(20ml)及び10%炭酸カリウム水溶液で洗浄した。有機層を分離し、硫酸マグネシウム上で乾燥し、高真空中で濃縮してガム状物にした。ガム状物を、ペトロール中15〜40%酢酸エチルの勾配を用いて120gのシリカカラム上でクロマトグラフィー処理した。主画分を集めることで、2−フルオロ−N−(2,3−ジヒドロベンゾ[1,4]ジオキシニル−5−イルメチル)−N−(2−フェノキシフェニル)アセトアミド(0.538g、1.43mmol、95%)を得た。
【0123】
1H NMR CDCl3中,300MHz,δ3.8−4.1(4H,M,CH2Ox2),4.65 and 4.81(1H,d,d,together CH2F),4.8 and 5.1(1H,d,d,together CH2N),6.6−7.4,(12Hm,ArH)。
【0124】
13C NMR CDCl3中,75MHz,δ45.2,63.72,63.83,77.41,79.75,116.58,119.16,120.41,122.98,123.00,124.16,124.30,129.00,129.74,130.00,141.91,143.05,153.71,155.23,166.49,166.75。
【0125】
実施例9:インビボイメージング剤4に対する非放射性標準の合成
実施例9(i):N−(2,2−ジメチル−2,3−ジヒドロベンゾフラン−7−イルメチル)−2−フルオロ−N−(2−フェノキシフェニル)アセトアミド
【0126】
【化19】

N−(2,2−ジメチル−2,3−ジヒドロベンゾフラン−7−イルメチル)−N−(2−フェノキシフェニル)アミン(0.20g、0.58mmol)をDCM(2mL)に溶解した溶液に、TEA(0.24g、2.32mmol、0.32mL)を添加した。反応物を0℃に冷却し、フルオロアセチルクロリド(0.11g、1.16mmol、0.08mL)を添加した。混合物を室温で1時間撹拌した。溶媒を真空中で除去し、残留物を水(10mL)で奪活し、DCM(2×20mL)で抽出し、MgSO4上で乾燥し、濾過し、真空中で溶媒を除去した。粗物質をDCM(A)及びMeOH(B)で溶出するシリカゲルクロマトグラフィー(1%B、80g、2CV、60mL/分)によって精製することで、170mg(72%)のN−(2,2−ジメチル−2,3−ジヒドロベンゾフラン−7−イルメチル)−2−フルオロ−N−(2−フェノキシフェニル)アセトアミドを淡黄色油状物として得た。
1H NMR(300MHz,CDCl3)δ1.12(3H,s,CH3),1.30(3H,s,CH3),2.83(1H,d,J=15Hz,ArCH),2.90(1H,d,J=15Hz,ArCH),4.58(1H,d,J=14Hz,NCH),4.65(1H,s,FCH),4.81(1H,s,FCH),5.22(1H,d,J=14Hz,NCH),6.65−7.40(12H,m,ArH)。
【0127】
19F NMR(282MHz,CDCl3)δ−226.6,−226.8,−227.0。
【0128】
LC−MS:C25H24FNO3に関するm/z計算値,405.5;実測値,406.1(M+H)+。
【0129】
実施例10:インビトロ効力アッセイ
Le Fur et al(Life Sci.1983;USA 33:449−57)の方法を改変した方法を用いて、PBRに対する親和性のスクリーニングを行った。試験した化合物は、PBR06及びインビボイメージング剤1〜4であった。
【0130】
(1%DMSOを含む50mMトリス−HCl、pH7.4、10mM MgCl2に溶解した)各試験化合物を、ウィスター系ラットの心臓PBRとの結合に関して0.3nM[3H]PK−11195と競合させた。反応は50mMトリス−HCl、pH7.4、10mM MgCl2中において25℃で15分間実施した。
【0131】
各試験化合物のスクリーニングは、推定Kiの周辺の300倍の濃度範囲にわたる6種の濃度で行った。PBR06及びインビボイメージング剤1〜4に関するKi値は、それぞれ0.28nM、0.31nM、2.03nM、1.14nM及び2.66nMであることが判明した。
【0132】
実施例11:インビボ体内分布方法
(Briard et al,J Med Chem 2009;52:688−699に従って合成した)PBR06及びインビボイメージング剤1〜3をインビボ体内分布モデルで試験し、それぞれの体内分布を比較した。
【0133】
成体雄ウィスター系ラット(200〜300g)に、側尾静脈を通して1〜3MBqの試験化合物を注射した。注射から2分後、10分後、30分後又は60分後(n=3)に、ラットを安楽死させ、γ線カウンター上での放射能測定のために組織又は体液の試料を採取した。
【0134】
図1〜3は、OBへのPBR06及びそれぞれインビボイメージング剤1〜3の取込み比を線条体への取込み比と比較して示している。
【0135】
実施例12:代謝アッセイ
試験インビボイメージング剤の注射から60分後に、成体雄ウィスター系ラット(200〜300g)から脳組織試料を採取した。次いで、これらの試料を溶剤抽出(下記参照)によって処理することで、HPLCへの導入前に18F標識母体を18F標識代謝産物と共に抽出した。
【0136】
(小脳+橋・延髄を除いた)脳を10mlの氷冷アセトニトリルと共に(5000rpmで5分間)ホモジナイズすることで、すべての18F標識化学種を抽出した。次いで、得られた上澄み液を(40℃での回転蒸発によって)蒸発乾固し、2.5mlの移動相中に濃縮し、濾過し、1mlをHPLCに注入した。
【0137】
18F分析用のHPLC装置を二重BGO放射線&UV検出器に連結した。7.8×300mm、10μm、125Åの寸法を有するμBondapak C18分取カラムを使用した。30〜40%の水及び60〜70%のアセトニトリルを用いるイソクラティック溶出系を使用した。流量は3ml/分であった。各試験インビボイメージング剤ごとに水性相/有機相比を変化させることで、10分±2分又はその付近の保持時間で母体ピークを得た。
【0138】
注射から60分後において、インタクトな試験化合物を表す脳内放射能の百分率は、PBR06及びインタクトイメージング剤1〜3についてそれぞれ90%、93%、92%及び82%であった。
【特許請求の範囲】
【請求項1】
次の式Iのインビボイメージング剤。
【化1】

式中、
A1は−CR1R2−(CH2)n−(式中、R1及びR2は水素、フルオロ及びC1-3アルキルから独立に選択され、nは0、1又は2である。)であって、
A2は−CH2−、−O−又は−O−CH2−であるか、或いは
−A1−A2は−CH=CH−である。
【請求項2】
A1が−CR1R2−(CH2)n−である、請求項1記載のインビボイメージング剤。
【請求項3】
A1が−(CH2)m−(式中、mは1、2又は3である。)である、請求項2記載のインビボイメージング剤。
【請求項4】
mが1又は2である、請求項3記載のインビボイメージング剤。
【請求項5】
A2が−CH2−又は−O−である、請求項1乃至請求項4のいずれか1項記載のインビボイメージング剤。
【請求項6】
請求項1乃至請求項5のいずれか1項記載のインビボイメージング剤の製造方法であって、18Fの適当な供給源を次の式IIの前駆体化合物と反応させる段階を含む方法。
【化2】

式中、A1及びA2は請求項1乃至請求項5の式Iのインビボイメージング剤に関して定義した通りであり、LGは脱離基である。
【請求項7】
LGがクロリド、ブロミド、ヨージド、トシレート、メシレート及びトリフレートから選択される、請求項6記載の方法。
【請求項8】
前記18Fの適当な供給源が[18F]フッ化物である、請求項6又は請求項7記載の方法。
【請求項9】
当該方法が自動化される、請求項6乃至請求項8のいずれか1項記載の方法。
【請求項10】
請求項6乃至請求項9のいずれか1項記載の方法で定義される前駆体化合物。
【請求項11】
請求項1乃至請求項5のいずれか1項記載のインビボイメージング剤を、哺乳動物への投与に適した形態の生体適合性キャリヤーと共に含む放射性医薬組成物。
【請求項12】
請求項6乃至請求項9のいずれか1項記載の方法を実施するためのキットであって、密封容器内に請求項10記載の前駆体化合物を含むキット。
【請求項13】
請求項9記載の方法を実施するためのカセットであって、
(i)請求項10記載の前駆体化合物を含む容器と、
(ii)請求項6又は請求項8に記載された18Fの適当な供給源を用いて容器を溶出するための手段と
を備えるカセット。
【請求項14】
さらに、
(iii)過剰の18Fを除去するためのイオン交換カートリッジ
を備える、請求項13記載のカセット。
【請求項15】
被験体におけるPBR発現の分布及び/又は程度を決定するためのインビボイメージング方法であって、
(i)請求項1乃至請求項5のいずれか1項記載のインビボイメージング剤を予め投与しておいた被験体を用意する段階、
(ii)前記インビボイメージング剤を前記被験体内のPBRに結合させる段階、
(iii)前記インビボイメージング剤の18Fから放出される信号をインビボイメージング技法によって検出する段階、
(iv)前記信号の位置及び/又は量を表す画像を生成する段階、並びに
(v)前記被験体におけるPBR発現の分布及び程度を決定する段階であって、前記発現は前記インビボイメージング剤から放出される前記信号と直接に相関している段階
を含むインビボイメージング方法。
【請求項16】
前記被験体に関する治療計画の進行中に繰り返して実施される請求項15記載のインビボイメージング方法であって、前記計画がPBR状態と戦うための薬物の投与を含むインビボイメージング方法。
【請求項17】
前記被験体がPBR状態に罹患しているか否かを診断するためにPBR発現の分布及び程度を帰因させる追加段階(vi)を含む、請求項15記載のインビボイメージング方法。
【請求項18】
請求項17記載のインビボイメージング方法で使用するための、請求項1乃至請求項5のいずれか1項記載のインビボイメージング剤。
【請求項19】
請求項15乃至請求項18のいずれか1項記載のインビボイメージング方法で使用するための請求項11記載の放射性医薬組成物を製造するための、請求項1乃至請求項5のいずれか1項記載のインビボイメージング剤。
【請求項1】
次の式Iのインビボイメージング剤。
【化1】

式中、
A1は−CR1R2−(CH2)n−(式中、R1及びR2は水素、フルオロ及びC1-3アルキルから独立に選択され、nは0、1又は2である。)であって、
A2は−CH2−、−O−又は−O−CH2−であるか、或いは
−A1−A2は−CH=CH−である。
【請求項2】
A1が−CR1R2−(CH2)n−である、請求項1記載のインビボイメージング剤。
【請求項3】
A1が−(CH2)m−(式中、mは1、2又は3である。)である、請求項2記載のインビボイメージング剤。
【請求項4】
mが1又は2である、請求項3記載のインビボイメージング剤。
【請求項5】
A2が−CH2−又は−O−である、請求項1乃至請求項4のいずれか1項記載のインビボイメージング剤。
【請求項6】
請求項1乃至請求項5のいずれか1項記載のインビボイメージング剤の製造方法であって、18Fの適当な供給源を次の式IIの前駆体化合物と反応させる段階を含む方法。
【化2】

式中、A1及びA2は請求項1乃至請求項5の式Iのインビボイメージング剤に関して定義した通りであり、LGは脱離基である。
【請求項7】
LGがクロリド、ブロミド、ヨージド、トシレート、メシレート及びトリフレートから選択される、請求項6記載の方法。
【請求項8】
前記18Fの適当な供給源が[18F]フッ化物である、請求項6又は請求項7記載の方法。
【請求項9】
当該方法が自動化される、請求項6乃至請求項8のいずれか1項記載の方法。
【請求項10】
請求項6乃至請求項9のいずれか1項記載の方法で定義される前駆体化合物。
【請求項11】
請求項1乃至請求項5のいずれか1項記載のインビボイメージング剤を、哺乳動物への投与に適した形態の生体適合性キャリヤーと共に含む放射性医薬組成物。
【請求項12】
請求項6乃至請求項9のいずれか1項記載の方法を実施するためのキットであって、密封容器内に請求項10記載の前駆体化合物を含むキット。
【請求項13】
請求項9記載の方法を実施するためのカセットであって、
(i)請求項10記載の前駆体化合物を含む容器と、
(ii)請求項6又は請求項8に記載された18Fの適当な供給源を用いて容器を溶出するための手段と
を備えるカセット。
【請求項14】
さらに、
(iii)過剰の18Fを除去するためのイオン交換カートリッジ
を備える、請求項13記載のカセット。
【請求項15】
被験体におけるPBR発現の分布及び/又は程度を決定するためのインビボイメージング方法であって、
(i)請求項1乃至請求項5のいずれか1項記載のインビボイメージング剤を予め投与しておいた被験体を用意する段階、
(ii)前記インビボイメージング剤を前記被験体内のPBRに結合させる段階、
(iii)前記インビボイメージング剤の18Fから放出される信号をインビボイメージング技法によって検出する段階、
(iv)前記信号の位置及び/又は量を表す画像を生成する段階、並びに
(v)前記被験体におけるPBR発現の分布及び程度を決定する段階であって、前記発現は前記インビボイメージング剤から放出される前記信号と直接に相関している段階
を含むインビボイメージング方法。
【請求項16】
前記被験体に関する治療計画の進行中に繰り返して実施される請求項15記載のインビボイメージング方法であって、前記計画がPBR状態と戦うための薬物の投与を含むインビボイメージング方法。
【請求項17】
前記被験体がPBR状態に罹患しているか否かを診断するためにPBR発現の分布及び程度を帰因させる追加段階(vi)を含む、請求項15記載のインビボイメージング方法。
【請求項18】
請求項17記載のインビボイメージング方法で使用するための、請求項1乃至請求項5のいずれか1項記載のインビボイメージング剤。
【請求項19】
請求項15乃至請求項18のいずれか1項記載のインビボイメージング方法で使用するための請求項11記載の放射性医薬組成物を製造するための、請求項1乃至請求項5のいずれか1項記載のインビボイメージング剤。
【図3】


【図1】


【図2】




【図1】


【図2】


【公表番号】特表2013−514319(P2013−514319A)
【公表日】平成25年4月25日(2013.4.25)
【国際特許分類】
【出願番号】特願2012−543742(P2012−543742)
【出願日】平成22年12月16日(2010.12.16)
【国際出願番号】PCT/EP2010/069866
【国際公開番号】WO2011/073304
【国際公開日】平成23年6月23日(2011.6.23)
【出願人】(305040710)ジーイー・ヘルスケア・リミテッド (99)
【Fターム(参考)】
【公表日】平成25年4月25日(2013.4.25)
【国際特許分類】
【出願日】平成22年12月16日(2010.12.16)
【国際出願番号】PCT/EP2010/069866
【国際公開番号】WO2011/073304
【国際公開日】平成23年6月23日(2011.6.23)
【出願人】(305040710)ジーイー・ヘルスケア・リミテッド (99)
【Fターム(参考)】
[ Back to top ]

