コンパートメント化スクリーニングによる選択
【課題】新薬開発のためのリードとして機能できる分子の大きなレパートリーをスクリーニングすることを可能とする。
【解決手段】生化学系の標的成分に結合する、または標的の活性をモジュレートさせる化合物を識別するための方法であって、a)任意の1つのマイクロカプセルにおいてレパートリーのサブセットのみが複数のコピーで示されるように、化合物を標的と一緒にマイクロカプセルにコンパートメント化するステップと;b)標的に結合する、または標的の活性をモジュレートさせる化合物を識別するステップとを含む方法。本発明は、新薬開発のためのリードとして機能できる分子の大きなレパートリーをスクリーニングすることを可能とする。
【解決手段】生化学系の標的成分に結合する、または標的の活性をモジュレートさせる化合物を識別するための方法であって、a)任意の1つのマイクロカプセルにおいてレパートリーのサブセットのみが複数のコピーで示されるように、化合物を標的と一緒にマイクロカプセルにコンパートメント化するステップと;b)標的に結合する、または標的の活性をモジュレートさせる化合物を識別するステップとを含む方法。本発明は、新薬開発のためのリードとして機能できる分子の大きなレパートリーをスクリーニングすることを可能とする。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、マイクロカプセルのスクリーニングにより化合物のライブラリから1以上の化合物を選択する方法に関する。本発明の方法は、特にいずれか所望の薬物標的に対する潜在的活性について候補薬物などの低分子量化合物の選択に適用できる。
【背景技術】
【0002】
本発明は、生化学的系における標的成分に結合するか、標的の活性をモジュレートする分子の識別に使用される方法に関する。
【0003】
過去10年間に渡り、化合物ライブラリのハイスループットスクリーニング(HTS)は医薬品研究の基礎となる技術となった。HTSの研究は盛んである。現在の推定では生物学的スクリーニングおよび前臨床の薬理学的試験のみで医薬品産業の総研究開発(R&D)経費の〜14%を計上する(Handen,Summer 2002)。運転コストを低減し、スクリーニングできる化合物および標的の数を増大させる必要性からHTSは近年顕著な進歩を示している。従来の96穴のプレートは現在では384ウェル、1536ウェル、さらには3456ウェルのフォーマットに大部分が置き換えられている。これが市販のプレート操作ロボット工学と組み合わせられて、一日当たり100,000試験以上のスクリーニングを可能とし、試験の小型化により試験当たりのコストを大幅に削減している。
【0004】
HTSは他の数種の開発により補完されている。コンビナトリアル化学は、HTSのための構造的に関連する多数の化合物を生成するための強力な技術である。現在、コンビナトリアル合成は大部分が空間的に分割されたパラレル合成を採用している。合成できる化合物の数は数百または数千に限定されるが、化合物は数ミリグラムまたは数十ミリグラムの規模で合成でき、完全な特性決定、さらには精製まで可能にする。より大型のライブラリは1ビーズ1化合物ライブラリを生成させるビーズ上のスプリット合成を用いて合成できる。この方法が採用されている範囲がはるかに狭小である理由は、一連の制約事項:例えば固相合成の必要性;最終生成物の特性決定の困難(シェア数と小規模のため);1回または2,3回の試験にしか十分でない程度の少量の、ビーズ上の化合物;ヒット化合物の構造の同定の困難(タグ付けまたはコード方法に依存する場合が多く、合成および分析の両方を複雑化させる)である。これにもかかわらず、スプリット合成およびシングルビーズ分析はなお信頼できるものである。最近、ミニチュア化されたスクリーニングおよびシングルビーズ分析における多大な開発が行われた。例えば、印刷技術によりタンパク質結合試験が、各1nl容量の10,800化合物スポットを含むスライド上で実施できるようになった(Hergenrother et al.,2000)。しかしながらコンビケムは限定された数量のリード化合物しか与えていない。2000年4月の段階で、コンビナトリアル化学のヒストリを有する化合物僅か10種のみが臨床研究に付され、これらの3種を除き全てが(オリゴ)ヌクレオチドまたはペプチドである(Adang and Hermkens,2001)。実際、過去10年間のHTSおよびコンビナトリアル化学における多大なる投資にもかかわらず、年間導入される新規薬剤の数が一定以上となることはない。
【0005】
ダイナミックコンビナトリアル化学(DCC)もまた可逆的に相互交換可能な成分のセットからダイナミックコンビナトリアルライブラリ(DCL)を生成するために使用できるが、今日まで生成されスクリーニングされたライブラリのサイズはなおかなり限定されている(≦40,000)(Ramstron and Lehn,2002)。
【0006】
試験のための候補分子のサブセットを識別するためにコンピューター試行を用いて多数の化合物ベースを検索する仮想スクリーニング(VS)(Lyne,2002)もまたHTSと統合されれば極めて有用である。しかしながら、VSおよびHTSの性能を直接比較した試験は今日までほとんど無く、更なる検証が必要である。
【0007】
これら全ての開発にもかかわらず、現在のスクリーニングのスループットはなお十分とは程遠いものである。ヒトゲノムの個体遺伝子の数(〜30,000)および既存の化学を用いて理論的に得られる独特の化学構造の数の現在の推定値によれば、全ての考えられる治療標的に対して構造−活性スペースを完全にマッピングするためには多大な数の試験が必要となることが示唆され得る(Burbaum,1998)。
【0008】
従って、僅か数フェムトリットルの反応容量を用いながら、極めて低コストで多大な数量(1010)の化合物を迅速にスクリーニングすることを許容する方法の提供は、新薬の手がかりを得る際に多大な有用性を有するであろう。
【0009】
Tawfik and Griffiths(1998)、およびPCT国際特許出願第GB98/01889号は、分子レベルで遺伝子型および表現型に関連するための、マイクロカプセル内のコンパートメント化を用いるインビトロでの進化のための系について記載している。Tawfik and Griffiths(1998)、およびPCT国際特許出願第GB98/01889号の幾つかの実施形態では、遺伝子産物の所望の活性はそれをコードする(そして、同一マイクロカプセル内に存在する)遺伝子エレメントの修飾を生じさせる。修飾された遺伝子エレメントは次に、その後のステップにおいて選択できる。
【先行技術文献】
【非特許文献】
【0010】
・Adang, A. E., and Hermkens, P. H. (2001). The contribution of combinatorial chemistry to lead generation: an interim analysis. Curr Med Chem 8, 985-998.
・Anderson, J. E. (1993). Restriction endonucleases and modification methylases. Curr Op Struct Biol 3, 24-30.
・Becher, P. (1957) Emulsions: theory and practice. Reinhold, New York.
・Benita, S. (ed.). (1996) Microencapsulation: methods and industrial applications. Marcel Dekker, New York.
・Bernath, K., Hai, M., Mastrobattista, E., Griffiths, A.D., Magdassi, S. and Tawfik, D.S. (2004) In vitro compartmentalization by double emulsions: sorting and gene enrichment by fluorescence activated cell sorting. Anal Biochem, 325, 151-157.
・Bru, R. and Walde, P. (1991) Product inhibition of alpha-chymotrypsin in reverse micelles. Eur J Biochem, 199, 95-103.
・Bru, R. and Walde, P. (1993) Catalytic activity of elastase in reverse micelles. Biochem Mol Biol Int, 31, 685-692.
・Burbaum, J. (1998). Miniaturization technologies in HTS: how fast, how small, how soon? Drug Discov Today 3, 313-322.
・Calvert, P. (2001) Inkjet printing for materials and devices. Chem. Mater., 13, 3299-3305.
・Chakrabarti, A.C., Breaker, R.R., Joyce, G.F. and Deamer, D.W. (1994) Production of RNA by a polymerase protein encapsulated within phospholipid vesicles. J Mol Evol, 39, 555-559.
・Chang, T.M. (1987) Recycling of NAD(P) by multienzyme systems immobilized by microencapsulation in artificial cells. Methods Enzymol, 136, 67-82.
・Chang, T.M.S. (1992) Recent advances in artificial cells based on microencapsulation. In Donbrow, M. (ed.), Microcapsules and nanoparticles in medicine and pharmacy. CRC Press, Boca Raton, Florida, pp. 323-339.
・Creagh, A.L., Prausnitz, J.M. and Blanch, H.W. (1993) Structural and catalytic properties of enzymes in reverse micelles. Enzyme Microb Technol, 15, 383-392.
・Curran, D.P. (1998) Strategy-level separations in organic synthesis: from planning to practice. Angew Chem Int Ed, 37, 1174-1196.
・Czarnik, A. W. (1997). Encoding methods for combinatorial chemistry. Curr Opin Chem Biol 1, 60-66.
Davis, S. S., and Walker, I. M. (1987). Multiple emulsions as targetable delivery systems. Methods in Enzymology 149, 51-64.
・de Gans, B.-J., Duineveld, P.C. and Schubert, U.S. (2004) Inkjet printing of polymers: state of the art and future developments. Advanced materials, 16, 203-213.
・Dickinson, E. (1994) Emulsions and droplet size control. In Wedlock, D.J. (ed.), Controlled particle, droplet and bubble formation. Butterworth-Heinemann, Oxford, pp. 191-257.
・Doi, N., and Yanagawa, H. (1999). STABLE: protein-DNA fusion system for screening of combinatorial protein libraries in vitro. FEBS Lett 457, 227-230.
・Doman, T.N., McGovern, S.L., Witherbee, B.J., Kasten, T.P., Kurumbail, R., Stallings, W.C., Connolly, D.T. and Shoichet, B.K. (2002) Molecular docking and high-throughput screening for novel inhibitors of protein tyrosine phosphatase-1B. J Med Chem, 45, 2213-2221.
・Finch, C.A. (1993) Encapsulation and controlled release. Spec. Publ.-R. Soc. Chem., 138, 35.
・Fornusek & Vetvicka, Crit Rev Ther Drug Carrier Syst. 1986;2(2):137-74
・Fu, A.Y., Chou, H.P., Spence, C., Arnold, F.H. and Quake, S.R. (2002) An integrated microfabricated cell sorter. Anal Chem, 74, 2451-2457.
・Fulton, R.J., McDade, R.L., Smith, P.L., Kienker, L.J. and Kettman, J.R., Jr. (1997) Advanced multiplexed analysis with the FlowMetrix system. Clin Chem, 43, 1749-1756.
・Ghadessy, F.J., Ong, J.L. and Holliger, P. (2001) Directed evolution of polymerase function by compartmentalized self- replication. Proc Natl Acad Sci U S A, 98, 4552-4557.
・Gordon, K., and Balasubramanian, S. (1999). Solid phase chemistry - designer linkers for combinatorial chemistry. J Chem Technol Biotechnol 74, 835-851.
・Griffiths, A. D., Williams, S. C., Hartley, O., Tomlinson, I. M., Waterhouse, P., Crosby, W. L., Kontermann, R. E., Jones, P. T., Low, N. M., Allison, T. J., and et al. (1994). Isolation of high affinity human antibodies directly from large synthetic repertoires. Embo J 13, 3245-3260.
・Griffiths, A.D. and Tawfik, D.S. (2003) Directed evolution of an extremely fast phosphotriesterase by in vitro compartmentalization. Embo J, 22, 24-35.
・Guixe et al., Ligand-induced conformational transitions in Escherichia coli phosphofructokinase 2: evidence for an allosteric site for MgATP2-.
Biochemistry. 1998 Sep 22;37(38):13269-75.
・Haber, J., Maslakiewicz, P., Rodakiewicz, N.J. and Walde, P. (1993) Activity and spectroscopic properties of bovine liver catalase in sodium bis(2-ethylhexyl)sulfosuccinate/isooctane reverse micelles. Eur J Biochem, 217, 567-573.
・Han, M., Gao, X., Su, J. Z., and Nie, S. (2001). Quantum-dot-tagged microbeads for multiplexed optical coding of biomolecules. Nat Biotechnol 19, 631-635.
・Han, M., Gao, X., Su, J.Z. and Nie, S. (2001) Quantum-dot-tagged microbeads for multiplexed optical coding of biomolecules. Nat Biotechnol, 19, 631-635.
・Handen, J. S. (Summer 2002). High-throughput screening - challenges for the future. Drug Discov World, 47-50.
・Harder, K. W., Owen, P., Wong, L. K., Aebersold, R., Clark-Lewis, I., and Jirik, F. R. (1994). Characterization and kinetic analysis of the intracellular domain of human protein tyrosine phosphatase beta (HPTP beta) using synthetic phosphopeptides. Biochem J 298 ( Pt 2), 395-401.
・Haugland, R.P., (1996). Handbook of fluorescent probes and research chemicals. Spence, M.T.Z. Ed
・Heim R, Tsien RY. Engineering green fluorescent protein for improved brightness, longer wavelengths and fluorescence resonance energy transfer. Curr Biol. 1996 Feb 1;6(2):178-82.
・Hergenrother, P. J., Depew, K. P., and Schreiber, S. L. (2000). Small-molecule microarrays: covalent attachment and screening of alcohol-containing small molecules on glass slides. J Am Chem Soc 122, 7849-7850.
・Hermanson, G.T. (1996) Bioconjugate techniques. Academic Press, San Diego.
・Hildebrand, J.H. and Cochran, D.F.R. (1949) J. Am. Chem. Soc., 71, 22.
・Hochuli, E., Dobeli, H., and Schacher, A. (1987). New metal chelate adsorbent selective for proteins and peptides containing neighbouring histidine residues. J Chromatogr 411, 177-184.
・Holmes, C. P., and Jones, D. G. (1995). Reagents for combinatorial crganic synthesis: development of a new o-nitrobenzyl photolabile linker for solid phase synthesis. J Org Chem 60, 2318-2319.
・Hudlicky, M. (1992) Chemistry of Organic Fluorine Compounds. Ellis Horwood, New York.
・Johannsson, A. (1991). Heterogeneous enzyme immunoassays. In Principles and practice of immunoassays, C. P. Price, and D. J. Newman, eds. (New York, Stockton Press), pp. 295-325.
・Johannsson, A., and Bates, D. L. (1988). Amplification by second enzymes. In ELISA and other solid phase immunoassays, D. M. Kemeny, and S. J. Challacombe, eds. (Chichester, John Wiley), pp. 85-106.
・Johnson, T. O., Ermolieff, J., and Jirousek, M. R. (2002). Protein tyrosine phosphatase 1B inhibitors for diabetes. Nature Reviews Drug Discovery 1, 696 -709.
・Keij et al., Cytometry. 1995 Mar 1;19(3):209-16
・Kerker, Cytometry. 1983 Jul;4(1):1-10
・Klug, A. (1995). Gene regulatory proteins and their interaction with DNA. Ann N Y Acad Sci 758, 143-160.
・Klug, A., and Schwabe, J. W. (1995). Protein motifs 5. Zinc fingers. Faseb J 9, 597-604.
・Krafft, M.P., Chittofrati, A. and Riess, J.G. (2003) Emulsions and microemulsions with a fluorocarbon phase. Curr. Op. Colloid Interface Sci., 8, 251-258.
・Kumar, A., Kumar, A. and Katiyar, S.S. (1989) Activity and kinetic characteristics of glutathione reductase in vitro in reverse micellar waterpool. Biochim Biophys Acta, 996, 1-6.
・Lee, Y.-F., Tawfik, D. S., and Griffiths, A. D. (2002). Investigating the target recognition of DNA cytosine-5 methyltransferase HhaI by library selection using in vitro compartmentalisation (IVC). Nucleic Acids Res 30, 4937-4944.
・Lim, F. (ed.). (1984) Biomedical applications of microencapsulation. CRC Press, Boca Raton, Florida.
・Lim, F. and Sun, A.M. (1980) Microencapsulated islets as bioartificial endocrine pancreas. Science, 210, 908-910.
・Link, D.R., Anna, S.L., Weitz, D.A. and Stone, H.A. (2004) Geometrically mediated breakup of drops in microfluidic devices. Phys. Rev. Letts., 92, 054503.
・Lipinski, C.A., Lombardo, F., Dominy, B.W. and Feeney, P.J. (2001) Experimental and computational approaches to estimate solubility and permeability in drug discovery and development settings. Adv Drug Deliv Rev, 46, 3-26.
・Lissant, K.J. (ed.). (1974) Emulsions and emulsion technology. Marcel Dekker, New York.
・Lissant, K.J. (ed.). (1984) Emulsions and emulsion technology. Marcel Dekker, New York.
・Lowe, K.C. (2002) Perfluorochemical respiratory gas carriers: benefits to cell culture systems. J. Fluorine Chem., 118, 19-26.
・Luisi, P.L. and B., S.-H. (1987) Activity and conformation of enzymes in reverse micellar solutions. Methods Enzymol, 136, 188-216.
・Lyne, P. D. (2002). Structure-based virtual screening: an overview. Drug Discov Today 7, 1047-1055.
・Mackenzie and Pinder, Dev Biol Stand. 1986;64:181-93.
・Mahajan NP, Linder K, Berry G, Gordon GW, Heim R, Herman B. Bcl-2 and Bax interactions in mitochondria probed with green fluorescent protein and fluorescence resonance energy transfer. Nat Biotechnol. 1998 Jun;16(6):547-52.
・Mao, Q. and Walde, P. (1991) Substrate effects on the enzymatic activity of alpha-chymotrypsin in reverse micelles. Biochem Biophys Res Commun, 178, 1105-1112.
・Mao, Q., Walde, P. and Luisi, P.L. (1992) Kinetic behaviour of alpha-chymotrypsin in reverse micelles. A stopped-flow study. Eur J Biochem, 208, 165-170.
・Masui and Kuramitsu, Probing of DNA-binding sites of Escherichia coli RecA protein utilizing 1-anilinonaphthalene-8-sulfonic acid. Biochemistry. 1998 Sep 1;37 (35): 12133 ? 43
・McDonald, J.C. and Whitesides, G.M. (2002) Poly(dimethylsiloxane) as a material for fabricating microfluidic devices. Acc Chem Res, 35, 491-499.・Menger, F.M. and Yamada, K. (1979) J. Am. Chem. Soc., 101, 6731-6734.・Meylan, W.M. and Howard, P.H. (1995) Atom/fragment contribution method for estimating octanol-water partition coefficients. J Pharm Sci, 84, 83-92.・Miyawaki A, Llopis J, Heim R, McCaffery JM, Adams JA, Ikura M, Tsien RY. Fluorescent indicators for Ca2+ based on green fluorescent proteins and calmodulin. Nature. 1997 Aug 28;388(6645):882-7.
・Mize, P. D., Hoke, R. A., Linn, C. P., Reardon, J. E., and Schulte, T. H. (1989). Dual-enzyme cascade--an amplified method for the detection of alkaline phosphatase. Anal Biochem 179, 229-235.
・Montigiani, S., Neri, G., Neri, P., and Neri, D. (1996). Alanine substitutions in calmodulin-binding peptides result in unexpected affinity enhancement. J Mol Biol 258, 6-13.
・New, R.R.C. (ed.). (1990) Liposomes: a practical approach. Oxford University Press, Oxford.
・Norman, Med Phys. 1980 Nov-Dec;7(6):609-15.
・Oberholzer, T., Albrizio, M. and Luisi, P.L. (1995) Polymerase chain reaction in liposomes. Chem Biol, 2, 677-682.
・Oberholzer, T., Wick, R., Luisi, P.L. and Biebricher, C.K. (1995) Enzymatic RNA replication in self-reproducing vesicles: an approach to a minimal cell. Biochem Biophys Res Commun, 207, 250-257.
・Obukowicz, M.G., Turner, M.A., Wong, E.Y. and Tacon, W.C. (1988) Secretion and export of IGF-1 in Escherichia coli strain JM101. Mol Gen Genet, 215, 19-25.
・Perelson, A. S., and Oster, G. F. (1979). Theoretical studies of clonal selection: minimal antibody repertoire size and reliability of self-non-self discrimination. J Theor Biol 81, 645-670.
・Perez, G.M., Sanchez, F.A. and Garcia, C.F. (1992) Application of active-phase plot to the kinetic analysis of lipoxygenase in reverse micelles. Biochem J.
・Pirrung, M. C., and Huang, C. Y. (1996). A general method for the spatially defined immobilization of biomolecules on glass surfaces using "caged" biotin. Bioconjug Chem 7, 317-321.
・Qi and Grabowski, Acid beta-glucosidase: intrinsic fluorescence and conformational changes induced by phospholipids and saposin C. Biochemistry. 1998 Aug 18;37(33):11544-54
・Ramstrom, O., and Lehn, J. M. (2002). Drug discovery by dynamic combinatorial libraries. Nat Rev Drug Discov 1, 26-36.
・Riess, J.G. (2002) Fluorous micro- and nanophases with a biomedical perspective. Tetrahedron, 58, 4113-4131.
・Rolland, J Immunol Methods. 1985 Jan 21;76(1):1-10
・Sadtler, V.M., Krafft, M.P. and Riess, J.G. (1996) Achieving stable, reverse water-in-fluorocarbon emulsions. Angew. Chem. Int. Ed. Engl., 35, 1976-1978.
・Sambrook, J., and Russell, D. W., eds. (2001). Molecular cloning: a laboratory manual (New York, Cold Spring Harbor Laboratory Press).
・Savage, M. D., Mattson, G., Desai, S., Nielander, G. W., Morgensen, S., and Conklin, E. J. (1994). Avidin-biotin chemistry: a handbook, 2 edn (Rockford, Pierce Chemical Company).
・Schick, M.J. (1966) Nonionic surfactants. Marcel Dekker, New York.
・Scott, R.L. (1948) J. Am. Chem. Soc., 70, 4090.
・Sepp, A., Tawfik, D. S., and Griffiths, A. D. (2002). Microbead display by in vitro compartmentalisation: selection for binding using flow cytometry. FEBS Letters 532, 455-458.
・Shapiro, H. M. (1995). Practical Flow Cytometry, 3 edn (New York, Wiley-Liss).
・Sherman, P. (1968) Emulsion science. Academic Press, London.
・Song, H. and Ismagilov, R.F. (2003) Millisecond kinetics on a microfluidic chip using nanoliters of reagents. J Am Chem Soc, 125, 14613-14619.
・Song, H., Tice, J.D. and Ismagilov, R.F. (2003) A microfluidic system for controlling reaction networks in time. Angew. Chem. Int. Ed. Engl., 42, 767-772.
・Stofko, H. R., Carr, D. W., and Scott, J. D. (1992). A single step purification for recombinant proteins. Characterization of a microtubule associated protein (MAP 2) fragment which associates with the type II cAMP-dependent protein kinase. Febs Lett 302, 274-278.
・Studer, A., Hadida, S., Ferritto, R., Kim, S.Y., Jeger, P., Wipf, P. and Curran, D.P. (1997) Fluorous synthesis: a fluorous-phase strategy for improving separation efficiency in organic synthesis. Science, 275, 823-826.
・Sun, A.M., Vasek, I. and Tai, I. (1992) Microencapsulation of living cells and tissues. In Donbrow, M. (ed.), Microencapsulation and nanoparticles in medicine and pharmacy. CRC Press, Boca Raton, Florida, pp. 315-322.
・Sundberg, S. A., Barrett, R. W., Pirrung, M., Lu, A. L., Kiangsoontra, B., and Holmes, C. P. (1995). Spatially-addressable immobilisation of macromolecules on solid supports. J Am Chem Soc 117, 12050-12057.
・Tawfik, D. S., and Griffiths, A. D. (1998). Man-made cell-like compartments for molecular evolution. Nat Biotechnol 16, 652-656.
・Thorsen, T., R.W., R., Arnold, F.H. and Quake, S.R. (2001) Dynamic pattern formation in a vesicle-generating microfluidic device. Phys. Rev. Letts., 86, 4163-4166.
・Tripet, B., Yu, L., Bautista, D. L., Wong, W. Y., Irvin, R. T., and Hodges, R. S. (1996). Engineering a de novo-designed coiled-coil heterodimerization domain off the rapid detection, purification and characterization of recombinantly expressed peptides and proteins. Protein Eng 9, 1029-1042.
・Umbanhowar, P.B., Prasad, V. and Weitz, D.A. (2000) Monodisperse emulsions generated via drop break off in a coflowing steam. Langmuir, 16, 347-351.
・van Hal, D.A., Bouwstra, J.A. and Junginger, H.E. (1996) Nonionic surfactant vesicles containing estradiol for topical application. In Benita, S. (ed.), Microencapsulation: methods and industrial applications. Marcel Dekker, New York, pp. 329-347.
・Voss EW Jr. Kinetic measurements of molecular interactions by spectrofluorometry. J Mol Recognit. 1993 Jun;6(2):51-8
・Walde, P., Goto, A., Monnard, P.-A., Wessicken, M. and Luisi, P.L. (1994) Oparin's reactions revisited: enzymatic synthesis of poly(adenylic acid) in micelles and self-reproducing vesicles. J. Am. Chem. Soc., 116, 7541-7547.
・Walde, P., Han, D. and Luisi, P.L. (1993) Spectroscopic and kinetic studies of lipases solubilized in reverse micelles. Biochemistry, 32, 4029-4034.
・Walde, P., Peng, Q., Fadnavis, N.W., Battistel, E. and Luisi, P.L. (1988) Structure and activity of trypsin in reverse micelles. Eur J Biochem, 173, 401-409.
・Whateley, T.L. (1996) Microcapsules: preparation by interfacial polymerisation and interfacial complexation and their applications. In Benita, S. (ed.), Microencapsulation: methods and industrial applications. Marcel Dekker, New York, pp. 349-375.
・Wick, R. and Luisi, P.L. (1996) Enzyme-containing liposomes can endogenously produce membrane-constituting lipids. Chem Biol, 3, 277-285.
・Zhang, Z. Y., Thieme-Sefler, A. M., Maclean, D., McNamara, D. J., Dobrusin, E. M., Sawyer, T. K., and Dixon, J. E. (1993). Substrate specificity of the protein tyrosine phosphatases. Proc Natl Acad Sci U S A 90, 4446-4450.
【発明の概要】
【0011】
我々は、Griffiths & Tawfik(1998)の記載に基づくコンパートメント化されたマイクロカプセル系を用いて、遺伝子エレメントによってコードされない化合物を選択するための方法を開発した。本発明による新規方法は、現代的HTSアプローチと適合する形で、低コストで標的に対する活性を有する化合物の迅速なハイスループットスクリーニングを可能とする。
【0012】
第1の態様では、レパートリーの化合物中において、所望の活性を有する1以上の化合物を識別する方法であって、
a)任意の1つのマイクロカプセルにおいて、レパートリーのサブセットのみが複数のコピーで示されるように、化合物をマイクロカプセルにコンパートメント化するステップと;
b)所望の活性を有する化合物を識別するステップと
を含む方法が提供される。
【0013】
好ましくは、所望の活性は標的の結合活性および活性のモジュレーションからなる群より選択される。標的は、好ましくは化合物と一緒にマイクロカプセル中にコンパートメント化され、標的および化合物を一緒に結合するマイクロカプセル中において標的上の化合物の活性を測定することを可能とする。
【0014】
好ましくは、任意の1つのマイクロカプセル中に存在するレパートリーのサブセットは単一化合物である。各マイクロカプセルは、有益には単一化合物の複数のコピーであるレパートリーのサブセットの複数分子を含有する。
【0015】
1以上の化合物は、本発明にかかるスクリーニングするステップにより、化合物を含有するマイクロカプセルの変化についてスクリーニングできる。好ましい実施形態では、マイクロカプセルはそれらの光学特性を変化させるなどの化合物の作用によって修飾される。
【0016】
マイクロカプセルの光学特性の変化は、標的に結合したときの化合物の光学特性の変化または化合物が結合したときの標的の光学特性の変化に起因してもよい。さらに、マイクロカプセルの光学特性の変化は、結合したときの標的および化合物両方の光学特性の変化に起因してもよい。
【0017】
マイクロカプセルの光学特性の変化は、化合物による標的の活性のモジュレーションに起因する可能性がある。化合物は、標的の活性を活性化または阻害することがある。例えば、標的が酵素である場合、基質と標的によって触媒された反応の生成物とは相違する光学特性を有する可能性がある。好ましくは、基質および生成物は相違する蛍光特性を有する。
【0018】
マイクロカプセル内で検出された変化は、化合物の直接的作用によって、または一連の反応(そのうちの1つ以上が所望の活性を有する化合物に関連する)により検出される変化が引き起こされる間接的作用によって引き起こされる可能性があると理解されたい。
【0019】
マイクロカプセルの1以上の化合物は、質量分析法、化学タグ付け法または光学タグ付け法を含む、当業者によく知られている様々な技術を用いて識別できる。好ましくは、化合物は、マイクロカプセルおよびその中に含有される化合物の識別を可能とする光学標識マイクロカプセル内に含有される。
【0020】
好ましくは、マイクロカプセルは、それらの蛍光の変化を検出することによって分析される。例えば、マイクロカプセルはフローサイトメトリーによって分析することができ、そして蛍光活性化セルソーター(FACS)を用いて任意に分類できる。標的および生成物の相違する蛍光特性は、蛍光共鳴エネルギー転移(FRET)に起因してもよい。
【0021】
また別の実施形態では、マイクロカプセルの内部環境は1以上の試薬を油相へ添加することによって修飾できる。これは、必要であれば、反応中に試薬がマイクロカプセル内に拡散するのを可能とする。
【0022】
本発明の好ましい形態によると、1以上の化合物は、化合物もしくはその誘導体の活性(全体としてマイクロカプセルを検出可能にする)にしたがってスクリーニングできる。したがって、本発明は、所望の活性を有する化合物が、マイクロカプセルの変化、またはマイクロカプセル内の1つ以上の分子の修飾(これらが、化合物を含有するマイクロカプセルの識別を可能とする)を誘導する方法を提供する。このため、この実施形態では、マイクロカプセルは、(a)その中に含有された1以上の化合物の活性にしたがって相互から物理的に分類され、分類されたマイクロカプセルの内容物が分析され、それらが含有する1以上の化合物の同一性が決定される;あるいは(b)分類せずに直接的に分析されて、マイクロカプセルが含有する1以上の化合物の同一性が決定される。
【0023】
好ましくは、マイクロカプセル化は油中水型エマルジョンを形成することによって達成される。
【0024】
レパートリーのサブセットの複数のコピーでのコンパートメント化は多数の方法で達成できる。例えば、化合物をビーズに結合させ、各コンパートメント内に実質的に単一ビーズだけが含まれるようにエマルジョンを形成することができる。上記のステップ(a)は、
a)任意の1つのマイクロビーズ上でレパートリーのサブセットのみが示されるように、化合物のレパートリーをマイクロビーズ上に結合させるステップと;
b)任意の1つのマイクロカプセルにおいて、レパートリーのサブセットが複数のコピーで示されるように、マイクロビーズをマイクロカプセルにコンパートメント化するステップと
を含むように修飾される。
【0025】
また別の態様では、レパートリーの化合物中の、所望の活性を有する1以上の化合物を識別する方法であって、
4.任意の1つのマイクロビーズ上でレパートリーのサブセットのみが示されるように、レパートリーの化合物をマイクロビーズ上に結合させるステップと;
5.マイクロビーズをマイクロカプセルにコンパートメント化するステップと;
6.任意選択的に、マイクロビーズから化合物を放出させるステップと;
7.所望の活性を有する化合物を識別するステップと
を含む方法が提供される。
【0026】
好ましくは、いずれか1つのマイクロビーズ上に存在するレパートリーのサブセットは単一化合物である。好ましくは、各マイクロビーズには単一化合物の複数の分子が結合している。
【0027】
好ましくは、化合物は切断可能なリンカー、例えば所望であればマイクロビーズからの化合物の放出を可能とする光切断可能なリンカーによってマイクロビーズへ結合させられる。
【0028】
化合物は、本発明によって、化合物を含有するマイクロカプセルの変化、またはそれに化合物が結合しているマイクロビーズ内もしくはマイクロビーズ上の変化のいずれかについてスクリーニングするステップによってスクリーニングできる。
【0029】
ビーズ上の化合物は、質量分析法、化学タグ付け法または光学タグ付け法を含む、当業者によく知られている様々な技術を用いて識別できる。好ましくは、化合物は、ビーズおよびステップ(d)においてそれに結合した化合物の識別を可能とするために光学タグ付けマイクロビーズに結合させられる。
【0030】
レパートリーは、さらに単一化合物の複数のコピーのカプセル化を達成するために様々な方法でエマルジョン化することもできる。
【0031】
例えば、各化合物の水溶液を油中水型エマルジョンのマイクロカプセル中にコンパートメント化し、次に様々な化合物を含有するエマルジョンのアリコートを混合することができる。マイクロカプセルは通常はさらに標的を含有でき、標的の活性はマイクロカプセルを低温に維持することによって抑制できる。
【0032】
さらにまた別の実施形態では、各化合物の水溶液の少量区分を、機械的エネルギーを与えながら油相(好ましくは界面活性剤および/または他の安定化分子を含有する)内に投入(deposit)することにより、各化合物を複数の水性マイクロカプセル(各々が(大部分において)1種類の化合物であるがその複数のコピーを含む)内に分散させることができる。好ましくは、化合物はインクジェット印刷技術(Calvert,2001;de Gans et al.,2004)を用いながら、より好ましくは圧電気ドロップオンデマンド(DOD)インクジェット印刷技術により産生された液滴の形態で油相内に投入できる。インクジェット印刷技術もまたエマルジョンの形成の直前に、試薬(例えば標的活性を試験するための化合物、標的および試薬)を混合するために使用できる。好ましくは、複数の化合物をコンビナトリアルな様式において複数の標的と混合できる。このアプローチによると、水性液滴から油相内でインサイチューで個々のエマルジョン(後に混合される)を形成して、類似の結果が達成される。
【0033】
即ち、上記ステップ(a)は、個々の化合物を含む個別のエマルジョンコンパートメントを形成するステップと、エマルジョンコンパートメントを混合して乳化された化合物のレパートリーを形成するステップであって、任意の1つのマイクロカプセルにおいて、そのレパートリーのサブセットが複数のコピーで示されるようにする、ステップとを含むように改変することができ。
【0034】
更にまた化合物ライブラリは微小流体手法を用いて作成した高度に単分散のマイクロカプセル内にコンパートメント化することができる。例えば、各化合物の少量分を油の共流動ストリーム内での液滴の破壊により生成された油中水エマルジョン中の水性マイクロカプセル1つ以上(多分散度3%未満)内にコンパートメント化できる(Umbanhowar et al.,2000)。好ましくは、その後、水性マイクロカプセルを微小流体チャンネル内の油のストリーム内の層流により輸送する(Thorsen et al.,2001)。単一の化合物を含有するこれらのマイクロカプセルは、任意選択的に微小流体を用いてより小さいマイクロカプセル2つ以上に分割することができる(Link et al.,2004;Song et al.,2003)。単一の化合物を含有するマイクロカプセルは、任意選択的に、標的を含有する他のマイクロカプセル(Song et al.,2003)と融合できる。標的を含有する単一のマイクロカプセルは、任意選択的に、より小型のマイクロカプセル2つ以上に分割し、これをその後異なる化合物、または異なる濃度の化合物を含有するマイクロカプセルと融合することができる。好ましくは、化合物および標的をマイクロカプセル融合により混合した後に、標的の活性を試験するために必要なもの(例えば標的が酵素である場合は標的のための基質)を送達する第2のマイクロカプセル融合を行う。これにより化合物が標的に結合する時間が与えられる。マイクロカプセルは微小流体装置を用いて分析、および任意選択的に分類することができる(Fu et al.,2002)。
【0035】
本発明の好ましい態様によれば、化合物のスクリーニングは例えば下記の通り実施することができる。
【0036】
(I)第1の実施形態において、マイクロカプセルは、全体としてマイクロカプセルを検出可能とする化合物またはその誘導体の活性に従ってスクリーニングされる。従って、本発明は所望の活性を有する化合物が、化合物を含有するマイクロカプセルを識別可能とする、マイクロカプセルの変化またはマイクロカプセル内の分子1つ以上の修飾をもたらす方法を提供する。従ってこの実施形態において、マイクロカプセルは、(a)そこに含有される化合物の活性に従って相互に物理的に分類され、分類されたマイクロカプセルの内容物は任意選択的に1つ以上の共通のコンパートメント内にプールされ、マイクロカプセルの内容物を分析することにより化合物の内容を決定するか;または(b)分類することなく直接分析することによりマイクロカプセルが含有していた化合物の内容を決定するかのいずれかである。マイクロカプセルがマイクロビーズを含有する場合は、マイクロビーズを分析することによりそれらをコーティングしている化合物を決定できる。
【0037】
(II)第2の実施形態において、マイクロビーズはコンパートメント1つ以上内にマイクロカプセルをプールした後に分析する。この実施形態においては、所望の活性を有する化合物はそれを担持している(そして同じマイクロカプセル内に存在している)マイクロビーズを、後のステップにおいて識別可能とするような方法で修飾する。反応を停止し、後にマイクロカプセルを破壊して個々のマイクロカプセルの内容物全てがプールされるようにする。修飾されたマイクロカプセルは識別され、(a)マイクロビーズ上にコーティングされた化合物の活性に従って相互に物理的に分類され、分類されたマイクロビーズを分析することによりそれらをコーティングする/していた化合物の内容を決定するか;または(b)分類することなく直接分析することによりマイクロビーズをコーティングする/していた化合物の内容を決定するかのいずれかである。当然ながら、マイクロビーズの修飾は、それが化合物の直接の作用により誘発されるという点において直接のものであるか、または、所望の活性を有する化合物を1つ以上が使用している一連の反応によりマイクロビーズの修飾がもたらされる間接的なものであってよい。好ましくは、標的をマイクロビーズに結合されており、リガンドであり、マイクロカプセル内の化合物は該リガンドに直接または間接的に結合することによりマイクロビーズの単離を可能とする。別の形態においては、標的に対する基質はマイクロビーズに結合されており、マイクロカプセル内の化合物の活性はマイクロビーズの部分として残存し、その単離を可能とする生成物への該基質の変換を直接または間接的にもたらす。あるいは、化合物の活性は生成物への該基質の変換を防止または抑制してよい。更にまた、マイクロカプセル内での化合物の活性の生成物は、後にマイクロビーズと複合体化してその識別を可能とする生成物の生成を直接または間接的にもたらす。
【0038】
(III)第3の実施形態においては、共通のコンパートメント1つ以上の中にマイクロカプセルをプールした後にマイクロビーズを分析する。本実施形態においては、所望の活性を有する化合物は、化合物を含有するマイクロカプセルおよびそれを担持するマイクロビーズの変化をもたらす。この変化は、検出されれば、コンパートメント内のマイクロビーズの修飾をトリガーする。反応を停止し、後にマイクロカプセルを破壊することにより個々のマイクロカプセルの内容物を全てプールする。修飾されたマイクロビーズを識別し、(a)マイクロビーズ上にコーティングされた化合物の活性に従って相互に物理的に分類し、分類されたマイクロビーズを分析してそれらをコーティングする/していた化合物の内容を決定するか;または(b)分類することなく直接分析することによりマイクロビーズをコーティングする/していた化合物の内容を決定するかのいずれかである。
【0039】
マイクロカプセルまたはマイクロビーズはその光学特性を変化させるように化合物の作用により修飾してよい。例えば、マイクロビーズの修飾はこれを更にマイクロカプセル外部で修飾可能とし、これによりその光学特性の変化を誘導できる。
【0040】
別の実施形態においては、マイクロカプセルまたはマイクロビーズの光学特性の変化は標的への特徴的な光学特性を有する化合物の結合によるものである。
【0041】
更に、マイクロカプセルまたはマイクロビーズの光学特性の変化は化合物による特徴的な光学特性を有する標的の結合によるものである。
【0042】
マイクロカプセルもしくはマイクロビーズの光学特性の変化は、標的に結合したときの化合物の光学特性の変化、または化合物が結合したときの標的の光学特性の変化に起因してもよい。さらに、マイクロカプセルもしくはマイクロビーズの光学特性の変化は、結合したときの標的および化合物両方の光学特性の変化に起因してもよい。
【0043】
マイクロカプセルの光学特性の変化は化合物による標的の活性のモジュレートによるものであってよい。化合物は標的の活性を活性化または抑制してよい。例えば標的が酵素である場合は、基質および標的により触媒される反応の生成物は異なる光学特性を有することができる。好ましくは、基質および生成物は異なる蛍光特性を有する。マイクロカプセルがマイクロビーズを含む場合は、基質および生成物の両方が同様の光学特性を有することができるが、ただし反応生成物のみがマイクロビーズと結合または反応するが基質はそれをせず、これにより、マイクロビーズの光学特性が変化する。
【0044】
別の態様においては、別の試薬が、マイクロカプセルまたはマイクロビーズに結合するかこれに含まれている生成物(基質ではない)に特異的に結合するか、または特異的に反応することにより、マイクロカプセルまたはマイクロビーズの光学特性を改変する。
【0045】
好ましくは、マイクロカプセルまたはマイクロビーズは化合物の活性により直接または間接的に修飾され、更にチラミドシグナル増幅(TSA(商標);NEN)により修飾され、その結果として直接または間接的に該マイクロカプセルまたはマイクロビーズの光学特性の変化がもたらされ、これによりその分離が可能となる。
【0046】
化合物がビーズに結合する場合は、化合物がマイクロビーズ上にコーティングされる密度がマイクロカプセルの大きさと組み合わせられてマイクロカプセル内の化合物の濃度を決定する。高い化合物のコーティング密度および小型のマイクロカプセルは共に、より高い化合物濃度をもたらし、これは標的に対する親和性が低い分子の選択に好ましいかもしれない。逆に、低い化合物コーティング密度および大型のマイクロカプセルは共により低い化合物濃度をもたらし、これは標的に対する親和性が高い分子の選択に好ましいかもしれない。
【0047】
マイクロビーズは非磁性、磁性または常磁性であることができる。
【0048】
好ましくは、マイクロカプセルまたはマイクロビーズはその蛍光の変化の検出により分析する。例えば、マイクロビーズはフローサイトメトリーで分析し、任意選択的に蛍光活性化細胞ソーター(FACS)を用いて分類できる。標的および生成物の異なる蛍光特性は蛍光共鳴エネルギー転移(FRET)によるものであることができる。
【0049】
本発明はまた本発明により識別される物を提供する。この点に関し、「物」とは本発明により選択可能である任意の化合物を指す。
【0050】
本発明のその他の実施形態は以下の詳細な説明および添付する請求項に記載する通りである。
【0051】
[定義]
「マイクロカプセル」という用語は本明細書においては、当分野で通常用いられており、さらに後述する意味に従う。しかしながら本質的にはマイクロカプセルは、所望の活性を有する分子の識別を可能にする本明細書に記載の分子機序における成分の交換をその輪郭となる境界が制限している人工のコンパートメントである。輪郭となる境界は好ましくはマイクロカプセルの内容物を完全に封入するものである。好ましくは、本発明の方法において使用するマイクロカプセルは極めて多数量で製造可能であり、これにより化合物のライブラリをコンパートメント化できる。任意選択的に、化合物をマイクロビーズに結合できる。本明細書において使用されるマイクロカプセルはその内部において混合および分類が可能であり、これにより本発明の方法の高スループット能を促進する。固体表面上の液滴およびマルチウェルプレートのアレイは本明細書においてはマイクロカプセルとは定義しない。
【0052】
「マイクロビーズ」という用語は本明細書においては、当分野で通常用いられており、さらに後述する意味に従う。マイクロビーズはまた、マイクロスフェア、ラテックス粒子、ビーズまたはミニビーズとして当業者に知られているものであり、20nm〜1mmの直径のものが入手可能であり、種々の材料、例えばシリカおよび種々の重合体、共重合体および3元重合体から製造できる。高度に均一の誘導体化された(derivatized)および誘導体化されていない非磁性および常磁性のマイクロビーズ(ビーズ)は多くの販売元より入手できる(例えばSigma、Bangs Laboratories、LuminexおよびMolecular Probes)(Fornusek and Vetvicka,1986)。
【0053】
マイクロビーズは、マイクロカプセルへ分配することにより本発明に従って「コンパートメント化」できる。例えば、好ましい態様において、マイクロビーズを水/油混合物中に入れ、乳化して、本発明のマイクロカプセルを含む油中水エマルジョンを形成できる。マイクロビーズの濃度は、各マイクロカプセル内に平均して単一のマイクロビーズが出現するように調整することができる。
【0054】
「化合物」という用語は本明細書においては当分野で通常用いられている意味に従う。化合物という用語は、その最も広い意味において、即ち、所定の割合で元素2つ以上を含む物質(分子および超分子複合体(supramolecular complex)を含む)として使用される。この定義には医薬品の大部分を構成する小分子(典型的には<500ダルトン)も包含される。しかしながら、定義はまたより大型の分子、例えば重合体、例えばポリペプチド、核酸および炭水化物およびその超分子複合体も包含する。
【0055】
化合物の「レパートリー」とは多様な化合物の群であり、これはまた化合物のライブラリとも称することができる。化合物のレパートリーは当分野で知られた任意の手段、例えばコンビナトリアル化学、化合物進化により生成させるか(本明細書と同一日に出願された同時係属の「Compartinentalised Combinatorial Chemistry」と題する英国特許出願の方法などによる)、または、Sigma Aldrich,Discovery Partners International,MaybridgeおよびTriposのような市販元より購入してよい。レパートリーは、好ましくは少なくとも102、103、104、105、106、107、108、109、1010、1011以上の異なる化合物を含み、これは構造または機能において関係していても無関係でもよい。
【0056】
レパートリーの「サブセット」はその一部であり、これは単一化合物または関連する、もしくは関連しない構造を有する一群の化合物であってよい。好ましくは、このサブセットは単一化合物である。好ましくは、各化合物の複数のコピーが1つのマイクロカプセル内に封入される。マイクロビーズに結合させることのできるレパートリーのサブセットは、好ましくは各化合物の複数のコピーで結合させられる;例えば、各マイクロビーズがたった1つの化合物に結合している場合は、その化合物の複数の分子がマイクロビーズへ結合させられる。マイクロビーズへ結合した化合物の量がマイクロカプセル内の化合物の濃度を決定するであろう。
【0057】
マイクロビーズへの化合物の結合を行うリンカーの切断により化合物をマイクロビーズから「放出」させることができる。マイクロビーズからの化合物の放出により化合物はより自由にマイクロカプセルの他の内容物と相互作用ができるようになり、その内部の反応に関与できるようになり、任意選択的に他の試薬と組み合わさって新しい化合物、複合体、分子または超分子複合体を形成できるようになる。リンカーの切断は任意の手段により実施でき、マイクロカプセルを用いることなく実施できる光化学的切断が好ましい。光化学的に切断できるリンカーは当分野で知られており(例えばGordon and Balasubramanian,1999参照)、さらに後述する通りである。
【0058】
本明細書においては、「標的(target)」とは任意の化合物、分子または超分子複合体である。典型的な標的は医療上の意味を有する標的を包含し、例えば薬剤標的、例えば受容体、例えばGタンパク質結合受容体およびホルモン受容体;シグナリング経路に関与する転写因子、プロテインキナーゼおよびホスファターゼ;微生物に特異的な遺伝子産物、例えば細胞壁成分、レプリカーゼおよび他の酵素;工業的に関連のある標的、例えば食品産業において使用される酵素、研究または生産目的の試薬等を包含する。
【0059】
「所望の活性」とは、本明細書においては、標的のいずれかの活性、または標的によって影響を及ぼされる分子の活性のモジュレーションであり、これは本明細書において試験する化合物により直接または間接的にモジュレートすることができる。
標的の活性は、任意の測定可能な生物学的または化学的な活性、例えば結合活性、酵素活性、第3の酵素または他の分子に対する活性化または抑制の活性、疾患を誘発するか代謝または他の機能に影響する能力等であってよい。本明細書において言及する活性化および抑制とは、所望の活性を1.5倍、2倍、3倍、4倍、5倍、10倍、100倍以上の増大または低減を指す。モジュレーションが不活性化である場合は、不活性化は実質的に完全な不活性化である。更にまた所望の活性は純粋に結合活性であってよく、これには結合する標的の活性のモジュレーションが関与してもしなくてもよい。
【0060】
本明細書において「低分子量」または「小分子」と定義される化合物は医薬品分野において「小分子」と一般的に称される分子である。このような化合物はポリペプチドおよび他の大型分子複合体よりも小型であり、患者および他の対象に容易に投与でき、消化(assimilate)されるものである。小分子薬剤は経口投与または筋肉内注射用に好適に製剤できる。例えば小分子は2000ダルトン以下;好ましくは1000ダルトン以下;好ましくは250〜750ダルトン;およびより好ましくは500ダルトン未満の分子量を有することができる。
【0061】
「選択可能な変化(selectable change)」とは、測定可能であり、当該変化を引き起こす化合物を識別または単離するために利用可能である任意の変化である。選択は、(任意選択的に他の試薬と複合体化された際に)、マイクロカプセル、マイクロビーズまたは化合物自体のレベルで起こってよい。特に好ましい実施形態は光学的検出であり、その場合、選択可能な変化は光学特性の変化であり、これは例えばFACS装置において検出および利用でき、これにより所望の変化を表すマイクロカプセルまたはマイクロビーズを分離できる。
【0062】
本明細書においては光学特性の変化は電磁放射の吸収または放射の任意の変化、例えば吸光度、ルミネセンス、燐光または蛍光の変化を指す。このような特性の全てが「光学的」という用語に包含される。マイクロカプセルまたはマイクロビーズは、例えばルミネセンス、蛍光または燐光活性化分類により識別され、任意選択的に分類される。好ましい実施形態においては、フローサイトメトリーを用いてマイクロカプセルまたはマイクロビーズを識別し、任意選択的に分類する。種々の光学特性を分析のためおよび分類をトリガーするために使用でき、例えば光散乱(Kerker,1983)および蛍光分極(Rolland et al.,1985)が挙げられる。高度に好ましい実施形態においては、マイクロカプセルまたはマイクロビーズは、蛍光活性化細胞ソーター(FACS)を用いて分析され、任意選択的に分類される(Norman,1980;Mackenzie and Pinder,1986)。
【0063】
マイクロカプセル中またはビーズ上の化合物は当業者がよく知る種々の手法、例えば質量スペクトル分析、化学的タグ付けまたは光学的タグ付けにより識別できる。
【0064】
[一般的方法]
特段の記載が無い限り、本明細書において使用する全ての技術的および専門的な用語は本分野(例えば細胞培養、分子遺伝学、核酸化学、ハイブリダイゼーション技術および生化学)の当業者が一般的に理解している意味と同様の意味を有する。分子、遺伝および生化学的方法(一般的には、引用により本明細書に組み込まれるSambrook et al.,Molecular Cloning:A Laboratory Manual,2d ed(1989)Cold Spring Harbor Laboratory Press,Cold Spring Harbor,N.Y.およびAusbel et al.,Short Protocols in Molecular Biology(1999)4th Ed,John Wiley&Sons,Inc.参照)および化学的方法には、標準的な技術が使用される。更にまた、Harlow&Lane,A Laboratory Manual Cold Spring Harbor,N.Y.も標準的な免疫学的技術について参照される。
【0065】
〔(A)一般的説明〕
本発明のマイクロカプセルは、本発明が機能するために適切な物理学的特性を必要とする。
【0066】
まず、複数のマイクロカプセル間で化合物および標的が拡散しないようにするためには、各マイクロカプセルの内容物を周囲のマイクロカプセルの内容物から隔離することにより、実験期間中を通じてマイクロカプセル間での化合物および標的の交換を皆無または極僅かとしなければならない。しかし、マイクロカプセルの透過性は、所望であれば試薬がマイクロカプセル内および/または外へ拡散するのを許容するように調整できる。
【0067】
第2に、本発明の方法はマイクロカプセル1つにつき相違する化合物が限定された数しか存在しないことを必要とする。化合物がビーズに付着している場合は、本発明の方法はマイクロカプセル1つにつき限定された数のビーズしか存在しないことを必要とする。
【0068】
第2に本発明の方法では、マイクロカプセル当たり限られた数量のみビーズが存在しなければならない。これにより化合物および標的が他のビーズから隔離されることになる。
【0069】
第3に、好ましくは、マイクロカプセルの形成および組成は標的の活性を低減させない。
【0070】
結果として、好ましくは、使用する任意のマイクロカプセル化系はこれらの3つの条件を満足している。適切な系は当業者に明らかなとおり、本発明の各用途における条件の厳密な性質により変動する。
【0071】
広範な種類のマイクロカプセル化の操作法(Benita,1996参照)が使用可能であり、本発明に従って使用するマイクロカプセルを産生するために使用してよい。実際、200を超えるマイクロカプセル化方法が文献に記載されている(Finch,1993)。
【0072】
これらには膜エンベロープ水性ベシクル、例えば脂質ベシクル(リポソーム)(New,1990)および非イオン系界面活性剤ベシクル(van Hal et al.,1996)が包含される。これらは非共有結合的に組み立てられた分子の単一または複数の二重層(bilayer)の閉じた膜カプセルであり、各二重層は水性のコンパートメントによりその近隣から分離されている。リポソームの場合は、膜は脂質分子からなり;これらは通常はリン脂質であるが、コレステロールのようなステロールも膜内に取り込んでよい(New,1990)。種々の酵素触媒性化学的反応、例えばRNAおよびDNA重合をリポソーム内で実施できる(Chakrabarti et al.,1994;Oberholzer et al.,1995a;Oberholzer et al.,1995b;Walde et al.,1994;Wick&Luisi,1996)。
【0073】
膜エンベロープベシクル系の場合は、水相の大部分がベシクル外部にあり、従って非コンパートメント化されている。反応がマイクロカプセル内に限定されるためには、この連続の水相を除去するか、または、その内部の生物学的な系を抑制または破壊しなければならない(Luisi et al.,1987)。
【0074】
酵素触媒性化学反応はまた、種々の他の方法により産生されたマイクロカプセル内でも実証されている。多くの酵素はAOT−イソオクタン−水系(Menger&Yamada,1979)のように逆ミセル溶液中(Bru&Walde,1991;Bru&Walde,1993;Creagh et al.,1993;Haber et al.,1993;Kumar et al.,1989;Luisi&B.,1987;Mao&Walde,1991;Mao et al.,1992;Perez et al.,1992;Walde et al.,1994;Walde et al.,1993;Walde et al.,1998)で活性である。
【0075】
マイクロカプセルはまた界面重合および界面複合体形成により産生させることができる(Whateley,1996)。この種のマイクロカプセルは剛性で非透過性の膜または半透過性の膜を有することができる。硝酸セルロース膜、ポリアミド膜および脂質−ポリアミド膜を境界とする半透過性のマイクロカプセルは全て、多酵素系を含む生化学的反応を支援できる(Chang,1987;Chang,1992;Lim,1984)。極めて穏やかな条件下で形成できるアルギネート/ポリリジンマイクロカプセル(Lim&Sum,1980)もまた極めて生体適合性が高いことがわかっており、例えば生細胞および組織のカプセル化の有効な方法を与える(Chang,1992;Sun et al.,1992)。
【0076】
エマルジョンのようなコロイド系における水性の環境の相分配に基づく非膜マイクロカプセル化系も使用してよい。
【0077】
好ましくは本発明のマイクロカプセルはエマルジョン、即ち、顕微鏡的またはコロイドサイズの液滴として相の一方が他方の内部に分散している2つの非混和性の液相の不均質な系から形成する(Becher,1957;Sherman,1968;Lissant,1974;Lissant,1984)。
【0078】
エマルジョンは、非混和性の液体の任意の適当な組み合わせから製造することができる。好ましくは本発明のエマルジョンは微細分割液滴の形態で存在する相(分散した内部または不連続の相)としての水(生化学的成分を含有)およびこれらの液滴が懸濁しているマトリックス(非分散の連続または外部の相)としての疎水性の非混和性液体(油)を有する。このようなエマルジョンを油中水(W/O)と称する。これは生化学的成分を含有する全水相が個別の液滴(内層)内にコンパートメント化されているという利点を有する。疎水性の油である外層は一般的には生化学的成分は含まず、従って不活性である。
【0079】
エマルジョンは界面活性剤1つ以上を添加することにより安定化する。これらの界面活性剤は乳化剤と称され、水/油界面に作用して相の分離を防止(または少なくとも遅延)する。多くの油状物および多くの乳化剤を油中水エマルジョンの産生のために使用でき、最近の集計では16,000を超える界面活性剤が存在し、その多くは乳化剤として使用されている(Ash and Ash,1993)。適当な油は軽質白色鉱物油およびデカンを包含する。適当な界面活性剤は、非イオン系界面活性剤(Schick,1966)、例えばソルビタンモノオレエート(Span(商標)80;ICI)、ソルビタンモノステアレート(Span(商標)60;ICI)、ポリオキシエチレンソルビタンモノオレエート(Tween(商標)80;ICI)およびオクチルフェノキシエトキシエタノール(Triton X-100);イオン系界面活性剤、例えばコール酸ナトリウムおよびタウロコール酸ナトリウムおよびデオキシコール酸ナトリウム;化学的に負活性なシリコーン系の界面活性剤、例えばポリシロキサン−ポリセチル−ポリエチレングリコール共重合体(セチルジメチコンコポリオール)(例えばAbil(商標)EM90;Glodschmidt);およびコレステロールを包含する。
【0080】
フッ化炭素(または過フッ化炭素)連続相を有するエマルジョン(Krafft et al.,2003;Riess,2002)は特に好ましい。例えば、安定なパーフルオロオクチルブロミド中水およびパーフルオロオクチルエタン中水のエマルジョンは界面活性剤としてF−アルキルジモルホリノホスフェートを用いながら形成できる(Sadtler et al.,1996)。非フッ化化合物は本質的にはフッ化炭素および過フッ化炭素中に不溶性であり(Curran,1998;Hildebrand and Cochran,1949;Hudlicky,1992;Scott,1948;Studer et al.,1997)、小型薬剤様分子(典型的には<500DaおよびLogP<5)(Lipinski et al.,2001)はフッ化炭素中水および過フッ化炭素中水のエマルジョンの水性マイクロカプセル中極めて効果的にコンパートメント化され、マイクロカプセル間の交換は殆どまたは全くない。
【0081】
エマルジョンの形成は一般的に相を強制的に共存させるための機械的エネルギーの適用を必要とする。これを行うための種々の機械的装置、例えば攪拌器(磁気攪拌子、プロペラおよびタービン攪拌器、パドル装置およびウイスク)、ホモゲナイザー(例えばローターステーターホモゲナイザー、高圧弁ホモゲナイザーおよびジェットホモゲナイザー)、コロイドミル、超音波および「膜乳化」装置(Becher,1957;Dickinson,1994)を利用した種々の方法がある。
【0082】
複雑な生化学的過程、特に遺伝子の転写および翻訳もまた油中水エマルジョン中に形成される水性マイクロカプセル内で活性である。これにより、油中水エマルジョン内のコンパートメント化が遺伝子の選択に使用可能となり、遺伝子はエマルジョンマイクロカプセル内で転写および翻訳され、それらがコードするタンパク質の結合または触媒活性により選択される(Doi and Yanagawa,1999;Griffiths and Tawfik,2003;Lee et al.,2002;Sepp et al.,2002;Tawfik and Griffiths,1998)。これはエマルジョン内に形成された水性マイクロカプセルが一般的に安定であり、マイクロカプセル間での核酸、タンパク質または酵素触媒反応の生成物の交換があったとしても極僅かであるために可能となった。
【0083】
数千リットルの工業的規模までの容量のエマルジョンを形成する技術も存在する(Becher,1957;Sherman,1968;Lissant,1974;Lissant,1984)。
【0084】
好ましいマイクロカプセルサイズは本発明に従って実施するべき任意の個々のスクリーニング方法の厳密な条件に応じて変動する。全ての場合において、化合物および標的の活性の特性(identity)を測定するためには、化合物ライブラリと試験の感度との間には最適なバランスが存在する。
【0085】
エマルジョンマイクロカプセルのサイズは、スクリーニング系の条件に応じてエマルジョンを形成するために使用されるエマルジョン条件を単に調節することにより変化させてよい。究極的な制約要因はマイクロカプセルのサイズ、即ち単位容量当たり可能なマイクロカプセル数であることから、マイクロカプセルサイズが大きくなるほど、所与の化合物ライブラリをカプセル化するために必要となる容量は大きくなる。
【0086】
油中水エマルジョンは外部(連続)水相を有する水中油中水のダブルエマルジョンを形成するために再乳化できる。これらのダブルエマルジョンを分析し、任意選択的にフローサイトメーターを用いて分類することができる(Bernath et al.,2004)。
【0087】
高度に単分散されたマイクロカプセルは微小流体技術を用いて製造できる。例えば、3%未満の多分散性を有する油中水エマルジョンは油中の共流動ストリームの液滴破壊により形成することができる(Umbanhowar et al.,2000)。微小流体システムはまた、微小流体チャンネル内の油のストリーム中に分散した水性微小液滴の層流のために使用できる(Thorsen et al.,2001)。これによりフロー分析のための微小流体装置の構築、および、任意選択的に微小液滴のフロー分類が可能となる(Fu et al.,2002)。
【0088】
マイクロカプセルは好ましくは融合するか分割(split)する。例えば微小流体システムを用いて水性微小液滴を融合および分割させることができる(Link et al.,2004;Song et al.,2003)。マイクロカプセルの融合により試薬の混合が可能となる。例えば標的を含有するマイクロカプセルと化合物を含有するマイクロカプセルの融合は標的と化合物の反応を開始させる。マイクロカプセルのスプリッティングにより、単一のマイクロカプセルをより小さいマイクロカプセル2個以上に分割させる。例えば化合物を含有する単一のマイクロカプセルを複数のマイクロカプセルに分割し、これをその後異なる標的を含有する異なるマイクロカプセルに各々融合させる。標的を含有する単一のマイクロカプセルはまた複数のマイクロカプセルに分割し、これをその後異なる化合物または異なる濃度の化合物を含有する異なるマイクロカプセルと各々融合させることができる。
【0089】
マイクロカプセルは例えば蛍光色素を取り込むことにより光学的にタグ付けできる。好ましい形態においては、マイクロカプセルは量子ドットを取り込むことにより光学的にタグ付けされ、10濃度の6色の量子ドットは106マイクロカプセルのコード化を可能とする(Han et al.,2001)。微小流体チャンネル内を秩序のある順序で流動するマイクロカプセルは、マイクロカプセルのストリームにおけるその順序によりコード化(完全または部分的)できる(位置コード化)。
【0090】
マイクロスフェア、ラテックス粒子、ビーズまたはミニビーズとして当業者に知られているマイクロビーズは20nm〜1mmの直径のものが入手可能であり、種々の材料、例えばシリカおよび種々の重合体、共重合体および3元重合体、例えばポリスチレン(PS)、ポリメチルメタクリレート(PMMA)、ポリビニルトルエン(PVT)、スチレン/ブタジエン(S/B)共重合体およびスチレン/ビニルトルエン(S/VT)共重合体から製造できる(www.bangslabs.com)。これらは広範な種類の機能表面基、即ちアルデヒド、脂肪族アミン、アミド、芳香族アミン、カルボン酸、クロロメチル、エポキシ、ヒドラジド、ヒドロキシル、スルホネートおよびトシルにより付与される疎水性表面(例えばプレーンポリスチレン)から極めて親水性の表面まで、種々の表面化学のものが入手可能である。官能基はマイクロビーズ表面への化合物の安定または過逆的な結合のための広範な共有結合反応を可能とする。
【0091】
マイクロビーズは例えば蛍光色素を取り込むことにより光学的にタグ付けできる。例えば、厳密な比率の赤色(>650nm)およびオレンジ色(585nm)の蛍光色素による標識のため、各々が独特のスペクトルアドレスを有する100種の異なるビーズのセットを形成し(Fulton et al.,1997)(www.luminex.com)、106ビーズ以下のセットを10強度6色の量子ドットを取り込むことによりコード化できる(Han et al.,2001)。
【0092】
化合物を当業者のよく知る種々の手段により共有結合的または非共有結合的にマイクロビーズに連結できる(例えばHarmanson,1996参照)。好ましくは、化合物は切断可能なリンカーを介して結合する。このような種々のリンカーは当業者が知る通りであり(例えばGordon and Balasubramanian,1999参照)、例えば光化学的に切断できるリンカーおよびpHの変更により(例えばイミンおよびアシルヒドラゾン)、酸化還元特性を調節することにより(例えばジスルフィド)または外部触媒を用いながら(例えば交差複分解(cross-methathesis)およびアミド転換)制御することができる可逆共有結合が挙げられる。
【0093】
本発明の方法は化合物のプール(ライブラリまたはレパートリー)中で標的の活性を所望の方法でモジュレートする化合物の識別を可能とする。
【0094】
本発明の方法は化合物のレパートリーまたはライブラリのスクリーニングのために有用である。従って本発明は化合物を化合物のライブラリから識別する本発明の前記の態様に従った方法を提供する。
【0095】
本発明により識別される化合物は好ましくは薬理学的または産業上の利益を有し、例えば診断および治療用途のために適する細胞シグナル伝達機序のような生物学的系の活性化剤または抑制剤を包含する。従って好ましい態様において本発明は臨床上または産業上有用な物の発見を可能にする。本発明の別の態様において、本発明の方法により単離される物が提供される。
【0096】
適当なカプセル化条件の選択が望ましい。スクリーニングすべき化合物ライブラリの複雑度およびサイズに応じて、マイクロカプセル当たり1つの化合物(または1つ以下のマイクロビーズ)がカプセル化されるようにカプセル化の操作法を設定することが有利である。これにより分割力が最大となる。しかしながらライブラリがより大きいおよび/またはより複雑である場合は、これは非現実的であり;数種の化合物(または数個のマイクロビーズ)を共にカプセル化し、本発明の方法の反復適用に依存して所望の化合物を識別することが好ましい。カプセル化の操作法の組み合わせを用いて所望の化合物を識別してよい。
【0097】
理論的な研究によれば、化合物の数量が多いほど所望の特性を有する化合物が生成されやすいことを示している(このことがどのように抗体のレパートリーに適用されるかの説明(Perelson and Oster,1979)を参照)。また実際には、より大きいファージ−抗体レパートリーは確実により小さいレパートリーよりも良好な結合親和性を有するより多くの抗体をもたらすことが確認されている(Griffiths et al.,1994)。まれな変異体が形成され識別を可能とするには、大型のライブラリのサイズが望ましい。即ち、至適に小型であるマイクロカプセルの使用が有利である。
【0098】
これまで、1nl容量のスポットの二次元のマイクロアレイを用いて単一の実験においてスクリーニングできる化合物の最大のレパートリーは〜103であった(Hergenrother et al.,2000)。本発明を用いれば、2.6mmのマイクロカプセル直径において(Tawfik and Griffiths,1998)、3次元の分散体を形成することにより、少なくとも1011のレパートリーサイズを20mlエマルジョン中1ml水相を用いてスクリーニングできる。
【0099】
上記した化合物または化合物でコーティングされたマイクロビーズのほかに、本発明のマイクロカプセルはスクリーニング過程を起こすために必要な別の成分を含む。それらは標的および適当な緩衝液を含む。適当な緩衝液は生物学的系の所望の成分の全てが活性となるようなものであり、従って、各々の特定の反応系の条件により異なる。生物学的および/または化学的反応に適する緩衝液は当分野で知られており、その処方はSambrook and Russell,2001のような種々の実験テキストに記載されている。
【0100】
系の別の成分は標的の活性を試験するために必要なものを包含する。それらは例えば標的により触媒される反応の基質およびコファクター、および、標的に結合するリガンドを含む。それらはまた標的の活性の検出を可能にする標的の活性にカップリングされた反応の他の触媒(酵素を含む)、基質およびコファクターを含む。
【0101】
〔(B)スクリーニング操作法〕
標的に結合するか標的の活性をモジュレートする化合物をスクリーニングするためには、標的を化合物または化合物コーティングマイクロビーズ1つ以上と共にマイクロカプセル内にコンパートメント化する。好ましくは、各マイクロカプセルは単一の種類のみの化合物であるがそのコピーの多くを含有する。好ましくは、各マイクロビーズは単一の種類のみの化合物であるがそのコピーの多くによりコーティングされる。好ましくは、化合物は切断可能なリンカーを介してマイクロビーズに連結され、それらはコンパートメント中のマイクロビーズから放出されるようになる。好ましくは、各マイクロカプセルまたはマイクロビーズは光学的にタグ付けされることによりマイクロビーズに結合しているマイクロカプセル内に含有される化合物の識別を可能にする。
【0102】
((i)結合に関するスクリーニング)
化合物は標的への結合について直接スクリーニングできる。本実施形態においては、化合物がマイクロビーズに結合し、標的への親和性を有する場合には、それは標的に結合する。反応の終了時に、全マイクロカプセルを合わせ、全てのマイクロビーズを1つの環境内に共にプールする。標的に特異的に結合するか、または特異的に反応する分子を用いながらアフィニティー精製により所望の結合を示す化合物を担持するマイクロビーズを選択できる。
【0103】
別の実施形態においては、標的を当業者の知る種々の手段によりマイクロビーズに結合できる(例えばHermanson,1996参照)。スクリーニングすべき化合物は共通の特徴、即ちタグを含有する。化合物はマイクロビーズから放出され、化合物が標的に対する親和性を有する場合にそれに結合する。反応終了時に、全マイクロカプセルを合わせ、全マイクロビーズを1つの環境内に共にプールする。「タグ」に特異的に結合するか、または特異的に反応する分子を用いながらアフィニティー精製により所望の結合を示す化合物を担持するマイクロビーズを選択できる。
【0104】
別の実施形態においては、標的に結合する化合物が例えば別の結合相手からのリガンドを単に隠すだけであることに基づき、マイクロビーズをスクリーニングしてよい。この偶発性において、マイクロビーズはアフィニティー精製工程中に保持されるよりはむしろ選択的に溶出される一方、他のマイクロビーズは結合される。
【0105】
親和性による分類は結合が起こる条件における結合対の2メンバーの存在に依存している。この目的のために任意の結合対を使用してよい。本明細書において用いられるように、結合対という用語は相互に結合することができる分子の任意の対を指す。本発明において使用してよい結合対の例は抗原と抗原に結合できる抗体またはそのフラグメント、ビオチン−アビジン/ストレプトアビジン対(Savage et al.,1994)、カルシウム依存性結合ポリペプチドおよびそのリガンド(例えばカルモジュリンとカルモジュリン結合ペプチド(Montigiani et al.,1996;Stofko et al.,1992));組み立てられてロイシンジッパーを形成するポリペプチドの対(Tripet et al.,1996)、ヒスチジン(典型的にはヘキサヒスチジンペプチド)とキレート化Cu2+、Zn2+およびNi2+(例えばNi−NTA;(Hochuli et al.,1987))、RNA結合とDNA結合タンパク質(Klug et al.,1995)、例えば亜鉛フィンガーモチーフを含有するもの(Klug and Schwabe,1995)およびDNAメチルトランスフェラーゼ(Anderson,1993)とそれらの核酸結合部位を包含する。
【0106】
別の実施形態においては、化合物はマイクロカプセルまたはマイクロビーズの光学特性の変化を用いて標的への結合についてスクリーニングできる。
【0107】
標的への化合物の結合の後のマイクロカプセルまたはマイクロビーズの光学特性の変化は以下に記載するものを含む種々の方法で誘導することができる。
(1)化合物自体が特徴的な光学特性を有してもよい。例えばそれは蛍光である。
(2)化合物の光学特性が標的への結合により修飾されてもよい。例えば、化合物の蛍光が結合によりクエンチングされるか増強される(Voss,1993;Masui and Kuramitsu,1998)。
(3)標的の光学特性が化合物への結合により修飾されてもよい。例えば、標的の蛍光が結合によりクエンチングされるか増強される(Guixe et al.,1998;Qi and Grabowski,1998)。
(4)標的および化合物の両方の光学特性が結合により修飾されてもよい。例えば標的から化合物(またはその逆)の蛍光共鳴エネルギー転移(FRET)が生じ、「ドナー」の吸収波長における励起があれば「アクセプター」発光波長における発光が生じる(Heim&Tsein,1996;Mahajan et al.,1998;Miyawaki et al.,1997)。
【0108】
本発明によると、所望の活性を有する化合物がマイクロカプセルの光学特性の変化を誘導し、これにより、当該化合物を含有するマイクロカプセルおよびそこに含有されるマイクロビーズの識別および任意選択的に分類が可能となる方法が提供される。
【0109】
別の実施形態においては、本発明によると、共通のコンパートメント1つ以上内にマイクロカプセルをプールした後にマイクロビーズを分析する方法が提供される。本実施形態においては所望の活性を有する化合物はそれを担持する(そして同じマイクロカプセル内に存在する)マイクロビーズの光学特性を修飾してその識別および任意選択的に分類を可能にする。
【0110】
本実施形態においては、標的への化合物の結合は必ずしも光学特性の変化を直接誘導する必要は無い。
【0111】
本実施形態において、マイクロビーズに結合した化合物が標的に対する親和性を有する場合は、それは標的に結合する。反応終了時、全マイクロカプセルを合わせ、全マイクロビーズを1つの環境内に共にプールする。所望の結合を示す化合物を担持するマイクロビーズは、標的と特異的に結合するか、または特異的に反応する試薬を添加し、これにより、識別を可能にするマイクロビーズの光学特性の変化を誘導することにより識別できる。例えば、蛍光標識抗標的抗体を用いるか、または、抗標的抗体、次いで第1のものに結合する第2の蛍光標識抗体を使用できる。
【0112】
別の実施形態においては、標的を当業者の知る種々の手段によりマイクロビーズに結合できる(例えばHermanson,1996参照)。スクリーニングすべき化合物は共通の特徴、即ちタグを含有する。化合物はマイクロビーズから放出され、化合物が標的に対する親和性を有する場合にそれに結合する。反応終了時に全マイクロカプセルを合わせ、全マイクロビーズを1つの環境内に共にプールする。所望の結合を示す化合物を担持するマイクロビーズは、「タグ」と特異的に結合するか、または特異的に反応する試薬を添加し、これにより、識別を可能にするマイクロビーズの光学特性の変化を誘導することにより識別できる。例えば、蛍光標識抗「タグ」抗体を用いるか、または、抗「タグ」抗体、次いで第1のものに結合する第2の蛍光標識抗体を使用できる。
【0113】
別の実施形態においては、リガンドに結合する遺伝子産物が、例えばマイクロビーズの光学特性を修飾する可能性がある別の結合相手からリガンドを単に隠すことに基づいて識別してよい。この場合未修飾の光学特性を有するマイクロビーズが選択されるであろう。
【0114】
マイクロビーズを蛍光性とするために、蛍光をチラミドシグナル増幅(TSA(商標))の増幅を用いて増強することができる(Sepp et al.,2002)。これは、マイクロビーズに結合し、フルオレセイン−チラミンから遊離のラジカル形態(その後(局所的に)マイクロビーズと反応する)への変換を触媒するパーオキシダーゼ(別の化合物に連結)を使用する。TSAを実施する方法は当分野で知られており、キットがNENより販売されている。
【0115】
TSAは、マイクロビーズの蛍光の直接の増大をもたらすか、または、第2の蛍光分子または(その1つ以上が蛍光性である)分子の配列が結合するマイクロビーズにリガンドが結合するように設定される。
【0116】
((ii)結合の調節のためのスクリーニング)
別の実施形態においては、本発明は生化学的過程を調節する作用を有する化合物をスクリーニングするために使用できる。化合物が標的の結合特性を活性化する場合、活性化される標的に対するリガンドを当業者の知る種々の手段によりマイクロビーズに結合できる(例えばHermanson,1996参照)。反応終了時に全マイクロカプセルを合わせ、全マイクロビーズを1つの環境内に共にプールする。所望の結合を示す化合物を担持するマイクロビーズは、標的と特異的に結合するか、または特異的に反応する分子を用いたアフィニティー精製により選択できる。
【0117】
別の実施形態においては、化合物が標的の結合活性を抑制することに基づいてマイクロビーズをスクリーニングしてよい。この偶発性において、マイクロビーズはアフィニティー精製工程中に保持されるよりはむしろ選択的に溶出される一方、他のマイクロビーズは結合される。
【0118】
別の実施形態において、化合物はマイクロカプセルまたはマイクロビーズの光学特性の変化を用いて標的の結合特性をモジュレートする能力についてスクリーニングできる。
【0119】
リガンドへの標的の結合の後のマイクロカプセルまたはマイクロビーズの光学特性の変化は以下に記載するものを含む種々の方法で誘導することができる。
(1)リガンド自体が特徴的な光学特性を有してもよい。例えばそれは蛍光である。
(2)リガンドの光学特性が標的への結合により修飾されてもよい。例えば、リガンドの蛍光が結合によりクエンチングされるか増強される(Voss,1993;Masui and Kuramitsu,1998)。
(3)標的の光学特性がリガンドへの結合により修飾されてもよい。例えば、標的の蛍光が結合によりクエンチングされるか増強される(Guixe et al.,1998;Qi and Grabowski,1998)。
(4)標的およびリガンドの両方の光学特性が結合により修飾されてもよい。例えば標的からリガンド(またはその逆)の蛍光共鳴エネルギー転移(FRET)が生じ、「ドナー」の吸収波長における励起があれば「アクセプター」発光波長における発光が生じる(Heim&Tsein,1996;Mahajan et al.,1998;Miyawaki et al.,1997)。
【0120】
本発明によると、所望の活性を有する化合物がマイクロカプセルの光学特性の変化を誘導し、これにより、化合物を含有するマイクロカプセルおよびそこに含有されるマイクロビーズの識別および任意選択的に分類が可能となる方法が提供される。
【0121】
別の実施形態においては、本発明によると、共通のコンパートメント1つ以上内にマイクロカプセルをプールした後にマイクロビーズを分析する方法が提供される。本実施形態においては所望の活性を有する化合物は、それを担持する(そして同じマイクロカプセル内に存在する)マイクロビーズの光学特性を修飾してその識別および任意選択的に分類を可能にする。
【0122】
本実施形態においては、リガンドへの標的の結合は必ずしも光学特性の変化を直接誘導する必要は無い。
【0123】
本実施形態において、マイクロビーズに結合したリガンドが標的に対する親和性を有する場合は、それは標的に結合する。反応終了時、全マイクロカプセルを合わせ、全マイクロビーズを1つの環境内に共にプールする。結合活性をモジュレートする化合物を担持するマイクロビーズは、標的と特異的に結合するか、または特異的に反応する試薬を添加し、これにより、識別を可能にするマイクロビーズの光学特性の変化を誘導することにより識別できる。例えば、蛍光標識抗標的抗体を用いるか、または、抗標的抗体、次いで第1のものに結合する第2の蛍光標識抗体を使用する。
【0124】
別の実施形態においては、標的を当業者の知る種々の手段によりマイクロビーズに結合できる(例えばHermanson,1996参照)。スクリーニングすべきリガンドは共通の特徴、即ちタグを含有する。反応終了時に全マイクロカプセルを合わせ、全マイクロビーズを1つの環境内に共にプールする。結合をモジュレートする化合物を担持するマイクロビーズは、「タグ」と特異的に結合するか、または特異的に反応する試薬を添加し、これにより、識別を可能にするマイクロビーズの光学特性の変化を誘導することにより識別できる。例えば、蛍光標識抗「タグ」抗体を用いるか、または、抗「タグ」抗体、次いで第1のものに結合する第2の蛍光標識抗体を使用する。
【0125】
上記した通り、蛍光はチラミドシグナル増幅(TSA(商標))の増幅を用いて増強されることによりマイクロビーズを蛍光性とする(Sepp et al.,2002)。
【0126】
((iii)触媒作用の調節のスクリーニング)
別の実施形態において、本発明によると、所望の活性を有する化合物がマイクロカプセルの光学特性の変化を誘導し、これにより、化合物を含有するマイクロカプセルおよび任意選択的にそこに含有されるマイクロビーズの識別および任意選択的に分類が可能となる方法が提供される。マイクロカプセルの光学特性は、
(1)異なる光学特性を有する調節された反応の基質および生成物(多くの蛍光発生酵素基質は例えばHaugland,1996およびwww.probes.comより入手可能である)、例えばグリコシダーゼ、ホスファターゼ、ペプチダーゼおよびプロテアーゼの基質、または
(2)マイクロカプセル内の調節された反応の生成物(または基質)と特異的に結合または反応し、これにより、その識別を可能とするように、マイクロカプセルの光学特性の変化を誘導する試薬の存在、の何れによっても修飾できる。
【0127】
標的の活性をモジュレートするものを得るために化合物のライブラリをスクリーニングするための広範な試験法は、光学特性の変化を検出することに基づいており、本発明に従って化合物をスクリーニングするために使用できる。このような試験は当業者に周知である(例えばHaugland,1996およびwww.probes.com参照)。
【0128】
あるいは、選択は同じマイクロカプセル内で起こるその後の反応に第1の反応をカップリングすることにより間接的に実施してよい。これを行うには2通りの一般的な方法がある。第1に第1の反応の生成物を、第1の反応の基質とは反応しない分子と反応させるか結合させる。第2に、カップリングされた反応は第1の反応の生成物の存在下にのみ進行するようにする。その後、調節化合物は、第2の反応の生成物または基質の特性により識別できる。
【0129】
あるいは、選択すべき反応の生成物は第2の酵素触媒反応の基質またはコファクターであってよい。第2の反応を触媒する酵素はマイクロカプセル化よりも前に反応混合物に取り込ませることができる。第1の反応が進行する場合のみ、カップリングされた酵素は識別可能な生成物を生成することになる。
【0130】
カップリングのこの概念は前の反応の生成物を基質として各々が使用する複数の酵素を取り込むために調整することができる。これにより固定化された基質とは反応しない酵素の調節物質の選択が可能になる。1つの反応の生成物が選択可能な生成物をもたらす第2の反応または反応のシリーズのための触媒またはコファクターである場合、シグナル増幅により増強された感度を得るように設計することもできる(例えばJohannsson,1991;Johannsson and Bates,1988参照)。更にまた、酵素カスケード系は酵素の活性化物質の生産または酵素阻害剤の破壊に基づくこともできる(Mize et al.,1989参照)。カップリングはまた、同じ生成物を生成する酵素の全体の群に対して共通のスクリーニング系を使用でき、複雑な多工程の化学的変換および経路の調節の選択を可能にするという利点も有する。
【0131】
別の実施形態においては、標的そのものが酵素である場合、または、標的が酵素的である生化学的過程を調節する場合、各マイクロカプセルにあのマイクロビーズは酵素的反応のための基質でコーティングしてよい。調節化合物は、基質が生成物に変換される程度を決定する。反応終了時、触媒された反応の生成物にマイクロビーズを物理的に連結する。マイクロカプセルを合わせて反応体をプールすると活性化化合物でコーティングされたマイクロビーズは生成物に特異的な任意の性質により識別できる。阻害剤が望まれる場合は、調節された反応の基質に特異的な化学的特性があるものを選択できる。
【0132】
更にまた、基質はマイクロビーズに結合しないことが望ましい場合もある。この場合、基質は光活性化のような自体の活性化のための別の工程を要する不活性の「タグ」を含有するであろう(例えば「ケージ化」ビオチン類縁体(Pirrung and Huang,1996;Sundberg et al.,1995)。基質から生成物への変換の後、「タグ」は活性化され、「タグ付け」された基質および/または生成物はマイクロビーズに結合したタグ結合分子(例えばアビジンまたはストレプトアビジン)に結合する。従って、「タグ」を介して核酸に結合した生成物に対する基質の比は溶液中の基質および生成物の比を反映するものとなる。ケージ化ビオチンでタグ付けされた基質はマイクロカプセル中のコンパートメント化に基づく操作法を用いたホスホトリエステラーゼ活性を有する酵素をコードする遺伝子の選択のために使用されている(Griffiths and Tawfik,2003)。ホスホトリエステラーゼ基質は活性酵素分子を含有するマイクロカプセル内の溶液中で加水分解され、反応が終了した後、ケージング基を放射線照射により放出させ、酵素をコードする遺伝子が結合したマイクロビーズにビオチン部分を介して生成物が結合できるようにされている。
【0133】
マイクロビーズおよびマイクロカプセル内の内容物が混合された後、適宜生成物または基質に対して特異的に結合する分子(例えば抗体)を用いたアフィニティー精製により調節物質でコーティングされたマイクロビーズを選択できる。
【0134】
別の実施形態においては、本発明によると、共通のコンパートメント1つ以上内にマイクロカプセルをプールした後にマイクロビーズを分析する方法が提供される。調節化合物でコーティングしたマイクロビーズはマイクロビーズの光学特性の変化を用いて識別できる。生成物(または基質)が結合したマイクロビーズの光学特性は、
(1)例えば下記の理由により、基質−マイクロビーズ複合体では検出されない特徴的な光学特性を有する生成物−マイクロビーズ複合体;
(a)異なる光学特性を有する基質および生成物(多くの蛍光発生酵素基質は例えばHaugland,1996およびwww.probes.comより入手可能である)、例えばグリコシダーゼ、ホスファターゼ、ペプチダーゼおよびプロテアーゼの基質、または、
(b)同じ光学特性を有する基質および生成物、ただし、基質ではなく生成物のみがマイクロビーズと結合または反応するもの;
(2)生成物(または基質)と特異的に結合または反応し、これにより、その識別を可能とするマイクロビーズの光学特性の変化を誘導する試薬の添加(これらの試薬はマイクロカプセルの破壊およびマイクロビーズのプールの前または後に添加できる)。その試薬は、基質および生成物の両方がマイクロビーズに結合する場合は、基質ではなく生成物のみ(またはその逆)に特異的に結合または特異的に反応するか、または、基質ではなく生成物のみがマイクロビーズに結合または反応する(またはその逆)場合に、任意選択的に基質および生成物の両方に結合する;の何れによっても修飾できる。
【0135】
このシナリオにおいて、基質(または基質の1つ)はマイクロビーズには連結されていないが分子「タグ」(例えばビオチン、DIGまたはDNPまたは蛍光基)を有する各マイクロカプセル内に存在できる。調節された酵素が基質を生成物に変換する場合、生成物は「タグ」を保有し、その後生成物特異的抗体によりマイクロカプセル内で捕獲される。全ての反応が停止しマイクロカプセルが合わせられた時点で、これらのマイクロビーズは「タグ付け」され、例えば「タグ」が蛍光基である場合は、変化した光学特性を既に有してもよい。あるいは、「タグ付け」されたマイクロビーズの光学特性の変化は「タグ」(例えば蛍光標識アビジン/ストレプトアビジン、蛍光性の抗「タグ」抗体または第2の蛍光標識抗体により検出できる非蛍光の抗「タグ」抗体)に結合する蛍光標識されたリガンドを添加することにより誘導できる。
【0136】
((iv)化合物の特異性/選択性のスクリーニング)
特定の標的に対する特異性または選択性を有するが他のものに対しては有さない化合物は、1つの基質を用いた反応の調節に関する積極的スクリーンまたは別の基質との反応の調節に関する消極的スクリーンを実施することにより特異的に識別できる。例えば、2種の異なる標的酵素に特異的な2種の基質を各々異なる蛍光発生部分で標識する。各標的酵素は異なる蛍光スペクトルを有する生成物の生成を触媒し、2種の標的に対する化合物の特異性に応じてマイクロカプセルの異なる光学特性をもたらす。
【0137】
((v)細胞を使用するスクリーニング)
現在の薬剤発見の状況においては、有効化された組み換え標的がインビトロの高スループットスクリーニング(HTS)試験の根拠を形成している。しかしながら単離されたタンパク質は複雑な生物学的系の代表とはみなされず;従って、細胞に基づく系は、インタクトな生物学的系において化合物の活性のより高い信頼性をもたらす。薬剤に関する広範な細胞系試験が当業者に知られている。細胞は、油中水エマルジョンの水性微小液滴のようなマイクロカプセル内にコンパートメント化できる(Ghadessy,2000)。標的に対する化合物の作用は、化合物と共にマイクロカプセル内に細胞をコンパートメント化すること、および、適切な細胞系試験を用いて細胞に対して所望の作用を有する化合物を含有するコンパートメントを識別することにより測定することができる。フッ化炭素中水のエマルジョンの使用は特に好ましく、フッ化炭素の高い気体溶解能が呼吸ガスの交換を支援でき、細胞培養系に有利であることが報告されている(Lowe,2002)。
【0138】
((vi)フローサイトメトリー)
本発明の好ましい実施形態においては、マイクロカプセルまたはマイクロビーズをフローサイトメトリーにより分析および任意選択的に分類する。マイクロカプセルの多くのフォーマットをフローサイトメトリーを用いておよび任意選択的に直接分類できる。マイクロカプセルの一部のフォーマットは分析または分類の前にマイクロカプセルを別途処理することを必要とする場合がある。例えば油中水エマルジョンはフローサイトメトリーによる分析を容易にするために水中油中水のダブルエマルジョンに変換できる(Bernath et al.,2004)。多重エマルジョンは単純な一次油中水(または水中油)エマルジョンを再乳化して水中油中水(または油中水中油)エマルジョンとすることにより製造される(Davis and Walker,1987)。
【0139】
高度に単分散したマイクロカプセルは微小流体技術を用いて製造できる。例えば多分散度3%未満の油中水エマルジョンは、油の共流動ストリーム内の液滴の破壊により産生できる(Umbanhowar,2000)。微小流体システムはまた微小流体チャンネル内の油のストリーム中に分散された水性の微小液滴の層流のためにも使用できる(Thorsen,2001)。これにより微小液滴の流動の分析および任意選択的に流動の分類のための微小流体装置の構築が可能となる(Fu,2002)。
【0140】
種々の光学特性を分析のため、および、分類をトリガーするために使用でき、例えば光散乱(Kerker,1983)および蛍光分極(Rolland et al.,1985)が挙げられる。高度に好ましい実施形態においては、マイクロカプセルまたはマイクロビーズの光学特性の差は蛍光の差であり、必要に応じて、マイクロカプセルまたはマイクロビーズは蛍光活性化細胞ソーター(Norman,1980;Mackenzie and Pinder,1986)または同様の装置を用いて分類する。フローサイトメトリーは下記の一連の利点を有する。
【0141】
(1)信頼できる製造元(例えばBecton-Dickinson,Coulter,Cytomation)の市販の蛍光活性化細胞分類装置により100,000マイクロカプセルまたはマイクロビーズs-1までの分析および分類が可能である。
【0142】
(2)各マイクロカプセルまたはマイクロビーズから生じる蛍光シグナルは存在する蛍光分子の数に厳格に対応している。マイクロカプセルまたはマイクロビーズ当たり僅か数百の蛍光分子でも定量的に検出できる。
【0143】
(3)蛍光検出器のダイナミックレンジが広い(典型的には4対数単位)ことにより、分類の操作法の厳密性を容易に設定でき、これにより、原料プールから至適数量のマイクロカプセルまたはマイクロビーズを回収できる(ゲートは蛍光の僅かな差を有するマイクロカプセルまたはマイクロビーズを分離するか、蛍光の大きな差を有するマイクロカプセルまたはマイクロビーズを分離するのみとするか、実施する選択に応じて設定できる)。
【0144】
(4)市販の蛍光活性化細胞分類装置は複数の波長において同時に励起および検出を実施でき(Shapiro,1995)、これにより、2〜13(またはそれ以上)の蛍光マーカーによるマイクロカプセルまたはマイクロビーズの標識をモニタリングすることにより積極的および消極的な選択を同時に実施でき、例えば2種の交互の標的に対する基質を異なる蛍光タグで標識する場合、マイクロカプセルまたはマイクロビーズは調節される標的に応じて異なる蛍光団で標識できる。
【0145】
マイクロカプセルまたはマイクロビーズを光学的にタグ付けする場合は、フローサイトメトリーを用いてマイクロカプセル内に存在するまたはマイクロビーズ上にコーティングされた化合物を識別することもできる(後述を参照)。光学的タグ付けはマイクロカプセル内の化合物の濃度(1段階より多い濃度を単一の実験で使用する場合)またはマイクロビーズ上にコーティングされた化合物の分子の数(1段階より多いコーティング密度を単一の実験で使用する場合)を識別するためにも使用できる。更にまた、光学的タグ付けは、マイクロカプセル内の標的を識別するためにも使用できる(1種より多い標的を単一の実験で使用する場合)。この分析はマイクロビーズを含有するマイクロカプセルの分類の後、または、マイクロビーズの分類の後に、活性の測定と同時に実施できる。
【0146】
((vii)マイクロカプセルの識別および分類)
本発明は、使用する分類技術により可能となるインタクトのマイクロカプセルの識別および任意選択的に分類を提供する。マイクロカプセルは、所望の化合物により誘導される変化がマイクロカプセルの表面で発生または顕在化するか、または、マイクロカプセルの外部から検出される場合に、そのまま識別され、任意選択的に分類することができる。変化は、化合物の直接の作用によるか、または、うち1つ以上が所望の活性を有する化合物を使用する一連の反応が変化をもたらすような間接的なものにより、誘導されてよい。例えば、マイクロカプセルが膜マイクロカプセルである場合、標的を含む生化学的系の化合物がその表面にディスプレイされ、これによりマイクロカプセル内のマイクロビーズ上の化合物により調節される生化学的系の変化を検出できる試薬に接触可能となるようにマイクロカプセルを構成させてよい。
【0147】
しかしながら本発明の好ましい態様においては、マイクロカプセルの識別および任意選択的に分類は、マイクロカプセルの光学特性、例えばその吸収または発光の特性の変化、例えばマイクロカプセルに伴う吸光度、ルミネセンス、燐光または蛍光の変化をもたらす反応から生じるマイクロカプセルの光学特性の改変に依存している。このような特性の全ては「光学的」という用語に包含される。そのような場合、マイクロカプセルは識別され、任意選択的にルミネセンス、蛍光または燐光により活性化された分類により分類できる。高度に好ましい実施形態においては、フローサイトメトリーを用いることにより、マイクロカプセル内の蛍光分子の生成をもたらす所望の活性を有する化合物を含有するマイクロカプセルを分析および任意選択的に分類する。
【0148】
別の実施形態においては、マイクロカプセルの蛍光の変化は、それが識別されれば、コンパートメント内のマイクロビーズの修飾をトリガーするのに用いられる。本発明の好ましい態様において、マイクロカプセルの識別はマイクロカプセル内部のルミネセンス、燐光または蛍光をもたらす反応から生じるマイクロカプセルの光学特性の変化に依存している。マイクロカプセル内のマイクロビーズの修飾は、ルミネセンス、燐光または蛍光の識別によりトリガーされる。例えば、ルミネセンス、燐光または蛍光の識別はマイクロビーズまたはそれに結合している分子の修飾をもたらす光子(または他の粒子または波動)に対するコンパートメントの衝突をトリガーすることができる。同様の操作法が細胞の急速分類に関して以前に記載されている(Keij et al.,1994)。マイクロビーズの修飾は、例えばマイクロビーズへの光不安定性保護基でケージ化された分子「タグ」のカップリングから生じるものであってよく、適切な波長の光子との衝突はケージの除去をもたらす。その後、全てのマイクロカプセルを合わせ、マイクロビーズを1つの環境内に共にプールする。所望の活性を示す化合物でコーティングされたマイクロビーズは「タグ」に特異的に結合するか特異的に反応する分子を用いてアフィニティー精製により選択できる。
【0149】
〔(C)化合物ライブラリ〕
ライブラリは種々の市販の原料から得ることができる。ライブラリ内の化合物は当業者の周知の種々の方法により製造できる。任意選択的に、化合物ライブラリは空間的に分割されたパラレル合成を用いた、または、スプリット合成を用いたコンビナトリアル合成により製造でき、任意選択的に1ビーズ1化合物のライブラリを生成させる。任意選択的に、化合物はビーズ上で合成できる。これらのビーズは直接マイクロカプセル内にコンパートメント化するかコンパートメント化の前に化合物を放出させることができる。
【0150】
好ましくは、化合物の僅か1種のみであるが、その複数のコピーを各マイクロカプセル内に存在させる。
【0151】
任意選択的に、化合物は当業者の知る種々の手段により共有結合的に、または、非共有結合的にマイクロビーズに連結できる(例えばHermanson,1996参照)。
【0152】
マイクロビーズは広範な種類の機能表面基、即ちアルデヒド、脂肪族アミン、アミド、芳香族アミン、カルボン酸、クロロメチル、エポキシ、ヒドラジド、ヒドロキシル、スルホネートおよびトシルにより付与される疎水性表面(例えばプレーンポリスチレン)から極めて親水性の表面まで、種々の表面化学のものが入手可能である。官能基はマイクロビーズ表面への化合物の安定または過逆的な結合のための当業者の周知の広範な共有結合反応を可能とする。
【0153】
好ましくは化合物は切断可能なリンカーを介してマイクロビーズに結合する。このような種々のリンカーは当業者の知る通りであり(例えばGordon and Balasubramanian,1999参照)、例えば光化学的に切断できるリンカー、および、pHの変更により(例えばイミンおよびアシルヒドラゾン)、酸化還元特性を調節することにより(例えばジスルフィド)または外部触媒を用いながら(例えば交差複分解およびアミド転換)制御することができる可逆共有結合が挙げられる。
【0154】
好ましくは、化合物の僅か1種のみであるが、その複数のコピーを各ビーズ内に結合させる。
【0155】
〔(D)化合物の識別〕
マイクロカプセル内またはマイクロビーズ上の化合物は種々の方法で識別できる。識別されたマイクロカプセルを分類(例えば蛍光活性化細胞ソーター:FACSを使用)する場合、化合物は例えば質量スペクトル分析による直接の分析により識別できる。選択(例えばアフィニティー精製による)または分類(例えばFACSを使用)の結果として単離されたビーズに結合したままで化合物が残存する場合、それらはまた例えば質量スペクトル分析による直接の分析により識別できる。マイクロカプセルまたはビーズは当業者の周知の種々の手段によりタグ付けでき、そのタグを用いてビーズに結合した化合物を識別する(Czarnik,1997)。化合物をコード化する化学的、スペクトル分析的、電子的および物理的な方法は全て使用してよい。好ましい実施形態においては、マイクロカプセルまたはビーズは異なる光学特性を有し、これにより光学的にコード化される。好ましい実施形態においては、コード化は異なる蛍光特性を有するマイクロカプセルまたはビーズに基づく。高度に好ましい実施形態においては、マイクロカプセルまたはビーズはマイクロカプセルまたはビーズ内に異なる濃度で存在する蛍光量子ドットを用いてコード化される(Han,2001)。微小流体チャンネル内を順序だった配列として流動しているマイクロカプセルはまたマイクロカプセルのストリーム内のその配列によりコード化(全体的または部分的)できる(位置コード化)。
【0156】
好ましくは、各化合物は異なる濃度(典型的にはmM〜nMの範囲の濃度)で異なるマイクロカプセル内に存在することにより、用量応答曲線の作成を可能とする。これは、例えば阻害化合物の阻害定数(Ki)の測定を可能にする。マイクロカプセル内の化合物の濃度は例えば上記したマイクロカプセルまたはマイクロビーズの光学的コード化または位置コード化により測定できる。
【0157】
〔(E)標的の識別〕
好ましくは、各マイクロカプセルが同じ標的の複数のコピーを含有するように複数の異なる標的をマイクロカプセル内にコンパートメント化できる。例えば複数のプロテインキナーゼ、または単一の標的の複数の多形変異体をコンパートメント化することにより化合物の特異性を測定可能にできる。マイクロカプセル内の標的の特性(identity)は、例えば上記したマイクロカプセルまたはマイクロビーズの光学的コード化または位置コード化により測定できる。
【図面の簡単な説明】
【0158】
【図1】PTP1B阻害剤の例。ビス−ジフルオロメチレンホスホネート部分を有する化合物(例えば2)は単一の部分を有するものよりも有意に大きい力価を有する。
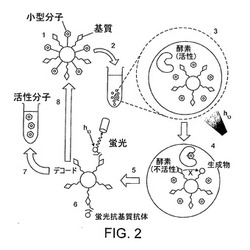
【図2】マイクロカプセル化を用いたPTP1B阻害剤のスクリーニング。オレンジ色または赤色の蛍光色素で染色した表面カルボキシレート基を有するポリスチレンビーズ(Fulton et al.,1997)をホスホペプチドPTP1B基質および切断可能なリンカーを介して結合したPTP1B阻害剤または非阻害化合物のいずれかで誘導する(1)。ビーズを混合した後、シングルのビーズおよび標的酵素(PTP1B)を、油中水エマルジョンを形成することによりマイクロコンパートメント内に共局在化させる(2)。化合物を放出する(光化学的)(3)。阻害剤は生成物(脱ホスホリル化ペプチド)に変換される基質の量を低減する(4)。酵素反応を停止し、エマルジョンを破壊する(5)。緑色蛍光抗基質抗体で標識した後、ビーズを3色フローサイトメトリーで分析し、阻害の程度およびビーズ上の化合物を同時に測定する(6)。最終的に、化合物ライブラリを光学的にタグ付けされたビーズ(後述)にカップリングし、フローサイトメトリーにより急速にデコードすることができる(100,000ビーズs-1以下)。ヒット化合物を再合成して、更に特性決定(7)するか合成進化の過程において産生して再スクリーニングすることができる(8)。
【図3】フッ化炭素中水エマルジョン中の小分子のコンパートメント化。実施例9に記載するとおりホモゲナイズにより水相中にテキサスレッド(1mM)およびカルセイン(1mM)を含有するパーフルオロオクチルブロミド中水エマルジョンを作成した。2種のエマルジョンを回転混合し、24時間後にエピ蛍光顕微鏡により画像化した。微小液滴間のテキサスレッド(赤色蛍光)およびカルセイン(緑色蛍光)の交換は観察されなかった。
【実施例】
【0159】
[実施例1:酵素タンパク質チロシンホスファターゼ1B(PTP1B)の阻害剤のスクリーニング]
PTP1Bはインスリンおよびレプチンのシグナル伝達の負の調節物質である。インスリンおよびレプチンに対する耐性はII型真性糖尿病および肥満の指標であり、従ってPTP1Bは糖尿病および肥満の治療のための魅力的な薬剤標的である(Johnson et al.,2002)。2種の油中水エマルジョンを以下の通り作成した。
【0160】
デカン中の1%(w/v)Span60および1%(w/v)コレステロールの溶液(全てSigma Aldrichから)は、デカン7.84mlにSpan60を80mg、コレステロールを80mg溶解することにより製造する。デカンを45に加熱し、界面活性剤およびコレステロールの完全な可溶化を可能とする。界面活性剤/デカンの溶液を200μlバッチに渡り分割し、37のブロックヒーター中に入れる。
【0161】
手操作押し出し装置(Mini extruder,Abanti Polar Lipids Inc,Alabaster,AL,USA)を製造元の取扱説明書に従って組み立てる。押し出しのためには、平均孔径14・高フシングルの19mmのTrack-Etchポリカーボネートフィルター(Whatman Nucleopore,Whatman,Maidstone,UK)をミニ押出機の内部に装着する。2本の気密性1mlハミルトンシリンジ(Gastight#1001、Hamilton Co,Reno,Nevada,USA)を押し出しに使用する。デカン1mlをにハミルトンシリンジ1本にロードしてシリンジをミニ押出機の一端に置き押出機の他方上の空のハミルトンシリンジ内にフィルターを経由してそれを押し出すことにより、デカン3ラ1mlで押出機を前洗浄した。
【0162】
第1のエマルジョンは、PTP1B活性に適合した緩衝液(25mM HEPES、pH7.4、125mM NaCl、10%グリセロール、1mM EDTA)(Doman et al.,2002)中のビス−ジフルオロメチレンホスホネートを有しており公知のPTP1B阻害剤である100・l化合物2(図1)50・・Johnson et al.,2002)、5mU/mlの標的酵素(ヒト組み換えPTP1B、残基1〜322;Biomol Research Laboratories,Inc.)、蛍光発生PTP1B基質6,8−ジフルオロ−4−メチルウンベリフェリルホスホネート(DiFMUP)(Molecular Probes)および100・lテキサスレッド(Sigma;励起/発光最大595/615nm;赤色蛍光)をハミルトンシリンジの1本に、予備加熱したデカン/界面活性剤混合物を他のハミルトンシリンジにロードすることにより作成する。シリンジを押出機のフィルターホルダーの両側の開口部内に装着する。化合物混合物を強制的にフィルターホルダーを通してデカン/界面活性剤混合物の入った別のシリンジ内に入れ、直接強制的に元のシリンジに戻すことにより、押し出しの1往復を完了する。合計で7.5往復の押し出しを完了する。充填されたシリンジを押出機から取り外し、1.7ml Axygen試験管内にあける(#MCT-175-C、Axygen Scientific,Inc.,Union City,CA,USA)。
【0163】
第2の油中水エマルジョンは化合物2の代わりにPTP1B阻害剤ではない化合物である100・lヒドロケイヒ酸(Aldrich)を、テキサスレッドの代わりに100・lカルセイン(Sigma;励起/発光最大470/509nm;緑色蛍光)を含有する以外は上記エマルジョンと同一に作成する。
【0164】
1:1000〜1:1(化合物2エマルジョン:ヒドロケイヒ酸エマルジョン)の範囲の比で2種のエマルジョンを振とうすることにより混合し、30分間37でインキュベートする。阻害剤は脱ホスホリル化生成物(DiFMU;励起/発光最大358/452nm;青色蛍光)に変換される非蛍光基質(DiFMUP)の量を低減する。
【0165】
次に油中水エマルジョンを以下の通り水中油中水ダブルエマルジョンに変換する。押出機(上記参照)を分解し、石鹸および逆浸透水で十分洗浄し、再度組み立てる。平均孔径8・高フシングルの19mmTrack-Etchポリカーボネートフィルターを装着する。押出機をリン酸緩衝食塩水(PBS)3×1mlで予備洗浄する。0.5%(w/v)Tween80(Sigma Aldrich)を含有するPBS 750μlを1mlの気密性ハミルトンシリンジにロードし、押出機に装着する。油中水エマルジョン250μlを別の1mlハミルトンシリンジにロードし、押出機に装着する。エマルジョンを強制的にフィルターを通してPBS/0.5%Tween80の入った別のシリンジ内に入れ、即座に強制的に元のシリンジに戻すことにより、押し出しの1サイクルを完了する。合計で4.5サイクルの押し出しを完了する。充填されたシリンジを押出機から取り外し、1.7mlAxygen試験管内にあける。形成された水中油中水のダブルエマルジョンを氷上に置く。
【0166】
次にダブルエマルジョンをMoFlo(Cytomation)フローサイトメトリーを用いた多色フローサイトメトリーにより分析する。主に、緑色蛍光を示す(ヒドロケイヒ酸を含有する)マイクロカプセルがPTP1BによるDiFMUPの脱ホスホリル化により青色蛍光も示す。主に、赤色蛍光を示す(化合物2を含有する)マイクロカプセルがPTP1Bの阻害により青色蛍光は殆どまたは全く示さない。
【0167】
[実施例2]
2種の水性混合物を氷上(反応を防止するため)において作成する。第1の混合物はPTP1B活性に適合した緩衝液(25mM HEPES、pH7.4、125mM NaCl、10%グリセロール、1mM EDTA)(Doman et al.,2002)中のビス−ジフルオロメチレンホスホネートを有しており知られたPTP1B阻害剤である100・l化合物2(図1)(Johnson et al.,2002)、5mU/mlの標的酵素(ヒト組み換えPTP1B、残基1〜322;Biomol Research Laboratories,Inc.)、蛍光発生PTP1B基質6,8−ジフルオロ−4−メチルウンベリフェリルホスホネート(DiFMUP)(Molecular Probes)および100・lテキサスレッド(Sigma;励起/発光最大595/615nm;赤色蛍光)を含有する。第2の混合物は化合物2の代わりにPTP1B阻害剤ではない化合物である100・lヒドロケイヒ酸(Aldrich)を、テキサスレッドの代わりに100・lカルセイン(Sigma;励起/発光最大470/509nm;緑色蛍光)を含有する以外は上記と同一に作成する。
【0168】
化合物混合物の各々の50μlを順次、実施例1に記載したとおり作成し37に保持したデカン中1%(w/v)Span60および1%(w/v)コレステロールの溶液に添加し、その間5mmの分散ツールでUltra-TurraxT8ホモゲナイザー(IKA)を用いながら25,000r.p.mでホモゲナイズする。ホモゲナイズは第2の小分量を添加した後3分間継続する。次に生成した粗野なエマルジョンを実施例1の通り押し出し、微小な油中水エマルジョンを作成し、30分間37でインキュベートする。阻害剤は脱ホスホリル化生成物(DiFMU;励起/発光最大358/452nm;青色蛍光)に変換される非蛍光基質(DiFMUP)の量を低減する。次に油中水エマルジョンを水中油中水ダブルエマルジョンに変換し、実施例1に記載の通り多色フローサイトメトリーで分析する。主に、緑色蛍光を示す(ヒドロケイヒ酸を含有する)マイクロカプセルがPTP1BによるDiFMUPの脱ホスホリル化により青色蛍光も示す。主に、赤色蛍光を示す(化合物2を含有する)マイクロカプセルがPTP1Bの阻害により青色蛍光は殆どまたは全く示さない。
【0169】
[実施例3:化合物ライブラリからのPTP1B阻害剤のスクリーニング]
実施例1に記載の通り100種の油中水エマルジョンを氷上(反応を防止するため)において作成する。第1のエマルジョンは、ビス−ジフルオロメチレンホスホネートを有しており知られたPTP1B阻害剤である100・l化合物2(図1)(Johnson et al.,2002)、5mU/mlの標的酵素(ヒト組み換えPTP1B、残基1〜322;Biomol Research Laboratories,Inc.)、蛍光発生PTP1B基質6,8−ジフルオロ−4−メチルウンベリフェリルホスホネート(DiFMUP)(Molecular Probes)および発光最大585nm、655nmおよび705nmを有する予備設定された比のQdot(商標)ストレプトアビジンコンジュゲート(Quantum Dot Corporation,Hayward CA)の混合物をPTP1B活性に適合した緩衝液(25mM HEPES、pH7.4、125mM NaCl、10%グリセロール、1mM EDTA)(Doman et al.,2002)に分散することにより作成する。99種の他の油中水エマルジョンは、化合物2の代わりにカルボン酸有機ビルディングブロックライブラリ(Aldrich)由来の99種のカルボン酸のうちの1つ、および、発光最大585nm、655nmおよび705nmを有する異なる比のQdot(商標)ストレプトアビジンコンジュゲートを各々が含有する以外は上記と同一である。全てのエマルジョンにおいて、705nmQdot(商標)ストレプトアビジンコンジュゲートの濃度は100nMであり、585nmおよび655nmQdot(商標)ストレプトアビジンコンジュゲートの濃度は0、11、22、33、44、55、66、77、88または100nMの何れかとする。従って、100(10ラ10)通りのQdot(商標)ストレプトアビジンコンジュゲートの濃度があることになり、これにより、705nm、585nmおよび655nmにおける蛍光の蛍光比を測定することにより読み取られる独特の蛍光シグネチャーを各化合物を含有するマイクロカプセルが保有できるようになる。
【0170】
100種のエマルジョンを振とう攪拌により等しい比で混合し、温度を30分間25まで上昇させる。阻害剤は脱ホスホリル化生成物(DiFMU;励起/発光最大358/452nm;青色蛍光)に変換される非蛍光基質(DiFMUP)の量を低減する。次に油中水エマルジョンを水中油中水ダブルエマルジョンに変換し、実施例1に記載の通り多色フローサイトメトリーで分析する。化合物2を含有するマイクロカプセルのQdot蛍光シグネチャーのものを除き、主に、全てのマイクロカプセルはPTP1BによるDiFMUPの脱ホスホリル化により青色蛍光を示す。
【0171】
[実施例4:化合物ライブラリからのPTP1B阻害剤のスクリーニング]
100種の水性混合物を氷上(反応を防止するため)において作成する。第1の混合物は、PTP1B活性に適合した緩衝液(25mM HEPES、pH7.4、125mM NaCl、10%グリセロール、1mM EDTA)(Doman et al.,2002)中のビス−ジフルオロメチレンホスホネートを有しており知られたPTP1B阻害剤である100・l化合物2(図1)(Johnson et al.,2002)、5mU/mlの標的酵素(ヒト組み換えPTP1B、残基1〜322;Biomol Research Laboratories,Inc.)、蛍光発生PTP1B基質6,8−ジフルオロ−4−メチルウンベリフェリルホスホネート(DiFMUP)(Molecular Probes)および発光最大585nm、655nmおよび705nmを有する予備設定された比のQdot(商標)ストレプトアビジンコンジュゲート(Quantum Dot Corporation,Hayward CA)を含有する。99種の他の水性混合物は、化合物2の代わりにカルボン酸有機ビルディングブロックライブラリ(Aldrich)由来の99種のカルボン酸のうちの1つ、および、発光最大585nm、655nmおよび705nmを有する異なる比のQdot(商標)ストレプトアビジンコンジュゲートを各々が含有する以外は上記と同一である。全ての混合物において、705nmQdot(商標)ストレプトアビジンコンジュゲートの濃度は100nMであり、585nmおよび655nmQdot(商標)ストレプトアビジンコンジュゲートの濃度は0、11、22、33、44、55、66、77、88または100nMの何れかとする。従って、100(10ラ10)通りのQdot(商標)ストレプトアビジンコンジュゲートの濃度があることになり、これにより、705nm、585nmおよび655nmにおける蛍光の蛍光比を測定することにより読み取られる独特の蛍光シグネチャーを各化合物を含有するマイクロカプセルが保有できるようになる。
【0172】
化合物混合物の各々0.5μlを順次、実施例1に記載したとおり作成し37に保持したデカン中1%(w/v)Span60および1%(w/v)コレステロールの溶液に添加し、その間5mmの分散ツールでUltra-TurraxT8ホモゲナイザー(IKA)を用いながら25,000r.p.mでホモゲナイズする。ホモゲナイズは第2の小分量を添加した後3分間継続する。次に生成した粗野なエマルジョンを実施例1の通り押し出し、微小な油中水エマルジョンを作成し、30分間37でインキュベートする。阻害剤は脱ホスホリル化生成物(DiFMU;励起/発光最大358/452nm;青色蛍光)に変換される非蛍光基質(DiFMUP)の量を低減する。次に油中水エマルジョンを水中油中水ダブルエマルジョンに変換し、実施例1に記載の通り多色フローサイトメトリーで分析する。化合物2を含有するマイクロカプセルのQdot蛍光シグネチャーのものを除き、主に、全てのマイクロカプセルはPTP1BによるDiFMUPの脱ホスホリル化により青色蛍光を示す。
【0173】
[実施例5:微小流体システムにおけるマイクロカプセルを使用したPTP1B阻害剤のスクリーニング]
微小チャンネルはポリ(ジメチルシロキサン)(PDMS)(McDonald and Whitesides,2002)中の急速なフォトタイピングを用いて長方形の断面を有するように加工し、Song and Ismagilov,2003に記載の通り疎水性を付与する。シリンジポンプを用いて流動を起こした(Harvard Apparatus PHD2000 Infusionポンプ)。水溶液については、取り外し可能な27ゲージ針のついた50μlのハミルトンガスタイトシリンジ(1700シリーズ、TLL)を30ゲージのテフロン(登録商標)チューブ(Weico Wire and Cable)と共に使用した。キャリア流体に対しては、1mlハミルトンガスタイトシリンジ(1700シリーズ、TLL)をハミルトンの1ハブを有する30ゲージのテフロン(登録商標)針と共に使用した(Song and Ismagilov,2003)。キャリア流体はパーフルオロデカリン(PFD)中9%(v/v)のC6F11C2H4OHとする(Song et al.,2003)。全ての水溶性試薬はPTP1B活性に適合した緩衝液(25mM HEPES、pH7.4、125mM NaCl、1mM EDTA)中に溶解した。
【0174】
50mU/mlの標的酵素(ヒト組み換えPTP1B、残基1〜322;Biomol Research Laboratories,Inc.)の溶液、および、a)ビス−ジフルオロメチレンホスホネートを有しており知られたPTP1B阻害剤である100・l化合物2(図1)(Johnson et al.,2002)またはb)PTP1B阻害剤ではない化合物である100・lヒドロケイヒ酸(Aldrich)を不活性の中心ストリーム(25mM HEPES、pH7.4、125mM NaCl、1mM EDTA)を有する2本の層流ストリームとしてのマイクロチャンネル中を流動させることにより、これらを分離し、酵素と化合物が液滴マイクロカプセル形成よりも前に接触することを防止する(Song et al.,2003)。これらの3ストリームを連続的に水非混和性のフッ化炭素キャリア流体(PFD中9%(v/v)C6F11C2H4OH)中に注入する。水溶液用の導入チャンネルは50・・SUP>2の広さとし、PFD用チャンネルは28・黒揩ニする。0.6:0.3、1.0:0.6、12.3:3.7、10:6および20:6を含む種々のPFD/水の計量的流量(・^分)を使用でき、得られる流量はそれぞれ10、19、190、190および300mm/秒となる。チャンネルの全幅を占有する水性マイクロカプセルはPFDストリーム中の液滴の破壊により形成する(Song et al.,2003)。化合物2またはヒドロケイヒ酸の何れかを含有するマイクロカプセルは、化合物2およびヒドロケイヒ酸を含有するシリンジを用いた注入を切り替えながら行うことにより形成できる。
【0175】
液滴形成地点のすぐ下流のチャンネルは1mmの距離に渡りピーク間の距離50・高ナ旋廻している。これにより混乱移流によるマイクロカプセルの内容物の急速な混合が起こる(Song et al.,2003)。この地点の後、マイクロカプセルは長さ60cmのマイクロチャンネルを経由して1分間まで流動する(これにより阻害剤の結合を可能とする)。次にこのマイクロチャンネルを上記した通り形成したPFD中9%(v/v)C6F11C2H4OH中に水性マイクロカプセルを含有する60ラ50・・SUP>2マイクロチャンネルと合流させる。これらのより大きいマイクロカプセルは25mM HEPES、pH7.4、125mM NaCl、1mM EDTA中の蛍光発生PTP1B基質6,8−ジフルオロ−4−メチルウンベリフェリルホスホネート(DiFMUP)(Molecular Probes)を含有する。マイクロチャンネルの間の注入の後、拡張した主チャンネルは100ラ50・・SUP>2であり、マイクロカプセルはチャンネルをブロックせず、大型のマイクロカプセル(DiFMUPを含有)が小型のマイクロカプセル(PTP1Bおよび化合物を含有)と合体するまで異なる速度で移動する(Song et al.,2003)。大型および小型のマイクロカプセルの生成の頻度は、各大型マイクロカプセルが融合すべき小型マイクロカプセルを有するように、等しくする。融合したマイクロカプセルは長さ60cmのマイクロチャンネルを経由して2分間まで流動する。DiFMUP(励起/発光最大358/452nm;青色蛍光)の生成によるマイクロカプセルの蛍光はエピ蛍光顕微鏡を用いて測定する。主に、青色蛍光を示すマイクロカプセルがヒドロケイヒ酸を含有するものであり、化合物2を含有するマイクロカプセルはPTP1Bの阻害により低い蛍光を示す。
【0176】
[実施例6:マイクロビーズへの化合物ライブラリの結合]
表面上にカルボキシレート官能基を有する直径5.5・高フポリスチレンマイクロビーズはオレンジ色(585nm)および赤色(>650nm)の蛍光色素の厳密な比の取り込みの結果として光学的にタグ付けされた形態で市販されている(www.luminexcorp.com)(Fulton et al.,1997)。各々が独特の光学的シグネチャー(www.luminexcorp.com)を有するこのようなビーズ100個のセットを過剰なエチレンジアミンおよびEDC(塩酸1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド(Pierce))でHermanson,1996に記載の通り修飾し、表面に第1アミノ基を形成した。次に上記した通りEDCを用いてアミド結合を形成することにより、光分解性のリンカー4−(4−ヒドロキシメチル−2−メトキシ−5−ニトロフェノキシ)ブタン酸(NovaBiochem)(Holmes and Jones,1995)をビーズに結合させる。次に、リンカーアルコールと反応させることによりカルボン酸有機ビルディングブロックライブラリ(Aldrich)由来の100種の異なるカルボン酸をビーズにカップリングさせてカルボキシレートエステルを形成し、100種の異なる光学的にタグ付けされたビーズの各々が異なるカルボン酸にカップリングし、そして各ビーズがカルボン酸〜106分子で誘導体化されるようにする。B100AP354nmUVランプ(UVP)を用いて〜5cmの距離から氷上4分間照射することによりカルボン酸としてビーズから化合物を放出させる。
【0177】
[実施例7:マイクロビーズに結合した化合物を用いた酵素タンパク質チロシンホスファターゼ1B(PTP1B)の阻害剤のスクリーニング]
PTP1Bはインスリンおよびレプチンのシグナル伝達の負の調節物質である。インスリンおよびレプチンに対する耐性はII型真性糖尿病および肥満の指標であり、従ってPTP1Bは糖尿病および肥満の治療のための魅力的な薬剤標的である(Johnson et al.,2002)。表面上にカルボキシレート官能基を有する直径5.5・高フポリスチレンマイクロビーズはオレンジ色(585nm)および赤色(>650nm)の蛍光色素の厳密な比の取り込みの結果として光学的にタグ付けされた形態で市販されている(www.luminexcorp.com)(Fulton et al.,1997)。まず、マイクロビーズ上のカルボキシレート官能基を実施例6の場合と同様にエチレンジアミンおよびEDCを用いて第1アミンに変換する。次にPTP1Bのホスホペプチド基質であるウンデカペプチドEGFR988-998(DADEpYLIPQQG)(Zhang et al.,1993)をEDCを用いて表面アミノ基を介してマイクロビーズの両方のセットにカップリングさせる。このペプチドはカルボキシレート−O−アリルエステルを用いた側鎖カルボキシレート基上の直角保護を用いてSieber Amide樹脂(9−Fmoc−アミノ−キサンテン−3−イルオキシ−Merrifield樹脂)(Novabiochem)上の固相合成により作成する。テトラデカンジ酸からなるリンカーをN末端にカップリングし、1%TFAを用いてビーズからペプチドを脱離させ、C末端アミドを有するペプチドを得る。ペプチドをリンカーを介してビーズにカップリングさせ(EDC使用)、ビーズ当たり〜105ペプチドを得る。次に実施例6に記載の通り光化学分解性リンカー4−(4−ヒドロキシメチル−2−メトキシ−5−ニトロフェノキシ)ブタン酸を結合することにより残余の表面アミノ基を修飾する。次にペプチドの側鎖カルボキシレート上の保護基をPd(Ph3)4/CHCl3/HOAc/N−メチルモルホリンを用いて脱離させる。第1のセットのマイクロビーズを知られたPTP1B阻害剤である化合物である3−(4−ジフルオロホスホノメチルフェニル)プロパン酸(化合物1、図1)で誘導体化する(Johnson et al.,2002)。第1のセットのビーズとは別の光学的タグを有する第2のセットのビーズはPTP1B阻害剤ではない化合物であるヒドロケイヒ酸(Aldrich)で誘導体化する。各々の場合において、実施例6に記載の通り、化合物はリンカーアルコールと反応させることによりカップリングしてカルボキシレートエステルを形成する。各マイクロビーズは〜106分子で誘導体化する(Fulton et al.,1997)。
【0178】
次にマイクロビーズを図2に示す方法を用いてスクリーンする。2セットのマイクロビーズを1:100〜1:1(化合物1ビーズ:ヒドロケイヒ酸ビーズ)の範囲の比で混合し、合計108マイクロビーズをPTP1B活性に適合した緩衝液(25mM HEPES、pH7.4、125mM NaCl、10%グリセロール、1mM EDTA)(Doman et al.,2002)中、氷上(反応を防止するため)で、10nMの濃度の標的酵素(ヒト組み換えPTP1B、残基1〜322;Biomol Research Laboratories,Inc.)と混合する。次にシングルのビーズおよび標的酵素(PTP1B)を、油中水エマルジョンを形成(やはり氷上)することによりマイクロカプセル内に共局在化させる。ビーズの濃度は大部分のマイクロカプセルが1個または0個のビーズを含有するようにする。化合物を光化学的(実施例6に記載)に放出させ、温度を25に上昇させる。阻害剤は生成物(脱ホスホリル化ペプチド)に変換される基質の量を低減する。エマルジョンを4に冷却し、Griffiths and Tawfik,2003に記載の通り破壊して100・lバナジン酸塩中にいれ、反応を停止させる(Harder et al.,1994)。製造元の取扱説明書に従って緑色(530nm)蛍光色素フルオレセインイソチオシアネートで標識した抗基質(抗ホスホチロシン)抗体(マウスモノクローナルIgG2bPY20,(Santa Cruz))で標識した後、FACScan(Becton-Dickinson)、FACScalibur(Becton-Dickinson)またはMoFlo(Cytomation)フローサイトメトリーを用いて3色フローサイトメトリーによりビーズを分析し、阻害の程度およびビーズ上の化合物を同時に測定する。主に、PTP1B阻害剤でコーティングされたマイクロビーズ上のみペプチドの脱ホスホリル化が観察され、他のマイクロビーズでは観察されなかった。
【0179】
[実施例8:マイクロビーズに結合した化合物ライブラリからのPTP1B阻害剤のスクリーニング]
表面上にカルボキシレート官能基を有し、各々がオレンジ色(585nm)および赤色(>650nm)の蛍光色素の厳密な比の取り込み(Fulton et al.,1997)の結果として独特の光学的シグネチャーを有する(www.luminexcorp.com)直径5.5・高フポリスチレンマイクロビーズ100個のセットをPTP1Bのホスホペプチド基質であるウンデカペプチドEGFR988-998(DADEpYLIPQQG)(Zhang et al.,1993)および光化学的に切断できるリンカーを介して各々結合した100種の異なるカルボン酸を用いて、実施例7に記載の通り誘導体化する。これらのカルボン酸の1つは知られたPTP1B阻害剤である化合物である3−(4−ジフルオロホスホノメチルフェニル)プロパン酸(化合物1、図1)である(Johnson et al.,2002)。他の99種のカルボン酸は実施例6と同様にカルボン酸有機ビルディングブロックライブラリ(Aldrich)由来である。次に100ビーズセットの各々の等しい数量を混合し、実施例7に記載の通りスクリーニングする。主に、PTP1B阻害剤の3−(4−ジフルオロホスホノメチルフェニル)プロパン酸(化合物1、図1)でコーティングされたマイクロビーズ上のみペプチドの脱ホスホリル化が観察され、他の化合物でコーティングされたマイクロビーズでは観察されなかった。
【0180】
[実施例9:フッ化炭素中水エマルジョンにおける小型分子のコンパートメント化]
95%(v/v)パーフルオロオクチルブロミド、溶液中目的の分子を含有する5%(v/v)リン酸塩緩衝食塩水、および、界面活性剤としての2%(w/v)C8F17C11H22OP(O)[N(CH2CH2)2O]2(F8H11DMP)を含有するフッ化炭素中水エマルジョンを14・tィルター(Osmonics)を通過させる押し出し(15回)によるか、または、5mmの分散ツールでUltra-TurraxT8ホモゲナイザー(IKA)を用いながら25,000r.p.mで5分間ホモゲナイズすることにより、本質的にSadtler et al.,1996に記載の通り形成した。100・香`2mMの濃度で水相中に溶解した一連の小型蛍光分子を含有するエマルジョンを作成した。カルセイン、テキサスレッド、フルオレセイン、クマリン102、7−ヒドロキシクマリン−3−カルボン酸および7−ジエチルアミノ−4−メチルクマリン(クマリン1)を含むこれらの分子は、分子量203〜625DaおよびSRCのLogKow/KowWinプログラム(Meylan and Howard,1995)を用いて計算した場合に0.49〜4.09の範囲のLogP値を有していた。異なる色の蛍光色素を含むエマルジョンを振とう攪拌により混合した。混合されたエマルジョンのエピ蛍光顕微鏡観察によればコンパートメント化が観察された。混合後24時間にはコンパートメント間の交換は観察されなかった(図3参照)。
【0181】
上記した本明細書において言及した全ての出版物および該出版物中に引用されている参考文献は参照により本明細書に組み込まれる。本発明の記載した方法および系の種々の変更および変形は本発明の範囲および精神を逸脱することなく当業者には明らかとなる。本発明は特定の好ましい実施形態との関連において説明してきたが、請求項に記載した本発明はそのような特定の実施形態に限定されない。実際、分子生物学または関連の分野の当業者には自明である本発明の実施のための記載した様式の種々の変更は添付する請求項の範囲内であることを意図するものである。
【技術分野】
【0001】
本発明は、マイクロカプセルのスクリーニングにより化合物のライブラリから1以上の化合物を選択する方法に関する。本発明の方法は、特にいずれか所望の薬物標的に対する潜在的活性について候補薬物などの低分子量化合物の選択に適用できる。
【背景技術】
【0002】
本発明は、生化学的系における標的成分に結合するか、標的の活性をモジュレートする分子の識別に使用される方法に関する。
【0003】
過去10年間に渡り、化合物ライブラリのハイスループットスクリーニング(HTS)は医薬品研究の基礎となる技術となった。HTSの研究は盛んである。現在の推定では生物学的スクリーニングおよび前臨床の薬理学的試験のみで医薬品産業の総研究開発(R&D)経費の〜14%を計上する(Handen,Summer 2002)。運転コストを低減し、スクリーニングできる化合物および標的の数を増大させる必要性からHTSは近年顕著な進歩を示している。従来の96穴のプレートは現在では384ウェル、1536ウェル、さらには3456ウェルのフォーマットに大部分が置き換えられている。これが市販のプレート操作ロボット工学と組み合わせられて、一日当たり100,000試験以上のスクリーニングを可能とし、試験の小型化により試験当たりのコストを大幅に削減している。
【0004】
HTSは他の数種の開発により補完されている。コンビナトリアル化学は、HTSのための構造的に関連する多数の化合物を生成するための強力な技術である。現在、コンビナトリアル合成は大部分が空間的に分割されたパラレル合成を採用している。合成できる化合物の数は数百または数千に限定されるが、化合物は数ミリグラムまたは数十ミリグラムの規模で合成でき、完全な特性決定、さらには精製まで可能にする。より大型のライブラリは1ビーズ1化合物ライブラリを生成させるビーズ上のスプリット合成を用いて合成できる。この方法が採用されている範囲がはるかに狭小である理由は、一連の制約事項:例えば固相合成の必要性;最終生成物の特性決定の困難(シェア数と小規模のため);1回または2,3回の試験にしか十分でない程度の少量の、ビーズ上の化合物;ヒット化合物の構造の同定の困難(タグ付けまたはコード方法に依存する場合が多く、合成および分析の両方を複雑化させる)である。これにもかかわらず、スプリット合成およびシングルビーズ分析はなお信頼できるものである。最近、ミニチュア化されたスクリーニングおよびシングルビーズ分析における多大な開発が行われた。例えば、印刷技術によりタンパク質結合試験が、各1nl容量の10,800化合物スポットを含むスライド上で実施できるようになった(Hergenrother et al.,2000)。しかしながらコンビケムは限定された数量のリード化合物しか与えていない。2000年4月の段階で、コンビナトリアル化学のヒストリを有する化合物僅か10種のみが臨床研究に付され、これらの3種を除き全てが(オリゴ)ヌクレオチドまたはペプチドである(Adang and Hermkens,2001)。実際、過去10年間のHTSおよびコンビナトリアル化学における多大なる投資にもかかわらず、年間導入される新規薬剤の数が一定以上となることはない。
【0005】
ダイナミックコンビナトリアル化学(DCC)もまた可逆的に相互交換可能な成分のセットからダイナミックコンビナトリアルライブラリ(DCL)を生成するために使用できるが、今日まで生成されスクリーニングされたライブラリのサイズはなおかなり限定されている(≦40,000)(Ramstron and Lehn,2002)。
【0006】
試験のための候補分子のサブセットを識別するためにコンピューター試行を用いて多数の化合物ベースを検索する仮想スクリーニング(VS)(Lyne,2002)もまたHTSと統合されれば極めて有用である。しかしながら、VSおよびHTSの性能を直接比較した試験は今日までほとんど無く、更なる検証が必要である。
【0007】
これら全ての開発にもかかわらず、現在のスクリーニングのスループットはなお十分とは程遠いものである。ヒトゲノムの個体遺伝子の数(〜30,000)および既存の化学を用いて理論的に得られる独特の化学構造の数の現在の推定値によれば、全ての考えられる治療標的に対して構造−活性スペースを完全にマッピングするためには多大な数の試験が必要となることが示唆され得る(Burbaum,1998)。
【0008】
従って、僅か数フェムトリットルの反応容量を用いながら、極めて低コストで多大な数量(1010)の化合物を迅速にスクリーニングすることを許容する方法の提供は、新薬の手がかりを得る際に多大な有用性を有するであろう。
【0009】
Tawfik and Griffiths(1998)、およびPCT国際特許出願第GB98/01889号は、分子レベルで遺伝子型および表現型に関連するための、マイクロカプセル内のコンパートメント化を用いるインビトロでの進化のための系について記載している。Tawfik and Griffiths(1998)、およびPCT国際特許出願第GB98/01889号の幾つかの実施形態では、遺伝子産物の所望の活性はそれをコードする(そして、同一マイクロカプセル内に存在する)遺伝子エレメントの修飾を生じさせる。修飾された遺伝子エレメントは次に、その後のステップにおいて選択できる。
【先行技術文献】
【非特許文献】
【0010】
・Adang, A. E., and Hermkens, P. H. (2001). The contribution of combinatorial chemistry to lead generation: an interim analysis. Curr Med Chem 8, 985-998.
・Anderson, J. E. (1993). Restriction endonucleases and modification methylases. Curr Op Struct Biol 3, 24-30.
・Becher, P. (1957) Emulsions: theory and practice. Reinhold, New York.
・Benita, S. (ed.). (1996) Microencapsulation: methods and industrial applications. Marcel Dekker, New York.
・Bernath, K., Hai, M., Mastrobattista, E., Griffiths, A.D., Magdassi, S. and Tawfik, D.S. (2004) In vitro compartmentalization by double emulsions: sorting and gene enrichment by fluorescence activated cell sorting. Anal Biochem, 325, 151-157.
・Bru, R. and Walde, P. (1991) Product inhibition of alpha-chymotrypsin in reverse micelles. Eur J Biochem, 199, 95-103.
・Bru, R. and Walde, P. (1993) Catalytic activity of elastase in reverse micelles. Biochem Mol Biol Int, 31, 685-692.
・Burbaum, J. (1998). Miniaturization technologies in HTS: how fast, how small, how soon? Drug Discov Today 3, 313-322.
・Calvert, P. (2001) Inkjet printing for materials and devices. Chem. Mater., 13, 3299-3305.
・Chakrabarti, A.C., Breaker, R.R., Joyce, G.F. and Deamer, D.W. (1994) Production of RNA by a polymerase protein encapsulated within phospholipid vesicles. J Mol Evol, 39, 555-559.
・Chang, T.M. (1987) Recycling of NAD(P) by multienzyme systems immobilized by microencapsulation in artificial cells. Methods Enzymol, 136, 67-82.
・Chang, T.M.S. (1992) Recent advances in artificial cells based on microencapsulation. In Donbrow, M. (ed.), Microcapsules and nanoparticles in medicine and pharmacy. CRC Press, Boca Raton, Florida, pp. 323-339.
・Creagh, A.L., Prausnitz, J.M. and Blanch, H.W. (1993) Structural and catalytic properties of enzymes in reverse micelles. Enzyme Microb Technol, 15, 383-392.
・Curran, D.P. (1998) Strategy-level separations in organic synthesis: from planning to practice. Angew Chem Int Ed, 37, 1174-1196.
・Czarnik, A. W. (1997). Encoding methods for combinatorial chemistry. Curr Opin Chem Biol 1, 60-66.
Davis, S. S., and Walker, I. M. (1987). Multiple emulsions as targetable delivery systems. Methods in Enzymology 149, 51-64.
・de Gans, B.-J., Duineveld, P.C. and Schubert, U.S. (2004) Inkjet printing of polymers: state of the art and future developments. Advanced materials, 16, 203-213.
・Dickinson, E. (1994) Emulsions and droplet size control. In Wedlock, D.J. (ed.), Controlled particle, droplet and bubble formation. Butterworth-Heinemann, Oxford, pp. 191-257.
・Doi, N., and Yanagawa, H. (1999). STABLE: protein-DNA fusion system for screening of combinatorial protein libraries in vitro. FEBS Lett 457, 227-230.
・Doman, T.N., McGovern, S.L., Witherbee, B.J., Kasten, T.P., Kurumbail, R., Stallings, W.C., Connolly, D.T. and Shoichet, B.K. (2002) Molecular docking and high-throughput screening for novel inhibitors of protein tyrosine phosphatase-1B. J Med Chem, 45, 2213-2221.
・Finch, C.A. (1993) Encapsulation and controlled release. Spec. Publ.-R. Soc. Chem., 138, 35.
・Fornusek & Vetvicka, Crit Rev Ther Drug Carrier Syst. 1986;2(2):137-74
・Fu, A.Y., Chou, H.P., Spence, C., Arnold, F.H. and Quake, S.R. (2002) An integrated microfabricated cell sorter. Anal Chem, 74, 2451-2457.
・Fulton, R.J., McDade, R.L., Smith, P.L., Kienker, L.J. and Kettman, J.R., Jr. (1997) Advanced multiplexed analysis with the FlowMetrix system. Clin Chem, 43, 1749-1756.
・Ghadessy, F.J., Ong, J.L. and Holliger, P. (2001) Directed evolution of polymerase function by compartmentalized self- replication. Proc Natl Acad Sci U S A, 98, 4552-4557.
・Gordon, K., and Balasubramanian, S. (1999). Solid phase chemistry - designer linkers for combinatorial chemistry. J Chem Technol Biotechnol 74, 835-851.
・Griffiths, A. D., Williams, S. C., Hartley, O., Tomlinson, I. M., Waterhouse, P., Crosby, W. L., Kontermann, R. E., Jones, P. T., Low, N. M., Allison, T. J., and et al. (1994). Isolation of high affinity human antibodies directly from large synthetic repertoires. Embo J 13, 3245-3260.
・Griffiths, A.D. and Tawfik, D.S. (2003) Directed evolution of an extremely fast phosphotriesterase by in vitro compartmentalization. Embo J, 22, 24-35.
・Guixe et al., Ligand-induced conformational transitions in Escherichia coli phosphofructokinase 2: evidence for an allosteric site for MgATP2-.
Biochemistry. 1998 Sep 22;37(38):13269-75.
・Haber, J., Maslakiewicz, P., Rodakiewicz, N.J. and Walde, P. (1993) Activity and spectroscopic properties of bovine liver catalase in sodium bis(2-ethylhexyl)sulfosuccinate/isooctane reverse micelles. Eur J Biochem, 217, 567-573.
・Han, M., Gao, X., Su, J. Z., and Nie, S. (2001). Quantum-dot-tagged microbeads for multiplexed optical coding of biomolecules. Nat Biotechnol 19, 631-635.
・Han, M., Gao, X., Su, J.Z. and Nie, S. (2001) Quantum-dot-tagged microbeads for multiplexed optical coding of biomolecules. Nat Biotechnol, 19, 631-635.
・Handen, J. S. (Summer 2002). High-throughput screening - challenges for the future. Drug Discov World, 47-50.
・Harder, K. W., Owen, P., Wong, L. K., Aebersold, R., Clark-Lewis, I., and Jirik, F. R. (1994). Characterization and kinetic analysis of the intracellular domain of human protein tyrosine phosphatase beta (HPTP beta) using synthetic phosphopeptides. Biochem J 298 ( Pt 2), 395-401.
・Haugland, R.P., (1996). Handbook of fluorescent probes and research chemicals. Spence, M.T.Z. Ed
・Heim R, Tsien RY. Engineering green fluorescent protein for improved brightness, longer wavelengths and fluorescence resonance energy transfer. Curr Biol. 1996 Feb 1;6(2):178-82.
・Hergenrother, P. J., Depew, K. P., and Schreiber, S. L. (2000). Small-molecule microarrays: covalent attachment and screening of alcohol-containing small molecules on glass slides. J Am Chem Soc 122, 7849-7850.
・Hermanson, G.T. (1996) Bioconjugate techniques. Academic Press, San Diego.
・Hildebrand, J.H. and Cochran, D.F.R. (1949) J. Am. Chem. Soc., 71, 22.
・Hochuli, E., Dobeli, H., and Schacher, A. (1987). New metal chelate adsorbent selective for proteins and peptides containing neighbouring histidine residues. J Chromatogr 411, 177-184.
・Holmes, C. P., and Jones, D. G. (1995). Reagents for combinatorial crganic synthesis: development of a new o-nitrobenzyl photolabile linker for solid phase synthesis. J Org Chem 60, 2318-2319.
・Hudlicky, M. (1992) Chemistry of Organic Fluorine Compounds. Ellis Horwood, New York.
・Johannsson, A. (1991). Heterogeneous enzyme immunoassays. In Principles and practice of immunoassays, C. P. Price, and D. J. Newman, eds. (New York, Stockton Press), pp. 295-325.
・Johannsson, A., and Bates, D. L. (1988). Amplification by second enzymes. In ELISA and other solid phase immunoassays, D. M. Kemeny, and S. J. Challacombe, eds. (Chichester, John Wiley), pp. 85-106.
・Johnson, T. O., Ermolieff, J., and Jirousek, M. R. (2002). Protein tyrosine phosphatase 1B inhibitors for diabetes. Nature Reviews Drug Discovery 1, 696 -709.
・Keij et al., Cytometry. 1995 Mar 1;19(3):209-16
・Kerker, Cytometry. 1983 Jul;4(1):1-10
・Klug, A. (1995). Gene regulatory proteins and their interaction with DNA. Ann N Y Acad Sci 758, 143-160.
・Klug, A., and Schwabe, J. W. (1995). Protein motifs 5. Zinc fingers. Faseb J 9, 597-604.
・Krafft, M.P., Chittofrati, A. and Riess, J.G. (2003) Emulsions and microemulsions with a fluorocarbon phase. Curr. Op. Colloid Interface Sci., 8, 251-258.
・Kumar, A., Kumar, A. and Katiyar, S.S. (1989) Activity and kinetic characteristics of glutathione reductase in vitro in reverse micellar waterpool. Biochim Biophys Acta, 996, 1-6.
・Lee, Y.-F., Tawfik, D. S., and Griffiths, A. D. (2002). Investigating the target recognition of DNA cytosine-5 methyltransferase HhaI by library selection using in vitro compartmentalisation (IVC). Nucleic Acids Res 30, 4937-4944.
・Lim, F. (ed.). (1984) Biomedical applications of microencapsulation. CRC Press, Boca Raton, Florida.
・Lim, F. and Sun, A.M. (1980) Microencapsulated islets as bioartificial endocrine pancreas. Science, 210, 908-910.
・Link, D.R., Anna, S.L., Weitz, D.A. and Stone, H.A. (2004) Geometrically mediated breakup of drops in microfluidic devices. Phys. Rev. Letts., 92, 054503.
・Lipinski, C.A., Lombardo, F., Dominy, B.W. and Feeney, P.J. (2001) Experimental and computational approaches to estimate solubility and permeability in drug discovery and development settings. Adv Drug Deliv Rev, 46, 3-26.
・Lissant, K.J. (ed.). (1974) Emulsions and emulsion technology. Marcel Dekker, New York.
・Lissant, K.J. (ed.). (1984) Emulsions and emulsion technology. Marcel Dekker, New York.
・Lowe, K.C. (2002) Perfluorochemical respiratory gas carriers: benefits to cell culture systems. J. Fluorine Chem., 118, 19-26.
・Luisi, P.L. and B., S.-H. (1987) Activity and conformation of enzymes in reverse micellar solutions. Methods Enzymol, 136, 188-216.
・Lyne, P. D. (2002). Structure-based virtual screening: an overview. Drug Discov Today 7, 1047-1055.
・Mackenzie and Pinder, Dev Biol Stand. 1986;64:181-93.
・Mahajan NP, Linder K, Berry G, Gordon GW, Heim R, Herman B. Bcl-2 and Bax interactions in mitochondria probed with green fluorescent protein and fluorescence resonance energy transfer. Nat Biotechnol. 1998 Jun;16(6):547-52.
・Mao, Q. and Walde, P. (1991) Substrate effects on the enzymatic activity of alpha-chymotrypsin in reverse micelles. Biochem Biophys Res Commun, 178, 1105-1112.
・Mao, Q., Walde, P. and Luisi, P.L. (1992) Kinetic behaviour of alpha-chymotrypsin in reverse micelles. A stopped-flow study. Eur J Biochem, 208, 165-170.
・Masui and Kuramitsu, Probing of DNA-binding sites of Escherichia coli RecA protein utilizing 1-anilinonaphthalene-8-sulfonic acid. Biochemistry. 1998 Sep 1;37 (35): 12133 ? 43
・McDonald, J.C. and Whitesides, G.M. (2002) Poly(dimethylsiloxane) as a material for fabricating microfluidic devices. Acc Chem Res, 35, 491-499.・Menger, F.M. and Yamada, K. (1979) J. Am. Chem. Soc., 101, 6731-6734.・Meylan, W.M. and Howard, P.H. (1995) Atom/fragment contribution method for estimating octanol-water partition coefficients. J Pharm Sci, 84, 83-92.・Miyawaki A, Llopis J, Heim R, McCaffery JM, Adams JA, Ikura M, Tsien RY. Fluorescent indicators for Ca2+ based on green fluorescent proteins and calmodulin. Nature. 1997 Aug 28;388(6645):882-7.
・Mize, P. D., Hoke, R. A., Linn, C. P., Reardon, J. E., and Schulte, T. H. (1989). Dual-enzyme cascade--an amplified method for the detection of alkaline phosphatase. Anal Biochem 179, 229-235.
・Montigiani, S., Neri, G., Neri, P., and Neri, D. (1996). Alanine substitutions in calmodulin-binding peptides result in unexpected affinity enhancement. J Mol Biol 258, 6-13.
・New, R.R.C. (ed.). (1990) Liposomes: a practical approach. Oxford University Press, Oxford.
・Norman, Med Phys. 1980 Nov-Dec;7(6):609-15.
・Oberholzer, T., Albrizio, M. and Luisi, P.L. (1995) Polymerase chain reaction in liposomes. Chem Biol, 2, 677-682.
・Oberholzer, T., Wick, R., Luisi, P.L. and Biebricher, C.K. (1995) Enzymatic RNA replication in self-reproducing vesicles: an approach to a minimal cell. Biochem Biophys Res Commun, 207, 250-257.
・Obukowicz, M.G., Turner, M.A., Wong, E.Y. and Tacon, W.C. (1988) Secretion and export of IGF-1 in Escherichia coli strain JM101. Mol Gen Genet, 215, 19-25.
・Perelson, A. S., and Oster, G. F. (1979). Theoretical studies of clonal selection: minimal antibody repertoire size and reliability of self-non-self discrimination. J Theor Biol 81, 645-670.
・Perez, G.M., Sanchez, F.A. and Garcia, C.F. (1992) Application of active-phase plot to the kinetic analysis of lipoxygenase in reverse micelles. Biochem J.
・Pirrung, M. C., and Huang, C. Y. (1996). A general method for the spatially defined immobilization of biomolecules on glass surfaces using "caged" biotin. Bioconjug Chem 7, 317-321.
・Qi and Grabowski, Acid beta-glucosidase: intrinsic fluorescence and conformational changes induced by phospholipids and saposin C. Biochemistry. 1998 Aug 18;37(33):11544-54
・Ramstrom, O., and Lehn, J. M. (2002). Drug discovery by dynamic combinatorial libraries. Nat Rev Drug Discov 1, 26-36.
・Riess, J.G. (2002) Fluorous micro- and nanophases with a biomedical perspective. Tetrahedron, 58, 4113-4131.
・Rolland, J Immunol Methods. 1985 Jan 21;76(1):1-10
・Sadtler, V.M., Krafft, M.P. and Riess, J.G. (1996) Achieving stable, reverse water-in-fluorocarbon emulsions. Angew. Chem. Int. Ed. Engl., 35, 1976-1978.
・Sambrook, J., and Russell, D. W., eds. (2001). Molecular cloning: a laboratory manual (New York, Cold Spring Harbor Laboratory Press).
・Savage, M. D., Mattson, G., Desai, S., Nielander, G. W., Morgensen, S., and Conklin, E. J. (1994). Avidin-biotin chemistry: a handbook, 2 edn (Rockford, Pierce Chemical Company).
・Schick, M.J. (1966) Nonionic surfactants. Marcel Dekker, New York.
・Scott, R.L. (1948) J. Am. Chem. Soc., 70, 4090.
・Sepp, A., Tawfik, D. S., and Griffiths, A. D. (2002). Microbead display by in vitro compartmentalisation: selection for binding using flow cytometry. FEBS Letters 532, 455-458.
・Shapiro, H. M. (1995). Practical Flow Cytometry, 3 edn (New York, Wiley-Liss).
・Sherman, P. (1968) Emulsion science. Academic Press, London.
・Song, H. and Ismagilov, R.F. (2003) Millisecond kinetics on a microfluidic chip using nanoliters of reagents. J Am Chem Soc, 125, 14613-14619.
・Song, H., Tice, J.D. and Ismagilov, R.F. (2003) A microfluidic system for controlling reaction networks in time. Angew. Chem. Int. Ed. Engl., 42, 767-772.
・Stofko, H. R., Carr, D. W., and Scott, J. D. (1992). A single step purification for recombinant proteins. Characterization of a microtubule associated protein (MAP 2) fragment which associates with the type II cAMP-dependent protein kinase. Febs Lett 302, 274-278.
・Studer, A., Hadida, S., Ferritto, R., Kim, S.Y., Jeger, P., Wipf, P. and Curran, D.P. (1997) Fluorous synthesis: a fluorous-phase strategy for improving separation efficiency in organic synthesis. Science, 275, 823-826.
・Sun, A.M., Vasek, I. and Tai, I. (1992) Microencapsulation of living cells and tissues. In Donbrow, M. (ed.), Microencapsulation and nanoparticles in medicine and pharmacy. CRC Press, Boca Raton, Florida, pp. 315-322.
・Sundberg, S. A., Barrett, R. W., Pirrung, M., Lu, A. L., Kiangsoontra, B., and Holmes, C. P. (1995). Spatially-addressable immobilisation of macromolecules on solid supports. J Am Chem Soc 117, 12050-12057.
・Tawfik, D. S., and Griffiths, A. D. (1998). Man-made cell-like compartments for molecular evolution. Nat Biotechnol 16, 652-656.
・Thorsen, T., R.W., R., Arnold, F.H. and Quake, S.R. (2001) Dynamic pattern formation in a vesicle-generating microfluidic device. Phys. Rev. Letts., 86, 4163-4166.
・Tripet, B., Yu, L., Bautista, D. L., Wong, W. Y., Irvin, R. T., and Hodges, R. S. (1996). Engineering a de novo-designed coiled-coil heterodimerization domain off the rapid detection, purification and characterization of recombinantly expressed peptides and proteins. Protein Eng 9, 1029-1042.
・Umbanhowar, P.B., Prasad, V. and Weitz, D.A. (2000) Monodisperse emulsions generated via drop break off in a coflowing steam. Langmuir, 16, 347-351.
・van Hal, D.A., Bouwstra, J.A. and Junginger, H.E. (1996) Nonionic surfactant vesicles containing estradiol for topical application. In Benita, S. (ed.), Microencapsulation: methods and industrial applications. Marcel Dekker, New York, pp. 329-347.
・Voss EW Jr. Kinetic measurements of molecular interactions by spectrofluorometry. J Mol Recognit. 1993 Jun;6(2):51-8
・Walde, P., Goto, A., Monnard, P.-A., Wessicken, M. and Luisi, P.L. (1994) Oparin's reactions revisited: enzymatic synthesis of poly(adenylic acid) in micelles and self-reproducing vesicles. J. Am. Chem. Soc., 116, 7541-7547.
・Walde, P., Han, D. and Luisi, P.L. (1993) Spectroscopic and kinetic studies of lipases solubilized in reverse micelles. Biochemistry, 32, 4029-4034.
・Walde, P., Peng, Q., Fadnavis, N.W., Battistel, E. and Luisi, P.L. (1988) Structure and activity of trypsin in reverse micelles. Eur J Biochem, 173, 401-409.
・Whateley, T.L. (1996) Microcapsules: preparation by interfacial polymerisation and interfacial complexation and their applications. In Benita, S. (ed.), Microencapsulation: methods and industrial applications. Marcel Dekker, New York, pp. 349-375.
・Wick, R. and Luisi, P.L. (1996) Enzyme-containing liposomes can endogenously produce membrane-constituting lipids. Chem Biol, 3, 277-285.
・Zhang, Z. Y., Thieme-Sefler, A. M., Maclean, D., McNamara, D. J., Dobrusin, E. M., Sawyer, T. K., and Dixon, J. E. (1993). Substrate specificity of the protein tyrosine phosphatases. Proc Natl Acad Sci U S A 90, 4446-4450.
【発明の概要】
【0011】
我々は、Griffiths & Tawfik(1998)の記載に基づくコンパートメント化されたマイクロカプセル系を用いて、遺伝子エレメントによってコードされない化合物を選択するための方法を開発した。本発明による新規方法は、現代的HTSアプローチと適合する形で、低コストで標的に対する活性を有する化合物の迅速なハイスループットスクリーニングを可能とする。
【0012】
第1の態様では、レパートリーの化合物中において、所望の活性を有する1以上の化合物を識別する方法であって、
a)任意の1つのマイクロカプセルにおいて、レパートリーのサブセットのみが複数のコピーで示されるように、化合物をマイクロカプセルにコンパートメント化するステップと;
b)所望の活性を有する化合物を識別するステップと
を含む方法が提供される。
【0013】
好ましくは、所望の活性は標的の結合活性および活性のモジュレーションからなる群より選択される。標的は、好ましくは化合物と一緒にマイクロカプセル中にコンパートメント化され、標的および化合物を一緒に結合するマイクロカプセル中において標的上の化合物の活性を測定することを可能とする。
【0014】
好ましくは、任意の1つのマイクロカプセル中に存在するレパートリーのサブセットは単一化合物である。各マイクロカプセルは、有益には単一化合物の複数のコピーであるレパートリーのサブセットの複数分子を含有する。
【0015】
1以上の化合物は、本発明にかかるスクリーニングするステップにより、化合物を含有するマイクロカプセルの変化についてスクリーニングできる。好ましい実施形態では、マイクロカプセルはそれらの光学特性を変化させるなどの化合物の作用によって修飾される。
【0016】
マイクロカプセルの光学特性の変化は、標的に結合したときの化合物の光学特性の変化または化合物が結合したときの標的の光学特性の変化に起因してもよい。さらに、マイクロカプセルの光学特性の変化は、結合したときの標的および化合物両方の光学特性の変化に起因してもよい。
【0017】
マイクロカプセルの光学特性の変化は、化合物による標的の活性のモジュレーションに起因する可能性がある。化合物は、標的の活性を活性化または阻害することがある。例えば、標的が酵素である場合、基質と標的によって触媒された反応の生成物とは相違する光学特性を有する可能性がある。好ましくは、基質および生成物は相違する蛍光特性を有する。
【0018】
マイクロカプセル内で検出された変化は、化合物の直接的作用によって、または一連の反応(そのうちの1つ以上が所望の活性を有する化合物に関連する)により検出される変化が引き起こされる間接的作用によって引き起こされる可能性があると理解されたい。
【0019】
マイクロカプセルの1以上の化合物は、質量分析法、化学タグ付け法または光学タグ付け法を含む、当業者によく知られている様々な技術を用いて識別できる。好ましくは、化合物は、マイクロカプセルおよびその中に含有される化合物の識別を可能とする光学標識マイクロカプセル内に含有される。
【0020】
好ましくは、マイクロカプセルは、それらの蛍光の変化を検出することによって分析される。例えば、マイクロカプセルはフローサイトメトリーによって分析することができ、そして蛍光活性化セルソーター(FACS)を用いて任意に分類できる。標的および生成物の相違する蛍光特性は、蛍光共鳴エネルギー転移(FRET)に起因してもよい。
【0021】
また別の実施形態では、マイクロカプセルの内部環境は1以上の試薬を油相へ添加することによって修飾できる。これは、必要であれば、反応中に試薬がマイクロカプセル内に拡散するのを可能とする。
【0022】
本発明の好ましい形態によると、1以上の化合物は、化合物もしくはその誘導体の活性(全体としてマイクロカプセルを検出可能にする)にしたがってスクリーニングできる。したがって、本発明は、所望の活性を有する化合物が、マイクロカプセルの変化、またはマイクロカプセル内の1つ以上の分子の修飾(これらが、化合物を含有するマイクロカプセルの識別を可能とする)を誘導する方法を提供する。このため、この実施形態では、マイクロカプセルは、(a)その中に含有された1以上の化合物の活性にしたがって相互から物理的に分類され、分類されたマイクロカプセルの内容物が分析され、それらが含有する1以上の化合物の同一性が決定される;あるいは(b)分類せずに直接的に分析されて、マイクロカプセルが含有する1以上の化合物の同一性が決定される。
【0023】
好ましくは、マイクロカプセル化は油中水型エマルジョンを形成することによって達成される。
【0024】
レパートリーのサブセットの複数のコピーでのコンパートメント化は多数の方法で達成できる。例えば、化合物をビーズに結合させ、各コンパートメント内に実質的に単一ビーズだけが含まれるようにエマルジョンを形成することができる。上記のステップ(a)は、
a)任意の1つのマイクロビーズ上でレパートリーのサブセットのみが示されるように、化合物のレパートリーをマイクロビーズ上に結合させるステップと;
b)任意の1つのマイクロカプセルにおいて、レパートリーのサブセットが複数のコピーで示されるように、マイクロビーズをマイクロカプセルにコンパートメント化するステップと
を含むように修飾される。
【0025】
また別の態様では、レパートリーの化合物中の、所望の活性を有する1以上の化合物を識別する方法であって、
4.任意の1つのマイクロビーズ上でレパートリーのサブセットのみが示されるように、レパートリーの化合物をマイクロビーズ上に結合させるステップと;
5.マイクロビーズをマイクロカプセルにコンパートメント化するステップと;
6.任意選択的に、マイクロビーズから化合物を放出させるステップと;
7.所望の活性を有する化合物を識別するステップと
を含む方法が提供される。
【0026】
好ましくは、いずれか1つのマイクロビーズ上に存在するレパートリーのサブセットは単一化合物である。好ましくは、各マイクロビーズには単一化合物の複数の分子が結合している。
【0027】
好ましくは、化合物は切断可能なリンカー、例えば所望であればマイクロビーズからの化合物の放出を可能とする光切断可能なリンカーによってマイクロビーズへ結合させられる。
【0028】
化合物は、本発明によって、化合物を含有するマイクロカプセルの変化、またはそれに化合物が結合しているマイクロビーズ内もしくはマイクロビーズ上の変化のいずれかについてスクリーニングするステップによってスクリーニングできる。
【0029】
ビーズ上の化合物は、質量分析法、化学タグ付け法または光学タグ付け法を含む、当業者によく知られている様々な技術を用いて識別できる。好ましくは、化合物は、ビーズおよびステップ(d)においてそれに結合した化合物の識別を可能とするために光学タグ付けマイクロビーズに結合させられる。
【0030】
レパートリーは、さらに単一化合物の複数のコピーのカプセル化を達成するために様々な方法でエマルジョン化することもできる。
【0031】
例えば、各化合物の水溶液を油中水型エマルジョンのマイクロカプセル中にコンパートメント化し、次に様々な化合物を含有するエマルジョンのアリコートを混合することができる。マイクロカプセルは通常はさらに標的を含有でき、標的の活性はマイクロカプセルを低温に維持することによって抑制できる。
【0032】
さらにまた別の実施形態では、各化合物の水溶液の少量区分を、機械的エネルギーを与えながら油相(好ましくは界面活性剤および/または他の安定化分子を含有する)内に投入(deposit)することにより、各化合物を複数の水性マイクロカプセル(各々が(大部分において)1種類の化合物であるがその複数のコピーを含む)内に分散させることができる。好ましくは、化合物はインクジェット印刷技術(Calvert,2001;de Gans et al.,2004)を用いながら、より好ましくは圧電気ドロップオンデマンド(DOD)インクジェット印刷技術により産生された液滴の形態で油相内に投入できる。インクジェット印刷技術もまたエマルジョンの形成の直前に、試薬(例えば標的活性を試験するための化合物、標的および試薬)を混合するために使用できる。好ましくは、複数の化合物をコンビナトリアルな様式において複数の標的と混合できる。このアプローチによると、水性液滴から油相内でインサイチューで個々のエマルジョン(後に混合される)を形成して、類似の結果が達成される。
【0033】
即ち、上記ステップ(a)は、個々の化合物を含む個別のエマルジョンコンパートメントを形成するステップと、エマルジョンコンパートメントを混合して乳化された化合物のレパートリーを形成するステップであって、任意の1つのマイクロカプセルにおいて、そのレパートリーのサブセットが複数のコピーで示されるようにする、ステップとを含むように改変することができ。
【0034】
更にまた化合物ライブラリは微小流体手法を用いて作成した高度に単分散のマイクロカプセル内にコンパートメント化することができる。例えば、各化合物の少量分を油の共流動ストリーム内での液滴の破壊により生成された油中水エマルジョン中の水性マイクロカプセル1つ以上(多分散度3%未満)内にコンパートメント化できる(Umbanhowar et al.,2000)。好ましくは、その後、水性マイクロカプセルを微小流体チャンネル内の油のストリーム内の層流により輸送する(Thorsen et al.,2001)。単一の化合物を含有するこれらのマイクロカプセルは、任意選択的に微小流体を用いてより小さいマイクロカプセル2つ以上に分割することができる(Link et al.,2004;Song et al.,2003)。単一の化合物を含有するマイクロカプセルは、任意選択的に、標的を含有する他のマイクロカプセル(Song et al.,2003)と融合できる。標的を含有する単一のマイクロカプセルは、任意選択的に、より小型のマイクロカプセル2つ以上に分割し、これをその後異なる化合物、または異なる濃度の化合物を含有するマイクロカプセルと融合することができる。好ましくは、化合物および標的をマイクロカプセル融合により混合した後に、標的の活性を試験するために必要なもの(例えば標的が酵素である場合は標的のための基質)を送達する第2のマイクロカプセル融合を行う。これにより化合物が標的に結合する時間が与えられる。マイクロカプセルは微小流体装置を用いて分析、および任意選択的に分類することができる(Fu et al.,2002)。
【0035】
本発明の好ましい態様によれば、化合物のスクリーニングは例えば下記の通り実施することができる。
【0036】
(I)第1の実施形態において、マイクロカプセルは、全体としてマイクロカプセルを検出可能とする化合物またはその誘導体の活性に従ってスクリーニングされる。従って、本発明は所望の活性を有する化合物が、化合物を含有するマイクロカプセルを識別可能とする、マイクロカプセルの変化またはマイクロカプセル内の分子1つ以上の修飾をもたらす方法を提供する。従ってこの実施形態において、マイクロカプセルは、(a)そこに含有される化合物の活性に従って相互に物理的に分類され、分類されたマイクロカプセルの内容物は任意選択的に1つ以上の共通のコンパートメント内にプールされ、マイクロカプセルの内容物を分析することにより化合物の内容を決定するか;または(b)分類することなく直接分析することによりマイクロカプセルが含有していた化合物の内容を決定するかのいずれかである。マイクロカプセルがマイクロビーズを含有する場合は、マイクロビーズを分析することによりそれらをコーティングしている化合物を決定できる。
【0037】
(II)第2の実施形態において、マイクロビーズはコンパートメント1つ以上内にマイクロカプセルをプールした後に分析する。この実施形態においては、所望の活性を有する化合物はそれを担持している(そして同じマイクロカプセル内に存在している)マイクロビーズを、後のステップにおいて識別可能とするような方法で修飾する。反応を停止し、後にマイクロカプセルを破壊して個々のマイクロカプセルの内容物全てがプールされるようにする。修飾されたマイクロカプセルは識別され、(a)マイクロビーズ上にコーティングされた化合物の活性に従って相互に物理的に分類され、分類されたマイクロビーズを分析することによりそれらをコーティングする/していた化合物の内容を決定するか;または(b)分類することなく直接分析することによりマイクロビーズをコーティングする/していた化合物の内容を決定するかのいずれかである。当然ながら、マイクロビーズの修飾は、それが化合物の直接の作用により誘発されるという点において直接のものであるか、または、所望の活性を有する化合物を1つ以上が使用している一連の反応によりマイクロビーズの修飾がもたらされる間接的なものであってよい。好ましくは、標的をマイクロビーズに結合されており、リガンドであり、マイクロカプセル内の化合物は該リガンドに直接または間接的に結合することによりマイクロビーズの単離を可能とする。別の形態においては、標的に対する基質はマイクロビーズに結合されており、マイクロカプセル内の化合物の活性はマイクロビーズの部分として残存し、その単離を可能とする生成物への該基質の変換を直接または間接的にもたらす。あるいは、化合物の活性は生成物への該基質の変換を防止または抑制してよい。更にまた、マイクロカプセル内での化合物の活性の生成物は、後にマイクロビーズと複合体化してその識別を可能とする生成物の生成を直接または間接的にもたらす。
【0038】
(III)第3の実施形態においては、共通のコンパートメント1つ以上の中にマイクロカプセルをプールした後にマイクロビーズを分析する。本実施形態においては、所望の活性を有する化合物は、化合物を含有するマイクロカプセルおよびそれを担持するマイクロビーズの変化をもたらす。この変化は、検出されれば、コンパートメント内のマイクロビーズの修飾をトリガーする。反応を停止し、後にマイクロカプセルを破壊することにより個々のマイクロカプセルの内容物を全てプールする。修飾されたマイクロビーズを識別し、(a)マイクロビーズ上にコーティングされた化合物の活性に従って相互に物理的に分類し、分類されたマイクロビーズを分析してそれらをコーティングする/していた化合物の内容を決定するか;または(b)分類することなく直接分析することによりマイクロビーズをコーティングする/していた化合物の内容を決定するかのいずれかである。
【0039】
マイクロカプセルまたはマイクロビーズはその光学特性を変化させるように化合物の作用により修飾してよい。例えば、マイクロビーズの修飾はこれを更にマイクロカプセル外部で修飾可能とし、これによりその光学特性の変化を誘導できる。
【0040】
別の実施形態においては、マイクロカプセルまたはマイクロビーズの光学特性の変化は標的への特徴的な光学特性を有する化合物の結合によるものである。
【0041】
更に、マイクロカプセルまたはマイクロビーズの光学特性の変化は化合物による特徴的な光学特性を有する標的の結合によるものである。
【0042】
マイクロカプセルもしくはマイクロビーズの光学特性の変化は、標的に結合したときの化合物の光学特性の変化、または化合物が結合したときの標的の光学特性の変化に起因してもよい。さらに、マイクロカプセルもしくはマイクロビーズの光学特性の変化は、結合したときの標的および化合物両方の光学特性の変化に起因してもよい。
【0043】
マイクロカプセルの光学特性の変化は化合物による標的の活性のモジュレートによるものであってよい。化合物は標的の活性を活性化または抑制してよい。例えば標的が酵素である場合は、基質および標的により触媒される反応の生成物は異なる光学特性を有することができる。好ましくは、基質および生成物は異なる蛍光特性を有する。マイクロカプセルがマイクロビーズを含む場合は、基質および生成物の両方が同様の光学特性を有することができるが、ただし反応生成物のみがマイクロビーズと結合または反応するが基質はそれをせず、これにより、マイクロビーズの光学特性が変化する。
【0044】
別の態様においては、別の試薬が、マイクロカプセルまたはマイクロビーズに結合するかこれに含まれている生成物(基質ではない)に特異的に結合するか、または特異的に反応することにより、マイクロカプセルまたはマイクロビーズの光学特性を改変する。
【0045】
好ましくは、マイクロカプセルまたはマイクロビーズは化合物の活性により直接または間接的に修飾され、更にチラミドシグナル増幅(TSA(商標);NEN)により修飾され、その結果として直接または間接的に該マイクロカプセルまたはマイクロビーズの光学特性の変化がもたらされ、これによりその分離が可能となる。
【0046】
化合物がビーズに結合する場合は、化合物がマイクロビーズ上にコーティングされる密度がマイクロカプセルの大きさと組み合わせられてマイクロカプセル内の化合物の濃度を決定する。高い化合物のコーティング密度および小型のマイクロカプセルは共に、より高い化合物濃度をもたらし、これは標的に対する親和性が低い分子の選択に好ましいかもしれない。逆に、低い化合物コーティング密度および大型のマイクロカプセルは共により低い化合物濃度をもたらし、これは標的に対する親和性が高い分子の選択に好ましいかもしれない。
【0047】
マイクロビーズは非磁性、磁性または常磁性であることができる。
【0048】
好ましくは、マイクロカプセルまたはマイクロビーズはその蛍光の変化の検出により分析する。例えば、マイクロビーズはフローサイトメトリーで分析し、任意選択的に蛍光活性化細胞ソーター(FACS)を用いて分類できる。標的および生成物の異なる蛍光特性は蛍光共鳴エネルギー転移(FRET)によるものであることができる。
【0049】
本発明はまた本発明により識別される物を提供する。この点に関し、「物」とは本発明により選択可能である任意の化合物を指す。
【0050】
本発明のその他の実施形態は以下の詳細な説明および添付する請求項に記載する通りである。
【0051】
[定義]
「マイクロカプセル」という用語は本明細書においては、当分野で通常用いられており、さらに後述する意味に従う。しかしながら本質的にはマイクロカプセルは、所望の活性を有する分子の識別を可能にする本明細書に記載の分子機序における成分の交換をその輪郭となる境界が制限している人工のコンパートメントである。輪郭となる境界は好ましくはマイクロカプセルの内容物を完全に封入するものである。好ましくは、本発明の方法において使用するマイクロカプセルは極めて多数量で製造可能であり、これにより化合物のライブラリをコンパートメント化できる。任意選択的に、化合物をマイクロビーズに結合できる。本明細書において使用されるマイクロカプセルはその内部において混合および分類が可能であり、これにより本発明の方法の高スループット能を促進する。固体表面上の液滴およびマルチウェルプレートのアレイは本明細書においてはマイクロカプセルとは定義しない。
【0052】
「マイクロビーズ」という用語は本明細書においては、当分野で通常用いられており、さらに後述する意味に従う。マイクロビーズはまた、マイクロスフェア、ラテックス粒子、ビーズまたはミニビーズとして当業者に知られているものであり、20nm〜1mmの直径のものが入手可能であり、種々の材料、例えばシリカおよび種々の重合体、共重合体および3元重合体から製造できる。高度に均一の誘導体化された(derivatized)および誘導体化されていない非磁性および常磁性のマイクロビーズ(ビーズ)は多くの販売元より入手できる(例えばSigma、Bangs Laboratories、LuminexおよびMolecular Probes)(Fornusek and Vetvicka,1986)。
【0053】
マイクロビーズは、マイクロカプセルへ分配することにより本発明に従って「コンパートメント化」できる。例えば、好ましい態様において、マイクロビーズを水/油混合物中に入れ、乳化して、本発明のマイクロカプセルを含む油中水エマルジョンを形成できる。マイクロビーズの濃度は、各マイクロカプセル内に平均して単一のマイクロビーズが出現するように調整することができる。
【0054】
「化合物」という用語は本明細書においては当分野で通常用いられている意味に従う。化合物という用語は、その最も広い意味において、即ち、所定の割合で元素2つ以上を含む物質(分子および超分子複合体(supramolecular complex)を含む)として使用される。この定義には医薬品の大部分を構成する小分子(典型的には<500ダルトン)も包含される。しかしながら、定義はまたより大型の分子、例えば重合体、例えばポリペプチド、核酸および炭水化物およびその超分子複合体も包含する。
【0055】
化合物の「レパートリー」とは多様な化合物の群であり、これはまた化合物のライブラリとも称することができる。化合物のレパートリーは当分野で知られた任意の手段、例えばコンビナトリアル化学、化合物進化により生成させるか(本明細書と同一日に出願された同時係属の「Compartinentalised Combinatorial Chemistry」と題する英国特許出願の方法などによる)、または、Sigma Aldrich,Discovery Partners International,MaybridgeおよびTriposのような市販元より購入してよい。レパートリーは、好ましくは少なくとも102、103、104、105、106、107、108、109、1010、1011以上の異なる化合物を含み、これは構造または機能において関係していても無関係でもよい。
【0056】
レパートリーの「サブセット」はその一部であり、これは単一化合物または関連する、もしくは関連しない構造を有する一群の化合物であってよい。好ましくは、このサブセットは単一化合物である。好ましくは、各化合物の複数のコピーが1つのマイクロカプセル内に封入される。マイクロビーズに結合させることのできるレパートリーのサブセットは、好ましくは各化合物の複数のコピーで結合させられる;例えば、各マイクロビーズがたった1つの化合物に結合している場合は、その化合物の複数の分子がマイクロビーズへ結合させられる。マイクロビーズへ結合した化合物の量がマイクロカプセル内の化合物の濃度を決定するであろう。
【0057】
マイクロビーズへの化合物の結合を行うリンカーの切断により化合物をマイクロビーズから「放出」させることができる。マイクロビーズからの化合物の放出により化合物はより自由にマイクロカプセルの他の内容物と相互作用ができるようになり、その内部の反応に関与できるようになり、任意選択的に他の試薬と組み合わさって新しい化合物、複合体、分子または超分子複合体を形成できるようになる。リンカーの切断は任意の手段により実施でき、マイクロカプセルを用いることなく実施できる光化学的切断が好ましい。光化学的に切断できるリンカーは当分野で知られており(例えばGordon and Balasubramanian,1999参照)、さらに後述する通りである。
【0058】
本明細書においては、「標的(target)」とは任意の化合物、分子または超分子複合体である。典型的な標的は医療上の意味を有する標的を包含し、例えば薬剤標的、例えば受容体、例えばGタンパク質結合受容体およびホルモン受容体;シグナリング経路に関与する転写因子、プロテインキナーゼおよびホスファターゼ;微生物に特異的な遺伝子産物、例えば細胞壁成分、レプリカーゼおよび他の酵素;工業的に関連のある標的、例えば食品産業において使用される酵素、研究または生産目的の試薬等を包含する。
【0059】
「所望の活性」とは、本明細書においては、標的のいずれかの活性、または標的によって影響を及ぼされる分子の活性のモジュレーションであり、これは本明細書において試験する化合物により直接または間接的にモジュレートすることができる。
標的の活性は、任意の測定可能な生物学的または化学的な活性、例えば結合活性、酵素活性、第3の酵素または他の分子に対する活性化または抑制の活性、疾患を誘発するか代謝または他の機能に影響する能力等であってよい。本明細書において言及する活性化および抑制とは、所望の活性を1.5倍、2倍、3倍、4倍、5倍、10倍、100倍以上の増大または低減を指す。モジュレーションが不活性化である場合は、不活性化は実質的に完全な不活性化である。更にまた所望の活性は純粋に結合活性であってよく、これには結合する標的の活性のモジュレーションが関与してもしなくてもよい。
【0060】
本明細書において「低分子量」または「小分子」と定義される化合物は医薬品分野において「小分子」と一般的に称される分子である。このような化合物はポリペプチドおよび他の大型分子複合体よりも小型であり、患者および他の対象に容易に投与でき、消化(assimilate)されるものである。小分子薬剤は経口投与または筋肉内注射用に好適に製剤できる。例えば小分子は2000ダルトン以下;好ましくは1000ダルトン以下;好ましくは250〜750ダルトン;およびより好ましくは500ダルトン未満の分子量を有することができる。
【0061】
「選択可能な変化(selectable change)」とは、測定可能であり、当該変化を引き起こす化合物を識別または単離するために利用可能である任意の変化である。選択は、(任意選択的に他の試薬と複合体化された際に)、マイクロカプセル、マイクロビーズまたは化合物自体のレベルで起こってよい。特に好ましい実施形態は光学的検出であり、その場合、選択可能な変化は光学特性の変化であり、これは例えばFACS装置において検出および利用でき、これにより所望の変化を表すマイクロカプセルまたはマイクロビーズを分離できる。
【0062】
本明細書においては光学特性の変化は電磁放射の吸収または放射の任意の変化、例えば吸光度、ルミネセンス、燐光または蛍光の変化を指す。このような特性の全てが「光学的」という用語に包含される。マイクロカプセルまたはマイクロビーズは、例えばルミネセンス、蛍光または燐光活性化分類により識別され、任意選択的に分類される。好ましい実施形態においては、フローサイトメトリーを用いてマイクロカプセルまたはマイクロビーズを識別し、任意選択的に分類する。種々の光学特性を分析のためおよび分類をトリガーするために使用でき、例えば光散乱(Kerker,1983)および蛍光分極(Rolland et al.,1985)が挙げられる。高度に好ましい実施形態においては、マイクロカプセルまたはマイクロビーズは、蛍光活性化細胞ソーター(FACS)を用いて分析され、任意選択的に分類される(Norman,1980;Mackenzie and Pinder,1986)。
【0063】
マイクロカプセル中またはビーズ上の化合物は当業者がよく知る種々の手法、例えば質量スペクトル分析、化学的タグ付けまたは光学的タグ付けにより識別できる。
【0064】
[一般的方法]
特段の記載が無い限り、本明細書において使用する全ての技術的および専門的な用語は本分野(例えば細胞培養、分子遺伝学、核酸化学、ハイブリダイゼーション技術および生化学)の当業者が一般的に理解している意味と同様の意味を有する。分子、遺伝および生化学的方法(一般的には、引用により本明細書に組み込まれるSambrook et al.,Molecular Cloning:A Laboratory Manual,2d ed(1989)Cold Spring Harbor Laboratory Press,Cold Spring Harbor,N.Y.およびAusbel et al.,Short Protocols in Molecular Biology(1999)4th Ed,John Wiley&Sons,Inc.参照)および化学的方法には、標準的な技術が使用される。更にまた、Harlow&Lane,A Laboratory Manual Cold Spring Harbor,N.Y.も標準的な免疫学的技術について参照される。
【0065】
〔(A)一般的説明〕
本発明のマイクロカプセルは、本発明が機能するために適切な物理学的特性を必要とする。
【0066】
まず、複数のマイクロカプセル間で化合物および標的が拡散しないようにするためには、各マイクロカプセルの内容物を周囲のマイクロカプセルの内容物から隔離することにより、実験期間中を通じてマイクロカプセル間での化合物および標的の交換を皆無または極僅かとしなければならない。しかし、マイクロカプセルの透過性は、所望であれば試薬がマイクロカプセル内および/または外へ拡散するのを許容するように調整できる。
【0067】
第2に、本発明の方法はマイクロカプセル1つにつき相違する化合物が限定された数しか存在しないことを必要とする。化合物がビーズに付着している場合は、本発明の方法はマイクロカプセル1つにつき限定された数のビーズしか存在しないことを必要とする。
【0068】
第2に本発明の方法では、マイクロカプセル当たり限られた数量のみビーズが存在しなければならない。これにより化合物および標的が他のビーズから隔離されることになる。
【0069】
第3に、好ましくは、マイクロカプセルの形成および組成は標的の活性を低減させない。
【0070】
結果として、好ましくは、使用する任意のマイクロカプセル化系はこれらの3つの条件を満足している。適切な系は当業者に明らかなとおり、本発明の各用途における条件の厳密な性質により変動する。
【0071】
広範な種類のマイクロカプセル化の操作法(Benita,1996参照)が使用可能であり、本発明に従って使用するマイクロカプセルを産生するために使用してよい。実際、200を超えるマイクロカプセル化方法が文献に記載されている(Finch,1993)。
【0072】
これらには膜エンベロープ水性ベシクル、例えば脂質ベシクル(リポソーム)(New,1990)および非イオン系界面活性剤ベシクル(van Hal et al.,1996)が包含される。これらは非共有結合的に組み立てられた分子の単一または複数の二重層(bilayer)の閉じた膜カプセルであり、各二重層は水性のコンパートメントによりその近隣から分離されている。リポソームの場合は、膜は脂質分子からなり;これらは通常はリン脂質であるが、コレステロールのようなステロールも膜内に取り込んでよい(New,1990)。種々の酵素触媒性化学的反応、例えばRNAおよびDNA重合をリポソーム内で実施できる(Chakrabarti et al.,1994;Oberholzer et al.,1995a;Oberholzer et al.,1995b;Walde et al.,1994;Wick&Luisi,1996)。
【0073】
膜エンベロープベシクル系の場合は、水相の大部分がベシクル外部にあり、従って非コンパートメント化されている。反応がマイクロカプセル内に限定されるためには、この連続の水相を除去するか、または、その内部の生物学的な系を抑制または破壊しなければならない(Luisi et al.,1987)。
【0074】
酵素触媒性化学反応はまた、種々の他の方法により産生されたマイクロカプセル内でも実証されている。多くの酵素はAOT−イソオクタン−水系(Menger&Yamada,1979)のように逆ミセル溶液中(Bru&Walde,1991;Bru&Walde,1993;Creagh et al.,1993;Haber et al.,1993;Kumar et al.,1989;Luisi&B.,1987;Mao&Walde,1991;Mao et al.,1992;Perez et al.,1992;Walde et al.,1994;Walde et al.,1993;Walde et al.,1998)で活性である。
【0075】
マイクロカプセルはまた界面重合および界面複合体形成により産生させることができる(Whateley,1996)。この種のマイクロカプセルは剛性で非透過性の膜または半透過性の膜を有することができる。硝酸セルロース膜、ポリアミド膜および脂質−ポリアミド膜を境界とする半透過性のマイクロカプセルは全て、多酵素系を含む生化学的反応を支援できる(Chang,1987;Chang,1992;Lim,1984)。極めて穏やかな条件下で形成できるアルギネート/ポリリジンマイクロカプセル(Lim&Sum,1980)もまた極めて生体適合性が高いことがわかっており、例えば生細胞および組織のカプセル化の有効な方法を与える(Chang,1992;Sun et al.,1992)。
【0076】
エマルジョンのようなコロイド系における水性の環境の相分配に基づく非膜マイクロカプセル化系も使用してよい。
【0077】
好ましくは本発明のマイクロカプセルはエマルジョン、即ち、顕微鏡的またはコロイドサイズの液滴として相の一方が他方の内部に分散している2つの非混和性の液相の不均質な系から形成する(Becher,1957;Sherman,1968;Lissant,1974;Lissant,1984)。
【0078】
エマルジョンは、非混和性の液体の任意の適当な組み合わせから製造することができる。好ましくは本発明のエマルジョンは微細分割液滴の形態で存在する相(分散した内部または不連続の相)としての水(生化学的成分を含有)およびこれらの液滴が懸濁しているマトリックス(非分散の連続または外部の相)としての疎水性の非混和性液体(油)を有する。このようなエマルジョンを油中水(W/O)と称する。これは生化学的成分を含有する全水相が個別の液滴(内層)内にコンパートメント化されているという利点を有する。疎水性の油である外層は一般的には生化学的成分は含まず、従って不活性である。
【0079】
エマルジョンは界面活性剤1つ以上を添加することにより安定化する。これらの界面活性剤は乳化剤と称され、水/油界面に作用して相の分離を防止(または少なくとも遅延)する。多くの油状物および多くの乳化剤を油中水エマルジョンの産生のために使用でき、最近の集計では16,000を超える界面活性剤が存在し、その多くは乳化剤として使用されている(Ash and Ash,1993)。適当な油は軽質白色鉱物油およびデカンを包含する。適当な界面活性剤は、非イオン系界面活性剤(Schick,1966)、例えばソルビタンモノオレエート(Span(商標)80;ICI)、ソルビタンモノステアレート(Span(商標)60;ICI)、ポリオキシエチレンソルビタンモノオレエート(Tween(商標)80;ICI)およびオクチルフェノキシエトキシエタノール(Triton X-100);イオン系界面活性剤、例えばコール酸ナトリウムおよびタウロコール酸ナトリウムおよびデオキシコール酸ナトリウム;化学的に負活性なシリコーン系の界面活性剤、例えばポリシロキサン−ポリセチル−ポリエチレングリコール共重合体(セチルジメチコンコポリオール)(例えばAbil(商標)EM90;Glodschmidt);およびコレステロールを包含する。
【0080】
フッ化炭素(または過フッ化炭素)連続相を有するエマルジョン(Krafft et al.,2003;Riess,2002)は特に好ましい。例えば、安定なパーフルオロオクチルブロミド中水およびパーフルオロオクチルエタン中水のエマルジョンは界面活性剤としてF−アルキルジモルホリノホスフェートを用いながら形成できる(Sadtler et al.,1996)。非フッ化化合物は本質的にはフッ化炭素および過フッ化炭素中に不溶性であり(Curran,1998;Hildebrand and Cochran,1949;Hudlicky,1992;Scott,1948;Studer et al.,1997)、小型薬剤様分子(典型的には<500DaおよびLogP<5)(Lipinski et al.,2001)はフッ化炭素中水および過フッ化炭素中水のエマルジョンの水性マイクロカプセル中極めて効果的にコンパートメント化され、マイクロカプセル間の交換は殆どまたは全くない。
【0081】
エマルジョンの形成は一般的に相を強制的に共存させるための機械的エネルギーの適用を必要とする。これを行うための種々の機械的装置、例えば攪拌器(磁気攪拌子、プロペラおよびタービン攪拌器、パドル装置およびウイスク)、ホモゲナイザー(例えばローターステーターホモゲナイザー、高圧弁ホモゲナイザーおよびジェットホモゲナイザー)、コロイドミル、超音波および「膜乳化」装置(Becher,1957;Dickinson,1994)を利用した種々の方法がある。
【0082】
複雑な生化学的過程、特に遺伝子の転写および翻訳もまた油中水エマルジョン中に形成される水性マイクロカプセル内で活性である。これにより、油中水エマルジョン内のコンパートメント化が遺伝子の選択に使用可能となり、遺伝子はエマルジョンマイクロカプセル内で転写および翻訳され、それらがコードするタンパク質の結合または触媒活性により選択される(Doi and Yanagawa,1999;Griffiths and Tawfik,2003;Lee et al.,2002;Sepp et al.,2002;Tawfik and Griffiths,1998)。これはエマルジョン内に形成された水性マイクロカプセルが一般的に安定であり、マイクロカプセル間での核酸、タンパク質または酵素触媒反応の生成物の交換があったとしても極僅かであるために可能となった。
【0083】
数千リットルの工業的規模までの容量のエマルジョンを形成する技術も存在する(Becher,1957;Sherman,1968;Lissant,1974;Lissant,1984)。
【0084】
好ましいマイクロカプセルサイズは本発明に従って実施するべき任意の個々のスクリーニング方法の厳密な条件に応じて変動する。全ての場合において、化合物および標的の活性の特性(identity)を測定するためには、化合物ライブラリと試験の感度との間には最適なバランスが存在する。
【0085】
エマルジョンマイクロカプセルのサイズは、スクリーニング系の条件に応じてエマルジョンを形成するために使用されるエマルジョン条件を単に調節することにより変化させてよい。究極的な制約要因はマイクロカプセルのサイズ、即ち単位容量当たり可能なマイクロカプセル数であることから、マイクロカプセルサイズが大きくなるほど、所与の化合物ライブラリをカプセル化するために必要となる容量は大きくなる。
【0086】
油中水エマルジョンは外部(連続)水相を有する水中油中水のダブルエマルジョンを形成するために再乳化できる。これらのダブルエマルジョンを分析し、任意選択的にフローサイトメーターを用いて分類することができる(Bernath et al.,2004)。
【0087】
高度に単分散されたマイクロカプセルは微小流体技術を用いて製造できる。例えば、3%未満の多分散性を有する油中水エマルジョンは油中の共流動ストリームの液滴破壊により形成することができる(Umbanhowar et al.,2000)。微小流体システムはまた、微小流体チャンネル内の油のストリーム中に分散した水性微小液滴の層流のために使用できる(Thorsen et al.,2001)。これによりフロー分析のための微小流体装置の構築、および、任意選択的に微小液滴のフロー分類が可能となる(Fu et al.,2002)。
【0088】
マイクロカプセルは好ましくは融合するか分割(split)する。例えば微小流体システムを用いて水性微小液滴を融合および分割させることができる(Link et al.,2004;Song et al.,2003)。マイクロカプセルの融合により試薬の混合が可能となる。例えば標的を含有するマイクロカプセルと化合物を含有するマイクロカプセルの融合は標的と化合物の反応を開始させる。マイクロカプセルのスプリッティングにより、単一のマイクロカプセルをより小さいマイクロカプセル2個以上に分割させる。例えば化合物を含有する単一のマイクロカプセルを複数のマイクロカプセルに分割し、これをその後異なる標的を含有する異なるマイクロカプセルに各々融合させる。標的を含有する単一のマイクロカプセルはまた複数のマイクロカプセルに分割し、これをその後異なる化合物または異なる濃度の化合物を含有する異なるマイクロカプセルと各々融合させることができる。
【0089】
マイクロカプセルは例えば蛍光色素を取り込むことにより光学的にタグ付けできる。好ましい形態においては、マイクロカプセルは量子ドットを取り込むことにより光学的にタグ付けされ、10濃度の6色の量子ドットは106マイクロカプセルのコード化を可能とする(Han et al.,2001)。微小流体チャンネル内を秩序のある順序で流動するマイクロカプセルは、マイクロカプセルのストリームにおけるその順序によりコード化(完全または部分的)できる(位置コード化)。
【0090】
マイクロスフェア、ラテックス粒子、ビーズまたはミニビーズとして当業者に知られているマイクロビーズは20nm〜1mmの直径のものが入手可能であり、種々の材料、例えばシリカおよび種々の重合体、共重合体および3元重合体、例えばポリスチレン(PS)、ポリメチルメタクリレート(PMMA)、ポリビニルトルエン(PVT)、スチレン/ブタジエン(S/B)共重合体およびスチレン/ビニルトルエン(S/VT)共重合体から製造できる(www.bangslabs.com)。これらは広範な種類の機能表面基、即ちアルデヒド、脂肪族アミン、アミド、芳香族アミン、カルボン酸、クロロメチル、エポキシ、ヒドラジド、ヒドロキシル、スルホネートおよびトシルにより付与される疎水性表面(例えばプレーンポリスチレン)から極めて親水性の表面まで、種々の表面化学のものが入手可能である。官能基はマイクロビーズ表面への化合物の安定または過逆的な結合のための広範な共有結合反応を可能とする。
【0091】
マイクロビーズは例えば蛍光色素を取り込むことにより光学的にタグ付けできる。例えば、厳密な比率の赤色(>650nm)およびオレンジ色(585nm)の蛍光色素による標識のため、各々が独特のスペクトルアドレスを有する100種の異なるビーズのセットを形成し(Fulton et al.,1997)(www.luminex.com)、106ビーズ以下のセットを10強度6色の量子ドットを取り込むことによりコード化できる(Han et al.,2001)。
【0092】
化合物を当業者のよく知る種々の手段により共有結合的または非共有結合的にマイクロビーズに連結できる(例えばHarmanson,1996参照)。好ましくは、化合物は切断可能なリンカーを介して結合する。このような種々のリンカーは当業者が知る通りであり(例えばGordon and Balasubramanian,1999参照)、例えば光化学的に切断できるリンカーおよびpHの変更により(例えばイミンおよびアシルヒドラゾン)、酸化還元特性を調節することにより(例えばジスルフィド)または外部触媒を用いながら(例えば交差複分解(cross-methathesis)およびアミド転換)制御することができる可逆共有結合が挙げられる。
【0093】
本発明の方法は化合物のプール(ライブラリまたはレパートリー)中で標的の活性を所望の方法でモジュレートする化合物の識別を可能とする。
【0094】
本発明の方法は化合物のレパートリーまたはライブラリのスクリーニングのために有用である。従って本発明は化合物を化合物のライブラリから識別する本発明の前記の態様に従った方法を提供する。
【0095】
本発明により識別される化合物は好ましくは薬理学的または産業上の利益を有し、例えば診断および治療用途のために適する細胞シグナル伝達機序のような生物学的系の活性化剤または抑制剤を包含する。従って好ましい態様において本発明は臨床上または産業上有用な物の発見を可能にする。本発明の別の態様において、本発明の方法により単離される物が提供される。
【0096】
適当なカプセル化条件の選択が望ましい。スクリーニングすべき化合物ライブラリの複雑度およびサイズに応じて、マイクロカプセル当たり1つの化合物(または1つ以下のマイクロビーズ)がカプセル化されるようにカプセル化の操作法を設定することが有利である。これにより分割力が最大となる。しかしながらライブラリがより大きいおよび/またはより複雑である場合は、これは非現実的であり;数種の化合物(または数個のマイクロビーズ)を共にカプセル化し、本発明の方法の反復適用に依存して所望の化合物を識別することが好ましい。カプセル化の操作法の組み合わせを用いて所望の化合物を識別してよい。
【0097】
理論的な研究によれば、化合物の数量が多いほど所望の特性を有する化合物が生成されやすいことを示している(このことがどのように抗体のレパートリーに適用されるかの説明(Perelson and Oster,1979)を参照)。また実際には、より大きいファージ−抗体レパートリーは確実により小さいレパートリーよりも良好な結合親和性を有するより多くの抗体をもたらすことが確認されている(Griffiths et al.,1994)。まれな変異体が形成され識別を可能とするには、大型のライブラリのサイズが望ましい。即ち、至適に小型であるマイクロカプセルの使用が有利である。
【0098】
これまで、1nl容量のスポットの二次元のマイクロアレイを用いて単一の実験においてスクリーニングできる化合物の最大のレパートリーは〜103であった(Hergenrother et al.,2000)。本発明を用いれば、2.6mmのマイクロカプセル直径において(Tawfik and Griffiths,1998)、3次元の分散体を形成することにより、少なくとも1011のレパートリーサイズを20mlエマルジョン中1ml水相を用いてスクリーニングできる。
【0099】
上記した化合物または化合物でコーティングされたマイクロビーズのほかに、本発明のマイクロカプセルはスクリーニング過程を起こすために必要な別の成分を含む。それらは標的および適当な緩衝液を含む。適当な緩衝液は生物学的系の所望の成分の全てが活性となるようなものであり、従って、各々の特定の反応系の条件により異なる。生物学的および/または化学的反応に適する緩衝液は当分野で知られており、その処方はSambrook and Russell,2001のような種々の実験テキストに記載されている。
【0100】
系の別の成分は標的の活性を試験するために必要なものを包含する。それらは例えば標的により触媒される反応の基質およびコファクター、および、標的に結合するリガンドを含む。それらはまた標的の活性の検出を可能にする標的の活性にカップリングされた反応の他の触媒(酵素を含む)、基質およびコファクターを含む。
【0101】
〔(B)スクリーニング操作法〕
標的に結合するか標的の活性をモジュレートする化合物をスクリーニングするためには、標的を化合物または化合物コーティングマイクロビーズ1つ以上と共にマイクロカプセル内にコンパートメント化する。好ましくは、各マイクロカプセルは単一の種類のみの化合物であるがそのコピーの多くを含有する。好ましくは、各マイクロビーズは単一の種類のみの化合物であるがそのコピーの多くによりコーティングされる。好ましくは、化合物は切断可能なリンカーを介してマイクロビーズに連結され、それらはコンパートメント中のマイクロビーズから放出されるようになる。好ましくは、各マイクロカプセルまたはマイクロビーズは光学的にタグ付けされることによりマイクロビーズに結合しているマイクロカプセル内に含有される化合物の識別を可能にする。
【0102】
((i)結合に関するスクリーニング)
化合物は標的への結合について直接スクリーニングできる。本実施形態においては、化合物がマイクロビーズに結合し、標的への親和性を有する場合には、それは標的に結合する。反応の終了時に、全マイクロカプセルを合わせ、全てのマイクロビーズを1つの環境内に共にプールする。標的に特異的に結合するか、または特異的に反応する分子を用いながらアフィニティー精製により所望の結合を示す化合物を担持するマイクロビーズを選択できる。
【0103】
別の実施形態においては、標的を当業者の知る種々の手段によりマイクロビーズに結合できる(例えばHermanson,1996参照)。スクリーニングすべき化合物は共通の特徴、即ちタグを含有する。化合物はマイクロビーズから放出され、化合物が標的に対する親和性を有する場合にそれに結合する。反応終了時に、全マイクロカプセルを合わせ、全マイクロビーズを1つの環境内に共にプールする。「タグ」に特異的に結合するか、または特異的に反応する分子を用いながらアフィニティー精製により所望の結合を示す化合物を担持するマイクロビーズを選択できる。
【0104】
別の実施形態においては、標的に結合する化合物が例えば別の結合相手からのリガンドを単に隠すだけであることに基づき、マイクロビーズをスクリーニングしてよい。この偶発性において、マイクロビーズはアフィニティー精製工程中に保持されるよりはむしろ選択的に溶出される一方、他のマイクロビーズは結合される。
【0105】
親和性による分類は結合が起こる条件における結合対の2メンバーの存在に依存している。この目的のために任意の結合対を使用してよい。本明細書において用いられるように、結合対という用語は相互に結合することができる分子の任意の対を指す。本発明において使用してよい結合対の例は抗原と抗原に結合できる抗体またはそのフラグメント、ビオチン−アビジン/ストレプトアビジン対(Savage et al.,1994)、カルシウム依存性結合ポリペプチドおよびそのリガンド(例えばカルモジュリンとカルモジュリン結合ペプチド(Montigiani et al.,1996;Stofko et al.,1992));組み立てられてロイシンジッパーを形成するポリペプチドの対(Tripet et al.,1996)、ヒスチジン(典型的にはヘキサヒスチジンペプチド)とキレート化Cu2+、Zn2+およびNi2+(例えばNi−NTA;(Hochuli et al.,1987))、RNA結合とDNA結合タンパク質(Klug et al.,1995)、例えば亜鉛フィンガーモチーフを含有するもの(Klug and Schwabe,1995)およびDNAメチルトランスフェラーゼ(Anderson,1993)とそれらの核酸結合部位を包含する。
【0106】
別の実施形態においては、化合物はマイクロカプセルまたはマイクロビーズの光学特性の変化を用いて標的への結合についてスクリーニングできる。
【0107】
標的への化合物の結合の後のマイクロカプセルまたはマイクロビーズの光学特性の変化は以下に記載するものを含む種々の方法で誘導することができる。
(1)化合物自体が特徴的な光学特性を有してもよい。例えばそれは蛍光である。
(2)化合物の光学特性が標的への結合により修飾されてもよい。例えば、化合物の蛍光が結合によりクエンチングされるか増強される(Voss,1993;Masui and Kuramitsu,1998)。
(3)標的の光学特性が化合物への結合により修飾されてもよい。例えば、標的の蛍光が結合によりクエンチングされるか増強される(Guixe et al.,1998;Qi and Grabowski,1998)。
(4)標的および化合物の両方の光学特性が結合により修飾されてもよい。例えば標的から化合物(またはその逆)の蛍光共鳴エネルギー転移(FRET)が生じ、「ドナー」の吸収波長における励起があれば「アクセプター」発光波長における発光が生じる(Heim&Tsein,1996;Mahajan et al.,1998;Miyawaki et al.,1997)。
【0108】
本発明によると、所望の活性を有する化合物がマイクロカプセルの光学特性の変化を誘導し、これにより、当該化合物を含有するマイクロカプセルおよびそこに含有されるマイクロビーズの識別および任意選択的に分類が可能となる方法が提供される。
【0109】
別の実施形態においては、本発明によると、共通のコンパートメント1つ以上内にマイクロカプセルをプールした後にマイクロビーズを分析する方法が提供される。本実施形態においては所望の活性を有する化合物はそれを担持する(そして同じマイクロカプセル内に存在する)マイクロビーズの光学特性を修飾してその識別および任意選択的に分類を可能にする。
【0110】
本実施形態においては、標的への化合物の結合は必ずしも光学特性の変化を直接誘導する必要は無い。
【0111】
本実施形態において、マイクロビーズに結合した化合物が標的に対する親和性を有する場合は、それは標的に結合する。反応終了時、全マイクロカプセルを合わせ、全マイクロビーズを1つの環境内に共にプールする。所望の結合を示す化合物を担持するマイクロビーズは、標的と特異的に結合するか、または特異的に反応する試薬を添加し、これにより、識別を可能にするマイクロビーズの光学特性の変化を誘導することにより識別できる。例えば、蛍光標識抗標的抗体を用いるか、または、抗標的抗体、次いで第1のものに結合する第2の蛍光標識抗体を使用できる。
【0112】
別の実施形態においては、標的を当業者の知る種々の手段によりマイクロビーズに結合できる(例えばHermanson,1996参照)。スクリーニングすべき化合物は共通の特徴、即ちタグを含有する。化合物はマイクロビーズから放出され、化合物が標的に対する親和性を有する場合にそれに結合する。反応終了時に全マイクロカプセルを合わせ、全マイクロビーズを1つの環境内に共にプールする。所望の結合を示す化合物を担持するマイクロビーズは、「タグ」と特異的に結合するか、または特異的に反応する試薬を添加し、これにより、識別を可能にするマイクロビーズの光学特性の変化を誘導することにより識別できる。例えば、蛍光標識抗「タグ」抗体を用いるか、または、抗「タグ」抗体、次いで第1のものに結合する第2の蛍光標識抗体を使用できる。
【0113】
別の実施形態においては、リガンドに結合する遺伝子産物が、例えばマイクロビーズの光学特性を修飾する可能性がある別の結合相手からリガンドを単に隠すことに基づいて識別してよい。この場合未修飾の光学特性を有するマイクロビーズが選択されるであろう。
【0114】
マイクロビーズを蛍光性とするために、蛍光をチラミドシグナル増幅(TSA(商標))の増幅を用いて増強することができる(Sepp et al.,2002)。これは、マイクロビーズに結合し、フルオレセイン−チラミンから遊離のラジカル形態(その後(局所的に)マイクロビーズと反応する)への変換を触媒するパーオキシダーゼ(別の化合物に連結)を使用する。TSAを実施する方法は当分野で知られており、キットがNENより販売されている。
【0115】
TSAは、マイクロビーズの蛍光の直接の増大をもたらすか、または、第2の蛍光分子または(その1つ以上が蛍光性である)分子の配列が結合するマイクロビーズにリガンドが結合するように設定される。
【0116】
((ii)結合の調節のためのスクリーニング)
別の実施形態においては、本発明は生化学的過程を調節する作用を有する化合物をスクリーニングするために使用できる。化合物が標的の結合特性を活性化する場合、活性化される標的に対するリガンドを当業者の知る種々の手段によりマイクロビーズに結合できる(例えばHermanson,1996参照)。反応終了時に全マイクロカプセルを合わせ、全マイクロビーズを1つの環境内に共にプールする。所望の結合を示す化合物を担持するマイクロビーズは、標的と特異的に結合するか、または特異的に反応する分子を用いたアフィニティー精製により選択できる。
【0117】
別の実施形態においては、化合物が標的の結合活性を抑制することに基づいてマイクロビーズをスクリーニングしてよい。この偶発性において、マイクロビーズはアフィニティー精製工程中に保持されるよりはむしろ選択的に溶出される一方、他のマイクロビーズは結合される。
【0118】
別の実施形態において、化合物はマイクロカプセルまたはマイクロビーズの光学特性の変化を用いて標的の結合特性をモジュレートする能力についてスクリーニングできる。
【0119】
リガンドへの標的の結合の後のマイクロカプセルまたはマイクロビーズの光学特性の変化は以下に記載するものを含む種々の方法で誘導することができる。
(1)リガンド自体が特徴的な光学特性を有してもよい。例えばそれは蛍光である。
(2)リガンドの光学特性が標的への結合により修飾されてもよい。例えば、リガンドの蛍光が結合によりクエンチングされるか増強される(Voss,1993;Masui and Kuramitsu,1998)。
(3)標的の光学特性がリガンドへの結合により修飾されてもよい。例えば、標的の蛍光が結合によりクエンチングされるか増強される(Guixe et al.,1998;Qi and Grabowski,1998)。
(4)標的およびリガンドの両方の光学特性が結合により修飾されてもよい。例えば標的からリガンド(またはその逆)の蛍光共鳴エネルギー転移(FRET)が生じ、「ドナー」の吸収波長における励起があれば「アクセプター」発光波長における発光が生じる(Heim&Tsein,1996;Mahajan et al.,1998;Miyawaki et al.,1997)。
【0120】
本発明によると、所望の活性を有する化合物がマイクロカプセルの光学特性の変化を誘導し、これにより、化合物を含有するマイクロカプセルおよびそこに含有されるマイクロビーズの識別および任意選択的に分類が可能となる方法が提供される。
【0121】
別の実施形態においては、本発明によると、共通のコンパートメント1つ以上内にマイクロカプセルをプールした後にマイクロビーズを分析する方法が提供される。本実施形態においては所望の活性を有する化合物は、それを担持する(そして同じマイクロカプセル内に存在する)マイクロビーズの光学特性を修飾してその識別および任意選択的に分類を可能にする。
【0122】
本実施形態においては、リガンドへの標的の結合は必ずしも光学特性の変化を直接誘導する必要は無い。
【0123】
本実施形態において、マイクロビーズに結合したリガンドが標的に対する親和性を有する場合は、それは標的に結合する。反応終了時、全マイクロカプセルを合わせ、全マイクロビーズを1つの環境内に共にプールする。結合活性をモジュレートする化合物を担持するマイクロビーズは、標的と特異的に結合するか、または特異的に反応する試薬を添加し、これにより、識別を可能にするマイクロビーズの光学特性の変化を誘導することにより識別できる。例えば、蛍光標識抗標的抗体を用いるか、または、抗標的抗体、次いで第1のものに結合する第2の蛍光標識抗体を使用する。
【0124】
別の実施形態においては、標的を当業者の知る種々の手段によりマイクロビーズに結合できる(例えばHermanson,1996参照)。スクリーニングすべきリガンドは共通の特徴、即ちタグを含有する。反応終了時に全マイクロカプセルを合わせ、全マイクロビーズを1つの環境内に共にプールする。結合をモジュレートする化合物を担持するマイクロビーズは、「タグ」と特異的に結合するか、または特異的に反応する試薬を添加し、これにより、識別を可能にするマイクロビーズの光学特性の変化を誘導することにより識別できる。例えば、蛍光標識抗「タグ」抗体を用いるか、または、抗「タグ」抗体、次いで第1のものに結合する第2の蛍光標識抗体を使用する。
【0125】
上記した通り、蛍光はチラミドシグナル増幅(TSA(商標))の増幅を用いて増強されることによりマイクロビーズを蛍光性とする(Sepp et al.,2002)。
【0126】
((iii)触媒作用の調節のスクリーニング)
別の実施形態において、本発明によると、所望の活性を有する化合物がマイクロカプセルの光学特性の変化を誘導し、これにより、化合物を含有するマイクロカプセルおよび任意選択的にそこに含有されるマイクロビーズの識別および任意選択的に分類が可能となる方法が提供される。マイクロカプセルの光学特性は、
(1)異なる光学特性を有する調節された反応の基質および生成物(多くの蛍光発生酵素基質は例えばHaugland,1996およびwww.probes.comより入手可能である)、例えばグリコシダーゼ、ホスファターゼ、ペプチダーゼおよびプロテアーゼの基質、または
(2)マイクロカプセル内の調節された反応の生成物(または基質)と特異的に結合または反応し、これにより、その識別を可能とするように、マイクロカプセルの光学特性の変化を誘導する試薬の存在、の何れによっても修飾できる。
【0127】
標的の活性をモジュレートするものを得るために化合物のライブラリをスクリーニングするための広範な試験法は、光学特性の変化を検出することに基づいており、本発明に従って化合物をスクリーニングするために使用できる。このような試験は当業者に周知である(例えばHaugland,1996およびwww.probes.com参照)。
【0128】
あるいは、選択は同じマイクロカプセル内で起こるその後の反応に第1の反応をカップリングすることにより間接的に実施してよい。これを行うには2通りの一般的な方法がある。第1に第1の反応の生成物を、第1の反応の基質とは反応しない分子と反応させるか結合させる。第2に、カップリングされた反応は第1の反応の生成物の存在下にのみ進行するようにする。その後、調節化合物は、第2の反応の生成物または基質の特性により識別できる。
【0129】
あるいは、選択すべき反応の生成物は第2の酵素触媒反応の基質またはコファクターであってよい。第2の反応を触媒する酵素はマイクロカプセル化よりも前に反応混合物に取り込ませることができる。第1の反応が進行する場合のみ、カップリングされた酵素は識別可能な生成物を生成することになる。
【0130】
カップリングのこの概念は前の反応の生成物を基質として各々が使用する複数の酵素を取り込むために調整することができる。これにより固定化された基質とは反応しない酵素の調節物質の選択が可能になる。1つの反応の生成物が選択可能な生成物をもたらす第2の反応または反応のシリーズのための触媒またはコファクターである場合、シグナル増幅により増強された感度を得るように設計することもできる(例えばJohannsson,1991;Johannsson and Bates,1988参照)。更にまた、酵素カスケード系は酵素の活性化物質の生産または酵素阻害剤の破壊に基づくこともできる(Mize et al.,1989参照)。カップリングはまた、同じ生成物を生成する酵素の全体の群に対して共通のスクリーニング系を使用でき、複雑な多工程の化学的変換および経路の調節の選択を可能にするという利点も有する。
【0131】
別の実施形態においては、標的そのものが酵素である場合、または、標的が酵素的である生化学的過程を調節する場合、各マイクロカプセルにあのマイクロビーズは酵素的反応のための基質でコーティングしてよい。調節化合物は、基質が生成物に変換される程度を決定する。反応終了時、触媒された反応の生成物にマイクロビーズを物理的に連結する。マイクロカプセルを合わせて反応体をプールすると活性化化合物でコーティングされたマイクロビーズは生成物に特異的な任意の性質により識別できる。阻害剤が望まれる場合は、調節された反応の基質に特異的な化学的特性があるものを選択できる。
【0132】
更にまた、基質はマイクロビーズに結合しないことが望ましい場合もある。この場合、基質は光活性化のような自体の活性化のための別の工程を要する不活性の「タグ」を含有するであろう(例えば「ケージ化」ビオチン類縁体(Pirrung and Huang,1996;Sundberg et al.,1995)。基質から生成物への変換の後、「タグ」は活性化され、「タグ付け」された基質および/または生成物はマイクロビーズに結合したタグ結合分子(例えばアビジンまたはストレプトアビジン)に結合する。従って、「タグ」を介して核酸に結合した生成物に対する基質の比は溶液中の基質および生成物の比を反映するものとなる。ケージ化ビオチンでタグ付けされた基質はマイクロカプセル中のコンパートメント化に基づく操作法を用いたホスホトリエステラーゼ活性を有する酵素をコードする遺伝子の選択のために使用されている(Griffiths and Tawfik,2003)。ホスホトリエステラーゼ基質は活性酵素分子を含有するマイクロカプセル内の溶液中で加水分解され、反応が終了した後、ケージング基を放射線照射により放出させ、酵素をコードする遺伝子が結合したマイクロビーズにビオチン部分を介して生成物が結合できるようにされている。
【0133】
マイクロビーズおよびマイクロカプセル内の内容物が混合された後、適宜生成物または基質に対して特異的に結合する分子(例えば抗体)を用いたアフィニティー精製により調節物質でコーティングされたマイクロビーズを選択できる。
【0134】
別の実施形態においては、本発明によると、共通のコンパートメント1つ以上内にマイクロカプセルをプールした後にマイクロビーズを分析する方法が提供される。調節化合物でコーティングしたマイクロビーズはマイクロビーズの光学特性の変化を用いて識別できる。生成物(または基質)が結合したマイクロビーズの光学特性は、
(1)例えば下記の理由により、基質−マイクロビーズ複合体では検出されない特徴的な光学特性を有する生成物−マイクロビーズ複合体;
(a)異なる光学特性を有する基質および生成物(多くの蛍光発生酵素基質は例えばHaugland,1996およびwww.probes.comより入手可能である)、例えばグリコシダーゼ、ホスファターゼ、ペプチダーゼおよびプロテアーゼの基質、または、
(b)同じ光学特性を有する基質および生成物、ただし、基質ではなく生成物のみがマイクロビーズと結合または反応するもの;
(2)生成物(または基質)と特異的に結合または反応し、これにより、その識別を可能とするマイクロビーズの光学特性の変化を誘導する試薬の添加(これらの試薬はマイクロカプセルの破壊およびマイクロビーズのプールの前または後に添加できる)。その試薬は、基質および生成物の両方がマイクロビーズに結合する場合は、基質ではなく生成物のみ(またはその逆)に特異的に結合または特異的に反応するか、または、基質ではなく生成物のみがマイクロビーズに結合または反応する(またはその逆)場合に、任意選択的に基質および生成物の両方に結合する;の何れによっても修飾できる。
【0135】
このシナリオにおいて、基質(または基質の1つ)はマイクロビーズには連結されていないが分子「タグ」(例えばビオチン、DIGまたはDNPまたは蛍光基)を有する各マイクロカプセル内に存在できる。調節された酵素が基質を生成物に変換する場合、生成物は「タグ」を保有し、その後生成物特異的抗体によりマイクロカプセル内で捕獲される。全ての反応が停止しマイクロカプセルが合わせられた時点で、これらのマイクロビーズは「タグ付け」され、例えば「タグ」が蛍光基である場合は、変化した光学特性を既に有してもよい。あるいは、「タグ付け」されたマイクロビーズの光学特性の変化は「タグ」(例えば蛍光標識アビジン/ストレプトアビジン、蛍光性の抗「タグ」抗体または第2の蛍光標識抗体により検出できる非蛍光の抗「タグ」抗体)に結合する蛍光標識されたリガンドを添加することにより誘導できる。
【0136】
((iv)化合物の特異性/選択性のスクリーニング)
特定の標的に対する特異性または選択性を有するが他のものに対しては有さない化合物は、1つの基質を用いた反応の調節に関する積極的スクリーンまたは別の基質との反応の調節に関する消極的スクリーンを実施することにより特異的に識別できる。例えば、2種の異なる標的酵素に特異的な2種の基質を各々異なる蛍光発生部分で標識する。各標的酵素は異なる蛍光スペクトルを有する生成物の生成を触媒し、2種の標的に対する化合物の特異性に応じてマイクロカプセルの異なる光学特性をもたらす。
【0137】
((v)細胞を使用するスクリーニング)
現在の薬剤発見の状況においては、有効化された組み換え標的がインビトロの高スループットスクリーニング(HTS)試験の根拠を形成している。しかしながら単離されたタンパク質は複雑な生物学的系の代表とはみなされず;従って、細胞に基づく系は、インタクトな生物学的系において化合物の活性のより高い信頼性をもたらす。薬剤に関する広範な細胞系試験が当業者に知られている。細胞は、油中水エマルジョンの水性微小液滴のようなマイクロカプセル内にコンパートメント化できる(Ghadessy,2000)。標的に対する化合物の作用は、化合物と共にマイクロカプセル内に細胞をコンパートメント化すること、および、適切な細胞系試験を用いて細胞に対して所望の作用を有する化合物を含有するコンパートメントを識別することにより測定することができる。フッ化炭素中水のエマルジョンの使用は特に好ましく、フッ化炭素の高い気体溶解能が呼吸ガスの交換を支援でき、細胞培養系に有利であることが報告されている(Lowe,2002)。
【0138】
((vi)フローサイトメトリー)
本発明の好ましい実施形態においては、マイクロカプセルまたはマイクロビーズをフローサイトメトリーにより分析および任意選択的に分類する。マイクロカプセルの多くのフォーマットをフローサイトメトリーを用いておよび任意選択的に直接分類できる。マイクロカプセルの一部のフォーマットは分析または分類の前にマイクロカプセルを別途処理することを必要とする場合がある。例えば油中水エマルジョンはフローサイトメトリーによる分析を容易にするために水中油中水のダブルエマルジョンに変換できる(Bernath et al.,2004)。多重エマルジョンは単純な一次油中水(または水中油)エマルジョンを再乳化して水中油中水(または油中水中油)エマルジョンとすることにより製造される(Davis and Walker,1987)。
【0139】
高度に単分散したマイクロカプセルは微小流体技術を用いて製造できる。例えば多分散度3%未満の油中水エマルジョンは、油の共流動ストリーム内の液滴の破壊により産生できる(Umbanhowar,2000)。微小流体システムはまた微小流体チャンネル内の油のストリーム中に分散された水性の微小液滴の層流のためにも使用できる(Thorsen,2001)。これにより微小液滴の流動の分析および任意選択的に流動の分類のための微小流体装置の構築が可能となる(Fu,2002)。
【0140】
種々の光学特性を分析のため、および、分類をトリガーするために使用でき、例えば光散乱(Kerker,1983)および蛍光分極(Rolland et al.,1985)が挙げられる。高度に好ましい実施形態においては、マイクロカプセルまたはマイクロビーズの光学特性の差は蛍光の差であり、必要に応じて、マイクロカプセルまたはマイクロビーズは蛍光活性化細胞ソーター(Norman,1980;Mackenzie and Pinder,1986)または同様の装置を用いて分類する。フローサイトメトリーは下記の一連の利点を有する。
【0141】
(1)信頼できる製造元(例えばBecton-Dickinson,Coulter,Cytomation)の市販の蛍光活性化細胞分類装置により100,000マイクロカプセルまたはマイクロビーズs-1までの分析および分類が可能である。
【0142】
(2)各マイクロカプセルまたはマイクロビーズから生じる蛍光シグナルは存在する蛍光分子の数に厳格に対応している。マイクロカプセルまたはマイクロビーズ当たり僅か数百の蛍光分子でも定量的に検出できる。
【0143】
(3)蛍光検出器のダイナミックレンジが広い(典型的には4対数単位)ことにより、分類の操作法の厳密性を容易に設定でき、これにより、原料プールから至適数量のマイクロカプセルまたはマイクロビーズを回収できる(ゲートは蛍光の僅かな差を有するマイクロカプセルまたはマイクロビーズを分離するか、蛍光の大きな差を有するマイクロカプセルまたはマイクロビーズを分離するのみとするか、実施する選択に応じて設定できる)。
【0144】
(4)市販の蛍光活性化細胞分類装置は複数の波長において同時に励起および検出を実施でき(Shapiro,1995)、これにより、2〜13(またはそれ以上)の蛍光マーカーによるマイクロカプセルまたはマイクロビーズの標識をモニタリングすることにより積極的および消極的な選択を同時に実施でき、例えば2種の交互の標的に対する基質を異なる蛍光タグで標識する場合、マイクロカプセルまたはマイクロビーズは調節される標的に応じて異なる蛍光団で標識できる。
【0145】
マイクロカプセルまたはマイクロビーズを光学的にタグ付けする場合は、フローサイトメトリーを用いてマイクロカプセル内に存在するまたはマイクロビーズ上にコーティングされた化合物を識別することもできる(後述を参照)。光学的タグ付けはマイクロカプセル内の化合物の濃度(1段階より多い濃度を単一の実験で使用する場合)またはマイクロビーズ上にコーティングされた化合物の分子の数(1段階より多いコーティング密度を単一の実験で使用する場合)を識別するためにも使用できる。更にまた、光学的タグ付けは、マイクロカプセル内の標的を識別するためにも使用できる(1種より多い標的を単一の実験で使用する場合)。この分析はマイクロビーズを含有するマイクロカプセルの分類の後、または、マイクロビーズの分類の後に、活性の測定と同時に実施できる。
【0146】
((vii)マイクロカプセルの識別および分類)
本発明は、使用する分類技術により可能となるインタクトのマイクロカプセルの識別および任意選択的に分類を提供する。マイクロカプセルは、所望の化合物により誘導される変化がマイクロカプセルの表面で発生または顕在化するか、または、マイクロカプセルの外部から検出される場合に、そのまま識別され、任意選択的に分類することができる。変化は、化合物の直接の作用によるか、または、うち1つ以上が所望の活性を有する化合物を使用する一連の反応が変化をもたらすような間接的なものにより、誘導されてよい。例えば、マイクロカプセルが膜マイクロカプセルである場合、標的を含む生化学的系の化合物がその表面にディスプレイされ、これによりマイクロカプセル内のマイクロビーズ上の化合物により調節される生化学的系の変化を検出できる試薬に接触可能となるようにマイクロカプセルを構成させてよい。
【0147】
しかしながら本発明の好ましい態様においては、マイクロカプセルの識別および任意選択的に分類は、マイクロカプセルの光学特性、例えばその吸収または発光の特性の変化、例えばマイクロカプセルに伴う吸光度、ルミネセンス、燐光または蛍光の変化をもたらす反応から生じるマイクロカプセルの光学特性の改変に依存している。このような特性の全ては「光学的」という用語に包含される。そのような場合、マイクロカプセルは識別され、任意選択的にルミネセンス、蛍光または燐光により活性化された分類により分類できる。高度に好ましい実施形態においては、フローサイトメトリーを用いることにより、マイクロカプセル内の蛍光分子の生成をもたらす所望の活性を有する化合物を含有するマイクロカプセルを分析および任意選択的に分類する。
【0148】
別の実施形態においては、マイクロカプセルの蛍光の変化は、それが識別されれば、コンパートメント内のマイクロビーズの修飾をトリガーするのに用いられる。本発明の好ましい態様において、マイクロカプセルの識別はマイクロカプセル内部のルミネセンス、燐光または蛍光をもたらす反応から生じるマイクロカプセルの光学特性の変化に依存している。マイクロカプセル内のマイクロビーズの修飾は、ルミネセンス、燐光または蛍光の識別によりトリガーされる。例えば、ルミネセンス、燐光または蛍光の識別はマイクロビーズまたはそれに結合している分子の修飾をもたらす光子(または他の粒子または波動)に対するコンパートメントの衝突をトリガーすることができる。同様の操作法が細胞の急速分類に関して以前に記載されている(Keij et al.,1994)。マイクロビーズの修飾は、例えばマイクロビーズへの光不安定性保護基でケージ化された分子「タグ」のカップリングから生じるものであってよく、適切な波長の光子との衝突はケージの除去をもたらす。その後、全てのマイクロカプセルを合わせ、マイクロビーズを1つの環境内に共にプールする。所望の活性を示す化合物でコーティングされたマイクロビーズは「タグ」に特異的に結合するか特異的に反応する分子を用いてアフィニティー精製により選択できる。
【0149】
〔(C)化合物ライブラリ〕
ライブラリは種々の市販の原料から得ることができる。ライブラリ内の化合物は当業者の周知の種々の方法により製造できる。任意選択的に、化合物ライブラリは空間的に分割されたパラレル合成を用いた、または、スプリット合成を用いたコンビナトリアル合成により製造でき、任意選択的に1ビーズ1化合物のライブラリを生成させる。任意選択的に、化合物はビーズ上で合成できる。これらのビーズは直接マイクロカプセル内にコンパートメント化するかコンパートメント化の前に化合物を放出させることができる。
【0150】
好ましくは、化合物の僅か1種のみであるが、その複数のコピーを各マイクロカプセル内に存在させる。
【0151】
任意選択的に、化合物は当業者の知る種々の手段により共有結合的に、または、非共有結合的にマイクロビーズに連結できる(例えばHermanson,1996参照)。
【0152】
マイクロビーズは広範な種類の機能表面基、即ちアルデヒド、脂肪族アミン、アミド、芳香族アミン、カルボン酸、クロロメチル、エポキシ、ヒドラジド、ヒドロキシル、スルホネートおよびトシルにより付与される疎水性表面(例えばプレーンポリスチレン)から極めて親水性の表面まで、種々の表面化学のものが入手可能である。官能基はマイクロビーズ表面への化合物の安定または過逆的な結合のための当業者の周知の広範な共有結合反応を可能とする。
【0153】
好ましくは化合物は切断可能なリンカーを介してマイクロビーズに結合する。このような種々のリンカーは当業者の知る通りであり(例えばGordon and Balasubramanian,1999参照)、例えば光化学的に切断できるリンカー、および、pHの変更により(例えばイミンおよびアシルヒドラゾン)、酸化還元特性を調節することにより(例えばジスルフィド)または外部触媒を用いながら(例えば交差複分解およびアミド転換)制御することができる可逆共有結合が挙げられる。
【0154】
好ましくは、化合物の僅か1種のみであるが、その複数のコピーを各ビーズ内に結合させる。
【0155】
〔(D)化合物の識別〕
マイクロカプセル内またはマイクロビーズ上の化合物は種々の方法で識別できる。識別されたマイクロカプセルを分類(例えば蛍光活性化細胞ソーター:FACSを使用)する場合、化合物は例えば質量スペクトル分析による直接の分析により識別できる。選択(例えばアフィニティー精製による)または分類(例えばFACSを使用)の結果として単離されたビーズに結合したままで化合物が残存する場合、それらはまた例えば質量スペクトル分析による直接の分析により識別できる。マイクロカプセルまたはビーズは当業者の周知の種々の手段によりタグ付けでき、そのタグを用いてビーズに結合した化合物を識別する(Czarnik,1997)。化合物をコード化する化学的、スペクトル分析的、電子的および物理的な方法は全て使用してよい。好ましい実施形態においては、マイクロカプセルまたはビーズは異なる光学特性を有し、これにより光学的にコード化される。好ましい実施形態においては、コード化は異なる蛍光特性を有するマイクロカプセルまたはビーズに基づく。高度に好ましい実施形態においては、マイクロカプセルまたはビーズはマイクロカプセルまたはビーズ内に異なる濃度で存在する蛍光量子ドットを用いてコード化される(Han,2001)。微小流体チャンネル内を順序だった配列として流動しているマイクロカプセルはまたマイクロカプセルのストリーム内のその配列によりコード化(全体的または部分的)できる(位置コード化)。
【0156】
好ましくは、各化合物は異なる濃度(典型的にはmM〜nMの範囲の濃度)で異なるマイクロカプセル内に存在することにより、用量応答曲線の作成を可能とする。これは、例えば阻害化合物の阻害定数(Ki)の測定を可能にする。マイクロカプセル内の化合物の濃度は例えば上記したマイクロカプセルまたはマイクロビーズの光学的コード化または位置コード化により測定できる。
【0157】
〔(E)標的の識別〕
好ましくは、各マイクロカプセルが同じ標的の複数のコピーを含有するように複数の異なる標的をマイクロカプセル内にコンパートメント化できる。例えば複数のプロテインキナーゼ、または単一の標的の複数の多形変異体をコンパートメント化することにより化合物の特異性を測定可能にできる。マイクロカプセル内の標的の特性(identity)は、例えば上記したマイクロカプセルまたはマイクロビーズの光学的コード化または位置コード化により測定できる。
【図面の簡単な説明】
【0158】
【図1】PTP1B阻害剤の例。ビス−ジフルオロメチレンホスホネート部分を有する化合物(例えば2)は単一の部分を有するものよりも有意に大きい力価を有する。
【図2】マイクロカプセル化を用いたPTP1B阻害剤のスクリーニング。オレンジ色または赤色の蛍光色素で染色した表面カルボキシレート基を有するポリスチレンビーズ(Fulton et al.,1997)をホスホペプチドPTP1B基質および切断可能なリンカーを介して結合したPTP1B阻害剤または非阻害化合物のいずれかで誘導する(1)。ビーズを混合した後、シングルのビーズおよび標的酵素(PTP1B)を、油中水エマルジョンを形成することによりマイクロコンパートメント内に共局在化させる(2)。化合物を放出する(光化学的)(3)。阻害剤は生成物(脱ホスホリル化ペプチド)に変換される基質の量を低減する(4)。酵素反応を停止し、エマルジョンを破壊する(5)。緑色蛍光抗基質抗体で標識した後、ビーズを3色フローサイトメトリーで分析し、阻害の程度およびビーズ上の化合物を同時に測定する(6)。最終的に、化合物ライブラリを光学的にタグ付けされたビーズ(後述)にカップリングし、フローサイトメトリーにより急速にデコードすることができる(100,000ビーズs-1以下)。ヒット化合物を再合成して、更に特性決定(7)するか合成進化の過程において産生して再スクリーニングすることができる(8)。
【図3】フッ化炭素中水エマルジョン中の小分子のコンパートメント化。実施例9に記載するとおりホモゲナイズにより水相中にテキサスレッド(1mM)およびカルセイン(1mM)を含有するパーフルオロオクチルブロミド中水エマルジョンを作成した。2種のエマルジョンを回転混合し、24時間後にエピ蛍光顕微鏡により画像化した。微小液滴間のテキサスレッド(赤色蛍光)およびカルセイン(緑色蛍光)の交換は観察されなかった。
【実施例】
【0159】
[実施例1:酵素タンパク質チロシンホスファターゼ1B(PTP1B)の阻害剤のスクリーニング]
PTP1Bはインスリンおよびレプチンのシグナル伝達の負の調節物質である。インスリンおよびレプチンに対する耐性はII型真性糖尿病および肥満の指標であり、従ってPTP1Bは糖尿病および肥満の治療のための魅力的な薬剤標的である(Johnson et al.,2002)。2種の油中水エマルジョンを以下の通り作成した。
【0160】
デカン中の1%(w/v)Span60および1%(w/v)コレステロールの溶液(全てSigma Aldrichから)は、デカン7.84mlにSpan60を80mg、コレステロールを80mg溶解することにより製造する。デカンを45に加熱し、界面活性剤およびコレステロールの完全な可溶化を可能とする。界面活性剤/デカンの溶液を200μlバッチに渡り分割し、37のブロックヒーター中に入れる。
【0161】
手操作押し出し装置(Mini extruder,Abanti Polar Lipids Inc,Alabaster,AL,USA)を製造元の取扱説明書に従って組み立てる。押し出しのためには、平均孔径14・高フシングルの19mmのTrack-Etchポリカーボネートフィルター(Whatman Nucleopore,Whatman,Maidstone,UK)をミニ押出機の内部に装着する。2本の気密性1mlハミルトンシリンジ(Gastight#1001、Hamilton Co,Reno,Nevada,USA)を押し出しに使用する。デカン1mlをにハミルトンシリンジ1本にロードしてシリンジをミニ押出機の一端に置き押出機の他方上の空のハミルトンシリンジ内にフィルターを経由してそれを押し出すことにより、デカン3ラ1mlで押出機を前洗浄した。
【0162】
第1のエマルジョンは、PTP1B活性に適合した緩衝液(25mM HEPES、pH7.4、125mM NaCl、10%グリセロール、1mM EDTA)(Doman et al.,2002)中のビス−ジフルオロメチレンホスホネートを有しており公知のPTP1B阻害剤である100・l化合物2(図1)50・・Johnson et al.,2002)、5mU/mlの標的酵素(ヒト組み換えPTP1B、残基1〜322;Biomol Research Laboratories,Inc.)、蛍光発生PTP1B基質6,8−ジフルオロ−4−メチルウンベリフェリルホスホネート(DiFMUP)(Molecular Probes)および100・lテキサスレッド(Sigma;励起/発光最大595/615nm;赤色蛍光)をハミルトンシリンジの1本に、予備加熱したデカン/界面活性剤混合物を他のハミルトンシリンジにロードすることにより作成する。シリンジを押出機のフィルターホルダーの両側の開口部内に装着する。化合物混合物を強制的にフィルターホルダーを通してデカン/界面活性剤混合物の入った別のシリンジ内に入れ、直接強制的に元のシリンジに戻すことにより、押し出しの1往復を完了する。合計で7.5往復の押し出しを完了する。充填されたシリンジを押出機から取り外し、1.7ml Axygen試験管内にあける(#MCT-175-C、Axygen Scientific,Inc.,Union City,CA,USA)。
【0163】
第2の油中水エマルジョンは化合物2の代わりにPTP1B阻害剤ではない化合物である100・lヒドロケイヒ酸(Aldrich)を、テキサスレッドの代わりに100・lカルセイン(Sigma;励起/発光最大470/509nm;緑色蛍光)を含有する以外は上記エマルジョンと同一に作成する。
【0164】
1:1000〜1:1(化合物2エマルジョン:ヒドロケイヒ酸エマルジョン)の範囲の比で2種のエマルジョンを振とうすることにより混合し、30分間37でインキュベートする。阻害剤は脱ホスホリル化生成物(DiFMU;励起/発光最大358/452nm;青色蛍光)に変換される非蛍光基質(DiFMUP)の量を低減する。
【0165】
次に油中水エマルジョンを以下の通り水中油中水ダブルエマルジョンに変換する。押出機(上記参照)を分解し、石鹸および逆浸透水で十分洗浄し、再度組み立てる。平均孔径8・高フシングルの19mmTrack-Etchポリカーボネートフィルターを装着する。押出機をリン酸緩衝食塩水(PBS)3×1mlで予備洗浄する。0.5%(w/v)Tween80(Sigma Aldrich)を含有するPBS 750μlを1mlの気密性ハミルトンシリンジにロードし、押出機に装着する。油中水エマルジョン250μlを別の1mlハミルトンシリンジにロードし、押出機に装着する。エマルジョンを強制的にフィルターを通してPBS/0.5%Tween80の入った別のシリンジ内に入れ、即座に強制的に元のシリンジに戻すことにより、押し出しの1サイクルを完了する。合計で4.5サイクルの押し出しを完了する。充填されたシリンジを押出機から取り外し、1.7mlAxygen試験管内にあける。形成された水中油中水のダブルエマルジョンを氷上に置く。
【0166】
次にダブルエマルジョンをMoFlo(Cytomation)フローサイトメトリーを用いた多色フローサイトメトリーにより分析する。主に、緑色蛍光を示す(ヒドロケイヒ酸を含有する)マイクロカプセルがPTP1BによるDiFMUPの脱ホスホリル化により青色蛍光も示す。主に、赤色蛍光を示す(化合物2を含有する)マイクロカプセルがPTP1Bの阻害により青色蛍光は殆どまたは全く示さない。
【0167】
[実施例2]
2種の水性混合物を氷上(反応を防止するため)において作成する。第1の混合物はPTP1B活性に適合した緩衝液(25mM HEPES、pH7.4、125mM NaCl、10%グリセロール、1mM EDTA)(Doman et al.,2002)中のビス−ジフルオロメチレンホスホネートを有しており知られたPTP1B阻害剤である100・l化合物2(図1)(Johnson et al.,2002)、5mU/mlの標的酵素(ヒト組み換えPTP1B、残基1〜322;Biomol Research Laboratories,Inc.)、蛍光発生PTP1B基質6,8−ジフルオロ−4−メチルウンベリフェリルホスホネート(DiFMUP)(Molecular Probes)および100・lテキサスレッド(Sigma;励起/発光最大595/615nm;赤色蛍光)を含有する。第2の混合物は化合物2の代わりにPTP1B阻害剤ではない化合物である100・lヒドロケイヒ酸(Aldrich)を、テキサスレッドの代わりに100・lカルセイン(Sigma;励起/発光最大470/509nm;緑色蛍光)を含有する以外は上記と同一に作成する。
【0168】
化合物混合物の各々の50μlを順次、実施例1に記載したとおり作成し37に保持したデカン中1%(w/v)Span60および1%(w/v)コレステロールの溶液に添加し、その間5mmの分散ツールでUltra-TurraxT8ホモゲナイザー(IKA)を用いながら25,000r.p.mでホモゲナイズする。ホモゲナイズは第2の小分量を添加した後3分間継続する。次に生成した粗野なエマルジョンを実施例1の通り押し出し、微小な油中水エマルジョンを作成し、30分間37でインキュベートする。阻害剤は脱ホスホリル化生成物(DiFMU;励起/発光最大358/452nm;青色蛍光)に変換される非蛍光基質(DiFMUP)の量を低減する。次に油中水エマルジョンを水中油中水ダブルエマルジョンに変換し、実施例1に記載の通り多色フローサイトメトリーで分析する。主に、緑色蛍光を示す(ヒドロケイヒ酸を含有する)マイクロカプセルがPTP1BによるDiFMUPの脱ホスホリル化により青色蛍光も示す。主に、赤色蛍光を示す(化合物2を含有する)マイクロカプセルがPTP1Bの阻害により青色蛍光は殆どまたは全く示さない。
【0169】
[実施例3:化合物ライブラリからのPTP1B阻害剤のスクリーニング]
実施例1に記載の通り100種の油中水エマルジョンを氷上(反応を防止するため)において作成する。第1のエマルジョンは、ビス−ジフルオロメチレンホスホネートを有しており知られたPTP1B阻害剤である100・l化合物2(図1)(Johnson et al.,2002)、5mU/mlの標的酵素(ヒト組み換えPTP1B、残基1〜322;Biomol Research Laboratories,Inc.)、蛍光発生PTP1B基質6,8−ジフルオロ−4−メチルウンベリフェリルホスホネート(DiFMUP)(Molecular Probes)および発光最大585nm、655nmおよび705nmを有する予備設定された比のQdot(商標)ストレプトアビジンコンジュゲート(Quantum Dot Corporation,Hayward CA)の混合物をPTP1B活性に適合した緩衝液(25mM HEPES、pH7.4、125mM NaCl、10%グリセロール、1mM EDTA)(Doman et al.,2002)に分散することにより作成する。99種の他の油中水エマルジョンは、化合物2の代わりにカルボン酸有機ビルディングブロックライブラリ(Aldrich)由来の99種のカルボン酸のうちの1つ、および、発光最大585nm、655nmおよび705nmを有する異なる比のQdot(商標)ストレプトアビジンコンジュゲートを各々が含有する以外は上記と同一である。全てのエマルジョンにおいて、705nmQdot(商標)ストレプトアビジンコンジュゲートの濃度は100nMであり、585nmおよび655nmQdot(商標)ストレプトアビジンコンジュゲートの濃度は0、11、22、33、44、55、66、77、88または100nMの何れかとする。従って、100(10ラ10)通りのQdot(商標)ストレプトアビジンコンジュゲートの濃度があることになり、これにより、705nm、585nmおよび655nmにおける蛍光の蛍光比を測定することにより読み取られる独特の蛍光シグネチャーを各化合物を含有するマイクロカプセルが保有できるようになる。
【0170】
100種のエマルジョンを振とう攪拌により等しい比で混合し、温度を30分間25まで上昇させる。阻害剤は脱ホスホリル化生成物(DiFMU;励起/発光最大358/452nm;青色蛍光)に変換される非蛍光基質(DiFMUP)の量を低減する。次に油中水エマルジョンを水中油中水ダブルエマルジョンに変換し、実施例1に記載の通り多色フローサイトメトリーで分析する。化合物2を含有するマイクロカプセルのQdot蛍光シグネチャーのものを除き、主に、全てのマイクロカプセルはPTP1BによるDiFMUPの脱ホスホリル化により青色蛍光を示す。
【0171】
[実施例4:化合物ライブラリからのPTP1B阻害剤のスクリーニング]
100種の水性混合物を氷上(反応を防止するため)において作成する。第1の混合物は、PTP1B活性に適合した緩衝液(25mM HEPES、pH7.4、125mM NaCl、10%グリセロール、1mM EDTA)(Doman et al.,2002)中のビス−ジフルオロメチレンホスホネートを有しており知られたPTP1B阻害剤である100・l化合物2(図1)(Johnson et al.,2002)、5mU/mlの標的酵素(ヒト組み換えPTP1B、残基1〜322;Biomol Research Laboratories,Inc.)、蛍光発生PTP1B基質6,8−ジフルオロ−4−メチルウンベリフェリルホスホネート(DiFMUP)(Molecular Probes)および発光最大585nm、655nmおよび705nmを有する予備設定された比のQdot(商標)ストレプトアビジンコンジュゲート(Quantum Dot Corporation,Hayward CA)を含有する。99種の他の水性混合物は、化合物2の代わりにカルボン酸有機ビルディングブロックライブラリ(Aldrich)由来の99種のカルボン酸のうちの1つ、および、発光最大585nm、655nmおよび705nmを有する異なる比のQdot(商標)ストレプトアビジンコンジュゲートを各々が含有する以外は上記と同一である。全ての混合物において、705nmQdot(商標)ストレプトアビジンコンジュゲートの濃度は100nMであり、585nmおよび655nmQdot(商標)ストレプトアビジンコンジュゲートの濃度は0、11、22、33、44、55、66、77、88または100nMの何れかとする。従って、100(10ラ10)通りのQdot(商標)ストレプトアビジンコンジュゲートの濃度があることになり、これにより、705nm、585nmおよび655nmにおける蛍光の蛍光比を測定することにより読み取られる独特の蛍光シグネチャーを各化合物を含有するマイクロカプセルが保有できるようになる。
【0172】
化合物混合物の各々0.5μlを順次、実施例1に記載したとおり作成し37に保持したデカン中1%(w/v)Span60および1%(w/v)コレステロールの溶液に添加し、その間5mmの分散ツールでUltra-TurraxT8ホモゲナイザー(IKA)を用いながら25,000r.p.mでホモゲナイズする。ホモゲナイズは第2の小分量を添加した後3分間継続する。次に生成した粗野なエマルジョンを実施例1の通り押し出し、微小な油中水エマルジョンを作成し、30分間37でインキュベートする。阻害剤は脱ホスホリル化生成物(DiFMU;励起/発光最大358/452nm;青色蛍光)に変換される非蛍光基質(DiFMUP)の量を低減する。次に油中水エマルジョンを水中油中水ダブルエマルジョンに変換し、実施例1に記載の通り多色フローサイトメトリーで分析する。化合物2を含有するマイクロカプセルのQdot蛍光シグネチャーのものを除き、主に、全てのマイクロカプセルはPTP1BによるDiFMUPの脱ホスホリル化により青色蛍光を示す。
【0173】
[実施例5:微小流体システムにおけるマイクロカプセルを使用したPTP1B阻害剤のスクリーニング]
微小チャンネルはポリ(ジメチルシロキサン)(PDMS)(McDonald and Whitesides,2002)中の急速なフォトタイピングを用いて長方形の断面を有するように加工し、Song and Ismagilov,2003に記載の通り疎水性を付与する。シリンジポンプを用いて流動を起こした(Harvard Apparatus PHD2000 Infusionポンプ)。水溶液については、取り外し可能な27ゲージ針のついた50μlのハミルトンガスタイトシリンジ(1700シリーズ、TLL)を30ゲージのテフロン(登録商標)チューブ(Weico Wire and Cable)と共に使用した。キャリア流体に対しては、1mlハミルトンガスタイトシリンジ(1700シリーズ、TLL)をハミルトンの1ハブを有する30ゲージのテフロン(登録商標)針と共に使用した(Song and Ismagilov,2003)。キャリア流体はパーフルオロデカリン(PFD)中9%(v/v)のC6F11C2H4OHとする(Song et al.,2003)。全ての水溶性試薬はPTP1B活性に適合した緩衝液(25mM HEPES、pH7.4、125mM NaCl、1mM EDTA)中に溶解した。
【0174】
50mU/mlの標的酵素(ヒト組み換えPTP1B、残基1〜322;Biomol Research Laboratories,Inc.)の溶液、および、a)ビス−ジフルオロメチレンホスホネートを有しており知られたPTP1B阻害剤である100・l化合物2(図1)(Johnson et al.,2002)またはb)PTP1B阻害剤ではない化合物である100・lヒドロケイヒ酸(Aldrich)を不活性の中心ストリーム(25mM HEPES、pH7.4、125mM NaCl、1mM EDTA)を有する2本の層流ストリームとしてのマイクロチャンネル中を流動させることにより、これらを分離し、酵素と化合物が液滴マイクロカプセル形成よりも前に接触することを防止する(Song et al.,2003)。これらの3ストリームを連続的に水非混和性のフッ化炭素キャリア流体(PFD中9%(v/v)C6F11C2H4OH)中に注入する。水溶液用の導入チャンネルは50・・SUP>2の広さとし、PFD用チャンネルは28・黒揩ニする。0.6:0.3、1.0:0.6、12.3:3.7、10:6および20:6を含む種々のPFD/水の計量的流量(・^分)を使用でき、得られる流量はそれぞれ10、19、190、190および300mm/秒となる。チャンネルの全幅を占有する水性マイクロカプセルはPFDストリーム中の液滴の破壊により形成する(Song et al.,2003)。化合物2またはヒドロケイヒ酸の何れかを含有するマイクロカプセルは、化合物2およびヒドロケイヒ酸を含有するシリンジを用いた注入を切り替えながら行うことにより形成できる。
【0175】
液滴形成地点のすぐ下流のチャンネルは1mmの距離に渡りピーク間の距離50・高ナ旋廻している。これにより混乱移流によるマイクロカプセルの内容物の急速な混合が起こる(Song et al.,2003)。この地点の後、マイクロカプセルは長さ60cmのマイクロチャンネルを経由して1分間まで流動する(これにより阻害剤の結合を可能とする)。次にこのマイクロチャンネルを上記した通り形成したPFD中9%(v/v)C6F11C2H4OH中に水性マイクロカプセルを含有する60ラ50・・SUP>2マイクロチャンネルと合流させる。これらのより大きいマイクロカプセルは25mM HEPES、pH7.4、125mM NaCl、1mM EDTA中の蛍光発生PTP1B基質6,8−ジフルオロ−4−メチルウンベリフェリルホスホネート(DiFMUP)(Molecular Probes)を含有する。マイクロチャンネルの間の注入の後、拡張した主チャンネルは100ラ50・・SUP>2であり、マイクロカプセルはチャンネルをブロックせず、大型のマイクロカプセル(DiFMUPを含有)が小型のマイクロカプセル(PTP1Bおよび化合物を含有)と合体するまで異なる速度で移動する(Song et al.,2003)。大型および小型のマイクロカプセルの生成の頻度は、各大型マイクロカプセルが融合すべき小型マイクロカプセルを有するように、等しくする。融合したマイクロカプセルは長さ60cmのマイクロチャンネルを経由して2分間まで流動する。DiFMUP(励起/発光最大358/452nm;青色蛍光)の生成によるマイクロカプセルの蛍光はエピ蛍光顕微鏡を用いて測定する。主に、青色蛍光を示すマイクロカプセルがヒドロケイヒ酸を含有するものであり、化合物2を含有するマイクロカプセルはPTP1Bの阻害により低い蛍光を示す。
【0176】
[実施例6:マイクロビーズへの化合物ライブラリの結合]
表面上にカルボキシレート官能基を有する直径5.5・高フポリスチレンマイクロビーズはオレンジ色(585nm)および赤色(>650nm)の蛍光色素の厳密な比の取り込みの結果として光学的にタグ付けされた形態で市販されている(www.luminexcorp.com)(Fulton et al.,1997)。各々が独特の光学的シグネチャー(www.luminexcorp.com)を有するこのようなビーズ100個のセットを過剰なエチレンジアミンおよびEDC(塩酸1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド(Pierce))でHermanson,1996に記載の通り修飾し、表面に第1アミノ基を形成した。次に上記した通りEDCを用いてアミド結合を形成することにより、光分解性のリンカー4−(4−ヒドロキシメチル−2−メトキシ−5−ニトロフェノキシ)ブタン酸(NovaBiochem)(Holmes and Jones,1995)をビーズに結合させる。次に、リンカーアルコールと反応させることによりカルボン酸有機ビルディングブロックライブラリ(Aldrich)由来の100種の異なるカルボン酸をビーズにカップリングさせてカルボキシレートエステルを形成し、100種の異なる光学的にタグ付けされたビーズの各々が異なるカルボン酸にカップリングし、そして各ビーズがカルボン酸〜106分子で誘導体化されるようにする。B100AP354nmUVランプ(UVP)を用いて〜5cmの距離から氷上4分間照射することによりカルボン酸としてビーズから化合物を放出させる。
【0177】
[実施例7:マイクロビーズに結合した化合物を用いた酵素タンパク質チロシンホスファターゼ1B(PTP1B)の阻害剤のスクリーニング]
PTP1Bはインスリンおよびレプチンのシグナル伝達の負の調節物質である。インスリンおよびレプチンに対する耐性はII型真性糖尿病および肥満の指標であり、従ってPTP1Bは糖尿病および肥満の治療のための魅力的な薬剤標的である(Johnson et al.,2002)。表面上にカルボキシレート官能基を有する直径5.5・高フポリスチレンマイクロビーズはオレンジ色(585nm)および赤色(>650nm)の蛍光色素の厳密な比の取り込みの結果として光学的にタグ付けされた形態で市販されている(www.luminexcorp.com)(Fulton et al.,1997)。まず、マイクロビーズ上のカルボキシレート官能基を実施例6の場合と同様にエチレンジアミンおよびEDCを用いて第1アミンに変換する。次にPTP1Bのホスホペプチド基質であるウンデカペプチドEGFR988-998(DADEpYLIPQQG)(Zhang et al.,1993)をEDCを用いて表面アミノ基を介してマイクロビーズの両方のセットにカップリングさせる。このペプチドはカルボキシレート−O−アリルエステルを用いた側鎖カルボキシレート基上の直角保護を用いてSieber Amide樹脂(9−Fmoc−アミノ−キサンテン−3−イルオキシ−Merrifield樹脂)(Novabiochem)上の固相合成により作成する。テトラデカンジ酸からなるリンカーをN末端にカップリングし、1%TFAを用いてビーズからペプチドを脱離させ、C末端アミドを有するペプチドを得る。ペプチドをリンカーを介してビーズにカップリングさせ(EDC使用)、ビーズ当たり〜105ペプチドを得る。次に実施例6に記載の通り光化学分解性リンカー4−(4−ヒドロキシメチル−2−メトキシ−5−ニトロフェノキシ)ブタン酸を結合することにより残余の表面アミノ基を修飾する。次にペプチドの側鎖カルボキシレート上の保護基をPd(Ph3)4/CHCl3/HOAc/N−メチルモルホリンを用いて脱離させる。第1のセットのマイクロビーズを知られたPTP1B阻害剤である化合物である3−(4−ジフルオロホスホノメチルフェニル)プロパン酸(化合物1、図1)で誘導体化する(Johnson et al.,2002)。第1のセットのビーズとは別の光学的タグを有する第2のセットのビーズはPTP1B阻害剤ではない化合物であるヒドロケイヒ酸(Aldrich)で誘導体化する。各々の場合において、実施例6に記載の通り、化合物はリンカーアルコールと反応させることによりカップリングしてカルボキシレートエステルを形成する。各マイクロビーズは〜106分子で誘導体化する(Fulton et al.,1997)。
【0178】
次にマイクロビーズを図2に示す方法を用いてスクリーンする。2セットのマイクロビーズを1:100〜1:1(化合物1ビーズ:ヒドロケイヒ酸ビーズ)の範囲の比で混合し、合計108マイクロビーズをPTP1B活性に適合した緩衝液(25mM HEPES、pH7.4、125mM NaCl、10%グリセロール、1mM EDTA)(Doman et al.,2002)中、氷上(反応を防止するため)で、10nMの濃度の標的酵素(ヒト組み換えPTP1B、残基1〜322;Biomol Research Laboratories,Inc.)と混合する。次にシングルのビーズおよび標的酵素(PTP1B)を、油中水エマルジョンを形成(やはり氷上)することによりマイクロカプセル内に共局在化させる。ビーズの濃度は大部分のマイクロカプセルが1個または0個のビーズを含有するようにする。化合物を光化学的(実施例6に記載)に放出させ、温度を25に上昇させる。阻害剤は生成物(脱ホスホリル化ペプチド)に変換される基質の量を低減する。エマルジョンを4に冷却し、Griffiths and Tawfik,2003に記載の通り破壊して100・lバナジン酸塩中にいれ、反応を停止させる(Harder et al.,1994)。製造元の取扱説明書に従って緑色(530nm)蛍光色素フルオレセインイソチオシアネートで標識した抗基質(抗ホスホチロシン)抗体(マウスモノクローナルIgG2bPY20,(Santa Cruz))で標識した後、FACScan(Becton-Dickinson)、FACScalibur(Becton-Dickinson)またはMoFlo(Cytomation)フローサイトメトリーを用いて3色フローサイトメトリーによりビーズを分析し、阻害の程度およびビーズ上の化合物を同時に測定する。主に、PTP1B阻害剤でコーティングされたマイクロビーズ上のみペプチドの脱ホスホリル化が観察され、他のマイクロビーズでは観察されなかった。
【0179】
[実施例8:マイクロビーズに結合した化合物ライブラリからのPTP1B阻害剤のスクリーニング]
表面上にカルボキシレート官能基を有し、各々がオレンジ色(585nm)および赤色(>650nm)の蛍光色素の厳密な比の取り込み(Fulton et al.,1997)の結果として独特の光学的シグネチャーを有する(www.luminexcorp.com)直径5.5・高フポリスチレンマイクロビーズ100個のセットをPTP1Bのホスホペプチド基質であるウンデカペプチドEGFR988-998(DADEpYLIPQQG)(Zhang et al.,1993)および光化学的に切断できるリンカーを介して各々結合した100種の異なるカルボン酸を用いて、実施例7に記載の通り誘導体化する。これらのカルボン酸の1つは知られたPTP1B阻害剤である化合物である3−(4−ジフルオロホスホノメチルフェニル)プロパン酸(化合物1、図1)である(Johnson et al.,2002)。他の99種のカルボン酸は実施例6と同様にカルボン酸有機ビルディングブロックライブラリ(Aldrich)由来である。次に100ビーズセットの各々の等しい数量を混合し、実施例7に記載の通りスクリーニングする。主に、PTP1B阻害剤の3−(4−ジフルオロホスホノメチルフェニル)プロパン酸(化合物1、図1)でコーティングされたマイクロビーズ上のみペプチドの脱ホスホリル化が観察され、他の化合物でコーティングされたマイクロビーズでは観察されなかった。
【0180】
[実施例9:フッ化炭素中水エマルジョンにおける小型分子のコンパートメント化]
95%(v/v)パーフルオロオクチルブロミド、溶液中目的の分子を含有する5%(v/v)リン酸塩緩衝食塩水、および、界面活性剤としての2%(w/v)C8F17C11H22OP(O)[N(CH2CH2)2O]2(F8H11DMP)を含有するフッ化炭素中水エマルジョンを14・tィルター(Osmonics)を通過させる押し出し(15回)によるか、または、5mmの分散ツールでUltra-TurraxT8ホモゲナイザー(IKA)を用いながら25,000r.p.mで5分間ホモゲナイズすることにより、本質的にSadtler et al.,1996に記載の通り形成した。100・香`2mMの濃度で水相中に溶解した一連の小型蛍光分子を含有するエマルジョンを作成した。カルセイン、テキサスレッド、フルオレセイン、クマリン102、7−ヒドロキシクマリン−3−カルボン酸および7−ジエチルアミノ−4−メチルクマリン(クマリン1)を含むこれらの分子は、分子量203〜625DaおよびSRCのLogKow/KowWinプログラム(Meylan and Howard,1995)を用いて計算した場合に0.49〜4.09の範囲のLogP値を有していた。異なる色の蛍光色素を含むエマルジョンを振とう攪拌により混合した。混合されたエマルジョンのエピ蛍光顕微鏡観察によればコンパートメント化が観察された。混合後24時間にはコンパートメント間の交換は観察されなかった(図3参照)。
【0181】
上記した本明細書において言及した全ての出版物および該出版物中に引用されている参考文献は参照により本明細書に組み込まれる。本発明の記載した方法および系の種々の変更および変形は本発明の範囲および精神を逸脱することなく当業者には明らかとなる。本発明は特定の好ましい実施形態との関連において説明してきたが、請求項に記載した本発明はそのような特定の実施形態に限定されない。実際、分子生物学または関連の分野の当業者には自明である本発明の実施のための記載した様式の種々の変更は添付する請求項の範囲内であることを意図するものである。
【特許請求の範囲】
【請求項1】
化合物のレパートリー中において、所望の活性を有する1以上の化合物を識別する方法であって、
a)任意の1つのマイクロカプセルにおいて、レパートリーのサブセットのみが複数のコピーで示されるように、化合物をマイクロカプセル中にコンパートメント化するステップと;
b)所望の活性を有する化合物を識別するステップと
を含む方法。
【請求項2】
ステップ(a)が、個々の化合物を含む個別のエマルジョンコンパートメントを形成するステップと、エマルジョンコンパートメントを混合して、エマルジョン化された化合物レパートリーを形成するステップであって、任意の1つのマイクロカプセルにおいて、レパートリーのサブセットが複数のコピーで示される、ステップとを含む、請求項1に記載の方法。
【請求項3】
ステップ(a)が、
c)任意の1つのマイクロビーズ上において、レパートリーのサブセット1つのみが示されるように、化合物レパートリーをマイクロビーズ上に付着させるステップと;
d)任意の1つのマイクロカプセルにおいて、レパートリーのサブセットが複数のコピーで示されるように、マイクロビーズをマイクロカプセルにコンパートメント化するステップと
を含む、請求項1に記載の方法。
【請求項4】
所望の活性が、結合活性および標的の活性のモジュレーションからなる群より選択される、請求項1〜3のいずれかに記載の方法。
【請求項5】
結合活性が、標的に対する結合である、請求項4に記載の方法。
【請求項6】
モジュレートされた活性が、結合活性である、請求項4に記載の方法。
【請求項7】
モジュレートされた活性が、触媒活性である、請求項4に記載の方法。
【請求項8】
化合物が標的と反応して反応生成物を生成する、請求項1から3のいずれかに記載の方法。
【請求項9】
化合物が、切断不能なリンカーを介してマイクロビーズへ結合している、請求項3またはそれに従属するいずれかに記載の方法。
【請求項10】
化合物が、切断可能なリンカーを介してマイクロビーズへ結合している、請求項3またはそれに従属するいずれかに記載の方法。
【請求項11】
化合物が、光化学的に切断可能なリンカーを介してマイクロビーズへ結合している、請求項10に記載の方法。
【請求項12】
化合物が、切断可能なリンカーおよび切断不能なリンカーの組み合わせによってマイクロビーズへ結合している、請求項3またはそれに従属するいずれかに記載の方法。
【請求項13】
標的が、化合物と一緒にマイクロカプセルにコンパートメント化される、請求項1〜12のいずれかに記載の方法。
【請求項14】
所望の活性を有する化合物が、それに関連するマイクロビーズもしくはマイクロカプセルにおける、マイクロビーズもしくはマイクロカプセルの識別、分類または選択を可能とする変化を引き起こす、請求項1〜13のいずれかに記載の方法。
【請求項15】
化合物がマイクロビーズに結合しており、マイクロビーズの単離が可能となるように、マイクロカプセル内の所望の活性が、直接的または間接的に、化合物が付着しているマイクロビーズの修飾をもたらす、請求項14に記載の方法。
【請求項16】
標的がマイクロビーズに結合しており、マイクロビーズの単離が可能となるように、マイクロカプセル内で所望の活性を有する化合物が、直接的または間接的に、標的に結合する、請求項15に記載の方法。
【請求項17】
マイクロビーズがアフィニティー精製によって単離される、請求項15または請求項16に記載の方法。
【請求項18】
基質がマイクロカプセル内に存在し、マイクロカプセル内の化合物の所望の活性が、直接的または間接的に、基質の生成物への転換の調節をもたらす、請求項7に記載の方法。
【請求項19】
基質が、標的の触媒作用によって生成物へ転換させられる、請求項18に記載の方法。
【請求項20】
基質および生成物が、相違する光学特性を有する、請求項18または19に記載の方法。
【請求項21】
基質および生成物が、相違する蛍光特性を有する、請求項20に記載の方法。
【請求項22】
基質がマイクロビーズへ結合しており、マイクロカプセル内の化合物の所望の活性が、直接的または間接的に、基質の生成物への転換の調節をもたらし、生成物がマイクロビーズの一部に残存し、その識別、および任意選択的にその単離を可能にする、請求項18に記載の方法。
【請求項23】
生成物、および任意選択的に未反応基質が、その後マイクロカプセル内のマイクロビーズと複合体化される、請求項18に記載の方法。
【請求項24】
所望の活性が、生成物への基質の転換を増強する、請求項18に記載の方法。
【請求項25】
所望の活性が、生成物への基質の転換を阻害する、請求項18に記載の方法。
【請求項26】
マイクロカプセル内の化合物の所望の活性が、直接的または間接的に、生成物の生成をもたらし、生成物が、その後マイクロビーズと複合体化し、その単離を可能にする、請求項7に記載の方法。
【請求項27】
所望の活性を有する化合物が、マイクロカプセルの識別、分類または選択を可能にするマイクロカプセルの変化をもたらす、請求項1から14のいずれかに記載の方法。
【請求項28】
マイクロカプセル内の化合物の所望の活性が、マイクロカプセルの光学特性の変化をもたらす、請求項1〜27のいずれかに記載の方法。
【請求項29】
マイクロカプセルが、それらの蛍光の変化の検出によって識別される、請求項28に記載の方法。
【請求項30】
蛍光の変化が、蛍光共鳴エネルギー転移(FRET)に起因する、請求項29に記載の方法。
【請求項31】
マイクロカプセル内の化合物が、マイクロカプセルの光学特性の相違によって識別される、請求項28に記載の方法。
【請求項32】
マイクロカプセルの光学特性の相違が、蛍光の相違である、請求項31に記載の方法。
【請求項33】
マイクロカプセルの蛍光の相違が、量子ドットの存在に起因する、請求項32に記載の方法。
【請求項34】
化合物が、相違するマイクロカプセルにおいて相違する濃度で存在する、請求項1〜33のいずれかに記載の方法。
【請求項35】
マイクロカプセル内の化合物の濃度が、マイクロカプセルの光学特性の相違によって識別される、請求項34に記載の方法。
【請求項36】
マイクロカプセルの光学特性の相違が、蛍光の相違である、請求項35に記載の方法。
【請求項37】
マイクロカプセルの蛍光の相違が、量子ドットの存在に起因する、請求項36に記載の方法。
【請求項38】
マイクロカプセル内の標的が、マイクロカプセルの光学特性の相違によって識別される、請求項28に記載の方法。
【請求項39】
マイクロカプセルの光学特性の相違が、蛍光の相違である、請求項38に記載の方法。
【請求項40】
マイクロカプセルの蛍光の相違が、量子ドットの存在に起因する、請求項39に記載の方法。
【請求項41】
マイクロカプセルの識別が、フローサイトメトリーによる、請求項28から40のいずれかに記載の方法。
【請求項42】
マイクロカプセルの分類が、蛍光活性化セルソーター(FACS)を用いて実施される、請求項41に記載の方法。
【請求項43】
マイクロカプセルが、油中水型エマルジョンから水中油中水型エマルジョンへの転換後に蛍光活性化セルソーター(FACS)を用いて分類される、請求項42記載の方法。
【請求項44】
マイクロビーズの修飾が、その光学特性の変化を含む、請求項15に記載の方法。
【請求項45】
マイクロビーズの光学特性の相違が、蛍光の相違である、請求項44に記載の方法。
【請求項46】
マイクロビーズ上の化合物が、マイクロビーズの光学特性の相違によって識別される、請求項44に記載の方法。
【請求項47】
マイクロビーズの光学特性の相違が、蛍光の相違である、請求項46に記載の方法。
【請求項48】
マイクロビーズの蛍光の相違が、量子ドットの存在に起因する、請求項47に記載の方法。
【請求項49】
マイクロビーズが、非磁性、磁性または常磁性である、請求項3に記載の方法。
【請求項50】
マイクロビーズが、それらの蛍光の変化の検出によって分類される、請求項45に記載の方法。
【請求項51】
マイクロビーズの識別が、フローサイトメトリーによる、請求項50に記載の方法。
【請求項52】
マイクロビーズの分類が、蛍光活性化セルソーター(FACS)を用いて実施される、請求項50に記載の方法。
【請求項53】
蛍光の変化が、蛍光共鳴エネルギー転移(FRET)に起因する、請求項50に記載の方法。
【請求項54】
マイクロビーズの修飾により、マイクロビーズの光学特性の変化を誘導するように、マイクロビーズがマイクロカプセルの外側でさらに修飾されることが可能になる、請求項45に記載の方法。
【請求項55】
マイクロビーズの光学特性の変化が、特徴的なの光学特性を有する化合物のマイクロビーズへの結合に起因する、請求項45に記載の方法。
【請求項56】
マイクロビーズの光学特性の変化が、化合物の特徴的なの光学特性を有する標的への結合に起因する、請求項45または46に記載の方法。
【請求項57】
マイクロビーズの光学特性の変化が、標的に結合したときの化合物の光学特性の変化に起因する、請求項45または46に記載の方法。
【請求項58】
マイクロビーズの光学特性の変化が、化合物が結合したときの標的の光学特性の変化に起因する、請求項45または46に記載の方法。
【請求項59】
マイクロビーズの光学特性の変化が、結合している標的および化合物両方の光学特性の変化に起因する、請求項45または46に記載の方法。
【請求項60】
所望の活性を有する化合物が、標的の変化を引き起こすように作用し、マイクロビーズの光学特性の変化が、標的と標的に対する化合物の作用での生成物との相違する光学特性に起因する、請求項45または46に記載の方法。
【請求項61】
所望の活性を有する化合物が、光学特性を変化させずに標的の変化を引き起こすように作用し、標的ではなく作用での生成物だけがマイクロビーズと結合または反応し、それによってマイクロビーズの光学特性を変化させる、請求項45または46に記載の方法。
【請求項62】
別の試薬が、マイクロビーズに結合した調節された反応の(基質ではなく)生成物に特異的に結合または特異的に反応し、それによってマイクロビーズの光学特性を変化させる、請求項45また46に記載の方法。
【請求項63】
別の試薬が、マイクロビーズに結合した調節された反応の基質(生成物ではなく)に特異的に結合特異的に反応し、それによってマイクロビーズの光学特性を変化させる、請求項45また46に記載の方法。
【請求項64】
化合物の非所望の活性が、所望の活性から生じる変化とは区別しえるマイクロビーズもしくはマイクロカプセルの変化をもたらす、請求項1〜63のいずれかに記載の方法。
【請求項65】
非所望の活性の結果として生じる変化が、マイクロビーズまたはマイクロカプセルを消極的に選択するために使用される、請求項64に記載の方法。
【請求項66】
反応特異性を向上させるために、消極的な選択を積極的な選択と組み合わせる、請求項65に記載の方法。
【請求項67】
改良された反応特異性が、結合特異性における改良である、請求項66に記載の方法。
【請求項68】
改良された反応特異性が、標的に対する位置選択性および/または立体選択性の改良である、請求項66に記載の方法。
【請求項69】
所望の化合物の活性によって直接的または間接的に修飾されたマイクロビーズが、さらにチラミドシグナル増幅(TSA(商標);NEN社)によって修飾されて、マイクロビーズの光学特性の変化を直接的または間接的に生じさせ、それによりそれらの識別および任意選択的に単離が可能となる請求項45から68のいずれかに記載の方法。
【請求項70】
各マイクロビーズまたはマイクロカプセルが、2以上の化合物を含み、マイクロビーズまたはマイクロカプセルを選択するために、各化合物が所望の活性を有していなければならない、請求項1〜69のいずれかに記載の方法。
【請求項71】
1以上の化合物が、低分子量化合物である、請求項1〜70のいずれかに記載の方法。
【請求項72】
レパートリーのサブセットが、単一化合物である、請求項1〜71のいずれかに記載の方法。
【請求項73】
各マイクロカプセルまたはマイクロビーズが、それと結合した単一化合物の複数の分子を有する、請求項72に記載の方法。
【請求項74】
ステップ(a)から(d)の1つ以上を反復して繰り返すステップをさらに含む、請求項1〜73のいずれかに記載の方法。
【請求項75】
マイクロカプセル化が、油中水型エマルジョンを形成するステップによって達成される、請求項1〜74のいずれかに記載の方法。
【請求項76】
油中水型エマルジョンが、微小流体システムを用いて作成される、請求項75に記載の方法。
【請求項77】
エマルジョンが、不混和性液体の共流動ストリーム内の水性液滴の破裂によって形成される、請求項76に記載の方法。
【請求項78】
微小流体チャネル内の油のストリーム内に分散した水性微小液滴の層流によって、マイクロカプセルが分析のために輸送される、請求項76に記載の方法。
【請求項79】
マイクロカプセルが、微小流体チャネル内の油のストリーム内に分散した水性微小液滴である、請求項76に記載の方法。
【請求項80】
マイクロカプセル内の化合物が、微小流体チャネル内の他の微小液滴に対するマイクロカプセルの相対的位置によって識別される、請求項76に記載の方法。
【請求項81】
マイクロカプセル内の化合物の濃度が、微小流体チャネル内の他の微小液滴に対するマイクロカプセルの相対的位置によって識別される、請求項76に記載の方法。
【請求項82】
マイクロカプセル内の標的が、微小流体チャネル内の他の微小液滴に対するマイクロカプセルの相対的位置によって識別される、請求項76に記載の方法。
【請求項83】
識別されたマイクロカプセルが、微小流体デバイスを用いて分類される、請求項1〜82のいずれかに記載の方法。
【請求項84】
マイクロカプセル化が、フッ化炭素中水型または過フッ化炭素中水型エマルジョンを形成するステップによって達成される、請求項75に記載の方法。
【請求項85】
フッ化炭素が、ペルフルオロオクチルブロミドまたはペルフルオロオクチルエタンである、請求項84に記載の方法。
【請求項86】
エマルジョンが、F−アルキルジモルホリノホスフェートを用いて形成される、請求項84に記載の方法。
【請求項87】
F−アルキルジモルホリノホスフェートが、一般式CnF2n+1CmH2mOP(O)[N(CH2CH2)2O]2を有する、請求項86に記載の方法。
【請求項88】
F−アルキルジモルホリノホスフェートが、C8F17C11H22OP(O)[N(CH2CH2)2O]2である、請求項87に記載の方法。
【請求項89】
マイクロカプセルの内部環境が、油相へ1以上の試薬を添加することによって修飾される、請求項1〜88のいずれかに記載の方法。
【請求項90】
化合物が、相違する光学特性を有するビーズへカップリングされている、請求項1〜89のいずれかに記載の方法。
【請求項91】
ビーズが、相違する蛍光特性を有する、請求項90に記載の方法。
【請求項92】
ビーズの相違する光学特性が、ビーズへの相違するレベルの2以上の蛍光色素の取り込みに起因する、請求項90に記載の方法。
【請求項93】
ビーズの相違する光学特性が、相違する発光スペクトルを有する量子ドットの相違する数での取り込みに起因する、請求項90に記載の方法。
【請求項94】
ビーズの相違する光学特性が、ビーズへ結合した化合物を識別するために使用される、請求項90に記載の方法。
【請求項95】
単離されたビーズ上の化合物が、ビーズから化合物を放出させ、直接分析することによって識別される、請求項1〜94のいずれかに記載の方法。
【請求項96】
単離されたビーズ上の化合物が、質量分光法によって識別される、請求項95に記載の方法。
【請求項97】
請求項1〜96のいずれかの方法によって単離された生成物。
【請求項98】
化合物を調製する方法であって、
(a)任意の1つのマイクロカプセルにおいて、レパートリーのサブセットのみが複数のコピーで示されるように、化合物をマイクロカプセルにコンパートメント化するステップと;
(b)所望の活性を有する化合物を識別するステップと、
(c)所望の活性を有する化合物を識別および生成するステップと
を含む方法。
【請求項99】
化合物を調製する方法であって、
(a)任意の1つのマイクロカプセルにおいて、レパートリーのサブセットのみが複数のコピーで示されるように、化合物をマイクロカプセルにコンパートメント化するステップと;
(b)所望の活性を有する1以上の化合物を含有するマイクロカプセルを、それらの光学特性の変化を用いて識別、および任意選択的に分類するステップと;
(c)所望の活性を有する化合物を識別および生成するステップと
を含む方法。
【請求項100】
標的の活性をモジュレートさせることのできる1以上の化合物をスクリーニングする方法であって、
(a)任意の1つのマイクロカプセルにおいて、レパートリーのサブセットのみが複数のコピーで示されるように、化合物をマイクロカプセルにコンパートメント化するステップと;
(b)所望の活性を有する1以上の化合物を含有するマイクロカプセルを、それらの光学特性の変化を用いて識別、および任意選択的に分類するステップと;
(c)所望の活性を有する標的を1以上の化合物と接触させ、1以上の化合物による標的の活性のモジュレーションを監視するステップと
を含む方法。
【請求項101】
標的を調製する方法であって、
(a)標的に対する合成プロトコールを供するステップであって、少なくとも1つのステップが化合物によって促進される、ステップと;
(b)このステップを促進する化合物の変異体を調製するステップと;
(c)任意の1つのマイクロカプセルにおいて、レパートリーのサブセットのみが複数のコピーで示されるように、化合物をマイクロカプセルにコンパートメント化するステップと;
(d)所望の活性を有する1以上の化合物を含有するマイクロカプセルを、それらの光学特性の変化を用いて識別、および任意選択的に分類するステップと;
(e)合成における関連するステップを促進するために、(d)において識別された化合物を用いて標的を調製するステップと
を含む方法。
【請求項102】
化合物がマイクロビーズに結合しており、任意選択的に化合物がマイクロカプセル内のマイクロビーズから放出させられる、請求項98から102のいずれかに記載の方法。
【請求項103】
化合物および標的が最初は、その後に融合される相違するマイクロカプセルに存在する、請求項13に記載の方法。
【請求項104】
化合物を含有するマイクロカプセルが、分割して2つ以上のマイクロカプセルを生成する、請求項1〜96および98〜103のいずれかに記載の方法。
【請求項105】
標的を含有するマイクロカプセルが、分割して2つ以上のマイクロカプセルを生成する、請求項13に記載の方法。
【請求項106】
1つ以上の細胞が、マイクロカプセル内に存在する、請求項1〜96および98〜103のいずれかに記載の方法。
【請求項107】
化合物が、細胞内の標的の活性をモジュレートする、請求項106に記載の方法。
【請求項108】
化合物が、細胞の活性をモジュレートする、請求項107に記載の方法。
【請求項1】
化合物のレパートリー中において、所望の活性を有する1以上の化合物を識別する方法であって、
a)任意の1つのマイクロカプセルにおいて、レパートリーのサブセットのみが複数のコピーで示されるように、化合物をマイクロカプセル中にコンパートメント化するステップと;
b)所望の活性を有する化合物を識別するステップと
を含む方法。
【請求項2】
ステップ(a)が、個々の化合物を含む個別のエマルジョンコンパートメントを形成するステップと、エマルジョンコンパートメントを混合して、エマルジョン化された化合物レパートリーを形成するステップであって、任意の1つのマイクロカプセルにおいて、レパートリーのサブセットが複数のコピーで示される、ステップとを含む、請求項1に記載の方法。
【請求項3】
ステップ(a)が、
c)任意の1つのマイクロビーズ上において、レパートリーのサブセット1つのみが示されるように、化合物レパートリーをマイクロビーズ上に付着させるステップと;
d)任意の1つのマイクロカプセルにおいて、レパートリーのサブセットが複数のコピーで示されるように、マイクロビーズをマイクロカプセルにコンパートメント化するステップと
を含む、請求項1に記載の方法。
【請求項4】
所望の活性が、結合活性および標的の活性のモジュレーションからなる群より選択される、請求項1〜3のいずれかに記載の方法。
【請求項5】
結合活性が、標的に対する結合である、請求項4に記載の方法。
【請求項6】
モジュレートされた活性が、結合活性である、請求項4に記載の方法。
【請求項7】
モジュレートされた活性が、触媒活性である、請求項4に記載の方法。
【請求項8】
化合物が標的と反応して反応生成物を生成する、請求項1から3のいずれかに記載の方法。
【請求項9】
化合物が、切断不能なリンカーを介してマイクロビーズへ結合している、請求項3またはそれに従属するいずれかに記載の方法。
【請求項10】
化合物が、切断可能なリンカーを介してマイクロビーズへ結合している、請求項3またはそれに従属するいずれかに記載の方法。
【請求項11】
化合物が、光化学的に切断可能なリンカーを介してマイクロビーズへ結合している、請求項10に記載の方法。
【請求項12】
化合物が、切断可能なリンカーおよび切断不能なリンカーの組み合わせによってマイクロビーズへ結合している、請求項3またはそれに従属するいずれかに記載の方法。
【請求項13】
標的が、化合物と一緒にマイクロカプセルにコンパートメント化される、請求項1〜12のいずれかに記載の方法。
【請求項14】
所望の活性を有する化合物が、それに関連するマイクロビーズもしくはマイクロカプセルにおける、マイクロビーズもしくはマイクロカプセルの識別、分類または選択を可能とする変化を引き起こす、請求項1〜13のいずれかに記載の方法。
【請求項15】
化合物がマイクロビーズに結合しており、マイクロビーズの単離が可能となるように、マイクロカプセル内の所望の活性が、直接的または間接的に、化合物が付着しているマイクロビーズの修飾をもたらす、請求項14に記載の方法。
【請求項16】
標的がマイクロビーズに結合しており、マイクロビーズの単離が可能となるように、マイクロカプセル内で所望の活性を有する化合物が、直接的または間接的に、標的に結合する、請求項15に記載の方法。
【請求項17】
マイクロビーズがアフィニティー精製によって単離される、請求項15または請求項16に記載の方法。
【請求項18】
基質がマイクロカプセル内に存在し、マイクロカプセル内の化合物の所望の活性が、直接的または間接的に、基質の生成物への転換の調節をもたらす、請求項7に記載の方法。
【請求項19】
基質が、標的の触媒作用によって生成物へ転換させられる、請求項18に記載の方法。
【請求項20】
基質および生成物が、相違する光学特性を有する、請求項18または19に記載の方法。
【請求項21】
基質および生成物が、相違する蛍光特性を有する、請求項20に記載の方法。
【請求項22】
基質がマイクロビーズへ結合しており、マイクロカプセル内の化合物の所望の活性が、直接的または間接的に、基質の生成物への転換の調節をもたらし、生成物がマイクロビーズの一部に残存し、その識別、および任意選択的にその単離を可能にする、請求項18に記載の方法。
【請求項23】
生成物、および任意選択的に未反応基質が、その後マイクロカプセル内のマイクロビーズと複合体化される、請求項18に記載の方法。
【請求項24】
所望の活性が、生成物への基質の転換を増強する、請求項18に記載の方法。
【請求項25】
所望の活性が、生成物への基質の転換を阻害する、請求項18に記載の方法。
【請求項26】
マイクロカプセル内の化合物の所望の活性が、直接的または間接的に、生成物の生成をもたらし、生成物が、その後マイクロビーズと複合体化し、その単離を可能にする、請求項7に記載の方法。
【請求項27】
所望の活性を有する化合物が、マイクロカプセルの識別、分類または選択を可能にするマイクロカプセルの変化をもたらす、請求項1から14のいずれかに記載の方法。
【請求項28】
マイクロカプセル内の化合物の所望の活性が、マイクロカプセルの光学特性の変化をもたらす、請求項1〜27のいずれかに記載の方法。
【請求項29】
マイクロカプセルが、それらの蛍光の変化の検出によって識別される、請求項28に記載の方法。
【請求項30】
蛍光の変化が、蛍光共鳴エネルギー転移(FRET)に起因する、請求項29に記載の方法。
【請求項31】
マイクロカプセル内の化合物が、マイクロカプセルの光学特性の相違によって識別される、請求項28に記載の方法。
【請求項32】
マイクロカプセルの光学特性の相違が、蛍光の相違である、請求項31に記載の方法。
【請求項33】
マイクロカプセルの蛍光の相違が、量子ドットの存在に起因する、請求項32に記載の方法。
【請求項34】
化合物が、相違するマイクロカプセルにおいて相違する濃度で存在する、請求項1〜33のいずれかに記載の方法。
【請求項35】
マイクロカプセル内の化合物の濃度が、マイクロカプセルの光学特性の相違によって識別される、請求項34に記載の方法。
【請求項36】
マイクロカプセルの光学特性の相違が、蛍光の相違である、請求項35に記載の方法。
【請求項37】
マイクロカプセルの蛍光の相違が、量子ドットの存在に起因する、請求項36に記載の方法。
【請求項38】
マイクロカプセル内の標的が、マイクロカプセルの光学特性の相違によって識別される、請求項28に記載の方法。
【請求項39】
マイクロカプセルの光学特性の相違が、蛍光の相違である、請求項38に記載の方法。
【請求項40】
マイクロカプセルの蛍光の相違が、量子ドットの存在に起因する、請求項39に記載の方法。
【請求項41】
マイクロカプセルの識別が、フローサイトメトリーによる、請求項28から40のいずれかに記載の方法。
【請求項42】
マイクロカプセルの分類が、蛍光活性化セルソーター(FACS)を用いて実施される、請求項41に記載の方法。
【請求項43】
マイクロカプセルが、油中水型エマルジョンから水中油中水型エマルジョンへの転換後に蛍光活性化セルソーター(FACS)を用いて分類される、請求項42記載の方法。
【請求項44】
マイクロビーズの修飾が、その光学特性の変化を含む、請求項15に記載の方法。
【請求項45】
マイクロビーズの光学特性の相違が、蛍光の相違である、請求項44に記載の方法。
【請求項46】
マイクロビーズ上の化合物が、マイクロビーズの光学特性の相違によって識別される、請求項44に記載の方法。
【請求項47】
マイクロビーズの光学特性の相違が、蛍光の相違である、請求項46に記載の方法。
【請求項48】
マイクロビーズの蛍光の相違が、量子ドットの存在に起因する、請求項47に記載の方法。
【請求項49】
マイクロビーズが、非磁性、磁性または常磁性である、請求項3に記載の方法。
【請求項50】
マイクロビーズが、それらの蛍光の変化の検出によって分類される、請求項45に記載の方法。
【請求項51】
マイクロビーズの識別が、フローサイトメトリーによる、請求項50に記載の方法。
【請求項52】
マイクロビーズの分類が、蛍光活性化セルソーター(FACS)を用いて実施される、請求項50に記載の方法。
【請求項53】
蛍光の変化が、蛍光共鳴エネルギー転移(FRET)に起因する、請求項50に記載の方法。
【請求項54】
マイクロビーズの修飾により、マイクロビーズの光学特性の変化を誘導するように、マイクロビーズがマイクロカプセルの外側でさらに修飾されることが可能になる、請求項45に記載の方法。
【請求項55】
マイクロビーズの光学特性の変化が、特徴的なの光学特性を有する化合物のマイクロビーズへの結合に起因する、請求項45に記載の方法。
【請求項56】
マイクロビーズの光学特性の変化が、化合物の特徴的なの光学特性を有する標的への結合に起因する、請求項45または46に記載の方法。
【請求項57】
マイクロビーズの光学特性の変化が、標的に結合したときの化合物の光学特性の変化に起因する、請求項45または46に記載の方法。
【請求項58】
マイクロビーズの光学特性の変化が、化合物が結合したときの標的の光学特性の変化に起因する、請求項45または46に記載の方法。
【請求項59】
マイクロビーズの光学特性の変化が、結合している標的および化合物両方の光学特性の変化に起因する、請求項45または46に記載の方法。
【請求項60】
所望の活性を有する化合物が、標的の変化を引き起こすように作用し、マイクロビーズの光学特性の変化が、標的と標的に対する化合物の作用での生成物との相違する光学特性に起因する、請求項45または46に記載の方法。
【請求項61】
所望の活性を有する化合物が、光学特性を変化させずに標的の変化を引き起こすように作用し、標的ではなく作用での生成物だけがマイクロビーズと結合または反応し、それによってマイクロビーズの光学特性を変化させる、請求項45または46に記載の方法。
【請求項62】
別の試薬が、マイクロビーズに結合した調節された反応の(基質ではなく)生成物に特異的に結合または特異的に反応し、それによってマイクロビーズの光学特性を変化させる、請求項45また46に記載の方法。
【請求項63】
別の試薬が、マイクロビーズに結合した調節された反応の基質(生成物ではなく)に特異的に結合特異的に反応し、それによってマイクロビーズの光学特性を変化させる、請求項45また46に記載の方法。
【請求項64】
化合物の非所望の活性が、所望の活性から生じる変化とは区別しえるマイクロビーズもしくはマイクロカプセルの変化をもたらす、請求項1〜63のいずれかに記載の方法。
【請求項65】
非所望の活性の結果として生じる変化が、マイクロビーズまたはマイクロカプセルを消極的に選択するために使用される、請求項64に記載の方法。
【請求項66】
反応特異性を向上させるために、消極的な選択を積極的な選択と組み合わせる、請求項65に記載の方法。
【請求項67】
改良された反応特異性が、結合特異性における改良である、請求項66に記載の方法。
【請求項68】
改良された反応特異性が、標的に対する位置選択性および/または立体選択性の改良である、請求項66に記載の方法。
【請求項69】
所望の化合物の活性によって直接的または間接的に修飾されたマイクロビーズが、さらにチラミドシグナル増幅(TSA(商標);NEN社)によって修飾されて、マイクロビーズの光学特性の変化を直接的または間接的に生じさせ、それによりそれらの識別および任意選択的に単離が可能となる請求項45から68のいずれかに記載の方法。
【請求項70】
各マイクロビーズまたはマイクロカプセルが、2以上の化合物を含み、マイクロビーズまたはマイクロカプセルを選択するために、各化合物が所望の活性を有していなければならない、請求項1〜69のいずれかに記載の方法。
【請求項71】
1以上の化合物が、低分子量化合物である、請求項1〜70のいずれかに記載の方法。
【請求項72】
レパートリーのサブセットが、単一化合物である、請求項1〜71のいずれかに記載の方法。
【請求項73】
各マイクロカプセルまたはマイクロビーズが、それと結合した単一化合物の複数の分子を有する、請求項72に記載の方法。
【請求項74】
ステップ(a)から(d)の1つ以上を反復して繰り返すステップをさらに含む、請求項1〜73のいずれかに記載の方法。
【請求項75】
マイクロカプセル化が、油中水型エマルジョンを形成するステップによって達成される、請求項1〜74のいずれかに記載の方法。
【請求項76】
油中水型エマルジョンが、微小流体システムを用いて作成される、請求項75に記載の方法。
【請求項77】
エマルジョンが、不混和性液体の共流動ストリーム内の水性液滴の破裂によって形成される、請求項76に記載の方法。
【請求項78】
微小流体チャネル内の油のストリーム内に分散した水性微小液滴の層流によって、マイクロカプセルが分析のために輸送される、請求項76に記載の方法。
【請求項79】
マイクロカプセルが、微小流体チャネル内の油のストリーム内に分散した水性微小液滴である、請求項76に記載の方法。
【請求項80】
マイクロカプセル内の化合物が、微小流体チャネル内の他の微小液滴に対するマイクロカプセルの相対的位置によって識別される、請求項76に記載の方法。
【請求項81】
マイクロカプセル内の化合物の濃度が、微小流体チャネル内の他の微小液滴に対するマイクロカプセルの相対的位置によって識別される、請求項76に記載の方法。
【請求項82】
マイクロカプセル内の標的が、微小流体チャネル内の他の微小液滴に対するマイクロカプセルの相対的位置によって識別される、請求項76に記載の方法。
【請求項83】
識別されたマイクロカプセルが、微小流体デバイスを用いて分類される、請求項1〜82のいずれかに記載の方法。
【請求項84】
マイクロカプセル化が、フッ化炭素中水型または過フッ化炭素中水型エマルジョンを形成するステップによって達成される、請求項75に記載の方法。
【請求項85】
フッ化炭素が、ペルフルオロオクチルブロミドまたはペルフルオロオクチルエタンである、請求項84に記載の方法。
【請求項86】
エマルジョンが、F−アルキルジモルホリノホスフェートを用いて形成される、請求項84に記載の方法。
【請求項87】
F−アルキルジモルホリノホスフェートが、一般式CnF2n+1CmH2mOP(O)[N(CH2CH2)2O]2を有する、請求項86に記載の方法。
【請求項88】
F−アルキルジモルホリノホスフェートが、C8F17C11H22OP(O)[N(CH2CH2)2O]2である、請求項87に記載の方法。
【請求項89】
マイクロカプセルの内部環境が、油相へ1以上の試薬を添加することによって修飾される、請求項1〜88のいずれかに記載の方法。
【請求項90】
化合物が、相違する光学特性を有するビーズへカップリングされている、請求項1〜89のいずれかに記載の方法。
【請求項91】
ビーズが、相違する蛍光特性を有する、請求項90に記載の方法。
【請求項92】
ビーズの相違する光学特性が、ビーズへの相違するレベルの2以上の蛍光色素の取り込みに起因する、請求項90に記載の方法。
【請求項93】
ビーズの相違する光学特性が、相違する発光スペクトルを有する量子ドットの相違する数での取り込みに起因する、請求項90に記載の方法。
【請求項94】
ビーズの相違する光学特性が、ビーズへ結合した化合物を識別するために使用される、請求項90に記載の方法。
【請求項95】
単離されたビーズ上の化合物が、ビーズから化合物を放出させ、直接分析することによって識別される、請求項1〜94のいずれかに記載の方法。
【請求項96】
単離されたビーズ上の化合物が、質量分光法によって識別される、請求項95に記載の方法。
【請求項97】
請求項1〜96のいずれかの方法によって単離された生成物。
【請求項98】
化合物を調製する方法であって、
(a)任意の1つのマイクロカプセルにおいて、レパートリーのサブセットのみが複数のコピーで示されるように、化合物をマイクロカプセルにコンパートメント化するステップと;
(b)所望の活性を有する化合物を識別するステップと、
(c)所望の活性を有する化合物を識別および生成するステップと
を含む方法。
【請求項99】
化合物を調製する方法であって、
(a)任意の1つのマイクロカプセルにおいて、レパートリーのサブセットのみが複数のコピーで示されるように、化合物をマイクロカプセルにコンパートメント化するステップと;
(b)所望の活性を有する1以上の化合物を含有するマイクロカプセルを、それらの光学特性の変化を用いて識別、および任意選択的に分類するステップと;
(c)所望の活性を有する化合物を識別および生成するステップと
を含む方法。
【請求項100】
標的の活性をモジュレートさせることのできる1以上の化合物をスクリーニングする方法であって、
(a)任意の1つのマイクロカプセルにおいて、レパートリーのサブセットのみが複数のコピーで示されるように、化合物をマイクロカプセルにコンパートメント化するステップと;
(b)所望の活性を有する1以上の化合物を含有するマイクロカプセルを、それらの光学特性の変化を用いて識別、および任意選択的に分類するステップと;
(c)所望の活性を有する標的を1以上の化合物と接触させ、1以上の化合物による標的の活性のモジュレーションを監視するステップと
を含む方法。
【請求項101】
標的を調製する方法であって、
(a)標的に対する合成プロトコールを供するステップであって、少なくとも1つのステップが化合物によって促進される、ステップと;
(b)このステップを促進する化合物の変異体を調製するステップと;
(c)任意の1つのマイクロカプセルにおいて、レパートリーのサブセットのみが複数のコピーで示されるように、化合物をマイクロカプセルにコンパートメント化するステップと;
(d)所望の活性を有する1以上の化合物を含有するマイクロカプセルを、それらの光学特性の変化を用いて識別、および任意選択的に分類するステップと;
(e)合成における関連するステップを促進するために、(d)において識別された化合物を用いて標的を調製するステップと
を含む方法。
【請求項102】
化合物がマイクロビーズに結合しており、任意選択的に化合物がマイクロカプセル内のマイクロビーズから放出させられる、請求項98から102のいずれかに記載の方法。
【請求項103】
化合物および標的が最初は、その後に融合される相違するマイクロカプセルに存在する、請求項13に記載の方法。
【請求項104】
化合物を含有するマイクロカプセルが、分割して2つ以上のマイクロカプセルを生成する、請求項1〜96および98〜103のいずれかに記載の方法。
【請求項105】
標的を含有するマイクロカプセルが、分割して2つ以上のマイクロカプセルを生成する、請求項13に記載の方法。
【請求項106】
1つ以上の細胞が、マイクロカプセル内に存在する、請求項1〜96および98〜103のいずれかに記載の方法。
【請求項107】
化合物が、細胞内の標的の活性をモジュレートする、請求項106に記載の方法。
【請求項108】
化合物が、細胞の活性をモジュレートする、請求項107に記載の方法。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2011−221028(P2011−221028A)
【公開日】平成23年11月4日(2011.11.4)
【国際特許分類】
【出願番号】特願2011−114932(P2011−114932)
【出願日】平成23年5月23日(2011.5.23)
【分割の表示】特願2006−506048(P2006−506048)の分割
【原出願日】平成16年3月31日(2004.3.31)
【出願人】(597166578)メディカル リサーチ カウンシル (60)
【Fターム(参考)】
【公開日】平成23年11月4日(2011.11.4)
【国際特許分類】
【出願日】平成23年5月23日(2011.5.23)
【分割の表示】特願2006−506048(P2006−506048)の分割
【原出願日】平成16年3月31日(2004.3.31)
【出願人】(597166578)メディカル リサーチ カウンシル (60)
【Fターム(参考)】
[ Back to top ]

