サイクリックGMP解析方法
【課題】細胞本来の状態を正確に定量できるサイクリックGMP解析方法を提供する。
【解決手段】発光酵素のN末端側断片、前記発光酵素のC末端側断片およびサイクリックGMP結合領域を含むサイクリックGMPセンサータンパク質であって、前記サイクリックGMP結合領域は前記N末端側断片と前記C末端側断片との間に配置されたサイクリックGMPセンサータンパク質を含む細胞を作製する細胞作製工程と、前記細胞作製工程で作製した前記細胞に当該細胞外から所定の発光基質を添加する添加工程と、前記添加工程で前記所定の発光基質が与えられた前記細胞の発光画像を撮像する撮像工程と、前記撮像工程で撮像した前記発光画像に基づいて、前記細胞内における前記サイクリックGMPの濃度を解析する解析工程とを含む細胞内サイクリックGMP解析方法。
【解決手段】発光酵素のN末端側断片、前記発光酵素のC末端側断片およびサイクリックGMP結合領域を含むサイクリックGMPセンサータンパク質であって、前記サイクリックGMP結合領域は前記N末端側断片と前記C末端側断片との間に配置されたサイクリックGMPセンサータンパク質を含む細胞を作製する細胞作製工程と、前記細胞作製工程で作製した前記細胞に当該細胞外から所定の発光基質を添加する添加工程と、前記添加工程で前記所定の発光基質が与えられた前記細胞の発光画像を撮像する撮像工程と、前記撮像工程で撮像した前記発光画像に基づいて、前記細胞内における前記サイクリックGMPの濃度を解析する解析工程とを含む細胞内サイクリックGMP解析方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、サイクリックGMP解析方法および当該方法に使用されるタンパク質に関する。
【背景技術】
【0002】
多くのホルモンや神経伝達物質はGタンパク質共役型受容体に働き、細胞内セカンドメッセンジャーを介して様々な細胞活動を引き起こしている。また、細胞活動の多様性は、細胞内のセカンドメッセンジャーの時間的および空間的な濃度分布によって制御されている。したがって、特定の細胞活動に関する細胞内情報伝達を解析するにあたって、セカンドメッセンジャーの時空間的な変化をリアルタイムに捉えることが必要である。
【0003】
細胞内セカンドメッセンジャーの1つである環状グアノシン一リン酸(サイクリックGMP)は、生体内において各種生化学反応過程のシグナル伝達分子として作用している。これまでに、循環器系筋細胞の弛緩、網膜における光受容−伝達、上皮における電解質運搬、骨の成長、ニューロンの活性化等の様々な生理的プロセスがサイクリックGMPによって制御されていることが明らかになっている。したがって、生細胞中でのサイクリックGMPの合成、分解、局在等がわかれば、細胞および組織レベルでの循環器系、腎臓、網膜、嗅覚、中枢神経等の作用機構が解明されるだけでなく、細胞内のサイクリックGMP濃度を調節する薬剤に関する知見を得ることが可能になると期待される。
【0004】
従来、サイクリックGMPの測定は、放射線ラベルした化合物を使用し、多数の細胞に対して行われている。また、近年、いくつかのサイクリックGMPバイオセンサーが見出され、細胞レベルでのサイクリックGMPの測定が可能になっている。
【0005】
例えば、特許文献1および非特許文献1には、シアン色蛍光タンパク質(ECFP)と黄色蛍光タンパク質(EYFP)との蛍光共鳴エネルギー移動(FRET)を利用し、サイクリックGMP依存性タンパク質キナーゼ(PKG)Iα遺伝子と蛍光タンパク質遺伝子とを融合した遺伝子を用いてイメージングするサイクリックGMP解析方法が開示されている。具体的には、PKGIα遺伝子配列の両端にYFPおよびCFPの配列を融合して細胞内で発現させている。通常の状態では、CFPを励起してもFRETが起こらないためYFPの蛍光は観察されない。一方、細胞内のサイクリックGMPが増加するとPKGIαの立体構造が変化し、FRETが起こるためアクセプターであるYFPの蛍光が観察される。このFRETシグナルを観察することで、サイクリックGMPの濃度変化を観察できることが明らかにされている。
【0006】
また、特許文献2には、ある種のCNGチャネルおよびカルシウム感受性発光タンパク質を利用する、細胞内の環状ヌクレオチドであるサイクリックGMPおよびサイクリックAMP濃度を定量解析する方法が開示されている。この方法では、細胞内に、環状ヌクレオチドにより活性化される特定のイオンチャネル(CNGチャネル)およびカルシウム感受性発光タンパク質を発現させている。このとき細胞内のサイクリックGMPまたはサイクリックAMPが増加すると、CNGチャネルが開口し、それによりカルシウムイオンが流入する。流入したカルシウムは、Fura−2もしくはFlou−3等のカルシウム感受性発光インジケーター、またはエクオリンもしくはオベリンといったカルシウム感受性発光タンパク質により検出できることが明らかにされている。
【0007】
また、非特許文献2には、青色発光タンパク質と緑色蛍光タンパク質(EGFP)との発光共鳴エネルギー移動(BRET)を利用する、サイクリックGMP特異的ホスホジエステラーゼ5A(PDE5A)のサイクリックGMP結合ドメイン遺伝子に発光タンパク質遺伝子および蛍光タンパク質遺伝子を融合して観察するサイクリックGMP解析方法が開示されている。PDE5AのサイクリックGMP結合ドメイン遺伝子、青色発光タンパク質であるレニラルシフェラーゼ遺伝子およびEGFP遺伝子を融合したタンパク質を発現させた細胞に対し、ルシフェラーゼの基質となるセレンテラジンを添加すると青色の発光が観察されている。この細胞において細胞内サイクリックGMPが増加すると、サイクリックGMP結合ドメインの立体構造が変化してルシフェラーゼの発光からEGFPの蛍光へ発光−蛍光共鳴エネルギーシフト(BRET)が起こり、EGFPの蛍光が検出される。このBRETシグナルを検出することで、サイクリックGMPの濃度変化を検出できることが明らかにされている。
【0008】
また、特許文献3には、ヒトサイクリックGMP活性化プロテインキナーゼ由来Bドメイン(GKI−B)またはヒトホスホジエステラーゼ2A(PDE2A)のサイクリックGMP結合ドメインと円順列置換したホタルルシフェラーゼとを融合したタンパク質を利用して細胞内のサイクリックGMP濃度を定量解析する方法が開示されている。この方法では、GKI−BまたはPDE2AのサイクリックGMP結合ドメイン遺伝子と円順列置換したホタルルシフェラーゼ遺伝子とを融合したタンパク質を発現させた細胞に、ルシフェラーゼの基質となるルシフェリンを添加し、細胞からの発光を計測している。細胞内のサイクリックGMPが増加すると、サイクリックGMP結合ドメインの立体構造が変化してルシフェラーゼの発光が消失または増強する。この発光シグナルを検出することで、サイクリックGMPの濃度変化を検出できることが明らかにされている。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】特許第3643520号公報
【特許文献2】特表2006−520203号
【特許文献3】特表2009−532063号
【非特許文献】
【0010】
【非特許文献1】Honda A, Adams SR, Sawyer CL, Lev−Ram V, Tsien RY, Dostmann WRG. “Spatiotemporal dynamics of guanosine 3’,5’−cyclic monophosphate revealed by a genetically encoded, fluorescent indicator.” Proceedings of the National Academy of Sciences of United States of America, vol.98, no.5, pp.2437−2442, 2001
【非特許文献2】Biswas KH, Sopory S, Visweswariah SS. “The GAF domain of the cGMP−binding, cGMP−specific phosphodiesterase (PDE5) is a sensor and a sink for cGMP.” Biochemistry, Vol.47, pp.3534−3543, 2008
【発明の概要】
【発明が解決しようとする課題】
【0011】
特許文献1または非特許文献1に開示されるようなPKG酵素を利用する方法では、レポーターのサイクリックGMP結合部位にPKGの全長または酵素ドメインが含まれるため、レポーターがリン酸化酵素活性を有し、細胞内の情報伝達に影響を及ぼすという問題があった。また、蛍光タンパク質を用いるため、その影響で細胞内に存在する不特定のタンパク質が励起され蛍光を生じ(自己蛍光)、シグナル/ノイズ比を下げるという問題があった。さらに、ダイナミックレンジが狭いことにより、利用可能な測定対象の範囲が狭いという問題があった。
【0012】
特許文献2に開示されるようなCNGチャネルおよびカルシウム感受性発光タンパク質を利用する方法では、2種類以上の遺伝子を同時に導入することが必要となり、細胞内への導入および発現効率が低いという問題があった。また、当該方法では、細胞内にカルシウムイオンが流入するため、細胞内の情報伝達に影響を及ぼし、細胞の本来の状態を測定できない可能性があるという問題があった。
【0013】
非特許文献2に開示されるような発光タンパク質と蛍光タンパク質とのBRETを用いる方法では、ルミノメーターまたはフォトンカウンティングでのみ測定が行われるため、単一の細胞における測定は最適化されておらず又は不可能であり、利用可能な測定方法の範囲が狭いという問題があった。特に、BRETの変換効率が低くシグナルが小さくなるため、イメージングに使用できる程度のシグナル/ノイズ比が得られない。
【0014】
特許文献3に開示されるような円順列置換ルシフェラーゼとGKI−BまたはPDE2AのサイクリックGMP結合ドメインとの融合タンパク質を用いる方法では、ルミノメーターまたはフォトンカウンティングでのみ測定が行われるため、単一の細胞における測定は最適化されておらず又は不可能であり、利用可能な測定方法の範囲が狭いという問題があった。特に、当該融合タンパク質からの発光量が小さいため、イメージングに使用できる程度のシグナル/ノイズ比が得られない。
【0015】
本発明は、上述のような従来技術が抱える数々の問題に鑑みてなされたものであり、細胞本来の状態を正確に定量できるサイクリックGMP解析方法を提供することを目的とする。特に、細胞内の情報伝達に影響を及ぼすことなく、各細胞からの正確な定量的結果を得ることができ、その結果、個々の細胞においてサイクリックGMP濃度の変化を再現性良く経時的に観察することができるサイクリックGMP解析方法を提供することを目的とする。
【課題を解決するための手段】
【0016】
本発明の一実施態様によれば、発光酵素のN末端側断片、前記発光酵素のC末端側断片およびサイクリックGMP結合領域を含むサイクリックGMPセンサータンパク質であって、前記サイクリックGMP結合領域は前記N末端側断片と前記C末端側断片との間に配置されたサイクリックGMPセンサータンパク質を含む細胞を作製する細胞作製工程と、前記細胞作製工程で作製した前記細胞に当該細胞外から所定の発光基質を添加する添加工程と、前記添加工程で前記所定の発光基質が与えられた前記細胞の発光画像を撮像する撮像工程と、前記撮像工程で撮像した前記発光画像に基づいて、前記細胞内における前記サイクリックGMPの濃度を解析する解析工程とを含む細胞内サイクリックGMP解析方法が提供される。
【0017】
また、本発明の一実施態様に因れば、発光酵素のN末端側断片、前記発光酵素のC末端側断片およびサイクリックGMP結合領域を含むサイクリックGMPセンサータンパク質であって、前記サイクリックGMP結合領域は前記N末端側断片と前記C末端側断片との間に配置されたサイクリックGMPセンサータンパク質が提供される。
【発明の効果】
【0018】
本発明によれば、細胞内のサイクリックGMPに関する情報を正確且つ定量的に個々の細胞から得ることができ、その結果、個々の細胞において細胞内のサイクリックGMP濃度を再現性良く観察することができる。
【図面の簡単な説明】
【0019】
【図1】発光観察システム100の全体構成の一例を示す図である。
【図2】発光観察システム100の発光画像撮像ユニット106の構成の一例を示す図である。
【図3】発光観察システム100の発光画像撮像ユニット106の構成の一例を示す図である。
【図4】発光観察システム100の画像解析装置110の構成の一例を示すブロック図である。
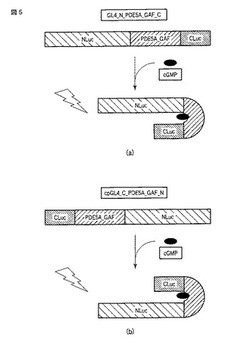
【図5】スプリットルシフェラーゼアッセイ法を用いたcGMPの検出原理を示す図である。
【図6】種々のサイクリックGMPセンサータンパク質について、ルミノメーターによって測定した発光量を示すグラフ図である。
【図7】GL4_N_PDE5A_GAFa1_Cを導入したHEK293細胞において、8−Br−cGMP刺激前の発光画像を示す図である。
【図8】GL4_N_PDE5A_GAFa1_Cを導入したHEK293細胞において、8−Br−cGMP刺激5分後の発光画像を示す図である。
【図9】選択した細胞での8−Br−cGMP刺激によるGL4_N_PDE5A_GAFa1_Cの発光強度の経時変化を示した図である。
【図10】GL4_N_PDE5A_GAFa7_Cを導入したHEK293細胞において、8−Br−cGMP刺激前の発光画像を示す図である。
【図11】GL4_N_PDE5A_GAFa7_Cを導入したHEK293細胞において、8−Br−cGMP刺激5分後の発光画像を示す図である。
【図12】選択した細胞での8−Br−cGMP刺激によるGL4_N_PDE5A_GAFa7_Cの発光強度の経時変化を示した図である。
【図13】cpGL4_C_PDE5A_GAFa7_Nを導入したHEK293細胞において、8−Br−cGMP刺激前の発光画像を示す図である。
【図14】cpGL4_C_PDE5A_GAFa7_Nを導入したHEK293細胞において、8−Br−cGMP刺激5分後の発光画像を示す図である。
【図15】選択した細胞での8−Br−cGMP刺激によるcpGL4_C_PDE5A_GAFa7_Nの発光強度の経時変化を示した図である。
【図16】種々のサイクリックGMPセンサータンパク質の作製を示す図である。
【発明を実施するための形態】
【0020】
[方法]
以下に、本発明に係る方法について説明する。
本発明は、発光酵素のN末端側断片、前記発光酵素のC末端側断片およびサイクリックGMP結合領域を含むサイクリックGMPセンサータンパク質であって、前記サイクリックGMP結合領域は前記N末端側断片と前記C末端側断片との間に配置されたサイクリックGMPセンサータンパク質を含む細胞を作製する細胞作製工程と、前記細胞作製工程で作製した前記細胞に当該細胞外から所定の発光基質を添加する添加工程と、前記添加工程で前記所定の発光基質が与えられた前記細胞の発光画像を撮像する撮像工程と、前記撮像工程で撮像した前記発光画像に基づいて、前記細胞内における前記サイクリックGMPの濃度を解析する解析工程とを含む細胞内サイクリックGMP解析方法に関する。
【0021】
簡潔には、本発明は、対象とする細胞にサイクリックGMPセンサータンパク質を導入し、発光基質を与えて発光を誘導し、その様子を撮像し、撮像した画像に基づいてcGMP濃度を特定等する方法に関する。
【0022】
本発明によれば、細胞内のサイクリックGMPの状態を解析することができる。特に、細胞内のサイクリックGMP濃度を定量的に測定することが可能である。また、測定はイメージングによって行うことができるため、細胞ごとに測定が可能であり、さらには細胞内の細胞小器官等の構造に絞って測定することもできる。さらに、一定間隔で同一の測定領域を測定することで、サイクリックGMP濃度の刺激に対する変化および時間的変化を解析することができる。細胞ごとに測定することで、細胞間の差異を解析することもできる。
【0023】
細胞作製工程では、サイクリックGMPセンサータンパク質を含む細胞が作製される。サイクリックGMPセンサータンパク質とは、発光酵素の2つのポリペプチド断片と、サイクリックGMPに結合できるポリペプチド断片と、任意にその他のポリペプチド断片とが融合したタンパク質であって、サイクリックGMPの存在に応じて当該発光酵素の活性が消失または回復するタンパク質である。サイクリックGMPセンサータンパク質の詳細については後述する。対象となる細胞の種類に限定はなく、細菌細胞、酵母細胞、植物細胞および動物細胞等を使用できる。動物細胞が使用される場合、特に哺乳細胞が使用され、例えばマウスの細胞、サルの細胞およびヒトの細胞が使用される。細胞は、生体組織の一部として培養された細胞集合体であってもよいし、生体組織が属している臓器等や生命個体の形態でもよい。細胞に対してサイクリックGMPセンサータンパク質を導入する方法に特別な限定はなく、既知の導入方法が使用できる。1つの方法は、当該タンパク質をコードする塩基配列を含む核酸を細胞に導入し、その後細胞内で当該タンパク質を発現させる方法である。例えば、当該核酸を含む発現ベクターを、リン酸カルシウム法、リポフェクション法またはエレクトロポレーション法等によって細胞内に導入し、発現ベクターから当該タンパク質を発現させることができる。ベクターから発現させるのではなく、当該核酸がゲノムに組み込まれた細胞を作製した後、ゲノムから当該タンパク質を発現させることもできる。別の方法は、細胞外で精製した当該タンパク質を細胞内に直接導入する方法である。例えば、マイクロインジェクション法によって当該タンパク質を細胞内に直接注入することができる。または、当該タンパク質を含む培養液にて細胞をインキュベートさせて、エンドサイトーシスによって当該タンパク質を細胞に取り込ませることができる。
【0024】
添加工程では、細胞作製工程にて作製された細胞に対し発光基質が添加される。本発明に係る方法は発光酵素による発光反応を利用するが、この発光反応を生じさせるためには発光基質が必要となる。発光基質は使用する発光酵素に応じて選択される。発光基質の詳細は後述する。発光基質を添加する方法に特別限定はなく、適宜選択できる。例えば、培養液に添加することで、培養液を介して細胞に発光酵素を取り込ませることができる。また、マイクロインジェクション法によって、発光基質を細胞内に直接注入することもできる。発光基質の添加のタイミングも適宜選択できる。例えば、細胞へのサイクリックGMPセンサータンパク質の導入の前に、それと同時に、またはその後に発光基質を添加することができる。例えば、一連の操作を通して、細胞を取り扱うための培養液中に発光基質を含めておくことができる。または、マイクロインジェクションにて当該タンパク質および発光基質を同時に細胞に注入することができる。好ましくは、発光基質は測定の直前に添加される。発光基質の添加量に特別な限定はないが、好ましくは、発光酵素が発光反応を生じるために十分な量で添加される。
【0025】
撮像工程では、発光反応が生じている細胞の画像が取得される。撮像は任意のタイミングで行うことができるが、好ましくは、基質添加から一定時間後に行われる。特に複数の測定を繰り返す場合、測定結果のばらつきを抑えるために、複数の測定を通じて同一のタイミングで撮像することが好ましい。撮像時間は条件に応じて最良の時間が適宜選択される。発光強度が小さい場合、撮像時間(顕微鏡を使用する場合、露出時間)は長くされ、逆に発光強度が大きすぎる場合、撮像時間は短くされる。例えば、5から10秒間の露出時間とすることができる。撮像は、発光反応に係る波長の光のみを取得して行うこともできるが、それと同時に明視野画像または別の波長の光による画像を取得してもよい。例えば、細胞にサイクリックGMPセンサータンパク質と同時にプローブ(例えば蛍光または発光タンパク質)を融合した特定のタンパク質を導入し、サイクリックGMPセンサータンパク質に由来する光と同時に、当該特定のタンパク質からの光を検出してもよい。なお、撮像に使用される装置については後述する。
【0026】
解析工程では、取得された画像に基づいて、細胞内のサイクリックGMP濃度等の解析が行われる。解析は、コンピュータにて機能するソフトウェアを使用して、発光量を数値に変換してもよい。当該数値を利用して、スタンダードとの比の算出、試料間の比較等が適宜行われる。このような処理によって、細胞内のサイクリックGMP濃度が特定される。また、濃度の特定とは、詳細な数値の特定でなくとも、サイクリックGMPが試料中に存在するか否かの特定、または設定した濃度範囲にあるかどうか等の大まかな特定であってもよい。なお、解析に使用される装置については後述する。
【0027】
また、本発明は、撮像工程が発光画像を繰り返し撮像することを含む上記の細胞内サイクリックGMP解析方法に関する。当該方法では、一定の間隔で撮像を繰り返し、または特定の時間に撮像が行われる。このように経時的に撮像されることで、タイムラプスによる観察または動画による観察が可能となる。撮像の都度、発光基質を添加してもよい。当該方法によって、同一細胞における時空間的な測定ができる。すなわち、時間に応じた又は刺激に応じたサイクリックGMP濃度の変化を測定することができる。また、明視野画像を同時に取得することで、サイクリックGMPの濃度変化と細胞の形態変化等との関係を知ることが出来る。また、プローブを付したタンパク質を発現させ、当該プローブの様子を同時に観察することで、当該タンパク質とサイクリックGMPとの関連性を知ることができる。
【0028】
また、本発明は、撮像工程が複数の異なる細胞に対して同時に行われ、且つ解析工程が細胞ごとに行われる細胞内サイクリックGMP解析方法に関する。当該方法では、一度の撮像において、複数の異なる細胞の画像が取得される。さらに、その後の解析が各々の細胞に対して行われる。撮像した1つの画像に含まれる複数の細胞について細胞ごとの解析を行うことが可能であり、または、撮像した複数の画像にそれぞれ含まれる複数の細胞について細胞ごとの解析を行うことが可能である。また、撮像を上述のような経時的な撮像にすることもできる。これらのような方法によって、個々の細胞におけるサイクリックGMP濃度変化を時空間的に解析できる。例えば、同一条件下におかれた細胞同士のサイクリックGMP濃度の比較に使用することができる。
【0029】
[サイクリックGMPセンサータンパク質]
次に、本発明に係るサイクリックGMPセンサータンパク質について説明する。本発明は、サイクリックGMPセンサータンパク質を利用する上記方法に関し、またサイクリックGMPセンサータンパク質自体に関する。
【0030】
本発明に係るサイクリックGMPセンサータンパク質は、発光酵素のN末端側断片、発光酵素のC末端側断片およびサイクリックGMP結合領域を含み、且つ、サイクリックGMP結合領域はN末端側断片とC末端側断片との間に配置されている。当該タンパク質は、サイクリックGMPの存在に応じて当該発光酵素の活性が消失または回復する。
【0031】
また、本発明に係るサイクリックGMPセンサータンパク質においては、サイクリックGMP結合領域をサイクリックGMP特異的ホスホジエステラーゼ由来のものとすることができる。これによって、サイクリックGMPセンサータンパク質はサイクリックGMP依存的に結合できる。
【0032】
サイクリックGMP特異的ホスホジエステラーゼとは、サイクリックGMPのホスホジエステル結合を加水分解してGMPを作り出す反応を促進する酵素である。この例として、ホスホジエステラーゼ5A(PDE5A)が存在する。サイクリックGMP特異的ホスホジエステラーゼは、サイクリックGMPと結合できる部位を2つ有しており、当該部位をサイクリックGMP結合領域として利用することができる。サイクリックGMP特異的ホスホジエステラーゼの由来となる生物種には、当該ホスホジエステラーゼがサイクリックGMP結合領域を有していれば特別限定はないが、哺乳類に由来する当該ホスホジエステラーゼ、特にヒトまたはマウスに由来する当該ホスホジエステラーゼが好ましい。
【0033】
サイクリックGMP結合領域は、マウスサイクリックGMP特異的ホスホジエステラーゼ5A中の特定の領域であってよい。当該「特定の領域」のアミノ酸配列における開始位置は、121番目、131番目または155番目のアミノ酸であってよく、終了位置は、308番目、320番目、330番目、343番目、358番目、366番目または384番目のアミノ酸であってよい。
【0034】
特に、本発明に係るサイクリックGMPセンサータンパク質において、サイクリックGMP結合領域が、マウスサイクリックGMP特異的ホスホジエステラーゼ5Aのアミノ酸番号121番目から330番目、131番目から320番目、131番目から330番目、131番目から343番目、または131番目から358番目のアミノ酸配列を含んでいてよい。これによって、哺乳類細胞においてルシフェラーゼ活性を高く保ちつつ、サイクリックGMP依存的に結合するという効果が得られる。
【0035】
また、サイクリックGMP結合領域の長さに関して、そのアミノ酸残基の数を、150から260としてよい。さらに、アミノ酸残基の数を190から230としてよい。特に、アミノ酸残基の数は、190、200、210、213または228であることが好ましい。
【0036】
なお、サイクリックGMP結合領域としては、好ましくは配列番号20、24、26、27または28に示されるアミノ酸配列を含むポリペプチドを使用できる。
【0037】
配列番号19には、マウス由来のサイクリックGMP特異的ホスホジエステラーゼ5A(PDE5A)のアミノ酸配列が示される。また、配列番号20から30には、当該マウス由来PDE5Aのポリペプチド断片のアミノ酸配列が示されており、それぞれ順に、PDE5A_GAFa1、PDE5A_GAFa2、PDE5A_GAFa3、PDE5A_GAFa4、PDE5A_GAFa5、PDE5A_GAFa6、PDE5A_GAFa7、PDE5A_GAFa8、PDE5A_GAFa9、PDE5A_GAFa10およびPDE5A_GAFa11と称されるポリペプチド断片のアミノ酸配列に対応する。
【0038】
本願において、発光酵素とは発光を伴う反応を触媒する酵素を意味する。発光酵素としてはルシフェラーゼを使用できる。ルシフェラーゼとしては、ホタル由来のもの、ウミシイタケ由来のものおよびバクテリア由来のもの等を使用できるが、特にホタル由来ルシフェラーゼを使用することが好ましい。また、発光基質は発光酵素に応じて選択されるが、ルシフェラーゼを発光酵素として使用する場合、発光基質としてはルシフェリンを使用することができる。
【0039】
サイクリックGMPセンサータンパク質に含まれる発光酵素は、当該タンパク質において、N末端側断片とC末端側断片として含まれている。「N末端側断片」とは、C末端から複数のアミノ酸が欠失した発光酵素の断片であって、発光酵素活性を失った断片を意味する。「C末端側断片」とは、N末端から複数のアミノ酸が欠失した発光酵素の断片であって、発光酵素活性を失った断片を意味する。N末端側断片とC末端側断片との間にサイクリックGMP結合領域が配置されており、その条件を満たせば、発光酵素のN末端側断片およびC末端側断片のサイクリックGMPセンタータンパク質内における配置に限定はない。すなわち、サイクリックGMPセンサータンパク質のN末端側に発光酵素のN末端側断片が配置され、サイクリックGMPセンサータンパク質のC末端側に発光酵素のC末端側断片が配置されたものを使用できる(図5a)。または、サイクリックGMPセンサータンパク質のN末端側に発光酵素のC末端側断片が配置され、サイクリックGMPセンサータンパク質のC末端側に発光酵素のN末端側断片が配置されたものを使用できる(図5b)。なお、後者のサイクリックGMPセンサータンパク質には「変異型」または「cp(circular permutaion)」といった用語が付され、前者のものと適宜区別される。
【0040】
サイクリックGMPセンサータンパク質において、発光酵素の断片は、それぞれ単独では全長の配列を有していないため通常の環境下(例えばサイクリックGMPが存在していない環境下)で活性が失われているが、特定の環境下(例えばサイクリックGMPが存在する環境下)で活性を回復する。例えば、サイクリックGMP結合領域にサイクリックGMPが結合し、サイクリックGMP結合領域の構造が変化する結果、離れていたN末端側断片とC末端側断片とが結合することで、本来の発光酵素の活性が回復する。この「結合」の態様に限定はなく、共有結合または非共有結合等の化学的結合であってもよいが、N末端側断片とC末端側断片とがルシフェラーゼの本来の機能を果たしうる程度に「接近」または「接触」している状態であることが好ましい。あるいは、N末端側断片とC末端側断片とが「会合」する状態であってもよい。すなわち、当該表現において使用される「結合」という用語は、「接近」、「接触」または「会合」という意味を含む。
【0041】
発光酵素が、その中のどの位置で分割されているかに限定はないが、発光酵素としてルシフェラーゼを使用する場合、N末端側断片はルシフェラーゼの1番目から400番目のアミノ酸を含み、C末端側断片はルシフェラーゼの401番目から550番目のアミノ酸を含むことが好ましい。また、N末端側断片はルシフェラーゼの1番目から416番目のアミノ酸を含み、C末端側断片はルシフェラーゼの399番目から550番目のアミノ酸を含む場合のように、N末端側断片およびC末端側断片は、それらの一部の配列が重複していてもよい。
【0042】
特に、本発明に係るサイクリックGMPセンサータンパク質において、発光酵素がホタルルシフェラーゼであり、N末端側断片がホタルルシフェラーゼのアミノ酸番号1番目から416番目のアミノ酸配列を含み、C末端側断片がホタルルシフェラーゼのアミノ酸番号399番目から550番目のアミノ酸配列を含むことが好ましい。これによって、発光酵素のN末断片とC末側断片とが再会合した時にだけ発光するので、シグナル/ノイズ比が大きいという効果が得られる。
【0043】
さらに、本発明に係るサイクリックGMPセンサータンパク質は、配列番号31、35、37、48、38または39に示されるアミノ酸配列を含むサイクリックGMPセンサータンパク質であってよい。これらの配列は、それぞれ、後述するサイクリックGMPセンサータンパク質GL4_N_PDE5A_GAFa1_C、GL4_N_PDE5A_GAFa5_C、GL4_N_PDE5A_GAFa7_C、cpGL4_C_PDE5A_GAFa7_N、GL4_N_PDE5A_GAFa8_CおよびGL4_N_PDE5A_GAFa9_Cのアミノ酸配列である。
【0044】
上述のとおり、本発明に係るサイクリックGMPセンサータンパク質は、サイクリックGMPの存在に応じて、発光酵素の活性が消失または回復する。また、本発明に係る方法は、当該タンパク質のこのような特徴を利用する。従来の分子間のエネルギー共鳴(FRET、BRET等)を利用する技術では、エネルギー共鳴の効率の低さに起因して発光量が少なく、また、検出される波長の違いによってサイクリックGMPの存在/非存在が解析される。これに対し、本発明では、ルシフェラーゼといった発光酵素による単純な反応を利用するため発光量は大きく、イメージングも可能となり、また、サイクリックGMPの存在/非存在は発光の発生/非発生に対応するため、シグナル/ノイズ比の高い検出結果が得られる。
【0045】
[核酸]
次に、本発明に係るサイクリックGMPセンサータンパク質をコードする遺伝子を含む核酸に関して説明する。
【0046】
当該核酸は、本発明に係るサイクリックGMPセンサータンパク質をコードする遺伝子を含む。特に、そのような遺伝子のORF領域を含む。この遺伝子のコドンは、対象とする細胞における発現に最適化されていてよい。また、Kozak配列等、発現量を上昇させるための配列を含んでよく、または付与されていてよい。
【0047】
また、本発明は上記核酸を含むベクターに関する。当該ベクターは、対象とする細胞における発現のための発現ベクターであってよい。発現ベクターである場合、サイクリックGMPセンサータンパク質をコードする遺伝子の配列のほかに、発現を制御するための配列、マーカー遺伝子の配列等、一般的な発現ベクターに含まれる配列を含んでよい。本発明に係る細胞内サイクリックGMP解析方法の細胞作製工程において、当該発現ベクターを使用することができる。すなわち、当該発現ベクターを細胞に導入し、サイクリックGMPセンサータンパク質を発現させて、サイクリックGMPの検出に使用できる。
【0048】
[装置]
次に、本発明に係るサイクリックGMP解析方法(特に撮像工程および解析工程)にて使用される発光観察システム100について、図1から3を用いて説明する。図1は、発光観察システム100の全体構成の一例を示す図である。図2は、発光観察システム100の発光画像撮像ユニット106の構成の一例を示す図である。図3は、発光観察システム100の発光画像撮像ユニット106の構成の一例を示す図である。
【0049】
まず、図1に示すように、発光観察システム100は、細胞102を収納した容器103(具体的にはシャーレ、スライドガラス、マイクロプレート、ゲル支持体、微粒子担体など)と、容器103を配置するステージ104と、発光画像撮像ユニット106と、画像解析装置110と、で構成されている。微弱な発光を測定するための発光画像撮像ユニット106をステージ104の下側に配置してもよい。これにより、カバー開閉によるサンプル上方からの外乱光を完全に遮断できて発光画像のS/N比を増すことができる。発光画像撮像ユニット106は、レーザー走査式の光学系であってもよい。
【0050】
ここで、細胞102は、例えば、サイクリックGMP濃度に依存して発光するよう発光標識された生きた細胞である。また、サイクリックGMP濃度に依存して発光するタンパク質として、N末側発光酵素とC末側発光酵素との間にサイクリックGMP結合タンパク質を挿入した融合タンパク質の他に、例えば、特表2009−532063号公報に開示されている融合タンパク質を用いてもよい。また、ここで、細胞102に、上記融合タンパク質が発現されるよう構成した、当該融合タンパク質をコードするポリヌクレオチドを含む発現ベクターを導入することにより、融合タンパク質が細胞102内で発現されるよう構成してもよい。なお、細胞102には、添加工程において、当該細胞外から所定の発光基質(例えばルシフェリンなど)および所定の刺激(例えば薬物刺激など)が与えられる。
【0051】
また、発光画像撮像ユニット106は、具体的には、正立型の発光顕微鏡であり、細胞102の発光画像を撮像する。発光画像撮像ユニット106は、図示の如く、対物レンズ106aと、ダイクロイックミラー106bと、CCDカメラ106cと、結像レンズ106fと、で構成されている。対物レンズ106aは、具体的には、(開口数/倍率)2の値が0.01以上のものである。ダイクロイックミラー106bは、細胞102から発せられた発光を色別に分離し、2色の発光を用いて発光量や発光強度を色別に測定する場合に用いる。CCDカメラ106cは、対物レンズ106a、ダイクロイックミラー106bおよび結像レンズ106fを介して当該CCDカメラ106cのチップ面に投影された細胞102の発光画像および明視野画像を撮る。また、CCDカメラ106cは、画像解析装置110と有線または無線で通信可能に接続される。ここで、細胞102が撮像範囲中に複数存在する場合、CCDカメラ106cは、当該撮像範囲中に含まれる複数の細胞102の発光画像および明視野画像を撮像してもよい。結像レンズ106fは、対物レンズ106aおよびダイクロイックミラー106bを介して当該結像レンズ106fに入射した像(具体的には細胞102を含む像)を結像する。なお、図1では、ダイクロイックミラー106bで分離した2つの発光に対応する発光画像を2台のCCDカメラ106cで別々に撮像する場合の一例を示しており、1つの発光を用いる場合には、発光画像撮像ユニット106は、対物レンズ106a、1台のCCDカメラ106cおよび結像レンズ106fで構成されてもよい。
【0052】
ここで、2色の発光を用いて発光量や発光強度を色別に測定する場合、発光画像撮像ユニット106は、図2に示すように、対物レンズ106aと、CCDカメラ106cと、スプリットイメージユニット106dと、結像レンズ106fと、で構成されてもよい。そして、CCDカメラ106cは、スプリットイメージユニット106dおよび結像レンズ106fを介して当該CCDカメラ106cのチップ面に投影された細胞102の発光画像(スプリットイメージ)および明視野画像を撮像してもよい。スプリットイメージユニット106dは、細胞102から発せられた発光を色別に分離し、ダイクロイックミラー106bと同様、2色の発光を用いて発光量や発光強度を色別に測定する場合に用いる。
【0053】
また、複数色の発光を用いて発光量や発光強度を色別に測定する場合(つまり、多色の発光を用いる場合)、発光画像撮像ユニット106は、図3に示すように、対物レンズ106aと、CCDカメラ106cと、フィルターホイール106eと、結像レンズ106fと、で構成されてもよい。そして、CCDカメラ106cは、フィルターホイール106eおよび結像レンズ106fを介して当該CCDカメラ106cのチップ面に投影された細胞102の発光画像および明視野画像を撮像してもよい。フィルターホイール106eは、細胞102から発せられた発光をフィルタ交換によって色別に分離し、複数色の発光を用いて発光量や発光強度を色別に測定する場合に用いる。
【0054】
図1に戻り、画像解析装置110は、具体的にはパーソナルコンピュータである。そして、画像解析装置110は、図4に示すように、大別して、制御部112と、システムの時刻を計時するクロック発生部114と、記憶部116と、通信インターフェース部118と、入出力インターフェース部120と、入力装置122と、出力装置124と、で構成されており、これら各部はバスを介して接続されている。
【0055】
記憶部116は、ストレージ手段であり、具体的には、RAMやROM等のメモリ装置、ハードディスクのような固定ディスク装置、フレキシブルディスク、光ディスク等を用いることができる。そして、記憶部116は制御部112の各部の処理により得られたデータなどを記憶する。通信インターフェース部118は、画像解析装置110と、CCDカメラ106cと、の間における通信を媒介する。すなわち、通信インターフェース部118は他の端末と有線または無線の通信回線を介してデータを通信する機能を有する。入出力インターフェース部120は、入力装置122や出力装置124に接続する。ここで、出力装置124には、モニタ(家庭用テレビを含む)の他、スピーカやプリンタを用いることができる(なお、以下で、出力装置124をモニターとして記載する場合がある。)。また、入力装置122には、キーボードやマウスやマイクの他、マウスと協働してポインティングデバイス機能を実現するモニターを用いることができる。
【0056】
また、制御部112は、OS(Operating System)等の制御プログラムや各種の処理手順等を規定したプログラムや所要データを格納するための内部メモリを有し、これらのプログラムに基づいて種々の処理を実行する。そして、制御部112は、大別して、発光画像撮像指示部112aと、発光画像取得部112bと、画像解析部112cと、解析結果出力部112dと、で構成されている。
【0057】
また、発光画像撮像指示部112aは、通信インターフェース部118を介して、CCDカメラ106cへ発光画像および明視野画像の撮像を指示する。発光画像取得部112bは、CCDカメラ106cで撮像した発光画像および明視野画像を、通信インターフェース部118を介して取得する。ここで、発光画像撮像指示部112aは、発光画像および明視野画像を繰り返し撮像する指示を行ってもよく、複数の異なる細胞102について同時に撮像を実行してもよい。なお、発光画像取得部112bは、撮像した発光画像および明視野画像を、クロック発生部114による時間情報とともに記憶部116に格納してもよい。
【0058】
また、画像解析部112cは、発光画像取得部112bで取得した発光画像に基づいて、細胞102から発せられる発光の発光強度に基づいてサイクリックGMPの濃度を解析する。ここで、画像解析部112cは、発光画像取得部112bにより繰り返し撮像された複数の発光画像に基づいて、経時的なサイクリックGMP濃度の変動を測定してもよく、複数の異なる細胞102について同時に発光画像が撮像された場合に、複数の発光画像を細胞102ごとに照合してサイクリックGMPの濃度を解析してもよい。
【0059】
解析結果出力部112dは、画像解析部112cでの解析結果を出力装置124に出力する。より具体的には、解析結果出力部112dは、画像解析部112cで得られた、細胞102から発せられる発光の発光強度に基づくサイクリックGMP濃度の時系列データを、グラフ化して出力装置124に表示する。
【実施例】
【0060】
[実施例1]
種々のサイクリックGMPセンサータンパク質を作製し、それぞれの特性を調べた。具体的には、マウスのサイクリックGMP特異的ホスホジエステラーゼ5A(PDE5A)由来のサイクリックGMP結合領域と、ホタルルシフェラーゼ由来の2つの断片とから成るサイクリックGMPセンサータンパク質を作製し、各種環状ヌクレオチドに対する応答性を調べた。
【0061】
(手順1)
PCR(polymerase chain reaction)によって、ルシフェラーゼの各種断片を増幅した。図5aに示すサイクリックGMPセンサータンパク質の作製のために、N末側発光酵素(NLuc)遺伝子およびC末側発光酵素(CLuc)遺伝子を増幅した。また、図5bに示すサイクリックGMPセンサータンパク質の作製のために、N末側発光酵素(cpNLuc)遺伝子およびC末側発光酵素(cpCLuc)遺伝子を増幅した。増幅のための合成オリゴDNAは以下のものを使用した。
[NLuc遺伝子作製用合成オリゴDNA配列]
NLuc_Fw (配列番号1): 5’ − TGTGGATCCAGCCACCATGGAAGATGCCAA − 3’
NLuc_Rv (配列番号2): 5’ − CAGCTCGAGGTCCTTGTCGATGAGAGCGTT − 3’
[CLuc遺伝子作製用合成オリゴDNA配列]
CLuc_Fw (配列番号3): 5’ − ATCAGATCTGGCTACGTTAACAACCCCGAG − 3’
CLuc_Rv (配列番号4): 5’ − CTAGAATTCTTACACGGCGATCTTGCCGCC − 3’
[cpNLuc遺伝子作製用合成オリゴDNA配列]
cpNLuc_Fw(配列番号5):5’−ATCAGATCTGAAGATGCCAAAAACATTAAG−3’
cpNLuc_Rv(配列番号6):5’−CTAGAATTCTTAGTCCTTGTCGATGAGAGC−3’
[cpCLuc遺伝子作製用合成オリゴDNA配列]
cpCLuc_Fw(配列番号7):5’−TGTGGATCCAGCCACCATGAGCGGCTACGTTAACAACCCC−3’
cpCLuc_Rv(配列番号8):5’−CAGCTCGAGCACGGCGATCTTGCCGCCCTT−3’
【0062】
また、PCRによって、PDE5AのcGMP結合ドメイン遺伝子を増幅した。増幅には以下のプライマーを組み合わせて用い、種々の遺伝子を取得した。
PDE5A_GAFa_1_Fw (配列番号9): 5’− CCCCTCGAGTTTGATCATGATGAAGGGGACCAGTGCTCA −3’
PDE5A_GAFa_2_Fw (配列番号10): 5’− CCCCTCGAGGTCACAGCATTGTGTCACAAA −3’
PDE5A_GAFa_3_Fw (配列番号11): 5’− CTCGAGAAGGAACAAATGCCACTAACCCCC −3’
PDE5A_GAFa_1_Rv (配列番号12): 5’− CCCAGATCTCTTGTTCTCCAGCAGTGAAGTCTCATAGAG −3’
PDE5A_GAFa_2_Rv (配列番号13): 5’− CCCAGATCTCTGAGCATTGTGAAGAACAAT −3’
PDE5A_GAFa_3_Rv (配列番号14): 5’− AGATCTGATTAAGCTGGCAAGGTCAAGTAA −3’
PDE5A_GAFa_4_Rv (配列番号15): 5’− AGATCTCTTCTTCAGAATGACTTCCAGTGA −3’
PDE5A_GAFa_5_Rv (配列番号16): 5’− AGATCTGGTGCACTTCTGCACCTGCATGAA −3’
PDE5A_GAFa_6_Rv (配列番号17): 5’− AGATCTACAGTCTTCATCCACAATGAAGAT −3’
PDE5A_GAFa_7_Rv (配列番号18): 5’− AGATCTGGGTTTTCCTACTTCCTCACACTC −3’
【0063】
(手順2)
pGL4.10(プロメガ(株)製)を鋳型とするPCRによって、N末側ルシフェラーゼ遺伝子(NLuc)、C末側ルシフェラーゼ遺伝子(CLuc)、変異型N末側ルシフェラーゼ遺伝子(cpNLuc)および変異型C末側ルシフェラーゼ遺伝子(cpCLuc)を、以下の表1に示されるプライマーを使用して増幅した。これらの遺伝子の、ルシフェラーゼ(GL4.10)のアミノ酸配列中の対応する位置を表1に示す。
【0064】
【表1】

(手順3)
サイクリックGMP結合領域として使用するために、マウスのサイクリックGMP特異的ホスホジエステラーゼ5A(PDE5A)のcDNAを鋳型として種々の遺伝子をPCRによって増幅した。図16に、増幅した遺伝子の名称および使用したプライマーを示す。さらに、増幅した遺伝子の、PDE5Aのアミノ酸配列中の対応する位置、および当該遺伝子がコードする断片のアミノ酸残基の数を示す。なお、PDE5AにはサイクリックGMP結合ドメインがAとBの2ヶ所存在するが、そのうちAを含む領域を増幅した。
【0065】
(手順4)
次のようにして、2種の原核生物発現用プラスミドを作製した。手順2にて取得したNLuc遺伝子を原核生物発現用プラスミドであるpRSET2B(インビトロジェン社製)内のBamHI部位とXhoI部位の間に挿入した後、手順2にて取得したCLuc遺伝子をBglII部位とEcoRI部位の間に挿入し、原核生物発現用プラスミド(pRSET/GL4_N_C)を作製した。また、手順2にて取得したcpCLuc遺伝子を原核生物発現用プラスミドであるpRSET2B内のBamHI部位とXhoI部位の間に挿入した後、手順2にて取得したcpNLuc遺伝子をBglII部位とEcoRI部位の間に挿入し、原核生物発現用プラスミド(pRSET/cpGL4_C_N)を作製した。
【0066】
(手順5)
次のようにして、サイクリックGMPセンサータンパク質の発現プラスミドを作製した。手順3にて増幅した11種のPDE5A由来の遺伝子を、手順4にて作製した2種の発現用プラスミドのXhoI認識部位とBglII認識部位との間にそれぞれ挿入した。作製された22種の発現用プラスミドの名称は、図16の表中「得られるプラスミドの名称」の項目に示される。
【0067】
(手順6)
各種サイクリックGMPセンサータンパク質を大腸菌で発現させ、さらに精製した。
【0068】
手順5にて作製した各種発現プラスミドを、それぞれ大腸菌JM109(DE3)株にトランスフォームし、The QIAexpressionist(キアゲン社製)を用いて、キットのマニュアルに従ってサイクリックGMPセンサータンパク質を精製した。精製手順を簡略に説明すると、上記原核生物発現用プラスミドを大腸菌JM109(DE3)株にトランスフォームして、5mLのLB培地中に植菌した。一晩培養した後、遠心分離して集菌し、集菌した大腸菌を溶解バッファー(50mM NaH2PO4、300mM NaCl、10mM イミダゾール、pH8.0)500μLに再懸濁してリゾチームを添加し(1mg/mL)、4℃で60分間インキュベートした。細胞を、ボルテックスミキサー等を用いて静かに撹拌して溶解し、15,000xgで10分間遠心分離して上清を新しいチューブに移した。50% Ni−NTAレジン懸濁液 50μLを添加し、4℃で60分間静かに混合した。15,000xgで10秒間遠心分離してレジンを沈殿させ、レジンを洗浄バッファー(50mM NaH2PO4、300mM NaCl、20mM イミダゾール、pH8.0) 500μLで2回洗浄した。溶出バッファー(50mM NaH2PO4、300mM NaCl、250mM イミダゾール、pH8.0)50μLでタンパク質を2回溶出し、種々のサイクリックGMPセンサータンパク質を得た。得られた22種のサイクリックGMPセンサータンパク質は、図16の表中「得られえるサイクリックGMPセンサータンパク質の名称」の項目に示される。
【0069】
(手順7)
種々のサイクリックGMPセンサータンパク質の特性を測定した。
【0070】
手順6にて取得されたタンパク質の発光活性を、環状ヌクレオチドの非存在下、サイクリックGMP存在下、8−Br−cGMP存在下またはサイクリックAMP存在下でそれぞれ測定した。測定方法を簡単に説明すると、上述のタンパク質溶液20μLに、リン酸緩衝液(PBS)20μLを加えた。そこへ、4mMのサイクリックGMP、8−Br−cGMPまたはサイクリックAMP溶液を1μL加え(終濃度100μM)、またネガティブコントロールにはPBSを同量加えた。さらに、Bright−Glo(プロメガ社製)を40μL加えて、Luminescencer JNR−II(アトー社製)を使用して発光量(5秒間の積算)を測定した。
【0071】
(結果)
手順7による測定の結果を図6に示す。
サイクリックGMP存在下において、発光量が特に高かったのは、GL4_N_PDE5A_GAFa1_C、GL4_N_PDE5A_GAFa5_CおよびGL4_N_PDE5A_GAFa8_Cであった。これらに準じて、GL4_N_PDE5A_GAFa7_C、GL4_N_PDE5A_GAFa9_CおよびGL4_C_PDE5A_GAFa7_Nが一定の発光量を示した。
【0072】
さらに、これらのタンパク質(GL4_N_PDE5A_GAFa1_C、GL4_N_PDE5A_GAFa5_C、GL4_N_PDE5A_GAFa7_C、GL4_N_PDE5A_GAFa8_C、GL4_N_PDE5A_GAFa9_CおよびGL4_C_PDE5A_GAFa7_N)では、環状ヌクレオチド非存在下(コントロール)における発光量と、サイクリックGMP存在下における発光量とで明確な差が示された。
【0073】
[実施例2]
本発明に係る方法により、HEK293細胞中のサイクリックGMP濃度の変動を測定した。
【0074】
(手順1)
次のようにして、種々のサイクリックGMPセンサータンパク質についての動物細胞発現用プラスミドを作製した。
【0075】
実施例1の手順5にて作製した原核細胞発現用プラスミドから、制限酵素BamHIおよびEcoRIを使用して、サイクリックGMPセンサータンパク質をコードする領域を切り出し、それを動物細胞発現用プラスミドであるpcDNA3.1(インビトロジェン社製)のBamHI認識部位とEcoRI認識部位との間に挿入した。具体的に使用した原核細胞発現用プラスミドは、pRSET/GL4_N_GAFa1_C、pRSET/GL4_N_GAFa5_C、pRSET/GL4_N_GAFa7_C、およびpRSET/cpGL4_C_GAFa7_Nの4種であり、これらに基づいて、動物細胞発現用プラスミドであるpcDNA/GL4_N_GAFa1_C、pcDNA/GL4_N_GAFa5_C、pcDNA/GL4_N_GAFa7_C、およびpcDNA/cpGL4_C_GAFa7_Nを作製した。
【0076】
(手順2)
使用するHEK293細胞の培養は次のように行った。HEK293細胞をATCC社より入手し、5% CO2インキュベーター内で、10% Fetal Bovine Serum、および、1x Nonessential amino acidsを添加したEarle’s MEM/培地(GIBCO社製)で培養した。
【0077】
(手順3)
次のようにして、HEK293細胞に手順1で作製した動物細胞発現用プラスミドを導入した。細胞を直径35mmガラスボトムディッシュに、2x105/dishの細胞密度で播種し、5% CO2インキュベーター内で一晩培養し、それぞれの動物細胞発現用プラスミドを、FuGENE HD(ロシュ社製)を用いてトランスフェクションを行い、5% CO2インキュベーター内で一晩培養した。
【0078】
(手順4)
次のようにして、手順3で作製した細胞のタイムラプス撮影を行った。培地中にルシフェリン2mM(プロメガ社製)を添加して1時間静置し、発光顕微鏡LV(LUMINOVIEW)−200(オリンパス社製)にセットし、5秒間隔で発光画像のタイムラプス撮影を行った。発光観察条件として、対物レンズの倍率は40倍、露出時間は5〜10秒間、ビニングは1x1、EM−CCDカメラiXon(アンドール社製)を用い、画像解析装置110として構成したパーソナルコンピュータに取り込んだ。
【0079】
(手順5)
タイムラプス撮影中のHEK293細胞に刺激を与えた。タイムラプス撮影開始から2分後、培養液に8−Br−cGMP(最終濃度 100μM)を添加し、引き続き発光画像のタイムラプス撮影を行った。
【0080】
(手順6)
撮影した画像の発光強度の解析を行った。
手順4および5による一連のタイムラプス撮影によって得られた発光画像においてROI(Region of Interest:関心領域)を指定した。指定したROIにおける発光強度の経時変化をグラフに表示した。
【0081】
図7から9は、GL4_N_PDE5A_GAFa1_Cを発現させた細胞における測定結果である。図7には、刺激前における発光画像が示される。画像中1から4のROIが指定されている。一方、図8には、刺激後における、図7と同一の位置を撮影した発光画像が示される。図8においても、図7と同様にROIが指定されている。さらに、図9には、指定した各ROIの発光強度の経時変化がグラフとして示される。図7および8にて指定した1から4のROIは、図9のグラフ中の「cell1」から「cell4」にそれぞれ対応する。なお、発光画像の解析は、画像解析部112cとして機能するMetamorphソフトウェア(ユニバーサルイメージング社製)を用いて行った。
【0082】
一方、図10から12はGL4_N_PDE5A_GAFa7_Cを発現させた細胞における測定結果であり、図13から15はcpGL4_C_PDE5A_GAFa7_N発現させた細胞における測定結果である。図10および13には刺激前の発光画像が示され、図11および14には刺激後の発光画像が示され、図12および15には指定した各ROIの発光強度の経時変化のグラフが示される。
【0083】
(結果)
8−Br−cGMPは膜透過性サイクリックGMPアナログであり、細胞培養液にこれを添加することで細胞内部のサイクリックGMPが上昇することが予想される。GL4_N_GAFa1_C、GL4_N_GAFa7_CおよびcpGL4_C_GAFa7_Nをそれぞれ利用する本発明に係る方法により、当該予想を反映した結果が得られた。すなわち、8−Br−cGMPの添加後、発光量が増大した。本発明によれば、そのような結果を単一の細胞にて確認することができた。また、個々の細胞における発光強度の変化を見ると、8−Br−cGMP刺激において細胞間の応答に大きなばらつきのあることがわかった(図9、図12および図15参照)。
【0084】
これまでのサイクリックGMPを介する細胞内情報伝達機構の研究から、サイクリックGMP濃度変化の細胞内分布あるいは時間経過が異なると、シグナルの意味が異なることが明らかにされている。従来のルミノメーターを用いた発光量変化の解析では、細胞集団全体の観測に留まり、個々の細胞の応答までは解析できなかった。しかし、本発明に係る方法(装置としてLV−200を使用する)では、生体内の変化を1細胞毎にリアルタイムに観察することができ、細胞内シグナルの働きを詳細に研究することができた。
【0085】
以上、本実施例によれば、細胞内の情報伝達に影響を及ぼすことなく、各細胞からの正確な定量的結果を得ることができ、その結果、個々の細胞においてサイクリックGMP濃度の変化を再現性良く経時的に観察することができる。上述した実施例において使用するルシフェラーゼ遺伝子やルシフェリン等は、他の市販試薬であってもよいし、生物発光等を発生する生物から直接抽出等されたものであってもよい。
【0086】
[その他の実施例]
上記実施例に示される実施の形態のほかに、本発明は、特許請求の範囲に記載した技術的思想の範囲内において種々の異なる実施の形態にて実施することができる。
【0087】
例えば、上述した実施の形態においては、主に、互いに結合することにより発光酵素活性が回復するよう分割させたN末側発光酵素とC末側発光酵素、および、PDE5AのサイクリックGMP結合ドメインからなる融合タンパク質をサイクリックGMPセンサータンパク質として使用するとしたが、これに限らず、特表2009−532063号公報等に開示されているサイクリックGMPセンサータンパク質を用いてもよい。
【0088】
また、上述した記載によれば、以下の要旨に表現されるポリペプチドの態様も本発明に包含される。
【0089】
[ポリペプチド態様1](機能:スプリットルシフェラーゼの相互作用)
発光酵素のN末端側断片、発光酵素のC末端側断片、および、サイクリックGMP結合タンパク質のアミノ酸配列を含むポリペプチドであって、前記N末端側断片およびC末端側断片は非共有結合的に相互作用し、前記非共有結合的相互作用は調整可能であることを特徴とするポリペプチド。
[ポリペプチド態様2](機能:サイクリックGMP結合タンパク質の作用)
前記サイクリックGMP結合タンパク質が前記非共有結合的相互作用を検出可能に変化させることを特徴とする前記態様1に記載のポリペプチド。
[ポリペプチド態様3](機能:外因性因子の作用)
前記非共有結合的相互作用は外因性因子の存在下で強化されること、を特徴とする前記態様1に記載のポリペプチド。
[ポリペプチド態様4](機能:サイクリックGMPの作用)
前記外因性因子はサイクリックGMPであること、を特徴とする前記態様2に記載のポリペプチド。
[ポリペプチド態様5](機能:発光)
前記態様3に記載のポリペプチドであって、前記非共有的相互作用により発光することを特徴とするポリペプチド。
【産業上の利用可能性】
【0090】
以上詳述に説明したように、本発明にかかるサイクリックGMP解析方法は、バイオ、製薬、医療など様々な分野で好適に用いることができる。
【符号の説明】
【0091】
100 発光観察システム
103 容器(シャーレ)
104 ステージ
106 発光画像撮像ユニット
106a 対物レンズ(発光観察用)
106b ダイクロイックミラー
106c CCDカメラ
106d スプリットイメージユニット
106e フィルターホイール
106f 結像レンズ
110 画像解析装置
112 制御部
112a 発光画像撮像指示部
112b 発光画像取得部
112c 画像解析部
112d 解析結果出力部
114 クロック発生部
116 記憶部
118 通信インターフェース部
120 入出力インターフェース部
122 入力装置
124 出力装置
【技術分野】
【0001】
本発明は、サイクリックGMP解析方法および当該方法に使用されるタンパク質に関する。
【背景技術】
【0002】
多くのホルモンや神経伝達物質はGタンパク質共役型受容体に働き、細胞内セカンドメッセンジャーを介して様々な細胞活動を引き起こしている。また、細胞活動の多様性は、細胞内のセカンドメッセンジャーの時間的および空間的な濃度分布によって制御されている。したがって、特定の細胞活動に関する細胞内情報伝達を解析するにあたって、セカンドメッセンジャーの時空間的な変化をリアルタイムに捉えることが必要である。
【0003】
細胞内セカンドメッセンジャーの1つである環状グアノシン一リン酸(サイクリックGMP)は、生体内において各種生化学反応過程のシグナル伝達分子として作用している。これまでに、循環器系筋細胞の弛緩、網膜における光受容−伝達、上皮における電解質運搬、骨の成長、ニューロンの活性化等の様々な生理的プロセスがサイクリックGMPによって制御されていることが明らかになっている。したがって、生細胞中でのサイクリックGMPの合成、分解、局在等がわかれば、細胞および組織レベルでの循環器系、腎臓、網膜、嗅覚、中枢神経等の作用機構が解明されるだけでなく、細胞内のサイクリックGMP濃度を調節する薬剤に関する知見を得ることが可能になると期待される。
【0004】
従来、サイクリックGMPの測定は、放射線ラベルした化合物を使用し、多数の細胞に対して行われている。また、近年、いくつかのサイクリックGMPバイオセンサーが見出され、細胞レベルでのサイクリックGMPの測定が可能になっている。
【0005】
例えば、特許文献1および非特許文献1には、シアン色蛍光タンパク質(ECFP)と黄色蛍光タンパク質(EYFP)との蛍光共鳴エネルギー移動(FRET)を利用し、サイクリックGMP依存性タンパク質キナーゼ(PKG)Iα遺伝子と蛍光タンパク質遺伝子とを融合した遺伝子を用いてイメージングするサイクリックGMP解析方法が開示されている。具体的には、PKGIα遺伝子配列の両端にYFPおよびCFPの配列を融合して細胞内で発現させている。通常の状態では、CFPを励起してもFRETが起こらないためYFPの蛍光は観察されない。一方、細胞内のサイクリックGMPが増加するとPKGIαの立体構造が変化し、FRETが起こるためアクセプターであるYFPの蛍光が観察される。このFRETシグナルを観察することで、サイクリックGMPの濃度変化を観察できることが明らかにされている。
【0006】
また、特許文献2には、ある種のCNGチャネルおよびカルシウム感受性発光タンパク質を利用する、細胞内の環状ヌクレオチドであるサイクリックGMPおよびサイクリックAMP濃度を定量解析する方法が開示されている。この方法では、細胞内に、環状ヌクレオチドにより活性化される特定のイオンチャネル(CNGチャネル)およびカルシウム感受性発光タンパク質を発現させている。このとき細胞内のサイクリックGMPまたはサイクリックAMPが増加すると、CNGチャネルが開口し、それによりカルシウムイオンが流入する。流入したカルシウムは、Fura−2もしくはFlou−3等のカルシウム感受性発光インジケーター、またはエクオリンもしくはオベリンといったカルシウム感受性発光タンパク質により検出できることが明らかにされている。
【0007】
また、非特許文献2には、青色発光タンパク質と緑色蛍光タンパク質(EGFP)との発光共鳴エネルギー移動(BRET)を利用する、サイクリックGMP特異的ホスホジエステラーゼ5A(PDE5A)のサイクリックGMP結合ドメイン遺伝子に発光タンパク質遺伝子および蛍光タンパク質遺伝子を融合して観察するサイクリックGMP解析方法が開示されている。PDE5AのサイクリックGMP結合ドメイン遺伝子、青色発光タンパク質であるレニラルシフェラーゼ遺伝子およびEGFP遺伝子を融合したタンパク質を発現させた細胞に対し、ルシフェラーゼの基質となるセレンテラジンを添加すると青色の発光が観察されている。この細胞において細胞内サイクリックGMPが増加すると、サイクリックGMP結合ドメインの立体構造が変化してルシフェラーゼの発光からEGFPの蛍光へ発光−蛍光共鳴エネルギーシフト(BRET)が起こり、EGFPの蛍光が検出される。このBRETシグナルを検出することで、サイクリックGMPの濃度変化を検出できることが明らかにされている。
【0008】
また、特許文献3には、ヒトサイクリックGMP活性化プロテインキナーゼ由来Bドメイン(GKI−B)またはヒトホスホジエステラーゼ2A(PDE2A)のサイクリックGMP結合ドメインと円順列置換したホタルルシフェラーゼとを融合したタンパク質を利用して細胞内のサイクリックGMP濃度を定量解析する方法が開示されている。この方法では、GKI−BまたはPDE2AのサイクリックGMP結合ドメイン遺伝子と円順列置換したホタルルシフェラーゼ遺伝子とを融合したタンパク質を発現させた細胞に、ルシフェラーゼの基質となるルシフェリンを添加し、細胞からの発光を計測している。細胞内のサイクリックGMPが増加すると、サイクリックGMP結合ドメインの立体構造が変化してルシフェラーゼの発光が消失または増強する。この発光シグナルを検出することで、サイクリックGMPの濃度変化を検出できることが明らかにされている。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】特許第3643520号公報
【特許文献2】特表2006−520203号
【特許文献3】特表2009−532063号
【非特許文献】
【0010】
【非特許文献1】Honda A, Adams SR, Sawyer CL, Lev−Ram V, Tsien RY, Dostmann WRG. “Spatiotemporal dynamics of guanosine 3’,5’−cyclic monophosphate revealed by a genetically encoded, fluorescent indicator.” Proceedings of the National Academy of Sciences of United States of America, vol.98, no.5, pp.2437−2442, 2001
【非特許文献2】Biswas KH, Sopory S, Visweswariah SS. “The GAF domain of the cGMP−binding, cGMP−specific phosphodiesterase (PDE5) is a sensor and a sink for cGMP.” Biochemistry, Vol.47, pp.3534−3543, 2008
【発明の概要】
【発明が解決しようとする課題】
【0011】
特許文献1または非特許文献1に開示されるようなPKG酵素を利用する方法では、レポーターのサイクリックGMP結合部位にPKGの全長または酵素ドメインが含まれるため、レポーターがリン酸化酵素活性を有し、細胞内の情報伝達に影響を及ぼすという問題があった。また、蛍光タンパク質を用いるため、その影響で細胞内に存在する不特定のタンパク質が励起され蛍光を生じ(自己蛍光)、シグナル/ノイズ比を下げるという問題があった。さらに、ダイナミックレンジが狭いことにより、利用可能な測定対象の範囲が狭いという問題があった。
【0012】
特許文献2に開示されるようなCNGチャネルおよびカルシウム感受性発光タンパク質を利用する方法では、2種類以上の遺伝子を同時に導入することが必要となり、細胞内への導入および発現効率が低いという問題があった。また、当該方法では、細胞内にカルシウムイオンが流入するため、細胞内の情報伝達に影響を及ぼし、細胞の本来の状態を測定できない可能性があるという問題があった。
【0013】
非特許文献2に開示されるような発光タンパク質と蛍光タンパク質とのBRETを用いる方法では、ルミノメーターまたはフォトンカウンティングでのみ測定が行われるため、単一の細胞における測定は最適化されておらず又は不可能であり、利用可能な測定方法の範囲が狭いという問題があった。特に、BRETの変換効率が低くシグナルが小さくなるため、イメージングに使用できる程度のシグナル/ノイズ比が得られない。
【0014】
特許文献3に開示されるような円順列置換ルシフェラーゼとGKI−BまたはPDE2AのサイクリックGMP結合ドメインとの融合タンパク質を用いる方法では、ルミノメーターまたはフォトンカウンティングでのみ測定が行われるため、単一の細胞における測定は最適化されておらず又は不可能であり、利用可能な測定方法の範囲が狭いという問題があった。特に、当該融合タンパク質からの発光量が小さいため、イメージングに使用できる程度のシグナル/ノイズ比が得られない。
【0015】
本発明は、上述のような従来技術が抱える数々の問題に鑑みてなされたものであり、細胞本来の状態を正確に定量できるサイクリックGMP解析方法を提供することを目的とする。特に、細胞内の情報伝達に影響を及ぼすことなく、各細胞からの正確な定量的結果を得ることができ、その結果、個々の細胞においてサイクリックGMP濃度の変化を再現性良く経時的に観察することができるサイクリックGMP解析方法を提供することを目的とする。
【課題を解決するための手段】
【0016】
本発明の一実施態様によれば、発光酵素のN末端側断片、前記発光酵素のC末端側断片およびサイクリックGMP結合領域を含むサイクリックGMPセンサータンパク質であって、前記サイクリックGMP結合領域は前記N末端側断片と前記C末端側断片との間に配置されたサイクリックGMPセンサータンパク質を含む細胞を作製する細胞作製工程と、前記細胞作製工程で作製した前記細胞に当該細胞外から所定の発光基質を添加する添加工程と、前記添加工程で前記所定の発光基質が与えられた前記細胞の発光画像を撮像する撮像工程と、前記撮像工程で撮像した前記発光画像に基づいて、前記細胞内における前記サイクリックGMPの濃度を解析する解析工程とを含む細胞内サイクリックGMP解析方法が提供される。
【0017】
また、本発明の一実施態様に因れば、発光酵素のN末端側断片、前記発光酵素のC末端側断片およびサイクリックGMP結合領域を含むサイクリックGMPセンサータンパク質であって、前記サイクリックGMP結合領域は前記N末端側断片と前記C末端側断片との間に配置されたサイクリックGMPセンサータンパク質が提供される。
【発明の効果】
【0018】
本発明によれば、細胞内のサイクリックGMPに関する情報を正確且つ定量的に個々の細胞から得ることができ、その結果、個々の細胞において細胞内のサイクリックGMP濃度を再現性良く観察することができる。
【図面の簡単な説明】
【0019】
【図1】発光観察システム100の全体構成の一例を示す図である。
【図2】発光観察システム100の発光画像撮像ユニット106の構成の一例を示す図である。
【図3】発光観察システム100の発光画像撮像ユニット106の構成の一例を示す図である。
【図4】発光観察システム100の画像解析装置110の構成の一例を示すブロック図である。
【図5】スプリットルシフェラーゼアッセイ法を用いたcGMPの検出原理を示す図である。
【図6】種々のサイクリックGMPセンサータンパク質について、ルミノメーターによって測定した発光量を示すグラフ図である。
【図7】GL4_N_PDE5A_GAFa1_Cを導入したHEK293細胞において、8−Br−cGMP刺激前の発光画像を示す図である。
【図8】GL4_N_PDE5A_GAFa1_Cを導入したHEK293細胞において、8−Br−cGMP刺激5分後の発光画像を示す図である。
【図9】選択した細胞での8−Br−cGMP刺激によるGL4_N_PDE5A_GAFa1_Cの発光強度の経時変化を示した図である。
【図10】GL4_N_PDE5A_GAFa7_Cを導入したHEK293細胞において、8−Br−cGMP刺激前の発光画像を示す図である。
【図11】GL4_N_PDE5A_GAFa7_Cを導入したHEK293細胞において、8−Br−cGMP刺激5分後の発光画像を示す図である。
【図12】選択した細胞での8−Br−cGMP刺激によるGL4_N_PDE5A_GAFa7_Cの発光強度の経時変化を示した図である。
【図13】cpGL4_C_PDE5A_GAFa7_Nを導入したHEK293細胞において、8−Br−cGMP刺激前の発光画像を示す図である。
【図14】cpGL4_C_PDE5A_GAFa7_Nを導入したHEK293細胞において、8−Br−cGMP刺激5分後の発光画像を示す図である。
【図15】選択した細胞での8−Br−cGMP刺激によるcpGL4_C_PDE5A_GAFa7_Nの発光強度の経時変化を示した図である。
【図16】種々のサイクリックGMPセンサータンパク質の作製を示す図である。
【発明を実施するための形態】
【0020】
[方法]
以下に、本発明に係る方法について説明する。
本発明は、発光酵素のN末端側断片、前記発光酵素のC末端側断片およびサイクリックGMP結合領域を含むサイクリックGMPセンサータンパク質であって、前記サイクリックGMP結合領域は前記N末端側断片と前記C末端側断片との間に配置されたサイクリックGMPセンサータンパク質を含む細胞を作製する細胞作製工程と、前記細胞作製工程で作製した前記細胞に当該細胞外から所定の発光基質を添加する添加工程と、前記添加工程で前記所定の発光基質が与えられた前記細胞の発光画像を撮像する撮像工程と、前記撮像工程で撮像した前記発光画像に基づいて、前記細胞内における前記サイクリックGMPの濃度を解析する解析工程とを含む細胞内サイクリックGMP解析方法に関する。
【0021】
簡潔には、本発明は、対象とする細胞にサイクリックGMPセンサータンパク質を導入し、発光基質を与えて発光を誘導し、その様子を撮像し、撮像した画像に基づいてcGMP濃度を特定等する方法に関する。
【0022】
本発明によれば、細胞内のサイクリックGMPの状態を解析することができる。特に、細胞内のサイクリックGMP濃度を定量的に測定することが可能である。また、測定はイメージングによって行うことができるため、細胞ごとに測定が可能であり、さらには細胞内の細胞小器官等の構造に絞って測定することもできる。さらに、一定間隔で同一の測定領域を測定することで、サイクリックGMP濃度の刺激に対する変化および時間的変化を解析することができる。細胞ごとに測定することで、細胞間の差異を解析することもできる。
【0023】
細胞作製工程では、サイクリックGMPセンサータンパク質を含む細胞が作製される。サイクリックGMPセンサータンパク質とは、発光酵素の2つのポリペプチド断片と、サイクリックGMPに結合できるポリペプチド断片と、任意にその他のポリペプチド断片とが融合したタンパク質であって、サイクリックGMPの存在に応じて当該発光酵素の活性が消失または回復するタンパク質である。サイクリックGMPセンサータンパク質の詳細については後述する。対象となる細胞の種類に限定はなく、細菌細胞、酵母細胞、植物細胞および動物細胞等を使用できる。動物細胞が使用される場合、特に哺乳細胞が使用され、例えばマウスの細胞、サルの細胞およびヒトの細胞が使用される。細胞は、生体組織の一部として培養された細胞集合体であってもよいし、生体組織が属している臓器等や生命個体の形態でもよい。細胞に対してサイクリックGMPセンサータンパク質を導入する方法に特別な限定はなく、既知の導入方法が使用できる。1つの方法は、当該タンパク質をコードする塩基配列を含む核酸を細胞に導入し、その後細胞内で当該タンパク質を発現させる方法である。例えば、当該核酸を含む発現ベクターを、リン酸カルシウム法、リポフェクション法またはエレクトロポレーション法等によって細胞内に導入し、発現ベクターから当該タンパク質を発現させることができる。ベクターから発現させるのではなく、当該核酸がゲノムに組み込まれた細胞を作製した後、ゲノムから当該タンパク質を発現させることもできる。別の方法は、細胞外で精製した当該タンパク質を細胞内に直接導入する方法である。例えば、マイクロインジェクション法によって当該タンパク質を細胞内に直接注入することができる。または、当該タンパク質を含む培養液にて細胞をインキュベートさせて、エンドサイトーシスによって当該タンパク質を細胞に取り込ませることができる。
【0024】
添加工程では、細胞作製工程にて作製された細胞に対し発光基質が添加される。本発明に係る方法は発光酵素による発光反応を利用するが、この発光反応を生じさせるためには発光基質が必要となる。発光基質は使用する発光酵素に応じて選択される。発光基質の詳細は後述する。発光基質を添加する方法に特別限定はなく、適宜選択できる。例えば、培養液に添加することで、培養液を介して細胞に発光酵素を取り込ませることができる。また、マイクロインジェクション法によって、発光基質を細胞内に直接注入することもできる。発光基質の添加のタイミングも適宜選択できる。例えば、細胞へのサイクリックGMPセンサータンパク質の導入の前に、それと同時に、またはその後に発光基質を添加することができる。例えば、一連の操作を通して、細胞を取り扱うための培養液中に発光基質を含めておくことができる。または、マイクロインジェクションにて当該タンパク質および発光基質を同時に細胞に注入することができる。好ましくは、発光基質は測定の直前に添加される。発光基質の添加量に特別な限定はないが、好ましくは、発光酵素が発光反応を生じるために十分な量で添加される。
【0025】
撮像工程では、発光反応が生じている細胞の画像が取得される。撮像は任意のタイミングで行うことができるが、好ましくは、基質添加から一定時間後に行われる。特に複数の測定を繰り返す場合、測定結果のばらつきを抑えるために、複数の測定を通じて同一のタイミングで撮像することが好ましい。撮像時間は条件に応じて最良の時間が適宜選択される。発光強度が小さい場合、撮像時間(顕微鏡を使用する場合、露出時間)は長くされ、逆に発光強度が大きすぎる場合、撮像時間は短くされる。例えば、5から10秒間の露出時間とすることができる。撮像は、発光反応に係る波長の光のみを取得して行うこともできるが、それと同時に明視野画像または別の波長の光による画像を取得してもよい。例えば、細胞にサイクリックGMPセンサータンパク質と同時にプローブ(例えば蛍光または発光タンパク質)を融合した特定のタンパク質を導入し、サイクリックGMPセンサータンパク質に由来する光と同時に、当該特定のタンパク質からの光を検出してもよい。なお、撮像に使用される装置については後述する。
【0026】
解析工程では、取得された画像に基づいて、細胞内のサイクリックGMP濃度等の解析が行われる。解析は、コンピュータにて機能するソフトウェアを使用して、発光量を数値に変換してもよい。当該数値を利用して、スタンダードとの比の算出、試料間の比較等が適宜行われる。このような処理によって、細胞内のサイクリックGMP濃度が特定される。また、濃度の特定とは、詳細な数値の特定でなくとも、サイクリックGMPが試料中に存在するか否かの特定、または設定した濃度範囲にあるかどうか等の大まかな特定であってもよい。なお、解析に使用される装置については後述する。
【0027】
また、本発明は、撮像工程が発光画像を繰り返し撮像することを含む上記の細胞内サイクリックGMP解析方法に関する。当該方法では、一定の間隔で撮像を繰り返し、または特定の時間に撮像が行われる。このように経時的に撮像されることで、タイムラプスによる観察または動画による観察が可能となる。撮像の都度、発光基質を添加してもよい。当該方法によって、同一細胞における時空間的な測定ができる。すなわち、時間に応じた又は刺激に応じたサイクリックGMP濃度の変化を測定することができる。また、明視野画像を同時に取得することで、サイクリックGMPの濃度変化と細胞の形態変化等との関係を知ることが出来る。また、プローブを付したタンパク質を発現させ、当該プローブの様子を同時に観察することで、当該タンパク質とサイクリックGMPとの関連性を知ることができる。
【0028】
また、本発明は、撮像工程が複数の異なる細胞に対して同時に行われ、且つ解析工程が細胞ごとに行われる細胞内サイクリックGMP解析方法に関する。当該方法では、一度の撮像において、複数の異なる細胞の画像が取得される。さらに、その後の解析が各々の細胞に対して行われる。撮像した1つの画像に含まれる複数の細胞について細胞ごとの解析を行うことが可能であり、または、撮像した複数の画像にそれぞれ含まれる複数の細胞について細胞ごとの解析を行うことが可能である。また、撮像を上述のような経時的な撮像にすることもできる。これらのような方法によって、個々の細胞におけるサイクリックGMP濃度変化を時空間的に解析できる。例えば、同一条件下におかれた細胞同士のサイクリックGMP濃度の比較に使用することができる。
【0029】
[サイクリックGMPセンサータンパク質]
次に、本発明に係るサイクリックGMPセンサータンパク質について説明する。本発明は、サイクリックGMPセンサータンパク質を利用する上記方法に関し、またサイクリックGMPセンサータンパク質自体に関する。
【0030】
本発明に係るサイクリックGMPセンサータンパク質は、発光酵素のN末端側断片、発光酵素のC末端側断片およびサイクリックGMP結合領域を含み、且つ、サイクリックGMP結合領域はN末端側断片とC末端側断片との間に配置されている。当該タンパク質は、サイクリックGMPの存在に応じて当該発光酵素の活性が消失または回復する。
【0031】
また、本発明に係るサイクリックGMPセンサータンパク質においては、サイクリックGMP結合領域をサイクリックGMP特異的ホスホジエステラーゼ由来のものとすることができる。これによって、サイクリックGMPセンサータンパク質はサイクリックGMP依存的に結合できる。
【0032】
サイクリックGMP特異的ホスホジエステラーゼとは、サイクリックGMPのホスホジエステル結合を加水分解してGMPを作り出す反応を促進する酵素である。この例として、ホスホジエステラーゼ5A(PDE5A)が存在する。サイクリックGMP特異的ホスホジエステラーゼは、サイクリックGMPと結合できる部位を2つ有しており、当該部位をサイクリックGMP結合領域として利用することができる。サイクリックGMP特異的ホスホジエステラーゼの由来となる生物種には、当該ホスホジエステラーゼがサイクリックGMP結合領域を有していれば特別限定はないが、哺乳類に由来する当該ホスホジエステラーゼ、特にヒトまたはマウスに由来する当該ホスホジエステラーゼが好ましい。
【0033】
サイクリックGMP結合領域は、マウスサイクリックGMP特異的ホスホジエステラーゼ5A中の特定の領域であってよい。当該「特定の領域」のアミノ酸配列における開始位置は、121番目、131番目または155番目のアミノ酸であってよく、終了位置は、308番目、320番目、330番目、343番目、358番目、366番目または384番目のアミノ酸であってよい。
【0034】
特に、本発明に係るサイクリックGMPセンサータンパク質において、サイクリックGMP結合領域が、マウスサイクリックGMP特異的ホスホジエステラーゼ5Aのアミノ酸番号121番目から330番目、131番目から320番目、131番目から330番目、131番目から343番目、または131番目から358番目のアミノ酸配列を含んでいてよい。これによって、哺乳類細胞においてルシフェラーゼ活性を高く保ちつつ、サイクリックGMP依存的に結合するという効果が得られる。
【0035】
また、サイクリックGMP結合領域の長さに関して、そのアミノ酸残基の数を、150から260としてよい。さらに、アミノ酸残基の数を190から230としてよい。特に、アミノ酸残基の数は、190、200、210、213または228であることが好ましい。
【0036】
なお、サイクリックGMP結合領域としては、好ましくは配列番号20、24、26、27または28に示されるアミノ酸配列を含むポリペプチドを使用できる。
【0037】
配列番号19には、マウス由来のサイクリックGMP特異的ホスホジエステラーゼ5A(PDE5A)のアミノ酸配列が示される。また、配列番号20から30には、当該マウス由来PDE5Aのポリペプチド断片のアミノ酸配列が示されており、それぞれ順に、PDE5A_GAFa1、PDE5A_GAFa2、PDE5A_GAFa3、PDE5A_GAFa4、PDE5A_GAFa5、PDE5A_GAFa6、PDE5A_GAFa7、PDE5A_GAFa8、PDE5A_GAFa9、PDE5A_GAFa10およびPDE5A_GAFa11と称されるポリペプチド断片のアミノ酸配列に対応する。
【0038】
本願において、発光酵素とは発光を伴う反応を触媒する酵素を意味する。発光酵素としてはルシフェラーゼを使用できる。ルシフェラーゼとしては、ホタル由来のもの、ウミシイタケ由来のものおよびバクテリア由来のもの等を使用できるが、特にホタル由来ルシフェラーゼを使用することが好ましい。また、発光基質は発光酵素に応じて選択されるが、ルシフェラーゼを発光酵素として使用する場合、発光基質としてはルシフェリンを使用することができる。
【0039】
サイクリックGMPセンサータンパク質に含まれる発光酵素は、当該タンパク質において、N末端側断片とC末端側断片として含まれている。「N末端側断片」とは、C末端から複数のアミノ酸が欠失した発光酵素の断片であって、発光酵素活性を失った断片を意味する。「C末端側断片」とは、N末端から複数のアミノ酸が欠失した発光酵素の断片であって、発光酵素活性を失った断片を意味する。N末端側断片とC末端側断片との間にサイクリックGMP結合領域が配置されており、その条件を満たせば、発光酵素のN末端側断片およびC末端側断片のサイクリックGMPセンタータンパク質内における配置に限定はない。すなわち、サイクリックGMPセンサータンパク質のN末端側に発光酵素のN末端側断片が配置され、サイクリックGMPセンサータンパク質のC末端側に発光酵素のC末端側断片が配置されたものを使用できる(図5a)。または、サイクリックGMPセンサータンパク質のN末端側に発光酵素のC末端側断片が配置され、サイクリックGMPセンサータンパク質のC末端側に発光酵素のN末端側断片が配置されたものを使用できる(図5b)。なお、後者のサイクリックGMPセンサータンパク質には「変異型」または「cp(circular permutaion)」といった用語が付され、前者のものと適宜区別される。
【0040】
サイクリックGMPセンサータンパク質において、発光酵素の断片は、それぞれ単独では全長の配列を有していないため通常の環境下(例えばサイクリックGMPが存在していない環境下)で活性が失われているが、特定の環境下(例えばサイクリックGMPが存在する環境下)で活性を回復する。例えば、サイクリックGMP結合領域にサイクリックGMPが結合し、サイクリックGMP結合領域の構造が変化する結果、離れていたN末端側断片とC末端側断片とが結合することで、本来の発光酵素の活性が回復する。この「結合」の態様に限定はなく、共有結合または非共有結合等の化学的結合であってもよいが、N末端側断片とC末端側断片とがルシフェラーゼの本来の機能を果たしうる程度に「接近」または「接触」している状態であることが好ましい。あるいは、N末端側断片とC末端側断片とが「会合」する状態であってもよい。すなわち、当該表現において使用される「結合」という用語は、「接近」、「接触」または「会合」という意味を含む。
【0041】
発光酵素が、その中のどの位置で分割されているかに限定はないが、発光酵素としてルシフェラーゼを使用する場合、N末端側断片はルシフェラーゼの1番目から400番目のアミノ酸を含み、C末端側断片はルシフェラーゼの401番目から550番目のアミノ酸を含むことが好ましい。また、N末端側断片はルシフェラーゼの1番目から416番目のアミノ酸を含み、C末端側断片はルシフェラーゼの399番目から550番目のアミノ酸を含む場合のように、N末端側断片およびC末端側断片は、それらの一部の配列が重複していてもよい。
【0042】
特に、本発明に係るサイクリックGMPセンサータンパク質において、発光酵素がホタルルシフェラーゼであり、N末端側断片がホタルルシフェラーゼのアミノ酸番号1番目から416番目のアミノ酸配列を含み、C末端側断片がホタルルシフェラーゼのアミノ酸番号399番目から550番目のアミノ酸配列を含むことが好ましい。これによって、発光酵素のN末断片とC末側断片とが再会合した時にだけ発光するので、シグナル/ノイズ比が大きいという効果が得られる。
【0043】
さらに、本発明に係るサイクリックGMPセンサータンパク質は、配列番号31、35、37、48、38または39に示されるアミノ酸配列を含むサイクリックGMPセンサータンパク質であってよい。これらの配列は、それぞれ、後述するサイクリックGMPセンサータンパク質GL4_N_PDE5A_GAFa1_C、GL4_N_PDE5A_GAFa5_C、GL4_N_PDE5A_GAFa7_C、cpGL4_C_PDE5A_GAFa7_N、GL4_N_PDE5A_GAFa8_CおよびGL4_N_PDE5A_GAFa9_Cのアミノ酸配列である。
【0044】
上述のとおり、本発明に係るサイクリックGMPセンサータンパク質は、サイクリックGMPの存在に応じて、発光酵素の活性が消失または回復する。また、本発明に係る方法は、当該タンパク質のこのような特徴を利用する。従来の分子間のエネルギー共鳴(FRET、BRET等)を利用する技術では、エネルギー共鳴の効率の低さに起因して発光量が少なく、また、検出される波長の違いによってサイクリックGMPの存在/非存在が解析される。これに対し、本発明では、ルシフェラーゼといった発光酵素による単純な反応を利用するため発光量は大きく、イメージングも可能となり、また、サイクリックGMPの存在/非存在は発光の発生/非発生に対応するため、シグナル/ノイズ比の高い検出結果が得られる。
【0045】
[核酸]
次に、本発明に係るサイクリックGMPセンサータンパク質をコードする遺伝子を含む核酸に関して説明する。
【0046】
当該核酸は、本発明に係るサイクリックGMPセンサータンパク質をコードする遺伝子を含む。特に、そのような遺伝子のORF領域を含む。この遺伝子のコドンは、対象とする細胞における発現に最適化されていてよい。また、Kozak配列等、発現量を上昇させるための配列を含んでよく、または付与されていてよい。
【0047】
また、本発明は上記核酸を含むベクターに関する。当該ベクターは、対象とする細胞における発現のための発現ベクターであってよい。発現ベクターである場合、サイクリックGMPセンサータンパク質をコードする遺伝子の配列のほかに、発現を制御するための配列、マーカー遺伝子の配列等、一般的な発現ベクターに含まれる配列を含んでよい。本発明に係る細胞内サイクリックGMP解析方法の細胞作製工程において、当該発現ベクターを使用することができる。すなわち、当該発現ベクターを細胞に導入し、サイクリックGMPセンサータンパク質を発現させて、サイクリックGMPの検出に使用できる。
【0048】
[装置]
次に、本発明に係るサイクリックGMP解析方法(特に撮像工程および解析工程)にて使用される発光観察システム100について、図1から3を用いて説明する。図1は、発光観察システム100の全体構成の一例を示す図である。図2は、発光観察システム100の発光画像撮像ユニット106の構成の一例を示す図である。図3は、発光観察システム100の発光画像撮像ユニット106の構成の一例を示す図である。
【0049】
まず、図1に示すように、発光観察システム100は、細胞102を収納した容器103(具体的にはシャーレ、スライドガラス、マイクロプレート、ゲル支持体、微粒子担体など)と、容器103を配置するステージ104と、発光画像撮像ユニット106と、画像解析装置110と、で構成されている。微弱な発光を測定するための発光画像撮像ユニット106をステージ104の下側に配置してもよい。これにより、カバー開閉によるサンプル上方からの外乱光を完全に遮断できて発光画像のS/N比を増すことができる。発光画像撮像ユニット106は、レーザー走査式の光学系であってもよい。
【0050】
ここで、細胞102は、例えば、サイクリックGMP濃度に依存して発光するよう発光標識された生きた細胞である。また、サイクリックGMP濃度に依存して発光するタンパク質として、N末側発光酵素とC末側発光酵素との間にサイクリックGMP結合タンパク質を挿入した融合タンパク質の他に、例えば、特表2009−532063号公報に開示されている融合タンパク質を用いてもよい。また、ここで、細胞102に、上記融合タンパク質が発現されるよう構成した、当該融合タンパク質をコードするポリヌクレオチドを含む発現ベクターを導入することにより、融合タンパク質が細胞102内で発現されるよう構成してもよい。なお、細胞102には、添加工程において、当該細胞外から所定の発光基質(例えばルシフェリンなど)および所定の刺激(例えば薬物刺激など)が与えられる。
【0051】
また、発光画像撮像ユニット106は、具体的には、正立型の発光顕微鏡であり、細胞102の発光画像を撮像する。発光画像撮像ユニット106は、図示の如く、対物レンズ106aと、ダイクロイックミラー106bと、CCDカメラ106cと、結像レンズ106fと、で構成されている。対物レンズ106aは、具体的には、(開口数/倍率)2の値が0.01以上のものである。ダイクロイックミラー106bは、細胞102から発せられた発光を色別に分離し、2色の発光を用いて発光量や発光強度を色別に測定する場合に用いる。CCDカメラ106cは、対物レンズ106a、ダイクロイックミラー106bおよび結像レンズ106fを介して当該CCDカメラ106cのチップ面に投影された細胞102の発光画像および明視野画像を撮る。また、CCDカメラ106cは、画像解析装置110と有線または無線で通信可能に接続される。ここで、細胞102が撮像範囲中に複数存在する場合、CCDカメラ106cは、当該撮像範囲中に含まれる複数の細胞102の発光画像および明視野画像を撮像してもよい。結像レンズ106fは、対物レンズ106aおよびダイクロイックミラー106bを介して当該結像レンズ106fに入射した像(具体的には細胞102を含む像)を結像する。なお、図1では、ダイクロイックミラー106bで分離した2つの発光に対応する発光画像を2台のCCDカメラ106cで別々に撮像する場合の一例を示しており、1つの発光を用いる場合には、発光画像撮像ユニット106は、対物レンズ106a、1台のCCDカメラ106cおよび結像レンズ106fで構成されてもよい。
【0052】
ここで、2色の発光を用いて発光量や発光強度を色別に測定する場合、発光画像撮像ユニット106は、図2に示すように、対物レンズ106aと、CCDカメラ106cと、スプリットイメージユニット106dと、結像レンズ106fと、で構成されてもよい。そして、CCDカメラ106cは、スプリットイメージユニット106dおよび結像レンズ106fを介して当該CCDカメラ106cのチップ面に投影された細胞102の発光画像(スプリットイメージ)および明視野画像を撮像してもよい。スプリットイメージユニット106dは、細胞102から発せられた発光を色別に分離し、ダイクロイックミラー106bと同様、2色の発光を用いて発光量や発光強度を色別に測定する場合に用いる。
【0053】
また、複数色の発光を用いて発光量や発光強度を色別に測定する場合(つまり、多色の発光を用いる場合)、発光画像撮像ユニット106は、図3に示すように、対物レンズ106aと、CCDカメラ106cと、フィルターホイール106eと、結像レンズ106fと、で構成されてもよい。そして、CCDカメラ106cは、フィルターホイール106eおよび結像レンズ106fを介して当該CCDカメラ106cのチップ面に投影された細胞102の発光画像および明視野画像を撮像してもよい。フィルターホイール106eは、細胞102から発せられた発光をフィルタ交換によって色別に分離し、複数色の発光を用いて発光量や発光強度を色別に測定する場合に用いる。
【0054】
図1に戻り、画像解析装置110は、具体的にはパーソナルコンピュータである。そして、画像解析装置110は、図4に示すように、大別して、制御部112と、システムの時刻を計時するクロック発生部114と、記憶部116と、通信インターフェース部118と、入出力インターフェース部120と、入力装置122と、出力装置124と、で構成されており、これら各部はバスを介して接続されている。
【0055】
記憶部116は、ストレージ手段であり、具体的には、RAMやROM等のメモリ装置、ハードディスクのような固定ディスク装置、フレキシブルディスク、光ディスク等を用いることができる。そして、記憶部116は制御部112の各部の処理により得られたデータなどを記憶する。通信インターフェース部118は、画像解析装置110と、CCDカメラ106cと、の間における通信を媒介する。すなわち、通信インターフェース部118は他の端末と有線または無線の通信回線を介してデータを通信する機能を有する。入出力インターフェース部120は、入力装置122や出力装置124に接続する。ここで、出力装置124には、モニタ(家庭用テレビを含む)の他、スピーカやプリンタを用いることができる(なお、以下で、出力装置124をモニターとして記載する場合がある。)。また、入力装置122には、キーボードやマウスやマイクの他、マウスと協働してポインティングデバイス機能を実現するモニターを用いることができる。
【0056】
また、制御部112は、OS(Operating System)等の制御プログラムや各種の処理手順等を規定したプログラムや所要データを格納するための内部メモリを有し、これらのプログラムに基づいて種々の処理を実行する。そして、制御部112は、大別して、発光画像撮像指示部112aと、発光画像取得部112bと、画像解析部112cと、解析結果出力部112dと、で構成されている。
【0057】
また、発光画像撮像指示部112aは、通信インターフェース部118を介して、CCDカメラ106cへ発光画像および明視野画像の撮像を指示する。発光画像取得部112bは、CCDカメラ106cで撮像した発光画像および明視野画像を、通信インターフェース部118を介して取得する。ここで、発光画像撮像指示部112aは、発光画像および明視野画像を繰り返し撮像する指示を行ってもよく、複数の異なる細胞102について同時に撮像を実行してもよい。なお、発光画像取得部112bは、撮像した発光画像および明視野画像を、クロック発生部114による時間情報とともに記憶部116に格納してもよい。
【0058】
また、画像解析部112cは、発光画像取得部112bで取得した発光画像に基づいて、細胞102から発せられる発光の発光強度に基づいてサイクリックGMPの濃度を解析する。ここで、画像解析部112cは、発光画像取得部112bにより繰り返し撮像された複数の発光画像に基づいて、経時的なサイクリックGMP濃度の変動を測定してもよく、複数の異なる細胞102について同時に発光画像が撮像された場合に、複数の発光画像を細胞102ごとに照合してサイクリックGMPの濃度を解析してもよい。
【0059】
解析結果出力部112dは、画像解析部112cでの解析結果を出力装置124に出力する。より具体的には、解析結果出力部112dは、画像解析部112cで得られた、細胞102から発せられる発光の発光強度に基づくサイクリックGMP濃度の時系列データを、グラフ化して出力装置124に表示する。
【実施例】
【0060】
[実施例1]
種々のサイクリックGMPセンサータンパク質を作製し、それぞれの特性を調べた。具体的には、マウスのサイクリックGMP特異的ホスホジエステラーゼ5A(PDE5A)由来のサイクリックGMP結合領域と、ホタルルシフェラーゼ由来の2つの断片とから成るサイクリックGMPセンサータンパク質を作製し、各種環状ヌクレオチドに対する応答性を調べた。
【0061】
(手順1)
PCR(polymerase chain reaction)によって、ルシフェラーゼの各種断片を増幅した。図5aに示すサイクリックGMPセンサータンパク質の作製のために、N末側発光酵素(NLuc)遺伝子およびC末側発光酵素(CLuc)遺伝子を増幅した。また、図5bに示すサイクリックGMPセンサータンパク質の作製のために、N末側発光酵素(cpNLuc)遺伝子およびC末側発光酵素(cpCLuc)遺伝子を増幅した。増幅のための合成オリゴDNAは以下のものを使用した。
[NLuc遺伝子作製用合成オリゴDNA配列]
NLuc_Fw (配列番号1): 5’ − TGTGGATCCAGCCACCATGGAAGATGCCAA − 3’
NLuc_Rv (配列番号2): 5’ − CAGCTCGAGGTCCTTGTCGATGAGAGCGTT − 3’
[CLuc遺伝子作製用合成オリゴDNA配列]
CLuc_Fw (配列番号3): 5’ − ATCAGATCTGGCTACGTTAACAACCCCGAG − 3’
CLuc_Rv (配列番号4): 5’ − CTAGAATTCTTACACGGCGATCTTGCCGCC − 3’
[cpNLuc遺伝子作製用合成オリゴDNA配列]
cpNLuc_Fw(配列番号5):5’−ATCAGATCTGAAGATGCCAAAAACATTAAG−3’
cpNLuc_Rv(配列番号6):5’−CTAGAATTCTTAGTCCTTGTCGATGAGAGC−3’
[cpCLuc遺伝子作製用合成オリゴDNA配列]
cpCLuc_Fw(配列番号7):5’−TGTGGATCCAGCCACCATGAGCGGCTACGTTAACAACCCC−3’
cpCLuc_Rv(配列番号8):5’−CAGCTCGAGCACGGCGATCTTGCCGCCCTT−3’
【0062】
また、PCRによって、PDE5AのcGMP結合ドメイン遺伝子を増幅した。増幅には以下のプライマーを組み合わせて用い、種々の遺伝子を取得した。
PDE5A_GAFa_1_Fw (配列番号9): 5’− CCCCTCGAGTTTGATCATGATGAAGGGGACCAGTGCTCA −3’
PDE5A_GAFa_2_Fw (配列番号10): 5’− CCCCTCGAGGTCACAGCATTGTGTCACAAA −3’
PDE5A_GAFa_3_Fw (配列番号11): 5’− CTCGAGAAGGAACAAATGCCACTAACCCCC −3’
PDE5A_GAFa_1_Rv (配列番号12): 5’− CCCAGATCTCTTGTTCTCCAGCAGTGAAGTCTCATAGAG −3’
PDE5A_GAFa_2_Rv (配列番号13): 5’− CCCAGATCTCTGAGCATTGTGAAGAACAAT −3’
PDE5A_GAFa_3_Rv (配列番号14): 5’− AGATCTGATTAAGCTGGCAAGGTCAAGTAA −3’
PDE5A_GAFa_4_Rv (配列番号15): 5’− AGATCTCTTCTTCAGAATGACTTCCAGTGA −3’
PDE5A_GAFa_5_Rv (配列番号16): 5’− AGATCTGGTGCACTTCTGCACCTGCATGAA −3’
PDE5A_GAFa_6_Rv (配列番号17): 5’− AGATCTACAGTCTTCATCCACAATGAAGAT −3’
PDE5A_GAFa_7_Rv (配列番号18): 5’− AGATCTGGGTTTTCCTACTTCCTCACACTC −3’
【0063】
(手順2)
pGL4.10(プロメガ(株)製)を鋳型とするPCRによって、N末側ルシフェラーゼ遺伝子(NLuc)、C末側ルシフェラーゼ遺伝子(CLuc)、変異型N末側ルシフェラーゼ遺伝子(cpNLuc)および変異型C末側ルシフェラーゼ遺伝子(cpCLuc)を、以下の表1に示されるプライマーを使用して増幅した。これらの遺伝子の、ルシフェラーゼ(GL4.10)のアミノ酸配列中の対応する位置を表1に示す。
【0064】
【表1】

(手順3)
サイクリックGMP結合領域として使用するために、マウスのサイクリックGMP特異的ホスホジエステラーゼ5A(PDE5A)のcDNAを鋳型として種々の遺伝子をPCRによって増幅した。図16に、増幅した遺伝子の名称および使用したプライマーを示す。さらに、増幅した遺伝子の、PDE5Aのアミノ酸配列中の対応する位置、および当該遺伝子がコードする断片のアミノ酸残基の数を示す。なお、PDE5AにはサイクリックGMP結合ドメインがAとBの2ヶ所存在するが、そのうちAを含む領域を増幅した。
【0065】
(手順4)
次のようにして、2種の原核生物発現用プラスミドを作製した。手順2にて取得したNLuc遺伝子を原核生物発現用プラスミドであるpRSET2B(インビトロジェン社製)内のBamHI部位とXhoI部位の間に挿入した後、手順2にて取得したCLuc遺伝子をBglII部位とEcoRI部位の間に挿入し、原核生物発現用プラスミド(pRSET/GL4_N_C)を作製した。また、手順2にて取得したcpCLuc遺伝子を原核生物発現用プラスミドであるpRSET2B内のBamHI部位とXhoI部位の間に挿入した後、手順2にて取得したcpNLuc遺伝子をBglII部位とEcoRI部位の間に挿入し、原核生物発現用プラスミド(pRSET/cpGL4_C_N)を作製した。
【0066】
(手順5)
次のようにして、サイクリックGMPセンサータンパク質の発現プラスミドを作製した。手順3にて増幅した11種のPDE5A由来の遺伝子を、手順4にて作製した2種の発現用プラスミドのXhoI認識部位とBglII認識部位との間にそれぞれ挿入した。作製された22種の発現用プラスミドの名称は、図16の表中「得られるプラスミドの名称」の項目に示される。
【0067】
(手順6)
各種サイクリックGMPセンサータンパク質を大腸菌で発現させ、さらに精製した。
【0068】
手順5にて作製した各種発現プラスミドを、それぞれ大腸菌JM109(DE3)株にトランスフォームし、The QIAexpressionist(キアゲン社製)を用いて、キットのマニュアルに従ってサイクリックGMPセンサータンパク質を精製した。精製手順を簡略に説明すると、上記原核生物発現用プラスミドを大腸菌JM109(DE3)株にトランスフォームして、5mLのLB培地中に植菌した。一晩培養した後、遠心分離して集菌し、集菌した大腸菌を溶解バッファー(50mM NaH2PO4、300mM NaCl、10mM イミダゾール、pH8.0)500μLに再懸濁してリゾチームを添加し(1mg/mL)、4℃で60分間インキュベートした。細胞を、ボルテックスミキサー等を用いて静かに撹拌して溶解し、15,000xgで10分間遠心分離して上清を新しいチューブに移した。50% Ni−NTAレジン懸濁液 50μLを添加し、4℃で60分間静かに混合した。15,000xgで10秒間遠心分離してレジンを沈殿させ、レジンを洗浄バッファー(50mM NaH2PO4、300mM NaCl、20mM イミダゾール、pH8.0) 500μLで2回洗浄した。溶出バッファー(50mM NaH2PO4、300mM NaCl、250mM イミダゾール、pH8.0)50μLでタンパク質を2回溶出し、種々のサイクリックGMPセンサータンパク質を得た。得られた22種のサイクリックGMPセンサータンパク質は、図16の表中「得られえるサイクリックGMPセンサータンパク質の名称」の項目に示される。
【0069】
(手順7)
種々のサイクリックGMPセンサータンパク質の特性を測定した。
【0070】
手順6にて取得されたタンパク質の発光活性を、環状ヌクレオチドの非存在下、サイクリックGMP存在下、8−Br−cGMP存在下またはサイクリックAMP存在下でそれぞれ測定した。測定方法を簡単に説明すると、上述のタンパク質溶液20μLに、リン酸緩衝液(PBS)20μLを加えた。そこへ、4mMのサイクリックGMP、8−Br−cGMPまたはサイクリックAMP溶液を1μL加え(終濃度100μM)、またネガティブコントロールにはPBSを同量加えた。さらに、Bright−Glo(プロメガ社製)を40μL加えて、Luminescencer JNR−II(アトー社製)を使用して発光量(5秒間の積算)を測定した。
【0071】
(結果)
手順7による測定の結果を図6に示す。
サイクリックGMP存在下において、発光量が特に高かったのは、GL4_N_PDE5A_GAFa1_C、GL4_N_PDE5A_GAFa5_CおよびGL4_N_PDE5A_GAFa8_Cであった。これらに準じて、GL4_N_PDE5A_GAFa7_C、GL4_N_PDE5A_GAFa9_CおよびGL4_C_PDE5A_GAFa7_Nが一定の発光量を示した。
【0072】
さらに、これらのタンパク質(GL4_N_PDE5A_GAFa1_C、GL4_N_PDE5A_GAFa5_C、GL4_N_PDE5A_GAFa7_C、GL4_N_PDE5A_GAFa8_C、GL4_N_PDE5A_GAFa9_CおよびGL4_C_PDE5A_GAFa7_N)では、環状ヌクレオチド非存在下(コントロール)における発光量と、サイクリックGMP存在下における発光量とで明確な差が示された。
【0073】
[実施例2]
本発明に係る方法により、HEK293細胞中のサイクリックGMP濃度の変動を測定した。
【0074】
(手順1)
次のようにして、種々のサイクリックGMPセンサータンパク質についての動物細胞発現用プラスミドを作製した。
【0075】
実施例1の手順5にて作製した原核細胞発現用プラスミドから、制限酵素BamHIおよびEcoRIを使用して、サイクリックGMPセンサータンパク質をコードする領域を切り出し、それを動物細胞発現用プラスミドであるpcDNA3.1(インビトロジェン社製)のBamHI認識部位とEcoRI認識部位との間に挿入した。具体的に使用した原核細胞発現用プラスミドは、pRSET/GL4_N_GAFa1_C、pRSET/GL4_N_GAFa5_C、pRSET/GL4_N_GAFa7_C、およびpRSET/cpGL4_C_GAFa7_Nの4種であり、これらに基づいて、動物細胞発現用プラスミドであるpcDNA/GL4_N_GAFa1_C、pcDNA/GL4_N_GAFa5_C、pcDNA/GL4_N_GAFa7_C、およびpcDNA/cpGL4_C_GAFa7_Nを作製した。
【0076】
(手順2)
使用するHEK293細胞の培養は次のように行った。HEK293細胞をATCC社より入手し、5% CO2インキュベーター内で、10% Fetal Bovine Serum、および、1x Nonessential amino acidsを添加したEarle’s MEM/培地(GIBCO社製)で培養した。
【0077】
(手順3)
次のようにして、HEK293細胞に手順1で作製した動物細胞発現用プラスミドを導入した。細胞を直径35mmガラスボトムディッシュに、2x105/dishの細胞密度で播種し、5% CO2インキュベーター内で一晩培養し、それぞれの動物細胞発現用プラスミドを、FuGENE HD(ロシュ社製)を用いてトランスフェクションを行い、5% CO2インキュベーター内で一晩培養した。
【0078】
(手順4)
次のようにして、手順3で作製した細胞のタイムラプス撮影を行った。培地中にルシフェリン2mM(プロメガ社製)を添加して1時間静置し、発光顕微鏡LV(LUMINOVIEW)−200(オリンパス社製)にセットし、5秒間隔で発光画像のタイムラプス撮影を行った。発光観察条件として、対物レンズの倍率は40倍、露出時間は5〜10秒間、ビニングは1x1、EM−CCDカメラiXon(アンドール社製)を用い、画像解析装置110として構成したパーソナルコンピュータに取り込んだ。
【0079】
(手順5)
タイムラプス撮影中のHEK293細胞に刺激を与えた。タイムラプス撮影開始から2分後、培養液に8−Br−cGMP(最終濃度 100μM)を添加し、引き続き発光画像のタイムラプス撮影を行った。
【0080】
(手順6)
撮影した画像の発光強度の解析を行った。
手順4および5による一連のタイムラプス撮影によって得られた発光画像においてROI(Region of Interest:関心領域)を指定した。指定したROIにおける発光強度の経時変化をグラフに表示した。
【0081】
図7から9は、GL4_N_PDE5A_GAFa1_Cを発現させた細胞における測定結果である。図7には、刺激前における発光画像が示される。画像中1から4のROIが指定されている。一方、図8には、刺激後における、図7と同一の位置を撮影した発光画像が示される。図8においても、図7と同様にROIが指定されている。さらに、図9には、指定した各ROIの発光強度の経時変化がグラフとして示される。図7および8にて指定した1から4のROIは、図9のグラフ中の「cell1」から「cell4」にそれぞれ対応する。なお、発光画像の解析は、画像解析部112cとして機能するMetamorphソフトウェア(ユニバーサルイメージング社製)を用いて行った。
【0082】
一方、図10から12はGL4_N_PDE5A_GAFa7_Cを発現させた細胞における測定結果であり、図13から15はcpGL4_C_PDE5A_GAFa7_N発現させた細胞における測定結果である。図10および13には刺激前の発光画像が示され、図11および14には刺激後の発光画像が示され、図12および15には指定した各ROIの発光強度の経時変化のグラフが示される。
【0083】
(結果)
8−Br−cGMPは膜透過性サイクリックGMPアナログであり、細胞培養液にこれを添加することで細胞内部のサイクリックGMPが上昇することが予想される。GL4_N_GAFa1_C、GL4_N_GAFa7_CおよびcpGL4_C_GAFa7_Nをそれぞれ利用する本発明に係る方法により、当該予想を反映した結果が得られた。すなわち、8−Br−cGMPの添加後、発光量が増大した。本発明によれば、そのような結果を単一の細胞にて確認することができた。また、個々の細胞における発光強度の変化を見ると、8−Br−cGMP刺激において細胞間の応答に大きなばらつきのあることがわかった(図9、図12および図15参照)。
【0084】
これまでのサイクリックGMPを介する細胞内情報伝達機構の研究から、サイクリックGMP濃度変化の細胞内分布あるいは時間経過が異なると、シグナルの意味が異なることが明らかにされている。従来のルミノメーターを用いた発光量変化の解析では、細胞集団全体の観測に留まり、個々の細胞の応答までは解析できなかった。しかし、本発明に係る方法(装置としてLV−200を使用する)では、生体内の変化を1細胞毎にリアルタイムに観察することができ、細胞内シグナルの働きを詳細に研究することができた。
【0085】
以上、本実施例によれば、細胞内の情報伝達に影響を及ぼすことなく、各細胞からの正確な定量的結果を得ることができ、その結果、個々の細胞においてサイクリックGMP濃度の変化を再現性良く経時的に観察することができる。上述した実施例において使用するルシフェラーゼ遺伝子やルシフェリン等は、他の市販試薬であってもよいし、生物発光等を発生する生物から直接抽出等されたものであってもよい。
【0086】
[その他の実施例]
上記実施例に示される実施の形態のほかに、本発明は、特許請求の範囲に記載した技術的思想の範囲内において種々の異なる実施の形態にて実施することができる。
【0087】
例えば、上述した実施の形態においては、主に、互いに結合することにより発光酵素活性が回復するよう分割させたN末側発光酵素とC末側発光酵素、および、PDE5AのサイクリックGMP結合ドメインからなる融合タンパク質をサイクリックGMPセンサータンパク質として使用するとしたが、これに限らず、特表2009−532063号公報等に開示されているサイクリックGMPセンサータンパク質を用いてもよい。
【0088】
また、上述した記載によれば、以下の要旨に表現されるポリペプチドの態様も本発明に包含される。
【0089】
[ポリペプチド態様1](機能:スプリットルシフェラーゼの相互作用)
発光酵素のN末端側断片、発光酵素のC末端側断片、および、サイクリックGMP結合タンパク質のアミノ酸配列を含むポリペプチドであって、前記N末端側断片およびC末端側断片は非共有結合的に相互作用し、前記非共有結合的相互作用は調整可能であることを特徴とするポリペプチド。
[ポリペプチド態様2](機能:サイクリックGMP結合タンパク質の作用)
前記サイクリックGMP結合タンパク質が前記非共有結合的相互作用を検出可能に変化させることを特徴とする前記態様1に記載のポリペプチド。
[ポリペプチド態様3](機能:外因性因子の作用)
前記非共有結合的相互作用は外因性因子の存在下で強化されること、を特徴とする前記態様1に記載のポリペプチド。
[ポリペプチド態様4](機能:サイクリックGMPの作用)
前記外因性因子はサイクリックGMPであること、を特徴とする前記態様2に記載のポリペプチド。
[ポリペプチド態様5](機能:発光)
前記態様3に記載のポリペプチドであって、前記非共有的相互作用により発光することを特徴とするポリペプチド。
【産業上の利用可能性】
【0090】
以上詳述に説明したように、本発明にかかるサイクリックGMP解析方法は、バイオ、製薬、医療など様々な分野で好適に用いることができる。
【符号の説明】
【0091】
100 発光観察システム
103 容器(シャーレ)
104 ステージ
106 発光画像撮像ユニット
106a 対物レンズ(発光観察用)
106b ダイクロイックミラー
106c CCDカメラ
106d スプリットイメージユニット
106e フィルターホイール
106f 結像レンズ
110 画像解析装置
112 制御部
112a 発光画像撮像指示部
112b 発光画像取得部
112c 画像解析部
112d 解析結果出力部
114 クロック発生部
116 記憶部
118 通信インターフェース部
120 入出力インターフェース部
122 入力装置
124 出力装置
【特許請求の範囲】
【請求項1】
発光酵素のN末端側断片、前記発光酵素のC末端側断片およびサイクリックGMP結合領域を含むサイクリックGMPセンサータンパク質であって、前記サイクリックGMP結合領域は前記N末端側断片と前記C末端側断片との間に配置されたサイクリックGMPセンサータンパク質を含む細胞を作製する細胞作製工程と、
前記細胞作製工程で作製した前記細胞に当該細胞外から所定の発光基質を添加する添加工程と、
前記添加工程で前記所定の発光基質が与えられた前記細胞の発光画像を撮像する撮像工程と、
前記撮像工程で撮像した前記発光画像に基づいて、前記細胞内における前記サイクリックGMPの濃度を解析する解析工程と
を含む細胞内サイクリックGMP解析方法。
【請求項2】
前記サイクリックGMP結合領域がサイクリックGMP特異的ホスホジエステラーゼ由来である、請求項1に記載の細胞内サイクリックGMP解析方法。
【請求項3】
前記サイクリックGMP結合領域が、マウスサイクリックGMP特異的ホスホジエステラーゼ5Aのアミノ酸番号
121番目から330番目、
131番目から320番目、
131番目から330番目、
131番目から343番目、または
131番目から358番目
のアミノ酸配列を含む、請求項2に記載の細胞内サイクリックGMP解析方法。
【請求項4】
前記発光酵素がホタルルシフェラーゼであり、
前記N末端側断片がホタルルシフェラーゼのアミノ酸番号1番目から416番目のアミノ酸配列を含み、
前記C末端側断片がホタルルシフェラーゼのアミノ酸番号399番目から550番目のアミノ酸配列を含む
請求項1から3の何れか1項に記載の細胞内サイクリックGMP解析方法。
【請求項5】
前記撮像工程が前記発光画像を繰り返し撮像することを含む、請求項1から4の何れか1項に記載の細胞内サイクリックGMP解析方法。
【請求項6】
前記撮像工程が複数の異なる細胞に対して同時に行われ、
前記解析工程が前記細胞ごとに行われる、
請求項1から6の何れか1項に記載の細胞内サイクリックGMP解析方法。
【請求項7】
発光酵素のN末端側断片、前記発光酵素のC末端側断片およびサイクリックGMP結合領域を含むサイクリックGMPセンサータンパク質であって、前記サイクリックGMP結合領域は前記N末端側断片と前記C末端側断片との間に配置されたサイクリックGMPセンサータンパク質。
【請求項8】
前記サイクリックGMP結合領域が、マウスサイクリックGMP特異的ホスホジエステラーゼ5Aのアミノ酸番号
121番目から330番目、
131番目から320番目、
131番目から330番目、
131番目から343番目、または
131番目から358番目
のアミノ酸配列を含む、請求項7に記載のサイクリックGMPセンサータンパク質。
【請求項9】
前記発光酵素がホタルルシフェラーゼであり、
前記N末端側断片がホタルルシフェラーゼのアミノ酸番号1番目から416番目のアミノ酸配列を含み、
前記C末端側断片がホタルルシフェラーゼのアミノ酸番号399番目から550番目のアミノ酸配列を含む
請求項7または8に記載のサイクリックGMPセンサータンパク質。
【請求項10】
配列番号31、35、37、48、38または39に示されるアミノ酸配列を含む請求項7から9の何れか1項に記載のサイクリックGMPセンサータンパク質。
【請求項1】
発光酵素のN末端側断片、前記発光酵素のC末端側断片およびサイクリックGMP結合領域を含むサイクリックGMPセンサータンパク質であって、前記サイクリックGMP結合領域は前記N末端側断片と前記C末端側断片との間に配置されたサイクリックGMPセンサータンパク質を含む細胞を作製する細胞作製工程と、
前記細胞作製工程で作製した前記細胞に当該細胞外から所定の発光基質を添加する添加工程と、
前記添加工程で前記所定の発光基質が与えられた前記細胞の発光画像を撮像する撮像工程と、
前記撮像工程で撮像した前記発光画像に基づいて、前記細胞内における前記サイクリックGMPの濃度を解析する解析工程と
を含む細胞内サイクリックGMP解析方法。
【請求項2】
前記サイクリックGMP結合領域がサイクリックGMP特異的ホスホジエステラーゼ由来である、請求項1に記載の細胞内サイクリックGMP解析方法。
【請求項3】
前記サイクリックGMP結合領域が、マウスサイクリックGMP特異的ホスホジエステラーゼ5Aのアミノ酸番号
121番目から330番目、
131番目から320番目、
131番目から330番目、
131番目から343番目、または
131番目から358番目
のアミノ酸配列を含む、請求項2に記載の細胞内サイクリックGMP解析方法。
【請求項4】
前記発光酵素がホタルルシフェラーゼであり、
前記N末端側断片がホタルルシフェラーゼのアミノ酸番号1番目から416番目のアミノ酸配列を含み、
前記C末端側断片がホタルルシフェラーゼのアミノ酸番号399番目から550番目のアミノ酸配列を含む
請求項1から3の何れか1項に記載の細胞内サイクリックGMP解析方法。
【請求項5】
前記撮像工程が前記発光画像を繰り返し撮像することを含む、請求項1から4の何れか1項に記載の細胞内サイクリックGMP解析方法。
【請求項6】
前記撮像工程が複数の異なる細胞に対して同時に行われ、
前記解析工程が前記細胞ごとに行われる、
請求項1から6の何れか1項に記載の細胞内サイクリックGMP解析方法。
【請求項7】
発光酵素のN末端側断片、前記発光酵素のC末端側断片およびサイクリックGMP結合領域を含むサイクリックGMPセンサータンパク質であって、前記サイクリックGMP結合領域は前記N末端側断片と前記C末端側断片との間に配置されたサイクリックGMPセンサータンパク質。
【請求項8】
前記サイクリックGMP結合領域が、マウスサイクリックGMP特異的ホスホジエステラーゼ5Aのアミノ酸番号
121番目から330番目、
131番目から320番目、
131番目から330番目、
131番目から343番目、または
131番目から358番目
のアミノ酸配列を含む、請求項7に記載のサイクリックGMPセンサータンパク質。
【請求項9】
前記発光酵素がホタルルシフェラーゼであり、
前記N末端側断片がホタルルシフェラーゼのアミノ酸番号1番目から416番目のアミノ酸配列を含み、
前記C末端側断片がホタルルシフェラーゼのアミノ酸番号399番目から550番目のアミノ酸配列を含む
請求項7または8に記載のサイクリックGMPセンサータンパク質。
【請求項10】
配列番号31、35、37、48、38または39に示されるアミノ酸配列を含む請求項7から9の何れか1項に記載のサイクリックGMPセンサータンパク質。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【公開番号】特開2011−195547(P2011−195547A)
【公開日】平成23年10月6日(2011.10.6)
【国際特許分類】
【出願番号】特願2010−66895(P2010−66895)
【出願日】平成22年3月23日(2010.3.23)
【出願人】(000000376)オリンパス株式会社 (11,466)
【Fターム(参考)】
【公開日】平成23年10月6日(2011.10.6)
【国際特許分類】
【出願日】平成22年3月23日(2010.3.23)
【出願人】(000000376)オリンパス株式会社 (11,466)
【Fターム(参考)】
[ Back to top ]

