スタチンの用法・用量を決定する方法
【課題】心疾患を罹患している患者に対して、スタチンの用法・用量を決定する方法の提供。
【解決手段】(1)スタチンの投与前および投与後において、心疾患を罹患した患者における細胞内のSmgGDS発現量を測定する工程、および、(2)前記工程(1)で測定されたSmgGDS発現量を基準に前記患者に対するスタチンの種類および/または投与量を決定する工程を含む、心疾患を罹患した患者へのスタチンの用法および/または用量を決定する。
【解決手段】(1)スタチンの投与前および投与後において、心疾患を罹患した患者における細胞内のSmgGDS発現量を測定する工程、および、(2)前記工程(1)で測定されたSmgGDS発現量を基準に前記患者に対するスタチンの種類および/または投与量を決定する工程を含む、心疾患を罹患した患者へのスタチンの用法および/または用量を決定する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、スタチンの用法・用量を決定する方法に関する。
【背景技術】
【0002】
HMG−CoAレダクターゼ阻害剤(スタチン)は、臨床現場において、冠動脈疾患の第1次および第2次予防に対して広く使用されているコレステロール低下剤である(非特許文献1および2を参照)。さらに、近年、スタチンに脂質低下作用に加え心血管病に対して保護的に働く作用(いわゆる多面的効果)があることが報告され、脚光を浴びている(非特許文献3および4を参照)。スタチンの多面的作用は、細胞内タンパク質の翻訳後制御を担うイソプレノイドの合成減少によって媒介されるとされている(非特許文献1を参照)。すなわち、Rho、RacおよびRasなどの低分子量GTP結合タンパク質の活性は、膜への局在およびGTPアーゼ活性がそれらタンパク質のイソプレニル化に依存するものであり、スタチンの多面的効果を媒介すると考えられている(非特許文献5および6を参照)。
【0003】
本発明者らは、正常な健康被験者において、低用量スタチン(アトルバスタチンおよびプラバスタチンの20mg/日を一週間投与)が、循環白血球中のRhoA/Rhoキナーゼ活性を抑制することなく、Rac1活性のみを著しく阻害することを以前に実証した(非特許文献7を参照)。Rac1は、活性酸素種(ROS)を産生する際、重要な役割を有することが知られている。Rac1が、ROS産生を増加させ、心筋肥大やリモデリングを増加させることが報告されていることから、心血管肥大の重要なメディエーターである可能性が示唆されている(非特許文献8を参照)。
【0004】
アンジオテンシンII(AngII)により誘導される心肥大を有するマウスモデルにおいて、シンバスタチンが心臓および血管平滑筋中のRac1の下流に存在するニコチンアミドアデニンジヌクレオチドリン酸(NADPH)オキシダーゼ活性を阻害することが報告されている(非特許文献9および10を参照)。これらの知見はヒト心臓組織の解析により支持されており、スタチンは、Rac1の活性化によるROS産生を抑制することが報告されている(非特許文献11を参照)。これにより本発明者らは、低用量スタチンの多面的効果が、Rho/Rhoキナーゼ経路よりむしろRac1経路の阻害によって主として媒介されることを提案した(非特許文献7を参照)。
【0005】
低分子量GTP結合タンパク質GDP解離刺激因子(SmgGDS)は、アルマジロ(ARM)タンパクファミリーの中で、唯一グアニンヌクレオチド交換因子(GEF)にも属している(非特許文献12および13を参照)。最近、心疾患におけるGEFの役割が脚光を浴びている(非特許文献14〜16を参照)。また、精製されたSmgGDSが低分子量GTPアーゼのC末端の多塩基領域(PBR)と相互作用し、GEF機能によって、RhoAおよびRhoCを活性化することが報告されている(非特許文献17を参照)。さらに、Rac1のPBRに、RhoAには存在しない機能性核移行シグナル(NLS)配列が存在することが報告されている(非特許文献13を参照)。NLSを有するRac1は、SmgGDSと結合し、核内へ移行することにより、プロテアソーム系によって分解される可能性がある(非特許文献18を参照)。
【先行技術文献】
【非特許文献】
【0006】
【非特許文献1】Scandinavian SimvastatinSurvival Study Group. Randomized trial of cholesterol lowering in 4444 patientswith coronary heart disease: the Scandinavian Survival Study (4S). Lancet 344,1383-1389 (1994)
【非特許文献2】Levine, G.N., Keaney,Jr., J.F. & Vita, J.A., N. Engl. J. Med. 332, 512-521 (1995)
【非特許文献3】Davignon J., Circulation109, 39-43 (2004)
【非特許文献4】Rikitake, Y., Liao, J.K.,Circ. Res. 97, 1232-1235 (2005)
【非特許文献5】Hall, A., Science 279,509-514 (1998)
【非特許文献6】Takemoto, M., Liao JK., Arterioscler.Thromb. Vasc. Biol. 21, 1712-1719 (2001)
【非特許文献7】Rashid M. et al., Circ.J. 73, 361-370 (2009)
【非特許文献8】Brown J.H., Del Re,D.P., Sussman, M.A., Circ. Res. 98, 730-742 (2006)
【非特許文献9】Takemoto M. et al., J.Clin. Invest. 108, 1429-1437 (2001)
【非特許文献10】Wassmann, S. et al., Mol.Pharmacol. 59, 646-654 (2001)
【非特許文献11】Maack, C. et al., Circulation108, 1567-1574 (2003)
【非特許文献12】Yamamoto, T. et al., J.Biol. Chem. 265, 16626-16634 (1990)
【非特許文献13】Williams, C.L., Cellsignal. 15, 1071-1080 (2003)
【非特許文献14】Guilluy, C. et al., Nat.Med. 16, 183-190 (2010)
【非特許文献15】Sauzeau, V., Sevilla,M.A., Montero, M.J. & Bustelo, X.R., J. Clin. Invest. 120, 315-330 (2010)
【非特許文献16】Sauzeau, V. et al., Nat.Med. 12, 841-845 (2006)
【非特許文献17】Hamel, B. et al., J.Biol. Chem. 286, 12141-12148 (2011)
【非特許文献18】Lannning, C.C. et al., J.Biol. Chem. 279, 44197-44210 (2004)
【発明の概要】
【発明が解決しようとする課題】
【0007】
上記の通り、Rho、RacおよびRasなどの低分子量GTP結合タンパク質の活性とスタチンの多面的効果との間には、なんらかの関係性があると考えられている。しかし、低用量スタチンの多面的作用の分子機序については、未だ不明な点が多い。
【0008】
また、本発明者らは、低用量スタチンの多面的効果がRac1経路の阻害によって主として媒介される可能性を提案した。しかし、低用量スタチンによるRac1シグナル経路の選択的阻害の分子機序は未だ解明されていない。また、そのことに起因して、現在臨床的に用いられているスタチンのほとんどが、高コレステロール血症に対する治療薬として用いられており、心疾患、たとえば、心血管肥大症への適用について十分に検討されていない。
【0009】
そこで、本発明は、スタチンによるRac1シグナル経路の選択的阻害の分子機序の一端を解明することにより、心疾患を罹患している患者に対して、スタチンの用法・用量を決定する方法を提供することを、発明が解決しようとする課題とした。
【課題を解決するための手段】
【0010】
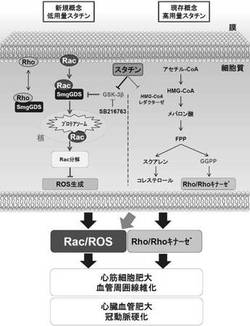
本発明者らは、これまでに得られた知見について検討を重ねたところ、スタチンによるRac1シグナル経路の選択的阻害に係る分子メカニズムにおいて、SmgGDSが重要な役割を果たすのではないかと仮定した。そこで、鋭意研究開発を進めて得られた本発明者らの結果は、動物およびヒトにおいて、核内Rac1の分解の増大をもたらすスタチンの多面的効果の分子機序では、SmgGDSが重大な役割を果たすという最初の証拠となるものである。この分子メカニズムは図6により概略される。
【0011】
まず、スタチンは、細胞質中のSmgGDS発現を増加させる。第2に、SmgGDSはRac1と結合して、核へ輸送する。第3に、Rac1は核プロテアソームによって分解される。第4に、Rac1の分解はROS産生の減少を引き起こす。最後に、このROS産生の減少は心血管の保護、すなわち、心血管肥大症、心筋細胞肥大症、血管周囲線維化症または冠動脈硬化症といった心疾患の治療や予防に関するスタチンの多面的効果が引き起こされる(図6)。本発明は、このような知見に基づいて完成された発明である。
【0012】
したがって、本発明によれば、(1)スタチンの投与前および投与後において、心疾患を罹患した患者における細胞内のSmgGDS発現量を測定する工程、および、(2)前記工程(1)で測定されたSmgGDS発現量を基準に前記患者に対するスタチンの種類および/または投与量を決定する工程を含む、心疾患を罹患した患者へのスタチンの用法および/または用量を決定する方法が提供される。
【0013】
好ましくは、前記心疾患が、心血管肥大症、心筋細胞肥大症、心血管周囲線維化、冠動脈硬化症、高血圧症または心不全である。
【0014】
好ましくは、前記スタチンが、アトルバスタチン、ジヒドロコンパクチン、ベルバスタチン、カルバスタチン、セリバスタチン、クリルバスタチン、ダルバスタチン、フルバスタチン、グレンバスタチン、フルインドスタチン、ベロスタチン、ロバスタチン、メバスタチン、コンパクチン、ピタバスタチン、プラバスタチン、リバスタチン、ロスバスタチン、シンバスタチン、シリバスタチン、CI−981およびそれらの薬学的に許容される塩からなる群から選択される。
【0015】
好ましくは、前記基準が、スタチン投与後のSmgGDS発現量がスタチン投与前のSmgGDS発現量の1.4倍以上である。
【発明の効果】
【0016】
本発明の方法によれば、心疾患を罹患している患者に対して、使用すべきスタチンの種類および/または投与量を決定することにより、スタチンの用法・用量を決定することができる。本発明の方法の利点としては、疾患の症状ではなく、細胞内SmgGDS発現量を確認することにより、迅速かつ客観的に、治療時のスタチンの用法・用量を決定できる。
【図面の簡単な説明】
【0017】
【図1a】図1aは、スタチンがGSK−3β経路を介してHUVEC中のSmgGDSを増加させたことを示す図である。HUVECを用いてアトルバスタチン(ATOR)を24時間作用させた後のSmgGDSタンパク質の発現量を示す(n=3)。結果は平均値±s.e.mとして表される。
【図1b】図1bは、スタチンがGSK−3β経路を介してHUVEC中のSmgGDSを増加させたことを示す図である。HUVECを用いてピタバスタチン(PITA)を24時間作用させた後のSmgGDSタンパク質の発現量を示す(n=3)。結果は平均値±s.e.mとして表される。
【図1c】図1cは、スタチンがGSK−3β経路を介してHUVEC中のSmgGDSを増加させたことを示す図である。HUVECを用いてGSK−3β阻害薬であるSB216763を24時間作用させた後のSmgGDSタンパク質の発現量を示す(n=3)。結果は平均値±s.e.mとして表される。
【図1d】図1dは、スタチンがGSK−3β経路を介してHUVEC中のSmgGDSを増加させたことを示す図である。HUVECを用いてRhoキナーゼ阻害薬を24時間作用させた後のSmgGDSタンパク質の発現量を示す(n=3)。結果は平均値±s.e.mとして表される。
【図1e】図1eは、スタチンがGSK−3β経路を介してHUVEC中のSmgGDSを増加させたことを示す図である。HUVECを用いて、アトルバスタチンおよびピタバスタチンに加えてファルネシルピロリン酸(FPP、10μM)およびゲラニルゲラニルピロリン酸(GGPP、10μM)を作用させた後のSmgGDSタンパク質の発現量を示す(n=3)。結果は平均値±s.e.mとして表される。
【図2a】図2aは、HUVECの細胞分画中のタンパク質発現に対するアトルバスタチンの影響を示した図である。アトルバスタチン(ATOR、10μM)を用いてHUVECを24時間インキュベーションした後のウエスタンブロット解析結果を示す。
【図2b】図2bは、HUVEC細胞分画中のタンパク質発現に対するアトルバスタチンの影響を示した図である。Rac1の定量解析結果を示す(n=3)。結果は平均値±s.e.mとして表される。
【図2c】図2cは、HUVEC細胞分画中のタンパク質発現に対するアトルバスタチンの影響を示した図である。SmgGDSの定量解析結果を示す(n=3)。結果は平均値±s.e.mとして表される。
【図2d】図2dは、HUVEC細胞分画中のタンパク質発現に対するアトルバスタチンの影響を示した図である。核分画中のRac1発現について、アトルバスタチンに加えてプロテアソーム阻害剤(MG−132)を作用させた際の影響を示す(n=3)。結果は平均値±s.e.mとして表される。
【図2e】図2eは、HUVEC中のタンパク質発現に対するアトルバスタチンの影響を示した図である。コントロールまたはSmgGDSのsiRNAを導入し、48時間後、アトルバスタチンを加え、24時間作用させた後のRac1の発現量を示す(n=3)。結果は平均値±s.e.mとして表される。
【図2f】図2fは、酸化ストレスに対するアトルバスタチンの影響を示した図である。HUVECをアトルバスタチン(1μM)で24時間プレインキュベートし、1μMのAngIIを3時間作用させた後のHUVECのジクロロフルオレセイン(DCF)染色の結果を示す。
【図2g】図2gは、酸化ストレスに対するアトルバスタチンの影響を示した図である。輝度定量解析の結果を示す(n=8)。結果は平均値±s.e.mとして表される。
【図3a】図3aは、スタチンによる改善作用がAngII誘導型心臓肥大および線維化を有するSmgGDS欠損マウスにおいて見られないことを示した図である。コントロール(−)、アトルバスタチン(AngII+ATOR、10mg/kg/日)またはプラバスタチン(AngII+PRA、50mg/kg/日)のいずれかで処理したAngII投与マウスおよびAngII投与マウス(溶媒投与、AngII(+))における心臓のマッソン・トリクローム染色の結果を示す。心筋の肥大(上部)。間質性心筋の線維化(中間)。冠動脈の血管周囲領域の線維化(下部)。
【図3b】図3bは、スタチンによる改善作用がAngII誘導型心臓肥大および線維化を有するSmgGDS欠損マウスにおいて見られないことを示した図である。溶媒またはスタチンを投与されたSmgGDS+/+マウスおよびSmgGDS+/−マウスの心臓重量/体重比を、AngII注入の2週間後に測定した結果を示す(n=10)。結果は平均値±s.e.mとして示される。
【図3c】図3cは、スタチンによる改善作用がAngII誘導型心臓肥大および線維化を有するSmgGDS欠損マウスにおいて見られないことを示した図である。溶媒またはスタチンで処理されたSmgGDS+/+マウスおよびSmgGDS+/−マウスの心筋細胞の断面積を、AngII注入の2週間後に測定した結果を示す(n=10)。結果は平均値±s.e.mとして示される。
【図3d】図3dは、スタチンによる改善作用がAngII誘導型心臓肥大および線維化を有するSmgGDS欠損マウスにおいて見られないことを示した図である。間質性心筋の線維化の定量解析結果を示す(n=10)。結果は平均値±s.e.mとして示される。
【図3e】図3eは、スタチンによる改善作用がAngII誘導型心臓肥大および線維化を有するSmgGDS欠損マウスにおいて見られないことを示した図である。血管周囲領域の線維化の定量解析結果を示す(n=10)。結果は平均値±s.e.mとして示される。
【図3f】図3fは、スタチンによる改善作用がAngII誘導型心臓肥大および線維化を有するSmgGDS欠損マウスにおいて見られないことを示した図である。心臓血管のリモデリングの定量解析結果を示す(n=10)。結果は平均値±s.e.mとして示される。
【図4a】図4aは、スタチンによる改善作用がAngII誘導型の心臓拡張機能障害を有するSmgGDS欠損マウスにおいて見られないことを示した図である。コントロール(−)、アトルバスタチン(AngII+ATOR、10mg/kg/日)またはプラバスタチン(AngII+PRA、50mg/kg/日)のいずれかで処理されたAngII投与マウスおよびAngII投与マウス(溶媒投与、AngII(+))の超音波心臓検査の結果を示す。図4aは、心臓の壁厚についての結果を示す(n=10)。結果は平均値±s.e.mとして示される。
【図4b】図4bは、スタチンによる改善作用がAngII誘導型の心臓拡張機能障害を有するSmgGDS欠損マウスにおいて見られないことを示した図である。コントロール(−)、アトルバスタチン(AngII+ATOR、10mg/kg/日)またはプラバスタチン(AngII+PRA、50mg/kg/日)のいずれかで処理されたAngII投与マウスおよびAngII投与マウス(溶媒投与、AngII(+))の超音波心臓検査の結果を示す。図4bは、左室内径短縮率についての結果を示す(n=10)。結果は平均値±s.e.mとして示される。
【図4c】図4cは、スタチンによる改善作用がAngII誘導型の心臓拡張機能障害を有するSmgGDS欠損マウスにおいて見られないことを示した図である。コントロール(−)、アトルバスタチン(AngII+ATOR、10mg/kg/日)またはプラバスタチン(AngII+PRA、50mg/kg/日)のいずれかで処理されたAngII投与マウスおよびAngII投与マウス(溶媒投与、AngII(+))の超音波心臓検査の結果を示す。図4cは、E/A比についての結果を示す(n=10)。結果は平均値±s.e.mとして示される。
【図4d】図4dは、スタチンによる改善作用がAngII誘導型の心臓拡張機能障害を有するSmgGDS欠損マウスにおいて見られないことを示した図である。コントロール(−)、アトルバスタチン(AngII+ATOR、10mg/kg/日)またはプラバスタチン(AngII+PRA、50mg/kg/日)のいずれかで処理されたAngII投与マウスおよびAngII投与マウス(溶媒投与、AngII(+))の超音波心臓検査の結果を示す。図4dは、心拍数についての結果を示す(n=10)。結果は平均値±s.e.mとして示される。
【図5a】図5aは、スタチンがヒトにおいてSmgGDSを増加させることを示した図である。ヒトの循環白血球中のSmgGDSのタンパク質量を示す。プラバスタチン(PRA、20mg/日)またはアトルバスタチン(ATOR、20mg/日)を2週間投与した後、投与前と比較して著しくSmgGDS値を増加させることを示した図である(n=20)。結果は平均値±s.dとして示される。
【図5b】図5bは、スタチンがヒトにおいてSmgGDSを増加させることを示した図である。ヒトのSmgGDS変化およびLDLコレステロール変化の間の相関を示す(n=20)。
【図5c】図5cは、スタチンがヒトにおいてSmgGDSを増加させることを示した図である。ヒトのSmgGDS変化およびLDLコレステロール変化の間の相関を示す(n=20)。
【図5d】図5dは、スタチンがヒトにおいてSmgGDSを増加させることを示した図である。ヒトのSmgGDS変化およびMDA−LDLコレステロール変化の間の相関を示す(n=20)。
【図5e】図5eは、スタチンがヒトにおいてSmgGDSを増加させることを示した図である。ヒトのSmgGDS変化およびMDA−LDLコレステロール変化の間の相関を示す(n=20)。
【図6】図6は、スタチンの多面的効果の新規分子機序を概略化した図である。低用量スタチンは、GSK−3βを介してSmgGDSを増加させる。増加したSmgGDSは、Rac1と結合し、核に移行させる。核内に移行したRac1は、プロテアソームにより分解される。Rac1の分解は、ROSの産生を減らし、最終的に、心筋細胞肥大や線維化、そして心肥大を抑制し、スタチンの多面的作用をもたらす。
【図7a】図7aは、HUVECの細胞分画中のタンパク質発現に対するピタバスタチンの影響を示した図である。ピタバスタチン(PITA、1μM)を用いてHUVECを24時間インキュベーションした後のウエスタンブロット解析結果を示す。
【図7b】図7bは、HUVECの細胞分画中のタンパク質発現に対するピタバスタチンの影響を示した図である。Rac1およびSmgGDSの定量解析結果を示す(n=3)。結果は平均値±s.e.mとして表される。
【図7c】図7cは、HUVEC細胞分画中のタンパク質発現に対するピタバスタチンの影響を示した図である。SmgGDSの定量解析結果を示す(n=3)。結果は平均値±s.e.mとして表される。
【図7d】図7dは、HUVEC細胞分画中のタンパク質発現に対するピタバスタチンの影響を示した図である。核分画中のRac1発現について、ピタバスタチンに加えてプロテアソーム阻害剤(MG−132)を作用させた際の影響を示す(n=3)。結果は平均値±s.e.mとして表される。
【図7e】図7eは、HUVEC中のタンパク質発現に対するピタバスタチンの影響を示した図である。コントロール、またはSmgGDSのsiRNAを導入し、48時間後、ピタバスタチンを加え、24時間作用させた後のRac1の発現量を示す(n=3)。結果は平均値±s.e.mとして表される。
【図8a】図8aは、酸化ストレスに対するピタバスタチンの影響を示した図である。HUVECをピタバスタチン(0.1μM)で24時間プレインキュベートし、1μMのAngIIを3時間作用させた後のHUVECのジクロロフルオレセイン(DCF)染色の結果を示す。
【図8b】図8bは、酸化ストレスに対するピタバスタチンの影響を示した図である。輝度定量解析の結果を示す(n=8)。結果は平均値±s.e.mとして表される。
【図9】図9は、臨床研究の実験計画のフロー図を示す。
【発明を実施するための形態】
【0018】
以下、本発明の詳細について説明する。
【0019】
本発明によれば、以下の工程を含む、心疾患を罹患した患者へのスタチンの用法、用量またはそれらの両方を決定する方法が提供される。
(1)スタチンの投与前および投与後において、心疾患を罹患した患者における細胞内のSmgGDS発現量を測定する工程(以下、工程(1)ともよぶ。)
(2)前記工程(1)で測定されたSmgGDS発現量を基準に前記患者に対するスタチンの種類および/または投与量を決定する工程(以下、工程(2)ともよぶ。)
【0020】
心疾患とは、心臓の疾患の総称である。本発明の方法は、スタチンの多面的効果の一つとしてスタチンが活性酸素種(ROS)を減少させることに基づいていることから、本発明の方法において対象となる心疾患は、ROSに起因する心疾患が好ましく、たとえば、心血管肥大症、心筋細胞肥大症、心血管周囲線維化、冠動脈硬化症、高血圧症、心不全などである。
【0021】
本発明の方法において対象となる心疾患を罹患した患者は、特に制限されず、現に心疾患を罹患している患者のみならず、心疾患の既往歴がある者、遺伝的または体質的に心疾患に罹患するおそれがある者、他の疾患との関係で心疾患に罹患する可能性がある者などを含む。また、心疾患の進行の程度についても特に制限はない。
【0022】
スタチンは、HMG−CoA還元酵素阻害剤ともいわれ、図6に示すRho/Rho−キナーゼ経路におけるHMG−CoAをメバロン酸塩へ変換する反応を触媒する酵素であるHMG−CoAレダクターゼを阻害する薬剤として知られている。スタチンとしては、種々のものが知られており、現在臨床で使用されているものの他にも、販売または開発が中止になったもの、現在臨床実験が進められているものなどがある。本発明の方法において対象となるスタチンは、特に制限はなく、スタチンとして知られているもののすべてを含むが、好ましくは、アトルバスタチン、ジヒドロコンパクチン、ベルバスタチン、カルバスタチン、セリバスタチン、クリルバスタチン、ダルバスタチン、フルバスタチン、グレンバスタチン、フルインドスタチン、ベロスタチン、ロバスタチン、メバスタチン、コンパクチン、ピタバスタチン、プラバスタチン、リバスタチン、ロスバスタチン、シンバスタチン、シリバスタチン、CI−981およびそれらの薬学的に許容される塩である。
【0023】
本明細書におけるスタチンは、化合物としてのスタチンに限らず、スタチンと賦形剤とを配合してなるスタチン製剤を含む。スタチン製剤としては、たとえば、アトルバスタチン塩を有効成分とするリピトール錠、プラバスタチン塩を有効成分とするメバロチン錠などが挙げられる。
【0024】
スタチンは、これまで高脂血症や高コレステロール血症の治療剤として臨床的に使用されており、心血管肥大症や心筋細胞肥大症などの心疾患の治療剤としては臨床的に使用されていない。本発明の方法は、このような現状を鑑みて、心疾患へのスタチンの臨床的応用を促進することを目的としてなされたものである。したがって、本発明は、スタチンの臨床的応用のさらなる可能性を追求した、画期的な発明である。本発明の方法によれば、心疾患の治療の選択肢が広がることから、本発明は患者および医師の双方にとって非常に有益なものである。
【0025】
本発明の方法における工程(1)では、スタチンの投与前および投与後において、心疾患を罹患した患者における細胞内のSmgGDS発現量を測定する。SmgGDS発現量の測定は、当業者により知られている細胞内タンパク質を定量化する方法を応用して実施できるが、たとえば、心疾患を罹患した患者から生体試料を採取し、次いで生体試料における細胞を単離し、次いで細胞をホモジナイズしてSmgGDSを含む溶解物を取得し、次いでSmgGDSを定量することにより実施する。
【0026】
より具体的には、絶食条件下で心疾患を罹患した患者の静脈血を採血し、次いで白血球を単離し、次いで単離した白血球を適当な緩衝液を用いて数回洗浄し、次いで洗浄した白血球を溶解用緩衝液に加えて超音波などで破砕して細胞溶解液を得て、次いで得られた細胞溶解液を試料として抗SmgGDS抗体などを用いてウエスタンブロット解析を実施することにより白血球内のSmgGDSを定量する。なお、細胞溶解液を細胞下分画して、細胞内でのSmgGDSの偏在を調べるなどしてもよい。
【0027】
SmgGDS発現量の測定は、スタチンの投与前、たとえばスタチンを投与する直前、および投与後、たとえばスタチンを投与した24時間後の少なくとも2回、心疾患を罹患した患者から採取した生体試料に基づいて実施する。
【0028】
本発明の方法における工程(2)では、工程(1)で測定されたSmgGDS発現量を基準に心疾患を罹患した患者に対するスタチンの種類、投与量またはそれらの両方を決定する。本発明の方法は、スタチンのROSの減少効果に基づいて、心疾患を罹患した患者に対してスタチンの臨床的応用を促すものである。スタチンのROS減少効果は、スタチンがGSK−3βを阻害し、それによりGSK−3βが標的とするSmgGDSが細胞内で増加またはその活性が増強することによってもたらされる。すなわち、SmgGDSは核にRac1を輸送する。Rac1は核プロテアソームによって分解される。Rac1分解はROS生産の減少を引き起こす。ROS生成量の上昇は心筋細胞の肥大および血管周囲の線維化を引き起こすので、Rac1が媒介するROS生成量の減少化は心血管の肥大を減少させることにつながる。したがって、スタチンを心疾患患者に投与した際にSmgGDSの細胞内発現量が上昇していれば、該患者において心疾患の改善が見込める。
【0029】
本発明の方法において、スタチン投与前と投与後の細胞内SmgGDS発現量を比較し、投与後の発現量が投与前の発現量と変わらない、または減少している場合、投与すべきスタチンの種類を変える、スタチンの投与量を増量する、それらの両方を実施するといった選択肢を取り得る。いずれの選択肢を採用するかはスタチンの投与回数や投与期間などを考慮して決定すればよく、たとえば、はじめにスタチンの投与量を増量し、次いで投与前後で細胞内SmgGDS発現量に差異が見られない場合は、スタチンの種類を変えるよう決定できる。これとは逆に、投与後のSmgGDS発現量が投与前のSmgGDS発現量よりも増加している場合は、スタチンの投与量を変えないように決定する。
【0030】
また、実施例において示されている通り、プラバスタチンの10mg投与により、被験者においては、LDLコレステロールの減少は認められるけれども、SmgGDSの増加が認められない場合がある。この場合、LDLコレステロールの増減を基準としては、スタチン投与量の増量や薬剤変更は考慮され得ず、心疾患を罹患した患者に対してスタチンの有効量を投与できない。したがって、本発明の方法を採用することによりはじめて、細胞内SmgGDS発現量の増減を基準とすることにより、心疾患を罹患した患者に対して適切なスタチンの有効量を投与することが可能となる。
【0031】
図5aの結果を考慮すれば、スタチンの10mg投与を20mg投与へ変更することにより細胞内SmgGDS発現量は1.4倍以上増加し得ることから、スタチン投与後のSmgGDS発現量がスタチン投与前のSmgGDS発現量の1.4倍以上であるか否かを基準として、スタチンの種類や投与量を決定するのが好ましい。
【0032】
本発明の方法は、本発明の目的を達成し得る範囲において、工程(1)および工程(2)のそれぞれの工程の前後に他の工程を組み入れることを排除しない。また、本発明の方法により心疾患患者に対して有益なスタチンの種類および投与量を決定することができるが、本発明の方法と合わせて心疾患の程度の指標となる様々な数値や症状などと組み合わせて、スタチンの種類および投与量を決定できる。
【0033】
当業者であれば、本発明の方法の有用性について、後述する実施例において示されている種々の実験結果により把握できる。そのような結果の一例として、培養内皮細胞において、スタチンは、メバロン酸塩またはRho/Rhoキナーゼ経路と無関係にSmgGDS発現を増強し、Rac1分解を増加させ、かつ、ROSの生成量を増加させたとの結果;SmgGDS欠損マウスではスタチンの心血管の保護効果は見られなかったとの結果;正常な健常個体においてスタチンは著しくSmgGDS発現を増加させたとの結果;SmgGDS発現量と酸化ストレスマーカーとの間に有意な逆相関があったとの結果;総コレステロールまたはLDLコレステロールと酸化ストレスマーカーとの間に相関は見られなかったとの結果などである。当業者であれば、これらの結果を参照することにより、メバロン酸塩およびRho/Rhoキナーゼ経路の阻害に加えて、Rac1分解の増加を媒介するスタチンの有益かつ新規な活性メカニズムを認識し、ひいては本発明の方法が有益かつ新規なものであることを認識し得る。
【0034】
以下、本発明を実施例によりさらに詳細に説明するが、本発明はこれら実施例に制限されるものではない。
【実施例】
【0035】
第1 実験方法の概要
HUVECをスタチンにより24時間処理し、次いで回収した。処理後、溶解バッファーを細胞に加え、次いで超音波処理をした。タンパク質発現値をウエスタンブロット解析によって測定した。細胞分画は市販の細胞分画キットを用いて実施した。SmgGDSに対するsiRNAの導入はチリらの文献(Thill,R.,Campbell,W.B.,Williams,C.L.、J.Cell Biol.104, 1760−1770(2008))に従い行った。HUVECにおいてsiRNAを用いてSmgGDSをノックダウンした後、Rac1発現量およびAngII誘導性ROS生産量をサトーらの文献(Satoh,K.et al.、Nat.Med.15,649−656(2008))の記載に従って測定した。SmgGDS欠損マウスは大阪府立成人病センター研究所から入手した(タカクラらの文献(Takakura,A.et al.、Mol.Biol.Cell 11,1875−1886(2000))を参照)。マウスのAngII誘導心血管肥大モデルは、ヤギらの文献(Yagi,S.et al.、Circ.Res.102,68−76(2008))の記載に従って作製した。2週間、毎日、強制経口投与によってマウスにスタチンを投与した。AngIIを浸透圧ポンプにて2週間持続投与後、本発明者らは超音波診断システムを使用して左心室機能および心臓の重量を測定した。上記ヤギらの文献に記載されている通り、断面積、壁厚および線維化を測定するために組織学的実験を実施した。ヒトの研究は、日本の東北大学病院にて、単一施設の、無作為化された交差実験として実施した。合計20人の健康な被験者に2週に渡って、毎日、20mgのアトルバスタチンまたは20mgのプラバスタチンのいずれかを無作為に投与した。2週に渡る休薬期間を経た後、次いで2週に渡って、被験者に別の薬剤を服用させるように切り替えた。脂質プロファイル、PMNL中のSmgGDS発現値、および薬物安全性を測定するために、治療前およびスタチンの最後の摂取の24時間後に、絶食条件下で静脈血を採血した。リューらの文献(Liu,P.Y.,Chen,J.H.,Lin,L.J.,Liao,J.K.、J.Am.Coll.Cardiol.49,1619−1624(2007))に記載されたものをわずかに修正した方法に従って白血球を単離した。
【0036】
第2 実験の詳細
1 細胞培養および薬剤処理
ヒト臍帯静脈の内皮細胞(HUVEC)(タカラBio社、大津、日本)を、培地(EGM−2、ロンザ)にて、5% CO2にて37℃で24時間インキュベートした。次いで、異なる濃度(1−30μM)の各スタチン(アトルバスタチンおよびピタバスタチン)、GSK−3β阻害剤(塩化リチウム、シグマ)またはRhoキナーゼ阻害剤(ヒドロキシファスジル)を用いて細胞を24時間処理した。本発明者らは、スタチンと共にファルネシルピロリン酸(シグマ)もしくはゲラニルゲラニルピロリン酸(シグマ)を用いて24時間、またはプロテアソーム阻害剤であるMG−132(カルバイオケム)を用いて14時間、HUVECを共処理した。各薬剤処理後、細胞を、氷冷したリン酸塩緩衝食塩水(PBS)で2度洗浄し、次いで溶解用緩衝液を加えた後に超音波で処理した。細胞下分画をQproteome細胞コンパートメントキット(キアゲン)を用いて実施した。
【0037】
2 ウエスタンブロット解析
HUVECおよびヒトPMNLにおけるRhoA、Rac1およびSmgGDSの発現値を定量するために、同数のタンパク質サンプルをSDS−PAGEゲルにロードし、PVDF膜(GEヘルスケア)に転写した。さらに転写後のPVDF膜を、抗RhoA(サンタクルズ)、抗Rac1(ミリポア)、抗SmgGDS(BDトランスダクション・ラボ)、抗β−アクチン(シグマ)、抗GAPDH(サンタクルズ)、抗TIM23(BDトランスダクション・ラボ)および抗LAMIN A/C(BDトランスダクション・ラボ)を用いて、イムノブロットした。ホースラディシュ・ペルオキシダーゼをコンジュゲートしたウサギ抗マウス、ヤギ抗ウサギまたはロバ抗ヤギIgG抗体でインキュベートした後に、増強型化学発光システム(ECLウェスタンブロッティング検出キット、GEヘルスケア)を用いてブロットを視覚化した。濃度解析はイメージJ(NIH)ソフトウェアを用いて実施した。
【0038】
3 HUVECへのsiRNAの導入
SmgGDSに対するsiRNAはQiagenから購入した。Qiagenによって設計された機能的な非標的siRNAを、コントロールとして使用した。10nMのコントロールsiRNAまたは10nMのSmgGDSに特異的なsiRNAのいずれかをHiPerFectトランスフェクション試薬(キアゲン)を用いてHUVECに導入した。導入から72時間後、細胞をウエスタンブロット解析またはROS解析によって解析した。
【0039】
4 活性酸素種解析
HUVEC中の細胞内ROS生産をサトーらの文献(Satoh,K.et al.、 Nat.Med.15,649−656(2008))の記載に従って測定した。本発明者らは5%CO2において37℃で3時間、AngII(1μM、和光)を用いてHUVECを処理した。次いでPBSでHUVECを洗浄し、さらに37℃で30分間、2,7−ジクロロフルオレセインジアセテート(H2DCF−DA)(5μM、ケイマン)を用いてHUVECを染色した。蛍光顕微鏡(バイオレボ、キーエンス)を用いて緑蛍光(488nm)でROSの産生を可視化した。相対的な蛍光強度をBZ−IIアナライザー(キーエンス)ソフトウェアで測定した。
【0040】
5 心血管の肥大の解析および定量化
本発明者らは、東北大学大学院医学部動物実験委員会により承認された実験プロトコルに従ってマウス実験のすべてを実施した。本発明者らは、低用量スタチンの多面的効果に対するSmgGDS欠損の影響を評価するために、AngII誘発性心肥大モデル(ヤギらの文献(Yagi,S.et al.、Circ.Res.102,68−76(2008))を参照)を使用した。本発明者らは、10週齢のオスSmgGDS+/+同腹子コントロールマウスおよびSmgGDS+/−マウスに2週に渡って2.0mg/kg/日のAngIIまたは食塩水を投与した。本発明者らは、無菌食塩水にAngIIを溶かし、浸透ミニポンプ(アルゼットモデル2002,アルゼ社)によって該溶液を投与した。本発明者らは、イソフルオランにより動物に麻酔をかけた。本発明者らは、イソフルオランで麻酔をかけたマウスの背部の皮下にポケットを作製し浸透圧ポンプを留置し縫合した。AngIIまたは食塩水を投与したマウスの両方を、毎日、2週に渡って、強制経口投与によってスタチンまたは溶媒のいずれかを投与した。すべての切開部位は感染せずに治癒した。ポンプ移植から2週間後に、非侵襲性テール−カフシステム(MK−2000、室町)を使用して収縮血圧を測定した。血漿脂質(トリグリセリド、総コレステロール、LDLコレステロールおよびHDLコレステロール)を、スカイライトバイテックによる高速液体クロマトグラフィーシステムで解析した。心エコー解析を超音波診断システム(Vevo 2100、ビジュアルサイエンス社)を使用して実施した。マウスの毛を刈り、心拍数を約500bpmで維持し、左心室のMモードイメージを記録した。パーセントの室内径短縮率(FS)および相対的な壁厚を、イケダらの文献(Ikeda,Y.et al.、J. Biol.Chem.280,29661−29666(2005))の記載に従って計算した。
【0041】
6 スタチンの血漿中濃度
本発明者らは、ヒガシらの文献(Higashi,M.et al.、Circ.Res.93,767−775(2003))の記載に従って、2週に渡ってマウスを処理した後に、スタチン(アトルバスタチンおよびプラバスタチン)の血漿中濃度を測定した。
【0042】
7 ヒト臨床実験
本プロトコルは、東北大学大学院医学部の臨床研究倫理委員会によって承認された。また、書面による同意を得た後に、20人の正常健常志願者(表1)を募集した。
【表1】

【0043】
スタチン投与の前およびその最中に、異常な肝臓または腎臓の機能不全を含んでいた方は、除外した。志願者は、2週間のウォッシュアウト間隔を有する無作為交差方法で、2週に渡ってプラバスタチン(20mg/日)またはアトルバスタチン(20mg/日)を服用した。
【0044】
8 統計解析
2群間のパラメーターの比較を、スチューデントt検定で実施した。統計解析について、一元配置分散分析の後、ダネット検定を実施した。統計的有意差はJMP 8(SASインスティチュート)で評価した。<0.05のP値は、統計的に有意であると考えられた。
【0045】
第3 結果
1 HUVECにおけるスタチンによるSmgGDSの増加効果
本発明者らは、2種のスタチン(アトルバスタチン、10μMおよび30μM;ならびにピタバスタチン1μMおよび10μM)を用いて24時間処理した培養ヒト臍帯静脈内皮細胞(HUVEC)内のSmgGDS発現について検討した。これらの2種のスタチンは、濃度依存的に、HUVEC中のSmgGDS発現量を増加させた(図1a、b)。これは、スタチンがSmgGDS発現量を増加させるクラス効果を有するという新規な発見である。
【0046】
次に、本発明者らは、スタチンがSmgGDS発現量を増加させるメカニズムについて検討した。スタチンが、SmgGDSと同じARMタンパク質ファミリーのメンバーであるβ−カテニンを増大させるとの報告がある(ベルグマンらの文献(Bergmann,M.W.et al.,J.Mol.Cell.Cardiol.37, 681−690(2004))を参照)。これは、グリコゲンシンセターゼキナーゼ−3β(GSK−3β)のスタチンによる阻害およびそれによるβ−カテニンのリン酸化の阻害によって引き起こされる(リューらの文献(Liu,C.et al.,Cell 108,837−847(2002))、サリンらの文献(Salins,P. et al.,Neurosci.Lett. 412,211−216(2007))を参照)。リン酸化されたβ−カテニンはユビキチン化されプロテアソームにより分解されるため、β−カテニンのリン酸化の阻害は、β−カテニンの安定性を増加させる。以前に示されているように、GSK−3β阻害剤は、β−カテニンの発現量を増加させる(サリンらの文献(Salins,P. et al.,Neurosci. Lett. 412,211−216(2007))を参照))。したがって、本発明者らは、HUVEC内のSmgGDS発現量について、GSK−3β阻害剤であるSB216763の作用を検討した。本発明者らが期待した通り、SB216763は濃度依存的に、SmgGDS発現量を増加させた(図1c)。
【0047】
次に、本発明者らは、コレステロール生合成経路中の重要な生成物であるファルネシルピロリン酸(FPP)およびゲラニルゲラニルピロリン酸(GGPP)のようなイソプレノイドが、SmgGDS発現量のスタチン誘導型増加を媒介する可能性を検討した(ゴールドステインらの文献(Goldstein,J.L.,Brown, M.S.,Nature 343,425−430(1990))を参照)。FPPおよびGGPPが細胞内タンパク質の翻訳後修飾および小型GTPアーゼの膜への局在ならびにそれらの活性をコントロールするので、それらのタンパク質は、スタチンの多面的効果に中心的な役割を果たすと考えられている(ヴァン・アエルストらの文献(Van Aelst,L.,D’Souza−Schorey,C.,Genes Dev.11,2295−2322(1997))、ワンらの文献(Wang, C.Y.,Liu,P.Y.,Liao,J.K.,Trends Mol. Med. 14,37−44(2008))、ゾウらの文献(Zhou,Q.,Liao,J.K.,Circ.J.74,818−826(2010))らの文献を参照)。SmgGDSのスプライシング変異体が低分子量GTPアーゼのプレニル化および膜への局在をコントロールすることもまた報告されている(バーグらの文献(Berg,T.J.et al.,J.Biol.Chem.285,35255−35266(2010))を参照)。したがって、本発明者らは、HUVEC内のSmgGDS発現量について、スタチン共処理によるFPPおよびGGPPの影響を検討した。重要なことに、本発明者らの期待に反して、FPPまたはGGPPは、スタチンによるSmgGDS発現量の増加を阻害しなかった(図1b)。したがって、SmgGDS発現量を増加させるスタチンの影響はこれらのイソプレノイドにより媒介されないことが示された。
【0048】
次に、GEF機能がRhoキナーゼによって制御されると報告されているので(タケフジらの文献(Takefuji,M.et al.,Biochem.Biophys.Res.Commun.355,788−794(2007))を参照)、本発明者らはSmgGDS発現値の増加がRhoキナーゼ経路へのスタチンの阻害作用によりもたらされる可能性について検討した。本発明者らは、HUVECにRhoキナーゼ阻害剤であるヒドロキシファスジル(hydroxyfasudil)(HF)を作用させたが、HFはSmgGDS発現量を増加させなかった(図1c)。したがって、SmgGDS発現を増加させるスタチンの作用は、Rhoキナーゼ経路の阻害によって媒介されないと考えられる。これらの結果から、スタチンがGSK−3β経路の阻害によってSmgGDS発現量を増加させることを示した。
【0049】
2 スタチンのSmgGDSを介したROS産生量の抑制
HUVECにおけるSmgGDS、Rac1およびRhoAの局在および発現量についてのスタチンの影響を検討するために、本発明者らはスタチンで24時間処理した後の、HUVECの細胞質、膜および核分画におけるタンパク質発現量を調べた。その結果、アトルバスタチンは細胞質のSmgGDS量を増加させ、核内のRac1量を減少させた(図2a−c)。ピタバスタチンもまた細胞質のSmgGDS量を増加させ、かつ、核内のRac1量を減少させた(図7a−c)。これは、スタチンが核内Rac1量を減少させる最初の報告である。
【0050】
次に、本発明者らは、スタチンが核内のRac1量を減少させるメカニズムについて検討した。Rac1が核のプロテアソームによって分解させられることが報告されている(ラニングらの文献(Lanning,C.C.et al.,J.Biol. Chem.279,44197−44210(2004))を参照)。そこで、本発明者らはHUVECをスタチンおよびプロテアソーム阻害剤(MG−132)で処理した。本発明者らが期待した通り、MG−132はアトルバスタチンが引き起こす核内のRac1発現量の減少を阻害した(図2d)。同様の結果はピタバスタチンでも得られた(図7c)。以上より、スタチンが、Rac1の核内プロテアソーム分解を促進させることを実証している。
【0051】
さらに、本発明者らは、SmgGDSをsiRNAによってノックダウンしたHUVECにおけるスタチンの作用を検討した。コントロールsiRNAを導入した細胞において、アトルバスタチンは、総細胞におけるRac1発現量を減少させた(図2e)。しかしながら、SmgGDSのsiRNAを導入した細胞では、アトルバスタチンによるRac1発現量減少作用は認められなかった(図2e)。同様の結果はピタバスタチンを用いても得られた(図7d)。したがって、本発明者らは、スタチンがSmgGDSを介してRac1分解を促進させるということを明確に示すことができた。
【0052】
さらに、本発明者らは、スタチンの抗酸化作用を評価することによって、スタチンの多面的効果がRac1分解を担う可能性を調べた。スタチンがAngII誘導型ROS産生量を減少させることが報告されている(ワスマンらの文献(Wassmann, S.et al.,Mol.Pharmacol.59,646−654(2001))、カストディスらの文献(Custodis,F.,Eberl,M.,Kilter, H.,Bohm,M.,Laufs,U.,Cardiovasc. Res.71, 342−351(2006))を参照)。コントロールのsiRNAを導入した細胞では、アトルバスタチン(1μM)は、AngII誘導型ROS産生量を減少させた(図2f、g)。対照的に、SmgGDSのsiRNAを導入した細胞では、アトルバスタチン(1μM)は、AngII誘導型ROS産生を減少させることができなかった(図2f、g)。同じ結果はさらにピタバスタチン(0.1μM)を用いても得られた(図8a、b)。
【0053】
3 SmgGDS欠損マウスにおいてスタチンの多面的作用は消失する
in vitroで発見されたスタチンの作用がさらにin vivoにおいて機能するかどうかを検討するために、本発明者らは、AngIIにより誘導されるマウス心肥大および心拡張機能障害モデルを用いてスタチンの多面的効果を調べた。
【0054】
スタチンが、血圧または血漿コレステロール値に依存せず、AngII誘導マウス心肥大および心拡張機能障害モデルの病態を改善することが報告されている(タケモトらの文献(Takemoto M.et al.,J.Clin.Invest.108,1429−1437(2001))、ヤギらの文献(Yagi,S. et al.,Circ.Res.102,68−76(2008))を参照)。この改善作用は、スタチンの多面的効果であると考えられている。
【0055】
AngIIを2週に渡ってSmgGDS+/−および同腹子(SmgGDS+/+)マウスに持続投与した。収縮期血圧は、AngIIの投与によりSmgGDS+/−および同腹子マウスの両方において上昇した(表2)。
【表2】

【0056】
また、AngIIの投与により血漿の総およびLDL−コレステロール値は、上昇する傾向にあった(表2)。
【0057】
さらに、AngII投与開始より2週間スタチン(アトルバスタチン、10mg/kg/日、またはプラバスタチン、50mg/kg/日)を強制経口投与する群を設けた。本発明者らは、最終投与24時間後のスタチンの血漿中濃度を測定した(表3)。
【表3】

【0058】
本発明者らは、マウスのスタチンの血漿中濃度がヒトにおける24時間血漿中濃度(C24h)と同等であることを確認した。溶媒およびスタチン投与群の間の血圧または血漿の脂質プロファイルに有意差はなかった(表2)。
【0059】
心臓の重量の測定および心臓切除の顕微鏡検査により、AngIIにより心筋細胞および心筋の肥大を誘導し、著しい間質の線維化血管周囲の線維化および冠動脈の肥厚を誘発することを確認した(図3a−c)。同腹子マウスでは、AngII誘導型心肥大および線維化に対するスタチンの保護効果が見られた。しかし、SmgGDS+/−マウスでは、スタチンの保護効果は見られなかった(図3a−f)。さらに、本発明者らは、超音波検査法を使用して、これらのマウスの心機能を評価した(図4a−d)。LV短縮率(LVFS)(LVの収縮機能の指標)はAngIIまたはスタチン処理のいずれによっても有意な影響を受けなかった(図4b)。しかし、AngIIの投与は、コントロールおよびSmgGDS+/−マウスの両方において、LV拡張機能の指標であるE/Aを顕著に悪化させた(図4c)。対照的に、スタチン処理は、AngIIによって引き起こされたLV拡張機能障害を改善した(図4c)。SmgGDS+/−マウスでは、LVの心拡張機能障害について、スタチンの改善効果は認められなかった(図4c)。
【0060】
4 ヒトにおけるスタチンによるSmgGDSに対する作用
最後に、本発明者らは、2週に渡って経口的にプラバスタチンおよびアトルバスタチン(それぞれ、20mg/日)を投与して、健常成人におけるSmgGDS発現についてのスタチンの効果を調べた(図9)。両スタチンは、健常成人においても、総コレステロールおよびLDLコレステロールの血中濃度を減少させた(表4)。
【表4】

【0061】
循環血白血球中のSmgGDS発現は、プラバスタチンまたはアトルバスタチン服用後に有意に増加された(図5a)。20名の平均で、プラバスタチンの20mg投与によりSmgGDSは約1.4倍増加した。同様に、アトルバスタチンの20mg投与により、SmgGDSは約1.5倍増加した。さらに予備検討においてプラバスタチンの10mg投与ではSmgGDSの増加が認められなかった4例の被験者について、プラバスタチンの20mg投与によってSmgGDSが増加していることが確認できた。同様に、上記4例の被験者のうち3例の被験者については、プラバスタチンからアトルバスタチンへ切り替えることにより、SmgGDS増加作用が認められた。なお、この4例の被験者のLDLコレステロールは減少していたことにより、高コレステロール血症を治療目的とする場合は、投与量の増量や薬剤変更の対象とはならない。興味深いことに、プラバスタチン(親水性スタチン)およびアトルバスタチン(脂溶性スタチン)の両方ともヒトにおけるSmgGDS発現量に同程度の漸増的な効果を発揮し、ヒトにおけるSmgGDS量の増加というスタチンのクラス効果を示唆する結果となった。
【0062】
さらに、酸化ストレスマーカーの1つであるマロンジアルデヒド修飾(MDA)−LDLコレステロールは、スタチン処理により減少し(表4)、SmgGDS変化量およびMDA−LDLコレステロール量の間で、有意な逆相関関係が認められた。しかし、総コレステロールまたはLDLコレステロール量との間においては、相関関係は認められなかった(図5b−e)。
【技術分野】
【0001】
本発明は、スタチンの用法・用量を決定する方法に関する。
【背景技術】
【0002】
HMG−CoAレダクターゼ阻害剤(スタチン)は、臨床現場において、冠動脈疾患の第1次および第2次予防に対して広く使用されているコレステロール低下剤である(非特許文献1および2を参照)。さらに、近年、スタチンに脂質低下作用に加え心血管病に対して保護的に働く作用(いわゆる多面的効果)があることが報告され、脚光を浴びている(非特許文献3および4を参照)。スタチンの多面的作用は、細胞内タンパク質の翻訳後制御を担うイソプレノイドの合成減少によって媒介されるとされている(非特許文献1を参照)。すなわち、Rho、RacおよびRasなどの低分子量GTP結合タンパク質の活性は、膜への局在およびGTPアーゼ活性がそれらタンパク質のイソプレニル化に依存するものであり、スタチンの多面的効果を媒介すると考えられている(非特許文献5および6を参照)。
【0003】
本発明者らは、正常な健康被験者において、低用量スタチン(アトルバスタチンおよびプラバスタチンの20mg/日を一週間投与)が、循環白血球中のRhoA/Rhoキナーゼ活性を抑制することなく、Rac1活性のみを著しく阻害することを以前に実証した(非特許文献7を参照)。Rac1は、活性酸素種(ROS)を産生する際、重要な役割を有することが知られている。Rac1が、ROS産生を増加させ、心筋肥大やリモデリングを増加させることが報告されていることから、心血管肥大の重要なメディエーターである可能性が示唆されている(非特許文献8を参照)。
【0004】
アンジオテンシンII(AngII)により誘導される心肥大を有するマウスモデルにおいて、シンバスタチンが心臓および血管平滑筋中のRac1の下流に存在するニコチンアミドアデニンジヌクレオチドリン酸(NADPH)オキシダーゼ活性を阻害することが報告されている(非特許文献9および10を参照)。これらの知見はヒト心臓組織の解析により支持されており、スタチンは、Rac1の活性化によるROS産生を抑制することが報告されている(非特許文献11を参照)。これにより本発明者らは、低用量スタチンの多面的効果が、Rho/Rhoキナーゼ経路よりむしろRac1経路の阻害によって主として媒介されることを提案した(非特許文献7を参照)。
【0005】
低分子量GTP結合タンパク質GDP解離刺激因子(SmgGDS)は、アルマジロ(ARM)タンパクファミリーの中で、唯一グアニンヌクレオチド交換因子(GEF)にも属している(非特許文献12および13を参照)。最近、心疾患におけるGEFの役割が脚光を浴びている(非特許文献14〜16を参照)。また、精製されたSmgGDSが低分子量GTPアーゼのC末端の多塩基領域(PBR)と相互作用し、GEF機能によって、RhoAおよびRhoCを活性化することが報告されている(非特許文献17を参照)。さらに、Rac1のPBRに、RhoAには存在しない機能性核移行シグナル(NLS)配列が存在することが報告されている(非特許文献13を参照)。NLSを有するRac1は、SmgGDSと結合し、核内へ移行することにより、プロテアソーム系によって分解される可能性がある(非特許文献18を参照)。
【先行技術文献】
【非特許文献】
【0006】
【非特許文献1】Scandinavian SimvastatinSurvival Study Group. Randomized trial of cholesterol lowering in 4444 patientswith coronary heart disease: the Scandinavian Survival Study (4S). Lancet 344,1383-1389 (1994)
【非特許文献2】Levine, G.N., Keaney,Jr., J.F. & Vita, J.A., N. Engl. J. Med. 332, 512-521 (1995)
【非特許文献3】Davignon J., Circulation109, 39-43 (2004)
【非特許文献4】Rikitake, Y., Liao, J.K.,Circ. Res. 97, 1232-1235 (2005)
【非特許文献5】Hall, A., Science 279,509-514 (1998)
【非特許文献6】Takemoto, M., Liao JK., Arterioscler.Thromb. Vasc. Biol. 21, 1712-1719 (2001)
【非特許文献7】Rashid M. et al., Circ.J. 73, 361-370 (2009)
【非特許文献8】Brown J.H., Del Re,D.P., Sussman, M.A., Circ. Res. 98, 730-742 (2006)
【非特許文献9】Takemoto M. et al., J.Clin. Invest. 108, 1429-1437 (2001)
【非特許文献10】Wassmann, S. et al., Mol.Pharmacol. 59, 646-654 (2001)
【非特許文献11】Maack, C. et al., Circulation108, 1567-1574 (2003)
【非特許文献12】Yamamoto, T. et al., J.Biol. Chem. 265, 16626-16634 (1990)
【非特許文献13】Williams, C.L., Cellsignal. 15, 1071-1080 (2003)
【非特許文献14】Guilluy, C. et al., Nat.Med. 16, 183-190 (2010)
【非特許文献15】Sauzeau, V., Sevilla,M.A., Montero, M.J. & Bustelo, X.R., J. Clin. Invest. 120, 315-330 (2010)
【非特許文献16】Sauzeau, V. et al., Nat.Med. 12, 841-845 (2006)
【非特許文献17】Hamel, B. et al., J.Biol. Chem. 286, 12141-12148 (2011)
【非特許文献18】Lannning, C.C. et al., J.Biol. Chem. 279, 44197-44210 (2004)
【発明の概要】
【発明が解決しようとする課題】
【0007】
上記の通り、Rho、RacおよびRasなどの低分子量GTP結合タンパク質の活性とスタチンの多面的効果との間には、なんらかの関係性があると考えられている。しかし、低用量スタチンの多面的作用の分子機序については、未だ不明な点が多い。
【0008】
また、本発明者らは、低用量スタチンの多面的効果がRac1経路の阻害によって主として媒介される可能性を提案した。しかし、低用量スタチンによるRac1シグナル経路の選択的阻害の分子機序は未だ解明されていない。また、そのことに起因して、現在臨床的に用いられているスタチンのほとんどが、高コレステロール血症に対する治療薬として用いられており、心疾患、たとえば、心血管肥大症への適用について十分に検討されていない。
【0009】
そこで、本発明は、スタチンによるRac1シグナル経路の選択的阻害の分子機序の一端を解明することにより、心疾患を罹患している患者に対して、スタチンの用法・用量を決定する方法を提供することを、発明が解決しようとする課題とした。
【課題を解決するための手段】
【0010】
本発明者らは、これまでに得られた知見について検討を重ねたところ、スタチンによるRac1シグナル経路の選択的阻害に係る分子メカニズムにおいて、SmgGDSが重要な役割を果たすのではないかと仮定した。そこで、鋭意研究開発を進めて得られた本発明者らの結果は、動物およびヒトにおいて、核内Rac1の分解の増大をもたらすスタチンの多面的効果の分子機序では、SmgGDSが重大な役割を果たすという最初の証拠となるものである。この分子メカニズムは図6により概略される。
【0011】
まず、スタチンは、細胞質中のSmgGDS発現を増加させる。第2に、SmgGDSはRac1と結合して、核へ輸送する。第3に、Rac1は核プロテアソームによって分解される。第4に、Rac1の分解はROS産生の減少を引き起こす。最後に、このROS産生の減少は心血管の保護、すなわち、心血管肥大症、心筋細胞肥大症、血管周囲線維化症または冠動脈硬化症といった心疾患の治療や予防に関するスタチンの多面的効果が引き起こされる(図6)。本発明は、このような知見に基づいて完成された発明である。
【0012】
したがって、本発明によれば、(1)スタチンの投与前および投与後において、心疾患を罹患した患者における細胞内のSmgGDS発現量を測定する工程、および、(2)前記工程(1)で測定されたSmgGDS発現量を基準に前記患者に対するスタチンの種類および/または投与量を決定する工程を含む、心疾患を罹患した患者へのスタチンの用法および/または用量を決定する方法が提供される。
【0013】
好ましくは、前記心疾患が、心血管肥大症、心筋細胞肥大症、心血管周囲線維化、冠動脈硬化症、高血圧症または心不全である。
【0014】
好ましくは、前記スタチンが、アトルバスタチン、ジヒドロコンパクチン、ベルバスタチン、カルバスタチン、セリバスタチン、クリルバスタチン、ダルバスタチン、フルバスタチン、グレンバスタチン、フルインドスタチン、ベロスタチン、ロバスタチン、メバスタチン、コンパクチン、ピタバスタチン、プラバスタチン、リバスタチン、ロスバスタチン、シンバスタチン、シリバスタチン、CI−981およびそれらの薬学的に許容される塩からなる群から選択される。
【0015】
好ましくは、前記基準が、スタチン投与後のSmgGDS発現量がスタチン投与前のSmgGDS発現量の1.4倍以上である。
【発明の効果】
【0016】
本発明の方法によれば、心疾患を罹患している患者に対して、使用すべきスタチンの種類および/または投与量を決定することにより、スタチンの用法・用量を決定することができる。本発明の方法の利点としては、疾患の症状ではなく、細胞内SmgGDS発現量を確認することにより、迅速かつ客観的に、治療時のスタチンの用法・用量を決定できる。
【図面の簡単な説明】
【0017】
【図1a】図1aは、スタチンがGSK−3β経路を介してHUVEC中のSmgGDSを増加させたことを示す図である。HUVECを用いてアトルバスタチン(ATOR)を24時間作用させた後のSmgGDSタンパク質の発現量を示す(n=3)。結果は平均値±s.e.mとして表される。
【図1b】図1bは、スタチンがGSK−3β経路を介してHUVEC中のSmgGDSを増加させたことを示す図である。HUVECを用いてピタバスタチン(PITA)を24時間作用させた後のSmgGDSタンパク質の発現量を示す(n=3)。結果は平均値±s.e.mとして表される。
【図1c】図1cは、スタチンがGSK−3β経路を介してHUVEC中のSmgGDSを増加させたことを示す図である。HUVECを用いてGSK−3β阻害薬であるSB216763を24時間作用させた後のSmgGDSタンパク質の発現量を示す(n=3)。結果は平均値±s.e.mとして表される。
【図1d】図1dは、スタチンがGSK−3β経路を介してHUVEC中のSmgGDSを増加させたことを示す図である。HUVECを用いてRhoキナーゼ阻害薬を24時間作用させた後のSmgGDSタンパク質の発現量を示す(n=3)。結果は平均値±s.e.mとして表される。
【図1e】図1eは、スタチンがGSK−3β経路を介してHUVEC中のSmgGDSを増加させたことを示す図である。HUVECを用いて、アトルバスタチンおよびピタバスタチンに加えてファルネシルピロリン酸(FPP、10μM)およびゲラニルゲラニルピロリン酸(GGPP、10μM)を作用させた後のSmgGDSタンパク質の発現量を示す(n=3)。結果は平均値±s.e.mとして表される。
【図2a】図2aは、HUVECの細胞分画中のタンパク質発現に対するアトルバスタチンの影響を示した図である。アトルバスタチン(ATOR、10μM)を用いてHUVECを24時間インキュベーションした後のウエスタンブロット解析結果を示す。
【図2b】図2bは、HUVEC細胞分画中のタンパク質発現に対するアトルバスタチンの影響を示した図である。Rac1の定量解析結果を示す(n=3)。結果は平均値±s.e.mとして表される。
【図2c】図2cは、HUVEC細胞分画中のタンパク質発現に対するアトルバスタチンの影響を示した図である。SmgGDSの定量解析結果を示す(n=3)。結果は平均値±s.e.mとして表される。
【図2d】図2dは、HUVEC細胞分画中のタンパク質発現に対するアトルバスタチンの影響を示した図である。核分画中のRac1発現について、アトルバスタチンに加えてプロテアソーム阻害剤(MG−132)を作用させた際の影響を示す(n=3)。結果は平均値±s.e.mとして表される。
【図2e】図2eは、HUVEC中のタンパク質発現に対するアトルバスタチンの影響を示した図である。コントロールまたはSmgGDSのsiRNAを導入し、48時間後、アトルバスタチンを加え、24時間作用させた後のRac1の発現量を示す(n=3)。結果は平均値±s.e.mとして表される。
【図2f】図2fは、酸化ストレスに対するアトルバスタチンの影響を示した図である。HUVECをアトルバスタチン(1μM)で24時間プレインキュベートし、1μMのAngIIを3時間作用させた後のHUVECのジクロロフルオレセイン(DCF)染色の結果を示す。
【図2g】図2gは、酸化ストレスに対するアトルバスタチンの影響を示した図である。輝度定量解析の結果を示す(n=8)。結果は平均値±s.e.mとして表される。
【図3a】図3aは、スタチンによる改善作用がAngII誘導型心臓肥大および線維化を有するSmgGDS欠損マウスにおいて見られないことを示した図である。コントロール(−)、アトルバスタチン(AngII+ATOR、10mg/kg/日)またはプラバスタチン(AngII+PRA、50mg/kg/日)のいずれかで処理したAngII投与マウスおよびAngII投与マウス(溶媒投与、AngII(+))における心臓のマッソン・トリクローム染色の結果を示す。心筋の肥大(上部)。間質性心筋の線維化(中間)。冠動脈の血管周囲領域の線維化(下部)。
【図3b】図3bは、スタチンによる改善作用がAngII誘導型心臓肥大および線維化を有するSmgGDS欠損マウスにおいて見られないことを示した図である。溶媒またはスタチンを投与されたSmgGDS+/+マウスおよびSmgGDS+/−マウスの心臓重量/体重比を、AngII注入の2週間後に測定した結果を示す(n=10)。結果は平均値±s.e.mとして示される。
【図3c】図3cは、スタチンによる改善作用がAngII誘導型心臓肥大および線維化を有するSmgGDS欠損マウスにおいて見られないことを示した図である。溶媒またはスタチンで処理されたSmgGDS+/+マウスおよびSmgGDS+/−マウスの心筋細胞の断面積を、AngII注入の2週間後に測定した結果を示す(n=10)。結果は平均値±s.e.mとして示される。
【図3d】図3dは、スタチンによる改善作用がAngII誘導型心臓肥大および線維化を有するSmgGDS欠損マウスにおいて見られないことを示した図である。間質性心筋の線維化の定量解析結果を示す(n=10)。結果は平均値±s.e.mとして示される。
【図3e】図3eは、スタチンによる改善作用がAngII誘導型心臓肥大および線維化を有するSmgGDS欠損マウスにおいて見られないことを示した図である。血管周囲領域の線維化の定量解析結果を示す(n=10)。結果は平均値±s.e.mとして示される。
【図3f】図3fは、スタチンによる改善作用がAngII誘導型心臓肥大および線維化を有するSmgGDS欠損マウスにおいて見られないことを示した図である。心臓血管のリモデリングの定量解析結果を示す(n=10)。結果は平均値±s.e.mとして示される。
【図4a】図4aは、スタチンによる改善作用がAngII誘導型の心臓拡張機能障害を有するSmgGDS欠損マウスにおいて見られないことを示した図である。コントロール(−)、アトルバスタチン(AngII+ATOR、10mg/kg/日)またはプラバスタチン(AngII+PRA、50mg/kg/日)のいずれかで処理されたAngII投与マウスおよびAngII投与マウス(溶媒投与、AngII(+))の超音波心臓検査の結果を示す。図4aは、心臓の壁厚についての結果を示す(n=10)。結果は平均値±s.e.mとして示される。
【図4b】図4bは、スタチンによる改善作用がAngII誘導型の心臓拡張機能障害を有するSmgGDS欠損マウスにおいて見られないことを示した図である。コントロール(−)、アトルバスタチン(AngII+ATOR、10mg/kg/日)またはプラバスタチン(AngII+PRA、50mg/kg/日)のいずれかで処理されたAngII投与マウスおよびAngII投与マウス(溶媒投与、AngII(+))の超音波心臓検査の結果を示す。図4bは、左室内径短縮率についての結果を示す(n=10)。結果は平均値±s.e.mとして示される。
【図4c】図4cは、スタチンによる改善作用がAngII誘導型の心臓拡張機能障害を有するSmgGDS欠損マウスにおいて見られないことを示した図である。コントロール(−)、アトルバスタチン(AngII+ATOR、10mg/kg/日)またはプラバスタチン(AngII+PRA、50mg/kg/日)のいずれかで処理されたAngII投与マウスおよびAngII投与マウス(溶媒投与、AngII(+))の超音波心臓検査の結果を示す。図4cは、E/A比についての結果を示す(n=10)。結果は平均値±s.e.mとして示される。
【図4d】図4dは、スタチンによる改善作用がAngII誘導型の心臓拡張機能障害を有するSmgGDS欠損マウスにおいて見られないことを示した図である。コントロール(−)、アトルバスタチン(AngII+ATOR、10mg/kg/日)またはプラバスタチン(AngII+PRA、50mg/kg/日)のいずれかで処理されたAngII投与マウスおよびAngII投与マウス(溶媒投与、AngII(+))の超音波心臓検査の結果を示す。図4dは、心拍数についての結果を示す(n=10)。結果は平均値±s.e.mとして示される。
【図5a】図5aは、スタチンがヒトにおいてSmgGDSを増加させることを示した図である。ヒトの循環白血球中のSmgGDSのタンパク質量を示す。プラバスタチン(PRA、20mg/日)またはアトルバスタチン(ATOR、20mg/日)を2週間投与した後、投与前と比較して著しくSmgGDS値を増加させることを示した図である(n=20)。結果は平均値±s.dとして示される。
【図5b】図5bは、スタチンがヒトにおいてSmgGDSを増加させることを示した図である。ヒトのSmgGDS変化およびLDLコレステロール変化の間の相関を示す(n=20)。
【図5c】図5cは、スタチンがヒトにおいてSmgGDSを増加させることを示した図である。ヒトのSmgGDS変化およびLDLコレステロール変化の間の相関を示す(n=20)。
【図5d】図5dは、スタチンがヒトにおいてSmgGDSを増加させることを示した図である。ヒトのSmgGDS変化およびMDA−LDLコレステロール変化の間の相関を示す(n=20)。
【図5e】図5eは、スタチンがヒトにおいてSmgGDSを増加させることを示した図である。ヒトのSmgGDS変化およびMDA−LDLコレステロール変化の間の相関を示す(n=20)。
【図6】図6は、スタチンの多面的効果の新規分子機序を概略化した図である。低用量スタチンは、GSK−3βを介してSmgGDSを増加させる。増加したSmgGDSは、Rac1と結合し、核に移行させる。核内に移行したRac1は、プロテアソームにより分解される。Rac1の分解は、ROSの産生を減らし、最終的に、心筋細胞肥大や線維化、そして心肥大を抑制し、スタチンの多面的作用をもたらす。
【図7a】図7aは、HUVECの細胞分画中のタンパク質発現に対するピタバスタチンの影響を示した図である。ピタバスタチン(PITA、1μM)を用いてHUVECを24時間インキュベーションした後のウエスタンブロット解析結果を示す。
【図7b】図7bは、HUVECの細胞分画中のタンパク質発現に対するピタバスタチンの影響を示した図である。Rac1およびSmgGDSの定量解析結果を示す(n=3)。結果は平均値±s.e.mとして表される。
【図7c】図7cは、HUVEC細胞分画中のタンパク質発現に対するピタバスタチンの影響を示した図である。SmgGDSの定量解析結果を示す(n=3)。結果は平均値±s.e.mとして表される。
【図7d】図7dは、HUVEC細胞分画中のタンパク質発現に対するピタバスタチンの影響を示した図である。核分画中のRac1発現について、ピタバスタチンに加えてプロテアソーム阻害剤(MG−132)を作用させた際の影響を示す(n=3)。結果は平均値±s.e.mとして表される。
【図7e】図7eは、HUVEC中のタンパク質発現に対するピタバスタチンの影響を示した図である。コントロール、またはSmgGDSのsiRNAを導入し、48時間後、ピタバスタチンを加え、24時間作用させた後のRac1の発現量を示す(n=3)。結果は平均値±s.e.mとして表される。
【図8a】図8aは、酸化ストレスに対するピタバスタチンの影響を示した図である。HUVECをピタバスタチン(0.1μM)で24時間プレインキュベートし、1μMのAngIIを3時間作用させた後のHUVECのジクロロフルオレセイン(DCF)染色の結果を示す。
【図8b】図8bは、酸化ストレスに対するピタバスタチンの影響を示した図である。輝度定量解析の結果を示す(n=8)。結果は平均値±s.e.mとして表される。
【図9】図9は、臨床研究の実験計画のフロー図を示す。
【発明を実施するための形態】
【0018】
以下、本発明の詳細について説明する。
【0019】
本発明によれば、以下の工程を含む、心疾患を罹患した患者へのスタチンの用法、用量またはそれらの両方を決定する方法が提供される。
(1)スタチンの投与前および投与後において、心疾患を罹患した患者における細胞内のSmgGDS発現量を測定する工程(以下、工程(1)ともよぶ。)
(2)前記工程(1)で測定されたSmgGDS発現量を基準に前記患者に対するスタチンの種類および/または投与量を決定する工程(以下、工程(2)ともよぶ。)
【0020】
心疾患とは、心臓の疾患の総称である。本発明の方法は、スタチンの多面的効果の一つとしてスタチンが活性酸素種(ROS)を減少させることに基づいていることから、本発明の方法において対象となる心疾患は、ROSに起因する心疾患が好ましく、たとえば、心血管肥大症、心筋細胞肥大症、心血管周囲線維化、冠動脈硬化症、高血圧症、心不全などである。
【0021】
本発明の方法において対象となる心疾患を罹患した患者は、特に制限されず、現に心疾患を罹患している患者のみならず、心疾患の既往歴がある者、遺伝的または体質的に心疾患に罹患するおそれがある者、他の疾患との関係で心疾患に罹患する可能性がある者などを含む。また、心疾患の進行の程度についても特に制限はない。
【0022】
スタチンは、HMG−CoA還元酵素阻害剤ともいわれ、図6に示すRho/Rho−キナーゼ経路におけるHMG−CoAをメバロン酸塩へ変換する反応を触媒する酵素であるHMG−CoAレダクターゼを阻害する薬剤として知られている。スタチンとしては、種々のものが知られており、現在臨床で使用されているものの他にも、販売または開発が中止になったもの、現在臨床実験が進められているものなどがある。本発明の方法において対象となるスタチンは、特に制限はなく、スタチンとして知られているもののすべてを含むが、好ましくは、アトルバスタチン、ジヒドロコンパクチン、ベルバスタチン、カルバスタチン、セリバスタチン、クリルバスタチン、ダルバスタチン、フルバスタチン、グレンバスタチン、フルインドスタチン、ベロスタチン、ロバスタチン、メバスタチン、コンパクチン、ピタバスタチン、プラバスタチン、リバスタチン、ロスバスタチン、シンバスタチン、シリバスタチン、CI−981およびそれらの薬学的に許容される塩である。
【0023】
本明細書におけるスタチンは、化合物としてのスタチンに限らず、スタチンと賦形剤とを配合してなるスタチン製剤を含む。スタチン製剤としては、たとえば、アトルバスタチン塩を有効成分とするリピトール錠、プラバスタチン塩を有効成分とするメバロチン錠などが挙げられる。
【0024】
スタチンは、これまで高脂血症や高コレステロール血症の治療剤として臨床的に使用されており、心血管肥大症や心筋細胞肥大症などの心疾患の治療剤としては臨床的に使用されていない。本発明の方法は、このような現状を鑑みて、心疾患へのスタチンの臨床的応用を促進することを目的としてなされたものである。したがって、本発明は、スタチンの臨床的応用のさらなる可能性を追求した、画期的な発明である。本発明の方法によれば、心疾患の治療の選択肢が広がることから、本発明は患者および医師の双方にとって非常に有益なものである。
【0025】
本発明の方法における工程(1)では、スタチンの投与前および投与後において、心疾患を罹患した患者における細胞内のSmgGDS発現量を測定する。SmgGDS発現量の測定は、当業者により知られている細胞内タンパク質を定量化する方法を応用して実施できるが、たとえば、心疾患を罹患した患者から生体試料を採取し、次いで生体試料における細胞を単離し、次いで細胞をホモジナイズしてSmgGDSを含む溶解物を取得し、次いでSmgGDSを定量することにより実施する。
【0026】
より具体的には、絶食条件下で心疾患を罹患した患者の静脈血を採血し、次いで白血球を単離し、次いで単離した白血球を適当な緩衝液を用いて数回洗浄し、次いで洗浄した白血球を溶解用緩衝液に加えて超音波などで破砕して細胞溶解液を得て、次いで得られた細胞溶解液を試料として抗SmgGDS抗体などを用いてウエスタンブロット解析を実施することにより白血球内のSmgGDSを定量する。なお、細胞溶解液を細胞下分画して、細胞内でのSmgGDSの偏在を調べるなどしてもよい。
【0027】
SmgGDS発現量の測定は、スタチンの投与前、たとえばスタチンを投与する直前、および投与後、たとえばスタチンを投与した24時間後の少なくとも2回、心疾患を罹患した患者から採取した生体試料に基づいて実施する。
【0028】
本発明の方法における工程(2)では、工程(1)で測定されたSmgGDS発現量を基準に心疾患を罹患した患者に対するスタチンの種類、投与量またはそれらの両方を決定する。本発明の方法は、スタチンのROSの減少効果に基づいて、心疾患を罹患した患者に対してスタチンの臨床的応用を促すものである。スタチンのROS減少効果は、スタチンがGSK−3βを阻害し、それによりGSK−3βが標的とするSmgGDSが細胞内で増加またはその活性が増強することによってもたらされる。すなわち、SmgGDSは核にRac1を輸送する。Rac1は核プロテアソームによって分解される。Rac1分解はROS生産の減少を引き起こす。ROS生成量の上昇は心筋細胞の肥大および血管周囲の線維化を引き起こすので、Rac1が媒介するROS生成量の減少化は心血管の肥大を減少させることにつながる。したがって、スタチンを心疾患患者に投与した際にSmgGDSの細胞内発現量が上昇していれば、該患者において心疾患の改善が見込める。
【0029】
本発明の方法において、スタチン投与前と投与後の細胞内SmgGDS発現量を比較し、投与後の発現量が投与前の発現量と変わらない、または減少している場合、投与すべきスタチンの種類を変える、スタチンの投与量を増量する、それらの両方を実施するといった選択肢を取り得る。いずれの選択肢を採用するかはスタチンの投与回数や投与期間などを考慮して決定すればよく、たとえば、はじめにスタチンの投与量を増量し、次いで投与前後で細胞内SmgGDS発現量に差異が見られない場合は、スタチンの種類を変えるよう決定できる。これとは逆に、投与後のSmgGDS発現量が投与前のSmgGDS発現量よりも増加している場合は、スタチンの投与量を変えないように決定する。
【0030】
また、実施例において示されている通り、プラバスタチンの10mg投与により、被験者においては、LDLコレステロールの減少は認められるけれども、SmgGDSの増加が認められない場合がある。この場合、LDLコレステロールの増減を基準としては、スタチン投与量の増量や薬剤変更は考慮され得ず、心疾患を罹患した患者に対してスタチンの有効量を投与できない。したがって、本発明の方法を採用することによりはじめて、細胞内SmgGDS発現量の増減を基準とすることにより、心疾患を罹患した患者に対して適切なスタチンの有効量を投与することが可能となる。
【0031】
図5aの結果を考慮すれば、スタチンの10mg投与を20mg投与へ変更することにより細胞内SmgGDS発現量は1.4倍以上増加し得ることから、スタチン投与後のSmgGDS発現量がスタチン投与前のSmgGDS発現量の1.4倍以上であるか否かを基準として、スタチンの種類や投与量を決定するのが好ましい。
【0032】
本発明の方法は、本発明の目的を達成し得る範囲において、工程(1)および工程(2)のそれぞれの工程の前後に他の工程を組み入れることを排除しない。また、本発明の方法により心疾患患者に対して有益なスタチンの種類および投与量を決定することができるが、本発明の方法と合わせて心疾患の程度の指標となる様々な数値や症状などと組み合わせて、スタチンの種類および投与量を決定できる。
【0033】
当業者であれば、本発明の方法の有用性について、後述する実施例において示されている種々の実験結果により把握できる。そのような結果の一例として、培養内皮細胞において、スタチンは、メバロン酸塩またはRho/Rhoキナーゼ経路と無関係にSmgGDS発現を増強し、Rac1分解を増加させ、かつ、ROSの生成量を増加させたとの結果;SmgGDS欠損マウスではスタチンの心血管の保護効果は見られなかったとの結果;正常な健常個体においてスタチンは著しくSmgGDS発現を増加させたとの結果;SmgGDS発現量と酸化ストレスマーカーとの間に有意な逆相関があったとの結果;総コレステロールまたはLDLコレステロールと酸化ストレスマーカーとの間に相関は見られなかったとの結果などである。当業者であれば、これらの結果を参照することにより、メバロン酸塩およびRho/Rhoキナーゼ経路の阻害に加えて、Rac1分解の増加を媒介するスタチンの有益かつ新規な活性メカニズムを認識し、ひいては本発明の方法が有益かつ新規なものであることを認識し得る。
【0034】
以下、本発明を実施例によりさらに詳細に説明するが、本発明はこれら実施例に制限されるものではない。
【実施例】
【0035】
第1 実験方法の概要
HUVECをスタチンにより24時間処理し、次いで回収した。処理後、溶解バッファーを細胞に加え、次いで超音波処理をした。タンパク質発現値をウエスタンブロット解析によって測定した。細胞分画は市販の細胞分画キットを用いて実施した。SmgGDSに対するsiRNAの導入はチリらの文献(Thill,R.,Campbell,W.B.,Williams,C.L.、J.Cell Biol.104, 1760−1770(2008))に従い行った。HUVECにおいてsiRNAを用いてSmgGDSをノックダウンした後、Rac1発現量およびAngII誘導性ROS生産量をサトーらの文献(Satoh,K.et al.、Nat.Med.15,649−656(2008))の記載に従って測定した。SmgGDS欠損マウスは大阪府立成人病センター研究所から入手した(タカクラらの文献(Takakura,A.et al.、Mol.Biol.Cell 11,1875−1886(2000))を参照)。マウスのAngII誘導心血管肥大モデルは、ヤギらの文献(Yagi,S.et al.、Circ.Res.102,68−76(2008))の記載に従って作製した。2週間、毎日、強制経口投与によってマウスにスタチンを投与した。AngIIを浸透圧ポンプにて2週間持続投与後、本発明者らは超音波診断システムを使用して左心室機能および心臓の重量を測定した。上記ヤギらの文献に記載されている通り、断面積、壁厚および線維化を測定するために組織学的実験を実施した。ヒトの研究は、日本の東北大学病院にて、単一施設の、無作為化された交差実験として実施した。合計20人の健康な被験者に2週に渡って、毎日、20mgのアトルバスタチンまたは20mgのプラバスタチンのいずれかを無作為に投与した。2週に渡る休薬期間を経た後、次いで2週に渡って、被験者に別の薬剤を服用させるように切り替えた。脂質プロファイル、PMNL中のSmgGDS発現値、および薬物安全性を測定するために、治療前およびスタチンの最後の摂取の24時間後に、絶食条件下で静脈血を採血した。リューらの文献(Liu,P.Y.,Chen,J.H.,Lin,L.J.,Liao,J.K.、J.Am.Coll.Cardiol.49,1619−1624(2007))に記載されたものをわずかに修正した方法に従って白血球を単離した。
【0036】
第2 実験の詳細
1 細胞培養および薬剤処理
ヒト臍帯静脈の内皮細胞(HUVEC)(タカラBio社、大津、日本)を、培地(EGM−2、ロンザ)にて、5% CO2にて37℃で24時間インキュベートした。次いで、異なる濃度(1−30μM)の各スタチン(アトルバスタチンおよびピタバスタチン)、GSK−3β阻害剤(塩化リチウム、シグマ)またはRhoキナーゼ阻害剤(ヒドロキシファスジル)を用いて細胞を24時間処理した。本発明者らは、スタチンと共にファルネシルピロリン酸(シグマ)もしくはゲラニルゲラニルピロリン酸(シグマ)を用いて24時間、またはプロテアソーム阻害剤であるMG−132(カルバイオケム)を用いて14時間、HUVECを共処理した。各薬剤処理後、細胞を、氷冷したリン酸塩緩衝食塩水(PBS)で2度洗浄し、次いで溶解用緩衝液を加えた後に超音波で処理した。細胞下分画をQproteome細胞コンパートメントキット(キアゲン)を用いて実施した。
【0037】
2 ウエスタンブロット解析
HUVECおよびヒトPMNLにおけるRhoA、Rac1およびSmgGDSの発現値を定量するために、同数のタンパク質サンプルをSDS−PAGEゲルにロードし、PVDF膜(GEヘルスケア)に転写した。さらに転写後のPVDF膜を、抗RhoA(サンタクルズ)、抗Rac1(ミリポア)、抗SmgGDS(BDトランスダクション・ラボ)、抗β−アクチン(シグマ)、抗GAPDH(サンタクルズ)、抗TIM23(BDトランスダクション・ラボ)および抗LAMIN A/C(BDトランスダクション・ラボ)を用いて、イムノブロットした。ホースラディシュ・ペルオキシダーゼをコンジュゲートしたウサギ抗マウス、ヤギ抗ウサギまたはロバ抗ヤギIgG抗体でインキュベートした後に、増強型化学発光システム(ECLウェスタンブロッティング検出キット、GEヘルスケア)を用いてブロットを視覚化した。濃度解析はイメージJ(NIH)ソフトウェアを用いて実施した。
【0038】
3 HUVECへのsiRNAの導入
SmgGDSに対するsiRNAはQiagenから購入した。Qiagenによって設計された機能的な非標的siRNAを、コントロールとして使用した。10nMのコントロールsiRNAまたは10nMのSmgGDSに特異的なsiRNAのいずれかをHiPerFectトランスフェクション試薬(キアゲン)を用いてHUVECに導入した。導入から72時間後、細胞をウエスタンブロット解析またはROS解析によって解析した。
【0039】
4 活性酸素種解析
HUVEC中の細胞内ROS生産をサトーらの文献(Satoh,K.et al.、 Nat.Med.15,649−656(2008))の記載に従って測定した。本発明者らは5%CO2において37℃で3時間、AngII(1μM、和光)を用いてHUVECを処理した。次いでPBSでHUVECを洗浄し、さらに37℃で30分間、2,7−ジクロロフルオレセインジアセテート(H2DCF−DA)(5μM、ケイマン)を用いてHUVECを染色した。蛍光顕微鏡(バイオレボ、キーエンス)を用いて緑蛍光(488nm)でROSの産生を可視化した。相対的な蛍光強度をBZ−IIアナライザー(キーエンス)ソフトウェアで測定した。
【0040】
5 心血管の肥大の解析および定量化
本発明者らは、東北大学大学院医学部動物実験委員会により承認された実験プロトコルに従ってマウス実験のすべてを実施した。本発明者らは、低用量スタチンの多面的効果に対するSmgGDS欠損の影響を評価するために、AngII誘発性心肥大モデル(ヤギらの文献(Yagi,S.et al.、Circ.Res.102,68−76(2008))を参照)を使用した。本発明者らは、10週齢のオスSmgGDS+/+同腹子コントロールマウスおよびSmgGDS+/−マウスに2週に渡って2.0mg/kg/日のAngIIまたは食塩水を投与した。本発明者らは、無菌食塩水にAngIIを溶かし、浸透ミニポンプ(アルゼットモデル2002,アルゼ社)によって該溶液を投与した。本発明者らは、イソフルオランにより動物に麻酔をかけた。本発明者らは、イソフルオランで麻酔をかけたマウスの背部の皮下にポケットを作製し浸透圧ポンプを留置し縫合した。AngIIまたは食塩水を投与したマウスの両方を、毎日、2週に渡って、強制経口投与によってスタチンまたは溶媒のいずれかを投与した。すべての切開部位は感染せずに治癒した。ポンプ移植から2週間後に、非侵襲性テール−カフシステム(MK−2000、室町)を使用して収縮血圧を測定した。血漿脂質(トリグリセリド、総コレステロール、LDLコレステロールおよびHDLコレステロール)を、スカイライトバイテックによる高速液体クロマトグラフィーシステムで解析した。心エコー解析を超音波診断システム(Vevo 2100、ビジュアルサイエンス社)を使用して実施した。マウスの毛を刈り、心拍数を約500bpmで維持し、左心室のMモードイメージを記録した。パーセントの室内径短縮率(FS)および相対的な壁厚を、イケダらの文献(Ikeda,Y.et al.、J. Biol.Chem.280,29661−29666(2005))の記載に従って計算した。
【0041】
6 スタチンの血漿中濃度
本発明者らは、ヒガシらの文献(Higashi,M.et al.、Circ.Res.93,767−775(2003))の記載に従って、2週に渡ってマウスを処理した後に、スタチン(アトルバスタチンおよびプラバスタチン)の血漿中濃度を測定した。
【0042】
7 ヒト臨床実験
本プロトコルは、東北大学大学院医学部の臨床研究倫理委員会によって承認された。また、書面による同意を得た後に、20人の正常健常志願者(表1)を募集した。
【表1】

【0043】
スタチン投与の前およびその最中に、異常な肝臓または腎臓の機能不全を含んでいた方は、除外した。志願者は、2週間のウォッシュアウト間隔を有する無作為交差方法で、2週に渡ってプラバスタチン(20mg/日)またはアトルバスタチン(20mg/日)を服用した。
【0044】
8 統計解析
2群間のパラメーターの比較を、スチューデントt検定で実施した。統計解析について、一元配置分散分析の後、ダネット検定を実施した。統計的有意差はJMP 8(SASインスティチュート)で評価した。<0.05のP値は、統計的に有意であると考えられた。
【0045】
第3 結果
1 HUVECにおけるスタチンによるSmgGDSの増加効果
本発明者らは、2種のスタチン(アトルバスタチン、10μMおよび30μM;ならびにピタバスタチン1μMおよび10μM)を用いて24時間処理した培養ヒト臍帯静脈内皮細胞(HUVEC)内のSmgGDS発現について検討した。これらの2種のスタチンは、濃度依存的に、HUVEC中のSmgGDS発現量を増加させた(図1a、b)。これは、スタチンがSmgGDS発現量を増加させるクラス効果を有するという新規な発見である。
【0046】
次に、本発明者らは、スタチンがSmgGDS発現量を増加させるメカニズムについて検討した。スタチンが、SmgGDSと同じARMタンパク質ファミリーのメンバーであるβ−カテニンを増大させるとの報告がある(ベルグマンらの文献(Bergmann,M.W.et al.,J.Mol.Cell.Cardiol.37, 681−690(2004))を参照)。これは、グリコゲンシンセターゼキナーゼ−3β(GSK−3β)のスタチンによる阻害およびそれによるβ−カテニンのリン酸化の阻害によって引き起こされる(リューらの文献(Liu,C.et al.,Cell 108,837−847(2002))、サリンらの文献(Salins,P. et al.,Neurosci.Lett. 412,211−216(2007))を参照)。リン酸化されたβ−カテニンはユビキチン化されプロテアソームにより分解されるため、β−カテニンのリン酸化の阻害は、β−カテニンの安定性を増加させる。以前に示されているように、GSK−3β阻害剤は、β−カテニンの発現量を増加させる(サリンらの文献(Salins,P. et al.,Neurosci. Lett. 412,211−216(2007))を参照))。したがって、本発明者らは、HUVEC内のSmgGDS発現量について、GSK−3β阻害剤であるSB216763の作用を検討した。本発明者らが期待した通り、SB216763は濃度依存的に、SmgGDS発現量を増加させた(図1c)。
【0047】
次に、本発明者らは、コレステロール生合成経路中の重要な生成物であるファルネシルピロリン酸(FPP)およびゲラニルゲラニルピロリン酸(GGPP)のようなイソプレノイドが、SmgGDS発現量のスタチン誘導型増加を媒介する可能性を検討した(ゴールドステインらの文献(Goldstein,J.L.,Brown, M.S.,Nature 343,425−430(1990))を参照)。FPPおよびGGPPが細胞内タンパク質の翻訳後修飾および小型GTPアーゼの膜への局在ならびにそれらの活性をコントロールするので、それらのタンパク質は、スタチンの多面的効果に中心的な役割を果たすと考えられている(ヴァン・アエルストらの文献(Van Aelst,L.,D’Souza−Schorey,C.,Genes Dev.11,2295−2322(1997))、ワンらの文献(Wang, C.Y.,Liu,P.Y.,Liao,J.K.,Trends Mol. Med. 14,37−44(2008))、ゾウらの文献(Zhou,Q.,Liao,J.K.,Circ.J.74,818−826(2010))らの文献を参照)。SmgGDSのスプライシング変異体が低分子量GTPアーゼのプレニル化および膜への局在をコントロールすることもまた報告されている(バーグらの文献(Berg,T.J.et al.,J.Biol.Chem.285,35255−35266(2010))を参照)。したがって、本発明者らは、HUVEC内のSmgGDS発現量について、スタチン共処理によるFPPおよびGGPPの影響を検討した。重要なことに、本発明者らの期待に反して、FPPまたはGGPPは、スタチンによるSmgGDS発現量の増加を阻害しなかった(図1b)。したがって、SmgGDS発現量を増加させるスタチンの影響はこれらのイソプレノイドにより媒介されないことが示された。
【0048】
次に、GEF機能がRhoキナーゼによって制御されると報告されているので(タケフジらの文献(Takefuji,M.et al.,Biochem.Biophys.Res.Commun.355,788−794(2007))を参照)、本発明者らはSmgGDS発現値の増加がRhoキナーゼ経路へのスタチンの阻害作用によりもたらされる可能性について検討した。本発明者らは、HUVECにRhoキナーゼ阻害剤であるヒドロキシファスジル(hydroxyfasudil)(HF)を作用させたが、HFはSmgGDS発現量を増加させなかった(図1c)。したがって、SmgGDS発現を増加させるスタチンの作用は、Rhoキナーゼ経路の阻害によって媒介されないと考えられる。これらの結果から、スタチンがGSK−3β経路の阻害によってSmgGDS発現量を増加させることを示した。
【0049】
2 スタチンのSmgGDSを介したROS産生量の抑制
HUVECにおけるSmgGDS、Rac1およびRhoAの局在および発現量についてのスタチンの影響を検討するために、本発明者らはスタチンで24時間処理した後の、HUVECの細胞質、膜および核分画におけるタンパク質発現量を調べた。その結果、アトルバスタチンは細胞質のSmgGDS量を増加させ、核内のRac1量を減少させた(図2a−c)。ピタバスタチンもまた細胞質のSmgGDS量を増加させ、かつ、核内のRac1量を減少させた(図7a−c)。これは、スタチンが核内Rac1量を減少させる最初の報告である。
【0050】
次に、本発明者らは、スタチンが核内のRac1量を減少させるメカニズムについて検討した。Rac1が核のプロテアソームによって分解させられることが報告されている(ラニングらの文献(Lanning,C.C.et al.,J.Biol. Chem.279,44197−44210(2004))を参照)。そこで、本発明者らはHUVECをスタチンおよびプロテアソーム阻害剤(MG−132)で処理した。本発明者らが期待した通り、MG−132はアトルバスタチンが引き起こす核内のRac1発現量の減少を阻害した(図2d)。同様の結果はピタバスタチンでも得られた(図7c)。以上より、スタチンが、Rac1の核内プロテアソーム分解を促進させることを実証している。
【0051】
さらに、本発明者らは、SmgGDSをsiRNAによってノックダウンしたHUVECにおけるスタチンの作用を検討した。コントロールsiRNAを導入した細胞において、アトルバスタチンは、総細胞におけるRac1発現量を減少させた(図2e)。しかしながら、SmgGDSのsiRNAを導入した細胞では、アトルバスタチンによるRac1発現量減少作用は認められなかった(図2e)。同様の結果はピタバスタチンを用いても得られた(図7d)。したがって、本発明者らは、スタチンがSmgGDSを介してRac1分解を促進させるということを明確に示すことができた。
【0052】
さらに、本発明者らは、スタチンの抗酸化作用を評価することによって、スタチンの多面的効果がRac1分解を担う可能性を調べた。スタチンがAngII誘導型ROS産生量を減少させることが報告されている(ワスマンらの文献(Wassmann, S.et al.,Mol.Pharmacol.59,646−654(2001))、カストディスらの文献(Custodis,F.,Eberl,M.,Kilter, H.,Bohm,M.,Laufs,U.,Cardiovasc. Res.71, 342−351(2006))を参照)。コントロールのsiRNAを導入した細胞では、アトルバスタチン(1μM)は、AngII誘導型ROS産生量を減少させた(図2f、g)。対照的に、SmgGDSのsiRNAを導入した細胞では、アトルバスタチン(1μM)は、AngII誘導型ROS産生を減少させることができなかった(図2f、g)。同じ結果はさらにピタバスタチン(0.1μM)を用いても得られた(図8a、b)。
【0053】
3 SmgGDS欠損マウスにおいてスタチンの多面的作用は消失する
in vitroで発見されたスタチンの作用がさらにin vivoにおいて機能するかどうかを検討するために、本発明者らは、AngIIにより誘導されるマウス心肥大および心拡張機能障害モデルを用いてスタチンの多面的効果を調べた。
【0054】
スタチンが、血圧または血漿コレステロール値に依存せず、AngII誘導マウス心肥大および心拡張機能障害モデルの病態を改善することが報告されている(タケモトらの文献(Takemoto M.et al.,J.Clin.Invest.108,1429−1437(2001))、ヤギらの文献(Yagi,S. et al.,Circ.Res.102,68−76(2008))を参照)。この改善作用は、スタチンの多面的効果であると考えられている。
【0055】
AngIIを2週に渡ってSmgGDS+/−および同腹子(SmgGDS+/+)マウスに持続投与した。収縮期血圧は、AngIIの投与によりSmgGDS+/−および同腹子マウスの両方において上昇した(表2)。
【表2】

【0056】
また、AngIIの投与により血漿の総およびLDL−コレステロール値は、上昇する傾向にあった(表2)。
【0057】
さらに、AngII投与開始より2週間スタチン(アトルバスタチン、10mg/kg/日、またはプラバスタチン、50mg/kg/日)を強制経口投与する群を設けた。本発明者らは、最終投与24時間後のスタチンの血漿中濃度を測定した(表3)。
【表3】

【0058】
本発明者らは、マウスのスタチンの血漿中濃度がヒトにおける24時間血漿中濃度(C24h)と同等であることを確認した。溶媒およびスタチン投与群の間の血圧または血漿の脂質プロファイルに有意差はなかった(表2)。
【0059】
心臓の重量の測定および心臓切除の顕微鏡検査により、AngIIにより心筋細胞および心筋の肥大を誘導し、著しい間質の線維化血管周囲の線維化および冠動脈の肥厚を誘発することを確認した(図3a−c)。同腹子マウスでは、AngII誘導型心肥大および線維化に対するスタチンの保護効果が見られた。しかし、SmgGDS+/−マウスでは、スタチンの保護効果は見られなかった(図3a−f)。さらに、本発明者らは、超音波検査法を使用して、これらのマウスの心機能を評価した(図4a−d)。LV短縮率(LVFS)(LVの収縮機能の指標)はAngIIまたはスタチン処理のいずれによっても有意な影響を受けなかった(図4b)。しかし、AngIIの投与は、コントロールおよびSmgGDS+/−マウスの両方において、LV拡張機能の指標であるE/Aを顕著に悪化させた(図4c)。対照的に、スタチン処理は、AngIIによって引き起こされたLV拡張機能障害を改善した(図4c)。SmgGDS+/−マウスでは、LVの心拡張機能障害について、スタチンの改善効果は認められなかった(図4c)。
【0060】
4 ヒトにおけるスタチンによるSmgGDSに対する作用
最後に、本発明者らは、2週に渡って経口的にプラバスタチンおよびアトルバスタチン(それぞれ、20mg/日)を投与して、健常成人におけるSmgGDS発現についてのスタチンの効果を調べた(図9)。両スタチンは、健常成人においても、総コレステロールおよびLDLコレステロールの血中濃度を減少させた(表4)。
【表4】

【0061】
循環血白血球中のSmgGDS発現は、プラバスタチンまたはアトルバスタチン服用後に有意に増加された(図5a)。20名の平均で、プラバスタチンの20mg投与によりSmgGDSは約1.4倍増加した。同様に、アトルバスタチンの20mg投与により、SmgGDSは約1.5倍増加した。さらに予備検討においてプラバスタチンの10mg投与ではSmgGDSの増加が認められなかった4例の被験者について、プラバスタチンの20mg投与によってSmgGDSが増加していることが確認できた。同様に、上記4例の被験者のうち3例の被験者については、プラバスタチンからアトルバスタチンへ切り替えることにより、SmgGDS増加作用が認められた。なお、この4例の被験者のLDLコレステロールは減少していたことにより、高コレステロール血症を治療目的とする場合は、投与量の増量や薬剤変更の対象とはならない。興味深いことに、プラバスタチン(親水性スタチン)およびアトルバスタチン(脂溶性スタチン)の両方ともヒトにおけるSmgGDS発現量に同程度の漸増的な効果を発揮し、ヒトにおけるSmgGDS量の増加というスタチンのクラス効果を示唆する結果となった。
【0062】
さらに、酸化ストレスマーカーの1つであるマロンジアルデヒド修飾(MDA)−LDLコレステロールは、スタチン処理により減少し(表4)、SmgGDS変化量およびMDA−LDLコレステロール量の間で、有意な逆相関関係が認められた。しかし、総コレステロールまたはLDLコレステロール量との間においては、相関関係は認められなかった(図5b−e)。
【特許請求の範囲】
【請求項1】
(1)スタチンの投与前および投与後において、心疾患を罹患した患者における細胞内のSmgGDS発現量を測定する工程、および、
(2)前記工程(1)で測定されたSmgGDS発現量を基準に前記患者に対するスタチンの種類および/または投与量を決定する工程
を含む、心疾患を罹患した患者へのスタチンの用法および/または用量を決定する方法。
【請求項2】
前記心疾患が、心血管肥大症、心筋細胞肥大症、心血管周囲線維化、冠動脈硬化症、高血圧症または心不全である、請求項1に記載の方法。
【請求項3】
前記スタチンが、アトルバスタチン、ジヒドロコンパクチン、ベルバスタチン、カルバスタチン、セリバスタチン、クリルバスタチン、ダルバスタチン、フルバスタチン、グレンバスタチン、フルインドスタチン、ベロスタチン、ロバスタチン、メバスタチン、コンパクチン、ピタバスタチン、プラバスタチン、リバスタチン、ロスバスタチン、シンバスタチン、シリバスタチン、CI−981およびそれらの薬学的に許容される塩からなる群から選択される、請求項1または2に記載の方法。
【請求項4】
前記基準が、スタチン投与後のSmgGDS発現量がスタチン投与前のSmgGDS発現量の1.4倍以上である、請求項1〜3のいずれか1項に記載の方法。
【請求項1】
(1)スタチンの投与前および投与後において、心疾患を罹患した患者における細胞内のSmgGDS発現量を測定する工程、および、
(2)前記工程(1)で測定されたSmgGDS発現量を基準に前記患者に対するスタチンの種類および/または投与量を決定する工程
を含む、心疾患を罹患した患者へのスタチンの用法および/または用量を決定する方法。
【請求項2】
前記心疾患が、心血管肥大症、心筋細胞肥大症、心血管周囲線維化、冠動脈硬化症、高血圧症または心不全である、請求項1に記載の方法。
【請求項3】
前記スタチンが、アトルバスタチン、ジヒドロコンパクチン、ベルバスタチン、カルバスタチン、セリバスタチン、クリルバスタチン、ダルバスタチン、フルバスタチン、グレンバスタチン、フルインドスタチン、ベロスタチン、ロバスタチン、メバスタチン、コンパクチン、ピタバスタチン、プラバスタチン、リバスタチン、ロスバスタチン、シンバスタチン、シリバスタチン、CI−981およびそれらの薬学的に許容される塩からなる群から選択される、請求項1または2に記載の方法。
【請求項4】
前記基準が、スタチン投与後のSmgGDS発現量がスタチン投与前のSmgGDS発現量の1.4倍以上である、請求項1〜3のいずれか1項に記載の方法。
【図1a】


【図1b】


【図1c】


【図1d】


【図1e】


【図2a】


【図2b】


【図2c】


【図2d】


【図2e】


【図2f】


【図2g】


【図3a】


【図3b】


【図3c】


【図3d】


【図3e】


【図3f】


【図4a】


【図4b】


【図4c】


【図4d】


【図5a】


【図5b】


【図5c】


【図5d】


【図5e】


【図6】


【図7a】


【図7b】


【図7c】


【図7d】


【図7e】


【図8a】


【図8b】


【図9】




【図1b】


【図1c】


【図1d】


【図1e】


【図2a】


【図2b】


【図2c】


【図2d】


【図2e】


【図2f】


【図2g】


【図3a】


【図3b】


【図3c】


【図3d】


【図3e】


【図3f】


【図4a】


【図4b】


【図4c】


【図4d】


【図5a】


【図5b】


【図5c】


【図5d】


【図5e】


【図6】


【図7a】


【図7b】


【図7c】


【図7d】


【図7e】


【図8a】


【図8b】


【図9】


【公開番号】特開2013−60369(P2013−60369A)
【公開日】平成25年4月4日(2013.4.4)
【国際特許分類】
【出願番号】特願2011−197906(P2011−197906)
【出願日】平成23年9月12日(2011.9.12)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 〔研究集会名〕第11回 日本NO学会学術集会 〔主催者名〕日本NO学会 〔開催日〕2011年5月13日,14日
【出願人】(504157024)国立大学法人東北大学 (2,297)
【Fターム(参考)】
【公開日】平成25年4月4日(2013.4.4)
【国際特許分類】
【出願日】平成23年9月12日(2011.9.12)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 〔研究集会名〕第11回 日本NO学会学術集会 〔主催者名〕日本NO学会 〔開催日〕2011年5月13日,14日
【出願人】(504157024)国立大学法人東北大学 (2,297)
【Fターム(参考)】
[ Back to top ]

