タンパク質のプロテオーム定量分析方法及び装置
【課題】複数のタンパク質の絶対定量を、迅速且つ正確に行なう。
【解決手段】測定対象から抽出したタンパク質混合物10を、分離操作を経ずに酵素による一斉消化や化学的切断を行ない、生成したペプチド混合物12中のマーカーペプチド14を液体クロマトグラフィー(LC)等により分離して、質量分析装置(MS)により検出する。
【解決手段】測定対象から抽出したタンパク質混合物10を、分離操作を経ずに酵素による一斉消化や化学的切断を行ない、生成したペプチド混合物12中のマーカーペプチド14を液体クロマトグラフィー(LC)等により分離して、質量分析装置(MS)により検出する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ある時期において細胞や組織に発現している全てのタンパク質のセットであるプロテオームの網羅的解析に用いるのに好適な、複数のタンパク質の絶対定量を、迅速且つ正確に行うことが可能な、タンパク質のプロテオーム定量分析方法及び装置に関する。
【背景技術】
【0002】
現在、タンパク質を定量分析するプロテオーム解析法として、(1)2次元ゲル電気泳動法、又は、(2)液体クロマトグラフィー(LC)を質量分析(MS)と組合せることによって定量を行なう方法の2つの手法が一般的に用いられている。
【0003】
(1)2次元ゲル電気泳動を用いた手法
これは、対象試料を2次元ゲル電気泳動(非特許文献1参照)により分離後、染色操作を行ない、各染色スポットの光学濃度、あるいは、予め蛍光標識したものについては、その蛍光強度を測定することで検出を行なう。それぞれの染色スポットに含まれるタンパク質の同定は、ゲル中での酵素消化により生じたペプチド断片の質量分析により行ない、得られた断片質量の組合せを、検索エンジンを用いてタンパク質データベースと照合するペプチドマスフィンガープリンティング(PMF)法(非特許文献2参照)、あるいは、質量分析計を2台直列に連結したタンデム質量分析(MS/MS)装置を用いてタンデム質量分析(MS/MS)を行ない、フラグメントパターンや部分配列情報をデータベースと比較することにより決定している(非特許文献3参照)。
【0004】
ここで、異なる複数の試料間での発現量変動解析が目的である場合、染色画像を差し引くデファレンシャル・ディスプレイ法により相対定量を行ない、変動したスポットを上述の方法により質量分析で同定する。
【0005】
しかし、2次元電気泳動の結果は、実験毎にばらつくことが多いため、擬陽性の結果が得られることがあり、その改良法として、2つの測定対象試料を異なる蛍光試薬により標識し、同一ゲル状で蛍光強度を比較するDIGE(Difference Gel Electrophoresis)法(非特許文献4参照)が開発されている。
【0006】
(2)液体クロマトグラフィーを用いた手法
これに対して、タンパク質を分離せずに消化を行ない、得られた混合物を一次元あるいは多次元の高速液体クロマトグラフィー(HPLC)により分離し、オンラインで質量分析測定を行なう(LC−MS)方法(ショットガン法)が普及されている。このような場合、一方の試料を安定同位体が豊富な培地で培養(非特許文献5参照)、あるいはICAT(Isotope Coding Affinity Tag)法(非特許文献6及び特許文献1参照)に代表される、抽出後に化学的な方法によって同位体標識された試料を、他方の試料に添加して内部標準として扱い、各消化ペプチドの相対的な変動を観測する。同時に自動MS/MS解析を行なうことで、各ペプチドからタンパク質への帰属を行ない、変動したタンパク質を決定できる。
【0007】
【特許文献1】特許第3345401号公報
【非特許文献1】P.O’Farrell,J.Biol.Chem.,250,4007(1975)
【非特許文献2】W.J.Henzel et al.,Proc.Natl.Acad.Sci.USA,90,5011(1993)
【非特許文献3】M.Wilm et al.,Nature,379,466(1996)
【非特許文献4】M.Unlu et al.,Electrophoresis,18,2071(1997)
【非特許文献5】Y.Oda et al.,Proc.Natl.Acad.Sci.USA,96,6591(1999)
【非特許文献6】S.P.Gygi et al.,Nat.Biotechnol.,17,994(1999)
【非特許文献7】K.Petris et al.,Anal.Chem.,75,1039(2003)
【非特許文献8】R.S,Johnson et al.,Int J Mass Specirom Ion Processes,86,137(1988)
【非特許文献9】J.B.Plomley,et al.,J.chromatogr.A.,854,245,(1999)
【発明の開示】
【発明が解決しようとする課題】
【0008】
しかしながら、(1)の電気泳動を用いた手法は、測定に長時間を要し、多数の試料を短時間で分析する必要がある場合には不向きである。又、泳動に供することができる試料量が制限される、染色による検出のダイナミックレンジが小さい等の理由から、検出されるタンパク質の殆どは、多くの組織や細胞中に共通して一定量発現する、細胞の維持、増殖に不可欠なハウスキーピング遺伝子の産物であり、微量タンパク質の変動解析を行なうことは困難である。更に、この手法は、異なる試料間でのタンパク質の発現量を相対的に評価することを目的としているため、各タンパク質の絶対量を知ることはできない等の問題点を有する。
【0009】
一方、(2)の液体クロマトグラフィーを用いた手法において、分離操作を行なわずにタンパク質混合物の酵素消化物をLC−MSにより定量する既存の手法では、試料中に含まれるペプチドの数が多いため、同一保持時間に複数のペプチドの溶出が起こる。質量分析を用いた定量分析の問題点として、同一物質であっても、共存する他の成分の量、種類に依存してイオン化効率が変化することや、検出器が大量のイオンで飽和することで、定量結果に影響を及ぼすことがある(イオンサプレッション効果)。そのため、正確な定量を行なう場合、同位体標識した試料を内部標準として用いることで、イオンサプレッションの影響を無くす必要がある。更に、この手法も、(1)の電気泳動を用いた手法と同様に、タンパク質の発現量を相対的に評価することを目的としているため、各タンパク質の絶対量を知ることはできないという問題点を有する。
【0010】
本発明は、前記問題点を解決するべくなされたもので、複数のタンパク質の絶対定量を、迅速且つ正確に行なえるようにすることを課題とする。
【課題を解決するための手段】
【0011】
本発明は、測定対象から抽出したタンパク質混合物を、分離操作を経ずに酵素による一斉消化や化学的切断を行ない、生成したペプチド混合物中のマーカーペプチドを分離して、質量分析するようにして、前記課題を解決したものである。
【0012】
又、一つのタンパク質に、複数のマーカーペプチドを設定して、再現性の高い測定を可能としたものである。
【0013】
又、前記分離を、液体クロマトグラフィー、キャピラリー電気泳動又はマイクロチップにより行なうようにしたものである。
【0014】
本発明は、又、測定対象から抽出したタンパク質混合物を、分離操作を経ずに酵素による一斉消化や化学的切断を行なう切断手段と、生成したペプチド混合物中のマーカーペプチドを分離する分離手段と、分離されたマーカーペプチドを検出する質量分析装置と、を備えたことを特徴とするタンパク質のプロテオーム定量分析装置を提供するものである。
【発明の効果】
【0015】
本発明による手法は、例えば1次元の液体クロマトグラフィー、キャピラリー電気泳動又はマイクロチップのみを分離手段として用いるため、短時間の測定が可能である。酵素による一斉消化や化学的切断により得られるペプチド混合物の中から、例えばLC−MSによって他と十分に識別ができ、イオンサプレッションの影響を受け難いものをマーカーペプチドとして選択してモニタリングすることで、信頼性の高い定量結果が得られる。又、タンパク質の定量は、濃度既知の生成タンパク質あるいは合成ペプチドを外部標準として用いて行なうことで、絶対定量が可能となる。
【0016】
特に、1つのタンパク質につき複数のマーカーペプチドの測定結果の平均値を採用するようにした場合は、再現性の高いタンパク質の絶対定量が可能となる。
【発明を実施するための最良の形態】
【0017】
以下図面を参照して、本発明の実施形態を詳細に説明する。
【0018】
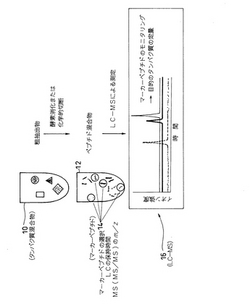
本実施形態は、図1に示す如く、測定対象となる細胞や組織から抽出したタンパク質混合物(粗抽出物)10を、分離操作を経ずに酵素による一斉消化や化学的切断を行ない、生成したペプチド混合物12中のマーカーペプチド14を、LC−MS16で分離し検出して、各タンパク質の定量を迅速に行なうものである。
【0019】
最初に、各タンパク質を特異的に抽出・定量する上で、目印になり得る固有なパラメータを持つ消化断片(マーカーペプチド)14を、予備実験の結果や、コンピュータ上のシミュレーション等により予測し決定する。
【0020】
マーカーペプチド14を選択する指標として、(1)液体クロマトグラフィー(LC)上での保持時間、(2)生成する高イオンの質量電荷比(m/z)、(3)MS/MS測定により生成するフラグメントイオンのm/z等のパラメータを用い、対象試料中に存在することが想定される他のタンパク質由来のペプチドと十分に識別可能なものを選択する。
【0021】
精製したタンパク質、あるいは合成ペプチドの既知量を外部標準指標とし、LC−MS分析で得られたピーク面積を比較することで、対象試料中に含まれる各タンパク質の絶対定量を行なうことができる。特に、1つのタンパク質に複数のマーカーペプチドを設定し、それぞれのペプチドの定量値の平均値を採用することで、元のタンパク質の正確な定量値が得られる。
【0022】
なお、本実施形態においては、分離手段として液体クロマトグラフィーが用いられていたが、キャピラリー電気泳動、マイクロチップ等の他の分離手段を用いることができる。
【0023】
又、検出に用いる質量分析装置も、後出実施例で用いた三連型四重極質量分析装置に限らず、通常の四重極型やイオントラップ型、飛行時間(TOF)型、四重極−飛行時間ハイブリッド(Q−TOF)型、四重極−イオントラップハイブリッド(Q−Trap)型、TOF−TOF型、フーリエ変換イオンサイクロトロン(FT−ICR)型等の他の質量分析装置が使用できる。
【0024】
又、本発明によりタンパク質定量を行なうことができる試料は、大腸菌に限定されず、全ての原核、真核生物の全体、又は、その一部であって、遺伝子あるいはアミノ酸配列情報をデータベース等から入手することができる全てのタンパク質が測定対象となり得る。
【0025】
更に、固定化酵素の使用による消化時間の短縮化で、スループットを向上することもできる。
【実施例】
【0026】
大腸菌株W3110内で発現しているエネルギ代謝に関わる57の主要酵素の定量を行なった。
【0027】
1.GenBankに登録されている大腸菌W3110株の、実際に遺伝子としてタンパク質をコードしている全ORF(Open Reading Frame)の発現産物を考慮し、Lys−Cエンドぺプチターゼによる消化により生成し得る全てのペプチドについて、(1)液体クロマトグラフィー上での保持時間、(2)生成する多価イオンの質量電荷比(m/z)、(3)MS/MS測定により生成するフラグメントイオンのm/zを予測した。又、それぞれの数値の予測は、(1)ニューラルネットワークによる学習(非特許文献7参照)、(2)ORF情報からの計算、(3)ペプチドに一般的にフラグメンテーションパターン(非特許文献8参照)を求め行なった。
【0028】
2.1の結果を元に、測定対象のタンパク質に固有なマーカーペプチドを選択した。
【0029】
3.Luria-Bertani(LB)培地中で定常期又は対数増殖期まで培養した大腸菌を5000×g、10分間の遠心分離により集菌し、6Mグアニジン塩酸を含む0.1mM Tris−HCL緩衝液(pH9.0)を加えて、ガラスビーズ法により細胞を破砕した。
【0030】
4.8000×g、20分間の遠心分離により不溶性画分を除去後、限外濾過により濃縮した。
【0031】
5.タンパク質500μg相当を含む溶液20μLに対し、10mg/mLジチオスレイトール溶液を1μL添加し、室温で30分間放置した。
【0032】
6.50mg/mLヨード酢酸溶液を1μL添加し、室温で30分間放置した。
【0033】
7.4M尿素溶液により希釈してグアニジン塩酸濃度1M以下にした後、10AU/mLのLy−Cエンドぺプチターゼ溶液を1μL添加し、室温で6時間放置した。
【0034】
8.トリフルオロ酢酸を終濃度0.1%になるように添加し、LC−MS測定を行なった。
【0035】
液体クロマトグラフィー(LC)には、アジレントテクノロジー社の1100シリーズを使用した。分析カラムは昭和電工製のShodex(登録商標)Asahipack ODS−50 2D(内径2.0mm×長さ150cm)、移動相Aは0.2%蟻酸/水、移動相Bは0.2%蟻酸/アセトニトリル、流量は0.2mL/分、勾配時間(gradient time)は、0/1→5/1→55/50→60/50→60.1/95/→65/95(分)/%B、カラム温度は40℃である。
【0036】
又、質量分析は、三連型四重極質量分析装置を用いて、MRM(Multiple Reaction Monitoring)(非特許文献9参照)により、マーカーペプチドの検出、定量を行なった。質量分析装置としては、アプライドバイオシステム社のAPI3000を使用した。極性は正、イオン源はターボイオンスプレィ(ESI)、モードはMRM、イオンスプレィ電圧は5500V、デクラスタリング電位は40V、乾燥ガスは窒素、ガス温度は550℃である。
【0037】
9.マーカーペプチドのピーク面積を濃度既知の標準試料と比較することにより、目的タンパク質の定量を行なった。標準試料は、大腸菌発現系により調製したリコンビナントタンパク質を精製し、測定対象試料と同様の手法で酵素消化したものを用いた。
【0038】
マーカーペプチドのクロマトグラムを図2、各酵素の定量結果を図3に示す。
【産業上の利用可能性】
【0039】
本発明により、迅速且つ正確に複数のタンパク質の絶対定量を行なうことができた。この方法により、単細胞内における各タンパク質の発現レベルの経時的追跡のような多数回の測定を必要とする研究が可能となる。又、その絶対量を知ることによって、細胞や組織の機能、制御機構の動的な解明を目的とした研究に応用が可能である。
【0040】
本発明は、環境変化に対しての各タンパク質の絶対量変化や、異なる試料間の発現レベルの差異を把握することで、医薬品開発における薬物に対しての応答の試験や、病気の診断、食品分野における高機能を有する食品や微生物の発見等、多分野への実用的な応用が期待できる。
【図面の簡単な説明】
【0041】
【図1】本発明の基本的な構成及び処理手順を示す図
【図2】本発明の実施例におけるマーカーペプチドのクロマトグラムを示す線図
【図3】同じく各酵素の定量結果を示す図
【符号の説明】
【0042】
10…タンパク質混合物(粗抽出物)
12…ペプチド混合物
14…マーカーペプチド
16…液体クロマトグラフィー/質量分析装置(LC−MS)
【技術分野】
【0001】
本発明は、ある時期において細胞や組織に発現している全てのタンパク質のセットであるプロテオームの網羅的解析に用いるのに好適な、複数のタンパク質の絶対定量を、迅速且つ正確に行うことが可能な、タンパク質のプロテオーム定量分析方法及び装置に関する。
【背景技術】
【0002】
現在、タンパク質を定量分析するプロテオーム解析法として、(1)2次元ゲル電気泳動法、又は、(2)液体クロマトグラフィー(LC)を質量分析(MS)と組合せることによって定量を行なう方法の2つの手法が一般的に用いられている。
【0003】
(1)2次元ゲル電気泳動を用いた手法
これは、対象試料を2次元ゲル電気泳動(非特許文献1参照)により分離後、染色操作を行ない、各染色スポットの光学濃度、あるいは、予め蛍光標識したものについては、その蛍光強度を測定することで検出を行なう。それぞれの染色スポットに含まれるタンパク質の同定は、ゲル中での酵素消化により生じたペプチド断片の質量分析により行ない、得られた断片質量の組合せを、検索エンジンを用いてタンパク質データベースと照合するペプチドマスフィンガープリンティング(PMF)法(非特許文献2参照)、あるいは、質量分析計を2台直列に連結したタンデム質量分析(MS/MS)装置を用いてタンデム質量分析(MS/MS)を行ない、フラグメントパターンや部分配列情報をデータベースと比較することにより決定している(非特許文献3参照)。
【0004】
ここで、異なる複数の試料間での発現量変動解析が目的である場合、染色画像を差し引くデファレンシャル・ディスプレイ法により相対定量を行ない、変動したスポットを上述の方法により質量分析で同定する。
【0005】
しかし、2次元電気泳動の結果は、実験毎にばらつくことが多いため、擬陽性の結果が得られることがあり、その改良法として、2つの測定対象試料を異なる蛍光試薬により標識し、同一ゲル状で蛍光強度を比較するDIGE(Difference Gel Electrophoresis)法(非特許文献4参照)が開発されている。
【0006】
(2)液体クロマトグラフィーを用いた手法
これに対して、タンパク質を分離せずに消化を行ない、得られた混合物を一次元あるいは多次元の高速液体クロマトグラフィー(HPLC)により分離し、オンラインで質量分析測定を行なう(LC−MS)方法(ショットガン法)が普及されている。このような場合、一方の試料を安定同位体が豊富な培地で培養(非特許文献5参照)、あるいはICAT(Isotope Coding Affinity Tag)法(非特許文献6及び特許文献1参照)に代表される、抽出後に化学的な方法によって同位体標識された試料を、他方の試料に添加して内部標準として扱い、各消化ペプチドの相対的な変動を観測する。同時に自動MS/MS解析を行なうことで、各ペプチドからタンパク質への帰属を行ない、変動したタンパク質を決定できる。
【0007】
【特許文献1】特許第3345401号公報
【非特許文献1】P.O’Farrell,J.Biol.Chem.,250,4007(1975)
【非特許文献2】W.J.Henzel et al.,Proc.Natl.Acad.Sci.USA,90,5011(1993)
【非特許文献3】M.Wilm et al.,Nature,379,466(1996)
【非特許文献4】M.Unlu et al.,Electrophoresis,18,2071(1997)
【非特許文献5】Y.Oda et al.,Proc.Natl.Acad.Sci.USA,96,6591(1999)
【非特許文献6】S.P.Gygi et al.,Nat.Biotechnol.,17,994(1999)
【非特許文献7】K.Petris et al.,Anal.Chem.,75,1039(2003)
【非特許文献8】R.S,Johnson et al.,Int J Mass Specirom Ion Processes,86,137(1988)
【非特許文献9】J.B.Plomley,et al.,J.chromatogr.A.,854,245,(1999)
【発明の開示】
【発明が解決しようとする課題】
【0008】
しかしながら、(1)の電気泳動を用いた手法は、測定に長時間を要し、多数の試料を短時間で分析する必要がある場合には不向きである。又、泳動に供することができる試料量が制限される、染色による検出のダイナミックレンジが小さい等の理由から、検出されるタンパク質の殆どは、多くの組織や細胞中に共通して一定量発現する、細胞の維持、増殖に不可欠なハウスキーピング遺伝子の産物であり、微量タンパク質の変動解析を行なうことは困難である。更に、この手法は、異なる試料間でのタンパク質の発現量を相対的に評価することを目的としているため、各タンパク質の絶対量を知ることはできない等の問題点を有する。
【0009】
一方、(2)の液体クロマトグラフィーを用いた手法において、分離操作を行なわずにタンパク質混合物の酵素消化物をLC−MSにより定量する既存の手法では、試料中に含まれるペプチドの数が多いため、同一保持時間に複数のペプチドの溶出が起こる。質量分析を用いた定量分析の問題点として、同一物質であっても、共存する他の成分の量、種類に依存してイオン化効率が変化することや、検出器が大量のイオンで飽和することで、定量結果に影響を及ぼすことがある(イオンサプレッション効果)。そのため、正確な定量を行なう場合、同位体標識した試料を内部標準として用いることで、イオンサプレッションの影響を無くす必要がある。更に、この手法も、(1)の電気泳動を用いた手法と同様に、タンパク質の発現量を相対的に評価することを目的としているため、各タンパク質の絶対量を知ることはできないという問題点を有する。
【0010】
本発明は、前記問題点を解決するべくなされたもので、複数のタンパク質の絶対定量を、迅速且つ正確に行なえるようにすることを課題とする。
【課題を解決するための手段】
【0011】
本発明は、測定対象から抽出したタンパク質混合物を、分離操作を経ずに酵素による一斉消化や化学的切断を行ない、生成したペプチド混合物中のマーカーペプチドを分離して、質量分析するようにして、前記課題を解決したものである。
【0012】
又、一つのタンパク質に、複数のマーカーペプチドを設定して、再現性の高い測定を可能としたものである。
【0013】
又、前記分離を、液体クロマトグラフィー、キャピラリー電気泳動又はマイクロチップにより行なうようにしたものである。
【0014】
本発明は、又、測定対象から抽出したタンパク質混合物を、分離操作を経ずに酵素による一斉消化や化学的切断を行なう切断手段と、生成したペプチド混合物中のマーカーペプチドを分離する分離手段と、分離されたマーカーペプチドを検出する質量分析装置と、を備えたことを特徴とするタンパク質のプロテオーム定量分析装置を提供するものである。
【発明の効果】
【0015】
本発明による手法は、例えば1次元の液体クロマトグラフィー、キャピラリー電気泳動又はマイクロチップのみを分離手段として用いるため、短時間の測定が可能である。酵素による一斉消化や化学的切断により得られるペプチド混合物の中から、例えばLC−MSによって他と十分に識別ができ、イオンサプレッションの影響を受け難いものをマーカーペプチドとして選択してモニタリングすることで、信頼性の高い定量結果が得られる。又、タンパク質の定量は、濃度既知の生成タンパク質あるいは合成ペプチドを外部標準として用いて行なうことで、絶対定量が可能となる。
【0016】
特に、1つのタンパク質につき複数のマーカーペプチドの測定結果の平均値を採用するようにした場合は、再現性の高いタンパク質の絶対定量が可能となる。
【発明を実施するための最良の形態】
【0017】
以下図面を参照して、本発明の実施形態を詳細に説明する。
【0018】
本実施形態は、図1に示す如く、測定対象となる細胞や組織から抽出したタンパク質混合物(粗抽出物)10を、分離操作を経ずに酵素による一斉消化や化学的切断を行ない、生成したペプチド混合物12中のマーカーペプチド14を、LC−MS16で分離し検出して、各タンパク質の定量を迅速に行なうものである。
【0019】
最初に、各タンパク質を特異的に抽出・定量する上で、目印になり得る固有なパラメータを持つ消化断片(マーカーペプチド)14を、予備実験の結果や、コンピュータ上のシミュレーション等により予測し決定する。
【0020】
マーカーペプチド14を選択する指標として、(1)液体クロマトグラフィー(LC)上での保持時間、(2)生成する高イオンの質量電荷比(m/z)、(3)MS/MS測定により生成するフラグメントイオンのm/z等のパラメータを用い、対象試料中に存在することが想定される他のタンパク質由来のペプチドと十分に識別可能なものを選択する。
【0021】
精製したタンパク質、あるいは合成ペプチドの既知量を外部標準指標とし、LC−MS分析で得られたピーク面積を比較することで、対象試料中に含まれる各タンパク質の絶対定量を行なうことができる。特に、1つのタンパク質に複数のマーカーペプチドを設定し、それぞれのペプチドの定量値の平均値を採用することで、元のタンパク質の正確な定量値が得られる。
【0022】
なお、本実施形態においては、分離手段として液体クロマトグラフィーが用いられていたが、キャピラリー電気泳動、マイクロチップ等の他の分離手段を用いることができる。
【0023】
又、検出に用いる質量分析装置も、後出実施例で用いた三連型四重極質量分析装置に限らず、通常の四重極型やイオントラップ型、飛行時間(TOF)型、四重極−飛行時間ハイブリッド(Q−TOF)型、四重極−イオントラップハイブリッド(Q−Trap)型、TOF−TOF型、フーリエ変換イオンサイクロトロン(FT−ICR)型等の他の質量分析装置が使用できる。
【0024】
又、本発明によりタンパク質定量を行なうことができる試料は、大腸菌に限定されず、全ての原核、真核生物の全体、又は、その一部であって、遺伝子あるいはアミノ酸配列情報をデータベース等から入手することができる全てのタンパク質が測定対象となり得る。
【0025】
更に、固定化酵素の使用による消化時間の短縮化で、スループットを向上することもできる。
【実施例】
【0026】
大腸菌株W3110内で発現しているエネルギ代謝に関わる57の主要酵素の定量を行なった。
【0027】
1.GenBankに登録されている大腸菌W3110株の、実際に遺伝子としてタンパク質をコードしている全ORF(Open Reading Frame)の発現産物を考慮し、Lys−Cエンドぺプチターゼによる消化により生成し得る全てのペプチドについて、(1)液体クロマトグラフィー上での保持時間、(2)生成する多価イオンの質量電荷比(m/z)、(3)MS/MS測定により生成するフラグメントイオンのm/zを予測した。又、それぞれの数値の予測は、(1)ニューラルネットワークによる学習(非特許文献7参照)、(2)ORF情報からの計算、(3)ペプチドに一般的にフラグメンテーションパターン(非特許文献8参照)を求め行なった。
【0028】
2.1の結果を元に、測定対象のタンパク質に固有なマーカーペプチドを選択した。
【0029】
3.Luria-Bertani(LB)培地中で定常期又は対数増殖期まで培養した大腸菌を5000×g、10分間の遠心分離により集菌し、6Mグアニジン塩酸を含む0.1mM Tris−HCL緩衝液(pH9.0)を加えて、ガラスビーズ法により細胞を破砕した。
【0030】
4.8000×g、20分間の遠心分離により不溶性画分を除去後、限外濾過により濃縮した。
【0031】
5.タンパク質500μg相当を含む溶液20μLに対し、10mg/mLジチオスレイトール溶液を1μL添加し、室温で30分間放置した。
【0032】
6.50mg/mLヨード酢酸溶液を1μL添加し、室温で30分間放置した。
【0033】
7.4M尿素溶液により希釈してグアニジン塩酸濃度1M以下にした後、10AU/mLのLy−Cエンドぺプチターゼ溶液を1μL添加し、室温で6時間放置した。
【0034】
8.トリフルオロ酢酸を終濃度0.1%になるように添加し、LC−MS測定を行なった。
【0035】
液体クロマトグラフィー(LC)には、アジレントテクノロジー社の1100シリーズを使用した。分析カラムは昭和電工製のShodex(登録商標)Asahipack ODS−50 2D(内径2.0mm×長さ150cm)、移動相Aは0.2%蟻酸/水、移動相Bは0.2%蟻酸/アセトニトリル、流量は0.2mL/分、勾配時間(gradient time)は、0/1→5/1→55/50→60/50→60.1/95/→65/95(分)/%B、カラム温度は40℃である。
【0036】
又、質量分析は、三連型四重極質量分析装置を用いて、MRM(Multiple Reaction Monitoring)(非特許文献9参照)により、マーカーペプチドの検出、定量を行なった。質量分析装置としては、アプライドバイオシステム社のAPI3000を使用した。極性は正、イオン源はターボイオンスプレィ(ESI)、モードはMRM、イオンスプレィ電圧は5500V、デクラスタリング電位は40V、乾燥ガスは窒素、ガス温度は550℃である。
【0037】
9.マーカーペプチドのピーク面積を濃度既知の標準試料と比較することにより、目的タンパク質の定量を行なった。標準試料は、大腸菌発現系により調製したリコンビナントタンパク質を精製し、測定対象試料と同様の手法で酵素消化したものを用いた。
【0038】
マーカーペプチドのクロマトグラムを図2、各酵素の定量結果を図3に示す。
【産業上の利用可能性】
【0039】
本発明により、迅速且つ正確に複数のタンパク質の絶対定量を行なうことができた。この方法により、単細胞内における各タンパク質の発現レベルの経時的追跡のような多数回の測定を必要とする研究が可能となる。又、その絶対量を知ることによって、細胞や組織の機能、制御機構の動的な解明を目的とした研究に応用が可能である。
【0040】
本発明は、環境変化に対しての各タンパク質の絶対量変化や、異なる試料間の発現レベルの差異を把握することで、医薬品開発における薬物に対しての応答の試験や、病気の診断、食品分野における高機能を有する食品や微生物の発見等、多分野への実用的な応用が期待できる。
【図面の簡単な説明】
【0041】
【図1】本発明の基本的な構成及び処理手順を示す図
【図2】本発明の実施例におけるマーカーペプチドのクロマトグラムを示す線図
【図3】同じく各酵素の定量結果を示す図
【符号の説明】
【0042】
10…タンパク質混合物(粗抽出物)
12…ペプチド混合物
14…マーカーペプチド
16…液体クロマトグラフィー/質量分析装置(LC−MS)
【特許請求の範囲】
【請求項1】
測定対象から抽出したタンパク質混合物を、分離操作を経ずに酵素による一斉消化や化学的切断を行ない、
生成したペプチド混合物中のマーカーペプチドを分離して、質量分析することを特徴とするタンパク質のプロテオーム定量分析方法。
【請求項2】
一つのタンパク質に、複数のマーカーペプチドを設定することを特徴とする請求項1に記載のタンパク質のプロテオーム定量分析方法。
【請求項3】
前記分離を、液体クロマトグラフィーにより行なうことを特徴とする請求項1又は2に記載のタンパク質のプロテオーム定量分析方法。
【請求項4】
前記分離を、キャピラリー電気泳動により行なうことを特徴とする請求項1又は2に記載のタンパク質のプロテオーム定量分析方法。
【請求項5】
前記分離を、マイクロチップにより行なうことを特徴とする請求項1又は2に記載のタンパク質のプロテオーム定量分析方法。
【請求項6】
測定対象から抽出したタンパク質混合物を、分離操作を経ずに酵素による一斉消化や化学的切断を行なう切断手段と、
生成したペプチド混合物中のマーカーペプチドを分離する分離手段と、
分離されたマーカーペプチドを検出する質量分析装置と、
を備えたことを特徴とするタンパク質のプロテオーム定量分析装置。
【請求項1】
測定対象から抽出したタンパク質混合物を、分離操作を経ずに酵素による一斉消化や化学的切断を行ない、
生成したペプチド混合物中のマーカーペプチドを分離して、質量分析することを特徴とするタンパク質のプロテオーム定量分析方法。
【請求項2】
一つのタンパク質に、複数のマーカーペプチドを設定することを特徴とする請求項1に記載のタンパク質のプロテオーム定量分析方法。
【請求項3】
前記分離を、液体クロマトグラフィーにより行なうことを特徴とする請求項1又は2に記載のタンパク質のプロテオーム定量分析方法。
【請求項4】
前記分離を、キャピラリー電気泳動により行なうことを特徴とする請求項1又は2に記載のタンパク質のプロテオーム定量分析方法。
【請求項5】
前記分離を、マイクロチップにより行なうことを特徴とする請求項1又は2に記載のタンパク質のプロテオーム定量分析方法。
【請求項6】
測定対象から抽出したタンパク質混合物を、分離操作を経ずに酵素による一斉消化や化学的切断を行なう切断手段と、
生成したペプチド混合物中のマーカーペプチドを分離する分離手段と、
分離されたマーカーペプチドを検出する質量分析装置と、
を備えたことを特徴とするタンパク質のプロテオーム定量分析装置。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2006−322733(P2006−322733A)
【公開日】平成18年11月30日(2006.11.30)
【国際特許分類】
【出願番号】特願2005−144003(P2005−144003)
【出願日】平成17年5月17日(2005.5.17)
【出願人】(504059429)ヒューマン・メタボローム・テクノロジーズ株式会社 (9)
【Fターム(参考)】
【公開日】平成18年11月30日(2006.11.30)
【国際特許分類】
【出願日】平成17年5月17日(2005.5.17)
【出願人】(504059429)ヒューマン・メタボローム・テクノロジーズ株式会社 (9)
【Fターム(参考)】
[ Back to top ]

