ツロブテロールを含有する経皮吸収製剤
【課題】皮膚に安全であり、経皮吸収率が高く、薬効の持続性及び粘着力に優れたツロブテロールを含有する経皮吸収製剤を提供することにある。また、本発明の目的は、経皮吸収剤を含まずに、ツロブテロールが溶解された状態で安全に皮膚に吸収されるツロブテロールを含有する経皮吸収製剤を提供する。
【解決手段】ツロブテロール及び天然ゴム系粘着基剤を含有する薬物層と、薬物層の一面に付着され、薬物層を支持する支持体とを含み、天然ゴム系粘着基剤は、10重量部〜40重量部の天然ゴム、54.5重量部〜85重量部のロジンエステル樹脂及び酸価調節剤を含有し、薬物層の厚さは25μm〜75μmである経皮吸収製剤を構成する。
【解決手段】ツロブテロール及び天然ゴム系粘着基剤を含有する薬物層と、薬物層の一面に付着され、薬物層を支持する支持体とを含み、天然ゴム系粘着基剤は、10重量部〜40重量部の天然ゴム、54.5重量部〜85重量部のロジンエステル樹脂及び酸価調節剤を含有し、薬物層の厚さは25μm〜75μmである経皮吸収製剤を構成する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ツロブテロールを含有する薬剤学的組成物に関するもので、具体的には、ツロブテロールを含有する経皮吸収製剤に関するものである。
【背景技術】
【0002】
ツロブテロール[2―t―ブチルアミノ―1―(2―クロロフェニル)エタノール]は、化学式1のように2次アミンを有し、分子量が227.7であるベータ―アドレナリン系の薬物として交感神経のβ2受容体に選択的に作用し、気管支平滑筋を弛緩させる役割をする。したがって、ツロブテロールは、気道狭窄による喘息及び呼吸器疾患者の呼吸困難を軽減又は治療するのに有用な気管支拡張剤として使用されてきた。ツロブテロールは、塩としても存在する。
【0003】
【化1】

皮膚を介して薬物を吸収させる経皮吸収製剤は、薬物を持続的に長時間の間一定に体内に伝達することができ、肝での初回代謝を防止することができる。特に、経皮吸収製剤は、患者の服薬順応度が高いので、薬物の投与回数及び副作用を減少できる良い方法として知られてきた。しかし、一般に、皮膚は非常に低い透過度を有しており、ほとんどの薬物は、物理化学的に経皮吸収製剤に適用するのに不適切であったり、人体に対する安全性を確保することが難しく、経皮吸収製剤として開発できる薬物が極めて制限的である。そのため、気管支拡張剤を含有する経皮吸収製剤の開発は、製薬産業において大きな関心の対象となってきた。特に、ツロブテロールを含有する経皮吸収製剤に対する研究は未だに持続的に行われている。
【0004】
特許文献1は、ツロブテロールが粘着剤中に溶解度以上の高農度で含有された経皮吸収製剤を開示している。ツロブテロールが粘着剤中に溶解度以上の高農度で含有されているので、薬物の経皮吸収率が増加し、放出持続時間がより長くなるという特徴がある。しかし、時間の経過によってツロブテロールの一部が結晶状態で薬物層に部分的に分散され、薬物層の表面にツロブテロール結晶が発生しにくい。その結果、経皮吸収製剤の皮膚に対する粘着力が低くなり、一定の薬物放出速度特性を表すことが難しくなる。
【0005】
特許文献2、3、4及び5は、アクリル粘着剤、ツロブテロール及び経皮吸収促進剤を含むマトリックス型経皮吸収製剤を開示している。アクリル粘着剤は、主モノマー、変形モノマー及びカルボキシル基、ヒドロキシル基、エポキシ基、アミン基、有機シラン基などの多様な官能基を有する。アクリル粘着剤は、官能基やモノマーによってやや差があるが、薬物を初期に過多に溶出するという特性を有するので、ツロブテロールを長時間の間一定の速度で放出できないという問題がある。また、経皮吸収促進剤は、人体安全性の良い組成であるとしても、非常に低い透過度を有している皮膚を介して薬物を透過させるためには皮膚組織に軽微な刺激を表すようになる。
【0006】
特許文献6は、経皮吸収促進剤を含有するアクリル系粘着剤又は合成ゴム系粘着剤にツロブテロールを5重量部以上の高濃度で含有させた経皮吸収製剤を開示している。特許文献6は、皮膚に対する優れた経皮吸収率、薬効の持続性及び優れた粘着力を表している。しかし、アクリル系粘着剤を使用する場合、初期に薬物が過多に溶出されるという特性があり、合成ゴム系粘着剤によって皮膚組織が損傷を受け、局所的に紅斑、かゆみ症又は炎症などの副作用を起こす可能性がある。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】日本特許公告第7―25669号
【特許文献2】大韓民国登録特許第10―0535302号
【特許文献3】大韓民国登録特許第10―0469995号
【特許文献4】大韓民国登録特許第10―0579721号
【特許文献5】大韓民国登録特許第10―0439659号
【特許文献6】日本登録特許第3930984号
【発明の概要】
【発明が解決しようとする課題】
【0008】
ツロブテロールを含有する経皮吸収製剤は、皮膚に安全であり、経皮吸収率が高く、薬効の持続性及び粘着力に優れていなければならない。したがって、経皮吸収製剤は、人体に安全な組成でなければならなく、皮膚を損傷させずに主薬物が溶解された状態で安全に皮膚に吸収される機転を研究する製剤学的研究が経皮吸収製剤の核心技術といえる。また、経皮吸収促進剤は、人体安全性が良いとしても、程度の差はあるが、皮膚刺激を完全に排除することはできない。経皮吸収促進剤を含有しない経皮吸収製剤が当業界で継続して要求されてきたが、経皮吸収促進剤のない状態で所望の薬物放出速度を表す経皮吸収製剤を開発するのは非常に難しい解決技術のうち一つである。
【0009】
したがって、本発明の目的は、皮膚に安全であり、経皮吸収率が高く、薬効の持続性及び粘着力に優れたツロブテロールを含有する経皮吸収製剤を提供することにある。また、本発明の目的は、経皮吸収剤を含まずに、ツロブテロールが溶解された状態で安全に皮膚に吸収されるツロブテロールを含有する経皮吸収製剤を提供することにある。
【課題を解決するための手段】
【0010】
上記課題を解決するために、本発明は、例えば、以下を提供する:
(項目1)
ツロブテロール及び天然ゴム系粘着基剤を含有する薬物層と、
薬物層の一面に付着され、薬物層を支持する支持体と、を含み、
天然ゴム系粘着基剤は、10重量部〜40重量部の天然ゴム、54.5重量部〜85重量部のロジンエステル樹脂及び酸価調節剤を含有し、
薬物層は、厚さが25μm〜75μmである経皮吸収製剤。
(項目2)
ツロブテロール及び天然ゴム系粘着基剤を含有する薬物層と、
薬物層の下面に付着され、薬物層を支持する支持体と、
支持体の下面に付着され、薬物層を皮膚に一定に固定する密着体と、
薬物層の上面に付着され、薬物層を保護し、薬物層から容易に分離される剥離フィルム又は剥離紙と、を含み、
天然ゴム系粘着基剤は、10重量部〜40重量部の天然ゴム、54.5重量部〜85重量部のロジンエステル樹脂及び酸価調節剤を含有し、
薬物層は、厚さが25μm〜75μmである経皮吸収製剤。
(項目3)
酸価調節剤は、薬剤学的に使用可能な有機塩基、無機塩基又はこれらの組み合わせを含む、上記項目のうちのいずれか一項に記載の経皮吸収製剤。
(項目4)
酸価調節剤の含量は数学式1にしたがう、上記項目のうちのいずれか一項に記載の経皮吸収製剤:
(数1)
酸価調節剤の含量=ロジンエステルの含量×ロジンエステルの酸価(mgKOH/g)×酸価調節剤の分子量/56100/酸価調節剤の純度(%)×100
(項目5)
ロジンエステル樹脂は、ロジングリセリンエステル、水添ロジングリセリンエステル、ロジンペンタエリスリトールエステル又はこれらの組み合わせを含む、上記項目のうちのいずれか一項に記載の経皮吸収製剤。
(項目6)
密着体は、粘着剤が塗布されたポリウレタンフィルム又は粘着剤が塗布されたポリウレタンフィルムに、切開されたポリエチレンテレフタレートフィルムが接合されたもので、ポリウレタンフィルムの厚さは20μm〜100μmである、上記項目のうちのいずれか一項に記載の経皮吸収製剤。
(項目7)
密着体は、支持体の各隅から5mm〜20mm大きくなるように切断された、上記項目のうちのいずれか一項に記載の経皮吸収製剤。
【0011】
前記目的を達成するために、本発明の経皮吸収製剤は、ツロブテロール及び天然ゴム系粘着基剤を含有する薬物層と、薬物層の一面に付着され、薬物層を支持する支持体とを含み、天然ゴム系粘着基剤は、10重量部〜40重量部の天然ゴム、54.5重量部〜85重量部のロジンエステル樹脂及び酸価調節剤を含有し、薬物層の厚さは25μm〜75μmであることを特徴とする。
【0012】
(摘要)
皮膚に安全であり、経皮吸収率が高く、薬効の持続性及び粘着力に優れたツロブテロールを含有する経皮吸収製剤を提供することにある。また、本発明の目的は、経皮吸収剤を含まずに、ツロブテロールが溶解された状態で安全に皮膚に吸収されるツロブテロールを含有する経皮吸収製剤を提供する。
ツロブテロール及び天然ゴム系粘着基剤を含有する薬物層と、薬物層の一面に付着され、薬物層を支持する支持体とを含み、天然ゴム系粘着基剤は、10重量部〜40重量部の天然ゴム、54.5重量部〜85重量部のロジンエステル樹脂及び酸価調節剤を含有し、薬物層の厚さは25μm〜75μmである経皮吸収製剤を構成する。
【発明の効果】
【0013】
本発明は、ツロブテロール及び天然ゴム系粘着基剤を含有する経皮吸収製剤を提供する。また、本発明は、薬物層、剥離フィルム又は剥離紙及び密着体を含む4層構造の経皮吸収製剤を提供する。本発明の経皮吸収製剤は、市販中の対照薬と同等の水準の範囲で効率的な薬物溶出及び皮膚透過効果を表す。また、皮膚に直接接触する薬物層には、人体に安全な組成を処方し、皮膚刺激がほぼない。また、密着体によって薬物層が皮膚に一定に固定されるので、長時間皮膚に付着しても皮膚から薬物層が分離されず、薬物が一定の速度で皮膚を介して吸収され、喘息及び呼吸器疾患者の呼吸困難を治療するのに有用である。
【図面の簡単な説明】
【0014】
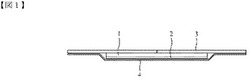
【図1】本発明の一実施例によってパッチ形態で提供される経皮吸収製剤の断面図である。
【図2】図1の剥離フィルム又は剥離紙の平面図である。
【図3】図1の密着体の断面図である。
【図4】本発明の実施例1〜実施例6、比較例1、比較例4、比較例5及びHに対する比較溶出試験結果を示すグラフである。
【図5】本発明の実施例1、実施例4、実施例6、比較例1、比較例4及びHに対する経皮透過試験結果を示すグラフである。
【発明を実施するための形態】
【0015】
本発明者らは、ツロブテロールを含有する経皮吸収製剤の組成物を研究し、天然ゴム系粘着基剤を用いて物理化学的にツロブテロールが完全に溶解された薬物層を製造することができた。本発明者らは、ツロブテロール及び天然ゴム系粘着基剤を含む薬物層の場合、粘着力に優れており、人体に安全であるので、皮膚刺激を最小化することができ、対照薬であるホクナリンパッチ(製造元:アボットジャパン株式会社;以下、「H」と称する。)と同等の薬物溶出及び皮膚透過特性を表すことを発見し、本発明を完成するに至った。
【0016】
本発明の一様相として、ツロブテロール及び天然ゴム系粘着基剤を含有する薬物層と、薬物層の一面に付着され、薬物層を支持する支持体とを含み、天然ゴム系粘着基剤は、10重量部〜40重量部の天然ゴム、54.5重量部〜85重量部のロジンエステル樹脂及び酸価調節剤を含有し、薬物層の厚さは25μm〜75μmである経皮吸収製剤が提供される。本明細書において、用語「量部」は「重量%」に取り替えられる。具体的に、薬物層に含有される各成分の総含量を100重量部とする場合、各成分の含量は重量%で表示される。この場合、各成分の含量は、薬物層の乾燥重量を基準にして表示される。
【0017】
特徴的に、本発明の経皮吸収製剤は、剥離フィルム、薬物層、支持体及び密着体の4層構造で構成される。したがって、本発明の他の様相として、ツロブテロール及び天然ゴム系粘着基剤を含有する薬物層と、薬物層の下面に付着され、薬物層を支持する支持体と、支持体の下面に付着され、薬物層を皮膚に一定に固定する密着体と、薬物層の上面に付着され、薬物層を保護し、薬物層から容易に分離される剥離フィルム又は剥離紙とを含み、天然ゴム系粘着基剤は、10重量部〜40重量部の天然ゴム、54.5重量部〜85重量部のロジンエステル樹脂及び酸価調節剤を含有し、薬物層の厚さは25μm〜75μmである経皮吸収製剤が提供される。薬物層における上面及び下面は、説明の便宜のために記載されたもので、単純に薬物層の互いに異なる面を称する。
【0018】
図1は、本発明に係るツロブテロールを含有する4層構造の経皮吸収製剤を例示する。本発明に係る4層構造の経皮吸収製剤は、市販中の対照薬Hと同等の水準の薬物溶出及び皮膚透過効果を表し、皮膚刺激がほぼない。また、長時間皮膚に付着しても、密着体によって薬物層が皮膚に一定に固定され、皮膚から薬物層が分離されずに薬物が一定の速度で皮膚を介して吸収されるので、喘息及び呼吸器疾患者の呼吸困難治療に非常に有用である。
【0019】
図1を参照すれば、本発明の経皮吸収製剤は、皮膚を介して薬物が効果的に吸収されるように4層で構成される。具体的に、本発明の経皮吸収製剤は、薬物層1、支持体2、剥離フィルム又は剥離紙3及び密着体4を含むことができる。
【0020】
本発明において、薬物層1は、人体の皮膚と直接接触し、薬物溶出及び皮膚透過速度を調節する。薬物層は、ツロブテロール及び天然ゴム系粘着基剤で組成される。ツロブテロールは、それ自体で又は塩形態で使用される。また、ツロブテロールは、薬物層に溶解された状態で存在し、ツロブテロールの含量は、これに制限されることはないが、薬物層の面積10cm2当たり約2mgを含むことができる。また、特徴的に、本発明において、薬物層は、経皮吸収促進剤を含まない。本明細書において、用語「約」は、該当値を中心にして一定の範囲(例えば、±5%以内、±10%以内)を表す。
【0021】
本発明において、天然ゴム系粘着基剤は、天然ゴム、ロジンエステル樹脂及び酸価調節剤で組成される。天然ゴムは、薬物層の強度を調節する目的で10重量部〜40重量部を使用することができ、天然ゴムを10重量部未満で使用する場合、薬物層の硬度が非常に低くなり、天然ゴムを40重量部を超えて使用する場合、硬度は上昇するが、粘着力が非常に低くなり、柔軟性が低下するようになる。本発明において、ロジンエステル樹脂は、粘着付与剤として54.5重量部〜85重量部を使用することができる。ロジンエステル樹脂を54.5重量部未満で使用する場合、粘着力が低いので、皮膚に付着しにくい。また、ロジンエステル樹脂を85重量部以上で使用する場合、薬物層が粘つき、皮膚から除去するとき、粘着残留物が残るという問題が発生する。ロジンエステル樹脂は、ロジングリセリンエステル、水添ロジングリセリンエステル、ロジンペンタエリスリトールエステル又はこれらの混合物を含む。望ましくは、ロジンエステル樹脂は、水添ロジングリセリンエステル又はその混合物を含む。
【0022】
ロジンエステル樹脂は、ロジン誘導体として、構造的にカルボン酸基を有するアビエチン酸で構成されている。したがって、ロジンエステル樹脂は、カルボン酸基によって人体に皮膚刺激を誘発することができ、化学的に酸価を表すが、通常、商業的に生産されるロジンエステルの酸価(mgKOH/g)は2〜20である。一方、ツロブテロールは、化学構造的にそれ自体に2次アミン基を有しており、ロジンエステル樹脂のカルボン酸基と化学的に結合するので、薬物の溶出及び経皮透過速度に直接的に影響を与えるようになる。主成分と粘着成分の親和力が非常に大きい場合、熱力学的に活性度が減少し、主成分の放出が遅延される。また、ロジンエステル樹脂は、アビエチン酸のカルボン酸基による皮膚刺激を最小化するために、塩基性物質で中和して使用することが最も望ましい。このように、本発明において、溶出及び経皮透過速度を調節し、人体皮膚刺激を減少させるための中和剤として非常に重要な組成である酸価調節剤は、ロジンエステルのカルボン酸基を中和することによってツロブテロールの2次アミンとロジンエステルの化学的反応を遮断する機能を有する。
【0023】
酸価調節剤は、薬剤学的に使用可能な全ての塩基成分を含む。酸価調節剤は、これに制限されることはないが、アルカノールアミン及びアルキルアミンなどの有機塩基、無機塩基又はこれらの組み合わせを含む。アルカノールアミンは、モノエタノールアミン、ジエタノールアミン、トリエタノールアミン又はジイソプロパノールアミンを含む。望ましくは、酸価調節剤はトリエタノールアミンを含む。薬物層内での酸価調節剤の含量は、ロジンエステルを中和するのに充分な量を含む。すなわち、酸価調節剤の含量は、ロジンエステルとの中和点を中心にして一定の範囲(例えば、±5%以内、±10%以内)にある。一例として、酸価調節剤の含量は、これに制限されることはないが、酸価調節剤としてトリエタノールアミンを使用し、水添ロジングリセリンエステルを使用した場合、0.6〜2、望ましくは、1〜1.7重量部である。酸価調節剤の含量は、ロジンエステルの含量、ロジンエステルの酸価、酸価調節剤の分子量などによって変わる。したがって、酸価調節剤の含量は、使用されたロジンエステル及び酸価調節剤によって、水添ロジングリセリンエステル/トリエタノールアミンを基準にして例示した含量に対応する値を有することができる。望ましくは、酸価調節剤の含量は、数1によって計算される。
(数1)
酸価調節剤の含量=ロジンエステルの含量×ロジンエステルの酸価×酸価調節剤の分子量/56100/酸価調節剤の純度×100。
【0024】
ここで、ロジンエステルの酸価は、1gのロジンエステルを中和するのに必要なKOHの量を意味する(mgKOH/g)。酸価調節剤の純度は%で表示される。
【0025】
本発明において、薬物層は、必要に応じてトコフェロール及びその誘導体、アスコルビン酸及びその誘導体、ジブチルヒドロキシトルエン(BHT)及びブチルヒドロキシアニソールなどの抗酸化剤、酸化亜鉛及び酸化チタンなどの色素、プロピルパラベン、メチルパラベン、イミダゾリン誘導体、ピリミジン誘導体及びジオキサン誘導体などの防腐剤、香料などを使用することができる。このような添加剤は、薬物層の重量に対して5重量部以下で使用することが望ましく、2重量部以下で配合することがより望ましい。
【0026】
本発明において、薬物層は、厚さが25μm〜75μmになるように調製される。薬物層の厚さが25μm未満である場合、均一な厚さで薬物層を塗布しにくくなり、塗布厚さ偏差及び含量偏差が高くなる。また、薬物層の厚さが75μmを超える場合、薬物層に含有される薬物の濃度が低いので、薬物の放出率が低くなる。また、薬物層の厚さを厚くするためには、天然ゴム系粘着基剤の濃度を相対的に高くしなければならないので、表面が先に乾燥され、薬物層に気孔が発生するようになる。
【0027】
本発明の薬物層は、多様な方法を用いて製造される。一例として、本発明の薬物層は、有機溶媒にツロブテロール及び天然ゴム系粘着基剤成分を溶解して薬物層製造溶液を得た後、薬物層製造溶液を剥離フィルムに塗布し、塗布された薬物製造溶液を所望の厚さで乾燥させることによって製造される。有機溶媒は、トルエンとヘプタンの混合溶液を含み、望ましくは、トルエンとヘプタンの混合比率は5〜8:2〜5(wt/wt又はv/v)である。このような混合比率でツロブテロールと天然ゴム系粘着基剤が容易に溶解される。また、共沸点が低く調整され、薬物層を低温で乾燥できるので、薬物の含量を高温乾燥時より一定に保存することができる。
【0028】
本発明で使用される支持体2は、薬物層を支持し、貼り付け時に外部からの汚染を防止し、薬物が皮膚方向に投与されるように薬物の逆拡散を防止する。支持体は、透明、半透明又は不透明状のアルミニウムが蒸着されたポリエステルフィルム、不織布が接合されたポリエステルフィルム、ポリエチレンテレフタレートフィルム又はこれらの組み合わせを含む。支持体の厚さは、望ましくは5μm〜50μm、より望ましくは約20μmである。支持体の厚さが5μm未満である場合、柔軟性が高いので、製造時に薬物層と不均一に接合される。その一方、支持体の厚さが50μm以上である場合、製剤の柔軟性が非常に低いので、薬物層の粘着力が高いとしても、皮膚の動きによって容易に分離される。
【0029】
本発明において、剥離フィルム又は剥離紙3は、薬物層の他の面に付着され、異物質から薬物層を保護し、製品使用時に薬物層から容易に分離される。剥離フィルム又は剥離紙の形態を図2に例示した。剥離フィルムとしては、ポリエステル、ポリビニルクロライド、ポリビニリデンクロライド、ポリエチレンテレフタレートなどから製造されるフィルムを使用することができる。また、剥離紙としては、ポリオレフィンが積層された上質紙やグラシン紙などの紙類を使用することができる。剥離フィルム又は剥離紙は、製品使用時に薬物層から容易に分離されるように、薬物層が接する表面にシリコン又はフッ素樹脂が塗布される。望ましくは、剥離フィルム又は剥離紙は、薬物の経時安定性に優れており、一面をシリコン樹脂で塗布した約75μm厚さの半透明状ポリエチレンテレフタレート剥離フィルムを含む。
【0030】
本発明において、密着体4は、支持体に付着され、長時間の間薬物層を皮膚に固定することによってツロブテロールを一定に皮膚に透過させる役割をする。すなわち、密着体は、長時間貼り付けるときにも、汗や水分によって薬物層が皮膚から分離されないようにし、ツロブテロールが最も効率的に皮膚に透過されるようにする。密着体は、これに制限されることはないが、粘着剤が塗布されたポリウレタンフィルム(図4(b))又は粘着剤が塗布されたポリウレタンフィルムにポリエチレンテレフタレートフィルムが接合されたもの(図4(a))を含む。ポリウレタンフィルムの厚さは、20μm〜100μmであることが望ましい。ポリウレタンフィルムの厚さが20μm未満である場合、皮膚によく密着されるが、フィルムが非常に薄いことから、皮膚に均一に付着しにくい。また、ポリウレタンフィルムの厚さが100μm以上である場合、フィルムが非常に厚いので、使用感が悪く、皮膚から容易に剥離される。また、密着体の大きさは、薬物層が塗布された支持体の各隅より5mm〜20mm大きくなるように切断することが望ましく、支持体の大きさと形状に応じて適宜調節することができる。望ましくは、密着体は、粘着剤が塗布された約30μm厚さのポリウレタンフィルムに(切開された)ポリエチレンテレフタレートフィルムが接合されたものであって、支持体の各隅より約10mm大きくなるように切断されたものを含む。
【0031】
以下、実施例を用いて本発明を説明するが、これは本発明の理解のためのものに過ぎず、これによって本発明の範囲が制限されることはない。
【0032】
実施例及び比較例は、実験計画によって実施した数多くの反復実験のうち、本発明の理解を促進するための最小の例を抜粋したものである。以下の実施例において、各成分の添加順序は、一例であって、実施例及び比較例によって限定されるものではない。
【実施例】
【0033】
実施例1
トルエンとヘプタンの比率が7:3(wt/wt)である混合溶液に乾燥重量を基準にして4.00重量%のツロブテロール、30.28重量%の天然ゴム、64.46重量%の水添ロジングリセリンエステル及び1.26重量%のツリーエタノールアミンを溶解した。溶解液を75μm厚さの半透明状ポリエチレンテレフタレート剥離フィルムのシリコン樹脂が処理された面に塗布した後、乾燥させて50μm厚さの薬物層を製造した。薬物層を20μm厚さの半透明状ポリエチレンテレフタレートフィルム支持体に転写した後、恒温恒湿器(40±2℃、75±5%)で3日間熟成させた。成形包装機を使用して、薬物層が転写された支持体を10μmの大きさに切断した。切断された支持体を、粘着剤が塗布された密着体と接合した後、一定の大きさに切断した。
【0034】
実施例2〜6及び比較例1〜5
実施例2〜6及び比較例1〜5は、組成及び薬物層の厚さを異ならせ、実施例1に例示した方法によって製造した。表1は、実施例2〜6及び比較例1〜5の組成及び薬物層の厚さを表す。
【0035】
【表1】

実験例
実施例1〜6及び比較例1〜5によって製造された経皮吸収製剤と市販中のホクナリンパッチ(H)の品質を評価するために、粘着力試験、皮膚刺激度試験、比較溶出試験及び経皮透過試験を実施した。特に、粘着力試験において、引張強度試験、比較溶出試験及び経皮透過試験に使用した試料は、市販中のHと類似した形態で品質を比較するために、密着体を接合していない状態で試験した。
【0036】
実験例1:粘着力試験
粘着力は、20人の被試験者の背中に実施例1〜6、比較例1〜5及びHを貼り付け、24時間経過後、表2の評価尺度によって粘着力について評価した。また、引張強度試験機を使用して実施例1及びHの薬物層に対する粘着力を代表的に比較した。引張強度試験方法は、次のように行った。試料を12mmの幅に切断し、37℃の恒温器に30分間放置したフェノール樹脂試験板(幅25mm、長さ125mm、厚さ5mm)に一端を合わせて付着した。850gのゴムローラを使用して300mm/分の速度で試料の上を2回通過し、試料が付着された試験板を37℃の恒温器に30分間放置した。試験板に付着した試料の端を180゜の角度で曲げた後、引張試験機の上部分に固定し、試験板は下部分に固定した。300mm/分の速度で20mmを引っ張るときの荷重を10回測定し、平均値を記録した。。
【0037】
【表2】

実験例2:皮膚刺激度試験
被試験者20人を対象にして直径1.5cmの大きさの円に切断した実施例1〜6、比較例1〜5及びHを両腕の下膊内側に6個ずつ8時間の間付着した。試料Hは、皮膚から容易に分離されないように密着布で固定した。試料を剥がしてから30分後の紅斑状態を、表3の評価尺度によって肉眼で評価した。
【0038】
【表3】

実験例3:比較溶出試験
実施例1〜6、比較例1、比較例4、比較例5及びHをそれぞれ6枚(10cm2/1枚)ずつとり、薬物層が上に向かうように支持体面を溶出機のディスクアセンブリの中央に両面接着テープで付着した。500mlの水を溶出容器に入れ、溶出温度32±0。5℃、パドル回転速度50rpmの条件で3時間、8時間及び24時間に溶出液10mlを採取した。薬局方一般試験法吸光度測定法によって波長211nmで吸光度を測定した。USP(United States Pharmacopeia)経皮製剤のパドルオーバーディスク法によって類似性を判断した。
【0039】
実験例4:経皮透過試験
比較溶出試験において、対照薬であるHと許容誤差範囲内(±10%)で同等の溶出傾向を表した各実験例のうち実施例1、実施例4及び実施例6を選定し、比較例1、比較例4及び対照薬Hに対する経皮透過試験を実施した。6週齢の男性無毛ネズミを頚椎脱臼し、3cm×3cmの大きさで皮膚を摘出した後、皮下脂肪を除去した。摘出した皮膚の表皮層に予め1.767cm2の大きさの円に切断した実施例1、実施例4、実施例6、比較例1、比較例4及びHを付着した。皮膚の内皮層は、フランツ拡散セルに向かうように付着した。フランツ拡散セルのレセプタ層にpH7.4のPBS(Phosphate buffered saline)緩衝溶液を気泡が発生しないように用心深く充填し、フランツ拡散装置の温度を32±0.5℃に維持しながら600rpmで撹拌した。試料は、0、1、2、4、6、8、10、12、16、24時間に250μlをとり、HPLCで経皮透過されたツロブテロールの含量を分析し、同一量の緩衝溶液をレセプタ層に充填した。フランツ拡散セルに付着した無毛ネズミの有効皮膚面積は1.767cm2で、レセプタの体積は13.0mlで、シンク条件で皮膚透過試験を実施した。HPLC分析条件で移動相として0.02Mのリン酸二水素カリウム水溶液とアセトニトリルの80:20(v/v)混合液を使用し、注入量は20μl、流速は1.2ml/分、検出波長は211nm、カラムとしてはAgilent Zorbox XDB C18を使用した。経皮透過試験結果は図5に示した。
【0040】
試験結果
粘着力試験結果を表4に示した。粘着力は、皮膚を介して薬物が吸収される経路において物理的に非常に重要な品質属性のうち一つである。実施例1〜6、比較例1〜5は、品質評価者が製品見本を人為的に剥がすとき(24時間)まで初期状態で貼り付けられており、対照薬であるHよりも粘着力に非常に優れていると評価された。比較例2は、24時間後にも皮膚によく貼り付けられていたが、剥がした後、多量の粘着剤が皮膚に残留した。また、引張強度試験機を使用して測定した結果、実施例1及びHの薬物層の粘着力は、それぞれ597.98±79.97gf及び359.91±37.88gfとして、実施例1の薬物層自体の粘着力が対照薬Hより優れていることが分かった。本発明の実施例が優れた粘着力を表す理由は、天然ゴムと粘着付与剤であるロジンエステル樹脂の適切な組成比によって薬物層に含まれる天然ゴム系粘着基剤が優れた粘着物性を表すためであると考えられ、特に、密着体によって薬物層が皮膚に一定に固定されるという特徴がある。
【0041】
【表4】

皮膚刺激試験結果を表5に示した。実施例1〜6、比較例3及び比較例5は、皮膚刺激がほぼないと評価され、対照薬Hは、普通の刺激、比較例1及び比較例4は、対照薬よりも高い刺激を表した。比較例1は、酸価調節剤を含有していないので、粘着付与樹脂に含有されたカルボン酸基によって刺激が誘発されたと判断される。また、比較例4は、他の組成よりも高い薬物含有量が皮膚刺激の直接的な原因であると推測される。比較例2は、9人の被試験者から皮膚に残留した粘着剤をアルコールガーゼで除去する過程で紅斑が発生した。
【0042】
【表5】

比較溶出試験及び経皮透過試験は、本発明の効能・効果に対して対照薬との同等性を予測できるよい試験方法である。特に、比較溶出試験は、対照薬との生物学的同等性を確認できる非常に重要な試験であって、対照薬と溶出率の許容誤差範囲が±10%である場合に生物学的に同等であると認定されている。比較溶出試験は、粘着力試験で粘着剤が皮膚に残る品質問題を有していた比較例2と、粘着力が非常に低かった比較例3を除いた本発明の実施例1〜6、比較例1、比較例4及び比較例5に対して対照薬であるHと比較溶出試験を実施した。試験結果を図4に示した。比較溶出試験において、実施例1〜6は、対照薬であるHと許容誤差範囲である±10%に符合することが分かった。薬物層に酸価調節剤が含有されていない比較例1は、下限基準とほぼ類似した溶出率を表した。薬物層の厚さが薄く、薬物濃度が高い比較例4は、溶出率の許容誤差の上限基準から脱する結果を表した。
【0043】
経皮透過試験は、対照薬であるHと許容誤差範囲内(±10%)で同等の溶出傾向を表した実験例のうち実施例1、実施例4及び実施例6を選定し、比較例1、比較例4、対照薬であるHと経皮透過傾向を比較し、試験結果を図5に示した。薬物層に酸価調節剤が含有されていない比較例1の放出傾向は、時間の経過にもかかわらず、薬物放出がほぼ一定の水準に留まる特性を表した。薬物層にカルボン酸基を有している粘着付与樹脂とツロブテロールの2次アミンとの化学的結合によって放出が遅延されると把握される。また、薬物濃度が高く組成された比較例4は、他の組成よりも相対的に薬物放出が高く表れ、実施例1、実施例4及び実施例6は、対照薬であるHと類似した範囲で薬物放出傾向を表した。
【産業上の利用可能性】
【0044】
本発明は、ツロブテロールを含有する薬剤学的組成物に適用され、具体的に、ツロブテロールを含有する経皮吸収製剤に適用される。
【符号の説明】
【0045】
1 薬物層
2 支持体
3 剥離フィルム又は剥離紙
4 密着体
5 ポリエチレンテレフタレートフィルム
6 ポリウレタンフィルム
7 粘着層
【技術分野】
【0001】
本発明は、ツロブテロールを含有する薬剤学的組成物に関するもので、具体的には、ツロブテロールを含有する経皮吸収製剤に関するものである。
【背景技術】
【0002】
ツロブテロール[2―t―ブチルアミノ―1―(2―クロロフェニル)エタノール]は、化学式1のように2次アミンを有し、分子量が227.7であるベータ―アドレナリン系の薬物として交感神経のβ2受容体に選択的に作用し、気管支平滑筋を弛緩させる役割をする。したがって、ツロブテロールは、気道狭窄による喘息及び呼吸器疾患者の呼吸困難を軽減又は治療するのに有用な気管支拡張剤として使用されてきた。ツロブテロールは、塩としても存在する。
【0003】
【化1】

皮膚を介して薬物を吸収させる経皮吸収製剤は、薬物を持続的に長時間の間一定に体内に伝達することができ、肝での初回代謝を防止することができる。特に、経皮吸収製剤は、患者の服薬順応度が高いので、薬物の投与回数及び副作用を減少できる良い方法として知られてきた。しかし、一般に、皮膚は非常に低い透過度を有しており、ほとんどの薬物は、物理化学的に経皮吸収製剤に適用するのに不適切であったり、人体に対する安全性を確保することが難しく、経皮吸収製剤として開発できる薬物が極めて制限的である。そのため、気管支拡張剤を含有する経皮吸収製剤の開発は、製薬産業において大きな関心の対象となってきた。特に、ツロブテロールを含有する経皮吸収製剤に対する研究は未だに持続的に行われている。
【0004】
特許文献1は、ツロブテロールが粘着剤中に溶解度以上の高農度で含有された経皮吸収製剤を開示している。ツロブテロールが粘着剤中に溶解度以上の高農度で含有されているので、薬物の経皮吸収率が増加し、放出持続時間がより長くなるという特徴がある。しかし、時間の経過によってツロブテロールの一部が結晶状態で薬物層に部分的に分散され、薬物層の表面にツロブテロール結晶が発生しにくい。その結果、経皮吸収製剤の皮膚に対する粘着力が低くなり、一定の薬物放出速度特性を表すことが難しくなる。
【0005】
特許文献2、3、4及び5は、アクリル粘着剤、ツロブテロール及び経皮吸収促進剤を含むマトリックス型経皮吸収製剤を開示している。アクリル粘着剤は、主モノマー、変形モノマー及びカルボキシル基、ヒドロキシル基、エポキシ基、アミン基、有機シラン基などの多様な官能基を有する。アクリル粘着剤は、官能基やモノマーによってやや差があるが、薬物を初期に過多に溶出するという特性を有するので、ツロブテロールを長時間の間一定の速度で放出できないという問題がある。また、経皮吸収促進剤は、人体安全性の良い組成であるとしても、非常に低い透過度を有している皮膚を介して薬物を透過させるためには皮膚組織に軽微な刺激を表すようになる。
【0006】
特許文献6は、経皮吸収促進剤を含有するアクリル系粘着剤又は合成ゴム系粘着剤にツロブテロールを5重量部以上の高濃度で含有させた経皮吸収製剤を開示している。特許文献6は、皮膚に対する優れた経皮吸収率、薬効の持続性及び優れた粘着力を表している。しかし、アクリル系粘着剤を使用する場合、初期に薬物が過多に溶出されるという特性があり、合成ゴム系粘着剤によって皮膚組織が損傷を受け、局所的に紅斑、かゆみ症又は炎症などの副作用を起こす可能性がある。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】日本特許公告第7―25669号
【特許文献2】大韓民国登録特許第10―0535302号
【特許文献3】大韓民国登録特許第10―0469995号
【特許文献4】大韓民国登録特許第10―0579721号
【特許文献5】大韓民国登録特許第10―0439659号
【特許文献6】日本登録特許第3930984号
【発明の概要】
【発明が解決しようとする課題】
【0008】
ツロブテロールを含有する経皮吸収製剤は、皮膚に安全であり、経皮吸収率が高く、薬効の持続性及び粘着力に優れていなければならない。したがって、経皮吸収製剤は、人体に安全な組成でなければならなく、皮膚を損傷させずに主薬物が溶解された状態で安全に皮膚に吸収される機転を研究する製剤学的研究が経皮吸収製剤の核心技術といえる。また、経皮吸収促進剤は、人体安全性が良いとしても、程度の差はあるが、皮膚刺激を完全に排除することはできない。経皮吸収促進剤を含有しない経皮吸収製剤が当業界で継続して要求されてきたが、経皮吸収促進剤のない状態で所望の薬物放出速度を表す経皮吸収製剤を開発するのは非常に難しい解決技術のうち一つである。
【0009】
したがって、本発明の目的は、皮膚に安全であり、経皮吸収率が高く、薬効の持続性及び粘着力に優れたツロブテロールを含有する経皮吸収製剤を提供することにある。また、本発明の目的は、経皮吸収剤を含まずに、ツロブテロールが溶解された状態で安全に皮膚に吸収されるツロブテロールを含有する経皮吸収製剤を提供することにある。
【課題を解決するための手段】
【0010】
上記課題を解決するために、本発明は、例えば、以下を提供する:
(項目1)
ツロブテロール及び天然ゴム系粘着基剤を含有する薬物層と、
薬物層の一面に付着され、薬物層を支持する支持体と、を含み、
天然ゴム系粘着基剤は、10重量部〜40重量部の天然ゴム、54.5重量部〜85重量部のロジンエステル樹脂及び酸価調節剤を含有し、
薬物層は、厚さが25μm〜75μmである経皮吸収製剤。
(項目2)
ツロブテロール及び天然ゴム系粘着基剤を含有する薬物層と、
薬物層の下面に付着され、薬物層を支持する支持体と、
支持体の下面に付着され、薬物層を皮膚に一定に固定する密着体と、
薬物層の上面に付着され、薬物層を保護し、薬物層から容易に分離される剥離フィルム又は剥離紙と、を含み、
天然ゴム系粘着基剤は、10重量部〜40重量部の天然ゴム、54.5重量部〜85重量部のロジンエステル樹脂及び酸価調節剤を含有し、
薬物層は、厚さが25μm〜75μmである経皮吸収製剤。
(項目3)
酸価調節剤は、薬剤学的に使用可能な有機塩基、無機塩基又はこれらの組み合わせを含む、上記項目のうちのいずれか一項に記載の経皮吸収製剤。
(項目4)
酸価調節剤の含量は数学式1にしたがう、上記項目のうちのいずれか一項に記載の経皮吸収製剤:
(数1)
酸価調節剤の含量=ロジンエステルの含量×ロジンエステルの酸価(mgKOH/g)×酸価調節剤の分子量/56100/酸価調節剤の純度(%)×100
(項目5)
ロジンエステル樹脂は、ロジングリセリンエステル、水添ロジングリセリンエステル、ロジンペンタエリスリトールエステル又はこれらの組み合わせを含む、上記項目のうちのいずれか一項に記載の経皮吸収製剤。
(項目6)
密着体は、粘着剤が塗布されたポリウレタンフィルム又は粘着剤が塗布されたポリウレタンフィルムに、切開されたポリエチレンテレフタレートフィルムが接合されたもので、ポリウレタンフィルムの厚さは20μm〜100μmである、上記項目のうちのいずれか一項に記載の経皮吸収製剤。
(項目7)
密着体は、支持体の各隅から5mm〜20mm大きくなるように切断された、上記項目のうちのいずれか一項に記載の経皮吸収製剤。
【0011】
前記目的を達成するために、本発明の経皮吸収製剤は、ツロブテロール及び天然ゴム系粘着基剤を含有する薬物層と、薬物層の一面に付着され、薬物層を支持する支持体とを含み、天然ゴム系粘着基剤は、10重量部〜40重量部の天然ゴム、54.5重量部〜85重量部のロジンエステル樹脂及び酸価調節剤を含有し、薬物層の厚さは25μm〜75μmであることを特徴とする。
【0012】
(摘要)
皮膚に安全であり、経皮吸収率が高く、薬効の持続性及び粘着力に優れたツロブテロールを含有する経皮吸収製剤を提供することにある。また、本発明の目的は、経皮吸収剤を含まずに、ツロブテロールが溶解された状態で安全に皮膚に吸収されるツロブテロールを含有する経皮吸収製剤を提供する。
ツロブテロール及び天然ゴム系粘着基剤を含有する薬物層と、薬物層の一面に付着され、薬物層を支持する支持体とを含み、天然ゴム系粘着基剤は、10重量部〜40重量部の天然ゴム、54.5重量部〜85重量部のロジンエステル樹脂及び酸価調節剤を含有し、薬物層の厚さは25μm〜75μmである経皮吸収製剤を構成する。
【発明の効果】
【0013】
本発明は、ツロブテロール及び天然ゴム系粘着基剤を含有する経皮吸収製剤を提供する。また、本発明は、薬物層、剥離フィルム又は剥離紙及び密着体を含む4層構造の経皮吸収製剤を提供する。本発明の経皮吸収製剤は、市販中の対照薬と同等の水準の範囲で効率的な薬物溶出及び皮膚透過効果を表す。また、皮膚に直接接触する薬物層には、人体に安全な組成を処方し、皮膚刺激がほぼない。また、密着体によって薬物層が皮膚に一定に固定されるので、長時間皮膚に付着しても皮膚から薬物層が分離されず、薬物が一定の速度で皮膚を介して吸収され、喘息及び呼吸器疾患者の呼吸困難を治療するのに有用である。
【図面の簡単な説明】
【0014】
【図1】本発明の一実施例によってパッチ形態で提供される経皮吸収製剤の断面図である。
【図2】図1の剥離フィルム又は剥離紙の平面図である。
【図3】図1の密着体の断面図である。
【図4】本発明の実施例1〜実施例6、比較例1、比較例4、比較例5及びHに対する比較溶出試験結果を示すグラフである。
【図5】本発明の実施例1、実施例4、実施例6、比較例1、比較例4及びHに対する経皮透過試験結果を示すグラフである。
【発明を実施するための形態】
【0015】
本発明者らは、ツロブテロールを含有する経皮吸収製剤の組成物を研究し、天然ゴム系粘着基剤を用いて物理化学的にツロブテロールが完全に溶解された薬物層を製造することができた。本発明者らは、ツロブテロール及び天然ゴム系粘着基剤を含む薬物層の場合、粘着力に優れており、人体に安全であるので、皮膚刺激を最小化することができ、対照薬であるホクナリンパッチ(製造元:アボットジャパン株式会社;以下、「H」と称する。)と同等の薬物溶出及び皮膚透過特性を表すことを発見し、本発明を完成するに至った。
【0016】
本発明の一様相として、ツロブテロール及び天然ゴム系粘着基剤を含有する薬物層と、薬物層の一面に付着され、薬物層を支持する支持体とを含み、天然ゴム系粘着基剤は、10重量部〜40重量部の天然ゴム、54.5重量部〜85重量部のロジンエステル樹脂及び酸価調節剤を含有し、薬物層の厚さは25μm〜75μmである経皮吸収製剤が提供される。本明細書において、用語「量部」は「重量%」に取り替えられる。具体的に、薬物層に含有される各成分の総含量を100重量部とする場合、各成分の含量は重量%で表示される。この場合、各成分の含量は、薬物層の乾燥重量を基準にして表示される。
【0017】
特徴的に、本発明の経皮吸収製剤は、剥離フィルム、薬物層、支持体及び密着体の4層構造で構成される。したがって、本発明の他の様相として、ツロブテロール及び天然ゴム系粘着基剤を含有する薬物層と、薬物層の下面に付着され、薬物層を支持する支持体と、支持体の下面に付着され、薬物層を皮膚に一定に固定する密着体と、薬物層の上面に付着され、薬物層を保護し、薬物層から容易に分離される剥離フィルム又は剥離紙とを含み、天然ゴム系粘着基剤は、10重量部〜40重量部の天然ゴム、54.5重量部〜85重量部のロジンエステル樹脂及び酸価調節剤を含有し、薬物層の厚さは25μm〜75μmである経皮吸収製剤が提供される。薬物層における上面及び下面は、説明の便宜のために記載されたもので、単純に薬物層の互いに異なる面を称する。
【0018】
図1は、本発明に係るツロブテロールを含有する4層構造の経皮吸収製剤を例示する。本発明に係る4層構造の経皮吸収製剤は、市販中の対照薬Hと同等の水準の薬物溶出及び皮膚透過効果を表し、皮膚刺激がほぼない。また、長時間皮膚に付着しても、密着体によって薬物層が皮膚に一定に固定され、皮膚から薬物層が分離されずに薬物が一定の速度で皮膚を介して吸収されるので、喘息及び呼吸器疾患者の呼吸困難治療に非常に有用である。
【0019】
図1を参照すれば、本発明の経皮吸収製剤は、皮膚を介して薬物が効果的に吸収されるように4層で構成される。具体的に、本発明の経皮吸収製剤は、薬物層1、支持体2、剥離フィルム又は剥離紙3及び密着体4を含むことができる。
【0020】
本発明において、薬物層1は、人体の皮膚と直接接触し、薬物溶出及び皮膚透過速度を調節する。薬物層は、ツロブテロール及び天然ゴム系粘着基剤で組成される。ツロブテロールは、それ自体で又は塩形態で使用される。また、ツロブテロールは、薬物層に溶解された状態で存在し、ツロブテロールの含量は、これに制限されることはないが、薬物層の面積10cm2当たり約2mgを含むことができる。また、特徴的に、本発明において、薬物層は、経皮吸収促進剤を含まない。本明細書において、用語「約」は、該当値を中心にして一定の範囲(例えば、±5%以内、±10%以内)を表す。
【0021】
本発明において、天然ゴム系粘着基剤は、天然ゴム、ロジンエステル樹脂及び酸価調節剤で組成される。天然ゴムは、薬物層の強度を調節する目的で10重量部〜40重量部を使用することができ、天然ゴムを10重量部未満で使用する場合、薬物層の硬度が非常に低くなり、天然ゴムを40重量部を超えて使用する場合、硬度は上昇するが、粘着力が非常に低くなり、柔軟性が低下するようになる。本発明において、ロジンエステル樹脂は、粘着付与剤として54.5重量部〜85重量部を使用することができる。ロジンエステル樹脂を54.5重量部未満で使用する場合、粘着力が低いので、皮膚に付着しにくい。また、ロジンエステル樹脂を85重量部以上で使用する場合、薬物層が粘つき、皮膚から除去するとき、粘着残留物が残るという問題が発生する。ロジンエステル樹脂は、ロジングリセリンエステル、水添ロジングリセリンエステル、ロジンペンタエリスリトールエステル又はこれらの混合物を含む。望ましくは、ロジンエステル樹脂は、水添ロジングリセリンエステル又はその混合物を含む。
【0022】
ロジンエステル樹脂は、ロジン誘導体として、構造的にカルボン酸基を有するアビエチン酸で構成されている。したがって、ロジンエステル樹脂は、カルボン酸基によって人体に皮膚刺激を誘発することができ、化学的に酸価を表すが、通常、商業的に生産されるロジンエステルの酸価(mgKOH/g)は2〜20である。一方、ツロブテロールは、化学構造的にそれ自体に2次アミン基を有しており、ロジンエステル樹脂のカルボン酸基と化学的に結合するので、薬物の溶出及び経皮透過速度に直接的に影響を与えるようになる。主成分と粘着成分の親和力が非常に大きい場合、熱力学的に活性度が減少し、主成分の放出が遅延される。また、ロジンエステル樹脂は、アビエチン酸のカルボン酸基による皮膚刺激を最小化するために、塩基性物質で中和して使用することが最も望ましい。このように、本発明において、溶出及び経皮透過速度を調節し、人体皮膚刺激を減少させるための中和剤として非常に重要な組成である酸価調節剤は、ロジンエステルのカルボン酸基を中和することによってツロブテロールの2次アミンとロジンエステルの化学的反応を遮断する機能を有する。
【0023】
酸価調節剤は、薬剤学的に使用可能な全ての塩基成分を含む。酸価調節剤は、これに制限されることはないが、アルカノールアミン及びアルキルアミンなどの有機塩基、無機塩基又はこれらの組み合わせを含む。アルカノールアミンは、モノエタノールアミン、ジエタノールアミン、トリエタノールアミン又はジイソプロパノールアミンを含む。望ましくは、酸価調節剤はトリエタノールアミンを含む。薬物層内での酸価調節剤の含量は、ロジンエステルを中和するのに充分な量を含む。すなわち、酸価調節剤の含量は、ロジンエステルとの中和点を中心にして一定の範囲(例えば、±5%以内、±10%以内)にある。一例として、酸価調節剤の含量は、これに制限されることはないが、酸価調節剤としてトリエタノールアミンを使用し、水添ロジングリセリンエステルを使用した場合、0.6〜2、望ましくは、1〜1.7重量部である。酸価調節剤の含量は、ロジンエステルの含量、ロジンエステルの酸価、酸価調節剤の分子量などによって変わる。したがって、酸価調節剤の含量は、使用されたロジンエステル及び酸価調節剤によって、水添ロジングリセリンエステル/トリエタノールアミンを基準にして例示した含量に対応する値を有することができる。望ましくは、酸価調節剤の含量は、数1によって計算される。
(数1)
酸価調節剤の含量=ロジンエステルの含量×ロジンエステルの酸価×酸価調節剤の分子量/56100/酸価調節剤の純度×100。
【0024】
ここで、ロジンエステルの酸価は、1gのロジンエステルを中和するのに必要なKOHの量を意味する(mgKOH/g)。酸価調節剤の純度は%で表示される。
【0025】
本発明において、薬物層は、必要に応じてトコフェロール及びその誘導体、アスコルビン酸及びその誘導体、ジブチルヒドロキシトルエン(BHT)及びブチルヒドロキシアニソールなどの抗酸化剤、酸化亜鉛及び酸化チタンなどの色素、プロピルパラベン、メチルパラベン、イミダゾリン誘導体、ピリミジン誘導体及びジオキサン誘導体などの防腐剤、香料などを使用することができる。このような添加剤は、薬物層の重量に対して5重量部以下で使用することが望ましく、2重量部以下で配合することがより望ましい。
【0026】
本発明において、薬物層は、厚さが25μm〜75μmになるように調製される。薬物層の厚さが25μm未満である場合、均一な厚さで薬物層を塗布しにくくなり、塗布厚さ偏差及び含量偏差が高くなる。また、薬物層の厚さが75μmを超える場合、薬物層に含有される薬物の濃度が低いので、薬物の放出率が低くなる。また、薬物層の厚さを厚くするためには、天然ゴム系粘着基剤の濃度を相対的に高くしなければならないので、表面が先に乾燥され、薬物層に気孔が発生するようになる。
【0027】
本発明の薬物層は、多様な方法を用いて製造される。一例として、本発明の薬物層は、有機溶媒にツロブテロール及び天然ゴム系粘着基剤成分を溶解して薬物層製造溶液を得た後、薬物層製造溶液を剥離フィルムに塗布し、塗布された薬物製造溶液を所望の厚さで乾燥させることによって製造される。有機溶媒は、トルエンとヘプタンの混合溶液を含み、望ましくは、トルエンとヘプタンの混合比率は5〜8:2〜5(wt/wt又はv/v)である。このような混合比率でツロブテロールと天然ゴム系粘着基剤が容易に溶解される。また、共沸点が低く調整され、薬物層を低温で乾燥できるので、薬物の含量を高温乾燥時より一定に保存することができる。
【0028】
本発明で使用される支持体2は、薬物層を支持し、貼り付け時に外部からの汚染を防止し、薬物が皮膚方向に投与されるように薬物の逆拡散を防止する。支持体は、透明、半透明又は不透明状のアルミニウムが蒸着されたポリエステルフィルム、不織布が接合されたポリエステルフィルム、ポリエチレンテレフタレートフィルム又はこれらの組み合わせを含む。支持体の厚さは、望ましくは5μm〜50μm、より望ましくは約20μmである。支持体の厚さが5μm未満である場合、柔軟性が高いので、製造時に薬物層と不均一に接合される。その一方、支持体の厚さが50μm以上である場合、製剤の柔軟性が非常に低いので、薬物層の粘着力が高いとしても、皮膚の動きによって容易に分離される。
【0029】
本発明において、剥離フィルム又は剥離紙3は、薬物層の他の面に付着され、異物質から薬物層を保護し、製品使用時に薬物層から容易に分離される。剥離フィルム又は剥離紙の形態を図2に例示した。剥離フィルムとしては、ポリエステル、ポリビニルクロライド、ポリビニリデンクロライド、ポリエチレンテレフタレートなどから製造されるフィルムを使用することができる。また、剥離紙としては、ポリオレフィンが積層された上質紙やグラシン紙などの紙類を使用することができる。剥離フィルム又は剥離紙は、製品使用時に薬物層から容易に分離されるように、薬物層が接する表面にシリコン又はフッ素樹脂が塗布される。望ましくは、剥離フィルム又は剥離紙は、薬物の経時安定性に優れており、一面をシリコン樹脂で塗布した約75μm厚さの半透明状ポリエチレンテレフタレート剥離フィルムを含む。
【0030】
本発明において、密着体4は、支持体に付着され、長時間の間薬物層を皮膚に固定することによってツロブテロールを一定に皮膚に透過させる役割をする。すなわち、密着体は、長時間貼り付けるときにも、汗や水分によって薬物層が皮膚から分離されないようにし、ツロブテロールが最も効率的に皮膚に透過されるようにする。密着体は、これに制限されることはないが、粘着剤が塗布されたポリウレタンフィルム(図4(b))又は粘着剤が塗布されたポリウレタンフィルムにポリエチレンテレフタレートフィルムが接合されたもの(図4(a))を含む。ポリウレタンフィルムの厚さは、20μm〜100μmであることが望ましい。ポリウレタンフィルムの厚さが20μm未満である場合、皮膚によく密着されるが、フィルムが非常に薄いことから、皮膚に均一に付着しにくい。また、ポリウレタンフィルムの厚さが100μm以上である場合、フィルムが非常に厚いので、使用感が悪く、皮膚から容易に剥離される。また、密着体の大きさは、薬物層が塗布された支持体の各隅より5mm〜20mm大きくなるように切断することが望ましく、支持体の大きさと形状に応じて適宜調節することができる。望ましくは、密着体は、粘着剤が塗布された約30μm厚さのポリウレタンフィルムに(切開された)ポリエチレンテレフタレートフィルムが接合されたものであって、支持体の各隅より約10mm大きくなるように切断されたものを含む。
【0031】
以下、実施例を用いて本発明を説明するが、これは本発明の理解のためのものに過ぎず、これによって本発明の範囲が制限されることはない。
【0032】
実施例及び比較例は、実験計画によって実施した数多くの反復実験のうち、本発明の理解を促進するための最小の例を抜粋したものである。以下の実施例において、各成分の添加順序は、一例であって、実施例及び比較例によって限定されるものではない。
【実施例】
【0033】
実施例1
トルエンとヘプタンの比率が7:3(wt/wt)である混合溶液に乾燥重量を基準にして4.00重量%のツロブテロール、30.28重量%の天然ゴム、64.46重量%の水添ロジングリセリンエステル及び1.26重量%のツリーエタノールアミンを溶解した。溶解液を75μm厚さの半透明状ポリエチレンテレフタレート剥離フィルムのシリコン樹脂が処理された面に塗布した後、乾燥させて50μm厚さの薬物層を製造した。薬物層を20μm厚さの半透明状ポリエチレンテレフタレートフィルム支持体に転写した後、恒温恒湿器(40±2℃、75±5%)で3日間熟成させた。成形包装機を使用して、薬物層が転写された支持体を10μmの大きさに切断した。切断された支持体を、粘着剤が塗布された密着体と接合した後、一定の大きさに切断した。
【0034】
実施例2〜6及び比較例1〜5
実施例2〜6及び比較例1〜5は、組成及び薬物層の厚さを異ならせ、実施例1に例示した方法によって製造した。表1は、実施例2〜6及び比較例1〜5の組成及び薬物層の厚さを表す。
【0035】
【表1】

実験例
実施例1〜6及び比較例1〜5によって製造された経皮吸収製剤と市販中のホクナリンパッチ(H)の品質を評価するために、粘着力試験、皮膚刺激度試験、比較溶出試験及び経皮透過試験を実施した。特に、粘着力試験において、引張強度試験、比較溶出試験及び経皮透過試験に使用した試料は、市販中のHと類似した形態で品質を比較するために、密着体を接合していない状態で試験した。
【0036】
実験例1:粘着力試験
粘着力は、20人の被試験者の背中に実施例1〜6、比較例1〜5及びHを貼り付け、24時間経過後、表2の評価尺度によって粘着力について評価した。また、引張強度試験機を使用して実施例1及びHの薬物層に対する粘着力を代表的に比較した。引張強度試験方法は、次のように行った。試料を12mmの幅に切断し、37℃の恒温器に30分間放置したフェノール樹脂試験板(幅25mm、長さ125mm、厚さ5mm)に一端を合わせて付着した。850gのゴムローラを使用して300mm/分の速度で試料の上を2回通過し、試料が付着された試験板を37℃の恒温器に30分間放置した。試験板に付着した試料の端を180゜の角度で曲げた後、引張試験機の上部分に固定し、試験板は下部分に固定した。300mm/分の速度で20mmを引っ張るときの荷重を10回測定し、平均値を記録した。。
【0037】
【表2】

実験例2:皮膚刺激度試験
被試験者20人を対象にして直径1.5cmの大きさの円に切断した実施例1〜6、比較例1〜5及びHを両腕の下膊内側に6個ずつ8時間の間付着した。試料Hは、皮膚から容易に分離されないように密着布で固定した。試料を剥がしてから30分後の紅斑状態を、表3の評価尺度によって肉眼で評価した。
【0038】
【表3】

実験例3:比較溶出試験
実施例1〜6、比較例1、比較例4、比較例5及びHをそれぞれ6枚(10cm2/1枚)ずつとり、薬物層が上に向かうように支持体面を溶出機のディスクアセンブリの中央に両面接着テープで付着した。500mlの水を溶出容器に入れ、溶出温度32±0。5℃、パドル回転速度50rpmの条件で3時間、8時間及び24時間に溶出液10mlを採取した。薬局方一般試験法吸光度測定法によって波長211nmで吸光度を測定した。USP(United States Pharmacopeia)経皮製剤のパドルオーバーディスク法によって類似性を判断した。
【0039】
実験例4:経皮透過試験
比較溶出試験において、対照薬であるHと許容誤差範囲内(±10%)で同等の溶出傾向を表した各実験例のうち実施例1、実施例4及び実施例6を選定し、比較例1、比較例4及び対照薬Hに対する経皮透過試験を実施した。6週齢の男性無毛ネズミを頚椎脱臼し、3cm×3cmの大きさで皮膚を摘出した後、皮下脂肪を除去した。摘出した皮膚の表皮層に予め1.767cm2の大きさの円に切断した実施例1、実施例4、実施例6、比較例1、比較例4及びHを付着した。皮膚の内皮層は、フランツ拡散セルに向かうように付着した。フランツ拡散セルのレセプタ層にpH7.4のPBS(Phosphate buffered saline)緩衝溶液を気泡が発生しないように用心深く充填し、フランツ拡散装置の温度を32±0.5℃に維持しながら600rpmで撹拌した。試料は、0、1、2、4、6、8、10、12、16、24時間に250μlをとり、HPLCで経皮透過されたツロブテロールの含量を分析し、同一量の緩衝溶液をレセプタ層に充填した。フランツ拡散セルに付着した無毛ネズミの有効皮膚面積は1.767cm2で、レセプタの体積は13.0mlで、シンク条件で皮膚透過試験を実施した。HPLC分析条件で移動相として0.02Mのリン酸二水素カリウム水溶液とアセトニトリルの80:20(v/v)混合液を使用し、注入量は20μl、流速は1.2ml/分、検出波長は211nm、カラムとしてはAgilent Zorbox XDB C18を使用した。経皮透過試験結果は図5に示した。
【0040】
試験結果
粘着力試験結果を表4に示した。粘着力は、皮膚を介して薬物が吸収される経路において物理的に非常に重要な品質属性のうち一つである。実施例1〜6、比較例1〜5は、品質評価者が製品見本を人為的に剥がすとき(24時間)まで初期状態で貼り付けられており、対照薬であるHよりも粘着力に非常に優れていると評価された。比較例2は、24時間後にも皮膚によく貼り付けられていたが、剥がした後、多量の粘着剤が皮膚に残留した。また、引張強度試験機を使用して測定した結果、実施例1及びHの薬物層の粘着力は、それぞれ597.98±79.97gf及び359.91±37.88gfとして、実施例1の薬物層自体の粘着力が対照薬Hより優れていることが分かった。本発明の実施例が優れた粘着力を表す理由は、天然ゴムと粘着付与剤であるロジンエステル樹脂の適切な組成比によって薬物層に含まれる天然ゴム系粘着基剤が優れた粘着物性を表すためであると考えられ、特に、密着体によって薬物層が皮膚に一定に固定されるという特徴がある。
【0041】
【表4】

皮膚刺激試験結果を表5に示した。実施例1〜6、比較例3及び比較例5は、皮膚刺激がほぼないと評価され、対照薬Hは、普通の刺激、比較例1及び比較例4は、対照薬よりも高い刺激を表した。比較例1は、酸価調節剤を含有していないので、粘着付与樹脂に含有されたカルボン酸基によって刺激が誘発されたと判断される。また、比較例4は、他の組成よりも高い薬物含有量が皮膚刺激の直接的な原因であると推測される。比較例2は、9人の被試験者から皮膚に残留した粘着剤をアルコールガーゼで除去する過程で紅斑が発生した。
【0042】
【表5】

比較溶出試験及び経皮透過試験は、本発明の効能・効果に対して対照薬との同等性を予測できるよい試験方法である。特に、比較溶出試験は、対照薬との生物学的同等性を確認できる非常に重要な試験であって、対照薬と溶出率の許容誤差範囲が±10%である場合に生物学的に同等であると認定されている。比較溶出試験は、粘着力試験で粘着剤が皮膚に残る品質問題を有していた比較例2と、粘着力が非常に低かった比較例3を除いた本発明の実施例1〜6、比較例1、比較例4及び比較例5に対して対照薬であるHと比較溶出試験を実施した。試験結果を図4に示した。比較溶出試験において、実施例1〜6は、対照薬であるHと許容誤差範囲である±10%に符合することが分かった。薬物層に酸価調節剤が含有されていない比較例1は、下限基準とほぼ類似した溶出率を表した。薬物層の厚さが薄く、薬物濃度が高い比較例4は、溶出率の許容誤差の上限基準から脱する結果を表した。
【0043】
経皮透過試験は、対照薬であるHと許容誤差範囲内(±10%)で同等の溶出傾向を表した実験例のうち実施例1、実施例4及び実施例6を選定し、比較例1、比較例4、対照薬であるHと経皮透過傾向を比較し、試験結果を図5に示した。薬物層に酸価調節剤が含有されていない比較例1の放出傾向は、時間の経過にもかかわらず、薬物放出がほぼ一定の水準に留まる特性を表した。薬物層にカルボン酸基を有している粘着付与樹脂とツロブテロールの2次アミンとの化学的結合によって放出が遅延されると把握される。また、薬物濃度が高く組成された比較例4は、他の組成よりも相対的に薬物放出が高く表れ、実施例1、実施例4及び実施例6は、対照薬であるHと類似した範囲で薬物放出傾向を表した。
【産業上の利用可能性】
【0044】
本発明は、ツロブテロールを含有する薬剤学的組成物に適用され、具体的に、ツロブテロールを含有する経皮吸収製剤に適用される。
【符号の説明】
【0045】
1 薬物層
2 支持体
3 剥離フィルム又は剥離紙
4 密着体
5 ポリエチレンテレフタレートフィルム
6 ポリウレタンフィルム
7 粘着層
【特許請求の範囲】
【請求項1】
ツロブテロール及び天然ゴム系粘着基剤を含有する薬物層と、
薬物層の一面に付着され、薬物層を支持する支持体と、を含み、
天然ゴム系粘着基剤は、10重量部〜40重量部の天然ゴム、54.5重量部〜85重量部のロジンエステル樹脂及び酸価調節剤を含有し、
薬物層は、厚さが25μm〜75μmである経皮吸収製剤。
【請求項2】
ツロブテロール及び天然ゴム系粘着基剤を含有する薬物層と、
薬物層の下面に付着され、薬物層を支持する支持体と、
支持体の下面に付着され、薬物層を皮膚に一定に固定する密着体と、
薬物層の上面に付着され、薬物層を保護し、薬物層から容易に分離される剥離フィルム又は剥離紙と、を含み、
天然ゴム系粘着基剤は、10重量部〜40重量部の天然ゴム、54.5重量部〜85重量部のロジンエステル樹脂及び酸価調節剤を含有し、
薬物層は、厚さが25μm〜75μmである経皮吸収製剤。
【請求項3】
酸価調節剤は、薬剤学的に使用可能な有機塩基、無機塩基又はこれらの組み合わせを含む、請求項1又は2に記載の経皮吸収製剤。
【請求項4】
酸価調節剤の含量は数学式1にしたがう、請求項3に記載の経皮吸収製剤:
(数1)
酸価調節剤の含量=ロジンエステルの含量×ロジンエステルの酸価(mgKOH/g)×酸価調節剤の分子量/56100/酸価調節剤の純度(%)×100
【請求項5】
ロジンエステル樹脂は、ロジングリセリンエステル、水添ロジングリセリンエステル、ロジンペンタエリスリトールエステル又はこれらの組み合わせを含む、請求項1又は2に記載の経皮吸収製剤。
【請求項6】
密着体は、粘着剤が塗布されたポリウレタンフィルム又は粘着剤が塗布されたポリウレタンフィルムに、切開されたポリエチレンテレフタレートフィルムが接合されたもので、ポリウレタンフィルムの厚さは20μm〜100μmである、請求項2に記載の経皮吸収製剤。
【請求項7】
密着体は、支持体の各隅から5mm〜20mm大きくなるように切断された、請求項6に記載の経皮吸収製剤。
【請求項1】
ツロブテロール及び天然ゴム系粘着基剤を含有する薬物層と、
薬物層の一面に付着され、薬物層を支持する支持体と、を含み、
天然ゴム系粘着基剤は、10重量部〜40重量部の天然ゴム、54.5重量部〜85重量部のロジンエステル樹脂及び酸価調節剤を含有し、
薬物層は、厚さが25μm〜75μmである経皮吸収製剤。
【請求項2】
ツロブテロール及び天然ゴム系粘着基剤を含有する薬物層と、
薬物層の下面に付着され、薬物層を支持する支持体と、
支持体の下面に付着され、薬物層を皮膚に一定に固定する密着体と、
薬物層の上面に付着され、薬物層を保護し、薬物層から容易に分離される剥離フィルム又は剥離紙と、を含み、
天然ゴム系粘着基剤は、10重量部〜40重量部の天然ゴム、54.5重量部〜85重量部のロジンエステル樹脂及び酸価調節剤を含有し、
薬物層は、厚さが25μm〜75μmである経皮吸収製剤。
【請求項3】
酸価調節剤は、薬剤学的に使用可能な有機塩基、無機塩基又はこれらの組み合わせを含む、請求項1又は2に記載の経皮吸収製剤。
【請求項4】
酸価調節剤の含量は数学式1にしたがう、請求項3に記載の経皮吸収製剤:
(数1)
酸価調節剤の含量=ロジンエステルの含量×ロジンエステルの酸価(mgKOH/g)×酸価調節剤の分子量/56100/酸価調節剤の純度(%)×100
【請求項5】
ロジンエステル樹脂は、ロジングリセリンエステル、水添ロジングリセリンエステル、ロジンペンタエリスリトールエステル又はこれらの組み合わせを含む、請求項1又は2に記載の経皮吸収製剤。
【請求項6】
密着体は、粘着剤が塗布されたポリウレタンフィルム又は粘着剤が塗布されたポリウレタンフィルムに、切開されたポリエチレンテレフタレートフィルムが接合されたもので、ポリウレタンフィルムの厚さは20μm〜100μmである、請求項2に記載の経皮吸収製剤。
【請求項7】
密着体は、支持体の各隅から5mm〜20mm大きくなるように切断された、請求項6に記載の経皮吸収製剤。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2011−153123(P2011−153123A)
【公開日】平成23年8月11日(2011.8.11)
【国際特許分類】
【出願番号】特願2010−176832(P2010−176832)
【出願日】平成22年8月5日(2010.8.5)
【出願人】(510214632)シンシン ファーマシューティカル カンパニー (1)
【Fターム(参考)】
【公開日】平成23年8月11日(2011.8.11)
【国際特許分類】
【出願日】平成22年8月5日(2010.8.5)
【出願人】(510214632)シンシン ファーマシューティカル カンパニー (1)
【Fターム(参考)】
[ Back to top ]

