ナチュラルキラーT細胞およびその取得方法
【課題】
非アルコール性脂肪性肝炎(NASH)におけるCXCL16の関与の検討を行い、新たにNASHの治療薬や治療法の構築に有用なツールを提供することである。
【解決手段】
CXCL16欠損マウスを用いたNASHモデルの作製を行い、病理所見など臨床的な評価方法によってNASHにおけるCXCL16の関与の検討し、さらに、CXCL16と肝NKT細胞の関係に着目し、NASHモデルマウスの肝NKT細胞の動態・機能解析を行い、非アルコール性脂肪性肝炎の発症に関与するナチュラルキラーT細胞を見出した。
非アルコール性脂肪性肝炎(NASH)におけるCXCL16の関与の検討を行い、新たにNASHの治療薬や治療法の構築に有用なツールを提供することである。
【解決手段】
CXCL16欠損マウスを用いたNASHモデルの作製を行い、病理所見など臨床的な評価方法によってNASHにおけるCXCL16の関与の検討し、さらに、CXCL16と肝NKT細胞の関係に着目し、NASHモデルマウスの肝NKT細胞の動態・機能解析を行い、非アルコール性脂肪性肝炎の発症に関与するナチュラルキラーT細胞を見出した。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、非アルコール性脂肪性肝炎の発症に関与するナチュラルキラーT細胞およびその取得方法に関する。
【背景技術】
【0002】
現在、非アルコール性脂肪性肝疾患(non-alcoholic fatty liver disease:NAFLD)および非アルコール性脂肪性肝炎(non-alcoholic steatohepatitis:NASH)は、メタボリックシンドローム罹患人口の増大に加え、その疾患の重篤性から臨床的・社会的な問題として注目を集めている。NASHに関しては、その疾患概念が病理診断所見から生まれた概念であるため、病理所見の変化については臨床一般にコンセンサスが得られているものの、分子病態機構についての詳細は未だ明らかになっておらず、効果的な治療法や診断法は未だ確立されていないのが現状である。
【0003】
ナチュラルキラーT細胞(NKT細胞)は、ナチュラルキラー細胞(NK細胞)とT細胞の両方の特性を有した、T細胞、B細胞、NK細胞に次ぐ第4のリンパ球である(非特許文献1)。NKT細胞は、主要組織適合遺伝子複合体(major histo- compatibility;MHC)クラスIb分子に属するCD1dにより提示される糖脂質や疎水性ペプチドを認識することが示され、生体内においてもCD1dにより胸腺内ポジティブセレクションされていると考えられている。胸腺内分化したNKT細胞は成熟に伴って末梢に遊走し、脾臓、骨髄そして肝臓に比較的多く存在している。特に、肝臓においては肝臓に存在する単核球細胞のうち10%〜20%がNKT細胞として存在しており、肝免疫系を制御している。
【0004】
ケモカインは、免疫細胞の遊走能力に特化したサイトカインの一群である。現在までにヒトでは約50種類のケモカインとそれに複数対応する受容体が同定されており、生体内における免疫細胞の恒常的な局在・移動を厳密に制御している。また、この厳密な制御機構の破綻が多くの免疫性の疾患の発症、および進展に関与しており、その疾患における重要性が認知されている。
ケモカインCXCL16は、比較的最近同定されたケモカインの1つであり、樹状細胞、B細胞などの抗原提示細胞に加え、肝臓の類洞内皮細胞に発現していることが報告されている(非特許文献2)。CXCL16は大変ユニークな機能性分子であり、一般的なケモカインと同様に可溶型ケモカインとして細胞遊走活性を有することに加えて、細胞の膜結合型ケモカインとしても発現し、細胞接着分子、抗原提示の際の共刺激分子、そしてスカベンジャー受容体としての機能することも報告(非特許文献3)されており、多機能性ケモカインとして知られている。
【0005】
肝臓において、類洞内皮細胞は恒常的にCXCL16を発現し、肝細胞では炎症時にCXCL16の発現が誘導される。特に、類洞内皮細胞に発現しているCXCL16は肝のNKT細胞を類洞内にトラップし、類洞内の免疫学的監視機構を行うために必須の分子であるとされている(非特許文献4)。
通常、NKT細胞はα−ガラクトシルセラミド(α−GalCer)刺激に伴って迅速かつ大量のサイトカインを産生することから、生体免疫の制御細胞として機能すると考えられているが、CXCL16欠損マウスでは、肝臓のNKT細胞数の減少に加え、α−GalCer刺激によるTh1応答性が減弱している。また、CXCL16の受容体CXCR6欠損マウスでも、同様に肝臓、肺におけるNKT細胞数の減少、α−GalCer刺激によるIFN−γ、IL−4産生能の低下が認められており、NKT細胞の質および量の減弱が報告されている(非特許文献5)。
【先行技術文献】
【非特許文献】
【0006】
【非特許文献1】Nat. Rev. Immunol., 7,505-518 (2007)
【非特許文献2】Nat. Immunol., 1(4),298-304 (2000)
【非特許文献3】J. Immunol., 179,8172-8179 (2007)
【非特許文献4】PLoS Biology, vol.3 (4),650-661 (2005)
【非特許文献5】J. Immunol., 181, 81-91(2008)
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明者らは、これまでケモカインによる種々疾病制御機構の解明を行ってきた。ケモカインは免疫細胞の動態を制御する一連のサイトカイン群であるため、特に炎症性疾患との関連性が強い。中でもCXCL16は、肝臓のiNKT細胞の動態・機能制御を行うことで、肝免疫系の恒常性維持や肝炎症性疾患に関わっているが、CXCL16と肝慢性炎症疾患であるNASHとの直接的な関連性は全く報告がない。
本発明の課題は、NASHにおけるCXCL16の関与の検討を行い、新たにNASHの治療薬や治療法の構築に有用なツールを提供することにある。
【課題を解決するための手段】
【0008】
本発明者らは、CXCL16欠損マウスを用いたNASHモデルの作製を行い、病理所見など臨床的な評価方法によってNASHにおけるCXCL16の関与の検討した。さらに、CXCL16と肝iNKT細胞の関係に着目し、NASHモデルマウスの肝iNKT細胞の動態・機能解析を行い、病態に寄与する可能性を検証した。加えて、解析したiNKT細胞を介した病態形成機序を検証するために養子移植実験およびエキソビボ(ex vivo)での解析を行った結果、非アルコール性脂肪性肝炎の発症に関与するインバリアントナチュラルキラーT細胞を見出し、本発明を完成した。
以下、本発明を詳細に説明する。
【0009】
本発明は、非アルコール性脂肪性肝炎の病態モデル動物の肝臓から単離される肝臓単核球からのTNF−α、およびIFN−γ産生を亢進することを特徴とするナチュラルキラーT細胞である。より具体的には、本発明のナチュラルキラーT細胞は、肝臓におけるケモカインCXCL16の発現が低下または発現してしない非アルコール性脂肪性肝炎の病態モデル動物から単離される肝臓単核球からのTNF−αおよびIFN−γ産生を亢進することを特徴とするナチュラルキラーT細胞である。
【0010】
本発明のナチュラルキラーT細胞とは、T細胞受容体(T
cell receptor:TCR)により、MHCクラスIb分子に属するCD1dにより提示される糖脂質や疎水性ペプチドを認識し、さらに、肝臓単核球からのTNF−αおよびIFN−γ産生を亢進することを特徴とするナチュラルキラーT細胞である。
【0011】
本発明のナチュラルキラーT細胞は、例えば、以下の方法によって取得することができる。
(1)肝臓におけるケモカインCXCL16の発現が低下または発現してしない病態モデル動物にコリン欠乏食などの脂肪肝を誘導する餌を摂食させる。
(2)病態モデル動物から肝臓を摘出する。
(3)摘出した肝臓から肝単核球を単離する。
(4)単離した肝単核球からにナチュラルキラーT細胞を分離する。
【0012】
本発明の肝臓単核球からのTNF−αおよびIFN−γ産生を亢進することを特徴とするナチュラルキラーT細胞により、NASHの初期病態(例えば、肝細胞への中性脂肪蓄積など)を誘導することができる。具体的には、例えば、肝臓単核球からのTNF−αおよびIFN−γ産生を亢進することを特徴とするナチュラルキラーT細胞を養子移植することが挙げられる。この場合、例えば、レシピエントとしてJα18ノックアウトマウスなどのNKT細胞を欠損させたマウスを用いればよい。
【発明の効果】
【0013】
本発明の肝臓単核球からのTNF−αおよびIFN−γ産生を亢進することを特徴とするナチュラルキラーT細胞により、NASHにおける肝細胞への中性脂肪蓄積などの初期病態を誘導することができる。また、CDAA食餌CXCL16ノックアウトマウスは、NASHの初期病態を誘導するモデル動物として、肝臓における異常免疫応答を基盤とする慢性炎症の研究に用いることができる。
【図面の簡単な説明】
【0014】
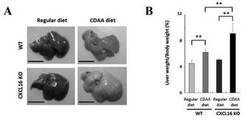
【図1】CDAA食摂食のCXCL16KOマウスにおける2週間後肝臓肉眼所見図(A)および肝肥大を示す図(B)である。
【図2】(A)CDAA食餌CXCL16KOマウスの肝臓の病理組織図である。(B)脂質構成成分を示す図である。(C)CDAA食餌WTマウスおよびCDAA食餌CXCL16KOマウスのNAS値を示す図である。
【図3】WTマウス群とCXCL16KOマウス群での肝単核球(mononuclear cells;MNCs)中の肝NKT細胞比率を、フローサイトメーターを用いて解析した結果を示す図である。
【図4】α−GalCer刺激によるサイトカイン産生プロファイルの結果を示す図である。
【図5】α−GalCer刺激によるNKT細胞自身のサイトカイン産生プロファイルを細胞内サイトカイン染色により評価した結果を示す図である。
【図6】CDAA食摂食のCXCL16KOマウスの肝NKT細胞を養子移植した際の、レシピエントマウスの肝単核球におけるNKT細胞の存在をフローサイトメーターにより確認した図である。
【図7】CDAA食摂食のCXCL16KOマウスの肝NKT細胞を単離し、同系 (BALB/cバックグラウンド)のNKT細胞欠損(Jα18KO)マウスに養子移植したときの肝臓の病理組織図とその肥大の結果を示す図である。
【図8】図7の肝臓に含まれる脂質を抽出して、各脂質の肝臓含量を定量した結果を示す図である。
【図9】リアルタイムRT−PCRによる図7の肝臓組織の各種遺伝子発現変動の評価結果の示す図である。
【図10】(A)CDAA食餌CXCL16KOマウス肝臓由来のNKT細胞をレシピエントに移入後、図7の肝単核球の共通活性化マーカーであるCD69の発現レベルをフローサイトメーターにより解析した図である。(B)CDAA食餌CXCL16KOマウス肝臓由来のNKT細胞の移入による図7の肝臓中のkupffer細胞の活性化の程度をフローサイトメーターにより解析した図である。
【図11】(A)CDAA食餌CXCL16KOマウス肝臓由来のNKT細胞と肝単核球の共培養によって得られた培養上清(CM)によるマウス初代肝細胞の脂質蓄積を示す図である。(B)CDAA食餌CXCL16KOマウス肝臓由来のNKT細胞と肝単核球の共培養によって得られた培養上清(CM)には、非常に高濃度のTNF−αおよびIFN−γの産生が確認されたことを示す図である。
【図12】図11(A)の脂肪蓄積が抑制されることを、中和抗体を用いたサイトカイン機能阻害実験により検証した図である。
【発明を実施するための形態】
【0015】
本発明の肝臓単核球からのTNF−αおよびIFN−γ産生を亢進することを特徴とするナチュラルキラーT細胞の取得に用いられる病態モデル動物として、肝臓におけるケモカインCXCL16の発現が低下または発現してしないマウス、ラットなどのげっ歯類が挙げられる。好ましいものとして、ケモカインCXCL16の発現が健常マウスの1/100以下に低下しているマウス、CXCL16欠損マウス、グルタミン酸ナトリウム誘発マウス(MSGマウス)などが挙げられる。
【0016】
コリン欠乏食としては、例えば、コリン欠乏・L−アミノ酸規定食(Choline deficient
L-amino acid defined diet:CDAA)、メチオニン・コリン欠乏食(Methionine- and Choline
deficien diet:MCD)などが挙げられるが、好ましいものとして、CDAAが挙げられる。
コリン欠乏食を摂取させる期間としては、例えば、CXCL16欠損マウスでは、1週間以上、好ましくは2週間以上である。
【0017】
肝単核球からにナチュラルキラーT細胞を分離するには、例えば、CD1dとβ2−ミクログロブリン(β2m)の複合体を蛍光色素のアロフイコシアニン(APC)やフィコエリスチン(PE)で標識されたストレプトアビジンにより4量体化した試薬(例えば、Cd1d
Tetramerなど)で肝単核球を標識した後、磁気細胞分離法(MACS)などを用いて行えばよい。
【実施例】
【0018】
以下、実施例で説明するが、本発明はこれらにより限定されるものではない。
実施例1
<コリン欠乏食食餌誘導性NAFLD/NASHモデルの作製>
(1)CXCL16欠損マウス
BALB/cマウスバックグラウンドのCXCL16(SR−PSOX)欠損マウス(CXCL16KOマウス)は、J. Immunol., 179, 8172-8179(2007)に記載の方法に準じて作製した。すなわち、定法に従い、ネオマイシン耐性遺伝子をコードしたターゲットベクターをエレクトロポレーション法によりES細胞に遺伝子導入し、ネオマイシン耐性株のうちCXCL16遺伝子欠損株をサザンブロット法にてスクリーニングすることで樹立した。
【0019】
(2)動物飼育環境
野生型BALB/cマウス(wild
type:WTマウス)およびCXCL16KOマウスは、富山大学和漢医薬学総合研究所病態生化学分野の動物飼育室にて飼育した。水および固形飼料は自由摂食とした。本実験は、国立大学法人富山大学動物実験取扱規則に基づき、動物実験委員会の承認後、動物倫理に十分配慮し行った。
【0020】
(3)コリン欠乏食食餌CXCL16欠損マウス
コリン欠乏食は、Choline
deficient L-amino acid defined diet (CDAA:Dyets社製) を用い、4〜5週齢、雄性のWTマウスおよびCXCL16KOマウスに2週間自由摂食させた。また、対照群として通常飼育食(Labo MR Stock, 日本農産工業製)を同様にWTマウスおよびCXCL16KOマウスの両マウスに摂食させた。
摂食開始から2週間後、マウスを犠牲死させ、血液、肝臓、脾臓、精巣上体部脂肪組織を採取した。血液は腹部下大静脈から採血をおこない、常温で1時間、4℃で一晩静置し、卓上遠心機にて4℃、3000回転、20分間遠心分離後、上清を血清サンプルとした。血清サンプルは解析に用いるまでディープフリーザー(−80℃)内で保存した。肝臓は、一部RT−PCR(後述)用サンプルとしてRNA Stabilization Reagent(RNA later:キアゲン社)に浸けて解析に用いるまで−20℃で保存した。また病理組織及び免疫染色用に10 %中性緩衝ホルマリン中にて4℃で保存した。精巣上体部脂肪組織は液体窒素にて瞬間凍結後、ディープフリーザーにて保管した。
【0021】
CXCL16KOマウスではわずか2週間のCDAA食摂食により、脂肪肝に特徴的な強い白色性の肝臓肉眼所見(図1A)および肝肥大を認めた(図1B)。
【0022】
(4)肝臓の病理組織学的所見とその評価
ホルマリン固定した肝臓はパラフィン包埋し、4μmの連続切片を作製した。薄切した組織サンプルはヘマトキシリン・エオジン(HE)染色を行い、病理組織像をもとに組織学的診断に供した。
NAFLD/NASHの病理組織学的評価は、NASH Clinical Network Scoring Systemに基づいてNAFLD Activity Score(NAS)を算出した(Hepatology, 41, 1313-1321(2005))。NAS≧5をNASH、NAS>3をNASH進行性脂肪肝と判断した。
このスコアリングシステムは、脂肪沈着を0〜3、肝小葉の細胞浸潤を0〜3、そして肝細胞のballooning変性の程度を0〜2として段階評価し、その合計値をNAS値として、NAS値<3を除外診断、NAS値≧5をNASHと診断するものである。
【0023】
CDAA食餌CXCL16KOマウスでは肝臓への著しい大滴性脂肪沈着を認め(図2A)、さらに脂質構成成分として中性脂肪が有意に増加している(図2B)。
【0024】
CDAA食餌WTではNAS値が3を越える個体が1匹も該当しなかったのに対し(平均NAS値:2.4)、CDAA食餌CXCL16KOマウスではNAS値が5以上の個体が全体の半数存在した(図2C)。
【0025】
(5)肝臓組織中中性脂肪の定量
肝臓組織中中性脂肪の抽出はFolchらの方法(J. Biol. Chem., 497-509(1987))を一部改変して行った。すなわち、100mg〜200mg肝臓に4mLのクロロホルム/メタノール(2:1,v/v)を加え、ガラスホモジナイザーでホモジナイズした後、ポリプロピレン製ファルコンチューブに移して、50mM塩化ナトリウム水溶液を1mL添加し、1分間ボルテックスした。室温、1500×g、10分間遠心分離し、パスツールピペットを用いて下層のクロロホルム層を別のファルコンチューブに移した。さらに収量を増やすため、上層に1容のクロロホルムを加えて同様にボルッテクス、遠心分離した後、下層を先の下層と合わせた。合わせたクロロホルム層のうち、100μLに20μLのイソプロピルアルコール/トリトンX(9:1,v/v)を加え、ドラフト内で自然乾燥させた。乾燥したものをイソプロピルアルコール/トリトンX(9:1,v/v)に溶かし、トリグリセライドE−テストワコー (和光純薬工業製)を用い、単位肝重量当たりの中性脂肪量を算出した(図2B)。
【0026】
実施例2
<コリン欠乏食餌CXCL16欠損マウスにおける肝iNKT細胞>
(1)マウス肝単核球の単離
通常食またはCDAA食を2週間摂食したWTおよびCXCL16欠損マウスの肝臓を温ハンクス平衡塩類液(Hanks' Balanced Salt Solutions:HBSS)にて還流後、摘出細断し、10%FCS含有RPMI1640培地で洗いこみながらナイロンメッシュ 上でホモジナイズして細胞懸濁液を得た。4℃、2000回転、10分間の条件下で細胞懸濁液を遠心分離した後、細胞を10%FCS含有RPMI1640培地に再懸濁して、33%Percoll(GEヘルスケア製)上に重層し、室温、2000回転、30分間の条件下、比重分離して単核球分画を得た。さらに、低張処理により赤血球を除去した。その後、細胞を10%FCS含有PRMI1640培地で2回洗浄し、リン酸緩衝生理食塩水(PBS)に106〜107cells/mLの細胞密度で懸濁した。
【0027】
(2)iNKT細胞の単離
磁気細胞分離法(MACS)用いて肝単核球からiNKT細胞を単離した。MACSには Miltenyi Biotech社のmini MACS kit(Anti−PEマイクロビーズ、MSカラム、MACSセパレーター)を用いた。すなわち、CD1d Tetramer−PE(MBL社製)によりiNKT細胞をラベルした後、iNKT細胞を80μLのMACS緩衝液(2%FCS、2mM EDTA含有PBSを脱気したもの)に懸濁し、Anti−PEマイクロビーズを20μL添加した。氷上にて15分間インキュベートした後、MACS緩衝液で洗浄して500μLのMACS緩衝液に再懸濁し、細胞懸濁液を調製した。MACS MSカラムをMACS緩衝液にてリンスした後、Mini MACSセパレーターを用いて調製した細胞懸濁液からiNKT細胞をポジティブセレクションした。また純度を高めるために、2回MSカラムに細胞を通し、純度が80%以上のものを実験及び解析に用いた。さらに細胞洗浄による細胞の損失を抑えるため、一部セルローション(日本全薬工業製)を用いて細胞の洗浄を行った。
【0028】
(3)iNKT細胞ポピュレーションの解析
肝単核球(5×105cells/100μL)を1.5mLエッペンドルフチューブに分注し、卓上遠心機にて4℃、2000回転、5分間遠心し、洗浄した。沈殿した細胞を50μLの2%FCS含有PBS(FCM緩衝液)に再懸濁した後、CD16/CD32モノクローナル抗体(クローン2.4G2)0.5mg/mLを1μL添加し、氷上にて10分間インキュベートした。CD16/CD32モノクローナル抗体によるFc受容体のブロッキングの後、CD1d Tetramer−PEを10mL添加し、室温にて30分間インキュベートしてiNKT細胞を蛍光標識した。続いて、PerCP−Cy5.5標識抗マウスCD3εモノクローナル抗体を加え、氷上にて30分間インキュベートした。FCM緩衝液を1mL加え、4℃、2000回転、5分間遠心して洗浄し、300μLのFCM緩衝液に懸濁した後、フローサイトメーターを用いて細胞表面上の蛍光強度を解析した。
【0029】
WTではCDAA食摂食による肝iNKT細胞比率の変化は認められなかったのに対し、CXCL16KOマウスでは通常食摂食時に比べて、CDAA食餌により肝iNKT細胞が2倍近く増加している(図3A)。
【0030】
(4)iNKT細胞のサブポピュレーションの解析
iNKT細胞ポピュレーション解析と同様に、CD1d Tetramer−PEにてiNKT細胞を蛍光標識し、その後PerCP−Cy5.5標識抗マウスCD4モノクローナルとFITC標識抗マウスCD8モノクローナル抗体を加え、氷上で30分間インキュベートした。続いて、磁気細胞分離法によりiNKT細胞を単離し、フローサイトメーターを用いてiNKT細胞のサブポピュレーションの解析を行った。
【0031】
WTマウス、CXCL16KOマウスともCDAA食摂食によりiNKT細胞数がベースラインよりも増加していたが、CDAA食餌CXCL16KOマウスの肝iNKT細胞の増加率の方が顕著であった(図3B)。また、CDAA食餌WTマウスとCXCL16KOマウスの肝iNKT細胞集団は構成しているiNKT細胞のサブポピュレーションが異なっていた(図3C)。
【0032】
実施例3
<コリン欠乏食食餌CXCL16KOマウス肝iNKT細胞の機能解析>
(1)in vitroにおける肝単核球培養とβ-ガラクトシルセラミド(β-GalCer)刺激
実施例2(1)の方法に従い、肝単核球を単離した後、細胞を10%FCS、50μM 2−メルカプトエタノール添加RPMI1640培地に懸濁し、2×105cells/100μLの細胞密度で96ウェルプレートに播種した。
iNKT細胞の特異的なリガンドであるβ−ガラクトシルセラミド(β−Galactosylceramide:β−GalCer)は、ジメチルスルスルホキシドにて1 mg/mLに調製し、肝単核球刺激の際には終濃度100ng/mLとして用いた。
【0033】
(2)酵素免疫測定法(Enzymed-linked
Immunosorbent Assay:ELISA)によるサイトカイン産生量
肝単核球の培養上清、およびマウスの血清サンプル中のIFN−γ、IL−2、IL−4、TNF−αはそれぞれ市販のELISAキット(ベイバイオサイエンス社製)を用いて定量した。
【0034】
(3)in vivoにおけるβ−ガラクトシルセラミド(β−GalCer)刺激
0.5%ポリソルベイト20添加生理食塩水によりDMSO溶解β−GalCerを希釈し、2μg/200μLとして、各WTマウス、CXCL16KOマウスに経尾静脈投与した。投与から1.5時間後に各マウスを犠牲死させて肝単核球を採取し、iNKT細胞の細胞内サイトカイン染色を行った。
【0035】
β−GalCer刺激によるサイトカイン産生プロファイルの結果、WTマウスではCDAA食の摂食によっていずれのサイトカインにも有意な産生能の変化は見られなかった。一方、CXCL16KOマウスではCDAA食餌により、いずれのサイトカインにおいてもベースラインよりもサイトカイン産生能が上昇していた。
【0036】
(4)iNKT細胞内サイトカイン染色によるサイトカイン産生プロファイル変化
細胞固定/細胞膜浸透化キット(BDバイオサイエンス社製)を用いて、細胞内部のサイトカインの保持、細胞固定、細胞膜透過処理を行った。
すなわち、単離した肝単核球を1×106cells/mLの細胞密度で24ウェルプレート(コースター)に播種し、ゴルジ体からの小胞輸送阻害剤であるモネンシン存在下で、3時間培養して細胞内にサイトカインを蓄積させ、その後、細胞を回収し、前述のようにFCM緩衝液で洗浄した後、PerCP−Cy5.5標識ラット抗マウスCD4モノクローナル抗体(RM4−5)およびCD1d TetramerによりiNKT細胞の細胞表面抗原を蛍光標識した。続いて、キットのプロトコールに従って細胞固定、細胞膜透過処理を行い、細胞内の各種サイトカインを蛍光標識抗サイトカイン抗体にて染色した後、CD1d tetramer陽性細胞をゲートし、フローサイトメーターにより解析を行った。なお、染色用抗サイトカイン抗体として、FITC標識抗マウスIFN−γ(クローン:XMG1.2)、FITC標識抗マウスIL−17A(TC11−18H10.1)、FITC標識抗マウスIL−4(BVD6−24G2)、FITC標識抗マウス/ラットTNF−α(TN3−19)、また同位体対照としてFITC標識ラットIgG1κ抗体を用いた。
【0037】
その結果、CDAA食摂食によりWTマウスのCD4+iNKT細胞は、IFN−γ(18.2%→25.2%)、IL−4(3.7%→8.4%)の発現が亢進していた。
CXCL16KOマウスではCDAA摂食によるCD4+iNKT細胞のサイトカイン産生亢進の程度がIFN−γ(9.6%→17.9%)、IL−4(4.3%→13.8%)共にWTよりも顕著であった(図5)。
【0038】
実施例4
<コリン欠乏食餌CXCL16欠損マウスのNASH病態形成における機能変異iNKT細胞の寄与>
(1)養子移植
通常食またはCDAA食を摂食したWTマウスおよびCXCL16KOマウス(ドナー)の肝iNKT細胞をMACSにより単離した。単離したiNKT細胞をPBSで洗浄した後、トリパンブルー染色により生細胞数をカウントし、5.5×105cell/200μL
PBSをiNKT細胞欠損マウス(Jα18ノックアウトマウス:レシピエント)に経尾静脈移入した。細胞移入から2週間後にマウスを犠牲死させ、血清、肝臓、精巣上体部脂肪組織を採取し、保存した。なお、肝臓へのiNKT細胞生着の有無については、フローサイトメーターによりレシピエント肝単核球中のiNKT細胞を検出することで確認した(図6)。
【0039】
(2)肝臓の病理組織学的所見
ホルマリン固定した肝臓はパラフィン包埋し、4μmの連続切片を作製した。薄切した組織サンプルはヘマトキシリン染色を行い、病理組織像をもとに組織学的診断に供した。また、ヘマトキシリンとスダンIVの対比染色により肝臓への脂肪沈着を評価した。
【0040】
CDAA食餌CXCL16KOマウスの肝iNKT細胞を養子移植したレシピエント肝では、他ドナーマウスから単離した肝iNKT細胞を移植した場合と比較しても、脂肪肝に特徴的な白色肝が明らかに認められた(図7A上)。この時、各群のレシピエント肝重量比を算出すると、CDAA食餌CXCL16KOマウスの肝iNKT細胞の移植した場合、通常食餌CXCL16KOマウスのiNKT細胞を移植した場合より有意に高値を示し、CDAA食餌WT群の肝iNKT細胞を移植した場合より、高い傾向を示した(図7B)。また、CDAA食餌CXCL16KOマウスの肝iNKT細胞を移植したレシピエント肝では脂質蓄積が誘導された(図7A下)。
【0041】
(3)肝臓組織中脂質
肝臓組織中の中性脂肪、コレステロール、遊離コレステロール、リン脂質量はリポタンパク質の受託解析サービス(スカイライト・バイオテック社)により解析を行った。なお、解析にはホルマリン固定肝臓サンプルを用いた。
【0042】
その結果、遊離コレステロール、総コレステロール、リン脂質はどのドナー由来の肝iNKT細胞を移植しても変化が認められないのに対し、CDAA食餌CXCL16KOマウスの肝iNKT細胞を移入した場合には、レシピエントマウスの肝臓に有意な中性脂肪の蓄積の誘導があった(図8)。
【0043】
(4)リアルタイムRT−PCRによる肝臓組織の各種遺伝子発現変動の評価
[RNA抽出]
肝組織中RNAは、RNeasy mini kit(キアゲン社)を用いて抽出した。すなわち、RNA later中で保存した肝組織50mgを1.5mLチューブ (RNase−free)にとり、600μLのRLT緩衝液(2−メルカプトエタノール添加(1%,v/v))を加えて氷上にてホモジナイズした。肝ホモジネートをキット付属のプロトコールにしたがってシリカゲルカラムに通し、RNAを溶出させた。得られたRNA濃度を吸光光度計にて測定し、各サンプル1ng/10μLに調製した。調製したRNAサンプルは解析に用いるまで−30℃で保存した。
[逆転写反応]
OLIGO DTプライマー(インビトロジェン)を用いてMRNAを増幅した後、逆転写反応はSuper Script II reverse transcription (インビトロジェン)を使用して行った。
[リアルタイムPCR]
逆転写反応によりcDNAを得た後、SYBR Premix Ex Taq(タカラバイオ社)と Mx3000p(ストラタジーン社)および測定・解析ソフト MxPro(ストラタジーン社)を用いてリアルタイムPCRを行った。測定結果はすべてハウスキーピング遺伝子であるglyceraldehyde−3−phosphate dehydrogenase(GAPDH)の発現量により比較Ct法にて補正した。
【0044】
NASH病態形成と関連の深い、TNF−α、IL−1βといった炎症性サイトカインの発現を指標に炎症状態を評価した。その結果、異常iNKT細胞を移入することで、レシピエントの肝臓でもTNF−α、IL−1βの発現誘導が確認された(図9)。
【0045】
(5)肝単核球の活性化状態解析
各レシピエントの肝単核球を単離し、RPE標識抗マウスF4/80モノクローナル抗体、FITC標識抗マウスCD69モノクローナル抗体(クローンH1.2F3)で染色した後、CD69の発現レベルをフローサイトメーターで解析し、単核球活性化の指標とした。
【0046】
ドナー由来iNKT細胞をレシピエントに移入後、肝単核球の共通活性化マーカーであるCD69の発現レベルをフローサイトメーターにより解析した。その結果、CDAA食餌CXCL16KOマウス由来の機能異常iNKT細胞を移入した場合には、CD69発現細胞の増加が認められた(図10A)。
【0047】
kupffer細胞のマーカーとしてF4/80を用い、CD69との二重染色によってiNKT細胞の移入によるkupffer細胞の活性化の程度をフローサイトメーターにより解析した。その結果、CDAA食餌CXCL16KOマウス由来の肝iNKT細胞移入によって、CD69陽性kupper細胞の割合が増加していた(図10B)。
【0048】
実施例5
<機能変異iNKT細胞を起点とした肝細胞への脂肪蓄積機構>
(1)肝iNKT細胞とその他肝単核球による共培養系
肝iNKT細胞は、それぞれ通常食またはCDAA食を2週間摂食させたWTマウスおよびCXCL16KOマウスの肝臓からMACSを用いて単離した。また、iNKT細胞との共培養に用いた肝単核球はiNKT細胞欠損マウス(Jα18ノックアウトマウス)の肝臓より単離し、これにより他のiNKT細胞による影響を排除した実験系を組み立てた。共培養系は、iNKT細胞:肝単核球=2×104cells:8×104cellsを10%FCS、50μM 2−メルカプトエタノール添加RPMI1640培地に懸濁して96ウェルプレートに播種し、37℃、炭酸ガスインキュベーター内で72時間培養した。
【0049】
(2)マウス初代肝細胞培養
肝細胞を捲き込む前日に、96ウェルプレートをマトリゲル(Matrigel、BD Biosciences社)でコーティングしておく。実際には、1mg/mLマトリゲルをPBSにより50μg/mLに希釈し、40μL/ウェルをプレートに添加した。続いて、クリーンベンチ内で一晩風乾し、無血清RPMI1640培地で1度洗浄した後に培養に用いた。
無処置WTマウスまたはiNKT細胞欠損マウスの肝臓をEGTA添加HBSSで還流後、肝臓を摘出し、125μg/mLコラゲナーゼIV(シグマ社)/HBSS溶液に浸けて細断して、37℃温浴シェーカー中で15分間インキュベートした。その後、肝組織をナイロンメッシュ(100μm)に通して細胞浮遊液を得た。細胞浮遊液を、4℃、500回転、1分間遠心し、上清をアスピレーターにより除去した後、10%FCS添加RPMI1640培地にて細胞を3回程洗浄し、上清が澄んできたら無血清RPMI1640培地で細胞を1〜2回洗浄して肝細胞を得た。3×104cells/100μLの細胞密度に調整し、マトリゲルでコーティングした96ウェルプレートに播種した。
【0050】
(3)共培養系上清
(馴化培地)によるマウス初代肝細胞への脂肪蓄積誘導
肝細胞を無血清RPMI1640培地で16時間培養し飢餓状態にしておく。肝細胞を無血清RPMI1640培地で1回洗浄し、共培養系馴化培地にて肝細胞を24 時間培養した。
【0051】
(4)肝細胞脂質染色
共培養系馴化培地下で24時間培養した後、培養上清を除去して4%パラホルムアルデヒドで肝細胞を固定し、Adipogenesis Assay Kit(Cayman Chemical社)を用いて肝細胞中の脂質を染色した(Oil red−O染色)。
【0052】
CDAA食餌CXCL16KOマウス肝臓由来の機能変異iNKT細胞と肝単核球の共培養によって得られたCMでマウス初代肝細胞を培養することで非常に強力な脂質蓄積が誘導された(図11A)。
【0053】
(5)共培養系におけるサイトカイン産生量
共培養系上清中に産生された液性因子として、IFN−γ、IL−2、IL−4、TNF−αはそれぞれ市販のELISAキット(Ready Set Go!, eBioscience社)を用いて定量した。
【0054】
CDAA食餌CXCL16KOマウスの肝iNKT細胞は肝単核球との共培養を行わずとも、それ単独でもCDAA食餌WTマウス、通常食餌CXCL16KOマウスの肝iNKT細胞よりも高いTNF−α産生能を有していた(図11B)。
【0055】
(6)中和抗体によるサイトカイン機能阻害実験
Putified anti−mouse/rat TNF−α(TN3−19)、anti−mouse IFN−γ(XMG1.2)(eBioscience)またはコントロールIgG(ラットIgG、Inter−Cell Technoligy)を終濃度1μg/mLとして、馴化培地を用いた初代肝細胞培養系に添加した。
【0056】
その結果、機能変異iNKT細胞と肝単核球の共培養CMに抗IFN−γ中和抗体、抗TNF−α中和抗体をそれぞれ単独で添加させるだけで、共培養CMによる脂質蓄積作用はほぼ完全に阻害された(図12)。
【産業上の利用可能性】
【0057】
本発明のTNF−αの産生能を有することを特徴とするインバリンアントナチュラルキラーT細胞は、NASHにおける異常免疫応答を解明するためのツールとして有用である。また、CDAA食餌CXCL16ノックアウトマウスは、NASHの初期病態を誘導するモデル動物として有用である。
【技術分野】
【0001】
本発明は、非アルコール性脂肪性肝炎の発症に関与するナチュラルキラーT細胞およびその取得方法に関する。
【背景技術】
【0002】
現在、非アルコール性脂肪性肝疾患(non-alcoholic fatty liver disease:NAFLD)および非アルコール性脂肪性肝炎(non-alcoholic steatohepatitis:NASH)は、メタボリックシンドローム罹患人口の増大に加え、その疾患の重篤性から臨床的・社会的な問題として注目を集めている。NASHに関しては、その疾患概念が病理診断所見から生まれた概念であるため、病理所見の変化については臨床一般にコンセンサスが得られているものの、分子病態機構についての詳細は未だ明らかになっておらず、効果的な治療法や診断法は未だ確立されていないのが現状である。
【0003】
ナチュラルキラーT細胞(NKT細胞)は、ナチュラルキラー細胞(NK細胞)とT細胞の両方の特性を有した、T細胞、B細胞、NK細胞に次ぐ第4のリンパ球である(非特許文献1)。NKT細胞は、主要組織適合遺伝子複合体(major histo- compatibility;MHC)クラスIb分子に属するCD1dにより提示される糖脂質や疎水性ペプチドを認識することが示され、生体内においてもCD1dにより胸腺内ポジティブセレクションされていると考えられている。胸腺内分化したNKT細胞は成熟に伴って末梢に遊走し、脾臓、骨髄そして肝臓に比較的多く存在している。特に、肝臓においては肝臓に存在する単核球細胞のうち10%〜20%がNKT細胞として存在しており、肝免疫系を制御している。
【0004】
ケモカインは、免疫細胞の遊走能力に特化したサイトカインの一群である。現在までにヒトでは約50種類のケモカインとそれに複数対応する受容体が同定されており、生体内における免疫細胞の恒常的な局在・移動を厳密に制御している。また、この厳密な制御機構の破綻が多くの免疫性の疾患の発症、および進展に関与しており、その疾患における重要性が認知されている。
ケモカインCXCL16は、比較的最近同定されたケモカインの1つであり、樹状細胞、B細胞などの抗原提示細胞に加え、肝臓の類洞内皮細胞に発現していることが報告されている(非特許文献2)。CXCL16は大変ユニークな機能性分子であり、一般的なケモカインと同様に可溶型ケモカインとして細胞遊走活性を有することに加えて、細胞の膜結合型ケモカインとしても発現し、細胞接着分子、抗原提示の際の共刺激分子、そしてスカベンジャー受容体としての機能することも報告(非特許文献3)されており、多機能性ケモカインとして知られている。
【0005】
肝臓において、類洞内皮細胞は恒常的にCXCL16を発現し、肝細胞では炎症時にCXCL16の発現が誘導される。特に、類洞内皮細胞に発現しているCXCL16は肝のNKT細胞を類洞内にトラップし、類洞内の免疫学的監視機構を行うために必須の分子であるとされている(非特許文献4)。
通常、NKT細胞はα−ガラクトシルセラミド(α−GalCer)刺激に伴って迅速かつ大量のサイトカインを産生することから、生体免疫の制御細胞として機能すると考えられているが、CXCL16欠損マウスでは、肝臓のNKT細胞数の減少に加え、α−GalCer刺激によるTh1応答性が減弱している。また、CXCL16の受容体CXCR6欠損マウスでも、同様に肝臓、肺におけるNKT細胞数の減少、α−GalCer刺激によるIFN−γ、IL−4産生能の低下が認められており、NKT細胞の質および量の減弱が報告されている(非特許文献5)。
【先行技術文献】
【非特許文献】
【0006】
【非特許文献1】Nat. Rev. Immunol., 7,505-518 (2007)
【非特許文献2】Nat. Immunol., 1(4),298-304 (2000)
【非特許文献3】J. Immunol., 179,8172-8179 (2007)
【非特許文献4】PLoS Biology, vol.3 (4),650-661 (2005)
【非特許文献5】J. Immunol., 181, 81-91(2008)
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明者らは、これまでケモカインによる種々疾病制御機構の解明を行ってきた。ケモカインは免疫細胞の動態を制御する一連のサイトカイン群であるため、特に炎症性疾患との関連性が強い。中でもCXCL16は、肝臓のiNKT細胞の動態・機能制御を行うことで、肝免疫系の恒常性維持や肝炎症性疾患に関わっているが、CXCL16と肝慢性炎症疾患であるNASHとの直接的な関連性は全く報告がない。
本発明の課題は、NASHにおけるCXCL16の関与の検討を行い、新たにNASHの治療薬や治療法の構築に有用なツールを提供することにある。
【課題を解決するための手段】
【0008】
本発明者らは、CXCL16欠損マウスを用いたNASHモデルの作製を行い、病理所見など臨床的な評価方法によってNASHにおけるCXCL16の関与の検討した。さらに、CXCL16と肝iNKT細胞の関係に着目し、NASHモデルマウスの肝iNKT細胞の動態・機能解析を行い、病態に寄与する可能性を検証した。加えて、解析したiNKT細胞を介した病態形成機序を検証するために養子移植実験およびエキソビボ(ex vivo)での解析を行った結果、非アルコール性脂肪性肝炎の発症に関与するインバリアントナチュラルキラーT細胞を見出し、本発明を完成した。
以下、本発明を詳細に説明する。
【0009】
本発明は、非アルコール性脂肪性肝炎の病態モデル動物の肝臓から単離される肝臓単核球からのTNF−α、およびIFN−γ産生を亢進することを特徴とするナチュラルキラーT細胞である。より具体的には、本発明のナチュラルキラーT細胞は、肝臓におけるケモカインCXCL16の発現が低下または発現してしない非アルコール性脂肪性肝炎の病態モデル動物から単離される肝臓単核球からのTNF−αおよびIFN−γ産生を亢進することを特徴とするナチュラルキラーT細胞である。
【0010】
本発明のナチュラルキラーT細胞とは、T細胞受容体(T
cell receptor:TCR)により、MHCクラスIb分子に属するCD1dにより提示される糖脂質や疎水性ペプチドを認識し、さらに、肝臓単核球からのTNF−αおよびIFN−γ産生を亢進することを特徴とするナチュラルキラーT細胞である。
【0011】
本発明のナチュラルキラーT細胞は、例えば、以下の方法によって取得することができる。
(1)肝臓におけるケモカインCXCL16の発現が低下または発現してしない病態モデル動物にコリン欠乏食などの脂肪肝を誘導する餌を摂食させる。
(2)病態モデル動物から肝臓を摘出する。
(3)摘出した肝臓から肝単核球を単離する。
(4)単離した肝単核球からにナチュラルキラーT細胞を分離する。
【0012】
本発明の肝臓単核球からのTNF−αおよびIFN−γ産生を亢進することを特徴とするナチュラルキラーT細胞により、NASHの初期病態(例えば、肝細胞への中性脂肪蓄積など)を誘導することができる。具体的には、例えば、肝臓単核球からのTNF−αおよびIFN−γ産生を亢進することを特徴とするナチュラルキラーT細胞を養子移植することが挙げられる。この場合、例えば、レシピエントとしてJα18ノックアウトマウスなどのNKT細胞を欠損させたマウスを用いればよい。
【発明の効果】
【0013】
本発明の肝臓単核球からのTNF−αおよびIFN−γ産生を亢進することを特徴とするナチュラルキラーT細胞により、NASHにおける肝細胞への中性脂肪蓄積などの初期病態を誘導することができる。また、CDAA食餌CXCL16ノックアウトマウスは、NASHの初期病態を誘導するモデル動物として、肝臓における異常免疫応答を基盤とする慢性炎症の研究に用いることができる。
【図面の簡単な説明】
【0014】
【図1】CDAA食摂食のCXCL16KOマウスにおける2週間後肝臓肉眼所見図(A)および肝肥大を示す図(B)である。
【図2】(A)CDAA食餌CXCL16KOマウスの肝臓の病理組織図である。(B)脂質構成成分を示す図である。(C)CDAA食餌WTマウスおよびCDAA食餌CXCL16KOマウスのNAS値を示す図である。
【図3】WTマウス群とCXCL16KOマウス群での肝単核球(mononuclear cells;MNCs)中の肝NKT細胞比率を、フローサイトメーターを用いて解析した結果を示す図である。
【図4】α−GalCer刺激によるサイトカイン産生プロファイルの結果を示す図である。
【図5】α−GalCer刺激によるNKT細胞自身のサイトカイン産生プロファイルを細胞内サイトカイン染色により評価した結果を示す図である。
【図6】CDAA食摂食のCXCL16KOマウスの肝NKT細胞を養子移植した際の、レシピエントマウスの肝単核球におけるNKT細胞の存在をフローサイトメーターにより確認した図である。
【図7】CDAA食摂食のCXCL16KOマウスの肝NKT細胞を単離し、同系 (BALB/cバックグラウンド)のNKT細胞欠損(Jα18KO)マウスに養子移植したときの肝臓の病理組織図とその肥大の結果を示す図である。
【図8】図7の肝臓に含まれる脂質を抽出して、各脂質の肝臓含量を定量した結果を示す図である。
【図9】リアルタイムRT−PCRによる図7の肝臓組織の各種遺伝子発現変動の評価結果の示す図である。
【図10】(A)CDAA食餌CXCL16KOマウス肝臓由来のNKT細胞をレシピエントに移入後、図7の肝単核球の共通活性化マーカーであるCD69の発現レベルをフローサイトメーターにより解析した図である。(B)CDAA食餌CXCL16KOマウス肝臓由来のNKT細胞の移入による図7の肝臓中のkupffer細胞の活性化の程度をフローサイトメーターにより解析した図である。
【図11】(A)CDAA食餌CXCL16KOマウス肝臓由来のNKT細胞と肝単核球の共培養によって得られた培養上清(CM)によるマウス初代肝細胞の脂質蓄積を示す図である。(B)CDAA食餌CXCL16KOマウス肝臓由来のNKT細胞と肝単核球の共培養によって得られた培養上清(CM)には、非常に高濃度のTNF−αおよびIFN−γの産生が確認されたことを示す図である。
【図12】図11(A)の脂肪蓄積が抑制されることを、中和抗体を用いたサイトカイン機能阻害実験により検証した図である。
【発明を実施するための形態】
【0015】
本発明の肝臓単核球からのTNF−αおよびIFN−γ産生を亢進することを特徴とするナチュラルキラーT細胞の取得に用いられる病態モデル動物として、肝臓におけるケモカインCXCL16の発現が低下または発現してしないマウス、ラットなどのげっ歯類が挙げられる。好ましいものとして、ケモカインCXCL16の発現が健常マウスの1/100以下に低下しているマウス、CXCL16欠損マウス、グルタミン酸ナトリウム誘発マウス(MSGマウス)などが挙げられる。
【0016】
コリン欠乏食としては、例えば、コリン欠乏・L−アミノ酸規定食(Choline deficient
L-amino acid defined diet:CDAA)、メチオニン・コリン欠乏食(Methionine- and Choline
deficien diet:MCD)などが挙げられるが、好ましいものとして、CDAAが挙げられる。
コリン欠乏食を摂取させる期間としては、例えば、CXCL16欠損マウスでは、1週間以上、好ましくは2週間以上である。
【0017】
肝単核球からにナチュラルキラーT細胞を分離するには、例えば、CD1dとβ2−ミクログロブリン(β2m)の複合体を蛍光色素のアロフイコシアニン(APC)やフィコエリスチン(PE)で標識されたストレプトアビジンにより4量体化した試薬(例えば、Cd1d
Tetramerなど)で肝単核球を標識した後、磁気細胞分離法(MACS)などを用いて行えばよい。
【実施例】
【0018】
以下、実施例で説明するが、本発明はこれらにより限定されるものではない。
実施例1
<コリン欠乏食食餌誘導性NAFLD/NASHモデルの作製>
(1)CXCL16欠損マウス
BALB/cマウスバックグラウンドのCXCL16(SR−PSOX)欠損マウス(CXCL16KOマウス)は、J. Immunol., 179, 8172-8179(2007)に記載の方法に準じて作製した。すなわち、定法に従い、ネオマイシン耐性遺伝子をコードしたターゲットベクターをエレクトロポレーション法によりES細胞に遺伝子導入し、ネオマイシン耐性株のうちCXCL16遺伝子欠損株をサザンブロット法にてスクリーニングすることで樹立した。
【0019】
(2)動物飼育環境
野生型BALB/cマウス(wild
type:WTマウス)およびCXCL16KOマウスは、富山大学和漢医薬学総合研究所病態生化学分野の動物飼育室にて飼育した。水および固形飼料は自由摂食とした。本実験は、国立大学法人富山大学動物実験取扱規則に基づき、動物実験委員会の承認後、動物倫理に十分配慮し行った。
【0020】
(3)コリン欠乏食食餌CXCL16欠損マウス
コリン欠乏食は、Choline
deficient L-amino acid defined diet (CDAA:Dyets社製) を用い、4〜5週齢、雄性のWTマウスおよびCXCL16KOマウスに2週間自由摂食させた。また、対照群として通常飼育食(Labo MR Stock, 日本農産工業製)を同様にWTマウスおよびCXCL16KOマウスの両マウスに摂食させた。
摂食開始から2週間後、マウスを犠牲死させ、血液、肝臓、脾臓、精巣上体部脂肪組織を採取した。血液は腹部下大静脈から採血をおこない、常温で1時間、4℃で一晩静置し、卓上遠心機にて4℃、3000回転、20分間遠心分離後、上清を血清サンプルとした。血清サンプルは解析に用いるまでディープフリーザー(−80℃)内で保存した。肝臓は、一部RT−PCR(後述)用サンプルとしてRNA Stabilization Reagent(RNA later:キアゲン社)に浸けて解析に用いるまで−20℃で保存した。また病理組織及び免疫染色用に10 %中性緩衝ホルマリン中にて4℃で保存した。精巣上体部脂肪組織は液体窒素にて瞬間凍結後、ディープフリーザーにて保管した。
【0021】
CXCL16KOマウスではわずか2週間のCDAA食摂食により、脂肪肝に特徴的な強い白色性の肝臓肉眼所見(図1A)および肝肥大を認めた(図1B)。
【0022】
(4)肝臓の病理組織学的所見とその評価
ホルマリン固定した肝臓はパラフィン包埋し、4μmの連続切片を作製した。薄切した組織サンプルはヘマトキシリン・エオジン(HE)染色を行い、病理組織像をもとに組織学的診断に供した。
NAFLD/NASHの病理組織学的評価は、NASH Clinical Network Scoring Systemに基づいてNAFLD Activity Score(NAS)を算出した(Hepatology, 41, 1313-1321(2005))。NAS≧5をNASH、NAS>3をNASH進行性脂肪肝と判断した。
このスコアリングシステムは、脂肪沈着を0〜3、肝小葉の細胞浸潤を0〜3、そして肝細胞のballooning変性の程度を0〜2として段階評価し、その合計値をNAS値として、NAS値<3を除外診断、NAS値≧5をNASHと診断するものである。
【0023】
CDAA食餌CXCL16KOマウスでは肝臓への著しい大滴性脂肪沈着を認め(図2A)、さらに脂質構成成分として中性脂肪が有意に増加している(図2B)。
【0024】
CDAA食餌WTではNAS値が3を越える個体が1匹も該当しなかったのに対し(平均NAS値:2.4)、CDAA食餌CXCL16KOマウスではNAS値が5以上の個体が全体の半数存在した(図2C)。
【0025】
(5)肝臓組織中中性脂肪の定量
肝臓組織中中性脂肪の抽出はFolchらの方法(J. Biol. Chem., 497-509(1987))を一部改変して行った。すなわち、100mg〜200mg肝臓に4mLのクロロホルム/メタノール(2:1,v/v)を加え、ガラスホモジナイザーでホモジナイズした後、ポリプロピレン製ファルコンチューブに移して、50mM塩化ナトリウム水溶液を1mL添加し、1分間ボルテックスした。室温、1500×g、10分間遠心分離し、パスツールピペットを用いて下層のクロロホルム層を別のファルコンチューブに移した。さらに収量を増やすため、上層に1容のクロロホルムを加えて同様にボルッテクス、遠心分離した後、下層を先の下層と合わせた。合わせたクロロホルム層のうち、100μLに20μLのイソプロピルアルコール/トリトンX(9:1,v/v)を加え、ドラフト内で自然乾燥させた。乾燥したものをイソプロピルアルコール/トリトンX(9:1,v/v)に溶かし、トリグリセライドE−テストワコー (和光純薬工業製)を用い、単位肝重量当たりの中性脂肪量を算出した(図2B)。
【0026】
実施例2
<コリン欠乏食餌CXCL16欠損マウスにおける肝iNKT細胞>
(1)マウス肝単核球の単離
通常食またはCDAA食を2週間摂食したWTおよびCXCL16欠損マウスの肝臓を温ハンクス平衡塩類液(Hanks' Balanced Salt Solutions:HBSS)にて還流後、摘出細断し、10%FCS含有RPMI1640培地で洗いこみながらナイロンメッシュ 上でホモジナイズして細胞懸濁液を得た。4℃、2000回転、10分間の条件下で細胞懸濁液を遠心分離した後、細胞を10%FCS含有RPMI1640培地に再懸濁して、33%Percoll(GEヘルスケア製)上に重層し、室温、2000回転、30分間の条件下、比重分離して単核球分画を得た。さらに、低張処理により赤血球を除去した。その後、細胞を10%FCS含有PRMI1640培地で2回洗浄し、リン酸緩衝生理食塩水(PBS)に106〜107cells/mLの細胞密度で懸濁した。
【0027】
(2)iNKT細胞の単離
磁気細胞分離法(MACS)用いて肝単核球からiNKT細胞を単離した。MACSには Miltenyi Biotech社のmini MACS kit(Anti−PEマイクロビーズ、MSカラム、MACSセパレーター)を用いた。すなわち、CD1d Tetramer−PE(MBL社製)によりiNKT細胞をラベルした後、iNKT細胞を80μLのMACS緩衝液(2%FCS、2mM EDTA含有PBSを脱気したもの)に懸濁し、Anti−PEマイクロビーズを20μL添加した。氷上にて15分間インキュベートした後、MACS緩衝液で洗浄して500μLのMACS緩衝液に再懸濁し、細胞懸濁液を調製した。MACS MSカラムをMACS緩衝液にてリンスした後、Mini MACSセパレーターを用いて調製した細胞懸濁液からiNKT細胞をポジティブセレクションした。また純度を高めるために、2回MSカラムに細胞を通し、純度が80%以上のものを実験及び解析に用いた。さらに細胞洗浄による細胞の損失を抑えるため、一部セルローション(日本全薬工業製)を用いて細胞の洗浄を行った。
【0028】
(3)iNKT細胞ポピュレーションの解析
肝単核球(5×105cells/100μL)を1.5mLエッペンドルフチューブに分注し、卓上遠心機にて4℃、2000回転、5分間遠心し、洗浄した。沈殿した細胞を50μLの2%FCS含有PBS(FCM緩衝液)に再懸濁した後、CD16/CD32モノクローナル抗体(クローン2.4G2)0.5mg/mLを1μL添加し、氷上にて10分間インキュベートした。CD16/CD32モノクローナル抗体によるFc受容体のブロッキングの後、CD1d Tetramer−PEを10mL添加し、室温にて30分間インキュベートしてiNKT細胞を蛍光標識した。続いて、PerCP−Cy5.5標識抗マウスCD3εモノクローナル抗体を加え、氷上にて30分間インキュベートした。FCM緩衝液を1mL加え、4℃、2000回転、5分間遠心して洗浄し、300μLのFCM緩衝液に懸濁した後、フローサイトメーターを用いて細胞表面上の蛍光強度を解析した。
【0029】
WTではCDAA食摂食による肝iNKT細胞比率の変化は認められなかったのに対し、CXCL16KOマウスでは通常食摂食時に比べて、CDAA食餌により肝iNKT細胞が2倍近く増加している(図3A)。
【0030】
(4)iNKT細胞のサブポピュレーションの解析
iNKT細胞ポピュレーション解析と同様に、CD1d Tetramer−PEにてiNKT細胞を蛍光標識し、その後PerCP−Cy5.5標識抗マウスCD4モノクローナルとFITC標識抗マウスCD8モノクローナル抗体を加え、氷上で30分間インキュベートした。続いて、磁気細胞分離法によりiNKT細胞を単離し、フローサイトメーターを用いてiNKT細胞のサブポピュレーションの解析を行った。
【0031】
WTマウス、CXCL16KOマウスともCDAA食摂食によりiNKT細胞数がベースラインよりも増加していたが、CDAA食餌CXCL16KOマウスの肝iNKT細胞の増加率の方が顕著であった(図3B)。また、CDAA食餌WTマウスとCXCL16KOマウスの肝iNKT細胞集団は構成しているiNKT細胞のサブポピュレーションが異なっていた(図3C)。
【0032】
実施例3
<コリン欠乏食食餌CXCL16KOマウス肝iNKT細胞の機能解析>
(1)in vitroにおける肝単核球培養とβ-ガラクトシルセラミド(β-GalCer)刺激
実施例2(1)の方法に従い、肝単核球を単離した後、細胞を10%FCS、50μM 2−メルカプトエタノール添加RPMI1640培地に懸濁し、2×105cells/100μLの細胞密度で96ウェルプレートに播種した。
iNKT細胞の特異的なリガンドであるβ−ガラクトシルセラミド(β−Galactosylceramide:β−GalCer)は、ジメチルスルスルホキシドにて1 mg/mLに調製し、肝単核球刺激の際には終濃度100ng/mLとして用いた。
【0033】
(2)酵素免疫測定法(Enzymed-linked
Immunosorbent Assay:ELISA)によるサイトカイン産生量
肝単核球の培養上清、およびマウスの血清サンプル中のIFN−γ、IL−2、IL−4、TNF−αはそれぞれ市販のELISAキット(ベイバイオサイエンス社製)を用いて定量した。
【0034】
(3)in vivoにおけるβ−ガラクトシルセラミド(β−GalCer)刺激
0.5%ポリソルベイト20添加生理食塩水によりDMSO溶解β−GalCerを希釈し、2μg/200μLとして、各WTマウス、CXCL16KOマウスに経尾静脈投与した。投与から1.5時間後に各マウスを犠牲死させて肝単核球を採取し、iNKT細胞の細胞内サイトカイン染色を行った。
【0035】
β−GalCer刺激によるサイトカイン産生プロファイルの結果、WTマウスではCDAA食の摂食によっていずれのサイトカインにも有意な産生能の変化は見られなかった。一方、CXCL16KOマウスではCDAA食餌により、いずれのサイトカインにおいてもベースラインよりもサイトカイン産生能が上昇していた。
【0036】
(4)iNKT細胞内サイトカイン染色によるサイトカイン産生プロファイル変化
細胞固定/細胞膜浸透化キット(BDバイオサイエンス社製)を用いて、細胞内部のサイトカインの保持、細胞固定、細胞膜透過処理を行った。
すなわち、単離した肝単核球を1×106cells/mLの細胞密度で24ウェルプレート(コースター)に播種し、ゴルジ体からの小胞輸送阻害剤であるモネンシン存在下で、3時間培養して細胞内にサイトカインを蓄積させ、その後、細胞を回収し、前述のようにFCM緩衝液で洗浄した後、PerCP−Cy5.5標識ラット抗マウスCD4モノクローナル抗体(RM4−5)およびCD1d TetramerによりiNKT細胞の細胞表面抗原を蛍光標識した。続いて、キットのプロトコールに従って細胞固定、細胞膜透過処理を行い、細胞内の各種サイトカインを蛍光標識抗サイトカイン抗体にて染色した後、CD1d tetramer陽性細胞をゲートし、フローサイトメーターにより解析を行った。なお、染色用抗サイトカイン抗体として、FITC標識抗マウスIFN−γ(クローン:XMG1.2)、FITC標識抗マウスIL−17A(TC11−18H10.1)、FITC標識抗マウスIL−4(BVD6−24G2)、FITC標識抗マウス/ラットTNF−α(TN3−19)、また同位体対照としてFITC標識ラットIgG1κ抗体を用いた。
【0037】
その結果、CDAA食摂食によりWTマウスのCD4+iNKT細胞は、IFN−γ(18.2%→25.2%)、IL−4(3.7%→8.4%)の発現が亢進していた。
CXCL16KOマウスではCDAA摂食によるCD4+iNKT細胞のサイトカイン産生亢進の程度がIFN−γ(9.6%→17.9%)、IL−4(4.3%→13.8%)共にWTよりも顕著であった(図5)。
【0038】
実施例4
<コリン欠乏食餌CXCL16欠損マウスのNASH病態形成における機能変異iNKT細胞の寄与>
(1)養子移植
通常食またはCDAA食を摂食したWTマウスおよびCXCL16KOマウス(ドナー)の肝iNKT細胞をMACSにより単離した。単離したiNKT細胞をPBSで洗浄した後、トリパンブルー染色により生細胞数をカウントし、5.5×105cell/200μL
PBSをiNKT細胞欠損マウス(Jα18ノックアウトマウス:レシピエント)に経尾静脈移入した。細胞移入から2週間後にマウスを犠牲死させ、血清、肝臓、精巣上体部脂肪組織を採取し、保存した。なお、肝臓へのiNKT細胞生着の有無については、フローサイトメーターによりレシピエント肝単核球中のiNKT細胞を検出することで確認した(図6)。
【0039】
(2)肝臓の病理組織学的所見
ホルマリン固定した肝臓はパラフィン包埋し、4μmの連続切片を作製した。薄切した組織サンプルはヘマトキシリン染色を行い、病理組織像をもとに組織学的診断に供した。また、ヘマトキシリンとスダンIVの対比染色により肝臓への脂肪沈着を評価した。
【0040】
CDAA食餌CXCL16KOマウスの肝iNKT細胞を養子移植したレシピエント肝では、他ドナーマウスから単離した肝iNKT細胞を移植した場合と比較しても、脂肪肝に特徴的な白色肝が明らかに認められた(図7A上)。この時、各群のレシピエント肝重量比を算出すると、CDAA食餌CXCL16KOマウスの肝iNKT細胞の移植した場合、通常食餌CXCL16KOマウスのiNKT細胞を移植した場合より有意に高値を示し、CDAA食餌WT群の肝iNKT細胞を移植した場合より、高い傾向を示した(図7B)。また、CDAA食餌CXCL16KOマウスの肝iNKT細胞を移植したレシピエント肝では脂質蓄積が誘導された(図7A下)。
【0041】
(3)肝臓組織中脂質
肝臓組織中の中性脂肪、コレステロール、遊離コレステロール、リン脂質量はリポタンパク質の受託解析サービス(スカイライト・バイオテック社)により解析を行った。なお、解析にはホルマリン固定肝臓サンプルを用いた。
【0042】
その結果、遊離コレステロール、総コレステロール、リン脂質はどのドナー由来の肝iNKT細胞を移植しても変化が認められないのに対し、CDAA食餌CXCL16KOマウスの肝iNKT細胞を移入した場合には、レシピエントマウスの肝臓に有意な中性脂肪の蓄積の誘導があった(図8)。
【0043】
(4)リアルタイムRT−PCRによる肝臓組織の各種遺伝子発現変動の評価
[RNA抽出]
肝組織中RNAは、RNeasy mini kit(キアゲン社)を用いて抽出した。すなわち、RNA later中で保存した肝組織50mgを1.5mLチューブ (RNase−free)にとり、600μLのRLT緩衝液(2−メルカプトエタノール添加(1%,v/v))を加えて氷上にてホモジナイズした。肝ホモジネートをキット付属のプロトコールにしたがってシリカゲルカラムに通し、RNAを溶出させた。得られたRNA濃度を吸光光度計にて測定し、各サンプル1ng/10μLに調製した。調製したRNAサンプルは解析に用いるまで−30℃で保存した。
[逆転写反応]
OLIGO DTプライマー(インビトロジェン)を用いてMRNAを増幅した後、逆転写反応はSuper Script II reverse transcription (インビトロジェン)を使用して行った。
[リアルタイムPCR]
逆転写反応によりcDNAを得た後、SYBR Premix Ex Taq(タカラバイオ社)と Mx3000p(ストラタジーン社)および測定・解析ソフト MxPro(ストラタジーン社)を用いてリアルタイムPCRを行った。測定結果はすべてハウスキーピング遺伝子であるglyceraldehyde−3−phosphate dehydrogenase(GAPDH)の発現量により比較Ct法にて補正した。
【0044】
NASH病態形成と関連の深い、TNF−α、IL−1βといった炎症性サイトカインの発現を指標に炎症状態を評価した。その結果、異常iNKT細胞を移入することで、レシピエントの肝臓でもTNF−α、IL−1βの発現誘導が確認された(図9)。
【0045】
(5)肝単核球の活性化状態解析
各レシピエントの肝単核球を単離し、RPE標識抗マウスF4/80モノクローナル抗体、FITC標識抗マウスCD69モノクローナル抗体(クローンH1.2F3)で染色した後、CD69の発現レベルをフローサイトメーターで解析し、単核球活性化の指標とした。
【0046】
ドナー由来iNKT細胞をレシピエントに移入後、肝単核球の共通活性化マーカーであるCD69の発現レベルをフローサイトメーターにより解析した。その結果、CDAA食餌CXCL16KOマウス由来の機能異常iNKT細胞を移入した場合には、CD69発現細胞の増加が認められた(図10A)。
【0047】
kupffer細胞のマーカーとしてF4/80を用い、CD69との二重染色によってiNKT細胞の移入によるkupffer細胞の活性化の程度をフローサイトメーターにより解析した。その結果、CDAA食餌CXCL16KOマウス由来の肝iNKT細胞移入によって、CD69陽性kupper細胞の割合が増加していた(図10B)。
【0048】
実施例5
<機能変異iNKT細胞を起点とした肝細胞への脂肪蓄積機構>
(1)肝iNKT細胞とその他肝単核球による共培養系
肝iNKT細胞は、それぞれ通常食またはCDAA食を2週間摂食させたWTマウスおよびCXCL16KOマウスの肝臓からMACSを用いて単離した。また、iNKT細胞との共培養に用いた肝単核球はiNKT細胞欠損マウス(Jα18ノックアウトマウス)の肝臓より単離し、これにより他のiNKT細胞による影響を排除した実験系を組み立てた。共培養系は、iNKT細胞:肝単核球=2×104cells:8×104cellsを10%FCS、50μM 2−メルカプトエタノール添加RPMI1640培地に懸濁して96ウェルプレートに播種し、37℃、炭酸ガスインキュベーター内で72時間培養した。
【0049】
(2)マウス初代肝細胞培養
肝細胞を捲き込む前日に、96ウェルプレートをマトリゲル(Matrigel、BD Biosciences社)でコーティングしておく。実際には、1mg/mLマトリゲルをPBSにより50μg/mLに希釈し、40μL/ウェルをプレートに添加した。続いて、クリーンベンチ内で一晩風乾し、無血清RPMI1640培地で1度洗浄した後に培養に用いた。
無処置WTマウスまたはiNKT細胞欠損マウスの肝臓をEGTA添加HBSSで還流後、肝臓を摘出し、125μg/mLコラゲナーゼIV(シグマ社)/HBSS溶液に浸けて細断して、37℃温浴シェーカー中で15分間インキュベートした。その後、肝組織をナイロンメッシュ(100μm)に通して細胞浮遊液を得た。細胞浮遊液を、4℃、500回転、1分間遠心し、上清をアスピレーターにより除去した後、10%FCS添加RPMI1640培地にて細胞を3回程洗浄し、上清が澄んできたら無血清RPMI1640培地で細胞を1〜2回洗浄して肝細胞を得た。3×104cells/100μLの細胞密度に調整し、マトリゲルでコーティングした96ウェルプレートに播種した。
【0050】
(3)共培養系上清
(馴化培地)によるマウス初代肝細胞への脂肪蓄積誘導
肝細胞を無血清RPMI1640培地で16時間培養し飢餓状態にしておく。肝細胞を無血清RPMI1640培地で1回洗浄し、共培養系馴化培地にて肝細胞を24 時間培養した。
【0051】
(4)肝細胞脂質染色
共培養系馴化培地下で24時間培養した後、培養上清を除去して4%パラホルムアルデヒドで肝細胞を固定し、Adipogenesis Assay Kit(Cayman Chemical社)を用いて肝細胞中の脂質を染色した(Oil red−O染色)。
【0052】
CDAA食餌CXCL16KOマウス肝臓由来の機能変異iNKT細胞と肝単核球の共培養によって得られたCMでマウス初代肝細胞を培養することで非常に強力な脂質蓄積が誘導された(図11A)。
【0053】
(5)共培養系におけるサイトカイン産生量
共培養系上清中に産生された液性因子として、IFN−γ、IL−2、IL−4、TNF−αはそれぞれ市販のELISAキット(Ready Set Go!, eBioscience社)を用いて定量した。
【0054】
CDAA食餌CXCL16KOマウスの肝iNKT細胞は肝単核球との共培養を行わずとも、それ単独でもCDAA食餌WTマウス、通常食餌CXCL16KOマウスの肝iNKT細胞よりも高いTNF−α産生能を有していた(図11B)。
【0055】
(6)中和抗体によるサイトカイン機能阻害実験
Putified anti−mouse/rat TNF−α(TN3−19)、anti−mouse IFN−γ(XMG1.2)(eBioscience)またはコントロールIgG(ラットIgG、Inter−Cell Technoligy)を終濃度1μg/mLとして、馴化培地を用いた初代肝細胞培養系に添加した。
【0056】
その結果、機能変異iNKT細胞と肝単核球の共培養CMに抗IFN−γ中和抗体、抗TNF−α中和抗体をそれぞれ単独で添加させるだけで、共培養CMによる脂質蓄積作用はほぼ完全に阻害された(図12)。
【産業上の利用可能性】
【0057】
本発明のTNF−αの産生能を有することを特徴とするインバリンアントナチュラルキラーT細胞は、NASHにおける異常免疫応答を解明するためのツールとして有用である。また、CDAA食餌CXCL16ノックアウトマウスは、NASHの初期病態を誘導するモデル動物として有用である。
【特許請求の範囲】
【請求項1】
肝臓単核球からのTNF−αおよびIFN−γ産生を亢進することを特徴とするナチュラルキラーT細胞。
【請求項2】
養子移植することによりレシピエント動物に、非アルコール性脂肪性肝炎を発症させる請求項1記載のナチュラルキラーT細胞。
【請求項3】
ナチュラルキラーT細胞が、非アルコール性脂肪性肝炎の病態モデル動物の肝臓から単離されるものである請求項1および2記載のナチュラルキラーT細胞。
【請求項4】
非アルコール性脂肪性肝炎の病態モデル動物が、肝臓におけるケモカインCXCL16の発現が低下または発現してしない病態モデル動物である請求項3記載のナチュラルキラーT細胞。
【請求項5】
病態モデル動物がげっ歯類である請求項3または4記載のナチュラルキラーT細胞。
【請求項6】
肝臓におけるケモカインCXCL16の発現が低下または発現してしない病態モデル動物にコリン欠乏食を摂食させ、該病態モデル動物の肝臓から単離することを特徴とする肝臓単核球からのTNF−αおよびIFN−γ産生を亢進することを特徴とするナチュラルキラーT細胞の取得方法。
【請求項7】
病態モデル動物がげっ歯類である請求項6記載の肝臓単核球からのTNF−αおよびIFN−γ産生を亢進するナチュラルキラーT細胞の取得方法。
【請求項1】
肝臓単核球からのTNF−αおよびIFN−γ産生を亢進することを特徴とするナチュラルキラーT細胞。
【請求項2】
養子移植することによりレシピエント動物に、非アルコール性脂肪性肝炎を発症させる請求項1記載のナチュラルキラーT細胞。
【請求項3】
ナチュラルキラーT細胞が、非アルコール性脂肪性肝炎の病態モデル動物の肝臓から単離されるものである請求項1および2記載のナチュラルキラーT細胞。
【請求項4】
非アルコール性脂肪性肝炎の病態モデル動物が、肝臓におけるケモカインCXCL16の発現が低下または発現してしない病態モデル動物である請求項3記載のナチュラルキラーT細胞。
【請求項5】
病態モデル動物がげっ歯類である請求項3または4記載のナチュラルキラーT細胞。
【請求項6】
肝臓におけるケモカインCXCL16の発現が低下または発現してしない病態モデル動物にコリン欠乏食を摂食させ、該病態モデル動物の肝臓から単離することを特徴とする肝臓単核球からのTNF−αおよびIFN−γ産生を亢進することを特徴とするナチュラルキラーT細胞の取得方法。
【請求項7】
病態モデル動物がげっ歯類である請求項6記載の肝臓単核球からのTNF−αおよびIFN−γ産生を亢進するナチュラルキラーT細胞の取得方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【公開番号】特開2013−34459(P2013−34459A)
【公開日】平成25年2月21日(2013.2.21)
【国際特許分類】
【出願番号】特願2011−175630(P2011−175630)
【出願日】平成23年8月11日(2011.8.11)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成23年2月14日 平成23年3月医学薬学教育部修士課程修了予定者修士論文発表会に発表(要旨集、スライド)
【出願人】(305060567)国立大学法人富山大学 (194)
【Fターム(参考)】
【公開日】平成25年2月21日(2013.2.21)
【国際特許分類】
【出願日】平成23年8月11日(2011.8.11)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成23年2月14日 平成23年3月医学薬学教育部修士課程修了予定者修士論文発表会に発表(要旨集、スライド)
【出願人】(305060567)国立大学法人富山大学 (194)
【Fターム(参考)】
[ Back to top ]

