ナノカーボンを用いた臨床検査
【課題】 血液などの生体由来物をサンプルとする臨床検査において、検出対象以外の血球成分などの生体物質を予め取り除くことなく、そのままで、検出対象成分のみを高感度で検出可能な、検出方法を提供すること。
【解決手段】 単層カーボンナノチューブ(SWCNT)などのナノカーボンが光励起により近赤外光を発光することを利用し、検出プローブをナノカーボンにより標識することにより、検出された対象が発する近赤外光を検出に利用することで、検出対象以外の血球成分などの生体物質をサンプルから予め取り除くことなく、そのままで、検出対象成分のみを高感度で検出することが可能となる。
【解決手段】 単層カーボンナノチューブ(SWCNT)などのナノカーボンが光励起により近赤外光を発光することを利用し、検出プローブをナノカーボンにより標識することにより、検出された対象が発する近赤外光を検出に利用することで、検出対象以外の血球成分などの生体物質をサンプルから予め取り除くことなく、そのままで、検出対象成分のみを高感度で検出することが可能となる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、近赤外領域で発光する標識プローブを用いる臨床検査技術に関する。
【背景技術】
【0002】
昨今の技術開発を背景として、各種疾患バイオマーカー探索が進められており、「がん」等の疾患の早期発見に役立つ可能性が高い候補分子が相次いで報告されている。産業技術総合研究所の糖鎖医工学研究センターでも、本発明者らの一人である池原らが糖鎖分析技術のアドバンテージを最大限に生かして、疾患の発生と進展に伴って出現する未完成品糖タンパク質(図1)(=糖鎖修飾異性体)を疾患バイオマーカーとする研究を進めて来た。未完成品の糖タンパク質などの疾病マーカーを検出することで、がんや生活習慣病を早期発見できる。
最近、池原らは、肝炎に伴って生じる線維化を測定できる未完成糖鎖バイオマーカーを発見し、侵襲性の高い生検に代わって血液検査での検出評価を可能とした。さらに、胃がんの腹腔内再発や、胆管がん、卵巣がんのように発見が極めて難しい腫瘍の存在や進展についても、評価できる未完成糖鎖バイオマーカーの発見に成功している。今後、同様のアプローチで開発を進めると、動脈硬化やアルツハイマー病の検査診断にも展開可能であると予想される。しかし、血液・体腔液・胆汁などに存在する疾患マーカー分子を検出することで、これらの疾病の超早期診断を達成するためには、現在の臨床検査で一般に利用される検出技術では、十分な感度を得ることは難しい。
【0003】
一般に血液・体腔液・胆汁等をサンプルとする臨床検査では、血球等の細胞成分(赤血球や白血球、血小板、中皮、脱落細胞)を遠心分離やフィルター濾過により除去する。しかし、いずれの操作でも除ききれないので、これら生体物質が少なからず混入する事となり、疾患バイオマーカー検出のために使うプローブ分子の光を妨害吸収してしまい疾病検出感度を下げてしまう。同時に、血球成分等の細胞や、体腔液や胆汁に含まれるタンパクが非特異的に発光し、プローブ発光検出の際にノイズの原因ともなる。こうした成分によるプローブ発光の妨害吸収や自家発光ノイズは、超早期診断を目的としたさまざまな疾患バイオマーカーの高感度検出を邪魔し、その実用化において非常に大きな障害となっている。
【先行技術文献】
【非特許文献】
【0004】
【非特許文献1】Journal of the American Chemical Society (2007) 5612-5620.
【非特許文献2】Analytical Chemistry (2009) Volume 81, 7885-7891.
【非特許文献3】Leeuw et al. Nano Lett. 2007,7(9),2650-4
【発明の概要】
【発明が解決しようとする課題】
【0005】
本発明は、血液・体腔液・胆汁などの生体由来物をサンプルとする臨床検査において、検出対象以外の血球や成分などの生体物質を予め取り除くことなく、そのままで、検出対象成分のみを高感度で検出可能な、検出方法を提供することを課題とする。
【課題を解決するための手段】
【0006】
本発明者らは、単層カーボンナノチューブ(SWCNT)などのナノカーボンが光励起により近赤外光を発光することに着目し、検出プローブをナノカーボンにより標識することにより、検出された対象が発する近赤外光を検出に利用することで、検出対象以外の血球成分などの生体物質をサンプルから予め取り除くことなく、そのままで、検出対象成分のみを高感度で検出することが可能であることを見出し、本発明を完成した。
【0007】
近赤外光は生体透過性が高いため、in vivoイメージングや腋窩リンパ節検査などの体内診断の高感度化をゴールに、技術開発が試みられている。血液や体腔液を対象として検索する臨床検査においても、近赤外光が利用可能となれば、高感度化と多種類の疾病マーカーの同時検出が可能となるが、実現していない。実現のためには、近赤外波長領域で効率良く発光するプローブが必要である。
SWCNTは、450−1350nmの光励起により700−2300nmで発光する(図2にその一部の波長範囲の発光マップを示す)。この波長範囲は、生体物質によって吸収されにくいあるいは自家発光の少ない波長範囲(波長600−1300nm)をふくむ 。SWCNTは、近赤外色素分子や近赤外量子ドットに比べて、10倍以上の光学的耐久性があり、化学修飾も可能である。つまり、SWCNTは近赤外発光プローブとしての優位性は比類なく、近赤外光を利用した次世代臨床検査の実現を可能にする強力な新規材料である。SWCNTの発光は2002年に発見され、これまで、生体内のSWCNTイメージングなども試みられた(非特許文献3)ものの、そのもっとも有力な応用である臨床検査への検討はこれまで全くなされていない。
【0008】
近赤外光の発光により、微量の検出対象を生体に由来する夾雑物が存在するサンプル中で検出するためには、また、微弱な近赤外光を検出する装置が必要とされる。
波長1000〜2000nmの近赤外光の検出には、通常シリコン電荷積分アンプに接続されたInGaAsフォトダイオードアレイを使用するが、室温付近においては、フォトダイオードの暗電流が大きくシリコンICで許容されるキャパシタンスでは、十分な積分時間が確保できない。この点は、フォトダイオードを液体窒素冷却することで解決可能であるが、価格や操作性の問題を鑑みると、臨床検査室での実用化は難しい。これに対して本発明者らの一人である小倉は、先に、極微弱光の計測が室温付近で可能となるよう、表面電流ブロック層を設けたヘテロバイポーラフォトトランジスタを開発した(PCT/JP2009/067689として特許出願中)。
この素子の特色として、内部増幅作用が大きいので(電流増幅率β〜数千)、外部電気回路によるノイズの影響を受けにくいこと、ベース領域に光励起キャリアの蓄積効果を持つため、電荷積分機能を内蔵していること、可視から赤外まで広い波長範囲に感度を有することなどが挙げられる。
更に、蛍光や透過スペクトラム計測の場合、光源を変調し、検出系を同期検波する(ロックイン 検波)ことにより暗電流成分を除去することが可能であるが、アレイ検出器に対しては、電子回路をIC化する必要があり、十分な対策が取られていない。
本発明者らは、フォトダイオードアレイのそれぞれの素子に、シリコンICによるロックインアンプアレイを接続することにより、室温アレイにおいてもフェムトワットレベルの微弱光検出を可能にした(上述のPCT/JP2009/067689)。
【0009】
すなわち、本発明は、近赤外光を高感度に検出できるシステム機器の基盤技術の存在のもと、近赤外光で発光するSWCNTなどのナノカーボンを標識基材として、目的物の検出に必要な抗体などのプローブを修飾することにより、従来の可視波長帯域に加えて、近赤外波長帯域における蛍光標識を用いた血液生化学検査の検体検査を可能とするものである。更に、検出波長帯域を2μmまで拡張することにより、赤血球中の糖化ヘモグロビンやグルコースの光吸収・透過特性による、HbA1c定量や血糖値計測も並行して行うことが可能となり、成人病の予防的な検診に大きく貢献する。
【0010】
本出願は、具体的には、以下の発明を提供する。
〈1〉ナノカーボン(単層カーボンナノチューブ、多層カーボンナノチューブ、カーボンナノホーン、ナノグラフェン、その他のナノカーボン)の特異な光学的性質(光吸収、発光、ラマン散乱光)を利用することを特徴とする、免疫測定方法あるいは臨床検査方法。
〈2〉波長450−1350nmの光励起により波長700−2300nmで発光する単層カーボンナノチューブ(SWCNT)あるいはナノグラフェンを発光標識として用いることを特徴とする、〈1〉に記載の免疫測定方法あるいは臨床検査方法。
〈3〉ナノカーボン(単層カーボンナノチューブ、多層カーボンナノチューブ、カーボンナノホーン、ナノグラフェン、その他のナノカーボン)を含有する発光標識物質。
〈4〉ナノカーボンが、波長450−1350nmの光励起により波長70−2300nmで発光する単層カーボンナノチューブ(SWCNT)あるいはナノグラフェンであることを特徴とする、〈3〉に記載の発光標識物質。
〈5〉特定の抗原を認識する抗体にナノカーボンを結合させて成り、抗原抗体反応をナノカーボンの蛍光、ラマン光、光吸収の計測により検出することを特徴とする、〈3〉または〈4〉に記載の発光標識物質。
〈6〉ストレプトアビジンおよびストレプトアビジンの関連分子にナノカーボンを結合させて成り、抗原に結合したビオチン化抗体とストレプトアビジンの反応物を、ナノカーボンの蛍光、ラマン光、光吸収の計測により検出することを特徴とする、〈3〉または〈4〉に記載の発光標識物質。
〈7〉Protein G, Protein Aなどのイムノグロブリン結合タンパクにナノカーボンを結合させて成り、抗原に結合した抗体を検出するため、抗体と抗体結合タンパクの結合反応をナノカーボンの蛍光、ラマン光、光吸収の計測により検出することを特徴とする、〈3〉または〈4〉に記載の発光標識物質。
〈8〉特定の抗原が、正常もしくは病的な状態になった際、血液や体腔液中に存在する各種の抗原(タンパクや糖鎖等の、がん関連抗原、疾患バイオマーカーを含む)であることを特徴とする、〈5〉に記載の発光標識物質。
〈9〉磁気ビーズ、セファロース、セファデックス等の担体に結合させた各種抗原に対する抗体をもちいてエンリッチしたサンプルについて、ナノカーボン標識抗体の結合後に、ナノカーボンの近赤外発光計測により抗原検出することを特徴とする、〈1〉または〈2〉に記載の免疫測定方法あるいは臨床検査方法。
〈10〉疾病マーカーである抗原をナノカーボン標識抗体にて標識し、電気泳動にて捕集した後に、ナノカーボンの近赤外発光計測により抗原検出することを特徴とする、〈1〉または〈2〉に記載の免疫測定方法あるいは臨床検査方法。
〈11〉単一検体において〈1〉〜〈10〉に記載の発光臨床検査法、あるいはこれと他の発光臨床検査法とを組み合わせて、異なった発光波長帯にて複数の抗原を検出することを特徴とする、免疫測定方法あるいは臨床検査方法。
〈12〉単一検体において、異なった発光波長帯における複数の抗原からの発光強度比を用いることを特徴とする、〈11〉に記載の免疫測定方法あるいは臨床検査方法。
〈13〉〈11〉または〈12〉の紫外、可視、近赤外、赤外発光計測において、単一あるいは複数の励起光を変調して、それに同期して近赤外発光を検出する臨床検査装置。
〈14〉酵素免疫測定法(ELISA)において二次抗体に用いられるペルオキシダーゼあるいはアルカリフォスファターゼに代えて、SWCNT標識抗体を二次抗体として用いることを特徴とする、免疫測定法。
〈15〉〈2〉に記載されたSWCNTの発光波長に加え、他の異なる発光波長における蛍光標識も併用して、複数の抗体反応を同一検体にて測定する計測方法。
【発明の効果】
【0011】
本発明により、近赤外光を発光するナノカーボンで検出対象を標識することによって、血液などの生体由来物をサンプルとする臨床検査において、検出対象以外の血球成分などの生体物質を予め取り除くことなく、そのままで、検出対象成分のみを高感度で検出することができる。
フローサイトメーターや共焦点レーザー顕微鏡では、利用できる波長域の拡大によって、得られる情報量が格段に増えてきた。本発明により、臨床検査機器も、今までの利用波長域400−500nm から、400−2300nmと近赤外領域にまで大幅に拡張することができ、得られる情報はさらに増加する。たとえば、異なる励起発光プローブを組み合わせる事で、1回のアッセイで同時に、数種類のバイオマーカーを検出評価できるようになる。本発明により、生体物質に対して透過性の高い近赤外光を使用することにより、生体由来の臨床サンプルを血清や血漿へと分離せずに検査ができるので、血球・血小板成分の分離操作によって失われていた情報を取得できるようになる。しかも、血清検査の際でも、混入した血球・血小板成分によるバイオマーカー由来のシグナル光吸収と非特異的ノイズが抑えられるので、微量バイオマーカーの検出が可能となり、がんやアルツハイマー病等の超早期発見・早期治療を可能とするなど、医学・医療の発展に大きく貢献できる。
本発明のSWCNTの近赤外発光を利用した臨床検査システムにより、世界ではじめて近赤外光を臨床検査へ持ち込むこととなり、診断薬・診断機器産業界に革命的な進歩をもたらす。
【図面の簡単な説明】
【0012】
【図1】完成された糖タンパク質と未完成品の比較模式図。
【図2】SWCNTの2次元発光マップ。
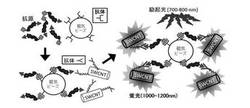
【図3】SWCNTを用いた疾病マーカー(未完成糖たんぱくなどの抗原)検出の概念図。
【図4】DSPE-PEGの分子構造。
【図5】NHS-DSPE-PEGの分子構造。
【図6】赤外抗体反応検出装置
【図7】小型近赤外分光器を装着した全血分光蛍光装置の断面模式図。
【図8】図7の装置による全血蛍光分析スペクトラムと従来法によるスペクトラムの比較図。
【図9】小型分光器に代えて発光ダイオードとフィルター及び受光素子を用いた装置の例。
【図10】本発明による検体の自動臨床検査装置の模式図。
【発明を実施するための形態】
【0013】
実施例1.SWCNTを用いた近赤外発光による抗原抗体反応の検出
1)本実施例では、卵白アルブミン(OVA)をモデル抗原として抗原抗体反応を行い、抗原抗体反応を近赤外発光で検出した。
まず、モデル抗原に対するモノクローナル抗体を準備し、ELISAプレートに固相化した。モデル抗原を含むサンプル溶液を固相化したプレート上で、室温において2時間反応させた後に上澄を捨て、リン酸バッファーやトリスバッファーで良く洗った。次いで、SWCNTで標識したモデル抗原に対するポリクローナル抗体プローブ(SWCNT-標識抗体)をリン酸バッファーやトリスバッファー中で、室温で2時間反応させた。プレートをリン酸バッファーやトリスバッファーで良く洗うことで、未反応のSWCNT-標識抗体を、洗浄除去し、プレート上に検出されるSWCNT由来の近赤外蛍光を検出することで、抗原抗体反応の検出を行なった。
2)ELISAプレートに固相化した抗体を用いる系のほかに、Protein Gビーズに抗体を結合させてバッチ処理で使用することも可能である。Protein Gビーズを用いた場合、ビーズに結合しているProtein Gと抗体のFc部との結合を介して、抗体はビーズに結合できる。抗体を固相化したビーズを、モデル抗原を含むサンプル溶液中で、室温において2時間反応させた後に上澄を捨て、リン酸バッファーやトリスバッファーで良く洗った。次いで、SWCNTで標識したモデル抗原に対するポリクローナル抗体プローブ(SWCNT-標識抗体)をリン酸バッファーやトリスバッファー中で、室温で2時間反応させた。ビーズをよく洗うことで、未反応のSWCNT-標識抗体を除去し、ビーズに検出されるSWCNT由来の近赤外蛍光を検出することで、抗原抗体反応の検出を行なった。
【0014】
これらの抗原抗体反応において使用するSWCNT-標識抗体の作製は、以下の手順で行った。
DSPE-PEGと抗体との結合
1)抗体125μgを50mMリン酸バッファー(pH7.2)6μlに溶かし、DSPE-PEG(図4参照、末端アミノ基)5μgを加え攪拌する。次に、WSC(1-ethyl-3-(3-dimethylaminopropyl)carbodiimide hydrochloride)触媒を8μg加え、4℃で10時間、スターラーで攪拌する。フィルターでろ過し、フィルター上に残った反応物をバッファーに溶かして回収する。
あるいは、
2)抗体125μgをNaHCO3緩衝液2.5μlに溶かす。純水5μgにNHS-PEG-DSPE(図5参照)を溶かし、抗体溶液に添加する。ボルテックスを用いて4℃、6時間で攪拌し、反応させる。反応溶液をゲル濾過にて精製し、回収する。
SWCNTの処理
まず、約1mgのカーボンナノチューブ(SWCNT)を約20mlの1重量%ドデシルベンゼンスルホン酸ナトリウム(SDBS)水溶液中に浸し、超音波破砕機によって分散させた。得られた分散液を171000gで2.5時間超遠心処理し、半透明な上澄み液(約10ml)を得た。
SWCNT-標識抗体プローブの作製
このSWCNT分散液の上澄み液1mlあたり、抗体を結合させた1mgのDSPE-PEGを加え、3分間バス型超音波洗浄機にかけ、抗体結合DSPE-PEGを完全に溶解させた。その後、分子量3500以下の分子を通過させる透析膜に入れ、5日間透析作業をおこなった。この透析作業によってSDBSを抗体結合DSPE-PEGに置き換えた。
【0015】
また、上記抗原抗体反応の詳細な手順は、以下のとおりである。
ELISAプレートでの反応系計測
PBSもしくは100mM Bicarbonate/carbonate coating bufferで20μg/mlに調整した抗OVA抗体溶液を50μl使用して、プレートを2時間室温でコートする。PBSでよく洗浄したのち、PBSに溶解した5%BSA溶液200μlをウエルに入れて、室温で30分間、ブロッキングする。PBSでよく洗浄した後、サンプルを加えて室温で2時間反応させたのち、PBSでよく洗浄する。次にPBS で20μg/mlに希釈したSWCNT-抗体プローブを室温で2時間反応させたのち、PBSでよく洗浄する。
プレートを乾かした後、発光を検出する。
磁気ビーズを用いたバッチ処理での反応系計測
Dynabeads ProteinG のプロトコールに従って、PBSで5μg/mlに調整した抗OVA抗体200μlを、1.5mgのDynabeads ProteinGと10分間反応させて、抗体の結合したDynabeadsを調整した。次に、モデル抗原を含むサンプル溶液500μlと室温で2時間反応させて、抗体の結合したDynabeadsで抗原を回収した。
つぎに、PBSでよく洗浄したのち、次にPBS で20μg/mlに希釈したSWCNT-抗体プローブ100μlと、室温で2時間反応させたのち、PBSでよく洗浄する。
Bufferを除いたのち、SWCNTの発光を検出する。
【0016】
また、標識プローブからの発光の検出は、以下のように行う。
磁気ビーズ-抗原-SWCNT-DSPE-PEG-抗体の検出
波長660nmの光照射により、SWCNTから波長1200nm前後の発光が観測できる。その近赤外発光スペクトルをInGaAs検出器を搭載した分光システムによって測定する。
更に、蛍光測定の場合、励起光を変調することが可能であることから、変調周期に対応して同期検波を行うロックインアンプ検出法を用いて微弱光の検出レベルを、暗電流相当レベル(数pW)からショットノイズ限界(〜数十fW)まで向上することが可能である。図6に、内部増幅作用を有するInGaAs近赤外フォトトランジスタアレイの各セルにロックインアンプおよびAD変換器を接続した高感度赤外光検出アレイモジュールを磁気ビーズ-抗原-SWCNT-DSPE-PEG-抗体の検出に用いた例を示す。この実施例の場合、暗電流の影響を抑制できるため、寒剤を使用せずにフェムトワットレベルの微弱光が検出可能である。
【0017】
実施例2.3波長による修飾異性体検出のための装置の作製
臨床検査に於いて、血清中に存在するタンパクの翻訳後修飾の程度を測定する事により、疾病の存在や進展の検出評価をして、治療方針を決定するための重要な情報を得ている。その例として1)糖化ヘモグロビンに代表される糖化タンパクの定量的検出、2)胎児性がん抗原(AFP)やMUC1などの疾患に関連して出現する特徴的な糖鎖構造で修飾された糖タンパクの定量的検出を挙げる事ができる。1)糖化タンパクは、グルコースの非酵素的な糖化反応の結果生じる物質で、a)ヘモグロビンAや水晶体クリスタリン等の細胞内タンパク、b)アルブミン、アポタンパク、トランスフェリン、ハプトグロビンなどの血漿タンパク、c)カテプシンや膵リボアーゼなどの酵素類、d)血管内皮や赤血球膜タンパク質などの膜タンパクの糖化物が、その例として知られている。糖化ヘモグロビンや糖化アルブミンの検出は、耐糖能異常や糖尿病の他、肝硬変などの検出評価および診断に有効である。2)疾患に関連した糖鎖で修飾されたタンパクとして例えば、a)AFPのフコシル化を検出するためLens culimaris agglutinin-A(LCA)を活用して行なわれるAFP-L3検査は精度の高い肝細胞がんの検査であるし、b)Wisteria floribunda agglutinin (WFA)が反応するMUC1の検出は、胆道系に由来するがんのスクリーニングに有効であるし、c)WFAの反応するM2BPの検出は、ウイルス性肝炎で進行する線維化の進行を評価するのに有効な検査であるし、d)α-1 acid glycoproteinにおけるAspergillus Oryzae I-fucose specific lectin(AOL)とRicinus Communis Agglutinin (RCA-I)の結合率から、肝臓で生じる線維化を評価する事が可能であるし、e)血液中のシアル化糖鎖MUC1の検出は、間質性肺炎を検出する指標となっている。
以上いずれのバイオマーカー検査も、特定のタンパクに生じる翻訳後の修飾をそれぞれ、定量的に検出測定した後、疾患に特徴的な翻訳後修飾が生じている割合を算出することで、疾患の進行度を評価しているものである。2ないし3項目の測定結果をもとに計算される理由は、一つの反応系で同時に、複数の修飾異性体タンパクを測定できないことが理由である。このような状況を鑑み、以下1)の実施例では、糖化血清アルブミンの直接検出を、2)では糖タンパクにおける糖鎖修飾について、同時検出を行なった。
1)糖化アルブミンの検出:
Dynabeads ProteinG のプロトコールに従って、PBSで5μg/mlに調整した抗ヒトアルブミン抗体200μlを、1.5mgのDynabeads ProteinGと10分間反応させて、抗体の結合したDynabeadsを調整した。
次に、糖化アルブミンを含む血液サンプル溶液500μlと室温で2時間反応させた後、抗体の結合したDynabeadsで抗原を回収した。よく洗浄した後、SWCNT-抗体ヒトアルブミン抗体100μgと、室温で2時間反応させたのち、PBSでよく洗浄した。Dynabeads に結合しているSWCNT-抗体ヒトアルブミン抗体に由来するSWCNTの近赤外発光を定量的に測定して、血清中のアルブミン量を定量する。また、アルブミンに対する糖化アルブミンの比率は、1000nm−1400nmで捉えられるアルブミンと糖化アルブミンに特徴的な光吸収を利用して算出する。
2)疾患に関連した糖鎖で修飾されたタンパクの検出:
Dynabeads ProteinG のプロトコールに従って、PBSで5μg/mlに調整した抗ヒトα-1 acid glycoprotein抗体(または、抗M2BP抗体、抗MUC1抗体)200μlを、1.5mgのDynabeads ProteinGと10分間反応させて、抗体の結合したDynabeadsを調整した。次に、血液サンプル溶液500μlと室温で2時間反応させた後、抗体の結合したDynabeadsで抗原を回収した。回収したDynabeadsを良く洗浄した後、Biotin化したWFAまたは、MAL-II、AOL、RCA-Iを室温で20分間反応させた。PBSで良く洗浄した後、SWCNT-付加ストレプトアビジンを反応させて、上記レクチンの結合状態を発光により測定した。このような方法では、サンプルに特段の前処理をする必要がないので、1つの生体サンプルについて、複数のレクチンの反応性を検出することが可能である。
例えば、α-1 acid glycoproteinにみられる異なる3種類の糖鎖修飾異性体を同時に検出するためにはまず、抗ヒトα-1 acid glycoprotein抗体を結合させたDynabeadsで血液等の検体から回収し、あらかじめそれぞれに反応させておいた励起波長の異なるSWCNT-付加ストレプトアビジンとビオチン化AOL, ビオチン化 MAL-II、ビオチン化RCA-Iを後に、同時に反応させることで、一度に3つの修飾異性体を定量評価することができる。
また、SWCNTを発光波長の異なる3種類に分離して用い、各々に検出すべき3種類の抗原に特異的な抗体を付加することにより得られた3種類のSWCNT−抗体を用いることで、3種類のタンパクに付いて検体中の存在量を決定することができる。抗ヒトα-1 acid glycoprotein抗体、抗M2BP抗体、抗MUC1抗体を結合させたDynabeadsでこれらに対する抗原を回収し、回収された抗原を検出するための検出抗体をそれぞれ、励起波長のことなるSWCNTによりラベルしておいて使用することで、同時に、3つの抗原量を定量評価することができる。
図7は、小型近赤外分光器を装着した全血分光蛍光装置の断面模式図である。SWCNT赤外蛍光標識を付加された全血サンプルに対して発光ダイオードにより間欠的に近赤外光を照射すると、SWCNTは、赤外波長帯域において、発光ダイオード光に同期して蛍光を発する。この蛍光を、ロウパスフィルターにより照明光波長成分を除去し、凹面グレーティングにより、近赤外光検出アレイに分光しつつ集光する。同図では、それぞれ分光波長帯域の異なる3系統の分光計測システムを配置し、同一サンプルにおいて、同時に3ヶの波長帯における蛍光および吸収を測定する。
【0018】
現在のバイオマーカーの検出は、シグナル検出に利用する光波長の制限があるため、臨床検査では通常、i)採血した全血から血球成分(赤血球や白血球、血小板)を除いた血漿、または、ii)血液を凝固させて血球成分と線維素を除いた血清をサンプルとして測定する。フィルター濾過により除去する方法も取り入れられているが、いずれの操作でもこれらの成分が除ききれない他、操作で生じる赤血球溶血によるヘモグロビンの混入がおこる。これらの生体由来物質混入は、疾患バイオマーカー検出評価で利用する発光(蛍光)を妨害吸収してしまい疾病検出感度を下げてしまう。同時に、血球成分が非特異的に発光し、プローブ発光検出の際にノイズの原因ともなる。こうした血球成分によるプローブ発光の妨害吸収や自家発光ノイズは、早期診断を目的とした疾患バイオマーカーの高感度検出を邪魔し、その実用化において非常に大きな障害となっている。
図8は、図7で示した装置により測定されたスペクトラムを、従来方法におけるスペクトラムと比較したものである。従来技術では、蛍光標識の発光波長は、高々800nmであるため、そのままではヘモグロビンの自家発光スペクトラムがバックグラウンド光として標識による蛍光を覆ってしまうので、まず、遠心分離器など大型の前処理装置により、赤血球を取り除く必要がある。また、蛍光標識の発光波長域が狭いので、通常1回の検出には1波長のみを使用するため、複数の抗原を検出するためには、それと同数の検体を用意する必要がある。
一方、本発明による蛍光検出装置では、ヘモグロビンによる発光帯よりも長波長における蛍光を高感度にて検出することができるため、サンプルは全血のままで解析装置に導入することができ、煩雑な前処理が不要であること、これにより遠心分離やフィルタリングの際の溶血などの影響が無いこと、その結果感度が数十倍向上すること、などの特徴がある。
また、肝機能、癌マーカーに加え、波長2μmまでの光の吸収を計測することにより、生活習慣病の監視に不可欠な血糖値の計測が安価に可能である。
さらにまた、可視、赤外の複数の発光帯で分光計測を行うことが可能であり、数種類の抗原をまとめて1つの反応ポットで検出を行うことができる。その結果、検体必要量が少ない、ランニングコストが安いなどの特徴がある。
図9は、小型分光器の代わりに、発光ダイオードとフィルターおよび単体の受光素子を3組配置した例を示す。この装置は、構造が簡単で安価であるため、診療所や個人病院における臨床検査に使用できる。
図10は、本発明で説明した検体分注、抗体添加、磁気ビーズ洗浄などの検体の処理を自動的に処理し、近赤外波長にて微弱蛍光を検出する装置の模式図を示す。比較的簡単な処理により、ヘモグロビンによる背景光を除去できる。
【技術分野】
【0001】
本発明は、近赤外領域で発光する標識プローブを用いる臨床検査技術に関する。
【背景技術】
【0002】
昨今の技術開発を背景として、各種疾患バイオマーカー探索が進められており、「がん」等の疾患の早期発見に役立つ可能性が高い候補分子が相次いで報告されている。産業技術総合研究所の糖鎖医工学研究センターでも、本発明者らの一人である池原らが糖鎖分析技術のアドバンテージを最大限に生かして、疾患の発生と進展に伴って出現する未完成品糖タンパク質(図1)(=糖鎖修飾異性体)を疾患バイオマーカーとする研究を進めて来た。未完成品の糖タンパク質などの疾病マーカーを検出することで、がんや生活習慣病を早期発見できる。
最近、池原らは、肝炎に伴って生じる線維化を測定できる未完成糖鎖バイオマーカーを発見し、侵襲性の高い生検に代わって血液検査での検出評価を可能とした。さらに、胃がんの腹腔内再発や、胆管がん、卵巣がんのように発見が極めて難しい腫瘍の存在や進展についても、評価できる未完成糖鎖バイオマーカーの発見に成功している。今後、同様のアプローチで開発を進めると、動脈硬化やアルツハイマー病の検査診断にも展開可能であると予想される。しかし、血液・体腔液・胆汁などに存在する疾患マーカー分子を検出することで、これらの疾病の超早期診断を達成するためには、現在の臨床検査で一般に利用される検出技術では、十分な感度を得ることは難しい。
【0003】
一般に血液・体腔液・胆汁等をサンプルとする臨床検査では、血球等の細胞成分(赤血球や白血球、血小板、中皮、脱落細胞)を遠心分離やフィルター濾過により除去する。しかし、いずれの操作でも除ききれないので、これら生体物質が少なからず混入する事となり、疾患バイオマーカー検出のために使うプローブ分子の光を妨害吸収してしまい疾病検出感度を下げてしまう。同時に、血球成分等の細胞や、体腔液や胆汁に含まれるタンパクが非特異的に発光し、プローブ発光検出の際にノイズの原因ともなる。こうした成分によるプローブ発光の妨害吸収や自家発光ノイズは、超早期診断を目的としたさまざまな疾患バイオマーカーの高感度検出を邪魔し、その実用化において非常に大きな障害となっている。
【先行技術文献】
【非特許文献】
【0004】
【非特許文献1】Journal of the American Chemical Society (2007) 5612-5620.
【非特許文献2】Analytical Chemistry (2009) Volume 81, 7885-7891.
【非特許文献3】Leeuw et al. Nano Lett. 2007,7(9),2650-4
【発明の概要】
【発明が解決しようとする課題】
【0005】
本発明は、血液・体腔液・胆汁などの生体由来物をサンプルとする臨床検査において、検出対象以外の血球や成分などの生体物質を予め取り除くことなく、そのままで、検出対象成分のみを高感度で検出可能な、検出方法を提供することを課題とする。
【課題を解決するための手段】
【0006】
本発明者らは、単層カーボンナノチューブ(SWCNT)などのナノカーボンが光励起により近赤外光を発光することに着目し、検出プローブをナノカーボンにより標識することにより、検出された対象が発する近赤外光を検出に利用することで、検出対象以外の血球成分などの生体物質をサンプルから予め取り除くことなく、そのままで、検出対象成分のみを高感度で検出することが可能であることを見出し、本発明を完成した。
【0007】
近赤外光は生体透過性が高いため、in vivoイメージングや腋窩リンパ節検査などの体内診断の高感度化をゴールに、技術開発が試みられている。血液や体腔液を対象として検索する臨床検査においても、近赤外光が利用可能となれば、高感度化と多種類の疾病マーカーの同時検出が可能となるが、実現していない。実現のためには、近赤外波長領域で効率良く発光するプローブが必要である。
SWCNTは、450−1350nmの光励起により700−2300nmで発光する(図2にその一部の波長範囲の発光マップを示す)。この波長範囲は、生体物質によって吸収されにくいあるいは自家発光の少ない波長範囲(波長600−1300nm)をふくむ 。SWCNTは、近赤外色素分子や近赤外量子ドットに比べて、10倍以上の光学的耐久性があり、化学修飾も可能である。つまり、SWCNTは近赤外発光プローブとしての優位性は比類なく、近赤外光を利用した次世代臨床検査の実現を可能にする強力な新規材料である。SWCNTの発光は2002年に発見され、これまで、生体内のSWCNTイメージングなども試みられた(非特許文献3)ものの、そのもっとも有力な応用である臨床検査への検討はこれまで全くなされていない。
【0008】
近赤外光の発光により、微量の検出対象を生体に由来する夾雑物が存在するサンプル中で検出するためには、また、微弱な近赤外光を検出する装置が必要とされる。
波長1000〜2000nmの近赤外光の検出には、通常シリコン電荷積分アンプに接続されたInGaAsフォトダイオードアレイを使用するが、室温付近においては、フォトダイオードの暗電流が大きくシリコンICで許容されるキャパシタンスでは、十分な積分時間が確保できない。この点は、フォトダイオードを液体窒素冷却することで解決可能であるが、価格や操作性の問題を鑑みると、臨床検査室での実用化は難しい。これに対して本発明者らの一人である小倉は、先に、極微弱光の計測が室温付近で可能となるよう、表面電流ブロック層を設けたヘテロバイポーラフォトトランジスタを開発した(PCT/JP2009/067689として特許出願中)。
この素子の特色として、内部増幅作用が大きいので(電流増幅率β〜数千)、外部電気回路によるノイズの影響を受けにくいこと、ベース領域に光励起キャリアの蓄積効果を持つため、電荷積分機能を内蔵していること、可視から赤外まで広い波長範囲に感度を有することなどが挙げられる。
更に、蛍光や透過スペクトラム計測の場合、光源を変調し、検出系を同期検波する(ロックイン 検波)ことにより暗電流成分を除去することが可能であるが、アレイ検出器に対しては、電子回路をIC化する必要があり、十分な対策が取られていない。
本発明者らは、フォトダイオードアレイのそれぞれの素子に、シリコンICによるロックインアンプアレイを接続することにより、室温アレイにおいてもフェムトワットレベルの微弱光検出を可能にした(上述のPCT/JP2009/067689)。
【0009】
すなわち、本発明は、近赤外光を高感度に検出できるシステム機器の基盤技術の存在のもと、近赤外光で発光するSWCNTなどのナノカーボンを標識基材として、目的物の検出に必要な抗体などのプローブを修飾することにより、従来の可視波長帯域に加えて、近赤外波長帯域における蛍光標識を用いた血液生化学検査の検体検査を可能とするものである。更に、検出波長帯域を2μmまで拡張することにより、赤血球中の糖化ヘモグロビンやグルコースの光吸収・透過特性による、HbA1c定量や血糖値計測も並行して行うことが可能となり、成人病の予防的な検診に大きく貢献する。
【0010】
本出願は、具体的には、以下の発明を提供する。
〈1〉ナノカーボン(単層カーボンナノチューブ、多層カーボンナノチューブ、カーボンナノホーン、ナノグラフェン、その他のナノカーボン)の特異な光学的性質(光吸収、発光、ラマン散乱光)を利用することを特徴とする、免疫測定方法あるいは臨床検査方法。
〈2〉波長450−1350nmの光励起により波長700−2300nmで発光する単層カーボンナノチューブ(SWCNT)あるいはナノグラフェンを発光標識として用いることを特徴とする、〈1〉に記載の免疫測定方法あるいは臨床検査方法。
〈3〉ナノカーボン(単層カーボンナノチューブ、多層カーボンナノチューブ、カーボンナノホーン、ナノグラフェン、その他のナノカーボン)を含有する発光標識物質。
〈4〉ナノカーボンが、波長450−1350nmの光励起により波長70−2300nmで発光する単層カーボンナノチューブ(SWCNT)あるいはナノグラフェンであることを特徴とする、〈3〉に記載の発光標識物質。
〈5〉特定の抗原を認識する抗体にナノカーボンを結合させて成り、抗原抗体反応をナノカーボンの蛍光、ラマン光、光吸収の計測により検出することを特徴とする、〈3〉または〈4〉に記載の発光標識物質。
〈6〉ストレプトアビジンおよびストレプトアビジンの関連分子にナノカーボンを結合させて成り、抗原に結合したビオチン化抗体とストレプトアビジンの反応物を、ナノカーボンの蛍光、ラマン光、光吸収の計測により検出することを特徴とする、〈3〉または〈4〉に記載の発光標識物質。
〈7〉Protein G, Protein Aなどのイムノグロブリン結合タンパクにナノカーボンを結合させて成り、抗原に結合した抗体を検出するため、抗体と抗体結合タンパクの結合反応をナノカーボンの蛍光、ラマン光、光吸収の計測により検出することを特徴とする、〈3〉または〈4〉に記載の発光標識物質。
〈8〉特定の抗原が、正常もしくは病的な状態になった際、血液や体腔液中に存在する各種の抗原(タンパクや糖鎖等の、がん関連抗原、疾患バイオマーカーを含む)であることを特徴とする、〈5〉に記載の発光標識物質。
〈9〉磁気ビーズ、セファロース、セファデックス等の担体に結合させた各種抗原に対する抗体をもちいてエンリッチしたサンプルについて、ナノカーボン標識抗体の結合後に、ナノカーボンの近赤外発光計測により抗原検出することを特徴とする、〈1〉または〈2〉に記載の免疫測定方法あるいは臨床検査方法。
〈10〉疾病マーカーである抗原をナノカーボン標識抗体にて標識し、電気泳動にて捕集した後に、ナノカーボンの近赤外発光計測により抗原検出することを特徴とする、〈1〉または〈2〉に記載の免疫測定方法あるいは臨床検査方法。
〈11〉単一検体において〈1〉〜〈10〉に記載の発光臨床検査法、あるいはこれと他の発光臨床検査法とを組み合わせて、異なった発光波長帯にて複数の抗原を検出することを特徴とする、免疫測定方法あるいは臨床検査方法。
〈12〉単一検体において、異なった発光波長帯における複数の抗原からの発光強度比を用いることを特徴とする、〈11〉に記載の免疫測定方法あるいは臨床検査方法。
〈13〉〈11〉または〈12〉の紫外、可視、近赤外、赤外発光計測において、単一あるいは複数の励起光を変調して、それに同期して近赤外発光を検出する臨床検査装置。
〈14〉酵素免疫測定法(ELISA)において二次抗体に用いられるペルオキシダーゼあるいはアルカリフォスファターゼに代えて、SWCNT標識抗体を二次抗体として用いることを特徴とする、免疫測定法。
〈15〉〈2〉に記載されたSWCNTの発光波長に加え、他の異なる発光波長における蛍光標識も併用して、複数の抗体反応を同一検体にて測定する計測方法。
【発明の効果】
【0011】
本発明により、近赤外光を発光するナノカーボンで検出対象を標識することによって、血液などの生体由来物をサンプルとする臨床検査において、検出対象以外の血球成分などの生体物質を予め取り除くことなく、そのままで、検出対象成分のみを高感度で検出することができる。
フローサイトメーターや共焦点レーザー顕微鏡では、利用できる波長域の拡大によって、得られる情報量が格段に増えてきた。本発明により、臨床検査機器も、今までの利用波長域400−500nm から、400−2300nmと近赤外領域にまで大幅に拡張することができ、得られる情報はさらに増加する。たとえば、異なる励起発光プローブを組み合わせる事で、1回のアッセイで同時に、数種類のバイオマーカーを検出評価できるようになる。本発明により、生体物質に対して透過性の高い近赤外光を使用することにより、生体由来の臨床サンプルを血清や血漿へと分離せずに検査ができるので、血球・血小板成分の分離操作によって失われていた情報を取得できるようになる。しかも、血清検査の際でも、混入した血球・血小板成分によるバイオマーカー由来のシグナル光吸収と非特異的ノイズが抑えられるので、微量バイオマーカーの検出が可能となり、がんやアルツハイマー病等の超早期発見・早期治療を可能とするなど、医学・医療の発展に大きく貢献できる。
本発明のSWCNTの近赤外発光を利用した臨床検査システムにより、世界ではじめて近赤外光を臨床検査へ持ち込むこととなり、診断薬・診断機器産業界に革命的な進歩をもたらす。
【図面の簡単な説明】
【0012】
【図1】完成された糖タンパク質と未完成品の比較模式図。
【図2】SWCNTの2次元発光マップ。
【図3】SWCNTを用いた疾病マーカー(未完成糖たんぱくなどの抗原)検出の概念図。
【図4】DSPE-PEGの分子構造。
【図5】NHS-DSPE-PEGの分子構造。
【図6】赤外抗体反応検出装置
【図7】小型近赤外分光器を装着した全血分光蛍光装置の断面模式図。
【図8】図7の装置による全血蛍光分析スペクトラムと従来法によるスペクトラムの比較図。
【図9】小型分光器に代えて発光ダイオードとフィルター及び受光素子を用いた装置の例。
【図10】本発明による検体の自動臨床検査装置の模式図。
【発明を実施するための形態】
【0013】
実施例1.SWCNTを用いた近赤外発光による抗原抗体反応の検出
1)本実施例では、卵白アルブミン(OVA)をモデル抗原として抗原抗体反応を行い、抗原抗体反応を近赤外発光で検出した。
まず、モデル抗原に対するモノクローナル抗体を準備し、ELISAプレートに固相化した。モデル抗原を含むサンプル溶液を固相化したプレート上で、室温において2時間反応させた後に上澄を捨て、リン酸バッファーやトリスバッファーで良く洗った。次いで、SWCNTで標識したモデル抗原に対するポリクローナル抗体プローブ(SWCNT-標識抗体)をリン酸バッファーやトリスバッファー中で、室温で2時間反応させた。プレートをリン酸バッファーやトリスバッファーで良く洗うことで、未反応のSWCNT-標識抗体を、洗浄除去し、プレート上に検出されるSWCNT由来の近赤外蛍光を検出することで、抗原抗体反応の検出を行なった。
2)ELISAプレートに固相化した抗体を用いる系のほかに、Protein Gビーズに抗体を結合させてバッチ処理で使用することも可能である。Protein Gビーズを用いた場合、ビーズに結合しているProtein Gと抗体のFc部との結合を介して、抗体はビーズに結合できる。抗体を固相化したビーズを、モデル抗原を含むサンプル溶液中で、室温において2時間反応させた後に上澄を捨て、リン酸バッファーやトリスバッファーで良く洗った。次いで、SWCNTで標識したモデル抗原に対するポリクローナル抗体プローブ(SWCNT-標識抗体)をリン酸バッファーやトリスバッファー中で、室温で2時間反応させた。ビーズをよく洗うことで、未反応のSWCNT-標識抗体を除去し、ビーズに検出されるSWCNT由来の近赤外蛍光を検出することで、抗原抗体反応の検出を行なった。
【0014】
これらの抗原抗体反応において使用するSWCNT-標識抗体の作製は、以下の手順で行った。
DSPE-PEGと抗体との結合
1)抗体125μgを50mMリン酸バッファー(pH7.2)6μlに溶かし、DSPE-PEG(図4参照、末端アミノ基)5μgを加え攪拌する。次に、WSC(1-ethyl-3-(3-dimethylaminopropyl)carbodiimide hydrochloride)触媒を8μg加え、4℃で10時間、スターラーで攪拌する。フィルターでろ過し、フィルター上に残った反応物をバッファーに溶かして回収する。
あるいは、
2)抗体125μgをNaHCO3緩衝液2.5μlに溶かす。純水5μgにNHS-PEG-DSPE(図5参照)を溶かし、抗体溶液に添加する。ボルテックスを用いて4℃、6時間で攪拌し、反応させる。反応溶液をゲル濾過にて精製し、回収する。
SWCNTの処理
まず、約1mgのカーボンナノチューブ(SWCNT)を約20mlの1重量%ドデシルベンゼンスルホン酸ナトリウム(SDBS)水溶液中に浸し、超音波破砕機によって分散させた。得られた分散液を171000gで2.5時間超遠心処理し、半透明な上澄み液(約10ml)を得た。
SWCNT-標識抗体プローブの作製
このSWCNT分散液の上澄み液1mlあたり、抗体を結合させた1mgのDSPE-PEGを加え、3分間バス型超音波洗浄機にかけ、抗体結合DSPE-PEGを完全に溶解させた。その後、分子量3500以下の分子を通過させる透析膜に入れ、5日間透析作業をおこなった。この透析作業によってSDBSを抗体結合DSPE-PEGに置き換えた。
【0015】
また、上記抗原抗体反応の詳細な手順は、以下のとおりである。
ELISAプレートでの反応系計測
PBSもしくは100mM Bicarbonate/carbonate coating bufferで20μg/mlに調整した抗OVA抗体溶液を50μl使用して、プレートを2時間室温でコートする。PBSでよく洗浄したのち、PBSに溶解した5%BSA溶液200μlをウエルに入れて、室温で30分間、ブロッキングする。PBSでよく洗浄した後、サンプルを加えて室温で2時間反応させたのち、PBSでよく洗浄する。次にPBS で20μg/mlに希釈したSWCNT-抗体プローブを室温で2時間反応させたのち、PBSでよく洗浄する。
プレートを乾かした後、発光を検出する。
磁気ビーズを用いたバッチ処理での反応系計測
Dynabeads ProteinG のプロトコールに従って、PBSで5μg/mlに調整した抗OVA抗体200μlを、1.5mgのDynabeads ProteinGと10分間反応させて、抗体の結合したDynabeadsを調整した。次に、モデル抗原を含むサンプル溶液500μlと室温で2時間反応させて、抗体の結合したDynabeadsで抗原を回収した。
つぎに、PBSでよく洗浄したのち、次にPBS で20μg/mlに希釈したSWCNT-抗体プローブ100μlと、室温で2時間反応させたのち、PBSでよく洗浄する。
Bufferを除いたのち、SWCNTの発光を検出する。
【0016】
また、標識プローブからの発光の検出は、以下のように行う。
磁気ビーズ-抗原-SWCNT-DSPE-PEG-抗体の検出
波長660nmの光照射により、SWCNTから波長1200nm前後の発光が観測できる。その近赤外発光スペクトルをInGaAs検出器を搭載した分光システムによって測定する。
更に、蛍光測定の場合、励起光を変調することが可能であることから、変調周期に対応して同期検波を行うロックインアンプ検出法を用いて微弱光の検出レベルを、暗電流相当レベル(数pW)からショットノイズ限界(〜数十fW)まで向上することが可能である。図6に、内部増幅作用を有するInGaAs近赤外フォトトランジスタアレイの各セルにロックインアンプおよびAD変換器を接続した高感度赤外光検出アレイモジュールを磁気ビーズ-抗原-SWCNT-DSPE-PEG-抗体の検出に用いた例を示す。この実施例の場合、暗電流の影響を抑制できるため、寒剤を使用せずにフェムトワットレベルの微弱光が検出可能である。
【0017】
実施例2.3波長による修飾異性体検出のための装置の作製
臨床検査に於いて、血清中に存在するタンパクの翻訳後修飾の程度を測定する事により、疾病の存在や進展の検出評価をして、治療方針を決定するための重要な情報を得ている。その例として1)糖化ヘモグロビンに代表される糖化タンパクの定量的検出、2)胎児性がん抗原(AFP)やMUC1などの疾患に関連して出現する特徴的な糖鎖構造で修飾された糖タンパクの定量的検出を挙げる事ができる。1)糖化タンパクは、グルコースの非酵素的な糖化反応の結果生じる物質で、a)ヘモグロビンAや水晶体クリスタリン等の細胞内タンパク、b)アルブミン、アポタンパク、トランスフェリン、ハプトグロビンなどの血漿タンパク、c)カテプシンや膵リボアーゼなどの酵素類、d)血管内皮や赤血球膜タンパク質などの膜タンパクの糖化物が、その例として知られている。糖化ヘモグロビンや糖化アルブミンの検出は、耐糖能異常や糖尿病の他、肝硬変などの検出評価および診断に有効である。2)疾患に関連した糖鎖で修飾されたタンパクとして例えば、a)AFPのフコシル化を検出するためLens culimaris agglutinin-A(LCA)を活用して行なわれるAFP-L3検査は精度の高い肝細胞がんの検査であるし、b)Wisteria floribunda agglutinin (WFA)が反応するMUC1の検出は、胆道系に由来するがんのスクリーニングに有効であるし、c)WFAの反応するM2BPの検出は、ウイルス性肝炎で進行する線維化の進行を評価するのに有効な検査であるし、d)α-1 acid glycoproteinにおけるAspergillus Oryzae I-fucose specific lectin(AOL)とRicinus Communis Agglutinin (RCA-I)の結合率から、肝臓で生じる線維化を評価する事が可能であるし、e)血液中のシアル化糖鎖MUC1の検出は、間質性肺炎を検出する指標となっている。
以上いずれのバイオマーカー検査も、特定のタンパクに生じる翻訳後の修飾をそれぞれ、定量的に検出測定した後、疾患に特徴的な翻訳後修飾が生じている割合を算出することで、疾患の進行度を評価しているものである。2ないし3項目の測定結果をもとに計算される理由は、一つの反応系で同時に、複数の修飾異性体タンパクを測定できないことが理由である。このような状況を鑑み、以下1)の実施例では、糖化血清アルブミンの直接検出を、2)では糖タンパクにおける糖鎖修飾について、同時検出を行なった。
1)糖化アルブミンの検出:
Dynabeads ProteinG のプロトコールに従って、PBSで5μg/mlに調整した抗ヒトアルブミン抗体200μlを、1.5mgのDynabeads ProteinGと10分間反応させて、抗体の結合したDynabeadsを調整した。
次に、糖化アルブミンを含む血液サンプル溶液500μlと室温で2時間反応させた後、抗体の結合したDynabeadsで抗原を回収した。よく洗浄した後、SWCNT-抗体ヒトアルブミン抗体100μgと、室温で2時間反応させたのち、PBSでよく洗浄した。Dynabeads に結合しているSWCNT-抗体ヒトアルブミン抗体に由来するSWCNTの近赤外発光を定量的に測定して、血清中のアルブミン量を定量する。また、アルブミンに対する糖化アルブミンの比率は、1000nm−1400nmで捉えられるアルブミンと糖化アルブミンに特徴的な光吸収を利用して算出する。
2)疾患に関連した糖鎖で修飾されたタンパクの検出:
Dynabeads ProteinG のプロトコールに従って、PBSで5μg/mlに調整した抗ヒトα-1 acid glycoprotein抗体(または、抗M2BP抗体、抗MUC1抗体)200μlを、1.5mgのDynabeads ProteinGと10分間反応させて、抗体の結合したDynabeadsを調整した。次に、血液サンプル溶液500μlと室温で2時間反応させた後、抗体の結合したDynabeadsで抗原を回収した。回収したDynabeadsを良く洗浄した後、Biotin化したWFAまたは、MAL-II、AOL、RCA-Iを室温で20分間反応させた。PBSで良く洗浄した後、SWCNT-付加ストレプトアビジンを反応させて、上記レクチンの結合状態を発光により測定した。このような方法では、サンプルに特段の前処理をする必要がないので、1つの生体サンプルについて、複数のレクチンの反応性を検出することが可能である。
例えば、α-1 acid glycoproteinにみられる異なる3種類の糖鎖修飾異性体を同時に検出するためにはまず、抗ヒトα-1 acid glycoprotein抗体を結合させたDynabeadsで血液等の検体から回収し、あらかじめそれぞれに反応させておいた励起波長の異なるSWCNT-付加ストレプトアビジンとビオチン化AOL, ビオチン化 MAL-II、ビオチン化RCA-Iを後に、同時に反応させることで、一度に3つの修飾異性体を定量評価することができる。
また、SWCNTを発光波長の異なる3種類に分離して用い、各々に検出すべき3種類の抗原に特異的な抗体を付加することにより得られた3種類のSWCNT−抗体を用いることで、3種類のタンパクに付いて検体中の存在量を決定することができる。抗ヒトα-1 acid glycoprotein抗体、抗M2BP抗体、抗MUC1抗体を結合させたDynabeadsでこれらに対する抗原を回収し、回収された抗原を検出するための検出抗体をそれぞれ、励起波長のことなるSWCNTによりラベルしておいて使用することで、同時に、3つの抗原量を定量評価することができる。
図7は、小型近赤外分光器を装着した全血分光蛍光装置の断面模式図である。SWCNT赤外蛍光標識を付加された全血サンプルに対して発光ダイオードにより間欠的に近赤外光を照射すると、SWCNTは、赤外波長帯域において、発光ダイオード光に同期して蛍光を発する。この蛍光を、ロウパスフィルターにより照明光波長成分を除去し、凹面グレーティングにより、近赤外光検出アレイに分光しつつ集光する。同図では、それぞれ分光波長帯域の異なる3系統の分光計測システムを配置し、同一サンプルにおいて、同時に3ヶの波長帯における蛍光および吸収を測定する。
【0018】
現在のバイオマーカーの検出は、シグナル検出に利用する光波長の制限があるため、臨床検査では通常、i)採血した全血から血球成分(赤血球や白血球、血小板)を除いた血漿、または、ii)血液を凝固させて血球成分と線維素を除いた血清をサンプルとして測定する。フィルター濾過により除去する方法も取り入れられているが、いずれの操作でもこれらの成分が除ききれない他、操作で生じる赤血球溶血によるヘモグロビンの混入がおこる。これらの生体由来物質混入は、疾患バイオマーカー検出評価で利用する発光(蛍光)を妨害吸収してしまい疾病検出感度を下げてしまう。同時に、血球成分が非特異的に発光し、プローブ発光検出の際にノイズの原因ともなる。こうした血球成分によるプローブ発光の妨害吸収や自家発光ノイズは、早期診断を目的とした疾患バイオマーカーの高感度検出を邪魔し、その実用化において非常に大きな障害となっている。
図8は、図7で示した装置により測定されたスペクトラムを、従来方法におけるスペクトラムと比較したものである。従来技術では、蛍光標識の発光波長は、高々800nmであるため、そのままではヘモグロビンの自家発光スペクトラムがバックグラウンド光として標識による蛍光を覆ってしまうので、まず、遠心分離器など大型の前処理装置により、赤血球を取り除く必要がある。また、蛍光標識の発光波長域が狭いので、通常1回の検出には1波長のみを使用するため、複数の抗原を検出するためには、それと同数の検体を用意する必要がある。
一方、本発明による蛍光検出装置では、ヘモグロビンによる発光帯よりも長波長における蛍光を高感度にて検出することができるため、サンプルは全血のままで解析装置に導入することができ、煩雑な前処理が不要であること、これにより遠心分離やフィルタリングの際の溶血などの影響が無いこと、その結果感度が数十倍向上すること、などの特徴がある。
また、肝機能、癌マーカーに加え、波長2μmまでの光の吸収を計測することにより、生活習慣病の監視に不可欠な血糖値の計測が安価に可能である。
さらにまた、可視、赤外の複数の発光帯で分光計測を行うことが可能であり、数種類の抗原をまとめて1つの反応ポットで検出を行うことができる。その結果、検体必要量が少ない、ランニングコストが安いなどの特徴がある。
図9は、小型分光器の代わりに、発光ダイオードとフィルターおよび単体の受光素子を3組配置した例を示す。この装置は、構造が簡単で安価であるため、診療所や個人病院における臨床検査に使用できる。
図10は、本発明で説明した検体分注、抗体添加、磁気ビーズ洗浄などの検体の処理を自動的に処理し、近赤外波長にて微弱蛍光を検出する装置の模式図を示す。比較的簡単な処理により、ヘモグロビンによる背景光を除去できる。
【特許請求の範囲】
【請求項1】
ナノカーボン(単層カーボンナノチューブ、多層カーボンナノチューブ、カーボンナノホーン、ナノグラフェン、その他のナノカーボン)の特異な光学的性質(光吸収、発光、ラマン散乱光)を利用することを特徴とする、免疫測定方法あるいは臨床検査方法。
【請求項2】
波長450−1350nmの光励起により波長700−2300nmで発光する単層カーボンナノチューブ(SWCNT)あるいはナノグラフェンを発光標識として用いることを特徴とする、請求項1に記載の免疫測定方法あるいは臨床検査方法。
【請求項3】
ナノカーボン(単層カーボンナノチューブ、多層カーボンナノチューブ、カーボンナノホーン、ナノグラフェン、その他のナノカーボン)を含有する発光標識物質。
【請求項4】
ナノカーボンが、波長450−1350nmの光励起により波長700−2300nmで発光する単層カーボンナノチューブ(SWCNT)あるいはナノグラフェンであることを特徴とする、請求項3に記載の発光標識物質。
【請求項5】
特定の抗原を認識する抗体にナノカーボンを結合させて成り、抗原抗体反応をナノカーボンの蛍光、ラマン光、光吸収の計測により検出することを特徴とする、請求項3または4に記載の発光標識物質。
【請求項6】
ストレプトアビジンおよびストレプトアビジンの関連分子にナノカーボンを結合させて成り、抗原に結合したビオチン化抗体とストレプトアビジンの反応物を、ナノカーボンの蛍光、ラマン光、光吸収の計測により検出することを特徴とする、請求項3または4に記載の発光標識物質。
【請求項7】
Protein G, Protein Aなどのイムノグロブリン結合タンパクにナノカーボンを結合させて成り、抗原に結合した抗体を検出するため、抗体と抗体結合タンパクの結合反応をナノカーボンの蛍光、ラマン光、光吸収の計測により検出することを特徴とする、請求項3または4に記載の発光標識物質。
【請求項8】
特定の抗原が、正常もしくは病的な状態になった際、血液や体腔液中に存在する各種の抗原(タンパクや糖鎖等の、がん関連抗原、疾患バイオマーカーを含む)であることを特徴とする、請求項5に記載の発光標識物質。
【請求項9】
磁気ビーズ、セファロース、セファデックス等の担体に結合させた各種抗原に対する抗体をもちいてエンリッチしたサンプルについて、ナノカーボン標識抗体の結合後に、ナノカーボンの近赤外発光計測により抗原検出することを特徴とする、請求項1または2に記載の免疫測定方法あるいは臨床検査方法。
【請求項10】
疾病マーカーである抗原をナノカーボン標識抗体にて標識し、電気泳動にて捕集した後に、ナノカーボンの近赤外発光計測により抗原検出することを特徴とする、請求項1または2に記載の免疫測定方法あるいは臨床検査方法。
【請求項11】
単一検体において請求項1〜10に記載の発光臨床検査法、あるいはこれと他の発光臨床検査法とを組み合わせて、異なった発光波長帯にて複数の抗原を検出することを特徴とする、免疫測定方法あるいは臨床検査方法。
【請求項12】
単一検体において、異なった発光波長帯における複数の抗原からの発光強度比を用いることを特徴とする、請求項11に記載の免疫測定方法あるいは臨床検査方法。
【請求項13】
請求項11または12の紫外、可視、近赤外、赤外発光計測において、単一あるいは複数の励起光を変調して、それに同期して近赤外発光を検出する臨床検査装置。
【請求項14】
酵素免疫測定法(ELISA)において二次抗体に用いられるペルオキシダーゼあるいはアルカリフォスファターゼに代えて、SWCNT標識抗体を二次抗体として用いることを特徴とする、免疫測定法。
【請求項15】
請求項2に記載されたSWCNTの発光波長に加え、他の異なる発光波長における蛍光標識も併用して、複数の抗体反応を同一検体にて測定する計測方法。
【請求項1】
ナノカーボン(単層カーボンナノチューブ、多層カーボンナノチューブ、カーボンナノホーン、ナノグラフェン、その他のナノカーボン)の特異な光学的性質(光吸収、発光、ラマン散乱光)を利用することを特徴とする、免疫測定方法あるいは臨床検査方法。
【請求項2】
波長450−1350nmの光励起により波長700−2300nmで発光する単層カーボンナノチューブ(SWCNT)あるいはナノグラフェンを発光標識として用いることを特徴とする、請求項1に記載の免疫測定方法あるいは臨床検査方法。
【請求項3】
ナノカーボン(単層カーボンナノチューブ、多層カーボンナノチューブ、カーボンナノホーン、ナノグラフェン、その他のナノカーボン)を含有する発光標識物質。
【請求項4】
ナノカーボンが、波長450−1350nmの光励起により波長700−2300nmで発光する単層カーボンナノチューブ(SWCNT)あるいはナノグラフェンであることを特徴とする、請求項3に記載の発光標識物質。
【請求項5】
特定の抗原を認識する抗体にナノカーボンを結合させて成り、抗原抗体反応をナノカーボンの蛍光、ラマン光、光吸収の計測により検出することを特徴とする、請求項3または4に記載の発光標識物質。
【請求項6】
ストレプトアビジンおよびストレプトアビジンの関連分子にナノカーボンを結合させて成り、抗原に結合したビオチン化抗体とストレプトアビジンの反応物を、ナノカーボンの蛍光、ラマン光、光吸収の計測により検出することを特徴とする、請求項3または4に記載の発光標識物質。
【請求項7】
Protein G, Protein Aなどのイムノグロブリン結合タンパクにナノカーボンを結合させて成り、抗原に結合した抗体を検出するため、抗体と抗体結合タンパクの結合反応をナノカーボンの蛍光、ラマン光、光吸収の計測により検出することを特徴とする、請求項3または4に記載の発光標識物質。
【請求項8】
特定の抗原が、正常もしくは病的な状態になった際、血液や体腔液中に存在する各種の抗原(タンパクや糖鎖等の、がん関連抗原、疾患バイオマーカーを含む)であることを特徴とする、請求項5に記載の発光標識物質。
【請求項9】
磁気ビーズ、セファロース、セファデックス等の担体に結合させた各種抗原に対する抗体をもちいてエンリッチしたサンプルについて、ナノカーボン標識抗体の結合後に、ナノカーボンの近赤外発光計測により抗原検出することを特徴とする、請求項1または2に記載の免疫測定方法あるいは臨床検査方法。
【請求項10】
疾病マーカーである抗原をナノカーボン標識抗体にて標識し、電気泳動にて捕集した後に、ナノカーボンの近赤外発光計測により抗原検出することを特徴とする、請求項1または2に記載の免疫測定方法あるいは臨床検査方法。
【請求項11】
単一検体において請求項1〜10に記載の発光臨床検査法、あるいはこれと他の発光臨床検査法とを組み合わせて、異なった発光波長帯にて複数の抗原を検出することを特徴とする、免疫測定方法あるいは臨床検査方法。
【請求項12】
単一検体において、異なった発光波長帯における複数の抗原からの発光強度比を用いることを特徴とする、請求項11に記載の免疫測定方法あるいは臨床検査方法。
【請求項13】
請求項11または12の紫外、可視、近赤外、赤外発光計測において、単一あるいは複数の励起光を変調して、それに同期して近赤外発光を検出する臨床検査装置。
【請求項14】
酵素免疫測定法(ELISA)において二次抗体に用いられるペルオキシダーゼあるいはアルカリフォスファターゼに代えて、SWCNT標識抗体を二次抗体として用いることを特徴とする、免疫測定法。
【請求項15】
請求項2に記載されたSWCNTの発光波長に加え、他の異なる発光波長における蛍光標識も併用して、複数の抗体反応を同一検体にて測定する計測方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【公開番号】特開2012−247188(P2012−247188A)
【公開日】平成24年12月13日(2012.12.13)
【国際特許分類】
【出願番号】特願2011−106564(P2011−106564)
【出願日】平成23年5月11日(2011.5.11)
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【Fターム(参考)】
【公開日】平成24年12月13日(2012.12.13)
【国際特許分類】
【出願日】平成23年5月11日(2011.5.11)
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【Fターム(参考)】
[ Back to top ]

