ナノ粒子を利用した遺伝子発現調節法
【課題】効率のよく細胞ないし生体を近赤外光を用いて加熱すること。
【解決手段】カーボンナノホーン(CNH)に血清アルブミンが結合した複合体。
【解決手段】カーボンナノホーン(CNH)に血清アルブミンが結合した複合体。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、近赤外光の照射により発熱されるカーボンナノホーンの複合体、該複合体から構成される光発熱体、該複合体の近赤外光による発熱のための使用、細胞又は生体の加熱方法及び遺伝子発現調節法に関する。
【背景技術】
【0002】
新しい細胞機能制御技術の開発は、革新的な細胞療法や再生医療を確立するうえで必要不可欠な技術の一つといえる。従来の細胞機能制御技術として、これまで紫外線や赤外線レーザーを、生物個体の局所領域(特定の細胞)に選択的に照射し、部位特異的遺伝子発現を引き起こさせることを特徴とする局所的遺伝子発現調節法が報告されている(特許文献1)。また、光活性化イオンチャネルであるチャネルロドプシン2またはハロロドプシンを特定領域の細胞(脳や心臓)に遺伝子工学的手法を用いて強制発現させた後、これらの細胞群に紫外線レーザーを照射することにより、標的とする細胞を興奮または抑制させる方法が知られている(非特許文献1)。しかしながら、紫外線レーザーは光毒性が高いため、細胞の損傷が避けられないことが問題となっている。とりわけ、生体透過性の低さの問題から、レーザーを直接体内に接続する必要があり、この結果、例えば、頭蓋骨に穴を開けるといった手技の熟練度に依存するなど煩雑な操作はもちろんのこと、このような手術自体、動物の苦痛度レベルは極めて高いことは明白である。
【0003】
また、光毒性が比較的低い赤外線レーザーが使用されることもあるが、赤外線レーザーと熱ショックプロモーターを利用した系に関しては、生体透過性が低く、有意な細胞機能制御を実現するために高いレーザー強度が必要であり、その加熱効率も低い。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特許第4380857号
【非特許文献】
【0005】
【非特許文献1】Wu YI et al., Nature, 104-108 (2009). T. Bruegmann et al., Nature Methods, 7, 897-900 (2010).
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明は、効率よく短時間で細胞ないし生体の一部を加熱し、細胞ないし生体を傷害することなく特定の遺伝子の発現を制御する技術を提供することを目的とする。
【課題を解決するための手段】
【0007】
本発明者らは、驚くべきことに、カーボンナノホーン(CNH)と血清アルブミンの複合体に近赤外光を吸収させて熱源とすれば、高効率で細胞ないし生体を加熱できることを見出し本発明を完成させるに至った。
【0008】
すなわち、本発明は以下の複合体、該複合体から構成される光発熱体、該複合体の近赤外光による発熱のための使用、細胞又は生体の加熱方法及び遺伝子発現調節法を提供するものである。
項1. カーボンナノホーン(CNH)に血清アルブミンが結合した複合体。
項2. 前記血清アルブミンがウシ血清アルブミンである、項1に記載の複合体。
項3. 項1又は2に記載の複合体から構成される、近赤外光により発熱される光発熱体。
項4. 項1又は2に記載の複合体の近赤外光により細胞又は生体の一部を発熱するための使用。
項5. 項3に記載の発熱体を細胞内又は生体内に埋め込み、近赤外光を照射することを特徴とする、細胞または生体の加熱方法。
項6. 発熱により遺伝子発現が調節可能な外来遺伝子を導入した生体もしくは細胞に項1又は2に記載の複合体を導入し、前記複合体に近赤外光を照射することを特徴とする、遺伝子発現調節法。
【発明の効果】
【0009】
本発明は、生体透過性の高い近赤外レーザーを利用するため煩雑な手術も必要なく、透明な生物個体に限定されることなく、不透明な身体を有する多様な生物種に活用可能となる。実際、補本発明のシステムによって、マウスの体内で細胞の遺伝子発現が可能であることを実証した。また、本発明は、カーボンナノホーン(CNH)の強力な光発熱特性を利用するため細胞の温度を10℃上昇させるのに必要なレーザー光の強度は集光領域でわずか〜8mW程度であり、これまでのおよそ13倍もの効率で加熱とそれに伴う遺伝子発現が可能である。さらに、本発明は、カーボンナノチューブ(CNT)に比較して生体毒性の低いCNHを利用している点でも優れている。
【0010】
CNH複合体は、細胞毒性、生体毒性が非常に低く、生体に適用する材料として優れている。
【図面の簡単な説明】
【0011】
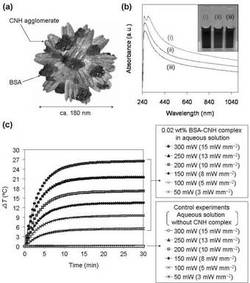
【図1】CNH複合体の光吸収特性と光発熱特性(a) BSA-CNH複合体の概念図 CNH表面を牛血清アルブミン(BSA)によって非共有結合的に修飾することで塩の入った水溶液中に均一分散化することができる。粒径は各種解析結果から180 nm程度と見積もった。(b) 各種水溶液中でのBSA-CNH複合体のUV-Vis-NIRスペクトルとデジカメ写真(i) DMEM培地、(ii) PBS緩衝液(pH 7.3)、(iii) 0.3%人工海水CNH濃度: 0.01 wt% BSAで修飾したCNH複合体は、水溶液中に均一に分散化可能であるため、CNH特有の光吸収スペクトルを確認できた。つまり、CNHは幅広い波長の光を吸収する特性がある。(c) BSA-CNH複合体溶液の各レーザー出力(50〜300 mW)に対する光発熱挙動(温度差測定)CNH濃度: 0.01 wt%、溶媒: 0.3%人工海水 系内にCNHが存在する場合でのみ各レーザー出力に対応した温度上昇が見られた。
【図2】BSA-CNH複合体を利用した細胞遺伝子発現制御(a) 各種細胞の蛍光タンパク質発現挙動(i) マウス繊維芽細胞(NIH/3T3):緑色蛍光タンパク質(GFP)(ii) マウス大腸癌細胞(colon-26):緑色蛍光タンパク質(GFP)(iii) ラットグリオーマ細胞(C6):赤色蛍光タンパク質(DsRed) CNHの光発熱特性と細胞内ヒートショックプロモーターを利用した各種蛍光タンパク質の発現ができた。(b) CNH複合体の光発熱特性を利用したNIH/3T3による発光タンパク質(ルシフェラーゼ)発現挙動 100 mWのレーザー出力のときにルシフェラーゼの発現を確認することができた。(c) CNH複合体の光発熱特性を利用したトランスジェニック(Tg)メダカ胚体内での蛍光タンパク質Venus発現挙動(i) レーザー照射前、(ii) 50 mW、(iii) 100 mW、(iv) 150 mW 各レーザー出力に対応したVenus発現挙動を観察することができた。レーザー出力が150 mWのとき溶液が42℃になり、この温度はTgメダカの遺伝子発現の最適温度である。従って、その温度になるにつれて発現されるVenusの蛍光量が増加することが分かった。(d) CNH複合体の光発熱特性を利用したメダカ幼生体内での蛍光タンパク質Venus発現挙動レーザー出力:150 mW CNH複合体の光発熱特性を利用することで、胚のみならず幼生の状態においてもVenusの発現を行うことができた。
【図3】CNHの光発熱特性を利用したマウス体内における細胞遺伝子発現制御(a) 概念図(b) BSA-CNH複合体を背部に接種したBALB/cSlc-nu/nuヌードマウスのデジカメ写真生理食塩水に分散化したBSA-CNH溶液を写真の(i)と(ii)の両方の部位に投与(左)、拡大写真(右)(i) レーザー未照射、(ii) レーザー照射(c) レーザー照射時のBALB/cSlc-nu/nuのデジカメ写真(d) サーモグラフィカメラによるレーザー照射に伴うBSA-CNH複合体投与部位の発熱挙動 レーザー照射によってBSA-CNH複合体投与部位がピンポイントで、およそ35℃から42℃に温度上昇することが分かった。
【図4】CNHの光発熱特性を利用したマウス体内のNIH/3T3のルシフェラーゼ発現挙動(i) 設定加熱温度:42℃、(ii) 設定加熱温度:39℃、(iii) 設定加熱温度:45℃ 設定加熱温度が42℃のとき最大のルシフェラーゼ発現挙動を示すことが分かった。in vitroのみならずin vivoにおいても設定加熱温度に対応した遺伝子発現制御が可能であることが明らかとなった。
【図5】BSA-CNH複合体の構造キャラクタリゼーションと光熱安定性(a) 原子間力顕微鏡(AFM)観察 比較的孤立分散したBSA-CNH複合体の像が観察できる。サイズも200 nm前後であることが分かった。(b) 動的光散乱(DLS) シャープなピークを呈していることから合成したBSA-CNH複合体は単分散であることが分かった。また、そのときの粒径は180 nmであることがわかり、この値はAFMとほぼ一致することが明らかとなった。(c) BSA-CNH複合体の光熱安定性 300 mWという比較的高強度なレーザー出力で照射しても凝集物等は観察されなかった。従って、合成したBSA-CNH複合体は比較的光熱安定性が高いといえる。
【図6】BSA-CNH複合体の細胞毒性評価(a) 細胞生存率(ミトコンドリア活性)に対するCNHの影響(WST-1アッセイ) CNH培地分散液を細胞に投与し、6時間後および24時間後にWST-1法により、ミトコンドリア活性を指標として細胞生存率を測定した。この結果、高濃度CNH溶液に曝露しても、いずれの細胞も細胞生存率は80%以上であることが分かった。(b) 細胞性属率に対するCNHの影響(Annexin V/PI二重染色)CNHを各細胞に投与し、24時間後にAnnexin V/PI二重染色を行い、フローサイトメーターにより細胞死を測定した。測定は10000個の細胞について行った。Annexin V陽性をアポトーシス細胞、PI陽性をネクローシスと判定した。 CNH投与細胞についてAnnexin V/PI二重染色を行い、フローサイトメーターで細胞死形態(アポトーシス/ネクローシス)を測定した。アポトーシス細胞では、細胞表面にAnnexin V結合性のホスファチジルセリンが露出するため、Annexin V陽性となる一方、ネクローシス細胞(アポトーシスからの二次的なネクローシスも含む)では細胞膜の透過性が変化しPI(ヨウ化プロピジウム)染色陽性となることから、細胞死形態の判定を行うことができる。Annexin V/PI二重染色の結果、いずれの細胞においてもCNH投与によって大部分の細胞が通常形態で生存していることが分かった。 (c) CNH投与細胞のカスパーゼ-3活性CNHを各細胞に投与し、6時間後、24時間後にカスパーゼ-3活性を測定した。値は、非投与細胞に対する相対値。 アポトーシスマーカーであるカスパーゼ-3活性を測定したが、CNH添加による各細胞のカスパーゼ-3の活性化も見られなかった。
【図7】Alexa488標識BSA-CNH複合体のNIH/3T3(マウス繊維芽細胞)の細胞内動態挙動(a) 5%CO2インキュベータ内(37℃)で24時間インキュベート(b) 冷蔵庫内(4℃)で24時間インキュベート(c) 5%CO2インキュベータ内(37℃)で6時間インキュベート(d) 冷蔵庫内(4℃)で6時間インキュベート BSA-CNH複合体は細胞のエンドサイトーシスにより細胞内に取り込まれることが分かった。
【図8】Alexa488標識BSA-CNH複合体のcolon-26(マウス大腸癌細胞)の細胞内動態挙動(a) 5%CO2インキュベータ内(37℃)で24時間インキュベート(b) 冷蔵庫内(4℃)で24時間インキュベート(c) 5%CO2インキュベータ内(37℃)で6時間インキュベート(d) 冷蔵庫内(4℃)で6時間インキュベート BSA-CNH複合体は細胞のエンドサイトーシスにより細胞内に取り込まれることが分かった。
【図9】Alexa488標識BSA-CNH複合体のC6(ラットグリオーマ細胞)の細胞内動態挙動(a) 5%CO2インキュベータ内(37℃)で24時間インキュベート(b) 冷蔵庫内(4℃)で24時間インキュベート(c) 5%CO2インキュベータ内(37℃)で6時間インキュベート(d) 冷蔵庫内(4℃)で6時間インキュベート BSA-CNH複合体は細胞のエンドサイトーシスにより細胞内に取り込まれることが分かった。
【図10】各種BSA-CNT複合体の細胞毒性評価 CNT培地分散液を細胞に投与し、24時間後にWST-1法により、ミトコンドリア活性を指標として細胞生存率を測定した。この結果、CNT溶液に曝露すると、いずれの細胞も細胞生存率が劇的に低下することが明らかとなった。
【図11】各種BSA-ナノカーボン複合体の水中分散特性と光発熱特性評価(a) 各種BSA-ナノカーボン複合体の超音波処理後24時間後の分散溶液のデジカメ写真(溶媒:PBS緩衝液)ナノカーボン濃度:100 mg/mL(i) CNH、(ii) Hipco SWNT、(iii) CoMoCAT SWNT、(iv) MWNT(b) 各種BSA-ナノカーボン複合体の遠心分離後のデジカメ写真(i) CNH、(ii) Hipco SWNT、(iii) CoMoCAT SWNT、(iv) MWNT(c) 各種BSA-ナノカーボン複合体の分散性が光発熱特性に与える影響レーザー波長:785 nm、レーザー出力:300 mW、レーザー照射時間:5 min BSA-CNH複合体は、超音波処理後24時間インキュベートしても凝集物一つなく、安定に分散している。一方、各種BSA-CNT複合体は、超音波処理後24時間インキュベートすると容器底面に凝集物が堆積しているが、ある程度の分散性を有していることがわかった。しかし、遠心分離を施すとBSA-CNH複合体が安定な黒色分散液を与えるのに対し、各種BSA-CNT複合体は、マイクロチューブ底面に大きな沈殿物を形成することが明らかとなった。これらの結果は、BSA-CNH複合体の方が、各種BSA-CNT複合体に比較して安定な分散性を有していることを示している。また、ナノカーボンの分散性が光発熱性能に与える影響を調べた。この結果、BSA-CNH複合体を用いたとき、最も高い温度差が得られることがわかった。
【図12】NIH/3T3のGFP発現における最適温度条件探索(a) 37℃(a-1) 接着系、倍率4倍、(a-2) 接着系、倍率10倍、(a-3) 浮遊系、倍率4倍、(a-4) 浮遊系、倍率10倍(b) 40℃(b-1) 接着系、倍率4倍、(b2) 接着系、倍率10倍、(b-3) 浮遊系、倍率4倍、(b-4) 浮遊系、倍率10倍(c) 42℃(c-1) 接着系、倍率4倍、(c-2) 接着系、倍率10倍、(c-3) 浮遊系、倍率4倍、(c-4) 浮遊系、倍率10倍(d) 45℃(d-1) 接着系、倍率4倍、(d-2) 接着系、倍率10倍、(d-3) 浮遊系、倍率4倍、(d-4) 浮遊系、倍率10倍(e) 50℃(e-1) 接着系、倍率4倍、(e-2) 接着系、倍率10倍、(e-3) 浮遊系、倍率4倍、(e-4) 浮遊系、倍率10倍 蛍光顕微鏡観察の結果から、NIH/3T3によるGFP発現の最適温度は42℃であることが分かった。また、45℃以上のインキュベートによって細胞の大量死が起こることが分かった。(f) NIH/3T3のルシフェラーゼ発現における最適温度条件探索NIH/3T3のルシフェラーゼ発現は37℃ではほとんど起こらないが、42℃で有意に起こることが分かった。
【図13】colon-26のGFP発現における最適温度条件探索(a) 37℃(a-1) 接着系、倍率4倍、(a-2) 接着系、倍率10倍、(a-3) 浮遊系、倍率4倍、(a-4) 浮遊系、倍率10倍(b) 40℃(b-1) 接着系、倍率4倍、(b2) 接着系、倍率10倍、(b-3) 浮遊系、倍率4倍、(b-4) 浮遊系、倍率10倍(c) 42℃(c-1) 接着系、倍率4倍、(c-2) 接着系、倍率10倍、(c-3) 浮遊系、倍率4倍、(c-4) 浮遊系、倍率10倍(d) 45℃(d-1) 接着系、倍率4倍、(d-2) 接着系、倍率10倍、(d-3) 浮遊系、倍率4倍、(d-4) 浮遊系、倍率10倍(e) 50℃(e-1) 接着系、倍率4倍、(e-2) 接着系、倍率10倍、(e-3) 浮遊系、倍率4倍、(e-4) 浮遊系、倍率10倍 蛍光顕微鏡観察の結果から、colon-26によるGFP発現の最適温度は42℃であることが分かった。また、45℃以上のインキュベートによって細胞の大量死が起こることが分かった。
【図14】C6のDsRed発現における最適温度条件探索(a) 37℃(a-1) 接着系、倍率4倍、(a-2) 接着系、倍率10倍、(a-3) 浮遊系、倍率4倍、(a-4) 浮遊系、倍率10倍(b) 40℃(b-1) 接着系、倍率4倍、(b2) 接着系、倍率10倍、(b-3) 浮遊系、倍率4倍、(b-4) 浮遊系、倍率10倍(c) 42℃(c-1) 接着系、倍率4倍、(c-2) 接着系、倍率10倍、(c-3) 浮遊系、倍率4倍、(c-4) 浮遊系、倍率10倍(d) 45℃(d-1) 接着系、倍率4倍、(d-2) 接着系、倍率10倍、(d-3) 浮遊系、倍率4倍、(d-4) 浮遊系、倍率10倍(e) 50℃(e-1) 接着系、倍率4倍、(e-2) 接着系、倍率10倍、(e-3) 浮遊系、倍率4倍、(e-4) 浮遊系、倍率10倍 蛍光顕微鏡観察の結果から、C6によるDsRed発現の最適温度は42℃であることが分かった。また、45℃以上のインキュベートによって細胞の大量死が起こることが分かった。
【図15】BSA-CNH複合体の光発熱特性を利用したNIH/3T3遺伝子発現制御(a) 概念図(b) BSA-CNH複合体の光発熱特性を利用したNIH/3T3のGFP発現挙動A: CNH +. Laser + (300 mW), B: CNH +, Laser + (150 mW), C: CNH +, Laser + (100 mW),D: CNH -, Laser + (300 mW), E: CNH -, Laser -, F: CNH +, Laser -(c) (b)の実験の数値・グラフ化 150 mWのレーザーを照射したとき、最大のGFP発現が起こることが分かった。
【図16】BSA-CNH複合体の光発熱特性を利用したcolon-26遺伝子発現制御(a) 概念図(b) BSA-CNH複合体の光発熱特性を利用したcolon-26のGFP発現挙動A: CNH +. Laser + (160 mW), B: CNH +, Laser + (170 mW), C: CNH +, Laser + (180 mW),D: CNH +, Laser + (190 mW), E: CNH +, Laser + (200 mW), F: CNH +, Laser + (210 mW),G: CNH +, Laser + (220 mW), H: CNH +, Laser + (230 mW), I: CNH +, Laser + (240 mW),J: CNH +, Laser + (250 mW), K: CNH -, Laser + (250 mW), L: CNH -, Laser -, M: CNH +, Laser -(c) (b)の実験の数値・グラフ化 210 mWのレーザーを照射したとき、最大のGFP発現が起こることが分かった。
【図17】BSA-CNH複合体の光発熱特性を利用したC6遺伝子発現制御(a) 概念図(b) BSA-CNH複合体の光発熱特性を利用したcolon-26のGFP発現挙動A: CNH +. Laser + (100 mW), B: CNH +, Laser + (110 mW), C: CNH +, Laser + (120 mW),D: CNH +, Laser + (130 mW), E: CNH +, Laser + (140 mW), F: CNH +, Laser + (150 mW),G: CNH +, Laser + (160 mW), H: CNH +, Laser + (170 mW), I: CNH +, Laser + (180 mW),J: CNH +, Laser + (190 mW), K: CNH -, Laser + (200 mW), L: CNH -, Laser -, M: CNH +, Laser -(c) (b)の実験の数値・グラフ化 140 mWのレーザーを照射したとき、最大のGFP発現が起こることが分かった。
【図18】BSA-CNH複合体の光発熱作用のNIH/3T3細胞への影響(a) 各レーザー出力におけるNIH/3T3細胞の影響(i) 300 mW, (ii) 250 mW, (iii) 200 mW, (iv) 150 mW, (v) 100 mW, (vi) 50 mW白い矢印はレーザー照射後に形成した凝集物を示している。 200 mW以上で黒い凝集物が出現することが分かった。(b) レーザー照射(300 mW)後のNIH/3T3細胞 光学顕微鏡観察から、BSA-CNH複合体の強力な光発熱作用によってNIH/3T3の大量の細胞死が起こっていることが分かった。(c) ルシフェラーゼ発現実験におけるBSA-CNH複合体の光発熱挙動CNH濃度: 0.1 wt%、溶媒: DMEM培地 系内にCNHが存在する場合でのみ各レーザー出力に対応した温度上昇が見られた。
【図19】マウス体内のNIH/3T3によるルシフェラーゼ発現挙動(再現性試験)設定加熱温度42℃ 再現性が高いことが分かった。
【図20】各出力のレーザー照射によるマウス皮膚性状(i) 設定加熱温度:39℃、(ii) 設定加熱温度:42℃、(iii) 設定加熱温度:45℃ 45℃以上になると火傷が起こることが分かった。
【図21】BSA-CNH複合体の生体毒性試験(投与部位の観察)(a) (左) BSA-CNH複合体溶液(100 μL)(溶媒:生理食塩水)と(右) 生理食塩水(100 μL)を投与直後のBALB/cSlcマウス背面のデジカメ写真CNH濃度: 0.01 wt%(b) 体重変化BSA-CNH複合体を接種しても著しい体重の増減は見られなかった。(c) 7日後のマウス(c-1) BSA-CNH複合体:マウス背面(左)、皮膚組織(中)、皮膚を除去した背面筋肉組織(右)(c-2) 生理食塩水:マウス背面(左)、皮膚組織(中)、皮膚を除去した背面筋肉組織(右)(d) 30日後のマウス(d-1) BSA-CNH複合体:マウス背面(左)、皮膚組織(中)、皮膚を除去した背面筋肉組織(右)(d-2) 生理食塩水:マウス背面(左)、皮膚組織(中)、皮膚を除去した背面筋肉組織(右) 日数が経過するごとにCNH凝集体が皮膚内を拡散することを目視で確認できた。また、形成するCNH凝集体は、皮下組織内に存在し、筋肉には存在しないことが分かった。
【図22】BSA-CNH複合体の生体毒性試験(組織切片の病理観察)(a) CNH複合体埋め込み30日後の皮膚組織切片のHE染色像(左:倍率10倍、右:倍率60倍)、(b) CNH複合体埋め込み30日後の皮膚組織切片の免疫染色像(倍率60倍)(Iba1抗体によってマクロファージが茶褐色に染色) 皮下組織内に存在するCNH凝集体周辺をマクロファージが取り囲んでいることが分かった。これは、免疫反応が起こり、CNH凝集体を体外に排除しようとしていると考えられる。しかし、肉芽腫の形成が見られないことから過剰な免疫反応が起こっているとは考えられない。
【図23】BSA-CNH複合体を取り込ませたNIH/3T3細胞のレーザー照射による遺伝子発現制御(a) 概念図 (b) NIH/3T3のGFP発現挙動A: CNH +, Laser + [50 mW (ca. 4 mW mm-2)], B: CNH +, Laser + [100 mW (ca. 8 mW mm-2)], C: CNH +, Laser + [150 mW (ca. 12 mW mm-2)], D: CNH +, Laser + [200 mW (ca. 16 mW mm-2)], E: CNH +, Laser + [250 mW (ca. 20 mW mm-2)], F: CNH +, Laser + [300 mW (ca. 24 mW mm-2)], G: CNH +, Laser + [350 mW (ca. 28 mW mm-2)], H: CNH +. Laser + [400 mW (ca. 32 mW mm-2)], I: CNH +, Laser + [450 mW (ca. 36 mW mm-2)], J: CNH +, Laser + [500 mW (ca. 40 mW mm-2)], K: CNH +, Laser -, L: CNH -, Laser + (c) (b)の実験の数値・グラフ化 300 mWのレーザーを照射したとき、最大のGFP発現が起こることが分かった。
【発明を実施するための形態】
【0012】
本発明のカーボンナノホーン複合体の原料であるカーボンナノホーン(以下、CNHと略すことがある)は、直径が約80nmで、大半が円錐キャップのついたチューブ状のナノ炭素材料が球状に凝集した構造を有する。円錐キャップは除かれていてもよく、円錐キャップ自体も本発明のカーボンナノホーンとして使用できる。
【0013】
カーボンナノホーンは、市販品を使用することができ、室温で炭素にレーザー光を照射するなどの常法により製造することができる。
【0014】
カルボキシル基を付加したCNH(以下、CNH−COOHと略すことがある)は、従来公知の方法に従って、例えば硝酸水溶液を用いて炭素原子をCOOHに酸化することによって製造すればよい(特開2003−95624号公報)。
【0015】
血清アルブミンは、哺乳類由来の血清アルブミンが広く用いられる。哺乳類としては、ヒト、ウシ、ブタ、サル、ウマ、ヒツジ、ウサギ、ヤギ、イヌ、ネコ、マウス、ラット、ハムスターなどが挙げられ、ヒト、ウシが好ましい。好ましい血清アルブミンは、ウシ血清アルブミン(BSA)、ヒト血清アルブミン(HSA)であり、特にBSAが好ましい。
【0016】
カーボンナノホーンと血清アルブミンの複合体(以下、「CNH複合体」と称することがある)は、水を含む媒体への分散性が高く、細胞ないし生体に取り込ませるのに適している。
【0017】
本発明のCNH複合体の概念図を図1に示し、構造を図S1に示す。
【0018】
本発明のCNH複合体の大きさは、30〜500nm程度、好ましくは40〜400nm程度、より好ましくは50〜350nm程度、さらに好ましくは80〜300nm程度である。生体に適用する場合には、300nm以下、好ましくは250nm以下、さらに好ましくは200nm以下がよい。
【0019】
本発明のCNH複合体は、酵素、蛍光物質、放射性同位体などで常法に従い標識してもよい。
【0020】
カーボンナノホーンと血清アルブミンの比率は、カーボンナノホーン100重量部当たり血清アルブミンを1〜1000重量部程度、好ましくは100〜200重量部程度である。
【0021】
本発明の複合体は、カーボンナノホーンと血清アルブミンを所定の割合で水などの媒体に分散させ、遠心分離、フィルターによる濾過などの常法により得ることができる。
【0022】
本発明のCNH複合体は、外部からレーザー光を照射することにより発熱する性質を有する(図2,3)。
【0023】
本発明のCNH複合体は、400〜1200nm程度(可視〜近赤外領域)の広い波長範囲の光を吸収して発熱する。さらに、該CNH複合体は、1200nmを超える波長の光も吸収して発熱することができるが、近赤外光を用いることで効率的に発熱させることができる。使用する光の波長は、近赤外領域を含む限り特に限定されないが、生体中のCNH複合体を発熱させるには、生体を透過する600〜2500nm程度、好ましくは650nm〜1800nm程度、より好ましくは700nm〜1200nm程度の光を近赤外光として照射すればよい。
【0024】
レーザーの出力は、使用する光の波長、その用途等によって適宜選択すればよいが、近赤外領域の光を用いる場合には、例えば、10mW以上、好ましくは100mW以上、さらに好ましくは300mW以上にするのがよい。
【0025】
本発明は、CNH複合体を有効成分とする医療用の発熱体を提供することができる。本発明の発熱体は、例えば細胞に予め高温になると遺伝子の発現が促進又は抑制(好ましくは促進)されるような外来遺伝子を導入しておき、その細胞に本発明の複合体を導入することで、遺伝子の発現を調節することができる。発現が調節される遺伝子としては、生理活性タンパク質、ペプチドホルモン、転写因子などをコードする遺伝子が挙げられる。例えばインスリンを高温で発現する遺伝子を含む細胞ないし細胞塊を含む生体に近赤外光を照射すると、インスリンの発現が促進され、照射を停止するか、細胞ないし細胞塊を含む生体の一部を冷却することで、インスリンが過剰に産生された場合には速やかに発現を抑制することができる。このように、加熱と冷却により容易に遺伝子発現を制御できるので、強力な生理活性を有する遺伝子産物であっても、本発明により発現制御することができる。
【0026】
細胞において高温で遺伝子を発現させる場合、例えばヒートショックタンパク質群(Hsp25, Hsp27, Hsp28,Hsp40,Hsp60, Hsp70, Hsp90, Hsp110など)のいずれかのプロモータの制御下に遺伝子を発現可能に連結することで、近赤外交渉者により加熱された細胞において特定の遺伝子の発現を促進できる。これらのヒートショックタンパク質群のいずれかのプロモータに制御対象の遺伝子を連結した場合の発現の好適な温度は38℃〜45℃程度、好ましくは39℃〜44℃程度、より好ましくは40℃〜43℃程度、さらに好ましくは41℃〜42℃程度である。
【0027】
本発明の複合体は、細胞の培養液中に加えることで容易に細胞内に取り込まれ得る。また、生体内に注入することにより生体内の細胞に取り込まれ得る。本発明の複合体の拡散を抑制することで、局所的に複合体を高い割合で導入することができる。さらに、抗体、リガンドなどを結合した特定の細胞に導入可能な細胞導入剤と本発明のCNH複合体を用いて本発明のCNH複合体を特定の細胞に導入し、その後に近赤外光を照射することにより、特定の細胞のみを加熱することができる。加熱により癌細胞などの特定の細胞は死滅させることができ、また、該細胞にCNH複合体と同時或いは逐次的に遺伝子を温度により発現調節される状態で導入することで、遺伝子発現を調節することができる。
【実施例】
【0028】
以下、本発明を具体的に説明するが、本発明は下記の例に限定されるものではない。
【0029】
本明細書において、以下の略号を用いる。
CNH:カーボンナノホーン、BSAウシ血清アルブミン、SWNT:単層カーボンナノチューブ、MWNT:多層カーボンナノチューブ。
【0030】
実施例1
ナノカーボン複合体の合成
BSA-CNH複合体は、基本的には次の方法により作製した。CNH(10 mg)[purity = 95%、metal-free; NEC]とBSA(10 mg)(Wako)を細胞培地(10 mL)に添加し、30 min間、氷冷下(< 8℃)で超音波処理(USD-2R; AS ONE)を施した。得られたBSA-CNH複合体溶液は所定量、培地で希釈することで実験に使用した。
【0031】
一方、各種BSA-CNT複合体は、BSA-CNH複合体と同様の手法により調製した。なお、使用したCNTの種類は以下の通りである。high-pressure carbon monoxide (HiPco) SWNT [super-purified SWNTs (purity > 95%), diameter 約0.8-1.2 nm, length 約1 μm; Carbon Nanotechnologies]、cobalt-molybdenum catalyst (CoMoCAT) SWNT [CG-100 (purity > 90%), diameter 約0.7-1.3 nm, length 約0.45-2.3 μm; SouthWest Nano Technologies]、 chemical vapor deposition (CVD) MWNT [purity > 95%, diameter 約10-40 nm, length 約10 μm; Meijo Nano Carbon]。
【0032】
ナノカーボン複合体の特性キャラクタリゼーション
BSA-CNH複合体の光吸収特性は、室温条件下で紫外-可視-近赤外(UV-Vis-NIR)スペクトル解析(UV-3100PC; Shimadzu)により評価した。BSA-CNH複合体の構造解析は原子間力顕微鏡(JSPM-4210; JEOL)(カンチレバー:タッピングモード)により行った。BSA-CNH複合体の粒径は、動的光散乱式粒径分布測定装置(HORIBA、LB-550)により測定した。
【0033】
温度アッセイ
様々な出力(50〜300 mW)に設定した670 nm(BWF-670-300E; B&W Tek)及び785 nm(BRM-785-1.0-100-0.22-SMA; B&W Tek)のレーザーをBSA-CNH複合体水溶液に照射し、熱電対(CT-280WR; Custom)と温度センサー(AD-5601A; A & D)を用いて温度測定を行った。なお、レーザービームが、熱電対あるいは温度センサーに直接当たらないようにした。
【0034】
プラスミドの作製
ルシフェラーゼは甲虫由来緑色発光ルシフェラーゼELuc(TOYOBO)のC末端にマウスオルニチンデカルボキシラーゼ由来PEST配列を融合したELuc-PESTを用いた。pGL3-Basicベクター(Promega)のluc(+)をHindIII/NcoIで削除後、ELuc-PESTを挿入、さらにELuc-PEST上流に約190 bpのヒトHSP70遺伝子のコアプロモーター領域(非特許文献:B.J. Wu et al., Human HSP70 promoter contains at least two distinct regulatory domains. Proc. Natl. Acad. Sci. USA, 83, 629-633 (1986).)をクローニングした。続いてpIRES2-AcGFP1ベクター(タカラバイオ)からIRES2-AcGFP1をPCRにより増幅し、ELuc-PESTの下流に挿入することで、pA-hHsp70-dPTGRm-IRES2-AcGFP1を作製した。また、hHsp70-DsRed1については、pDsRed1-N1からDsRed1をPCRにより増幅し、pGL3-Basicベクターのluc(+)を削除後、ヒトHSP70遺伝子のコアプロモーター領域の下流にクローニングすることで、pA-hHsp70-dDsRed-pGL3を作製した。
【0035】
細胞培養と形質転換
NIH3T3細胞(RCB1862)はDulbecco's Modified Eagle medium培地(DMEM)(Invitrogen)、colon-26(RCB2657)およびC6(JCRB9096)細胞はRMPI-1640培地(Nakarai)を用い、37℃、5%CO2雰囲気下で培養した。なお、各種培地には10%FBS(ICN)、ペニシリン(100 units/mL)(Nakarai)、ストレプトマイシン(100 μg/mL)(Nakarai)、アムホテリシンB(250 ng/mL)(Nakarai)を添加した。各種細胞へのレポーターベクター導入は、LipofectAMINE2000(Invitrogen)またはLipofectamine PLUS(Invitrogen)を用いた。
【0036】
安定的発現細胞株の構築
レポーターベクターおよびpcDNA3を10:1の割合で混合し、NIH3T3、colon-26およびC6細胞へLipofectAMINE2000を用いて導入し、限界希釈した後、10 cmポリスチレンディッシュへ撒き込みを行った。あらかじめ各細胞におけるジェネティシン(G418 sulfate; Gibco)に対する感受性を評価しておき、処理後7日程度で死滅する濃度を決定した。本濃度で7日間、選択培養を行うことにより染色体に遺伝子導入の起こったジェネティシン耐性細胞を選択した。更に単離した各細胞へ42℃、1時間のヒートショック処理を行い、一晩培養の後、蛍光顕微鏡下で観察することにより目的とする領域(Hsp70プロモータ下流にGFPもしくはDsRedが保持されている領域)が染色体へ導入された細胞株を確定した。本細胞株を継代し、クローン化したものを安定的発現細胞株として実験に用いた。
【0037】
ナノカーボン複合体の毒性評価
BSA-CNH複合体およびNH2-PEG2000-PL-SWNT複合体の細胞毒性は、WST-1法(ミトコンドリア活性)とAnnexin V/PI二重染色(細胞死形態の判定)により評価した。一方、マウスに対するBSA-CNH複合体の毒性評価は、BSA-CNH複合体(CNH濃度:0.01 wt%)を分散化した生理食塩水(100 μL)を7週齢、♀のBALB/cSlcマウス(日本SLC)の皮下に投与し、その接種部位の経時的観察、体重測定、組織切片の病理観察、血液検査により行った。7日後と30日後に血液サンプルを下大静脈より採血し、BioGate社とOriental Yeast社により血液検査が行われた。パラフィン固定化した組織切片の病理検査はHist Science Laboratory社が行った。
【0038】
BSA-CNH複合体の細胞内動態評価
BSA-CNH複合体の細胞内動態を評価するために次の方法によりAlexa488で蛍光標識したBSAを共有結合的手法により表面化学修飾したAlexa488-BSA-CNH複合体を合成した。CNH(50 mg)を70%硝酸水溶液(200 mL)に添加し、加熱還流を行った(130℃、15分間)。氷浴下、得られた溶液に蒸留水(600 mL)を徐々に添加した。次に、蒸留水を用いて溶液が中性になるまで吸引ろ過を行った[PTFE膜(Omnipore)、孔径=100 nm; Millipore]。得られたカルボキシル化CNH(CNH-COOH)が堆積したPTFE膜を蒸留水(50 mL)に入れ、数分間、超音波処理を行った。得られた黒色のCNH-COOH水溶液を液体窒素で予備凍結し、48時間凍結乾燥(EYELA Freeze Dryer FD-5N; Tokyo Rikakikai)を施した。FT-IR(Spectrum-2000; PerkinElmer)により、得られたCNH-COOHに-COOH基(1724 cm-1)および-COO-基(1571 cm-1)が表示されていることを確認した。次に、CNH-COOH (5 mg)と1-ethyl-3-(3-dimethylaminopropyl) carbodiimide hydrochloride(WSC)(50 mg)(Wako)をPBS緩衝液(pH 7.3)(5 mL)に添加し、60 min間、氷冷下(< 8℃)で超音波処理(USD-2R; AS ONE)を施した。当該溶液にAlexa488-BSA(5 mg)を添加し、遮光下、24 h、室温で攪拌後、吸引ろ過(PTFE膜、孔径=100 nm)を施し、PBS緩衝液(pH 7.3)(100 mL)にて洗浄した。得られた黒色粉末を堆積させた膜を10%FBSと25 mM HEPES/NaOH(pH 7.0)から成る各種培地(10 mL)に入れ、1 min間、氷冷下(< 8℃)で超音波処理(USD-2R; AS ONE)を施した。同培地にて100倍希釈後、細胞(2×105 cells/mL)を播種したガラスボトムディッシュ(Matsunami)に当該溶液(2 mL)を添加し、所定の温度(37℃と4℃)で6時間と24時間インキュベート後、共焦点レーザー顕微鏡(FV10i; Olympus)にて観察した。
【0039】
細胞レーザー実験
CNHの光発熱特性を利用した各種細胞の蛍光タンパク質発現実験は、基本的には以下の方法により実施した。10 cmポリスチレン製ディッシュ(Nunc)中で2×105 cells/mLになるように細胞を培養した。アスピレーターにより培地を除去後、PBS緩衝液(pH 7.3)(10 mL)にて洗浄した。2.5%トリプシン(300 μL)を添加し、10% FBSを含む培地(10 mL)を加え、同培地にて10倍希釈した後、4つに分注し、それぞれ遠心分離(室温、1000 rpm、3 min)を施した。アスピレーターで培地を除去後、0.01 wt%CNH分散培地(250 μL)を添加後、当該溶液をPMMA製ディスポーザブルキュベット(Tokyo Glass Kikai)に移し変え、各出力のレーザーを30 min照射した。2 mLの培地を添加後、遠心分離(室温、1000 rpm、3 min)を施し、アスピレーターで培地を除去後、新しいフェノールレッドフリーの培地(2 mL)に溶媒置換し、35 mmポリスチレン製ディッシュ(Nunc、6穴タイプ)中で37℃、5%CO2雰囲気下で一晩インキュベートした。各種蛍光タンパク質の発現量は、蛍光顕微鏡(IX71; Olimpus)にて測定し、イメージ解析ソフト(Image J; NIH)により解析した。一方、CNHの光発熱特性を利用したNIH/3T3細胞のルシフェラーゼ発現実験は、次の方法で実施した。35 mmガラスボトムディッシュ(IWAKI)中に播種したNIH3T3細胞を一晩培養後、BSAによって0.1 wt% CNHを分散した溶液(250 μL)をディッシュ中央に置いた。各出力の670 nmレーザーを照射後、10% FBS、4 mMグルタミン、25 mM HEPES/NaOH(pH 7.0)、200 μM D-ルシフェリン(TOYOBO)から成る2 mLのフェノールレッドフリーDMEM培地(Invitrogen社)に置換した。ルシフェラーゼ発現量は、1分間の積算を7分間隔で遺伝子発現連続測定装置(AB-2250; ATTO)によりリアルタイム測定した。
【0040】
メダカレーザー実験
CNHの光発熱特性を利用したトランスジェニックメダカの蛍光タンパク質発現実験は、以下の方法により実施した。ヒートショックプロモーター(HSP70)に黄色蛍光タンパク質(Venus)を結合させたトランスジェニックメダカは、既報の調製法に従い作製した(非特許文献:S. Oda et al., Identification of a Functional Medaka Heat Shock Promoter and Characterization of Its Ability to Induce Exogenous Gene Expression in Medaka In Vitro and In Vivo. Zoological Science 27, 410-415 (2010).)。PMMA製ディスポーザブルキュベット(Tokyo Glass Kikai)中にBSAにより0.01 wt%のCNHを分散した0.3%人工海水(Marin Art SF; Osaka Yakken)(250 μL)を添加後、1個のトランスジェニックメダカ胚あるいは1匹のトランスジェニックメダカ幼魚を入れた。各出力の670 nmレーザーを30 min照射後、新しい0.3%人工海水(250 μL)に溶媒置換し、ポリスチレン製ディッシュ(Nunc、96穴タイプ)中で、37℃、一晩インキュベートした。トランスジェニックメダカ体内のVenus発現は、蛍光顕微鏡(M205FA; Leica)にて観察した。
【0041】
マウスレーザー実験
CNHの光発熱特性を利用した生体内ルシフェラーゼ発現実験は、以下の方法により実施した。10 cmポリスチレン製ディッシュ(Nunc)中で2×105 cells/mLになるようにNIH3T3細胞を培養した。アスピレーターにより培地を除去後、PBS緩衝液(pH 7.3)(10 mL)にて洗浄した。2.5%トリプシン(300 μL)を添加し、10% FBSを含むDMEM培地(5 mL)を加え、遠心分離(室温、1000 rpm、3 min)を行った。アスピレーターで培地を除去後、0.01 wt%CNHを分散した生理食塩水(100 mL)を添加後、当該溶液50 μLをマウス[8週齢、♀のBALB/cSlc-nu/nu(日本SLC)]皮下2箇所に注入した。赤外線サーモグラフィカメラ(Ti10; Fluke)を用いて各設定温度になるように出力を調整しながらレーザーを30 min間照射した。ルシフェラーゼの発現挙動は、およそ5時間後にin vivoバイオイメージング装置(Nightowl NC320; Berthold technologies)により測定した。
【0042】
以下の表1にCNH複合体を投与したマウスの血液検査の結果を示す。
【0043】
【表1】

【0044】
BSA-CNH複合体の皮下投与有無に関わらず、CBCと生化学検査に大きな変化は見られなかった。とりわけ、炎症性マーカーであるCRPに変化が見られないことからCNHは生体毒性が低いと考えられる。
【0045】
実施例2
CNH複合体を取り込ませた細胞のレーザー照射による遺伝子発現実験
CNHの光発熱特性を利用したNIH3T3細胞のGFP発現実験は、基本的には以下の方法により実施した。10 cmポリスチレン製ディッシュ(Nunc)中で2×105cells/mLになるように細胞を培養した。アスピレーターにより培地を除去後、0.01 wt%CNH分散培地を添加し、24時間インキュベートした。24時間後、細胞をPBS緩衝液(pH 7.3)(10 mL)にて3回洗浄し、細胞内に取り込まれなかったCNH複合体を除去した。2.5%トリプシン(300 μL)を添加し、10% FBSを含む培地(10 mL)を加え、同培地にて10倍希釈した後、4つに分注し、それぞれ遠心分離(室温、1000 rpm、3 min)を施した。アスピレーターで培地を除去し、培地(250 μL)を添加後、当該溶液をPMMA製ディスポーザブルキュベット(Tokyo Glass Kikai)に移し変え、各出力のレーザーを30 min照射した。2 mLの培地を添加後、遠心分離(室温、1000 rpm、3 min)を施し、アスピレーターで培地を除去後、新しいフェノールレッドフリーの培地(2 mL)に溶媒置換し、35 mmポリスチレン製ディッシュ(Nunc、6穴タイプ)中で37℃、5%CO2雰囲気下で一晩インキュベートした。GFP発現量は、蛍光顕微鏡(IX71; Olimpus)にて測定し、イメージ解析ソフト(Image J; NIH)により解析した。結果を図23に示す。
【産業上の利用可能性】
【0046】
次世代の治療システムとして幹細胞を代表とする機能性細胞を利用した治療法(細胞療法、再生医療)に大きな期待が寄せられている。本発明によって、体内に導入したCNHを目的の位置と空間で自由自在に光発熱制御が可能である。従って、本発明を利用すれば、これまで不可能であった、とりわけ高等生物の体内深部における細胞の動態および分化等の時空間制御が可能となるため、新しい細胞療法や再生医療の開発へとつながる強力なツールとなる。
【0047】
癌細胞などの熱に弱い細胞は、42〜43℃程度の加熱により死滅させることができる。近赤外光は外部から生体の深部まで到達させることができるので、赤外光により高効率で発熱する本発明の複合体は癌細胞に選択的に取り込ませることで、癌の温熱療法にも利用できる。
【技術分野】
【0001】
本発明は、近赤外光の照射により発熱されるカーボンナノホーンの複合体、該複合体から構成される光発熱体、該複合体の近赤外光による発熱のための使用、細胞又は生体の加熱方法及び遺伝子発現調節法に関する。
【背景技術】
【0002】
新しい細胞機能制御技術の開発は、革新的な細胞療法や再生医療を確立するうえで必要不可欠な技術の一つといえる。従来の細胞機能制御技術として、これまで紫外線や赤外線レーザーを、生物個体の局所領域(特定の細胞)に選択的に照射し、部位特異的遺伝子発現を引き起こさせることを特徴とする局所的遺伝子発現調節法が報告されている(特許文献1)。また、光活性化イオンチャネルであるチャネルロドプシン2またはハロロドプシンを特定領域の細胞(脳や心臓)に遺伝子工学的手法を用いて強制発現させた後、これらの細胞群に紫外線レーザーを照射することにより、標的とする細胞を興奮または抑制させる方法が知られている(非特許文献1)。しかしながら、紫外線レーザーは光毒性が高いため、細胞の損傷が避けられないことが問題となっている。とりわけ、生体透過性の低さの問題から、レーザーを直接体内に接続する必要があり、この結果、例えば、頭蓋骨に穴を開けるといった手技の熟練度に依存するなど煩雑な操作はもちろんのこと、このような手術自体、動物の苦痛度レベルは極めて高いことは明白である。
【0003】
また、光毒性が比較的低い赤外線レーザーが使用されることもあるが、赤外線レーザーと熱ショックプロモーターを利用した系に関しては、生体透過性が低く、有意な細胞機能制御を実現するために高いレーザー強度が必要であり、その加熱効率も低い。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特許第4380857号
【非特許文献】
【0005】
【非特許文献1】Wu YI et al., Nature, 104-108 (2009). T. Bruegmann et al., Nature Methods, 7, 897-900 (2010).
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明は、効率よく短時間で細胞ないし生体の一部を加熱し、細胞ないし生体を傷害することなく特定の遺伝子の発現を制御する技術を提供することを目的とする。
【課題を解決するための手段】
【0007】
本発明者らは、驚くべきことに、カーボンナノホーン(CNH)と血清アルブミンの複合体に近赤外光を吸収させて熱源とすれば、高効率で細胞ないし生体を加熱できることを見出し本発明を完成させるに至った。
【0008】
すなわち、本発明は以下の複合体、該複合体から構成される光発熱体、該複合体の近赤外光による発熱のための使用、細胞又は生体の加熱方法及び遺伝子発現調節法を提供するものである。
項1. カーボンナノホーン(CNH)に血清アルブミンが結合した複合体。
項2. 前記血清アルブミンがウシ血清アルブミンである、項1に記載の複合体。
項3. 項1又は2に記載の複合体から構成される、近赤外光により発熱される光発熱体。
項4. 項1又は2に記載の複合体の近赤外光により細胞又は生体の一部を発熱するための使用。
項5. 項3に記載の発熱体を細胞内又は生体内に埋め込み、近赤外光を照射することを特徴とする、細胞または生体の加熱方法。
項6. 発熱により遺伝子発現が調節可能な外来遺伝子を導入した生体もしくは細胞に項1又は2に記載の複合体を導入し、前記複合体に近赤外光を照射することを特徴とする、遺伝子発現調節法。
【発明の効果】
【0009】
本発明は、生体透過性の高い近赤外レーザーを利用するため煩雑な手術も必要なく、透明な生物個体に限定されることなく、不透明な身体を有する多様な生物種に活用可能となる。実際、補本発明のシステムによって、マウスの体内で細胞の遺伝子発現が可能であることを実証した。また、本発明は、カーボンナノホーン(CNH)の強力な光発熱特性を利用するため細胞の温度を10℃上昇させるのに必要なレーザー光の強度は集光領域でわずか〜8mW程度であり、これまでのおよそ13倍もの効率で加熱とそれに伴う遺伝子発現が可能である。さらに、本発明は、カーボンナノチューブ(CNT)に比較して生体毒性の低いCNHを利用している点でも優れている。
【0010】
CNH複合体は、細胞毒性、生体毒性が非常に低く、生体に適用する材料として優れている。
【図面の簡単な説明】
【0011】
【図1】CNH複合体の光吸収特性と光発熱特性(a) BSA-CNH複合体の概念図 CNH表面を牛血清アルブミン(BSA)によって非共有結合的に修飾することで塩の入った水溶液中に均一分散化することができる。粒径は各種解析結果から180 nm程度と見積もった。(b) 各種水溶液中でのBSA-CNH複合体のUV-Vis-NIRスペクトルとデジカメ写真(i) DMEM培地、(ii) PBS緩衝液(pH 7.3)、(iii) 0.3%人工海水CNH濃度: 0.01 wt% BSAで修飾したCNH複合体は、水溶液中に均一に分散化可能であるため、CNH特有の光吸収スペクトルを確認できた。つまり、CNHは幅広い波長の光を吸収する特性がある。(c) BSA-CNH複合体溶液の各レーザー出力(50〜300 mW)に対する光発熱挙動(温度差測定)CNH濃度: 0.01 wt%、溶媒: 0.3%人工海水 系内にCNHが存在する場合でのみ各レーザー出力に対応した温度上昇が見られた。
【図2】BSA-CNH複合体を利用した細胞遺伝子発現制御(a) 各種細胞の蛍光タンパク質発現挙動(i) マウス繊維芽細胞(NIH/3T3):緑色蛍光タンパク質(GFP)(ii) マウス大腸癌細胞(colon-26):緑色蛍光タンパク質(GFP)(iii) ラットグリオーマ細胞(C6):赤色蛍光タンパク質(DsRed) CNHの光発熱特性と細胞内ヒートショックプロモーターを利用した各種蛍光タンパク質の発現ができた。(b) CNH複合体の光発熱特性を利用したNIH/3T3による発光タンパク質(ルシフェラーゼ)発現挙動 100 mWのレーザー出力のときにルシフェラーゼの発現を確認することができた。(c) CNH複合体の光発熱特性を利用したトランスジェニック(Tg)メダカ胚体内での蛍光タンパク質Venus発現挙動(i) レーザー照射前、(ii) 50 mW、(iii) 100 mW、(iv) 150 mW 各レーザー出力に対応したVenus発現挙動を観察することができた。レーザー出力が150 mWのとき溶液が42℃になり、この温度はTgメダカの遺伝子発現の最適温度である。従って、その温度になるにつれて発現されるVenusの蛍光量が増加することが分かった。(d) CNH複合体の光発熱特性を利用したメダカ幼生体内での蛍光タンパク質Venus発現挙動レーザー出力:150 mW CNH複合体の光発熱特性を利用することで、胚のみならず幼生の状態においてもVenusの発現を行うことができた。
【図3】CNHの光発熱特性を利用したマウス体内における細胞遺伝子発現制御(a) 概念図(b) BSA-CNH複合体を背部に接種したBALB/cSlc-nu/nuヌードマウスのデジカメ写真生理食塩水に分散化したBSA-CNH溶液を写真の(i)と(ii)の両方の部位に投与(左)、拡大写真(右)(i) レーザー未照射、(ii) レーザー照射(c) レーザー照射時のBALB/cSlc-nu/nuのデジカメ写真(d) サーモグラフィカメラによるレーザー照射に伴うBSA-CNH複合体投与部位の発熱挙動 レーザー照射によってBSA-CNH複合体投与部位がピンポイントで、およそ35℃から42℃に温度上昇することが分かった。
【図4】CNHの光発熱特性を利用したマウス体内のNIH/3T3のルシフェラーゼ発現挙動(i) 設定加熱温度:42℃、(ii) 設定加熱温度:39℃、(iii) 設定加熱温度:45℃ 設定加熱温度が42℃のとき最大のルシフェラーゼ発現挙動を示すことが分かった。in vitroのみならずin vivoにおいても設定加熱温度に対応した遺伝子発現制御が可能であることが明らかとなった。
【図5】BSA-CNH複合体の構造キャラクタリゼーションと光熱安定性(a) 原子間力顕微鏡(AFM)観察 比較的孤立分散したBSA-CNH複合体の像が観察できる。サイズも200 nm前後であることが分かった。(b) 動的光散乱(DLS) シャープなピークを呈していることから合成したBSA-CNH複合体は単分散であることが分かった。また、そのときの粒径は180 nmであることがわかり、この値はAFMとほぼ一致することが明らかとなった。(c) BSA-CNH複合体の光熱安定性 300 mWという比較的高強度なレーザー出力で照射しても凝集物等は観察されなかった。従って、合成したBSA-CNH複合体は比較的光熱安定性が高いといえる。
【図6】BSA-CNH複合体の細胞毒性評価(a) 細胞生存率(ミトコンドリア活性)に対するCNHの影響(WST-1アッセイ) CNH培地分散液を細胞に投与し、6時間後および24時間後にWST-1法により、ミトコンドリア活性を指標として細胞生存率を測定した。この結果、高濃度CNH溶液に曝露しても、いずれの細胞も細胞生存率は80%以上であることが分かった。(b) 細胞性属率に対するCNHの影響(Annexin V/PI二重染色)CNHを各細胞に投与し、24時間後にAnnexin V/PI二重染色を行い、フローサイトメーターにより細胞死を測定した。測定は10000個の細胞について行った。Annexin V陽性をアポトーシス細胞、PI陽性をネクローシスと判定した。 CNH投与細胞についてAnnexin V/PI二重染色を行い、フローサイトメーターで細胞死形態(アポトーシス/ネクローシス)を測定した。アポトーシス細胞では、細胞表面にAnnexin V結合性のホスファチジルセリンが露出するため、Annexin V陽性となる一方、ネクローシス細胞(アポトーシスからの二次的なネクローシスも含む)では細胞膜の透過性が変化しPI(ヨウ化プロピジウム)染色陽性となることから、細胞死形態の判定を行うことができる。Annexin V/PI二重染色の結果、いずれの細胞においてもCNH投与によって大部分の細胞が通常形態で生存していることが分かった。 (c) CNH投与細胞のカスパーゼ-3活性CNHを各細胞に投与し、6時間後、24時間後にカスパーゼ-3活性を測定した。値は、非投与細胞に対する相対値。 アポトーシスマーカーであるカスパーゼ-3活性を測定したが、CNH添加による各細胞のカスパーゼ-3の活性化も見られなかった。
【図7】Alexa488標識BSA-CNH複合体のNIH/3T3(マウス繊維芽細胞)の細胞内動態挙動(a) 5%CO2インキュベータ内(37℃)で24時間インキュベート(b) 冷蔵庫内(4℃)で24時間インキュベート(c) 5%CO2インキュベータ内(37℃)で6時間インキュベート(d) 冷蔵庫内(4℃)で6時間インキュベート BSA-CNH複合体は細胞のエンドサイトーシスにより細胞内に取り込まれることが分かった。
【図8】Alexa488標識BSA-CNH複合体のcolon-26(マウス大腸癌細胞)の細胞内動態挙動(a) 5%CO2インキュベータ内(37℃)で24時間インキュベート(b) 冷蔵庫内(4℃)で24時間インキュベート(c) 5%CO2インキュベータ内(37℃)で6時間インキュベート(d) 冷蔵庫内(4℃)で6時間インキュベート BSA-CNH複合体は細胞のエンドサイトーシスにより細胞内に取り込まれることが分かった。
【図9】Alexa488標識BSA-CNH複合体のC6(ラットグリオーマ細胞)の細胞内動態挙動(a) 5%CO2インキュベータ内(37℃)で24時間インキュベート(b) 冷蔵庫内(4℃)で24時間インキュベート(c) 5%CO2インキュベータ内(37℃)で6時間インキュベート(d) 冷蔵庫内(4℃)で6時間インキュベート BSA-CNH複合体は細胞のエンドサイトーシスにより細胞内に取り込まれることが分かった。
【図10】各種BSA-CNT複合体の細胞毒性評価 CNT培地分散液を細胞に投与し、24時間後にWST-1法により、ミトコンドリア活性を指標として細胞生存率を測定した。この結果、CNT溶液に曝露すると、いずれの細胞も細胞生存率が劇的に低下することが明らかとなった。
【図11】各種BSA-ナノカーボン複合体の水中分散特性と光発熱特性評価(a) 各種BSA-ナノカーボン複合体の超音波処理後24時間後の分散溶液のデジカメ写真(溶媒:PBS緩衝液)ナノカーボン濃度:100 mg/mL(i) CNH、(ii) Hipco SWNT、(iii) CoMoCAT SWNT、(iv) MWNT(b) 各種BSA-ナノカーボン複合体の遠心分離後のデジカメ写真(i) CNH、(ii) Hipco SWNT、(iii) CoMoCAT SWNT、(iv) MWNT(c) 各種BSA-ナノカーボン複合体の分散性が光発熱特性に与える影響レーザー波長:785 nm、レーザー出力:300 mW、レーザー照射時間:5 min BSA-CNH複合体は、超音波処理後24時間インキュベートしても凝集物一つなく、安定に分散している。一方、各種BSA-CNT複合体は、超音波処理後24時間インキュベートすると容器底面に凝集物が堆積しているが、ある程度の分散性を有していることがわかった。しかし、遠心分離を施すとBSA-CNH複合体が安定な黒色分散液を与えるのに対し、各種BSA-CNT複合体は、マイクロチューブ底面に大きな沈殿物を形成することが明らかとなった。これらの結果は、BSA-CNH複合体の方が、各種BSA-CNT複合体に比較して安定な分散性を有していることを示している。また、ナノカーボンの分散性が光発熱性能に与える影響を調べた。この結果、BSA-CNH複合体を用いたとき、最も高い温度差が得られることがわかった。
【図12】NIH/3T3のGFP発現における最適温度条件探索(a) 37℃(a-1) 接着系、倍率4倍、(a-2) 接着系、倍率10倍、(a-3) 浮遊系、倍率4倍、(a-4) 浮遊系、倍率10倍(b) 40℃(b-1) 接着系、倍率4倍、(b2) 接着系、倍率10倍、(b-3) 浮遊系、倍率4倍、(b-4) 浮遊系、倍率10倍(c) 42℃(c-1) 接着系、倍率4倍、(c-2) 接着系、倍率10倍、(c-3) 浮遊系、倍率4倍、(c-4) 浮遊系、倍率10倍(d) 45℃(d-1) 接着系、倍率4倍、(d-2) 接着系、倍率10倍、(d-3) 浮遊系、倍率4倍、(d-4) 浮遊系、倍率10倍(e) 50℃(e-1) 接着系、倍率4倍、(e-2) 接着系、倍率10倍、(e-3) 浮遊系、倍率4倍、(e-4) 浮遊系、倍率10倍 蛍光顕微鏡観察の結果から、NIH/3T3によるGFP発現の最適温度は42℃であることが分かった。また、45℃以上のインキュベートによって細胞の大量死が起こることが分かった。(f) NIH/3T3のルシフェラーゼ発現における最適温度条件探索NIH/3T3のルシフェラーゼ発現は37℃ではほとんど起こらないが、42℃で有意に起こることが分かった。
【図13】colon-26のGFP発現における最適温度条件探索(a) 37℃(a-1) 接着系、倍率4倍、(a-2) 接着系、倍率10倍、(a-3) 浮遊系、倍率4倍、(a-4) 浮遊系、倍率10倍(b) 40℃(b-1) 接着系、倍率4倍、(b2) 接着系、倍率10倍、(b-3) 浮遊系、倍率4倍、(b-4) 浮遊系、倍率10倍(c) 42℃(c-1) 接着系、倍率4倍、(c-2) 接着系、倍率10倍、(c-3) 浮遊系、倍率4倍、(c-4) 浮遊系、倍率10倍(d) 45℃(d-1) 接着系、倍率4倍、(d-2) 接着系、倍率10倍、(d-3) 浮遊系、倍率4倍、(d-4) 浮遊系、倍率10倍(e) 50℃(e-1) 接着系、倍率4倍、(e-2) 接着系、倍率10倍、(e-3) 浮遊系、倍率4倍、(e-4) 浮遊系、倍率10倍 蛍光顕微鏡観察の結果から、colon-26によるGFP発現の最適温度は42℃であることが分かった。また、45℃以上のインキュベートによって細胞の大量死が起こることが分かった。
【図14】C6のDsRed発現における最適温度条件探索(a) 37℃(a-1) 接着系、倍率4倍、(a-2) 接着系、倍率10倍、(a-3) 浮遊系、倍率4倍、(a-4) 浮遊系、倍率10倍(b) 40℃(b-1) 接着系、倍率4倍、(b2) 接着系、倍率10倍、(b-3) 浮遊系、倍率4倍、(b-4) 浮遊系、倍率10倍(c) 42℃(c-1) 接着系、倍率4倍、(c-2) 接着系、倍率10倍、(c-3) 浮遊系、倍率4倍、(c-4) 浮遊系、倍率10倍(d) 45℃(d-1) 接着系、倍率4倍、(d-2) 接着系、倍率10倍、(d-3) 浮遊系、倍率4倍、(d-4) 浮遊系、倍率10倍(e) 50℃(e-1) 接着系、倍率4倍、(e-2) 接着系、倍率10倍、(e-3) 浮遊系、倍率4倍、(e-4) 浮遊系、倍率10倍 蛍光顕微鏡観察の結果から、C6によるDsRed発現の最適温度は42℃であることが分かった。また、45℃以上のインキュベートによって細胞の大量死が起こることが分かった。
【図15】BSA-CNH複合体の光発熱特性を利用したNIH/3T3遺伝子発現制御(a) 概念図(b) BSA-CNH複合体の光発熱特性を利用したNIH/3T3のGFP発現挙動A: CNH +. Laser + (300 mW), B: CNH +, Laser + (150 mW), C: CNH +, Laser + (100 mW),D: CNH -, Laser + (300 mW), E: CNH -, Laser -, F: CNH +, Laser -(c) (b)の実験の数値・グラフ化 150 mWのレーザーを照射したとき、最大のGFP発現が起こることが分かった。
【図16】BSA-CNH複合体の光発熱特性を利用したcolon-26遺伝子発現制御(a) 概念図(b) BSA-CNH複合体の光発熱特性を利用したcolon-26のGFP発現挙動A: CNH +. Laser + (160 mW), B: CNH +, Laser + (170 mW), C: CNH +, Laser + (180 mW),D: CNH +, Laser + (190 mW), E: CNH +, Laser + (200 mW), F: CNH +, Laser + (210 mW),G: CNH +, Laser + (220 mW), H: CNH +, Laser + (230 mW), I: CNH +, Laser + (240 mW),J: CNH +, Laser + (250 mW), K: CNH -, Laser + (250 mW), L: CNH -, Laser -, M: CNH +, Laser -(c) (b)の実験の数値・グラフ化 210 mWのレーザーを照射したとき、最大のGFP発現が起こることが分かった。
【図17】BSA-CNH複合体の光発熱特性を利用したC6遺伝子発現制御(a) 概念図(b) BSA-CNH複合体の光発熱特性を利用したcolon-26のGFP発現挙動A: CNH +. Laser + (100 mW), B: CNH +, Laser + (110 mW), C: CNH +, Laser + (120 mW),D: CNH +, Laser + (130 mW), E: CNH +, Laser + (140 mW), F: CNH +, Laser + (150 mW),G: CNH +, Laser + (160 mW), H: CNH +, Laser + (170 mW), I: CNH +, Laser + (180 mW),J: CNH +, Laser + (190 mW), K: CNH -, Laser + (200 mW), L: CNH -, Laser -, M: CNH +, Laser -(c) (b)の実験の数値・グラフ化 140 mWのレーザーを照射したとき、最大のGFP発現が起こることが分かった。
【図18】BSA-CNH複合体の光発熱作用のNIH/3T3細胞への影響(a) 各レーザー出力におけるNIH/3T3細胞の影響(i) 300 mW, (ii) 250 mW, (iii) 200 mW, (iv) 150 mW, (v) 100 mW, (vi) 50 mW白い矢印はレーザー照射後に形成した凝集物を示している。 200 mW以上で黒い凝集物が出現することが分かった。(b) レーザー照射(300 mW)後のNIH/3T3細胞 光学顕微鏡観察から、BSA-CNH複合体の強力な光発熱作用によってNIH/3T3の大量の細胞死が起こっていることが分かった。(c) ルシフェラーゼ発現実験におけるBSA-CNH複合体の光発熱挙動CNH濃度: 0.1 wt%、溶媒: DMEM培地 系内にCNHが存在する場合でのみ各レーザー出力に対応した温度上昇が見られた。
【図19】マウス体内のNIH/3T3によるルシフェラーゼ発現挙動(再現性試験)設定加熱温度42℃ 再現性が高いことが分かった。
【図20】各出力のレーザー照射によるマウス皮膚性状(i) 設定加熱温度:39℃、(ii) 設定加熱温度:42℃、(iii) 設定加熱温度:45℃ 45℃以上になると火傷が起こることが分かった。
【図21】BSA-CNH複合体の生体毒性試験(投与部位の観察)(a) (左) BSA-CNH複合体溶液(100 μL)(溶媒:生理食塩水)と(右) 生理食塩水(100 μL)を投与直後のBALB/cSlcマウス背面のデジカメ写真CNH濃度: 0.01 wt%(b) 体重変化BSA-CNH複合体を接種しても著しい体重の増減は見られなかった。(c) 7日後のマウス(c-1) BSA-CNH複合体:マウス背面(左)、皮膚組織(中)、皮膚を除去した背面筋肉組織(右)(c-2) 生理食塩水:マウス背面(左)、皮膚組織(中)、皮膚を除去した背面筋肉組織(右)(d) 30日後のマウス(d-1) BSA-CNH複合体:マウス背面(左)、皮膚組織(中)、皮膚を除去した背面筋肉組織(右)(d-2) 生理食塩水:マウス背面(左)、皮膚組織(中)、皮膚を除去した背面筋肉組織(右) 日数が経過するごとにCNH凝集体が皮膚内を拡散することを目視で確認できた。また、形成するCNH凝集体は、皮下組織内に存在し、筋肉には存在しないことが分かった。
【図22】BSA-CNH複合体の生体毒性試験(組織切片の病理観察)(a) CNH複合体埋め込み30日後の皮膚組織切片のHE染色像(左:倍率10倍、右:倍率60倍)、(b) CNH複合体埋め込み30日後の皮膚組織切片の免疫染色像(倍率60倍)(Iba1抗体によってマクロファージが茶褐色に染色) 皮下組織内に存在するCNH凝集体周辺をマクロファージが取り囲んでいることが分かった。これは、免疫反応が起こり、CNH凝集体を体外に排除しようとしていると考えられる。しかし、肉芽腫の形成が見られないことから過剰な免疫反応が起こっているとは考えられない。
【図23】BSA-CNH複合体を取り込ませたNIH/3T3細胞のレーザー照射による遺伝子発現制御(a) 概念図 (b) NIH/3T3のGFP発現挙動A: CNH +, Laser + [50 mW (ca. 4 mW mm-2)], B: CNH +, Laser + [100 mW (ca. 8 mW mm-2)], C: CNH +, Laser + [150 mW (ca. 12 mW mm-2)], D: CNH +, Laser + [200 mW (ca. 16 mW mm-2)], E: CNH +, Laser + [250 mW (ca. 20 mW mm-2)], F: CNH +, Laser + [300 mW (ca. 24 mW mm-2)], G: CNH +, Laser + [350 mW (ca. 28 mW mm-2)], H: CNH +. Laser + [400 mW (ca. 32 mW mm-2)], I: CNH +, Laser + [450 mW (ca. 36 mW mm-2)], J: CNH +, Laser + [500 mW (ca. 40 mW mm-2)], K: CNH +, Laser -, L: CNH -, Laser + (c) (b)の実験の数値・グラフ化 300 mWのレーザーを照射したとき、最大のGFP発現が起こることが分かった。
【発明を実施するための形態】
【0012】
本発明のカーボンナノホーン複合体の原料であるカーボンナノホーン(以下、CNHと略すことがある)は、直径が約80nmで、大半が円錐キャップのついたチューブ状のナノ炭素材料が球状に凝集した構造を有する。円錐キャップは除かれていてもよく、円錐キャップ自体も本発明のカーボンナノホーンとして使用できる。
【0013】
カーボンナノホーンは、市販品を使用することができ、室温で炭素にレーザー光を照射するなどの常法により製造することができる。
【0014】
カルボキシル基を付加したCNH(以下、CNH−COOHと略すことがある)は、従来公知の方法に従って、例えば硝酸水溶液を用いて炭素原子をCOOHに酸化することによって製造すればよい(特開2003−95624号公報)。
【0015】
血清アルブミンは、哺乳類由来の血清アルブミンが広く用いられる。哺乳類としては、ヒト、ウシ、ブタ、サル、ウマ、ヒツジ、ウサギ、ヤギ、イヌ、ネコ、マウス、ラット、ハムスターなどが挙げられ、ヒト、ウシが好ましい。好ましい血清アルブミンは、ウシ血清アルブミン(BSA)、ヒト血清アルブミン(HSA)であり、特にBSAが好ましい。
【0016】
カーボンナノホーンと血清アルブミンの複合体(以下、「CNH複合体」と称することがある)は、水を含む媒体への分散性が高く、細胞ないし生体に取り込ませるのに適している。
【0017】
本発明のCNH複合体の概念図を図1に示し、構造を図S1に示す。
【0018】
本発明のCNH複合体の大きさは、30〜500nm程度、好ましくは40〜400nm程度、より好ましくは50〜350nm程度、さらに好ましくは80〜300nm程度である。生体に適用する場合には、300nm以下、好ましくは250nm以下、さらに好ましくは200nm以下がよい。
【0019】
本発明のCNH複合体は、酵素、蛍光物質、放射性同位体などで常法に従い標識してもよい。
【0020】
カーボンナノホーンと血清アルブミンの比率は、カーボンナノホーン100重量部当たり血清アルブミンを1〜1000重量部程度、好ましくは100〜200重量部程度である。
【0021】
本発明の複合体は、カーボンナノホーンと血清アルブミンを所定の割合で水などの媒体に分散させ、遠心分離、フィルターによる濾過などの常法により得ることができる。
【0022】
本発明のCNH複合体は、外部からレーザー光を照射することにより発熱する性質を有する(図2,3)。
【0023】
本発明のCNH複合体は、400〜1200nm程度(可視〜近赤外領域)の広い波長範囲の光を吸収して発熱する。さらに、該CNH複合体は、1200nmを超える波長の光も吸収して発熱することができるが、近赤外光を用いることで効率的に発熱させることができる。使用する光の波長は、近赤外領域を含む限り特に限定されないが、生体中のCNH複合体を発熱させるには、生体を透過する600〜2500nm程度、好ましくは650nm〜1800nm程度、より好ましくは700nm〜1200nm程度の光を近赤外光として照射すればよい。
【0024】
レーザーの出力は、使用する光の波長、その用途等によって適宜選択すればよいが、近赤外領域の光を用いる場合には、例えば、10mW以上、好ましくは100mW以上、さらに好ましくは300mW以上にするのがよい。
【0025】
本発明は、CNH複合体を有効成分とする医療用の発熱体を提供することができる。本発明の発熱体は、例えば細胞に予め高温になると遺伝子の発現が促進又は抑制(好ましくは促進)されるような外来遺伝子を導入しておき、その細胞に本発明の複合体を導入することで、遺伝子の発現を調節することができる。発現が調節される遺伝子としては、生理活性タンパク質、ペプチドホルモン、転写因子などをコードする遺伝子が挙げられる。例えばインスリンを高温で発現する遺伝子を含む細胞ないし細胞塊を含む生体に近赤外光を照射すると、インスリンの発現が促進され、照射を停止するか、細胞ないし細胞塊を含む生体の一部を冷却することで、インスリンが過剰に産生された場合には速やかに発現を抑制することができる。このように、加熱と冷却により容易に遺伝子発現を制御できるので、強力な生理活性を有する遺伝子産物であっても、本発明により発現制御することができる。
【0026】
細胞において高温で遺伝子を発現させる場合、例えばヒートショックタンパク質群(Hsp25, Hsp27, Hsp28,Hsp40,Hsp60, Hsp70, Hsp90, Hsp110など)のいずれかのプロモータの制御下に遺伝子を発現可能に連結することで、近赤外交渉者により加熱された細胞において特定の遺伝子の発現を促進できる。これらのヒートショックタンパク質群のいずれかのプロモータに制御対象の遺伝子を連結した場合の発現の好適な温度は38℃〜45℃程度、好ましくは39℃〜44℃程度、より好ましくは40℃〜43℃程度、さらに好ましくは41℃〜42℃程度である。
【0027】
本発明の複合体は、細胞の培養液中に加えることで容易に細胞内に取り込まれ得る。また、生体内に注入することにより生体内の細胞に取り込まれ得る。本発明の複合体の拡散を抑制することで、局所的に複合体を高い割合で導入することができる。さらに、抗体、リガンドなどを結合した特定の細胞に導入可能な細胞導入剤と本発明のCNH複合体を用いて本発明のCNH複合体を特定の細胞に導入し、その後に近赤外光を照射することにより、特定の細胞のみを加熱することができる。加熱により癌細胞などの特定の細胞は死滅させることができ、また、該細胞にCNH複合体と同時或いは逐次的に遺伝子を温度により発現調節される状態で導入することで、遺伝子発現を調節することができる。
【実施例】
【0028】
以下、本発明を具体的に説明するが、本発明は下記の例に限定されるものではない。
【0029】
本明細書において、以下の略号を用いる。
CNH:カーボンナノホーン、BSAウシ血清アルブミン、SWNT:単層カーボンナノチューブ、MWNT:多層カーボンナノチューブ。
【0030】
実施例1
ナノカーボン複合体の合成
BSA-CNH複合体は、基本的には次の方法により作製した。CNH(10 mg)[purity = 95%、metal-free; NEC]とBSA(10 mg)(Wako)を細胞培地(10 mL)に添加し、30 min間、氷冷下(< 8℃)で超音波処理(USD-2R; AS ONE)を施した。得られたBSA-CNH複合体溶液は所定量、培地で希釈することで実験に使用した。
【0031】
一方、各種BSA-CNT複合体は、BSA-CNH複合体と同様の手法により調製した。なお、使用したCNTの種類は以下の通りである。high-pressure carbon monoxide (HiPco) SWNT [super-purified SWNTs (purity > 95%), diameter 約0.8-1.2 nm, length 約1 μm; Carbon Nanotechnologies]、cobalt-molybdenum catalyst (CoMoCAT) SWNT [CG-100 (purity > 90%), diameter 約0.7-1.3 nm, length 約0.45-2.3 μm; SouthWest Nano Technologies]、 chemical vapor deposition (CVD) MWNT [purity > 95%, diameter 約10-40 nm, length 約10 μm; Meijo Nano Carbon]。
【0032】
ナノカーボン複合体の特性キャラクタリゼーション
BSA-CNH複合体の光吸収特性は、室温条件下で紫外-可視-近赤外(UV-Vis-NIR)スペクトル解析(UV-3100PC; Shimadzu)により評価した。BSA-CNH複合体の構造解析は原子間力顕微鏡(JSPM-4210; JEOL)(カンチレバー:タッピングモード)により行った。BSA-CNH複合体の粒径は、動的光散乱式粒径分布測定装置(HORIBA、LB-550)により測定した。
【0033】
温度アッセイ
様々な出力(50〜300 mW)に設定した670 nm(BWF-670-300E; B&W Tek)及び785 nm(BRM-785-1.0-100-0.22-SMA; B&W Tek)のレーザーをBSA-CNH複合体水溶液に照射し、熱電対(CT-280WR; Custom)と温度センサー(AD-5601A; A & D)を用いて温度測定を行った。なお、レーザービームが、熱電対あるいは温度センサーに直接当たらないようにした。
【0034】
プラスミドの作製
ルシフェラーゼは甲虫由来緑色発光ルシフェラーゼELuc(TOYOBO)のC末端にマウスオルニチンデカルボキシラーゼ由来PEST配列を融合したELuc-PESTを用いた。pGL3-Basicベクター(Promega)のluc(+)をHindIII/NcoIで削除後、ELuc-PESTを挿入、さらにELuc-PEST上流に約190 bpのヒトHSP70遺伝子のコアプロモーター領域(非特許文献:B.J. Wu et al., Human HSP70 promoter contains at least two distinct regulatory domains. Proc. Natl. Acad. Sci. USA, 83, 629-633 (1986).)をクローニングした。続いてpIRES2-AcGFP1ベクター(タカラバイオ)からIRES2-AcGFP1をPCRにより増幅し、ELuc-PESTの下流に挿入することで、pA-hHsp70-dPTGRm-IRES2-AcGFP1を作製した。また、hHsp70-DsRed1については、pDsRed1-N1からDsRed1をPCRにより増幅し、pGL3-Basicベクターのluc(+)を削除後、ヒトHSP70遺伝子のコアプロモーター領域の下流にクローニングすることで、pA-hHsp70-dDsRed-pGL3を作製した。
【0035】
細胞培養と形質転換
NIH3T3細胞(RCB1862)はDulbecco's Modified Eagle medium培地(DMEM)(Invitrogen)、colon-26(RCB2657)およびC6(JCRB9096)細胞はRMPI-1640培地(Nakarai)を用い、37℃、5%CO2雰囲気下で培養した。なお、各種培地には10%FBS(ICN)、ペニシリン(100 units/mL)(Nakarai)、ストレプトマイシン(100 μg/mL)(Nakarai)、アムホテリシンB(250 ng/mL)(Nakarai)を添加した。各種細胞へのレポーターベクター導入は、LipofectAMINE2000(Invitrogen)またはLipofectamine PLUS(Invitrogen)を用いた。
【0036】
安定的発現細胞株の構築
レポーターベクターおよびpcDNA3を10:1の割合で混合し、NIH3T3、colon-26およびC6細胞へLipofectAMINE2000を用いて導入し、限界希釈した後、10 cmポリスチレンディッシュへ撒き込みを行った。あらかじめ各細胞におけるジェネティシン(G418 sulfate; Gibco)に対する感受性を評価しておき、処理後7日程度で死滅する濃度を決定した。本濃度で7日間、選択培養を行うことにより染色体に遺伝子導入の起こったジェネティシン耐性細胞を選択した。更に単離した各細胞へ42℃、1時間のヒートショック処理を行い、一晩培養の後、蛍光顕微鏡下で観察することにより目的とする領域(Hsp70プロモータ下流にGFPもしくはDsRedが保持されている領域)が染色体へ導入された細胞株を確定した。本細胞株を継代し、クローン化したものを安定的発現細胞株として実験に用いた。
【0037】
ナノカーボン複合体の毒性評価
BSA-CNH複合体およびNH2-PEG2000-PL-SWNT複合体の細胞毒性は、WST-1法(ミトコンドリア活性)とAnnexin V/PI二重染色(細胞死形態の判定)により評価した。一方、マウスに対するBSA-CNH複合体の毒性評価は、BSA-CNH複合体(CNH濃度:0.01 wt%)を分散化した生理食塩水(100 μL)を7週齢、♀のBALB/cSlcマウス(日本SLC)の皮下に投与し、その接種部位の経時的観察、体重測定、組織切片の病理観察、血液検査により行った。7日後と30日後に血液サンプルを下大静脈より採血し、BioGate社とOriental Yeast社により血液検査が行われた。パラフィン固定化した組織切片の病理検査はHist Science Laboratory社が行った。
【0038】
BSA-CNH複合体の細胞内動態評価
BSA-CNH複合体の細胞内動態を評価するために次の方法によりAlexa488で蛍光標識したBSAを共有結合的手法により表面化学修飾したAlexa488-BSA-CNH複合体を合成した。CNH(50 mg)を70%硝酸水溶液(200 mL)に添加し、加熱還流を行った(130℃、15分間)。氷浴下、得られた溶液に蒸留水(600 mL)を徐々に添加した。次に、蒸留水を用いて溶液が中性になるまで吸引ろ過を行った[PTFE膜(Omnipore)、孔径=100 nm; Millipore]。得られたカルボキシル化CNH(CNH-COOH)が堆積したPTFE膜を蒸留水(50 mL)に入れ、数分間、超音波処理を行った。得られた黒色のCNH-COOH水溶液を液体窒素で予備凍結し、48時間凍結乾燥(EYELA Freeze Dryer FD-5N; Tokyo Rikakikai)を施した。FT-IR(Spectrum-2000; PerkinElmer)により、得られたCNH-COOHに-COOH基(1724 cm-1)および-COO-基(1571 cm-1)が表示されていることを確認した。次に、CNH-COOH (5 mg)と1-ethyl-3-(3-dimethylaminopropyl) carbodiimide hydrochloride(WSC)(50 mg)(Wako)をPBS緩衝液(pH 7.3)(5 mL)に添加し、60 min間、氷冷下(< 8℃)で超音波処理(USD-2R; AS ONE)を施した。当該溶液にAlexa488-BSA(5 mg)を添加し、遮光下、24 h、室温で攪拌後、吸引ろ過(PTFE膜、孔径=100 nm)を施し、PBS緩衝液(pH 7.3)(100 mL)にて洗浄した。得られた黒色粉末を堆積させた膜を10%FBSと25 mM HEPES/NaOH(pH 7.0)から成る各種培地(10 mL)に入れ、1 min間、氷冷下(< 8℃)で超音波処理(USD-2R; AS ONE)を施した。同培地にて100倍希釈後、細胞(2×105 cells/mL)を播種したガラスボトムディッシュ(Matsunami)に当該溶液(2 mL)を添加し、所定の温度(37℃と4℃)で6時間と24時間インキュベート後、共焦点レーザー顕微鏡(FV10i; Olympus)にて観察した。
【0039】
細胞レーザー実験
CNHの光発熱特性を利用した各種細胞の蛍光タンパク質発現実験は、基本的には以下の方法により実施した。10 cmポリスチレン製ディッシュ(Nunc)中で2×105 cells/mLになるように細胞を培養した。アスピレーターにより培地を除去後、PBS緩衝液(pH 7.3)(10 mL)にて洗浄した。2.5%トリプシン(300 μL)を添加し、10% FBSを含む培地(10 mL)を加え、同培地にて10倍希釈した後、4つに分注し、それぞれ遠心分離(室温、1000 rpm、3 min)を施した。アスピレーターで培地を除去後、0.01 wt%CNH分散培地(250 μL)を添加後、当該溶液をPMMA製ディスポーザブルキュベット(Tokyo Glass Kikai)に移し変え、各出力のレーザーを30 min照射した。2 mLの培地を添加後、遠心分離(室温、1000 rpm、3 min)を施し、アスピレーターで培地を除去後、新しいフェノールレッドフリーの培地(2 mL)に溶媒置換し、35 mmポリスチレン製ディッシュ(Nunc、6穴タイプ)中で37℃、5%CO2雰囲気下で一晩インキュベートした。各種蛍光タンパク質の発現量は、蛍光顕微鏡(IX71; Olimpus)にて測定し、イメージ解析ソフト(Image J; NIH)により解析した。一方、CNHの光発熱特性を利用したNIH/3T3細胞のルシフェラーゼ発現実験は、次の方法で実施した。35 mmガラスボトムディッシュ(IWAKI)中に播種したNIH3T3細胞を一晩培養後、BSAによって0.1 wt% CNHを分散した溶液(250 μL)をディッシュ中央に置いた。各出力の670 nmレーザーを照射後、10% FBS、4 mMグルタミン、25 mM HEPES/NaOH(pH 7.0)、200 μM D-ルシフェリン(TOYOBO)から成る2 mLのフェノールレッドフリーDMEM培地(Invitrogen社)に置換した。ルシフェラーゼ発現量は、1分間の積算を7分間隔で遺伝子発現連続測定装置(AB-2250; ATTO)によりリアルタイム測定した。
【0040】
メダカレーザー実験
CNHの光発熱特性を利用したトランスジェニックメダカの蛍光タンパク質発現実験は、以下の方法により実施した。ヒートショックプロモーター(HSP70)に黄色蛍光タンパク質(Venus)を結合させたトランスジェニックメダカは、既報の調製法に従い作製した(非特許文献:S. Oda et al., Identification of a Functional Medaka Heat Shock Promoter and Characterization of Its Ability to Induce Exogenous Gene Expression in Medaka In Vitro and In Vivo. Zoological Science 27, 410-415 (2010).)。PMMA製ディスポーザブルキュベット(Tokyo Glass Kikai)中にBSAにより0.01 wt%のCNHを分散した0.3%人工海水(Marin Art SF; Osaka Yakken)(250 μL)を添加後、1個のトランスジェニックメダカ胚あるいは1匹のトランスジェニックメダカ幼魚を入れた。各出力の670 nmレーザーを30 min照射後、新しい0.3%人工海水(250 μL)に溶媒置換し、ポリスチレン製ディッシュ(Nunc、96穴タイプ)中で、37℃、一晩インキュベートした。トランスジェニックメダカ体内のVenus発現は、蛍光顕微鏡(M205FA; Leica)にて観察した。
【0041】
マウスレーザー実験
CNHの光発熱特性を利用した生体内ルシフェラーゼ発現実験は、以下の方法により実施した。10 cmポリスチレン製ディッシュ(Nunc)中で2×105 cells/mLになるようにNIH3T3細胞を培養した。アスピレーターにより培地を除去後、PBS緩衝液(pH 7.3)(10 mL)にて洗浄した。2.5%トリプシン(300 μL)を添加し、10% FBSを含むDMEM培地(5 mL)を加え、遠心分離(室温、1000 rpm、3 min)を行った。アスピレーターで培地を除去後、0.01 wt%CNHを分散した生理食塩水(100 mL)を添加後、当該溶液50 μLをマウス[8週齢、♀のBALB/cSlc-nu/nu(日本SLC)]皮下2箇所に注入した。赤外線サーモグラフィカメラ(Ti10; Fluke)を用いて各設定温度になるように出力を調整しながらレーザーを30 min間照射した。ルシフェラーゼの発現挙動は、およそ5時間後にin vivoバイオイメージング装置(Nightowl NC320; Berthold technologies)により測定した。
【0042】
以下の表1にCNH複合体を投与したマウスの血液検査の結果を示す。
【0043】
【表1】

【0044】
BSA-CNH複合体の皮下投与有無に関わらず、CBCと生化学検査に大きな変化は見られなかった。とりわけ、炎症性マーカーであるCRPに変化が見られないことからCNHは生体毒性が低いと考えられる。
【0045】
実施例2
CNH複合体を取り込ませた細胞のレーザー照射による遺伝子発現実験
CNHの光発熱特性を利用したNIH3T3細胞のGFP発現実験は、基本的には以下の方法により実施した。10 cmポリスチレン製ディッシュ(Nunc)中で2×105cells/mLになるように細胞を培養した。アスピレーターにより培地を除去後、0.01 wt%CNH分散培地を添加し、24時間インキュベートした。24時間後、細胞をPBS緩衝液(pH 7.3)(10 mL)にて3回洗浄し、細胞内に取り込まれなかったCNH複合体を除去した。2.5%トリプシン(300 μL)を添加し、10% FBSを含む培地(10 mL)を加え、同培地にて10倍希釈した後、4つに分注し、それぞれ遠心分離(室温、1000 rpm、3 min)を施した。アスピレーターで培地を除去し、培地(250 μL)を添加後、当該溶液をPMMA製ディスポーザブルキュベット(Tokyo Glass Kikai)に移し変え、各出力のレーザーを30 min照射した。2 mLの培地を添加後、遠心分離(室温、1000 rpm、3 min)を施し、アスピレーターで培地を除去後、新しいフェノールレッドフリーの培地(2 mL)に溶媒置換し、35 mmポリスチレン製ディッシュ(Nunc、6穴タイプ)中で37℃、5%CO2雰囲気下で一晩インキュベートした。GFP発現量は、蛍光顕微鏡(IX71; Olimpus)にて測定し、イメージ解析ソフト(Image J; NIH)により解析した。結果を図23に示す。
【産業上の利用可能性】
【0046】
次世代の治療システムとして幹細胞を代表とする機能性細胞を利用した治療法(細胞療法、再生医療)に大きな期待が寄せられている。本発明によって、体内に導入したCNHを目的の位置と空間で自由自在に光発熱制御が可能である。従って、本発明を利用すれば、これまで不可能であった、とりわけ高等生物の体内深部における細胞の動態および分化等の時空間制御が可能となるため、新しい細胞療法や再生医療の開発へとつながる強力なツールとなる。
【0047】
癌細胞などの熱に弱い細胞は、42〜43℃程度の加熱により死滅させることができる。近赤外光は外部から生体の深部まで到達させることができるので、赤外光により高効率で発熱する本発明の複合体は癌細胞に選択的に取り込ませることで、癌の温熱療法にも利用できる。
【特許請求の範囲】
【請求項1】
カーボンナノホーン(CNH)に血清アルブミンが結合した複合体。
【請求項2】
前記血清アルブミンがウシ血清アルブミンである、請求項1に記載の複合体。
【請求項3】
請求項1又は2に記載の複合体から構成される、近赤外光により発熱される光発熱体。
【請求項4】
請求項1又は2に記載の複合体の近赤外光により細胞又は生体の一部を発熱するための使用。
【請求項5】
請求項3に記載の発熱体を細胞内又は生体内に埋め込み、近赤外光を照射することを特徴とする、細胞または生体の加熱方法。
【請求項6】
発熱により遺伝子発現が調節可能な外来遺伝子を導入した生体もしくは細胞に請求項1又は2に記載の複合体を導入し、前記複合体に近赤外光を照射することを特徴とする、遺伝子発現調節法。
【請求項1】
カーボンナノホーン(CNH)に血清アルブミンが結合した複合体。
【請求項2】
前記血清アルブミンがウシ血清アルブミンである、請求項1に記載の複合体。
【請求項3】
請求項1又は2に記載の複合体から構成される、近赤外光により発熱される光発熱体。
【請求項4】
請求項1又は2に記載の複合体の近赤外光により細胞又は生体の一部を発熱するための使用。
【請求項5】
請求項3に記載の発熱体を細胞内又は生体内に埋め込み、近赤外光を照射することを特徴とする、細胞または生体の加熱方法。
【請求項6】
発熱により遺伝子発現が調節可能な外来遺伝子を導入した生体もしくは細胞に請求項1又は2に記載の複合体を導入し、前記複合体に近赤外光を照射することを特徴とする、遺伝子発現調節法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【公開番号】特開2013−107866(P2013−107866A)
【公開日】平成25年6月6日(2013.6.6)
【国際特許分類】
【出願番号】特願2012−39102(P2012−39102)
【出願日】平成24年2月24日(2012.2.24)
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【Fターム(参考)】
【公開日】平成25年6月6日(2013.6.6)
【国際特許分類】
【出願日】平成24年2月24日(2012.2.24)
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【Fターム(参考)】
[ Back to top ]

