ハイブリドーマ、モノクローナル抗体及び細胞融合方法
【課題】Hzfタンパク質を検出可能とする抗体、及びその抗体を産出可能とするハイブリドーマ、並びにそのハイブリドーマを製造する細胞融合方法を提供する。
【解決手段】LHPAPGPIRTAHGPILFSPYで免疫した哺乳動物の抗体産生細胞と、哺乳動物の骨髄腫細胞とを細胞融合することにより、ハイブリドーマを得る。ハイブリドーマは、独立行政法人製品評価技術基盤機構特許微生物寄託センターに受領番号NITE AP−853で寄託されている。また、独立行政法人製品評価技術基盤機構特許微生物寄託センターに受領番号NITE AP−854で寄託されている。これらハイブリドーマから産生される抗体は、Hzfタンパク質をイムノブロッティング、免疫沈降法、及び細胞免疫染色法にて検出可能である。
【解決手段】LHPAPGPIRTAHGPILFSPYで免疫した哺乳動物の抗体産生細胞と、哺乳動物の骨髄腫細胞とを細胞融合することにより、ハイブリドーマを得る。ハイブリドーマは、独立行政法人製品評価技術基盤機構特許微生物寄託センターに受領番号NITE AP−853で寄託されている。また、独立行政法人製品評価技術基盤機構特許微生物寄託センターに受領番号NITE AP−854で寄託されている。これらハイブリドーマから産生される抗体は、Hzfタンパク質をイムノブロッティング、免疫沈降法、及び細胞免疫染色法にて検出可能である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ハイブリドーマ、そのハイブリドーマにより産出されるモノクローナル抗体、及びそのハイブリドーマを製造する細胞融合方法に関する。
【背景技術】
【0002】
細胞がストレスを受けると、細胞周期チェックポイント機構の働きにより、一時的な細胞周期停止若しくは細胞老化と呼ばれる恒久的な増殖停止状態に陥る。近年の研究により、細胞老化は個体の老化、癌抑制、及び代謝系疾患等に関与することが示されている。
【0003】
癌抑制タンパク質p53は、細胞老化誘導において中心的な役割を果たすことが知られており、例えば特許文献1には、p53タンパク質及びDNA損傷剤を癌の治療に有効な組み合わせ量でヒトの細胞に接触させる癌治療薬剤が記載されている。また、特許文献2には、p53遺伝子は53kDaの核タンパク質をコードし、p53をコードする野生型遺伝子は抗癌活性を有する旨が記載されている。
【0004】
p53タンパク質は転写因子として働き、GADD45、MDM2、p21CIP1/WAF1、BAX、14-3-3δ等多くの遺伝子群の発現に関与し多彩な生理機能を持つ。近年、非特許文献1に記載されているように、新たにp53タンパク質の標的因子としてRNA結合タンパク質Hzf(hematopoietic zinc finger)が同定された。
【0005】
Hzfタンパク質は、脳と精巣に強く発現し、中枢神経系においては小脳プルキンエ細胞の細胞質及び樹状突起、海馬ニューロン等に発現が認められ、その発現パターンは運動学習に必須である小脳シナプス可塑性に重要な細胞内カルシウムチャネルの一つであるイノシトール3リン酸受容体(IP3R1)と高い類似性を示している。
【0006】
最近の研究により、Hzfタンパク質は、特定のmRNAの翻訳及び局在を調節するRNA結合タンパク質であることが判明し、イノシトール3リン酸受容体(IP3R1)のmRNAの樹状突起への局在に関与している。また、Hzfタンパク質は生体で脂肪組織に強く発現し、DNA損傷に反応して又はArf腫瘍抑制タンパク質により導かれる。
【0007】
しかし、Hzfタンパク質のRNA結合活性は、小脳プルキンエ細胞及び脂肪細胞の機能に必要であるが、mRNA調節の基礎にある分子メカニズムはほとんど解明されていない。
【0008】
Hzfは癌抑制タンパク質p53の標的因子であり、また脂肪細胞の機能に不可欠であると考えられるので、Hzfタンパク質の検出に貢献する抗体が産出されれば、癌及び脂肪機能不全(肥満等)の診断にも貢献する。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】特開2003−277272号公報
【特許文献2】特開2007−190020号公報
【非特許文献】
【0010】
【非特許文献1】Hzf, a p53-Responsive Gene, Regulates Maintenance of the G2 Phase Checkpoint Induced by DNA Damage,Sugimoto et al.,MOLECULAR AND CELLULAR BIOLOGY, Jan. 2006, p. 502-512
【発明の概要】
【発明が解決しようとする課題】
【0011】
本発明はかかる問題点に鑑みてなされたものであって、Hzfタンパク質を検出可能とする抗体、及びその抗体を産出可能とするハイブリドーマ、並びにそのハイブリドーマを製造する細胞融合方法を提供することを目的とする。
【課題を解決するための手段】
【0012】
本発明の第1の観点に係る細胞は、独立行政法人製品評価技術基盤機構特許微生物寄託センターに受領番号NITE AP−853で寄託されたハイブリドーマ(231−9)である。
【0013】
本発明の第2の観点に係る細胞は、独立行政法人製品評価技術基盤機構特許微生物寄託センターに受領番号NITE AP−854で寄託されたハイブリドーマ(391−18)である。
【0014】
本発明の第3の観点に係る細胞融合方法は、LHPAPGPIRTAHGPILFSPY(Leu His Pro Ala Pro Gly Pro Ile Arg Thr Ala His Gly Pro Ile Leu Phe Ser Pro Tyr)で免疫した哺乳動物の抗体産生細胞と、哺乳動物の骨髄腫細胞とを細胞融合することを特徴とする。
【0015】
本発明の第4の観点に係るモノクローナル抗体は、独立行政法人製品評価技術基盤機構特許微生物寄託センターに受領番号NITE AP−853で寄託されたハイブリドーマにより産生される、抗原Hzf-C末ペプチドに対するモノクローナル抗体である。
【0016】
前記Hzf-C末ペプチドは、LHPAPGPIRTAHGPILFSPY(Leu His Pro Ala Pro Gly Pro Ile Arg Thr Ala His Gly Pro Ile Leu Phe Ser Pro Tyr)であることが好ましい。
【0017】
本発明の第5の観点に係るモノクローナル抗体は、独立行政法人製品評価技術基盤機構特許微生物寄託センターに受領番号NITE AP−854で寄託されたハイブリドーマにより産生される、抗原Hzf-C末ペプチドに対するモノクローナル抗体である。
【0018】
前記Hzf-C末ペプチドは、LHPAPGPIRTAHGPILFSPY(Leu His Pro Ala Pro Gly Pro Ile Arg Thr Ala His Gly Pro Ile Leu Phe Ser Pro Tyr)であることが好ましい。
【発明の効果】
【0019】
本発明のモノクローナル抗体によれば、Hzfタンパク質を的確に検出することができる。また、本発明のハイブリドーマは、そのモノクローナル抗体を産出させることができる。
【図面の簡単な説明】
【0020】
【図1】Hzfのイムノブロッティングを示す図であり、コントロール又はsh-Hzfレトロウイルスと共にp19ARF発現レトロウイルスに感染したNIH-3T3からの細胞溶解産物を抗体を使用してイムノブロッティングした図である。
【図2】Hzfのイムノブロッティングを示す図であり、3T3-L1からの細胞溶解産物を抗体を使用してイムノブロッティングした図である。
【図3】Hzfの免疫沈降法を示す図であり、Hzfレトロウイルスに感染させたNIH-3T3細胞溶解産物を、モノクローナル抗体231-9及び391-18にて免疫沈降し、M2-HRPにて検出した図である。
【図4】Hzfの免疫沈降法を示す図であり、Hzfレトロウイルスに感染させたNIH-3T3細胞溶解産物を、モノクローナル抗体231-9及び391-18にて免疫沈降し、ビオチンラベルされたHzf抗体(231-9)にて検出した図である。
【図5】細胞免疫染色法に基づくモノクローナル抗体231-9及び391-18によるHzfタンパク質の検出を示す図である。
【発明を実施するための形態】
【0021】
(細胞融合)
抗原として、キーホール・リンペット・ヘモシアニン(keyhole limpet hemocyanin:KLH)に共役するマウス/ヒトHzf-C末ペプチドを用いる。Hzf-C末ペプチドは、LHPAPGPIRTAHGPILFSPY(Leu His Pro Ala Pro Gly Pro Ile Arg Thr Ala His Gly Pro Ile Leu Phe Ser Pro Tyr)である。Hzfペプチドは、マウスとヒトとの間で相同性を有する。
【0022】
上記の抗原を、3〜10週齢好ましくは4週齢のマウスに投与する。免疫は、既存の方法であれば何れの方法をも用いることができるが、主として腹腔内、静脈内、皮下に適当なアジュバンド、例えば市販のフロイント完全アジュバンド、フロイントの不完全アジュバンド、水酸化アルミニウムゲル、BCG、百日咳菌ワクチン等とともに注入するのが好ましい。
【0023】
免疫の間隔は特に限定されないが、例えば1週間から10日間おきに2〜5回免疫する。抗原の免疫量は例えば1回にラット若しくはマウス1匹当たり、50〜500μg用いる。最終の免疫日から4〜10日後に抗体産生細胞を採集する。抗体産生細胞としては、特に限定されるものではないが、例えばリンパ節細胞、脾臓細胞、胸腺細胞、末梢血細胞が挙げられる。かかる抗体産生細胞は、マウスからリンパ節、脾臓、胸腺、末梢血等を採取して組織を破砕する。得られる破砕物をPBS、DMEM、RPMI1640、E-RDF等の培地又は緩衝液に懸濁し、100〜250μmのナイロンメッシュ等で濾過した後に、遠心分離を行うこと等により抗体産生細胞を調製する。
【0024】
上記の抗体産生細胞と融合させる骨髄腫(ミエローマ)細胞としては、マウスから得られた当業者が入手可能な株化細胞を使用する。使用する細胞株は、薬剤抵抗性を有し、未融合の状態では選択培地(例えばHAT培地)で生存できず、抗体産生細胞として融合した状態でのみ生存できる性質を有するものが好ましい。骨髄腫細胞は、特に限定されるものではないが、例えばP3 X63 Ag8U.1(P3U1)[ATCC CRL-1580; Current Topics in Microbiology and Immunology, 81, 1-7(1978)]、Sp2/0-Ag14[ATCC CRL-1581 ; Nature, 276, 271 (1978)]、P3X63Ag8[ATCC TIB-9; Nature, 256, 495-497(1978)]、P3X63Ag8.653[ATCC TIB-18; Europian J. Immunology,6, 511-519(1976)]、P2/NSI/1-Ag4-1[ATCC CRL-1581; Nature, 276, 269-270(1978)]等のマウス骨髄腫細胞株等が使用され、中でもP3U1が好ましい。
【0025】
LHPAPGPIRTAHGPILFSPYで免疫した抗体産生細胞と、上記で得られた骨髄腫細胞とを細胞融合させる。細胞融合は例えばDMEM、MEM、RPMI-1640、E-RDF等の動物細胞培養用培地中で107〜108細胞/mLの骨髄腫細胞と抗体産生細胞とを、混合比1:1〜1:10の割合で、32〜37℃で1〜15分間細胞同士を接触させることによって効率的に融合反応を進める。
【0026】
細胞融合を促進させるためには、平均分子量2,000〜8,000のポリエチレングリコール、ポリビニールアルコール、又はセンダイウイルス等の融合促進剤や融合ウイルスを使用できる。また、電気刺激を利用した市販の細胞融合装置を用いて抗体産生細胞と骨髄腫細胞とを融合させてもよい。
【0027】
次に、細胞融合処理後の細胞から目的とするハイブリドーマを選別する。ハイブリドーマの選別は、選択培地における細胞の選択的増殖を利用する方法を用いることができる。細胞懸濁液を、例えばHAT(hypoxanthine-aminoprotein-thymidine)を添加したGIT培地(IMDM)に103〜107細胞/mLとなるよう希釈後、96ウェルの細胞培養用マイクロプレートに102〜106細胞/ウェル播種して、各ウェルに例えばHAT培地等の選択培地を加えて、以後は適宜選択培地を交換して培養を行う。その結果、培養6〜10日前後から生育してくる細胞をハイブリドーマとして得ることができる。本実施形態に係る細胞は混在した状態で得られるので、細胞をひとつずつ分取(クローニング)し、その中から抗原に強く反応するハイブリドーマクローン231-9細胞(独立行政法人製品評価技術基盤機構特許微生物寄託センターに受領番号NITE AP−853で寄託)と、ハイブリドーマクローン391-18細胞(独立行政法人製品評価技術基盤機構特許微生物寄託センターに受領番号NITE AP−854で寄託)とを得る。
【0028】
ハイブリドーマのスクリーニングは通常の方法によれば良く、特に限定はされない。例えば、ハイブリドーマとして生育したウェルに含まれる培養上清の一部を採集し、抗原に該上清を添加した後、標識した第二抗体を加えてインキュベートし、その結合能を酵素免疫測定法(ELISA)によって測定することができる。
【0029】
(モノクローナル抗体)
取得したハイブリドーマからモノクローナル抗体を採取する方法は、特に限定されるものではないが、例えば通常の腹水形成法や細胞培養法等を用いることが可能である。腹水形成法においては、骨髄腫細胞由来の哺乳動物と同種の動物の腹腔内にプリスタン(2,6,10,14−テトラメチルペンタデカン)等の鉱物油を投与し、その後ハイブリドーマ1×106〜1×109個、好ましくは1×107〜1×108個を腹腔内に投与し、ハイブリドーマを大量に増殖させる。そして、1〜4週間、好適には2〜3週間後に腹水又は血清を採集する。
【0030】
細胞培養法においては、ハイブリドーマを10〜20%仔ウシ血清含有IMDM、RPMI-1640、MEM、E-RDF又は無血清培地等の動物細胞培養培地中で、通常の培養条件(例えば37℃,5%CO2濃度)で3〜14日間培養し、その培養上清から抗体を取得することができる。
【0031】
なお、抗体の精製が必要とされる場合は、硫安塩析法、DEAEセルロース等の陰イオン交換体を利用するイオン交換クロマトグラフィー、プロテインAセファロース等を用いるアフィニティークロマトグラフィー、分子量や構造によってふるい分ける分子ふるいクロマトグラフィー等の公知の方法を適宜に選択して精製することが可能である。
【0032】
以上のようにして本実施形態に係るモノクローナル抗体を得ることができる。
【実施例】
【0033】
(細胞及び培養条件)
NIH-3T3線維芽細胞、Arf誘導NIH-3T3細胞亜株MT-Arf、及び293T細胞は、10%胎生仔牛血清(FCS)及びペニシリン/ストレプトマイシンを添加したダルベコの改変イーグル培地(DMEM、ワコー純薬化学工業、大阪、日本)中にて維持された。腹膜マクロファージ、P3U1骨髄腫細胞、及びハイブリドーマ細胞は、抗生物質非添加のGIT培地(日本製薬、大阪、日本)にて維持された。
【0034】
(免疫化)
抗原として、キーホール・リンペット・ヘモシアニン(keyhole limpet hemocyanin:KLH)に共役したマウス/ヒトHzf-C末ペプチド(LHPAPGPIRTAHGPILFSPY)(サーモフィッシャーサイエンティフィック株式会社製)を用意した。このペプチドの配列は過去の研究におけるウサギHzfポリクローナル抗血清を確立するために使用された。50μgのKLH-共役Hzfペプチドを、6週齢雌ウィスターラットの肉球に注入した。10日おきに3回の50μgのHzfペプチドの追加注入を行った。夫々の追加注入の1週間後に、尾静脈から得たテスト血清がELISAによってスクリーニングされた。ELISAにより十分な免疫反応が得られたら、10日後に最終注入を行い、さらにその4日後に免疫動物からリンパ節を摘出し、抗体産生細胞を融合のために準備した。
【0035】
(ELISAスクリーニング)
ポリスチレンの96ウェルプレートをHzf-C末ペプチドにて4℃で一晩コートし、37℃にて0.1%w/vウシ血清アルブミン(BSA)を含むPBS中で1時間ブロックした。ハイブリドーマの培養上清又は免疫動物の血清を添加し、37℃にて1時間インキュベートした。PBSにて3回洗浄した後、プレートは37℃にて1時間、アルカリフォスファターゼ共役ヤギ抗ラットIgG抗体存在下でインキュベートした。PBSにて3回洗浄した後、プレートに基質溶液を添加し、37℃にてインキュベートした。陽性クローンの判定は、マイクロプレートリーダーにて405nmの吸光度測定により行った。
【0036】
(細胞融合、ハイブリドーマスクリーニング、サブクローニング、及びイソタイピング)
KLHに共役したマウスHzf-C末ペプチド(LHPAPGPIRTAHGPILSPY)にてラットを免疫した。KLH非共役Hzf-C末ペプチドを使用したELISAにより、免疫動物から血清のスクリーニングを行った。ゲノムONE-CF(石原産業、大阪、日本)を使用して、通常の手法によりラットリンパ細胞サスペンジョンを5:1の割合で骨髄腫細胞P3U1と融合した。
【0037】
X線照射処理を行った腹膜マクロファージ存在下で、ハイブリドーマをHAT(hypoxanthine-aminoprotein-thymidine)を添加したGIT培地にて選択し、1248ウェル中1004ウェルにおいて増殖するハイブリドーマが観察された。夫々のウェルから上清を回収し、第1ELISAを行った結果、10ウェルのハイブリドーマ上清がHzfペプチドと強く反応することが確認された。これらのウェルから細胞を回収し、第2ELISAスクリーニングのために限界希釈(96ウェルプレートに1ウェルあたり0.8〜1個の細胞になるように播種)を行った。9つのクローンが第2スクリーニングにて得られ、これらのクローンの全てがIgG2aイソタイプの抗体を産生し、イムノブロッティングにおいてNIH-3T3細胞に発現させたフラッグタグ融合Hzfタンパク質と反応した。得られたHzf抗体産生細胞培地は、徐々にマクロファージ無しの無添加GIT培地に置換された。
【0038】
(モノクローナル抗体の精製)
プリスタン(2,6,10,14−テトラメチルペンタデカン)(ワコー純薬化学工業)投与後、10日目のSCID(Severe Combined Immunodeficient)マウスの腹腔内に、陽性ハイブリドーマクローン(231-9若しくは391-18、1×107セル/クローン)を注入した。2〜3週間後これらのマウスから腹水液を得、0.313g/mLの最終濃度まで(NH4)2SO4を徐々に滴下し、イムノグロブリンを沈降させた。遠心分離によりイムノグロブリンを回収し、2.5mLのPBSに懸濁した。脱塩処理後、231-9の一部分をECLタンパク質ビオチン標識システム(GEヘルスケア UK)を使用してビオチン標識した。
【0039】
(レトロウイルス発現プラスミド、レトロウイルスベクター生産、及び感染)
293T細胞にレトロウイルス発現プラスミドをトランスフェクトし、24〜60時間後に培養上清をウィルス液として回収した。10cm径の細胞培養用シャーレの上で増殖中の細胞を、8μg/mLのポリブレンを含むウィルス液で感染させた。感染は、GFPタンパク質発現によるフローサイトメトリーアッセイ又は薬剤耐性選択により確認した。
【0040】
(イムノブロッティング)
モノクローナル抗体231-9及び391-18が、イムノブロッティングにて内在性Hzfタンパク質を検出できるか否かを調べた。細胞は、RIPA緩衝液(10mM リン酸ナトリウム[pH7.2]、150mM塩化ナトリウム、2mM EDTA、0.1% SDS、1% デオキシコレートナトリウム、1% NP-40、及びプロテアーゼ阻害剤)を添加して溶解し、さらに20秒間氷上にて超音波破砕を行った。不溶性画分は、4℃で10分間15,000gの遠心分離にて除き、溶解液中のタンパク質濃度をBCAアッセイにて定量した。20μgのタンパク質を変性ポリアクリルアミドゲルの上で分離し、二フッ化ポリビニリデン膜(PVDF膜)に転写した。PVDF膜は、5%スキムミルクを含有するTBS-T(10mM トリス[pH7.4]、150mM 塩化ナトリウム、及び0.1%ツウィーン20)中にてブロッキングした。PVDF膜は、5%スキムミルク含有TBS-Tで希釈した一次抗体にて1時間反応させ、TBS-Tにて3回洗浄し、さらにHRPと共役した二次抗体と反応させた。TBS-Tにて数回洗浄した後、イモビロン(ミリポア社)にて検出を行った。Hzfタンパク質は231-9、391-18又はビオチンラベルされた231-9にて検出した。フラッグエピトープタグ(M2-HRP、シグマ)、p19ARF(5C3-1、サンタクルツバイオテクノロジー)、C/EBPδ、及びβ−チューブリン(シグマ)を検出するために、市販の抗体を使用した。
【0041】
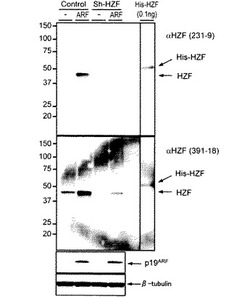
コントロールあるいはsh-Hzfウイルスを感染させたNIH-3T3細胞にさらにp19ARF発現レトロウイルスを感染させ、夫々の細胞溶解産物を変性ポリアクリルアミドゲル上にて分離し、PVDF膜上に転写し、Hzfモノクローナル抗体を使用してブロットした。ポジティブコントロールとして、バクテリアにて産生したHis-Hzfタンパク質を使用した。図1は、コントロール又はsh-Hzfレトロウイルスと共にp19ARF発現レトロウイルスに感染させたNIH-3T3からの細胞溶解産物をHzf抗体でイムノブロッティングを行ったものである。図1に示されるように、モノクローナル抗体231-9及び391-18は、共に内在性Hzfタンパク質を検出することが可能であり、p19ARF発現レトロウイルスがHzfタンパク質の更なる蓄積を誘導した。内在性Hzfが効率的に抑制されたsh-Hzf感染細胞においては、Hzfタンパク質は両方のモノクローナル抗体231-9及び391-18によって検知困難であり、これらのモノクローナル抗体231-9及び391-18が高い特異性を持つことを確認した。
【0042】
図2は、3T3-L1からの細胞溶解産物をHzf抗体を使用してイムノブロッティングしたものである。コントロール又はsh-Hzfレトロウイルスを感染させた3T3-L1細胞を3日間の分化刺激(5μg/mLインシュリン、1μMデキサメタゾン、及び0.5mM 1−メチル−3−イソブチルザンチン)を行い、脂肪細胞へと分化させ、細胞溶解液を調製し、それぞれの抗体を使用してイムノブロッティングを行った。分化はC/EBPδの発現により確認し、βチューブリンをコントロールとして使用した。脂肪分化刺激によるHzfタンパク質の誘導は、コントロールウイルス感染3T3-L1細胞において明白に両モノクローナル抗体(231-9及び391-18)により検知されたが、sh-Hzfを感染させた細胞においては検出されず、これらのモノクローナル抗体231-9及び391-18がイムノブロッティングにおいて内在性Hzfタンパク質の検出を高効率に行うことができることを確認した。
【0043】
(免疫沈降法)
次に、これらのモノクローナル抗体231-9及び391-18がHzfタンパク質を免疫沈降できるか否かを調べた。細胞溶液を10%グリセロール及びプロテアーゼ抑制剤を含有する免疫沈降(IP)用緩衝液(50mM N−2−ヒドロキシエチルピペラジン−N’−2−硫酸エタン[HEPES、pH7.5]、150mM塩化ナトリウム、1mM EDTA、2.5mM EGTA、1mM ジチオトレイトール、0.1%ツウィーン20)を使用して調製し、さらに5秒間の氷上での超音波処理を行った。不溶性画分は、4℃で10分間15,000gの遠心分離にて除き、溶解液中のタンパク質濃度をBCAアッセイにて定量した。IP用緩衝液で平衡化した5μgのモノクローナル抗体(231-9又は391-18)を、10μLのプロテインG−セファロースと共に、1μg/μLに調製した細胞溶解産物500μLと4℃にて12時間反応させた。IP反応産物を1mLのIP緩衝液にて3回洗浄後、短期の遠心分離にて回収し、Laemmli SDSゲルサンプル緩衝液に懸濁した。
【0044】
NIH-3T3細胞をフラッグタグ融合マウス全長Hzfをコードするレトロウイルスに感染させた。細胞溶解産物を、5μgのモノクローナル抗体231-9、又は5μgのモノクローナル抗体391-18と混合され、プロテインG−セファロースが加えられた。ネガティブコントロールとして抗体無添加にてIPを行った。IP後のHzfタンパク質の検出には、フラッグ抗体又はビオチンラベルした231-9Hzfモノクローナル抗体を使用したイムノブロッティングを行った。
【0045】
図3は、Hzfレトロウイルスに感染させたNIH-3T3細胞溶解産物をモノクローナル抗体231-9及び391-18にてIPし、M2-HRPを用いて検出した図であり、図4は、ビオチンラベルされたHzf抗体(231-9)にて検知したものである。イムノ錯体はプロテインG−セファロースを使用して回収し、変性ポリアクリルアミドゲルにて分離され、PVDF膜に転写後、フラッグエピトープに対するHRP共役抗体、若しくはビオチン化Hzf抗体(231-9)にて反応後HRP共役ストレプトアビジンを用いて検出された。図3において、*は非特異性タンパク質の検出を示す。図3及び図4に示すように、フラッグタグHzfタンパク質が231-9又は391-18モノクローナル抗体の存在下にてIPされたが、抗体が非存在下ではIPされなかった。ウサギポリクローナルHzf抗体ではHzfタンパク質のIPはできなかった。これらの結果から、ウサギのポリクローナル抗体と比較してモノクローナル抗体231-9及び391-18は効率的にマウスHzfタンパク質をIPさせることができることが示された。モノクローナル抗体231-9及び391-18は共にIgG2aサブタイプであるが、図3に示すように、フラッグタグ融合Hzfタンパク質をM2-HRPにより検出した場合、モノクローナル抗体231-9のみ約40kDaのM2-HRPと反応する非特異的タンパク質をIPした。これにより、モノクローナル抗体231-9及び391-18は、同一のクローン由来ではない可能性が示唆された。
【0046】
(細胞免疫染色法)
次に、モノクローナル抗体231-9及び391-18が、MT-Arf細胞におけるHzfを免疫染色可能であるかを調べた。カバーグラス上で培養した細胞をPBSで3回洗浄し、4%パラホルムアルデヒドにて15分間固定し、PBSで洗浄後、0.5%トリトンX-100含有PBS中にて15分間にて処理した。固定された細胞をPBSで3回洗浄し、10%FCS含有PBSにて1時間ブロッキングを行い、10%FCS含有PBSに10μg/mLになるように希釈したHzfモノクローナル抗体(231-9又は391-18)と1時間反応させた。次にPBSで3回洗浄し、10%FCS含有PBS中にて、Cy3(登録商標、CyDye DIGE Fluor saturation dye, GE Healthcare Biosciences, Uppsala, Sweden)ラベルヤギ抗ラットIgGと1時間反応させ、Hzfタンパク質を蛍光顕微鏡にて観察した。
【0047】
MT-Arf細胞をカバーグラス上で培養し、パラホルムアルデヒドにて固定し、モノクローナル抗体231-9又は391-18にて反応させ、その後Cy3と共役したヤギ抗ラットIgGと反応させた。MT-Arf細胞は、メタロチオニンプロモータのコントロール下で外来性p19ARFを発現する。硫酸亜鉛の添加によりこの細胞ではp19ARFタンパク質が発現し、続いて内在性Hzfタンパク質が誘導される。
【0048】
図5は、細胞免疫染色法に基づくモノクローナル抗体231-9及び391-18によるHzfの細胞免疫染色を示すものである。MT-Arf細胞を通常培地若しくは80μM硫酸亜鉛を含む培地で24時間培養し、4%パラホルムアルデヒドにて固定し、モノクローナル抗体231-9及び391-18を使用した細胞免疫染色を行った。細胞核はDAPIにより染色された。図5に示すように、両モノクローナル抗体231-9及び391-18は、MT-Arf細胞にて特に核質を染色した。加えて両モノクローナル抗体231-9及び391-18無しでシグナルは検知されなかった。両モノクローナル抗体231-9及び391-18により、NIH-3T3細胞及び未処置MT-Arf細胞においても若干のHzfタンパク質が検出された。これらの結果は、ウサギポリクローナルHzf抗体を使用した過去の研究と一致している。
【0049】
以上、上述したように、両モノクローナル抗体231-9及び391-18は、ウサギポリクローナル抗体と比較して、イムノブロッティング及び細胞免疫染色共に、内在性及びリコビナントHzfタンパク質の検出に非常に効率的であった。また、Hzfタンパク質は、両モノクローナル抗体231-9及び391-18共に効率的にIP可能であった。免疫に使用したHzfペプチドは、マウス-ヒト間で一致した配列であることから、両モノクローナル抗体231-9及び391-18はヒトHzfタンパク質の検出にも使用できると考えられる。
【0050】
HzfはIP3R及びC/EBPαmRNAと相互作用し、C2H2タイプZnフィンガー領域を介してそれらの局在及び翻訳を調節する。このmRNA調節の正確なメカニズムは現在不明であるが、Hzf相互作用タンパク質の同定を行うことにより、mRNA調節機構の解明へとつながることが期待される。ウサギポリクローナル抗体よりも効率的に両モノクローナル抗体231-9及び391-18はHzfタンパク質をIPできるため、これらモノクローナル抗体は極めて有益であることが判明した。IPサンプルから抽出したRNAのマイクロアレイ解析を行うことにより、Hzfの標的となる他のRNA分子をも同定することが可能であると考えられる。ヒトHzf遺伝子は染色体12q13に存在するが、この遺伝子領域はヒト・2型糖尿病患者サンプルを用いた連鎖解析により疾患と強いリンクがあることが示されているため、Hzfがこの疾患に関与する可能性が示唆される。以上より、両モノクローナル抗体231-9及び391-18は、HzfによるRNA調節の分子メカニズムの研究に役立つのみならず、癌及び脂肪機能不全(肥満等)の診断にも貢献すると考えられる。
【技術分野】
【0001】
本発明は、ハイブリドーマ、そのハイブリドーマにより産出されるモノクローナル抗体、及びそのハイブリドーマを製造する細胞融合方法に関する。
【背景技術】
【0002】
細胞がストレスを受けると、細胞周期チェックポイント機構の働きにより、一時的な細胞周期停止若しくは細胞老化と呼ばれる恒久的な増殖停止状態に陥る。近年の研究により、細胞老化は個体の老化、癌抑制、及び代謝系疾患等に関与することが示されている。
【0003】
癌抑制タンパク質p53は、細胞老化誘導において中心的な役割を果たすことが知られており、例えば特許文献1には、p53タンパク質及びDNA損傷剤を癌の治療に有効な組み合わせ量でヒトの細胞に接触させる癌治療薬剤が記載されている。また、特許文献2には、p53遺伝子は53kDaの核タンパク質をコードし、p53をコードする野生型遺伝子は抗癌活性を有する旨が記載されている。
【0004】
p53タンパク質は転写因子として働き、GADD45、MDM2、p21CIP1/WAF1、BAX、14-3-3δ等多くの遺伝子群の発現に関与し多彩な生理機能を持つ。近年、非特許文献1に記載されているように、新たにp53タンパク質の標的因子としてRNA結合タンパク質Hzf(hematopoietic zinc finger)が同定された。
【0005】
Hzfタンパク質は、脳と精巣に強く発現し、中枢神経系においては小脳プルキンエ細胞の細胞質及び樹状突起、海馬ニューロン等に発現が認められ、その発現パターンは運動学習に必須である小脳シナプス可塑性に重要な細胞内カルシウムチャネルの一つであるイノシトール3リン酸受容体(IP3R1)と高い類似性を示している。
【0006】
最近の研究により、Hzfタンパク質は、特定のmRNAの翻訳及び局在を調節するRNA結合タンパク質であることが判明し、イノシトール3リン酸受容体(IP3R1)のmRNAの樹状突起への局在に関与している。また、Hzfタンパク質は生体で脂肪組織に強く発現し、DNA損傷に反応して又はArf腫瘍抑制タンパク質により導かれる。
【0007】
しかし、Hzfタンパク質のRNA結合活性は、小脳プルキンエ細胞及び脂肪細胞の機能に必要であるが、mRNA調節の基礎にある分子メカニズムはほとんど解明されていない。
【0008】
Hzfは癌抑制タンパク質p53の標的因子であり、また脂肪細胞の機能に不可欠であると考えられるので、Hzfタンパク質の検出に貢献する抗体が産出されれば、癌及び脂肪機能不全(肥満等)の診断にも貢献する。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】特開2003−277272号公報
【特許文献2】特開2007−190020号公報
【非特許文献】
【0010】
【非特許文献1】Hzf, a p53-Responsive Gene, Regulates Maintenance of the G2 Phase Checkpoint Induced by DNA Damage,Sugimoto et al.,MOLECULAR AND CELLULAR BIOLOGY, Jan. 2006, p. 502-512
【発明の概要】
【発明が解決しようとする課題】
【0011】
本発明はかかる問題点に鑑みてなされたものであって、Hzfタンパク質を検出可能とする抗体、及びその抗体を産出可能とするハイブリドーマ、並びにそのハイブリドーマを製造する細胞融合方法を提供することを目的とする。
【課題を解決するための手段】
【0012】
本発明の第1の観点に係る細胞は、独立行政法人製品評価技術基盤機構特許微生物寄託センターに受領番号NITE AP−853で寄託されたハイブリドーマ(231−9)である。
【0013】
本発明の第2の観点に係る細胞は、独立行政法人製品評価技術基盤機構特許微生物寄託センターに受領番号NITE AP−854で寄託されたハイブリドーマ(391−18)である。
【0014】
本発明の第3の観点に係る細胞融合方法は、LHPAPGPIRTAHGPILFSPY(Leu His Pro Ala Pro Gly Pro Ile Arg Thr Ala His Gly Pro Ile Leu Phe Ser Pro Tyr)で免疫した哺乳動物の抗体産生細胞と、哺乳動物の骨髄腫細胞とを細胞融合することを特徴とする。
【0015】
本発明の第4の観点に係るモノクローナル抗体は、独立行政法人製品評価技術基盤機構特許微生物寄託センターに受領番号NITE AP−853で寄託されたハイブリドーマにより産生される、抗原Hzf-C末ペプチドに対するモノクローナル抗体である。
【0016】
前記Hzf-C末ペプチドは、LHPAPGPIRTAHGPILFSPY(Leu His Pro Ala Pro Gly Pro Ile Arg Thr Ala His Gly Pro Ile Leu Phe Ser Pro Tyr)であることが好ましい。
【0017】
本発明の第5の観点に係るモノクローナル抗体は、独立行政法人製品評価技術基盤機構特許微生物寄託センターに受領番号NITE AP−854で寄託されたハイブリドーマにより産生される、抗原Hzf-C末ペプチドに対するモノクローナル抗体である。
【0018】
前記Hzf-C末ペプチドは、LHPAPGPIRTAHGPILFSPY(Leu His Pro Ala Pro Gly Pro Ile Arg Thr Ala His Gly Pro Ile Leu Phe Ser Pro Tyr)であることが好ましい。
【発明の効果】
【0019】
本発明のモノクローナル抗体によれば、Hzfタンパク質を的確に検出することができる。また、本発明のハイブリドーマは、そのモノクローナル抗体を産出させることができる。
【図面の簡単な説明】
【0020】
【図1】Hzfのイムノブロッティングを示す図であり、コントロール又はsh-Hzfレトロウイルスと共にp19ARF発現レトロウイルスに感染したNIH-3T3からの細胞溶解産物を抗体を使用してイムノブロッティングした図である。
【図2】Hzfのイムノブロッティングを示す図であり、3T3-L1からの細胞溶解産物を抗体を使用してイムノブロッティングした図である。
【図3】Hzfの免疫沈降法を示す図であり、Hzfレトロウイルスに感染させたNIH-3T3細胞溶解産物を、モノクローナル抗体231-9及び391-18にて免疫沈降し、M2-HRPにて検出した図である。
【図4】Hzfの免疫沈降法を示す図であり、Hzfレトロウイルスに感染させたNIH-3T3細胞溶解産物を、モノクローナル抗体231-9及び391-18にて免疫沈降し、ビオチンラベルされたHzf抗体(231-9)にて検出した図である。
【図5】細胞免疫染色法に基づくモノクローナル抗体231-9及び391-18によるHzfタンパク質の検出を示す図である。
【発明を実施するための形態】
【0021】
(細胞融合)
抗原として、キーホール・リンペット・ヘモシアニン(keyhole limpet hemocyanin:KLH)に共役するマウス/ヒトHzf-C末ペプチドを用いる。Hzf-C末ペプチドは、LHPAPGPIRTAHGPILFSPY(Leu His Pro Ala Pro Gly Pro Ile Arg Thr Ala His Gly Pro Ile Leu Phe Ser Pro Tyr)である。Hzfペプチドは、マウスとヒトとの間で相同性を有する。
【0022】
上記の抗原を、3〜10週齢好ましくは4週齢のマウスに投与する。免疫は、既存の方法であれば何れの方法をも用いることができるが、主として腹腔内、静脈内、皮下に適当なアジュバンド、例えば市販のフロイント完全アジュバンド、フロイントの不完全アジュバンド、水酸化アルミニウムゲル、BCG、百日咳菌ワクチン等とともに注入するのが好ましい。
【0023】
免疫の間隔は特に限定されないが、例えば1週間から10日間おきに2〜5回免疫する。抗原の免疫量は例えば1回にラット若しくはマウス1匹当たり、50〜500μg用いる。最終の免疫日から4〜10日後に抗体産生細胞を採集する。抗体産生細胞としては、特に限定されるものではないが、例えばリンパ節細胞、脾臓細胞、胸腺細胞、末梢血細胞が挙げられる。かかる抗体産生細胞は、マウスからリンパ節、脾臓、胸腺、末梢血等を採取して組織を破砕する。得られる破砕物をPBS、DMEM、RPMI1640、E-RDF等の培地又は緩衝液に懸濁し、100〜250μmのナイロンメッシュ等で濾過した後に、遠心分離を行うこと等により抗体産生細胞を調製する。
【0024】
上記の抗体産生細胞と融合させる骨髄腫(ミエローマ)細胞としては、マウスから得られた当業者が入手可能な株化細胞を使用する。使用する細胞株は、薬剤抵抗性を有し、未融合の状態では選択培地(例えばHAT培地)で生存できず、抗体産生細胞として融合した状態でのみ生存できる性質を有するものが好ましい。骨髄腫細胞は、特に限定されるものではないが、例えばP3 X63 Ag8U.1(P3U1)[ATCC CRL-1580; Current Topics in Microbiology and Immunology, 81, 1-7(1978)]、Sp2/0-Ag14[ATCC CRL-1581 ; Nature, 276, 271 (1978)]、P3X63Ag8[ATCC TIB-9; Nature, 256, 495-497(1978)]、P3X63Ag8.653[ATCC TIB-18; Europian J. Immunology,6, 511-519(1976)]、P2/NSI/1-Ag4-1[ATCC CRL-1581; Nature, 276, 269-270(1978)]等のマウス骨髄腫細胞株等が使用され、中でもP3U1が好ましい。
【0025】
LHPAPGPIRTAHGPILFSPYで免疫した抗体産生細胞と、上記で得られた骨髄腫細胞とを細胞融合させる。細胞融合は例えばDMEM、MEM、RPMI-1640、E-RDF等の動物細胞培養用培地中で107〜108細胞/mLの骨髄腫細胞と抗体産生細胞とを、混合比1:1〜1:10の割合で、32〜37℃で1〜15分間細胞同士を接触させることによって効率的に融合反応を進める。
【0026】
細胞融合を促進させるためには、平均分子量2,000〜8,000のポリエチレングリコール、ポリビニールアルコール、又はセンダイウイルス等の融合促進剤や融合ウイルスを使用できる。また、電気刺激を利用した市販の細胞融合装置を用いて抗体産生細胞と骨髄腫細胞とを融合させてもよい。
【0027】
次に、細胞融合処理後の細胞から目的とするハイブリドーマを選別する。ハイブリドーマの選別は、選択培地における細胞の選択的増殖を利用する方法を用いることができる。細胞懸濁液を、例えばHAT(hypoxanthine-aminoprotein-thymidine)を添加したGIT培地(IMDM)に103〜107細胞/mLとなるよう希釈後、96ウェルの細胞培養用マイクロプレートに102〜106細胞/ウェル播種して、各ウェルに例えばHAT培地等の選択培地を加えて、以後は適宜選択培地を交換して培養を行う。その結果、培養6〜10日前後から生育してくる細胞をハイブリドーマとして得ることができる。本実施形態に係る細胞は混在した状態で得られるので、細胞をひとつずつ分取(クローニング)し、その中から抗原に強く反応するハイブリドーマクローン231-9細胞(独立行政法人製品評価技術基盤機構特許微生物寄託センターに受領番号NITE AP−853で寄託)と、ハイブリドーマクローン391-18細胞(独立行政法人製品評価技術基盤機構特許微生物寄託センターに受領番号NITE AP−854で寄託)とを得る。
【0028】
ハイブリドーマのスクリーニングは通常の方法によれば良く、特に限定はされない。例えば、ハイブリドーマとして生育したウェルに含まれる培養上清の一部を採集し、抗原に該上清を添加した後、標識した第二抗体を加えてインキュベートし、その結合能を酵素免疫測定法(ELISA)によって測定することができる。
【0029】
(モノクローナル抗体)
取得したハイブリドーマからモノクローナル抗体を採取する方法は、特に限定されるものではないが、例えば通常の腹水形成法や細胞培養法等を用いることが可能である。腹水形成法においては、骨髄腫細胞由来の哺乳動物と同種の動物の腹腔内にプリスタン(2,6,10,14−テトラメチルペンタデカン)等の鉱物油を投与し、その後ハイブリドーマ1×106〜1×109個、好ましくは1×107〜1×108個を腹腔内に投与し、ハイブリドーマを大量に増殖させる。そして、1〜4週間、好適には2〜3週間後に腹水又は血清を採集する。
【0030】
細胞培養法においては、ハイブリドーマを10〜20%仔ウシ血清含有IMDM、RPMI-1640、MEM、E-RDF又は無血清培地等の動物細胞培養培地中で、通常の培養条件(例えば37℃,5%CO2濃度)で3〜14日間培養し、その培養上清から抗体を取得することができる。
【0031】
なお、抗体の精製が必要とされる場合は、硫安塩析法、DEAEセルロース等の陰イオン交換体を利用するイオン交換クロマトグラフィー、プロテインAセファロース等を用いるアフィニティークロマトグラフィー、分子量や構造によってふるい分ける分子ふるいクロマトグラフィー等の公知の方法を適宜に選択して精製することが可能である。
【0032】
以上のようにして本実施形態に係るモノクローナル抗体を得ることができる。
【実施例】
【0033】
(細胞及び培養条件)
NIH-3T3線維芽細胞、Arf誘導NIH-3T3細胞亜株MT-Arf、及び293T細胞は、10%胎生仔牛血清(FCS)及びペニシリン/ストレプトマイシンを添加したダルベコの改変イーグル培地(DMEM、ワコー純薬化学工業、大阪、日本)中にて維持された。腹膜マクロファージ、P3U1骨髄腫細胞、及びハイブリドーマ細胞は、抗生物質非添加のGIT培地(日本製薬、大阪、日本)にて維持された。
【0034】
(免疫化)
抗原として、キーホール・リンペット・ヘモシアニン(keyhole limpet hemocyanin:KLH)に共役したマウス/ヒトHzf-C末ペプチド(LHPAPGPIRTAHGPILFSPY)(サーモフィッシャーサイエンティフィック株式会社製)を用意した。このペプチドの配列は過去の研究におけるウサギHzfポリクローナル抗血清を確立するために使用された。50μgのKLH-共役Hzfペプチドを、6週齢雌ウィスターラットの肉球に注入した。10日おきに3回の50μgのHzfペプチドの追加注入を行った。夫々の追加注入の1週間後に、尾静脈から得たテスト血清がELISAによってスクリーニングされた。ELISAにより十分な免疫反応が得られたら、10日後に最終注入を行い、さらにその4日後に免疫動物からリンパ節を摘出し、抗体産生細胞を融合のために準備した。
【0035】
(ELISAスクリーニング)
ポリスチレンの96ウェルプレートをHzf-C末ペプチドにて4℃で一晩コートし、37℃にて0.1%w/vウシ血清アルブミン(BSA)を含むPBS中で1時間ブロックした。ハイブリドーマの培養上清又は免疫動物の血清を添加し、37℃にて1時間インキュベートした。PBSにて3回洗浄した後、プレートは37℃にて1時間、アルカリフォスファターゼ共役ヤギ抗ラットIgG抗体存在下でインキュベートした。PBSにて3回洗浄した後、プレートに基質溶液を添加し、37℃にてインキュベートした。陽性クローンの判定は、マイクロプレートリーダーにて405nmの吸光度測定により行った。
【0036】
(細胞融合、ハイブリドーマスクリーニング、サブクローニング、及びイソタイピング)
KLHに共役したマウスHzf-C末ペプチド(LHPAPGPIRTAHGPILSPY)にてラットを免疫した。KLH非共役Hzf-C末ペプチドを使用したELISAにより、免疫動物から血清のスクリーニングを行った。ゲノムONE-CF(石原産業、大阪、日本)を使用して、通常の手法によりラットリンパ細胞サスペンジョンを5:1の割合で骨髄腫細胞P3U1と融合した。
【0037】
X線照射処理を行った腹膜マクロファージ存在下で、ハイブリドーマをHAT(hypoxanthine-aminoprotein-thymidine)を添加したGIT培地にて選択し、1248ウェル中1004ウェルにおいて増殖するハイブリドーマが観察された。夫々のウェルから上清を回収し、第1ELISAを行った結果、10ウェルのハイブリドーマ上清がHzfペプチドと強く反応することが確認された。これらのウェルから細胞を回収し、第2ELISAスクリーニングのために限界希釈(96ウェルプレートに1ウェルあたり0.8〜1個の細胞になるように播種)を行った。9つのクローンが第2スクリーニングにて得られ、これらのクローンの全てがIgG2aイソタイプの抗体を産生し、イムノブロッティングにおいてNIH-3T3細胞に発現させたフラッグタグ融合Hzfタンパク質と反応した。得られたHzf抗体産生細胞培地は、徐々にマクロファージ無しの無添加GIT培地に置換された。
【0038】
(モノクローナル抗体の精製)
プリスタン(2,6,10,14−テトラメチルペンタデカン)(ワコー純薬化学工業)投与後、10日目のSCID(Severe Combined Immunodeficient)マウスの腹腔内に、陽性ハイブリドーマクローン(231-9若しくは391-18、1×107セル/クローン)を注入した。2〜3週間後これらのマウスから腹水液を得、0.313g/mLの最終濃度まで(NH4)2SO4を徐々に滴下し、イムノグロブリンを沈降させた。遠心分離によりイムノグロブリンを回収し、2.5mLのPBSに懸濁した。脱塩処理後、231-9の一部分をECLタンパク質ビオチン標識システム(GEヘルスケア UK)を使用してビオチン標識した。
【0039】
(レトロウイルス発現プラスミド、レトロウイルスベクター生産、及び感染)
293T細胞にレトロウイルス発現プラスミドをトランスフェクトし、24〜60時間後に培養上清をウィルス液として回収した。10cm径の細胞培養用シャーレの上で増殖中の細胞を、8μg/mLのポリブレンを含むウィルス液で感染させた。感染は、GFPタンパク質発現によるフローサイトメトリーアッセイ又は薬剤耐性選択により確認した。
【0040】
(イムノブロッティング)
モノクローナル抗体231-9及び391-18が、イムノブロッティングにて内在性Hzfタンパク質を検出できるか否かを調べた。細胞は、RIPA緩衝液(10mM リン酸ナトリウム[pH7.2]、150mM塩化ナトリウム、2mM EDTA、0.1% SDS、1% デオキシコレートナトリウム、1% NP-40、及びプロテアーゼ阻害剤)を添加して溶解し、さらに20秒間氷上にて超音波破砕を行った。不溶性画分は、4℃で10分間15,000gの遠心分離にて除き、溶解液中のタンパク質濃度をBCAアッセイにて定量した。20μgのタンパク質を変性ポリアクリルアミドゲルの上で分離し、二フッ化ポリビニリデン膜(PVDF膜)に転写した。PVDF膜は、5%スキムミルクを含有するTBS-T(10mM トリス[pH7.4]、150mM 塩化ナトリウム、及び0.1%ツウィーン20)中にてブロッキングした。PVDF膜は、5%スキムミルク含有TBS-Tで希釈した一次抗体にて1時間反応させ、TBS-Tにて3回洗浄し、さらにHRPと共役した二次抗体と反応させた。TBS-Tにて数回洗浄した後、イモビロン(ミリポア社)にて検出を行った。Hzfタンパク質は231-9、391-18又はビオチンラベルされた231-9にて検出した。フラッグエピトープタグ(M2-HRP、シグマ)、p19ARF(5C3-1、サンタクルツバイオテクノロジー)、C/EBPδ、及びβ−チューブリン(シグマ)を検出するために、市販の抗体を使用した。
【0041】
コントロールあるいはsh-Hzfウイルスを感染させたNIH-3T3細胞にさらにp19ARF発現レトロウイルスを感染させ、夫々の細胞溶解産物を変性ポリアクリルアミドゲル上にて分離し、PVDF膜上に転写し、Hzfモノクローナル抗体を使用してブロットした。ポジティブコントロールとして、バクテリアにて産生したHis-Hzfタンパク質を使用した。図1は、コントロール又はsh-Hzfレトロウイルスと共にp19ARF発現レトロウイルスに感染させたNIH-3T3からの細胞溶解産物をHzf抗体でイムノブロッティングを行ったものである。図1に示されるように、モノクローナル抗体231-9及び391-18は、共に内在性Hzfタンパク質を検出することが可能であり、p19ARF発現レトロウイルスがHzfタンパク質の更なる蓄積を誘導した。内在性Hzfが効率的に抑制されたsh-Hzf感染細胞においては、Hzfタンパク質は両方のモノクローナル抗体231-9及び391-18によって検知困難であり、これらのモノクローナル抗体231-9及び391-18が高い特異性を持つことを確認した。
【0042】
図2は、3T3-L1からの細胞溶解産物をHzf抗体を使用してイムノブロッティングしたものである。コントロール又はsh-Hzfレトロウイルスを感染させた3T3-L1細胞を3日間の分化刺激(5μg/mLインシュリン、1μMデキサメタゾン、及び0.5mM 1−メチル−3−イソブチルザンチン)を行い、脂肪細胞へと分化させ、細胞溶解液を調製し、それぞれの抗体を使用してイムノブロッティングを行った。分化はC/EBPδの発現により確認し、βチューブリンをコントロールとして使用した。脂肪分化刺激によるHzfタンパク質の誘導は、コントロールウイルス感染3T3-L1細胞において明白に両モノクローナル抗体(231-9及び391-18)により検知されたが、sh-Hzfを感染させた細胞においては検出されず、これらのモノクローナル抗体231-9及び391-18がイムノブロッティングにおいて内在性Hzfタンパク質の検出を高効率に行うことができることを確認した。
【0043】
(免疫沈降法)
次に、これらのモノクローナル抗体231-9及び391-18がHzfタンパク質を免疫沈降できるか否かを調べた。細胞溶液を10%グリセロール及びプロテアーゼ抑制剤を含有する免疫沈降(IP)用緩衝液(50mM N−2−ヒドロキシエチルピペラジン−N’−2−硫酸エタン[HEPES、pH7.5]、150mM塩化ナトリウム、1mM EDTA、2.5mM EGTA、1mM ジチオトレイトール、0.1%ツウィーン20)を使用して調製し、さらに5秒間の氷上での超音波処理を行った。不溶性画分は、4℃で10分間15,000gの遠心分離にて除き、溶解液中のタンパク質濃度をBCAアッセイにて定量した。IP用緩衝液で平衡化した5μgのモノクローナル抗体(231-9又は391-18)を、10μLのプロテインG−セファロースと共に、1μg/μLに調製した細胞溶解産物500μLと4℃にて12時間反応させた。IP反応産物を1mLのIP緩衝液にて3回洗浄後、短期の遠心分離にて回収し、Laemmli SDSゲルサンプル緩衝液に懸濁した。
【0044】
NIH-3T3細胞をフラッグタグ融合マウス全長Hzfをコードするレトロウイルスに感染させた。細胞溶解産物を、5μgのモノクローナル抗体231-9、又は5μgのモノクローナル抗体391-18と混合され、プロテインG−セファロースが加えられた。ネガティブコントロールとして抗体無添加にてIPを行った。IP後のHzfタンパク質の検出には、フラッグ抗体又はビオチンラベルした231-9Hzfモノクローナル抗体を使用したイムノブロッティングを行った。
【0045】
図3は、Hzfレトロウイルスに感染させたNIH-3T3細胞溶解産物をモノクローナル抗体231-9及び391-18にてIPし、M2-HRPを用いて検出した図であり、図4は、ビオチンラベルされたHzf抗体(231-9)にて検知したものである。イムノ錯体はプロテインG−セファロースを使用して回収し、変性ポリアクリルアミドゲルにて分離され、PVDF膜に転写後、フラッグエピトープに対するHRP共役抗体、若しくはビオチン化Hzf抗体(231-9)にて反応後HRP共役ストレプトアビジンを用いて検出された。図3において、*は非特異性タンパク質の検出を示す。図3及び図4に示すように、フラッグタグHzfタンパク質が231-9又は391-18モノクローナル抗体の存在下にてIPされたが、抗体が非存在下ではIPされなかった。ウサギポリクローナルHzf抗体ではHzfタンパク質のIPはできなかった。これらの結果から、ウサギのポリクローナル抗体と比較してモノクローナル抗体231-9及び391-18は効率的にマウスHzfタンパク質をIPさせることができることが示された。モノクローナル抗体231-9及び391-18は共にIgG2aサブタイプであるが、図3に示すように、フラッグタグ融合Hzfタンパク質をM2-HRPにより検出した場合、モノクローナル抗体231-9のみ約40kDaのM2-HRPと反応する非特異的タンパク質をIPした。これにより、モノクローナル抗体231-9及び391-18は、同一のクローン由来ではない可能性が示唆された。
【0046】
(細胞免疫染色法)
次に、モノクローナル抗体231-9及び391-18が、MT-Arf細胞におけるHzfを免疫染色可能であるかを調べた。カバーグラス上で培養した細胞をPBSで3回洗浄し、4%パラホルムアルデヒドにて15分間固定し、PBSで洗浄後、0.5%トリトンX-100含有PBS中にて15分間にて処理した。固定された細胞をPBSで3回洗浄し、10%FCS含有PBSにて1時間ブロッキングを行い、10%FCS含有PBSに10μg/mLになるように希釈したHzfモノクローナル抗体(231-9又は391-18)と1時間反応させた。次にPBSで3回洗浄し、10%FCS含有PBS中にて、Cy3(登録商標、CyDye DIGE Fluor saturation dye, GE Healthcare Biosciences, Uppsala, Sweden)ラベルヤギ抗ラットIgGと1時間反応させ、Hzfタンパク質を蛍光顕微鏡にて観察した。
【0047】
MT-Arf細胞をカバーグラス上で培養し、パラホルムアルデヒドにて固定し、モノクローナル抗体231-9又は391-18にて反応させ、その後Cy3と共役したヤギ抗ラットIgGと反応させた。MT-Arf細胞は、メタロチオニンプロモータのコントロール下で外来性p19ARFを発現する。硫酸亜鉛の添加によりこの細胞ではp19ARFタンパク質が発現し、続いて内在性Hzfタンパク質が誘導される。
【0048】
図5は、細胞免疫染色法に基づくモノクローナル抗体231-9及び391-18によるHzfの細胞免疫染色を示すものである。MT-Arf細胞を通常培地若しくは80μM硫酸亜鉛を含む培地で24時間培養し、4%パラホルムアルデヒドにて固定し、モノクローナル抗体231-9及び391-18を使用した細胞免疫染色を行った。細胞核はDAPIにより染色された。図5に示すように、両モノクローナル抗体231-9及び391-18は、MT-Arf細胞にて特に核質を染色した。加えて両モノクローナル抗体231-9及び391-18無しでシグナルは検知されなかった。両モノクローナル抗体231-9及び391-18により、NIH-3T3細胞及び未処置MT-Arf細胞においても若干のHzfタンパク質が検出された。これらの結果は、ウサギポリクローナルHzf抗体を使用した過去の研究と一致している。
【0049】
以上、上述したように、両モノクローナル抗体231-9及び391-18は、ウサギポリクローナル抗体と比較して、イムノブロッティング及び細胞免疫染色共に、内在性及びリコビナントHzfタンパク質の検出に非常に効率的であった。また、Hzfタンパク質は、両モノクローナル抗体231-9及び391-18共に効率的にIP可能であった。免疫に使用したHzfペプチドは、マウス-ヒト間で一致した配列であることから、両モノクローナル抗体231-9及び391-18はヒトHzfタンパク質の検出にも使用できると考えられる。
【0050】
HzfはIP3R及びC/EBPαmRNAと相互作用し、C2H2タイプZnフィンガー領域を介してそれらの局在及び翻訳を調節する。このmRNA調節の正確なメカニズムは現在不明であるが、Hzf相互作用タンパク質の同定を行うことにより、mRNA調節機構の解明へとつながることが期待される。ウサギポリクローナル抗体よりも効率的に両モノクローナル抗体231-9及び391-18はHzfタンパク質をIPできるため、これらモノクローナル抗体は極めて有益であることが判明した。IPサンプルから抽出したRNAのマイクロアレイ解析を行うことにより、Hzfの標的となる他のRNA分子をも同定することが可能であると考えられる。ヒトHzf遺伝子は染色体12q13に存在するが、この遺伝子領域はヒト・2型糖尿病患者サンプルを用いた連鎖解析により疾患と強いリンクがあることが示されているため、Hzfがこの疾患に関与する可能性が示唆される。以上より、両モノクローナル抗体231-9及び391-18は、HzfによるRNA調節の分子メカニズムの研究に役立つのみならず、癌及び脂肪機能不全(肥満等)の診断にも貢献すると考えられる。
【特許請求の範囲】
【請求項1】
独立行政法人製品評価技術基盤機構特許微生物寄託センターに受領番号NITE AP−853で寄託されたハイブリドーマ。
【請求項2】
独立行政法人製品評価技術基盤機構特許微生物寄託センターに受領番号NITE AP−854で寄託されたハイブリドーマ。
【請求項3】
LHPAPGPIRTAHGPILFSPYで免疫した哺乳動物の抗体産生細胞と、哺乳動物の骨髄腫細胞とを細胞融合することを特徴とする細胞融合方法。
【請求項4】
独立行政法人製品評価技術基盤機構特許微生物寄託センターに受領番号NITE AP−853で寄託されたハイブリドーマにより産生される、抗原Hzf-C末ペプチドに対するモノクローナル抗体。
【請求項5】
前記Hzf-C末ペプチドは、LHPAPGPIRTAHGPILFSPYである請求項4記載のモノクローナル抗体。
【請求項6】
独立行政法人製品評価技術基盤機構特許微生物寄託センターに受領番号NITE AP−854で寄託されたハイブリドーマにより産生される、抗原Hzf-C末ペプチドに対するモノクローナル抗体。
【請求項7】
前記Hzf-C末ペプチドは、LHPAPGPIRTAHGPILFSPYである請求項6記載のモノクローナル抗体。
【請求項1】
独立行政法人製品評価技術基盤機構特許微生物寄託センターに受領番号NITE AP−853で寄託されたハイブリドーマ。
【請求項2】
独立行政法人製品評価技術基盤機構特許微生物寄託センターに受領番号NITE AP−854で寄託されたハイブリドーマ。
【請求項3】
LHPAPGPIRTAHGPILFSPYで免疫した哺乳動物の抗体産生細胞と、哺乳動物の骨髄腫細胞とを細胞融合することを特徴とする細胞融合方法。
【請求項4】
独立行政法人製品評価技術基盤機構特許微生物寄託センターに受領番号NITE AP−853で寄託されたハイブリドーマにより産生される、抗原Hzf-C末ペプチドに対するモノクローナル抗体。
【請求項5】
前記Hzf-C末ペプチドは、LHPAPGPIRTAHGPILFSPYである請求項4記載のモノクローナル抗体。
【請求項6】
独立行政法人製品評価技術基盤機構特許微生物寄託センターに受領番号NITE AP−854で寄託されたハイブリドーマにより産生される、抗原Hzf-C末ペプチドに対するモノクローナル抗体。
【請求項7】
前記Hzf-C末ペプチドは、LHPAPGPIRTAHGPILFSPYである請求項6記載のモノクローナル抗体。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2011−130728(P2011−130728A)
【公開日】平成23年7月7日(2011.7.7)
【国際特許分類】
【出願番号】特願2009−294814(P2009−294814)
【出願日】平成21年12月25日(2009.12.25)
【出願人】(803000056)財団法人ヒューマンサイエンス振興財団 (341)
【Fターム(参考)】
【公開日】平成23年7月7日(2011.7.7)
【国際特許分類】
【出願日】平成21年12月25日(2009.12.25)
【出願人】(803000056)財団法人ヒューマンサイエンス振興財団 (341)
【Fターム(参考)】
[ Back to top ]

