ヒートショックプロテイン発現誘導剤
【課題】 ヒートショックプロテイン(HSP)発現誘導作用に基づくヒートショックプロテイン発現誘導剤を提供することを課題とする。
【解決手段】 ユーパリノライドA及び/又はB(Eupalinolide A及び/又はB)からなるヒートショックプロテイン(HSP)発現誘導剤であり、また、ユーパリノライドA及び/又はBが、サワヒヨドリ(Eupatorium lindleyanum)の地上部乾燥生薬(ヤバツイ)から抽出したものであるヒートショックプロテイン発現誘導剤であって、ヤバツイをエタノール抽出して得たエタノール抽出物を、各種カラムクロマトグラフィー、HPLCにより分画処理することからなるユーパリノライドA及び/又はB(Eupalinolide A及びBの抽出方法である。
【解決手段】 ユーパリノライドA及び/又はB(Eupalinolide A及び/又はB)からなるヒートショックプロテイン(HSP)発現誘導剤であり、また、ユーパリノライドA及び/又はBが、サワヒヨドリ(Eupatorium lindleyanum)の地上部乾燥生薬(ヤバツイ)から抽出したものであるヒートショックプロテイン発現誘導剤であって、ヤバツイをエタノール抽出して得たエタノール抽出物を、各種カラムクロマトグラフィー、HPLCにより分画処理することからなるユーパリノライドA及び/又はB(Eupalinolide A及びBの抽出方法である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、医薬品として有用な熱ショックタンパク質(ヒートショックプロテイン)の発現誘導剤に関する。
【背景技術】
【0002】
細胞、組織あるいは固体においては、一般的な生理的温度より3℃以上高い温度に晒されたときに、生体の防御システムの一つとして、特異的タンパク質の発現(産生)が誘導されることが知られている。
このタンパク質は、SDS−PAGE(ドデシル硫酸ナトリウム−ポリアクリルアミドゲル電気泳動法)によって測定した場合、分子量範囲10〜110KDaを有する一群のタンパク質として存在しており、熱ショックタンパク質(ヒートショックプロテイン:heat shock proteins、以下、「HSP」と称する場合もある)と呼ばれている。
【0003】
HSPは、その分子量の相違により幾つかのファミリーが形成されており、例えば、HSP90ファミリー(分子量:90kDa以上110kDa以下)、HSP70ファミリー(分子量:70kDa以上80kDa未満)、HSP60ファミリー(分子量:60kDa以上70kDa未満)、及び低分子量HSPファミリー(分子量:60kDa未満)のように分類されている。
【0004】
HSPの機能は多岐にわたっており、例えば、HSP70及びHSP60ファミリーは、変性タンパク質に結合して、天然のフォールディング(高次構造・折り畳み構造)に巻き戻す作用や、第三のタンパク質や核酸との会合、細胞内での局在化や膜透過への関与など、いわゆる分子シャペロンと呼ばれる機能を担っていることが明らかにされている(非特許文献1及び2)。
なお、分子シャペロンとは、ポリペプチド鎖の合成に引き続くフォールディングや酵素の不可逆的な熱変性の抑制に関与している一連の蛋白質をさす。
【0005】
このHSP発現の誘導(産生)を利用した療法の一つとして、癌温熱免疫療法がある。すなわち、全身を加温することによりHSPの生成を誘導し、全身の免疫機能を活発にするのと同時に、がん細胞と正常細胞の識別能力を向上させ、副作用が無く、癌細胞のみを死滅させる治療法である。
【0006】
ところで、このHSPは、高温ばかりではなく、外的傷害、放射線、紫外線などの外界からのストレスに晒された場合にも、生体防御システムとして、その発現(産生)が誘導される。
すなわち、高温、紫外線などの生体に対するストレスは、細胞のタンパク質を変性させ、不溶性沈殿を形成して細胞にダメージを与える。したがって、かかる細胞へのダメージを防御する目的で、HSPの発現が誘導されることとなる。
【0007】
かかる観点から、水生プランクトンであるアルテミアの孵化直前の耐久卵から水抽出した活性エキス(アルテミアエキス)成分が、ヒト皮膚細胞においてHSP70の産生を誘発することが見出され、かかる作用を利用した抗皮膚ストレス(ストレス防御)用化粧料が提案されている(特許文献1)。
【0008】
更に最近、脳梗塞やアルツハイマー病など脳疾患の原因である神経細胞死が、細胞を保護する熱ショックタンパク質(HSP)の損傷によって生じることが明らかにされた(非特許文献3)。
また、HSP誘導物質が潰瘍性大腸炎やアルツハイマー病に有効であることが示されている(非特許文献4)。
【0009】
したがって、ヒートショックプロテイン(HSP)の発現誘導は、種々の病態の治療に有効であり、また、メラニン産生を抑制するものであり、効果的なHSP70発現誘導作用を有する成分は、極めて有力な医薬品、或いは化粧品となる。
かかる観点より本発明者は、更に検討を進め、各種植物成分(生薬)について、HSP70発現を誘導する安全性の高い成分の検索を行ってきていたが、その検討の中で、植物成分としてサワヒヨドリ(Eupatorium lindleyanum)の地上部の乾燥生薬(ヤバツイ)の抽出物が、HSP70の発現誘導を強化させることを見出した。
特に、ヤバツイのエタノール抽出エキスを、各種カラムクロマトグラフィー、或いは高速液体クロマトグラフィー(HPLC)等で分画して得た成分(画分)には、極めて強いHSP70の発現誘導が認められることを確認し、その画分の主成分を検討したところ、セスキテルペンラクトン化合物であるユーパリノライドA(Eupalinolide A)、及びユーパリノライドB(Eupalinolide B)であることが判明した。
【0010】
これらセスキテルペンラクトンであるユーパリノライドA及びBは、すでに公知の化合物であるが、これまでの研究では、その構造決定と、細胞毒性に関する報告(非特許文献5)のみであって、このものにHSPの発現を誘導する作用があることについては、一切記載されていない。
【先行技術文献】
【特許文献】
【0011】
【特許文献1】特開2004−238297号公報
【非特許文献】
【0012】
【非特許文献1】Hendrick, J. P. & Hartl, F. -U., Ann. Rev. Biochem., 62, 349-384 (1993)
【非特許文献2】Georgopoulos, C. & Welch, W. J., Ann. Rev. Cell Biol., 9, 601-634 (1993)
【非特許文献3】北国新聞、2009年10月24日
【非特許文献4】Tanaka, K. & Mizushima, T., Int. J. Hyperthermia, 8,668-676(2009)
【非特許文献5】Yang, N. Y., et al., J. Asian Nat. Prod. Res., 9(3-5), 339-345 (2007)
【発明の概要】
【発明が解決しようとする課題】
【0013】
したがって、本発明は、セスキテルペンラクトンであるユーパリノライドA及びBからなるヒートショックプロテイン発現誘導剤を提供することを課題とする。
【課題を解決するための手段】
【0014】
かかる課題を解決するための本発明は、その態様は、以下の構成からなる。
(1)ユーパリノライドA及び/又はB(Eupalinolide A及び/又はB)からなるヒートショックプロテイン(HSP)発現誘導剤;
(2)ユーパリノライドA及び/又はB(Eupalinolide A及び/又はB)が、サワヒヨドリ(Eupatorium lindleyanum)の地上部乾燥生薬(ヤバツイ)から抽出したものである上記(1)に記載のヒートショックプロテイン(HSP)発現誘導剤;
(3)サワヒヨドリ(Eupatorium lindleyanum)の地上部乾燥生薬(ヤバツイ)より、以下の抽出・分画処理することからなるユーパリノライドA及び/又はB(Eupalinolide A及び/又はB)の抽出方法であって、
(a)サワヒヨドリ(Eupatorium lindleyanum)の地上部乾燥生薬(ヤバツイ)をエタノール抽出して得た抽出物を、ヘキサンにより脱脂処理を行った後、90%メタノール溶液に溶解して得た90%メタノール溶液画分(画分A)を得、
(b)次いで、上記で得た90%メタノール溶液画分(画分A)を、MCl・GEL CHP−20Pカラムクロマトグラフィーに付し、順次、水溶出−50%メタノール溶出−メタノール溶出−アセトン溶出を行い、メタノール溶出画分(画分B)を得、
(c)上記で得たメタノール溶出画分(画分B)を、更にODSカラムクロマトグラフィーに付し、順次50%メタノール溶液、75%メタノール溶液、及びメタノール溶液で溶出を行い、50%メタノール溶出画分(画分C)を得、
(d)最後に、上記で得た50%メタノール溶出画分(画分C)をHPLC(カラム:AR−II ODS)に付し、40%メタノールにて溶出すること、
からなる抽出方法;
である。
【発明の効果】
【0015】
本発明により、セスキテルペンラクトン化合物であるユーパリノライドA及び/又はB(Eupalinolide A及び/又はB)からなるヒートショックプロテイン(HSP)発現誘導剤、特にHSP70の発現誘導剤が提供される。
本発明が提供するHSP発現誘導剤は、サワヒヨドリ(Eupatorium lindleyanum)の地上部乾燥生薬(ヤバツイ)から抽出・単離されたものであり、HSPの発現誘導作用により、特に生成したHSP70がチロシナーゼ、及び小眼球症関連転写因子(MITF:microphthalmia転写因子)を制御させ、メラニン産生を抑制するとともに、脳梗塞やアルツハイマー病など脳疾患、潰瘍性大腸炎などの治療剤として有用である。
【図面の簡単な説明】
【0016】
【図1】実施例1で行った、ヤバツイから、本発明のHSP発現誘導剤であるユーパリノライドA及びBの抽出・単離について、その分画操作の流れを示したフロー図である。
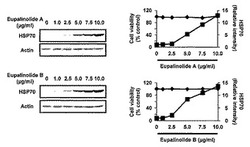
【図2】実施例2におけるHSPの発現と細胞生存率について、ユーパリノライドA及びBの結果を示した図である。
【図3】実施例3のAGS細胞におけるHSP70発現効果について、ユーパリノライドA及びBの結果を示した図である。
【図4】実施例4における、ヒートショック等のストレスと、ユーパリノライドA及びBのHSP70発現増強効果を示した図である。
【図5】実施例5における、アルコールストレスに晒した場合のユーパリノライドA及びBの細胞保護作用の結果を示した図である。
【図6】実施例5における、menadioneと共に培養した場合のユーパリノライドA及びBの細胞保護作用の結果を示した図である。
【0017】
【図7】実施例6における、本発明のHSP誘導剤であるユーパリノライドA及びBによるIBMX刺激によるメラニン生成抑制効果を示す、メラニン含有量を示した図である。
【図8】実施例6における、本発明のHSP誘導剤であるユーパリノライドA及びBによるIBMX刺激によるメラニン生成抑制効果を示す、チロシナーゼ活性を示した図である。
【発明を実施するための形態】
【0018】
本発明は、上記したように、その基本は、ユーパリノライドA及び/又はB(Eupalinolide A及び/又はB)からなるヒートショックプロテイン(HSP)発現誘導剤であって、特に、HSP70の生成により、チロシナーゼ及び小眼球症関連転写因子(MITF:microphthalmia転写因子)を制御させ、メラニン産生を抑制する効果を発揮するとともに、HSPの損傷によって生じる脳梗塞やアルツハイマー病などの脳疾患、潰瘍性大腸炎などの治療剤として有用である。
【0019】
本発明が提供するHSP発現誘導剤であるユーパリノライドA及び/又はB(Eupalinolide A及び/又はB)の化学式を以下に示した。
すなわち、ユーパリノライドAにあっては下記化学式(I)、ユーパリノライドBにあっては下記化学式(II)で示される化合物である。
【0020】
【化1】

【0021】
両者は同一の分子式(C24H30O9)を有し、その化学構造式も極めて類似するものであるが、立体的構造として、その4位において、ユーパリノライドAがZ型を保持しているのに対して、ユーパリノライドBがE型を保持している点で相違するのみである。
【0022】
このユーパリノライドA及びBは、好ましくは、サワヒヨドリ(Eupatorium lindleyanum)の地上部乾燥生薬(ヤバツイ)から抽出・単離することにより得ることができ、本発明の一態様としては、ユーパリノライドA及び/又はBが、サワヒヨドリ(Eupatorium lindleyanum)の地上部乾燥生薬(ヤバツイ)から抽出したものであるヒートショックプロテイン(HSP)誘導剤でもある。
【0023】
サワヒヨドリ(Eupatorium lindleyanum)は、キク科ヒヨドリバナ属植物に属し、日本全国、東南アジアに生育する多年草である。この地上部乾燥生薬は、ヤバツイ(野馬追)と称され、中国においては解熱・解毒薬として使用されている生薬成分である。
【0024】
本願発明が提供するHSP誘導剤であるユーパリノライドA及び/又はBのヤバツイからの抽出、単離は、具体的には以下のようにして行うことができる。
すなわち、サワヒヨドリ(Eupatorium lindleyanum)の地上部乾燥生薬(以下、特に断らない限り、「ヤバツイ」と称する。)をエタノール抽出してエタノール抽出物を得る。
なお、ヤバツイは、生薬として市販されており、例えば、丸善製薬(株)から入手することができる。
抽出にあたっては、ヤバツイ100gに対して、エタノールを0.5〜2L程度加え、加熱還流条件下で抽出を行うのがよい。抽出時間は一概に限定できないが、1〜5時間程度、好ましくは2時間程度でよい。また、抽出温度は、70℃〜エタノールの沸点付近の温度で行うのがよい。抽出操作を完了した段階で、冷却後綿栓濾過を行い、エタノール抽出液を得る。
この抽出操作を2〜5回、好ましくは3〜4回程度繰り返し、併せたエタノール抽出溶液を減圧下に濃縮し、残渣として、ヤバツイの粗エタノール抽出物を得る。
【0025】
上記で得たヤバツイの粗エタノール抽出物を分画操作することにより、目的とするユーパリノライドA及び/又はBを単離するのであるが、具体的には以下のようにして行うことができる。
最初に、ヤバツイの粗エタノール抽出物を、ヘキサンにより脱脂処理を行う。具体的には、粗エタノール抽出物を90%メタノール溶液に懸濁させ、分液漏斗に移して少量のヘキサンにより抽出することにより脱脂処理を行う。
脱脂処理した90%メタノール層を減圧乾固し、90%メタノール溶液画分(画分A)が得られる。
【0026】
次いで、上記で得られた90%メタノール溶液画分(画分A)を、ポリスチレンゲルカラムクロマトグラフィー、具体的には、MCl・GEL CHP−20P(和光純薬工業)カラムクロマトグラフィーに付し、順次、水、50%メタノール、メタノール溶液の段階的グラジエント法、及びアセトン溶液にて溶出を行い、各溶出画分を得る。
かかる操作において得られたメタノール溶出画分(画分B)に、HSP発現誘導が強く認められた。
【0027】
HSP発現誘導が強く観察されたメタノール溶出画分(画分B)を、更にODSカラムクロマトグラフィーに付し、順次50%メタノール溶液、75%メタノール溶液、及びメタノール溶液による段階的グラジエント法で溶出を行い、それぞれの溶出画分を得た。
かかる操作において得られた50%メタノール溶出画分(画分C)に、HSP発現誘導が強く認められた。
【0028】
次いで、HSP発現誘導が強く観察された50%メタノール溶出画分(画分C)を、高速液体クロマトグラフィー(HPLC、カラム:AR−II ODS)に付し、40%メタノールにて溶出して全12個の溶出画分(画分D1〜D12)を得た。
かくして得られた溶出画分D1〜D12のうち、特に、画分D3並びに画分D7に、極めて強いHSP発現誘導作用があることが判明した。
【0029】
この画分D3及びD7について、HSP発現誘導作用物質の特定を検討したところ、画分D3には、ユーパリノライドAが、画分D7にはユーパリノライドBが主成分として含有されていることが判明した。
かかる画分D3及びD7について、一般的に汎用されている単離・結晶化等の操作を行い、目的とするユーパリノライドA及び/又はBを得ることができる。
したがって、本発明は、また、サワヒヨドリ(Eupatorium lindleyanum)の地上部乾燥生薬(ヤバツイ)より、抽出・分画処理することからなるユーパリノライドA及び/又はB(Eupalinolide A及び/又はB)の抽出方法でもある。
【0030】
本発明が提供するHSP発現誘導剤は、HSPのなかでも、特に、HSP70の発現誘導によるメラニン産生抑制作用を発揮する。
すなわち、HSP70は、メラニン産生に関与するチロシナーゼ及び小眼球症関連転写因子(MITF:microphthalmia転写因子)を制御させるものであり、その結果、メラニンの産生が抑制されるとともに、HSPの損傷によって生じる脳梗塞やアルツハイマー病などの脳疾患、潰瘍性大腸炎などの治療剤として有用である。
【0031】
したがって、本発明が提供するHSP発現誘導剤は、例えば、脳梗塞やアルツハイマー病などの脳疾患、潰瘍性大腸炎などの治療剤、メラニン産生抑制化粧料、特に美白化粧料として使用するのに適している。
本発明が提供するHSP発現誘導剤は、医薬品として錠剤、カプセル、粉末剤などの経口投与剤、注射剤、点滴剤などの非経口投与剤とし、化粧料としては、具体的には、化粧水、乳液、クリーム、美容液、パック等の皮膚化粧料、メイクアップベースローション、メイクアップベースクリーム等の下地化粧料、乳液剤、油性、固形状等の各剤型のファンデーション、アイカラー、チークカラー等のメイクアップ化粧料、ハンドクリーム、レッグクリーム、ネッククリーム、ボディローション等の身体用化粧料等を挙げることができる。
【0032】
本発明が提供するHSP発現誘導剤は、ユーパリノライドA及び/又はBを含有するものであるが、上記の抽出・単離操作により得たヤバツイの抽出物を、そのまま含有してもよい。
また、各種製剤として使用されている薬理学的に許容されている他の慣用成分と共に、所望の形態で使用することができる。
【0033】
この場合において、本発明が提供するHSP発現誘導剤であるユーパリノライドA及び/又はBの含有量は、一概に限定できず、また、病態の予防・改善の目的、用いる人の性別、体重、年齢、剤型、病態の種類や程度、使用部位、使用回数などの種々の条件により一概に限定できない。
例えば、経口剤として投与する場合には、0.1〜100μg/kg/日で、一日1回から数回に分けて適用することができるが、使用量は、必ずしもこの範囲に限定されるものではない。
また、上記の抽出・単離操作により得たヤバツイの抽出物を、そのまま含有する場合には、その抽出画分に含有されるユーパリノライドA及び/又はBの量に換算した量で含有させることができる。
【0034】
本発明が提供するHSP発現誘導剤は、上記したように、医療効果を目的として使用されるとともに、メラニン産生抑制化粧料として使用される。
【実施例】
【0035】
以下に本発明を、ヤバツイからのユーパリノライドA及び/又はBの抽出・単離の実際、並びに、HSP70の発現の誘導の試験を説明しながら、より詳細に説明していく。
【0036】
なお、以下の実施例に示す材料、使用量、割合、処理内容、処理手順等は、本発明の趣旨を逸脱しない限り、適宜、変更することができる。したがって、本発明の範囲は以下に示す具体例に限定されるものではない。
【0037】
実施例1:ユーパリノライドA及び/又はBの抽出・単離
丸善製薬(株)から入手したヤバツイ[サワヒヨドリ(Eupatorium lindleyanum)の地上部乾燥生薬]の10.1gを500mLのナス型フラスコに入れ、100mLのエタノールを加え、70℃の水浴上で2時間還流抽出した。冷却後、綿栓濾過してエタノール抽出液を得た。
この還流抽出操作を3回繰り返した後、得られたエタノール抽出液を合わせて減圧濃縮し、エタノール抽出物(499mg)を得た。
このエタノール抽出物を100mLの90%メタノールに懸濁させ、分液漏斗に移して30mLのヘキサンにて3回処理を行い、脱脂した。90%メタノール溶液層をエバポレーターで減圧乾固し、310mgの90%メタノール溶液画分(画分A)を得た。
この段階で得られた、ヘキサン溶液溶解画分と、90%メタノール溶液画分(画分A)について、免疫ブロット法により活性を検討したところ、90%メタノール溶液画分(画分A)が、活性が強いものであった。
【0038】
この活性の強かった90%メタノール溶出画分を、MCl・GEL CHP−20Pカラムクロマトグラフィー(φ17mm×100mm:和光純薬工業)の段階的グラジエント法に付し、順次、水(80mL)、50%メタノール(100mL)、メタノール(100mL)、及びアセトン(100mL)溶液にて溶出を行い、各溶出画分を得た。
その結果、水溶出画分(119mg)、50%メタノール溶出画分(49mg)、メタノール溶出画分(画分B)(125mg)及びアセトン溶出画分(20mg)を得た。
得られた四つの画分のうち、メタノール溶出画分(画分B)(125mg)が最も活性が強いものであった。
【0039】
次いで、活性の強かったメタノール溶出画分(画分B)を、Chromatorex ODSカラムロマトグラフィー(φ15mm×150mm)に付し、水−メタノール(1:0→0:1、v/v)の段階的グラジエント法により溶出し、これにより、順次50%メタノール溶液、75%メタノール溶液、及びメタノール溶液で溶出を行い得た50%メタノール溶出画分(画分C)(49mg)を得た。
得られた三つの画分のうち、50%メタノール溶出画分(画分C)が最も活性が強いものであった。
【0040】
最後に、得られた50%メタノール溶出画分(画分C)を高速液体クロマトグラフィー(HPLC,Cosmosil AR−II ODSカラム:φ20mm×350mm)に付し、40%メタノールにて分取し、12個の溶出画分(画分D1〜D12)を得た。
これらの溶出画分D1〜D12について活性を検討したところ、画分D3及び画分D7が最も活性が強いものであり、画分D3より式(I)で示されるユーパリノライドAを4.6mg(収率:0.05%)、画分D7より式(II)で示されるユーパリノライドBを4.5mg(収率:0.04%)得ることができた。
これらの化学構造は、赤外線吸収スペクトル、H1或いはC13磁気共鳴スペクトル等の標品との比較による物理化学的手段により決定することができた。
【0041】
以上の分画処理の流れ(フロー)を、図1に示した。
【0042】
実施例2:HSPの発現と細胞生存率
マウスメラノーマ由来のB16細胞(理研バイオリソースセンター)を、各濃度のユーパリノライドA又はBと共に、DMEM培地(10%の牛胎児血清、100U/mLのペニシリン、100U/mLのストレプトマイシン)で、37℃/5%CO2雰囲気下で24時間培養した。
HSP70の発現量は、細胞培養液をSDS−PAGE電気泳動にかけた後、抗HSP70抗体(Stressgen社)を用いたウエスタン・ブロット法によりHSP70の発現量を測定した。
細胞生存率は、MTT法に従い、全細胞の抽出物を、抗HSP70抗体又はアクチンと共にイムノブロット法により測定した。
【0043】
その結果を図2に示した。
図2中、上段にユーパリノライドAの結果を、下段にユーパリノライドBの結果を示した。
図中に示した結果からも判明するように、ユーパリノライドA及びBは、濃度依存的にHSPを発現しており、その時の細胞生存率に変化がなく、安全なものであることが確認された。
【0044】
実施例3:AGS細胞におけるHSP70発現効果
ヒト胃粘膜上皮細胞(AGS細胞)を、ユーパリノライドA又はBの各濃度と共に、RPMI培地(10%の牛胎児血清、100U/mLのペニシリン、100U/mLのストレプトマイシン)で、37℃/5%CO2雰囲気下で24時間培養した。
HSP70の発現量は、細胞培養液をSDS−PAGE電気泳動にかけた後、抗HSP70抗体(Stressgen社)を用いたウエスタン・ブロット法により測定した。
細胞生存率は、MTT法に従い、全細胞の抽出物を、抗HSP70抗体又はアクチンと共にイムノブロット法により測定した。
【0045】
その結果を、図3に示した。
図3中、上段にユーパリノライドAの結果を、下段にユーパリノライドBの結果を示した。
図中に示した結果からも判明するように、AGS細胞においても、実施例2と同様にユーパリノライドA及びBは、濃度依存的にHSP70を発現しており、その時の細胞生存率に変化がなく、安全なものであることが確認された。
【0046】
実施例4:他のストレスとのHSP70発現増強効果
AGS細胞を、ユーパリノライドA又はBの各濃度(0、1及び2μg/mL)と共に、RPMI培地(10%の牛胎児血清、100U/mLのペニシリン、100U/mLのストレプトマイシン)で、37℃/5%CO2雰囲気下で3時間培養した。次いで、40℃/1時間のヒートショックを与え、続いて37℃にて6時間ヒートショックからの回復を行った。
一方、AGS細胞を同様に、ストレスとして3.5%エタノールと共に24時間培養した。
ストレスを与えないで培養したAGS細胞、並びにヒートショックストレス或いはアルコールストレスを与えて培養した各AGS細胞におけるHSP70の発現量を、上記実施例と同様に、細胞培養液をSDS−PAGE電気泳動にかけた後、抗HSP70抗体(Stressgen社)を用いたウエスタン・ブロット法によりHSP70の発現量を測定した。
また、細胞生存率は、MTT法に従い、全細胞の抽出物を、抗HSP70抗体又はアクチンと共にイムノブロット法により測定した。
【0047】
その結果を、図4に示した。
図4中、上段にヒートショックを与えた場合の結果を、下段にアルコールストレスを与えた場合の結果を示した。
図中に示した結果からも判明するように、ヒートショックを与えない場合であってもHSP70の発現は誘導されているが、ヒートショックを与えた場合においては、HSP70がより多く誘導されることが判明した。
アルコールストレスを与えた場合であっても同様であった。
以上の結果から、ユーパリノライドA又はBは、他のストレスによりHSP70発現の増強効果があることが理解される。
【0048】
実施例5:ストレスに晒した場合のユーパリノライドA及びBの細胞保護作用
AGS細胞を、ユーパリノライドA又はBの各濃度(0、2.5及び5.0μg/mL)と共に前処理し、新鮮な培地で洗浄し、RPMI培地(10%の牛胎児血清、100U/mLのペニシリン、100U/mLのストレプトマイシン)で、37℃/5%CO2雰囲気下で18時間培養した。最後に3.5%エタノール、又は15μMのmenadioneと共に24時間培養した。
細胞の生存率は、前実施例と同様にMTT法により行った。アポトーシスを起こした細胞(sub-G1中の細胞)は、fluorescence activated cell sortingによりカウントした、値は、平均値±S.D.で表示した。
【0049】
その結果を、図5及び図6に示した。
図5は、3.5%エタノールと共に培養した結果であるが、ユーパリノライドA又はBは、濃度依存的に細胞生存率を高めていることが判明する。
また、図6は15μMのmenadioneと共に培養した結果であるが、3.5%エタノールの場合と同様、ユーパリノライドA又はBは、濃度依存的に細胞生存率を高めていることが判明する。
【0050】
実施例6:ユーパリノライドA及びBによるIBMX刺激によるメラニン生成抑制効果
B16細胞を、ユーパリノライドA又はBの各濃度(5.0及び10.0μg/mL)と共に培養した。細胞を、さらに100μMのIBMX(3-isobutyl-1-methylxanthine:Sigma社)の添加、或いは無添加にて72時間、或いは48時間培養した。
各サンプルの蛋白質量を、Bio-Rad protein assay kitにより求め、同量の蛋白質量に揃えた後、490nmの吸光度を、プレートリーダー(Fluostar Galaxy社)により測定した。
細胞抽出中のメラニンの量を測定し、コントロールとの比較で表示した。
また、チロシナーゼ活性をコントロールとの比較で表示した。
【0051】
その結果を、図7及び図8に示した。
図7に、メラニン含有量を示し、図8にチロシナーゼ活性を示した。
いずれの場合において、ユーパリノライドA又はBは、メラニン生成を抑制し、チロシナーゼ活性も低下させていることが理解される。
特に、IBMXの添加におけるメラニン生成の抑制、並びにチロシナーゼ活性の低下は強いものであることが判明した。
【0052】
実施例7:HSP70発現の確認
培養液を満たした培養皿に、ヒト線維芽細胞株(NBIRGB:理化学研究所、バイオリソースセンター)を1×102個/mLの細胞懸濁となるように播種し、5%炭酸ガス雰囲気下に37℃にて24時間培養を行った。
この培養液に、上記実施例1で抽出・単離したユーパリノライドA又はB、並びに実施例1の分離過程で得たヤバツイの溶媒抽出物(画分A〜C)を上記したイムノブロット法に従ってHSP70の発現誘導を検討した。
評価は、HSP70の発現を2倍にする最小有効濃度(MEC2.0(μg/ml))として表示した。
あわせて、その時の細胞生存率(Safe Induction(SI)Index)(%)も検討した。
その結果を下記表1に示した。
なお、表中には、実施例1で調製したヤバツイの溶媒抽出物として画分A〜Cの結果も示した。
【0053】
【表1】

【0054】
表中の結果より明らかなように、ユーパリノライドA及びBには、極めて強いHSP70の発現誘導作用があることが判明する。
また、画分A〜Cにあっても、HSP70発現誘導作用があることが判明する。
ヤバツイ自体はすでに中国において解熱・解毒薬として使用されている生薬であることから、ヤバツイから抽出・単離したユーパリノライドA及びBは、細胞毒性がなく、安全なものであることが判明した。
【0055】
既に上記で説明したように、HSP発現誘導剤であるユーパリノライドA及び/又はBによるHSPの発現、特にHSP70の発現誘導は、脳梗塞やアルツハイマー病などの脳疾患、潰瘍性大腸炎などの治療剤としての医薬品として有用であり、さらにメラニン産生抑制化粧料となる。
【0056】
以下に、本発明が提供するHSP発現誘導剤であるユーパリノライドA及びBの製剤応用例を示した。
応用例1:皮膚外用剤
以下の処方により、皮膚外用剤(クリーム剤)を得た。
スクワラン 20重量%
ミツロウ 5
精製ホホバ油 5
グリセリンモノステアレート 2
ソルビタンモノステアレート 2
ポリオキシエチレン(20)ソルビタンモノステアレート 2
グリセリン 5
ユーパリノライドA 1
ユーパリノライドB 1
精製水 100とする残部
【0057】
応用例2:注射剤
ユーパリノライドA又はBを、塩化ナトリウム、及び溶解補助剤としてポリソルベート20ともに注射用滅菌精製水に溶解し、1%含有注射剤を得た。
【0058】
応用例3:静脈注射剤
ユーパリノライドA又はBの1%(w/w)、シュークロース10%(w/w)、塩化ベンザルコニウム0.05%(w/w)を5%キシリトール水溶液に溶解した後、凍結乾燥した。得られた凍結乾燥剤に、別にバイアル充填した0.5%カルメロースあるいは注射用水を加えることにより静脈注射用剤を得た。
【産業上の利用可能性】
【0059】
以上記載のように、本発明により、ユーパリノライドA及び/又はBからなるヒートショックプロテイン(HSP)発現誘導剤が提供される。
本発明が提供するユーパリノライドA及び/又はBは、HSP、特にHSP70の発現を誘導し、HSPの損傷によって生じる脳梗塞やアルツハイマー病などの脳疾患、潰瘍性大腸炎などの治療剤として有用であるとともに、発現が誘導されたHSP70がメラニン産生を制御させ、その結果、メラニンの産生を抑制するものであり、その結果、シミの予防・改善作用のある化粧料を提供することができる、極めて特異的なものである。
【技術分野】
【0001】
本発明は、医薬品として有用な熱ショックタンパク質(ヒートショックプロテイン)の発現誘導剤に関する。
【背景技術】
【0002】
細胞、組織あるいは固体においては、一般的な生理的温度より3℃以上高い温度に晒されたときに、生体の防御システムの一つとして、特異的タンパク質の発現(産生)が誘導されることが知られている。
このタンパク質は、SDS−PAGE(ドデシル硫酸ナトリウム−ポリアクリルアミドゲル電気泳動法)によって測定した場合、分子量範囲10〜110KDaを有する一群のタンパク質として存在しており、熱ショックタンパク質(ヒートショックプロテイン:heat shock proteins、以下、「HSP」と称する場合もある)と呼ばれている。
【0003】
HSPは、その分子量の相違により幾つかのファミリーが形成されており、例えば、HSP90ファミリー(分子量:90kDa以上110kDa以下)、HSP70ファミリー(分子量:70kDa以上80kDa未満)、HSP60ファミリー(分子量:60kDa以上70kDa未満)、及び低分子量HSPファミリー(分子量:60kDa未満)のように分類されている。
【0004】
HSPの機能は多岐にわたっており、例えば、HSP70及びHSP60ファミリーは、変性タンパク質に結合して、天然のフォールディング(高次構造・折り畳み構造)に巻き戻す作用や、第三のタンパク質や核酸との会合、細胞内での局在化や膜透過への関与など、いわゆる分子シャペロンと呼ばれる機能を担っていることが明らかにされている(非特許文献1及び2)。
なお、分子シャペロンとは、ポリペプチド鎖の合成に引き続くフォールディングや酵素の不可逆的な熱変性の抑制に関与している一連の蛋白質をさす。
【0005】
このHSP発現の誘導(産生)を利用した療法の一つとして、癌温熱免疫療法がある。すなわち、全身を加温することによりHSPの生成を誘導し、全身の免疫機能を活発にするのと同時に、がん細胞と正常細胞の識別能力を向上させ、副作用が無く、癌細胞のみを死滅させる治療法である。
【0006】
ところで、このHSPは、高温ばかりではなく、外的傷害、放射線、紫外線などの外界からのストレスに晒された場合にも、生体防御システムとして、その発現(産生)が誘導される。
すなわち、高温、紫外線などの生体に対するストレスは、細胞のタンパク質を変性させ、不溶性沈殿を形成して細胞にダメージを与える。したがって、かかる細胞へのダメージを防御する目的で、HSPの発現が誘導されることとなる。
【0007】
かかる観点から、水生プランクトンであるアルテミアの孵化直前の耐久卵から水抽出した活性エキス(アルテミアエキス)成分が、ヒト皮膚細胞においてHSP70の産生を誘発することが見出され、かかる作用を利用した抗皮膚ストレス(ストレス防御)用化粧料が提案されている(特許文献1)。
【0008】
更に最近、脳梗塞やアルツハイマー病など脳疾患の原因である神経細胞死が、細胞を保護する熱ショックタンパク質(HSP)の損傷によって生じることが明らかにされた(非特許文献3)。
また、HSP誘導物質が潰瘍性大腸炎やアルツハイマー病に有効であることが示されている(非特許文献4)。
【0009】
したがって、ヒートショックプロテイン(HSP)の発現誘導は、種々の病態の治療に有効であり、また、メラニン産生を抑制するものであり、効果的なHSP70発現誘導作用を有する成分は、極めて有力な医薬品、或いは化粧品となる。
かかる観点より本発明者は、更に検討を進め、各種植物成分(生薬)について、HSP70発現を誘導する安全性の高い成分の検索を行ってきていたが、その検討の中で、植物成分としてサワヒヨドリ(Eupatorium lindleyanum)の地上部の乾燥生薬(ヤバツイ)の抽出物が、HSP70の発現誘導を強化させることを見出した。
特に、ヤバツイのエタノール抽出エキスを、各種カラムクロマトグラフィー、或いは高速液体クロマトグラフィー(HPLC)等で分画して得た成分(画分)には、極めて強いHSP70の発現誘導が認められることを確認し、その画分の主成分を検討したところ、セスキテルペンラクトン化合物であるユーパリノライドA(Eupalinolide A)、及びユーパリノライドB(Eupalinolide B)であることが判明した。
【0010】
これらセスキテルペンラクトンであるユーパリノライドA及びBは、すでに公知の化合物であるが、これまでの研究では、その構造決定と、細胞毒性に関する報告(非特許文献5)のみであって、このものにHSPの発現を誘導する作用があることについては、一切記載されていない。
【先行技術文献】
【特許文献】
【0011】
【特許文献1】特開2004−238297号公報
【非特許文献】
【0012】
【非特許文献1】Hendrick, J. P. & Hartl, F. -U., Ann. Rev. Biochem., 62, 349-384 (1993)
【非特許文献2】Georgopoulos, C. & Welch, W. J., Ann. Rev. Cell Biol., 9, 601-634 (1993)
【非特許文献3】北国新聞、2009年10月24日
【非特許文献4】Tanaka, K. & Mizushima, T., Int. J. Hyperthermia, 8,668-676(2009)
【非特許文献5】Yang, N. Y., et al., J. Asian Nat. Prod. Res., 9(3-5), 339-345 (2007)
【発明の概要】
【発明が解決しようとする課題】
【0013】
したがって、本発明は、セスキテルペンラクトンであるユーパリノライドA及びBからなるヒートショックプロテイン発現誘導剤を提供することを課題とする。
【課題を解決するための手段】
【0014】
かかる課題を解決するための本発明は、その態様は、以下の構成からなる。
(1)ユーパリノライドA及び/又はB(Eupalinolide A及び/又はB)からなるヒートショックプロテイン(HSP)発現誘導剤;
(2)ユーパリノライドA及び/又はB(Eupalinolide A及び/又はB)が、サワヒヨドリ(Eupatorium lindleyanum)の地上部乾燥生薬(ヤバツイ)から抽出したものである上記(1)に記載のヒートショックプロテイン(HSP)発現誘導剤;
(3)サワヒヨドリ(Eupatorium lindleyanum)の地上部乾燥生薬(ヤバツイ)より、以下の抽出・分画処理することからなるユーパリノライドA及び/又はB(Eupalinolide A及び/又はB)の抽出方法であって、
(a)サワヒヨドリ(Eupatorium lindleyanum)の地上部乾燥生薬(ヤバツイ)をエタノール抽出して得た抽出物を、ヘキサンにより脱脂処理を行った後、90%メタノール溶液に溶解して得た90%メタノール溶液画分(画分A)を得、
(b)次いで、上記で得た90%メタノール溶液画分(画分A)を、MCl・GEL CHP−20Pカラムクロマトグラフィーに付し、順次、水溶出−50%メタノール溶出−メタノール溶出−アセトン溶出を行い、メタノール溶出画分(画分B)を得、
(c)上記で得たメタノール溶出画分(画分B)を、更にODSカラムクロマトグラフィーに付し、順次50%メタノール溶液、75%メタノール溶液、及びメタノール溶液で溶出を行い、50%メタノール溶出画分(画分C)を得、
(d)最後に、上記で得た50%メタノール溶出画分(画分C)をHPLC(カラム:AR−II ODS)に付し、40%メタノールにて溶出すること、
からなる抽出方法;
である。
【発明の効果】
【0015】
本発明により、セスキテルペンラクトン化合物であるユーパリノライドA及び/又はB(Eupalinolide A及び/又はB)からなるヒートショックプロテイン(HSP)発現誘導剤、特にHSP70の発現誘導剤が提供される。
本発明が提供するHSP発現誘導剤は、サワヒヨドリ(Eupatorium lindleyanum)の地上部乾燥生薬(ヤバツイ)から抽出・単離されたものであり、HSPの発現誘導作用により、特に生成したHSP70がチロシナーゼ、及び小眼球症関連転写因子(MITF:microphthalmia転写因子)を制御させ、メラニン産生を抑制するとともに、脳梗塞やアルツハイマー病など脳疾患、潰瘍性大腸炎などの治療剤として有用である。
【図面の簡単な説明】
【0016】
【図1】実施例1で行った、ヤバツイから、本発明のHSP発現誘導剤であるユーパリノライドA及びBの抽出・単離について、その分画操作の流れを示したフロー図である。
【図2】実施例2におけるHSPの発現と細胞生存率について、ユーパリノライドA及びBの結果を示した図である。
【図3】実施例3のAGS細胞におけるHSP70発現効果について、ユーパリノライドA及びBの結果を示した図である。
【図4】実施例4における、ヒートショック等のストレスと、ユーパリノライドA及びBのHSP70発現増強効果を示した図である。
【図5】実施例5における、アルコールストレスに晒した場合のユーパリノライドA及びBの細胞保護作用の結果を示した図である。
【図6】実施例5における、menadioneと共に培養した場合のユーパリノライドA及びBの細胞保護作用の結果を示した図である。
【0017】
【図7】実施例6における、本発明のHSP誘導剤であるユーパリノライドA及びBによるIBMX刺激によるメラニン生成抑制効果を示す、メラニン含有量を示した図である。
【図8】実施例6における、本発明のHSP誘導剤であるユーパリノライドA及びBによるIBMX刺激によるメラニン生成抑制効果を示す、チロシナーゼ活性を示した図である。
【発明を実施するための形態】
【0018】
本発明は、上記したように、その基本は、ユーパリノライドA及び/又はB(Eupalinolide A及び/又はB)からなるヒートショックプロテイン(HSP)発現誘導剤であって、特に、HSP70の生成により、チロシナーゼ及び小眼球症関連転写因子(MITF:microphthalmia転写因子)を制御させ、メラニン産生を抑制する効果を発揮するとともに、HSPの損傷によって生じる脳梗塞やアルツハイマー病などの脳疾患、潰瘍性大腸炎などの治療剤として有用である。
【0019】
本発明が提供するHSP発現誘導剤であるユーパリノライドA及び/又はB(Eupalinolide A及び/又はB)の化学式を以下に示した。
すなわち、ユーパリノライドAにあっては下記化学式(I)、ユーパリノライドBにあっては下記化学式(II)で示される化合物である。
【0020】
【化1】

【0021】
両者は同一の分子式(C24H30O9)を有し、その化学構造式も極めて類似するものであるが、立体的構造として、その4位において、ユーパリノライドAがZ型を保持しているのに対して、ユーパリノライドBがE型を保持している点で相違するのみである。
【0022】
このユーパリノライドA及びBは、好ましくは、サワヒヨドリ(Eupatorium lindleyanum)の地上部乾燥生薬(ヤバツイ)から抽出・単離することにより得ることができ、本発明の一態様としては、ユーパリノライドA及び/又はBが、サワヒヨドリ(Eupatorium lindleyanum)の地上部乾燥生薬(ヤバツイ)から抽出したものであるヒートショックプロテイン(HSP)誘導剤でもある。
【0023】
サワヒヨドリ(Eupatorium lindleyanum)は、キク科ヒヨドリバナ属植物に属し、日本全国、東南アジアに生育する多年草である。この地上部乾燥生薬は、ヤバツイ(野馬追)と称され、中国においては解熱・解毒薬として使用されている生薬成分である。
【0024】
本願発明が提供するHSP誘導剤であるユーパリノライドA及び/又はBのヤバツイからの抽出、単離は、具体的には以下のようにして行うことができる。
すなわち、サワヒヨドリ(Eupatorium lindleyanum)の地上部乾燥生薬(以下、特に断らない限り、「ヤバツイ」と称する。)をエタノール抽出してエタノール抽出物を得る。
なお、ヤバツイは、生薬として市販されており、例えば、丸善製薬(株)から入手することができる。
抽出にあたっては、ヤバツイ100gに対して、エタノールを0.5〜2L程度加え、加熱還流条件下で抽出を行うのがよい。抽出時間は一概に限定できないが、1〜5時間程度、好ましくは2時間程度でよい。また、抽出温度は、70℃〜エタノールの沸点付近の温度で行うのがよい。抽出操作を完了した段階で、冷却後綿栓濾過を行い、エタノール抽出液を得る。
この抽出操作を2〜5回、好ましくは3〜4回程度繰り返し、併せたエタノール抽出溶液を減圧下に濃縮し、残渣として、ヤバツイの粗エタノール抽出物を得る。
【0025】
上記で得たヤバツイの粗エタノール抽出物を分画操作することにより、目的とするユーパリノライドA及び/又はBを単離するのであるが、具体的には以下のようにして行うことができる。
最初に、ヤバツイの粗エタノール抽出物を、ヘキサンにより脱脂処理を行う。具体的には、粗エタノール抽出物を90%メタノール溶液に懸濁させ、分液漏斗に移して少量のヘキサンにより抽出することにより脱脂処理を行う。
脱脂処理した90%メタノール層を減圧乾固し、90%メタノール溶液画分(画分A)が得られる。
【0026】
次いで、上記で得られた90%メタノール溶液画分(画分A)を、ポリスチレンゲルカラムクロマトグラフィー、具体的には、MCl・GEL CHP−20P(和光純薬工業)カラムクロマトグラフィーに付し、順次、水、50%メタノール、メタノール溶液の段階的グラジエント法、及びアセトン溶液にて溶出を行い、各溶出画分を得る。
かかる操作において得られたメタノール溶出画分(画分B)に、HSP発現誘導が強く認められた。
【0027】
HSP発現誘導が強く観察されたメタノール溶出画分(画分B)を、更にODSカラムクロマトグラフィーに付し、順次50%メタノール溶液、75%メタノール溶液、及びメタノール溶液による段階的グラジエント法で溶出を行い、それぞれの溶出画分を得た。
かかる操作において得られた50%メタノール溶出画分(画分C)に、HSP発現誘導が強く認められた。
【0028】
次いで、HSP発現誘導が強く観察された50%メタノール溶出画分(画分C)を、高速液体クロマトグラフィー(HPLC、カラム:AR−II ODS)に付し、40%メタノールにて溶出して全12個の溶出画分(画分D1〜D12)を得た。
かくして得られた溶出画分D1〜D12のうち、特に、画分D3並びに画分D7に、極めて強いHSP発現誘導作用があることが判明した。
【0029】
この画分D3及びD7について、HSP発現誘導作用物質の特定を検討したところ、画分D3には、ユーパリノライドAが、画分D7にはユーパリノライドBが主成分として含有されていることが判明した。
かかる画分D3及びD7について、一般的に汎用されている単離・結晶化等の操作を行い、目的とするユーパリノライドA及び/又はBを得ることができる。
したがって、本発明は、また、サワヒヨドリ(Eupatorium lindleyanum)の地上部乾燥生薬(ヤバツイ)より、抽出・分画処理することからなるユーパリノライドA及び/又はB(Eupalinolide A及び/又はB)の抽出方法でもある。
【0030】
本発明が提供するHSP発現誘導剤は、HSPのなかでも、特に、HSP70の発現誘導によるメラニン産生抑制作用を発揮する。
すなわち、HSP70は、メラニン産生に関与するチロシナーゼ及び小眼球症関連転写因子(MITF:microphthalmia転写因子)を制御させるものであり、その結果、メラニンの産生が抑制されるとともに、HSPの損傷によって生じる脳梗塞やアルツハイマー病などの脳疾患、潰瘍性大腸炎などの治療剤として有用である。
【0031】
したがって、本発明が提供するHSP発現誘導剤は、例えば、脳梗塞やアルツハイマー病などの脳疾患、潰瘍性大腸炎などの治療剤、メラニン産生抑制化粧料、特に美白化粧料として使用するのに適している。
本発明が提供するHSP発現誘導剤は、医薬品として錠剤、カプセル、粉末剤などの経口投与剤、注射剤、点滴剤などの非経口投与剤とし、化粧料としては、具体的には、化粧水、乳液、クリーム、美容液、パック等の皮膚化粧料、メイクアップベースローション、メイクアップベースクリーム等の下地化粧料、乳液剤、油性、固形状等の各剤型のファンデーション、アイカラー、チークカラー等のメイクアップ化粧料、ハンドクリーム、レッグクリーム、ネッククリーム、ボディローション等の身体用化粧料等を挙げることができる。
【0032】
本発明が提供するHSP発現誘導剤は、ユーパリノライドA及び/又はBを含有するものであるが、上記の抽出・単離操作により得たヤバツイの抽出物を、そのまま含有してもよい。
また、各種製剤として使用されている薬理学的に許容されている他の慣用成分と共に、所望の形態で使用することができる。
【0033】
この場合において、本発明が提供するHSP発現誘導剤であるユーパリノライドA及び/又はBの含有量は、一概に限定できず、また、病態の予防・改善の目的、用いる人の性別、体重、年齢、剤型、病態の種類や程度、使用部位、使用回数などの種々の条件により一概に限定できない。
例えば、経口剤として投与する場合には、0.1〜100μg/kg/日で、一日1回から数回に分けて適用することができるが、使用量は、必ずしもこの範囲に限定されるものではない。
また、上記の抽出・単離操作により得たヤバツイの抽出物を、そのまま含有する場合には、その抽出画分に含有されるユーパリノライドA及び/又はBの量に換算した量で含有させることができる。
【0034】
本発明が提供するHSP発現誘導剤は、上記したように、医療効果を目的として使用されるとともに、メラニン産生抑制化粧料として使用される。
【実施例】
【0035】
以下に本発明を、ヤバツイからのユーパリノライドA及び/又はBの抽出・単離の実際、並びに、HSP70の発現の誘導の試験を説明しながら、より詳細に説明していく。
【0036】
なお、以下の実施例に示す材料、使用量、割合、処理内容、処理手順等は、本発明の趣旨を逸脱しない限り、適宜、変更することができる。したがって、本発明の範囲は以下に示す具体例に限定されるものではない。
【0037】
実施例1:ユーパリノライドA及び/又はBの抽出・単離
丸善製薬(株)から入手したヤバツイ[サワヒヨドリ(Eupatorium lindleyanum)の地上部乾燥生薬]の10.1gを500mLのナス型フラスコに入れ、100mLのエタノールを加え、70℃の水浴上で2時間還流抽出した。冷却後、綿栓濾過してエタノール抽出液を得た。
この還流抽出操作を3回繰り返した後、得られたエタノール抽出液を合わせて減圧濃縮し、エタノール抽出物(499mg)を得た。
このエタノール抽出物を100mLの90%メタノールに懸濁させ、分液漏斗に移して30mLのヘキサンにて3回処理を行い、脱脂した。90%メタノール溶液層をエバポレーターで減圧乾固し、310mgの90%メタノール溶液画分(画分A)を得た。
この段階で得られた、ヘキサン溶液溶解画分と、90%メタノール溶液画分(画分A)について、免疫ブロット法により活性を検討したところ、90%メタノール溶液画分(画分A)が、活性が強いものであった。
【0038】
この活性の強かった90%メタノール溶出画分を、MCl・GEL CHP−20Pカラムクロマトグラフィー(φ17mm×100mm:和光純薬工業)の段階的グラジエント法に付し、順次、水(80mL)、50%メタノール(100mL)、メタノール(100mL)、及びアセトン(100mL)溶液にて溶出を行い、各溶出画分を得た。
その結果、水溶出画分(119mg)、50%メタノール溶出画分(49mg)、メタノール溶出画分(画分B)(125mg)及びアセトン溶出画分(20mg)を得た。
得られた四つの画分のうち、メタノール溶出画分(画分B)(125mg)が最も活性が強いものであった。
【0039】
次いで、活性の強かったメタノール溶出画分(画分B)を、Chromatorex ODSカラムロマトグラフィー(φ15mm×150mm)に付し、水−メタノール(1:0→0:1、v/v)の段階的グラジエント法により溶出し、これにより、順次50%メタノール溶液、75%メタノール溶液、及びメタノール溶液で溶出を行い得た50%メタノール溶出画分(画分C)(49mg)を得た。
得られた三つの画分のうち、50%メタノール溶出画分(画分C)が最も活性が強いものであった。
【0040】
最後に、得られた50%メタノール溶出画分(画分C)を高速液体クロマトグラフィー(HPLC,Cosmosil AR−II ODSカラム:φ20mm×350mm)に付し、40%メタノールにて分取し、12個の溶出画分(画分D1〜D12)を得た。
これらの溶出画分D1〜D12について活性を検討したところ、画分D3及び画分D7が最も活性が強いものであり、画分D3より式(I)で示されるユーパリノライドAを4.6mg(収率:0.05%)、画分D7より式(II)で示されるユーパリノライドBを4.5mg(収率:0.04%)得ることができた。
これらの化学構造は、赤外線吸収スペクトル、H1或いはC13磁気共鳴スペクトル等の標品との比較による物理化学的手段により決定することができた。
【0041】
以上の分画処理の流れ(フロー)を、図1に示した。
【0042】
実施例2:HSPの発現と細胞生存率
マウスメラノーマ由来のB16細胞(理研バイオリソースセンター)を、各濃度のユーパリノライドA又はBと共に、DMEM培地(10%の牛胎児血清、100U/mLのペニシリン、100U/mLのストレプトマイシン)で、37℃/5%CO2雰囲気下で24時間培養した。
HSP70の発現量は、細胞培養液をSDS−PAGE電気泳動にかけた後、抗HSP70抗体(Stressgen社)を用いたウエスタン・ブロット法によりHSP70の発現量を測定した。
細胞生存率は、MTT法に従い、全細胞の抽出物を、抗HSP70抗体又はアクチンと共にイムノブロット法により測定した。
【0043】
その結果を図2に示した。
図2中、上段にユーパリノライドAの結果を、下段にユーパリノライドBの結果を示した。
図中に示した結果からも判明するように、ユーパリノライドA及びBは、濃度依存的にHSPを発現しており、その時の細胞生存率に変化がなく、安全なものであることが確認された。
【0044】
実施例3:AGS細胞におけるHSP70発現効果
ヒト胃粘膜上皮細胞(AGS細胞)を、ユーパリノライドA又はBの各濃度と共に、RPMI培地(10%の牛胎児血清、100U/mLのペニシリン、100U/mLのストレプトマイシン)で、37℃/5%CO2雰囲気下で24時間培養した。
HSP70の発現量は、細胞培養液をSDS−PAGE電気泳動にかけた後、抗HSP70抗体(Stressgen社)を用いたウエスタン・ブロット法により測定した。
細胞生存率は、MTT法に従い、全細胞の抽出物を、抗HSP70抗体又はアクチンと共にイムノブロット法により測定した。
【0045】
その結果を、図3に示した。
図3中、上段にユーパリノライドAの結果を、下段にユーパリノライドBの結果を示した。
図中に示した結果からも判明するように、AGS細胞においても、実施例2と同様にユーパリノライドA及びBは、濃度依存的にHSP70を発現しており、その時の細胞生存率に変化がなく、安全なものであることが確認された。
【0046】
実施例4:他のストレスとのHSP70発現増強効果
AGS細胞を、ユーパリノライドA又はBの各濃度(0、1及び2μg/mL)と共に、RPMI培地(10%の牛胎児血清、100U/mLのペニシリン、100U/mLのストレプトマイシン)で、37℃/5%CO2雰囲気下で3時間培養した。次いで、40℃/1時間のヒートショックを与え、続いて37℃にて6時間ヒートショックからの回復を行った。
一方、AGS細胞を同様に、ストレスとして3.5%エタノールと共に24時間培養した。
ストレスを与えないで培養したAGS細胞、並びにヒートショックストレス或いはアルコールストレスを与えて培養した各AGS細胞におけるHSP70の発現量を、上記実施例と同様に、細胞培養液をSDS−PAGE電気泳動にかけた後、抗HSP70抗体(Stressgen社)を用いたウエスタン・ブロット法によりHSP70の発現量を測定した。
また、細胞生存率は、MTT法に従い、全細胞の抽出物を、抗HSP70抗体又はアクチンと共にイムノブロット法により測定した。
【0047】
その結果を、図4に示した。
図4中、上段にヒートショックを与えた場合の結果を、下段にアルコールストレスを与えた場合の結果を示した。
図中に示した結果からも判明するように、ヒートショックを与えない場合であってもHSP70の発現は誘導されているが、ヒートショックを与えた場合においては、HSP70がより多く誘導されることが判明した。
アルコールストレスを与えた場合であっても同様であった。
以上の結果から、ユーパリノライドA又はBは、他のストレスによりHSP70発現の増強効果があることが理解される。
【0048】
実施例5:ストレスに晒した場合のユーパリノライドA及びBの細胞保護作用
AGS細胞を、ユーパリノライドA又はBの各濃度(0、2.5及び5.0μg/mL)と共に前処理し、新鮮な培地で洗浄し、RPMI培地(10%の牛胎児血清、100U/mLのペニシリン、100U/mLのストレプトマイシン)で、37℃/5%CO2雰囲気下で18時間培養した。最後に3.5%エタノール、又は15μMのmenadioneと共に24時間培養した。
細胞の生存率は、前実施例と同様にMTT法により行った。アポトーシスを起こした細胞(sub-G1中の細胞)は、fluorescence activated cell sortingによりカウントした、値は、平均値±S.D.で表示した。
【0049】
その結果を、図5及び図6に示した。
図5は、3.5%エタノールと共に培養した結果であるが、ユーパリノライドA又はBは、濃度依存的に細胞生存率を高めていることが判明する。
また、図6は15μMのmenadioneと共に培養した結果であるが、3.5%エタノールの場合と同様、ユーパリノライドA又はBは、濃度依存的に細胞生存率を高めていることが判明する。
【0050】
実施例6:ユーパリノライドA及びBによるIBMX刺激によるメラニン生成抑制効果
B16細胞を、ユーパリノライドA又はBの各濃度(5.0及び10.0μg/mL)と共に培養した。細胞を、さらに100μMのIBMX(3-isobutyl-1-methylxanthine:Sigma社)の添加、或いは無添加にて72時間、或いは48時間培養した。
各サンプルの蛋白質量を、Bio-Rad protein assay kitにより求め、同量の蛋白質量に揃えた後、490nmの吸光度を、プレートリーダー(Fluostar Galaxy社)により測定した。
細胞抽出中のメラニンの量を測定し、コントロールとの比較で表示した。
また、チロシナーゼ活性をコントロールとの比較で表示した。
【0051】
その結果を、図7及び図8に示した。
図7に、メラニン含有量を示し、図8にチロシナーゼ活性を示した。
いずれの場合において、ユーパリノライドA又はBは、メラニン生成を抑制し、チロシナーゼ活性も低下させていることが理解される。
特に、IBMXの添加におけるメラニン生成の抑制、並びにチロシナーゼ活性の低下は強いものであることが判明した。
【0052】
実施例7:HSP70発現の確認
培養液を満たした培養皿に、ヒト線維芽細胞株(NBIRGB:理化学研究所、バイオリソースセンター)を1×102個/mLの細胞懸濁となるように播種し、5%炭酸ガス雰囲気下に37℃にて24時間培養を行った。
この培養液に、上記実施例1で抽出・単離したユーパリノライドA又はB、並びに実施例1の分離過程で得たヤバツイの溶媒抽出物(画分A〜C)を上記したイムノブロット法に従ってHSP70の発現誘導を検討した。
評価は、HSP70の発現を2倍にする最小有効濃度(MEC2.0(μg/ml))として表示した。
あわせて、その時の細胞生存率(Safe Induction(SI)Index)(%)も検討した。
その結果を下記表1に示した。
なお、表中には、実施例1で調製したヤバツイの溶媒抽出物として画分A〜Cの結果も示した。
【0053】
【表1】

【0054】
表中の結果より明らかなように、ユーパリノライドA及びBには、極めて強いHSP70の発現誘導作用があることが判明する。
また、画分A〜Cにあっても、HSP70発現誘導作用があることが判明する。
ヤバツイ自体はすでに中国において解熱・解毒薬として使用されている生薬であることから、ヤバツイから抽出・単離したユーパリノライドA及びBは、細胞毒性がなく、安全なものであることが判明した。
【0055】
既に上記で説明したように、HSP発現誘導剤であるユーパリノライドA及び/又はBによるHSPの発現、特にHSP70の発現誘導は、脳梗塞やアルツハイマー病などの脳疾患、潰瘍性大腸炎などの治療剤としての医薬品として有用であり、さらにメラニン産生抑制化粧料となる。
【0056】
以下に、本発明が提供するHSP発現誘導剤であるユーパリノライドA及びBの製剤応用例を示した。
応用例1:皮膚外用剤
以下の処方により、皮膚外用剤(クリーム剤)を得た。
スクワラン 20重量%
ミツロウ 5
精製ホホバ油 5
グリセリンモノステアレート 2
ソルビタンモノステアレート 2
ポリオキシエチレン(20)ソルビタンモノステアレート 2
グリセリン 5
ユーパリノライドA 1
ユーパリノライドB 1
精製水 100とする残部
【0057】
応用例2:注射剤
ユーパリノライドA又はBを、塩化ナトリウム、及び溶解補助剤としてポリソルベート20ともに注射用滅菌精製水に溶解し、1%含有注射剤を得た。
【0058】
応用例3:静脈注射剤
ユーパリノライドA又はBの1%(w/w)、シュークロース10%(w/w)、塩化ベンザルコニウム0.05%(w/w)を5%キシリトール水溶液に溶解した後、凍結乾燥した。得られた凍結乾燥剤に、別にバイアル充填した0.5%カルメロースあるいは注射用水を加えることにより静脈注射用剤を得た。
【産業上の利用可能性】
【0059】
以上記載のように、本発明により、ユーパリノライドA及び/又はBからなるヒートショックプロテイン(HSP)発現誘導剤が提供される。
本発明が提供するユーパリノライドA及び/又はBは、HSP、特にHSP70の発現を誘導し、HSPの損傷によって生じる脳梗塞やアルツハイマー病などの脳疾患、潰瘍性大腸炎などの治療剤として有用であるとともに、発現が誘導されたHSP70がメラニン産生を制御させ、その結果、メラニンの産生を抑制するものであり、その結果、シミの予防・改善作用のある化粧料を提供することができる、極めて特異的なものである。
【特許請求の範囲】
【請求項1】
ユーパリノライドA及び/又はB(Eupalinolide A及び/又はB)からなるヒートショックプロテイン(HSP)発現誘導剤。
【請求項2】
ユーパリノライドA及び/又はB(Eupalinolide A及び/又はB)が、サワヒヨドリ(Eupatorium lindleyanum)の地上部乾燥生薬(ヤバツイ)から抽出したものである請求項1に記載のヒートショックプロテイン(HSP)発現誘導剤。
【請求項3】
サワヒヨドリ(Eupatorium lindleyanum)の地上部乾燥生薬(ヤバツイ)より、以下の抽出・分画処理することからなるユーパリノライドA及び/又はB(Eupalinolide A及び/又はB)の抽出方法であって、
(a)サワヒヨドリ(Eupatorium lindleyanum)の地上部乾燥生薬(ヤバツイ)をエタノール抽出して得た抽出物を、ヘキサンにより脱脂処理を行った後、90%メタノール溶液に溶解して得た90%メタノール溶液画分(画分A)を得、
(b)次いで、上記で得た90%メタノール溶液画分(画分A)を、MCl・GEL CHP−20Pカラムクロマトグラフィーに付し、順次、水溶出−50%メタノール溶出−メタノール溶出−アセトン溶出を行い、メタノール溶出画分(画分B)を得、
(c)上記で得たメタノール溶出画分(画分B)を、更にODSカラムクロマトグラフィーに付し、順次50%メタノール溶液、75%メタノール溶液、及びメタノール溶液で溶出を行い、50%メタノール溶出画分(画分C)を得、
(d)最後に、上記で得た50%メタノール溶出画分(画分C)をHPLC(カラム:AR−II ODS)に付し、40%メタノールにて溶出すること、
からなる抽出方法。
【請求項1】
ユーパリノライドA及び/又はB(Eupalinolide A及び/又はB)からなるヒートショックプロテイン(HSP)発現誘導剤。
【請求項2】
ユーパリノライドA及び/又はB(Eupalinolide A及び/又はB)が、サワヒヨドリ(Eupatorium lindleyanum)の地上部乾燥生薬(ヤバツイ)から抽出したものである請求項1に記載のヒートショックプロテイン(HSP)発現誘導剤。
【請求項3】
サワヒヨドリ(Eupatorium lindleyanum)の地上部乾燥生薬(ヤバツイ)より、以下の抽出・分画処理することからなるユーパリノライドA及び/又はB(Eupalinolide A及び/又はB)の抽出方法であって、
(a)サワヒヨドリ(Eupatorium lindleyanum)の地上部乾燥生薬(ヤバツイ)をエタノール抽出して得た抽出物を、ヘキサンにより脱脂処理を行った後、90%メタノール溶液に溶解して得た90%メタノール溶液画分(画分A)を得、
(b)次いで、上記で得た90%メタノール溶液画分(画分A)を、MCl・GEL CHP−20Pカラムクロマトグラフィーに付し、順次、水溶出−50%メタノール溶出−メタノール溶出−アセトン溶出を行い、メタノール溶出画分(画分B)を得、
(c)上記で得たメタノール溶出画分(画分B)を、更にODSカラムクロマトグラフィーに付し、順次50%メタノール溶液、75%メタノール溶液、及びメタノール溶液で溶出を行い、50%メタノール溶出画分(画分C)を得、
(d)最後に、上記で得た50%メタノール溶出画分(画分C)をHPLC(カラム:AR−II ODS)に付し、40%メタノールにて溶出すること、
からなる抽出方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公開番号】特開2013−71902(P2013−71902A)
【公開日】平成25年4月22日(2013.4.22)
【国際特許分類】
【出願番号】特願2011−210757(P2011−210757)
【出願日】平成23年9月27日(2011.9.27)
【出願人】(303010452)株式会社LTTバイオファーマ (27)
【Fターム(参考)】
【公開日】平成25年4月22日(2013.4.22)
【国際特許分類】
【出願日】平成23年9月27日(2011.9.27)
【出願人】(303010452)株式会社LTTバイオファーマ (27)
【Fターム(参考)】
[ Back to top ]

