ピモベンダンを含む医薬組成物
【課題】哺乳類対象、特に小動物によって自発的に受け入れられるピモベンダン固形製剤を提供する。
【解決手段】医薬的に活性な化合物としてピモベンダンを含む新規な固形製剤及び該固形製剤の製造方法に関する。さらに、該固形製剤を使用するうっ血性心不全の予防及び/又は治療用薬物の製造方法に関する。
【解決手段】医薬的に活性な化合物としてピモベンダンを含む新規な固形製剤及び該固形製剤の製造方法に関する。さらに、該固形製剤を使用するうっ血性心不全の予防及び/又は治療用薬物の製造方法に関する。
【発明の詳細な説明】
【技術分野】
【0001】
〔発明の背景〕
〔技術分野〕
本発明は、動物の健康の分野に関する。特に、本発明は、医薬的に活性な化合物としてピモベンダンを含む新規な経口医薬組成物に関する。
【背景技術】
【0002】
〔背景情報〕
ピモベンダン(4,5-ジヒドロ-6-[2-(4-メトキシフェニル)-1H-ベンズイミダゾール-5-イル]-5-メチル-3(2H)-ピリダゾン)は、EP 008 391 B1(引用により完全に本明細書に含まれるものとする)に開示されている。ピモベンダンは、強心薬、降圧薬及び抗血栓薬である。前記物質は、徴候うっ血性心不全における標準物質である。
ピモベンダンは水にほとんど溶けない。経口投与用の既知又は通常の剤形に該活性物質が組み込まれている場合、経口投与したとき、ピモベンダンの吸収は個体間及び個体内でかなり変動する傾向がある。この理由は、ピモベンダンが水性媒体での低い溶解度と非常に高いpH依存性溶解度を特徴とするからである。これを克服するため、クエン酸と配合したピモベンダン(特に、ピモベンダン対クエン酸の重量比1:10〜1:20で)を含有する硬ゼラチンカプセルが使用された(EP 008 391 B1;引用により完全に本明細書に含まれるものとする)。しかし、多量のクエン酸及びクエン酸の酸味は多くの動物によって自発的に受け入れられないので、このようなカプセル剤は動物に強制して与えるか、又は投与前に食物と混合しなければならない。
【発明の概要】
【発明が解決しようとする課題】
【0003】
本発明に内在する問題は、哺乳類対象、特に小動物によって自発的に受け入れられるピモベンダン固形製剤を提供することだった。
【課題を解決するための手段】
【0004】
〔発明の簡単な概要〕
本発明は、医薬的に活性な化合物として、小動物に受け入れられる多価酸及びフレーバーに均質に分散したピモベンダン又はその医薬的に許容しうる塩を含む新規な固形製剤に関する。好ましくは、該固形製剤は顆粒剤又は錠剤である。最も好ましくは錠剤であって、該錠剤が1.25mg、2.5mg、5mg又は10mgのピモベンダンを含み、好ましくは該錠剤が1.25mg、2.5mg、5mg又は10mgのピモベンダンから成り、かつさらにラクトース、トウモロコシデンプン、クロスカルメロース(croscarmellose)-ナトリウム、クエン酸(好ましくは1gの該固形製剤当たり50mgの量で)、人工ビーフフレーバー、ポリビドン、コロイド状無水シリカ及びステアリン酸マグネシウムから成ることを特徴とする錠剤である。
【0005】
さらに、本発明は、以下の工程を含むか又は以下の工程から成る、固形製剤製造のための流動層造粒法に関する:
a)ピモベンダンと上述したような結合剤の水溶液を、1種又は数種の担体及び/又は賦形剤、フレーバー及び無水クエン酸を含む固形担体層上に噴霧する工程及び
b)a)の混合物を乾燥させる工程及び
c)b)の混合物を篩いにかけて脱凝集する工程及び
d)c)の混合物に流動調節剤を添加する工程及び
e)d)の混合物に潤沢剤を添加する工程及び
f)e)の混合物を顆粒の均一性のためブレンドして最終顆粒を得る工程及び/又は
g)f)の最終顆粒を圧縮して固形製剤にする工程。
固形製剤が顆粒剤の場合、工程g)は省かれる。固形製剤が錠剤の場合、工程g)が行われる。
【0006】
さらに、本発明は、強心性、降圧性及び抗血栓性物質が治療利益を有する疾患の予防及び/又は治療方法であって、該治療が必要な哺乳動物に、治療的に有効な量の上述した本発明の固形製剤を投与することを含む方法に関する。
うっ血性心不全の予防及び/又は治療方法であって、該治療が必要な哺乳動物に、治療的に有効な量の上述した本発明の固形製剤を投与することを含む方法が好ましい。最も好ましくは、本方法は、上述したとおりの本発明の錠剤を投与することを含む。
さらに、本発明は、うっ血性心不全の予防及び/又は治療用薬物の製造方法であって、本発明の固形製剤を使用することを特徴とする方法に関する。好ましくは、本発明は、うっ血性心不全の予防及び/又は治療用薬物の製造方法であって、1.25mg、2.5mg、5mg又は10mgのピモベンダンを含み、好ましくは1.25mg、2.5mg、5mg又は10mgのピモベンダンから成り、かつさらにラクトース、トウモロコシデンプン、クロスカルメロース-ナトリウム、50mg/gのクエン酸、人工ビーフフレーバー、ポリビドン、コロイド状無水シリカ及びステアリン酸マグネシウムから成る錠剤を使用することを特徴とする方法に関する。
【図面の簡単な説明】
【0007】
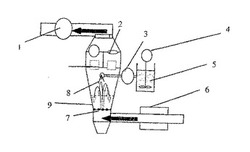
【図1】基本的なトップ噴霧流動層法の説明図である。
【図2】製造法のフローチャートである。
【図3】平均値の95%信頼区間を示すピモベンダン1.25mg錠剤の溶解プロフィール;USP装置2(パドル)、回転速度75rpm、緩衝液pH 4.0、HDPEボトル内で40℃/75%にて1カ月及び6カ月貯蔵した錠剤の溶解プロフィールの比較;バッチ番号PB020049を示す。
【図4】平均値の95%信頼区間を示すピモベンダン1.25mg錠剤の溶解プロフィール;USP装置2(パドル)、回転速度75rpm、緩衝液pH 4.0、開いたガラスビン内で25℃/60%にて12日貯蔵した錠剤の溶解プロフィールの比較;バッチ番号PB010080を示す。
【図5】平均値の95%信頼区間を示すピモベンダン2.5mg錠剤の溶解プロフィール;USP装置2(パドル)、回転速度75rpm、緩衝液pH 4.0、Alu-Aluブリスター内で40℃/75%にて3カ月及び6カ月貯蔵した錠剤の溶解プロフィールの比較;バッチ番号PB010076を示す。
【図6】平均値の95%信頼区間を示すピモベンダン5.0mg錠剤の溶解プロフィール;USP装置2(パドル)、回転速度75rpm、緩衝液pH 4.0、HDPEボトル内で40℃/75%にて6カ月貯蔵した錠剤の溶解プロフィールの比較;バッチ番号PB020059を示す。
【図7】平均値の95%信頼区間を示すピモベンダン5.0mg錠剤の溶解プロフィール;USP装置2(パドル)、回転速度75rpm、緩衝液pH 4.0、製造変量:種々の圧縮力;バッチ番号PB02025を示す。
【発明を実施するための形態】
【0008】
〔発明の詳細な説明〕
本発明の実施態様を述べる前に、本明細書及び添付の特許請求の範囲で使用する場合、単数表現“1(a、an)”、及び“その(the)”は、該文脈が明白に特定しない限り、複数の言及を包含することに留意しなければならない。従って、例えば、“1錠剤”という言及は複数の該錠剤を包含し、“担体(carrier)”は、1種又は2種以上の担体及び当業者に既知のその等価物を指す、などである。特に定義しない限り、本明細書で使用するすべての技術用語及び科学用語は、この発明が属する技術の当業者が一般的に解釈するのと同じ意味を有する。すべての与えられる範囲及び値は、特に指定せず、或いは当業者によって別に考えられない限り、1〜5%まで変化しうる。従って、本明細書では用語“約”を省いた。本明細書で述べたのと同様又は等価ないずれの方法及び材料も本発明の実施又は試験で使用できるが、ここでは好ましい方法、装置及び材料について述べる。本明細書で言及するすべての刊行物は、該刊行物で報告されている、本発明と関連して使用しうる物質、賦形剤、担体、及び方法論を記述かつ開示する目的のため引用により完全に本明細書に含まれるものとする。該開示の日付が前であるため、先行発明によって本発明に権利を与えないことを承認するものと解釈すべきでない。
【0009】
本明細書及び請求項で特徴づけされる実施態様によって、上記技術的問題に対する解決が達成される。
当技術における困難を克服するため、ある方法を発明した。この新規な流動層造粒法の発明のみが、本発明の自発的に受け入れられる固形製剤の調製を可能にした。本発明の方法により、自発的に受け入れられ、長期間安定で、大規模生産可能な、均質に分散した、高速放出性固形製剤を調製することができた。大きいサイズにかかわらず、ピモベンダンが均質に分散している。小動物に適したフレーバーを含む該固形製剤は、驚くべきことに、該製剤が多価酸を含むことを許容し、なおかつ70%を超える嗜好率を有し、多くの場合90%を超える嗜好率を有する。従って、本発明の固形製剤は、動物に強制して与えなければならないような治療用途で前進した主要ステップである。
【0010】
第1の重要な実施態様では、本発明はピモベンダン又はその医薬的に許容しうる塩(例えば、EP 008 391 B1又はEP 439 030 B1(両者は引用により完全に本明細書に含まれるものとする)を参照されたい)を含む固形製剤に関する。前記ピモベンダン又はその医薬的に許容しうる塩は、クエン酸、酢酸、マレイン酸、酒石酸又は前記いずれかの多価酸の無水物の群から選択される多過酸と、小動物に受け入れられるフレーバーとに均質に分散している。本発明の該フレーバーは、好ましくは人工ビーフフレーバー、人工チキンフレーバー、ポーク肝臓エキス、人工ミートフレーバー、ハチミツフレーバー等から選択される。前記フレーバーは、多価酸の味を隠すのみならず、ピモベンダンの味をも隠す。
好ましくは、本発明の固形製剤は錠剤又は顆粒製剤である。本発明の顆粒製剤はさらに詳細に後述される。さらに好ましくは、本固形製剤は咀嚼できる。
【0011】
本発明は、好ましくはさらに1種又は数種の医薬的に許容しうる賦形剤を含む本発明の固形製剤にも関する。本発明の賦形剤は、好ましくは希釈剤、崩壊剤、担体、結合剤、流動調節剤、潤沢剤及び溶剤から成る群より選択される。当業者に知られ、また本発明の固形製剤に適することが分かっているいずれの他の賦形剤も本発明の固形製剤に含めうる。Remington, J.P. The science and Practice of Pharmacy (2000). 20th ed. Lippincott Williams & Wilkins Publishers, Philiadelphia, USも参照されたい。さらに好ましくは、前記賦形剤は、群ラクトース、デンプン、セルロース、微結晶性セルロース及びセルロース誘導体、例えばメチルセルロース等から選択される担体/崩壊剤である。当業者に知られ、また本発明の固形製剤に適することが分かっているいずれの他の担体も本発明の固形製剤に含めうる。Remington, J.P. The science and Practice of Pharmacy (2000). 20th ed. Lippincott Williams & Wilkins Publishers, Philiadelphia, USも参照されたい。
【0012】
本発明の1種又は数種の結合剤は、好ましくはポリビドン(ポビドンの同義語として使用される)、メチルセルロース、ヒドロキシプロピルメチルセルロース(HPMC)、ヒドロキシメチルセルロース、デンプン、ゼラチン等から成る群より選択される。当業者に知られ、また本発明の固形製剤に適することが分かっているいずれの他の結合剤も本発明の固形製剤に含めうる。Remington, J.P. The science and Practice of Pharmacy (同所)も参照されたい。
本発明の固形製剤は、シリカ、好ましくはコロイド状無水シリカ、ケイ酸カルシウム、ケイ酸マグネシウム、タルク等から成る群より選択される1種又は数種の流動調節剤をも含みうる。当業者に知られ、また本発明の固形製剤に適することが分かっているいずれの他の流動調節剤も本発明の固形製剤に含めうる。Remington, J.P. The science and Practice of Pharmacy (同所)も参照されたい。
本発明の固形製剤は、クロスカルメロースナトリウム、ナトリウムデンプングリコレート、アルファ化デンプン、架橋ポリビニルピロリドン等から成る群より選択される1種又は数種の崩壊剤をも含みうる。当業者に知られ、また本発明の固形製剤に適することが分かっているいずれの他の崩壊剤も本発明の固形製剤に含めうる。Remington, J.P. The science and Practice of Pharmacy (同所)も参照されたい。
本発明の固形製剤は、ステアリン酸マグネシウム、ステアリン酸カルシウム、ベヘン酸グリセリル、ポリエチレングリコール、ステアリン酸、タルク等から成る群より選択される1種又は数種の潤沢剤をも含みうる。当業者に知られ、また本発明の固形製剤に適することが分かっているいずれの他の潤沢剤も本発明の固形製剤に含めうる。Remington, J.P. The science and Practice of Pharmacy (同所)も参照されたい。
【0013】
本発明は、好ましくは担体がデンプン及びラクトースであることを特徴とする本発明の固形製剤にも関する。本発明は、好ましくは前記ラクトースが200μmより大きいサイズの粗い粒子から成ることを特徴とする本発明の固形製剤にも関する。当業者は、本発明の担体にも好適な他のタイプのラクトース、例えば200μm以下のサイズの微細ラクトース又は噴霧乾燥ラクトースを知っている。200μmより大きいサイズの粗い粒子から成るラクトースが好ましい。
本発明は、好ましくはデンプン又は種々のデンプンが天然のデンプン、アルファ化デンプン、部分アルファ化デンプン、デンプン粉末、デンプン顆粒、化学的に改変したデンプン及び膨潤性の物理的に改変したデンプンから成る群より選択されることを特徴とする本発明の固形製剤にも関する。
本発明は、好ましくはデンプンがトウモロコシデンプンであることを特徴とする本発明の固形製剤にも関する。
本発明は、好ましくは0.5〜20mgのピモベンダンを含む本発明の固形製剤にも関する。さらに好ましい固形製剤は1〜10mgのピモベンダンを含む。なおさらに好ましい固形製剤は1.25〜5mgのピモベンダンを含む。最も好ましい固形製剤は、1.25mg、2.5mg、5mg又は10mgのピモベンダンを含む。
本発明は、好ましくは無水クエン酸に対するピモベンダンの含量が1:10〜1:40、好ましくは1:20であることを特徴とする本発明の固形製剤にも関する。
本発明は、好ましくは固形製剤全体の重量が250〜3000mgの範囲、さらに好ましくは500mg〜2000mgの重量範囲、最も好ましくは500mg〜1000mg又は2000mgの重量であることを特徴とする本発明の固形製剤にも関する。
【0014】
本発明は、好ましくは以下の工程を含み、或いは以下の工程から成る流動層造粒法で製造されることを特徴とする本発明の固形製剤にも関する:
a)ピモベンダンと上述したような結合剤の水溶液を、上記定義どおりの1種又は数種の担体及び/又は賦形剤、フレーバー及び無水クエン酸を含む固形担体層上に噴霧する工程及び
b)a)の混合物を乾燥させる工程及び
c)b)の混合物を篩いにかけて脱凝集する工程及び
d)c)の混合物に流動調節剤を添加する工程及び
e)d)の混合物に潤沢剤を添加する工程及び
f)e)の混合物を顆粒の均一性のためブレンドして最終顆粒を得る工程及び/又は
g)f)の最終顆粒を圧縮して固形製剤にする工程。
固形製剤が顆粒剤の場合、工程g)は省かれる。固形製剤が錠剤の場合、工程g)が行われる。
【0015】
本発明は、好ましくは以下の工程を含み、或いは以下の工程から成る流動層造粒法で製造されることを特徴とする本発明の固形製剤にも関する:
a)ピモベンダンとポビドンの水溶液を、ラクトース、デンプン、フレーバー及び無水クエン酸を含む固形担体層上に噴霧する工程及び
b)a)の混合物を乾燥させる工程及び
c)b)の混合物を篩いにかけて脱凝集する工程及び
d)c)の混合物に流動調節剤を添加する工程及び
e)d)の混合物に潤沢剤を添加する工程及び
f)e)の混合物を顆粒の均一性のためブレンドして最終顆粒を得る工程及び/又は
g)f)の最終顆粒を圧縮して固形製剤にする工程。
固形製剤が顆粒剤の場合、工程g)は省かれる。固形製剤が錠剤の場合、工程g)が行われる。
【0016】
本発明は、好ましくは上記方法で得られる顆粒製剤に関し、この顆粒製剤を顆粒形態で投与することもでき、或いは最終顆粒を圧縮して錠剤とした後、錠剤として投与することもできる。従って、本発明の固形製剤は、好ましくは顆粒剤(又は複数の該顆粒剤)又は錠剤である。食物と混合して、或いは直接動物に、例えばボウルに入れて顆粒剤の投与を行うことができる。顆粒形態で与えると、動物の体重に応じた個々の用量のピモベンダンを投与することができる。
本発明の錠剤は驚くべき利点を有する。その溶解プロフィールがピモベンダンの即時放出を確実にしている。驚くべきことに、上述したように最終顆粒を圧縮しているのに、その溶解特性の低減が観察されないことを実証できた。ピモベンダンの即時放出プロフィールを保証することによって、投与すべき薬物の量を可能な限り低く維持することができ、ひいては特に長期治療のための安全プロフィールを改善することができる。
さらに、錠剤の投薬精度が優れる。これは、この発明の製造方法によれば、ピモベンダン含量の優れた均一性が達成されるという事実のためである。さらに、錠剤を半分に割って2つにできるので、1錠の半量を投与することができる。現存するゼラチンカプセル剤に比し、動物と動物所有者の両方の投薬精度とコンプライアンスが保証される。本薬物は長期治療のために投与されるので、このことはさらに重要である。
【0017】
また、錠剤の嗜好性が優れる。この発明の錠剤が与えられるイヌの90%より多くは、ボウルに与えられた本錠剤だけを自発的に受け入れる。現存するゼラチンカプセル剤に比し、動物と動物所有者の両方のコンプライアンスが有意に改善される。本薬物は長期治療のために投与されるので、このことはさらに重要である。
本発明は、好ましくは25℃かつ60%の相対湿度で少なくとも18カ月間安定であることを特徴とする本発明の錠剤にも関する。実施例では、ピモベンダンの分解、錠剤の溶解、乾燥減量、硬度及び崩壊についての試験パラメーター分析を開示する。本発明の錠剤は、ピモベンダンの分解、溶解、乾燥減量、硬度及び崩壊について規格限界内である。
本発明の錠剤に適した包装材料は、限定するものではないが、アルミニウム/アルミニウムブリスター、PVC/PVDCブリスター、及びHDPE(高密度ポリエチレンボトル)から選択される。
本発明は、好ましくは形状が長方形(oblong)である。このような錠剤では、圧縮強度、崩壊、重量の均一性及び含量均一性のような特性がヨーロッパ薬局方(ISBN/ISSN 92-871-5106-7 of 4th Edition 2004, Vol. 4.8, European Directorate for the Quality of Medicines (EDQM), European Pharmacopoeia, 226 avenue de Colmar, F-67029 Strasbourg, France, http://www.pheur.org)及び米国薬局方(http://www.usp.org; 印刷:USP-NF, カタログ番号2270001)の要求を満たす。
【0018】
本発明は好ましくは固形製剤、最も好ましくは錠剤に関し、該固形製剤又は錠剤は0.5〜20mgのピモベンダン、好ましくは1.25mg、2.5mg、5mg又は10mgのピモベンダンを含み、かつさらに、ラクトース(該固形製剤/錠剤の乾燥質量に対して35〜50質量%(w/w))、トウモロコシデンプン(25〜50%w/w)、クロスカルメロース-ナトリウム(1〜5%)、クエン酸(2.5〜10%w/w)、人工ビーフフレーバー(5〜30%w/w)、ポリビドン(1〜5%w/w)、コロイド状無水シリカ(0.1〜1、好ましくは0.1〜0.5%w/w)及びステアリン酸マグネシウム(0.25〜1.5%w/w)を含み、好ましくは前記成分から成ることを特徴とする。ここで、ピモベンダンの質量%は好ましくは約0.25%(w/w)を含み、かつピモベンダンを含む該固形製剤の全成分の質量%の合計は100%(w/w)である。当業者は、このような固形製剤、好ましくは錠剤を調製することができる。従って、当業者には、ラクトースの量が32.625%(w/w)の場合、0.25%(w/w)のピモベンダン、最高32.625%(w/w)のトウモロコシデンプン、4%(w/w)のクロスカルメロース-ナトリウム、5%(w/w)のクエン酸、20%(w/w)の人工ビーフフレーバー、4%(w/w)のポリビドン、コロイド状の0.5%(w/w)の無水シリカ、1%(w/w)のステアリン酸マグネシウムを添加できることが分かる。さらに、当業者には、人工ビーフフレーバーの量を例えば最小5%(w/w)に減らすと決めた場合、ラクトースの量を例えば47.265%(w/w)に増やせることが分かる。本発明は、約0.25%(w/w)のピモベンダンと、固形製剤、好ましくは錠剤の上記他のいずれかの成分とを個々の製剤成分の質量の合計が100%になるように含む固形製剤、好ましくは錠剤にも関する。
【0019】
本発明は、好ましくは総重量400mgの固形製剤、好ましくは錠剤毎に、1mgのピモベンダン、100〜200mgのラクトース、100〜200mgのトウモロコシデンプン、4〜20mgのクロスカルメロース-ナトリウム、10〜40mgの無水クエン酸、20〜120mgの人工ビーフフレーバー、4〜20mgのポリビドン、0.4〜4mgのコロイド状無水シリカ、及び1〜6mgのステアリン酸マグネシウムを含み、好ましくは前記成分から成る固形製剤、好ましくは錠剤にも関する。本発明のさらなる実施態様によれば、本固形製剤、好ましくは錠剤は総重量400mgの固形製剤/錠剤毎に、1mgのピモベンダン、120〜180mgのラクトース、120〜180mgのトウモロコシデンプン、8〜18mgのクロスカルメロース-ナトリウム、15〜30mgの無水クエン酸、40〜100mgの人工ビーフフレーバー、8〜18mgのポリビドン、0.5〜2mgのコロイド状無水シリカ、及び2〜5mgのステアリン酸マグネシウムを含み、好ましくは前記成分から成る。例えば、本発明は、総重量400mg毎に以下の成分を含む固形製剤に関する:1mgのピモベンダン、20mgの無水クエン酸、130.5mgのラクトース、130.5mgのトウモロコシデンプン、16mgのポリビドン、16mgのクロスカルメロース-ナトリウム、80mgの人工ビーフフレーバー、4mgのステアリン酸マグネシウム、及び2mgのコロイド状無水シリカ。当業者は、このような固形製剤/錠剤を調製することができる。当業者には、各1mgのピモベンダンに対する固形製剤/錠剤の総重量が400mgである上記範囲内の固形製剤/錠剤の各成分の量を変えられることも分かるだろう。例えば、約1mgのピモベンダンを含む総重量400mgの各固形製剤、好ましくは錠剤についてラクトースの量は、100、101、102、…108、109、110等;111、112、…118、119、120等;121、122、…128、129、120等;131、132、…138、139、140等;141、142、…148、149、150等;151、152、…158、159、160等;161、162、…168、169、170等;171、172、…178、179、180等;108、182、…188、189、190等;191、192、…198、199、200mgでよい。同様に、約1mgのピモベンダンを含む総重量400mgの各固形製剤、好ましくは錠剤についてトウモロコシデンプンの量は、100、101、102、…108、109、110等;111、112、…118、119、120等;121、122、…128、129、120等;131、132、…138、139、140等;141、142、…148、149、150等;151、152、…158、159、160等;161、162、…168、169、170等;171、172、…178、179、180等;108、182、…188、189、190等;191、192、…198、199、200mgでよい。さらに、約1mgのピモベンダンを含む総重量400mgの各固形製剤、好ましくは錠剤について無水クエン酸の量は、10、11、12、…18、19、20等;21、22、…28、29、30等;31、32、…38、39、40mgでよい。さらに、約1mgのピモベンダンを含む総重量400mgの各固形製剤、好ましくは錠剤について人工ビーフフレーバーの量は、20、21、22、…28、29、30等;31、32、…38、39、40等;41、42、…48、49、50等;50、51、52、…58、59、60等;61、62、…68、69、70等;71、72、…78、79、80等、81、82、83、…88、89、90等;91、92、…98、99、100等;101、102、…108、109、110等;111、112、…118、119、120mgでよい。さらに、約1mgのピモベンダンを含む総重量400mgの各固形製剤、好ましくは錠剤についてポリビドンの量は、4、5、6、…8、9、10等;11、12、…18、19、20mgでよい。さらに、約1mgのピモベンダンを含む総重量400mgの各固形製剤、好ましくは錠剤についてクロスカルメロース-ナトリウムの量は、4、5、6、…8、9、10等;11、12、…18、19、20mgでよい。さらに、約1mgのピモベンダンを含む総重量400mgの各固形製剤、好ましくは錠剤についてステアリン酸マグネシウムの量は、1.0、1.1、1.2、…1.8、1.9、2.0等;2.1、2.2、…2.8、2.9、3.0等;3.1、3.2、…3.8、3.9、40等;4.0、4.1、4.2、…4.8、4.9、5.0等;5.1、5.2、…5.8、5.9、6.0mgでよい。さらに、約1mgのピモベンダンを含む総重量400mgの各固形製剤、好ましくは錠剤についてコロイド状無水シリカの量は、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、…1.8、1.9、2.0等;2.1、2.2、…2.8、2.9、3.0等;3.1、3.2、…3.8、3.9、4.0mgでよい。当業者は、このような本発明のいずれの固形製剤も好ましくは錠剤として調製することができる。
【0020】
別の重要な実施態様では、本発明は、以下の工程を含む、好ましくは以下の工程から成る流動層造粒法に関する:
a)ピモベンダンと上述したような結合剤の水溶液を、上記定義どおりの1種又は数種の担体及び/又は賦形剤、フレーバー及び無水クエン酸を含む固形担体層上に噴霧する工程及び
b)a)の混合物を乾燥させる工程及び
c)b)の混合物を篩いにかけて脱凝集する工程及び
d)c)の混合物に流動調節剤を添加する工程及び
e)d)の混合物に潤沢剤を添加する工程及び
f)e)の混合物を顆粒の均一性のためブレンドして最終顆粒を得る工程及び/又は
g)f)の最終顆粒を圧縮して固形製剤にする工程。
固形製剤が顆粒剤の場合、工程g)は省かれる。固形製剤が錠剤の場合、工程g)が行われる。
【0021】
本発明は、好ましくは以下の工程を含み、好ましくは以下の工程から成る流動層造粒法に関する:
a)ピモベンダンとポビドンの水溶液を、ラクトース、デンプン、フレーバー及び無水クエン酸を含む固形支持体上に噴霧する工程及び
b)a)の混合物を乾燥させる工程及び
c)b)の混合物を篩いにかけて脱凝集する工程及び
d)c)の混合物に流動調節剤を添加する工程及び
e)d)の混合物に潤沢剤を添加する工程及び
f)e)の混合物を顆粒の均一性のためブレンドして最終顆粒を得る工程及び/又は
g)f)の最終顆粒を錠剤にする工程。
固形製剤が顆粒剤の場合、工程g)は省かれる。固形製剤が錠剤の場合、工程g)が行われる。
【0022】
別の実施態様は、強心性、降圧性及び抗血栓性物質が治療利益を有する疾患の予防及び/又は治療方法であって、該治療が必要な哺乳動物に、治療的に有効な量の上述したとおりの本発明の固形製剤を投与することを含む方法である。うっ血性心不全の予防及び/又は治療方法であって、該治療が必要な哺乳動物に、治療的に有効な量の上述したとおりの本発明の固形製剤を投与することを含む方法が好ましい。最も好ましくは、この方法は、本発明の錠剤を投与することを含む方法であって、前記錠剤が、1.25mg、2.5mg、5mg又は10mgのピモベンダンを含み、好ましくは1.25mg、2.5mg、5mg又は10mgのピモベンダンから成り、かつさらに、ラクトース、トウモロコシデンプン、クロスカルメロース-ナトリウム、クエン酸(好ましくは50mg/gの量で)、人工ビーフフレーバー、ポリビドン、コロイド状無水シリカ及びステアリン酸マグネシウムを含み、好ましくはラクトース、トウモロコシデンプン、クロスカルメロース-ナトリウム、クエン酸(好ましくは50mg/gの量で)、人工ビーフフレーバー、ポリビドン、コロイド状無水シリカ及びステアリン酸マグネシウムから成ることを特徴とする。好ましくは、該治療は、本発明の固形製剤を経口投与することによる。
本発明の哺乳動物は、好ましくはイヌ、ネコ及びげっ歯類、例えばウサギから成る群より選択される哺乳動物である。
【0023】
さらに、本発明は、うっ血性心不全の予防及び/又は治療用薬物の製造方法であって、本発明の固形製剤を使用することを特徴とする方法に関する。好ましくは、本発明は、うっ血性心不全の予防及び/又は治療用薬物の製造方法であって、1.25mg、2.5mg、5mg又は10mgのピモベンダンから成り、かつさらにラクトース、トウモロコシデンプン、クロスカルメロース-ナトリウム、50mg/gのクエン酸、人工ビーフフレーバー、ポリビドン、コロイド状無水シリカ及びステアリン酸マグネシウムから成る錠剤を使用することを特徴とする方法に関する。
さらに、本発明は、本明細書で述べた本発明の固形製剤、好ましくは錠剤と、うっ血性心不全の予防及び/又は治療のため、該予防又は治療が必要な哺乳動物、好ましくはイヌ、ネコ又はげっ歯類に前記固形製剤、好ましくは錠剤を好ましくは経口で使用できるという情報を含むパッケージリーフレット又は使用説明書とを含むキットに関する。
【実施例】
【0024】
〔実施例〕
以下の実施例は本発明をさらに説明するために役立つが、本出願で開示される本発明の範囲を限定するものと解釈すべきでない。
実施例1:組成物
組成物A

【0025】
組成物B

【0026】
実施例2:原材料
(01) ピモベンダン
機能:活性成分
(02) 無水クエン酸<200μm
機能:希釈剤、崩壊剤
(03) デンプン
機能:担体、崩壊剤
(04) ラクトース、粗粒
機能:担体、崩壊剤
(05) ポビドン
機能:結合剤
(06) クロスカルメロースナトリウム
機能:崩壊剤
(07) 人工粉末ビーフフレーバー
機能:フレーバー
(08) シリカ、コロイド状無水物
機能:流動調節剤、崩壊剤
(09) ステアリン酸マグネシウム
機能:潤沢剤
(10) 純水
機能:溶剤
【0027】
実施例3:製品明細
外観:茶色がかった長方形の錠剤、分割線つき。

【0028】
実施例4:製造方法
1バッチ=140000錠(1.25mg薬用量)
1バッチ= 70000錠(2.50mg薬用量)
1バッチ= 35000錠(5.00mg薬用量)
1.造粒
以下の成分を予備篩い分け後、適切な造粒機に移す:
(01) デンプン(例えば18メッシュ篩い) 22.8375 kg
(02) ラクトース(例えば18メッシュ篩い) 22.8375 kg
(03) 無水クエン酸(例えば18メッシュ篩い) 3.500 kg
(04) クロスカルメロースナトリウム(例えば18メッシュ篩い) 2.800 kg
(05) 人工ビーフフレーバー(例えば45メッシュ篩い) 14.000 kg
(05) ポビドン(噴霧溶液) 2.800 kg
(06) UDCG 115 BS(噴霧液) 0.175 kg
造粒機内で予混合して造粒する
68.950 kg
ポビドンの噴霧溶液用及びピモベンダンの分散用溶剤として純水(例えば16.8kg、範囲:12.0〜18.0kg)を使用する。
2.篩い分け
予混合物(1.)を篩いにかける 68.950 kg
68.950 kg
3.最終混合
以下の成分を加える。
(07) シリカ、コロイド状無水物(例えば25メッシュ篩い) 0.350 kg
(08) ステアリン酸マグネシウム(例えば25メッシュ篩い) 0.700 kg
回転ミキサーで、篩いにかけた予混合物(2.)
と上記二成分を混合する。
70.000 kg
4.圧縮
ロータリープレスを用いて最終混合物(3.) 70.000 kg
を圧縮して500mg、1000mg、2000mgの錠剤にする。
70.000 kg
5.包装
錠剤を適切な容器に移す。
例えば、適切な機械で錠剤をブリスター包装することによって錠剤を包装することができる。
【0029】
実施例5:プロセス制御
1.顆粒
1.1 外観:茶色がかった白い斑点のある顆粒
1.2 乾燥減量:乾燥減量を定量する
例えば、HR73;3g/105℃/5分
目標:約3.0%
許容限界:5.0%未満
2.錠剤
2.1 外観:茶色がかった白い斑点のある長方形の錠剤(分割線つき)
2.2 重量の均一性:
1) 1.25mg咀嚼錠の平均重量:475〜525mg
2) 2.5mg咀嚼錠の平均重量:950〜1050mg
3) 5mg咀嚼錠の平均重量:1900〜2100mg
2.3 硬度:硬度を定量する
1) 1.25mg 目標:140 N
許容:60〜250 N
2) 2.5mg 目標:160 N
許容:60〜250N
3) 5.0mg 目標:190 N
許容:60〜300 N
2.4 崩壊時間:USP/EPに準拠して崩壊時間を定量する
許容限界:≦37℃の水で15分(ディスクあり)
【0030】
実施例6:嗜好性の研究
ピモベンダン含有錠剤の嗜好性を調べるための研究を行った。4日間、自発的な摂取のため、20又は10匹のイヌに二製品をそれぞれ与えた。例えば、活性成分量が5mg/500mgの以下の製剤を調べた。
【0031】

【0032】
造粒形式が同じ製剤と競合させたCh. 010123の場合、40回の可能な機会(すなわち、10日間10匹のイヌに与えた場合)のうち36回で自発的な摂取が観察された。これは90.0%の受け入れ率に匹敵する。
30%のフレーバーと等量の造粒形式の製剤と競合させたCh. 010222の場合、40回の可能な機会のうち31回で自発的な摂取が観察された。これは77.5%の受け入れ率に匹敵する。
【0033】
実施例7:溶解プロフィール
この発明の錠剤の代表的な溶解プロフィールの例は図3に開示したとおりである。
溶解プロフィール、ピモベンダン1.25MG錠剤(平均値の95%信頼区間を示す)
USP装置2(パドル)、回転速度75 rpm、緩衝液pH 4.0、HDPEボトル内で40℃/75%にて1カ月及び6カ月貯蔵した錠剤の溶解プロフィールの比較(バッチ番号PB020049)
この発明の錠剤の代表的な溶解プロフィールの例は図4に開示したとおりである。
溶解プロフィール、ピモベンダン1.25MG錠剤(平均値の95%信頼区間を示す)
USP装置2(パドル)、回転速度75 rpm、緩衝液pH 4.0、開いたガラスビン内で25℃/60%にて12日貯蔵した錠剤の溶解プロフィールの比較(バッチ番号PB010080)
【0034】
溶解プロフィール、ピモベンダン1.25MG錠剤(製造変量:種々の圧縮力)

【0035】
この発明の錠剤の代表的な溶解プロフィールの例は図5に開示したとおりである。
溶解プロフィール、ピモベンダン2.5MG錠剤(平均値の95%信頼区間を示す)
USP装置2(パドル)、回転速度75 rpm、緩衝液pH 4.0、ALU-ALUブリスター内で40℃/75%にて3カ月及び6カ月貯蔵した錠剤の溶解プロフィールの比較(バッチ番号PB010076)
この発明の錠剤の代表的な溶解プロフィールの例は図6に開示したとおりである。
溶解プロフィール、ピモベンダン5.0MG錠剤(平均値の95%信頼区間を示す)
USP装置2(パドル)、回転速度75 rpm、緩衝液pH 4.0、HDPEボトル内で40℃/75%にて6カ月貯蔵した錠剤の溶解プロフィールの比較(バッチ番号PB020059)
この発明の錠剤の代表的な溶解プロフィールの例は図7に開示したとおりである。
溶解プロフィール、ピモベンダン5.0MG錠剤(平均値の95%信頼区間を示す)
USP装置2(パドル)、回転速度75 rpm、緩衝液pH 4.0(製造変量:種々の圧縮力)
【0036】
バッチ番号020205

【0037】
安定性研究で用いたピモベンダン咀嚼錠バッチの分析結果

n.d.=測定せず
【0038】
実施例8:含量均一性
錠剤成形前の最終ブレンドと錠剤成形プロセスの両方からサンプルを取った。以下の結果はピモベンダン含量の均一性を実証する。
【0039】
ブレンドの均一性

【0040】
プロセスの均一性

【0041】
実施例9:分割錠の精度
この発明の錠剤は分割錠の含量均一性試験の一部だった。錠剤成形プロセスの最初、中間及び最後から10錠取り、半分に割った。ピモベンダン含量を定量した。
【0042】

【0043】

【0044】
実施例10:24カ月後の安定性データ(溶解/ピモベンダンの分析/ピモベンダンの分解)

【0045】

【0046】

【0047】

【0048】

【0049】

【0050】

【0051】

【0052】

【符号の説明】
【0053】
1 排気ベンチレーター
2 フィルター
3 ポンプ
4 撹拌機
5 微粉化ピモベンダンと結合剤溶液(PVP、HPMC、デンプン、ゼラチン)の水性懸濁液
6 吸込空気の加熱装置
7 篩い
8 ノズル(水性懸濁液が粉末層上に噴霧される(クエン酸、ラクトース、デンプン、フレーバー))
9 粉末層
【技術分野】
【0001】
〔発明の背景〕
〔技術分野〕
本発明は、動物の健康の分野に関する。特に、本発明は、医薬的に活性な化合物としてピモベンダンを含む新規な経口医薬組成物に関する。
【背景技術】
【0002】
〔背景情報〕
ピモベンダン(4,5-ジヒドロ-6-[2-(4-メトキシフェニル)-1H-ベンズイミダゾール-5-イル]-5-メチル-3(2H)-ピリダゾン)は、EP 008 391 B1(引用により完全に本明細書に含まれるものとする)に開示されている。ピモベンダンは、強心薬、降圧薬及び抗血栓薬である。前記物質は、徴候うっ血性心不全における標準物質である。
ピモベンダンは水にほとんど溶けない。経口投与用の既知又は通常の剤形に該活性物質が組み込まれている場合、経口投与したとき、ピモベンダンの吸収は個体間及び個体内でかなり変動する傾向がある。この理由は、ピモベンダンが水性媒体での低い溶解度と非常に高いpH依存性溶解度を特徴とするからである。これを克服するため、クエン酸と配合したピモベンダン(特に、ピモベンダン対クエン酸の重量比1:10〜1:20で)を含有する硬ゼラチンカプセルが使用された(EP 008 391 B1;引用により完全に本明細書に含まれるものとする)。しかし、多量のクエン酸及びクエン酸の酸味は多くの動物によって自発的に受け入れられないので、このようなカプセル剤は動物に強制して与えるか、又は投与前に食物と混合しなければならない。
【発明の概要】
【発明が解決しようとする課題】
【0003】
本発明に内在する問題は、哺乳類対象、特に小動物によって自発的に受け入れられるピモベンダン固形製剤を提供することだった。
【課題を解決するための手段】
【0004】
〔発明の簡単な概要〕
本発明は、医薬的に活性な化合物として、小動物に受け入れられる多価酸及びフレーバーに均質に分散したピモベンダン又はその医薬的に許容しうる塩を含む新規な固形製剤に関する。好ましくは、該固形製剤は顆粒剤又は錠剤である。最も好ましくは錠剤であって、該錠剤が1.25mg、2.5mg、5mg又は10mgのピモベンダンを含み、好ましくは該錠剤が1.25mg、2.5mg、5mg又は10mgのピモベンダンから成り、かつさらにラクトース、トウモロコシデンプン、クロスカルメロース(croscarmellose)-ナトリウム、クエン酸(好ましくは1gの該固形製剤当たり50mgの量で)、人工ビーフフレーバー、ポリビドン、コロイド状無水シリカ及びステアリン酸マグネシウムから成ることを特徴とする錠剤である。
【0005】
さらに、本発明は、以下の工程を含むか又は以下の工程から成る、固形製剤製造のための流動層造粒法に関する:
a)ピモベンダンと上述したような結合剤の水溶液を、1種又は数種の担体及び/又は賦形剤、フレーバー及び無水クエン酸を含む固形担体層上に噴霧する工程及び
b)a)の混合物を乾燥させる工程及び
c)b)の混合物を篩いにかけて脱凝集する工程及び
d)c)の混合物に流動調節剤を添加する工程及び
e)d)の混合物に潤沢剤を添加する工程及び
f)e)の混合物を顆粒の均一性のためブレンドして最終顆粒を得る工程及び/又は
g)f)の最終顆粒を圧縮して固形製剤にする工程。
固形製剤が顆粒剤の場合、工程g)は省かれる。固形製剤が錠剤の場合、工程g)が行われる。
【0006】
さらに、本発明は、強心性、降圧性及び抗血栓性物質が治療利益を有する疾患の予防及び/又は治療方法であって、該治療が必要な哺乳動物に、治療的に有効な量の上述した本発明の固形製剤を投与することを含む方法に関する。
うっ血性心不全の予防及び/又は治療方法であって、該治療が必要な哺乳動物に、治療的に有効な量の上述した本発明の固形製剤を投与することを含む方法が好ましい。最も好ましくは、本方法は、上述したとおりの本発明の錠剤を投与することを含む。
さらに、本発明は、うっ血性心不全の予防及び/又は治療用薬物の製造方法であって、本発明の固形製剤を使用することを特徴とする方法に関する。好ましくは、本発明は、うっ血性心不全の予防及び/又は治療用薬物の製造方法であって、1.25mg、2.5mg、5mg又は10mgのピモベンダンを含み、好ましくは1.25mg、2.5mg、5mg又は10mgのピモベンダンから成り、かつさらにラクトース、トウモロコシデンプン、クロスカルメロース-ナトリウム、50mg/gのクエン酸、人工ビーフフレーバー、ポリビドン、コロイド状無水シリカ及びステアリン酸マグネシウムから成る錠剤を使用することを特徴とする方法に関する。
【図面の簡単な説明】
【0007】
【図1】基本的なトップ噴霧流動層法の説明図である。
【図2】製造法のフローチャートである。
【図3】平均値の95%信頼区間を示すピモベンダン1.25mg錠剤の溶解プロフィール;USP装置2(パドル)、回転速度75rpm、緩衝液pH 4.0、HDPEボトル内で40℃/75%にて1カ月及び6カ月貯蔵した錠剤の溶解プロフィールの比較;バッチ番号PB020049を示す。
【図4】平均値の95%信頼区間を示すピモベンダン1.25mg錠剤の溶解プロフィール;USP装置2(パドル)、回転速度75rpm、緩衝液pH 4.0、開いたガラスビン内で25℃/60%にて12日貯蔵した錠剤の溶解プロフィールの比較;バッチ番号PB010080を示す。
【図5】平均値の95%信頼区間を示すピモベンダン2.5mg錠剤の溶解プロフィール;USP装置2(パドル)、回転速度75rpm、緩衝液pH 4.0、Alu-Aluブリスター内で40℃/75%にて3カ月及び6カ月貯蔵した錠剤の溶解プロフィールの比較;バッチ番号PB010076を示す。
【図6】平均値の95%信頼区間を示すピモベンダン5.0mg錠剤の溶解プロフィール;USP装置2(パドル)、回転速度75rpm、緩衝液pH 4.0、HDPEボトル内で40℃/75%にて6カ月貯蔵した錠剤の溶解プロフィールの比較;バッチ番号PB020059を示す。
【図7】平均値の95%信頼区間を示すピモベンダン5.0mg錠剤の溶解プロフィール;USP装置2(パドル)、回転速度75rpm、緩衝液pH 4.0、製造変量:種々の圧縮力;バッチ番号PB02025を示す。
【発明を実施するための形態】
【0008】
〔発明の詳細な説明〕
本発明の実施態様を述べる前に、本明細書及び添付の特許請求の範囲で使用する場合、単数表現“1(a、an)”、及び“その(the)”は、該文脈が明白に特定しない限り、複数の言及を包含することに留意しなければならない。従って、例えば、“1錠剤”という言及は複数の該錠剤を包含し、“担体(carrier)”は、1種又は2種以上の担体及び当業者に既知のその等価物を指す、などである。特に定義しない限り、本明細書で使用するすべての技術用語及び科学用語は、この発明が属する技術の当業者が一般的に解釈するのと同じ意味を有する。すべての与えられる範囲及び値は、特に指定せず、或いは当業者によって別に考えられない限り、1〜5%まで変化しうる。従って、本明細書では用語“約”を省いた。本明細書で述べたのと同様又は等価ないずれの方法及び材料も本発明の実施又は試験で使用できるが、ここでは好ましい方法、装置及び材料について述べる。本明細書で言及するすべての刊行物は、該刊行物で報告されている、本発明と関連して使用しうる物質、賦形剤、担体、及び方法論を記述かつ開示する目的のため引用により完全に本明細書に含まれるものとする。該開示の日付が前であるため、先行発明によって本発明に権利を与えないことを承認するものと解釈すべきでない。
【0009】
本明細書及び請求項で特徴づけされる実施態様によって、上記技術的問題に対する解決が達成される。
当技術における困難を克服するため、ある方法を発明した。この新規な流動層造粒法の発明のみが、本発明の自発的に受け入れられる固形製剤の調製を可能にした。本発明の方法により、自発的に受け入れられ、長期間安定で、大規模生産可能な、均質に分散した、高速放出性固形製剤を調製することができた。大きいサイズにかかわらず、ピモベンダンが均質に分散している。小動物に適したフレーバーを含む該固形製剤は、驚くべきことに、該製剤が多価酸を含むことを許容し、なおかつ70%を超える嗜好率を有し、多くの場合90%を超える嗜好率を有する。従って、本発明の固形製剤は、動物に強制して与えなければならないような治療用途で前進した主要ステップである。
【0010】
第1の重要な実施態様では、本発明はピモベンダン又はその医薬的に許容しうる塩(例えば、EP 008 391 B1又はEP 439 030 B1(両者は引用により完全に本明細書に含まれるものとする)を参照されたい)を含む固形製剤に関する。前記ピモベンダン又はその医薬的に許容しうる塩は、クエン酸、酢酸、マレイン酸、酒石酸又は前記いずれかの多価酸の無水物の群から選択される多過酸と、小動物に受け入れられるフレーバーとに均質に分散している。本発明の該フレーバーは、好ましくは人工ビーフフレーバー、人工チキンフレーバー、ポーク肝臓エキス、人工ミートフレーバー、ハチミツフレーバー等から選択される。前記フレーバーは、多価酸の味を隠すのみならず、ピモベンダンの味をも隠す。
好ましくは、本発明の固形製剤は錠剤又は顆粒製剤である。本発明の顆粒製剤はさらに詳細に後述される。さらに好ましくは、本固形製剤は咀嚼できる。
【0011】
本発明は、好ましくはさらに1種又は数種の医薬的に許容しうる賦形剤を含む本発明の固形製剤にも関する。本発明の賦形剤は、好ましくは希釈剤、崩壊剤、担体、結合剤、流動調節剤、潤沢剤及び溶剤から成る群より選択される。当業者に知られ、また本発明の固形製剤に適することが分かっているいずれの他の賦形剤も本発明の固形製剤に含めうる。Remington, J.P. The science and Practice of Pharmacy (2000). 20th ed. Lippincott Williams & Wilkins Publishers, Philiadelphia, USも参照されたい。さらに好ましくは、前記賦形剤は、群ラクトース、デンプン、セルロース、微結晶性セルロース及びセルロース誘導体、例えばメチルセルロース等から選択される担体/崩壊剤である。当業者に知られ、また本発明の固形製剤に適することが分かっているいずれの他の担体も本発明の固形製剤に含めうる。Remington, J.P. The science and Practice of Pharmacy (2000). 20th ed. Lippincott Williams & Wilkins Publishers, Philiadelphia, USも参照されたい。
【0012】
本発明の1種又は数種の結合剤は、好ましくはポリビドン(ポビドンの同義語として使用される)、メチルセルロース、ヒドロキシプロピルメチルセルロース(HPMC)、ヒドロキシメチルセルロース、デンプン、ゼラチン等から成る群より選択される。当業者に知られ、また本発明の固形製剤に適することが分かっているいずれの他の結合剤も本発明の固形製剤に含めうる。Remington, J.P. The science and Practice of Pharmacy (同所)も参照されたい。
本発明の固形製剤は、シリカ、好ましくはコロイド状無水シリカ、ケイ酸カルシウム、ケイ酸マグネシウム、タルク等から成る群より選択される1種又は数種の流動調節剤をも含みうる。当業者に知られ、また本発明の固形製剤に適することが分かっているいずれの他の流動調節剤も本発明の固形製剤に含めうる。Remington, J.P. The science and Practice of Pharmacy (同所)も参照されたい。
本発明の固形製剤は、クロスカルメロースナトリウム、ナトリウムデンプングリコレート、アルファ化デンプン、架橋ポリビニルピロリドン等から成る群より選択される1種又は数種の崩壊剤をも含みうる。当業者に知られ、また本発明の固形製剤に適することが分かっているいずれの他の崩壊剤も本発明の固形製剤に含めうる。Remington, J.P. The science and Practice of Pharmacy (同所)も参照されたい。
本発明の固形製剤は、ステアリン酸マグネシウム、ステアリン酸カルシウム、ベヘン酸グリセリル、ポリエチレングリコール、ステアリン酸、タルク等から成る群より選択される1種又は数種の潤沢剤をも含みうる。当業者に知られ、また本発明の固形製剤に適することが分かっているいずれの他の潤沢剤も本発明の固形製剤に含めうる。Remington, J.P. The science and Practice of Pharmacy (同所)も参照されたい。
【0013】
本発明は、好ましくは担体がデンプン及びラクトースであることを特徴とする本発明の固形製剤にも関する。本発明は、好ましくは前記ラクトースが200μmより大きいサイズの粗い粒子から成ることを特徴とする本発明の固形製剤にも関する。当業者は、本発明の担体にも好適な他のタイプのラクトース、例えば200μm以下のサイズの微細ラクトース又は噴霧乾燥ラクトースを知っている。200μmより大きいサイズの粗い粒子から成るラクトースが好ましい。
本発明は、好ましくはデンプン又は種々のデンプンが天然のデンプン、アルファ化デンプン、部分アルファ化デンプン、デンプン粉末、デンプン顆粒、化学的に改変したデンプン及び膨潤性の物理的に改変したデンプンから成る群より選択されることを特徴とする本発明の固形製剤にも関する。
本発明は、好ましくはデンプンがトウモロコシデンプンであることを特徴とする本発明の固形製剤にも関する。
本発明は、好ましくは0.5〜20mgのピモベンダンを含む本発明の固形製剤にも関する。さらに好ましい固形製剤は1〜10mgのピモベンダンを含む。なおさらに好ましい固形製剤は1.25〜5mgのピモベンダンを含む。最も好ましい固形製剤は、1.25mg、2.5mg、5mg又は10mgのピモベンダンを含む。
本発明は、好ましくは無水クエン酸に対するピモベンダンの含量が1:10〜1:40、好ましくは1:20であることを特徴とする本発明の固形製剤にも関する。
本発明は、好ましくは固形製剤全体の重量が250〜3000mgの範囲、さらに好ましくは500mg〜2000mgの重量範囲、最も好ましくは500mg〜1000mg又は2000mgの重量であることを特徴とする本発明の固形製剤にも関する。
【0014】
本発明は、好ましくは以下の工程を含み、或いは以下の工程から成る流動層造粒法で製造されることを特徴とする本発明の固形製剤にも関する:
a)ピモベンダンと上述したような結合剤の水溶液を、上記定義どおりの1種又は数種の担体及び/又は賦形剤、フレーバー及び無水クエン酸を含む固形担体層上に噴霧する工程及び
b)a)の混合物を乾燥させる工程及び
c)b)の混合物を篩いにかけて脱凝集する工程及び
d)c)の混合物に流動調節剤を添加する工程及び
e)d)の混合物に潤沢剤を添加する工程及び
f)e)の混合物を顆粒の均一性のためブレンドして最終顆粒を得る工程及び/又は
g)f)の最終顆粒を圧縮して固形製剤にする工程。
固形製剤が顆粒剤の場合、工程g)は省かれる。固形製剤が錠剤の場合、工程g)が行われる。
【0015】
本発明は、好ましくは以下の工程を含み、或いは以下の工程から成る流動層造粒法で製造されることを特徴とする本発明の固形製剤にも関する:
a)ピモベンダンとポビドンの水溶液を、ラクトース、デンプン、フレーバー及び無水クエン酸を含む固形担体層上に噴霧する工程及び
b)a)の混合物を乾燥させる工程及び
c)b)の混合物を篩いにかけて脱凝集する工程及び
d)c)の混合物に流動調節剤を添加する工程及び
e)d)の混合物に潤沢剤を添加する工程及び
f)e)の混合物を顆粒の均一性のためブレンドして最終顆粒を得る工程及び/又は
g)f)の最終顆粒を圧縮して固形製剤にする工程。
固形製剤が顆粒剤の場合、工程g)は省かれる。固形製剤が錠剤の場合、工程g)が行われる。
【0016】
本発明は、好ましくは上記方法で得られる顆粒製剤に関し、この顆粒製剤を顆粒形態で投与することもでき、或いは最終顆粒を圧縮して錠剤とした後、錠剤として投与することもできる。従って、本発明の固形製剤は、好ましくは顆粒剤(又は複数の該顆粒剤)又は錠剤である。食物と混合して、或いは直接動物に、例えばボウルに入れて顆粒剤の投与を行うことができる。顆粒形態で与えると、動物の体重に応じた個々の用量のピモベンダンを投与することができる。
本発明の錠剤は驚くべき利点を有する。その溶解プロフィールがピモベンダンの即時放出を確実にしている。驚くべきことに、上述したように最終顆粒を圧縮しているのに、その溶解特性の低減が観察されないことを実証できた。ピモベンダンの即時放出プロフィールを保証することによって、投与すべき薬物の量を可能な限り低く維持することができ、ひいては特に長期治療のための安全プロフィールを改善することができる。
さらに、錠剤の投薬精度が優れる。これは、この発明の製造方法によれば、ピモベンダン含量の優れた均一性が達成されるという事実のためである。さらに、錠剤を半分に割って2つにできるので、1錠の半量を投与することができる。現存するゼラチンカプセル剤に比し、動物と動物所有者の両方の投薬精度とコンプライアンスが保証される。本薬物は長期治療のために投与されるので、このことはさらに重要である。
【0017】
また、錠剤の嗜好性が優れる。この発明の錠剤が与えられるイヌの90%より多くは、ボウルに与えられた本錠剤だけを自発的に受け入れる。現存するゼラチンカプセル剤に比し、動物と動物所有者の両方のコンプライアンスが有意に改善される。本薬物は長期治療のために投与されるので、このことはさらに重要である。
本発明は、好ましくは25℃かつ60%の相対湿度で少なくとも18カ月間安定であることを特徴とする本発明の錠剤にも関する。実施例では、ピモベンダンの分解、錠剤の溶解、乾燥減量、硬度及び崩壊についての試験パラメーター分析を開示する。本発明の錠剤は、ピモベンダンの分解、溶解、乾燥減量、硬度及び崩壊について規格限界内である。
本発明の錠剤に適した包装材料は、限定するものではないが、アルミニウム/アルミニウムブリスター、PVC/PVDCブリスター、及びHDPE(高密度ポリエチレンボトル)から選択される。
本発明は、好ましくは形状が長方形(oblong)である。このような錠剤では、圧縮強度、崩壊、重量の均一性及び含量均一性のような特性がヨーロッパ薬局方(ISBN/ISSN 92-871-5106-7 of 4th Edition 2004, Vol. 4.8, European Directorate for the Quality of Medicines (EDQM), European Pharmacopoeia, 226 avenue de Colmar, F-67029 Strasbourg, France, http://www.pheur.org)及び米国薬局方(http://www.usp.org; 印刷:USP-NF, カタログ番号2270001)の要求を満たす。
【0018】
本発明は好ましくは固形製剤、最も好ましくは錠剤に関し、該固形製剤又は錠剤は0.5〜20mgのピモベンダン、好ましくは1.25mg、2.5mg、5mg又は10mgのピモベンダンを含み、かつさらに、ラクトース(該固形製剤/錠剤の乾燥質量に対して35〜50質量%(w/w))、トウモロコシデンプン(25〜50%w/w)、クロスカルメロース-ナトリウム(1〜5%)、クエン酸(2.5〜10%w/w)、人工ビーフフレーバー(5〜30%w/w)、ポリビドン(1〜5%w/w)、コロイド状無水シリカ(0.1〜1、好ましくは0.1〜0.5%w/w)及びステアリン酸マグネシウム(0.25〜1.5%w/w)を含み、好ましくは前記成分から成ることを特徴とする。ここで、ピモベンダンの質量%は好ましくは約0.25%(w/w)を含み、かつピモベンダンを含む該固形製剤の全成分の質量%の合計は100%(w/w)である。当業者は、このような固形製剤、好ましくは錠剤を調製することができる。従って、当業者には、ラクトースの量が32.625%(w/w)の場合、0.25%(w/w)のピモベンダン、最高32.625%(w/w)のトウモロコシデンプン、4%(w/w)のクロスカルメロース-ナトリウム、5%(w/w)のクエン酸、20%(w/w)の人工ビーフフレーバー、4%(w/w)のポリビドン、コロイド状の0.5%(w/w)の無水シリカ、1%(w/w)のステアリン酸マグネシウムを添加できることが分かる。さらに、当業者には、人工ビーフフレーバーの量を例えば最小5%(w/w)に減らすと決めた場合、ラクトースの量を例えば47.265%(w/w)に増やせることが分かる。本発明は、約0.25%(w/w)のピモベンダンと、固形製剤、好ましくは錠剤の上記他のいずれかの成分とを個々の製剤成分の質量の合計が100%になるように含む固形製剤、好ましくは錠剤にも関する。
【0019】
本発明は、好ましくは総重量400mgの固形製剤、好ましくは錠剤毎に、1mgのピモベンダン、100〜200mgのラクトース、100〜200mgのトウモロコシデンプン、4〜20mgのクロスカルメロース-ナトリウム、10〜40mgの無水クエン酸、20〜120mgの人工ビーフフレーバー、4〜20mgのポリビドン、0.4〜4mgのコロイド状無水シリカ、及び1〜6mgのステアリン酸マグネシウムを含み、好ましくは前記成分から成る固形製剤、好ましくは錠剤にも関する。本発明のさらなる実施態様によれば、本固形製剤、好ましくは錠剤は総重量400mgの固形製剤/錠剤毎に、1mgのピモベンダン、120〜180mgのラクトース、120〜180mgのトウモロコシデンプン、8〜18mgのクロスカルメロース-ナトリウム、15〜30mgの無水クエン酸、40〜100mgの人工ビーフフレーバー、8〜18mgのポリビドン、0.5〜2mgのコロイド状無水シリカ、及び2〜5mgのステアリン酸マグネシウムを含み、好ましくは前記成分から成る。例えば、本発明は、総重量400mg毎に以下の成分を含む固形製剤に関する:1mgのピモベンダン、20mgの無水クエン酸、130.5mgのラクトース、130.5mgのトウモロコシデンプン、16mgのポリビドン、16mgのクロスカルメロース-ナトリウム、80mgの人工ビーフフレーバー、4mgのステアリン酸マグネシウム、及び2mgのコロイド状無水シリカ。当業者は、このような固形製剤/錠剤を調製することができる。当業者には、各1mgのピモベンダンに対する固形製剤/錠剤の総重量が400mgである上記範囲内の固形製剤/錠剤の各成分の量を変えられることも分かるだろう。例えば、約1mgのピモベンダンを含む総重量400mgの各固形製剤、好ましくは錠剤についてラクトースの量は、100、101、102、…108、109、110等;111、112、…118、119、120等;121、122、…128、129、120等;131、132、…138、139、140等;141、142、…148、149、150等;151、152、…158、159、160等;161、162、…168、169、170等;171、172、…178、179、180等;108、182、…188、189、190等;191、192、…198、199、200mgでよい。同様に、約1mgのピモベンダンを含む総重量400mgの各固形製剤、好ましくは錠剤についてトウモロコシデンプンの量は、100、101、102、…108、109、110等;111、112、…118、119、120等;121、122、…128、129、120等;131、132、…138、139、140等;141、142、…148、149、150等;151、152、…158、159、160等;161、162、…168、169、170等;171、172、…178、179、180等;108、182、…188、189、190等;191、192、…198、199、200mgでよい。さらに、約1mgのピモベンダンを含む総重量400mgの各固形製剤、好ましくは錠剤について無水クエン酸の量は、10、11、12、…18、19、20等;21、22、…28、29、30等;31、32、…38、39、40mgでよい。さらに、約1mgのピモベンダンを含む総重量400mgの各固形製剤、好ましくは錠剤について人工ビーフフレーバーの量は、20、21、22、…28、29、30等;31、32、…38、39、40等;41、42、…48、49、50等;50、51、52、…58、59、60等;61、62、…68、69、70等;71、72、…78、79、80等、81、82、83、…88、89、90等;91、92、…98、99、100等;101、102、…108、109、110等;111、112、…118、119、120mgでよい。さらに、約1mgのピモベンダンを含む総重量400mgの各固形製剤、好ましくは錠剤についてポリビドンの量は、4、5、6、…8、9、10等;11、12、…18、19、20mgでよい。さらに、約1mgのピモベンダンを含む総重量400mgの各固形製剤、好ましくは錠剤についてクロスカルメロース-ナトリウムの量は、4、5、6、…8、9、10等;11、12、…18、19、20mgでよい。さらに、約1mgのピモベンダンを含む総重量400mgの各固形製剤、好ましくは錠剤についてステアリン酸マグネシウムの量は、1.0、1.1、1.2、…1.8、1.9、2.0等;2.1、2.2、…2.8、2.9、3.0等;3.1、3.2、…3.8、3.9、40等;4.0、4.1、4.2、…4.8、4.9、5.0等;5.1、5.2、…5.8、5.9、6.0mgでよい。さらに、約1mgのピモベンダンを含む総重量400mgの各固形製剤、好ましくは錠剤についてコロイド状無水シリカの量は、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、…1.8、1.9、2.0等;2.1、2.2、…2.8、2.9、3.0等;3.1、3.2、…3.8、3.9、4.0mgでよい。当業者は、このような本発明のいずれの固形製剤も好ましくは錠剤として調製することができる。
【0020】
別の重要な実施態様では、本発明は、以下の工程を含む、好ましくは以下の工程から成る流動層造粒法に関する:
a)ピモベンダンと上述したような結合剤の水溶液を、上記定義どおりの1種又は数種の担体及び/又は賦形剤、フレーバー及び無水クエン酸を含む固形担体層上に噴霧する工程及び
b)a)の混合物を乾燥させる工程及び
c)b)の混合物を篩いにかけて脱凝集する工程及び
d)c)の混合物に流動調節剤を添加する工程及び
e)d)の混合物に潤沢剤を添加する工程及び
f)e)の混合物を顆粒の均一性のためブレンドして最終顆粒を得る工程及び/又は
g)f)の最終顆粒を圧縮して固形製剤にする工程。
固形製剤が顆粒剤の場合、工程g)は省かれる。固形製剤が錠剤の場合、工程g)が行われる。
【0021】
本発明は、好ましくは以下の工程を含み、好ましくは以下の工程から成る流動層造粒法に関する:
a)ピモベンダンとポビドンの水溶液を、ラクトース、デンプン、フレーバー及び無水クエン酸を含む固形支持体上に噴霧する工程及び
b)a)の混合物を乾燥させる工程及び
c)b)の混合物を篩いにかけて脱凝集する工程及び
d)c)の混合物に流動調節剤を添加する工程及び
e)d)の混合物に潤沢剤を添加する工程及び
f)e)の混合物を顆粒の均一性のためブレンドして最終顆粒を得る工程及び/又は
g)f)の最終顆粒を錠剤にする工程。
固形製剤が顆粒剤の場合、工程g)は省かれる。固形製剤が錠剤の場合、工程g)が行われる。
【0022】
別の実施態様は、強心性、降圧性及び抗血栓性物質が治療利益を有する疾患の予防及び/又は治療方法であって、該治療が必要な哺乳動物に、治療的に有効な量の上述したとおりの本発明の固形製剤を投与することを含む方法である。うっ血性心不全の予防及び/又は治療方法であって、該治療が必要な哺乳動物に、治療的に有効な量の上述したとおりの本発明の固形製剤を投与することを含む方法が好ましい。最も好ましくは、この方法は、本発明の錠剤を投与することを含む方法であって、前記錠剤が、1.25mg、2.5mg、5mg又は10mgのピモベンダンを含み、好ましくは1.25mg、2.5mg、5mg又は10mgのピモベンダンから成り、かつさらに、ラクトース、トウモロコシデンプン、クロスカルメロース-ナトリウム、クエン酸(好ましくは50mg/gの量で)、人工ビーフフレーバー、ポリビドン、コロイド状無水シリカ及びステアリン酸マグネシウムを含み、好ましくはラクトース、トウモロコシデンプン、クロスカルメロース-ナトリウム、クエン酸(好ましくは50mg/gの量で)、人工ビーフフレーバー、ポリビドン、コロイド状無水シリカ及びステアリン酸マグネシウムから成ることを特徴とする。好ましくは、該治療は、本発明の固形製剤を経口投与することによる。
本発明の哺乳動物は、好ましくはイヌ、ネコ及びげっ歯類、例えばウサギから成る群より選択される哺乳動物である。
【0023】
さらに、本発明は、うっ血性心不全の予防及び/又は治療用薬物の製造方法であって、本発明の固形製剤を使用することを特徴とする方法に関する。好ましくは、本発明は、うっ血性心不全の予防及び/又は治療用薬物の製造方法であって、1.25mg、2.5mg、5mg又は10mgのピモベンダンから成り、かつさらにラクトース、トウモロコシデンプン、クロスカルメロース-ナトリウム、50mg/gのクエン酸、人工ビーフフレーバー、ポリビドン、コロイド状無水シリカ及びステアリン酸マグネシウムから成る錠剤を使用することを特徴とする方法に関する。
さらに、本発明は、本明細書で述べた本発明の固形製剤、好ましくは錠剤と、うっ血性心不全の予防及び/又は治療のため、該予防又は治療が必要な哺乳動物、好ましくはイヌ、ネコ又はげっ歯類に前記固形製剤、好ましくは錠剤を好ましくは経口で使用できるという情報を含むパッケージリーフレット又は使用説明書とを含むキットに関する。
【実施例】
【0024】
〔実施例〕
以下の実施例は本発明をさらに説明するために役立つが、本出願で開示される本発明の範囲を限定するものと解釈すべきでない。
実施例1:組成物
組成物A

【0025】
組成物B

【0026】
実施例2:原材料
(01) ピモベンダン
機能:活性成分
(02) 無水クエン酸<200μm
機能:希釈剤、崩壊剤
(03) デンプン
機能:担体、崩壊剤
(04) ラクトース、粗粒
機能:担体、崩壊剤
(05) ポビドン
機能:結合剤
(06) クロスカルメロースナトリウム
機能:崩壊剤
(07) 人工粉末ビーフフレーバー
機能:フレーバー
(08) シリカ、コロイド状無水物
機能:流動調節剤、崩壊剤
(09) ステアリン酸マグネシウム
機能:潤沢剤
(10) 純水
機能:溶剤
【0027】
実施例3:製品明細
外観:茶色がかった長方形の錠剤、分割線つき。

【0028】
実施例4:製造方法
1バッチ=140000錠(1.25mg薬用量)
1バッチ= 70000錠(2.50mg薬用量)
1バッチ= 35000錠(5.00mg薬用量)
1.造粒
以下の成分を予備篩い分け後、適切な造粒機に移す:
(01) デンプン(例えば18メッシュ篩い) 22.8375 kg
(02) ラクトース(例えば18メッシュ篩い) 22.8375 kg
(03) 無水クエン酸(例えば18メッシュ篩い) 3.500 kg
(04) クロスカルメロースナトリウム(例えば18メッシュ篩い) 2.800 kg
(05) 人工ビーフフレーバー(例えば45メッシュ篩い) 14.000 kg
(05) ポビドン(噴霧溶液) 2.800 kg
(06) UDCG 115 BS(噴霧液) 0.175 kg
造粒機内で予混合して造粒する
68.950 kg
ポビドンの噴霧溶液用及びピモベンダンの分散用溶剤として純水(例えば16.8kg、範囲:12.0〜18.0kg)を使用する。
2.篩い分け
予混合物(1.)を篩いにかける 68.950 kg
68.950 kg
3.最終混合
以下の成分を加える。
(07) シリカ、コロイド状無水物(例えば25メッシュ篩い) 0.350 kg
(08) ステアリン酸マグネシウム(例えば25メッシュ篩い) 0.700 kg
回転ミキサーで、篩いにかけた予混合物(2.)
と上記二成分を混合する。
70.000 kg
4.圧縮
ロータリープレスを用いて最終混合物(3.) 70.000 kg
を圧縮して500mg、1000mg、2000mgの錠剤にする。
70.000 kg
5.包装
錠剤を適切な容器に移す。
例えば、適切な機械で錠剤をブリスター包装することによって錠剤を包装することができる。
【0029】
実施例5:プロセス制御
1.顆粒
1.1 外観:茶色がかった白い斑点のある顆粒
1.2 乾燥減量:乾燥減量を定量する
例えば、HR73;3g/105℃/5分
目標:約3.0%
許容限界:5.0%未満
2.錠剤
2.1 外観:茶色がかった白い斑点のある長方形の錠剤(分割線つき)
2.2 重量の均一性:
1) 1.25mg咀嚼錠の平均重量:475〜525mg
2) 2.5mg咀嚼錠の平均重量:950〜1050mg
3) 5mg咀嚼錠の平均重量:1900〜2100mg
2.3 硬度:硬度を定量する
1) 1.25mg 目標:140 N
許容:60〜250 N
2) 2.5mg 目標:160 N
許容:60〜250N
3) 5.0mg 目標:190 N
許容:60〜300 N
2.4 崩壊時間:USP/EPに準拠して崩壊時間を定量する
許容限界:≦37℃の水で15分(ディスクあり)
【0030】
実施例6:嗜好性の研究
ピモベンダン含有錠剤の嗜好性を調べるための研究を行った。4日間、自発的な摂取のため、20又は10匹のイヌに二製品をそれぞれ与えた。例えば、活性成分量が5mg/500mgの以下の製剤を調べた。
【0031】

【0032】
造粒形式が同じ製剤と競合させたCh. 010123の場合、40回の可能な機会(すなわち、10日間10匹のイヌに与えた場合)のうち36回で自発的な摂取が観察された。これは90.0%の受け入れ率に匹敵する。
30%のフレーバーと等量の造粒形式の製剤と競合させたCh. 010222の場合、40回の可能な機会のうち31回で自発的な摂取が観察された。これは77.5%の受け入れ率に匹敵する。
【0033】
実施例7:溶解プロフィール
この発明の錠剤の代表的な溶解プロフィールの例は図3に開示したとおりである。
溶解プロフィール、ピモベンダン1.25MG錠剤(平均値の95%信頼区間を示す)
USP装置2(パドル)、回転速度75 rpm、緩衝液pH 4.0、HDPEボトル内で40℃/75%にて1カ月及び6カ月貯蔵した錠剤の溶解プロフィールの比較(バッチ番号PB020049)
この発明の錠剤の代表的な溶解プロフィールの例は図4に開示したとおりである。
溶解プロフィール、ピモベンダン1.25MG錠剤(平均値の95%信頼区間を示す)
USP装置2(パドル)、回転速度75 rpm、緩衝液pH 4.0、開いたガラスビン内で25℃/60%にて12日貯蔵した錠剤の溶解プロフィールの比較(バッチ番号PB010080)
【0034】
溶解プロフィール、ピモベンダン1.25MG錠剤(製造変量:種々の圧縮力)

【0035】
この発明の錠剤の代表的な溶解プロフィールの例は図5に開示したとおりである。
溶解プロフィール、ピモベンダン2.5MG錠剤(平均値の95%信頼区間を示す)
USP装置2(パドル)、回転速度75 rpm、緩衝液pH 4.0、ALU-ALUブリスター内で40℃/75%にて3カ月及び6カ月貯蔵した錠剤の溶解プロフィールの比較(バッチ番号PB010076)
この発明の錠剤の代表的な溶解プロフィールの例は図6に開示したとおりである。
溶解プロフィール、ピモベンダン5.0MG錠剤(平均値の95%信頼区間を示す)
USP装置2(パドル)、回転速度75 rpm、緩衝液pH 4.0、HDPEボトル内で40℃/75%にて6カ月貯蔵した錠剤の溶解プロフィールの比較(バッチ番号PB020059)
この発明の錠剤の代表的な溶解プロフィールの例は図7に開示したとおりである。
溶解プロフィール、ピモベンダン5.0MG錠剤(平均値の95%信頼区間を示す)
USP装置2(パドル)、回転速度75 rpm、緩衝液pH 4.0(製造変量:種々の圧縮力)
【0036】
バッチ番号020205

【0037】
安定性研究で用いたピモベンダン咀嚼錠バッチの分析結果

n.d.=測定せず
【0038】
実施例8:含量均一性
錠剤成形前の最終ブレンドと錠剤成形プロセスの両方からサンプルを取った。以下の結果はピモベンダン含量の均一性を実証する。
【0039】
ブレンドの均一性

【0040】
プロセスの均一性

【0041】
実施例9:分割錠の精度
この発明の錠剤は分割錠の含量均一性試験の一部だった。錠剤成形プロセスの最初、中間及び最後から10錠取り、半分に割った。ピモベンダン含量を定量した。
【0042】

【0043】

【0044】
実施例10:24カ月後の安定性データ(溶解/ピモベンダンの分析/ピモベンダンの分解)

【0045】

【0046】

【0047】

【0048】

【0049】

【0050】

【0051】

【0052】

【符号の説明】
【0053】
1 排気ベンチレーター
2 フィルター
3 ポンプ
4 撹拌機
5 微粉化ピモベンダンと結合剤溶液(PVP、HPMC、デンプン、ゼラチン)の水性懸濁液
6 吸込空気の加熱装置
7 篩い
8 ノズル(水性懸濁液が粉末層上に噴霧される(クエン酸、ラクトース、デンプン、フレーバー))
9 粉末層
【特許請求の範囲】
【請求項1】
酢酸、酒石酸又はその無水物の群から選択される多価酸に均質に分散したピモベンダン又はその医薬的に許容しうる塩と、小動物に適したフレーバーとを含む固形製剤。
【請求項2】
医薬的に許容しうる担体及び/又は賦形剤をさらに含む、請求項1記載の固形製剤。
【請求項3】
前記担体及び/又は賦形剤が、希釈剤、崩壊剤、担体、結合剤、流動調節剤、潤沢剤及び溶剤から成る群より選択されることを特徴とする請求項1又は2記載の固形製剤。
【請求項4】
前記担体がデンプン及びラクトースであることを特徴とする請求項1〜3のいずれか1項に記載の固形製剤。
【請求項5】
前記デンプン又は種々のデンプンが、天然のデンプン、アルファ化デンプン、部分アルファ化デンプン、デンプン粉末、デンプン顆粒、化学的に改変したデンプン及び膨潤性の物理的に改変したデンプンから成る群より選択されることを特徴とする請求項1〜4のいずれか1項に記載の固形製剤。
【請求項6】
前記デンプンがトウモロコシデンプンであることを特徴とする請求項1〜5のいずれか1項に記載の固形製剤。
【請求項7】
前記ラクトースが、200μmより大きいサイズの粗い粒子から成ることを特徴とする請求項1〜6のいずれか1項に記載の固形製剤。
【請求項8】
0.5〜20mgのピモベンダンを含む、請求項1〜7のいずれか1項に記載の固形製剤。
【請求項9】
1.25mg、2.5mg、5mg又は10mgの群から選択される用量のピモベンダンを含む、請求項1〜8のいずれか1項に記載の固形製剤。
【請求項10】
前記固形製剤全体の重量が250〜3000mgの範囲内であることを特徴とする請求項1〜9のいずれか1項に記載の固形製剤。
【請求項11】
前記固形製剤又は錠剤が、1.25mg、2.5mg、5mg又は10mgのピモベンダンから成り、かつさらにラクトース、トウモロコシデンプン、クロスカルメロース-ナトリウム、50mg/gのクエン酸、人工ビーフフレーバー、ポリビドン、コロイド状無水シリカ及びステアリン酸マグネシウムから成ることを特徴とする請求項1〜10のいずれか1項に記載の固形製剤。
【請求項12】
前記固形製剤が錠剤又は顆粒剤であることを特徴とする請求項1〜11のいずれか1項に記載の固形製剤。
【請求項13】
以下の工程:
a)ピモベンダンと結合剤の水溶液を、1種又は数種の担体及び/又は賦形剤、フレーバー及び無水クエン酸を含む固形支持体上に噴霧する工程及び
b)a)の混合物を乾燥させる工程及び
c)b)の混合物を篩いにかけて脱凝集する工程及び
d)c)の混合物に流動調節剤を添加する工程及び
e)d)の混合物に潤沢剤を添加する工程及び
f)e)の混合物を顆粒の均一性のためブレンドして最終顆粒を得る工程及び/又は
g)f)の最終顆粒を圧縮して錠剤にする工程
を含む流動層造粒法。
【請求項14】
以下の工程:
a)ピモベンダンとポビドンの水溶液を、ラクトース、デンプン、フレーバー及び無水クエン酸を含む固形支持体上に噴霧する工程及び
b)a)の混合物を乾燥させる工程及び
c)b)の混合物を篩いにかけて脱凝集する工程及び
d)c)の混合物に流動調節剤を添加する工程及び
e)d)の混合物に潤沢剤を添加する工程及び
f)e)の混合物を顆粒の均一性のためブレンドして最終顆粒を得る工程及び/又は
g)f)の最終顆粒を圧縮して錠剤にする工程
を含む請求項13記載の流動層造粒法。
【請求項15】
うっ血性心不全の予防及び/又は治療用薬物の製造方法であって、請求項1〜12のいずれか1項に記載の固形製剤を使用することを特徴とする方法。
【請求項16】
請求項1〜12のいずれか1項に記載の固形製剤と、うっ血性心不全の予防又は治療が必要な哺乳動物のうっ血性心不全の予防及び/又は治療のために前記製剤を使用できるという情報を含むパッケージリーフレット又は使用説明書とを含むキット。
【請求項1】
酢酸、酒石酸又はその無水物の群から選択される多価酸に均質に分散したピモベンダン又はその医薬的に許容しうる塩と、小動物に適したフレーバーとを含む固形製剤。
【請求項2】
医薬的に許容しうる担体及び/又は賦形剤をさらに含む、請求項1記載の固形製剤。
【請求項3】
前記担体及び/又は賦形剤が、希釈剤、崩壊剤、担体、結合剤、流動調節剤、潤沢剤及び溶剤から成る群より選択されることを特徴とする請求項1又は2記載の固形製剤。
【請求項4】
前記担体がデンプン及びラクトースであることを特徴とする請求項1〜3のいずれか1項に記載の固形製剤。
【請求項5】
前記デンプン又は種々のデンプンが、天然のデンプン、アルファ化デンプン、部分アルファ化デンプン、デンプン粉末、デンプン顆粒、化学的に改変したデンプン及び膨潤性の物理的に改変したデンプンから成る群より選択されることを特徴とする請求項1〜4のいずれか1項に記載の固形製剤。
【請求項6】
前記デンプンがトウモロコシデンプンであることを特徴とする請求項1〜5のいずれか1項に記載の固形製剤。
【請求項7】
前記ラクトースが、200μmより大きいサイズの粗い粒子から成ることを特徴とする請求項1〜6のいずれか1項に記載の固形製剤。
【請求項8】
0.5〜20mgのピモベンダンを含む、請求項1〜7のいずれか1項に記載の固形製剤。
【請求項9】
1.25mg、2.5mg、5mg又は10mgの群から選択される用量のピモベンダンを含む、請求項1〜8のいずれか1項に記載の固形製剤。
【請求項10】
前記固形製剤全体の重量が250〜3000mgの範囲内であることを特徴とする請求項1〜9のいずれか1項に記載の固形製剤。
【請求項11】
前記固形製剤又は錠剤が、1.25mg、2.5mg、5mg又は10mgのピモベンダンから成り、かつさらにラクトース、トウモロコシデンプン、クロスカルメロース-ナトリウム、50mg/gのクエン酸、人工ビーフフレーバー、ポリビドン、コロイド状無水シリカ及びステアリン酸マグネシウムから成ることを特徴とする請求項1〜10のいずれか1項に記載の固形製剤。
【請求項12】
前記固形製剤が錠剤又は顆粒剤であることを特徴とする請求項1〜11のいずれか1項に記載の固形製剤。
【請求項13】
以下の工程:
a)ピモベンダンと結合剤の水溶液を、1種又は数種の担体及び/又は賦形剤、フレーバー及び無水クエン酸を含む固形支持体上に噴霧する工程及び
b)a)の混合物を乾燥させる工程及び
c)b)の混合物を篩いにかけて脱凝集する工程及び
d)c)の混合物に流動調節剤を添加する工程及び
e)d)の混合物に潤沢剤を添加する工程及び
f)e)の混合物を顆粒の均一性のためブレンドして最終顆粒を得る工程及び/又は
g)f)の最終顆粒を圧縮して錠剤にする工程
を含む流動層造粒法。
【請求項14】
以下の工程:
a)ピモベンダンとポビドンの水溶液を、ラクトース、デンプン、フレーバー及び無水クエン酸を含む固形支持体上に噴霧する工程及び
b)a)の混合物を乾燥させる工程及び
c)b)の混合物を篩いにかけて脱凝集する工程及び
d)c)の混合物に流動調節剤を添加する工程及び
e)d)の混合物に潤沢剤を添加する工程及び
f)e)の混合物を顆粒の均一性のためブレンドして最終顆粒を得る工程及び/又は
g)f)の最終顆粒を圧縮して錠剤にする工程
を含む請求項13記載の流動層造粒法。
【請求項15】
うっ血性心不全の予防及び/又は治療用薬物の製造方法であって、請求項1〜12のいずれか1項に記載の固形製剤を使用することを特徴とする方法。
【請求項16】
請求項1〜12のいずれか1項に記載の固形製剤と、うっ血性心不全の予防又は治療が必要な哺乳動物のうっ血性心不全の予防及び/又は治療のために前記製剤を使用できるという情報を含むパッケージリーフレット又は使用説明書とを含むキット。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公開番号】特開2011−98977(P2011−98977A)
【公開日】平成23年5月19日(2011.5.19)
【国際特許分類】
【出願番号】特願2011−21706(P2011−21706)
【出願日】平成23年2月3日(2011.2.3)
【分割の表示】特願2007−501196(P2007−501196)の分割
【原出願日】平成17年3月1日(2005.3.1)
【出願人】(504225895)ベーリンガー インゲルハイム フェトメディカ ゲゼルシャフト ミット ベシュレンクテル ハフツング (34)
【Fターム(参考)】
【公開日】平成23年5月19日(2011.5.19)
【国際特許分類】
【出願日】平成23年2月3日(2011.2.3)
【分割の表示】特願2007−501196(P2007−501196)の分割
【原出願日】平成17年3月1日(2005.3.1)
【出願人】(504225895)ベーリンガー インゲルハイム フェトメディカ ゲゼルシャフト ミット ベシュレンクテル ハフツング (34)
【Fターム(参考)】
[ Back to top ]

