ファイバー状導電性ポリマーとその製造方法
【課題】 ファイバー状に集積した導電性ポリマーを製造することのできる新しい技術を提供する。
【解決手段】 1本鎖のβ−1,3−グルカンを含有する非プロトン性極性溶媒溶液またはアルカリ水溶液と、所望のポリマーの源となるモノマーを含有する非プロトン性極性溶媒とを混合し、水を加えた後、重合反応(特に、光重合反応または酸化重合反応)を行なわせることによって、導電性ポリマーとβ−1,3−グルカンとから成るファイバー状複合体を製造することができる。
【解決手段】 1本鎖のβ−1,3−グルカンを含有する非プロトン性極性溶媒溶液またはアルカリ水溶液と、所望のポリマーの源となるモノマーを含有する非プロトン性極性溶媒とを混合し、水を加えた後、重合反応(特に、光重合反応または酸化重合反応)を行なわせることによって、導電性ポリマーとβ−1,3−グルカンとから成るファイバー状複合体を製造することができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ナノテクノロジーおよびバイオテクノロジーの技術分野に属し、特に、多糖を利用して、ファイバー状に組織化された導電性ポリマーを製造する新規な技術に関する。
【背景技術】
【0002】
従来、マイクロ電子回路は感光性フィルムで覆った金属薄膜基板の表面をリソグラフによってマイクロパターニングした後、酸などでエッチングする事によって作成されてきた。これらトップダウン的方法論は設計図通りのマイクロ電子回路を均質かつ簡便に作成できる利点はあるものの、マイクロパターニングのスケールを使用する光の波長以下にする事は原理的に不可能である。トップダウン的方法によるマイクロ電子回路作成が限界を迎えるにつれ、低分子の自己組織化を基にしたボトムアップ的方法によりマイクロ電子回路を作成しようとする試みが近年盛んに行われてきている。
【0003】
上記のトップダウン法によるマイクロ電子回路において電子回路自体を構成するのは金属薄膜であったが、それに対してボトムアップ法に基づいたマイクロ電子回路作成は種々の有機分子を構成要素として達成される。たとえばテトラチアフルバレンとテトラシアノキノジメタンが交互にチャージトランスファー(CT)相互作用によって積層した超分子構造体や、主鎖がπ−共役系を有するπ−共役高分子などがその範疇に入る。特にπ−共役高分子はその主鎖π−電子が高分子主鎖全体に局在化して自由に動き回れることから比較的高い導電性を示すことがわかってきている。
【非特許文献1】J. Fraxedas, Y. J. Lee, I. Jimenez, R.Gago, R. M. Nieminen, P. Ordejon and E. Canadell; Phys. Pev. B, 19, 68 (2003)
【非特許文献2】D. F. Perepichka, M. R. Bryce, C.Pearson, M. C. Micheal, E. J. L. McInnes and J. P. Zhao; Angew. Chem. Int.Ed.,42, 4636 (2003)
【0004】
代表的なπ−共役高分子としてポリジアセチレンやポリアセチレン、ポリチオフェン、ポリピロール、ポリアニリン、ポリフェニレンビニレン、ポリフェニレンエチニレンなどをあげることができる。特にポリジアセチレン類は紫外光によって容易に重合が進行することから非常にきれいな重合系を構築できる興味深い導電性ポリマーである。
【非特許文献3】M. Gross, D. C. Mullar, H. -G. Nothfer,U. Scherf, D. Neher, C. Brauchle and K. Meerholz; Nature, 405, 661 (2000)
【非特許文献4】S. Hara, T. Zama, S. Sewa, W. Takashima and K.Kaneto; Chem. Lett., 32, 576 (2003)
【0005】
π−共役高分子を用いることにより高分子主鎖に沿った導電性が発現できることがわかってきたが、次に問題となってくるのは有機分子の異方性の問題である。π−共役高分子中で電子は高分子主鎖に沿った一次元方向にのみ流れ、主鎖に対して直角方向には決して流れない。
【0006】
以上の諸性質より、π−共役高分子を次世代の極微小電子回路の導線として用いるためにはπ−共役高分子そのものの性能向上だけでなく、π−共役高分子を思いのままに配置・配列させるための配線技術が重要になってくる。特に優れた導電性を有する分子導線を実現するためにはπ−共役高分子の主鎖方向を一方方向にそろえたファイバー状のポリマー集合体の実現が必要不可欠である。しかし、モノマーの単純な重合では対応するモノマーの均一溶液またはアモルファス凝集体が生じるだけであり、ポリマーの配向はおろかそのコンホメーションさえも一切制御されてはいない。
【0007】
ナノスケールのファイバー状ポリマー集合体の構築方法として報告されている方法は、精密にデザインされた両親媒性構造を有するジアセチレンモノマーを自己集合化させてチューブ状構造を作り、そのチューブに対しての光照射を行いナノファイバー状ポリマーを得る手法である。
【非特許文献5】T.Aida and K.Tajima; Angew. Chem. Int.Ed., 40, 3803 (2001)
【非特許文献6】M.Masuda, T.Hanada, K.Yase andT.Shimizu; Macromolecules, 31, 9408 (1998)
【非特許文献7】K.Morigaki, T.Baumgart, U.Jonas,A.Offenhausser and W.Knoll; Langmuir, 18, 4082 (2002)
【0008】
最近、我々は柔軟ならせん構造を有する多糖として知られるβ−1,3−グルカンの一種であるシゾフィランおよびカードランが、剛直かつ直線状構造を有するカーボンナノチューブの周囲をらせん状に被覆することで安定な複合体を形成する現象を発見した。また、原子間力顕微鏡(AFM)や透過型電子顕微鏡(TEM)を用いた直接観察によって得られるデータの詳しい検証により、このシゾフィラン/カーボンナノチューブ複合体内部では数本から数十本のカーボンナノチューブが平行に配向していることが示唆された。
【非特許文献8】M.Numata, M.Asai, K.Kaneko, T.Hasegawa,N.Fujita, Y.Kitada, K.Sakurai and S.Shinkai; Chem. Lett., 232 (2004)
【非特許文献9】T.Hasegawa, T.Fujisawa, M.Numata,M.Umeda, T.Matsumoto, T.Kimura, S.Okumura, K.Sakurai and S.Shinkai; Chem.Commun, 19, 2150 (2004)
【特許文献1】特願2003−339569
【特許文献2】特願2004−138260
【0009】
さらに、我々はカーボンナノチューブだけでなく、同様の剛直直線状構造を有するポリアニリンもまたシゾフィランおよびカードランと安定な複合体を形成し、複合体内部でポリマー鎖が平行に配列制御されていることも明らかにしている。この手法はポリアニリンの水溶化と機能化を簡便に行えることが特徴であり、ポリアニリンを基体としたナノデバイス開発に拍車をかけるものである。
【非特許文献10】M.Numata, T.Hasegawa, T.Fujisawa,K.Sakurai and S.Shinkai;Org. Lett., in press
【0010】
このような複合化の主たる駆動力は疎水性相互作用であると考えられる。実際にシゾフィランなどのβ−1,3−グルカン類が疎水性の低分子蛍光色素類と相互作用する例が報告されている。しかしこれらの低分子蛍光色素類とβ−1,3−グルカン類の相互作用のメカニズムは一切明らかにされていない。
【非特許文献11】N.A.Evans, P.A.Hoyne and B.A.Stone;Carbohydr. Polym., 4, 215 (1984).
【発明の開示】
【発明が解決しようとする課題】
【0011】
本発明の目的は、ファイバー状に集積した導電性ポリマーを効率よく製造することのできる新しい技術を提供することにある。
【課題を解決するための手段】
【0012】
本発明者は、β−1,3−グルカンが形成する一次元疎水性空間を反応場として利用し、モノマーを一次元的に包接させて重合することにより、ファイバー状のポリマーを得ることができることを見出し、本発明を導き出した。
かくして、本発明に従えば、導電性ポリマーとβ−1,3−グルカンとから成ることを特徴とするファイバー状複合体が提供される。
さらに、本発明は、導電性ポリマーとβ−1,3−グルカンとから成るファイバー状複合体を製造する方法であって、1本鎖のβ−1,3−グルカンを含有する非プロトン性極性溶媒溶液またはアルカリ水溶液と、所望のポリマーの源となるモノマーを含有する非プロトン性極性溶媒とを混合し、水を加えた後、重合反応を行なわせることを特徴とする方法を提供するものである。
【発明の効果】
【0013】
従来の単純な重合法ではランダムコイル状のポリマー鎖溶液かアモルファスなポリマー凝集体しか生成しないが、本発明の手法により、ファイバー状に組織化されたポリマー集合体を得ることができる。また、モノマーの段階から重合に好適な配列化がなされることから、重合が促進される。さらに、β−1,3−グルカンのラッピング効果により導電性ポリマーを水溶性複合体(コンポジット)として得ることが可能になる。
【発明を実施するための最良の形態】
【0014】
本発明において用いられるβ−1,3−グルカンとは、よく知られているように、グルコースがβ1→3グルコシド結合により結合された多糖である。β−1,3−グルカンは、天然に存在する状態では、一般に3重のらせん構造を形成していることが知られている。また、非プロトン性極性溶媒またはアルカリ水溶液の中で1本鎖のランダムコイル状に解離すること、そして、そのランダムコイル状のβ−1,3−グルカンは水中で3重の螺旋状に巻き戻ること、さらにその際に1本鎖の核酸などが共存すると、共存物を巻き込みながら、らせん状の複合体を形成することが本発明者らにより発見されている。
【特許文献3】再表2001−034207
【0015】
本発明は、β−1,3−グルカンのこのような特性を利用したものであり、本発明に従えば、予め非プロトン性極性溶媒またはアルカリ性水溶液に溶解させて1本鎖に解離させたβ−1,3−グルカンの溶液と、非プロトン性極性溶媒に溶解させたモノマー(所望のポリマー源)とを混合し、水を加え適当な撹拌処理を行なう。これによって、当該モノマーが、β−1,3−グルカンの内部に取り込まれβ−1,3−グルカンによって包接されたβ−1,3−グルカン/モノマー複合体(錯体)が形成されることが確認されている(後述の実施例3、比較例1、実施例4、比較例2、実施例5参照)。これは、1本鎖の状態に解離したβ−1,3−グルカンを中性の水中に入れると既述のように3重らせんに巻き戻ろうとするが、この際、モノマーが共存すると、そのモノマーへのβ−1,3−グルカンの巻き付き・ラッピングが起こり、当該モノマーとβ−1,3−グルカンとの複合体が形成されるためと理解される。
【0016】
なお、β−1,3−グルカンを溶解する非プロトン性極性溶媒および/またはモノマーを溶解する非プロトン性極性溶媒として用いられるのに特に好適な例はジメチルスルホキシド(DMSO)であるが、これに限定されるものではない。また、β−1,3−グルカンを溶解させて1本鎖に解離させる好適なアルカリ水溶液の1例は苛性ソーダ水溶液であるが、これに限定されるものではない。
【0017】
本発明においては、如上の操作の後、重合反応を行なわせるが、この際、β−1,3−グルカンの内部は一次元疎水性空間として重合反応の反応場を供することになる。すなわち、本発明に従えば、モノマーの段階から一次元的な配列化がなされて重合化が行なわせることができ、これによって、ファイバー状に組織化されたポリマー集合体を得ることができる。
【0018】
本発明が適用されるポリマーの種類および重合法は特に限定されるものではなく、従来より知られた各種のπ共役系高分子から成る導電性ポリマーおよび該ポリマーを合成するための重合法に本発明を適用することができる。特に好ましいのは、導電性ポリマーがアセチレンまたはジアセチレンの誘導体のポリマーである場合であり、この場合は、光重合によってポリマーが合成される。本発明が適用されるのに好適な他の例は、導電性ポリマーが、チオフェン、ピロールまたはアニリンの誘導体のポリマーである場合であり、この場合、重合反応は酸化重合反応による。
【0019】
先ず、種々のπ−共役高分子の中で、本発明が特に好ましく適用されるポリジアセチレン系ポリマーについて説明する。ジアセチレン系モノマーは紫外光照射によって重合することが知られており、触媒や酸化還元剤が必要な他のπ−共役高分子と比べて重合系が非常にきれいであることが特徴である。
【0020】
しかし一般に、ジアセチレンの重合に際してはジアセチレン系モノマー間の相対的な位置関係が非常に重要であり、均一系での重合の進行はほとんど例がない。これはジアセチレン系モノマー間の重合がラジカルやアニオン・カチオンといった中間体を経ることなく協奏的に進行するためであり、ジアセチレン系モノマー同士がある一定の相対距離および相対角度を有するときのみ重合が進行することが知られている。このような制限からこれまではジアセチレン系モノマーの結晶やジアセチレン部位を有する界面活性剤からなるベシクル内部などでの重合しか報告されていない。たとえばジフェニルジアセチレン系モノマーの場合、モノマー間の相対距離がおおよそ3.5Åかつ相対角度がおおよそ75°ずれた結晶構造の時のみ重合が進行することが報告されている。
【非特許文献12】K. Tajima and T. Aida;Chem. Commun., 2399 (2000)
【0021】
β−1,3−グルカンを用いる本発明の方法により重合が促進されるのは、β−1,3−グルカンの内部の疎水性空間内にジアセチレン系モノマーが一次元的に配列するためと考えられる。ここで、ジアセチレン系モノマーの重合をさらに効率的に行うために、モノマーとして、アミド基で修飾されたジフェニルジアセチレンモノマーを用いることが好ましい。このモノマーを用いると、ジフェニル部位同士のπ−π相互作用によるモノマー同士の自己集合に加えてアミド部位によるモノマー分子間もしくはモノマー/多糖間の水素結合によってモノマー間パッキングがさらに安定化される。
【0022】
本発明が適用されるのに好ましい別の導電性ポリマーは、酸化重合法で合成されるチオフェン、ピロールまたはアニリンの誘導体のポリマーであり、特に好ましいのはチオフェン系(チオフェンの誘導体)のポリマーである。ポリチオフェンに代表されるチオフェン系のポリマーは導電性であると同時にそのコンフョメーション変化に応じて多彩な色調変化を示すことが知られている。このような色の変化を利用することによりポリマー近傍で起こる分子の認識を色の変化として鋭敏に読み出すセンサー、特に生体(高)分子をターゲットとしたバイオセンサーなどへの応用がチオフェン系ポリマーでは期待されている。
【0023】
しかし、チオフェン系のポリマー鎖に水溶性と分子認識部位の両方を付与するのは困難な作業である。これまでは、合成化学的な手法により(共有結合的に)主鎖に水溶性部位あるいは機能性部位を導入する方法がとられてきたが、緻密な分子設計と合成段階に多大な労力を要しているのも事実である。
【0024】
本発明に従えば、β−1,3−グルカンを用いることにより、水溶性の複合体として導電性ポリマー(チオフェン系ポリマー)を得ることができ、また、β−1,3−グルカンの側鎖に、分子認識等の機能を有する官能基を付与することも容易である。
このとき、チオフェン系モノマーとして疎水性部位を含むような構造のものを用いるとβ−1,3−グルカン内の疎水性空間内に当該モノマーが一層規則的に配列して重合が促進される。このような観点から、本発明が適用されるのに好ましいチオフェン系ポリマーの例は、ポリ(3,4−エチレンジオキシチオフェン)(PEDOTと略記)であり、上記ジアセチレン系の場合と同様に、β−1,3−グルカンでモノマーを包接・組織化し、酸化重合することにより、水溶性の複合体(コンポジット)として得られる。
【0025】
本発明で使用するβ−1,3−グルカンには多くの種類のものが知られており、そのいずれもジアセチレン系やチオフェン系モノマーなどのファイバー状への重合・組織化に効果を示すが、中でも、シゾフィラン(図1参照)、レンチナンまたはスクレログルカンのような、6位の炭素にグルコース置換基を30%程度以上有するものは、水に良く溶けて取り扱いやすいため、好適に使用される。
【0026】
本発明の方法を効率的に行うためには重合反応を行なわせる混合溶媒中の水の比率(以下Vw(%v/v)と略記する)も重要である。β−1,3−グルカンの3重らせん構造を再生するためにはVwが50以上であることが必要である。また、あまりにも高いVw値であるとβ−1,3−グルカン類は比較的早期に完全に3重らせん構造に巻き戻ってしまい、内部に対象モノマーを取り込む空間と時間がなくなってしまう。これらのことから、例えば、ジアセチレン系モノマーの重合の場合、Vwが70程度の含水DMSOが本発明の方法を効率的に達成するために好ましい。
【0027】
また、β−1,3−グルカンとモノマーの比率も本発明の方法を効率的に行うためには重要である。β−1,3−グルカンが多すぎるとその3重らせん構造内で対象モノマーがまばらにしか存在できず、重合がスムーズに進行しない。またβ−1,3−グルカンが少なすぎた場合、β−1,3−グルカンの3重らせん構造内に取り込まれることのできなかったジアセチレンモノマーが凝集体として混在することになる。これらのことから、例えば、β−1,3−グルカンとジアセチレンモノマーが質量比でほぼ1:1の時に本発明の方法の効果が最も明確に現れる。
【0028】
本発明に従いβ−1,3−グルカンの3重らせん内部の一次元疎水性場で一次元配列したジアセチレンモノマーなどのモノマーを効率的に重合させるためには紫外光照射が必要である。この紫外光照射は市販の高圧水銀ランプ等を用いて簡便に行うことができる。
【0029】
本発明に従いチオフェン、ピロールまたはアニリンなどの誘導体を酸化重合して、それぞれに対応する導電性ポリマーを得るには、従来より知られた各種の酸化重合触媒を使用することができる。なお、本発明が適用される酸化重合とは、電解重合を含まない。電解重合では酸化が電極表面でしか起こらないため、ポリマー鎖の拡散効率がファイバー形成の重要なファクターになるが、高分子量で無電荷のβ−1,3−グルカンでは高効率な電極表面への拡散は期待できず、ファイバー形成に効果的な手法ではない。
【0030】
本発明の方法によりβ−1,3−グルカンとともにモノマーを重合すれば、相当するファイバー状導電性ポリマーが多糖(β−1,3−グルカン)に包接された(周囲を包まれた)複合体の水溶液の状態で得られる。この多糖はファイバー状導電性ポリマーの水溶性を向上させると共に、一種の絶縁体としてポリマーの導電性を良好に保つのに効果的である。さらに、β−1,3−グルカンには側鎖に位置選択的に種々の機能性官能基を導入することも可能であり、これによって、β−1,3−グルカンを介した導電性ポリマーへの機能付加も期待される。
【0031】
かくして、本発明に従えば、導電性ポリマーとβ−1,3−グルカンとから成るファイバー状複合体を含有する水溶液が得られ、この水溶液は、例えば、スピンコート法、ディップコート法またはバーコート法などの簡便な手段により各種の用途の機能性薄膜に調製されることができる。このようにして得られた複合体の膜から、必要に応じて、多糖分解酵素を利用した酵素処理や酸処理等によりβ−1,3−グルカンを除くこともできる。
本発明の特徴をさらに具体的に明らかにするため以下に実施例を示す。以下の実施例においては、ポリジアセチレンおよびポリチオフェンの場合を代表例として詳述するが、本発明はこれに限定されるものではない。
【実施例1】
【0032】
β−1,3−グルカンの調製(シゾフィランを例として) 3重らせん構造のシゾフィランを文献記載の定法に従って製造した。すなわち、ATCC(American Type Culture Collection)から入手したSchizophyllum commune. Fries(ATCC 44200)を、最小培地を用いて7日間静置培養した後、細胞成分および不溶残渣を遠心分離して得られた上清を超音波処理して分子量45万の3重らせんシゾフィランを得た。なお、本明細書および図面においては、シゾフィランをSPG、3重らせんシゾフィランをt-SPG、1本鎖シゾフィランをs-SPGと略記していることがある。
【非特許文献13】Gregory G. Martin, Michael F. Richardson, Gordon C.Cannon and Charles L. McCormick, Am. Chem. Soc. Poly. Prep. 1997, 38, 253
【非特許文献14】Kengo Tabata, Wataru Ito, Takemasa Kojima, ShozoKawabata and Akira Misaki, Carbohydrate Res. 1981, 89, 121.
【実施例2】
【0033】
1,4−ビス(p−アミドフェニル)ブタジインの合成 光重合に用いるモノマーである1,4−ビス(p−アミドフェニル)ブタジインは図2のスキームに従って合成した。例として1,4−ビス(p−プロピルアミドフェニル)ブタジインの合成法を示しているが、本合成法は全ての1,4−ビス(p−アミドフェニル)ブタジイン類に適用することが可能である。以下に1,4−ビス(p−プロピルアミドフェニル)ブタジインについての具体的な合成法を述べる。
200mlナス型フラスコに4−エチニルアニリンを500mg(4.283mmol)、トリエチルアミン0.5mlを入れ、ジクロロメタン30mlに溶かした。これにプロピオニルクロライド0.447ml(5.124mmol)を加えた。5分後、TLC(展開溶媒、ヘキサン:酢酸エチル=3:1)により原料の消失と新たなスポットの出現を確認した。これを水で洗浄し、硫酸マグネシウムを加え撹拌した後これを吸引ろ過して水分を除去した。ろ液を減圧留去したところ、薄い黄色の粉末が得られた。同定はMALDI−TOF−Massスペクトルにて行った。Calc.
173.08、obs. 174.07 [M+H] 196.06 [M+Na]。収量0.6998g(収率94.4%)。
次に300mlナス型フラスコに得られた化合物400mg(2.31mmol)、酢酸銅1水和物1.147g(5.74mmol)、ピリジン30ml、メタノール約50mlを加え2日間還流した。TLC(展開溶媒、ヘキサン:酢酸エチル=3:1)より新たなスポットの出現を確認した。溶媒を減圧留去して得られた残渣を酢酸エチルに溶かし、飽和塩化アンモニウム水溶液で数回洗浄した。この溶液を硫酸ナトリウム乾燥、吸引ろ過した後、ろ液を減圧留去して薄い黄色の固体が得た。
【実施例3】
【0034】
および比較例1
シゾフィランと1,4−ビス(p−アミドフェニル)ブタジインとの複合体の調製
実施例1にて得られたシゾフィランと実施例2にて得られた1,4−ビス(p−アミドフェニル)ブタジインとの複合体(一次元包接錯体)の調製は以下のように行った(図3参照)。まずシゾフィランのジメチルスルホキシド(DMSO)溶液(ランダムコイル状のシゾフィラン:s−SPG
5mg/ml、10μl)と1,4−ビス(p−アミドフェニル)ブタジインのDMSO溶液(5mg/ml、10μl)を混合し、DMSO(180μl)にて希釈した。蒸留水200μlを加えて5分間の超音波処理を行ったあと蒸留水266μlをさらに加えてVw(水の体積分率、%)=70の溶液を調製した。その後Vw=70の含水DMSO溶液で希釈を行い、モノマーおよびシゾフィラン濃度が0.025mg/mlの含水DMSO溶液を調製した。同様の操作によって、シゾフィランの代わりに界面活性剤であるn−ドデシル−β−D−グルコピラノシドやアミロース(amylose)、デキストラン(dextran)、プルラン(pullulan)などの他の多糖類を用いた比較参照サンプルも調製した。
【実施例4】
【0035】
および比較例2
シゾフィランと1,4−ビス(p−アミドフェニル)ブタジインとの相互作用の円二色性スペクトルによる評価 実施例3により得られたシゾフィランと1,4−ビス(p−アミドフェニル)ブタジインとの相互作用を円二色性(CD)スペクトルにより評価した(図4)。シゾフィラン存在下において1,4−ビス(p−プロピルアミドフェニル)ブタジインはそのUV吸収帯領域(600〜250nm)に負の励起子カップリング型のCDスペクトルを示した(図4(a))。これは1,4−ビス(p−プロピルアミドフェニル)ブタジイン同士が近接し、しかも左回りのらせん状に配置していることを強く示唆するデータである。
一方で比較例1で調製したn−ドデシル−β−D−グルコピラノシドやアミロース、デキストラン、プルランなどの他の多糖類をシゾフィランの代わりに用いた系では、1,4−ビス(p−プロピルアミドフェニル)ブタジインは明瞭なCDシグナルを一切示さなかった(図4(b)〜(d))。これらのデータはこれら比較例で用いた添加剤が1,4−ビス(p−プロピルアミドフェニル)ブタジインと全く相互作用しないか、相互作用しても1,4−ビス(p−プロピルアミドフェニル)ブタジイン同士の相対配置が明瞭に制御されていないことを示す。
【実施例5】
【0036】
シゾフィランと1,4−ビス(p−プロピルアミドフェニル)ブタジインとの相互作用メカニズムの解明 シゾフィランはDMSO中ではランダムコイル状構造をとるが、溶媒を水に置換する特徴的な3重らせん構造に巻き戻ることが知られている。この巻き戻りはDMSOと水の比率に依存しており、Vwが0〜50までの含水DMSO中ではランダムコイルを取るが、それ以上Vwを上昇させると徐々に3重鎖に巻き戻り、完全水中ではじめて3重らせん構造が回復する。実施例3のサンプル作成条件をもとに、シゾフィランと1,4−ビス(p−プロピルアミドフェニル)ブタジインそれぞれのDMSO溶液を混合後、加えるDMSOおよび蒸留水の比率を変化させて様々なVw値を有するサンプル溶液を調製した。
それぞれのサンプルのCDスペクトルを測定したところ、Vw =0〜50のサンプルに関してはほとんどCDスペクトルは観察されなかったのに対し、Vw=50〜100のサンプルで大きなCDスペクトルが観察された(図5)。また、Vw=50〜100のサンプルの中でもそのVw値つまりシゾフィランのコンホメーションに応じてCDスペクトルは様々に変化した。またシゾフィランDMSO溶液に蒸留水を加え、3重らせんに巻き戻した後に1,4−ビス(p−プロピルアミドフェニル)ブタジインを加えた場合、CDスペクトルは全く現れないことも明らかとなった。このように、シゾフィランと1,4−ビスプロピルアミドフェニル)ブタジインの相互作用にはシゾフィランのランダムコイルから3重鎖への巻き戻りが必須である。これは1,4−ビス(p−プロピルアミドフェニル)ブタジインがシゾフィランの外側に存在しているのではなく、シゾフィランのらせん構造内部に取り込まれていることを示している。
【非特許文献15】T.Yanaki, T. Norisuye and H. Fujita;Macromolecules, 13, 1462 (1980)
【非特許文献16】T. Norisuye, T. Yanaki and H. Fujita;J. Polym. Sci.Polym. Phys. Ed., 18, 547 (1980)
【実施例6】
【0037】
シゾフィランと1,4−ビス(p−プロピルアミドフェニル)ブタジインとの一次元包接錯体の光重合 実施例3で調製したシゾフィランと1,4−ビス(p−アミドフェニル)ブタジインとの一次元包接錯体に高圧水銀ランプを用いて全波長の光を光源から5cmの距離から照射した。時間の経過に従い溶液の色が無色から薄青色へと変化し、1,4−ビス(p−プロピルアミドフェニル)ブタジインが光照射によって重合していることが示唆された。光照射前後の紫外−可視吸光スペクトルの変化を図6に示した。シゾフィラン非存在下で1,4−ジ(p−プロピルアミドフェニル)ブタジイン溶液に光照射しても溶液の色に全く変化は現れなかったことから、シゾフィランの3重らせん内部に取り込まれた1,4−ビス(p−プロピルアミドフェニル)ブタジインが重合したものと考えられる。
【実施例7】
【0038】
ラマン分光法によるポリジアセチレンの生成確認 実施例6の光照射によって得られた赤色溶液および薄青色溶液を用いてキャストフィルムを作成し、そのキャストフィルムのラマンスペクトルを測定した。光照射後の溶液から調製したキャストフィルムからポリジアセチレンに特徴的なラマンピーク(2000cm-1)が確認できた(図7)。このピークは光照射前の溶液から調製したキャストフィルムには全く確認できなかった。光照射によって1,4−ビス(p−プロピルアミドフェニル)ブタジインが重合し、対応するポリジアセチレンが生成したことが示された。
【非特許文献17】E.Shirai, Y.Urai and K.Itoh;J. Phys. Chem. B,102, 3765 (1998)
【実施例8】
【0039】
1,4−ビス(p−プロピルアミドフェニル)ブタジインのシゾフィラン共存下での重合におけるp−プロピルアミド基の効果 実施例3と同様の手法に基づいて、1,4−ジフェニルブタジインとシゾフィランを相互作用させた。CDスペクトルを測定したところ、1,4−ビス(p−プロピルアミドフェニル)ブタジインの時と比べて非常に微弱(強度約1/4)ではあるもののCDシグナルが観察され、1,4−ジフェニルブタジインもシゾフィランと相互作用可能であることが示された。しかしこの溶液を用いて実施例6の操作に基づいた光重合を試みたものの、溶液色の変化は全く観測されなかった。1,4−ビス(p−プロピルアミドフェニル)ブタジインのアミド基は、モノマー間もしくはシゾフィラン−モノマー間の水素結合により、モノマーを光重合に適した空間配置に固定する効果があるものと考えられる。
【実施例9】
【0040】
および比較例3
光重合後のポリジアセチレンのモルフォロジーに及ぼすシゾフィランの効果 実施例6によって得られた薄青色溶液を蒸留水に対して透析(MWCO3500)し、得られた溶液を透過型電子顕微鏡(TEM)グリッドにキャストした。TEMグリッドを真空乾燥した後、電子顕微鏡にて直接観察を行った。シゾフィランと1,4−ビス(p−プロピルアミドフェニル)ブタジインとの一次元包接錯体の光重合から得られたポリマーは直径が2〜20ナノメートルのファイバー状集合体として観察された(図8(a))。シゾフィラン内部で一次元に重合が進行したことによりこのような直線状のポリマー集合体が得られたものと考えられる。
その一方で界面活性剤であるn−ドデシル−β−D−グルコピラノシド(図8(b))やアミロース(図8(c))、ならびにデキストラン、プルランなど他の多糖を用いた系ではアモルファスな凝集体のみが観察され、シゾフィラン共存下のような直線状ポリマー集合体は一切観察されなかった。以上より本現象はシゾフィランに代表されるβ−1,3−グルカンに特徴的な現象である。
【実施例10】
【0041】
シゾフィラン存在下におけるジアセチレンの光重合によって得られたファイバー状ポリマー集合体のEDX分析 実施例9と同一サンプルを用いてエネルギー散乱X線分析法(EDX)に基づいた元素分析を行った。カーボングリッドに由来する大きな炭素ピークに加えて、ポリジアセチレン誘導体に由来する窒素の存在が確認できた。さらに、窒素を大きく上回る量の酸素も検出された(図9)。得られたファイバーが仮にポリジアセチレンのみから構成されている場合、そのときの窒素と酸素の比率はほぼ等しくなることが化学構造から推測できる。EDX分析で確認された大量の酸素の存在はこのファイバー構造中にシゾフィランが共存していることを示しており、シゾフィランがポリジアセチレンファーバーの周囲をラッピングしているものと考えられる。
【実施例11】
【0042】
APSを酸化剤としたEDOTの重合 EDOT(3,4−エチレンジオキシチオフェンモノマー;図10)とSPG(Mw=150,000)をDMSO中で混合した後、水をゆっくり滴下、希釈した。得られた溶液に重合開始剤である過硫酸アンモニウム(ammonium persulfate:APS)を10当量加え、反応溶液を35℃に保ちながら重合を開始した(重合時のSPGの濃度は0.5mg/ml)。48時間後、遠心分離操作(9000rpm)により得られた複合体(コンポジット)を沈殿させ未反応のモノマーや重合開始剤が含まれた上澄みを除去、コンポジットを水に再分散させた。この操作によりPEDOTに由来する濃青色を呈した均一水溶液を得ることが出来た。重合後のUVスペクトルよりPEDOT(酸化型)に由来する750nm付近のピークが確認できる(図11)。これらのことは重合反応が進行したことと同時にPEDOTがSPGにより水溶化されていることを示している。重合の概念図は図3に示したものと同様である。
【0043】
比較例4
比較参照実験として1)SPG非存在化でのEDOTの重合、2)t−SPG共存下での重合、3)アミロース(Mw=160,000)共存下での重合について検討を行った。しかし、いずれの場合も重合の進行に伴い沈殿を生じ、上記のような均一な溶液を与えるものは無かった。これらの結果は均一溶液を得るためには、SPGが不可欠であると同時に1本鎖から3本鎖への巻き戻り過程(つまりモノマーの疎水空間への取り込み過程)が不可欠であることを示している。
【実施例12】
【0044】
および比較例5
酸化重合後のポリチオフェンのモルフォロジーに及ぼすシゾフィランの効果 得られた溶液の形態観察を透過型電子顕微鏡(TEM)にて行った。図12(a)に示すように、直径20nmのファイバー状のSPGとPEDOTのコンポジットが生成していた(SPG量:3.0mg/ml)。一方、比較参照化合物であるアミロースとPEDOTのコンポジットは、図12(b)に示したように、ファイバー状などの特定の構造を与えるものではなかった。
【実施例13】
【0045】
EDX分析による元素組成 図12(a)で観察されたファイバー状コンポジットにSPGとPEDOTの両成分が含まれていることをEDXを用いて確認した。PEDOTとSPGの共存は酸素(O)/硫黄(S)両元素の成分比から判断できると考えられる。表1に示したEDX分析の結果、コンポジットのO/S比はおよそ6/1であり、計算されたPEDOTのみの場合(2/1)と比較して酸素存在量が多い。この酸素はSPGに由来するものであると考えられ、この結果はコンポジットがSPGとPEDOTの両成分より成ることを示している。
【0046】
【表1】

【実施例14】
【0047】
塩化鉄を用いたEDOTの重合 APSによる重合系の代わりに塩化鉄(FeCl3)を酸化剤とした系についても検討を行った。鉄イオンはシゾフィランの水酸基と強い親和性を有している。塩化鉄がシゾフィランと相互作用した状態でEDOTの重合が進行すれば、ポリマーはシゾフィランに沿って重合するため、よりファイバー構造を得やすいのではないかと考えられる。EDOT(モノマー)とSPG(Mw=150,000)をDMSO中で混合した後、水をゆっくり滴下、希釈した。得られた溶液に重合開始剤である塩化鉄(III)を10当量加え、反応溶液を25℃に保ちながら重合を開始した(重合時のSPGの濃度は0.5mg/ml)。72時間後、遠心分離操作(9000rpm)により得られた複合体(コンポジット)を沈殿させ未反応のモノマーや重合開始剤が含まれた上澄みを除去、コンポジットを水に再分散させた。この操作によりPEDOTに由来する濃青色を呈した均一水溶液を得ることが出来た。重合後のUVスペクトルは図11に示したAPSを用いた場合とほぼ同様であった。
【実施例15】
【0048】
酸化重合後のポリチオフェンのモルフォロジーに及ぼすシゾフィランおよび塩化鉄の効果 EDOT=9.4mmol/dm3、SPG=0.5mg/mL、FeCl3=94mmol/dm3の条件で得られた溶液の形態観察を、透過型電子顕微鏡(TEM)を用いて行った。図13(a)より、長さが150−200nmの楕円形(木の葉状)の構造体が多数確認できる。さらに図13(b)の拡大図では内部に細いスジが確認でき、この構造体が細いファイバーの会合体であることがわかる。この細いファイバー(直径は5nm程度)はシゾフィランの内部でEDOTが重合した結果生成したと考えられる。鉄イオンを介したシゾフィランとEDOT重合種との強い相互作用がファイバー形成を促進させたことが理解される。
【0049】
上記の実験結果よりSPGはPEDOTの水溶化と同時に重合補助剤としても機能する。EDOTの重合をSPG非存在下で行うと、重合の進行に伴い溶解性が減少し沈殿を生じる。また、単独重合したPEDOTとSPGを混合しても水溶性のコンポジットは形成されない。すなわち、水溶性コンポジットの形成にはSPG存在下でEDPTの重合を行うことが必須である。本系はSPGの一次元疎水空間が単に一次元ポリマーを取り込むだけでなく、重合反応の場としても利用できることを示している。
【産業上の利用可能性】
【0050】
本発明により、導電性ポリマーをファイバー状に集合化させることができる。本発明は分子電線などのナノテクノロジー材料の開発に有用と期待される。
【図面の簡単な説明】
【0051】
【図1】シゾフィラン(β−1,3−グルカンの一例)の化学構造式(実施例1)。
【図2】1,4−ビス(プロピオニルアミドフェニル)ブタジインの構造式(実施例2)。
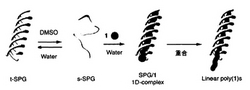
【図3】シゾフィラン(SPG)をホストとして用いる導電性ポリマーの製造概念図(実施例3および実施例11)。
【図4】(a)シゾフィラン(SPG)、(b)アミロース、(c)デキストラン、および(d)プルラン共存下での1,4−ビス(プロピオニルアミドフェニル)ブタジインの円偏向二色性スペクトル(実施例4および比較例2)。
【図5】シゾフィランおよび1,4−ビス(プロピオニルアミドフェニル)ブタジインから構成される一次元複合体が様々なDMSO含有率の水溶液で示す円偏向二色性スペクトル(実施例5)。
【図6】高圧水銀ランプによる光照射前後の、シゾフィランと1,4−ビス(プロピオニルアミドフェニル)ブタジインの複合体水溶液(30%のDMSOを含む)のUV−visスペクトル(実施例6)。
【図7】生成ポリジアセチレンのラマン分光スペクトル(実施例7)。
【図8】(a)シゾフィラン、(b)n−ドデシル−β−D−グルコシド、(c)アミロース存在下における1,4−ビス(プロピオニルアミドフェニル)ブタジインの光重合後の透過型電子顕微鏡写真(実施例9)。
【図9】シゾフィラン存在下で得られたファイバー状ポリマー集合体のEDXプロファイル(実施例10)。
【図10】EDOTの構造式(実施例11)。
【図11】重合反応後のSPG/PEDOT複合体水溶液のUVスペクトル。
【図12】(a)SPG/PEDOT複合体のTEM像、(b)アミロース/PEDOT混合物のTEM像(実施例12)。
【図13】(a)FeCl3を酸化剤とした場合のSPG/PEDOT複合体のTEM像、(b)(a)の部分拡大像(実施例15)。
【技術分野】
【0001】
本発明は、ナノテクノロジーおよびバイオテクノロジーの技術分野に属し、特に、多糖を利用して、ファイバー状に組織化された導電性ポリマーを製造する新規な技術に関する。
【背景技術】
【0002】
従来、マイクロ電子回路は感光性フィルムで覆った金属薄膜基板の表面をリソグラフによってマイクロパターニングした後、酸などでエッチングする事によって作成されてきた。これらトップダウン的方法論は設計図通りのマイクロ電子回路を均質かつ簡便に作成できる利点はあるものの、マイクロパターニングのスケールを使用する光の波長以下にする事は原理的に不可能である。トップダウン的方法によるマイクロ電子回路作成が限界を迎えるにつれ、低分子の自己組織化を基にしたボトムアップ的方法によりマイクロ電子回路を作成しようとする試みが近年盛んに行われてきている。
【0003】
上記のトップダウン法によるマイクロ電子回路において電子回路自体を構成するのは金属薄膜であったが、それに対してボトムアップ法に基づいたマイクロ電子回路作成は種々の有機分子を構成要素として達成される。たとえばテトラチアフルバレンとテトラシアノキノジメタンが交互にチャージトランスファー(CT)相互作用によって積層した超分子構造体や、主鎖がπ−共役系を有するπ−共役高分子などがその範疇に入る。特にπ−共役高分子はその主鎖π−電子が高分子主鎖全体に局在化して自由に動き回れることから比較的高い導電性を示すことがわかってきている。
【非特許文献1】J. Fraxedas, Y. J. Lee, I. Jimenez, R.Gago, R. M. Nieminen, P. Ordejon and E. Canadell; Phys. Pev. B, 19, 68 (2003)
【非特許文献2】D. F. Perepichka, M. R. Bryce, C.Pearson, M. C. Micheal, E. J. L. McInnes and J. P. Zhao; Angew. Chem. Int.Ed.,42, 4636 (2003)
【0004】
代表的なπ−共役高分子としてポリジアセチレンやポリアセチレン、ポリチオフェン、ポリピロール、ポリアニリン、ポリフェニレンビニレン、ポリフェニレンエチニレンなどをあげることができる。特にポリジアセチレン類は紫外光によって容易に重合が進行することから非常にきれいな重合系を構築できる興味深い導電性ポリマーである。
【非特許文献3】M. Gross, D. C. Mullar, H. -G. Nothfer,U. Scherf, D. Neher, C. Brauchle and K. Meerholz; Nature, 405, 661 (2000)
【非特許文献4】S. Hara, T. Zama, S. Sewa, W. Takashima and K.Kaneto; Chem. Lett., 32, 576 (2003)
【0005】
π−共役高分子を用いることにより高分子主鎖に沿った導電性が発現できることがわかってきたが、次に問題となってくるのは有機分子の異方性の問題である。π−共役高分子中で電子は高分子主鎖に沿った一次元方向にのみ流れ、主鎖に対して直角方向には決して流れない。
【0006】
以上の諸性質より、π−共役高分子を次世代の極微小電子回路の導線として用いるためにはπ−共役高分子そのものの性能向上だけでなく、π−共役高分子を思いのままに配置・配列させるための配線技術が重要になってくる。特に優れた導電性を有する分子導線を実現するためにはπ−共役高分子の主鎖方向を一方方向にそろえたファイバー状のポリマー集合体の実現が必要不可欠である。しかし、モノマーの単純な重合では対応するモノマーの均一溶液またはアモルファス凝集体が生じるだけであり、ポリマーの配向はおろかそのコンホメーションさえも一切制御されてはいない。
【0007】
ナノスケールのファイバー状ポリマー集合体の構築方法として報告されている方法は、精密にデザインされた両親媒性構造を有するジアセチレンモノマーを自己集合化させてチューブ状構造を作り、そのチューブに対しての光照射を行いナノファイバー状ポリマーを得る手法である。
【非特許文献5】T.Aida and K.Tajima; Angew. Chem. Int.Ed., 40, 3803 (2001)
【非特許文献6】M.Masuda, T.Hanada, K.Yase andT.Shimizu; Macromolecules, 31, 9408 (1998)
【非特許文献7】K.Morigaki, T.Baumgart, U.Jonas,A.Offenhausser and W.Knoll; Langmuir, 18, 4082 (2002)
【0008】
最近、我々は柔軟ならせん構造を有する多糖として知られるβ−1,3−グルカンの一種であるシゾフィランおよびカードランが、剛直かつ直線状構造を有するカーボンナノチューブの周囲をらせん状に被覆することで安定な複合体を形成する現象を発見した。また、原子間力顕微鏡(AFM)や透過型電子顕微鏡(TEM)を用いた直接観察によって得られるデータの詳しい検証により、このシゾフィラン/カーボンナノチューブ複合体内部では数本から数十本のカーボンナノチューブが平行に配向していることが示唆された。
【非特許文献8】M.Numata, M.Asai, K.Kaneko, T.Hasegawa,N.Fujita, Y.Kitada, K.Sakurai and S.Shinkai; Chem. Lett., 232 (2004)
【非特許文献9】T.Hasegawa, T.Fujisawa, M.Numata,M.Umeda, T.Matsumoto, T.Kimura, S.Okumura, K.Sakurai and S.Shinkai; Chem.Commun, 19, 2150 (2004)
【特許文献1】特願2003−339569
【特許文献2】特願2004−138260
【0009】
さらに、我々はカーボンナノチューブだけでなく、同様の剛直直線状構造を有するポリアニリンもまたシゾフィランおよびカードランと安定な複合体を形成し、複合体内部でポリマー鎖が平行に配列制御されていることも明らかにしている。この手法はポリアニリンの水溶化と機能化を簡便に行えることが特徴であり、ポリアニリンを基体としたナノデバイス開発に拍車をかけるものである。
【非特許文献10】M.Numata, T.Hasegawa, T.Fujisawa,K.Sakurai and S.Shinkai;Org. Lett., in press
【0010】
このような複合化の主たる駆動力は疎水性相互作用であると考えられる。実際にシゾフィランなどのβ−1,3−グルカン類が疎水性の低分子蛍光色素類と相互作用する例が報告されている。しかしこれらの低分子蛍光色素類とβ−1,3−グルカン類の相互作用のメカニズムは一切明らかにされていない。
【非特許文献11】N.A.Evans, P.A.Hoyne and B.A.Stone;Carbohydr. Polym., 4, 215 (1984).
【発明の開示】
【発明が解決しようとする課題】
【0011】
本発明の目的は、ファイバー状に集積した導電性ポリマーを効率よく製造することのできる新しい技術を提供することにある。
【課題を解決するための手段】
【0012】
本発明者は、β−1,3−グルカンが形成する一次元疎水性空間を反応場として利用し、モノマーを一次元的に包接させて重合することにより、ファイバー状のポリマーを得ることができることを見出し、本発明を導き出した。
かくして、本発明に従えば、導電性ポリマーとβ−1,3−グルカンとから成ることを特徴とするファイバー状複合体が提供される。
さらに、本発明は、導電性ポリマーとβ−1,3−グルカンとから成るファイバー状複合体を製造する方法であって、1本鎖のβ−1,3−グルカンを含有する非プロトン性極性溶媒溶液またはアルカリ水溶液と、所望のポリマーの源となるモノマーを含有する非プロトン性極性溶媒とを混合し、水を加えた後、重合反応を行なわせることを特徴とする方法を提供するものである。
【発明の効果】
【0013】
従来の単純な重合法ではランダムコイル状のポリマー鎖溶液かアモルファスなポリマー凝集体しか生成しないが、本発明の手法により、ファイバー状に組織化されたポリマー集合体を得ることができる。また、モノマーの段階から重合に好適な配列化がなされることから、重合が促進される。さらに、β−1,3−グルカンのラッピング効果により導電性ポリマーを水溶性複合体(コンポジット)として得ることが可能になる。
【発明を実施するための最良の形態】
【0014】
本発明において用いられるβ−1,3−グルカンとは、よく知られているように、グルコースがβ1→3グルコシド結合により結合された多糖である。β−1,3−グルカンは、天然に存在する状態では、一般に3重のらせん構造を形成していることが知られている。また、非プロトン性極性溶媒またはアルカリ水溶液の中で1本鎖のランダムコイル状に解離すること、そして、そのランダムコイル状のβ−1,3−グルカンは水中で3重の螺旋状に巻き戻ること、さらにその際に1本鎖の核酸などが共存すると、共存物を巻き込みながら、らせん状の複合体を形成することが本発明者らにより発見されている。
【特許文献3】再表2001−034207
【0015】
本発明は、β−1,3−グルカンのこのような特性を利用したものであり、本発明に従えば、予め非プロトン性極性溶媒またはアルカリ性水溶液に溶解させて1本鎖に解離させたβ−1,3−グルカンの溶液と、非プロトン性極性溶媒に溶解させたモノマー(所望のポリマー源)とを混合し、水を加え適当な撹拌処理を行なう。これによって、当該モノマーが、β−1,3−グルカンの内部に取り込まれβ−1,3−グルカンによって包接されたβ−1,3−グルカン/モノマー複合体(錯体)が形成されることが確認されている(後述の実施例3、比較例1、実施例4、比較例2、実施例5参照)。これは、1本鎖の状態に解離したβ−1,3−グルカンを中性の水中に入れると既述のように3重らせんに巻き戻ろうとするが、この際、モノマーが共存すると、そのモノマーへのβ−1,3−グルカンの巻き付き・ラッピングが起こり、当該モノマーとβ−1,3−グルカンとの複合体が形成されるためと理解される。
【0016】
なお、β−1,3−グルカンを溶解する非プロトン性極性溶媒および/またはモノマーを溶解する非プロトン性極性溶媒として用いられるのに特に好適な例はジメチルスルホキシド(DMSO)であるが、これに限定されるものではない。また、β−1,3−グルカンを溶解させて1本鎖に解離させる好適なアルカリ水溶液の1例は苛性ソーダ水溶液であるが、これに限定されるものではない。
【0017】
本発明においては、如上の操作の後、重合反応を行なわせるが、この際、β−1,3−グルカンの内部は一次元疎水性空間として重合反応の反応場を供することになる。すなわち、本発明に従えば、モノマーの段階から一次元的な配列化がなされて重合化が行なわせることができ、これによって、ファイバー状に組織化されたポリマー集合体を得ることができる。
【0018】
本発明が適用されるポリマーの種類および重合法は特に限定されるものではなく、従来より知られた各種のπ共役系高分子から成る導電性ポリマーおよび該ポリマーを合成するための重合法に本発明を適用することができる。特に好ましいのは、導電性ポリマーがアセチレンまたはジアセチレンの誘導体のポリマーである場合であり、この場合は、光重合によってポリマーが合成される。本発明が適用されるのに好適な他の例は、導電性ポリマーが、チオフェン、ピロールまたはアニリンの誘導体のポリマーである場合であり、この場合、重合反応は酸化重合反応による。
【0019】
先ず、種々のπ−共役高分子の中で、本発明が特に好ましく適用されるポリジアセチレン系ポリマーについて説明する。ジアセチレン系モノマーは紫外光照射によって重合することが知られており、触媒や酸化還元剤が必要な他のπ−共役高分子と比べて重合系が非常にきれいであることが特徴である。
【0020】
しかし一般に、ジアセチレンの重合に際してはジアセチレン系モノマー間の相対的な位置関係が非常に重要であり、均一系での重合の進行はほとんど例がない。これはジアセチレン系モノマー間の重合がラジカルやアニオン・カチオンといった中間体を経ることなく協奏的に進行するためであり、ジアセチレン系モノマー同士がある一定の相対距離および相対角度を有するときのみ重合が進行することが知られている。このような制限からこれまではジアセチレン系モノマーの結晶やジアセチレン部位を有する界面活性剤からなるベシクル内部などでの重合しか報告されていない。たとえばジフェニルジアセチレン系モノマーの場合、モノマー間の相対距離がおおよそ3.5Åかつ相対角度がおおよそ75°ずれた結晶構造の時のみ重合が進行することが報告されている。
【非特許文献12】K. Tajima and T. Aida;Chem. Commun., 2399 (2000)
【0021】
β−1,3−グルカンを用いる本発明の方法により重合が促進されるのは、β−1,3−グルカンの内部の疎水性空間内にジアセチレン系モノマーが一次元的に配列するためと考えられる。ここで、ジアセチレン系モノマーの重合をさらに効率的に行うために、モノマーとして、アミド基で修飾されたジフェニルジアセチレンモノマーを用いることが好ましい。このモノマーを用いると、ジフェニル部位同士のπ−π相互作用によるモノマー同士の自己集合に加えてアミド部位によるモノマー分子間もしくはモノマー/多糖間の水素結合によってモノマー間パッキングがさらに安定化される。
【0022】
本発明が適用されるのに好ましい別の導電性ポリマーは、酸化重合法で合成されるチオフェン、ピロールまたはアニリンの誘導体のポリマーであり、特に好ましいのはチオフェン系(チオフェンの誘導体)のポリマーである。ポリチオフェンに代表されるチオフェン系のポリマーは導電性であると同時にそのコンフョメーション変化に応じて多彩な色調変化を示すことが知られている。このような色の変化を利用することによりポリマー近傍で起こる分子の認識を色の変化として鋭敏に読み出すセンサー、特に生体(高)分子をターゲットとしたバイオセンサーなどへの応用がチオフェン系ポリマーでは期待されている。
【0023】
しかし、チオフェン系のポリマー鎖に水溶性と分子認識部位の両方を付与するのは困難な作業である。これまでは、合成化学的な手法により(共有結合的に)主鎖に水溶性部位あるいは機能性部位を導入する方法がとられてきたが、緻密な分子設計と合成段階に多大な労力を要しているのも事実である。
【0024】
本発明に従えば、β−1,3−グルカンを用いることにより、水溶性の複合体として導電性ポリマー(チオフェン系ポリマー)を得ることができ、また、β−1,3−グルカンの側鎖に、分子認識等の機能を有する官能基を付与することも容易である。
このとき、チオフェン系モノマーとして疎水性部位を含むような構造のものを用いるとβ−1,3−グルカン内の疎水性空間内に当該モノマーが一層規則的に配列して重合が促進される。このような観点から、本発明が適用されるのに好ましいチオフェン系ポリマーの例は、ポリ(3,4−エチレンジオキシチオフェン)(PEDOTと略記)であり、上記ジアセチレン系の場合と同様に、β−1,3−グルカンでモノマーを包接・組織化し、酸化重合することにより、水溶性の複合体(コンポジット)として得られる。
【0025】
本発明で使用するβ−1,3−グルカンには多くの種類のものが知られており、そのいずれもジアセチレン系やチオフェン系モノマーなどのファイバー状への重合・組織化に効果を示すが、中でも、シゾフィラン(図1参照)、レンチナンまたはスクレログルカンのような、6位の炭素にグルコース置換基を30%程度以上有するものは、水に良く溶けて取り扱いやすいため、好適に使用される。
【0026】
本発明の方法を効率的に行うためには重合反応を行なわせる混合溶媒中の水の比率(以下Vw(%v/v)と略記する)も重要である。β−1,3−グルカンの3重らせん構造を再生するためにはVwが50以上であることが必要である。また、あまりにも高いVw値であるとβ−1,3−グルカン類は比較的早期に完全に3重らせん構造に巻き戻ってしまい、内部に対象モノマーを取り込む空間と時間がなくなってしまう。これらのことから、例えば、ジアセチレン系モノマーの重合の場合、Vwが70程度の含水DMSOが本発明の方法を効率的に達成するために好ましい。
【0027】
また、β−1,3−グルカンとモノマーの比率も本発明の方法を効率的に行うためには重要である。β−1,3−グルカンが多すぎるとその3重らせん構造内で対象モノマーがまばらにしか存在できず、重合がスムーズに進行しない。またβ−1,3−グルカンが少なすぎた場合、β−1,3−グルカンの3重らせん構造内に取り込まれることのできなかったジアセチレンモノマーが凝集体として混在することになる。これらのことから、例えば、β−1,3−グルカンとジアセチレンモノマーが質量比でほぼ1:1の時に本発明の方法の効果が最も明確に現れる。
【0028】
本発明に従いβ−1,3−グルカンの3重らせん内部の一次元疎水性場で一次元配列したジアセチレンモノマーなどのモノマーを効率的に重合させるためには紫外光照射が必要である。この紫外光照射は市販の高圧水銀ランプ等を用いて簡便に行うことができる。
【0029】
本発明に従いチオフェン、ピロールまたはアニリンなどの誘導体を酸化重合して、それぞれに対応する導電性ポリマーを得るには、従来より知られた各種の酸化重合触媒を使用することができる。なお、本発明が適用される酸化重合とは、電解重合を含まない。電解重合では酸化が電極表面でしか起こらないため、ポリマー鎖の拡散効率がファイバー形成の重要なファクターになるが、高分子量で無電荷のβ−1,3−グルカンでは高効率な電極表面への拡散は期待できず、ファイバー形成に効果的な手法ではない。
【0030】
本発明の方法によりβ−1,3−グルカンとともにモノマーを重合すれば、相当するファイバー状導電性ポリマーが多糖(β−1,3−グルカン)に包接された(周囲を包まれた)複合体の水溶液の状態で得られる。この多糖はファイバー状導電性ポリマーの水溶性を向上させると共に、一種の絶縁体としてポリマーの導電性を良好に保つのに効果的である。さらに、β−1,3−グルカンには側鎖に位置選択的に種々の機能性官能基を導入することも可能であり、これによって、β−1,3−グルカンを介した導電性ポリマーへの機能付加も期待される。
【0031】
かくして、本発明に従えば、導電性ポリマーとβ−1,3−グルカンとから成るファイバー状複合体を含有する水溶液が得られ、この水溶液は、例えば、スピンコート法、ディップコート法またはバーコート法などの簡便な手段により各種の用途の機能性薄膜に調製されることができる。このようにして得られた複合体の膜から、必要に応じて、多糖分解酵素を利用した酵素処理や酸処理等によりβ−1,3−グルカンを除くこともできる。
本発明の特徴をさらに具体的に明らかにするため以下に実施例を示す。以下の実施例においては、ポリジアセチレンおよびポリチオフェンの場合を代表例として詳述するが、本発明はこれに限定されるものではない。
【実施例1】
【0032】
β−1,3−グルカンの調製(シゾフィランを例として) 3重らせん構造のシゾフィランを文献記載の定法に従って製造した。すなわち、ATCC(American Type Culture Collection)から入手したSchizophyllum commune. Fries(ATCC 44200)を、最小培地を用いて7日間静置培養した後、細胞成分および不溶残渣を遠心分離して得られた上清を超音波処理して分子量45万の3重らせんシゾフィランを得た。なお、本明細書および図面においては、シゾフィランをSPG、3重らせんシゾフィランをt-SPG、1本鎖シゾフィランをs-SPGと略記していることがある。
【非特許文献13】Gregory G. Martin, Michael F. Richardson, Gordon C.Cannon and Charles L. McCormick, Am. Chem. Soc. Poly. Prep. 1997, 38, 253
【非特許文献14】Kengo Tabata, Wataru Ito, Takemasa Kojima, ShozoKawabata and Akira Misaki, Carbohydrate Res. 1981, 89, 121.
【実施例2】
【0033】
1,4−ビス(p−アミドフェニル)ブタジインの合成 光重合に用いるモノマーである1,4−ビス(p−アミドフェニル)ブタジインは図2のスキームに従って合成した。例として1,4−ビス(p−プロピルアミドフェニル)ブタジインの合成法を示しているが、本合成法は全ての1,4−ビス(p−アミドフェニル)ブタジイン類に適用することが可能である。以下に1,4−ビス(p−プロピルアミドフェニル)ブタジインについての具体的な合成法を述べる。
200mlナス型フラスコに4−エチニルアニリンを500mg(4.283mmol)、トリエチルアミン0.5mlを入れ、ジクロロメタン30mlに溶かした。これにプロピオニルクロライド0.447ml(5.124mmol)を加えた。5分後、TLC(展開溶媒、ヘキサン:酢酸エチル=3:1)により原料の消失と新たなスポットの出現を確認した。これを水で洗浄し、硫酸マグネシウムを加え撹拌した後これを吸引ろ過して水分を除去した。ろ液を減圧留去したところ、薄い黄色の粉末が得られた。同定はMALDI−TOF−Massスペクトルにて行った。Calc.
173.08、obs. 174.07 [M+H] 196.06 [M+Na]。収量0.6998g(収率94.4%)。
次に300mlナス型フラスコに得られた化合物400mg(2.31mmol)、酢酸銅1水和物1.147g(5.74mmol)、ピリジン30ml、メタノール約50mlを加え2日間還流した。TLC(展開溶媒、ヘキサン:酢酸エチル=3:1)より新たなスポットの出現を確認した。溶媒を減圧留去して得られた残渣を酢酸エチルに溶かし、飽和塩化アンモニウム水溶液で数回洗浄した。この溶液を硫酸ナトリウム乾燥、吸引ろ過した後、ろ液を減圧留去して薄い黄色の固体が得た。
【実施例3】
【0034】
および比較例1
シゾフィランと1,4−ビス(p−アミドフェニル)ブタジインとの複合体の調製
実施例1にて得られたシゾフィランと実施例2にて得られた1,4−ビス(p−アミドフェニル)ブタジインとの複合体(一次元包接錯体)の調製は以下のように行った(図3参照)。まずシゾフィランのジメチルスルホキシド(DMSO)溶液(ランダムコイル状のシゾフィラン:s−SPG
5mg/ml、10μl)と1,4−ビス(p−アミドフェニル)ブタジインのDMSO溶液(5mg/ml、10μl)を混合し、DMSO(180μl)にて希釈した。蒸留水200μlを加えて5分間の超音波処理を行ったあと蒸留水266μlをさらに加えてVw(水の体積分率、%)=70の溶液を調製した。その後Vw=70の含水DMSO溶液で希釈を行い、モノマーおよびシゾフィラン濃度が0.025mg/mlの含水DMSO溶液を調製した。同様の操作によって、シゾフィランの代わりに界面活性剤であるn−ドデシル−β−D−グルコピラノシドやアミロース(amylose)、デキストラン(dextran)、プルラン(pullulan)などの他の多糖類を用いた比較参照サンプルも調製した。
【実施例4】
【0035】
および比較例2
シゾフィランと1,4−ビス(p−アミドフェニル)ブタジインとの相互作用の円二色性スペクトルによる評価 実施例3により得られたシゾフィランと1,4−ビス(p−アミドフェニル)ブタジインとの相互作用を円二色性(CD)スペクトルにより評価した(図4)。シゾフィラン存在下において1,4−ビス(p−プロピルアミドフェニル)ブタジインはそのUV吸収帯領域(600〜250nm)に負の励起子カップリング型のCDスペクトルを示した(図4(a))。これは1,4−ビス(p−プロピルアミドフェニル)ブタジイン同士が近接し、しかも左回りのらせん状に配置していることを強く示唆するデータである。
一方で比較例1で調製したn−ドデシル−β−D−グルコピラノシドやアミロース、デキストラン、プルランなどの他の多糖類をシゾフィランの代わりに用いた系では、1,4−ビス(p−プロピルアミドフェニル)ブタジインは明瞭なCDシグナルを一切示さなかった(図4(b)〜(d))。これらのデータはこれら比較例で用いた添加剤が1,4−ビス(p−プロピルアミドフェニル)ブタジインと全く相互作用しないか、相互作用しても1,4−ビス(p−プロピルアミドフェニル)ブタジイン同士の相対配置が明瞭に制御されていないことを示す。
【実施例5】
【0036】
シゾフィランと1,4−ビス(p−プロピルアミドフェニル)ブタジインとの相互作用メカニズムの解明 シゾフィランはDMSO中ではランダムコイル状構造をとるが、溶媒を水に置換する特徴的な3重らせん構造に巻き戻ることが知られている。この巻き戻りはDMSOと水の比率に依存しており、Vwが0〜50までの含水DMSO中ではランダムコイルを取るが、それ以上Vwを上昇させると徐々に3重鎖に巻き戻り、完全水中ではじめて3重らせん構造が回復する。実施例3のサンプル作成条件をもとに、シゾフィランと1,4−ビス(p−プロピルアミドフェニル)ブタジインそれぞれのDMSO溶液を混合後、加えるDMSOおよび蒸留水の比率を変化させて様々なVw値を有するサンプル溶液を調製した。
それぞれのサンプルのCDスペクトルを測定したところ、Vw =0〜50のサンプルに関してはほとんどCDスペクトルは観察されなかったのに対し、Vw=50〜100のサンプルで大きなCDスペクトルが観察された(図5)。また、Vw=50〜100のサンプルの中でもそのVw値つまりシゾフィランのコンホメーションに応じてCDスペクトルは様々に変化した。またシゾフィランDMSO溶液に蒸留水を加え、3重らせんに巻き戻した後に1,4−ビス(p−プロピルアミドフェニル)ブタジインを加えた場合、CDスペクトルは全く現れないことも明らかとなった。このように、シゾフィランと1,4−ビスプロピルアミドフェニル)ブタジインの相互作用にはシゾフィランのランダムコイルから3重鎖への巻き戻りが必須である。これは1,4−ビス(p−プロピルアミドフェニル)ブタジインがシゾフィランの外側に存在しているのではなく、シゾフィランのらせん構造内部に取り込まれていることを示している。
【非特許文献15】T.Yanaki, T. Norisuye and H. Fujita;Macromolecules, 13, 1462 (1980)
【非特許文献16】T. Norisuye, T. Yanaki and H. Fujita;J. Polym. Sci.Polym. Phys. Ed., 18, 547 (1980)
【実施例6】
【0037】
シゾフィランと1,4−ビス(p−プロピルアミドフェニル)ブタジインとの一次元包接錯体の光重合 実施例3で調製したシゾフィランと1,4−ビス(p−アミドフェニル)ブタジインとの一次元包接錯体に高圧水銀ランプを用いて全波長の光を光源から5cmの距離から照射した。時間の経過に従い溶液の色が無色から薄青色へと変化し、1,4−ビス(p−プロピルアミドフェニル)ブタジインが光照射によって重合していることが示唆された。光照射前後の紫外−可視吸光スペクトルの変化を図6に示した。シゾフィラン非存在下で1,4−ジ(p−プロピルアミドフェニル)ブタジイン溶液に光照射しても溶液の色に全く変化は現れなかったことから、シゾフィランの3重らせん内部に取り込まれた1,4−ビス(p−プロピルアミドフェニル)ブタジインが重合したものと考えられる。
【実施例7】
【0038】
ラマン分光法によるポリジアセチレンの生成確認 実施例6の光照射によって得られた赤色溶液および薄青色溶液を用いてキャストフィルムを作成し、そのキャストフィルムのラマンスペクトルを測定した。光照射後の溶液から調製したキャストフィルムからポリジアセチレンに特徴的なラマンピーク(2000cm-1)が確認できた(図7)。このピークは光照射前の溶液から調製したキャストフィルムには全く確認できなかった。光照射によって1,4−ビス(p−プロピルアミドフェニル)ブタジインが重合し、対応するポリジアセチレンが生成したことが示された。
【非特許文献17】E.Shirai, Y.Urai and K.Itoh;J. Phys. Chem. B,102, 3765 (1998)
【実施例8】
【0039】
1,4−ビス(p−プロピルアミドフェニル)ブタジインのシゾフィラン共存下での重合におけるp−プロピルアミド基の効果 実施例3と同様の手法に基づいて、1,4−ジフェニルブタジインとシゾフィランを相互作用させた。CDスペクトルを測定したところ、1,4−ビス(p−プロピルアミドフェニル)ブタジインの時と比べて非常に微弱(強度約1/4)ではあるもののCDシグナルが観察され、1,4−ジフェニルブタジインもシゾフィランと相互作用可能であることが示された。しかしこの溶液を用いて実施例6の操作に基づいた光重合を試みたものの、溶液色の変化は全く観測されなかった。1,4−ビス(p−プロピルアミドフェニル)ブタジインのアミド基は、モノマー間もしくはシゾフィラン−モノマー間の水素結合により、モノマーを光重合に適した空間配置に固定する効果があるものと考えられる。
【実施例9】
【0040】
および比較例3
光重合後のポリジアセチレンのモルフォロジーに及ぼすシゾフィランの効果 実施例6によって得られた薄青色溶液を蒸留水に対して透析(MWCO3500)し、得られた溶液を透過型電子顕微鏡(TEM)グリッドにキャストした。TEMグリッドを真空乾燥した後、電子顕微鏡にて直接観察を行った。シゾフィランと1,4−ビス(p−プロピルアミドフェニル)ブタジインとの一次元包接錯体の光重合から得られたポリマーは直径が2〜20ナノメートルのファイバー状集合体として観察された(図8(a))。シゾフィラン内部で一次元に重合が進行したことによりこのような直線状のポリマー集合体が得られたものと考えられる。
その一方で界面活性剤であるn−ドデシル−β−D−グルコピラノシド(図8(b))やアミロース(図8(c))、ならびにデキストラン、プルランなど他の多糖を用いた系ではアモルファスな凝集体のみが観察され、シゾフィラン共存下のような直線状ポリマー集合体は一切観察されなかった。以上より本現象はシゾフィランに代表されるβ−1,3−グルカンに特徴的な現象である。
【実施例10】
【0041】
シゾフィラン存在下におけるジアセチレンの光重合によって得られたファイバー状ポリマー集合体のEDX分析 実施例9と同一サンプルを用いてエネルギー散乱X線分析法(EDX)に基づいた元素分析を行った。カーボングリッドに由来する大きな炭素ピークに加えて、ポリジアセチレン誘導体に由来する窒素の存在が確認できた。さらに、窒素を大きく上回る量の酸素も検出された(図9)。得られたファイバーが仮にポリジアセチレンのみから構成されている場合、そのときの窒素と酸素の比率はほぼ等しくなることが化学構造から推測できる。EDX分析で確認された大量の酸素の存在はこのファイバー構造中にシゾフィランが共存していることを示しており、シゾフィランがポリジアセチレンファーバーの周囲をラッピングしているものと考えられる。
【実施例11】
【0042】
APSを酸化剤としたEDOTの重合 EDOT(3,4−エチレンジオキシチオフェンモノマー;図10)とSPG(Mw=150,000)をDMSO中で混合した後、水をゆっくり滴下、希釈した。得られた溶液に重合開始剤である過硫酸アンモニウム(ammonium persulfate:APS)を10当量加え、反応溶液を35℃に保ちながら重合を開始した(重合時のSPGの濃度は0.5mg/ml)。48時間後、遠心分離操作(9000rpm)により得られた複合体(コンポジット)を沈殿させ未反応のモノマーや重合開始剤が含まれた上澄みを除去、コンポジットを水に再分散させた。この操作によりPEDOTに由来する濃青色を呈した均一水溶液を得ることが出来た。重合後のUVスペクトルよりPEDOT(酸化型)に由来する750nm付近のピークが確認できる(図11)。これらのことは重合反応が進行したことと同時にPEDOTがSPGにより水溶化されていることを示している。重合の概念図は図3に示したものと同様である。
【0043】
比較例4
比較参照実験として1)SPG非存在化でのEDOTの重合、2)t−SPG共存下での重合、3)アミロース(Mw=160,000)共存下での重合について検討を行った。しかし、いずれの場合も重合の進行に伴い沈殿を生じ、上記のような均一な溶液を与えるものは無かった。これらの結果は均一溶液を得るためには、SPGが不可欠であると同時に1本鎖から3本鎖への巻き戻り過程(つまりモノマーの疎水空間への取り込み過程)が不可欠であることを示している。
【実施例12】
【0044】
および比較例5
酸化重合後のポリチオフェンのモルフォロジーに及ぼすシゾフィランの効果 得られた溶液の形態観察を透過型電子顕微鏡(TEM)にて行った。図12(a)に示すように、直径20nmのファイバー状のSPGとPEDOTのコンポジットが生成していた(SPG量:3.0mg/ml)。一方、比較参照化合物であるアミロースとPEDOTのコンポジットは、図12(b)に示したように、ファイバー状などの特定の構造を与えるものではなかった。
【実施例13】
【0045】
EDX分析による元素組成 図12(a)で観察されたファイバー状コンポジットにSPGとPEDOTの両成分が含まれていることをEDXを用いて確認した。PEDOTとSPGの共存は酸素(O)/硫黄(S)両元素の成分比から判断できると考えられる。表1に示したEDX分析の結果、コンポジットのO/S比はおよそ6/1であり、計算されたPEDOTのみの場合(2/1)と比較して酸素存在量が多い。この酸素はSPGに由来するものであると考えられ、この結果はコンポジットがSPGとPEDOTの両成分より成ることを示している。
【0046】
【表1】

【実施例14】
【0047】
塩化鉄を用いたEDOTの重合 APSによる重合系の代わりに塩化鉄(FeCl3)を酸化剤とした系についても検討を行った。鉄イオンはシゾフィランの水酸基と強い親和性を有している。塩化鉄がシゾフィランと相互作用した状態でEDOTの重合が進行すれば、ポリマーはシゾフィランに沿って重合するため、よりファイバー構造を得やすいのではないかと考えられる。EDOT(モノマー)とSPG(Mw=150,000)をDMSO中で混合した後、水をゆっくり滴下、希釈した。得られた溶液に重合開始剤である塩化鉄(III)を10当量加え、反応溶液を25℃に保ちながら重合を開始した(重合時のSPGの濃度は0.5mg/ml)。72時間後、遠心分離操作(9000rpm)により得られた複合体(コンポジット)を沈殿させ未反応のモノマーや重合開始剤が含まれた上澄みを除去、コンポジットを水に再分散させた。この操作によりPEDOTに由来する濃青色を呈した均一水溶液を得ることが出来た。重合後のUVスペクトルは図11に示したAPSを用いた場合とほぼ同様であった。
【実施例15】
【0048】
酸化重合後のポリチオフェンのモルフォロジーに及ぼすシゾフィランおよび塩化鉄の効果 EDOT=9.4mmol/dm3、SPG=0.5mg/mL、FeCl3=94mmol/dm3の条件で得られた溶液の形態観察を、透過型電子顕微鏡(TEM)を用いて行った。図13(a)より、長さが150−200nmの楕円形(木の葉状)の構造体が多数確認できる。さらに図13(b)の拡大図では内部に細いスジが確認でき、この構造体が細いファイバーの会合体であることがわかる。この細いファイバー(直径は5nm程度)はシゾフィランの内部でEDOTが重合した結果生成したと考えられる。鉄イオンを介したシゾフィランとEDOT重合種との強い相互作用がファイバー形成を促進させたことが理解される。
【0049】
上記の実験結果よりSPGはPEDOTの水溶化と同時に重合補助剤としても機能する。EDOTの重合をSPG非存在下で行うと、重合の進行に伴い溶解性が減少し沈殿を生じる。また、単独重合したPEDOTとSPGを混合しても水溶性のコンポジットは形成されない。すなわち、水溶性コンポジットの形成にはSPG存在下でEDPTの重合を行うことが必須である。本系はSPGの一次元疎水空間が単に一次元ポリマーを取り込むだけでなく、重合反応の場としても利用できることを示している。
【産業上の利用可能性】
【0050】
本発明により、導電性ポリマーをファイバー状に集合化させることができる。本発明は分子電線などのナノテクノロジー材料の開発に有用と期待される。
【図面の簡単な説明】
【0051】
【図1】シゾフィラン(β−1,3−グルカンの一例)の化学構造式(実施例1)。
【図2】1,4−ビス(プロピオニルアミドフェニル)ブタジインの構造式(実施例2)。
【図3】シゾフィラン(SPG)をホストとして用いる導電性ポリマーの製造概念図(実施例3および実施例11)。
【図4】(a)シゾフィラン(SPG)、(b)アミロース、(c)デキストラン、および(d)プルラン共存下での1,4−ビス(プロピオニルアミドフェニル)ブタジインの円偏向二色性スペクトル(実施例4および比較例2)。
【図5】シゾフィランおよび1,4−ビス(プロピオニルアミドフェニル)ブタジインから構成される一次元複合体が様々なDMSO含有率の水溶液で示す円偏向二色性スペクトル(実施例5)。
【図6】高圧水銀ランプによる光照射前後の、シゾフィランと1,4−ビス(プロピオニルアミドフェニル)ブタジインの複合体水溶液(30%のDMSOを含む)のUV−visスペクトル(実施例6)。
【図7】生成ポリジアセチレンのラマン分光スペクトル(実施例7)。
【図8】(a)シゾフィラン、(b)n−ドデシル−β−D−グルコシド、(c)アミロース存在下における1,4−ビス(プロピオニルアミドフェニル)ブタジインの光重合後の透過型電子顕微鏡写真(実施例9)。
【図9】シゾフィラン存在下で得られたファイバー状ポリマー集合体のEDXプロファイル(実施例10)。
【図10】EDOTの構造式(実施例11)。
【図11】重合反応後のSPG/PEDOT複合体水溶液のUVスペクトル。
【図12】(a)SPG/PEDOT複合体のTEM像、(b)アミロース/PEDOT混合物のTEM像(実施例12)。
【図13】(a)FeCl3を酸化剤とした場合のSPG/PEDOT複合体のTEM像、(b)(a)の部分拡大像(実施例15)。
【特許請求の範囲】
【請求項1】
導電性ポリマーとβ−1,3−グルカンとから成ることを特徴とするファイバー状複合体。
【請求項2】
導電性ポリマーが、アセチレンまたはジアセチレンの誘導体のポリマーであることを特徴とする請求項1に記載の複合体。
【請求項3】
導電性ポリマーが、アミド基修飾ジフェニルジアセチレンのポリマーであることを特徴とする請求項2に記載の複合体。
【請求項4】
導電性ポリマーが、チオフェン、ピロールまたはアニリンの誘導体のポリマーであることを特徴とする請求項1に記載の複合体。
【請求項5】
導電性ポリマーが、3,4−エチレンジオキシチオフェンのポリマーであることを特徴とする請求項4に記載の複合体。
【請求項6】
β-1,3-グルカンが、シゾフィラン、レンチナンまたはスクレログルカンから選ばれたものであることを特徴とする請求項1〜5のいずれかに記載の複合体。
【請求項7】
β−1,3−グルカンが側鎖に機能性官能基を有するものであることを特徴とする請求項1〜6のいずれかに記載の複合体。
【請求項8】
導電性ポリマーとβ−1,3−グルカンとから成るファイバー状複合体を製造する方法であって、1本鎖のβ−1,3−グルカンを含有する非プロトン性極性溶媒溶液またはアルカリ水溶液と、所望のポリマーの源となるモノマーを含有する非プロトン性極性溶媒とを混合し、水を加えた後、重合反応を行なわせることを特徴とする方法。
【請求項9】
重合反応が光重合反応によるものであることを特徴とする請求項8に記載の方法。
【請求項10】
重合反応が酸化重合反応によるものであることを特徴とする請求項8に記載の方法。
【請求項11】
非プロトン性溶媒としてジメチルスルホキシドを用いることを特徴とする請求項8〜10のいずれかに記載の方法。
【請求項12】
1本鎖のβ−1,3−グルカンを含有する非プロトン性極性溶媒溶液またはアルカリ水溶液と、所望のポリマーの源となるモノマーを含有する非プロトン性極性溶媒とを混合し、水を加えた後、重合反応を行なわせることによって、導電性ポリマーとβ−1,3−グルカンとから成るファイバー状複合体を調製する工程、および、前記複合体からβ−1,3−グルカンを除去する工程を含むことを特徴とするファイバー状導電性ポリマーを製造する方法。
【請求項13】
請求項12によって製造されることを特徴とするファイバー状導電性ポリマー。
【請求項1】
導電性ポリマーとβ−1,3−グルカンとから成ることを特徴とするファイバー状複合体。
【請求項2】
導電性ポリマーが、アセチレンまたはジアセチレンの誘導体のポリマーであることを特徴とする請求項1に記載の複合体。
【請求項3】
導電性ポリマーが、アミド基修飾ジフェニルジアセチレンのポリマーであることを特徴とする請求項2に記載の複合体。
【請求項4】
導電性ポリマーが、チオフェン、ピロールまたはアニリンの誘導体のポリマーであることを特徴とする請求項1に記載の複合体。
【請求項5】
導電性ポリマーが、3,4−エチレンジオキシチオフェンのポリマーであることを特徴とする請求項4に記載の複合体。
【請求項6】
β-1,3-グルカンが、シゾフィラン、レンチナンまたはスクレログルカンから選ばれたものであることを特徴とする請求項1〜5のいずれかに記載の複合体。
【請求項7】
β−1,3−グルカンが側鎖に機能性官能基を有するものであることを特徴とする請求項1〜6のいずれかに記載の複合体。
【請求項8】
導電性ポリマーとβ−1,3−グルカンとから成るファイバー状複合体を製造する方法であって、1本鎖のβ−1,3−グルカンを含有する非プロトン性極性溶媒溶液またはアルカリ水溶液と、所望のポリマーの源となるモノマーを含有する非プロトン性極性溶媒とを混合し、水を加えた後、重合反応を行なわせることを特徴とする方法。
【請求項9】
重合反応が光重合反応によるものであることを特徴とする請求項8に記載の方法。
【請求項10】
重合反応が酸化重合反応によるものであることを特徴とする請求項8に記載の方法。
【請求項11】
非プロトン性溶媒としてジメチルスルホキシドを用いることを特徴とする請求項8〜10のいずれかに記載の方法。
【請求項12】
1本鎖のβ−1,3−グルカンを含有する非プロトン性極性溶媒溶液またはアルカリ水溶液と、所望のポリマーの源となるモノマーを含有する非プロトン性極性溶媒とを混合し、水を加えた後、重合反応を行なわせることによって、導電性ポリマーとβ−1,3−グルカンとから成るファイバー状複合体を調製する工程、および、前記複合体からβ−1,3−グルカンを除去する工程を含むことを特徴とするファイバー状導電性ポリマーを製造する方法。
【請求項13】
請求項12によって製造されることを特徴とするファイバー状導電性ポリマー。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図9】


【図10】


【図11】


【図8】


【図12】


【図13】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図9】


【図10】


【図11】


【図8】


【図12】


【図13】


【公開番号】特開2006−160770(P2006−160770A)
【公開日】平成18年6月22日(2006.6.22)
【国際特許分類】
【出願番号】特願2004−349277(P2004−349277)
【出願日】平成16年12月2日(2004.12.2)
【出願人】(503360115)独立行政法人科学技術振興機構 (1,734)
【出願人】(501190941)三井製糖株式会社 (52)
【Fターム(参考)】
【公開日】平成18年6月22日(2006.6.22)
【国際特許分類】
【出願日】平成16年12月2日(2004.12.2)
【出願人】(503360115)独立行政法人科学技術振興機構 (1,734)
【出願人】(501190941)三井製糖株式会社 (52)
【Fターム(参考)】
[ Back to top ]

