プラスミド除去用組み換えプラスミドおよびその利用
【課題】アグロバクテリア菌内のTiプラスミドまたはRiプラスミドの除去効率が高く、かつ生育抑制または細胞死に至ることが少ないプラスミド除去用組み換えプラスミド、プラスミドの除去方法、および、当該プラスミド除去用組み換えプラスミドを利用する遺伝子組み換え用アグロバクテリア菌の作成方法を提供する。
【解決手段】プラスミド除去用組み換えプラスミドは、野生型アグロバクテリア菌が持つ複製遺伝子と不和合性を示す複製遺伝子と、プラスミド安定化遺伝子と、感受性遺伝子とを含有することを特徴とする。好ましくは、当該プラスミド安定化遺伝子は、トキシン−アンチトキシンシステムを構成する遺伝子である。
【解決手段】プラスミド除去用組み換えプラスミドは、野生型アグロバクテリア菌が持つ複製遺伝子と不和合性を示す複製遺伝子と、プラスミド安定化遺伝子と、感受性遺伝子とを含有することを特徴とする。好ましくは、当該プラスミド安定化遺伝子は、トキシン−アンチトキシンシステムを構成する遺伝子である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、アグロバクテリア菌を用いる遺伝子組み換えに利用される、プラスミド除去用組み換えプラスミド、プラスミドの除去方法、および、遺伝子組み換え用アグロバクテリア菌の作成方法に関する。
【背景技術】
【0002】
作物の耐性を増したり、貯蔵性または薬効成分の付与等の目的で、植物に組み換え遺伝子を導入し、遺伝子組み換え植物を作成する技術が頻用されている。アグロバクテリア菌(Agrobacterium tumefaciens(別名Rhizobium radiobacter)等の細菌)は、遺伝子を植物細胞核に輸送する機能を有するため、遺伝子組み換え植物を作成する主要な技術に必要不可欠な細菌である。アグロバクテリア菌は、根頭癌腫病菌および毛状根病菌として自然界から多数分離・保管されている。これらの菌は、種々の宿主範囲を有し、特定の植物種に高い感染・病徴誘導能を持つものも知られている。しかし、採取・保管された野生型アグロバクテリア菌の菌株の大部分は、遺伝子組み換えに使われていない。
【0003】
一般的に、アグロバクテリア菌を用いて外来遺伝子を植物に組み込む方法には、バイナリーベクター法が用いられている。図1は、バイナリーベクター法でのアグロバクテリア菌を用いて外来遺伝子を植物に組み込む方法の概念を示す図である。なお、例として、アグロバクテリウム・ツメファシエンス(Agrobacterium tumefaciens)の場合を示す。
【0004】
図1に示すように、まず、野生型アグロバクテリア菌(a)がもつ病原プラスミドAを、植物への感染に必須であるvir領域を保持させたままで、全T−DNA領域(LBとRBとその内部領域を含む)を除去したプラスミドA’に改変する(b)。次に、大腸菌と野生型アグロバクテリア菌との両方で複製可能な小型プラスミドの境界領域(LBとRB)の中に所要のDNAを組み込んでT−DNA領域としたプラスミドBを導入する(c、d)。このように作成した当該アグロバクテリア菌を植物に感染させると、プラスミドA’にあるvir領域の働きで、プラスミドBのT−DNA領域を植物に導入することが可能となる(e)。
【0005】
バイナリーベクター法において、遺伝子組み換え植物を作成するためのアグロバクテリア菌は、腫瘍形成の主体であるTiプラスミド、または、毛状根形成の主体であるRiプラスミドを改変し、病原発現遺伝子を含むT−DNA領域が除去されている必要がある。植物に感染し、細胞核にDNAを注入する機能領域は有するが、このようなT−DNA領域が除去された菌株を作成することは容易ではない。従って、遺伝子組み換え植物の作成に利用されるアグロバクテリア菌株の数は少ない。
【0006】
病原性アグロバクテリア菌の菌株を用い、遺伝子組み換え植物を作成できるように改変する有力な方法として、野生型アグロバクテリア菌が有するTiプラスミドまたはRiプラスミドをいったん除去し、既に加工しておいたvir領域を有するがT−DNA領域は除去されているTiプラスミドを導入する、という方法が開発された(非特許文献1参照)。
【0007】
TiプラスミドまたはRiプラスミドを除去する手段において、不和合性を用いたプラスミド除去法の場合であれば、除去効率が高く染色体DNAへの影響も少ない(特許文献1参照)。図2は、不和合性を用いるTiプラスミド除去法を示す図である。図2に示すように、TiプラスミドAと同じ複製遺伝子、薬剤耐性遺伝子(カナマイシン耐性遺伝子またはゲンタマイシン耐性遺伝子等)、および、ショ糖感受性遺伝子等を含むTi除去用プラスミドCを、大腸菌(a)を介し、野生型アグロバクテリア菌(b)に接合導入する。このように得られるカナマイシンまたはゲンタマイシン、および、リファンピシン耐性等を持つ接合体細胞(c)のうち、Tiプラスミドを失ったアグロバクテリア菌を、オパインの資化性またはハイブリダイゼーション法等により選別する。
【0008】
TiプラスミドAを失い、Ti除去用プラスミドCをもっているアグロバクテリア菌(d)を、高濃度ショ糖添加寒天培地に塗布、培養し、Ti除去用プラスミドを失った細胞を選別することで、プラスミドの無いアグロバクテリア菌(e)を得ることができる。なお、同様の方法にてRiプラスミドを除去することも可能である。
【0009】
しかしながら、TiプラスミドまたはRiプラスミドは、アグロバクテリア菌内で安定に維持する複製機構と共に、当該プラスミドの脱落を妨げるプラスミド安定化遺伝子を有するものが多いため、前述したような方法を用いてもプラスミドを除去することができない菌株が存在することが明らかとなった(非特許文献2参照)。
【0010】
安定なTiプラスミドまたはRiプラスミドの中には、複製遺伝子とは別に、プラスミド安定化遺伝子であるトキシン−アンチトキシン遺伝子を持つものがあることもわかっている(非特許文献2および非特許文献3参照)。図3は、トキシン−アンチトキシン遺伝子によるプラスミド安定化メカニズムの一例を示す図である。図3に示すように、細胞内に存在するトキシン−アンチトキシン遺伝子を含むプラスミドDは、細胞内において安定な毒性タンパク質と不安定な無毒化タンパク質とを発現しており、毒性タンパク質の毒性は無毒化タンパク質により抑制されている(a)。
【0011】
しかし、プラスミドが脱落した細胞では不安定な無毒化タンパク質は速やかに分解される。その一方で、安定な毒性タンパク質が細胞内に残存して毒性を発揮するため、生育抑制または細胞死が引き起こされる(b)。結果として、プラスミドを失った細胞は生育できず、プラスミドを維持している細胞のみが生育することになる。また、細胞死に至らずとも、毒性タンパク質の作用で生育が強く抑制を受けた細胞では遺伝子の変異率が上昇することが示唆されている(非特許文献2および非特許文献3参照)。
【先行技術文献】
【特許文献】
【0012】
【特許文献1】特開2003−284561号公報
【非特許文献】
【0013】
【非特許文献1】Kiyokawa K., et al., 2009, Appl. Environ. Microbiol. 75, 1845-1851
【非特許文献2】Yamamoto S., et al., 2009, J. Bacteriol. 191, 4656-4666
【非特許文献3】Yamamoto S., et al., 2007, Genes Genet. Syst. 82, 197-206
【発明の概要】
【発明が解決しようとする課題】
【0014】
以上のように、図2に示される不和合性を用いた方法によりTiプラスミドまたはRiプラスミドを除去する際においても、除去するTiプラスミドまたはRiプラスミド上に存在するトキシン−アンチトキシン遺伝子が、除去効率を大きく低下させ、その結果細胞の生育抑制または細胞死に繋がる場合があることがわかっている。しかし、除去効率を高めるために、TiプラスミドまたはRiプラスミド上のトキシン−アンチトキシン遺伝子を予め破壊しておくことは容易ではない。
【0015】
本発明は上記事情に鑑みてなされたものであり、アグロバクテリア菌内のTiプラスミドまたはRiプラスミドの除去効率が高く、かつ生育抑制または細胞死に至ることが少ないプラスミド除去用組み換えプラスミド、プラスミドの除去方法、および、当該プラスミド除去用組み換えプラスミドを利用する遺伝子組み換え用アグロバクテリア菌の作成方法を提供することを目的とする。
【課題を解決するための手段】
【0016】
上記目的を達成するため、本発明者らが鋭意研究を重ねた結果、従来のプラスミド除去用組み換えプラスミドよりもアグロバクテリア菌内から高頻度でTiプラスミドまたはRiプラスミドを除去し、さらには用いたプラスミドを高頻度で脱落させることができる、新規なプラスミドを作成した。具体的には、トキシン−アンチトキシン遺伝子の安定化効果を無効化し、アグロバクテリア菌内のTiプラスミドまたはRiプラスミドを着実かつ容易な方法で脱落させることが可能である、プラスミド除去用組み換えプラスミドを作成した。
【0017】
そこで、本発明の第1の態様に係るプラスミド除去用組み換えプラスミドは、野生型アグロバクテリア菌が持つ複製遺伝子と不和合性を示す複製遺伝子と、プラスミド安定化遺伝子と、感受性遺伝子とを含有することを特徴とする。
【0018】
好ましくは、前記プラスミド安定化遺伝子は、トキシン−アンチトキシンシステムを構成する遺伝子であることを特徴とする。
【0019】
また、好ましくは、前記トキシン−アンチトキシンシステムを構成する遺伝子は、tiorf24、および/または、ietAであることを特徴とする。
【0020】
より好ましくは、さらに、薬剤耐性遺伝子を有することを特徴とする。
【0021】
さらに好ましくは、以下(a)ないし(d)のいずれかの塩基配列を含有することを特徴とする。
(a)配列番号1ないし3のいずれかに記載の塩基配列。
(b)配列番号1ないし3のいずれかに記載の塩基配列に相補的な塩基配列。
(c)配列番号1ないし3のいずれかに記載の塩基配列、または、配列番号1ないし3のいずれかに記載の塩基配列に相補的な塩基配列に対して80%以上の相同性を有する塩基配列。
(d)配列番号1ないし3のいずれかに記載の塩基配列、または、配列番号1ないし3のいずれかに記載の塩基配列に相補的な塩基配列とストリンジェントな条件下でハイブリダイズする塩基配列。
【0022】
本発明の第2の態様に係るプラスミドの除去方法は、第1の態様に係るプラスミド除去用組み換えプラスミドを、アグロバクテリア菌に導入する工程を含むことを特徴とする。
【0023】
本発明の第3の態様に係る遺伝子組み換え用アグロバクテリア菌の作成方法は、第1の態様に係るプラスミド除去用組み換えプラスミドを、アグロバクテリア菌に導入する工程と、
前記プラスミド除去用組み換えプラスミドを前記アグロバクテリア菌から脱落させる工程と、
を含むことを特徴とする。
【0024】
好ましくは、前記アグロバクテリア菌は、アグロバクテリウム・ツメファシエンス菌、アグロバクテリウム・リゾゲネス菌、アグロバクテリウム・ビティス菌、アグロバクテリウム・ルビー菌またはアグロバクテリウム・ラリームレイ菌のいずれかであることを特徴とする。
【発明の効果】
【0025】
本発明によれば、アグロバクテリア菌内のTiプラスミドまたはRiプラスミドの除去効率が高く、かつ生育抑制または細胞死に至ることが少ないプラスミド除去用組み換えプラスミド、プラスミドの除去方法、および、当該プラスミド除去用組み換えプラスミドを利用する遺伝子組み換え用アグロバクテリア菌の作成方法が提供される。
【図面の簡単な説明】
【0026】
【図1】バイナリーベクター法でのアグロバクテリア菌を用いて外来遺伝子を植物に組み込む方法の概念を示す図である。
【図2】不合和性を用いるTiプラスミド除去法を示す図である。
【図3】トキシン−アンチトキシン遺伝子によるプラスミド安定化メカニズムの一例を示す図である。
【図4】実施例1に係るpK18msr24Aの遺伝子地図を示す図である。
【図5】実施例2に係るプラスミド除去用組み換えプラスミドのプラスミド安定化遺伝子の様子を示す図である。
【図6】実施例2に係るプラスミド除去用組み換えプラスミドの導入による各種アグロバクテリア菌株の接合効率を示す図である。
【図7】実施例3に係るプラスミド除去用組み換えプラスミドの導入による各種アグロバクテリア菌株のTiプラスミド除去率を示す図である。
【図8】実施例4に係るsacBカウンター選別による各種アグロバクテリア菌株のプラスミド除去用組み換えプラスミド脱落率を示す図である。
【図9】実施例5に係る無毒化Tiプラスミドおよびバイナリープラスミドを持つアグロバクテリア菌株の作成方法を示す図である。
【図10】実施例6に係る大根に対する形質転換効率の比較を示す図である。
【発明を実施するための形態】
【0027】
以下、本発明の実施の形態について詳細に説明する。なお、本明細書において「有する」、「含む」または「含有する」といった表現は、「からなる」または「から構成される」という意も含むものとする。
【0028】
(プラスミド除去用組み換えプラスミド)
本発明の実施の形態1は、プラスミド除去用組み換えプラスミドに関する。具体的には、野生型アグロバクテリア菌が持つ複製遺伝子に不和合性を示す複製遺伝子と、プラスミド安定化遺伝子と、感受性遺伝子とを含有するプラスミド除去用組み換えプラスミドに関する。
【0029】
本発明において「野生型アグロバクテリア菌」とは、当業者にとって公知である植物への感染能を持つ任意の野生型のアグロバクテリア菌の菌株を意味する。例えば、アグロバクテリウム・ツメファシエンスまたはアグロバクテリウム・リゾゲネス等の菌株を挙げることができる。これらは土壌や宿主植物から採取することができる。なお、当該野生型アグロバクテリア菌は、TiプラスミドまたはRiプラスミドに複製遺伝子repABCを有している。
【0030】
また、本発明において「不和合性」とは、一般的に当業者において使用される意味と同様であり、プラスミドの不和合性を指す。すなわち、系統的に近縁もしくは同一の複製遺伝子を有する2種類のプラスミドは、同一宿主細胞内では共存できないというプラスミドの性質を意味する。不和合性を示すプラスミド同士は、その複製遺伝子が系統的に近縁であることに由来するため、その塩基配列は類似している。例えば、後述する本実施の形態1に係るプラスミド除去用組み換えプラスミドは、IncRh1に属するTiプラスミドの複製遺伝子repABCを有する。
【0031】
本発明において、「感受性遺伝子」とは、特定の条件下において細胞増殖能力または生存能力が低下する機能を有する遺伝子を意味する。このような遺伝子としては、例えば、レヴァンスクラーゼ遺伝子等を挙げることができる。この場合、ホスト細胞にショ糖高感受性を付与し、ショ糖を添加した培地中で培養することにより、レヴァンスクラーゼ遺伝子を含むプラスミドが除去された細胞のみを得ることができる。なお、当業者に公知であるその他の任意の感受性遺伝子を用いても構わない。例えば、他の感受性遺伝子としては、発現を制御できるよう加工した毒素遺伝子、または、Fluoro-orotic acid感受性となるpyrB遺伝子等を挙げることができる。
【0032】
ここで、本実施の形態1に係るプラスミド除去用組み換えプラスミドは、特許文献1に記載されているプラスミド除去用組み換えプラスミドとは異なり、プラスミド安定化遺伝子を有している。本発明において、「プラスミド安定化遺伝子」とは、プラスミドを失った細胞(図3参照)の出現頻度を低下させる働きを持ち、当業者において公知である任意の遺伝子を意味する。
【0033】
例えば、アグロバクテリア菌内において機能するプラスミド安定化遺伝子としては、トキシン−アンチトキシン遺伝子を挙げることができる。本発明において、「トキシン−アンチトキシンシステムを構成する」とは、図3の(a)を用いて前述したように、細胞内において安定な毒性タンパク質と不安定な無毒化タンパク質とを発現しており、毒性タンパク質の毒性が無毒化タンパク質により抑制されている状態を意味している。本実施の形態1に係るプラスミド除去用組み換えプラスミドがこのようなトキシン−アンチトキシン遺伝子を有することにより、例えば、アグロバクテリア内のTiプラスミドまたはRiプラスミドが除去された場合であっても、プラスミド除去用組み換えプラスミドから発現している無毒化タンパク質が働くことで、アグロバクテリアの生育抑制または細胞死が引き起こされる頻度を低下させることができる。
【0034】
トキシン−アンチトキシンシステムを構成する遺伝子としては、例えば、tiorf24−tiorf25および/またはietA−ietS等を挙げることができる。なお、トキシン−アンチトキシンシステムを構成する遺伝子として、アンチトキシン遺伝子のみ(例えば、tiorf24および/またはietA、特にtiorf24およびietA)を持たせることで、最終的に当該プラスミド除去用組み換えプラスミドを脱落させる際の脱落率(%)も高頻度に保つことができる。
【0035】
本実施の形態1に係るプラスミド除去用組み換えプラスミドのさらに好ましい例としては、薬剤耐性遺伝子を有する。薬剤耐性遺伝子を有することによって、その薬剤にて細胞培養することにより、本実施の形態1に係るプラスミド除去用組み換えプラスミドが導入されたアグロバクテリア菌を、導入されなかったアグロバクテリア菌から容易に選別することができる。薬剤耐性遺伝子は、当業者において公知である任意の薬剤耐性遺伝子で構わない。例えば、ゲンタマイシン耐性遺伝子GmR、カナマイシン耐性遺伝子KmRまたはテトラサイクリン耐性TcR等を挙げることができる。また、薬剤耐性遺伝子は、単独または複数組合せて含有させることができる。なお、野生型アグロバクテリア菌は菌株ごとに異なる薬剤耐性を示すため、当該菌株に適当である薬剤耐性遺伝子を使用すればよい。
【0036】
このような本実施の形態1に係るプラスミド除去用組み換えプラスミドの具体例としては、配列表の配列番号1に記載の塩基配列から構成されるpK18msr24、配列番号2に記載の塩基配列から構成されるpK18msrA、および、配列番号3に記載の塩基配列から構成されるpK18msr24Aを挙げることができる。本実施の形態1に係るプラスミド除去用組み換えプラスミドは、配列番号1ないし3のいずれかの塩基配列を含んでいればよい。
【0037】
プラスミド除去用組み換えプラスミドは、配列番号1ないし3のいずれかの塩基配列に相補的な塩基配列を含有している場合でもよい。また、配列番号1ないし3のいずれかの塩基配列、または、配列番号1ないし3のいずれかの塩基配列に相補的な塩基配列に対して80%以上の相同性を有する塩基配列を含有している場合でもよい。相同性に関しては、好ましくは85%以上であり、より好ましくは90%以上であり、さらに好ましくは95%以上である。プラスミド除去用組み換えプラスミドは、配列番号1ないし3のいずれかの塩基配列、または、配列番号1ないし3のいずれかの塩基配列に相補的な塩基配列とストリンジェントな条件下でハイブリダイズする塩基配列を含有している場合でもよい。ここで、ストリンジェントな条件とは、いわゆる特異的なハイブリッドが形成され、非特異的なハイブリッドが形成されない条件をいう。
【0038】
(プラスミドの除去方法)
本発明の実施の形態2は、前述の実施の形態1のプラスミド除去用組み換えプラスミドをアグロバクテリア菌に導入する工程を含む、プラスミドの除去方法に関する。
【0039】
実施の形態1において述べたような遺伝子から構成される、プラスミド除去用組み換えプラスミドは、野生型のアグロバクテリア菌に導入される。導入の方法としては当業者において公知である任意の方法を用いることができる。例えば、当該プラスミド除去用組み換えプラスミドがincP型のoriTまたはincQ型のoriT等の接合起点遺伝子を有する場合、細胞接合による導入方法を用いることができる。当該プラスミド除去用組み換えプラスミドを大腸菌内に作成した場合は、アグロバクテリアとの接合効率が10−2から10−3程度と高いため、細胞接合法が広汎に適用できる。その他、電気的導入方法(エレクトロポレーション法)、または化学的処理によるDNA導入法等の手段を用いることも可能である。当該プラスミド除去用組み換えプラスミドを作成するバクテリアとしては大腸菌以外でも構わない。例えば、ネズミチフス菌等であっても構わない。
【0040】
図2に示したように、前述の実施の形態1に係るプラスミド除去用組み換えプラスミドと、野生型アグロバクテリア菌に元々存在したTiプラスミドとが共存するアグロバクテリア菌は、細胞培養すると、不和合性によって殆どが一方のプラスミドのみを有するアグロバクテリア菌となる。さらに、前述した薬剤耐性遺伝子を利用することによって、Tiプラスミドが除去されたアグロバクテリア菌のみを選別することができる。選別方法については、例えば、オパインによる選別法、サザンハイブリダイゼーション法または電気泳動法等を挙げることができる。これらの方法を用いての選別は、当業者であれば容易に実施可能である(特許文献1参照)。
【0041】
(遺伝子組み換え用アグロバクテリア菌の作成方法)
本発明の実施の形態3は、前述の実施の形態1に係るプラスミド除去用組み換えプラスミドをアグロバクテリア菌に導入することにより、前述の実施の形態2の通りTiプラスミドまたはRiプラスミドを除去し、次いで、当該プラスミド除去用組み換えプラスミドを脱落させる、遺伝子組み換え用アグロバクテリア菌の作成方法に関する。なお、当該アグロバクテリア菌の好ましい例としては、アグロバクテリウム・ツメファシエンス菌、アグロバクテリウム・リゾゲネス菌、アグロバクテリウム・ビティス菌、アグロバクテリウム・ルビー菌またはアグロバクテリウム・ラリームレイ菌等を挙げることができる。
【0042】
TiプラスミドまたはRiプラスミドが除去されたアグロバクテリア菌を選別した後は、当該アグロバクテリア菌に残っている、前述の実施の形態1に係るプラスミド除去用組み換えプラスミドを脱落させる。この際、前述した感受性遺伝子を利用することによって、プラスミド除去用組み換えプラスミドが脱落した遺伝子組み換え用のアグロバクテリア菌を得ることができる。
【0043】
このようにして得られたアグロバクテリア菌株細胞に、外来DNAを持つ別の外来型プラスミドを導入する。プラスミド導入の方法は、当業者において公知の手段を利用すればよい。また、プラスミドが導入されたアグロバクテリアを選別する方法についても、当業者において公知の手段を利用すればよい。例えば、外来型プラスミドとして中間ベクター法による遺伝子組み換えプラスミドを用いることによって、そのまま植物へ感染させて植物の形質転換を行なうことができる。その他の方法としては、後述の実施例5において詳細に説明する。なお、本発明において「遺伝子組み換え用アグロバクテリア菌」とは、TiプラスミドまたはRiプラスミド、および、前述の実施の形態1に係るプラスミド除去用組み換えプラスミドが欠失したアグロバクテリア菌、または、当該TiプラスミドまたはRiプラスミド、および、前述の実施の形態1に係るプラスミド除去用組み換えプラスミドが欠失したアグロバクテリア菌に外来DNAが導入されたアグロバクテリア菌を意味する。
【実施例】
【0044】
以下、実施例を用いて本発明をより詳細に説明するが、実施例は本発明を限定するものではない。
【0045】
(実施例1)
本実施例1では、プラスミド除去用組み換えプラスミドの作成方法に係る実施例について詳細に述べる。
【0046】
本実施例1では、プラスミド除去用組み換えプラスミドとしてpK18msr24、pK18msrAおよびpK18msr24Aを作成した例について詳細に述べる。これらのプラスミド除去用組み換えプラスミドのプラスミド安定遺伝子として、pK18msr24はpTi−SAKURA由来のtiorf24を、pK18msrAはpTiC58由来のietAを、pK18msr24Aはtiorf24およびietAの両方を有するよう作成した。
【0047】
これらのプラスミド除去用組み換えプラスミドの作成は、RP4からのoriTをもつpK18msrを出発材料とした。当該pK18msrのプラスミドは、大腸菌からアグロバクテリア菌だけでなく、グラム陽性およびグラム陰性の両方のバクテリアにも移動可能であるプラスミドである(特許文献1および非特許文献3参照)。
【0048】
当該プラスミド上に存在するsacB遺伝子は、細胞を高濃度のショ糖を含む培地で培養すると、細胞を死滅させる効果がある(Steinmetz M., et al., 1983, Mol. Gen. Genet. Syst. 77, 1-9およびGay P., et al., 1985, J. Bacteriol. 164, 918-921参照)。そのため、遺伝子を欠失した細胞の単離、すなわちカウンター選別に有用である。また、pK18msrは、pTi−SAKURAの複製遺伝子であるrepABC遺伝子を有しており、アグロバクテリア細胞内で多くのTiプラスミドと不和合なプラスミドとして維持される。
【0049】
次に、tiorf24を含むDNA断片(pTi−SAKURA(GenBankアクセッション番号AB016260)の全塩基配列中24,297〜25,118)およびietAを含むDNA断片(pTiC58(GenBankアクセッション番号AE007871)の全塩基配列中97,533〜98,938)を、末端にXbaI切断部位を付加したプライマーを用い、PCRで増幅後、XbaIで消化し、それぞれ前述したpK18msrのXbaI切断部位に挿入した。
【0050】
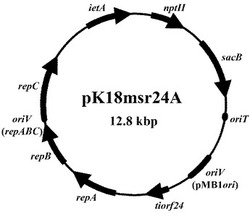
このように本実施例1に係るプラスミド除去用組み換えプラスミド、pK18msr24およびpK18msrAを作成した。なお、pK18msr24Aについては、pK18msr24のNheI切断部位にietAを含むXbaI切断DNA断片を挿入することによって作成した。図4は、実施例1に係るpK18msr24Aの遺伝子地図を示す図である。これらの実施例1に係るプラスミド除去用組み換えプラスミドを構成するプラスミド、DNA断片(tiorf24、repABC、ietAおよびsacB等)の塩基配列は全て公知であるため、GenBank等のデータベースを用いて前述のプラスミド除去用組み換えプラスミドを作成することは当業者であれば容易である。前述した通り、当該三つのプラスミドの塩基配列を配列表の配列番号1ないし3に示す。
【0051】
(実施例2)
本実施例2では、前述の実施例1のプラスミド除去用組み換えプラスミドの接合導入効率に係る実施例について詳細に説明する。
【0052】
本実施例2では、従来のプラスミド除去用組み換えプラスミドと、本発明に係るプラスミド除去用組み換えプラスミドとの接合導入効率における比較について説明する。従来のプラスミド除去用組み換えプラスミドとしては、pK18msrを用いた。本発明に係るプラスミド除去用組み換えプラスミドとしては、tiorf24−tiorf25およびietA−ietSを含むプラスミドであるpK18SCatと、前述したpK18msr24、pK18msrAまたはpK18msr24Aのプラスミドとを用いた。それぞれこれらのプラスミド除去用組み換えプラスミドを用い、種々のアグロバクテリア菌の菌株におけるTiプラスミド除去操作を行った(Uraji M., et al., 2002, Genes Genet. Syst. 77, 1-9参照)。
【0053】
アグロバクテリア菌の菌株は、MAFF301001、C58、Ch−Ag−10、Pch−Ag−2、Pl−Ag−1、Ch−Ag−2およびPch−Ag−4を使用した。各プラスミド除去用組み換えプラスミドの各アグロバクテリア菌株への導入は、それぞれのプラスミド除去用組み換えプラスミドを有する大腸菌S17−1λpirとの接合によって実施した。接合方法は当該分野にて一般的な方法を用いた(Simon R., et al., 1983, Bio/Technology 1, 784-794参照)。まず、ドナーの大腸菌と受け取り側のアグロバクテリア細胞の細胞密度を1.0OD600となるまで培養し、0.9%(W/V)NaClを用いて洗浄した。
【0054】
次に、アグロバクテリア菌細胞を同量のドナーである大腸菌細胞と混合した後に、LB寒天培地上のナイロン膜フィルター(Amersham社製)に滴下した。その後、28℃で15時間インキュベートし、フィルター上の細胞混合物を0.9%NaClに懸濁し、リファンピシン(終濃度30μg/ml)およびカナマイシン(終濃度50μg/ml)を添加したLB寒天培地上に塗布した。
【0055】
なお、菌株にPch−Ag−2、Pl−Ag−1、Ch−Ag−2、Ch−Ag−10またはPch−Ag−4を用いた際には、細胞の洗浄および懸濁は0.9%NaClの代わりにYMA培地(1%Mannitol、0.4%Yeast extract、0.05%K2HPO4、0.01%NaClおよび0.02%MgSO4)を、LB寒天培地の代わりにYMA寒天培地を用い、選択培地としてはナルジクス酸(終濃度30μg/ml)およびネオマイシン(終濃度50μg/ml)を添加したYMA寒天培地を使用した。その後、三日間の培養で生じたコロニー(接合体)を数え、実験に用いた細胞数当たりの比率(接合効率)として計算した。
【0056】
図5は、実施例2に係るプラスミド除去用組み換えプラスミドのプラスミド安定化遺伝子の様子を示す図である。図6は、実施例2に係るプラスミド除去用組み換えプラスミドの導入による各種アグロバクテリア菌株の接合効率を示す図である。図5において、+は該安定化遺伝子が該プラスミド除去用組み換えプラスミド上に存在していることを示し、−は該安定化遺伝子が該プラスミド除去用組み換えプラスミド上に存在していないことを示す。図6において、ntは未実施であることを示している。
【0057】
図6に示すように、従来のプラスミド除去用組み換えプラスミド(pK18msr)と比較すると、特に、pK18msr24Aが大半のアグロバクテリア菌株において高い接合導入効率(Transconjugant efficiency)を示していた。
【0058】
(実施例3)
本実施例3では、従来のプラスミド除去用組み換えプラスミドと、前述の実施例1のプラスミド除去用組み換えプラスミドとを比較した際の、Tiプラスミド除去効率に係る実施例について詳細に説明する。
【0059】
前述の実施例2における接合体細胞の中に、Tiプラスミドが存在するか否かを試験した。Tiプラスミドのvir領域は菌株間で高度に保存されているため、virC増幅プライマー(VCF3およびVCR3(塩基配列を配列番号4および5に示す))を用いるPCRによって、多くのアグロバクテリア菌の菌株が持つTiプラスミドは高感度に検出できる。すなわち、接合体細胞のゲノムDNAをテンプレートとし、配列番号4および5に示されるvirC増幅プライマーを用いてPCRを行った場合、Tiプラスミドを有している細胞でのみ約400bpのDNA断片の増幅が見られる。
【0060】
まず、このような方法によって各プラスミド除去用組み換えプラスミドによる接合体細胞のTiプラスミドの有無を確認し、Tiプラスミド除去率として算出した。図7は、実施例3に係るプラスミド除去用組み換えプラスミドの導入による各種アグロバクテリア菌株のTiプラスミド除去率を示す図である。図6と同様に、ntは未実施を示す。
【0061】
従来のプラスミド除去用組み換えプラスミドであるpK18msrと比較すると、本発明に係るpK18SCatおよびpK18msr24Aを導入した接合体細胞で、大半のアグロバクテリア菌の菌株においてTi除去率(%)が大きく上昇していた。他の本発明に係るプラスミド除去用組み換えプラスミドに関しては、pK18msr24についてはMAFF301001接合体において、pK18msrAについてはC58接合体において、pK18msrよりも高いTi除去率(%)を示した。さらには、Ch−Ag−10、Pl−Ag−1およびPch−Ag−2については従来のプラスミド除去用組み換えプラスミドではTiプラスミドが除去された細胞は殆ど得られなかったが、本実施例3において実施したpK18SCatおよびpK18msr24Aでは、特に効率よく種々のTiプラスミド除去株を得ることができていた。
【0062】
(実施例4)
本実施例4では、従来のプラスミド除去用組み換えプラスミドと、前述の実施例1のプラスミド除去用組み換えプラスミドとを比較した際の、sacBカウンター選別によるプラスミド除去用組み換えプラスミドの脱落率に係る実施例について詳細に説明する。
【0063】
前述の実施例3のTiプラスミド除去接合体細胞は、Tiプラスミドの代わりにプラスミド除去用組み換えプラスミドを含んでいる状態である。アグロバクテリア細胞を活用するには、プラスミド除去用組み換えプラスミドを除去する必要がある。図4に示したように、pK18msr24Aはホスト細胞をショ糖高感受性にするsacB遺伝子を有している。図示していないが、他の実施例1にて述べた本発明に係るプラスミド除去用組み換えプラスミドにも同様にsacB遺伝子を持たせた。
【0064】
前述した実施例3のTiプラスミド脱落菌株を0.9%NaClで希釈後、ショ糖を添加したLB寒天培地(終濃度5%)に塗布し、2、3日培養後、コロニーを出現させた。出現したコロニーを、カナマイシン(終濃度50μg/ml)を加えたLB寒天培地に移植後、28℃で2、3日培養し、生育の有無を観察した。Ch−Ag−10、Pch−Ag−2、Ch−Ag−2、Pch−Ag−4およびPl−Ag−1由来の接合体細胞に関しては、Tiプラスミド脱落菌株の希釈には0.9%NaClの代わりにYMA培地を用い、塗布および移植にはLB寒天培地の代わりにYMA寒天培地を用い、カナマイシンの代わりにネオマイシン(終濃度50μg/ml)を用いた。
【0065】
このように培養を行った結果、カナマイシンあるいはネオマイシン添加固体培地上で生育しないものをプラスミド除去用組み換えプラスミドを失った細胞と判断した。図8は、実施例4に係るsacBカウンター選別による各種アグロバクテリア菌株のプラスミド除去用組み換えプラスミド脱落率を示す図である。図6および図7と同様に、ntは未実施を示す。
【0066】
図8に示すように、安定化遺伝子全て(tiorf24、tiorf25、ietAおよびietS)を有しているプラスミド除去用組み換えプラスミドでは、MAFF301001およびC58で約30%、その他の菌株ではほぼ0%の脱落率となっていた。すなわち、前述のTiプラスミド除去率の結果では、従来のプラスミド(pK18msr)よりも優れていたが、本実施例4に係る脱落率では、従来のプラスミドには劣る結果となり、少々扱い難い点を有することも示唆される。その一方で、pK18msr24Aについては全ての菌株において極めて効率よく、プラスミド除去用組み換えプラスミドを脱落させた細胞を得ることができた。
【0067】
(実施例5)
本実施例5では、Tiプラスミドを除去し、プラスミド除去用組み換えプラスミドを脱落させたアグロバクテリア細胞菌株のその後の操作に係る実施例について詳細に説明する。
【0068】
なお、本実施例5に係る実験操作は、従来のプラスミド除去用組み換えプラスミドを用いて作成したアグロバクテリア細胞菌株を用いて操作する場合と、本発明に係るプラスミド除去用組み換えプラスミドを用いて作成したアグロバクテリア細胞菌株を用いて操作する場合と同様である。アグロバクテリア菌のC58では従来のプラスミド除去用組み換えプラスミドpK18msrを用い、Pch−Ag−2では本発明に係るプラスミド除去用組み換えプラスミドpK18msr24Aを用い、前述の実施例3および実施例4の方法にてプラスミド脱落アグロバクテリア菌株を作成した。
【0069】
当該アグロバクテリア菌株に、無毒化TiプラスミドpTi−SAKURA−Sを大腸菌S17−1λpirを介し、導入した。無毒化TiプラスミドpTi−SAKURA−Sは、pTi−SAKURAのT−DNA領域を削除し、代わりに大腸菌において働く複製起点oriVpSC101、ゲンタマイシン耐性遺伝子GmR、アンピシリン耐性遺伝子AmpRおよび転移起点oriTを持たせた無毒化Tiプラスミドである(非特許文献1参照)。
【0070】
次いで、無毒化TiプラスミドpTi−SAKURA−Sを導入したアグロバクテリアC58およびPch−Ag−2に、バイナリープラスミドpBINGIを大腸菌S17−1λpirを介して導入した。バイナリープラスミドpBINGIは、T−DNA領域(LBとRBに挟まれた領域)に、レポーター遺伝子intron−GUSおよびカナマイシン耐性遺伝子nptIIを持つ(非特許文献1参照)。
【0071】
このように作成した、無毒化Tiプラスミドとバイナリープラスミドとを持つアグロバクテリアC58およびPch−Ag−2は、腫瘍または毛状根等の病気を引き起こすこと無く植物または菌類へ、遺伝子導入をすることが可能である。図9は、実施例5に係る無毒化Tiプラスミドおよびバイナリープラスミドを持つアグロバクテリア菌株の作成方法を示す図である。なお、本実施例5では、カナマイシン耐性遺伝子nptIIを使用しているため、カナマイシンを含む植物用培地を利用することで遺伝子が導入された植物細胞のみを選択的に生育させることが可能である。また、レポーター遺伝子intron−GUSは、β−グルクロニダーゼをコードしている。これは、実施例6にて後述するが、形質転換操作を行った植物組織に含まれる当該タンパク質の活性(GUS活性)を測定することにより、遺伝子導入の効率を評価するためである。
【0072】
(実施例6)
本実施例6では、従来使用されていたアグロバクテリア菌株と、本発明での方法によって作出されたアグロバクテリア菌株との形質転換効率の比較に係る実施例について詳細に説明する。
【0073】
比較した菌株はいずれも無毒化TiプラスミドpTi−SAKURA−SとバイナリープラスミドpBINGIとを持つアグロバクテリア菌株であるということは同様であるが、当該アグロバクテリア菌株の作成方法(使用したプラスミド除去用組み換えプラスミド)が異なる。遺伝子導入のためのアグロバクテリア菌株は、それぞれ前述の実施例5の菌株と同様である。形質転換効率は、大根(Raphanus sativus L. cv. Aonosachi)の外植片を以て比較した。
【0074】
まず、無菌処理を施した大根の種子を発芽させ、その子葉、胚軸をそれぞれのアグロバクテリア菌液(0.4OD660)に5分間浸漬した。その後、植物ホルモン(3μg/mlナフタレン酢酸および4μg/mlベンジルアデニン)を含むMS固体培地に移し、22℃において3日間照明下で共存培養した。次いで、形質転換細胞を選択的に生育させるため、セフォタキシム200μg/mlおよびカナマイシン25μg/mlを加えた前述と同様のMS固体培地上に移し、22℃において2週間照明下で培養した。その後、培地上の植物細胞を回収し、タンパク質を抽出後、GUS活性を測定し、形質転換効率を評価した。なお、GUS活性評価方法の詳細については、Jefferson R. A. et al., 1987, EMBO J. 6, 3901-3907を参照されたい。
【0075】
図10は、実施例6に係る大根に対する形質転換効率の比較を示す図である。図10に示すように、本発明に係るプラスミド除去用組み換えプラスミドを利用し作成した遺伝子組み換え用アグロバクテリアPch−Ag−2では、従来のものを利用し作成した遺伝子組み換え用アグロバクテリアC58よりも、約1.7倍高い形質転換効率を示していた。
【0076】
本発明は、上記発明の実施の形態および実施例の説明に何ら限定されるものではない。特許請求の範囲の記載を逸脱せず、当業者が容易に想到できる範囲で種々の変形態様もこの発明に含まれる。
【0077】
本明細書の中で明示した論文および公開特許公報等の内容は、その全ての内容を援用によって引用することとする。
【産業上の利用可能性】
【0078】
本発明者らは鋭意研究を行い、従来のプラスミド除去用組み換えプラスミドよりもアグロバクテリア菌内から高頻度でTiプラスミドまたはRiプラスミドを除去し、かつ用いたプラスミドを高頻度で脱落させることができる、新規なプラスミドを作成した。具体的には、トキシン−アンチトキシン遺伝子の安定化効果を無効化し、アグロバクテリア菌内のTiプラスミドまたはRiプラスミドを着実かつ容易な方法で脱落させることが可能なプラスミド除去用組み換えプラスミドを作成した。
【0079】
すなわち、本発明によれば、アグロバクテリア菌内のTiプラスミドまたはRiプラスミドの除去効率が高く、かつ生育抑制または細胞死に至ることが少ないプラスミド除去用組み換えプラスミド、プラスミドの除去方法、および、当該プラスミド除去用組み換えプラスミドを利用する遺伝子組み換え用アグロバクテリア菌の作成方法が提供される。詳細には、今まで植物の形質転換に活用することができなかった極めて安定なTiプラスミドを持つアグロバクテリア病原株を、形質転換に活用できる形に改変することが可能となり、さらには、その菌株のもつ特性が染色体側にあるのかプラスミド側にあるのかを判別することも可能となる。このように改変された菌株は、加工したTiプラスミドあるいはRiプラスミドを容易に導入可能な有用形質となる。
【技術分野】
【0001】
本発明は、アグロバクテリア菌を用いる遺伝子組み換えに利用される、プラスミド除去用組み換えプラスミド、プラスミドの除去方法、および、遺伝子組み換え用アグロバクテリア菌の作成方法に関する。
【背景技術】
【0002】
作物の耐性を増したり、貯蔵性または薬効成分の付与等の目的で、植物に組み換え遺伝子を導入し、遺伝子組み換え植物を作成する技術が頻用されている。アグロバクテリア菌(Agrobacterium tumefaciens(別名Rhizobium radiobacter)等の細菌)は、遺伝子を植物細胞核に輸送する機能を有するため、遺伝子組み換え植物を作成する主要な技術に必要不可欠な細菌である。アグロバクテリア菌は、根頭癌腫病菌および毛状根病菌として自然界から多数分離・保管されている。これらの菌は、種々の宿主範囲を有し、特定の植物種に高い感染・病徴誘導能を持つものも知られている。しかし、採取・保管された野生型アグロバクテリア菌の菌株の大部分は、遺伝子組み換えに使われていない。
【0003】
一般的に、アグロバクテリア菌を用いて外来遺伝子を植物に組み込む方法には、バイナリーベクター法が用いられている。図1は、バイナリーベクター法でのアグロバクテリア菌を用いて外来遺伝子を植物に組み込む方法の概念を示す図である。なお、例として、アグロバクテリウム・ツメファシエンス(Agrobacterium tumefaciens)の場合を示す。
【0004】
図1に示すように、まず、野生型アグロバクテリア菌(a)がもつ病原プラスミドAを、植物への感染に必須であるvir領域を保持させたままで、全T−DNA領域(LBとRBとその内部領域を含む)を除去したプラスミドA’に改変する(b)。次に、大腸菌と野生型アグロバクテリア菌との両方で複製可能な小型プラスミドの境界領域(LBとRB)の中に所要のDNAを組み込んでT−DNA領域としたプラスミドBを導入する(c、d)。このように作成した当該アグロバクテリア菌を植物に感染させると、プラスミドA’にあるvir領域の働きで、プラスミドBのT−DNA領域を植物に導入することが可能となる(e)。
【0005】
バイナリーベクター法において、遺伝子組み換え植物を作成するためのアグロバクテリア菌は、腫瘍形成の主体であるTiプラスミド、または、毛状根形成の主体であるRiプラスミドを改変し、病原発現遺伝子を含むT−DNA領域が除去されている必要がある。植物に感染し、細胞核にDNAを注入する機能領域は有するが、このようなT−DNA領域が除去された菌株を作成することは容易ではない。従って、遺伝子組み換え植物の作成に利用されるアグロバクテリア菌株の数は少ない。
【0006】
病原性アグロバクテリア菌の菌株を用い、遺伝子組み換え植物を作成できるように改変する有力な方法として、野生型アグロバクテリア菌が有するTiプラスミドまたはRiプラスミドをいったん除去し、既に加工しておいたvir領域を有するがT−DNA領域は除去されているTiプラスミドを導入する、という方法が開発された(非特許文献1参照)。
【0007】
TiプラスミドまたはRiプラスミドを除去する手段において、不和合性を用いたプラスミド除去法の場合であれば、除去効率が高く染色体DNAへの影響も少ない(特許文献1参照)。図2は、不和合性を用いるTiプラスミド除去法を示す図である。図2に示すように、TiプラスミドAと同じ複製遺伝子、薬剤耐性遺伝子(カナマイシン耐性遺伝子またはゲンタマイシン耐性遺伝子等)、および、ショ糖感受性遺伝子等を含むTi除去用プラスミドCを、大腸菌(a)を介し、野生型アグロバクテリア菌(b)に接合導入する。このように得られるカナマイシンまたはゲンタマイシン、および、リファンピシン耐性等を持つ接合体細胞(c)のうち、Tiプラスミドを失ったアグロバクテリア菌を、オパインの資化性またはハイブリダイゼーション法等により選別する。
【0008】
TiプラスミドAを失い、Ti除去用プラスミドCをもっているアグロバクテリア菌(d)を、高濃度ショ糖添加寒天培地に塗布、培養し、Ti除去用プラスミドを失った細胞を選別することで、プラスミドの無いアグロバクテリア菌(e)を得ることができる。なお、同様の方法にてRiプラスミドを除去することも可能である。
【0009】
しかしながら、TiプラスミドまたはRiプラスミドは、アグロバクテリア菌内で安定に維持する複製機構と共に、当該プラスミドの脱落を妨げるプラスミド安定化遺伝子を有するものが多いため、前述したような方法を用いてもプラスミドを除去することができない菌株が存在することが明らかとなった(非特許文献2参照)。
【0010】
安定なTiプラスミドまたはRiプラスミドの中には、複製遺伝子とは別に、プラスミド安定化遺伝子であるトキシン−アンチトキシン遺伝子を持つものがあることもわかっている(非特許文献2および非特許文献3参照)。図3は、トキシン−アンチトキシン遺伝子によるプラスミド安定化メカニズムの一例を示す図である。図3に示すように、細胞内に存在するトキシン−アンチトキシン遺伝子を含むプラスミドDは、細胞内において安定な毒性タンパク質と不安定な無毒化タンパク質とを発現しており、毒性タンパク質の毒性は無毒化タンパク質により抑制されている(a)。
【0011】
しかし、プラスミドが脱落した細胞では不安定な無毒化タンパク質は速やかに分解される。その一方で、安定な毒性タンパク質が細胞内に残存して毒性を発揮するため、生育抑制または細胞死が引き起こされる(b)。結果として、プラスミドを失った細胞は生育できず、プラスミドを維持している細胞のみが生育することになる。また、細胞死に至らずとも、毒性タンパク質の作用で生育が強く抑制を受けた細胞では遺伝子の変異率が上昇することが示唆されている(非特許文献2および非特許文献3参照)。
【先行技術文献】
【特許文献】
【0012】
【特許文献1】特開2003−284561号公報
【非特許文献】
【0013】
【非特許文献1】Kiyokawa K., et al., 2009, Appl. Environ. Microbiol. 75, 1845-1851
【非特許文献2】Yamamoto S., et al., 2009, J. Bacteriol. 191, 4656-4666
【非特許文献3】Yamamoto S., et al., 2007, Genes Genet. Syst. 82, 197-206
【発明の概要】
【発明が解決しようとする課題】
【0014】
以上のように、図2に示される不和合性を用いた方法によりTiプラスミドまたはRiプラスミドを除去する際においても、除去するTiプラスミドまたはRiプラスミド上に存在するトキシン−アンチトキシン遺伝子が、除去効率を大きく低下させ、その結果細胞の生育抑制または細胞死に繋がる場合があることがわかっている。しかし、除去効率を高めるために、TiプラスミドまたはRiプラスミド上のトキシン−アンチトキシン遺伝子を予め破壊しておくことは容易ではない。
【0015】
本発明は上記事情に鑑みてなされたものであり、アグロバクテリア菌内のTiプラスミドまたはRiプラスミドの除去効率が高く、かつ生育抑制または細胞死に至ることが少ないプラスミド除去用組み換えプラスミド、プラスミドの除去方法、および、当該プラスミド除去用組み換えプラスミドを利用する遺伝子組み換え用アグロバクテリア菌の作成方法を提供することを目的とする。
【課題を解決するための手段】
【0016】
上記目的を達成するため、本発明者らが鋭意研究を重ねた結果、従来のプラスミド除去用組み換えプラスミドよりもアグロバクテリア菌内から高頻度でTiプラスミドまたはRiプラスミドを除去し、さらには用いたプラスミドを高頻度で脱落させることができる、新規なプラスミドを作成した。具体的には、トキシン−アンチトキシン遺伝子の安定化効果を無効化し、アグロバクテリア菌内のTiプラスミドまたはRiプラスミドを着実かつ容易な方法で脱落させることが可能である、プラスミド除去用組み換えプラスミドを作成した。
【0017】
そこで、本発明の第1の態様に係るプラスミド除去用組み換えプラスミドは、野生型アグロバクテリア菌が持つ複製遺伝子と不和合性を示す複製遺伝子と、プラスミド安定化遺伝子と、感受性遺伝子とを含有することを特徴とする。
【0018】
好ましくは、前記プラスミド安定化遺伝子は、トキシン−アンチトキシンシステムを構成する遺伝子であることを特徴とする。
【0019】
また、好ましくは、前記トキシン−アンチトキシンシステムを構成する遺伝子は、tiorf24、および/または、ietAであることを特徴とする。
【0020】
より好ましくは、さらに、薬剤耐性遺伝子を有することを特徴とする。
【0021】
さらに好ましくは、以下(a)ないし(d)のいずれかの塩基配列を含有することを特徴とする。
(a)配列番号1ないし3のいずれかに記載の塩基配列。
(b)配列番号1ないし3のいずれかに記載の塩基配列に相補的な塩基配列。
(c)配列番号1ないし3のいずれかに記載の塩基配列、または、配列番号1ないし3のいずれかに記載の塩基配列に相補的な塩基配列に対して80%以上の相同性を有する塩基配列。
(d)配列番号1ないし3のいずれかに記載の塩基配列、または、配列番号1ないし3のいずれかに記載の塩基配列に相補的な塩基配列とストリンジェントな条件下でハイブリダイズする塩基配列。
【0022】
本発明の第2の態様に係るプラスミドの除去方法は、第1の態様に係るプラスミド除去用組み換えプラスミドを、アグロバクテリア菌に導入する工程を含むことを特徴とする。
【0023】
本発明の第3の態様に係る遺伝子組み換え用アグロバクテリア菌の作成方法は、第1の態様に係るプラスミド除去用組み換えプラスミドを、アグロバクテリア菌に導入する工程と、
前記プラスミド除去用組み換えプラスミドを前記アグロバクテリア菌から脱落させる工程と、
を含むことを特徴とする。
【0024】
好ましくは、前記アグロバクテリア菌は、アグロバクテリウム・ツメファシエンス菌、アグロバクテリウム・リゾゲネス菌、アグロバクテリウム・ビティス菌、アグロバクテリウム・ルビー菌またはアグロバクテリウム・ラリームレイ菌のいずれかであることを特徴とする。
【発明の効果】
【0025】
本発明によれば、アグロバクテリア菌内のTiプラスミドまたはRiプラスミドの除去効率が高く、かつ生育抑制または細胞死に至ることが少ないプラスミド除去用組み換えプラスミド、プラスミドの除去方法、および、当該プラスミド除去用組み換えプラスミドを利用する遺伝子組み換え用アグロバクテリア菌の作成方法が提供される。
【図面の簡単な説明】
【0026】
【図1】バイナリーベクター法でのアグロバクテリア菌を用いて外来遺伝子を植物に組み込む方法の概念を示す図である。
【図2】不合和性を用いるTiプラスミド除去法を示す図である。
【図3】トキシン−アンチトキシン遺伝子によるプラスミド安定化メカニズムの一例を示す図である。
【図4】実施例1に係るpK18msr24Aの遺伝子地図を示す図である。
【図5】実施例2に係るプラスミド除去用組み換えプラスミドのプラスミド安定化遺伝子の様子を示す図である。
【図6】実施例2に係るプラスミド除去用組み換えプラスミドの導入による各種アグロバクテリア菌株の接合効率を示す図である。
【図7】実施例3に係るプラスミド除去用組み換えプラスミドの導入による各種アグロバクテリア菌株のTiプラスミド除去率を示す図である。
【図8】実施例4に係るsacBカウンター選別による各種アグロバクテリア菌株のプラスミド除去用組み換えプラスミド脱落率を示す図である。
【図9】実施例5に係る無毒化Tiプラスミドおよびバイナリープラスミドを持つアグロバクテリア菌株の作成方法を示す図である。
【図10】実施例6に係る大根に対する形質転換効率の比較を示す図である。
【発明を実施するための形態】
【0027】
以下、本発明の実施の形態について詳細に説明する。なお、本明細書において「有する」、「含む」または「含有する」といった表現は、「からなる」または「から構成される」という意も含むものとする。
【0028】
(プラスミド除去用組み換えプラスミド)
本発明の実施の形態1は、プラスミド除去用組み換えプラスミドに関する。具体的には、野生型アグロバクテリア菌が持つ複製遺伝子に不和合性を示す複製遺伝子と、プラスミド安定化遺伝子と、感受性遺伝子とを含有するプラスミド除去用組み換えプラスミドに関する。
【0029】
本発明において「野生型アグロバクテリア菌」とは、当業者にとって公知である植物への感染能を持つ任意の野生型のアグロバクテリア菌の菌株を意味する。例えば、アグロバクテリウム・ツメファシエンスまたはアグロバクテリウム・リゾゲネス等の菌株を挙げることができる。これらは土壌や宿主植物から採取することができる。なお、当該野生型アグロバクテリア菌は、TiプラスミドまたはRiプラスミドに複製遺伝子repABCを有している。
【0030】
また、本発明において「不和合性」とは、一般的に当業者において使用される意味と同様であり、プラスミドの不和合性を指す。すなわち、系統的に近縁もしくは同一の複製遺伝子を有する2種類のプラスミドは、同一宿主細胞内では共存できないというプラスミドの性質を意味する。不和合性を示すプラスミド同士は、その複製遺伝子が系統的に近縁であることに由来するため、その塩基配列は類似している。例えば、後述する本実施の形態1に係るプラスミド除去用組み換えプラスミドは、IncRh1に属するTiプラスミドの複製遺伝子repABCを有する。
【0031】
本発明において、「感受性遺伝子」とは、特定の条件下において細胞増殖能力または生存能力が低下する機能を有する遺伝子を意味する。このような遺伝子としては、例えば、レヴァンスクラーゼ遺伝子等を挙げることができる。この場合、ホスト細胞にショ糖高感受性を付与し、ショ糖を添加した培地中で培養することにより、レヴァンスクラーゼ遺伝子を含むプラスミドが除去された細胞のみを得ることができる。なお、当業者に公知であるその他の任意の感受性遺伝子を用いても構わない。例えば、他の感受性遺伝子としては、発現を制御できるよう加工した毒素遺伝子、または、Fluoro-orotic acid感受性となるpyrB遺伝子等を挙げることができる。
【0032】
ここで、本実施の形態1に係るプラスミド除去用組み換えプラスミドは、特許文献1に記載されているプラスミド除去用組み換えプラスミドとは異なり、プラスミド安定化遺伝子を有している。本発明において、「プラスミド安定化遺伝子」とは、プラスミドを失った細胞(図3参照)の出現頻度を低下させる働きを持ち、当業者において公知である任意の遺伝子を意味する。
【0033】
例えば、アグロバクテリア菌内において機能するプラスミド安定化遺伝子としては、トキシン−アンチトキシン遺伝子を挙げることができる。本発明において、「トキシン−アンチトキシンシステムを構成する」とは、図3の(a)を用いて前述したように、細胞内において安定な毒性タンパク質と不安定な無毒化タンパク質とを発現しており、毒性タンパク質の毒性が無毒化タンパク質により抑制されている状態を意味している。本実施の形態1に係るプラスミド除去用組み換えプラスミドがこのようなトキシン−アンチトキシン遺伝子を有することにより、例えば、アグロバクテリア内のTiプラスミドまたはRiプラスミドが除去された場合であっても、プラスミド除去用組み換えプラスミドから発現している無毒化タンパク質が働くことで、アグロバクテリアの生育抑制または細胞死が引き起こされる頻度を低下させることができる。
【0034】
トキシン−アンチトキシンシステムを構成する遺伝子としては、例えば、tiorf24−tiorf25および/またはietA−ietS等を挙げることができる。なお、トキシン−アンチトキシンシステムを構成する遺伝子として、アンチトキシン遺伝子のみ(例えば、tiorf24および/またはietA、特にtiorf24およびietA)を持たせることで、最終的に当該プラスミド除去用組み換えプラスミドを脱落させる際の脱落率(%)も高頻度に保つことができる。
【0035】
本実施の形態1に係るプラスミド除去用組み換えプラスミドのさらに好ましい例としては、薬剤耐性遺伝子を有する。薬剤耐性遺伝子を有することによって、その薬剤にて細胞培養することにより、本実施の形態1に係るプラスミド除去用組み換えプラスミドが導入されたアグロバクテリア菌を、導入されなかったアグロバクテリア菌から容易に選別することができる。薬剤耐性遺伝子は、当業者において公知である任意の薬剤耐性遺伝子で構わない。例えば、ゲンタマイシン耐性遺伝子GmR、カナマイシン耐性遺伝子KmRまたはテトラサイクリン耐性TcR等を挙げることができる。また、薬剤耐性遺伝子は、単独または複数組合せて含有させることができる。なお、野生型アグロバクテリア菌は菌株ごとに異なる薬剤耐性を示すため、当該菌株に適当である薬剤耐性遺伝子を使用すればよい。
【0036】
このような本実施の形態1に係るプラスミド除去用組み換えプラスミドの具体例としては、配列表の配列番号1に記載の塩基配列から構成されるpK18msr24、配列番号2に記載の塩基配列から構成されるpK18msrA、および、配列番号3に記載の塩基配列から構成されるpK18msr24Aを挙げることができる。本実施の形態1に係るプラスミド除去用組み換えプラスミドは、配列番号1ないし3のいずれかの塩基配列を含んでいればよい。
【0037】
プラスミド除去用組み換えプラスミドは、配列番号1ないし3のいずれかの塩基配列に相補的な塩基配列を含有している場合でもよい。また、配列番号1ないし3のいずれかの塩基配列、または、配列番号1ないし3のいずれかの塩基配列に相補的な塩基配列に対して80%以上の相同性を有する塩基配列を含有している場合でもよい。相同性に関しては、好ましくは85%以上であり、より好ましくは90%以上であり、さらに好ましくは95%以上である。プラスミド除去用組み換えプラスミドは、配列番号1ないし3のいずれかの塩基配列、または、配列番号1ないし3のいずれかの塩基配列に相補的な塩基配列とストリンジェントな条件下でハイブリダイズする塩基配列を含有している場合でもよい。ここで、ストリンジェントな条件とは、いわゆる特異的なハイブリッドが形成され、非特異的なハイブリッドが形成されない条件をいう。
【0038】
(プラスミドの除去方法)
本発明の実施の形態2は、前述の実施の形態1のプラスミド除去用組み換えプラスミドをアグロバクテリア菌に導入する工程を含む、プラスミドの除去方法に関する。
【0039】
実施の形態1において述べたような遺伝子から構成される、プラスミド除去用組み換えプラスミドは、野生型のアグロバクテリア菌に導入される。導入の方法としては当業者において公知である任意の方法を用いることができる。例えば、当該プラスミド除去用組み換えプラスミドがincP型のoriTまたはincQ型のoriT等の接合起点遺伝子を有する場合、細胞接合による導入方法を用いることができる。当該プラスミド除去用組み換えプラスミドを大腸菌内に作成した場合は、アグロバクテリアとの接合効率が10−2から10−3程度と高いため、細胞接合法が広汎に適用できる。その他、電気的導入方法(エレクトロポレーション法)、または化学的処理によるDNA導入法等の手段を用いることも可能である。当該プラスミド除去用組み換えプラスミドを作成するバクテリアとしては大腸菌以外でも構わない。例えば、ネズミチフス菌等であっても構わない。
【0040】
図2に示したように、前述の実施の形態1に係るプラスミド除去用組み換えプラスミドと、野生型アグロバクテリア菌に元々存在したTiプラスミドとが共存するアグロバクテリア菌は、細胞培養すると、不和合性によって殆どが一方のプラスミドのみを有するアグロバクテリア菌となる。さらに、前述した薬剤耐性遺伝子を利用することによって、Tiプラスミドが除去されたアグロバクテリア菌のみを選別することができる。選別方法については、例えば、オパインによる選別法、サザンハイブリダイゼーション法または電気泳動法等を挙げることができる。これらの方法を用いての選別は、当業者であれば容易に実施可能である(特許文献1参照)。
【0041】
(遺伝子組み換え用アグロバクテリア菌の作成方法)
本発明の実施の形態3は、前述の実施の形態1に係るプラスミド除去用組み換えプラスミドをアグロバクテリア菌に導入することにより、前述の実施の形態2の通りTiプラスミドまたはRiプラスミドを除去し、次いで、当該プラスミド除去用組み換えプラスミドを脱落させる、遺伝子組み換え用アグロバクテリア菌の作成方法に関する。なお、当該アグロバクテリア菌の好ましい例としては、アグロバクテリウム・ツメファシエンス菌、アグロバクテリウム・リゾゲネス菌、アグロバクテリウム・ビティス菌、アグロバクテリウム・ルビー菌またはアグロバクテリウム・ラリームレイ菌等を挙げることができる。
【0042】
TiプラスミドまたはRiプラスミドが除去されたアグロバクテリア菌を選別した後は、当該アグロバクテリア菌に残っている、前述の実施の形態1に係るプラスミド除去用組み換えプラスミドを脱落させる。この際、前述した感受性遺伝子を利用することによって、プラスミド除去用組み換えプラスミドが脱落した遺伝子組み換え用のアグロバクテリア菌を得ることができる。
【0043】
このようにして得られたアグロバクテリア菌株細胞に、外来DNAを持つ別の外来型プラスミドを導入する。プラスミド導入の方法は、当業者において公知の手段を利用すればよい。また、プラスミドが導入されたアグロバクテリアを選別する方法についても、当業者において公知の手段を利用すればよい。例えば、外来型プラスミドとして中間ベクター法による遺伝子組み換えプラスミドを用いることによって、そのまま植物へ感染させて植物の形質転換を行なうことができる。その他の方法としては、後述の実施例5において詳細に説明する。なお、本発明において「遺伝子組み換え用アグロバクテリア菌」とは、TiプラスミドまたはRiプラスミド、および、前述の実施の形態1に係るプラスミド除去用組み換えプラスミドが欠失したアグロバクテリア菌、または、当該TiプラスミドまたはRiプラスミド、および、前述の実施の形態1に係るプラスミド除去用組み換えプラスミドが欠失したアグロバクテリア菌に外来DNAが導入されたアグロバクテリア菌を意味する。
【実施例】
【0044】
以下、実施例を用いて本発明をより詳細に説明するが、実施例は本発明を限定するものではない。
【0045】
(実施例1)
本実施例1では、プラスミド除去用組み換えプラスミドの作成方法に係る実施例について詳細に述べる。
【0046】
本実施例1では、プラスミド除去用組み換えプラスミドとしてpK18msr24、pK18msrAおよびpK18msr24Aを作成した例について詳細に述べる。これらのプラスミド除去用組み換えプラスミドのプラスミド安定遺伝子として、pK18msr24はpTi−SAKURA由来のtiorf24を、pK18msrAはpTiC58由来のietAを、pK18msr24Aはtiorf24およびietAの両方を有するよう作成した。
【0047】
これらのプラスミド除去用組み換えプラスミドの作成は、RP4からのoriTをもつpK18msrを出発材料とした。当該pK18msrのプラスミドは、大腸菌からアグロバクテリア菌だけでなく、グラム陽性およびグラム陰性の両方のバクテリアにも移動可能であるプラスミドである(特許文献1および非特許文献3参照)。
【0048】
当該プラスミド上に存在するsacB遺伝子は、細胞を高濃度のショ糖を含む培地で培養すると、細胞を死滅させる効果がある(Steinmetz M., et al., 1983, Mol. Gen. Genet. Syst. 77, 1-9およびGay P., et al., 1985, J. Bacteriol. 164, 918-921参照)。そのため、遺伝子を欠失した細胞の単離、すなわちカウンター選別に有用である。また、pK18msrは、pTi−SAKURAの複製遺伝子であるrepABC遺伝子を有しており、アグロバクテリア細胞内で多くのTiプラスミドと不和合なプラスミドとして維持される。
【0049】
次に、tiorf24を含むDNA断片(pTi−SAKURA(GenBankアクセッション番号AB016260)の全塩基配列中24,297〜25,118)およびietAを含むDNA断片(pTiC58(GenBankアクセッション番号AE007871)の全塩基配列中97,533〜98,938)を、末端にXbaI切断部位を付加したプライマーを用い、PCRで増幅後、XbaIで消化し、それぞれ前述したpK18msrのXbaI切断部位に挿入した。
【0050】
このように本実施例1に係るプラスミド除去用組み換えプラスミド、pK18msr24およびpK18msrAを作成した。なお、pK18msr24Aについては、pK18msr24のNheI切断部位にietAを含むXbaI切断DNA断片を挿入することによって作成した。図4は、実施例1に係るpK18msr24Aの遺伝子地図を示す図である。これらの実施例1に係るプラスミド除去用組み換えプラスミドを構成するプラスミド、DNA断片(tiorf24、repABC、ietAおよびsacB等)の塩基配列は全て公知であるため、GenBank等のデータベースを用いて前述のプラスミド除去用組み換えプラスミドを作成することは当業者であれば容易である。前述した通り、当該三つのプラスミドの塩基配列を配列表の配列番号1ないし3に示す。
【0051】
(実施例2)
本実施例2では、前述の実施例1のプラスミド除去用組み換えプラスミドの接合導入効率に係る実施例について詳細に説明する。
【0052】
本実施例2では、従来のプラスミド除去用組み換えプラスミドと、本発明に係るプラスミド除去用組み換えプラスミドとの接合導入効率における比較について説明する。従来のプラスミド除去用組み換えプラスミドとしては、pK18msrを用いた。本発明に係るプラスミド除去用組み換えプラスミドとしては、tiorf24−tiorf25およびietA−ietSを含むプラスミドであるpK18SCatと、前述したpK18msr24、pK18msrAまたはpK18msr24Aのプラスミドとを用いた。それぞれこれらのプラスミド除去用組み換えプラスミドを用い、種々のアグロバクテリア菌の菌株におけるTiプラスミド除去操作を行った(Uraji M., et al., 2002, Genes Genet. Syst. 77, 1-9参照)。
【0053】
アグロバクテリア菌の菌株は、MAFF301001、C58、Ch−Ag−10、Pch−Ag−2、Pl−Ag−1、Ch−Ag−2およびPch−Ag−4を使用した。各プラスミド除去用組み換えプラスミドの各アグロバクテリア菌株への導入は、それぞれのプラスミド除去用組み換えプラスミドを有する大腸菌S17−1λpirとの接合によって実施した。接合方法は当該分野にて一般的な方法を用いた(Simon R., et al., 1983, Bio/Technology 1, 784-794参照)。まず、ドナーの大腸菌と受け取り側のアグロバクテリア細胞の細胞密度を1.0OD600となるまで培養し、0.9%(W/V)NaClを用いて洗浄した。
【0054】
次に、アグロバクテリア菌細胞を同量のドナーである大腸菌細胞と混合した後に、LB寒天培地上のナイロン膜フィルター(Amersham社製)に滴下した。その後、28℃で15時間インキュベートし、フィルター上の細胞混合物を0.9%NaClに懸濁し、リファンピシン(終濃度30μg/ml)およびカナマイシン(終濃度50μg/ml)を添加したLB寒天培地上に塗布した。
【0055】
なお、菌株にPch−Ag−2、Pl−Ag−1、Ch−Ag−2、Ch−Ag−10またはPch−Ag−4を用いた際には、細胞の洗浄および懸濁は0.9%NaClの代わりにYMA培地(1%Mannitol、0.4%Yeast extract、0.05%K2HPO4、0.01%NaClおよび0.02%MgSO4)を、LB寒天培地の代わりにYMA寒天培地を用い、選択培地としてはナルジクス酸(終濃度30μg/ml)およびネオマイシン(終濃度50μg/ml)を添加したYMA寒天培地を使用した。その後、三日間の培養で生じたコロニー(接合体)を数え、実験に用いた細胞数当たりの比率(接合効率)として計算した。
【0056】
図5は、実施例2に係るプラスミド除去用組み換えプラスミドのプラスミド安定化遺伝子の様子を示す図である。図6は、実施例2に係るプラスミド除去用組み換えプラスミドの導入による各種アグロバクテリア菌株の接合効率を示す図である。図5において、+は該安定化遺伝子が該プラスミド除去用組み換えプラスミド上に存在していることを示し、−は該安定化遺伝子が該プラスミド除去用組み換えプラスミド上に存在していないことを示す。図6において、ntは未実施であることを示している。
【0057】
図6に示すように、従来のプラスミド除去用組み換えプラスミド(pK18msr)と比較すると、特に、pK18msr24Aが大半のアグロバクテリア菌株において高い接合導入効率(Transconjugant efficiency)を示していた。
【0058】
(実施例3)
本実施例3では、従来のプラスミド除去用組み換えプラスミドと、前述の実施例1のプラスミド除去用組み換えプラスミドとを比較した際の、Tiプラスミド除去効率に係る実施例について詳細に説明する。
【0059】
前述の実施例2における接合体細胞の中に、Tiプラスミドが存在するか否かを試験した。Tiプラスミドのvir領域は菌株間で高度に保存されているため、virC増幅プライマー(VCF3およびVCR3(塩基配列を配列番号4および5に示す))を用いるPCRによって、多くのアグロバクテリア菌の菌株が持つTiプラスミドは高感度に検出できる。すなわち、接合体細胞のゲノムDNAをテンプレートとし、配列番号4および5に示されるvirC増幅プライマーを用いてPCRを行った場合、Tiプラスミドを有している細胞でのみ約400bpのDNA断片の増幅が見られる。
【0060】
まず、このような方法によって各プラスミド除去用組み換えプラスミドによる接合体細胞のTiプラスミドの有無を確認し、Tiプラスミド除去率として算出した。図7は、実施例3に係るプラスミド除去用組み換えプラスミドの導入による各種アグロバクテリア菌株のTiプラスミド除去率を示す図である。図6と同様に、ntは未実施を示す。
【0061】
従来のプラスミド除去用組み換えプラスミドであるpK18msrと比較すると、本発明に係るpK18SCatおよびpK18msr24Aを導入した接合体細胞で、大半のアグロバクテリア菌の菌株においてTi除去率(%)が大きく上昇していた。他の本発明に係るプラスミド除去用組み換えプラスミドに関しては、pK18msr24についてはMAFF301001接合体において、pK18msrAについてはC58接合体において、pK18msrよりも高いTi除去率(%)を示した。さらには、Ch−Ag−10、Pl−Ag−1およびPch−Ag−2については従来のプラスミド除去用組み換えプラスミドではTiプラスミドが除去された細胞は殆ど得られなかったが、本実施例3において実施したpK18SCatおよびpK18msr24Aでは、特に効率よく種々のTiプラスミド除去株を得ることができていた。
【0062】
(実施例4)
本実施例4では、従来のプラスミド除去用組み換えプラスミドと、前述の実施例1のプラスミド除去用組み換えプラスミドとを比較した際の、sacBカウンター選別によるプラスミド除去用組み換えプラスミドの脱落率に係る実施例について詳細に説明する。
【0063】
前述の実施例3のTiプラスミド除去接合体細胞は、Tiプラスミドの代わりにプラスミド除去用組み換えプラスミドを含んでいる状態である。アグロバクテリア細胞を活用するには、プラスミド除去用組み換えプラスミドを除去する必要がある。図4に示したように、pK18msr24Aはホスト細胞をショ糖高感受性にするsacB遺伝子を有している。図示していないが、他の実施例1にて述べた本発明に係るプラスミド除去用組み換えプラスミドにも同様にsacB遺伝子を持たせた。
【0064】
前述した実施例3のTiプラスミド脱落菌株を0.9%NaClで希釈後、ショ糖を添加したLB寒天培地(終濃度5%)に塗布し、2、3日培養後、コロニーを出現させた。出現したコロニーを、カナマイシン(終濃度50μg/ml)を加えたLB寒天培地に移植後、28℃で2、3日培養し、生育の有無を観察した。Ch−Ag−10、Pch−Ag−2、Ch−Ag−2、Pch−Ag−4およびPl−Ag−1由来の接合体細胞に関しては、Tiプラスミド脱落菌株の希釈には0.9%NaClの代わりにYMA培地を用い、塗布および移植にはLB寒天培地の代わりにYMA寒天培地を用い、カナマイシンの代わりにネオマイシン(終濃度50μg/ml)を用いた。
【0065】
このように培養を行った結果、カナマイシンあるいはネオマイシン添加固体培地上で生育しないものをプラスミド除去用組み換えプラスミドを失った細胞と判断した。図8は、実施例4に係るsacBカウンター選別による各種アグロバクテリア菌株のプラスミド除去用組み換えプラスミド脱落率を示す図である。図6および図7と同様に、ntは未実施を示す。
【0066】
図8に示すように、安定化遺伝子全て(tiorf24、tiorf25、ietAおよびietS)を有しているプラスミド除去用組み換えプラスミドでは、MAFF301001およびC58で約30%、その他の菌株ではほぼ0%の脱落率となっていた。すなわち、前述のTiプラスミド除去率の結果では、従来のプラスミド(pK18msr)よりも優れていたが、本実施例4に係る脱落率では、従来のプラスミドには劣る結果となり、少々扱い難い点を有することも示唆される。その一方で、pK18msr24Aについては全ての菌株において極めて効率よく、プラスミド除去用組み換えプラスミドを脱落させた細胞を得ることができた。
【0067】
(実施例5)
本実施例5では、Tiプラスミドを除去し、プラスミド除去用組み換えプラスミドを脱落させたアグロバクテリア細胞菌株のその後の操作に係る実施例について詳細に説明する。
【0068】
なお、本実施例5に係る実験操作は、従来のプラスミド除去用組み換えプラスミドを用いて作成したアグロバクテリア細胞菌株を用いて操作する場合と、本発明に係るプラスミド除去用組み換えプラスミドを用いて作成したアグロバクテリア細胞菌株を用いて操作する場合と同様である。アグロバクテリア菌のC58では従来のプラスミド除去用組み換えプラスミドpK18msrを用い、Pch−Ag−2では本発明に係るプラスミド除去用組み換えプラスミドpK18msr24Aを用い、前述の実施例3および実施例4の方法にてプラスミド脱落アグロバクテリア菌株を作成した。
【0069】
当該アグロバクテリア菌株に、無毒化TiプラスミドpTi−SAKURA−Sを大腸菌S17−1λpirを介し、導入した。無毒化TiプラスミドpTi−SAKURA−Sは、pTi−SAKURAのT−DNA領域を削除し、代わりに大腸菌において働く複製起点oriVpSC101、ゲンタマイシン耐性遺伝子GmR、アンピシリン耐性遺伝子AmpRおよび転移起点oriTを持たせた無毒化Tiプラスミドである(非特許文献1参照)。
【0070】
次いで、無毒化TiプラスミドpTi−SAKURA−Sを導入したアグロバクテリアC58およびPch−Ag−2に、バイナリープラスミドpBINGIを大腸菌S17−1λpirを介して導入した。バイナリープラスミドpBINGIは、T−DNA領域(LBとRBに挟まれた領域)に、レポーター遺伝子intron−GUSおよびカナマイシン耐性遺伝子nptIIを持つ(非特許文献1参照)。
【0071】
このように作成した、無毒化Tiプラスミドとバイナリープラスミドとを持つアグロバクテリアC58およびPch−Ag−2は、腫瘍または毛状根等の病気を引き起こすこと無く植物または菌類へ、遺伝子導入をすることが可能である。図9は、実施例5に係る無毒化Tiプラスミドおよびバイナリープラスミドを持つアグロバクテリア菌株の作成方法を示す図である。なお、本実施例5では、カナマイシン耐性遺伝子nptIIを使用しているため、カナマイシンを含む植物用培地を利用することで遺伝子が導入された植物細胞のみを選択的に生育させることが可能である。また、レポーター遺伝子intron−GUSは、β−グルクロニダーゼをコードしている。これは、実施例6にて後述するが、形質転換操作を行った植物組織に含まれる当該タンパク質の活性(GUS活性)を測定することにより、遺伝子導入の効率を評価するためである。
【0072】
(実施例6)
本実施例6では、従来使用されていたアグロバクテリア菌株と、本発明での方法によって作出されたアグロバクテリア菌株との形質転換効率の比較に係る実施例について詳細に説明する。
【0073】
比較した菌株はいずれも無毒化TiプラスミドpTi−SAKURA−SとバイナリープラスミドpBINGIとを持つアグロバクテリア菌株であるということは同様であるが、当該アグロバクテリア菌株の作成方法(使用したプラスミド除去用組み換えプラスミド)が異なる。遺伝子導入のためのアグロバクテリア菌株は、それぞれ前述の実施例5の菌株と同様である。形質転換効率は、大根(Raphanus sativus L. cv. Aonosachi)の外植片を以て比較した。
【0074】
まず、無菌処理を施した大根の種子を発芽させ、その子葉、胚軸をそれぞれのアグロバクテリア菌液(0.4OD660)に5分間浸漬した。その後、植物ホルモン(3μg/mlナフタレン酢酸および4μg/mlベンジルアデニン)を含むMS固体培地に移し、22℃において3日間照明下で共存培養した。次いで、形質転換細胞を選択的に生育させるため、セフォタキシム200μg/mlおよびカナマイシン25μg/mlを加えた前述と同様のMS固体培地上に移し、22℃において2週間照明下で培養した。その後、培地上の植物細胞を回収し、タンパク質を抽出後、GUS活性を測定し、形質転換効率を評価した。なお、GUS活性評価方法の詳細については、Jefferson R. A. et al., 1987, EMBO J. 6, 3901-3907を参照されたい。
【0075】
図10は、実施例6に係る大根に対する形質転換効率の比較を示す図である。図10に示すように、本発明に係るプラスミド除去用組み換えプラスミドを利用し作成した遺伝子組み換え用アグロバクテリアPch−Ag−2では、従来のものを利用し作成した遺伝子組み換え用アグロバクテリアC58よりも、約1.7倍高い形質転換効率を示していた。
【0076】
本発明は、上記発明の実施の形態および実施例の説明に何ら限定されるものではない。特許請求の範囲の記載を逸脱せず、当業者が容易に想到できる範囲で種々の変形態様もこの発明に含まれる。
【0077】
本明細書の中で明示した論文および公開特許公報等の内容は、その全ての内容を援用によって引用することとする。
【産業上の利用可能性】
【0078】
本発明者らは鋭意研究を行い、従来のプラスミド除去用組み換えプラスミドよりもアグロバクテリア菌内から高頻度でTiプラスミドまたはRiプラスミドを除去し、かつ用いたプラスミドを高頻度で脱落させることができる、新規なプラスミドを作成した。具体的には、トキシン−アンチトキシン遺伝子の安定化効果を無効化し、アグロバクテリア菌内のTiプラスミドまたはRiプラスミドを着実かつ容易な方法で脱落させることが可能なプラスミド除去用組み換えプラスミドを作成した。
【0079】
すなわち、本発明によれば、アグロバクテリア菌内のTiプラスミドまたはRiプラスミドの除去効率が高く、かつ生育抑制または細胞死に至ることが少ないプラスミド除去用組み換えプラスミド、プラスミドの除去方法、および、当該プラスミド除去用組み換えプラスミドを利用する遺伝子組み換え用アグロバクテリア菌の作成方法が提供される。詳細には、今まで植物の形質転換に活用することができなかった極めて安定なTiプラスミドを持つアグロバクテリア病原株を、形質転換に活用できる形に改変することが可能となり、さらには、その菌株のもつ特性が染色体側にあるのかプラスミド側にあるのかを判別することも可能となる。このように改変された菌株は、加工したTiプラスミドあるいはRiプラスミドを容易に導入可能な有用形質となる。
【特許請求の範囲】
【請求項1】
野生型アグロバクテリア菌が持つ複製遺伝子と不和合性を示す複製遺伝子と、プラスミド安定化遺伝子と、感受性遺伝子とを含有することを特徴とする、プラスミド除去用組み換えプラスミド。
【請求項2】
前記プラスミド安定化遺伝子は、トキシン−アンチトキシンシステムを構成する遺伝子であることを特徴とする、請求項1に記載のプラスミド除去用組み換えプラスミド。
【請求項3】
前記トキシン−アンチトキシンシステムを構成する遺伝子は、tiorf24、および/または、ietAであることを特徴とする、請求項2に記載のプラスミド除去用組み換えプラスミド。
【請求項4】
さらに、薬剤耐性遺伝子を有することを特徴とする、請求項1ないし3のいずれか1項に記載のプラスミド除去用組み換えプラスミド。
【請求項5】
以下(a)ないし(d)のいずれかの塩基配列を含有することを特徴とする、請求項1ないし4のいずれか1項に記載のプラスミド除去用組み換えプラスミド。
(a)配列番号1ないし3のいずれかに記載の塩基配列。
(b)配列番号1ないし3のいずれかに記載の塩基配列に相補的な塩基配列。
(c)配列番号1ないし3のいずれかに記載の塩基配列、または、配列番号1ないし3のいずれかに記載の塩基配列に相補的な塩基配列に対して80%以上の相同性を有する塩基配列。
(d)配列番号1ないし3のいずれかに記載の塩基配列、または、配列番号1ないし3のいずれかに記載の塩基配列に相補的な塩基配列とストリンジェントな条件下でハイブリダイズする塩基配列。
【請求項6】
請求項1ないし5のいずれか1項に記載のプラスミド除去用組み換えプラスミドを、アグロバクテリア菌に導入する工程を含むことを特徴とする、プラスミドの除去方法。
【請求項7】
請求項1ないし5のいずれか1項に記載のプラスミド除去用組み換えプラスミドを、アグロバクテリア菌に導入する工程と、
前記プラスミド除去用組み換えプラスミドを前記アグロバクテリア菌から脱落させる工程と、
を含むことを特徴とする、遺伝子組み換え用アグロバクテリア菌の作成方法。
【請求項8】
前記アグロバクテリア菌は、アグロバクテリウム・ツメファシエンス菌、アグロバクテリウム・リゾゲネス菌、アグロバクテリウム・ビティス菌、アグロバクテリウム・ルビー菌またはアグロバクテリウム・ラリームレイ菌のいずれかであることを特徴とする、請求項7に記載の遺伝子組み換え用アグロバクテリア菌の作成方法。
【請求項1】
野生型アグロバクテリア菌が持つ複製遺伝子と不和合性を示す複製遺伝子と、プラスミド安定化遺伝子と、感受性遺伝子とを含有することを特徴とする、プラスミド除去用組み換えプラスミド。
【請求項2】
前記プラスミド安定化遺伝子は、トキシン−アンチトキシンシステムを構成する遺伝子であることを特徴とする、請求項1に記載のプラスミド除去用組み換えプラスミド。
【請求項3】
前記トキシン−アンチトキシンシステムを構成する遺伝子は、tiorf24、および/または、ietAであることを特徴とする、請求項2に記載のプラスミド除去用組み換えプラスミド。
【請求項4】
さらに、薬剤耐性遺伝子を有することを特徴とする、請求項1ないし3のいずれか1項に記載のプラスミド除去用組み換えプラスミド。
【請求項5】
以下(a)ないし(d)のいずれかの塩基配列を含有することを特徴とする、請求項1ないし4のいずれか1項に記載のプラスミド除去用組み換えプラスミド。
(a)配列番号1ないし3のいずれかに記載の塩基配列。
(b)配列番号1ないし3のいずれかに記載の塩基配列に相補的な塩基配列。
(c)配列番号1ないし3のいずれかに記載の塩基配列、または、配列番号1ないし3のいずれかに記載の塩基配列に相補的な塩基配列に対して80%以上の相同性を有する塩基配列。
(d)配列番号1ないし3のいずれかに記載の塩基配列、または、配列番号1ないし3のいずれかに記載の塩基配列に相補的な塩基配列とストリンジェントな条件下でハイブリダイズする塩基配列。
【請求項6】
請求項1ないし5のいずれか1項に記載のプラスミド除去用組み換えプラスミドを、アグロバクテリア菌に導入する工程を含むことを特徴とする、プラスミドの除去方法。
【請求項7】
請求項1ないし5のいずれか1項に記載のプラスミド除去用組み換えプラスミドを、アグロバクテリア菌に導入する工程と、
前記プラスミド除去用組み換えプラスミドを前記アグロバクテリア菌から脱落させる工程と、
を含むことを特徴とする、遺伝子組み換え用アグロバクテリア菌の作成方法。
【請求項8】
前記アグロバクテリア菌は、アグロバクテリウム・ツメファシエンス菌、アグロバクテリウム・リゾゲネス菌、アグロバクテリウム・ビティス菌、アグロバクテリウム・ルビー菌またはアグロバクテリウム・ラリームレイ菌のいずれかであることを特徴とする、請求項7に記載の遺伝子組み換え用アグロバクテリア菌の作成方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【公開番号】特開2013−17442(P2013−17442A)
【公開日】平成25年1月31日(2013.1.31)
【国際特許分類】
【出願番号】特願2011−155056(P2011−155056)
【出願日】平成23年7月13日(2011.7.13)
【出願人】(504136568)国立大学法人広島大学 (924)
【Fターム(参考)】
【公開日】平成25年1月31日(2013.1.31)
【国際特許分類】
【出願日】平成23年7月13日(2011.7.13)
【出願人】(504136568)国立大学法人広島大学 (924)
【Fターム(参考)】
[ Back to top ]

