プラスミドDNA抽出プロセス
pDNAを細胞から抽出するためのプロセスを提供する。1つの側面において、該プロセスは、細胞を含む液体を、10秒未満の時間に渡って、95℃〜約120℃の平均温度に加熱する工程を含む。特定の好ましい側面において、pDNAは、フロースルー装置の使用によって抽出される。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、プラスミドDNA(pDNA)を細胞から抽出するためのプロセスに関する。
【背景技術】
【0002】
微生物発酵からpDNAを単離するための多くの技術は、小規模または実験室規模のプラスミド調製に適しているにすぎない。1つの一般的に使用される方法は、エチジウムブロミドの存在下で、CsClを用いた等密度遠心分離を含む。該方法は、高価でそして有害な試薬を使用しており、これは療法目的のためのpDNAの製造には不適当である。さらに、エチジウムブロミドはpDNAを損傷しうる。該方法は、多くの他の不都合な点も有するため、大規模pDNA製造に不適当なものとなっている。
【0003】
HolmesおよびQuigley(1981, Analytical Biochem., 114, pp 193−197)は、プラスミドDNAを細菌から単離し、そして精製するためのプロセスであって、約100℃で20〜40秒間沸騰させる工程を含む、前記プロセスを開示する。関連する開示であるUS4,830,969において、10秒から約3分間の接触時間に関して、60〜105℃の温度が開示される。この技術は、大規模pDNA製造には不適当である。
【0004】
US2002/0001829は、修飾STET緩衝液中に微生物細胞を懸濁し、そして懸濁物をフロースルー熱交換装置中で70〜100℃に加熱する、pDNAの単離法であって、70〜77℃の温度が好ましい、前記方法を開示する。多くの適用に好ましいpDNA型である、スーパーコイル型pDNAのレベルは、93℃を越える温度で減少すると解説されている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】US4,830,969
【特許文献2】US2002/0001829
【非特許文献】
【0006】
【非特許文献1】HolmesおよびQuigley(1981, Analytical Biochem., 114, pp.193−197)
【発明の概要】
【0007】
本発明の特定の態様にしたがって、pDNAを細胞から抽出するためのプロセスであって、細胞を含む液体を、10秒未満の時間に渡って、95℃〜約120℃の平均温度に加熱する工程を含む、前記プロセスを提供する。
【0008】
本発明のさらなる態様にしたがって、pDNAを細胞から抽出するためのプロセスであって、細胞を含む液体をフロースルー装置中で95℃またはそれより高い温度に加熱する工程を含む、但し、液体が、5秒より長い時間に渡って、120℃より高い平均温度に加熱されない、前記プロセスを提供する。
【図面の簡単な説明】
【0009】
【図1】図1は比較例に記載するように設定した熱処理装置の模式図である。
【図2】図2はアガロースゲル電気泳動分析の結果を示す図である。
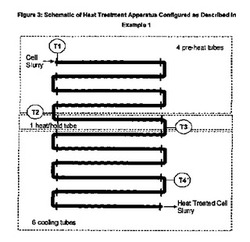
【図3】図3は実施例1に記載するように設定した熱処理装置の模式図である。
【図4】図4はアガロースゲル電気泳動分析の結果を示す図である。
【発明を実施するための形態】
【0010】
本発明のプロセスによって抽出可能なpDNAは、複数の型、例えばスーパーコイル型、直鎖および開環(すなわちニックが入ったかまたは弛緩した)アイソフォームの1またはそれより多くで産生されてもよい。スーパーコイル型pDNAアイソフォームは、共有結合的閉環型を有し、そしてpDNAは宿主酵素系の作用によって、宿主細胞において負のスーパーコイル状である。開環アイソフォームにおいて、pDNA二重鎖の一方の鎖は、1またはそれより多い箇所で破壊される。多くのプラスミド適用のため、スーパーコイル型アイソフォームが最も好ましく、そして直鎖および開環アイソフォームから好適に分離される。遺伝子移入、例えばin vitro DNA形質転換またはin vivo遺伝子療法のためのプラスミドは、スーパーコイル型プラスミド・アイソフォームが高い割合であり、そして開環アイソフォームが低い割合であることを必要とする可能性もある。したがって、非常に精製されたスーパーコイル型プラスミドDNAを得ることに関する商業的必要性は非常に高い。開環プラスミド・アイソフォームをスーパーコイル型アイソフォームに変換する方法が当該技術分野に知られる。例えば、US20060057683は、これが酵素的に達成されるプロセスを開示する。したがって、特定の態様において、本発明を用いた抽出後、当該技術分野で確立された方法を用いて、開環アイソフォームのpDNAをスーパーコイル型アイソフォームに変換する。
【0011】
本発明のプロセスによって抽出されるpDNAは、一般的に、宿主細胞の増殖および採取によって産生され、そして好ましくは組換え微生物の微生物発酵による。最も好ましい宿主細胞は大腸菌(E. coli)であるが、多くの他のタイプの細胞がプラスミドを所持することが知られる。これには、他の細菌、酵母およびより高次の真核細胞が含まれる。例には、酵母、サッカロミセス・セレビシエ(Saccharomyces cerevisiae)およびクロイベロミセス・ラクティス(Kluyveromyces lactis)、糸状菌、例えばアカパンカビ属(Neurospora)種および藻類、クラミドモナス属(Chamydomomas)が含まれる。
【0012】
pDNAの産生法は当該技術分野に周知である。pDNAは天然または人工、例えば外来(foreign)DNA挿入物を所持するクローニングベクターであってもよい。多くの態様において、pDNAは、1キロ塩基〜50キロ塩基のサイズ範囲である。例えば、発現される干渉RNAをコードするpDNAは、典型的には、3キロ塩基〜4キロ塩基のサイズ範囲である。
【0013】
本発明のプロセスで使用可能な細胞を含む液体には、細胞が増殖されてきた培養ブロスが含まれる。多くの態様において、液体は、細胞を培養ブロスから採取し、そして次いで、細胞を好ましくは水性緩衝溶液中に再懸濁することによって調製される、細胞の懸濁物である。細胞は、当該技術分野に周知の方法、例えば遠心分離または精密ろ過によって採取される。
【0014】
細胞の再懸濁を使用する場合、細胞は、好ましくは、通常は4〜10の範囲のpH、そして好ましくはほぼ中性pH、例えば7〜9のpHを持つ、水性緩衝液中に再懸濁される。緩衝塩濃度は、一般的に、10〜100mMの範囲、例えば20〜80mMの範囲である。特定の態様において、特定の適切な緩衝液は、pH8の50mM Tris HClである。緩衝液は、溶液中の金属イオンを維持し、そして細胞壁陽イオン、例えばカルシウムを可溶化するため、EDTAなどのキレート剤を含有してもよい。懸濁緩衝液はまた、通常、2〜15%w/w、好ましくは5〜10%w/wの範囲のポリオール、例えばスクロース;通常、1〜5%w/w、好ましくは1〜3%w/wの範囲の界面活性剤、例えばTritonTMX−100;および/または0.5〜8M、好ましくは1〜3Mの範囲の濃度のカオトロープ、例えば尿素などの、pDNA遊離を補助する他の化合物も含有してもよい。
【0015】
細胞を含む液体が培養ブロスである場合、pHを4〜10の範囲のpHに、そして好ましくはほぼ中性pHに、例えば7〜9に調整してもよい。望ましい場合、細胞懸濁のため、上述のようなpDNA遊離を補助するため、キレート剤および他の化合物を使用してもよい。
【0016】
本発明のプロセスは、pDNA抽出を達成するために、細胞壁溶解酵素、例えばリゾチームの使用を必要としないが、望ましい場合、こうした酵素を使用してもよい。
本発明のプロセスは、小規模、中規模または大規模で産生されるpDNAのプロセシングに適している。小規模は、典型的には、通常、振盪フラスコを使用する、最大2リットルまでの規模と見なされる。中規模は、典型的には、2リットルから500リットルの規模と見なされる。大規模は、典型的には、500リットルより大きい、例えば最大100,000リットル、例えば1000リットル〜10,000リットルの規模と見なされる。
【0017】
本発明のプロセスにおいて、初期温度、つまり実行される産生プロセスの正確な性質に応じて、最も一般的には、液体が有意な期間、例えば1時間から最大少なくとも数日に渡って安定である温度から、95℃またはそれより高く、細胞を含む液体を加熱するが、95℃より高い温度が好ましい。いくつかの態様において、例えば、液体が、細胞を増殖させてきた培養ブロスを含む場合、初期温度は、30〜45℃、例えば約35〜38℃の範囲である。他の態様において、初期温度は、例えば液体が培養ブロスの形でまたは細胞の再懸濁物としてのいずれかで冷却されてきた場合、約2〜約10℃の範囲である。多くの態様において、初期温度は、2〜30℃の範囲であり、そしてしばしば、周囲温度、例えば15〜25℃である。加熱は、最も好ましくは迅速に達成され、例えば、10秒未満、特に5秒未満の期間に渡る。液体を望ましい期間に渡って望ましい範囲の温度で維持した後、通常は液体が安定である温度、そして好ましくは10〜45℃の範囲の温度に液体を冷却する。冷却は、好ましくは迅速に達成され、例えば最長40秒の期間に渡る。特定の態様において、液体は20秒またはそれ未満で、例えば10〜15秒間で、70℃未満の温度に冷却される。
【0018】
多くの態様において、液体は、2〜6秒間、95℃より高く、そして最大110℃、好ましくは96℃〜110℃、特に100℃〜109℃の温度で維持される。他の態様において、液体は、1〜3秒間、115℃〜120℃の温度で維持される。さらにさらなる態様において、液体は、0.5〜1.5秒間、120℃〜130℃の温度で維持される。
【0019】
本発明のプロセスが、フロースルー装置を用いて実行されることが特に好ましい。こうした装置は、一般的に、液体を初期温度から95℃より高い温度に加熱する加熱ゾーン、液体を望ましい期間に渡って望ましい温度で保持する保持ゾーン、および液体を望ましい温度に冷却する冷却ゾーンを含む。最も好ましくは、望ましい状態を提供するように、チューブに適用する温度および液体流速を調整しつつ、加熱、保持および冷却ゾーンを通過するチューブを通じて、液体を流動させる。特定の好ましい態様において、チューブは、液体の加熱および冷却の均一性を改善するため、混合要素、例えば静的混合要素を取り込む。
【0020】
本発明のプロセスを実行するのに適したフロースルー装置、特に熱交換装置が当該技術分野に周知である。例には、UHT殺菌業で一般的に使用される高温短時間熱交換器、および連続培地滅菌装置が含まれる。商業的に入手可能な装置には、Armfield FT74X UHT/HTST系およびArmfield FT94X UHT/HTSTミニパイロット系(Armfield Ltd、英国リングウッド)が含まれる。より大規模な装置は、例えばSchmidt SigmaTherm系(API Heat Transfer、米国ニューヨーク州バッファロー)、IPEC(米国ウィスコンシン州)およびGEA Process Engineering Inc(米国メリーランド州コロンビア)より入手可能である。本発明で使用するのに適した装置を、容易に修飾するかまたは個々に設計して、そして特定のプロセシング必要性にマッチする、例えば発酵体積および入手可能な発酵ブロスをプロセシングするのに利用可能な遠心分離能力にマッチするように構築可能であることが、当業者には明らかであろう。
【0021】
本発明のプロセスによって抽出されているpDNAは、一般的に、当該技術分野に知られる方法によって精製され、そして単離される。こうした方法の例には、遠心分離、ろ過、クロマトグラフィー、ディアフィルトレーション、CTABの添加などのまたはLanderら US6797476に記載されるような沈殿、およびHubbunchら, Biotechnol Appl Biochem.(2005)42 pp57−66に記載されるような二相水性抽出が含まれる。
【0022】
巨大な細胞破片、タンパク質および大部分のゲノムDNAは、通常、遠心分離によって除去される。RNアーゼを用いた場合による処理を使用してもよく、そしてpDNAをろ過して、例えば0.45ミクロン・フィルターを通じたろ過で、小さい破片をさらに取り除いてもよい。
【0023】
pDNAのサイズにしたがって選択される分子量カットオフを有する限外ろ過膜を通常用いて、さらなる不純物をディアフィルトレーションによって除去してもよい。
使用可能なクロマトグラフィー法には、荷電膜クロマトグラフィー(例えばEndresら, Biotechnol Appl Biochem.(2003)37 pp259−66に記載されるようなもの)、モノリス・クロマトグラフィー(例えばStancarら, Adv Biochem Eng Biotechnol.(2002)76: pp49−85に記載されるようなもの)、陰イオン交換クロマトグラフィーおよび逆相クロマトグラフィーが含まれる。多くの態様において、陰イオン交換法および逆相法が使用される。遠心分離、ろ過およびディアフィルトレーション工程の少なくとも1つ、そして好ましくは各々が、クロマトグラフィー前に使用されることが好ましい。適切な陰イオン交換マトリックスの例には、POROS陰イオン交換樹脂、Qiagen、Toso Haas、Sterogene、Spherodex、Nucleopac、およびGE Healthcareより入手可能なものが含まれる。適切な逆相マトリックスの例には、POROS、Polymer Labs、Toso Haas、GE Healthcare、PQ Corp.、Zorbax、BioSepra樹脂、BioSepra Hyper D樹脂、BioSepra Q−Hyper D樹脂およびAmiconより入手可能なものが含まれる。好ましくは、陰イオン交換クロマトグラフィーが逆相クロマトグラフィーに先行する。
【0024】
精製pDNAを濃縮し、そして/またはディアフィルトレーションして、体積を減少させるかまたは緩衝液を交換してもよく、例えばpDNAを薬学的に許容されうるキャリアーまたは緩衝溶液内に移して、場合によってその後、滅菌してもよい。薬学的に許容されうるキャリアーまたは緩衝溶液の例が、当該技術分野に知られる。pDNAの濃縮に適した方法が当該技術分野に周知であり、そしてこれには、ディアフィルトレーション、アルコール沈殿および凍結乾燥が含まれ、ディアフィルトレーションが好ましい。pDNAの有用性に影響を及ぼさない滅菌法が当該技術分野に周知であり、例えば小さい孔サイズ、例えば0.2ミクロンおよびそれより小さい孔サイズを有する膜の通過による滅菌がある。
【0025】
本発明は、以下の実施例によって、限定されることなく例示される。
【実施例】
【0026】
株調製
IgG−Fcタンパク質の遺伝子配列をpCMV−Script(Stratageneカタログ212220)内にクローニングした。制限消化によって5.7kb組換えプラスミドを含有する組換えクローンを同定し、そして配列決定によって確認した。エレクトロポレーションを用いて1つのプラスミドクローンを大腸菌宿主株XL−1 Blue MR(Stratagene、カタログ200229)内に形質転換して、組換え大腸菌株を生成した。CLD327と命名した組換え株を精製し、そしてグリセロールストック中、−80℃で維持した。
【0027】
比較例
グリセロールおよび酵母エキスを補充した最小塩発酵基本培地を用いて、CLD327を用いたバッチ発酵(15L)を30℃およびpH7.0で行った。溶解酸素のセットポイントは飽和の30%であり、そして発酵装置攪拌速度を自動的に調整することによって、これを調節した。細胞増殖(OD600)を測定するため、発酵を通じて試料を採取した。OD600が〜30単位に到達するまで(グリセロール枯渇前)、発酵を続けた。発酵装置培養の試料を採取し、遠心分離して上清から細胞ペレットを分離し、そして細胞ペレットを−20℃で凍結保存した。次いで、発酵装置容器内容物を〜10℃に冷却し、そして1L密封可能遠心瓶に移し、そして8〜12℃でバッチ遠心分離によって細胞を収集した。冷(2〜8℃)緩衝液(50mM Tris、10mM EDTA、pH8.0)を用いて、回収した細胞ペレットを12Lの体積まで再懸濁した。細胞再懸濁物を8〜10℃の温度で攪拌して、細胞を完全に再懸濁し(OD600=23単位)、そして生じる細胞スラリーが均一であることを確実にした。
【0028】
パイロット規模の高温短時間(HTST)プロセシング系(Armfield FT74−20−MkIIIチューブ状熱交換器UHT/HTST系、Armfield Ltd、英国リングウッド)を用いて、熱処理を行った。該系は、用いる熱交換器チューブの数を調整することによって、加熱前、加熱/保持および冷却(滞留(resitdence))時間を設定可能にする。産物(細胞スラリー)流速を変化させることによって、そして使用する加熱前、加熱/保持および冷却チューブの数を再設定することによって、広範囲の滞留時間が達成可能である。製造者のプロトコルにしたがって使用する前に、Armfield FT74−20−MkIIIチューブ状熱交換器系を設定し、そして清浄にした。この例で用いるチューブ状熱交換器は、二重同心円の316ステンレス鋼チューブ(チューブ直径8.1mm(産物側)、全体直径15.8mm、各チューブ・セクション長0.4m、15バール(最大)作業圧)の多数のセクションを、静的ミキサー(Armfield FT74−21)とともに含んだ。産物(細胞スラリー)は中央を流れる一方、加熱または冷却水は、外部チューブを流れる。該系は、細胞スラリーを迅速に所望の入口温度にするため、4つの「加熱前チューブ」(長さ各0.4m)を伴って設定された。これらのチューブの後に、細胞スラリーを必要な保持温度まで上げる、2つの「加熱/保持チューブ」(長さ各0.4m)が続いた。熱交換器の加熱前および保持チューブに供給される加圧加熱水の温度を自動的に調整することによって、所望の保持温度プロファイルを調節した。熱処理装置を通る細胞スラリー流速を手動で調整することによって、保持/滞留時間を変化させた。次いで、細胞スラリーを6つの冷却チューブ(長さ各0.4m)に通過させ、ここでスラリーを迅速に冷却した後、熱処理プロセシング状態各々から、熱処理した細胞スラリー産物を収集した。冷却水を熱交換器の冷却チューブに提供した。温度センサー/モニターは、熱処理装置への産物入口(T1)、加熱前の出口/加熱/保持チューブの入口(T2)および加熱/保持チューブの出口(T3)および第四の冷却チューブの出口(T4)に位置した。センサーT2からのアウトプットを用いて、熱交換器の加熱前および保持チューブに供給される温水の流動および温度を調節した。各熱処理「条件」(表1に記載する)に関して、調べている熱処理条件を代表する熱処理物質を収集する前に、少なくとも2体積の細胞スラリーで系をフラッシュした。系から収集した熱処理物質の温度は、15〜20℃の間であり、すなわち冷却チューブに供給するために用いた冷却水の温度に近かった。当業者には、必要な場合に、熱交換器に供給される冷却水温度をどのように減少させると、熱処理物質の出口温度がさらに減少するかが明らかであろう。各熱処理プロセシング条件から試料を採取し、遠心分離して、細胞破片から上清を分離し、そして抽出されたpDNAを含有する上清を、後に分析するため、−20℃で凍結保存した。図1は、この実施例で用いられるように設定された熱処理装置のレイアウト図を提供する。用いた細胞スラリー流速、滞留時間および熱処理温度を表1に提供する。総パイプ体積(ベンドを含む)、および製造者(Armfield)によって提供されるデータを用いて、静的ミキサーによる置換を考慮することによって、滞留時間を概算した。
【0029】
表1:流速、滞留時間および熱処理温度
【0030】
【表1】

【0031】
細胞ペレット試料(熱処理前の発酵採取物由来の細胞)および清澄化上清試料(熱処理後)を融解し、そしてスーパーコイル型pDNAに関して分析した。製造者のプロトコルにしたがって、プラスミド調製キット(Qiagenカタログ番号12123)を用いて、発酵装置採取試料から、プラスミドDNAを抽出して、陽性対照を提供した。次いで、エチジウムブロミドを用いて視覚化した1%アガロースゲルを用いたゲル電気泳動を用いて、pDNA陽性対照試料および熱処理後に収集した上清試料を分析した。未希釈および希釈(1/5)の両方で、アガロースゲル上で上清試料を泳動した。結果を図2に示す。
【0032】
結果によって、熱処理条件A、B、CおよびDの後にDNAが回収されたが、回収されたDNAは損なわれていない(intact)ものではなかったことが明らかになる。DNAは、異なるサイズの断片のスメアとして泳動される(レーン3〜6)。DNA断片サイズ範囲は、インキュベーション時間を増加させるにつれて減少し、熱処理「条件A、B、CおよびD」がpDNAを傷つけたことがさらに示される。発酵採取細胞ペレット試料から抽出されたpDNAは、この例において行われる熱処理の前、細胞中にスーパーコイル型pDNAが存在することを示す。希釈上清試料によって、レーン3〜6で観察されるスメアはゲル装填過剰の結果ではないことが確認された。
【0033】
実施例1
CLD327を用いたバッチ発酵(15L)を比較例に記載するように反復した。細胞増殖(OD600)を測定するため、発酵を通じて試料を採取した。OD600が〜30単位に到達するまで(グリセロール枯渇前)、発酵を続けた。発酵装置培養の試料を採取し、遠心分離して上清から細胞ペレットを分離し、そして細胞ペレットを−20℃で凍結保存した。次いで、発酵装置容器内容物を〜10℃に冷却し、そして1L密封可能遠心瓶に移し、そして8〜12℃でバッチ遠心分離によって細胞を収集した。冷(2〜8℃)緩衝液(50mM Tris、10mM EDTA、pH8.0)を用いて、回収した細胞ペレットを12Lの体積まで再懸濁した。細胞再懸濁物を8〜10℃の温度で攪拌して、細胞を完全に再懸濁し(OD600=27単位)、そして生じる細胞スラリーが均一であることを確実にした。
【0034】
以下に記載するような例外を除いて、比較例に記載するパイロット規模の高温短時間(HTST)プロセシング系を用いて、熱処理を行った。製造者のプロトコルにしたがって使用する前に、該系を設定し、そして清浄にした。該系は、細胞スラリーを迅速に所望の入口温度にするため、4つの「加熱前チューブ」を伴って設定された。これらのチューブの後に、細胞スラリーを必要な保持温度まで上げる単一の「加熱/保持チューブ」が続いた。熱交換器の加熱前および保持チューブに供給される加圧加熱水の温度を自動的に調整することによって、所望の保持温度プロファイルを調節した。熱処理装置を通る細胞スラリー流速を手動で調整することによって、保持/滞留時間を変化させた。次いで、細胞スラリーを6つの冷却チューブに通過させ、ここでスラリーを迅速に冷却した後、熱処理プロセシング状態各々から、熱処理した細胞スラリー産物を収集した。冷却水を熱交換器の冷却チューブに提供した。温度センサー/モニターは、熱処理装置への産物入口(T1)、加熱前の出口/加熱/保持チューブの入口(T2)および加熱/保持チューブの出口(T3)および第四の冷却チューブの出口(T4)に位置した。センサーT2からのアウトプットを用いて、熱交換器の加熱前および保持チューブに供給される温水の流動および温度を調節した。チューブ直径および長さは比較例に記載するのと同じであった。各熱処理「条件」(表2に記載する)に関して、調べている熱処理条件を代表する熱処理物質を収集する前に、少なくとも2体積の細胞スラリーで系をフラッシュした。系から収集した熱処理物質の温度は、15〜20℃の間であり、すなわち冷却チューブに供給するために用いた冷却水の温度に近かった。当業者には、必要な場合に、熱交換器に供給される冷却水温度をどのように減少させると、熱処理物質の出口温度がさらに減少するかが明らかであろう。各熱処理プロセシング条件から試料を採取し、遠心分離して、細胞破片から上清を分離し、そして抽出されたpDNAを含有する上清を、後に分析するため、−20℃で凍結保存した。図3は、この実施例で用いられるように設定された熱処理装置のレイアウト図を提供する。用いた細胞スラリー流速、滞留時間および熱処理温度を表2に提供する。総パイプ体積(ベンドを含む)、および製造者(Armfield)によって提供されるデータを用いて、用いた静的ミキサーによる置換を考慮することによって、滞留時間を概算した。
【0035】
表2:流速、滞留時間および熱処理温度
【0036】
【表2】

【0037】
細胞ペレット試料(熱処理前の発酵採取物由来の細胞)および清澄化上清試料(熱処理後)を融解し、そしてスーパーコイル型pDNAに関して分析した。製造者のプロトコルにしたがって、プラスミド調製キット(Machery−Nagel Nucleospinプラスミド精製キット、カタログ番号740588250)を用いて、発酵装置採取試料から、プラスミドDNAを抽出して、陽性対照を提供した。次いで、エチジウムブロミドを用いて視覚化した1%アガロースゲルを用いたゲル電気泳動を用いて、pDNA陽性対照試料および熱処理後に収集した上清試料を分析した。結果を図4に示す。
【0038】
図4に示すデータは、実施例1に記載する熱処理条件が、細胞スラリーから、スーパーコイル型プラスミドDNAを含むDNAを成功裡に遊離させたことを立証する。
実施例2
実施例1の方法を反復したが、以下の表3に示す条件を使用した。
【0039】
表3
【0040】
【表3】

【0041】
条件L〜X由来の熱処理後に収集した上清試料を、実施例1、条件E由来の上清試料とともに、コンピテント大腸菌細胞内に形質転換した。カナマイシン選択寒天プレート上で形質転換細胞を連続希釈した。プラスミドがカナマイシン耐性マーカーを含有する場合、生存細胞が検出されたならば、損なわれていないプラスミドを上清が含有することが示される。このアッセイの結果によって、試験した各試料が損なわれていないプラスミドDNAを含有することが示された。
【技術分野】
【0001】
本発明は、プラスミドDNA(pDNA)を細胞から抽出するためのプロセスに関する。
【背景技術】
【0002】
微生物発酵からpDNAを単離するための多くの技術は、小規模または実験室規模のプラスミド調製に適しているにすぎない。1つの一般的に使用される方法は、エチジウムブロミドの存在下で、CsClを用いた等密度遠心分離を含む。該方法は、高価でそして有害な試薬を使用しており、これは療法目的のためのpDNAの製造には不適当である。さらに、エチジウムブロミドはpDNAを損傷しうる。該方法は、多くの他の不都合な点も有するため、大規模pDNA製造に不適当なものとなっている。
【0003】
HolmesおよびQuigley(1981, Analytical Biochem., 114, pp 193−197)は、プラスミドDNAを細菌から単離し、そして精製するためのプロセスであって、約100℃で20〜40秒間沸騰させる工程を含む、前記プロセスを開示する。関連する開示であるUS4,830,969において、10秒から約3分間の接触時間に関して、60〜105℃の温度が開示される。この技術は、大規模pDNA製造には不適当である。
【0004】
US2002/0001829は、修飾STET緩衝液中に微生物細胞を懸濁し、そして懸濁物をフロースルー熱交換装置中で70〜100℃に加熱する、pDNAの単離法であって、70〜77℃の温度が好ましい、前記方法を開示する。多くの適用に好ましいpDNA型である、スーパーコイル型pDNAのレベルは、93℃を越える温度で減少すると解説されている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】US4,830,969
【特許文献2】US2002/0001829
【非特許文献】
【0006】
【非特許文献1】HolmesおよびQuigley(1981, Analytical Biochem., 114, pp.193−197)
【発明の概要】
【0007】
本発明の特定の態様にしたがって、pDNAを細胞から抽出するためのプロセスであって、細胞を含む液体を、10秒未満の時間に渡って、95℃〜約120℃の平均温度に加熱する工程を含む、前記プロセスを提供する。
【0008】
本発明のさらなる態様にしたがって、pDNAを細胞から抽出するためのプロセスであって、細胞を含む液体をフロースルー装置中で95℃またはそれより高い温度に加熱する工程を含む、但し、液体が、5秒より長い時間に渡って、120℃より高い平均温度に加熱されない、前記プロセスを提供する。
【図面の簡単な説明】
【0009】
【図1】図1は比較例に記載するように設定した熱処理装置の模式図である。
【図2】図2はアガロースゲル電気泳動分析の結果を示す図である。
【図3】図3は実施例1に記載するように設定した熱処理装置の模式図である。
【図4】図4はアガロースゲル電気泳動分析の結果を示す図である。
【発明を実施するための形態】
【0010】
本発明のプロセスによって抽出可能なpDNAは、複数の型、例えばスーパーコイル型、直鎖および開環(すなわちニックが入ったかまたは弛緩した)アイソフォームの1またはそれより多くで産生されてもよい。スーパーコイル型pDNAアイソフォームは、共有結合的閉環型を有し、そしてpDNAは宿主酵素系の作用によって、宿主細胞において負のスーパーコイル状である。開環アイソフォームにおいて、pDNA二重鎖の一方の鎖は、1またはそれより多い箇所で破壊される。多くのプラスミド適用のため、スーパーコイル型アイソフォームが最も好ましく、そして直鎖および開環アイソフォームから好適に分離される。遺伝子移入、例えばin vitro DNA形質転換またはin vivo遺伝子療法のためのプラスミドは、スーパーコイル型プラスミド・アイソフォームが高い割合であり、そして開環アイソフォームが低い割合であることを必要とする可能性もある。したがって、非常に精製されたスーパーコイル型プラスミドDNAを得ることに関する商業的必要性は非常に高い。開環プラスミド・アイソフォームをスーパーコイル型アイソフォームに変換する方法が当該技術分野に知られる。例えば、US20060057683は、これが酵素的に達成されるプロセスを開示する。したがって、特定の態様において、本発明を用いた抽出後、当該技術分野で確立された方法を用いて、開環アイソフォームのpDNAをスーパーコイル型アイソフォームに変換する。
【0011】
本発明のプロセスによって抽出されるpDNAは、一般的に、宿主細胞の増殖および採取によって産生され、そして好ましくは組換え微生物の微生物発酵による。最も好ましい宿主細胞は大腸菌(E. coli)であるが、多くの他のタイプの細胞がプラスミドを所持することが知られる。これには、他の細菌、酵母およびより高次の真核細胞が含まれる。例には、酵母、サッカロミセス・セレビシエ(Saccharomyces cerevisiae)およびクロイベロミセス・ラクティス(Kluyveromyces lactis)、糸状菌、例えばアカパンカビ属(Neurospora)種および藻類、クラミドモナス属(Chamydomomas)が含まれる。
【0012】
pDNAの産生法は当該技術分野に周知である。pDNAは天然または人工、例えば外来(foreign)DNA挿入物を所持するクローニングベクターであってもよい。多くの態様において、pDNAは、1キロ塩基〜50キロ塩基のサイズ範囲である。例えば、発現される干渉RNAをコードするpDNAは、典型的には、3キロ塩基〜4キロ塩基のサイズ範囲である。
【0013】
本発明のプロセスで使用可能な細胞を含む液体には、細胞が増殖されてきた培養ブロスが含まれる。多くの態様において、液体は、細胞を培養ブロスから採取し、そして次いで、細胞を好ましくは水性緩衝溶液中に再懸濁することによって調製される、細胞の懸濁物である。細胞は、当該技術分野に周知の方法、例えば遠心分離または精密ろ過によって採取される。
【0014】
細胞の再懸濁を使用する場合、細胞は、好ましくは、通常は4〜10の範囲のpH、そして好ましくはほぼ中性pH、例えば7〜9のpHを持つ、水性緩衝液中に再懸濁される。緩衝塩濃度は、一般的に、10〜100mMの範囲、例えば20〜80mMの範囲である。特定の態様において、特定の適切な緩衝液は、pH8の50mM Tris HClである。緩衝液は、溶液中の金属イオンを維持し、そして細胞壁陽イオン、例えばカルシウムを可溶化するため、EDTAなどのキレート剤を含有してもよい。懸濁緩衝液はまた、通常、2〜15%w/w、好ましくは5〜10%w/wの範囲のポリオール、例えばスクロース;通常、1〜5%w/w、好ましくは1〜3%w/wの範囲の界面活性剤、例えばTritonTMX−100;および/または0.5〜8M、好ましくは1〜3Mの範囲の濃度のカオトロープ、例えば尿素などの、pDNA遊離を補助する他の化合物も含有してもよい。
【0015】
細胞を含む液体が培養ブロスである場合、pHを4〜10の範囲のpHに、そして好ましくはほぼ中性pHに、例えば7〜9に調整してもよい。望ましい場合、細胞懸濁のため、上述のようなpDNA遊離を補助するため、キレート剤および他の化合物を使用してもよい。
【0016】
本発明のプロセスは、pDNA抽出を達成するために、細胞壁溶解酵素、例えばリゾチームの使用を必要としないが、望ましい場合、こうした酵素を使用してもよい。
本発明のプロセスは、小規模、中規模または大規模で産生されるpDNAのプロセシングに適している。小規模は、典型的には、通常、振盪フラスコを使用する、最大2リットルまでの規模と見なされる。中規模は、典型的には、2リットルから500リットルの規模と見なされる。大規模は、典型的には、500リットルより大きい、例えば最大100,000リットル、例えば1000リットル〜10,000リットルの規模と見なされる。
【0017】
本発明のプロセスにおいて、初期温度、つまり実行される産生プロセスの正確な性質に応じて、最も一般的には、液体が有意な期間、例えば1時間から最大少なくとも数日に渡って安定である温度から、95℃またはそれより高く、細胞を含む液体を加熱するが、95℃より高い温度が好ましい。いくつかの態様において、例えば、液体が、細胞を増殖させてきた培養ブロスを含む場合、初期温度は、30〜45℃、例えば約35〜38℃の範囲である。他の態様において、初期温度は、例えば液体が培養ブロスの形でまたは細胞の再懸濁物としてのいずれかで冷却されてきた場合、約2〜約10℃の範囲である。多くの態様において、初期温度は、2〜30℃の範囲であり、そしてしばしば、周囲温度、例えば15〜25℃である。加熱は、最も好ましくは迅速に達成され、例えば、10秒未満、特に5秒未満の期間に渡る。液体を望ましい期間に渡って望ましい範囲の温度で維持した後、通常は液体が安定である温度、そして好ましくは10〜45℃の範囲の温度に液体を冷却する。冷却は、好ましくは迅速に達成され、例えば最長40秒の期間に渡る。特定の態様において、液体は20秒またはそれ未満で、例えば10〜15秒間で、70℃未満の温度に冷却される。
【0018】
多くの態様において、液体は、2〜6秒間、95℃より高く、そして最大110℃、好ましくは96℃〜110℃、特に100℃〜109℃の温度で維持される。他の態様において、液体は、1〜3秒間、115℃〜120℃の温度で維持される。さらにさらなる態様において、液体は、0.5〜1.5秒間、120℃〜130℃の温度で維持される。
【0019】
本発明のプロセスが、フロースルー装置を用いて実行されることが特に好ましい。こうした装置は、一般的に、液体を初期温度から95℃より高い温度に加熱する加熱ゾーン、液体を望ましい期間に渡って望ましい温度で保持する保持ゾーン、および液体を望ましい温度に冷却する冷却ゾーンを含む。最も好ましくは、望ましい状態を提供するように、チューブに適用する温度および液体流速を調整しつつ、加熱、保持および冷却ゾーンを通過するチューブを通じて、液体を流動させる。特定の好ましい態様において、チューブは、液体の加熱および冷却の均一性を改善するため、混合要素、例えば静的混合要素を取り込む。
【0020】
本発明のプロセスを実行するのに適したフロースルー装置、特に熱交換装置が当該技術分野に周知である。例には、UHT殺菌業で一般的に使用される高温短時間熱交換器、および連続培地滅菌装置が含まれる。商業的に入手可能な装置には、Armfield FT74X UHT/HTST系およびArmfield FT94X UHT/HTSTミニパイロット系(Armfield Ltd、英国リングウッド)が含まれる。より大規模な装置は、例えばSchmidt SigmaTherm系(API Heat Transfer、米国ニューヨーク州バッファロー)、IPEC(米国ウィスコンシン州)およびGEA Process Engineering Inc(米国メリーランド州コロンビア)より入手可能である。本発明で使用するのに適した装置を、容易に修飾するかまたは個々に設計して、そして特定のプロセシング必要性にマッチする、例えば発酵体積および入手可能な発酵ブロスをプロセシングするのに利用可能な遠心分離能力にマッチするように構築可能であることが、当業者には明らかであろう。
【0021】
本発明のプロセスによって抽出されているpDNAは、一般的に、当該技術分野に知られる方法によって精製され、そして単離される。こうした方法の例には、遠心分離、ろ過、クロマトグラフィー、ディアフィルトレーション、CTABの添加などのまたはLanderら US6797476に記載されるような沈殿、およびHubbunchら, Biotechnol Appl Biochem.(2005)42 pp57−66に記載されるような二相水性抽出が含まれる。
【0022】
巨大な細胞破片、タンパク質および大部分のゲノムDNAは、通常、遠心分離によって除去される。RNアーゼを用いた場合による処理を使用してもよく、そしてpDNAをろ過して、例えば0.45ミクロン・フィルターを通じたろ過で、小さい破片をさらに取り除いてもよい。
【0023】
pDNAのサイズにしたがって選択される分子量カットオフを有する限外ろ過膜を通常用いて、さらなる不純物をディアフィルトレーションによって除去してもよい。
使用可能なクロマトグラフィー法には、荷電膜クロマトグラフィー(例えばEndresら, Biotechnol Appl Biochem.(2003)37 pp259−66に記載されるようなもの)、モノリス・クロマトグラフィー(例えばStancarら, Adv Biochem Eng Biotechnol.(2002)76: pp49−85に記載されるようなもの)、陰イオン交換クロマトグラフィーおよび逆相クロマトグラフィーが含まれる。多くの態様において、陰イオン交換法および逆相法が使用される。遠心分離、ろ過およびディアフィルトレーション工程の少なくとも1つ、そして好ましくは各々が、クロマトグラフィー前に使用されることが好ましい。適切な陰イオン交換マトリックスの例には、POROS陰イオン交換樹脂、Qiagen、Toso Haas、Sterogene、Spherodex、Nucleopac、およびGE Healthcareより入手可能なものが含まれる。適切な逆相マトリックスの例には、POROS、Polymer Labs、Toso Haas、GE Healthcare、PQ Corp.、Zorbax、BioSepra樹脂、BioSepra Hyper D樹脂、BioSepra Q−Hyper D樹脂およびAmiconより入手可能なものが含まれる。好ましくは、陰イオン交換クロマトグラフィーが逆相クロマトグラフィーに先行する。
【0024】
精製pDNAを濃縮し、そして/またはディアフィルトレーションして、体積を減少させるかまたは緩衝液を交換してもよく、例えばpDNAを薬学的に許容されうるキャリアーまたは緩衝溶液内に移して、場合によってその後、滅菌してもよい。薬学的に許容されうるキャリアーまたは緩衝溶液の例が、当該技術分野に知られる。pDNAの濃縮に適した方法が当該技術分野に周知であり、そしてこれには、ディアフィルトレーション、アルコール沈殿および凍結乾燥が含まれ、ディアフィルトレーションが好ましい。pDNAの有用性に影響を及ぼさない滅菌法が当該技術分野に周知であり、例えば小さい孔サイズ、例えば0.2ミクロンおよびそれより小さい孔サイズを有する膜の通過による滅菌がある。
【0025】
本発明は、以下の実施例によって、限定されることなく例示される。
【実施例】
【0026】
株調製
IgG−Fcタンパク質の遺伝子配列をpCMV−Script(Stratageneカタログ212220)内にクローニングした。制限消化によって5.7kb組換えプラスミドを含有する組換えクローンを同定し、そして配列決定によって確認した。エレクトロポレーションを用いて1つのプラスミドクローンを大腸菌宿主株XL−1 Blue MR(Stratagene、カタログ200229)内に形質転換して、組換え大腸菌株を生成した。CLD327と命名した組換え株を精製し、そしてグリセロールストック中、−80℃で維持した。
【0027】
比較例
グリセロールおよび酵母エキスを補充した最小塩発酵基本培地を用いて、CLD327を用いたバッチ発酵(15L)を30℃およびpH7.0で行った。溶解酸素のセットポイントは飽和の30%であり、そして発酵装置攪拌速度を自動的に調整することによって、これを調節した。細胞増殖(OD600)を測定するため、発酵を通じて試料を採取した。OD600が〜30単位に到達するまで(グリセロール枯渇前)、発酵を続けた。発酵装置培養の試料を採取し、遠心分離して上清から細胞ペレットを分離し、そして細胞ペレットを−20℃で凍結保存した。次いで、発酵装置容器内容物を〜10℃に冷却し、そして1L密封可能遠心瓶に移し、そして8〜12℃でバッチ遠心分離によって細胞を収集した。冷(2〜8℃)緩衝液(50mM Tris、10mM EDTA、pH8.0)を用いて、回収した細胞ペレットを12Lの体積まで再懸濁した。細胞再懸濁物を8〜10℃の温度で攪拌して、細胞を完全に再懸濁し(OD600=23単位)、そして生じる細胞スラリーが均一であることを確実にした。
【0028】
パイロット規模の高温短時間(HTST)プロセシング系(Armfield FT74−20−MkIIIチューブ状熱交換器UHT/HTST系、Armfield Ltd、英国リングウッド)を用いて、熱処理を行った。該系は、用いる熱交換器チューブの数を調整することによって、加熱前、加熱/保持および冷却(滞留(resitdence))時間を設定可能にする。産物(細胞スラリー)流速を変化させることによって、そして使用する加熱前、加熱/保持および冷却チューブの数を再設定することによって、広範囲の滞留時間が達成可能である。製造者のプロトコルにしたがって使用する前に、Armfield FT74−20−MkIIIチューブ状熱交換器系を設定し、そして清浄にした。この例で用いるチューブ状熱交換器は、二重同心円の316ステンレス鋼チューブ(チューブ直径8.1mm(産物側)、全体直径15.8mm、各チューブ・セクション長0.4m、15バール(最大)作業圧)の多数のセクションを、静的ミキサー(Armfield FT74−21)とともに含んだ。産物(細胞スラリー)は中央を流れる一方、加熱または冷却水は、外部チューブを流れる。該系は、細胞スラリーを迅速に所望の入口温度にするため、4つの「加熱前チューブ」(長さ各0.4m)を伴って設定された。これらのチューブの後に、細胞スラリーを必要な保持温度まで上げる、2つの「加熱/保持チューブ」(長さ各0.4m)が続いた。熱交換器の加熱前および保持チューブに供給される加圧加熱水の温度を自動的に調整することによって、所望の保持温度プロファイルを調節した。熱処理装置を通る細胞スラリー流速を手動で調整することによって、保持/滞留時間を変化させた。次いで、細胞スラリーを6つの冷却チューブ(長さ各0.4m)に通過させ、ここでスラリーを迅速に冷却した後、熱処理プロセシング状態各々から、熱処理した細胞スラリー産物を収集した。冷却水を熱交換器の冷却チューブに提供した。温度センサー/モニターは、熱処理装置への産物入口(T1)、加熱前の出口/加熱/保持チューブの入口(T2)および加熱/保持チューブの出口(T3)および第四の冷却チューブの出口(T4)に位置した。センサーT2からのアウトプットを用いて、熱交換器の加熱前および保持チューブに供給される温水の流動および温度を調節した。各熱処理「条件」(表1に記載する)に関して、調べている熱処理条件を代表する熱処理物質を収集する前に、少なくとも2体積の細胞スラリーで系をフラッシュした。系から収集した熱処理物質の温度は、15〜20℃の間であり、すなわち冷却チューブに供給するために用いた冷却水の温度に近かった。当業者には、必要な場合に、熱交換器に供給される冷却水温度をどのように減少させると、熱処理物質の出口温度がさらに減少するかが明らかであろう。各熱処理プロセシング条件から試料を採取し、遠心分離して、細胞破片から上清を分離し、そして抽出されたpDNAを含有する上清を、後に分析するため、−20℃で凍結保存した。図1は、この実施例で用いられるように設定された熱処理装置のレイアウト図を提供する。用いた細胞スラリー流速、滞留時間および熱処理温度を表1に提供する。総パイプ体積(ベンドを含む)、および製造者(Armfield)によって提供されるデータを用いて、静的ミキサーによる置換を考慮することによって、滞留時間を概算した。
【0029】
表1:流速、滞留時間および熱処理温度
【0030】
【表1】

【0031】
細胞ペレット試料(熱処理前の発酵採取物由来の細胞)および清澄化上清試料(熱処理後)を融解し、そしてスーパーコイル型pDNAに関して分析した。製造者のプロトコルにしたがって、プラスミド調製キット(Qiagenカタログ番号12123)を用いて、発酵装置採取試料から、プラスミドDNAを抽出して、陽性対照を提供した。次いで、エチジウムブロミドを用いて視覚化した1%アガロースゲルを用いたゲル電気泳動を用いて、pDNA陽性対照試料および熱処理後に収集した上清試料を分析した。未希釈および希釈(1/5)の両方で、アガロースゲル上で上清試料を泳動した。結果を図2に示す。
【0032】
結果によって、熱処理条件A、B、CおよびDの後にDNAが回収されたが、回収されたDNAは損なわれていない(intact)ものではなかったことが明らかになる。DNAは、異なるサイズの断片のスメアとして泳動される(レーン3〜6)。DNA断片サイズ範囲は、インキュベーション時間を増加させるにつれて減少し、熱処理「条件A、B、CおよびD」がpDNAを傷つけたことがさらに示される。発酵採取細胞ペレット試料から抽出されたpDNAは、この例において行われる熱処理の前、細胞中にスーパーコイル型pDNAが存在することを示す。希釈上清試料によって、レーン3〜6で観察されるスメアはゲル装填過剰の結果ではないことが確認された。
【0033】
実施例1
CLD327を用いたバッチ発酵(15L)を比較例に記載するように反復した。細胞増殖(OD600)を測定するため、発酵を通じて試料を採取した。OD600が〜30単位に到達するまで(グリセロール枯渇前)、発酵を続けた。発酵装置培養の試料を採取し、遠心分離して上清から細胞ペレットを分離し、そして細胞ペレットを−20℃で凍結保存した。次いで、発酵装置容器内容物を〜10℃に冷却し、そして1L密封可能遠心瓶に移し、そして8〜12℃でバッチ遠心分離によって細胞を収集した。冷(2〜8℃)緩衝液(50mM Tris、10mM EDTA、pH8.0)を用いて、回収した細胞ペレットを12Lの体積まで再懸濁した。細胞再懸濁物を8〜10℃の温度で攪拌して、細胞を完全に再懸濁し(OD600=27単位)、そして生じる細胞スラリーが均一であることを確実にした。
【0034】
以下に記載するような例外を除いて、比較例に記載するパイロット規模の高温短時間(HTST)プロセシング系を用いて、熱処理を行った。製造者のプロトコルにしたがって使用する前に、該系を設定し、そして清浄にした。該系は、細胞スラリーを迅速に所望の入口温度にするため、4つの「加熱前チューブ」を伴って設定された。これらのチューブの後に、細胞スラリーを必要な保持温度まで上げる単一の「加熱/保持チューブ」が続いた。熱交換器の加熱前および保持チューブに供給される加圧加熱水の温度を自動的に調整することによって、所望の保持温度プロファイルを調節した。熱処理装置を通る細胞スラリー流速を手動で調整することによって、保持/滞留時間を変化させた。次いで、細胞スラリーを6つの冷却チューブに通過させ、ここでスラリーを迅速に冷却した後、熱処理プロセシング状態各々から、熱処理した細胞スラリー産物を収集した。冷却水を熱交換器の冷却チューブに提供した。温度センサー/モニターは、熱処理装置への産物入口(T1)、加熱前の出口/加熱/保持チューブの入口(T2)および加熱/保持チューブの出口(T3)および第四の冷却チューブの出口(T4)に位置した。センサーT2からのアウトプットを用いて、熱交換器の加熱前および保持チューブに供給される温水の流動および温度を調節した。チューブ直径および長さは比較例に記載するのと同じであった。各熱処理「条件」(表2に記載する)に関して、調べている熱処理条件を代表する熱処理物質を収集する前に、少なくとも2体積の細胞スラリーで系をフラッシュした。系から収集した熱処理物質の温度は、15〜20℃の間であり、すなわち冷却チューブに供給するために用いた冷却水の温度に近かった。当業者には、必要な場合に、熱交換器に供給される冷却水温度をどのように減少させると、熱処理物質の出口温度がさらに減少するかが明らかであろう。各熱処理プロセシング条件から試料を採取し、遠心分離して、細胞破片から上清を分離し、そして抽出されたpDNAを含有する上清を、後に分析するため、−20℃で凍結保存した。図3は、この実施例で用いられるように設定された熱処理装置のレイアウト図を提供する。用いた細胞スラリー流速、滞留時間および熱処理温度を表2に提供する。総パイプ体積(ベンドを含む)、および製造者(Armfield)によって提供されるデータを用いて、用いた静的ミキサーによる置換を考慮することによって、滞留時間を概算した。
【0035】
表2:流速、滞留時間および熱処理温度
【0036】
【表2】

【0037】
細胞ペレット試料(熱処理前の発酵採取物由来の細胞)および清澄化上清試料(熱処理後)を融解し、そしてスーパーコイル型pDNAに関して分析した。製造者のプロトコルにしたがって、プラスミド調製キット(Machery−Nagel Nucleospinプラスミド精製キット、カタログ番号740588250)を用いて、発酵装置採取試料から、プラスミドDNAを抽出して、陽性対照を提供した。次いで、エチジウムブロミドを用いて視覚化した1%アガロースゲルを用いたゲル電気泳動を用いて、pDNA陽性対照試料および熱処理後に収集した上清試料を分析した。結果を図4に示す。
【0038】
図4に示すデータは、実施例1に記載する熱処理条件が、細胞スラリーから、スーパーコイル型プラスミドDNAを含むDNAを成功裡に遊離させたことを立証する。
実施例2
実施例1の方法を反復したが、以下の表3に示す条件を使用した。
【0039】
表3
【0040】
【表3】

【0041】
条件L〜X由来の熱処理後に収集した上清試料を、実施例1、条件E由来の上清試料とともに、コンピテント大腸菌細胞内に形質転換した。カナマイシン選択寒天プレート上で形質転換細胞を連続希釈した。プラスミドがカナマイシン耐性マーカーを含有する場合、生存細胞が検出されたならば、損なわれていないプラスミドを上清が含有することが示される。このアッセイの結果によって、試験した各試料が損なわれていないプラスミドDNAを含有することが示された。
【特許請求の範囲】
【請求項1】
pDNAを細胞から抽出するためのプロセスであって、細胞を含む液体を、10秒未満の時間に渡って、95℃〜約120℃の平均温度に加熱する工程を含む、前記プロセス。
【請求項2】
液体をフロースルー装置中で加熱する、請求項1記載のプロセス。
【請求項3】
pDNAを細胞から抽出するためのプロセスであって、細胞を含む液体を、フロースルー装置中で95℃またはそれより高い温度に加熱する工程を含む、但し、液体が120℃より高い平均温度で5秒間より長く加熱されない、前記プロセス。
【請求項4】
細胞を含む液体を、10秒未満の時間に渡って、95℃〜約120℃の平均温度に加熱する工程を含む、請求項3記載のプロセス。
【請求項5】
液体が、細胞が増殖されてきた培養ブロスである、先行する請求項いずれか記載のプロセス。
【請求項6】
液体が、細胞を培養ブロスから採取し、そして次いで好ましくは水性緩衝溶液中に、細胞を再懸濁することによって調製される細胞懸濁物である、請求項1〜4のいずれか一項記載のプロセス。
【請求項7】
95℃より高い温度で、最長6秒間、液体を維持する、先行する請求項いずれか記載のプロセス。
【請求項8】
液体を初期温度から95℃より高い温度に加熱する加熱ゾーン、液体を95℃より高い温度で保持する保持ゾーン、および液体を好ましくは70℃未満の温度に冷却する冷却ゾーンを含む、フロースルー装置を使用する、先行する請求項いずれか記載のプロセス。
【請求項9】
液体の初期温度が2℃〜45℃である、請求項8記載のプロセス。
【請求項10】
液体を10℃〜45℃の温度に冷却する、請求項8または9いずれか記載のプロセス。
【請求項11】
液体を約95℃より高く、そして110℃までの温度で、2〜6秒間維持する、先行する請求項いずれか記載のプロセス。
【請求項12】
液体を約115℃〜120℃の温度で、1〜3秒間維持する、請求項1〜10のいずれか一項記載のプロセス。
【請求項13】
液体を約120℃〜130℃の温度で、0.5〜1.5秒間維持する、請求項1〜10のいずれか一項記載のプロセス。
【請求項14】
細胞が大腸菌(E.coli)細胞である、先行する請求項いずれか記載のプロセス。
【請求項15】
pDNAがスーパーコイル型アイソフォームで抽出される、先行する請求項いずれか記載のプロセス。
【請求項16】
pDNAが開環アイソフォームで抽出される、請求項1〜14のいずれか一項記載のプロセス。
【請求項17】
開環アイソフォームpDNAが、続いてスーパーコイル型アイソフォームに変換される、請求項16記載のプロセス。
【請求項1】
pDNAを細胞から抽出するためのプロセスであって、細胞を含む液体を、10秒未満の時間に渡って、95℃〜約120℃の平均温度に加熱する工程を含む、前記プロセス。
【請求項2】
液体をフロースルー装置中で加熱する、請求項1記載のプロセス。
【請求項3】
pDNAを細胞から抽出するためのプロセスであって、細胞を含む液体を、フロースルー装置中で95℃またはそれより高い温度に加熱する工程を含む、但し、液体が120℃より高い平均温度で5秒間より長く加熱されない、前記プロセス。
【請求項4】
細胞を含む液体を、10秒未満の時間に渡って、95℃〜約120℃の平均温度に加熱する工程を含む、請求項3記載のプロセス。
【請求項5】
液体が、細胞が増殖されてきた培養ブロスである、先行する請求項いずれか記載のプロセス。
【請求項6】
液体が、細胞を培養ブロスから採取し、そして次いで好ましくは水性緩衝溶液中に、細胞を再懸濁することによって調製される細胞懸濁物である、請求項1〜4のいずれか一項記載のプロセス。
【請求項7】
95℃より高い温度で、最長6秒間、液体を維持する、先行する請求項いずれか記載のプロセス。
【請求項8】
液体を初期温度から95℃より高い温度に加熱する加熱ゾーン、液体を95℃より高い温度で保持する保持ゾーン、および液体を好ましくは70℃未満の温度に冷却する冷却ゾーンを含む、フロースルー装置を使用する、先行する請求項いずれか記載のプロセス。
【請求項9】
液体の初期温度が2℃〜45℃である、請求項8記載のプロセス。
【請求項10】
液体を10℃〜45℃の温度に冷却する、請求項8または9いずれか記載のプロセス。
【請求項11】
液体を約95℃より高く、そして110℃までの温度で、2〜6秒間維持する、先行する請求項いずれか記載のプロセス。
【請求項12】
液体を約115℃〜120℃の温度で、1〜3秒間維持する、請求項1〜10のいずれか一項記載のプロセス。
【請求項13】
液体を約120℃〜130℃の温度で、0.5〜1.5秒間維持する、請求項1〜10のいずれか一項記載のプロセス。
【請求項14】
細胞が大腸菌(E.coli)細胞である、先行する請求項いずれか記載のプロセス。
【請求項15】
pDNAがスーパーコイル型アイソフォームで抽出される、先行する請求項いずれか記載のプロセス。
【請求項16】
pDNAが開環アイソフォームで抽出される、請求項1〜14のいずれか一項記載のプロセス。
【請求項17】
開環アイソフォームpDNAが、続いてスーパーコイル型アイソフォームに変換される、請求項16記載のプロセス。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公表番号】特表2013−500041(P2013−500041A)
【公表日】平成25年1月7日(2013.1.7)
【国際特許分類】
【出願番号】特願2012−522239(P2012−522239)
【出願日】平成22年7月22日(2010.7.22)
【国際出願番号】PCT/GB2010/001388
【国際公開番号】WO2011/012841
【国際公開日】平成23年2月3日(2011.2.3)
【出願人】(508236033)フジフィルム・ダイオシンス・バイオテクノロジーズ ・ユーケイ・リミテッド (8)
【Fターム(参考)】
【公表日】平成25年1月7日(2013.1.7)
【国際特許分類】
【出願日】平成22年7月22日(2010.7.22)
【国際出願番号】PCT/GB2010/001388
【国際公開番号】WO2011/012841
【国際公開日】平成23年2月3日(2011.2.3)
【出願人】(508236033)フジフィルム・ダイオシンス・バイオテクノロジーズ ・ユーケイ・リミテッド (8)
【Fターム(参考)】
[ Back to top ]

