プロテインA組成物および使用方法
【課題】被験体における免疫応答を調節するための方法を提供すること。
【解決手段】被験体における免疫応答を調節するための方法および組成物を提供する。方法は、この免疫応答を調節するのに十分な、有効量のリンパ球分化因子(例えば、プロテインA(PA))を含む組成物を、この被験体に投与する工程を包含する。組成物は、1μg未満の量のリンパ球分化因子(例えば、プロテインA(PA))を含む。本方法はまた、炎症応答を有する被験体または炎症応答のリスクを伴う被験体における炎症応答を軽減する方法であって、該方法は、炎症応答を軽減するのに十分な、有効量のプロテインA(PA)を含む組成物を該被験体に投与する工程を包含する方法である。
【解決手段】被験体における免疫応答を調節するための方法および組成物を提供する。方法は、この免疫応答を調節するのに十分な、有効量のリンパ球分化因子(例えば、プロテインA(PA))を含む組成物を、この被験体に投与する工程を包含する。組成物は、1μg未満の量のリンパ球分化因子(例えば、プロテインA(PA))を含む。本方法はまた、炎症応答を有する被験体または炎症応答のリスクを伴う被験体における炎症応答を軽減する方法であって、該方法は、炎症応答を軽減するのに十分な、有効量のプロテインA(PA)を含む組成物を該被験体に投与する工程を包含する方法である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、免疫応答調節ならびに免疫障害および免疫障害に関連する免疫病理または免疫障害によって引き起こされた免疫病理の処置に関する。
【背景技術】
【0002】
(背景)
プロテインAは、種々の細菌の細胞壁から抽出された40,000Daの糖タンパク質である。細菌は、組織結合のための標的部位および結合部位として、PAを使用する。プロテインAは、特定の免疫グロブリンクラスのFc部位に対して高いアフィニティーを有し、一旦、免疫グロブリンが抗原に結合すると、これらの免疫グロブリンに対してさらに高いアフィニティーを有する。PAのこの生化学的特性は、多くの適用に使用されている。PAのこれらの適用は、分子のFc結合特性の使用、または特定の抗原誘導(スーパー抗原の適用)の非存在下で体液性免疫を刺激するPA能力を反映する。
【発明の概要】
【課題を解決するための手段】
【0003】
(要旨)
本発明は、Fc結合特性およびスーパー抗原特性とは異なるPAの特徴に少なくとも部分的に基づく。この特徴は、動物において、以下の活性のうちの一つ以上を与える:異常なプロセスを再調節する能力、および組織損傷を阻害する能力または調節されていないプロセスによって引き起こされた既存の組織損傷の少なくとも一部を回復する能力;異常な免疫プロセスまたは所望でない免疫プロセスを再調節する能力。
【0004】
従って、本発明は、被験体における免疫応答を調節するための方法を提供する。一つの実施形態において、方法は、免疫応答を調節するのに十分な、有効量のリンパ球分化因子を含む組成物を、被験体に投与する工程を包含する。一つの局面において、リンパ球分化因子は、プロテインA(PA)を含む。
【0005】
免疫機能不全を有する被験体、または免疫機能不全のリスクを伴う被験体において、免疫機能不全を処置するための方法もまた提供される。一つの実施形態において、方法は、免疫機能不全を処置するのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。一つの局面において、免疫機能不全は、自己免疫障害(例えば、慢性関節リウマチ、若年性慢性関節リウマチ、変形性関節症、乾癬性関節炎、糖尿病、多発性硬化症、脳脊髄炎、重症筋無力症、全身性エリテマトーデス(SLE)、自己免疫性甲状腺炎、アトピー性皮膚炎、湿疹性皮膚炎、乾癬、シェーグレン症候群、クローン病、アフタ性潰瘍、虹彩炎、結膜炎、角結膜炎、潰瘍性大腸炎、喘息、アレルギー性喘息、皮膚エリテマトーデス、強皮症、腟炎、直腸炎、癩性結節性紅斑、自己免疫性ブドウ膜炎、アレルギー性脳脊髄炎、急性壊死性出血性脳症、特発性両側性進行性感音難聴、再生不良性貧血、赤芽球癆、特発性血小板減少症、多発性軟骨炎、ヴェーゲナー肉芽腫症、慢性活動性肝炎、スティーブンス・ジョンソン症候群、特発性スプルー、扁平苔癬、グレーブス病、サルコイドーシス、原発性胆汁性肝硬変、後部ブドウ膜炎、間質性肺線維症、橋本甲状腺炎、自己免疫性多腺性症候群、インスリン依存性糖尿病、インスリン抵抗性糖尿病、免疫調節性不妊症、自己免疫性アジソン病、尋常性天疱瘡、落葉状天疱瘡、疱疹状皮膚炎、自己免疫性脱毛症、白斑、自己免疫性溶血性貧血、自己免疫性血小板減少性紫斑病、悪性貧血、ギヤン−バレー症候群、スティッフマン症候群、急性リウマチ熱、交感性眼炎、グッドパスチャー症候群、全身性壊死性血管炎、抗リン脂質抗体症候群またはアレルギー)を包含する。別の局面において、免疫機能不全は、免疫不全(例えば、リコンビナーゼ活性化遺伝子(RAG1/2)欠損症、アデノシンデアミナーゼ(ADA)欠損症、インターロイキンレセプターγ鎖(γc)欠損症、ヤヌース関連キナーゼ3(JAK3)欠損症および細網発育不全などの重症複合型免疫不全(SCID);ディ・ジョージ症候群、ヌード症候群、T細胞レセプター欠損症、MHCクラスII欠損症、TAP−2欠損症(MHCクラスI欠損症)、ZAP70チロシンキナーゼ欠損症、およびプリンヌクレオチドホスホリラーゼ(PNP)欠損症などの原発性T細胞免疫不全;X連鎖無γグロブリン血症(ブルトンチロシンキナーゼ欠損症)などの優性抗体欠損症;μ重鎖欠損症などの常染色体劣性無γグロブリン血症;代用軽鎖(γ5/14.1)欠損症;X連鎖(CD40リガンド欠損症)およびその他のどちらかの高IgM症候群;Ig重鎖遺伝子欠失;IgA欠損症;IgGサブクラスの欠損症(IgA欠損症有、または無し);分類不能型免疫不全(CVID);正常免疫グロブリンを有する抗体欠損症;一過性乳児低ガンマグロブリン血症;インターフェロンγレセプター(IFNGR1、IFNGR2)欠損症;インターロイキン12レセプター欠損症およびインターロイキン12レセプター欠損症;胸腺腫を有する免疫不全;ヴィスコット−オールドリッチ症候群(WASタンパク欠損症);毛細管拡張性運動失調(ATM欠損症);X連鎖リンパ増殖性症候群(SH2D1A/SAP欠損症);および高IgE症候群)を含む。さらに別の局面において、免疫機能不全は、別の疾患(例えば、ブルーム症候群、色素性乾皮症、ファンコーニ貧血、ICF症候群、ナイメーヘン切断症候群およびゼッケル症候群などの染色体不安定または欠損修復;ダウン症候群(21トリソミー)、ターナー症候群および第18番染色体の欠失または環状化(18p−および18q−)などの染色体欠損症;短肢骨格形成異常(短肢矮小発育症)および軟骨毛髪形成不全症(骨幹端軟骨形成)などの骨格異常;シムケ免疫骨性形成異常、デュボヴッツ症候群、SCIDを有する後弯肢異形成症(Kyphomelic dysplasia)、マリブレイ小人症、成長遅延、顔の奇形ならびに免疫不全および早老症(ハッチソン−ギルフォード症候群)などの全身性成長遅延に関連する免疫不全;欠指・外胚葉異形成・裂隙症候群、母指欠損を有する免疫不全、臭覚障害および魚鱗癬、部分的な白皮症、先天性角化不全症、ネザートン症候群、無汗性外胚葉性形成異常、パピヨン−ルフェーヴル症候群および先天性魚鱗症などの皮膚欠損を有する免疫不全;腸性先端皮膚炎、第2トランスコバラミン欠損、1型遺伝性オロチン酸尿、難治性下痢、異常顔面、裂毛症および免疫不全、メチルマロン酸血症、ビオチン依存性カルボキシラーゼ欠損、マンノシドーシス、グリコーゲン蓄積症、1b型、チェディアック−東症候群などの遺伝性代謝欠損;家族性異化亢進、腸リンパ管拡張症などの免疫グロブリンの異化亢進;慢性粘膜皮膚カンジダ症;遺伝性または先天性の脾機能低下症または無脾症;およびアイベルマルク(Ivermark)症候群)に関連するか、または続発性の免疫不全を含む。
【0006】
さらに、炎症応答を有する被験体、または炎症応答のリスクを伴う被験体における炎症応答を軽減するための方法を提供する。一つの実施形態において、方法は、炎症応答を軽減するのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。一つの局面において、炎症応答は、慢性または急性である。別の局面において、炎症応答は、抗体(例えば、一つ以上の自己抗体)によって少なくとも部分的に媒介されているか、または細胞性免疫によって少なくとも部分的に媒介される。
【0007】
さらに、被験体の炎症を軽減するための方法を提供する。一つの実施形態において、方法は、炎症を軽減するのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。一つの局面において、炎症は、慢性または急性である。別の局面において、炎症は、抗体または細胞によって少なくとも部分的に媒介される。なお別の局面において、処置は、炎症症状(例えば、腫脹、疼痛、頭痛、発熱、嘔気、骨格関節硬直、または組織損傷もしくは細胞損傷)の重篤度の軽減をもたらす。さらに別の局面において、この処置は、抗体産生またはリンパ系細胞増殖の阻害をもたらす。
【0008】
さらに、被験体における炎症応答または炎症によって引き起こされた組織損傷または細胞損傷を阻害するための方法を提供する。一つの実施形態において、方法は、炎症応答または炎症によって引き起こされた組織損傷または細胞損害の阻害を処置するのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。一つの局面において、組織損傷または細胞損傷は、慢性または急性の炎症応答または炎症によって引き起こされる。別の局面において、炎症応答または炎症は、抗体または細胞によって少なくとも部分的に媒介される。なお別の局面において、組織損傷または細胞損傷は、胸腺、肝臓、腎臓、脾臓、皮膚、または骨格関節(例えば、膝、足首、臀部、肩、手首、手指、足指または肘)に存在する。さらに別の局面において、この処置は、さらなる組織損傷または細胞損傷の阻害または予防をもたらす。
【0009】
被験体における炎症応答または炎症によって引き起こされた既存の組織損傷または細胞損傷を処置するための方法を提供する。一つの実施形態において、方法は、炎症応答または炎症によって引き起こされた既存の組織損傷または細胞損傷を処置するのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。一つの局面において、既存の組織損傷または細胞損傷は、慢性または急性の炎症応答または炎症によって引き起こされる。別の側面において、炎症応答または炎症は、抗体または細胞によって少なくとも部分的に媒介される。なお別の局面において、既存の組織損傷または細胞損傷は、胸腺、肝臓、腎臓、脾臓、皮膚、または骨格関節(例えば、膝、足首、臀部、肩、手首、手指、足指または肘)に存在する。さらに別の局面において、この処置は、組織損傷もしくは細胞損傷の逆転をもたらすか、またはさらなる組織損傷もしくは細胞損傷の阻害もしくは予防をもたらす。
【0010】
被験体における巨脾腫症を処置する方法もまた、提供する。一つの実施形態において、方法は、巨脾腫症を処置するのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。
【0011】
さらに、所望でない脾細胞の増殖もしくは生存を有する被験体または所望でない脾細胞の増殖もしくは生存を有するリスクを伴う被験体における脾細胞の増殖または生存を阻害する方法を提供する。一つの実施形態において、方法は、脾細胞の増殖または生存を阻害するのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。
【0012】
さらに、所望でない脾細胞の増殖もしくはアポトーシスを有する被験体または所望でない脾細胞の増殖もしくはアポトーシスを有するリスクを伴う被験体における脾細胞の分化またはアポトーシスを刺激する方法を提供する。一つの実施形態において、方法は、脾細胞の分化またはアポトーシスを刺激するのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。
【0013】
所望でない抗体数を有する被験体または所望でない抗体数を有するリスクを伴う被験体における脾細胞による抗体産生を減少させる方法を提供する。一つの実施形態において、方法は、脾細胞による抗体(例えば、自己抗体)産生を減少させるのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。
【0014】
所望でない脾細胞数を有する被験体または所望でない脾細胞数を有するリスクを伴う被験体における抗体を産生する脾細胞の数を減少させる方法もまた提供する。一つの実施形態において、方法は、抗体(例えば、自己抗体)を産生する脾細胞の数を減少させるのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。
【0015】
さらに、所望でないナチュラルキラー(NK)細胞の細胞傷害性を有する被験体または所望でないNK細胞の細胞傷害性を有するリスクを伴う被験体におけるNK細胞の細胞傷害性を減少させる方法を提供する。一つの実施形態において、方法は、所望でないNK細胞の細胞傷害性を減少させるのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。
【0016】
さらに、被験体における移植細胞、移植組織または移植器官の拒絶を阻害する方法を提供する。一つの実施形態において、方法は、移植細胞、移植組織または移植器官(例えば、同種移植片または異種移植片)の拒絶を阻害するのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。種々の局面において、PAは、細胞、組織または器官の移植前に、移植と実質的に同時に、または移植後に投与される。
【0017】
リンパ系細胞の分化を刺激する方法を提供する。一つの実施形態において、方法は、一つ以上のリンパ系細胞の分化を刺激するのに十分な、有効量のプロテインA(PA)を含む組成物と、一つ以上のリンパ系細胞とをインビトロ、エキソビボまたはインビボで接触させる工程を包含する。種々の局面において、リンパ系細胞は、T細胞またはB細胞である。
【0018】
本発明はまた、活性を達成するために必要とされる少ない量のPAに少なくとも一部基づいている。特に、PAは、低濃度(代表的に、スーパー抗原の適用に使用されるよりも少ない量)で前述の活性を有する。
【0019】
従って、本発明の方法は、実質的なスーパー抗原活性、Fc結合活性または実質的な体液性免疫の刺激はないが、本明細書に開示された一つ以上の活性を惹起するために有効な量のPAで実施され得る。一つの実施形態において、量は、約1pg〜約1μgのPA用量である。別の実施形態において、量は、約1〜15週間にわたって断続的に投与される、約1pg〜約1μgのPAの単回用量である。さらに別の実施形態において、量は、約7〜21日間にわたって隔日で投与される、約1pg〜約1μgのPAの単回用量である。
【0020】
さらに、本発明は、単位投与形態において、本明細書に開示された一つ以上の活性を惹起する組成物を提供する。一つの実施形態において、組成物は、約0.5〜5pg、5〜10pg、10〜20pg、20〜50pg、50〜100pg、100〜500pgまたは100〜1000pgの単位投与形態のPAを含む。別の実施形態において、組成物は、約1〜10ng、10〜100ng、100〜500ngまたは約500〜1000ngの単位投与形態のPAを含む。さらに別の実施形態において、組成物は、被験体の炎症応答または炎症を軽減するのに十分な、単位投与形態のPAを包含する。
【0021】
単位投与形態のPA(例えば、0.5〜5pg、5〜10pg、10〜20pg、20〜50pg、50〜100pg、100〜500pgまたは100〜1000pg;1〜10ng、10〜100ng、100〜500ngまたは約500〜1000ng)を含む薬学的組成物を提供する。本明細書に開示された一つ以上の活性(例えば、被験体における炎症応答または炎症を軽減する)を惹起する単位投与形態のPAを含む薬学的組成物を提供する。
【0022】
単位投与形態のPA(または薬学的組成物)を含むキットもまた提供し、このようなキットは必要に応じて、本発明の方法(例えば、被験体における炎症応答、炎症、または炎症応答もしくは炎症によって引き起こされる組織損傷もしくは細胞損傷を軽減する)における使用説明書をさらに含む。一つの実施形態において、キットは、複数の単位投与形態のPAを含む。別の実施形態において、キットはさらに、薬物(例えば、炎症応答または炎症を軽減する)を含む。
本発明は、例えば以下の項目を提供する。
(項目1)
被験体における免疫応答を調節するための方法であって、該方法は、該免疫応答を調節するのに十分な、有効量のリンパ球分化因子を含む組成物を該被験体に投与する工程を包含する、方法。
(項目2)
前記リンパ球分化因子がプロテインA(PA)を含む、項目1に記載の方法。
(項目3)
免疫機能不全を有する被験体または免疫機能不全のリスクを伴う被験体における免疫機能不全を処置するための方法であって、該方法は、該免疫機能不全を処置するのに十分な、有効量のプロテインA(PA)を含む組成物を該被験体に投与する工程を包含する、方法。
(項目4)
前記免疫機能不全が自己免疫障害を含む、項目3に記載の方法。
(項目5)
前記自己免疫障害が慢性関節リウマチ、若年性慢性関節リウマチ、変形性関節症、乾癬性関節炎、糖尿病、多発性硬化症、脳脊髄炎、重症筋無力症、全身性エリテマトーデス(SLE)、自己免疫性甲状腺炎、アトピー性皮膚炎、湿疹性皮膚炎、乾癬、シェーグレン症候群、クローン病、アフタ性潰瘍、虹彩炎、結膜炎、角結膜炎、潰瘍性大腸炎、喘息、アレルギー性喘息、皮膚エリテマトーデス、強皮症、腟炎、直腸炎、癩性結節性紅斑、自己免疫性ブドウ膜炎、アレルギー性脳脊髄炎、急性壊死性出血性脳症、特発性両側性進行性感音難聴、再生不良性貧血、赤芽球癆、特発性血小板減少症、多発性軟骨炎、ヴェーゲナー肉芽腫症、慢性活動性肝炎、スティーブンス・ジョンソン症候群、特発性スプルー、扁平苔癬、グレーブス病、サルコイドーシス、原発性胆汁性肝硬変、後部ブドウ膜炎、間質性肺線維症、橋本甲状腺炎、自己免疫性多腺性症候群、インスリン依存性糖尿病、インスリン抵抗性糖尿病、免疫調節性不妊症、自己免疫性アジソン病、尋常性天疱瘡、落葉状天疱瘡、疱疹状皮膚炎、自己免疫性脱毛症、白斑、自己免疫性溶血性貧血、自己免疫性血小板減少性紫斑病、悪性貧血、ギヤン−バレー症候群、スティッフマン症候群、急性リウマチ熱、交感性眼炎、グッドパスチャー症候群、全身性壊死性血管炎、抗リン脂質抗体症候群またはアレルギーを含む、項目4に記載の方法。
(項目6)
炎症応答を有する被験体または炎症応答のリスクを伴う被験体における炎症応答を軽減する方法であって、該方法は、炎症応答を軽減するのに十分な、有効量のプロテインA(PA)を含む組成物を該被験体に投与する工程を包含する、方法。
(項目7)
前記炎症応答が、慢性または急性である、項目6に記載の方法。
(項目8)
前記炎症応答が、抗体によって少なくとも部分的に媒介される、項目6に記載の方法。
(項目9)
前記抗体が、一つ以上の自己抗体を含む、項目8に記載の方法。
(項目10)
前記炎症応答が、細胞性免疫によって少なくとも部分的に媒介される、項目6に記載の方法。
(項目11)
炎症を有する被験体または炎症のリスクを伴う被験体における炎症を処置するための方法であって、該方法は、該炎症を軽減するのに十分な、有効量のプロテインA(PA)を含む組成物を該被験体に投与する工程を包含する、方法。
(項目12)
前記炎症が、慢性または急性である、項目11に記載の方法。
(項目13)
前記炎症が、抗体または細胞によって少なくとも部分的に媒介される、項目11に記載の方法。
(項目14)
前記処置が、炎症症状の重篤度の軽減をもたらす、項目11に記載の方法。
(項目15)
前記症状が、腫脹、疼痛、頭痛、発熱、嘔気、骨格関節硬直、または組織損傷もしくは細胞損傷を含む、項目14に記載の方法。
(項目16)
前記処置が、抗体産生またはリンパ系細胞増殖の阻害をもたらす、項目11に記載の方法。
(項目17)
被験体における炎症応答または炎症によって引き起こされた組織損傷または細胞損傷を阻害する方法であって、該方法は、炎症応答または炎症によって引き起こされた組織損傷または細胞損傷を処置して阻害するのに十分な、有効量のプロテインA(PA)を含む組成物を該被験体に投与する工程を包含する、方法。
(項目18)
前記組織損傷または細胞損傷が、慢性または急性の炎症応答または炎症によって引き起こされる、項目17に記載の方法。
(項目19)
前記炎症応答または炎症が、抗体または細胞によって少なくとも部分的に媒介される、項目17に記載の方法。
(項目20)
前記組織損傷または細胞損傷が、胸腺、肝臓、腎臓、脾臓、皮膚、または骨格関節に存在する、項目17に記載の方法。
(項目21)
前記骨格関節が、膝、足首、臀部、肩、手首、手指、足指または肘を含む、項目20に記載の方法。
(項目22)
前記処置が、さらなる組織損傷または細胞損傷の阻害または予防をもたらす、項目17に記載の方法。
(項目23)
被験体における炎症応答または炎症によって引き起こされた既存の組織損傷または細胞損傷を処置する方法であって、該方法は、炎症応答または炎症によって引き起こされた既存の組織損傷または細胞損傷を処置するのに十分な、有効量のプロテインA(PA)を含む組成物を該被験体に投与する工程を包含する、方法。
(項目24)
前記既存の組織損傷または細胞損傷が、慢性または急性の炎症応答または炎症によって引き起こされる、項目23に記載の方法。
(項目25)
前記炎症応答または炎症が、抗体または細胞によって少なくとも部分的に媒介される、項目23に記載の方法。
(項目26)
前記既存の組織損傷または細胞損傷が、胸腺、肝臓、腎臓、脾臓、皮膚、または骨格関節に存在する、項目23に記載の方法。
(項目27)
前記骨格関節が、膝、足首、臀部、肩、手首、手指、足指または肘を含む、項目26に記載の方法。
(項目28)
前記処置が、組織損傷または細胞損傷の逆転をもたらす、項目23に記載の方法。
(項目29)
前記処置が、さらなる組織損傷または細胞損傷の阻害または予防をもたらす、項目23に記載の方法。
(項目30)
被験体における巨脾腫症を処置する方法であって、該方法は、巨脾腫症を処置するのに十分な、有効量のプロテインA(PA)を含む組成物を該被験体に投与する工程を包含する、方法。
(項目31)
所望でない脾細胞の増殖もしくは生存を有する被験体、または所望でない脾細胞の増殖もしくは生存を有するリスクを伴う被験体における脾細胞の増殖または生存を阻害する方法であって、該方法は、該脾細胞の増殖または生存を阻害するのに十分な、有効量のプロテインA(PA)を含む組成物を該被験体に投与する工程を包含する、方法。
(項目32)
所望でない脾細胞の増殖もしくはアポトーシスを有する被験体または所望でない脾細胞の増殖もしくはアポトーシスを有するリスクを伴う被験体における脾細胞の分化またはアポトーシスを刺激する方法であって、該方法は、該脾細胞の分化またはアポトーシスを刺激するのに十分な、有効量のプロテインA(PA)を含む組成物を該被験体に投与する工程を包含する、方法。
(項目33)
所望でない抗体数を有する被験体または所望でない抗体数を有するリスクを伴う被験体における脾細胞による抗体産生を減少させる方法であって、該方法は、脾細胞による抗体産生を減少させるのに十分な、有効量のプロテインA(PA)を含む組成物を該被験体に投与する工程を包含する、方法。
(項目34)
所望でない脾細胞数を有する被験体または所望でない脾細胞数を有するリスクを伴う被験体における抗体を産生する脾細胞の数を減少させる方法であって、該方法は、該抗体を産生する脾細胞の数を減少させるのに十分な、有効量のプロテインA(PA)を含む組成物を該被験体に投与する工程を包含する、方法。
(項目35)
前記抗体が、一つ以上の自己抗体を含む、項目33または項目34のいずれかに記載の方法。
(項目36)
所望でないナチュラルキラー(NK)細胞の細胞傷害性を有する被験体または所望でないNK細胞の細胞傷害性を有するリスクを伴う被験体におけるNK細胞の細胞傷害性を減少させる方法であって、該方法は、所望でないNK細胞の細胞傷害性を減少させるのに十分な、有効量のプロテインA(PA)を含む組成物を該被験体に投与する工程を包含する、方法。
(項目37)
被験体における移植細胞、移植組織または移植器官の拒絶を阻害する方法であって、該方法は、移植細胞、移植組織または移植器官の拒絶を阻害するのに十分な、有効量のプロテインA(PA)を含む組成物を該被験体に投与する工程を包含する、方法。
(項目38)
前記細胞、前記組織または前記器官の移植前に、移植と実質的に同時に、または移植後にPAが投与される、項目37に記載の方法。
(項目39)
前記移植細胞、前記移植組織または前記移植器官が、同種移植片または異種移植片である、項目38に記載の方法。
(項目40)
リンパ系細胞の分化を刺激する方法であって、該方法は、一つ以上のリンパ系細胞の分化を刺激するのに十分な、有効量のプロテインA(PA)を含む組成物と、一つ以上のリンパ系細胞とをインビトロ、エキソビボまたはインビボで接触させる工程を包含する、方法。
(項目41)
前記リンパ系細胞が、T細胞またはB細胞である、項目40に記載の方法。
(項目42)
前記有効量が、約1pg〜約1μgのPAの用量である、項目1、3、6、11、17、23、30〜34、36、37または40のいずれかに記載の方法。
(項目43)
前記有効量が、約1pg〜約1μgのPAの用量である、項目1、3、6、11、17、23、30〜34、36、37または40のいずれかに記載の方法。
(項目44)
前記有効量が、約1〜15週間にわたって断続的に投与される、約100pg〜約1000pgのPAの単回投与である、項目1、3、6、11、17、23、30〜34、36、37または40のいずれかに記載の方法。
(項目45)
前記有効量が、約7〜21日間にわたって隔日で投与される、約1pg〜約1μgのPAの単回用量である、項目1、3、6、11、17、23、30〜34、36、37または40のいずれかに記載の方法。
(項目46)
被験体における炎症応答、炎症を軽減するのに十分な、単位投与形態のPAを含む、組成物。
(項目47)
前記単位投与形態が、約0.5〜5、5〜10、10〜20、20〜50、50〜100、100〜500または100〜1000pgである、項目46に記載の組成物。
(項目48)
炎症応答または炎症を軽減する薬物をさらに含む、項目47に記載の組成物。
(項目49)
被験体における 炎症応答、炎症を軽減するのに十分な、単位投与形態のPAを含む、薬学的組成物。
(項目50)
被験体における炎症応答、炎症または炎症応答もしくは炎症によって引き起こされる組織損傷もしくは細胞損傷を軽減するのに十分な単位投与形態のPAを含む、キット。
(項目51)
単位投与形態のPAおよび使用説明書を含む、キット。
(項目52)
複数の単位投与形態のPAをさらに含む、項目50または項目51に記載のキット。
(項目53)
炎症応答または炎症を軽減する薬物をさらに含む、項目50または項目51に記載のキット。
【図面の簡単な説明】
【0023】
【図1A】図1は、A)コントロールの未処置の正常マウス(C57BL/6J)の体重増加および成長動態を示す。
【図1B】図1は、B)未処置のBXSBマウスの体重増加および成長動態を示す。
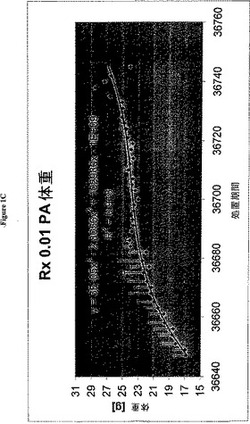
【図1C】図1は、C)PA処置を用いたBXSBマウスの体重増加および成長動態を示す。
【発明を実施するための形態】
【0024】
(詳細な説明)
本発明は、スーパー抗原特性、Fc結合活性または体液性免疫を刺激するその能力とは異なるように見える、プロテインA(PA)の一つ以上の活性の特徴づけに少なくとも一部基づいている。これらの異なるPA活性は、免疫機能不全などの所望でない生理学的プロセスまたは異常な生理学的プロセスを再調節するか、または正常にするPA能力に、少なくとも部分的に起因していると考えられている。生理学的プロセスを再調節するか、または正常にするPA能力は、多くの異なる有益な活性(例えば、異常な免疫応答または所望でない免疫応答を調節する(例えば、再調節するかまたは正常にする)活性、自己免疫を改善するかまたは減少させる活性、炎症または炎症応答を軽減させる活性、所望でない免疫応答または異常な免疫応答などの調節されていないプロセスによって引き起こされる組織損傷の少なくとも一部を阻害するかまたは逆転させる活性が挙げられる)を生じる。
特に、PA効力は、コラーゲン誘発性関節炎(CIA)のマウス炎症モデルの使用で示される。II型コラーゲンへの誘発された免疫応答は媒介され、抗体によって急激に進行する炎症応答を引き起こす(炎症応答は、罹患した関節の炎症を測定することによって、そしてまた、罹患した関節に対する標準臨床評価(「臨床指標」または「CI」と名づけられる)を適用することによって評価され得る)。CI評価は、腫脹および移動性の測定の両方にかかわる。実施例1に示されるように、低濃度のPAは、CIAマウスモデル系において急性の炎症応答を阻害する。膝および足関節の組織学的検査は、組織損傷における軽減および滑膜の免疫細胞の浸潤の減少を明らかにした。
【0025】
PA効力はまた、BXSB動物モデル(これは、雄動物の早期死を引き起こす、遺伝的な基礎を有する複合性自己免疫不全疾患を表す)で示される。実施例3〜実施例8に示されるように、低濃度のPAは、BXSB動物における多くの疾患特性を改変し、多くの場合、種々の疾病症状(細胞性および組織学的)を基準レベルに向けて(すなわち、正常化に向けて)、再調節する。例えば、PAは、るいそう(体重減少)の早期発症を阻害するか、または予防し;脾臓区画の拡大を調節し;体液性免疫の過剰発現または体液性免疫の過剰活性を阻害し;細胞性免疫の過剰発現または細胞性免疫の過剰活性を阻害し;リンパ系細胞系列の細胞分化を調節し;そして、疾患プロセスに起因する組織損傷または疾患プロセスに関連する組織損傷を改善するか軽減するかまたは逆転させる。このデータはさらに、PAがCIAモデルと同じ投与応答パターンを有することを示す。
【0026】
従って、低濃度でのPA活性としては、例えば、脾臓区画の拡大を調節する活性(増殖、アポトーシスまたは分化を調節する活性)、異常な体液性免疫または所望でない体液性免疫を調節する活性(自己抗体産生を阻害するかまたは自己抗体を産生する細胞を阻害する活性)、異常な細胞性免疫または所望でない細胞性免疫を調節する活性(TH1/TH2バランスを正常化し、細胞傷害性応答を阻害する活性)、リンパ系細胞系列内の細胞の増殖、アポトーシスまたは分化を調節する活性(例えば、CD69−CD4+などの成熟T細胞数を増加させるような、T細胞集団を正常化する活性)、所望でない免疫応答または異常な免疫応答によって引き起こされる細胞損傷または組織損傷を阻害するかまたは逆転させる活性(疾患の進行を阻害するかまたは予防する活性、疾患の逆転または組織再生を促進するかまたは増強する活性)、そしてT脾細胞数またはB脾細胞数あるいは一つ以上のマイトジェンに対する応答を正常化する活性のうちの1以上が挙げられる。
【0027】
従って、PAは、PAに関連する一つ以上の上記活性を必要とする被験体を処置するのに有用である。従って、本発明はとりわけ、(細胞性または体液性)免疫応答を調節する方法、所望でない免疫応答または異常な免疫応答(例えば、免疫機能不全)を処置するための方法、および被験体において免疫応答によって引き起こされる生理的な影響または免疫応答に関連する生理的影響を阻害するか、予防するかまたは逆転させるための方法を提供する。一つの実施形態において、方法は、免疫応答を調節するのに十分な、有効量のリンパ球分化因子を含む組成物を被験体に投与する工程を包含する。別の実施形態において、方法は、免疫応答を調節するのに十分な、有効量のPAを含む組成物を被験体に投与する工程を包含する。
【0028】
本明細書で使用される場合、用語「調節する」とは、この用語が言及する活性、機能または影響における検出可能な変化を意味する。調節するとは、この用語が言及する活性、機能または影響における任意の増加、減少、軽減、阻害、予防、刺激、促進、増強を意味し得る。例えば、免疫応答を調節するとは、免疫応答の活性、機能もしくは影響を、検出可能に変化させ(例えば、体液性免疫または細胞性免疫の増加、減少、低下、阻害、予防、刺激、促進、または増強など)ることを意味する。調節を示す免疫応答(例えば、T細胞数もしくはB細胞数、増殖、アポトーシス、分化、細胞傷害性、抗体産生もしくは抗体(例えば、自己抗体)産生細胞数、マイトジェン応答性、炎症、細胞損傷もしくは組織損傷、またはそれらの症状が挙げられる)における変化は、本明細書で開示された種々の方法または当該分野で公知の種々の方法によって、測定され得る。「有効量」または「十分な量」とは、活性または効果を達成するのに必要とされる量を意味する。
【0029】
本明細書で使用される場合、用語「再調節する」、「正常化する」およびそれらの文法的なバリエーションは、基準レベルに向けたシフトを意味する。基準レベルに向けたシフトとしては、例えば、細胞数の変化、分化状態、抗体産生もしくは抗体量(例えば、血液循環における自己抗体)、細胞傷害性またはマイトジェンへの反応が挙げられ得る。従って、BXSBの脾臓における脾細胞数を再調節するか、または正常化することは、例えば、正常(例えば、疾患のない)動物(例えば、C57BL/6)の脾臓で代表的に見出される脾細胞数に向けた回復を意味する。同様に、自己抗体を再調節するか、または正常化するとは、正常(例えば、疾患のない)動物でさらに代表的に見出される抗体の量を減少させることを意味する。BXSBにおけるT細胞集団を再調節するか、または正常化するとは、例えば、C57BL/6で代表的に観察されたT細胞集団に向けてT細胞集団をシフトさせること(例えば、未成熟T細胞集団から成熟T細胞集団への変化)を意味する。
【0030】
生じ得る再調節量または正常化量は、正常動物において代表的な基準レベルへの、またはほぼ基準レベル(基準の5〜25%内)への回復であり得るが、より低くてもよい(例えば、このシフトが基準レベルまたはほぼ基準レベル(例えば、基準レベルの25〜100%内または基準レベルの25〜200%内)へ回復しないとしても、基準レベルに向けての検出可能なシフト)。このシフトは、未処置の状態においての基準レベルからの偏りの程度、投与されたPA量、および基準レベルに戻るものに依存する。例えば、BXSBの脾細胞数は、C57BL/6より5倍〜6倍多い。従って、BXSBの脾細胞数の再調節または正常化は、脾細胞数が処置後のBXSBにおいて減少したことを意味する。例えば、C57BL/6マウスより5倍〜6倍多い脾細胞数からC57BL/6マウスより1倍〜3倍大きい脾細胞数への減少、またはさらに、例えば、C57BL/6マウスにおいて代表的に観察される(脾細胞数の約10〜50%以内の減少)。同様に、BXSBにおいて、5週目に200%のANAの増加、そして11週目に1000%のANAの増加がある。従って、BXSBにおける自己抗体の再調節または正常化は、自己抗体数(例えば、ANA)が処置後に減少することを意味する。例えば、0.01μgのPAを用いた処置は、これらの値を、基準またはほぼ基準(例えば、基準の25%の以内)に戻した。従って、自己抗体数は、C57BL/6マウスより10倍多い自己抗体数からC57BL/6マウスより5倍〜8倍多い自己抗体数へと、もしくはC57BL/6マウスより1倍〜5倍多い自己抗体数へと、またはさらに、例えば、C57BL/6マウスにおける自己抗体数の約10〜50%以内と減少し得る。
【0031】
本発明はさらに、とりわけ、免疫機能不全を有する被験体または免疫機能不全のリスクを伴う被験体における免疫機能不全を処置するための方法を提供する。一つの実施形態において、方法は、免疫機能不全を処置するのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。一つの局面において、免疫機能不全は自己免疫障害を含む。
【0032】
本明細書で使用される場合、「免疫機能不全」または「免疫障害」とは、所望でない免疫応答、所望でない免疫機能または所望でない免疫活性、すなわち、所望よりも高い免疫応答(例えば、自己免疫)または所望よりも低い免疫応答(例えば、免疫不全)を意味する。所望でない免疫応答、所望でない免疫機能または所望でない免疫活性は、正常な応答、正常な機能または正常な活性であり得る。従って、これらが所望でない限り、異常と考えらない正常な免疫応答は、これらの用語の意味の中に含まれる。所望でない免疫応答、所望でない免疫機能または所望でない免疫活性はまた、異常応答、異常機能または異常活性であり得る。異常(abnormal)または異常(aberrant)な免疫応答、異常(abnormal)または異常(aberrant)な免疫機能または異常(abnormal)または異常(aberrant)な免疫活性は、正常から逸脱している。免疫機能不全または免疫障害は、本質的に、主として、慢性または急性のいずれかの、体液性もしくは細胞性またはその両方の、免疫機能不全または免疫障害であり得る。
【0033】
免疫機能不全または免疫障害は、多くの異なる生理的な症状または生理的な異常によって特徴付けられる障害を含む。本明細書で開示される場合、BXSBマウスモデルは、本発明に従って処置され得る、非常に多数の生理的な症状および生理学的な異常によって特徴付けられる免疫障害である(例えば、実施例4〜実施例9を参照のこと)。従って、本発明は、BXSBマウスモデルと類似の一つ以上の生理的な症状または生理学的な異常を有する障害を含む、多くの異なる生理学的な症状または生理学的な異常によって特徴付けられる任意の免疫機能不全または免疫障害、または、異なる種における同等の障害を処置するのに有用である。例えば、BXSBマウスは、脾臓区画の拡大および結果的な未成熟脾細胞数の増加を導く、異常な脾細胞増殖、脾細胞アポトーシスまたは脾細胞分化によって特徴付けられる。従って、BXSBマウスにおいて数が増加する特定の脾細胞型は、免疫障害を伴う別の種のものとは(例えば、それらのCDマーカーに関して)異なるかもしれないが、本発明は、被験体において所望でない未成熟脾細胞数(過剰な細胞増殖、細胞生存またはアポトーシス不全によって引き起こされる)または減少した成熟脾細胞数を有すると特徴付けられる任意の傷害に適用可能である。
【0034】
従って、本発明は、免疫応答の多くの局面を再調節または正常化するために有用である(このことは、免疫障害の多くの異なる症状または異常の一つ以上を改善するかまたは軽減することを導く)ので、本発明は、BXSBマウスで生じる障害と異なる障害に対して広範に適用可能である。もちろん、本発明に従って処置可能な障害は、BXSBマウスに存在するものほど重篤ではないとはいえ、BXSBの一つ以上の特徴、症状または異常を有すると特徴付けられる障害を含む。
【0035】
本発明が適用する免疫障害の特定の例としては、自己免疫障害および免疫機能不全が挙げられる。自己免疫障害は、免疫系の所望でないまたは異常な、応答活性または機能として一般的に特徴づけられる。免疫機能不全は、減少したかもしくは不十分な、体液性免疫応答性もしくは細胞媒介性免疫応答性もしくは記憶によって一般的に特徴付けられるか、または増加した寛容もしくは所望でない寛容によって特徴付けられる。本発明に従って処置され得るこのような障害は、被験体において細胞損傷または組織/器官損傷を引き起こす障害を含むが、これらに限定されない。
【0036】
従って、本発明は、特に、自己免疫障害を有する被験体または自己免疫障害のリスクを伴う被験体における自己免疫障害を処置するための方法をさらに提供する。一つの実施形態において、方法は、自己免疫障害を処置するのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。種々の局面において、自己免疫障害は、慢性関節リウマチ、若年性慢性関節リウマチ、変形性関節症、乾癬性関節炎、糖尿病、多発性硬化症、脳脊髄炎、重症筋無力症、全身性エリテマトーデス(SLE)、自己免疫性甲状腺炎、アトピー性皮膚炎、湿疹性皮膚炎、乾癬、シェーグレン症候群、クローン病、アフタ性潰瘍、虹彩炎、結膜炎、角結膜炎、潰瘍性大腸炎、喘息、アレルギー性喘息、皮膚エリテマトーデス、強皮症、腟炎、直腸炎、癩性結節性紅斑、自己免疫性ブドウ膜炎、アレルギー性脳脊髄炎、急性壊死性出血性脳症、特発性両側性進行性感音難聴、再生不良性貧血、赤芽球癆、特発性血小板減少症、多発性軟骨炎、ヴェーゲナー肉芽腫症、慢性活動性肝炎、スティーブンス・ジョンソン症候群、特発性スプルー、扁平苔癬、グレーブス病、サルコイドーシス、原発性胆汁性肝硬変、後部ブドウ膜炎、間質性肺線維症、橋本甲状腺炎、自己免疫性多腺性症候群、インスリン依存性糖尿病、インスリン抵抗性糖尿病、免疫調節性不妊症、自己免疫性アジソン病、尋常性天疱瘡、落葉状天疱瘡、疱疹状皮膚炎、自己免疫性脱毛症、白斑、自己免疫性溶血性貧血、自己免疫性血小板減少性紫斑病、悪性貧血、ギヤン−バレー症候群、スティッフマン症候群、急性リウマチ熱、交感性眼炎、グッドパスチャー症候群、全身性壊死性血管炎、抗リン脂質抗体症候群またはアレルギーを含む。
【0037】
本発明は、特に、免疫不全を有する被験体または免疫不全のリスクを伴う被験体における免疫不全を処置するための方法をさらに提供する。一つの実施形態において、方法は、免疫不全を処置するのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。種々の局面において、免疫不全は、リコンビナーゼ活性化遺伝子(RAG1/2)欠損症、アデノシンデアミナーゼ(ADA)欠損症、インターロイキンレセプターγ鎖(γc)欠損症、ヤヌース関連キナーゼ3(JAK3)欠損症および細網発育不全などの重症複合型免疫不全(SCID);ディ・ジョージ症候群、ヌード症候群、T細胞レセプター欠損症、MHCクラスII欠損症、TAP−2欠損症(MHCクラスI欠損症)、ZAP70チロシンキナーゼ欠損症、およびプリンヌクレオチドホスホリラーゼ(PNP)欠損症などの原発性T細胞免疫不全;X連鎖無γグロブリン血症(ブルトンチロシンキナーゼ欠損症)などの優性抗体欠損症;μ重鎖欠損症などの常染色体劣性無γグロブリン血症;代用軽鎖(γ5/14.1)欠損症;X連鎖(CD40リガンド欠損症)などの高IgM症候群;Ig重鎖遺伝子欠失;IgA欠損症;IgGサブクラスの欠損症(IgA欠損症有、または無し);分類不能型免疫不全(CVID);正常免疫グロブリンを有する抗体欠損症;一過性乳児低ガンマグロブリン血症;インターフェロンγレセプター(IFNGR1、IFNGR2)欠損症;インターロイキン12レセプター欠損症およびインターロイキン12レセプター欠損症;胸腺腫を有する免疫不全;ヴィスコット−オールドリッチ症候群(WASタンパク欠損症);毛細管拡張性運動失調(ATM欠損症);X連鎖リンパ増殖性症候群(SH2D1A/SAP欠損症);および高IgE症候群を含む。さらに別の局面において、免疫機能不全は、別の疾患(例えば、ブルーム症候群、色素性乾皮症、ファンコーニ貧血、ICF症候群、ナイメーヘン切断症候群およびゼッケル症候群などの染色体不安定または欠損修復;ダウン症候群(21トリソミー)、ターナー症候群および第18番染色体の欠失または環状化(18p−および18q−)などの染色体欠損症;短肢骨格形成異常(短肢矮小発育症)および軟骨毛髪形成不全症(骨幹端軟骨形成)などの骨格異常;シムケ免疫骨性形成異常、デュボヴッツ症候群、SCIDを有する後弯肢異形成症(Kyphomelic dysplasia)、マリブレイ小人症、成長遅延、顔の奇形ならびに免疫不全および早老症(ハッチソン−ギルフォード症候群)などの全身性成長遅延に関連する免疫不全;欠指・外胚葉異形成・裂隙症候群、母指欠損を有する免疫不全、臭覚障害および魚鱗癬、部分的な白皮症、先天性角化不全症、ネザートン症候群、無汗性外胚葉性形成異常、パピヨン−ルフェーヴル症候群および先天性魚鱗症などの皮膚欠損を有する免疫不全;腸性先端皮膚炎、第2トランスコバラミン欠損、1型遺伝性オロチン酸尿、難治性下痢、異常顔面、裂毛症および免疫不全、メチルマロン酸血症、ビオチン依存性カルボキシラーゼ欠損、マンノシドーシス、グリコーゲン蓄積症、lb型、チェディアック−東症候群などの遺伝性代謝欠損;家族性異化亢進、腸リンパ管拡張症などの免疫グロブリンの異化亢進;慢性粘膜皮膚カンジダ症;遺伝性または先天性の脾機能低下症または無脾症;あるいはアイベルマルク(Ivermark)症候群)に関連するか、または続発性の免疫不全を含む。
【0038】
本発明が適用する免疫機能不全または免疫障害のさらなる特定の例は、所望でないかまたは異常な炎症応答または炎症を含む。このような障害は、細胞性免疫または体液性免疫、あるいは両方の組み合わせによって媒介され得る。
【0039】
従って、本発明はまた、特に、炎症応答もしくは炎症を有する被験体または炎症応答炎症応答もしくは炎症のリスクを伴う被験体における、炎症応答または炎症(慢性または急性)を軽減するかまたは阻害するための方法を提供する。一つの実施形態において、方法は、炎症応答を軽減するかまたは阻害するのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。別の実施形態では、方法は、炎症を軽減または阻害するのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。一つの局面において、炎症応答または炎症は、抗体(例えば、一つ以上の自己抗体)によって少なくとも部分的に媒介される。別の局面において、炎症応答または炎症は、細胞性免疫によって少なくとも部分的に媒介される。種々の局面において、方法(例えば、処置)は、炎症応答症状または炎症症状の重篤度または頻度の軽減をもたらす。特定の局面において、症状は、腫脹、疼痛、頭痛、発熱、嘔気、骨格関節硬直、または組織損傷もしくは細胞損傷のうち1以上を含む。さらなる特定の局面において、方法(例えば、処置)は、抗体産生またはリンパ系細胞増殖の阻害をもたらす。
【0040】
免疫機能不全、例えば、所望でないかまたは異常な炎症または炎症応答は、直接的にまたは間接的に、細胞損傷または組織/器官損傷(複数の細胞、組織または器官のいずれかにおいて、あるいは特に、単一の細胞型、器官、または組織型において)を引き起こし得る。例えば、実施例で開示されているように、CIAモデルおよびBXSBモデルは、組織学における変化によって証明されるように、複数の組織において損傷を示した。損傷を示した組織は、膝、足首、胸腺、腎臓および肝臓を含んだ。本発明に従った処置は、既存の組織障害の少なくとも部分的な逆転または正常組織の再生をもたらした(例えば、表9および表10を参照のこと)。
【0041】
従って、本発明はまた、特に、組織損傷または細胞損傷を処置するための方法、阻害するための方法および逆転するための方法、ならびに被験体において免疫機能不全(例えば、所望でないかまたは異常な炎症応答または炎症)によって引き起こされる組織再生または細胞再生を促進するための方法または増強するための方法を提供する。一つの実施形態において、方法は、免疫機能不全(例えば、所望でないかまたは異常な炎症応答または炎症)によって引き起こされた既存の組織損傷または細胞損傷を処置するのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。別の実施形態において、方法は、免疫機能不全(例えば、慢性または急性の所望でないかまたは異常な炎症応答または炎症)によって引き起こされた(既存のまたは予防)組織損傷または細胞損傷を阻害するのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。さらに別の実施形態において、方法は、免疫機能不全(例えば、所望でないかまたは異常な炎症応答または炎症)によって引き起こされた既存の組織損傷または細胞損傷を逆転するのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。さらに別の実施形態において、方法は、免疫機能不全(例えば、所望でないかまたは異常な炎症応答または炎症)によって引き起こされた組織再生または細胞再生を促進するかまたは増強するのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。一つの局面において、炎症応答または炎症は、抗体(例えば、一つ以上の自己抗体)によって少なくとも部分的に媒介される。別の局面において、炎症応答または炎症は、細胞性免疫によって少なくとも部分的に媒介される。さらに他の局面において、組織損傷は、胸腺、肝臓、腎臓、脾臓、皮膚、または骨格関節に存在する。特定の局面において、骨格関節の組織損傷は、膝、足首、臀部、肩、手首、手指、足指または肘に存在する。
【0042】
本発明の方法は、さらなる組織損傷または細胞損傷を阻害するかまたは予防する処置方法を含む。従って、本発明はまた、被験体における免疫機能不全(例えば、所望でないかまたは異常な炎症応答または炎症)によって引き起こされた既存の組織損傷または細胞損傷を処置する方法、およびさらなる組織損傷または細胞損傷を阻害するかまたは予防する方法を提供する。一つの実施形態において、方法は、免疫機能不全(例えば、所望でないかまたは異常な炎症応答または炎症)によって引き起こされるさらなる組織損傷または細胞損傷を阻害するかまたは予防するのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。本発明に従って処置できる既存の損傷の例としては、例えば、組織損傷または器官損傷が挙げられる。本明細書に開示されたように、例示的な損傷は、胸腺、肝臓、腎臓、脾臓、皮膚、または骨格関節(例えば、膝または足首)に存在する。
炎症応答または炎症の処置を含む本発明の方法は、炎症応答または炎症の症状または特性を軽減することが望ましい。全身レベルで、炎症応答または炎症は、一般的に、腫脹、疼痛、頭痛、発熱、嘔気、骨格関節硬直もしくは運動性の欠如、潮紅または他の変色によって特徴付けられる。細胞性レベルで、炎症応答または炎症は、その領域の細胞浸潤、抗体産生(例えば、自己抗体)、サイトカイン、リンフォカイン、ケモカイン、インターフェロンおよびインターロイキンの産生、増殖および成熟(例えば、分化因子)、細胞の増殖、分化、蓄積または移動、ならびに細胞損傷、組織損傷または器官損傷のうちの一つ以上によって特徴付けられる。従って、処置は、炎症応答または炎症の一つ以上の症状(重篤度または発生頻度)または特性を軽減するか、阻害するかまたは予防する。
【0043】
本発明の方法はまた、被験体における巨脾腫(すなわち、肥大した脾臓)を処置する工程を包含する。このような方法は、巨脾腫を処置するのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。任意の理論によって制限されることなく、巨脾腫を処置することは、代表的に、成熟リンパ球(例えば、T脾細胞またはB脾細胞)の増殖もしくは生存または未成熟細胞から成熟細胞への分化を刺激するか、増大させるかまたは促進するか、あるいは正常動物(すなわち、巨脾腫を示さない動物)のより代表的な生理学的状態への未成熟細胞の増殖または生存を阻害するかまたは減少させる。従って、成熟リンパ球(例えば、T脾細胞またはB脾細胞)の増殖もしくは生存または未成熟リンパ球から成熟リンパ球(例えば、T脾細胞またはB脾細胞)への分化を刺激する方法、増大させる方法または促進する方法、ならびに未成熟リンパ球(例えば、T脾細胞またはB脾細胞)の増殖または生存を阻害する方法または減少させる方法を、提供する。
【0044】
本発明の方法はさらに、被験体における抗体産生を阻害する工程、減少させる工程または予防する工程を包含する。一つの実施形態において、方法は、抗体産生を減少させるのに十分な、有効量のプロテインA(PA)を含む組成物を、所望でない抗体または異常な抗体を有する被験体に投与する工程を包含する。しかし、自己抗体は、その産生を阻害するか、減少させるかまたは予防することを望まれ得る抗体の例の一つである。抗体産生は、抗体を産生する細胞(例えば、脾細胞)に抗体産生を減少させることを引き起こすことによって直接的に、または抗体を産生する細胞(例えば、脾細胞)の数を減少させることによって間接的に、阻害され得、減少し得または予防され得る。
【0045】
本発明の方法はさらに、所望でないナチュラルキラー(NK)細胞の細胞傷害性を有する被験体または所望でないNK細胞の細胞傷害性を有するリスクを伴う被験体におけるNK細胞の細胞傷害性を阻害する工程、減少させる工程または予防する工程を包含する。一つの実施形態において、方法は、所望でないNK細胞の細胞傷害性を阻害するか、減少させるかまたは予防するのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。
【0046】
本発明の方法はさらに、リンパ系細胞の分化を刺激する工程、促進する工程または増強する工程を包含する。一つの実施形態において、方法は、リンパ系細胞の分化を刺激するか、促進するかまたは増強するのに十分な、有効量のプロテインA(PA)を含む組成物と、リンパ系細胞とをインビトロ、エキソビボまたはインビボで接触させる工程を包含する。
【0047】
用語「接触する」とは、二つ以上の実体の間(例えば、PAと細胞または分子との間)の直接的なまたは間接的な結合または相互作用を意味する。本明細書で使用される場合、接触は、溶液、固相、インビトロ、細胞およびインビボにおけるものを含む。
【0048】
PAの活性を検出するためのアッセイは、本明細書で開示されたように、そしてさらに当該分野で公知であるように、以下を含む;リンパ球数、増殖、アポトーシスまたは生存および分化における細胞変化(トリパンブルー排除(生存率を含む));細胞のCDマーカーまたは他の分子(分化)における変化;抗体量(例えば、循環している自己抗体は、ELISAまたは他の抗体検出アッセイを用いて測定され得る);さらなる損傷を阻害する工程または既存の組織損傷を回復する工程を包含する組織改善または器官改善(改善された機能を示す、組織、組織機能または器官機能あるいは酵素レベル);全身効果(体重増加または体重減少もしくはるいそう状態の減少(改善された移動性));および脾臓の拡大(組織、リンパ球数およびそれらの分化状態)。
【0049】
本発明は、被験体における所望でない免疫応答を阻害および、減少させるかまたは予防するために使用され得るので、被験体における移植細胞の拒絶、移植組織の拒絶または移植器官の拒絶(すなわち、対宿主性移植片病)を阻害するための方法、減少させるための方法または予防するための方法がさらに提供される。一つの実施形態において、方法は、移植細胞、移植組織または移植器官の拒絶を阻害するか、減少させるかまたは予防するのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。例示的な細胞としては、神経細胞が挙げられる。例示的な組織としては、皮膚、血管、眼および骨髄が挙げられる。例示的な器官としては、心臓、肺、肝臓および腎臓が挙げられる。種々の局面において、PAは、細胞、組織または器官の移植前に、移植と実質的に同時に、または移植後に投与される。移植細胞、移植組織または移植器官は、同種移植片または異種移植片であり得る。
【0050】
本明細書で使用される場合、用語「移植(transplant)」、「移植(transplantation)」およびそれらの文法的なバリエーションは、体の一部分から別な部分へまたは一つの個体/動物から別の個体/動物へ、細胞、組織または器官を移植すること(grafting)、移植すること(implanting)または移植すること(transplanting)を意味する。この用語はまた、例えば、エキソビボ遺伝子治療(ここでは、形質転換細胞、形質転換組織および形質転換器官は、移植を受けるヒトからもしくは異なるヒト/動物から得られたかまたは誘導される)によって、遺伝子的に改変された細胞、組織および器官を含む。
【0051】
本発明の方法および組成物は、インビトロ、エキソビボまたはインビボで使用され得る。組成物は、単回投与形態または複数回投与形態として、連続的に、隔日でまたは断続的に投与され得る。例えば、単回投与形態または複数回投与形態は、約7〜45日間または約1〜15週間にわたって、隔日でまたは断続的に投与され得る。一つの実施形態において、組成物は、3週間と5週間との間にわたって、隔日で単回用量として投与される。
処置は通常、被験体の状態における改善、すなわち、検出可能な被験体、被験体における組織または細胞または細胞集団に対して有益な変化を生じる。従って、処置は、状態または障害または症状の進行または悪化、あるいはさらなる悪化または状態もしくは障害の一つ以上の追加の症状の発症を、阻害するか軽減するか、または予防する結果となり得る。従って、成功裏の処置結果は、「治療効果」を導くか、あるいは、症状の重篤度もしくは頻度、または被験体における障害もしくは状態の根本にある原因を阻害するか、軽減するかもしくは予防することを導く。障害または状態を安定化させることはまた、成功裏の処置結果である。従って、処置は、状態または障害の一つ以上の症状の重篤度または頻度を軽減するかまたは予防し得、状態または障害の進行または悪化を阻害し得、そして、ある場合には、状態または障害を逆転し得る。従って、免疫障害の場合、例えば、処置は、免疫障害によって引き起こされる組織病理学的な変化または免疫障害に関連する組織病理学的な変化の改善を導き得る(例えば、骨格関節浸潤もしくは組織破壊、または胸腺、腎臓、肝臓、脾臓もしくは皮膚の組織浸潤もしくは組織破壊をさらに予防するかまたは軽減するかまたは再生する)。
【0052】
処置はまた、状態もしくは障害またはそれらの症状の根本にある原因に影響する工程を包含する。従って、免疫障害の場合、例えば、正常な基準に向けてリンパ球(例えば、脾細胞)絶対数または成熟リンパ球数を再調節するかまたは正常化することは、成功裏の処置結果であると考えられる。同様に、正常な基準に向けての循環抗体(例えば、自己抗体)の減少は、成功裏の処置結果であると考えられる。
【0053】
用語「改善する」とは、被験体の全般的な状態における検出可能な改善を意味する。検出可能な改善は、障害もしくは状態によって引き起こされる症状または障害もしくは状態に関連する症状の重篤度または頻度における主観的な減少、障害または状態の根本にある原因における改善、あるいは障害または状態の逆転(これは、アッセイを用いて検出可能である)を含む。
【0054】
本発明の方法は、症状が始まる前(すなわち、予防)もしくは症状が始まった後、症状または障害が発症する前または後(例えば、細胞移植、組織移植もしくは器官移植の前)に行われ得る。症状の発症前または症状発症後に組成物を投与することは、被験体における症状の重篤度または頻度を減少させ得る。さらに、症状発症前または症状発症直後に組成物を投与することは、例えば、免疫機能不全(例えば、自己免疫)の間に生じる細胞、組織および器官への損傷を減少させ得るかまたは予防し得る。
用語「被験体」とは、動物、代表的に哺乳動物(例えば、非ヒト霊長類(ゴリラ、チンパンジー、オランウータン、マカク、テナガザル)、家庭内動物(イヌおよびネコ)、農場動物(ウマ、ウシ、ヤギ、ヒツジ、ブタ)、実験動物(マウス、ラット、ウサギ、モルモット)ならびにヒト)をいう。ヒト被験体は、成人および小児を含む。ヒト被験体は、免疫機能不全を有する被験体または免疫機能不全を有するリスクを伴う被験体を含む。リスクを伴う被験体は、遺伝学的なスクリーニングを通して同定され得る。同定され得る遺伝的に連鎖した免疫障害の特定の例としては、X連鎖重症複合免疫不全症、アデノシンデアミナーゼ欠損症、ディ・ジョージ異常、毛細血管拡張性運動失調、ヴィスコット−オールドリッチ症候群、白血球接着不全および筋緊張性ジストロフィが挙げられる。これらの障害および他の障害は、胎児血液もしくは羊膜細胞を介してまたはサムター(Samter)免疫病;MM Frank、KF Austen,HN ClamanおよびER Unanue編集者;Little,Brown and Companyに記載されるように、成体組織サンプルを介して検出可能である。家族歴を再調査することは、障害(例えば、自己免疫または免疫不全)を発症する遺伝パターンまたはリスク(素因)増大を検出するのに使用され得る。リスクを伴う被験体はまた、特定の特性(例えば、所望でないかまたは異常なリンパ球集団(例えば、脾細胞)または自己抗体の存在)について、スクリーニングすることによって同定され得る。リスクを伴う被験体としては、細胞移植、組織移植または器官移植の必要性がある被験体が挙げられる。被験体はさらに、本発明の組成物のインビボでの効力を試験するための、疾患モデル動物(例えば、マウスおよび非ヒト霊長類)を含む(例えば、CIA、BXSB、EAEおよびSCIDマウスモデル)。
【0055】
本発明は、「リンパ球分化因子」(これは、細胞シグナル伝達またはシグナル伝達に対する応答を調節(regulating)または調節(modulating)し得る分子であり、これは、次に、その細胞自身、他の細胞の細胞行動またはその細胞が関与するプロセス(例えば、免疫系機能)を再調節し得るか、正常化し得るかまたは調節し得る)として既知の化合物を用いて実施される。本明細書で示される場合、リンパ球分化因子の特定の例は、PAである。PAについて本明細書で示されるように、リンパ球分化因子は、少ない量で、本発明に従って使用され得る。
【0056】
本発明はまた、本明細書に開示された活性のうちの一つ以上を生じ得る少ない量のPAに、少なくとも一部基づいている。例えば、二次性の抗原誘導時に開始する、隔日(M/W/F)で投与される1×10−5μg(1×10−11G)/用量のPAは、その後の炎症応答の発現および/もしくは進行を調節し、発現を調節し、そして/または炎症応答によって引き起こされた組織損傷を逆転した。しかし、このPA量において、実質的なスーパー抗原活性も体液性免疫の刺激もなかった。
【0057】
従って、本発明はまた、実質的なスーパー抗原活性を生じず、実質的な体液性免疫の刺激を生じず、またはFc結合とは実質的に独立してい、PAに関連する活性の一つ以上を生じ得る量のPAを含む、組成物を提供する。このような量でのPA活性としては、例えば、異常なまたは所望でない体液性免疫応答または細胞性免疫応答を再調節するかまたは正常化する(リンパ球の増殖、アポトーシスまたは分化を調節する)活性、自己免疫、炎症もしくは炎症応答または所望でないかもしくは異常な免疫応答によって引き起こされた組織損傷の少なくとも一部を阻害するか、逆転するか、改善するかまたは軽減する(疾患進行を阻害するかまたは予防する、疾患逆転もしくは組織再生を促進するかまたは増強する)活性、およびT脾細胞数もしくはB脾細胞数または一つ以上のマイトジェンに対するそれらの応答パターンを正常化する活性が挙げられる。
【0058】
従って、一つの実施形態において、組成物は、リンパ球の増殖、アポトーシスまたは分化を調節するのに十分な量のPAを含む。別の実施形態において、組成物は、自己免疫、炎症または炎症応答を阻害するか、逆転するか、改善するかまたは軽減するのに十分な量のPA量を含む。さらに別の実施形態において、組成物は、所望でないか異常な免疫応答によって引き起こされる細胞損傷、組織損傷または器官損傷の少なくとも一部を阻害するか、逆転するか、改善するかまたは軽減させるのに十分な量のPA量を含む。さらに別の実施形態において、組成物は、T脾細胞数もしくはB脾細胞数または一つ以上のマイトジェンに対するそれらの応答を再調節するかまたは正常化するのに十分な量のPA量を含む。一つの局面において、PA量は、1μg未満である。別の局面において、PA量は、1μg未満であるが、0.01ピコグラム(pG)より多くである。さらに別の局面において、PA量は、0.5〜0.1μg未満であるが、0.1pGより多くである。さらに別の局面において、PA量は、0.1〜0.01μg未満であるが、1pGより多くである。さらなる局面において、PA量は、1〜0.1μg未満であるが、1pGより多くである;0.1〜0.01μg未満であるが、1pGより多くである;0.01〜0.001μg未満であるが、1pGより多くである;1〜0.5μg未満であるが、1pGより多くである;500〜250pG未満であるが、1pGより多くである;250〜50pG未満であるが、5pGより多くである;そして、50〜25pg未満であるが、5pG(例えば、20pG、15pGまたは約10pG)より多くである。なおさらなる局面において、PA量は、実質的なスーパー抗原活性を生じないか、実質的な体液性免疫の刺激を生じないか、またはFc結合とは実質的に独立している。
【0059】
本明細書で使用される場合、用語「実質的にない」または「実質的に独立した」とは、スーパー抗原活性、体液性免疫の刺激またはPAのFc結合を参照して使用される場合、言及された特徴が、その量で観察されたPA活性に対して有意に寄与しないことを意味する。従って、実質的なスーパー抗原活性を生じないPA量は、PAのスーパー抗原活性がその量のPA活性に有意に寄与しないことを意味する。同様に、体液性免疫の実質的な刺激を生じないPA量は、少量の体液性活性を産生し得るが、一方、生じた免疫は、使用されるPA量において、PAの活性に有意に寄与しない。同様に、Fc結合とは実質的に独立したPA量は、使用されるPA量において、Fc結合がPA活性に有意に寄与しないことを意味する。言い換えれば、PAのFc機能を除去するかまたは損なうことは、使用された量におけるPAの活性を無効にしない。一般に、使用される少ない量のPA量において、スーパー抗原活性、体液性免疫の刺激またはPAのFc結合は、PA活性に有意に寄与しない。
【0060】
スーパー抗原活性は代表的に、非特異的なT細胞サブセットの増殖刺激によって特徴づけられる。すなわち、T細胞増殖は、エピトープ特異性から大部分は独立している。スーパー抗原活性は代表的に、約5〜10%のT細胞を増殖するように刺激するが、従来の抗原は、個体において約106個の細胞のうち一つを刺激し得る。従って、増殖するように刺激されたT細胞数を決定することによって、スーパー抗原活性はアッセイされ得る。このようなアッセイの例は、例えば、Johnsonら,Scientific American,1992年4月,92〜101頁;およびKotzinら,Adv.Immunol.54:99(1993)に記載される。スーパー抗原およびFC結合アッセイは、例えば、Romagnaniら,J.Immunol.129:596(1982)に記載される。FC結合アッセイは、例えば、Langone JJ,Adv.Immunol.32:157(1982)に記載される。体液性免疫刺激アッセイは、例えば、Leonettiら,J.Exp.Med.189:1217(1999)に記載される。
【0061】
従って、本発明の方法は、本発明の組成物を使用することによって実施され得る。例えば、一つの実施形態において、有効量のPAは、約0.1pg〜約1μgの用量である。別の実施形態において、有効量のPAは、約1pg〜約1μgの用量である。さらに別の実施形態において、有効量のPAは、約1pg〜約1μgの用量である。さらに別の実施形態において、有効量のPAは、約10pg〜約0.1μgの用量である。さらなる実施形態において、有効量のPAは、約10pg〜約0.1μgの単回用量である。
【0062】
組成物は、任意の経路によって、全身にまたは局所的に投与され得る。例えば、PAは、静脈内、経口(例えば、経口摂取もしくは吸入)、筋肉内、腹腔内、皮内、皮下、体腔内、頭蓋内、経皮(局所)、非経口(例えば、経粘膜(transmucosal))および直腸内に投与され得る。薬学的処方物を含む本発明の組成物は、マイクロカプセル化送達系を介して投与され得るか、または投与中移植物中に詰められ得る。
【0063】
組成物はさらに、本明細書に開示された活性の一つ以上を有する量のPAを含む薬学的処方物を含む。種々の実施形態において、薬学的処方物は、実質的なスーパー抗原活性がない状態で、実質的な体液性免疫の刺激がない状態で、またはFc結合とは実質的に独立した状態で、異常なもしくは所望でない体液性免疫応答もしくは細胞性免疫応答を再調節するかまたは正常化し(リンパ球の増殖、アポトーシスもしくは分化を調節する)、自己免疫、炎症もしくは炎症応答または所望でないかもしくは異常な免疫応答によって引き起こされた組織障害の少なくとも一部を阻害するか、逆転するか、改善するかまたは軽減し(疾患進行を阻害するかまたは予防する、疾患逆転もしくは組織再生を促進するかまたは増強する)、T脾細胞数もしくはB脾細胞数または一つ以上のマイトジェンに対するそれらの応答を正常化するのに十分な量のPA、ならびに薬学的に受容可能なキャリアまたは賦形剤を含む。
【0064】
本明細書で使用される場合、用語「薬学的に受容可能な」および「生理的に受容可能な」とは、(好ましくは、過度の有害な副作用(例えば、嘔気、腹痛、頭痛など)を生じないで)被験体に投与され得る、キャリア、賦形剤、希釈剤などをいう。投与のためのこのような調製物は、無菌の水性または非水性の溶液、懸濁液および乳濁液を含む。
【0065】
薬学的処方物は、被験体への投与に適合性のある、キャリア、希釈剤、賦形剤、溶媒、分散媒、コーティング、抗細菌剤および抗真菌剤、等張剤および吸収遅延剤などから作製され得る。このような処方物は、(コーティングされたかもしくはコーティングされていない)錠剤、(硬質もしくは軟質の)カプセル剤、マイクロビーズ、乳濁剤、散剤、顆粒剤、結晶、懸濁剤、シロップ剤またはエリキシル剤に含まれ得る。他の添加物の中でも補助活性化合物および保存剤はまた、例えば、抗微生物剤、抗酸化剤、キレート剤および不活性ガスなどを表し得る。
【0066】
薬学的処方物は、その意図される投与経路と適合性であるように処方され得る。従って、薬学的処方物は、腹腔内、皮内、皮下、経口(例えば、経口摂取もしくは吸入)、静脈内、体腔内、頭蓋内、経皮的(局所)、非経口的(例えば、経粘膜)および直腸内を含む経路による投与のために適切な、キャリア、希釈剤、または賦形剤を含む。
【0067】
非経口的、皮内もしくは皮下に適用するために使用される溶液または懸濁液は、以下を含み得る:無菌希釈剤(例えば、注射のための水、生理食塩水溶液、不揮発性油、ポリエチレングリコール、グリセリン、プロピレングリコールまたは他の合成溶液);抗細菌剤(例えば、ベンジルアルコールまたはメチルパラベン類);抗酸化剤(例えば、アスコルビン酸または重亜硫酸ナトリウム);キレート剤(例えば、エチレンジアミン四アセテート);緩衝剤(例えば、アセテート、シトレートまたはフォスフェート)および張度の調整のための因子(例えば、塩化ナトリウムまたはブドウ糖)。pHは、酸または塩基(例えば、塩酸または水酸化ナトリウム)で調整され得る。非経口用調製物は、ガラスまたはプラスチック製のアンプル、使い捨ての注射器または複数回用量のバイアルに入れられ得る。
【0068】
注射に適した薬学的処方物としては、無菌の水溶液(水溶性の場合)または水性分散物、および無菌の注射用溶液または分散液の即座の調製のための無菌粉末が挙げられる。静脈内投与については、適切なキャリアとしては、生理食塩水、静菌水、Cremophor ELTM(BASF、Parsippany,NJ)またはリン酸緩衝化生理食塩水(PBS)が挙げられる。このキャリアは、例えば、水、エタノール、ポリオール(例えば、グリセロール、プロピレングリコールおよび液体ポリエチレングリコールなど)、およびそれらの適切な混合物を含む、溶媒または分散媒であり得る。流動性は、例えば、レシチンなどのコーティングの使用によって、分散の場合における、必要な粒子サイズの維持によって、そして、界面活性剤の使用によって維持され得る。微生物の作用の予防は、種々の抗細菌剤および抗真菌剤(例えば、パラベン類、クロロブタノール、フェノール、アスコルビン酸、チメロサールなど)によって達成され得る。等張剤(例えば、糖、マンニトール(manitol)などの多価アルコール、ソルビトール、塩化ナトリウム)は、組成物内に含まれ得る。注射可能な処方物の長期吸収は、吸収を遅らせる因子(例えば、モノステアリン酸アルミニウムまたはゼラチン)を含むことによって達成され得る。
【0069】
経口投与について、組成物は、錠剤、トローチ剤またはカプセル剤(例えば、ゼラチンカプセル)の形態に、賦形剤と共に取り込まれ得る。薬学的に適合性のある結合剤および/またはアジュバント物質は、経口処方物に含まれ得る。錠剤、丸剤、カプセル剤、トローチ剤などは、以下の成分のどれか、または類似特性の化合物を含み得る:微結晶性セルロース、トラガカントゴムまたはゼラチンなどの結合剤;デンプンまたはラクトースなどの賦形剤、アルギン酸、Primogelまたはトウモロコシデンプンなどの崩壊剤;ステアリン酸マグネシウムまたはSterotesなどの滑沢剤;コロイド状二酸化ケイ素などのグリダント;スクロースまたはサッカリンなどの甘味剤;または、ペパーミント、サリチル酸メチルまたは香料などの矯味矯臭剤。
【0070】
処方物(例えば、放出を制御された処方物)はまた、急速な分解または体からの除去から組成物を保護するためのキャリア(体内でゆっくりと分解し、次に有効成分を放出する物質を含む)を含み得る。例えば、時間遅延物質(グリセリルモノステアレートまたはグリセリルステアレート)は、単独であるいはワックスとの組み合わせで、使用され得る。
【0071】
さらなる処方物は、投与された組成物の送達を制御するために、生分解性粒子もしくは生体適合性粒子、または高分子物質(例えば、ポリエステル、ポリアミン酸、ヒドロゲル、ポリビニルピロリドン、ポリ無水物、ポリグリコール酸、エチレン−ビニルアセテート、メチルセルロース、カルボキシメチルセルロース、硫酸プロタミン、またはラクチド/グリコリドコポリマー、ポリラクチド/グリコリドコポリマー、またはエチレンビニルアセテートコポリマー)を含む。このような処方物の調製方法は、当業者に明らかである。これらの物質はまた、例えば、Alza CorporationおよびNova Pharmaceuticals,Inc.から市販され得る。
【0072】
組成物の放出速度は、このような高分子の濃度または組成を変更することによって、制御され得る。例えば、組成物は、コアセルベーション技術または界面重合によって(例えば、ヒドロキシメチルセルロースもしくはゼラチンマイクロカプセルまたはポリ(メチルメタクリレート)マイクロカプセルの使用によって)、各々調製されたマイクロカプセル中に、あるいはコロイド薬物送達システム中に封入され得る。コロイド分散系としては、高分子複合体、ナノカプセル、マイクロスフェア、マイクロビーズならびに水中油型乳剤、ミセル、混合ミセルおよびリポソームを含む脂質ベースのシステムが挙げられる。例えば、米国特許第4,522,811号に記載されるような、当業者に公知の方法に従って、これらは調製され得る。
【0073】
投与に対して適切なさらなる薬学的処方物は、当該分野で公知であり、本発明の方法および組成物において適用できる(例えば、Remington’s Pharmaceutical Sciences(1990)第18版,Mack Publishing
Co.,Easton,PA;The Merck Index(1996)第12版,Merck Publishing Group,Whitehouse,NJ;およびPharmaceutical Principles of Solid Dosage Forms,Technonic Publishing Co.,Inc.,Lancaster,Pa.,(1993)を参照のこと)。
【0074】
本発明の組成物は、他の組成物との組み合わせを含み得、そして、本発明の薬学的組成物に含まれ得る。例えば、炎症応答もしくは炎症を減少させるか、または細胞の分化を刺激する薬物は、少ない量のPAと共に含まれ得る。例示的な薬物としては、ステロイド性抗炎症剤(SAI)および非ステロイド性抗炎症剤(NSAI)(例えば、コルチコステロイド、cox−2インヒビターまたはケモカインおよびサイトカイン(例えば、インターロイキンおよびインターフェロン)などの免疫系に影響を与える薬物)が挙げられる。
【0075】
薬学的処方物を含め、本発明の組成物は、例えば、本発明の方法を実施するキット(必要に応じて、使用説明書を含み得る)にパッケージされ得る。従って、本発明はキットを提供する。一つの実施形態において、キットは、適切な包装材料の中にパッケージされた、薬学的処方物を含む、本発明の一つ以上組成物(例えば、PA)を含む。さらなる実施形態において、キットは、本発明の方法を実施するためのラベルまたは添付文書を含む。従って、一つの実施形態において、キットは、免疫障害または免疫機能不全を有する被験体または免疫障害または免疫機能不全のリスクを伴う被験体をインビトロ、インビボもしくはエキソビボにおいて処置するための説明書を含む。なおさらなる実施形態において、キットは、自己免疫障害を有する被験体を少ない量のPAでインビボまたはエキソビボにおいて処置するための説明書を含む、ラベルまたは添付文書を含む。
【0076】
本明細書で使用される場合、用語「包装材料」とは、キットの構成要素を収容する物理的構造体をいう。包装材料は、構成要素を無菌的に維持し得、このような目的のために一般的に使用される物質(例えば、紙、波形繊維、ガラス、プラスチック、ホイル、アンプルなど)で作製され得る。このラベルまたは添付文書は、例えば、本発明の方法を実施する、適切な書面での説明書を含み得る。従って、本発明のキットはさらに、本発明の方法においてキットの構成要素を使用するための説明書を含み得る。
【0077】
説明書は、本明細書に記載された本発明の任意の方法を実施するための説明を含み得る。従って、本発明の薬学的組成物は、被験体への投与のための説明書と共に、容器、包装またはディスペンサーに含まれ得る。説明書はさらに、適応症、良好な臨床上の終点、起こり得る任意の有害な症状、またはヒト被験体での使用について米国食品医薬品局によって必要とされる追加情報を含み得る。
【0078】
この説明書は、「印刷物」(例えば、キット内の紙もしくは厚紙、キットもしくは包装材料に付けられたラベル、またはキットの構成要素を含むバイアルもしくはチューブに取り付けられたラベル)であり得る。説明書は、コンピュータ読み取り可能な媒体(例えば、ディスク(フロッピー(登録商標)ディスクもしくはハードディスク)、CD−ROMもしくはDVD−ROM/RAMなどの光学CD、磁気テープ、RAMおよびROMなどの電子記憶媒体および磁気/光学記憶媒体などのこれらのハイブリッド)に必要に応じて含まれ得る、音声またはビデオ・テープを含み得る。
【0079】
本発明のキットはまた、相乗効果もしくは相加効果を提供するか、または薬物もしくは障害の一つ以上の症状を軽減するかもしくは改善させる、一つ以上の薬物を含み得る。例えば、炎症応答または炎症を軽減する薬物が含まれ得る。例示的な薬物としては、ステロイド性抗炎症剤(SAI)および非ステロイド性抗炎症剤(NSAI)(例えば、コルチコステロイド、cox−2インヒビター)が挙げられる。本発明のキットはさらに、緩衝剤、保存剤または安定剤を含み得る。このキットはさらに、処置の活性または効果をアッセイするための制御成分を含み得る。このキットの各構成要素は、別々の個々の容器の中に入れられ得る。例えば、キットは、本明細書で説明されるように、少ない量のPAの1単位の投薬量(例えば、1μg未満から1pGまで)を含み得る。あるいは、キットは、少ない量のPAの複数単位投薬形態を含み得る。例えば、それぞれの複数単位投薬形態は、別々の個々の容器の中に少ない量のPAを含む(例えば、PAの各単位用量が、1用量あたり1μg未満から1pGまでである)。キット構成要素は、一つ以上の容器の混合物であり得、そして、種々の容器の全ては、単一のまたは複数のパッケージの中にあり得る。
【0080】
別に定義されない限り、本明細書で使用される全ての専門用語および学術用語は、この発明が属する分野の当業者によって一般的に理解されるのと同じ意味を有する。本発明に記載されるものと類似のまたは同等の方法および物質が、本発明の実施または試験で使用され得るが、適切な方法および物質が本明細書に記載される。
【0081】
本明細書に引用された全ての刊行物、特許および他の参考文献は、その全体が参考として援用される。矛盾する場合には、定義を含む本明細書が支配する。
【0082】
本明細書で使用される場合、単数形「a」、「an」および「the」は、文脈がそうでないと明確に示さない限り、複数の対象物を含む。従って、例えば、「リンパ球(a lymphocyte)」への言及は、複数のこのような細胞を含む。
【0083】
本発明の多くの実施形態が記載されている。それにもかかわらず、種々の改変が本発明の精神および範囲から逸脱しないで行われ得ることが理解される。従って、以下の実施例は例示であることが意図されるが、特許請求の範囲に記載される本発明の範囲を限定しないことが意図される。
【実施例】
【0084】
(実施例1)
本実施例は、動物炎症(関節炎)モデルおよび組織学データを記載し、非常に低い濃度で投与されたPAが、炎症を軽減し得、また炎症によって引き起こされた組織損傷を阻害または逆転し得ることを示す。
【0085】
各々5匹の動物の3つの群(処置群あたり合計15匹の動物)を用いた3つの別々の研究。最初の群は、リン酸緩衝化生理食塩水(PBS)を注射されたコントロールのキャリアである。第2群は、1日あたり1マウスあたり100μgのエンブレル(Enbrel)を受けた。製造業者(Immunex,Corp.,Seattle,WA)によって記載されるように、これは、最適のエンブレルの用量であった。第3群には、処置期間の間、月曜日、水曜日および金曜日に、10ピコグラム(pG)PA含有PBSキャリアを注入した(Amersham/Pharmacia Biotech,Piscataway,NJ)。PAはまた、Sigma−Aldrich,St.Louis,MO;Pierce Chemical Co.,Pittsburgh,PA;およびCalbiochem,San Diego,CAから獲得され得る。
【0086】
以下の表1は、これらの病気のかかりやすい動物において、進行性の炎症応答を示すコントロール群についての臨床指標データの概要を述べる。この応答は、使用制限時間内に、ピークまたはプラトーにならず、この応答がこれらの健康状態を危険にさらした場合に、コントロール動物を屠殺した。
【0087】
【表1】

【0088】
表1:CIAプロトコールによって処置した15匹のコントロール動物における、平均臨床指標測定値の生データ。このデータは、3つの別々の研究からプールしたデータである。
【0089】
表2は、同じ期間の間の、コントロール群の動物の足のカリパス測定値についての同様のデータを示す。これらのデータは、反応におけるプラトーが10日目より後に現れること以外は、臨床指標データを反映する。この反応プラトーは、代表的な抗体誘発性炎症応答の動態と一致する。
【0090】
【表2】

【0091】
表2:CIAプロトコールによって処置した15匹のコントロール動物における、平均カリパス足測定値の生データ。このデータは、3つの別々の研究からプールされたデータである。
【0092】
炎症応答の15日目に採取したコントロール動物の膝および足首の組織学的な分析は、広範囲の免疫浸潤および組織破壊を示した。免疫担当細胞は、コントロール動物の滑膜に蓄積した。エンブレルで処置した動物は、35日目に、膝および足首の滑膜における継続的な免疫の浸潤、ならびに継続的な組織破壊の証拠を示した。
【0093】
表3は、コントロールの未処置DBA/1動物の膝関節および足首関節の組織学的な検査結果の概要を述べる。これらの評点は、1から10までの連続スケール(1は「正常な」組織学的外観を表し、10は高度の損傷を表す)に対して、組織学者によって盲検に基づいて割りあてられる。コラーゲン誘発後のコントロール動物の膝関節および足首関節は、最大の組織損傷(「10」)を示す。これは、臨床指標(表1)および身体測定データ(表2)の両方と相関する。
【0094】
【表3】

【0095】
炎症応答35日目のPA処置した動物は、免疫浸潤のずっと少ない証拠および組織破壊のほんのわずかな証拠を示した。ほんのわずかな宿主免疫担当細胞が滑膜に存在し、また、組織片の証拠も組織破壊の証拠も無かった。従って、これらのデータは、PAがCIAモデルにおいて、急性炎症を軽減することを示す。これらのデータはまた、PAが組織損傷を軽減するか、または組織修復をエンブレルよりも促進することを示す。
【0096】
表4および表5は、PA(M/W/F注射あたり10pGで)の影響を試験する、3つの別々の研究結果を示す。エンブレルを比較として試験した;得られた結果は、公表された結果に匹敵した。PA処置は非常に効果的であり、標準エンブレルに必要とされる動物の数の約10%で有意性に達した。総臨床指標(表4)および身体測定(表5)についての結果は、匹敵する。
【0097】
【表4】

【0098】
【表5】

【0099】
表6は、これらの処置レジメンの間、1週目、2週目および3週目に屠殺したDBA/1マウスの組織学的評価の結果を示す。PA処置およびエンブレル処置の両方が、組織レベルにおいて有意な損傷を示す。これらのデータは、総臨床指標および足測定値(表4および表5)における有意な減少にもかかわらず、組織レベルでまだ損傷があることを示す。PA処置は、組織損傷を遅らせる(処置1週目 対 コントロール)ように見えるが、損傷を予防しない。
【0100】
【表6】

【0101】
CIAモデルプロトコールのように、2型コラーゲンを用いて誘発したDBA/1マウスを、2回目の抗原注射(コントロールについては溶媒キャリア(PBS)、PA(M/W/F注射あたり10pGで)およびエンブレル(毎日100μg/注射))の直後処置した。
【0102】
表7は、35日間まで処置を延ばした後の、組織学的な結果を示す。18日目に、人道的見地からコントロールマウスを屠殺し、そして、これらの18日目のデータを比較として含める。エンブレルの処置は、組織学的な損傷の改善を全く示さなかった。対照的に、PAの処置は、14〜21日目に、組織学的な損傷を逆転した。この組織学的なデータは、これらの動物の総臨床指標と相関する。従って、PA処置は、急性炎症応答の重篤度を有意に軽減し、そして、継続した処置は、この応答によって引き起こされた既存の組織損傷を逆転した。
【0103】
【表7】

【0104】
これらの組織の組織学的な評価は、低倍率、中程度の倍率および高倍率での評価を含んだ。コントロール(屠殺時、18日目)群およびエンブレル処置群の両方において、滑膜は多数の活性化リンパ球を有したが、処置35日目のPA群は、2型コラーゲン抗原誘発前のDBA/1動物におけるリンパ系細胞と数および形態が類似の小さなリンパ系細胞しか有さなかった。
【0105】
要するに、これらのデータは、足測定値および臨床指標評価がCIA動物モデルにおける誘発性炎症応答を実証すること;PAが、急性期の間、炎症応答を軽減し(P値 対 コントロール <0.05)、そして処置35日目までに応答によって引き起こされた組織学的な損傷を逆転すること;PAが、BXSB動物モデルおよび組織培養評価(以下においてさらに検討される)によって予測される濃度および投薬スケジュールにおいて、その改善効果を有すること;そして、エンブレル用量は、14日目に炎症を軽減する(N=15で有意とはいえない)が、35日目に観察された炎症損傷は軽減せず、これは、PAが、エンブレルよりも有効であることを示すことを示す。
【0106】
(実施例2)
本実施例は、PAの作用機序(MOA)が、エンブレルと異なるように見えることを示すデータについて説明する。
【0107】
CIA動物モデルにおいて受け入れられたMOAは、α−TNFの発現の競合阻害である。エンブレルは、既知のα−TNFインヒビターである。エンブレルのデータの回帰分析は、炎症応答の開始において遅延を示した。対照的に、PAのデータの回帰分析は、炎症プロセス自体における変化を示した。従って、PAのMOAは、主にα−TNF阻害を介するようには見えない。さらに、PAは、処置動物における誘発性炎症応答を軽減することにおいてエンブレルより効果的であるだけでなく、その応答によって引き起こされた既存の組織損傷を逆転し得る。
【0108】
任意の理論によって束縛されることはないが、従って、PAは、免疫依存性応答を統合する原因となる基底の制御機構を「調節」し得る。このMOAは、自己調節の観点から、単純な標的分子競合阻害の代わりにα−TNF阻害を含む。このようなMOAは、以下の特性を有すると予測される:
1)少量が必要とされる−付加機構に影響を及ぼす「分岐する」初期制御機構に対する調節効果;
2)自己調節性−PAが早期の制御点として作用する場合、このシステムは、副作用があったとえいてもほとんどない機構の強さおよび方向を調節する能力を有する;
3)多能性標的(すなわち、非細胞系列特異的)−PA制御点が早期である場合、その後の制御は多様であるはずであり、PAの濃度および投薬スケジュールは、一定であるはずである;ならびに
4)PAエフェクター分子構造は、多くのより複雑な構造と関連して見つけられるはずである。
【0109】
(実施例3)
本実施例は、早期死亡をもたらす遺伝学的な基礎を有する複合自己免疫不全疾患(combined autoimmune deficiency disease)によって特徴付けられた動物モデルにおいて、PAが多数の調節活性を有することを示すデータについて説明する。特に、PAは、るいそうの早期発症、脾臓区画の拡大を予防し、疾患プロセスによって引き起こされた組織損傷を改善するとともに、体液性免疫(自己抗体)、細胞性免疫(THl/TH2バランス)およびリンパ系細胞分化を調節する。
【0110】
BXSBマウスモデルは、オスにおける早期死亡(代表的には、腎不全による)を表す遺伝子(Yaa)に基づく動物モデルである。このモデルは、ヒト全身性エリテマトーデスについての類似物と文献で認められている。この遺伝子の欠損は、以下のパターンを有する一連の相関連した進行性全身性自己免疫疾患として発症する:胸腺萎縮症、抗核抗体、肝臓疾患、関節炎疾患、腎疾患および早期死亡。
【0111】
これは、複数の結果を有する遺伝的モデルであるので、他の研究者による以前の研究は、この疾患のただ一つの局面に集中した。本明細書で研究されたこの疾患プロセスの複数の局面に対するPAの影響は、以下を含む:
1.動物の生理機能に対する全体的影響
a.成長曲線
b.胸腺、肝臓、脳、腎臓、足首および膝の組織学
2.免疫調節−細胞増殖/アポトーシス
a.脾臓のサイズ、および
b.細胞数
3.リンパ球の動態
a.マイトジェン刺激に対するT/B応答
4.リンパ球の機能
a.体液性免疫
i.Ig−PFC産生
ii.自己抗体:ANA、抗カルジオリピン
b.細胞性免疫
i.ナチュラルキラー
c.細胞表面マーカー
d.細胞性サイトカイン
(研究検討)
1.慢性処置、異常:25匹のオスBXSB(コントロール+4つの処置群)の群を、15週間の期間にわたり、M/W/FにおいてPAで処置し、定期的に集団から離して(peel−off)屠殺した(通常処置3週間毎)。
【0112】
2.慢性処置、正常:15匹のオスC57BL/6Jの群を、15週間の期間にわたり、M/W/FにおいてPAで処置し、定期的に集団から離して屠殺した(通常処置3週間毎)。
【0113】
3.急性処置、異常:15匹のオスBXSBの群を、上記で決定したPA量を用いて、3週間にわたって処置し、次いで、これらの動物を処置3週後、処置6週後そして処置9週後に屠殺した。
【0114】
4.急性処置、正常:15匹のオスC57BL/6Jの群を、上記で決定したPA量を用いて、3週間にわたって処置し、次いで、これらの動物を処置3週後、処置6週後そして処置9週後に屠殺した。
【0115】
(PA濃度の決定)
PA量を、8ログにわたる濃度(1μG/注射から10−7μG/注射まで)でBXSBに投与した。この結果は、二つの最適なPAを示す(一方は0.01μG/注射、もう一方は10−5μG/注射)。用量応答曲線の形は、ガウス曲線である。明確にするために、提示されたデータは,10−5μG/注射についてである(図1)。
【0116】
図1は、PA投与後のオスBXSBの体重増加を示す。体重を、動物に、キャリアまたはPAのいずれかを注射した各時点で測定した。パネルAは、正常なC57BL/6Jマウス系統についての体重増加成長曲線であり、正常な体重増加成長曲線の代表的な形を示すために提示される。パネルBは、25匹のコントロールオスBXSBマウスからの体重増加データの累積和を示す。この曲線は、約4カ月齢における体重のピーク、その後の体重減少(これは、報告されたBSXB自己免疫疾患の発症に対応する)を示す。体重減少は、腎臓における免疫複合体の沈着に関連する「るいそう」症候群に至る。
【0117】
パネルCは、最適な2つの濃度(8つの濃度が研究された)におけるPAの慢性投与の影響を示す。0.01μG/注射および0.00001μG/注射の両方は、正常なロジスティックな形状であり、BXSBコントロールと比較してより良好な、体重増加成長曲線の両方の形に有意な変化を示し、両方の処置された動物群の平均体重は、コントロールよりも有意に高い(10−5μG用量について、X=24.16 P=0.0002)。
【0118】
これらの成長曲線を分析して、PAを用いてBXSB動物群を処置した場合のものとこれらを比較するために、回帰分析をデータについて実施した。上記に提示したC57BL/6Jの成長データは、以下の3次方程式によって最もよく表される:
【0119】
【数1】

【0120】
Rを二乗した値は、実際のデータと一次方程式との間で、非常に良いあてはめを示す。この方程式自体は「ロジスティック」形状の曲線(これは、正常成長曲線(図1)の代表である)の比較的に単純な抽出である。
【0121】
コントロールBXSBの成長曲線について、4つの別個のデータセットがある。全てのデータセットは内部で一致し、また、プールされたデータについての総合的な方程式は以下の通りである;
【0122】
【数2】

【0123】
この方程式は、図1のパネルAとパネルBとの間で示される曲線形状における相違の定量的な表示である。三次関数および二次関数は、全体の形状を規定し、非常に低い値は、重さの増加率および体重が時間の関数として減少するようである「るいそう」相を規定する。本研究において、目的は、各系統が各自の特定の増殖特性を有するので、C57BL/6J曲線の「ような(look like)」BXSB成長曲線を作成することではなく、むしろ、初期の増加率を増大し、図1(パネルD)において明確な「るいそう相」を減少させるかまたは除外することである。
【0124】
表8は、BXSB動物の種々のPA処置群に対するあてはめ方程式を示す。初期成長曲線の傾き(これは、増殖率を示す)は、BXSBコントロール動物において厳しく制限される。BXSBコントロール動物における変曲点は、疾患プロセスの致死効果を示す。この結果は、PA処置が、増殖率および致死率の両方に対して、用量依存性様式で正の効果を有することを示す。
【0125】
【表8】

【0126】
(組織学的な分析)
BXSBマウスモデルの種々の器官の組織学的な悪化は、複合自己免疫不全疾患の特徴である。この症候群は、複数の様相を有し、多数の器官に関わる。器官損傷は進行性であり、そして、個々の損傷は組織型によって変化し得る。
【0127】
表9は、より多くの量のPA(1〜0.001μg/注射)の組織学的な分析からの結果を示し、PAが組織学的な変化の開始および/または重篤度を用量依存性の様式で、変えたことを示す。表10は、より少ない量(0.00001〜0.0000001μg/注射)のPAについて同様のデータを示す。両方のPA用量は、器官組織学において最大の改善を示した。
【0128】
【表9】

【0129】
【表10】

【0130】
表9および表10における結果は、BXSBマウスのPA処置が、自己免疫性損傷を用量依存性の様式で減少させ得たことを表す。処置は、胸腺萎縮の発症を遅らせ、肝臓および関節の炎症の重篤度を軽減した。腎臓は、正常範囲内のままであった。PAを処置した動物の組織は、BXSBコントロール組織内に存在する損傷の逆転を示したが、C57BL/6J動物と比べて、それらは完全に正常であったというわけではない。最適なPA用量は、0.0001μgであり、これは、他のアッセイ系(例えば、Ig−PFC産生、NK活性、マイトジェン応答パターン、サイトカイン産生、自己抗体産生、脾臓サイズ、組織学的な改善)に一致する。
【0131】
要するに、本研究は、PAがるいそうの早期発症を予防し、そして、胸腺、肝臓、腎臓、膝および足首を含む組織での自己免疫疾患プロセスによって引き起こされる損傷を改善するかまたは逆転することを示す。
【0132】
(実施例4)
本実施例は、PAが、脾臓拡大および脾細胞数の阻害によって反映される、脾臓における免疫調節活性(例えば、増殖、アポトーシスまたは分化)を有することを示すデータについて説明する。
【0133】
研究の間、動物から脾臓を除去した。正常のC57BL/6Jの脾臓を基準点とした。未処置のBXSB動物からの脾臓は、有意に肥大していた。対照的に、PAを処置したBXSB動物の脾臓は、正常のC57BL/6Jの脾臓サイズに類似した。
【0134】
未処置のBXSB動物の肥大した脾臓は、巨脾腫として既知であり、広範囲の全身性の感染プロセスまたは異常な細胞アポトーシスもしくは異常な細胞増殖のいずれかの結果である。これらの動物は無菌環境で維持されるので、肥大した脾臓は不完全な細胞増殖/細胞死制御の結果のようである。肥大した脾臓についての別の説明は、この細胞が個々のサイズにおいて増大した(芽細胞症(blastosis)として知られているプロセス)ことであった。細胞サイズを測定する、蛍光活性化細胞選別(FACS)データの検査は、この可能性を除外した。FACS分析は、わずかに大きい細胞がBXSBコントロールで観察される傾向があるが、統計的に有意な増加は細胞サイズにおいて観察されなかったことを明らかにした。これらの所見と一致するのは、BXSB脾細胞数が、正常動物の脾細胞数の5倍より多いことである(表11、上)。
【0135】
【表11】

【0136】
表11(上)は、コントロールのマウス系統(C57BL/6JおよびDBA/2J)およびBXSBの両方のオスの脾臓の内容物を示す。BXSB脾細胞数は、両方の正常の系統で認められる脾細胞数の5倍より多い。PA処置は、BXSB脾細胞数を有意に減少させた(表11、下)。
【0137】
要するに、本研究は、PAが自己免疫疾患および脾細胞数によって引き起こされる脾臓区画の拡大(増殖/アポトーシス)を調節することを表す。PA処置は、脾臓サイズおよび脾細胞数を用量依存性の様式で、有意に減少させた。
【0138】
(実施例5)
本実施例は、BXSB動物が異常な脾細胞の分化または増殖またはアポトーシスを表すことを示すデータについて説明する。従って、このデータは、BXSB脾臓におけるPA活性が、異常な/不完全な脾細胞の分化または脾細胞の増殖/アポトーシスを再調節する(すなわち、正常な細胞増殖またはアポトーシスを回復する)ことを包含することを示す。
【0139】
マイトジェンは、細胞の一般集団(例えば、Tリンパ球および/またはBリンパ球)における細胞分裂を刺激する非特異的な能力を有するレクチンである。レクチンは、植物および動物で検出され、現代の抗体分子に対する前駆体として、最もよく特徴付けられる。レクチンは、細胞内連絡および他の連絡の形態で使用される。
【0140】
BXSBマウスにおけるTリンパ球区画が異常であるか否かを決定するために、T細胞特異的なおよびB細胞特異的な二つのマイトジェンを、BXSBマウスから単離された脾細胞の応答を研究するために、使用した。7つの異なるマイトジェン濃度および4つの動態学的な時点を、応答の大きさ(存在する細胞数の指標)、そして第二に最適の刺激濃度(細胞の分化状態の指標)に関して、BXSB動物の脾細胞応答を試験するために使用した。
【0141】
要するに、処置レジメンの間、BXSBマウスおよびコントロールマウスを、定期的に屠殺にし、それらの脾臓を除去した。1〜2×106/mlでの脾細胞懸濁液を、96ウェルプレートに分配する。マイトジェン(10μG/10μL〜0.01μG/10μL)を3連でウェルに添加し、24時間の間隔を置いて、培養24時間から96時間まで、この培養物を収集した。収集前の16時間の間に、全ての培養物をトリチウム化チミジンで処理した。新たに合成した放射性標識DNAを含むDNAをガラス繊維フィルター上に抽出し、この放射活性を液体シンチレーション計数によって決定する。
【0142】
【表12】

【0143】
表12は、植物性血球凝集素(PHA)、コンカナバリンA(Con−A)、ブドウ球菌エンテロトキシンB(SEB)およびリポポリサッカライド(LPS)に対するC57BL/6Jマウスのマイトジェン応答を示す。PHAおよびCon−Aは、基準となるTリンパ球集団を用量依存性様式で増殖するように刺激するが、SEBおよびLPSは、Bリンパ球集団の用量依存性増殖を刺激する。
【0144】
【表13】

【0145】
表13は、BXSBコントロールのマイトジェン研究からの結果を示す。統計的分析は、全てのマイトジェン応答がC57BL/6Jコントロールより有意に低いことを示す。さらに、BXSBコントロールに対するPHA応答曲線およびCon−A応答曲線の形は、正常なC57BL/6Jコントロールと異なる。両方において、ピーク応答を達するために、より低いマイトジェン濃度へのシフトがあった。応答曲線の形におけるこれらの変化は、分化状態における変化に関連した。
【0146】
【表14】

【0147】
表14は、コントロールBXSBとの統計的な比較を示す。マイトジェンは、コントロールC57BL/6に応答する。ほとんど全ての場合において、BXSBのマイトジェン応答の大きさは制御され、このことは、成熟細胞集団の縮小および最適応答濃度におけるより低い値へのシフトを示す。従って、これらのデータは、コントロールBXSB脾細胞における異常な分化(脾細胞の過剰増殖または減少したアポトーシスを導く)を示す。
【0148】
【表15】

【0149】
【表16】

【0150】
【表17】

【0151】
【表18】

【0152】
表15〜表18は、BXSB脾細胞のマイトジェン応答に対するPAの効果を示す。動態は複雑であるが、いくつかの結論に達し得る。PA(0.5μG)がPHA応答およびCon−A応答を上昇させることは、T細胞集団動態およびB細胞集団動態の正常化を示す。PAがまた、マイトジェン応答の大きさおよび応答曲線の形状の多くを回復させること、マイトジェンに対するT細胞応答またはB細胞応答の部分的または完全な回復を示す。
【0153】
要するに、本研究は、異常なBXSB脾性リンパ球数ならびに代表的なTマイトジェン応答およびBマイトジェン応答を、PA処置を用いて少なくとも部分的に訂正し得ることを示す。
【0154】
(実施例6)
本実施例は、PAがおそらくBXSB動物における組織破壊の原因となるようである自己抗体の量を減少させることを示すデータについて説明する。
【0155】
リウマチ様抗体が、RA患者において有意なパーセントで見出されるので、体液性免疫は、抗体産生の原因であり、そして重要である。異常抗体は、何人かの患者の滑膜で見出されている。BXSBモデルにおいて、異常抗体が産生される。
【0156】
コントロール動物およびPAを処置したBXSB動物から獲得した脾細胞を、プラーク形成細胞(PFC)アッセイにおいて研究した。このアッセイにおいて、標的赤血球は、抗原特異性にかかわらず任意の分泌された免疫グロブリンと結合する、プロテインAで標識され、その結果、体液性免疫の広い見解を提供する。
【0157】
【表19】

【0158】
表19は、コントロールBXSB脾細胞のIg−PFC応答を示す(これは、コントロールC57BL/6脾細胞よりも100倍以上大きく、BXSB動物における異常な抗体産生を示す)。
【0159】
【表20】

【0160】
表20は、Ig−PFC産生に対するPAの用量関連効果を示す。全てのPA量は、0.0001μG PA(最大の減少を示す)を用いて、Ig−PFCの過剰産生を有意に減少させた。
【0161】
BXSBコントロール脾細胞は、莫大なレベル(61400±6435PFC/1E06)で抗体を作製し、分泌する。これは、C57BL/6J正常コントロールで観察された値の約100倍である。PA処置は、自己抗体レベルを用量依存性様式および時間依存性様式において、有意に減少させる。
【0162】
【表21】

【0163】
表21は、BXSB動物における自己抗体の発生を示す(より大きい数ほど、より多い量の循環自己抗体を示す)。PA処置は、測定した全ての時点において、自己抗体レベルを減少させる。
【0164】
【表22】

【0165】
表22は、PA媒介性の自己抗体の減少が、用量依存性であることを示す。最大の減少は、0.00001μGで生じる。
【0166】
要するに、PAは、非特異的な自己抗体の数を調節し、損傷を与える自己抗体の量を減少させる。PAがまた、BXSBの脾臓における抗体産生細胞を減少させることは、このデータと関連する。従って、PA処置は、体液性免疫を少なくとも一部、回復させる。
【0167】
(実施例7)
本実施例は、PAがBXSBマウスの細胞傷害性応答を減少させ、この応答を基準レベルに、または基準レベル付近に再調節することを示すデータについて説明する。
【0168】
免疫系の細胞成分は、免疫系全体についての機能の主な積算器(primary integrator of function)であり、それらの種々の分化した形態のT細胞およびB細胞性を認識機能およびエフェクター機能の両方に供給する。BXSB動物モデルでは、細胞性免疫(CMI)系は完全であると報告されている。しかし、これらの報告とは反対に、以下に記載されるデータは、CMIがBXSBマウスにおいて影響を受けることを示す。
【0169】
放射性標識クロムで標識した非特異的な標的を認識し、溶解する可能性について、BXSBマウス(コントロールマウスおよびPAで処置されたマウスの両方)を研究した。手短にのべると、コントロール動物および処置したBXSBマウスからの約200μlの脾臓細胞(1×107/ml)を、マイクロタイタープレート上のRPMI培地にプレーティングし、5つの2倍連続希釈物をRPMI培地中に作製した。P815細胞をクロム(Cr5l)で放射性標識し、96ウェルプレートの各ウェルに添加し、12分間遠心分離し、次いで、37℃で3〜4時間インキュベートした。細胞を再度遠心分離し、Cr5lについて110μlのサンプルを計数した。より詳細なプロトコールは、Current
Protocols in Immunology,3.11,Assays for
T cell Functionに含まれる。
【0170】
【表23】

【0171】
表23は、正常マウス(真ん中のカラム)が、Cr51で標識したP−815標的に対するナチュラルキラー活性の代表的な基準レベルを有することを示す;このレベルは、100:1のエフェクター標的比において、0%と3%との間の細胞傷害性である;左のカラムは、同じ標的に対するBXSBマウスの細胞傷害性応答を示す;細胞傷害性のレベルは、6:1のエフェクター標的比において、50%を超えて、非常に高い。3〜15週間の期間にわたるBXSBのPA処置(右のカラム)は、何の回帰分析の可能性も有さず、細胞傷害性を基準レベルまで減少させた(すなわち、100:1のE/T比において、0〜3%)。
【0172】
要するに、この研究は、PA処置が未調節のBXSB細胞傷害性応答をコントロール基準レベルまでまたはコントロール基準レベル付近にまで20倍減少させることを示す。従って、PA処置は、細胞性免疫を少なくとも一部、回復させる。
【0173】
(実施例8)
本実施例は、PAが、リンパ系系列の細胞の細胞分化、増殖またはアポトーシスの調節を反映する、CDマーカーの発現を調節することを示すデータについて説明する。
【0174】
クラスター化決定基(CDマーカー)の発現は、リンパ系細胞の分化状態を示す。PAは、これらのマーカーを特異的に調節する。この調節は、上記に記載されるデータと直接的な相関を有する。
【0175】
【表24A】

【0176】
表24Aは、多くのT細胞性CDマーカーのデータを示す。約80%の正常脾細胞(BL6コントロール)は、非活性化(CD69−)T細胞(CD69−、CD4+)である。この集団は、若い(実験2〜10週、および10〜18週の暦齢)BXSB動物および老いた(実験11〜15週、および19〜23週の暦齢)BXSB動物の両方において減少する。また、動態学的な効果もある:11〜15週のBXSB動物は、それらのT細胞マーカーに関して、若いBXSB動物よりも厳しく損なわれている。これは、低下した細胞機能および増加した総死亡率に相関する。
【0177】
【表24B】

【0178】
表24Bは、多くのB細胞性CDマーカーのデータを示す。3つのマーカーの第1セットは、静止B細胞(すなわち、非活性化)を示し、最後の3つは、活性化B細胞を表す。これらのデータは、B細胞集団が、BXSBマウスにおける疾患プロセスの系統および段階の両方に抵抗性があることを示す。従って、BXSB複合免疫不全疾患プロセスの一次細胞性免疫の成分は、T細胞に関与するように見える。
【0179】
グラフ1は、種々のPA濃度(1E−03〜1E−07μgのPA/注射)を用いたBXSBマウスの慢性処置(3〜15週)の効果からのデータを示す。このデータの最初の著しい特徴は、PAを用いたBXSBマウスの処置が、CD69−/CD4+T細胞の集団を調節するということである。この調節は、1つの細胞集団がフィードバックと方向機構およびフィードフォワード方向との両方においてその系列(および他の細胞系列)において他に作用するので、予想される他のT細胞マーカーの調節に相関する。また、細胞集団についてのPA用量応答効果があり、これは、機能アッセイにおいて、上記に記載される応答と一致する;同様に、用量時間の動態学的な応答もある。これらのデータは、事実上、PA処置用量がT細胞の分化を調節することを示す。
【0180】
グラフ1はまた、E−03のPA用量が、早い時点においてBXSBコントロールで観察されるCD69−CD4+の減少を調整するが、慢性処置のより長期の時点でこの効果を失うことを表すデータを示す。対照的に、E−07用量は、短い時点と長い時点との両方において、有効であるように見える。これらのデータは、生体調節レジメン(Bio−Regulatory regimen))の特徴と一致する:1)用量応答曲線は、ガウス曲線である;そして、2)効果を産生する少量のPAは、より伝統的な単一エフェクター標的の代わりに、標的に指向したプロセスを示唆する。
【0181】
【表24C】

【0182】
表25は、単一の3週間の間、1週間につき3回、同じ量での急性処置、続いて、処置がないさらに6〜9週間と比べて、6〜9週間の期間にわたって1週間につき3回投与された慢性的なPA(1E−05μG/用量)の効果を示す。急性処置は、CDマーカーの提示を調節するのに有効である。複雑であるが、データは種々のマーカー間の相関を示す;一方、CD8系列は、CD4細胞系列またはB細胞系列よりもPAに対して感受性が最も低いように見える。
【0183】
【表25】

【0184】
表26は、これらの研究で使用された9つのT細胞マーカー系列についての、単一のPA用量(1E−05μG)の時間プロフィールを示す。さらに、二重陽性細胞(アポトーシスが運命づけられている)およびCD8を有する活性化系列は、処置に対して相対的に抵抗性である。PA処置用量は、活性化CD4系列および成熟細胞傷害性T細胞(CD8+CD4−)を調節する。
【0185】
【表26】

【0186】
要するに、本研究は、急性または慢性のPA処置が、BXSBマウスにおけるT細胞性CDマーカーを用量依存性様式および動態学依存的様式において調節したこと(これは、正常なマイトジェン応答の一部の回復(実施例5)、自己抗体産生の減少(実施例6)および細胞傷害性応答の軽減(実施例7)を含む、上記に記載される機能的な変化と関連がある)を示す。従って、PAはリンパ系系列の細胞の分化結果を調節する。
【技術分野】
【0001】
本発明は、免疫応答調節ならびに免疫障害および免疫障害に関連する免疫病理または免疫障害によって引き起こされた免疫病理の処置に関する。
【背景技術】
【0002】
(背景)
プロテインAは、種々の細菌の細胞壁から抽出された40,000Daの糖タンパク質である。細菌は、組織結合のための標的部位および結合部位として、PAを使用する。プロテインAは、特定の免疫グロブリンクラスのFc部位に対して高いアフィニティーを有し、一旦、免疫グロブリンが抗原に結合すると、これらの免疫グロブリンに対してさらに高いアフィニティーを有する。PAのこの生化学的特性は、多くの適用に使用されている。PAのこれらの適用は、分子のFc結合特性の使用、または特定の抗原誘導(スーパー抗原の適用)の非存在下で体液性免疫を刺激するPA能力を反映する。
【発明の概要】
【課題を解決するための手段】
【0003】
(要旨)
本発明は、Fc結合特性およびスーパー抗原特性とは異なるPAの特徴に少なくとも部分的に基づく。この特徴は、動物において、以下の活性のうちの一つ以上を与える:異常なプロセスを再調節する能力、および組織損傷を阻害する能力または調節されていないプロセスによって引き起こされた既存の組織損傷の少なくとも一部を回復する能力;異常な免疫プロセスまたは所望でない免疫プロセスを再調節する能力。
【0004】
従って、本発明は、被験体における免疫応答を調節するための方法を提供する。一つの実施形態において、方法は、免疫応答を調節するのに十分な、有効量のリンパ球分化因子を含む組成物を、被験体に投与する工程を包含する。一つの局面において、リンパ球分化因子は、プロテインA(PA)を含む。
【0005】
免疫機能不全を有する被験体、または免疫機能不全のリスクを伴う被験体において、免疫機能不全を処置するための方法もまた提供される。一つの実施形態において、方法は、免疫機能不全を処置するのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。一つの局面において、免疫機能不全は、自己免疫障害(例えば、慢性関節リウマチ、若年性慢性関節リウマチ、変形性関節症、乾癬性関節炎、糖尿病、多発性硬化症、脳脊髄炎、重症筋無力症、全身性エリテマトーデス(SLE)、自己免疫性甲状腺炎、アトピー性皮膚炎、湿疹性皮膚炎、乾癬、シェーグレン症候群、クローン病、アフタ性潰瘍、虹彩炎、結膜炎、角結膜炎、潰瘍性大腸炎、喘息、アレルギー性喘息、皮膚エリテマトーデス、強皮症、腟炎、直腸炎、癩性結節性紅斑、自己免疫性ブドウ膜炎、アレルギー性脳脊髄炎、急性壊死性出血性脳症、特発性両側性進行性感音難聴、再生不良性貧血、赤芽球癆、特発性血小板減少症、多発性軟骨炎、ヴェーゲナー肉芽腫症、慢性活動性肝炎、スティーブンス・ジョンソン症候群、特発性スプルー、扁平苔癬、グレーブス病、サルコイドーシス、原発性胆汁性肝硬変、後部ブドウ膜炎、間質性肺線維症、橋本甲状腺炎、自己免疫性多腺性症候群、インスリン依存性糖尿病、インスリン抵抗性糖尿病、免疫調節性不妊症、自己免疫性アジソン病、尋常性天疱瘡、落葉状天疱瘡、疱疹状皮膚炎、自己免疫性脱毛症、白斑、自己免疫性溶血性貧血、自己免疫性血小板減少性紫斑病、悪性貧血、ギヤン−バレー症候群、スティッフマン症候群、急性リウマチ熱、交感性眼炎、グッドパスチャー症候群、全身性壊死性血管炎、抗リン脂質抗体症候群またはアレルギー)を包含する。別の局面において、免疫機能不全は、免疫不全(例えば、リコンビナーゼ活性化遺伝子(RAG1/2)欠損症、アデノシンデアミナーゼ(ADA)欠損症、インターロイキンレセプターγ鎖(γc)欠損症、ヤヌース関連キナーゼ3(JAK3)欠損症および細網発育不全などの重症複合型免疫不全(SCID);ディ・ジョージ症候群、ヌード症候群、T細胞レセプター欠損症、MHCクラスII欠損症、TAP−2欠損症(MHCクラスI欠損症)、ZAP70チロシンキナーゼ欠損症、およびプリンヌクレオチドホスホリラーゼ(PNP)欠損症などの原発性T細胞免疫不全;X連鎖無γグロブリン血症(ブルトンチロシンキナーゼ欠損症)などの優性抗体欠損症;μ重鎖欠損症などの常染色体劣性無γグロブリン血症;代用軽鎖(γ5/14.1)欠損症;X連鎖(CD40リガンド欠損症)およびその他のどちらかの高IgM症候群;Ig重鎖遺伝子欠失;IgA欠損症;IgGサブクラスの欠損症(IgA欠損症有、または無し);分類不能型免疫不全(CVID);正常免疫グロブリンを有する抗体欠損症;一過性乳児低ガンマグロブリン血症;インターフェロンγレセプター(IFNGR1、IFNGR2)欠損症;インターロイキン12レセプター欠損症およびインターロイキン12レセプター欠損症;胸腺腫を有する免疫不全;ヴィスコット−オールドリッチ症候群(WASタンパク欠損症);毛細管拡張性運動失調(ATM欠損症);X連鎖リンパ増殖性症候群(SH2D1A/SAP欠損症);および高IgE症候群)を含む。さらに別の局面において、免疫機能不全は、別の疾患(例えば、ブルーム症候群、色素性乾皮症、ファンコーニ貧血、ICF症候群、ナイメーヘン切断症候群およびゼッケル症候群などの染色体不安定または欠損修復;ダウン症候群(21トリソミー)、ターナー症候群および第18番染色体の欠失または環状化(18p−および18q−)などの染色体欠損症;短肢骨格形成異常(短肢矮小発育症)および軟骨毛髪形成不全症(骨幹端軟骨形成)などの骨格異常;シムケ免疫骨性形成異常、デュボヴッツ症候群、SCIDを有する後弯肢異形成症(Kyphomelic dysplasia)、マリブレイ小人症、成長遅延、顔の奇形ならびに免疫不全および早老症(ハッチソン−ギルフォード症候群)などの全身性成長遅延に関連する免疫不全;欠指・外胚葉異形成・裂隙症候群、母指欠損を有する免疫不全、臭覚障害および魚鱗癬、部分的な白皮症、先天性角化不全症、ネザートン症候群、無汗性外胚葉性形成異常、パピヨン−ルフェーヴル症候群および先天性魚鱗症などの皮膚欠損を有する免疫不全;腸性先端皮膚炎、第2トランスコバラミン欠損、1型遺伝性オロチン酸尿、難治性下痢、異常顔面、裂毛症および免疫不全、メチルマロン酸血症、ビオチン依存性カルボキシラーゼ欠損、マンノシドーシス、グリコーゲン蓄積症、1b型、チェディアック−東症候群などの遺伝性代謝欠損;家族性異化亢進、腸リンパ管拡張症などの免疫グロブリンの異化亢進;慢性粘膜皮膚カンジダ症;遺伝性または先天性の脾機能低下症または無脾症;およびアイベルマルク(Ivermark)症候群)に関連するか、または続発性の免疫不全を含む。
【0006】
さらに、炎症応答を有する被験体、または炎症応答のリスクを伴う被験体における炎症応答を軽減するための方法を提供する。一つの実施形態において、方法は、炎症応答を軽減するのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。一つの局面において、炎症応答は、慢性または急性である。別の局面において、炎症応答は、抗体(例えば、一つ以上の自己抗体)によって少なくとも部分的に媒介されているか、または細胞性免疫によって少なくとも部分的に媒介される。
【0007】
さらに、被験体の炎症を軽減するための方法を提供する。一つの実施形態において、方法は、炎症を軽減するのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。一つの局面において、炎症は、慢性または急性である。別の局面において、炎症は、抗体または細胞によって少なくとも部分的に媒介される。なお別の局面において、処置は、炎症症状(例えば、腫脹、疼痛、頭痛、発熱、嘔気、骨格関節硬直、または組織損傷もしくは細胞損傷)の重篤度の軽減をもたらす。さらに別の局面において、この処置は、抗体産生またはリンパ系細胞増殖の阻害をもたらす。
【0008】
さらに、被験体における炎症応答または炎症によって引き起こされた組織損傷または細胞損傷を阻害するための方法を提供する。一つの実施形態において、方法は、炎症応答または炎症によって引き起こされた組織損傷または細胞損害の阻害を処置するのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。一つの局面において、組織損傷または細胞損傷は、慢性または急性の炎症応答または炎症によって引き起こされる。別の局面において、炎症応答または炎症は、抗体または細胞によって少なくとも部分的に媒介される。なお別の局面において、組織損傷または細胞損傷は、胸腺、肝臓、腎臓、脾臓、皮膚、または骨格関節(例えば、膝、足首、臀部、肩、手首、手指、足指または肘)に存在する。さらに別の局面において、この処置は、さらなる組織損傷または細胞損傷の阻害または予防をもたらす。
【0009】
被験体における炎症応答または炎症によって引き起こされた既存の組織損傷または細胞損傷を処置するための方法を提供する。一つの実施形態において、方法は、炎症応答または炎症によって引き起こされた既存の組織損傷または細胞損傷を処置するのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。一つの局面において、既存の組織損傷または細胞損傷は、慢性または急性の炎症応答または炎症によって引き起こされる。別の側面において、炎症応答または炎症は、抗体または細胞によって少なくとも部分的に媒介される。なお別の局面において、既存の組織損傷または細胞損傷は、胸腺、肝臓、腎臓、脾臓、皮膚、または骨格関節(例えば、膝、足首、臀部、肩、手首、手指、足指または肘)に存在する。さらに別の局面において、この処置は、組織損傷もしくは細胞損傷の逆転をもたらすか、またはさらなる組織損傷もしくは細胞損傷の阻害もしくは予防をもたらす。
【0010】
被験体における巨脾腫症を処置する方法もまた、提供する。一つの実施形態において、方法は、巨脾腫症を処置するのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。
【0011】
さらに、所望でない脾細胞の増殖もしくは生存を有する被験体または所望でない脾細胞の増殖もしくは生存を有するリスクを伴う被験体における脾細胞の増殖または生存を阻害する方法を提供する。一つの実施形態において、方法は、脾細胞の増殖または生存を阻害するのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。
【0012】
さらに、所望でない脾細胞の増殖もしくはアポトーシスを有する被験体または所望でない脾細胞の増殖もしくはアポトーシスを有するリスクを伴う被験体における脾細胞の分化またはアポトーシスを刺激する方法を提供する。一つの実施形態において、方法は、脾細胞の分化またはアポトーシスを刺激するのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。
【0013】
所望でない抗体数を有する被験体または所望でない抗体数を有するリスクを伴う被験体における脾細胞による抗体産生を減少させる方法を提供する。一つの実施形態において、方法は、脾細胞による抗体(例えば、自己抗体)産生を減少させるのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。
【0014】
所望でない脾細胞数を有する被験体または所望でない脾細胞数を有するリスクを伴う被験体における抗体を産生する脾細胞の数を減少させる方法もまた提供する。一つの実施形態において、方法は、抗体(例えば、自己抗体)を産生する脾細胞の数を減少させるのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。
【0015】
さらに、所望でないナチュラルキラー(NK)細胞の細胞傷害性を有する被験体または所望でないNK細胞の細胞傷害性を有するリスクを伴う被験体におけるNK細胞の細胞傷害性を減少させる方法を提供する。一つの実施形態において、方法は、所望でないNK細胞の細胞傷害性を減少させるのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。
【0016】
さらに、被験体における移植細胞、移植組織または移植器官の拒絶を阻害する方法を提供する。一つの実施形態において、方法は、移植細胞、移植組織または移植器官(例えば、同種移植片または異種移植片)の拒絶を阻害するのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。種々の局面において、PAは、細胞、組織または器官の移植前に、移植と実質的に同時に、または移植後に投与される。
【0017】
リンパ系細胞の分化を刺激する方法を提供する。一つの実施形態において、方法は、一つ以上のリンパ系細胞の分化を刺激するのに十分な、有効量のプロテインA(PA)を含む組成物と、一つ以上のリンパ系細胞とをインビトロ、エキソビボまたはインビボで接触させる工程を包含する。種々の局面において、リンパ系細胞は、T細胞またはB細胞である。
【0018】
本発明はまた、活性を達成するために必要とされる少ない量のPAに少なくとも一部基づいている。特に、PAは、低濃度(代表的に、スーパー抗原の適用に使用されるよりも少ない量)で前述の活性を有する。
【0019】
従って、本発明の方法は、実質的なスーパー抗原活性、Fc結合活性または実質的な体液性免疫の刺激はないが、本明細書に開示された一つ以上の活性を惹起するために有効な量のPAで実施され得る。一つの実施形態において、量は、約1pg〜約1μgのPA用量である。別の実施形態において、量は、約1〜15週間にわたって断続的に投与される、約1pg〜約1μgのPAの単回用量である。さらに別の実施形態において、量は、約7〜21日間にわたって隔日で投与される、約1pg〜約1μgのPAの単回用量である。
【0020】
さらに、本発明は、単位投与形態において、本明細書に開示された一つ以上の活性を惹起する組成物を提供する。一つの実施形態において、組成物は、約0.5〜5pg、5〜10pg、10〜20pg、20〜50pg、50〜100pg、100〜500pgまたは100〜1000pgの単位投与形態のPAを含む。別の実施形態において、組成物は、約1〜10ng、10〜100ng、100〜500ngまたは約500〜1000ngの単位投与形態のPAを含む。さらに別の実施形態において、組成物は、被験体の炎症応答または炎症を軽減するのに十分な、単位投与形態のPAを包含する。
【0021】
単位投与形態のPA(例えば、0.5〜5pg、5〜10pg、10〜20pg、20〜50pg、50〜100pg、100〜500pgまたは100〜1000pg;1〜10ng、10〜100ng、100〜500ngまたは約500〜1000ng)を含む薬学的組成物を提供する。本明細書に開示された一つ以上の活性(例えば、被験体における炎症応答または炎症を軽減する)を惹起する単位投与形態のPAを含む薬学的組成物を提供する。
【0022】
単位投与形態のPA(または薬学的組成物)を含むキットもまた提供し、このようなキットは必要に応じて、本発明の方法(例えば、被験体における炎症応答、炎症、または炎症応答もしくは炎症によって引き起こされる組織損傷もしくは細胞損傷を軽減する)における使用説明書をさらに含む。一つの実施形態において、キットは、複数の単位投与形態のPAを含む。別の実施形態において、キットはさらに、薬物(例えば、炎症応答または炎症を軽減する)を含む。
本発明は、例えば以下の項目を提供する。
(項目1)
被験体における免疫応答を調節するための方法であって、該方法は、該免疫応答を調節するのに十分な、有効量のリンパ球分化因子を含む組成物を該被験体に投与する工程を包含する、方法。
(項目2)
前記リンパ球分化因子がプロテインA(PA)を含む、項目1に記載の方法。
(項目3)
免疫機能不全を有する被験体または免疫機能不全のリスクを伴う被験体における免疫機能不全を処置するための方法であって、該方法は、該免疫機能不全を処置するのに十分な、有効量のプロテインA(PA)を含む組成物を該被験体に投与する工程を包含する、方法。
(項目4)
前記免疫機能不全が自己免疫障害を含む、項目3に記載の方法。
(項目5)
前記自己免疫障害が慢性関節リウマチ、若年性慢性関節リウマチ、変形性関節症、乾癬性関節炎、糖尿病、多発性硬化症、脳脊髄炎、重症筋無力症、全身性エリテマトーデス(SLE)、自己免疫性甲状腺炎、アトピー性皮膚炎、湿疹性皮膚炎、乾癬、シェーグレン症候群、クローン病、アフタ性潰瘍、虹彩炎、結膜炎、角結膜炎、潰瘍性大腸炎、喘息、アレルギー性喘息、皮膚エリテマトーデス、強皮症、腟炎、直腸炎、癩性結節性紅斑、自己免疫性ブドウ膜炎、アレルギー性脳脊髄炎、急性壊死性出血性脳症、特発性両側性進行性感音難聴、再生不良性貧血、赤芽球癆、特発性血小板減少症、多発性軟骨炎、ヴェーゲナー肉芽腫症、慢性活動性肝炎、スティーブンス・ジョンソン症候群、特発性スプルー、扁平苔癬、グレーブス病、サルコイドーシス、原発性胆汁性肝硬変、後部ブドウ膜炎、間質性肺線維症、橋本甲状腺炎、自己免疫性多腺性症候群、インスリン依存性糖尿病、インスリン抵抗性糖尿病、免疫調節性不妊症、自己免疫性アジソン病、尋常性天疱瘡、落葉状天疱瘡、疱疹状皮膚炎、自己免疫性脱毛症、白斑、自己免疫性溶血性貧血、自己免疫性血小板減少性紫斑病、悪性貧血、ギヤン−バレー症候群、スティッフマン症候群、急性リウマチ熱、交感性眼炎、グッドパスチャー症候群、全身性壊死性血管炎、抗リン脂質抗体症候群またはアレルギーを含む、項目4に記載の方法。
(項目6)
炎症応答を有する被験体または炎症応答のリスクを伴う被験体における炎症応答を軽減する方法であって、該方法は、炎症応答を軽減するのに十分な、有効量のプロテインA(PA)を含む組成物を該被験体に投与する工程を包含する、方法。
(項目7)
前記炎症応答が、慢性または急性である、項目6に記載の方法。
(項目8)
前記炎症応答が、抗体によって少なくとも部分的に媒介される、項目6に記載の方法。
(項目9)
前記抗体が、一つ以上の自己抗体を含む、項目8に記載の方法。
(項目10)
前記炎症応答が、細胞性免疫によって少なくとも部分的に媒介される、項目6に記載の方法。
(項目11)
炎症を有する被験体または炎症のリスクを伴う被験体における炎症を処置するための方法であって、該方法は、該炎症を軽減するのに十分な、有効量のプロテインA(PA)を含む組成物を該被験体に投与する工程を包含する、方法。
(項目12)
前記炎症が、慢性または急性である、項目11に記載の方法。
(項目13)
前記炎症が、抗体または細胞によって少なくとも部分的に媒介される、項目11に記載の方法。
(項目14)
前記処置が、炎症症状の重篤度の軽減をもたらす、項目11に記載の方法。
(項目15)
前記症状が、腫脹、疼痛、頭痛、発熱、嘔気、骨格関節硬直、または組織損傷もしくは細胞損傷を含む、項目14に記載の方法。
(項目16)
前記処置が、抗体産生またはリンパ系細胞増殖の阻害をもたらす、項目11に記載の方法。
(項目17)
被験体における炎症応答または炎症によって引き起こされた組織損傷または細胞損傷を阻害する方法であって、該方法は、炎症応答または炎症によって引き起こされた組織損傷または細胞損傷を処置して阻害するのに十分な、有効量のプロテインA(PA)を含む組成物を該被験体に投与する工程を包含する、方法。
(項目18)
前記組織損傷または細胞損傷が、慢性または急性の炎症応答または炎症によって引き起こされる、項目17に記載の方法。
(項目19)
前記炎症応答または炎症が、抗体または細胞によって少なくとも部分的に媒介される、項目17に記載の方法。
(項目20)
前記組織損傷または細胞損傷が、胸腺、肝臓、腎臓、脾臓、皮膚、または骨格関節に存在する、項目17に記載の方法。
(項目21)
前記骨格関節が、膝、足首、臀部、肩、手首、手指、足指または肘を含む、項目20に記載の方法。
(項目22)
前記処置が、さらなる組織損傷または細胞損傷の阻害または予防をもたらす、項目17に記載の方法。
(項目23)
被験体における炎症応答または炎症によって引き起こされた既存の組織損傷または細胞損傷を処置する方法であって、該方法は、炎症応答または炎症によって引き起こされた既存の組織損傷または細胞損傷を処置するのに十分な、有効量のプロテインA(PA)を含む組成物を該被験体に投与する工程を包含する、方法。
(項目24)
前記既存の組織損傷または細胞損傷が、慢性または急性の炎症応答または炎症によって引き起こされる、項目23に記載の方法。
(項目25)
前記炎症応答または炎症が、抗体または細胞によって少なくとも部分的に媒介される、項目23に記載の方法。
(項目26)
前記既存の組織損傷または細胞損傷が、胸腺、肝臓、腎臓、脾臓、皮膚、または骨格関節に存在する、項目23に記載の方法。
(項目27)
前記骨格関節が、膝、足首、臀部、肩、手首、手指、足指または肘を含む、項目26に記載の方法。
(項目28)
前記処置が、組織損傷または細胞損傷の逆転をもたらす、項目23に記載の方法。
(項目29)
前記処置が、さらなる組織損傷または細胞損傷の阻害または予防をもたらす、項目23に記載の方法。
(項目30)
被験体における巨脾腫症を処置する方法であって、該方法は、巨脾腫症を処置するのに十分な、有効量のプロテインA(PA)を含む組成物を該被験体に投与する工程を包含する、方法。
(項目31)
所望でない脾細胞の増殖もしくは生存を有する被験体、または所望でない脾細胞の増殖もしくは生存を有するリスクを伴う被験体における脾細胞の増殖または生存を阻害する方法であって、該方法は、該脾細胞の増殖または生存を阻害するのに十分な、有効量のプロテインA(PA)を含む組成物を該被験体に投与する工程を包含する、方法。
(項目32)
所望でない脾細胞の増殖もしくはアポトーシスを有する被験体または所望でない脾細胞の増殖もしくはアポトーシスを有するリスクを伴う被験体における脾細胞の分化またはアポトーシスを刺激する方法であって、該方法は、該脾細胞の分化またはアポトーシスを刺激するのに十分な、有効量のプロテインA(PA)を含む組成物を該被験体に投与する工程を包含する、方法。
(項目33)
所望でない抗体数を有する被験体または所望でない抗体数を有するリスクを伴う被験体における脾細胞による抗体産生を減少させる方法であって、該方法は、脾細胞による抗体産生を減少させるのに十分な、有効量のプロテインA(PA)を含む組成物を該被験体に投与する工程を包含する、方法。
(項目34)
所望でない脾細胞数を有する被験体または所望でない脾細胞数を有するリスクを伴う被験体における抗体を産生する脾細胞の数を減少させる方法であって、該方法は、該抗体を産生する脾細胞の数を減少させるのに十分な、有効量のプロテインA(PA)を含む組成物を該被験体に投与する工程を包含する、方法。
(項目35)
前記抗体が、一つ以上の自己抗体を含む、項目33または項目34のいずれかに記載の方法。
(項目36)
所望でないナチュラルキラー(NK)細胞の細胞傷害性を有する被験体または所望でないNK細胞の細胞傷害性を有するリスクを伴う被験体におけるNK細胞の細胞傷害性を減少させる方法であって、該方法は、所望でないNK細胞の細胞傷害性を減少させるのに十分な、有効量のプロテインA(PA)を含む組成物を該被験体に投与する工程を包含する、方法。
(項目37)
被験体における移植細胞、移植組織または移植器官の拒絶を阻害する方法であって、該方法は、移植細胞、移植組織または移植器官の拒絶を阻害するのに十分な、有効量のプロテインA(PA)を含む組成物を該被験体に投与する工程を包含する、方法。
(項目38)
前記細胞、前記組織または前記器官の移植前に、移植と実質的に同時に、または移植後にPAが投与される、項目37に記載の方法。
(項目39)
前記移植細胞、前記移植組織または前記移植器官が、同種移植片または異種移植片である、項目38に記載の方法。
(項目40)
リンパ系細胞の分化を刺激する方法であって、該方法は、一つ以上のリンパ系細胞の分化を刺激するのに十分な、有効量のプロテインA(PA)を含む組成物と、一つ以上のリンパ系細胞とをインビトロ、エキソビボまたはインビボで接触させる工程を包含する、方法。
(項目41)
前記リンパ系細胞が、T細胞またはB細胞である、項目40に記載の方法。
(項目42)
前記有効量が、約1pg〜約1μgのPAの用量である、項目1、3、6、11、17、23、30〜34、36、37または40のいずれかに記載の方法。
(項目43)
前記有効量が、約1pg〜約1μgのPAの用量である、項目1、3、6、11、17、23、30〜34、36、37または40のいずれかに記載の方法。
(項目44)
前記有効量が、約1〜15週間にわたって断続的に投与される、約100pg〜約1000pgのPAの単回投与である、項目1、3、6、11、17、23、30〜34、36、37または40のいずれかに記載の方法。
(項目45)
前記有効量が、約7〜21日間にわたって隔日で投与される、約1pg〜約1μgのPAの単回用量である、項目1、3、6、11、17、23、30〜34、36、37または40のいずれかに記載の方法。
(項目46)
被験体における炎症応答、炎症を軽減するのに十分な、単位投与形態のPAを含む、組成物。
(項目47)
前記単位投与形態が、約0.5〜5、5〜10、10〜20、20〜50、50〜100、100〜500または100〜1000pgである、項目46に記載の組成物。
(項目48)
炎症応答または炎症を軽減する薬物をさらに含む、項目47に記載の組成物。
(項目49)
被験体における 炎症応答、炎症を軽減するのに十分な、単位投与形態のPAを含む、薬学的組成物。
(項目50)
被験体における炎症応答、炎症または炎症応答もしくは炎症によって引き起こされる組織損傷もしくは細胞損傷を軽減するのに十分な単位投与形態のPAを含む、キット。
(項目51)
単位投与形態のPAおよび使用説明書を含む、キット。
(項目52)
複数の単位投与形態のPAをさらに含む、項目50または項目51に記載のキット。
(項目53)
炎症応答または炎症を軽減する薬物をさらに含む、項目50または項目51に記載のキット。
【図面の簡単な説明】
【0023】
【図1A】図1は、A)コントロールの未処置の正常マウス(C57BL/6J)の体重増加および成長動態を示す。
【図1B】図1は、B)未処置のBXSBマウスの体重増加および成長動態を示す。
【図1C】図1は、C)PA処置を用いたBXSBマウスの体重増加および成長動態を示す。
【発明を実施するための形態】
【0024】
(詳細な説明)
本発明は、スーパー抗原特性、Fc結合活性または体液性免疫を刺激するその能力とは異なるように見える、プロテインA(PA)の一つ以上の活性の特徴づけに少なくとも一部基づいている。これらの異なるPA活性は、免疫機能不全などの所望でない生理学的プロセスまたは異常な生理学的プロセスを再調節するか、または正常にするPA能力に、少なくとも部分的に起因していると考えられている。生理学的プロセスを再調節するか、または正常にするPA能力は、多くの異なる有益な活性(例えば、異常な免疫応答または所望でない免疫応答を調節する(例えば、再調節するかまたは正常にする)活性、自己免疫を改善するかまたは減少させる活性、炎症または炎症応答を軽減させる活性、所望でない免疫応答または異常な免疫応答などの調節されていないプロセスによって引き起こされる組織損傷の少なくとも一部を阻害するかまたは逆転させる活性が挙げられる)を生じる。
特に、PA効力は、コラーゲン誘発性関節炎(CIA)のマウス炎症モデルの使用で示される。II型コラーゲンへの誘発された免疫応答は媒介され、抗体によって急激に進行する炎症応答を引き起こす(炎症応答は、罹患した関節の炎症を測定することによって、そしてまた、罹患した関節に対する標準臨床評価(「臨床指標」または「CI」と名づけられる)を適用することによって評価され得る)。CI評価は、腫脹および移動性の測定の両方にかかわる。実施例1に示されるように、低濃度のPAは、CIAマウスモデル系において急性の炎症応答を阻害する。膝および足関節の組織学的検査は、組織損傷における軽減および滑膜の免疫細胞の浸潤の減少を明らかにした。
【0025】
PA効力はまた、BXSB動物モデル(これは、雄動物の早期死を引き起こす、遺伝的な基礎を有する複合性自己免疫不全疾患を表す)で示される。実施例3〜実施例8に示されるように、低濃度のPAは、BXSB動物における多くの疾患特性を改変し、多くの場合、種々の疾病症状(細胞性および組織学的)を基準レベルに向けて(すなわち、正常化に向けて)、再調節する。例えば、PAは、るいそう(体重減少)の早期発症を阻害するか、または予防し;脾臓区画の拡大を調節し;体液性免疫の過剰発現または体液性免疫の過剰活性を阻害し;細胞性免疫の過剰発現または細胞性免疫の過剰活性を阻害し;リンパ系細胞系列の細胞分化を調節し;そして、疾患プロセスに起因する組織損傷または疾患プロセスに関連する組織損傷を改善するか軽減するかまたは逆転させる。このデータはさらに、PAがCIAモデルと同じ投与応答パターンを有することを示す。
【0026】
従って、低濃度でのPA活性としては、例えば、脾臓区画の拡大を調節する活性(増殖、アポトーシスまたは分化を調節する活性)、異常な体液性免疫または所望でない体液性免疫を調節する活性(自己抗体産生を阻害するかまたは自己抗体を産生する細胞を阻害する活性)、異常な細胞性免疫または所望でない細胞性免疫を調節する活性(TH1/TH2バランスを正常化し、細胞傷害性応答を阻害する活性)、リンパ系細胞系列内の細胞の増殖、アポトーシスまたは分化を調節する活性(例えば、CD69−CD4+などの成熟T細胞数を増加させるような、T細胞集団を正常化する活性)、所望でない免疫応答または異常な免疫応答によって引き起こされる細胞損傷または組織損傷を阻害するかまたは逆転させる活性(疾患の進行を阻害するかまたは予防する活性、疾患の逆転または組織再生を促進するかまたは増強する活性)、そしてT脾細胞数またはB脾細胞数あるいは一つ以上のマイトジェンに対する応答を正常化する活性のうちの1以上が挙げられる。
【0027】
従って、PAは、PAに関連する一つ以上の上記活性を必要とする被験体を処置するのに有用である。従って、本発明はとりわけ、(細胞性または体液性)免疫応答を調節する方法、所望でない免疫応答または異常な免疫応答(例えば、免疫機能不全)を処置するための方法、および被験体において免疫応答によって引き起こされる生理的な影響または免疫応答に関連する生理的影響を阻害するか、予防するかまたは逆転させるための方法を提供する。一つの実施形態において、方法は、免疫応答を調節するのに十分な、有効量のリンパ球分化因子を含む組成物を被験体に投与する工程を包含する。別の実施形態において、方法は、免疫応答を調節するのに十分な、有効量のPAを含む組成物を被験体に投与する工程を包含する。
【0028】
本明細書で使用される場合、用語「調節する」とは、この用語が言及する活性、機能または影響における検出可能な変化を意味する。調節するとは、この用語が言及する活性、機能または影響における任意の増加、減少、軽減、阻害、予防、刺激、促進、増強を意味し得る。例えば、免疫応答を調節するとは、免疫応答の活性、機能もしくは影響を、検出可能に変化させ(例えば、体液性免疫または細胞性免疫の増加、減少、低下、阻害、予防、刺激、促進、または増強など)ることを意味する。調節を示す免疫応答(例えば、T細胞数もしくはB細胞数、増殖、アポトーシス、分化、細胞傷害性、抗体産生もしくは抗体(例えば、自己抗体)産生細胞数、マイトジェン応答性、炎症、細胞損傷もしくは組織損傷、またはそれらの症状が挙げられる)における変化は、本明細書で開示された種々の方法または当該分野で公知の種々の方法によって、測定され得る。「有効量」または「十分な量」とは、活性または効果を達成するのに必要とされる量を意味する。
【0029】
本明細書で使用される場合、用語「再調節する」、「正常化する」およびそれらの文法的なバリエーションは、基準レベルに向けたシフトを意味する。基準レベルに向けたシフトとしては、例えば、細胞数の変化、分化状態、抗体産生もしくは抗体量(例えば、血液循環における自己抗体)、細胞傷害性またはマイトジェンへの反応が挙げられ得る。従って、BXSBの脾臓における脾細胞数を再調節するか、または正常化することは、例えば、正常(例えば、疾患のない)動物(例えば、C57BL/6)の脾臓で代表的に見出される脾細胞数に向けた回復を意味する。同様に、自己抗体を再調節するか、または正常化するとは、正常(例えば、疾患のない)動物でさらに代表的に見出される抗体の量を減少させることを意味する。BXSBにおけるT細胞集団を再調節するか、または正常化するとは、例えば、C57BL/6で代表的に観察されたT細胞集団に向けてT細胞集団をシフトさせること(例えば、未成熟T細胞集団から成熟T細胞集団への変化)を意味する。
【0030】
生じ得る再調節量または正常化量は、正常動物において代表的な基準レベルへの、またはほぼ基準レベル(基準の5〜25%内)への回復であり得るが、より低くてもよい(例えば、このシフトが基準レベルまたはほぼ基準レベル(例えば、基準レベルの25〜100%内または基準レベルの25〜200%内)へ回復しないとしても、基準レベルに向けての検出可能なシフト)。このシフトは、未処置の状態においての基準レベルからの偏りの程度、投与されたPA量、および基準レベルに戻るものに依存する。例えば、BXSBの脾細胞数は、C57BL/6より5倍〜6倍多い。従って、BXSBの脾細胞数の再調節または正常化は、脾細胞数が処置後のBXSBにおいて減少したことを意味する。例えば、C57BL/6マウスより5倍〜6倍多い脾細胞数からC57BL/6マウスより1倍〜3倍大きい脾細胞数への減少、またはさらに、例えば、C57BL/6マウスにおいて代表的に観察される(脾細胞数の約10〜50%以内の減少)。同様に、BXSBにおいて、5週目に200%のANAの増加、そして11週目に1000%のANAの増加がある。従って、BXSBにおける自己抗体の再調節または正常化は、自己抗体数(例えば、ANA)が処置後に減少することを意味する。例えば、0.01μgのPAを用いた処置は、これらの値を、基準またはほぼ基準(例えば、基準の25%の以内)に戻した。従って、自己抗体数は、C57BL/6マウスより10倍多い自己抗体数からC57BL/6マウスより5倍〜8倍多い自己抗体数へと、もしくはC57BL/6マウスより1倍〜5倍多い自己抗体数へと、またはさらに、例えば、C57BL/6マウスにおける自己抗体数の約10〜50%以内と減少し得る。
【0031】
本発明はさらに、とりわけ、免疫機能不全を有する被験体または免疫機能不全のリスクを伴う被験体における免疫機能不全を処置するための方法を提供する。一つの実施形態において、方法は、免疫機能不全を処置するのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。一つの局面において、免疫機能不全は自己免疫障害を含む。
【0032】
本明細書で使用される場合、「免疫機能不全」または「免疫障害」とは、所望でない免疫応答、所望でない免疫機能または所望でない免疫活性、すなわち、所望よりも高い免疫応答(例えば、自己免疫)または所望よりも低い免疫応答(例えば、免疫不全)を意味する。所望でない免疫応答、所望でない免疫機能または所望でない免疫活性は、正常な応答、正常な機能または正常な活性であり得る。従って、これらが所望でない限り、異常と考えらない正常な免疫応答は、これらの用語の意味の中に含まれる。所望でない免疫応答、所望でない免疫機能または所望でない免疫活性はまた、異常応答、異常機能または異常活性であり得る。異常(abnormal)または異常(aberrant)な免疫応答、異常(abnormal)または異常(aberrant)な免疫機能または異常(abnormal)または異常(aberrant)な免疫活性は、正常から逸脱している。免疫機能不全または免疫障害は、本質的に、主として、慢性または急性のいずれかの、体液性もしくは細胞性またはその両方の、免疫機能不全または免疫障害であり得る。
【0033】
免疫機能不全または免疫障害は、多くの異なる生理的な症状または生理的な異常によって特徴付けられる障害を含む。本明細書で開示される場合、BXSBマウスモデルは、本発明に従って処置され得る、非常に多数の生理的な症状および生理学的な異常によって特徴付けられる免疫障害である(例えば、実施例4〜実施例9を参照のこと)。従って、本発明は、BXSBマウスモデルと類似の一つ以上の生理的な症状または生理学的な異常を有する障害を含む、多くの異なる生理学的な症状または生理学的な異常によって特徴付けられる任意の免疫機能不全または免疫障害、または、異なる種における同等の障害を処置するのに有用である。例えば、BXSBマウスは、脾臓区画の拡大および結果的な未成熟脾細胞数の増加を導く、異常な脾細胞増殖、脾細胞アポトーシスまたは脾細胞分化によって特徴付けられる。従って、BXSBマウスにおいて数が増加する特定の脾細胞型は、免疫障害を伴う別の種のものとは(例えば、それらのCDマーカーに関して)異なるかもしれないが、本発明は、被験体において所望でない未成熟脾細胞数(過剰な細胞増殖、細胞生存またはアポトーシス不全によって引き起こされる)または減少した成熟脾細胞数を有すると特徴付けられる任意の傷害に適用可能である。
【0034】
従って、本発明は、免疫応答の多くの局面を再調節または正常化するために有用である(このことは、免疫障害の多くの異なる症状または異常の一つ以上を改善するかまたは軽減することを導く)ので、本発明は、BXSBマウスで生じる障害と異なる障害に対して広範に適用可能である。もちろん、本発明に従って処置可能な障害は、BXSBマウスに存在するものほど重篤ではないとはいえ、BXSBの一つ以上の特徴、症状または異常を有すると特徴付けられる障害を含む。
【0035】
本発明が適用する免疫障害の特定の例としては、自己免疫障害および免疫機能不全が挙げられる。自己免疫障害は、免疫系の所望でないまたは異常な、応答活性または機能として一般的に特徴づけられる。免疫機能不全は、減少したかもしくは不十分な、体液性免疫応答性もしくは細胞媒介性免疫応答性もしくは記憶によって一般的に特徴付けられるか、または増加した寛容もしくは所望でない寛容によって特徴付けられる。本発明に従って処置され得るこのような障害は、被験体において細胞損傷または組織/器官損傷を引き起こす障害を含むが、これらに限定されない。
【0036】
従って、本発明は、特に、自己免疫障害を有する被験体または自己免疫障害のリスクを伴う被験体における自己免疫障害を処置するための方法をさらに提供する。一つの実施形態において、方法は、自己免疫障害を処置するのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。種々の局面において、自己免疫障害は、慢性関節リウマチ、若年性慢性関節リウマチ、変形性関節症、乾癬性関節炎、糖尿病、多発性硬化症、脳脊髄炎、重症筋無力症、全身性エリテマトーデス(SLE)、自己免疫性甲状腺炎、アトピー性皮膚炎、湿疹性皮膚炎、乾癬、シェーグレン症候群、クローン病、アフタ性潰瘍、虹彩炎、結膜炎、角結膜炎、潰瘍性大腸炎、喘息、アレルギー性喘息、皮膚エリテマトーデス、強皮症、腟炎、直腸炎、癩性結節性紅斑、自己免疫性ブドウ膜炎、アレルギー性脳脊髄炎、急性壊死性出血性脳症、特発性両側性進行性感音難聴、再生不良性貧血、赤芽球癆、特発性血小板減少症、多発性軟骨炎、ヴェーゲナー肉芽腫症、慢性活動性肝炎、スティーブンス・ジョンソン症候群、特発性スプルー、扁平苔癬、グレーブス病、サルコイドーシス、原発性胆汁性肝硬変、後部ブドウ膜炎、間質性肺線維症、橋本甲状腺炎、自己免疫性多腺性症候群、インスリン依存性糖尿病、インスリン抵抗性糖尿病、免疫調節性不妊症、自己免疫性アジソン病、尋常性天疱瘡、落葉状天疱瘡、疱疹状皮膚炎、自己免疫性脱毛症、白斑、自己免疫性溶血性貧血、自己免疫性血小板減少性紫斑病、悪性貧血、ギヤン−バレー症候群、スティッフマン症候群、急性リウマチ熱、交感性眼炎、グッドパスチャー症候群、全身性壊死性血管炎、抗リン脂質抗体症候群またはアレルギーを含む。
【0037】
本発明は、特に、免疫不全を有する被験体または免疫不全のリスクを伴う被験体における免疫不全を処置するための方法をさらに提供する。一つの実施形態において、方法は、免疫不全を処置するのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。種々の局面において、免疫不全は、リコンビナーゼ活性化遺伝子(RAG1/2)欠損症、アデノシンデアミナーゼ(ADA)欠損症、インターロイキンレセプターγ鎖(γc)欠損症、ヤヌース関連キナーゼ3(JAK3)欠損症および細網発育不全などの重症複合型免疫不全(SCID);ディ・ジョージ症候群、ヌード症候群、T細胞レセプター欠損症、MHCクラスII欠損症、TAP−2欠損症(MHCクラスI欠損症)、ZAP70チロシンキナーゼ欠損症、およびプリンヌクレオチドホスホリラーゼ(PNP)欠損症などの原発性T細胞免疫不全;X連鎖無γグロブリン血症(ブルトンチロシンキナーゼ欠損症)などの優性抗体欠損症;μ重鎖欠損症などの常染色体劣性無γグロブリン血症;代用軽鎖(γ5/14.1)欠損症;X連鎖(CD40リガンド欠損症)などの高IgM症候群;Ig重鎖遺伝子欠失;IgA欠損症;IgGサブクラスの欠損症(IgA欠損症有、または無し);分類不能型免疫不全(CVID);正常免疫グロブリンを有する抗体欠損症;一過性乳児低ガンマグロブリン血症;インターフェロンγレセプター(IFNGR1、IFNGR2)欠損症;インターロイキン12レセプター欠損症およびインターロイキン12レセプター欠損症;胸腺腫を有する免疫不全;ヴィスコット−オールドリッチ症候群(WASタンパク欠損症);毛細管拡張性運動失調(ATM欠損症);X連鎖リンパ増殖性症候群(SH2D1A/SAP欠損症);および高IgE症候群を含む。さらに別の局面において、免疫機能不全は、別の疾患(例えば、ブルーム症候群、色素性乾皮症、ファンコーニ貧血、ICF症候群、ナイメーヘン切断症候群およびゼッケル症候群などの染色体不安定または欠損修復;ダウン症候群(21トリソミー)、ターナー症候群および第18番染色体の欠失または環状化(18p−および18q−)などの染色体欠損症;短肢骨格形成異常(短肢矮小発育症)および軟骨毛髪形成不全症(骨幹端軟骨形成)などの骨格異常;シムケ免疫骨性形成異常、デュボヴッツ症候群、SCIDを有する後弯肢異形成症(Kyphomelic dysplasia)、マリブレイ小人症、成長遅延、顔の奇形ならびに免疫不全および早老症(ハッチソン−ギルフォード症候群)などの全身性成長遅延に関連する免疫不全;欠指・外胚葉異形成・裂隙症候群、母指欠損を有する免疫不全、臭覚障害および魚鱗癬、部分的な白皮症、先天性角化不全症、ネザートン症候群、無汗性外胚葉性形成異常、パピヨン−ルフェーヴル症候群および先天性魚鱗症などの皮膚欠損を有する免疫不全;腸性先端皮膚炎、第2トランスコバラミン欠損、1型遺伝性オロチン酸尿、難治性下痢、異常顔面、裂毛症および免疫不全、メチルマロン酸血症、ビオチン依存性カルボキシラーゼ欠損、マンノシドーシス、グリコーゲン蓄積症、lb型、チェディアック−東症候群などの遺伝性代謝欠損;家族性異化亢進、腸リンパ管拡張症などの免疫グロブリンの異化亢進;慢性粘膜皮膚カンジダ症;遺伝性または先天性の脾機能低下症または無脾症;あるいはアイベルマルク(Ivermark)症候群)に関連するか、または続発性の免疫不全を含む。
【0038】
本発明が適用する免疫機能不全または免疫障害のさらなる特定の例は、所望でないかまたは異常な炎症応答または炎症を含む。このような障害は、細胞性免疫または体液性免疫、あるいは両方の組み合わせによって媒介され得る。
【0039】
従って、本発明はまた、特に、炎症応答もしくは炎症を有する被験体または炎症応答炎症応答もしくは炎症のリスクを伴う被験体における、炎症応答または炎症(慢性または急性)を軽減するかまたは阻害するための方法を提供する。一つの実施形態において、方法は、炎症応答を軽減するかまたは阻害するのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。別の実施形態では、方法は、炎症を軽減または阻害するのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。一つの局面において、炎症応答または炎症は、抗体(例えば、一つ以上の自己抗体)によって少なくとも部分的に媒介される。別の局面において、炎症応答または炎症は、細胞性免疫によって少なくとも部分的に媒介される。種々の局面において、方法(例えば、処置)は、炎症応答症状または炎症症状の重篤度または頻度の軽減をもたらす。特定の局面において、症状は、腫脹、疼痛、頭痛、発熱、嘔気、骨格関節硬直、または組織損傷もしくは細胞損傷のうち1以上を含む。さらなる特定の局面において、方法(例えば、処置)は、抗体産生またはリンパ系細胞増殖の阻害をもたらす。
【0040】
免疫機能不全、例えば、所望でないかまたは異常な炎症または炎症応答は、直接的にまたは間接的に、細胞損傷または組織/器官損傷(複数の細胞、組織または器官のいずれかにおいて、あるいは特に、単一の細胞型、器官、または組織型において)を引き起こし得る。例えば、実施例で開示されているように、CIAモデルおよびBXSBモデルは、組織学における変化によって証明されるように、複数の組織において損傷を示した。損傷を示した組織は、膝、足首、胸腺、腎臓および肝臓を含んだ。本発明に従った処置は、既存の組織障害の少なくとも部分的な逆転または正常組織の再生をもたらした(例えば、表9および表10を参照のこと)。
【0041】
従って、本発明はまた、特に、組織損傷または細胞損傷を処置するための方法、阻害するための方法および逆転するための方法、ならびに被験体において免疫機能不全(例えば、所望でないかまたは異常な炎症応答または炎症)によって引き起こされる組織再生または細胞再生を促進するための方法または増強するための方法を提供する。一つの実施形態において、方法は、免疫機能不全(例えば、所望でないかまたは異常な炎症応答または炎症)によって引き起こされた既存の組織損傷または細胞損傷を処置するのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。別の実施形態において、方法は、免疫機能不全(例えば、慢性または急性の所望でないかまたは異常な炎症応答または炎症)によって引き起こされた(既存のまたは予防)組織損傷または細胞損傷を阻害するのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。さらに別の実施形態において、方法は、免疫機能不全(例えば、所望でないかまたは異常な炎症応答または炎症)によって引き起こされた既存の組織損傷または細胞損傷を逆転するのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。さらに別の実施形態において、方法は、免疫機能不全(例えば、所望でないかまたは異常な炎症応答または炎症)によって引き起こされた組織再生または細胞再生を促進するかまたは増強するのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。一つの局面において、炎症応答または炎症は、抗体(例えば、一つ以上の自己抗体)によって少なくとも部分的に媒介される。別の局面において、炎症応答または炎症は、細胞性免疫によって少なくとも部分的に媒介される。さらに他の局面において、組織損傷は、胸腺、肝臓、腎臓、脾臓、皮膚、または骨格関節に存在する。特定の局面において、骨格関節の組織損傷は、膝、足首、臀部、肩、手首、手指、足指または肘に存在する。
【0042】
本発明の方法は、さらなる組織損傷または細胞損傷を阻害するかまたは予防する処置方法を含む。従って、本発明はまた、被験体における免疫機能不全(例えば、所望でないかまたは異常な炎症応答または炎症)によって引き起こされた既存の組織損傷または細胞損傷を処置する方法、およびさらなる組織損傷または細胞損傷を阻害するかまたは予防する方法を提供する。一つの実施形態において、方法は、免疫機能不全(例えば、所望でないかまたは異常な炎症応答または炎症)によって引き起こされるさらなる組織損傷または細胞損傷を阻害するかまたは予防するのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。本発明に従って処置できる既存の損傷の例としては、例えば、組織損傷または器官損傷が挙げられる。本明細書に開示されたように、例示的な損傷は、胸腺、肝臓、腎臓、脾臓、皮膚、または骨格関節(例えば、膝または足首)に存在する。
炎症応答または炎症の処置を含む本発明の方法は、炎症応答または炎症の症状または特性を軽減することが望ましい。全身レベルで、炎症応答または炎症は、一般的に、腫脹、疼痛、頭痛、発熱、嘔気、骨格関節硬直もしくは運動性の欠如、潮紅または他の変色によって特徴付けられる。細胞性レベルで、炎症応答または炎症は、その領域の細胞浸潤、抗体産生(例えば、自己抗体)、サイトカイン、リンフォカイン、ケモカイン、インターフェロンおよびインターロイキンの産生、増殖および成熟(例えば、分化因子)、細胞の増殖、分化、蓄積または移動、ならびに細胞損傷、組織損傷または器官損傷のうちの一つ以上によって特徴付けられる。従って、処置は、炎症応答または炎症の一つ以上の症状(重篤度または発生頻度)または特性を軽減するか、阻害するかまたは予防する。
【0043】
本発明の方法はまた、被験体における巨脾腫(すなわち、肥大した脾臓)を処置する工程を包含する。このような方法は、巨脾腫を処置するのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。任意の理論によって制限されることなく、巨脾腫を処置することは、代表的に、成熟リンパ球(例えば、T脾細胞またはB脾細胞)の増殖もしくは生存または未成熟細胞から成熟細胞への分化を刺激するか、増大させるかまたは促進するか、あるいは正常動物(すなわち、巨脾腫を示さない動物)のより代表的な生理学的状態への未成熟細胞の増殖または生存を阻害するかまたは減少させる。従って、成熟リンパ球(例えば、T脾細胞またはB脾細胞)の増殖もしくは生存または未成熟リンパ球から成熟リンパ球(例えば、T脾細胞またはB脾細胞)への分化を刺激する方法、増大させる方法または促進する方法、ならびに未成熟リンパ球(例えば、T脾細胞またはB脾細胞)の増殖または生存を阻害する方法または減少させる方法を、提供する。
【0044】
本発明の方法はさらに、被験体における抗体産生を阻害する工程、減少させる工程または予防する工程を包含する。一つの実施形態において、方法は、抗体産生を減少させるのに十分な、有効量のプロテインA(PA)を含む組成物を、所望でない抗体または異常な抗体を有する被験体に投与する工程を包含する。しかし、自己抗体は、その産生を阻害するか、減少させるかまたは予防することを望まれ得る抗体の例の一つである。抗体産生は、抗体を産生する細胞(例えば、脾細胞)に抗体産生を減少させることを引き起こすことによって直接的に、または抗体を産生する細胞(例えば、脾細胞)の数を減少させることによって間接的に、阻害され得、減少し得または予防され得る。
【0045】
本発明の方法はさらに、所望でないナチュラルキラー(NK)細胞の細胞傷害性を有する被験体または所望でないNK細胞の細胞傷害性を有するリスクを伴う被験体におけるNK細胞の細胞傷害性を阻害する工程、減少させる工程または予防する工程を包含する。一つの実施形態において、方法は、所望でないNK細胞の細胞傷害性を阻害するか、減少させるかまたは予防するのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。
【0046】
本発明の方法はさらに、リンパ系細胞の分化を刺激する工程、促進する工程または増強する工程を包含する。一つの実施形態において、方法は、リンパ系細胞の分化を刺激するか、促進するかまたは増強するのに十分な、有効量のプロテインA(PA)を含む組成物と、リンパ系細胞とをインビトロ、エキソビボまたはインビボで接触させる工程を包含する。
【0047】
用語「接触する」とは、二つ以上の実体の間(例えば、PAと細胞または分子との間)の直接的なまたは間接的な結合または相互作用を意味する。本明細書で使用される場合、接触は、溶液、固相、インビトロ、細胞およびインビボにおけるものを含む。
【0048】
PAの活性を検出するためのアッセイは、本明細書で開示されたように、そしてさらに当該分野で公知であるように、以下を含む;リンパ球数、増殖、アポトーシスまたは生存および分化における細胞変化(トリパンブルー排除(生存率を含む));細胞のCDマーカーまたは他の分子(分化)における変化;抗体量(例えば、循環している自己抗体は、ELISAまたは他の抗体検出アッセイを用いて測定され得る);さらなる損傷を阻害する工程または既存の組織損傷を回復する工程を包含する組織改善または器官改善(改善された機能を示す、組織、組織機能または器官機能あるいは酵素レベル);全身効果(体重増加または体重減少もしくはるいそう状態の減少(改善された移動性));および脾臓の拡大(組織、リンパ球数およびそれらの分化状態)。
【0049】
本発明は、被験体における所望でない免疫応答を阻害および、減少させるかまたは予防するために使用され得るので、被験体における移植細胞の拒絶、移植組織の拒絶または移植器官の拒絶(すなわち、対宿主性移植片病)を阻害するための方法、減少させるための方法または予防するための方法がさらに提供される。一つの実施形態において、方法は、移植細胞、移植組織または移植器官の拒絶を阻害するか、減少させるかまたは予防するのに十分な、有効量のプロテインA(PA)を含む組成物を被験体に投与する工程を包含する。例示的な細胞としては、神経細胞が挙げられる。例示的な組織としては、皮膚、血管、眼および骨髄が挙げられる。例示的な器官としては、心臓、肺、肝臓および腎臓が挙げられる。種々の局面において、PAは、細胞、組織または器官の移植前に、移植と実質的に同時に、または移植後に投与される。移植細胞、移植組織または移植器官は、同種移植片または異種移植片であり得る。
【0050】
本明細書で使用される場合、用語「移植(transplant)」、「移植(transplantation)」およびそれらの文法的なバリエーションは、体の一部分から別な部分へまたは一つの個体/動物から別の個体/動物へ、細胞、組織または器官を移植すること(grafting)、移植すること(implanting)または移植すること(transplanting)を意味する。この用語はまた、例えば、エキソビボ遺伝子治療(ここでは、形質転換細胞、形質転換組織および形質転換器官は、移植を受けるヒトからもしくは異なるヒト/動物から得られたかまたは誘導される)によって、遺伝子的に改変された細胞、組織および器官を含む。
【0051】
本発明の方法および組成物は、インビトロ、エキソビボまたはインビボで使用され得る。組成物は、単回投与形態または複数回投与形態として、連続的に、隔日でまたは断続的に投与され得る。例えば、単回投与形態または複数回投与形態は、約7〜45日間または約1〜15週間にわたって、隔日でまたは断続的に投与され得る。一つの実施形態において、組成物は、3週間と5週間との間にわたって、隔日で単回用量として投与される。
処置は通常、被験体の状態における改善、すなわち、検出可能な被験体、被験体における組織または細胞または細胞集団に対して有益な変化を生じる。従って、処置は、状態または障害または症状の進行または悪化、あるいはさらなる悪化または状態もしくは障害の一つ以上の追加の症状の発症を、阻害するか軽減するか、または予防する結果となり得る。従って、成功裏の処置結果は、「治療効果」を導くか、あるいは、症状の重篤度もしくは頻度、または被験体における障害もしくは状態の根本にある原因を阻害するか、軽減するかもしくは予防することを導く。障害または状態を安定化させることはまた、成功裏の処置結果である。従って、処置は、状態または障害の一つ以上の症状の重篤度または頻度を軽減するかまたは予防し得、状態または障害の進行または悪化を阻害し得、そして、ある場合には、状態または障害を逆転し得る。従って、免疫障害の場合、例えば、処置は、免疫障害によって引き起こされる組織病理学的な変化または免疫障害に関連する組織病理学的な変化の改善を導き得る(例えば、骨格関節浸潤もしくは組織破壊、または胸腺、腎臓、肝臓、脾臓もしくは皮膚の組織浸潤もしくは組織破壊をさらに予防するかまたは軽減するかまたは再生する)。
【0052】
処置はまた、状態もしくは障害またはそれらの症状の根本にある原因に影響する工程を包含する。従って、免疫障害の場合、例えば、正常な基準に向けてリンパ球(例えば、脾細胞)絶対数または成熟リンパ球数を再調節するかまたは正常化することは、成功裏の処置結果であると考えられる。同様に、正常な基準に向けての循環抗体(例えば、自己抗体)の減少は、成功裏の処置結果であると考えられる。
【0053】
用語「改善する」とは、被験体の全般的な状態における検出可能な改善を意味する。検出可能な改善は、障害もしくは状態によって引き起こされる症状または障害もしくは状態に関連する症状の重篤度または頻度における主観的な減少、障害または状態の根本にある原因における改善、あるいは障害または状態の逆転(これは、アッセイを用いて検出可能である)を含む。
【0054】
本発明の方法は、症状が始まる前(すなわち、予防)もしくは症状が始まった後、症状または障害が発症する前または後(例えば、細胞移植、組織移植もしくは器官移植の前)に行われ得る。症状の発症前または症状発症後に組成物を投与することは、被験体における症状の重篤度または頻度を減少させ得る。さらに、症状発症前または症状発症直後に組成物を投与することは、例えば、免疫機能不全(例えば、自己免疫)の間に生じる細胞、組織および器官への損傷を減少させ得るかまたは予防し得る。
用語「被験体」とは、動物、代表的に哺乳動物(例えば、非ヒト霊長類(ゴリラ、チンパンジー、オランウータン、マカク、テナガザル)、家庭内動物(イヌおよびネコ)、農場動物(ウマ、ウシ、ヤギ、ヒツジ、ブタ)、実験動物(マウス、ラット、ウサギ、モルモット)ならびにヒト)をいう。ヒト被験体は、成人および小児を含む。ヒト被験体は、免疫機能不全を有する被験体または免疫機能不全を有するリスクを伴う被験体を含む。リスクを伴う被験体は、遺伝学的なスクリーニングを通して同定され得る。同定され得る遺伝的に連鎖した免疫障害の特定の例としては、X連鎖重症複合免疫不全症、アデノシンデアミナーゼ欠損症、ディ・ジョージ異常、毛細血管拡張性運動失調、ヴィスコット−オールドリッチ症候群、白血球接着不全および筋緊張性ジストロフィが挙げられる。これらの障害および他の障害は、胎児血液もしくは羊膜細胞を介してまたはサムター(Samter)免疫病;MM Frank、KF Austen,HN ClamanおよびER Unanue編集者;Little,Brown and Companyに記載されるように、成体組織サンプルを介して検出可能である。家族歴を再調査することは、障害(例えば、自己免疫または免疫不全)を発症する遺伝パターンまたはリスク(素因)増大を検出するのに使用され得る。リスクを伴う被験体はまた、特定の特性(例えば、所望でないかまたは異常なリンパ球集団(例えば、脾細胞)または自己抗体の存在)について、スクリーニングすることによって同定され得る。リスクを伴う被験体としては、細胞移植、組織移植または器官移植の必要性がある被験体が挙げられる。被験体はさらに、本発明の組成物のインビボでの効力を試験するための、疾患モデル動物(例えば、マウスおよび非ヒト霊長類)を含む(例えば、CIA、BXSB、EAEおよびSCIDマウスモデル)。
【0055】
本発明は、「リンパ球分化因子」(これは、細胞シグナル伝達またはシグナル伝達に対する応答を調節(regulating)または調節(modulating)し得る分子であり、これは、次に、その細胞自身、他の細胞の細胞行動またはその細胞が関与するプロセス(例えば、免疫系機能)を再調節し得るか、正常化し得るかまたは調節し得る)として既知の化合物を用いて実施される。本明細書で示される場合、リンパ球分化因子の特定の例は、PAである。PAについて本明細書で示されるように、リンパ球分化因子は、少ない量で、本発明に従って使用され得る。
【0056】
本発明はまた、本明細書に開示された活性のうちの一つ以上を生じ得る少ない量のPAに、少なくとも一部基づいている。例えば、二次性の抗原誘導時に開始する、隔日(M/W/F)で投与される1×10−5μg(1×10−11G)/用量のPAは、その後の炎症応答の発現および/もしくは進行を調節し、発現を調節し、そして/または炎症応答によって引き起こされた組織損傷を逆転した。しかし、このPA量において、実質的なスーパー抗原活性も体液性免疫の刺激もなかった。
【0057】
従って、本発明はまた、実質的なスーパー抗原活性を生じず、実質的な体液性免疫の刺激を生じず、またはFc結合とは実質的に独立してい、PAに関連する活性の一つ以上を生じ得る量のPAを含む、組成物を提供する。このような量でのPA活性としては、例えば、異常なまたは所望でない体液性免疫応答または細胞性免疫応答を再調節するかまたは正常化する(リンパ球の増殖、アポトーシスまたは分化を調節する)活性、自己免疫、炎症もしくは炎症応答または所望でないかもしくは異常な免疫応答によって引き起こされた組織損傷の少なくとも一部を阻害するか、逆転するか、改善するかまたは軽減する(疾患進行を阻害するかまたは予防する、疾患逆転もしくは組織再生を促進するかまたは増強する)活性、およびT脾細胞数もしくはB脾細胞数または一つ以上のマイトジェンに対するそれらの応答パターンを正常化する活性が挙げられる。
【0058】
従って、一つの実施形態において、組成物は、リンパ球の増殖、アポトーシスまたは分化を調節するのに十分な量のPAを含む。別の実施形態において、組成物は、自己免疫、炎症または炎症応答を阻害するか、逆転するか、改善するかまたは軽減するのに十分な量のPA量を含む。さらに別の実施形態において、組成物は、所望でないか異常な免疫応答によって引き起こされる細胞損傷、組織損傷または器官損傷の少なくとも一部を阻害するか、逆転するか、改善するかまたは軽減させるのに十分な量のPA量を含む。さらに別の実施形態において、組成物は、T脾細胞数もしくはB脾細胞数または一つ以上のマイトジェンに対するそれらの応答を再調節するかまたは正常化するのに十分な量のPA量を含む。一つの局面において、PA量は、1μg未満である。別の局面において、PA量は、1μg未満であるが、0.01ピコグラム(pG)より多くである。さらに別の局面において、PA量は、0.5〜0.1μg未満であるが、0.1pGより多くである。さらに別の局面において、PA量は、0.1〜0.01μg未満であるが、1pGより多くである。さらなる局面において、PA量は、1〜0.1μg未満であるが、1pGより多くである;0.1〜0.01μg未満であるが、1pGより多くである;0.01〜0.001μg未満であるが、1pGより多くである;1〜0.5μg未満であるが、1pGより多くである;500〜250pG未満であるが、1pGより多くである;250〜50pG未満であるが、5pGより多くである;そして、50〜25pg未満であるが、5pG(例えば、20pG、15pGまたは約10pG)より多くである。なおさらなる局面において、PA量は、実質的なスーパー抗原活性を生じないか、実質的な体液性免疫の刺激を生じないか、またはFc結合とは実質的に独立している。
【0059】
本明細書で使用される場合、用語「実質的にない」または「実質的に独立した」とは、スーパー抗原活性、体液性免疫の刺激またはPAのFc結合を参照して使用される場合、言及された特徴が、その量で観察されたPA活性に対して有意に寄与しないことを意味する。従って、実質的なスーパー抗原活性を生じないPA量は、PAのスーパー抗原活性がその量のPA活性に有意に寄与しないことを意味する。同様に、体液性免疫の実質的な刺激を生じないPA量は、少量の体液性活性を産生し得るが、一方、生じた免疫は、使用されるPA量において、PAの活性に有意に寄与しない。同様に、Fc結合とは実質的に独立したPA量は、使用されるPA量において、Fc結合がPA活性に有意に寄与しないことを意味する。言い換えれば、PAのFc機能を除去するかまたは損なうことは、使用された量におけるPAの活性を無効にしない。一般に、使用される少ない量のPA量において、スーパー抗原活性、体液性免疫の刺激またはPAのFc結合は、PA活性に有意に寄与しない。
【0060】
スーパー抗原活性は代表的に、非特異的なT細胞サブセットの増殖刺激によって特徴づけられる。すなわち、T細胞増殖は、エピトープ特異性から大部分は独立している。スーパー抗原活性は代表的に、約5〜10%のT細胞を増殖するように刺激するが、従来の抗原は、個体において約106個の細胞のうち一つを刺激し得る。従って、増殖するように刺激されたT細胞数を決定することによって、スーパー抗原活性はアッセイされ得る。このようなアッセイの例は、例えば、Johnsonら,Scientific American,1992年4月,92〜101頁;およびKotzinら,Adv.Immunol.54:99(1993)に記載される。スーパー抗原およびFC結合アッセイは、例えば、Romagnaniら,J.Immunol.129:596(1982)に記載される。FC結合アッセイは、例えば、Langone JJ,Adv.Immunol.32:157(1982)に記載される。体液性免疫刺激アッセイは、例えば、Leonettiら,J.Exp.Med.189:1217(1999)に記載される。
【0061】
従って、本発明の方法は、本発明の組成物を使用することによって実施され得る。例えば、一つの実施形態において、有効量のPAは、約0.1pg〜約1μgの用量である。別の実施形態において、有効量のPAは、約1pg〜約1μgの用量である。さらに別の実施形態において、有効量のPAは、約1pg〜約1μgの用量である。さらに別の実施形態において、有効量のPAは、約10pg〜約0.1μgの用量である。さらなる実施形態において、有効量のPAは、約10pg〜約0.1μgの単回用量である。
【0062】
組成物は、任意の経路によって、全身にまたは局所的に投与され得る。例えば、PAは、静脈内、経口(例えば、経口摂取もしくは吸入)、筋肉内、腹腔内、皮内、皮下、体腔内、頭蓋内、経皮(局所)、非経口(例えば、経粘膜(transmucosal))および直腸内に投与され得る。薬学的処方物を含む本発明の組成物は、マイクロカプセル化送達系を介して投与され得るか、または投与中移植物中に詰められ得る。
【0063】
組成物はさらに、本明細書に開示された活性の一つ以上を有する量のPAを含む薬学的処方物を含む。種々の実施形態において、薬学的処方物は、実質的なスーパー抗原活性がない状態で、実質的な体液性免疫の刺激がない状態で、またはFc結合とは実質的に独立した状態で、異常なもしくは所望でない体液性免疫応答もしくは細胞性免疫応答を再調節するかまたは正常化し(リンパ球の増殖、アポトーシスもしくは分化を調節する)、自己免疫、炎症もしくは炎症応答または所望でないかもしくは異常な免疫応答によって引き起こされた組織障害の少なくとも一部を阻害するか、逆転するか、改善するかまたは軽減し(疾患進行を阻害するかまたは予防する、疾患逆転もしくは組織再生を促進するかまたは増強する)、T脾細胞数もしくはB脾細胞数または一つ以上のマイトジェンに対するそれらの応答を正常化するのに十分な量のPA、ならびに薬学的に受容可能なキャリアまたは賦形剤を含む。
【0064】
本明細書で使用される場合、用語「薬学的に受容可能な」および「生理的に受容可能な」とは、(好ましくは、過度の有害な副作用(例えば、嘔気、腹痛、頭痛など)を生じないで)被験体に投与され得る、キャリア、賦形剤、希釈剤などをいう。投与のためのこのような調製物は、無菌の水性または非水性の溶液、懸濁液および乳濁液を含む。
【0065】
薬学的処方物は、被験体への投与に適合性のある、キャリア、希釈剤、賦形剤、溶媒、分散媒、コーティング、抗細菌剤および抗真菌剤、等張剤および吸収遅延剤などから作製され得る。このような処方物は、(コーティングされたかもしくはコーティングされていない)錠剤、(硬質もしくは軟質の)カプセル剤、マイクロビーズ、乳濁剤、散剤、顆粒剤、結晶、懸濁剤、シロップ剤またはエリキシル剤に含まれ得る。他の添加物の中でも補助活性化合物および保存剤はまた、例えば、抗微生物剤、抗酸化剤、キレート剤および不活性ガスなどを表し得る。
【0066】
薬学的処方物は、その意図される投与経路と適合性であるように処方され得る。従って、薬学的処方物は、腹腔内、皮内、皮下、経口(例えば、経口摂取もしくは吸入)、静脈内、体腔内、頭蓋内、経皮的(局所)、非経口的(例えば、経粘膜)および直腸内を含む経路による投与のために適切な、キャリア、希釈剤、または賦形剤を含む。
【0067】
非経口的、皮内もしくは皮下に適用するために使用される溶液または懸濁液は、以下を含み得る:無菌希釈剤(例えば、注射のための水、生理食塩水溶液、不揮発性油、ポリエチレングリコール、グリセリン、プロピレングリコールまたは他の合成溶液);抗細菌剤(例えば、ベンジルアルコールまたはメチルパラベン類);抗酸化剤(例えば、アスコルビン酸または重亜硫酸ナトリウム);キレート剤(例えば、エチレンジアミン四アセテート);緩衝剤(例えば、アセテート、シトレートまたはフォスフェート)および張度の調整のための因子(例えば、塩化ナトリウムまたはブドウ糖)。pHは、酸または塩基(例えば、塩酸または水酸化ナトリウム)で調整され得る。非経口用調製物は、ガラスまたはプラスチック製のアンプル、使い捨ての注射器または複数回用量のバイアルに入れられ得る。
【0068】
注射に適した薬学的処方物としては、無菌の水溶液(水溶性の場合)または水性分散物、および無菌の注射用溶液または分散液の即座の調製のための無菌粉末が挙げられる。静脈内投与については、適切なキャリアとしては、生理食塩水、静菌水、Cremophor ELTM(BASF、Parsippany,NJ)またはリン酸緩衝化生理食塩水(PBS)が挙げられる。このキャリアは、例えば、水、エタノール、ポリオール(例えば、グリセロール、プロピレングリコールおよび液体ポリエチレングリコールなど)、およびそれらの適切な混合物を含む、溶媒または分散媒であり得る。流動性は、例えば、レシチンなどのコーティングの使用によって、分散の場合における、必要な粒子サイズの維持によって、そして、界面活性剤の使用によって維持され得る。微生物の作用の予防は、種々の抗細菌剤および抗真菌剤(例えば、パラベン類、クロロブタノール、フェノール、アスコルビン酸、チメロサールなど)によって達成され得る。等張剤(例えば、糖、マンニトール(manitol)などの多価アルコール、ソルビトール、塩化ナトリウム)は、組成物内に含まれ得る。注射可能な処方物の長期吸収は、吸収を遅らせる因子(例えば、モノステアリン酸アルミニウムまたはゼラチン)を含むことによって達成され得る。
【0069】
経口投与について、組成物は、錠剤、トローチ剤またはカプセル剤(例えば、ゼラチンカプセル)の形態に、賦形剤と共に取り込まれ得る。薬学的に適合性のある結合剤および/またはアジュバント物質は、経口処方物に含まれ得る。錠剤、丸剤、カプセル剤、トローチ剤などは、以下の成分のどれか、または類似特性の化合物を含み得る:微結晶性セルロース、トラガカントゴムまたはゼラチンなどの結合剤;デンプンまたはラクトースなどの賦形剤、アルギン酸、Primogelまたはトウモロコシデンプンなどの崩壊剤;ステアリン酸マグネシウムまたはSterotesなどの滑沢剤;コロイド状二酸化ケイ素などのグリダント;スクロースまたはサッカリンなどの甘味剤;または、ペパーミント、サリチル酸メチルまたは香料などの矯味矯臭剤。
【0070】
処方物(例えば、放出を制御された処方物)はまた、急速な分解または体からの除去から組成物を保護するためのキャリア(体内でゆっくりと分解し、次に有効成分を放出する物質を含む)を含み得る。例えば、時間遅延物質(グリセリルモノステアレートまたはグリセリルステアレート)は、単独であるいはワックスとの組み合わせで、使用され得る。
【0071】
さらなる処方物は、投与された組成物の送達を制御するために、生分解性粒子もしくは生体適合性粒子、または高分子物質(例えば、ポリエステル、ポリアミン酸、ヒドロゲル、ポリビニルピロリドン、ポリ無水物、ポリグリコール酸、エチレン−ビニルアセテート、メチルセルロース、カルボキシメチルセルロース、硫酸プロタミン、またはラクチド/グリコリドコポリマー、ポリラクチド/グリコリドコポリマー、またはエチレンビニルアセテートコポリマー)を含む。このような処方物の調製方法は、当業者に明らかである。これらの物質はまた、例えば、Alza CorporationおよびNova Pharmaceuticals,Inc.から市販され得る。
【0072】
組成物の放出速度は、このような高分子の濃度または組成を変更することによって、制御され得る。例えば、組成物は、コアセルベーション技術または界面重合によって(例えば、ヒドロキシメチルセルロースもしくはゼラチンマイクロカプセルまたはポリ(メチルメタクリレート)マイクロカプセルの使用によって)、各々調製されたマイクロカプセル中に、あるいはコロイド薬物送達システム中に封入され得る。コロイド分散系としては、高分子複合体、ナノカプセル、マイクロスフェア、マイクロビーズならびに水中油型乳剤、ミセル、混合ミセルおよびリポソームを含む脂質ベースのシステムが挙げられる。例えば、米国特許第4,522,811号に記載されるような、当業者に公知の方法に従って、これらは調製され得る。
【0073】
投与に対して適切なさらなる薬学的処方物は、当該分野で公知であり、本発明の方法および組成物において適用できる(例えば、Remington’s Pharmaceutical Sciences(1990)第18版,Mack Publishing
Co.,Easton,PA;The Merck Index(1996)第12版,Merck Publishing Group,Whitehouse,NJ;およびPharmaceutical Principles of Solid Dosage Forms,Technonic Publishing Co.,Inc.,Lancaster,Pa.,(1993)を参照のこと)。
【0074】
本発明の組成物は、他の組成物との組み合わせを含み得、そして、本発明の薬学的組成物に含まれ得る。例えば、炎症応答もしくは炎症を減少させるか、または細胞の分化を刺激する薬物は、少ない量のPAと共に含まれ得る。例示的な薬物としては、ステロイド性抗炎症剤(SAI)および非ステロイド性抗炎症剤(NSAI)(例えば、コルチコステロイド、cox−2インヒビターまたはケモカインおよびサイトカイン(例えば、インターロイキンおよびインターフェロン)などの免疫系に影響を与える薬物)が挙げられる。
【0075】
薬学的処方物を含め、本発明の組成物は、例えば、本発明の方法を実施するキット(必要に応じて、使用説明書を含み得る)にパッケージされ得る。従って、本発明はキットを提供する。一つの実施形態において、キットは、適切な包装材料の中にパッケージされた、薬学的処方物を含む、本発明の一つ以上組成物(例えば、PA)を含む。さらなる実施形態において、キットは、本発明の方法を実施するためのラベルまたは添付文書を含む。従って、一つの実施形態において、キットは、免疫障害または免疫機能不全を有する被験体または免疫障害または免疫機能不全のリスクを伴う被験体をインビトロ、インビボもしくはエキソビボにおいて処置するための説明書を含む。なおさらなる実施形態において、キットは、自己免疫障害を有する被験体を少ない量のPAでインビボまたはエキソビボにおいて処置するための説明書を含む、ラベルまたは添付文書を含む。
【0076】
本明細書で使用される場合、用語「包装材料」とは、キットの構成要素を収容する物理的構造体をいう。包装材料は、構成要素を無菌的に維持し得、このような目的のために一般的に使用される物質(例えば、紙、波形繊維、ガラス、プラスチック、ホイル、アンプルなど)で作製され得る。このラベルまたは添付文書は、例えば、本発明の方法を実施する、適切な書面での説明書を含み得る。従って、本発明のキットはさらに、本発明の方法においてキットの構成要素を使用するための説明書を含み得る。
【0077】
説明書は、本明細書に記載された本発明の任意の方法を実施するための説明を含み得る。従って、本発明の薬学的組成物は、被験体への投与のための説明書と共に、容器、包装またはディスペンサーに含まれ得る。説明書はさらに、適応症、良好な臨床上の終点、起こり得る任意の有害な症状、またはヒト被験体での使用について米国食品医薬品局によって必要とされる追加情報を含み得る。
【0078】
この説明書は、「印刷物」(例えば、キット内の紙もしくは厚紙、キットもしくは包装材料に付けられたラベル、またはキットの構成要素を含むバイアルもしくはチューブに取り付けられたラベル)であり得る。説明書は、コンピュータ読み取り可能な媒体(例えば、ディスク(フロッピー(登録商標)ディスクもしくはハードディスク)、CD−ROMもしくはDVD−ROM/RAMなどの光学CD、磁気テープ、RAMおよびROMなどの電子記憶媒体および磁気/光学記憶媒体などのこれらのハイブリッド)に必要に応じて含まれ得る、音声またはビデオ・テープを含み得る。
【0079】
本発明のキットはまた、相乗効果もしくは相加効果を提供するか、または薬物もしくは障害の一つ以上の症状を軽減するかもしくは改善させる、一つ以上の薬物を含み得る。例えば、炎症応答または炎症を軽減する薬物が含まれ得る。例示的な薬物としては、ステロイド性抗炎症剤(SAI)および非ステロイド性抗炎症剤(NSAI)(例えば、コルチコステロイド、cox−2インヒビター)が挙げられる。本発明のキットはさらに、緩衝剤、保存剤または安定剤を含み得る。このキットはさらに、処置の活性または効果をアッセイするための制御成分を含み得る。このキットの各構成要素は、別々の個々の容器の中に入れられ得る。例えば、キットは、本明細書で説明されるように、少ない量のPAの1単位の投薬量(例えば、1μg未満から1pGまで)を含み得る。あるいは、キットは、少ない量のPAの複数単位投薬形態を含み得る。例えば、それぞれの複数単位投薬形態は、別々の個々の容器の中に少ない量のPAを含む(例えば、PAの各単位用量が、1用量あたり1μg未満から1pGまでである)。キット構成要素は、一つ以上の容器の混合物であり得、そして、種々の容器の全ては、単一のまたは複数のパッケージの中にあり得る。
【0080】
別に定義されない限り、本明細書で使用される全ての専門用語および学術用語は、この発明が属する分野の当業者によって一般的に理解されるのと同じ意味を有する。本発明に記載されるものと類似のまたは同等の方法および物質が、本発明の実施または試験で使用され得るが、適切な方法および物質が本明細書に記載される。
【0081】
本明細書に引用された全ての刊行物、特許および他の参考文献は、その全体が参考として援用される。矛盾する場合には、定義を含む本明細書が支配する。
【0082】
本明細書で使用される場合、単数形「a」、「an」および「the」は、文脈がそうでないと明確に示さない限り、複数の対象物を含む。従って、例えば、「リンパ球(a lymphocyte)」への言及は、複数のこのような細胞を含む。
【0083】
本発明の多くの実施形態が記載されている。それにもかかわらず、種々の改変が本発明の精神および範囲から逸脱しないで行われ得ることが理解される。従って、以下の実施例は例示であることが意図されるが、特許請求の範囲に記載される本発明の範囲を限定しないことが意図される。
【実施例】
【0084】
(実施例1)
本実施例は、動物炎症(関節炎)モデルおよび組織学データを記載し、非常に低い濃度で投与されたPAが、炎症を軽減し得、また炎症によって引き起こされた組織損傷を阻害または逆転し得ることを示す。
【0085】
各々5匹の動物の3つの群(処置群あたり合計15匹の動物)を用いた3つの別々の研究。最初の群は、リン酸緩衝化生理食塩水(PBS)を注射されたコントロールのキャリアである。第2群は、1日あたり1マウスあたり100μgのエンブレル(Enbrel)を受けた。製造業者(Immunex,Corp.,Seattle,WA)によって記載されるように、これは、最適のエンブレルの用量であった。第3群には、処置期間の間、月曜日、水曜日および金曜日に、10ピコグラム(pG)PA含有PBSキャリアを注入した(Amersham/Pharmacia Biotech,Piscataway,NJ)。PAはまた、Sigma−Aldrich,St.Louis,MO;Pierce Chemical Co.,Pittsburgh,PA;およびCalbiochem,San Diego,CAから獲得され得る。
【0086】
以下の表1は、これらの病気のかかりやすい動物において、進行性の炎症応答を示すコントロール群についての臨床指標データの概要を述べる。この応答は、使用制限時間内に、ピークまたはプラトーにならず、この応答がこれらの健康状態を危険にさらした場合に、コントロール動物を屠殺した。
【0087】
【表1】

【0088】
表1:CIAプロトコールによって処置した15匹のコントロール動物における、平均臨床指標測定値の生データ。このデータは、3つの別々の研究からプールしたデータである。
【0089】
表2は、同じ期間の間の、コントロール群の動物の足のカリパス測定値についての同様のデータを示す。これらのデータは、反応におけるプラトーが10日目より後に現れること以外は、臨床指標データを反映する。この反応プラトーは、代表的な抗体誘発性炎症応答の動態と一致する。
【0090】
【表2】

【0091】
表2:CIAプロトコールによって処置した15匹のコントロール動物における、平均カリパス足測定値の生データ。このデータは、3つの別々の研究からプールされたデータである。
【0092】
炎症応答の15日目に採取したコントロール動物の膝および足首の組織学的な分析は、広範囲の免疫浸潤および組織破壊を示した。免疫担当細胞は、コントロール動物の滑膜に蓄積した。エンブレルで処置した動物は、35日目に、膝および足首の滑膜における継続的な免疫の浸潤、ならびに継続的な組織破壊の証拠を示した。
【0093】
表3は、コントロールの未処置DBA/1動物の膝関節および足首関節の組織学的な検査結果の概要を述べる。これらの評点は、1から10までの連続スケール(1は「正常な」組織学的外観を表し、10は高度の損傷を表す)に対して、組織学者によって盲検に基づいて割りあてられる。コラーゲン誘発後のコントロール動物の膝関節および足首関節は、最大の組織損傷(「10」)を示す。これは、臨床指標(表1)および身体測定データ(表2)の両方と相関する。
【0094】
【表3】

【0095】
炎症応答35日目のPA処置した動物は、免疫浸潤のずっと少ない証拠および組織破壊のほんのわずかな証拠を示した。ほんのわずかな宿主免疫担当細胞が滑膜に存在し、また、組織片の証拠も組織破壊の証拠も無かった。従って、これらのデータは、PAがCIAモデルにおいて、急性炎症を軽減することを示す。これらのデータはまた、PAが組織損傷を軽減するか、または組織修復をエンブレルよりも促進することを示す。
【0096】
表4および表5は、PA(M/W/F注射あたり10pGで)の影響を試験する、3つの別々の研究結果を示す。エンブレルを比較として試験した;得られた結果は、公表された結果に匹敵した。PA処置は非常に効果的であり、標準エンブレルに必要とされる動物の数の約10%で有意性に達した。総臨床指標(表4)および身体測定(表5)についての結果は、匹敵する。
【0097】
【表4】

【0098】
【表5】

【0099】
表6は、これらの処置レジメンの間、1週目、2週目および3週目に屠殺したDBA/1マウスの組織学的評価の結果を示す。PA処置およびエンブレル処置の両方が、組織レベルにおいて有意な損傷を示す。これらのデータは、総臨床指標および足測定値(表4および表5)における有意な減少にもかかわらず、組織レベルでまだ損傷があることを示す。PA処置は、組織損傷を遅らせる(処置1週目 対 コントロール)ように見えるが、損傷を予防しない。
【0100】
【表6】

【0101】
CIAモデルプロトコールのように、2型コラーゲンを用いて誘発したDBA/1マウスを、2回目の抗原注射(コントロールについては溶媒キャリア(PBS)、PA(M/W/F注射あたり10pGで)およびエンブレル(毎日100μg/注射))の直後処置した。
【0102】
表7は、35日間まで処置を延ばした後の、組織学的な結果を示す。18日目に、人道的見地からコントロールマウスを屠殺し、そして、これらの18日目のデータを比較として含める。エンブレルの処置は、組織学的な損傷の改善を全く示さなかった。対照的に、PAの処置は、14〜21日目に、組織学的な損傷を逆転した。この組織学的なデータは、これらの動物の総臨床指標と相関する。従って、PA処置は、急性炎症応答の重篤度を有意に軽減し、そして、継続した処置は、この応答によって引き起こされた既存の組織損傷を逆転した。
【0103】
【表7】

【0104】
これらの組織の組織学的な評価は、低倍率、中程度の倍率および高倍率での評価を含んだ。コントロール(屠殺時、18日目)群およびエンブレル処置群の両方において、滑膜は多数の活性化リンパ球を有したが、処置35日目のPA群は、2型コラーゲン抗原誘発前のDBA/1動物におけるリンパ系細胞と数および形態が類似の小さなリンパ系細胞しか有さなかった。
【0105】
要するに、これらのデータは、足測定値および臨床指標評価がCIA動物モデルにおける誘発性炎症応答を実証すること;PAが、急性期の間、炎症応答を軽減し(P値 対 コントロール <0.05)、そして処置35日目までに応答によって引き起こされた組織学的な損傷を逆転すること;PAが、BXSB動物モデルおよび組織培養評価(以下においてさらに検討される)によって予測される濃度および投薬スケジュールにおいて、その改善効果を有すること;そして、エンブレル用量は、14日目に炎症を軽減する(N=15で有意とはいえない)が、35日目に観察された炎症損傷は軽減せず、これは、PAが、エンブレルよりも有効であることを示すことを示す。
【0106】
(実施例2)
本実施例は、PAの作用機序(MOA)が、エンブレルと異なるように見えることを示すデータについて説明する。
【0107】
CIA動物モデルにおいて受け入れられたMOAは、α−TNFの発現の競合阻害である。エンブレルは、既知のα−TNFインヒビターである。エンブレルのデータの回帰分析は、炎症応答の開始において遅延を示した。対照的に、PAのデータの回帰分析は、炎症プロセス自体における変化を示した。従って、PAのMOAは、主にα−TNF阻害を介するようには見えない。さらに、PAは、処置動物における誘発性炎症応答を軽減することにおいてエンブレルより効果的であるだけでなく、その応答によって引き起こされた既存の組織損傷を逆転し得る。
【0108】
任意の理論によって束縛されることはないが、従って、PAは、免疫依存性応答を統合する原因となる基底の制御機構を「調節」し得る。このMOAは、自己調節の観点から、単純な標的分子競合阻害の代わりにα−TNF阻害を含む。このようなMOAは、以下の特性を有すると予測される:
1)少量が必要とされる−付加機構に影響を及ぼす「分岐する」初期制御機構に対する調節効果;
2)自己調節性−PAが早期の制御点として作用する場合、このシステムは、副作用があったとえいてもほとんどない機構の強さおよび方向を調節する能力を有する;
3)多能性標的(すなわち、非細胞系列特異的)−PA制御点が早期である場合、その後の制御は多様であるはずであり、PAの濃度および投薬スケジュールは、一定であるはずである;ならびに
4)PAエフェクター分子構造は、多くのより複雑な構造と関連して見つけられるはずである。
【0109】
(実施例3)
本実施例は、早期死亡をもたらす遺伝学的な基礎を有する複合自己免疫不全疾患(combined autoimmune deficiency disease)によって特徴付けられた動物モデルにおいて、PAが多数の調節活性を有することを示すデータについて説明する。特に、PAは、るいそうの早期発症、脾臓区画の拡大を予防し、疾患プロセスによって引き起こされた組織損傷を改善するとともに、体液性免疫(自己抗体)、細胞性免疫(THl/TH2バランス)およびリンパ系細胞分化を調節する。
【0110】
BXSBマウスモデルは、オスにおける早期死亡(代表的には、腎不全による)を表す遺伝子(Yaa)に基づく動物モデルである。このモデルは、ヒト全身性エリテマトーデスについての類似物と文献で認められている。この遺伝子の欠損は、以下のパターンを有する一連の相関連した進行性全身性自己免疫疾患として発症する:胸腺萎縮症、抗核抗体、肝臓疾患、関節炎疾患、腎疾患および早期死亡。
【0111】
これは、複数の結果を有する遺伝的モデルであるので、他の研究者による以前の研究は、この疾患のただ一つの局面に集中した。本明細書で研究されたこの疾患プロセスの複数の局面に対するPAの影響は、以下を含む:
1.動物の生理機能に対する全体的影響
a.成長曲線
b.胸腺、肝臓、脳、腎臓、足首および膝の組織学
2.免疫調節−細胞増殖/アポトーシス
a.脾臓のサイズ、および
b.細胞数
3.リンパ球の動態
a.マイトジェン刺激に対するT/B応答
4.リンパ球の機能
a.体液性免疫
i.Ig−PFC産生
ii.自己抗体:ANA、抗カルジオリピン
b.細胞性免疫
i.ナチュラルキラー
c.細胞表面マーカー
d.細胞性サイトカイン
(研究検討)
1.慢性処置、異常:25匹のオスBXSB(コントロール+4つの処置群)の群を、15週間の期間にわたり、M/W/FにおいてPAで処置し、定期的に集団から離して(peel−off)屠殺した(通常処置3週間毎)。
【0112】
2.慢性処置、正常:15匹のオスC57BL/6Jの群を、15週間の期間にわたり、M/W/FにおいてPAで処置し、定期的に集団から離して屠殺した(通常処置3週間毎)。
【0113】
3.急性処置、異常:15匹のオスBXSBの群を、上記で決定したPA量を用いて、3週間にわたって処置し、次いで、これらの動物を処置3週後、処置6週後そして処置9週後に屠殺した。
【0114】
4.急性処置、正常:15匹のオスC57BL/6Jの群を、上記で決定したPA量を用いて、3週間にわたって処置し、次いで、これらの動物を処置3週後、処置6週後そして処置9週後に屠殺した。
【0115】
(PA濃度の決定)
PA量を、8ログにわたる濃度(1μG/注射から10−7μG/注射まで)でBXSBに投与した。この結果は、二つの最適なPAを示す(一方は0.01μG/注射、もう一方は10−5μG/注射)。用量応答曲線の形は、ガウス曲線である。明確にするために、提示されたデータは,10−5μG/注射についてである(図1)。
【0116】
図1は、PA投与後のオスBXSBの体重増加を示す。体重を、動物に、キャリアまたはPAのいずれかを注射した各時点で測定した。パネルAは、正常なC57BL/6Jマウス系統についての体重増加成長曲線であり、正常な体重増加成長曲線の代表的な形を示すために提示される。パネルBは、25匹のコントロールオスBXSBマウスからの体重増加データの累積和を示す。この曲線は、約4カ月齢における体重のピーク、その後の体重減少(これは、報告されたBSXB自己免疫疾患の発症に対応する)を示す。体重減少は、腎臓における免疫複合体の沈着に関連する「るいそう」症候群に至る。
【0117】
パネルCは、最適な2つの濃度(8つの濃度が研究された)におけるPAの慢性投与の影響を示す。0.01μG/注射および0.00001μG/注射の両方は、正常なロジスティックな形状であり、BXSBコントロールと比較してより良好な、体重増加成長曲線の両方の形に有意な変化を示し、両方の処置された動物群の平均体重は、コントロールよりも有意に高い(10−5μG用量について、X=24.16 P=0.0002)。
【0118】
これらの成長曲線を分析して、PAを用いてBXSB動物群を処置した場合のものとこれらを比較するために、回帰分析をデータについて実施した。上記に提示したC57BL/6Jの成長データは、以下の3次方程式によって最もよく表される:
【0119】
【数1】

【0120】
Rを二乗した値は、実際のデータと一次方程式との間で、非常に良いあてはめを示す。この方程式自体は「ロジスティック」形状の曲線(これは、正常成長曲線(図1)の代表である)の比較的に単純な抽出である。
【0121】
コントロールBXSBの成長曲線について、4つの別個のデータセットがある。全てのデータセットは内部で一致し、また、プールされたデータについての総合的な方程式は以下の通りである;
【0122】
【数2】

【0123】
この方程式は、図1のパネルAとパネルBとの間で示される曲線形状における相違の定量的な表示である。三次関数および二次関数は、全体の形状を規定し、非常に低い値は、重さの増加率および体重が時間の関数として減少するようである「るいそう」相を規定する。本研究において、目的は、各系統が各自の特定の増殖特性を有するので、C57BL/6J曲線の「ような(look like)」BXSB成長曲線を作成することではなく、むしろ、初期の増加率を増大し、図1(パネルD)において明確な「るいそう相」を減少させるかまたは除外することである。
【0124】
表8は、BXSB動物の種々のPA処置群に対するあてはめ方程式を示す。初期成長曲線の傾き(これは、増殖率を示す)は、BXSBコントロール動物において厳しく制限される。BXSBコントロール動物における変曲点は、疾患プロセスの致死効果を示す。この結果は、PA処置が、増殖率および致死率の両方に対して、用量依存性様式で正の効果を有することを示す。
【0125】
【表8】

【0126】
(組織学的な分析)
BXSBマウスモデルの種々の器官の組織学的な悪化は、複合自己免疫不全疾患の特徴である。この症候群は、複数の様相を有し、多数の器官に関わる。器官損傷は進行性であり、そして、個々の損傷は組織型によって変化し得る。
【0127】
表9は、より多くの量のPA(1〜0.001μg/注射)の組織学的な分析からの結果を示し、PAが組織学的な変化の開始および/または重篤度を用量依存性の様式で、変えたことを示す。表10は、より少ない量(0.00001〜0.0000001μg/注射)のPAについて同様のデータを示す。両方のPA用量は、器官組織学において最大の改善を示した。
【0128】
【表9】

【0129】
【表10】

【0130】
表9および表10における結果は、BXSBマウスのPA処置が、自己免疫性損傷を用量依存性の様式で減少させ得たことを表す。処置は、胸腺萎縮の発症を遅らせ、肝臓および関節の炎症の重篤度を軽減した。腎臓は、正常範囲内のままであった。PAを処置した動物の組織は、BXSBコントロール組織内に存在する損傷の逆転を示したが、C57BL/6J動物と比べて、それらは完全に正常であったというわけではない。最適なPA用量は、0.0001μgであり、これは、他のアッセイ系(例えば、Ig−PFC産生、NK活性、マイトジェン応答パターン、サイトカイン産生、自己抗体産生、脾臓サイズ、組織学的な改善)に一致する。
【0131】
要するに、本研究は、PAがるいそうの早期発症を予防し、そして、胸腺、肝臓、腎臓、膝および足首を含む組織での自己免疫疾患プロセスによって引き起こされる損傷を改善するかまたは逆転することを示す。
【0132】
(実施例4)
本実施例は、PAが、脾臓拡大および脾細胞数の阻害によって反映される、脾臓における免疫調節活性(例えば、増殖、アポトーシスまたは分化)を有することを示すデータについて説明する。
【0133】
研究の間、動物から脾臓を除去した。正常のC57BL/6Jの脾臓を基準点とした。未処置のBXSB動物からの脾臓は、有意に肥大していた。対照的に、PAを処置したBXSB動物の脾臓は、正常のC57BL/6Jの脾臓サイズに類似した。
【0134】
未処置のBXSB動物の肥大した脾臓は、巨脾腫として既知であり、広範囲の全身性の感染プロセスまたは異常な細胞アポトーシスもしくは異常な細胞増殖のいずれかの結果である。これらの動物は無菌環境で維持されるので、肥大した脾臓は不完全な細胞増殖/細胞死制御の結果のようである。肥大した脾臓についての別の説明は、この細胞が個々のサイズにおいて増大した(芽細胞症(blastosis)として知られているプロセス)ことであった。細胞サイズを測定する、蛍光活性化細胞選別(FACS)データの検査は、この可能性を除外した。FACS分析は、わずかに大きい細胞がBXSBコントロールで観察される傾向があるが、統計的に有意な増加は細胞サイズにおいて観察されなかったことを明らかにした。これらの所見と一致するのは、BXSB脾細胞数が、正常動物の脾細胞数の5倍より多いことである(表11、上)。
【0135】
【表11】

【0136】
表11(上)は、コントロールのマウス系統(C57BL/6JおよびDBA/2J)およびBXSBの両方のオスの脾臓の内容物を示す。BXSB脾細胞数は、両方の正常の系統で認められる脾細胞数の5倍より多い。PA処置は、BXSB脾細胞数を有意に減少させた(表11、下)。
【0137】
要するに、本研究は、PAが自己免疫疾患および脾細胞数によって引き起こされる脾臓区画の拡大(増殖/アポトーシス)を調節することを表す。PA処置は、脾臓サイズおよび脾細胞数を用量依存性の様式で、有意に減少させた。
【0138】
(実施例5)
本実施例は、BXSB動物が異常な脾細胞の分化または増殖またはアポトーシスを表すことを示すデータについて説明する。従って、このデータは、BXSB脾臓におけるPA活性が、異常な/不完全な脾細胞の分化または脾細胞の増殖/アポトーシスを再調節する(すなわち、正常な細胞増殖またはアポトーシスを回復する)ことを包含することを示す。
【0139】
マイトジェンは、細胞の一般集団(例えば、Tリンパ球および/またはBリンパ球)における細胞分裂を刺激する非特異的な能力を有するレクチンである。レクチンは、植物および動物で検出され、現代の抗体分子に対する前駆体として、最もよく特徴付けられる。レクチンは、細胞内連絡および他の連絡の形態で使用される。
【0140】
BXSBマウスにおけるTリンパ球区画が異常であるか否かを決定するために、T細胞特異的なおよびB細胞特異的な二つのマイトジェンを、BXSBマウスから単離された脾細胞の応答を研究するために、使用した。7つの異なるマイトジェン濃度および4つの動態学的な時点を、応答の大きさ(存在する細胞数の指標)、そして第二に最適の刺激濃度(細胞の分化状態の指標)に関して、BXSB動物の脾細胞応答を試験するために使用した。
【0141】
要するに、処置レジメンの間、BXSBマウスおよびコントロールマウスを、定期的に屠殺にし、それらの脾臓を除去した。1〜2×106/mlでの脾細胞懸濁液を、96ウェルプレートに分配する。マイトジェン(10μG/10μL〜0.01μG/10μL)を3連でウェルに添加し、24時間の間隔を置いて、培養24時間から96時間まで、この培養物を収集した。収集前の16時間の間に、全ての培養物をトリチウム化チミジンで処理した。新たに合成した放射性標識DNAを含むDNAをガラス繊維フィルター上に抽出し、この放射活性を液体シンチレーション計数によって決定する。
【0142】
【表12】

【0143】
表12は、植物性血球凝集素(PHA)、コンカナバリンA(Con−A)、ブドウ球菌エンテロトキシンB(SEB)およびリポポリサッカライド(LPS)に対するC57BL/6Jマウスのマイトジェン応答を示す。PHAおよびCon−Aは、基準となるTリンパ球集団を用量依存性様式で増殖するように刺激するが、SEBおよびLPSは、Bリンパ球集団の用量依存性増殖を刺激する。
【0144】
【表13】

【0145】
表13は、BXSBコントロールのマイトジェン研究からの結果を示す。統計的分析は、全てのマイトジェン応答がC57BL/6Jコントロールより有意に低いことを示す。さらに、BXSBコントロールに対するPHA応答曲線およびCon−A応答曲線の形は、正常なC57BL/6Jコントロールと異なる。両方において、ピーク応答を達するために、より低いマイトジェン濃度へのシフトがあった。応答曲線の形におけるこれらの変化は、分化状態における変化に関連した。
【0146】
【表14】

【0147】
表14は、コントロールBXSBとの統計的な比較を示す。マイトジェンは、コントロールC57BL/6に応答する。ほとんど全ての場合において、BXSBのマイトジェン応答の大きさは制御され、このことは、成熟細胞集団の縮小および最適応答濃度におけるより低い値へのシフトを示す。従って、これらのデータは、コントロールBXSB脾細胞における異常な分化(脾細胞の過剰増殖または減少したアポトーシスを導く)を示す。
【0148】
【表15】

【0149】
【表16】

【0150】
【表17】

【0151】
【表18】

【0152】
表15〜表18は、BXSB脾細胞のマイトジェン応答に対するPAの効果を示す。動態は複雑であるが、いくつかの結論に達し得る。PA(0.5μG)がPHA応答およびCon−A応答を上昇させることは、T細胞集団動態およびB細胞集団動態の正常化を示す。PAがまた、マイトジェン応答の大きさおよび応答曲線の形状の多くを回復させること、マイトジェンに対するT細胞応答またはB細胞応答の部分的または完全な回復を示す。
【0153】
要するに、本研究は、異常なBXSB脾性リンパ球数ならびに代表的なTマイトジェン応答およびBマイトジェン応答を、PA処置を用いて少なくとも部分的に訂正し得ることを示す。
【0154】
(実施例6)
本実施例は、PAがおそらくBXSB動物における組織破壊の原因となるようである自己抗体の量を減少させることを示すデータについて説明する。
【0155】
リウマチ様抗体が、RA患者において有意なパーセントで見出されるので、体液性免疫は、抗体産生の原因であり、そして重要である。異常抗体は、何人かの患者の滑膜で見出されている。BXSBモデルにおいて、異常抗体が産生される。
【0156】
コントロール動物およびPAを処置したBXSB動物から獲得した脾細胞を、プラーク形成細胞(PFC)アッセイにおいて研究した。このアッセイにおいて、標的赤血球は、抗原特異性にかかわらず任意の分泌された免疫グロブリンと結合する、プロテインAで標識され、その結果、体液性免疫の広い見解を提供する。
【0157】
【表19】

【0158】
表19は、コントロールBXSB脾細胞のIg−PFC応答を示す(これは、コントロールC57BL/6脾細胞よりも100倍以上大きく、BXSB動物における異常な抗体産生を示す)。
【0159】
【表20】

【0160】
表20は、Ig−PFC産生に対するPAの用量関連効果を示す。全てのPA量は、0.0001μG PA(最大の減少を示す)を用いて、Ig−PFCの過剰産生を有意に減少させた。
【0161】
BXSBコントロール脾細胞は、莫大なレベル(61400±6435PFC/1E06)で抗体を作製し、分泌する。これは、C57BL/6J正常コントロールで観察された値の約100倍である。PA処置は、自己抗体レベルを用量依存性様式および時間依存性様式において、有意に減少させる。
【0162】
【表21】

【0163】
表21は、BXSB動物における自己抗体の発生を示す(より大きい数ほど、より多い量の循環自己抗体を示す)。PA処置は、測定した全ての時点において、自己抗体レベルを減少させる。
【0164】
【表22】

【0165】
表22は、PA媒介性の自己抗体の減少が、用量依存性であることを示す。最大の減少は、0.00001μGで生じる。
【0166】
要するに、PAは、非特異的な自己抗体の数を調節し、損傷を与える自己抗体の量を減少させる。PAがまた、BXSBの脾臓における抗体産生細胞を減少させることは、このデータと関連する。従って、PA処置は、体液性免疫を少なくとも一部、回復させる。
【0167】
(実施例7)
本実施例は、PAがBXSBマウスの細胞傷害性応答を減少させ、この応答を基準レベルに、または基準レベル付近に再調節することを示すデータについて説明する。
【0168】
免疫系の細胞成分は、免疫系全体についての機能の主な積算器(primary integrator of function)であり、それらの種々の分化した形態のT細胞およびB細胞性を認識機能およびエフェクター機能の両方に供給する。BXSB動物モデルでは、細胞性免疫(CMI)系は完全であると報告されている。しかし、これらの報告とは反対に、以下に記載されるデータは、CMIがBXSBマウスにおいて影響を受けることを示す。
【0169】
放射性標識クロムで標識した非特異的な標的を認識し、溶解する可能性について、BXSBマウス(コントロールマウスおよびPAで処置されたマウスの両方)を研究した。手短にのべると、コントロール動物および処置したBXSBマウスからの約200μlの脾臓細胞(1×107/ml)を、マイクロタイタープレート上のRPMI培地にプレーティングし、5つの2倍連続希釈物をRPMI培地中に作製した。P815細胞をクロム(Cr5l)で放射性標識し、96ウェルプレートの各ウェルに添加し、12分間遠心分離し、次いで、37℃で3〜4時間インキュベートした。細胞を再度遠心分離し、Cr5lについて110μlのサンプルを計数した。より詳細なプロトコールは、Current
Protocols in Immunology,3.11,Assays for
T cell Functionに含まれる。
【0170】
【表23】

【0171】
表23は、正常マウス(真ん中のカラム)が、Cr51で標識したP−815標的に対するナチュラルキラー活性の代表的な基準レベルを有することを示す;このレベルは、100:1のエフェクター標的比において、0%と3%との間の細胞傷害性である;左のカラムは、同じ標的に対するBXSBマウスの細胞傷害性応答を示す;細胞傷害性のレベルは、6:1のエフェクター標的比において、50%を超えて、非常に高い。3〜15週間の期間にわたるBXSBのPA処置(右のカラム)は、何の回帰分析の可能性も有さず、細胞傷害性を基準レベルまで減少させた(すなわち、100:1のE/T比において、0〜3%)。
【0172】
要するに、この研究は、PA処置が未調節のBXSB細胞傷害性応答をコントロール基準レベルまでまたはコントロール基準レベル付近にまで20倍減少させることを示す。従って、PA処置は、細胞性免疫を少なくとも一部、回復させる。
【0173】
(実施例8)
本実施例は、PAが、リンパ系系列の細胞の細胞分化、増殖またはアポトーシスの調節を反映する、CDマーカーの発現を調節することを示すデータについて説明する。
【0174】
クラスター化決定基(CDマーカー)の発現は、リンパ系細胞の分化状態を示す。PAは、これらのマーカーを特異的に調節する。この調節は、上記に記載されるデータと直接的な相関を有する。
【0175】
【表24A】

【0176】
表24Aは、多くのT細胞性CDマーカーのデータを示す。約80%の正常脾細胞(BL6コントロール)は、非活性化(CD69−)T細胞(CD69−、CD4+)である。この集団は、若い(実験2〜10週、および10〜18週の暦齢)BXSB動物および老いた(実験11〜15週、および19〜23週の暦齢)BXSB動物の両方において減少する。また、動態学的な効果もある:11〜15週のBXSB動物は、それらのT細胞マーカーに関して、若いBXSB動物よりも厳しく損なわれている。これは、低下した細胞機能および増加した総死亡率に相関する。
【0177】
【表24B】

【0178】
表24Bは、多くのB細胞性CDマーカーのデータを示す。3つのマーカーの第1セットは、静止B細胞(すなわち、非活性化)を示し、最後の3つは、活性化B細胞を表す。これらのデータは、B細胞集団が、BXSBマウスにおける疾患プロセスの系統および段階の両方に抵抗性があることを示す。従って、BXSB複合免疫不全疾患プロセスの一次細胞性免疫の成分は、T細胞に関与するように見える。
【0179】
グラフ1は、種々のPA濃度(1E−03〜1E−07μgのPA/注射)を用いたBXSBマウスの慢性処置(3〜15週)の効果からのデータを示す。このデータの最初の著しい特徴は、PAを用いたBXSBマウスの処置が、CD69−/CD4+T細胞の集団を調節するということである。この調節は、1つの細胞集団がフィードバックと方向機構およびフィードフォワード方向との両方においてその系列(および他の細胞系列)において他に作用するので、予想される他のT細胞マーカーの調節に相関する。また、細胞集団についてのPA用量応答効果があり、これは、機能アッセイにおいて、上記に記載される応答と一致する;同様に、用量時間の動態学的な応答もある。これらのデータは、事実上、PA処置用量がT細胞の分化を調節することを示す。
【0180】
グラフ1はまた、E−03のPA用量が、早い時点においてBXSBコントロールで観察されるCD69−CD4+の減少を調整するが、慢性処置のより長期の時点でこの効果を失うことを表すデータを示す。対照的に、E−07用量は、短い時点と長い時点との両方において、有効であるように見える。これらのデータは、生体調節レジメン(Bio−Regulatory regimen))の特徴と一致する:1)用量応答曲線は、ガウス曲線である;そして、2)効果を産生する少量のPAは、より伝統的な単一エフェクター標的の代わりに、標的に指向したプロセスを示唆する。
【0181】
【表24C】

【0182】
表25は、単一の3週間の間、1週間につき3回、同じ量での急性処置、続いて、処置がないさらに6〜9週間と比べて、6〜9週間の期間にわたって1週間につき3回投与された慢性的なPA(1E−05μG/用量)の効果を示す。急性処置は、CDマーカーの提示を調節するのに有効である。複雑であるが、データは種々のマーカー間の相関を示す;一方、CD8系列は、CD4細胞系列またはB細胞系列よりもPAに対して感受性が最も低いように見える。
【0183】
【表25】

【0184】
表26は、これらの研究で使用された9つのT細胞マーカー系列についての、単一のPA用量(1E−05μG)の時間プロフィールを示す。さらに、二重陽性細胞(アポトーシスが運命づけられている)およびCD8を有する活性化系列は、処置に対して相対的に抵抗性である。PA処置用量は、活性化CD4系列および成熟細胞傷害性T細胞(CD8+CD4−)を調節する。
【0185】
【表26】

【0186】
要するに、本研究は、急性または慢性のPA処置が、BXSBマウスにおけるT細胞性CDマーカーを用量依存性様式および動態学依存的様式において調節したこと(これは、正常なマイトジェン応答の一部の回復(実施例5)、自己抗体産生の減少(実施例6)および細胞傷害性応答の軽減(実施例7)を含む、上記に記載される機能的な変化と関連がある)を示す。従って、PAはリンパ系系列の細胞の分化結果を調節する。
【特許請求の範囲】
【請求項1】
明細書に記載の発明。
【請求項1】
明細書に記載の発明。
【図1A】


【図1B】


【図1C】




【図1B】


【図1C】


【公開番号】特開2010−31050(P2010−31050A)
【公開日】平成22年2月12日(2010.2.12)
【国際特許分類】
【出願番号】特願2009−256593(P2009−256593)
【出願日】平成21年11月9日(2009.11.9)
【分割の表示】特願2003−583342(P2003−583342)の分割
【原出願日】平成15年3月6日(2003.3.6)
【出願人】(504376821)プロタレックス, インコーポレイテッド (3)
【Fターム(参考)】
【公開日】平成22年2月12日(2010.2.12)
【国際特許分類】
【出願日】平成21年11月9日(2009.11.9)
【分割の表示】特願2003−583342(P2003−583342)の分割
【原出願日】平成15年3月6日(2003.3.6)
【出願人】(504376821)プロタレックス, インコーポレイテッド (3)
【Fターム(参考)】
[ Back to top ]

