ペプチド、合成ペプチド、及び抗菌剤
【課題】抗菌性に優れたペプチド等を提供する。
【解決手段】イシカワガエル(Odorrana ishikawae)の皮膚から36個のアミノ酸からなるペプチド(palustrin-2ISb)を単離した。更に、このペプチドに基づいて29個のアミノ酸からなる合成ペプチド(palustrin-2ISb-des-C7)を作製した。これらペプチド及び合成ペプチドは、いずれも優れた抗菌性を有することが認められた。
【解決手段】イシカワガエル(Odorrana ishikawae)の皮膚から36個のアミノ酸からなるペプチド(palustrin-2ISb)を単離した。更に、このペプチドに基づいて29個のアミノ酸からなる合成ペプチド(palustrin-2ISb-des-C7)を作製した。これらペプチド及び合成ペプチドは、いずれも優れた抗菌性を有することが認められた。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、抗菌性を有するペプチド等に関する。
【背景技術】
【0002】
カエルの皮膚から分泌される分泌液には、抗菌性を有するペプチド(抗菌ペプチドともいう)が含まれていることが知られており、この種の抗菌ペプチドについては様々な検討が行われている(特許文献1,2)。
【0003】
本発明者らは、奄美大島と沖縄本島の固有種であるイシカワガエル(Odorrana ishikawae)について研究を行っている。イシカワガエルは、天然記念物であり、絶滅危惧IB類に分類された絶滅危惧種でもある。広島大学両生類研究施設では、そのイシカワガエルの人工繁殖に成功している。
【0004】
イシカワガエルは、感染症に対して強い抵抗性を示すことが分かっており、本発明者らは、イシカワガエルの皮膚から9種類の抗菌ペプチドを単離、同定している(非特許文献1)。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開平6−80695号公報
【特許文献2】特表2002−522556号公報
【非特許文献】
【0006】
【非特許文献1】Iwakoshi-Ukena E, Ukena K, Okimoto A, Soga M, Okada G, Sano N, Fujii T, Sugawara Y, Sumida M. Identification and characterization of antimicrobial peptides from the skin of the endangered frog Odorrana ishikawae. Peptides 32:670-676 (2011)
【発明の概要】
【発明が解決しようとする課題】
【0007】
近年、MRSA(メチシリン耐性黄色ブドウ球菌)等、多剤耐性菌による院内感染が大きな社会問題となっている。抗生物質は、細菌の基質の合成を特異的に阻害するため、優れた抗菌性を発揮するが、抗生物質が乱用されると、細菌の薬剤耐性遺伝子に変異が生じ、細菌に抗生物質が作用しなくなるという問題がある。
【0008】
それに対し、抗菌ペプチドは、抗生物質とは作用機序が異なり、耐性菌が生まれにくいということが分かってきている。そのため、抗菌ペプチドは、抗生物質の代替品として期待されている。
【0009】
そこで、本発明の目的は、抗菌性に優れ、特にMRSAに対して有効なペプチド等を提供することにある。
【課題を解決するための手段】
【0010】
本発明者らは、イシカワガエルの皮膚に含まれる抗菌ペプチドについて、更なる同定を進めた結果、先の9種の抗菌ペプチドとは異なる、36個のアミノ酸からなる新たな抗菌ペプチドを単離、同定した(palustrin-2ISb)。
【0011】
palustrin-2ISbのアミノ酸配列は、「Gly-Leu-Trp-Asn-Ser-Ile-Lys-Ile-Ala-Gly-Lys-Lys-Leu-Phe-Val-Asn-Val-Leu-Asp-Lys-Ile-Arg-Cys-Lys-Val-Ala-Gly-Gly-Cys-Lys-Thr-Ser-Pro-Asp-Val-Glu」である(配列番号2)。
【0012】
このpalustrin-2ISbのC末端側には、2個のシステインがジスルフィド結合した構造(この構造をラナボックスと称する)が存在し、そのラナボックスに続いて7つのアミノ酸が連なるという構造的な特徴が認められる。先の9種の抗菌ペプチドでもラナボックスは認められたが、ラナボックス以降に連なるアミノ酸は認められなかったことから、palustrin-2ISbのラナボックス以降の7つのアミノ酸を除去した29個のアミノ酸からなる合成ペプチドを作製した(palustrin-2ISb-des-C7)。
【0013】
palustrin-2ISb-des-C7のアミノ酸配列は、「Gly-Leu-Trp-Asn-Ser-Ile-Lys-Ile-Ala-Gly-Lys-Lys-Leu-Phe-Val-Asn-Val-Leu-Asp-Lys-Ile-Arg-Cys-Lys-Val-Ala-Gly-Gly-Cys」である(配列番号1)。
【0014】
天然ペプチドであるpalustrin-2ISbと、合成ペプチドであるpalustrin-2ISb-des-C7とについて、抗菌活性を調べたところ、いずれのペプチドにも抗菌活性が認められた。特に、palustrin-2ISb-des-C7は、palustrin-2ISbに比べて強い抗菌活性が認められた。
【発明の効果】
【0015】
本発明のペプチド等には、優れた抗菌性があるので、抗菌剤等に活用できる。
【図面の簡単な説明】
【0016】
【図1】抗菌性の測定結果を示す図である。
【発明を実施するための形態】
【0017】
以下、本発明の実施形態を図面に基づいて詳細に説明する。ただし、以下の説明は、本質的に例示に過ぎず、本発明、その適用物あるいはその用途を制限するものではない。
【0018】
<palustrin-2ISbの単離、同定>
(1)抽出
奄美大島産(人工増殖体:2004年4月7日交配)のイシカワガエル(2年4ヶ月齢:体長約6cm)の5個体を試料とした。試料のそれぞれについて、断頭後、全身の皮膚を剥がした。次に、その皮膚を直ちにハサミで細断した後、液体窒素で凍結しながら粉砕した。粉砕した皮膚は、ペプチド分解酵素を失活させるために、少量ずつ沸騰した100mlの湯の中に投入し、7分間保持した。皮膚を含む湯を氷水で冷却することにより、粗抽出液を得た。その粗抽出液に対し、容量の5%になるように酢酸を4ml加え、ハンディミキサーでホモジナイズすることにより酢酸抽出を行った。
【0019】
更に、酢酸抽出を行った粗抽出液に対し、容量の60%になるように冷アセトンを120ml加え、30分間冷却しながら攪拌し、除タンパクを行った。その後、4℃、10000g、20分間の条件で遠心分離することにより、粗抽出液から沈殿物を除去した。そうして得られた上清を遠心エバポレーターにより濃縮し、第1試料液を得た。
【0020】
第1試料液は、使い捨てカラムであるC18カートリッジ(BOND ELUT)に通し、次の各ステップの処理を行うことにより、精製に用いる保持物質(第2試料液)を得た。
【0021】
第1ステップ:C18カートリッジに100%メタノールを6ml通して、活性基を活性化した。
【0022】
第2ステップ:C18カートリッジに0.1%トリフルオロ酢酸(TFA)を6ml通して、C18カートリッジを洗浄した。
【0023】
第3ステップ:C18カートリッジに第1試料液を注入し、非吸着物質を溶出した。
【0024】
第4ステップ:C18カートリッジに0.1%TFAを12ml通して、非吸着物質を溶出した。
【0025】
第5ステップ:C18カートリッジに70%メタノールを12ml通して、C18カートリッジに保持されていた保持物質を溶出し、第2試料液を回収した。
【0026】
(2)精製
第2試料液を遠心エバポレーターを用いて濃縮し、その濃縮した第2試料液を用いて逆相HPLC(高速液体クロマトグラフィー)により、5段階の処理を通じて精製を行った。HPLCの諸条件は次の通りである。
【0027】
カラムオーブン温度は40℃、第2試料液の流速は0.5ml/minとした。溶出液については220nmの波長での吸光度をモニタリングし、2分毎の分画をサンプリングした。第2段階以降の精製は、後述する抗菌アッセイによって抗菌活性が見られた分画に対してのみ、続けて逆相HPLCによる精製を進めた。
【0028】
精製に用いた逆相HPLCカラムとアセトニトリルの濃度勾配を次に示す。
・第1段階:C18逆相カラム(ODS−80TM 4.6×150mm、東ソー株式会社製)、0−70%アセトニトリル/35分間
・第2段階:C18逆相カラム(ODS−80TM 4.6×150mm、東ソー株式会社製)、35−65%アセトニトリル/60分間
・第3段階:C18逆相カラム(ODS‐80TM 4.6×150mm、東ソー株式会社製)、35−45%アセトニトリル/50分間
・第4段階:C8逆相カラム(Octyl−80TS 4.6×250mm、東ソー株式会社製)、36−46%アセトニトリル/50分間
・第5段階(最終段階):シアノプロピル逆相カラム(CN−80TS 4.6×250mm、東ソー株式会社製)、22−26%アセトニトリル/20分間
【0029】
(3)抗菌アッセイ
精製した各分画を乾固し、その1/50量を50μlのMueller−Hinton培地に溶解し、試料培地を作製した。対数増殖期のBL21大腸菌を1×106cfu(colony forming units)/mlに希釈し、大腸菌希釈液を作製した。そして、各試料培地に50μlの大腸菌希釈液を混合し、96穴マイクロプレートに入れ、37℃で一晩培養した。なお、Mueller−Hinton培地のみに50μlの大腸菌希釈液を混合したブランクコントロールも同じプレートで培養した。
【0030】
一晩培養後、大腸菌希釈液を混合した各試料培地の吸光度(波長600nm)を測定した。大腸菌が増殖すれば、培地が濁って吸光度が増加する。従って、ブランクコントロールよりも吸光度が著しく(1/2〜1/3程度)低い分画を抗菌活性のある分画として選択した。
【0031】
(4)構造決定
精製によって最終的に得られた試料に含まれるペプチドの質量値は、MALDI−TOF−MS(AXIMA−CFR plus、島津製作所製)により測定した。また、そのペプチドのアミノ酸配列は、アミノ酸シーケンサ(PPSQ−10、島津製作所製)により決定した。その結果、得られたペプチド(palustrin-2ISb)のアミノ酸一次配列(1文字表記)を次に示す。
【0032】
GLWNSIKIAGKKLFVNVLDKIR「C」KVAGG「C」KTSPDVE
【0033】
3文字表記に変換して表すと、Gly-Leu-Trp-Asn-Ser-Ile-Lys-Ile-Ala-Gly-Lys-Lys-Leu-Phe-Val-Asn-Val-Leu-Asp-Lys-Ile-Arg-「Cys」-Lys-Val-Ala-Gly-Gly-「Cys」-Lys-Thr-Ser-Pro-Asp-Val-Gluとなる(配列番号2)。
【0034】
このように、palustrin-2ISbは、36個のアミノ酸からなり、そのC末端側には、2つのシステイン(配列中「」で示す)がジスルフィド結合した構造(ラナボックス)が存在していることがわかった。palustrin-2ISbでは、ラナボックス以降に更に連なる7つのアミノ産(KTSPDVEの部分)が認められた。
【0035】
本発明者らが先にイシカワガエルの皮膚から単離、同定した9種類の抗菌ペプチドにも、同様のラナボックスは認められたが、いずれもC末端に位置しており(非特許文献1参照)、palustrin-2ISbのように、ラナボックス以降に連なるアミノ酸は認められなかった。
【0036】
そこで、本発明者らは、palustrin-2ISbのラナボックス以降に連なる7個のアミノ酸を削除することで抗菌活性が高まるのではないかとの仮説を立て、そのような29個のアミノ酸の配列からなる合成ペプチド(palustrin-2ISb-des-C7)を作製した。
【0037】
(5)合成ペプチドの作製
合成ペプチド(palustrin-2ISb-des-C7)は、ペプチド合成機(PSSM−8、島津製作所製)を用いて作製した。palustrin-2ISb-des-C7のアミノ酸一次配列(1文字表記)を次に示す。
【0038】
GLWNSIKIAGKKLFVNVLDKIRCKVAGGC
【0039】
3文字表記に変換して表すと、Gly-Leu-Trp-Asn-Ser-Ile-Lys-Ile-Ala-Gly-Lys-Lys-Leu-Phe-Val-Asn-Val-Leu-Asp-Lys-Ile-Arg-Cys-Lys-Val-Ala-Gly-Gly-Cysとなる(配列番号1)。
【0040】
(6)抗菌性の測定
天然ペプチド(palustrin-2ISb)と、合成ペプチド(palustrin-2ISb-des-C7)のそれぞれの抗菌性を、最小発育阻止濃度(MIC)の測定により行った。
【0041】
具体的には、96穴マイクロプレートの各ウェルに、培地49μl、ペプチド1μl(2倍希釈系列で7段階の濃度)、各菌種の菌液50μlを加えて混合し、37℃で1晩静置培養した。培養後、各ウェルに対し、マイクロプレートリーダーで吸光度(波長600nm)の測定を行うとともに、ウェル内の白濁や沈殿の有無を目視により観察し、その発育阻止効果を判定した。
【0042】
抗菌性を評価する菌種には、大腸菌(Escherichia coli)、黄色ブドウ球菌(Staphylococcus aureus)、メチシリン耐性黄色ブドウ球菌(MRSA)、真菌のカンジダ(Candida albicans)の4種を用いた。それぞれの菌種に用いた培地と接種した菌濃度を次の表1に示す。
【0043】
【表1】

【0044】
図1に、これら菌種に対する天然のペプチド(palustrin-2ISb)及び合成ペプチド(palustrin-2ISb-des-C7)のMICの測定結果を示す。なお、MICは微生物の発育を阻止する最も低い濃度であり、その数値が低いほど抗菌活性が強いことを意味する。また、NAは、100μMでも抗菌活性が認められなかったことを示している。
【0045】
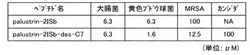
同図に示すように、palustrin-2ISbは、カンジダでは100μMでは抗菌活性は認められなかったが、MRSAでは100μM、大腸菌及び黄色ブドウ球菌では6.3μMで抗菌活性が認められた。また、palustrin-2ISb-des-C7は、カンジダで100μM、MRSAで12.5μM、大腸菌で6.3μM、黄色ブドウ球菌で1.6μMで抗菌活性が認められた。
【0046】
ペプチド(palustrin-2ISb)、合成ペプチド(palustrin-2ISb-des-C7)の双方に抗菌活性が認められたことから、これらは抗菌剤として利用できる。抗菌剤の具体例としては、例えば、ペプチドを希釈媒体に混合して所定濃度に調整し、液状や粉状に加工して抗菌剤を作製する。そして、求める抗菌性を示す濃度以上となるように、被抗菌対象の素材に抗菌剤を添加すればよい。
【0047】
特に、palustrin-2ISb-des-C7は、palustrin-2ISbよりも強い抗菌活性が認められ、院内感染が問題となっているMRSAに強い抗菌活性が認められたことから、MRSAに対する抗菌剤としての利用が期待できる。
【産業上の利用可能性】
【0048】
本発明のペプチド等は、医療分野や生活関連分野などの分野で利用でき、塗料、洗剤、食品添加物など、抗菌性が求められる用途に好適である。
【技術分野】
【0001】
本発明は、抗菌性を有するペプチド等に関する。
【背景技術】
【0002】
カエルの皮膚から分泌される分泌液には、抗菌性を有するペプチド(抗菌ペプチドともいう)が含まれていることが知られており、この種の抗菌ペプチドについては様々な検討が行われている(特許文献1,2)。
【0003】
本発明者らは、奄美大島と沖縄本島の固有種であるイシカワガエル(Odorrana ishikawae)について研究を行っている。イシカワガエルは、天然記念物であり、絶滅危惧IB類に分類された絶滅危惧種でもある。広島大学両生類研究施設では、そのイシカワガエルの人工繁殖に成功している。
【0004】
イシカワガエルは、感染症に対して強い抵抗性を示すことが分かっており、本発明者らは、イシカワガエルの皮膚から9種類の抗菌ペプチドを単離、同定している(非特許文献1)。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開平6−80695号公報
【特許文献2】特表2002−522556号公報
【非特許文献】
【0006】
【非特許文献1】Iwakoshi-Ukena E, Ukena K, Okimoto A, Soga M, Okada G, Sano N, Fujii T, Sugawara Y, Sumida M. Identification and characterization of antimicrobial peptides from the skin of the endangered frog Odorrana ishikawae. Peptides 32:670-676 (2011)
【発明の概要】
【発明が解決しようとする課題】
【0007】
近年、MRSA(メチシリン耐性黄色ブドウ球菌)等、多剤耐性菌による院内感染が大きな社会問題となっている。抗生物質は、細菌の基質の合成を特異的に阻害するため、優れた抗菌性を発揮するが、抗生物質が乱用されると、細菌の薬剤耐性遺伝子に変異が生じ、細菌に抗生物質が作用しなくなるという問題がある。
【0008】
それに対し、抗菌ペプチドは、抗生物質とは作用機序が異なり、耐性菌が生まれにくいということが分かってきている。そのため、抗菌ペプチドは、抗生物質の代替品として期待されている。
【0009】
そこで、本発明の目的は、抗菌性に優れ、特にMRSAに対して有効なペプチド等を提供することにある。
【課題を解決するための手段】
【0010】
本発明者らは、イシカワガエルの皮膚に含まれる抗菌ペプチドについて、更なる同定を進めた結果、先の9種の抗菌ペプチドとは異なる、36個のアミノ酸からなる新たな抗菌ペプチドを単離、同定した(palustrin-2ISb)。
【0011】
palustrin-2ISbのアミノ酸配列は、「Gly-Leu-Trp-Asn-Ser-Ile-Lys-Ile-Ala-Gly-Lys-Lys-Leu-Phe-Val-Asn-Val-Leu-Asp-Lys-Ile-Arg-Cys-Lys-Val-Ala-Gly-Gly-Cys-Lys-Thr-Ser-Pro-Asp-Val-Glu」である(配列番号2)。
【0012】
このpalustrin-2ISbのC末端側には、2個のシステインがジスルフィド結合した構造(この構造をラナボックスと称する)が存在し、そのラナボックスに続いて7つのアミノ酸が連なるという構造的な特徴が認められる。先の9種の抗菌ペプチドでもラナボックスは認められたが、ラナボックス以降に連なるアミノ酸は認められなかったことから、palustrin-2ISbのラナボックス以降の7つのアミノ酸を除去した29個のアミノ酸からなる合成ペプチドを作製した(palustrin-2ISb-des-C7)。
【0013】
palustrin-2ISb-des-C7のアミノ酸配列は、「Gly-Leu-Trp-Asn-Ser-Ile-Lys-Ile-Ala-Gly-Lys-Lys-Leu-Phe-Val-Asn-Val-Leu-Asp-Lys-Ile-Arg-Cys-Lys-Val-Ala-Gly-Gly-Cys」である(配列番号1)。
【0014】
天然ペプチドであるpalustrin-2ISbと、合成ペプチドであるpalustrin-2ISb-des-C7とについて、抗菌活性を調べたところ、いずれのペプチドにも抗菌活性が認められた。特に、palustrin-2ISb-des-C7は、palustrin-2ISbに比べて強い抗菌活性が認められた。
【発明の効果】
【0015】
本発明のペプチド等には、優れた抗菌性があるので、抗菌剤等に活用できる。
【図面の簡単な説明】
【0016】
【図1】抗菌性の測定結果を示す図である。
【発明を実施するための形態】
【0017】
以下、本発明の実施形態を図面に基づいて詳細に説明する。ただし、以下の説明は、本質的に例示に過ぎず、本発明、その適用物あるいはその用途を制限するものではない。
【0018】
<palustrin-2ISbの単離、同定>
(1)抽出
奄美大島産(人工増殖体:2004年4月7日交配)のイシカワガエル(2年4ヶ月齢:体長約6cm)の5個体を試料とした。試料のそれぞれについて、断頭後、全身の皮膚を剥がした。次に、その皮膚を直ちにハサミで細断した後、液体窒素で凍結しながら粉砕した。粉砕した皮膚は、ペプチド分解酵素を失活させるために、少量ずつ沸騰した100mlの湯の中に投入し、7分間保持した。皮膚を含む湯を氷水で冷却することにより、粗抽出液を得た。その粗抽出液に対し、容量の5%になるように酢酸を4ml加え、ハンディミキサーでホモジナイズすることにより酢酸抽出を行った。
【0019】
更に、酢酸抽出を行った粗抽出液に対し、容量の60%になるように冷アセトンを120ml加え、30分間冷却しながら攪拌し、除タンパクを行った。その後、4℃、10000g、20分間の条件で遠心分離することにより、粗抽出液から沈殿物を除去した。そうして得られた上清を遠心エバポレーターにより濃縮し、第1試料液を得た。
【0020】
第1試料液は、使い捨てカラムであるC18カートリッジ(BOND ELUT)に通し、次の各ステップの処理を行うことにより、精製に用いる保持物質(第2試料液)を得た。
【0021】
第1ステップ:C18カートリッジに100%メタノールを6ml通して、活性基を活性化した。
【0022】
第2ステップ:C18カートリッジに0.1%トリフルオロ酢酸(TFA)を6ml通して、C18カートリッジを洗浄した。
【0023】
第3ステップ:C18カートリッジに第1試料液を注入し、非吸着物質を溶出した。
【0024】
第4ステップ:C18カートリッジに0.1%TFAを12ml通して、非吸着物質を溶出した。
【0025】
第5ステップ:C18カートリッジに70%メタノールを12ml通して、C18カートリッジに保持されていた保持物質を溶出し、第2試料液を回収した。
【0026】
(2)精製
第2試料液を遠心エバポレーターを用いて濃縮し、その濃縮した第2試料液を用いて逆相HPLC(高速液体クロマトグラフィー)により、5段階の処理を通じて精製を行った。HPLCの諸条件は次の通りである。
【0027】
カラムオーブン温度は40℃、第2試料液の流速は0.5ml/minとした。溶出液については220nmの波長での吸光度をモニタリングし、2分毎の分画をサンプリングした。第2段階以降の精製は、後述する抗菌アッセイによって抗菌活性が見られた分画に対してのみ、続けて逆相HPLCによる精製を進めた。
【0028】
精製に用いた逆相HPLCカラムとアセトニトリルの濃度勾配を次に示す。
・第1段階:C18逆相カラム(ODS−80TM 4.6×150mm、東ソー株式会社製)、0−70%アセトニトリル/35分間
・第2段階:C18逆相カラム(ODS−80TM 4.6×150mm、東ソー株式会社製)、35−65%アセトニトリル/60分間
・第3段階:C18逆相カラム(ODS‐80TM 4.6×150mm、東ソー株式会社製)、35−45%アセトニトリル/50分間
・第4段階:C8逆相カラム(Octyl−80TS 4.6×250mm、東ソー株式会社製)、36−46%アセトニトリル/50分間
・第5段階(最終段階):シアノプロピル逆相カラム(CN−80TS 4.6×250mm、東ソー株式会社製)、22−26%アセトニトリル/20分間
【0029】
(3)抗菌アッセイ
精製した各分画を乾固し、その1/50量を50μlのMueller−Hinton培地に溶解し、試料培地を作製した。対数増殖期のBL21大腸菌を1×106cfu(colony forming units)/mlに希釈し、大腸菌希釈液を作製した。そして、各試料培地に50μlの大腸菌希釈液を混合し、96穴マイクロプレートに入れ、37℃で一晩培養した。なお、Mueller−Hinton培地のみに50μlの大腸菌希釈液を混合したブランクコントロールも同じプレートで培養した。
【0030】
一晩培養後、大腸菌希釈液を混合した各試料培地の吸光度(波長600nm)を測定した。大腸菌が増殖すれば、培地が濁って吸光度が増加する。従って、ブランクコントロールよりも吸光度が著しく(1/2〜1/3程度)低い分画を抗菌活性のある分画として選択した。
【0031】
(4)構造決定
精製によって最終的に得られた試料に含まれるペプチドの質量値は、MALDI−TOF−MS(AXIMA−CFR plus、島津製作所製)により測定した。また、そのペプチドのアミノ酸配列は、アミノ酸シーケンサ(PPSQ−10、島津製作所製)により決定した。その結果、得られたペプチド(palustrin-2ISb)のアミノ酸一次配列(1文字表記)を次に示す。
【0032】
GLWNSIKIAGKKLFVNVLDKIR「C」KVAGG「C」KTSPDVE
【0033】
3文字表記に変換して表すと、Gly-Leu-Trp-Asn-Ser-Ile-Lys-Ile-Ala-Gly-Lys-Lys-Leu-Phe-Val-Asn-Val-Leu-Asp-Lys-Ile-Arg-「Cys」-Lys-Val-Ala-Gly-Gly-「Cys」-Lys-Thr-Ser-Pro-Asp-Val-Gluとなる(配列番号2)。
【0034】
このように、palustrin-2ISbは、36個のアミノ酸からなり、そのC末端側には、2つのシステイン(配列中「」で示す)がジスルフィド結合した構造(ラナボックス)が存在していることがわかった。palustrin-2ISbでは、ラナボックス以降に更に連なる7つのアミノ産(KTSPDVEの部分)が認められた。
【0035】
本発明者らが先にイシカワガエルの皮膚から単離、同定した9種類の抗菌ペプチドにも、同様のラナボックスは認められたが、いずれもC末端に位置しており(非特許文献1参照)、palustrin-2ISbのように、ラナボックス以降に連なるアミノ酸は認められなかった。
【0036】
そこで、本発明者らは、palustrin-2ISbのラナボックス以降に連なる7個のアミノ酸を削除することで抗菌活性が高まるのではないかとの仮説を立て、そのような29個のアミノ酸の配列からなる合成ペプチド(palustrin-2ISb-des-C7)を作製した。
【0037】
(5)合成ペプチドの作製
合成ペプチド(palustrin-2ISb-des-C7)は、ペプチド合成機(PSSM−8、島津製作所製)を用いて作製した。palustrin-2ISb-des-C7のアミノ酸一次配列(1文字表記)を次に示す。
【0038】
GLWNSIKIAGKKLFVNVLDKIRCKVAGGC
【0039】
3文字表記に変換して表すと、Gly-Leu-Trp-Asn-Ser-Ile-Lys-Ile-Ala-Gly-Lys-Lys-Leu-Phe-Val-Asn-Val-Leu-Asp-Lys-Ile-Arg-Cys-Lys-Val-Ala-Gly-Gly-Cysとなる(配列番号1)。
【0040】
(6)抗菌性の測定
天然ペプチド(palustrin-2ISb)と、合成ペプチド(palustrin-2ISb-des-C7)のそれぞれの抗菌性を、最小発育阻止濃度(MIC)の測定により行った。
【0041】
具体的には、96穴マイクロプレートの各ウェルに、培地49μl、ペプチド1μl(2倍希釈系列で7段階の濃度)、各菌種の菌液50μlを加えて混合し、37℃で1晩静置培養した。培養後、各ウェルに対し、マイクロプレートリーダーで吸光度(波長600nm)の測定を行うとともに、ウェル内の白濁や沈殿の有無を目視により観察し、その発育阻止効果を判定した。
【0042】
抗菌性を評価する菌種には、大腸菌(Escherichia coli)、黄色ブドウ球菌(Staphylococcus aureus)、メチシリン耐性黄色ブドウ球菌(MRSA)、真菌のカンジダ(Candida albicans)の4種を用いた。それぞれの菌種に用いた培地と接種した菌濃度を次の表1に示す。
【0043】
【表1】

【0044】
図1に、これら菌種に対する天然のペプチド(palustrin-2ISb)及び合成ペプチド(palustrin-2ISb-des-C7)のMICの測定結果を示す。なお、MICは微生物の発育を阻止する最も低い濃度であり、その数値が低いほど抗菌活性が強いことを意味する。また、NAは、100μMでも抗菌活性が認められなかったことを示している。
【0045】
同図に示すように、palustrin-2ISbは、カンジダでは100μMでは抗菌活性は認められなかったが、MRSAでは100μM、大腸菌及び黄色ブドウ球菌では6.3μMで抗菌活性が認められた。また、palustrin-2ISb-des-C7は、カンジダで100μM、MRSAで12.5μM、大腸菌で6.3μM、黄色ブドウ球菌で1.6μMで抗菌活性が認められた。
【0046】
ペプチド(palustrin-2ISb)、合成ペプチド(palustrin-2ISb-des-C7)の双方に抗菌活性が認められたことから、これらは抗菌剤として利用できる。抗菌剤の具体例としては、例えば、ペプチドを希釈媒体に混合して所定濃度に調整し、液状や粉状に加工して抗菌剤を作製する。そして、求める抗菌性を示す濃度以上となるように、被抗菌対象の素材に抗菌剤を添加すればよい。
【0047】
特に、palustrin-2ISb-des-C7は、palustrin-2ISbよりも強い抗菌活性が認められ、院内感染が問題となっているMRSAに強い抗菌活性が認められたことから、MRSAに対する抗菌剤としての利用が期待できる。
【産業上の利用可能性】
【0048】
本発明のペプチド等は、医療分野や生活関連分野などの分野で利用でき、塗料、洗剤、食品添加物など、抗菌性が求められる用途に好適である。
【特許請求の範囲】
【請求項1】
配列番号1で表される29個のアミノ酸の配列からなる合成ペプチド。
【請求項2】
配列番号2で表される36個のアミノ酸の配列からなるペプチド。
【請求項3】
請求項1に記載の合成ペプチドを含む抗菌剤。
【請求項4】
請求項2に記載のペプチドを含む抗菌剤。
【請求項1】
配列番号1で表される29個のアミノ酸の配列からなる合成ペプチド。
【請求項2】
配列番号2で表される36個のアミノ酸の配列からなるペプチド。
【請求項3】
請求項1に記載の合成ペプチドを含む抗菌剤。
【請求項4】
請求項2に記載のペプチドを含む抗菌剤。
【図1】




【公開番号】特開2013−35782(P2013−35782A)
【公開日】平成25年2月21日(2013.2.21)
【国際特許分類】
【出願番号】特願2011−173297(P2011−173297)
【出願日】平成23年8月8日(2011.8.8)
【出願人】(504136568)国立大学法人広島大学 (924)
【出願人】(507234438)公立大学法人県立広島大学 (24)
【Fターム(参考)】
【公開日】平成25年2月21日(2013.2.21)
【国際特許分類】
【出願日】平成23年8月8日(2011.8.8)
【出願人】(504136568)国立大学法人広島大学 (924)
【出願人】(507234438)公立大学法人県立広島大学 (24)
【Fターム(参考)】
[ Back to top ]

