リウマチ疾患の診断方法
【課題】リウマチ疾患に関連した、特に関節リウマチに関連した抗体の検出のための新規ポリペプチドを提供する。
【解決手段】前記ポリペプチドのうち1種を含有する診断薬、前記診断薬を含有する診断キット、並びに、リウマチ疾患のin vitro検出のための方法に関する。更に本発明は、前記ポリペプチドのうち1種を含有する医薬品、並びに、リウマチ疾患の予防及び/又は治療のための医薬品の製造のための前記ポリペプチドの使用に関する。
【解決手段】前記ポリペプチドのうち1種を含有する診断薬、前記診断薬を含有する診断キット、並びに、リウマチ疾患のin vitro検出のための方法に関する。更に本発明は、前記ポリペプチドのうち1種を含有する医薬品、並びに、リウマチ疾患の予防及び/又は治療のための医薬品の製造のための前記ポリペプチドの使用に関する。
【発明の詳細な説明】
【技術分野】
【0001】
発明の詳細な説明
本発明は、リウマチに関連した自己抗体と反応するポリペプチドに関する。本発明は更に、前記ポリペプチドのうち1種を含有する診断薬、前記診断薬を含有する診断キット、並びに、リウマチ疾患のin vitro検出のための方法に関する。更に本発明は、前記ポリペプチドのうち1種を含有する医薬品、並びに、リウマチ疾患の予防及び/又は治療のための医薬品の製造のための前記ポリペプチドの使用に関する。
【背景技術】
【0002】
リウマチ疾患、特に、関節及び運動器官の範囲内での痛みは、ドイツ国内で最も頻繁な疾病に属する。害のない筋肉緊張(Verspannung)、関節症、又は最も頻繁かつ最も深刻な疾病、関節リウマチ(RA)の痛みを分類することを可能にする実験室試験はこれまでに公知でない。
【0003】
関節リウマチは、人体の防御機構が、誤って身体特有の関節軟骨を異物かつ敵として取り扱い、これらを攻撃する自己免疫疾患である。およそ100人につき1人が、西ヨーロッパ諸国において関節リウマチに苦しむ。この疾病の最初の月に、この疾病は極めて迅速に進行する。
【0004】
現代のリウマチ学における重要な鍵となる戦略は従って、この疾病の進行に変化を及ぼす、生物学的な医薬物質の早期の使用である。数々の臨床研究が、適した作用物質を用いて、例えばTNFアンタゴニストを用いて、これらを患者が既に早期段階で使用する場合に、極めて良好な治療成果及び応答速度を達成することができることを示している。リウマチ学は、この疾病の開始時と構造上の軟骨損傷の発生時との間の狭い時間範囲を利用することを試みている。これまでにはしかしながら、技術水準からは、この時間範囲における関節リウマチの確実であってかつ感受性のある検出手段は公知ではない。
【0005】
関節リウマチの診断は、ACR(American College of Rheumatology)の分類診断基準に応じて行われる。ACRの診断基準によれば、関節リウマチ(RA)の診断のためにこれまでに基礎となる血清学的な指示薬(Indikator)は、リウマトイド因子である。リウマトイド因子は、免疫グロブリンG(IgG)のFc領域に対する免疫学的な交差反応により特徴付けられる、免疫グロブリンの部分基(Teilgruppe)である。
【0006】
リウマトイド因子の存在はしかしながら、リウマチ性症状群(鑑別診断的根拠)の疾患に限定されておらず、リウマトイド因子はまた、感染症、高グロブリン血症、リンパ球増殖性B細胞疾患を有する患者の血清中にも、そして一般的には老齢の人口層でも見出される。
【0007】
一般的には、リウマトイド因子の高められた濃度は、より深刻な疾病進行と関連する。この際、この濃度は、活動度(Aktivitaetgrad)及び治療成果とは相関しない。リウマトイド因子の濃度を基礎として、関節リウマチの開始について、感受性がありかつ特異的な予後を的確に言い当てることはできない健康な人間は、患うこと無く高められたリウマトイド因子濃度を有し、これに対してリウマトイド因子を有しない患者は、関節リウマチの極めて攻撃性の形態を有する。
【0008】
その他の血清学的マーカー、例えば抗シトルリン抗体(CCP)又は初期HAQスコア(これを用いて毎日素質を判定する)、又は、レントゲン−又はコンピュータートモグラフィ(CT)画像は、早期の形態ではわずかな情報のみを与え、かつ、単独では、患者の予後がいかになるかを判定するには説得性が十分でない。
【0009】
ACRの既にある分類判断基準の最適化のためには、アメリカリウマチ学会(US-amerikanischen Rheumatologischen Fachgesellschaft)により、劣悪な予後を示す7つの分類判断基準が提案されている:
1.1時間より長く続く朝の関節こわばり、
2.3箇所以上の関節炎、
3.少なくとも3箇所の関節領域の同時期の関節炎症、
4.手の関節又は指の関節が同じように襲われる、
5.中手指節関節の左右対称性の触接による痛み
6.レントゲン画像中のびらん、
7.特殊なリウマトイド因子の検出及び抗核周囲因子陽性(APF)。
【0010】
このいわゆる抗核周囲因子に対する自己抗体は、最初にYoung et al.により、関節リウマチを有する患者で記載された (Young, B.J.J. et al., Antikeratin antibodies in rheumatoid arthritis, B.M.J., 2 (1979), 97-99)。ラットの食道断片での角質層の角質上皮に対するその特異的な反応のために、ケラチンは相応する抗原として長い間考慮されてきた(Vincent, CH. et al.; High diagnostic value in rheumatoid arthritis of antibodies to the stratum corneum of rat Oesophagus epithelium, so-called "antikeratin antibodies", Ann. Rheumat. Dis. 48 (1989), 712-722)。この抗体は、この理由から、今日まで抗ケラチン−抗体(AKA)と呼ばれる(Vincent, CH. et al, Natural IgG to Epidermal Cytokeratins vs IgG to the Stratum Corneum of the Rat Oesophagus Epithelium, so-called "Antikeratin Antibodies", in Rheumatoid Arthritis and other Rheumatic Diseases; J. of Autoimmunity 4 (1991), 493-505; Paimela, L. et al., Antikeratin antibodies:diagnostic and prognostic markers for early rheumatoid Arthritis, Ann. Rheumat Dis. , 51 (1992) 743-746)。
【0011】
この後の調査は更に、AKA又はAPFが、抗フィラグリン抗体によっても認識されることを示した。従って、この塩基性タンパク質フィラグリンは目的抗原として同定された。この40kDaのタンパク質は、サイトケラチンフィラメントを凝集させ、角質細胞の細胞内繊維マトリックスを形成するのに加勢する(Simon, M. et al., The Cytokeratin FilamentAggregating Protein Filaggrin is the Target of the So-called "Antikeratin Antibodies", Autoantibodies Specific for Rheumatoid Arthritis, J. Clin. Invest., 92 (1993), 1387-93)。
【0012】
APF、AKA及び抗フィラグリン抗体を含有する血清は同じように反応するので、この抗体系は見かけ上同一である。99%を上回る特異性でもって、IgGタイプの抗フィラグリン抗体は、関節リウマチのための高特異性マーカーである。この抗体は原則的に、早期に検出可能であり、かつ、臨床学的な症状に先立つ。複数の研究において、疾病の深刻度(Schwere)及び活動性に対して正の相関が見出されることができる。抗フィラグリン抗体は、年齢、性別又は疾病期間とは相関しない。これらは、約34%のリウマトイド因子陰性患者において検出されることができ、かつここで有用な診断手段を提供する。前記抗体はしかしながら、今日利用できる方法を用いて、約40%の症例においてのみ血清中で見出すことができる。
【先行技術文献】
【非特許文献】
【0013】
【非特許文献1】Young, B.J.J. et al., Antikeratin antibodies in rheumatoid arthritis, B.M.J., 2 (1979), 97-99
【発明の概要】
【発明が解決しようとする課題】
【0014】
本発明の課題は従って、リウマチ疾患の、特に、関節及び運動器官の範囲の痛みの、感受性がありかつ特異的な診断、分類化及び予後を可能にする、リウマチ疾患に関連した、特に関節リウマチに関連した抗体の検出のための新規ポリペプチドを提供することであった。
【0015】
天然のビメンチンに対する抗体結合、即ち、APF陽性又は抗Sa反応性(anti-Sa-Reaktivitaet)(E. R. Vossenaar et al; Rheumatoid arthritis specific anti-Sa antibodies target citrullinated vimentin; Arthritis Res. Ther. 6(2), (2004), 142-150))の分析の際に、免疫学的に反応性でないことが技術水準から公知の天然のビメンチン(CA. Hitchon et al.; Immune features of seronegative and seropositive arthritis in early synovitis studies; Curr. Opin. Rheumatol. 14(4), (2002), 348-353)は、変異した免疫学的に反応性の変異体の形態で存在することが見出された。この認識は意外なものであり、というのもこれまでの技術水準によれば、免疫学的に反応性であるためにはビメンチンはシトルリン化されていなくてはらないことを前提としていたからである。ディファレンシャルイムノアフィニティクロマトグラフィ(differenzielle Immunaffinitaetschromatographie)により、免疫学的に反応性のビメンチン変異体を、ヒト単球からの変異配列を用いて濃縮できたことにより、この仮定は誤っていることが我々により確認された。天然のビメンチンの変異した変異体は、天然のビメンチンとは、更なるアルギニン残基及び場合により更なる配列相違の存在により区別される。これらは、ヒトのRA関連抗体と反応し、意外にも、公知技術から公知のシトルリン化ペプチドと比較してより高い特異性及び感受性を示す。
【課題を解決するための手段】
【0016】
本発明の主題は従って、SEQ ID NO:1を有する天然のビメンチンから誘導されていて、かつ、この天然の配列に対して、少なくとも1つの更なるアルギニン残基の存在により区別されるポリペプチドである。
【0017】
更なるアルギニン残基は、有利には、天然のヒトのビメンチンのその他のアミノ酸残基の置換により、この配列中に挿入されている。有利には前記ポリペプチドは、16、17、19、41、58、59、60、68、76、140、142、147、363、406又は452の位置の少なくとも1つにアルギニン残基を有する。特に有利な位置は、41、58、59、60及び/又は68である。例えば、このポリペプチドは、少なくとも1つ、2つ、3つ又は4つの位置に更なるアルギニン残基を有する。
【0018】
更なる一実施態様において、このポリペプチドは更に、3、20、33、36、37、94、165、361、399又は426の位置の少なくとも1つに、天然の配列に対して更なるロイシン残基を有し、有利には位置、33、36及び/又は37に有する。例えば前記ポリペプチドは少なくとも1つ、2つ、3つ又は4つの位置に更なるロイシン残基を有する。
【0019】
更なる一実施態様において、このポリペプチドは、少なくとも1つの位置に、例えば21、41、43、50、54、62、64又は89の少なくとも1つの位置に、天然の配列に対して更なるプロリン残基を有し、有利には位置、41、43、50、54、62及び/又は64に有する。例えば前記ポリペプチドは少なくとも1つ、2つ、3つ又は4つの位置に更なるプロリン残基を有する。
【0020】
更なる一実施態様において、このポリペプチドは、少なくとも1つの位置に、例えば、24、35又は99の1つの位置に、天然の配列に対して更なるトレオニン残基を有する。例えば前記ポリペプチドは少なくとも1つ、2つ、又は3つの位置にトレオニン残基を有する。
【0021】
更なる一実施態様において、このポリペプチドは、少なくとも1つの位置に、例えば、25、39、42、49、55又は67の1つの位置に、天然の配列に対して更なるチロシン残基を有する。例えば前記ポリペプチドは少なくとも1つ、2つ、3つ又は4つの位置にチロシン残基を有する。
【0022】
一実施態様において、前記ポリペプチド中には少なくとも1つのアルギニン残基が、シトルリン残基として、例えば、4、12、23、28、36、45、50、64、71、100、320、364又は378の少なくとも1つの前記位置に存在する。例えば、前記ポリペプチドは、少なくとも1つ、2つ、3つ又は4つの位置に、シトルリン残基を有する。他方では、このポリペプチドはしかしながら、シトルリン不含ポリペプチドとして存在することもできる。
【0023】
ヒトのビメンチンのムテインのための有利な例は、SEQ ID NO:2、3、4、5、6、7、8又は9を有する配列を有する。
【0024】
本発明の更なる主題は、SEQ ID NO:1を有する天然のビメンチンから誘導されていて、かつ、少なくとも1つのアルギニン残基を有する少なくとも1の範囲を含有し、かつ、リウマチ疾患に関連した自己抗体に対する反応性を示す、前述したポリペプチドうちの1つの断片である。有利には前記断片は、位置10〜145の範囲にある。特に有利には、前記断片は、位置30〜70の範囲にある。断片の有利な例は、断片51〜65(C2)である。前記断片の長さは、有利には、少なくとも6アミノ酸、特に有利には少なくとも8アミノ酸から、120アミノ酸まで、有利には100アミノ酸まで、特に有利には50アミノ酸までである。
【0025】
本発明の更なる主題は、前述したポリペプチド又は断片のペプチド誘導体である。例えば、前記ペプチド誘導体は、レトロ−/インベルソ−ポリペプチド(Retro-/Inverso-Polypeptid)であることができ、即ち、前記したポリペプチドのインバースポリペプチド(inverse Polypeptid)(これは、前記ポリペプチドの鏡像(「mirror image」)に相当して、D−アミノ酸から製造される)、レトロポリペプチド(RetroPolypeptid)(これは、「逆の」配列を有する)、並びに、レトロインベルソポリペプチド(RetroInverso-Polypeptid)(これは、前記したポリペプチドの鏡像であり、更に「逆の」配列を有する)であることができる。
【0026】
ペプチド誘導体の更なる例は、アミノ基の側基−、アミノ−又は/及びカルボキシ末端修飾されたポリペプチド、例えば、例えばカルボン酸又はアルキル残基で修飾されているポリペプチド、又は、カルボン酸基で、アミノ基又はエステル基で修飾されているポリペプチドである。このポリペプチド及び/又はペプチド誘導体は、環式ペプチドとしても存在することができる。
【0027】
本発明の更なる主題は、前記したポリペプチドをコートする核酸である。核酸としては、例えばDNA及びRNA、特にcDNAが考慮される。この核酸は、ポリペプチドの組み換え製造のために、慣用の真核ベクター又は原核ベクター中にクローニングされることができ、かつ適した宿主細胞中で発現されることができる。
【0028】
本発明の更なる主題は、前記したポリペプチド又はその断片の1種又は複数種を含有する診断薬(Diagnostikum)である。診断薬は、遊離の又は担体に結合した形で前記ポリペプチド又は断片を含有することができる。
【発明の効果】
【0029】
著しく意外であると言えることができることに、本発明によるポリペプチドは、リウマチ疾患を有する、特に関節及び運動器官の炎症性疾患を有する、特に有利には関節リウマチの患者の体液中での抗体の診断のために、高特異性かつ高感受性の抗原であることが判明した。有利な体液は、本発明の意味合いにおいて、血液、血清又は血漿であり、特に有利には血清である。
【0030】
本発明による診断薬は一連の利点を示す。つまり、前記ポリペプチドは複数の抗体結合部位を含有するので、モノマーの、また同様にマルチマーの抗体に効率的に結合することができる。この変異したポリペプチドの更なる利点は、これが、炎症性のかつ慢性的な、関節及び運動器官の疾患を有する患者を、特に、関節リウマチを有する患者を、99%の特異性及び85%の感受性で同定できる、診断薬の提供を可能にすることである。
【図面の簡単な説明】
【0031】
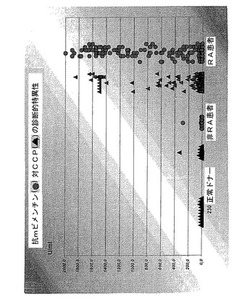
【図1】図1は、シトルリン化ペプチド(CCP)と比較した、変異したビメンチンを有するRA自己抗体の検出の診断的特異性の比較を示す図である。
【図2】図2は。単離したCD4陽性T細胞は、ペプチド免疫療法後に、CD4陰性細胞の増殖性応答を抑制することを示す図である。
【図3】図3は、緑茶からの抽出物、変異したビメンチン及びこれらの組み合わせによるRA血清からの抗体の反応の抑制を示す図である。
【図4】図4は、RA患者からの自己抗体の遮断の際の緑茶からの抽出物の選択性を示す図である。
【図5】図5は、関節炎動物モデルの一般的な図示を示す図である。
【図6】図6は、in vivoでの緑茶からの抽出物の有効性を示す図である。
【図7】図7は、in vivoでの緑茶からの抽出物の有効性を示す図である。
【図8】図8は、in vivoでの緑茶からの抽出物の有効性を示す図である。
【発明を実施するための形態】
【0032】
技術水準からは、これまでには、リウマチ疾患、特に関節リウマチの検出を、シトルリン不含タンパク質又はペプチドの使用下で可能にする、比較可能な特異性の又は感受性の診断薬は公知でない(P. J. Utz, Death, autoantigen modifications, and tolerance; Arthritis Res., 2, (2000), 101-114)。
【0033】
本発明の更なる主題は、前記した診断薬を含有する、リウマチ疾患、特に関節リウマチの検出のための使用のための診断キットである。その他に、前記診断キットは慣用の成分、例えば緩衝剤、溶媒及び/又はマーカーグループ(Markierungsgruppe)を含有することができる。
【0034】
キャリアとして、高分子、例えば、DNA、RNA、医薬的に認容性のポリマー、例えばポリエチレン、D,L−ラクチド、ポリD,L−ラクチド−コ−グリコライド、合成生体高分子、例えばポリリシン及びデキストラン、及びタンパク質、例えば血清アルブミン及びヘモシアニンが考慮される。有利には、デキストランは、いわゆる「ヒドロコーティング−塗布方法(Hydrocoating-Beschichtungsverfahren)」において使用される(Gregorius, K., Mouritsen, S. 及び Elsner, H.I., Hydrocoating: a new method for coupling biomolecules to solid phases, J. Immunol. Methods 12 (1995), 65-73)。
【0035】
本発明の更なる主題は、自己抗体の濃度を体液中で測定する、リウマチ疾患、特に関節リウマチのin vitro検出のための方法である。この方法は、疾患の診断、分類及び/又は重症度の評価を可能にする。検出手段として、前記の診断薬又は前記の診断キットが用いられる。
【0036】
本発明による方法においては、検出方法として、診断薬の領域での慣用の全ての方法、例えば
(a)酵素学的方法、
(b)ルミネセンスを基礎とする方法、又は
(c)放射化学的方法
が使用されることができる。
【0037】
有利な検出方法として、本発明による方法においては、ラジオイムノアッセイ、化学発光イムノアッセイ、イムノブロットアッセイ又は酵素イムノアッセイ、例えばELISAが考慮される。
【0038】
本発明による方法の一実施態様において、担体に結合している前記したポリペプチドに、試料として分析する体液が添加される。前記試料のインキュベーション後に、結合していない成分を洗浄により除去する。検出すべき抗体の、ポリペプチドに対する特異的な結合は、マーカーグループを有する二次抗体により検出される。
【0039】
二次抗体として、本発明による方法においては、例えば、ヒトの抗体、例えばIgG、IgM、IgA及び/又はIgEに対して、例えば、ヒトのIgG1のFc部分に対して指向されている抗体が考慮される。
【0040】
マーカーグループとして、本発明による方法においては、例えば、酵素、例えばペルオキシダーゼ又はアルカリホスファターゼ、放射性マーカー又は発光性マーカーグループ、例えばアクリジニウム化合物が考慮される。
【0041】
選択的に、拮抗性阻害試験が、本発明によるポリペプチドを用いて実施されることもでき、この試験においては、標識化された関節リウマチ(RA)自己抗体の結合は試料の存在下で、この試料中に同様にRA自己抗体が存在している限り阻害される。
【0042】
本発明によるペプチドは、リウマチ疾患、特に関節リウマチの治療の際の、予後のための又は/及び経過制御のための手段としても使用されることができる。予後手段(prognostische Mittel)としてはこの際、位置30〜65、又は/及び、位置55〜70領域のからのペプチドが有利である。
【0043】
本発明の更なる課題は、自己免疫複合体の結合を選択的に、リウマチ疾患、特に炎症性プロセスとの関連において、特に有利には炎症性の関節において阻害するか又は妨げるが、抗体産生の一般的な遮断は引き起こさない医薬品を提供することであった。
【0044】
この課題は、本発明により、前記したポリペプチド又は断片を含有し、かつ、ヒト−又は獣医薬における適用に適している医薬品により解決される。前記医薬品は、例えば、体液、例えば血液又は血漿の中に含有される自己抗体を固相に結合した抗体を用いて捕捉し、かつこの処理された体液を再度患者中に返送するための、体液、例えば血液又は血漿の体外処理のために用いられる。
【0045】
本発明による実施例は意外にも、本発明によるポリペプチドが、第一に疾病進行と関連した抗原であり、又は、それどころか第一にこの疾患を開始するタンパク質でさえあることを示した。患者体液からの抗体の選択的除去により、この病気の進行に有利に影響を及ぼすことができる。
【0046】
更に、前記ポリペプチド又はその断片は、直接的にも、医薬的に認容性の担体、溶媒及び/又は助剤を含有することができる医薬組成物の形において使用されることができる。
【0047】
この医薬組成物は、タブレット、カプセル、溶液、懸濁液、エアロゾル、スプレー(経鼻スプレー又は喉スプレー)、ゲル、プラスターその他の形で投与されることができる。
【0048】
前記医薬品は、全ての公知の方法により投与されることができ、その際、経口及び静脈投与が特に有利である。
【0049】
この用量を、この疾患の種類及び深刻度に応じて変動させることができ、かつ、通常は、1〜2000mg/日の範囲内、有利には10〜200mg/日の範囲内にある。
【0050】
更に、RA患者は、天然のビメンチンのアミノ酸配列から誘導される、同定された、短い、合成の、前記ポリペプチドのタンパク質エピトープ(とりわけ、C2エピトープ)により治療されることができる。
【0051】
RA患者のB細胞エピトープの分析は、本発明によるポリペプチドの、短い、合成の、線状ペプチドエピトープ(C2エピトープ)を有する全患者の91%が相互反応するとの意外な発見を提供した。
【0052】
更に、マウス実験により、マウスがこのような処理後に抗原特異的な免疫細胞の分裂を成功して抑制する免疫細胞を形成することが確認されることができた。
【0053】
リウマチ疾患、特に関節リウマチの治療の経過及び成功の制御は、目下のところ慣用の診断方法に応じて、手間及び時間のかかる、Disease Activity Score (DAS)の方法を用いてのみ可能である。この方法の際には、腫れた関節の数、痛みのある関節の数、炎症パラメーター(BSR又はCRP)が算出され、この患者の感受性(Befindlichkeit)は、visual analog scale(visuell Analog-Skala)で確認した。
【0054】
この4つの個々の成分を、1つの式によりまとめた。
【0055】
この生じる数値は、患者での実際の疾病活動性(Erkrankungsaktivitaet)及び療法の質について比較的信頼できかつ客観的である情報を与える。
【0056】
本発明によるポリペプチドは、今や、リウマチ疾患、特に関節リウマチの治療の経過及び成功を制御することを可能にする。
【0057】
例示的に、30〜65の位置にある前記ポリペプチドと交差反応した患者では、迅速かつ効果的な治療が観察されることができ、これは一部では2年間後に完全な治癒でもってその前向きの完結が見出された。
【0058】
少ない疾患活動性(平均して2.8のDASスコア)を有する患者は、ELISAにより、本発明によるポリペプチドを基礎として同定されることができた(平均して<300U/ml)。スルファサラジン又はコルチゾンを用いた処置(処置後のDASスコア、1.5未満)の成果に相関して、1〜2年間の経過の間に抗体価は、平均して、出発値の1/6に減少した。
【0059】
深刻な関節リウマチを有する患者(平均してDASスコア4.9)は、平均して抗体価>1000U/mlを示した。このDASスコアは、レミケード及び/又はメトトレキセートを用いた処置により著しく変更しないで、50%の患者では、抗体量が、本発明によるポリペプチドに対して約30〜50%だけ減少した。変更した抗体価に並行して、患者に、既往歴での客観的な疾病状況の実質的によりポジティブな全体的な判断がプロトコルに付与され、即ち、本発明による診断薬はまた、深刻な関節リウマチ療法の質的制御にも適する。
【0060】
実質的な利点は、数分間のうちにまず定量的及び定性的に信頼できる情報が、関節リウマチの種類、進行及び療法について付与されることができることである。
【0061】
この意外な発見は、本発明によるポリペプチドが治療に使用されることができるとの認識に導き、というのも、その使用により意外にも、これまでに不所望であった医薬品作用の回避が、同等の有効性でもって期待することができるからである。
【0062】
特に、本発明によるポリペプチドは意外にも、リウマチ疾患、特に炎症の治療のための、新しい種類の、これまでに公知でない作用原理の提供を可能にする。本発明によるポリペプチドのこの作用スペクトルは既知の炎症阻害剤とは異なり、というのも選択的に、抗体依存性メディエーターのみが減少して形成されることができるからである。本発明のポリペプチドの更なる利点は、副作用スペクトルがおそらくは、技術水準から公知の医薬品のスペクトルよりも著しくより少ないことであり、というのも健康な供血者の抗体との交差反応が観察されることができないからである。
【0063】
上記した本発明による診断薬及び治療薬は従って、ビメンチン依存性プロセスに基づく全ての表現型の診断、予防又は治療のために適用されることができる。
【0064】
本発明の更なる主題は、歯周病病原菌バクテロイデス・フォーサイス(Bacteroides forsythus)及びプレボテラ・インターメディア(Prevotella intermedia)の仮想タンパク質BF0786及びBF0713であり、これらにより、これらが、リウマチ疾患、特に関節及び運動器官の慢性炎症性疾患のイニシエーターであることが確認された。
【0065】
これらのこのタンパク質及び断片は従って、リウマチ疾患、特に、関節及び運動器官中の痛みの検出、予防及び/又は治療のための診断薬、診断キット又は医薬品の製造のために適する。診断適用及び医薬適用に関しては、ビメンチン類似体の上の説明が参照される。
【0066】
タンパク質BF0786及びその配列は、Kuwahara, T. et al.(Kuwahara, T. et. al., Proc. Natl. Acad. Sei. U.S.A 101 (41 ), 14919-14924 (2004))により記載されている。タンパク質BF0713及びその配列は、Cerdeno-Tarraga, A.M. et al.(Cerdeno-Tarraga, A.M. et. al., Science 307 (5714), 1463-1465 (2005))により記載されている。診断及び治療の領域での医薬的な適用はこれまでに公知でない。
【0067】
本発明の更なる課題は、選択的に、リウマチ関連自己抗体からの自己免疫複合体の形成を、自己抗原、特にビメンチンでもって遮断し、即ち、病理発生に関与する抗体の反応のみを妨げ、抗体産生及び抗体反応に影響を及ぼすがしかしながら一般的には影響を及ぼさず、かつ、従って、関節及び運動器官の範囲内での痛みのリウマチ関連疾患の、感受性がありかつ特異的な療法又は予防を可能にする物質を見出すことであった。
【0068】
緑茶成分が、この課題を解決することが見出された。Tariq, M. et al., "Prevention of collagen-induced arthritis in mice by a polyphenolic fraction from green tea", Proc. Natl. Acad. Sei. USA, Vol. 96, 4524-4529頁(1999)からは、緑茶の成分エピガロカテキンガレート(EGCG)が公知である。これは、ビメンチンに結合しかつリン酸化を遮断する(S. Ermakova et al., The intermediate filament protein vimentin is a new target for epigallocatechin gallate; J. Biol. Chem. 280 (17), (2005), 16882-16890)。エピガロカテキンガレートを用いて、変異したビメンチンに対する自己抗体の自己免疫複合体形成が濃度依存的に遮断されることができることが示されることができた。
【0069】
競合実験においては、非結合性物質、エピカテキン(EC)が抗体結合を最大で10%までしか遮断しないことが示されることができた。エピガロカテキンガレート(EGCG)を用いて、10〜100μg/mlの濃度では、抗体結合の最大45%が遮断されることが示されることができた。
【0070】
しかしながら、緑茶が、適した有機溶媒又は有機−水性溶媒又は溶媒混合物、例えばジメチルスルホキシド(DMSO)、エタノール及び水からの混合物を用いて抽出される場合には、意外にも、この抽出物の少量を用いて、自己免疫複合体形成のほぼ完全な遮断が達成されることができる。更には、例えば乾燥、凍結乾燥、分別その他によりこのような抽出物から得ることができる生成物も使用できる。この抽出物の作用は、技術水準とは対立しており、というのもこれまでには、緑茶の公知の単独物質についても、更には、天然物質混合物についても、抗体反応の特殊な遮断は公知でないからである。その他の自己免疫疾患を有する患者の血清中でのこの抗体複合体形成は、本発明による抽出物により、著しく変更されることはできない。
【0071】
この結果は、最も意外に見えるものであり、というのも、技術水準からはこれまでには、変異したビメンチンに対する独自の結合は公知でないからである。更に、この緑茶成分の相互作用は、技術水準からの抗体を用いては公知でない。
【0072】
更にこれまでにはECGCについては、a)抗酸化作用を有すること、b)発癌物質の反応性の中間段階を防ぐこと、c)発癌物質活性性の酵素を阻害すること、そしてd)ニトロソ化及び細胞増殖(特に腫瘍細胞の増殖)を阻害することのみが公知であった。
【0073】
本発明の更なる主題は、最後に、前記したペプチド、前記したペプチド断片、前記したレトロ−インベルソ−ポリペプチド又は環式ペプチドの、抗体駆動性炎症反応に対する遮断性天然物質及び/又は化学物質の検出のための使用である。
【0074】
更に、本発明によるペプチドを基礎としたバイオアッセイが開発されることができ、これを用いて天然物質ライブラリー、コンビナトリアルライブラリー及び化学的ライブラリーを炎症阻害性物質の存在に対して分析することができる。疾病関連した抗体の使用下で、前記混合物から物質が同定及び精製されることができ、この物質は、本発明による抗原を直接的に又は非直接的に、この抗体の遮断を介して遮断する。この物質については、動物実験において関節リウマチ遅延性の、そしてより高い用量においては完全な治癒が観察されることができた。
【0075】
更に、本発明は、以下の図及び実施例により詳細に説明される。
【0076】
図の説明
図1:シトルリン化ペプチド(CCP)

と比較した、変異したビメンチン(●)を有するRA自己抗体の検出の診断的特異性の比較。
【0077】
図2:単離したCD4陽性T細胞は、ペプチド免疫療法後に、CD4陰性細胞の増殖性応答を抑制する。
【0078】
図3:緑茶からの抽出物、変異したビメンチン及びこれらの組み合わせによるRA血清からの抗体の反応の抑制。
【0079】
図4:RA患者からの自己抗体の遮断の際の緑茶からの抽出物の選択性。
【0080】
図5:関節炎動物モデルの一般的な図示。
【0081】
図6〜8:in vivoでの緑茶からの抽出物の有効性。
【実施例】
【0082】
実施例
例1:RA関連抗原としてのヒトのビメンチンの突然変異した変異体の同定
U937細胞(ヒトの単球細胞系列)からの細胞抽出物を製造した。シトルリン化タンパク質をこの細胞抽出物から、市販の抗シトルリン抗体を用いた前吸収により除去した。ニワトリの抗ビメンチン抗体を用いた引き続くアフィニティクロマトグラフィは溶離物を提供し、ここから、RAを有する患者の抗体と交差反応するビメンチン変異体を単離することができた。この得られたビメンチン変異体を、更に、逆相クロマトグラフィ、タンパク質分解による消化、及び、アミノ酸配列決定により特性決定した。この結果において、アミノ酸配列SEQ ID NO:2〜9を有する以下に記載するポリペプチドが同定されることができた。
【0083】
例2:検出抗原としての突然変異したビメンチンを用いたRA関連自己抗体の検出
例1からの天然のビメンチンの組み替えした、突然変異した変異体(SEQ ID NO:9)を、大腸菌中で発現させ、His−Tagの使用下でアフィニティクロマトグラフィを用いて精製した。この精製したタンパク質の2mg/mlの溶液を、展開緩衝液(50mM Tris、2M グアニジンヒドロクロリド、5mM CaCl2、2mM DTT、0.5mM EDTA、5mM メチルアンモニウムクロリド、pH7.4)で前処理し、そして少なくとも14時間4℃で、そしてこの後にPBS1:1000で希釈した。この溶液100μlを、一晩4℃で、マイクロタイタープレート(製造者:COSTAR)の穴中に配置した。結合していないポリペプチドを、3回の洗浄により除去した(175μl、緩衝液PBS/0.05%Tween)。可能性のある非特異的な交差反応を、PBS中の3%ウシ血清アルブミン(BSA)溶液150μlを用いて前記穴のインキュベーションにより遮断した。この遮断した、空にしたプレートを37℃で30分間乾燥させ、湿分の排除下で4℃で貯蔵した。
【0084】
このようにして製造されたマイクロタイタープレートを、自己抗体の、突然変異したビメンチンに対する定量的検出のために、非直接的な酵素イムノアッセイの原理に応じて使用した。比較として、CCP(シトルリン化ペプチド)に対する自己抗体の検出を実施した。このために、健康な発端者及び/又は異なる疾患の患者の血清試料を、1:100で1%のBSA/PBSで希釈し、30分間この穴中でインキュベーションした。PBS/0.05%Tweenを用いた繰り返した洗浄により、結合していない血清−抗体を除去した。酵素標識した検出抗体(特に、ペルオキシダーゼコンジュゲートした抗ヒトIgG抗体、希釈、1:10000)を引き続き15分間インキュベーションした。
【0085】
過剰の検出抗体の洗い流しの後に、基質溶液100μl(TMB(3,3′,5,5′−テトラメチルベンジジン)タブレットを、0.05Mのリン酸−クエン酸−緩衝液10ml中に溶解させ、かつ過酸化水素8mlを、この使用前に添加した)を15分間にわたり添加した。1M HCl 100μlの添加により、この反応を停止させ、この反応生成物は黄色に色づいた。黄色の着色の強度を、測光により450nmで測定し、その際この吸収は、検査した自己抗体濃度に対して直接的に比例している。
【0086】
この際、以下の測定結果が達成された:
【表1】

【0087】
「関節リウマチ」との診断を有する全ての患者血清は、この測定の際に、Tecan 「SPECTRA」測光計中で、正常の血清及び、その他の疾患に苦しむ患者の血清と比較して顕著に高められた吸収値を示した。
【0088】
例3:天然のビメンチンの突然変異した変異体を基礎とする診断薬の開発
突然変異したビメンチンを基礎とする診断薬の開発のために、天然のビメンチンの異なる突然変異したポリペプチド変異体(参照、例1)をクローニングし、大腸菌中で発現させた。ACR判断基準により定義された、関節リウマチ(RA)を有する患者集団(約100人)の血清を、RAでの自己抗体の検出のために最高の感受性を有するポリペプチド変異体を同定すべく使用した。このために、例2と同様に、発現しかつ精製されたタンパク質を、マイクロタイタープレート中に塗布し、古典的なELISAアッセイにおいて、RA患者での自己抗体の交差反応を分析した。
【0089】
第一のスクリーニング方法で得られた、突然変異した配列を、可能性のある最大の感受性を達成すべく、更なる評価(Ansatz)において組み合わせた。RAのための診断薬としての見出された突然変異したポリペプチド変異体の特異性の検査のために、他の自己免疫疾患(特に、SLE,シェーグレン症候群 IDDM)を有する34人の患者の血清及び53人の健康な人間の血清を使用した。この最終的に得られた突然変異したポリペプチド変異体を、例2と同様に、マイクロタイタープレート中に配置した。
【0090】
例2からの突然変異した変異体の使用下で、意外にも、シトルリン化ペプチド(CCP)について技術水準から公知である選択性及び感受性よりも、より高い選択性(>98%)及び感受性が、RA患者及び他の自己免疫疾患を有する患者の自己抗体の分析の際に達成されることができた(図1)。
【0091】
例4:突然変異したビメンチン中の自己エピトープの測定
抗ビメンチン抗体をELISAにおいて、オーバーラップしてビオチン化された、合成の、突然変異したビメンチンの17量体のペプチド(例2、参照)に対するその結合能に関して試験した。この際、RAを有する患者のこの抗体が、同じB細胞エピトープに対して指向しているかどうかとの問いが中心となっている。
【0092】
RA及び異なる抗ビメンチン抗体価を有する102人の患者の集団において、意外にも、91%のこの血清が、ビメンチンのアミノ末端領域からの線状ペプチド配列の1つと反応した。カルボキシ末端領域又は真ん中のα−ヘリックスの棒状ドメインに対する交差反応は観察されることができなかった。健康な発端者及び他の自己免疫疾患を有する患者(特に、シェーグレン症候群、全身性エリテマトーデス又は脈管炎)の血清は、ビメンチン−ペプチド配列に対して反応を示さなかった。
【0093】
特に高い反応性は、アミノ酸30〜70の範囲、特にアミノ酸50〜65の範囲で見出された。
【0094】
例5:RA患者での予後
RAは極めて異なって進行し、治療法の決定は、最終的なものではなくて連続的に制御し、かつ要求に応じて適合されなくてはならないものである。従って、薬物投与療法下の21人のRA患者を、本発明によるポリペプチドに対する反応について分析した。追跡調査(1〜2年間の経過の間に一患者につき少なくとも7回の検査)において、突然変異したビメンチンの、オーバーラップしている、ビオチン化した、合成のペプチドに対する交差反応(参照、例4)をELISAにおいて特性決定した。この際、例えば、ビメンチン配列の30〜65の位置にあるペプチドと交差反応するRA患者では、迅速かつ効果的な治療が観察され、これは一部では、2年後に、完全な治癒でもってその前向きな結末を迎えたことが確認された。これとは対称的に、55〜67の位置にあるペプチドと交差反応したRA患者では、試験したいずれの場合においても、処置の成功は、この患者資料から確認されなかった。健康な患者は分析したペプチドにいずれに対しても交差反応を示さなかった。
【0095】
このデータに基づいて、本発明によるポリペプチドは、リウマチ疾患、特に関節リウマチの治療の進行及び成功を制御するための診断薬として用いることができる。即ち、定量的なELISAは、本発明によるペプチドの使用下で、治療の開始時に既に、患者を、薬物投与「応答者」と「非応答者」とを区分することができる。
【0096】
例6:ペプチドの治療的有効性
特定の伝達物質(Botenstoff)は、関節粘膜中で、軟骨中で、そして骨中での炎症性プロセスを担う。この公知のメディエーターは、腫瘍壊死因子(TNF)である。慢性的な多発性関節炎のために、初期から抗TNF療法を実質的に支援している形質転換マウスモデルが以前から存在する。このマウスは、ヒトTNFを過剰発現し、かつこれは、前記マウスが深刻な、慢性的な破壊性の多発性関節炎を進展させるのに十分である。
【0097】
この背景のもとで、この形質転換マウスは、生理学的食塩溶液のみで処置されるか、又は、前記マウスに、突然変異したビメンチンのペプチド(50〜65)1μgの溶液を注入した(以下と同様に、Puga Yung et al., Epitope-specific immunotherapy induces immune deviation of proinflammatory T cells in rheumatoid arthritis, PNAS 2004 101 : 4228-4233 及び Zwerina et al., Single and combined inhibition of tumor necrosis factor, interleukin-1 , and RANKL pathways in tumor necrosis factor induced arthritis: effects on synovial inflammation, bone erosion, and cartilage destruction. Arthritis Rheum. 2004 Jan; 50(1):277-90)。引き続き、この関節腫れを測定し、この関節粘膜、骨−及び軟骨損傷を、微細組織的(feingeweblich)に試験した。ビメンチンペプチドの注射により、この関節の腫れは41%に、そしてこの関節粘膜の炎症は38%に抑制され、生理学的食塩溶液は、影響を示さなかった。無論、突然変異したビメンチンの複数のペプチドを組み合わせた場合には、この結果炎症はほぼ完全に抑制される。
【0098】
調節性Tリンパ球は、末梢性トレランスの有望なメディエーターとして適する。従って、この動物で、限定されたアロ免疫応答を、レギュレーター細胞の形成が抗原特異的に誘導するかどうかとの問いを更に追跡した。この際、前記マウスは、このような処理の後に、抗原特異的な免疫細胞の分裂を成功して抑制する免疫細胞を形成し、その際、これは、表現型CD4+CD45RCnegを有する肝内T細胞群であることが見出された(図2)。
【0099】
例7:in vitroでの自己抗体複合体の形成の遮断
突然変異したビメンチンに対する抗体結合の遮断のために、次の物質を、終濃度1μg/mlで、単独で又は組み合わせて使用した:
1.エピカテキン(EC)
2.エピガロカテキンガレート(EGCG)
3.緑茶からのDMSO抽出物
4.突然変異したビメンチン 1.4mg/ml
5.突然変異したビメンチン 0.7mg/ml
6.シトルリン化したビメンチン 1.5mg/ml。
【0100】
緑茶からの抽出物の製造のために、任意の市販のお茶5gを、80%のDMSO10mlで覆い、一晩撹拌した。この溶液を13000rpmで、10分間遠心分離し、茶抽出物として定義する。上述の固体物質1,2−及び4−6に対して、この製造の茶抽出物10μl/mlを使用した。この抗体結合を、物質の存在下及び非存在下で、ELISAにおいて分析し、このために例2と同様にマイクロタイタープレートを製造した。RA患者の異なる血清を、1:100〜1:400の希釈率において使用した。この抗体結合の遮断を、希釈した血清100μlを10分間、記載した物質又は茶溶液を用いて前インキュベーションすることにより誘導した。引き続き、この残存する交差反応を、記載したマイクロタイタープレートの穴への血清−物質混合物100μlの添加により、分析した。典型的なELISAの実施に相当して、この見出された抗体の検出をHRPコンジュゲートした抗ヒトIgGを用いて行った。図3中には、例示的に、患者番号Nr.400725で得られた結果を記載した。
【0101】
緑茶からの抽出物による、RA患者からの自己抗体(突然変異したビメンチンに対する抗体)の抑制の特異性を、図4に示した。
【0102】
例8:in vivoでの自己抗体複合体の形成の遮断
緑茶のカテキンの経口吸収は、経口摂取の際には極めて少なく、従って通常の茶の摂取ではおそらくは最小限の血清濃度しか達成されない(Zhu et al., Oral absorption and bioavailability of tea catechins. Planta Medica 66 (2000) 444-7;Schrader et al., Bioverfuegbarkeit verschiedener Tee-Catechine im Plasma in Abhaengigkeit von der Darreichungsform. Proc. Germ. Nutr. Soc. 3 (2001) 36も参照のこと)。
【0103】
従って、我々により製造された茶抽出物(参照、例7)を凍結乾燥させ、カカオ油又はサケ油で再構成した。5gの緑茶から製造された抽出物のラットへの経口適用の後(5g/kg 体重量)に、半時間毎に血液を採りだし、HPLC及びGC/MSを用いて分析した。ラットでは、吸収のおよそ2時間後に、最大血漿濃度75μg/ml EC及びEGCG(抽出物質量の5〜13%)を、並びにおよそ245μg/mlをEGCG(50%まで抽出物中に含有される)について測定されることができた。毒性作用は、この動物実験において、検査時間1ヶ月の間に生じなかった。
【0104】
この結果をヒトに転用した場合には、この投与形態を用いて、自己抗体複合体形成の完全な遮断を可能にすることができた、茶成分(特にカテキン)についての血漿濃度を達成することとなる。
【0105】
例9:in vitroでの緑茶の抽出物の有効性
10又は100mg/kg 体重の濃度での緑茶の抽出物の腹腔内投与は、関節炎動物モデル(図5;アジュバントの投与後の前足の腫れの測定)中で、顕著に有利な作用を示した。この結果は図6〜8中に示されている。
【技術分野】
【0001】
発明の詳細な説明
本発明は、リウマチに関連した自己抗体と反応するポリペプチドに関する。本発明は更に、前記ポリペプチドのうち1種を含有する診断薬、前記診断薬を含有する診断キット、並びに、リウマチ疾患のin vitro検出のための方法に関する。更に本発明は、前記ポリペプチドのうち1種を含有する医薬品、並びに、リウマチ疾患の予防及び/又は治療のための医薬品の製造のための前記ポリペプチドの使用に関する。
【背景技術】
【0002】
リウマチ疾患、特に、関節及び運動器官の範囲内での痛みは、ドイツ国内で最も頻繁な疾病に属する。害のない筋肉緊張(Verspannung)、関節症、又は最も頻繁かつ最も深刻な疾病、関節リウマチ(RA)の痛みを分類することを可能にする実験室試験はこれまでに公知でない。
【0003】
関節リウマチは、人体の防御機構が、誤って身体特有の関節軟骨を異物かつ敵として取り扱い、これらを攻撃する自己免疫疾患である。およそ100人につき1人が、西ヨーロッパ諸国において関節リウマチに苦しむ。この疾病の最初の月に、この疾病は極めて迅速に進行する。
【0004】
現代のリウマチ学における重要な鍵となる戦略は従って、この疾病の進行に変化を及ぼす、生物学的な医薬物質の早期の使用である。数々の臨床研究が、適した作用物質を用いて、例えばTNFアンタゴニストを用いて、これらを患者が既に早期段階で使用する場合に、極めて良好な治療成果及び応答速度を達成することができることを示している。リウマチ学は、この疾病の開始時と構造上の軟骨損傷の発生時との間の狭い時間範囲を利用することを試みている。これまでにはしかしながら、技術水準からは、この時間範囲における関節リウマチの確実であってかつ感受性のある検出手段は公知ではない。
【0005】
関節リウマチの診断は、ACR(American College of Rheumatology)の分類診断基準に応じて行われる。ACRの診断基準によれば、関節リウマチ(RA)の診断のためにこれまでに基礎となる血清学的な指示薬(Indikator)は、リウマトイド因子である。リウマトイド因子は、免疫グロブリンG(IgG)のFc領域に対する免疫学的な交差反応により特徴付けられる、免疫グロブリンの部分基(Teilgruppe)である。
【0006】
リウマトイド因子の存在はしかしながら、リウマチ性症状群(鑑別診断的根拠)の疾患に限定されておらず、リウマトイド因子はまた、感染症、高グロブリン血症、リンパ球増殖性B細胞疾患を有する患者の血清中にも、そして一般的には老齢の人口層でも見出される。
【0007】
一般的には、リウマトイド因子の高められた濃度は、より深刻な疾病進行と関連する。この際、この濃度は、活動度(Aktivitaetgrad)及び治療成果とは相関しない。リウマトイド因子の濃度を基礎として、関節リウマチの開始について、感受性がありかつ特異的な予後を的確に言い当てることはできない健康な人間は、患うこと無く高められたリウマトイド因子濃度を有し、これに対してリウマトイド因子を有しない患者は、関節リウマチの極めて攻撃性の形態を有する。
【0008】
その他の血清学的マーカー、例えば抗シトルリン抗体(CCP)又は初期HAQスコア(これを用いて毎日素質を判定する)、又は、レントゲン−又はコンピュータートモグラフィ(CT)画像は、早期の形態ではわずかな情報のみを与え、かつ、単独では、患者の予後がいかになるかを判定するには説得性が十分でない。
【0009】
ACRの既にある分類判断基準の最適化のためには、アメリカリウマチ学会(US-amerikanischen Rheumatologischen Fachgesellschaft)により、劣悪な予後を示す7つの分類判断基準が提案されている:
1.1時間より長く続く朝の関節こわばり、
2.3箇所以上の関節炎、
3.少なくとも3箇所の関節領域の同時期の関節炎症、
4.手の関節又は指の関節が同じように襲われる、
5.中手指節関節の左右対称性の触接による痛み
6.レントゲン画像中のびらん、
7.特殊なリウマトイド因子の検出及び抗核周囲因子陽性(APF)。
【0010】
このいわゆる抗核周囲因子に対する自己抗体は、最初にYoung et al.により、関節リウマチを有する患者で記載された (Young, B.J.J. et al., Antikeratin antibodies in rheumatoid arthritis, B.M.J., 2 (1979), 97-99)。ラットの食道断片での角質層の角質上皮に対するその特異的な反応のために、ケラチンは相応する抗原として長い間考慮されてきた(Vincent, CH. et al.; High diagnostic value in rheumatoid arthritis of antibodies to the stratum corneum of rat Oesophagus epithelium, so-called "antikeratin antibodies", Ann. Rheumat. Dis. 48 (1989), 712-722)。この抗体は、この理由から、今日まで抗ケラチン−抗体(AKA)と呼ばれる(Vincent, CH. et al, Natural IgG to Epidermal Cytokeratins vs IgG to the Stratum Corneum of the Rat Oesophagus Epithelium, so-called "Antikeratin Antibodies", in Rheumatoid Arthritis and other Rheumatic Diseases; J. of Autoimmunity 4 (1991), 493-505; Paimela, L. et al., Antikeratin antibodies:diagnostic and prognostic markers for early rheumatoid Arthritis, Ann. Rheumat Dis. , 51 (1992) 743-746)。
【0011】
この後の調査は更に、AKA又はAPFが、抗フィラグリン抗体によっても認識されることを示した。従って、この塩基性タンパク質フィラグリンは目的抗原として同定された。この40kDaのタンパク質は、サイトケラチンフィラメントを凝集させ、角質細胞の細胞内繊維マトリックスを形成するのに加勢する(Simon, M. et al., The Cytokeratin FilamentAggregating Protein Filaggrin is the Target of the So-called "Antikeratin Antibodies", Autoantibodies Specific for Rheumatoid Arthritis, J. Clin. Invest., 92 (1993), 1387-93)。
【0012】
APF、AKA及び抗フィラグリン抗体を含有する血清は同じように反応するので、この抗体系は見かけ上同一である。99%を上回る特異性でもって、IgGタイプの抗フィラグリン抗体は、関節リウマチのための高特異性マーカーである。この抗体は原則的に、早期に検出可能であり、かつ、臨床学的な症状に先立つ。複数の研究において、疾病の深刻度(Schwere)及び活動性に対して正の相関が見出されることができる。抗フィラグリン抗体は、年齢、性別又は疾病期間とは相関しない。これらは、約34%のリウマトイド因子陰性患者において検出されることができ、かつここで有用な診断手段を提供する。前記抗体はしかしながら、今日利用できる方法を用いて、約40%の症例においてのみ血清中で見出すことができる。
【先行技術文献】
【非特許文献】
【0013】
【非特許文献1】Young, B.J.J. et al., Antikeratin antibodies in rheumatoid arthritis, B.M.J., 2 (1979), 97-99
【発明の概要】
【発明が解決しようとする課題】
【0014】
本発明の課題は従って、リウマチ疾患の、特に、関節及び運動器官の範囲の痛みの、感受性がありかつ特異的な診断、分類化及び予後を可能にする、リウマチ疾患に関連した、特に関節リウマチに関連した抗体の検出のための新規ポリペプチドを提供することであった。
【0015】
天然のビメンチンに対する抗体結合、即ち、APF陽性又は抗Sa反応性(anti-Sa-Reaktivitaet)(E. R. Vossenaar et al; Rheumatoid arthritis specific anti-Sa antibodies target citrullinated vimentin; Arthritis Res. Ther. 6(2), (2004), 142-150))の分析の際に、免疫学的に反応性でないことが技術水準から公知の天然のビメンチン(CA. Hitchon et al.; Immune features of seronegative and seropositive arthritis in early synovitis studies; Curr. Opin. Rheumatol. 14(4), (2002), 348-353)は、変異した免疫学的に反応性の変異体の形態で存在することが見出された。この認識は意外なものであり、というのもこれまでの技術水準によれば、免疫学的に反応性であるためにはビメンチンはシトルリン化されていなくてはらないことを前提としていたからである。ディファレンシャルイムノアフィニティクロマトグラフィ(differenzielle Immunaffinitaetschromatographie)により、免疫学的に反応性のビメンチン変異体を、ヒト単球からの変異配列を用いて濃縮できたことにより、この仮定は誤っていることが我々により確認された。天然のビメンチンの変異した変異体は、天然のビメンチンとは、更なるアルギニン残基及び場合により更なる配列相違の存在により区別される。これらは、ヒトのRA関連抗体と反応し、意外にも、公知技術から公知のシトルリン化ペプチドと比較してより高い特異性及び感受性を示す。
【課題を解決するための手段】
【0016】
本発明の主題は従って、SEQ ID NO:1を有する天然のビメンチンから誘導されていて、かつ、この天然の配列に対して、少なくとも1つの更なるアルギニン残基の存在により区別されるポリペプチドである。
【0017】
更なるアルギニン残基は、有利には、天然のヒトのビメンチンのその他のアミノ酸残基の置換により、この配列中に挿入されている。有利には前記ポリペプチドは、16、17、19、41、58、59、60、68、76、140、142、147、363、406又は452の位置の少なくとも1つにアルギニン残基を有する。特に有利な位置は、41、58、59、60及び/又は68である。例えば、このポリペプチドは、少なくとも1つ、2つ、3つ又は4つの位置に更なるアルギニン残基を有する。
【0018】
更なる一実施態様において、このポリペプチドは更に、3、20、33、36、37、94、165、361、399又は426の位置の少なくとも1つに、天然の配列に対して更なるロイシン残基を有し、有利には位置、33、36及び/又は37に有する。例えば前記ポリペプチドは少なくとも1つ、2つ、3つ又は4つの位置に更なるロイシン残基を有する。
【0019】
更なる一実施態様において、このポリペプチドは、少なくとも1つの位置に、例えば21、41、43、50、54、62、64又は89の少なくとも1つの位置に、天然の配列に対して更なるプロリン残基を有し、有利には位置、41、43、50、54、62及び/又は64に有する。例えば前記ポリペプチドは少なくとも1つ、2つ、3つ又は4つの位置に更なるプロリン残基を有する。
【0020】
更なる一実施態様において、このポリペプチドは、少なくとも1つの位置に、例えば、24、35又は99の1つの位置に、天然の配列に対して更なるトレオニン残基を有する。例えば前記ポリペプチドは少なくとも1つ、2つ、又は3つの位置にトレオニン残基を有する。
【0021】
更なる一実施態様において、このポリペプチドは、少なくとも1つの位置に、例えば、25、39、42、49、55又は67の1つの位置に、天然の配列に対して更なるチロシン残基を有する。例えば前記ポリペプチドは少なくとも1つ、2つ、3つ又は4つの位置にチロシン残基を有する。
【0022】
一実施態様において、前記ポリペプチド中には少なくとも1つのアルギニン残基が、シトルリン残基として、例えば、4、12、23、28、36、45、50、64、71、100、320、364又は378の少なくとも1つの前記位置に存在する。例えば、前記ポリペプチドは、少なくとも1つ、2つ、3つ又は4つの位置に、シトルリン残基を有する。他方では、このポリペプチドはしかしながら、シトルリン不含ポリペプチドとして存在することもできる。
【0023】
ヒトのビメンチンのムテインのための有利な例は、SEQ ID NO:2、3、4、5、6、7、8又は9を有する配列を有する。
【0024】
本発明の更なる主題は、SEQ ID NO:1を有する天然のビメンチンから誘導されていて、かつ、少なくとも1つのアルギニン残基を有する少なくとも1の範囲を含有し、かつ、リウマチ疾患に関連した自己抗体に対する反応性を示す、前述したポリペプチドうちの1つの断片である。有利には前記断片は、位置10〜145の範囲にある。特に有利には、前記断片は、位置30〜70の範囲にある。断片の有利な例は、断片51〜65(C2)である。前記断片の長さは、有利には、少なくとも6アミノ酸、特に有利には少なくとも8アミノ酸から、120アミノ酸まで、有利には100アミノ酸まで、特に有利には50アミノ酸までである。
【0025】
本発明の更なる主題は、前述したポリペプチド又は断片のペプチド誘導体である。例えば、前記ペプチド誘導体は、レトロ−/インベルソ−ポリペプチド(Retro-/Inverso-Polypeptid)であることができ、即ち、前記したポリペプチドのインバースポリペプチド(inverse Polypeptid)(これは、前記ポリペプチドの鏡像(「mirror image」)に相当して、D−アミノ酸から製造される)、レトロポリペプチド(RetroPolypeptid)(これは、「逆の」配列を有する)、並びに、レトロインベルソポリペプチド(RetroInverso-Polypeptid)(これは、前記したポリペプチドの鏡像であり、更に「逆の」配列を有する)であることができる。
【0026】
ペプチド誘導体の更なる例は、アミノ基の側基−、アミノ−又は/及びカルボキシ末端修飾されたポリペプチド、例えば、例えばカルボン酸又はアルキル残基で修飾されているポリペプチド、又は、カルボン酸基で、アミノ基又はエステル基で修飾されているポリペプチドである。このポリペプチド及び/又はペプチド誘導体は、環式ペプチドとしても存在することができる。
【0027】
本発明の更なる主題は、前記したポリペプチドをコートする核酸である。核酸としては、例えばDNA及びRNA、特にcDNAが考慮される。この核酸は、ポリペプチドの組み換え製造のために、慣用の真核ベクター又は原核ベクター中にクローニングされることができ、かつ適した宿主細胞中で発現されることができる。
【0028】
本発明の更なる主題は、前記したポリペプチド又はその断片の1種又は複数種を含有する診断薬(Diagnostikum)である。診断薬は、遊離の又は担体に結合した形で前記ポリペプチド又は断片を含有することができる。
【発明の効果】
【0029】
著しく意外であると言えることができることに、本発明によるポリペプチドは、リウマチ疾患を有する、特に関節及び運動器官の炎症性疾患を有する、特に有利には関節リウマチの患者の体液中での抗体の診断のために、高特異性かつ高感受性の抗原であることが判明した。有利な体液は、本発明の意味合いにおいて、血液、血清又は血漿であり、特に有利には血清である。
【0030】
本発明による診断薬は一連の利点を示す。つまり、前記ポリペプチドは複数の抗体結合部位を含有するので、モノマーの、また同様にマルチマーの抗体に効率的に結合することができる。この変異したポリペプチドの更なる利点は、これが、炎症性のかつ慢性的な、関節及び運動器官の疾患を有する患者を、特に、関節リウマチを有する患者を、99%の特異性及び85%の感受性で同定できる、診断薬の提供を可能にすることである。
【図面の簡単な説明】
【0031】
【図1】図1は、シトルリン化ペプチド(CCP)と比較した、変異したビメンチンを有するRA自己抗体の検出の診断的特異性の比較を示す図である。
【図2】図2は。単離したCD4陽性T細胞は、ペプチド免疫療法後に、CD4陰性細胞の増殖性応答を抑制することを示す図である。
【図3】図3は、緑茶からの抽出物、変異したビメンチン及びこれらの組み合わせによるRA血清からの抗体の反応の抑制を示す図である。
【図4】図4は、RA患者からの自己抗体の遮断の際の緑茶からの抽出物の選択性を示す図である。
【図5】図5は、関節炎動物モデルの一般的な図示を示す図である。
【図6】図6は、in vivoでの緑茶からの抽出物の有効性を示す図である。
【図7】図7は、in vivoでの緑茶からの抽出物の有効性を示す図である。
【図8】図8は、in vivoでの緑茶からの抽出物の有効性を示す図である。
【発明を実施するための形態】
【0032】
技術水準からは、これまでには、リウマチ疾患、特に関節リウマチの検出を、シトルリン不含タンパク質又はペプチドの使用下で可能にする、比較可能な特異性の又は感受性の診断薬は公知でない(P. J. Utz, Death, autoantigen modifications, and tolerance; Arthritis Res., 2, (2000), 101-114)。
【0033】
本発明の更なる主題は、前記した診断薬を含有する、リウマチ疾患、特に関節リウマチの検出のための使用のための診断キットである。その他に、前記診断キットは慣用の成分、例えば緩衝剤、溶媒及び/又はマーカーグループ(Markierungsgruppe)を含有することができる。
【0034】
キャリアとして、高分子、例えば、DNA、RNA、医薬的に認容性のポリマー、例えばポリエチレン、D,L−ラクチド、ポリD,L−ラクチド−コ−グリコライド、合成生体高分子、例えばポリリシン及びデキストラン、及びタンパク質、例えば血清アルブミン及びヘモシアニンが考慮される。有利には、デキストランは、いわゆる「ヒドロコーティング−塗布方法(Hydrocoating-Beschichtungsverfahren)」において使用される(Gregorius, K., Mouritsen, S. 及び Elsner, H.I., Hydrocoating: a new method for coupling biomolecules to solid phases, J. Immunol. Methods 12 (1995), 65-73)。
【0035】
本発明の更なる主題は、自己抗体の濃度を体液中で測定する、リウマチ疾患、特に関節リウマチのin vitro検出のための方法である。この方法は、疾患の診断、分類及び/又は重症度の評価を可能にする。検出手段として、前記の診断薬又は前記の診断キットが用いられる。
【0036】
本発明による方法においては、検出方法として、診断薬の領域での慣用の全ての方法、例えば
(a)酵素学的方法、
(b)ルミネセンスを基礎とする方法、又は
(c)放射化学的方法
が使用されることができる。
【0037】
有利な検出方法として、本発明による方法においては、ラジオイムノアッセイ、化学発光イムノアッセイ、イムノブロットアッセイ又は酵素イムノアッセイ、例えばELISAが考慮される。
【0038】
本発明による方法の一実施態様において、担体に結合している前記したポリペプチドに、試料として分析する体液が添加される。前記試料のインキュベーション後に、結合していない成分を洗浄により除去する。検出すべき抗体の、ポリペプチドに対する特異的な結合は、マーカーグループを有する二次抗体により検出される。
【0039】
二次抗体として、本発明による方法においては、例えば、ヒトの抗体、例えばIgG、IgM、IgA及び/又はIgEに対して、例えば、ヒトのIgG1のFc部分に対して指向されている抗体が考慮される。
【0040】
マーカーグループとして、本発明による方法においては、例えば、酵素、例えばペルオキシダーゼ又はアルカリホスファターゼ、放射性マーカー又は発光性マーカーグループ、例えばアクリジニウム化合物が考慮される。
【0041】
選択的に、拮抗性阻害試験が、本発明によるポリペプチドを用いて実施されることもでき、この試験においては、標識化された関節リウマチ(RA)自己抗体の結合は試料の存在下で、この試料中に同様にRA自己抗体が存在している限り阻害される。
【0042】
本発明によるペプチドは、リウマチ疾患、特に関節リウマチの治療の際の、予後のための又は/及び経過制御のための手段としても使用されることができる。予後手段(prognostische Mittel)としてはこの際、位置30〜65、又は/及び、位置55〜70領域のからのペプチドが有利である。
【0043】
本発明の更なる課題は、自己免疫複合体の結合を選択的に、リウマチ疾患、特に炎症性プロセスとの関連において、特に有利には炎症性の関節において阻害するか又は妨げるが、抗体産生の一般的な遮断は引き起こさない医薬品を提供することであった。
【0044】
この課題は、本発明により、前記したポリペプチド又は断片を含有し、かつ、ヒト−又は獣医薬における適用に適している医薬品により解決される。前記医薬品は、例えば、体液、例えば血液又は血漿の中に含有される自己抗体を固相に結合した抗体を用いて捕捉し、かつこの処理された体液を再度患者中に返送するための、体液、例えば血液又は血漿の体外処理のために用いられる。
【0045】
本発明による実施例は意外にも、本発明によるポリペプチドが、第一に疾病進行と関連した抗原であり、又は、それどころか第一にこの疾患を開始するタンパク質でさえあることを示した。患者体液からの抗体の選択的除去により、この病気の進行に有利に影響を及ぼすことができる。
【0046】
更に、前記ポリペプチド又はその断片は、直接的にも、医薬的に認容性の担体、溶媒及び/又は助剤を含有することができる医薬組成物の形において使用されることができる。
【0047】
この医薬組成物は、タブレット、カプセル、溶液、懸濁液、エアロゾル、スプレー(経鼻スプレー又は喉スプレー)、ゲル、プラスターその他の形で投与されることができる。
【0048】
前記医薬品は、全ての公知の方法により投与されることができ、その際、経口及び静脈投与が特に有利である。
【0049】
この用量を、この疾患の種類及び深刻度に応じて変動させることができ、かつ、通常は、1〜2000mg/日の範囲内、有利には10〜200mg/日の範囲内にある。
【0050】
更に、RA患者は、天然のビメンチンのアミノ酸配列から誘導される、同定された、短い、合成の、前記ポリペプチドのタンパク質エピトープ(とりわけ、C2エピトープ)により治療されることができる。
【0051】
RA患者のB細胞エピトープの分析は、本発明によるポリペプチドの、短い、合成の、線状ペプチドエピトープ(C2エピトープ)を有する全患者の91%が相互反応するとの意外な発見を提供した。
【0052】
更に、マウス実験により、マウスがこのような処理後に抗原特異的な免疫細胞の分裂を成功して抑制する免疫細胞を形成することが確認されることができた。
【0053】
リウマチ疾患、特に関節リウマチの治療の経過及び成功の制御は、目下のところ慣用の診断方法に応じて、手間及び時間のかかる、Disease Activity Score (DAS)の方法を用いてのみ可能である。この方法の際には、腫れた関節の数、痛みのある関節の数、炎症パラメーター(BSR又はCRP)が算出され、この患者の感受性(Befindlichkeit)は、visual analog scale(visuell Analog-Skala)で確認した。
【0054】
この4つの個々の成分を、1つの式によりまとめた。
【0055】
この生じる数値は、患者での実際の疾病活動性(Erkrankungsaktivitaet)及び療法の質について比較的信頼できかつ客観的である情報を与える。
【0056】
本発明によるポリペプチドは、今や、リウマチ疾患、特に関節リウマチの治療の経過及び成功を制御することを可能にする。
【0057】
例示的に、30〜65の位置にある前記ポリペプチドと交差反応した患者では、迅速かつ効果的な治療が観察されることができ、これは一部では2年間後に完全な治癒でもってその前向きの完結が見出された。
【0058】
少ない疾患活動性(平均して2.8のDASスコア)を有する患者は、ELISAにより、本発明によるポリペプチドを基礎として同定されることができた(平均して<300U/ml)。スルファサラジン又はコルチゾンを用いた処置(処置後のDASスコア、1.5未満)の成果に相関して、1〜2年間の経過の間に抗体価は、平均して、出発値の1/6に減少した。
【0059】
深刻な関節リウマチを有する患者(平均してDASスコア4.9)は、平均して抗体価>1000U/mlを示した。このDASスコアは、レミケード及び/又はメトトレキセートを用いた処置により著しく変更しないで、50%の患者では、抗体量が、本発明によるポリペプチドに対して約30〜50%だけ減少した。変更した抗体価に並行して、患者に、既往歴での客観的な疾病状況の実質的によりポジティブな全体的な判断がプロトコルに付与され、即ち、本発明による診断薬はまた、深刻な関節リウマチ療法の質的制御にも適する。
【0060】
実質的な利点は、数分間のうちにまず定量的及び定性的に信頼できる情報が、関節リウマチの種類、進行及び療法について付与されることができることである。
【0061】
この意外な発見は、本発明によるポリペプチドが治療に使用されることができるとの認識に導き、というのも、その使用により意外にも、これまでに不所望であった医薬品作用の回避が、同等の有効性でもって期待することができるからである。
【0062】
特に、本発明によるポリペプチドは意外にも、リウマチ疾患、特に炎症の治療のための、新しい種類の、これまでに公知でない作用原理の提供を可能にする。本発明によるポリペプチドのこの作用スペクトルは既知の炎症阻害剤とは異なり、というのも選択的に、抗体依存性メディエーターのみが減少して形成されることができるからである。本発明のポリペプチドの更なる利点は、副作用スペクトルがおそらくは、技術水準から公知の医薬品のスペクトルよりも著しくより少ないことであり、というのも健康な供血者の抗体との交差反応が観察されることができないからである。
【0063】
上記した本発明による診断薬及び治療薬は従って、ビメンチン依存性プロセスに基づく全ての表現型の診断、予防又は治療のために適用されることができる。
【0064】
本発明の更なる主題は、歯周病病原菌バクテロイデス・フォーサイス(Bacteroides forsythus)及びプレボテラ・インターメディア(Prevotella intermedia)の仮想タンパク質BF0786及びBF0713であり、これらにより、これらが、リウマチ疾患、特に関節及び運動器官の慢性炎症性疾患のイニシエーターであることが確認された。
【0065】
これらのこのタンパク質及び断片は従って、リウマチ疾患、特に、関節及び運動器官中の痛みの検出、予防及び/又は治療のための診断薬、診断キット又は医薬品の製造のために適する。診断適用及び医薬適用に関しては、ビメンチン類似体の上の説明が参照される。
【0066】
タンパク質BF0786及びその配列は、Kuwahara, T. et al.(Kuwahara, T. et. al., Proc. Natl. Acad. Sei. U.S.A 101 (41 ), 14919-14924 (2004))により記載されている。タンパク質BF0713及びその配列は、Cerdeno-Tarraga, A.M. et al.(Cerdeno-Tarraga, A.M. et. al., Science 307 (5714), 1463-1465 (2005))により記載されている。診断及び治療の領域での医薬的な適用はこれまでに公知でない。
【0067】
本発明の更なる課題は、選択的に、リウマチ関連自己抗体からの自己免疫複合体の形成を、自己抗原、特にビメンチンでもって遮断し、即ち、病理発生に関与する抗体の反応のみを妨げ、抗体産生及び抗体反応に影響を及ぼすがしかしながら一般的には影響を及ぼさず、かつ、従って、関節及び運動器官の範囲内での痛みのリウマチ関連疾患の、感受性がありかつ特異的な療法又は予防を可能にする物質を見出すことであった。
【0068】
緑茶成分が、この課題を解決することが見出された。Tariq, M. et al., "Prevention of collagen-induced arthritis in mice by a polyphenolic fraction from green tea", Proc. Natl. Acad. Sei. USA, Vol. 96, 4524-4529頁(1999)からは、緑茶の成分エピガロカテキンガレート(EGCG)が公知である。これは、ビメンチンに結合しかつリン酸化を遮断する(S. Ermakova et al., The intermediate filament protein vimentin is a new target for epigallocatechin gallate; J. Biol. Chem. 280 (17), (2005), 16882-16890)。エピガロカテキンガレートを用いて、変異したビメンチンに対する自己抗体の自己免疫複合体形成が濃度依存的に遮断されることができることが示されることができた。
【0069】
競合実験においては、非結合性物質、エピカテキン(EC)が抗体結合を最大で10%までしか遮断しないことが示されることができた。エピガロカテキンガレート(EGCG)を用いて、10〜100μg/mlの濃度では、抗体結合の最大45%が遮断されることが示されることができた。
【0070】
しかしながら、緑茶が、適した有機溶媒又は有機−水性溶媒又は溶媒混合物、例えばジメチルスルホキシド(DMSO)、エタノール及び水からの混合物を用いて抽出される場合には、意外にも、この抽出物の少量を用いて、自己免疫複合体形成のほぼ完全な遮断が達成されることができる。更には、例えば乾燥、凍結乾燥、分別その他によりこのような抽出物から得ることができる生成物も使用できる。この抽出物の作用は、技術水準とは対立しており、というのもこれまでには、緑茶の公知の単独物質についても、更には、天然物質混合物についても、抗体反応の特殊な遮断は公知でないからである。その他の自己免疫疾患を有する患者の血清中でのこの抗体複合体形成は、本発明による抽出物により、著しく変更されることはできない。
【0071】
この結果は、最も意外に見えるものであり、というのも、技術水準からはこれまでには、変異したビメンチンに対する独自の結合は公知でないからである。更に、この緑茶成分の相互作用は、技術水準からの抗体を用いては公知でない。
【0072】
更にこれまでにはECGCについては、a)抗酸化作用を有すること、b)発癌物質の反応性の中間段階を防ぐこと、c)発癌物質活性性の酵素を阻害すること、そしてd)ニトロソ化及び細胞増殖(特に腫瘍細胞の増殖)を阻害することのみが公知であった。
【0073】
本発明の更なる主題は、最後に、前記したペプチド、前記したペプチド断片、前記したレトロ−インベルソ−ポリペプチド又は環式ペプチドの、抗体駆動性炎症反応に対する遮断性天然物質及び/又は化学物質の検出のための使用である。
【0074】
更に、本発明によるペプチドを基礎としたバイオアッセイが開発されることができ、これを用いて天然物質ライブラリー、コンビナトリアルライブラリー及び化学的ライブラリーを炎症阻害性物質の存在に対して分析することができる。疾病関連した抗体の使用下で、前記混合物から物質が同定及び精製されることができ、この物質は、本発明による抗原を直接的に又は非直接的に、この抗体の遮断を介して遮断する。この物質については、動物実験において関節リウマチ遅延性の、そしてより高い用量においては完全な治癒が観察されることができた。
【0075】
更に、本発明は、以下の図及び実施例により詳細に説明される。
【0076】
図の説明
図1:シトルリン化ペプチド(CCP)

と比較した、変異したビメンチン(●)を有するRA自己抗体の検出の診断的特異性の比較。
【0077】
図2:単離したCD4陽性T細胞は、ペプチド免疫療法後に、CD4陰性細胞の増殖性応答を抑制する。
【0078】
図3:緑茶からの抽出物、変異したビメンチン及びこれらの組み合わせによるRA血清からの抗体の反応の抑制。
【0079】
図4:RA患者からの自己抗体の遮断の際の緑茶からの抽出物の選択性。
【0080】
図5:関節炎動物モデルの一般的な図示。
【0081】
図6〜8:in vivoでの緑茶からの抽出物の有効性。
【実施例】
【0082】
実施例
例1:RA関連抗原としてのヒトのビメンチンの突然変異した変異体の同定
U937細胞(ヒトの単球細胞系列)からの細胞抽出物を製造した。シトルリン化タンパク質をこの細胞抽出物から、市販の抗シトルリン抗体を用いた前吸収により除去した。ニワトリの抗ビメンチン抗体を用いた引き続くアフィニティクロマトグラフィは溶離物を提供し、ここから、RAを有する患者の抗体と交差反応するビメンチン変異体を単離することができた。この得られたビメンチン変異体を、更に、逆相クロマトグラフィ、タンパク質分解による消化、及び、アミノ酸配列決定により特性決定した。この結果において、アミノ酸配列SEQ ID NO:2〜9を有する以下に記載するポリペプチドが同定されることができた。
【0083】
例2:検出抗原としての突然変異したビメンチンを用いたRA関連自己抗体の検出
例1からの天然のビメンチンの組み替えした、突然変異した変異体(SEQ ID NO:9)を、大腸菌中で発現させ、His−Tagの使用下でアフィニティクロマトグラフィを用いて精製した。この精製したタンパク質の2mg/mlの溶液を、展開緩衝液(50mM Tris、2M グアニジンヒドロクロリド、5mM CaCl2、2mM DTT、0.5mM EDTA、5mM メチルアンモニウムクロリド、pH7.4)で前処理し、そして少なくとも14時間4℃で、そしてこの後にPBS1:1000で希釈した。この溶液100μlを、一晩4℃で、マイクロタイタープレート(製造者:COSTAR)の穴中に配置した。結合していないポリペプチドを、3回の洗浄により除去した(175μl、緩衝液PBS/0.05%Tween)。可能性のある非特異的な交差反応を、PBS中の3%ウシ血清アルブミン(BSA)溶液150μlを用いて前記穴のインキュベーションにより遮断した。この遮断した、空にしたプレートを37℃で30分間乾燥させ、湿分の排除下で4℃で貯蔵した。
【0084】
このようにして製造されたマイクロタイタープレートを、自己抗体の、突然変異したビメンチンに対する定量的検出のために、非直接的な酵素イムノアッセイの原理に応じて使用した。比較として、CCP(シトルリン化ペプチド)に対する自己抗体の検出を実施した。このために、健康な発端者及び/又は異なる疾患の患者の血清試料を、1:100で1%のBSA/PBSで希釈し、30分間この穴中でインキュベーションした。PBS/0.05%Tweenを用いた繰り返した洗浄により、結合していない血清−抗体を除去した。酵素標識した検出抗体(特に、ペルオキシダーゼコンジュゲートした抗ヒトIgG抗体、希釈、1:10000)を引き続き15分間インキュベーションした。
【0085】
過剰の検出抗体の洗い流しの後に、基質溶液100μl(TMB(3,3′,5,5′−テトラメチルベンジジン)タブレットを、0.05Mのリン酸−クエン酸−緩衝液10ml中に溶解させ、かつ過酸化水素8mlを、この使用前に添加した)を15分間にわたり添加した。1M HCl 100μlの添加により、この反応を停止させ、この反応生成物は黄色に色づいた。黄色の着色の強度を、測光により450nmで測定し、その際この吸収は、検査した自己抗体濃度に対して直接的に比例している。
【0086】
この際、以下の測定結果が達成された:
【表1】

【0087】
「関節リウマチ」との診断を有する全ての患者血清は、この測定の際に、Tecan 「SPECTRA」測光計中で、正常の血清及び、その他の疾患に苦しむ患者の血清と比較して顕著に高められた吸収値を示した。
【0088】
例3:天然のビメンチンの突然変異した変異体を基礎とする診断薬の開発
突然変異したビメンチンを基礎とする診断薬の開発のために、天然のビメンチンの異なる突然変異したポリペプチド変異体(参照、例1)をクローニングし、大腸菌中で発現させた。ACR判断基準により定義された、関節リウマチ(RA)を有する患者集団(約100人)の血清を、RAでの自己抗体の検出のために最高の感受性を有するポリペプチド変異体を同定すべく使用した。このために、例2と同様に、発現しかつ精製されたタンパク質を、マイクロタイタープレート中に塗布し、古典的なELISAアッセイにおいて、RA患者での自己抗体の交差反応を分析した。
【0089】
第一のスクリーニング方法で得られた、突然変異した配列を、可能性のある最大の感受性を達成すべく、更なる評価(Ansatz)において組み合わせた。RAのための診断薬としての見出された突然変異したポリペプチド変異体の特異性の検査のために、他の自己免疫疾患(特に、SLE,シェーグレン症候群 IDDM)を有する34人の患者の血清及び53人の健康な人間の血清を使用した。この最終的に得られた突然変異したポリペプチド変異体を、例2と同様に、マイクロタイタープレート中に配置した。
【0090】
例2からの突然変異した変異体の使用下で、意外にも、シトルリン化ペプチド(CCP)について技術水準から公知である選択性及び感受性よりも、より高い選択性(>98%)及び感受性が、RA患者及び他の自己免疫疾患を有する患者の自己抗体の分析の際に達成されることができた(図1)。
【0091】
例4:突然変異したビメンチン中の自己エピトープの測定
抗ビメンチン抗体をELISAにおいて、オーバーラップしてビオチン化された、合成の、突然変異したビメンチンの17量体のペプチド(例2、参照)に対するその結合能に関して試験した。この際、RAを有する患者のこの抗体が、同じB細胞エピトープに対して指向しているかどうかとの問いが中心となっている。
【0092】
RA及び異なる抗ビメンチン抗体価を有する102人の患者の集団において、意外にも、91%のこの血清が、ビメンチンのアミノ末端領域からの線状ペプチド配列の1つと反応した。カルボキシ末端領域又は真ん中のα−ヘリックスの棒状ドメインに対する交差反応は観察されることができなかった。健康な発端者及び他の自己免疫疾患を有する患者(特に、シェーグレン症候群、全身性エリテマトーデス又は脈管炎)の血清は、ビメンチン−ペプチド配列に対して反応を示さなかった。
【0093】
特に高い反応性は、アミノ酸30〜70の範囲、特にアミノ酸50〜65の範囲で見出された。
【0094】
例5:RA患者での予後
RAは極めて異なって進行し、治療法の決定は、最終的なものではなくて連続的に制御し、かつ要求に応じて適合されなくてはならないものである。従って、薬物投与療法下の21人のRA患者を、本発明によるポリペプチドに対する反応について分析した。追跡調査(1〜2年間の経過の間に一患者につき少なくとも7回の検査)において、突然変異したビメンチンの、オーバーラップしている、ビオチン化した、合成のペプチドに対する交差反応(参照、例4)をELISAにおいて特性決定した。この際、例えば、ビメンチン配列の30〜65の位置にあるペプチドと交差反応するRA患者では、迅速かつ効果的な治療が観察され、これは一部では、2年後に、完全な治癒でもってその前向きな結末を迎えたことが確認された。これとは対称的に、55〜67の位置にあるペプチドと交差反応したRA患者では、試験したいずれの場合においても、処置の成功は、この患者資料から確認されなかった。健康な患者は分析したペプチドにいずれに対しても交差反応を示さなかった。
【0095】
このデータに基づいて、本発明によるポリペプチドは、リウマチ疾患、特に関節リウマチの治療の進行及び成功を制御するための診断薬として用いることができる。即ち、定量的なELISAは、本発明によるペプチドの使用下で、治療の開始時に既に、患者を、薬物投与「応答者」と「非応答者」とを区分することができる。
【0096】
例6:ペプチドの治療的有効性
特定の伝達物質(Botenstoff)は、関節粘膜中で、軟骨中で、そして骨中での炎症性プロセスを担う。この公知のメディエーターは、腫瘍壊死因子(TNF)である。慢性的な多発性関節炎のために、初期から抗TNF療法を実質的に支援している形質転換マウスモデルが以前から存在する。このマウスは、ヒトTNFを過剰発現し、かつこれは、前記マウスが深刻な、慢性的な破壊性の多発性関節炎を進展させるのに十分である。
【0097】
この背景のもとで、この形質転換マウスは、生理学的食塩溶液のみで処置されるか、又は、前記マウスに、突然変異したビメンチンのペプチド(50〜65)1μgの溶液を注入した(以下と同様に、Puga Yung et al., Epitope-specific immunotherapy induces immune deviation of proinflammatory T cells in rheumatoid arthritis, PNAS 2004 101 : 4228-4233 及び Zwerina et al., Single and combined inhibition of tumor necrosis factor, interleukin-1 , and RANKL pathways in tumor necrosis factor induced arthritis: effects on synovial inflammation, bone erosion, and cartilage destruction. Arthritis Rheum. 2004 Jan; 50(1):277-90)。引き続き、この関節腫れを測定し、この関節粘膜、骨−及び軟骨損傷を、微細組織的(feingeweblich)に試験した。ビメンチンペプチドの注射により、この関節の腫れは41%に、そしてこの関節粘膜の炎症は38%に抑制され、生理学的食塩溶液は、影響を示さなかった。無論、突然変異したビメンチンの複数のペプチドを組み合わせた場合には、この結果炎症はほぼ完全に抑制される。
【0098】
調節性Tリンパ球は、末梢性トレランスの有望なメディエーターとして適する。従って、この動物で、限定されたアロ免疫応答を、レギュレーター細胞の形成が抗原特異的に誘導するかどうかとの問いを更に追跡した。この際、前記マウスは、このような処理の後に、抗原特異的な免疫細胞の分裂を成功して抑制する免疫細胞を形成し、その際、これは、表現型CD4+CD45RCnegを有する肝内T細胞群であることが見出された(図2)。
【0099】
例7:in vitroでの自己抗体複合体の形成の遮断
突然変異したビメンチンに対する抗体結合の遮断のために、次の物質を、終濃度1μg/mlで、単独で又は組み合わせて使用した:
1.エピカテキン(EC)
2.エピガロカテキンガレート(EGCG)
3.緑茶からのDMSO抽出物
4.突然変異したビメンチン 1.4mg/ml
5.突然変異したビメンチン 0.7mg/ml
6.シトルリン化したビメンチン 1.5mg/ml。
【0100】
緑茶からの抽出物の製造のために、任意の市販のお茶5gを、80%のDMSO10mlで覆い、一晩撹拌した。この溶液を13000rpmで、10分間遠心分離し、茶抽出物として定義する。上述の固体物質1,2−及び4−6に対して、この製造の茶抽出物10μl/mlを使用した。この抗体結合を、物質の存在下及び非存在下で、ELISAにおいて分析し、このために例2と同様にマイクロタイタープレートを製造した。RA患者の異なる血清を、1:100〜1:400の希釈率において使用した。この抗体結合の遮断を、希釈した血清100μlを10分間、記載した物質又は茶溶液を用いて前インキュベーションすることにより誘導した。引き続き、この残存する交差反応を、記載したマイクロタイタープレートの穴への血清−物質混合物100μlの添加により、分析した。典型的なELISAの実施に相当して、この見出された抗体の検出をHRPコンジュゲートした抗ヒトIgGを用いて行った。図3中には、例示的に、患者番号Nr.400725で得られた結果を記載した。
【0101】
緑茶からの抽出物による、RA患者からの自己抗体(突然変異したビメンチンに対する抗体)の抑制の特異性を、図4に示した。
【0102】
例8:in vivoでの自己抗体複合体の形成の遮断
緑茶のカテキンの経口吸収は、経口摂取の際には極めて少なく、従って通常の茶の摂取ではおそらくは最小限の血清濃度しか達成されない(Zhu et al., Oral absorption and bioavailability of tea catechins. Planta Medica 66 (2000) 444-7;Schrader et al., Bioverfuegbarkeit verschiedener Tee-Catechine im Plasma in Abhaengigkeit von der Darreichungsform. Proc. Germ. Nutr. Soc. 3 (2001) 36も参照のこと)。
【0103】
従って、我々により製造された茶抽出物(参照、例7)を凍結乾燥させ、カカオ油又はサケ油で再構成した。5gの緑茶から製造された抽出物のラットへの経口適用の後(5g/kg 体重量)に、半時間毎に血液を採りだし、HPLC及びGC/MSを用いて分析した。ラットでは、吸収のおよそ2時間後に、最大血漿濃度75μg/ml EC及びEGCG(抽出物質量の5〜13%)を、並びにおよそ245μg/mlをEGCG(50%まで抽出物中に含有される)について測定されることができた。毒性作用は、この動物実験において、検査時間1ヶ月の間に生じなかった。
【0104】
この結果をヒトに転用した場合には、この投与形態を用いて、自己抗体複合体形成の完全な遮断を可能にすることができた、茶成分(特にカテキン)についての血漿濃度を達成することとなる。
【0105】
例9:in vitroでの緑茶の抽出物の有効性
10又は100mg/kg 体重の濃度での緑茶の抽出物の腹腔内投与は、関節炎動物モデル(図5;アジュバントの投与後の前足の腫れの測定)中で、顕著に有利な作用を示した。この結果は図6〜8中に示されている。
【特許請求の範囲】
【請求項1】
天然の配列に対して少なくとも1つの更なるアルギニン残基を含有することを特徴とする、SEQ ID NO:1を有する天然のビメンチンから誘導されたポリペプチド。
【請求項2】
16、17、19、41、58、59、60、68、76、140、142、147、363、406又は452の位置の少なくとも1つに更なるアルギニン残基を有することを特徴とする、請求項1記載のポリペプチド。
【請求項3】
前記の位置の少なくとも2つに更なるアルギニン残基を有することを特徴とする、請求項2記載のポリペプチド。
【請求項4】
天然の配列に対して、3、20、33、36、37、94、165、361、399又は426の位置の少なくとも1つに更なるロイシン残基を有することを特徴とする、請求項1記載のポリペプチド。
【請求項5】
前記の位置の少なくとも2つに更なるロイシン残基を有することを特徴とする、請求項4記載のポリペプチド。
【請求項6】
天然の配列に対して、21、41、43、50、54、62、64又は89の位置の少なくとも1つに更なるプロリン残基を有することを特徴とする、請求項1記載のポリペプチド。
【請求項7】
前記の位置の少なくとも2つに更なるプロリン残基を有することを特徴とする、請求項6記載のポリペプチド。
【請求項8】
天然の配列に対して、24、35又は99の位置の少なくとも1つに更なるトレオニン残基を有することを特徴とする、請求項1記載のポリペプチド。
【請求項9】
前記の位置の少なくとも2つに更なるトレオニン残基を有することを特徴とする、請求項8記載のポリペプチド。
【請求項10】
天然の配列に対して、25、39、42、49、55又は67の位置の少なくとも1つに更なるチロシン残基を有することを特徴とする、請求項1記載のポリペプチド。
【請求項11】
前記の位置の少なくとも2つに更なるチロシン残基を有することを特徴とする、請求項10記載のポリペプチド。
【請求項12】
少なくとも1つのアルギニン残基が、シトルリン残基として存在することを特徴とする、請求項1記載のポリペプチド。
【請求項13】
4、12、23、28、36、45、50、64、71、100、320、364又は378の位置の少なくとも1つにシトルリン残基を有することを特徴とする、請求項12記載のポリペプチド。
【請求項14】
前記の位置の少なくとも2つにシトルリン残基を有することを特徴とする、請求項13記載のポリペプチド。
【請求項15】
SEQ ID NO:1を有する天然のビメンチンから誘導された、少なくとも6アミノ酸からなる断片であって、少なくとも1つの更なるアルギニン残基を有する少なくとも1の領域を含有し、かつリウマチに関連した自己抗体に対する反応性を示すことを特徴とする、SEQ ID NO:1を有する天然のビメンチンから誘導された、少なくとも6アミノ酸からなる断片。
【請求項16】
請求項1から14までのいずれか1項記載のポリペプチド又は請求項15記載の断片の、ペプチド誘導体。
【請求項17】
レトロ−又は/及びインベルソポリペプチド及び環式ペプチドから選択されていることを特徴とする、請求項16記載のペプチド誘導体。
【請求項18】
請求項1から17までのいずれか1項において定義された、ポリペプチド又はペプチド誘導体を含有することを特徴とする、診断薬。
【請求項19】
請求項18に定義された診断薬を含有することを特徴とする、リウマチ疾患の検出のための使用のための診断キット。
【請求項20】
関節リウマチの検出のために使用されることを特徴とする、請求項19記載の診断キット。
【請求項21】
キャリアが、DNA、RNA、医薬的に認容性のポリマー、合成生体高分子又はタンパク質であることを特徴とする、請求項19又は20記載の診断キット。
【請求項22】
自己抗体の濃度を体液中で決定し、かつ場合により、疾病の診断、分類化及び重症度の評価に用いる、リウマチ疾患のin vitro検出のための方法であって、請求項18で定義した診断薬又は請求項19又は20で定義した診断キットを使用することを特徴とする、方法。
【請求項23】
関節リウマチの検出のために使用することを特徴とする、請求項22記載の方法。
【請求項24】
請求項1から17までのいずれか1項において定義されたポリペプチド又はペプチド誘導体を含有することを特徴とする、医薬品。
【請求項25】
請求項1から17までのいずれか1項において定義されたポリペプチド又はペプチド誘導体の、リウマチ疾患の予防及び/又は治療のための医薬品の製造のための使用。
【請求項26】
リウマチ疾患が関節リウマチであることを特徴とする、請求項25記載の使用。
【請求項27】
リウマチ疾患、特に関節リウマチの予防及び/又は治療のための医薬品の製造のための、タンパク質BF0786又は/及びBF0713の使用。
【請求項28】
リウマチ疾患、特に関節リウマチの検出のための診断手段としての、タンパク質BF0786又は/及びBF0713の使用。
【請求項29】
抗体又は/及び抗原により駆動される炎症反応に対する遮断性の天然物質及び/又は化学物質の検出のための、請求項1から17までのいずれか1項において定義されたポリペプチド又はペプチド誘導体の使用。
【請求項30】
リウマチ疾患、特に関節リウマチの予防又は/及び治療のための、エピガロカテキンガレート(EGCG)の使用。
【請求項31】
リウマチ疾患、特に関節リウマチの予防又は/及び治療のための、緑茶からの抽出物の使用。
【請求項32】
有機抽出物又は有機−水性抽出物又はこのような抽出物から得られる生成物を使用することを特徴とする、請求項31記載の使用。
【請求項33】
前記抽出物が、作用物質としてエピガロカテキンガレート(EGCG)を含有することを特徴とする、請求項31又は32記載の使用。
【請求項1】
天然の配列に対して少なくとも1つの更なるアルギニン残基を含有することを特徴とする、SEQ ID NO:1を有する天然のビメンチンから誘導されたポリペプチド。
【請求項2】
16、17、19、41、58、59、60、68、76、140、142、147、363、406又は452の位置の少なくとも1つに更なるアルギニン残基を有することを特徴とする、請求項1記載のポリペプチド。
【請求項3】
前記の位置の少なくとも2つに更なるアルギニン残基を有することを特徴とする、請求項2記載のポリペプチド。
【請求項4】
天然の配列に対して、3、20、33、36、37、94、165、361、399又は426の位置の少なくとも1つに更なるロイシン残基を有することを特徴とする、請求項1記載のポリペプチド。
【請求項5】
前記の位置の少なくとも2つに更なるロイシン残基を有することを特徴とする、請求項4記載のポリペプチド。
【請求項6】
天然の配列に対して、21、41、43、50、54、62、64又は89の位置の少なくとも1つに更なるプロリン残基を有することを特徴とする、請求項1記載のポリペプチド。
【請求項7】
前記の位置の少なくとも2つに更なるプロリン残基を有することを特徴とする、請求項6記載のポリペプチド。
【請求項8】
天然の配列に対して、24、35又は99の位置の少なくとも1つに更なるトレオニン残基を有することを特徴とする、請求項1記載のポリペプチド。
【請求項9】
前記の位置の少なくとも2つに更なるトレオニン残基を有することを特徴とする、請求項8記載のポリペプチド。
【請求項10】
天然の配列に対して、25、39、42、49、55又は67の位置の少なくとも1つに更なるチロシン残基を有することを特徴とする、請求項1記載のポリペプチド。
【請求項11】
前記の位置の少なくとも2つに更なるチロシン残基を有することを特徴とする、請求項10記載のポリペプチド。
【請求項12】
少なくとも1つのアルギニン残基が、シトルリン残基として存在することを特徴とする、請求項1記載のポリペプチド。
【請求項13】
4、12、23、28、36、45、50、64、71、100、320、364又は378の位置の少なくとも1つにシトルリン残基を有することを特徴とする、請求項12記載のポリペプチド。
【請求項14】
前記の位置の少なくとも2つにシトルリン残基を有することを特徴とする、請求項13記載のポリペプチド。
【請求項15】
SEQ ID NO:1を有する天然のビメンチンから誘導された、少なくとも6アミノ酸からなる断片であって、少なくとも1つの更なるアルギニン残基を有する少なくとも1の領域を含有し、かつリウマチに関連した自己抗体に対する反応性を示すことを特徴とする、SEQ ID NO:1を有する天然のビメンチンから誘導された、少なくとも6アミノ酸からなる断片。
【請求項16】
請求項1から14までのいずれか1項記載のポリペプチド又は請求項15記載の断片の、ペプチド誘導体。
【請求項17】
レトロ−又は/及びインベルソポリペプチド及び環式ペプチドから選択されていることを特徴とする、請求項16記載のペプチド誘導体。
【請求項18】
請求項1から17までのいずれか1項において定義された、ポリペプチド又はペプチド誘導体を含有することを特徴とする、診断薬。
【請求項19】
請求項18に定義された診断薬を含有することを特徴とする、リウマチ疾患の検出のための使用のための診断キット。
【請求項20】
関節リウマチの検出のために使用されることを特徴とする、請求項19記載の診断キット。
【請求項21】
キャリアが、DNA、RNA、医薬的に認容性のポリマー、合成生体高分子又はタンパク質であることを特徴とする、請求項19又は20記載の診断キット。
【請求項22】
自己抗体の濃度を体液中で決定し、かつ場合により、疾病の診断、分類化及び重症度の評価に用いる、リウマチ疾患のin vitro検出のための方法であって、請求項18で定義した診断薬又は請求項19又は20で定義した診断キットを使用することを特徴とする、方法。
【請求項23】
関節リウマチの検出のために使用することを特徴とする、請求項22記載の方法。
【請求項24】
請求項1から17までのいずれか1項において定義されたポリペプチド又はペプチド誘導体を含有することを特徴とする、医薬品。
【請求項25】
請求項1から17までのいずれか1項において定義されたポリペプチド又はペプチド誘導体の、リウマチ疾患の予防及び/又は治療のための医薬品の製造のための使用。
【請求項26】
リウマチ疾患が関節リウマチであることを特徴とする、請求項25記載の使用。
【請求項27】
リウマチ疾患、特に関節リウマチの予防及び/又は治療のための医薬品の製造のための、タンパク質BF0786又は/及びBF0713の使用。
【請求項28】
リウマチ疾患、特に関節リウマチの検出のための診断手段としての、タンパク質BF0786又は/及びBF0713の使用。
【請求項29】
抗体又は/及び抗原により駆動される炎症反応に対する遮断性の天然物質及び/又は化学物質の検出のための、請求項1から17までのいずれか1項において定義されたポリペプチド又はペプチド誘導体の使用。
【請求項30】
リウマチ疾患、特に関節リウマチの予防又は/及び治療のための、エピガロカテキンガレート(EGCG)の使用。
【請求項31】
リウマチ疾患、特に関節リウマチの予防又は/及び治療のための、緑茶からの抽出物の使用。
【請求項32】
有機抽出物又は有機−水性抽出物又はこのような抽出物から得られる生成物を使用することを特徴とする、請求項31記載の使用。
【請求項33】
前記抽出物が、作用物質としてエピガロカテキンガレート(EGCG)を含有することを特徴とする、請求項31又は32記載の使用。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公開番号】特開2013−32358(P2013−32358A)
【公開日】平成25年2月14日(2013.2.14)
【国際特許分類】
【出願番号】特願2012−193246(P2012−193246)
【出願日】平成24年9月3日(2012.9.3)
【分割の表示】特願2008−518703(P2008−518703)の分割
【原出願日】平成18年6月27日(2006.6.27)
【出願人】(502057669)オルゲンテック ディアグノスティカ ゲゼルシャフト ミット ベシュレンクテル ハフツング (2)
【Fターム(参考)】
【公開日】平成25年2月14日(2013.2.14)
【国際特許分類】
【出願日】平成24年9月3日(2012.9.3)
【分割の表示】特願2008−518703(P2008−518703)の分割
【原出願日】平成18年6月27日(2006.6.27)
【出願人】(502057669)オルゲンテック ディアグノスティカ ゲゼルシャフト ミット ベシュレンクテル ハフツング (2)
【Fターム(参考)】
[ Back to top ]

