リンゴ抽出物及びコラーゲントリペプチド含有美容飲料
【課題】美容飲料を提供する。
【解決手段】コラーゲンおよび線維芽細胞を含むコラーゲンゲルを収縮させるコラーゲンゲル収縮剤であって、リンゴ抽出物及びコラーゲントリペプチドを有効成分とする美容飲料。
【解決手段】コラーゲンおよび線維芽細胞を含むコラーゲンゲルを収縮させるコラーゲンゲル収縮剤であって、リンゴ抽出物及びコラーゲントリペプチドを有効成分とする美容飲料。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、皮膚改善美容用飲料に関する。
【背景技術】
【0002】
近年、真皮組織モデルとして、コラーゲン入りの飲料が注目されている。
本出願人は、特許文献1(特許第4388289号公報)として、ゼラチン分解物、大豆由来のサポニン、大豆イソフラボン、セラミド、グルコサミンとアルコールとを含有する飲料と大豆胚芽エキスを含有する外用剤からなる皮膚老化防止・改善及び/又は肌荒れ防止・改善キットを提案した。
特許文献2(特許第4506880号)には、コラーゲンペプチド、酵母エキス、植物由来カテキン、タンニン及びゆずポリフェノールからなる群より選ばれる1種類以上、かつ寒天分解物を乳酸菌で発酵させて得られた発酵組成物を含有することを特徴とする美容飲料が開示されている。
特許文献3(特許第4505322号公報)には、魚臭がマスキングされて良好な風味と食感を有しており、美容健康食品である魚類由来コラーゲンペプチドが高濃度で含有されているゼリー飲料が開示されている。
特許文献4(特許第4057163号公報)には、クマザサとコラーゲンペプチドを含有することを特徴とする飲料が開示されている。
特許文献5(特開2002−27957号公報)には、茶、ブドウまたはリンゴ由来の植物ポリフェノールとコラーゲンを含む液体にペクチンを添加することにより、植物ポリフェノールと水溶性タンパク質による白濁物質および/または沈澱物質の生成が抑制された液体組成物が開示されている。
特許文献6(特許第3802721号公報)において、Gly−Pro−Hypのアミノ酸配列を有するトリペプチドを含有する生体コラーゲン合成促進剤を本出願人は提案した。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】特許第4388289号公報
【特許文献2】特許第4506880号
【特許文献3】特許第4505322号公報
【特許文献4】特許第4057163号公報
【特許文献5】特開2002−027957号公報
【特許文献6】特許第3802721号公報
【発明の概要】
【発明が解決しようとする課題】
【0004】
本発明は、コラーゲン収縮能を有する美容性を高めたコラーゲン飲料を開発することを目的とする。
【課題を解決するための手段】
【0005】
本発明者らは、リンゴ抽出物にコラーゲン収縮能があることを知見し、さらにコラーゲントリペプチドとの併用によってコラーゲン収縮能を増強できることを見出して、本発明に至った。更に、研究を進めた結果、リンゴ抽出物とコラーゲントリペプチドとの併用によって、シワ形成抑制機能、DNA損傷抑制機能、角質層水分量保持機能、表皮肥厚抑制機能があることを知見した。
1.コラーゲンおよび線維芽細胞を含むコラーゲンゲルを収縮させるコラーゲンゲル収縮剤であって、リンゴ抽出物及びコラーゲントリペプチドを有効成分とする美容飲料。
2.リンゴ抽出物がリンゴ由来のポリフェノールであり、コラーゲントリペプチドの平均分子量が400以下のものを含有するコラーゲントリペプチドであることを特徴とする1.記載の美容飲料。
3.シワ形成抑制用美容飲料である1.又は2記載の美容飲料。
4.紫外線被曝によるシワ形成を抑制する3.記載のシワ形成抑制用美容飲料。
5.DNA損傷抑制用美容飲料である1.又は2記載の美容飲料。
6.紫外線被曝によるDNA損傷を抑制する5.記載のDNA損傷抑制用美容飲料。
7.角質層水分量保持用美容飲料である1.又は2記載の美容飲料。
8.紫外線被曝による角質層水分量の減少を抑制する7.記載の角質層水分量保持用美容飲料。
9.表皮肥厚抑制用美容飲料である1.又は2記載の美容飲料。
10.皮膚弾力性向上用美容飲料である1.又は2記載の美容飲料。
【発明の効果】
【0006】
本発明の美容飲料は、リンゴポリフェノールとコラーゲントリペプチドを併用することにより、低濃度領域でコラーゲンゲルを収縮する機能が顕著に向上することが認められた。更に、リンゴ抽出物とコラーゲントリペプチドを併用することにより、シワ形成抑制、DNA損傷抑制、角質層水分量保持、表皮肥厚抑制に効果があることが認められた。これらの機能は、特に、日光などに含まれる紫外線被曝を原因とする障害に対して、有効な効果である。
長期間の継続服用によって、皮膚の滑らかさや乾燥の改善が実感され、皮膚の弾力性の改善が認められ、ニキビの悪化や発症などの症状も抑制でき、化粧料ののりの改善も認められ、全体として美容用飲料に適している。
【図面の簡単な説明】
【0007】
【図1】リンゴポリフェノール添加による評価サンプルのコラーゲンゲル収縮率の結果を示すグラフ。
【図2】コラーゲントリペプチド添加による評価サンプルのコラーゲンゲル収縮率の結果を示すグラフ。
【図3】リンゴポリフェノールとコラーゲントリペプチド併用による評価サンプルのコラーゲンゲル収縮率の結果を示すグラフ。
【図4】シワ体積率を示すグラフ。
【図5】経皮水分蒸散量 TEWLを示すグラフ。
【図6】角質層水分量 SC hydrationを示すグラフ。
【図7】表皮厚を示すグラフ。
【図8】DNA傷害(8-OH dG)を示すグラフ。
【図9】PCNA(細胞増殖マーカー)を示すグラフ。
【図10】皮膚ヒドロキシプロリン(Hyp)を示すグラフ。
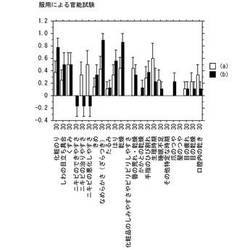
【図11】服用による官能試験結果を示すグラフ。
【図12(a)】皮膚の粘弾性を測定した結果を示すグラフ。
【図12(b)】皮膚の弾力性を測定した結果を示すグラフ。
【発明を実施するための形態】
【0008】
本発明者は、先にリンゴ抽出物に、コラーゲンゲル収縮作用があることを知見し、リンゴ抽出物を有効成分とするコラーゲンゲル収縮剤に関する特許出願(特願2009−83818号)を行った。本発明者は、さらに、リンゴ抽出物のコラーゲンゲル収縮作用について探求を続けた結果、コラーゲントリペプチドを併用することにより、飛躍的にコラーゲンゲル収縮作用が増強されることを見出した。
本願発明は、経口摂取できる美容飲料である。
本発明は、コラーゲンおよび線維芽細胞を含むコラーゲンゲルを収縮させる、コラーゲンゲル収縮作用を奏する。また、リンゴ抽出物とコラーゲントリペプチドとの併用成分を有効成分とする、シワ形成抑制用美容飲料、DNA損傷抑制用美容飲料、角質層水分量保持用美容飲料、表皮肥厚抑制用美容飲料である。
本発明は、コラーゲンおよび線維芽細胞を含むコラーゲンゲルを収縮させる。コラーゲンゲルの収縮とは、例えば、ゲルの大きさが小さくなることをいう。コラーゲンゲルの大きさの指標としては、特に制限されないが、例えば、コラーゲンゲルの直径、表面積、体積などが挙げられる。
また、リンゴ抽出物とコラーゲントリペプチドとの併用成分は、シワ形成抑制、DNA損傷抑制、角質層水分量保持、表皮肥厚抑制としても有効成分となる。特に、日光などに含まれる紫外線の被曝を原因とするシワ形成、DNA損傷、角質層水分量減少、表皮肥厚などの障害に対して抑制作用として有効に機能する。
長期間の服用によって、皮膚の乾燥が防止され、滑らかさが増進し、ニキビなどの吹き出物が抑えられて、皮膚外用剤である化粧料ののりが改善する美容用飲料である。
【0009】
<コラーゲンゲル>
本発明において、コラーゲンゲルは、収縮可能な形状であれば良く、ゲル状以外に、例えば、固形状であっても良い。
コラーゲンゲルに含まれるコラーゲンの種類は、特に制限されず、例えば、I型、II型、III型、IV型、V型コラーゲンなどが挙げられ、好ましくは、I型コラーゲンである。また、コラーゲンは、例えば、コラーゲンを加工処理したものであっても良い。加工処理としては、特に制限されないが、例えば、熱処理、酵素処理などが挙げられる。熱処理したコラーゲンとしては、例えば、ゼラチンなどが挙げられ、酵素処理したコラーゲンとしては、例えば、アテロコラーゲン、コラーゲンペプチドなどが挙げられる。コラーゲンゲル中の前記コラーゲン濃度は、特に制限されず、例えば、形状などに応じて、適宜設定可能である。
コラーゲンゲルにおいて、線維芽細胞の由来組織は、特に制限されず、例えば、皮膚、肺、心臓などが挙げられ、好ましくは、皮膚である。線維芽細胞の由来種は、特に制限されず、例えば、ヒト、ブタ、ウシ、ウサギ、ラット、マウスなどがあげられ、好ましくは、ヒトである。コラーゲンゲル中の線維芽細胞の細胞密度は、特に制限されず、適宜設定可能である。
コラーゲンゲルは、例えば、コラーゲンおよび線維芽細胞以外のその他成分を含んでも良い。その他成分としては、特に制限されず、例えば、培養液、血清などが挙げられる。
【0010】
<リンゴ抽出物>
リンゴ抽出物が、リンゴ果実の抽出物であるのが好ましい。特に、リンゴ幼果抽出物に含まれるポリフェノールを主成分とすることが好ましい。
リンゴ抽出物には、ポリフェノール、有機酸、アミノ酸などを含むことが知られている。
リンゴ抽出物は、血管機能改善作用を高めることが可能なBNP調節剤として抽出物を有効成分として含有してなるBNP調節剤、血行促進剤(特開2007−008837号公報、特開2006−265220号公報)や飲料(特開2004−305087号公報)、化粧料(特開2001−187724号公報)、消臭剤成分(特開平11−319051号公報)、香料成分(特開平08−023939号公報)などに用いられることが知られている。
しかしながら、リンゴ抽出物およびリンゴ由来のポリフェノールについて、コラーゲンゲル収縮効果は、未だ報告されていない。
【0011】
リンゴ抽出物において、リンゴ(Malus pumila)の品種は、例えば、ふじ、国光、王林、紅玉、ジョナゴールド、デリシャス、さんさ、千秋などが挙げられ、特に制限されない。リンゴの抽出部位は、特に制限されず、例えば、果実、葉、幹、花などが挙げられ、好ましくは、果実である。前記果実は、例えば、未熟果(幼果)でも良く、完熟果でも良く、特に制限されない。抽出に用いる前記果実の部位は、特に制限されず、例えば、全果、果肉、果皮、種などが挙げられる。リンゴ抽出物は、これらの部位を、単独で、または2種以上組み合わせて抽出しても良い。
【0012】
リンゴ抽出物を抽出する方法は、特に制限されず、従来公知の方法を採用できる。抽出方法の具体例としては、例えば、以下のようであっても良い。まず、リンゴの全果を、水洗後、グラインダーなどにより粉砕する。この粉砕物を、ペクチナーゼ処理に供し、遠心分離後、抽出溶媒により分配ろ過して、リンゴ抽出物を調製しても良い。前記ペクチナーゼ処理としては、特に制限されないが、例えば、20〜60℃の温度条件化で、ペクチナーゼを10〜50ppm添加して行っても良い。抽出溶媒としては、特に制限されないが、例えば、ヘキサン、クロロホルムなどの有機溶媒が挙げられる。
【0013】
リンゴ抽出物は、例えば、市販のリンゴ抽出物を用いても良く、リンゴ果実から抽出して調製しても良く、特に制限されない。
コラーゲンゲル収縮剤中に含まれるリンゴ抽出物含量は、特に制限されないが、例えば、0.001〜99重量%、好ましくは、0.001〜5重量%である。コラーゲンやゼラチンとの併用によって、コラーゲンゲル収縮能が飛躍的に向上するので、0.01以下で十分である。コラーゲンゲル収縮剤は、リンゴ由来のポリフェノールを含むリンゴ抽出物が好ましい。
【0014】
ポリフェノールの分画方法は、特に制限されず、従来公知の方法を採用できる。ポリフェノールは、例えば、リンゴ抽出物をカラムに通液後、カラムの吸着物を溶出し、この溶出画分を減圧留去濃縮して分画しても良い。また、さらに、この濃縮液に粉末助剤を添加し、凍結乾燥または噴霧乾燥して、ポリフェノール粉末を調製しても良い。
ポリフェノールは、例えば、市販のリンゴ由来のポリフェノール含有物を用いても良く、リンゴ果実から抽出および分画して調製しても良く、特に制限されない。本発明のコラーゲンゲル収縮剤中に含まれる前記ポリフェノール含量は、特に制限されないが、例えば、0.01〜99重量%、好ましくは、0.1〜50重量%である。
【0015】
<コラーゲントリペプチド>
リンゴ抽出物を併用するコラーゲントリペプチドは、平均分子量が400以下のものを含有するトリペプチドであり、通常一般のコラーゲンと称するものとは区別されるものである。さらに詳しくは、アミノ酸配列がGly−X−Y(X,Yはアミノ酸)であるペプタイドが好ましく、特に好ましくはアミノ酸配列がGly−Pro−Hypのものである。
本発明のコラーゲントリペプチドは、豚などの動物由来、魚由来いずれも使用可能である。
本発明のコラーゲントリペプチドは、主にコラーゲンを加水分解して製造することができる。コラーゲン加水分解物は、既に市販されているが、これらの酵素的に加水分解されたコラーゲンの多くは、分子量の分布範囲が二千から八万である。これらの加水分解物は水に対する分散性の向上を目的とするものである。
これに対して本発明のコラーゲン加水分解物は、特定の有効成分として分子量で約400以下のペプタイドを含むことを特徴とする。
添加量は、0.01%以上が好ましい。本試験系の試験ではコラーゲンゲルの収縮は80%程度が上限と想定されるので、コラーゲンゲルの収縮が70%程度以上は、添加濃度を増やしても増加効果は小さい。したがって、マイナスとなることは無いと言う意味では、上限は無いが、実質的には1.0%程度が上限となる。
【0016】
〔試験例1〕
<リンゴ抽出物に関するコラーゲンゲル収縮作用試験>
この試験では、コラーゲンゲル収縮剤として、リンゴ抽出物(商品名:アップルフェノンSH;アサヒフードアンドヘルスケア社製)を用い、以下のように、コラーゲンゲル収縮作用を測定した。
[材料]
(1)アテロコラーゲン(商品名:AteloCell、アテロコラーゲン(牛真皮由来)5mg/ml
(2)DMEM(粉末)(商品名:ダルベッコ変法イーグル培地(2)、日水)
(3)DMEM(液体)(商品名;Gibco)
[評価検体]
(1)リンゴ抽出物(リンゴポリフェノール)
商品名:アップルフェノンSH(アサヒフードアンド ヘルスケア(株)製)
規格;全ポリフェノール量98%以上(UV法)
【0017】
[試験方法]
予め継代培養した皮膚線維芽細胞(新生児由来)を細胞懸濁液(6×105cells/ml 溶媒10%FBS含有DMEM)として調整した。氷冷中でアテロコラーゲン(5mg/ml)4ml、3倍濃度DMEM(D-Glc1.2M含有およびアップルフェノンSH0.03%含有)2ml、FBS(牛血清)0.67ml、10%FBS含有DMEM 3.34ml及び細胞懸濁液2mlを混合し、平底1
2ウェルプレートに1mlずつ添加した。37℃5%CO2インキューベーターで培養し、5時間後にアテロコラーゲンが再線維化することでゲル化することを認めた。
添加から6時間後に滅菌したスパチュラの柄を用いてゲルをウェルプレートから剥がした後、10%FBS含有DMEM溶液1ml(0.5%、0.2%、0.1%HACP-01含有)を添加して、再び37℃5%CO2インキューベーターで7日間培養した。
培養液は1日おきに評価薬剤を任意の濃度に溶解させた10%FBS含有DMEM溶液1mlを培地交換した。培養終了後、培養液を完全に除去しPBSで洗浄後、10%中性ホルマリン溶液(Wako)で24時間浸潤しゲルを固定した。
その後、1%(w/v)Triton−X溶液に置換して、ゲル直径の計測を行った。
リンゴ抽出物(リンゴポリフェノール)は、ゲル形成後に添加した場合と、ゲル内包時に添加した場合の試験を行った。添加量は表1に記載したとおりである。
【0018】
表1に記載の添加濃度A1、A2、A3、A4の添加濃度はゲル形成後に添加する10%FBS含有DMEM溶液1ml中にリンゴ抽出物を添加させた数値を示している。
また、表1に記載の添加濃度B1、B2、B3はゲル内包時にリンゴ抽出物を添加したゲル容量1ml中の添加濃度を示している。すなわちゲル1mlを組成する各試料の容量は(1)アテロコラーゲン333.3μl、(2)1.2M D−グルコース含有3倍濃度DMEM166.7μl、(3)FBS(牛血清)55.8μl、(4)10%FBS含有DMEM277.5μl、(5)細胞懸濁液166.7μlから構成されており、評価検体のリンゴ抽出物は(2)3倍濃度DMEMの溶媒に対して、0.3%の濃度で調整したリンゴ抽出物含有1.2M D−グルコース含有3倍濃度DMEM溶液はゲル添加濃度として0.3%×(166.7μl/ゲル容量1ml)=0.05%のB1に示した添加濃度となる。同様に、B2およびB3の添加濃度はそれぞれ0.1%および0.03%のリンゴ抽出物含有1.2M D−グルコース含有3倍濃度DMEM溶液をそれぞれ調整してゲル内包時に添加したことで、それぞれB2→0.0167%、B3→0.005%の添加濃度としてコラーゲンゲル収縮率を求めた。
【0019】
[ゲル直径の計測およびゲル面積の算出]
ゲルの形状はウェルプレートと同様に真円状になることを利用してゲル面積を算出した。
上記処理方法によって調整したゲルを2方向について直径を計測し、2直線の平均値を算出した。そのゲル直径の平均値からゲル半径が算出され、ゲル面積は次の式で算出することができる。
ゲル面積=(ゲル半径 cm)×(ゲル半径 cm)×円周率
薬剤未処理のコラーゲンゲルのゲル面積に対する薬剤処理時のコラーゲンゲルのゲル面積の面積比からコラーゲンゲル収縮率(%)を算出した。
コラーゲンゲル収縮率(%)=100×{(薬剤未処理のゲル面積)−(薬剤処理時のゲル面積)}/(薬剤未処理のゲル面積)
一つのデータについてn=3ウェルで評価し、平均±標準偏差(mean±S.D.)でグラフ表記した。
【0020】
[試験結果]
表1及び図1に、リンゴ抽出物単独添加の試験例についてのコラーゲンゲル収縮率(%)の結果を示す。
リンゴ抽出物をゲル形成後に添加した場合もゲル内包時に添加した時もいずれの場合もコラーゲンゲル収縮能が濃度依存的に認められた。そして、0.005%(w/v)添加時のゲル収縮能はそれぞれ15.2±6.9%、16.3±6.5%で非常に近い値を示した。
【0021】
【表1】

【0022】
〔試験例2〕
<コラーゲントリペプチドに関するコラーゲンゲル収縮作用試験>
この試験では、コラーゲンゲル収縮剤として、コラーゲントリペプチドを用い、以下のように、コラーゲンゲル収縮作用を測定した。
[材料]
(1)アテロコラーゲン(商品名:AteloCell、アテロコラーゲン(牛真皮由来)5mg/ml(2)DMEM(粉末)(商品名:ダルベッコ変法イーグル培地(2)、日水)
(3)DMEM(液体)(商品名;Gibco)
[評価検体]
(2)コラーゲントリペプチド
商品名:HACP-01(ゼライス株式会社製)
規格; トリペプチド(G−X−Y;X、Yは任意のアミノ酸)を15%以上含有
【0023】
[試験方法]
予め継代培養した皮膚線維芽細胞(新生児由来)を細胞懸濁液(6×105cells/ml 溶媒10%FBS含有DMEM)として調整した。氷冷中でアテロコラーゲン(5mg/ml)4ml、3倍濃度DMEM(D-Glc1.2M含有およびアップルフェノンSH0.03%含有)2ml、FBS(牛血清)0.67ml、10%FBS含有DMEM 3.33ml及び細胞懸濁液2mlを混合し、平底12ウェルプレートに1mlずつ添加した。37℃5%CO2インキューベーターで培養し、5時間後にアテロコラーゲンが再線維化することでゲル化することを認めた。
添加から6時間後に滅菌したスパチュラの柄を用いてゲルをウェルプレートから剥がした後、10%FBS含有DMEM溶液1ml(0.5%、0.2%、0.1%HACP-01含有)を添加して、再び37℃5%CO2インキューベーターで7日間培養した。
培養液は1日おきに評価薬剤を任意の濃度に溶解させた10%FBS含有DMEM溶液1mlを培地交換した。培養終了後、培養液を完全に除去しPBSで洗浄後、10%中性ホルマリン溶液(Wako)で24時間浸潤しゲルを固定した。
その後、1%(w/v)Triton−X溶液に置換して、ゲル直径の計測を行った。
コラーゲントリペプチドは、ゲル形成後に添加した場合と、ゲル内包時に添加した場合の試験を行った。添加量は表2に記載したとおりである。
【0024】
表2に記載の添加濃度A1、A2、A3の添加濃度はゲル形成後に添加する10%FBS含有DMEM溶液1ml中にコラーゲントリペプチドを添加させた数値を示している。
また、表2に記載の添加濃度B1、B2、B3はゲル内包時にコラーゲントリペプチドを添加したゲル容量1ml中の添加濃度を示している。すなわちゲル1mlを組成する各試料の容量は(1)アテロコラーゲン333.3μl、(2)1.2M D−グルコース含有3倍濃度DMEM166.7μl、(3)FBS(牛血清)55.8μl、(4)10%FBS含有DMEM277.5μl、(5)細胞懸濁液166.7μlから構成されており、評価検体のコラーゲントリペプチドは(2)3倍濃度DMEMの溶媒に対して、6.0%の濃度で調整したコラーゲントリペプチド含有1.2M D−グルコース含有3倍濃度DMEM溶液はゲル添加濃度として0.3%×(166.7μl/ゲル容量1ml)=1.0%のB1に示した添加濃度となる。同様に、B2およびB3の添加濃度はそれぞれ3.0%および0.6%のコラーゲントリペプチド含有1.2M D−グルコース含有3倍濃度DMEM溶液をそれぞれ調整してゲル内包時に添加したことで、それぞれB2→0.0167%、B3→0.005%の添加濃度としてコラーゲンゲル収縮率を求めた。
【0025】
[ゲル直径の計測およびゲル面積の算出]
ゲルの形状はウェルプレートと同様に真円状になることを利用してゲル面積を算出した。図4に示すコラーゲンゲル収縮剤のコラーゲンゲル収縮状態を示した図を参照。
上記処理方法によって調整したゲルを2方向について直径を計測し、2直線の平均値を算出した。そのゲル直径の平均値からゲル半径が算出され、ゲル面積は次の式で算出することができる。
ゲル面積=(ゲル半径 cm)×(ゲル半径 cm)×円周率
薬剤未処理のコラーゲンゲルのゲル面積に対する薬剤処理時のコラーゲンゲルのゲル面積の面積比からコラーゲンゲル収縮率(%)を算出した。
コラーゲンゲル収縮率(%)=100×{(薬剤未処理のゲル面積)−(薬剤処理時のゲル面積)}/(薬剤未処理のゲル面積)
一つのデータについてn=3ウェルで評価し、平均±標準偏差(mean±S.D.)でグラフ表記した。
【0026】
[試験結果]
表2及び図2に、コラーゲントリペプチド単独添加の試験例についてのコラーゲンゲル収縮率(%)の結果を示す。
コラーゲントリペプチドをゲル形成後に添加した場合もゲル内包時に添加した時もいずれの場合もコラーゲンゲル収縮能が濃度依存的に認められた。そして、0.1%(w/v)添加時のゲル収縮能はそれぞれ20.1±1.0%、24.2±15.5%で非常に近い値を示した。
【0027】
【表2】

【実施例1】
【0028】
[リンゴポリフェノール、コラーゲントリペプチド併用例]
リンゴポリフェノールとコラーゲントリペプチド併用試験を前記試験方法と同様に行った。リンゴポリフェノールをゲル内包時に添加し、ゲル形成後にコラーゲントリペプチドを添加した。その結果を表3、図3に示す。
リンゴポリフェノールとしてアップルフェノンSHを用い、コラーゲントリペプチドとして分子量約400の豚由来コラーゲントリペプチド(製品名:HACP-01 ゼライス株式会社製)を用いた。
【0029】
【表3】

【0030】
試験例1は、リンゴ抽出物であるアップルフェノンSHを0.005%添加した例である。 試験例2はコラーゲントリペプチドであるHACP-01を0.1%添加した例である。
実施例1は、試験例1と試験例2を併用した例である。
実施例1は、想定される相加効果である参考に比べても顕著な効果を発揮することが分かる。
この結果、実施例1は、いずれも単独使用よりも格段にコラーゲンゲルを収縮させる作用を果たすことが確認された。また、単純に想定される相加数字である参考と比較しても顕著な効果を示し、これは、予想し得ない効果である。
【実施例2】
【0031】
[光老化抑制試験]
前記試験において、コラーゲンおよび線維芽細胞を含むコラーゲンゲルを収縮させるin vitroの試験系を用いて、リンゴ抽出物及びコラーゲントリペプチド併用することによりコラーゲンゲル収縮を相乗的に促進させる事を確認した。
長期間太陽(紫外線)に当たり続けると、顔、首筋の深いシワを増加させ、更に皮膚の乾燥及び肌荒れやシミ、ソバカス等の色素沈着を起こすことが知られており、この光老化による肌のトラブル対策として、新たに知見したリンゴ抽出物及びコラーゲントリペプチド併用が有するコラーゲン収縮能の活用試験を行った。すなわち、皮膚老化や皮膚の光老化現象を緩和、予防、抑制、改善する成分として、ポリフェノールを主成分とするリンゴ抽出物に着目して、試験を行った。
【0032】
<試験方法>
UVA波およびUVB波をヘアレスマウスに照射させてシワを形成させる試験系において被験物質であるそれぞれの食品原料を経口摂取させてシワの抑制および皮膚老化抑制効果について検討を行った。
試験開始時6週齢のヘアレスマウス(Hos:HR−1雌)を用いて以下の1)〜11)の条件・方法で試験を行った。
【0033】
1)試験対象物の調製および投与
ヘアレスマウスの群分けは投与開始日に、一般状態が良好な動物を体重により、群間での差が無いように1群6匹に振り分けた。なお、試験群5の「2者併用混餌」の群についてはn=5で評価し、各群の個体は1ゲージ/群で飼育とした。
マウス用飼料MF(オリエンタルバイオサービス製)に、表4に示すそれぞれ被験物質が均一混ざるように混合処理を施し、混餌にて自由摂取させた。投与群の一覧を示す。混餌は動物搬入直後から解剖18時間前まで実施した。
(1)リンゴ抽出物として、ポマクティブHFV(フランスのヴァル・デ・ヴィル・バイオアクティブズ社(VVB社)製(日本代理店 ユニテックフーズ))を用いた。ポマクティブHFVは、フランス産シードル用リンゴを原料にしたリンゴポリフェノール製品。規格成分は全ポリフェノール90%以上(UV法で算出)である。プロシアニジン、ケルセチン(配糖体)、フロリジン、カテキン類を主成分とする。
(2)コラーゲントリペプチド原料としてHACP−01を用いた。
HACP−01(コラーゲントリペプチド原料)は、豚由来のコラーゲンを原料とし、ゼライス社が製造販売しているコラーゲントリペプチドである。
このコラーゲントリペプチドは、平均分子量が400以下のものを含有するトリペプチドであり、通常一般のコラーゲンと称するものとは区別されるものである。さらに詳しくは、アミノ酸配列がGly−X−Y(X,Yはアミノ酸)であるペプタイドが好ましく、特に好ましくはアミノ酸配列がGly−Pro−Hypのものである。
コラーゲンペプチドは、豚などの動物由来、魚由来いずれも使用可能である。コラーゲントリペプチドは、主にコラーゲンを加水分解して製造することができる。コラーゲン加水分解物は、既に市販されているが、これらの酵素的に加水分解されたコラーゲンの多くは、分子量の分布範囲が2千から8万である。これらの加水分解物は水に対する分散性の向上を目的とするものである。
これに対してゼライス製のコラーゲン加水分解物HACP−01は、特定の有効成分として分子量で約400以下のペプタイドを含むことを特徴とする。
【0034】
【表4】

【0035】
2)UV照射(表4;試験概要)
UV照射時は、動物を専用のケージに移し、1群ずつUVB20mJ/cm2およびUVA10J/cm2を照射した。照射は週三回の月曜、水曜、金曜で10週間実施した。
3)経皮水分蒸散量(TEWL)の測定
経皮水分蒸散量の測定は、vapometer(キーストンサイエンティフィック製)を用い、背部の尾付け根より首に向かい2cm、腰椎から右側に0.5cm部位に端末をあてて測定した。測定日は、試験開始日に実施し各群のTEWL値にバラつきが無い事を確認し、その後、解剖直前に測定した。
4)角質層水分量の測定
角質層水分量の測定は、MoistureCheckerMY−808S(SCALAR 製)を用い、背部の尾付け根より首に向かい2cm、腰椎から右側に0.5cm部位に端末をあてて測定した。
5)解剖
各群、本飼育期間終了翌日より18時間絶食後、氷冷したAvertin(2,2,2−トリブロモエタノール)を0.5mg/kg体重腹腔内投与により麻酔を導入した。その後、皮膚背部の尾付け根より首に向かい2cm、腰椎から右側に0.5cm部位範囲で反射型レプリカ((有)アサヒバイオメッド製)を採取した。その後、開腹し解剖を行った。皮膚組織は10%中性ホルマリン浸潤、パラフィン包埋後にヘマトキシリン−エオシン染色した。
6)皮膚形態観察およびシワ体積率計測
皮膚表面部の写真撮影と採取したレプリカの判定を行った。シワ形成度合を指標としてASA−03RXD((有)アサヒバイオメッド製)を用いてシワ体積率%(μm3/mm2/100) を算出した。
7)表皮肥厚
「5)解剖」の項で実施した皮膚組織のヘマトキシリン−エオシン染色により、表皮の厚さを計測した。同一染色画像500μm中から任意に6箇所を選択し、それぞれの場所における表皮の厚さを計測し、その6点の平均値をその個体の表皮の厚さとした。
【0036】
8)8−ヒドロキシ−2’−デオキシグアノシン(8−OH dG)測定
免疫組織染色によりDNA損傷のバイオマーカーである8−OH dGの測定を表皮細胞に着目して実施した。
「5)解剖」の項で用意したパラフィン包埋済みの皮膚組織を5μm厚で切片を適宜作製し、脱パラフィン、親水化は公知の方法に基づいて実施した。抗原賦活化は0.01Mクエン酸緩衝液(pH6.0)沸騰中でマイクロウェーブ処理5分を実施した。室温まで冷却後、常温下0.3%過酸化水素含有メタノールで30分反応させて内因性ペルオキシダーゼを阻害した。水洗、10mMPBS(−)洗浄後、ウサギ血清75倍(希釈溶液はPBS(−))で30分間室温放置してブロッキング反応を行った。血清をスライドガラスから落として1次抗体(N45.1:日研ザイル(株)製)を5μg/mlで4℃1晩放置して1次抗体を反応させた。PBS(−)で2回洗浄し、ビオチン化二次抗体(ビオチン化ウサギ免疫グロブリンM;DAKO製)を300倍希釈したものを30分間室温にて2次抗体を反応させた。PBS(−)で2回洗浄し、ABC試薬(ABC−HRP;Vectastain製)を30分間室温にて反応させた。発色試薬としてDAB(3,3-ジアミノベンジジンテトラヒドロクロライド:DAKO製)を用いて3分30秒常温下で反応させた。水洗後、公知の方法に基づいて脱水、封入処理を行った。顕微鏡下で皮膚組織の染色状況を観察し、以下の基準に基づいてスコア化した。スコア化の判別が困難なものはその中間値0.5を足し、各群のスコアを算出した。
【0037】
スコア
×;スコア3;表皮細胞よりも上層の細胞核が何層にも染色
△;スコア2;表皮細胞よりも上層の細胞核が染色
○;スコア1;表皮細胞の細胞核が染色
◎;スコア0; 表皮細胞の細胞核が点在する程度の染色
【0038】
9)Proliferation Cell Nuclear Antigen(PCNA;増殖細胞核抗原)測定
PCNAは細胞周期の細胞成長期後期からDNA合成期初期で発現が認められる核タンパク質であり、DNA損傷時にDNAポリメラーゼやRFC(複製因子C;クランプ装着因子)と複合体を形成し、新しくDNAを合成・修復する。しかしながら、微弱な紫外線の連続照射といった常時PCNAが発現している環境においては細胞周期が異常になり、引き続いて細胞増殖が過剰となり表皮細胞のターンオーバーが亢進して、角化不全や表皮肥厚を招き、最終的には光老化現象を引き起こすと考えられる。
免疫組織染色により細胞増殖のバイオマーカーであるPCNAの測定を表皮細胞に着目して実施した。
「5)解剖」の項で用意したパラフィン包埋済みの皮膚組織を5μm厚で切片を適宜作製し、脱パラフィン、親水化は公知の方法に基づいて実施した。抗原賦活化は0.01Mクエン酸緩衝液(pH6.0)沸騰中でマイクロウェーブ処理5分間を実施した。室温まで冷却後、常温下0.3%過酸化水素含有メタノールで30分反応させて内因性ペルオキシダーゼを阻害した。水洗、PBS(−)洗浄後、ウサギ血清75倍(希釈溶液はPBS(−))で30分間室温放置してブロッキング反応を行った。血清をスライドガラスから落として1次抗体(PC−10:Santa Cruz製)を1μg/mlで4℃1晩放置して1次抗体を反応させた。PBS(−)で2回洗浄し、ビオチン化二次抗体(ビオチ・BR>悼サウサギ免疫グロブリンM;DAKO製)を300倍希釈したものを30分間室温にて2次抗体を反応させた。PBS(−)で2回洗浄し、ABC試薬(ABC−HRP;Vectastain製)を30分間室温にて反応させた。発色試薬としてDAB(3,3-ジアミノベンジジンテトラヒドロクロライド:DAKO製)を用いて3分30秒常温下で反応させた。水洗後、公知の方法に基づいて脱水、封入処理を行った。顕微鏡下で皮膚組織の染色状況を観察し、以下の基準に基づいてスコア化した。スコア化の判別が困難なものはその中間値0.5を足し、各群のスコアを算出した。
【0039】
スコア
×;スコア3;表皮細胞よりも上層の細胞核が何層にも染色
△;スコア2;表皮細胞よりも上層の細胞核が染色
○;スコア1;表皮細胞の細胞核が染色
◎;スコア0; 表皮細胞の細胞核が点在する程度の染色
【0040】
10)皮膚ヒドロキシプロリン(Hyp)
皮膚タンパク質を塩酸加水分解し、LC/MS/MSによりヒドロキシプロリン量を測定した。
「5)解剖」の項で凍結保存しておいたマウス皮膚からコラーゲン測定用に10mgを切り出した。その皮膚片を鋏で細かく切りスクリューキャップ付の試験管に入れた後、6N 塩酸1mlを加え、110℃で24時間酸加水分解した。反応溶液をMilliQ水で50倍に希釈した後に、フィルターろ過(φ=0.45mm)し、更に、MilliQ水で100倍希釈したものをヒドロキシプロリン測定用のサンプルとした。
ヒドロキシプロリンはLC/MS/MSシステムのACQUITY(R) TQD(Waters)を使用して測定した。
LC条件
・カラム HSS T3 2.1X100mm(Waters製)
・流速 0.4mL/min
・カラム温度 50℃
・移動相 A:0.1%ギ酸
B:0.1%ギ酸、80%アセトニトリル
・グラジエント
【0041】
【表5】

【0042】
MS/MS条件
・イオン化 ESI+(Positive)
・キャピラリー電圧 0.5kV
・脱溶媒ガス 1,000L/Hr
・コーンガス 50L/Hr
・イオン源ヒーター 150℃
・モニター MRM
・プリカーサーイオン(m/z) 132.16
・プロダクトイオン(m/z) 86.1
・Dwell時間(秒) 0.05
・コーン電圧(V) 28
・コリジョンエネルギー(eV) 12
標準品のヒドロキシプロリン(Wako製)とのピークエリアを比較する事で皮膚コラーゲン中のヒドロキシプロリン量(Hyp)を算出した。
【0043】
11)統計処理
試験結果は平均値±標準偏差(mean ± S.D.)で表し、多重比較(Steel’s test)をエクセル統計2008の解析ソフトで有意差検定を行った。**⇒p<0.01、*⇒p<0.05とし、p<0.1については有意傾向として注意書きした。
【0044】
<試験結果>
以下に、本実施例2の各試験例の結果を順次示す。
1.一般状態観察およびシワ体積率計測
紫外線照射第4週目頃よりUV照射動物において、頭部の皮膚の軽度褐色化や頸部のしわの深さならびに後肢背部のしわがUV非照射動物に比較して目立つようになった。
解剖時の外観観察では、UV照射動物で顔、頸部および後肢背部のしわが明瞭に確認されたが、UV照射においても2者併用混餌(ポマクティブHFV 0.006%およびHACP−01 0.5%混餌)したマウスにおいてその症状は軽度であり、2者併用混餌群ではしわの深度が浅く、肉眼的にはしわの程度が皆無であった。また、高濃度摂取動物は、コントロール群に比較して皮膚にしっとり感があった。
表6、図4のシワ体積率のグラフが示すように、紫外線照射により明確なシワの形成が認められ、同一紫外線照射条件下で 混餌群では濃度依存的にシワ抑制効果が有意に認められた。一方、リンゴ混餌群およびコラーゲントリペプチド混餌群ではシワの抑制効果は極僅かなものであり、有意差検定により、UV+群との有意なシワ体積率の抑制は認められなかった。一方、2者併用混餌群でのみ有意にシワ体積率を抑制した。
2.体重推移
表6に示すように体重推移は、各群大きな差異は認められなかった。
3.摂餌量
表6に示すように摂餌量についても体重推移同様に大きな差異は認められなかった。摂食量は、体重増加が緩慢になった紫外線照射6週間から10週間における平均値から算出した。この摂取量は、ヒトが無理なく摂取できる量で光老化現象に伴うシワを抑制する事が出来ると考えられる。
4.肝臓重量
肝臓重量についても大きな差異は認められず異常な症状は観察されなかった。また、他の臓器についても異常は認められなかった。
5.経皮水分蒸散量(TEWL)
結果を表6に示す。
経皮水分蒸散量はその数値が高いほど、角質層から水分が蒸発し皮膚の乾燥状態を引き起こしていると考えられる。UV照射により経皮水分蒸散量の上昇が一般的に知られており、本試験でも解剖日の経皮水分蒸散量はUV−群に比較してUV+群では高くなり乾燥状態を裏付けていた。この時、UV+照射およびポマクティブHFV混餌群は低いTEWL値を示した。UV+照射群に比較してUV−群、リンゴ混餌群および2者併用群で有意に低いTEWL値を示した。コラーゲントリペプチド混餌群では有意傾向(p=0.0987)として低いTEWL値を示した。
【0045】
【表6】

【0046】
6.角質層水分量
結果を表7に示す。
角質層水分量はその数値が低いほど、角質層の水分もしくは水分保持に関わる天然保湿因子(Natural Moisturizing Factor;NMF)が減少し、皮膚の乾燥状態を引き起こしていると考えられる。UV照射により角質層水分量が減少すると一般的に知られており、本試験でも解剖日の角質層水分量は[UV−/コントロール食]群に比較して[UV+/コントロール食]群では低くなり乾燥状態を裏付けていた。この時、リンゴ混餌群は角質層水分量の回復を示した。UV+照射群に比較してリンゴ混餌群および2者併用群で有意に高い角質水分量を示した。
7.表皮肥厚
結果を表7に示す。
[UV+/コントロール食]群に対し、[UV−/コントロール食]群、コラーゲントリペプチド混餌群および2者併用群で有意な表皮肥厚(アカントーシス)の抑制が証明された。また、0.006%混餌群では有意傾向(p=0.0831)として表皮肥厚が抑制されていた。
8.8−OHdG
結果を表7に示す。
[UV+/コントロール食]群に対し、[UV−/コントロール食]群、2者併用群で有意に8−OHdGを抑制した。一方、リンゴ混餌群では8−OHdGを抑制しなかった。また、コラーゲントリペプチド混餌群では有意傾向(p=0.0596)として8−OHdGを抑制した。
8−OHdGは細胞のDNA損傷の指標の一つであり、紫外線や放射線、化学汚染物質、タバコ煙など酸化ストレスの暴露によりDNAのグアニンが酸化されて形成する。本試験での紫外線照射によりマウス皮膚の基底細胞層に8−OHdGが増加していたのでDNA損傷が引き起こされた事およびリンゴとコラーゲントリペプチドの2者併用混餌群ではそのDNA損傷が抑制されていた事を示唆している。
9.PCNA
結果を表7に示す。
[UV+/コントロール食]群に対し、[UV−/コントロール食]群、リンゴ混餌群および2者併用群で有意にPCNAを抑制した。コラーゲントリペプチド混餌群では有意傾向(p=0.0645)としてPCNAの発現が抑制された。
PCNAは細胞増殖や細胞周期の指標の一つであり、細胞成長期後期〜DNA合成期初期で発現増強し、DNAポリメラーゼや複製因子C(RFC)などと複合体を形成してDNA損傷部位の切り出しと新たなDNAの合成や修復を行う核タンパク質である。本試験において、紫外線照射で過剰に増加したDNA傷害を正常状態に修復するためにPCNAが過剰発現しDNAが過剰に合成され表皮基底細胞の細胞周期異常を招き、引き続き基底細胞の増殖過剰が表皮のターンオーバー異常へとつながり、最終的には表皮の肥厚や皮膚外観のシワを引き起こしたと考えられる。このPCNAの過剰発現をリンゴとコラーゲントリペプチド2者併用混餌群で有意に抑制した事は、リンゴとコラーゲントリペプチド2者併用により未然に紫外線ダメージを緩和してシワ形成抑制や表皮肥厚抑制へと導いたと示唆される。
10. 皮膚ヒドロキシプロリン(Hyp)
結果を表7に示す。
[UV+/コントロール食]群に対し、2者併用群で有意傾向(p=0.0938)なHypの上昇が認められた。Hyp上昇は皮膚組織におけるコラーゲン量の増加を示唆している。
【0047】
【表7】

【0048】
上記各動物実験を総括すると、各試験において、リンゴ抽出物とコラーゲントリペプチドとの2者併用が効果を発揮することが確認できた。
特に、シワ体積率、8−OHdG の2項目が紫外線照射条件においても2者併用群でのみ有意に抑制することが確認され、リンゴ抽出物とコラーゲントリペプチドとの2者併用効果を発揮した。
その他、TEWL、角質層水分量、表皮厚においても2者併用群で有意に紫外線ダメージの影響を緩和・抑制しており、皮膚組織中のHypも2者併用群でのみ有意傾向として上昇を示した事も2者併用の有用性を示唆している。
本出願人は、添加量を変えてポマクティブHFVのみを混餌した試験を本試験同内容について別途行った。添加量は0.006重量%、0.012重量%、0.060重量%の3種類とした。この試験結果、濃度依存的に作用効果を発揮することが確認されている。例えば、シワ体積率を参考に示すと、それぞれの添加量応じて、31.1%、13.4%、9.0%である。コントロール食のUV有無の結果は、本試験例と同じである。本試験例では、リンゴ抽出物0.006重量%とコラーゲントリペプチド0.5重量%との2者併用は、12.0%のシワ体積率を示していることは、低濃度添加において、顕著なシワ形成抑制能を発揮することが確認できる。このように、リンゴ抽出物とコラーゲントリペプチドとの2者併用は、低濃度でも顕著な相乗作用を発揮する。
【実施例3】
【0049】
リンゴ抽出物(実施例2と同様)とコラーゲントリペプチド(実施例2と同様)とを混合した飲料の連日経口摂取による健常者の肌状態に及ぼす有効性の確認試験を行った。
1.試験方法
試験デザイン:並行群間二重盲検法
被験者数:20名(各群10名)、30代以上の健常女性
摂取期間:30日間
摂取量 :ドリンク1日1本50ml 就寝前の摂取推奨
調査時期:摂取前、10日後、30日後
調査方法:直前、試験開始後10日、30日
【0050】
2.試験品
(a)コラーゲントリペプチド配合飲料 50ml/1本
トリペプチド含有コラーゲンペプチド :2600mg、
セラミド : 600μg、
ビタミンC : 250mg、
ハスカップエキス : 15mg、
コエンザイムQ10 : 1mg、
ビタミンE(α-トコフェロールとして) : 2mg、
ヒアルロン酸 : 1mg
(b)コラーゲントリペプチドとリンゴポリフェノール配合飲料 50ml/1本
抗老化素材として知られているハスカップエキスに代えて、リンゴポリフェノールを配合した。
トリペプチド高含有コラーゲンペプチド :2600mg、
リンゴポリフェノール : 83mg、
※リンゴポリフェノール原料は熱水抽出乾燥物
セラミド : 600μg、
ビタミンC : 250mg、
コエンザイムQ10 : 1mg、
ビタミンE(α-トコフェロールとして) : 2mg、
ヒアルロン酸 : 1mg
【0051】
3.試験期間の留意事項
1)試験期間中は暴飲暴食を避ける。
2)試験期間中は生活習慣を変えないようにする。
3)コラーゲンペプチド、大豆イソフラボン、ビタミンCなど特に美容を目的とした健康食品の摂取、エステティックなどの施術、新たな化粧品の使用は慎む。
【0052】
4.調査項目
1)問診票 :乾燥、化粧のり、はり、明るさ、やわらかさ、他
2)機器測定:弾力性
弾力性 :皮膚弾力キュートメーターMPA580 2回
測定部位:顔面右頬部
【0053】
5.試験結果
(1)問診票による試験結果を図11に示す。図11に示すデータは、試験前の状態と試験期間である30日経過後の状態についておこなったアンケートの回答をまとめたものである。回答種類は、それぞれの項目について、「1.改善した 2.変わらない 3.悪くなった 4.もともと気にならない」等の4項目からの選択とした。
自覚症状アンケートは改善したを+1、変わらないを0、悪くなったを−1とした。
この結果、コラーゲントリペプチドとリンゴポリフェノールを併用した(b)は、コラーゲントリペプチドを配合した(a)に比較して、皮膚のなめらかさ、乾燥、化粧のりなどにおいて、優れた改善効果が自覚されている。さらに、ニキビに関して、できやすさ、直りにくさ、悪化のしやすさについては、抑制効果があることが自覚されている。
したがって、継続的な服用によって、肌がうるおい、化粧ののりが良くなると共に、ニキビの発生、症状が抑制されることが期待できる。
【0054】
(2)皮膚弾力性の評価
キュートメーターMPA580(Courage+Khazaka Electronic Gmbh 社製)を用いて計測した皮膚の粘弾性と弾力性を計測した結果を図12(a)(b)に示した。皮膚粘弾性については、キュートメーターMPA580の計測パラメーターR0、皮膚弾力性についてはパラメーターR2を用いて評価した。計測は、試験開始前、試験開始後10日目、試験開始30日後(試験期間終了後)の3回測定した。表中aはコラーゲントリペプチドを配合した試飲料を示し、bはリンゴポリフェノールとコラーゲントリペプチドを配合した試飲料を示す。
図12(a)に示す、粘弾性については中間の10日摂取では、リンゴポリフェノールの有無による差は認められないが、30日間摂取では、リンゴポリフェノールとコラーゲントリペプチドを併用したサンプル(b)の改善効果が大きくなっている。
図12(b)に示す弾力性については、中間の10日摂取、30日摂取ともリンゴポリフェノールとコラーゲントリペプチドを併用したサンプル(b)の改善効果が大きくなっている。
したがって、長期継続摂取によって、サンプル(b)の方が皮膚の弾力性、ハリが改善することが機器計測によっても確認できた。
【技術分野】
【0001】
本発明は、皮膚改善美容用飲料に関する。
【背景技術】
【0002】
近年、真皮組織モデルとして、コラーゲン入りの飲料が注目されている。
本出願人は、特許文献1(特許第4388289号公報)として、ゼラチン分解物、大豆由来のサポニン、大豆イソフラボン、セラミド、グルコサミンとアルコールとを含有する飲料と大豆胚芽エキスを含有する外用剤からなる皮膚老化防止・改善及び/又は肌荒れ防止・改善キットを提案した。
特許文献2(特許第4506880号)には、コラーゲンペプチド、酵母エキス、植物由来カテキン、タンニン及びゆずポリフェノールからなる群より選ばれる1種類以上、かつ寒天分解物を乳酸菌で発酵させて得られた発酵組成物を含有することを特徴とする美容飲料が開示されている。
特許文献3(特許第4505322号公報)には、魚臭がマスキングされて良好な風味と食感を有しており、美容健康食品である魚類由来コラーゲンペプチドが高濃度で含有されているゼリー飲料が開示されている。
特許文献4(特許第4057163号公報)には、クマザサとコラーゲンペプチドを含有することを特徴とする飲料が開示されている。
特許文献5(特開2002−27957号公報)には、茶、ブドウまたはリンゴ由来の植物ポリフェノールとコラーゲンを含む液体にペクチンを添加することにより、植物ポリフェノールと水溶性タンパク質による白濁物質および/または沈澱物質の生成が抑制された液体組成物が開示されている。
特許文献6(特許第3802721号公報)において、Gly−Pro−Hypのアミノ酸配列を有するトリペプチドを含有する生体コラーゲン合成促進剤を本出願人は提案した。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】特許第4388289号公報
【特許文献2】特許第4506880号
【特許文献3】特許第4505322号公報
【特許文献4】特許第4057163号公報
【特許文献5】特開2002−027957号公報
【特許文献6】特許第3802721号公報
【発明の概要】
【発明が解決しようとする課題】
【0004】
本発明は、コラーゲン収縮能を有する美容性を高めたコラーゲン飲料を開発することを目的とする。
【課題を解決するための手段】
【0005】
本発明者らは、リンゴ抽出物にコラーゲン収縮能があることを知見し、さらにコラーゲントリペプチドとの併用によってコラーゲン収縮能を増強できることを見出して、本発明に至った。更に、研究を進めた結果、リンゴ抽出物とコラーゲントリペプチドとの併用によって、シワ形成抑制機能、DNA損傷抑制機能、角質層水分量保持機能、表皮肥厚抑制機能があることを知見した。
1.コラーゲンおよび線維芽細胞を含むコラーゲンゲルを収縮させるコラーゲンゲル収縮剤であって、リンゴ抽出物及びコラーゲントリペプチドを有効成分とする美容飲料。
2.リンゴ抽出物がリンゴ由来のポリフェノールであり、コラーゲントリペプチドの平均分子量が400以下のものを含有するコラーゲントリペプチドであることを特徴とする1.記載の美容飲料。
3.シワ形成抑制用美容飲料である1.又は2記載の美容飲料。
4.紫外線被曝によるシワ形成を抑制する3.記載のシワ形成抑制用美容飲料。
5.DNA損傷抑制用美容飲料である1.又は2記載の美容飲料。
6.紫外線被曝によるDNA損傷を抑制する5.記載のDNA損傷抑制用美容飲料。
7.角質層水分量保持用美容飲料である1.又は2記載の美容飲料。
8.紫外線被曝による角質層水分量の減少を抑制する7.記載の角質層水分量保持用美容飲料。
9.表皮肥厚抑制用美容飲料である1.又は2記載の美容飲料。
10.皮膚弾力性向上用美容飲料である1.又は2記載の美容飲料。
【発明の効果】
【0006】
本発明の美容飲料は、リンゴポリフェノールとコラーゲントリペプチドを併用することにより、低濃度領域でコラーゲンゲルを収縮する機能が顕著に向上することが認められた。更に、リンゴ抽出物とコラーゲントリペプチドを併用することにより、シワ形成抑制、DNA損傷抑制、角質層水分量保持、表皮肥厚抑制に効果があることが認められた。これらの機能は、特に、日光などに含まれる紫外線被曝を原因とする障害に対して、有効な効果である。
長期間の継続服用によって、皮膚の滑らかさや乾燥の改善が実感され、皮膚の弾力性の改善が認められ、ニキビの悪化や発症などの症状も抑制でき、化粧料ののりの改善も認められ、全体として美容用飲料に適している。
【図面の簡単な説明】
【0007】
【図1】リンゴポリフェノール添加による評価サンプルのコラーゲンゲル収縮率の結果を示すグラフ。
【図2】コラーゲントリペプチド添加による評価サンプルのコラーゲンゲル収縮率の結果を示すグラフ。
【図3】リンゴポリフェノールとコラーゲントリペプチド併用による評価サンプルのコラーゲンゲル収縮率の結果を示すグラフ。
【図4】シワ体積率を示すグラフ。
【図5】経皮水分蒸散量 TEWLを示すグラフ。
【図6】角質層水分量 SC hydrationを示すグラフ。
【図7】表皮厚を示すグラフ。
【図8】DNA傷害(8-OH dG)を示すグラフ。
【図9】PCNA(細胞増殖マーカー)を示すグラフ。
【図10】皮膚ヒドロキシプロリン(Hyp)を示すグラフ。
【図11】服用による官能試験結果を示すグラフ。
【図12(a)】皮膚の粘弾性を測定した結果を示すグラフ。
【図12(b)】皮膚の弾力性を測定した結果を示すグラフ。
【発明を実施するための形態】
【0008】
本発明者は、先にリンゴ抽出物に、コラーゲンゲル収縮作用があることを知見し、リンゴ抽出物を有効成分とするコラーゲンゲル収縮剤に関する特許出願(特願2009−83818号)を行った。本発明者は、さらに、リンゴ抽出物のコラーゲンゲル収縮作用について探求を続けた結果、コラーゲントリペプチドを併用することにより、飛躍的にコラーゲンゲル収縮作用が増強されることを見出した。
本願発明は、経口摂取できる美容飲料である。
本発明は、コラーゲンおよび線維芽細胞を含むコラーゲンゲルを収縮させる、コラーゲンゲル収縮作用を奏する。また、リンゴ抽出物とコラーゲントリペプチドとの併用成分を有効成分とする、シワ形成抑制用美容飲料、DNA損傷抑制用美容飲料、角質層水分量保持用美容飲料、表皮肥厚抑制用美容飲料である。
本発明は、コラーゲンおよび線維芽細胞を含むコラーゲンゲルを収縮させる。コラーゲンゲルの収縮とは、例えば、ゲルの大きさが小さくなることをいう。コラーゲンゲルの大きさの指標としては、特に制限されないが、例えば、コラーゲンゲルの直径、表面積、体積などが挙げられる。
また、リンゴ抽出物とコラーゲントリペプチドとの併用成分は、シワ形成抑制、DNA損傷抑制、角質層水分量保持、表皮肥厚抑制としても有効成分となる。特に、日光などに含まれる紫外線の被曝を原因とするシワ形成、DNA損傷、角質層水分量減少、表皮肥厚などの障害に対して抑制作用として有効に機能する。
長期間の服用によって、皮膚の乾燥が防止され、滑らかさが増進し、ニキビなどの吹き出物が抑えられて、皮膚外用剤である化粧料ののりが改善する美容用飲料である。
【0009】
<コラーゲンゲル>
本発明において、コラーゲンゲルは、収縮可能な形状であれば良く、ゲル状以外に、例えば、固形状であっても良い。
コラーゲンゲルに含まれるコラーゲンの種類は、特に制限されず、例えば、I型、II型、III型、IV型、V型コラーゲンなどが挙げられ、好ましくは、I型コラーゲンである。また、コラーゲンは、例えば、コラーゲンを加工処理したものであっても良い。加工処理としては、特に制限されないが、例えば、熱処理、酵素処理などが挙げられる。熱処理したコラーゲンとしては、例えば、ゼラチンなどが挙げられ、酵素処理したコラーゲンとしては、例えば、アテロコラーゲン、コラーゲンペプチドなどが挙げられる。コラーゲンゲル中の前記コラーゲン濃度は、特に制限されず、例えば、形状などに応じて、適宜設定可能である。
コラーゲンゲルにおいて、線維芽細胞の由来組織は、特に制限されず、例えば、皮膚、肺、心臓などが挙げられ、好ましくは、皮膚である。線維芽細胞の由来種は、特に制限されず、例えば、ヒト、ブタ、ウシ、ウサギ、ラット、マウスなどがあげられ、好ましくは、ヒトである。コラーゲンゲル中の線維芽細胞の細胞密度は、特に制限されず、適宜設定可能である。
コラーゲンゲルは、例えば、コラーゲンおよび線維芽細胞以外のその他成分を含んでも良い。その他成分としては、特に制限されず、例えば、培養液、血清などが挙げられる。
【0010】
<リンゴ抽出物>
リンゴ抽出物が、リンゴ果実の抽出物であるのが好ましい。特に、リンゴ幼果抽出物に含まれるポリフェノールを主成分とすることが好ましい。
リンゴ抽出物には、ポリフェノール、有機酸、アミノ酸などを含むことが知られている。
リンゴ抽出物は、血管機能改善作用を高めることが可能なBNP調節剤として抽出物を有効成分として含有してなるBNP調節剤、血行促進剤(特開2007−008837号公報、特開2006−265220号公報)や飲料(特開2004−305087号公報)、化粧料(特開2001−187724号公報)、消臭剤成分(特開平11−319051号公報)、香料成分(特開平08−023939号公報)などに用いられることが知られている。
しかしながら、リンゴ抽出物およびリンゴ由来のポリフェノールについて、コラーゲンゲル収縮効果は、未だ報告されていない。
【0011】
リンゴ抽出物において、リンゴ(Malus pumila)の品種は、例えば、ふじ、国光、王林、紅玉、ジョナゴールド、デリシャス、さんさ、千秋などが挙げられ、特に制限されない。リンゴの抽出部位は、特に制限されず、例えば、果実、葉、幹、花などが挙げられ、好ましくは、果実である。前記果実は、例えば、未熟果(幼果)でも良く、完熟果でも良く、特に制限されない。抽出に用いる前記果実の部位は、特に制限されず、例えば、全果、果肉、果皮、種などが挙げられる。リンゴ抽出物は、これらの部位を、単独で、または2種以上組み合わせて抽出しても良い。
【0012】
リンゴ抽出物を抽出する方法は、特に制限されず、従来公知の方法を採用できる。抽出方法の具体例としては、例えば、以下のようであっても良い。まず、リンゴの全果を、水洗後、グラインダーなどにより粉砕する。この粉砕物を、ペクチナーゼ処理に供し、遠心分離後、抽出溶媒により分配ろ過して、リンゴ抽出物を調製しても良い。前記ペクチナーゼ処理としては、特に制限されないが、例えば、20〜60℃の温度条件化で、ペクチナーゼを10〜50ppm添加して行っても良い。抽出溶媒としては、特に制限されないが、例えば、ヘキサン、クロロホルムなどの有機溶媒が挙げられる。
【0013】
リンゴ抽出物は、例えば、市販のリンゴ抽出物を用いても良く、リンゴ果実から抽出して調製しても良く、特に制限されない。
コラーゲンゲル収縮剤中に含まれるリンゴ抽出物含量は、特に制限されないが、例えば、0.001〜99重量%、好ましくは、0.001〜5重量%である。コラーゲンやゼラチンとの併用によって、コラーゲンゲル収縮能が飛躍的に向上するので、0.01以下で十分である。コラーゲンゲル収縮剤は、リンゴ由来のポリフェノールを含むリンゴ抽出物が好ましい。
【0014】
ポリフェノールの分画方法は、特に制限されず、従来公知の方法を採用できる。ポリフェノールは、例えば、リンゴ抽出物をカラムに通液後、カラムの吸着物を溶出し、この溶出画分を減圧留去濃縮して分画しても良い。また、さらに、この濃縮液に粉末助剤を添加し、凍結乾燥または噴霧乾燥して、ポリフェノール粉末を調製しても良い。
ポリフェノールは、例えば、市販のリンゴ由来のポリフェノール含有物を用いても良く、リンゴ果実から抽出および分画して調製しても良く、特に制限されない。本発明のコラーゲンゲル収縮剤中に含まれる前記ポリフェノール含量は、特に制限されないが、例えば、0.01〜99重量%、好ましくは、0.1〜50重量%である。
【0015】
<コラーゲントリペプチド>
リンゴ抽出物を併用するコラーゲントリペプチドは、平均分子量が400以下のものを含有するトリペプチドであり、通常一般のコラーゲンと称するものとは区別されるものである。さらに詳しくは、アミノ酸配列がGly−X−Y(X,Yはアミノ酸)であるペプタイドが好ましく、特に好ましくはアミノ酸配列がGly−Pro−Hypのものである。
本発明のコラーゲントリペプチドは、豚などの動物由来、魚由来いずれも使用可能である。
本発明のコラーゲントリペプチドは、主にコラーゲンを加水分解して製造することができる。コラーゲン加水分解物は、既に市販されているが、これらの酵素的に加水分解されたコラーゲンの多くは、分子量の分布範囲が二千から八万である。これらの加水分解物は水に対する分散性の向上を目的とするものである。
これに対して本発明のコラーゲン加水分解物は、特定の有効成分として分子量で約400以下のペプタイドを含むことを特徴とする。
添加量は、0.01%以上が好ましい。本試験系の試験ではコラーゲンゲルの収縮は80%程度が上限と想定されるので、コラーゲンゲルの収縮が70%程度以上は、添加濃度を増やしても増加効果は小さい。したがって、マイナスとなることは無いと言う意味では、上限は無いが、実質的には1.0%程度が上限となる。
【0016】
〔試験例1〕
<リンゴ抽出物に関するコラーゲンゲル収縮作用試験>
この試験では、コラーゲンゲル収縮剤として、リンゴ抽出物(商品名:アップルフェノンSH;アサヒフードアンドヘルスケア社製)を用い、以下のように、コラーゲンゲル収縮作用を測定した。
[材料]
(1)アテロコラーゲン(商品名:AteloCell、アテロコラーゲン(牛真皮由来)5mg/ml
(2)DMEM(粉末)(商品名:ダルベッコ変法イーグル培地(2)、日水)
(3)DMEM(液体)(商品名;Gibco)
[評価検体]
(1)リンゴ抽出物(リンゴポリフェノール)
商品名:アップルフェノンSH(アサヒフードアンド ヘルスケア(株)製)
規格;全ポリフェノール量98%以上(UV法)
【0017】
[試験方法]
予め継代培養した皮膚線維芽細胞(新生児由来)を細胞懸濁液(6×105cells/ml 溶媒10%FBS含有DMEM)として調整した。氷冷中でアテロコラーゲン(5mg/ml)4ml、3倍濃度DMEM(D-Glc1.2M含有およびアップルフェノンSH0.03%含有)2ml、FBS(牛血清)0.67ml、10%FBS含有DMEM 3.34ml及び細胞懸濁液2mlを混合し、平底1
2ウェルプレートに1mlずつ添加した。37℃5%CO2インキューベーターで培養し、5時間後にアテロコラーゲンが再線維化することでゲル化することを認めた。
添加から6時間後に滅菌したスパチュラの柄を用いてゲルをウェルプレートから剥がした後、10%FBS含有DMEM溶液1ml(0.5%、0.2%、0.1%HACP-01含有)を添加して、再び37℃5%CO2インキューベーターで7日間培養した。
培養液は1日おきに評価薬剤を任意の濃度に溶解させた10%FBS含有DMEM溶液1mlを培地交換した。培養終了後、培養液を完全に除去しPBSで洗浄後、10%中性ホルマリン溶液(Wako)で24時間浸潤しゲルを固定した。
その後、1%(w/v)Triton−X溶液に置換して、ゲル直径の計測を行った。
リンゴ抽出物(リンゴポリフェノール)は、ゲル形成後に添加した場合と、ゲル内包時に添加した場合の試験を行った。添加量は表1に記載したとおりである。
【0018】
表1に記載の添加濃度A1、A2、A3、A4の添加濃度はゲル形成後に添加する10%FBS含有DMEM溶液1ml中にリンゴ抽出物を添加させた数値を示している。
また、表1に記載の添加濃度B1、B2、B3はゲル内包時にリンゴ抽出物を添加したゲル容量1ml中の添加濃度を示している。すなわちゲル1mlを組成する各試料の容量は(1)アテロコラーゲン333.3μl、(2)1.2M D−グルコース含有3倍濃度DMEM166.7μl、(3)FBS(牛血清)55.8μl、(4)10%FBS含有DMEM277.5μl、(5)細胞懸濁液166.7μlから構成されており、評価検体のリンゴ抽出物は(2)3倍濃度DMEMの溶媒に対して、0.3%の濃度で調整したリンゴ抽出物含有1.2M D−グルコース含有3倍濃度DMEM溶液はゲル添加濃度として0.3%×(166.7μl/ゲル容量1ml)=0.05%のB1に示した添加濃度となる。同様に、B2およびB3の添加濃度はそれぞれ0.1%および0.03%のリンゴ抽出物含有1.2M D−グルコース含有3倍濃度DMEM溶液をそれぞれ調整してゲル内包時に添加したことで、それぞれB2→0.0167%、B3→0.005%の添加濃度としてコラーゲンゲル収縮率を求めた。
【0019】
[ゲル直径の計測およびゲル面積の算出]
ゲルの形状はウェルプレートと同様に真円状になることを利用してゲル面積を算出した。
上記処理方法によって調整したゲルを2方向について直径を計測し、2直線の平均値を算出した。そのゲル直径の平均値からゲル半径が算出され、ゲル面積は次の式で算出することができる。
ゲル面積=(ゲル半径 cm)×(ゲル半径 cm)×円周率
薬剤未処理のコラーゲンゲルのゲル面積に対する薬剤処理時のコラーゲンゲルのゲル面積の面積比からコラーゲンゲル収縮率(%)を算出した。
コラーゲンゲル収縮率(%)=100×{(薬剤未処理のゲル面積)−(薬剤処理時のゲル面積)}/(薬剤未処理のゲル面積)
一つのデータについてn=3ウェルで評価し、平均±標準偏差(mean±S.D.)でグラフ表記した。
【0020】
[試験結果]
表1及び図1に、リンゴ抽出物単独添加の試験例についてのコラーゲンゲル収縮率(%)の結果を示す。
リンゴ抽出物をゲル形成後に添加した場合もゲル内包時に添加した時もいずれの場合もコラーゲンゲル収縮能が濃度依存的に認められた。そして、0.005%(w/v)添加時のゲル収縮能はそれぞれ15.2±6.9%、16.3±6.5%で非常に近い値を示した。
【0021】
【表1】

【0022】
〔試験例2〕
<コラーゲントリペプチドに関するコラーゲンゲル収縮作用試験>
この試験では、コラーゲンゲル収縮剤として、コラーゲントリペプチドを用い、以下のように、コラーゲンゲル収縮作用を測定した。
[材料]
(1)アテロコラーゲン(商品名:AteloCell、アテロコラーゲン(牛真皮由来)5mg/ml(2)DMEM(粉末)(商品名:ダルベッコ変法イーグル培地(2)、日水)
(3)DMEM(液体)(商品名;Gibco)
[評価検体]
(2)コラーゲントリペプチド
商品名:HACP-01(ゼライス株式会社製)
規格; トリペプチド(G−X−Y;X、Yは任意のアミノ酸)を15%以上含有
【0023】
[試験方法]
予め継代培養した皮膚線維芽細胞(新生児由来)を細胞懸濁液(6×105cells/ml 溶媒10%FBS含有DMEM)として調整した。氷冷中でアテロコラーゲン(5mg/ml)4ml、3倍濃度DMEM(D-Glc1.2M含有およびアップルフェノンSH0.03%含有)2ml、FBS(牛血清)0.67ml、10%FBS含有DMEM 3.33ml及び細胞懸濁液2mlを混合し、平底12ウェルプレートに1mlずつ添加した。37℃5%CO2インキューベーターで培養し、5時間後にアテロコラーゲンが再線維化することでゲル化することを認めた。
添加から6時間後に滅菌したスパチュラの柄を用いてゲルをウェルプレートから剥がした後、10%FBS含有DMEM溶液1ml(0.5%、0.2%、0.1%HACP-01含有)を添加して、再び37℃5%CO2インキューベーターで7日間培養した。
培養液は1日おきに評価薬剤を任意の濃度に溶解させた10%FBS含有DMEM溶液1mlを培地交換した。培養終了後、培養液を完全に除去しPBSで洗浄後、10%中性ホルマリン溶液(Wako)で24時間浸潤しゲルを固定した。
その後、1%(w/v)Triton−X溶液に置換して、ゲル直径の計測を行った。
コラーゲントリペプチドは、ゲル形成後に添加した場合と、ゲル内包時に添加した場合の試験を行った。添加量は表2に記載したとおりである。
【0024】
表2に記載の添加濃度A1、A2、A3の添加濃度はゲル形成後に添加する10%FBS含有DMEM溶液1ml中にコラーゲントリペプチドを添加させた数値を示している。
また、表2に記載の添加濃度B1、B2、B3はゲル内包時にコラーゲントリペプチドを添加したゲル容量1ml中の添加濃度を示している。すなわちゲル1mlを組成する各試料の容量は(1)アテロコラーゲン333.3μl、(2)1.2M D−グルコース含有3倍濃度DMEM166.7μl、(3)FBS(牛血清)55.8μl、(4)10%FBS含有DMEM277.5μl、(5)細胞懸濁液166.7μlから構成されており、評価検体のコラーゲントリペプチドは(2)3倍濃度DMEMの溶媒に対して、6.0%の濃度で調整したコラーゲントリペプチド含有1.2M D−グルコース含有3倍濃度DMEM溶液はゲル添加濃度として0.3%×(166.7μl/ゲル容量1ml)=1.0%のB1に示した添加濃度となる。同様に、B2およびB3の添加濃度はそれぞれ3.0%および0.6%のコラーゲントリペプチド含有1.2M D−グルコース含有3倍濃度DMEM溶液をそれぞれ調整してゲル内包時に添加したことで、それぞれB2→0.0167%、B3→0.005%の添加濃度としてコラーゲンゲル収縮率を求めた。
【0025】
[ゲル直径の計測およびゲル面積の算出]
ゲルの形状はウェルプレートと同様に真円状になることを利用してゲル面積を算出した。図4に示すコラーゲンゲル収縮剤のコラーゲンゲル収縮状態を示した図を参照。
上記処理方法によって調整したゲルを2方向について直径を計測し、2直線の平均値を算出した。そのゲル直径の平均値からゲル半径が算出され、ゲル面積は次の式で算出することができる。
ゲル面積=(ゲル半径 cm)×(ゲル半径 cm)×円周率
薬剤未処理のコラーゲンゲルのゲル面積に対する薬剤処理時のコラーゲンゲルのゲル面積の面積比からコラーゲンゲル収縮率(%)を算出した。
コラーゲンゲル収縮率(%)=100×{(薬剤未処理のゲル面積)−(薬剤処理時のゲル面積)}/(薬剤未処理のゲル面積)
一つのデータについてn=3ウェルで評価し、平均±標準偏差(mean±S.D.)でグラフ表記した。
【0026】
[試験結果]
表2及び図2に、コラーゲントリペプチド単独添加の試験例についてのコラーゲンゲル収縮率(%)の結果を示す。
コラーゲントリペプチドをゲル形成後に添加した場合もゲル内包時に添加した時もいずれの場合もコラーゲンゲル収縮能が濃度依存的に認められた。そして、0.1%(w/v)添加時のゲル収縮能はそれぞれ20.1±1.0%、24.2±15.5%で非常に近い値を示した。
【0027】
【表2】

【実施例1】
【0028】
[リンゴポリフェノール、コラーゲントリペプチド併用例]
リンゴポリフェノールとコラーゲントリペプチド併用試験を前記試験方法と同様に行った。リンゴポリフェノールをゲル内包時に添加し、ゲル形成後にコラーゲントリペプチドを添加した。その結果を表3、図3に示す。
リンゴポリフェノールとしてアップルフェノンSHを用い、コラーゲントリペプチドとして分子量約400の豚由来コラーゲントリペプチド(製品名:HACP-01 ゼライス株式会社製)を用いた。
【0029】
【表3】

【0030】
試験例1は、リンゴ抽出物であるアップルフェノンSHを0.005%添加した例である。 試験例2はコラーゲントリペプチドであるHACP-01を0.1%添加した例である。
実施例1は、試験例1と試験例2を併用した例である。
実施例1は、想定される相加効果である参考に比べても顕著な効果を発揮することが分かる。
この結果、実施例1は、いずれも単独使用よりも格段にコラーゲンゲルを収縮させる作用を果たすことが確認された。また、単純に想定される相加数字である参考と比較しても顕著な効果を示し、これは、予想し得ない効果である。
【実施例2】
【0031】
[光老化抑制試験]
前記試験において、コラーゲンおよび線維芽細胞を含むコラーゲンゲルを収縮させるin vitroの試験系を用いて、リンゴ抽出物及びコラーゲントリペプチド併用することによりコラーゲンゲル収縮を相乗的に促進させる事を確認した。
長期間太陽(紫外線)に当たり続けると、顔、首筋の深いシワを増加させ、更に皮膚の乾燥及び肌荒れやシミ、ソバカス等の色素沈着を起こすことが知られており、この光老化による肌のトラブル対策として、新たに知見したリンゴ抽出物及びコラーゲントリペプチド併用が有するコラーゲン収縮能の活用試験を行った。すなわち、皮膚老化や皮膚の光老化現象を緩和、予防、抑制、改善する成分として、ポリフェノールを主成分とするリンゴ抽出物に着目して、試験を行った。
【0032】
<試験方法>
UVA波およびUVB波をヘアレスマウスに照射させてシワを形成させる試験系において被験物質であるそれぞれの食品原料を経口摂取させてシワの抑制および皮膚老化抑制効果について検討を行った。
試験開始時6週齢のヘアレスマウス(Hos:HR−1雌)を用いて以下の1)〜11)の条件・方法で試験を行った。
【0033】
1)試験対象物の調製および投与
ヘアレスマウスの群分けは投与開始日に、一般状態が良好な動物を体重により、群間での差が無いように1群6匹に振り分けた。なお、試験群5の「2者併用混餌」の群についてはn=5で評価し、各群の個体は1ゲージ/群で飼育とした。
マウス用飼料MF(オリエンタルバイオサービス製)に、表4に示すそれぞれ被験物質が均一混ざるように混合処理を施し、混餌にて自由摂取させた。投与群の一覧を示す。混餌は動物搬入直後から解剖18時間前まで実施した。
(1)リンゴ抽出物として、ポマクティブHFV(フランスのヴァル・デ・ヴィル・バイオアクティブズ社(VVB社)製(日本代理店 ユニテックフーズ))を用いた。ポマクティブHFVは、フランス産シードル用リンゴを原料にしたリンゴポリフェノール製品。規格成分は全ポリフェノール90%以上(UV法で算出)である。プロシアニジン、ケルセチン(配糖体)、フロリジン、カテキン類を主成分とする。
(2)コラーゲントリペプチド原料としてHACP−01を用いた。
HACP−01(コラーゲントリペプチド原料)は、豚由来のコラーゲンを原料とし、ゼライス社が製造販売しているコラーゲントリペプチドである。
このコラーゲントリペプチドは、平均分子量が400以下のものを含有するトリペプチドであり、通常一般のコラーゲンと称するものとは区別されるものである。さらに詳しくは、アミノ酸配列がGly−X−Y(X,Yはアミノ酸)であるペプタイドが好ましく、特に好ましくはアミノ酸配列がGly−Pro−Hypのものである。
コラーゲンペプチドは、豚などの動物由来、魚由来いずれも使用可能である。コラーゲントリペプチドは、主にコラーゲンを加水分解して製造することができる。コラーゲン加水分解物は、既に市販されているが、これらの酵素的に加水分解されたコラーゲンの多くは、分子量の分布範囲が2千から8万である。これらの加水分解物は水に対する分散性の向上を目的とするものである。
これに対してゼライス製のコラーゲン加水分解物HACP−01は、特定の有効成分として分子量で約400以下のペプタイドを含むことを特徴とする。
【0034】
【表4】

【0035】
2)UV照射(表4;試験概要)
UV照射時は、動物を専用のケージに移し、1群ずつUVB20mJ/cm2およびUVA10J/cm2を照射した。照射は週三回の月曜、水曜、金曜で10週間実施した。
3)経皮水分蒸散量(TEWL)の測定
経皮水分蒸散量の測定は、vapometer(キーストンサイエンティフィック製)を用い、背部の尾付け根より首に向かい2cm、腰椎から右側に0.5cm部位に端末をあてて測定した。測定日は、試験開始日に実施し各群のTEWL値にバラつきが無い事を確認し、その後、解剖直前に測定した。
4)角質層水分量の測定
角質層水分量の測定は、MoistureCheckerMY−808S(SCALAR 製)を用い、背部の尾付け根より首に向かい2cm、腰椎から右側に0.5cm部位に端末をあてて測定した。
5)解剖
各群、本飼育期間終了翌日より18時間絶食後、氷冷したAvertin(2,2,2−トリブロモエタノール)を0.5mg/kg体重腹腔内投与により麻酔を導入した。その後、皮膚背部の尾付け根より首に向かい2cm、腰椎から右側に0.5cm部位範囲で反射型レプリカ((有)アサヒバイオメッド製)を採取した。その後、開腹し解剖を行った。皮膚組織は10%中性ホルマリン浸潤、パラフィン包埋後にヘマトキシリン−エオシン染色した。
6)皮膚形態観察およびシワ体積率計測
皮膚表面部の写真撮影と採取したレプリカの判定を行った。シワ形成度合を指標としてASA−03RXD((有)アサヒバイオメッド製)を用いてシワ体積率%(μm3/mm2/100) を算出した。
7)表皮肥厚
「5)解剖」の項で実施した皮膚組織のヘマトキシリン−エオシン染色により、表皮の厚さを計測した。同一染色画像500μm中から任意に6箇所を選択し、それぞれの場所における表皮の厚さを計測し、その6点の平均値をその個体の表皮の厚さとした。
【0036】
8)8−ヒドロキシ−2’−デオキシグアノシン(8−OH dG)測定
免疫組織染色によりDNA損傷のバイオマーカーである8−OH dGの測定を表皮細胞に着目して実施した。
「5)解剖」の項で用意したパラフィン包埋済みの皮膚組織を5μm厚で切片を適宜作製し、脱パラフィン、親水化は公知の方法に基づいて実施した。抗原賦活化は0.01Mクエン酸緩衝液(pH6.0)沸騰中でマイクロウェーブ処理5分を実施した。室温まで冷却後、常温下0.3%過酸化水素含有メタノールで30分反応させて内因性ペルオキシダーゼを阻害した。水洗、10mMPBS(−)洗浄後、ウサギ血清75倍(希釈溶液はPBS(−))で30分間室温放置してブロッキング反応を行った。血清をスライドガラスから落として1次抗体(N45.1:日研ザイル(株)製)を5μg/mlで4℃1晩放置して1次抗体を反応させた。PBS(−)で2回洗浄し、ビオチン化二次抗体(ビオチン化ウサギ免疫グロブリンM;DAKO製)を300倍希釈したものを30分間室温にて2次抗体を反応させた。PBS(−)で2回洗浄し、ABC試薬(ABC−HRP;Vectastain製)を30分間室温にて反応させた。発色試薬としてDAB(3,3-ジアミノベンジジンテトラヒドロクロライド:DAKO製)を用いて3分30秒常温下で反応させた。水洗後、公知の方法に基づいて脱水、封入処理を行った。顕微鏡下で皮膚組織の染色状況を観察し、以下の基準に基づいてスコア化した。スコア化の判別が困難なものはその中間値0.5を足し、各群のスコアを算出した。
【0037】
スコア
×;スコア3;表皮細胞よりも上層の細胞核が何層にも染色
△;スコア2;表皮細胞よりも上層の細胞核が染色
○;スコア1;表皮細胞の細胞核が染色
◎;スコア0; 表皮細胞の細胞核が点在する程度の染色
【0038】
9)Proliferation Cell Nuclear Antigen(PCNA;増殖細胞核抗原)測定
PCNAは細胞周期の細胞成長期後期からDNA合成期初期で発現が認められる核タンパク質であり、DNA損傷時にDNAポリメラーゼやRFC(複製因子C;クランプ装着因子)と複合体を形成し、新しくDNAを合成・修復する。しかしながら、微弱な紫外線の連続照射といった常時PCNAが発現している環境においては細胞周期が異常になり、引き続いて細胞増殖が過剰となり表皮細胞のターンオーバーが亢進して、角化不全や表皮肥厚を招き、最終的には光老化現象を引き起こすと考えられる。
免疫組織染色により細胞増殖のバイオマーカーであるPCNAの測定を表皮細胞に着目して実施した。
「5)解剖」の項で用意したパラフィン包埋済みの皮膚組織を5μm厚で切片を適宜作製し、脱パラフィン、親水化は公知の方法に基づいて実施した。抗原賦活化は0.01Mクエン酸緩衝液(pH6.0)沸騰中でマイクロウェーブ処理5分間を実施した。室温まで冷却後、常温下0.3%過酸化水素含有メタノールで30分反応させて内因性ペルオキシダーゼを阻害した。水洗、PBS(−)洗浄後、ウサギ血清75倍(希釈溶液はPBS(−))で30分間室温放置してブロッキング反応を行った。血清をスライドガラスから落として1次抗体(PC−10:Santa Cruz製)を1μg/mlで4℃1晩放置して1次抗体を反応させた。PBS(−)で2回洗浄し、ビオチン化二次抗体(ビオチ・BR>悼サウサギ免疫グロブリンM;DAKO製)を300倍希釈したものを30分間室温にて2次抗体を反応させた。PBS(−)で2回洗浄し、ABC試薬(ABC−HRP;Vectastain製)を30分間室温にて反応させた。発色試薬としてDAB(3,3-ジアミノベンジジンテトラヒドロクロライド:DAKO製)を用いて3分30秒常温下で反応させた。水洗後、公知の方法に基づいて脱水、封入処理を行った。顕微鏡下で皮膚組織の染色状況を観察し、以下の基準に基づいてスコア化した。スコア化の判別が困難なものはその中間値0.5を足し、各群のスコアを算出した。
【0039】
スコア
×;スコア3;表皮細胞よりも上層の細胞核が何層にも染色
△;スコア2;表皮細胞よりも上層の細胞核が染色
○;スコア1;表皮細胞の細胞核が染色
◎;スコア0; 表皮細胞の細胞核が点在する程度の染色
【0040】
10)皮膚ヒドロキシプロリン(Hyp)
皮膚タンパク質を塩酸加水分解し、LC/MS/MSによりヒドロキシプロリン量を測定した。
「5)解剖」の項で凍結保存しておいたマウス皮膚からコラーゲン測定用に10mgを切り出した。その皮膚片を鋏で細かく切りスクリューキャップ付の試験管に入れた後、6N 塩酸1mlを加え、110℃で24時間酸加水分解した。反応溶液をMilliQ水で50倍に希釈した後に、フィルターろ過(φ=0.45mm)し、更に、MilliQ水で100倍希釈したものをヒドロキシプロリン測定用のサンプルとした。
ヒドロキシプロリンはLC/MS/MSシステムのACQUITY(R) TQD(Waters)を使用して測定した。
LC条件
・カラム HSS T3 2.1X100mm(Waters製)
・流速 0.4mL/min
・カラム温度 50℃
・移動相 A:0.1%ギ酸
B:0.1%ギ酸、80%アセトニトリル
・グラジエント
【0041】
【表5】

【0042】
MS/MS条件
・イオン化 ESI+(Positive)
・キャピラリー電圧 0.5kV
・脱溶媒ガス 1,000L/Hr
・コーンガス 50L/Hr
・イオン源ヒーター 150℃
・モニター MRM
・プリカーサーイオン(m/z) 132.16
・プロダクトイオン(m/z) 86.1
・Dwell時間(秒) 0.05
・コーン電圧(V) 28
・コリジョンエネルギー(eV) 12
標準品のヒドロキシプロリン(Wako製)とのピークエリアを比較する事で皮膚コラーゲン中のヒドロキシプロリン量(Hyp)を算出した。
【0043】
11)統計処理
試験結果は平均値±標準偏差(mean ± S.D.)で表し、多重比較(Steel’s test)をエクセル統計2008の解析ソフトで有意差検定を行った。**⇒p<0.01、*⇒p<0.05とし、p<0.1については有意傾向として注意書きした。
【0044】
<試験結果>
以下に、本実施例2の各試験例の結果を順次示す。
1.一般状態観察およびシワ体積率計測
紫外線照射第4週目頃よりUV照射動物において、頭部の皮膚の軽度褐色化や頸部のしわの深さならびに後肢背部のしわがUV非照射動物に比較して目立つようになった。
解剖時の外観観察では、UV照射動物で顔、頸部および後肢背部のしわが明瞭に確認されたが、UV照射においても2者併用混餌(ポマクティブHFV 0.006%およびHACP−01 0.5%混餌)したマウスにおいてその症状は軽度であり、2者併用混餌群ではしわの深度が浅く、肉眼的にはしわの程度が皆無であった。また、高濃度摂取動物は、コントロール群に比較して皮膚にしっとり感があった。
表6、図4のシワ体積率のグラフが示すように、紫外線照射により明確なシワの形成が認められ、同一紫外線照射条件下で 混餌群では濃度依存的にシワ抑制効果が有意に認められた。一方、リンゴ混餌群およびコラーゲントリペプチド混餌群ではシワの抑制効果は極僅かなものであり、有意差検定により、UV+群との有意なシワ体積率の抑制は認められなかった。一方、2者併用混餌群でのみ有意にシワ体積率を抑制した。
2.体重推移
表6に示すように体重推移は、各群大きな差異は認められなかった。
3.摂餌量
表6に示すように摂餌量についても体重推移同様に大きな差異は認められなかった。摂食量は、体重増加が緩慢になった紫外線照射6週間から10週間における平均値から算出した。この摂取量は、ヒトが無理なく摂取できる量で光老化現象に伴うシワを抑制する事が出来ると考えられる。
4.肝臓重量
肝臓重量についても大きな差異は認められず異常な症状は観察されなかった。また、他の臓器についても異常は認められなかった。
5.経皮水分蒸散量(TEWL)
結果を表6に示す。
経皮水分蒸散量はその数値が高いほど、角質層から水分が蒸発し皮膚の乾燥状態を引き起こしていると考えられる。UV照射により経皮水分蒸散量の上昇が一般的に知られており、本試験でも解剖日の経皮水分蒸散量はUV−群に比較してUV+群では高くなり乾燥状態を裏付けていた。この時、UV+照射およびポマクティブHFV混餌群は低いTEWL値を示した。UV+照射群に比較してUV−群、リンゴ混餌群および2者併用群で有意に低いTEWL値を示した。コラーゲントリペプチド混餌群では有意傾向(p=0.0987)として低いTEWL値を示した。
【0045】
【表6】

【0046】
6.角質層水分量
結果を表7に示す。
角質層水分量はその数値が低いほど、角質層の水分もしくは水分保持に関わる天然保湿因子(Natural Moisturizing Factor;NMF)が減少し、皮膚の乾燥状態を引き起こしていると考えられる。UV照射により角質層水分量が減少すると一般的に知られており、本試験でも解剖日の角質層水分量は[UV−/コントロール食]群に比較して[UV+/コントロール食]群では低くなり乾燥状態を裏付けていた。この時、リンゴ混餌群は角質層水分量の回復を示した。UV+照射群に比較してリンゴ混餌群および2者併用群で有意に高い角質水分量を示した。
7.表皮肥厚
結果を表7に示す。
[UV+/コントロール食]群に対し、[UV−/コントロール食]群、コラーゲントリペプチド混餌群および2者併用群で有意な表皮肥厚(アカントーシス)の抑制が証明された。また、0.006%混餌群では有意傾向(p=0.0831)として表皮肥厚が抑制されていた。
8.8−OHdG
結果を表7に示す。
[UV+/コントロール食]群に対し、[UV−/コントロール食]群、2者併用群で有意に8−OHdGを抑制した。一方、リンゴ混餌群では8−OHdGを抑制しなかった。また、コラーゲントリペプチド混餌群では有意傾向(p=0.0596)として8−OHdGを抑制した。
8−OHdGは細胞のDNA損傷の指標の一つであり、紫外線や放射線、化学汚染物質、タバコ煙など酸化ストレスの暴露によりDNAのグアニンが酸化されて形成する。本試験での紫外線照射によりマウス皮膚の基底細胞層に8−OHdGが増加していたのでDNA損傷が引き起こされた事およびリンゴとコラーゲントリペプチドの2者併用混餌群ではそのDNA損傷が抑制されていた事を示唆している。
9.PCNA
結果を表7に示す。
[UV+/コントロール食]群に対し、[UV−/コントロール食]群、リンゴ混餌群および2者併用群で有意にPCNAを抑制した。コラーゲントリペプチド混餌群では有意傾向(p=0.0645)としてPCNAの発現が抑制された。
PCNAは細胞増殖や細胞周期の指標の一つであり、細胞成長期後期〜DNA合成期初期で発現増強し、DNAポリメラーゼや複製因子C(RFC)などと複合体を形成してDNA損傷部位の切り出しと新たなDNAの合成や修復を行う核タンパク質である。本試験において、紫外線照射で過剰に増加したDNA傷害を正常状態に修復するためにPCNAが過剰発現しDNAが過剰に合成され表皮基底細胞の細胞周期異常を招き、引き続き基底細胞の増殖過剰が表皮のターンオーバー異常へとつながり、最終的には表皮の肥厚や皮膚外観のシワを引き起こしたと考えられる。このPCNAの過剰発現をリンゴとコラーゲントリペプチド2者併用混餌群で有意に抑制した事は、リンゴとコラーゲントリペプチド2者併用により未然に紫外線ダメージを緩和してシワ形成抑制や表皮肥厚抑制へと導いたと示唆される。
10. 皮膚ヒドロキシプロリン(Hyp)
結果を表7に示す。
[UV+/コントロール食]群に対し、2者併用群で有意傾向(p=0.0938)なHypの上昇が認められた。Hyp上昇は皮膚組織におけるコラーゲン量の増加を示唆している。
【0047】
【表7】

【0048】
上記各動物実験を総括すると、各試験において、リンゴ抽出物とコラーゲントリペプチドとの2者併用が効果を発揮することが確認できた。
特に、シワ体積率、8−OHdG の2項目が紫外線照射条件においても2者併用群でのみ有意に抑制することが確認され、リンゴ抽出物とコラーゲントリペプチドとの2者併用効果を発揮した。
その他、TEWL、角質層水分量、表皮厚においても2者併用群で有意に紫外線ダメージの影響を緩和・抑制しており、皮膚組織中のHypも2者併用群でのみ有意傾向として上昇を示した事も2者併用の有用性を示唆している。
本出願人は、添加量を変えてポマクティブHFVのみを混餌した試験を本試験同内容について別途行った。添加量は0.006重量%、0.012重量%、0.060重量%の3種類とした。この試験結果、濃度依存的に作用効果を発揮することが確認されている。例えば、シワ体積率を参考に示すと、それぞれの添加量応じて、31.1%、13.4%、9.0%である。コントロール食のUV有無の結果は、本試験例と同じである。本試験例では、リンゴ抽出物0.006重量%とコラーゲントリペプチド0.5重量%との2者併用は、12.0%のシワ体積率を示していることは、低濃度添加において、顕著なシワ形成抑制能を発揮することが確認できる。このように、リンゴ抽出物とコラーゲントリペプチドとの2者併用は、低濃度でも顕著な相乗作用を発揮する。
【実施例3】
【0049】
リンゴ抽出物(実施例2と同様)とコラーゲントリペプチド(実施例2と同様)とを混合した飲料の連日経口摂取による健常者の肌状態に及ぼす有効性の確認試験を行った。
1.試験方法
試験デザイン:並行群間二重盲検法
被験者数:20名(各群10名)、30代以上の健常女性
摂取期間:30日間
摂取量 :ドリンク1日1本50ml 就寝前の摂取推奨
調査時期:摂取前、10日後、30日後
調査方法:直前、試験開始後10日、30日
【0050】
2.試験品
(a)コラーゲントリペプチド配合飲料 50ml/1本
トリペプチド含有コラーゲンペプチド :2600mg、
セラミド : 600μg、
ビタミンC : 250mg、
ハスカップエキス : 15mg、
コエンザイムQ10 : 1mg、
ビタミンE(α-トコフェロールとして) : 2mg、
ヒアルロン酸 : 1mg
(b)コラーゲントリペプチドとリンゴポリフェノール配合飲料 50ml/1本
抗老化素材として知られているハスカップエキスに代えて、リンゴポリフェノールを配合した。
トリペプチド高含有コラーゲンペプチド :2600mg、
リンゴポリフェノール : 83mg、
※リンゴポリフェノール原料は熱水抽出乾燥物
セラミド : 600μg、
ビタミンC : 250mg、
コエンザイムQ10 : 1mg、
ビタミンE(α-トコフェロールとして) : 2mg、
ヒアルロン酸 : 1mg
【0051】
3.試験期間の留意事項
1)試験期間中は暴飲暴食を避ける。
2)試験期間中は生活習慣を変えないようにする。
3)コラーゲンペプチド、大豆イソフラボン、ビタミンCなど特に美容を目的とした健康食品の摂取、エステティックなどの施術、新たな化粧品の使用は慎む。
【0052】
4.調査項目
1)問診票 :乾燥、化粧のり、はり、明るさ、やわらかさ、他
2)機器測定:弾力性
弾力性 :皮膚弾力キュートメーターMPA580 2回
測定部位:顔面右頬部
【0053】
5.試験結果
(1)問診票による試験結果を図11に示す。図11に示すデータは、試験前の状態と試験期間である30日経過後の状態についておこなったアンケートの回答をまとめたものである。回答種類は、それぞれの項目について、「1.改善した 2.変わらない 3.悪くなった 4.もともと気にならない」等の4項目からの選択とした。
自覚症状アンケートは改善したを+1、変わらないを0、悪くなったを−1とした。
この結果、コラーゲントリペプチドとリンゴポリフェノールを併用した(b)は、コラーゲントリペプチドを配合した(a)に比較して、皮膚のなめらかさ、乾燥、化粧のりなどにおいて、優れた改善効果が自覚されている。さらに、ニキビに関して、できやすさ、直りにくさ、悪化のしやすさについては、抑制効果があることが自覚されている。
したがって、継続的な服用によって、肌がうるおい、化粧ののりが良くなると共に、ニキビの発生、症状が抑制されることが期待できる。
【0054】
(2)皮膚弾力性の評価
キュートメーターMPA580(Courage+Khazaka Electronic Gmbh 社製)を用いて計測した皮膚の粘弾性と弾力性を計測した結果を図12(a)(b)に示した。皮膚粘弾性については、キュートメーターMPA580の計測パラメーターR0、皮膚弾力性についてはパラメーターR2を用いて評価した。計測は、試験開始前、試験開始後10日目、試験開始30日後(試験期間終了後)の3回測定した。表中aはコラーゲントリペプチドを配合した試飲料を示し、bはリンゴポリフェノールとコラーゲントリペプチドを配合した試飲料を示す。
図12(a)に示す、粘弾性については中間の10日摂取では、リンゴポリフェノールの有無による差は認められないが、30日間摂取では、リンゴポリフェノールとコラーゲントリペプチドを併用したサンプル(b)の改善効果が大きくなっている。
図12(b)に示す弾力性については、中間の10日摂取、30日摂取ともリンゴポリフェノールとコラーゲントリペプチドを併用したサンプル(b)の改善効果が大きくなっている。
したがって、長期継続摂取によって、サンプル(b)の方が皮膚の弾力性、ハリが改善することが機器計測によっても確認できた。
【特許請求の範囲】
【請求項1】
コラーゲンおよび線維芽細胞を含むコラーゲンゲルを収縮させるコラーゲンゲル収縮剤であって、リンゴ抽出物及びコラーゲントリペプチドを有効成分とする美容飲料。
【請求項2】
リンゴ抽出物がリンゴ由来のポリフェノールであり、コラーゲントリペプチドの平均分子量が400以下のものを含有するコラーゲントリペプチドであることを特徴とする請求項1記載の美容飲料。
【請求項3】
シワ形成抑制用美容飲料である請求項1又は2記載の美容飲料。
【請求項4】
紫外線被曝によるシワ形成を抑制する請求項3記載のシワ形成抑制用美容飲料。
【請求項5】
DNA損傷抑制用美容飲料である請求項1又は2記載の美容飲料。
【請求項6】
紫外線被曝によるDNA損傷を抑制する請求項5記載のDNA損傷抑制用美容飲料。
【請求項7】
角質層水分量保持用美容飲料である請求項1又は2記載の美容飲料。
【請求項8】
紫外線被曝による角質層水分量の減少を抑制する請求項7記載の角質層水分量保持用美容飲料。
【請求項9】
表皮肥厚抑制用美容飲料である請求項1又は2記載の美容飲料。
【請求項10】
皮膚弾力性向上用美容飲料である請求項1又は2記載の美容飲料。
【請求項1】
コラーゲンおよび線維芽細胞を含むコラーゲンゲルを収縮させるコラーゲンゲル収縮剤であって、リンゴ抽出物及びコラーゲントリペプチドを有効成分とする美容飲料。
【請求項2】
リンゴ抽出物がリンゴ由来のポリフェノールであり、コラーゲントリペプチドの平均分子量が400以下のものを含有するコラーゲントリペプチドであることを特徴とする請求項1記載の美容飲料。
【請求項3】
シワ形成抑制用美容飲料である請求項1又は2記載の美容飲料。
【請求項4】
紫外線被曝によるシワ形成を抑制する請求項3記載のシワ形成抑制用美容飲料。
【請求項5】
DNA損傷抑制用美容飲料である請求項1又は2記載の美容飲料。
【請求項6】
紫外線被曝によるDNA損傷を抑制する請求項5記載のDNA損傷抑制用美容飲料。
【請求項7】
角質層水分量保持用美容飲料である請求項1又は2記載の美容飲料。
【請求項8】
紫外線被曝による角質層水分量の減少を抑制する請求項7記載の角質層水分量保持用美容飲料。
【請求項9】
表皮肥厚抑制用美容飲料である請求項1又は2記載の美容飲料。
【請求項10】
皮膚弾力性向上用美容飲料である請求項1又は2記載の美容飲料。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12(a)】


【図12(b)】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12(a)】


【図12(b)】


【公開番号】特開2012−62278(P2012−62278A)
【公開日】平成24年3月29日(2012.3.29)
【国際特許分類】
【出願番号】特願2010−208008(P2010−208008)
【出願日】平成22年9月16日(2010.9.16)
【出願人】(593106918)株式会社ファンケル (310)
【Fターム(参考)】
【公開日】平成24年3月29日(2012.3.29)
【国際特許分類】
【出願日】平成22年9月16日(2010.9.16)
【出願人】(593106918)株式会社ファンケル (310)
【Fターム(参考)】
[ Back to top ]

