レプトマイシン化合物
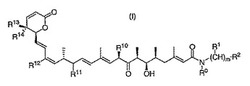
下記式I
【化1】

(式中、R0、R1、R2、R10、R11、R12、R13、R14及びmは、本出願で定義するとおり)のレプトマイシン型化合物は、抗腫瘍活性を示す。
【化1】

(式中、R0、R1、R2、R10、R11、R12、R13、R14及びmは、本出願で定義するとおり)のレプトマイシン型化合物は、抗腫瘍活性を示す。
【発明の詳細な説明】
【発明の詳細な説明】
【0001】
〔発明の技術分野〕
この発明は、レプトマイシン化合物並びにその製造方法及び使用方法に関する。
【0002】
〔発明の背景〕
下記式のレプトマイシンB(“LMB”)は、Hokansonらの米国特許第4,771,070号(1988)及びNettletonらの米国特許第4,792,522号(1988)で報告されているように、もとはストレプトマイセス属から単離された抗腫瘍、抗菌性の天然産物である。
【0003】
【化1】

LMBは、レプトマイシンファミリーと呼ばれる天然産物ファミリーの原型であり、該分子の一端の2,3-デヒドロ-δ-バレロラクトン環と、C5に位置する伸長した炭素鎖(6E、8Z及び12E、14Eジエン系を有する)とを特徴とする。ニトロメチルバレロラクトンLMB類似体は不活性であるが、ビオチン化LMBは活性であることが分かっており、2,3-デヒドロ-δ-バレロラクトン構造が重大なファルマコフォアであることを示唆している(Kudo et al., Exp. Cell Res. 1998, 242, 540-547)。
【0004】
【化2】

レプトマイシンファミリーの他のメンバーとして、 レプトマイシンA、ラートジャドン(ratjadone)、アンギノマイシン(anguinomycin)A〜D、カリスタチン(callystatin)A、カズサマイシン(kazusamycin)A(CL-1957Bとしても知られる)、カズサマイシンB(CL-1957Eとしても知られる)、レプトスタチン(leptolstatin)、及びレプトフラニン(leptofuranin)A〜Dが挙げられる。レプトマイシンBに最も構造的に類似する他のファミリーメンバーの式を以下に示す。
【0005】
【化3】

【0006】
もとは抗菌活性のスクリーニングの結果として同定されたが、LMBの現在の関心は主に抗腫瘍薬としてのその可能性にある。例えば、Komiyama et al., J. Antibiotics 1985, 38 (3), 427-429; Wang et al., US 2003/0162740 A1 (2003)を参照されたい。細胞レベルでは、LMBは、細胞周期のG1とG2相の最後で細胞を静止することによって作用する。分子レベルでは、LMBは核外移行受容体CRM1のインヒビターとして働き、P53、P73、STAT1、(i)ADAR1、Rev、アクチン、及びBcr-ablのような“カーゴタンパク質(cargo proteins)”に結合して核の転位置に影響を及ぼす。Nishi et al., J. Biol. Chem. 1994, 269 (9), 6320-6324; Fukuda et al., Nature 1997, 390, 308-311; Kudo et al.(上掲)を参照されたい。
しかし、LMBは、哺乳動物の細胞に対して顕著な細胞毒性を示し(Hamamoto et al., J. Antibiotics 1983, 36 (6), 639-645)、その抗癌薬としての魅力を軽減してしまう。従って、極端な毒性のため1994年にLMBの相1試験は停止された。LMB様活性を示すが、毒性が低い、より見込みのある抗癌薬を同定するための努力において、LMBをいくつかの細菌及び真菌との生物変換スクリーニングに供したところ、いくつかの誘導体が単離された(Kuhnt et al., Applied Environ. Microbiol. 1998, 64 (2), 714-720):26-ヒドロキシレプトマイシンB、4,11-ジヒドロキシレプトマイシンB、2,3-ジヒドロレプトマイシンB、及びレプトマイシンBグルタミンアミド。
【0007】
【化4】

このアプローチはいくつかの欠点に悩まされる。得られる産物の構造上の多様性が乏しかった:導入される官能基の種類が限定され、かつ官能基が導入される位置がでたらめであり、構造と活性の関係の体系的な誘導を妨げた。費やした努力の代償として得られた化合物の数は少なかった(合計101種の細菌及び真菌株に係るスクリーニングから4つの化合物)。多くの場合、生物変換収率は低かった。従って、抗癌薬として使うためのレプトマイシン化合物を得ることへの代替アプローチが望まれる。
【0008】
〔発明の簡単な概要〕
第1局面では、この発明は、下記式Iの構造を有する化合物及びその薬剤的に許容しうるエステル、塩、溶媒和物、水和物及びプロドラッグ形を提供する。
【化5】

【0009】
式中、mは0、1、2、3、4、又は5であり;
R0は、H、C1-C5アルキル、C2-C5アルケニル、又はC2-C5アルキニルであり;
各R1は、独立的にH、C1-C5アルキル、C2-C5アルケニル、又はC2-C5アルキニルであり;
R2は、H、アリール、シクロアルキル、ヘテロ環成分、下記式であり;
【化6】

【0010】
(式中、
R3は、H、C1-C5アルキル、C2-C5アルケニル、又はC2-C5アルキニルであり(mが0のときはR3がHでないという条件で);
R4は、H、C1-C5アルキル、C2-C5アルケニル、C2-C5アルキニル、アリール、シクロアルキル、又はヘテロ環成分であり;
R5は、H、C1-C5アルキル、C2-C5アルケニル、C2-C5アルキニル、アリール、シクロアルキル、ヘテロ環成分、又はC(=O)O(C1-C5アルキル)であり;かつ
R6は、H、C1-C5アルキル、C2-C5アルケニル、C2-C5アルキニル、シクロアルキル又は蛍光成分であり;或いはR5及びR6とそれらが共通に結合している窒素が一緒に4、5、6、又は7員の窒素含有ヘテロ環式環構造を形成する);
R10は、CH3又はCH2OHであり;
R11は、H又はOHであり;
R12は、CH3、CH2CH3;又はCH(OH)CH3であり;かつ
R13とR14の一方はH又はCH3であり、他方はH又はOHである。
【0011】
第2態様では、標的細胞の増殖を阻害する方法であって、前記標的細胞を、有効量のこの発明の化合物と接触させることを含む方法が提供される。標的細胞は癌細胞、特にヒトの乳癌、肺癌、卵巣癌、前立腺癌、又は白血病細胞でよい。また、標的細胞はヒトパピローマウイルス(HPV)-関連子宮頚癌細胞又は膀胱癌細胞でもよい。
第3態様では、過剰増殖性疾患の治療方法であって、該過剰増殖性疾患に苦しむ患者に治療的に有効な量のこの発明の化合物を投与することを含む方法が提供される。こうして治療される過剰増殖性疾患は、癌、特に乳癌、肺癌、卵巣癌、前立腺癌、又は白血病でよい。また、HPV-関連子宮頚癌又は膀胱癌でもよい。患者は好ましくは哺乳動物、特にヒトである。
第4態様では、過剰増殖性疾患(癌、特に乳癌、肺癌、卵巣癌、前立腺癌、又は白血病でよい)の治療用薬物の調製のためのこの発明の化合物の使用が提供される。また、前記癌は、HPV-関連子宮頚癌又は膀胱癌でもよい。
第5態様では、この発明の化合物と賦形剤を含んでなる医薬製剤が提供される。
第6態様では、CRM1媒介プロセスを経て細胞の核からタンパク質が移出することを阻害する方法であって、前記細胞を、阻害量のこの発明の化合物と接触させることを含む方法が提供される。
第7態様では、膀胱癌の治療方法であって、膀胱癌に苦しむ患者に治療的に有効な量のレプトマイシンBを投与することを含む方法が提供される。
【0012】
〔発明の詳細な説明〕
〔定義〕
“アルキル”は、その最長鎖部分に指定数の炭素原子を有する、任意に置換されていてもよい直鎖若しくは分岐鎖炭化水素成分を意味し(例えば“C3アルキル”、“C1-C5アルキル”、又は“C1〜C5アルキル”のように。後の2つの表現は1〜5個の炭素原子を最長鎖部分に有するアルキル基を指す)、或いは炭素原子の数が指定されていない場合、最長鎖部分に1〜4個の炭素原子を有するアルキル基を意味する。
“アルケニル”は、その最長鎖部分に少なくとも1個の炭素-炭素二重結合と指定数の炭素原子を有する、任意に置換されていてもよい直鎖若しくは分岐鎖炭化水素成分を意味し(例えば、“C3アルケニル”、“C2-C5アルケニル”、又は“C2〜C5アルケニル”のように。後の2つの表現は2〜5個の炭素原子を最長鎖部分に有するアルキル基を指す)、或いは炭素原子の数が指定されていない場合、最長鎖部分に2〜4個の炭素原子を有するアルケニル基を意味する。
“アルキニル”は、その最長鎖部分に少なくとも1個の炭素-炭素三重結合と指定数の炭素原子を有する、任意に置換されていてもよい直鎖若しくは分岐鎖炭化水素成分を意味し(例えば、“C3アルキニル”、“C2-C5アルキニル”、又は“C2〜C5アルキニル”のように。後の2つの表現は2〜5個の炭素原子を最長鎖部分に有するアルキル基を指す)、或いは或いは炭素原子の数が指定されていない場合、最長鎖部分に2〜4個の炭素原子を有するアルキニル基を意味する。
【0013】
“アリール”は、任意に置換されていてもよい芳香族単環式、縮合二環式、又は縮合多環式炭化水素若しくはヘテロ環式基(該環部分に1〜20個の炭素原子を有する)、例えば、フェニル、ナフチル、ピロリル、インドリル、ピラゾリル、ピラゾリニル、イミダゾリル、オキサゾリル、イソキサゾリル、チアゾリル、チアダゾリル、イソチアゾリル、フリル、チエニル、オキサジアゾリル、ピリジニル、N-オキソ-ピリジル、ピラジニル、ピリミジニル、ピリダジニル、テトラジニル、トリアジニル、トリアゾリル、ベンゾチアゾリル、ベンゾオキサゾリル、ベンゾチエニル、キノリニル、キノリニル-N-オキシド、イソキノリニル、ベンゾイミダゾリル、ベンゾフリル、クロモニル、クマリニル、シンノリニル、キノキサリニル、インダゾリル、ベンゾイソチアゾリル、ベンゾイソキサゾリル、ベンゾジアジニル、テトラゾリル、ベンゾフラザニル、ベンゾチオピラニル、ベンゾピラゾリル、インドリニル、イソクロマニル、イソインドリニル、ナフチリジニル、フタラジニル、プリニル、キナゾリニル等を意味する。
【0014】
“シクロアルキル”は、任意に置換されていてもよい飽和若しくは不飽和の非芳香族環式炭化水素環系を意味し、好ましくは1〜3個の環及び1つの環当たり3〜7個の炭素を含み、さらに飽和若しくは不飽和のC3-C7炭素環式環と縮合していてもよい。典型的なシクロアルキル環系として、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、シクロヘプチル、シクロオクチル、シクロデシル、シクロドデシル、及びアダマンチルが挙げられる。
“アリールアルキル”は、アリール成分で置換されているアルキル成分を意味し、例えば、ベンジル、フェネチル、N-イミダゾイルエチル、N-モルフォリノエチル、エチルピリジニル等のように、該アルキル成分のところで原子価がオープンである(満たされてない)。
“ヘテロ環”、“ヘテロ環式”、又は“ヘテロシクロ”は、少なくとも1個の炭素原子含有環中に少なくとも1個のヘテロ原子を有する、任意に置換されていてもよい、完全飽和若しくは不飽和の、芳香族又は非芳香族環系を意味し、例えば、4〜7員単環式、7〜11員二環式、又は10〜15員三環式環系を意味する。“ヘテロアリール”は、該環系がアリールであるヘテロ環を意味する。ヘテロ原子を含むヘテロ環式基の各環は、N、O及びS(N及びSは、任意に酸化されていてもよく、かつNは任意に四級化されていてもよい)から選択される1、2又は3個のヘテロ原子を有しうる。単環式ヘテロ環式環系として、ピロリジニル、ピロリル、ビオチニル、インドリル、ピラゾリル、オキセタニル、ピラゾリニル、イミダゾリル、イミダゾリニル、イミダゾリジニル、オキサゾリル、オキサゾリジニル、イソキサゾリニル、イソキサゾリル、チアゾリル、チアジアゾリル、チアゾリジニル、イソチアゾリル、イソチアゾリジニル、フリル、テトラヒドロフリル、チエニル、オキサジアゾリル、ピペリジニル、ピペラジニル、2-オキソピペラジニル、2-オキソピペリジニル、2-オキソピロリジニル、2-オキソアゼピニル、アゼピニル、4-ピペリドニル、ピリジニル、N-オキソ-ピリジル、ピラジニル、ピリミジニル、ピリダジニル、テトラヒドロピラニル、テトラヒドロチオピラニル、テトラヒドロチオピラニルスルホン、モルフォリニル、チオモルフォリニル、チオモルフォリニルスルホキシド、チオモルフォリニルスルホン、1,3-ジオキソラン及びテトラヒドロ-1,1-ジオキソチエニル、ジオキサニル、イソチアゾリジニル、チエタニル(thietanyl)、チイラニル(thiiranyl)、テトラゾリル、トリアジニル、及びトリアゾリル等が挙げられる。好ましいヘテロシクロ基として、ピリジニル、モルフォリニル、ピラジニル、ピリジニル、ピロリル、ピラゾリル、イミダゾリル、チアゾリル、オキサゾリル、イソキサゾリル、チアジアゾリル、オキサジアゾリル、チエニル、フラニル、キノリニル、イソキノリニル、ピペラジニル、及びピペリジニルが挙げられる。
【0015】
例えば、“置換若しくは無置換”又は“任意に置換されていてもよい”という表現を用いて、基が置換されうると示されている場合、該基は、1個以上の独立的に選択される置換基、好ましくは置換基の数が1〜5、さらに好ましくはに1又は2個の置換基を有しうる。当業者は、置換基及び置換パターンを選択して、化学的に安定な、かつ技術的に既知の方法及び本明細書で述べる方法で合成できる化合物を提供できることが分かる。好適な置換基の例として、本明細書で指定されるものに加え、アルキル、アルケニル、アルキニル、アリール、ハロ、トリフルオロメトキシ、トリフルオロメチル、ヒドロキシ、アルコキシ、シクロアルキルオキシ、ヘテロシクロオキシ、アルカノイル、アルカノイルオキシ、アミノ、アルキルアミノ四級アンモニウム、アラルキルアミノ、ヘテロシクロアルキル、シクロアルキルアミノ、ヘテロシクロアミノ、ジアルキルアミノ、アルカノイルアミノ、チオ、アルキルチオ、シクロアルキルチオ、ヘテロシクロチオ、ウレイド、ニトロ、シアノ、カルボキ、カルボキシルアルキル、カルバミル、アルコキシカルボニル、アルキルチオノ、アリールチオノ、アルキルスルホニル、スルホンアミンド(sulfonamindo)、アリールオキシ等が挙げられる。好ましくは、アルキル、アルケニル、及びアルキニル成分の置換基は、数が1〜3で、N-ピロリジニル、N-モルフォリニル、N-アゼチジニル、ヒドロキシル、ハロ、アルコキシ、シアノ、アミノ、アルキルアミノ、及びジアルキルアミノから独立的に選択される。好ましくは、アリール、シクロアルキル、及びヘテロシクロアルキル成分の置換基は、数が1〜3で、アルキル、アルケニル、アルキニル、ヒドロキシアルキル、ハロアルキル、ヒドロキシル、ハロ、アルコキシ、シアノ、アミノアルキル、アルキルアミノアルキル、ジアルキルアミノアルキル、アミノ、アルキルアミノ、及びジアルキルアミノから独立的に選択される。
【0016】
特定の立体異性体が具体的に示されない場合(例えば、構造式の相応の立体中心における太線若しくは破線結合によって、又は構造式でE若しくはZ配置を有するように二重結合を示すことによって、又は立体化学を指示する命名法を用いることによって)、純粋化合物のみならずその混合物のようにすべての立体異性体が本発明の範囲内に含まれる。特に指示しない限り、個々のエナンチオマー、ジアステレオマー、幾何異性体、並びにその組合せ及び混合物がすべて本発明に包含される。多形性結晶形及び溶媒和物も本発明の範囲内に包含される。
“薬剤的に許容しうるエステル”は、in vivo(例えば人体内で)加水分解して親化合物若しくはその塩を生成し、又はそれ自体親化合物の活性に似た活性を有するエステルを意味する。好適なエステル基として、限定するものではないが、薬剤的に許容しうる脂肪族カルボン酸、特にアルカン酸、アルケン酸、シクロアルカン酸及びアルカン二酸(各アルキル若しくはアルケニル成分は、好ましくは6個以下の炭素原子を有する)から誘導されるものが挙げられる。例示エステルとして、ギ酸エステル、酢酸エステル、プロピオン酸エステル、酪酸エステル、アクリル酸エステル、クエン酸エステル、コハク酸エステル、及びエチルコハク酸エステルが挙げられる。
“薬剤的に許容しうる塩”は、本明細書で述べる化合物にある個々の置換基によって決まる比較的無毒の酸又は塩基と調製される、該活性化合物の塩を意味する。化合物が相対的に酸性の官能性を含む場合、該化合物の中性形を十分な量の所望の塩基と、純粋又は適切な不活性溶媒中で接触させることによって塩基付加塩を得ることができる。薬剤的に許容しうる塩基付加塩の例として、ナトリウム塩、カリウム塩、カルシウム塩、アンモニウム塩、有機アミノ塩、若しくはマグネシウム塩、又は同様の塩が挙げられる。化合物が相対的に塩基性の官能性を含む場合、該化合物の中性形を十分な量の所望の酸と、純粋又は適切な不活性溶媒中で接触させることによって酸付加塩を得ることができる。薬剤的に許容しうる酸付加塩の例として、塩酸、臭化水素酸、硝酸、炭酸、一水素-炭酸、リン酸、一水素リン酸、二水素リン酸、硫酸、一水素-硫酸、ヨウ化水素酸、又は亜リン酸等のような無機酸から誘導されるもの、並びに酢酸、アスコルビン酸、プロピオン酸、イソ酪酸、マレイン酸、マロン酸、乳酸、リンゴ酸、グルタミン酸、安息香酸、コハク酸、スベリン酸、フマル酸、マンデル酸、フタル酸、ベンゼンスルホン酸、p-トリルスルホン酸、クエン酸、酒石酸、メタンスルホン酸、ラクトビオン酸等のような比較的無毒の有機酸から誘導される塩が挙げられる。アルギネート(arginate)等のようなアミノ酸の塩、及びグルクロン酸又はガラクツノル酸(galactunoric acid)等のような有機酸の塩も包含される。化合物が塩基性と酸性の両官能性を含む場合、化合物を塩基付加塩又は酸付加塩に変換することができる。
【0017】
本発明は、その範囲内にこの発明の化合物のプロドラッグをも包含する。このようなプロドラッグは、一般的に、必要な化合物に容易にin vivo変換しうる化合物の官能誘導体である。従って、本発明の治療方法において、用語“投与”は、具体的に開示された化合物又は具体的には開示されないが、特定化合物が必要な被験者に投与後、該特定化合物にin vivo変換する化合物による、記載された種々の障害の治療方法を含むものとする。適切なプロドラッグ誘導体の選択と調製の常法は、例えば、Wermuth, “Designing Prodrugs and Bioprecursors,” in Wermuth, ed., The Practice of Medicinal Chemistry, 2nd Ed., pp. 561-586 (Academic Press 2003)に記載されており、この開示は、参照によって本明細書に取り込まれる。プロドラッグとして、in vivo(例えば人体内で)加水分解してこの発明の化合物又はその塩を生成するエステルが挙げられる。好適なエステル基として、限定するものではないが、薬剤的に許容しうる脂肪族カルボン酸、特にアルカン酸、アルケン酸、シクロアルカン酸及びアルカン二酸(各アルキル又はアルケニル成分は、好ましくは6個以下の炭素原子を有する)から誘導されるものが挙げられる。例示エステルとして、限定するものではないが、ギ酸エステル、酢酸エステル、プロピオン酸エステル、酪酸エステル、アクリル酸エステル、クエン酸エステル、コハク酸エステル、及びエチルコハク酸エステルが挙げられる。
“治療的に有効な量”は、研究者、獣医、医師又は他の臨床医が探究してい組織系、動物若しくはヒト内における生物学的又は医学的反応(治療する疾患又は障害の症候の軽減を包む)を誘発する活性化合物又は医薬の当該量を意味する。
“C1〜C5アルキル”又は“5〜10%”のように範囲を規定する場合、該範囲はその範囲の終点を包含する。
【0018】
〔化合物及び方法〕
式Iに戻って、好ましい態様では、R0がH、R10がCH3、R11がH、R12がCH3、R13がCH3、かつR14がHであり、R1、R2、及びmは、上記「発明の簡単な概要」セクションで割り当てた意味をもつ。
別の好ましい態様では、R0がH、R10がCH3、R11がH、R12がCH3又はCH2CH3、R13がH、かつR14がHであり、R1、R2、及びmは、上記「発明の簡単な概要」セクションで割り当てた意味をもつ。
さらに別の好ましい態様では、R0がH、R10がCH2OH、R11がH、R12がCH3又はCH2CH3、R13がCH3、かつR14がHであり、R1、R2、及びmは、上記「発明の簡単な概要」セクションで割り当てた意味をもつ。
本発明の特に好ましい態様では、R0がH、R10がCH3、R11がH、R12がCH2CH3、R13がCH3、かつR14がHであり、下記式Iaの構造を有する化合物に相当する。(R1、R2及びmは、上記「発明の簡単な概要」セクションで割り当てた意味をもつ。)
【0019】
【化7】

式中、R2はヘテロ環式成分であり、好ましくは下記式である。
【化8】

【0020】
(式中、nは2、3、又は4である。)
好ましい態様では、R3がH以外である。
典型的なR6蛍光成分として以下のものが挙げられる。
【化9】

【0021】
これら及び他の蛍光成分のLMBへの付着用シントンは、Molecular Probes, Eugene, Oregon, USAから入手可能である。予想外に細胞毒活性を有することを除いて、LMB化合物の作用及び細胞内分布の機序を研究するためのバイオマーカーとして、LMB化合物を有する蛍光プローブを使用できる。しかし、特定の態様では、R6は、好ましくは蛍光成分以外である。
【0022】
下表1に式Iaの化合物の実例を示す。

【0023】

【0024】
この発明の化合物は、限定するものではないが、以下の疾患を治療するために使用できる:頭頚部癌の癌(頭、首、鼻腔、副鼻腔、鼻咽頭、口腔、口咽頭、咽頭、下咽頭、唾液腺の腫瘍、及び傍神経節腫を含む);肝臓及び胆樹の癌、特に肝細胞癌;腸癌、特に結腸直腸癌;処置卵巣癌;小細胞肺癌及び非小細胞肺癌;乳癌肉腫、例えば線維肉腫、悪性線維性組織球腫、胎児性横紋筋肉腫、平滑筋肉腫、神経線維肉腫、骨肉腫、滑膜肉腫、脂肪肉腫、及び胞状軟部肉腫;中枢神経系の新生物、特に脳癌;リンパ腫、例えばホジキンリンパ腫、リンパ形質細胞性リンパ腫、濾胞性リンパ腫、粘膜関連リンパ組織リンパ腫、マントル細胞リンパ腫、B-系列大細胞リンパ腫、バーキットリンパ腫、及びT-細胞未分化大細胞リンパ腫。臨床的には、本明細書で述べる方法の実施及び組成物の使用は、癌腫の大きさ若しくは数の減少及び/又は関連症候の低減(当てはまる場合)をもたらすだろう。病理学的には、本明細書で述べる方法の実施及び組成物の使用は、病理学的に関連する反応、例えば癌細胞増殖の阻害、癌若しくは腫瘍の大きさの減少、さらなる転移の防止、及び腫瘍脈管形成の阻害を引き起こすだろう。このような疾患の治療方法は、治療的に有効な量の本発明の化合物を被験者に投与することを含む。本方法は、必要に応じて繰り返してよい。特に、癌は、前立腺癌、ヒトパピローマウイルス(HPV)-関連子宮頚癌、白血病(特に慢性骨髄性白血病又はCML)、及び膀胱癌でよい。
【0025】
この発明の化合物によって、細胞の過剰増殖の特徴がある非癌障害も治療することができる。このような障害の実例として、限定するものではないが、萎縮性胃炎、炎症性溶血性貧血症、移植片拒絶反応、炎症性好中球減少症、水疱性類天疱瘡、小児脂肪便症、脱髄性脳症、皮膚筋炎、炎症性腸疾患(潰瘍性結腸炎及びクローン病)、多発性硬化症、心筋炎、筋炎、鼻ポリープ、慢性副鼻腔炎、尋常性天疱瘡、原発性糸球体腎炎、乾癬、外科的癒着、狭窄若しくは再狭窄、強膜炎、強皮症、湿疹(アトピー性皮膚炎、刺激性皮膚炎、アレルギー性皮膚炎を含む)、歯周病(すなわち、歯根膜炎)、多嚢胞性腎臓病、及びI型糖尿病が挙げられる。他の例として、脈管炎(例えば、巨細胞性動脈炎(側頭動脈炎、Takayasu動脈炎)、結節性多発動脈炎、アレルギー性脈管炎及び肉芽腫症(チャーグ-ストラウス病)、多発脈管炎オーバーラップ症候群、過敏性脈管炎(ヘーノホ-シェーンライン紫斑病)、血清病、薬物誘発脈管炎、感染性脈管炎、腫瘍性脈管炎、結合組織障害と関係ある脈管炎、補体系の先天的欠失と関係ある脈管炎、ウェゲネル肉芽腫症、川崎病、中枢神経系の脈管炎、バーガー病及び全身性硬化症);胃腸管疾患(例えば、膵臓炎、クローン病、潰瘍性結腸炎、潰瘍性直腸炎、原発性硬化性胆管炎、特発性を含むいずれかの原因の良性狭窄症(例えば、胆管、食道、十二指腸、小腸又は結腸の狭窄);呼吸器疾患(例えば、喘息、過敏性肺臓炎、アスベスト症、珪肺及び他形態の塵肺、慢性気管支炎及び慢性閉塞性気道疾患);鼻涙管疾患(例えば、特発性を含むすべての原因の狭窄);及び耳管疾患(例えば、特発性を含むすべての原因の狭窄)が挙げられる。特に、非癌状態は、足底いぼ、心臓肥大、又は癌悪液質でよい。
【0026】
この発明の化合物は、アルキル化薬、血管形成インヒビター、代謝拮抗薬、DNA切断薬、DNA架橋薬、DNAインターカレーター、DNA小溝バインダー、エンジイン、熱ショックタンパク質90インヒビター、ヒストンデアセチラーゼインヒビター、微小管安定薬、ヌクレオシド(プリン又はピリミジン)類似体、核外移行インヒビター、プロテアソームインヒビター、トポイソメラーゼ(I又はII)インヒビター、チロシンキナーゼインヒビターといった他の抗癌薬又は細胞毒性薬と組み合わせて投与することができる。特有の抗癌薬又は細胞毒性薬として、β-ラパコン、アンサマイシンP3、アウリスタチン(auristatin)、ビカルタミド、ブレオマイシン、ブレオマイシン、ボルテゾミブ、ブスルファン、カリケアマイシン、カリスタチン(callistatin)A、カンプトセシン、カペシタビン、CC-1065、シスプラチン、クリプトフィシン(cryptophycins)、ダウノルビシン、ディスコダーモライド(discodermolide)、ディソラゾール(disorazole)、ドセタキセル、ドキソルビシン、ドュオカルマイシン(duocarmycin)、ディネマイシン(dynemycin)A、エポチロン、エトポシド、フロクスウリジン、フロクスウリジン、フルダラビン、フルオロウラシル(fluoruracil)、ゲフィチニブ、ゲルダナマイシン、17-アリルアミノ-17-デメトキシゲルダナマイシン(17-AAG)、17-(2-ジメチルアミノエチル)アミノ-17-デメトキシゲルダナマイシン(17-DMAG)、ゲムシタビン、ヒドロキシウレア、イマチニブ、インターフェロン、インターロイキン、イリノテカン、レプトマイシンB、マイタンシン(maytansine)、メトトレキセート、マイトマイシンC、オキサリプラチン、パクリタキセル、スポンジスタチン、スベロイルアニリドヒドロキサム酸(SAHA)、チオテパ、トポテカン、トリコスタチンA、ビンブラスチン、ビンクリスチン及びビンデシンが挙げられる。
【0027】
好ましくは、この発明の化合物は、例えば、カラムクロマトグラフィー、高圧液体クロマトグラフィー、再結晶、又は他の精製法後の精製形及び単離形で提供される。この発明の化合物の特定の立体異性体が示されている場合、該立体異性体は、好ましくは実質的に他の立体異性体がない。
この発明の化合物は、この発明の化合物と賦形剤を含む医薬製剤に使用される。使用しうる賦形剤として、担体、表面活性剤、増粘剤若しくは乳化剤、固体バインダー、分散若しくは懸濁助剤、可溶化剤、着色剤、調味剤、コーティング剤、崩壊剤、潤沢剤、甘味料、保存剤、等張剤、及びその組合せが挙げられる。適切な賦形剤の選択と使用はGennaro, ed., Remington: The Science and Practice of Pharmacy, 20th Ed. (Lippincott Williams & Wilkins 2003)(この開示は、参照によって本明細書に取り込まれる)で教示されている。
【0028】
本組成物は、固体、半固体、又は液体形態のようないずれの適切な形態でもよい。一般に、本医薬製剤は、外部、腸内、又は腸管外投与に好適な有機若しくは無機担体又は賦形剤との混合物中の活性成分として1種以上の本発明の化合物を含む。例えば、錠剤、丸剤、カプセル剤、座剤、腟坐剤、液剤、乳剤、懸濁剤、及び用途に適した他の形態用の通常の無毒の薬剤的に許容しうる担体と活性成分をコンパウンドすることができる。使用可能な担体として、水、グルコース、ラクトース、アカシアゴム、ゼラチン、マンニトール、デンプンペースト、三ケイ酸マグネシウム、タルク、トウモロコシデンプン、ケラチン、コロイドシリカ、ジャガイモデンプン、尿素、及び固体、半固体、又は液体形態の製剤の製造で使うのに適した他の担体が挙げられる。さらに、補助的な安定剤、増粘剤、並びに着色剤及び香料を使用しうる。好ましい投与態様として静脈内投与が挙げられ、子宮頚癌、膀胱癌、又は足底いぼのような特定適応症の場合、局所投与が挙げられる。
適用できる場合、この発明の化合物をマイクロカプセル及びナノ粒子として製剤化することができる。一般的なプロトコルは、例えばBosch et al., US 5,510,118 (1996); De Castro, US 5,534,270 (1996);及びBagchi et al., US 5,662,883 (1997)(すべて参照によって本明細書に取り込まれる)に記載されている。体積に対する表面積の比率を増すことによって、別のやり方では経口送達に適用できない化合物の経口送達を可能にする。
【0029】
本発明の化合物の用量レベルは、1日当たり約0.1mg〜約100mg/kg(体重)、好ましくは1日当たり約1〜約50mg/kg(体重)のオーダーである。さらに好ましくは、用量レベルは、1日当たり約5mg〜約20mg/kg(体重)であり、体重70kgの患者を想定した場合、1日当たり約350mg〜約1400mg/患者に相当する。本発明の化合物は、間欠性を基礎として、すなわち、半周、週、半月、又は月間隔で投与される。
担体材料と合わせて単一剤形を生成しうる活性成分の量は、治療する宿主及び個々の投与態様によって変わるだろう。例えば、ヒトへの経口投与を意図した製剤は、組成物全体の約5%〜約95%で変化しうる担体材料を含みうる。単位剤形は、通常、約5mg〜約500mgの活性成分を含む。
しかし、いずれかの特定患者に特有の用量レベルは種々の因子に左右されることが分かるだろう。この因子として、利用する特有の化合物の活性;被験者の体重、一般的健康、性別、及び食事制限;投与の時間と経路及び薬物の排泄率;治療で複合製剤を利用するかどうか;及び治療が求められている特定の疾患又は状態の重症度が挙げられる。
【0030】
当業者は、ターゲティング成分、リンカー成分、及び活性薬を含む治療複合物において、化合物15〜17のような一級又は二級アミン基を有するこの発明の化合物を使用できることが分かるだろう。このような複合物では、レプトマイシン化合物は活性薬、つまりターゲティング成分の作用によって標的細胞に送達される弾頭である。ターゲティング成分は、該標的細胞上の特徴分子に対して親和性を有する抗体(特にモノクロナール抗体)でよい。詳細に説明するため、癌の化学療法では、特徴分子は該モノクロナール抗体によって認識される腫瘍関連抗原でよい。リンカー成分は、該複合物が癌細胞によって、又は癌細胞に近接して内部に取り入れられるとき切断して抗癌薬としてレプトマイシン化合物を放出することが任じられる。一級又は二級アミンは、リンカー成分へのレプトマイシン化合物の便利な付着点、特にp-アミノベンジルオキシカルボニル(PABC)基のような“自己犠牲にする”基として働く。例えば、Carl et al., J. Med. Chem. 1981, 24 (3), 479-480;及びCarl et al., WO 81/01145 (1981)(これら開示は、参照によって本明細書に取り込まれる)を参照されたい。
【0031】
理論に拘泥されないが、我々は、我々の発明の化合物は、LMBの機序に似た機序で作用して標的癌細胞内でのCRM-1媒介核外移行プロセスを阻害することによってアポトーシスを誘発すると考える。LMB中の2,3-デヒドロ-δ-バレロラクトン成分はマイケル(Michael)反応アクセプターである。LMBは、CRM1のシステイン529とこの位置でマイケル付加物を形成することによってCRM1を阻害することが分かっている(Kudo et al., Proc. Nat'l Acad. Sci. (USA) 1999, 96 (3), 9112-9117)。この発明の化合物は重要な2,3-デヒドロ-δ-バレロラクトンファルマコフォアを保持しているので、同じ阻害機序によって作用すると予想することができる。
【0032】
【化10】

【0033】
多くの癌細胞は、アポトーシス誘導腫瘍サプレッサータンパク質p53の機能の損失をもたらす突然変異を有する(Vousden et al., Nat. Rev. Cancer 2002, 2, 594-504)。このような癌の例として、前立腺癌及びヒトパピローマウイルス(HPV)関連子宮頚癌が挙げられる。LMBが、子宮頚癌細胞の核内でp53タンパク質を蓄積させることが分かっている(Lane et al., Proc. Nat'l Acad. Sci. (USA) 2000, 97, 8501-8506)。DNA損傷によるp53の不完全な上方制御の特徴がある前立腺癌では、細胞核はp53が欠損している。LMBが核内でp53をトラップしてアポトーシスを誘導することが分かっている。従って、前立腺癌は、LMBに高度に感受性である(Peehl et al., Prostate 2003, 54, 258-267)。
適切なタイプの癌に対しては、他の抗癌薬、特にイマチニブ(そのメシラートは登録商標名GleevecTMで知られる)のようなチロシンキナーゼインヒビターと相乗的にこの発明の化合物を使用することができる。慢性骨髄性白血病(CML)のように融合タンパク質Bcr-Ablの発現によって特徴づけられる癌がある。Bcr-Ablは正常に核内に移入されず、Bcr-Abl/イマチニブ複合体が核内に移入される。LMBも存在する場合、LMBは、核からのBcr-Ablの移出を阻害する。さらに、核-トラップされたBcr-Ablはアポトーシスを誘導し、Bcr-Ablポジティブ細胞の死をもたらす。例えばVigneri et al., Nature Medicine 2001, 7, 228-234; Wang et al., US 2003/0162740 A1 (2003)を参照されたい。従って、イマチニブとこの発明のLMB化合物の組合せは、相乗的にBcr-Ablポジティブ癌細胞を攻撃するための機序を提供しうる。
従って、この発明の化合物を用いて、CRM1と共有結合付加物を形成し、かつ該タンパク質のCRM1媒介移行プロセスを妨げることによって、p53、p73、Bcr-Abl、STAT1、(i)ADAR1、Rev、及びアクチンのようなタンパク質の細胞核からの核外移行を阻害することができる。ある態様では、阻害されるタンパク質がp53である。別の態様では、阻害されるタンパク質がBcr-Ablである。特定の可変性は細胞型及び標的タンパク質によって予想されるが、一般的に、使用する阻害量は、0.3〜740nM、好ましくは0.3〜20nM、さらに好ましくは0.3〜2.0nMの範囲内である。
以下の実施例を参照して、さらにこの発明の実施を理解できるだろう。なお、実施例は例示として提供したものであり、限定するものではない。
【0034】
実施例1−液相合成の一般手順
下記式に示すように、原型としてLMBを用いて液相法でこの発明の化合物を合成することができる。
【化11】

【0035】
アメリカ培養細胞系統保存機関(American Type Culture Collection)(Manassas, Virginia)から得たストレプトマイセス属ATCC 39366の発酵によってLMBを得た。ATCCから受け取った試料からの単一アイソレートのスクリーニングにより高産生性アイソレートを得、発酵に使用した。LMBはSigma-Aldrich(St. Louis, Missouri)から商業的に入手することもできる。
LMB(12.2mg,0.027mmol,1当量)、N-ヒドロキシベンゾトリアゾール(“HOBt”,3.4mg,0.025mmol,1.1当量)、及び(ベンゾトリアゾール-1-イルオキシ)トリピロリジノホスホニウムヘキサフルオロホスフェート(“PyBOP”,13mg,0.025mmol,1.1当量)を乾燥N,N-ジメチルホルムアミド(“DMF”,400μL)に溶かした。引き続きアミンA(0.025mmol,1.1当量)とジイソプロピルエチルアミン(“DIEA”,ヒューニッヒ塩基としても知られる,16μL,0.09mmol,4当量)を添加した。反応を窒素下室温で20時間撹拌した。反応を水とジクロロメタン(“DCM”)に分配した。有機層を水(2×)、飽和炭酸水素ナトリウム(1×)、及び食塩水(1x)で洗浄した。有機層を硫酸ナトリウム上で乾燥させ、ろ過し、真空中で濃縮した。粗生成物(油)をシリカフラッシュカラム(0.5×5cm)に適用して0%〜60%のアセトン/ヘキサン又は0%〜10%のメタノール/DCMで溶出した。生成物Iaを含むフラクションをプールして真空中で濃縮した。
【0036】
実施例2−固相合成の一般手順
或いは、下記式に示されるように、固相合成を用いてこの発明の化合物を作製することができる。
【化12】

【0037】
10mLの固相反応器をPS-HOBT(HL)樹脂(B,267mg,約0.24mmol,1.0当量,0.9mmol/g,Argonaut;上式中、樹脂マトリックスは黒玉で示される)及びDCM(3.2mL)中の4-ジメチルアミノピリジン(“DMAP”,18mg,0.144mmol,0.6当量)の溶液で充填する。反応混合物に乾燥DMF(960μL)中のLMB(200mg,0.37mmol,1.53当量)の溶液を加えて窒素と共に1分撹拌する。反応にDCM中のジイソプロピルカルボジイミド(“DIC”,170μL,1.06mmol,4.4当量)の溶液を加え、反応混合物を振動テーブル上で室温にて3時間撹拌する。真空ろ過で溶媒を除去する。樹脂をDMF(3×)、DCM(3×)、DMF(3×)、及びテトラヒドロフラン(3×)で洗浄してLMB-装填樹脂Cを得、回収して-20℃で貯蔵する。
アミンA(0.036mmol, 0.6当量)及びジイソプロピルエチルアミン(7μL,0.04 mmol,0.67当量)を乾燥DCM(1mL)に溶かす。この溶液にLMB-装填樹脂C(110mg,約0.06mmol,1当量)を懸濁させ、室温で3時間撹拌する。溶液をろ過し、樹脂をDCM(3×)ですすぐ。混ぜ合わせたろ液を真空中で濃縮して黄色油を得る。粗製油をシリカフラッシュカラム(0.5×5cm)に適用して0%〜60%のアセトン/ヘキサン又は0%〜10%のメタノール/DCMで溶出する。生成物Iaを含むフラクションをプールして真空中で濃縮する。
【0038】
実施例3−化合物1
実施例1の手順に従い、メチルアミン(Sigma-Aldrich)を用いて化合物1を作製した。
C34H51NO5について計算したLRMS:553.4;実測値 554.4 (M+H)。
実施例4−化合物2
実施例1の手順に従い、2-アミノエタノール(Sigma-Aldrich)を用いて化合物2を作製した。13C NMR (100 MHz, CDCl3) δ 12.27, 13.02, 13.25, 13.52, 16.06, 17.94, 20.91, 26.45, 30.90, 32.22, 33.27, 33.48, 40.76, 42.27, 45.11, 45.59, 47.25, 62.47, 73.41, 81.59, 119.50, 119.85, 122.50, 128.06, 130.20, 135.04, 135.42, 136.37, 136.96, 151.83, 152.69, 164.58, 168.37, 215.39;C35H53NO6について計算したHRMS:583.39729;実測値 584.39423 (M+H)。
実施例5−化合物3
実施例1の手順に従い、4-フェニルベンジルアミン(Sigma-Aldrich)を用いて化合物3を作製した。13C NMR (100 MHz, CDCl3) δ 12.27, 12.65, 13.00, 13.35, 13.67, 16.09, 18.04, 20.92, 26.49, 32.23, 33.30, 33.48, 40.77, 42.91, 45.00, 45.49, 46.92, 73.98, 81.48, 119.60, 119.92, 122.59, 126.99, 127.23, 127.31, 128.02, 128.23, 128.72, 130.16, 135.07, 135.46, 136.30, 136.91, 137.69, 151.56, 152.58, 164.35, 166.69, 215.25;C46H59NO5について計算したLRMS:705.4;実測値 707.0 (M+H)。
実施例6−化合物4
実施例1の手順に従い、Lancaster Synthesisから入手可能な3-(2-アミノエチル)ピリジンを用いて化合物4を作製した。13C NMR (100 MHz, CDCl3) δ 12.27, 12.99, 13.09, 13.52, 16.11, 17.96, 20.87, 26.46, 30.87, 32.19, 32.95, 33.30, 33.48, 40.06, 40.76, 44.96, 45.55, 47.20, 73.59, 81.48, 119.57, 119.90, 122.58, 123.54, 127.96, 128.15, 130.11, 134.78, 135.09, 135.42, 136.28, 136.54, 136.91, 147.52, 149.86, 151.64, 152.33, 164.37, 167.05, 215.20;C40H56N2O5について計算したLRMS:644.9;実測値 646.0 (M+H)。
【0039】
実施例7−化合物5
実施例1の手順に従い、6-アミノインダゾール(Sigma-Aldrich)を用いて化合物5を作製した。C40H53N3O5について計算したLRMS:655.9;実測値 657.0 (M+H)。
実施例8−化合物6
実施例1の手順に従い、N-Boc-エチレンジアミン(Sigma-Aldrich)を用いて化合物6を作製した。13C NMR (100 MHz, CDCl3) δ 12.26; 12.87, 12.97, 13.51, 16.11, 17.84, 20.84, 26.30, 26.38, 26.45, 28.30, 32.15, 33.28, 33.48, 39.94, 40.50, 40.74, 45.05, 45.51, 45.60, 46.19, 46.23, 47.03, 73.82, 79.29, 81.46, 119.80, 119.91, 122.60, 127.91, 128.16, 130.08, 135.10, 135.40, 136.23, 136.89, 151.60, 151.96, 156.62, 164.34, 167.53, 215.24;C40H62N2O7について計算したLRMS:682.5;実測値 683.6 (M+H)。
実施例9−化合物7
実施例1の手順に従い、N,N-ジメチルエチレンジアミン(Sigma-Aldrich)を用いて化合物7を作製した。13C NMR (100 MHz, CDCl3) δ 12.29, 12.68, 12.99, 13.53, 13.61, 16.09, 17.77, 20.81, 26.48, 32.13, 33.25, 33.49, 36.28, 40.75, 45.02, 45.52, 46.82, 57.90, 73.93, 81.43, 119.97, 122.66, 127.90, 128.17, 130.05, 135.15, 135.39, 136.27, 136.90, 151.49, 164.25, 166.92, 215.25;C37H58N2O5について計算したLRMS:610.4;実測値 612.0 (M+H)。
【0040】
実施例10−化合物8
実施例1の手順に従い、4-(3-アミノプロピル)モルフォリン(Sigma-Aldrich)を用いて化合物8を作製した。13C NMR (100 MHz, CDCl3) δ 8.61, 12.28, 12.84, 12.99, 13.56, 16.11, 17.86, 20.84, 25.16, 26.47, 32.17, 33.22, 33.49, 38.17, 40.76, 45.03, 45.52, 46.01, 46.95, 53.43, 57.15, 66.61, 73.72, 81.46, 119.94, 120.03, 122.62, 127.94, 128.14, 130.09, 135.12, 135.42, 136.31, 136.90, 151.57, 215.27;C40H62N2O6について計算したLRMS:666.5;実測値 667.5 (M+H)。
実施例11−化合物9
実施例1の手順に従い、2-フェノキシエチルアミン(Sigma-Aldrich)を用いて化合物9を作製した。13C NMR (100 MHz, CDCl3) δ 12.28, 12.65, 13.00, 13.54, 13.63, 16.08, 17.95, 20.87, 26.48, 32.19, 33.26, 33.48, 38.57, 40.76, 44.99, 45.51, 46.85, 66.75, 74.00, 81.45, 114.39, 119.60, 119.96, 121.00, 122.62, 127.98, 128.17, 129.47, 130.10, 135.09, 135.43, 136.30, 136.89, 151.53, 152.58, 158.46, 166.87, 215.20;C41H57NO6について計算したLRMS:659.4; 実測値 661.0 (M+H)。
【0041】
実施例12−化合物10
実施例1の手順に従い、Novabiochemから入手可能なグリシンメチルエステルを用いて化合物10を作製した。13C NMR (100 MHz, CDCl3) δ 12.27, 12.77, 12.99, 13.52, 16.06, 18.00, 20.84, 26.47, 31.36, 32.16, 33.25, 33.47, 36.43, 40.74, 40.94, 45.06, 45.52, 46.90, 52.22, 73.91, 81.45, 118.95, 119.94, 122.62, 127.95, 128.14, 130.10, 135.09, 135.41, 136.30, 136.89, 151.56, 153.58, 162.49, 164.32, 166.74, 170.67, 215.16;C36H53NO7について計算したLRMS:611.4;実測値 613.0 (M+H)。
実施例13−化合物11
実施例1の手順に従い、TCI-Americaから入手可能な2-(2-アミノエチル)-1,3-ジオキソランを用いて化合物11を作製した。13C NMR (100 MHz, CDCl3) δ 12.28, 12.65, 12.98, 13.52, 13.58, 16.07, 17.84, 20.82, 26.47, 32.14, 32.75, 33.24, 33.48, 34.27, 40.74, 44.95, 45.51, 46.81, 64.85, 74.02, 81.43, 103.67, 119.95, 120.08, 122.64, 127.93, 128.14, 130.06, 135.11, 135.41, 136.29, 136.88, 151.40, 151.52, 164.27, 166.68, 215.20;C38H57NO7について計算したLRMS:639.4;実測値 641.0 (M+H)。
【0042】
実施例14−化合物12
実施例1の手順に従い、(R)-2-アミノ-3-ベンジルオキシ-1-プロパノール(Sigma-Aldrich)を用いて化合物12を作製した。13C NMR (100 MHz, CDCl3) δ 12.28, 12.84, 13.00, 13.57, 16.08, 17.88, 20.84, 26.48, 32.16, 33.25, 33.48, 40.76, 45.16, 45.52, 46.93, 50.56, 63.87, 70.30, 73.39, 73.81, 81.45, 119.62, 119.94, 122.63, 127.66, 127.84, 127.95, 128.16, 128.45, 130.08, 135.12, 135.41, 136.30, 136.90, 137.59, 151.56, 152.94, 164.34, 167.26, 215.21;C43H61NO7について計算したLRMS:703.4;実測値 705.0 (M+H)。
実施例15−化合物13
実施例1の手順に従い、D-アラニンtert-ブチルエステル(Novabiochem)を用いて化合物13を作製した。13C NMR (100 MHz, CDCl3) δ 12.28, 12.60, 13.00, 13.56, 16.07, 17.85, 18.79, 20.85, 26.48, 27.90, 32.18, 33.26, 33.48, 40.74, 45.08, 45.46, 46.80, 48.25, 74.13, 81.50, 81.77, 119.61, 119.97, 122.61, 127.97, 128.18, 130.18, 135.08, 135.42, 136.29, 136.91, 151.52, 152.68, 165.97, 172.53, 215.18;C40H61NO7について計算したLRMS:667.4;実測値 669.0 (M+H)。
実施例16−化合物14
実施例1の手順に従い、Flukaから入手可能なN-Boc-1,4-ブタンジアミンを用いて化合物14を作製した。13C NMR (100 MHz, CDCl3) δ 12.25, 12.96, 13.05, 13.51, 16.09, 17.84, 20.83, 26.29, 26.37, 26.45, 26.75, 27.52, 28.33, 32.14, 33.28, 33.46, 38.70, 40.73, 45.00, 45.52, 46.07, 46.17, 46.21, 47.14, 73.67, 81.43, 119.88, 119.96, 122.60, 127.88, 128.16, 130.04, 135.10, 135.38, 136.22, 136.87, 151.43, 151.61, 156.04, 164.32, 167.05, 215.18;C42H66N2O7について計算したLRMS:710.5;実測値 711.6 (M+H)。
【0043】
実施例17−化合物15
実施例1の手順に従い、ジイソプロピルエチルアミンを省略する変形で、エチレンジアミン(Sigma-Aldrich)を用いて化合物15を作製した。1H NMR, 部分データ,(400 MHz, CD3OD) δ 7.13 (dd, 1H), 6.71 (d, 1H), 6.01 (d, 1H), 5.96 (dd, 1H), 5.78 (dd, 1 H), 5.69-5.61 (m, 2H), 5.24 (d, 1H), 5.10 (ddd, 1H), 5.03 (d, 1H), 3.77 (m, 1H), 3.56 (dd, 1H), 3.42 (app t, 2H), 3.07 (app t, 2H), 2.84 (m, 1H), 2.73 (m, 1H), 2.63 (m, 1H), 2.26-1.82 (m), 1.59 (m, 1H), 1.14 (d, 3H), 1.08-1.02 (m, 9H), 0.97 (d, 3H), 0.69 (d, 3H)。
実施例18−化合物16
実施例1の手順に従い、ジイソプロピルエチルアミンを省略する変形で、Sigma-Aldrichから入手可能なN-メチルエチレンジアミンを用いて化合物16を作製した。C36H57N2O5について計算したLRMS:597.4262;実測値 597.4278 (M+H)。.
実施例19−化合物17
実施例1の手順に従い、ジイソプロピルエチルアミンを省略する変形で、Sigma-Aldrichから入手可能なN-イソプロピルエチレンジアミンを用いて化合物17を作製した。1H NMR, 部分データ, (400 MHz, CD3OD) δ 7.13 (dd, 1H), 6.71 (d, 1H), 6.03-5.96 (m, 2H), 5.78 (dd, 1 H), 5.68-5.61 (m, 2H), 5.24 (d, 1H), 5.10 (dd, 1H), 5.03 (d, 1H), 3.77 (m, 1H), 3.55 (dd, 1H), 3.46 (app t, 2H), 3.26 (m, 1H), 3.04 (app t, 2H), 2.84 (m 1H), 2.71 (m, 1H), 2.63 (m, 1H), 2.27-1.83 (m), 1.59 (m, 1H), 1.26 (d, 6H), 1.14 (d, 3H), 1.10-1.02 (m, 9H), 0.98 (d, 3H), 0.69 (d, 3H)。
【0044】
実施例20−化合物18
実施例1の一般手順を用い、室温で12時間の反応時間で化合物18を作製した。下記式のアミンはMolecular Probes, Eugene, Oregonから得た。
【化13】

【0045】
13C NMR (100 MHz, CDCl3) δ 6.58, 11.04, 12.28, 13.00, 13.41, 13.51, 14.43, 16.12, 17.59, 20.73, 26.31, 26.39, 32.05, 33.10, 33.50, 40.75, 45.71, 46.18, 43.23, 47.56, 71.96, 81.40, 111.30, 114.39, 119.13, 119.91, 122.68, 127.73, 128.24, 129.90, 135.27, 136.17, 136.89, 146.03, 147.84, 151.55, 154.62, 160.33, 160.89, 164.28, 166.86, 214.74;C43H59N3O7について計算したLRMS:729.4;実測値 731.0 (M+H)。
実施例21−化合物19
実施例1の一般手順を用いて化合物19を作製した。下記式のアミンはMolecular Probesから得た。
【化14】

【0046】
13C NMR (100 MHz, CDCl3) δ 11.25, 12.27, 12.82, 12.97, 13.53, 14.88, 16.12, 17.78, 20.85, 24.73, 26.30, 26.38, 26.47, 29.62, 32.16, 33.25, 33.49, 35.53, 39.72, 40.75, 45.08, 45.51, 46.26, 47.00, 73.77, 81.47, 117.24, 119.73, 119.92, 120.42, 122.63, 123.79, 127.93, 128.16, 130.10, 133.25, 135.11, 135.43, 136.26, 136.90, 143.95, 151.58, 152.26, 160.29, 164.34, 167.56, 172.80, 215.25;;C49H68BF2N4O6について計算したLRMS:857.51945;実測値 857.52108 (M+H)。
実施例22−化合物20
実施例1の一般手順を用いて化合物20を作製した。下記式のアミンはMolecular Probesから得た。
【化15】

【0047】
C60H73BF2N4O7SNaについて計算したLRMS:1053.51457;実測値 1053.51533 (M+Na)。
実施例24−化合物21
LMB(20mg,0.037mmol,1当量)を乾燥Et2O(150μL)とTHF(100μL)に溶かした。この清澄な溶液にトリエチルアミン(6.1μL,0.044mmol,1.2当量)とエチルクロロホルメート(4.2μL,0.044mmol,1.2当量)を加え、反応をN2下で室温にて45分撹拌した。2分後、反応混合物が曇ってきた。
この粗製活性化LMBを、50mMのNa2HPO4(100μL)、EtOH(50μL)、及びEtOAc(50μL)中のグリシン(3.2mg,0.042mmol,1.1当量)の溶液に滴加した。時々濃KOH水溶液を添加してpHを約9に維持しながら反応混合物を室温で1.5時間撹拌した。
2N HClで反応混合物を酸性にしてpH 2としてからEtOAc(2mL)と飽和NH4Cl(2mL)に分配した。水層をEtOAc(2mL,2×)で抽出した。混ぜ合わせた有機部分を食塩水(5mL,1×)で洗浄し、Na2SO4上で乾燥させ、ろ過し、真空中で濃縮して明黄色油を得た。粗生成物をシリカフラッシュカラム(0.5×3cm)に適用し、0、5、及び10%(+0.1% AcOH)のMeOH/CH2Cl2で溶出した。5% MeOH/CH2Cl2で溶出するフラクションをプールし、真空中で濃縮して化合物21を得た(8.3mg,0.014mmol,37%)。13C NMR (100 MHz, CDCl3) δ 12.23, 12.95, 13.27, 13.51, 13.71, 16.06, 17.88, 20.78, 26.47, 29.07, 32.13, 33.15, 33.45, 40.73, 41.47, 45.32, 45.61, 47.40, 53.73, 73.30, 81.49, 119.16, 119.82, 122.59, 127.86, 128.09, 128.22, 130.10, 135.15, 135.41, 136.31, 136.88, 151.79, 153.65, 164.59, 167.86, 173.35, 175.76, 215.05;C35H51N4O7Naについて計算したLRMS:620.65511;実測値:620.35577 (M+Na)。
当業者には、上記手順を他の出発原料又は試薬と適合させ、必要な変更を加えて、この発明の他の化合物を作製できることが分かるだろう。
【0048】
〔生物学的活性〕
この発明の化合物が種々の腫瘍細胞系統の増殖に及ぼす阻害効果を測定することによって、これら化合物の生物学的活性を評価した。LMBについての比較結果を含め、結果を表2に示す。MCF-7、A549、及びSKOV-3は、それぞれヒト乳癌、肺癌、及び卵巣癌の細胞系統である。NCI/ADRは多剤耐性乳癌細胞系統である。CCRF-CEM及びCCRF-CEM/PTXは、ヒト白血病細胞系統であり、後者はパクリタキセル耐性亜系統である。LNCaPは前立腺癌細胞系統である。
【0049】

【0050】
表2のデータは、この発明の化合物が抗増殖薬としてLMBの活性に匹敵する活性を有することを示す。
下表3にLMBについての比較データを含めて示すように、この発明のいくつかの化合物のK562、Bcr-AblポジティブCML細胞系統に対する細胞毒性についてもデータを得た。
【0051】

【0052】
単一用量静脈内投与時のマウスの最大耐量(MTD)を代表的選択の化合物について決定した。LMBについての比較データを含めてデータを下表4にまとめた。

【0053】
表5は、マウス膀胱癌細胞の系統であるMB 49細胞に対するLMBとこの発明の選ばれた化合物の細胞毒性に関するデータを示す。

【0054】
さらに、2系統のヒト膀胱癌細胞(UMUC-3とT24)に対するLMBの細胞毒性を決定した。EC50値は、それぞれ0.00033μM及び0.0012μMだった。
上述した本発明の詳細な説明は、主に又は排他的に本発明の特定の部分又は局面に関する節を含む。これは明瞭さと簡便さのためであり、個々の特徴はそれが開示されているその節だけでなく関連することもあり、かつ本明細書の開示は異なる節で見られる情報のすべての適切な組合せを包含するものと解釈する。同様に、本明細書の種々の図及び説明は本発明の特有の態様に関するものであるが、個々の図又は態様の文脈で特有の特徴が開示されている場合、該特徴は、妥当な範囲まで、別の図又は態様の文脈で、又は別の特徴と組み合わせて、又は本発明一般にも使用できるものと解釈する。
さらに、本発明は特に特定の好ましい態様に関して記載されているが、本発明はこのような好ましい態様に限定されない。むしろ、本発明の範囲は、添付の特許請求の範囲によって定義される。
【発明の詳細な説明】
【0001】
〔発明の技術分野〕
この発明は、レプトマイシン化合物並びにその製造方法及び使用方法に関する。
【0002】
〔発明の背景〕
下記式のレプトマイシンB(“LMB”)は、Hokansonらの米国特許第4,771,070号(1988)及びNettletonらの米国特許第4,792,522号(1988)で報告されているように、もとはストレプトマイセス属から単離された抗腫瘍、抗菌性の天然産物である。
【0003】
【化1】

LMBは、レプトマイシンファミリーと呼ばれる天然産物ファミリーの原型であり、該分子の一端の2,3-デヒドロ-δ-バレロラクトン環と、C5に位置する伸長した炭素鎖(6E、8Z及び12E、14Eジエン系を有する)とを特徴とする。ニトロメチルバレロラクトンLMB類似体は不活性であるが、ビオチン化LMBは活性であることが分かっており、2,3-デヒドロ-δ-バレロラクトン構造が重大なファルマコフォアであることを示唆している(Kudo et al., Exp. Cell Res. 1998, 242, 540-547)。
【0004】
【化2】

レプトマイシンファミリーの他のメンバーとして、 レプトマイシンA、ラートジャドン(ratjadone)、アンギノマイシン(anguinomycin)A〜D、カリスタチン(callystatin)A、カズサマイシン(kazusamycin)A(CL-1957Bとしても知られる)、カズサマイシンB(CL-1957Eとしても知られる)、レプトスタチン(leptolstatin)、及びレプトフラニン(leptofuranin)A〜Dが挙げられる。レプトマイシンBに最も構造的に類似する他のファミリーメンバーの式を以下に示す。
【0005】
【化3】

【0006】
もとは抗菌活性のスクリーニングの結果として同定されたが、LMBの現在の関心は主に抗腫瘍薬としてのその可能性にある。例えば、Komiyama et al., J. Antibiotics 1985, 38 (3), 427-429; Wang et al., US 2003/0162740 A1 (2003)を参照されたい。細胞レベルでは、LMBは、細胞周期のG1とG2相の最後で細胞を静止することによって作用する。分子レベルでは、LMBは核外移行受容体CRM1のインヒビターとして働き、P53、P73、STAT1、(i)ADAR1、Rev、アクチン、及びBcr-ablのような“カーゴタンパク質(cargo proteins)”に結合して核の転位置に影響を及ぼす。Nishi et al., J. Biol. Chem. 1994, 269 (9), 6320-6324; Fukuda et al., Nature 1997, 390, 308-311; Kudo et al.(上掲)を参照されたい。
しかし、LMBは、哺乳動物の細胞に対して顕著な細胞毒性を示し(Hamamoto et al., J. Antibiotics 1983, 36 (6), 639-645)、その抗癌薬としての魅力を軽減してしまう。従って、極端な毒性のため1994年にLMBの相1試験は停止された。LMB様活性を示すが、毒性が低い、より見込みのある抗癌薬を同定するための努力において、LMBをいくつかの細菌及び真菌との生物変換スクリーニングに供したところ、いくつかの誘導体が単離された(Kuhnt et al., Applied Environ. Microbiol. 1998, 64 (2), 714-720):26-ヒドロキシレプトマイシンB、4,11-ジヒドロキシレプトマイシンB、2,3-ジヒドロレプトマイシンB、及びレプトマイシンBグルタミンアミド。
【0007】
【化4】

このアプローチはいくつかの欠点に悩まされる。得られる産物の構造上の多様性が乏しかった:導入される官能基の種類が限定され、かつ官能基が導入される位置がでたらめであり、構造と活性の関係の体系的な誘導を妨げた。費やした努力の代償として得られた化合物の数は少なかった(合計101種の細菌及び真菌株に係るスクリーニングから4つの化合物)。多くの場合、生物変換収率は低かった。従って、抗癌薬として使うためのレプトマイシン化合物を得ることへの代替アプローチが望まれる。
【0008】
〔発明の簡単な概要〕
第1局面では、この発明は、下記式Iの構造を有する化合物及びその薬剤的に許容しうるエステル、塩、溶媒和物、水和物及びプロドラッグ形を提供する。
【化5】

【0009】
式中、mは0、1、2、3、4、又は5であり;
R0は、H、C1-C5アルキル、C2-C5アルケニル、又はC2-C5アルキニルであり;
各R1は、独立的にH、C1-C5アルキル、C2-C5アルケニル、又はC2-C5アルキニルであり;
R2は、H、アリール、シクロアルキル、ヘテロ環成分、下記式であり;
【化6】

【0010】
(式中、
R3は、H、C1-C5アルキル、C2-C5アルケニル、又はC2-C5アルキニルであり(mが0のときはR3がHでないという条件で);
R4は、H、C1-C5アルキル、C2-C5アルケニル、C2-C5アルキニル、アリール、シクロアルキル、又はヘテロ環成分であり;
R5は、H、C1-C5アルキル、C2-C5アルケニル、C2-C5アルキニル、アリール、シクロアルキル、ヘテロ環成分、又はC(=O)O(C1-C5アルキル)であり;かつ
R6は、H、C1-C5アルキル、C2-C5アルケニル、C2-C5アルキニル、シクロアルキル又は蛍光成分であり;或いはR5及びR6とそれらが共通に結合している窒素が一緒に4、5、6、又は7員の窒素含有ヘテロ環式環構造を形成する);
R10は、CH3又はCH2OHであり;
R11は、H又はOHであり;
R12は、CH3、CH2CH3;又はCH(OH)CH3であり;かつ
R13とR14の一方はH又はCH3であり、他方はH又はOHである。
【0011】
第2態様では、標的細胞の増殖を阻害する方法であって、前記標的細胞を、有効量のこの発明の化合物と接触させることを含む方法が提供される。標的細胞は癌細胞、特にヒトの乳癌、肺癌、卵巣癌、前立腺癌、又は白血病細胞でよい。また、標的細胞はヒトパピローマウイルス(HPV)-関連子宮頚癌細胞又は膀胱癌細胞でもよい。
第3態様では、過剰増殖性疾患の治療方法であって、該過剰増殖性疾患に苦しむ患者に治療的に有効な量のこの発明の化合物を投与することを含む方法が提供される。こうして治療される過剰増殖性疾患は、癌、特に乳癌、肺癌、卵巣癌、前立腺癌、又は白血病でよい。また、HPV-関連子宮頚癌又は膀胱癌でもよい。患者は好ましくは哺乳動物、特にヒトである。
第4態様では、過剰増殖性疾患(癌、特に乳癌、肺癌、卵巣癌、前立腺癌、又は白血病でよい)の治療用薬物の調製のためのこの発明の化合物の使用が提供される。また、前記癌は、HPV-関連子宮頚癌又は膀胱癌でもよい。
第5態様では、この発明の化合物と賦形剤を含んでなる医薬製剤が提供される。
第6態様では、CRM1媒介プロセスを経て細胞の核からタンパク質が移出することを阻害する方法であって、前記細胞を、阻害量のこの発明の化合物と接触させることを含む方法が提供される。
第7態様では、膀胱癌の治療方法であって、膀胱癌に苦しむ患者に治療的に有効な量のレプトマイシンBを投与することを含む方法が提供される。
【0012】
〔発明の詳細な説明〕
〔定義〕
“アルキル”は、その最長鎖部分に指定数の炭素原子を有する、任意に置換されていてもよい直鎖若しくは分岐鎖炭化水素成分を意味し(例えば“C3アルキル”、“C1-C5アルキル”、又は“C1〜C5アルキル”のように。後の2つの表現は1〜5個の炭素原子を最長鎖部分に有するアルキル基を指す)、或いは炭素原子の数が指定されていない場合、最長鎖部分に1〜4個の炭素原子を有するアルキル基を意味する。
“アルケニル”は、その最長鎖部分に少なくとも1個の炭素-炭素二重結合と指定数の炭素原子を有する、任意に置換されていてもよい直鎖若しくは分岐鎖炭化水素成分を意味し(例えば、“C3アルケニル”、“C2-C5アルケニル”、又は“C2〜C5アルケニル”のように。後の2つの表現は2〜5個の炭素原子を最長鎖部分に有するアルキル基を指す)、或いは炭素原子の数が指定されていない場合、最長鎖部分に2〜4個の炭素原子を有するアルケニル基を意味する。
“アルキニル”は、その最長鎖部分に少なくとも1個の炭素-炭素三重結合と指定数の炭素原子を有する、任意に置換されていてもよい直鎖若しくは分岐鎖炭化水素成分を意味し(例えば、“C3アルキニル”、“C2-C5アルキニル”、又は“C2〜C5アルキニル”のように。後の2つの表現は2〜5個の炭素原子を最長鎖部分に有するアルキル基を指す)、或いは或いは炭素原子の数が指定されていない場合、最長鎖部分に2〜4個の炭素原子を有するアルキニル基を意味する。
【0013】
“アリール”は、任意に置換されていてもよい芳香族単環式、縮合二環式、又は縮合多環式炭化水素若しくはヘテロ環式基(該環部分に1〜20個の炭素原子を有する)、例えば、フェニル、ナフチル、ピロリル、インドリル、ピラゾリル、ピラゾリニル、イミダゾリル、オキサゾリル、イソキサゾリル、チアゾリル、チアダゾリル、イソチアゾリル、フリル、チエニル、オキサジアゾリル、ピリジニル、N-オキソ-ピリジル、ピラジニル、ピリミジニル、ピリダジニル、テトラジニル、トリアジニル、トリアゾリル、ベンゾチアゾリル、ベンゾオキサゾリル、ベンゾチエニル、キノリニル、キノリニル-N-オキシド、イソキノリニル、ベンゾイミダゾリル、ベンゾフリル、クロモニル、クマリニル、シンノリニル、キノキサリニル、インダゾリル、ベンゾイソチアゾリル、ベンゾイソキサゾリル、ベンゾジアジニル、テトラゾリル、ベンゾフラザニル、ベンゾチオピラニル、ベンゾピラゾリル、インドリニル、イソクロマニル、イソインドリニル、ナフチリジニル、フタラジニル、プリニル、キナゾリニル等を意味する。
【0014】
“シクロアルキル”は、任意に置換されていてもよい飽和若しくは不飽和の非芳香族環式炭化水素環系を意味し、好ましくは1〜3個の環及び1つの環当たり3〜7個の炭素を含み、さらに飽和若しくは不飽和のC3-C7炭素環式環と縮合していてもよい。典型的なシクロアルキル環系として、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、シクロヘプチル、シクロオクチル、シクロデシル、シクロドデシル、及びアダマンチルが挙げられる。
“アリールアルキル”は、アリール成分で置換されているアルキル成分を意味し、例えば、ベンジル、フェネチル、N-イミダゾイルエチル、N-モルフォリノエチル、エチルピリジニル等のように、該アルキル成分のところで原子価がオープンである(満たされてない)。
“ヘテロ環”、“ヘテロ環式”、又は“ヘテロシクロ”は、少なくとも1個の炭素原子含有環中に少なくとも1個のヘテロ原子を有する、任意に置換されていてもよい、完全飽和若しくは不飽和の、芳香族又は非芳香族環系を意味し、例えば、4〜7員単環式、7〜11員二環式、又は10〜15員三環式環系を意味する。“ヘテロアリール”は、該環系がアリールであるヘテロ環を意味する。ヘテロ原子を含むヘテロ環式基の各環は、N、O及びS(N及びSは、任意に酸化されていてもよく、かつNは任意に四級化されていてもよい)から選択される1、2又は3個のヘテロ原子を有しうる。単環式ヘテロ環式環系として、ピロリジニル、ピロリル、ビオチニル、インドリル、ピラゾリル、オキセタニル、ピラゾリニル、イミダゾリル、イミダゾリニル、イミダゾリジニル、オキサゾリル、オキサゾリジニル、イソキサゾリニル、イソキサゾリル、チアゾリル、チアジアゾリル、チアゾリジニル、イソチアゾリル、イソチアゾリジニル、フリル、テトラヒドロフリル、チエニル、オキサジアゾリル、ピペリジニル、ピペラジニル、2-オキソピペラジニル、2-オキソピペリジニル、2-オキソピロリジニル、2-オキソアゼピニル、アゼピニル、4-ピペリドニル、ピリジニル、N-オキソ-ピリジル、ピラジニル、ピリミジニル、ピリダジニル、テトラヒドロピラニル、テトラヒドロチオピラニル、テトラヒドロチオピラニルスルホン、モルフォリニル、チオモルフォリニル、チオモルフォリニルスルホキシド、チオモルフォリニルスルホン、1,3-ジオキソラン及びテトラヒドロ-1,1-ジオキソチエニル、ジオキサニル、イソチアゾリジニル、チエタニル(thietanyl)、チイラニル(thiiranyl)、テトラゾリル、トリアジニル、及びトリアゾリル等が挙げられる。好ましいヘテロシクロ基として、ピリジニル、モルフォリニル、ピラジニル、ピリジニル、ピロリル、ピラゾリル、イミダゾリル、チアゾリル、オキサゾリル、イソキサゾリル、チアジアゾリル、オキサジアゾリル、チエニル、フラニル、キノリニル、イソキノリニル、ピペラジニル、及びピペリジニルが挙げられる。
【0015】
例えば、“置換若しくは無置換”又は“任意に置換されていてもよい”という表現を用いて、基が置換されうると示されている場合、該基は、1個以上の独立的に選択される置換基、好ましくは置換基の数が1〜5、さらに好ましくはに1又は2個の置換基を有しうる。当業者は、置換基及び置換パターンを選択して、化学的に安定な、かつ技術的に既知の方法及び本明細書で述べる方法で合成できる化合物を提供できることが分かる。好適な置換基の例として、本明細書で指定されるものに加え、アルキル、アルケニル、アルキニル、アリール、ハロ、トリフルオロメトキシ、トリフルオロメチル、ヒドロキシ、アルコキシ、シクロアルキルオキシ、ヘテロシクロオキシ、アルカノイル、アルカノイルオキシ、アミノ、アルキルアミノ四級アンモニウム、アラルキルアミノ、ヘテロシクロアルキル、シクロアルキルアミノ、ヘテロシクロアミノ、ジアルキルアミノ、アルカノイルアミノ、チオ、アルキルチオ、シクロアルキルチオ、ヘテロシクロチオ、ウレイド、ニトロ、シアノ、カルボキ、カルボキシルアルキル、カルバミル、アルコキシカルボニル、アルキルチオノ、アリールチオノ、アルキルスルホニル、スルホンアミンド(sulfonamindo)、アリールオキシ等が挙げられる。好ましくは、アルキル、アルケニル、及びアルキニル成分の置換基は、数が1〜3で、N-ピロリジニル、N-モルフォリニル、N-アゼチジニル、ヒドロキシル、ハロ、アルコキシ、シアノ、アミノ、アルキルアミノ、及びジアルキルアミノから独立的に選択される。好ましくは、アリール、シクロアルキル、及びヘテロシクロアルキル成分の置換基は、数が1〜3で、アルキル、アルケニル、アルキニル、ヒドロキシアルキル、ハロアルキル、ヒドロキシル、ハロ、アルコキシ、シアノ、アミノアルキル、アルキルアミノアルキル、ジアルキルアミノアルキル、アミノ、アルキルアミノ、及びジアルキルアミノから独立的に選択される。
【0016】
特定の立体異性体が具体的に示されない場合(例えば、構造式の相応の立体中心における太線若しくは破線結合によって、又は構造式でE若しくはZ配置を有するように二重結合を示すことによって、又は立体化学を指示する命名法を用いることによって)、純粋化合物のみならずその混合物のようにすべての立体異性体が本発明の範囲内に含まれる。特に指示しない限り、個々のエナンチオマー、ジアステレオマー、幾何異性体、並びにその組合せ及び混合物がすべて本発明に包含される。多形性結晶形及び溶媒和物も本発明の範囲内に包含される。
“薬剤的に許容しうるエステル”は、in vivo(例えば人体内で)加水分解して親化合物若しくはその塩を生成し、又はそれ自体親化合物の活性に似た活性を有するエステルを意味する。好適なエステル基として、限定するものではないが、薬剤的に許容しうる脂肪族カルボン酸、特にアルカン酸、アルケン酸、シクロアルカン酸及びアルカン二酸(各アルキル若しくはアルケニル成分は、好ましくは6個以下の炭素原子を有する)から誘導されるものが挙げられる。例示エステルとして、ギ酸エステル、酢酸エステル、プロピオン酸エステル、酪酸エステル、アクリル酸エステル、クエン酸エステル、コハク酸エステル、及びエチルコハク酸エステルが挙げられる。
“薬剤的に許容しうる塩”は、本明細書で述べる化合物にある個々の置換基によって決まる比較的無毒の酸又は塩基と調製される、該活性化合物の塩を意味する。化合物が相対的に酸性の官能性を含む場合、該化合物の中性形を十分な量の所望の塩基と、純粋又は適切な不活性溶媒中で接触させることによって塩基付加塩を得ることができる。薬剤的に許容しうる塩基付加塩の例として、ナトリウム塩、カリウム塩、カルシウム塩、アンモニウム塩、有機アミノ塩、若しくはマグネシウム塩、又は同様の塩が挙げられる。化合物が相対的に塩基性の官能性を含む場合、該化合物の中性形を十分な量の所望の酸と、純粋又は適切な不活性溶媒中で接触させることによって酸付加塩を得ることができる。薬剤的に許容しうる酸付加塩の例として、塩酸、臭化水素酸、硝酸、炭酸、一水素-炭酸、リン酸、一水素リン酸、二水素リン酸、硫酸、一水素-硫酸、ヨウ化水素酸、又は亜リン酸等のような無機酸から誘導されるもの、並びに酢酸、アスコルビン酸、プロピオン酸、イソ酪酸、マレイン酸、マロン酸、乳酸、リンゴ酸、グルタミン酸、安息香酸、コハク酸、スベリン酸、フマル酸、マンデル酸、フタル酸、ベンゼンスルホン酸、p-トリルスルホン酸、クエン酸、酒石酸、メタンスルホン酸、ラクトビオン酸等のような比較的無毒の有機酸から誘導される塩が挙げられる。アルギネート(arginate)等のようなアミノ酸の塩、及びグルクロン酸又はガラクツノル酸(galactunoric acid)等のような有機酸の塩も包含される。化合物が塩基性と酸性の両官能性を含む場合、化合物を塩基付加塩又は酸付加塩に変換することができる。
【0017】
本発明は、その範囲内にこの発明の化合物のプロドラッグをも包含する。このようなプロドラッグは、一般的に、必要な化合物に容易にin vivo変換しうる化合物の官能誘導体である。従って、本発明の治療方法において、用語“投与”は、具体的に開示された化合物又は具体的には開示されないが、特定化合物が必要な被験者に投与後、該特定化合物にin vivo変換する化合物による、記載された種々の障害の治療方法を含むものとする。適切なプロドラッグ誘導体の選択と調製の常法は、例えば、Wermuth, “Designing Prodrugs and Bioprecursors,” in Wermuth, ed., The Practice of Medicinal Chemistry, 2nd Ed., pp. 561-586 (Academic Press 2003)に記載されており、この開示は、参照によって本明細書に取り込まれる。プロドラッグとして、in vivo(例えば人体内で)加水分解してこの発明の化合物又はその塩を生成するエステルが挙げられる。好適なエステル基として、限定するものではないが、薬剤的に許容しうる脂肪族カルボン酸、特にアルカン酸、アルケン酸、シクロアルカン酸及びアルカン二酸(各アルキル又はアルケニル成分は、好ましくは6個以下の炭素原子を有する)から誘導されるものが挙げられる。例示エステルとして、限定するものではないが、ギ酸エステル、酢酸エステル、プロピオン酸エステル、酪酸エステル、アクリル酸エステル、クエン酸エステル、コハク酸エステル、及びエチルコハク酸エステルが挙げられる。
“治療的に有効な量”は、研究者、獣医、医師又は他の臨床医が探究してい組織系、動物若しくはヒト内における生物学的又は医学的反応(治療する疾患又は障害の症候の軽減を包む)を誘発する活性化合物又は医薬の当該量を意味する。
“C1〜C5アルキル”又は“5〜10%”のように範囲を規定する場合、該範囲はその範囲の終点を包含する。
【0018】
〔化合物及び方法〕
式Iに戻って、好ましい態様では、R0がH、R10がCH3、R11がH、R12がCH3、R13がCH3、かつR14がHであり、R1、R2、及びmは、上記「発明の簡単な概要」セクションで割り当てた意味をもつ。
別の好ましい態様では、R0がH、R10がCH3、R11がH、R12がCH3又はCH2CH3、R13がH、かつR14がHであり、R1、R2、及びmは、上記「発明の簡単な概要」セクションで割り当てた意味をもつ。
さらに別の好ましい態様では、R0がH、R10がCH2OH、R11がH、R12がCH3又はCH2CH3、R13がCH3、かつR14がHであり、R1、R2、及びmは、上記「発明の簡単な概要」セクションで割り当てた意味をもつ。
本発明の特に好ましい態様では、R0がH、R10がCH3、R11がH、R12がCH2CH3、R13がCH3、かつR14がHであり、下記式Iaの構造を有する化合物に相当する。(R1、R2及びmは、上記「発明の簡単な概要」セクションで割り当てた意味をもつ。)
【0019】
【化7】

式中、R2はヘテロ環式成分であり、好ましくは下記式である。
【化8】

【0020】
(式中、nは2、3、又は4である。)
好ましい態様では、R3がH以外である。
典型的なR6蛍光成分として以下のものが挙げられる。
【化9】

【0021】
これら及び他の蛍光成分のLMBへの付着用シントンは、Molecular Probes, Eugene, Oregon, USAから入手可能である。予想外に細胞毒活性を有することを除いて、LMB化合物の作用及び細胞内分布の機序を研究するためのバイオマーカーとして、LMB化合物を有する蛍光プローブを使用できる。しかし、特定の態様では、R6は、好ましくは蛍光成分以外である。
【0022】
下表1に式Iaの化合物の実例を示す。

【0023】

【0024】
この発明の化合物は、限定するものではないが、以下の疾患を治療するために使用できる:頭頚部癌の癌(頭、首、鼻腔、副鼻腔、鼻咽頭、口腔、口咽頭、咽頭、下咽頭、唾液腺の腫瘍、及び傍神経節腫を含む);肝臓及び胆樹の癌、特に肝細胞癌;腸癌、特に結腸直腸癌;処置卵巣癌;小細胞肺癌及び非小細胞肺癌;乳癌肉腫、例えば線維肉腫、悪性線維性組織球腫、胎児性横紋筋肉腫、平滑筋肉腫、神経線維肉腫、骨肉腫、滑膜肉腫、脂肪肉腫、及び胞状軟部肉腫;中枢神経系の新生物、特に脳癌;リンパ腫、例えばホジキンリンパ腫、リンパ形質細胞性リンパ腫、濾胞性リンパ腫、粘膜関連リンパ組織リンパ腫、マントル細胞リンパ腫、B-系列大細胞リンパ腫、バーキットリンパ腫、及びT-細胞未分化大細胞リンパ腫。臨床的には、本明細書で述べる方法の実施及び組成物の使用は、癌腫の大きさ若しくは数の減少及び/又は関連症候の低減(当てはまる場合)をもたらすだろう。病理学的には、本明細書で述べる方法の実施及び組成物の使用は、病理学的に関連する反応、例えば癌細胞増殖の阻害、癌若しくは腫瘍の大きさの減少、さらなる転移の防止、及び腫瘍脈管形成の阻害を引き起こすだろう。このような疾患の治療方法は、治療的に有効な量の本発明の化合物を被験者に投与することを含む。本方法は、必要に応じて繰り返してよい。特に、癌は、前立腺癌、ヒトパピローマウイルス(HPV)-関連子宮頚癌、白血病(特に慢性骨髄性白血病又はCML)、及び膀胱癌でよい。
【0025】
この発明の化合物によって、細胞の過剰増殖の特徴がある非癌障害も治療することができる。このような障害の実例として、限定するものではないが、萎縮性胃炎、炎症性溶血性貧血症、移植片拒絶反応、炎症性好中球減少症、水疱性類天疱瘡、小児脂肪便症、脱髄性脳症、皮膚筋炎、炎症性腸疾患(潰瘍性結腸炎及びクローン病)、多発性硬化症、心筋炎、筋炎、鼻ポリープ、慢性副鼻腔炎、尋常性天疱瘡、原発性糸球体腎炎、乾癬、外科的癒着、狭窄若しくは再狭窄、強膜炎、強皮症、湿疹(アトピー性皮膚炎、刺激性皮膚炎、アレルギー性皮膚炎を含む)、歯周病(すなわち、歯根膜炎)、多嚢胞性腎臓病、及びI型糖尿病が挙げられる。他の例として、脈管炎(例えば、巨細胞性動脈炎(側頭動脈炎、Takayasu動脈炎)、結節性多発動脈炎、アレルギー性脈管炎及び肉芽腫症(チャーグ-ストラウス病)、多発脈管炎オーバーラップ症候群、過敏性脈管炎(ヘーノホ-シェーンライン紫斑病)、血清病、薬物誘発脈管炎、感染性脈管炎、腫瘍性脈管炎、結合組織障害と関係ある脈管炎、補体系の先天的欠失と関係ある脈管炎、ウェゲネル肉芽腫症、川崎病、中枢神経系の脈管炎、バーガー病及び全身性硬化症);胃腸管疾患(例えば、膵臓炎、クローン病、潰瘍性結腸炎、潰瘍性直腸炎、原発性硬化性胆管炎、特発性を含むいずれかの原因の良性狭窄症(例えば、胆管、食道、十二指腸、小腸又は結腸の狭窄);呼吸器疾患(例えば、喘息、過敏性肺臓炎、アスベスト症、珪肺及び他形態の塵肺、慢性気管支炎及び慢性閉塞性気道疾患);鼻涙管疾患(例えば、特発性を含むすべての原因の狭窄);及び耳管疾患(例えば、特発性を含むすべての原因の狭窄)が挙げられる。特に、非癌状態は、足底いぼ、心臓肥大、又は癌悪液質でよい。
【0026】
この発明の化合物は、アルキル化薬、血管形成インヒビター、代謝拮抗薬、DNA切断薬、DNA架橋薬、DNAインターカレーター、DNA小溝バインダー、エンジイン、熱ショックタンパク質90インヒビター、ヒストンデアセチラーゼインヒビター、微小管安定薬、ヌクレオシド(プリン又はピリミジン)類似体、核外移行インヒビター、プロテアソームインヒビター、トポイソメラーゼ(I又はII)インヒビター、チロシンキナーゼインヒビターといった他の抗癌薬又は細胞毒性薬と組み合わせて投与することができる。特有の抗癌薬又は細胞毒性薬として、β-ラパコン、アンサマイシンP3、アウリスタチン(auristatin)、ビカルタミド、ブレオマイシン、ブレオマイシン、ボルテゾミブ、ブスルファン、カリケアマイシン、カリスタチン(callistatin)A、カンプトセシン、カペシタビン、CC-1065、シスプラチン、クリプトフィシン(cryptophycins)、ダウノルビシン、ディスコダーモライド(discodermolide)、ディソラゾール(disorazole)、ドセタキセル、ドキソルビシン、ドュオカルマイシン(duocarmycin)、ディネマイシン(dynemycin)A、エポチロン、エトポシド、フロクスウリジン、フロクスウリジン、フルダラビン、フルオロウラシル(fluoruracil)、ゲフィチニブ、ゲルダナマイシン、17-アリルアミノ-17-デメトキシゲルダナマイシン(17-AAG)、17-(2-ジメチルアミノエチル)アミノ-17-デメトキシゲルダナマイシン(17-DMAG)、ゲムシタビン、ヒドロキシウレア、イマチニブ、インターフェロン、インターロイキン、イリノテカン、レプトマイシンB、マイタンシン(maytansine)、メトトレキセート、マイトマイシンC、オキサリプラチン、パクリタキセル、スポンジスタチン、スベロイルアニリドヒドロキサム酸(SAHA)、チオテパ、トポテカン、トリコスタチンA、ビンブラスチン、ビンクリスチン及びビンデシンが挙げられる。
【0027】
好ましくは、この発明の化合物は、例えば、カラムクロマトグラフィー、高圧液体クロマトグラフィー、再結晶、又は他の精製法後の精製形及び単離形で提供される。この発明の化合物の特定の立体異性体が示されている場合、該立体異性体は、好ましくは実質的に他の立体異性体がない。
この発明の化合物は、この発明の化合物と賦形剤を含む医薬製剤に使用される。使用しうる賦形剤として、担体、表面活性剤、増粘剤若しくは乳化剤、固体バインダー、分散若しくは懸濁助剤、可溶化剤、着色剤、調味剤、コーティング剤、崩壊剤、潤沢剤、甘味料、保存剤、等張剤、及びその組合せが挙げられる。適切な賦形剤の選択と使用はGennaro, ed., Remington: The Science and Practice of Pharmacy, 20th Ed. (Lippincott Williams & Wilkins 2003)(この開示は、参照によって本明細書に取り込まれる)で教示されている。
【0028】
本組成物は、固体、半固体、又は液体形態のようないずれの適切な形態でもよい。一般に、本医薬製剤は、外部、腸内、又は腸管外投与に好適な有機若しくは無機担体又は賦形剤との混合物中の活性成分として1種以上の本発明の化合物を含む。例えば、錠剤、丸剤、カプセル剤、座剤、腟坐剤、液剤、乳剤、懸濁剤、及び用途に適した他の形態用の通常の無毒の薬剤的に許容しうる担体と活性成分をコンパウンドすることができる。使用可能な担体として、水、グルコース、ラクトース、アカシアゴム、ゼラチン、マンニトール、デンプンペースト、三ケイ酸マグネシウム、タルク、トウモロコシデンプン、ケラチン、コロイドシリカ、ジャガイモデンプン、尿素、及び固体、半固体、又は液体形態の製剤の製造で使うのに適した他の担体が挙げられる。さらに、補助的な安定剤、増粘剤、並びに着色剤及び香料を使用しうる。好ましい投与態様として静脈内投与が挙げられ、子宮頚癌、膀胱癌、又は足底いぼのような特定適応症の場合、局所投与が挙げられる。
適用できる場合、この発明の化合物をマイクロカプセル及びナノ粒子として製剤化することができる。一般的なプロトコルは、例えばBosch et al., US 5,510,118 (1996); De Castro, US 5,534,270 (1996);及びBagchi et al., US 5,662,883 (1997)(すべて参照によって本明細書に取り込まれる)に記載されている。体積に対する表面積の比率を増すことによって、別のやり方では経口送達に適用できない化合物の経口送達を可能にする。
【0029】
本発明の化合物の用量レベルは、1日当たり約0.1mg〜約100mg/kg(体重)、好ましくは1日当たり約1〜約50mg/kg(体重)のオーダーである。さらに好ましくは、用量レベルは、1日当たり約5mg〜約20mg/kg(体重)であり、体重70kgの患者を想定した場合、1日当たり約350mg〜約1400mg/患者に相当する。本発明の化合物は、間欠性を基礎として、すなわち、半周、週、半月、又は月間隔で投与される。
担体材料と合わせて単一剤形を生成しうる活性成分の量は、治療する宿主及び個々の投与態様によって変わるだろう。例えば、ヒトへの経口投与を意図した製剤は、組成物全体の約5%〜約95%で変化しうる担体材料を含みうる。単位剤形は、通常、約5mg〜約500mgの活性成分を含む。
しかし、いずれかの特定患者に特有の用量レベルは種々の因子に左右されることが分かるだろう。この因子として、利用する特有の化合物の活性;被験者の体重、一般的健康、性別、及び食事制限;投与の時間と経路及び薬物の排泄率;治療で複合製剤を利用するかどうか;及び治療が求められている特定の疾患又は状態の重症度が挙げられる。
【0030】
当業者は、ターゲティング成分、リンカー成分、及び活性薬を含む治療複合物において、化合物15〜17のような一級又は二級アミン基を有するこの発明の化合物を使用できることが分かるだろう。このような複合物では、レプトマイシン化合物は活性薬、つまりターゲティング成分の作用によって標的細胞に送達される弾頭である。ターゲティング成分は、該標的細胞上の特徴分子に対して親和性を有する抗体(特にモノクロナール抗体)でよい。詳細に説明するため、癌の化学療法では、特徴分子は該モノクロナール抗体によって認識される腫瘍関連抗原でよい。リンカー成分は、該複合物が癌細胞によって、又は癌細胞に近接して内部に取り入れられるとき切断して抗癌薬としてレプトマイシン化合物を放出することが任じられる。一級又は二級アミンは、リンカー成分へのレプトマイシン化合物の便利な付着点、特にp-アミノベンジルオキシカルボニル(PABC)基のような“自己犠牲にする”基として働く。例えば、Carl et al., J. Med. Chem. 1981, 24 (3), 479-480;及びCarl et al., WO 81/01145 (1981)(これら開示は、参照によって本明細書に取り込まれる)を参照されたい。
【0031】
理論に拘泥されないが、我々は、我々の発明の化合物は、LMBの機序に似た機序で作用して標的癌細胞内でのCRM-1媒介核外移行プロセスを阻害することによってアポトーシスを誘発すると考える。LMB中の2,3-デヒドロ-δ-バレロラクトン成分はマイケル(Michael)反応アクセプターである。LMBは、CRM1のシステイン529とこの位置でマイケル付加物を形成することによってCRM1を阻害することが分かっている(Kudo et al., Proc. Nat'l Acad. Sci. (USA) 1999, 96 (3), 9112-9117)。この発明の化合物は重要な2,3-デヒドロ-δ-バレロラクトンファルマコフォアを保持しているので、同じ阻害機序によって作用すると予想することができる。
【0032】
【化10】

【0033】
多くの癌細胞は、アポトーシス誘導腫瘍サプレッサータンパク質p53の機能の損失をもたらす突然変異を有する(Vousden et al., Nat. Rev. Cancer 2002, 2, 594-504)。このような癌の例として、前立腺癌及びヒトパピローマウイルス(HPV)関連子宮頚癌が挙げられる。LMBが、子宮頚癌細胞の核内でp53タンパク質を蓄積させることが分かっている(Lane et al., Proc. Nat'l Acad. Sci. (USA) 2000, 97, 8501-8506)。DNA損傷によるp53の不完全な上方制御の特徴がある前立腺癌では、細胞核はp53が欠損している。LMBが核内でp53をトラップしてアポトーシスを誘導することが分かっている。従って、前立腺癌は、LMBに高度に感受性である(Peehl et al., Prostate 2003, 54, 258-267)。
適切なタイプの癌に対しては、他の抗癌薬、特にイマチニブ(そのメシラートは登録商標名GleevecTMで知られる)のようなチロシンキナーゼインヒビターと相乗的にこの発明の化合物を使用することができる。慢性骨髄性白血病(CML)のように融合タンパク質Bcr-Ablの発現によって特徴づけられる癌がある。Bcr-Ablは正常に核内に移入されず、Bcr-Abl/イマチニブ複合体が核内に移入される。LMBも存在する場合、LMBは、核からのBcr-Ablの移出を阻害する。さらに、核-トラップされたBcr-Ablはアポトーシスを誘導し、Bcr-Ablポジティブ細胞の死をもたらす。例えばVigneri et al., Nature Medicine 2001, 7, 228-234; Wang et al., US 2003/0162740 A1 (2003)を参照されたい。従って、イマチニブとこの発明のLMB化合物の組合せは、相乗的にBcr-Ablポジティブ癌細胞を攻撃するための機序を提供しうる。
従って、この発明の化合物を用いて、CRM1と共有結合付加物を形成し、かつ該タンパク質のCRM1媒介移行プロセスを妨げることによって、p53、p73、Bcr-Abl、STAT1、(i)ADAR1、Rev、及びアクチンのようなタンパク質の細胞核からの核外移行を阻害することができる。ある態様では、阻害されるタンパク質がp53である。別の態様では、阻害されるタンパク質がBcr-Ablである。特定の可変性は細胞型及び標的タンパク質によって予想されるが、一般的に、使用する阻害量は、0.3〜740nM、好ましくは0.3〜20nM、さらに好ましくは0.3〜2.0nMの範囲内である。
以下の実施例を参照して、さらにこの発明の実施を理解できるだろう。なお、実施例は例示として提供したものであり、限定するものではない。
【0034】
実施例1−液相合成の一般手順
下記式に示すように、原型としてLMBを用いて液相法でこの発明の化合物を合成することができる。
【化11】

【0035】
アメリカ培養細胞系統保存機関(American Type Culture Collection)(Manassas, Virginia)から得たストレプトマイセス属ATCC 39366の発酵によってLMBを得た。ATCCから受け取った試料からの単一アイソレートのスクリーニングにより高産生性アイソレートを得、発酵に使用した。LMBはSigma-Aldrich(St. Louis, Missouri)から商業的に入手することもできる。
LMB(12.2mg,0.027mmol,1当量)、N-ヒドロキシベンゾトリアゾール(“HOBt”,3.4mg,0.025mmol,1.1当量)、及び(ベンゾトリアゾール-1-イルオキシ)トリピロリジノホスホニウムヘキサフルオロホスフェート(“PyBOP”,13mg,0.025mmol,1.1当量)を乾燥N,N-ジメチルホルムアミド(“DMF”,400μL)に溶かした。引き続きアミンA(0.025mmol,1.1当量)とジイソプロピルエチルアミン(“DIEA”,ヒューニッヒ塩基としても知られる,16μL,0.09mmol,4当量)を添加した。反応を窒素下室温で20時間撹拌した。反応を水とジクロロメタン(“DCM”)に分配した。有機層を水(2×)、飽和炭酸水素ナトリウム(1×)、及び食塩水(1x)で洗浄した。有機層を硫酸ナトリウム上で乾燥させ、ろ過し、真空中で濃縮した。粗生成物(油)をシリカフラッシュカラム(0.5×5cm)に適用して0%〜60%のアセトン/ヘキサン又は0%〜10%のメタノール/DCMで溶出した。生成物Iaを含むフラクションをプールして真空中で濃縮した。
【0036】
実施例2−固相合成の一般手順
或いは、下記式に示されるように、固相合成を用いてこの発明の化合物を作製することができる。
【化12】

【0037】
10mLの固相反応器をPS-HOBT(HL)樹脂(B,267mg,約0.24mmol,1.0当量,0.9mmol/g,Argonaut;上式中、樹脂マトリックスは黒玉で示される)及びDCM(3.2mL)中の4-ジメチルアミノピリジン(“DMAP”,18mg,0.144mmol,0.6当量)の溶液で充填する。反応混合物に乾燥DMF(960μL)中のLMB(200mg,0.37mmol,1.53当量)の溶液を加えて窒素と共に1分撹拌する。反応にDCM中のジイソプロピルカルボジイミド(“DIC”,170μL,1.06mmol,4.4当量)の溶液を加え、反応混合物を振動テーブル上で室温にて3時間撹拌する。真空ろ過で溶媒を除去する。樹脂をDMF(3×)、DCM(3×)、DMF(3×)、及びテトラヒドロフラン(3×)で洗浄してLMB-装填樹脂Cを得、回収して-20℃で貯蔵する。
アミンA(0.036mmol, 0.6当量)及びジイソプロピルエチルアミン(7μL,0.04 mmol,0.67当量)を乾燥DCM(1mL)に溶かす。この溶液にLMB-装填樹脂C(110mg,約0.06mmol,1当量)を懸濁させ、室温で3時間撹拌する。溶液をろ過し、樹脂をDCM(3×)ですすぐ。混ぜ合わせたろ液を真空中で濃縮して黄色油を得る。粗製油をシリカフラッシュカラム(0.5×5cm)に適用して0%〜60%のアセトン/ヘキサン又は0%〜10%のメタノール/DCMで溶出する。生成物Iaを含むフラクションをプールして真空中で濃縮する。
【0038】
実施例3−化合物1
実施例1の手順に従い、メチルアミン(Sigma-Aldrich)を用いて化合物1を作製した。
C34H51NO5について計算したLRMS:553.4;実測値 554.4 (M+H)。
実施例4−化合物2
実施例1の手順に従い、2-アミノエタノール(Sigma-Aldrich)を用いて化合物2を作製した。13C NMR (100 MHz, CDCl3) δ 12.27, 13.02, 13.25, 13.52, 16.06, 17.94, 20.91, 26.45, 30.90, 32.22, 33.27, 33.48, 40.76, 42.27, 45.11, 45.59, 47.25, 62.47, 73.41, 81.59, 119.50, 119.85, 122.50, 128.06, 130.20, 135.04, 135.42, 136.37, 136.96, 151.83, 152.69, 164.58, 168.37, 215.39;C35H53NO6について計算したHRMS:583.39729;実測値 584.39423 (M+H)。
実施例5−化合物3
実施例1の手順に従い、4-フェニルベンジルアミン(Sigma-Aldrich)を用いて化合物3を作製した。13C NMR (100 MHz, CDCl3) δ 12.27, 12.65, 13.00, 13.35, 13.67, 16.09, 18.04, 20.92, 26.49, 32.23, 33.30, 33.48, 40.77, 42.91, 45.00, 45.49, 46.92, 73.98, 81.48, 119.60, 119.92, 122.59, 126.99, 127.23, 127.31, 128.02, 128.23, 128.72, 130.16, 135.07, 135.46, 136.30, 136.91, 137.69, 151.56, 152.58, 164.35, 166.69, 215.25;C46H59NO5について計算したLRMS:705.4;実測値 707.0 (M+H)。
実施例6−化合物4
実施例1の手順に従い、Lancaster Synthesisから入手可能な3-(2-アミノエチル)ピリジンを用いて化合物4を作製した。13C NMR (100 MHz, CDCl3) δ 12.27, 12.99, 13.09, 13.52, 16.11, 17.96, 20.87, 26.46, 30.87, 32.19, 32.95, 33.30, 33.48, 40.06, 40.76, 44.96, 45.55, 47.20, 73.59, 81.48, 119.57, 119.90, 122.58, 123.54, 127.96, 128.15, 130.11, 134.78, 135.09, 135.42, 136.28, 136.54, 136.91, 147.52, 149.86, 151.64, 152.33, 164.37, 167.05, 215.20;C40H56N2O5について計算したLRMS:644.9;実測値 646.0 (M+H)。
【0039】
実施例7−化合物5
実施例1の手順に従い、6-アミノインダゾール(Sigma-Aldrich)を用いて化合物5を作製した。C40H53N3O5について計算したLRMS:655.9;実測値 657.0 (M+H)。
実施例8−化合物6
実施例1の手順に従い、N-Boc-エチレンジアミン(Sigma-Aldrich)を用いて化合物6を作製した。13C NMR (100 MHz, CDCl3) δ 12.26; 12.87, 12.97, 13.51, 16.11, 17.84, 20.84, 26.30, 26.38, 26.45, 28.30, 32.15, 33.28, 33.48, 39.94, 40.50, 40.74, 45.05, 45.51, 45.60, 46.19, 46.23, 47.03, 73.82, 79.29, 81.46, 119.80, 119.91, 122.60, 127.91, 128.16, 130.08, 135.10, 135.40, 136.23, 136.89, 151.60, 151.96, 156.62, 164.34, 167.53, 215.24;C40H62N2O7について計算したLRMS:682.5;実測値 683.6 (M+H)。
実施例9−化合物7
実施例1の手順に従い、N,N-ジメチルエチレンジアミン(Sigma-Aldrich)を用いて化合物7を作製した。13C NMR (100 MHz, CDCl3) δ 12.29, 12.68, 12.99, 13.53, 13.61, 16.09, 17.77, 20.81, 26.48, 32.13, 33.25, 33.49, 36.28, 40.75, 45.02, 45.52, 46.82, 57.90, 73.93, 81.43, 119.97, 122.66, 127.90, 128.17, 130.05, 135.15, 135.39, 136.27, 136.90, 151.49, 164.25, 166.92, 215.25;C37H58N2O5について計算したLRMS:610.4;実測値 612.0 (M+H)。
【0040】
実施例10−化合物8
実施例1の手順に従い、4-(3-アミノプロピル)モルフォリン(Sigma-Aldrich)を用いて化合物8を作製した。13C NMR (100 MHz, CDCl3) δ 8.61, 12.28, 12.84, 12.99, 13.56, 16.11, 17.86, 20.84, 25.16, 26.47, 32.17, 33.22, 33.49, 38.17, 40.76, 45.03, 45.52, 46.01, 46.95, 53.43, 57.15, 66.61, 73.72, 81.46, 119.94, 120.03, 122.62, 127.94, 128.14, 130.09, 135.12, 135.42, 136.31, 136.90, 151.57, 215.27;C40H62N2O6について計算したLRMS:666.5;実測値 667.5 (M+H)。
実施例11−化合物9
実施例1の手順に従い、2-フェノキシエチルアミン(Sigma-Aldrich)を用いて化合物9を作製した。13C NMR (100 MHz, CDCl3) δ 12.28, 12.65, 13.00, 13.54, 13.63, 16.08, 17.95, 20.87, 26.48, 32.19, 33.26, 33.48, 38.57, 40.76, 44.99, 45.51, 46.85, 66.75, 74.00, 81.45, 114.39, 119.60, 119.96, 121.00, 122.62, 127.98, 128.17, 129.47, 130.10, 135.09, 135.43, 136.30, 136.89, 151.53, 152.58, 158.46, 166.87, 215.20;C41H57NO6について計算したLRMS:659.4; 実測値 661.0 (M+H)。
【0041】
実施例12−化合物10
実施例1の手順に従い、Novabiochemから入手可能なグリシンメチルエステルを用いて化合物10を作製した。13C NMR (100 MHz, CDCl3) δ 12.27, 12.77, 12.99, 13.52, 16.06, 18.00, 20.84, 26.47, 31.36, 32.16, 33.25, 33.47, 36.43, 40.74, 40.94, 45.06, 45.52, 46.90, 52.22, 73.91, 81.45, 118.95, 119.94, 122.62, 127.95, 128.14, 130.10, 135.09, 135.41, 136.30, 136.89, 151.56, 153.58, 162.49, 164.32, 166.74, 170.67, 215.16;C36H53NO7について計算したLRMS:611.4;実測値 613.0 (M+H)。
実施例13−化合物11
実施例1の手順に従い、TCI-Americaから入手可能な2-(2-アミノエチル)-1,3-ジオキソランを用いて化合物11を作製した。13C NMR (100 MHz, CDCl3) δ 12.28, 12.65, 12.98, 13.52, 13.58, 16.07, 17.84, 20.82, 26.47, 32.14, 32.75, 33.24, 33.48, 34.27, 40.74, 44.95, 45.51, 46.81, 64.85, 74.02, 81.43, 103.67, 119.95, 120.08, 122.64, 127.93, 128.14, 130.06, 135.11, 135.41, 136.29, 136.88, 151.40, 151.52, 164.27, 166.68, 215.20;C38H57NO7について計算したLRMS:639.4;実測値 641.0 (M+H)。
【0042】
実施例14−化合物12
実施例1の手順に従い、(R)-2-アミノ-3-ベンジルオキシ-1-プロパノール(Sigma-Aldrich)を用いて化合物12を作製した。13C NMR (100 MHz, CDCl3) δ 12.28, 12.84, 13.00, 13.57, 16.08, 17.88, 20.84, 26.48, 32.16, 33.25, 33.48, 40.76, 45.16, 45.52, 46.93, 50.56, 63.87, 70.30, 73.39, 73.81, 81.45, 119.62, 119.94, 122.63, 127.66, 127.84, 127.95, 128.16, 128.45, 130.08, 135.12, 135.41, 136.30, 136.90, 137.59, 151.56, 152.94, 164.34, 167.26, 215.21;C43H61NO7について計算したLRMS:703.4;実測値 705.0 (M+H)。
実施例15−化合物13
実施例1の手順に従い、D-アラニンtert-ブチルエステル(Novabiochem)を用いて化合物13を作製した。13C NMR (100 MHz, CDCl3) δ 12.28, 12.60, 13.00, 13.56, 16.07, 17.85, 18.79, 20.85, 26.48, 27.90, 32.18, 33.26, 33.48, 40.74, 45.08, 45.46, 46.80, 48.25, 74.13, 81.50, 81.77, 119.61, 119.97, 122.61, 127.97, 128.18, 130.18, 135.08, 135.42, 136.29, 136.91, 151.52, 152.68, 165.97, 172.53, 215.18;C40H61NO7について計算したLRMS:667.4;実測値 669.0 (M+H)。
実施例16−化合物14
実施例1の手順に従い、Flukaから入手可能なN-Boc-1,4-ブタンジアミンを用いて化合物14を作製した。13C NMR (100 MHz, CDCl3) δ 12.25, 12.96, 13.05, 13.51, 16.09, 17.84, 20.83, 26.29, 26.37, 26.45, 26.75, 27.52, 28.33, 32.14, 33.28, 33.46, 38.70, 40.73, 45.00, 45.52, 46.07, 46.17, 46.21, 47.14, 73.67, 81.43, 119.88, 119.96, 122.60, 127.88, 128.16, 130.04, 135.10, 135.38, 136.22, 136.87, 151.43, 151.61, 156.04, 164.32, 167.05, 215.18;C42H66N2O7について計算したLRMS:710.5;実測値 711.6 (M+H)。
【0043】
実施例17−化合物15
実施例1の手順に従い、ジイソプロピルエチルアミンを省略する変形で、エチレンジアミン(Sigma-Aldrich)を用いて化合物15を作製した。1H NMR, 部分データ,(400 MHz, CD3OD) δ 7.13 (dd, 1H), 6.71 (d, 1H), 6.01 (d, 1H), 5.96 (dd, 1H), 5.78 (dd, 1 H), 5.69-5.61 (m, 2H), 5.24 (d, 1H), 5.10 (ddd, 1H), 5.03 (d, 1H), 3.77 (m, 1H), 3.56 (dd, 1H), 3.42 (app t, 2H), 3.07 (app t, 2H), 2.84 (m, 1H), 2.73 (m, 1H), 2.63 (m, 1H), 2.26-1.82 (m), 1.59 (m, 1H), 1.14 (d, 3H), 1.08-1.02 (m, 9H), 0.97 (d, 3H), 0.69 (d, 3H)。
実施例18−化合物16
実施例1の手順に従い、ジイソプロピルエチルアミンを省略する変形で、Sigma-Aldrichから入手可能なN-メチルエチレンジアミンを用いて化合物16を作製した。C36H57N2O5について計算したLRMS:597.4262;実測値 597.4278 (M+H)。.
実施例19−化合物17
実施例1の手順に従い、ジイソプロピルエチルアミンを省略する変形で、Sigma-Aldrichから入手可能なN-イソプロピルエチレンジアミンを用いて化合物17を作製した。1H NMR, 部分データ, (400 MHz, CD3OD) δ 7.13 (dd, 1H), 6.71 (d, 1H), 6.03-5.96 (m, 2H), 5.78 (dd, 1 H), 5.68-5.61 (m, 2H), 5.24 (d, 1H), 5.10 (dd, 1H), 5.03 (d, 1H), 3.77 (m, 1H), 3.55 (dd, 1H), 3.46 (app t, 2H), 3.26 (m, 1H), 3.04 (app t, 2H), 2.84 (m 1H), 2.71 (m, 1H), 2.63 (m, 1H), 2.27-1.83 (m), 1.59 (m, 1H), 1.26 (d, 6H), 1.14 (d, 3H), 1.10-1.02 (m, 9H), 0.98 (d, 3H), 0.69 (d, 3H)。
【0044】
実施例20−化合物18
実施例1の一般手順を用い、室温で12時間の反応時間で化合物18を作製した。下記式のアミンはMolecular Probes, Eugene, Oregonから得た。
【化13】

【0045】
13C NMR (100 MHz, CDCl3) δ 6.58, 11.04, 12.28, 13.00, 13.41, 13.51, 14.43, 16.12, 17.59, 20.73, 26.31, 26.39, 32.05, 33.10, 33.50, 40.75, 45.71, 46.18, 43.23, 47.56, 71.96, 81.40, 111.30, 114.39, 119.13, 119.91, 122.68, 127.73, 128.24, 129.90, 135.27, 136.17, 136.89, 146.03, 147.84, 151.55, 154.62, 160.33, 160.89, 164.28, 166.86, 214.74;C43H59N3O7について計算したLRMS:729.4;実測値 731.0 (M+H)。
実施例21−化合物19
実施例1の一般手順を用いて化合物19を作製した。下記式のアミンはMolecular Probesから得た。
【化14】

【0046】
13C NMR (100 MHz, CDCl3) δ 11.25, 12.27, 12.82, 12.97, 13.53, 14.88, 16.12, 17.78, 20.85, 24.73, 26.30, 26.38, 26.47, 29.62, 32.16, 33.25, 33.49, 35.53, 39.72, 40.75, 45.08, 45.51, 46.26, 47.00, 73.77, 81.47, 117.24, 119.73, 119.92, 120.42, 122.63, 123.79, 127.93, 128.16, 130.10, 133.25, 135.11, 135.43, 136.26, 136.90, 143.95, 151.58, 152.26, 160.29, 164.34, 167.56, 172.80, 215.25;;C49H68BF2N4O6について計算したLRMS:857.51945;実測値 857.52108 (M+H)。
実施例22−化合物20
実施例1の一般手順を用いて化合物20を作製した。下記式のアミンはMolecular Probesから得た。
【化15】

【0047】
C60H73BF2N4O7SNaについて計算したLRMS:1053.51457;実測値 1053.51533 (M+Na)。
実施例24−化合物21
LMB(20mg,0.037mmol,1当量)を乾燥Et2O(150μL)とTHF(100μL)に溶かした。この清澄な溶液にトリエチルアミン(6.1μL,0.044mmol,1.2当量)とエチルクロロホルメート(4.2μL,0.044mmol,1.2当量)を加え、反応をN2下で室温にて45分撹拌した。2分後、反応混合物が曇ってきた。
この粗製活性化LMBを、50mMのNa2HPO4(100μL)、EtOH(50μL)、及びEtOAc(50μL)中のグリシン(3.2mg,0.042mmol,1.1当量)の溶液に滴加した。時々濃KOH水溶液を添加してpHを約9に維持しながら反応混合物を室温で1.5時間撹拌した。
2N HClで反応混合物を酸性にしてpH 2としてからEtOAc(2mL)と飽和NH4Cl(2mL)に分配した。水層をEtOAc(2mL,2×)で抽出した。混ぜ合わせた有機部分を食塩水(5mL,1×)で洗浄し、Na2SO4上で乾燥させ、ろ過し、真空中で濃縮して明黄色油を得た。粗生成物をシリカフラッシュカラム(0.5×3cm)に適用し、0、5、及び10%(+0.1% AcOH)のMeOH/CH2Cl2で溶出した。5% MeOH/CH2Cl2で溶出するフラクションをプールし、真空中で濃縮して化合物21を得た(8.3mg,0.014mmol,37%)。13C NMR (100 MHz, CDCl3) δ 12.23, 12.95, 13.27, 13.51, 13.71, 16.06, 17.88, 20.78, 26.47, 29.07, 32.13, 33.15, 33.45, 40.73, 41.47, 45.32, 45.61, 47.40, 53.73, 73.30, 81.49, 119.16, 119.82, 122.59, 127.86, 128.09, 128.22, 130.10, 135.15, 135.41, 136.31, 136.88, 151.79, 153.65, 164.59, 167.86, 173.35, 175.76, 215.05;C35H51N4O7Naについて計算したLRMS:620.65511;実測値:620.35577 (M+Na)。
当業者には、上記手順を他の出発原料又は試薬と適合させ、必要な変更を加えて、この発明の他の化合物を作製できることが分かるだろう。
【0048】
〔生物学的活性〕
この発明の化合物が種々の腫瘍細胞系統の増殖に及ぼす阻害効果を測定することによって、これら化合物の生物学的活性を評価した。LMBについての比較結果を含め、結果を表2に示す。MCF-7、A549、及びSKOV-3は、それぞれヒト乳癌、肺癌、及び卵巣癌の細胞系統である。NCI/ADRは多剤耐性乳癌細胞系統である。CCRF-CEM及びCCRF-CEM/PTXは、ヒト白血病細胞系統であり、後者はパクリタキセル耐性亜系統である。LNCaPは前立腺癌細胞系統である。
【0049】

【0050】
表2のデータは、この発明の化合物が抗増殖薬としてLMBの活性に匹敵する活性を有することを示す。
下表3にLMBについての比較データを含めて示すように、この発明のいくつかの化合物のK562、Bcr-AblポジティブCML細胞系統に対する細胞毒性についてもデータを得た。
【0051】

【0052】
単一用量静脈内投与時のマウスの最大耐量(MTD)を代表的選択の化合物について決定した。LMBについての比較データを含めてデータを下表4にまとめた。

【0053】
表5は、マウス膀胱癌細胞の系統であるMB 49細胞に対するLMBとこの発明の選ばれた化合物の細胞毒性に関するデータを示す。

【0054】
さらに、2系統のヒト膀胱癌細胞(UMUC-3とT24)に対するLMBの細胞毒性を決定した。EC50値は、それぞれ0.00033μM及び0.0012μMだった。
上述した本発明の詳細な説明は、主に又は排他的に本発明の特定の部分又は局面に関する節を含む。これは明瞭さと簡便さのためであり、個々の特徴はそれが開示されているその節だけでなく関連することもあり、かつ本明細書の開示は異なる節で見られる情報のすべての適切な組合せを包含するものと解釈する。同様に、本明細書の種々の図及び説明は本発明の特有の態様に関するものであるが、個々の図又は態様の文脈で特有の特徴が開示されている場合、該特徴は、妥当な範囲まで、別の図又は態様の文脈で、又は別の特徴と組み合わせて、又は本発明一般にも使用できるものと解釈する。
さらに、本発明は特に特定の好ましい態様に関して記載されているが、本発明はこのような好ましい態様に限定されない。むしろ、本発明の範囲は、添付の特許請求の範囲によって定義される。
【特許請求の範囲】
【請求項1】
下記式Iの構造を有する化合物、その薬剤的に許容しうる塩、エステル、溶媒和物、水和物又はプロドラッグ形。
【化1】

(式中、mは0、1、2、3、4、又は5であり;
R0は、H、C1-C5アルキル、C2-C5アルケニル、又はC2-C5アルキニルであり;
各R1は、独立的にH、C1-C5アルキル、C2-C5アルケニル、又はC2-C5アルキニルであり;
R2は、H、アリール、シクロアルキル、ヘテロ環成分、下記式であり;
【化2】

(式中、
R3は、H、C1-C5アルキル、C2-C5アルケニル、又はC2-C5アルキニルであり(mが0のときはR3がHでないという条件で);
R4は、H、C1-C5アルキル、C2-C5アルケニル、C2-C5アルキニル、アリール、シクロアルキル、又はヘテロ環成分であり;
R5は、H、C1-C5アルキル、C2-C5アルケニル、C2-C5アルキニル、アリール、シクロアルキル、ヘテロ環成分、又はC(=O)O(C1-C5アルキル)であり;かつ
R6は、H、C1-C5アルキル、C2-C5アルケニル、C2-C5アルキニル、シクロアルキル又は蛍光成分であり;或いはR5及びR6とそれらが共通に結合している窒素が一緒に4、5、6、又は7員の窒素含有ヘテロ環式環構造を形成する);
R10は、CH3又はCH2OHであり;
R11は、H又はOHであり;
R12は、CH3、CH2CH3;又はCH(OH)CH3であり;かつ
R13とR14の一方はH又はCH3であり、他方はH又はOHである。)
【請求項2】
下記式Iaの構造を有する、請求項1記載の化合物。
【化3】

【請求項3】
式Ia中の下記成分が、
【化4】

下記式から成る群より選択される、請求項2記載の化合物。
【化5】

【請求項4】
式中、R0がH、R10がCH3、R11がH、R12がCH3、R13がCH3、かつR14がHである、請求項1記載の化合物。
【請求項5】
式中、R0がH、R10がCH3、R11がH、R12がCH3又はCH2CH3、R13がH、かつR14がHである、請求項1記載の化合物。
【請求項6】
式中、R0がH、R10がCH2OH、R11がH、R12がCH3又はCH2CH3、R13がCH3、かつR14がHである、請求項1記載の化合物。
【請求項7】
標的細胞の増殖を阻害する方法であって、前記標的細胞を、有効量の請求項1又は2記載の化合物と接触させることを含む方法。
【請求項8】
前記標的細胞が、ヒトの乳癌細胞、肺癌細胞、卵巣癌細胞、前立腺癌細胞、又は白血病細胞である、請求項7記載の方法。
【請求項9】
前記標的細胞が、HPV-関連子宮頚癌細胞又は膀胱癌細胞である、請求項7記載の方法。
【請求項10】
過剰増殖性疾患の治療方法であって、該過剰増殖性疾患に苦しむ患者に、治療的に有効な量の請求項1又は2記載の化合物を投与することを含む方法。
【請求項11】
前記過剰増殖性疾患が、乳癌、肺癌、卵巣癌、前立腺癌、又は白血病であり、かつ前記患者がヒトである、請求項10記載の方法。
【請求項12】
前記過剰増殖性疾患が、HPV-関連子宮頚癌又は膀胱癌である、請求項10記載の方法。
【請求項13】
前記化合物を局所投与する、請求項12記載の方法。
【請求項14】
前記化合物を別の治療薬と組み合わせて投与する、請求項10記載の方法。
【請求項15】
前記別の治療薬がチロシンキナーゼインヒビターである、請求項14記載の方法。
【請求項16】
前記チロシンキナーゼインヒビターがイマチニブである、請求項15記載の方法。
【請求項17】
請求項1又は2記載の化合物と賦形剤とを含んでなる医薬組成物。
【請求項18】
CRM1媒介プロセスを経て細胞の核からタンパク質が移出することを阻害する方法であって、前記細胞を、阻害量の請求項1又は2記載の化合物と接触させることを含む方法。
【請求項19】
前記タンパク質がp53である、請求項18記載の方法。
【請求項20】
前記タンパク質がBcr-Ablである、請求項18記載の方法。
【請求項21】
前記阻害量が、0.3〜20nMである、請求項18記載の方法。
【請求項22】
過剰増殖性疾患の治療用薬物の調製のための請求項1又は2記載の化合物の使用。
【請求項23】
膀胱癌の治療方法であって、膀胱癌に苦しむ患者に治療的に有効な量のレプトマイシンBを投与することを含む方法。
【請求項24】
前記レプトマイシンBを局所投与する、請求項23記載の方法。
【請求項25】
膀胱癌の治療用薬物の調製のためのレプトマイシンの使用。
【請求項1】
下記式Iの構造を有する化合物、その薬剤的に許容しうる塩、エステル、溶媒和物、水和物又はプロドラッグ形。
【化1】

(式中、mは0、1、2、3、4、又は5であり;
R0は、H、C1-C5アルキル、C2-C5アルケニル、又はC2-C5アルキニルであり;
各R1は、独立的にH、C1-C5アルキル、C2-C5アルケニル、又はC2-C5アルキニルであり;
R2は、H、アリール、シクロアルキル、ヘテロ環成分、下記式であり;
【化2】

(式中、
R3は、H、C1-C5アルキル、C2-C5アルケニル、又はC2-C5アルキニルであり(mが0のときはR3がHでないという条件で);
R4は、H、C1-C5アルキル、C2-C5アルケニル、C2-C5アルキニル、アリール、シクロアルキル、又はヘテロ環成分であり;
R5は、H、C1-C5アルキル、C2-C5アルケニル、C2-C5アルキニル、アリール、シクロアルキル、ヘテロ環成分、又はC(=O)O(C1-C5アルキル)であり;かつ
R6は、H、C1-C5アルキル、C2-C5アルケニル、C2-C5アルキニル、シクロアルキル又は蛍光成分であり;或いはR5及びR6とそれらが共通に結合している窒素が一緒に4、5、6、又は7員の窒素含有ヘテロ環式環構造を形成する);
R10は、CH3又はCH2OHであり;
R11は、H又はOHであり;
R12は、CH3、CH2CH3;又はCH(OH)CH3であり;かつ
R13とR14の一方はH又はCH3であり、他方はH又はOHである。)
【請求項2】
下記式Iaの構造を有する、請求項1記載の化合物。
【化3】

【請求項3】
式Ia中の下記成分が、
【化4】

下記式から成る群より選択される、請求項2記載の化合物。
【化5】

【請求項4】
式中、R0がH、R10がCH3、R11がH、R12がCH3、R13がCH3、かつR14がHである、請求項1記載の化合物。
【請求項5】
式中、R0がH、R10がCH3、R11がH、R12がCH3又はCH2CH3、R13がH、かつR14がHである、請求項1記載の化合物。
【請求項6】
式中、R0がH、R10がCH2OH、R11がH、R12がCH3又はCH2CH3、R13がCH3、かつR14がHである、請求項1記載の化合物。
【請求項7】
標的細胞の増殖を阻害する方法であって、前記標的細胞を、有効量の請求項1又は2記載の化合物と接触させることを含む方法。
【請求項8】
前記標的細胞が、ヒトの乳癌細胞、肺癌細胞、卵巣癌細胞、前立腺癌細胞、又は白血病細胞である、請求項7記載の方法。
【請求項9】
前記標的細胞が、HPV-関連子宮頚癌細胞又は膀胱癌細胞である、請求項7記載の方法。
【請求項10】
過剰増殖性疾患の治療方法であって、該過剰増殖性疾患に苦しむ患者に、治療的に有効な量の請求項1又は2記載の化合物を投与することを含む方法。
【請求項11】
前記過剰増殖性疾患が、乳癌、肺癌、卵巣癌、前立腺癌、又は白血病であり、かつ前記患者がヒトである、請求項10記載の方法。
【請求項12】
前記過剰増殖性疾患が、HPV-関連子宮頚癌又は膀胱癌である、請求項10記載の方法。
【請求項13】
前記化合物を局所投与する、請求項12記載の方法。
【請求項14】
前記化合物を別の治療薬と組み合わせて投与する、請求項10記載の方法。
【請求項15】
前記別の治療薬がチロシンキナーゼインヒビターである、請求項14記載の方法。
【請求項16】
前記チロシンキナーゼインヒビターがイマチニブである、請求項15記載の方法。
【請求項17】
請求項1又は2記載の化合物と賦形剤とを含んでなる医薬組成物。
【請求項18】
CRM1媒介プロセスを経て細胞の核からタンパク質が移出することを阻害する方法であって、前記細胞を、阻害量の請求項1又は2記載の化合物と接触させることを含む方法。
【請求項19】
前記タンパク質がp53である、請求項18記載の方法。
【請求項20】
前記タンパク質がBcr-Ablである、請求項18記載の方法。
【請求項21】
前記阻害量が、0.3〜20nMである、請求項18記載の方法。
【請求項22】
過剰増殖性疾患の治療用薬物の調製のための請求項1又は2記載の化合物の使用。
【請求項23】
膀胱癌の治療方法であって、膀胱癌に苦しむ患者に治療的に有効な量のレプトマイシンBを投与することを含む方法。
【請求項24】
前記レプトマイシンBを局所投与する、請求項23記載の方法。
【請求項25】
膀胱癌の治療用薬物の調製のためのレプトマイシンの使用。
【公表番号】特表2008−501710(P2008−501710A)
【公表日】平成20年1月24日(2008.1.24)
【国際特許分類】
【出願番号】特願2007−515625(P2007−515625)
【出願日】平成17年6月3日(2005.6.3)
【国際出願番号】PCT/US2005/019591
【国際公開番号】WO2005/117894
【国際公開日】平成17年12月15日(2005.12.15)
【出願人】(504269110)コーザン バイオサイエンシス インコーポレイテッド (17)
【Fターム(参考)】
【公表日】平成20年1月24日(2008.1.24)
【国際特許分類】
【出願日】平成17年6月3日(2005.6.3)
【国際出願番号】PCT/US2005/019591
【国際公開番号】WO2005/117894
【国際公開日】平成17年12月15日(2005.12.15)
【出願人】(504269110)コーザン バイオサイエンシス インコーポレイテッド (17)
【Fターム(参考)】
[ Back to top ]

