免疫アッセイに用いるための物質固定化用担体
【課題】本発明は、ELISAにおいて高い検出感度を実現するPEGリンカーを有する物質固定化用担体を提供することを目的とする。
【解決手段】本発明は、免疫アッセイに用いるための物質固定化用担体であって、支持体と、前記支持体の表面に配置された親水性ポリマー層とを少なくとも含み、前記親水性ポリマー層が、ポリエチレングリコール鎖と、標的物質と結合する抗原又は抗体である被固定化物質或いは標的物質である被固定化物質と共有結合を形成可能な、前記ポリエチレングリコール鎖に連結された官能基とを含む、物質固定化用担体、該担体への被固定化物質の固定化方法、並びに、該担体を使用した免疫アッセイによる測定法及びそのためのキットに関する。
【解決手段】本発明は、免疫アッセイに用いるための物質固定化用担体であって、支持体と、前記支持体の表面に配置された親水性ポリマー層とを少なくとも含み、前記親水性ポリマー層が、ポリエチレングリコール鎖と、標的物質と結合する抗原又は抗体である被固定化物質或いは標的物質である被固定化物質と共有結合を形成可能な、前記ポリエチレングリコール鎖に連結された官能基とを含む、物質固定化用担体、該担体への被固定化物質の固定化方法、並びに、該担体を使用した免疫アッセイによる測定法及びそのためのキットに関する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、免疫アッセイに用いるための固相担体に関する。
【背景技術】
【0002】
免疫測定法の一種である酵素結合免疫吸着アッセイ(Enzyme−Linked Immunosorbent Assay、以下ELISA)は、創薬、診断、環境計測、食品を含む幅広い分野で利用されている。典型的なELISAは、(1)抗体または抗原の固定化(固相化)、(2)標的物質の結合、(3)酵素標識抗体の結合、(4)酵素反応、(5)光学的検出(吸収、蛍光、発光)、の5つの工程からなる。標識用酵素としては西洋わさびペルオキシダーゼやアルカリホスファターゼなどが用いられる。ELISAは数ある免疫測定法のなかでも特に感度が高い。しかし、実際には固相担体への生体分子の非特異吸着が原因で期待する感度が得られないことも多い。特に酵素標識抗体のような複合体は固相担体に吸着しやすく、これがELISAにおけるノイズの主な原因となっている。このような非特異吸着を防ぐためにウシ血清アルブミン(BSA)によるブロッキング処理が試みられるが、その効果は限定的と言わざるを得ない。そこで、生体分子の非特異吸着を効果的に防ぐポリエチレングリコール(以下PEG)に注目が集まっている。すなわち、抗体または抗原の固定化を、PEGリンカーを介して行うことによって、固相担体への生体分子の非特異吸着を防ぐ試みがなされている。
【0003】
特許文献1には、PEGリンカーを介して抗体を金表面に固定化する方法が開示されている。具体的には、金表面に非イオン性官能基を導入し、ここにヘテロ二官能性PEGの片末端を共有結合させ、別の末端に抗体を結合させる、というものである。この方法によって表面プラズモン共鳴法におけるノイズが有意に低減されることが記載されている。
【0004】
特許文献2には、PEGリンカーを介して核酸やタンパク質をガラス表面に固定化する方法が開示されている。具体的には、PEGリンカーを有するシラン化合物を合成し、これをガラス表面に適用した後、PEGリンカーの末端に核酸やタンパク質を結合させる、というものである。この方法によってバイオチップのS/N比(感度)が改善されることが記載されている。
【0005】
特許文献3には、PEGリンカーを介して核酸をガラス表面に固定化する方法が開示されている。具体的には、シランカップリング剤をガラス表面に適用してアミノ基を導入し、ここにホモ二官能性PEGの片末端を共有結合させ、別の末端に核酸を結合させる、というものである。この方法によってバイオセンサの感度が改善されることが記載されている。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2005−164348号公報
【特許文献2】特開2006−143715号公報
【特許文献3】特開2006−509201号公報
【発明の概要】
【発明が解決しようとする課題】
【0007】
従来、PEGリンカーを介して生体分子を固定化する方法は知られているが、ELISA等の免疫アッセイにおいて高い感度が発揮される、PEGリンカーを介して固定化を行う物質固定化用担体は開示されていない。
【0008】
また、標的物質と特異的に結合する抗体、抗原等の被固定化物質を固相担体に固定化する免疫アッセイにおいて、PEGリンカーを有する物質固定化用担体に、生体関連物質である被固定化物質をその活性を維持したまま高密度に固定化することは困難であった。
【0009】
本発明はこのような実情に鑑みてなされたものであり、ELISA等の免疫アッセイにおいて高い検出感度を実現する、PEGリンカーを有する物質固定化用担体、該担体への被固定化物質の固定化方法、並びに、該担体を使用した免疫アッセイ法及びそのためのキットを提供することを目的とする。
【課題を解決するための手段】
【0010】
本発明者は、表面に特定の条件を満足するPEGリンカーを含む親水性ポリマー層を備える支持体を物質固定化用担体として用いて免疫アッセイを行った場合に高い検出感度を実現できることを見出し、本発明を完成させるに至った。本発明は以下の発明群を包含する。
(1)免疫アッセイに用いるための物質固定化用担体であって、
支持体と、
前記支持体の表面に配置された親水性ポリマー層と
を少なくとも含み、
前記親水性ポリマー層が、
数平均分子量が176以上であるポリエチレングリコール鎖と、
標的物質と結合する抗原又は抗体である被固定化物質或いは標的物質である被固定化物質と共有結合を形成可能な、前記ポリエチレングリコール鎖に連結された官能基と
を含む、物質固定化用担体。
(2)前記官能基が、n個の窒素原子を含有する官能基を含み、
前記親水性ポリマー層中の窒素濃度が、前記親水性ポリマー層中のC−O結合に由来する炭素濃度を1としたとき、0.010以上、0.050×n以下である、
(1)の物質固定化用担体。
(3)前記窒素を含有する官能基が、(1H−イミダゾール−1−イル)カルボニル基又はスクシンイミジルオキシカルボニル基である、(2)の物質固定化用担体。
(4)免疫アッセイに用いるための物質固定化担体であって、
支持体と、
前記支持体の表面に配置された親水性ポリマー層と、
標的物質と結合する抗原又は抗体である被固定化物質或いは標的物質である被固定化物質と
を少なくとも含み、
前記親水性ポリマー層が、数平均分子量が176以上であるポリエチレングリコール鎖を含み、
前記ポリエチレングリコール鎖と、前記被固定化物質とが共有結合を介して連結されている、物質固定化担体。
(5)(1)〜(3)のいずれかの物質固定化用担体と、前記被固定化物質とから、前記官能基と前記被固定化物質とを反応させて共有結合を形成することにより製造されたものである、(4)の物質固定化担体。
(6)(4)又は(5)の物質固定化担体の製造方法であって、
(1)〜(3)のいずれかの物質固定化用担体と、前記被固定化物質を溶解した溶液とを接触させる、被固定化物質接触工程と、
前記物質固定化用担体に接触させた前記溶液を乾燥濃縮させる、乾燥濃縮工程と、
を含む方法。
(7)前記溶液が糖類を含む、(6)の方法。
(8)前記糖類がトレハロースである、(7)の方法。
(9)前記溶液が非イオン性界面活性剤を含む、(6)〜(8)のいずれかの方法。
(10)前記乾燥濃縮工程の後に、前記物質固定化担体とアミノ基を有する低分子化合物とを接触させる工程を更に含む、(6)〜(9)のいずれかの方法。
(11)(4)又は(5)の物質固定化担体を用いて標的物質を測定する工程を含む、免疫アッセイにより標的物質を測定する方法。
(12)(1)〜(3)のいずれかの物質固定化用担体を含む、免疫アッセイにより標的物質を測定するためのキット。
(13)(4)又は(5)の物質固定化担体を含む、免疫アッセイにより標的物質を測定するためのキット。
(14)サンドイッチ方式の免疫アッセイに用いるための、(13)のキットであって、
被固定化物質が標的物質と結合する抗原又は抗体である、(4)又は(5)の物質固定化担体と、
被固定化物質と非競合的に標的物質と結合する、直接的又は間接的に検出可能な抗原又は抗体である、検出可能抗原又は検出可能抗体と、
を少なくとも含むキット。
(15)直接競合方式の免疫アッセイに用いるための、(13)のキットであって、
被固定化物質が標的物質と結合する抗原又は抗体である、(4)又は(5)の物質固定化担体と、
測定対象試料中の標的物質と競合的に前記被固定化物質と結合する、直接的又は間接的に検出可能な標的物質である、検出可能標的物質と
を少なくとも含むキット。
(16)間接競合方式の免疫アッセイに用いるための、(13)のキットであって、
被固定化物質が標的物質である、(4)又は(5)の物質固定化担体と、
測定対象試料中の標的物質と被固定化物質とが競合的に結合する、直接的又は間接的に検出可能な抗原又は抗体である、検出可能抗原又は検出可能抗体と、
を少なくとも含むキット。
(17)免疫アッセイに用いるための物質固定化用担体であって、
支持体と、
前記支持体の表面に配置された親水性ポリマー層と
を少なくとも含み、
前記親水性ポリマー層が、
ポリエチレングリコール鎖と、
標的物質と結合する抗原又は抗体である被固定化物質或いは標的物質である被固定化物質と共有結合を形成可能な、前記ポリエチレングリコール鎖に連結された官能基と
を含み、
前記官能基が、n個の窒素原子を含有する官能基を含み、
前記親水性ポリマー層中の窒素濃度が、前記親水性ポリマー層中のC−O結合に由来する炭素濃度を1としたとき、0.010以上、0.050×n以下である、
物質固定化用担体。
(18)(17)の物質固定化用担体を含む、免疫アッセイにより標的物質を測定するためのキット。
【発明の効果】
【0011】
本発明の物質固定化用担体を用いて免疫アッセイを行うことにより高い検出感度を実現することができる。
【図面の簡単な説明】
【0012】
【図1】図1は、物質固定化用担体に関する本発明の一実施形態を示す。
【図2】図2は、物質固定化用担体の製造方法に関する本発明の一実施形態を示す。
【図3】図3は、本発明の物質固定化担体を用いたELISA(間接法)の一実施形態を示す。
【図4】図4は、本発明の物質固定化担体を用いたELISA(間接法)の検量線を示す。
【図5】図5は、本発明の物質固定化担体を用いたELISA(サンドイッチ法)の一実施形態を示す。
【図6】図6は、本発明の物質固定化担体を用いたELISA(サンドイッチ法)の検量線を示す。
【図7−1】図7−1は、実施例7における被固定化物質溶解液のトレハロース濃度0%(w/v)である場合のELISA(サンドイッチ法)の検量線を示す。
【図7−2】図7−2は、実施例7における被固定化物質溶解液のトレハロース濃度0.6%(w/v)である場合のELISA(サンドイッチ法)の検量線を示す。
【図7−3】図7−3は、実施例7における被固定化物質溶解液のトレハロース濃度1.25%(w/v)である場合のELISA(サンドイッチ法)の検量線を示す。
【図7−4】図7−4は、実施例7における被固定化物質溶解液のトレハロース濃度2.5%(w/v)である場合のELISA(サンドイッチ法)の検量線を示す。
【図7−5】図7−5は、実施例7における被固定化物質溶解液のトレハロース濃度5%(w/v)である場合のELISA(サンドイッチ法)の検量線を示す。
【図7−6】図7−6は、実施例7における被固定化物質溶解液のトレハロース濃度10%(w/v)である場合のELISA(サンドイッチ法)の検量線を示す。
【図8】図8は、サンドイッチELISAの反応系の一例を模式的に示す。
【図9】図9は、直接競合ELISAの反応系の一例を模式的に示す。
【図10】図10は、間接競合ELISAの反応系の一例を模式的に示す。
【図11】図11は、本発明の物質固定化用担体の製造方法の一例の概略を示す。
【図12】図12は、本発明の物質固定化担体の製造方法の一例の概略を示す。
【図13】図13は、本発明の物質固定化用担体の実施形態の一例を模式的に示す。
【発明を実施するための形態】
【0013】
(支持体)
本発明における支持体の材料及び形状は、免疫アッセイにおける固相の支持体として利用可能な材料及び形状であれば特に限定されない。支持体の材料としてはプラスチック、ガラス、石英、シリコン、金属等が挙げられる。プラスチックは成型が容易であること、輸送及び廃棄における問題が小さいことから免疫アッセイ用担体の支持体の材料として特に好ましい。すなわち本発明において好ましい支持体は、その全部又は少なくとも一部にプラスチックを含む。支持体の、後述する親水性ポリマー層が形成される側の表面がプラスチックを含むことが好ましく、該表面がプラスチックからなることがより好ましい。プラスチックの具体例としては、ポリスチレン、ポリプロピレン、ポリ塩化ビニル、ポリエチレン、環状ポリオレフィン、アクリル樹脂、ポリエチレンテレフタラートなどが挙げられる。予め支持体表面にプラズマ処理やコロナ処理などの親水化処理が施されていてもよい。支持体は、免疫アッセイにおける固相として利用可能な表面を有している支持体であればよく、全体の形状は特に限定されない。例えばマイクロウェルプレート(複数の凹部が形成された板状体)、粒子、スライド、チューブ、キャピラリー、マイクロ流路などの形態の支持体を用いることができる。特にマイクロウェルプレート、とりわけポリスチレン製のマイクロウェルプレートの形態の支持体は有用である。
【0014】
(親水性ポリマー層)
支持体の表面には、親水性ポリマー層が配置される。親水性ポリマー層はポリエチレングリコール鎖(PEG鎖)を少なくとも含む。「ポリエチレングリコール鎖(又はPEG鎖)」とは次式:
−(CH2−CH2−O)m−
(mは重合度を示す整数である)
で表される構造を指す。驚くべきことに、親水性ポリマー層におけるPEG鎖の数平均分子量が免疫アッセイの感度に影響を与える。十分に高感度の免疫アッセイを行うためにはPEG鎖の数平均分子量は176以上(mが4以上)であることが好ましく、より好ましくは362以上である。PEG鎖の数平均分子量が上記の下限よりも小さい場合には実験例で確認されている通り十分な感度が達成できない場合がある。PEG鎖の数平均分子量の上限は特に限定されないが、数平均分子量が大きくなるほど粘度が増すため取扱いが難しいこと、及び、PEG鎖の高密度での配置が難しいことから、PEG鎖の数平均分子量は25000以下であることが好ましく、10000以下であることがより好ましい。
【0015】
PEG鎖の数平均分子量は、原料として用いられるPEG又は担体から解離させたPEG:
HO−(CH2−CH2−O)m−H
(mは重合度を示す整数である)
の数平均分子量からH2Oの分子量(18.015)を控除することにより求めることができる。PEG数平均分子量は蒸気圧浸透圧法または膜浸透圧法によって求められる。蒸気圧浸透圧法はPEGの数平均分子量が100,000未満のときに使用することができる。膜浸透圧法はPEGの数平均分子量が10,000〜1,000,000のときに使用することができる。
【0016】
固定化前の物質固定化用担体におけるPEG鎖の一端には、被固定化物質との共有結合を形成することが可能な、少なくとも1つの官能基が直接的又は間接的に連結されていることが好ましい。このような官能基としては、被固定化物質と共有結合を形成することが可能な、(1H−イミダゾール−1−イル)カルボニル基、スクシンイミジルオキシカルボニル基、エポキシ基、アルデヒド基、アミノ基、チオール基、カルボキシル基、アジド基、シアノ基、活性エステル基(1H−ベンゾトリアゾール−1−イルオキシカルボニル基、ペンタフルオロフェニルオキシカルボニル基、パラニトロフェニルオキシカルボニル基等)、ハロゲン化カルボニル基(塩化カルボニル基、フッ化カルボニル基、臭化カルボニル基、ヨウ化カルボニル基)等が挙げられる。これらの官能基は、PEG鎖の末端のヒドロキシル基の水素を置換する置換基として、PEG鎖に直接的に連結されていてもよいし、PEG鎖の末端に結合したリンカー構造に結合した官能基として、PEG鎖に間接的に連結されていてもよい。被固定化物質への反応性と、保存安定性のバランスを考慮すると、(1H−イミダゾール−1−イル)カルボニル基及びスクシンイミジルオキシカルボニル基が好ましい。これらの官能基は被固定化物質が有するアミノ基等の官能基と反応して共有結合を形成することができる。
【0017】
PEG鎖の結合密度も免疫アッセイの検出感度に影響する。PEG鎖の結合密度はX線光電子分光法(XPS)を用いてある程度推定することができる。エチレングリコール単位(CH2−CH2−O)は(XPS)においてC(1s)シグナルのC−O成分を与え、(1H−イミダゾール−1−イル)カルボニル基、スクシンイミジルオキシカルボニル基等の窒素原子含有官能基はXPSにおいてN(1s)シグナルを与える。元素濃度比N(1s)/C−OはPEG鎖の結合密度と明確な相関がある。免疫アッセイでの高い検出感度を実現するためには、官能基がn個の窒素原子を含有する場合、元素濃度比N(1s)/C−Oが0.010以上、0.050×n以下であることが好ましい。「0.010以上、0.050×n以下」とは、例えば、n=1の場合は「0.010以上、0.050以下」を意味し、n=2の場合は「0.010以上、0.100以下」を意味し、n=3の場合は「0.010以上、0.150以下」を意味し、n=4の場合は「0.010以上、0.200以下」を意味する。本発明におけるXPSは、アルバック・ファイ社製のX線分光分析装置「ESCA5600」を用い、光電子取り込み角度を45°に設定して測定される。n個の窒素原子を含有する官能基としては、(1H−イミダゾール−1−イル)カルボニル基(n=2)及びスクシンイミジルオキシカルボニル基(n=1)以外にイソシアネート基(n=1)、アジドカルボニル基(n=3)、カルボジイミド基(n=2)、マレイミジル基(n=1)、アジリジン−2−イル基(n=1)、1H−ベンゾトリアゾール−1−イルオキシカルボニル基(n=3)、1H−7−アザベンゾトリアゾール−1−イルオキシカルボニル基(n=4)が挙げられる。これらの官能基についても、XPSにより求められる、親水性ポリマー層中のC−O結合に由来する炭素濃度を1としたときの窒素濃度(N(1s)/C−O)が上記と同様の数値範囲であることが好ましい。
【0018】
親水性ポリマー層には官能基が付加されていないPEG鎖や、他の親水性化合物が更に含まれていてもよい。
【0019】
(親水性ポリマー層の形成方法)
支持体の、免疫アッセイにおける固相として利用される位置の表面に親水性ポリマー層が形成される。親水性ポリマー層は、支持体表面に化学的又は物理的に固定された官能基との共有結合により支持体に固定化されることができる。
【0020】
本発明の物質固定化用担体は、図11に概略を示すとおり、プライマー層又はカップリング剤を用いて支持体の表面に官能基を導入する工程S1101と、前記官能基にPEG鎖を連結させる工程S1102と、PEG鎖末端へ官能基を連結する工程S1103とを含む方法により製造することができる。
【0021】
(プライマー層による官能基の導入)
支持体が表面にプラスチックを含む支持体である場合、該表面にはプライマー層が形成され、該プライマー層の表面に親水性ポリマー層が形成されていることが好ましい。このとき、プライマー層のポリシロキサンの側鎖上の官能基が、PEG鎖末端と共有結合を形成される。この場合の、本発明の物質固定化用担体の実施形態の概要を図13を参照して説明する。
【0022】
物質固定化用担体10は、表面Sにプラスチックを含む支持体11と、表面S上に配置された、ポリシロキサンを含むプライマー層12と、プライマー層12上に配置された、PEG鎖を含む親水性ポリマー層13とを備える。
【0023】
親水性ポリマー層13のPEG鎖−(CH2−CH2−O)m−はプライマー層12を構成するポリシロキサンの側鎖Aと共有結合を介して連結されている。ここで側鎖Aは、後述する式1のシラノール化合物が有する、R1に由来する基であり、R1上の官能基又は該官能基から誘導された官能基がPEG鎖の末端のヒドロキシル基と共有結合を形成して形成された二価の基を指す。ケイ素原子に結合する基Xは式1のシラノール化合物のR1(p=2の場合)、R2(p+q=3の場合)、又はヒドロキシル基(q=3の場合)に由来する基である。プライマー層12中のポリシロキサンは直鎖状であってもよいし、分岐鎖状又は網目状の構造を有していてもよいが、好ましくは分岐鎖状又は網目状の構造を有する。ポリシロキサンが分岐鎖状又は網目状の構造を有するとき、Xは、他の繰り返し単位(図示していない)のケイ素原子と結合する架橋基である。架橋基としてのXとしては、式1のシラノール化合物のヒドロキシル基に由来するエーテル基(−O−)が挙げられる。ポリシロキサンが直鎖状の構造を有するとき、Xは、式1に定義するR1又はR2、未反応のヒドロキシル基、加水分解されずに残存した式2に定義する基Y等の一価の基である。PEG鎖の両端のうち、ポリシロキサンと連結されていない側の端部には、被固定化物質と共有結合を形成可能な官能基R3が、直接的に、或いは必要に応じてリンカーを介して間接的に連結されていることが好ましい。図13においてQは結合、又はリンカーを示す。
【0024】
図13に示す本実施形態において、支持体11は、少なくとも表面Sにプラスチックを含む。ポリシロキサンを含むプライマー層12は支持体11の表面Sに物理吸着により結合することができる。物理吸着はファンデルワールス力または疎水性相互作用により生じると考えられる。プライマー層12と支持体11の表面Sとの間には共有結合等の化学結合が形成される必要はないため、表面Sがポリスチレン等の、反応性官能基を含まないプラスチックからなる場合であっても、プライマー層12を結合させることができる。
【0025】
プライマー層12中におけるポリシロキサンの状態は必ずしも明らかではないが、図2に示すように複数のポリシロキサン分子の主鎖部分同士が会合し、側鎖である有機基が支持体表面及び親水性層の側に面した二層構造を形成している可能性がある。このような二重構造が形成される機構は以下のように推定される。まず、シラノールのポリマー化によってファンデルワールス力が増大したポリシロキサンがプラスチック表面に物理吸着する。このとき、プラスチック表面とシラノール化合物の有機基との間に働く疎水性相互作用によりシラノール化合物の有機基はプラスチック側に配向する。ポリシロキサンの一層目が形成された後、溶媒側に配向したシラノール基(Si−OH)に別のポリシロキサンが結合する。このとき、シラノール基同士の水素結合によりシラノール化合物の有機基は溶媒側に配向する。その結果、ポリシロキサンは図2に示すような二層構造となると考えられる。溶媒側に配向した有機基は親水性層との共有結合を形成することができる。
【0026】
プライマー層は、少なくともポリシロキサンを含む層により形成することができる。ここで、ポリシロキサンとはシロキサン結合(Si−O−Si)の繰り返し単位からなるポリマーであり、シラノール化合物の縮合重合によって得ることができる。シラノール化合物の縮合はシラノール化合物の分子間で起こる反応である。支持体表面のプラスチック分子が反応性の官能基を有してない場合には、シラノール化合物と支持体表面のプラスチック分子との間では反応は起こらない。すなわち、シラノール化合物及び形成されたポリシロキサンは支持体表面のプラスチック分子とは化学的に反応せずに、単に物理的に吸着しているだけである。この点は、ガラスを支持体とする場合とは大きく異なる。このようなシラノール化合物のプラスチック表面への物理吸着力は、モノマーでは極めて弱いが、ある程度縮合が進み、ポリマー(ポリシロキサン)となれば強くなる。シラノール化合物を適度に縮合することによって、プラスチック表面にポリシロキサンを含むプライマー層が形成される。
【0027】
(シラノール化合物)
本発明で用いられるシラノール化合物は、シラノール基(Si−OH)に加えて、ケイ素原子に直結した炭素原子を含み且つ官能基を有する有機基を有する。この有機基はポリシロキサンの側鎖となる。シラノール化合物は典型的には式1で表される構造を有する:
(R1)p(R2)4−p−qSi(OH)q ・・・・(式1)
(pは1又は2であり、qは2又は3であり、p+qは3又は4であり、R1は、独立に、ケイ素原子に直結した炭素原子を含み且つ官能基を有する有機基であり、R2はケイ素原子に直結した炭素原子を含む有機基である)。p=1かつq=2又は3であることが好ましく、p=1かつq=3であることがより好ましい。p+q=4である場合、R2は存在しない。
【0028】
R1は、好ましくは、水素原子が1つ以上(好ましくは1つ)の官能基により、必要に応じて適当なリンカー構造を介して、置換されている、炭素数が1〜20、好ましくは1〜15、より好ましくは1〜10、特に好ましくは1〜6の炭化水素基である(ただし、前記炭化水素基の全部又は一部がビニル基である場合のように、前記炭化水素基自体が官能基である場合は官能基により置換されている必要はない)。前記炭化水素基は、直鎖又は分岐鎖或いは環構造を有する、飽和又は不飽和の脂肪族炭化水素基(アルキル基、炭素数2以上のアルケニル基、又は炭素数2以上のアルキニル基)であってもよいし、単環又は多環の炭素数6以上の芳香族炭化水素基であってもよいし、1つ以上の前記脂肪族炭化水素基によって置換された前記芳香族炭化水素基であってもよいし、1つ以上の前記芳香族炭化水素基によって置換され前記脂肪族炭化水素基であってもよい。前記炭化水素基では、炭素−炭素結合が、1又は2個の、酸素、窒素及び硫黄から選択される同一又は異なる原子により中断されていてもよい。炭化水素基の例としては好ましくはプロピル基、エチル基が挙げられる。
【0029】
R1における、前記炭化水素基の1つ以上の水素を、必要に応じて適当なリンカー構造を介して、置換する官能基としては、PEGのヒドロキシル基と反応して共有結合を形成することができる官能基、又はPEGのヒドロキシル基と反応して共有結合を形成することができる官能基に変換可能な官能基であれば特に限定されないが、典型的には、(1H−イミダゾール−1−イル)カルボニル基、スクシンイミジルオキシカルボニル基、グリシジル基、エポキシ基、アルデヒド基、アミノ基、チオール基、カルボキシル基、アジド基、シアノ基、活性エステル基(1H−ベンゾトリアゾール−1−イルオキシカルボニル基、ペンタフルオロフェニルオキシカルボニル基、パラニトロフェニルオキシカルボニル基等)、ハロゲン化カルボニル基、イソシアネート基、マレイミド基等が挙げられ、なかでも、グリシジル基又はエポキシ基が好ましい。グリシジル基又はエポキシ基は、それ自体がPEGのヒドロキシル基と反応して共有結合を形成可能であるが、特開2009−156864号公報に記載されている方法に従って、グリシジル基又はエポキシ基をアルデヒド基に変換し、形成されたアルデヒド基と、PEGが有するヒドロキシル基とを反応させてもよい。これらの官能基は、前記炭化水素基の水素原子を直接置換してもよいし、適切なリンカー構造を介して置換してもよい。リンカー構造としては、例えば炭素の数が0〜3個、窒素、酸素及び硫黄から選択される同一又は異なるヘテロ原子の数が0〜3個である二価の基が挙げられ、例えば、炭化水素基が左側に、官能基が右側にそれぞれ結合するとしたとき、−O−、−S−、−NH−、−(C=O)O−、−O(C=O)−、−NH(C=O)−、−(C=O)NH−、−(C=O)S−、−S(C=O)−、−NH(C=S)−、−(C=S)NH−、−(N=C=N)−、−CH=N−、−N=CH−、−O−O−、−S−S−、−(O=S=O)−で表される構造が挙げられる。
【0030】
R1の特に好ましい態様としては3−グリシドキシプロピル基、2−(3,4−エポキシシクロヘキシル)エチル基が挙げられる。
【0031】
R2は、好ましくは、置換基により置換されていないという点を除いてR1について上述したものと同様の(ただしR1とは独立して選択される)炭化水素基であり、なかでも、炭素数が1〜6の直鎖又は分岐鎖のアルキル基が好ましく、メチル基又はエチル基が特に好ましい。
【0032】
(加水分解によりシラノール化合物を生成するケイ素化合物)
前記シラノール化合物は、加水分解によりシラノール基(Si-OH)を生成可能な基を有するケイ素化合物を、加水分解することにより生成することができる。このようなケイ素化合物は式2で表される構造を有する:
(R1)p(R2)4−p−qSi(Y)q ・・・・(式2)
(Yは、独立に、加水分解によりシラノール基を生成可能な基であり、p、q、R1、R2はそれぞれシラノール化合物に関して定義したとおりである)。
【0033】
Yとしては、アルコキシ基、ハロゲン原子、アリールオキシ基、アルコキシ基又はアリールオキシ基により置換されたアルコキシ基、アルコキシ基又はアリールオキシ基により置換されたアリールオキシ基、アルキルカルボニルオキシ基等が好ましい。Yとしては特に、炭素数1〜6のアルコキシ基(特にメトキシ基、エトキシ基、イソプロポキシ基、tert−ブトキシ基)、炭素数1〜6の、アルコキシ基により置換されたアルコキシ基(例えばメトキシエトキシ基)、炭素数1〜6のアルキルカルボニルオキシ基(例えばアセトキシ基)、塩素原子が好ましい。
【0034】
式2のケイ素化合物としては、シランカップリング剤として市販されている化合物を好適に使用することができ、3−グリシドキシプロピルトリメトキシシラン又は3−グリシドキシプロピルトリエトキシシランが特に好ましい。
【0035】
(プライマー層の形成方法)
ポリシロキサンを含むプライマー層は、支持体の表面上において式1のシラノール化合物を重合させる工程(プライマー層形成工程)を含む方法により形成可能である。該工程は、好ましくは、式2のケイ素化合物を以下のように加水分解し、式1のシラノール化合物を生成する工程と、生成したシラノール化合物と塩基とがアルコール中に溶解された溶液を前記支持体の表面上に接触させる工程とを含む。加水分解の条件は特に限定されないが、例えば次の方法が可能である。まず、式2のケイ素化合物に希塩酸を添加し、基Yを加水分解する。希塩酸のpHは2.0〜3.0に調整するのが望ましい。ケイ素化合物に対する水分子のモル比は2〜4とする。この操作によって基Yはシラノール基へ変換され、式1のシラノール化合物が生成する。
【0036】
次いでシラノール化合物を支持体表面に適用し、縮合重合によりポリシロキサンを形成する。式1のシラノール化合物は、塩基とともにアルコールに溶解する。シラノール化合物の終濃度は0.1〜10%(v/v)の範囲で調整することが望ましい。塩基はトリエチルアミン、N,N−ジイソプロピルエチルアミン、ピリジン、4−ジメチルアミノピリジンなどを用いることができるが、これらに限定されない。塩基の終濃度は0.1〜10%(v/v)の範囲で調整することが望ましい。アルコールはエタノール、2−プロパノール、tert−ブチルアルコール等を用いることができるが、これらに限定されない。このシラノール化合物溶液を支持体のプラスチック表面に接触させ、10分〜24時間放置する。反応温度は4〜80℃の範囲で設定できるが、特に室温(20〜25℃)が好ましい。以上の操作によって、プラスチック表面にポリシロキサンを含むプライマー層が物理吸着によって形成される。プライマー層の被覆密度は、シラノールや塩基の濃度、あるいはシラノール溶液をプラスチック表面に接触させる時間によって制御可能である。プライマー層の被覆密度が高ければ高いほど、次の工程で共有結合させるPEG鎖の結合密度も高くなる。
【0037】
形成されたポリシロキサンの側鎖上のシラノール化合物からの官能基を誘導体化して他の官能基に変換する場合には、プライマー層形成後に引き続き、ポリシロキサンの側鎖上のシラノール化合物からの官能基を、PEGのヒドロキシル基と反応して共有結合を形成することができる官能基に変換する誘導体化工程を行う。
【0038】
(シランカップリング剤による官能基の導入)
支持体が表面にガラス、石英またはシリコンを含む支持体である場合、該表面に、シランカップリング剤の加水分解により生成される、ケイ素原子に直結した炭素原子を含み且つ官能基を有する有機基を有するシラノール化合物を結合させることにより、或いは、更に、必要に応じて該官能基をPEGと共有結合を形成することができる他の官能基に変換する誘導体化により、支持体表面にPEGと共有結合を形成することができる官能基を導入することができる。該官能基とPEGの一端との反応によりシランカップリング剤と親水性ポリマー層のPEG鎖とを共有結合により連結することができる。
【0039】
シラノール化合物としては、プライマー層に関して上述した式1のシラノール化合物と同様のものを使用することができる。
【0040】
シランカップリング剤としては、プライマー層に関して上述した式2のケイ素化合物と同様のものを使用することができる。
【0041】
この実施形態では、支持体表面に導入された、シラノール化合物又はシランカップリング剤に由来する有機基上の官能基又は該官能基から誘導された他の官能基がPEG末端のヒドロキシル基と共有結合を形成するために用いられる。
【0042】
(親水性ポリマー層の形成)
プライマー層、シランカップリング剤等により官能基が導入された支持体表面に、PEGを反応させてPEG鎖を形成する(S1102)。このとき触媒量の濃硫酸を含むPEGを接触させる。ここで、数平均分子量が1000を超えるPEGはあらかじめ加熱融解しておく。必要に応じて、PEGをtert−ブチルアルコールなどで希釈して用いてもよい。このPEG溶液をプラスチック表面に接触させ、加熱する。加熱温度は60〜100℃の範囲で設定できるが、プラスチックの耐熱性を加味すると80℃前後(75℃〜85℃)が好ましい。加熱時間は10分間〜24時間の範囲で設定できるが、加熱温度が80℃前後の場合は10〜60分間が好ましい。以上の操作によって、プライマー層にPEG鎖が共有結合する。このとき、PEG鎖の結合密度はプライマー層の被覆密度に依存する。
【0043】
最後に、PEG鎖の一端に、被固定化物質との共有結合を形成することが可能な、少なくとも1つの官能基を直接的又は間接的に連結させる(S1103)。官能基の導入方法は特に限定されない。(1H−イミダゾール−1−イル)カルボニル基及びスクシンイミジルオキシカルボニル基を、PEG鎖の末端のヒドロキシル基の水素を置換する置換基として導入する方法の好ましい実施形態は次の通りである。一端がプライマー層、シランカップリング剤等を介して支持体表面に固定されたPEG鎖の他端に、1,1’−カルボニルジイミダゾール(以下CDI)または炭酸ジ(N−スクシンイミジル)(以下DSC)を以下のように反応させる。
【0044】
【化1】

【0045】
上記の反応は、水分をほとんど含まない有機溶媒中で実施される必要がある。一般にプラスチックは有機溶剤に対する耐性が低いため、支持体がプラスチックを含む場合には、アセトニトリル、ジメチルスルホキシド、又はこれらの有機溶媒を適当な割合で混合した混合溶媒を利用することが好ましい。これらの有機溶剤の水分含有率は0.1重量%以下であることが望ましい。CDIまたはDSCの終濃度は0.01〜1Mの範囲で設定できるが、室温以下で反応させる場合は0.1M以上であることが望ましい。支持体がプラスチックを含む場合には、プラスチックへのダメージを避けるために反応温度を4〜25℃の範囲で設定することが望ましい。反応時間は10分間〜24時間の範囲で設定することが好ましく、CDI濃度が0.5M前後(0.4〜0.6M)のときは10分間〜60分間が好ましい。以上の操作によって、官能基が共有結合されたPEG鎖を含む親水性ポリマー層が形成される。
【0046】
(被固定化物質)
本発明の物質固定化用担体には、目的とする免疫アッセイの態様に応じて、標的物質と結合する抗原又は抗体や、標的物質が固定化される。本発明ではこれらの固定化の対象物質を「被固定化物質」と呼ぶ。「標的物質と結合する抗原又は抗体」が被固定化物質である実施形態(後述するサンドイッチ法又は直接競合法)において、被固定化物質と標的物質との組合せは、抗原抗体反応に基づく特異的な結合が可能な組合せであれば特に限定されない。例えば、標的物質が抗原(ハプテンを含む)である場合には、被固定化物質は抗体(抗体断片を含む)であることができ、標的物質が抗体(抗体断片を含む)である場合には、被固定化物質は抗原(ハプテンを含む)であることができる。「標的物質」が被固定化物質である実施形態(後述する間接競合法)では、標的物質は抗原(ハプテンを含む)又は抗体(抗体断片を含む)である。
【0047】
被固定化物質及び/又は標的物質としての抗原は、抗体との特異的な抗原抗体反応性を示す物質であれば特に限定されない。代表的な抗原として、タンパク質、ペプチド、糖類、核酸(DNA、RNA)、脂質、補酵素、細胞、ウイルス、細菌、これらの複合体等の天然抗原や、天然抗原の誘導体や、人為的に合成されたハプテン、人工抗原等が挙げられる。
【0048】
被固定化物質及び/又は標的物質としての抗体は、ある抗原に対して特異的な抗原抗体反応性を示す免疫グロブリン及びその断片を指し、必要に応じて化学修飾等が施されていてもよい。
【0049】
被固定化物質は、PEG鎖が有する官能基と反応して共有結合を形成可能な官能基を有する物質であれば特に限定されない。このような官能基としては代表的にはアミノ基が挙げられるが、チオール基、カルボキシル基、ヒドロキシル基、アルコキシド、2級アミン、3級アミン、アジド基、シアノ基等も包含される。なお、固定化しようとする物質に、アミノ基等の、PEG鎖に連結された官能基との反応で共有結合を形成可能な官能基が存在しない場合であっても、これらの物質にアミノ基等を人為的に導入することにより固定化に供することができる。
【0050】
(被固定化物質の固定化)
被固定化物質の固定化は例えば、図12に概略を示すように、本発明の物質固定化用担体と、被固定化物質を溶解した溶液とを接触させる工程S1201と、該溶液を乾燥濃縮して被固定化物質を物質固定化用担体のPEG鎖末端に共有結合させる工程S1202とを少なくとも含み、必要に応じてさらに、未反応のPEG鎖末端の官能基と、アミノ基含有低分子化合物とを接触させ、PEG鎖末端の官能基を不活性化する工程S1203とを含む方法により行うことができる。
【0051】
まず、被固定化物質を緩衝液に溶解する。ここで、アミノ基成分を含まない緩衝液を用いることが好ましい。例えば、リン酸緩衝液や炭酸−重炭酸緩衝液などを用いることができる。緩衝液のpHは7.0〜10.0の範囲で調整することが望ましい。被固定化物質の終濃度は0.01〜10mg/mlの範囲で調整するとよい。この被固定化物質溶解液を担体と接触させ(S1201)、そのまま乾燥濃縮させる(S1202)。乾燥濃縮によって、被固定化物質の反応系中での濃度が高まるため被固定化物質の固定化が著しく促進される。被固定化物質が少量しか準備できない場合は溶液中の被固定化物質の濃度を高めることは困難であるが、このような場合でも、比較的低濃度の被固定化物質溶解液を物質固定化用担体に接触させ、次いで乾燥濃縮することにより、被固定化物質の反応系中での濃度を高めることができ、固定化反応を促進することができる。被固定化物質が抗原、抗体等のタンパク質である場合は、乾燥によってタンパク質が変性することがある。乾燥に伴うタンパク質の変性を防ぐためには、被固定化物質溶解液にトレハロース、スクロース、ラクトース、マルトース等の糖類を添加することが好ましい。糖類のなかでもトレハロースは、適度な保湿性を有していること、溶液の乾燥濃縮が容易であること、並びに、乾燥濃縮時に粗大な結晶が形成されにくく均質な乾燥濃縮が可能であることから好ましい。糖類の終濃度は1〜20%(w/v)、より好ましくは1〜10%(w/v)の範囲で調整すると良い。被固定化物質溶解液を担体の広範囲に渡って接触させたい場合は、被固定化物質溶解液にTriton(登録商標) X−100やTween(登録商標) 20などの非イオン性界面活性剤を添加することが好ましい。非イオン性界面活性剤の使用により、被固定化物質溶解液が担体表面に薄く濡れ広がるため、被固定化物質の使用量を節約できるだけでなく、乾燥濃縮に要する時間を短縮することができる。被固定化物質溶解液中の非イオン性界面活性剤の終濃度は0.01〜0.1%(v/v)の範囲で調整するとよい。
【0052】
乾燥濃縮が進行すると、被固定化物質に含まれるアミノ基等の官能基がPEG鎖に連結された官能基と反応し、アミド結合、ウレタン結合等の共有結合が形成される。ここで、反応温度は4〜37℃、接触時間は5分〜24時間の範囲で設定するとよい。その結果、被固定化物質はPEG鎖を介して担体に固定化される。
【0053】
所望の被固定化物質をPEG鎖に結合させた後は、PEG鎖に連結された未反応の官能基を、アミノ基を有する低分子化合物と結合させることにより、当該官能基を反応性のより低い官能基に変換してもよい(S1203)。これによって、免疫アッセイに関与する物質が不本意に担体表面に固定化されるのを防ぐことができる。この操作は、当該官能基の反応性が高い場合に特に必要性が高い。ただし、官能基を前記低分子化合物と反応させた後の担体表面は、親水性であることが望ましい。なぜなら、親水性の表面は一般に生体関連物質の非特異吸着を抑制する効果をもつからである。このためにはアミノ基を含有する低分子化合物として、アミノ基以外に親水性基を更に有する低分子化合物を使用することが好ましい。このような低分子化合物の例としては、2−アミノエタノールや2−(2−アミノエトキシ)エタノールなどが挙げられるが、特に2−(2−アミノエトキシ)エタノールが好ましい。この低分子化合物をPBSなどの緩衝液に10〜1000mMとなるように溶解し、既に所望の物質を固定化した担体と接触させる。反応温度は4〜37℃、反応時間は2分〜24時間の範囲で設定するとよい。
【0054】
(免疫アッセイ)
本発明はまた、本発明の物質固定化担体を用いて標的物質を測定する工程を含む免疫アッセイに関する。本発明において「標的物質を測定する」とは、測定対象試料中の標的物質の存在の有無、及び/又は、測定対象試料中の標的物質の量を測定することを指す。免疫アッセイは、具体的には、本発明の物質固定化担体と、測定対象試料とを、該担体上の被固定化物質に、該測定対象試料中の標的物質の量に相関した量の抗原又は抗体(ここで該抗原又は抗体とは、測定対象試料中の標的物質、必要に応じて抗原抗体反応系に添加された検出可能標的物質、必要に応じて抗原抗体反応系に添加された検出可能抗原又は検出可能抗体等を指す)が抗原抗体反応により結合する条件において接触させる工程と、前記工程において被固定化物質に結合した抗原又は抗体を検出する工程とを含む。
【0055】
本発明の物質固定化担体を用いた免疫アッセイは公知の方法で実施することができ、サンドイッチ方式、直接競合方式、間接競合方式等の任意の態様とすることができる。
【0056】
サンドイッチ方式の免疫アッセイでは、通常、標的物質と結合する抗原又は抗体が被固定化物質として固定化された物質固定化担体と、該被固定化物質と非競合的に標的物質と結合する、直接的又は間接的に検出可能な抗原又は抗体である、検出可能抗原又は検出可能抗体とが少なくとも用いられる。図8では、抗原である標的物質103と特異的に結合する抗体102が固定化された物質固定化担体101と、標識物質(酵素など)により標識された、直接的に検出可能な標識抗体104とを用いて測定対象試料中の標的物質103を測定するサンドイッチ方式の免疫アッセイの一例を模式的に示す。
【0057】
サンドイッチ方式の免疫アッセイは、典型的には、
測定対象試料と、前記物質固定化担体とを接触させ、測定対象試料中の標的物質と被固定化物質との抗原抗体反応を行う、一次反応工程(図8(b))と、
一次反応工程の後に、前記物質固定化担体と、前記検出可能抗原又は検出可能抗体とを接触させ、被固定化物質に結合した標的物質と、前記検出可能抗原又は検出可能抗体との抗原抗体反応を行う、二次反応工程(図8(c))と、
二次反応工程の後に、前記物質固定化担体に結合した前記検出可能抗原又は検出可能抗体を検出する、検出工程(図8(d))と
を少なくとも含む。
【0058】
一次反応工程及び二次反応工程では、抗原抗体反応後に、担体に固定化されていない成分を洗浄除去する洗浄工程を適宜含む。
【0059】
二次反応工程に用いられる「検出可能抗原又は検出可能抗体」は、被固定化物質と競合しない位置において標的物質と結合する。検出可能抗原又は検出可能抗体は、検出可能な標識物質と連結された標識抗原又は標識抗体(直接的に検出可能な抗原又は抗体)であってもよいし、検出可能な標識物質と、更なる反応によって連結されて標識されうる抗原又は抗体(間接的に検出可能な抗原又は抗体)であってもよい。後者の例としては、検出可能な標識物質と連結された二次抗体と結合可能な抗原又は抗体や、ビオチン−アビジン(又はビオチン−ストレプトアビジン)結合対の一方と連結された標識物質と結合可能な、前記結合対の他方と連結された抗原又は抗体等が挙げられる。
【0060】
直接競合方式による免疫アッセイでは、通常、標的物質と結合する抗原又は抗体が被固定化物質として固定化された物質固定化担体と、測定対象試料中の標的物質と競合的に前記被固定化物質と結合する、直接的又は間接的に検出可能な標的物質である、検出可能標的物質とが少なくとも用いられる。図9では、抗原である標的物質113と特異的に結合する抗体112が固定化された物質固定化担体111と、測定対象試料中の標的物質113と競合的に抗体112と結合する、標識物質(酵素など)により標識された、直接的に検出可能な標的物質114(標識抗原)とを用いて測定対象試料中の標的物質113を測定する直接競合方式による免疫アッセイの一例を模式的に示す。
【0061】
直接競合方式による免疫アッセイは、典型的には、
測定対象試料と、検出可能標的物質と、前記物質固定化担体とを接触させ、測定対象試料中の標的物質と前記被固定化物質との間の抗原抗体反応と、検出可能標的物質と前記被固定化物質との間の抗原抗体反応とを競合的に行う、直接競合反応工程(図9(b),(c))と、
直接競合反応工程の後に、前記物質固定化担体に結合した検出可能標的物質を検出する、検出工程(図9(e))と
を少なくとも含む。
【0062】
直接競合反応工程では、抗原抗体反応後に担体に結合していない標的物質と検出可能標的物質とを洗浄除去する工程(図9(d))が適宜含まれる。
【0063】
直接競合方式による免疫アッセイにおいて、標的物質は抗原又は抗体であり、検出可能標的物質は対応する検出可能抗原又は検出可能抗体である。検出可能標的物質としては、測定対象試料中の標的物質とは独立して検出することができるものである限り、サンドイッチ法に関して上述した検出可能抗原又は検出可能抗体において、抗原又は抗体として標的物質が用いられたものが使用可能である。
【0064】
間接競合方式による免疫アッセイでは、通常、標的物質が被固定化物質として固定化された物質固定化担体と、測定対象試料中の標的物質と被固定化物質とが競合的に結合する、直接的又は間接的に検出可能な抗原又は抗体である、検出可能抗原又は検出可能抗体とが少なくとも用いられる。図10では、抗原である標的物質123と同一の被固定化物質122が固定化された物質固定化担体121と、測定対象試料中の標的物質123と被固定化物質122とが競合的に結合する、標識された二次抗体125を介して間接的に検出可能な一次抗体124とを用いて測定対象試料中の標的物質123を測定する間接競合方式による免疫アッセイの一例を模式的に示す。
【0065】
間接競合方式による免疫アッセイは、典型的には、
測定対象試料と、検出可能抗原又は検出可能抗体と、前記物質固定化担体とを接触させ、測定対象試料中の標的物質と前記検出可能抗原又は検出可能抗体との間の抗原抗体反応と、前記被固定化物質と前記検出可能抗原又は検出可能抗体との間の抗原抗体反応とを競合的に行う、間接競合反応工程(図10(b),(c))と、
間接競合反応工程の後に、前記物質固定化担体に結合した前記検出可能抗原又は検出可能抗体を検出する、検出工程(図10(e),(f))と
を少なくとも含む。
【0066】
間接競合反応工程では、抗原抗体反応後に担体に結合していない標的物質と検出可能抗原又は検出可能抗体とを洗浄除去する工程(図10(d))が適宜含まれる。
【0067】
検出可能抗原又は検出可能抗体としては、サンドイッチ法に関して上述した検出可能抗原又は検出可能抗体と同様のものが使用できる。
【0068】
本発明の物質固定化担体を用いた免疫アッセイにおいて抗原又は抗体を検出する手段は特に限定されず、任意の標識物質により直接的又は間接的に標識された抗原又は抗体を用いることができる。標識物質としては、酵素(ELISA法)、核酸(イムノPCR)、電気化学発光物質(電気化学発光法)、蛍光物質、化学発光物質、放射性物質等の、増幅された検出シグナルを生成することができる標識物質が挙げられる。本発明の免疫アッセイは、安全性及び簡便性を考慮すると、標識物質として酵素を用いる、酵素活性に基づいて検出を行う酵素結合免疫吸着アッセイ(ELISA)であることが好ましい。標識物質として用いることができる酵素は特に限定されないが、例えば西洋わさびペルオキシダーゼ等のペルオキシダーゼ、β−ガラクトシダーゼ、アルカリフォスファターゼ、グルコースオキシダーゼが挙げられる。酵素活性による検出の方法としては、酵素活性により化学発光する化学発光基質、酵素活性により発色する発色基質、酵素活性により化学蛍光を発する化学蛍光基質等を用いた検出方法が挙げられ、なかでも化学発光基質を用いた検出方法が好ましい。発色基質を用いると酵素反応にかなりの時間がかかる。これは、本発明において定量しようとする標的物質の濃度領域が従来の1〜2桁も低いためである。化学発光基質を用いた検出は、一般に、発色基質を用いた検出よりも感度が高いため、酵素反応に要する時間を短縮することができる。特に、フェムトグラムのレベルの微量な標的物質の検出に使用される高感度な化学発光基質を用いれば、感度の点で相乗効果を得ることができる。このような化学発光基質としてはECLTMAdvance(GEヘルスケア)、ECLTMPlus(GEヘルスケア)、イムノスター(登録商標)LD(和光純薬)、CDP−STAR(登録商標)(ロシュ・ダイアグノスティックス)、CSPD(登録商標)(ロシュ・ダイアグノスティックス)、SuperSignal West Femto Maxmum Sensitivity Substrate(サーモフィッシャーサイエンティフィック)が挙げられ、そのための酵素としては西洋わさびペルオキシダーゼ等のペルオキシダーゼ、アルカリフォスファターゼが挙げられる。化学発光を検出するための検出器としては、発光プレートリーダーやCCDイメージャーを用いることができる。これらの検出器はダイナミックレンジが広いという点でも都合がよい。すなわち、本発明の物質固定化担体と化学発光基質とを組み合わせれば、迅速かつ高感度でダイナミックレンジの広いELISAを達成できる。
【0069】
(免疫アッセイ用キット)
本発明の物質固定化用担体は、免疫アッセイにより標的物質を測定するためのキットを構成することができる。該キットは更に免疫アッセイに必要な成分を含むことができる。免疫アッセイに必要な成分としては、免疫アッセイの種類に応じて、被固定化物質に抗原抗体反応により結合した標的物質と抗原抗体反応により結合する、直接的又は間接的に検出可能な抗原又は抗体や、被固定化物質と抗原抗体反応により結合する、直接的又は間接的に検出可能な抗原又は抗体(直接的又は間接的に検出可能な標的物質を含む)が例示できる。更に、免疫アッセイに必要な成分としては、間接的な検出に用いるための、前記間接的に検出可能な抗原又は抗体と結合可能な標識物質や、検出用試薬(例えば標識物質が酵素である場合には酵素活性により化学発光する化学発光基質、酵素活性により発色する発色基質、酵素活性により化学蛍光を発する化学蛍光基質等)が挙げられる。「直接的又は間接的に検出可能な抗原又は抗体」及び「直接的又は間接的に検出可能な標的物質」は上記「免疫アッセイ」の欄にて説明したのと同様のものが使用できる。該キットは更に、被固定化物質を物質固定化用担体に固定化するために用いられる試薬(例えば糖類や非イオン性界面活性剤が溶解された、被固定化物質を溶解するための緩衝液)を含んでもよい。
【0070】
本発明の物質固定化担体は、免疫アッセイにより標的物質を測定するためのキットを構成することができる。該キットは更に免疫アッセイに必要な成分を含むことができる。免疫アッセイに必要な成分の具体例は上記の通りである。
【0071】
以下、図面と具体的な実施例を用いて本発明を説明する。
【0072】
[実施例1]
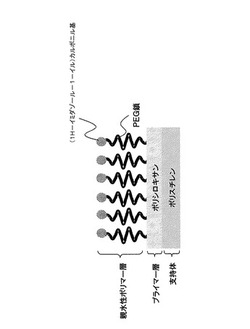
図1は物質固定化用担体に関する本発明の一実施形態を表す。ポリスチレンからなる支持体表面にポリシロキサンを含むプライマー層が形成されている。プライマー層にはPEG鎖の片末端が共有結合している。PEG鎖の別の片末端には(1H−イミダゾール−1−イル)カルボニル基が存在する。親水性ポリマー層は、PEG鎖の数平均分子量が176〜25000であるという条件、XPSにおける元素濃度比N(1s)/C−Oが0.010〜0.100の範囲にあるという条件、のうち少なくとも1つの条件を満足する。
【0073】
[実施例2]
図2に示した方法で物質固定化用担体を製造した。具体的な手順を以下に記す。
1.65mlの3−グリシドキシプロピルトリメトキシシラン(モメンティブ・パフォーマンス・マテリアルズ)に0.35mlの希塩酸(pH2.4)を添加してシラノールを調製した。これを100mlの2−プロパノール(純正化学)に添加した。ここに、さらに4mlのトリエチルアミン(和光純薬)を添加した。このシラノール溶液を96穴マイクロプレート(BD FalconTM)の各ウェルに100μlずつ分注した。そのまま室温で75分間放置した。その後、ウェル内を純水で洗浄し、窒素ブローで乾燥させた。この操作によってマイクロプレートのウェル内にポリシロキサンとエポキシ基を含むプライマー層が形成された。次に、触媒量の濃硫酸を含んだPEG4000(数平均分子量2700〜3400、関東化学)を各ウェルに100μlずつ分注した。そのまま90℃で30分間加熱した。その後、ウェル内を純水で洗浄し、窒素ブローで乾燥させた。この操作によってプライマー層上にPEGを含む親水性ポリマー層が形成された。次に、脱水アセトニトリル(関東化学)と脱水ジメチルスルホキシド(関東化学)の等重量混合溶媒を用いて終濃度0.5MのCDI(東京化成)溶液を調製し、これを各ウェルに10μlずつ分注した。そのまま室温で20分間放置した。その後、ウェル内を純水で洗浄し、窒素ブローで乾燥させた。この操作によって親水性ポリマー層に含まれるPEGの末端に(1H−イミダゾール−1−イル)カルボニル基が導入されたPEG誘導体が形成された。
【0074】
[実施例3]
実施例2の物質固定化用担体(96穴マイクロプレート)を用いて図3に示すELISA(間接法、抗原-抗体-抗体サンドイッチ法)を実施した。具体的な手順を以下に記す。
【0075】
以下、0.025%Triton(登録商標) X−100(和光純薬)を含む炭酸−重炭酸緩衝液(pH9.6)を固相化バッファー、0.1%Triton(登録商標) X−100および0.5MのNaClを含むリン酸緩衝液(PBS)を洗浄バッファー、1%BSAを含むPBSを希釈バッファーとする。まず、リゾチーム(和光純薬)を固相化バッファーに溶解し、終濃度50μg/mlのリゾチーム溶液を調製した。この溶液を実施例2の96穴マイクロプレートの各ウェルに5μlずつ分注した。37℃で10分間放置して乾燥濃縮させた後、ウェル内を洗浄バッファーで2回洗浄した。次に、希釈バッファーを用いて0〜500ng/mlの抗リゾチーム抗体(Rockland)を調製し、各ウェルに50μlずつ分注した。室温で30分間放置した後、ウェル内を洗浄バッファーで1回洗浄した。希釈バッファーを用いてHRP標識2次抗体(Nordic Immunological Laboratories)を4000倍希釈し(終濃度0.5μg/ml)、これを各ウェルに50μlずつ分注した。室温で30分間放置した後、ウェル内を洗浄バッファーで3回洗浄した。各ウェルに化学発光基質であるイムノスターLD(和光純薬)を30μl添加し、LAS4000mini(GEヘルスケア)を用いて化学発光画像を取得した。最後に、専用のソフトウェアを用いて化学発光強度を算出し、図4(本発明)のような検量線を作成した。感度は0.03ng/mlであった。
【0076】
(比較例1)
未処理の96穴マイクロプレート(BD FalconTM)および従来品の96穴マイクロプレート(酸素プラズマ処理によって親水化されたポリスチレン製96穴マイクロプレート)を用いて図3に示すELISA(間接法)を実施した。具体的な手順を以下に記す。
【0077】
以下、炭酸−重炭酸緩衝液(pH9.6)を固相化バッファー、0.05%Tween(登録商標) 20を含むPBSを洗浄バッファー、1%BSAを含むPBSをブロッキングバッファーおよび希釈バッファーとする。まず、リゾチーム(和光純薬)を固相化バッファーに溶解し、終濃度5μg/mlのリゾチーム溶液を調製した。この溶液を96穴マイクロプレートの各ウェルに100μlずつ分注した。室温で2時間放置した後、ウェル内を洗浄バッファーで2回洗浄した。次に、ブロッキングバッファーを各ウェルに200μlずつ分注した。室温で60分間放置した後、ウェル内を洗浄バッファーで2回洗浄した。希釈バッファーを用いて0〜500ng/mlの抗リゾチーム抗体(Rockland)を調製し、各ウェルに100μlずつ分注した。室温で60分間放置した後、ウェル内を洗浄バッファーで1回洗浄した。希釈バッファーを用いてHRP標識2次抗体(Nordic Immunological Laboratories)を4000倍希釈し(終濃度0.5μg/ml)、これを各ウェルに100μlずつ分注した。室温で30分間放置した後、ウェル内を洗浄バッファーで3回洗浄した。各ウェルに化学発光基質であるイムノスターLD(和光純薬)を30μl添加し、LAS4000mini(GEヘルスケア)を用いて化学発光画像を取得した。最後に、専用のソフトウェアを用いて化学発光強度を算出し、図4(未処理、従来品)のような検量線を作成した。未処理品と従来品の感度はいずれも3.9ng/mlであった。
【0078】
[実施例4]
実施例2で得られた96穴マイクロプレートを用いて図5に示すELISA(抗体-抗原-抗体サンドイッチ法)を実施した。具体的な手順を以下に記す。
【0079】
5%トレハロース(和光純薬)及び0.025%Triton(登録商標) X−100(和光純薬)を含む炭酸−重炭酸緩衝液(pH9.6)を固相化バッファーとする。抗IL−1β抗体(Biolegend)を固相化バッファーに溶解し、終濃度50μg/mlの抗体溶液を調製した。この溶液を実施例2で得られた96穴マイクロプレートの各ウェルに5μlずつ分注した。37℃で2時間放置して乾燥濃縮させた後、ウェル内を洗浄バッファーで2回洗浄した。次に、希釈バッファーを用いて0〜2500pg/mlのIL−1β(和光純薬)を調製し、各ウェルに50μlずつ分注した。室温で60分間放置した後、ウェル内を洗浄バッファーで1回洗浄した。希釈バッファーを用いてビオチン標識2次抗体(Biolegend)を500倍希釈し、これを各ウェルに50μlずつ分注した。室温で30分間放置した後、ウェル内を洗浄バッファーで1回洗浄した。次に、希釈バッファーを用いてHRP標識ストレプトアビジン(Prozyme)を4000倍希釈し(終濃度0.25μg/ml)、これを各ウェルに50μlずつ分注した。室温で10分間放置した後、ウェル内を洗浄バッファーで3回洗浄した。化学発光基質であるイムノスターLD(和光純薬)を30μl添加し、LAS4000mini(GEヘルスケア)を用いて化学発光画像を取得した。最後に、専用のソフトウェアを用いて化学発光強度を算出、図6(本発明)のような検量線を作成した。感度は0.15pg/mlであった。
【0080】
(比較例2)
未処理の96穴マイクロプレート(BD FalconTM)および従来品の96穴マイクロプレート(酸素プラズマ処理によって親水化されたポリスチレン製96穴マイクロプレート)を用いて図5に示すELISA(抗体-抗原-抗体サンドイッチ法)を実施した。具体的な手順を以下に記す。
【0081】
比較例1と同様の各種バッファーを用いた。抗IL−1β抗体(Biolegend)を固相化バッファーに溶解し、終濃度5μg/mlの抗体溶液を調製した。この溶液を96穴マイクロプレートの各ウェルに50μlずつ分注した。室温で2時間放置した後、ウェル内を洗浄バッファーで2回洗浄した。次に、ブロッキングバッファーを各ウェルに100μlずつ分注した。室温で60分間放置した後、ウェル内を洗浄バッファーで2回洗浄した。希釈バッファーを用いて0〜2500pg/mlのIL−1β(和光純薬)を調製し、各ウェルに50μlずつ分注した。室温で60分間放置した後、ウェル内を洗浄バッファーで1回洗浄した。希釈バッファーを用いてビオチン標識2次抗体(Biolegend)を500倍希釈し、これを各ウェルに50μlずつ分注した。室温で30分間放置した後、ウェル内を洗浄バッファーで1回洗浄した。次に、希釈バッファーを用いてHRP標識ストレプトアビジン(Prozyme)を4000倍希釈し(終濃度0.25μg/ml)、これを各ウェルに50μlずつ分注した。室温で30分間放置した後、ウェル内を洗浄バッファーで3回洗浄した。化学発光基質であるイムノスターLD(和光純薬)を30μl添加し、LAS4000mini(GEヘルスケア)を用いて化学発光画像を取得した。最後に、専用のソフトウェアを用いて化学発光強度を算出、図6(未処理、従来品)のような検量線を作成した。未処理品と従来品の感度はそれぞれ9.8pg/mlと2.4pg/mlであった。
【0082】
【表1】

【0083】
[実施例5]
シラノール処理時間およびPEG鎖の数平均分子量がELISA(間接法)の感度に及ぼす影響を調べた。具体的な手順を以下に記す。
【0084】
1.65mlの3−グリシドキシプロピルトリメトキシシラン(モメンティブ・パフォーマンス・マテリアルズ)に0.35mlの希塩酸(pH2.4)を添加してシラノールを調製した。これを100mlの2−プロパノール(純正化学)に添加した。ここに、さらに0.5mlのトリエチルアミン(和光純薬)を添加した。このシラノール溶液を96穴マイクロプレート(BD FalconTM)の各ウェルに100μlずつ分注した。そのまま室温で60〜135分間放置した。その後、ウェル内を純水で洗浄し、窒素ブローで乾燥させた。この操作によってマイクロプレートのウェル内にポリシロキサンとエポキシ基を含むプライマー層が形成された。次に、触媒量の濃硫酸を含んだPEG(13種)を各ウェルに100μlずつ分注した。そのまま80℃で45分間加熱した。その後、ウェル内を純水で洗浄し、窒素ブローで乾燥させた。この操作によってプライマー層上にPEGを含む親水性ポリマー層が形成された。次に、脱水アセトニトリル(関東化学)と脱水ジメチルスルホキシド(関東化学)の等重量混合溶媒を用いて終濃度0.5MのCDI(東京化成)溶液を調製し、これを各ウェルに20μlずつ分注した。そのまま室温で30分間放置した。その後、ウェル内を純水で洗浄し、窒素ブローで乾燥させた。この操作によって親水性ポリマー層に含まれるPEGの末端に(1H−イミダゾール−1−イル)カルボニル基が導入されたPEG誘導体が形成された。以上の操作により、PEG鎖の結合密度やPEG鎖の数平均分子量の異なる物質固定化用担体が得られた。これらの物質固定化用担体を用いて実施例3に記載の方法でELISAの感度を測定した。その結果、表2に示すようにPEG鎖の数平均分子量が176以上で従来よりも顕著に高い感度が得られることがわかった。また、PEG鎖の分子量が大きい場合は比較的低密度であっても高い感度が実現できることがわかった。
【0085】
【表2】

【0086】
表2に示す各原料の数平均分子量は以下の通りである。
【0087】
【表3】

【0088】
[実施例6]
実施例5で得られた物質固定化用担体のXPS分析を行った。XPS分析は、アルバック・ファイ社製のX線分光分析装置「ESCA5600」を用い、光電子取り込み角度を45°に設定して行った。その結果、表2に示すようにELISAの感度とN(1s)/C−Oとの間に明確な相関が認められた。すなわち、N(1s)/C−Oの値が0.010〜0.100の範囲にあるときに従来よりも顕著に高い感度が得られることがわかった。
【0089】
[実施例7]
前述のように、乾燥に伴うタンパク質の変性を防ぐ目的で、緩衝液にトレハロースを添加することが重要である。実施例4において、トレハロース濃度の異なる緩衝液を6種類用意し、ELISAにおけるトレハロース濃度依存性を検討した。その結果、図7−1〜7−6に示すように、5〜10%(w/v)のトレハロースで固相化時間(被固定化物質溶解溶液の接触から乾燥濃縮工程完了までの時間)に伴うシグナルの低下を防ぐことができることがわかった。
【技術分野】
【0001】
本発明は、免疫アッセイに用いるための固相担体に関する。
【背景技術】
【0002】
免疫測定法の一種である酵素結合免疫吸着アッセイ(Enzyme−Linked Immunosorbent Assay、以下ELISA)は、創薬、診断、環境計測、食品を含む幅広い分野で利用されている。典型的なELISAは、(1)抗体または抗原の固定化(固相化)、(2)標的物質の結合、(3)酵素標識抗体の結合、(4)酵素反応、(5)光学的検出(吸収、蛍光、発光)、の5つの工程からなる。標識用酵素としては西洋わさびペルオキシダーゼやアルカリホスファターゼなどが用いられる。ELISAは数ある免疫測定法のなかでも特に感度が高い。しかし、実際には固相担体への生体分子の非特異吸着が原因で期待する感度が得られないことも多い。特に酵素標識抗体のような複合体は固相担体に吸着しやすく、これがELISAにおけるノイズの主な原因となっている。このような非特異吸着を防ぐためにウシ血清アルブミン(BSA)によるブロッキング処理が試みられるが、その効果は限定的と言わざるを得ない。そこで、生体分子の非特異吸着を効果的に防ぐポリエチレングリコール(以下PEG)に注目が集まっている。すなわち、抗体または抗原の固定化を、PEGリンカーを介して行うことによって、固相担体への生体分子の非特異吸着を防ぐ試みがなされている。
【0003】
特許文献1には、PEGリンカーを介して抗体を金表面に固定化する方法が開示されている。具体的には、金表面に非イオン性官能基を導入し、ここにヘテロ二官能性PEGの片末端を共有結合させ、別の末端に抗体を結合させる、というものである。この方法によって表面プラズモン共鳴法におけるノイズが有意に低減されることが記載されている。
【0004】
特許文献2には、PEGリンカーを介して核酸やタンパク質をガラス表面に固定化する方法が開示されている。具体的には、PEGリンカーを有するシラン化合物を合成し、これをガラス表面に適用した後、PEGリンカーの末端に核酸やタンパク質を結合させる、というものである。この方法によってバイオチップのS/N比(感度)が改善されることが記載されている。
【0005】
特許文献3には、PEGリンカーを介して核酸をガラス表面に固定化する方法が開示されている。具体的には、シランカップリング剤をガラス表面に適用してアミノ基を導入し、ここにホモ二官能性PEGの片末端を共有結合させ、別の末端に核酸を結合させる、というものである。この方法によってバイオセンサの感度が改善されることが記載されている。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2005−164348号公報
【特許文献2】特開2006−143715号公報
【特許文献3】特開2006−509201号公報
【発明の概要】
【発明が解決しようとする課題】
【0007】
従来、PEGリンカーを介して生体分子を固定化する方法は知られているが、ELISA等の免疫アッセイにおいて高い感度が発揮される、PEGリンカーを介して固定化を行う物質固定化用担体は開示されていない。
【0008】
また、標的物質と特異的に結合する抗体、抗原等の被固定化物質を固相担体に固定化する免疫アッセイにおいて、PEGリンカーを有する物質固定化用担体に、生体関連物質である被固定化物質をその活性を維持したまま高密度に固定化することは困難であった。
【0009】
本発明はこのような実情に鑑みてなされたものであり、ELISA等の免疫アッセイにおいて高い検出感度を実現する、PEGリンカーを有する物質固定化用担体、該担体への被固定化物質の固定化方法、並びに、該担体を使用した免疫アッセイ法及びそのためのキットを提供することを目的とする。
【課題を解決するための手段】
【0010】
本発明者は、表面に特定の条件を満足するPEGリンカーを含む親水性ポリマー層を備える支持体を物質固定化用担体として用いて免疫アッセイを行った場合に高い検出感度を実現できることを見出し、本発明を完成させるに至った。本発明は以下の発明群を包含する。
(1)免疫アッセイに用いるための物質固定化用担体であって、
支持体と、
前記支持体の表面に配置された親水性ポリマー層と
を少なくとも含み、
前記親水性ポリマー層が、
数平均分子量が176以上であるポリエチレングリコール鎖と、
標的物質と結合する抗原又は抗体である被固定化物質或いは標的物質である被固定化物質と共有結合を形成可能な、前記ポリエチレングリコール鎖に連結された官能基と
を含む、物質固定化用担体。
(2)前記官能基が、n個の窒素原子を含有する官能基を含み、
前記親水性ポリマー層中の窒素濃度が、前記親水性ポリマー層中のC−O結合に由来する炭素濃度を1としたとき、0.010以上、0.050×n以下である、
(1)の物質固定化用担体。
(3)前記窒素を含有する官能基が、(1H−イミダゾール−1−イル)カルボニル基又はスクシンイミジルオキシカルボニル基である、(2)の物質固定化用担体。
(4)免疫アッセイに用いるための物質固定化担体であって、
支持体と、
前記支持体の表面に配置された親水性ポリマー層と、
標的物質と結合する抗原又は抗体である被固定化物質或いは標的物質である被固定化物質と
を少なくとも含み、
前記親水性ポリマー層が、数平均分子量が176以上であるポリエチレングリコール鎖を含み、
前記ポリエチレングリコール鎖と、前記被固定化物質とが共有結合を介して連結されている、物質固定化担体。
(5)(1)〜(3)のいずれかの物質固定化用担体と、前記被固定化物質とから、前記官能基と前記被固定化物質とを反応させて共有結合を形成することにより製造されたものである、(4)の物質固定化担体。
(6)(4)又は(5)の物質固定化担体の製造方法であって、
(1)〜(3)のいずれかの物質固定化用担体と、前記被固定化物質を溶解した溶液とを接触させる、被固定化物質接触工程と、
前記物質固定化用担体に接触させた前記溶液を乾燥濃縮させる、乾燥濃縮工程と、
を含む方法。
(7)前記溶液が糖類を含む、(6)の方法。
(8)前記糖類がトレハロースである、(7)の方法。
(9)前記溶液が非イオン性界面活性剤を含む、(6)〜(8)のいずれかの方法。
(10)前記乾燥濃縮工程の後に、前記物質固定化担体とアミノ基を有する低分子化合物とを接触させる工程を更に含む、(6)〜(9)のいずれかの方法。
(11)(4)又は(5)の物質固定化担体を用いて標的物質を測定する工程を含む、免疫アッセイにより標的物質を測定する方法。
(12)(1)〜(3)のいずれかの物質固定化用担体を含む、免疫アッセイにより標的物質を測定するためのキット。
(13)(4)又は(5)の物質固定化担体を含む、免疫アッセイにより標的物質を測定するためのキット。
(14)サンドイッチ方式の免疫アッセイに用いるための、(13)のキットであって、
被固定化物質が標的物質と結合する抗原又は抗体である、(4)又は(5)の物質固定化担体と、
被固定化物質と非競合的に標的物質と結合する、直接的又は間接的に検出可能な抗原又は抗体である、検出可能抗原又は検出可能抗体と、
を少なくとも含むキット。
(15)直接競合方式の免疫アッセイに用いるための、(13)のキットであって、
被固定化物質が標的物質と結合する抗原又は抗体である、(4)又は(5)の物質固定化担体と、
測定対象試料中の標的物質と競合的に前記被固定化物質と結合する、直接的又は間接的に検出可能な標的物質である、検出可能標的物質と
を少なくとも含むキット。
(16)間接競合方式の免疫アッセイに用いるための、(13)のキットであって、
被固定化物質が標的物質である、(4)又は(5)の物質固定化担体と、
測定対象試料中の標的物質と被固定化物質とが競合的に結合する、直接的又は間接的に検出可能な抗原又は抗体である、検出可能抗原又は検出可能抗体と、
を少なくとも含むキット。
(17)免疫アッセイに用いるための物質固定化用担体であって、
支持体と、
前記支持体の表面に配置された親水性ポリマー層と
を少なくとも含み、
前記親水性ポリマー層が、
ポリエチレングリコール鎖と、
標的物質と結合する抗原又は抗体である被固定化物質或いは標的物質である被固定化物質と共有結合を形成可能な、前記ポリエチレングリコール鎖に連結された官能基と
を含み、
前記官能基が、n個の窒素原子を含有する官能基を含み、
前記親水性ポリマー層中の窒素濃度が、前記親水性ポリマー層中のC−O結合に由来する炭素濃度を1としたとき、0.010以上、0.050×n以下である、
物質固定化用担体。
(18)(17)の物質固定化用担体を含む、免疫アッセイにより標的物質を測定するためのキット。
【発明の効果】
【0011】
本発明の物質固定化用担体を用いて免疫アッセイを行うことにより高い検出感度を実現することができる。
【図面の簡単な説明】
【0012】
【図1】図1は、物質固定化用担体に関する本発明の一実施形態を示す。
【図2】図2は、物質固定化用担体の製造方法に関する本発明の一実施形態を示す。
【図3】図3は、本発明の物質固定化担体を用いたELISA(間接法)の一実施形態を示す。
【図4】図4は、本発明の物質固定化担体を用いたELISA(間接法)の検量線を示す。
【図5】図5は、本発明の物質固定化担体を用いたELISA(サンドイッチ法)の一実施形態を示す。
【図6】図6は、本発明の物質固定化担体を用いたELISA(サンドイッチ法)の検量線を示す。
【図7−1】図7−1は、実施例7における被固定化物質溶解液のトレハロース濃度0%(w/v)である場合のELISA(サンドイッチ法)の検量線を示す。
【図7−2】図7−2は、実施例7における被固定化物質溶解液のトレハロース濃度0.6%(w/v)である場合のELISA(サンドイッチ法)の検量線を示す。
【図7−3】図7−3は、実施例7における被固定化物質溶解液のトレハロース濃度1.25%(w/v)である場合のELISA(サンドイッチ法)の検量線を示す。
【図7−4】図7−4は、実施例7における被固定化物質溶解液のトレハロース濃度2.5%(w/v)である場合のELISA(サンドイッチ法)の検量線を示す。
【図7−5】図7−5は、実施例7における被固定化物質溶解液のトレハロース濃度5%(w/v)である場合のELISA(サンドイッチ法)の検量線を示す。
【図7−6】図7−6は、実施例7における被固定化物質溶解液のトレハロース濃度10%(w/v)である場合のELISA(サンドイッチ法)の検量線を示す。
【図8】図8は、サンドイッチELISAの反応系の一例を模式的に示す。
【図9】図9は、直接競合ELISAの反応系の一例を模式的に示す。
【図10】図10は、間接競合ELISAの反応系の一例を模式的に示す。
【図11】図11は、本発明の物質固定化用担体の製造方法の一例の概略を示す。
【図12】図12は、本発明の物質固定化担体の製造方法の一例の概略を示す。
【図13】図13は、本発明の物質固定化用担体の実施形態の一例を模式的に示す。
【発明を実施するための形態】
【0013】
(支持体)
本発明における支持体の材料及び形状は、免疫アッセイにおける固相の支持体として利用可能な材料及び形状であれば特に限定されない。支持体の材料としてはプラスチック、ガラス、石英、シリコン、金属等が挙げられる。プラスチックは成型が容易であること、輸送及び廃棄における問題が小さいことから免疫アッセイ用担体の支持体の材料として特に好ましい。すなわち本発明において好ましい支持体は、その全部又は少なくとも一部にプラスチックを含む。支持体の、後述する親水性ポリマー層が形成される側の表面がプラスチックを含むことが好ましく、該表面がプラスチックからなることがより好ましい。プラスチックの具体例としては、ポリスチレン、ポリプロピレン、ポリ塩化ビニル、ポリエチレン、環状ポリオレフィン、アクリル樹脂、ポリエチレンテレフタラートなどが挙げられる。予め支持体表面にプラズマ処理やコロナ処理などの親水化処理が施されていてもよい。支持体は、免疫アッセイにおける固相として利用可能な表面を有している支持体であればよく、全体の形状は特に限定されない。例えばマイクロウェルプレート(複数の凹部が形成された板状体)、粒子、スライド、チューブ、キャピラリー、マイクロ流路などの形態の支持体を用いることができる。特にマイクロウェルプレート、とりわけポリスチレン製のマイクロウェルプレートの形態の支持体は有用である。
【0014】
(親水性ポリマー層)
支持体の表面には、親水性ポリマー層が配置される。親水性ポリマー層はポリエチレングリコール鎖(PEG鎖)を少なくとも含む。「ポリエチレングリコール鎖(又はPEG鎖)」とは次式:
−(CH2−CH2−O)m−
(mは重合度を示す整数である)
で表される構造を指す。驚くべきことに、親水性ポリマー層におけるPEG鎖の数平均分子量が免疫アッセイの感度に影響を与える。十分に高感度の免疫アッセイを行うためにはPEG鎖の数平均分子量は176以上(mが4以上)であることが好ましく、より好ましくは362以上である。PEG鎖の数平均分子量が上記の下限よりも小さい場合には実験例で確認されている通り十分な感度が達成できない場合がある。PEG鎖の数平均分子量の上限は特に限定されないが、数平均分子量が大きくなるほど粘度が増すため取扱いが難しいこと、及び、PEG鎖の高密度での配置が難しいことから、PEG鎖の数平均分子量は25000以下であることが好ましく、10000以下であることがより好ましい。
【0015】
PEG鎖の数平均分子量は、原料として用いられるPEG又は担体から解離させたPEG:
HO−(CH2−CH2−O)m−H
(mは重合度を示す整数である)
の数平均分子量からH2Oの分子量(18.015)を控除することにより求めることができる。PEG数平均分子量は蒸気圧浸透圧法または膜浸透圧法によって求められる。蒸気圧浸透圧法はPEGの数平均分子量が100,000未満のときに使用することができる。膜浸透圧法はPEGの数平均分子量が10,000〜1,000,000のときに使用することができる。
【0016】
固定化前の物質固定化用担体におけるPEG鎖の一端には、被固定化物質との共有結合を形成することが可能な、少なくとも1つの官能基が直接的又は間接的に連結されていることが好ましい。このような官能基としては、被固定化物質と共有結合を形成することが可能な、(1H−イミダゾール−1−イル)カルボニル基、スクシンイミジルオキシカルボニル基、エポキシ基、アルデヒド基、アミノ基、チオール基、カルボキシル基、アジド基、シアノ基、活性エステル基(1H−ベンゾトリアゾール−1−イルオキシカルボニル基、ペンタフルオロフェニルオキシカルボニル基、パラニトロフェニルオキシカルボニル基等)、ハロゲン化カルボニル基(塩化カルボニル基、フッ化カルボニル基、臭化カルボニル基、ヨウ化カルボニル基)等が挙げられる。これらの官能基は、PEG鎖の末端のヒドロキシル基の水素を置換する置換基として、PEG鎖に直接的に連結されていてもよいし、PEG鎖の末端に結合したリンカー構造に結合した官能基として、PEG鎖に間接的に連結されていてもよい。被固定化物質への反応性と、保存安定性のバランスを考慮すると、(1H−イミダゾール−1−イル)カルボニル基及びスクシンイミジルオキシカルボニル基が好ましい。これらの官能基は被固定化物質が有するアミノ基等の官能基と反応して共有結合を形成することができる。
【0017】
PEG鎖の結合密度も免疫アッセイの検出感度に影響する。PEG鎖の結合密度はX線光電子分光法(XPS)を用いてある程度推定することができる。エチレングリコール単位(CH2−CH2−O)は(XPS)においてC(1s)シグナルのC−O成分を与え、(1H−イミダゾール−1−イル)カルボニル基、スクシンイミジルオキシカルボニル基等の窒素原子含有官能基はXPSにおいてN(1s)シグナルを与える。元素濃度比N(1s)/C−OはPEG鎖の結合密度と明確な相関がある。免疫アッセイでの高い検出感度を実現するためには、官能基がn個の窒素原子を含有する場合、元素濃度比N(1s)/C−Oが0.010以上、0.050×n以下であることが好ましい。「0.010以上、0.050×n以下」とは、例えば、n=1の場合は「0.010以上、0.050以下」を意味し、n=2の場合は「0.010以上、0.100以下」を意味し、n=3の場合は「0.010以上、0.150以下」を意味し、n=4の場合は「0.010以上、0.200以下」を意味する。本発明におけるXPSは、アルバック・ファイ社製のX線分光分析装置「ESCA5600」を用い、光電子取り込み角度を45°に設定して測定される。n個の窒素原子を含有する官能基としては、(1H−イミダゾール−1−イル)カルボニル基(n=2)及びスクシンイミジルオキシカルボニル基(n=1)以外にイソシアネート基(n=1)、アジドカルボニル基(n=3)、カルボジイミド基(n=2)、マレイミジル基(n=1)、アジリジン−2−イル基(n=1)、1H−ベンゾトリアゾール−1−イルオキシカルボニル基(n=3)、1H−7−アザベンゾトリアゾール−1−イルオキシカルボニル基(n=4)が挙げられる。これらの官能基についても、XPSにより求められる、親水性ポリマー層中のC−O結合に由来する炭素濃度を1としたときの窒素濃度(N(1s)/C−O)が上記と同様の数値範囲であることが好ましい。
【0018】
親水性ポリマー層には官能基が付加されていないPEG鎖や、他の親水性化合物が更に含まれていてもよい。
【0019】
(親水性ポリマー層の形成方法)
支持体の、免疫アッセイにおける固相として利用される位置の表面に親水性ポリマー層が形成される。親水性ポリマー層は、支持体表面に化学的又は物理的に固定された官能基との共有結合により支持体に固定化されることができる。
【0020】
本発明の物質固定化用担体は、図11に概略を示すとおり、プライマー層又はカップリング剤を用いて支持体の表面に官能基を導入する工程S1101と、前記官能基にPEG鎖を連結させる工程S1102と、PEG鎖末端へ官能基を連結する工程S1103とを含む方法により製造することができる。
【0021】
(プライマー層による官能基の導入)
支持体が表面にプラスチックを含む支持体である場合、該表面にはプライマー層が形成され、該プライマー層の表面に親水性ポリマー層が形成されていることが好ましい。このとき、プライマー層のポリシロキサンの側鎖上の官能基が、PEG鎖末端と共有結合を形成される。この場合の、本発明の物質固定化用担体の実施形態の概要を図13を参照して説明する。
【0022】
物質固定化用担体10は、表面Sにプラスチックを含む支持体11と、表面S上に配置された、ポリシロキサンを含むプライマー層12と、プライマー層12上に配置された、PEG鎖を含む親水性ポリマー層13とを備える。
【0023】
親水性ポリマー層13のPEG鎖−(CH2−CH2−O)m−はプライマー層12を構成するポリシロキサンの側鎖Aと共有結合を介して連結されている。ここで側鎖Aは、後述する式1のシラノール化合物が有する、R1に由来する基であり、R1上の官能基又は該官能基から誘導された官能基がPEG鎖の末端のヒドロキシル基と共有結合を形成して形成された二価の基を指す。ケイ素原子に結合する基Xは式1のシラノール化合物のR1(p=2の場合)、R2(p+q=3の場合)、又はヒドロキシル基(q=3の場合)に由来する基である。プライマー層12中のポリシロキサンは直鎖状であってもよいし、分岐鎖状又は網目状の構造を有していてもよいが、好ましくは分岐鎖状又は網目状の構造を有する。ポリシロキサンが分岐鎖状又は網目状の構造を有するとき、Xは、他の繰り返し単位(図示していない)のケイ素原子と結合する架橋基である。架橋基としてのXとしては、式1のシラノール化合物のヒドロキシル基に由来するエーテル基(−O−)が挙げられる。ポリシロキサンが直鎖状の構造を有するとき、Xは、式1に定義するR1又はR2、未反応のヒドロキシル基、加水分解されずに残存した式2に定義する基Y等の一価の基である。PEG鎖の両端のうち、ポリシロキサンと連結されていない側の端部には、被固定化物質と共有結合を形成可能な官能基R3が、直接的に、或いは必要に応じてリンカーを介して間接的に連結されていることが好ましい。図13においてQは結合、又はリンカーを示す。
【0024】
図13に示す本実施形態において、支持体11は、少なくとも表面Sにプラスチックを含む。ポリシロキサンを含むプライマー層12は支持体11の表面Sに物理吸着により結合することができる。物理吸着はファンデルワールス力または疎水性相互作用により生じると考えられる。プライマー層12と支持体11の表面Sとの間には共有結合等の化学結合が形成される必要はないため、表面Sがポリスチレン等の、反応性官能基を含まないプラスチックからなる場合であっても、プライマー層12を結合させることができる。
【0025】
プライマー層12中におけるポリシロキサンの状態は必ずしも明らかではないが、図2に示すように複数のポリシロキサン分子の主鎖部分同士が会合し、側鎖である有機基が支持体表面及び親水性層の側に面した二層構造を形成している可能性がある。このような二重構造が形成される機構は以下のように推定される。まず、シラノールのポリマー化によってファンデルワールス力が増大したポリシロキサンがプラスチック表面に物理吸着する。このとき、プラスチック表面とシラノール化合物の有機基との間に働く疎水性相互作用によりシラノール化合物の有機基はプラスチック側に配向する。ポリシロキサンの一層目が形成された後、溶媒側に配向したシラノール基(Si−OH)に別のポリシロキサンが結合する。このとき、シラノール基同士の水素結合によりシラノール化合物の有機基は溶媒側に配向する。その結果、ポリシロキサンは図2に示すような二層構造となると考えられる。溶媒側に配向した有機基は親水性層との共有結合を形成することができる。
【0026】
プライマー層は、少なくともポリシロキサンを含む層により形成することができる。ここで、ポリシロキサンとはシロキサン結合(Si−O−Si)の繰り返し単位からなるポリマーであり、シラノール化合物の縮合重合によって得ることができる。シラノール化合物の縮合はシラノール化合物の分子間で起こる反応である。支持体表面のプラスチック分子が反応性の官能基を有してない場合には、シラノール化合物と支持体表面のプラスチック分子との間では反応は起こらない。すなわち、シラノール化合物及び形成されたポリシロキサンは支持体表面のプラスチック分子とは化学的に反応せずに、単に物理的に吸着しているだけである。この点は、ガラスを支持体とする場合とは大きく異なる。このようなシラノール化合物のプラスチック表面への物理吸着力は、モノマーでは極めて弱いが、ある程度縮合が進み、ポリマー(ポリシロキサン)となれば強くなる。シラノール化合物を適度に縮合することによって、プラスチック表面にポリシロキサンを含むプライマー層が形成される。
【0027】
(シラノール化合物)
本発明で用いられるシラノール化合物は、シラノール基(Si−OH)に加えて、ケイ素原子に直結した炭素原子を含み且つ官能基を有する有機基を有する。この有機基はポリシロキサンの側鎖となる。シラノール化合物は典型的には式1で表される構造を有する:
(R1)p(R2)4−p−qSi(OH)q ・・・・(式1)
(pは1又は2であり、qは2又は3であり、p+qは3又は4であり、R1は、独立に、ケイ素原子に直結した炭素原子を含み且つ官能基を有する有機基であり、R2はケイ素原子に直結した炭素原子を含む有機基である)。p=1かつq=2又は3であることが好ましく、p=1かつq=3であることがより好ましい。p+q=4である場合、R2は存在しない。
【0028】
R1は、好ましくは、水素原子が1つ以上(好ましくは1つ)の官能基により、必要に応じて適当なリンカー構造を介して、置換されている、炭素数が1〜20、好ましくは1〜15、より好ましくは1〜10、特に好ましくは1〜6の炭化水素基である(ただし、前記炭化水素基の全部又は一部がビニル基である場合のように、前記炭化水素基自体が官能基である場合は官能基により置換されている必要はない)。前記炭化水素基は、直鎖又は分岐鎖或いは環構造を有する、飽和又は不飽和の脂肪族炭化水素基(アルキル基、炭素数2以上のアルケニル基、又は炭素数2以上のアルキニル基)であってもよいし、単環又は多環の炭素数6以上の芳香族炭化水素基であってもよいし、1つ以上の前記脂肪族炭化水素基によって置換された前記芳香族炭化水素基であってもよいし、1つ以上の前記芳香族炭化水素基によって置換され前記脂肪族炭化水素基であってもよい。前記炭化水素基では、炭素−炭素結合が、1又は2個の、酸素、窒素及び硫黄から選択される同一又は異なる原子により中断されていてもよい。炭化水素基の例としては好ましくはプロピル基、エチル基が挙げられる。
【0029】
R1における、前記炭化水素基の1つ以上の水素を、必要に応じて適当なリンカー構造を介して、置換する官能基としては、PEGのヒドロキシル基と反応して共有結合を形成することができる官能基、又はPEGのヒドロキシル基と反応して共有結合を形成することができる官能基に変換可能な官能基であれば特に限定されないが、典型的には、(1H−イミダゾール−1−イル)カルボニル基、スクシンイミジルオキシカルボニル基、グリシジル基、エポキシ基、アルデヒド基、アミノ基、チオール基、カルボキシル基、アジド基、シアノ基、活性エステル基(1H−ベンゾトリアゾール−1−イルオキシカルボニル基、ペンタフルオロフェニルオキシカルボニル基、パラニトロフェニルオキシカルボニル基等)、ハロゲン化カルボニル基、イソシアネート基、マレイミド基等が挙げられ、なかでも、グリシジル基又はエポキシ基が好ましい。グリシジル基又はエポキシ基は、それ自体がPEGのヒドロキシル基と反応して共有結合を形成可能であるが、特開2009−156864号公報に記載されている方法に従って、グリシジル基又はエポキシ基をアルデヒド基に変換し、形成されたアルデヒド基と、PEGが有するヒドロキシル基とを反応させてもよい。これらの官能基は、前記炭化水素基の水素原子を直接置換してもよいし、適切なリンカー構造を介して置換してもよい。リンカー構造としては、例えば炭素の数が0〜3個、窒素、酸素及び硫黄から選択される同一又は異なるヘテロ原子の数が0〜3個である二価の基が挙げられ、例えば、炭化水素基が左側に、官能基が右側にそれぞれ結合するとしたとき、−O−、−S−、−NH−、−(C=O)O−、−O(C=O)−、−NH(C=O)−、−(C=O)NH−、−(C=O)S−、−S(C=O)−、−NH(C=S)−、−(C=S)NH−、−(N=C=N)−、−CH=N−、−N=CH−、−O−O−、−S−S−、−(O=S=O)−で表される構造が挙げられる。
【0030】
R1の特に好ましい態様としては3−グリシドキシプロピル基、2−(3,4−エポキシシクロヘキシル)エチル基が挙げられる。
【0031】
R2は、好ましくは、置換基により置換されていないという点を除いてR1について上述したものと同様の(ただしR1とは独立して選択される)炭化水素基であり、なかでも、炭素数が1〜6の直鎖又は分岐鎖のアルキル基が好ましく、メチル基又はエチル基が特に好ましい。
【0032】
(加水分解によりシラノール化合物を生成するケイ素化合物)
前記シラノール化合物は、加水分解によりシラノール基(Si-OH)を生成可能な基を有するケイ素化合物を、加水分解することにより生成することができる。このようなケイ素化合物は式2で表される構造を有する:
(R1)p(R2)4−p−qSi(Y)q ・・・・(式2)
(Yは、独立に、加水分解によりシラノール基を生成可能な基であり、p、q、R1、R2はそれぞれシラノール化合物に関して定義したとおりである)。
【0033】
Yとしては、アルコキシ基、ハロゲン原子、アリールオキシ基、アルコキシ基又はアリールオキシ基により置換されたアルコキシ基、アルコキシ基又はアリールオキシ基により置換されたアリールオキシ基、アルキルカルボニルオキシ基等が好ましい。Yとしては特に、炭素数1〜6のアルコキシ基(特にメトキシ基、エトキシ基、イソプロポキシ基、tert−ブトキシ基)、炭素数1〜6の、アルコキシ基により置換されたアルコキシ基(例えばメトキシエトキシ基)、炭素数1〜6のアルキルカルボニルオキシ基(例えばアセトキシ基)、塩素原子が好ましい。
【0034】
式2のケイ素化合物としては、シランカップリング剤として市販されている化合物を好適に使用することができ、3−グリシドキシプロピルトリメトキシシラン又は3−グリシドキシプロピルトリエトキシシランが特に好ましい。
【0035】
(プライマー層の形成方法)
ポリシロキサンを含むプライマー層は、支持体の表面上において式1のシラノール化合物を重合させる工程(プライマー層形成工程)を含む方法により形成可能である。該工程は、好ましくは、式2のケイ素化合物を以下のように加水分解し、式1のシラノール化合物を生成する工程と、生成したシラノール化合物と塩基とがアルコール中に溶解された溶液を前記支持体の表面上に接触させる工程とを含む。加水分解の条件は特に限定されないが、例えば次の方法が可能である。まず、式2のケイ素化合物に希塩酸を添加し、基Yを加水分解する。希塩酸のpHは2.0〜3.0に調整するのが望ましい。ケイ素化合物に対する水分子のモル比は2〜4とする。この操作によって基Yはシラノール基へ変換され、式1のシラノール化合物が生成する。
【0036】
次いでシラノール化合物を支持体表面に適用し、縮合重合によりポリシロキサンを形成する。式1のシラノール化合物は、塩基とともにアルコールに溶解する。シラノール化合物の終濃度は0.1〜10%(v/v)の範囲で調整することが望ましい。塩基はトリエチルアミン、N,N−ジイソプロピルエチルアミン、ピリジン、4−ジメチルアミノピリジンなどを用いることができるが、これらに限定されない。塩基の終濃度は0.1〜10%(v/v)の範囲で調整することが望ましい。アルコールはエタノール、2−プロパノール、tert−ブチルアルコール等を用いることができるが、これらに限定されない。このシラノール化合物溶液を支持体のプラスチック表面に接触させ、10分〜24時間放置する。反応温度は4〜80℃の範囲で設定できるが、特に室温(20〜25℃)が好ましい。以上の操作によって、プラスチック表面にポリシロキサンを含むプライマー層が物理吸着によって形成される。プライマー層の被覆密度は、シラノールや塩基の濃度、あるいはシラノール溶液をプラスチック表面に接触させる時間によって制御可能である。プライマー層の被覆密度が高ければ高いほど、次の工程で共有結合させるPEG鎖の結合密度も高くなる。
【0037】
形成されたポリシロキサンの側鎖上のシラノール化合物からの官能基を誘導体化して他の官能基に変換する場合には、プライマー層形成後に引き続き、ポリシロキサンの側鎖上のシラノール化合物からの官能基を、PEGのヒドロキシル基と反応して共有結合を形成することができる官能基に変換する誘導体化工程を行う。
【0038】
(シランカップリング剤による官能基の導入)
支持体が表面にガラス、石英またはシリコンを含む支持体である場合、該表面に、シランカップリング剤の加水分解により生成される、ケイ素原子に直結した炭素原子を含み且つ官能基を有する有機基を有するシラノール化合物を結合させることにより、或いは、更に、必要に応じて該官能基をPEGと共有結合を形成することができる他の官能基に変換する誘導体化により、支持体表面にPEGと共有結合を形成することができる官能基を導入することができる。該官能基とPEGの一端との反応によりシランカップリング剤と親水性ポリマー層のPEG鎖とを共有結合により連結することができる。
【0039】
シラノール化合物としては、プライマー層に関して上述した式1のシラノール化合物と同様のものを使用することができる。
【0040】
シランカップリング剤としては、プライマー層に関して上述した式2のケイ素化合物と同様のものを使用することができる。
【0041】
この実施形態では、支持体表面に導入された、シラノール化合物又はシランカップリング剤に由来する有機基上の官能基又は該官能基から誘導された他の官能基がPEG末端のヒドロキシル基と共有結合を形成するために用いられる。
【0042】
(親水性ポリマー層の形成)
プライマー層、シランカップリング剤等により官能基が導入された支持体表面に、PEGを反応させてPEG鎖を形成する(S1102)。このとき触媒量の濃硫酸を含むPEGを接触させる。ここで、数平均分子量が1000を超えるPEGはあらかじめ加熱融解しておく。必要に応じて、PEGをtert−ブチルアルコールなどで希釈して用いてもよい。このPEG溶液をプラスチック表面に接触させ、加熱する。加熱温度は60〜100℃の範囲で設定できるが、プラスチックの耐熱性を加味すると80℃前後(75℃〜85℃)が好ましい。加熱時間は10分間〜24時間の範囲で設定できるが、加熱温度が80℃前後の場合は10〜60分間が好ましい。以上の操作によって、プライマー層にPEG鎖が共有結合する。このとき、PEG鎖の結合密度はプライマー層の被覆密度に依存する。
【0043】
最後に、PEG鎖の一端に、被固定化物質との共有結合を形成することが可能な、少なくとも1つの官能基を直接的又は間接的に連結させる(S1103)。官能基の導入方法は特に限定されない。(1H−イミダゾール−1−イル)カルボニル基及びスクシンイミジルオキシカルボニル基を、PEG鎖の末端のヒドロキシル基の水素を置換する置換基として導入する方法の好ましい実施形態は次の通りである。一端がプライマー層、シランカップリング剤等を介して支持体表面に固定されたPEG鎖の他端に、1,1’−カルボニルジイミダゾール(以下CDI)または炭酸ジ(N−スクシンイミジル)(以下DSC)を以下のように反応させる。
【0044】
【化1】

【0045】
上記の反応は、水分をほとんど含まない有機溶媒中で実施される必要がある。一般にプラスチックは有機溶剤に対する耐性が低いため、支持体がプラスチックを含む場合には、アセトニトリル、ジメチルスルホキシド、又はこれらの有機溶媒を適当な割合で混合した混合溶媒を利用することが好ましい。これらの有機溶剤の水分含有率は0.1重量%以下であることが望ましい。CDIまたはDSCの終濃度は0.01〜1Mの範囲で設定できるが、室温以下で反応させる場合は0.1M以上であることが望ましい。支持体がプラスチックを含む場合には、プラスチックへのダメージを避けるために反応温度を4〜25℃の範囲で設定することが望ましい。反応時間は10分間〜24時間の範囲で設定することが好ましく、CDI濃度が0.5M前後(0.4〜0.6M)のときは10分間〜60分間が好ましい。以上の操作によって、官能基が共有結合されたPEG鎖を含む親水性ポリマー層が形成される。
【0046】
(被固定化物質)
本発明の物質固定化用担体には、目的とする免疫アッセイの態様に応じて、標的物質と結合する抗原又は抗体や、標的物質が固定化される。本発明ではこれらの固定化の対象物質を「被固定化物質」と呼ぶ。「標的物質と結合する抗原又は抗体」が被固定化物質である実施形態(後述するサンドイッチ法又は直接競合法)において、被固定化物質と標的物質との組合せは、抗原抗体反応に基づく特異的な結合が可能な組合せであれば特に限定されない。例えば、標的物質が抗原(ハプテンを含む)である場合には、被固定化物質は抗体(抗体断片を含む)であることができ、標的物質が抗体(抗体断片を含む)である場合には、被固定化物質は抗原(ハプテンを含む)であることができる。「標的物質」が被固定化物質である実施形態(後述する間接競合法)では、標的物質は抗原(ハプテンを含む)又は抗体(抗体断片を含む)である。
【0047】
被固定化物質及び/又は標的物質としての抗原は、抗体との特異的な抗原抗体反応性を示す物質であれば特に限定されない。代表的な抗原として、タンパク質、ペプチド、糖類、核酸(DNA、RNA)、脂質、補酵素、細胞、ウイルス、細菌、これらの複合体等の天然抗原や、天然抗原の誘導体や、人為的に合成されたハプテン、人工抗原等が挙げられる。
【0048】
被固定化物質及び/又は標的物質としての抗体は、ある抗原に対して特異的な抗原抗体反応性を示す免疫グロブリン及びその断片を指し、必要に応じて化学修飾等が施されていてもよい。
【0049】
被固定化物質は、PEG鎖が有する官能基と反応して共有結合を形成可能な官能基を有する物質であれば特に限定されない。このような官能基としては代表的にはアミノ基が挙げられるが、チオール基、カルボキシル基、ヒドロキシル基、アルコキシド、2級アミン、3級アミン、アジド基、シアノ基等も包含される。なお、固定化しようとする物質に、アミノ基等の、PEG鎖に連結された官能基との反応で共有結合を形成可能な官能基が存在しない場合であっても、これらの物質にアミノ基等を人為的に導入することにより固定化に供することができる。
【0050】
(被固定化物質の固定化)
被固定化物質の固定化は例えば、図12に概略を示すように、本発明の物質固定化用担体と、被固定化物質を溶解した溶液とを接触させる工程S1201と、該溶液を乾燥濃縮して被固定化物質を物質固定化用担体のPEG鎖末端に共有結合させる工程S1202とを少なくとも含み、必要に応じてさらに、未反応のPEG鎖末端の官能基と、アミノ基含有低分子化合物とを接触させ、PEG鎖末端の官能基を不活性化する工程S1203とを含む方法により行うことができる。
【0051】
まず、被固定化物質を緩衝液に溶解する。ここで、アミノ基成分を含まない緩衝液を用いることが好ましい。例えば、リン酸緩衝液や炭酸−重炭酸緩衝液などを用いることができる。緩衝液のpHは7.0〜10.0の範囲で調整することが望ましい。被固定化物質の終濃度は0.01〜10mg/mlの範囲で調整するとよい。この被固定化物質溶解液を担体と接触させ(S1201)、そのまま乾燥濃縮させる(S1202)。乾燥濃縮によって、被固定化物質の反応系中での濃度が高まるため被固定化物質の固定化が著しく促進される。被固定化物質が少量しか準備できない場合は溶液中の被固定化物質の濃度を高めることは困難であるが、このような場合でも、比較的低濃度の被固定化物質溶解液を物質固定化用担体に接触させ、次いで乾燥濃縮することにより、被固定化物質の反応系中での濃度を高めることができ、固定化反応を促進することができる。被固定化物質が抗原、抗体等のタンパク質である場合は、乾燥によってタンパク質が変性することがある。乾燥に伴うタンパク質の変性を防ぐためには、被固定化物質溶解液にトレハロース、スクロース、ラクトース、マルトース等の糖類を添加することが好ましい。糖類のなかでもトレハロースは、適度な保湿性を有していること、溶液の乾燥濃縮が容易であること、並びに、乾燥濃縮時に粗大な結晶が形成されにくく均質な乾燥濃縮が可能であることから好ましい。糖類の終濃度は1〜20%(w/v)、より好ましくは1〜10%(w/v)の範囲で調整すると良い。被固定化物質溶解液を担体の広範囲に渡って接触させたい場合は、被固定化物質溶解液にTriton(登録商標) X−100やTween(登録商標) 20などの非イオン性界面活性剤を添加することが好ましい。非イオン性界面活性剤の使用により、被固定化物質溶解液が担体表面に薄く濡れ広がるため、被固定化物質の使用量を節約できるだけでなく、乾燥濃縮に要する時間を短縮することができる。被固定化物質溶解液中の非イオン性界面活性剤の終濃度は0.01〜0.1%(v/v)の範囲で調整するとよい。
【0052】
乾燥濃縮が進行すると、被固定化物質に含まれるアミノ基等の官能基がPEG鎖に連結された官能基と反応し、アミド結合、ウレタン結合等の共有結合が形成される。ここで、反応温度は4〜37℃、接触時間は5分〜24時間の範囲で設定するとよい。その結果、被固定化物質はPEG鎖を介して担体に固定化される。
【0053】
所望の被固定化物質をPEG鎖に結合させた後は、PEG鎖に連結された未反応の官能基を、アミノ基を有する低分子化合物と結合させることにより、当該官能基を反応性のより低い官能基に変換してもよい(S1203)。これによって、免疫アッセイに関与する物質が不本意に担体表面に固定化されるのを防ぐことができる。この操作は、当該官能基の反応性が高い場合に特に必要性が高い。ただし、官能基を前記低分子化合物と反応させた後の担体表面は、親水性であることが望ましい。なぜなら、親水性の表面は一般に生体関連物質の非特異吸着を抑制する効果をもつからである。このためにはアミノ基を含有する低分子化合物として、アミノ基以外に親水性基を更に有する低分子化合物を使用することが好ましい。このような低分子化合物の例としては、2−アミノエタノールや2−(2−アミノエトキシ)エタノールなどが挙げられるが、特に2−(2−アミノエトキシ)エタノールが好ましい。この低分子化合物をPBSなどの緩衝液に10〜1000mMとなるように溶解し、既に所望の物質を固定化した担体と接触させる。反応温度は4〜37℃、反応時間は2分〜24時間の範囲で設定するとよい。
【0054】
(免疫アッセイ)
本発明はまた、本発明の物質固定化担体を用いて標的物質を測定する工程を含む免疫アッセイに関する。本発明において「標的物質を測定する」とは、測定対象試料中の標的物質の存在の有無、及び/又は、測定対象試料中の標的物質の量を測定することを指す。免疫アッセイは、具体的には、本発明の物質固定化担体と、測定対象試料とを、該担体上の被固定化物質に、該測定対象試料中の標的物質の量に相関した量の抗原又は抗体(ここで該抗原又は抗体とは、測定対象試料中の標的物質、必要に応じて抗原抗体反応系に添加された検出可能標的物質、必要に応じて抗原抗体反応系に添加された検出可能抗原又は検出可能抗体等を指す)が抗原抗体反応により結合する条件において接触させる工程と、前記工程において被固定化物質に結合した抗原又は抗体を検出する工程とを含む。
【0055】
本発明の物質固定化担体を用いた免疫アッセイは公知の方法で実施することができ、サンドイッチ方式、直接競合方式、間接競合方式等の任意の態様とすることができる。
【0056】
サンドイッチ方式の免疫アッセイでは、通常、標的物質と結合する抗原又は抗体が被固定化物質として固定化された物質固定化担体と、該被固定化物質と非競合的に標的物質と結合する、直接的又は間接的に検出可能な抗原又は抗体である、検出可能抗原又は検出可能抗体とが少なくとも用いられる。図8では、抗原である標的物質103と特異的に結合する抗体102が固定化された物質固定化担体101と、標識物質(酵素など)により標識された、直接的に検出可能な標識抗体104とを用いて測定対象試料中の標的物質103を測定するサンドイッチ方式の免疫アッセイの一例を模式的に示す。
【0057】
サンドイッチ方式の免疫アッセイは、典型的には、
測定対象試料と、前記物質固定化担体とを接触させ、測定対象試料中の標的物質と被固定化物質との抗原抗体反応を行う、一次反応工程(図8(b))と、
一次反応工程の後に、前記物質固定化担体と、前記検出可能抗原又は検出可能抗体とを接触させ、被固定化物質に結合した標的物質と、前記検出可能抗原又は検出可能抗体との抗原抗体反応を行う、二次反応工程(図8(c))と、
二次反応工程の後に、前記物質固定化担体に結合した前記検出可能抗原又は検出可能抗体を検出する、検出工程(図8(d))と
を少なくとも含む。
【0058】
一次反応工程及び二次反応工程では、抗原抗体反応後に、担体に固定化されていない成分を洗浄除去する洗浄工程を適宜含む。
【0059】
二次反応工程に用いられる「検出可能抗原又は検出可能抗体」は、被固定化物質と競合しない位置において標的物質と結合する。検出可能抗原又は検出可能抗体は、検出可能な標識物質と連結された標識抗原又は標識抗体(直接的に検出可能な抗原又は抗体)であってもよいし、検出可能な標識物質と、更なる反応によって連結されて標識されうる抗原又は抗体(間接的に検出可能な抗原又は抗体)であってもよい。後者の例としては、検出可能な標識物質と連結された二次抗体と結合可能な抗原又は抗体や、ビオチン−アビジン(又はビオチン−ストレプトアビジン)結合対の一方と連結された標識物質と結合可能な、前記結合対の他方と連結された抗原又は抗体等が挙げられる。
【0060】
直接競合方式による免疫アッセイでは、通常、標的物質と結合する抗原又は抗体が被固定化物質として固定化された物質固定化担体と、測定対象試料中の標的物質と競合的に前記被固定化物質と結合する、直接的又は間接的に検出可能な標的物質である、検出可能標的物質とが少なくとも用いられる。図9では、抗原である標的物質113と特異的に結合する抗体112が固定化された物質固定化担体111と、測定対象試料中の標的物質113と競合的に抗体112と結合する、標識物質(酵素など)により標識された、直接的に検出可能な標的物質114(標識抗原)とを用いて測定対象試料中の標的物質113を測定する直接競合方式による免疫アッセイの一例を模式的に示す。
【0061】
直接競合方式による免疫アッセイは、典型的には、
測定対象試料と、検出可能標的物質と、前記物質固定化担体とを接触させ、測定対象試料中の標的物質と前記被固定化物質との間の抗原抗体反応と、検出可能標的物質と前記被固定化物質との間の抗原抗体反応とを競合的に行う、直接競合反応工程(図9(b),(c))と、
直接競合反応工程の後に、前記物質固定化担体に結合した検出可能標的物質を検出する、検出工程(図9(e))と
を少なくとも含む。
【0062】
直接競合反応工程では、抗原抗体反応後に担体に結合していない標的物質と検出可能標的物質とを洗浄除去する工程(図9(d))が適宜含まれる。
【0063】
直接競合方式による免疫アッセイにおいて、標的物質は抗原又は抗体であり、検出可能標的物質は対応する検出可能抗原又は検出可能抗体である。検出可能標的物質としては、測定対象試料中の標的物質とは独立して検出することができるものである限り、サンドイッチ法に関して上述した検出可能抗原又は検出可能抗体において、抗原又は抗体として標的物質が用いられたものが使用可能である。
【0064】
間接競合方式による免疫アッセイでは、通常、標的物質が被固定化物質として固定化された物質固定化担体と、測定対象試料中の標的物質と被固定化物質とが競合的に結合する、直接的又は間接的に検出可能な抗原又は抗体である、検出可能抗原又は検出可能抗体とが少なくとも用いられる。図10では、抗原である標的物質123と同一の被固定化物質122が固定化された物質固定化担体121と、測定対象試料中の標的物質123と被固定化物質122とが競合的に結合する、標識された二次抗体125を介して間接的に検出可能な一次抗体124とを用いて測定対象試料中の標的物質123を測定する間接競合方式による免疫アッセイの一例を模式的に示す。
【0065】
間接競合方式による免疫アッセイは、典型的には、
測定対象試料と、検出可能抗原又は検出可能抗体と、前記物質固定化担体とを接触させ、測定対象試料中の標的物質と前記検出可能抗原又は検出可能抗体との間の抗原抗体反応と、前記被固定化物質と前記検出可能抗原又は検出可能抗体との間の抗原抗体反応とを競合的に行う、間接競合反応工程(図10(b),(c))と、
間接競合反応工程の後に、前記物質固定化担体に結合した前記検出可能抗原又は検出可能抗体を検出する、検出工程(図10(e),(f))と
を少なくとも含む。
【0066】
間接競合反応工程では、抗原抗体反応後に担体に結合していない標的物質と検出可能抗原又は検出可能抗体とを洗浄除去する工程(図10(d))が適宜含まれる。
【0067】
検出可能抗原又は検出可能抗体としては、サンドイッチ法に関して上述した検出可能抗原又は検出可能抗体と同様のものが使用できる。
【0068】
本発明の物質固定化担体を用いた免疫アッセイにおいて抗原又は抗体を検出する手段は特に限定されず、任意の標識物質により直接的又は間接的に標識された抗原又は抗体を用いることができる。標識物質としては、酵素(ELISA法)、核酸(イムノPCR)、電気化学発光物質(電気化学発光法)、蛍光物質、化学発光物質、放射性物質等の、増幅された検出シグナルを生成することができる標識物質が挙げられる。本発明の免疫アッセイは、安全性及び簡便性を考慮すると、標識物質として酵素を用いる、酵素活性に基づいて検出を行う酵素結合免疫吸着アッセイ(ELISA)であることが好ましい。標識物質として用いることができる酵素は特に限定されないが、例えば西洋わさびペルオキシダーゼ等のペルオキシダーゼ、β−ガラクトシダーゼ、アルカリフォスファターゼ、グルコースオキシダーゼが挙げられる。酵素活性による検出の方法としては、酵素活性により化学発光する化学発光基質、酵素活性により発色する発色基質、酵素活性により化学蛍光を発する化学蛍光基質等を用いた検出方法が挙げられ、なかでも化学発光基質を用いた検出方法が好ましい。発色基質を用いると酵素反応にかなりの時間がかかる。これは、本発明において定量しようとする標的物質の濃度領域が従来の1〜2桁も低いためである。化学発光基質を用いた検出は、一般に、発色基質を用いた検出よりも感度が高いため、酵素反応に要する時間を短縮することができる。特に、フェムトグラムのレベルの微量な標的物質の検出に使用される高感度な化学発光基質を用いれば、感度の点で相乗効果を得ることができる。このような化学発光基質としてはECLTMAdvance(GEヘルスケア)、ECLTMPlus(GEヘルスケア)、イムノスター(登録商標)LD(和光純薬)、CDP−STAR(登録商標)(ロシュ・ダイアグノスティックス)、CSPD(登録商標)(ロシュ・ダイアグノスティックス)、SuperSignal West Femto Maxmum Sensitivity Substrate(サーモフィッシャーサイエンティフィック)が挙げられ、そのための酵素としては西洋わさびペルオキシダーゼ等のペルオキシダーゼ、アルカリフォスファターゼが挙げられる。化学発光を検出するための検出器としては、発光プレートリーダーやCCDイメージャーを用いることができる。これらの検出器はダイナミックレンジが広いという点でも都合がよい。すなわち、本発明の物質固定化担体と化学発光基質とを組み合わせれば、迅速かつ高感度でダイナミックレンジの広いELISAを達成できる。
【0069】
(免疫アッセイ用キット)
本発明の物質固定化用担体は、免疫アッセイにより標的物質を測定するためのキットを構成することができる。該キットは更に免疫アッセイに必要な成分を含むことができる。免疫アッセイに必要な成分としては、免疫アッセイの種類に応じて、被固定化物質に抗原抗体反応により結合した標的物質と抗原抗体反応により結合する、直接的又は間接的に検出可能な抗原又は抗体や、被固定化物質と抗原抗体反応により結合する、直接的又は間接的に検出可能な抗原又は抗体(直接的又は間接的に検出可能な標的物質を含む)が例示できる。更に、免疫アッセイに必要な成分としては、間接的な検出に用いるための、前記間接的に検出可能な抗原又は抗体と結合可能な標識物質や、検出用試薬(例えば標識物質が酵素である場合には酵素活性により化学発光する化学発光基質、酵素活性により発色する発色基質、酵素活性により化学蛍光を発する化学蛍光基質等)が挙げられる。「直接的又は間接的に検出可能な抗原又は抗体」及び「直接的又は間接的に検出可能な標的物質」は上記「免疫アッセイ」の欄にて説明したのと同様のものが使用できる。該キットは更に、被固定化物質を物質固定化用担体に固定化するために用いられる試薬(例えば糖類や非イオン性界面活性剤が溶解された、被固定化物質を溶解するための緩衝液)を含んでもよい。
【0070】
本発明の物質固定化担体は、免疫アッセイにより標的物質を測定するためのキットを構成することができる。該キットは更に免疫アッセイに必要な成分を含むことができる。免疫アッセイに必要な成分の具体例は上記の通りである。
【0071】
以下、図面と具体的な実施例を用いて本発明を説明する。
【0072】
[実施例1]
図1は物質固定化用担体に関する本発明の一実施形態を表す。ポリスチレンからなる支持体表面にポリシロキサンを含むプライマー層が形成されている。プライマー層にはPEG鎖の片末端が共有結合している。PEG鎖の別の片末端には(1H−イミダゾール−1−イル)カルボニル基が存在する。親水性ポリマー層は、PEG鎖の数平均分子量が176〜25000であるという条件、XPSにおける元素濃度比N(1s)/C−Oが0.010〜0.100の範囲にあるという条件、のうち少なくとも1つの条件を満足する。
【0073】
[実施例2]
図2に示した方法で物質固定化用担体を製造した。具体的な手順を以下に記す。
1.65mlの3−グリシドキシプロピルトリメトキシシラン(モメンティブ・パフォーマンス・マテリアルズ)に0.35mlの希塩酸(pH2.4)を添加してシラノールを調製した。これを100mlの2−プロパノール(純正化学)に添加した。ここに、さらに4mlのトリエチルアミン(和光純薬)を添加した。このシラノール溶液を96穴マイクロプレート(BD FalconTM)の各ウェルに100μlずつ分注した。そのまま室温で75分間放置した。その後、ウェル内を純水で洗浄し、窒素ブローで乾燥させた。この操作によってマイクロプレートのウェル内にポリシロキサンとエポキシ基を含むプライマー層が形成された。次に、触媒量の濃硫酸を含んだPEG4000(数平均分子量2700〜3400、関東化学)を各ウェルに100μlずつ分注した。そのまま90℃で30分間加熱した。その後、ウェル内を純水で洗浄し、窒素ブローで乾燥させた。この操作によってプライマー層上にPEGを含む親水性ポリマー層が形成された。次に、脱水アセトニトリル(関東化学)と脱水ジメチルスルホキシド(関東化学)の等重量混合溶媒を用いて終濃度0.5MのCDI(東京化成)溶液を調製し、これを各ウェルに10μlずつ分注した。そのまま室温で20分間放置した。その後、ウェル内を純水で洗浄し、窒素ブローで乾燥させた。この操作によって親水性ポリマー層に含まれるPEGの末端に(1H−イミダゾール−1−イル)カルボニル基が導入されたPEG誘導体が形成された。
【0074】
[実施例3]
実施例2の物質固定化用担体(96穴マイクロプレート)を用いて図3に示すELISA(間接法、抗原-抗体-抗体サンドイッチ法)を実施した。具体的な手順を以下に記す。
【0075】
以下、0.025%Triton(登録商標) X−100(和光純薬)を含む炭酸−重炭酸緩衝液(pH9.6)を固相化バッファー、0.1%Triton(登録商標) X−100および0.5MのNaClを含むリン酸緩衝液(PBS)を洗浄バッファー、1%BSAを含むPBSを希釈バッファーとする。まず、リゾチーム(和光純薬)を固相化バッファーに溶解し、終濃度50μg/mlのリゾチーム溶液を調製した。この溶液を実施例2の96穴マイクロプレートの各ウェルに5μlずつ分注した。37℃で10分間放置して乾燥濃縮させた後、ウェル内を洗浄バッファーで2回洗浄した。次に、希釈バッファーを用いて0〜500ng/mlの抗リゾチーム抗体(Rockland)を調製し、各ウェルに50μlずつ分注した。室温で30分間放置した後、ウェル内を洗浄バッファーで1回洗浄した。希釈バッファーを用いてHRP標識2次抗体(Nordic Immunological Laboratories)を4000倍希釈し(終濃度0.5μg/ml)、これを各ウェルに50μlずつ分注した。室温で30分間放置した後、ウェル内を洗浄バッファーで3回洗浄した。各ウェルに化学発光基質であるイムノスターLD(和光純薬)を30μl添加し、LAS4000mini(GEヘルスケア)を用いて化学発光画像を取得した。最後に、専用のソフトウェアを用いて化学発光強度を算出し、図4(本発明)のような検量線を作成した。感度は0.03ng/mlであった。
【0076】
(比較例1)
未処理の96穴マイクロプレート(BD FalconTM)および従来品の96穴マイクロプレート(酸素プラズマ処理によって親水化されたポリスチレン製96穴マイクロプレート)を用いて図3に示すELISA(間接法)を実施した。具体的な手順を以下に記す。
【0077】
以下、炭酸−重炭酸緩衝液(pH9.6)を固相化バッファー、0.05%Tween(登録商標) 20を含むPBSを洗浄バッファー、1%BSAを含むPBSをブロッキングバッファーおよび希釈バッファーとする。まず、リゾチーム(和光純薬)を固相化バッファーに溶解し、終濃度5μg/mlのリゾチーム溶液を調製した。この溶液を96穴マイクロプレートの各ウェルに100μlずつ分注した。室温で2時間放置した後、ウェル内を洗浄バッファーで2回洗浄した。次に、ブロッキングバッファーを各ウェルに200μlずつ分注した。室温で60分間放置した後、ウェル内を洗浄バッファーで2回洗浄した。希釈バッファーを用いて0〜500ng/mlの抗リゾチーム抗体(Rockland)を調製し、各ウェルに100μlずつ分注した。室温で60分間放置した後、ウェル内を洗浄バッファーで1回洗浄した。希釈バッファーを用いてHRP標識2次抗体(Nordic Immunological Laboratories)を4000倍希釈し(終濃度0.5μg/ml)、これを各ウェルに100μlずつ分注した。室温で30分間放置した後、ウェル内を洗浄バッファーで3回洗浄した。各ウェルに化学発光基質であるイムノスターLD(和光純薬)を30μl添加し、LAS4000mini(GEヘルスケア)を用いて化学発光画像を取得した。最後に、専用のソフトウェアを用いて化学発光強度を算出し、図4(未処理、従来品)のような検量線を作成した。未処理品と従来品の感度はいずれも3.9ng/mlであった。
【0078】
[実施例4]
実施例2で得られた96穴マイクロプレートを用いて図5に示すELISA(抗体-抗原-抗体サンドイッチ法)を実施した。具体的な手順を以下に記す。
【0079】
5%トレハロース(和光純薬)及び0.025%Triton(登録商標) X−100(和光純薬)を含む炭酸−重炭酸緩衝液(pH9.6)を固相化バッファーとする。抗IL−1β抗体(Biolegend)を固相化バッファーに溶解し、終濃度50μg/mlの抗体溶液を調製した。この溶液を実施例2で得られた96穴マイクロプレートの各ウェルに5μlずつ分注した。37℃で2時間放置して乾燥濃縮させた後、ウェル内を洗浄バッファーで2回洗浄した。次に、希釈バッファーを用いて0〜2500pg/mlのIL−1β(和光純薬)を調製し、各ウェルに50μlずつ分注した。室温で60分間放置した後、ウェル内を洗浄バッファーで1回洗浄した。希釈バッファーを用いてビオチン標識2次抗体(Biolegend)を500倍希釈し、これを各ウェルに50μlずつ分注した。室温で30分間放置した後、ウェル内を洗浄バッファーで1回洗浄した。次に、希釈バッファーを用いてHRP標識ストレプトアビジン(Prozyme)を4000倍希釈し(終濃度0.25μg/ml)、これを各ウェルに50μlずつ分注した。室温で10分間放置した後、ウェル内を洗浄バッファーで3回洗浄した。化学発光基質であるイムノスターLD(和光純薬)を30μl添加し、LAS4000mini(GEヘルスケア)を用いて化学発光画像を取得した。最後に、専用のソフトウェアを用いて化学発光強度を算出、図6(本発明)のような検量線を作成した。感度は0.15pg/mlであった。
【0080】
(比較例2)
未処理の96穴マイクロプレート(BD FalconTM)および従来品の96穴マイクロプレート(酸素プラズマ処理によって親水化されたポリスチレン製96穴マイクロプレート)を用いて図5に示すELISA(抗体-抗原-抗体サンドイッチ法)を実施した。具体的な手順を以下に記す。
【0081】
比較例1と同様の各種バッファーを用いた。抗IL−1β抗体(Biolegend)を固相化バッファーに溶解し、終濃度5μg/mlの抗体溶液を調製した。この溶液を96穴マイクロプレートの各ウェルに50μlずつ分注した。室温で2時間放置した後、ウェル内を洗浄バッファーで2回洗浄した。次に、ブロッキングバッファーを各ウェルに100μlずつ分注した。室温で60分間放置した後、ウェル内を洗浄バッファーで2回洗浄した。希釈バッファーを用いて0〜2500pg/mlのIL−1β(和光純薬)を調製し、各ウェルに50μlずつ分注した。室温で60分間放置した後、ウェル内を洗浄バッファーで1回洗浄した。希釈バッファーを用いてビオチン標識2次抗体(Biolegend)を500倍希釈し、これを各ウェルに50μlずつ分注した。室温で30分間放置した後、ウェル内を洗浄バッファーで1回洗浄した。次に、希釈バッファーを用いてHRP標識ストレプトアビジン(Prozyme)を4000倍希釈し(終濃度0.25μg/ml)、これを各ウェルに50μlずつ分注した。室温で30分間放置した後、ウェル内を洗浄バッファーで3回洗浄した。化学発光基質であるイムノスターLD(和光純薬)を30μl添加し、LAS4000mini(GEヘルスケア)を用いて化学発光画像を取得した。最後に、専用のソフトウェアを用いて化学発光強度を算出、図6(未処理、従来品)のような検量線を作成した。未処理品と従来品の感度はそれぞれ9.8pg/mlと2.4pg/mlであった。
【0082】
【表1】

【0083】
[実施例5]
シラノール処理時間およびPEG鎖の数平均分子量がELISA(間接法)の感度に及ぼす影響を調べた。具体的な手順を以下に記す。
【0084】
1.65mlの3−グリシドキシプロピルトリメトキシシラン(モメンティブ・パフォーマンス・マテリアルズ)に0.35mlの希塩酸(pH2.4)を添加してシラノールを調製した。これを100mlの2−プロパノール(純正化学)に添加した。ここに、さらに0.5mlのトリエチルアミン(和光純薬)を添加した。このシラノール溶液を96穴マイクロプレート(BD FalconTM)の各ウェルに100μlずつ分注した。そのまま室温で60〜135分間放置した。その後、ウェル内を純水で洗浄し、窒素ブローで乾燥させた。この操作によってマイクロプレートのウェル内にポリシロキサンとエポキシ基を含むプライマー層が形成された。次に、触媒量の濃硫酸を含んだPEG(13種)を各ウェルに100μlずつ分注した。そのまま80℃で45分間加熱した。その後、ウェル内を純水で洗浄し、窒素ブローで乾燥させた。この操作によってプライマー層上にPEGを含む親水性ポリマー層が形成された。次に、脱水アセトニトリル(関東化学)と脱水ジメチルスルホキシド(関東化学)の等重量混合溶媒を用いて終濃度0.5MのCDI(東京化成)溶液を調製し、これを各ウェルに20μlずつ分注した。そのまま室温で30分間放置した。その後、ウェル内を純水で洗浄し、窒素ブローで乾燥させた。この操作によって親水性ポリマー層に含まれるPEGの末端に(1H−イミダゾール−1−イル)カルボニル基が導入されたPEG誘導体が形成された。以上の操作により、PEG鎖の結合密度やPEG鎖の数平均分子量の異なる物質固定化用担体が得られた。これらの物質固定化用担体を用いて実施例3に記載の方法でELISAの感度を測定した。その結果、表2に示すようにPEG鎖の数平均分子量が176以上で従来よりも顕著に高い感度が得られることがわかった。また、PEG鎖の分子量が大きい場合は比較的低密度であっても高い感度が実現できることがわかった。
【0085】
【表2】

【0086】
表2に示す各原料の数平均分子量は以下の通りである。
【0087】
【表3】

【0088】
[実施例6]
実施例5で得られた物質固定化用担体のXPS分析を行った。XPS分析は、アルバック・ファイ社製のX線分光分析装置「ESCA5600」を用い、光電子取り込み角度を45°に設定して行った。その結果、表2に示すようにELISAの感度とN(1s)/C−Oとの間に明確な相関が認められた。すなわち、N(1s)/C−Oの値が0.010〜0.100の範囲にあるときに従来よりも顕著に高い感度が得られることがわかった。
【0089】
[実施例7]
前述のように、乾燥に伴うタンパク質の変性を防ぐ目的で、緩衝液にトレハロースを添加することが重要である。実施例4において、トレハロース濃度の異なる緩衝液を6種類用意し、ELISAにおけるトレハロース濃度依存性を検討した。その結果、図7−1〜7−6に示すように、5〜10%(w/v)のトレハロースで固相化時間(被固定化物質溶解溶液の接触から乾燥濃縮工程完了までの時間)に伴うシグナルの低下を防ぐことができることがわかった。
【特許請求の範囲】
【請求項1】
免疫アッセイに用いるための物質固定化用担体であって、
支持体と、
前記支持体の表面に配置された親水性ポリマー層と
を少なくとも含み、
前記親水性ポリマー層が、
数平均分子量が176以上であるポリエチレングリコール鎖と、
標的物質と結合する抗原又は抗体である被固定化物質或いは標的物質である被固定化物質と共有結合を形成可能な、前記ポリエチレングリコール鎖に連結された官能基と
を含む、物質固定化用担体。
【請求項2】
前記官能基が、n個の窒素原子を含有する官能基を含み、
前記親水性ポリマー層中の窒素濃度が、前記親水性ポリマー層中のC−O結合に由来する炭素濃度を1としたとき、0.010以上、0.050×n以下である、
請求項1の物質固定化用担体。
【請求項3】
前記窒素を含有する官能基が、(1H−イミダゾール−1−イル)カルボニル基又はスクシンイミジルオキシカルボニル基である、請求項2の物質固定化用担体。
【請求項4】
免疫アッセイに用いるための物質固定化担体であって、
支持体と、
前記支持体の表面に配置された親水性ポリマー層と、
標的物質と結合する抗原又は抗体である被固定化物質或いは標的物質である被固定化物質と
を少なくとも含み、
前記親水性ポリマー層が、数平均分子量が176以上であるポリエチレングリコール鎖を含み、
前記ポリエチレングリコール鎖と、前記被固定化物質とが共有結合を介して連結されている、物質固定化担体。
【請求項5】
請求項1〜3のいずれか1項の物質固定化用担体と、前記被固定化物質とから、前記官能基と前記被固定化物質とを反応させて共有結合を形成することにより製造されたものである、請求項4の物質固定化担体。
【請求項6】
請求項4又は5の物質固定化担体の製造方法であって、
請求項1〜3のいずれか1項の物質固定化用担体と、前記被固定化物質を溶解した溶液とを接触させる、被固定化物質接触工程と、
前記物質固定化用担体に接触させた前記溶液を乾燥濃縮させる、乾燥濃縮工程と、
を含む方法。
【請求項7】
前記溶液が糖類を含む、請求項6の方法。
【請求項8】
前記糖類がトレハロースである、請求項7の方法。
【請求項9】
前記溶液が非イオン性界面活性剤を含む、請求項6〜8のいずれか1項の方法。
【請求項10】
前記乾燥濃縮工程の後に、前記物質固定化担体とアミノ基を有する低分子化合物とを接触させる工程を更に含む、請求項6〜9のいずれか1項の方法。
【請求項11】
請求項4又は5の物質固定化担体を用いて標的物質を測定する工程を含む、免疫アッセイにより標的物質を測定する方法。
【請求項12】
請求項1〜3のいずれか1項の物質固定化用担体を含む、免疫アッセイにより標的物質を測定するためのキット。
【請求項13】
請求項4又は5の物質固定化担体を含む、免疫アッセイにより標的物質を測定するためのキット。
【請求項14】
サンドイッチ方式の免疫アッセイに用いるための、請求項13のキットであって、
被固定化物質が標的物質と結合する抗原又は抗体である、請求項4又は5の物質固定化担体と、
被固定化物質と非競合的に標的物質と結合する、直接的又は間接的に検出可能な抗原又は抗体である、検出可能抗原又は検出可能抗体と、
を少なくとも含むキット。
【請求項15】
直接競合方式の免疫アッセイに用いるための、請求項13のキットであって、
被固定化物質が標的物質と結合する抗原又は抗体である、請求項4又は5の物質固定化担体と、
測定対象試料中の標的物質と競合的に前記被固定化物質と結合する、直接的又は間接的に検出可能な標的物質である、検出可能標的物質と
を少なくとも含むキット。
【請求項16】
間接競合方式の免疫アッセイに用いるための、請求項13のキットであって、
被固定化物質が標的物質である、請求項4又は5の物質固定化担体と、
測定対象試料中の標的物質と被固定化物質とが競合的に結合する、直接的又は間接的に検出可能な抗原又は抗体である、検出可能抗原又は検出可能抗体と、
を少なくとも含むキット。
【請求項17】
免疫アッセイに用いるための物質固定化用担体であって、
支持体と、
前記支持体の表面に配置された親水性ポリマー層と
を少なくとも含み、
前記親水性ポリマー層が、
ポリエチレングリコール鎖と、
標的物質と結合する抗原又は抗体である被固定化物質或いは標的物質である被固定化物質と共有結合を形成可能な、前記ポリエチレングリコール鎖に連結された官能基と
を含み、
前記官能基が、n個の窒素原子を含有する官能基を含み、
前記親水性ポリマー層中の窒素濃度が、前記親水性ポリマー層中のC−O結合に由来する炭素濃度を1としたとき、0.010以上、0.050×n以下である、
物質固定化用担体。
【請求項18】
請求項17の物質固定化用担体を含む、免疫アッセイにより標的物質を測定するためのキット。
【請求項1】
免疫アッセイに用いるための物質固定化用担体であって、
支持体と、
前記支持体の表面に配置された親水性ポリマー層と
を少なくとも含み、
前記親水性ポリマー層が、
数平均分子量が176以上であるポリエチレングリコール鎖と、
標的物質と結合する抗原又は抗体である被固定化物質或いは標的物質である被固定化物質と共有結合を形成可能な、前記ポリエチレングリコール鎖に連結された官能基と
を含む、物質固定化用担体。
【請求項2】
前記官能基が、n個の窒素原子を含有する官能基を含み、
前記親水性ポリマー層中の窒素濃度が、前記親水性ポリマー層中のC−O結合に由来する炭素濃度を1としたとき、0.010以上、0.050×n以下である、
請求項1の物質固定化用担体。
【請求項3】
前記窒素を含有する官能基が、(1H−イミダゾール−1−イル)カルボニル基又はスクシンイミジルオキシカルボニル基である、請求項2の物質固定化用担体。
【請求項4】
免疫アッセイに用いるための物質固定化担体であって、
支持体と、
前記支持体の表面に配置された親水性ポリマー層と、
標的物質と結合する抗原又は抗体である被固定化物質或いは標的物質である被固定化物質と
を少なくとも含み、
前記親水性ポリマー層が、数平均分子量が176以上であるポリエチレングリコール鎖を含み、
前記ポリエチレングリコール鎖と、前記被固定化物質とが共有結合を介して連結されている、物質固定化担体。
【請求項5】
請求項1〜3のいずれか1項の物質固定化用担体と、前記被固定化物質とから、前記官能基と前記被固定化物質とを反応させて共有結合を形成することにより製造されたものである、請求項4の物質固定化担体。
【請求項6】
請求項4又は5の物質固定化担体の製造方法であって、
請求項1〜3のいずれか1項の物質固定化用担体と、前記被固定化物質を溶解した溶液とを接触させる、被固定化物質接触工程と、
前記物質固定化用担体に接触させた前記溶液を乾燥濃縮させる、乾燥濃縮工程と、
を含む方法。
【請求項7】
前記溶液が糖類を含む、請求項6の方法。
【請求項8】
前記糖類がトレハロースである、請求項7の方法。
【請求項9】
前記溶液が非イオン性界面活性剤を含む、請求項6〜8のいずれか1項の方法。
【請求項10】
前記乾燥濃縮工程の後に、前記物質固定化担体とアミノ基を有する低分子化合物とを接触させる工程を更に含む、請求項6〜9のいずれか1項の方法。
【請求項11】
請求項4又は5の物質固定化担体を用いて標的物質を測定する工程を含む、免疫アッセイにより標的物質を測定する方法。
【請求項12】
請求項1〜3のいずれか1項の物質固定化用担体を含む、免疫アッセイにより標的物質を測定するためのキット。
【請求項13】
請求項4又は5の物質固定化担体を含む、免疫アッセイにより標的物質を測定するためのキット。
【請求項14】
サンドイッチ方式の免疫アッセイに用いるための、請求項13のキットであって、
被固定化物質が標的物質と結合する抗原又は抗体である、請求項4又は5の物質固定化担体と、
被固定化物質と非競合的に標的物質と結合する、直接的又は間接的に検出可能な抗原又は抗体である、検出可能抗原又は検出可能抗体と、
を少なくとも含むキット。
【請求項15】
直接競合方式の免疫アッセイに用いるための、請求項13のキットであって、
被固定化物質が標的物質と結合する抗原又は抗体である、請求項4又は5の物質固定化担体と、
測定対象試料中の標的物質と競合的に前記被固定化物質と結合する、直接的又は間接的に検出可能な標的物質である、検出可能標的物質と
を少なくとも含むキット。
【請求項16】
間接競合方式の免疫アッセイに用いるための、請求項13のキットであって、
被固定化物質が標的物質である、請求項4又は5の物質固定化担体と、
測定対象試料中の標的物質と被固定化物質とが競合的に結合する、直接的又は間接的に検出可能な抗原又は抗体である、検出可能抗原又は検出可能抗体と、
を少なくとも含むキット。
【請求項17】
免疫アッセイに用いるための物質固定化用担体であって、
支持体と、
前記支持体の表面に配置された親水性ポリマー層と
を少なくとも含み、
前記親水性ポリマー層が、
ポリエチレングリコール鎖と、
標的物質と結合する抗原又は抗体である被固定化物質或いは標的物質である被固定化物質と共有結合を形成可能な、前記ポリエチレングリコール鎖に連結された官能基と
を含み、
前記官能基が、n個の窒素原子を含有する官能基を含み、
前記親水性ポリマー層中の窒素濃度が、前記親水性ポリマー層中のC−O結合に由来する炭素濃度を1としたとき、0.010以上、0.050×n以下である、
物質固定化用担体。
【請求項18】
請求項17の物質固定化用担体を含む、免疫アッセイにより標的物質を測定するためのキット。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7−1】


【図7−2】


【図7−3】


【図7−4】


【図7−5】


【図7−6】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7−1】


【図7−2】


【図7−3】


【図7−4】


【図7−5】


【図7−6】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【公開番号】特開2013−11479(P2013−11479A)
【公開日】平成25年1月17日(2013.1.17)
【国際特許分類】
【出願番号】特願2011−143258(P2011−143258)
【出願日】平成23年6月28日(2011.6.28)
【出願人】(000002897)大日本印刷株式会社 (14,506)
【公開日】平成25年1月17日(2013.1.17)
【国際特許分類】
【出願日】平成23年6月28日(2011.6.28)
【出願人】(000002897)大日本印刷株式会社 (14,506)
[ Back to top ]

