分析方法
【課題】生体試料に対する複雑な前処理をすることなく、高精度に対象とする生理活性物質が分析できるようにする。
【解決手段】生体試料より測定対象とする生理活性物質のみを除去した除去試料を作製する。次に、除去試料に濃度既知の上記生理活性物質を添加した試料標準溶液の生理活性物質濃度を所定の分析方法により分析して検量線(標準曲線)を作製する。この後、生体試料における生理活性物質の濃度を、上記分析方法で検量線を用いて分析する。
【解決手段】生体試料より測定対象とする生理活性物質のみを除去した除去試料を作製する。次に、除去試料に濃度既知の上記生理活性物質を添加した試料標準溶液の生理活性物質濃度を所定の分析方法により分析して検量線(標準曲線)を作製する。この後、生体試料における生理活性物質の濃度を、上記分析方法で検量線を用いて分析する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、検体中のコルチゾールなどの生理活性物質の濃度を分析する分析方法に関するものである。
【背景技術】
【0002】
例えば、コルチゾールは、副腎皮質ホルモンの1つであり、血液,尿,および唾液などに含まれている。これらにおけるコルチゾールの濃度変動は、ストレス応答と関連があるとされ、典型的なストレスバイオマーカーとして認知されている。
【0003】
このような生理活性物質の、血液,尿,および唾液などの生体試料における代表的な定量分析手法には、液体クロマトグラフィー(Liquid Chromatography:LC)で分離して質量分析装置(Mass spectrometry:MS)で検出するLC/MSがある。また、LC(カラム)で分離した成分を、1段目のMSでイオン化し、質量ごとにわけ、さらに分離されたイオンを不活性ガスに衝突させて解離させ、解離させたイオンを2段目のMSで分析するLC/MS/MSがある。また、これらのLCでは、いわゆる高速液体クロマトグラフィー(HPLC)が用いられている。
【0004】
また、コルチゾールなどの生理活性物質の分析では、放射免疫測定法(ラジオイムノアッセイ:RIA)および酵素面積測定法(ELISA)も用いられている。
【0005】
上述した液体クロマトグラフィーを用いる分析では、極低濃度領域でも高い測定精度が得られるが、高感度に検出するために、分析対象とする生理活性物質以外に生体試料中に多種多様に存在する他の物質(生理活性物質)による妨害が大きい。例えば、よく知られているように、対象とする物質の分離を目的としたカラムでは、この物質と大きく分子量が異なる物質の存在により分離の性能が低下する。このため、LC/MSやLC/MS/MSでは、通常、様々な前処理を施してこれらの妨害成分を除去している。
【0006】
ここで、この種の分析(定量)では、濃度が既知の試料標準溶液を用いて測定を行い、標準物質と、これに対する測定データとの間の相関を示す検量線を作製し、実際の試料の測定に用いている。LC/MSやLC/MS/MSでは、上述したように、前処理をしているため、検量線作成のための参照とする試料標準溶液としては、妨害成分が含まれていない理想的な溶液を用いればよいものとなっている。
【0007】
一方、抗原抗体反応を利用するRIAやELISAは、分析対象の目的とする生理活性物質以外の物質による妨害が少ないことから、複雑な前処理をあまり必要とせずにある程度高感度な分析が可能であることが特徴である。血液,尿,および唾液などの生体試料を前処理無しに迅速分析できれば、リアルタイム分析やオンサイト分析技術として非常に有望である。
【先行技術文献】
【非特許文献】
【0008】
【非特許文献1】M.Groschl, "Current Status of Salivary Hormone Analysis", Clinical Chemistry, vol.54, no.11, pp1759-1769, 2008.
【非特許文献2】井澤修平、鈴木克彦、「唾液中コルチゾールの測定キットの比較 ―唾液中・血漿中コルチゾールの相関ならびに測定法間の比較―」、日本補完代替医療学会誌、第4巻、第3号、113−118頁、2007年。
【非特許文献3】U.Erdbruegger et al. , "Circulating endothelial cells: A novel marker of endothelial damage", Clinica Chimica Acta, vol.373, pp.17-26, 2006.
【非特許文献4】K.Aoki et al. , "Quantitative analysis of reversible diffusion-controlled currents of redox soluble species at interdigitated array electrodes under steady-state conditions", J. Electroanal. Chem. , vol.256, pp.269-282, 1988.
【発明の概要】
【発明が解決しようとする課題】
【0009】
しかし、RIAやELISAにおいても、LC/MSやLC/MS/MSのように生理活性物質を高精度に分析(定量)する場合、生体試料中の対象とする生理活性物質以外の物質(妨害成分)からの影響が無視できなくなる。ここで、RIAやELISAなどの分析方法においても、検量線を用いることになる。しかしながら、妨害成分が含まれていない理想的な試料標準溶液による検量線を用いると、このような試料標準溶液の測定では妨害イオンの影響がないため、上述したようなより高精度な分析では、測定の誤差が大きくなるという問題がある。
【0010】
本発明は、以上のような問題点を解消するためになされたものであり、生体試料に対する複雑な前処理をすることなく、高精度に対象とする生理活性物質が分析できるようにすることを目的とする。
【課題を解決するための手段】
【0011】
本発明に係る分析方法は、生体試料より測定対象とする生理活性物質のみを除去した除去試料を作製する第1ステップと、除去試料に濃度既知の生理活性物質を添加した試料標準溶液の生理活性物質の濃度を所定の分析方法により分析して検量線を作製する第2ステップと、生体試料における生理活性物質の濃度を、分析方法により検量線を用いて分析する第3ステップとを備える。
【0012】
上記分析方法において、第1ステップでは、プロテインGが修飾された磁気ビーズおよび生理活性物質の抗体を生体試料の一部に混合した後、磁気ビーズを磁石に吸着させることで、一部の生体試料より生理活性物質のみを除去することができる。この場合、第1ステップでは、抗体が吸着しているプロテインGが修飾された磁気ビーズを生体試料の一部に混合した後、磁気ビーズを磁石に吸着させることで、一部の生体試料より生理活性物質のみを除去すればよい。なお、生理活性物質は、例えば、コルチゾールである。
【発明の効果】
【0013】
以上説明したように、本発明によれば、生体試料より測定対象とする生理活性物質のみを除去した除去試料を利用して検量線を作製するようにしたので、生体試料に対する複雑な前処理をすることなく、高精度に生理活性物質が分析できるようになるという優れた効果が得られる。
【図面の簡単な説明】
【0014】
【図1】図1は、本発明の実施の形態における分析方法を説明するためのフローチャートである。
【図2】図2は、本発明の実施の形態における分析方法をより詳細に説明するためのフローチャートである。
【図3】図3は、実施例1における試料標準溶液,参照標準溶液A,および参照標準溶液Bより作製した検量線を示す特性図である。
【図4】図4は、図3に示す検量線を用いた唾液試料S1,S2,S3のコルチゾール濃度分析結果と、LC/MS/MSを用いた唾液試料S1,S2,S3のコルチゾール濃度分析結果とを示す特性図である。
【図5】図5は、電気化学的測定を行う測定装置の構成を示す構成図である。
【図6】図6は、電極チップ504の構成を示す斜視図である。
【図7】図7は、実施例2における試料標準溶液および参照標準溶液Aより作製した検量線を示す特性図である。
【図8】図8は、図7に示す検量線を用いた唾液試料S1,S2,S3のコルチゾール濃度分析結果と、LC/MS/MSを用いた唾液試料S1,S2,S3のコルチゾール濃度分析結果とを示す特性図である。
【発明を実施するための形態】
【0015】
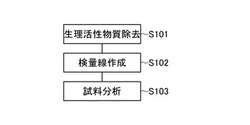
以下、本発明の実施の形態について図を参照して説明する。図1は、本発明の実施の形態における分析方法を説明するフローチャートである。この分析方法は、まず、ステップS101で、生体試料より測定対象とする生理活性物質のみを除去した除去試料を作製する。次に、ステップS102で、除去試料に濃度既知の上記生理活性物質を添加した試料標準溶液の生理活性物質濃度を所定の分析方法により分析して検量線(標準曲線)を作製する。この後、ステップS103で、生体試料における生理活性物質の濃度を、上記分析方法で検量線を用いて分析する。なお、ステップS101では、生体試料の一部を分取して用い、ステップS103では、残りの生体試料を用いて実際の測定を行えばよい。
【0016】
上述した本実施の形態では、試料標準溶液と生体試料とは、測定対象とする生理活性物質以外の成分は同じ状態となる。このため、検量線を作成する時の分析と、実際の生体試料の分析とにおいては、測定対象の生理活性物質以外の物質からの影響が、同等の状態となる。言い換えると、検量線を作成する時の分析と、生体試料の実際の分析との間では、異なる点があるとすれば、測定対象とする生理活性物質の濃度のみとなる。従って、本実施の形態によれば、対象とする生理活性物質以外の物質による影響を除いた状態で、対象とする生理活性物質の濃度の測定が行えるので、高精度な分析が行える。また、検量線作成のために用いる試料標準溶液の作製では、既知の成分である測定対象の生理活性物質の除去をすればよいので、複雑な処理を必要とせずに容易である。
【0017】
また、本実施の形態では、実際の生体試料の分析では、生体試料に対して前処理を行う必要がない。例えば、前処理としては、一般には、測定対象となる生理活性物質の検出を妨害する他の生理活性物質を生体試料中より除去するものとなる。しかしながら、生体試料中には、どのような妨害成分が含まれているか明確ではなく、生体試料より全ての妨害成分を除去することは容易ではない。これに対し、本実施の形態では、未知の成分である妨害成分の除去をすることなく分析が行えるので、より簡便に分析が行える。
【0018】
次に、本実施の形態における分析方法について、図2のフローチャートを用いてより詳細に説明する。
【0019】
まず、ステップS201で、プロテインGが修飾された磁気ビーズを作製する。プロテインGが磁気ビーズは、市販されている「Dynabeads Protein G」(DYNAL社製)を用いればよい。また、プロテインGが修飾された磁気ビーズに、対象とする生理活性物質の抗体を修飾する。例えば、対象とする生理活性物質がコルチゾールの場合、用いるコルチゾール抗体は、「Cortisol antibody [XM210]」(ab1949;アブカム社製)であればよい。
【0020】
例えば、プロテインGが修飾された磁気ビーズ50μLに対し、0.2〜1μgのコルチゾール抗体を混合すればよい。混合は、室温(20℃程度)で、約10〜30分の間、転倒混和させることで行えばよい。
【0021】
次に、ステップS202で、生体試料の一部を分取し、この分取試料に、プロテインGを介して測定対象とする生理活性物質の抗体(例えばコルチゾール抗体)が修飾されている磁気ビーズを混合する。例えば、分取試料に上記磁気ビーズを混合し、室温にて約10分〜60分、転倒混和すればよい。
【0022】
上述した転倒混和の処理において、処理時間が長すぎた場合、また、用いた抗体の濃度が高すぎた場合、および、磁気ビーズに修飾されているプロテインGに対する抗体の結合が弱い場合は、対象とする生理活性物質が結合した抗体が、磁気ビーズより離間する恐れがある。このような場合、プロテインGが修飾されている磁気ビーズを新たに加え、例えば、約10〜60分、室温にて転倒混和すればよい。この追加により、浮遊した抗体が回収できるので、試料中の対象とする生理活性物質をより確実に取り除くことができる。例えば、コルチゾール抗体の場合の抗体未固定の磁気ビーズと生体試料の混合比の一例としては、磁気ビーズ20μLにつき、生体試料100〜150μLを混合する条件が好ましい。
【0023】
次に、ステップS203で、分取試料より磁気ビーズを分離する。例えば、分取試料を収容している容器の外側(底部)に磁石を配置し、磁気ビーズを磁石の配置位置に引き寄せて収集して分画させ、この状態で、容器上部の分取試料を取り出せばよい。この生理活性物質の除去方法を、コルチゾールに適用した場合、コルチゾールを取り除いた分取試料の残留しているコルチゾールの濃度を、LC/MS/MSで分析したところ、0.03ng/mL以下であることが確認された、なお、LC/MS/MSによるコルチゾールの定量下限値は、0.03ng/mLである。このように、磁気ビーズを利用した上述のコルチゾール除去は、有効であることが確認されている。
【0024】
なお、ステップS201では、プロテインGが修飾された磁気ビーズを用意(作製)し、ステップS202で、分取試料に、プロテインGが修飾された磁気ビーズおよび抗体を加え、これらを混合するようにしてもよい。いずれにしても、生理活性物質に対する抗体を利用することで、生体試料中より対象とする生理活性物質を選択的に除去することが可能である。言い換えると、抗体が存在する生理活性物質であれば、生体試料中より選択的に除去することが可能である。
【0025】
次に、ステップS204で、生理活性物質を取り除いた除去試料に、濃度既知の生理活性物質を添加した試料標準溶液を作製する。例えば、生理活性物質がコルチゾールの場合、コルチゾールをリン酸緩衝液または炭酸緩衝液に溶解したコルチゾール緩衝溶液を、除去試料に添加して試料標準溶液とすればよい。この場合、生体試料の特性を保つために、除去試料に対する緩衝溶液の量は、1000分の1以下であることが好ましい。また、試料標準溶液は、検量線作成に十分な量として、全量が100〜500μL程度に作製するとよい。また、生体試料が唾液の場合、試料標準溶液中のコルチゾール濃度が、0〜80ng/mLの範囲内で、3〜10種類となるように、複数の試料標準溶液を作製するとよい。
【0026】
次に、ステップS205で、上述したように作製した各々生理活性物質濃度が異なる複数の試料標準溶液の濃度を、所定の分析方法を用いて分析する。分析方法としては、生体試料の前処理が不要であるという点などから、RIA,ELISA,および電気化学的検出法などであるとよい。
【0027】
例えば、ELISAによるコルチゾールの分析では、酵素標識コルチゾールと試料標準溶液とを、コルチゾール抗体を固定したプレート上で競合反応させ、吸着した酵素標識コルチゾールと基質の反応による発色を吸光度測定によって検出する。酵素および基質の組み合わせの例としては、まず、西洋ワサビペルオキシダーゼ(HRP)と3,3’,5,5’−トリメチルベンジジン(TMB)がある(組み合わせA)。また、アルカリフォスファターゼ(ALP)とp−ニトロフェニルホスフェート(pNPP)との組み合わせがある(組み合わせB)。組み合わせAの場合、TMB酸化物の450nmの吸収を検出信号として用いる。また、組み合わせBの場合、pNP(p−ニトロフェノール)の405nmの吸収を検出信号として用いる。
【0028】
また、電気化学的検出によるコルチゾールの分析では、酵素標識コルチゾールと試料標準溶液とを、コルチゾール抗体を固定したプレート上で競合反応させ、吸着した酵素標識コルチゾールと基質の反応により生成した物質を、酸化還元反応により検出する。酵素および基質の組み合わせの例としては、ELISAで用いた上記の2つの組み合わせのほか、アルカリフォスファターゼ(ALP)とp−アミノフェニルホスフェート(pAPP)との組み合わせがある(組み合わせC)。また、アセチルコリンエステラーゼ(AChE)とアセチルチオコリン(ATCh)との組み合わせがある(組み合わせD)。
【0029】
組み合わせAの場合は、未反応のTMB(TMBの還元体)の酸化反応を電極上で測定し、応答電流値を検出信号として用いる。また、組み合わせCの場合は、反応生成物であるチオコリンの酸化反応を電極上で測定し、応答電流値を検出信号として用いる。
【0030】
また、組み合わせBの場合は、反応生成物であるpNPおよびの酸化反応を電極上で測定し、応答電流値を検出信号として用いる。また、組み合わせDの場合は、反応生成物であるpAP(p−アミノフェノール)の酸化反応を電極上で測定し、応答電流値を検出信号として用いる。
【0031】
さらに、くし形電極などを用いてレドックスサイクルによる増幅効果を利用することもできる(非特許文献4参照)。この場合は、pNPおよびpAPの還元反応を電極上で測定し、応答電流値を検出信号として用いることもできる。還元反応の応答電流値を検出信号とする場合は、酸化体を還元側電極で捕捉して反応する効率により、酸化反応と比較して電流値が小さくなる。しかしながら、この場合、pNPおよびpAP以外の物質からの応答はほとんど寄与しないため、酸化反応の応答電流値を検出信号とした場合と比較して、定量精度が良くなるという特徴がある。
【0032】
いずれの分析手法においても、検量線の精度をより高めるためには、2セット以上の測定を実施し、平均値および測定誤差を得ることが好ましい。
【0033】
次に、ステップS206で、上述した分析の結果として得られた測定値と、既知の濃度値との組み合わせ(相関)により、検量線を作製する。検量線は、測定値に対して濃度値が対応して示されたグラフである。所定の生理活性物質の濃度範囲において得られた測定値について、回帰分析を行い、この結果を検量線として用いればよい。例えばELISAの場合、0〜80ng/mLの範囲で、4パラメータロジスティック関数、指数減衰関数、多項式関数などを用いた回帰フィッティングにより検量線を得ることができる。
【0034】
次に、ステップS207で、検量線作成で用いた分析方法により、生体試料の測定を行う。この分析では、前処理を施すことなく測定を行う。
【0035】
最後に、ステップS208で、ステップS207の測定で得られた測定値に対応する濃度値を、検量線により求める(算出する)。
【0036】
以下、実施例を用いてより詳細に説明する。以下では、測定対象とする生理活性物質としてコルチゾールを例にとって説明する。
【0037】
[実施例1]
はじめに、実施例1について説明する。
【0038】
まず、生体試料として、起床後30分以内の唾液試料を成人男女数名から個別に採取した。各人の唾液2〜3mLを直接テストチューブに採取し、採取直後に冷凍保存し、測定前に解凍して用いた。採取時間は、個人差があるが、5〜10分程度であった。これらの試料を、検量線作成用および濃度測定用に分別し、検量線作成用には、個体差による偏りを防止するため、濃度測定用とは別の個人数名から採取した試料を等量ずつ混合して用いた。
【0039】
次に、上述した唾液試料より、生体試料の性質になるべく近い試料標準溶液の作製について説明する。プロテインGが修飾された市販の磁気ビーズ「Dynabeads Protein G」(DYNAL社製)を用意する。次に、この磁気ビーズ50μLあたりに、コルチゾール抗体溶液(ab1949、abcam)1μgの割合でこれらを混合し、室温にて30分転倒混和を行い、磁気ビーズにコルチゾール抗体を修飾した。
【0040】
このコルチゾール抗体を修飾した磁気ビーズ25μLにつき120μLの唾液試料を混合し、室温にて30分転倒混和を行い、唾液中のコルチゾールを取り除いた。容器底部の外側からネオジウム磁石を用いて溶液中の磁気ビーズを底部に集め、上澄み(容器上部)の生体試料のみを回収して除去試料とした。この除去試料について、LC/MS/MSを用いて残留コルチゾール定量分析を行い、コルチゾール濃度が0.03 ng/mL以下であることを確認し、コルチゾールを取り除く工程が有効であることを確認した。
【0041】
このコルチゾールを取り除いた除去試料に、既知量のコルチゾール緩衝溶液を添加し、コルチゾール濃度が既知の試料標準溶液を作製する。コルチゾール緩衝溶液は、ヒドロコルチゾン(hydrocortisone;SIGMA製,H0135)をリン酸緩衝液(1×Dulbecco'sPBS)に溶解して1mg/mLとした溶液である。このコルチゾール緩衝溶液を、上述した除去試料を用いて段階的に希釈し、0,2,5,10,20,40,80ng/mLの7種類の試料標準溶液を作製した。なお、なるべく生体試料の性質を保つため、除去試料に対するコルチゾール緩衝溶液の量は1000分の1以下となっている。また、各濃度の試料標準溶液の作製量は、検量線作成に十分な量として、全量を300μLとした。
【0042】
また、上述した試料標準溶液に対する参照として、従来法で用いられる手法で参照標準溶液を作製した。まず、緩衝液としてリン酸緩衝液(1×Dullbecco'sPBS;pH7)を用い、上述したコルチゾール緩衝溶液を段階希釈し、0,2,5,10,20,40,80ng/mLの7種類の参照標準溶液Aを作製した。また、緩衝液として炭酸緩衝液(pH9.6)を用い、上述したコルチゾール緩衝溶液を段階希釈し、0,2,5,10,20,40,80ng/mLの7種類の参照標準溶液Bを作製した。
【0043】
コルチゾール濃度の分析には、市販されているELISAキット(Salivary Cortisol ELISA,SLV-2930,DRG)を用いた。
【0044】
はじめに、次に示すようにして検量線を作製した。まず、コルチゾール抗体が修飾されたプレート上に、成人男女数名から個別に採取した試料のうち、任意に選んだコルチゾール濃度が未知の前処理無し唾液試料(S1、S2、S3)と、試料標準溶液,参照標準溶液A,および参照標準溶液Bを、各々100μLずつ添加し、続いて酵素標識コルチゾール(HRP標識コルチゾール)を200μLずつ各ウェルに添加し、競合反応させた。これらをシェーカーに乗せて室温で1時間反応させた後、洗浄緩衝液(400μL/ウェル)で3回洗浄した。最後に、基質溶液(TMB溶液)を各ウェルに100μLずつ添加し、室温で30分静置し、酵素と基質の反応による発色を得た。
【0045】
この後、反応停止液(希硫酸)を各ウェルに100μLずつ添加し、プレートリーダーで波長450nmにて吸光度を2回測定し、発色の度合いの平均値を求めた。ここで、試料標準溶液,参照標準溶液A,および参照標準溶液B,または唾液試料中のコルチゾール濃度が高くなるのに応じ、酵素標識コルチゾールがコルチゾール抗体に吸着する量が減少するため、発色反応の量も減少する。よって、吸光度の減少分をコルチゾール濃度に換算して定量分析が可能となる。
【0046】
次に、試料標準溶液,参照標準溶液A,および参照標準溶液Bのセットから得られた吸光度データを、指数減衰関数として「two phase exponential decay」関数を用いてフィッティングすることにより、標準試料セットごとに異なる、コルチゾール0〜80 ng/mLの濃度範囲における検量線を得た。これらの検量線を図3に示す。図3において、黒丸による線が試料標準溶液による検量線であり、黒四角による線が参照標準溶液Aによる検量線であり、黒三角による線が参照標準溶液Bによる検量線である。
【0047】
図3に示すように、本実施の形態における試料標準溶液から得られた検量線は、従来法で用いられる参照標準溶液A,Bから得られた検量線よりも、同じコルチゾール濃度の場合の吸光度が低い値を示すことがわかった。
【0048】
次に、上述した各検量線を用い、唾液試料S1,S2,S3のコルチゾール濃度を求めた。また、唾液試料S1、S2、S3について、LC/MS/MSの定量分析も行った。LC/MS/MSの定量分析では、各唾液試料を遠心分離して高分子成分のムチンを除去し、上澄みを分取した後、内部標準試料を添加し、さらに有機溶媒抽出を行い、カラムを用いて精製分離して前処理した試料を作製し、LC/MS/MSの定量分析を行った。
【0049】
上述した各検量線を用いた唾液試料S1,S2,S3のコルチゾール濃度分析結果と、LC/MS/MSを用いた唾液試料S1,S2,S3のコルチゾール濃度分析結果とを、図4に示す。図4において、(a)は、試料標準溶液による検量線を用いた分析結果であり、(b)は、参照標準溶液Aによる検量線を用いた分析結果であり、(c)は、参照標準溶液Bによる検量線を用いた分析結果であり、(d)は、LC/MS/MSによる分析結果である。
【0050】
図4に示すように、従来法(参照標準溶液A,B)の検量線から求めたコルチゾール濃度は、低濃度においてLC/MS/MSによる定量分析結果よりも高い濃度として算出されている。まず、参照標準溶液Aによる検量線を用いた分析結果(b)では、LC/MS/MSによる分析結果より約1.5倍高い濃度となる。また、参照標準溶液Bによる検量線を用いた分析結果(c)では、LC/MS/MSによる分析結果より約2倍高い濃度となる。
【0051】
これらの結果に対し、試料標準溶液による検量線を用いたS1、S2、S3中のコルチゾール濃度の分析結果(a)は、LC/MS/MSによる分析結果による分析結果に近い値(誤差±5%以内)を示すことがわかった。
【0052】
以上に説明したように、生体試料の性質になるべく近い試料標準溶液を用いてELISAにおける検量線を作成することにより、コルチゾール以外の物質による影響を全て含んだ検量線が得られるため、理想的な溶液を用いることによる定量誤差をなくすことができることが示された。この実施例により、本実施の形態によれば、極低濃度領域におけるコルチゾールの高精度定量方法が提供されることが示された。
【0053】
[実施例2]
次に、実施例2について説明する。
【0054】
生体試料としての唾液試料は、実施例1と同様に採取したものを用いた。また、実施例1と同様にして、試料標準溶液および参照標準溶液Aを作製した。
【0055】
本実施例2では、唾液中コルチゾール濃度の分析を、コルチゾールを抗原抗体反応させた溶液についての電気化学的測定法により行った。コルチゾールの抗原抗体反応は、ELISA用のプレート(maxisorp,NUNC)を用いて行った。コルチゾール抗体(ab1949、abcam)を2.5μg/mLの濃度に調整し、200μL/ウェルの条件で4℃として一晩静置し、抗体をプレート上に固定した。次に、洗浄緩衝液(400μL/ウェル)で3回洗浄した後、ブロッキング剤(2%ブロックエース、雪印乳業製)を350μL/ウェルの条件で37℃として2時間静置し、ブロッキングを行った。
【0056】
このプレートに、コルチゾール濃度が未知の前処理無し唾液試料(S1、S2、S3)と、試料標準溶液および参照標準溶液Aを100μLずつ添加し、続いて2μg/mLに調整した酵素(ALP)標識コルチゾール(EC152、Michigan Diagnostis LLC)を200μLずつ各ウェルに添加し、競合反応させた。これらをシェーカーに乗せて室温で30分反応させた後、洗浄緩衝液(400μL/ウェル)で3回洗浄した。
【0057】
最後に、各ウェルに基質溶液(1mM p−アミノフェニルホスフェートナトリウム塩(フナコシ)、ジエタノールアミン緩衝溶液または炭酸緩衝溶液)を各ウェルに100μLずつ添加し、室温で10分静置し、酵素と基質の反応によりpAPを生成させた。各溶液をテストチューブにとり、反応した溶液を、測定直前まで4℃で保存した。
【0058】
ここで、電気化学的測定について説明する。実施例2における電気化学的測定は、図5に示す測定装置を用いて行う。この測定装置は、櫛歯部で対向する2つの電極構造からなる作用電極501,対向電極502,および参照電極503を備える電極チップ504と、各電極が接続されるポテンシオスタット505およびクーロメータ506と、レコーダ507とを備える。ポテンシオスタット505により、作用電極501と参照電極503との間の電圧が設定した値となるように、作用電極501と対向電極502に流れる電流を制御し、クーロメータ506で、作用電極501に流れる電流を測定する。
【0059】
電極チップ504は、例えば、図6の斜視図に示すような、ビー・エー・エス株式会社製のくし形電極(10μm幅,5μm間隔の金電極)を用いればよい。この電極チップ504は、板厚0.5mmで12×20(mm)の基板500の上に、作用電極501,対向電極502,および参照電極503が配置されている。例えば、ビュレット601より、作用電極501の櫛歯部で対向する2つの電極構造の部分に試料を滴下する。
【0060】
また、作用電極501には、電極端子501aおよび電極端子502ビーが接続し、対向電極502には、電極端子502aが接続し、参照電極503には電極端子503が接続している。
【0061】
上述した櫛歯部で対向する2つの電極構造の作用電極501を用いることで、よく知られたレドックスサイクルによる増幅効果を利用し、pAPの酸化還元反応を定電位法により追跡する。作用電極501の一方の酸化側電極(+0.25V)で酸化したpAPは、作用電極501の他方の還元側(−0.2V)で還元され、隣接した二つの電極で酸化還元を繰り返すことにより電流の増幅が起こる。還元反応の応答電流値を検出信号とした場合は、酸化体を還元側電極で捕捉して反応する効率により、酸化反応と比較して電流値が小さくなるが、pAP以外の物質からの応答はほとんど寄与しないため、酸化反応の応答電流値を検出信号とした場合と比較して、定量精度が良くなるという特徴がある。
【0062】
ここで、試料標準溶液または唾液試料中のコルチゾール濃度が高くなるのに応じ、酵素標識コルチゾールがコルチゾール抗体に吸着する量が減少するため、pAPの生成量も減少する。よって、pAPからの応答電流値(∝pAP濃度)の減少分をコルチゾール濃度に換算して定量分析が可能となる。
【0063】
各標準試料セットから得られた電流値データを、指数減衰関数として「two phase exponential decay」関数を用いてフィッティングすることにより、標準試料セットごとに異なる、コルチゾール0〜80ng/mLの濃度範囲における検量線を得た。これらの検量線を図7に示す。図7において、黒丸による線が試料標準溶液による検量線であり、黒四角による線が参照標準溶液Aによる検量線である。
【0064】
図7から、生体試料の性質になるべく近い試料標準溶液から得られた本実施の形態による試料標準溶液から作製した検量線は、参照標準溶液Aから作製した検量線よりも、同じコルチゾール濃度の場合の電流値が高い値を示すことがわかった。
【0065】
次に、上述した各検量線を用い、唾液試料S1,S2,S3のコルチゾール濃度を求めた。また、唾液試料S1、S2、S3について、LC/MS/MSの定量分析も行った。LC/MS/MSの定量分析では、各唾液試料を遠心分離して高分子成分のムチンを除去し、上澄みを分取した後、内部標準試料を添加し、さらに有機溶媒抽出を行い、カラムを用いて精製分離して前処理した試料を作製し、LC/MS/MSの定量分析を行った。
【0066】
上述した各検量線を用いた唾液試料S1,S2,S3のコルチゾール濃度分析結果と、LC/MS/MSを用いた唾液試料S1,S2,S3のコルチゾール濃度分析結果とを、図8に示す。図8において、(a)は、試料標準溶液による検量線を用いた分析結果であり、(b)は、参照標準溶液Aによる検量線を用いた分析結果であり、(c)は、LC/MS/MSによる分析結果である。
【0067】
図8に示すように、従来法(参照標準溶液A)の検量線から求めたコルチゾール濃度は、低濃度においてLC/MS/MSによる定量分析結果よりも数倍低い濃度として算出されている。これに対し、試料標準溶液による検量線を用いたS1、S2、S3中のコルチゾール濃度の分析結果(a)は、LC/MS/MSによる分析結果による分析結果に近い値を示すことがわかった。
【0068】
以上に説明したように、生体試料の性質になるべく近い試料標準溶液を用いて電気化学的測定法における検量線を作成することにより、コルチゾール以外の物質による影響を全て含んだ検量線が得られるため、理想的な溶液を用いることによる定量誤差をなくすことができることが示された。このように、本実施の形態によれば、極低濃度領域におけるコルチゾールの高精度定量方法が提供されることが示された。
【0069】
なお、本発明は以上に説明した実施の形態に限定されるものではなく、本発明の技術的思想内で、当分野において通常の知識を有する者により、多くの変形および組み合わせが実施可能であることは明白である。例えば、上述した実施例では、検量線作成用には、濃度測定用とは別の個人数名から採取した試料を等量ずつ混合して用いたが、これに限るものではない。検量線作成用にも、濃度測定用の試料をこのまま用いるようにしてもよい。
【0070】
また、上述した実施例では、生理活性物質としてコルチゾールを例に説明したが、これに限るものではない。例えば、テストステロン、エストラジオール、プロゲステロン、エストロゲン、デハイドロエピアンドロステロンサルフェート(DHEA-S)、および上皮成長因子(EGF)などの、唾液中に含まれる他のホルモンの分析であっても、上述同様の効果が得られる。また、アミラーゼ、クロモグラニンA、およびイムノグロブリンA(IgA)などの唾液中に含まれるストレスマーカーホルモンの分析であっても、上述同様の効果が得られる。また、アルドステロンなどの副腎皮質ホルモンを含む他のホルモンの分析であっても、上述同様の効果が得られる。
【技術分野】
【0001】
本発明は、検体中のコルチゾールなどの生理活性物質の濃度を分析する分析方法に関するものである。
【背景技術】
【0002】
例えば、コルチゾールは、副腎皮質ホルモンの1つであり、血液,尿,および唾液などに含まれている。これらにおけるコルチゾールの濃度変動は、ストレス応答と関連があるとされ、典型的なストレスバイオマーカーとして認知されている。
【0003】
このような生理活性物質の、血液,尿,および唾液などの生体試料における代表的な定量分析手法には、液体クロマトグラフィー(Liquid Chromatography:LC)で分離して質量分析装置(Mass spectrometry:MS)で検出するLC/MSがある。また、LC(カラム)で分離した成分を、1段目のMSでイオン化し、質量ごとにわけ、さらに分離されたイオンを不活性ガスに衝突させて解離させ、解離させたイオンを2段目のMSで分析するLC/MS/MSがある。また、これらのLCでは、いわゆる高速液体クロマトグラフィー(HPLC)が用いられている。
【0004】
また、コルチゾールなどの生理活性物質の分析では、放射免疫測定法(ラジオイムノアッセイ:RIA)および酵素面積測定法(ELISA)も用いられている。
【0005】
上述した液体クロマトグラフィーを用いる分析では、極低濃度領域でも高い測定精度が得られるが、高感度に検出するために、分析対象とする生理活性物質以外に生体試料中に多種多様に存在する他の物質(生理活性物質)による妨害が大きい。例えば、よく知られているように、対象とする物質の分離を目的としたカラムでは、この物質と大きく分子量が異なる物質の存在により分離の性能が低下する。このため、LC/MSやLC/MS/MSでは、通常、様々な前処理を施してこれらの妨害成分を除去している。
【0006】
ここで、この種の分析(定量)では、濃度が既知の試料標準溶液を用いて測定を行い、標準物質と、これに対する測定データとの間の相関を示す検量線を作製し、実際の試料の測定に用いている。LC/MSやLC/MS/MSでは、上述したように、前処理をしているため、検量線作成のための参照とする試料標準溶液としては、妨害成分が含まれていない理想的な溶液を用いればよいものとなっている。
【0007】
一方、抗原抗体反応を利用するRIAやELISAは、分析対象の目的とする生理活性物質以外の物質による妨害が少ないことから、複雑な前処理をあまり必要とせずにある程度高感度な分析が可能であることが特徴である。血液,尿,および唾液などの生体試料を前処理無しに迅速分析できれば、リアルタイム分析やオンサイト分析技術として非常に有望である。
【先行技術文献】
【非特許文献】
【0008】
【非特許文献1】M.Groschl, "Current Status of Salivary Hormone Analysis", Clinical Chemistry, vol.54, no.11, pp1759-1769, 2008.
【非特許文献2】井澤修平、鈴木克彦、「唾液中コルチゾールの測定キットの比較 ―唾液中・血漿中コルチゾールの相関ならびに測定法間の比較―」、日本補完代替医療学会誌、第4巻、第3号、113−118頁、2007年。
【非特許文献3】U.Erdbruegger et al. , "Circulating endothelial cells: A novel marker of endothelial damage", Clinica Chimica Acta, vol.373, pp.17-26, 2006.
【非特許文献4】K.Aoki et al. , "Quantitative analysis of reversible diffusion-controlled currents of redox soluble species at interdigitated array electrodes under steady-state conditions", J. Electroanal. Chem. , vol.256, pp.269-282, 1988.
【発明の概要】
【発明が解決しようとする課題】
【0009】
しかし、RIAやELISAにおいても、LC/MSやLC/MS/MSのように生理活性物質を高精度に分析(定量)する場合、生体試料中の対象とする生理活性物質以外の物質(妨害成分)からの影響が無視できなくなる。ここで、RIAやELISAなどの分析方法においても、検量線を用いることになる。しかしながら、妨害成分が含まれていない理想的な試料標準溶液による検量線を用いると、このような試料標準溶液の測定では妨害イオンの影響がないため、上述したようなより高精度な分析では、測定の誤差が大きくなるという問題がある。
【0010】
本発明は、以上のような問題点を解消するためになされたものであり、生体試料に対する複雑な前処理をすることなく、高精度に対象とする生理活性物質が分析できるようにすることを目的とする。
【課題を解決するための手段】
【0011】
本発明に係る分析方法は、生体試料より測定対象とする生理活性物質のみを除去した除去試料を作製する第1ステップと、除去試料に濃度既知の生理活性物質を添加した試料標準溶液の生理活性物質の濃度を所定の分析方法により分析して検量線を作製する第2ステップと、生体試料における生理活性物質の濃度を、分析方法により検量線を用いて分析する第3ステップとを備える。
【0012】
上記分析方法において、第1ステップでは、プロテインGが修飾された磁気ビーズおよび生理活性物質の抗体を生体試料の一部に混合した後、磁気ビーズを磁石に吸着させることで、一部の生体試料より生理活性物質のみを除去することができる。この場合、第1ステップでは、抗体が吸着しているプロテインGが修飾された磁気ビーズを生体試料の一部に混合した後、磁気ビーズを磁石に吸着させることで、一部の生体試料より生理活性物質のみを除去すればよい。なお、生理活性物質は、例えば、コルチゾールである。
【発明の効果】
【0013】
以上説明したように、本発明によれば、生体試料より測定対象とする生理活性物質のみを除去した除去試料を利用して検量線を作製するようにしたので、生体試料に対する複雑な前処理をすることなく、高精度に生理活性物質が分析できるようになるという優れた効果が得られる。
【図面の簡単な説明】
【0014】
【図1】図1は、本発明の実施の形態における分析方法を説明するためのフローチャートである。
【図2】図2は、本発明の実施の形態における分析方法をより詳細に説明するためのフローチャートである。
【図3】図3は、実施例1における試料標準溶液,参照標準溶液A,および参照標準溶液Bより作製した検量線を示す特性図である。
【図4】図4は、図3に示す検量線を用いた唾液試料S1,S2,S3のコルチゾール濃度分析結果と、LC/MS/MSを用いた唾液試料S1,S2,S3のコルチゾール濃度分析結果とを示す特性図である。
【図5】図5は、電気化学的測定を行う測定装置の構成を示す構成図である。
【図6】図6は、電極チップ504の構成を示す斜視図である。
【図7】図7は、実施例2における試料標準溶液および参照標準溶液Aより作製した検量線を示す特性図である。
【図8】図8は、図7に示す検量線を用いた唾液試料S1,S2,S3のコルチゾール濃度分析結果と、LC/MS/MSを用いた唾液試料S1,S2,S3のコルチゾール濃度分析結果とを示す特性図である。
【発明を実施するための形態】
【0015】
以下、本発明の実施の形態について図を参照して説明する。図1は、本発明の実施の形態における分析方法を説明するフローチャートである。この分析方法は、まず、ステップS101で、生体試料より測定対象とする生理活性物質のみを除去した除去試料を作製する。次に、ステップS102で、除去試料に濃度既知の上記生理活性物質を添加した試料標準溶液の生理活性物質濃度を所定の分析方法により分析して検量線(標準曲線)を作製する。この後、ステップS103で、生体試料における生理活性物質の濃度を、上記分析方法で検量線を用いて分析する。なお、ステップS101では、生体試料の一部を分取して用い、ステップS103では、残りの生体試料を用いて実際の測定を行えばよい。
【0016】
上述した本実施の形態では、試料標準溶液と生体試料とは、測定対象とする生理活性物質以外の成分は同じ状態となる。このため、検量線を作成する時の分析と、実際の生体試料の分析とにおいては、測定対象の生理活性物質以外の物質からの影響が、同等の状態となる。言い換えると、検量線を作成する時の分析と、生体試料の実際の分析との間では、異なる点があるとすれば、測定対象とする生理活性物質の濃度のみとなる。従って、本実施の形態によれば、対象とする生理活性物質以外の物質による影響を除いた状態で、対象とする生理活性物質の濃度の測定が行えるので、高精度な分析が行える。また、検量線作成のために用いる試料標準溶液の作製では、既知の成分である測定対象の生理活性物質の除去をすればよいので、複雑な処理を必要とせずに容易である。
【0017】
また、本実施の形態では、実際の生体試料の分析では、生体試料に対して前処理を行う必要がない。例えば、前処理としては、一般には、測定対象となる生理活性物質の検出を妨害する他の生理活性物質を生体試料中より除去するものとなる。しかしながら、生体試料中には、どのような妨害成分が含まれているか明確ではなく、生体試料より全ての妨害成分を除去することは容易ではない。これに対し、本実施の形態では、未知の成分である妨害成分の除去をすることなく分析が行えるので、より簡便に分析が行える。
【0018】
次に、本実施の形態における分析方法について、図2のフローチャートを用いてより詳細に説明する。
【0019】
まず、ステップS201で、プロテインGが修飾された磁気ビーズを作製する。プロテインGが磁気ビーズは、市販されている「Dynabeads Protein G」(DYNAL社製)を用いればよい。また、プロテインGが修飾された磁気ビーズに、対象とする生理活性物質の抗体を修飾する。例えば、対象とする生理活性物質がコルチゾールの場合、用いるコルチゾール抗体は、「Cortisol antibody [XM210]」(ab1949;アブカム社製)であればよい。
【0020】
例えば、プロテインGが修飾された磁気ビーズ50μLに対し、0.2〜1μgのコルチゾール抗体を混合すればよい。混合は、室温(20℃程度)で、約10〜30分の間、転倒混和させることで行えばよい。
【0021】
次に、ステップS202で、生体試料の一部を分取し、この分取試料に、プロテインGを介して測定対象とする生理活性物質の抗体(例えばコルチゾール抗体)が修飾されている磁気ビーズを混合する。例えば、分取試料に上記磁気ビーズを混合し、室温にて約10分〜60分、転倒混和すればよい。
【0022】
上述した転倒混和の処理において、処理時間が長すぎた場合、また、用いた抗体の濃度が高すぎた場合、および、磁気ビーズに修飾されているプロテインGに対する抗体の結合が弱い場合は、対象とする生理活性物質が結合した抗体が、磁気ビーズより離間する恐れがある。このような場合、プロテインGが修飾されている磁気ビーズを新たに加え、例えば、約10〜60分、室温にて転倒混和すればよい。この追加により、浮遊した抗体が回収できるので、試料中の対象とする生理活性物質をより確実に取り除くことができる。例えば、コルチゾール抗体の場合の抗体未固定の磁気ビーズと生体試料の混合比の一例としては、磁気ビーズ20μLにつき、生体試料100〜150μLを混合する条件が好ましい。
【0023】
次に、ステップS203で、分取試料より磁気ビーズを分離する。例えば、分取試料を収容している容器の外側(底部)に磁石を配置し、磁気ビーズを磁石の配置位置に引き寄せて収集して分画させ、この状態で、容器上部の分取試料を取り出せばよい。この生理活性物質の除去方法を、コルチゾールに適用した場合、コルチゾールを取り除いた分取試料の残留しているコルチゾールの濃度を、LC/MS/MSで分析したところ、0.03ng/mL以下であることが確認された、なお、LC/MS/MSによるコルチゾールの定量下限値は、0.03ng/mLである。このように、磁気ビーズを利用した上述のコルチゾール除去は、有効であることが確認されている。
【0024】
なお、ステップS201では、プロテインGが修飾された磁気ビーズを用意(作製)し、ステップS202で、分取試料に、プロテインGが修飾された磁気ビーズおよび抗体を加え、これらを混合するようにしてもよい。いずれにしても、生理活性物質に対する抗体を利用することで、生体試料中より対象とする生理活性物質を選択的に除去することが可能である。言い換えると、抗体が存在する生理活性物質であれば、生体試料中より選択的に除去することが可能である。
【0025】
次に、ステップS204で、生理活性物質を取り除いた除去試料に、濃度既知の生理活性物質を添加した試料標準溶液を作製する。例えば、生理活性物質がコルチゾールの場合、コルチゾールをリン酸緩衝液または炭酸緩衝液に溶解したコルチゾール緩衝溶液を、除去試料に添加して試料標準溶液とすればよい。この場合、生体試料の特性を保つために、除去試料に対する緩衝溶液の量は、1000分の1以下であることが好ましい。また、試料標準溶液は、検量線作成に十分な量として、全量が100〜500μL程度に作製するとよい。また、生体試料が唾液の場合、試料標準溶液中のコルチゾール濃度が、0〜80ng/mLの範囲内で、3〜10種類となるように、複数の試料標準溶液を作製するとよい。
【0026】
次に、ステップS205で、上述したように作製した各々生理活性物質濃度が異なる複数の試料標準溶液の濃度を、所定の分析方法を用いて分析する。分析方法としては、生体試料の前処理が不要であるという点などから、RIA,ELISA,および電気化学的検出法などであるとよい。
【0027】
例えば、ELISAによるコルチゾールの分析では、酵素標識コルチゾールと試料標準溶液とを、コルチゾール抗体を固定したプレート上で競合反応させ、吸着した酵素標識コルチゾールと基質の反応による発色を吸光度測定によって検出する。酵素および基質の組み合わせの例としては、まず、西洋ワサビペルオキシダーゼ(HRP)と3,3’,5,5’−トリメチルベンジジン(TMB)がある(組み合わせA)。また、アルカリフォスファターゼ(ALP)とp−ニトロフェニルホスフェート(pNPP)との組み合わせがある(組み合わせB)。組み合わせAの場合、TMB酸化物の450nmの吸収を検出信号として用いる。また、組み合わせBの場合、pNP(p−ニトロフェノール)の405nmの吸収を検出信号として用いる。
【0028】
また、電気化学的検出によるコルチゾールの分析では、酵素標識コルチゾールと試料標準溶液とを、コルチゾール抗体を固定したプレート上で競合反応させ、吸着した酵素標識コルチゾールと基質の反応により生成した物質を、酸化還元反応により検出する。酵素および基質の組み合わせの例としては、ELISAで用いた上記の2つの組み合わせのほか、アルカリフォスファターゼ(ALP)とp−アミノフェニルホスフェート(pAPP)との組み合わせがある(組み合わせC)。また、アセチルコリンエステラーゼ(AChE)とアセチルチオコリン(ATCh)との組み合わせがある(組み合わせD)。
【0029】
組み合わせAの場合は、未反応のTMB(TMBの還元体)の酸化反応を電極上で測定し、応答電流値を検出信号として用いる。また、組み合わせCの場合は、反応生成物であるチオコリンの酸化反応を電極上で測定し、応答電流値を検出信号として用いる。
【0030】
また、組み合わせBの場合は、反応生成物であるpNPおよびの酸化反応を電極上で測定し、応答電流値を検出信号として用いる。また、組み合わせDの場合は、反応生成物であるpAP(p−アミノフェノール)の酸化反応を電極上で測定し、応答電流値を検出信号として用いる。
【0031】
さらに、くし形電極などを用いてレドックスサイクルによる増幅効果を利用することもできる(非特許文献4参照)。この場合は、pNPおよびpAPの還元反応を電極上で測定し、応答電流値を検出信号として用いることもできる。還元反応の応答電流値を検出信号とする場合は、酸化体を還元側電極で捕捉して反応する効率により、酸化反応と比較して電流値が小さくなる。しかしながら、この場合、pNPおよびpAP以外の物質からの応答はほとんど寄与しないため、酸化反応の応答電流値を検出信号とした場合と比較して、定量精度が良くなるという特徴がある。
【0032】
いずれの分析手法においても、検量線の精度をより高めるためには、2セット以上の測定を実施し、平均値および測定誤差を得ることが好ましい。
【0033】
次に、ステップS206で、上述した分析の結果として得られた測定値と、既知の濃度値との組み合わせ(相関)により、検量線を作製する。検量線は、測定値に対して濃度値が対応して示されたグラフである。所定の生理活性物質の濃度範囲において得られた測定値について、回帰分析を行い、この結果を検量線として用いればよい。例えばELISAの場合、0〜80ng/mLの範囲で、4パラメータロジスティック関数、指数減衰関数、多項式関数などを用いた回帰フィッティングにより検量線を得ることができる。
【0034】
次に、ステップS207で、検量線作成で用いた分析方法により、生体試料の測定を行う。この分析では、前処理を施すことなく測定を行う。
【0035】
最後に、ステップS208で、ステップS207の測定で得られた測定値に対応する濃度値を、検量線により求める(算出する)。
【0036】
以下、実施例を用いてより詳細に説明する。以下では、測定対象とする生理活性物質としてコルチゾールを例にとって説明する。
【0037】
[実施例1]
はじめに、実施例1について説明する。
【0038】
まず、生体試料として、起床後30分以内の唾液試料を成人男女数名から個別に採取した。各人の唾液2〜3mLを直接テストチューブに採取し、採取直後に冷凍保存し、測定前に解凍して用いた。採取時間は、個人差があるが、5〜10分程度であった。これらの試料を、検量線作成用および濃度測定用に分別し、検量線作成用には、個体差による偏りを防止するため、濃度測定用とは別の個人数名から採取した試料を等量ずつ混合して用いた。
【0039】
次に、上述した唾液試料より、生体試料の性質になるべく近い試料標準溶液の作製について説明する。プロテインGが修飾された市販の磁気ビーズ「Dynabeads Protein G」(DYNAL社製)を用意する。次に、この磁気ビーズ50μLあたりに、コルチゾール抗体溶液(ab1949、abcam)1μgの割合でこれらを混合し、室温にて30分転倒混和を行い、磁気ビーズにコルチゾール抗体を修飾した。
【0040】
このコルチゾール抗体を修飾した磁気ビーズ25μLにつき120μLの唾液試料を混合し、室温にて30分転倒混和を行い、唾液中のコルチゾールを取り除いた。容器底部の外側からネオジウム磁石を用いて溶液中の磁気ビーズを底部に集め、上澄み(容器上部)の生体試料のみを回収して除去試料とした。この除去試料について、LC/MS/MSを用いて残留コルチゾール定量分析を行い、コルチゾール濃度が0.03 ng/mL以下であることを確認し、コルチゾールを取り除く工程が有効であることを確認した。
【0041】
このコルチゾールを取り除いた除去試料に、既知量のコルチゾール緩衝溶液を添加し、コルチゾール濃度が既知の試料標準溶液を作製する。コルチゾール緩衝溶液は、ヒドロコルチゾン(hydrocortisone;SIGMA製,H0135)をリン酸緩衝液(1×Dulbecco'sPBS)に溶解して1mg/mLとした溶液である。このコルチゾール緩衝溶液を、上述した除去試料を用いて段階的に希釈し、0,2,5,10,20,40,80ng/mLの7種類の試料標準溶液を作製した。なお、なるべく生体試料の性質を保つため、除去試料に対するコルチゾール緩衝溶液の量は1000分の1以下となっている。また、各濃度の試料標準溶液の作製量は、検量線作成に十分な量として、全量を300μLとした。
【0042】
また、上述した試料標準溶液に対する参照として、従来法で用いられる手法で参照標準溶液を作製した。まず、緩衝液としてリン酸緩衝液(1×Dullbecco'sPBS;pH7)を用い、上述したコルチゾール緩衝溶液を段階希釈し、0,2,5,10,20,40,80ng/mLの7種類の参照標準溶液Aを作製した。また、緩衝液として炭酸緩衝液(pH9.6)を用い、上述したコルチゾール緩衝溶液を段階希釈し、0,2,5,10,20,40,80ng/mLの7種類の参照標準溶液Bを作製した。
【0043】
コルチゾール濃度の分析には、市販されているELISAキット(Salivary Cortisol ELISA,SLV-2930,DRG)を用いた。
【0044】
はじめに、次に示すようにして検量線を作製した。まず、コルチゾール抗体が修飾されたプレート上に、成人男女数名から個別に採取した試料のうち、任意に選んだコルチゾール濃度が未知の前処理無し唾液試料(S1、S2、S3)と、試料標準溶液,参照標準溶液A,および参照標準溶液Bを、各々100μLずつ添加し、続いて酵素標識コルチゾール(HRP標識コルチゾール)を200μLずつ各ウェルに添加し、競合反応させた。これらをシェーカーに乗せて室温で1時間反応させた後、洗浄緩衝液(400μL/ウェル)で3回洗浄した。最後に、基質溶液(TMB溶液)を各ウェルに100μLずつ添加し、室温で30分静置し、酵素と基質の反応による発色を得た。
【0045】
この後、反応停止液(希硫酸)を各ウェルに100μLずつ添加し、プレートリーダーで波長450nmにて吸光度を2回測定し、発色の度合いの平均値を求めた。ここで、試料標準溶液,参照標準溶液A,および参照標準溶液B,または唾液試料中のコルチゾール濃度が高くなるのに応じ、酵素標識コルチゾールがコルチゾール抗体に吸着する量が減少するため、発色反応の量も減少する。よって、吸光度の減少分をコルチゾール濃度に換算して定量分析が可能となる。
【0046】
次に、試料標準溶液,参照標準溶液A,および参照標準溶液Bのセットから得られた吸光度データを、指数減衰関数として「two phase exponential decay」関数を用いてフィッティングすることにより、標準試料セットごとに異なる、コルチゾール0〜80 ng/mLの濃度範囲における検量線を得た。これらの検量線を図3に示す。図3において、黒丸による線が試料標準溶液による検量線であり、黒四角による線が参照標準溶液Aによる検量線であり、黒三角による線が参照標準溶液Bによる検量線である。
【0047】
図3に示すように、本実施の形態における試料標準溶液から得られた検量線は、従来法で用いられる参照標準溶液A,Bから得られた検量線よりも、同じコルチゾール濃度の場合の吸光度が低い値を示すことがわかった。
【0048】
次に、上述した各検量線を用い、唾液試料S1,S2,S3のコルチゾール濃度を求めた。また、唾液試料S1、S2、S3について、LC/MS/MSの定量分析も行った。LC/MS/MSの定量分析では、各唾液試料を遠心分離して高分子成分のムチンを除去し、上澄みを分取した後、内部標準試料を添加し、さらに有機溶媒抽出を行い、カラムを用いて精製分離して前処理した試料を作製し、LC/MS/MSの定量分析を行った。
【0049】
上述した各検量線を用いた唾液試料S1,S2,S3のコルチゾール濃度分析結果と、LC/MS/MSを用いた唾液試料S1,S2,S3のコルチゾール濃度分析結果とを、図4に示す。図4において、(a)は、試料標準溶液による検量線を用いた分析結果であり、(b)は、参照標準溶液Aによる検量線を用いた分析結果であり、(c)は、参照標準溶液Bによる検量線を用いた分析結果であり、(d)は、LC/MS/MSによる分析結果である。
【0050】
図4に示すように、従来法(参照標準溶液A,B)の検量線から求めたコルチゾール濃度は、低濃度においてLC/MS/MSによる定量分析結果よりも高い濃度として算出されている。まず、参照標準溶液Aによる検量線を用いた分析結果(b)では、LC/MS/MSによる分析結果より約1.5倍高い濃度となる。また、参照標準溶液Bによる検量線を用いた分析結果(c)では、LC/MS/MSによる分析結果より約2倍高い濃度となる。
【0051】
これらの結果に対し、試料標準溶液による検量線を用いたS1、S2、S3中のコルチゾール濃度の分析結果(a)は、LC/MS/MSによる分析結果による分析結果に近い値(誤差±5%以内)を示すことがわかった。
【0052】
以上に説明したように、生体試料の性質になるべく近い試料標準溶液を用いてELISAにおける検量線を作成することにより、コルチゾール以外の物質による影響を全て含んだ検量線が得られるため、理想的な溶液を用いることによる定量誤差をなくすことができることが示された。この実施例により、本実施の形態によれば、極低濃度領域におけるコルチゾールの高精度定量方法が提供されることが示された。
【0053】
[実施例2]
次に、実施例2について説明する。
【0054】
生体試料としての唾液試料は、実施例1と同様に採取したものを用いた。また、実施例1と同様にして、試料標準溶液および参照標準溶液Aを作製した。
【0055】
本実施例2では、唾液中コルチゾール濃度の分析を、コルチゾールを抗原抗体反応させた溶液についての電気化学的測定法により行った。コルチゾールの抗原抗体反応は、ELISA用のプレート(maxisorp,NUNC)を用いて行った。コルチゾール抗体(ab1949、abcam)を2.5μg/mLの濃度に調整し、200μL/ウェルの条件で4℃として一晩静置し、抗体をプレート上に固定した。次に、洗浄緩衝液(400μL/ウェル)で3回洗浄した後、ブロッキング剤(2%ブロックエース、雪印乳業製)を350μL/ウェルの条件で37℃として2時間静置し、ブロッキングを行った。
【0056】
このプレートに、コルチゾール濃度が未知の前処理無し唾液試料(S1、S2、S3)と、試料標準溶液および参照標準溶液Aを100μLずつ添加し、続いて2μg/mLに調整した酵素(ALP)標識コルチゾール(EC152、Michigan Diagnostis LLC)を200μLずつ各ウェルに添加し、競合反応させた。これらをシェーカーに乗せて室温で30分反応させた後、洗浄緩衝液(400μL/ウェル)で3回洗浄した。
【0057】
最後に、各ウェルに基質溶液(1mM p−アミノフェニルホスフェートナトリウム塩(フナコシ)、ジエタノールアミン緩衝溶液または炭酸緩衝溶液)を各ウェルに100μLずつ添加し、室温で10分静置し、酵素と基質の反応によりpAPを生成させた。各溶液をテストチューブにとり、反応した溶液を、測定直前まで4℃で保存した。
【0058】
ここで、電気化学的測定について説明する。実施例2における電気化学的測定は、図5に示す測定装置を用いて行う。この測定装置は、櫛歯部で対向する2つの電極構造からなる作用電極501,対向電極502,および参照電極503を備える電極チップ504と、各電極が接続されるポテンシオスタット505およびクーロメータ506と、レコーダ507とを備える。ポテンシオスタット505により、作用電極501と参照電極503との間の電圧が設定した値となるように、作用電極501と対向電極502に流れる電流を制御し、クーロメータ506で、作用電極501に流れる電流を測定する。
【0059】
電極チップ504は、例えば、図6の斜視図に示すような、ビー・エー・エス株式会社製のくし形電極(10μm幅,5μm間隔の金電極)を用いればよい。この電極チップ504は、板厚0.5mmで12×20(mm)の基板500の上に、作用電極501,対向電極502,および参照電極503が配置されている。例えば、ビュレット601より、作用電極501の櫛歯部で対向する2つの電極構造の部分に試料を滴下する。
【0060】
また、作用電極501には、電極端子501aおよび電極端子502ビーが接続し、対向電極502には、電極端子502aが接続し、参照電極503には電極端子503が接続している。
【0061】
上述した櫛歯部で対向する2つの電極構造の作用電極501を用いることで、よく知られたレドックスサイクルによる増幅効果を利用し、pAPの酸化還元反応を定電位法により追跡する。作用電極501の一方の酸化側電極(+0.25V)で酸化したpAPは、作用電極501の他方の還元側(−0.2V)で還元され、隣接した二つの電極で酸化還元を繰り返すことにより電流の増幅が起こる。還元反応の応答電流値を検出信号とした場合は、酸化体を還元側電極で捕捉して反応する効率により、酸化反応と比較して電流値が小さくなるが、pAP以外の物質からの応答はほとんど寄与しないため、酸化反応の応答電流値を検出信号とした場合と比較して、定量精度が良くなるという特徴がある。
【0062】
ここで、試料標準溶液または唾液試料中のコルチゾール濃度が高くなるのに応じ、酵素標識コルチゾールがコルチゾール抗体に吸着する量が減少するため、pAPの生成量も減少する。よって、pAPからの応答電流値(∝pAP濃度)の減少分をコルチゾール濃度に換算して定量分析が可能となる。
【0063】
各標準試料セットから得られた電流値データを、指数減衰関数として「two phase exponential decay」関数を用いてフィッティングすることにより、標準試料セットごとに異なる、コルチゾール0〜80ng/mLの濃度範囲における検量線を得た。これらの検量線を図7に示す。図7において、黒丸による線が試料標準溶液による検量線であり、黒四角による線が参照標準溶液Aによる検量線である。
【0064】
図7から、生体試料の性質になるべく近い試料標準溶液から得られた本実施の形態による試料標準溶液から作製した検量線は、参照標準溶液Aから作製した検量線よりも、同じコルチゾール濃度の場合の電流値が高い値を示すことがわかった。
【0065】
次に、上述した各検量線を用い、唾液試料S1,S2,S3のコルチゾール濃度を求めた。また、唾液試料S1、S2、S3について、LC/MS/MSの定量分析も行った。LC/MS/MSの定量分析では、各唾液試料を遠心分離して高分子成分のムチンを除去し、上澄みを分取した後、内部標準試料を添加し、さらに有機溶媒抽出を行い、カラムを用いて精製分離して前処理した試料を作製し、LC/MS/MSの定量分析を行った。
【0066】
上述した各検量線を用いた唾液試料S1,S2,S3のコルチゾール濃度分析結果と、LC/MS/MSを用いた唾液試料S1,S2,S3のコルチゾール濃度分析結果とを、図8に示す。図8において、(a)は、試料標準溶液による検量線を用いた分析結果であり、(b)は、参照標準溶液Aによる検量線を用いた分析結果であり、(c)は、LC/MS/MSによる分析結果である。
【0067】
図8に示すように、従来法(参照標準溶液A)の検量線から求めたコルチゾール濃度は、低濃度においてLC/MS/MSによる定量分析結果よりも数倍低い濃度として算出されている。これに対し、試料標準溶液による検量線を用いたS1、S2、S3中のコルチゾール濃度の分析結果(a)は、LC/MS/MSによる分析結果による分析結果に近い値を示すことがわかった。
【0068】
以上に説明したように、生体試料の性質になるべく近い試料標準溶液を用いて電気化学的測定法における検量線を作成することにより、コルチゾール以外の物質による影響を全て含んだ検量線が得られるため、理想的な溶液を用いることによる定量誤差をなくすことができることが示された。このように、本実施の形態によれば、極低濃度領域におけるコルチゾールの高精度定量方法が提供されることが示された。
【0069】
なお、本発明は以上に説明した実施の形態に限定されるものではなく、本発明の技術的思想内で、当分野において通常の知識を有する者により、多くの変形および組み合わせが実施可能であることは明白である。例えば、上述した実施例では、検量線作成用には、濃度測定用とは別の個人数名から採取した試料を等量ずつ混合して用いたが、これに限るものではない。検量線作成用にも、濃度測定用の試料をこのまま用いるようにしてもよい。
【0070】
また、上述した実施例では、生理活性物質としてコルチゾールを例に説明したが、これに限るものではない。例えば、テストステロン、エストラジオール、プロゲステロン、エストロゲン、デハイドロエピアンドロステロンサルフェート(DHEA-S)、および上皮成長因子(EGF)などの、唾液中に含まれる他のホルモンの分析であっても、上述同様の効果が得られる。また、アミラーゼ、クロモグラニンA、およびイムノグロブリンA(IgA)などの唾液中に含まれるストレスマーカーホルモンの分析であっても、上述同様の効果が得られる。また、アルドステロンなどの副腎皮質ホルモンを含む他のホルモンの分析であっても、上述同様の効果が得られる。
【特許請求の範囲】
【請求項1】
生体試料より測定対象とする生理活性物質のみを除去した除去試料を作製する第1ステップと、
前記除去試料に濃度既知の前記生理活性物質を添加した試料標準溶液の前記生理活性物質の濃度を所定の分析方法により分析して検量線を作製する第2ステップと、
前記生体試料における前記生理活性物質の濃度を、前記分析方法により前記検量線を用いて分析する第3ステップと
を備えることを特徴とする分析方法。
【請求項2】
請求項1記載の分析方法において、
前記第1ステップでは、プロテインGが修飾された磁気ビーズおよび前記生理活性物質の抗体を前記生体試料の一部に混合した後、前記磁気ビーズを磁石に吸着させることで、一部の前記生体試料より前記生理活性物質のみを除去する
ことを特徴とする分析方法。
【請求項3】
請求項2記載の分析方法において、
前記第1ステップでは、前記抗体が吸着しているプロテインGが修飾された磁気ビーズを前記生体試料の一部に混合した後、前記磁気ビーズを磁石に吸着させることで、一部の前記生体試料より前記生理活性物質のみを除去する
ことを特徴とする分析方法。
【請求項4】
請求項1〜3のいずれか1項に記載の分析方法において、
前記生理活性物質は、コルチゾールであることを特徴とする分析方法。
【請求項1】
生体試料より測定対象とする生理活性物質のみを除去した除去試料を作製する第1ステップと、
前記除去試料に濃度既知の前記生理活性物質を添加した試料標準溶液の前記生理活性物質の濃度を所定の分析方法により分析して検量線を作製する第2ステップと、
前記生体試料における前記生理活性物質の濃度を、前記分析方法により前記検量線を用いて分析する第3ステップと
を備えることを特徴とする分析方法。
【請求項2】
請求項1記載の分析方法において、
前記第1ステップでは、プロテインGが修飾された磁気ビーズおよび前記生理活性物質の抗体を前記生体試料の一部に混合した後、前記磁気ビーズを磁石に吸着させることで、一部の前記生体試料より前記生理活性物質のみを除去する
ことを特徴とする分析方法。
【請求項3】
請求項2記載の分析方法において、
前記第1ステップでは、前記抗体が吸着しているプロテインGが修飾された磁気ビーズを前記生体試料の一部に混合した後、前記磁気ビーズを磁石に吸着させることで、一部の前記生体試料より前記生理活性物質のみを除去する
ことを特徴とする分析方法。
【請求項4】
請求項1〜3のいずれか1項に記載の分析方法において、
前記生理活性物質は、コルチゾールであることを特徴とする分析方法。
【図1】


【図2】


【図3】


【図5】


【図7】


【図4】


【図6】


【図8】




【図2】


【図3】


【図5】


【図7】


【図4】


【図6】


【図8】


【公開番号】特開2012−108027(P2012−108027A)
【公開日】平成24年6月7日(2012.6.7)
【国際特許分類】
【出願番号】特願2010−257737(P2010−257737)
【出願日】平成22年11月18日(2010.11.18)
【出願人】(000004226)日本電信電話株式会社 (13,992)
【Fターム(参考)】
【公開日】平成24年6月7日(2012.6.7)
【国際特許分類】
【出願日】平成22年11月18日(2010.11.18)
【出願人】(000004226)日本電信電話株式会社 (13,992)
【Fターム(参考)】
[ Back to top ]

