分離装置および分離方法
【課題】精度よく、また試料中の生死状態を維持したままグラム陰性菌を全細菌から分離して検出することのできる分離装置を提供する。
【解決手段】分離装置500は、チェンバ53内に外気を導入するためのエア管56およびファン55と、チェンバ53内のグラム陰性菌のトラップした微粒子を残留させて液体を排出するための流路管58、バルブ58A、およびフィルタ58Bと、チェンバ53内に解離液を導入するためのチェンバ54、流路管57、およびバルブ57Aとを備え、チェンバ53内の、グラム陰性菌と特異的に反応する抗体を表面に修飾した微粒子を含む液体に外気を導入し、チェンバ53内の液体とグラム陰性菌のトラップした微粒子とを分離し、グラム陰性菌のトラップした微粒子が残留したチェンバ53内に解離液を導入することで、グラム陰性菌と微粒子の表面に修飾された抗体との結合を解離させる。
【解決手段】分離装置500は、チェンバ53内に外気を導入するためのエア管56およびファン55と、チェンバ53内のグラム陰性菌のトラップした微粒子を残留させて液体を排出するための流路管58、バルブ58A、およびフィルタ58Bと、チェンバ53内に解離液を導入するためのチェンバ54、流路管57、およびバルブ57Aとを備え、チェンバ53内の、グラム陰性菌と特異的に反応する抗体を表面に修飾した微粒子を含む液体に外気を導入し、チェンバ53内の液体とグラム陰性菌のトラップした微粒子とを分離し、グラム陰性菌のトラップした微粒子が残留したチェンバ53内に解離液を導入することで、グラム陰性菌と微粒子の表面に修飾された抗体との結合を解離させる。
【発明の詳細な説明】
【技術分野】
【0001】
この発明は分離装置および分離方法に関し、特に、グラム陰性菌を分離するための分離装置および分離方法に関する。
【背景技術】
【0002】
菌類は、その構造から大きく分けてグラム陽性菌とグラム陰性菌とに分類され、一般的に、グラム陰性菌の方が毒性が高いとされている。そのため、これらの菌種を判別することは重要である。
【0003】
従来、菌類を測定する方法として、エアサンプラによって捕集した菌類を培養する方法が代表的なものとして挙げられる。しかしながら、この手法では測定に数日間を要し、また生菌のみしか検出できない。
【0004】
生物発光を利用した菌検出方法は、迅速であるが、菌由来以外のATP(アデノシン三リン酸)が存在した場合、正確な測定が行なうことができない。その結果、グラム陽性菌とグラム陰性菌との区別もできない。
【0005】
このような問題を解消するため、たとえば特開2007−121282号公報(以下、特許文献1)は、グラム陽性菌表層に結合するたんぱく質を用いた判別方法を開示している。詳しくは、特許文献1に開示の判別方法は、細菌の細胞壁に結合するたんぱく質とレポーターたんぱく質との融合たんぱく質を用い、グラム陰性細菌の外膜の透過性亢進処理の有無により、グラム陽性細菌およびグラム陰性細菌の検出、または、グラム陽性細菌のみの検出を行なうものである。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2007−121282号公報
【発明の概要】
【発明が解決しようとする課題】
【0007】
しかしながら、特許文献1に開示されている方法でグラム陰性菌を検出しようとした場合、上述のように特許文献1の方法では外膜の透過性亢進処理を行なうため、検出されたグラム陰性菌は死菌となる可能性が高い。つまり、たとえば検出後の実験等に生菌として用いるなどの用途でグラム陰性菌を検出しようとしても、特許文献1の方法を利用すると試料中の菌の生死状態を維持したままグラム陰性菌が検出されない場合がある、という問題がある。
【0008】
また、他の問題として、グラム陰性菌を識別/計測するためには、全細菌からグラム陽性菌を差し引く必要がある。そのため、全細菌とグラム陽性菌とのそれぞれを計測するために2つの試料が必須となる。ところが、それら2つの試料中に細菌数の偏りが有ると、グラム陰性菌の検出が精度よく検出されない、という問題もある。
【0009】
本発明はこのような問題に鑑みてなされたものであって、精度よく、また試料中の生死状態を維持したままグラム陰性菌を全細菌から分離して検出することのできる分離装置および分離方法を提供することを目的としている。
【課題を解決するための手段】
【0010】
上記目的を達成するために、本発明のある局面に従うと、分離装置はグラム陰性菌を分離するための分離装置であって、チェンバと、チェンバ内に外気を導入するための第1の機構と、チェンバ内にグラム陰性菌のトラップした微粒子を残留させて液体を排出するための第2の機構と、チェンバ内に解離液を導入するための第3の機構と、それら機構を制御するための制御装置とを備える。制御装置は第1〜第3の機構を制御することで、チェンバ内の、グラム陰性菌と特異的に反応する抗体を表面に修飾した微粒子を含む液体に、外気を導入する動作と、チェンバ内にグラム陰性菌のトラップした微粒子を残留させて、液体を排出する動作と、グラム陰性菌のトラップした微粒子が残留したチェンバ内に解離液を導入し、微粒子からグラム陰性菌を解離させる動作とを実行する。
【0011】
好ましくは、第2の機構は、チェンバ内の液体を微粒子よりも孔のサイズの小さいフィルタを通してチェンバ外に排出するための機構である。
【0012】
好ましくは、微粒子は磁気の影響を受ける素材を含み、第2の機構は、磁気分離によってチェンバ内の液体からグラム陰性菌のトラップした微粒子を分離するための機構である。
【0013】
好ましくは、分離装置は、液体に含まれる生物由来の粒子を捕集するための捕集装置に解離液が導入された後のチェンバ内の液体を導入するための第4の機構をさらに備える。
【0014】
より好ましくは、捕集装置は、誘電泳動を利用して液体中の、微粒子から解離したグラム陰性菌を電極上に付着させることで、グラム陰性菌を捕集する。
【0015】
本発明の他の局面に従うと、分離方法はグラム陰性菌を分離する方法であって、外気を、グラム陰性菌と特異的に反応する抗体を表面に修飾した微粒子を含む液体に取り込むステップと、液体とグラム陰性菌のトラップした微粒子とを分離し、液体を排出するステップと、グラム陰性菌のトラップした微粒子を解離液に取り込むことで、微粒子からグラム陰性菌を解離させるステップとを備える。
【発明の効果】
【0016】
この発明によると、精度よく、また試料中の生死状態を維持したままグラム陰性菌を全細菌から分離して検出することができる。
【図面の簡単な説明】
【0017】
【図1】グラム陽性菌の細胞壁の構造(A)とグラム陰性菌の細胞壁の構造(B)との概略を表わした図である。
【図2】実施の形態にかかる捕集システムの構成の具体例、および該捕集システムに含まれる分離装置の構成の具体例を示す図である。
【図3】分離装置での分離方法を説明するための概略図である。
【図4】実施の形態にかかる捕集システムに含まれる捕集装置の構成の具体例を示す図である。
【図5】捕集装置の基板の排出孔側に設けられる流路の1つの具体例を示す図である。
【図6】捕集装置の基板の構成の1つの具体例を示す図である。
【図7】捕集装置の電極表面に付着したグラム陰性菌の状態を表わした図である。
【図8】捕集システムでの捕集動作の流れの概要を表わした図である。
【図9】制御装置50での制御の流れを表わすフローチャートである。
【図10】制御装置10での制御の流れを表わすフローチャートである。
【発明を実施するための形態】
【0018】
以下に、図面を参照しつつ、本発明の実施の形態について説明する。以下の説明では、同一の部品および構成要素には同一の符号を付してある。それらの名称および機能も同じである。
【0019】
<分離の原理>
実施の形態にかかる分離装置は、グラム陽性菌とグラム陰性菌との細胞壁の構造の差異による細胞表面の性質の差異に着目し、抗原抗体反応を利用してグラム陽性菌を分離する。なお、代表的なグラム陽性菌としては黄色ブドウ球菌やボツリヌス菌などが挙げられ、代表的なグラム陰性菌としては大腸菌やサルモネラ菌などが挙げられる。
【0020】
図1は、グラム陽性菌の細胞壁の構造(A)とグラム陰性菌の細胞壁の構造(B)との概略を表わした図である。
【0021】
図1を参照して、大きな差異として、グラム陽性菌はグラム陰性菌と比較してペプチドグルカンが厚く、そのペプチドグルカンにタイコ酸、蛋白、多糖が存在している。
【0022】
一方、グラム陰性菌はグラム陽性菌と比較してペプチドグルカンが薄く、そのペプチドグルカンの外側に外膜が存在する。外膜は、糖鎖からなるリポ多糖(LPS)を含む。リポ多糖(LPS)は内毒素(エンドトキシン)であり、グラム陰性菌の菌体成分である。
【0023】
グラム陰性菌の表層は、菌の内側から細胞質膜、ペプチドグリカン、および外膜の順の3層構造を有している。すなわち、外膜の最も外側であって、グラム陰性菌が外界と接する表面にリポ多糖が存在する。
【0024】
リポ多糖は、疎水性の脂質部分を外膜脂質二重層に埋め込み、親水性の多糖部分を菌体外に突き出した形で存在している。
【0025】
リポ多糖に含まれる糖鎖は特定の抗体に対して抗原として認識される。特定の抗体としては、たとえばポリクローナル抗体が挙げられる。ポリクローナル抗体は、免疫したウサギ、ラット、マウス、モルモットなどの動物から回収した血清を精製することで得られる。
【0026】
そこで、本実施の形態にかかる分離装置では、グラム陰性菌を含んだ試料液中にポリクローナル抗体などの抗体を混入して試料液中のグラム陰性菌を抗原抗体反応を利用して抗体に吸着させることで、他の菌などから分離して捕集する。
【0027】
<システム構成>
図2は、本実施の形態にかかる捕集システムの構成の具体例、および該捕集システムに含まれる分離装置500の構成の具体例を示す図である。
【0028】
図2を参照して、本実施の形態にかかる捕集システムは、捕集装置100と分離装置500とを含み、分離装置500で空気中の粒子からグラム陰性菌を分離した後、捕集装置100でグラム陰性菌を捕集する。
【0029】
<分離装置の説明>
さらに図2を参照して、分離装置500は、装置全体を制御するための制御装置50と、制御装置50で実行されるプログラムを記憶するためのメモリ51と、動作開始などの指示入力を行なうための入力部52と、分離用のチェンバ53と、緩衝液や洗浄液などを保持するためのチェンバ54と、ファン55と、エア管56と、チェンバ54からチェンバ53に液体を流入させるための流路管57と、チェンバ53から廃液を排出させるための流路管58と、チェンバ53から捕集装置100に液体を流入させるための流路管59と、を含む。
【0030】
制御装置50が入力部52からの操作信号の入力を受け付けると、制御装置50内の図示しないCPU(Central Processing Unit)がメモリ51に記憶されるプログラムを読み出して実行し、その実行に伴って各部に対して制御信号を出力する。
【0031】
エア管56は、一方端をチェンバ53内に位置させ、他端をチェンバ53外に位置させるように配置される。
【0032】
ファン55はエア管56の途中に設置され、稼動することで、チェンバ53外に位置する一端からチェンバ53内に位置する他端に向けて気流が発生する。ファン55の稼動は制御装置50からの制御信号によって制御される。
【0033】
流路管57,58,59には、それぞれ、バルブ57A,58A,59Aが設けられ、その開閉が制御装置50からの制御信号によって制御される。
【0034】
さらに、図2に示される例では、チェンバ53と流路管58との間にフィルタ58Bが設けられる。
【0035】
一例として、図2では、チェンバ54がチェンバ53の上方に設置される例が示されている。これにより、バルブ57Aが開状態となることで、チェンバ54内の液体が流路管57内を通ってチェンバ53に導入される。
【0036】
たとえば、チェンバ54からチェンバ53に向かう方向に流路管57内の液体を移動させるためのポンプなどの導入機構が備えられる場合には、これらチェンバの位置関係は図2の例に限定されない。
【0037】
また、一例として、図2では、チェンバ53が捕集装置100の上方に設置される例が示されている。これにより、バルブ58Aが開状態となり、かつバルブ59Aが閉状態なることで、チェンバ53内の液体が流路管58内を通って捕集装置100に導入される。なお、チェンバ53内の液体が流路管58内を通って捕集装置100に移動する際、チェンバ53と流路管58との間に設けられたフィルタ58Bを通り抜けることになる。
【0038】
チェンバ53と捕集装置100との位置関係についても、たとえば、チェンバ53から捕集装置100チェンバ54に向かう方向に流路管58内の液体を移動させるためのポンプなどの導入機構が備えられる場合には、その位置関係は図2の例に限定されない。
【0039】
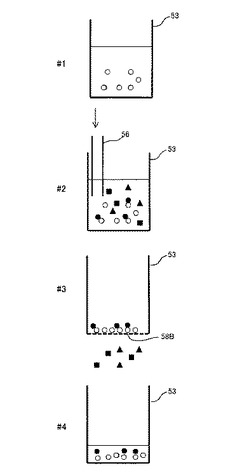
図3は、分離装置500での分離方法を説明するための概略図である。
図3を参照して、分離装置500で分離動作を行なう第1段階(#1)として、チェンバ53内に、水面がエア管56の先端を越える位置までバッファ液を満たし、その中にグラム陰性菌と特異的に反応する、ポリクロール抗体やモノクロール抗体などの抗体を表面に修飾させた個体担体を分散させる。
【0040】
ここでのバッファ液は特定の液体に限定されず、純水、緩衝液、マニトールなどの化合物を所定濃度含む水溶液等、どのような液体であってもよい。
【0041】
個体担体は不溶性担体であって、たとえばビーズ等の、ガラス、プラスチック、ゴムなどからなる微粒子が該当する。ここで用いられるビーズ等の微粒子である個体担体は、その径がフィルタ58Bの孔径よりも大きいものであればよい。図3において、個体担体は白丸で表わされている。
【0042】
第2段階(#2)として、エア管56のバッファ液面下にある端部とは逆の端部から、バッファ液に外気を導入する。これにより、チェンバ53内のバッファ液内に外気中の浮遊粒子が取り込まれる。図3において、チェンバ53内のバッファ液内に取り込まれた粒子は塗りつぶし丸、三角、および四角で表わされ、その内の黒丸がグラム陰性菌を表わしている。
【0043】
バッファ液内に取り込まれたグラム陰性菌は、バッファ液内の個体担体表面に修飾された抗体と反応する。グラム陰性菌は、その表面構造の違いからグラム陽性菌と比較して格段に親水性が高い。そのため、グラム陰性菌のみが抗体と結合し、その結果、個体担体表面にトラップ(吸着)する。
【0044】
第3段階(#3)として、チェンバ53内のバッファ液を排出する。このとき、バッファ液はフィルタ58Bを通って流路管58内へ流れ込み、そのまま排出される。そのため、フィルタ58Bの孔よりもサイズの大きい個体担体は、その表面にグラム陰性菌がトラップした状態でチェンバ53内に残留し、グラム陽性菌等の他の粒子は廃液であるバッファ液と共にチェンバ53外に排出される。すなわち、この状態で、第2段階でバッファ液に取り込まれた粒子からグラム陰性菌が分離される。
【0045】
第4段階(#4)として、チェンバ53にチェンバ54から解離液を導入する。解離液とは、抗原抗体反応によるグラム陰性菌と抗体との結合を解離させるための溶液であって、通常、酢酸溶液や塩酸溶液などの酸性溶液が用いられる。
【0046】
第4段階では、第1段階でチェンバ53内に満たされたバッファ液よりも少ない量の解離液をチェンバ53内に導入する。これにより、第3段階でチェンバ53内に残留した個体担体が解離液内で解離し、グラム陰性菌の溶液中の濃度が第2段階での濃度よりも濃縮される。
【0047】
なお、この例では、チェンバ53の流路管58への排出口にフィルタ58Bが設けられ、フィルタ58Bを利用してグラム陰性菌がトラップした個体担体を分離するものとしているが、分離方法はこの方法に限定されない。他の方法として、いわゆる磁気分離と呼ばれる方法を利用したものであってもよい。すなわち、個体担体として酸化鉄などの磁気の影響を受ける物質を含んだ微粒子を利用し、磁力でグラム陰性菌がトラップした個体担体を分離するようにしてもよい。
【0048】
<捕集装置の説明>
図4は、捕集装置100の構成の具体例を示す図である。
【0049】
ここでは、一例として、捕集装置100が誘電泳動を利用して、溶液中のグラム陰性菌を捕集するものであるとして説明する。しかしながら、捕集装置100での捕集原理は誘電泳動を利用するものに限定されず、他の方法であってもよい。他の方法として、たとえば、グラム陰性菌と個体担体との比重の差を利用した遠心分離を行なうことでグラム陰性菌を捕集する方法などが挙げられる。
【0050】
図4を参照して、捕集装置100は、装置全体を制御するための制御装置10と、制御装置10で実行されるプログラムを記憶するためのメモリ11と、流路管59の分離装置500側の端部と逆側の端部側に配置される、誘電泳動に適した液体を保持するためのチェンバ16とを含む。
【0051】
制御装置10は分離装置500の制御装置50と電気的に接続され、制御装置50からの分離動作の終了を通知する信号の入力を受け付ける。該操作信号を受け付けると、制御装置10内の図示しないCPUがメモリ11に記憶されるプログラムを読み出して実行し、その実行に伴って各部に対して制御信号を出力する。
【0052】
チェンバ16内部には、複数の貫通孔20が削孔された基板15が設けられる。基板15の表面には誘電泳動用の電極14が設けられる。
【0053】
チェンバ16の、流路管59と反対側の面(図では下面)に排出孔17が設けられる。基板15と排出孔17との間には空間が設けられ、基板15が排出孔17の備えられた側のチェンバ16の内面に対して壁31で支持されてもよい。
【0054】
図5は、基板15の排出孔17側に設けられる流路の1つの具体例を示す図である。
図5を参照して、壁31は基板15に設けられた貫通孔20と接続され、貫通孔20から排出孔17へ向けてらせん状に形成されたらせん状流路21を有してもよい。
【0055】
図6は、基板15の構成の1つの具体例を示す図である。
図6を参照して、基板15の流路管59に近い側の面(図では上面)には、複数の円形の貫通孔20と、電極端子35,36を有した櫛型の1対の電極14とが形成される。貫通孔20の形状は円形には限定されず、基板15を貫通して、液体を通すことができれば他の形状であってもよい。また、その数は1つまたは複数のいずれでもよい。また、貫通孔20の位置および配置は、後述するように、チェンバ16内の基板15の上にある液体が排出孔17を通って流れた場合に、電極14の表面を流れるか、電極14表面に衝突して流れるように形成されれば、特定の位置および配置に限定されない。
【0056】
さらに図4を参照して、排出孔17には、流路管4,5が接続されている。流路管4の排出孔17近傍にはバルブ22Aが設けられ、流路管5の排出孔17近傍にはバルブ22Bが設けられている。バルブ22A,22Bの開閉は制御装置10からの制御信号によって制御される。
【0057】
流路管4には、循環用の機構として、ポンプ7およびフィルタ12が、チェンバ16から排出孔17へ向かう方向にその順で配されている。ポンプ7の稼動も、制御装置10からの制御信号によって制御される。
【0058】
誘電泳動用の電極14としては櫛型電極が一般に提案されているが、従来提案されているものをそのまま使用できる。また、図6では電極14が一対の櫛型電極で形成される例が示されているが、基板15表面に複数対形成されてもよい。後述するように、複数対形成されることは、液体中の微生物を短時間でより多く電極付近に集めることが可能になるので利点がある。
【0059】
捕集装置100では、誘電泳動の原理を利用して、分離装置500から流路管59を通って導入されたグラム陰性菌を含んだ液中のグラム陰性菌を電極に付着させる。ここで利用される誘電泳動とは、生物由来の粒子であるグラム陰性菌と媒質(ここでは水等)との誘電率などの電気的な性質の差異を利用し、生物由来の粒子を電極に付着させたり乖離させたりする現象を指す。
【0060】
詳しくは、グラム陰性菌を含む液体中に交流の電界を発生させることでグラム陰性菌内部がプラスとマイナスとに分極する。特定の周波数帯とすることによって細胞膜の破損していない正常なグラム陰性菌(生菌)のみ強電場側に引き寄せられ(正の誘電泳動)、破損したグラム陰性菌(死菌または損傷菌)は生菌と誘電率が異なるために反発する(負の誘電泳動)、という現象が起きる。
【0061】
捕集装置100では、この現象を利用して所定の電圧を印加した電極14に液体中のグラム陰性菌を付着させた上で液体を排出して、液体中のグラム陰性菌を濃縮することでグラム陰性菌を捕集する。上記のように、生菌と死菌または損傷菌とが分離できる周波数を用いた場合は、グラム陰性菌のうちの、さらに生菌のみまたは死菌または損傷菌のみを捕集することができる。また、生菌と死菌または損傷菌ともに電極に引き寄せられる周波数を用いた場合は、両方のグラム陰性菌が捕集できる。
【0062】
捕集装置100では、バルブ22Bは閉塞したままでバルブ22Aのみ開放してポンプ7を稼動させることでチェンバ16内から流路管4を通る流路で循環させつつ、電極14(図6の例では電極端子35,36)に所定の周波数の電圧が印加されることで、誘電泳動が行なわれる。液体の循環に伴って液体中のグラム陰性菌が順次電極14付近に接近するので、電極14表面に形成される誘電泳動力により液体中のグラム陰性菌が順次電極14表面に付着する。これにより、効率的に電極14表面にグラム陰性菌が捕集される。
【0063】
図7は、電極14表面に付着したグラム陰性菌の状態を表わした図である。図7に示されるように、液体中のグラム陰性菌は、電極14の間に鎖状に付着する。
【0064】
<動作概要>
図8は、本実施の形態にかかる捕集システムでの捕集動作の流れの概要を表わした図である。
【0065】
図8を参照して、まず、分離動作として、ステップS1で分離装置500に大気が導入される。これによって、分離装置500のチェンバ53内の、抗体が表面に修飾された個体担体にグラム陰性菌がトラップする。
【0066】
次に、ステップS2でチェンバ53中のバッファ液とグラム陰性菌がトラップした担体とを分離する。この一例として、以降の例ではフィルタ58Bを通して排水する例を用いて説明するが、固体担体が磁力の影響を受ける素材である場合、磁気分離してもよい。
【0067】
次に、ステップS3でチェンバ53に解離液を導入することで、グラム陰性菌と抗体との結合を解離させる。
【0068】
以上で、グラム陰性菌を分離するための分離動作を終了し、ステップS4で分離装置500から捕集装置100に液体を移動させる。
【0069】
そして、ステップS5で捕集装置100において捕集動作が行なわれ、液体中のグラム陰性菌が捕集される。一例として捕集装置100が図4に示された誘電泳動を利用した者である場合、チェンバ16および流路管4内で液体を循環させつつ電極14に電圧を印加することで電極14表面にグラム陰性菌を付着させ、その後、チェンバ16から液体を排出させることで、グラム陰性菌を捕集する。
【0070】
<動作フロー>
図9および図10は、上記捕集動作を行なう際の、制御装置50および制御装置10それぞれでの制御の流れを表わすフローチャートである。これらフローチャートで表わされる制御は、制御装置50および制御装置10それぞれに含まれる図示しないCPUがメモリ51,11に記憶されるプログラムを読み出して実行し、主にCPU上に形成される各機能を発揮させることで実現される。
【0071】
図9を参照して、ステップS101で制御装置50は、初期状態としてすべてのバルブ57A,58A,59Aを閉塞する。
【0072】
入力部52からの捕集開始の指示入力を受け付けると(ステップS103でYES)、ステップS105で制御装置50はファン55を駆動させる。これによって、チェンバ53内の、抗体が表面に修飾された個体担体を含む液体中にエア管56を通って外気が取り込まれ、外気中のグラム陰性菌が個体担体の抗体と結合する。このときの状態が図3の第2段階(#2)で表わされている。
【0073】
予め規定されている駆動量、または指示された駆動量駆動させた後、ファン55の駆動を終了し(ステップS107)、制御装置50はステップS109でバルブ58Aを開放する。これによって、チェンバ53内の液体はフィルタ58Bを通って流路管58内に流れ込み、排出される。チェンバ53内には、フィルタ58Bの孔よりもサイズの大きな個体担体が残留することによって、その表面に付着したグラム陰性菌が残留し、グラム陽性菌が排出される。このときの状態が図3の第3段階(#3)で表わされている。
【0074】
ステップS111で制御装置50はバルブ58Aを閉塞した後にバルブ57Aを開放する。これによって、チェンバ54内の解離液が流路管57を通ってチェンバ53に導入される。チェンバ53に残留していたグラム陰性菌は、解離液によって抗体との結合から解離する。この状態が図3の第4段階(#4)で表わされている。
【0075】
ステップS113で制御装置50は、バルブ59Aを開放する。これによって、チェンバ53内の液体は流路管59を通って捕集装置100のチェンバ16に移動する。この液中では、グラム陰性菌が抗体から解離した状態で存在している。
【0076】
なお、このとき、ステップS115で制御装置50は、捕集装置100の制御装置10に対して、分離動作の終了を通知する信号を出力し、一連の動作を終了する。
【0077】
図10を参照して、ステップS201で制御装置10は、初期状態としてすべてのバルブ22A,22Bを閉塞する。
【0078】
分離装置500の制御装置50からの、分離動作終了の通知を受け付けると(ステップS203でYES)、制御装置10はステップS205でバルブ22Aを開放して、ステップS207でポンプを駆動し、ステップS209で電極14に所定電圧を印加する。これによって、チェンバ16および流路管4内をグラム陰性菌を含んだ液体が循環し、電極14付近を通過する。そして、電極14に形成される誘電泳動力によりグラム陰性菌が電極14表面に付着する。
【0079】
制御装置10は予め規定した時間が経過すると、ステップS211でポンプの駆動を終了し、電極14への印加を終了する。そして、ステップS213でバルブ22Bを開放する。これによって、チェンバ16内の液体が廃液として流路管5を通って排出される。
【0080】
<実施の形態の効果>
捕集システムが上述のように構成され、上述のように動作することで、分離装置500において精度よくグラム陰性菌がグラム陽性菌等から分離され、グラム陰性菌を高濃度で含む液体が得られる。
【0081】
さらに、分離装置500では抗原抗体反応を利用してグラム陰性菌を分離するため、試料とする外気中のグラム陰性菌の静止状態を維持したまま分離することができる。
【0082】
また、捕集装置100が一例として上述のように誘電泳動を利用したものである場合、効率的に短時間でグラム陽性菌が捕集できると共に、その生死状態を維持したまま捕集することができる。
【0083】
従って、これら装置を含む捕集システムでは、試料とする外気中からグラム陰性菌を精度よく、またその生死状態を維持したまま捕集することができる。
【0084】
今回開示された実施の形態はすべての点で例示であって制限的なものではないと考えられるべきである。本発明の範囲は上記した説明ではなくて特許請求の範囲によって示され、特許請求の範囲と均等の意味および範囲内でのすべての変更が含まれることが意図される。
【符号の説明】
【0085】
4,5,57,58,59 流路管、7 ポンプ、10,50 制御装置、11,51 メモリ、12,58B フィルタ、14 電極、15 基板、16,53,54 チェンバ、17 排出孔、20 貫通孔、21 らせん状流路、22A,22B,57A,58A,59A バルブ、31 壁、35,36 電極端子、52 入力部、55 ファン、56 エア管、100 捕集装置、500 分離装置。
【技術分野】
【0001】
この発明は分離装置および分離方法に関し、特に、グラム陰性菌を分離するための分離装置および分離方法に関する。
【背景技術】
【0002】
菌類は、その構造から大きく分けてグラム陽性菌とグラム陰性菌とに分類され、一般的に、グラム陰性菌の方が毒性が高いとされている。そのため、これらの菌種を判別することは重要である。
【0003】
従来、菌類を測定する方法として、エアサンプラによって捕集した菌類を培養する方法が代表的なものとして挙げられる。しかしながら、この手法では測定に数日間を要し、また生菌のみしか検出できない。
【0004】
生物発光を利用した菌検出方法は、迅速であるが、菌由来以外のATP(アデノシン三リン酸)が存在した場合、正確な測定が行なうことができない。その結果、グラム陽性菌とグラム陰性菌との区別もできない。
【0005】
このような問題を解消するため、たとえば特開2007−121282号公報(以下、特許文献1)は、グラム陽性菌表層に結合するたんぱく質を用いた判別方法を開示している。詳しくは、特許文献1に開示の判別方法は、細菌の細胞壁に結合するたんぱく質とレポーターたんぱく質との融合たんぱく質を用い、グラム陰性細菌の外膜の透過性亢進処理の有無により、グラム陽性細菌およびグラム陰性細菌の検出、または、グラム陽性細菌のみの検出を行なうものである。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2007−121282号公報
【発明の概要】
【発明が解決しようとする課題】
【0007】
しかしながら、特許文献1に開示されている方法でグラム陰性菌を検出しようとした場合、上述のように特許文献1の方法では外膜の透過性亢進処理を行なうため、検出されたグラム陰性菌は死菌となる可能性が高い。つまり、たとえば検出後の実験等に生菌として用いるなどの用途でグラム陰性菌を検出しようとしても、特許文献1の方法を利用すると試料中の菌の生死状態を維持したままグラム陰性菌が検出されない場合がある、という問題がある。
【0008】
また、他の問題として、グラム陰性菌を識別/計測するためには、全細菌からグラム陽性菌を差し引く必要がある。そのため、全細菌とグラム陽性菌とのそれぞれを計測するために2つの試料が必須となる。ところが、それら2つの試料中に細菌数の偏りが有ると、グラム陰性菌の検出が精度よく検出されない、という問題もある。
【0009】
本発明はこのような問題に鑑みてなされたものであって、精度よく、また試料中の生死状態を維持したままグラム陰性菌を全細菌から分離して検出することのできる分離装置および分離方法を提供することを目的としている。
【課題を解決するための手段】
【0010】
上記目的を達成するために、本発明のある局面に従うと、分離装置はグラム陰性菌を分離するための分離装置であって、チェンバと、チェンバ内に外気を導入するための第1の機構と、チェンバ内にグラム陰性菌のトラップした微粒子を残留させて液体を排出するための第2の機構と、チェンバ内に解離液を導入するための第3の機構と、それら機構を制御するための制御装置とを備える。制御装置は第1〜第3の機構を制御することで、チェンバ内の、グラム陰性菌と特異的に反応する抗体を表面に修飾した微粒子を含む液体に、外気を導入する動作と、チェンバ内にグラム陰性菌のトラップした微粒子を残留させて、液体を排出する動作と、グラム陰性菌のトラップした微粒子が残留したチェンバ内に解離液を導入し、微粒子からグラム陰性菌を解離させる動作とを実行する。
【0011】
好ましくは、第2の機構は、チェンバ内の液体を微粒子よりも孔のサイズの小さいフィルタを通してチェンバ外に排出するための機構である。
【0012】
好ましくは、微粒子は磁気の影響を受ける素材を含み、第2の機構は、磁気分離によってチェンバ内の液体からグラム陰性菌のトラップした微粒子を分離するための機構である。
【0013】
好ましくは、分離装置は、液体に含まれる生物由来の粒子を捕集するための捕集装置に解離液が導入された後のチェンバ内の液体を導入するための第4の機構をさらに備える。
【0014】
より好ましくは、捕集装置は、誘電泳動を利用して液体中の、微粒子から解離したグラム陰性菌を電極上に付着させることで、グラム陰性菌を捕集する。
【0015】
本発明の他の局面に従うと、分離方法はグラム陰性菌を分離する方法であって、外気を、グラム陰性菌と特異的に反応する抗体を表面に修飾した微粒子を含む液体に取り込むステップと、液体とグラム陰性菌のトラップした微粒子とを分離し、液体を排出するステップと、グラム陰性菌のトラップした微粒子を解離液に取り込むことで、微粒子からグラム陰性菌を解離させるステップとを備える。
【発明の効果】
【0016】
この発明によると、精度よく、また試料中の生死状態を維持したままグラム陰性菌を全細菌から分離して検出することができる。
【図面の簡単な説明】
【0017】
【図1】グラム陽性菌の細胞壁の構造(A)とグラム陰性菌の細胞壁の構造(B)との概略を表わした図である。
【図2】実施の形態にかかる捕集システムの構成の具体例、および該捕集システムに含まれる分離装置の構成の具体例を示す図である。
【図3】分離装置での分離方法を説明するための概略図である。
【図4】実施の形態にかかる捕集システムに含まれる捕集装置の構成の具体例を示す図である。
【図5】捕集装置の基板の排出孔側に設けられる流路の1つの具体例を示す図である。
【図6】捕集装置の基板の構成の1つの具体例を示す図である。
【図7】捕集装置の電極表面に付着したグラム陰性菌の状態を表わした図である。
【図8】捕集システムでの捕集動作の流れの概要を表わした図である。
【図9】制御装置50での制御の流れを表わすフローチャートである。
【図10】制御装置10での制御の流れを表わすフローチャートである。
【発明を実施するための形態】
【0018】
以下に、図面を参照しつつ、本発明の実施の形態について説明する。以下の説明では、同一の部品および構成要素には同一の符号を付してある。それらの名称および機能も同じである。
【0019】
<分離の原理>
実施の形態にかかる分離装置は、グラム陽性菌とグラム陰性菌との細胞壁の構造の差異による細胞表面の性質の差異に着目し、抗原抗体反応を利用してグラム陽性菌を分離する。なお、代表的なグラム陽性菌としては黄色ブドウ球菌やボツリヌス菌などが挙げられ、代表的なグラム陰性菌としては大腸菌やサルモネラ菌などが挙げられる。
【0020】
図1は、グラム陽性菌の細胞壁の構造(A)とグラム陰性菌の細胞壁の構造(B)との概略を表わした図である。
【0021】
図1を参照して、大きな差異として、グラム陽性菌はグラム陰性菌と比較してペプチドグルカンが厚く、そのペプチドグルカンにタイコ酸、蛋白、多糖が存在している。
【0022】
一方、グラム陰性菌はグラム陽性菌と比較してペプチドグルカンが薄く、そのペプチドグルカンの外側に外膜が存在する。外膜は、糖鎖からなるリポ多糖(LPS)を含む。リポ多糖(LPS)は内毒素(エンドトキシン)であり、グラム陰性菌の菌体成分である。
【0023】
グラム陰性菌の表層は、菌の内側から細胞質膜、ペプチドグリカン、および外膜の順の3層構造を有している。すなわち、外膜の最も外側であって、グラム陰性菌が外界と接する表面にリポ多糖が存在する。
【0024】
リポ多糖は、疎水性の脂質部分を外膜脂質二重層に埋め込み、親水性の多糖部分を菌体外に突き出した形で存在している。
【0025】
リポ多糖に含まれる糖鎖は特定の抗体に対して抗原として認識される。特定の抗体としては、たとえばポリクローナル抗体が挙げられる。ポリクローナル抗体は、免疫したウサギ、ラット、マウス、モルモットなどの動物から回収した血清を精製することで得られる。
【0026】
そこで、本実施の形態にかかる分離装置では、グラム陰性菌を含んだ試料液中にポリクローナル抗体などの抗体を混入して試料液中のグラム陰性菌を抗原抗体反応を利用して抗体に吸着させることで、他の菌などから分離して捕集する。
【0027】
<システム構成>
図2は、本実施の形態にかかる捕集システムの構成の具体例、および該捕集システムに含まれる分離装置500の構成の具体例を示す図である。
【0028】
図2を参照して、本実施の形態にかかる捕集システムは、捕集装置100と分離装置500とを含み、分離装置500で空気中の粒子からグラム陰性菌を分離した後、捕集装置100でグラム陰性菌を捕集する。
【0029】
<分離装置の説明>
さらに図2を参照して、分離装置500は、装置全体を制御するための制御装置50と、制御装置50で実行されるプログラムを記憶するためのメモリ51と、動作開始などの指示入力を行なうための入力部52と、分離用のチェンバ53と、緩衝液や洗浄液などを保持するためのチェンバ54と、ファン55と、エア管56と、チェンバ54からチェンバ53に液体を流入させるための流路管57と、チェンバ53から廃液を排出させるための流路管58と、チェンバ53から捕集装置100に液体を流入させるための流路管59と、を含む。
【0030】
制御装置50が入力部52からの操作信号の入力を受け付けると、制御装置50内の図示しないCPU(Central Processing Unit)がメモリ51に記憶されるプログラムを読み出して実行し、その実行に伴って各部に対して制御信号を出力する。
【0031】
エア管56は、一方端をチェンバ53内に位置させ、他端をチェンバ53外に位置させるように配置される。
【0032】
ファン55はエア管56の途中に設置され、稼動することで、チェンバ53外に位置する一端からチェンバ53内に位置する他端に向けて気流が発生する。ファン55の稼動は制御装置50からの制御信号によって制御される。
【0033】
流路管57,58,59には、それぞれ、バルブ57A,58A,59Aが設けられ、その開閉が制御装置50からの制御信号によって制御される。
【0034】
さらに、図2に示される例では、チェンバ53と流路管58との間にフィルタ58Bが設けられる。
【0035】
一例として、図2では、チェンバ54がチェンバ53の上方に設置される例が示されている。これにより、バルブ57Aが開状態となることで、チェンバ54内の液体が流路管57内を通ってチェンバ53に導入される。
【0036】
たとえば、チェンバ54からチェンバ53に向かう方向に流路管57内の液体を移動させるためのポンプなどの導入機構が備えられる場合には、これらチェンバの位置関係は図2の例に限定されない。
【0037】
また、一例として、図2では、チェンバ53が捕集装置100の上方に設置される例が示されている。これにより、バルブ58Aが開状態となり、かつバルブ59Aが閉状態なることで、チェンバ53内の液体が流路管58内を通って捕集装置100に導入される。なお、チェンバ53内の液体が流路管58内を通って捕集装置100に移動する際、チェンバ53と流路管58との間に設けられたフィルタ58Bを通り抜けることになる。
【0038】
チェンバ53と捕集装置100との位置関係についても、たとえば、チェンバ53から捕集装置100チェンバ54に向かう方向に流路管58内の液体を移動させるためのポンプなどの導入機構が備えられる場合には、その位置関係は図2の例に限定されない。
【0039】
図3は、分離装置500での分離方法を説明するための概略図である。
図3を参照して、分離装置500で分離動作を行なう第1段階(#1)として、チェンバ53内に、水面がエア管56の先端を越える位置までバッファ液を満たし、その中にグラム陰性菌と特異的に反応する、ポリクロール抗体やモノクロール抗体などの抗体を表面に修飾させた個体担体を分散させる。
【0040】
ここでのバッファ液は特定の液体に限定されず、純水、緩衝液、マニトールなどの化合物を所定濃度含む水溶液等、どのような液体であってもよい。
【0041】
個体担体は不溶性担体であって、たとえばビーズ等の、ガラス、プラスチック、ゴムなどからなる微粒子が該当する。ここで用いられるビーズ等の微粒子である個体担体は、その径がフィルタ58Bの孔径よりも大きいものであればよい。図3において、個体担体は白丸で表わされている。
【0042】
第2段階(#2)として、エア管56のバッファ液面下にある端部とは逆の端部から、バッファ液に外気を導入する。これにより、チェンバ53内のバッファ液内に外気中の浮遊粒子が取り込まれる。図3において、チェンバ53内のバッファ液内に取り込まれた粒子は塗りつぶし丸、三角、および四角で表わされ、その内の黒丸がグラム陰性菌を表わしている。
【0043】
バッファ液内に取り込まれたグラム陰性菌は、バッファ液内の個体担体表面に修飾された抗体と反応する。グラム陰性菌は、その表面構造の違いからグラム陽性菌と比較して格段に親水性が高い。そのため、グラム陰性菌のみが抗体と結合し、その結果、個体担体表面にトラップ(吸着)する。
【0044】
第3段階(#3)として、チェンバ53内のバッファ液を排出する。このとき、バッファ液はフィルタ58Bを通って流路管58内へ流れ込み、そのまま排出される。そのため、フィルタ58Bの孔よりもサイズの大きい個体担体は、その表面にグラム陰性菌がトラップした状態でチェンバ53内に残留し、グラム陽性菌等の他の粒子は廃液であるバッファ液と共にチェンバ53外に排出される。すなわち、この状態で、第2段階でバッファ液に取り込まれた粒子からグラム陰性菌が分離される。
【0045】
第4段階(#4)として、チェンバ53にチェンバ54から解離液を導入する。解離液とは、抗原抗体反応によるグラム陰性菌と抗体との結合を解離させるための溶液であって、通常、酢酸溶液や塩酸溶液などの酸性溶液が用いられる。
【0046】
第4段階では、第1段階でチェンバ53内に満たされたバッファ液よりも少ない量の解離液をチェンバ53内に導入する。これにより、第3段階でチェンバ53内に残留した個体担体が解離液内で解離し、グラム陰性菌の溶液中の濃度が第2段階での濃度よりも濃縮される。
【0047】
なお、この例では、チェンバ53の流路管58への排出口にフィルタ58Bが設けられ、フィルタ58Bを利用してグラム陰性菌がトラップした個体担体を分離するものとしているが、分離方法はこの方法に限定されない。他の方法として、いわゆる磁気分離と呼ばれる方法を利用したものであってもよい。すなわち、個体担体として酸化鉄などの磁気の影響を受ける物質を含んだ微粒子を利用し、磁力でグラム陰性菌がトラップした個体担体を分離するようにしてもよい。
【0048】
<捕集装置の説明>
図4は、捕集装置100の構成の具体例を示す図である。
【0049】
ここでは、一例として、捕集装置100が誘電泳動を利用して、溶液中のグラム陰性菌を捕集するものであるとして説明する。しかしながら、捕集装置100での捕集原理は誘電泳動を利用するものに限定されず、他の方法であってもよい。他の方法として、たとえば、グラム陰性菌と個体担体との比重の差を利用した遠心分離を行なうことでグラム陰性菌を捕集する方法などが挙げられる。
【0050】
図4を参照して、捕集装置100は、装置全体を制御するための制御装置10と、制御装置10で実行されるプログラムを記憶するためのメモリ11と、流路管59の分離装置500側の端部と逆側の端部側に配置される、誘電泳動に適した液体を保持するためのチェンバ16とを含む。
【0051】
制御装置10は分離装置500の制御装置50と電気的に接続され、制御装置50からの分離動作の終了を通知する信号の入力を受け付ける。該操作信号を受け付けると、制御装置10内の図示しないCPUがメモリ11に記憶されるプログラムを読み出して実行し、その実行に伴って各部に対して制御信号を出力する。
【0052】
チェンバ16内部には、複数の貫通孔20が削孔された基板15が設けられる。基板15の表面には誘電泳動用の電極14が設けられる。
【0053】
チェンバ16の、流路管59と反対側の面(図では下面)に排出孔17が設けられる。基板15と排出孔17との間には空間が設けられ、基板15が排出孔17の備えられた側のチェンバ16の内面に対して壁31で支持されてもよい。
【0054】
図5は、基板15の排出孔17側に設けられる流路の1つの具体例を示す図である。
図5を参照して、壁31は基板15に設けられた貫通孔20と接続され、貫通孔20から排出孔17へ向けてらせん状に形成されたらせん状流路21を有してもよい。
【0055】
図6は、基板15の構成の1つの具体例を示す図である。
図6を参照して、基板15の流路管59に近い側の面(図では上面)には、複数の円形の貫通孔20と、電極端子35,36を有した櫛型の1対の電極14とが形成される。貫通孔20の形状は円形には限定されず、基板15を貫通して、液体を通すことができれば他の形状であってもよい。また、その数は1つまたは複数のいずれでもよい。また、貫通孔20の位置および配置は、後述するように、チェンバ16内の基板15の上にある液体が排出孔17を通って流れた場合に、電極14の表面を流れるか、電極14表面に衝突して流れるように形成されれば、特定の位置および配置に限定されない。
【0056】
さらに図4を参照して、排出孔17には、流路管4,5が接続されている。流路管4の排出孔17近傍にはバルブ22Aが設けられ、流路管5の排出孔17近傍にはバルブ22Bが設けられている。バルブ22A,22Bの開閉は制御装置10からの制御信号によって制御される。
【0057】
流路管4には、循環用の機構として、ポンプ7およびフィルタ12が、チェンバ16から排出孔17へ向かう方向にその順で配されている。ポンプ7の稼動も、制御装置10からの制御信号によって制御される。
【0058】
誘電泳動用の電極14としては櫛型電極が一般に提案されているが、従来提案されているものをそのまま使用できる。また、図6では電極14が一対の櫛型電極で形成される例が示されているが、基板15表面に複数対形成されてもよい。後述するように、複数対形成されることは、液体中の微生物を短時間でより多く電極付近に集めることが可能になるので利点がある。
【0059】
捕集装置100では、誘電泳動の原理を利用して、分離装置500から流路管59を通って導入されたグラム陰性菌を含んだ液中のグラム陰性菌を電極に付着させる。ここで利用される誘電泳動とは、生物由来の粒子であるグラム陰性菌と媒質(ここでは水等)との誘電率などの電気的な性質の差異を利用し、生物由来の粒子を電極に付着させたり乖離させたりする現象を指す。
【0060】
詳しくは、グラム陰性菌を含む液体中に交流の電界を発生させることでグラム陰性菌内部がプラスとマイナスとに分極する。特定の周波数帯とすることによって細胞膜の破損していない正常なグラム陰性菌(生菌)のみ強電場側に引き寄せられ(正の誘電泳動)、破損したグラム陰性菌(死菌または損傷菌)は生菌と誘電率が異なるために反発する(負の誘電泳動)、という現象が起きる。
【0061】
捕集装置100では、この現象を利用して所定の電圧を印加した電極14に液体中のグラム陰性菌を付着させた上で液体を排出して、液体中のグラム陰性菌を濃縮することでグラム陰性菌を捕集する。上記のように、生菌と死菌または損傷菌とが分離できる周波数を用いた場合は、グラム陰性菌のうちの、さらに生菌のみまたは死菌または損傷菌のみを捕集することができる。また、生菌と死菌または損傷菌ともに電極に引き寄せられる周波数を用いた場合は、両方のグラム陰性菌が捕集できる。
【0062】
捕集装置100では、バルブ22Bは閉塞したままでバルブ22Aのみ開放してポンプ7を稼動させることでチェンバ16内から流路管4を通る流路で循環させつつ、電極14(図6の例では電極端子35,36)に所定の周波数の電圧が印加されることで、誘電泳動が行なわれる。液体の循環に伴って液体中のグラム陰性菌が順次電極14付近に接近するので、電極14表面に形成される誘電泳動力により液体中のグラム陰性菌が順次電極14表面に付着する。これにより、効率的に電極14表面にグラム陰性菌が捕集される。
【0063】
図7は、電極14表面に付着したグラム陰性菌の状態を表わした図である。図7に示されるように、液体中のグラム陰性菌は、電極14の間に鎖状に付着する。
【0064】
<動作概要>
図8は、本実施の形態にかかる捕集システムでの捕集動作の流れの概要を表わした図である。
【0065】
図8を参照して、まず、分離動作として、ステップS1で分離装置500に大気が導入される。これによって、分離装置500のチェンバ53内の、抗体が表面に修飾された個体担体にグラム陰性菌がトラップする。
【0066】
次に、ステップS2でチェンバ53中のバッファ液とグラム陰性菌がトラップした担体とを分離する。この一例として、以降の例ではフィルタ58Bを通して排水する例を用いて説明するが、固体担体が磁力の影響を受ける素材である場合、磁気分離してもよい。
【0067】
次に、ステップS3でチェンバ53に解離液を導入することで、グラム陰性菌と抗体との結合を解離させる。
【0068】
以上で、グラム陰性菌を分離するための分離動作を終了し、ステップS4で分離装置500から捕集装置100に液体を移動させる。
【0069】
そして、ステップS5で捕集装置100において捕集動作が行なわれ、液体中のグラム陰性菌が捕集される。一例として捕集装置100が図4に示された誘電泳動を利用した者である場合、チェンバ16および流路管4内で液体を循環させつつ電極14に電圧を印加することで電極14表面にグラム陰性菌を付着させ、その後、チェンバ16から液体を排出させることで、グラム陰性菌を捕集する。
【0070】
<動作フロー>
図9および図10は、上記捕集動作を行なう際の、制御装置50および制御装置10それぞれでの制御の流れを表わすフローチャートである。これらフローチャートで表わされる制御は、制御装置50および制御装置10それぞれに含まれる図示しないCPUがメモリ51,11に記憶されるプログラムを読み出して実行し、主にCPU上に形成される各機能を発揮させることで実現される。
【0071】
図9を参照して、ステップS101で制御装置50は、初期状態としてすべてのバルブ57A,58A,59Aを閉塞する。
【0072】
入力部52からの捕集開始の指示入力を受け付けると(ステップS103でYES)、ステップS105で制御装置50はファン55を駆動させる。これによって、チェンバ53内の、抗体が表面に修飾された個体担体を含む液体中にエア管56を通って外気が取り込まれ、外気中のグラム陰性菌が個体担体の抗体と結合する。このときの状態が図3の第2段階(#2)で表わされている。
【0073】
予め規定されている駆動量、または指示された駆動量駆動させた後、ファン55の駆動を終了し(ステップS107)、制御装置50はステップS109でバルブ58Aを開放する。これによって、チェンバ53内の液体はフィルタ58Bを通って流路管58内に流れ込み、排出される。チェンバ53内には、フィルタ58Bの孔よりもサイズの大きな個体担体が残留することによって、その表面に付着したグラム陰性菌が残留し、グラム陽性菌が排出される。このときの状態が図3の第3段階(#3)で表わされている。
【0074】
ステップS111で制御装置50はバルブ58Aを閉塞した後にバルブ57Aを開放する。これによって、チェンバ54内の解離液が流路管57を通ってチェンバ53に導入される。チェンバ53に残留していたグラム陰性菌は、解離液によって抗体との結合から解離する。この状態が図3の第4段階(#4)で表わされている。
【0075】
ステップS113で制御装置50は、バルブ59Aを開放する。これによって、チェンバ53内の液体は流路管59を通って捕集装置100のチェンバ16に移動する。この液中では、グラム陰性菌が抗体から解離した状態で存在している。
【0076】
なお、このとき、ステップS115で制御装置50は、捕集装置100の制御装置10に対して、分離動作の終了を通知する信号を出力し、一連の動作を終了する。
【0077】
図10を参照して、ステップS201で制御装置10は、初期状態としてすべてのバルブ22A,22Bを閉塞する。
【0078】
分離装置500の制御装置50からの、分離動作終了の通知を受け付けると(ステップS203でYES)、制御装置10はステップS205でバルブ22Aを開放して、ステップS207でポンプを駆動し、ステップS209で電極14に所定電圧を印加する。これによって、チェンバ16および流路管4内をグラム陰性菌を含んだ液体が循環し、電極14付近を通過する。そして、電極14に形成される誘電泳動力によりグラム陰性菌が電極14表面に付着する。
【0079】
制御装置10は予め規定した時間が経過すると、ステップS211でポンプの駆動を終了し、電極14への印加を終了する。そして、ステップS213でバルブ22Bを開放する。これによって、チェンバ16内の液体が廃液として流路管5を通って排出される。
【0080】
<実施の形態の効果>
捕集システムが上述のように構成され、上述のように動作することで、分離装置500において精度よくグラム陰性菌がグラム陽性菌等から分離され、グラム陰性菌を高濃度で含む液体が得られる。
【0081】
さらに、分離装置500では抗原抗体反応を利用してグラム陰性菌を分離するため、試料とする外気中のグラム陰性菌の静止状態を維持したまま分離することができる。
【0082】
また、捕集装置100が一例として上述のように誘電泳動を利用したものである場合、効率的に短時間でグラム陽性菌が捕集できると共に、その生死状態を維持したまま捕集することができる。
【0083】
従って、これら装置を含む捕集システムでは、試料とする外気中からグラム陰性菌を精度よく、またその生死状態を維持したまま捕集することができる。
【0084】
今回開示された実施の形態はすべての点で例示であって制限的なものではないと考えられるべきである。本発明の範囲は上記した説明ではなくて特許請求の範囲によって示され、特許請求の範囲と均等の意味および範囲内でのすべての変更が含まれることが意図される。
【符号の説明】
【0085】
4,5,57,58,59 流路管、7 ポンプ、10,50 制御装置、11,51 メモリ、12,58B フィルタ、14 電極、15 基板、16,53,54 チェンバ、17 排出孔、20 貫通孔、21 らせん状流路、22A,22B,57A,58A,59A バルブ、31 壁、35,36 電極端子、52 入力部、55 ファン、56 エア管、100 捕集装置、500 分離装置。
【特許請求の範囲】
【請求項1】
グラム陰性菌を分離するための分離装置であって、
チェンバと、
前記チェンバ内に外気を導入するための第1の機構と、
前記チェンバ内に前記グラム陰性菌のトラップした微粒子を残留させて液体を排出するための第2の機構と、
前記チェンバ内に解離液を導入するための第3の機構と、
それら機構を制御するための制御装置とを備え、
前記制御装置は前記第1〜第3の機構を制御することで、
前記チェンバ内の、グラム陰性菌と特異的に反応する抗体を表面に修飾した微粒子を含む液体に、外気を導入する動作と、
前記チェンバ内にグラム陰性菌のトラップした微粒子を残留させて、前記液体を排出する動作と、
前記グラム陰性菌のトラップした微粒子が残留した前記チェンバ内に前記解離液を導入し、前記微粒子からグラム陰性菌を解離させる動作とを実行する、分離装置。
【請求項2】
前記第2の機構は、前記チェンバ内の液体を前記微粒子よりも孔のサイズの小さいフィルタを通して前記チェンバ外に排出するための機構である、請求項1に記載の分離装置。
【請求項3】
前記微粒子は磁気の影響を受ける素材を含み、
前記第2の機構は、磁気分離によって前記チェンバ内の液体から前記グラム陰性菌のトラップした微粒子を分離するための機構である、請求項1に記載の分離装置。
【請求項4】
液体に含まれる生物由来の粒子を捕集するための捕集装置に、前記解離液が導入された後の前記チェンバ内の液体を導入するための第4の機構をさらに備える、請求項1〜3のいずれかに記載の分離装置。
【請求項5】
前記捕集装置は、誘電泳動を利用して前記液体中の、前記微粒子から解離したグラム陰性菌を電極上に付着させることで、グラム陰性菌を捕集する、請求項4に記載の分離装置。
【請求項6】
グラム陰性菌を分離する方法であって、
外気を、グラム陰性菌と特異的に反応する抗体を表面に修飾した微粒子を含む液体に取り込むステップと、
前記液体とグラム陰性菌のトラップした前記微粒子とを分離し、前記液体を排出するステップと、
前記グラム陰性菌のトラップした微粒子を解離液に取り込むことで、前記微粒子からグラム陰性菌を解離させるステップとを備える、分離方法。
【請求項1】
グラム陰性菌を分離するための分離装置であって、
チェンバと、
前記チェンバ内に外気を導入するための第1の機構と、
前記チェンバ内に前記グラム陰性菌のトラップした微粒子を残留させて液体を排出するための第2の機構と、
前記チェンバ内に解離液を導入するための第3の機構と、
それら機構を制御するための制御装置とを備え、
前記制御装置は前記第1〜第3の機構を制御することで、
前記チェンバ内の、グラム陰性菌と特異的に反応する抗体を表面に修飾した微粒子を含む液体に、外気を導入する動作と、
前記チェンバ内にグラム陰性菌のトラップした微粒子を残留させて、前記液体を排出する動作と、
前記グラム陰性菌のトラップした微粒子が残留した前記チェンバ内に前記解離液を導入し、前記微粒子からグラム陰性菌を解離させる動作とを実行する、分離装置。
【請求項2】
前記第2の機構は、前記チェンバ内の液体を前記微粒子よりも孔のサイズの小さいフィルタを通して前記チェンバ外に排出するための機構である、請求項1に記載の分離装置。
【請求項3】
前記微粒子は磁気の影響を受ける素材を含み、
前記第2の機構は、磁気分離によって前記チェンバ内の液体から前記グラム陰性菌のトラップした微粒子を分離するための機構である、請求項1に記載の分離装置。
【請求項4】
液体に含まれる生物由来の粒子を捕集するための捕集装置に、前記解離液が導入された後の前記チェンバ内の液体を導入するための第4の機構をさらに備える、請求項1〜3のいずれかに記載の分離装置。
【請求項5】
前記捕集装置は、誘電泳動を利用して前記液体中の、前記微粒子から解離したグラム陰性菌を電極上に付着させることで、グラム陰性菌を捕集する、請求項4に記載の分離装置。
【請求項6】
グラム陰性菌を分離する方法であって、
外気を、グラム陰性菌と特異的に反応する抗体を表面に修飾した微粒子を含む液体に取り込むステップと、
前記液体とグラム陰性菌のトラップした前記微粒子とを分離し、前記液体を排出するステップと、
前記グラム陰性菌のトラップした微粒子を解離液に取り込むことで、前記微粒子からグラム陰性菌を解離させるステップとを備える、分離方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【公開番号】特開2012−254048(P2012−254048A)
【公開日】平成24年12月27日(2012.12.27)
【国際特許分類】
【出願番号】特願2011−129788(P2011−129788)
【出願日】平成23年6月10日(2011.6.10)
【出願人】(000005049)シャープ株式会社 (33,933)
【Fターム(参考)】
【公開日】平成24年12月27日(2012.12.27)
【国際特許分類】
【出願日】平成23年6月10日(2011.6.10)
【出願人】(000005049)シャープ株式会社 (33,933)
【Fターム(参考)】
[ Back to top ]

