化合物、組成物、製剤、およびそれらの使用
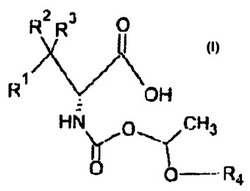
化学式1の化合物を合成、使用する化合物、組成物、方法が開示されている。化学式1の化合物はまた、その塩、多形体、溶媒和物、水和物から構成される。化合物は医薬品組成物として処方することができる。製薬組成物は経口、局所、経粘膜、吸入、標的送達、および徐放性制剤のために処方することができる。このような組成物は銅過負荷に関連する肝性および遺伝性障害を治療するために使用することができる。他の複数の化合物を瞬間的に主張される化合物とともに添加でき、ウィルソン病治療に適した薬品投与として送達することができる。
【発明の詳細な説明】
【技術分野】
【0001】
(関連する出願の相互参照)
当出願は2010年3月5日に提出されたアメリカ合衆国仮特許出願番号61/310719の優先権を主張するものである。当出願はその全開示を参照として組み込むものである。
【0002】
当開示は一般的には化合物とその合成に関連したものである。特に、当開示は哺乳類を薬学的に許容される量の化合物、組成物、製剤、および、化合物のプロドラッグによって治療することに関連するものである。
【背景技術】
【0003】
金属の毒性は必須の金属の過負荷や種しゅの原因で重金属に接触することにより生ずる。大部分の金属は炭素と共有結合し金属−有機化合物を形成することができる。金属や金属化合物は中枢神経系(CNS)、造血系、肝臓、腎臓などの器官の機能に干渉する。(フローラほか2010)。
【0004】
金属の蓄積は肝臓病における多種の機能障害をもたらす。ウィルソン病、ポストシャント脊髄症、肝性脳症、後天性ウィルソン肝脳変性などの肝脳疾患における脳機能障害と神経細胞死をもたらす病態生理学的メカニズムは、肝脳疾患の主要な特徴です。アストロサイト(アルツハイマー病II型アストロサイト)への形態学的変化は、銅、マンガン、鉄等の金属の神経毒性作用が含まれる。肝脳疾患の管理と治療には、キレート療法(ウィルソン病)や肝臓移植などが含まれる。
【0005】
銅蓄積は肝臓、腎臓および眼疾患の多くの機能障害をもたらす。余分な銅はウィルソン病においては実際に角膜全体に堆積される。腎尿細管機能障害はその結果として高カルシウム尿症と高リン尿症をもたらし、腎尿細管機能障害は、腎石灰沈着症を誘発し得る。薬理学的管理としてはペニシラミンとトリエンチンが使用されている。これらの薬剤を使用するうえで長期的な効果があり、以前の技術(ファイファー2007)において議論されてきた。改良された特殊性を持ち毒性の副作用の少ない新しい銅キレート剤と抗がん性メタロドラッグの開発が必要である。
【発明の概要】
【0006】
一実施例として、化学式1(化学式1として表示)により構成される化合物を開示する。
化学式1

【0007】
もうひとつの実施例として、以下のごとく構成される化学式1の一つ以上の化合物、中間体、プロドラッグ、一つ以上の薬学的に許容される媒介物を持つ薬学的に許容される化学式1の化合物の塩、と媒介物または希釈剤が開示される。これら組成物は、肝疾患、障害における銅の保持、およびその合併症に関連した疾患の治療に用いることができる。
【0008】
もうひとつの実施例として、本願の開示は、化合物、化学式1の組成、または、薬学的に許容される塩を含む。
化学式I

ここで、
R1、R2、およびR3の各々は以下を独立して表す:水素、チオール、アルキル、アルキルチオール、アセチルチオール、ジスルフィド基、アシル基、アシルアルキル、アルケニル、アルキルチオアルキル、アルキニル、アルコキシアルコキシアルキル、アラルキル、アリールオキシ、アリールオ−ルキル、シクロアルキル、エーテル、エステル、ヘテロアリール、ヘテロシクリル、低級アルキル基、スルホン、スルホキシド、またはヒドロキシアルキル。
R4は、グアニジン、ヒドラジンの残留物、酸、ピルビン酸の残基、オキサロ酢酸の残留物、トコフェロールの残留物、アスコルビン酸の残基、チアミンの残留物、チオクト酸、チオクト酸の残基、アセチルシステイン残基、α−ケトグルタル酸の残基、ジメルカプロールの残留物は、NO供与体の残留物、グルタチオンの残基、(RS)−2、3ヂサルファニルプロパン−1の残基オール、(R)−2−アセトアミド−3−スルファニルプロパン酸、及び以上のいずれかのアナログの少なくとも1つを表す。
化合物1

ここで、nは0〜8の整数を表し、ここで、R4は、R−(+)−チオクト酸、nは0〜4間の整数である。
【0009】
他の好ましい実施例としては、化学式1は下記の化合物を表わし得る:
化合物1A

ここで:
R1、R2、およびR3の各々は独立して、水素、チオール、アルキル、アルキルチオール、アセチルチオール、ジスルフィド基、アシル基、アシルアルキル、アルケニル、アルキルチオアルキル、アルキニル、アルコキシアルコキシ、アリール、アラルキル、アリール、アリールオ−ルキル、シクロアルキル、エーテル、エステル、ヘテロアリール、ヘテロシクリル、低級アルキル基、スルホン、スルホキシド、またはヒドロキシを表し、
R4はチオクト酸を表し、nは4〜8間の整数を表わす。
【0010】
ひとつの実施例として、R1、R2およびR3は、水素、メチル基、エチル基またはチオールを表し、R4は、チオクト酸の残基、アナログ、誘導体、または代謝産物のR−異性体を表す。
化合物2

【0011】
もうひとつの実施例として、R1、R2およびR3は、水素、メチル基、エチル基またはチオールを表し、R4はRS)−2、3ジサルファニルプロパン−1−オールを表す。
化合物3

【0012】
もうひとつの実施例として、R1、R2およびR3は、水素、メチル基、エチル基またはチオールを表し、R4は、(R)−2−アセトアミド−3−スルファニルプロパン酸を表す。
【0013】
さらに、当開示は下記の組成物を含む実施例を提供する:
a) R−(+)−リポ酸またはチオクト酸
b) 酢酸亜鉛(または)トリエチレンテトラミン、および
c) 化学式1の化合物
化学式1

ここで、
R1、R2、およびR3の各々は独自に、水素、チオール、アルキル、アルキルチオール、アセチルチオール、ジスルフィド基、アシル基、アシルアルキル、アルケニル、アルキルチオアルキル、アルキニル、アルコキシアルコキシ、アリール、アラルキル、アリール、アリールシオ−ルキル、シクロアルキル、エーテル、エステル、ヘテロアリール、ヘテロシクリル、低級アルキル基、スルホン、スルホキシド、またはヒドロキシを表し、
R4は、グアニジン、ヒドラジンの残留物、酸、ピルビン酸の残基、オキサロ酢酸の残留物、トコフェロールの残留物、アスコルビン酸の残基、チアミンの残留物、チオクト酸、チオクト酸の残基、アセチルシステイン残基、α−ケトグルタル酸の残基、ジメルカプロールの残基、ドナーNOの残留物、グルタチオンの残留物および上記のいずれかのアナログの少なくとも1つを表す。
【0014】
さらに、もうひとつの実施例としてここに開示されるのは、薬学的に許容される組成、例えば薬学的に許容される塩、酒石酸塩、エシル酸塩、メシル酸塩、硫酸塩、化学式1の水和物及び塩酸塩(但しこれらに限定されるわけではない)で以下のごとく構成される:
a)R−(+)−リポ酸(または)アセチルシステイン(または)ジメルカ;
b)酢酸亜鉛(または)トリエチレンテトラミン、および
c)化学式1の化合物
化学式1

ここで、R1、R2、およびR3は独自に、水素、チオール、アルキル、アルキルチオール、アセチルチオール、ジスルフィド基、アシル基、アシルアルキル、アルケニル、アルキルチオアルキル、アルキニル、アルコキシアルコキシ、アリール、アラルキル、アリール、アリールシオールキル、シクロアルキル、エーテル、エステル、ヘテロアリール、ヘテロシクリル、低級アルキル基、スルホン、スルホキシド、またはヒドロキシを表し、
R4は、グアニジン、ヒドラジンの残留物、酸、ピルビン酸の残基、オキサロ酢酸の残留物、トコフェロールの残留物、アスコルビン酸の残基、チアミンの残留物、チオクト酸、チオクト酸、アセチルシステイン残基、α−ケトグルタル酸の残基、ジメルカプロールの残留物は、NO供与体の残留物、グルタチオンの残基、(RS)−2、3ヂサルファニルプロパン−1の残基オール、(R)−2−アセトアミド−3−スルファニルプロパン酸及びこれらのいずれかのアナログの少なくとも1つを表す。
【0015】
実施例の一つとして、治療上有効な量を注射する(注射に限定されるわけではないないが)ことができる。他の実施例としては経口、局所、経粘膜、吸入、標的を合わせた送達、徐放性制剤を含む。局所に関する出願は点滴使用の眼科用薬でありうる。標的を合わせた送達は臓器への注入、経口のシロップ、錠剤またはカプセルでもありうる。
【0016】
ここで、この出願はさらにここに記載する製薬組成物を含むキットも提供する。このキットはさらに、銅の保持、肝障害またはそれに関連した合併症に関連する疾患の治療において使用する指示書も含み得る。
【0017】
さらに、ここで、以下のごとく、第1、第2の組成物により構成されるキットを提供する:a)第1の組成物はR−(+)−リポ酸やアセチルシステインまたはジメルカを含み;b)第2の組成物は化合物1A、化合物2、および/または化合物3の組み合わせ;c)第3の組成物は、トリエチレンテトラミン(または)亜鉛または酢酸テトラチオモリブデン酸アンモニウムである:
化学式1

ここで、
R1、R2、およびR3は独自に、水素、チオール、アルキル、アルキルチオール、アセチルチオール、ジスルフィド基、アシル基、アシルアルキル、アルケニル、アルキルチオアルキル、アルキニル、アルコキシアルコキシ、アリール、アラルキル、アリール、アリールシオールキル、シクロアルキル、エーテル、エステル、ヘテロアリール、ヘテロシクリル、低級アルキル基、スルホン、スルホキシド、またはヒドロキシを表し、
R4は、グアニジン、ヒドラジンの残留物、酸、ピルビン酸の残基、オキサロ酢酸の残留物、トコフェロールの残留物、アスコルビン酸の残基、チアミンの残留物、チオクト酸、チオクト酸の残基、アセチルシステイン残基、α−ケトグルタル酸の残基、ジメルカプロールの残基、ドナーNOの残留物、グルタチオンの残留物(R)−2−アセトアミド−3−スルファニルプロパン酸及びこれらのいずれかのアナログの少なくとも1つを表す。
【0018】
もうひとつの実施例として、R−リポ酸、ジメルカ、酢酸亜鉛、テトラチオモリブデン酸アンモニウムまたはトリエチレンテトラミンは、薬学的に許容される化合物1A、化合物2と3の塩のうちの少なくとも一つと組み合わされる。
【0019】
ここに開示される化合物、組成物、製剤、合成の方法、および治療は、様々な側面を達成するために任意の手段で実現することができ、また、哺乳動物に適した形で実行することができる。その他の機能は、以下に添付された詳細な説明により明らかになるであろう。
【図面の簡単な説明】
【0020】
【図1】図1は化合物1Aを代表する化合物を合成する最初の方法を示す。
【0021】
【図2】図2は化合物2によって代表される化合物を合成する2番目の方法を示す。
【0022】
【図3】図3は化合物3によって代表される化合物を合成する2番目の方法を示す。
【発明を実施するための形態】
【0023】
当開示においては、金属キレート化合物、組成物、制剤及びそれらの使用が開示される。化合物は化学式1の誘導体を含む。さらに、R−リポ酸、ジメルカ、酢酸亜鉛、テトラチオモリブデン酸アンモニウムまたはトリエチレンテトラミンを含む種しゅの化合物の組成は、薬学的に許容される化学式1による化合物の塩と組み合わされる。もうひとつの実施例としては、化学式1を異なる化合物に製造する方法が開示される。
【0024】
化合物は、酒石酸塩、エシル、メシル酸塩、硫酸塩、化学式1の含水塩をも含む。当出願はここに開示される製薬組成物を含むキットも提供する。キットは、銅の毒性、肝障害や合併症に関連する疾患の治療において使用される指示書を含む。
【0025】
定義
【0026】
本明細書において、以下の用語やフレーズは、以下に定める意味を有するものとする。別途の規定がない限り、ここに使用されるすべての技術用語および科学用語は、当技術分野で一般に理解されているのと同じ意味を持つ。
【0027】
用語アルキル」は、直鎖アルキル基、分岐鎖アルキル基、シクロアルキル(脂環式)基、アルキル置換シクロアルキル基及びシクロアルキル置換アルキル基を含む飽和脂肪族基のラジカルを意味する。好ましい実施例においては、直鎖または分岐鎖アルキルは30以下の炭素原子を主鎖中に(例えば、直鎖においてC1−C30、分岐鎖においてC3〜C30)を有するが、さらに好ましいのは20以下を有する。同様に、好ましいシクロアルキルは、3から10の炭素原子をその環構造に有し、より好ましくは5,6、または7の炭素を環構造に持つことである。
【0028】
本明細書で使用されている用語アルキル」は、1から12の炭素原子の飽和直鎖状又は分岐鎖状の一価の炭化水素基を意味する。アルキル基の例としては、これらに限定はされないが、メチル(Me、−CH3)、エチル(Et、−CH2CH3)、1−プロピル(n−PR、n−プロピル、−CH2CH2CH3)、2−プロピル(I−PR、i−プロピル、−CH(CH3)2)、1−ブチル(n−Bu、n−ブチル、−CH2CH2CH2CH3)、2−メチル−L−プロピル(I−Bu、i−ブチル、−CH2CH(CH3)2)、2−ブチル(S−Buは、s−ブチル、−CH(CH3)CH2CH3)、2−メチル−2−プロピル(T−Bu、t−ブチル、−C(CH3)3)、1−ペンチル(n−ペンチル、−CH2CH2CH2CH22CH3)、2−ペンチル(−CH(CH3)CH2CH2CH3)、3−ペンチル(−CH(CH2CH3)2)、2−メチル−2−ブチル(−C(CH3)2CH2CH3)3−メチル−2−ブチル(−CH(CH3)−CH(CH3)2)、3−メチル−1−ブチル(−CH2CH2CH(CH3)2)、2−メチル−L−ブチル(−CH2CH(CH3)CH2CH3)、1−ヘキシル(−CH2CH2CH2CH2CH2CH3)、2−ヘキシル(−CH(CH3)CH2CH2CH2CH3)、3−ヘキシル(−CH(CH2CH3)(CH2CH2CH3))、2−メチル−2−ペンチル(−C(CH3)2CH2CH2CH3)、3−メチル−2−ペンチル(−CH(CH3)−CH(CH3)CH2CH3)、4−メチル−2−ペンチル(−CH(CH3)CH2CH(CH3)2)、3−メチル−3−ペンチル(−C(CH3)(CH2CH3)22)、2−メチル−3−ペンチル(−CH(CH2CH3)CH(CH3)2)、2,3−ジメチル−2−ブチル(−C(CH3)2CH(CH3)2)、3,3−ジメチル−2−ブチル(−CH(CH3)C(CH3)3、1−ヘプチル、1−オクチルなどが挙げられる。用語アルケニル」は、少なくとも1つの部位が不飽和結合である、2から12の炭素原子を持つ一価の炭化水素のラジカルの直鎖状または分枝状連鎖、すなわち、炭素−炭素、sp二重結合であり、そこにおいて、アルケニルラジカルが、シス」とトランス」の向き、あるいは、E」とZ」の向きを持つラジカルを含む。例としては、これらに限定されるわけではないが、エチレニル又はビニル(−CH=CH2)、アリル(−CH2CH=CH2)などが挙げられる。アルキニル」という用語は、少なくとも1つの部位が不飽和結合である、2から12の炭素原子を持つ一価の炭化水素のラジカルの直鎖状または分枝状連鎖、すなわち、炭素−炭素、sp三重結合である。例としては、これらに限定されるわけではないが、エチニル(−C≡CH)、プロピニル(プロパルギル、−CH2C≡CH)などが挙げられる。
【0029】
また、本明細書、実施例、および特許請求の範囲全体で使用される用語アルキル」(または低級アルキル」)は非置換アルキル」および置換アルキル」―後者は炭化水素骨格の1つ以上の炭素上に水素を置換するアルキル部分を意味する―を含むことを意図する。このような置換基は、特に指定のない場合は、例えば、ハロゲン、ヒドロキシル、カルボニル(例えば、ホルミル基、アルコキシカルボニル基、カルボキシル基、アシル基など)、チオカルボニル(例えばチオエステル、チオ、チオホルメート)、アルコキシル、ホスホリル、ホスフェート、ホスホネート、ホスフィン酸塩、アミノ、アミド、アミジン、イミン、シアノ、ニトロ、アジド、スルフヒドリル、アルキルチオ、硫酸塩、スルホネート、スルファモイル、スルホンアミド、スルホニル、ヘテロシクリル、アラルキル、または芳香族またはヘテロ芳香族部分である。炭化水素鎖で置換された部分は適切な場合にはそれ自体が置換されてもよいということは、当分野の者によって理解されるであろう。例えば、置換アルキルの置換基は、アミノ、アジド、イミノ、アミド、ホスホリル(ホスホネート、ホスフィンを含む)、スルホニル(硫酸塩、スルホンアミド、スルファモイルおよびスルホン酸を含む)、およびシリル基の置換および非置換の形態を含むだけでなく、エーテル、アルキルチオ、カルボニル(ケトン、アルデヒド、カルボン酸塩、及びエステルを含む)、−CF3、−CNなどが挙げられる。代表的な置換アルキルは以下のごとくである。シクロアルキルはさらにアルキル、アルケニル、アルコキシ、アルキルチオ、アミノ、カルボニル置換アルキル、−CF3、−CNで置換されることができる。
【0030】
アシル」は当該分野では広く知られており、一般的化学式ヒドロカルビルC(O)−は、好ましくはアルキルC−(O)により代表されるグループである。
【0031】
アリール」は、各環が芳香族であるか、または1個以上の環と縮合して芳香環集合体を形成、単環または多環集合体を意味する。1つ以上の環原子が炭素(例えば、N、S)でない場合には、アリールはヘテロアリールである。Cxアリール及びCx−YアリールはXとYがリング内の炭素原子の数を示す場合に一般的に使用される。
【0032】
アシルアミノ」は当分野では広く知られており、アシル基で置換されるアミノ基を意味する用語であり、例えば、化学式ヒドロカルビルC(O)NH−によって表現され得る。
【0033】
アシルアルキル」は当分野では広く知られており、アシル基で置換されるアルキル基を意味する用語であり、例えば、化学式ヒドロカルビルC(O)アルキルによって表現され得る。
【0034】
アシルオキシ」は当分野では広く知られており、一般的な化学式ヒドロカルビルC(O)O−、好ましくはアルキルC(O)O−によって表現される基である。
【0035】
用語「アルコキシ」は、酸素が取り付いた、アルキル基、好ましくは低級アルキル基を意味する。代表的なアルコキシ基としては、メトキシ基、エトキシ基、プロポキシ基、第三−ブトキシ等が挙げられる。
【0036】
用語「アルコキシアルキル」はアルコキシ基で置換されたアルキル基を意味し、一般的な化学式アルキル−O−アルキルで表現される。
【0037】
本明細書において使用されている用語「アルケニル」は、少なくとも1つの二重結合を含む脂肪族基を意味し、「非置換アルケニル」および「置換アルケニル」−後者は、アルケニル基の1つ以上の炭素上の水素を置換するアルケニル部分を意味する−、を含むことを意図する。このような置換基は、1つ以上の二重結合に含まれる、あるいは含まれない、1つ以上の炭素上で発生する可能性がある。
【0038】
また、そのような置換基は、安定性が困難である場合を除き、以下に述べるように、アルキル基のために考えられるすべてのものを含む。例えば、1個以上のアルキル、カルボシクリル、アリール、ヘテロシクリル、またはヘテロアリール基によるアルケニル基の置換が考えられる。
【0039】
本明細書において使用されている用語「アルキルアミノ」は、少なくとも一つのアルキル基で置換されたアミノ基を意味する。
【0040】
本明細書において使用されている用語「アルキルチオ」は、アルキル基で置換されたチオール基を意味し、一般的な化学式アルキルS−により表現される。
【0041】
本明細書において使用されている用語「アルキニル」は、少なくとも一つの三重結合を含む脂肪族基を意味し、「非置換アルキニル」および「置換アルキニル」(後者はアルキニル基の1つ以上の炭素上の水素を置換するアルキニル部分を意味する)を含むことを意図している。このような置換基は、1個以上の三重結合に含まれる、あるいは含まれない1つ以上の炭素上で発生する可能性がある。また、このような置換基は、安定性が困難である場合を除いて、上述したようにアルキル基のために企図されたすべてが含まれる。例えば、1個以上のアルキル、カルボシクリル、アリール、ヘテロシクリル、またはヘテロアリール基によって置換することが考えられる。
【0042】
本明細書において使用されている用語「エーテル」は、他のヒドロカルビル基に酸素を介して結合するヒドロカルビル基を意味する。したがって、ヒドロカルビル基のエーテル置換基はヒドロカルビル−O−であり得る。エーテルは、対称、または非対称であり得る。エーテル類の例としては、これらに限定されるわけではないが、複素環−O−複素環、アリール−O−複素環が含まれる。エーテルは、一般的な化学式アルキル−O−アルキルで表現される「アルコキシアルキル」基を含む。
【0043】
本明細書で使用されている用語「ハロ」と「ハロゲン」はハロゲンを意味し、クロロ、フルオロ、ブロモ、およびヨードを含む。
【0044】
本明細書で使用されている用語「ヘタアルキル」と「ヘテロ」は、ヘタリール基で置換されたアルキル基を意味する。
【0045】
本明細書において使用されている用語「ヘテロアルキル」は、炭素原子と少なくとも1つのヘテロ原子の、飽和または不飽和の鎖を意味し、そこにおいては2つのヘテロ原子が隣接していない。
【0046】
用語「ヘテロアリール」および「ヘタリール」は置換または非置換の芳香族単環構造、好ましくは5−7の構成員を有する環構造で、その環構造は、少なくとも1個のヘテロ原子、好ましくは1〜4個のヘテロ原子、より好ましくは、1個または2個のヘテロ原子により構成される。用語「ヘテロアリール」および「ヘタリール」はまた、環の少なくとも一つは、ヘテロであるところの、2つの隣接する環に対して2つ以上の炭素が共通していることを特徴する2つ以上の環を有する多環式環系を含む。すなはち、他の環はシクロアルキル、シクロアルケニル、シクロアルキニル、アリール、ヘテロアリール、及び/又はヘテロシクリルであり得る。ヘテロアリール基は、例えば、ピロール、フラン、チオフェン、イミダゾール、オキサゾール、チアゾール、ピラゾール、ピリジン、ピラジン、ピリダジン、ピリミジンなどを含む。
【0047】
本明細書で使用されている用語「ヘテロ原子」は、炭素または水素以外の元素の原子を意味する。好ましいヘテロ原子は、窒素、酸素、硫黄である。
【0048】
用語「ヘテロシクリル」、「複素環」、および「複素環的」とは、好ましくは3−10の構成員、より好ましくは3−7の構成員の、置換もしくは非置換の非芳香族環構造を意味する。そして、その環構造は少なくとも一つのヘテロ原子、好ましくは1〜4個のヘテロ原子、より好ましくは1または2個のヘテロ原子を含む。「ヘテロシクリル」および「複素環」という用語はまた、環の少なくとも一つが複素環であるところの、2つ以上の炭素が2つの隣接する環に共通している、2つ以上の環を有する多環式環系を含む。すなはち、他の環はシクロアルキル、シクロアルケニル、シクロアルキニル、アリール、ヘテロアリール、及び/又はヘテロシクリルであり得る。ヘテロシクリル基は、例えば、ピペリジン、ピペラジン、ピロリジン、モルホリン、ラクトン、ラクタム等を含む。
【0049】
本明細書において使用されている用語「ヘテロサイクリルアルキル」は、複素環基で置換されたアルキル基を意味する。
【0050】
本明細書で用いられる用語「ヒドロカルビル」は、=Oまたは=S置換基を持たない炭素原子を介して結合した基を意味し、典型的には少なくとも1つの炭素−水素結合と主要な炭素バックボーンを有し、任意にヘテロ原子を含んでもよい。したがって、メチル、エチル、2−ピリジル、およびトリフルオロメチルは当出願に関しては、アセチルなどの置換基はヒドロカルビルであるとみなされる。但し、アセチルのような置換基(連結炭素上に=Oの置換基を有する)およびエトキシ(炭素ではなく酸素を介してリンクされている)はそうではない。ヒドロカルビル基は、アリール、ヘテロアリール、炭素環、複素環、アルキル、アルケニル、アルキニル、およびそれらの組み合わせを含みまたこれらに限定されるものではない。
【0051】
本明細書で用いられる用語「ヒドロキシアルキル」とは、ヒドロキシ基で置換されたアルキル基を意味する。
【0052】
用語「ケトン」は当分野で認識されており、例えば、化学式C(O)R9によって表現することができる。ここで、R9はヒドロカルビル基を表す。
【0053】
用語「低級」はアシル、アシルオキシ、アルキル、アルケニル、アルキニル、アルコキシ等の化学的部分と共に使用される場合には、10個以下、好ましくは6個以下の非水素原子が存在する置換基を含むことを意味する。「低級アルキル」とは、例えば、10個以下、好ましくは6個以下、の炭素原子を含むアルキル基を意味する。低級アルキルは、メチルおよびエチルを含む。特定の実施例においては、本明細書中で定義されたアシル、アシルオキシ、アルキル、アルケニル、アルキニル、またはアルコキシ置換基は、それらが単独で、または他の置換基との組み合わせ(詳細にはヒドロキシアルキルおよびアラルキル等(例えば、アルキル置換基で炭素原子を数える際に、アリール基内の原子は数えられない))として現れるかどうかに関わらず低級アシルオキシ、低級アルキル、低級アルケニル、低級アルキニル、または低級アルコキシ、それぞれ低級アシルアールである。
【0054】
「置換」という用語は、1つ以上の炭素骨格上の水素を置換する置換基を有する部分を意味する。「置換」、「による置換」は、置換される原子と置換基の許容価に従ったものであり、このような置換が安定した化合物―例えば、転位、環化、除去などなどにより自発的変換を受けない−を結果として生み出すという暗黙の但し書きを含むことが理解される。本明細書においては、「置換される」という用語は有機化合物のすべての許容可能な置換基を含むように意図されている。広義では、許容可能な置換基とは、有機化合物の非環式および環式、分枝状および非分岐、炭素環および複素環式、芳香族および非芳香族置換基を挙げることができる。許容可能な置換基は、適切な有機化合物に対しては1つ以上で、同一または異なっているかもしれない。当出願に関しては、窒素などのヘテロ原子は、水素置換基、あるいは、置換基を有するヘテロ原子の原子価を満たす本明細書に記載の任意の許容可能な有機化合物の置換を持ちうる。置換基は本明細書において記述された任意の置換基、例えば、ハロゲン原子、水酸基、カルボニル(例えば、ホルミル基、アルコキシカルボニル基、カルボキシル基、アシル基など)、チオカルボニル(例えばチオエステル、チオアセテート、チオホルメート)、アルコキシル、ホスホリル、ホスフェート、ホスホネート、ホスフィン酸塩、アミノ、アミド、アミジン、イミン、シアノ、ニトロ、アジド、スルフヒドリル、アルキルチオ、硫酸塩、スルホン酸塩、スルファモイル、スルホンアミド、スルホニル、ヘテロシクリル、アラルキル、または芳香族またはヘテロ芳香族部分を含みうる。適切な場合には、炭化水素鎖上で置換された部分はそれ自体が置換され得ることは、当業者には理解されるであろう。
【0055】
特に「置換されていない」として明記されていない限り、本明細書における化学的部分への言及は置換変異体を含むものと理解される。例えば、「アリール」基または部分への言及は、明記されなくても置換および非置換の変異体の両方を含む。
【0056】
「置換または非置換」は与えられた部分は利用可能な原子価を通じ、水素置換基(置換されていない)により、またはさらに他の方法で指定された部分の名前で指定されていない使用可能な原子価(置換)を介して1つ以上の非水素置換基により、構成されることを意味する。例えば、イソプロピルは−CH3で置換されているエチレン部分の例である。一般的に、非水素置換基は、置換されるように指定されている特定の部分の原子に結合され得る任意の置換基であり得る。置換基の例としては、これらに限定されるわけではないが、アルデヒド基、脂環族、脂肪族、(C1−10)アルキル、アルキレン、アルキリデン、アミド、アミノ、アミノアルキル、芳香族、アリール、ビシクロアルキル、ビシクロアリル、カルバモイル、炭素環基、カルボキシル基、カルボ二ル基、シクロアルキル、シクロアルキレン、エステル、ハロ、ヘテロビシクロアルキル、ヘテロシクロアルキレン、ヘテロアリル、ヘテロビシクロアリル、ヘテロシクロアルキル、オキソ、ヒドロキシ、イミノケトン、ケトン、ニトロ、オキサアルキル及びオクソアルキル部分を含み、また、これらの各々は必要に応じて置換または非置換でありうる。特定の実施例の1つとしては、置換基の例は、これらに限定されるわけではないが、水素、ハロ、ニトロ、シアノ、チオ、オキシ、ヒドロキシ、カルボニルオキシ、(C1−10)アルコキシ、(C4−12)アリールオキシ、ヘテロ(C1−10)アリールオキシ、カルボニル、オキシカルボニル、アミノカルボニル、アミノ、(C1−10)アルキルアミノ基、スルホンアミド基、イミノ基、スルホニル基、スルフィニル基、(C1−10)アルキル、ハロ(C1−10)アルキル、ヒドロキシ(C1−10)アルキル、カルボニル(C1−10)アルキル、チオカルボニル(C1−10)アルキル基、スルホニル(C1−10)アルキル基、スルフィニル(C1−10)アルキル、(C1−10)アザアルキル、イミノ(C1−10)アルキル、(C3−12)シクロアルキル(C1−5)アルキル、ヘテロ(C3−12)シクロアルキル(C1−10)アルキル、アリール(C1−10)アルキル、ヘテロ(1−10)アリール(C1−5)アルキル、(C9−12)ビシクロアリル(Ci_s)アルキル、ヘテロ(Ce−12)ビシクロアリル(C1−5)アルキル、(C3−12)シクロアルキル、ヘテロ(C3−12)シクロアルキル、(C9−12)ビシクロアルキル、ヘテロ(C3−12アリール)ビシクロアルキル、(C4−12)アリール、ヘテロ(C1−10)アリール、(C9−12)ビシクロアリルおよびヘテロ(C4−12)ビシクロアリルを含む。また、置換基自体が任意にさらに置換基で置換される。特定の実施例の1つとしては、さらなる置換基の例は、これらに限定されるわけではないが、水素、ハロ、ニトロ、シアノ、チオ、オキシ、ヒドロキシ、カルボニルオキシ、(C1−10)アルコキシ、(C4−12)アリールオキシ、ヘテロ(C1−10)アリール、カルボニル、オキシカルボニル、アミノカルボニル、アミノ、(C1−10)アルキルアミノ基、スルホンアミド基、イミノ基、スルホニル基、スルフィニル基、(C1−10)アルキル、ハロ(C1−10)アルキル、ヒドロキシ(C1−10)アルキル、カルボニル(C1−10)アルキル、チオカルボニル(C1−10)アルキル基、スルホニル(C1−10)アルキル基、スルフィニル(C1−10)アルキル、(C1−10)アザアルキル、イミノ(C1−10)アルキル、(C3−12)シクロアルキル(C1−5)アルキル、ヘテロ(C3−12)シクロアルキル(C1−10)アルキル、アリール(C1−10)アルキル、ヘテロ(C1−10)アリール(Ci_5)アルキル、(C9−I2)ビシクロアリル(C1−5)アルキル、ヘテロ(C8−12)ビシクロアリル(Ci_s)アルキル、(C3−12)シクロアルキル、ヘテロ(C3−12)シクロアルキル、(C9−12)ビシクロアルキル、ヘテロ(C3−12)ビシクロアルキル、(C4−12)アリール、ヘテロ(1−10)アリール、(C9−12)ビシクロアリルおよびヘテロ(C4−12)ビシクロアリルを含む。
【0057】
化学式1における当化合物の化合物は、薬学的に許容される塩の形で存在し得る。当開示の化合物は薬学的に許容されるエステル(すなわち、化学式Iの酸のメチル及びエチルエステルがプロドラッグとして使用される)の形で存在し得る。当開示の化合物は溶媒和、すなわち水和することができる。溶媒和は、製造工程の途中で行うことができるし、あるいは、化学式I(水和)の初期無水化合物の吸湿性の結果として起こり得る。
【0058】
同じ分子化学式を持つが、空間内の原子の配列、原子の結合順序、性質が異なる化合物は「異性体」と呼ばれる。空間内のそれらの原子の配置が異なる異性体は、「立体異性体」と呼ばれる。ジアステレオマーは、鏡像異性体ではない、一つ以上のキラル中心において正反対の構成を持つ立体異性体である。互いに重ね合わせることができない鏡像である1つ以上の非対称中心をもつ立体異性体は、「鏡像異性体」と呼ばれる。化合物が非対称中心を有する場合、例えば、炭素原子が4つの異なる基に結合している場合、鏡像異性体のペアが可能である。鏡像異性体は、その非対称中心または中心の絶対配置によって特徴づけることができ、カーン、インゴルドおよびプレローグのR−及びS−シーケンシングルールにより、あるいは、分子が偏光面を回転させ、右旋性または左旋性(すなわち、(+)または(−)−異性体)として指定される方法により、記述される。キラル化合物は、1個の鏡像異性体、又はその混合物として存在し得る。鏡像異性体を等しい割合で含有する混合物は「ラセミ混合物」と呼ばれる。
【0059】
用語「硫酸塩」は当該分野で認識され、グループOSO3H、または薬学的に許容されるその塩を指す。化学式1の化合物の硫酸塩、あるいは、その水晶体は水和物であり得る。結合された水の数は、再結晶や乾燥の条件を変えることによって制御することができる。塩の形は塩酸塩でもあり得る。
【0060】
本明細書で使用する用語「多形」は当分野で認識されており、与えられた化合物の一つの結晶構造を意味する。
【0061】
「残基」とは、当該分野で認識される用語であり、分子の部分を指す。例えば、チオクト酸の残基は以下のようになります。ジヒドロリポ酸、ビスノリポイク酸、テトラノリポイク酸、6,8−ビスメチルメルカプト−オクタン酸、4,6−ビスメチルメルカプト−ヘキサン酸、2,4−ビスメチルメルカプト−ブタン酸、4,6−ビスメチルメルカプト−ヘキサン酸。
【0062】
用語「プロドラッグ」は、生理的条件下で、当開示の治療上活性な薬剤に変換される化合物を包含することが意図されている。プロドラッグを作る一般的な方法は、所望の分子を明らかにするために、生理学的条件下で加水分解される選択された部分を含む。他の実施例においては、プロドラッグは宿主動物の酵素活性によって変換される。
【0063】
用語「予防的、又は療法的」な治療は当分野では知られており、一つ以上の該当組成物のホストへの投与を含む。望ましくない状態の臨床症状(例えば、疾患または宿主動物の他の望ましくない状態)前に投与される場合は、治療は予防的である。
すなわち、それは宿主が望ましくない状態におちいることから保護する。他方で、望ましくない状態の起こった後で投与される場合は、治療は療法的(すなわち、それは、既存の望ましくない状態や副作用を減少、改善、安定させるために意図されている)である。
【0064】
本明細書で用いられる用語「溶媒和物」は、溶媒(例えば、溶質の分子またはイオンと溶媒分子の組み合わせによって形成さ化合物)によって形成された化合物を指す。
【0065】
本開示は本明細書において開示されるごとく、組成物のプロドラッグや薬学的に許容されるプロドラッグの塩も考察する。
【0066】
当出願はまた、薬学的に許容される媒介物により構成される医薬組成物および、チオクト酸、あるいは、チオクト酸残基、ジメルカプロールまたはアセチルシステインおよび、化合物1A、2または3の化合物の塩の組成物を開示する。当出願はさらに薬学的に許容される媒介物、(a)リポ酸またはリポ酸残基(b)化学式Iの化合物(c)ジメルカ、アセチルシステイン、酢酸亜鉛、またはアンモニウムチオモリブデイトにより構成される医薬組成物を開示する。医薬組成物は、全身または局所投与のために処方することができる。医薬組成物は、経口投与、注射、皮下投与、または経皮投与のために処方することができる。医薬組成物はさらに、薬学的に許容される安定剤、希釈剤、界面活性剤、フィラー、バインダー、ルブリマイトの少なくとも一つを含むことができる。
【0067】
加えて、特定化合物1A、2、3、または組成物の最適な濃度、量は、治療パラメータの変化に適応するように調整することができる。このような治療パラメータは臨床使用に対する準備、例えば、治療部位、患者のタイプ、例えば、ヒトかヒトでないか、大人か子供か、また、疾患、状態の性質が含まれる。
【0068】
ウィルソン病(WD)は、さまざまな臓器や組織において当金属の蓄積につながる銅代謝の常染色体劣性遺伝疾患である。肝臓と神経症状は、この病気の主な臨床特徴である。銅に関連した疾患に関する報告は人間と動物の両方で増加している。銅はまた、銅代謝の遺伝的異常を持つ子供に影響を与える致命的な、非ウィルソンの肝臓疾患において役割をはたしている。銅の過剰蓄積はまた、原発性胆汁性肝硬変などの慢性肝臓疾患、及び、人間や動物などの哺乳動物における慢性肝炎の結果としても起こる。
【0069】
特定の実施例においては、化学式Iの化合物1A、2と3、および組成物、1つまたは複数の銅の毒性に関連した疾患または合併症を治療に用いることができる。合併症は、肝(肝硬変、慢性活動性肝炎、劇症肝不全)、神経(運動緩慢、硬直、振戦、運動失調、ジスキネジア、構音障害、発作)、精神科(行動障害、認知障害、精神病)、眼科(カイザー?フライシャー環、サンフロー白内障)、血液(溶血、凝固障害)、腎臓(腎尿細管の欠陥、減少、糸球体濾過、腎結石)、循環器病(心筋症、不整脈、伝導障害、自律神経障害)、筋骨格系(骨軟化症、骨粗しょう症、変形性関節疾患)、消化器(胆石症、膵炎、細菌性腹膜炎)、内分泌(無月経、自然流産、思春期遅発症、女性化乳房)、皮膚科(色素沈着、アメイソシスニグリメイ)を含む。
【0070】
組成物は、単独または薬学的に許容される媒介物、仲介物、または希釈剤と組み合わせて、また単一または複数の用量で、他の薬剤、例えば、鎮痛剤と共に投与することができる。ただしこれらに限定されるわけではない。 適当な医薬媒介物、仲介物、希釈剤としては、不活性固体希釈剤または充填剤、滅菌水溶液および各種有機溶媒が挙げられる。組成物および薬学的に許容される媒介物、仲介物、希釈剤を組み合わせることによって形成される製薬組成物は、その後直ちに、錠剤、散剤、トローチ剤、シロップ剤、注射用液剤等の形で投与される。これらの医薬組成物は、望みに応じて、香料、結合剤、賦形剤などの追加の成分を含有することができる。したがって、経口投与の目的のために、例えば、L−アルギニン、クエン酸ナトリウム、カルシウム炭素、リン酸カルシウムのような種しゅの賦形剤を含む錠剤を、デンプン、アルギン酸およびある種の複合ケイ酸塩などの様々な崩壊物と一緒に、また、ポリビニルピロリドン、スクロース、ゼラチン、アカシアなどの結合剤と共に投与することができる。さらに、ステアリン酸マグネシウム、ラウリル硫酸ナトリウム及びタルクなどの滑沢剤は、錠剤化目的にはしばしば有用である。同様なタイプの固体組成物は、ソフト、ハード充填されたゼラチンカプセル中の充填剤として用いることができる。これに適した材料は、ラクトース、乳糖および高分子量ポリエチレングリコールが挙げられる。水性懸濁液またはエリキシル剤が経口投与のために所望される場合、必須の有効成分は、種々の甘味剤または香味剤、染色剤、着色剤、また、望むならば、乳化剤または懸濁剤、そして、水、エタノール、プロピレングリコール、グリセリンなどの希釈剤、およびそれらの組み合わせと混ぜあわせることができる。
【0071】
活性成分または治療成分に加え、錠剤は、賦形剤として知られる不活性材料をいくつも含めることができる。それらは最終的に錠剤において果たす役割により分類することができる。一次組成物は一つ以上の充填剤、結合剤、滑沢剤と流動化剤を含み得る。タブレットが完成された状態に物理的な特性を与える他の賦形剤は、着色剤、及び味剤(特にチュアブル錠の場合)である。賦形剤なしでは大部分の薬や医薬品成分は錠剤に直接圧縮することができない。これは大部分の薬剤には流動、凝集特性が余り無いことが主要な原因である。通常、賦形剤は、圧縮されている材料に良好な流動性および圧縮特性を付与するために添加される。このような特性は、湿式造粒、スラッギング、噴霧乾燥球形化、あるいは、結晶化などの前処理ステップを通じて付与される。
【0072】
潤滑剤は、典型的には、錠剤化材がパンチに粘着するのを防ぎ、錠剤圧縮中の摩擦を最小限に抑え、ダイからの圧縮された錠剤の除去を可能にするために追加される。このような潤滑剤は、一般的に通常重量で約1%の量が最終の錠剤ミックスに含まれている。
【0073】
賦形剤の他の望ましい特徴には、次のものがある:低圧縮力で強い錠剤を作る高圧縮性;粉末材料に凝集性を付与する;受け入れられる崩壊速度;化学式中の他の賦形剤の流動性を改善する良好な流動特性;結束性(処理、輸送および取り扱い中に錠剤が割れることを防ぐため)。
【0074】
圧縮された錠剤を作る上で少なくとも3つの商業的に重要なプロセスがある:湿式造粒、直接圧縮及び乾式造粒(スラッギングまたはローラー圧縮)。賦形剤の準備方法、種類は錠剤処方に錠剤の急速な圧縮を可能にする所望の物理的特性を与えるように選択される。圧縮した後、錠剤は外観、硬さ、崩壊能力など幾つかの追加属性と受け入れられる溶解性のプロファイルを持っている必要がある。フィラーその他の賦形剤の選択は、薬物の化学的および物理的特性、加工中の混合物の挙動、最終タブレットのプロパティに依存する。提案された賦形剤と活性成分の化学的および物理的な互換性を判断するために、処方前の試験が行われる。
【0075】
薬剤の性質、その剤形および操作の経済性が、錠剤製造の最適プロセスの選択を決定する。一般的には、湿式造粒法と直接圧縮の両方がタブレットの開発に使用されている。
【0076】
ひとつの製剤は以下を含む:化学式Iの化合物とバインダー。薬学的に許容されるバインダーの例としては、澱粉、セルロース及びその誘導体を含む。ただし、これだけに限定されるわけではない。例えば、微結晶セルロース、ヒドロキシプロピルセルロース、ヒドロキシエチルセルロースとヒドロキシエチルプロピリメチル、セルロース、スクロース、ブドウ糖、コーンシロップ、多糖類とゼラチン。バインダーは例えば、組成物の重量に対して、約1%から約40%、つまり、1%〜30%、1%〜25%、または1%〜20%として存在し得る。
【0077】
必要に応じて、1つ、2つ、3つまたはそれ以上の希釈剤をここに開示された制剤に追加することができる。薬学的に許容されるフィラーおよび薬学的に許容される希釈剤の例は、これらに限定されるわけではないが、粉砂糖、圧縮糖、デキストレート、デキストリン、デキストロース、ラクトース、マンニトール、微結晶セルロース、粉末セルロース、ソルビトール、スクロースおよびタルクを含む。充填剤または希釈剤は、例えば、組成物の重量で約15%〜約40%存在し得る。特定の実施例では、希釈剤は、α−セルロースの制御された加水分解によって製造され、希鉱酸溶液により、繊維状の植物原料からパルプとして得られた微結晶セルロースである。加水分解後、水和セルロースを濾過により精製し、水性スラリーは、幅広く分布した乾燥、多孔質粒子を形成するために乾燥スプレーされる。適切な微結晶性セルロースは約20nm〜約200nmの平均粒径を持つ。微結晶性セルロースは、いくつかの業者から入手可能である。適切な微結晶セルロースは、FMC社製アビセルPH101、アビセルPH102、アビセルPH103、アビセルPH105、アビセルPH200である。微結晶性セルロース量は重量で約25%から約70%が処方された錠剤中に存在し得る。この材料の他の適切な範囲は、重量で約30%〜約35%であり、重量で約30%から約32%も他の適切な範囲である。別の希釈剤はラクトースである。乳糖は、処方前に約50μmと約500μmとの間の平均粒子サイズを有するように粉砕することができる。ラクトースは重量で約5%〜約40%、処方錠剤中に存在してよいし、重量で約18%から約35%、例えば、約20%から約25にすることができる。
【0078】
必要に応じて1個、2個、3個またはそれ以上の崩壊剤をここに記述された制剤に追加することができる。薬学的に許容される崩壊剤の例には、これらに限定されるわけではないが、デンプン、粘土、セルロース、アルギン酸塩、ガム、架橋ポリマー、例えば、架橋ポリビニルピロリドン、架橋カルボキシメチルセルロースカルシウム、架橋カルボキシメチルセルロースナトリウム、大豆多糖類、及びグアーガムがある。崩壊剤は、例えば、組成物の重量について、2%から約20%、例えば、約5%から約10%、約7%の量で存在し得る。崩壊剤はまた、錠剤製剤のオプションではあるが、有用な成分である。崩壊剤は、錠剤が受け入れられる崩壊率を持っていることを確認するために含まれる。典型的な崩壊剤としては、デンプン誘導体およびカルボキシメチルセルロースの塩が挙げられる。デンプングリコール酸ナトリウムは、当製剤用に適切な崩壊剤である。特定の実施例においては、崩壊剤は重量で約0%〜約10%で錠剤処方中に存在し、約1%〜約4%、例えば、重量で約2.5%にすることができる。
【0079】
必要に応じて1個、2個、3個またはそれ以上の潤滑剤をここに開示された制剤に追加することができる。薬学的に許容される潤滑剤および薬学的に許容される滑剤の例としては、これらに限定されるわけではないが、コロイド状シリカ、三ケイ酸マグネシウム、デンプン、タルク、第三リン酸カルシウム、ステアリン酸マグネシウム、ステアリン酸アルミニウム、ステアリン酸カルシウム、マグネシウムカルボネイト、酸化マグネシウム、ポリエチレングリコール、粉末セルロース、微結晶セルロースが含まれる。潤滑剤は、例えば、組成物の重量で約0.1%〜約5%、存在し得る。他方、グリダントは、例えば、重量で約0.1%〜約10%として存在し得る。潤滑剤は、典型的には、錠剤化材料がパンチに粘着するのを防ぎ、錠剤圧縮中の摩擦を最小限に抑え、ダイからの圧縮された錠剤の除去を可能にするために追加される。このような潤滑剤は、一般的に最終錠剤ミックスに重量で1%未満で含まれている。潤滑成分は疎水性または親水性であり得る。潤滑剤の例は、ステアリン酸、タルク、ステアリン酸マグネシウムを含む。ステアリン酸マグネシウムは、錠剤の圧縮?吐出時にダイ壁やタブレットミックスとの間の摩擦を低減する。それはまた、パンチとダイへの錠剤の付着を防止するのに役立つ。ステアリン酸マグネシウムはまた、ホッパー内、ダイへの粉体の流れを助ける。それは450から550ミクロンの粒径範囲を持ち、1.00〜1.80グラム/mLの濃度範囲を持つ。それは安定しており、錠剤ミックス内で重合されない。一潤滑剤、ステアリン酸マグネシウムもまた、製剤に使用することができる。いくつかの態様では、潤滑剤は約0.25%〜約6%で錠剤処方中に存在する。また、適切なのは重量で約0.5%〜約4%、約0.1%〜約2%の水準である。他の可能な潤滑剤には、タルク、ポリエチレングリコール、シリカ、硬化植物油が含まれる。オプションの実施例においては、潤滑剤は製剤中に存在せず、ダイまたはパンチに噴霧され、製剤には直接追加されない。
【0080】
その他の従来の固体充填剤又は媒介物、例えば、コーンスターチ、リン酸カルシウム、硫酸カルシウム、ステアリン酸カルシウム、ステアリン酸マグネシウム、ステアリン酸グリセリル、モノおよびジステアリン酸、ソルビトール、マンニトール、ゼラチン、天然または合成ゴム、例えば、カルボキシメチルセルロース、メチルセルロース、アルギン酸塩、デキストラン、アカシアガム、カラヤガム、ローカストビーンガム、トラガントガムなど、希釈剤、結合剤、滑沢剤、崩壊剤、着色料及び香料は必要に応じて使用することができる。
【0081】
必要に応じて組成物に添加することができる有用な賦形剤のさらなる例が編医薬品添加物ハンドブック、第3版、AHKibbe編集、アメリカの薬剤師会発行、ワシントンDC、ISBN:0−917330−96−X、または医薬品添加物ハンドブック(第4版)、レイモンド・C・ロウ編集、出版社:科学と実践に記載されている。
【0082】
制剤、例えば、錠剤、は3から800、または20から600,例えば50、250、300、400mgの化合物1A、2、3の化合物と組成物を含み得る。例えば、化学式IまたはII、または化合物1A、2、3の化合物の塩、あるいは(a)リポ酸,リポ酸残基と(b)化合物1A、2,3の化合物と(c)ジメルカプロール、アセチルシステイン、酢酸亜鉛またはアンモニウムチオモルブデイトを含み得る。
【0083】
当該組成物は一回投与することも、または組成物の放出速度および所望の投薬量により、時間の間隔を変えて少ない用量を何回かに分けて投与することもできる。
【0084】
眼科製剤、眼軟膏剤、散剤、液剤なども、当開示の範囲内であると考えられる。製薬組成物に使用できる適切な水性および非水性媒介物の例は水、エタノール、ポリオール(例えば、グリセロール、プロピレングリコール、ポリエチレングリコール等)、およびそれらの適切な混合物、オリーブ油などの植物油、およびオレイン酸エチルなどの注射用有機エステルなどを含む。適切な流動性は、例えば、レシチンなどのコーティング材料の使用により、分散液の場合には必要な粒子サイズを維持することにより、また、界面活性剤の使用によって維持することができる。
【0085】
合成の方法
合成例1:
【0086】
図の1、2、3は、化合物1A、2と3のような様々な化合物ための化学式1の組成のための5ステップの合成プロセスを示す。
化合物1A、2および3のステップ1:(2S)−2−アミノ−3−メチル−3−スルファニル−ブタン酸(初期化合物1)またはD−(−)−ペンシラミンおよびジクロロメタン(DCM)を一緒に混合し、マグネチックスターラーを含む耐圧瓶内の反応混合物とした。反応混合物(中間化合物1)を含む耐圧瓶はしっかりとゴム隔膜で閉じた。反応混合物を含む耐圧瓶はさらにドライアイス浴で7−8℃で2−アイソプロポノル/ドライアイスで冷却した。凝縮されたイソブチレンをカニューレを使用して耐圧瓶に移し、次に反応混合物に硫酸を数滴を追加した。イソブチレンの追加を2時間続けた。反応混合物の撹拌をさらに16時間、室温で続けた。耐圧瓶はi−PrOH/ドライアイス浴中で維持し、ゴム隔膜を慎重に除去した。反応混合物を数分間攪拌することにより、完全に脱気させるようにした。飽和NaHCO3水溶液を反応混合物に添加し、得られた反応混合物を室温で2時間撹拌した。水層のpHを測定し、8として記録した。水が中和工程中に形成された乳剤の除去のために追加された。水層をDCMで使用して処理し、抽出した。全体のDCM抽出物は一緒にした。一緒にされたDCM抽出物を飽和NaHCO3水溶液、水および飽和塩化ナトリウム水溶液で洗浄した。結果有機層は、中間化合物2を作るために、減圧下で濃縮し、濾過し、MgSO4雰囲気下で乾燥させた。
化合物1A、2、3のステップ2:室温で30分間、エタノールパラホルムアルデヒドと共にアミノチオールを縮合して、中間化合物3としてのチアゾリジン誘導体が得られた。
化合物1A、2、3のステップ3:チアゾリジン誘導体中間化合物3は、0℃で無水ジメルカプロール内で、N、N−ジイソプロピルエチルアミン(DIPEA)の1.5当量の存在下で、1−クロロエチルクロロホルメートの1.0当量で処理した。反応混合物を0℃で30分間攪拌し、中間化合物4を得た。反応が終了した時点で、品質を薄層クロマトグラフィー(TLC)を行うことによって監視、記録した。観察に基づき、品質が良好であった場合、ステップ3の中間化合物4は、さらなる精製工程なしで、直接次の工程に用いた。
化合物1Aのステップ4:リポ酸のカリウム塩を0℃で乾燥ジメチルホルムアルデヒド下において、リポ酸、無水K2CO3を反応させて得た。ステップ3の当反応混合物を上記の溶液にゆっくりと加えた後、粗反応混合物を室温で16時間攪拌した。反応をTLCによりモニターした。粗反応混合物を水とジクロロメタンを用いて真空蒸留、分画した。合わせた水と有機層をブライン溶液で洗浄し、無水Na2SO4上で乾燥し、減圧下で蒸発させた。粗反応混合物は、100〜200メッシュのシリカゲル上のカラムクロマトグラフィーにより精製し、リポ酸誘導体の中間化合物5を得た。
化合物2のステップ4:中間化合物4を、0℃で乾燥ジメチルホルムアミド内で、(2,2−ジメチル−1,3−ジチオラン−4−イル)メタノールナトリウム塩(DMF)溶液にゆっくりと加え、反応混合物3を作った。反応混合物3を室温で16時間攪拌した。反応混合物の3を蒸発法を用いて乾燥させた。乾燥した反応混合物を分割した後、水及びDCMで洗浄した。複合有機層をブライン溶液で洗浄し、無水Na2SO4上で乾燥後、減圧下で蒸発させた。得られた粗化合物は100〜200メッシュのシリカゲル上のカラムクロマトグラフィーにより精製し、化合物5を得た。
化合物3のステップ4:中間化合物4は反応混合物3を作るために0℃で乾燥ジメチルホルムアミド(DMF)中の3−アセチルチアゾリダイン−4−カルボン酸カリウム塩の溶液にゆっくりと加えた。反応混合物3を室温で16時間攪拌した。反応混合物の3を蒸発法を用いて乾燥させた。乾燥した反応混合物を分割した後、水及びDCMで洗浄した。複合有機層をブライン溶液で洗浄し、無水Na2SO4で乾燥後、減圧下で蒸発させた。得られた粗化合物は化合物5を得るために100〜200メッシュのシリカゲル上のカラムクロマトグラフィーにより精製した。
化合物1Aのステップ5:前のステップ4で得られた中間化合物5は、中間化合物5のチアゾリジングループとテルト−ブチルエステルを加水分解するためにDCMに溶解された25パーセントトリフルオロ酢酸で処理した。当反により、最終化合物6を得た。
化合物2のステップ5:最後のステップは、テルト−ブチルエステル、アセトニドと、中間化合物5チアゾリジン基の加水分解である。中間化合物5は最終化合物6を生成するためにDCMに溶解された25%のTFAで処理される。実施例の一つとしては、テルト−ブチルエステルを条件カップリング1−エチル−3−(3’−ジメチルアミノプロピル)カルボジイミド(EDCI)を用いて調製することができる。それはまた、EDCIカップリング条件を用いてt−ブタノールとD−(−)−ペンシラミンを反応させることにより調製することができる。もうひとつの実施例として、最初のものは、D−(−)−ペニシラミンのアミノチオールを保護し、次いでBoc無水物と、DCMに溶解された4−(N、N−ジメチルアミノ)ピリジン(DMAP)と反応する。
もうひとつの実施例として、アミノ酸は、t−ブタノール、硫酸マグネシウムと、DCMと混合された硫酸とアミノ酸とを反応させることにより、テルト−ブチルブチルエステルに変換され得る。
化合物3のステップ5:最後のステップは、テルト−ブチルエステル、アセトニドと中間化合物5のチアゾリジン基の加水分解である。中間化合物5は最終化合物6を生成するためにDCMに溶解された25%のTFAで処理される。
実施例の一つとしては、テルト−ブチルエステルを1−エチル−3−(3’−ジメチルアミノプロピル)カルボジイミド(EDCI)のカップリング条件を用いて調製することができる。それはEDCIカップリング条件を用いて、t−ブタノールと(2S)−2−アミノ−3−メチル−3−スルファニル−ブタン酸とを反応させることにより調製することができる。
もうひとつの実施例として、最初のものは、(2S)−2−アミノ−3−メチル−3−スルファニル−ブタン酸のアミノチオールを保護し、次に、SBoc無水フタル酸とDCMに溶解された4−(N、N−ジメチルアミノ)ピリジン(DMAP)とを反応させることができる。もうひとつの実施例として、アミノ酸は、t−ブタノール、硫酸マグネシウム、DCMと混合された硫酸とアミノ酸とを反応させることにより、テルト−ブチルブチルエステルに変換され得る。
【0087】
合成の結果:
【0088】
化合物1A

【0089】
M.F:C16H27NO6S3、Mol.Wt.:426
【0090】
表1:CHN分析

【0091】
表2:HNMR分析

【0092】
化合物2

【0093】
M.F:C11H21NO5S3、Mol.Wt.:343
【0094】
表3−CHN分析

【0095】
表4−HNMR分析

【0096】
化合物3:

【0097】
M.F:C13H22N2O7S2、Mol.Wt.:382
【0098】
表5−CHN分析

【0099】
表6−H NMR分析

【0100】
もうひとつの実施例として、化学式1の化合物の効果的な投与量は、単一または分割投与で約0.3ミリグラム/kg/日から約60mg/kg/日kg/日の範囲であり、例えば、単一または分割投与で1mg/kg/日から約50mg/kg/日範囲である。化学式1の化合物は、例えば、2mg/kg/日、5mg/kg/日、10mg/kg/日、20mg/kg/日、30mg/kgの/日、または40mg/kg/日未満の用量で投与することができる。化学の式1の化合物は、例えば、1日あたり50mg及び1000mgの間、100mgおよび800mgの間、または1000、900、800、700、600、500、400、300、200、または100mg未満を、人間の患者に投与することができる、特定の実施例においては、当組成物の投与される量は、化学式1の化合物の95%未満、90%、80%、70%、60%、50%、40%、30%、20%、または10%であることが、同じ治療上の効果を得るために必要である。徐放性の錠剤には、ゆっくりと薬物を放出するコーティングを付けることができる。
【0101】
本開示は、とりわけ、銅の毒性に関連した疾患や合併症を治療する組成物および方法を提供する。当開示の特定の実施例が議論されてはきたが、上記の仕様は単に例示であって、これに制限されるものではない。ここにおける化合物、組成物および方法の多くのバリエーションは、当仕様を検討することにより、当分野の者には明らかになるであろう。
【産業上の利用可能性】
【0102】
化学式1の化合物、そして、肝疾患、更に一般的に言えば、遺伝的で異常な金属の肝臓への蓄積を患う哺乳類を治療する薬学的に許容される添加物と化学式1との組成物については複数の出願がある。
これら組成物は、肝疾患における銅の保持とその合併症に関連した疾患の治療に用いることができる。
【技術分野】
【0001】
(関連する出願の相互参照)
当出願は2010年3月5日に提出されたアメリカ合衆国仮特許出願番号61/310719の優先権を主張するものである。当出願はその全開示を参照として組み込むものである。
【0002】
当開示は一般的には化合物とその合成に関連したものである。特に、当開示は哺乳類を薬学的に許容される量の化合物、組成物、製剤、および、化合物のプロドラッグによって治療することに関連するものである。
【背景技術】
【0003】
金属の毒性は必須の金属の過負荷や種しゅの原因で重金属に接触することにより生ずる。大部分の金属は炭素と共有結合し金属−有機化合物を形成することができる。金属や金属化合物は中枢神経系(CNS)、造血系、肝臓、腎臓などの器官の機能に干渉する。(フローラほか2010)。
【0004】
金属の蓄積は肝臓病における多種の機能障害をもたらす。ウィルソン病、ポストシャント脊髄症、肝性脳症、後天性ウィルソン肝脳変性などの肝脳疾患における脳機能障害と神経細胞死をもたらす病態生理学的メカニズムは、肝脳疾患の主要な特徴です。アストロサイト(アルツハイマー病II型アストロサイト)への形態学的変化は、銅、マンガン、鉄等の金属の神経毒性作用が含まれる。肝脳疾患の管理と治療には、キレート療法(ウィルソン病)や肝臓移植などが含まれる。
【0005】
銅蓄積は肝臓、腎臓および眼疾患の多くの機能障害をもたらす。余分な銅はウィルソン病においては実際に角膜全体に堆積される。腎尿細管機能障害はその結果として高カルシウム尿症と高リン尿症をもたらし、腎尿細管機能障害は、腎石灰沈着症を誘発し得る。薬理学的管理としてはペニシラミンとトリエンチンが使用されている。これらの薬剤を使用するうえで長期的な効果があり、以前の技術(ファイファー2007)において議論されてきた。改良された特殊性を持ち毒性の副作用の少ない新しい銅キレート剤と抗がん性メタロドラッグの開発が必要である。
【発明の概要】
【0006】
一実施例として、化学式1(化学式1として表示)により構成される化合物を開示する。
化学式1

【0007】
もうひとつの実施例として、以下のごとく構成される化学式1の一つ以上の化合物、中間体、プロドラッグ、一つ以上の薬学的に許容される媒介物を持つ薬学的に許容される化学式1の化合物の塩、と媒介物または希釈剤が開示される。これら組成物は、肝疾患、障害における銅の保持、およびその合併症に関連した疾患の治療に用いることができる。
【0008】
もうひとつの実施例として、本願の開示は、化合物、化学式1の組成、または、薬学的に許容される塩を含む。
化学式I

ここで、
R1、R2、およびR3の各々は以下を独立して表す:水素、チオール、アルキル、アルキルチオール、アセチルチオール、ジスルフィド基、アシル基、アシルアルキル、アルケニル、アルキルチオアルキル、アルキニル、アルコキシアルコキシアルキル、アラルキル、アリールオキシ、アリールオ−ルキル、シクロアルキル、エーテル、エステル、ヘテロアリール、ヘテロシクリル、低級アルキル基、スルホン、スルホキシド、またはヒドロキシアルキル。
R4は、グアニジン、ヒドラジンの残留物、酸、ピルビン酸の残基、オキサロ酢酸の残留物、トコフェロールの残留物、アスコルビン酸の残基、チアミンの残留物、チオクト酸、チオクト酸の残基、アセチルシステイン残基、α−ケトグルタル酸の残基、ジメルカプロールの残留物は、NO供与体の残留物、グルタチオンの残基、(RS)−2、3ヂサルファニルプロパン−1の残基オール、(R)−2−アセトアミド−3−スルファニルプロパン酸、及び以上のいずれかのアナログの少なくとも1つを表す。
化合物1

ここで、nは0〜8の整数を表し、ここで、R4は、R−(+)−チオクト酸、nは0〜4間の整数である。
【0009】
他の好ましい実施例としては、化学式1は下記の化合物を表わし得る:
化合物1A

ここで:
R1、R2、およびR3の各々は独立して、水素、チオール、アルキル、アルキルチオール、アセチルチオール、ジスルフィド基、アシル基、アシルアルキル、アルケニル、アルキルチオアルキル、アルキニル、アルコキシアルコキシ、アリール、アラルキル、アリール、アリールオ−ルキル、シクロアルキル、エーテル、エステル、ヘテロアリール、ヘテロシクリル、低級アルキル基、スルホン、スルホキシド、またはヒドロキシを表し、
R4はチオクト酸を表し、nは4〜8間の整数を表わす。
【0010】
ひとつの実施例として、R1、R2およびR3は、水素、メチル基、エチル基またはチオールを表し、R4は、チオクト酸の残基、アナログ、誘導体、または代謝産物のR−異性体を表す。
化合物2

【0011】
もうひとつの実施例として、R1、R2およびR3は、水素、メチル基、エチル基またはチオールを表し、R4はRS)−2、3ジサルファニルプロパン−1−オールを表す。
化合物3

【0012】
もうひとつの実施例として、R1、R2およびR3は、水素、メチル基、エチル基またはチオールを表し、R4は、(R)−2−アセトアミド−3−スルファニルプロパン酸を表す。
【0013】
さらに、当開示は下記の組成物を含む実施例を提供する:
a) R−(+)−リポ酸またはチオクト酸
b) 酢酸亜鉛(または)トリエチレンテトラミン、および
c) 化学式1の化合物
化学式1

ここで、
R1、R2、およびR3の各々は独自に、水素、チオール、アルキル、アルキルチオール、アセチルチオール、ジスルフィド基、アシル基、アシルアルキル、アルケニル、アルキルチオアルキル、アルキニル、アルコキシアルコキシ、アリール、アラルキル、アリール、アリールシオ−ルキル、シクロアルキル、エーテル、エステル、ヘテロアリール、ヘテロシクリル、低級アルキル基、スルホン、スルホキシド、またはヒドロキシを表し、
R4は、グアニジン、ヒドラジンの残留物、酸、ピルビン酸の残基、オキサロ酢酸の残留物、トコフェロールの残留物、アスコルビン酸の残基、チアミンの残留物、チオクト酸、チオクト酸の残基、アセチルシステイン残基、α−ケトグルタル酸の残基、ジメルカプロールの残基、ドナーNOの残留物、グルタチオンの残留物および上記のいずれかのアナログの少なくとも1つを表す。
【0014】
さらに、もうひとつの実施例としてここに開示されるのは、薬学的に許容される組成、例えば薬学的に許容される塩、酒石酸塩、エシル酸塩、メシル酸塩、硫酸塩、化学式1の水和物及び塩酸塩(但しこれらに限定されるわけではない)で以下のごとく構成される:
a)R−(+)−リポ酸(または)アセチルシステイン(または)ジメルカ;
b)酢酸亜鉛(または)トリエチレンテトラミン、および
c)化学式1の化合物
化学式1

ここで、R1、R2、およびR3は独自に、水素、チオール、アルキル、アルキルチオール、アセチルチオール、ジスルフィド基、アシル基、アシルアルキル、アルケニル、アルキルチオアルキル、アルキニル、アルコキシアルコキシ、アリール、アラルキル、アリール、アリールシオールキル、シクロアルキル、エーテル、エステル、ヘテロアリール、ヘテロシクリル、低級アルキル基、スルホン、スルホキシド、またはヒドロキシを表し、
R4は、グアニジン、ヒドラジンの残留物、酸、ピルビン酸の残基、オキサロ酢酸の残留物、トコフェロールの残留物、アスコルビン酸の残基、チアミンの残留物、チオクト酸、チオクト酸、アセチルシステイン残基、α−ケトグルタル酸の残基、ジメルカプロールの残留物は、NO供与体の残留物、グルタチオンの残基、(RS)−2、3ヂサルファニルプロパン−1の残基オール、(R)−2−アセトアミド−3−スルファニルプロパン酸及びこれらのいずれかのアナログの少なくとも1つを表す。
【0015】
実施例の一つとして、治療上有効な量を注射する(注射に限定されるわけではないないが)ことができる。他の実施例としては経口、局所、経粘膜、吸入、標的を合わせた送達、徐放性制剤を含む。局所に関する出願は点滴使用の眼科用薬でありうる。標的を合わせた送達は臓器への注入、経口のシロップ、錠剤またはカプセルでもありうる。
【0016】
ここで、この出願はさらにここに記載する製薬組成物を含むキットも提供する。このキットはさらに、銅の保持、肝障害またはそれに関連した合併症に関連する疾患の治療において使用する指示書も含み得る。
【0017】
さらに、ここで、以下のごとく、第1、第2の組成物により構成されるキットを提供する:a)第1の組成物はR−(+)−リポ酸やアセチルシステインまたはジメルカを含み;b)第2の組成物は化合物1A、化合物2、および/または化合物3の組み合わせ;c)第3の組成物は、トリエチレンテトラミン(または)亜鉛または酢酸テトラチオモリブデン酸アンモニウムである:
化学式1

ここで、
R1、R2、およびR3は独自に、水素、チオール、アルキル、アルキルチオール、アセチルチオール、ジスルフィド基、アシル基、アシルアルキル、アルケニル、アルキルチオアルキル、アルキニル、アルコキシアルコキシ、アリール、アラルキル、アリール、アリールシオールキル、シクロアルキル、エーテル、エステル、ヘテロアリール、ヘテロシクリル、低級アルキル基、スルホン、スルホキシド、またはヒドロキシを表し、
R4は、グアニジン、ヒドラジンの残留物、酸、ピルビン酸の残基、オキサロ酢酸の残留物、トコフェロールの残留物、アスコルビン酸の残基、チアミンの残留物、チオクト酸、チオクト酸の残基、アセチルシステイン残基、α−ケトグルタル酸の残基、ジメルカプロールの残基、ドナーNOの残留物、グルタチオンの残留物(R)−2−アセトアミド−3−スルファニルプロパン酸及びこれらのいずれかのアナログの少なくとも1つを表す。
【0018】
もうひとつの実施例として、R−リポ酸、ジメルカ、酢酸亜鉛、テトラチオモリブデン酸アンモニウムまたはトリエチレンテトラミンは、薬学的に許容される化合物1A、化合物2と3の塩のうちの少なくとも一つと組み合わされる。
【0019】
ここに開示される化合物、組成物、製剤、合成の方法、および治療は、様々な側面を達成するために任意の手段で実現することができ、また、哺乳動物に適した形で実行することができる。その他の機能は、以下に添付された詳細な説明により明らかになるであろう。
【図面の簡単な説明】
【0020】
【図1】図1は化合物1Aを代表する化合物を合成する最初の方法を示す。
【0021】
【図2】図2は化合物2によって代表される化合物を合成する2番目の方法を示す。
【0022】
【図3】図3は化合物3によって代表される化合物を合成する2番目の方法を示す。
【発明を実施するための形態】
【0023】
当開示においては、金属キレート化合物、組成物、制剤及びそれらの使用が開示される。化合物は化学式1の誘導体を含む。さらに、R−リポ酸、ジメルカ、酢酸亜鉛、テトラチオモリブデン酸アンモニウムまたはトリエチレンテトラミンを含む種しゅの化合物の組成は、薬学的に許容される化学式1による化合物の塩と組み合わされる。もうひとつの実施例としては、化学式1を異なる化合物に製造する方法が開示される。
【0024】
化合物は、酒石酸塩、エシル、メシル酸塩、硫酸塩、化学式1の含水塩をも含む。当出願はここに開示される製薬組成物を含むキットも提供する。キットは、銅の毒性、肝障害や合併症に関連する疾患の治療において使用される指示書を含む。
【0025】
定義
【0026】
本明細書において、以下の用語やフレーズは、以下に定める意味を有するものとする。別途の規定がない限り、ここに使用されるすべての技術用語および科学用語は、当技術分野で一般に理解されているのと同じ意味を持つ。
【0027】
用語アルキル」は、直鎖アルキル基、分岐鎖アルキル基、シクロアルキル(脂環式)基、アルキル置換シクロアルキル基及びシクロアルキル置換アルキル基を含む飽和脂肪族基のラジカルを意味する。好ましい実施例においては、直鎖または分岐鎖アルキルは30以下の炭素原子を主鎖中に(例えば、直鎖においてC1−C30、分岐鎖においてC3〜C30)を有するが、さらに好ましいのは20以下を有する。同様に、好ましいシクロアルキルは、3から10の炭素原子をその環構造に有し、より好ましくは5,6、または7の炭素を環構造に持つことである。
【0028】
本明細書で使用されている用語アルキル」は、1から12の炭素原子の飽和直鎖状又は分岐鎖状の一価の炭化水素基を意味する。アルキル基の例としては、これらに限定はされないが、メチル(Me、−CH3)、エチル(Et、−CH2CH3)、1−プロピル(n−PR、n−プロピル、−CH2CH2CH3)、2−プロピル(I−PR、i−プロピル、−CH(CH3)2)、1−ブチル(n−Bu、n−ブチル、−CH2CH2CH2CH3)、2−メチル−L−プロピル(I−Bu、i−ブチル、−CH2CH(CH3)2)、2−ブチル(S−Buは、s−ブチル、−CH(CH3)CH2CH3)、2−メチル−2−プロピル(T−Bu、t−ブチル、−C(CH3)3)、1−ペンチル(n−ペンチル、−CH2CH2CH2CH22CH3)、2−ペンチル(−CH(CH3)CH2CH2CH3)、3−ペンチル(−CH(CH2CH3)2)、2−メチル−2−ブチル(−C(CH3)2CH2CH3)3−メチル−2−ブチル(−CH(CH3)−CH(CH3)2)、3−メチル−1−ブチル(−CH2CH2CH(CH3)2)、2−メチル−L−ブチル(−CH2CH(CH3)CH2CH3)、1−ヘキシル(−CH2CH2CH2CH2CH2CH3)、2−ヘキシル(−CH(CH3)CH2CH2CH2CH3)、3−ヘキシル(−CH(CH2CH3)(CH2CH2CH3))、2−メチル−2−ペンチル(−C(CH3)2CH2CH2CH3)、3−メチル−2−ペンチル(−CH(CH3)−CH(CH3)CH2CH3)、4−メチル−2−ペンチル(−CH(CH3)CH2CH(CH3)2)、3−メチル−3−ペンチル(−C(CH3)(CH2CH3)22)、2−メチル−3−ペンチル(−CH(CH2CH3)CH(CH3)2)、2,3−ジメチル−2−ブチル(−C(CH3)2CH(CH3)2)、3,3−ジメチル−2−ブチル(−CH(CH3)C(CH3)3、1−ヘプチル、1−オクチルなどが挙げられる。用語アルケニル」は、少なくとも1つの部位が不飽和結合である、2から12の炭素原子を持つ一価の炭化水素のラジカルの直鎖状または分枝状連鎖、すなわち、炭素−炭素、sp二重結合であり、そこにおいて、アルケニルラジカルが、シス」とトランス」の向き、あるいは、E」とZ」の向きを持つラジカルを含む。例としては、これらに限定されるわけではないが、エチレニル又はビニル(−CH=CH2)、アリル(−CH2CH=CH2)などが挙げられる。アルキニル」という用語は、少なくとも1つの部位が不飽和結合である、2から12の炭素原子を持つ一価の炭化水素のラジカルの直鎖状または分枝状連鎖、すなわち、炭素−炭素、sp三重結合である。例としては、これらに限定されるわけではないが、エチニル(−C≡CH)、プロピニル(プロパルギル、−CH2C≡CH)などが挙げられる。
【0029】
また、本明細書、実施例、および特許請求の範囲全体で使用される用語アルキル」(または低級アルキル」)は非置換アルキル」および置換アルキル」―後者は炭化水素骨格の1つ以上の炭素上に水素を置換するアルキル部分を意味する―を含むことを意図する。このような置換基は、特に指定のない場合は、例えば、ハロゲン、ヒドロキシル、カルボニル(例えば、ホルミル基、アルコキシカルボニル基、カルボキシル基、アシル基など)、チオカルボニル(例えばチオエステル、チオ、チオホルメート)、アルコキシル、ホスホリル、ホスフェート、ホスホネート、ホスフィン酸塩、アミノ、アミド、アミジン、イミン、シアノ、ニトロ、アジド、スルフヒドリル、アルキルチオ、硫酸塩、スルホネート、スルファモイル、スルホンアミド、スルホニル、ヘテロシクリル、アラルキル、または芳香族またはヘテロ芳香族部分である。炭化水素鎖で置換された部分は適切な場合にはそれ自体が置換されてもよいということは、当分野の者によって理解されるであろう。例えば、置換アルキルの置換基は、アミノ、アジド、イミノ、アミド、ホスホリル(ホスホネート、ホスフィンを含む)、スルホニル(硫酸塩、スルホンアミド、スルファモイルおよびスルホン酸を含む)、およびシリル基の置換および非置換の形態を含むだけでなく、エーテル、アルキルチオ、カルボニル(ケトン、アルデヒド、カルボン酸塩、及びエステルを含む)、−CF3、−CNなどが挙げられる。代表的な置換アルキルは以下のごとくである。シクロアルキルはさらにアルキル、アルケニル、アルコキシ、アルキルチオ、アミノ、カルボニル置換アルキル、−CF3、−CNで置換されることができる。
【0030】
アシル」は当該分野では広く知られており、一般的化学式ヒドロカルビルC(O)−は、好ましくはアルキルC−(O)により代表されるグループである。
【0031】
アリール」は、各環が芳香族であるか、または1個以上の環と縮合して芳香環集合体を形成、単環または多環集合体を意味する。1つ以上の環原子が炭素(例えば、N、S)でない場合には、アリールはヘテロアリールである。Cxアリール及びCx−YアリールはXとYがリング内の炭素原子の数を示す場合に一般的に使用される。
【0032】
アシルアミノ」は当分野では広く知られており、アシル基で置換されるアミノ基を意味する用語であり、例えば、化学式ヒドロカルビルC(O)NH−によって表現され得る。
【0033】
アシルアルキル」は当分野では広く知られており、アシル基で置換されるアルキル基を意味する用語であり、例えば、化学式ヒドロカルビルC(O)アルキルによって表現され得る。
【0034】
アシルオキシ」は当分野では広く知られており、一般的な化学式ヒドロカルビルC(O)O−、好ましくはアルキルC(O)O−によって表現される基である。
【0035】
用語「アルコキシ」は、酸素が取り付いた、アルキル基、好ましくは低級アルキル基を意味する。代表的なアルコキシ基としては、メトキシ基、エトキシ基、プロポキシ基、第三−ブトキシ等が挙げられる。
【0036】
用語「アルコキシアルキル」はアルコキシ基で置換されたアルキル基を意味し、一般的な化学式アルキル−O−アルキルで表現される。
【0037】
本明細書において使用されている用語「アルケニル」は、少なくとも1つの二重結合を含む脂肪族基を意味し、「非置換アルケニル」および「置換アルケニル」−後者は、アルケニル基の1つ以上の炭素上の水素を置換するアルケニル部分を意味する−、を含むことを意図する。このような置換基は、1つ以上の二重結合に含まれる、あるいは含まれない、1つ以上の炭素上で発生する可能性がある。
【0038】
また、そのような置換基は、安定性が困難である場合を除き、以下に述べるように、アルキル基のために考えられるすべてのものを含む。例えば、1個以上のアルキル、カルボシクリル、アリール、ヘテロシクリル、またはヘテロアリール基によるアルケニル基の置換が考えられる。
【0039】
本明細書において使用されている用語「アルキルアミノ」は、少なくとも一つのアルキル基で置換されたアミノ基を意味する。
【0040】
本明細書において使用されている用語「アルキルチオ」は、アルキル基で置換されたチオール基を意味し、一般的な化学式アルキルS−により表現される。
【0041】
本明細書において使用されている用語「アルキニル」は、少なくとも一つの三重結合を含む脂肪族基を意味し、「非置換アルキニル」および「置換アルキニル」(後者はアルキニル基の1つ以上の炭素上の水素を置換するアルキニル部分を意味する)を含むことを意図している。このような置換基は、1個以上の三重結合に含まれる、あるいは含まれない1つ以上の炭素上で発生する可能性がある。また、このような置換基は、安定性が困難である場合を除いて、上述したようにアルキル基のために企図されたすべてが含まれる。例えば、1個以上のアルキル、カルボシクリル、アリール、ヘテロシクリル、またはヘテロアリール基によって置換することが考えられる。
【0042】
本明細書において使用されている用語「エーテル」は、他のヒドロカルビル基に酸素を介して結合するヒドロカルビル基を意味する。したがって、ヒドロカルビル基のエーテル置換基はヒドロカルビル−O−であり得る。エーテルは、対称、または非対称であり得る。エーテル類の例としては、これらに限定されるわけではないが、複素環−O−複素環、アリール−O−複素環が含まれる。エーテルは、一般的な化学式アルキル−O−アルキルで表現される「アルコキシアルキル」基を含む。
【0043】
本明細書で使用されている用語「ハロ」と「ハロゲン」はハロゲンを意味し、クロロ、フルオロ、ブロモ、およびヨードを含む。
【0044】
本明細書で使用されている用語「ヘタアルキル」と「ヘテロ」は、ヘタリール基で置換されたアルキル基を意味する。
【0045】
本明細書において使用されている用語「ヘテロアルキル」は、炭素原子と少なくとも1つのヘテロ原子の、飽和または不飽和の鎖を意味し、そこにおいては2つのヘテロ原子が隣接していない。
【0046】
用語「ヘテロアリール」および「ヘタリール」は置換または非置換の芳香族単環構造、好ましくは5−7の構成員を有する環構造で、その環構造は、少なくとも1個のヘテロ原子、好ましくは1〜4個のヘテロ原子、より好ましくは、1個または2個のヘテロ原子により構成される。用語「ヘテロアリール」および「ヘタリール」はまた、環の少なくとも一つは、ヘテロであるところの、2つの隣接する環に対して2つ以上の炭素が共通していることを特徴する2つ以上の環を有する多環式環系を含む。すなはち、他の環はシクロアルキル、シクロアルケニル、シクロアルキニル、アリール、ヘテロアリール、及び/又はヘテロシクリルであり得る。ヘテロアリール基は、例えば、ピロール、フラン、チオフェン、イミダゾール、オキサゾール、チアゾール、ピラゾール、ピリジン、ピラジン、ピリダジン、ピリミジンなどを含む。
【0047】
本明細書で使用されている用語「ヘテロ原子」は、炭素または水素以外の元素の原子を意味する。好ましいヘテロ原子は、窒素、酸素、硫黄である。
【0048】
用語「ヘテロシクリル」、「複素環」、および「複素環的」とは、好ましくは3−10の構成員、より好ましくは3−7の構成員の、置換もしくは非置換の非芳香族環構造を意味する。そして、その環構造は少なくとも一つのヘテロ原子、好ましくは1〜4個のヘテロ原子、より好ましくは1または2個のヘテロ原子を含む。「ヘテロシクリル」および「複素環」という用語はまた、環の少なくとも一つが複素環であるところの、2つ以上の炭素が2つの隣接する環に共通している、2つ以上の環を有する多環式環系を含む。すなはち、他の環はシクロアルキル、シクロアルケニル、シクロアルキニル、アリール、ヘテロアリール、及び/又はヘテロシクリルであり得る。ヘテロシクリル基は、例えば、ピペリジン、ピペラジン、ピロリジン、モルホリン、ラクトン、ラクタム等を含む。
【0049】
本明細書において使用されている用語「ヘテロサイクリルアルキル」は、複素環基で置換されたアルキル基を意味する。
【0050】
本明細書で用いられる用語「ヒドロカルビル」は、=Oまたは=S置換基を持たない炭素原子を介して結合した基を意味し、典型的には少なくとも1つの炭素−水素結合と主要な炭素バックボーンを有し、任意にヘテロ原子を含んでもよい。したがって、メチル、エチル、2−ピリジル、およびトリフルオロメチルは当出願に関しては、アセチルなどの置換基はヒドロカルビルであるとみなされる。但し、アセチルのような置換基(連結炭素上に=Oの置換基を有する)およびエトキシ(炭素ではなく酸素を介してリンクされている)はそうではない。ヒドロカルビル基は、アリール、ヘテロアリール、炭素環、複素環、アルキル、アルケニル、アルキニル、およびそれらの組み合わせを含みまたこれらに限定されるものではない。
【0051】
本明細書で用いられる用語「ヒドロキシアルキル」とは、ヒドロキシ基で置換されたアルキル基を意味する。
【0052】
用語「ケトン」は当分野で認識されており、例えば、化学式C(O)R9によって表現することができる。ここで、R9はヒドロカルビル基を表す。
【0053】
用語「低級」はアシル、アシルオキシ、アルキル、アルケニル、アルキニル、アルコキシ等の化学的部分と共に使用される場合には、10個以下、好ましくは6個以下の非水素原子が存在する置換基を含むことを意味する。「低級アルキル」とは、例えば、10個以下、好ましくは6個以下、の炭素原子を含むアルキル基を意味する。低級アルキルは、メチルおよびエチルを含む。特定の実施例においては、本明細書中で定義されたアシル、アシルオキシ、アルキル、アルケニル、アルキニル、またはアルコキシ置換基は、それらが単独で、または他の置換基との組み合わせ(詳細にはヒドロキシアルキルおよびアラルキル等(例えば、アルキル置換基で炭素原子を数える際に、アリール基内の原子は数えられない))として現れるかどうかに関わらず低級アシルオキシ、低級アルキル、低級アルケニル、低級アルキニル、または低級アルコキシ、それぞれ低級アシルアールである。
【0054】
「置換」という用語は、1つ以上の炭素骨格上の水素を置換する置換基を有する部分を意味する。「置換」、「による置換」は、置換される原子と置換基の許容価に従ったものであり、このような置換が安定した化合物―例えば、転位、環化、除去などなどにより自発的変換を受けない−を結果として生み出すという暗黙の但し書きを含むことが理解される。本明細書においては、「置換される」という用語は有機化合物のすべての許容可能な置換基を含むように意図されている。広義では、許容可能な置換基とは、有機化合物の非環式および環式、分枝状および非分岐、炭素環および複素環式、芳香族および非芳香族置換基を挙げることができる。許容可能な置換基は、適切な有機化合物に対しては1つ以上で、同一または異なっているかもしれない。当出願に関しては、窒素などのヘテロ原子は、水素置換基、あるいは、置換基を有するヘテロ原子の原子価を満たす本明細書に記載の任意の許容可能な有機化合物の置換を持ちうる。置換基は本明細書において記述された任意の置換基、例えば、ハロゲン原子、水酸基、カルボニル(例えば、ホルミル基、アルコキシカルボニル基、カルボキシル基、アシル基など)、チオカルボニル(例えばチオエステル、チオアセテート、チオホルメート)、アルコキシル、ホスホリル、ホスフェート、ホスホネート、ホスフィン酸塩、アミノ、アミド、アミジン、イミン、シアノ、ニトロ、アジド、スルフヒドリル、アルキルチオ、硫酸塩、スルホン酸塩、スルファモイル、スルホンアミド、スルホニル、ヘテロシクリル、アラルキル、または芳香族またはヘテロ芳香族部分を含みうる。適切な場合には、炭化水素鎖上で置換された部分はそれ自体が置換され得ることは、当業者には理解されるであろう。
【0055】
特に「置換されていない」として明記されていない限り、本明細書における化学的部分への言及は置換変異体を含むものと理解される。例えば、「アリール」基または部分への言及は、明記されなくても置換および非置換の変異体の両方を含む。
【0056】
「置換または非置換」は与えられた部分は利用可能な原子価を通じ、水素置換基(置換されていない)により、またはさらに他の方法で指定された部分の名前で指定されていない使用可能な原子価(置換)を介して1つ以上の非水素置換基により、構成されることを意味する。例えば、イソプロピルは−CH3で置換されているエチレン部分の例である。一般的に、非水素置換基は、置換されるように指定されている特定の部分の原子に結合され得る任意の置換基であり得る。置換基の例としては、これらに限定されるわけではないが、アルデヒド基、脂環族、脂肪族、(C1−10)アルキル、アルキレン、アルキリデン、アミド、アミノ、アミノアルキル、芳香族、アリール、ビシクロアルキル、ビシクロアリル、カルバモイル、炭素環基、カルボキシル基、カルボ二ル基、シクロアルキル、シクロアルキレン、エステル、ハロ、ヘテロビシクロアルキル、ヘテロシクロアルキレン、ヘテロアリル、ヘテロビシクロアリル、ヘテロシクロアルキル、オキソ、ヒドロキシ、イミノケトン、ケトン、ニトロ、オキサアルキル及びオクソアルキル部分を含み、また、これらの各々は必要に応じて置換または非置換でありうる。特定の実施例の1つとしては、置換基の例は、これらに限定されるわけではないが、水素、ハロ、ニトロ、シアノ、チオ、オキシ、ヒドロキシ、カルボニルオキシ、(C1−10)アルコキシ、(C4−12)アリールオキシ、ヘテロ(C1−10)アリールオキシ、カルボニル、オキシカルボニル、アミノカルボニル、アミノ、(C1−10)アルキルアミノ基、スルホンアミド基、イミノ基、スルホニル基、スルフィニル基、(C1−10)アルキル、ハロ(C1−10)アルキル、ヒドロキシ(C1−10)アルキル、カルボニル(C1−10)アルキル、チオカルボニル(C1−10)アルキル基、スルホニル(C1−10)アルキル基、スルフィニル(C1−10)アルキル、(C1−10)アザアルキル、イミノ(C1−10)アルキル、(C3−12)シクロアルキル(C1−5)アルキル、ヘテロ(C3−12)シクロアルキル(C1−10)アルキル、アリール(C1−10)アルキル、ヘテロ(1−10)アリール(C1−5)アルキル、(C9−12)ビシクロアリル(Ci_s)アルキル、ヘテロ(Ce−12)ビシクロアリル(C1−5)アルキル、(C3−12)シクロアルキル、ヘテロ(C3−12)シクロアルキル、(C9−12)ビシクロアルキル、ヘテロ(C3−12アリール)ビシクロアルキル、(C4−12)アリール、ヘテロ(C1−10)アリール、(C9−12)ビシクロアリルおよびヘテロ(C4−12)ビシクロアリルを含む。また、置換基自体が任意にさらに置換基で置換される。特定の実施例の1つとしては、さらなる置換基の例は、これらに限定されるわけではないが、水素、ハロ、ニトロ、シアノ、チオ、オキシ、ヒドロキシ、カルボニルオキシ、(C1−10)アルコキシ、(C4−12)アリールオキシ、ヘテロ(C1−10)アリール、カルボニル、オキシカルボニル、アミノカルボニル、アミノ、(C1−10)アルキルアミノ基、スルホンアミド基、イミノ基、スルホニル基、スルフィニル基、(C1−10)アルキル、ハロ(C1−10)アルキル、ヒドロキシ(C1−10)アルキル、カルボニル(C1−10)アルキル、チオカルボニル(C1−10)アルキル基、スルホニル(C1−10)アルキル基、スルフィニル(C1−10)アルキル、(C1−10)アザアルキル、イミノ(C1−10)アルキル、(C3−12)シクロアルキル(C1−5)アルキル、ヘテロ(C3−12)シクロアルキル(C1−10)アルキル、アリール(C1−10)アルキル、ヘテロ(C1−10)アリール(Ci_5)アルキル、(C9−I2)ビシクロアリル(C1−5)アルキル、ヘテロ(C8−12)ビシクロアリル(Ci_s)アルキル、(C3−12)シクロアルキル、ヘテロ(C3−12)シクロアルキル、(C9−12)ビシクロアルキル、ヘテロ(C3−12)ビシクロアルキル、(C4−12)アリール、ヘテロ(1−10)アリール、(C9−12)ビシクロアリルおよびヘテロ(C4−12)ビシクロアリルを含む。
【0057】
化学式1における当化合物の化合物は、薬学的に許容される塩の形で存在し得る。当開示の化合物は薬学的に許容されるエステル(すなわち、化学式Iの酸のメチル及びエチルエステルがプロドラッグとして使用される)の形で存在し得る。当開示の化合物は溶媒和、すなわち水和することができる。溶媒和は、製造工程の途中で行うことができるし、あるいは、化学式I(水和)の初期無水化合物の吸湿性の結果として起こり得る。
【0058】
同じ分子化学式を持つが、空間内の原子の配列、原子の結合順序、性質が異なる化合物は「異性体」と呼ばれる。空間内のそれらの原子の配置が異なる異性体は、「立体異性体」と呼ばれる。ジアステレオマーは、鏡像異性体ではない、一つ以上のキラル中心において正反対の構成を持つ立体異性体である。互いに重ね合わせることができない鏡像である1つ以上の非対称中心をもつ立体異性体は、「鏡像異性体」と呼ばれる。化合物が非対称中心を有する場合、例えば、炭素原子が4つの異なる基に結合している場合、鏡像異性体のペアが可能である。鏡像異性体は、その非対称中心または中心の絶対配置によって特徴づけることができ、カーン、インゴルドおよびプレローグのR−及びS−シーケンシングルールにより、あるいは、分子が偏光面を回転させ、右旋性または左旋性(すなわち、(+)または(−)−異性体)として指定される方法により、記述される。キラル化合物は、1個の鏡像異性体、又はその混合物として存在し得る。鏡像異性体を等しい割合で含有する混合物は「ラセミ混合物」と呼ばれる。
【0059】
用語「硫酸塩」は当該分野で認識され、グループOSO3H、または薬学的に許容されるその塩を指す。化学式1の化合物の硫酸塩、あるいは、その水晶体は水和物であり得る。結合された水の数は、再結晶や乾燥の条件を変えることによって制御することができる。塩の形は塩酸塩でもあり得る。
【0060】
本明細書で使用する用語「多形」は当分野で認識されており、与えられた化合物の一つの結晶構造を意味する。
【0061】
「残基」とは、当該分野で認識される用語であり、分子の部分を指す。例えば、チオクト酸の残基は以下のようになります。ジヒドロリポ酸、ビスノリポイク酸、テトラノリポイク酸、6,8−ビスメチルメルカプト−オクタン酸、4,6−ビスメチルメルカプト−ヘキサン酸、2,4−ビスメチルメルカプト−ブタン酸、4,6−ビスメチルメルカプト−ヘキサン酸。
【0062】
用語「プロドラッグ」は、生理的条件下で、当開示の治療上活性な薬剤に変換される化合物を包含することが意図されている。プロドラッグを作る一般的な方法は、所望の分子を明らかにするために、生理学的条件下で加水分解される選択された部分を含む。他の実施例においては、プロドラッグは宿主動物の酵素活性によって変換される。
【0063】
用語「予防的、又は療法的」な治療は当分野では知られており、一つ以上の該当組成物のホストへの投与を含む。望ましくない状態の臨床症状(例えば、疾患または宿主動物の他の望ましくない状態)前に投与される場合は、治療は予防的である。
すなわち、それは宿主が望ましくない状態におちいることから保護する。他方で、望ましくない状態の起こった後で投与される場合は、治療は療法的(すなわち、それは、既存の望ましくない状態や副作用を減少、改善、安定させるために意図されている)である。
【0064】
本明細書で用いられる用語「溶媒和物」は、溶媒(例えば、溶質の分子またはイオンと溶媒分子の組み合わせによって形成さ化合物)によって形成された化合物を指す。
【0065】
本開示は本明細書において開示されるごとく、組成物のプロドラッグや薬学的に許容されるプロドラッグの塩も考察する。
【0066】
当出願はまた、薬学的に許容される媒介物により構成される医薬組成物および、チオクト酸、あるいは、チオクト酸残基、ジメルカプロールまたはアセチルシステインおよび、化合物1A、2または3の化合物の塩の組成物を開示する。当出願はさらに薬学的に許容される媒介物、(a)リポ酸またはリポ酸残基(b)化学式Iの化合物(c)ジメルカ、アセチルシステイン、酢酸亜鉛、またはアンモニウムチオモリブデイトにより構成される医薬組成物を開示する。医薬組成物は、全身または局所投与のために処方することができる。医薬組成物は、経口投与、注射、皮下投与、または経皮投与のために処方することができる。医薬組成物はさらに、薬学的に許容される安定剤、希釈剤、界面活性剤、フィラー、バインダー、ルブリマイトの少なくとも一つを含むことができる。
【0067】
加えて、特定化合物1A、2、3、または組成物の最適な濃度、量は、治療パラメータの変化に適応するように調整することができる。このような治療パラメータは臨床使用に対する準備、例えば、治療部位、患者のタイプ、例えば、ヒトかヒトでないか、大人か子供か、また、疾患、状態の性質が含まれる。
【0068】
ウィルソン病(WD)は、さまざまな臓器や組織において当金属の蓄積につながる銅代謝の常染色体劣性遺伝疾患である。肝臓と神経症状は、この病気の主な臨床特徴である。銅に関連した疾患に関する報告は人間と動物の両方で増加している。銅はまた、銅代謝の遺伝的異常を持つ子供に影響を与える致命的な、非ウィルソンの肝臓疾患において役割をはたしている。銅の過剰蓄積はまた、原発性胆汁性肝硬変などの慢性肝臓疾患、及び、人間や動物などの哺乳動物における慢性肝炎の結果としても起こる。
【0069】
特定の実施例においては、化学式Iの化合物1A、2と3、および組成物、1つまたは複数の銅の毒性に関連した疾患または合併症を治療に用いることができる。合併症は、肝(肝硬変、慢性活動性肝炎、劇症肝不全)、神経(運動緩慢、硬直、振戦、運動失調、ジスキネジア、構音障害、発作)、精神科(行動障害、認知障害、精神病)、眼科(カイザー?フライシャー環、サンフロー白内障)、血液(溶血、凝固障害)、腎臓(腎尿細管の欠陥、減少、糸球体濾過、腎結石)、循環器病(心筋症、不整脈、伝導障害、自律神経障害)、筋骨格系(骨軟化症、骨粗しょう症、変形性関節疾患)、消化器(胆石症、膵炎、細菌性腹膜炎)、内分泌(無月経、自然流産、思春期遅発症、女性化乳房)、皮膚科(色素沈着、アメイソシスニグリメイ)を含む。
【0070】
組成物は、単独または薬学的に許容される媒介物、仲介物、または希釈剤と組み合わせて、また単一または複数の用量で、他の薬剤、例えば、鎮痛剤と共に投与することができる。ただしこれらに限定されるわけではない。 適当な医薬媒介物、仲介物、希釈剤としては、不活性固体希釈剤または充填剤、滅菌水溶液および各種有機溶媒が挙げられる。組成物および薬学的に許容される媒介物、仲介物、希釈剤を組み合わせることによって形成される製薬組成物は、その後直ちに、錠剤、散剤、トローチ剤、シロップ剤、注射用液剤等の形で投与される。これらの医薬組成物は、望みに応じて、香料、結合剤、賦形剤などの追加の成分を含有することができる。したがって、経口投与の目的のために、例えば、L−アルギニン、クエン酸ナトリウム、カルシウム炭素、リン酸カルシウムのような種しゅの賦形剤を含む錠剤を、デンプン、アルギン酸およびある種の複合ケイ酸塩などの様々な崩壊物と一緒に、また、ポリビニルピロリドン、スクロース、ゼラチン、アカシアなどの結合剤と共に投与することができる。さらに、ステアリン酸マグネシウム、ラウリル硫酸ナトリウム及びタルクなどの滑沢剤は、錠剤化目的にはしばしば有用である。同様なタイプの固体組成物は、ソフト、ハード充填されたゼラチンカプセル中の充填剤として用いることができる。これに適した材料は、ラクトース、乳糖および高分子量ポリエチレングリコールが挙げられる。水性懸濁液またはエリキシル剤が経口投与のために所望される場合、必須の有効成分は、種々の甘味剤または香味剤、染色剤、着色剤、また、望むならば、乳化剤または懸濁剤、そして、水、エタノール、プロピレングリコール、グリセリンなどの希釈剤、およびそれらの組み合わせと混ぜあわせることができる。
【0071】
活性成分または治療成分に加え、錠剤は、賦形剤として知られる不活性材料をいくつも含めることができる。それらは最終的に錠剤において果たす役割により分類することができる。一次組成物は一つ以上の充填剤、結合剤、滑沢剤と流動化剤を含み得る。タブレットが完成された状態に物理的な特性を与える他の賦形剤は、着色剤、及び味剤(特にチュアブル錠の場合)である。賦形剤なしでは大部分の薬や医薬品成分は錠剤に直接圧縮することができない。これは大部分の薬剤には流動、凝集特性が余り無いことが主要な原因である。通常、賦形剤は、圧縮されている材料に良好な流動性および圧縮特性を付与するために添加される。このような特性は、湿式造粒、スラッギング、噴霧乾燥球形化、あるいは、結晶化などの前処理ステップを通じて付与される。
【0072】
潤滑剤は、典型的には、錠剤化材がパンチに粘着するのを防ぎ、錠剤圧縮中の摩擦を最小限に抑え、ダイからの圧縮された錠剤の除去を可能にするために追加される。このような潤滑剤は、一般的に通常重量で約1%の量が最終の錠剤ミックスに含まれている。
【0073】
賦形剤の他の望ましい特徴には、次のものがある:低圧縮力で強い錠剤を作る高圧縮性;粉末材料に凝集性を付与する;受け入れられる崩壊速度;化学式中の他の賦形剤の流動性を改善する良好な流動特性;結束性(処理、輸送および取り扱い中に錠剤が割れることを防ぐため)。
【0074】
圧縮された錠剤を作る上で少なくとも3つの商業的に重要なプロセスがある:湿式造粒、直接圧縮及び乾式造粒(スラッギングまたはローラー圧縮)。賦形剤の準備方法、種類は錠剤処方に錠剤の急速な圧縮を可能にする所望の物理的特性を与えるように選択される。圧縮した後、錠剤は外観、硬さ、崩壊能力など幾つかの追加属性と受け入れられる溶解性のプロファイルを持っている必要がある。フィラーその他の賦形剤の選択は、薬物の化学的および物理的特性、加工中の混合物の挙動、最終タブレットのプロパティに依存する。提案された賦形剤と活性成分の化学的および物理的な互換性を判断するために、処方前の試験が行われる。
【0075】
薬剤の性質、その剤形および操作の経済性が、錠剤製造の最適プロセスの選択を決定する。一般的には、湿式造粒法と直接圧縮の両方がタブレットの開発に使用されている。
【0076】
ひとつの製剤は以下を含む:化学式Iの化合物とバインダー。薬学的に許容されるバインダーの例としては、澱粉、セルロース及びその誘導体を含む。ただし、これだけに限定されるわけではない。例えば、微結晶セルロース、ヒドロキシプロピルセルロース、ヒドロキシエチルセルロースとヒドロキシエチルプロピリメチル、セルロース、スクロース、ブドウ糖、コーンシロップ、多糖類とゼラチン。バインダーは例えば、組成物の重量に対して、約1%から約40%、つまり、1%〜30%、1%〜25%、または1%〜20%として存在し得る。
【0077】
必要に応じて、1つ、2つ、3つまたはそれ以上の希釈剤をここに開示された制剤に追加することができる。薬学的に許容されるフィラーおよび薬学的に許容される希釈剤の例は、これらに限定されるわけではないが、粉砂糖、圧縮糖、デキストレート、デキストリン、デキストロース、ラクトース、マンニトール、微結晶セルロース、粉末セルロース、ソルビトール、スクロースおよびタルクを含む。充填剤または希釈剤は、例えば、組成物の重量で約15%〜約40%存在し得る。特定の実施例では、希釈剤は、α−セルロースの制御された加水分解によって製造され、希鉱酸溶液により、繊維状の植物原料からパルプとして得られた微結晶セルロースである。加水分解後、水和セルロースを濾過により精製し、水性スラリーは、幅広く分布した乾燥、多孔質粒子を形成するために乾燥スプレーされる。適切な微結晶性セルロースは約20nm〜約200nmの平均粒径を持つ。微結晶性セルロースは、いくつかの業者から入手可能である。適切な微結晶セルロースは、FMC社製アビセルPH101、アビセルPH102、アビセルPH103、アビセルPH105、アビセルPH200である。微結晶性セルロース量は重量で約25%から約70%が処方された錠剤中に存在し得る。この材料の他の適切な範囲は、重量で約30%〜約35%であり、重量で約30%から約32%も他の適切な範囲である。別の希釈剤はラクトースである。乳糖は、処方前に約50μmと約500μmとの間の平均粒子サイズを有するように粉砕することができる。ラクトースは重量で約5%〜約40%、処方錠剤中に存在してよいし、重量で約18%から約35%、例えば、約20%から約25にすることができる。
【0078】
必要に応じて1個、2個、3個またはそれ以上の崩壊剤をここに記述された制剤に追加することができる。薬学的に許容される崩壊剤の例には、これらに限定されるわけではないが、デンプン、粘土、セルロース、アルギン酸塩、ガム、架橋ポリマー、例えば、架橋ポリビニルピロリドン、架橋カルボキシメチルセルロースカルシウム、架橋カルボキシメチルセルロースナトリウム、大豆多糖類、及びグアーガムがある。崩壊剤は、例えば、組成物の重量について、2%から約20%、例えば、約5%から約10%、約7%の量で存在し得る。崩壊剤はまた、錠剤製剤のオプションではあるが、有用な成分である。崩壊剤は、錠剤が受け入れられる崩壊率を持っていることを確認するために含まれる。典型的な崩壊剤としては、デンプン誘導体およびカルボキシメチルセルロースの塩が挙げられる。デンプングリコール酸ナトリウムは、当製剤用に適切な崩壊剤である。特定の実施例においては、崩壊剤は重量で約0%〜約10%で錠剤処方中に存在し、約1%〜約4%、例えば、重量で約2.5%にすることができる。
【0079】
必要に応じて1個、2個、3個またはそれ以上の潤滑剤をここに開示された制剤に追加することができる。薬学的に許容される潤滑剤および薬学的に許容される滑剤の例としては、これらに限定されるわけではないが、コロイド状シリカ、三ケイ酸マグネシウム、デンプン、タルク、第三リン酸カルシウム、ステアリン酸マグネシウム、ステアリン酸アルミニウム、ステアリン酸カルシウム、マグネシウムカルボネイト、酸化マグネシウム、ポリエチレングリコール、粉末セルロース、微結晶セルロースが含まれる。潤滑剤は、例えば、組成物の重量で約0.1%〜約5%、存在し得る。他方、グリダントは、例えば、重量で約0.1%〜約10%として存在し得る。潤滑剤は、典型的には、錠剤化材料がパンチに粘着するのを防ぎ、錠剤圧縮中の摩擦を最小限に抑え、ダイからの圧縮された錠剤の除去を可能にするために追加される。このような潤滑剤は、一般的に最終錠剤ミックスに重量で1%未満で含まれている。潤滑成分は疎水性または親水性であり得る。潤滑剤の例は、ステアリン酸、タルク、ステアリン酸マグネシウムを含む。ステアリン酸マグネシウムは、錠剤の圧縮?吐出時にダイ壁やタブレットミックスとの間の摩擦を低減する。それはまた、パンチとダイへの錠剤の付着を防止するのに役立つ。ステアリン酸マグネシウムはまた、ホッパー内、ダイへの粉体の流れを助ける。それは450から550ミクロンの粒径範囲を持ち、1.00〜1.80グラム/mLの濃度範囲を持つ。それは安定しており、錠剤ミックス内で重合されない。一潤滑剤、ステアリン酸マグネシウムもまた、製剤に使用することができる。いくつかの態様では、潤滑剤は約0.25%〜約6%で錠剤処方中に存在する。また、適切なのは重量で約0.5%〜約4%、約0.1%〜約2%の水準である。他の可能な潤滑剤には、タルク、ポリエチレングリコール、シリカ、硬化植物油が含まれる。オプションの実施例においては、潤滑剤は製剤中に存在せず、ダイまたはパンチに噴霧され、製剤には直接追加されない。
【0080】
その他の従来の固体充填剤又は媒介物、例えば、コーンスターチ、リン酸カルシウム、硫酸カルシウム、ステアリン酸カルシウム、ステアリン酸マグネシウム、ステアリン酸グリセリル、モノおよびジステアリン酸、ソルビトール、マンニトール、ゼラチン、天然または合成ゴム、例えば、カルボキシメチルセルロース、メチルセルロース、アルギン酸塩、デキストラン、アカシアガム、カラヤガム、ローカストビーンガム、トラガントガムなど、希釈剤、結合剤、滑沢剤、崩壊剤、着色料及び香料は必要に応じて使用することができる。
【0081】
必要に応じて組成物に添加することができる有用な賦形剤のさらなる例が編医薬品添加物ハンドブック、第3版、AHKibbe編集、アメリカの薬剤師会発行、ワシントンDC、ISBN:0−917330−96−X、または医薬品添加物ハンドブック(第4版)、レイモンド・C・ロウ編集、出版社:科学と実践に記載されている。
【0082】
制剤、例えば、錠剤、は3から800、または20から600,例えば50、250、300、400mgの化合物1A、2、3の化合物と組成物を含み得る。例えば、化学式IまたはII、または化合物1A、2、3の化合物の塩、あるいは(a)リポ酸,リポ酸残基と(b)化合物1A、2,3の化合物と(c)ジメルカプロール、アセチルシステイン、酢酸亜鉛またはアンモニウムチオモルブデイトを含み得る。
【0083】
当該組成物は一回投与することも、または組成物の放出速度および所望の投薬量により、時間の間隔を変えて少ない用量を何回かに分けて投与することもできる。
【0084】
眼科製剤、眼軟膏剤、散剤、液剤なども、当開示の範囲内であると考えられる。製薬組成物に使用できる適切な水性および非水性媒介物の例は水、エタノール、ポリオール(例えば、グリセロール、プロピレングリコール、ポリエチレングリコール等)、およびそれらの適切な混合物、オリーブ油などの植物油、およびオレイン酸エチルなどの注射用有機エステルなどを含む。適切な流動性は、例えば、レシチンなどのコーティング材料の使用により、分散液の場合には必要な粒子サイズを維持することにより、また、界面活性剤の使用によって維持することができる。
【0085】
合成の方法
合成例1:
【0086】
図の1、2、3は、化合物1A、2と3のような様々な化合物ための化学式1の組成のための5ステップの合成プロセスを示す。
化合物1A、2および3のステップ1:(2S)−2−アミノ−3−メチル−3−スルファニル−ブタン酸(初期化合物1)またはD−(−)−ペンシラミンおよびジクロロメタン(DCM)を一緒に混合し、マグネチックスターラーを含む耐圧瓶内の反応混合物とした。反応混合物(中間化合物1)を含む耐圧瓶はしっかりとゴム隔膜で閉じた。反応混合物を含む耐圧瓶はさらにドライアイス浴で7−8℃で2−アイソプロポノル/ドライアイスで冷却した。凝縮されたイソブチレンをカニューレを使用して耐圧瓶に移し、次に反応混合物に硫酸を数滴を追加した。イソブチレンの追加を2時間続けた。反応混合物の撹拌をさらに16時間、室温で続けた。耐圧瓶はi−PrOH/ドライアイス浴中で維持し、ゴム隔膜を慎重に除去した。反応混合物を数分間攪拌することにより、完全に脱気させるようにした。飽和NaHCO3水溶液を反応混合物に添加し、得られた反応混合物を室温で2時間撹拌した。水層のpHを測定し、8として記録した。水が中和工程中に形成された乳剤の除去のために追加された。水層をDCMで使用して処理し、抽出した。全体のDCM抽出物は一緒にした。一緒にされたDCM抽出物を飽和NaHCO3水溶液、水および飽和塩化ナトリウム水溶液で洗浄した。結果有機層は、中間化合物2を作るために、減圧下で濃縮し、濾過し、MgSO4雰囲気下で乾燥させた。
化合物1A、2、3のステップ2:室温で30分間、エタノールパラホルムアルデヒドと共にアミノチオールを縮合して、中間化合物3としてのチアゾリジン誘導体が得られた。
化合物1A、2、3のステップ3:チアゾリジン誘導体中間化合物3は、0℃で無水ジメルカプロール内で、N、N−ジイソプロピルエチルアミン(DIPEA)の1.5当量の存在下で、1−クロロエチルクロロホルメートの1.0当量で処理した。反応混合物を0℃で30分間攪拌し、中間化合物4を得た。反応が終了した時点で、品質を薄層クロマトグラフィー(TLC)を行うことによって監視、記録した。観察に基づき、品質が良好であった場合、ステップ3の中間化合物4は、さらなる精製工程なしで、直接次の工程に用いた。
化合物1Aのステップ4:リポ酸のカリウム塩を0℃で乾燥ジメチルホルムアルデヒド下において、リポ酸、無水K2CO3を反応させて得た。ステップ3の当反応混合物を上記の溶液にゆっくりと加えた後、粗反応混合物を室温で16時間攪拌した。反応をTLCによりモニターした。粗反応混合物を水とジクロロメタンを用いて真空蒸留、分画した。合わせた水と有機層をブライン溶液で洗浄し、無水Na2SO4上で乾燥し、減圧下で蒸発させた。粗反応混合物は、100〜200メッシュのシリカゲル上のカラムクロマトグラフィーにより精製し、リポ酸誘導体の中間化合物5を得た。
化合物2のステップ4:中間化合物4を、0℃で乾燥ジメチルホルムアミド内で、(2,2−ジメチル−1,3−ジチオラン−4−イル)メタノールナトリウム塩(DMF)溶液にゆっくりと加え、反応混合物3を作った。反応混合物3を室温で16時間攪拌した。反応混合物の3を蒸発法を用いて乾燥させた。乾燥した反応混合物を分割した後、水及びDCMで洗浄した。複合有機層をブライン溶液で洗浄し、無水Na2SO4上で乾燥後、減圧下で蒸発させた。得られた粗化合物は100〜200メッシュのシリカゲル上のカラムクロマトグラフィーにより精製し、化合物5を得た。
化合物3のステップ4:中間化合物4は反応混合物3を作るために0℃で乾燥ジメチルホルムアミド(DMF)中の3−アセチルチアゾリダイン−4−カルボン酸カリウム塩の溶液にゆっくりと加えた。反応混合物3を室温で16時間攪拌した。反応混合物の3を蒸発法を用いて乾燥させた。乾燥した反応混合物を分割した後、水及びDCMで洗浄した。複合有機層をブライン溶液で洗浄し、無水Na2SO4で乾燥後、減圧下で蒸発させた。得られた粗化合物は化合物5を得るために100〜200メッシュのシリカゲル上のカラムクロマトグラフィーにより精製した。
化合物1Aのステップ5:前のステップ4で得られた中間化合物5は、中間化合物5のチアゾリジングループとテルト−ブチルエステルを加水分解するためにDCMに溶解された25パーセントトリフルオロ酢酸で処理した。当反により、最終化合物6を得た。
化合物2のステップ5:最後のステップは、テルト−ブチルエステル、アセトニドと、中間化合物5チアゾリジン基の加水分解である。中間化合物5は最終化合物6を生成するためにDCMに溶解された25%のTFAで処理される。実施例の一つとしては、テルト−ブチルエステルを条件カップリング1−エチル−3−(3’−ジメチルアミノプロピル)カルボジイミド(EDCI)を用いて調製することができる。それはまた、EDCIカップリング条件を用いてt−ブタノールとD−(−)−ペンシラミンを反応させることにより調製することができる。もうひとつの実施例として、最初のものは、D−(−)−ペニシラミンのアミノチオールを保護し、次いでBoc無水物と、DCMに溶解された4−(N、N−ジメチルアミノ)ピリジン(DMAP)と反応する。
もうひとつの実施例として、アミノ酸は、t−ブタノール、硫酸マグネシウムと、DCMと混合された硫酸とアミノ酸とを反応させることにより、テルト−ブチルブチルエステルに変換され得る。
化合物3のステップ5:最後のステップは、テルト−ブチルエステル、アセトニドと中間化合物5のチアゾリジン基の加水分解である。中間化合物5は最終化合物6を生成するためにDCMに溶解された25%のTFAで処理される。
実施例の一つとしては、テルト−ブチルエステルを1−エチル−3−(3’−ジメチルアミノプロピル)カルボジイミド(EDCI)のカップリング条件を用いて調製することができる。それはEDCIカップリング条件を用いて、t−ブタノールと(2S)−2−アミノ−3−メチル−3−スルファニル−ブタン酸とを反応させることにより調製することができる。
もうひとつの実施例として、最初のものは、(2S)−2−アミノ−3−メチル−3−スルファニル−ブタン酸のアミノチオールを保護し、次に、SBoc無水フタル酸とDCMに溶解された4−(N、N−ジメチルアミノ)ピリジン(DMAP)とを反応させることができる。もうひとつの実施例として、アミノ酸は、t−ブタノール、硫酸マグネシウム、DCMと混合された硫酸とアミノ酸とを反応させることにより、テルト−ブチルブチルエステルに変換され得る。
【0087】
合成の結果:
【0088】
化合物1A

【0089】
M.F:C16H27NO6S3、Mol.Wt.:426
【0090】
表1:CHN分析

【0091】
表2:HNMR分析

【0092】
化合物2

【0093】
M.F:C11H21NO5S3、Mol.Wt.:343
【0094】
表3−CHN分析

【0095】
表4−HNMR分析

【0096】
化合物3:

【0097】
M.F:C13H22N2O7S2、Mol.Wt.:382
【0098】
表5−CHN分析

【0099】
表6−H NMR分析

【0100】
もうひとつの実施例として、化学式1の化合物の効果的な投与量は、単一または分割投与で約0.3ミリグラム/kg/日から約60mg/kg/日kg/日の範囲であり、例えば、単一または分割投与で1mg/kg/日から約50mg/kg/日範囲である。化学式1の化合物は、例えば、2mg/kg/日、5mg/kg/日、10mg/kg/日、20mg/kg/日、30mg/kgの/日、または40mg/kg/日未満の用量で投与することができる。化学の式1の化合物は、例えば、1日あたり50mg及び1000mgの間、100mgおよび800mgの間、または1000、900、800、700、600、500、400、300、200、または100mg未満を、人間の患者に投与することができる、特定の実施例においては、当組成物の投与される量は、化学式1の化合物の95%未満、90%、80%、70%、60%、50%、40%、30%、20%、または10%であることが、同じ治療上の効果を得るために必要である。徐放性の錠剤には、ゆっくりと薬物を放出するコーティングを付けることができる。
【0101】
本開示は、とりわけ、銅の毒性に関連した疾患や合併症を治療する組成物および方法を提供する。当開示の特定の実施例が議論されてはきたが、上記の仕様は単に例示であって、これに制限されるものではない。ここにおける化合物、組成物および方法の多くのバリエーションは、当仕様を検討することにより、当分野の者には明らかになるであろう。
【産業上の利用可能性】
【0102】
化学式1の化合物、そして、肝疾患、更に一般的に言えば、遺伝的で異常な金属の肝臓への蓄積を患う哺乳類を治療する薬学的に許容される添加物と化学式1との組成物については複数の出願がある。
これら組成物は、肝疾患における銅の保持とその合併症に関連した疾患の治療に用いることができる。
【特許請求の範囲】
【請求項1】
下記化学式1で表される薬学的に許容される化合物を含む化合物。
化学式1:

[式中、R1、R2、およびR3はそれぞれ独立して、水素、チオール、アルキル、アルキルチオール、アセチルチオール、ジスルフィド基、アシル基、アシルアルキル、アルケニル、アルキルチオアルキル、アルキニル、アルコキシアルコキシ、アリール、アラルキル、アリール、アリールシオールキル、シクロアルキル、エーテル、エステル、ヘテロアリール、ヘテロシクリル、低級アルキル基、スルホン、スルホキシド、またはヒドロキシを表し、
R4は、グアニジン、ヒドラジンの残留物、酸、ピルビン酸の残基、オキサロ酢酸の残留物、トコフェロールの残留物、アスコルビン酸の残基、チアミンの残留物、チオクト酸、チオクト酸の残基、アセチルシステイン残基、α−ケトグルタル酸の残基、ジメルカプロールの残基、ドナーNOの残留物、グルタチオンの残留物(RS)−2、3−ヂスルファニルプロパン−1−ol、(R)−2−アセタミド−3−スルファニルプロパン酸および前述のいずれかのアナログを表す。]
【請求項2】
下記化合物1Aを更に含む、請求項1に記載の化合物。
化合物1A:

[ここで、R1、R2、およびR3はそれぞれ独立して、水素、チオール、アルキル、アルキルチオール、アセチルチオール、ジスルフィド基、アシル基、アシルアルキル、アルケニル、アルキルチオアルキル、アルキニル、アルコキシアルコキシ、アリール、アラルキル、アリール、アリールシオールキル、シクロアルキル、エーテル、エステル、ヘテロアリール、ヘテロシクリル、低アルキル、スルホン、スルホキシド、およびヒドロキシを表し、
R4は、チオクト酸を表し、nは0から8の間の整数に等しい。]
【請求項3】
以下のごとく構成される薬学的に許容される化合物1Aを更に含む、請求項2に記載の化合物。

[ここで、R1、R2、およびR3はそれぞれ独立して、水素、チオール、アルキル、アルキルチオール、アセチルチオール、ジスルフィド基、アシル基、アシルアルキル、アルケニル、アルキルチオアルキル、アルキニル、アルコキシアルコキシ、アリール、アラルキル、アリール、アリールシオールキル、シクロアルキル、エーテル、エステル、ヘテロアリール、ヘテロシクリル、低アルキル、スルホン、スルホキシド、ヒドロキシを表し、
R4は、R−(+)−チオクト酸であり、
nは0から4までの間の整数に等しい。]
【請求項4】
下記化合物2を更に含む、化学式1の化合物。
化合物2:

[ここで、R1、R2、およびR3は、水素、メチル基、エチル基、チオールの少なくとも一つを表し、
R4は(RS)−2、3−ヂサルファニルプロパン−1−オールを表す。]
【請求項5】
下記化合物3を更に含む、請求項1に記載の化合物。
化合物3:

[ここで、R1、R2、およびR3は、水素、メチル基、エチル基、チオールの少なくともいずれかを表し、
R4は、(R)−2−アセタミド−3−スルファニル−プロパン酸を表す。]
【請求項6】
化学式1の薬学的に許容される化合物は、酒石酸塩、エシル、メシル酸塩、硫酸塩、水和物、および塩酸塩の少なくとも1つを含む、請求項1に記載の化合物。
【請求項7】
化学式1:

[ここで、R1、R2、およびR3はそれぞれ独立して水素、チオール、アルキル、アルキルチオール、アセチルチオール、ジスルフィド基、アシル基、アシルアルキル、アルケニル、アルキルチオアルキル、アルキニル、アルコキシアルコキシ、アリール、アラルキル、アリール、アリールチオアルキル、シクロアルキル、エーテル、エステル、ヘテロアリール、ヘテロシクリル、低アルキル、スルホン、スルホキシド、及び、ヒドロキシの少なくとも1つを表し、
R4は、グアニジン、ヒドラジンの残留物、酸、ピルビン酸の残基、オキサロ酢酸の残留物、トコフェロールの残留物、アスコルビン酸の残基、チアミンの残留物、チオクト酸、チオクト酸の残基、アセチルシステイン残基、α−ケトグルタル酸の残基、ジメルカプロールの残基、ドナーNOの残留物、グルタチオンの残留物(RS)−2、3−ヂサルファニルプロパン−1−オール、(R)−2−アセタミド−3−スルファニル−プロパン酸およびこれらのいずれかの類似物を表す。]で表される化合物を含む、肝障害を有する哺乳動物に投与される組成物であって、
この組成物は、少なくとも1つのR−(+)−リポ酸、アセチルシステインとジメルカを含み、少なくとも1つの酢酸亜鉛とトリエチレンテトラミンを含む組成物。
【請求項8】
前記投与は、経口、局所、経粘膜、吸入、標的送達、および徐放制剤の少なくとも一つである、請求項7に記載の組成物。
【請求項9】
下記化合物1Aを更に含む、請求項7に記載の組成物。
化合物1A:

[ここで、R1、R2、およびR3はそれぞれ独立して、水素、チオール、アルキル、アルキルチオール、アセチルチオール、ジスルフィド基、アシル基、アシルアルキル、アルケニル、アルキルチオアルキル、アルキニル、アルコキシアルコキシ、アリール、アラルキル、アリール、アリールシオールキル、シクロアルキル、エーテル、エステル、ヘテロアリール、ヘテロシクリル、低アルキル、スルホン、スルホキシド、およびヒドロキシを表しており、
R4は、チオクト酸を表し、nは0から8の間の整数に等しい。]
【請求項10】
以下のごとく構成される薬学的に許容される化合物1Aを更に含む、請求項9に記載の組成物。

[ここで、R1、R2、およびR3はそれぞれ独立して、水素、チオール、アルキル、アルキルチオール、アセチルチオール、ジスルフィド基、アシル基、アシルアルキル、アルケニル、アルキルチオアルキル、アルキニル、アルコキシアルコキシ、アリール、アラルキル、アリール、アリールシオールキル、シクロアルキル、エーテル、エステル、ヘテロアリール、ヘテロシクリル、低アルキル、スルホン、スルホキシド、およびヒドロキシを表し、
R4は、R−(+)−チオクト酸であり、
nは0から4までの間の整数に等しい。]
【請求項11】
以下のごとく構成される化合物2を更に含む、化学式7の組成物。

[R1、R2、およびR3は、水素、メチル基、エチル基、チオールの少なくとも1つを表し、
R4は(RS)−2、3−ヂサルファニルプロパン−1−オールを表す。]
【請求項12】
以下のごとく構成される化合物3を更に含む、請求項7に記載の組成物。

[ここで、R1、R2、およびR3は、水素、メチル基、エチル基、チオールの少なくとも1つを表し、
R4は、(R)−2−アセタミド−3−スルファニル−プロパン酸を表す。]
【請求項13】
化合物1Aと化合物2の少なくとも2つを更に含む、請求項10に記載の組成物。
【請求項14】
化合物1Aと化合物3の少なくとも2つを更に含む、請求項10に記載の組成物。
【請求項15】
化合物2と化合物3の少なくとも2つを更に含む、請求項11に記載の組成物。
【請求項16】
銅毒性を治療する方法であって、
R−(+)−リポ酸、アセチルシステインおよびジメルカのうち少なくとも一つを酢酸亜鉛およびトリエチレンテトラミンの少なくとも一つと混合し、
化学式1:

[ここで、R1、R2、およびR3は独自に、水素、チオール、アルキル、アルキルチオール、アセチルチオール、ジスルフィド基、アシル基、アシルアルキル、アルケニル、アルキルチオアルキル、アルキニル、アルコキシアルコキシ、アリール、アラルキル、アリール、アリールシオールキル、シクロアルキル、エーテル、エステル、ヘテロアリール、ヘテロシクリル、低級アルキル基、スルホン、スルホキシド、またはヒドロキシを表し、また、
ここにおいて、R4は、グアニジン、ヒドラジンの残留物、酸、ピルビン酸の残基、オキサロ酢酸の残留物、トコフェロールの残留物、アスコルビン酸の残基、チアミンの残留物、チオクト酸、チオクト酸残基、アセチルシステイン残基、α−ケトグルタル酸の残基、ジメルカプロールの残基、ドナーNOの残留物、グルタチオンの残留物およびこれらのいずれかの類似物のうち少なくとも1つを表す。]で表される化合物を治療用薬剤として最適化することを含む方法。
【請求項17】
前記薬剤は、点眼剤、注射および錠剤の少なくとも一つである、請求項16に記載の方法。
【請求項18】
前記組成物を肝障害を有する哺乳動物に投与することを更に含む、請求項17に記載の方法。
【請求項1】
下記化学式1で表される薬学的に許容される化合物を含む化合物。
化学式1:

[式中、R1、R2、およびR3はそれぞれ独立して、水素、チオール、アルキル、アルキルチオール、アセチルチオール、ジスルフィド基、アシル基、アシルアルキル、アルケニル、アルキルチオアルキル、アルキニル、アルコキシアルコキシ、アリール、アラルキル、アリール、アリールシオールキル、シクロアルキル、エーテル、エステル、ヘテロアリール、ヘテロシクリル、低級アルキル基、スルホン、スルホキシド、またはヒドロキシを表し、
R4は、グアニジン、ヒドラジンの残留物、酸、ピルビン酸の残基、オキサロ酢酸の残留物、トコフェロールの残留物、アスコルビン酸の残基、チアミンの残留物、チオクト酸、チオクト酸の残基、アセチルシステイン残基、α−ケトグルタル酸の残基、ジメルカプロールの残基、ドナーNOの残留物、グルタチオンの残留物(RS)−2、3−ヂスルファニルプロパン−1−ol、(R)−2−アセタミド−3−スルファニルプロパン酸および前述のいずれかのアナログを表す。]
【請求項2】
下記化合物1Aを更に含む、請求項1に記載の化合物。
化合物1A:

[ここで、R1、R2、およびR3はそれぞれ独立して、水素、チオール、アルキル、アルキルチオール、アセチルチオール、ジスルフィド基、アシル基、アシルアルキル、アルケニル、アルキルチオアルキル、アルキニル、アルコキシアルコキシ、アリール、アラルキル、アリール、アリールシオールキル、シクロアルキル、エーテル、エステル、ヘテロアリール、ヘテロシクリル、低アルキル、スルホン、スルホキシド、およびヒドロキシを表し、
R4は、チオクト酸を表し、nは0から8の間の整数に等しい。]
【請求項3】
以下のごとく構成される薬学的に許容される化合物1Aを更に含む、請求項2に記載の化合物。

[ここで、R1、R2、およびR3はそれぞれ独立して、水素、チオール、アルキル、アルキルチオール、アセチルチオール、ジスルフィド基、アシル基、アシルアルキル、アルケニル、アルキルチオアルキル、アルキニル、アルコキシアルコキシ、アリール、アラルキル、アリール、アリールシオールキル、シクロアルキル、エーテル、エステル、ヘテロアリール、ヘテロシクリル、低アルキル、スルホン、スルホキシド、ヒドロキシを表し、
R4は、R−(+)−チオクト酸であり、
nは0から4までの間の整数に等しい。]
【請求項4】
下記化合物2を更に含む、化学式1の化合物。
化合物2:

[ここで、R1、R2、およびR3は、水素、メチル基、エチル基、チオールの少なくとも一つを表し、
R4は(RS)−2、3−ヂサルファニルプロパン−1−オールを表す。]
【請求項5】
下記化合物3を更に含む、請求項1に記載の化合物。
化合物3:

[ここで、R1、R2、およびR3は、水素、メチル基、エチル基、チオールの少なくともいずれかを表し、
R4は、(R)−2−アセタミド−3−スルファニル−プロパン酸を表す。]
【請求項6】
化学式1の薬学的に許容される化合物は、酒石酸塩、エシル、メシル酸塩、硫酸塩、水和物、および塩酸塩の少なくとも1つを含む、請求項1に記載の化合物。
【請求項7】
化学式1:

[ここで、R1、R2、およびR3はそれぞれ独立して水素、チオール、アルキル、アルキルチオール、アセチルチオール、ジスルフィド基、アシル基、アシルアルキル、アルケニル、アルキルチオアルキル、アルキニル、アルコキシアルコキシ、アリール、アラルキル、アリール、アリールチオアルキル、シクロアルキル、エーテル、エステル、ヘテロアリール、ヘテロシクリル、低アルキル、スルホン、スルホキシド、及び、ヒドロキシの少なくとも1つを表し、
R4は、グアニジン、ヒドラジンの残留物、酸、ピルビン酸の残基、オキサロ酢酸の残留物、トコフェロールの残留物、アスコルビン酸の残基、チアミンの残留物、チオクト酸、チオクト酸の残基、アセチルシステイン残基、α−ケトグルタル酸の残基、ジメルカプロールの残基、ドナーNOの残留物、グルタチオンの残留物(RS)−2、3−ヂサルファニルプロパン−1−オール、(R)−2−アセタミド−3−スルファニル−プロパン酸およびこれらのいずれかの類似物を表す。]で表される化合物を含む、肝障害を有する哺乳動物に投与される組成物であって、
この組成物は、少なくとも1つのR−(+)−リポ酸、アセチルシステインとジメルカを含み、少なくとも1つの酢酸亜鉛とトリエチレンテトラミンを含む組成物。
【請求項8】
前記投与は、経口、局所、経粘膜、吸入、標的送達、および徐放制剤の少なくとも一つである、請求項7に記載の組成物。
【請求項9】
下記化合物1Aを更に含む、請求項7に記載の組成物。
化合物1A:

[ここで、R1、R2、およびR3はそれぞれ独立して、水素、チオール、アルキル、アルキルチオール、アセチルチオール、ジスルフィド基、アシル基、アシルアルキル、アルケニル、アルキルチオアルキル、アルキニル、アルコキシアルコキシ、アリール、アラルキル、アリール、アリールシオールキル、シクロアルキル、エーテル、エステル、ヘテロアリール、ヘテロシクリル、低アルキル、スルホン、スルホキシド、およびヒドロキシを表しており、
R4は、チオクト酸を表し、nは0から8の間の整数に等しい。]
【請求項10】
以下のごとく構成される薬学的に許容される化合物1Aを更に含む、請求項9に記載の組成物。

[ここで、R1、R2、およびR3はそれぞれ独立して、水素、チオール、アルキル、アルキルチオール、アセチルチオール、ジスルフィド基、アシル基、アシルアルキル、アルケニル、アルキルチオアルキル、アルキニル、アルコキシアルコキシ、アリール、アラルキル、アリール、アリールシオールキル、シクロアルキル、エーテル、エステル、ヘテロアリール、ヘテロシクリル、低アルキル、スルホン、スルホキシド、およびヒドロキシを表し、
R4は、R−(+)−チオクト酸であり、
nは0から4までの間の整数に等しい。]
【請求項11】
以下のごとく構成される化合物2を更に含む、化学式7の組成物。

[R1、R2、およびR3は、水素、メチル基、エチル基、チオールの少なくとも1つを表し、
R4は(RS)−2、3−ヂサルファニルプロパン−1−オールを表す。]
【請求項12】
以下のごとく構成される化合物3を更に含む、請求項7に記載の組成物。

[ここで、R1、R2、およびR3は、水素、メチル基、エチル基、チオールの少なくとも1つを表し、
R4は、(R)−2−アセタミド−3−スルファニル−プロパン酸を表す。]
【請求項13】
化合物1Aと化合物2の少なくとも2つを更に含む、請求項10に記載の組成物。
【請求項14】
化合物1Aと化合物3の少なくとも2つを更に含む、請求項10に記載の組成物。
【請求項15】
化合物2と化合物3の少なくとも2つを更に含む、請求項11に記載の組成物。
【請求項16】
銅毒性を治療する方法であって、
R−(+)−リポ酸、アセチルシステインおよびジメルカのうち少なくとも一つを酢酸亜鉛およびトリエチレンテトラミンの少なくとも一つと混合し、
化学式1:

[ここで、R1、R2、およびR3は独自に、水素、チオール、アルキル、アルキルチオール、アセチルチオール、ジスルフィド基、アシル基、アシルアルキル、アルケニル、アルキルチオアルキル、アルキニル、アルコキシアルコキシ、アリール、アラルキル、アリール、アリールシオールキル、シクロアルキル、エーテル、エステル、ヘテロアリール、ヘテロシクリル、低級アルキル基、スルホン、スルホキシド、またはヒドロキシを表し、また、
ここにおいて、R4は、グアニジン、ヒドラジンの残留物、酸、ピルビン酸の残基、オキサロ酢酸の残留物、トコフェロールの残留物、アスコルビン酸の残基、チアミンの残留物、チオクト酸、チオクト酸残基、アセチルシステイン残基、α−ケトグルタル酸の残基、ジメルカプロールの残基、ドナーNOの残留物、グルタチオンの残留物およびこれらのいずれかの類似物のうち少なくとも1つを表す。]で表される化合物を治療用薬剤として最適化することを含む方法。
【請求項17】
前記薬剤は、点眼剤、注射および錠剤の少なくとも一つである、請求項16に記載の方法。
【請求項18】
前記組成物を肝障害を有する哺乳動物に投与することを更に含む、請求項17に記載の方法。
【図1】


【図2】


【図3】




【図2】


【図3】


【公表番号】特表2013−521270(P2013−521270A)
【公表日】平成25年6月10日(2013.6.10)
【国際特許分類】
【出願番号】特願2012−555510(P2012−555510)
【出願日】平成23年2月26日(2011.2.26)
【国際出願番号】PCT/IB2011/000592
【国際公開番号】WO2011/107881
【国際公開日】平成23年9月9日(2011.9.9)
【出願人】(512229849)
【出願人】(512315131)
【Fターム(参考)】
【公表日】平成25年6月10日(2013.6.10)
【国際特許分類】
【出願日】平成23年2月26日(2011.2.26)
【国際出願番号】PCT/IB2011/000592
【国際公開番号】WO2011/107881
【国際公開日】平成23年9月9日(2011.9.9)
【出願人】(512229849)

【出願人】(512315131)

【Fターム(参考)】
[ Back to top ]

