医薬固形製剤
【課題】本発明は、薬理活性物質の放出挙動が制御された逐次崩壊型の徐放性医薬固形製剤を提供することを課題とする。
【解決手段】本発明の医薬固形製剤は、マトリックス型の医薬固形製剤であって、(a)薬理活性物質、(b)ポリカルボフィルカルシウム、並びに(c)特定の糖及び/又は糖アルコールを含有する。
【解決手段】本発明の医薬固形製剤は、マトリックス型の医薬固形製剤であって、(a)薬理活性物質、(b)ポリカルボフィルカルシウム、並びに(c)特定の糖及び/又は糖アルコールを含有する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、医薬固形製剤に関する。
【背景技術】
【0002】
医薬の分野において、薬剤放出を制御し、薬剤血中濃度を適正レベルに長時間維持させる試みが広く行われている。薬剤血中濃度を適正レベルに長時間維持するためには、薬剤の吸収を長時間持続できるような製剤学的工夫(放出制御)が必要である。このような放出制御された製剤を徐放性製剤という。
【0003】
徐放性製剤とは、投与回数の減少又は副作用の軽減を図る等の目的で製剤からの薬剤の放出速度、放出時間、放出部位を調節した製剤であると定義されている。また、即放性製剤とは、製剤からの薬剤の放出性を特に調節していない製剤であると定義されている。今日まで、放出制御された徐放性製剤として、例えば、経口投与製剤である場合、水不溶性マトリックス型、ハイドロゲルマトリックス型、フィルムコーティング型、浸透圧ポンプ型等の製剤が広く知られている。
【0004】
一方、即放性製剤と徐放性製剤とを、放出制御の有無ではなく、崩壊時間の長短で分類することができる。つまり、製剤の崩壊時間が短く即放性の薬剤放出を示すのが即放性製剤であり、崩壊時間が長く徐放性の薬剤放出を示すのが徐放性製剤である。製剤の崩壊速度を制御する上で崩壊剤の配合が重要であり、また所望の崩壊速度を得るには最適な崩壊剤の選択も重要である。崩壊剤が関与する崩壊現象は、膨潤(swelling)と毛管現象(wicking)との2つに大別される。膨潤型の崩壊剤は、その強力な吸水能及び膨潤能によって製剤を崩壊させる。一方、毛管現象型の崩壊剤は、水を製剤内部の空隙に素早く浸透させることによって粒子間結合力を破壊して分散させる。
【0005】
しかしながら、膨潤型の崩壊剤及び毛管現象型の崩壊剤には、それぞれ難点がある。膨潤型の崩壊剤は、配合量が少なくても製剤を速やかに内部から崩壊させる効果が強いため、持続的な崩壊制御、すなわち徐放化には適していない。また、毛管現象型の崩壊剤は、膨潤力が小さく、製剤内部からの崩壊を起こしにくいが、崩壊剤の配合量のわずかな増減によって、即放性製剤様の崩壊挙動を示したり、崩壊力不足を示したりする。すなわち、毛管現象型の崩壊剤は、配合量の微調整が困難である。
【0006】
このように、崩壊制御による徐放化を達成するには、崩壊剤の選択やその配合割合の調整だけでは極めて困難である。
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明は、薬理活性物質の放出挙動が制御された逐次崩壊型の徐放性医薬固形製剤を提供することを課題とする。
【課題を解決するための手段】
【0008】
本発明者らは、上記課題を解決するために鋭意研究を重ねた結果、下記に示す特定の成分を組み合わせることにより、所望の徐放性医薬固形製剤が得られることを見い出した。本発明は、このような知見に基づき完成されたものである。
【0009】
すなわち、本発明は、下記項1〜項17に示す医薬固形製剤を提供する。
項1 (a)薬理活性物質、(b)ポリカルボフィルカルシウム、並びに(c)糖及び/又は糖アルコールを含有するマトリックス型の医薬固形製剤であって、前記(c)の糖及び/又は糖アルコールは、トレハロース、ラクチトール、マルトース、マルチトール、シュクロース、ソルビトール、キシリトール、エリスリトール、マンニトール、ラクトース、及びイソマルトオリゴ糖からなる群から選択される少なくとも1種である医薬固形製剤。
項2 (b)ポリカルボフィルカルシウムの含有量が1〜50重量%である項1に記載の医薬固形製剤。
項3 (c)糖及び/又は糖アルコールの含有量が0.1〜70重量%である、項1に記載の医薬固形製剤。
項4 更に、(d)水不溶性微粒子を含有する項1に記載の医薬固形製剤。
項5 (d)水不溶性微粒子が、医薬固形製剤の空隙を小さくすることができる微粒子である項4に記載の医薬固形製剤。
項6 (d)水不溶性微粒子の平均粒子径が0.002〜50μmである項4に記載の医薬固形製剤。
項7 更に、(e)毛管現象型の崩壊剤を含有する項1又は4に記載の医薬固形製剤。
項8 (e)毛管現象型の崩壊剤がカルメロースである項7に記載の医薬固形製剤。
項9 (d)水不溶性微粒子が、コロイド状二酸化ケイ素、含水二酸化ケイ素、軽質無水ケイ酸、タルク、酸化チタン、ステアリン酸マグネシウム及びエチルセルロースからなる群から選ばれる少なくとも1種である、項4に記載の医薬固形製剤。
項10 (d)水不溶性微粒子の平均粒子径が0.002〜50μmである項9に記載の医薬固形製剤。
項11 (d)水不溶性微粒子の含有量が0.01〜30重量%である、項4に記載の医薬固形製剤。
項12 (e)毛管現象型の崩壊剤の含有量が0.1〜15重量%である、項7に記載の医薬固形製剤。
項13 (c)糖及び/又は糖アルコールが、トレハロース、ラクチトール、マルトース、マルチトール、シュクロース、ソルビトール、キシリトール、及びイソマルトオリゴ糖からなる群から選ばれる少なくとも1種である、項1に記載の医薬固形製剤。
項14 (c)糖及び/又は糖アルコールが、含水結晶マルトース、マルチトール、ラクチトール一水和物、及びトレハロース二水和物からなる群から選ばれる少なくとも1種である、項1に記載の医薬固形製剤。
項15 (a)薬理活性物質の含有量が0.01〜80重量%である、項1に記載の医薬固形製剤。
項16 (a)薬理活性物質が、トルバプタン、シロスタゾール、又はテオフィリンである項1に記載の医薬固形製剤。
項17 トルバプタンが調製例1と同様にして得られる非晶質粉末として含有される項16に記載の医薬固形製剤。
【発明の効果】
【0010】
本発明の医薬固形製剤は、表層部から逐次的に固形剥離物質を生じながら崩壊する、いわゆる逐次崩壊型の医薬固形製剤であり、長期に亘って優れた一定の溶出挙動を発現する徐放性医薬固形製剤である。
【0011】
本発明の医薬固形製剤は、酸性溶液及び中性溶液での薬理活性物質の溶出挙動が類似しており、生体内での消化器官、つまり胃、小腸、大腸等のような異なるpH条件下において、pHの影響を受けずに一定速度で薬理活性物質を放出することができる。
【0012】
本発明の医薬固形製剤は、崩壊部位が常に製剤表層部に限定されるので、食事の影響を受けにくい製剤である。
【図面の簡単な説明】
【0013】
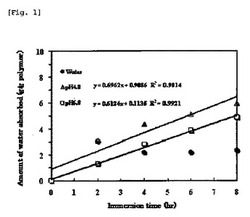
【図1】図1は、参考例1におけるポリカルボフィルカルシウムの酸性溶液及び中性溶液での吸水量と浸積時間との関係を示すグラフである。
【図2】図2は、試験例2の溶出試験における錠剤の経時的な形状変化と薬理活性物質放出挙動との関係を示すグラフである。
【発明を実施するための形態】
【0014】
以下、本発明を詳細に説明する。
本発明の医薬固形製剤は、(a)薬理活性物質、(b)ポリカルボフィルカルシウム、並びに(c)糖及び/又は糖アルコールを含有するマトリックス型の医薬固形製剤である。また、本発明の医薬固形製剤に配合される(c)の糖及び/又は糖アルコールは、トレハロース、ラクチトール、マルトース、マルチトール、シュクロース、ソルビトール、キシリトール、エリスリトール、マンニトール、ラクトース、及びイソマルトオリゴ糖からなる群から選択される少なくとも1種である。
【0015】
本発明の医薬固形製剤は、マトリックス型であり、(a)〜(c)の各成分が均一に混合されたものである。このような本発明の医薬固形製剤は、溶出試験を行うと、逐次崩壊型の崩壊を示す。逐次崩壊型の崩壊は、製剤全体に崩壊現象が及ぶのではなく、製剤の一部、特に製剤表層部に崩壊が限定されることで達成される。これは、製剤内部への水の浸透が精緻に制御されていることを意味する。
【0016】
(a)薬理活性物質
本発明で使用される薬理活性物質は、医薬活性成分として疾病の治療又は予防に供されるものである限り、特に限定されるものではない。薬理活性物質としては、フリー体、その塩、溶媒和物(水和物、エタノール和物等)又は結晶多形を用いることができる。本発明で配合される薬理活性物質は、特に、徐放化によって副作用の発現が抑えられ、治療効果が高まるような薬理活性物質が適している。薬理活性物質は、結晶性であっても非結晶性であってもよい。また、薬理活性物質は、水溶性及び脂溶性のいずれであってもよく、水に対して難溶性であってもよい。
【0017】
薬理活性物質が難溶性の場合、難溶性の薬理活性物質の溶解性を改善するために、ナノ粉砕、微粉砕、非晶質化、晶析、ナノ晶析等の公知の製剤技術を適用することができる。例えば、調製例1に示すように、薬理活性物質を単独で、あるいは薬理活性物質をヒドロキシプロピルセルロース(HPC)等のような水溶性高分子化合物とともに適当な溶媒(例えば、エタノール、ジクロロメタン等)に溶解して、その溶液を噴霧乾燥することにより非晶質性粉末を得ることができる。或いは、調製例2に示すように、薬理活性物質とラウリル硫酸ナトリウム(SLS)とを混合し、ジェットミル等の粉砕機を用いて粉砕することにより微粉砕物を得ることができる。
【0018】
本発明で用いられる薬理活性物質としては、例えば、5−アミノサリチル酸、アシクロビル、アスピリン、アセチルサリチル酸、アセトアミノフェン、アリピプラゾール、アンピシリン、イソニアジド、イブプロフェン、インドメタシン、エシタロプラム、エテンザミド、エナラプリル、エリスロマイシン、オメプラゾール、グリメピリド、ケトコナゾール、コニバプタン、サタバプタン、サルブタモール、サラゾスルファピリジン、サラゾピリン、ジアゼパム、ジクロフェナク、ジクロフェナクナトリウム、ジピリダモール、シメチジン、シロスタゾール、シンバスタチン、スクラルファート、スルピリド、スルファサラジン、セレコキシブ、タクロリムス、テオフィリン、テガフール、デキサメタゾン、デキストロメトルファン、テトミラスト、テルフェナジン、ドキソルビシン、トリアムシノロン、トルバプタン、ナジフロキサシン、ナプロキセン、ニフェジピン、尿素、バルプロ酸ナトリウム、ハロペリドール、バラシクロビル、パリペリドン、ヒドロコルチゾン、ピオグリタゾン、ファモチジン、フェナセチン、フェニトイン、フェニルプロパノールアミン、ブデソニド、プラバスタチン、プラバスタチンナトリウム、フルオロウラシル、プレドニゾロン、プレドニゾン、フロセミド、プロブコール、ベスナリノン、ペニシリン、ペルフェナジン、ボグリボース、マレイン酸クロルフェニラミン、ミダゾラム、メシル酸ドキサゾシン、メトトレキセート、モルヒネ、ラニチジン、ランソプラゾール、リシノプリル、リスペリドン、リドカイン、リボグリタゾン、レバミピド、レボドパ、ロチゴチン、ロバスタチン、ロラゼパム、ワーファリン、塩酸アンブロキソール、塩酸カルテオロール、塩酸ジフェンヒドラミン、塩酸タムスロシン、塩酸ニカルジピン、塩酸ヒドララジン、塩酸ピオグリタゾン、塩酸ブプレノルフィン、塩酸プロカテロール、塩酸モザバプタン、塩酸ラニチジン、塩酸レボカルニチン、酢酸コルチゾン、硫酸サルブタモール等を例示できる。好ましくは、シロスタゾール、トルバプタン、レバミピド、塩酸プロカテロール、アリピプラゾール、テオフィリンであり、最も好ましくはトルバプタン、シロスタゾール、テオフィリンである。
【0019】
上記薬理活性物質の含有量は、医薬製剤中、通常0.01〜80重量%、好ましくは0.1〜70重量%、より好ましくは1〜50重量%である。
【0020】
(b)ポリカルボフィルカルシウム
ポリカルボフィルカルシウムは、医薬用途で使用されている品質のものであるのが好ましい。具体的には、米国薬局方(USP31)に適合する公知のものを広く使用することができる。ポリカルボフィルカルシウムは、ジビニルアルコールで架橋されたアクリル酸ポリマーのカルシウム塩である。
【0021】
ポリカルボフィルカルシウムとしては、カルシウム含有量 18〜22重量%であり、米国薬局方(USP31)に従って測定する吸水量(Absorbing power)が35.0g−重炭酸ナトリウム水溶液/g−乾燥ポリカルボフィルカルシウム以上(乾燥ポリカルボフィルカルシウム粉末1gあたりの重炭酸ナトリウム水溶液の吸水量が35.0g以上)であるのが好ましい。また、ポリカルボフィルカルシウムの粒度としては、例えば音波振動式全自動ふるい分け測定器(ロボットシフターRPS−95型、セイシン企業社製)で測定した時に、75μm未満の粒子存在割合が10%以上で、かつ250μm以上の粒子存在割合が10%未満であるポリカルボフィルカルシウムが、混合適正の面で好ましい。ポリカルボフィルカルシウムの市販品を例示すると、例えば、Lubrizol社製の「NOVEON CA-1」,「NOVEON CA-2」,BF Goodrich社製の「Carbopol EX-83 Resin」,「Carbopol EX-788 Resin」,Boehringer Ingelheim Chemicals社製の「Calcium Polycarbophil」等である。
【0022】
本発明の医薬固形製剤を調製する場合、製造工程のいずれかでポリカルボフィルカルシウムからカルシウムが外れ、製造された医薬固形製剤内にはポリカルボフィルカルシウム以外に、ポリカルボフィルがわずかに含まれる場合がある。
【0023】
上記ポリカルボフィルカルシウムの含有量は、医薬固形製剤中、通常1〜50重量%、好ましくは7〜40重量%、より好ましくは10〜30重量%である。
【0024】
(c)糖及び/又は糖アルコール
本発明で使用される(c)の糖及び/又は糖アルコールは、トレハロース、ラクチトール、マルトース、マルチトール、シュクロース、ソルビトール、キシリトール、エリスリトール、マンニトール、ラクトース、及びイソマルトオリゴ糖からなる群から選択される1種以上が挙げられる。これらの中でも、トレハロース、ラクチトール、マルトース、マルチトール、シュクロース、ソルビトール、キシリトール、及びイソマルトオリゴ糖がより好ましい。
【0025】
なお、本発明にて使用される糖及び/又は糖アルコールは、水和物の形態であってもよい。
【0026】
本発明においては、特に下記のような糖及び/又は糖アルコールが好ましく、記載のような市販品として入手可能なものを使用することができる。
【0027】
トレハロース二水和物(例えば、旭化成ケミカルズ社の「トレハロースP」、林原社の「トレハ」等);
ラクチトール一水和物(例えば、日研化成社の「ラクチトールLC−1」等);
含水結晶マルトース(例えば、三和澱粉工業社の「サンマルト−S」、日本食品化工社の「日食結晶マルトース」等);
マルチトール(例えば、ロケット社製の「MALTISORB」シリーズ,林原生物化学研究所社製の「マビット」等);
シュクロース(例えば、塩水港精糖社製の「グラニュー糖CH」等);
ソルビトール(例えば、日研化成社の「ソルビトールSP」、ロケット社の「NEOSORB Powder」、東和化成工業の「ソルビットDP−10M」等);
キシリトール(例えば、日研化成社の「キシリトールP」、ロケット社の「XYLISORB」、東和化成工業の「キシリットP」等);等。
【0028】
最も好ましい糖及び/又は糖アルコールとしては、含水結晶マルトース、マルチトール、ラクチトール一水和物、トレハロース二水和物が挙げられる。上記糖及び/又は糖アルコールは、1種単独で又は2種以上を併用できる。
【0029】
上記糖及び/又は糖アルコールの含有量は、医薬固形製剤中、通常0.1〜70重量%、好ましくは1〜60重量%、より好ましくは5〜50重量%である。
【0030】
本発明の医薬固形製剤は、上記(a)〜(c)の成分に加えて、更に(d)水不溶性微粒子及び/又は(e)毛管現象型の崩壊剤を含有していてもよい。
【0031】
(d)水不溶性微粒子
本発明において使用される(d)水不溶性微粒子としては、固形製剤の空隙を小さくすることができる公知の水不溶性微粒子を例示することができる。医薬固形製剤内部の空隙をそのような水不溶性微粒子で満たすことによって、製剤内部への水の浸透を精緻に制御することができる。本発明の医薬固形製剤に更に(d)水不溶性微粒子が含有している場合、特に酸性溶液及び中性溶液のいずれにおいても薬理活性物質を一定の速度で放出することができ、胃、腸等のpH値が異なる環境下で優れた徐放性能を発現することができる。
【0032】
(d)水不溶性微粒子の平均粒子径は、通常0.002〜50μm、好ましくは0.005〜40μm、より好ましくは0.01〜30μmである。(d)水不溶性微粒子の平均粒子径は、レーザー回折法による測定、あるいは電子顕微鏡観察による直接的な計測によって求めることができる。
【0033】
(d)水不溶性微粒子は、製剤内部に浸透する水に溶解しないため、あらたな空隙が形成されず、製剤内部への水の浸透性を保持できる。
【0034】
水不溶性微粒子としては、例えば、コロイド状二酸化ケイ素、含水二酸化ケイ素、軽質無水ケイ酸、タルク、酸化チタン、等の無機化合物;ステアリン酸マグネシウム、ステアリン酸カルシウム等の脂肪酸金属塩化合物; エチルセルロース、アミノアルキルメタクリレートコポリマーRS等の水不溶性高分子化合物等が挙げられる。好ましい水不溶性微粒子としては、コロイド状二酸化ケイ素、含水二酸化ケイ素、軽質無水ケイ酸、タルク、酸化チタン、ステアリン酸マグネシウム、エチルセルロース等である。これらの水不溶性微粒子は、1種単独で又は2種以上併用できる。
【0035】
水不溶性微粒子を2種類併用する場合,水不溶性高分子化合物と,無機化合物及び/又は脂肪酸金属塩化合物とを組み合わせて使用すると,薬理活性物質の放出制御の効果を維持しながら薬理活性物質濃度をより希釈することが可能となるので,強い薬理活性を有する化合物のように投与量が低い薬理活性物質に対しても本発明の放出制御効果がより期待できる。好ましい組み合わせとしては,水不溶性高分子化合物のエチルセルロースと,無機化合物であるコロイド状二酸化ケイ素、含水二酸化ケイ素、軽質無水ケイ酸、タルク、もしくは酸化チタン,又は脂肪酸金属塩化合物であるステアリン酸マグネシウム,もしくはステアリン酸カルシウムである。
【0036】
より好ましい組み合わせはエチルセルロースと、コロイド状二酸化ケイ素、含水二酸化ケイ素、軽質無水ケイ酸、タルク、酸化チタン及びステアリン酸マグネシウムからなる群から選択される1種類以上のものとの組み合わせである。
【0037】
水不溶性微粒子を2種類併用する場合の配合比率は,水不溶性高分子化合物と,無機化合物及び/又は脂肪酸金属塩化合物とが,重量比でそれぞれ4:1〜1:4であり,好ましくは3:1〜1:1である。
【0038】
水不溶性微粒子を3種類以上併用する場合は,少なくとも1種類以上の水不溶性高分子化合物と,2種類以上の無機化合物及び/あるいは脂肪酸金属塩化合物を組み合わせて使用する。
【0039】
(d)水不溶性微粒子の含有量は、混合適正、流動適正、圧縮成形性等の観点から、医薬固形製剤中、通常0.01〜30重量%、好ましくは0.1〜20重量%、より好ましくは0.5〜15重量%である。
【0040】
好ましい水不溶性微粒子について以下に詳述する。これらの水不溶性微粒子は、医薬の分野において使用可能な品質を有し、かつ容易に入手可能なものである。
【0041】
(d-i) コロイド状二酸化ケイ素:
コロイド状二酸化ケイ素は、一次粒子径がおよそ15nmの極微小なシリカである。青白色で無味無臭の非晶質な粉末である(以上、医薬品添加物ハンドブック 永井恒司 監修,日本医薬品添加物協会 訳編,250頁,2001年,薬事日報社刊行)。コロイド状二酸化ケイ素は四塩化珪素のようなクロロシランを酸水素焔中で、高温加水分解することにより製造される(以上、日本アエロジル社製品カタログ)。本発明において使用できるコロイド状二酸化ケイ素としては、市販品が入手可能であり、例えば、日本アエロジル社製の「Aerosol 200」等を使用できる。
【0042】
(d-ii) 含水二酸化ケイ素:
高純度珪砂を原料としたケイ酸ソーダと硫酸を混合し、ケイ酸ゾルを生成させる。ケイ酸ゾルを重合すると一次粒子を形成され、次いで三次元的な二次凝集体が形成されるが、含水二酸化ケイ素はその過程において凝集体の成長を制御することで製造される。この製法はコロイド状二酸化ケイ素、軽質無水ケイ酸の製造方法(乾式法)と区別され、湿式法と呼ばれる(以上、富士シリシア化学社製品カタログ)。含水二酸化ケイ素の平均粒子径は、およそ5μmである。本発明において使用できる含水二酸化ケイ素としては、市販品が入手可能であり、例えば、富士シリシア化学社製の「アドソリダー−102」等を使用できる。
【0043】
(d-iii) 軽質無水ケイ酸:
含水二酸化ケイ素とほぼ同様な製法によって製造されるが、二次凝集体の成長は別段制御せずにゲル化を進行させ、その後乾燥したものをミクロンサイズに微粉砕することにより軽質無水ケイ酸を得る(以上、富士シリシア化学社製品カタログ)。平均粒子径は2〜4μmである。本発明において使用できる軽質無水ケイ酸としては、市販品が入手可能であり、例えば、ワイ・ケイ・エフ社製の「アドソリダー−101」等を使用できる。
【0044】
(d-iv) タルク:
タルクは、自然界に存在する含水ポリケイ酸鉱物である。タルクは精製された含水ケイ酸マグネシウムで、ほぼMg6(Si2O5)4(OH)4であり、少量のケイ酸アルミニウムと鉄を含むことがある。タルクは採掘後、アスベスト、炭素、ドロマイド、酸化鉄、その他あらゆるマグネシウムと炭素塩鉱物を浮遊法によって取り除かれてから、微粉砕され、その後希塩酸で処理し、水洗浄後、乾燥することによって得られる(以上、医薬品添加物ハンドブック 永井恒司 監修,日本医薬品添加物協会 訳編,404〜405頁,2001年,薬事日報社刊行)。本発明において使用できるタルクとしては、市販品が入手可能であり、例えば、浅田製粉社製の「MMR」(平均粒子径 約4μm),富士タルク社製の「PKP-81」(平均粒子径 約14μm)等を使用できる。
【0045】
(d-v) 酸化チタン:
酸化チタンは、アモルファス状で無味無臭の吸湿性のない粉末である。酸化チタン粉末の平均粒径は1μm以下である。酸化チタンはルチル、アナターゼ、ブルッカイト等の種々の結晶形態を採り得るが、医薬の分野で重要な形態はルチル及びアナターゼである。ルチルの方が熱的に安定で支配的である。酸化チタンは、チタンと酸素の直接結合、水溶液中におけるチタン塩の処理、揮発性無機チタン化合物と酸素の反応、及び有機チタン化合物の酸化又は加水分解によって製造される(以上、医薬品添加物ハンドブック 永井恒司 監修,日本医薬品添加物協会 訳編,279〜281頁,2001年,薬事日報社刊行)。本発明において使用できる酸化チタンとしては、市販品が入手可能であり、例えばフロイント産業社製の「A-HR」、石原産業社の「タイペークA−100」等を使用できる。
【0046】
(d-vi) ステアリン酸マグネシウム:
ステアリン酸マグネシウムは、微細で白色の沈殿あるいは粉砕された無定形のかさ高い疎水性粉末である。ステアリン酸マグネシウムの平均粒径は4〜12μmである。ステアリン酸マグネシウムは様々な結晶形があり、商業用途のステアリン酸マグネシウムは結晶構造の混合物である(以上、医薬品添加物ハンドブック 永井恒司 監修,日本医薬品添加物協会 訳編,343〜345頁,2001年,薬事日報社刊行)。ステアリン酸マグネシウムの製造方法には沈殿法と融解法とがあるが、軽質で均一な品質が得易い沈殿法が汎用される。まずステアリン酸と水酸化ナトリウムを加えて加温し反応させ、次いで硫酸マグネシウムの水溶液を加えてステアリン酸マグネシウムの沈殿物を得る。それをろ過、水洗浄、乾燥し、微粉砕したものが製品となる(以上、医薬品添加物要覧 松田芳久 監修,76〜77頁,平成4年,薬事時報社刊行)。近年は植物由来のステアリン酸を原料に使われている。本発明において使用できるステアリン酸マグネシウムとしては、市販品が入手可能であり、例えば太平化学産業社製の「植物性ステアリン酸マグネシウム」等を使用できる。
【0047】
(d-vii) エチルセルロース
エチルセルロースは広く経口医薬用途に使用されている水不溶性の熱可塑性セルロースエーテルである。エチルセルロースのエトキシル基含有量が46.5〜51重量%の範囲にあると,日本,米国,欧州において医薬品用途として使用できる。エチルセルロースにはエトキシル含量及び粘度によってさまざまなグレード及び粘度品種が存在する。例えば,The Dow Chemical社のエチルセルロース「Ethocel」には,エトキシル基が45.0〜47.0重量%のMED型,48.0〜49.5重量%のSTD型,及び49.6〜53.0重量%のHE型があり,それぞれ4〜200cpsの粘度品種が存在し,特に医薬用途としてSTD型の「Ethocel Premium」が使用可能である。またHercules社のエチルセルロース「AQUALON Ethylcellulose」には,エトキシル基が45.0〜47.2重量%のK−type,48.0〜49.5重量%のN−type,及び49.6〜51.5重量%のT−typeがあり,それぞれ4〜300cpsの粘度品種が存在し,特に医薬用途としてT−typeの「AQUALON T10 Pharm EC」が使用可能である(以上,Hercules社AQUALON Ethylcellulose製品技術資料)。
【0048】
The Dow Chemical社の「Ethocel」のSTD型には粉末グレードがあり、粘度が3.5〜5.5cpsの7FP、9.0〜11.0cpsの10FP、及び90.0〜110.0cpsの100FPが存在し、それぞれの平均粒子径は7FPが5〜15μmであり、10FPが3〜15μmであり、100FPは30〜60μmである。(以上,日新化成社エトセル製品技術資料)
本発明において使用できるエチルセルロースとしては市販品が入手可能であり、例えばThe Dow Chemical社の「Ethocel Premium STD−7FP」、「Ethocel Premium STD−10FP」等が挙げられる。これらのエチルセルロースの平均粒子径は3〜15μmである。
【0049】
(e)毛管現象型の崩壊剤
本発明において、毛管現象型の崩壊剤とは、崩壊剤自身の存在が、いわば導水管的な役割を果たして製剤内部に水を浸透させる機能を有する崩壊剤のことを意味する。
【0050】
(e)毛管現象型の崩壊剤としては、例えばカルメロースを挙げることができる。毛管現象型の崩壊剤を配合すると、医薬固形製剤の崩壊速度に所望の制御を付与することができ、その結果薬理活性物質の放出速度がより制御可能となる。例えば,薬理活性物質の放出速度をより速やかにしたい場合は,毛管現象型の崩壊剤の配合割合を高く設定すればよい。あるいは薬理活性物質の放出速度をより緩やかにしたい場合は毛管現象型の崩壊剤の配合割合を低く設定すればよい。
【0051】
毛管現象型の崩壊剤は製剤内部へ水を速やかに浸透させるので、本発明のように製剤内部への水の浸透を制御し、製剤表層部のみを崩壊させるためには、毛管現象型の崩壊剤を(d)水不溶性微粒子と併用するのがより効果的である。
【0052】
(e)毛管現象型の崩壊剤の含有量は、医薬固形製剤中、通常0.1〜15重量%、好ましくは0.5〜10重量%、より好ましくは1〜7.5重量%である。
【0053】
カルメロースとしては、医薬の分野において使用可能な品質でかつ容易に入手可能なものが使用される。カルメロースは、カルボキシメチルで化学修飾された酸性のセルロース誘導体で、カルメロースナトリウムを鉱酸でpHを下げて析出させることにより得られる。カルメロースは酸性のカルボン酸に属するが、解離恒数が1.4×10−3の微弱酸性であり、緩衝力がある。カルメロースは他の一般的な崩壊補助剤、崩壊剤に比べ、水の取り込みが弱く、膨潤性に劣る。しかしながら、水濡れ性に優れるため、製剤内部に速やかに水を浸透させ、製剤内の粒子間の結合力を切断して、崩壊を促す(以上、カルメロース技術資料 五徳薬品社)。本発明において使用できるカルメロースとしては、市販品が入手可能であり、例えばニチリン化学工業社製の「NS-300」等を使用できる。
【0054】
本発明の医薬固形製剤には、上記(a)〜(c)成分、更には(d)及び/又は(e)成分に加え、その他の成分を含有することができる。その他の成分としては、例えば、賦形剤、結合剤、pH調整剤、吸収促進剤、滑沢剤、着色剤、矯味剤、香料、剤皮等の固形医薬製剤に配合可能な各種添加剤を挙げることができる。また必要に応じてフィルムコーティングを施してもよい。これらの成分は、本発明の効果を妨げない範囲内で本発明の医薬固形製剤に配合できる。
【0055】
本発明の医薬固形製剤は、上記各成分を混合し、公知の方法により製造することができる。例えば、直接打錠法により製造するか、或いは、乾式造粒法、湿式造粒法等により顆粒を製造し、打錠法を経て製造できる。本発明の固形製剤を錠剤とする場合の具体的な製造工程は、混合工程及び打錠工程を備え、必要に応じて、これらの工程の前後に、乾式造粒工程、湿式造粒工程、乾燥工程、整粒工程等を備えていてもよい。また打錠工程の後に、フィルムコーティング工程を備えていてもよい。本発明の医薬固形製剤は、医薬の分野で通例、汎用される製造用機器を用いて製造される。
【0056】
本発明において、医薬固形製剤の剤型は、特に限定されるものではなく、例えば、錠剤、顆粒剤、カプセル剤等が挙げられる。剤型がカプセル剤である場合、1種類以上の錠剤及び/又は顆粒剤を含有するカプセル剤としてもよい。本発明の医薬固形製剤の剤型が錠剤及びカプセル剤であると、取扱い易さ及び服用のし易さの点で好ましい。また、本発明の医薬固形製剤に配合される薬理活性物質が、光に不安定である場合、あるいは不快な味又は臭いを有する場合には、錠剤に通例汎用される被膜を施して、それをマスキングすることにより、品質の向上を図り、服用を容易にすることができる。さらに、錠剤強度の向上、及び湿度対策の観点から、被膜を本発明の効果を妨げない程度に施してもよい。
【0057】
本発明の医薬固形製剤が、錠剤として製造される場合、その錠剤の直径又は長径が3〜30mmの範囲にあることが、生産性、取扱い易さ及び服用のし易さの観点から好ましい。また、本発明の医薬固形製剤が、顆粒剤として製造される場合、その顆粒の粒子径が0.3〜3mmの範囲にあることが、生産性の観点から好ましい。さらに、本発明の医薬固形製剤が、カプセル剤として製造させる場合、カプセルのサイズが5〜00号であることが、取扱い易さ及び服用のし易さの観点から好ましい。
【実施例】
【0058】
以下に参考例、実施例及び比較例を挙げて本発明をより一層明らかにする。
【0059】
参考例1(吸水性高分子化合物の吸水性の試験)
(1.1) 吸水性高分子化合物 以下の5種の吸水性高分子化合物を用いて吸水性の試験を行った。
【0060】
(a) ポリカルボフィルカルシウム,商品名「NOVEON CA-1」,Lubrizol社製(この吸水性高分子化合物を以下「CA−1」という)
(b) ポリビニルアルコール,商品名「ゴーセノールAH-17」,日本合成化学工業社製(この吸水性高分子化合物を以下「AH−17」という)
(c) カルボキシビニルポリマー,商品名「Carbopol 71GNF」,Lubrizol社製(この吸水性高分子化合物を以下「71GNF」という)
(d) ポリアクリル酸ナトリウム架橋分岐型,商品名「ジュンロンPW-110」,日本純薬社製(この吸水性高分子化合物を以下「PW−110」という)
(e) ポリカルボフィル,商品名「NOVEON AA-1」,Lubrizol社製(この吸水性高分子化合物を以下「AA−1」という)
(1.2) 試験方法:ティーバッグ法(吸水能の評価)
ポリエステル製不織布のティーバック(70mm×95mm)に、106〜300μmの範囲の粒子径を有する乾燥吸水性高分子化合物約0.5gを入れ、20±5℃、過剰量の試験液A又は試験液Bに浸漬し、上記高分子化合物を2時間、4時間、6時間及び8時間吸水させた後、ティーバックを引き上げて1分間水切りを行い、重量(g)を測定した。この値を(x)とした。同様の操作をティーバックのみで行った場合の重量(g)をブランクとして、経時的に測定した。この値を(y)とする。そして、下記式のように、得られた値(x)から(y)を減じた値を、吸水性高分子化合物の乾燥重量で除し、得られた値を吸水量(g/高分子1g)とした。
【0061】
吸水量={(x)−(y)}/(吸水性高分子化合物の乾燥重量)
試験液Aに浸漬して得られた結果を表1に、試験液Bに浸漬して得られた結果を表2に示す。なお、使用する試験液A及び試験液Bは、以下の通りである。
【0062】
試験液A:薄めたMcIlvaine緩衝液(酸性溶液)、pH4.0
試験液B:日本薬局方溶出試験液第二液(中性溶液)、pH6.8
【0063】
【表1】

【0064】
【表2】

【0065】
(1.3) 試験結果及び考察
CA−1のポリカルボフィルカルシウムは、pH4.0及びpH6.8のいずれの試験液においても、時間の経過と共に吸水量が増大するが、吸水量は他の吸水性高分子化合物(AH−17、71GNF及びPW−110)に比べて少なかった。
【0066】
ポリカルボフィルカルシウムに関して、吸水量と時間との関係をプロットした。結果を図1に示す。
【0067】
図1に示すように、ポリカルボフィルカルシウムは、pH4.0及びpH6.8のいずれの試験液においても、ほぼ一定速度で吸水が進行していることが判明した。相関係数もR2=0.9以上と、良好な相関性が確認された。
【0068】
調製例1(トルバプタンの非晶質性粉末の製造方法)
非晶質化したトルバプタンを次のようにして調製した。即ち、トルバプタン(7−クロロ−5−ヒドロキシ−1−[2−メチル−4−(2−メチルベンゾイルアミノ)ベンゾイル]−2,3,4,5−テトラヒドロ−1H−ベンゾアゼピン)100g及びヒドロキシプロピルセルロース(HPC―SL、日本曹達社製、ヒドロキシプロポキシル基含量:53〜78重量%)50gをジクロロメタン1390g及びエタノール350gの混合溶媒に溶解し、噴霧乾燥機(大川原加工機社製,ODT―8型)で処理後、直ちに真空乾燥機(タバイエスペック社製,LCV―232)で乾燥し、非晶質性粉末(非晶質化トルバプタン)を調製した。
【0069】
以下の実施例、比較例で使用されるトルバプタン非晶質性粉末は、本調製例1と同様にして調製した。
【0070】
調製例2(シロスタゾールのSLSとの混合微粉砕品の製造方法)
シロスタゾール(大塚製薬社製)100gとラウリル硫酸ナトリウム(SLS,日光ケミカルズ社製)5gとを混合し、ジェットミル粉砕機(100AS型,パウレック社製)で混合微粉砕を行った。
【0071】
実施例1
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末9g、マルチトール (マルチソルブ P90,ロケット社製) 2.9g、ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 3g、ステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm) 0.1gをよく混合後、精密万能機(島津製作所社製,オートグラフAG-I型)によって、直径7.5mm、圧縮力8kN、圧縮速度50mm/分の操作条件で主剤60mgを含有する重量約150mgの円形錠を製造した。
【0072】
実施例2
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末9g、マルチトール (マルチソルブ P90,ロケット社製) 2.6g、ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 3g、コロイド状二酸化ケイ素 (アエロジル200,アエロジル社製、平均粒子径:0.015μm) 0.3g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm) 0.1gをよく混合後、精密万能機(島津製作所社製,オートグラフAG-I型)によって、直径7.5mm、圧縮力8kN、圧縮速度50mm/分の操作条件で主剤60mgを含有する重量約150mgの円形錠を製造した。
【0073】
実施例3
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末9g、含水マルトース (サンマルト-S,三和澱粉工業社製) 4.4g、ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 3.6g、カルメロース(NS-300,ニチリン化学工業社製) 0.9g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm)0.1gをよく混合後、精密万能機(島津製作所社製,オートグラフAG-I型)によって、直径8mm、圧縮力10kN、圧縮速度50mm/分の操作条件で主剤60mgを含有する重量約180mgの円形錠を製造した。
【0074】
実施例4
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末9g、マルチトール (マルチソルブ P90,ロケット社製) 7.4g、ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 0.2g、カルメロース (NS-300,ニチリン化学工業社製) 0.9g、コロイド状二酸化ケイ素 (アエロジル200,アエロジル社製、平均粒子径:0.015μm) 0.4g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm) 0.2gをよく混合後、精密万能機(島津製作所社製,オートグラフAG-I型)によって、直径7.5mm、圧縮力7kN、圧縮速度100mm/分の操作条件で主剤60mgを含有する重量約180mgの円形錠を製造した。
【0075】
実施例5
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末9g、マルチトール (マルチソルブ P90,ロケット社製) 6.6g、ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 0.9g、カルメロース (NS-300,ニチリン化学工業社製) 0.9g、コロイド状二酸化ケイ素 (アエロジル200,アエロジル社製、平均粒子径:0.015μm) 0.4g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm) 0.2gをよく混合後、精密万能機(島津製作所社製、オートグラフAG-I型)によって、直径7.5mm、圧縮力7kN、圧縮速度100mm/分の操作条件で主剤60mgを含有する重量約180mgの円形錠を製造した。
【0076】
実施例6
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末9g、マルチトール (マルチソルブ P90,ロケット社製) 5.7g、ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 7.2g、カルメロース (NS-300,ニチリン化学工業社製) 1.8g、コロイド状二酸化ケイ素 (アエロジル200,アエロジル社製、平均粒子径:0.015μm) 0.2g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm) 0.2gをよく混合後、精密万能機(島津製作所社製、オートグラフAG-I型)によって、直径8.5mm、圧縮力9kN、圧縮速度50mm/分の操作条件で主剤60mgを含有する重量約240mgの円形錠を製造した。
【0077】
実施例7
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末9g、含水マルトース (サンマルト-S,三和澱粉工業社製) 11.7g、ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 2.4g、カルメロース(NS-300,ニチリン化学工業社製) 0.6g、コロイド状二酸化ケイ素 (アエロジル200,アエロジル社製、平均粒子径:0.015μm) 0.1g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm)0.2gをよく混合後、精密万能機(島津製作所社製、オートグラフAG-I型)によって、直径8.5mm、圧縮力9kN、圧縮速度50mm/分の操作条件で主剤60mgを含有する重量約240mgの円形錠を製造した。
【0078】
実施例8
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末9g、含水マルトース (サンマルト-S,三和澱粉工業社製) 5.6g、ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 4g、カルメロース( NS-300,ニチリン化学工業社製)0.5g、コロイド状二酸化ケイ素 (アエロジル200,アエロジル社製、平均粒子径:0.015μm) 0.7g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm)0.2gをよく混合後、精密万能機(島津製作所社製、オートグラフAG-I型)によって、直径8mm、圧縮力8kN、圧縮速度50mm/分の操作条件で主剤60mgを含有する重量約200mgの円形錠を製造した。
【0079】
実施例9
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末9g、トレハロース(トレハロースP,旭化成ケミカルズ製) 3.9g、ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 3.6g、カルメロース (NS-300,ニチリン化学工業社製) 0.9g、コロイド状二酸化ケイ素 (アエロジル200,アエロジル社製、平均粒子径:0.015μm) 0.4g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm) 0.2gをよく混合後、精密万能機(島津製作所社製、オートグラフAG-I型)によって、直径8mm、圧縮力8kN、圧縮速度50mm/分の操作条件で主剤60mgを含有する重量約180mgの円形錠を製造した。
【0080】
実施例10
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末9g、マルチトール (マルチソルブ P90,ロケット社製) 3.9g、ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 3.6g、カルメロース (NS-300,ニチリン化学工業社製) 0.9g、コロイド状二酸化ケイ素 (アエロジル200,アエロジル社製、平均粒子径:0.015μm) 0.4g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm) 0.2gをよく混合後、精密万能機(島津製作所社製、オートグラフAG-I型)によって、直径8mm、圧縮力8kN、圧縮速度50mm/分の操作条件で主剤60mgを含有する重量約180mgの円形錠を製造した。
【0081】
実施例11
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末9g、マルチトール (マルチソルブ P90,ロケット社製) 5.7g、ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 1.8g、カルメロース (NS-300,ニチリン化学工業社製) 0.9g、コロイド状二酸化ケイ素 (アエロジル200,アエロジル社製、平均粒子径:0.015μm) 0.4g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm) 0.2gをよく混合後、精密万能機(島津製作所社製、オートグラフAG-I型)によって、直径7.5mm、圧縮力7kN、圧縮速度100mm/分の操作条件で主剤60mgを含有する重量約180mgの円形錠を製造した。
【0082】
実施例12
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末9g、マルチトール (マルチソルブ P90,ロケット社製) 2.1g、ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 3.6g、カルメロース (NS-300,ニチリン化学工業社製) 0.9g、結晶セルロース (KG-802,旭化成ケミカルズ社製) 1.8g、コロイド状二酸化ケイ素 (アエロジル200,アエロジル社製、平均粒子径:0.015μm) 0.4g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm) 0.2gをよく混合後、精密万能機(島津製作所社製、オートグラフAG-I型)によって、直径7.5mm、圧縮力10kN、圧縮速度100mm/分の操作条件で主剤60mgを含有する重量約180mgの円形錠を製造した。
【0083】
実施例13
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末9g、マルチトール (マルチソルブ P90,ロケット社製) 3.6g、ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 3.6g、カルメロース (NS-300,ニチリン化学工業社製) 0.9g、タルク (MMR,浅田製粉社製、平均粒子径:4μm) 0.4g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm) 0.2gをよく混合後、精密万能機(島津製作所社製、オートグラフAG-I型)によって、直径8mm、圧縮力8kN、圧縮速度50mm/分の操作条件で主剤60mgを含有する重量約177mgの円形錠を製造した。
【0084】
実施例14
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末9g、マルチトール (マルチソルブ P90,ロケット社製) 3.6g、ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 3.6g、カルメロース (NS-300,ニチリン化学工業社製) 0.9g、酸化チタン (A-HR,フロイント産業社製、平均粒子径:1μm) 0.4g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm) 0.2gをよく混合後、精密万能機(島津製作所社製、オートグラフAG-I型)によって、直径8mm、圧縮力8kN、圧縮速度50mm/分の操作条件で主剤60mgを含有する重量約177mgの円形錠を製造した。
【0085】
実施例15
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末360g、マルチトール (マルチソルブ P90,ロケット社製) 148g、ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 120g、カルメロース (NS-300,ニチリン化学工業社製) 36g、ヒドロキシプロピルセルロース (HCP-L微粉,日本曹達社製) 36g、コロイド状二酸化ケイ素 (アエロジル200,アエロジル社製、平均粒子径:0.015μm) 12g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm) 8gを容積3リットルのドラム混合機内でよく混合後、ロータリー式連続打錠機 (12HUK-AWC型、菊水製作所社製)によって、直径7.5mm、打錠圧1,100kg、回転速度40rpmの操作条件で主剤60mgを含有する重量約180mgの円形錠を製造した。
【0086】
実施例16
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末360g、 マルチトール (マルチソルブ P90,ロケット社製) 160g、ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 120g、カルメロース (NS-300,ニチリン化学工業社製) 24g、ヒドロキシプロピルセルロース (HCP-L微粉,日本曹達社製) 36g、コロイド状二酸化ケイ素 (アエロジル200,アエロジル社製、平均粒子径:0.015μm) 12g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm) 8gを容積3リットルのドラム混合機内でよく混合後、ロータリー式連続打錠機 (12HUK-AWC型,菊水製作所社製)によって、直径7.5mm、打錠圧1,100kg、回転速度40rpmの操作条件で主剤60mgを含有する重量約180mgの円形錠を製造した。
【0087】
実施例17
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末9g、ラクチトール (ラクチトール LC-1,日研化成社製) 3.7g、ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 3g、カルメロース (NS-300,ニチリン化学工業社製) 0.9g、ヒドロキシプロピルセルロース (HCP-L微粉,日本曹達社製) 0.9g、コロイド状二酸化ケイ素 (アエロジル200,アエロジル社製、平均粒子径:0.015μm) 0.3g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm) 0.2gをよく混合後、精密万能機(島津製作所社製,オートグラフAG-I型)によって、直径7.5mm、圧縮力7kN、圧縮速度100mm/分の操作条件で主剤60mgを含有する重量約180mgの円形錠を製造した。
【0088】
実施例18
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末9g、マルチトール (マルチソルブ P90,ロケット社製) 3.1g、ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 3g、カルメロース (NS-300,ニチリン化学工業社製)0.9g、ヒドロキシプロピルセルロース (HCP-L微粉,日本曹達社製) 0.9g、コロイド状二酸化ケイ素 (アエロジル200,アエロジル社製、平均粒子径:0.015μm) 0.9g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm)0.2gをよく混合後、精密万能機(島津製作所社製,オートグラフAG-I型)によって、直径7.5mm、圧縮力7kN、圧縮速度100mm/分の操作条件で主剤60mgを含有する重量約180mgの円形錠を製造した。
【0089】
実施例19
テオフィリン (日本薬局方テオフィリン,白鳥製薬社製)10g、 マルチトール(マルチソルブ P90,ロケット社製) 0.75g、ポリカルボフィルカルシウム(NOVEON CA-1,Lubrizol社製)2g、カルメロース(NS-300,ニチリン化学工業社製) 0.3g、ヒドロキシプロピルセルロース (HPC-L微粉,日本曹達社製) 1.5g、コロイド状二酸化ケイ素 (アエロジル200,アエロジル社製、平均粒子径:0.015μm) 0.3g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm) 0.2gをよく混合後、精密万能機(島津製作所社製、オートグラフAG-I型)によって、直径8.5mm、圧縮力8kN、圧縮速度100mm/分の操作条件で主剤200mgを含有する重量約300mgの円形錠を製造した。
【0090】
実施例20
ラウリル硫酸ナトリウムとともに混合微粉砕されたシロスタゾール5.25g (シロスタゾール/ラウリル硫酸ナトリウム = 10/0.5,シロスタゾールとして5g),マルチトール (マルチソルブP90,ロケット社製) 3.15g,ポリカルボフィルカルシウム(NOVEON CA-1,Lubrizol社製) 3g,カルメロース (NS-300,ニチリン化学工業社製) 0.15g,結晶セルロース (KG-802,旭化成ケミカルズ社製) 1.5g,ヒドロキシプロピルセルロース (HPC-L微粉,日本曹達社製) 1.5g,酸化チタン (A-HR,フロイント産業社製,平均粒子径:1μm) 0.3 g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm)0.15gをよく混合後,精密万能機(島津製作所社製,オートグラフAG-I型)によって,直径8.5mm,圧縮力9kN,圧縮速度100mm/minの操作条件で主剤100mgを含有する重量約300mgの円形錠を製造した。
【0091】
実施例21
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末9g、含水マルトース (サンマルト-S,三和澱粉工業社製) 20.5g、ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 8g、カルメロース( NS-300,ニチリン化学工業社製) 2g、コロイド状二酸化ケイ素 (アエロジル200,アエロジル社製、平均粒子径:0.015μm) 0.4g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm)0.1gをよく混合後、精密万能機(島津製作所社製,オートグラフAG-I型)によって、直径10.5mm、圧縮力17.2kN、圧縮速度50mm/分の操作条件で主剤60mgを含有する重量約400mgの円形錠を製造した。
【0092】
実施例22
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末9g、含水マルトース (サンマルト-S,三和澱粉工業社製) 13.1g、ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 6g、カルメロース (NS-300,ニチリン化学工業社製) 1.5g、コロイド状二酸化ケイ素 (アエロジル200,アエロジル社製、平均粒子径:0.015μm) 0.3g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm)0.1gをよく混合後、精密万能機(島津製作所社製,オートグラフAG-I型)によって、直径9mm、圧縮力12.7kN、圧縮速度50mm/分の操作条件で主剤60mgを含有する重量約300mgの円形錠を製造した。
【0093】
実施例23
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末900g,マルチトール (マルチソルブ P90,ロケット社製) 600g,ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 300g,カルメロース(NS-300,ニチリン化学工業社製) 30g,ヒドロキシプロピルセルロース (HCP-L微粉,日本曹達社製) 240g,エチルセルロース (エトセル SDT 10cps FP,The Dow Chemical社製,平均粒子径:5μm) 150g,タルク (PKP-81,富士タルク社製,平均粒子径:14μm) 150g及びコロイド状二酸化ケイ素 (アエロジル200,アエロジル社製,平均粒子径:0.015μm) 6gを高速攪拌混合造粒機 FM-VG-25P型,パウレック社製)内でよく混合後,ドラム混合機内でステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm) 24gと混合し,打錠用粉末を得た。ロータリー式連続打錠機 (12HUK-AWC型,菊水製作所社製)によって,直径6mm,打錠圧900kg,回転速度50rpmの操作条件で主剤20mgを含有する重量約80mgの円形錠を製造した。
【0094】
実施例24
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末900g,マルチトール (マルチソルブ P90,ロケット社製) 540g,ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 300g,カルメロース (NS-300,ニチリン化学工業社製) 90g,ヒドロキシプロピルセルロース (HCP-L微粉,日本曹達社製) 240g,エチルセルロース (エトセル SDT 10cps FP,The Dow Chemical社製,平均粒子径:5μm) 150g,タルク (PKP-81,富士タルク社製,平均粒子径:14μm) 150g及びコロイド状二酸化ケイ素 (アエロジル200,アエロジル社製,平均粒子径:0.015μm) 6gを高速攪拌混合造粒機 FM-VG-25P型,パウレック社製)内でよく混合後,ドラム混合機内でステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm) 24gと混合し,打錠用粉末を得た。ロータリー式連続打錠機 (12HUK-AWC型,菊水製作所社製)によって,直径6mm,打錠圧900kg,回転速度50rpmの操作条件で主剤20mgを含有する重量約80mgの円形錠を製造した。
【0095】
実施例25
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末900g,マルチトール (マルチソルブ P90,ロケット社製) 480g,ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 300g,カルメロース (NS-300,ニチリン化学工業社製) 150g,ヒドロキシプロピルセルロース (HCP-L微粉,日本曹達社製) 240g,エチルセルロース(エトセル SDT 10cps FP,The Dow Chemical社製,平均粒子径:5μm) 150g,タルク (PKP-81,富士タルク社製,平均粒子径:14μm) 150g及びコロイド状二酸化ケイ素 (アエロジル200,アエロジル社製,平均粒子径:0.015μm) 6gを高速攪拌混合造粒機 FM-VG-25P型,パウレック社製)内でよく混合後,ドラム混合機内でステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm) 24gと混合し,打錠用粉末を得た。ロータリー式連続打錠機 (12HUK-AWC型,菊水製作所社製)によって,直径6mm,打錠圧900kg,回転速度50rpmの操作条件で主剤20mgを含有する重量約80mgの円形錠を製造した。
【0096】
実施例26
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末6g, マルチトール (マルチソルブ P90,ロケット社製) 3.6g,ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 2g,カルメロース (NS-300,ニチリン化学工業社製) 0.2g,ヒドロキシプロピルセルロース (HCP-L微粉,日本曹達社製) 1.6g,エチルセルロース (エトセル SDT 10cps FP,The Dow Chemical社製,平均粒子径:5μm) 1.2g,コロイド状二酸化ケイ素 (アエロジル200,アエロジル社製,平均粒子径:0.015μm) 1.2g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm) 0.2gをよく混合後,精密万能機(島津製作所社製,オートグラフAG-I型)によって,直径5.5mm,圧縮力5kN,圧縮速度100mm/minの操作条件で主剤20mgを含有する重量約80mgの円形錠を製造した。
【0097】
実施例27
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末300g,マルチトール (マルチソルブ P90,ロケット社製) 202g,ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 100g,カルメロース (NS-300,ニチリン化学工業社製) 10g,ヒドロキシプロピルセルロース (HCP-L微粉,日本曹達社製) 80g,エチルセルロース (エトセル SDT 10cps FP,The Dow Chemical社製,平均粒子径:5μm) 50g,タルク (PKP-81,富士タルク社製,平均粒子径:14μm) 50g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm) 8gを容積5Lの高速攪拌混合造粒機 FM-VG-05型,パウレック社製)内でよく混合後,ロータリー式連続打錠機 (12HUK-AWC型,菊水製作所社製)によって,直径5.5mm,打錠圧800kg,回転速度50rpmの操作条件で主剤20mgを含有する重量約80mgの円形錠を製造した。
【0098】
実施例28
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末6g, マルチトール (マルチソルブ P90,ロケット社製) 3g,ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 3gをよく混合後,精密万能機(島津製作所社製,オートグラフAG-I型)によって,直径7.5mm,圧縮力8kN,圧縮速度50mm/minの操作条件で主剤60mgを含有する重量約150mgの円形錠を製造した。
【0099】
実施例29
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末6g, D-マンニトール (ペアリトール200SD,ロケット社製) 3g,ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 3gをよく混合後,精密万能機(島津製作所社製,オートグラフAG-I型)によって,直径7.5mm,圧縮力8kN,圧縮速度50mm/minの操作条件で主剤60mgを含有する重量約150mgの円形錠を製造した。
【0100】
実施例30
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末6g, イソマルト (galenIQ 721,PALATINIT GmbH製) 3g,ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 3gをよく混合後,精密万能機(島津製作所社製,オートグラフAG-I型)によって,直径7.5mm,圧縮力8kN,圧縮速度50mm/minの操作条件で主剤60mgを含有する重量約150mgの円形錠を製造した。
【0101】
実施例31
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末9g, マルチトール(マルチソルブ P90,ロケット社製) 2.25g,ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 3g,及びをカルメロース (NS-300,ニチリン化学工業社製) 0.75gをよく混合後,精密万能機(島津製作所社製,オートグラフAG-I型)によって,直径7.5mm,圧縮力8kN,圧縮速度50mm/minの操作条件で主剤60mgを含有する重量約150mgの円形錠を製造した。
【0102】
実施例32
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末3g, マルチトール (マルチソルブ P90,ロケット社製) 3.5g,ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 2g,カルメロース (NS-300,ニチリン化学工業社製) 0.6g,ヒドロキシプロピルセルロース (HCP-L微粉,日本曹達社製) 1g,エチルセルロース (エトセル SDT 10cps FP,The Dow Chemical社製,平均粒子径:5μm) 0.6g,コロイド状二酸化ケイ素 (アエロジル200,アエロジル社製,平均粒子径:0.015μm) 0.2g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm) 0.1gをよく混合後,精密万能機(島津製作所社製,オートグラフAG-I型)によって,直径6mm,圧縮力6kN,圧縮速度100mm/minの操作条件で主剤20mgを含有する重量約100mgの円形錠を製造した。
【0103】
比較例1
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末9g、マルチトール (マルチソルブ P90,ロケット社製) 4.9g、カルメロース (NS-300,ニチリン化学工業社製) 0.8g、コロイド状二酸化ケイ素 (アエロジル200,アエロジル社製、平均粒子径:0.015μm) 0.3g、及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm) 0.1gをよく混合後、精密万能機(島津製作所社製,オートグラフAG-I型)によって、直径7.5mm、圧縮力8kN、圧縮速度100mm/分の操作条件で主剤60mgを含有する重量約150mgの円形錠を製造した。
【0104】
比較例2
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末9g、カルボキシビニルポリマー(Carbopol 71GNF,Lubrizol社製)3g、マルチトール (マルチソルブ P90,ロケット社製) 3.7g、カルメロース (NS-300,ニチリン化学工業社製) 0.9g、ヒドロキシプロピルセルロース (HPC-L,日本曹達社製) 0.9g、コロイド状二酸化ケイ素 (アエロジル200,アエロジル社製、平均粒子径:0.015μm) 0.3g、ステアリン酸マグネシウム(植物性,太平化学産業社製,平均粒子径:6μm) 0.2gを秤取し、よく混合後、精密万能機(オートグラフ AG-I型,島津製作所製)によって、直径7.5mm、圧縮力7kN、圧縮速度100mm/分の操作条件で主剤60mgを含有する重量約180mgの円形錠を製造した。
【0105】
比較例3
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末9g、ポリビニルアルコール (ゴーセノール AH-17,日本合成化学社製) 3g、マルチトール (マルチソルブ P90,ロケット社製) 3.7g、カルメロース (NS-300,ニチリン化学工業社製) 0.9g、ヒドロキシプロピルセルロース (HPC-L,日本曹達社製) 0.9g、コロイド状二酸化ケイ素 (アエロジル200,アエロジル社製、平均粒子径:0.015μm) 0.3g、ステアリン酸マグネシウム(植物性,太平化学産業社製,平均粒子径:6μm) 0.2gを秤取し、よく混合後、精密万能機(オートグラフ AG-I型,島津製作所製)によって、直径7.5mm、圧縮力7kN、圧縮速度100mm/分の操作条件で主剤60mgを含有する重量約180mgの円形錠を製造した。
【0106】
比較例4
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末9g、ポリカルボフィル (NOVEON AA-1,Lubrizol社製) 3g、マルチトール (マルチソルブ P90,ロケット社製) 3.7g、カルメロース (NS-300,ニチリン化学工業社製) 0.9g、ヒドロキシプロピルセルロース (HPC-L,日本曹達社製) 0.9g、コロイド状二酸化ケイ素 (アエロジル200,アエロジル社製、平均粒子径:0.015μm) 0.3g、ステアリン酸マグネシウム(植物性,太平化学産業社製,平均粒子径:6μm) 0.2gを秤取し、よく混合後、精密万能機(オートグラフ AG-I型,島津製作所製)によって、直径7.5mm、圧縮力7kN、圧縮速度100mm/分の操作条件で主剤60mgを含有する重量約180mgの円形錠を製造した。
【0107】
比較例5
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末9g、ポリカルボフィルカルシウム(NOVEON CA-1,Lubrizol社製)4g、カルメロース (NS-300,ニチリン化学工業社製) 0.8g、コロイド状二酸化ケイ素 (アエロジル200,アエロジル社製、平均粒子径:0.015μm) 0.3g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm) 0.1gをよく混合後、精密万能機(島津製作所社製,オートグラフAG-I型)によって、直径6.5mm、圧縮力7kN、圧縮速度50mm/分の操作条件で主剤60mgを含有する重量約142mgの円形錠を製造した。
【0108】
試験例1
実施例1〜実施例32及び比較例1〜5で製造された円形錠について、溶出試験時の製剤の形態変化が、表層部から逐次的に固形剥離物質を生じながら崩壊する形(逐次崩壊型)であるか、それとも内部崩壊型、ハイドロゲル型(膨潤型)又は不溶性マトリックス型であるかを目視観察により判定した。
【0109】
本発明の医薬固形製剤の経時的な形状変化と薬理活性物質放出挙動の関係を図2に示す。図2に示すように、本発明の医薬固形製剤は、薬理活性物質を放出していく過程(1)〜(5)において、製剤表層部から逐次固形剥離物質を生じながら浸食を受け、最終的に錠剤は消失し、固形剥離物質が残存する。製剤の崩壊の過程で生じる固形剥離物質はそのままの状態を保っているのではなく、薬理活性物質を放出しながら溶解又は崩壊し、最終的に透明なゲルビーズを残渣として認める。このゲルビースは吸水によって膨潤、ゲル化した吸水性高分子化合物である。
【0110】
目視観察の結果を後記表3に示すが、全ての実施例で調製した製剤は逐次崩壊型の薬理活性物質溶出挙動を示した。一方、比較例1で製造された円形錠は不溶性マトリックス型の溶出挙動を示し,溶出試験後も製剤の形状が強く維持されていた。比較例2、4で製造された円形錠はいずれも製剤表層部にハイドロゲル型のような水和したゲル層が形成されており,逐次的な崩壊挙動は観察されなかった。比較例3で製造された円形錠は製剤内部へ水が急激に浸透したことによって大きく崩壊する内部崩壊型の溶出挙動を示していた。比較例5で製造された円形錠は製剤の側面部分から強く浸食を受ける上下破断型の溶出挙動を示し,逐次崩壊型ではなかった。
【0111】
試験例2
実施例で製造された各円形錠について、酸性の試験溶液(試験液C)及び中性の試験溶液(試験液D)のそれぞれを用いて溶出試験を行った。溶出試験は、次の通りである。
【0112】
試験液C(酸性条件):pH4.0の薄めたMcIlvaine緩衝液にポリソルベート80を1w/v%の濃度となるよう添加した溶液900ml
試験液D(中性条件):pH6.8日本薬局方溶出試験液第二液にポリソルベート80を1w/v%の濃度となるよう添加した溶液900ml
溶出試験システムNTR−6200A(富山産業社製)を用いて日本薬局方溶出試験方法第二法(パドル法)によって固形製剤からのトルバプタンの溶出試験を行った。パドルの回転数は100rpmとし、測定波長に268nm及び350nmの二波長を用いた。
【0113】
(1)薬理活性物質放出速度
溶出試験経過時間と、最初のサンプリング時点から85%以上薬理活性物質が溶出する最初のサンプリング時点までの溶出率データを用いて、直線回帰を行った時に得られる回帰式の相関係数が、実施例1〜実施例32で製造された円形錠は、酸性試験液及び中性試験液のいずれの試験液に対しても0.90以上であり、円形錠から薬理活性物質が一定の速度で放出され,薬理活性物質の溶出率の時間推移から実施例1〜実施例32は全て徐放性の薬理活性物質放出挙動を示していることが確認された。結果を表3〜表6に示す。
【0114】
【表3】

【0115】
【表4】

【0116】
【表5】

【0117】
【表6】

【0118】
(2)薬理活性物質放出挙動
酸性試験液及び中性試験液のそれぞれにおいて得られる各測定サンプリングポイントにおける溶出率の差が常に15%以内である場合に、酸性、中性それぞれのpHにおいて得られる薬理活性物質の放出挙動が類似していると判断した。この判定基準は、昭和63年3月11日付 薬審1第5号「徐放性製剤(経口投与製剤)の設計及び評価に関するガイドライン」に溶出規格を設定する際の許容域である±10〜15%を考慮して設定した。
【0119】
結果を表7に示す。
【0120】
【表7】

【0121】
表7より,酸性、中性それぞれのpHの試験液において得られる薬理活性物質の放出挙動がこれらの実施例において類似していることが確認された。
【0122】
試験例3(ビーグル犬による薬物動態試験)
実施例22で製造された錠剤を用いて薬物動態試験を行った。
【0123】
実施例22で製造された錠剤(トルバプタン60mg含有)をイヌ用ゼラチンカプセルに充填し、このゼラチンカプセル1個を3〜5頭のビーグル犬に空腹時又は食後に経口投与し、経時的に採血を行い、血中トルバプタン濃度を測定した。また、同様にトルバプタンを60mg含有する錠剤(ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン、乳糖、コーンスターチ、結晶セルロース、ヒドロキシプロピルセルロース、低置換度ヒドロキシプロピルセルロース及びステアリン酸マグネシウムからなる即放性製剤)を比較例として空腹下で経口投与し、経時的に採血を行い、血中トルバプタン濃度を測定した。
【0124】
表8は上記経口投与試験によって得られた薬物動態パラメータである。
【0125】
【表8】

【0126】
なお、表8において、AUCtは血中濃度時間曲線下面積 (台形法)、AUCinfは無限大時間までの血中濃度時間曲線下面積、Cmaxは最高血中濃度、Tmaxは最高血中濃度到達時間、MRTtは平均滞留時間である。
【0127】
表8から明らかなように、実施例22で製造された製剤は、約6時間かけて薬理活性物質を放出するよう設計されている。これらを強制経口投与後の血中薬理活性物質濃度推移は、薬理活性物質の放出挙動に類似する傾向が認められた。すなわち、薬理活性物質を6時間で放出するよう設計された実施例22の製剤の最高血中薬理活性物質濃度は約6時間で到達していた。特に、実施例22の製剤を空腹下投与する場合、得られた血中薬理活性物質濃度の個体間変動(標準誤差)は対照の即放錠と比較して、極めて小さく、本発明の徐放性製剤は個体間変動の影響を受けにくいことが明らかになった。
【0128】
また、実施例22の製剤を食後投与した時においても最高血中薬理活性物質濃度は4〜6時間で到達していた。食事によって血中薬理活性物質濃度は多少高くなる傾向を示しているが、全体的な血中薬理活性物質濃度推移は食事によって大きく変化することはなく、本発明の製剤は食事の影響が少ない徐放性製剤であることが明らかとなった。
【技術分野】
【0001】
本発明は、医薬固形製剤に関する。
【背景技術】
【0002】
医薬の分野において、薬剤放出を制御し、薬剤血中濃度を適正レベルに長時間維持させる試みが広く行われている。薬剤血中濃度を適正レベルに長時間維持するためには、薬剤の吸収を長時間持続できるような製剤学的工夫(放出制御)が必要である。このような放出制御された製剤を徐放性製剤という。
【0003】
徐放性製剤とは、投与回数の減少又は副作用の軽減を図る等の目的で製剤からの薬剤の放出速度、放出時間、放出部位を調節した製剤であると定義されている。また、即放性製剤とは、製剤からの薬剤の放出性を特に調節していない製剤であると定義されている。今日まで、放出制御された徐放性製剤として、例えば、経口投与製剤である場合、水不溶性マトリックス型、ハイドロゲルマトリックス型、フィルムコーティング型、浸透圧ポンプ型等の製剤が広く知られている。
【0004】
一方、即放性製剤と徐放性製剤とを、放出制御の有無ではなく、崩壊時間の長短で分類することができる。つまり、製剤の崩壊時間が短く即放性の薬剤放出を示すのが即放性製剤であり、崩壊時間が長く徐放性の薬剤放出を示すのが徐放性製剤である。製剤の崩壊速度を制御する上で崩壊剤の配合が重要であり、また所望の崩壊速度を得るには最適な崩壊剤の選択も重要である。崩壊剤が関与する崩壊現象は、膨潤(swelling)と毛管現象(wicking)との2つに大別される。膨潤型の崩壊剤は、その強力な吸水能及び膨潤能によって製剤を崩壊させる。一方、毛管現象型の崩壊剤は、水を製剤内部の空隙に素早く浸透させることによって粒子間結合力を破壊して分散させる。
【0005】
しかしながら、膨潤型の崩壊剤及び毛管現象型の崩壊剤には、それぞれ難点がある。膨潤型の崩壊剤は、配合量が少なくても製剤を速やかに内部から崩壊させる効果が強いため、持続的な崩壊制御、すなわち徐放化には適していない。また、毛管現象型の崩壊剤は、膨潤力が小さく、製剤内部からの崩壊を起こしにくいが、崩壊剤の配合量のわずかな増減によって、即放性製剤様の崩壊挙動を示したり、崩壊力不足を示したりする。すなわち、毛管現象型の崩壊剤は、配合量の微調整が困難である。
【0006】
このように、崩壊制御による徐放化を達成するには、崩壊剤の選択やその配合割合の調整だけでは極めて困難である。
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明は、薬理活性物質の放出挙動が制御された逐次崩壊型の徐放性医薬固形製剤を提供することを課題とする。
【課題を解決するための手段】
【0008】
本発明者らは、上記課題を解決するために鋭意研究を重ねた結果、下記に示す特定の成分を組み合わせることにより、所望の徐放性医薬固形製剤が得られることを見い出した。本発明は、このような知見に基づき完成されたものである。
【0009】
すなわち、本発明は、下記項1〜項17に示す医薬固形製剤を提供する。
項1 (a)薬理活性物質、(b)ポリカルボフィルカルシウム、並びに(c)糖及び/又は糖アルコールを含有するマトリックス型の医薬固形製剤であって、前記(c)の糖及び/又は糖アルコールは、トレハロース、ラクチトール、マルトース、マルチトール、シュクロース、ソルビトール、キシリトール、エリスリトール、マンニトール、ラクトース、及びイソマルトオリゴ糖からなる群から選択される少なくとも1種である医薬固形製剤。
項2 (b)ポリカルボフィルカルシウムの含有量が1〜50重量%である項1に記載の医薬固形製剤。
項3 (c)糖及び/又は糖アルコールの含有量が0.1〜70重量%である、項1に記載の医薬固形製剤。
項4 更に、(d)水不溶性微粒子を含有する項1に記載の医薬固形製剤。
項5 (d)水不溶性微粒子が、医薬固形製剤の空隙を小さくすることができる微粒子である項4に記載の医薬固形製剤。
項6 (d)水不溶性微粒子の平均粒子径が0.002〜50μmである項4に記載の医薬固形製剤。
項7 更に、(e)毛管現象型の崩壊剤を含有する項1又は4に記載の医薬固形製剤。
項8 (e)毛管現象型の崩壊剤がカルメロースである項7に記載の医薬固形製剤。
項9 (d)水不溶性微粒子が、コロイド状二酸化ケイ素、含水二酸化ケイ素、軽質無水ケイ酸、タルク、酸化チタン、ステアリン酸マグネシウム及びエチルセルロースからなる群から選ばれる少なくとも1種である、項4に記載の医薬固形製剤。
項10 (d)水不溶性微粒子の平均粒子径が0.002〜50μmである項9に記載の医薬固形製剤。
項11 (d)水不溶性微粒子の含有量が0.01〜30重量%である、項4に記載の医薬固形製剤。
項12 (e)毛管現象型の崩壊剤の含有量が0.1〜15重量%である、項7に記載の医薬固形製剤。
項13 (c)糖及び/又は糖アルコールが、トレハロース、ラクチトール、マルトース、マルチトール、シュクロース、ソルビトール、キシリトール、及びイソマルトオリゴ糖からなる群から選ばれる少なくとも1種である、項1に記載の医薬固形製剤。
項14 (c)糖及び/又は糖アルコールが、含水結晶マルトース、マルチトール、ラクチトール一水和物、及びトレハロース二水和物からなる群から選ばれる少なくとも1種である、項1に記載の医薬固形製剤。
項15 (a)薬理活性物質の含有量が0.01〜80重量%である、項1に記載の医薬固形製剤。
項16 (a)薬理活性物質が、トルバプタン、シロスタゾール、又はテオフィリンである項1に記載の医薬固形製剤。
項17 トルバプタンが調製例1と同様にして得られる非晶質粉末として含有される項16に記載の医薬固形製剤。
【発明の効果】
【0010】
本発明の医薬固形製剤は、表層部から逐次的に固形剥離物質を生じながら崩壊する、いわゆる逐次崩壊型の医薬固形製剤であり、長期に亘って優れた一定の溶出挙動を発現する徐放性医薬固形製剤である。
【0011】
本発明の医薬固形製剤は、酸性溶液及び中性溶液での薬理活性物質の溶出挙動が類似しており、生体内での消化器官、つまり胃、小腸、大腸等のような異なるpH条件下において、pHの影響を受けずに一定速度で薬理活性物質を放出することができる。
【0012】
本発明の医薬固形製剤は、崩壊部位が常に製剤表層部に限定されるので、食事の影響を受けにくい製剤である。
【図面の簡単な説明】
【0013】
【図1】図1は、参考例1におけるポリカルボフィルカルシウムの酸性溶液及び中性溶液での吸水量と浸積時間との関係を示すグラフである。
【図2】図2は、試験例2の溶出試験における錠剤の経時的な形状変化と薬理活性物質放出挙動との関係を示すグラフである。
【発明を実施するための形態】
【0014】
以下、本発明を詳細に説明する。
本発明の医薬固形製剤は、(a)薬理活性物質、(b)ポリカルボフィルカルシウム、並びに(c)糖及び/又は糖アルコールを含有するマトリックス型の医薬固形製剤である。また、本発明の医薬固形製剤に配合される(c)の糖及び/又は糖アルコールは、トレハロース、ラクチトール、マルトース、マルチトール、シュクロース、ソルビトール、キシリトール、エリスリトール、マンニトール、ラクトース、及びイソマルトオリゴ糖からなる群から選択される少なくとも1種である。
【0015】
本発明の医薬固形製剤は、マトリックス型であり、(a)〜(c)の各成分が均一に混合されたものである。このような本発明の医薬固形製剤は、溶出試験を行うと、逐次崩壊型の崩壊を示す。逐次崩壊型の崩壊は、製剤全体に崩壊現象が及ぶのではなく、製剤の一部、特に製剤表層部に崩壊が限定されることで達成される。これは、製剤内部への水の浸透が精緻に制御されていることを意味する。
【0016】
(a)薬理活性物質
本発明で使用される薬理活性物質は、医薬活性成分として疾病の治療又は予防に供されるものである限り、特に限定されるものではない。薬理活性物質としては、フリー体、その塩、溶媒和物(水和物、エタノール和物等)又は結晶多形を用いることができる。本発明で配合される薬理活性物質は、特に、徐放化によって副作用の発現が抑えられ、治療効果が高まるような薬理活性物質が適している。薬理活性物質は、結晶性であっても非結晶性であってもよい。また、薬理活性物質は、水溶性及び脂溶性のいずれであってもよく、水に対して難溶性であってもよい。
【0017】
薬理活性物質が難溶性の場合、難溶性の薬理活性物質の溶解性を改善するために、ナノ粉砕、微粉砕、非晶質化、晶析、ナノ晶析等の公知の製剤技術を適用することができる。例えば、調製例1に示すように、薬理活性物質を単独で、あるいは薬理活性物質をヒドロキシプロピルセルロース(HPC)等のような水溶性高分子化合物とともに適当な溶媒(例えば、エタノール、ジクロロメタン等)に溶解して、その溶液を噴霧乾燥することにより非晶質性粉末を得ることができる。或いは、調製例2に示すように、薬理活性物質とラウリル硫酸ナトリウム(SLS)とを混合し、ジェットミル等の粉砕機を用いて粉砕することにより微粉砕物を得ることができる。
【0018】
本発明で用いられる薬理活性物質としては、例えば、5−アミノサリチル酸、アシクロビル、アスピリン、アセチルサリチル酸、アセトアミノフェン、アリピプラゾール、アンピシリン、イソニアジド、イブプロフェン、インドメタシン、エシタロプラム、エテンザミド、エナラプリル、エリスロマイシン、オメプラゾール、グリメピリド、ケトコナゾール、コニバプタン、サタバプタン、サルブタモール、サラゾスルファピリジン、サラゾピリン、ジアゼパム、ジクロフェナク、ジクロフェナクナトリウム、ジピリダモール、シメチジン、シロスタゾール、シンバスタチン、スクラルファート、スルピリド、スルファサラジン、セレコキシブ、タクロリムス、テオフィリン、テガフール、デキサメタゾン、デキストロメトルファン、テトミラスト、テルフェナジン、ドキソルビシン、トリアムシノロン、トルバプタン、ナジフロキサシン、ナプロキセン、ニフェジピン、尿素、バルプロ酸ナトリウム、ハロペリドール、バラシクロビル、パリペリドン、ヒドロコルチゾン、ピオグリタゾン、ファモチジン、フェナセチン、フェニトイン、フェニルプロパノールアミン、ブデソニド、プラバスタチン、プラバスタチンナトリウム、フルオロウラシル、プレドニゾロン、プレドニゾン、フロセミド、プロブコール、ベスナリノン、ペニシリン、ペルフェナジン、ボグリボース、マレイン酸クロルフェニラミン、ミダゾラム、メシル酸ドキサゾシン、メトトレキセート、モルヒネ、ラニチジン、ランソプラゾール、リシノプリル、リスペリドン、リドカイン、リボグリタゾン、レバミピド、レボドパ、ロチゴチン、ロバスタチン、ロラゼパム、ワーファリン、塩酸アンブロキソール、塩酸カルテオロール、塩酸ジフェンヒドラミン、塩酸タムスロシン、塩酸ニカルジピン、塩酸ヒドララジン、塩酸ピオグリタゾン、塩酸ブプレノルフィン、塩酸プロカテロール、塩酸モザバプタン、塩酸ラニチジン、塩酸レボカルニチン、酢酸コルチゾン、硫酸サルブタモール等を例示できる。好ましくは、シロスタゾール、トルバプタン、レバミピド、塩酸プロカテロール、アリピプラゾール、テオフィリンであり、最も好ましくはトルバプタン、シロスタゾール、テオフィリンである。
【0019】
上記薬理活性物質の含有量は、医薬製剤中、通常0.01〜80重量%、好ましくは0.1〜70重量%、より好ましくは1〜50重量%である。
【0020】
(b)ポリカルボフィルカルシウム
ポリカルボフィルカルシウムは、医薬用途で使用されている品質のものであるのが好ましい。具体的には、米国薬局方(USP31)に適合する公知のものを広く使用することができる。ポリカルボフィルカルシウムは、ジビニルアルコールで架橋されたアクリル酸ポリマーのカルシウム塩である。
【0021】
ポリカルボフィルカルシウムとしては、カルシウム含有量 18〜22重量%であり、米国薬局方(USP31)に従って測定する吸水量(Absorbing power)が35.0g−重炭酸ナトリウム水溶液/g−乾燥ポリカルボフィルカルシウム以上(乾燥ポリカルボフィルカルシウム粉末1gあたりの重炭酸ナトリウム水溶液の吸水量が35.0g以上)であるのが好ましい。また、ポリカルボフィルカルシウムの粒度としては、例えば音波振動式全自動ふるい分け測定器(ロボットシフターRPS−95型、セイシン企業社製)で測定した時に、75μm未満の粒子存在割合が10%以上で、かつ250μm以上の粒子存在割合が10%未満であるポリカルボフィルカルシウムが、混合適正の面で好ましい。ポリカルボフィルカルシウムの市販品を例示すると、例えば、Lubrizol社製の「NOVEON CA-1」,「NOVEON CA-2」,BF Goodrich社製の「Carbopol EX-83 Resin」,「Carbopol EX-788 Resin」,Boehringer Ingelheim Chemicals社製の「Calcium Polycarbophil」等である。
【0022】
本発明の医薬固形製剤を調製する場合、製造工程のいずれかでポリカルボフィルカルシウムからカルシウムが外れ、製造された医薬固形製剤内にはポリカルボフィルカルシウム以外に、ポリカルボフィルがわずかに含まれる場合がある。
【0023】
上記ポリカルボフィルカルシウムの含有量は、医薬固形製剤中、通常1〜50重量%、好ましくは7〜40重量%、より好ましくは10〜30重量%である。
【0024】
(c)糖及び/又は糖アルコール
本発明で使用される(c)の糖及び/又は糖アルコールは、トレハロース、ラクチトール、マルトース、マルチトール、シュクロース、ソルビトール、キシリトール、エリスリトール、マンニトール、ラクトース、及びイソマルトオリゴ糖からなる群から選択される1種以上が挙げられる。これらの中でも、トレハロース、ラクチトール、マルトース、マルチトール、シュクロース、ソルビトール、キシリトール、及びイソマルトオリゴ糖がより好ましい。
【0025】
なお、本発明にて使用される糖及び/又は糖アルコールは、水和物の形態であってもよい。
【0026】
本発明においては、特に下記のような糖及び/又は糖アルコールが好ましく、記載のような市販品として入手可能なものを使用することができる。
【0027】
トレハロース二水和物(例えば、旭化成ケミカルズ社の「トレハロースP」、林原社の「トレハ」等);
ラクチトール一水和物(例えば、日研化成社の「ラクチトールLC−1」等);
含水結晶マルトース(例えば、三和澱粉工業社の「サンマルト−S」、日本食品化工社の「日食結晶マルトース」等);
マルチトール(例えば、ロケット社製の「MALTISORB」シリーズ,林原生物化学研究所社製の「マビット」等);
シュクロース(例えば、塩水港精糖社製の「グラニュー糖CH」等);
ソルビトール(例えば、日研化成社の「ソルビトールSP」、ロケット社の「NEOSORB Powder」、東和化成工業の「ソルビットDP−10M」等);
キシリトール(例えば、日研化成社の「キシリトールP」、ロケット社の「XYLISORB」、東和化成工業の「キシリットP」等);等。
【0028】
最も好ましい糖及び/又は糖アルコールとしては、含水結晶マルトース、マルチトール、ラクチトール一水和物、トレハロース二水和物が挙げられる。上記糖及び/又は糖アルコールは、1種単独で又は2種以上を併用できる。
【0029】
上記糖及び/又は糖アルコールの含有量は、医薬固形製剤中、通常0.1〜70重量%、好ましくは1〜60重量%、より好ましくは5〜50重量%である。
【0030】
本発明の医薬固形製剤は、上記(a)〜(c)の成分に加えて、更に(d)水不溶性微粒子及び/又は(e)毛管現象型の崩壊剤を含有していてもよい。
【0031】
(d)水不溶性微粒子
本発明において使用される(d)水不溶性微粒子としては、固形製剤の空隙を小さくすることができる公知の水不溶性微粒子を例示することができる。医薬固形製剤内部の空隙をそのような水不溶性微粒子で満たすことによって、製剤内部への水の浸透を精緻に制御することができる。本発明の医薬固形製剤に更に(d)水不溶性微粒子が含有している場合、特に酸性溶液及び中性溶液のいずれにおいても薬理活性物質を一定の速度で放出することができ、胃、腸等のpH値が異なる環境下で優れた徐放性能を発現することができる。
【0032】
(d)水不溶性微粒子の平均粒子径は、通常0.002〜50μm、好ましくは0.005〜40μm、より好ましくは0.01〜30μmである。(d)水不溶性微粒子の平均粒子径は、レーザー回折法による測定、あるいは電子顕微鏡観察による直接的な計測によって求めることができる。
【0033】
(d)水不溶性微粒子は、製剤内部に浸透する水に溶解しないため、あらたな空隙が形成されず、製剤内部への水の浸透性を保持できる。
【0034】
水不溶性微粒子としては、例えば、コロイド状二酸化ケイ素、含水二酸化ケイ素、軽質無水ケイ酸、タルク、酸化チタン、等の無機化合物;ステアリン酸マグネシウム、ステアリン酸カルシウム等の脂肪酸金属塩化合物; エチルセルロース、アミノアルキルメタクリレートコポリマーRS等の水不溶性高分子化合物等が挙げられる。好ましい水不溶性微粒子としては、コロイド状二酸化ケイ素、含水二酸化ケイ素、軽質無水ケイ酸、タルク、酸化チタン、ステアリン酸マグネシウム、エチルセルロース等である。これらの水不溶性微粒子は、1種単独で又は2種以上併用できる。
【0035】
水不溶性微粒子を2種類併用する場合,水不溶性高分子化合物と,無機化合物及び/又は脂肪酸金属塩化合物とを組み合わせて使用すると,薬理活性物質の放出制御の効果を維持しながら薬理活性物質濃度をより希釈することが可能となるので,強い薬理活性を有する化合物のように投与量が低い薬理活性物質に対しても本発明の放出制御効果がより期待できる。好ましい組み合わせとしては,水不溶性高分子化合物のエチルセルロースと,無機化合物であるコロイド状二酸化ケイ素、含水二酸化ケイ素、軽質無水ケイ酸、タルク、もしくは酸化チタン,又は脂肪酸金属塩化合物であるステアリン酸マグネシウム,もしくはステアリン酸カルシウムである。
【0036】
より好ましい組み合わせはエチルセルロースと、コロイド状二酸化ケイ素、含水二酸化ケイ素、軽質無水ケイ酸、タルク、酸化チタン及びステアリン酸マグネシウムからなる群から選択される1種類以上のものとの組み合わせである。
【0037】
水不溶性微粒子を2種類併用する場合の配合比率は,水不溶性高分子化合物と,無機化合物及び/又は脂肪酸金属塩化合物とが,重量比でそれぞれ4:1〜1:4であり,好ましくは3:1〜1:1である。
【0038】
水不溶性微粒子を3種類以上併用する場合は,少なくとも1種類以上の水不溶性高分子化合物と,2種類以上の無機化合物及び/あるいは脂肪酸金属塩化合物を組み合わせて使用する。
【0039】
(d)水不溶性微粒子の含有量は、混合適正、流動適正、圧縮成形性等の観点から、医薬固形製剤中、通常0.01〜30重量%、好ましくは0.1〜20重量%、より好ましくは0.5〜15重量%である。
【0040】
好ましい水不溶性微粒子について以下に詳述する。これらの水不溶性微粒子は、医薬の分野において使用可能な品質を有し、かつ容易に入手可能なものである。
【0041】
(d-i) コロイド状二酸化ケイ素:
コロイド状二酸化ケイ素は、一次粒子径がおよそ15nmの極微小なシリカである。青白色で無味無臭の非晶質な粉末である(以上、医薬品添加物ハンドブック 永井恒司 監修,日本医薬品添加物協会 訳編,250頁,2001年,薬事日報社刊行)。コロイド状二酸化ケイ素は四塩化珪素のようなクロロシランを酸水素焔中で、高温加水分解することにより製造される(以上、日本アエロジル社製品カタログ)。本発明において使用できるコロイド状二酸化ケイ素としては、市販品が入手可能であり、例えば、日本アエロジル社製の「Aerosol 200」等を使用できる。
【0042】
(d-ii) 含水二酸化ケイ素:
高純度珪砂を原料としたケイ酸ソーダと硫酸を混合し、ケイ酸ゾルを生成させる。ケイ酸ゾルを重合すると一次粒子を形成され、次いで三次元的な二次凝集体が形成されるが、含水二酸化ケイ素はその過程において凝集体の成長を制御することで製造される。この製法はコロイド状二酸化ケイ素、軽質無水ケイ酸の製造方法(乾式法)と区別され、湿式法と呼ばれる(以上、富士シリシア化学社製品カタログ)。含水二酸化ケイ素の平均粒子径は、およそ5μmである。本発明において使用できる含水二酸化ケイ素としては、市販品が入手可能であり、例えば、富士シリシア化学社製の「アドソリダー−102」等を使用できる。
【0043】
(d-iii) 軽質無水ケイ酸:
含水二酸化ケイ素とほぼ同様な製法によって製造されるが、二次凝集体の成長は別段制御せずにゲル化を進行させ、その後乾燥したものをミクロンサイズに微粉砕することにより軽質無水ケイ酸を得る(以上、富士シリシア化学社製品カタログ)。平均粒子径は2〜4μmである。本発明において使用できる軽質無水ケイ酸としては、市販品が入手可能であり、例えば、ワイ・ケイ・エフ社製の「アドソリダー−101」等を使用できる。
【0044】
(d-iv) タルク:
タルクは、自然界に存在する含水ポリケイ酸鉱物である。タルクは精製された含水ケイ酸マグネシウムで、ほぼMg6(Si2O5)4(OH)4であり、少量のケイ酸アルミニウムと鉄を含むことがある。タルクは採掘後、アスベスト、炭素、ドロマイド、酸化鉄、その他あらゆるマグネシウムと炭素塩鉱物を浮遊法によって取り除かれてから、微粉砕され、その後希塩酸で処理し、水洗浄後、乾燥することによって得られる(以上、医薬品添加物ハンドブック 永井恒司 監修,日本医薬品添加物協会 訳編,404〜405頁,2001年,薬事日報社刊行)。本発明において使用できるタルクとしては、市販品が入手可能であり、例えば、浅田製粉社製の「MMR」(平均粒子径 約4μm),富士タルク社製の「PKP-81」(平均粒子径 約14μm)等を使用できる。
【0045】
(d-v) 酸化チタン:
酸化チタンは、アモルファス状で無味無臭の吸湿性のない粉末である。酸化チタン粉末の平均粒径は1μm以下である。酸化チタンはルチル、アナターゼ、ブルッカイト等の種々の結晶形態を採り得るが、医薬の分野で重要な形態はルチル及びアナターゼである。ルチルの方が熱的に安定で支配的である。酸化チタンは、チタンと酸素の直接結合、水溶液中におけるチタン塩の処理、揮発性無機チタン化合物と酸素の反応、及び有機チタン化合物の酸化又は加水分解によって製造される(以上、医薬品添加物ハンドブック 永井恒司 監修,日本医薬品添加物協会 訳編,279〜281頁,2001年,薬事日報社刊行)。本発明において使用できる酸化チタンとしては、市販品が入手可能であり、例えばフロイント産業社製の「A-HR」、石原産業社の「タイペークA−100」等を使用できる。
【0046】
(d-vi) ステアリン酸マグネシウム:
ステアリン酸マグネシウムは、微細で白色の沈殿あるいは粉砕された無定形のかさ高い疎水性粉末である。ステアリン酸マグネシウムの平均粒径は4〜12μmである。ステアリン酸マグネシウムは様々な結晶形があり、商業用途のステアリン酸マグネシウムは結晶構造の混合物である(以上、医薬品添加物ハンドブック 永井恒司 監修,日本医薬品添加物協会 訳編,343〜345頁,2001年,薬事日報社刊行)。ステアリン酸マグネシウムの製造方法には沈殿法と融解法とがあるが、軽質で均一な品質が得易い沈殿法が汎用される。まずステアリン酸と水酸化ナトリウムを加えて加温し反応させ、次いで硫酸マグネシウムの水溶液を加えてステアリン酸マグネシウムの沈殿物を得る。それをろ過、水洗浄、乾燥し、微粉砕したものが製品となる(以上、医薬品添加物要覧 松田芳久 監修,76〜77頁,平成4年,薬事時報社刊行)。近年は植物由来のステアリン酸を原料に使われている。本発明において使用できるステアリン酸マグネシウムとしては、市販品が入手可能であり、例えば太平化学産業社製の「植物性ステアリン酸マグネシウム」等を使用できる。
【0047】
(d-vii) エチルセルロース
エチルセルロースは広く経口医薬用途に使用されている水不溶性の熱可塑性セルロースエーテルである。エチルセルロースのエトキシル基含有量が46.5〜51重量%の範囲にあると,日本,米国,欧州において医薬品用途として使用できる。エチルセルロースにはエトキシル含量及び粘度によってさまざまなグレード及び粘度品種が存在する。例えば,The Dow Chemical社のエチルセルロース「Ethocel」には,エトキシル基が45.0〜47.0重量%のMED型,48.0〜49.5重量%のSTD型,及び49.6〜53.0重量%のHE型があり,それぞれ4〜200cpsの粘度品種が存在し,特に医薬用途としてSTD型の「Ethocel Premium」が使用可能である。またHercules社のエチルセルロース「AQUALON Ethylcellulose」には,エトキシル基が45.0〜47.2重量%のK−type,48.0〜49.5重量%のN−type,及び49.6〜51.5重量%のT−typeがあり,それぞれ4〜300cpsの粘度品種が存在し,特に医薬用途としてT−typeの「AQUALON T10 Pharm EC」が使用可能である(以上,Hercules社AQUALON Ethylcellulose製品技術資料)。
【0048】
The Dow Chemical社の「Ethocel」のSTD型には粉末グレードがあり、粘度が3.5〜5.5cpsの7FP、9.0〜11.0cpsの10FP、及び90.0〜110.0cpsの100FPが存在し、それぞれの平均粒子径は7FPが5〜15μmであり、10FPが3〜15μmであり、100FPは30〜60μmである。(以上,日新化成社エトセル製品技術資料)
本発明において使用できるエチルセルロースとしては市販品が入手可能であり、例えばThe Dow Chemical社の「Ethocel Premium STD−7FP」、「Ethocel Premium STD−10FP」等が挙げられる。これらのエチルセルロースの平均粒子径は3〜15μmである。
【0049】
(e)毛管現象型の崩壊剤
本発明において、毛管現象型の崩壊剤とは、崩壊剤自身の存在が、いわば導水管的な役割を果たして製剤内部に水を浸透させる機能を有する崩壊剤のことを意味する。
【0050】
(e)毛管現象型の崩壊剤としては、例えばカルメロースを挙げることができる。毛管現象型の崩壊剤を配合すると、医薬固形製剤の崩壊速度に所望の制御を付与することができ、その結果薬理活性物質の放出速度がより制御可能となる。例えば,薬理活性物質の放出速度をより速やかにしたい場合は,毛管現象型の崩壊剤の配合割合を高く設定すればよい。あるいは薬理活性物質の放出速度をより緩やかにしたい場合は毛管現象型の崩壊剤の配合割合を低く設定すればよい。
【0051】
毛管現象型の崩壊剤は製剤内部へ水を速やかに浸透させるので、本発明のように製剤内部への水の浸透を制御し、製剤表層部のみを崩壊させるためには、毛管現象型の崩壊剤を(d)水不溶性微粒子と併用するのがより効果的である。
【0052】
(e)毛管現象型の崩壊剤の含有量は、医薬固形製剤中、通常0.1〜15重量%、好ましくは0.5〜10重量%、より好ましくは1〜7.5重量%である。
【0053】
カルメロースとしては、医薬の分野において使用可能な品質でかつ容易に入手可能なものが使用される。カルメロースは、カルボキシメチルで化学修飾された酸性のセルロース誘導体で、カルメロースナトリウムを鉱酸でpHを下げて析出させることにより得られる。カルメロースは酸性のカルボン酸に属するが、解離恒数が1.4×10−3の微弱酸性であり、緩衝力がある。カルメロースは他の一般的な崩壊補助剤、崩壊剤に比べ、水の取り込みが弱く、膨潤性に劣る。しかしながら、水濡れ性に優れるため、製剤内部に速やかに水を浸透させ、製剤内の粒子間の結合力を切断して、崩壊を促す(以上、カルメロース技術資料 五徳薬品社)。本発明において使用できるカルメロースとしては、市販品が入手可能であり、例えばニチリン化学工業社製の「NS-300」等を使用できる。
【0054】
本発明の医薬固形製剤には、上記(a)〜(c)成分、更には(d)及び/又は(e)成分に加え、その他の成分を含有することができる。その他の成分としては、例えば、賦形剤、結合剤、pH調整剤、吸収促進剤、滑沢剤、着色剤、矯味剤、香料、剤皮等の固形医薬製剤に配合可能な各種添加剤を挙げることができる。また必要に応じてフィルムコーティングを施してもよい。これらの成分は、本発明の効果を妨げない範囲内で本発明の医薬固形製剤に配合できる。
【0055】
本発明の医薬固形製剤は、上記各成分を混合し、公知の方法により製造することができる。例えば、直接打錠法により製造するか、或いは、乾式造粒法、湿式造粒法等により顆粒を製造し、打錠法を経て製造できる。本発明の固形製剤を錠剤とする場合の具体的な製造工程は、混合工程及び打錠工程を備え、必要に応じて、これらの工程の前後に、乾式造粒工程、湿式造粒工程、乾燥工程、整粒工程等を備えていてもよい。また打錠工程の後に、フィルムコーティング工程を備えていてもよい。本発明の医薬固形製剤は、医薬の分野で通例、汎用される製造用機器を用いて製造される。
【0056】
本発明において、医薬固形製剤の剤型は、特に限定されるものではなく、例えば、錠剤、顆粒剤、カプセル剤等が挙げられる。剤型がカプセル剤である場合、1種類以上の錠剤及び/又は顆粒剤を含有するカプセル剤としてもよい。本発明の医薬固形製剤の剤型が錠剤及びカプセル剤であると、取扱い易さ及び服用のし易さの点で好ましい。また、本発明の医薬固形製剤に配合される薬理活性物質が、光に不安定である場合、あるいは不快な味又は臭いを有する場合には、錠剤に通例汎用される被膜を施して、それをマスキングすることにより、品質の向上を図り、服用を容易にすることができる。さらに、錠剤強度の向上、及び湿度対策の観点から、被膜を本発明の効果を妨げない程度に施してもよい。
【0057】
本発明の医薬固形製剤が、錠剤として製造される場合、その錠剤の直径又は長径が3〜30mmの範囲にあることが、生産性、取扱い易さ及び服用のし易さの観点から好ましい。また、本発明の医薬固形製剤が、顆粒剤として製造される場合、その顆粒の粒子径が0.3〜3mmの範囲にあることが、生産性の観点から好ましい。さらに、本発明の医薬固形製剤が、カプセル剤として製造させる場合、カプセルのサイズが5〜00号であることが、取扱い易さ及び服用のし易さの観点から好ましい。
【実施例】
【0058】
以下に参考例、実施例及び比較例を挙げて本発明をより一層明らかにする。
【0059】
参考例1(吸水性高分子化合物の吸水性の試験)
(1.1) 吸水性高分子化合物 以下の5種の吸水性高分子化合物を用いて吸水性の試験を行った。
【0060】
(a) ポリカルボフィルカルシウム,商品名「NOVEON CA-1」,Lubrizol社製(この吸水性高分子化合物を以下「CA−1」という)
(b) ポリビニルアルコール,商品名「ゴーセノールAH-17」,日本合成化学工業社製(この吸水性高分子化合物を以下「AH−17」という)
(c) カルボキシビニルポリマー,商品名「Carbopol 71GNF」,Lubrizol社製(この吸水性高分子化合物を以下「71GNF」という)
(d) ポリアクリル酸ナトリウム架橋分岐型,商品名「ジュンロンPW-110」,日本純薬社製(この吸水性高分子化合物を以下「PW−110」という)
(e) ポリカルボフィル,商品名「NOVEON AA-1」,Lubrizol社製(この吸水性高分子化合物を以下「AA−1」という)
(1.2) 試験方法:ティーバッグ法(吸水能の評価)
ポリエステル製不織布のティーバック(70mm×95mm)に、106〜300μmの範囲の粒子径を有する乾燥吸水性高分子化合物約0.5gを入れ、20±5℃、過剰量の試験液A又は試験液Bに浸漬し、上記高分子化合物を2時間、4時間、6時間及び8時間吸水させた後、ティーバックを引き上げて1分間水切りを行い、重量(g)を測定した。この値を(x)とした。同様の操作をティーバックのみで行った場合の重量(g)をブランクとして、経時的に測定した。この値を(y)とする。そして、下記式のように、得られた値(x)から(y)を減じた値を、吸水性高分子化合物の乾燥重量で除し、得られた値を吸水量(g/高分子1g)とした。
【0061】
吸水量={(x)−(y)}/(吸水性高分子化合物の乾燥重量)
試験液Aに浸漬して得られた結果を表1に、試験液Bに浸漬して得られた結果を表2に示す。なお、使用する試験液A及び試験液Bは、以下の通りである。
【0062】
試験液A:薄めたMcIlvaine緩衝液(酸性溶液)、pH4.0
試験液B:日本薬局方溶出試験液第二液(中性溶液)、pH6.8
【0063】
【表1】

【0064】
【表2】

【0065】
(1.3) 試験結果及び考察
CA−1のポリカルボフィルカルシウムは、pH4.0及びpH6.8のいずれの試験液においても、時間の経過と共に吸水量が増大するが、吸水量は他の吸水性高分子化合物(AH−17、71GNF及びPW−110)に比べて少なかった。
【0066】
ポリカルボフィルカルシウムに関して、吸水量と時間との関係をプロットした。結果を図1に示す。
【0067】
図1に示すように、ポリカルボフィルカルシウムは、pH4.0及びpH6.8のいずれの試験液においても、ほぼ一定速度で吸水が進行していることが判明した。相関係数もR2=0.9以上と、良好な相関性が確認された。
【0068】
調製例1(トルバプタンの非晶質性粉末の製造方法)
非晶質化したトルバプタンを次のようにして調製した。即ち、トルバプタン(7−クロロ−5−ヒドロキシ−1−[2−メチル−4−(2−メチルベンゾイルアミノ)ベンゾイル]−2,3,4,5−テトラヒドロ−1H−ベンゾアゼピン)100g及びヒドロキシプロピルセルロース(HPC―SL、日本曹達社製、ヒドロキシプロポキシル基含量:53〜78重量%)50gをジクロロメタン1390g及びエタノール350gの混合溶媒に溶解し、噴霧乾燥機(大川原加工機社製,ODT―8型)で処理後、直ちに真空乾燥機(タバイエスペック社製,LCV―232)で乾燥し、非晶質性粉末(非晶質化トルバプタン)を調製した。
【0069】
以下の実施例、比較例で使用されるトルバプタン非晶質性粉末は、本調製例1と同様にして調製した。
【0070】
調製例2(シロスタゾールのSLSとの混合微粉砕品の製造方法)
シロスタゾール(大塚製薬社製)100gとラウリル硫酸ナトリウム(SLS,日光ケミカルズ社製)5gとを混合し、ジェットミル粉砕機(100AS型,パウレック社製)で混合微粉砕を行った。
【0071】
実施例1
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末9g、マルチトール (マルチソルブ P90,ロケット社製) 2.9g、ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 3g、ステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm) 0.1gをよく混合後、精密万能機(島津製作所社製,オートグラフAG-I型)によって、直径7.5mm、圧縮力8kN、圧縮速度50mm/分の操作条件で主剤60mgを含有する重量約150mgの円形錠を製造した。
【0072】
実施例2
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末9g、マルチトール (マルチソルブ P90,ロケット社製) 2.6g、ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 3g、コロイド状二酸化ケイ素 (アエロジル200,アエロジル社製、平均粒子径:0.015μm) 0.3g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm) 0.1gをよく混合後、精密万能機(島津製作所社製,オートグラフAG-I型)によって、直径7.5mm、圧縮力8kN、圧縮速度50mm/分の操作条件で主剤60mgを含有する重量約150mgの円形錠を製造した。
【0073】
実施例3
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末9g、含水マルトース (サンマルト-S,三和澱粉工業社製) 4.4g、ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 3.6g、カルメロース(NS-300,ニチリン化学工業社製) 0.9g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm)0.1gをよく混合後、精密万能機(島津製作所社製,オートグラフAG-I型)によって、直径8mm、圧縮力10kN、圧縮速度50mm/分の操作条件で主剤60mgを含有する重量約180mgの円形錠を製造した。
【0074】
実施例4
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末9g、マルチトール (マルチソルブ P90,ロケット社製) 7.4g、ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 0.2g、カルメロース (NS-300,ニチリン化学工業社製) 0.9g、コロイド状二酸化ケイ素 (アエロジル200,アエロジル社製、平均粒子径:0.015μm) 0.4g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm) 0.2gをよく混合後、精密万能機(島津製作所社製,オートグラフAG-I型)によって、直径7.5mm、圧縮力7kN、圧縮速度100mm/分の操作条件で主剤60mgを含有する重量約180mgの円形錠を製造した。
【0075】
実施例5
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末9g、マルチトール (マルチソルブ P90,ロケット社製) 6.6g、ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 0.9g、カルメロース (NS-300,ニチリン化学工業社製) 0.9g、コロイド状二酸化ケイ素 (アエロジル200,アエロジル社製、平均粒子径:0.015μm) 0.4g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm) 0.2gをよく混合後、精密万能機(島津製作所社製、オートグラフAG-I型)によって、直径7.5mm、圧縮力7kN、圧縮速度100mm/分の操作条件で主剤60mgを含有する重量約180mgの円形錠を製造した。
【0076】
実施例6
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末9g、マルチトール (マルチソルブ P90,ロケット社製) 5.7g、ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 7.2g、カルメロース (NS-300,ニチリン化学工業社製) 1.8g、コロイド状二酸化ケイ素 (アエロジル200,アエロジル社製、平均粒子径:0.015μm) 0.2g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm) 0.2gをよく混合後、精密万能機(島津製作所社製、オートグラフAG-I型)によって、直径8.5mm、圧縮力9kN、圧縮速度50mm/分の操作条件で主剤60mgを含有する重量約240mgの円形錠を製造した。
【0077】
実施例7
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末9g、含水マルトース (サンマルト-S,三和澱粉工業社製) 11.7g、ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 2.4g、カルメロース(NS-300,ニチリン化学工業社製) 0.6g、コロイド状二酸化ケイ素 (アエロジル200,アエロジル社製、平均粒子径:0.015μm) 0.1g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm)0.2gをよく混合後、精密万能機(島津製作所社製、オートグラフAG-I型)によって、直径8.5mm、圧縮力9kN、圧縮速度50mm/分の操作条件で主剤60mgを含有する重量約240mgの円形錠を製造した。
【0078】
実施例8
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末9g、含水マルトース (サンマルト-S,三和澱粉工業社製) 5.6g、ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 4g、カルメロース( NS-300,ニチリン化学工業社製)0.5g、コロイド状二酸化ケイ素 (アエロジル200,アエロジル社製、平均粒子径:0.015μm) 0.7g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm)0.2gをよく混合後、精密万能機(島津製作所社製、オートグラフAG-I型)によって、直径8mm、圧縮力8kN、圧縮速度50mm/分の操作条件で主剤60mgを含有する重量約200mgの円形錠を製造した。
【0079】
実施例9
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末9g、トレハロース(トレハロースP,旭化成ケミカルズ製) 3.9g、ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 3.6g、カルメロース (NS-300,ニチリン化学工業社製) 0.9g、コロイド状二酸化ケイ素 (アエロジル200,アエロジル社製、平均粒子径:0.015μm) 0.4g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm) 0.2gをよく混合後、精密万能機(島津製作所社製、オートグラフAG-I型)によって、直径8mm、圧縮力8kN、圧縮速度50mm/分の操作条件で主剤60mgを含有する重量約180mgの円形錠を製造した。
【0080】
実施例10
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末9g、マルチトール (マルチソルブ P90,ロケット社製) 3.9g、ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 3.6g、カルメロース (NS-300,ニチリン化学工業社製) 0.9g、コロイド状二酸化ケイ素 (アエロジル200,アエロジル社製、平均粒子径:0.015μm) 0.4g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm) 0.2gをよく混合後、精密万能機(島津製作所社製、オートグラフAG-I型)によって、直径8mm、圧縮力8kN、圧縮速度50mm/分の操作条件で主剤60mgを含有する重量約180mgの円形錠を製造した。
【0081】
実施例11
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末9g、マルチトール (マルチソルブ P90,ロケット社製) 5.7g、ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 1.8g、カルメロース (NS-300,ニチリン化学工業社製) 0.9g、コロイド状二酸化ケイ素 (アエロジル200,アエロジル社製、平均粒子径:0.015μm) 0.4g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm) 0.2gをよく混合後、精密万能機(島津製作所社製、オートグラフAG-I型)によって、直径7.5mm、圧縮力7kN、圧縮速度100mm/分の操作条件で主剤60mgを含有する重量約180mgの円形錠を製造した。
【0082】
実施例12
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末9g、マルチトール (マルチソルブ P90,ロケット社製) 2.1g、ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 3.6g、カルメロース (NS-300,ニチリン化学工業社製) 0.9g、結晶セルロース (KG-802,旭化成ケミカルズ社製) 1.8g、コロイド状二酸化ケイ素 (アエロジル200,アエロジル社製、平均粒子径:0.015μm) 0.4g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm) 0.2gをよく混合後、精密万能機(島津製作所社製、オートグラフAG-I型)によって、直径7.5mm、圧縮力10kN、圧縮速度100mm/分の操作条件で主剤60mgを含有する重量約180mgの円形錠を製造した。
【0083】
実施例13
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末9g、マルチトール (マルチソルブ P90,ロケット社製) 3.6g、ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 3.6g、カルメロース (NS-300,ニチリン化学工業社製) 0.9g、タルク (MMR,浅田製粉社製、平均粒子径:4μm) 0.4g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm) 0.2gをよく混合後、精密万能機(島津製作所社製、オートグラフAG-I型)によって、直径8mm、圧縮力8kN、圧縮速度50mm/分の操作条件で主剤60mgを含有する重量約177mgの円形錠を製造した。
【0084】
実施例14
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末9g、マルチトール (マルチソルブ P90,ロケット社製) 3.6g、ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 3.6g、カルメロース (NS-300,ニチリン化学工業社製) 0.9g、酸化チタン (A-HR,フロイント産業社製、平均粒子径:1μm) 0.4g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm) 0.2gをよく混合後、精密万能機(島津製作所社製、オートグラフAG-I型)によって、直径8mm、圧縮力8kN、圧縮速度50mm/分の操作条件で主剤60mgを含有する重量約177mgの円形錠を製造した。
【0085】
実施例15
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末360g、マルチトール (マルチソルブ P90,ロケット社製) 148g、ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 120g、カルメロース (NS-300,ニチリン化学工業社製) 36g、ヒドロキシプロピルセルロース (HCP-L微粉,日本曹達社製) 36g、コロイド状二酸化ケイ素 (アエロジル200,アエロジル社製、平均粒子径:0.015μm) 12g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm) 8gを容積3リットルのドラム混合機内でよく混合後、ロータリー式連続打錠機 (12HUK-AWC型、菊水製作所社製)によって、直径7.5mm、打錠圧1,100kg、回転速度40rpmの操作条件で主剤60mgを含有する重量約180mgの円形錠を製造した。
【0086】
実施例16
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末360g、 マルチトール (マルチソルブ P90,ロケット社製) 160g、ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 120g、カルメロース (NS-300,ニチリン化学工業社製) 24g、ヒドロキシプロピルセルロース (HCP-L微粉,日本曹達社製) 36g、コロイド状二酸化ケイ素 (アエロジル200,アエロジル社製、平均粒子径:0.015μm) 12g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm) 8gを容積3リットルのドラム混合機内でよく混合後、ロータリー式連続打錠機 (12HUK-AWC型,菊水製作所社製)によって、直径7.5mm、打錠圧1,100kg、回転速度40rpmの操作条件で主剤60mgを含有する重量約180mgの円形錠を製造した。
【0087】
実施例17
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末9g、ラクチトール (ラクチトール LC-1,日研化成社製) 3.7g、ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 3g、カルメロース (NS-300,ニチリン化学工業社製) 0.9g、ヒドロキシプロピルセルロース (HCP-L微粉,日本曹達社製) 0.9g、コロイド状二酸化ケイ素 (アエロジル200,アエロジル社製、平均粒子径:0.015μm) 0.3g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm) 0.2gをよく混合後、精密万能機(島津製作所社製,オートグラフAG-I型)によって、直径7.5mm、圧縮力7kN、圧縮速度100mm/分の操作条件で主剤60mgを含有する重量約180mgの円形錠を製造した。
【0088】
実施例18
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末9g、マルチトール (マルチソルブ P90,ロケット社製) 3.1g、ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 3g、カルメロース (NS-300,ニチリン化学工業社製)0.9g、ヒドロキシプロピルセルロース (HCP-L微粉,日本曹達社製) 0.9g、コロイド状二酸化ケイ素 (アエロジル200,アエロジル社製、平均粒子径:0.015μm) 0.9g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm)0.2gをよく混合後、精密万能機(島津製作所社製,オートグラフAG-I型)によって、直径7.5mm、圧縮力7kN、圧縮速度100mm/分の操作条件で主剤60mgを含有する重量約180mgの円形錠を製造した。
【0089】
実施例19
テオフィリン (日本薬局方テオフィリン,白鳥製薬社製)10g、 マルチトール(マルチソルブ P90,ロケット社製) 0.75g、ポリカルボフィルカルシウム(NOVEON CA-1,Lubrizol社製)2g、カルメロース(NS-300,ニチリン化学工業社製) 0.3g、ヒドロキシプロピルセルロース (HPC-L微粉,日本曹達社製) 1.5g、コロイド状二酸化ケイ素 (アエロジル200,アエロジル社製、平均粒子径:0.015μm) 0.3g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm) 0.2gをよく混合後、精密万能機(島津製作所社製、オートグラフAG-I型)によって、直径8.5mm、圧縮力8kN、圧縮速度100mm/分の操作条件で主剤200mgを含有する重量約300mgの円形錠を製造した。
【0090】
実施例20
ラウリル硫酸ナトリウムとともに混合微粉砕されたシロスタゾール5.25g (シロスタゾール/ラウリル硫酸ナトリウム = 10/0.5,シロスタゾールとして5g),マルチトール (マルチソルブP90,ロケット社製) 3.15g,ポリカルボフィルカルシウム(NOVEON CA-1,Lubrizol社製) 3g,カルメロース (NS-300,ニチリン化学工業社製) 0.15g,結晶セルロース (KG-802,旭化成ケミカルズ社製) 1.5g,ヒドロキシプロピルセルロース (HPC-L微粉,日本曹達社製) 1.5g,酸化チタン (A-HR,フロイント産業社製,平均粒子径:1μm) 0.3 g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm)0.15gをよく混合後,精密万能機(島津製作所社製,オートグラフAG-I型)によって,直径8.5mm,圧縮力9kN,圧縮速度100mm/minの操作条件で主剤100mgを含有する重量約300mgの円形錠を製造した。
【0091】
実施例21
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末9g、含水マルトース (サンマルト-S,三和澱粉工業社製) 20.5g、ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 8g、カルメロース( NS-300,ニチリン化学工業社製) 2g、コロイド状二酸化ケイ素 (アエロジル200,アエロジル社製、平均粒子径:0.015μm) 0.4g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm)0.1gをよく混合後、精密万能機(島津製作所社製,オートグラフAG-I型)によって、直径10.5mm、圧縮力17.2kN、圧縮速度50mm/分の操作条件で主剤60mgを含有する重量約400mgの円形錠を製造した。
【0092】
実施例22
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末9g、含水マルトース (サンマルト-S,三和澱粉工業社製) 13.1g、ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 6g、カルメロース (NS-300,ニチリン化学工業社製) 1.5g、コロイド状二酸化ケイ素 (アエロジル200,アエロジル社製、平均粒子径:0.015μm) 0.3g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm)0.1gをよく混合後、精密万能機(島津製作所社製,オートグラフAG-I型)によって、直径9mm、圧縮力12.7kN、圧縮速度50mm/分の操作条件で主剤60mgを含有する重量約300mgの円形錠を製造した。
【0093】
実施例23
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末900g,マルチトール (マルチソルブ P90,ロケット社製) 600g,ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 300g,カルメロース(NS-300,ニチリン化学工業社製) 30g,ヒドロキシプロピルセルロース (HCP-L微粉,日本曹達社製) 240g,エチルセルロース (エトセル SDT 10cps FP,The Dow Chemical社製,平均粒子径:5μm) 150g,タルク (PKP-81,富士タルク社製,平均粒子径:14μm) 150g及びコロイド状二酸化ケイ素 (アエロジル200,アエロジル社製,平均粒子径:0.015μm) 6gを高速攪拌混合造粒機 FM-VG-25P型,パウレック社製)内でよく混合後,ドラム混合機内でステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm) 24gと混合し,打錠用粉末を得た。ロータリー式連続打錠機 (12HUK-AWC型,菊水製作所社製)によって,直径6mm,打錠圧900kg,回転速度50rpmの操作条件で主剤20mgを含有する重量約80mgの円形錠を製造した。
【0094】
実施例24
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末900g,マルチトール (マルチソルブ P90,ロケット社製) 540g,ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 300g,カルメロース (NS-300,ニチリン化学工業社製) 90g,ヒドロキシプロピルセルロース (HCP-L微粉,日本曹達社製) 240g,エチルセルロース (エトセル SDT 10cps FP,The Dow Chemical社製,平均粒子径:5μm) 150g,タルク (PKP-81,富士タルク社製,平均粒子径:14μm) 150g及びコロイド状二酸化ケイ素 (アエロジル200,アエロジル社製,平均粒子径:0.015μm) 6gを高速攪拌混合造粒機 FM-VG-25P型,パウレック社製)内でよく混合後,ドラム混合機内でステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm) 24gと混合し,打錠用粉末を得た。ロータリー式連続打錠機 (12HUK-AWC型,菊水製作所社製)によって,直径6mm,打錠圧900kg,回転速度50rpmの操作条件で主剤20mgを含有する重量約80mgの円形錠を製造した。
【0095】
実施例25
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末900g,マルチトール (マルチソルブ P90,ロケット社製) 480g,ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 300g,カルメロース (NS-300,ニチリン化学工業社製) 150g,ヒドロキシプロピルセルロース (HCP-L微粉,日本曹達社製) 240g,エチルセルロース(エトセル SDT 10cps FP,The Dow Chemical社製,平均粒子径:5μm) 150g,タルク (PKP-81,富士タルク社製,平均粒子径:14μm) 150g及びコロイド状二酸化ケイ素 (アエロジル200,アエロジル社製,平均粒子径:0.015μm) 6gを高速攪拌混合造粒機 FM-VG-25P型,パウレック社製)内でよく混合後,ドラム混合機内でステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm) 24gと混合し,打錠用粉末を得た。ロータリー式連続打錠機 (12HUK-AWC型,菊水製作所社製)によって,直径6mm,打錠圧900kg,回転速度50rpmの操作条件で主剤20mgを含有する重量約80mgの円形錠を製造した。
【0096】
実施例26
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末6g, マルチトール (マルチソルブ P90,ロケット社製) 3.6g,ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 2g,カルメロース (NS-300,ニチリン化学工業社製) 0.2g,ヒドロキシプロピルセルロース (HCP-L微粉,日本曹達社製) 1.6g,エチルセルロース (エトセル SDT 10cps FP,The Dow Chemical社製,平均粒子径:5μm) 1.2g,コロイド状二酸化ケイ素 (アエロジル200,アエロジル社製,平均粒子径:0.015μm) 1.2g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm) 0.2gをよく混合後,精密万能機(島津製作所社製,オートグラフAG-I型)によって,直径5.5mm,圧縮力5kN,圧縮速度100mm/minの操作条件で主剤20mgを含有する重量約80mgの円形錠を製造した。
【0097】
実施例27
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末300g,マルチトール (マルチソルブ P90,ロケット社製) 202g,ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 100g,カルメロース (NS-300,ニチリン化学工業社製) 10g,ヒドロキシプロピルセルロース (HCP-L微粉,日本曹達社製) 80g,エチルセルロース (エトセル SDT 10cps FP,The Dow Chemical社製,平均粒子径:5μm) 50g,タルク (PKP-81,富士タルク社製,平均粒子径:14μm) 50g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm) 8gを容積5Lの高速攪拌混合造粒機 FM-VG-05型,パウレック社製)内でよく混合後,ロータリー式連続打錠機 (12HUK-AWC型,菊水製作所社製)によって,直径5.5mm,打錠圧800kg,回転速度50rpmの操作条件で主剤20mgを含有する重量約80mgの円形錠を製造した。
【0098】
実施例28
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末6g, マルチトール (マルチソルブ P90,ロケット社製) 3g,ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 3gをよく混合後,精密万能機(島津製作所社製,オートグラフAG-I型)によって,直径7.5mm,圧縮力8kN,圧縮速度50mm/minの操作条件で主剤60mgを含有する重量約150mgの円形錠を製造した。
【0099】
実施例29
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末6g, D-マンニトール (ペアリトール200SD,ロケット社製) 3g,ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 3gをよく混合後,精密万能機(島津製作所社製,オートグラフAG-I型)によって,直径7.5mm,圧縮力8kN,圧縮速度50mm/minの操作条件で主剤60mgを含有する重量約150mgの円形錠を製造した。
【0100】
実施例30
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末6g, イソマルト (galenIQ 721,PALATINIT GmbH製) 3g,ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 3gをよく混合後,精密万能機(島津製作所社製,オートグラフAG-I型)によって,直径7.5mm,圧縮力8kN,圧縮速度50mm/minの操作条件で主剤60mgを含有する重量約150mgの円形錠を製造した。
【0101】
実施例31
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末9g, マルチトール(マルチソルブ P90,ロケット社製) 2.25g,ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 3g,及びをカルメロース (NS-300,ニチリン化学工業社製) 0.75gをよく混合後,精密万能機(島津製作所社製,オートグラフAG-I型)によって,直径7.5mm,圧縮力8kN,圧縮速度50mm/minの操作条件で主剤60mgを含有する重量約150mgの円形錠を製造した。
【0102】
実施例32
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末3g, マルチトール (マルチソルブ P90,ロケット社製) 3.5g,ポリカルボフィルカルシウム (NOVEON CA-1,Lubrizol社製) 2g,カルメロース (NS-300,ニチリン化学工業社製) 0.6g,ヒドロキシプロピルセルロース (HCP-L微粉,日本曹達社製) 1g,エチルセルロース (エトセル SDT 10cps FP,The Dow Chemical社製,平均粒子径:5μm) 0.6g,コロイド状二酸化ケイ素 (アエロジル200,アエロジル社製,平均粒子径:0.015μm) 0.2g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm) 0.1gをよく混合後,精密万能機(島津製作所社製,オートグラフAG-I型)によって,直径6mm,圧縮力6kN,圧縮速度100mm/minの操作条件で主剤20mgを含有する重量約100mgの円形錠を製造した。
【0103】
比較例1
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末9g、マルチトール (マルチソルブ P90,ロケット社製) 4.9g、カルメロース (NS-300,ニチリン化学工業社製) 0.8g、コロイド状二酸化ケイ素 (アエロジル200,アエロジル社製、平均粒子径:0.015μm) 0.3g、及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm) 0.1gをよく混合後、精密万能機(島津製作所社製,オートグラフAG-I型)によって、直径7.5mm、圧縮力8kN、圧縮速度100mm/分の操作条件で主剤60mgを含有する重量約150mgの円形錠を製造した。
【0104】
比較例2
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末9g、カルボキシビニルポリマー(Carbopol 71GNF,Lubrizol社製)3g、マルチトール (マルチソルブ P90,ロケット社製) 3.7g、カルメロース (NS-300,ニチリン化学工業社製) 0.9g、ヒドロキシプロピルセルロース (HPC-L,日本曹達社製) 0.9g、コロイド状二酸化ケイ素 (アエロジル200,アエロジル社製、平均粒子径:0.015μm) 0.3g、ステアリン酸マグネシウム(植物性,太平化学産業社製,平均粒子径:6μm) 0.2gを秤取し、よく混合後、精密万能機(オートグラフ AG-I型,島津製作所製)によって、直径7.5mm、圧縮力7kN、圧縮速度100mm/分の操作条件で主剤60mgを含有する重量約180mgの円形錠を製造した。
【0105】
比較例3
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末9g、ポリビニルアルコール (ゴーセノール AH-17,日本合成化学社製) 3g、マルチトール (マルチソルブ P90,ロケット社製) 3.7g、カルメロース (NS-300,ニチリン化学工業社製) 0.9g、ヒドロキシプロピルセルロース (HPC-L,日本曹達社製) 0.9g、コロイド状二酸化ケイ素 (アエロジル200,アエロジル社製、平均粒子径:0.015μm) 0.3g、ステアリン酸マグネシウム(植物性,太平化学産業社製,平均粒子径:6μm) 0.2gを秤取し、よく混合後、精密万能機(オートグラフ AG-I型,島津製作所製)によって、直径7.5mm、圧縮力7kN、圧縮速度100mm/分の操作条件で主剤60mgを含有する重量約180mgの円形錠を製造した。
【0106】
比較例4
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末9g、ポリカルボフィル (NOVEON AA-1,Lubrizol社製) 3g、マルチトール (マルチソルブ P90,ロケット社製) 3.7g、カルメロース (NS-300,ニチリン化学工業社製) 0.9g、ヒドロキシプロピルセルロース (HPC-L,日本曹達社製) 0.9g、コロイド状二酸化ケイ素 (アエロジル200,アエロジル社製、平均粒子径:0.015μm) 0.3g、ステアリン酸マグネシウム(植物性,太平化学産業社製,平均粒子径:6μm) 0.2gを秤取し、よく混合後、精密万能機(オートグラフ AG-I型,島津製作所製)によって、直径7.5mm、圧縮力7kN、圧縮速度100mm/分の操作条件で主剤60mgを含有する重量約180mgの円形錠を製造した。
【0107】
比較例5
ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン非晶質粉末9g、ポリカルボフィルカルシウム(NOVEON CA-1,Lubrizol社製)4g、カルメロース (NS-300,ニチリン化学工業社製) 0.8g、コロイド状二酸化ケイ素 (アエロジル200,アエロジル社製、平均粒子径:0.015μm) 0.3g及びステアリン酸マグネシウム (植物性,太平化学産業社製,平均粒子径:6μm) 0.1gをよく混合後、精密万能機(島津製作所社製,オートグラフAG-I型)によって、直径6.5mm、圧縮力7kN、圧縮速度50mm/分の操作条件で主剤60mgを含有する重量約142mgの円形錠を製造した。
【0108】
試験例1
実施例1〜実施例32及び比較例1〜5で製造された円形錠について、溶出試験時の製剤の形態変化が、表層部から逐次的に固形剥離物質を生じながら崩壊する形(逐次崩壊型)であるか、それとも内部崩壊型、ハイドロゲル型(膨潤型)又は不溶性マトリックス型であるかを目視観察により判定した。
【0109】
本発明の医薬固形製剤の経時的な形状変化と薬理活性物質放出挙動の関係を図2に示す。図2に示すように、本発明の医薬固形製剤は、薬理活性物質を放出していく過程(1)〜(5)において、製剤表層部から逐次固形剥離物質を生じながら浸食を受け、最終的に錠剤は消失し、固形剥離物質が残存する。製剤の崩壊の過程で生じる固形剥離物質はそのままの状態を保っているのではなく、薬理活性物質を放出しながら溶解又は崩壊し、最終的に透明なゲルビーズを残渣として認める。このゲルビースは吸水によって膨潤、ゲル化した吸水性高分子化合物である。
【0110】
目視観察の結果を後記表3に示すが、全ての実施例で調製した製剤は逐次崩壊型の薬理活性物質溶出挙動を示した。一方、比較例1で製造された円形錠は不溶性マトリックス型の溶出挙動を示し,溶出試験後も製剤の形状が強く維持されていた。比較例2、4で製造された円形錠はいずれも製剤表層部にハイドロゲル型のような水和したゲル層が形成されており,逐次的な崩壊挙動は観察されなかった。比較例3で製造された円形錠は製剤内部へ水が急激に浸透したことによって大きく崩壊する内部崩壊型の溶出挙動を示していた。比較例5で製造された円形錠は製剤の側面部分から強く浸食を受ける上下破断型の溶出挙動を示し,逐次崩壊型ではなかった。
【0111】
試験例2
実施例で製造された各円形錠について、酸性の試験溶液(試験液C)及び中性の試験溶液(試験液D)のそれぞれを用いて溶出試験を行った。溶出試験は、次の通りである。
【0112】
試験液C(酸性条件):pH4.0の薄めたMcIlvaine緩衝液にポリソルベート80を1w/v%の濃度となるよう添加した溶液900ml
試験液D(中性条件):pH6.8日本薬局方溶出試験液第二液にポリソルベート80を1w/v%の濃度となるよう添加した溶液900ml
溶出試験システムNTR−6200A(富山産業社製)を用いて日本薬局方溶出試験方法第二法(パドル法)によって固形製剤からのトルバプタンの溶出試験を行った。パドルの回転数は100rpmとし、測定波長に268nm及び350nmの二波長を用いた。
【0113】
(1)薬理活性物質放出速度
溶出試験経過時間と、最初のサンプリング時点から85%以上薬理活性物質が溶出する最初のサンプリング時点までの溶出率データを用いて、直線回帰を行った時に得られる回帰式の相関係数が、実施例1〜実施例32で製造された円形錠は、酸性試験液及び中性試験液のいずれの試験液に対しても0.90以上であり、円形錠から薬理活性物質が一定の速度で放出され,薬理活性物質の溶出率の時間推移から実施例1〜実施例32は全て徐放性の薬理活性物質放出挙動を示していることが確認された。結果を表3〜表6に示す。
【0114】
【表3】

【0115】
【表4】

【0116】
【表5】

【0117】
【表6】

【0118】
(2)薬理活性物質放出挙動
酸性試験液及び中性試験液のそれぞれにおいて得られる各測定サンプリングポイントにおける溶出率の差が常に15%以内である場合に、酸性、中性それぞれのpHにおいて得られる薬理活性物質の放出挙動が類似していると判断した。この判定基準は、昭和63年3月11日付 薬審1第5号「徐放性製剤(経口投与製剤)の設計及び評価に関するガイドライン」に溶出規格を設定する際の許容域である±10〜15%を考慮して設定した。
【0119】
結果を表7に示す。
【0120】
【表7】

【0121】
表7より,酸性、中性それぞれのpHの試験液において得られる薬理活性物質の放出挙動がこれらの実施例において類似していることが確認された。
【0122】
試験例3(ビーグル犬による薬物動態試験)
実施例22で製造された錠剤を用いて薬物動態試験を行った。
【0123】
実施例22で製造された錠剤(トルバプタン60mg含有)をイヌ用ゼラチンカプセルに充填し、このゼラチンカプセル1個を3〜5頭のビーグル犬に空腹時又は食後に経口投与し、経時的に採血を行い、血中トルバプタン濃度を測定した。また、同様にトルバプタンを60mg含有する錠剤(ヒドロキシプロピルセルロースと共に非晶質化されたトルバプタン、乳糖、コーンスターチ、結晶セルロース、ヒドロキシプロピルセルロース、低置換度ヒドロキシプロピルセルロース及びステアリン酸マグネシウムからなる即放性製剤)を比較例として空腹下で経口投与し、経時的に採血を行い、血中トルバプタン濃度を測定した。
【0124】
表8は上記経口投与試験によって得られた薬物動態パラメータである。
【0125】
【表8】

【0126】
なお、表8において、AUCtは血中濃度時間曲線下面積 (台形法)、AUCinfは無限大時間までの血中濃度時間曲線下面積、Cmaxは最高血中濃度、Tmaxは最高血中濃度到達時間、MRTtは平均滞留時間である。
【0127】
表8から明らかなように、実施例22で製造された製剤は、約6時間かけて薬理活性物質を放出するよう設計されている。これらを強制経口投与後の血中薬理活性物質濃度推移は、薬理活性物質の放出挙動に類似する傾向が認められた。すなわち、薬理活性物質を6時間で放出するよう設計された実施例22の製剤の最高血中薬理活性物質濃度は約6時間で到達していた。特に、実施例22の製剤を空腹下投与する場合、得られた血中薬理活性物質濃度の個体間変動(標準誤差)は対照の即放錠と比較して、極めて小さく、本発明の徐放性製剤は個体間変動の影響を受けにくいことが明らかになった。
【0128】
また、実施例22の製剤を食後投与した時においても最高血中薬理活性物質濃度は4〜6時間で到達していた。食事によって血中薬理活性物質濃度は多少高くなる傾向を示しているが、全体的な血中薬理活性物質濃度推移は食事によって大きく変化することはなく、本発明の製剤は食事の影響が少ない徐放性製剤であることが明らかとなった。
【特許請求の範囲】
【請求項1】
(a)薬理活性物質、(b)ポリカルボフィルカルシウム、並びに(c)糖及び/又は糖アルコールを含有するマトリックス型の医薬固形製剤であって、
前記(c)の糖及び/又は糖アルコールは、トレハロース、ラクチトール、マルトース、マルチトール、シュクロース、ソルビトール、キシリトール、エリスリトール、マンニトール、ラクトース、及びイソマルトオリゴ糖からなる群から選択される少なくとも1種である医薬固形製剤。
【請求項2】
(b)ポリカルボフィルカルシウムの含有量が1〜50重量%である請求項1に記載の医薬固形製剤。
【請求項3】
(c)糖及び/又は糖アルコールの含有量が0.1〜70重量%である、請求項1に記載の医薬固形製剤。
【請求項4】
更に、(d)水不溶性微粒子を含有する請求項1に記載の医薬固形製剤。
【請求項5】
(d)水不溶性微粒子が、医薬固形製剤の空隙を小さくすることができる微粒子である請求項4に記載の医薬固形製剤。
【請求項6】
(d)水不溶性微粒子の平均粒子径が0.002〜50μmである請求項4に記載の医薬固形製剤。
【請求項7】
更に、(e)毛管現象型の崩壊剤を含有する請求項1又は4に記載の医薬固形製剤。
【請求項8】
(e)毛管現象型の崩壊剤がカルメロースである請求項7に記載の医薬固形製剤。
【請求項9】
(d)水不溶性微粒子が、コロイド状二酸化ケイ素、含水二酸化ケイ素、軽質無水ケイ酸、タルク、酸化チタン、ステアリン酸マグネシウム及びエチルセルロースからなる群から選ばれる少なくとも1種である、請求項4に記載の医薬固形製剤。
【請求項10】
(d)水不溶性微粒子の平均粒子径が0.002〜50μmである請求項9に記載の医薬固形製剤。
【請求項11】
(d)水不溶性微粒子の含有量が0.01〜30重量%である、請求項4に記載の医薬固形製剤。
【請求項12】
(e)毛管現象型の崩壊剤の含有量が0.1〜15重量%である、請求項7に記載の医薬固形製剤。
【請求項13】
(c)糖及び/又は糖アルコールが、トレハロース、ラクチトール、マルトース、マルチトール、シュクロース、ソルビトール、キシリトール、及びイソマルトオリゴ糖からなる群から選ばれる少なくとも1種である、請求項1に記載の医薬固形製剤。
【請求項14】
(c)糖及び/又は糖アルコールが、含水結晶マルトース、マルチトール、ラクチトール一水和物、及びトレハロース二水和物からなる群から選ばれる少なくとも1種である、請求項1に記載の医薬固形製剤。
【請求項15】
(a)薬理活性物質の含有量が0.01〜80重量%である、請求項1に記載の医薬固形製剤。
【請求項1】
(a)薬理活性物質、(b)ポリカルボフィルカルシウム、並びに(c)糖及び/又は糖アルコールを含有するマトリックス型の医薬固形製剤であって、
前記(c)の糖及び/又は糖アルコールは、トレハロース、ラクチトール、マルトース、マルチトール、シュクロース、ソルビトール、キシリトール、エリスリトール、マンニトール、ラクトース、及びイソマルトオリゴ糖からなる群から選択される少なくとも1種である医薬固形製剤。
【請求項2】
(b)ポリカルボフィルカルシウムの含有量が1〜50重量%である請求項1に記載の医薬固形製剤。
【請求項3】
(c)糖及び/又は糖アルコールの含有量が0.1〜70重量%である、請求項1に記載の医薬固形製剤。
【請求項4】
更に、(d)水不溶性微粒子を含有する請求項1に記載の医薬固形製剤。
【請求項5】
(d)水不溶性微粒子が、医薬固形製剤の空隙を小さくすることができる微粒子である請求項4に記載の医薬固形製剤。
【請求項6】
(d)水不溶性微粒子の平均粒子径が0.002〜50μmである請求項4に記載の医薬固形製剤。
【請求項7】
更に、(e)毛管現象型の崩壊剤を含有する請求項1又は4に記載の医薬固形製剤。
【請求項8】
(e)毛管現象型の崩壊剤がカルメロースである請求項7に記載の医薬固形製剤。
【請求項9】
(d)水不溶性微粒子が、コロイド状二酸化ケイ素、含水二酸化ケイ素、軽質無水ケイ酸、タルク、酸化チタン、ステアリン酸マグネシウム及びエチルセルロースからなる群から選ばれる少なくとも1種である、請求項4に記載の医薬固形製剤。
【請求項10】
(d)水不溶性微粒子の平均粒子径が0.002〜50μmである請求項9に記載の医薬固形製剤。
【請求項11】
(d)水不溶性微粒子の含有量が0.01〜30重量%である、請求項4に記載の医薬固形製剤。
【請求項12】
(e)毛管現象型の崩壊剤の含有量が0.1〜15重量%である、請求項7に記載の医薬固形製剤。
【請求項13】
(c)糖及び/又は糖アルコールが、トレハロース、ラクチトール、マルトース、マルチトール、シュクロース、ソルビトール、キシリトール、及びイソマルトオリゴ糖からなる群から選ばれる少なくとも1種である、請求項1に記載の医薬固形製剤。
【請求項14】
(c)糖及び/又は糖アルコールが、含水結晶マルトース、マルチトール、ラクチトール一水和物、及びトレハロース二水和物からなる群から選ばれる少なくとも1種である、請求項1に記載の医薬固形製剤。
【請求項15】
(a)薬理活性物質の含有量が0.01〜80重量%である、請求項1に記載の医薬固形製剤。
【図1】


【図2】




【図2】


【公表番号】特表2012−501960(P2012−501960A)
【公表日】平成24年1月26日(2012.1.26)
【国際特許分類】
【出願番号】特願2011−510209(P2011−510209)
【出願日】平成21年8月26日(2009.8.26)
【国際出願番号】PCT/JP2009/065283
【国際公開番号】WO2010/026971
【国際公開日】平成22年3月11日(2010.3.11)
【出願人】(000206956)大塚製薬株式会社 (230)
【Fターム(参考)】
【公表日】平成24年1月26日(2012.1.26)
【国際特許分類】
【出願日】平成21年8月26日(2009.8.26)
【国際出願番号】PCT/JP2009/065283
【国際公開番号】WO2010/026971
【国際公開日】平成22年3月11日(2010.3.11)
【出願人】(000206956)大塚製薬株式会社 (230)
【Fターム(参考)】
[ Back to top ]

