即時放出および徐放特性を組み合わせて有する組成物
【課題】活性物質の即時放出および徐放特性の組み合わせを有する溶解度の低い活性物質の製剤を提供。
【解決手段】少なくとも1つの溶解度の低いナノ微粒子活性物質の粒子とナノ微粒子活性物質粒子の表面に吸着した、アグロメレーションおよび粒径の増大を防止することによりナノ微粒子活性物質を安定化する機能を有する少なくとも1つの表面安定化剤、および前記活性物質と同一のまたは異なる、少なくとも1つの溶解度の低いミクロ微粒子活性物質からなる組成物。
【解決手段】少なくとも1つの溶解度の低いナノ微粒子活性物質の粒子とナノ微粒子活性物質粒子の表面に吸着した、アグロメレーションおよび粒径の増大を防止することによりナノ微粒子活性物質を安定化する機能を有する少なくとも1つの表面安定化剤、および前記活性物質と同一のまたは異なる、少なくとも1つの溶解度の低いミクロ微粒子活性物質からなる組成物。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、即時放出(immediate release)および徐放(controlled release)特性を組み合わせて示す組成物に関する。この組成物は少なくとも1つのナノ微粒子の粒径を有する溶解度の低い活性成分、上記のナノ微粒子の活性物質粒子の表面に吸着した少なくとも1つの表面安定化剤、および少なくとも1つのミクロ微粒子の粒径を有する溶解度の低い活性成分からなる。
【背景技術】
【0002】
A. ナノ微粒子組成物に関する背景技術
ナノ微粒子組成物は、米国特許第5,145,684号(「‘684特許」)に最初に記載されたもので、その表面に非架橋表面安定化剤を吸収させた溶解度の低い活性物質からなる粒子である。‘684特許にはこのようなナノ微粒子組成物を製造する方法も記載されている。ナノ微粒子組成物は、粒径が減少し、その結果表面積が増加することにより、組成物が投与後に急速に溶解し、吸収されるので望ましい。このような組成物の製造方法は、「医薬物質を粉砕する方法」に関する米国特許第5,518,187および5,862,999号、「医薬物質を粉砕する連続的な方法」に関する米国特許第5,718,388号、および「ナノ微粒子を含む治療用組成物を調製する方法」に関する米国特許第5,510,118号に記載されている。
【0003】
また、ナノ微粒子組成物は、たとえば、「滅菌中の粒子の凝集を防止するためのイオン曇り点調節剤の使用」に関する米国特許第5,298,262号、「凍結乾燥中の粒径の増大を減少させる方法」に関する米国特許第5,302,401号、「医療用画像に有用なX-線造影組成物」に関する米国特許第5,318,767号、「高分子量非イオン性界面活性剤を用いるナノ微粒子X-線血液プール造影剤の新規の製剤」に関する米国特許第5,326,552号、「ヨウ素化芳香族プロパンジオエートを用いるX-線画像法」に関する米国特許第5,328,404号、「ナノ微粒子の凝集を減少させるための荷電リン脂質の使用」に関する米国特許第5,336,507号、「粒子の凝集を防止し、安定性を増大するためのOlin 10-Gからなる製剤」に関する米国特許第5,340,564号、「滅菌中のナノ微粒子の凝集を最小化するための非イオン性曇り点調節剤の使用」に関する米国特許第5,346,702号、「非常に小さい磁性デキストラン粒子の調製および磁気特性」に関する米国特許第5,349,957号、「滅菌中の粒子の凝集を防止するための精製された表面修飾剤の使用」に関する米国特許第5,352,459号、「表面を修飾した抗癌ナノ微粒子」に関する米国特許第5,399,363および5,494,683号、「磁気共鳴増強剤としての水不溶性非磁性マンガン粒子」に関する米国特許第5,401,492号、「ナノ微粒子安定化剤としてのチロキサポールの使用」に関する米国特許第5,429,824号、「高分子量非イオン性界面活性剤を用いるナノ微粒子X-線血液プール造影剤の製造方法」に関する米国特許第5,447,710号、「医療用画像に有用なX-線造影組成物」に関する米国特許第5,451,393号、「製薬上許容されるクレーと組み合わせた経口胃腸診断用X-線造影剤の製剤」に関する米国特許第5,466,440号、「凝集を減少させるために荷電リン脂質を含むナノ微粒子組成物を調製する方法」に関する米国特許第5,470,583号、「血液プールおよびリンパ系画像用のX-線造影剤としてのナノ微粒子診断用カルバミン酸無水物混合物」に関する米国特許第5,472,683号、「血液プールおよびリンパ系画像用のX-線造影剤としてのナノ微粒子診断用二量体」に関する米国特許第5,500,204
号、「医薬物質を粉砕する方法」に関する米国特許第5,518,187号、「ナノ微粒子NSAID製剤」に関する米国特許第5,518,738号、「X-線造影剤として使用するためのナノ微粒子ヨードジパミド誘導体」に関する米国特許第5,521,218号、「血液プールおよびリンパ系画像用ナノ微粒子診断用ジアトリゾキシエステルX-線造影剤」に関する米国特許第5,525,328号、「ナノ微粒子を含むX-線造影剤組成物を調製する方法」に関する米国特許第5,543,133号、「表面を修飾されたNSAIDナノ微粒子」に関する米国特許第5,552,160号、「消化可能な油または脂肪酸中へのナノ微粒子分散物としての化合物の製剤」に関する米国特許第5,560,931号、「ナノ微粒子の表面修飾剤としてのポリアルキレンブロック共重合体」に関する米国特許第5,565,188号、「ナノ微粒子組成物の安定化剤コーティングとしての硫酸エステル化された非イオン性ブロック共重合体界面活性剤」に関する米国特許第5,569,448号、「消化可能な油または脂肪酸中へのナノ微粒子分散物としての化合物の製剤」に関する米国特許第5,571,536号、「血液プールおよびリンパ系画像用X-線造影剤としてのナノ微粒子診断用カルボン酸無水物混合物」に関する米国特許第5,573,749号、「診断用画像X-線造影剤」に関する米国特許第5,573,750号、「保護用オーバーコートを有する再分散可能なナノ微粒子フィルムマトリックス」に関する米国特許第5,573,783号、「高分子量直鎖ポリ(エチレンオキシド)ポリマーにより安定化されたナノ微粒子を用いるGI管内の部位特異的付着」に関する米国特許第5,580,579号、「製薬上許容されるクレーと組み合わせた経口胃腸治療薬の製剤」に関する米国特許第5,585,108号、「ナノ微粒子組成物の安定化剤コーティングとしてのブチレンオキシド-エチレンオキシドブロック共重合体界面活性剤」に関する米国特許第5,587,143号、「分散安定化剤としてヒドロプロピルセルロースを含む粉砕されたナプロキセン」に関する米国特許第5,591,456号、「非イオン性およびアニオン性安定化剤により安定化された新規のバリウム塩製剤」に関する米国特許第5,593,657号、「ナノ結晶用の糖を基本とする界面活性剤」に関する米
国特許第5,622,938号、「経口胃腸診断用X-線造影剤および経口胃腸治療薬の改良された製剤」に関する米国特許第5,628,981号、「血液プールおよびリンパ系画像用のX-線造影剤としてのナノ微粒子診断用カルボン酸無水物混合物」に関する米国特許第5,643,552号、「医薬物質を粉砕する連続的方法」に関する米国特許第5,718,388号、「イブプロフェンのR(-)エナンチオマーを含むナノ微粒子」に関する米国特許第5,718,919号、「ベクロメタゾンナノ微粒子分散物を含むエアロゾル」に関する米国特許第5,747,001号、「静脈内投与されたナノ微粒子製剤に誘導される有害な生理反応の減少」に関する米国特許第5,834,025号、「セルロース誘導体表面安定化剤を用いるヒト免疫不全ウイルス(HIV)プロテアーゼ阻害剤のナノ結晶製剤」に関する米国特許第6,045,829号、「セルロース誘導体表面安定化剤を用いるヒト免疫不全ウイルス(HIV)プロテアーゼ阻害剤のナノ結晶製剤の製造方法」に関する米国特許第6,068,858号、「ナノ微粒子ナプロキセンの注射用製剤」に関する米国特許第6,153,225号、「ナノ微粒子ナプロキセンの新規の固形の剤形」に関する米国特許第6,165,506号、「ヒト免疫不全ウイルス(HIV)プロテアーゼ阻害剤のナノ結晶製剤を用いる哺乳類を治療する方法」に関する米国特許第6,221,400号、「ナノ微粒子分散物を含む噴霧されたエアロゾル」に関する米国特許第6,264,922号、「ナノ微粒子組成物において結晶の成長および粒子の凝集を防止する方法」に関する米国特許第6,267,989号、「ナノ微粒子組成物の表面安定化剤としてのPEG-誘導体化脂質の使用」に関する米国特許第6,270,806号、「固形の急速崩壊型経口用剤形」に関する米国特許第6,316,029号、「高分子の表面安定化剤およびジオクチルスルホコハク酸ナトリウムの相乗的組み合わせからなる固体の剤形のナノ微粒子組成物」に関する米国特許第6,375,986号、「カチオン性表面安定化剤を有する生体付着性ナノ微粒子組成物」に関する米国特許第6,428,814号、および、「上部および/または下部胃腸管への標的薬物送達の方法」に関する米国特許第6,432,381号にも記載されている。これらのすべての文献を特
に参照により本明細書に組み入れる。さらに、2002年1月31日に公開された、「徐放性ナノ微粒子組成物」に関する米国特許出願第20020012675 A1には、ナノ微粒子組成物について記載されており、これを特に参照により本明細書に組み入れる。
【0004】
アモルファスの微小粒子組成物については、たとえば、「粒子組成物およびその抗微生物剤としての使用」に関する米国特許第4,783,484号、「水不溶性有機化合物からの均一な粒径の粒子の製造方法」に関する米国特許第4,826,689号、「不溶性化合物からの均一な粒径の粒子の製造方法」に関する米国特許第4,997,454号、「内部の気泡をトラップするための均一な粒径の超微小、非凝集多孔性粒子および方法」に関する米国特許第5,741,522号、および、「超音波の後方散乱を増強するための超微小多孔性粒子」に関する米国特許第5,776,496号に記載されている。
【0005】
これらの参照文献、または他のナノ微粒子組成物について記載した参照文献のいずれにも、即時放出および徐放特性を組み合わせて有するナノ微粒子組成物については記載されていない。
【0006】
B. 即時放出型組成物に関する背景技術
「速溶(fast melt)」または「急速崩壊型(rapidly disintegrating)」製剤とも呼ばれる従来の即時放出型製剤は、活性物質粒子成分の粒径よりも、活性物質粒子成分の迅速な放出を達成する薬物マトリックスの組成によるものである。
【0007】
最近の急速崩壊型または急速溶解型の固形の経口製剤の製造元には、Cima Labs、Fuisz Technologies Ltd.、Prographarm, R.P.Scherer、およびYamanouchi-Shakleeが含まれる。これらのすべての製造元は、異なるタイプの急速溶解型の固形の経口製剤を市場に出している。
【0008】
Cima Labsは、5から30分の経口溶解時間を有する発泡性直接圧縮錠剤であるOraSolv(商標)、および、味覚マスクされた活性物質および15から45秒の経口溶解時間を有する直接圧縮錠剤であるDuraSolv(商標)を市場に出している。Cimaの「経口製剤用の味覚マスクミクロ微粒子」に関する米国特許第5,607,697号には、口腔中で崩壊するコーティングされたミクロ微粒子からなる固形の製剤が記載されている。ミクロ微粒子のコアは、薬剤および、マンニトール、ソルビトール、人工甘味料とメントールの混合物、砂糖とメントールの混合物、およびサリチル酸メチルから選択される負の溶解熱を有する1つ以上の甘味化合物を有する。ミクロ微粒子のコアは口腔内での溶解を遅らせ、薬剤の味をマスクする材料により少なくとも部分的にコーティングされる。次いでミクロ微粒子を錠剤に圧縮成形する。他の添加剤も錠剤の製剤に加えることができる。
【0009】
Cima Labsに帰属する「急速溶解型ローバスト製剤」に関するWO98/46215は、活性成分および少なくとも非直接圧縮賦形剤および滑沢剤からなるマトリックスを有する硬い、圧縮された速溶性製剤に関する。非直接圧縮賦形剤は、直接圧縮(DC等級)賦形剤とは異なり、典型的には自由に流れず、通常は自由に流れる顆粒を形成する付加的な工程を必要とする。
【0010】
Cimaはまた、発泡性の製剤(米国特許第5,503,846、5,223,246、および5,178,878号)および急速溶解型製剤のための錠剤補助剤(米国特許第5,401,513および5,219,574号)、および水溶性薬物のための急速溶解型製剤(「味覚マスクされたミクロカプセル組成物および製造方法」に関するWO98/14179)に関する米国特許および国際特許出願を有する。
【0011】
Fuisz Technologiesは、現在Bio Vailの一部であるが、Shearform(商標)と呼ばれる加工された添加剤を含む直接圧縮錠剤であるFlash Dose(商標)を市場に出している。Shearform(商標)は、アモルファス繊維に変換した多糖混合物の綿菓子様の物質である。この技術について記載した米国特許には、「急速溶解型製剤を製造するための装置」に関する米国特許第5,871,781号、「高速/高圧の条件下で形成された速く溶解する可食製剤」に関する米国特許第5,869,098号、「急速溶解型製剤を製造する方法および装置ならびにそれによる製品」に関する米国特許第5,866,163、5,851,553、および5,622,719号、「徐放系の送達」に関する米国特許第5,567,439号、および「瞬時に分散する可食製剤を形成する方法およびそれによる製品」に関する米国特許第5,587,172号が含まれる。
【0012】
Prographarmは、カルボキシメチルセルロースのような崩壊剤、修飾されたデンプンのような膨潤剤、および味覚マスクされた活性物質を有する速溶性錠剤であるFlashtab(商標)を市場に出している。この錠剤は1分未満の経口崩壊時間を有する(米国特許第5,464,632号)。
【0013】
R. P. Schererは、2から5秒の経口崩壊時間を有する凍結乾燥された錠剤であるZydis(商標)を市場に出している。凍結乾燥された錠剤は製造コストが高く、錠剤の湿度および温度に対する感受性のために包装が難しい。米国特許第4,642,903号(R. P. Scherer Corp.)には、凍結乾燥される溶液または懸濁液全体に気体を分散させることにより調製される速溶性製剤について記載されている。米国特許第5,188,825号(R. P. Scherer Corp.)には、水溶性の活性物質をイオン交換樹脂に結合または複合体化して実質的に水不溶性の複合体を形成した後、適当な担体と混合して凍結乾燥することにより調製される製剤について記載されている。米国特許第5,631,023号(R.P.Scherer Corp.)には、ゼラチンおよび活性物質の懸濁液にキサンタンガムを加えることにより作られる凍結乾燥された薬物の製剤について記載されている。米国特許第5,827,541号(R.P.Scherer Corp.)には、疎水性物質の固形の医薬品製剤を調製する方法が開示されている。この方法は、疎水性の活性成分および界面活性剤を非水相に、担体物質を水相に含む分散物を凍結乾燥することを含む。
【0014】
Yamanouchi-Shakleeは、成形性の低いサッカライドと高いサッカライドとの組み合わせを有する錠剤であるWowtab(商標)を市場に出している。この技術を記載する米国特許には、「口腔内で溶解する圧縮成型物およびその製造工程」に関する米国特許第5,576,014号、および「口腔内で崩壊する調製物およびその製造」に関する米国特許第5,446,464号が含まれる。
【0015】
急速溶解型の技術を有する他の会社にはJanssen Pharmaceuticaが含まれる。Janssenに帰属する米国特許には、2つのポリペプチド(またはゼラチン)成分および充填剤を有する急速溶解型錠剤で、2つの成分が同じ記号の実効電荷を有し、第1の成分が第2の成分よりも水溶液に対する溶解度が高いものが記載されている。「急速溶解型錠剤」に関する米国特許第5,807,576号、「急速溶解型錠剤を製造する方法」に関する米国特許第5,635,210号、「急速溶解型錠剤を製造するための粒子の支持マトリックス」に関する米国特許第5,595,761号、「急速溶解型錠剤を製造するための粒子の支持マトリックスを製造する工程」に関する米国特許第5,587,180号、および「急速溶解型製剤」に関する米国特許第5,776,491号を参照されたい。
【0016】
Eurand America, Inc.は、炭酸水素ナトリウム、クエン酸、およびエチルセルロースの混合物を有する急速溶解型発泡性組成物に関する米国特許を有する(米国特許第5,639,475および5,709,886号)。
【0017】
L.A.B. Pharmaceutical Researchは、発泡性の酸および発泡性の塩基の発泡性の組み合わせを有する発泡に基づく急速溶解型製剤に関する米国特許を有する(米国特許第5,807,578および5,807,577号)。
【0018】
Schering Corporationは、活性物質、添加剤(界面活性剤であってよい)またはスクロース、ラクトース、またはソルビトールのうちの少なくとも1つ、およびステアリン酸マグネシウムまたはドデシル硫酸ナトリウムのいずれか一方を有する口腔錠に関する技術を有する(米国特許第5,112,616および5,073,374号)。
【0019】
Laboratoire L.LaFonは、2つの相のうち少なくとも1つが界面活性剤を含むo/wエマルションの凍結乾燥により作られた従来の製剤に関する技術を有する(米国特許第4,616,047号)。このタイプの製剤を製造するためには、活性成分は凍結した懸濁液の状態で維持され、微細化または圧縮のプロセスは活性成分を損なう可能性があるのでこれらの工程なしで錠剤化される。
【0020】
Takeda Chemicals Inc., Ltd.は、活性物質および湿らせた可溶性炭水化物を錠剤に圧縮成型した後、錠剤を乾燥することからなる、急速溶解型錠剤を製造する方法に関する技術を有する。
【0021】
いずれの先行技術の文献にも、溶解度の低い活性成分がナノ微粒子の形態をとる即時放出型製剤については記載されていない。先行技術の即時放出型製剤は溶解度の低い薬物のバイオアベイラビリティーに関する問題に取り組んでいないので、これは重要である。先行技術の即時放出型製剤は薬物を迅速に出現させることができるかもしれないが、薬物の溶解度の低さおよびそれに伴う溶解速度の遅さのために、しばしば治療作用の開始までに望ましくない遅れが存在する。そのため、先行技術の即時放出型製剤が薬物担体マトリックスの急速な崩壊を示したとしても、これは製剤中に含まれる溶解度の低い薬物の急速な溶解および吸収にはつながらない。
【0022】
C. 徐放型組成物に関する背景技術
徐放とは、組成物または製剤からの薬物のような物質の放出であって、上記物質が延長された時間にわたって望まれるプロファイルに従って放出されるものを指す。徐放のプロファイルには、たとえば、徐放性、長時間(prolonged)放出、パルス(pulsatile)放出および遅延放出プロファイルが含まれる。即時放出型組成物とは異なり、徐放型組成物はあらかじめ決められたプロファイルによる、より長い時間にわたっての被験体への薬剤の送達を可能にする。このような放出速度により、より長い時間にわたって薬剤の治療上有効なレベルを提供することが可能になり、それにより従来の急速放出型剤形と比較してより長時間の薬理的または診断上の反応を提供する。このような長時間の反応は、相当する短時間作用型の、即時放出型製剤によっては達成されない多くの固有の利点を提供する。たとえば、慢性の痛みの治療において、徐放型製剤は、従来の短時間作用型製剤よりも非常に好ましいことが多い。
【0023】
徐放型医薬組成物および剤形は、薬物、医薬、活性物質、診断薬、またはヒトを含む動物に内服投与されるすべての物質のような薬剤の送達プロファイルを改良するように設計される。徐放型組成物は、典型的には、送達の速度を最適化することにより投与された物質の効果を改良するために用いられ、それにより、バイオアベイラビリティー、利便性、および患者の協力を増大し、同時に、高い初期放出速度のような不適切な即時放出速度、および望まれない場合には不均一な血液または組織レベルに伴う副作用を最小化する。
【0024】
活性化合物の徐放を提供する組成物の調製および使用に関する先行技術は、投与後の薬物の放出を延長する様々な方法を提供する。
【0025】
当業者に公知の徐放型製剤の例には、薬物の徐放が、たとえば、製剤のコーティングの選択的崩壊により、コーティングを通しての放出により、薬物の放出に影響を与える特異的なマトリックスとの混合により、またはこれらの技術の組み合わせにより達成される、特別にコーティングされたペレット、ミクロ微粒子、植込錠、錠剤、ミニタブ、およびカプセルが含まれる。いくつかの徐放型製剤は、投与後のあらかじめ決定された時間に活性化合物の一回分用量をパルス放出することができる。
【0026】
Acharyaらへの米国特許第5,110,605号には、ポリカルボフィルアルギン酸カルシウム徐放型組成物について記載されている。Krishnamurthyらへの米国特許第5,215,758号には、アルギン酸ナトリウムおよびカルシウム塩の徐放坐剤組成物について記載されている。Friendらへの米国特許第5,811,388号には、経口投与される化合物の徐放を提供するための、アルギン酸塩、水膨潤性ポリマーおよび消化可能な炭化水素誘導体を含む固形のアルギン酸を基礎とする製剤について記載されている。
【0027】
WO91/13612には、薬物がイオン交換樹脂と複合体を形成している組成物を用いる薬物の遅延放出について記載されている。この公開された特許出願に記載された特定のイオン交換樹脂は、ポリスチレンスルホン酸ナトリウム樹脂である、AMBERLITE IRP 69(商標)である。
【0028】
Woodsらへの米国特許第5,811,425号には、体組織に適合性の生物により分解されるポリマー、リポソーム、またはミクロエマルション中に薬物のミクロカプセル化したマトリックスを形成することにより作られた徐放薬物の注射用デポ製剤について記載されている。Lamらへの米国特許第5,811,422号には、ポリ乳酸、ポリグリコール酸、ポリ乳酸とポリグリコール酸のコポリマー、ポリイプシロンカプロラクトン、ポリヒドロキシ酪酸等のような生物により分解されるポリマーにある種の薬物を結合することにより得られる徐放型組成物について記載されている。
【0029】
De Freesらへの米国特許第5,811,404号には、薬物組成物の遅延放出を実現するために延長された循環半減期を有するリポソームを使用することが記載されている。
【0030】
最後に、「徐放性ナノ微粒子組成物」に関するWO 00/18374には、ナノ微粒子活性物質からなる徐放型製剤について記載されている。
【発明の概要】
【発明が解決しようとする課題】
【0031】
当技術分野において、即時放出および徐放特性を組み合わせて有する溶解度の低い薬物の組成物が必要とされている。本発明はこの必要性を満たす。
【課題を解決するための手段】
【0032】
発明の概要
本発明は、活性物質の即時放出および徐放特性の組み合わせを有する溶解度の低い活性物質の製剤の、驚くべき、予期せぬ発見に関する。本発明の製剤は、非常に小さい活性物質の粒子、すなわちナノ微粒子活性物質粒子(nanoparticulate active agent particle)と、より大きい活性物質の粒子、すなわち微細化(micronized)活性物質粒子との組み合わせからなり、活性物質成分の即時放出(IR)および徐放(CR) を同時に実現することを可能にする。
【0033】
IR成分であるナノ微粒子活性物質粒子は、その小さい粒径およびその大きな特有の表面のために、in vivoで急速に溶解する。一方、CR成分である微細化活性物質(micronized active agent)粒子は、比較的大きい粒径およびその小さい特有の表面のため、in vivoでよりゆっくりと溶解する。
【0034】
in vivoでの広い範囲の溶解速度(即ち、in vivoでの吸収のための取り込み速度)を示すIRおよびCR成分は、活性物質の粒径の正確な制御により作り出すことができる。そこで、組成物は、それぞれの粒子の集団が正確な放出速度と相関する限定された粒径を有するようなナノ微粒子活性物質粒子の混合物からなってもよく、また、組成物は、それぞれの粒子の集団が正確な放出速度と相関する限定された粒径を有するようなミクロ微粒子活性物質粒子(microparticulate active agent particle)の混合物からなってもよい。
【0035】
特に、活性物質の制御された送達は、伝統的に、単に製剤の活性物質成分の粒径によるよりも、速度制御膜、膨潤性および浸食性ポリマー、およびイオン交換樹脂を用いることにより達成されてきたので、本発明の組成物はきわめて予期されないものである。
【0036】
本発明の別の態様において、IRおよびCR特性を組み合わせて有する製剤を調製する方法が提供される。この方法は、(1) 少なくとも1つの投与されるナノ微粒子活性物質粒子およびナノ微粒子活性物質粒子の表面に吸着した少なくとも1つの表面安定化剤からなる組成物を形成し;(2) (1)の活性物質と同一のまたは異なる、少なくとも1つのミクロ微粒子活性物質を加え;(3) 投与のための(1)および(2)の混合物の製剤を形成することからなる。付加的な製薬上許容される添加剤もまた、投与のための組成物に加えることができる。
【0037】
本発明のさらに別の態様は、本発明の組成物によりヒトを含む哺乳類を治療する方法を提供する。
【0038】
上記の一般的な説明および下記の詳細な説明および図面の簡単な説明は、例示および説明のためのものであり、請求の範囲に記載された発明をさらに説明することを目的とすることが理解されるべきである。別の目的、利点および新規の特徴は、以下の発明の詳細な説明から当業者に容易に明らかになるであろう。
【0039】
発明の詳細な説明
A. 組成物
本発明は、IRおよびCRの組み合わせ特性を示す新規の組成物の、驚くべき、予期せぬ発見に関する。本組成物は、CR特性を得るために、速度制御ポリマーまたは膜、膨潤性または浸食性ポリマー、またはイオン交換樹脂のような付加的な材料の存在を必要としない。IRおよびCR特性は、1つ以上の活性物質について正確に検定した粒径を用いて得られる。より小さい粒径はIRプロファイルを与え、より大きい粒径はCRプロファイルを与える。
【0040】
本発明の組成物は、(1) 少なくとも1つの溶解度の低いナノ微粒子活性物質の粒子;(2) ナノ微粒子活性物質粒子の表面に吸着した少なくとも1つの表面安定化剤;および(3) (1)の活性物質と同一のまたは異なる、少なくとも1つの溶解度の低いミクロ微粒子活性物質からなる。‘684特許に記載されるように、表面安定化剤は、アグロメレーション(agglomeration)および粒径の増大を防止することによりナノ微粒子活性物質を安定化する機能を有する。
【0041】
ナノ微粒子活性物質組成物を作る方法は、機械的粉砕、沈殿(precipitation)、均質化(homogenization)、または他の適した粒径減少工程からなってよいが、当業者に公知であり、たとえば、‘684特許および「背景技術」に開示した他の先行技術の参照文献に記載されている。
【0042】
ナノ微粒子およびミクロ微粒子活性物質粒子は、結晶形態、半結晶形態、アモルファス形態、半アモルファス形態、またはそれらの組み合わせであってよい。
【0043】
組成物は、経口、直腸、非経口(静脈内、筋内、または皮下)、槽内、肺、腟内、腹腔内、局所(粉末、軟膏または滴剤)、眼内、耳内、または口腔もしくは鼻用スプレーを含むがこれらに限定されない、あらゆる通常の手段により、ヒトおよび動物に投与するために製剤化することができる。
【0044】
本発明はまた、1つ以上の毒性のない、生理的に許容される担体、佐剤、または賦形剤(これらを集合的に担体と呼ぶ)を加えて製剤された本発明の組成物をも包含する。組成物は非経口注射、固体または液体の剤形による経口投与、直腸または局所投与、眼または耳への投与等のために製剤することができる。
【0045】
経口用製剤において、IR成分は、薬物のナノ微粒子の粒径の結果として、溶解度の低い活性物質の口腔内での急速な溶解をもたらす。さらに、本発明により、溶解度の低い活性成分の頬からの吸収の機会が増大する。ナノ微粒子IR成分のさらに別の利点は、ナノ微粒子活性物質粒子の使用が、先行技術の溶解度の低い活性物質のIR経口製剤で感じられたざらついた感触を排除または最小化することである。
【0046】
IR製剤に伴う典型的な利点の1つは、投薬から活性成分が身体に現れるまでの時間差が減少することである。この時間差は、通常、製剤の崩壊およびその後の活性成分の分布に伴うものである。経口IR製剤の別の利点は、投与後に活性物質が迅速に口中に現れることにより、活性成分の頬から血流への直接の吸収が促進され、それにより一回投与量からの活性成分の全バイオアベイラビリティーに対する、肝臓の初回通過効果を減少させることである。活性物質のナノ微粒子の粒径が口腔内での急速な溶解を可能にするので、この第2の効果は本発明のIR製剤において劇的に増大する。
【0047】
組成物のCR成分は、より長い時間にわたって、含まれる活性物質の患者における有効な血液レベルを提供することが期待される。本明細書において、「徐放」は、物質が約2から約24時間またはそれ以上の延長された時間にわたって望まれるプロファイルに従って放出されるような、組成物または製剤からの薬物のような活性物質の放出を意味する。より長い時間にわたる放出はまた、本発明の「徐放」製剤として意図されるものである。典型的な製剤を下に図示する。
【0048】

【0049】
1. 固形の剤形
本発明の第1の実施形態において、IRおよびCRの両方の成分が、経口投与を目的とした、固形の、急速崩壊型または「無水錠剤(waterless tablet)」マトリックスに組み込まれる。
【0050】
本発明の第2の実施形態において、IRおよびCR成分は、経口投与を目的とした製薬上許容される錠剤に混合される。
【0051】
本発明の第3の実施形態において、IRおよびCR成分は、経口投与を目的とした製薬上許容される硬ゼラチンカプセルに混合される。
【0052】
本発明の第4の実施形態において、IRおよびCR成分は、経口投与を目的とした製薬上許容される軟ゼラチンカプセルに混合される。この剤形の1つの変形は、可溶化された(solubilized)薬物およびミクロ微粒子薬物粒子からなり、ここで可溶化された薬物が剤形のIR成分として機能し、ミクロ微粒子薬物粒子がCR成分として機能するものである。この変形は、「粒子化された」ナノ微粒子薬物粒子の存在を必要としない点で、本明細書に記載された他の剤形と異なっている。
【0053】
本発明の第5の実施形態において、IRおよびCR成分は、経口投与を目的とした製薬上許容されるロゼンジまたはトローチに混合される。
【0054】
本発明の第6の実施形態において、IRおよびCR成分は、経口投与を目的とした製薬上許容される小袋(sachet)、粉末、または「スプリンクル(sprinkle)」に混合される。
【0055】
2. 他の剤形
他の好ましい剤形には、直腸または腟内に使用するための坐剤;静脈内、筋内、または皮下投与のための注射剤を含む注射剤;肺または鼻への投与のためのエアロゾル;口腔用製剤;粉末、軟膏、または滴剤のような局所適用のための製剤;眼および耳用の製剤および槽内および腹腔内投与のための製剤が含まれるが、これらに限定されない。
本発明のIRおよびCR組成物は上に特に記載したものに限らず、いかなる製薬上許容される製剤に組み入れてもよい。
【0056】
3. 溶解度の低い活性物質
本発明の組成物は少なくとも1つの溶解度の低い治療薬、診断薬、または他の活性物質からなる。治療薬は薬物または医薬品であってよく、診断薬は典型的にはX-線造影剤のような造影剤、または他のタイプの診断用物質である。
【0057】
本発明は、広範な溶解度の低い薬物または診断薬を用いて実施することができる。薬物または診断薬は好ましくは基本的に純粋な形で存在し、溶解度が低く、少なくとも1つの液体の媒体に分散可能である。「溶解度が低い」という用語は、薬物または診断薬が、液体の分散媒体に、約30mg/ml未満、好ましくは約10mg/ml、より好ましくは約1mg/ml未満の溶解度を有することを意味する。このような液体の分散媒体は、たとえば、水、塩の水溶液、ベニバナ油のような油、およびエタノール、t-ブタノール、ヘキサンおよびグリコールのような溶媒であってよい。
【0058】
溶解度の低い活性物質はさまざまな公知の薬物または診断薬のクラスから選択することができ、それには、たとえば、タンパク質、ペプチド、ヌクレオチド、抗肥満薬、栄養補給食品、コルチコステロイド、エラスターゼ阻害剤、鎮痛薬、抗真菌薬、腫瘍治療薬、制吐薬、鎮痛薬、心血管薬、抗炎症薬、駆虫薬、抗不整脈薬、抗生物質(ペニシリンを含む)、抗凝血薬、抗うつ薬、抗糖尿病薬、抗てんかん薬、抗ヒスタミン薬、抗高血圧薬、抗ムスカリン薬、抗ミコバクテリア薬、抗腫瘍薬、免疫抑制薬、抗甲状腺薬、抗ウイルス薬、抗不安薬、鎮静薬(たとえば、催眠薬および神経弛緩薬)、収斂薬、β-アドレナリン受容体遮断薬、血液製品および代替物、心臓変力薬、造影剤、コルチコステロイド、鎮咳薬(去痰薬および粘液溶解薬)、診断薬、診断画像薬、利尿薬、ドパミン作動薬(抗パーキンソン病薬)、止血薬、免疫薬、脂質調節薬、筋弛緩薬、副交感神経作動薬、上皮小体カルシトニンおよびビホスホネート、プロスタグランジン、放射性医薬品、性ホルモン(ステロイドを含む)、抗アレルギー薬、興奮薬および食欲抑制薬、交感神経作動薬、乾燥甲状腺製剤、血管拡張薬およびキサンチンが含まれる。
【0059】
典型的な栄養補給食品および栄養補助食品は、たとえば、Robertsら、「栄養補給食品:栄養補助食品、ハーブ、ビタミン、および治療用食物の完全な辞典(Nutraceuticals: The Complete Encyclopedia of Supplements, Herbs, Vitamins, and Healing Foods)(American Nutraceutical Association, 2001)に記載されており、この文献を特に参照により本明細書に組み入れる。植物化学物質または機能食品としても知られる栄養補給食品または栄養補助食品は、一般的に、栄養補助食品、ビタミン、無機質、ハーブ、または体に医学的または薬学的作用を有する治療用食品のクラスのいずれか1つである。典型的な栄養補給食品または栄養補助食品には、葉酸、脂肪酸(たとえば、DHAおよびARA)、果物および野菜抽出物、ビタミンおよび無機質補助剤、ホスファチジルセリン、リポ酸、メラトニン、グルコサミン/コンドロイチン、薬用アロエ、Guggul、グルタミン、アミノ酸(たとえば、イソロイシン、ロイシン、リシン、メチオニン、フェニラニン(phenilanine)、スレオニン、トリプトファン、およびバリン)、緑茶、リコペン、自然食品、食品添加物、ハーブ、植物栄養剤、抗酸化剤、果物のフラボノイド成分、マツヨイグサ油、亜麻仁、魚および海獣油、および体に良いバクテリア(probiotics)を含むが、これらに限定されない。栄養補給食品および栄養補助食品はまた、「ファーマフード(pharmafoods)」としても知られる、望まれる特性を持つように遺伝子工学により処理した生物工学食物をも含む。
【0060】
活性物質は、販売されている、および/または当業者に公知の技術により調製することができる。
【0061】
溶解度の低い活性成分は、治療効果を引き出すのに十分ないかなる量で存在してもよく、また、該当する場合には、一方の光学的に純粋なエナンチオマーの形で、またはエナンチオマーの混合物、ラセミ体もしくは他の形で存在してよい。
【0062】
4. 表面安定化剤
当業者に公知で、たとえば‘684特許に記載された有用な表面安定化剤は、活性物質の表面に物理的に付着するが、活性物質と化学的に結合または相互作用をしないものを含むと考えられる。表面安定化剤は、活性物質が約1000nm未満の有効平均粒径を維持するのに十分な量でナノ微粒子活性物質の表面に吸収される。さらに、吸着した表面安定化剤の個々の分子は、基本的に分子間架橋をおこなわない。本発明の組成物および方法において、2つ以上の表面安定化剤を用いてもよい。
【0063】
適当な表面安定化剤は、好ましくは、公知の有機および無機医薬品添加物から選択される。このような添加物には、さまざまなポリマー、低分子量オリゴマー、天然物、および界面活性剤が含まれる。好ましい表面安定化剤には、アニオン性およびカチオン性界面活性剤を含む、非イオン性およびイオン性界面活性剤が含まれる。
【0064】
表面安定化剤の代表的な例には、ゼラチン、カゼイン、レシチン(ホスファチド)、デキストラン、アラビアゴム、コレステロール、トラガカント、ステアリン酸、塩化ベンザルコニウム、ステアリン酸カルシウム、モノステアリン酸グリセリン、セトステアリルアルコール、セトマクロゴール、乳化ワックス、ソルビタンエステル、ポリオキシエチレンアルキルエーテル(たとえば、セトマクロゴール1000のようなマクロゴールエーテル)、ポリオキシエチレンヒマシ油誘導体、ポリオキシエチレンソルビタン脂肪酸エステル(たとえば、販売されているTween20(商標)およびTween80(商標)のようなTween(商標)(ICI Speciality Chemicals))、ポリエチレングリコール(たとえば、Carbowax3550(商標)および934(商標)(Union Carbide))、ステアリン酸ポリオキシエチレン、コロイド二酸化ケイ素、リン酸塩、ドデシル硫酸ナトリウム、カルボキシメチルセルロースカルシウム、カルボキシメチルセルロースナトリウム、メチルセルロース、ヒドロキシエチルセルロース、ヒドロキシプロピルセルロース、フタル酸ヒドロキシプロピルメチルセルロース、非結晶セルロース、ケイ酸マグネシウムアルミニウム、トリエタノールアミン、ポリビニルアルコール(PVA)、ポリビニルピロリドン(PVP)、4-(1,1,3,3-テトラメチルブチル)-フェノールとエチレンオキシドおよびホルムアルデヒドとのポリマー(チロキサポール、スペリオン(sperione)、およびトリトンとしても知られている)、ポロキサマー(たとえば、エチレンオキシドおよびプロピレンオキシドのブロック共重合体である、Pluronics F68(商標)およびF108(商標))、ポロキサミン(たとえば、エチレンジアミンにプロピレンオキシドおよびエチレンオキシドを順次加えて作られる4官能基ブロック共重合体である、Poloxamine 908(商標)としても知られるTetronic 908(商標)(BASF Wyandotte Corporation, Parsippany, N.J.))、Tetronic 1508(商標)(T-1508)(BASF Wyandotte Corporation)、スルホコハク酸ナトリウムのジアルキルエステル(たとえば、スルホコハク酸ナトリウムのジオクチルエステルである、Aerosol OT(商標)(American Cyanamid))、ラウリル硫酸ナトリウムである、Duponol P(商標)(DuPont)、アルキルアリールポリエーテルスルホネートである、Tritons X-200(商標)(Rohm and Haas)、ステアリン酸スクロースおよびジステアリン酸スクロースの混合物であるCrodestas F-110(商標)(Croda Inc.)、Olin-IOG(商標)またはSurfactant 10-G(商標)(Olin Chemicals, Stamford, CT)としても知られる、p-イソノニルフェノキシポリ-(グリシドール)、Crodestas SL-40(商標)(Croda, Inc.)、およびC18H37CH2C(O)N(CH3)-CH2(CHOH)4(CH2OH)2である、SA9OHCO(Eastman Kodak Co.)、デカノイル-N-メチルグルカミド、n-デシルβ-D-グルコピラノシド、n-デシルβ-D-マルトピラノシド、n-ドデシルβ-D-グルコピラノシド、n-ドデシルβ-D-マルトシド、ヘプタノイル-N-メチルグルカミド、n-ヘプチル-β-D-グルコピラノシド、n-ヘプチルβ-D-チオグルコシド、n-ヘキシルβ-D-グルコピラノシド、ノナノイル-N-メチルグルカミド、n-ノニルβ-D-グルコピラノシド、オクタノイル-N-メチルグルカミド、n-オクチル-β-D-グルコピラノシド、オクチルβ-D-チオグルコピラノシド、リゾチーム、Plasdone S630のような、ビニルピロリドンおよび酢酸ビニルのランダム共重合体、PEG-誘導体化リン脂質、PEG-誘導体化コレステロール、PEG誘導体化コレステロール誘導体、PEG-誘導体化ビタミンA、PEG-誘導体化ビタミンE体等が含まれる。
【0065】
他の有用な表面安定化剤には、ラウリル硫酸ナトリウム、ジオクチルスルホコハク酸ナトリウム、またはそれらの組み合わせが含まれる。
【0066】
有用なカチオン性表面安定化剤には、高分子、生体高分子、多糖、セルロース誘導体、アルギン酸塩、リン脂質、および両性イオン安定化剤のような非高分子化合物、ポリ-n-メチルピリジニウム、塩化アントリウル(anthryul)ピリジミウム、カチオン性リン脂質、キトサン、ポリリシン、ポリビニルイミダゾール、ポリブレン、ポリメタクリル酸メチル臭化トリメチルアンモニウムブロマイド(PMMTMABr)、臭化ヘキシルデシルトリメチルアンモニウム(HDMAB)、およびポリビニルピロリドン-2-ジメチルアミノエチルメタクリル酸ジメチルスルフェートが含まれるが、これらに限定されない。
【0067】
他の有用なカチオン性安定化剤には、カチオン性脂質、スルホニウム、ホスホニウムおよび第4アンモニウム化合物、たとえば、塩化ステアリルトリメチルアンモニウム、臭化ベンジル-ジ(2-クロロエチル) エチルアンモニウム、塩化または臭化ヤシ油トリメチルアンモニウム、塩化または臭化ヤシ油メチルジヒドロキシエチルアンモニウム、塩化デシルトリエチルアンモニウム、塩化または臭化デシルジメチルヒドロキシエチルアンモニウム、塩化または臭化C12-15ジメチルヒドロキシエチルアンモニウム、塩化または臭化ヤシ油ジメチルヒドロキシエチルアンモニウム、メチルスルホン酸ミリスチルトリメチルアンモニウム、塩化または臭化ラウリルジメチルベンジルアンモニウム、塩化または臭化ラウリルジメチル(エテノキシ)4アンモニウム、塩化N-アルキル(C12-18)ジメチルベンジルアンモニウム、塩化N-アルキル(C14-18)ジメチルベンジルアンモニウム、塩化N-テトラデシリドメチルベンジルアンモニウム一水和物、塩化ジメチルジデシルアンモニウム、塩化N-アルキル(C12-14)ジメチル1-ナフチルメチルアンモニウム、ハロゲン化トリメチルアンモニウム、アルキルトリメチルアンモニウム塩およびジアルキルジメチルアンモニウム塩、塩化ラウリルトリメチルアンモニウム、エトキシ化されたアルキルアミドアルキルジアルキルアンモニウム塩および/またはエトキシ化されたトリアルキルアンモニウム塩、塩化ジアルキルベンゼンジアルキルアンモニウム、塩化N-ジデシルジメチルアンモニウム、塩化N-テトラデシルジメチルベンジルアンモニウム一水和物、塩化N-アルキル(C12-14)ジメチル1-ナフチルメチルアンモニウムおよび塩化ドデシルジメチルベンジルアンモニウム、塩化ジアルキルベンゼンアルキルアンモニウム、塩化ラウリルトリメチルアンモニウム、塩化アルキルベンジルメチルアンモニウム、臭化アルキルベンジルジメチルアンモニウム、臭化C12,C15,C17トリメチルアンモニウム、塩化ドデシルベンジルトリエチルアンモニウム、ポリ塩化ジアリルジメチルアンモニウム(DADMAC)、塩化ジメチルアンモニウム、ハロゲン化アルキルジメチルアンモニウム、塩化トリセチルメチルアンモニウム、臭化デシルトリメチルアンモニウム、臭化ドデシルトリエチルアンモニウム、臭化テトラデシルトリメチルアンモニウム、塩化メチルトリオクチルアンモニウム(ALIQUAT 336(商標))、POLYQUAT 10(商標)、臭化テトラブチルアンモニウム、臭化ベンジルトリメチルアンモニウム、コリンエステル(脂肪酸のコリンエステルのような)、塩化ベンザルコニウム、塩化ステアルアルコニウム(stearalkonium)化合物(塩化ステアリルトリモニウムおよび塩化ジステアリルジモニウムのような)、臭化または塩化セチルピリジニウム、4級化されたポリオキシエチルアルキルアミンのハロゲン化物塩、MIRAPOL(商標)およびALKAQUAT(商標)(Alkaril Chemical Company)、アルキルピリジニウム塩;アミン、たとえば、アルキルアミン、ジアルキルアミン、アルカノールアミン、ポリエチレンポリアミン、N,N-ジアルキルアミノアルキルアクリレート、およびビニルピリジン;アミン塩、たとえば、酢酸ラウリルアミン、酢酸ステアリルアミン、アルキルピリジニウム塩、およびアルキルイミダゾリウム塩;およびアミンオキシド;イミドアゾリニウム塩;プロトン化第4級アクリルアミド;メチル化第4級ポリマー、たとえば、ポリ[塩化ジアリルジメチルアンモニウム]およびポリ[塩化N-メチルビニルピリジニウム];およびカチオン性グアールが含まれるが、これらに限定されない。
【0068】
上記の典型的なカチオン性表面安定化剤および他の有用なカチオン性表面安定化剤は、J. CrossおよびE. Singer, 「カチオン性界面活性剤:分析的および生物学的評価」(Cationic Surfactants: Analytical and Biological Evaluation) (Marcel Dekker, 1994);P.およびD.Rubingh編、「カチオン性界面活性剤:物理化学」(Cationic Surfactants: Physical Chemistry) (Marcel Dekker, 1991);およびJ. Richmond,「カチオン性界面活性剤:有機化学」(Cationic Surfactants: Organic Chemistry) (Marcel Dekker, 1990)に記載されている。
【0069】
特に好ましい非高分子の主要な安定化剤は、塩化ベンザルコニウム、カルボニウム化合物、ホスホニウム化合物、オキソニウム化合物、ハロニウム化合物、カチオン性有機金属化合物、第4級リン化合物、ピリジニウム化合物、アニリニウム化合物、アンモニウム化合物、ヒドロキシアンモニウム化合物、第1級アンモニウム化合物、第2級アンモニウム化合物、第3級アンモニウム化合物、および一般式NR1R2R3R4(+)の第4級アンモニウム化合物のような、すべての非高分子化合物である。一般式NR1R2R3R4(+)の化合物に関して、
(i) R1-R4のいずれもCH3ではない;
(ii) R1-R4のうち1つがCH3である;
(iii) R1-R4のうち3つがCH3である;
(iv) R1-R4のすべてがCH3である;
(v) R1-R4のうち2つがCH3であり、R1-R4のうち1つがC6H5CH2であり、R1-R4のうち1つが7炭素原子以下のアルキル鎖である;
(vi) R1-R4のうち2つがCH3であり、R1-R4のうち1つがC6H5CH2であり、R1-R4のうち1つが19炭素原子以上のアルキル鎖である;
(vii) R1-R4のうち2つがCH3であり、R1-R4のうち1つがC6H5(CH2)n基であり、ここでn>1である;
(viii) R1-R4のうち2つがCH3であり、R1-R4のうち1つがC6H5CH2であり、R1-R4のうち1つが少なくとも1つのヘテロ原子からなる;
(ix) R1-R4のうち2つがCH3であり、R1-R4のうち1つがC6H5CH2であり、R1-R4のうち1つが少なくとも1つのハロゲンからなる;
(x) R1-R4のうち2つがCH3であり、R1-R4のうち1つがC6H5CH2であり、R1-R4のうち1つが少なくとも1つの環式フラグメントからなる;
(xi) R1-R4のうち2つがCH3であり、R1-R4のうち1つがフェニル環である;または
(xii) R1-R4のうち2つがCH3であり、R1-R4のうち2つが純粋な脂肪族フラグメントである。
【0070】
このような化合物には、塩化ベヘンアルコニウム、塩化ベンゼトニウム、塩化セチルピリジニウム、塩化ベヘントリモニウム、塩化ラウルアルコニウム(lauralkonium)、塩化セトアルコニウム(cetalkonium)、臭化セトリモニウム、塩化セトリモニウム、フッ化水素酸セチルアミン、塩化クロルアリルメテナミン(Quaternium-15)、塩化ジステアリルジモニウム(Quaternium-5)、塩化ドデシルジメチルエチルベンジルアンモニウム(Quaternium-14)、Quaternium-22、Quaternium-26、Quaternium-18、ヘクトライト(hectorite)、塩化ジメチルアミノエチル塩酸塩、システイン塩酸塩、ジエタノールアンモニウムPOE(10)オレチルエーテルホスフェート、ジエタノールアンモニウムPOE(3)オレチルエーテルホスフェート、獣脂アルコニウムクロライド、ジメチルジオクタデシルアンモニウムベントナイト、塩化ステアルアルコニウム、臭化ドミフェン、安息香酸デナトニウム、塩化ミリストアルコニウム(myristalkonium)、塩化ラウルトリモニウム、二塩酸エチレンジアミン、塩酸グアニジン、ピリドキシンHCl、塩酸イオフェタミン(iofetamine)、塩酸メグルミン、塩化メチルベンゼトニウム、臭化ミルトリモニウム(myrtrimonium)、塩化オレイルトリモニウム、ポリクオーテルニウム-1(polyquaternium-1)、塩酸プロカイン、ココベタイン、ステアルアルコニウムベントナイト、ステアルアルコニウムヘクトナイト、二フッ化水素酸ステアリルトリヒドロキシエチルプロピレンジアミン、塩化獣脂トリモニウム、および臭化ヘキサデシルトリメチルアンモニウムが含まれるが、これらに限定されない。
【0071】
これらの表面安定化剤のほとんどは公知の薬品添加物であり、米国薬学会(American Pharmaceutical Association)および英国薬学会(Pharmaceutical Society of Great Britain)が共同で出版した、「医薬品添加物ハンドブック」(the Handbook of Pharmaceutical Excipients) (The Pharmaceutical Press, 2000)に詳細に記載されている。この文献を参照により本明細書に組み入れる。表面安定化剤は、販売されているか、当業者に公知の技術により製造可能である。
【0072】
5. 粒径
製剤のIR特性は、約1000nm未満、約900nm未満、約800nm未満、約700nm未満、約600nm未満、約500nm未満、約400nm未満、約300nm未満、約250nm未満、約200nm未満、約150nm未満、約100nm未満、または約50nm未満の有効平均粒径を有する、少なくとも1つのナノ微粒子活性物質を利用することにより得られる。
【0073】
製剤のCR特性は、約1ミクロンより大きく、且つ約100ミクロンより小さい、約90ミクロンより小さい、約80ミクロンより小さい、約70ミクロンより小さい、約60ミクロンより小さい、約50ミクロンより小さい、約40ミクロンより小さい、約30ミクロンより小さい、約20ミクロンより小さい、約10ミクロンより小さい、約9ミクロンより小さい、約8ミクロンより小さい、約7ミクロンより小さい、約6ミクロンより小さい、約5ミクロンより小さい、約4ミクロンより小さい、約3ミクロンより小さい、または約2ミクロンより小さい、有効平均粒径を有する少なくとも1つのミクロ微粒子活性物質を利用することにより得られる。
【0074】
組成物は、ナノ微粒子活性物質粒子の複数の集団からなっていてもよく、ここで、それぞれの粒子の集団は、正確な放出速度と相関する限定された粒径を有する。すなわち、たとえば、第1の集団は約1ミクロン未満の有効平均粒径を有し、第2の集団は約800nm未満の有効平均粒径を有し、第3の集団は約500nm未満の有効平均粒径を有し、第4の集団は約50nm未満の有効平均粒径を有し、それぞれの集団は特定の放出速度に対応している。
【0075】
同様に、組成物はミクロ微粒子活性物質の複数の集団からなっていてもよく、ここで、それぞれの粒子の集団は、正確な放出速度と相関する限定された粒径を有する。すなわち、たとえば、第1の集団は約100ミクロン未満の有効平均粒径を有し、第2の集団は約60ミクロン未満の有効平均粒径を有し、第3の集団は約40ミクロン未満の有効平均粒径を有し、第4の集団は約20ミクロン未満の有効平均粒径を有し、それぞれの集団は特定の放出速度に対応している。
【0076】
組成物中のそれぞれの粒子の集団は、ナノ微粒子およびミクロ微粒子の両方とも、少なくとも、50%、60%、70%、80%、または90%のベースラインリゾリューション(baseline resolution)を示す。これは、不均一な集団が、2つの隣接するピークの高さと比較して50%であるような最小ベースラインリゾリューションを有する、多数の状態の粒径分布により特徴づけられることを意味する。50%ベースラインリゾリューションは、2つの隣接するピークの平均高さに対して、分布のベースラインから半分の距離であると定義される。
【0077】
従来のミクロ微粒子組成物においては粒径がランダムに分布し、2以上の粒径について50%以上のベースラインリゾリューションを有さないので、本発明は少なくとも50%のベースラインリゾリューションにより、異なる粒径の混合物を有する従来のミクロ微粒子組成物と区別される。
【0078】
本明細書において、粒径は、当業者に公知の従来からの粒径測定技術により測定された重量平均粒径を基礎として決定される。このような技術には、たとえば、沈降場流動分画、光子相関分光分析、光散乱法、およびディスク遠心分離が含まれる。
【0079】
「約1000nm未満の有効平均粒径」という用語は、上記の技術により測定した場合に、活性物質粒子の少なくとも50%が約1000nm未満の平均粒径を有することを意味する。同様に、「約100ミクロン未満の有効平均粒径」という用語は、上記の技術により測定した場合に、活性物質粒子の少なくとも50%が約100ミクロン未満の平均粒径を有することを意味する。好ましくは、粒子の70%以上が有効平均よりも小さい平均粒径を有し、より好ましくは、粒子の約90%以上が有効平均よりも小さい平均粒径を有する。
【0080】
6. 他の医薬品添加物
本発明の医薬組成物は、さらに1つ以上の結合剤、賦形剤、滑沢剤、懸濁剤、甘味料、着香剤、保存料、緩衝剤、湿潤剤、崩壊剤、発泡剤、および他の添加剤からなってもよい。このような添加剤は当業者に公知である。
【0081】
賦形剤の例としては、ラクトース一水和物、ラクトース無水物、およびさまざまなデンプンが挙げられ、結合剤の例としては、さまざまなセルロースおよび架橋ポリビニルピロリドン、Avicel(商標) PH101およびAvicel(商標) PH102のような微結晶セルロース、およびケイ化された微結晶セルロース(SMCC)が挙げられる。
【0082】
好ましい滑沢剤は、圧縮される粉末の流動性に作用するものも含むが、Aerosil(商標) 200のようなコロイド二酸化ケイ素、タルク、ステアリン酸、ステアリン酸マグネシウム、ステアリン酸カルシウム、およびシリカゲルである。
【0083】
甘味料の例としては、スクロース、キシリトール、サッカリンナトリウム、シクラミン酸塩、アスパルテーム、およびアクスルフェーム(acsulfame)のようなすべての天然および人工甘味料が挙げられる。着香剤の例としては、Magnasweet(商標) (MAFCOの商標)、バブルガム着香料、フルーツ着香料等が挙げられる。
【0084】
保存料の例としては、ソルビン酸カリウム、メチルパラベン、プロピルパラベン、安息香酸およびその塩、ブチルパラベンのような他のパラヒドロキシ安息香酸のエステル、エチルまたはベンジルアルコールのようなアルコール、フェノールのようなフェノール系化合物、または塩化ベンザルコニウムのような第4級化合物が挙げられる。
【0085】
好ましい希釈剤には、微結晶セルロース、ラクトース、二塩基性リン酸カルシウム、サッカライド、および/または上記のいずれかの混合物のような、製薬上許容される不活性な賦形剤が含まれる。希釈剤の例には、Avicel(商標) PH101およびAvicel(商標) PH102のような微結晶セルロース;ラクトース一水和物、ラクトース無水物、およびPharmatose(商標) DCL21のようなラクトース;Emcompress(商標)のような二塩基性リン酸カルシウム;マンニトール;デンプン;ソルビトール;スクロース;およびグルコースが含まれる。好ましい崩壊剤には、軽度に架橋したポリビニルピロリドン、コーンスターチ、馬鈴薯デンプン、トウモロコシデンプン、および修飾されたデンプン、クロスカルメロースナトリウム、クロスポビドン、デンプングリコール酸ナトリウム、およびそれらの混合物が含まれる。
【0086】
発泡剤の例には、有機酸および炭酸塩または炭酸水素塩のような発泡性の組合せが挙げられる。好ましい有機酸には、たとえば、クエン酸、酒石酸、リンゴ酸、フマル酸、アジピン酸、コハク酸、およびアルギニン酸およびこれらの酸の無水物および塩が含まれる。好ましい炭酸塩および炭酸水素塩には、たとえば、炭酸ナトリウム、炭酸水素ナトリウム、炭酸カリウム、炭酸水素カリウム、炭酸マグネシウム、グリシン炭酸ナトリウム、L-リシン炭酸塩、アルギニン炭酸塩が含まれる。あるいは、発泡性の組合せの酸成分のみが存在してもよい。
【0087】
7. ナノ微粒子活性物質、表面安定化剤、およびミクロ微粒子活性物質の量
少なくとも1つのナノ微粒子活性物質、1つ以上の表面安定化剤、および少なくとも1つのミクロ微粒子活性物質の相対量はさまざまであってよい。表面安定化剤の最適な量は、たとえば、選択された特定の活性物質、親水性親油性比(HLB)、融点、および表面安定化剤の水溶性、および安定化剤の水溶液の表面張力等に依存する。
【0088】
少なくとも1つのナノ微粒子活性物質の濃度は、少なくとも1つの活性物質および少なくとも1つの表面安定化剤を合わせた、他の添加物を含まない総重量に基づいて、重量で約99.5%から約0.001%まで、約95%から約0.1%まで、または約90%から約0.5%まで変化し得る。
【0089】
少なくとも1つの表面安定化剤の濃度は、少なくとも1つの活性物質および少なくとも1つの表面安定化剤を合わせた、他の添加物を含まない総乾燥重量に基づいて、重量で約0.5%から約99.999%まで、約5%から約99.9%まで、または約10%から約99.5%まで変化し得る。
【0090】
ミクロ微粒子活性物質の濃度は、ナノ微粒子活性物質、表面安定化剤、およびミクロ微粒子活性物質を合わせた、他の添加物を含まない総重量に基づいて、重量で約5%から約85%まで変化し得る。
【0091】
B. 本発明の組成物の製造方法
本発明の別の態様において、CRおよびIR特性を組み合わせて有する製剤を調製する方法が提供される。この方法は、(1) 少なくとも1つの投与されるナノ微粒子活性物質および少なくとも1つの表面安定化剤からなるナノ微粒子組成物を形成し;(2) (1)のナノ微粒子活性物質と同一のまたは異なる、少なくとも1つのミクロ微粒子活性物質を加え;(3) 組成物を投与に適した剤形に形成することからなる。投与のために組成物に製薬上許容される添加物を加えることもできる。
【0092】
1. ナノ微粒子組成物を製造する方法
機械的粉砕、沈殿、ホモジナイズ、または他の適した粒径減少工程からなるナノ微粒子組成物の製造方法は、当業者に公知であり、たとえば、‘684特許に記載されている。
【0093】
ナノ微粒子組成物の製造方法はまた、「医薬物質を粉砕する方法」に関する米国特許第5,518,187および5,862,999号、「医薬物質を粉砕する連続的な方法」に関する米国特許第5,718,388号、「ナノ微粒子医薬品と結晶成長調節剤との共微小沈殿」に関する米国特許第5,665,331号、「ナノ微粒子医薬品と結晶成長調節剤との共微小沈殿」に関する米国特許第5,662,883号、「ナノ微粒子医薬品の微少沈殿」に関する米国特許第5,560,932号、「ナノ微粒子を含むX-線造影剤組成物の調製方法」に関する米国特許第5,543,133号、「安定な薬物ナノ微粒子を調製する方法」に関する米国特許第5,534,270号、「ナノ微粒子を含む治療用組成物を調製する方法」に関する米国特許第5,510,118号、および「凝集を減少させるために荷電したリン脂質を含むナノ微粒子組成物を調製する方法」に関する米国特許第5,470,583号にも記載されている。これらの文献を参照により本明細書に組み入れる。
【0094】
a. ナノ微粒子活性物質分散物を得るための粉砕
ナノ微粒子分散物を得るための活性物質の水中分散物の粉砕は、少なくとも1つの活性物質を活性物質の溶解度が低い液体の分散媒体に分散することからなる。「溶解度の低い」という用語は、活性物質が液体の分散媒体に、約30mg/ml未満、好ましくは約10mg/ml未満、より好ましくは約1mg/ml未満の溶解度を有することを意味する。このような液体の分散媒体は、たとえば、水、塩水溶液、ベニバナ油のような油、エタノール、t-ブタノール、ヘキサン、およびグリコールのような溶媒であってよい。
【0095】
この後に、粉砕媒体の存在下で機械的手段を適用して、活性物質の粒径を所望の有効平均粒径まで減少させる。活性物質粒子は少なくとも1つの表面安定化剤の存在下で粒径を減少させることができる。あるいは、摩耗の後に活性物質粒子を1つ以上の表面安定化剤と接触させてもよい。粒径減少工程の間に、希釈剤のような他の成分を活性物質/表面安定化剤組成物に加えることができる。分散物は、連続的に、またはバッチ方式で処理することができる。得られたナノ微粒子活性物質分散物は、直接製剤に使用することもできるし、または、分散物から粉末を調製した後に剤形に製剤することもできる。
【0096】
b. ナノ微粒子活性物質組成物を得るための沈殿
望まれるナノ微粒子組成物を形成する別の方法は、微小沈殿(microprecipitation)による。これは、1つ以上の表面安定化剤および1つ以上のコロイド安定性を増大する界面活性剤の存在下で、毒性の溶媒または可溶化された重金属不純物をわずかな痕跡も含まない、溶解度の低い活性物質の安定な分散物を調製する方法である。このような方法は、たとえば、(1) 水に対する溶解度の低い活性物質を適当な溶媒に溶解し;(2) (1)の過程で得られた調製物を少なくとも1つの表面安定化剤からなる溶液に加えて溶液を形成し;(3) (2)の過程で得られた調製物を適切な非溶媒を用いて沈殿させることからなる。この方法の後、もし存在すれば形成された塩を透析またはダイアフィルトレーション(diafiltration)により除去し、通常の手段により分散物を濃縮する。得られたナノ微粒子活性物質分散物は、直接製剤に使用することもできるし、分散物から粉末を調製した後に製剤することもできる。
【0097】
c. ナノ微粒子活性物質組成物を得るためのホモジナイズ
活性物質ナノ微粒子組成物を調製するための代表的なホモジナイズ方法は、「ナノ微粒子を含む治療用組成物を調製する方法」に関する米国特許第5,510,118号に記載されている。
【0098】
上記の方法は活性物質粒子を液体の分散媒体に分散させた後、分散物をホモジナイズして活性物質粒子の粒径を所望の有効平均粒径に減少させることからなる。活性物質粒子は少なくとも1つの表面安定化剤の存在下で粒径を減少させることができる。あるいは、粒径の減少の前または後のいずれかに活性物質粒子を1つ以上の表面安定化剤と接触させてもよい。けれども、活性物質粒子の湿潤補助剤として作用する1つ以上の表面安定化剤の存在下で、活性物質粒子を液体の分散媒体に分散させるのが好ましい。希釈剤のような他の化合物を、粒径減少工程の前、間または後のいずれかに活性物質/表面安定化剤組成物に加えることができる。分散は連続的に、またはバッチ方式で処理することができる。得られたナノ微粒子活性物質分散物は、直接製剤に使用することもできるし、分散物から粉末を調製した後に製剤することもできる。
【0099】
2. 製剤
経口、注射用、経皮、エアロゾル、口腔、局所、眼内、耳内等の製剤を製造する方法は当業者に公知であり、このような方法を本発明に採用することができる。
【0100】
本発明の1つの実施形態において、粒子表面に1つ以上の表面安定化剤を吸収させたナノ微粒子活性物質粒子を乾燥粉末マトリックスに組み入れ(たとえば、噴霧乾燥、噴霧造粒、または関連する製薬上許容される乾燥工程により)、乾式混合または同様の混合工程により微細化活性物質粒子のバルクと混合する。
【0101】
本発明の第2の実施形態において、ナノ微粒子活性物質粒子を乾燥粉末マトリックスに組み入れる(たとえば、噴霧乾燥、噴霧造粒、または関連する製薬上許容される乾燥工程により)。別に、微細化活性物質粒子を同様の方法を用いて乾燥粉末マトリックスに組み入れた後、得られたマトリックスを乾式混合または同様の混合工程により混合する。
【0102】
本発明の第3の実施形態において、微細化活性物質粒子を乾式粉砕(たとえば、ジェット粉砕またはピン粉砕(pin milling))により調製する。
【0103】
本発明の第4の実施形態によれば、微細化活性物質粒子を、‘684特許に記載されたナノ微粒子活性物質粒子の調製に採用した方法と同様の湿式粉砕により調製する。
【0104】
本発明の第5の実施形態によれば、微細化活性物質粒子を、噴霧造粒、回転造粒、噴霧コーティング、または関連する製薬工程において、その上にナノ微粒子活性物質粒子を分散する、または外層を形成するように堆積させるための基体(substrate)(またはその一部)として用いることができる。この特定の方法により、生体の液体に曝された場合にマトリックスの外層からのナノ微粒子活性物質粒子の放出が促進され、その後に微細化活性物質粒子が曝され、それに続いて溶解する。
【0105】
本発明の第6の実施形態によれば、微細化活性物質粒子は、ナノ微粒子活性物質粒子が造粒液(granulating fluid)の形態で適用される高剪断造粒(high-shear granulation)または関連する製薬湿式混合工程において基体(またはその一部)として用いることができる。この特定の方法は、乾燥後にナノ微粒子活性物質粒子および微細化活性物質粒子が得られた固体のマトリックス中に均一に分散することを可能にする。
【0106】
本発明の第7の実施形態において、ナノ微粒子活性物質粒子および微細化活性物質粒子は、固形の急速崩壊型または「無水錠剤」マトリックスに組み入れるのに適した乾燥粉末または粉末混合物の形態で存在する。上記の「無水錠剤」マトリックスは、乾燥粉末または粉末混合物を錠剤圧縮機または同様の製薬上許容される圧縮機を用いて圧縮することにより得られる。
【0107】
典型的な噴霧乾燥、凍結乾燥、造粒、および打錠法を下に記載する。
【0108】
a. ナノ微粒子分散物の噴霧乾燥
粒径を小さくした後にナノ微粒子調製物を乾燥することにより、ナノ微粒子分散物の製剤を調製することができる。好ましい乾燥法は噴霧乾燥である。噴霧乾燥工程は、活性物質をナノ微粒子サイズの粒子に変えるために用いられる粒径減少工程の後に、ナノ微粒子粉末を得るために用いられる。
【0109】
典型的な噴霧乾燥工程において、ナノ微粒子活性物質懸濁液を蠕動ポンプを用いて噴霧器に送り込み、液滴の微細スプレーに霧化する。このスプレーを、乾燥チャンバー中で熱い空気と接触させて、液滴から水分を蒸発させる。得られたスプレーをサイクロンに通して、粉末を分離して収集する。ナノ微粒子分散物を添加剤を存在させてまたは存在させずに噴霧乾燥して、噴霧乾燥した中間体の粉末を与える。
【0110】
粉末は、たとえば、錠剤、坐剤、または他の固形の剤形に製剤することができる。または、粉末は、鼻内または肺投与用のエアロゾルに製剤してもよい。粉末はまた、液体に再構成して、たとえば、注射用、眼内、耳内、または経口用剤形に用いることができる。
【0111】
b. 凍結乾燥
粒径の減少の後にナノ微粒子調製物を凍結乾燥することによっても、ナノ微粒子分散物の固形の製剤を調製することができる。適当な凍結乾燥条件には、たとえば、欧州特許第0,363,365号(McNeil-PPC Inc.)、米国特許第4,178,695号(A. Erbeia)、および米国特許第5,384,,124号(Farmalyoc)に記載されるものが含まれる。これらのすべての文献を参照により本明細書に組み入れる。典型的には、ナノ微粒子分散物を適当な容器に入れて、約−5℃と約−100℃の間の温度で凍結する。次に、凍結した分散物を約48時間以下の時間にわたって減圧にする。温度、圧力、分散媒体、およびバッチサイズのようなパラメーターの組み合わせが、凍結乾燥工程に必要な時間に影響を与える。低い温度および圧力下で、凍結した溶媒が昇華により除去され、全体的に分布する活性成分を有する固体の、多孔性の、固形のIR剤形が得られる。
【0112】
粉末は、たとえば、錠剤、坐剤、または他の固形の剤形に製剤することができる。または、粉末は、鼻内または肺投与用のエアロゾルに製剤してもよい。粉末はまた、液体に再構成して、たとえば、注射用、眼内、耳内、または経口用の剤形に用いることができる。
【0113】
c. 造粒
あるいは、本発明の固形の経口用剤形は、活性物質のナノ微粒子分散物および少なくとも1つの表面安定化剤、および顆粒を形成するための少なくとも1つの製薬上許容される水溶性または水分散性の添加物の溶液からなる混合物を流動床中で造粒することにより調製することができる。この後に、顆粒を錠剤として固形の剤形を形成する。
【0114】
d. 打錠
本発明の製剤は錠剤の形態であってよい。このような錠剤の調製は当業者に公知の医薬品圧縮または成形技術による。本発明の錠剤は、円板状、円型、楕円形、長方形、円柱状、三角柱、六方晶形等のような、いかなる適当な形であってもよい。
【0115】
打錠用の粉末は、当業者に公知のいかなる方法により錠剤に製剤してもよい。適当な方法には、粉砕、流動床造粒、乾式造粒、直接圧縮、球状化、噴霧凝結、およびスプレーダイス(spray-dying)が含まれるが、これらに限定されない。打錠法に関する詳細な説明は、Remington: 「調剤の科学および実践」(The Science and Practice of Pharmacy)、第19版、第11巻(1995)(Mack Publishing Co., Pennsylvania);および「Remingtonの薬学」(Remington’s Pharmaceutical Sciences)、第89章、pp.1633-1658(Mach Publishing Company, 1990)に記載されており、これらの文献を特に参照により本明細書に組み入れる。
【0116】
錠剤はコーティングしてもしなくてもよい。コーティングする場合には、糖衣(不快な味またはにおいを覆うためおよび酸化から保護するため)またはフィルムコーティング(同様の目的のための水溶性物質の薄いフィルム)であってよい。
【0117】
C. 本発明の組成物の投与
本発明は、少なくとも1つの溶解度の低い活性成分の迅速なアベイラビリティー、およびこれと同一のまたは異なる溶解度の低い活性成分の徐放を組み合わせて必要とする、ヒトを含む哺乳類を治療する方法を提供する。投与された本発明の組成物は、組み込まれた活性物質を急速に放出して活性の速い開始をもたらし、同時に、同一のまたは異なる活性物質をゆっくりと放出して長時間の薬理効果を与える。
【0118】
一般的に、本発明の組成物は、これを必要とする哺乳類被験体に、望まれる生理的効果を与えるのに十分な医薬または活性物質のレベルを用いて投与される。哺乳類被験体は、家畜またはペットであってもよいが、好ましくはヒト被験体である。望まれる生理的結果を与えるのに必要な医薬または活性物質のレベルは、GoodnanおよびGillman、および「医師用添付文書集」(Physician’s Desk Reference)のような標準的な文献を参照して当業者が容易に決定することができる。
【図面の簡単な説明】
【0119】
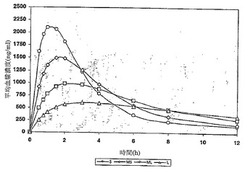
【図1】単一の規定された粒径を有する活性物質を含む製剤の1回の経口投与後の薬物動態学的プロファイルの、数学的モデルを用いたシミュレーションを示す図である。
【図2】異なる粒径の粒子の混合物を含む製剤の1回の経口投与後の薬物動態学的プロファイルの、数学的モデルを用いたシミュレーションを示す図である。
【図3】異なる粒径の粒子の混合物を含む製剤の1回の経口投与後の薬物動態学的プロファイルの、数学的モデルを用いたシミュレーションを示す図である。
【実施例】
【0120】
以下の実施例は本発明を説明するために記載するものである。したがって、本発明はこれらの実施例に記載される特定の条件または細部に限定されないものと理解されるべきである。明細書を通して、出版された文献に関するすべての引用を、特に参照により本特許出願に組み入れる。
【0121】
(実施例1)
この実施例の目的は、1つの限定された粒径を有する活性物質を含む製剤の1回の経口投与後の薬物動態学的プロファイルを、数学的モデルを用いてシミュレートすることであった。
【0122】
このシミュレーションに用いたソフトウェアは、Windows用MicroMath PKAnalyst version 1.1, MicroMath, Inc.である。以下の仮定をおこなった:活性物質は、中枢コンパートメントからの1次吸収および1次排泄を有する2つのコンパートメント(中枢および末梢コンパートメント)の薬物動態モデルに従う。
【0123】
D/V(用量/体積)= 5000;
Ka > 1.000 h-1 (溶解速度に相当する速度定数);
Ke = 0.50 h-1 (排泄速度定数);
K12 = 0.25 h-1 (中枢コンパートメントから末梢コンパートメントへの分散速度を表す定数);および
K21 = 0.125 h-1 (末梢コンパートメントから中枢コンパートメントへの分散速度を表す定数)。
【0124】
下記の溶解速度定数を有する、(S)小さい粒子、(MS)適度に小さい粒子、(ML)適度に大きい粒子、および(L)粒子の4つのサンプルを設計した。
【0125】
小さい(S)粒子の溶解速度定数 = 1.000h-1
適度に小さい(MS)粒子の溶解速度定数 = 0.500h-1
適度に大きい(ML)粒子の溶解速度定数 = 0.250h-1
大きい(L)粒子の溶解速度定数 = 0.125h-1
シミュレーションの結果を図1に示す。
【0126】
小さい粒子の集団(S)は、迅速な活性の開始を示し、投与後数分で250mg/ml以上の血漿レベルになり、投与後1時間と少しで約2100mg/mlの血漿濃度レベルのピークに達した。けれども、このサンプルはまた、投与後12時間では最も低い血漿レベルを示した。
【0127】
これに対して、大きい粒子の集団(L)は、活性の開始が遅く、投与後約2時間で500mg/mlを少し上回る血漿濃度レベルのピークに達した。けれども、このサンプルは投与後12時間では最も高い血漿レベルを示した。
【0128】
シミュレーションの結果は、小さい粒子はより大きい粒子よりも速く溶解するが、これらはまたより速く低下することを示している。その結果、より大きい薬物粒子は最も長く続く血漿レベルを提供するが、これらの同じ粒子は遅い溶解を示す。
【0129】
(実施例2)
この実施例の目的は、異なる粒径の粒子の混合物を含む製剤の1回の経口投与後の薬物動態学的プロファイルを、数学的モデルを用いてシミュレートすることであった。
【0130】
実施例1に記載された仮定を実施例2にも適用する。
【0131】
活性医薬成分の小さい(S)粒子と、適度に小さい(MS)、適度に大きい(ML)、または大きい(L)粒子の50:50混合物を含む製剤の1回の経口投与後のシミュレートされた薬物動態プロファイルを図2に示す。
【0132】
結果は、特に、(S)小さい粒子および(L)大きい粒子の混合物が、実施例1において投与された(L)大きい粒子と比較して、顕著に大きい最大平均血漿濃度(1000mg/ml近く)を示し、また、この製剤は、実施例1において投与された(S)小さい粒子と比較して、より長時間にわたる血漿レベルを示した。
【0133】
(実施例3)
この実施例の目的は、異なる粒径の粒子の混合物を含む製剤の1回の経口投与後の薬物動態学的プロファイルを、数学的モデルを用いてシミュレートすることであった。
【0134】
実施例1に記載された仮定を実施例3にも適用する。
【0135】
活性医薬成分の小さい(S)粒子と、適度に小さい(MS)、適度に大きい(ML)、または大きい(L)粒子の25:75混合物を含む製剤の1回の経口投与後のシミュレートされた薬物動態プロファイルを図3に示す。
【0136】
結果は、特に、(S)小さい粒子および(L)大きい粒子の混合物が、実施例1において投与された(L)大きい粒子と比較して、顕著に大きい最大平均血漿濃度(900mg/ml近く)を示し、また、この製剤は、実施例1において投与された(S)小さい粒子と比較して、より長時間にわたる血漿レベルを示した。
【0137】
本発明の趣旨または範囲から逸脱することなく、本発明の方法および組成物にさまざまな修正および変更を行うことができることは当業者には明白であろう。したがって、本発明は、添付した請求の範囲およびその同等物により提供される発明の修正および変更をも含むものと意図される。
【技術分野】
【0001】
本発明は、即時放出(immediate release)および徐放(controlled release)特性を組み合わせて示す組成物に関する。この組成物は少なくとも1つのナノ微粒子の粒径を有する溶解度の低い活性成分、上記のナノ微粒子の活性物質粒子の表面に吸着した少なくとも1つの表面安定化剤、および少なくとも1つのミクロ微粒子の粒径を有する溶解度の低い活性成分からなる。
【背景技術】
【0002】
A. ナノ微粒子組成物に関する背景技術
ナノ微粒子組成物は、米国特許第5,145,684号(「‘684特許」)に最初に記載されたもので、その表面に非架橋表面安定化剤を吸収させた溶解度の低い活性物質からなる粒子である。‘684特許にはこのようなナノ微粒子組成物を製造する方法も記載されている。ナノ微粒子組成物は、粒径が減少し、その結果表面積が増加することにより、組成物が投与後に急速に溶解し、吸収されるので望ましい。このような組成物の製造方法は、「医薬物質を粉砕する方法」に関する米国特許第5,518,187および5,862,999号、「医薬物質を粉砕する連続的な方法」に関する米国特許第5,718,388号、および「ナノ微粒子を含む治療用組成物を調製する方法」に関する米国特許第5,510,118号に記載されている。
【0003】
また、ナノ微粒子組成物は、たとえば、「滅菌中の粒子の凝集を防止するためのイオン曇り点調節剤の使用」に関する米国特許第5,298,262号、「凍結乾燥中の粒径の増大を減少させる方法」に関する米国特許第5,302,401号、「医療用画像に有用なX-線造影組成物」に関する米国特許第5,318,767号、「高分子量非イオン性界面活性剤を用いるナノ微粒子X-線血液プール造影剤の新規の製剤」に関する米国特許第5,326,552号、「ヨウ素化芳香族プロパンジオエートを用いるX-線画像法」に関する米国特許第5,328,404号、「ナノ微粒子の凝集を減少させるための荷電リン脂質の使用」に関する米国特許第5,336,507号、「粒子の凝集を防止し、安定性を増大するためのOlin 10-Gからなる製剤」に関する米国特許第5,340,564号、「滅菌中のナノ微粒子の凝集を最小化するための非イオン性曇り点調節剤の使用」に関する米国特許第5,346,702号、「非常に小さい磁性デキストラン粒子の調製および磁気特性」に関する米国特許第5,349,957号、「滅菌中の粒子の凝集を防止するための精製された表面修飾剤の使用」に関する米国特許第5,352,459号、「表面を修飾した抗癌ナノ微粒子」に関する米国特許第5,399,363および5,494,683号、「磁気共鳴増強剤としての水不溶性非磁性マンガン粒子」に関する米国特許第5,401,492号、「ナノ微粒子安定化剤としてのチロキサポールの使用」に関する米国特許第5,429,824号、「高分子量非イオン性界面活性剤を用いるナノ微粒子X-線血液プール造影剤の製造方法」に関する米国特許第5,447,710号、「医療用画像に有用なX-線造影組成物」に関する米国特許第5,451,393号、「製薬上許容されるクレーと組み合わせた経口胃腸診断用X-線造影剤の製剤」に関する米国特許第5,466,440号、「凝集を減少させるために荷電リン脂質を含むナノ微粒子組成物を調製する方法」に関する米国特許第5,470,583号、「血液プールおよびリンパ系画像用のX-線造影剤としてのナノ微粒子診断用カルバミン酸無水物混合物」に関する米国特許第5,472,683号、「血液プールおよびリンパ系画像用のX-線造影剤としてのナノ微粒子診断用二量体」に関する米国特許第5,500,204
号、「医薬物質を粉砕する方法」に関する米国特許第5,518,187号、「ナノ微粒子NSAID製剤」に関する米国特許第5,518,738号、「X-線造影剤として使用するためのナノ微粒子ヨードジパミド誘導体」に関する米国特許第5,521,218号、「血液プールおよびリンパ系画像用ナノ微粒子診断用ジアトリゾキシエステルX-線造影剤」に関する米国特許第5,525,328号、「ナノ微粒子を含むX-線造影剤組成物を調製する方法」に関する米国特許第5,543,133号、「表面を修飾されたNSAIDナノ微粒子」に関する米国特許第5,552,160号、「消化可能な油または脂肪酸中へのナノ微粒子分散物としての化合物の製剤」に関する米国特許第5,560,931号、「ナノ微粒子の表面修飾剤としてのポリアルキレンブロック共重合体」に関する米国特許第5,565,188号、「ナノ微粒子組成物の安定化剤コーティングとしての硫酸エステル化された非イオン性ブロック共重合体界面活性剤」に関する米国特許第5,569,448号、「消化可能な油または脂肪酸中へのナノ微粒子分散物としての化合物の製剤」に関する米国特許第5,571,536号、「血液プールおよびリンパ系画像用X-線造影剤としてのナノ微粒子診断用カルボン酸無水物混合物」に関する米国特許第5,573,749号、「診断用画像X-線造影剤」に関する米国特許第5,573,750号、「保護用オーバーコートを有する再分散可能なナノ微粒子フィルムマトリックス」に関する米国特許第5,573,783号、「高分子量直鎖ポリ(エチレンオキシド)ポリマーにより安定化されたナノ微粒子を用いるGI管内の部位特異的付着」に関する米国特許第5,580,579号、「製薬上許容されるクレーと組み合わせた経口胃腸治療薬の製剤」に関する米国特許第5,585,108号、「ナノ微粒子組成物の安定化剤コーティングとしてのブチレンオキシド-エチレンオキシドブロック共重合体界面活性剤」に関する米国特許第5,587,143号、「分散安定化剤としてヒドロプロピルセルロースを含む粉砕されたナプロキセン」に関する米国特許第5,591,456号、「非イオン性およびアニオン性安定化剤により安定化された新規のバリウム塩製剤」に関する米国特許第5,593,657号、「ナノ結晶用の糖を基本とする界面活性剤」に関する米
国特許第5,622,938号、「経口胃腸診断用X-線造影剤および経口胃腸治療薬の改良された製剤」に関する米国特許第5,628,981号、「血液プールおよびリンパ系画像用のX-線造影剤としてのナノ微粒子診断用カルボン酸無水物混合物」に関する米国特許第5,643,552号、「医薬物質を粉砕する連続的方法」に関する米国特許第5,718,388号、「イブプロフェンのR(-)エナンチオマーを含むナノ微粒子」に関する米国特許第5,718,919号、「ベクロメタゾンナノ微粒子分散物を含むエアロゾル」に関する米国特許第5,747,001号、「静脈内投与されたナノ微粒子製剤に誘導される有害な生理反応の減少」に関する米国特許第5,834,025号、「セルロース誘導体表面安定化剤を用いるヒト免疫不全ウイルス(HIV)プロテアーゼ阻害剤のナノ結晶製剤」に関する米国特許第6,045,829号、「セルロース誘導体表面安定化剤を用いるヒト免疫不全ウイルス(HIV)プロテアーゼ阻害剤のナノ結晶製剤の製造方法」に関する米国特許第6,068,858号、「ナノ微粒子ナプロキセンの注射用製剤」に関する米国特許第6,153,225号、「ナノ微粒子ナプロキセンの新規の固形の剤形」に関する米国特許第6,165,506号、「ヒト免疫不全ウイルス(HIV)プロテアーゼ阻害剤のナノ結晶製剤を用いる哺乳類を治療する方法」に関する米国特許第6,221,400号、「ナノ微粒子分散物を含む噴霧されたエアロゾル」に関する米国特許第6,264,922号、「ナノ微粒子組成物において結晶の成長および粒子の凝集を防止する方法」に関する米国特許第6,267,989号、「ナノ微粒子組成物の表面安定化剤としてのPEG-誘導体化脂質の使用」に関する米国特許第6,270,806号、「固形の急速崩壊型経口用剤形」に関する米国特許第6,316,029号、「高分子の表面安定化剤およびジオクチルスルホコハク酸ナトリウムの相乗的組み合わせからなる固体の剤形のナノ微粒子組成物」に関する米国特許第6,375,986号、「カチオン性表面安定化剤を有する生体付着性ナノ微粒子組成物」に関する米国特許第6,428,814号、および、「上部および/または下部胃腸管への標的薬物送達の方法」に関する米国特許第6,432,381号にも記載されている。これらのすべての文献を特
に参照により本明細書に組み入れる。さらに、2002年1月31日に公開された、「徐放性ナノ微粒子組成物」に関する米国特許出願第20020012675 A1には、ナノ微粒子組成物について記載されており、これを特に参照により本明細書に組み入れる。
【0004】
アモルファスの微小粒子組成物については、たとえば、「粒子組成物およびその抗微生物剤としての使用」に関する米国特許第4,783,484号、「水不溶性有機化合物からの均一な粒径の粒子の製造方法」に関する米国特許第4,826,689号、「不溶性化合物からの均一な粒径の粒子の製造方法」に関する米国特許第4,997,454号、「内部の気泡をトラップするための均一な粒径の超微小、非凝集多孔性粒子および方法」に関する米国特許第5,741,522号、および、「超音波の後方散乱を増強するための超微小多孔性粒子」に関する米国特許第5,776,496号に記載されている。
【0005】
これらの参照文献、または他のナノ微粒子組成物について記載した参照文献のいずれにも、即時放出および徐放特性を組み合わせて有するナノ微粒子組成物については記載されていない。
【0006】
B. 即時放出型組成物に関する背景技術
「速溶(fast melt)」または「急速崩壊型(rapidly disintegrating)」製剤とも呼ばれる従来の即時放出型製剤は、活性物質粒子成分の粒径よりも、活性物質粒子成分の迅速な放出を達成する薬物マトリックスの組成によるものである。
【0007】
最近の急速崩壊型または急速溶解型の固形の経口製剤の製造元には、Cima Labs、Fuisz Technologies Ltd.、Prographarm, R.P.Scherer、およびYamanouchi-Shakleeが含まれる。これらのすべての製造元は、異なるタイプの急速溶解型の固形の経口製剤を市場に出している。
【0008】
Cima Labsは、5から30分の経口溶解時間を有する発泡性直接圧縮錠剤であるOraSolv(商標)、および、味覚マスクされた活性物質および15から45秒の経口溶解時間を有する直接圧縮錠剤であるDuraSolv(商標)を市場に出している。Cimaの「経口製剤用の味覚マスクミクロ微粒子」に関する米国特許第5,607,697号には、口腔中で崩壊するコーティングされたミクロ微粒子からなる固形の製剤が記載されている。ミクロ微粒子のコアは、薬剤および、マンニトール、ソルビトール、人工甘味料とメントールの混合物、砂糖とメントールの混合物、およびサリチル酸メチルから選択される負の溶解熱を有する1つ以上の甘味化合物を有する。ミクロ微粒子のコアは口腔内での溶解を遅らせ、薬剤の味をマスクする材料により少なくとも部分的にコーティングされる。次いでミクロ微粒子を錠剤に圧縮成形する。他の添加剤も錠剤の製剤に加えることができる。
【0009】
Cima Labsに帰属する「急速溶解型ローバスト製剤」に関するWO98/46215は、活性成分および少なくとも非直接圧縮賦形剤および滑沢剤からなるマトリックスを有する硬い、圧縮された速溶性製剤に関する。非直接圧縮賦形剤は、直接圧縮(DC等級)賦形剤とは異なり、典型的には自由に流れず、通常は自由に流れる顆粒を形成する付加的な工程を必要とする。
【0010】
Cimaはまた、発泡性の製剤(米国特許第5,503,846、5,223,246、および5,178,878号)および急速溶解型製剤のための錠剤補助剤(米国特許第5,401,513および5,219,574号)、および水溶性薬物のための急速溶解型製剤(「味覚マスクされたミクロカプセル組成物および製造方法」に関するWO98/14179)に関する米国特許および国際特許出願を有する。
【0011】
Fuisz Technologiesは、現在Bio Vailの一部であるが、Shearform(商標)と呼ばれる加工された添加剤を含む直接圧縮錠剤であるFlash Dose(商標)を市場に出している。Shearform(商標)は、アモルファス繊維に変換した多糖混合物の綿菓子様の物質である。この技術について記載した米国特許には、「急速溶解型製剤を製造するための装置」に関する米国特許第5,871,781号、「高速/高圧の条件下で形成された速く溶解する可食製剤」に関する米国特許第5,869,098号、「急速溶解型製剤を製造する方法および装置ならびにそれによる製品」に関する米国特許第5,866,163、5,851,553、および5,622,719号、「徐放系の送達」に関する米国特許第5,567,439号、および「瞬時に分散する可食製剤を形成する方法およびそれによる製品」に関する米国特許第5,587,172号が含まれる。
【0012】
Prographarmは、カルボキシメチルセルロースのような崩壊剤、修飾されたデンプンのような膨潤剤、および味覚マスクされた活性物質を有する速溶性錠剤であるFlashtab(商標)を市場に出している。この錠剤は1分未満の経口崩壊時間を有する(米国特許第5,464,632号)。
【0013】
R. P. Schererは、2から5秒の経口崩壊時間を有する凍結乾燥された錠剤であるZydis(商標)を市場に出している。凍結乾燥された錠剤は製造コストが高く、錠剤の湿度および温度に対する感受性のために包装が難しい。米国特許第4,642,903号(R. P. Scherer Corp.)には、凍結乾燥される溶液または懸濁液全体に気体を分散させることにより調製される速溶性製剤について記載されている。米国特許第5,188,825号(R. P. Scherer Corp.)には、水溶性の活性物質をイオン交換樹脂に結合または複合体化して実質的に水不溶性の複合体を形成した後、適当な担体と混合して凍結乾燥することにより調製される製剤について記載されている。米国特許第5,631,023号(R.P.Scherer Corp.)には、ゼラチンおよび活性物質の懸濁液にキサンタンガムを加えることにより作られる凍結乾燥された薬物の製剤について記載されている。米国特許第5,827,541号(R.P.Scherer Corp.)には、疎水性物質の固形の医薬品製剤を調製する方法が開示されている。この方法は、疎水性の活性成分および界面活性剤を非水相に、担体物質を水相に含む分散物を凍結乾燥することを含む。
【0014】
Yamanouchi-Shakleeは、成形性の低いサッカライドと高いサッカライドとの組み合わせを有する錠剤であるWowtab(商標)を市場に出している。この技術を記載する米国特許には、「口腔内で溶解する圧縮成型物およびその製造工程」に関する米国特許第5,576,014号、および「口腔内で崩壊する調製物およびその製造」に関する米国特許第5,446,464号が含まれる。
【0015】
急速溶解型の技術を有する他の会社にはJanssen Pharmaceuticaが含まれる。Janssenに帰属する米国特許には、2つのポリペプチド(またはゼラチン)成分および充填剤を有する急速溶解型錠剤で、2つの成分が同じ記号の実効電荷を有し、第1の成分が第2の成分よりも水溶液に対する溶解度が高いものが記載されている。「急速溶解型錠剤」に関する米国特許第5,807,576号、「急速溶解型錠剤を製造する方法」に関する米国特許第5,635,210号、「急速溶解型錠剤を製造するための粒子の支持マトリックス」に関する米国特許第5,595,761号、「急速溶解型錠剤を製造するための粒子の支持マトリックスを製造する工程」に関する米国特許第5,587,180号、および「急速溶解型製剤」に関する米国特許第5,776,491号を参照されたい。
【0016】
Eurand America, Inc.は、炭酸水素ナトリウム、クエン酸、およびエチルセルロースの混合物を有する急速溶解型発泡性組成物に関する米国特許を有する(米国特許第5,639,475および5,709,886号)。
【0017】
L.A.B. Pharmaceutical Researchは、発泡性の酸および発泡性の塩基の発泡性の組み合わせを有する発泡に基づく急速溶解型製剤に関する米国特許を有する(米国特許第5,807,578および5,807,577号)。
【0018】
Schering Corporationは、活性物質、添加剤(界面活性剤であってよい)またはスクロース、ラクトース、またはソルビトールのうちの少なくとも1つ、およびステアリン酸マグネシウムまたはドデシル硫酸ナトリウムのいずれか一方を有する口腔錠に関する技術を有する(米国特許第5,112,616および5,073,374号)。
【0019】
Laboratoire L.LaFonは、2つの相のうち少なくとも1つが界面活性剤を含むo/wエマルションの凍結乾燥により作られた従来の製剤に関する技術を有する(米国特許第4,616,047号)。このタイプの製剤を製造するためには、活性成分は凍結した懸濁液の状態で維持され、微細化または圧縮のプロセスは活性成分を損なう可能性があるのでこれらの工程なしで錠剤化される。
【0020】
Takeda Chemicals Inc., Ltd.は、活性物質および湿らせた可溶性炭水化物を錠剤に圧縮成型した後、錠剤を乾燥することからなる、急速溶解型錠剤を製造する方法に関する技術を有する。
【0021】
いずれの先行技術の文献にも、溶解度の低い活性成分がナノ微粒子の形態をとる即時放出型製剤については記載されていない。先行技術の即時放出型製剤は溶解度の低い薬物のバイオアベイラビリティーに関する問題に取り組んでいないので、これは重要である。先行技術の即時放出型製剤は薬物を迅速に出現させることができるかもしれないが、薬物の溶解度の低さおよびそれに伴う溶解速度の遅さのために、しばしば治療作用の開始までに望ましくない遅れが存在する。そのため、先行技術の即時放出型製剤が薬物担体マトリックスの急速な崩壊を示したとしても、これは製剤中に含まれる溶解度の低い薬物の急速な溶解および吸収にはつながらない。
【0022】
C. 徐放型組成物に関する背景技術
徐放とは、組成物または製剤からの薬物のような物質の放出であって、上記物質が延長された時間にわたって望まれるプロファイルに従って放出されるものを指す。徐放のプロファイルには、たとえば、徐放性、長時間(prolonged)放出、パルス(pulsatile)放出および遅延放出プロファイルが含まれる。即時放出型組成物とは異なり、徐放型組成物はあらかじめ決められたプロファイルによる、より長い時間にわたっての被験体への薬剤の送達を可能にする。このような放出速度により、より長い時間にわたって薬剤の治療上有効なレベルを提供することが可能になり、それにより従来の急速放出型剤形と比較してより長時間の薬理的または診断上の反応を提供する。このような長時間の反応は、相当する短時間作用型の、即時放出型製剤によっては達成されない多くの固有の利点を提供する。たとえば、慢性の痛みの治療において、徐放型製剤は、従来の短時間作用型製剤よりも非常に好ましいことが多い。
【0023】
徐放型医薬組成物および剤形は、薬物、医薬、活性物質、診断薬、またはヒトを含む動物に内服投与されるすべての物質のような薬剤の送達プロファイルを改良するように設計される。徐放型組成物は、典型的には、送達の速度を最適化することにより投与された物質の効果を改良するために用いられ、それにより、バイオアベイラビリティー、利便性、および患者の協力を増大し、同時に、高い初期放出速度のような不適切な即時放出速度、および望まれない場合には不均一な血液または組織レベルに伴う副作用を最小化する。
【0024】
活性化合物の徐放を提供する組成物の調製および使用に関する先行技術は、投与後の薬物の放出を延長する様々な方法を提供する。
【0025】
当業者に公知の徐放型製剤の例には、薬物の徐放が、たとえば、製剤のコーティングの選択的崩壊により、コーティングを通しての放出により、薬物の放出に影響を与える特異的なマトリックスとの混合により、またはこれらの技術の組み合わせにより達成される、特別にコーティングされたペレット、ミクロ微粒子、植込錠、錠剤、ミニタブ、およびカプセルが含まれる。いくつかの徐放型製剤は、投与後のあらかじめ決定された時間に活性化合物の一回分用量をパルス放出することができる。
【0026】
Acharyaらへの米国特許第5,110,605号には、ポリカルボフィルアルギン酸カルシウム徐放型組成物について記載されている。Krishnamurthyらへの米国特許第5,215,758号には、アルギン酸ナトリウムおよびカルシウム塩の徐放坐剤組成物について記載されている。Friendらへの米国特許第5,811,388号には、経口投与される化合物の徐放を提供するための、アルギン酸塩、水膨潤性ポリマーおよび消化可能な炭化水素誘導体を含む固形のアルギン酸を基礎とする製剤について記載されている。
【0027】
WO91/13612には、薬物がイオン交換樹脂と複合体を形成している組成物を用いる薬物の遅延放出について記載されている。この公開された特許出願に記載された特定のイオン交換樹脂は、ポリスチレンスルホン酸ナトリウム樹脂である、AMBERLITE IRP 69(商標)である。
【0028】
Woodsらへの米国特許第5,811,425号には、体組織に適合性の生物により分解されるポリマー、リポソーム、またはミクロエマルション中に薬物のミクロカプセル化したマトリックスを形成することにより作られた徐放薬物の注射用デポ製剤について記載されている。Lamらへの米国特許第5,811,422号には、ポリ乳酸、ポリグリコール酸、ポリ乳酸とポリグリコール酸のコポリマー、ポリイプシロンカプロラクトン、ポリヒドロキシ酪酸等のような生物により分解されるポリマーにある種の薬物を結合することにより得られる徐放型組成物について記載されている。
【0029】
De Freesらへの米国特許第5,811,404号には、薬物組成物の遅延放出を実現するために延長された循環半減期を有するリポソームを使用することが記載されている。
【0030】
最後に、「徐放性ナノ微粒子組成物」に関するWO 00/18374には、ナノ微粒子活性物質からなる徐放型製剤について記載されている。
【発明の概要】
【発明が解決しようとする課題】
【0031】
当技術分野において、即時放出および徐放特性を組み合わせて有する溶解度の低い薬物の組成物が必要とされている。本発明はこの必要性を満たす。
【課題を解決するための手段】
【0032】
発明の概要
本発明は、活性物質の即時放出および徐放特性の組み合わせを有する溶解度の低い活性物質の製剤の、驚くべき、予期せぬ発見に関する。本発明の製剤は、非常に小さい活性物質の粒子、すなわちナノ微粒子活性物質粒子(nanoparticulate active agent particle)と、より大きい活性物質の粒子、すなわち微細化(micronized)活性物質粒子との組み合わせからなり、活性物質成分の即時放出(IR)および徐放(CR) を同時に実現することを可能にする。
【0033】
IR成分であるナノ微粒子活性物質粒子は、その小さい粒径およびその大きな特有の表面のために、in vivoで急速に溶解する。一方、CR成分である微細化活性物質(micronized active agent)粒子は、比較的大きい粒径およびその小さい特有の表面のため、in vivoでよりゆっくりと溶解する。
【0034】
in vivoでの広い範囲の溶解速度(即ち、in vivoでの吸収のための取り込み速度)を示すIRおよびCR成分は、活性物質の粒径の正確な制御により作り出すことができる。そこで、組成物は、それぞれの粒子の集団が正確な放出速度と相関する限定された粒径を有するようなナノ微粒子活性物質粒子の混合物からなってもよく、また、組成物は、それぞれの粒子の集団が正確な放出速度と相関する限定された粒径を有するようなミクロ微粒子活性物質粒子(microparticulate active agent particle)の混合物からなってもよい。
【0035】
特に、活性物質の制御された送達は、伝統的に、単に製剤の活性物質成分の粒径によるよりも、速度制御膜、膨潤性および浸食性ポリマー、およびイオン交換樹脂を用いることにより達成されてきたので、本発明の組成物はきわめて予期されないものである。
【0036】
本発明の別の態様において、IRおよびCR特性を組み合わせて有する製剤を調製する方法が提供される。この方法は、(1) 少なくとも1つの投与されるナノ微粒子活性物質粒子およびナノ微粒子活性物質粒子の表面に吸着した少なくとも1つの表面安定化剤からなる組成物を形成し;(2) (1)の活性物質と同一のまたは異なる、少なくとも1つのミクロ微粒子活性物質を加え;(3) 投与のための(1)および(2)の混合物の製剤を形成することからなる。付加的な製薬上許容される添加剤もまた、投与のための組成物に加えることができる。
【0037】
本発明のさらに別の態様は、本発明の組成物によりヒトを含む哺乳類を治療する方法を提供する。
【0038】
上記の一般的な説明および下記の詳細な説明および図面の簡単な説明は、例示および説明のためのものであり、請求の範囲に記載された発明をさらに説明することを目的とすることが理解されるべきである。別の目的、利点および新規の特徴は、以下の発明の詳細な説明から当業者に容易に明らかになるであろう。
【0039】
発明の詳細な説明
A. 組成物
本発明は、IRおよびCRの組み合わせ特性を示す新規の組成物の、驚くべき、予期せぬ発見に関する。本組成物は、CR特性を得るために、速度制御ポリマーまたは膜、膨潤性または浸食性ポリマー、またはイオン交換樹脂のような付加的な材料の存在を必要としない。IRおよびCR特性は、1つ以上の活性物質について正確に検定した粒径を用いて得られる。より小さい粒径はIRプロファイルを与え、より大きい粒径はCRプロファイルを与える。
【0040】
本発明の組成物は、(1) 少なくとも1つの溶解度の低いナノ微粒子活性物質の粒子;(2) ナノ微粒子活性物質粒子の表面に吸着した少なくとも1つの表面安定化剤;および(3) (1)の活性物質と同一のまたは異なる、少なくとも1つの溶解度の低いミクロ微粒子活性物質からなる。‘684特許に記載されるように、表面安定化剤は、アグロメレーション(agglomeration)および粒径の増大を防止することによりナノ微粒子活性物質を安定化する機能を有する。
【0041】
ナノ微粒子活性物質組成物を作る方法は、機械的粉砕、沈殿(precipitation)、均質化(homogenization)、または他の適した粒径減少工程からなってよいが、当業者に公知であり、たとえば、‘684特許および「背景技術」に開示した他の先行技術の参照文献に記載されている。
【0042】
ナノ微粒子およびミクロ微粒子活性物質粒子は、結晶形態、半結晶形態、アモルファス形態、半アモルファス形態、またはそれらの組み合わせであってよい。
【0043】
組成物は、経口、直腸、非経口(静脈内、筋内、または皮下)、槽内、肺、腟内、腹腔内、局所(粉末、軟膏または滴剤)、眼内、耳内、または口腔もしくは鼻用スプレーを含むがこれらに限定されない、あらゆる通常の手段により、ヒトおよび動物に投与するために製剤化することができる。
【0044】
本発明はまた、1つ以上の毒性のない、生理的に許容される担体、佐剤、または賦形剤(これらを集合的に担体と呼ぶ)を加えて製剤された本発明の組成物をも包含する。組成物は非経口注射、固体または液体の剤形による経口投与、直腸または局所投与、眼または耳への投与等のために製剤することができる。
【0045】
経口用製剤において、IR成分は、薬物のナノ微粒子の粒径の結果として、溶解度の低い活性物質の口腔内での急速な溶解をもたらす。さらに、本発明により、溶解度の低い活性成分の頬からの吸収の機会が増大する。ナノ微粒子IR成分のさらに別の利点は、ナノ微粒子活性物質粒子の使用が、先行技術の溶解度の低い活性物質のIR経口製剤で感じられたざらついた感触を排除または最小化することである。
【0046】
IR製剤に伴う典型的な利点の1つは、投薬から活性成分が身体に現れるまでの時間差が減少することである。この時間差は、通常、製剤の崩壊およびその後の活性成分の分布に伴うものである。経口IR製剤の別の利点は、投与後に活性物質が迅速に口中に現れることにより、活性成分の頬から血流への直接の吸収が促進され、それにより一回投与量からの活性成分の全バイオアベイラビリティーに対する、肝臓の初回通過効果を減少させることである。活性物質のナノ微粒子の粒径が口腔内での急速な溶解を可能にするので、この第2の効果は本発明のIR製剤において劇的に増大する。
【0047】
組成物のCR成分は、より長い時間にわたって、含まれる活性物質の患者における有効な血液レベルを提供することが期待される。本明細書において、「徐放」は、物質が約2から約24時間またはそれ以上の延長された時間にわたって望まれるプロファイルに従って放出されるような、組成物または製剤からの薬物のような活性物質の放出を意味する。より長い時間にわたる放出はまた、本発明の「徐放」製剤として意図されるものである。典型的な製剤を下に図示する。
【0048】

【0049】
1. 固形の剤形
本発明の第1の実施形態において、IRおよびCRの両方の成分が、経口投与を目的とした、固形の、急速崩壊型または「無水錠剤(waterless tablet)」マトリックスに組み込まれる。
【0050】
本発明の第2の実施形態において、IRおよびCR成分は、経口投与を目的とした製薬上許容される錠剤に混合される。
【0051】
本発明の第3の実施形態において、IRおよびCR成分は、経口投与を目的とした製薬上許容される硬ゼラチンカプセルに混合される。
【0052】
本発明の第4の実施形態において、IRおよびCR成分は、経口投与を目的とした製薬上許容される軟ゼラチンカプセルに混合される。この剤形の1つの変形は、可溶化された(solubilized)薬物およびミクロ微粒子薬物粒子からなり、ここで可溶化された薬物が剤形のIR成分として機能し、ミクロ微粒子薬物粒子がCR成分として機能するものである。この変形は、「粒子化された」ナノ微粒子薬物粒子の存在を必要としない点で、本明細書に記載された他の剤形と異なっている。
【0053】
本発明の第5の実施形態において、IRおよびCR成分は、経口投与を目的とした製薬上許容されるロゼンジまたはトローチに混合される。
【0054】
本発明の第6の実施形態において、IRおよびCR成分は、経口投与を目的とした製薬上許容される小袋(sachet)、粉末、または「スプリンクル(sprinkle)」に混合される。
【0055】
2. 他の剤形
他の好ましい剤形には、直腸または腟内に使用するための坐剤;静脈内、筋内、または皮下投与のための注射剤を含む注射剤;肺または鼻への投与のためのエアロゾル;口腔用製剤;粉末、軟膏、または滴剤のような局所適用のための製剤;眼および耳用の製剤および槽内および腹腔内投与のための製剤が含まれるが、これらに限定されない。
本発明のIRおよびCR組成物は上に特に記載したものに限らず、いかなる製薬上許容される製剤に組み入れてもよい。
【0056】
3. 溶解度の低い活性物質
本発明の組成物は少なくとも1つの溶解度の低い治療薬、診断薬、または他の活性物質からなる。治療薬は薬物または医薬品であってよく、診断薬は典型的にはX-線造影剤のような造影剤、または他のタイプの診断用物質である。
【0057】
本発明は、広範な溶解度の低い薬物または診断薬を用いて実施することができる。薬物または診断薬は好ましくは基本的に純粋な形で存在し、溶解度が低く、少なくとも1つの液体の媒体に分散可能である。「溶解度が低い」という用語は、薬物または診断薬が、液体の分散媒体に、約30mg/ml未満、好ましくは約10mg/ml、より好ましくは約1mg/ml未満の溶解度を有することを意味する。このような液体の分散媒体は、たとえば、水、塩の水溶液、ベニバナ油のような油、およびエタノール、t-ブタノール、ヘキサンおよびグリコールのような溶媒であってよい。
【0058】
溶解度の低い活性物質はさまざまな公知の薬物または診断薬のクラスから選択することができ、それには、たとえば、タンパク質、ペプチド、ヌクレオチド、抗肥満薬、栄養補給食品、コルチコステロイド、エラスターゼ阻害剤、鎮痛薬、抗真菌薬、腫瘍治療薬、制吐薬、鎮痛薬、心血管薬、抗炎症薬、駆虫薬、抗不整脈薬、抗生物質(ペニシリンを含む)、抗凝血薬、抗うつ薬、抗糖尿病薬、抗てんかん薬、抗ヒスタミン薬、抗高血圧薬、抗ムスカリン薬、抗ミコバクテリア薬、抗腫瘍薬、免疫抑制薬、抗甲状腺薬、抗ウイルス薬、抗不安薬、鎮静薬(たとえば、催眠薬および神経弛緩薬)、収斂薬、β-アドレナリン受容体遮断薬、血液製品および代替物、心臓変力薬、造影剤、コルチコステロイド、鎮咳薬(去痰薬および粘液溶解薬)、診断薬、診断画像薬、利尿薬、ドパミン作動薬(抗パーキンソン病薬)、止血薬、免疫薬、脂質調節薬、筋弛緩薬、副交感神経作動薬、上皮小体カルシトニンおよびビホスホネート、プロスタグランジン、放射性医薬品、性ホルモン(ステロイドを含む)、抗アレルギー薬、興奮薬および食欲抑制薬、交感神経作動薬、乾燥甲状腺製剤、血管拡張薬およびキサンチンが含まれる。
【0059】
典型的な栄養補給食品および栄養補助食品は、たとえば、Robertsら、「栄養補給食品:栄養補助食品、ハーブ、ビタミン、および治療用食物の完全な辞典(Nutraceuticals: The Complete Encyclopedia of Supplements, Herbs, Vitamins, and Healing Foods)(American Nutraceutical Association, 2001)に記載されており、この文献を特に参照により本明細書に組み入れる。植物化学物質または機能食品としても知られる栄養補給食品または栄養補助食品は、一般的に、栄養補助食品、ビタミン、無機質、ハーブ、または体に医学的または薬学的作用を有する治療用食品のクラスのいずれか1つである。典型的な栄養補給食品または栄養補助食品には、葉酸、脂肪酸(たとえば、DHAおよびARA)、果物および野菜抽出物、ビタミンおよび無機質補助剤、ホスファチジルセリン、リポ酸、メラトニン、グルコサミン/コンドロイチン、薬用アロエ、Guggul、グルタミン、アミノ酸(たとえば、イソロイシン、ロイシン、リシン、メチオニン、フェニラニン(phenilanine)、スレオニン、トリプトファン、およびバリン)、緑茶、リコペン、自然食品、食品添加物、ハーブ、植物栄養剤、抗酸化剤、果物のフラボノイド成分、マツヨイグサ油、亜麻仁、魚および海獣油、および体に良いバクテリア(probiotics)を含むが、これらに限定されない。栄養補給食品および栄養補助食品はまた、「ファーマフード(pharmafoods)」としても知られる、望まれる特性を持つように遺伝子工学により処理した生物工学食物をも含む。
【0060】
活性物質は、販売されている、および/または当業者に公知の技術により調製することができる。
【0061】
溶解度の低い活性成分は、治療効果を引き出すのに十分ないかなる量で存在してもよく、また、該当する場合には、一方の光学的に純粋なエナンチオマーの形で、またはエナンチオマーの混合物、ラセミ体もしくは他の形で存在してよい。
【0062】
4. 表面安定化剤
当業者に公知で、たとえば‘684特許に記載された有用な表面安定化剤は、活性物質の表面に物理的に付着するが、活性物質と化学的に結合または相互作用をしないものを含むと考えられる。表面安定化剤は、活性物質が約1000nm未満の有効平均粒径を維持するのに十分な量でナノ微粒子活性物質の表面に吸収される。さらに、吸着した表面安定化剤の個々の分子は、基本的に分子間架橋をおこなわない。本発明の組成物および方法において、2つ以上の表面安定化剤を用いてもよい。
【0063】
適当な表面安定化剤は、好ましくは、公知の有機および無機医薬品添加物から選択される。このような添加物には、さまざまなポリマー、低分子量オリゴマー、天然物、および界面活性剤が含まれる。好ましい表面安定化剤には、アニオン性およびカチオン性界面活性剤を含む、非イオン性およびイオン性界面活性剤が含まれる。
【0064】
表面安定化剤の代表的な例には、ゼラチン、カゼイン、レシチン(ホスファチド)、デキストラン、アラビアゴム、コレステロール、トラガカント、ステアリン酸、塩化ベンザルコニウム、ステアリン酸カルシウム、モノステアリン酸グリセリン、セトステアリルアルコール、セトマクロゴール、乳化ワックス、ソルビタンエステル、ポリオキシエチレンアルキルエーテル(たとえば、セトマクロゴール1000のようなマクロゴールエーテル)、ポリオキシエチレンヒマシ油誘導体、ポリオキシエチレンソルビタン脂肪酸エステル(たとえば、販売されているTween20(商標)およびTween80(商標)のようなTween(商標)(ICI Speciality Chemicals))、ポリエチレングリコール(たとえば、Carbowax3550(商標)および934(商標)(Union Carbide))、ステアリン酸ポリオキシエチレン、コロイド二酸化ケイ素、リン酸塩、ドデシル硫酸ナトリウム、カルボキシメチルセルロースカルシウム、カルボキシメチルセルロースナトリウム、メチルセルロース、ヒドロキシエチルセルロース、ヒドロキシプロピルセルロース、フタル酸ヒドロキシプロピルメチルセルロース、非結晶セルロース、ケイ酸マグネシウムアルミニウム、トリエタノールアミン、ポリビニルアルコール(PVA)、ポリビニルピロリドン(PVP)、4-(1,1,3,3-テトラメチルブチル)-フェノールとエチレンオキシドおよびホルムアルデヒドとのポリマー(チロキサポール、スペリオン(sperione)、およびトリトンとしても知られている)、ポロキサマー(たとえば、エチレンオキシドおよびプロピレンオキシドのブロック共重合体である、Pluronics F68(商標)およびF108(商標))、ポロキサミン(たとえば、エチレンジアミンにプロピレンオキシドおよびエチレンオキシドを順次加えて作られる4官能基ブロック共重合体である、Poloxamine 908(商標)としても知られるTetronic 908(商標)(BASF Wyandotte Corporation, Parsippany, N.J.))、Tetronic 1508(商標)(T-1508)(BASF Wyandotte Corporation)、スルホコハク酸ナトリウムのジアルキルエステル(たとえば、スルホコハク酸ナトリウムのジオクチルエステルである、Aerosol OT(商標)(American Cyanamid))、ラウリル硫酸ナトリウムである、Duponol P(商標)(DuPont)、アルキルアリールポリエーテルスルホネートである、Tritons X-200(商標)(Rohm and Haas)、ステアリン酸スクロースおよびジステアリン酸スクロースの混合物であるCrodestas F-110(商標)(Croda Inc.)、Olin-IOG(商標)またはSurfactant 10-G(商標)(Olin Chemicals, Stamford, CT)としても知られる、p-イソノニルフェノキシポリ-(グリシドール)、Crodestas SL-40(商標)(Croda, Inc.)、およびC18H37CH2C(O)N(CH3)-CH2(CHOH)4(CH2OH)2である、SA9OHCO(Eastman Kodak Co.)、デカノイル-N-メチルグルカミド、n-デシルβ-D-グルコピラノシド、n-デシルβ-D-マルトピラノシド、n-ドデシルβ-D-グルコピラノシド、n-ドデシルβ-D-マルトシド、ヘプタノイル-N-メチルグルカミド、n-ヘプチル-β-D-グルコピラノシド、n-ヘプチルβ-D-チオグルコシド、n-ヘキシルβ-D-グルコピラノシド、ノナノイル-N-メチルグルカミド、n-ノニルβ-D-グルコピラノシド、オクタノイル-N-メチルグルカミド、n-オクチル-β-D-グルコピラノシド、オクチルβ-D-チオグルコピラノシド、リゾチーム、Plasdone S630のような、ビニルピロリドンおよび酢酸ビニルのランダム共重合体、PEG-誘導体化リン脂質、PEG-誘導体化コレステロール、PEG誘導体化コレステロール誘導体、PEG-誘導体化ビタミンA、PEG-誘導体化ビタミンE体等が含まれる。
【0065】
他の有用な表面安定化剤には、ラウリル硫酸ナトリウム、ジオクチルスルホコハク酸ナトリウム、またはそれらの組み合わせが含まれる。
【0066】
有用なカチオン性表面安定化剤には、高分子、生体高分子、多糖、セルロース誘導体、アルギン酸塩、リン脂質、および両性イオン安定化剤のような非高分子化合物、ポリ-n-メチルピリジニウム、塩化アントリウル(anthryul)ピリジミウム、カチオン性リン脂質、キトサン、ポリリシン、ポリビニルイミダゾール、ポリブレン、ポリメタクリル酸メチル臭化トリメチルアンモニウムブロマイド(PMMTMABr)、臭化ヘキシルデシルトリメチルアンモニウム(HDMAB)、およびポリビニルピロリドン-2-ジメチルアミノエチルメタクリル酸ジメチルスルフェートが含まれるが、これらに限定されない。
【0067】
他の有用なカチオン性安定化剤には、カチオン性脂質、スルホニウム、ホスホニウムおよび第4アンモニウム化合物、たとえば、塩化ステアリルトリメチルアンモニウム、臭化ベンジル-ジ(2-クロロエチル) エチルアンモニウム、塩化または臭化ヤシ油トリメチルアンモニウム、塩化または臭化ヤシ油メチルジヒドロキシエチルアンモニウム、塩化デシルトリエチルアンモニウム、塩化または臭化デシルジメチルヒドロキシエチルアンモニウム、塩化または臭化C12-15ジメチルヒドロキシエチルアンモニウム、塩化または臭化ヤシ油ジメチルヒドロキシエチルアンモニウム、メチルスルホン酸ミリスチルトリメチルアンモニウム、塩化または臭化ラウリルジメチルベンジルアンモニウム、塩化または臭化ラウリルジメチル(エテノキシ)4アンモニウム、塩化N-アルキル(C12-18)ジメチルベンジルアンモニウム、塩化N-アルキル(C14-18)ジメチルベンジルアンモニウム、塩化N-テトラデシリドメチルベンジルアンモニウム一水和物、塩化ジメチルジデシルアンモニウム、塩化N-アルキル(C12-14)ジメチル1-ナフチルメチルアンモニウム、ハロゲン化トリメチルアンモニウム、アルキルトリメチルアンモニウム塩およびジアルキルジメチルアンモニウム塩、塩化ラウリルトリメチルアンモニウム、エトキシ化されたアルキルアミドアルキルジアルキルアンモニウム塩および/またはエトキシ化されたトリアルキルアンモニウム塩、塩化ジアルキルベンゼンジアルキルアンモニウム、塩化N-ジデシルジメチルアンモニウム、塩化N-テトラデシルジメチルベンジルアンモニウム一水和物、塩化N-アルキル(C12-14)ジメチル1-ナフチルメチルアンモニウムおよび塩化ドデシルジメチルベンジルアンモニウム、塩化ジアルキルベンゼンアルキルアンモニウム、塩化ラウリルトリメチルアンモニウム、塩化アルキルベンジルメチルアンモニウム、臭化アルキルベンジルジメチルアンモニウム、臭化C12,C15,C17トリメチルアンモニウム、塩化ドデシルベンジルトリエチルアンモニウム、ポリ塩化ジアリルジメチルアンモニウム(DADMAC)、塩化ジメチルアンモニウム、ハロゲン化アルキルジメチルアンモニウム、塩化トリセチルメチルアンモニウム、臭化デシルトリメチルアンモニウム、臭化ドデシルトリエチルアンモニウム、臭化テトラデシルトリメチルアンモニウム、塩化メチルトリオクチルアンモニウム(ALIQUAT 336(商標))、POLYQUAT 10(商標)、臭化テトラブチルアンモニウム、臭化ベンジルトリメチルアンモニウム、コリンエステル(脂肪酸のコリンエステルのような)、塩化ベンザルコニウム、塩化ステアルアルコニウム(stearalkonium)化合物(塩化ステアリルトリモニウムおよび塩化ジステアリルジモニウムのような)、臭化または塩化セチルピリジニウム、4級化されたポリオキシエチルアルキルアミンのハロゲン化物塩、MIRAPOL(商標)およびALKAQUAT(商標)(Alkaril Chemical Company)、アルキルピリジニウム塩;アミン、たとえば、アルキルアミン、ジアルキルアミン、アルカノールアミン、ポリエチレンポリアミン、N,N-ジアルキルアミノアルキルアクリレート、およびビニルピリジン;アミン塩、たとえば、酢酸ラウリルアミン、酢酸ステアリルアミン、アルキルピリジニウム塩、およびアルキルイミダゾリウム塩;およびアミンオキシド;イミドアゾリニウム塩;プロトン化第4級アクリルアミド;メチル化第4級ポリマー、たとえば、ポリ[塩化ジアリルジメチルアンモニウム]およびポリ[塩化N-メチルビニルピリジニウム];およびカチオン性グアールが含まれるが、これらに限定されない。
【0068】
上記の典型的なカチオン性表面安定化剤および他の有用なカチオン性表面安定化剤は、J. CrossおよびE. Singer, 「カチオン性界面活性剤:分析的および生物学的評価」(Cationic Surfactants: Analytical and Biological Evaluation) (Marcel Dekker, 1994);P.およびD.Rubingh編、「カチオン性界面活性剤:物理化学」(Cationic Surfactants: Physical Chemistry) (Marcel Dekker, 1991);およびJ. Richmond,「カチオン性界面活性剤:有機化学」(Cationic Surfactants: Organic Chemistry) (Marcel Dekker, 1990)に記載されている。
【0069】
特に好ましい非高分子の主要な安定化剤は、塩化ベンザルコニウム、カルボニウム化合物、ホスホニウム化合物、オキソニウム化合物、ハロニウム化合物、カチオン性有機金属化合物、第4級リン化合物、ピリジニウム化合物、アニリニウム化合物、アンモニウム化合物、ヒドロキシアンモニウム化合物、第1級アンモニウム化合物、第2級アンモニウム化合物、第3級アンモニウム化合物、および一般式NR1R2R3R4(+)の第4級アンモニウム化合物のような、すべての非高分子化合物である。一般式NR1R2R3R4(+)の化合物に関して、
(i) R1-R4のいずれもCH3ではない;
(ii) R1-R4のうち1つがCH3である;
(iii) R1-R4のうち3つがCH3である;
(iv) R1-R4のすべてがCH3である;
(v) R1-R4のうち2つがCH3であり、R1-R4のうち1つがC6H5CH2であり、R1-R4のうち1つが7炭素原子以下のアルキル鎖である;
(vi) R1-R4のうち2つがCH3であり、R1-R4のうち1つがC6H5CH2であり、R1-R4のうち1つが19炭素原子以上のアルキル鎖である;
(vii) R1-R4のうち2つがCH3であり、R1-R4のうち1つがC6H5(CH2)n基であり、ここでn>1である;
(viii) R1-R4のうち2つがCH3であり、R1-R4のうち1つがC6H5CH2であり、R1-R4のうち1つが少なくとも1つのヘテロ原子からなる;
(ix) R1-R4のうち2つがCH3であり、R1-R4のうち1つがC6H5CH2であり、R1-R4のうち1つが少なくとも1つのハロゲンからなる;
(x) R1-R4のうち2つがCH3であり、R1-R4のうち1つがC6H5CH2であり、R1-R4のうち1つが少なくとも1つの環式フラグメントからなる;
(xi) R1-R4のうち2つがCH3であり、R1-R4のうち1つがフェニル環である;または
(xii) R1-R4のうち2つがCH3であり、R1-R4のうち2つが純粋な脂肪族フラグメントである。
【0070】
このような化合物には、塩化ベヘンアルコニウム、塩化ベンゼトニウム、塩化セチルピリジニウム、塩化ベヘントリモニウム、塩化ラウルアルコニウム(lauralkonium)、塩化セトアルコニウム(cetalkonium)、臭化セトリモニウム、塩化セトリモニウム、フッ化水素酸セチルアミン、塩化クロルアリルメテナミン(Quaternium-15)、塩化ジステアリルジモニウム(Quaternium-5)、塩化ドデシルジメチルエチルベンジルアンモニウム(Quaternium-14)、Quaternium-22、Quaternium-26、Quaternium-18、ヘクトライト(hectorite)、塩化ジメチルアミノエチル塩酸塩、システイン塩酸塩、ジエタノールアンモニウムPOE(10)オレチルエーテルホスフェート、ジエタノールアンモニウムPOE(3)オレチルエーテルホスフェート、獣脂アルコニウムクロライド、ジメチルジオクタデシルアンモニウムベントナイト、塩化ステアルアルコニウム、臭化ドミフェン、安息香酸デナトニウム、塩化ミリストアルコニウム(myristalkonium)、塩化ラウルトリモニウム、二塩酸エチレンジアミン、塩酸グアニジン、ピリドキシンHCl、塩酸イオフェタミン(iofetamine)、塩酸メグルミン、塩化メチルベンゼトニウム、臭化ミルトリモニウム(myrtrimonium)、塩化オレイルトリモニウム、ポリクオーテルニウム-1(polyquaternium-1)、塩酸プロカイン、ココベタイン、ステアルアルコニウムベントナイト、ステアルアルコニウムヘクトナイト、二フッ化水素酸ステアリルトリヒドロキシエチルプロピレンジアミン、塩化獣脂トリモニウム、および臭化ヘキサデシルトリメチルアンモニウムが含まれるが、これらに限定されない。
【0071】
これらの表面安定化剤のほとんどは公知の薬品添加物であり、米国薬学会(American Pharmaceutical Association)および英国薬学会(Pharmaceutical Society of Great Britain)が共同で出版した、「医薬品添加物ハンドブック」(the Handbook of Pharmaceutical Excipients) (The Pharmaceutical Press, 2000)に詳細に記載されている。この文献を参照により本明細書に組み入れる。表面安定化剤は、販売されているか、当業者に公知の技術により製造可能である。
【0072】
5. 粒径
製剤のIR特性は、約1000nm未満、約900nm未満、約800nm未満、約700nm未満、約600nm未満、約500nm未満、約400nm未満、約300nm未満、約250nm未満、約200nm未満、約150nm未満、約100nm未満、または約50nm未満の有効平均粒径を有する、少なくとも1つのナノ微粒子活性物質を利用することにより得られる。
【0073】
製剤のCR特性は、約1ミクロンより大きく、且つ約100ミクロンより小さい、約90ミクロンより小さい、約80ミクロンより小さい、約70ミクロンより小さい、約60ミクロンより小さい、約50ミクロンより小さい、約40ミクロンより小さい、約30ミクロンより小さい、約20ミクロンより小さい、約10ミクロンより小さい、約9ミクロンより小さい、約8ミクロンより小さい、約7ミクロンより小さい、約6ミクロンより小さい、約5ミクロンより小さい、約4ミクロンより小さい、約3ミクロンより小さい、または約2ミクロンより小さい、有効平均粒径を有する少なくとも1つのミクロ微粒子活性物質を利用することにより得られる。
【0074】
組成物は、ナノ微粒子活性物質粒子の複数の集団からなっていてもよく、ここで、それぞれの粒子の集団は、正確な放出速度と相関する限定された粒径を有する。すなわち、たとえば、第1の集団は約1ミクロン未満の有効平均粒径を有し、第2の集団は約800nm未満の有効平均粒径を有し、第3の集団は約500nm未満の有効平均粒径を有し、第4の集団は約50nm未満の有効平均粒径を有し、それぞれの集団は特定の放出速度に対応している。
【0075】
同様に、組成物はミクロ微粒子活性物質の複数の集団からなっていてもよく、ここで、それぞれの粒子の集団は、正確な放出速度と相関する限定された粒径を有する。すなわち、たとえば、第1の集団は約100ミクロン未満の有効平均粒径を有し、第2の集団は約60ミクロン未満の有効平均粒径を有し、第3の集団は約40ミクロン未満の有効平均粒径を有し、第4の集団は約20ミクロン未満の有効平均粒径を有し、それぞれの集団は特定の放出速度に対応している。
【0076】
組成物中のそれぞれの粒子の集団は、ナノ微粒子およびミクロ微粒子の両方とも、少なくとも、50%、60%、70%、80%、または90%のベースラインリゾリューション(baseline resolution)を示す。これは、不均一な集団が、2つの隣接するピークの高さと比較して50%であるような最小ベースラインリゾリューションを有する、多数の状態の粒径分布により特徴づけられることを意味する。50%ベースラインリゾリューションは、2つの隣接するピークの平均高さに対して、分布のベースラインから半分の距離であると定義される。
【0077】
従来のミクロ微粒子組成物においては粒径がランダムに分布し、2以上の粒径について50%以上のベースラインリゾリューションを有さないので、本発明は少なくとも50%のベースラインリゾリューションにより、異なる粒径の混合物を有する従来のミクロ微粒子組成物と区別される。
【0078】
本明細書において、粒径は、当業者に公知の従来からの粒径測定技術により測定された重量平均粒径を基礎として決定される。このような技術には、たとえば、沈降場流動分画、光子相関分光分析、光散乱法、およびディスク遠心分離が含まれる。
【0079】
「約1000nm未満の有効平均粒径」という用語は、上記の技術により測定した場合に、活性物質粒子の少なくとも50%が約1000nm未満の平均粒径を有することを意味する。同様に、「約100ミクロン未満の有効平均粒径」という用語は、上記の技術により測定した場合に、活性物質粒子の少なくとも50%が約100ミクロン未満の平均粒径を有することを意味する。好ましくは、粒子の70%以上が有効平均よりも小さい平均粒径を有し、より好ましくは、粒子の約90%以上が有効平均よりも小さい平均粒径を有する。
【0080】
6. 他の医薬品添加物
本発明の医薬組成物は、さらに1つ以上の結合剤、賦形剤、滑沢剤、懸濁剤、甘味料、着香剤、保存料、緩衝剤、湿潤剤、崩壊剤、発泡剤、および他の添加剤からなってもよい。このような添加剤は当業者に公知である。
【0081】
賦形剤の例としては、ラクトース一水和物、ラクトース無水物、およびさまざまなデンプンが挙げられ、結合剤の例としては、さまざまなセルロースおよび架橋ポリビニルピロリドン、Avicel(商標) PH101およびAvicel(商標) PH102のような微結晶セルロース、およびケイ化された微結晶セルロース(SMCC)が挙げられる。
【0082】
好ましい滑沢剤は、圧縮される粉末の流動性に作用するものも含むが、Aerosil(商標) 200のようなコロイド二酸化ケイ素、タルク、ステアリン酸、ステアリン酸マグネシウム、ステアリン酸カルシウム、およびシリカゲルである。
【0083】
甘味料の例としては、スクロース、キシリトール、サッカリンナトリウム、シクラミン酸塩、アスパルテーム、およびアクスルフェーム(acsulfame)のようなすべての天然および人工甘味料が挙げられる。着香剤の例としては、Magnasweet(商標) (MAFCOの商標)、バブルガム着香料、フルーツ着香料等が挙げられる。
【0084】
保存料の例としては、ソルビン酸カリウム、メチルパラベン、プロピルパラベン、安息香酸およびその塩、ブチルパラベンのような他のパラヒドロキシ安息香酸のエステル、エチルまたはベンジルアルコールのようなアルコール、フェノールのようなフェノール系化合物、または塩化ベンザルコニウムのような第4級化合物が挙げられる。
【0085】
好ましい希釈剤には、微結晶セルロース、ラクトース、二塩基性リン酸カルシウム、サッカライド、および/または上記のいずれかの混合物のような、製薬上許容される不活性な賦形剤が含まれる。希釈剤の例には、Avicel(商標) PH101およびAvicel(商標) PH102のような微結晶セルロース;ラクトース一水和物、ラクトース無水物、およびPharmatose(商標) DCL21のようなラクトース;Emcompress(商標)のような二塩基性リン酸カルシウム;マンニトール;デンプン;ソルビトール;スクロース;およびグルコースが含まれる。好ましい崩壊剤には、軽度に架橋したポリビニルピロリドン、コーンスターチ、馬鈴薯デンプン、トウモロコシデンプン、および修飾されたデンプン、クロスカルメロースナトリウム、クロスポビドン、デンプングリコール酸ナトリウム、およびそれらの混合物が含まれる。
【0086】
発泡剤の例には、有機酸および炭酸塩または炭酸水素塩のような発泡性の組合せが挙げられる。好ましい有機酸には、たとえば、クエン酸、酒石酸、リンゴ酸、フマル酸、アジピン酸、コハク酸、およびアルギニン酸およびこれらの酸の無水物および塩が含まれる。好ましい炭酸塩および炭酸水素塩には、たとえば、炭酸ナトリウム、炭酸水素ナトリウム、炭酸カリウム、炭酸水素カリウム、炭酸マグネシウム、グリシン炭酸ナトリウム、L-リシン炭酸塩、アルギニン炭酸塩が含まれる。あるいは、発泡性の組合せの酸成分のみが存在してもよい。
【0087】
7. ナノ微粒子活性物質、表面安定化剤、およびミクロ微粒子活性物質の量
少なくとも1つのナノ微粒子活性物質、1つ以上の表面安定化剤、および少なくとも1つのミクロ微粒子活性物質の相対量はさまざまであってよい。表面安定化剤の最適な量は、たとえば、選択された特定の活性物質、親水性親油性比(HLB)、融点、および表面安定化剤の水溶性、および安定化剤の水溶液の表面張力等に依存する。
【0088】
少なくとも1つのナノ微粒子活性物質の濃度は、少なくとも1つの活性物質および少なくとも1つの表面安定化剤を合わせた、他の添加物を含まない総重量に基づいて、重量で約99.5%から約0.001%まで、約95%から約0.1%まで、または約90%から約0.5%まで変化し得る。
【0089】
少なくとも1つの表面安定化剤の濃度は、少なくとも1つの活性物質および少なくとも1つの表面安定化剤を合わせた、他の添加物を含まない総乾燥重量に基づいて、重量で約0.5%から約99.999%まで、約5%から約99.9%まで、または約10%から約99.5%まで変化し得る。
【0090】
ミクロ微粒子活性物質の濃度は、ナノ微粒子活性物質、表面安定化剤、およびミクロ微粒子活性物質を合わせた、他の添加物を含まない総重量に基づいて、重量で約5%から約85%まで変化し得る。
【0091】
B. 本発明の組成物の製造方法
本発明の別の態様において、CRおよびIR特性を組み合わせて有する製剤を調製する方法が提供される。この方法は、(1) 少なくとも1つの投与されるナノ微粒子活性物質および少なくとも1つの表面安定化剤からなるナノ微粒子組成物を形成し;(2) (1)のナノ微粒子活性物質と同一のまたは異なる、少なくとも1つのミクロ微粒子活性物質を加え;(3) 組成物を投与に適した剤形に形成することからなる。投与のために組成物に製薬上許容される添加物を加えることもできる。
【0092】
1. ナノ微粒子組成物を製造する方法
機械的粉砕、沈殿、ホモジナイズ、または他の適した粒径減少工程からなるナノ微粒子組成物の製造方法は、当業者に公知であり、たとえば、‘684特許に記載されている。
【0093】
ナノ微粒子組成物の製造方法はまた、「医薬物質を粉砕する方法」に関する米国特許第5,518,187および5,862,999号、「医薬物質を粉砕する連続的な方法」に関する米国特許第5,718,388号、「ナノ微粒子医薬品と結晶成長調節剤との共微小沈殿」に関する米国特許第5,665,331号、「ナノ微粒子医薬品と結晶成長調節剤との共微小沈殿」に関する米国特許第5,662,883号、「ナノ微粒子医薬品の微少沈殿」に関する米国特許第5,560,932号、「ナノ微粒子を含むX-線造影剤組成物の調製方法」に関する米国特許第5,543,133号、「安定な薬物ナノ微粒子を調製する方法」に関する米国特許第5,534,270号、「ナノ微粒子を含む治療用組成物を調製する方法」に関する米国特許第5,510,118号、および「凝集を減少させるために荷電したリン脂質を含むナノ微粒子組成物を調製する方法」に関する米国特許第5,470,583号にも記載されている。これらの文献を参照により本明細書に組み入れる。
【0094】
a. ナノ微粒子活性物質分散物を得るための粉砕
ナノ微粒子分散物を得るための活性物質の水中分散物の粉砕は、少なくとも1つの活性物質を活性物質の溶解度が低い液体の分散媒体に分散することからなる。「溶解度の低い」という用語は、活性物質が液体の分散媒体に、約30mg/ml未満、好ましくは約10mg/ml未満、より好ましくは約1mg/ml未満の溶解度を有することを意味する。このような液体の分散媒体は、たとえば、水、塩水溶液、ベニバナ油のような油、エタノール、t-ブタノール、ヘキサン、およびグリコールのような溶媒であってよい。
【0095】
この後に、粉砕媒体の存在下で機械的手段を適用して、活性物質の粒径を所望の有効平均粒径まで減少させる。活性物質粒子は少なくとも1つの表面安定化剤の存在下で粒径を減少させることができる。あるいは、摩耗の後に活性物質粒子を1つ以上の表面安定化剤と接触させてもよい。粒径減少工程の間に、希釈剤のような他の成分を活性物質/表面安定化剤組成物に加えることができる。分散物は、連続的に、またはバッチ方式で処理することができる。得られたナノ微粒子活性物質分散物は、直接製剤に使用することもできるし、または、分散物から粉末を調製した後に剤形に製剤することもできる。
【0096】
b. ナノ微粒子活性物質組成物を得るための沈殿
望まれるナノ微粒子組成物を形成する別の方法は、微小沈殿(microprecipitation)による。これは、1つ以上の表面安定化剤および1つ以上のコロイド安定性を増大する界面活性剤の存在下で、毒性の溶媒または可溶化された重金属不純物をわずかな痕跡も含まない、溶解度の低い活性物質の安定な分散物を調製する方法である。このような方法は、たとえば、(1) 水に対する溶解度の低い活性物質を適当な溶媒に溶解し;(2) (1)の過程で得られた調製物を少なくとも1つの表面安定化剤からなる溶液に加えて溶液を形成し;(3) (2)の過程で得られた調製物を適切な非溶媒を用いて沈殿させることからなる。この方法の後、もし存在すれば形成された塩を透析またはダイアフィルトレーション(diafiltration)により除去し、通常の手段により分散物を濃縮する。得られたナノ微粒子活性物質分散物は、直接製剤に使用することもできるし、分散物から粉末を調製した後に製剤することもできる。
【0097】
c. ナノ微粒子活性物質組成物を得るためのホモジナイズ
活性物質ナノ微粒子組成物を調製するための代表的なホモジナイズ方法は、「ナノ微粒子を含む治療用組成物を調製する方法」に関する米国特許第5,510,118号に記載されている。
【0098】
上記の方法は活性物質粒子を液体の分散媒体に分散させた後、分散物をホモジナイズして活性物質粒子の粒径を所望の有効平均粒径に減少させることからなる。活性物質粒子は少なくとも1つの表面安定化剤の存在下で粒径を減少させることができる。あるいは、粒径の減少の前または後のいずれかに活性物質粒子を1つ以上の表面安定化剤と接触させてもよい。けれども、活性物質粒子の湿潤補助剤として作用する1つ以上の表面安定化剤の存在下で、活性物質粒子を液体の分散媒体に分散させるのが好ましい。希釈剤のような他の化合物を、粒径減少工程の前、間または後のいずれかに活性物質/表面安定化剤組成物に加えることができる。分散は連続的に、またはバッチ方式で処理することができる。得られたナノ微粒子活性物質分散物は、直接製剤に使用することもできるし、分散物から粉末を調製した後に製剤することもできる。
【0099】
2. 製剤
経口、注射用、経皮、エアロゾル、口腔、局所、眼内、耳内等の製剤を製造する方法は当業者に公知であり、このような方法を本発明に採用することができる。
【0100】
本発明の1つの実施形態において、粒子表面に1つ以上の表面安定化剤を吸収させたナノ微粒子活性物質粒子を乾燥粉末マトリックスに組み入れ(たとえば、噴霧乾燥、噴霧造粒、または関連する製薬上許容される乾燥工程により)、乾式混合または同様の混合工程により微細化活性物質粒子のバルクと混合する。
【0101】
本発明の第2の実施形態において、ナノ微粒子活性物質粒子を乾燥粉末マトリックスに組み入れる(たとえば、噴霧乾燥、噴霧造粒、または関連する製薬上許容される乾燥工程により)。別に、微細化活性物質粒子を同様の方法を用いて乾燥粉末マトリックスに組み入れた後、得られたマトリックスを乾式混合または同様の混合工程により混合する。
【0102】
本発明の第3の実施形態において、微細化活性物質粒子を乾式粉砕(たとえば、ジェット粉砕またはピン粉砕(pin milling))により調製する。
【0103】
本発明の第4の実施形態によれば、微細化活性物質粒子を、‘684特許に記載されたナノ微粒子活性物質粒子の調製に採用した方法と同様の湿式粉砕により調製する。
【0104】
本発明の第5の実施形態によれば、微細化活性物質粒子を、噴霧造粒、回転造粒、噴霧コーティング、または関連する製薬工程において、その上にナノ微粒子活性物質粒子を分散する、または外層を形成するように堆積させるための基体(substrate)(またはその一部)として用いることができる。この特定の方法により、生体の液体に曝された場合にマトリックスの外層からのナノ微粒子活性物質粒子の放出が促進され、その後に微細化活性物質粒子が曝され、それに続いて溶解する。
【0105】
本発明の第6の実施形態によれば、微細化活性物質粒子は、ナノ微粒子活性物質粒子が造粒液(granulating fluid)の形態で適用される高剪断造粒(high-shear granulation)または関連する製薬湿式混合工程において基体(またはその一部)として用いることができる。この特定の方法は、乾燥後にナノ微粒子活性物質粒子および微細化活性物質粒子が得られた固体のマトリックス中に均一に分散することを可能にする。
【0106】
本発明の第7の実施形態において、ナノ微粒子活性物質粒子および微細化活性物質粒子は、固形の急速崩壊型または「無水錠剤」マトリックスに組み入れるのに適した乾燥粉末または粉末混合物の形態で存在する。上記の「無水錠剤」マトリックスは、乾燥粉末または粉末混合物を錠剤圧縮機または同様の製薬上許容される圧縮機を用いて圧縮することにより得られる。
【0107】
典型的な噴霧乾燥、凍結乾燥、造粒、および打錠法を下に記載する。
【0108】
a. ナノ微粒子分散物の噴霧乾燥
粒径を小さくした後にナノ微粒子調製物を乾燥することにより、ナノ微粒子分散物の製剤を調製することができる。好ましい乾燥法は噴霧乾燥である。噴霧乾燥工程は、活性物質をナノ微粒子サイズの粒子に変えるために用いられる粒径減少工程の後に、ナノ微粒子粉末を得るために用いられる。
【0109】
典型的な噴霧乾燥工程において、ナノ微粒子活性物質懸濁液を蠕動ポンプを用いて噴霧器に送り込み、液滴の微細スプレーに霧化する。このスプレーを、乾燥チャンバー中で熱い空気と接触させて、液滴から水分を蒸発させる。得られたスプレーをサイクロンに通して、粉末を分離して収集する。ナノ微粒子分散物を添加剤を存在させてまたは存在させずに噴霧乾燥して、噴霧乾燥した中間体の粉末を与える。
【0110】
粉末は、たとえば、錠剤、坐剤、または他の固形の剤形に製剤することができる。または、粉末は、鼻内または肺投与用のエアロゾルに製剤してもよい。粉末はまた、液体に再構成して、たとえば、注射用、眼内、耳内、または経口用剤形に用いることができる。
【0111】
b. 凍結乾燥
粒径の減少の後にナノ微粒子調製物を凍結乾燥することによっても、ナノ微粒子分散物の固形の製剤を調製することができる。適当な凍結乾燥条件には、たとえば、欧州特許第0,363,365号(McNeil-PPC Inc.)、米国特許第4,178,695号(A. Erbeia)、および米国特許第5,384,,124号(Farmalyoc)に記載されるものが含まれる。これらのすべての文献を参照により本明細書に組み入れる。典型的には、ナノ微粒子分散物を適当な容器に入れて、約−5℃と約−100℃の間の温度で凍結する。次に、凍結した分散物を約48時間以下の時間にわたって減圧にする。温度、圧力、分散媒体、およびバッチサイズのようなパラメーターの組み合わせが、凍結乾燥工程に必要な時間に影響を与える。低い温度および圧力下で、凍結した溶媒が昇華により除去され、全体的に分布する活性成分を有する固体の、多孔性の、固形のIR剤形が得られる。
【0112】
粉末は、たとえば、錠剤、坐剤、または他の固形の剤形に製剤することができる。または、粉末は、鼻内または肺投与用のエアロゾルに製剤してもよい。粉末はまた、液体に再構成して、たとえば、注射用、眼内、耳内、または経口用の剤形に用いることができる。
【0113】
c. 造粒
あるいは、本発明の固形の経口用剤形は、活性物質のナノ微粒子分散物および少なくとも1つの表面安定化剤、および顆粒を形成するための少なくとも1つの製薬上許容される水溶性または水分散性の添加物の溶液からなる混合物を流動床中で造粒することにより調製することができる。この後に、顆粒を錠剤として固形の剤形を形成する。
【0114】
d. 打錠
本発明の製剤は錠剤の形態であってよい。このような錠剤の調製は当業者に公知の医薬品圧縮または成形技術による。本発明の錠剤は、円板状、円型、楕円形、長方形、円柱状、三角柱、六方晶形等のような、いかなる適当な形であってもよい。
【0115】
打錠用の粉末は、当業者に公知のいかなる方法により錠剤に製剤してもよい。適当な方法には、粉砕、流動床造粒、乾式造粒、直接圧縮、球状化、噴霧凝結、およびスプレーダイス(spray-dying)が含まれるが、これらに限定されない。打錠法に関する詳細な説明は、Remington: 「調剤の科学および実践」(The Science and Practice of Pharmacy)、第19版、第11巻(1995)(Mack Publishing Co., Pennsylvania);および「Remingtonの薬学」(Remington’s Pharmaceutical Sciences)、第89章、pp.1633-1658(Mach Publishing Company, 1990)に記載されており、これらの文献を特に参照により本明細書に組み入れる。
【0116】
錠剤はコーティングしてもしなくてもよい。コーティングする場合には、糖衣(不快な味またはにおいを覆うためおよび酸化から保護するため)またはフィルムコーティング(同様の目的のための水溶性物質の薄いフィルム)であってよい。
【0117】
C. 本発明の組成物の投与
本発明は、少なくとも1つの溶解度の低い活性成分の迅速なアベイラビリティー、およびこれと同一のまたは異なる溶解度の低い活性成分の徐放を組み合わせて必要とする、ヒトを含む哺乳類を治療する方法を提供する。投与された本発明の組成物は、組み込まれた活性物質を急速に放出して活性の速い開始をもたらし、同時に、同一のまたは異なる活性物質をゆっくりと放出して長時間の薬理効果を与える。
【0118】
一般的に、本発明の組成物は、これを必要とする哺乳類被験体に、望まれる生理的効果を与えるのに十分な医薬または活性物質のレベルを用いて投与される。哺乳類被験体は、家畜またはペットであってもよいが、好ましくはヒト被験体である。望まれる生理的結果を与えるのに必要な医薬または活性物質のレベルは、GoodnanおよびGillman、および「医師用添付文書集」(Physician’s Desk Reference)のような標準的な文献を参照して当業者が容易に決定することができる。
【図面の簡単な説明】
【0119】
【図1】単一の規定された粒径を有する活性物質を含む製剤の1回の経口投与後の薬物動態学的プロファイルの、数学的モデルを用いたシミュレーションを示す図である。
【図2】異なる粒径の粒子の混合物を含む製剤の1回の経口投与後の薬物動態学的プロファイルの、数学的モデルを用いたシミュレーションを示す図である。
【図3】異なる粒径の粒子の混合物を含む製剤の1回の経口投与後の薬物動態学的プロファイルの、数学的モデルを用いたシミュレーションを示す図である。
【実施例】
【0120】
以下の実施例は本発明を説明するために記載するものである。したがって、本発明はこれらの実施例に記載される特定の条件または細部に限定されないものと理解されるべきである。明細書を通して、出版された文献に関するすべての引用を、特に参照により本特許出願に組み入れる。
【0121】
(実施例1)
この実施例の目的は、1つの限定された粒径を有する活性物質を含む製剤の1回の経口投与後の薬物動態学的プロファイルを、数学的モデルを用いてシミュレートすることであった。
【0122】
このシミュレーションに用いたソフトウェアは、Windows用MicroMath PKAnalyst version 1.1, MicroMath, Inc.である。以下の仮定をおこなった:活性物質は、中枢コンパートメントからの1次吸収および1次排泄を有する2つのコンパートメント(中枢および末梢コンパートメント)の薬物動態モデルに従う。
【0123】
D/V(用量/体積)= 5000;
Ka > 1.000 h-1 (溶解速度に相当する速度定数);
Ke = 0.50 h-1 (排泄速度定数);
K12 = 0.25 h-1 (中枢コンパートメントから末梢コンパートメントへの分散速度を表す定数);および
K21 = 0.125 h-1 (末梢コンパートメントから中枢コンパートメントへの分散速度を表す定数)。
【0124】
下記の溶解速度定数を有する、(S)小さい粒子、(MS)適度に小さい粒子、(ML)適度に大きい粒子、および(L)粒子の4つのサンプルを設計した。
【0125】
小さい(S)粒子の溶解速度定数 = 1.000h-1
適度に小さい(MS)粒子の溶解速度定数 = 0.500h-1
適度に大きい(ML)粒子の溶解速度定数 = 0.250h-1
大きい(L)粒子の溶解速度定数 = 0.125h-1
シミュレーションの結果を図1に示す。
【0126】
小さい粒子の集団(S)は、迅速な活性の開始を示し、投与後数分で250mg/ml以上の血漿レベルになり、投与後1時間と少しで約2100mg/mlの血漿濃度レベルのピークに達した。けれども、このサンプルはまた、投与後12時間では最も低い血漿レベルを示した。
【0127】
これに対して、大きい粒子の集団(L)は、活性の開始が遅く、投与後約2時間で500mg/mlを少し上回る血漿濃度レベルのピークに達した。けれども、このサンプルは投与後12時間では最も高い血漿レベルを示した。
【0128】
シミュレーションの結果は、小さい粒子はより大きい粒子よりも速く溶解するが、これらはまたより速く低下することを示している。その結果、より大きい薬物粒子は最も長く続く血漿レベルを提供するが、これらの同じ粒子は遅い溶解を示す。
【0129】
(実施例2)
この実施例の目的は、異なる粒径の粒子の混合物を含む製剤の1回の経口投与後の薬物動態学的プロファイルを、数学的モデルを用いてシミュレートすることであった。
【0130】
実施例1に記載された仮定を実施例2にも適用する。
【0131】
活性医薬成分の小さい(S)粒子と、適度に小さい(MS)、適度に大きい(ML)、または大きい(L)粒子の50:50混合物を含む製剤の1回の経口投与後のシミュレートされた薬物動態プロファイルを図2に示す。
【0132】
結果は、特に、(S)小さい粒子および(L)大きい粒子の混合物が、実施例1において投与された(L)大きい粒子と比較して、顕著に大きい最大平均血漿濃度(1000mg/ml近く)を示し、また、この製剤は、実施例1において投与された(S)小さい粒子と比較して、より長時間にわたる血漿レベルを示した。
【0133】
(実施例3)
この実施例の目的は、異なる粒径の粒子の混合物を含む製剤の1回の経口投与後の薬物動態学的プロファイルを、数学的モデルを用いてシミュレートすることであった。
【0134】
実施例1に記載された仮定を実施例3にも適用する。
【0135】
活性医薬成分の小さい(S)粒子と、適度に小さい(MS)、適度に大きい(ML)、または大きい(L)粒子の25:75混合物を含む製剤の1回の経口投与後のシミュレートされた薬物動態プロファイルを図3に示す。
【0136】
結果は、特に、(S)小さい粒子および(L)大きい粒子の混合物が、実施例1において投与された(L)大きい粒子と比較して、顕著に大きい最大平均血漿濃度(900mg/ml近く)を示し、また、この製剤は、実施例1において投与された(S)小さい粒子と比較して、より長時間にわたる血漿レベルを示した。
【0137】
本発明の趣旨または範囲から逸脱することなく、本発明の方法および組成物にさまざまな修正および変更を行うことができることは当業者には明白であろう。したがって、本発明は、添付した請求の範囲およびその同等物により提供される発明の修正および変更をも含むものと意図される。
【特許請求の範囲】
【請求項1】
(a) 少なくとも1つの約1ミクロン未満の有効平均粒径を有する溶解度の低い活性物質粒子;
(b) 上記のナノ微粒子活性物質粒子の表面に吸着した少なくとも1つの表面安定化剤;および
(c) (a)の活性物質と同一であるか、または異なっており、約1ミクロンよりも大きく、約100ミクロンよりも小さい有効平均粒径を有する、少なくとも1つの微細化活性物質
からなる組成物。
【請求項2】
ナノ微粒子活性物質粒子の有効平均粒径が、約900nm未満、約800nm未満、約700nm未満、約600nm未満、約500nm未満、約400nm未満、約300nm未満、約250nm未満、約200nm未満、約150nm未満、約100nm未満、および約50nm未満からなる群より選択される、請求項1記載の組成物。
【請求項3】
ミクロ微粒子活性物質粒子の有効平均粒径が、約1ミクロンより大きく、且つ約90ミクロン未満、約80ミクロン未満、約70ミクロン未満、約60ミクロン未満、約50ミクロン未満、約40ミクロン未満、約30ミクロン未満、約20ミクロン未満、約10ミクロン未満、約9ミクロン未満、約8ミクロン未満、約7ミクロン未満、約6ミクロン未満、約5ミクロン未満、約4ミクロン未満、約3ミクロン未満、および約2ミクロン未満からなる群より選択される粒径よりも小さい、請求項1または2記載の組成物。
【請求項4】
それぞれの粒子の集団が約1ミクロン未満の有効平均粒径を有するような、2つ以上のナノ微粒子活性物質粒子の集団からなる、請求項1−3のいずれか1項記載の組成物。
【請求項5】
それぞれの粒子の集団が約1ミクロンより大きく、約100ミクロンより小さい有効平均粒径を有するような、2つ以上のミクロ微粒子活性物質粒子の集団からなる、請求項1−4のいずれか1項記載の組成物。
【請求項6】
ナノ微粒子活性物質の濃度が、ナノ微粒子活性物質および表面安定化剤の総重量に基づいて、約99.5%から約0.001%である、請求項1−5のいずれか1項記載の組成物。
【請求項7】
ナノ微粒子活性物質の濃度が、ナノ微粒子活性物質および表面安定化剤の総重量に基づいて、約95%から約0.1% (w/w)である、請求項1−6のいずれか1項記載の組成物。
【請求項8】
ナノ微粒子活性物質の濃度が、ナノ微粒子活性物質および表面安定化剤の総重量に基づいて、約90%から約0.5% (w/w)である、請求項1−7のいずれか1項記載の組成物。
【請求項9】
表面安定化剤の濃度が、ナノ微粒子活性物質および表面安定化剤の総重量に基づいて、約0.5%から約99.999% (w/w)である、請求項1−8のいずれか1項記載の組成物。
【請求項10】
表面安定化剤の濃度が、ナノ微粒子活性物質および表面安定化剤の総重量に基づいて、約5%から約99.9% (w/w)である、請求項1−9のいずれか1項記載の組成物。
【請求項11】
表面安定化剤の濃度が、ナノ微粒子活性物質および表面安定化剤の総重量に基づいて、約10%から約99.5% (w/w)である、請求項1−10のいずれか1項記載の組成物。
【請求項12】
ミクロ微粒子薬物の濃度が、ミクロ微粒子活性物質、ナノ微粒子活性物質、および表面安定化剤の総重量に基づいて、約5%から約85%である、請求項1−11のいずれか1項記載の組成物。
【請求項13】
固形の、急速崩壊型の「無水錠剤」マトリックスに製剤化された、請求項1−12のいずれか1項記載の組成物。
【請求項14】
製薬上許容される錠剤に製剤化された、請求項1−12のいずれか1項記載の組成物。
【請求項15】
製薬上許容される硬ゼラチンカプセルに製剤化された、請求項1−12のいずれか1項記載の組成物。
【請求項16】
製薬上許容される軟ゼラチンカプセルに製剤化された、請求項1−12のいずれか1項記載の組成物。
【請求項17】
組成物が、ナノ微粒子活性物質粒子に代えて、可溶化された活性物質を含む、請求項16記載の組成物。
【請求項18】
製薬上許容されるロゼンジまたはトローチに製剤化された、請求項1−12のいずれか1項記載の組成物。
【請求項19】
製薬上許容される小袋、粉末、または「スプリンクル」に製剤化された、請求項1−12のいずれか1項記載の組成物。
【請求項20】
経口、直腸、腟内、注射用、肺、鼻内、口腔内、局所(topical, local)、槽内、腹腔内、眼内、耳内、口中スプレー、または鼻内スプレー投与用剤形に製剤化された、請求項1−19のいずれか1項記載の組成物。
【請求項21】
噴霧乾燥、噴霧造粒、流動床造粒、高剪断造粒、流動床乾燥、凍結乾燥、打錠、ジェット粉砕、ピン粉砕、湿式粉砕、回転造粒、および噴霧コーティングからなる群より選択される少なくとも1つの方法を利用して製剤化された、請求項1−20のいずれか1項記載の組成物。
【請求項22】
ナノ微粒子およびミクロ微粒子活性物質が、タンパク質、ペプチド、ヌクレオチド、抗肥満薬、栄養補給食品、コルチコステロイド、エラスターゼ阻害剤、抗真菌薬、腫瘍治療薬、制吐薬、鎮痛薬、心血管薬、抗炎症薬、駆虫薬、抗不整脈薬、抗生物質、抗凝血薬、抗うつ薬、抗糖尿病薬、抗てんかん薬、抗ヒスタミン薬、抗高血圧薬、抗ムスカリン薬、抗ミコバクテリア薬、抗腫瘍薬、免疫抑制薬、抗甲状腺薬、抗ウイルス薬、抗不安薬、鎮静薬、収斂薬、β-アドレナリン受容体遮断薬、血液製品および代替物、心臓変力薬、造影剤、コルチコステロイド、鎮咳薬、診断薬、診断画像薬、利尿薬、ドパミン作動薬、止血薬、免疫薬、脂質調節薬、筋弛緩薬、副交感神経作動薬、上皮小体カルシトニンおよびビホスホネート、プロスタグランジン、放射性医薬品、性ホルモン、抗アレルギー薬、興奮薬および食欲抑制薬、交感神経作動薬、乾燥甲状腺製剤、血管拡張薬およびキサンチンからなる群より選択される、請求項1−21のいずれか1項記載の組成物。
【請求項23】
少なくとも1つの表面安定化剤が、非イオン性表面安定化剤、アニオン性表面安定化剤、カチオン性表面安定化剤、およびイオン性表面安定化剤からなる群より選択される、請求項1−22のいずれか1項記載の組成物。
【請求項24】
少なくとも1つの表面安定化剤が、塩化セチルピリジニウム、ゼラチン、カゼイン、ホスファチド、デキストラン、グリセリン、アラビアゴム、コレステロール、トラガカント、ステアリン酸、ステアリン酸エステルおよび塩、ステアリン酸カルシウム、モノステアリン酸グリセリン、セトステアリルアルコール、セトマクロゴール乳化ワックス、ソルビタンエステル、ポリオキシエチレンアルキルエーテル、ポリオキシエチレンヒマシ油誘導体、ポリオキシエチレンソルビタン脂肪酸エステル、ポリエチレングリコール、臭化ドデシルトリメチルアンモニウム、ステアリン酸ポリオキシエチレン、コロイド二酸化ケイ素、リン酸塩、ドデシル硫酸ナトリウム、カルボキシメチルセルロースカルシウム、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、カルボキシメチルセルロースナトリウム、メチルセルロース、ヒドロキシエチルセルロース、フタル酸ヒドロキシプロピルメチルセルロース、非結晶セルロース、マグネシウムアルミニウムシリケート、トリエタノールアミン、ポリビニルアルコール、ポリビニルピロリドン、4-(1,1,3,3-テトラメチルブチル)-フェノールとエチレンオキシドおよびホルムアルデヒドとのポリマー、ポロキサマー、ポロキサミン、荷電リン脂質、ジミリストイルホスファチジルグリセリン、ジオクチルスルホコハク酸塩、スルホコハク酸ナトリウムのジアルキルエステル、ラウリル硫酸ナトリウム、アルキルアリールポリエーテルスルホネート、ステアリン酸スクロースおよびジステアリン酸スクロースの混合物、-(-PEO)--(-PBO-)--(-PEO-)-の構造のトリブロック共重合体、p-イソノニルフェノキシポリ-(グリシドール)、デカノイル-N-メチルグルカミド、n-デシルβ-D-グルコピラノシド、n-デシルβ-D-マルトピラノシド、n-ドデシルβ-D-グルコピラノシド、n-ドデシルβ-D-マルトシド、ヘプタノイル-N-メチルグルカミド、n-ヘプチル-β-D-グルコピラノシド、n-ヘプチルβ-D-チオグルコシド、n-ヘキシルβ-D-グルコピラノシド、ノナノイル-N-メチルグルカミド、n-ノイルβ-D-グルコピラノシド、オクタノイル-N-メチルグルカミド、n-オクチルβ-D-グルコピラノシド、オクチルβ-D-チオグルコピラノシド、リソザイム、PEG誘導体化リン脂質、PEG誘導体化コレステロール、PEG誘導体化コレステロール誘導体、PEG誘導体化ビタミンA、PEG誘導体化ビタミンE、および酢酸ビニルとビニルピロリドンのランダム共重合体からなる群より選択される、請求項1−23のいずれか1項記載の組成物。
【請求項25】
少なくとも1つのカチオン性表面安定化剤が、高分子、生体高分子、多糖、セルロース、アルギン酸塩、非高分子化合物、およびリン脂質からなる群より選択される、請求項1−23のいずれか1項記載の組成物。
【請求項26】
少なくとも1つの表面安定化剤が、カチオン性脂質、塩化ベンザルコニウム、スルホニウム化合物、ホスホニウム化合物、第4級アンモニウム化合物、臭化ベンジル-ジ(2-クロロエチル) エチルアンモニウム、塩化ヤシ油トリメチルアンモニウム、臭化ヤシ油トリメチルアンモニウム、塩化ヤシ油メチルジヒドロキシエチルアンモニウム、臭化ヤシ油メチルジヒドロキシエチルアンモニウム、塩化デシルトリエチルアンモニウム、塩化デシルジメチルヒドロキシエチルアンモニウム、塩化臭化デシルジメチルヒドロキシエチルアンモニウム(訳者注:「塩化」は不要。誤記と思われる)、塩化C12-15ジメチルヒドロキシエチルアンモニウム、塩化臭化C12-15ジメチルヒドロキシエチルアンモニウム(訳者注:同上)、塩化ヤシ油ジメチルヒドロキシエチルアンモニウム、臭化ヤシ油ジメチルヒドロキシエチルアンモニウム、メチル硫酸ミリスチルトリメチルアンモニウム、塩化ラウリルジメチルベンジルアンモニウム、臭化ラウリルジメチルベンジルアンモニウム、塩化ラウリルジメチル(エテノキシ)4アンモニウム、臭化ラウリルジメチル(エテノキシ)4アンモニウム、塩化N-アルキル(C12-18)ジメチルベンジルアンモニウム、塩化N-アルキル(C14-18)ジメチルベンジルアンモニウム、塩化N-テトラデシリドメチルベンジルアンモニウム一水和物、塩化ジメチルジデシルアンモニウム、塩化N-アルキル(C12-14)ジメチル1-ナフチルメチルアンモニウム、ハロゲン化トリメチルアンモニウム、アルキルトリメチルアンモニウム塩、ジアルキルジメチルアンモニウム塩、塩化ラウリルトリメチルアンモニウム、エトキシ化されたアルキルアミドアルキルジアルキルアンモニウム塩、エトキシ化されたトリアルキルアンモニウム塩、塩化ジアルキルベンゼンジアルキルアンモニウム、塩化N-ジデシルジメチルアンモニウム、塩化N-テトラデシルジメチルベンジルアンモニウム一水和物、塩化N-アルキル(C12-14)ジメチル1-ナフチルメチルアンモニウム、塩化ドデシルジメチルベンジルアンモニウム、塩化ジアルキルベンゼンアルキルアンモニウム、塩化ラウリルトリメチルアンモニウム、塩化アルキルベンジルメチルアンモニウム、臭化アルキルベンジルジメチルアンモニウム、臭化C12トリメチルアンモニウム、臭化C15トリメチルアンモニウム、臭化C17トリメチルアンモニウム、塩化ドデシルベンジルトリエチルアンモニウム、ポリ塩化ジアリルジメチルアンモニウム(DADMAC)、塩化ジメチルアンモニウム、ハロゲン化アルキルジメチルアンモニウム、塩化トリセチルメチルアンモニウム、臭化デシルトリメチルアンモニウム、臭化ドデシルトリエチルアンモニウム、臭化テトラデシルトリメチルアンモニウム、塩化メチルトリオクチルアンモニウム、POLYQUAT 10(商標)、臭化テトラブチルアンモニウム、臭化ベンジルトリメチルアンモニウム、コリンエステル、塩化ベンザルコニウム、塩化ステアルアルコニウム(stearalkonium)化合物、臭化セチルピリジニウム、塩化セチルピリジニウム、4級化されたポリオキシエチルアルキルアミンのハロゲン化物塩、MIRAPOL(商標)、ALKAQUAT(商標)、アルキルピリジニウム塩、アミン、アミン塩、アミンオキシド、イミドアゾリニウム塩、プロトン化第4級アクリルアミド、メチル化第4級ポリマー、カチオン性グアール、ポリメチルメタクリル酸臭化トリメチルアンモニウム、ポリビニルピロリドン-2-ジメチルアミノエチルメタクリル酸ジメチル硫酸、臭化ヘキサデシルトリメチルアンモニウム、ポリ(臭化2-メタクリルオキシエチルトリメチルアンモニウム)(S1001)、ポリ(N-ビニルピロリドン/2-ジメチルアミノエチルメタクリル酸)ジメチル硫酸第4級(S1002)、およびポリ(塩化2-メチルアクリルオキシアミドプロピルトリメチルアンモニウム)(S1004)からなる群より選択される、請求項1−23のいずれか1項記載の組成物。
【請求項27】
2つ以上の表面安定化剤からなる、請求項1−26記載の組成物。
【請求項28】
表面安定化剤として、ラウリル硫酸ナトリウム、ジオクチルスルホコハク酸ナトリウム、またはそれらの組み合わせからなる、請求項1−27のいずれか1項記載の組成物。
【請求項29】
(a) (i) 少なくとも1つの溶解度の低いナノ微粒子活性物質およびその表面に吸着した少なくとも1つの表面安定化剤であって、上記ナノ微粒子活性物質が約1000nm未満の有効平均粒径を有するものと、(ii) 約1ミクロンより大きく、約10ミクロンより小さい有効平均粒径を有する少なくとも1つのミクロ微粒子活性物質とを組み合わせ、
(b) 適当な製剤を形成する
ことからなる、製剤を調製する方法。
【請求項30】
ミクロ微粒子活性物質粒子が乾式粉砕により調製される、請求項29記載の方法。
【請求項31】
ミクロ微粒子、ナノ微粒子、または両方の活性物質粒子が湿式粉砕により調製される、請求項29または30記載の方法。
【請求項32】
粒子の表面に吸着した少なくとも1つの表面安定化剤を有するナノ微粒子活性物質粒子を、噴霧乾燥、噴霧造粒、凍結乾燥、または関連する製薬上許容される乾燥工程により乾燥粉末マトリックスに組み入れた後、乾式混合または同様の混合工程により前記微細化活性物質粒子のバルクと組み合わせる、請求項29−31のいずれか1項記載の方法。
【請求項33】
(a) 粒子の表面に吸着した少なくとも1つの表面安定化剤を有するナノ微粒子活性物質粒子を、噴霧乾燥、噴霧造粒、凍結乾燥、または関連する製薬上許容される乾燥工程により乾燥粉末マトリックスに組み入れ、
(b) 前記微細化活性物質粒子を、噴霧乾燥、噴霧造粒、凍結乾燥、または関連する製薬上許容される乾燥工程により乾燥粉末マトリックスに組み入れ、
(c) (a)および(b)から得られたマトリックスを乾式混合または同様の混合工程により組み合わせる、
請求項29−32のいずれか1項記載の方法。
【請求項34】
ミクロ微粒子活性物質粒子が、ナノ微粒子活性物質/表面安定化剤粒子によりコーティングされている、請求項29−31のいずれか1項記載の方法。
【請求項35】
コーティングが、噴霧造粒、回転造粒、噴霧コーティング、または関連する製薬工程からなる群より選択される方法により達成される、請求項34記載の方法。
【請求項36】
ミクロ微粒子活性物質粒子が、高剪断造粒または関連する製薬湿式混合工程の基体として用いられ(ここで、ナノ微粒子活性物質/表面安定化剤粒子は造粒液の形態で適用される)、乾燥した後に得られる固体のマトリックス中に、ナノ微粒子活性物質粒子およびミクロ微粒子活性物質粒子が均一に分散している、請求項29−31のいずれか1項記載の方法。
【請求項37】
ナノ微粒子活性物質/表面安定化剤粒子およびミクロ微粒子活性物質粒子を、固形の急速崩壊型マトリックスに組み入れるための乾燥粉末または粉末混合物に製剤した後、前記乾燥粉末または粉末混合物を錠剤圧縮機または同様の製薬上許容される圧縮機を用いて圧縮して錠剤を形成する、請求項29−36のいずれか1項記載の方法。
【請求項38】
哺乳類を治療するのに有用な医薬品を製造するための、請求項1記載の組成物の使用。
【請求項1】
(a) 少なくとも1つの約1ミクロン未満の有効平均粒径を有する溶解度の低い活性物質粒子;
(b) 上記のナノ微粒子活性物質粒子の表面に吸着した少なくとも1つの表面安定化剤;および
(c) (a)の活性物質と同一であるか、または異なっており、約1ミクロンよりも大きく、約100ミクロンよりも小さい有効平均粒径を有する、少なくとも1つの微細化活性物質
からなる組成物。
【請求項2】
ナノ微粒子活性物質粒子の有効平均粒径が、約900nm未満、約800nm未満、約700nm未満、約600nm未満、約500nm未満、約400nm未満、約300nm未満、約250nm未満、約200nm未満、約150nm未満、約100nm未満、および約50nm未満からなる群より選択される、請求項1記載の組成物。
【請求項3】
ミクロ微粒子活性物質粒子の有効平均粒径が、約1ミクロンより大きく、且つ約90ミクロン未満、約80ミクロン未満、約70ミクロン未満、約60ミクロン未満、約50ミクロン未満、約40ミクロン未満、約30ミクロン未満、約20ミクロン未満、約10ミクロン未満、約9ミクロン未満、約8ミクロン未満、約7ミクロン未満、約6ミクロン未満、約5ミクロン未満、約4ミクロン未満、約3ミクロン未満、および約2ミクロン未満からなる群より選択される粒径よりも小さい、請求項1または2記載の組成物。
【請求項4】
それぞれの粒子の集団が約1ミクロン未満の有効平均粒径を有するような、2つ以上のナノ微粒子活性物質粒子の集団からなる、請求項1−3のいずれか1項記載の組成物。
【請求項5】
それぞれの粒子の集団が約1ミクロンより大きく、約100ミクロンより小さい有効平均粒径を有するような、2つ以上のミクロ微粒子活性物質粒子の集団からなる、請求項1−4のいずれか1項記載の組成物。
【請求項6】
ナノ微粒子活性物質の濃度が、ナノ微粒子活性物質および表面安定化剤の総重量に基づいて、約99.5%から約0.001%である、請求項1−5のいずれか1項記載の組成物。
【請求項7】
ナノ微粒子活性物質の濃度が、ナノ微粒子活性物質および表面安定化剤の総重量に基づいて、約95%から約0.1% (w/w)である、請求項1−6のいずれか1項記載の組成物。
【請求項8】
ナノ微粒子活性物質の濃度が、ナノ微粒子活性物質および表面安定化剤の総重量に基づいて、約90%から約0.5% (w/w)である、請求項1−7のいずれか1項記載の組成物。
【請求項9】
表面安定化剤の濃度が、ナノ微粒子活性物質および表面安定化剤の総重量に基づいて、約0.5%から約99.999% (w/w)である、請求項1−8のいずれか1項記載の組成物。
【請求項10】
表面安定化剤の濃度が、ナノ微粒子活性物質および表面安定化剤の総重量に基づいて、約5%から約99.9% (w/w)である、請求項1−9のいずれか1項記載の組成物。
【請求項11】
表面安定化剤の濃度が、ナノ微粒子活性物質および表面安定化剤の総重量に基づいて、約10%から約99.5% (w/w)である、請求項1−10のいずれか1項記載の組成物。
【請求項12】
ミクロ微粒子薬物の濃度が、ミクロ微粒子活性物質、ナノ微粒子活性物質、および表面安定化剤の総重量に基づいて、約5%から約85%である、請求項1−11のいずれか1項記載の組成物。
【請求項13】
固形の、急速崩壊型の「無水錠剤」マトリックスに製剤化された、請求項1−12のいずれか1項記載の組成物。
【請求項14】
製薬上許容される錠剤に製剤化された、請求項1−12のいずれか1項記載の組成物。
【請求項15】
製薬上許容される硬ゼラチンカプセルに製剤化された、請求項1−12のいずれか1項記載の組成物。
【請求項16】
製薬上許容される軟ゼラチンカプセルに製剤化された、請求項1−12のいずれか1項記載の組成物。
【請求項17】
組成物が、ナノ微粒子活性物質粒子に代えて、可溶化された活性物質を含む、請求項16記載の組成物。
【請求項18】
製薬上許容されるロゼンジまたはトローチに製剤化された、請求項1−12のいずれか1項記載の組成物。
【請求項19】
製薬上許容される小袋、粉末、または「スプリンクル」に製剤化された、請求項1−12のいずれか1項記載の組成物。
【請求項20】
経口、直腸、腟内、注射用、肺、鼻内、口腔内、局所(topical, local)、槽内、腹腔内、眼内、耳内、口中スプレー、または鼻内スプレー投与用剤形に製剤化された、請求項1−19のいずれか1項記載の組成物。
【請求項21】
噴霧乾燥、噴霧造粒、流動床造粒、高剪断造粒、流動床乾燥、凍結乾燥、打錠、ジェット粉砕、ピン粉砕、湿式粉砕、回転造粒、および噴霧コーティングからなる群より選択される少なくとも1つの方法を利用して製剤化された、請求項1−20のいずれか1項記載の組成物。
【請求項22】
ナノ微粒子およびミクロ微粒子活性物質が、タンパク質、ペプチド、ヌクレオチド、抗肥満薬、栄養補給食品、コルチコステロイド、エラスターゼ阻害剤、抗真菌薬、腫瘍治療薬、制吐薬、鎮痛薬、心血管薬、抗炎症薬、駆虫薬、抗不整脈薬、抗生物質、抗凝血薬、抗うつ薬、抗糖尿病薬、抗てんかん薬、抗ヒスタミン薬、抗高血圧薬、抗ムスカリン薬、抗ミコバクテリア薬、抗腫瘍薬、免疫抑制薬、抗甲状腺薬、抗ウイルス薬、抗不安薬、鎮静薬、収斂薬、β-アドレナリン受容体遮断薬、血液製品および代替物、心臓変力薬、造影剤、コルチコステロイド、鎮咳薬、診断薬、診断画像薬、利尿薬、ドパミン作動薬、止血薬、免疫薬、脂質調節薬、筋弛緩薬、副交感神経作動薬、上皮小体カルシトニンおよびビホスホネート、プロスタグランジン、放射性医薬品、性ホルモン、抗アレルギー薬、興奮薬および食欲抑制薬、交感神経作動薬、乾燥甲状腺製剤、血管拡張薬およびキサンチンからなる群より選択される、請求項1−21のいずれか1項記載の組成物。
【請求項23】
少なくとも1つの表面安定化剤が、非イオン性表面安定化剤、アニオン性表面安定化剤、カチオン性表面安定化剤、およびイオン性表面安定化剤からなる群より選択される、請求項1−22のいずれか1項記載の組成物。
【請求項24】
少なくとも1つの表面安定化剤が、塩化セチルピリジニウム、ゼラチン、カゼイン、ホスファチド、デキストラン、グリセリン、アラビアゴム、コレステロール、トラガカント、ステアリン酸、ステアリン酸エステルおよび塩、ステアリン酸カルシウム、モノステアリン酸グリセリン、セトステアリルアルコール、セトマクロゴール乳化ワックス、ソルビタンエステル、ポリオキシエチレンアルキルエーテル、ポリオキシエチレンヒマシ油誘導体、ポリオキシエチレンソルビタン脂肪酸エステル、ポリエチレングリコール、臭化ドデシルトリメチルアンモニウム、ステアリン酸ポリオキシエチレン、コロイド二酸化ケイ素、リン酸塩、ドデシル硫酸ナトリウム、カルボキシメチルセルロースカルシウム、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、カルボキシメチルセルロースナトリウム、メチルセルロース、ヒドロキシエチルセルロース、フタル酸ヒドロキシプロピルメチルセルロース、非結晶セルロース、マグネシウムアルミニウムシリケート、トリエタノールアミン、ポリビニルアルコール、ポリビニルピロリドン、4-(1,1,3,3-テトラメチルブチル)-フェノールとエチレンオキシドおよびホルムアルデヒドとのポリマー、ポロキサマー、ポロキサミン、荷電リン脂質、ジミリストイルホスファチジルグリセリン、ジオクチルスルホコハク酸塩、スルホコハク酸ナトリウムのジアルキルエステル、ラウリル硫酸ナトリウム、アルキルアリールポリエーテルスルホネート、ステアリン酸スクロースおよびジステアリン酸スクロースの混合物、-(-PEO)--(-PBO-)--(-PEO-)-の構造のトリブロック共重合体、p-イソノニルフェノキシポリ-(グリシドール)、デカノイル-N-メチルグルカミド、n-デシルβ-D-グルコピラノシド、n-デシルβ-D-マルトピラノシド、n-ドデシルβ-D-グルコピラノシド、n-ドデシルβ-D-マルトシド、ヘプタノイル-N-メチルグルカミド、n-ヘプチル-β-D-グルコピラノシド、n-ヘプチルβ-D-チオグルコシド、n-ヘキシルβ-D-グルコピラノシド、ノナノイル-N-メチルグルカミド、n-ノイルβ-D-グルコピラノシド、オクタノイル-N-メチルグルカミド、n-オクチルβ-D-グルコピラノシド、オクチルβ-D-チオグルコピラノシド、リソザイム、PEG誘導体化リン脂質、PEG誘導体化コレステロール、PEG誘導体化コレステロール誘導体、PEG誘導体化ビタミンA、PEG誘導体化ビタミンE、および酢酸ビニルとビニルピロリドンのランダム共重合体からなる群より選択される、請求項1−23のいずれか1項記載の組成物。
【請求項25】
少なくとも1つのカチオン性表面安定化剤が、高分子、生体高分子、多糖、セルロース、アルギン酸塩、非高分子化合物、およびリン脂質からなる群より選択される、請求項1−23のいずれか1項記載の組成物。
【請求項26】
少なくとも1つの表面安定化剤が、カチオン性脂質、塩化ベンザルコニウム、スルホニウム化合物、ホスホニウム化合物、第4級アンモニウム化合物、臭化ベンジル-ジ(2-クロロエチル) エチルアンモニウム、塩化ヤシ油トリメチルアンモニウム、臭化ヤシ油トリメチルアンモニウム、塩化ヤシ油メチルジヒドロキシエチルアンモニウム、臭化ヤシ油メチルジヒドロキシエチルアンモニウム、塩化デシルトリエチルアンモニウム、塩化デシルジメチルヒドロキシエチルアンモニウム、塩化臭化デシルジメチルヒドロキシエチルアンモニウム(訳者注:「塩化」は不要。誤記と思われる)、塩化C12-15ジメチルヒドロキシエチルアンモニウム、塩化臭化C12-15ジメチルヒドロキシエチルアンモニウム(訳者注:同上)、塩化ヤシ油ジメチルヒドロキシエチルアンモニウム、臭化ヤシ油ジメチルヒドロキシエチルアンモニウム、メチル硫酸ミリスチルトリメチルアンモニウム、塩化ラウリルジメチルベンジルアンモニウム、臭化ラウリルジメチルベンジルアンモニウム、塩化ラウリルジメチル(エテノキシ)4アンモニウム、臭化ラウリルジメチル(エテノキシ)4アンモニウム、塩化N-アルキル(C12-18)ジメチルベンジルアンモニウム、塩化N-アルキル(C14-18)ジメチルベンジルアンモニウム、塩化N-テトラデシリドメチルベンジルアンモニウム一水和物、塩化ジメチルジデシルアンモニウム、塩化N-アルキル(C12-14)ジメチル1-ナフチルメチルアンモニウム、ハロゲン化トリメチルアンモニウム、アルキルトリメチルアンモニウム塩、ジアルキルジメチルアンモニウム塩、塩化ラウリルトリメチルアンモニウム、エトキシ化されたアルキルアミドアルキルジアルキルアンモニウム塩、エトキシ化されたトリアルキルアンモニウム塩、塩化ジアルキルベンゼンジアルキルアンモニウム、塩化N-ジデシルジメチルアンモニウム、塩化N-テトラデシルジメチルベンジルアンモニウム一水和物、塩化N-アルキル(C12-14)ジメチル1-ナフチルメチルアンモニウム、塩化ドデシルジメチルベンジルアンモニウム、塩化ジアルキルベンゼンアルキルアンモニウム、塩化ラウリルトリメチルアンモニウム、塩化アルキルベンジルメチルアンモニウム、臭化アルキルベンジルジメチルアンモニウム、臭化C12トリメチルアンモニウム、臭化C15トリメチルアンモニウム、臭化C17トリメチルアンモニウム、塩化ドデシルベンジルトリエチルアンモニウム、ポリ塩化ジアリルジメチルアンモニウム(DADMAC)、塩化ジメチルアンモニウム、ハロゲン化アルキルジメチルアンモニウム、塩化トリセチルメチルアンモニウム、臭化デシルトリメチルアンモニウム、臭化ドデシルトリエチルアンモニウム、臭化テトラデシルトリメチルアンモニウム、塩化メチルトリオクチルアンモニウム、POLYQUAT 10(商標)、臭化テトラブチルアンモニウム、臭化ベンジルトリメチルアンモニウム、コリンエステル、塩化ベンザルコニウム、塩化ステアルアルコニウム(stearalkonium)化合物、臭化セチルピリジニウム、塩化セチルピリジニウム、4級化されたポリオキシエチルアルキルアミンのハロゲン化物塩、MIRAPOL(商標)、ALKAQUAT(商標)、アルキルピリジニウム塩、アミン、アミン塩、アミンオキシド、イミドアゾリニウム塩、プロトン化第4級アクリルアミド、メチル化第4級ポリマー、カチオン性グアール、ポリメチルメタクリル酸臭化トリメチルアンモニウム、ポリビニルピロリドン-2-ジメチルアミノエチルメタクリル酸ジメチル硫酸、臭化ヘキサデシルトリメチルアンモニウム、ポリ(臭化2-メタクリルオキシエチルトリメチルアンモニウム)(S1001)、ポリ(N-ビニルピロリドン/2-ジメチルアミノエチルメタクリル酸)ジメチル硫酸第4級(S1002)、およびポリ(塩化2-メチルアクリルオキシアミドプロピルトリメチルアンモニウム)(S1004)からなる群より選択される、請求項1−23のいずれか1項記載の組成物。
【請求項27】
2つ以上の表面安定化剤からなる、請求項1−26記載の組成物。
【請求項28】
表面安定化剤として、ラウリル硫酸ナトリウム、ジオクチルスルホコハク酸ナトリウム、またはそれらの組み合わせからなる、請求項1−27のいずれか1項記載の組成物。
【請求項29】
(a) (i) 少なくとも1つの溶解度の低いナノ微粒子活性物質およびその表面に吸着した少なくとも1つの表面安定化剤であって、上記ナノ微粒子活性物質が約1000nm未満の有効平均粒径を有するものと、(ii) 約1ミクロンより大きく、約10ミクロンより小さい有効平均粒径を有する少なくとも1つのミクロ微粒子活性物質とを組み合わせ、
(b) 適当な製剤を形成する
ことからなる、製剤を調製する方法。
【請求項30】
ミクロ微粒子活性物質粒子が乾式粉砕により調製される、請求項29記載の方法。
【請求項31】
ミクロ微粒子、ナノ微粒子、または両方の活性物質粒子が湿式粉砕により調製される、請求項29または30記載の方法。
【請求項32】
粒子の表面に吸着した少なくとも1つの表面安定化剤を有するナノ微粒子活性物質粒子を、噴霧乾燥、噴霧造粒、凍結乾燥、または関連する製薬上許容される乾燥工程により乾燥粉末マトリックスに組み入れた後、乾式混合または同様の混合工程により前記微細化活性物質粒子のバルクと組み合わせる、請求項29−31のいずれか1項記載の方法。
【請求項33】
(a) 粒子の表面に吸着した少なくとも1つの表面安定化剤を有するナノ微粒子活性物質粒子を、噴霧乾燥、噴霧造粒、凍結乾燥、または関連する製薬上許容される乾燥工程により乾燥粉末マトリックスに組み入れ、
(b) 前記微細化活性物質粒子を、噴霧乾燥、噴霧造粒、凍結乾燥、または関連する製薬上許容される乾燥工程により乾燥粉末マトリックスに組み入れ、
(c) (a)および(b)から得られたマトリックスを乾式混合または同様の混合工程により組み合わせる、
請求項29−32のいずれか1項記載の方法。
【請求項34】
ミクロ微粒子活性物質粒子が、ナノ微粒子活性物質/表面安定化剤粒子によりコーティングされている、請求項29−31のいずれか1項記載の方法。
【請求項35】
コーティングが、噴霧造粒、回転造粒、噴霧コーティング、または関連する製薬工程からなる群より選択される方法により達成される、請求項34記載の方法。
【請求項36】
ミクロ微粒子活性物質粒子が、高剪断造粒または関連する製薬湿式混合工程の基体として用いられ(ここで、ナノ微粒子活性物質/表面安定化剤粒子は造粒液の形態で適用される)、乾燥した後に得られる固体のマトリックス中に、ナノ微粒子活性物質粒子およびミクロ微粒子活性物質粒子が均一に分散している、請求項29−31のいずれか1項記載の方法。
【請求項37】
ナノ微粒子活性物質/表面安定化剤粒子およびミクロ微粒子活性物質粒子を、固形の急速崩壊型マトリックスに組み入れるための乾燥粉末または粉末混合物に製剤した後、前記乾燥粉末または粉末混合物を錠剤圧縮機または同様の製薬上許容される圧縮機を用いて圧縮して錠剤を形成する、請求項29−36のいずれか1項記載の方法。
【請求項38】
哺乳類を治療するのに有用な医薬品を製造するための、請求項1記載の組成物の使用。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2010−47599(P2010−47599A)
【公開日】平成22年3月4日(2010.3.4)
【国際特許分類】
【出願番号】特願2009−242799(P2009−242799)
【出願日】平成21年10月21日(2009.10.21)
【分割の表示】特願2003−533905(P2003−533905)の分割
【原出願日】平成14年10月11日(2002.10.11)
【出願人】(500370883)エラン ファーマ インターナショナル,リミティド (45)
【Fターム(参考)】
【公開日】平成22年3月4日(2010.3.4)
【国際特許分類】
【出願日】平成21年10月21日(2009.10.21)
【分割の表示】特願2003−533905(P2003−533905)の分割
【原出願日】平成14年10月11日(2002.10.11)
【出願人】(500370883)エラン ファーマ インターナショナル,リミティド (45)
【Fターム(参考)】
[ Back to top ]

