哺乳動物組織材料の前処理方法
【課題】 異常型プリオン蛋白(PrPSc)の検出や測定値に悪影響を及ぼすことがなく、少ない工程数で短時間の内にその前処理を完了することが可能な、PrPScの検出又は測定用の試料を調製するための哺乳動物組織材料の前処理方法を提供する。
【解決手段】 採取した哺乳動物組織材料に、界面活性剤とプロティナーゼKとを含んでなる分解酵素混液を加えてホモジナイズ処理する可溶化PrPC分解工程を備える。また、分解酵素混液に、DNA分解酵素及び/又はRNA分解酵素及び/又はコラーゲン分解酵素を添加する。
【解決手段】 採取した哺乳動物組織材料に、界面活性剤とプロティナーゼKとを含んでなる分解酵素混液を加えてホモジナイズ処理する可溶化PrPC分解工程を備える。また、分解酵素混液に、DNA分解酵素及び/又はRNA分解酵素及び/又はコラーゲン分解酵素を添加する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、哺乳動物組織材料の前処理方法に係り、特に、プリオン病発症の際など哺乳動物組織に蓄積する異常型プリオン蛋白(PrPSc)につき、主にウェスタンブロット法(WB法)や酵素免疫測定法(ELISAを含むEIA法)等による検出又は測定用の試料を調製するための哺乳動物組織材料の前処理方法に関する。
【背景技術】
【0002】
哺乳動物のプリオン病には、ヒトにおける代表的疾患としてクロイツフェルト・ヤコブ病(CJD)の他、遺伝性プリオン病であるゲルストマン・ストロイスラー・シャインカー症候群(Gerstmann−Straussler−Scheinker Syndrome:GSS)や、致死性家族性不眠症、クールー(Kuru)などがある。CJDは、病因が不明の散発性CJD、遺伝性の家族性CJD、ウシ海綿状脳症(BSE)からの経口感染による変異型CJD〔例えば、非特許文献1参照〕、ヒト下垂体の抽出製剤やヒト由来硬膜、角膜等を介する感染による医原性CJDなどに区分されるが、異常型プリオン蛋白(PrPSc)が中枢神経系に蓄積する点では共通している。一方、変異型CJDでは、扁桃などのリンパ組織にもPrPScが認められている〔例えば、非特許文献2参照〕。BSEは、ヒツジやヤギのスクレイピー臓器などにより汚染した配合飼料からの感染によるものとされており、スクレイピーと同様に中枢神経系などに変性を認めPrPScが沈着するが、リンパ組織にPrPScの沈着が認められない点でスクレイピーとは異なっている〔例えば、非特許文献3参照〕。
【0003】
BSEについては、これまで組織病理学的、臨床学的、疫学的方法を用いて検出が行われており、脳幹(延髄)組織を採取し、正常プリオン蛋白(PrPC)ではプロティナーゼK(PK)により完全に分解されるが、PrPScの凝集体ではPKで分解した後に残る「PrP27−30」と呼ばれるフラグメントをプリオン蛋白質(PrPC、PrPSc)特異抗体と反応させることによりPrPScを検出又は測定するWB法やELISA法を用いる検査キットが市販されている〔例えば、非特許文献4参照〕。このような検査キットによりPrPScを検出又は測定するための試料調製法(延髄組織からの前処理法)は、各検査キット毎に異なり、それぞれ操作手順が示されている。例えば、A社製検査キットの前処理手順では、延髄組織500±40mgをホモジナイザーバッグに取り、16%メタノール混合15%陰イオン性界面活性剤(ラウリル硫酸ナトリウム)溶液を加えて2分間ホモジナイズし、5〜10分間静置した後、ホモジネート(脳乳剤)180μLを遠心用マイクロプレートに移して18〜30℃、2750×gにて5分間遠心分離する。次に上清100μLを、PK溶液20μLをあらかじめ入れたアッセイプレートに採取し、34℃、60分間、PK消化処理した後、塩酸グアニジン溶液150μLを加えて34℃にて15分間変性処理している。
【0004】
B社製検査キットの前処理手順では、延髄組織350±40mgを1.4mLのブドウ糖液とビーズの入った2mLマイクロチューブに入れ、ビーズ式破砕機を用いて完全にホモジナイズする。得られたホモジネート500μLを別の2mLマイクロチューブに採り、2M 尿素を含むPK溶液500μLを加えて37℃にて10分間、反応させた後、250μLの1−ブタノールを添加、撹拌し、20000×gにて5分間遠心分離する。得られた沈殿物を5分間乾燥した後、6M尿素50μLを加えて100℃、5分間変性処理を行い、希釈液で6倍希釈するようになっている。
【0005】
また、以上のような前処理法の他に、例えば、脳組織及び脾臓組織をハサミで細かく切り刻んだ組織サンプルについて、界面活性剤〔(8%Zwittergent3−12(商品名)、カルビオケミカル社製)、サーコシル(Sarkosyl(商品名)、シグマ社製:C15H25NO3 Na)〕と、100mM塩化ナトリウムと、5mM塩化マグネシウムと、50mM、pH=7.5のトリス−塩酸緩衝液(Tris−HCl)とを加えて、脳組織を均一化することによって、均一化物(ホモジネート)を作製し(第1の工程)、次に、第2の工程において、分解(消化)処理するものがある(例えば、特許文献1参照)。消化処理する第2の工程では、第1の工程で得たホモジネートを、0.5mg/100mgコラゲナーゼ及び40μg/100mgのDNaseを用いて、温度37℃、4〜12時間、分解(消化)処理を行い、さらに、50μg/100mgのPK(ProteinaseK)を用いて、温度37℃、0.5〜2時間、消化処理を行っている。次いで第3の工程において、反応を停止した後、回転数15,000rpm、室温で20分間遠心分離を行い、5%ドデシル硫酸ナトリウムで10分間加熱溶解させ、PrPSc含有の濃縮物を得ている。
【0006】
【特許文献1】特開平11−32795号公報、(実施例、第1図〜第3図など)
【非特許文献1】Will,R.G. et al;Lancet Vol.347、pp.921−925(1996)
【非特許文献2】Hill,A.F. et al;Lancet Vol.349、pp.99−100(1997)
【非特許文献3】O′Rourke,K.I. et al;J.Clin.Microbiol. Vol.38、pp.3254−3259(2000)
【非特許文献4】能田健、永井英貴、平沢緑著、獣医畜産新報、56巻、9号、719〜725頁、(2003年)
【発明の開示】
【発明が解決しようとする課題】
【0007】
上記A社及びB社検査キットの前処理手順、並びに、特許文献1に記載のPrPScの濃縮法などによれば、採取した哺乳動物組織材料に含まれるPrPCが分解され、WB法やELISA法等によりPrPScを検出又は測定するために適し、可溶化されたPrPScを高回収率にて含有する試料を調製することはできるが、前処理の工程数が多く操作が煩雑であり、処理に長時間を要するという問題があった。特に、BSE検査の場合では、20分間程で解体処理された動物の各処理体を、それぞれの検査結果が判明するまで冷凍又は冷蔵保管するための大規模な保管設備が必要となっている。また、単に各工程における処理時間を短縮したり、工程数を減らした場合には、PrPCの分解や夾雑蛋白などの非特異物質の除去が不充分となったり、PrPScの回収率が低下するなど、PrPScの検出や測定値に影響を及ぼすという問題が発生する。
【0008】
本発明は、上記のような問題に鑑みてなされたものであり、PrPScの検定や測定値に悪影響を及ぼすことがなく、少ない工程数で短時間の内にその前処理を完了することが可能な、PrPScの検出又は測定用の試料を調製するための哺乳動物組織材料の前処理方法を提供することを目的とする。
【課題を解決するための手段】
【0009】
上記目的を達成するため、本発明による哺乳動物組織材料の前処理方法は、異常型プリオン蛋白(PrPSc)の検出又は測定用試料を調製するための哺乳動物組織材料の前処理方法であって;採取した哺乳動物組織材料に、界面活性剤とプロティナーゼK(PK)とを含んでなる分解酵素混液を加えてホモジナイズ処理を施すことによって、哺乳動物組織材料を可溶化すると共に正常プリオン蛋白(PrPC)を分解する可溶化PrPC分解工程を備えることを特徴とする。
【0010】
このような哺乳動物組織材料の前処理方法において、哺乳動物組織材料が、ヒト、ウシ、ヤギ、ヒツジ、シカ、オオジカ、ミンク、ブタ、サル、マウス、ラット、ハムスター、ネコから選ばれた哺乳動物の延髄組織又は中枢神経組織であることが好ましく、また、分解酵素混液が、DNA分解酵素及び/又はRNA分解酵素及び/又はコラーゲン分解酵素を含むことが好適である。さらに、界面活性剤が、両性界面活性剤を含むものであることが好ましく、さらにまた、界面活性剤が、両性界面活性剤と陰イオン界面活性剤との組み合わせからなることが良い。そして、両性界面活性剤が、ラウリン酸アミドプロピルヒドロキシスルホベタイン(LSB)、ラウリン酸アミドプロピルベタイン(LPB)、コカミドプロピルベタイン(CPB)、カプリン酸プロピルベタイン(CAPB)、n−ドデシル−N,N−ジメチルグリシン(DDGly)、ラウリルアミノプロピオン酸(LAPA)、n−ドデシル−N,N−(ジメチルアンモニオ)ブチル酸(DDMAB)、n−ドデシル−N,N−(ジメチルアンモニオ)ウンデカン酸(DDMAU)、3−[(3−コラミドプロピル)ジメチルアンモニオ]−1−プロパンスルホン酸(CHAPS)、3−[(3−コラミドプロピル)ジメチルアンモニオ]−2−ヒドロキシ−1−プロパンスルホン酸(CHAPSO)、又はこれらの塩から1以上選ばれたものであることが好適であり、また、陰イオン界面活性剤が、ドデシル硫酸ナトリウム(SDS)、ラウロイルサルコシン(LSarc)、ココイルサルコシンナトリウム、ドデカノイルサルコシンナトリウム、ラウロイルメチル−β−アラニンナトリウム、コール酸ナトリウム(SChol)、デオキシコール酸ナトリウム(SDChol)、グリココール酸ナトリウム、タウロコール酸ナトリウムから1以上選ばれたものであることが良く、さらに、分解酵素混液中の界面活性剤の配合割合を0.1乃至30重量%とすることが好ましい。
【0011】
以上のような哺乳動物組織材料の前処理方法において、可溶化PrPC分解工程におけるホモジナイズ処理は、容器内にビーズを入れたビーズ式破砕機によって行うことが好ましく、また、可溶化PrPC分解工程において、ホモジナイズ処理したのち、20℃以上、70℃以下、より好ましくは35℃以上、55℃以下の温度で加温することが好適であり、さらに、可溶化PrPC分解工程におけるホモジナイズ処理を20℃以上、70℃以下、より好ましくは35℃以上、55℃以下の温度条件下にて実施することもできる。そして、可溶化PrPC分解工程で得られた処理液に、PK阻害剤と粉末状尿素とを添加して加熱する蛋白変性処理工程(A)を含むことが好適であり、また、前記可溶化PrPC分解工程で得られた処理液に、蛋白沈殿化剤を加えて撹拌後遠心分離して得られる沈殿物につき、尿素液を添加して加熱する蛋白変性処理工程(B)を含むこともでき、さらに、このような蛋白変性処理工程で得られた蛋白変性処理済液に、希釈液を添加して、PrPScの検出又は測定用試料とすることが好ましい。なお、可溶化PrPC分解工程で得られた処理液に、PK阻害剤を加えるPK阻害剤添加工程を含むことができ、さらに、このようなPK阻害剤添加工程で得られた処理液に、希釈液を添加して、PrPScの検出又は測定用試料とすることも良い。
【発明の効果】
【0012】
本発明によれば、界面活性剤とPKとを含んでなる分解酵素混液を加えてホモジナイズ処理を施すことによって、哺乳動物組織材料を可溶化すると共に正常プリオン蛋白(PrPC)を分解することから、PrPScの検出や測定に悪影響を及ぼすことなく処理工程を減じることができ、処理時間の短縮が可能である。また、哺乳動物組織材料は、ヒト、ウシ、ヤギ、ヒツジ、シカ、オオジカ、ミンク、ブタ、サル、マウス、ラット、ハムスター、ネコなどプリオン病に羅患する可能性のある如何なる哺乳動物における、如何なる組織材料にも適応できる。動物組織材料のうち、例えばウシでは、PrPScが最も多く蓄積すると言われており、比較的その可溶化が困難な延髄組織であっても15分間以内程度の短時間のうちに効率良く澄明な状態に可溶化することができる。界面活性剤とPKに加えてDNA分解酵素及び/又はRNA分解酵素及び/又はコラーゲン分解酵素を含む分解酵素混液を用い、ホモジナイズ処理を行うことで、より確実に哺乳動物組織材料を可溶化すると共にPrPCを分解することが可能である。分解酵素混液に添加する界面活性剤として、例えば、ラウリン酸アミドプロピルヒドロキシスルホベタイン(LSB)、ラウリン酸アミドプロピルベタイン(LPB)、コカミドプロピルベタイン(CPB)、カプリン酸プロピルベタイン(CAPB)、n−ドデシル−N,N−ジメチルグリシン(DDGly)、ラウリルアミノプロピオン酸(LAPA)、n−ドデシル−N,N−(ジメチルアンモニオ)ブチル酸(DDMAB)、n−ドデシル−N,N−(ジメチルアンモニオ)ウンデカン酸(DDMAU)、3−[(3−コラミドプロピル)ジメチルアンモニオ]−1−プロパンスルホン酸(CHAPS)、3−[(3−コラミドプロピル)ジメチルアンモニオ]−2−ヒドロキシ−1−プロパンスルホン酸(CHAPSO)、又はこれらの塩から1以上選ばれた両性界面活性剤を用いることで、中動物乃至大動物の組織材料であっても、より短時間の内に澄明な状態にまで哺乳動物組織材料を可溶化できることがある。また、界面活性剤として、両性界面活性剤と陰イオン界面活性剤との組み合わせとすることで、哺乳動物組織材料をさらに効率良く可溶化できる場合がある。
【0013】
可溶化PrPC分解工程において、ホモジナイズ処理したのち、20℃以上、70℃以下、より好ましくは35℃以上、55℃以下の温度で加温(インキュベート)することで、より確実にPrPCを分解し、PrPScの検出や測定の感度、精度をさらに高める場合がある。蛋白変性処理工程(A)として、可溶化PrPC分解工程で得られた処理液に、PK阻害剤と粉末状尿素とを添加して加熱する方法を採用した場合には、処理液量が増加することがなく、蛋白変性処理工程の後段において遠心分離、再溶解操作などの濃縮工程を省略可能である点で有利である。蛋白変性処理工程(B)として、可溶化PrPC分解工程で得られた処理液に、ブタノールを加えて撹拌後、遠心分離して得られる沈殿物につき、尿素液を添加して加熱する方法を採用した場合には、PrPScの検出、測定用の試料中から、検出、測定の感度や精度を低下させる可能性のある非特異物質を予め減少或いは除去できることもある。
【発明を実施するための最良の形態】
【0014】
以下、本発明の哺乳動物における哺乳動物組織材料の前処理方法を実施するための最良の形態について、図面を参照して詳細に説明する。
【0015】
〔第1の実施形態〕
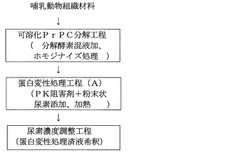
第1の実施形態による哺乳動物組織材料の前処理方法は、図1に前処理方法のフローを示すように、PrPScの検出又は測定用試料を調製するために採取された哺乳動物組織材料に、分解酵素混液を加えてホモジナイズ処理を施す可溶化PrPC分解工程を備えている。本第1の実施形態の前処理方法に用いられる哺乳動物組織材料としては、マウス、ラット、ハムスターなどの小動物からヒトを含むウシ、ヤギ、ヒツジ、シカ、オオジカ、ミンク、ブタ、サル、ネコなどの中動物乃至大動物に至る如何なる哺乳動物の組織材料であっても適用できる。例えば、BSEの検査では、PrPScが最も多く蓄積すると言われるウシ延髄の閂部組織について、病理組織検査や免疫組織化学検査による確定診断が行われており、WB法やEIA法等によるスクリーニングには、閂部延髄組織の中央で二分した半分を用いてPrPScの検出又は測定用の試料を調製することが適当とされている。ウシ延髄組織は、その可溶化が比較的困難な組織材料の内の一つであるが、界面活性剤とPKとを含んでなる分解酵素混液を加えてホモジナイズ処理を施すことによって、短時間内にほぼ澄明な状態にまでの組織材料可溶化とPrPC分解が可能である。
【0016】
本実施の形態における分解酵素混液に加える界面活性剤としては、両性界面活性剤、陰イオン界面活性剤、陽イオン界面活性剤、非イオン界面活性剤など如何なる界面活性剤であっても使用でき、複数の界面活性剤を併用しても良い。また、このような界面活性剤のうち、比較的親水性の高いものが好適であり、例えば、HLB値(吉田時行ら編、工学図書株式会社1987年発行「新版 界面活性剤ハンドブック」pp.234〜245、及び、日本油化学協会編、丸善株式会社1990年発行「改訂三版 油脂化学便覧」、pp.489−493)が6以上、40程度までの界面活性剤が良く、10以上のHLB値を有するものを用いることで、より効率良く短時間の内に可溶化できる場合がある。なお、界面活性剤のうち両性界面活性剤を用いることが好ましく、また、両性界面活性剤と陰イオン界面活性剤とを併用しても良く、このような場合には、前処理対象の哺乳動物組織材料をより効率良く可溶化できることもある。PKとしては、WB法や酵素免疫測定法(ELISAを含むEIA法)等による各種蛋白の検出又は測定用の試料を調製するための哺乳動物組織材料の前処理に通常用いられるようなPKであれば、如何なるPKであっても用いることができ、例えば、トリチラキウム アルブム(Tritirachium album)のような真菌由来のPK(EndopeptidaseK:EC 3.4.21.64)の他、細菌、真菌、酵母、動物細胞などを宿主細胞としPKと同等以上のPrPC分解活性を有する蛋白質を発現するように遺伝子組換された組換原核細胞又は組換真核細胞の産生物から得られるリコンビナントPKなども使用できる。
【0017】
分解酵素混液としては、界面活性剤とPKに加えて、DNA分解酵素及び/又はRNA分解酵素及び/又はコラーゲン分解酵素を含むものとすることができ、主成分として界面活性剤とPKとからなる分解酵素混液の場合に比して、より短時間の内に組織可溶化とPrPCの分解を可能とする点でより好ましい。また、分解酵素混液に界面活性剤とPKに加えて、DNA分解酵素及び/又はRNA分解酵素及び/又はコラーゲン分解酵素を添加する場合には、本実施形態の前処理法により得られるPrPScの検出、測定用の試料中から、検出、測定の感度や精度を低下させる可能性のある非特異物質などを予め減少又は除去できることもある。なお、この場合に加えるDNA分解酵素(DNase:デオキシリボヌクレアーゼ)としては、特に限定されず、例えばエキソDNase−I(EC 3.1.11.1)、エキソDNase−III(EC 3.1.11.3)、エキソDNase−V(EC 3.1.11.5)、エキソDNase−VII(EC 3.1.11.6)などのようなポリヌクレオチド鎖の末端から逐次切断するエキソ型(Exonuclease)、また、例えばウシ膵臓由来のDNase−I(EC 3.1.21.1)、エンドDNase(EC 3.1.21.2)のようなポリヌクレオチド鎖又はオリゴヌクレオチド鎖の内部結合を切断するエンド型(Endonuclease)などいずれのDNaseであっても用いることができる。哺乳動物組織中に含まれるDNAを短時間で小さなフラグメント鎖に分解可能である点では、エンド型DNaseが好ましく、また、分解酵素としての特異性が低く、2本鎖及び1本鎖DNAを切断分解可能であることからDNase−Iがより好適に使用できる。また、例えば、DNase−Iとエキソ型又は他のエンド型等のDNaseとを組み合わせて用いても良い。
【0018】
RNA分解酵素(RNase:リボヌクレアーゼ)としては、例えばRNase−II(EC. 3.1.13.1)のようなポリヌクレオチド鎖の末端から逐次切断するエキソ型(Exonuclease)、また、例えばウシ膵臓由来のRNase−A(EC 3.1.27.5)、RNase−T1(EC 3.1.27.3)のようなポリヌクレオチド鎖の内部結合を切断するエンド型(Endonuclease)などいずれのRNaseであっても用いることができるが、短時間で小さなフラグメント鎖に分解可能である点では、エンド型RNaseが好ましく、さらに、比較的広いpH範囲において安定である点ではRNase−Aがより好適に使用できる。また、RNase−Aとその他のRNaseとの組み合わせとするなど、複数のRNaseとしても良い。なお、DNA分解酵素とRNA分解酵素とに加えて又は替えて、DNA及びRNAの両ヌクレオチド鎖におけるホスホジエステル結合を切断するヌクレアーゼを加えることもできる。このようなヌクレアーゼとしては、例えば、アスペルギルス オリゼ(Aspergillus Oryzae)由来のエンドヌクレアーゼS1(EC 3.1.30.1)、セラチア マルセッセンス(Seratia marcescens)由来のエンドヌクレアーゼ(EC 3.1.30.2)、スタフィロコッカス オウレウス(Staphylococcus aureus)由来のミクロコッカスエンドヌクレアーゼ(EC 3.1.31.1)などを挙げることができる。
【0019】
コラーゲンは、哺乳動物組織に含まれる蛋白質のうち3割前後を占める主要な蛋白質であるが、3重らせん構造を有することから一般的なプロテアーゼではこれを切断分解することが困難であり、また、例えばタイプI、II、III、・・・、XIII、XIVコラーゲンなどと呼ばれコラーゲンファミリー蛋白質を構成する分子構造の異なるコラーゲン蛋白質が哺乳動物の各結合組織に特異的に分布する。このようなコラーゲンファミリー蛋白質の3重らせん構造を切断したり分解するコラーゲン分解酵素を分解酵素混液に加える場合には、本第1の実施形態の前処理法により得られるPrPScの検出、測定用の試料中から、検出、測定の感度や精度を低下させる可能性のある非特異蛋白やポリペプチドなどを予め減少又は除去できることもある。分解酵素混液に加える際のコラーゲン分解酵素としては、特に限定されず、コラーゲンファミリー蛋白質の内、1種類(タイプ)以上のコラーゲンを分解するものであれば如何なるコラーゲン分解酵素をも使用できる。主にメタロエンドペプチダーゼ(Metalloendopeptidases:EC 3.4.24.)に分類され、また、マトリックスメタロプロティナーゼ(MMP:matrix metalloproteinase)とも呼ばれるコラゲナーゼ類(Collagenase)、ゼラチナーゼ類(Gelatinase)、ストロメライシン類(Stromelysin)などのコラーゲン分解酵素が好適に使用できる。前処理対象の動物組織材料に多く含まれるタイプのコラーゲンを分解するコラーゲン分解酵素を1種以上用いることが好ましく、複数タイプのコラーゲン蛋白質を分解することが可能なコラーゲン分解酵素を用いることがより好ましい。
【0020】
このようなコラゲナーゼ類としては、例えば、クロストリディウム属(Clostridium)、バチルス属(Bacillus)、シュードモナス属(Pseudomonas)、ビブリオ属(Vibrio)、ストレプトマイセス属(Streptomyces)等細菌由来の各種コラゲナーゼ〔Microbial collagenase :EC 3.4.24.3(別名:コラゲナーゼA、コラゲナーゼI、MMP−1、8、18等を含む)〕、I〜IIIの各タイプを含む複数のコラーゲンを分解する脊椎動物由来の間質性コラゲナーゼ〔Interstitial collagenase:EC 3.4.24.7(別名:コラゲナーゼ−1、MMP−1)〕、また、I〜III、V、VII、VIII、Xの各タイプのコラーゲンを分解する好中球コラゲナーゼ〔Neutrophil collagenase:EC 3.4.24.34(別名コラゲナーゼ−2、MMP−8等)〕、コラゲナーゼ−3〔EC 3.4.24.− (別名MMP−13)〕、コラゲナーゼ−4〔EC 3.4.24.− (別名MMP−18)〕などを挙げることができる。また、ゼラチナーゼ類としては、例えば、IV、V、VII、Xの各タイプのコラーゲンを分解するゼラチナーゼA〔EC 3.4.24.24(別名:タイプIVコラゲナーゼ、MMP−2等)〕、また、IV及びVタイプのコラーゲンを分解するゼラチナーゼB〔EC 3.4.24.35(別名:タイプVコラゲナーゼ、MMP−9等〕などを挙げることができる。ストロメライシン類としては、例えば、III〜V、IXなどの各タイプのコラーゲンを分解するストロメライシン−1〔EC 3.4.24.17(別名:MMP−3)〕、ストロメライシン−2〔EC 3.4.24.22(別名:MMP−10)〕などが挙げられる。さらに、本実施形態においては、以上のようなコラーゲン分解酵素に加えて、動物組織材料を可溶化する際に一般的に用いられる蛋白分解酵素や脂質分解酵素などを分解酵素混液に添加することも可能である。
【0021】
本第1の実施形態における分解酵素混液に両性界面活性剤を添加する場合に用いる界面活性剤としては、特に限定されず、例えばアミドアルキルベタイン系、スルホベタイン系、カルボキシベタイン系、イミダゾリニウムベタイン系等のベタイン型、また、例えばアルキルアミノ酢酸系、アルキルアミノプロピオン酸系、アルキル・ジメチルアミノ酢酸系、アルキルアミノジプロピオン酸系等のアミノ酸型やアミノ脂肪酸型などの両性界面活性剤の他、例えば、コール酸アミドアルキル・ジメチルアンモニオプロパンスルホン酸系、アルキルアミドタウリン塩系、アルキルアミドプロピルアミンオキシド系、レシチン系など如何なる両性界面活性剤であっても良い。また、同系或いは異系の2以上を併用することもできる。このような両性界面活性剤の具体例としては、例えば、ラウリン酸アミドプロピルヒドロキシスルホベタイン(LSB)、ラウリン酸アミドプロピルベタイン(LPB)、コカミドプロピルベタイン(CPB:ヤシ油脂肪酸アミドプロピルベタイン)、カプリン酸プロピルベタイン(CAPB)、n−ドデシル−N,N−ジメチルグリシン(DDGly:EMPIGEN BB商品名、Calbiochem社製)、ラウリルアミノプロピオン酸(LAPA:商品名レボン、三洋化成工業など)、n−ドデシル−N,N−(ジメチルアンモニオ)ブチル酸(DDMAB;Calbiochem社製など)、n−ドデシル−N,N−(ジメチルアンモニオ)ウンデカン酸(DDMAU;Calbiochem社製など)、3−[(3−コラミドプロピル)ジメチルアンモニオ]−1−プロパンスルホン酸(CHAPS)、3−[(3−コラミドプロピル)ジメチルアンモニオ]−2−ヒドロキシ−1−プロパンスルホン酸(CHAPSO)などを挙げることができる。なお、以上のような両性界面活性剤は、アルカリ金属塩、アルカリ土類金属塩、アンモニウム塩やアミン塩、塩酸塩や酢酸塩などの塩であっても良く、また、適当な濃度の水溶液、生理食塩液など希薄な塩溶液、pH緩衝液溶液などに溶解又は希釈させた両性界面活性剤であっても良い。
【0022】
また、本第1の実施形態における分解酵素混液に陰イオン界面活性剤を添加する場合に用いる界面活性剤としては、特に限定されず、例えば脂肪酸系、アルケニルコハク酸系、N−アシルサルコシン系、N−アシルグルタミン酸系等のカルボン酸型、また、例えば硫酸アルキル系、硫酸アルキルポリオキシエチレン系、硫酸モノアシルグリセリン系、アシルアミノ硫酸エステル系等の硫酸エステル型、また、例えばオレフィンスルホン酸系、アルカンスルホン酸系、スルホ脂肪酸系、N−アシルタウリン系、N−アシル−N−メチルタウリン酸系、ジアルキルスルホコハク酸系等のスルホン酸型、また、例えばリン酸アルキル系、リン酸アルキルポリオキシエチレン系等のリン酸エステル型などの他、コール酸系、デオキシコール酸系等如何なる陰イオン界面活性剤であっても良い。このような陰イオン界面活性剤の具体例としては、例えば、ドデシル硫酸ナトリウム(SDS)、ラウロイルサルコシン(LSarc)、ココイルサルコシンナトリウム、ドデカノイルサルコシンナトリウム、ラウロイルメチル−β−アラニンナトリウム、コール酸ナトリウム(SChol)、デオキシコール酸ナトリウム(SDChol)、グリココール酸ナトリウム、タウロコール酸ナトリウムなどを挙げることができる。また、同系或いは異系の2以上を併用することもできる。なお、以上のような陰イオン界面活性剤は、主にナトリウム塩として示したが、他のアルカリ金属塩、アルカリ土類金属塩、アンモニウム塩やアミン塩、塩酸塩や酢酸塩などの塩であっても良く、また、適当な濃度の水溶液、生理食塩液など希薄な塩溶液、pH緩衝液溶液などに溶解又は希釈させた界面活性剤であっても良い。
【0023】
また、分解酵素混液に陽イオン界面活性剤を添加する場合に用いる界面活性剤としては、特に限定されず、例えばアルキルポリオキシエチレンアミン系、脂肪酸トリエタノールアミンエステル系、N−アシル−N′,N′−ジエチルエチレンジアミン系等のアミン・アミン塩型、また、例えばアルキルトリメチルアンモニウム系、ジアルキルジメチルアンモニウム系、アルキルジメチルベンジルアンモニウム系、アルキルピリジニウム系等の第4級アンモニウム塩型など如何なる陽イオン界面活性剤であっても良い。また、同系或いは異系の2以上を併用することもできる。このような陽イオン界面活性剤の具体例としては、例えば、ラウリン酸トリエタノールアミンモノエステル、N−ラウロイル−N′,N′−ジエチルエチレンジアミン、セチルトリメチルアンモニウムクロライド、セチルジメチレンアンモニウムクロライド、ドデシルトリメチルアンモニウムクロライド、ドデシルジメチレンアンモニウムクロライド、ジデシルジメチルアンモニウム、セチルピリジニウムクロライド、グアニジンチオシアネートなどを挙げることができる。なお、以上のような陽イオン界面活性剤は、主に塩化物塩として示したが、臭化物塩など他のハロゲン化塩、塩酸塩、ギ酸塩、酢酸塩などの塩であっても良く、また、適当な濃度の水溶液、生理食塩液など希薄な塩溶液、pH緩衝液溶液などに溶解又は希釈させた界面活性剤であっても良い。
【0024】
本実施形態における分解酵素混液に非イオン界面活性剤を添加する場合に用いる界面活性剤としては、特に限定されず、例えば脂肪酸ポリオキシエチレンエステル系、脂肪酸ポリオキシエチレンソルビタンエステル系、アルキルポリオキシエチレンエーテル系、アルキルポリオキシエチレンポリオキシプロピレンエーテル系、アルキルフェニルポリオキシエチレンエーテル系、アルキルポリオキシエチレンアミン系、アルキルポリオキシエチレンアミド系、脂肪酸アルカノールアミド系、アミンオキシド系、脂肪酸ソルビタンエステル系、脂肪酸ポリグリセロールエステル系、脂肪酸ショ糖エステル系、アルキルポリグリコシド系、N−アルカノイル−N−メチルグルカミン系等如何なる非イオン界面活性剤であっても良い。また、同系或いは異系の2以上を併用することもできる。このような非イオン界面活性剤の具体例としては、例えば、ポリオキシエチレン−p−オクチルフェノール(商品名NP40;p−Tert−Octylphenol)、ポリオキシエチレン(80)ソルビトールエステル(商品名Tween20)、ポリオキシエチレン(20)ソルビトールエステル(商品名Tween80)、ポリオキシエチレングリコール(9−10)−p−オクチルフェノール(商品名TritonX100)、オクチル−β−D−グルコシド(Octyl−β−D−Glucoside)などを挙げることができる。なお、以上のような非イオン界面活性剤は、適当な濃度の水溶液、生理食塩液など希薄な塩溶液、pH緩衝液溶液などに溶解又は希釈させた非イオン界面活性剤であっても良い。
【0025】
以上のような界面活性剤の分解酵素混液中における総配合割合としては、前処理対象の哺乳動物組織材料についてその可溶化困難性など組織材料の種類に応じて適宜増減すれば良く、特に限定されないが、0.1重量%以上、30重量%以下とすることが好ましい。1重量%以上、20重量%以下がより好ましく、3重量%以上、15重量%以下とすることがさらに好ましい。0.1重量%未満では、組織材料の可溶化が不充分となることがあり、30重量%を超えるとPrPScの測定値に影響を及ぼす場合がある。また、複数の界面活性剤を用いる際の配合割合についても、選択した界面活性剤に応じて適宜決定すれば良く、特に限定されない。分解酵素混液に加えるPKの量については、通常のPrPC分解に使用される量に準じて適宜増減して添加することができ、本実施の形態においては、分解酵素混液1mL中の配合量を10μg以上、300μg以下とすることが好ましく、30μg以上、250μg以下とすることがより好ましい。
【0026】
このような分解酵素混液に、DNA分解酵素及び/又はRNA分解酵素及び/又はコラーゲン分解酵素を加える場合の添加量についても、特に限定されず、前処理対象の組織材料の種類や選択したDNA分解酵素、RNA分解酵素、コラーゲン分解酵素の種類に応じて適宜決定することができる。本実施の形態においては、DNA分解酵素の配合量は分解酵素混液1mL中に1μg以上、1000μg以下とすることが好ましく、5μg以上、200μg以下とすることがより好ましい。また、RNA分解酵素の配合量としては、分解酵素混液1mL中に2μg以上、2000μg以下とすることが好ましく、10μg以上、400μg以下とすることがより好ましい。コラーゲン分解酵素の配合量としては、分解酵素混液1mL中に0.05mg以上、50mg以下とすることが好ましく、0.25mg以上、10mg以下とすることがより好ましい。さらに、以上のような分解酵素混液には、例えばメタノール、クロロホルム、メタノール・クロロホルム混液、1−ブタノール、2−ブタノールなどの有機溶媒を加えることができ、このような有機溶媒を添加する場合に、分解酵素混液中の配合割合としては、0.1重量%以上、10重量%以下とすることが好ましい。また、例えばヨウ化ナトリウム、ヨウ化カリウム、塩化ナトリウム、塩化マグネシウム等の無機塩を分解酵素酵素混液に溶解可能な範囲で添加することができる。なお、上述のような分解酵素混液では、そのpHを所定範囲に調整することが好ましく、配合される界面活性剤やPKの他、DNA分解酵素、RNA分解酵素、コラーゲン分解酵素などの添加状態などに応じて適宜pH緩衝剤を選定し添加すれば良い。また、このような、分解酵素混液は、例えば、凍結乾燥したり、粉末状の各成分を配合して固体状に調製した部分と界面活性剤、pH緩衝液等の液状部分とに分離しておき、用時溶解して使用する形態とすることもできる。
【0027】
本実施形態における可溶化PrPC分解工程では、前処理対象の哺乳動物組織材料に、上述のような分解酵素混液を加えてホモジナイズ処理を施す。分解酵素混液の使用量は、組織材料の動物種や組織種類に応じて適宜決定することができるが、ここでは、前処理対象の組織材料重量に対して、2倍重量以上、20倍重量以下とすることが好ましく、3倍重量以上、15倍重量以下がより好ましい。ホモジナイズ処理には、例えば、ポリテトラフルオロエチレン(PTFE)のようなフッ素樹脂製の棒をその外径よりわずかに大きな内径を有する円筒容器内で回転させるポッターエルベジェム型、金属固定刃と回転刃により組織材料を破砕するタイプ(例えばポリトロン社製など)、閉鎖容器内に高速回転刃を取付けたブレンダー型(例えばWaring社製など)、閉鎖可能な容器内に処理対象の組織材料などと共にビーズを入れ、振とう、回転などにより組織材料を破砕するビーズ式破砕機(和研薬株式会社製、安井機械社製など)、これらに超音波処理を組み合わせたタイプ等の各種ホモジナイザーを用いることができる他、2本連結した注射筒内で内筒を往復移動させることで組織を破砕しても良く、複数のタイプを併用することも可能である。本第1の実施形態においては、より短時間内で効率的に組織材料の可溶化ができる場合があること、また、ホモジナイズ処理中に組織材料が飛散する可能性が低い点で、ビーズ式破砕機を用いることが好ましい。このようなビーズ式破砕型のホモジナイザーを用いた場合のホモジナイズ処理は、1分間以上、10分間以下行うことが好ましく、2分間以上、5分間以下とすることがより好ましい。また、ホモジナイザーによる処理後の処理液を、20℃以上、70℃以下、より好ましくは35℃以上、55℃以下の所定温度に保持した恒温器又はヒートブロック内にて加温することができる。加温時間は、1分間以上、10分間以下とすることが好ましく、2分間以上、5分間以下がより好ましい。なお、ホモジナイズ処理を、20℃以上、70℃以下、より好ましくは35℃以上、55℃以下の温度条件下にて実施することもでき、PrPScの検出や測定に悪影響を及ぼすことなく、より前処理時間を短縮できる場合もある。
【0028】
上述のような本第1の実施形態における可溶化PrPC分解工程で得られた処理液(PrPC分解済み液)は、哺乳動物組織材料が可溶化され正常プリオンが分解された状態となっている。次に、このPrPC分解済み液について、図1に示すような蛋白変性処理工程(A)を施す。本実施形態の蛋白変性処理工程(A)では、PK阻害剤と粉末状尿素とを添加して加熱する。PK阻害剤としては、PK活性を阻害することが可能であれば、例えばセリンプロテアーゼ阻害剤、システインプロテアーゼ阻害剤、メタロエンドペプチダーゼ阻害剤など如何なるプロテアーゼ阻害剤をも使用可能であり、複数のプロテアーゼ阻害剤を併用することもできる。ここでは、セリンプロテアーゼ阻害剤を含むものを用いることがより好ましく、例えばフェニルメタンスルホニルフルオライド(PMSF)、ベンズアミジン(Benzamidine)、4−(2−アミノエチル)−ベンゼンスルホニルフルオライド(AEBSF:例えば商品名;PEFABLOC SC、ロシュダイアグノスティック社)のようなセリンプロテアーゼ阻害剤が好適に使用できる。PK阻害剤の添加量は、前段の可溶化PrPC分解工程において分解酵素混液に加えられたPK量に応じて適宜決定すれば良いが、本実施形態では、PrPC分解済み液に添加後の濃度が0.1mM以上、10mM以下となるように加えることが好ましく、0.5mM以上、5mM以下がより好ましい。また、粉末状の尿素を、添加後の濃度が4〜8M、より好ましくは5〜7Mとなるように添加した後、加熱することが良く、この加熱条件としては、例えば30℃以上、110℃以下の温度にて、1分間以上、10分間以下加熱することができる。50℃以上、100℃以下の温度にて、3分間以上、7分間以下の加熱条件とすることがより好ましい。
【0029】
本第1の実施形態では、必要に応じ、上述のような蛋白変性処理工程(A)により得られる蛋白変性処理済液に、希釈液を添加してPrPScの検出又は測定用試料とする尿素濃度調整工程を実施することができる(図1)。なお、前段の蛋白変性処理工程(A)で得られた蛋白変性処理済液は、PrPCが完全に分解され、前処理前の哺乳動物組織材料にPrPScが蓄積していた場合には、「PrP27−30」フラグメントが含まれた状態となっており、プリオン蛋白質(PrPC、PrPSc)特異抗体と反応させることによりPrPScを検出又は測定するための試料として、尿素濃度調整工程を省略し、蛋白変性処理済液をそのまま用いることも可能である。一方で、蛋白変性処理済液は尿素濃度などが高く、例えばWB法やELISA法などを用いる測定系に影響を及ぼすことがあり、この場合に、この尿素濃度調整工程を実施すれば良い。希釈液としては、PrPScを検出又は測定するための測定に適するように調製すれば良く、特に限定されない。例えば、水、生理食塩液の他、リン酸塩系(リン酸緩衝生理食塩液:PBS)、トリス(ヒドロキシメチル)アミノメタン塩系(Tris緩衝液)、N−トリス(ヒドロキシメチル)メチルグリシン塩系(Tricine緩衝液)、N−2−ヒドロキシエチルピペラジン−N′−エタンスルホン酸塩系(HEPES緩衝液)、3−(モルホリノ)プロパンスルホン酸塩系(MOPS緩衝液)、グリシン−塩酸系、酢酸塩系等のpH緩衝液、また、ELISA法等における非特異吸着を防止するアルブミンやスキムミルク等のブロッキング剤溶液などが好適に使用できる。さらに希釈液には、例えば、測定系の感度を高めたり、蛋白変性処理済液中に残存する組織材料由来の測定妨害物質又は界面活性剤やPK阻害剤など尿素以外の配合成分による測定系への影響を防止するような物質を添加することもできる。また、希釈倍率についても、希釈液と同様に特に限定されない。本実施形態では、PrPScを検出又は測定する一般的な測定系に影響を及ぼすことが少ない点で、希釈後の尿素濃度を0.05M以上、3M以下とすることが好ましく、0.5M以上、2.5M以下とすることがより好ましく、1M以上、2M以下となるように希釈することがさらに良い。
【0030】
〔第2の実施形態〕
第2の実施形態による哺乳動物組織材料の前処理方法は、図2に前処理方法のフローを示すように、第1の実施形態とは、主として蛋白変性処理工程が異なる。すなわち、第1の実施形態の場合と同様、PrPScの検出又は測定用試料を調製するために採取された哺乳動物組織材料に、分解酵素混液を加えてホモジナイズ処理を施す可溶化PrPC分解工程を備える。次に、本第2の実施形態では、第1の実施形態における蛋白変性処理工程(A)に替わる蛋白変性処理工程(B)を実施することとなるが、蛋白変性処理工程(A)との処理条件の差異を考慮した上で、第1の実施形態における可溶化PrPC分解工程について上記した処理条件に準じて行うことができる。本第2の実施形態による可溶化PrPC分解工程については、重複した詳細説明を省略するが、第1の実施形態の場合と同様に、可溶化PrPC分解工程で得られた処理液(PrPC分解済み液)は、哺乳動物組織材料が可溶化されPrPCが分解された状態となっている。本第2の実施形態の蛋白変性処理工程(B)では、このPrPC分解済み液について、図2に示すように、蛋白沈殿化剤を加えて撹拌した後、遠心分離して上清を除き、得られる沈殿物につき、尿素液を添加して加熱する。
【0031】
蛋白沈殿化剤としては、前処理前の哺乳動物組織材料にPrPScが蓄積していた場合に「PrP27−30」フラグメントなどを含む蛋白質を凝集、析出、沈殿化できれば如何なる蛋白沈殿化剤であっても良く、例えば、アセトン、メタノール、エタノール、プロパノール、1−ブタノール、2−ブタノールのような有機溶媒又は複数の有機溶媒混液、硫酸アンモニウムのような塩析効果を有する塩類、SiW11 のようなタングステン化合物、トリクロロ酢酸など特に限定されない。本第2の実施形態における蛋白沈殿化剤としては、ELISA法などの測定系に影響を及ぼす可能性のある測定妨害物質と成り得る哺乳動物組織材料由来の成分を沈殿物に混入共沈することを防ぐ場合もある点では、有機溶媒又は複数の有機溶媒混液が好ましく、ブタノールを含む有機溶媒がより好ましく、2−ブタノールがさらに好適である。また、このような蛋白沈殿化剤の添加量についても、選択した蛋白沈殿化剤の種類や、前段の可溶化PrPC分解工程において分解酵素混液に加えた界面活性剤の種類などに応じて適宜決定することができる。例えば、蛋白沈殿化剤として有機溶媒又は有機溶媒混液を用いる場合には、PrPC分解済み液1mLに対して、0.1mL以上、2mL以下添加することが好ましく、0.2mL以上、1mL以下がより好ましい。
【0032】
蛋白沈殿化剤を加えて撹拌後の遠心分離条件としては、上清が澄明な状態に沈殿物と分離可能であれば、如何なる遠心分離条件であっても良く、特に限定されない。例えば、17000×gでは、5分間で分離することができ、また、冷却型遠心分離装置を用いて遠心分離しても良い。上清を除去した後、沈殿物に尿素液を添加する。尿素液の尿素濃度としては、4〜8Mとすることが好ましく、5〜7Mとすることがより好ましい。このような尿素液の添加量は、前処理のために採取した哺乳動物組織材料の種類や量に応じて適宜決定することができ、特に限定されない。例えば、哺乳動物組織材料の採取量100mgにつき、25μL〜250μL程度の尿素液を添加すれば良く、50μL〜150μLがより好ましい。蛋白変性処理工程(B)における加熱条件としては、例えば30℃以上、110℃以下の温度にて、1分間以上、10分間以下加熱することができる。50℃以上、100℃以下の温度にて、3分間以上、7分間以下の加熱条件とすることがより好ましい。
【0033】
本第2の実施形態では、必要に応じ、上述のような蛋白変性処理工程(B)により得られる蛋白変性処理済液に、希釈液を添加してPrPScの検出又は測定用試料とする尿素濃度調整工程を実施することができる(図2)。蛋白変性処理工程(B)で得られた蛋白変性処理済液は、PrPCが完全に分解され、前処理前の哺乳動物組織材料にPrPScが蓄積していた場合には、「PrP27−30」フラグメントが含まれた状態となっている。したがって、プリオン蛋白質(PrPC、PrPSc)特異抗体と反応させることによりPrPScを検出又は測定するための前処理済み試料として、尿素濃度調整工程を省略し、蛋白変性処理済液をそのまま用いることも可能である。一方で、蛋白変性処理済液は尿素濃度などが高く、例えばWB法やELISA法などを用いる測定系に影響を及ぼすことがあり、このような場合に、この尿素濃度調整工程を実施すれば良い。本第2の実施形態による尿素濃度調整工程において、使用できる希釈液、希釈液にさらに添加可能な物質、希釈倍率などについては、第1の実施形態の場合と同様であり、重複を避けるため詳細説明を省略する。
【0034】
〔第3の実施形態〕
第3の実施形態による哺乳動物組織材料の前処理方法は、図3に前処理方法のフローを示すように、第1の実施形態とは、主として、蛋白変性処理工程を具備せず、可溶化PrPC分解工程で得られた処理液(PrPC分解済み液)にPK阻害剤を添加する点で異なる。すなわち、第1の実施形態の場合と同様、PrPScの検出又は測定用試料を調製するために採取された哺乳動物組織材料に、分解酵素混液を加えてホモジナイズ処理を施す可溶化PrPC分解工程を備える。次に、本第3の実施形態では、蛋白変性処理工程(A)に替えて、PrPC分解済み液に尿素を添加することなくPK阻害剤を加えるPK阻害剤添加工程を実施することとなるが、第1の実施形態における蛋白変性処理工程(A)との処理条件の差異を考慮した上で、第1の実施形態における可溶化PrPC分解工程について上記した処理条件に準じて行うことができる。本第3の実施形態による可溶化PrPC分解工程については、重複した詳細説明を省略するが、第1の実施形態の場合と同様に、可溶化PrPC分解工程で得られたPrPC分解済み液は、哺乳動物組織材料が可溶化されPrPCが分解された状態となっている。
【0035】
本第3の実施形態のPK阻害剤添加工程において、PrPC分解済み液に加えるPK阻害剤及びPK阻害剤の添加量としては、第1の実施形態の蛋白変性処理工程(A)においてPrPC分解済み液に加える場合と同様のPK阻害剤を用いることができ、PK阻害剤の添加量についても同様であり、重複した詳細説明を省略する。また、本第3の実施形態では、必要に応じ、上述のようなPK阻害剤添加工程により得られる処理液(PK阻害剤が添加されたPrPC分解済み液)に、希釈液を添加してPrPScの検出又は測定用試料とする界面活性剤濃度調整工程を実施することができる(図3)。なお、前段のPK阻害剤添加工程で得られた処理液は、PrPCが完全に分解され、前処理前の哺乳動物組織材料にPrPScが蓄積していた場合には、未変性の「PrP27−30」フラグメントが含まれた状態となっている。したがって未変性プリオン蛋白質(PrPSc)特異抗体と反応させることによりPrPScを検出又は測定するための試料として、界面活性剤濃度調整工程を省略し、PK阻害剤が添加されたPrPC分解済み液をそのまま用いることも可能である。一方で、PK阻害剤が添加されたPrPC分解済み液は界面活性剤濃度などが高く、例えばWB法やELISA法などを用いる測定系に影響を及ぼすことがあり、この場合に、界面活性剤濃度調整工程を実施すれば良い。本第3の実施形態による界面活性剤濃度調整工程において、使用できる希釈液、希釈液にさらに添加可能な物質などについては、第1の実施形態の尿素濃度調整工程における場合と同様であり、重複説明を省略する。なお、本第3の実施形態による界面活性剤濃度調整工程において、上述のような希釈液を用い、PK阻害剤が添加されたPrPC分解済み液を希釈する際の希釈倍率としては、PrPScを検出又は測定するための測定に適するような希釈倍率とすれば良く、特に限定されない。本実施形態では、例えば、PrPScを検出又は測定する一般的な測定系に影響を及ぼすことが少ない点で、2倍以上、120倍以下とすることが好ましく、2.4倍以上、12倍以下とすることがより好ましく、3倍以上、6倍以下となるように希釈することがさらに良い。このような第3の実施形態の前処理方法によれば、PrPScの検定や測定系において未変性の「PrP27−30」フラグメントに対する特異抗体を用いる必要があるものの、第1又は第2の実施形態に比して、より短時間の内に前処理を行うことができる。
【実施例】
【0036】
以下、本発明の哺乳動物組織材料の前処理方法について、実施例、試験例を示して具体的に説明するが、これによって本発明を限定するものではない。
【0037】
〔実施例1〕(組織材料の可溶化)
正常マウスの中枢神経組織(脳内組織)及びウシ延髄組織をそれぞれ動物組織材料として、第1の実施形態に準じて組織可溶化の検討を行った。分解酵素混液には、3重量%のラウロイルサルコシン(LSarc)及び1重量%のp−オクチルフェノール(NP40)の界面活性剤とPK(200μg/mL)を添加したPBS溶液を用いた。組織材料採取量の5倍重量の分解酵素混液を加え、2本連結した注射筒内で内筒を往復移動させることで組織を破砕する方式にて、2分間ホモジナイズ処理した後、37℃、5分間加温した。この状態で、マウス脳組織材料は澄明に可溶化されたが、ウシ延髄組織材料は濁りが認められた。続く、蛋白変性処理工程における尿素添加は6M濃度、加熱条件は、100℃、5分間とした。尿素濃度調整工程では、PBSを希釈液として尿素濃度1Mに希釈した。この状態においても、マウス脳組織材料からの前処理済み液は澄明であったが、ウシ延髄組織材料からの前処理済み液は濁りが認められた。
【0038】
〔実施例2〕(組織材料の可溶化)
分解酵素混液に、2−ブタノール及び界面活性剤として、ポリオキシエチレン(80)ソルビトールエステル(商品名Tween20)を追加し、表1に示すように配合を代えた以外は、実施例1と同様の条件にて検討を行った。何れの条件においても実施例1の場合と同様に、マウス脳組織材料は澄明に可溶化されたが、ウシ延髄組織材料は濁りが認められた。
【0039】
【表1】

【0040】
〔実施例3〕(組織材料の可溶化)
分解酵素混液に、塩化ナトリウムを添加し、また、pHを表2に示すように組み合わせ変更した以外は、実施例1と同様の条件にて検討を行った。何れの条件においても実施例1の場合と同様に、マウス脳組織材料は澄明に可溶化されたが、ウシ延髄組織材料は濁りが認められた。
【0041】
【表2】

【0042】
〔実施例4〕(組織材料の可溶化)
分解酵素混液に、1−ブタノール、塩化マグネシウム、DNase−I、RNase−A、コラゲナーゼA、ウシ膵臓由来リパーゼ(pancrealipase)などを加え、界面活性剤として、ラウロイルサルコシン(LSarc)のみとし、表3に示すように配合を組み合わせ変更した以外は、実施例1と同様の条件にて検討を行った。何れの条件においても実施例1の場合と同様に、マウス脳組織材料は澄明に可溶化されたが、ウシ延髄組織材料は濁りが認められた。
【0043】
【表3】

【0044】
〔実施例5〕(組織材料の可溶化)
分解酵素混液に、DNase−I、RNase−A、コラゲナーゼA、ウシ膵臓由来リパーゼなどを加え、界面活性剤を、オクチル−β−D−グルコシド(Octyl−β−D−Glucoside)、3−[(3−コラミドプロピル)ジメチルアンモニオ]−1−プロパンスルホン酸(CHAPS)、3−[(3−コラミドプロピル)ジメチルアンモニオ]−2−ヒドロキシ−1−プロパンスルホン酸(CHAPSO)とし、表4に示すように配合を組み合わせ変更した以外は、実施例1と同様の条件にて検討を行った。何れの条件においても実施例1の場合と同様に、マウス脳組織材料は澄明に可溶化されたが、ウシ延髄組織材料は濁りが認められた。
【0045】
【表4】

【0046】
〔実施例6〕(組織材料の可溶化)
分解酵素混液に、DNase−I、RNase−A、コラゲナーゼA、ウシ膵臓由来リパーゼなどを加え、界面活性剤を、ラウロイルサルコシン(LSarc)及びオクチル−β−D−グルコシドとし、表5に示すように配合を組み合わせ変更した以外は、実施例1と同様の条件にて検討を行った。何れの条件においても実施例1の場合と同様に、マウス脳組織材料は澄明に可溶化されたが、ウシ延髄組織材料は濁りが認められた。
【0047】
【表5】

【0048】
〔実施例7〕(組織材料の可溶化)
ウシ延髄組織を動物組織材料として、第2の実施形態に準じて組織可溶化の検討を行った。分解酵素混液には、2−ブタノール、DNase−I、RNase−A、コラゲナーゼA、ウシ膵臓由来リパーゼなどを加え、ラウロイルサルコシン(LSarc)及びオクチル−β−D−グルコシドの界面活性剤とPK(200μg/mL)を表6のように添加配合したPBS溶液を用いた。組織材料採取量の10倍重量の分解酵素混液を加え、ビーズ式破砕機(商品名Bead Smash 12;和研薬株式会社製、又は、商品名マルチビーズショッカー;安井機械製)にて、2分間ホモジナイズ処理した後、ヒートブロック(TAITEC製ドライサーモユニットDTU−1B又はアルミブロックAL−1136B)を用い、37℃〜42℃、5分間加温(インキュベート)した。この状態で、ウシ延髄組織材料は澄明に可溶化されるが、室温に保存すると濁りが認められた。PK阻害剤として4−(2−アミノエチル)−ベンゼンスルホニルフルオライド(AEBSF:商品名;PEFABLOC SC、ロシュダイアグノスティック社製)を2mM相当濃度となるように加え、SiW11 0.5重量%を添加した後、15000×g、5分間遠心分離した。上清を除去し、得られた沈殿物に6M尿素液を組織材料採取重量に対して1.5〜3倍容量加えて、100℃、5分間蛋白変性処理した。尿素濃度調整工程では、PBSを希釈液として尿素濃度1Mに希釈した。蛋白変性処理工程、及び尿素濃度調整工程後の処理液には濁りが認められ可溶化が不充分であった。また、可溶化が不充分な状態の尿素濃度調整工程処理液では、ウシr−PrPCを添加してもELISA法により検出できなかった。なお、マウス脳組織材料を動物組織材料として用いた場合には、澄明に可溶化され検出可能であった。
【0049】
【表6】

【0050】
〔実施例8〕(組織材料の可溶化)
ウシ延髄組織を動物組織材料として、第1の実施形態に準じて組織可溶化の検討を行った。分解酵素混液には、DNase−I、RNase−A、コラゲナーゼAを加え、両性界面活性剤[n−ドデシル−N,N−ジメチルグリシン(DDGly:EMPIGEN BB商品名、Calbiochem社製)又は、n−ドデシル−N,N−(ジメチルアンモニオ)ブチレート(DDMAB;Calbiochem社製)]及び陰イオン界面活性剤[ラウロイルサルコシン(LSarc)]を組み合わせた界面活性剤とPK(200μg/mL)をそれぞれ表7のように添加配合したPBS溶液を用いた。組織材料採取量の10倍重量の分解酵素混液を加え、ビーズ式破砕機(商品名Bead Smash 12;和研薬株式会社製、又は、商品名マルチビーズショッカー;安井機械製)にて、2500rpm、2分間ホモジナイズ処理した後、ヒートブロック(TAITEC社製ドライサーモユニットDTU−1B又はアルミブロックAL−1136B)を用い、37℃〜42℃、5分間加温(インキュベート)した。ウシ延髄組織材料について可溶化PrPC分解工程を行った処理液は、ほぼ澄明に可溶化されていた。
【0051】
【表7】

【0052】
〔実施例9〕(組織材料の可溶化)
両性界面活性剤として、ラウリン酸アミドプロピルヒドロキシスルホベタイン(LSB)、ラウリン酸アミドプロピルベタイン(LPB)、コカミドプロピルベタイン(CPB:ヤシ油脂肪酸アミドプロピルベタイン)を用いた以外は、実施例8の場合と同様にそれぞれ表8のように添加配合し、組織可溶化の検討を行った。実施例8の場合同様、ウシ延髄組織材料について可溶化PrPC分解工程を行った処理液は、ほぼ澄明に可溶化されていた。
【0053】
【表8】

【0054】
〔実施例10〕(組織材料の可溶化)
両性界面活性剤として、ラウリン酸アミドプロピルベタイン(LPB)を追加して用いた以外は、実施例8の場合と同様にそれぞれ表9のように添加配合し、組織可溶化の検討を行った。実施例8の場合同様、ウシ延髄組織材料について可溶化PrPC分解工程を行った処理液は、ほぼ澄明に可溶化されていた。
【0055】
【表9】

【0056】
〔実施例11〕(ELISA測定用試料調製)
哺乳動物組織材料として正常ウシ延髄組織材料100mg及びウシ延髄組織材料100mgにPrPSc感染マウスの脳乳剤5重量%を添加したPrPSc添加ウシ延髄組織材料をそれぞれ2mL容量のマイクロチューブに採取し、4重量%のn−ドデシル−N,N−(ジメチルアンモニオ)ブチル酸塩(DDMAB;Calbiochem社製)、0.01重量%のDNase−I、0.01重量%のRNase−A、0.5重量%のコラゲナーゼA、0.005重量%のPKを添加した50mM、pH7.5のTris緩衝液1mLとステンレスビーズを加え、ビーズ式破砕機(商品名;マルチビーズショッカー、安井機械社製)にて2500rpmで2分間ホモジナイズ処理を行い、続いてアルミブロックヒーターで37℃、3分間加温(インキュベート)し、可溶化PrPC分解工程処理液を得た。次に、PK阻害剤として4−(2−アミノエチル)−ベンゼンスルホニルフルオライド(AEBSF:商品名;PEFABLOC SC、ロシュダイアグノスティック社製)25μLを加えてアルミブロックヒーターで100℃、2分間加熱した。この段階で得られた正常ウシ延髄組織材料由来の試料、0、120、160、180、190、200μLと、PrPSc添加ウシ延髄組織材料由来の試料200、80、40、20、10、0μLをそれぞれ別のマイクロチューブにて混合し、5重量%、2重量%、1重量%、0.5重量%、0.25重量%及び0%(PrPSc不含)のPrPSc感染マウス脳乳剤混入試料を作製した。各試料に尿素72mgを添加し、100℃、5分間加熱し蛋白変性処理工程を行う。良く攪拌してから精製水で10倍に希釈したブロックエース(大日本製薬社製)をそれぞれ0.4mL加えて前処理済みの測定試料を得た(尿素終濃度約2M)。
【0057】
〔試験例1〕(ELISA測定)
あらかじめマウス抗PrPモノクローナル抗体を固相化した96穴マイクロプレートを用いて試験を行った。実施例11にて得られた各測定試料について、それぞれ2ウェルに各50μLを分注した(2重測定)。HRP標識マウス抗PrPモノクローナル抗体溶液50μLをそれぞれ各ウェルに添加し、室温で1時間放置したのち、PBSTで洗浄した。発色基質溶液(TMBZ:3,3′,5,5′−テトラメチルベンジジン、Sigma社製)100μLを添加して室温で遮光して30分間放置したのち、1M濃度の硫酸100μLを加えてマイクロプレートリーダーにて450nmの吸光度を測定した。この結果、図4に示すようにPrPSc感染マウス脳乳剤の添加量に比例した吸光度の上昇が認められ、本発明による迅速前処理法が大動物の組織材料であってもPrPScの測定用の試料調製に有効であることが確認された。
【図面の簡単な説明】
【0058】
【図1】本発明の第1の実施形態による哺乳動物組織材料前処理方法のフロー図である。
【図2】本発明の第2の実施形態による哺乳動物組織材料前処理方法のフロー図である。
【図3】本発明の第3の実施形態による哺乳動物組織材料前処理方法のフロー図である。
【図4】本発明により得られた前処理試料につきELISA法によるPrPSc測定の一例を示す図である。
【技術分野】
【0001】
本発明は、哺乳動物組織材料の前処理方法に係り、特に、プリオン病発症の際など哺乳動物組織に蓄積する異常型プリオン蛋白(PrPSc)につき、主にウェスタンブロット法(WB法)や酵素免疫測定法(ELISAを含むEIA法)等による検出又は測定用の試料を調製するための哺乳動物組織材料の前処理方法に関する。
【背景技術】
【0002】
哺乳動物のプリオン病には、ヒトにおける代表的疾患としてクロイツフェルト・ヤコブ病(CJD)の他、遺伝性プリオン病であるゲルストマン・ストロイスラー・シャインカー症候群(Gerstmann−Straussler−Scheinker Syndrome:GSS)や、致死性家族性不眠症、クールー(Kuru)などがある。CJDは、病因が不明の散発性CJD、遺伝性の家族性CJD、ウシ海綿状脳症(BSE)からの経口感染による変異型CJD〔例えば、非特許文献1参照〕、ヒト下垂体の抽出製剤やヒト由来硬膜、角膜等を介する感染による医原性CJDなどに区分されるが、異常型プリオン蛋白(PrPSc)が中枢神経系に蓄積する点では共通している。一方、変異型CJDでは、扁桃などのリンパ組織にもPrPScが認められている〔例えば、非特許文献2参照〕。BSEは、ヒツジやヤギのスクレイピー臓器などにより汚染した配合飼料からの感染によるものとされており、スクレイピーと同様に中枢神経系などに変性を認めPrPScが沈着するが、リンパ組織にPrPScの沈着が認められない点でスクレイピーとは異なっている〔例えば、非特許文献3参照〕。
【0003】
BSEについては、これまで組織病理学的、臨床学的、疫学的方法を用いて検出が行われており、脳幹(延髄)組織を採取し、正常プリオン蛋白(PrPC)ではプロティナーゼK(PK)により完全に分解されるが、PrPScの凝集体ではPKで分解した後に残る「PrP27−30」と呼ばれるフラグメントをプリオン蛋白質(PrPC、PrPSc)特異抗体と反応させることによりPrPScを検出又は測定するWB法やELISA法を用いる検査キットが市販されている〔例えば、非特許文献4参照〕。このような検査キットによりPrPScを検出又は測定するための試料調製法(延髄組織からの前処理法)は、各検査キット毎に異なり、それぞれ操作手順が示されている。例えば、A社製検査キットの前処理手順では、延髄組織500±40mgをホモジナイザーバッグに取り、16%メタノール混合15%陰イオン性界面活性剤(ラウリル硫酸ナトリウム)溶液を加えて2分間ホモジナイズし、5〜10分間静置した後、ホモジネート(脳乳剤)180μLを遠心用マイクロプレートに移して18〜30℃、2750×gにて5分間遠心分離する。次に上清100μLを、PK溶液20μLをあらかじめ入れたアッセイプレートに採取し、34℃、60分間、PK消化処理した後、塩酸グアニジン溶液150μLを加えて34℃にて15分間変性処理している。
【0004】
B社製検査キットの前処理手順では、延髄組織350±40mgを1.4mLのブドウ糖液とビーズの入った2mLマイクロチューブに入れ、ビーズ式破砕機を用いて完全にホモジナイズする。得られたホモジネート500μLを別の2mLマイクロチューブに採り、2M 尿素を含むPK溶液500μLを加えて37℃にて10分間、反応させた後、250μLの1−ブタノールを添加、撹拌し、20000×gにて5分間遠心分離する。得られた沈殿物を5分間乾燥した後、6M尿素50μLを加えて100℃、5分間変性処理を行い、希釈液で6倍希釈するようになっている。
【0005】
また、以上のような前処理法の他に、例えば、脳組織及び脾臓組織をハサミで細かく切り刻んだ組織サンプルについて、界面活性剤〔(8%Zwittergent3−12(商品名)、カルビオケミカル社製)、サーコシル(Sarkosyl(商品名)、シグマ社製:C15H25NO3 Na)〕と、100mM塩化ナトリウムと、5mM塩化マグネシウムと、50mM、pH=7.5のトリス−塩酸緩衝液(Tris−HCl)とを加えて、脳組織を均一化することによって、均一化物(ホモジネート)を作製し(第1の工程)、次に、第2の工程において、分解(消化)処理するものがある(例えば、特許文献1参照)。消化処理する第2の工程では、第1の工程で得たホモジネートを、0.5mg/100mgコラゲナーゼ及び40μg/100mgのDNaseを用いて、温度37℃、4〜12時間、分解(消化)処理を行い、さらに、50μg/100mgのPK(ProteinaseK)を用いて、温度37℃、0.5〜2時間、消化処理を行っている。次いで第3の工程において、反応を停止した後、回転数15,000rpm、室温で20分間遠心分離を行い、5%ドデシル硫酸ナトリウムで10分間加熱溶解させ、PrPSc含有の濃縮物を得ている。
【0006】
【特許文献1】特開平11−32795号公報、(実施例、第1図〜第3図など)
【非特許文献1】Will,R.G. et al;Lancet Vol.347、pp.921−925(1996)
【非特許文献2】Hill,A.F. et al;Lancet Vol.349、pp.99−100(1997)
【非特許文献3】O′Rourke,K.I. et al;J.Clin.Microbiol. Vol.38、pp.3254−3259(2000)
【非特許文献4】能田健、永井英貴、平沢緑著、獣医畜産新報、56巻、9号、719〜725頁、(2003年)
【発明の開示】
【発明が解決しようとする課題】
【0007】
上記A社及びB社検査キットの前処理手順、並びに、特許文献1に記載のPrPScの濃縮法などによれば、採取した哺乳動物組織材料に含まれるPrPCが分解され、WB法やELISA法等によりPrPScを検出又は測定するために適し、可溶化されたPrPScを高回収率にて含有する試料を調製することはできるが、前処理の工程数が多く操作が煩雑であり、処理に長時間を要するという問題があった。特に、BSE検査の場合では、20分間程で解体処理された動物の各処理体を、それぞれの検査結果が判明するまで冷凍又は冷蔵保管するための大規模な保管設備が必要となっている。また、単に各工程における処理時間を短縮したり、工程数を減らした場合には、PrPCの分解や夾雑蛋白などの非特異物質の除去が不充分となったり、PrPScの回収率が低下するなど、PrPScの検出や測定値に影響を及ぼすという問題が発生する。
【0008】
本発明は、上記のような問題に鑑みてなされたものであり、PrPScの検定や測定値に悪影響を及ぼすことがなく、少ない工程数で短時間の内にその前処理を完了することが可能な、PrPScの検出又は測定用の試料を調製するための哺乳動物組織材料の前処理方法を提供することを目的とする。
【課題を解決するための手段】
【0009】
上記目的を達成するため、本発明による哺乳動物組織材料の前処理方法は、異常型プリオン蛋白(PrPSc)の検出又は測定用試料を調製するための哺乳動物組織材料の前処理方法であって;採取した哺乳動物組織材料に、界面活性剤とプロティナーゼK(PK)とを含んでなる分解酵素混液を加えてホモジナイズ処理を施すことによって、哺乳動物組織材料を可溶化すると共に正常プリオン蛋白(PrPC)を分解する可溶化PrPC分解工程を備えることを特徴とする。
【0010】
このような哺乳動物組織材料の前処理方法において、哺乳動物組織材料が、ヒト、ウシ、ヤギ、ヒツジ、シカ、オオジカ、ミンク、ブタ、サル、マウス、ラット、ハムスター、ネコから選ばれた哺乳動物の延髄組織又は中枢神経組織であることが好ましく、また、分解酵素混液が、DNA分解酵素及び/又はRNA分解酵素及び/又はコラーゲン分解酵素を含むことが好適である。さらに、界面活性剤が、両性界面活性剤を含むものであることが好ましく、さらにまた、界面活性剤が、両性界面活性剤と陰イオン界面活性剤との組み合わせからなることが良い。そして、両性界面活性剤が、ラウリン酸アミドプロピルヒドロキシスルホベタイン(LSB)、ラウリン酸アミドプロピルベタイン(LPB)、コカミドプロピルベタイン(CPB)、カプリン酸プロピルベタイン(CAPB)、n−ドデシル−N,N−ジメチルグリシン(DDGly)、ラウリルアミノプロピオン酸(LAPA)、n−ドデシル−N,N−(ジメチルアンモニオ)ブチル酸(DDMAB)、n−ドデシル−N,N−(ジメチルアンモニオ)ウンデカン酸(DDMAU)、3−[(3−コラミドプロピル)ジメチルアンモニオ]−1−プロパンスルホン酸(CHAPS)、3−[(3−コラミドプロピル)ジメチルアンモニオ]−2−ヒドロキシ−1−プロパンスルホン酸(CHAPSO)、又はこれらの塩から1以上選ばれたものであることが好適であり、また、陰イオン界面活性剤が、ドデシル硫酸ナトリウム(SDS)、ラウロイルサルコシン(LSarc)、ココイルサルコシンナトリウム、ドデカノイルサルコシンナトリウム、ラウロイルメチル−β−アラニンナトリウム、コール酸ナトリウム(SChol)、デオキシコール酸ナトリウム(SDChol)、グリココール酸ナトリウム、タウロコール酸ナトリウムから1以上選ばれたものであることが良く、さらに、分解酵素混液中の界面活性剤の配合割合を0.1乃至30重量%とすることが好ましい。
【0011】
以上のような哺乳動物組織材料の前処理方法において、可溶化PrPC分解工程におけるホモジナイズ処理は、容器内にビーズを入れたビーズ式破砕機によって行うことが好ましく、また、可溶化PrPC分解工程において、ホモジナイズ処理したのち、20℃以上、70℃以下、より好ましくは35℃以上、55℃以下の温度で加温することが好適であり、さらに、可溶化PrPC分解工程におけるホモジナイズ処理を20℃以上、70℃以下、より好ましくは35℃以上、55℃以下の温度条件下にて実施することもできる。そして、可溶化PrPC分解工程で得られた処理液に、PK阻害剤と粉末状尿素とを添加して加熱する蛋白変性処理工程(A)を含むことが好適であり、また、前記可溶化PrPC分解工程で得られた処理液に、蛋白沈殿化剤を加えて撹拌後遠心分離して得られる沈殿物につき、尿素液を添加して加熱する蛋白変性処理工程(B)を含むこともでき、さらに、このような蛋白変性処理工程で得られた蛋白変性処理済液に、希釈液を添加して、PrPScの検出又は測定用試料とすることが好ましい。なお、可溶化PrPC分解工程で得られた処理液に、PK阻害剤を加えるPK阻害剤添加工程を含むことができ、さらに、このようなPK阻害剤添加工程で得られた処理液に、希釈液を添加して、PrPScの検出又は測定用試料とすることも良い。
【発明の効果】
【0012】
本発明によれば、界面活性剤とPKとを含んでなる分解酵素混液を加えてホモジナイズ処理を施すことによって、哺乳動物組織材料を可溶化すると共に正常プリオン蛋白(PrPC)を分解することから、PrPScの検出や測定に悪影響を及ぼすことなく処理工程を減じることができ、処理時間の短縮が可能である。また、哺乳動物組織材料は、ヒト、ウシ、ヤギ、ヒツジ、シカ、オオジカ、ミンク、ブタ、サル、マウス、ラット、ハムスター、ネコなどプリオン病に羅患する可能性のある如何なる哺乳動物における、如何なる組織材料にも適応できる。動物組織材料のうち、例えばウシでは、PrPScが最も多く蓄積すると言われており、比較的その可溶化が困難な延髄組織であっても15分間以内程度の短時間のうちに効率良く澄明な状態に可溶化することができる。界面活性剤とPKに加えてDNA分解酵素及び/又はRNA分解酵素及び/又はコラーゲン分解酵素を含む分解酵素混液を用い、ホモジナイズ処理を行うことで、より確実に哺乳動物組織材料を可溶化すると共にPrPCを分解することが可能である。分解酵素混液に添加する界面活性剤として、例えば、ラウリン酸アミドプロピルヒドロキシスルホベタイン(LSB)、ラウリン酸アミドプロピルベタイン(LPB)、コカミドプロピルベタイン(CPB)、カプリン酸プロピルベタイン(CAPB)、n−ドデシル−N,N−ジメチルグリシン(DDGly)、ラウリルアミノプロピオン酸(LAPA)、n−ドデシル−N,N−(ジメチルアンモニオ)ブチル酸(DDMAB)、n−ドデシル−N,N−(ジメチルアンモニオ)ウンデカン酸(DDMAU)、3−[(3−コラミドプロピル)ジメチルアンモニオ]−1−プロパンスルホン酸(CHAPS)、3−[(3−コラミドプロピル)ジメチルアンモニオ]−2−ヒドロキシ−1−プロパンスルホン酸(CHAPSO)、又はこれらの塩から1以上選ばれた両性界面活性剤を用いることで、中動物乃至大動物の組織材料であっても、より短時間の内に澄明な状態にまで哺乳動物組織材料を可溶化できることがある。また、界面活性剤として、両性界面活性剤と陰イオン界面活性剤との組み合わせとすることで、哺乳動物組織材料をさらに効率良く可溶化できる場合がある。
【0013】
可溶化PrPC分解工程において、ホモジナイズ処理したのち、20℃以上、70℃以下、より好ましくは35℃以上、55℃以下の温度で加温(インキュベート)することで、より確実にPrPCを分解し、PrPScの検出や測定の感度、精度をさらに高める場合がある。蛋白変性処理工程(A)として、可溶化PrPC分解工程で得られた処理液に、PK阻害剤と粉末状尿素とを添加して加熱する方法を採用した場合には、処理液量が増加することがなく、蛋白変性処理工程の後段において遠心分離、再溶解操作などの濃縮工程を省略可能である点で有利である。蛋白変性処理工程(B)として、可溶化PrPC分解工程で得られた処理液に、ブタノールを加えて撹拌後、遠心分離して得られる沈殿物につき、尿素液を添加して加熱する方法を採用した場合には、PrPScの検出、測定用の試料中から、検出、測定の感度や精度を低下させる可能性のある非特異物質を予め減少或いは除去できることもある。
【発明を実施するための最良の形態】
【0014】
以下、本発明の哺乳動物における哺乳動物組織材料の前処理方法を実施するための最良の形態について、図面を参照して詳細に説明する。
【0015】
〔第1の実施形態〕
第1の実施形態による哺乳動物組織材料の前処理方法は、図1に前処理方法のフローを示すように、PrPScの検出又は測定用試料を調製するために採取された哺乳動物組織材料に、分解酵素混液を加えてホモジナイズ処理を施す可溶化PrPC分解工程を備えている。本第1の実施形態の前処理方法に用いられる哺乳動物組織材料としては、マウス、ラット、ハムスターなどの小動物からヒトを含むウシ、ヤギ、ヒツジ、シカ、オオジカ、ミンク、ブタ、サル、ネコなどの中動物乃至大動物に至る如何なる哺乳動物の組織材料であっても適用できる。例えば、BSEの検査では、PrPScが最も多く蓄積すると言われるウシ延髄の閂部組織について、病理組織検査や免疫組織化学検査による確定診断が行われており、WB法やEIA法等によるスクリーニングには、閂部延髄組織の中央で二分した半分を用いてPrPScの検出又は測定用の試料を調製することが適当とされている。ウシ延髄組織は、その可溶化が比較的困難な組織材料の内の一つであるが、界面活性剤とPKとを含んでなる分解酵素混液を加えてホモジナイズ処理を施すことによって、短時間内にほぼ澄明な状態にまでの組織材料可溶化とPrPC分解が可能である。
【0016】
本実施の形態における分解酵素混液に加える界面活性剤としては、両性界面活性剤、陰イオン界面活性剤、陽イオン界面活性剤、非イオン界面活性剤など如何なる界面活性剤であっても使用でき、複数の界面活性剤を併用しても良い。また、このような界面活性剤のうち、比較的親水性の高いものが好適であり、例えば、HLB値(吉田時行ら編、工学図書株式会社1987年発行「新版 界面活性剤ハンドブック」pp.234〜245、及び、日本油化学協会編、丸善株式会社1990年発行「改訂三版 油脂化学便覧」、pp.489−493)が6以上、40程度までの界面活性剤が良く、10以上のHLB値を有するものを用いることで、より効率良く短時間の内に可溶化できる場合がある。なお、界面活性剤のうち両性界面活性剤を用いることが好ましく、また、両性界面活性剤と陰イオン界面活性剤とを併用しても良く、このような場合には、前処理対象の哺乳動物組織材料をより効率良く可溶化できることもある。PKとしては、WB法や酵素免疫測定法(ELISAを含むEIA法)等による各種蛋白の検出又は測定用の試料を調製するための哺乳動物組織材料の前処理に通常用いられるようなPKであれば、如何なるPKであっても用いることができ、例えば、トリチラキウム アルブム(Tritirachium album)のような真菌由来のPK(EndopeptidaseK:EC 3.4.21.64)の他、細菌、真菌、酵母、動物細胞などを宿主細胞としPKと同等以上のPrPC分解活性を有する蛋白質を発現するように遺伝子組換された組換原核細胞又は組換真核細胞の産生物から得られるリコンビナントPKなども使用できる。
【0017】
分解酵素混液としては、界面活性剤とPKに加えて、DNA分解酵素及び/又はRNA分解酵素及び/又はコラーゲン分解酵素を含むものとすることができ、主成分として界面活性剤とPKとからなる分解酵素混液の場合に比して、より短時間の内に組織可溶化とPrPCの分解を可能とする点でより好ましい。また、分解酵素混液に界面活性剤とPKに加えて、DNA分解酵素及び/又はRNA分解酵素及び/又はコラーゲン分解酵素を添加する場合には、本実施形態の前処理法により得られるPrPScの検出、測定用の試料中から、検出、測定の感度や精度を低下させる可能性のある非特異物質などを予め減少又は除去できることもある。なお、この場合に加えるDNA分解酵素(DNase:デオキシリボヌクレアーゼ)としては、特に限定されず、例えばエキソDNase−I(EC 3.1.11.1)、エキソDNase−III(EC 3.1.11.3)、エキソDNase−V(EC 3.1.11.5)、エキソDNase−VII(EC 3.1.11.6)などのようなポリヌクレオチド鎖の末端から逐次切断するエキソ型(Exonuclease)、また、例えばウシ膵臓由来のDNase−I(EC 3.1.21.1)、エンドDNase(EC 3.1.21.2)のようなポリヌクレオチド鎖又はオリゴヌクレオチド鎖の内部結合を切断するエンド型(Endonuclease)などいずれのDNaseであっても用いることができる。哺乳動物組織中に含まれるDNAを短時間で小さなフラグメント鎖に分解可能である点では、エンド型DNaseが好ましく、また、分解酵素としての特異性が低く、2本鎖及び1本鎖DNAを切断分解可能であることからDNase−Iがより好適に使用できる。また、例えば、DNase−Iとエキソ型又は他のエンド型等のDNaseとを組み合わせて用いても良い。
【0018】
RNA分解酵素(RNase:リボヌクレアーゼ)としては、例えばRNase−II(EC. 3.1.13.1)のようなポリヌクレオチド鎖の末端から逐次切断するエキソ型(Exonuclease)、また、例えばウシ膵臓由来のRNase−A(EC 3.1.27.5)、RNase−T1(EC 3.1.27.3)のようなポリヌクレオチド鎖の内部結合を切断するエンド型(Endonuclease)などいずれのRNaseであっても用いることができるが、短時間で小さなフラグメント鎖に分解可能である点では、エンド型RNaseが好ましく、さらに、比較的広いpH範囲において安定である点ではRNase−Aがより好適に使用できる。また、RNase−Aとその他のRNaseとの組み合わせとするなど、複数のRNaseとしても良い。なお、DNA分解酵素とRNA分解酵素とに加えて又は替えて、DNA及びRNAの両ヌクレオチド鎖におけるホスホジエステル結合を切断するヌクレアーゼを加えることもできる。このようなヌクレアーゼとしては、例えば、アスペルギルス オリゼ(Aspergillus Oryzae)由来のエンドヌクレアーゼS1(EC 3.1.30.1)、セラチア マルセッセンス(Seratia marcescens)由来のエンドヌクレアーゼ(EC 3.1.30.2)、スタフィロコッカス オウレウス(Staphylococcus aureus)由来のミクロコッカスエンドヌクレアーゼ(EC 3.1.31.1)などを挙げることができる。
【0019】
コラーゲンは、哺乳動物組織に含まれる蛋白質のうち3割前後を占める主要な蛋白質であるが、3重らせん構造を有することから一般的なプロテアーゼではこれを切断分解することが困難であり、また、例えばタイプI、II、III、・・・、XIII、XIVコラーゲンなどと呼ばれコラーゲンファミリー蛋白質を構成する分子構造の異なるコラーゲン蛋白質が哺乳動物の各結合組織に特異的に分布する。このようなコラーゲンファミリー蛋白質の3重らせん構造を切断したり分解するコラーゲン分解酵素を分解酵素混液に加える場合には、本第1の実施形態の前処理法により得られるPrPScの検出、測定用の試料中から、検出、測定の感度や精度を低下させる可能性のある非特異蛋白やポリペプチドなどを予め減少又は除去できることもある。分解酵素混液に加える際のコラーゲン分解酵素としては、特に限定されず、コラーゲンファミリー蛋白質の内、1種類(タイプ)以上のコラーゲンを分解するものであれば如何なるコラーゲン分解酵素をも使用できる。主にメタロエンドペプチダーゼ(Metalloendopeptidases:EC 3.4.24.)に分類され、また、マトリックスメタロプロティナーゼ(MMP:matrix metalloproteinase)とも呼ばれるコラゲナーゼ類(Collagenase)、ゼラチナーゼ類(Gelatinase)、ストロメライシン類(Stromelysin)などのコラーゲン分解酵素が好適に使用できる。前処理対象の動物組織材料に多く含まれるタイプのコラーゲンを分解するコラーゲン分解酵素を1種以上用いることが好ましく、複数タイプのコラーゲン蛋白質を分解することが可能なコラーゲン分解酵素を用いることがより好ましい。
【0020】
このようなコラゲナーゼ類としては、例えば、クロストリディウム属(Clostridium)、バチルス属(Bacillus)、シュードモナス属(Pseudomonas)、ビブリオ属(Vibrio)、ストレプトマイセス属(Streptomyces)等細菌由来の各種コラゲナーゼ〔Microbial collagenase :EC 3.4.24.3(別名:コラゲナーゼA、コラゲナーゼI、MMP−1、8、18等を含む)〕、I〜IIIの各タイプを含む複数のコラーゲンを分解する脊椎動物由来の間質性コラゲナーゼ〔Interstitial collagenase:EC 3.4.24.7(別名:コラゲナーゼ−1、MMP−1)〕、また、I〜III、V、VII、VIII、Xの各タイプのコラーゲンを分解する好中球コラゲナーゼ〔Neutrophil collagenase:EC 3.4.24.34(別名コラゲナーゼ−2、MMP−8等)〕、コラゲナーゼ−3〔EC 3.4.24.− (別名MMP−13)〕、コラゲナーゼ−4〔EC 3.4.24.− (別名MMP−18)〕などを挙げることができる。また、ゼラチナーゼ類としては、例えば、IV、V、VII、Xの各タイプのコラーゲンを分解するゼラチナーゼA〔EC 3.4.24.24(別名:タイプIVコラゲナーゼ、MMP−2等)〕、また、IV及びVタイプのコラーゲンを分解するゼラチナーゼB〔EC 3.4.24.35(別名:タイプVコラゲナーゼ、MMP−9等〕などを挙げることができる。ストロメライシン類としては、例えば、III〜V、IXなどの各タイプのコラーゲンを分解するストロメライシン−1〔EC 3.4.24.17(別名:MMP−3)〕、ストロメライシン−2〔EC 3.4.24.22(別名:MMP−10)〕などが挙げられる。さらに、本実施形態においては、以上のようなコラーゲン分解酵素に加えて、動物組織材料を可溶化する際に一般的に用いられる蛋白分解酵素や脂質分解酵素などを分解酵素混液に添加することも可能である。
【0021】
本第1の実施形態における分解酵素混液に両性界面活性剤を添加する場合に用いる界面活性剤としては、特に限定されず、例えばアミドアルキルベタイン系、スルホベタイン系、カルボキシベタイン系、イミダゾリニウムベタイン系等のベタイン型、また、例えばアルキルアミノ酢酸系、アルキルアミノプロピオン酸系、アルキル・ジメチルアミノ酢酸系、アルキルアミノジプロピオン酸系等のアミノ酸型やアミノ脂肪酸型などの両性界面活性剤の他、例えば、コール酸アミドアルキル・ジメチルアンモニオプロパンスルホン酸系、アルキルアミドタウリン塩系、アルキルアミドプロピルアミンオキシド系、レシチン系など如何なる両性界面活性剤であっても良い。また、同系或いは異系の2以上を併用することもできる。このような両性界面活性剤の具体例としては、例えば、ラウリン酸アミドプロピルヒドロキシスルホベタイン(LSB)、ラウリン酸アミドプロピルベタイン(LPB)、コカミドプロピルベタイン(CPB:ヤシ油脂肪酸アミドプロピルベタイン)、カプリン酸プロピルベタイン(CAPB)、n−ドデシル−N,N−ジメチルグリシン(DDGly:EMPIGEN BB商品名、Calbiochem社製)、ラウリルアミノプロピオン酸(LAPA:商品名レボン、三洋化成工業など)、n−ドデシル−N,N−(ジメチルアンモニオ)ブチル酸(DDMAB;Calbiochem社製など)、n−ドデシル−N,N−(ジメチルアンモニオ)ウンデカン酸(DDMAU;Calbiochem社製など)、3−[(3−コラミドプロピル)ジメチルアンモニオ]−1−プロパンスルホン酸(CHAPS)、3−[(3−コラミドプロピル)ジメチルアンモニオ]−2−ヒドロキシ−1−プロパンスルホン酸(CHAPSO)などを挙げることができる。なお、以上のような両性界面活性剤は、アルカリ金属塩、アルカリ土類金属塩、アンモニウム塩やアミン塩、塩酸塩や酢酸塩などの塩であっても良く、また、適当な濃度の水溶液、生理食塩液など希薄な塩溶液、pH緩衝液溶液などに溶解又は希釈させた両性界面活性剤であっても良い。
【0022】
また、本第1の実施形態における分解酵素混液に陰イオン界面活性剤を添加する場合に用いる界面活性剤としては、特に限定されず、例えば脂肪酸系、アルケニルコハク酸系、N−アシルサルコシン系、N−アシルグルタミン酸系等のカルボン酸型、また、例えば硫酸アルキル系、硫酸アルキルポリオキシエチレン系、硫酸モノアシルグリセリン系、アシルアミノ硫酸エステル系等の硫酸エステル型、また、例えばオレフィンスルホン酸系、アルカンスルホン酸系、スルホ脂肪酸系、N−アシルタウリン系、N−アシル−N−メチルタウリン酸系、ジアルキルスルホコハク酸系等のスルホン酸型、また、例えばリン酸アルキル系、リン酸アルキルポリオキシエチレン系等のリン酸エステル型などの他、コール酸系、デオキシコール酸系等如何なる陰イオン界面活性剤であっても良い。このような陰イオン界面活性剤の具体例としては、例えば、ドデシル硫酸ナトリウム(SDS)、ラウロイルサルコシン(LSarc)、ココイルサルコシンナトリウム、ドデカノイルサルコシンナトリウム、ラウロイルメチル−β−アラニンナトリウム、コール酸ナトリウム(SChol)、デオキシコール酸ナトリウム(SDChol)、グリココール酸ナトリウム、タウロコール酸ナトリウムなどを挙げることができる。また、同系或いは異系の2以上を併用することもできる。なお、以上のような陰イオン界面活性剤は、主にナトリウム塩として示したが、他のアルカリ金属塩、アルカリ土類金属塩、アンモニウム塩やアミン塩、塩酸塩や酢酸塩などの塩であっても良く、また、適当な濃度の水溶液、生理食塩液など希薄な塩溶液、pH緩衝液溶液などに溶解又は希釈させた界面活性剤であっても良い。
【0023】
また、分解酵素混液に陽イオン界面活性剤を添加する場合に用いる界面活性剤としては、特に限定されず、例えばアルキルポリオキシエチレンアミン系、脂肪酸トリエタノールアミンエステル系、N−アシル−N′,N′−ジエチルエチレンジアミン系等のアミン・アミン塩型、また、例えばアルキルトリメチルアンモニウム系、ジアルキルジメチルアンモニウム系、アルキルジメチルベンジルアンモニウム系、アルキルピリジニウム系等の第4級アンモニウム塩型など如何なる陽イオン界面活性剤であっても良い。また、同系或いは異系の2以上を併用することもできる。このような陽イオン界面活性剤の具体例としては、例えば、ラウリン酸トリエタノールアミンモノエステル、N−ラウロイル−N′,N′−ジエチルエチレンジアミン、セチルトリメチルアンモニウムクロライド、セチルジメチレンアンモニウムクロライド、ドデシルトリメチルアンモニウムクロライド、ドデシルジメチレンアンモニウムクロライド、ジデシルジメチルアンモニウム、セチルピリジニウムクロライド、グアニジンチオシアネートなどを挙げることができる。なお、以上のような陽イオン界面活性剤は、主に塩化物塩として示したが、臭化物塩など他のハロゲン化塩、塩酸塩、ギ酸塩、酢酸塩などの塩であっても良く、また、適当な濃度の水溶液、生理食塩液など希薄な塩溶液、pH緩衝液溶液などに溶解又は希釈させた界面活性剤であっても良い。
【0024】
本実施形態における分解酵素混液に非イオン界面活性剤を添加する場合に用いる界面活性剤としては、特に限定されず、例えば脂肪酸ポリオキシエチレンエステル系、脂肪酸ポリオキシエチレンソルビタンエステル系、アルキルポリオキシエチレンエーテル系、アルキルポリオキシエチレンポリオキシプロピレンエーテル系、アルキルフェニルポリオキシエチレンエーテル系、アルキルポリオキシエチレンアミン系、アルキルポリオキシエチレンアミド系、脂肪酸アルカノールアミド系、アミンオキシド系、脂肪酸ソルビタンエステル系、脂肪酸ポリグリセロールエステル系、脂肪酸ショ糖エステル系、アルキルポリグリコシド系、N−アルカノイル−N−メチルグルカミン系等如何なる非イオン界面活性剤であっても良い。また、同系或いは異系の2以上を併用することもできる。このような非イオン界面活性剤の具体例としては、例えば、ポリオキシエチレン−p−オクチルフェノール(商品名NP40;p−Tert−Octylphenol)、ポリオキシエチレン(80)ソルビトールエステル(商品名Tween20)、ポリオキシエチレン(20)ソルビトールエステル(商品名Tween80)、ポリオキシエチレングリコール(9−10)−p−オクチルフェノール(商品名TritonX100)、オクチル−β−D−グルコシド(Octyl−β−D−Glucoside)などを挙げることができる。なお、以上のような非イオン界面活性剤は、適当な濃度の水溶液、生理食塩液など希薄な塩溶液、pH緩衝液溶液などに溶解又は希釈させた非イオン界面活性剤であっても良い。
【0025】
以上のような界面活性剤の分解酵素混液中における総配合割合としては、前処理対象の哺乳動物組織材料についてその可溶化困難性など組織材料の種類に応じて適宜増減すれば良く、特に限定されないが、0.1重量%以上、30重量%以下とすることが好ましい。1重量%以上、20重量%以下がより好ましく、3重量%以上、15重量%以下とすることがさらに好ましい。0.1重量%未満では、組織材料の可溶化が不充分となることがあり、30重量%を超えるとPrPScの測定値に影響を及ぼす場合がある。また、複数の界面活性剤を用いる際の配合割合についても、選択した界面活性剤に応じて適宜決定すれば良く、特に限定されない。分解酵素混液に加えるPKの量については、通常のPrPC分解に使用される量に準じて適宜増減して添加することができ、本実施の形態においては、分解酵素混液1mL中の配合量を10μg以上、300μg以下とすることが好ましく、30μg以上、250μg以下とすることがより好ましい。
【0026】
このような分解酵素混液に、DNA分解酵素及び/又はRNA分解酵素及び/又はコラーゲン分解酵素を加える場合の添加量についても、特に限定されず、前処理対象の組織材料の種類や選択したDNA分解酵素、RNA分解酵素、コラーゲン分解酵素の種類に応じて適宜決定することができる。本実施の形態においては、DNA分解酵素の配合量は分解酵素混液1mL中に1μg以上、1000μg以下とすることが好ましく、5μg以上、200μg以下とすることがより好ましい。また、RNA分解酵素の配合量としては、分解酵素混液1mL中に2μg以上、2000μg以下とすることが好ましく、10μg以上、400μg以下とすることがより好ましい。コラーゲン分解酵素の配合量としては、分解酵素混液1mL中に0.05mg以上、50mg以下とすることが好ましく、0.25mg以上、10mg以下とすることがより好ましい。さらに、以上のような分解酵素混液には、例えばメタノール、クロロホルム、メタノール・クロロホルム混液、1−ブタノール、2−ブタノールなどの有機溶媒を加えることができ、このような有機溶媒を添加する場合に、分解酵素混液中の配合割合としては、0.1重量%以上、10重量%以下とすることが好ましい。また、例えばヨウ化ナトリウム、ヨウ化カリウム、塩化ナトリウム、塩化マグネシウム等の無機塩を分解酵素酵素混液に溶解可能な範囲で添加することができる。なお、上述のような分解酵素混液では、そのpHを所定範囲に調整することが好ましく、配合される界面活性剤やPKの他、DNA分解酵素、RNA分解酵素、コラーゲン分解酵素などの添加状態などに応じて適宜pH緩衝剤を選定し添加すれば良い。また、このような、分解酵素混液は、例えば、凍結乾燥したり、粉末状の各成分を配合して固体状に調製した部分と界面活性剤、pH緩衝液等の液状部分とに分離しておき、用時溶解して使用する形態とすることもできる。
【0027】
本実施形態における可溶化PrPC分解工程では、前処理対象の哺乳動物組織材料に、上述のような分解酵素混液を加えてホモジナイズ処理を施す。分解酵素混液の使用量は、組織材料の動物種や組織種類に応じて適宜決定することができるが、ここでは、前処理対象の組織材料重量に対して、2倍重量以上、20倍重量以下とすることが好ましく、3倍重量以上、15倍重量以下がより好ましい。ホモジナイズ処理には、例えば、ポリテトラフルオロエチレン(PTFE)のようなフッ素樹脂製の棒をその外径よりわずかに大きな内径を有する円筒容器内で回転させるポッターエルベジェム型、金属固定刃と回転刃により組織材料を破砕するタイプ(例えばポリトロン社製など)、閉鎖容器内に高速回転刃を取付けたブレンダー型(例えばWaring社製など)、閉鎖可能な容器内に処理対象の組織材料などと共にビーズを入れ、振とう、回転などにより組織材料を破砕するビーズ式破砕機(和研薬株式会社製、安井機械社製など)、これらに超音波処理を組み合わせたタイプ等の各種ホモジナイザーを用いることができる他、2本連結した注射筒内で内筒を往復移動させることで組織を破砕しても良く、複数のタイプを併用することも可能である。本第1の実施形態においては、より短時間内で効率的に組織材料の可溶化ができる場合があること、また、ホモジナイズ処理中に組織材料が飛散する可能性が低い点で、ビーズ式破砕機を用いることが好ましい。このようなビーズ式破砕型のホモジナイザーを用いた場合のホモジナイズ処理は、1分間以上、10分間以下行うことが好ましく、2分間以上、5分間以下とすることがより好ましい。また、ホモジナイザーによる処理後の処理液を、20℃以上、70℃以下、より好ましくは35℃以上、55℃以下の所定温度に保持した恒温器又はヒートブロック内にて加温することができる。加温時間は、1分間以上、10分間以下とすることが好ましく、2分間以上、5分間以下がより好ましい。なお、ホモジナイズ処理を、20℃以上、70℃以下、より好ましくは35℃以上、55℃以下の温度条件下にて実施することもでき、PrPScの検出や測定に悪影響を及ぼすことなく、より前処理時間を短縮できる場合もある。
【0028】
上述のような本第1の実施形態における可溶化PrPC分解工程で得られた処理液(PrPC分解済み液)は、哺乳動物組織材料が可溶化され正常プリオンが分解された状態となっている。次に、このPrPC分解済み液について、図1に示すような蛋白変性処理工程(A)を施す。本実施形態の蛋白変性処理工程(A)では、PK阻害剤と粉末状尿素とを添加して加熱する。PK阻害剤としては、PK活性を阻害することが可能であれば、例えばセリンプロテアーゼ阻害剤、システインプロテアーゼ阻害剤、メタロエンドペプチダーゼ阻害剤など如何なるプロテアーゼ阻害剤をも使用可能であり、複数のプロテアーゼ阻害剤を併用することもできる。ここでは、セリンプロテアーゼ阻害剤を含むものを用いることがより好ましく、例えばフェニルメタンスルホニルフルオライド(PMSF)、ベンズアミジン(Benzamidine)、4−(2−アミノエチル)−ベンゼンスルホニルフルオライド(AEBSF:例えば商品名;PEFABLOC SC、ロシュダイアグノスティック社)のようなセリンプロテアーゼ阻害剤が好適に使用できる。PK阻害剤の添加量は、前段の可溶化PrPC分解工程において分解酵素混液に加えられたPK量に応じて適宜決定すれば良いが、本実施形態では、PrPC分解済み液に添加後の濃度が0.1mM以上、10mM以下となるように加えることが好ましく、0.5mM以上、5mM以下がより好ましい。また、粉末状の尿素を、添加後の濃度が4〜8M、より好ましくは5〜7Mとなるように添加した後、加熱することが良く、この加熱条件としては、例えば30℃以上、110℃以下の温度にて、1分間以上、10分間以下加熱することができる。50℃以上、100℃以下の温度にて、3分間以上、7分間以下の加熱条件とすることがより好ましい。
【0029】
本第1の実施形態では、必要に応じ、上述のような蛋白変性処理工程(A)により得られる蛋白変性処理済液に、希釈液を添加してPrPScの検出又は測定用試料とする尿素濃度調整工程を実施することができる(図1)。なお、前段の蛋白変性処理工程(A)で得られた蛋白変性処理済液は、PrPCが完全に分解され、前処理前の哺乳動物組織材料にPrPScが蓄積していた場合には、「PrP27−30」フラグメントが含まれた状態となっており、プリオン蛋白質(PrPC、PrPSc)特異抗体と反応させることによりPrPScを検出又は測定するための試料として、尿素濃度調整工程を省略し、蛋白変性処理済液をそのまま用いることも可能である。一方で、蛋白変性処理済液は尿素濃度などが高く、例えばWB法やELISA法などを用いる測定系に影響を及ぼすことがあり、この場合に、この尿素濃度調整工程を実施すれば良い。希釈液としては、PrPScを検出又は測定するための測定に適するように調製すれば良く、特に限定されない。例えば、水、生理食塩液の他、リン酸塩系(リン酸緩衝生理食塩液:PBS)、トリス(ヒドロキシメチル)アミノメタン塩系(Tris緩衝液)、N−トリス(ヒドロキシメチル)メチルグリシン塩系(Tricine緩衝液)、N−2−ヒドロキシエチルピペラジン−N′−エタンスルホン酸塩系(HEPES緩衝液)、3−(モルホリノ)プロパンスルホン酸塩系(MOPS緩衝液)、グリシン−塩酸系、酢酸塩系等のpH緩衝液、また、ELISA法等における非特異吸着を防止するアルブミンやスキムミルク等のブロッキング剤溶液などが好適に使用できる。さらに希釈液には、例えば、測定系の感度を高めたり、蛋白変性処理済液中に残存する組織材料由来の測定妨害物質又は界面活性剤やPK阻害剤など尿素以外の配合成分による測定系への影響を防止するような物質を添加することもできる。また、希釈倍率についても、希釈液と同様に特に限定されない。本実施形態では、PrPScを検出又は測定する一般的な測定系に影響を及ぼすことが少ない点で、希釈後の尿素濃度を0.05M以上、3M以下とすることが好ましく、0.5M以上、2.5M以下とすることがより好ましく、1M以上、2M以下となるように希釈することがさらに良い。
【0030】
〔第2の実施形態〕
第2の実施形態による哺乳動物組織材料の前処理方法は、図2に前処理方法のフローを示すように、第1の実施形態とは、主として蛋白変性処理工程が異なる。すなわち、第1の実施形態の場合と同様、PrPScの検出又は測定用試料を調製するために採取された哺乳動物組織材料に、分解酵素混液を加えてホモジナイズ処理を施す可溶化PrPC分解工程を備える。次に、本第2の実施形態では、第1の実施形態における蛋白変性処理工程(A)に替わる蛋白変性処理工程(B)を実施することとなるが、蛋白変性処理工程(A)との処理条件の差異を考慮した上で、第1の実施形態における可溶化PrPC分解工程について上記した処理条件に準じて行うことができる。本第2の実施形態による可溶化PrPC分解工程については、重複した詳細説明を省略するが、第1の実施形態の場合と同様に、可溶化PrPC分解工程で得られた処理液(PrPC分解済み液)は、哺乳動物組織材料が可溶化されPrPCが分解された状態となっている。本第2の実施形態の蛋白変性処理工程(B)では、このPrPC分解済み液について、図2に示すように、蛋白沈殿化剤を加えて撹拌した後、遠心分離して上清を除き、得られる沈殿物につき、尿素液を添加して加熱する。
【0031】
蛋白沈殿化剤としては、前処理前の哺乳動物組織材料にPrPScが蓄積していた場合に「PrP27−30」フラグメントなどを含む蛋白質を凝集、析出、沈殿化できれば如何なる蛋白沈殿化剤であっても良く、例えば、アセトン、メタノール、エタノール、プロパノール、1−ブタノール、2−ブタノールのような有機溶媒又は複数の有機溶媒混液、硫酸アンモニウムのような塩析効果を有する塩類、SiW11 のようなタングステン化合物、トリクロロ酢酸など特に限定されない。本第2の実施形態における蛋白沈殿化剤としては、ELISA法などの測定系に影響を及ぼす可能性のある測定妨害物質と成り得る哺乳動物組織材料由来の成分を沈殿物に混入共沈することを防ぐ場合もある点では、有機溶媒又は複数の有機溶媒混液が好ましく、ブタノールを含む有機溶媒がより好ましく、2−ブタノールがさらに好適である。また、このような蛋白沈殿化剤の添加量についても、選択した蛋白沈殿化剤の種類や、前段の可溶化PrPC分解工程において分解酵素混液に加えた界面活性剤の種類などに応じて適宜決定することができる。例えば、蛋白沈殿化剤として有機溶媒又は有機溶媒混液を用いる場合には、PrPC分解済み液1mLに対して、0.1mL以上、2mL以下添加することが好ましく、0.2mL以上、1mL以下がより好ましい。
【0032】
蛋白沈殿化剤を加えて撹拌後の遠心分離条件としては、上清が澄明な状態に沈殿物と分離可能であれば、如何なる遠心分離条件であっても良く、特に限定されない。例えば、17000×gでは、5分間で分離することができ、また、冷却型遠心分離装置を用いて遠心分離しても良い。上清を除去した後、沈殿物に尿素液を添加する。尿素液の尿素濃度としては、4〜8Mとすることが好ましく、5〜7Mとすることがより好ましい。このような尿素液の添加量は、前処理のために採取した哺乳動物組織材料の種類や量に応じて適宜決定することができ、特に限定されない。例えば、哺乳動物組織材料の採取量100mgにつき、25μL〜250μL程度の尿素液を添加すれば良く、50μL〜150μLがより好ましい。蛋白変性処理工程(B)における加熱条件としては、例えば30℃以上、110℃以下の温度にて、1分間以上、10分間以下加熱することができる。50℃以上、100℃以下の温度にて、3分間以上、7分間以下の加熱条件とすることがより好ましい。
【0033】
本第2の実施形態では、必要に応じ、上述のような蛋白変性処理工程(B)により得られる蛋白変性処理済液に、希釈液を添加してPrPScの検出又は測定用試料とする尿素濃度調整工程を実施することができる(図2)。蛋白変性処理工程(B)で得られた蛋白変性処理済液は、PrPCが完全に分解され、前処理前の哺乳動物組織材料にPrPScが蓄積していた場合には、「PrP27−30」フラグメントが含まれた状態となっている。したがって、プリオン蛋白質(PrPC、PrPSc)特異抗体と反応させることによりPrPScを検出又は測定するための前処理済み試料として、尿素濃度調整工程を省略し、蛋白変性処理済液をそのまま用いることも可能である。一方で、蛋白変性処理済液は尿素濃度などが高く、例えばWB法やELISA法などを用いる測定系に影響を及ぼすことがあり、このような場合に、この尿素濃度調整工程を実施すれば良い。本第2の実施形態による尿素濃度調整工程において、使用できる希釈液、希釈液にさらに添加可能な物質、希釈倍率などについては、第1の実施形態の場合と同様であり、重複を避けるため詳細説明を省略する。
【0034】
〔第3の実施形態〕
第3の実施形態による哺乳動物組織材料の前処理方法は、図3に前処理方法のフローを示すように、第1の実施形態とは、主として、蛋白変性処理工程を具備せず、可溶化PrPC分解工程で得られた処理液(PrPC分解済み液)にPK阻害剤を添加する点で異なる。すなわち、第1の実施形態の場合と同様、PrPScの検出又は測定用試料を調製するために採取された哺乳動物組織材料に、分解酵素混液を加えてホモジナイズ処理を施す可溶化PrPC分解工程を備える。次に、本第3の実施形態では、蛋白変性処理工程(A)に替えて、PrPC分解済み液に尿素を添加することなくPK阻害剤を加えるPK阻害剤添加工程を実施することとなるが、第1の実施形態における蛋白変性処理工程(A)との処理条件の差異を考慮した上で、第1の実施形態における可溶化PrPC分解工程について上記した処理条件に準じて行うことができる。本第3の実施形態による可溶化PrPC分解工程については、重複した詳細説明を省略するが、第1の実施形態の場合と同様に、可溶化PrPC分解工程で得られたPrPC分解済み液は、哺乳動物組織材料が可溶化されPrPCが分解された状態となっている。
【0035】
本第3の実施形態のPK阻害剤添加工程において、PrPC分解済み液に加えるPK阻害剤及びPK阻害剤の添加量としては、第1の実施形態の蛋白変性処理工程(A)においてPrPC分解済み液に加える場合と同様のPK阻害剤を用いることができ、PK阻害剤の添加量についても同様であり、重複した詳細説明を省略する。また、本第3の実施形態では、必要に応じ、上述のようなPK阻害剤添加工程により得られる処理液(PK阻害剤が添加されたPrPC分解済み液)に、希釈液を添加してPrPScの検出又は測定用試料とする界面活性剤濃度調整工程を実施することができる(図3)。なお、前段のPK阻害剤添加工程で得られた処理液は、PrPCが完全に分解され、前処理前の哺乳動物組織材料にPrPScが蓄積していた場合には、未変性の「PrP27−30」フラグメントが含まれた状態となっている。したがって未変性プリオン蛋白質(PrPSc)特異抗体と反応させることによりPrPScを検出又は測定するための試料として、界面活性剤濃度調整工程を省略し、PK阻害剤が添加されたPrPC分解済み液をそのまま用いることも可能である。一方で、PK阻害剤が添加されたPrPC分解済み液は界面活性剤濃度などが高く、例えばWB法やELISA法などを用いる測定系に影響を及ぼすことがあり、この場合に、界面活性剤濃度調整工程を実施すれば良い。本第3の実施形態による界面活性剤濃度調整工程において、使用できる希釈液、希釈液にさらに添加可能な物質などについては、第1の実施形態の尿素濃度調整工程における場合と同様であり、重複説明を省略する。なお、本第3の実施形態による界面活性剤濃度調整工程において、上述のような希釈液を用い、PK阻害剤が添加されたPrPC分解済み液を希釈する際の希釈倍率としては、PrPScを検出又は測定するための測定に適するような希釈倍率とすれば良く、特に限定されない。本実施形態では、例えば、PrPScを検出又は測定する一般的な測定系に影響を及ぼすことが少ない点で、2倍以上、120倍以下とすることが好ましく、2.4倍以上、12倍以下とすることがより好ましく、3倍以上、6倍以下となるように希釈することがさらに良い。このような第3の実施形態の前処理方法によれば、PrPScの検定や測定系において未変性の「PrP27−30」フラグメントに対する特異抗体を用いる必要があるものの、第1又は第2の実施形態に比して、より短時間の内に前処理を行うことができる。
【実施例】
【0036】
以下、本発明の哺乳動物組織材料の前処理方法について、実施例、試験例を示して具体的に説明するが、これによって本発明を限定するものではない。
【0037】
〔実施例1〕(組織材料の可溶化)
正常マウスの中枢神経組織(脳内組織)及びウシ延髄組織をそれぞれ動物組織材料として、第1の実施形態に準じて組織可溶化の検討を行った。分解酵素混液には、3重量%のラウロイルサルコシン(LSarc)及び1重量%のp−オクチルフェノール(NP40)の界面活性剤とPK(200μg/mL)を添加したPBS溶液を用いた。組織材料採取量の5倍重量の分解酵素混液を加え、2本連結した注射筒内で内筒を往復移動させることで組織を破砕する方式にて、2分間ホモジナイズ処理した後、37℃、5分間加温した。この状態で、マウス脳組織材料は澄明に可溶化されたが、ウシ延髄組織材料は濁りが認められた。続く、蛋白変性処理工程における尿素添加は6M濃度、加熱条件は、100℃、5分間とした。尿素濃度調整工程では、PBSを希釈液として尿素濃度1Mに希釈した。この状態においても、マウス脳組織材料からの前処理済み液は澄明であったが、ウシ延髄組織材料からの前処理済み液は濁りが認められた。
【0038】
〔実施例2〕(組織材料の可溶化)
分解酵素混液に、2−ブタノール及び界面活性剤として、ポリオキシエチレン(80)ソルビトールエステル(商品名Tween20)を追加し、表1に示すように配合を代えた以外は、実施例1と同様の条件にて検討を行った。何れの条件においても実施例1の場合と同様に、マウス脳組織材料は澄明に可溶化されたが、ウシ延髄組織材料は濁りが認められた。
【0039】
【表1】

【0040】
〔実施例3〕(組織材料の可溶化)
分解酵素混液に、塩化ナトリウムを添加し、また、pHを表2に示すように組み合わせ変更した以外は、実施例1と同様の条件にて検討を行った。何れの条件においても実施例1の場合と同様に、マウス脳組織材料は澄明に可溶化されたが、ウシ延髄組織材料は濁りが認められた。
【0041】
【表2】

【0042】
〔実施例4〕(組織材料の可溶化)
分解酵素混液に、1−ブタノール、塩化マグネシウム、DNase−I、RNase−A、コラゲナーゼA、ウシ膵臓由来リパーゼ(pancrealipase)などを加え、界面活性剤として、ラウロイルサルコシン(LSarc)のみとし、表3に示すように配合を組み合わせ変更した以外は、実施例1と同様の条件にて検討を行った。何れの条件においても実施例1の場合と同様に、マウス脳組織材料は澄明に可溶化されたが、ウシ延髄組織材料は濁りが認められた。
【0043】
【表3】

【0044】
〔実施例5〕(組織材料の可溶化)
分解酵素混液に、DNase−I、RNase−A、コラゲナーゼA、ウシ膵臓由来リパーゼなどを加え、界面活性剤を、オクチル−β−D−グルコシド(Octyl−β−D−Glucoside)、3−[(3−コラミドプロピル)ジメチルアンモニオ]−1−プロパンスルホン酸(CHAPS)、3−[(3−コラミドプロピル)ジメチルアンモニオ]−2−ヒドロキシ−1−プロパンスルホン酸(CHAPSO)とし、表4に示すように配合を組み合わせ変更した以外は、実施例1と同様の条件にて検討を行った。何れの条件においても実施例1の場合と同様に、マウス脳組織材料は澄明に可溶化されたが、ウシ延髄組織材料は濁りが認められた。
【0045】
【表4】

【0046】
〔実施例6〕(組織材料の可溶化)
分解酵素混液に、DNase−I、RNase−A、コラゲナーゼA、ウシ膵臓由来リパーゼなどを加え、界面活性剤を、ラウロイルサルコシン(LSarc)及びオクチル−β−D−グルコシドとし、表5に示すように配合を組み合わせ変更した以外は、実施例1と同様の条件にて検討を行った。何れの条件においても実施例1の場合と同様に、マウス脳組織材料は澄明に可溶化されたが、ウシ延髄組織材料は濁りが認められた。
【0047】
【表5】

【0048】
〔実施例7〕(組織材料の可溶化)
ウシ延髄組織を動物組織材料として、第2の実施形態に準じて組織可溶化の検討を行った。分解酵素混液には、2−ブタノール、DNase−I、RNase−A、コラゲナーゼA、ウシ膵臓由来リパーゼなどを加え、ラウロイルサルコシン(LSarc)及びオクチル−β−D−グルコシドの界面活性剤とPK(200μg/mL)を表6のように添加配合したPBS溶液を用いた。組織材料採取量の10倍重量の分解酵素混液を加え、ビーズ式破砕機(商品名Bead Smash 12;和研薬株式会社製、又は、商品名マルチビーズショッカー;安井機械製)にて、2分間ホモジナイズ処理した後、ヒートブロック(TAITEC製ドライサーモユニットDTU−1B又はアルミブロックAL−1136B)を用い、37℃〜42℃、5分間加温(インキュベート)した。この状態で、ウシ延髄組織材料は澄明に可溶化されるが、室温に保存すると濁りが認められた。PK阻害剤として4−(2−アミノエチル)−ベンゼンスルホニルフルオライド(AEBSF:商品名;PEFABLOC SC、ロシュダイアグノスティック社製)を2mM相当濃度となるように加え、SiW11 0.5重量%を添加した後、15000×g、5分間遠心分離した。上清を除去し、得られた沈殿物に6M尿素液を組織材料採取重量に対して1.5〜3倍容量加えて、100℃、5分間蛋白変性処理した。尿素濃度調整工程では、PBSを希釈液として尿素濃度1Mに希釈した。蛋白変性処理工程、及び尿素濃度調整工程後の処理液には濁りが認められ可溶化が不充分であった。また、可溶化が不充分な状態の尿素濃度調整工程処理液では、ウシr−PrPCを添加してもELISA法により検出できなかった。なお、マウス脳組織材料を動物組織材料として用いた場合には、澄明に可溶化され検出可能であった。
【0049】
【表6】

【0050】
〔実施例8〕(組織材料の可溶化)
ウシ延髄組織を動物組織材料として、第1の実施形態に準じて組織可溶化の検討を行った。分解酵素混液には、DNase−I、RNase−A、コラゲナーゼAを加え、両性界面活性剤[n−ドデシル−N,N−ジメチルグリシン(DDGly:EMPIGEN BB商品名、Calbiochem社製)又は、n−ドデシル−N,N−(ジメチルアンモニオ)ブチレート(DDMAB;Calbiochem社製)]及び陰イオン界面活性剤[ラウロイルサルコシン(LSarc)]を組み合わせた界面活性剤とPK(200μg/mL)をそれぞれ表7のように添加配合したPBS溶液を用いた。組織材料採取量の10倍重量の分解酵素混液を加え、ビーズ式破砕機(商品名Bead Smash 12;和研薬株式会社製、又は、商品名マルチビーズショッカー;安井機械製)にて、2500rpm、2分間ホモジナイズ処理した後、ヒートブロック(TAITEC社製ドライサーモユニットDTU−1B又はアルミブロックAL−1136B)を用い、37℃〜42℃、5分間加温(インキュベート)した。ウシ延髄組織材料について可溶化PrPC分解工程を行った処理液は、ほぼ澄明に可溶化されていた。
【0051】
【表7】

【0052】
〔実施例9〕(組織材料の可溶化)
両性界面活性剤として、ラウリン酸アミドプロピルヒドロキシスルホベタイン(LSB)、ラウリン酸アミドプロピルベタイン(LPB)、コカミドプロピルベタイン(CPB:ヤシ油脂肪酸アミドプロピルベタイン)を用いた以外は、実施例8の場合と同様にそれぞれ表8のように添加配合し、組織可溶化の検討を行った。実施例8の場合同様、ウシ延髄組織材料について可溶化PrPC分解工程を行った処理液は、ほぼ澄明に可溶化されていた。
【0053】
【表8】

【0054】
〔実施例10〕(組織材料の可溶化)
両性界面活性剤として、ラウリン酸アミドプロピルベタイン(LPB)を追加して用いた以外は、実施例8の場合と同様にそれぞれ表9のように添加配合し、組織可溶化の検討を行った。実施例8の場合同様、ウシ延髄組織材料について可溶化PrPC分解工程を行った処理液は、ほぼ澄明に可溶化されていた。
【0055】
【表9】

【0056】
〔実施例11〕(ELISA測定用試料調製)
哺乳動物組織材料として正常ウシ延髄組織材料100mg及びウシ延髄組織材料100mgにPrPSc感染マウスの脳乳剤5重量%を添加したPrPSc添加ウシ延髄組織材料をそれぞれ2mL容量のマイクロチューブに採取し、4重量%のn−ドデシル−N,N−(ジメチルアンモニオ)ブチル酸塩(DDMAB;Calbiochem社製)、0.01重量%のDNase−I、0.01重量%のRNase−A、0.5重量%のコラゲナーゼA、0.005重量%のPKを添加した50mM、pH7.5のTris緩衝液1mLとステンレスビーズを加え、ビーズ式破砕機(商品名;マルチビーズショッカー、安井機械社製)にて2500rpmで2分間ホモジナイズ処理を行い、続いてアルミブロックヒーターで37℃、3分間加温(インキュベート)し、可溶化PrPC分解工程処理液を得た。次に、PK阻害剤として4−(2−アミノエチル)−ベンゼンスルホニルフルオライド(AEBSF:商品名;PEFABLOC SC、ロシュダイアグノスティック社製)25μLを加えてアルミブロックヒーターで100℃、2分間加熱した。この段階で得られた正常ウシ延髄組織材料由来の試料、0、120、160、180、190、200μLと、PrPSc添加ウシ延髄組織材料由来の試料200、80、40、20、10、0μLをそれぞれ別のマイクロチューブにて混合し、5重量%、2重量%、1重量%、0.5重量%、0.25重量%及び0%(PrPSc不含)のPrPSc感染マウス脳乳剤混入試料を作製した。各試料に尿素72mgを添加し、100℃、5分間加熱し蛋白変性処理工程を行う。良く攪拌してから精製水で10倍に希釈したブロックエース(大日本製薬社製)をそれぞれ0.4mL加えて前処理済みの測定試料を得た(尿素終濃度約2M)。
【0057】
〔試験例1〕(ELISA測定)
あらかじめマウス抗PrPモノクローナル抗体を固相化した96穴マイクロプレートを用いて試験を行った。実施例11にて得られた各測定試料について、それぞれ2ウェルに各50μLを分注した(2重測定)。HRP標識マウス抗PrPモノクローナル抗体溶液50μLをそれぞれ各ウェルに添加し、室温で1時間放置したのち、PBSTで洗浄した。発色基質溶液(TMBZ:3,3′,5,5′−テトラメチルベンジジン、Sigma社製)100μLを添加して室温で遮光して30分間放置したのち、1M濃度の硫酸100μLを加えてマイクロプレートリーダーにて450nmの吸光度を測定した。この結果、図4に示すようにPrPSc感染マウス脳乳剤の添加量に比例した吸光度の上昇が認められ、本発明による迅速前処理法が大動物の組織材料であってもPrPScの測定用の試料調製に有効であることが確認された。
【図面の簡単な説明】
【0058】
【図1】本発明の第1の実施形態による哺乳動物組織材料前処理方法のフロー図である。
【図2】本発明の第2の実施形態による哺乳動物組織材料前処理方法のフロー図である。
【図3】本発明の第3の実施形態による哺乳動物組織材料前処理方法のフロー図である。
【図4】本発明により得られた前処理試料につきELISA法によるPrPSc測定の一例を示す図である。
【特許請求の範囲】
【請求項1】
異常型プリオン蛋白(PrPSc)の検出又は測定用試料を調製するための哺乳動物組織材料の前処理方法であって、
採取した哺乳動物組織材料に、界面活性剤とプロティナーゼK(PK)とを含んでなる分解酵素混液を加えてホモジナイズ処理する可溶化PrPC分解工程を備えることを特徴とする哺乳動物組織材料の前処理方法。
【請求項2】
前記哺乳動物組織材料が、ヒト、ウシ、ヤギ、ヒツジ、シカ、オオジカ、ミンク、ブタ、サル、マウス、ラット、ハムスター、ネコから選ばれた哺乳動物の延髄組織又は中枢神経組織であることを特徴とする請求項1に記載の哺乳動物組織材料の前処理方法。
【請求項3】
前記分解酵素混液が、DNA分解酵素及び/又はRNA分解酵素及び/又はコラーゲン分解酵素を含むことを特徴とする請求項1又は2に記載の哺乳動物組織材料の前処理方法。
【請求項4】
前記界面活性剤が、両性界面活性剤を含むものであることを特徴とする請求項1乃至3のいずれかに記載の哺乳動物組織材料の前処理方法。
【請求項5】
前記界面活性剤が、両性界面活性剤と陰イオン界面活性剤との組み合わせからなることを特徴とする請求項1乃至4のいずれかに記載の哺乳動物組織材料の前処理方法。
【請求項6】
前記両性界面活性剤が、ラウリン酸アミドプロピルヒドロキシスルホベタイン(LSB)、ラウリン酸アミドプロピルベタイン(LPB)、コカミドプロピルベタイン(CPB)、カプリン酸プロピルベタイン(CAPB)、n−ドデシル−N,N−ジメチルグリシン(DDGly)、ラウリルアミノプロピオン酸(LAPA)、n−ドデシル−N,N−(ジメチルアンモニオ)ブチル酸(DDMAB)、n−ドデシル−N,N−(ジメチルアンモニオ)ウンデカン酸(DDMAU)、3−[(3−コラミドプロピル)ジメチルアンモニオ]−1−プロパンスルホン酸(CHAPS)、3−[(3−コラミドプロピル)ジメチルアンモニオ]−2−ヒドロキシ−1−プロパンスルホン酸(CHAPSO)、又はこれらの塩から1以上選ばれたものであることを特徴とする請求項4又は5に記載の哺乳動物組織材料の前処理方法。
【請求項7】
前記陰イオン界面活性剤が、ドデシル硫酸ナトリウム(SDS)、ラウロイルサルコシン(LSarc)、ココイルサルコシンナトリウム、ドデカノイルサルコシンナトリウム、ラウロイルメチル−β−アラニンナトリウム、コール酸ナトリウム(SChol)、デオキシコール酸ナトリウム(SDChol)、グリココール酸ナトリウム、タウロコール酸ナトリウムから1以上選ばれたものであることを特徴とする請求項5に記載の哺乳動物組織材料の前処理方法。
【請求項8】
前記分解酵素混液中の界面活性剤の配合割合を0.1乃至30重量%とすることを特徴とする請求項1乃至7のいずれかに記載の哺乳動物組織材料の前処理方法。
【請求項9】
前記可溶化PrPC分解工程におけるホモジナイズ処理は、容器内にビーズを入れたビーズ式破砕機によって行うことを特徴とする請求項1乃至8のいずれかに記載の哺乳動物組織材料の前処理方法。
【請求項10】
前記可溶化PrPC分解工程において、ホモジナイズ処理したのち、20℃以上、70℃以下の温度で加温(インキュベート)することを特徴とする請求項1乃至9のいずれかに記載の哺乳動物組織材料の前処理方法。
【請求項11】
前記可溶化PrPC分解工程で得られた処理液に、PK阻害剤と粉末状尿素とを添加して加熱する蛋白変性処理工程(A)を含むことを特徴とする請求項1乃至10のいずれかに記載の哺乳動物組織材料の前処理方法。
【請求項12】
前記可溶化PrPC分解工程で得られた処理液に、蛋白沈殿化剤を加えて撹拌後遠心分離して得られる沈殿物につき、尿素液を添加して加熱する蛋白変性処理工程(B)を含むことを特徴とする請求項1乃至10のいずれかに記載の哺乳動物組織材料の前処理方法。
【請求項13】
前記請求項11又は12に記載の蛋白変性処理工程で得られた蛋白変性処理済液に、希釈液を添加して、PrPScの検出又は測定用試料とすることを特徴とする哺乳動物組織材料の前処理方法。
【請求項14】
前記可溶化PrPC分解工程で得られた処理液に、PK阻害剤を加えるPK阻害剤添加工程を含むことを特徴とする請求項1乃至10のいずれかに記載の哺乳動物組織材料の前処理方法。
【請求項15】
前記請求項14に記載のPK阻害剤添加工程で得られた処理液に、希釈液を添加して、PrPScの検出又は測定用試料とすることを特徴とする哺乳動物組織材料の前処理方法。
【請求項1】
異常型プリオン蛋白(PrPSc)の検出又は測定用試料を調製するための哺乳動物組織材料の前処理方法であって、
採取した哺乳動物組織材料に、界面活性剤とプロティナーゼK(PK)とを含んでなる分解酵素混液を加えてホモジナイズ処理する可溶化PrPC分解工程を備えることを特徴とする哺乳動物組織材料の前処理方法。
【請求項2】
前記哺乳動物組織材料が、ヒト、ウシ、ヤギ、ヒツジ、シカ、オオジカ、ミンク、ブタ、サル、マウス、ラット、ハムスター、ネコから選ばれた哺乳動物の延髄組織又は中枢神経組織であることを特徴とする請求項1に記載の哺乳動物組織材料の前処理方法。
【請求項3】
前記分解酵素混液が、DNA分解酵素及び/又はRNA分解酵素及び/又はコラーゲン分解酵素を含むことを特徴とする請求項1又は2に記載の哺乳動物組織材料の前処理方法。
【請求項4】
前記界面活性剤が、両性界面活性剤を含むものであることを特徴とする請求項1乃至3のいずれかに記載の哺乳動物組織材料の前処理方法。
【請求項5】
前記界面活性剤が、両性界面活性剤と陰イオン界面活性剤との組み合わせからなることを特徴とする請求項1乃至4のいずれかに記載の哺乳動物組織材料の前処理方法。
【請求項6】
前記両性界面活性剤が、ラウリン酸アミドプロピルヒドロキシスルホベタイン(LSB)、ラウリン酸アミドプロピルベタイン(LPB)、コカミドプロピルベタイン(CPB)、カプリン酸プロピルベタイン(CAPB)、n−ドデシル−N,N−ジメチルグリシン(DDGly)、ラウリルアミノプロピオン酸(LAPA)、n−ドデシル−N,N−(ジメチルアンモニオ)ブチル酸(DDMAB)、n−ドデシル−N,N−(ジメチルアンモニオ)ウンデカン酸(DDMAU)、3−[(3−コラミドプロピル)ジメチルアンモニオ]−1−プロパンスルホン酸(CHAPS)、3−[(3−コラミドプロピル)ジメチルアンモニオ]−2−ヒドロキシ−1−プロパンスルホン酸(CHAPSO)、又はこれらの塩から1以上選ばれたものであることを特徴とする請求項4又は5に記載の哺乳動物組織材料の前処理方法。
【請求項7】
前記陰イオン界面活性剤が、ドデシル硫酸ナトリウム(SDS)、ラウロイルサルコシン(LSarc)、ココイルサルコシンナトリウム、ドデカノイルサルコシンナトリウム、ラウロイルメチル−β−アラニンナトリウム、コール酸ナトリウム(SChol)、デオキシコール酸ナトリウム(SDChol)、グリココール酸ナトリウム、タウロコール酸ナトリウムから1以上選ばれたものであることを特徴とする請求項5に記載の哺乳動物組織材料の前処理方法。
【請求項8】
前記分解酵素混液中の界面活性剤の配合割合を0.1乃至30重量%とすることを特徴とする請求項1乃至7のいずれかに記載の哺乳動物組織材料の前処理方法。
【請求項9】
前記可溶化PrPC分解工程におけるホモジナイズ処理は、容器内にビーズを入れたビーズ式破砕機によって行うことを特徴とする請求項1乃至8のいずれかに記載の哺乳動物組織材料の前処理方法。
【請求項10】
前記可溶化PrPC分解工程において、ホモジナイズ処理したのち、20℃以上、70℃以下の温度で加温(インキュベート)することを特徴とする請求項1乃至9のいずれかに記載の哺乳動物組織材料の前処理方法。
【請求項11】
前記可溶化PrPC分解工程で得られた処理液に、PK阻害剤と粉末状尿素とを添加して加熱する蛋白変性処理工程(A)を含むことを特徴とする請求項1乃至10のいずれかに記載の哺乳動物組織材料の前処理方法。
【請求項12】
前記可溶化PrPC分解工程で得られた処理液に、蛋白沈殿化剤を加えて撹拌後遠心分離して得られる沈殿物につき、尿素液を添加して加熱する蛋白変性処理工程(B)を含むことを特徴とする請求項1乃至10のいずれかに記載の哺乳動物組織材料の前処理方法。
【請求項13】
前記請求項11又は12に記載の蛋白変性処理工程で得られた蛋白変性処理済液に、希釈液を添加して、PrPScの検出又は測定用試料とすることを特徴とする哺乳動物組織材料の前処理方法。
【請求項14】
前記可溶化PrPC分解工程で得られた処理液に、PK阻害剤を加えるPK阻害剤添加工程を含むことを特徴とする請求項1乃至10のいずれかに記載の哺乳動物組織材料の前処理方法。
【請求項15】
前記請求項14に記載のPK阻害剤添加工程で得られた処理液に、希釈液を添加して、PrPScの検出又は測定用試料とすることを特徴とする哺乳動物組織材料の前処理方法。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2007−97508(P2007−97508A)
【公開日】平成19年4月19日(2007.4.19)
【国際特許分類】
【出願番号】特願2005−293011(P2005−293011)
【出願日】平成17年10月5日(2005.10.5)
【出願人】(504157024)国立大学法人東北大学 (2,297)
【出願人】(000118497)伊藤ハム株式会社 (57)
【出願人】(502100415)マイクロ化学技研株式会社 (8)
【Fターム(参考)】
【公開日】平成19年4月19日(2007.4.19)
【国際特許分類】
【出願日】平成17年10月5日(2005.10.5)
【出願人】(504157024)国立大学法人東北大学 (2,297)
【出願人】(000118497)伊藤ハム株式会社 (57)
【出願人】(502100415)マイクロ化学技研株式会社 (8)
【Fターム(参考)】
[ Back to top ]

