変異および/または多型の検出方法
【課題】本発明の課題は、類似する遺伝子の識別と、わずかな塩基配列の相違の正確な検出を同時に達成することができる新規な反応原理を提供することである。
【解決手段】本発明は、相補鎖合成を完了した3'末端が自身の塩基配列上に存在する標的塩基配列に由来する特定の領域にハイブリダイズして次の相補鎖合成の起点となる核酸の合成方法に基づいている。本発明においては、変異や多型を検出すべき特定の領域に対して繰り返しハイブリダイズが行われることから、標的塩基配列における変異や多型が反応生成物に正確に反映される。
【解決手段】本発明は、相補鎖合成を完了した3'末端が自身の塩基配列上に存在する標的塩基配列に由来する特定の領域にハイブリダイズして次の相補鎖合成の起点となる核酸の合成方法に基づいている。本発明においては、変異や多型を検出すべき特定の領域に対して繰り返しハイブリダイズが行われることから、標的塩基配列における変異や多型が反応生成物に正確に反映される。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、塩基配列の変異や多型の検出方法に関する。
【背景技術】
【0002】
遺伝子領域における変異は、翻訳アミノ酸の変化を伴うミスセンス変異、アミノ酸の変化を伴わないサイレント変異、更に塩基の欠質や挿入によって翻訳フレームがずれるフレームシフト変異などの原因となる可能性がある。ミスセンス変異には、誤った位置にストップコドンが生じてしまうナンセンス変異が含まれる。また、遺伝子領域における変異は、スプライシングの異常等を通じて遺伝子の翻訳異常につながる可能性もある。サイレント変異以外の変異は、タンパク質の構造的な、あるいは機能的な変化を伴うケースが多い。
更に、発現調節領域の異常は、タンパク質の発現調節機構に影響を与える恐れがある。
【0003】
さて、核酸の塩基配列上の差異のうち、ある集団内で1%以上の頻度で存在する変異は、特に多型と呼ばれている。集団とは、地理的な隔離や亜種によって区別される集団を意味する。例えば日本人では1%に満たない変異であっても、他の人種で1%以上の頻度で見出されれば、変異ではなく多型である。
【0004】
多型の中でも、一塩基の挿入、欠失、置換による多型は、特に一塩基多型(以下、SNPs;single nucleotide polymorphismsと省略する)と呼ばれている。SNPsは、ヒトゲノムの中で最も出現頻度が高い多型であるため注目されている。
【0005】
多型は、一定の頻度で集団に広がっていることから、全く形質の変化を伴わないものか、特に生存(生殖)に不利な形質ではなく、いわば体質といえる形質を左右しているものと考えられる。たとえば、糖尿病、リュウマチ、アレルギー、自己免疫疾患、肥満、あるいは癌などの代表的な成人病に対する罹りやすさが遺伝的な特性に支配されているとすれば、多型によって決定されていると考えられる。その他、薬剤代謝やヒト白血球組織適合型抗原(以下、HLAと省略する)なども多型によって支配されている。そして、その多くはSNPsであることが明らかにされつつある。
【0006】
多型にはこのような特徴があることから、マイクロサテライト多型のように、染色体へのマッピングと連鎖解析などによって疾患関連遺伝子の絞り込みに用いられる。SNPsは、300〜600塩基に一つの割合で存在するため詳細なマップが得られ、遺伝子の絞り込みを容易にすることが期待されている。
【0007】
更に、多型の位置と変動に関する情報を集積し、ある表現型との関連性を解析することによって、多くの情報を得られる可能性があると期待されている。たとえば、薬剤に対する副作用に関連するSNPsを明らかにすることができれば、副作用を未然に防ぐことが可能となる。副作用の克服によって、実用化を諦めざるを得なかった多くの薬剤を、安全な薬剤として再評価できる可能性がある。
【0008】
細菌やウイルスの場合においても、C型肝炎ウイルス(以下、HCVと略する)のサブタイプ等は、一定の割合で共通して見出される塩基配列の特徴に基づく分類であることから、多型と考えることができる。変異解析のなかでも、これら多型の遺伝子型を調べることを目的とする場合を、タイピングと呼んでいる。
【0009】
HCVでは、αインターフェロンによる治療効果にサブタイプによる違いがあることから、タイピングの結果は治療方法の選択において重要な情報である。HCVのほか、インフルエンザ・ウイルス、マラリア、あるいはヘリコバクター・ピロリなども、サブタイプによって治療効果に違いのあることが明らかにされている病原体である。これらの病原体においても、タイピングは治療方針の決定における重要な情報を与える。
【0010】
多型に対して、1%未満で見出される変異は、人の場合は集団内で広がらない変異で、ほとんどが疾患にかかわるものといって良い。すなわち、遺伝病において見出される変異が相当する。また、個体内で見出される変異においても、癌等において見出される変異のように疾患にかかわるものがある。このような変異の検出は、対応する疾患の診断において決定的な情報を与える。
【0011】
ある遺伝子について、その塩基配列が予測された塩基配列と比較して相違しているのかどうかは、相補的な塩基配列のハイブリダイズによって確認できる。具体的には、プライマーやプローブのハイブリダイズが利用される。
【0012】
たとえばPCR用のプライマーは、標的塩基配列がプライマーに相補的な塩基配列を持つ場合にのみプライマーとして作用することができる。この原理に基づいて、PCRの増幅産物を指標として、標的塩基配列がプライマーに相補的であるかどうかを知ることができる。しかしPCRに基づく塩基配列の確認方法には、いくつかの問題点がある。第一に、プライマーによる塩基配列のチェック機構が不完全である。PCR法においても、1塩基の違いを増幅反応で検出する方法が考案されている(allele-specific PCR、Nucleic Acids Res 17:p25031989, Genomics 5:p535 1989, J. Lab. Clin. Med 114:p105 1989)。しかし、S.Kwokらが報告しているとおり(Nucleic Acids Res 18:p999 1990)、1塩基の違いのプライマーを用いた場合、完全に相補的なプライマーに比べて、増幅サイクルあたり約0.1%〜85%(配列の違いによって異なる)の反応が進行してしまう。言いかえれば、塩基配列がプライマーと完全に相補的な塩基配列でなくてもしばしば相補鎖の合成が起きてしまう。このため、allele-specific PCRで1塩基の違いを区別するためには、人為的にもう一カ所ミスマッチをいれる必要があるとされている。しかしこの場合も配列の違いにより厳密な条件設定が必要であり、汎用技術とはなっていない。したがって、通常の条件ではPCR法によってSNPsのような1塩基の相違を識別することは困難である。
【0013】
言いかえれば、相補的な塩基配列のハイブリダイズに基づいてわずかな塩基配列の相違を検出する方法は、誤りが起きる可能性を含んでいると言える。PCR法では、誤って生成された合成産物が完全な鋳型として機能するため、指数的な増幅をトリガーしてしまう。つまり、誤りが起きる可能性があるのにもかかわらず、誤った反応に基づいて高度な増幅が起きてしまう点が、わずかな塩基配列の識別においては問題となる。
【0014】
PCR法の第2の問題点として、その原理上プライマーが2つの領域にしか設定できないことが挙げられる。したがって、類似した塩基配列からなる複数の遺伝子が同一の試料中に存在する場合、各遺伝子における変異や多型をPCR法に基づく増幅生成物の有無を指標として確認することはきわめて困難である。ある遺伝子に変異が存在していたとしても、他方の遺伝子にプライマーがハイブリダイズすれば反応が進行してしまうためである。
【0015】
たとえばヒトCYP2C19のようなファミリー遺伝子においては、ある遺伝子の変異を検出するためのプライマーは、他の遺伝子に対してもプライマーとして作用してしまう。図6にヒトCYP2C19ファミリーに見出される互いに類似した塩基配列を示した。この図からわかるように、ある遺伝子の変異を検出するためのプライマーは、他の遺伝子の野生型においてプライマーとして作用してしまう。このような条件下では、2つの領域のみで、類似する遺伝子の識別と変異の検出とを同時に行うことは困難である。
【0016】
以上の2つの問題点より、PCRによる変異検出では、まず標的遺伝子をPCRにより特異的に増幅し、その後、プローブ、あるいはプライマーを用いて変異を検出するといういわゆるPCR依存型変異検出技術が多数報告されている。その中でも、DNAチップ法は特に注目されている検出技術である。DNAチップ上には、数多くの類似する塩基配列を微小な区画に整列させることができる。DNAチップ上では、微細な空間の反応環境を制御することによって、わずかな塩基配列の相違に基づくハイブリダイズの有無を、検出できるとされている。しかし現実には、解析データの再現性が最大の課題とされている。DNAチップ上でのハイブリダイズの条件は、反応空間が微細なために、繊細な条件設定が求められる。一定の水準で再現性を維持するには、高度な技術と、細心の注意が要求される。さらに、PCR依存技術であるため大きく分けて2工程が必要であること、加えて、現状ではDNAチップの価格が高いことも、解決が望まれる課題である。
【0017】
一方、PCR非依存型変異検出技術としては、Invader法(Mol Diagn. 4:p135 1999)や、RCA法(Nat Genet 19:p225 1998)が報告されている。しかし、いずれの方法も、その反応特異性は近接する2つの領域に設定されたプローブに依存している。PCRについて指摘したように2つの領域のみで、類似する遺伝子の識別と変異の検出とを同時に行うことは困難である。
【0018】
以上のように、公知の塩基配列の確認方法は、一工程でわずかな塩基配列を正確に識別することができない、あるいは類似する遺伝子の識別と変異の検出とを同時に行うことが困難であるという問題点があった。また、PCR依存技術のように技術的には類似する遺伝子の識別と変異の検出を行うことが可能であっても、精度の維持が困難であったり、複数の工程が必要なために煩雑な操作が必要となっていた。加えて、経済性の面でも改善が望まれていた。
【発明の概要】
【発明が解決しようとする課題】
【0019】
本発明の課題は、類似する遺伝子の識別と、わずかな塩基配列の相違の正確な検出を同時に達成することができる新規な反応原理を提供することである。より具体的には、相補鎖合成の過程において、標的塩基配列における塩基配列を繰り返しチェックすることが可能な核酸の合成方法を利用して、標的塩基配列における変異や多型を検出することができる方法の提供が本発明の課題である。
【課題を解決するための手段】
【0020】
発明者らは、公知の核酸増幅反応に基づく塩基配列の確認方法の問題点として、大部分のプライマーが標的塩基配列にハイブリダイズできなくなる点に着目した。すなわちPCR法においては、プライマーに由来する塩基配列がそのまま鋳型として相補鎖合成に利用される。したがってプライマーのハイブリダイズによる標的塩基配列のチェック機構が働くのは、事実上、反応全体のごく一部にすぎない。反応の大部分は、単にプライマーの塩基配列を写し取った相補鎖に対してプライマーがハイブリダイズすることによって進行している。これでは、標的塩基配列のチェックを行っているとは言いがたい。
【0021】
そこで本発明者らは、プライマーではなく、標的塩基配列に由来する塩基配列に対してハイブリダイズする工程を多く含む核酸の合成反応を利用すれば、標的塩基配列のわずかな塩基配列の相違を正確に検出できると考えた。そして本発明者らは、標的塩基配列に対するより厳密なチェック機構が、相補鎖合成を完了した3'末端を次の相補鎖合成の起点として利用することによって達成できることを見出し、本発明を完成した。
【0022】
より具体的には、塩基配列の識別のためのプライマーが相補鎖合成によって初めてもたらされ、しかもこのプライマーが自身を鋳型とする相補鎖合成の起点となる核酸の合成方法に基づいて、高度なチェック機構が実現できることを見出した。このような核酸の合成反応は、本発明者らが既に報告している(Nucleic Acid Res. 2000 Vol.28 No.12 e63、WO 00/28082)。本発明は、この核酸の合成方法に基づいて前記課題の解決を達成した。即ち本発明は、以下の変異および/または多型の検出方法、ならびにそのための試薬キットに関する。
【0023】
〔1〕次の要素を、第2および第1のプライマーを起点とする相補鎖合成が可能な条件下でインキュベートし、標的塩基配列を鋳型とする相補鎖合成反応生成物の量と特定の領域の変異および/または多型の存在と関連付ける工程を含む、標的塩基配列における特定の領域の変異および/または多型の検出方法であって、第2および第1のプライマーの少なくとも一方の5'末端に配置された塩基配列が、前記特定の領域、またはその相補鎖の予測される塩基配列に相補的な塩基配列を含み、この5'末端に配置された塩基配列を鋳型として合成された相補鎖は、特定の領域、またはその相補鎖にアニールして相補鎖合成の起点となるとき、特定の領域を構成する塩基配列が予測していたものでなかった場合に、相補鎖合成が阻害されることを特徴とする方法。
(a)標的塩基配列を含む核酸試料、
(b)鎖置換を伴う相補鎖合成を触媒することができるDNAポリメラーゼ、
(c)第2のプライマー;ここで第2のプライマーはその3'末端において前記標的塩基配列を構成する一方の鎖の3'側を規定する領域に対してアニールすることができ、かつ第2のプライマーの5'側には、このプライマーを起点とする相補鎖合成反応生成物上の領域を構成する予測される塩基配列に相補的な塩基配列を備える、
(d)第1のプライマー;ここで第1のプライマーはその3'末端において前記標的塩基配列を構成する他方の鎖の3'側を規定する領域に対してアニールすることができ、かつ第1のプライマーの5'側には、このプライマーを起点とする相補鎖合成反応生成物上の領域を構成する予測される塩基配列に相補的な塩基配列を備える、
(e)ヌクレオチド基質。
【0024】
〔2〕第2のプライマー、および第1のプライマーが、いずれもその5'末端に配置された塩基配列が、前記特定の領域、またはその相補鎖の予測される塩基配列に相補的な塩基配列を含み、この5'末端に配置された塩基配列を鋳型として合成された相補鎖は、特定の領域、またはその相補鎖にアニールして相補鎖合成の起点となるとき、特定の領域を構成する塩基配列が予測していたものでなかった場合に、相補鎖合成が阻害されることを特徴とする〔1〕に記載の方法。
【0025】
〔3〕更に付加的に次の要素を存在させる〔1〕に記載の方法。
・第3のプライマー;ここで第3のプライマーは、鋳型における第1のプライマーがアニールすべき領域の3'側を起点とする相補鎖合成反応の起点となる、および
・第4のプライマー;ここで第4のプライマーは、鋳型における第2のプライマーがアニールすべき領域の3'側を起点とする相補鎖合成反応の起点となる。
【0026】
〔4〕標的塩基配列の塩基配列と類似する塩基配列を含む遺伝子が同じ試料中に存在する可能性があるものである〔1〕に記載の方法。
〔5〕標的塩基配列の塩基配列と類似する塩基配列を含む遺伝子が、ファミリー遺伝子および/または擬似遺伝子である〔4〕に記載の方法。
【0027】
〔6〕ファミリー遺伝子および/または擬似遺伝子が、チトクロムP450ファミリー、ヒト白血球組織適合型抗原、および血小板同種抗原からなる群から選択されるいずれかの遺伝子である〔5〕に記載の方法。
【0028】
〔7〕多型が1塩基多型である〔1〕に記載の方法。
〔8〕標的塩基配列が、C型肝炎ウイルス、インフルエンザウイルス、マラリア、およびヘリコバクター・ピロリからなる群から選択されるいずれかの病原性ウイルスまたは病原性微生物の遺伝子の塩基配列から選択される〔1〕に記載の方法。
【0029】
〔9〕融解温度調整剤の存在下でインキュベートする〔1〕に記載の方法。
〔10〕融解温度調整剤が、ベタイン、プロリン、およびジメチルスルホキシドから選択される少なくとも1つの化合物である〔9〕に記載の方法。
【0030】
〔11〕核酸試料が2本鎖の形態である〔1〕に記載の方法。
〔12〕核酸の検出剤存在下で〔1〕に記載の方法を行い、検出剤のシグナル変化に基づいて変異および/または多型の存在を検出することを特徴とする〔1〕に記載の方法。
【0031】
〔13〕変異および/または多型を検出すべき生物と同一の生物に由来し、変異および/または多型を伴わないことが明らかな塩基配列を内部標準として利用し、両者を鋳型とする合成生成物の量の比較によって、変異および/または多型の存在を検出することを特徴とする〔1〕に記載の方法。
【0032】
〔14〕更に次の要素(f)および/または(g)を存在させる〔1〕に記載の方法。
(f)第1のループプライマー;ここで第1のループプライマーは、第1のプライマーの伸長生成物における第1のプライマーに由来する領域と、第1のプライマーに対する前記任意の領域の間において相補鎖合成の起点を与えることができるものである、
(g)第2のループプライマー;ここで第2のループプライマーは、第2のプライマーの伸長生成物における第2のプライマーに由来する領域と、第2のプライマーに対する前記任意の領域の間において相補鎖合成の起点を与えることができるものである。
【0033】
〔15〕前記特定の領域を構成する塩基配列が予測された塩基配列でなかった場合に、第1のプライマーおよび/または第2のプライマーの5'末端に配置された塩基配列を鋳型として合成された相補鎖が、特定の領域、またはその相補鎖にアニールするとき、当該相補鎖の3'末端から2〜4番目の塩基においてミスマッチを生じることを特徴とする〔1〕に記載の方法。
【0034】
〔16〕次の要素を含む、標的塩基配列における特定の領域の変異および/または多型の検出用キットであって、第2および第1のプライマーの少なくとも一方の5'末端に配置された塩基配列が、前記特定の領域、またはその相補鎖の予測される塩基配列に相補的な塩基配列を含み、この5'末端に配置された塩基配列を鋳型として合成された相補鎖は、特定の領域、またはその相補鎖にアニールして相補鎖合成の起点となるとき、特定の領域を構成する塩基配列が予測していたものでなかった場合に、相補鎖合成が阻害されることを特徴とするキット。
i)第2のプライマー;ここで第2のプライマーはその3'末端において前記標的塩基配列を構成する一方の鎖の3'側を規定する領域に対してアニールすることができ、かつ第2のプライマーの5'側には、このプライマーを起点とする相補鎖合成反応生成物上の領域を構成する予測される塩基配列に相補的な塩基配列を備えるものであり、
ii)第1のプライマー;ここで第1のプライマーはその3'末端において前記標的塩基配列を構成する他方の鎖の3'側を規定する領域に対してアニールすることができ、かつ第1のプライマーの5'側には、このプライマーを起点とする相補鎖合成反応生成物上の領域を構成する予測される塩基配列に相補的な塩基配列を備えるものである、
iii) 鎖置換を伴う相補鎖合成を触媒することができるDNAポリメラーゼ、
iv)ヌクレオチド基質。
【0035】
〔17〕更に次の要素を含む〔16〕に記載のキット。
v)鋳型における第1のプライマーがアニールすべき領域の3'側にアニールして相補鎖合成の起点となることができる第3のプライマー、および
vi)鋳型における第2のプライマーがアニールすべき領域の3'側にアニールして相補鎖合成の起点となることができる第4のプライマー。
【0036】
〔18〕更に次の要素を含む〔16〕に記載のキット。
vii)内部標準を増幅することができる第5のプライマー;ここで第5のプライマーは、その3'末端において内部標準の標的塩基配列を構成する一方の鎖の3'側を規定する領域に対してアニールすることができ、かつ第5のプライマーの5'側には、このプライマーを起点とする相補鎖合成反応生成物の任意の領域を構成する塩基配列に相補的な塩基配列を備えるものであり、そして
iix)内部標準を増幅することができる第6のプライマー;ここで第6のプライマーはその3'末端において内部標準の標的塩基配列を構成する一方の鎖の3'側を規定する領域に対してアニールすることができ、かつ第6のプライマーの5'側には、このプライマーを起点とする相補鎖合成反応生成物の領域を構成する塩基配列に相補的な塩基配列を備えるものである。
【0037】
〔19〕更に次の要素を含む〔18〕に記載のキット。
ix)鋳型における第5のプライマーがアニールすべき領域の3'側にアニールして相補鎖合成の起点となることができる第7のプライマー、および
x)鋳型における第6のプライマーがアニールすべき領域の3'側にアニールして相補鎖合成の起点となることができる第8のプライマー。
【0038】
〔20〕以下の工程を含む標的塩基配列の特定の領域における変異および/または多型の検出方法であって、第2および第1のプライマーの少なくとも一方の5'末端に配置された塩基配列が、前記特定の領域、またはその相補鎖の予測される塩基配列に相補的な塩基配列を含み、この5'末端に配置された塩基配列を鋳型として合成された相補鎖は、特定の領域、またはその相補鎖にアニールして相補鎖合成の起点となるとき、特定の領域を構成する塩基配列が予測していたものでなかった場合に、相補鎖合成が阻害されることを特徴とする方法。
a)標的塩基配列に第1のプライマーをアニールさせ、これを起点とする相補鎖合成反応を行う工程;ここで第1のプライマーはその3'末端において前記標的塩基配列を構成する一方の鎖の3'側を規定する領域に対してアニールすることができ、かつ第1のプライマーの5'側には、このプライマーを起点とする相補鎖合成反応生成物上の領域を構成する予測される塩基配列に相補的な塩基配列を備える、
b)工程a)で合成された第1のプライマーの伸長産物における第2のプライマーがアニールすべき領域を塩基対結合が可能な状態とし、両者をアニールさせて第1のプライマーの伸長産物を鋳型とする相補鎖合成を行う工程;ここで第2のプライマーはその3'末端において前記標的塩基配列を構成する他方の鎖の3'側を規定する領域に対してアニールすることができ、かつ第2のプライマーの5'側には、このプライマーを起点とする相補鎖合成反応生成物上の領域を構成する予測される塩基配列に相補的な塩基配列を備える、
c)第2のプライマーの伸長生成物の3'末端と、該伸長生成物における第1のプライマーに対する前記予測される塩基配列をアニールさせて自身を鋳型とする相補鎖合成を行う工程、
d)工程c)で合成された相補鎖における3'末端と、該伸長生成物における第2のプライマーに対する前記予測される塩基配列をアニールさせて自身を鋳型とする相補鎖合成を行う工程、
e)第2のプライマーを起点とする合成生成物の量を特定の領域における変異および/または多型の存在と関連付ける工程。
【0039】
〔21〕工程b)が、鋳型における鋳型における第1のプライマーがアニールすべき領域の3'側を起点とする第3のプライマーの相補鎖合成反応による置換によって第1のプライマーの伸長生成物を1本鎖とする工程を含む〔20〕に記載の方法。
【0040】
〔22〕工程c)が、鋳型における第2のプライマーがアニールすべき領域の3'側を起点とする第4のプライマーの相補鎖合成反応による置換によって第2のプライマーの伸長生成物を1本鎖とする工程を含む〔20〕に記載の方法。
【0041】
〔23〕更に以下の工程を含む〔20〕に記載の方法であって、第2および第1のプライマーの少なくとも一方の5'末端に配置された塩基配列が、前記特定の領域、またはその相補鎖の予測される塩基配列に相補的な塩基配列を含み、この5'末端に配置された塩基配列を鋳型として合成された相補鎖は、特定の領域、またはその相補鎖にアニールして相補鎖合成の起点となるとき、特定の領域を構成する塩基配列が予測していたものでなかった場合に、相補鎖合成が阻害されることを特徴とする方法。
1)〔20〕に記載の方法において、工程c)の3'末端と自身の前記予測される塩基配列とのアニールによって、第1のプライマーの3'末端に相補的な塩基配列を含む塩基対結合が可能なループ形成領域を形成するとともに、自身の3'末端を相補鎖合成の起点とし、自身を鋳型とする相補鎖合成反応を行う工程、
2)ループ形成領域に第1のプライマーをアニールさせて、鎖置換を伴う相補鎖合成を触媒することができるDNAポリメラーゼによりそれを起点とする相補鎖合成を行う工程、
3)ループ形成領域にアニールするプライマーを起点とする相補鎖合成反応によって、自身の3'末端からの伸長生成物を置換し、その3'末端と前記予測される塩基配列を再び塩基対結合が可能な状態とする工程、
4)工程3)によって塩基対結合が可能となった3'末端を前記予測される塩基配列にアニールさせて相補鎖合成の起点とし、自身を鋳型とする相補鎖合成反応を行うことによって、ループ形成領域を起点として合成された相補鎖を置換して1本鎖の核酸を生成する工程、
5)3'末端の第2のプライマーに対する前記予測される塩基配列に対するアニールと相補鎖合成によって、第2のプライマーの3'末端に相補的な塩基配列を含む塩基対結合が可能なループ形成領域を形成する工程、
6)ループ形成領域に第2のプライマーをアニールさせて、鎖置換を伴う相補鎖合成を触媒することができるDNAポリメラーゼによりそれを起点とする相補鎖合成を行う工程、
7)工程3)−6)を繰り返す工程、および
8)工程7)の後に、および/または工程7)と並行して標的塩基配列とその相補鎖とが繰り返し連結された1本鎖核酸の生成を観察し、その生成量を変異および/または多型と関連付ける工程。
【0042】
〔24〕更に次の工程を含む〔23〕に記載の方法。
9)工程4)で生成する1本鎖の核酸の3'末端を第2のプライマーに対する前記予測される塩基配列にアニールさせて、第2のプライマーの3'末端に相補的な塩基配列を含む塩基対結合が可能なループ形成領域を形成するとともに、自身の3'末端を相補鎖合成の起点とし、自身を鋳型とする相補鎖合成反応を行う工程、予測される塩基配列、
10)3'末端と自身の前記特定の領域とのアニールによって形成された、ループ形成領域に第2のプライマーをアニールさせて、鎖置換を伴う相補鎖合成を触媒することができるDNAポリメラーゼによりそれを起点とする相補鎖合成を行う工程、
11)ループ形成領域にアニールするプライマーを起点とする相補鎖合成反応によって、自身の3'末端からの伸長生成物を置換し、その3'末端と前記予測される塩基配列を再び塩基対結合が可能な状態とする工程、
12)工程11)によって塩基対結合が可能となった3'末端を前記予測される塩基配列にアニールさせて相補鎖合成の起点とし、自身を鋳型とする相補鎖合成反応を行うことによって、ループ形成領域を起点として合成された相補鎖を置換して1本鎖の核酸を生成する工程、
13)3'末端の前記予測される塩基配列に対するアニールと相補鎖合成によって、第1のプライマーの3'末端に相補的な塩基配列を含む塩基対結合が可能なループ形成領域を形成する工程、
14)ループ形成領域に第1のプライマーをアニールさせて、鎖置換を伴う相補鎖合成を触媒することができるDNAポリメラーゼによりそれを起点とする相補鎖合成を行う工程、
15)工程11)−14)を繰り返す工程、および
16)工程15)の後に、および/または工程15)と並行して標的塩基配列とその相補鎖とが繰り返し連結された1本鎖核酸の生成を観察し、その生成量を変異および/または多型と関連付ける工程。
【0043】
〔25〕更に次の工程を含む〔24〕に記載の方法。
17)工程12)において生成する1本鎖の核酸の3'末端を自身の前記予測される塩基配列にアニールさせて、第1のプライマーの3'末端に相補的な塩基配列を含む塩基対結合が可能なループ形成領域を形成するとともに、自身の3'末端を相補鎖合成の起点とし、自身を鋳型とする相補鎖合成反応を行う工程。
【0044】
〔26〕第2のプライマー、および第1のプライマーが、いずれもその5'末端に配置された塩基配列が、前記特定の領域、またはその相補鎖の予測される塩基配列に相補的な塩基配列を含み、この5'末端に配置された塩基配列を鋳型として合成された相補鎖は、特定の領域、またはその相補鎖にアニールして相補鎖合成の起点となるとき、特定の領域を構成する塩基配列が予測していたものでなかった場合に、相補鎖合成が阻害されることを特徴とする〔20〕に記載の方法。
【発明の効果】
【0045】
本発明によって、標的塩基配列が予測する塩基配列と異なっているかどうかを、正確に識別することができる。本発明の方法は、核酸の変異や多型の解析に有用である。この方法は、簡単な酵素的な反応に基づいている。したがって、特殊な機器や、反応成分を必要とせず、安価に、しかも容易に実施することができる。
【0046】
また本発明による変異や多型の検出方法は、標的塩基配列の増幅を伴う反応を伴っているので、塩基配列の識別結果を核酸の増幅反応生成物の量を指標として検出できる。その結果、感度と再現性の高い塩基配列の解析が可能となる。しかも本発明で用いる反応原理は、相補鎖合成の開始が繰り返し標的塩基配列のチェックを経て進行している。そのため、たとえ誤った相補鎖合成が起きたとしても、その反応が最終的な解析結果に影響を与えることがない。公知の遺伝子増幅反応であるPCR法では、いったん誤った相補鎖合成が起きてしまうと、正確な判定を行えなくなってしまうため、このような解析には現実には応用することができない。プライマーのハイブリダイズに基づく塩基配列のチェック機構には、常に一定の誤りを伴うことは、いわば宿命的な特性である。本発明では、核酸の相補鎖合成における誤りの影響を常に最小限にすると同時に、正確な反応に基づく生成物のみが多量に蓄積するという、高いS/N比を現実のものとした。したがって、本発明は、核酸の増幅反応による塩基配列の識別方法をはじめて現実的なものとした先駆的な発明と言うことできる。
【0047】
更に、複数の領域によって反応の進行が制御されるという本発明の特徴は、類似する塩基配列を含む複数の遺伝子が存在する条件の基での、わずかな塩基配列の相違の検出において有用である。この特徴に基づいて、本発明は、HLAや血小板同種抗原、あるいは病原微生物のタイピングを正確に、そして簡便に行うことができる。また、薬剤代謝酵素の活性に関連するSNPsの検出も、本発明によって容易に行うことができる。
【図面の簡単な説明】
【0048】
【図1】図1は、本発明の望ましい態様の反応原理の一部(1)-(2)を示す模式図である。
【図2】図2は、本発明の望ましい態様の反応原理の一部(3)-(5)を示す模式図である。
【図3】図3は、本発明の望ましい態様の反応原理の一部(6)-(8)を示す模式図である。
【図4】図4は、本発明の望ましい態様の反応原理の一部(9)-(11)を示す模式図である。
【図5】図5は、本発明による1本鎖核酸が形成するループの構造を示す模式図である。
【図6】図6は、ヒトCYP2C19ファミリーに見出される互いに類似した塩基配列を示す図である。
【図7】図7は、実施例においてSNPsの検出を行った標的塩基配列と、標的塩基配列におけるプライマーの位置関係を示す図である。
【図8】図8は、本発明による変異の検出方法の結果を示す写真である。各レーンは、標的テンプレート:特定の領域が予測される塩基配列であった場合、一塩基違いテンプレート:予測される塩基配列と1塩基相違していた場合、そして対照としてのプライマーのみの場合:テンプレート無しを示している。
【図9】図9は、本発明による変異の検出方法の結果を示すグラフである。図中、縦軸は蛍光強度を、横軸は反応時間(時間)を示す。−■−:ターゲットなし、−○−:m1、−●−:WT。
【図10】図10は、実施例3においてSNPsの検出を行った標的塩基配列と、標的塩基配列におけるプライマーの位置関係を示す図である。
【図11】図11は、本発明による変異検出方法の結果を示すグラフである。a)は野生型(WT)用プライマーセットを、そしてb)は変異型(MUT)用プライマーセットを各鋳型DNAと反応させた結果を示す。図中、縦軸は蛍光強度を、横軸は反応時間(分)を示す。−●−:野生型(WT)、−○−:変異型(MUT)、―▲―:DNAなし。
【図12】図12は、本発明による変異検出方法の結果を示す写真である。各レーンは、野生型(WT)用プライマーセット、および変異型(MUT)用プライマーセットを各鋳型DNAと反応させた結果を示す。DNAなし:鋳型DNA無し、MUT DNA:変異型のCYP2C19遺伝子が鋳型、WT DNA:野生型のCYP2C19遺伝子が鋳型。
【図13】図13は、本発明による変異検出方法の特異性を検討した結果を示すグラフである。a)は野生型(WT)用プライマーセットを、そしてb)は変異型(MUT)用プライマーセットを各鋳型DNAと反応させた結果を示す。図中、縦軸は蛍光強度を、横軸は反応時間(分)を示す。―◆―:DNAなし、―▲―:CYP2C9遺伝子、―×―:CYP2C18遺伝子、−●−:CYP2C19野生型(WT)、−○−:CYP2C19変異型(MUT)。
【図14】図14は、実施例5においてSNPsの検出を行った標的塩基配列と、標的塩基配列におけるプライマーの位置関係を示す図である。
【図15】図15は、ループプライマーを応用した本発明による変異検出方法の結果を示すグラフである。a)は野生型(WT)用プライマーセットを、そしてb)は変異型(MUT)用プライマーセットを各鋳型DNAと反応させた結果を示す。図中、縦軸は蛍光強度を、横軸は反応時間(分)を示す。−●−:野生型(WT)、−○−:変異型(MUT)、―▲―:DNAなし。
【図16】図16は、ループプライマーを応用した本発明による変異検出方法の特異性を検討した結果を示すグラフである。a)は野生型(WT)用プライマーセットを、そしてb)は変異型(MUT)用プライマーセットを各鋳型DNAと反応させた結果を示す。図中、縦軸は蛍光強度を、横軸は反応時間(分)を示す。―◆―:DNAなし、―▲―:CYP2C9遺伝子、―×―:CYP2C18遺伝子、−●−:CYP2C19野生型(WT)、−○−:CYP2C19変異型(MUT)。
【図17】図17は、ループプライマーを応用した本発明による変異検出方法によって血液検体の変異を検出した結果を示すグラフである。検体No.10は野生型ホモ(WT/WT)、検体No.11は野生型/変異型ヘテロ(WT/MUT)、そして検体No.8は変異型ホモ(MUT/MUT)である。図中、縦軸は蛍光強度を、横軸は反応時間(分)を示す。−●−:野生型(WT)用プライマー、−○−:変異型(MUT)用プライマー。
【発明を実施するための形態】
【0049】
[用語の定義]
本発明において、以下の用語はそれぞれ次のような意味で用いられる。
変異:本発明において、変異とは、起源を同一とする生物(ウイルスを含む)個体間に見られる核酸塩基配列の差異をいう。多細胞生物においては個体内での器官や細胞などの間に見られる差異も変異に含まれる。変異は、点変異、欠質、挿入、重複、逆位、転座によって生じる。また、変異は遺伝子領域(タンパク質のコード領域およびイントロン配列)に生じることもあれば、プロモーターやエンハンサーのような発現調節領域に生じる場合もある。あるいは、それ以外のゲノム配列上に見いだされる塩基配列の差異も変異に含むものとする。
【0050】
多型:上記変異のうち、ある集団内で1%以上の頻度で存在するものを特に多型と呼ぶ。多型の中でも、特に1塩基の置換、挿入、あるいは欠失からなる多型を、1塩基多型(Single Nucleic Polymorphism;SNPs)と呼ぶ。
【0051】
標的塩基配列:標的塩基配列は、検出すべき変異や多型が含まれる塩基配列であって、プライマーによって3'側が規定された領域を構成する塩基配列を意味する。以下本明細書において単に5'側、あるいは3'側と表現するときには、いずれも鋳型となっている方の鎖における方向を意味している。言いかえれば、本発明におけるプライマーがアニールする領域に挟まれて存在する塩基配列が、本発明における標的塩基配列を構成する。一般に核酸の塩基配列は、5'側から3'側に向けてセンス鎖の塩基配列を記載する。本発明における標的塩基配列とは、センス鎖の塩基配列に加えて、その相補鎖、すなわちアンチセンス鎖の塩基配列も含む。すなわち、用語「標的塩基配列」とは、合成すべき塩基配列、およびその相補鎖の少なくともいずれかを意味する用語として用いる。標的塩基配列は、後に述べる特定の領域を含んでいる。
【0052】
特定の領域:前記標的塩基配列に含まれ、検出すべき変異や多型が存在する領域が、特定の領域である。本発明の検出方法においては、特定の領域に予測される塩基配列に相補的な塩基配列を5'側に付加した相補鎖が合成される。なお特定の領域に相補的な塩基配列は、合成される相補鎖の5'末端を構成するように付加しなければならない。
【0053】
予測される塩基配列:予測される塩基配列とは、野生型の塩基配列であることもできるし、特定の変異を含む塩基配列を予測される塩基配列として用いることもできる。予測される塩基配列に野生型の塩基配列を用いた場合は、標的塩基配列中の野生型塩基配列の有無が見出されることになり、予測される塩基配列に特定の変異や多型の塩基配列を用いれば、標的塩基配列中の特定の変異や多型の塩基配列の有無が検出される。
【0054】
3'末端、あるいは5'末端:3'末端、あるいは5'末端とは、単にいずれかの末端の1塩基のみならず、末端の1塩基を含み、かつ末端に位置する領域を意味する。より具体的には、いずれかの末端から500塩基、望ましくは100塩基、あるいは少なくとも20塩基は、3'末端、あるいは5'末端に含まれる。これに対して、末端の1塩基や末端付近に存在する特定の位置の塩基を示すためには、その位置を数値で特定することによって示すものとする。
【0055】
鋳型と相補鎖:本発明において用いられる鋳型という用語は、相補鎖合成の鋳型となる側の核酸を意味する。鋳型に相補的な塩基配列を持つ相補鎖は、鋳型に対応する鎖としての意味を持つが、両者の関係はあくまでも相対的なものに過ぎない。すなわち、相補鎖として合成された鎖は、再び鋳型として機能することができる。つまり、相補鎖は鋳型になることができる。
【0056】
核酸の合成(synthesis)と増幅(amplification):本発明における核酸の合成とは、合成起点となったオリゴヌクレオチドからの核酸の伸長を意味する。合成に加えて、更に他の核酸の生成と、この生成された核酸の伸長反応とが連続して起きるとき、一連の反応を総合して増幅という。
【0057】
アニール:「アニール」と「ハイブリダイズ」は、核酸がワトソン−クリックのモデルに基づく塩基対結合によって2重らせん構造(double helix structure)を形成することを意味する。したがって、塩基対結合を構成する核酸鎖が1本鎖であっても、分子内の相補的な塩基配列が塩基対結合を形成すれば、アニール、あるいはハイブリダイズである。本発明において、アニールとハイブリダイズは、核酸が塩基対結合による2重らせん構造を構成する点で同義である。塩基対結合した3'末端が相補鎖合成の起点となるときに、特にアニールという場合がある。ただし、ハイブリダイズが相補鎖合成の起点となることを否定するものではない。
【0058】
実質的に同じ塩基配列:ある配列を鋳型として合成された相補鎖が、目的の塩基配列に対してアニールし相補鎖合成の起点を与えるとき、このある配列は目的の塩基配列に対して実質的に同一である。本発明において同一、あるいは相補的という用語は、いずれも完全に同一でない場合、あるいは完全に相補的でない場合を含む。すなわち、ある配列と同一とは、ある配列に対してアニールすることができる塩基配列に対して相補的な配列をも含むことができる。他方、相補的とは、ストリンジェントな条件下でアニールすることができ、相補鎖合成の起点となる3'末端を提供することができる配列を意味する。具体的には、ある塩基配列に対して、一般に50−100%、通常は70−100%、好ましくは80−100%の同一性を有する塩基配列は、実質的に同一と言うことができる。同一性はBLAST等の公知のアルゴリズムに基づいて決定することができる。
【0059】
[原理の説明]
本発明による変異や多型の検出方法は、次のような原理に基づいて標的塩基配列における特定の領域の塩基配列チェック機構を実現している。まず本発明においては、下記第2のプライマーおよび第1のプライマーを用いる。本発明に用いる第2のプライマーと第1のプライマーは、それぞれその3'末端に標的塩基配列の3'側の塩基配列に対してアニールすることができる塩基配列を備え、かつ5'末端には、その3'末端を起点とする伸長生成物における任意の領域に相補的な塩基配列を配置する。そして第2および第1のプライマーの少なくとも一方の5'末端に配置された塩基配列が、前記特定の領域、またはその相補鎖の予測される塩基配列に相補的な塩基配列を含むようにする。プライマーの5'末端に配置された塩基配列を鋳型として合成された相補鎖は、特定の領域、またはその相補鎖にアニールして相補鎖合成の起点となるとき、特定の領域を構成する塩基配列が予測していたものでなかった場合に、相補鎖合成が阻害されることを利用して、塩基配列がチェックされる。3'末端が特定の領域(またはその相補鎖)にアニールして相補鎖合成の起点となるときには、常にチェック機構が働くことから、特定の領域の塩基配列の相違を反応生成物の量の差として明瞭に検出することができる。
【0060】
以上のような反応原理に基づいて実際に変異および/または多型の検出を行うには、例えば以下のような反応を利用することができる。すなわち本発明は、以下の工程を含む標的塩基配列の特定の領域における変異および/または多型の検出方法であって、第2および第1のプライマーの少なくとも一方の5'末端に配置された塩基配列が、前記特定の領域、またはその相補鎖の予測される塩基配列に相補的な塩基配列を含み、この5'末端に配置された塩基配列を鋳型として合成された相補鎖は、特定の領域、またはその相補鎖に対してアニールして相補鎖合成の起点となるとき、特定の領域を構成する塩基配列が予測していたものでなかった場合に、相補鎖合成が阻害されることを特徴とする方法に関する。
【0061】
a)標的塩基配列に第1のプライマーをアニールさせ、これを起点とする相補鎖合成反応を行う工程;ここで第1のプライマーはその3'末端において前記標的塩基配列を構成する一方の鎖の3'側を規定する領域に対してアニールすることができ、かつ第1のプライマーの5'側には、このプライマーを起点とする相補鎖合成反応生成物上の領域を構成する予測される塩基配列に相補的な塩基配列を備える、
b)工程a)で合成された第1のプライマーの伸長産物における第2のプライマーがアニールすべき領域を塩基対結合が可能な状態とし、両者をアニールさせて第1のプライマーの伸長産物を鋳型とする相補鎖合成を行う工程;ここで第2のプライマーはその3'末端において前記標的塩基配列を構成する他方の鎖の3'側を規定する領域に対してアニールすることができ、かつ第2のプライマーの5'側には、このプライマーを起点とする相補鎖合成反応生成物上の領域を構成する予測される塩基配列に相補的な塩基配列を備える、
c)第2のプライマーの伸長生成物の3'末端と、該伸長生成物における第1のプライマーに対する前記予測される塩基配列をアニールさせて自身を鋳型とする相補鎖合成を行う工程、
d)工程c)で合成された相補鎖における3'末端と、該伸長生成物における第2のプライマーに対する前記予測される塩基配列をアニールさせて自身を鋳型とする相補鎖合成を行う工程、
e)第2のプライマーを起点とする合成生成物の量を特定の領域における変異および/または多型の存在と関連付ける工程。
【0062】
本発明において、第2および/または第1のプライマーの伸長生成物の3'末端は自身が持つ特定の領域にアニールし、自身を鋳型とする相補鎖合成の起点となる。このとき、特定の領域を構成する塩基配列が予測された塩基配列であれば、3'末端を起点として相補鎖合成が進行する。逆に予測された塩基配列と異なっていた場合には、3'末端を相補鎖合成の起点とすることができず、相補鎖合成が阻害される。その結果、3'末端をプライマーとする自身を鋳型とした相補鎖の合成生成物を指標として、特定の領域における塩基配列が予測されたものかどうかを知ることができる。
【0063】
このとき合成される相補鎖は、自身の5'末端に達して完了する。本発明においては、5'末端には常にプライマーの5'末端に配置された塩基配列が存在する。つまり、鋳型の5'末端には伸長生成物における任意の領域に相補的な塩基配列が付加されている。したがってこれを鋳型として合成される相補鎖においては、その3'末端に任意の領域に対してアニールすることができる塩基配列が再現されることになる。この後、何らかの手段でその3'末端と、それがアニールすべき任意の領域とが塩基対結合が可能な状態となれば、再び自身を鋳型とする相補鎖合成が開始される。
【0064】
さて、本発明においては、第2のプライマーおよび第1のプライマーの少なくともいずれか一方には、そのプライマーの3'末端を起点として生成された伸長生成物における特定の領域(またはその相補鎖)に相補的な塩基配列がその5'末端に配置されている。以下の説明において、5'末端に特定の領域(またはその相補鎖)に相補的な塩基配列が配置された第2のプライマーまたは第1のプライマーを、特にチェックプライマーと記載することがある。
【0065】
したがって、チェックプライマーの5'末端を鋳型として生成した伸長生成物の3'末端は、特定の領域(またはその相補鎖)にアニールするたびに、その塩基配列をチェックすることになる。そしてこの相補鎖合成が開始するかどうかは、特定の領域が予測された塩基配列で構成されているかどうかによって決定される。このように、自身を鋳型として進行する相補鎖合成反応が、繰り返し特定の領域における塩基配列のチェックを経て進行することが本発明の重要な特徴である。この特徴により、たとえ誤って相補鎖合成が行われた場合であっても、その産物が鋳型として次の相補鎖合成が行われるときに、再び塩基配列のチェック機構が働く。その結果、以降の相補鎖合成が阻害されることから、本発明においては、誤った相補鎖合成によって生じるノイズを劇的に抑制することができる。
【0066】
さて、本発明の原理に基づいて実際に変異および/または多型の検出を行うための上記のような反応は、実際には、以下のような要素を適切な条件の基でインキュベートするだけで進行する。すなわち本発明は、次の要素を、第2および第1のプライマーを起点とする相補鎖合成が可能な条件下でインキュベートし、標的塩基配列を鋳型とする相補鎖合成反応生成物の量と特定の領域における変異および/または多型の存在と関連付ける工程を含む、前記変異および/または多型の検出方法であって、第2および第1のプライマーの少なくとも一方にチェックプライマーを用いることを特徴とする方法である。
【0067】
(a)標的塩基配列を含む核酸試料、
(b)鎖置換を伴う相補鎖合成を触媒することができるDNAポリメラーゼ、
(c)第2のプライマー;ここで第2のプライマーはその3'末端において前記標的塩基配列を構成する一方の鎖の3'側を規定する領域に対してアニールすることができ、かつ第2のプライマーの5'側には、このプライマーを起点とする相補鎖合成反応生成物上の領域を構成する予測される塩基配列に相補的な塩基配列を備える、
(d)第1のプライマー;ここで第1のプライマーはその3'末端において前記標的塩基配列を構成する他方の鎖の3'側を規定する領域に対してアニールすることができ、かつ第1のプライマーの5'側には、このプライマーを起点とする相補鎖合成反応生成物上の領域を構成する予測される塩基配列に相補的な塩基配列を備える、
(e)ヌクレオチド基質。
【0068】
第2のプライマーおよび第1のプライマーに基づく核酸の増幅方法は、既に本発明者らが報告したLAMP法 (Nucleic Acid Res. 2000 Vol.28 No.12 e63、WO 00/28082)に他ならない。しかしLAMP法を構成するプライマーの少なくともいずれかをチェックプライマーとして変異や多型の検出方法に用いたときに、塩基配列の高度なチェック機能を期待できることは、本発明によって明らかにされた新規な知見である。
【0069】
上記反応を構成している第1のプライマーは、次の領域から構成されている。
X2:標的塩基配列の3'側を規定するX2cに相補的な塩基配列を持つ領域。
X1c:前記X2cの5'側に位置し、第1のプライマーの伸長生成物上に存在する領域X1に予測される塩基配列に対して相補的な塩基配列を備えるものである。X1は、第1のプライマーの伸長生成物におけるそのプライマーの3'末端から特定の塩基配列を含む配列の間の任意の領域の配列である。ここでX1cは、任意の領域X1cに予測される塩基配列と実質的に同じ塩基配列を持つ領域と表現することもできる。
【0070】
以下に、LAMP法の反応原理と、本発明への応用について、図1〜図4を参照しながら説明する。ここで、仮に第1のプライマーFA、および第2のプライマーRAを想定する。FAは、前記X2に相当するF2と、X1cに相当するF1cとで構成されている。FAを構成するF1cは、F1cに対して実質的に同一な塩基配列を含む。本発明において、たとえば前記F1のように任意に選択される領域は、その領域に相補的な塩基配列を持つポリヌクレオチドをアニールすることができ、そしてそのポリヌクレオチドを合成起点として合成される相補鎖が本発明に必要な機能を備えている限り、任意の領域から選択することができる。
【0071】
一方本発明における第2のプライマーRAとしては、前記X2に相当するR2と、X1cに相当するR1cとで構成されるプライマーを組み合わせることができる。ここで、たとえばRAをチェックプライマーとする場合には、R1cはFAの伸長生成物における検出すべき変異および/または多型が存在する特定の領域R1cとして予測される塩基配列で構成され、またR2はFAの伸長生成物における任意の領域を構成する塩基配列R2cに相補的な塩基配列からなる。
【0072】
チェックプライマーRAを用いて本発明の検出方法を行うとき、FAをチェックプライマーとすることもできる。後に述べるように、チェックプライマーRAを用いて相補鎖合成反応を行うとき、FAの伸長生成物は、その3'末端が常に塩基対結合が可能な状態となり、自身を鋳型とする相補鎖合成反応を繰り返す。その一方で、RAの伸長生成物が1本鎖の状態で連続的に生成される。更にRAの伸長生成物自身もFAと同様に、その3'末端によって自身を鋳型とする相補鎖合成反応を繰り返す。このとき、FAをチェックプライマーとすることにより、FAの伸長生成物による塩基配列のチェック機構をも実現することができるのである。本発明において、FAによってもたらされる相補鎖合成による特定の領域の塩基配列のチェック機構は、実は前記RAによる塩基配列のチェック機構と全く同じ原理で進行している。つまり、特定の領域の相補鎖に対して、同じ原理を適用することに他ならない。
【0073】
ここで、FAとRAの両方をチェックプライマーとして用いる場合の反応をより詳細に説明する。RAがチェックプライマーであれば、R1を起点とする相補鎖合成[図4−(9)]は阻害を受けるはずである。同様にFAがチェックプライマーの場合はF1を起点とする相補鎖合成反応[図3−(8)]が阻害される。しかしPCRがそうであったように、わずかな塩基配列の相違をポリヌクレオチドのアニールの特異性によって識別することは、現実的ではない。本発明に基づく反応も例外ではなく、特定の領域が予測した塩基配列でない場合に相補鎖合成が阻害されるとはいえ、反応を完全に阻止できない場合を想定するのが現実的である。
【0074】
さて、特定の領域が予測した塩基配列でないのにもかかわらず、万が一相補鎖合成が阻止できなかった場合について以下に考察する。なお図1〜図4では、F1とR1c(あるいはR1とF1c)が分離して記載されている。これらの図では、FAとRAのいずれか一方のみをチェックプライマーとして用いる場合の反応を示している。
【0075】
他方、FAとRAの両方をチェックプライマーとするときには、いずれの方向からも特定の領域に対して相補的な塩基配列がアニールすることになる。したがって、R1がアニールすべきR1cの少なくとも一部は、F1と重複する。同時に、その相補鎖であるF1cは、少なくともその一部がR1と重複する。
【0076】
まずF1を起点とする相補鎖合成反応[図3−(8)]で誤って相補鎖合成が行われた場合を想定する。誤って合成された伸長生成物に対して、まず最初にR1が特定の領域にアニールして相補鎖合成が行われる。RAはチェックプライマーだが、それを鋳型として合成された3'末端R1がアニールするのは、実はFAの3'末端であった領域を含んでいる。つまり、予測した塩基配列となっているためにチェック機構が働かず相補鎖合成が進んでしまう。しかし、この相補鎖合成が5'末端に達したときには、その3'末端はチェックプライマーであるFAの5'末端を鋳型とする相補鎖となっている。そしてこの3'末端は、再び特定の領域に対してアニールすることになり、このときにはチェック機構が働く。
【0077】
以上のように、FAとRAの両方をチェックプライマーとする場合、FAのチェック機構が機能するときには、RAのチェック機構が機能できない場合があることは事実である。しかし現実には、標的塩基配列が2本鎖の場合には、RAとFAが図1〜図4に示すとおりの順番で反応する確率は、理論的には1/2である。残る1/2の反応は、図1〜図4とは対称的な順番で反応する。言い換えれば、残る1/2の反応を説明するために、図1〜図4における「F」と「R」を読み換える必要がある。なぜなら、RAとFAは、標的塩基配列を構成する2本鎖のそれぞれに対してアニールし、以降の反応もまったく同じように進行するためである。
【0078】
あるいは、本発明による反応を図1〜図4に基づいて説明するときに、RA(あるいはFA)は、標的塩基配列のいずれかの鎖にアニールする特定のプライマーを想定しているのではない、と言うこともできる。つまり、単に先にアニールした方を便宜上RAとして説明しているのにすぎないということになる。
【0079】
このような事実に基づけば、FAに加えてRAがチェックプライマーであることの意義が容易に理解できるであろう。つまり、先に述べたFAの相補鎖によるチェック機構と同様のチェック機構が、相補鎖においても働くことから、反応系全体で見ると、結果としてより多くのチェック機構が働くことになるのである。したがって、FAとRAの両方をチェックプライマーとすることは、本発明の望ましい態様の一つである。
【0080】
本発明に基づくチェック機構について、更に説明する。本発明においては、たとえFAとRAの両方をチェックプライマーとした場合であっても、理論的に本発明のチェック機構が作用しない反応もいくつか起きることは事実である。具体的には、チェックプライマーの5'末端由来の塩基配列を含んだ領域に近接するループ部分に対して、アニールしたプライマーからの伸長生成物は、その3'末端が、特定の領域ではなく、いずれプライマーに由来する塩基配列に対してアニールすることになる。3'末端が特定の領域ではなくプライマー由来の塩基配列にアニールするときは、チェック機構が働かなくなる。しかし、本発明において重要なことは、このようなチェック機構が働かなくなる生成物ができるまでに、何度もチェック機構が作用することである。
【0081】
ここで、特定の領域が予測した塩基配列でないのにも関わらず、反応が進行する割合を仮にAとし、チェック機構が働かない生成物ができるまでにチェック機構が作用した回数をnとすると、本発明においてチェック機構が働かない生成物ができる割合Xは、Anで表される。たとえば5%の割合でチェック機構をすり抜ける反応が生じてしまう場合であっても、チェック機構が3回作用するだけで、割合Xは0.053=0.000125(0.01%)となる。つまりチェック機構が1回しか作用できない場合に比べて、その危険性をおよそ1/500にすることができるのである。このように、本発明では1回のチェック機構しか働かない反応に比べて、チェック機構が働かない生成物を生じる可能性が著しく小さくなることが明らかである。
【0082】
前記標的塩基配列とは、検出対象、あるいは検出対象から誘導された核酸の一部、あるいは全てを構成する。標的塩基配列は2本鎖であっても、1本鎖であっても良い。2本鎖の場合には、標的塩基配列を規定する各鎖の3'末端、並びにこの標的塩基配列の中に位置する特定の領域は、少なくともその一部の塩基配列が明らかとなっている、あるいは推測が可能な状態にある。また標的塩基配列が1本鎖として存在する場合には、その3'側を規定する塩基配列と、想定される相補鎖の3'側の塩基配列、そして標的塩基配列中に位置する特定の領域は、少なくともその一部の塩基配列が明らかとなっている、あるいは推測が可能な状態にある。塩基配列を明らかにすべき部分とは、前記3'末端X2cおよびその5'側に位置する特定の領域X1cである。本発明の特定の領域には、変異および/または多型が予測される塩基が含まれている。そして本発明におけるチェックプライマーは、特定の領域における変異および/または多型が予測される塩基が、予測された塩基ではなかった場合に、相補鎖合成反応が阻害されるように設計しなければならない。
【0083】
本発明のチェックプライマーは、たとえば次のように設計される。すなわち、チェックプライマーを鋳型として相補鎖を合成したときに、合成された相補鎖の3'末端付近が、変異や多型が予想される塩基に相補的な位置に相当するように設計される。相補鎖の合成起点となる3'末端や、その付近にミスマッチが存在すると核酸の相補鎖合成反応は著しく阻害される。より具体的には、相補鎖合成の起点となる3'末端〜10塩基以内、特に望ましくは3'末端からカウントして2〜4番目、より望ましくは2〜3番目の塩基にミスマッチがある場合には、相補鎖合成が著しく阻害される。したがって、本発明において検出すべき変異や多型の存在(あるいは不存在)によって、この部分にミスマッチを生じるようにチェックプライマーの5'側の塩基配列を設計するのが望ましい。
【0084】
本発明においては、反応初期の生成物における末端構造が繰り返し反応を行わなければ高度な増幅反応に結びつかない。したがって、たとえ誤った合成が行われたとしても、増幅反応を構成する相補鎖合成がいずれかの段階で妨げられるのでミスマッチを含んだままでは高度な増幅は起きない。結果的にミスマッチが増幅反応を効果的に抑制し、最終的には正確な結果をもたらすことになる。つまり本発明に基づく核酸の増幅反応は、より完成度の高い塩基配列のチェック機構を備えていると言うことができる。これらの特徴は、たとえば単純に2つの領域で増幅反応を行っているPCR法などでは期待しにくい利点である。
【0085】
更に本発明に用いるプライマーを特徴付ける領域X1cは、相補配列が合成されてはじめて合成起点となり、この相補配列が、新たに合成された同一鎖内の配列X1にアニールすることにより、自己を鋳型とする合成反応が進行する。このため、たとえ先行技術でしばしば重要な問題となるいわゆるプライマーダイマーを生成しても、本発明に用いるプライマーはループを形成しない。したがって、プライマーダイマーに起因する非特異的な増幅は原理的に生じ得ず、反応の特異性向上に貢献する。
【0086】
これらの2つの領域X2cおよびX1c(標的塩基配列となる核酸においては、X2およびX1)は、連続する場合、そして離れて存在する場合とを想定することができる。両者の相対的な位置関係により、生成物である核酸が自己アニールしたときに形成されるループ部分の状態が決定される。また、生成物である核酸が分子間のアニールではなく自己アニールを優先的に行うためには、両者の距離が不必要に離れないほうが望ましい。したがって、両者の位置関係は、通常0−500塩基分の距離を介して連続するようにするのが望ましい。ただし、後に述べる自己アニールによるループの形成において、両者があまりにも接近している場合には望ましい状態のループの形成を行うには不利となるケースも予想される。ループにおいては、新たなプライマーのアニールと、それを合成起点とする鎖置換を伴う相補鎖合成反応がスムーズに開始できる構造が求められる。したがってより望ましくは、領域X2cおよびその5'側に位置する領域X1cとの距離が、0〜100塩基、さらに望ましくは10〜70塩基となるように設計する。なおこの数値はX1cとX2を含まない長さを示している。ループ部分を構成する塩基数は、更にX2に相当する領域を加えた長さとなる。
【0087】
上記特定の塩基配列を持つ核酸に対して本発明に用いるプライマーを構成する領域X2およびX1cは、通常は重複することなく連続して配置される。あるいはもしも両者の塩基配列に共通の部分があるのであれば、部分的に両者を重ねて配置することもできる。X2はプライマーとして機能する必要があることから、常に3'末端となるようにしなければならない。一方X1cは、後に述べるように、これを鋳型として合成された相補鎖の3'末端にプライマーとしての機能を与える必要があることから、5'末端に配置する。このプライマーを合成起点として得られる相補鎖は、次のステップにおいては逆向きからの相補鎖合成の鋳型となり、最終的にはプライマー部分も鋳型として相補鎖に写し取られる。写し取られることによって生じる3'末端は塩基配列X1を備えており、同一鎖上のX1cにアニールするとともに、ループを形成する。このとき、鋳型における5'末端に含まれているプライマーがチェックプライマーであれば、X1cは、特定の領域に対してアニールすることになる。
【0088】
本発明に用いるプライマーとは、相補的な塩基対結合を形成できること、そしてその3'末端において相補鎖合成の起点となる-OH基を与えること、の2つの条件を満たすオリゴヌクレオチドを意味する。したがって、そのバックボーンは必ずしもホスホジエステル結合によるものに限定されない。たとえばOではなくSをバックボーンとしたホスホチオエート体であることもできる。また、塩基は、相補的な塩基対結合を可能とするものであれば良い。天然の状態では、一般にはACTGおよびUの5種類となるが、たとえばブロモデオキシウリジン(bromodeoxyuridine)といった類似体であることもできる。本発明に用いるオリゴヌクレオチドは、合成の起点となるのみならず、相補鎖合成の鋳型としても機能するものであることが望ましい。
【0089】
本発明に用いるプライマーは、以下に述べる各種の核酸合成反応において、与えられた環境の下で必要な特異性を維持しながら相補鎖との塩基対結合を行うことができる程度の鎖長を持つ。具体的には、5−200塩基、より望ましくは7−50塩基対とする。配列依存的な核酸合成反応を触媒する公知のポリメラーゼが認識するプライマーの鎖長が、最低5塩基前後であることから、アニールする部分の鎖長はそれ以上であることが望ましい。加えて、塩基配列としての特異性を期待するためには、一般的には6塩基以上、好ましくは7塩基以上の長さを利用するのが望ましい。一方、あまりにも長い塩基配列は化学合成によって調製することが困難となることから、前記のような鎖長が望ましい範囲として例示される。なお、ここで例示した鎖長はあくまでも相補鎖とアニールする部分の鎖長である。後に述べるように、本発明によるオリゴヌクレオチドは最終的には少なくとも2つの領域に個別にアニールすることができる。したがって、ここに例示する鎖長は、プライマーを構成する各領域の鎖長と理解するべきである。
【0090】
更に、本発明に用いるプライマーは、公知の標識物質によって標識することができる。標識物質としては、ジゴキシンやビオチンのような結合性リガンド、酵素、蛍光物質や発光物質、あるいは放射性同位元素などを示すことができる。あるいは、オリゴヌクレオチドを構成する塩基を蛍光性のアナログに置換する技術(WO95/05391, Proc.Natl.Acad.Sci.USA,91,6644-6648,1994)も公知である。
【0091】
この他本発明に用いるプライマーは、それ自身を固相に結合させておくこともできる。あるいは、プライマーの任意の部分にビオチンのような結合性のリガンドで標識しておき、これを固相化アビジンのような結合パートナーによって間接的に固相化することもできる。固相化プライマーを合成開始点とする場合には、核酸の合成反応生成物が固相に捕捉されることから、分離が容易となる。分離された生成物に対して、核酸特異的な指示薬や、あるいは更に標識プローブをハイブリダイズさせることによって、検出を行うこともできる。あるいは、任意の制限酵素で消化することによって、目的とする核酸の断片を回収することもできる。
【0092】
本発明に用いるプライマーは前記2つの領域のみならず、更に付加的な領域を含むことができる。X2とX1cとがそれぞれ3'末端と5'末端に配置される一方、両者の間に任意の配列を介在させることが可能である。それは、たとえば制限酵素認識配列、RNAポリメラーゼが認識するプロモーター、あるいはリボザイムをコードするDNA等であることができる。制限酵素認識配列とすることにより、本発明の合成産物である1本鎖上に相補的な塩基配列が交互に連結された核酸を同じ長さを持った2本鎖核酸に切りそろえることができるようになる。RNAポリメラーゼが認識するプロモーター配列を配置すれば、本発明の合成生成物を鋳型として更にRNAへの転写が行われる。このときに、更にリボザイムをコードするDNAを配置すれば、転写生成物を自身で切断する系が実現する。なお、これらの付随的な塩基配列はいずれも2本鎖となった場合に機能するものである。したがって、本発明による1本鎖の核酸がループを形成しているときには、これらの配列は機能しない。核酸の伸長が進み、ループを含まない状態で相補的な塩基配列を持つ鎖とアニールした状態になったときにはじめて機能する。
【0093】
さて、本発明を構成する上記反応工程a)〜f)を具体的に説明する。
まず、5'側に標的塩基配列における任意の領域と同一の塩基配列を持った第1のプライマーによって標的塩基配列を鋳型とする相補鎖合成反応を行う。この伸長産物を鋳型として更に第2のプライマーによる相補鎖合成が行われる。第2のプライマーによる相補鎖合成のために、それがアニールすべき領域が塩基対結合が可能な状態とされる。この工程は、標的塩基配列における第1のプライマーがアニールしている領域よりも3'側にアニールする第3のプライマーを起点とする相補鎖合成反応に伴う置換によって行うことができる。本発明において第3のプライマーは、第1のプライマーよりも3'側にアニールし、第1のプライマーがアニールする領域に向かって進行する相補鎖合成反応の起点となる。この工程は、鎖置換を伴う相補鎖合成を触媒することができるDNAポリメラーゼによって行われる。この他、第1のプライマーの伸長生成物を過熱変性などの方法によって1本鎖とすることもできる。
【0094】
次に、第2のプライマーの伸長生成物は、その3'末端をプライマーとして自身を鋳型とする相補鎖合成反応を開始する。第2のプライマーに基づく相補鎖合成の鋳型として用いられた第1のプライマーの5'末端には、第1のプライマーの伸長生成物における任意の領域の予測される塩基配列に相補的な塩基配列が付加されている。したがって、それを鋳型として生成する第2のプライマーによる伸長生成物の3'末端には、前記任意の領域と実質的に同一の塩基配列が備わることになる。
【0095】
このとき、第2のプライマーの伸長生成物の3'末端と、それがアニールすべき領域を塩基対結合が可能な状態とする必要がある。この工程は、通常、この伸長生成物を1本鎖とすることによって行われる。伸長生成物を1本鎖とするには、たとえば第2のプライマーがアニールしている領域よりも3'側にアニールする第4のプライマーを起点とする相補鎖合成反応に伴う置換によって行われる。本発明においては、前記第3のプライマーや、ここで用いる第4のプライマーのような、置換反応用のプライマーをアウタープライマーと記載する。
【0096】
さて、第2のプライマーは、5'末端に特定の領域に予測される塩基配列に相補的な塩基配列を備えている。すなわち第2のプライマーはチェックプライマーである。この塩基配列は、プライマーによって導入された塩基配列である。したがってこれを鋳型として合成された3'末端には、その3'末端に自身の特定の領域に対して相補的な塩基配列を備えることになる。この段階で特定の領域の塩基配列をチェックする準備が整えられたことになる。そして、以降の反応で実際に塩基配列のチェックが行われる。
【0097】
塩基配列のチェックのための反応は、次のようにして進行する。まず、このようにして合成された1本鎖ポリヌクレオチドの3'末端、および特定の領域を塩基対結合が可能な状態とする。この工程は、望ましくは次のようにして行うことができる。すなわち、ヘアピン構造のループ形成領域を起点とする相補合成反応によって3'末端を置換するのである。
【0098】
本発明の望ましい態様においては、1本鎖ポリヌクレオチドの相補的な塩基配列の間にループを形成するための塩基配列が含まれる。本発明においては、この配列をループ形成配列と呼ぶ。前記1本鎖ポリヌクレオチドは、実質的にループ形成配列によって連結された相補的な塩基配列で構成される。なお一般的には、それが部分的に塩基対結合を伴っているかどうかにかかわらず、塩基対結合を解離させたときに2つ以上の分子に分離しないものを1本鎖と呼ぶ。相補的な塩基配列は、同一鎖上で塩基対結合を形成することができる。前記1本鎖ポリヌクレオチドを、同一鎖上で塩基対結合させることによって得ることができる分子内塩基対結合生成物は、見かけ上2本鎖を構成する領域と、塩基対結合を伴わないループ部分を与える。
【0099】
すなわち、この1本鎖ポリヌクレオチドは、同一鎖上でアニールすることが可能な相補的な塩基配列を含み、そのアニール生成物は折れ曲がったヒンジ部分に塩基対結合を伴わないループを構成する1本鎖核酸と定義することもできる。そして塩基対結合を伴わないループには、相補的な塩基配列を持つヌクレオチドがアニールすることができる。ループ形成配列は任意の塩基配列であることができる。置換のための相補鎖合成を開始することができるように塩基対結合が可能であり、望ましくは特異的なアニーリングを達成するために他の領域に存在する塩基配列から識別可能な配列を備える。たとえば望ましい態様においては、第1のプライマーと相補的な塩基配列を含む。ループ形成領域に対してFAがアニールする状態を、図5に示した。
【0100】
ループ形成領域に第1のプライマーをアニールさせて相補鎖合成反応を行うと、1本鎖ポリヌクレオチドのハイブリダイズしている部分が置換されて1本鎖ポリヌクレオチドにおける特定の領域、並びに3'末端は塩基対結合が可能な状態となる。両者がアニールして3'末端は相補鎖合成の起点となる3'-OHを与える。さて、この段階で3'末端がアニールしているのは、塩基配列をチェックすべき特定の領域である。したがって、この領域の塩基配列が予測した塩基配列であれば、3'末端を起点とする相補鎖合成反応が進行する。あるいは予測した塩基配列と相違していた場合には、相補鎖合成反応が阻害される。
【0101】
本発明の最大の特徴は、LAMP法を利用したことによって、この塩基配列のチェック機構が以降の反応でも繰り返し機能できる点にある。たとえば、塩基配列が予測されていたものと異なっていたにもかかわらず、相補鎖合成反応が進行してしまったと仮定する。本発明における1本鎖ポリヌクレオチドを鋳型とする相補鎖合成反応の生成物は、その3'末端に、再び特定の領域に対する相補鎖を備えたものとなる。自身の5'末端が、特定の領域に予測される塩基配列を備えているため、この構造は何度相補鎖合成を繰り返しても変わらない。一方3'末端がアニールすべき特定の領域は、標的塩基配列を鋳型として写し取ったものであるから、両者の間のアニールは、ミスマッチをともなったままである。そのため、2回目以降の反応においても、阻害が起きることになる。本発明による塩基配列のチェック機構は、誤って起きてしまった相補鎖合成反応の影響を最小限度にとどめる機構を備えていると言うことができる。
【0102】
以上のように、特定の構造を持つプライマーを用い、鎖置換を伴う相補鎖合成を触媒することができるDNAポリメラーゼによって標的塩基配列の存在下で相補鎖合成を行えば、塩基配列のチェック機構を伴った相補鎖合成反応が進行する。その結果、特定の領域を構成する塩基配列が予測される塩基配列であった場合には、相補鎖合成産物の連続的な生成が開始される。他方、もしも予測される塩基配列でなかった場合には、本発明による塩基配列のチェック機構によって、相補鎖合成が著しく阻害される。したがって、一定時間の反応の後に、増幅生成物が検出できれば、その試料の特定の領域を構成する塩基配列が予測された塩基配列であると判定される。
【0103】
本発明において、相補鎖合成が進行した場合にもたらされる核酸は、1本鎖上に相補的な塩基配列が交互に連結された核酸となる。本発明においては、この核酸の生成量が、特定の領域における予測される塩基配列の存在と関連付けられる。すなわち、予測された塩基配列であった場合の生成量に対して、塩基配列が予測と異なっていた場合にはこのような構造の核酸の生成が阻害される。本発明において指標としている1本鎖上に相補的な塩基配列が交互に連結された核酸とは、1本鎖上に互いに相補的な塩基配列を隣り合せに連結した核酸を意味する。
【0104】
相補鎖合成反応の進行に伴う生成物は、公知の手法によって検出することができる。たとえばゲル電気泳動によって反応液を分析すれば、本発明に固有の増幅生成物を明瞭なバンドとして確認することができる。本発明における増幅生成物は、標的塩基配列とその相補鎖を1単位とする塩基配列の繰り返しからなっている。これを電気泳動で分離すると、一定の間隔で並んだラダー状のバンドが表れる。この他、相補鎖合成の進行を反応させながら追跡する手法も公知である。たとえば、エチジウムブロマイドやサイバーグリーン等の2本鎖核酸特異的な蛍光染料によって、相補鎖合成産物の蓄積を蛍光強度の変化として追跡することができる。後に述べる内部標準を用いた場合には、内部標準におけるシグナルの増大が確認できたとき、あるいは内部標準におけるシグナル変化がプラトーに達したときに、試料におけるシグナルが実質的に増大していなければ、試料の特定の領域が予測された塩基配列でなかったことを意味する。
【0105】
本発明の検出方法において、相補鎖合成産物の量は内部標準と比較することができる。内部標準には、たとえば同一の核酸試料に由来し変異や多型が存在しないことが明らかな核酸を用いることができる。ゲノムの塩基配列の解析を目的とする場合には、ゲノムにおいて変異や多型が知られていない塩基配列を内部標準として利用することができる。あるいはmRNAを鋳型として本発明の検出方法を行う場合には、たとえばいずれの細胞でも一定の発現量が観察される遺伝子を内部標準とすることができる。これら内部標準に対しても、その塩基配列を標的塩基配列として本発明と同じ条件で相補鎖合成反応を行い、その生成物の量を対照として変異を検出すべき塩基配列から得られた結果と比較することができる。内部標準と同レベルの生成物が生じた場合には、特定の塩基配列が予測された塩基配列と同一であったことが確認できる。逆に、特定の領域の塩基配列が予測されたものと相違していれば、相補鎖合成反応生成物の量は内部標準よりも少なくなるはずである。
【0106】
更に、本来相補鎖合成反応生成物を生じるべき内部標準において生成物が検出できないとき、あるいは少ないときには、反応自体に何らかの問題があった可能性が疑われる。一般に内部標準は、試験用のプライマーとともに同一の反応液で反応させるものが多い。しかし本発明においては、同一試料を用いて共通の条件で反応させる限り、内部標準とすることができる。たとえば、同一試料について第1の反応系で標準を測定し、第2の反応系で試料核酸を測定するような場合も、この標準を内部標準という。
【0107】
本発明において、特定の領域が予測される塩基配列を備えていた場合に合成される核酸を構成する相補的な塩基配列の数は、少なくとも1組である。本発明の望ましい態様によれば、その整数倍となることもある。そしてこの場合、理論的には本発明における前記核酸を構成する相補的な塩基配列のペアの数に上限はない。本発明の合成生成物である核酸が複数組の相補的な塩基配列で構成されるとき、この核酸は同じ塩基配列の繰り返しからなる。なお反応生成物の中には、相補鎖合成反応が5'末端に至らず、鋳型の途中で終了しているものなどが混在する可能性のあることは言うまでも無い。
【0108】
本発明に基づいて合成される1本鎖上に相補的な塩基配列が交互に連結した核酸は、必ずしも天然の核酸と同じ構造である必要はない。DNAポリメラーゼの作用によって核酸を合成するときに基質としてヌクレオチド誘導体を利用すれば、核酸の誘導体の合成が可能なことは公知である。このようなヌクレオチド誘導体には、ラジオアイソトープで標識したヌクレオチドや、ビオチンやジゴキシンのような結合性リガンドで標識したヌクレオチド誘導体などが用いられる。これらのヌクレオチド誘導体を用いることにより、生成物である核酸誘導体の標識が達成される。あるいは、蛍光性のヌクレオチドを基質として用いることによって、生成物である核酸を蛍光性の誘導体とすることができる。更にこの生成物は、DNAであることもできるし、RNAとすることもできる。いずれを生成するかは、プライマーの構造、重合のための基質の種類、そして核酸の重合を行う重合化試薬との組み合わせによって決定される。
【0109】
本発明において、核酸とは、DNA、またはRNA、あるいはそれらのキメラ分子であることができる。核酸は、天然のものであることもできるし、人工的に合成されたものであることもできる。また部分的に、あるいは全体が完全に人工的な構造からなるヌクレオチド誘導体であっても、それが塩基対結合を形成しうるものであるかぎり、あるいは相補鎖合成のための鋳型として機能する限り、本発明の核酸に含まれる。本発明における核酸の構成塩基数は、制限されない。核酸は、用語ポリヌクレオチドと同義である。一方本発明におけるオリゴヌクレオチドとは、ポリヌクレオチドの中でも特に構成塩基数が少ないものを示す用語として用いる。一般にオリゴヌクレオチドは、2〜100、より一般的には、2〜50程度の塩基数のポリヌクレオチドを指してオリゴヌクレオチドと呼ぶが、これらの数値に限定されるものではない。
【0110】
本発明の検出方法は、あらゆる核酸に対して応用することができる。具体的には、たとえば原核細胞や真核細胞のゲノム、ウイルスのゲノムDNAやゲノムRNA、マイコプラズマやリケッチアのような細胞内寄生体のゲノム、これらの生物種のmRNAから誘導されたcDNA、更にこれらの遺伝子ソースから誘導されたライブラリーや、ライブラリーから単離されたクローンなどを示すことができる。変異や多型を検出すべき遺伝子がRNAであれば、逆転写酵素活性を持つDNAポリメラーゼの作用によってcDNAとすることができる。本発明の試料とする核酸は、一般に生物学的な試料に含まれる。生物学的試料とは、動物、植物、あるいは微生物の組織、細胞、培養物、排泄物あるいはそれらの抽出物を示すことができる。本発明は、これらの生物学的試料に含まれる、その生物に由来する核酸、あるいはその生物を宿主としている感染性の寄生生物、微生物、並びにウイルスに由来する核酸等を検出対象とすることができる。また本発明における核酸は、前記生物学的試料に含まれる核酸から誘導されたものであってもよい。たとえば、mRNAをもとに合成されたcDNAや、生物学的試料に由来する核酸をもとに増幅された核酸等を本発明による検出方法の試料とすることができる。これらの遺伝子は、変性によって1本鎖とすることにより、あるいは後で述べるように2本鎖のまま、本発明による検出方法の試料とすることができる。
【0111】
本発明における標的塩基配列を含む核酸は、プライマーのアニールと、これを起点とする相補鎖合成反応が進行する条件下でインキュベートされる場合、2本鎖の状態のままで試料とすることができる。通常、核酸試料をプローブやプライマーとのハイブリダイズによって解析するとき、変性処理によって1本鎖とする工程が必要とされている。しかし、プライマーからの相補鎖合成反応は、2本鎖核酸が不安定化される条件の元では、完全に1本鎖とする工程を省略できる場合のあることを本発明者らは見出している(2000年4月7日出願、特願2000-111939)。
【0112】
すなわち、単に2本鎖核酸を不安定化する条件とするのみでは、相補鎖を効率的に合成することは難しいが、もともと等温で進行する核酸の増幅反応と組み合わせるときに、1本鎖核酸を鋳型とする場合と比べて遜色の無い増幅効率を達成することができるのである。本発明に応用することができる核酸の増幅方法は、1本鎖の鋳型核酸に応用した場合には、等温で進行する。この方法は、鎖置換を伴う相補鎖合成を触媒することができるDNAポリメラーゼを用いているとともに、自身へのアニールと相補鎖合成、そしてループへの新たなプライマーのアニールと相補鎖合成とを繰り返すことによって、等温条件下での相補鎖合成が繰り返し行われる反応原理に基づいている。したがって、本発明における標的塩基配列には、2本鎖核酸を用いることができる。
【0113】
本発明に基づき、2本鎖核酸を直接鋳型として変異や多型の検出を行う方法について述べる。なお以下の説明においては、特定の領域を構成する塩基配列が予測される塩基配列であった場合に開始される相補鎖合成の過程を説明している。特定の領域の塩基配列が予測した塩基配列と相違している場合には、以下に述べるいくつかの相補鎖合成反応に、自身の3'末端が特定の領域にアニールして自身を鋳型として進行する相補鎖合成反応を阻害する工程が組みこまれる。
【0114】
2本鎖核酸としては、たとえばcDNAやゲノムDNAを示すことができる。あるいはこれらのDNAを各種のベクターに挿入したものを本発明の2本鎖核酸として用いることもできる。本発明の2本鎖核酸は、精製されたものであっても良いし、未精製のものであることもできる。また、細胞内に存在する状態(in situ)で、本発明の方法を適用することもできる。細胞内の2本鎖核酸を鋳型とすることによって、ゲノムのin situ解析が可能となる。
【0115】
本発明においてcDNAを鋳型として用いる場合、cDNAを合成する工程と、本発明に基づく核酸の合成方法とを、同一の条件下で実施することができる。RNAを鋳型としてcDNAの第1鎖を合成すると、DNA-RNAハイブリッドによる2本鎖核酸が完成する。この2本鎖核酸を本発明における鋳型として、核酸の合成方法を実施することができる。本発明の核酸の合成方法に用いるDNAポリメラーゼが、逆転写酵素活性を備えるものであれば、単一の酵素を用い、同一の条件下で核酸の合成を行うことができる。たとえばBca DNA ポリメラーゼは、鎖置換活性を有し、逆転写酵素活性を併せ持つDNAポリメラーゼである。なお、第2鎖を合成したうえで完全な2本鎖cDNAとした後に、本発明による核酸の合成方法を適用しうることは言うまでも無い。
【0116】
本発明の変異や多型の検出には、鎖置換を伴う相補鎖合成を触媒することができるポリメラーゼが利用される。この種のポリメラーゼは、SDAなどに用いられたDNAポリメラーゼと同様のものが用いられる。すなわち、ある塩基配列の3'側に相補的なプライマーを合成起点として相補鎖合成を行うときに、鋳型の5'側に2本鎖の領域が有るとその2本鎖を置換しながら相補鎖の合成を行う特殊なポリメラーゼが公知である。鋳型の5'側とは、プライマーの3'側、すなわち相補鎖合成反応が進行する方向である。本発明においては、更に相補鎖合成に必要な基質が添加される。
【0117】
本発明においては、2本鎖核酸に任意のプライマーを加え、このプライマーを起点とする相補鎖合成反応が達成できる条件のもとでインキュベートされる。本発明の任意のプライマーとは、FAがアニールすべき領域を塩基対結合可能な状態とするために用いられる。したがって、任意のプライマーは、鋳型となる2本鎖核酸の、FAがアニールすべき核酸鎖に対して、その相補鎖にアニールすることができるものである必要がある。更に、本発明における任意のプライマーを複製起点とする相補鎖合成は、FAがアニールすべき領域の方向に向かって進行するような位置関係にあるべきである。言いかえれば、FAを起点とする相補鎖合成反応において鋳型として機能する領域の、任意の領域に対してアニールするものであることができる。任意のプライマーは、この条件を満たす限り、任意の領域から選択することができる。たとえば、RAや、鋳型におけるRAがアニールする領域よりも更に3’側にアニールするアウタープライマー(後述)を、任意のプライマーとして用いることもできる。このような態様は反応に必要な成分を少なくすることから、本発明における望ましい態様の一つである。
【0118】
任意のプライマーを起点とする相補鎖合成で2本鎖核酸の一方の鎖を置換し、FAによる塩基対結合が可能な状態とすることができる。この条件を採用したことによって、本発明の方法を2本鎖核酸を試料として温度変化無しで実現することができた。任意のプライマーの2本鎖核酸に対するアニール、およびこのプライマーを起点とする相補鎖合成反応が達成できる条件とは、実際には次の複数の工程を同じ条件下で進めることができる条件ということができる。
i) 2本鎖核酸からなる鋳型に対してプライマーがアニールする
ii) アニールしたプライマーを複製起点とする相補鎖合成が進む。
【0119】
一般にプライマーは少なくともそれがアニールすべき領域が1本鎖でなければアニールすることはできないと考えられていた。そのため従来は、2本鎖の核酸を鋳型とする場合には、プライマーのアニールに先立って必ず変性によって1本鎖とする工程が実施されてきた。しかし必ずしも完全な1本鎖としなくとも、何らかの手段によって2本鎖が不安定化される条件のもとで、プライマーとインキュベートすることにより、プライマーのアニールが可能となる。2本鎖が不安定化される条件としては、たとえば融解温度(以下、Tmと省略する)近くにまで加温する方法を示すことができる。あるいは、更にTm調整剤を存在させることも有効である。
【0120】
一連の反応は、酵素反応に好適なpHを与える緩衝剤、酵素の触媒活性の維持やアニールのために必要な塩類、酵素の保護剤、更には必要に応じて融解温度(Tm)の調整剤等の共存下で行う。緩衝剤としては、Tris-HCl等の中性から弱アルカリ性に緩衝作用を持つものが用いられる。pHは使用するDNAポリメラーゼに応じて調整する。塩類としてはKCl、NaCl、あるいは(NH4)2SO4等が、酵素の活性維持と核酸の融解温度(Tm)調整のために適宜添加される。酵素の保護剤としては、ウシ血清アルブミンや糖類が利用される。
【0121】
更に融解温度(Tm)の調整剤には、ベタイン、プロリン、ジメチルスルホキシド(以下、DMSOと省略する)、あるいはホルムアミドが一般に利用される。融解温度(Tm)の調整剤を利用することによって、前記オリゴヌクレオチドのアニールを限られた温度条件の下で調整することができる。更にベタイン(N,N,N,-trimethylglycine)やテトラアルキルアンモニウム塩は、そのisostabilize作用によって鎖置換効率の向上にも有効である。ベタインは、反応液中0.2〜3.0 M、好ましくは0.5〜1.5 M程度の添加により、本発明の核酸増幅反応の促進作用を期待できる。これらの融解温度の調整剤は、融解温度を下げる方向に作用するので、塩濃度や反応温度等のその他の反応条件を考慮して、適切なストリンジェンシーと反応性を与える条件を経験的に設定する。
【0122】
Tm調整剤を利用することにより、酵素反応に好適な温度条件を容易に設定することができる。Tmはプライマーと標的塩基配列の関係によって変動する。したがって、酵素活性を維持できる条件と、本発明の条件を満たすインキュベーションの条件とが一致するように、Tm調整剤の使用量を調整することが望ましい。本発明の開示に基づいて、プライマーの塩基配列に応じて適切なTm調整剤の使用量を設定することは、当業者にとって自明である。たとえば、アニールする塩基配列の長さとそのGC含量、塩濃度、およびTm調整剤の濃度に基づいて、Tmを算出することができる。
【0123】
このような条件下における2本鎖の核酸に対するプライマーのアニールは、おそらく不安定であると推測される。しかし鎖置換を伴う相補鎖合成を触媒することができるDNAポリメラーゼとともにインキュベートすることにより、不安定ながらアニールしたプライマーを複製起点として相補鎖が合成される。相補鎖が合成されれば、プライマーのアニールは次第に安定化されることになる。以下に示すようなDNAポリメラーゼは、2本鎖核酸に対するプライマーのアニールが可能な条件下で、相補鎖の合成を触媒することができる。
【0124】
本発明による変異や多型の検出方法を支えているのは、鎖置換を伴う相補鎖合成を触媒することができるDNAポリメラーゼである。この種のDNAポリメラーゼには、以下のようなものが知られている。また、これらの酵素の各種変異体についても、それが配列依存型の相補鎖合成活性と鎖置換活性を有する限り、本発明に利用することができる。ここで言う変異体とは、酵素の必要とする触媒活性をもたらす構造のみを取り出したもの、あるいはアミノ酸の変異等によって触媒活性、安定性、あるいは耐熱性を改変したもの等を示すことができる。
【0125】
Bst DNAポリメラーゼ
Bca(exo-)DNAポリメラーゼ
DNA ポリメラーゼIのクレノウ・フラグメント
Vent DNAポリメラーゼ
Vent(Exo-)DNAポリメラーゼ(Vent DNAポリメラーゼからエクソヌクレアーゼ活性を除いたもの)
DeepVent DNAポリメラーゼ
DeepVent(Exo-)DNAポリメラーゼ(DeepVent DNAポリメラーゼからエクソヌクレアーゼ活性を除いたもの)
Φ29ファージDNAポリメラーゼ
MS-2ファージDNAポリメラーゼ
Z-Taq DNAポリメラーゼ(宝酒造)
KOD DNAポリメラーゼ(東洋紡績)。
【0126】
これらの酵素の中でもBst DNAポリメラーゼやBca(exo-)DNAポリメラーゼは、ある程度の耐熱性を持ち、触媒活性も高いことから特に望ましい酵素である。本発明は2本鎖の状態にある核酸に対して、プライマーのアニールと相補鎖合成反応とを同一条件下で行う。このような反応は、しばしばある程度の加温を必要とすることから、酵素が耐熱性であることは望ましい条件の一つである。耐熱性の酵素を用いることにより、幅広い反応条件に対応することができる。
【0127】
たとえばVent(Exo-)DNAポリメラーゼは、鎖置換活性と共に高度な耐熱性を備えた酵素である。ところでDNAポリメラーゼによる鎖置換を伴う相補鎖合成反応は、1本鎖結合タンパク質(single strand binding protein)の添加によって促進されることが知られている(Paul M.Lizardi et al, Nature Genetics 19, 225-232, July,1998)。この作用を本発明に応用し、1本鎖結合タンパク質を添加することによって相補鎖合成の促進効果を期待することができる。Vent(Exo-)DNAポリメラーゼに対しては、1本鎖結合タンパク質としてT4 gene 32が有効である。
【0128】
なお3'-5'エクソヌクレアーゼ活性を持たないDNAポリメラーゼには、相補鎖合成が鋳型の5'末端に達した部分で停止せず、1塩基突出させた状態まで合成を進める現象が知られている。本発明では、相補鎖合成が末端に至ったときの3'末端の配列が次の相補鎖合成の開始につながるため、このような現象は望ましくない。しかし、DNAポリメラーゼによる3'末端への塩基の付加は、高い確率でAとなる。したがって、dATPが誤って1塩基付加しても問題とならないように、3'末端からの合成がAで開始するように配列を選択すれば良い。また、相補鎖合成時に3'末端がたとえ突出してしまっても、これを消化してblunt endとする3'→5'エクソヌクレアーゼ活性を利用することもできる。たとえば、天然型のVent DNAポリメラーゼはこの活性を持つことから、Vent(Exo-)DNAポリメラーゼと混合して利用することにより、この問題を回避することができる。
【0129】
これらのDNAポリメラーゼに対して、PCRなどで一般に用いられているTaqポリメラーゼ等のDNAポリメラーゼは、通常の条件では鎖置換作用は実質的に見られない。しかし、この種のDNAポリメラーゼであっても、鎖置換が可能な条件を与えることができる場合には、本発明に利用することができる。
【0130】
本発明においては、LAMP法の増幅効率を高めるためにループプライマーを利用することができる。ループプライマーとは、前記FAの伸長生成物におけるFAに由来する領域と、FAに対する任意の領域(つまりFAの5'末端に相補的な塩基配列からなる領域)の間において相補鎖合成の起点を与えることができるプライマーである。RAについても同様に、前記RAの伸長生成物におけるRAに由来する領域と、RAに対する任意の領域(つまりRAの5'末端に相補的な塩基配列からなる領域)の間において相補鎖合成の起点を与えることができるプライマーをループプライマーとして利用することができる。本発明においては、便宜上、FAに対するループプライマーをループプライマーF、RAに対するループプライマーをループプライマーRと記載する。ループプライマーは、LAMP法の生成物の中に、RAやFAがアニールすることができないループを含むものがあることに着目して考え出された。ループプライマーを利用したLAMP法について、本出願人は特許出願している(2000年9月19日出願、特願2000-283862)。ループプライマーをLAMP法に組み合わせることにより、その反応効率は著しく改善される。ループプライマーを利用するときには、ループプライマーFおよび/またはループプライマーRをRA、FA、そして必要に応じてアウタープライマーとともに加えて反応を開始する。ループプライマーのみを後から加えてもその効果を期待することはできるが、反応の効率化を目的とするのであるから、反応開始時より存在させておくのが合理的である。
【0131】
本発明に基づいて、前記本発明の反応を構成する成分を予め組み合わせてキットとすることができる。すなわち本発明は、2つのインナープライマーからなるプライマーセット、鎖置換を伴う相補鎖合成を触媒することができるDNAポリメラーゼ、およびヌクレオチド基質で構成され、前記プライマーセットを構成するインナープライマーの少なくとも1つがチェックプライマーである、変異および/または多型の検出用キットに関する。本発明のキットには、前記インナープライマーに対するアウタープライマーや、内部標準用の別のプライマーセットを組み合わせることができる。また、反応効率を改善するループプライマーを組み合わせることもできる。あるいは、陽性対照や陰性対照として用いる標準試料、取り扱い指示書などを添付することもできる。更に、増幅生成物を検出するための指示薬成分を組み合わせることもできる。指示薬としては、たとえばEtBrのような蛍光染料、あるいは増幅生成物の塩基配列を認識してシグナルを生成するプローブなどを用いることができる。
【0132】
また、前記インナープライマーからなるプライマーセットとして、野生型用および変異型用の2種類のプライマーセットを組み合わせることによって、ヘテロ/ホモのgenotyping用のキットとすることができる。genotypeが複数の変異型を含む場合には、変異型の種類に応じた数のプライマーセットを用いれば、あらゆるgenotypeのホモとヘテロを判定することができるキットとなる。ヘテロとホモの判定は、家系の解析や、genotypeに基づくphenotypeの予測において重要である。
【0133】
前記インナープライマーRAおよびFAを利用し、鎖置換活性を持ったDNAポリメラーゼと組み合わせて2本鎖の核酸を増幅する反応について、基本的な原理を図1−図4に基づいて以下に説明する。この例においては、インナープライマーであるRAおよびFAが増幅用プライマーのセットを構成しており、更にRAは2本鎖として存在する標的塩基配列におけるFAがアニールすべき領域を塩基対結合が可能な状態とするための任意のプライマーとしても作用する。本発明においては特定の領域、すなわちR1が予測された塩基配列で構成されている場合に、以下に述べるような増幅反応が進行する。一方、予測した塩基配列とは異なっていた場合には、R1に対して3'末端であるR1cがアニールを繰り返すたびに相補鎖合成反応が阻害され、原理的には増幅反応は進行しない。また、あるいは一定の確率でR1cを起点とする相補鎖合成が誤って生じたとしても、その生成物はわずかしか生じないので、最終的な結果に与える影響は実質的に無いと言える。
【0134】
上記任意のプライマー(図1-(1)におけるRA)は、まず鋳型となる2本鎖核酸におけるX2c(R2cに相当)にアニールし相補鎖合成の起点となる。このとき2本鎖核酸は不安定化する条件下に置かれており、2本鎖の核酸に対してプライマーが直接相補鎖合成反応の起点として機能する。図1-(2)においてはRAを起点として合成された相補鎖が、鋳型となった2本鎖核酸の一方の鎖を置換し、他方のインナープライマーであるFAがアニールする領域F2cが塩基対結合が可能な状態となっている(図1-(2))。
【0135】
得られた塩基対結合が可能となった領域F2cに対してFAをアニールさせて相補鎖合成を行う。この例においては、更にFAの3’側から相補鎖合成を開始するアウタープライマーF3がアニールする(図2-(4))。アウタープライマーは、各インナープライマーの3’側からの相補鎖合成を開始するように設計されており、しかもインナープライマーよりも低濃度で用いるので、高い確率でインナープライマーよりも低い確率で相補鎖合成を開始する。
【0136】
インナープライマーとしてRA、およびFAを用い、ループプライマーを組み合わせて本発明による変異の検出方法を実施するとき、チェック機構の厳しさは、主としてF1/F1cのTmに左右される。F1/F1cのTmを、許される範囲でできるだけ低く設定することにより、塩基配列の厳密なチェック機構を実現できる。ただしF1/F1cのTmが許容限度を越えて低く設定された場合には、特定の領域の塩基配列が予測された塩基配列であった場合であっても、効率的な増幅反応が期待できなくなる場合がある。たとえば後に述べる実施例においては、60℃の反応条件に対して、F1/F1cのTmが45℃という条件で、効率的な合成が起きている。Tmよりも15℃も高い反応温度は、一般的には、異なるポリヌクレオチド分子のハイブリダイズは期待できない。つまり、効率的な相補鎖合成は期待できない。しかし本発明においては、F1/F1cのアニールが同一分子内で起きるために、反応温度よりも多少低いTmでも、反応効率を犠牲にすることなく、十分な厳しさで塩基配列のチェックが実現できるのである。したがって、異なるポリヌクレオチド間ではハイブリダイズできないが、同一分子内であればハイブリダイズすることができるようにF1/F1c間のTmを設定することは、本発明における有利な条件と言うことができる。たとえば後に述べる実施例5で用いた各プライマーのTmは、以下のとおりである。
【0137】
アウタープライマーF3(R3):60℃
ループプライマーFL:56℃
ループプライマーRL:58℃
インナープライマーFAの3'側F2(またはRAの3'側R2):55℃
インナープライマーFAの5'側F1c(またはRAの5’側R1c):45℃。
【0138】
本発明においては、ループプライマーを組み合わせる場合、反応全体の効率が上がるので、F1c(R1c)のTmが低く設定されていても短時間で高度な増幅反応を期待することができる。つまり、それだけプライマーの長さを短くすることができる。
【0139】
アウタープライマーF3を起点とする相補鎖合成の結果、インナープライマーFAを起点として伸長した合成生成物が置換されて1本鎖となる(図2-(5))。この1本鎖を鋳型として、RA、およびRAに対するアウタープライマーR3が更にアニールと相補鎖合成を開始する(図3-(6))。その結果として生成するRAからの伸長生成物は、その3'末端F1を自身に対してアニールすることができる構造を備える(図3-(8))。
【0140】
なお図3-(6)においては5'末端が自身にアニールしている。しかし5'末端は相補鎖合成の起点とならないことから、この構造では増幅反応を開始することはできない。図3-(6)に対する相補鎖を合成し、更にその3'末端において自身にアニールすることができる構造(図3-(8))が実現して初めて、増幅反応がスタートする。ここまでの反応は、言わば、本発明に用いる増幅反応の準備段階と言える。
【0141】
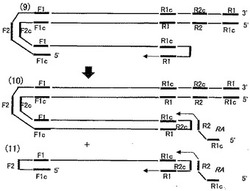
続いて、本発明によって達成される核酸の増幅反応と特定の領域R1cを構成する塩基配列のチェック機構について、引き続き図面に基づいて具体的に説明する。自身にアニールした3'末端F1(図3-(8))は、相補鎖合成の起点となることができる。このとき3'末端へのアニールはF1/F1c間で生じるので、同じくF1cを持つFAと競合する可能性がある。しかし現実には、同一鎖の隣接する領域に存在する相補的な塩基配列F1/F1cは、優先的にアニールする。したがって、自身を鋳型とする相補鎖合成反応が優先的に始まる。この反応によって、標的塩基配列が1本鎖上に交互に連結された核酸が合成される。更に、3'末端F1の自身へのアニールによって形成されたループ形成領域には、インナープライマーFAがアニールすることができるF2cが存在しており、ここにFAがアニールして相補鎖合成反応が始まる(図3-(8))。ループ部分にアニールするインナープライマーFAの位置関係を図5に示した。ループにアニールしたFAからの相補鎖合成反応は、先に自身を鋳型として3'末端から開始した相補鎖合成反応の生成物を置換し、その3'末端R1を再び自身にアニール可能な状態とする(図4-(9))。この後は、3'末端を起点とする自身を鋳型とする相補鎖合成反応と、ループ部分を起点とするインナープライマーRAを起点とする相補鎖合成反応が交互に起きる。こうして、自身を鋳型として3'末端が繰り返し伸長する反応と、ループ部分からの新たなプライマーによる伸長とが繰り返し生じて、核酸の増幅反応が成立する。
【0142】
一方、自分自身を鋳型として伸長を継続する1本鎖の核酸に対して、そのループ部分にアニールするオリゴヌクレオチドを合成起点として相補鎖合成される核酸に注目すると、ここでも1本鎖上に相補的な塩基配列が交互に連結された核酸の合成が進行している。すなわち、ループ部分からの相補鎖合成は、たとえば図4−(9)においては、R1に達した時点で完了する。そして、この核酸の合成によって置換された3'末端を起点として補鎖合成が始まる(図4−(9))。すると、やがてその反応はかつて合成起点であったループ部分に達して再び置換が始まる。こうしてループ部分から合成を開始した核酸も置換され、その結果同一鎖上にアニールすることができる3'末端R1を得る(図4−(11))。この3'末端R1は同一鎖のR1cにアニールして相補鎖合成を開始する。さて、この反応のFとRを読みかえれば、図3−(8)で起きている反応と同じである。したがって図4−(11)に示す構造は、自身の伸長と新たな核酸の生成を継続する新しい核酸として機能することができる。
【0143】
以上のように、この方法においては、1つの核酸の伸長に伴って、これとは別に伸長を開始する新たな核酸を供給しつづける反応が進行する。更に鎖が伸長するのに従い、末端のみならず、同一鎖上に複数のループ形成配列がもたらされる。これらのループ形成配列は、鎖置換合成反応により塩基対形成可能な状態となると、インナープライマーがアニールし、新たな核酸の生成反応の基点となる。末端のみならず鎖の途中からの合成反応も組み合わされることにより、さらに効率のよい増幅反応が達成されるのである。
【0144】
更に本発明においては、RAに加えてFAもチェックプライマーとすることによって、チェック機構が働く機会を増やすことができる。あるいはRAを鋳型として生成した3'末端のみで特定の領域における塩基配列のチェックを行わせる場合であっても、特定の領域の塩基配列のチェックを経て相補鎖合成反応が進行する。その結果、特定の領域が予測される塩基配列であった場合に生成する相補鎖合成生成物の量と比較して、相違があった場合の生成物の量は大幅に減少する。したがって本発明による変異および/または多型の検出方法は、その原理上、たいへんS/N比に優れた検出方法を提供することができる。
【0145】
以上のように特定構造のプライマーの利用により、伸長とそれに伴う新たな核酸の生成が起きる。更に本発明においては、この新たに生成した核酸自身が伸長し、それに付随する更に新たな核酸の生成をもたらす。一連の反応は、理論的には永久に継続し、きわめて効率的な核酸の増幅を達成することができる。しかも本発明の方法は、すべての反応を等温条件のもとで行うことができる。
【0146】
本発明においてインナープライマーとしてRA、およびFAを用いるときは、一連の反応が常に複数の領域の位置関係を維持した状態でなければ進行しないことが重要な特徴である。更にアウタープライマーを組み合わせる態様においては、少なくとも6つの領域が反応に関与する。この特徴によって、非特異的な相補鎖合成に伴う非特異的な合成反応が効果的に防止できるのである。すなわち、たとえ何らかの非特異的な反応が起きたとしても、その生成物が以降の増幅工程に対して出発材料となる可能性を低く押さえることにつながるのである。
【0147】
またより多くの領域によって反応の進行が制御されているということは、類似した塩基配列の厳密な識別を可能とする検出系を自由に構成できる可能性をもたらす。ヒトCYP2C19のように相互に類似する塩基配列を含む遺伝子の間で、類似する塩基配列の中に存在するSNPsの検出は重要な課題である。しかしPCR法等の公知の遺伝子増幅技術や、あるいはInvader法のような公知のシグナル増幅技術に基づいて、類似する塩基配列中のわずかな変異を一回の増幅反応のみで検出することは困難である。本発明によれば、複数の領域が、予測した塩基配列を備え、しかも特定の位置関係にあるときに限り、高度な増幅反応が起きるようにプライマーを設計することができる。
【0148】
したがって本発明は、たとえばHLAや血小板同種抗原、あるいは病原微生物のタイピングのような、類似する塩基配列を含む複数の遺伝子間の微細な塩基配列の相違の検出に有用である。これらの形質を決定している遺伝子は、その大部分が共通であり、いくつかの領域における変異のパターンに基づいて、タイピングが行われる。複数の領域における塩基配列が予測されたとおりでなければ、一定レベルの増幅生成物を生じることができない本発明の方法は、このような解析に好適である。
【0149】
更に、本発明によれば特定の領域を構成する塩基配列が野生型の塩基配列であるときに増幅が起きるプライマーと、変異型であるときに増幅が起きるプライマーを組みあわせて同一検体のゲノムDNAを解析することにより、ヘテロとホモを明瞭に判定することができる。すなわちいずれか一方でのみ増幅が観察された場合には、被検体は野生型か変異型のいずれかをホモで有することを示している。他方、両方のプライマーで増幅が観察されるときには、変異型と野生型をヘテロで有することを示している。
【0150】
この他本発明は、テーラーメード医療を支える薬剤代謝遺伝子の解析技術としても有用である。薬剤代謝遺伝子は、薬剤に対する感受性を左右する重要な遺伝子である。その活性の違いは、その薬剤の代謝に関与する酵素をコードする遺伝子に見出されるわずかな塩基配列の相違に起因していると考えられている。ヒトゲノムプロジェクトの成果によって、標準的なヒト遺伝子の姿が明らかにされようとしている。この成果の実用的な応用として最も注目されているのが薬剤代謝遺伝子の解析である。したがって本発明は、ポストゲノム時代において高い有用性を持つ技術を提供するものである。
【0151】
なお本明細書において引用された全ての先行技術文献は、参照として本明細書に組み入れられる。
【実施例】
【0152】
以下、実施例に基づいて本発明を更に具体的に説明する。
【0153】
実施例1.ヒトCYP2C19遺伝子における変異の検出(1)
ヒトCYP2C19の遺伝子をPCRにより増幅し、SNPs部分を認識する制限酵素SmaIで消化し野生型(WT)か1塩基変異(m1)かのタイピングを行った。さらに、その結果に基づいてWTおよびm1と判定したPCR産物を、pBluescript IIのEcoRVにクローニングし、塩基配列を決定してSNPs部分の塩基配列を確認した。野生型の塩基配列は、配列番号:5に示した。m1では、配列番号:5の111番目がGではなくAとなっていた(図7)。
【0154】
続いて、本発明に基づいてヒトCYP2C19のWTとm1を識別するためのプライマーとして、次の塩基配列からなるプライマーを設計した。各プライマーと標的塩基配列の関係は、図7に示したとおりである。FAの5'末端が、変異を検出すべき部分を含んでいる。したがって、標的塩基配列のこの領域において予測される塩基配列が存在しない場合、相補鎖合成反応は阻害される。
【0155】
RA(R1+R2)/配列番号:1
5'-GGGAACCCATAACAAATTACTTAAAAACCTGTGTTCTTTTACTTTCTCCAAAATATC-3'
アウタープライマーR3/配列番号:2
5'-AGGGTTGTTGATGTCCATC-3'
FA(F1+F2)/配列番号:3
5'-CGGGAAATAATCAATGATAGTGGGAAAATATGCTTTTAATTTAATAAATTATTGTTTTCTCTTAG-3'
アウタープライマーF3/配列番号:4
5'-CCAGAGCTTGGCATATTGTATC-3'
上記塩基配列からなるプライマーを用い、WTあるいはm1を組み込んだpBluescript II(EcoRIで直鎖状にしたもの)10-19 mol/ tube(約60000分子)を鋳型とし、60℃で2時間反応させた。鋳型は2本鎖のまま反応させた。反応液の組成は次のとおりである。
【0156】
・反応液組成(25μL中)
20 mM Tris-HCl pH 8.8
10 mM KCl
10 mM (NH4)2SO4
4 mM MgSO4
1 M Betaine
0.1% Triton X-100
0.4 mM dNTP
8 U Bst DNA ポリメラーゼ (NEW ENGLAND BioLabs)
プライマー:
1600 nM FA
1600 nM RA
200 nM F3
200 nM R3
【0157】
上記反応液の5μLに5μLのloading bufferを添加し、2%アガロースゲル(0.5% TBE)を使って、0.5時間、100 Vで電気泳動した。泳動後のゲルをエチジウムブロマイド(EtBr)で染色して核酸を確認した。結果は図8に示すとおりである。テンプレート無しと、一塩基違いのm1をテンプレートとしたときは増幅反応が起きなかったが、WTをテンプレートとしたときは増幅生成物が確認された。本発明によって、1塩基の相違を明瞭に識別できることが確認された。
【0158】
実施例2.ヒトCYP2C19遺伝子における変異の検出(2)
実施例1と同じプライマーを用い、本発明に基づく変異の検出方法を実施した。標的塩基配列として、WT、およびm1を組み込んだpBluescript II(EcoRIで直鎖状にしたもの)10-21mol/ tube(約600分子)を用いる他は実施例1と同様の反応液組成とし、64℃で反応させた。反応液中には最終濃度0.25μg/mlになるようにEtBrを添加し、反応はABI Prism 7700(パーキンエルマ社)を用いて6時間追跡した。
【0159】
結果は図9に示した。6時間の反応中、テンプレート無しと一塩基違いのm1をテンプレートとしたときは増幅反応は起きなかった。WTをテンプレートとしたときには、増幅反応に伴う傾向強度の増強が観察された。本発明に基づいて、特定の領域における1塩基の相違を正確に識別できることが確認できた。また本発明に基づく変異の検出方法は、等温で実施することができ、しかも汎用の蛍光測定装置で反応追跡が可能であることが示された。
【0160】
なお、この実施例で用いたABI Prism 7700は、もともとPCR法のモニタリングを目的とする装置である。しかし本発明に基づく検出方法においてはPCR法のような温度サイクルは行っておらず、等温(64℃)でインキュベーションしたのみである。したがって、本実施例に基づく変異の検出方法は、インキュベーターを備えた蛍光測定装置でありさえすれば、実施することができる。
【0161】
実施例3.ヒトCYP2C19遺伝子における変異の検出(3)
本発明による塩基配列の変異検出方法の特異性を確認するために、以下の実験を行った。すなわち、特定の領域に予測される塩基配列を変異型とした場合と、野生型とした場合のそれぞれについてプライマーを設定し、本発明による変異の検出方法を試みた。用意したプライマーの塩基配列は次のとおりである。実施例1、2と同様にヒトCYP2C19遺伝子を鋳型とし、検出すべき変異に対して、変異がある場合(MUT)に増幅が起きるプライマーセット(予測される塩基配列が変異型)と、野生型(WT)の場合に増幅が起きるプライマーセット(予測される塩基配列が野生型)を用いた。各プライマーと標的塩基配列の関係は、図10に示したとおりである。FAおよびRAの両者の5'末端から2番目の塩基が、SNPsに相当する。
【0162】
野生型検出用プライマーセット
FA(F1+F2)/配列番号:6
: 5'-CCGGGAAATAATCAATGTAATTTAATAAATTATTGTTTTCTCTTAG-3'
RA(R1+R2) /配列番号:7
: 5'-CGGGAACCCATAACTGTTCTTTTACTTTCTCC-3'
変異型検出用プライマーセット
FA(F1+F2) /配列番号:8
: 5'-CAGGAACCCATAACAAATTACTTAGTGTTCTTTTACTTTCTC-3'
RA(R1+R2) /配列番号:9
: 5'-CAGGAACCCATAACAAATGTGTTCTTTTACTTTCTCC-3'
アウタープライマーR3には配列番号:2、アウタープライマーF3には配列番号:4に示す塩基配列からなるプライマーを用いた(実施例1と同じ)。
【0163】
上記塩基配列からなるプライマーを用い、WTあるいはm1を組み込んだpBluescript II(EcoRIで直鎖状にしたもの)6000分子/ tubeを鋳型とし、95℃で3分間処理後、下記の反応液に添加し反応液量を25μLとして60℃で3時間反応させた。反応液の組成は次のとおりである。
【0164】
・反応液組成(25μL中)
20mM Tris-HCl pH 8.8
10mM (NH4)2SO4
10mM KCl
3.5mM MgSO4
1M Betaine
0.1% Triton X-100
0.4mM dNTPs
8U Bst DNA ポリメラーゼ
1600nM FA
1600nM RA
200nM F3
200nM R3
反応液中には最終濃度0.25μg/mlになるようにEtBrを添加し、反応はABI Prism 7700(パーキンエルマー社)を用いて3時間追跡した。
【0165】
結果は図11に示した。また、反応後の上記反応液の5μLを実施例1と同じ操作で電気泳動した結果を図12に示した。3時間の反応中、野生型用プライマーセットおよび変異型プライマーセットのいずれも、鋳型が予測された塩基配列であった場合にのみ増幅反応が進行していることが確認できた。またわずか6000分子の鋳型を用いた実験であるにもかかわらず増幅反応は100分程度でプラトーに達し、本発明による検出方法の感度の高さが証明された。6000分子のDNAは、ちょうど血液1μLに含まれる白血球に由来するゲノムの数に相当する。成人の白血球数の正常値が4000〜8000と言われていることから、中間値6000がちょうど白血球の数に相当する。血液に含まれるDNAの大部分が白血球に由来するものであることから、白血球の数は血液中に存在するDNAの数を意味する。すなわち、6000分子のDNAを解析できる条件とは、1μLの血液を試料として遺伝子の解析ができることを意味している。
【0166】
一方で、鋳型の塩基配列が予測された塩基配列でなかった場合には、野生型用プライマーセット、変異型プライマーセットのいずれにおいても、3時間の反応で増幅は観察されなかった。本発明による変異検出方法が、わずかな試料によって信頼性の高い塩基配列のチェック機構を実現していることが示された。
【0167】
実施例4.ヒトp450CYP2C19遺伝子における特異性の検討
本発明による変異検出方法の特異性を検討するために、変異を検出すべき鋳型と類似する塩基配列からなる鋳型を100倍量で用いた実験を行った。変異を検出すべき鋳型としては実施例3と同じヒトp450CYP2C19遺伝子を用いた。一方、この遺伝子と塩基配列が類似する鋳型としては、ヒトp450CYP2C9遺伝子、およびヒトp450CYP2C18遺伝子を用いた。これらの遺伝子についても実施例1と同様にpBluescript IIにクローニングし塩基配列を確認した上で実験に用いた。
【0168】
ヒトp450CYP2C19を6000分子に代えて、600000分子のヒトp450CYP2C9遺伝子およびヒトp450CYP2C18遺伝子を鋳型としてチューブに加えた他は実施例3と同じ条件で反応させた。
【0169】
結果は図13に示したとおりである。野生型用プライマーセットでは、CYP2C19WT DNA 6000分子で増幅が見られたのに対して、CYP2C9、CYP2C18遺伝子では600000分子でも増幅は観察されなかった。同様に変異型用プライマーセットにおいても、CYP2C19MUT DNA 6000分子で増幅が見られたのに対して、CYP2C9、CYP2C18遺伝子では600000分子でも増幅は観察されなかった。以上の結果より、本発明による変異検出方法は、相互に類似する塩基配列からなる遺伝子群の中でも、目的とする塩基配列を類似する塩基配列から識別することができ、しかも目的とする変異は正確に検出できることが示された。
【0170】
図6にも示すように、p450CYP2C19、p450CYP2C9、およびp450CYP2C18の塩基配列は極めて類似性が高い。公知の塩基配列の検出法では、これほど類似性の高い塩基配列を識別し、同時に変異を検出することは不可能と言って良い。
【0171】
実施例5.ループプライマーを用いた検討1
−ヒトp450CYP2C19遺伝子におけるSNPs検出−
本出願人によって見出されたループプライマー(2000年9月19日出願、特願2000-283862)によるLAMP法の反応効率の改善効果が、本発明による変異検出方法においても有効であることを確認するために、以下の実験を行った。
【0172】
まず以下の塩基配列からなるプライマー、およびループプライマーを設計した。ループプライマーとは、FAの伸長生成物上のF2とF1の間において相補鎖合成の起点を与えることができるプライマーである。RAについても同様に、前記RAの伸長生成物におけるR2とR1の間において相補鎖合成の起点を与えることができるプライマーをループプライマーとして用いる。具体的には、以下の塩基配列からなるループプライマーを設定した。野生型(WT)用、変異型(MUT)用の各プライマーセットに対してループプライマーは共通である。反応に用いた各プライマーと標的塩基配列の関係を図14に示した。実施例3と同様に、FAおよびRAの両者の5'末端から2番目の塩基が、SNPsに相当する。
【0173】
野生型検出用プライマーセット
FA(F1+F2)/配列番号:10
: 5'- CCGGGAAATAATCTAATTTAATAAATTATTGTTTTCTCTTAG-3'
RA(R1+R2) /配列番号:11
: 5'-CGGGAACCCTGTTCTTTTACTTTCTCC-3'
変異型検出用プライマーセット
FA(F1+F2) /配列番号:12
: 5'-CTGGGAAATAATCATAATTTAATAAATTATTGTTTTCTCTTAG-3'
RA(R1+R2) /配列番号:13
: 5'-CAGGAACCCATATGTTCTTTTACTTTCTCC-3'
ループプライマーFL/配列番号:14
: 5'-GATAGTGGGAAAATTATTGC-3'
ループプライマーRL/配列番号:15
: 5'-CAAATTACTTAAAAACCTTGCTT-3'
アウタープライマーR3には配列番号:2、アウタープライマーF3には配列番号:4に示す塩基配列からなるプライマーを用いた(実施例1と同じ)。
【0174】
上記プライマーセットに、ループプライマーを組み合わせ、WTあるいはm1を組み込んだpBluescript II(EcoRIで直鎖状にしたもの)6000分子/ tubeを鋳型とし、95℃で3分間処理後、下記の反応液に添加し反応液量を25μLとして60℃で3時間反応させた。反応液の組成は次のとおりである。
【0175】
反応組成(25μL中)
20mM Tris-HCl pH 8.8
10mM (NH4)2SO4
10mM KCl
4.0mM MgSO4
1M Betaine
0.1% Triton X-100
0.5mM dNTPs
8U Bst DNA ポリメラーゼ
1600nM FA
1600nM RA
200nM F3
200nM R3
800nM FL
800nM RL
鋳型DNA 6000分子/ tube
反応液中には最終濃度0.25μg/mlになるようにEtBrを添加し、反応はABI Prism 7700(パーキンエルマー社)を用いて1時間追跡した。結果は図15に示した。
【0176】
ループプライマーを用いない反応では、WT用プライマーで反応開始後約70分からMUT用プライマーで約80分から増幅生成物による蛍光シグナルの増加が観察された(図11)た。一方、ループプライマーを用いた反応では野生型用、変異型用の両方のプライマーで、反応開始後約20分から増幅生成物による蛍光シグナルの増加が観察されている(図15)。ループプライマーの応用によって、反応速度が速くなることが確認された。
【0177】
一方、SNPsの識別においては、ループプライマーを用いてもループプライマーを用いない時と同様に、1塩基の違いを識別しながら増幅反応が起こっていることが確認された。ループプライマーの添加によって、特異性を犠牲にすることなく反応速度を大幅に向上させることが確認できた。
【0178】
実施例6.ループプライマーを用いた検討2
−ヒトp450CYP2C19遺伝子における特異性の検討−
鋳型として類似する塩基配列からなるDNAを100倍量用いて、ループプライマーを応用した場合の本発明による変異検出方法の特異性を検討した。ヒトp450CYP2C19を6000分子に代えて、600000分子のヒトp450CYP2C9遺伝子およびヒトp450CYP2C18遺伝子を鋳型としてチューブに加えた他は実施例5と同じ条件で反応させた。
【0179】
結果は図16に示したとおりである。野生型用プライマーセットでは、CYP2C19WT DNA 6000分子で増幅が見られたのに対して、CYP2C9、CYP2C18遺伝子では600000分子でも増幅は観察されなかった。同様に変異型用プライマーセットにおいても、CYP2C19MUT DNA 6000分子で増幅が見られたのに対して、CYP2C9、CYP2C18遺伝子では600000分子でも増幅は観察されなかった。以上の結果より、ループプライマーを応用した場合であっても、本発明による変異検出方法は、相互に類似する塩基配列からなる遺伝子群の中でも、目的とする塩基配列を類似する塩基配列から識別することができ、しかも目的とする変異は正確に検出できることが示された。
【0180】
実施例7.血液検体を用いた検討
ボランティアより提供された血液(35検体)から、QIAamp DNA Blood Kit (キアゲン)を用いてDNAを抽出した。抽出したDNAは、特開平10-14585に記載されているプライマー配列を用いてヒトp450CYP2C19遺伝子のm1領域をPCRにより増幅した。増幅は、Z-Taq ポリメラーゼ(宝酒造)を用いてZ-Taq用のプロトコールに準じて行った。
【0181】
得られたPCR産物をPCR-RFLPにより解析した。操作は以下のとおりである。まずPCR産物3μLを制限酵素Msp Iで37℃3時間消化し、4%アガロースゲル(Amplisize Agarose,BIO-RAD)で電気泳動した。泳動後、ゲルをSYBR-Green I(FMC)で染色し、DNAのバンドのパターンを検出することによりm1領域のタイピングを行った。
【0182】
このうち、m1領域について野生型ホモ(WT/WT)、野生型/変異型ヘテロ(WT/MUT)、および変異型ホモ(MUT/MUT)を各3検体、合計9検体について本発明に基づく変異の検出方法によって解析した。用いた9検体については、PCR産物の塩基配列を決定し、PCR-RFLPによるタイピング結果が正しい事を確認した。実施例5に記載のプロトコルにしたがって、本発明による変異の検出方法を実施した。ただし、検体DNAは計算上血液1μL分より抽出された量を用いた。すなわち、7mlの血液から抽出したDNAの1/7000を検体DNAとして加えた。
【0183】
その結果、本発明による変異の検出方法の結果は、9検体全てでPCR-RFLPの結果と一致した。このうち、検体No.10(PCR-RFLPの結果WT/WT)、検体No.11(PCR-RFLPの結果WT/MUT)、検体No.8(PCR-RFLPの結果MUT/MUT)についての反応を図17に示した。
【0184】
野生型ホモ(WT/WT)検体では野生型(WT)用プライマーセットでのみ増幅反応が起こり、変異型(MUT)用のプライマーでは増幅反応が起きなかった。ヘテロ(WT/MUT)検体では野生型(WT)用、変異型(MUT)用の両方のプライマーセットで同じ様に遺伝子が増幅された。変異型ホモ(MUT/MUT)検体では変異型(MUT)用のプライマーでのみ増幅反応が起き、野生型(WT)用プライマーでは増幅反応は起こらなかった。このことは、野生型用と変異型用のプライマーセットを組み合わせて反応させることによって、次のようなマトリクスに基づいて、ホモとヘテロを容易に判定できることを示している。
【0185】
野生型 変異型
野生型ホモ + −
変異型ホモ − +
ヘテロ + +
【0186】
さらに増幅された核酸については、塩基配列を決定し、CYP2C19遺伝子であることを確認した。血液に由来する検体DNA中では、CYP2C19遺伝子の他にCYP2C9、CYP2C18等の類似配列が多数混在するが、そのような類似配列存在下でも、目的とするCYP2C19遺伝子のみを特異的に増幅し、かつ、1塩基の違いを識別するという反応が一回の増幅反応でおこなえた。従って類似配列が多数存在する遺伝子のSNPタイピングが一回の増幅反応の有無のみで判定できる事が確認された。
【技術分野】
【0001】
本発明は、塩基配列の変異や多型の検出方法に関する。
【背景技術】
【0002】
遺伝子領域における変異は、翻訳アミノ酸の変化を伴うミスセンス変異、アミノ酸の変化を伴わないサイレント変異、更に塩基の欠質や挿入によって翻訳フレームがずれるフレームシフト変異などの原因となる可能性がある。ミスセンス変異には、誤った位置にストップコドンが生じてしまうナンセンス変異が含まれる。また、遺伝子領域における変異は、スプライシングの異常等を通じて遺伝子の翻訳異常につながる可能性もある。サイレント変異以外の変異は、タンパク質の構造的な、あるいは機能的な変化を伴うケースが多い。
更に、発現調節領域の異常は、タンパク質の発現調節機構に影響を与える恐れがある。
【0003】
さて、核酸の塩基配列上の差異のうち、ある集団内で1%以上の頻度で存在する変異は、特に多型と呼ばれている。集団とは、地理的な隔離や亜種によって区別される集団を意味する。例えば日本人では1%に満たない変異であっても、他の人種で1%以上の頻度で見出されれば、変異ではなく多型である。
【0004】
多型の中でも、一塩基の挿入、欠失、置換による多型は、特に一塩基多型(以下、SNPs;single nucleotide polymorphismsと省略する)と呼ばれている。SNPsは、ヒトゲノムの中で最も出現頻度が高い多型であるため注目されている。
【0005】
多型は、一定の頻度で集団に広がっていることから、全く形質の変化を伴わないものか、特に生存(生殖)に不利な形質ではなく、いわば体質といえる形質を左右しているものと考えられる。たとえば、糖尿病、リュウマチ、アレルギー、自己免疫疾患、肥満、あるいは癌などの代表的な成人病に対する罹りやすさが遺伝的な特性に支配されているとすれば、多型によって決定されていると考えられる。その他、薬剤代謝やヒト白血球組織適合型抗原(以下、HLAと省略する)なども多型によって支配されている。そして、その多くはSNPsであることが明らかにされつつある。
【0006】
多型にはこのような特徴があることから、マイクロサテライト多型のように、染色体へのマッピングと連鎖解析などによって疾患関連遺伝子の絞り込みに用いられる。SNPsは、300〜600塩基に一つの割合で存在するため詳細なマップが得られ、遺伝子の絞り込みを容易にすることが期待されている。
【0007】
更に、多型の位置と変動に関する情報を集積し、ある表現型との関連性を解析することによって、多くの情報を得られる可能性があると期待されている。たとえば、薬剤に対する副作用に関連するSNPsを明らかにすることができれば、副作用を未然に防ぐことが可能となる。副作用の克服によって、実用化を諦めざるを得なかった多くの薬剤を、安全な薬剤として再評価できる可能性がある。
【0008】
細菌やウイルスの場合においても、C型肝炎ウイルス(以下、HCVと略する)のサブタイプ等は、一定の割合で共通して見出される塩基配列の特徴に基づく分類であることから、多型と考えることができる。変異解析のなかでも、これら多型の遺伝子型を調べることを目的とする場合を、タイピングと呼んでいる。
【0009】
HCVでは、αインターフェロンによる治療効果にサブタイプによる違いがあることから、タイピングの結果は治療方法の選択において重要な情報である。HCVのほか、インフルエンザ・ウイルス、マラリア、あるいはヘリコバクター・ピロリなども、サブタイプによって治療効果に違いのあることが明らかにされている病原体である。これらの病原体においても、タイピングは治療方針の決定における重要な情報を与える。
【0010】
多型に対して、1%未満で見出される変異は、人の場合は集団内で広がらない変異で、ほとんどが疾患にかかわるものといって良い。すなわち、遺伝病において見出される変異が相当する。また、個体内で見出される変異においても、癌等において見出される変異のように疾患にかかわるものがある。このような変異の検出は、対応する疾患の診断において決定的な情報を与える。
【0011】
ある遺伝子について、その塩基配列が予測された塩基配列と比較して相違しているのかどうかは、相補的な塩基配列のハイブリダイズによって確認できる。具体的には、プライマーやプローブのハイブリダイズが利用される。
【0012】
たとえばPCR用のプライマーは、標的塩基配列がプライマーに相補的な塩基配列を持つ場合にのみプライマーとして作用することができる。この原理に基づいて、PCRの増幅産物を指標として、標的塩基配列がプライマーに相補的であるかどうかを知ることができる。しかしPCRに基づく塩基配列の確認方法には、いくつかの問題点がある。第一に、プライマーによる塩基配列のチェック機構が不完全である。PCR法においても、1塩基の違いを増幅反応で検出する方法が考案されている(allele-specific PCR、Nucleic Acids Res 17:p25031989, Genomics 5:p535 1989, J. Lab. Clin. Med 114:p105 1989)。しかし、S.Kwokらが報告しているとおり(Nucleic Acids Res 18:p999 1990)、1塩基の違いのプライマーを用いた場合、完全に相補的なプライマーに比べて、増幅サイクルあたり約0.1%〜85%(配列の違いによって異なる)の反応が進行してしまう。言いかえれば、塩基配列がプライマーと完全に相補的な塩基配列でなくてもしばしば相補鎖の合成が起きてしまう。このため、allele-specific PCRで1塩基の違いを区別するためには、人為的にもう一カ所ミスマッチをいれる必要があるとされている。しかしこの場合も配列の違いにより厳密な条件設定が必要であり、汎用技術とはなっていない。したがって、通常の条件ではPCR法によってSNPsのような1塩基の相違を識別することは困難である。
【0013】
言いかえれば、相補的な塩基配列のハイブリダイズに基づいてわずかな塩基配列の相違を検出する方法は、誤りが起きる可能性を含んでいると言える。PCR法では、誤って生成された合成産物が完全な鋳型として機能するため、指数的な増幅をトリガーしてしまう。つまり、誤りが起きる可能性があるのにもかかわらず、誤った反応に基づいて高度な増幅が起きてしまう点が、わずかな塩基配列の識別においては問題となる。
【0014】
PCR法の第2の問題点として、その原理上プライマーが2つの領域にしか設定できないことが挙げられる。したがって、類似した塩基配列からなる複数の遺伝子が同一の試料中に存在する場合、各遺伝子における変異や多型をPCR法に基づく増幅生成物の有無を指標として確認することはきわめて困難である。ある遺伝子に変異が存在していたとしても、他方の遺伝子にプライマーがハイブリダイズすれば反応が進行してしまうためである。
【0015】
たとえばヒトCYP2C19のようなファミリー遺伝子においては、ある遺伝子の変異を検出するためのプライマーは、他の遺伝子に対してもプライマーとして作用してしまう。図6にヒトCYP2C19ファミリーに見出される互いに類似した塩基配列を示した。この図からわかるように、ある遺伝子の変異を検出するためのプライマーは、他の遺伝子の野生型においてプライマーとして作用してしまう。このような条件下では、2つの領域のみで、類似する遺伝子の識別と変異の検出とを同時に行うことは困難である。
【0016】
以上の2つの問題点より、PCRによる変異検出では、まず標的遺伝子をPCRにより特異的に増幅し、その後、プローブ、あるいはプライマーを用いて変異を検出するといういわゆるPCR依存型変異検出技術が多数報告されている。その中でも、DNAチップ法は特に注目されている検出技術である。DNAチップ上には、数多くの類似する塩基配列を微小な区画に整列させることができる。DNAチップ上では、微細な空間の反応環境を制御することによって、わずかな塩基配列の相違に基づくハイブリダイズの有無を、検出できるとされている。しかし現実には、解析データの再現性が最大の課題とされている。DNAチップ上でのハイブリダイズの条件は、反応空間が微細なために、繊細な条件設定が求められる。一定の水準で再現性を維持するには、高度な技術と、細心の注意が要求される。さらに、PCR依存技術であるため大きく分けて2工程が必要であること、加えて、現状ではDNAチップの価格が高いことも、解決が望まれる課題である。
【0017】
一方、PCR非依存型変異検出技術としては、Invader法(Mol Diagn. 4:p135 1999)や、RCA法(Nat Genet 19:p225 1998)が報告されている。しかし、いずれの方法も、その反応特異性は近接する2つの領域に設定されたプローブに依存している。PCRについて指摘したように2つの領域のみで、類似する遺伝子の識別と変異の検出とを同時に行うことは困難である。
【0018】
以上のように、公知の塩基配列の確認方法は、一工程でわずかな塩基配列を正確に識別することができない、あるいは類似する遺伝子の識別と変異の検出とを同時に行うことが困難であるという問題点があった。また、PCR依存技術のように技術的には類似する遺伝子の識別と変異の検出を行うことが可能であっても、精度の維持が困難であったり、複数の工程が必要なために煩雑な操作が必要となっていた。加えて、経済性の面でも改善が望まれていた。
【発明の概要】
【発明が解決しようとする課題】
【0019】
本発明の課題は、類似する遺伝子の識別と、わずかな塩基配列の相違の正確な検出を同時に達成することができる新規な反応原理を提供することである。より具体的には、相補鎖合成の過程において、標的塩基配列における塩基配列を繰り返しチェックすることが可能な核酸の合成方法を利用して、標的塩基配列における変異や多型を検出することができる方法の提供が本発明の課題である。
【課題を解決するための手段】
【0020】
発明者らは、公知の核酸増幅反応に基づく塩基配列の確認方法の問題点として、大部分のプライマーが標的塩基配列にハイブリダイズできなくなる点に着目した。すなわちPCR法においては、プライマーに由来する塩基配列がそのまま鋳型として相補鎖合成に利用される。したがってプライマーのハイブリダイズによる標的塩基配列のチェック機構が働くのは、事実上、反応全体のごく一部にすぎない。反応の大部分は、単にプライマーの塩基配列を写し取った相補鎖に対してプライマーがハイブリダイズすることによって進行している。これでは、標的塩基配列のチェックを行っているとは言いがたい。
【0021】
そこで本発明者らは、プライマーではなく、標的塩基配列に由来する塩基配列に対してハイブリダイズする工程を多く含む核酸の合成反応を利用すれば、標的塩基配列のわずかな塩基配列の相違を正確に検出できると考えた。そして本発明者らは、標的塩基配列に対するより厳密なチェック機構が、相補鎖合成を完了した3'末端を次の相補鎖合成の起点として利用することによって達成できることを見出し、本発明を完成した。
【0022】
より具体的には、塩基配列の識別のためのプライマーが相補鎖合成によって初めてもたらされ、しかもこのプライマーが自身を鋳型とする相補鎖合成の起点となる核酸の合成方法に基づいて、高度なチェック機構が実現できることを見出した。このような核酸の合成反応は、本発明者らが既に報告している(Nucleic Acid Res. 2000 Vol.28 No.12 e63、WO 00/28082)。本発明は、この核酸の合成方法に基づいて前記課題の解決を達成した。即ち本発明は、以下の変異および/または多型の検出方法、ならびにそのための試薬キットに関する。
【0023】
〔1〕次の要素を、第2および第1のプライマーを起点とする相補鎖合成が可能な条件下でインキュベートし、標的塩基配列を鋳型とする相補鎖合成反応生成物の量と特定の領域の変異および/または多型の存在と関連付ける工程を含む、標的塩基配列における特定の領域の変異および/または多型の検出方法であって、第2および第1のプライマーの少なくとも一方の5'末端に配置された塩基配列が、前記特定の領域、またはその相補鎖の予測される塩基配列に相補的な塩基配列を含み、この5'末端に配置された塩基配列を鋳型として合成された相補鎖は、特定の領域、またはその相補鎖にアニールして相補鎖合成の起点となるとき、特定の領域を構成する塩基配列が予測していたものでなかった場合に、相補鎖合成が阻害されることを特徴とする方法。
(a)標的塩基配列を含む核酸試料、
(b)鎖置換を伴う相補鎖合成を触媒することができるDNAポリメラーゼ、
(c)第2のプライマー;ここで第2のプライマーはその3'末端において前記標的塩基配列を構成する一方の鎖の3'側を規定する領域に対してアニールすることができ、かつ第2のプライマーの5'側には、このプライマーを起点とする相補鎖合成反応生成物上の領域を構成する予測される塩基配列に相補的な塩基配列を備える、
(d)第1のプライマー;ここで第1のプライマーはその3'末端において前記標的塩基配列を構成する他方の鎖の3'側を規定する領域に対してアニールすることができ、かつ第1のプライマーの5'側には、このプライマーを起点とする相補鎖合成反応生成物上の領域を構成する予測される塩基配列に相補的な塩基配列を備える、
(e)ヌクレオチド基質。
【0024】
〔2〕第2のプライマー、および第1のプライマーが、いずれもその5'末端に配置された塩基配列が、前記特定の領域、またはその相補鎖の予測される塩基配列に相補的な塩基配列を含み、この5'末端に配置された塩基配列を鋳型として合成された相補鎖は、特定の領域、またはその相補鎖にアニールして相補鎖合成の起点となるとき、特定の領域を構成する塩基配列が予測していたものでなかった場合に、相補鎖合成が阻害されることを特徴とする〔1〕に記載の方法。
【0025】
〔3〕更に付加的に次の要素を存在させる〔1〕に記載の方法。
・第3のプライマー;ここで第3のプライマーは、鋳型における第1のプライマーがアニールすべき領域の3'側を起点とする相補鎖合成反応の起点となる、および
・第4のプライマー;ここで第4のプライマーは、鋳型における第2のプライマーがアニールすべき領域の3'側を起点とする相補鎖合成反応の起点となる。
【0026】
〔4〕標的塩基配列の塩基配列と類似する塩基配列を含む遺伝子が同じ試料中に存在する可能性があるものである〔1〕に記載の方法。
〔5〕標的塩基配列の塩基配列と類似する塩基配列を含む遺伝子が、ファミリー遺伝子および/または擬似遺伝子である〔4〕に記載の方法。
【0027】
〔6〕ファミリー遺伝子および/または擬似遺伝子が、チトクロムP450ファミリー、ヒト白血球組織適合型抗原、および血小板同種抗原からなる群から選択されるいずれかの遺伝子である〔5〕に記載の方法。
【0028】
〔7〕多型が1塩基多型である〔1〕に記載の方法。
〔8〕標的塩基配列が、C型肝炎ウイルス、インフルエンザウイルス、マラリア、およびヘリコバクター・ピロリからなる群から選択されるいずれかの病原性ウイルスまたは病原性微生物の遺伝子の塩基配列から選択される〔1〕に記載の方法。
【0029】
〔9〕融解温度調整剤の存在下でインキュベートする〔1〕に記載の方法。
〔10〕融解温度調整剤が、ベタイン、プロリン、およびジメチルスルホキシドから選択される少なくとも1つの化合物である〔9〕に記載の方法。
【0030】
〔11〕核酸試料が2本鎖の形態である〔1〕に記載の方法。
〔12〕核酸の検出剤存在下で〔1〕に記載の方法を行い、検出剤のシグナル変化に基づいて変異および/または多型の存在を検出することを特徴とする〔1〕に記載の方法。
【0031】
〔13〕変異および/または多型を検出すべき生物と同一の生物に由来し、変異および/または多型を伴わないことが明らかな塩基配列を内部標準として利用し、両者を鋳型とする合成生成物の量の比較によって、変異および/または多型の存在を検出することを特徴とする〔1〕に記載の方法。
【0032】
〔14〕更に次の要素(f)および/または(g)を存在させる〔1〕に記載の方法。
(f)第1のループプライマー;ここで第1のループプライマーは、第1のプライマーの伸長生成物における第1のプライマーに由来する領域と、第1のプライマーに対する前記任意の領域の間において相補鎖合成の起点を与えることができるものである、
(g)第2のループプライマー;ここで第2のループプライマーは、第2のプライマーの伸長生成物における第2のプライマーに由来する領域と、第2のプライマーに対する前記任意の領域の間において相補鎖合成の起点を与えることができるものである。
【0033】
〔15〕前記特定の領域を構成する塩基配列が予測された塩基配列でなかった場合に、第1のプライマーおよび/または第2のプライマーの5'末端に配置された塩基配列を鋳型として合成された相補鎖が、特定の領域、またはその相補鎖にアニールするとき、当該相補鎖の3'末端から2〜4番目の塩基においてミスマッチを生じることを特徴とする〔1〕に記載の方法。
【0034】
〔16〕次の要素を含む、標的塩基配列における特定の領域の変異および/または多型の検出用キットであって、第2および第1のプライマーの少なくとも一方の5'末端に配置された塩基配列が、前記特定の領域、またはその相補鎖の予測される塩基配列に相補的な塩基配列を含み、この5'末端に配置された塩基配列を鋳型として合成された相補鎖は、特定の領域、またはその相補鎖にアニールして相補鎖合成の起点となるとき、特定の領域を構成する塩基配列が予測していたものでなかった場合に、相補鎖合成が阻害されることを特徴とするキット。
i)第2のプライマー;ここで第2のプライマーはその3'末端において前記標的塩基配列を構成する一方の鎖の3'側を規定する領域に対してアニールすることができ、かつ第2のプライマーの5'側には、このプライマーを起点とする相補鎖合成反応生成物上の領域を構成する予測される塩基配列に相補的な塩基配列を備えるものであり、
ii)第1のプライマー;ここで第1のプライマーはその3'末端において前記標的塩基配列を構成する他方の鎖の3'側を規定する領域に対してアニールすることができ、かつ第1のプライマーの5'側には、このプライマーを起点とする相補鎖合成反応生成物上の領域を構成する予測される塩基配列に相補的な塩基配列を備えるものである、
iii) 鎖置換を伴う相補鎖合成を触媒することができるDNAポリメラーゼ、
iv)ヌクレオチド基質。
【0035】
〔17〕更に次の要素を含む〔16〕に記載のキット。
v)鋳型における第1のプライマーがアニールすべき領域の3'側にアニールして相補鎖合成の起点となることができる第3のプライマー、および
vi)鋳型における第2のプライマーがアニールすべき領域の3'側にアニールして相補鎖合成の起点となることができる第4のプライマー。
【0036】
〔18〕更に次の要素を含む〔16〕に記載のキット。
vii)内部標準を増幅することができる第5のプライマー;ここで第5のプライマーは、その3'末端において内部標準の標的塩基配列を構成する一方の鎖の3'側を規定する領域に対してアニールすることができ、かつ第5のプライマーの5'側には、このプライマーを起点とする相補鎖合成反応生成物の任意の領域を構成する塩基配列に相補的な塩基配列を備えるものであり、そして
iix)内部標準を増幅することができる第6のプライマー;ここで第6のプライマーはその3'末端において内部標準の標的塩基配列を構成する一方の鎖の3'側を規定する領域に対してアニールすることができ、かつ第6のプライマーの5'側には、このプライマーを起点とする相補鎖合成反応生成物の領域を構成する塩基配列に相補的な塩基配列を備えるものである。
【0037】
〔19〕更に次の要素を含む〔18〕に記載のキット。
ix)鋳型における第5のプライマーがアニールすべき領域の3'側にアニールして相補鎖合成の起点となることができる第7のプライマー、および
x)鋳型における第6のプライマーがアニールすべき領域の3'側にアニールして相補鎖合成の起点となることができる第8のプライマー。
【0038】
〔20〕以下の工程を含む標的塩基配列の特定の領域における変異および/または多型の検出方法であって、第2および第1のプライマーの少なくとも一方の5'末端に配置された塩基配列が、前記特定の領域、またはその相補鎖の予測される塩基配列に相補的な塩基配列を含み、この5'末端に配置された塩基配列を鋳型として合成された相補鎖は、特定の領域、またはその相補鎖にアニールして相補鎖合成の起点となるとき、特定の領域を構成する塩基配列が予測していたものでなかった場合に、相補鎖合成が阻害されることを特徴とする方法。
a)標的塩基配列に第1のプライマーをアニールさせ、これを起点とする相補鎖合成反応を行う工程;ここで第1のプライマーはその3'末端において前記標的塩基配列を構成する一方の鎖の3'側を規定する領域に対してアニールすることができ、かつ第1のプライマーの5'側には、このプライマーを起点とする相補鎖合成反応生成物上の領域を構成する予測される塩基配列に相補的な塩基配列を備える、
b)工程a)で合成された第1のプライマーの伸長産物における第2のプライマーがアニールすべき領域を塩基対結合が可能な状態とし、両者をアニールさせて第1のプライマーの伸長産物を鋳型とする相補鎖合成を行う工程;ここで第2のプライマーはその3'末端において前記標的塩基配列を構成する他方の鎖の3'側を規定する領域に対してアニールすることができ、かつ第2のプライマーの5'側には、このプライマーを起点とする相補鎖合成反応生成物上の領域を構成する予測される塩基配列に相補的な塩基配列を備える、
c)第2のプライマーの伸長生成物の3'末端と、該伸長生成物における第1のプライマーに対する前記予測される塩基配列をアニールさせて自身を鋳型とする相補鎖合成を行う工程、
d)工程c)で合成された相補鎖における3'末端と、該伸長生成物における第2のプライマーに対する前記予測される塩基配列をアニールさせて自身を鋳型とする相補鎖合成を行う工程、
e)第2のプライマーを起点とする合成生成物の量を特定の領域における変異および/または多型の存在と関連付ける工程。
【0039】
〔21〕工程b)が、鋳型における鋳型における第1のプライマーがアニールすべき領域の3'側を起点とする第3のプライマーの相補鎖合成反応による置換によって第1のプライマーの伸長生成物を1本鎖とする工程を含む〔20〕に記載の方法。
【0040】
〔22〕工程c)が、鋳型における第2のプライマーがアニールすべき領域の3'側を起点とする第4のプライマーの相補鎖合成反応による置換によって第2のプライマーの伸長生成物を1本鎖とする工程を含む〔20〕に記載の方法。
【0041】
〔23〕更に以下の工程を含む〔20〕に記載の方法であって、第2および第1のプライマーの少なくとも一方の5'末端に配置された塩基配列が、前記特定の領域、またはその相補鎖の予測される塩基配列に相補的な塩基配列を含み、この5'末端に配置された塩基配列を鋳型として合成された相補鎖は、特定の領域、またはその相補鎖にアニールして相補鎖合成の起点となるとき、特定の領域を構成する塩基配列が予測していたものでなかった場合に、相補鎖合成が阻害されることを特徴とする方法。
1)〔20〕に記載の方法において、工程c)の3'末端と自身の前記予測される塩基配列とのアニールによって、第1のプライマーの3'末端に相補的な塩基配列を含む塩基対結合が可能なループ形成領域を形成するとともに、自身の3'末端を相補鎖合成の起点とし、自身を鋳型とする相補鎖合成反応を行う工程、
2)ループ形成領域に第1のプライマーをアニールさせて、鎖置換を伴う相補鎖合成を触媒することができるDNAポリメラーゼによりそれを起点とする相補鎖合成を行う工程、
3)ループ形成領域にアニールするプライマーを起点とする相補鎖合成反応によって、自身の3'末端からの伸長生成物を置換し、その3'末端と前記予測される塩基配列を再び塩基対結合が可能な状態とする工程、
4)工程3)によって塩基対結合が可能となった3'末端を前記予測される塩基配列にアニールさせて相補鎖合成の起点とし、自身を鋳型とする相補鎖合成反応を行うことによって、ループ形成領域を起点として合成された相補鎖を置換して1本鎖の核酸を生成する工程、
5)3'末端の第2のプライマーに対する前記予測される塩基配列に対するアニールと相補鎖合成によって、第2のプライマーの3'末端に相補的な塩基配列を含む塩基対結合が可能なループ形成領域を形成する工程、
6)ループ形成領域に第2のプライマーをアニールさせて、鎖置換を伴う相補鎖合成を触媒することができるDNAポリメラーゼによりそれを起点とする相補鎖合成を行う工程、
7)工程3)−6)を繰り返す工程、および
8)工程7)の後に、および/または工程7)と並行して標的塩基配列とその相補鎖とが繰り返し連結された1本鎖核酸の生成を観察し、その生成量を変異および/または多型と関連付ける工程。
【0042】
〔24〕更に次の工程を含む〔23〕に記載の方法。
9)工程4)で生成する1本鎖の核酸の3'末端を第2のプライマーに対する前記予測される塩基配列にアニールさせて、第2のプライマーの3'末端に相補的な塩基配列を含む塩基対結合が可能なループ形成領域を形成するとともに、自身の3'末端を相補鎖合成の起点とし、自身を鋳型とする相補鎖合成反応を行う工程、予測される塩基配列、
10)3'末端と自身の前記特定の領域とのアニールによって形成された、ループ形成領域に第2のプライマーをアニールさせて、鎖置換を伴う相補鎖合成を触媒することができるDNAポリメラーゼによりそれを起点とする相補鎖合成を行う工程、
11)ループ形成領域にアニールするプライマーを起点とする相補鎖合成反応によって、自身の3'末端からの伸長生成物を置換し、その3'末端と前記予測される塩基配列を再び塩基対結合が可能な状態とする工程、
12)工程11)によって塩基対結合が可能となった3'末端を前記予測される塩基配列にアニールさせて相補鎖合成の起点とし、自身を鋳型とする相補鎖合成反応を行うことによって、ループ形成領域を起点として合成された相補鎖を置換して1本鎖の核酸を生成する工程、
13)3'末端の前記予測される塩基配列に対するアニールと相補鎖合成によって、第1のプライマーの3'末端に相補的な塩基配列を含む塩基対結合が可能なループ形成領域を形成する工程、
14)ループ形成領域に第1のプライマーをアニールさせて、鎖置換を伴う相補鎖合成を触媒することができるDNAポリメラーゼによりそれを起点とする相補鎖合成を行う工程、
15)工程11)−14)を繰り返す工程、および
16)工程15)の後に、および/または工程15)と並行して標的塩基配列とその相補鎖とが繰り返し連結された1本鎖核酸の生成を観察し、その生成量を変異および/または多型と関連付ける工程。
【0043】
〔25〕更に次の工程を含む〔24〕に記載の方法。
17)工程12)において生成する1本鎖の核酸の3'末端を自身の前記予測される塩基配列にアニールさせて、第1のプライマーの3'末端に相補的な塩基配列を含む塩基対結合が可能なループ形成領域を形成するとともに、自身の3'末端を相補鎖合成の起点とし、自身を鋳型とする相補鎖合成反応を行う工程。
【0044】
〔26〕第2のプライマー、および第1のプライマーが、いずれもその5'末端に配置された塩基配列が、前記特定の領域、またはその相補鎖の予測される塩基配列に相補的な塩基配列を含み、この5'末端に配置された塩基配列を鋳型として合成された相補鎖は、特定の領域、またはその相補鎖にアニールして相補鎖合成の起点となるとき、特定の領域を構成する塩基配列が予測していたものでなかった場合に、相補鎖合成が阻害されることを特徴とする〔20〕に記載の方法。
【発明の効果】
【0045】
本発明によって、標的塩基配列が予測する塩基配列と異なっているかどうかを、正確に識別することができる。本発明の方法は、核酸の変異や多型の解析に有用である。この方法は、簡単な酵素的な反応に基づいている。したがって、特殊な機器や、反応成分を必要とせず、安価に、しかも容易に実施することができる。
【0046】
また本発明による変異や多型の検出方法は、標的塩基配列の増幅を伴う反応を伴っているので、塩基配列の識別結果を核酸の増幅反応生成物の量を指標として検出できる。その結果、感度と再現性の高い塩基配列の解析が可能となる。しかも本発明で用いる反応原理は、相補鎖合成の開始が繰り返し標的塩基配列のチェックを経て進行している。そのため、たとえ誤った相補鎖合成が起きたとしても、その反応が最終的な解析結果に影響を与えることがない。公知の遺伝子増幅反応であるPCR法では、いったん誤った相補鎖合成が起きてしまうと、正確な判定を行えなくなってしまうため、このような解析には現実には応用することができない。プライマーのハイブリダイズに基づく塩基配列のチェック機構には、常に一定の誤りを伴うことは、いわば宿命的な特性である。本発明では、核酸の相補鎖合成における誤りの影響を常に最小限にすると同時に、正確な反応に基づく生成物のみが多量に蓄積するという、高いS/N比を現実のものとした。したがって、本発明は、核酸の増幅反応による塩基配列の識別方法をはじめて現実的なものとした先駆的な発明と言うことできる。
【0047】
更に、複数の領域によって反応の進行が制御されるという本発明の特徴は、類似する塩基配列を含む複数の遺伝子が存在する条件の基での、わずかな塩基配列の相違の検出において有用である。この特徴に基づいて、本発明は、HLAや血小板同種抗原、あるいは病原微生物のタイピングを正確に、そして簡便に行うことができる。また、薬剤代謝酵素の活性に関連するSNPsの検出も、本発明によって容易に行うことができる。
【図面の簡単な説明】
【0048】
【図1】図1は、本発明の望ましい態様の反応原理の一部(1)-(2)を示す模式図である。
【図2】図2は、本発明の望ましい態様の反応原理の一部(3)-(5)を示す模式図である。
【図3】図3は、本発明の望ましい態様の反応原理の一部(6)-(8)を示す模式図である。
【図4】図4は、本発明の望ましい態様の反応原理の一部(9)-(11)を示す模式図である。
【図5】図5は、本発明による1本鎖核酸が形成するループの構造を示す模式図である。
【図6】図6は、ヒトCYP2C19ファミリーに見出される互いに類似した塩基配列を示す図である。
【図7】図7は、実施例においてSNPsの検出を行った標的塩基配列と、標的塩基配列におけるプライマーの位置関係を示す図である。
【図8】図8は、本発明による変異の検出方法の結果を示す写真である。各レーンは、標的テンプレート:特定の領域が予測される塩基配列であった場合、一塩基違いテンプレート:予測される塩基配列と1塩基相違していた場合、そして対照としてのプライマーのみの場合:テンプレート無しを示している。
【図9】図9は、本発明による変異の検出方法の結果を示すグラフである。図中、縦軸は蛍光強度を、横軸は反応時間(時間)を示す。−■−:ターゲットなし、−○−:m1、−●−:WT。
【図10】図10は、実施例3においてSNPsの検出を行った標的塩基配列と、標的塩基配列におけるプライマーの位置関係を示す図である。
【図11】図11は、本発明による変異検出方法の結果を示すグラフである。a)は野生型(WT)用プライマーセットを、そしてb)は変異型(MUT)用プライマーセットを各鋳型DNAと反応させた結果を示す。図中、縦軸は蛍光強度を、横軸は反応時間(分)を示す。−●−:野生型(WT)、−○−:変異型(MUT)、―▲―:DNAなし。
【図12】図12は、本発明による変異検出方法の結果を示す写真である。各レーンは、野生型(WT)用プライマーセット、および変異型(MUT)用プライマーセットを各鋳型DNAと反応させた結果を示す。DNAなし:鋳型DNA無し、MUT DNA:変異型のCYP2C19遺伝子が鋳型、WT DNA:野生型のCYP2C19遺伝子が鋳型。
【図13】図13は、本発明による変異検出方法の特異性を検討した結果を示すグラフである。a)は野生型(WT)用プライマーセットを、そしてb)は変異型(MUT)用プライマーセットを各鋳型DNAと反応させた結果を示す。図中、縦軸は蛍光強度を、横軸は反応時間(分)を示す。―◆―:DNAなし、―▲―:CYP2C9遺伝子、―×―:CYP2C18遺伝子、−●−:CYP2C19野生型(WT)、−○−:CYP2C19変異型(MUT)。
【図14】図14は、実施例5においてSNPsの検出を行った標的塩基配列と、標的塩基配列におけるプライマーの位置関係を示す図である。
【図15】図15は、ループプライマーを応用した本発明による変異検出方法の結果を示すグラフである。a)は野生型(WT)用プライマーセットを、そしてb)は変異型(MUT)用プライマーセットを各鋳型DNAと反応させた結果を示す。図中、縦軸は蛍光強度を、横軸は反応時間(分)を示す。−●−:野生型(WT)、−○−:変異型(MUT)、―▲―:DNAなし。
【図16】図16は、ループプライマーを応用した本発明による変異検出方法の特異性を検討した結果を示すグラフである。a)は野生型(WT)用プライマーセットを、そしてb)は変異型(MUT)用プライマーセットを各鋳型DNAと反応させた結果を示す。図中、縦軸は蛍光強度を、横軸は反応時間(分)を示す。―◆―:DNAなし、―▲―:CYP2C9遺伝子、―×―:CYP2C18遺伝子、−●−:CYP2C19野生型(WT)、−○−:CYP2C19変異型(MUT)。
【図17】図17は、ループプライマーを応用した本発明による変異検出方法によって血液検体の変異を検出した結果を示すグラフである。検体No.10は野生型ホモ(WT/WT)、検体No.11は野生型/変異型ヘテロ(WT/MUT)、そして検体No.8は変異型ホモ(MUT/MUT)である。図中、縦軸は蛍光強度を、横軸は反応時間(分)を示す。−●−:野生型(WT)用プライマー、−○−:変異型(MUT)用プライマー。
【発明を実施するための形態】
【0049】
[用語の定義]
本発明において、以下の用語はそれぞれ次のような意味で用いられる。
変異:本発明において、変異とは、起源を同一とする生物(ウイルスを含む)個体間に見られる核酸塩基配列の差異をいう。多細胞生物においては個体内での器官や細胞などの間に見られる差異も変異に含まれる。変異は、点変異、欠質、挿入、重複、逆位、転座によって生じる。また、変異は遺伝子領域(タンパク質のコード領域およびイントロン配列)に生じることもあれば、プロモーターやエンハンサーのような発現調節領域に生じる場合もある。あるいは、それ以外のゲノム配列上に見いだされる塩基配列の差異も変異に含むものとする。
【0050】
多型:上記変異のうち、ある集団内で1%以上の頻度で存在するものを特に多型と呼ぶ。多型の中でも、特に1塩基の置換、挿入、あるいは欠失からなる多型を、1塩基多型(Single Nucleic Polymorphism;SNPs)と呼ぶ。
【0051】
標的塩基配列:標的塩基配列は、検出すべき変異や多型が含まれる塩基配列であって、プライマーによって3'側が規定された領域を構成する塩基配列を意味する。以下本明細書において単に5'側、あるいは3'側と表現するときには、いずれも鋳型となっている方の鎖における方向を意味している。言いかえれば、本発明におけるプライマーがアニールする領域に挟まれて存在する塩基配列が、本発明における標的塩基配列を構成する。一般に核酸の塩基配列は、5'側から3'側に向けてセンス鎖の塩基配列を記載する。本発明における標的塩基配列とは、センス鎖の塩基配列に加えて、その相補鎖、すなわちアンチセンス鎖の塩基配列も含む。すなわち、用語「標的塩基配列」とは、合成すべき塩基配列、およびその相補鎖の少なくともいずれかを意味する用語として用いる。標的塩基配列は、後に述べる特定の領域を含んでいる。
【0052】
特定の領域:前記標的塩基配列に含まれ、検出すべき変異や多型が存在する領域が、特定の領域である。本発明の検出方法においては、特定の領域に予測される塩基配列に相補的な塩基配列を5'側に付加した相補鎖が合成される。なお特定の領域に相補的な塩基配列は、合成される相補鎖の5'末端を構成するように付加しなければならない。
【0053】
予測される塩基配列:予測される塩基配列とは、野生型の塩基配列であることもできるし、特定の変異を含む塩基配列を予測される塩基配列として用いることもできる。予測される塩基配列に野生型の塩基配列を用いた場合は、標的塩基配列中の野生型塩基配列の有無が見出されることになり、予測される塩基配列に特定の変異や多型の塩基配列を用いれば、標的塩基配列中の特定の変異や多型の塩基配列の有無が検出される。
【0054】
3'末端、あるいは5'末端:3'末端、あるいは5'末端とは、単にいずれかの末端の1塩基のみならず、末端の1塩基を含み、かつ末端に位置する領域を意味する。より具体的には、いずれかの末端から500塩基、望ましくは100塩基、あるいは少なくとも20塩基は、3'末端、あるいは5'末端に含まれる。これに対して、末端の1塩基や末端付近に存在する特定の位置の塩基を示すためには、その位置を数値で特定することによって示すものとする。
【0055】
鋳型と相補鎖:本発明において用いられる鋳型という用語は、相補鎖合成の鋳型となる側の核酸を意味する。鋳型に相補的な塩基配列を持つ相補鎖は、鋳型に対応する鎖としての意味を持つが、両者の関係はあくまでも相対的なものに過ぎない。すなわち、相補鎖として合成された鎖は、再び鋳型として機能することができる。つまり、相補鎖は鋳型になることができる。
【0056】
核酸の合成(synthesis)と増幅(amplification):本発明における核酸の合成とは、合成起点となったオリゴヌクレオチドからの核酸の伸長を意味する。合成に加えて、更に他の核酸の生成と、この生成された核酸の伸長反応とが連続して起きるとき、一連の反応を総合して増幅という。
【0057】
アニール:「アニール」と「ハイブリダイズ」は、核酸がワトソン−クリックのモデルに基づく塩基対結合によって2重らせん構造(double helix structure)を形成することを意味する。したがって、塩基対結合を構成する核酸鎖が1本鎖であっても、分子内の相補的な塩基配列が塩基対結合を形成すれば、アニール、あるいはハイブリダイズである。本発明において、アニールとハイブリダイズは、核酸が塩基対結合による2重らせん構造を構成する点で同義である。塩基対結合した3'末端が相補鎖合成の起点となるときに、特にアニールという場合がある。ただし、ハイブリダイズが相補鎖合成の起点となることを否定するものではない。
【0058】
実質的に同じ塩基配列:ある配列を鋳型として合成された相補鎖が、目的の塩基配列に対してアニールし相補鎖合成の起点を与えるとき、このある配列は目的の塩基配列に対して実質的に同一である。本発明において同一、あるいは相補的という用語は、いずれも完全に同一でない場合、あるいは完全に相補的でない場合を含む。すなわち、ある配列と同一とは、ある配列に対してアニールすることができる塩基配列に対して相補的な配列をも含むことができる。他方、相補的とは、ストリンジェントな条件下でアニールすることができ、相補鎖合成の起点となる3'末端を提供することができる配列を意味する。具体的には、ある塩基配列に対して、一般に50−100%、通常は70−100%、好ましくは80−100%の同一性を有する塩基配列は、実質的に同一と言うことができる。同一性はBLAST等の公知のアルゴリズムに基づいて決定することができる。
【0059】
[原理の説明]
本発明による変異や多型の検出方法は、次のような原理に基づいて標的塩基配列における特定の領域の塩基配列チェック機構を実現している。まず本発明においては、下記第2のプライマーおよび第1のプライマーを用いる。本発明に用いる第2のプライマーと第1のプライマーは、それぞれその3'末端に標的塩基配列の3'側の塩基配列に対してアニールすることができる塩基配列を備え、かつ5'末端には、その3'末端を起点とする伸長生成物における任意の領域に相補的な塩基配列を配置する。そして第2および第1のプライマーの少なくとも一方の5'末端に配置された塩基配列が、前記特定の領域、またはその相補鎖の予測される塩基配列に相補的な塩基配列を含むようにする。プライマーの5'末端に配置された塩基配列を鋳型として合成された相補鎖は、特定の領域、またはその相補鎖にアニールして相補鎖合成の起点となるとき、特定の領域を構成する塩基配列が予測していたものでなかった場合に、相補鎖合成が阻害されることを利用して、塩基配列がチェックされる。3'末端が特定の領域(またはその相補鎖)にアニールして相補鎖合成の起点となるときには、常にチェック機構が働くことから、特定の領域の塩基配列の相違を反応生成物の量の差として明瞭に検出することができる。
【0060】
以上のような反応原理に基づいて実際に変異および/または多型の検出を行うには、例えば以下のような反応を利用することができる。すなわち本発明は、以下の工程を含む標的塩基配列の特定の領域における変異および/または多型の検出方法であって、第2および第1のプライマーの少なくとも一方の5'末端に配置された塩基配列が、前記特定の領域、またはその相補鎖の予測される塩基配列に相補的な塩基配列を含み、この5'末端に配置された塩基配列を鋳型として合成された相補鎖は、特定の領域、またはその相補鎖に対してアニールして相補鎖合成の起点となるとき、特定の領域を構成する塩基配列が予測していたものでなかった場合に、相補鎖合成が阻害されることを特徴とする方法に関する。
【0061】
a)標的塩基配列に第1のプライマーをアニールさせ、これを起点とする相補鎖合成反応を行う工程;ここで第1のプライマーはその3'末端において前記標的塩基配列を構成する一方の鎖の3'側を規定する領域に対してアニールすることができ、かつ第1のプライマーの5'側には、このプライマーを起点とする相補鎖合成反応生成物上の領域を構成する予測される塩基配列に相補的な塩基配列を備える、
b)工程a)で合成された第1のプライマーの伸長産物における第2のプライマーがアニールすべき領域を塩基対結合が可能な状態とし、両者をアニールさせて第1のプライマーの伸長産物を鋳型とする相補鎖合成を行う工程;ここで第2のプライマーはその3'末端において前記標的塩基配列を構成する他方の鎖の3'側を規定する領域に対してアニールすることができ、かつ第2のプライマーの5'側には、このプライマーを起点とする相補鎖合成反応生成物上の領域を構成する予測される塩基配列に相補的な塩基配列を備える、
c)第2のプライマーの伸長生成物の3'末端と、該伸長生成物における第1のプライマーに対する前記予測される塩基配列をアニールさせて自身を鋳型とする相補鎖合成を行う工程、
d)工程c)で合成された相補鎖における3'末端と、該伸長生成物における第2のプライマーに対する前記予測される塩基配列をアニールさせて自身を鋳型とする相補鎖合成を行う工程、
e)第2のプライマーを起点とする合成生成物の量を特定の領域における変異および/または多型の存在と関連付ける工程。
【0062】
本発明において、第2および/または第1のプライマーの伸長生成物の3'末端は自身が持つ特定の領域にアニールし、自身を鋳型とする相補鎖合成の起点となる。このとき、特定の領域を構成する塩基配列が予測された塩基配列であれば、3'末端を起点として相補鎖合成が進行する。逆に予測された塩基配列と異なっていた場合には、3'末端を相補鎖合成の起点とすることができず、相補鎖合成が阻害される。その結果、3'末端をプライマーとする自身を鋳型とした相補鎖の合成生成物を指標として、特定の領域における塩基配列が予測されたものかどうかを知ることができる。
【0063】
このとき合成される相補鎖は、自身の5'末端に達して完了する。本発明においては、5'末端には常にプライマーの5'末端に配置された塩基配列が存在する。つまり、鋳型の5'末端には伸長生成物における任意の領域に相補的な塩基配列が付加されている。したがってこれを鋳型として合成される相補鎖においては、その3'末端に任意の領域に対してアニールすることができる塩基配列が再現されることになる。この後、何らかの手段でその3'末端と、それがアニールすべき任意の領域とが塩基対結合が可能な状態となれば、再び自身を鋳型とする相補鎖合成が開始される。
【0064】
さて、本発明においては、第2のプライマーおよび第1のプライマーの少なくともいずれか一方には、そのプライマーの3'末端を起点として生成された伸長生成物における特定の領域(またはその相補鎖)に相補的な塩基配列がその5'末端に配置されている。以下の説明において、5'末端に特定の領域(またはその相補鎖)に相補的な塩基配列が配置された第2のプライマーまたは第1のプライマーを、特にチェックプライマーと記載することがある。
【0065】
したがって、チェックプライマーの5'末端を鋳型として生成した伸長生成物の3'末端は、特定の領域(またはその相補鎖)にアニールするたびに、その塩基配列をチェックすることになる。そしてこの相補鎖合成が開始するかどうかは、特定の領域が予測された塩基配列で構成されているかどうかによって決定される。このように、自身を鋳型として進行する相補鎖合成反応が、繰り返し特定の領域における塩基配列のチェックを経て進行することが本発明の重要な特徴である。この特徴により、たとえ誤って相補鎖合成が行われた場合であっても、その産物が鋳型として次の相補鎖合成が行われるときに、再び塩基配列のチェック機構が働く。その結果、以降の相補鎖合成が阻害されることから、本発明においては、誤った相補鎖合成によって生じるノイズを劇的に抑制することができる。
【0066】
さて、本発明の原理に基づいて実際に変異および/または多型の検出を行うための上記のような反応は、実際には、以下のような要素を適切な条件の基でインキュベートするだけで進行する。すなわち本発明は、次の要素を、第2および第1のプライマーを起点とする相補鎖合成が可能な条件下でインキュベートし、標的塩基配列を鋳型とする相補鎖合成反応生成物の量と特定の領域における変異および/または多型の存在と関連付ける工程を含む、前記変異および/または多型の検出方法であって、第2および第1のプライマーの少なくとも一方にチェックプライマーを用いることを特徴とする方法である。
【0067】
(a)標的塩基配列を含む核酸試料、
(b)鎖置換を伴う相補鎖合成を触媒することができるDNAポリメラーゼ、
(c)第2のプライマー;ここで第2のプライマーはその3'末端において前記標的塩基配列を構成する一方の鎖の3'側を規定する領域に対してアニールすることができ、かつ第2のプライマーの5'側には、このプライマーを起点とする相補鎖合成反応生成物上の領域を構成する予測される塩基配列に相補的な塩基配列を備える、
(d)第1のプライマー;ここで第1のプライマーはその3'末端において前記標的塩基配列を構成する他方の鎖の3'側を規定する領域に対してアニールすることができ、かつ第1のプライマーの5'側には、このプライマーを起点とする相補鎖合成反応生成物上の領域を構成する予測される塩基配列に相補的な塩基配列を備える、
(e)ヌクレオチド基質。
【0068】
第2のプライマーおよび第1のプライマーに基づく核酸の増幅方法は、既に本発明者らが報告したLAMP法 (Nucleic Acid Res. 2000 Vol.28 No.12 e63、WO 00/28082)に他ならない。しかしLAMP法を構成するプライマーの少なくともいずれかをチェックプライマーとして変異や多型の検出方法に用いたときに、塩基配列の高度なチェック機能を期待できることは、本発明によって明らかにされた新規な知見である。
【0069】
上記反応を構成している第1のプライマーは、次の領域から構成されている。
X2:標的塩基配列の3'側を規定するX2cに相補的な塩基配列を持つ領域。
X1c:前記X2cの5'側に位置し、第1のプライマーの伸長生成物上に存在する領域X1に予測される塩基配列に対して相補的な塩基配列を備えるものである。X1は、第1のプライマーの伸長生成物におけるそのプライマーの3'末端から特定の塩基配列を含む配列の間の任意の領域の配列である。ここでX1cは、任意の領域X1cに予測される塩基配列と実質的に同じ塩基配列を持つ領域と表現することもできる。
【0070】
以下に、LAMP法の反応原理と、本発明への応用について、図1〜図4を参照しながら説明する。ここで、仮に第1のプライマーFA、および第2のプライマーRAを想定する。FAは、前記X2に相当するF2と、X1cに相当するF1cとで構成されている。FAを構成するF1cは、F1cに対して実質的に同一な塩基配列を含む。本発明において、たとえば前記F1のように任意に選択される領域は、その領域に相補的な塩基配列を持つポリヌクレオチドをアニールすることができ、そしてそのポリヌクレオチドを合成起点として合成される相補鎖が本発明に必要な機能を備えている限り、任意の領域から選択することができる。
【0071】
一方本発明における第2のプライマーRAとしては、前記X2に相当するR2と、X1cに相当するR1cとで構成されるプライマーを組み合わせることができる。ここで、たとえばRAをチェックプライマーとする場合には、R1cはFAの伸長生成物における検出すべき変異および/または多型が存在する特定の領域R1cとして予測される塩基配列で構成され、またR2はFAの伸長生成物における任意の領域を構成する塩基配列R2cに相補的な塩基配列からなる。
【0072】
チェックプライマーRAを用いて本発明の検出方法を行うとき、FAをチェックプライマーとすることもできる。後に述べるように、チェックプライマーRAを用いて相補鎖合成反応を行うとき、FAの伸長生成物は、その3'末端が常に塩基対結合が可能な状態となり、自身を鋳型とする相補鎖合成反応を繰り返す。その一方で、RAの伸長生成物が1本鎖の状態で連続的に生成される。更にRAの伸長生成物自身もFAと同様に、その3'末端によって自身を鋳型とする相補鎖合成反応を繰り返す。このとき、FAをチェックプライマーとすることにより、FAの伸長生成物による塩基配列のチェック機構をも実現することができるのである。本発明において、FAによってもたらされる相補鎖合成による特定の領域の塩基配列のチェック機構は、実は前記RAによる塩基配列のチェック機構と全く同じ原理で進行している。つまり、特定の領域の相補鎖に対して、同じ原理を適用することに他ならない。
【0073】
ここで、FAとRAの両方をチェックプライマーとして用いる場合の反応をより詳細に説明する。RAがチェックプライマーであれば、R1を起点とする相補鎖合成[図4−(9)]は阻害を受けるはずである。同様にFAがチェックプライマーの場合はF1を起点とする相補鎖合成反応[図3−(8)]が阻害される。しかしPCRがそうであったように、わずかな塩基配列の相違をポリヌクレオチドのアニールの特異性によって識別することは、現実的ではない。本発明に基づく反応も例外ではなく、特定の領域が予測した塩基配列でない場合に相補鎖合成が阻害されるとはいえ、反応を完全に阻止できない場合を想定するのが現実的である。
【0074】
さて、特定の領域が予測した塩基配列でないのにもかかわらず、万が一相補鎖合成が阻止できなかった場合について以下に考察する。なお図1〜図4では、F1とR1c(あるいはR1とF1c)が分離して記載されている。これらの図では、FAとRAのいずれか一方のみをチェックプライマーとして用いる場合の反応を示している。
【0075】
他方、FAとRAの両方をチェックプライマーとするときには、いずれの方向からも特定の領域に対して相補的な塩基配列がアニールすることになる。したがって、R1がアニールすべきR1cの少なくとも一部は、F1と重複する。同時に、その相補鎖であるF1cは、少なくともその一部がR1と重複する。
【0076】
まずF1を起点とする相補鎖合成反応[図3−(8)]で誤って相補鎖合成が行われた場合を想定する。誤って合成された伸長生成物に対して、まず最初にR1が特定の領域にアニールして相補鎖合成が行われる。RAはチェックプライマーだが、それを鋳型として合成された3'末端R1がアニールするのは、実はFAの3'末端であった領域を含んでいる。つまり、予測した塩基配列となっているためにチェック機構が働かず相補鎖合成が進んでしまう。しかし、この相補鎖合成が5'末端に達したときには、その3'末端はチェックプライマーであるFAの5'末端を鋳型とする相補鎖となっている。そしてこの3'末端は、再び特定の領域に対してアニールすることになり、このときにはチェック機構が働く。
【0077】
以上のように、FAとRAの両方をチェックプライマーとする場合、FAのチェック機構が機能するときには、RAのチェック機構が機能できない場合があることは事実である。しかし現実には、標的塩基配列が2本鎖の場合には、RAとFAが図1〜図4に示すとおりの順番で反応する確率は、理論的には1/2である。残る1/2の反応は、図1〜図4とは対称的な順番で反応する。言い換えれば、残る1/2の反応を説明するために、図1〜図4における「F」と「R」を読み換える必要がある。なぜなら、RAとFAは、標的塩基配列を構成する2本鎖のそれぞれに対してアニールし、以降の反応もまったく同じように進行するためである。
【0078】
あるいは、本発明による反応を図1〜図4に基づいて説明するときに、RA(あるいはFA)は、標的塩基配列のいずれかの鎖にアニールする特定のプライマーを想定しているのではない、と言うこともできる。つまり、単に先にアニールした方を便宜上RAとして説明しているのにすぎないということになる。
【0079】
このような事実に基づけば、FAに加えてRAがチェックプライマーであることの意義が容易に理解できるであろう。つまり、先に述べたFAの相補鎖によるチェック機構と同様のチェック機構が、相補鎖においても働くことから、反応系全体で見ると、結果としてより多くのチェック機構が働くことになるのである。したがって、FAとRAの両方をチェックプライマーとすることは、本発明の望ましい態様の一つである。
【0080】
本発明に基づくチェック機構について、更に説明する。本発明においては、たとえFAとRAの両方をチェックプライマーとした場合であっても、理論的に本発明のチェック機構が作用しない反応もいくつか起きることは事実である。具体的には、チェックプライマーの5'末端由来の塩基配列を含んだ領域に近接するループ部分に対して、アニールしたプライマーからの伸長生成物は、その3'末端が、特定の領域ではなく、いずれプライマーに由来する塩基配列に対してアニールすることになる。3'末端が特定の領域ではなくプライマー由来の塩基配列にアニールするときは、チェック機構が働かなくなる。しかし、本発明において重要なことは、このようなチェック機構が働かなくなる生成物ができるまでに、何度もチェック機構が作用することである。
【0081】
ここで、特定の領域が予測した塩基配列でないのにも関わらず、反応が進行する割合を仮にAとし、チェック機構が働かない生成物ができるまでにチェック機構が作用した回数をnとすると、本発明においてチェック機構が働かない生成物ができる割合Xは、Anで表される。たとえば5%の割合でチェック機構をすり抜ける反応が生じてしまう場合であっても、チェック機構が3回作用するだけで、割合Xは0.053=0.000125(0.01%)となる。つまりチェック機構が1回しか作用できない場合に比べて、その危険性をおよそ1/500にすることができるのである。このように、本発明では1回のチェック機構しか働かない反応に比べて、チェック機構が働かない生成物を生じる可能性が著しく小さくなることが明らかである。
【0082】
前記標的塩基配列とは、検出対象、あるいは検出対象から誘導された核酸の一部、あるいは全てを構成する。標的塩基配列は2本鎖であっても、1本鎖であっても良い。2本鎖の場合には、標的塩基配列を規定する各鎖の3'末端、並びにこの標的塩基配列の中に位置する特定の領域は、少なくともその一部の塩基配列が明らかとなっている、あるいは推測が可能な状態にある。また標的塩基配列が1本鎖として存在する場合には、その3'側を規定する塩基配列と、想定される相補鎖の3'側の塩基配列、そして標的塩基配列中に位置する特定の領域は、少なくともその一部の塩基配列が明らかとなっている、あるいは推測が可能な状態にある。塩基配列を明らかにすべき部分とは、前記3'末端X2cおよびその5'側に位置する特定の領域X1cである。本発明の特定の領域には、変異および/または多型が予測される塩基が含まれている。そして本発明におけるチェックプライマーは、特定の領域における変異および/または多型が予測される塩基が、予測された塩基ではなかった場合に、相補鎖合成反応が阻害されるように設計しなければならない。
【0083】
本発明のチェックプライマーは、たとえば次のように設計される。すなわち、チェックプライマーを鋳型として相補鎖を合成したときに、合成された相補鎖の3'末端付近が、変異や多型が予想される塩基に相補的な位置に相当するように設計される。相補鎖の合成起点となる3'末端や、その付近にミスマッチが存在すると核酸の相補鎖合成反応は著しく阻害される。より具体的には、相補鎖合成の起点となる3'末端〜10塩基以内、特に望ましくは3'末端からカウントして2〜4番目、より望ましくは2〜3番目の塩基にミスマッチがある場合には、相補鎖合成が著しく阻害される。したがって、本発明において検出すべき変異や多型の存在(あるいは不存在)によって、この部分にミスマッチを生じるようにチェックプライマーの5'側の塩基配列を設計するのが望ましい。
【0084】
本発明においては、反応初期の生成物における末端構造が繰り返し反応を行わなければ高度な増幅反応に結びつかない。したがって、たとえ誤った合成が行われたとしても、増幅反応を構成する相補鎖合成がいずれかの段階で妨げられるのでミスマッチを含んだままでは高度な増幅は起きない。結果的にミスマッチが増幅反応を効果的に抑制し、最終的には正確な結果をもたらすことになる。つまり本発明に基づく核酸の増幅反応は、より完成度の高い塩基配列のチェック機構を備えていると言うことができる。これらの特徴は、たとえば単純に2つの領域で増幅反応を行っているPCR法などでは期待しにくい利点である。
【0085】
更に本発明に用いるプライマーを特徴付ける領域X1cは、相補配列が合成されてはじめて合成起点となり、この相補配列が、新たに合成された同一鎖内の配列X1にアニールすることにより、自己を鋳型とする合成反応が進行する。このため、たとえ先行技術でしばしば重要な問題となるいわゆるプライマーダイマーを生成しても、本発明に用いるプライマーはループを形成しない。したがって、プライマーダイマーに起因する非特異的な増幅は原理的に生じ得ず、反応の特異性向上に貢献する。
【0086】
これらの2つの領域X2cおよびX1c(標的塩基配列となる核酸においては、X2およびX1)は、連続する場合、そして離れて存在する場合とを想定することができる。両者の相対的な位置関係により、生成物である核酸が自己アニールしたときに形成されるループ部分の状態が決定される。また、生成物である核酸が分子間のアニールではなく自己アニールを優先的に行うためには、両者の距離が不必要に離れないほうが望ましい。したがって、両者の位置関係は、通常0−500塩基分の距離を介して連続するようにするのが望ましい。ただし、後に述べる自己アニールによるループの形成において、両者があまりにも接近している場合には望ましい状態のループの形成を行うには不利となるケースも予想される。ループにおいては、新たなプライマーのアニールと、それを合成起点とする鎖置換を伴う相補鎖合成反応がスムーズに開始できる構造が求められる。したがってより望ましくは、領域X2cおよびその5'側に位置する領域X1cとの距離が、0〜100塩基、さらに望ましくは10〜70塩基となるように設計する。なおこの数値はX1cとX2を含まない長さを示している。ループ部分を構成する塩基数は、更にX2に相当する領域を加えた長さとなる。
【0087】
上記特定の塩基配列を持つ核酸に対して本発明に用いるプライマーを構成する領域X2およびX1cは、通常は重複することなく連続して配置される。あるいはもしも両者の塩基配列に共通の部分があるのであれば、部分的に両者を重ねて配置することもできる。X2はプライマーとして機能する必要があることから、常に3'末端となるようにしなければならない。一方X1cは、後に述べるように、これを鋳型として合成された相補鎖の3'末端にプライマーとしての機能を与える必要があることから、5'末端に配置する。このプライマーを合成起点として得られる相補鎖は、次のステップにおいては逆向きからの相補鎖合成の鋳型となり、最終的にはプライマー部分も鋳型として相補鎖に写し取られる。写し取られることによって生じる3'末端は塩基配列X1を備えており、同一鎖上のX1cにアニールするとともに、ループを形成する。このとき、鋳型における5'末端に含まれているプライマーがチェックプライマーであれば、X1cは、特定の領域に対してアニールすることになる。
【0088】
本発明に用いるプライマーとは、相補的な塩基対結合を形成できること、そしてその3'末端において相補鎖合成の起点となる-OH基を与えること、の2つの条件を満たすオリゴヌクレオチドを意味する。したがって、そのバックボーンは必ずしもホスホジエステル結合によるものに限定されない。たとえばOではなくSをバックボーンとしたホスホチオエート体であることもできる。また、塩基は、相補的な塩基対結合を可能とするものであれば良い。天然の状態では、一般にはACTGおよびUの5種類となるが、たとえばブロモデオキシウリジン(bromodeoxyuridine)といった類似体であることもできる。本発明に用いるオリゴヌクレオチドは、合成の起点となるのみならず、相補鎖合成の鋳型としても機能するものであることが望ましい。
【0089】
本発明に用いるプライマーは、以下に述べる各種の核酸合成反応において、与えられた環境の下で必要な特異性を維持しながら相補鎖との塩基対結合を行うことができる程度の鎖長を持つ。具体的には、5−200塩基、より望ましくは7−50塩基対とする。配列依存的な核酸合成反応を触媒する公知のポリメラーゼが認識するプライマーの鎖長が、最低5塩基前後であることから、アニールする部分の鎖長はそれ以上であることが望ましい。加えて、塩基配列としての特異性を期待するためには、一般的には6塩基以上、好ましくは7塩基以上の長さを利用するのが望ましい。一方、あまりにも長い塩基配列は化学合成によって調製することが困難となることから、前記のような鎖長が望ましい範囲として例示される。なお、ここで例示した鎖長はあくまでも相補鎖とアニールする部分の鎖長である。後に述べるように、本発明によるオリゴヌクレオチドは最終的には少なくとも2つの領域に個別にアニールすることができる。したがって、ここに例示する鎖長は、プライマーを構成する各領域の鎖長と理解するべきである。
【0090】
更に、本発明に用いるプライマーは、公知の標識物質によって標識することができる。標識物質としては、ジゴキシンやビオチンのような結合性リガンド、酵素、蛍光物質や発光物質、あるいは放射性同位元素などを示すことができる。あるいは、オリゴヌクレオチドを構成する塩基を蛍光性のアナログに置換する技術(WO95/05391, Proc.Natl.Acad.Sci.USA,91,6644-6648,1994)も公知である。
【0091】
この他本発明に用いるプライマーは、それ自身を固相に結合させておくこともできる。あるいは、プライマーの任意の部分にビオチンのような結合性のリガンドで標識しておき、これを固相化アビジンのような結合パートナーによって間接的に固相化することもできる。固相化プライマーを合成開始点とする場合には、核酸の合成反応生成物が固相に捕捉されることから、分離が容易となる。分離された生成物に対して、核酸特異的な指示薬や、あるいは更に標識プローブをハイブリダイズさせることによって、検出を行うこともできる。あるいは、任意の制限酵素で消化することによって、目的とする核酸の断片を回収することもできる。
【0092】
本発明に用いるプライマーは前記2つの領域のみならず、更に付加的な領域を含むことができる。X2とX1cとがそれぞれ3'末端と5'末端に配置される一方、両者の間に任意の配列を介在させることが可能である。それは、たとえば制限酵素認識配列、RNAポリメラーゼが認識するプロモーター、あるいはリボザイムをコードするDNA等であることができる。制限酵素認識配列とすることにより、本発明の合成産物である1本鎖上に相補的な塩基配列が交互に連結された核酸を同じ長さを持った2本鎖核酸に切りそろえることができるようになる。RNAポリメラーゼが認識するプロモーター配列を配置すれば、本発明の合成生成物を鋳型として更にRNAへの転写が行われる。このときに、更にリボザイムをコードするDNAを配置すれば、転写生成物を自身で切断する系が実現する。なお、これらの付随的な塩基配列はいずれも2本鎖となった場合に機能するものである。したがって、本発明による1本鎖の核酸がループを形成しているときには、これらの配列は機能しない。核酸の伸長が進み、ループを含まない状態で相補的な塩基配列を持つ鎖とアニールした状態になったときにはじめて機能する。
【0093】
さて、本発明を構成する上記反応工程a)〜f)を具体的に説明する。
まず、5'側に標的塩基配列における任意の領域と同一の塩基配列を持った第1のプライマーによって標的塩基配列を鋳型とする相補鎖合成反応を行う。この伸長産物を鋳型として更に第2のプライマーによる相補鎖合成が行われる。第2のプライマーによる相補鎖合成のために、それがアニールすべき領域が塩基対結合が可能な状態とされる。この工程は、標的塩基配列における第1のプライマーがアニールしている領域よりも3'側にアニールする第3のプライマーを起点とする相補鎖合成反応に伴う置換によって行うことができる。本発明において第3のプライマーは、第1のプライマーよりも3'側にアニールし、第1のプライマーがアニールする領域に向かって進行する相補鎖合成反応の起点となる。この工程は、鎖置換を伴う相補鎖合成を触媒することができるDNAポリメラーゼによって行われる。この他、第1のプライマーの伸長生成物を過熱変性などの方法によって1本鎖とすることもできる。
【0094】
次に、第2のプライマーの伸長生成物は、その3'末端をプライマーとして自身を鋳型とする相補鎖合成反応を開始する。第2のプライマーに基づく相補鎖合成の鋳型として用いられた第1のプライマーの5'末端には、第1のプライマーの伸長生成物における任意の領域の予測される塩基配列に相補的な塩基配列が付加されている。したがって、それを鋳型として生成する第2のプライマーによる伸長生成物の3'末端には、前記任意の領域と実質的に同一の塩基配列が備わることになる。
【0095】
このとき、第2のプライマーの伸長生成物の3'末端と、それがアニールすべき領域を塩基対結合が可能な状態とする必要がある。この工程は、通常、この伸長生成物を1本鎖とすることによって行われる。伸長生成物を1本鎖とするには、たとえば第2のプライマーがアニールしている領域よりも3'側にアニールする第4のプライマーを起点とする相補鎖合成反応に伴う置換によって行われる。本発明においては、前記第3のプライマーや、ここで用いる第4のプライマーのような、置換反応用のプライマーをアウタープライマーと記載する。
【0096】
さて、第2のプライマーは、5'末端に特定の領域に予測される塩基配列に相補的な塩基配列を備えている。すなわち第2のプライマーはチェックプライマーである。この塩基配列は、プライマーによって導入された塩基配列である。したがってこれを鋳型として合成された3'末端には、その3'末端に自身の特定の領域に対して相補的な塩基配列を備えることになる。この段階で特定の領域の塩基配列をチェックする準備が整えられたことになる。そして、以降の反応で実際に塩基配列のチェックが行われる。
【0097】
塩基配列のチェックのための反応は、次のようにして進行する。まず、このようにして合成された1本鎖ポリヌクレオチドの3'末端、および特定の領域を塩基対結合が可能な状態とする。この工程は、望ましくは次のようにして行うことができる。すなわち、ヘアピン構造のループ形成領域を起点とする相補合成反応によって3'末端を置換するのである。
【0098】
本発明の望ましい態様においては、1本鎖ポリヌクレオチドの相補的な塩基配列の間にループを形成するための塩基配列が含まれる。本発明においては、この配列をループ形成配列と呼ぶ。前記1本鎖ポリヌクレオチドは、実質的にループ形成配列によって連結された相補的な塩基配列で構成される。なお一般的には、それが部分的に塩基対結合を伴っているかどうかにかかわらず、塩基対結合を解離させたときに2つ以上の分子に分離しないものを1本鎖と呼ぶ。相補的な塩基配列は、同一鎖上で塩基対結合を形成することができる。前記1本鎖ポリヌクレオチドを、同一鎖上で塩基対結合させることによって得ることができる分子内塩基対結合生成物は、見かけ上2本鎖を構成する領域と、塩基対結合を伴わないループ部分を与える。
【0099】
すなわち、この1本鎖ポリヌクレオチドは、同一鎖上でアニールすることが可能な相補的な塩基配列を含み、そのアニール生成物は折れ曲がったヒンジ部分に塩基対結合を伴わないループを構成する1本鎖核酸と定義することもできる。そして塩基対結合を伴わないループには、相補的な塩基配列を持つヌクレオチドがアニールすることができる。ループ形成配列は任意の塩基配列であることができる。置換のための相補鎖合成を開始することができるように塩基対結合が可能であり、望ましくは特異的なアニーリングを達成するために他の領域に存在する塩基配列から識別可能な配列を備える。たとえば望ましい態様においては、第1のプライマーと相補的な塩基配列を含む。ループ形成領域に対してFAがアニールする状態を、図5に示した。
【0100】
ループ形成領域に第1のプライマーをアニールさせて相補鎖合成反応を行うと、1本鎖ポリヌクレオチドのハイブリダイズしている部分が置換されて1本鎖ポリヌクレオチドにおける特定の領域、並びに3'末端は塩基対結合が可能な状態となる。両者がアニールして3'末端は相補鎖合成の起点となる3'-OHを与える。さて、この段階で3'末端がアニールしているのは、塩基配列をチェックすべき特定の領域である。したがって、この領域の塩基配列が予測した塩基配列であれば、3'末端を起点とする相補鎖合成反応が進行する。あるいは予測した塩基配列と相違していた場合には、相補鎖合成反応が阻害される。
【0101】
本発明の最大の特徴は、LAMP法を利用したことによって、この塩基配列のチェック機構が以降の反応でも繰り返し機能できる点にある。たとえば、塩基配列が予測されていたものと異なっていたにもかかわらず、相補鎖合成反応が進行してしまったと仮定する。本発明における1本鎖ポリヌクレオチドを鋳型とする相補鎖合成反応の生成物は、その3'末端に、再び特定の領域に対する相補鎖を備えたものとなる。自身の5'末端が、特定の領域に予測される塩基配列を備えているため、この構造は何度相補鎖合成を繰り返しても変わらない。一方3'末端がアニールすべき特定の領域は、標的塩基配列を鋳型として写し取ったものであるから、両者の間のアニールは、ミスマッチをともなったままである。そのため、2回目以降の反応においても、阻害が起きることになる。本発明による塩基配列のチェック機構は、誤って起きてしまった相補鎖合成反応の影響を最小限度にとどめる機構を備えていると言うことができる。
【0102】
以上のように、特定の構造を持つプライマーを用い、鎖置換を伴う相補鎖合成を触媒することができるDNAポリメラーゼによって標的塩基配列の存在下で相補鎖合成を行えば、塩基配列のチェック機構を伴った相補鎖合成反応が進行する。その結果、特定の領域を構成する塩基配列が予測される塩基配列であった場合には、相補鎖合成産物の連続的な生成が開始される。他方、もしも予測される塩基配列でなかった場合には、本発明による塩基配列のチェック機構によって、相補鎖合成が著しく阻害される。したがって、一定時間の反応の後に、増幅生成物が検出できれば、その試料の特定の領域を構成する塩基配列が予測された塩基配列であると判定される。
【0103】
本発明において、相補鎖合成が進行した場合にもたらされる核酸は、1本鎖上に相補的な塩基配列が交互に連結された核酸となる。本発明においては、この核酸の生成量が、特定の領域における予測される塩基配列の存在と関連付けられる。すなわち、予測された塩基配列であった場合の生成量に対して、塩基配列が予測と異なっていた場合にはこのような構造の核酸の生成が阻害される。本発明において指標としている1本鎖上に相補的な塩基配列が交互に連結された核酸とは、1本鎖上に互いに相補的な塩基配列を隣り合せに連結した核酸を意味する。
【0104】
相補鎖合成反応の進行に伴う生成物は、公知の手法によって検出することができる。たとえばゲル電気泳動によって反応液を分析すれば、本発明に固有の増幅生成物を明瞭なバンドとして確認することができる。本発明における増幅生成物は、標的塩基配列とその相補鎖を1単位とする塩基配列の繰り返しからなっている。これを電気泳動で分離すると、一定の間隔で並んだラダー状のバンドが表れる。この他、相補鎖合成の進行を反応させながら追跡する手法も公知である。たとえば、エチジウムブロマイドやサイバーグリーン等の2本鎖核酸特異的な蛍光染料によって、相補鎖合成産物の蓄積を蛍光強度の変化として追跡することができる。後に述べる内部標準を用いた場合には、内部標準におけるシグナルの増大が確認できたとき、あるいは内部標準におけるシグナル変化がプラトーに達したときに、試料におけるシグナルが実質的に増大していなければ、試料の特定の領域が予測された塩基配列でなかったことを意味する。
【0105】
本発明の検出方法において、相補鎖合成産物の量は内部標準と比較することができる。内部標準には、たとえば同一の核酸試料に由来し変異や多型が存在しないことが明らかな核酸を用いることができる。ゲノムの塩基配列の解析を目的とする場合には、ゲノムにおいて変異や多型が知られていない塩基配列を内部標準として利用することができる。あるいはmRNAを鋳型として本発明の検出方法を行う場合には、たとえばいずれの細胞でも一定の発現量が観察される遺伝子を内部標準とすることができる。これら内部標準に対しても、その塩基配列を標的塩基配列として本発明と同じ条件で相補鎖合成反応を行い、その生成物の量を対照として変異を検出すべき塩基配列から得られた結果と比較することができる。内部標準と同レベルの生成物が生じた場合には、特定の塩基配列が予測された塩基配列と同一であったことが確認できる。逆に、特定の領域の塩基配列が予測されたものと相違していれば、相補鎖合成反応生成物の量は内部標準よりも少なくなるはずである。
【0106】
更に、本来相補鎖合成反応生成物を生じるべき内部標準において生成物が検出できないとき、あるいは少ないときには、反応自体に何らかの問題があった可能性が疑われる。一般に内部標準は、試験用のプライマーとともに同一の反応液で反応させるものが多い。しかし本発明においては、同一試料を用いて共通の条件で反応させる限り、内部標準とすることができる。たとえば、同一試料について第1の反応系で標準を測定し、第2の反応系で試料核酸を測定するような場合も、この標準を内部標準という。
【0107】
本発明において、特定の領域が予測される塩基配列を備えていた場合に合成される核酸を構成する相補的な塩基配列の数は、少なくとも1組である。本発明の望ましい態様によれば、その整数倍となることもある。そしてこの場合、理論的には本発明における前記核酸を構成する相補的な塩基配列のペアの数に上限はない。本発明の合成生成物である核酸が複数組の相補的な塩基配列で構成されるとき、この核酸は同じ塩基配列の繰り返しからなる。なお反応生成物の中には、相補鎖合成反応が5'末端に至らず、鋳型の途中で終了しているものなどが混在する可能性のあることは言うまでも無い。
【0108】
本発明に基づいて合成される1本鎖上に相補的な塩基配列が交互に連結した核酸は、必ずしも天然の核酸と同じ構造である必要はない。DNAポリメラーゼの作用によって核酸を合成するときに基質としてヌクレオチド誘導体を利用すれば、核酸の誘導体の合成が可能なことは公知である。このようなヌクレオチド誘導体には、ラジオアイソトープで標識したヌクレオチドや、ビオチンやジゴキシンのような結合性リガンドで標識したヌクレオチド誘導体などが用いられる。これらのヌクレオチド誘導体を用いることにより、生成物である核酸誘導体の標識が達成される。あるいは、蛍光性のヌクレオチドを基質として用いることによって、生成物である核酸を蛍光性の誘導体とすることができる。更にこの生成物は、DNAであることもできるし、RNAとすることもできる。いずれを生成するかは、プライマーの構造、重合のための基質の種類、そして核酸の重合を行う重合化試薬との組み合わせによって決定される。
【0109】
本発明において、核酸とは、DNA、またはRNA、あるいはそれらのキメラ分子であることができる。核酸は、天然のものであることもできるし、人工的に合成されたものであることもできる。また部分的に、あるいは全体が完全に人工的な構造からなるヌクレオチド誘導体であっても、それが塩基対結合を形成しうるものであるかぎり、あるいは相補鎖合成のための鋳型として機能する限り、本発明の核酸に含まれる。本発明における核酸の構成塩基数は、制限されない。核酸は、用語ポリヌクレオチドと同義である。一方本発明におけるオリゴヌクレオチドとは、ポリヌクレオチドの中でも特に構成塩基数が少ないものを示す用語として用いる。一般にオリゴヌクレオチドは、2〜100、より一般的には、2〜50程度の塩基数のポリヌクレオチドを指してオリゴヌクレオチドと呼ぶが、これらの数値に限定されるものではない。
【0110】
本発明の検出方法は、あらゆる核酸に対して応用することができる。具体的には、たとえば原核細胞や真核細胞のゲノム、ウイルスのゲノムDNAやゲノムRNA、マイコプラズマやリケッチアのような細胞内寄生体のゲノム、これらの生物種のmRNAから誘導されたcDNA、更にこれらの遺伝子ソースから誘導されたライブラリーや、ライブラリーから単離されたクローンなどを示すことができる。変異や多型を検出すべき遺伝子がRNAであれば、逆転写酵素活性を持つDNAポリメラーゼの作用によってcDNAとすることができる。本発明の試料とする核酸は、一般に生物学的な試料に含まれる。生物学的試料とは、動物、植物、あるいは微生物の組織、細胞、培養物、排泄物あるいはそれらの抽出物を示すことができる。本発明は、これらの生物学的試料に含まれる、その生物に由来する核酸、あるいはその生物を宿主としている感染性の寄生生物、微生物、並びにウイルスに由来する核酸等を検出対象とすることができる。また本発明における核酸は、前記生物学的試料に含まれる核酸から誘導されたものであってもよい。たとえば、mRNAをもとに合成されたcDNAや、生物学的試料に由来する核酸をもとに増幅された核酸等を本発明による検出方法の試料とすることができる。これらの遺伝子は、変性によって1本鎖とすることにより、あるいは後で述べるように2本鎖のまま、本発明による検出方法の試料とすることができる。
【0111】
本発明における標的塩基配列を含む核酸は、プライマーのアニールと、これを起点とする相補鎖合成反応が進行する条件下でインキュベートされる場合、2本鎖の状態のままで試料とすることができる。通常、核酸試料をプローブやプライマーとのハイブリダイズによって解析するとき、変性処理によって1本鎖とする工程が必要とされている。しかし、プライマーからの相補鎖合成反応は、2本鎖核酸が不安定化される条件の元では、完全に1本鎖とする工程を省略できる場合のあることを本発明者らは見出している(2000年4月7日出願、特願2000-111939)。
【0112】
すなわち、単に2本鎖核酸を不安定化する条件とするのみでは、相補鎖を効率的に合成することは難しいが、もともと等温で進行する核酸の増幅反応と組み合わせるときに、1本鎖核酸を鋳型とする場合と比べて遜色の無い増幅効率を達成することができるのである。本発明に応用することができる核酸の増幅方法は、1本鎖の鋳型核酸に応用した場合には、等温で進行する。この方法は、鎖置換を伴う相補鎖合成を触媒することができるDNAポリメラーゼを用いているとともに、自身へのアニールと相補鎖合成、そしてループへの新たなプライマーのアニールと相補鎖合成とを繰り返すことによって、等温条件下での相補鎖合成が繰り返し行われる反応原理に基づいている。したがって、本発明における標的塩基配列には、2本鎖核酸を用いることができる。
【0113】
本発明に基づき、2本鎖核酸を直接鋳型として変異や多型の検出を行う方法について述べる。なお以下の説明においては、特定の領域を構成する塩基配列が予測される塩基配列であった場合に開始される相補鎖合成の過程を説明している。特定の領域の塩基配列が予測した塩基配列と相違している場合には、以下に述べるいくつかの相補鎖合成反応に、自身の3'末端が特定の領域にアニールして自身を鋳型として進行する相補鎖合成反応を阻害する工程が組みこまれる。
【0114】
2本鎖核酸としては、たとえばcDNAやゲノムDNAを示すことができる。あるいはこれらのDNAを各種のベクターに挿入したものを本発明の2本鎖核酸として用いることもできる。本発明の2本鎖核酸は、精製されたものであっても良いし、未精製のものであることもできる。また、細胞内に存在する状態(in situ)で、本発明の方法を適用することもできる。細胞内の2本鎖核酸を鋳型とすることによって、ゲノムのin situ解析が可能となる。
【0115】
本発明においてcDNAを鋳型として用いる場合、cDNAを合成する工程と、本発明に基づく核酸の合成方法とを、同一の条件下で実施することができる。RNAを鋳型としてcDNAの第1鎖を合成すると、DNA-RNAハイブリッドによる2本鎖核酸が完成する。この2本鎖核酸を本発明における鋳型として、核酸の合成方法を実施することができる。本発明の核酸の合成方法に用いるDNAポリメラーゼが、逆転写酵素活性を備えるものであれば、単一の酵素を用い、同一の条件下で核酸の合成を行うことができる。たとえばBca DNA ポリメラーゼは、鎖置換活性を有し、逆転写酵素活性を併せ持つDNAポリメラーゼである。なお、第2鎖を合成したうえで完全な2本鎖cDNAとした後に、本発明による核酸の合成方法を適用しうることは言うまでも無い。
【0116】
本発明の変異や多型の検出には、鎖置換を伴う相補鎖合成を触媒することができるポリメラーゼが利用される。この種のポリメラーゼは、SDAなどに用いられたDNAポリメラーゼと同様のものが用いられる。すなわち、ある塩基配列の3'側に相補的なプライマーを合成起点として相補鎖合成を行うときに、鋳型の5'側に2本鎖の領域が有るとその2本鎖を置換しながら相補鎖の合成を行う特殊なポリメラーゼが公知である。鋳型の5'側とは、プライマーの3'側、すなわち相補鎖合成反応が進行する方向である。本発明においては、更に相補鎖合成に必要な基質が添加される。
【0117】
本発明においては、2本鎖核酸に任意のプライマーを加え、このプライマーを起点とする相補鎖合成反応が達成できる条件のもとでインキュベートされる。本発明の任意のプライマーとは、FAがアニールすべき領域を塩基対結合可能な状態とするために用いられる。したがって、任意のプライマーは、鋳型となる2本鎖核酸の、FAがアニールすべき核酸鎖に対して、その相補鎖にアニールすることができるものである必要がある。更に、本発明における任意のプライマーを複製起点とする相補鎖合成は、FAがアニールすべき領域の方向に向かって進行するような位置関係にあるべきである。言いかえれば、FAを起点とする相補鎖合成反応において鋳型として機能する領域の、任意の領域に対してアニールするものであることができる。任意のプライマーは、この条件を満たす限り、任意の領域から選択することができる。たとえば、RAや、鋳型におけるRAがアニールする領域よりも更に3’側にアニールするアウタープライマー(後述)を、任意のプライマーとして用いることもできる。このような態様は反応に必要な成分を少なくすることから、本発明における望ましい態様の一つである。
【0118】
任意のプライマーを起点とする相補鎖合成で2本鎖核酸の一方の鎖を置換し、FAによる塩基対結合が可能な状態とすることができる。この条件を採用したことによって、本発明の方法を2本鎖核酸を試料として温度変化無しで実現することができた。任意のプライマーの2本鎖核酸に対するアニール、およびこのプライマーを起点とする相補鎖合成反応が達成できる条件とは、実際には次の複数の工程を同じ条件下で進めることができる条件ということができる。
i) 2本鎖核酸からなる鋳型に対してプライマーがアニールする
ii) アニールしたプライマーを複製起点とする相補鎖合成が進む。
【0119】
一般にプライマーは少なくともそれがアニールすべき領域が1本鎖でなければアニールすることはできないと考えられていた。そのため従来は、2本鎖の核酸を鋳型とする場合には、プライマーのアニールに先立って必ず変性によって1本鎖とする工程が実施されてきた。しかし必ずしも完全な1本鎖としなくとも、何らかの手段によって2本鎖が不安定化される条件のもとで、プライマーとインキュベートすることにより、プライマーのアニールが可能となる。2本鎖が不安定化される条件としては、たとえば融解温度(以下、Tmと省略する)近くにまで加温する方法を示すことができる。あるいは、更にTm調整剤を存在させることも有効である。
【0120】
一連の反応は、酵素反応に好適なpHを与える緩衝剤、酵素の触媒活性の維持やアニールのために必要な塩類、酵素の保護剤、更には必要に応じて融解温度(Tm)の調整剤等の共存下で行う。緩衝剤としては、Tris-HCl等の中性から弱アルカリ性に緩衝作用を持つものが用いられる。pHは使用するDNAポリメラーゼに応じて調整する。塩類としてはKCl、NaCl、あるいは(NH4)2SO4等が、酵素の活性維持と核酸の融解温度(Tm)調整のために適宜添加される。酵素の保護剤としては、ウシ血清アルブミンや糖類が利用される。
【0121】
更に融解温度(Tm)の調整剤には、ベタイン、プロリン、ジメチルスルホキシド(以下、DMSOと省略する)、あるいはホルムアミドが一般に利用される。融解温度(Tm)の調整剤を利用することによって、前記オリゴヌクレオチドのアニールを限られた温度条件の下で調整することができる。更にベタイン(N,N,N,-trimethylglycine)やテトラアルキルアンモニウム塩は、そのisostabilize作用によって鎖置換効率の向上にも有効である。ベタインは、反応液中0.2〜3.0 M、好ましくは0.5〜1.5 M程度の添加により、本発明の核酸増幅反応の促進作用を期待できる。これらの融解温度の調整剤は、融解温度を下げる方向に作用するので、塩濃度や反応温度等のその他の反応条件を考慮して、適切なストリンジェンシーと反応性を与える条件を経験的に設定する。
【0122】
Tm調整剤を利用することにより、酵素反応に好適な温度条件を容易に設定することができる。Tmはプライマーと標的塩基配列の関係によって変動する。したがって、酵素活性を維持できる条件と、本発明の条件を満たすインキュベーションの条件とが一致するように、Tm調整剤の使用量を調整することが望ましい。本発明の開示に基づいて、プライマーの塩基配列に応じて適切なTm調整剤の使用量を設定することは、当業者にとって自明である。たとえば、アニールする塩基配列の長さとそのGC含量、塩濃度、およびTm調整剤の濃度に基づいて、Tmを算出することができる。
【0123】
このような条件下における2本鎖の核酸に対するプライマーのアニールは、おそらく不安定であると推測される。しかし鎖置換を伴う相補鎖合成を触媒することができるDNAポリメラーゼとともにインキュベートすることにより、不安定ながらアニールしたプライマーを複製起点として相補鎖が合成される。相補鎖が合成されれば、プライマーのアニールは次第に安定化されることになる。以下に示すようなDNAポリメラーゼは、2本鎖核酸に対するプライマーのアニールが可能な条件下で、相補鎖の合成を触媒することができる。
【0124】
本発明による変異や多型の検出方法を支えているのは、鎖置換を伴う相補鎖合成を触媒することができるDNAポリメラーゼである。この種のDNAポリメラーゼには、以下のようなものが知られている。また、これらの酵素の各種変異体についても、それが配列依存型の相補鎖合成活性と鎖置換活性を有する限り、本発明に利用することができる。ここで言う変異体とは、酵素の必要とする触媒活性をもたらす構造のみを取り出したもの、あるいはアミノ酸の変異等によって触媒活性、安定性、あるいは耐熱性を改変したもの等を示すことができる。
【0125】
Bst DNAポリメラーゼ
Bca(exo-)DNAポリメラーゼ
DNA ポリメラーゼIのクレノウ・フラグメント
Vent DNAポリメラーゼ
Vent(Exo-)DNAポリメラーゼ(Vent DNAポリメラーゼからエクソヌクレアーゼ活性を除いたもの)
DeepVent DNAポリメラーゼ
DeepVent(Exo-)DNAポリメラーゼ(DeepVent DNAポリメラーゼからエクソヌクレアーゼ活性を除いたもの)
Φ29ファージDNAポリメラーゼ
MS-2ファージDNAポリメラーゼ
Z-Taq DNAポリメラーゼ(宝酒造)
KOD DNAポリメラーゼ(東洋紡績)。
【0126】
これらの酵素の中でもBst DNAポリメラーゼやBca(exo-)DNAポリメラーゼは、ある程度の耐熱性を持ち、触媒活性も高いことから特に望ましい酵素である。本発明は2本鎖の状態にある核酸に対して、プライマーのアニールと相補鎖合成反応とを同一条件下で行う。このような反応は、しばしばある程度の加温を必要とすることから、酵素が耐熱性であることは望ましい条件の一つである。耐熱性の酵素を用いることにより、幅広い反応条件に対応することができる。
【0127】
たとえばVent(Exo-)DNAポリメラーゼは、鎖置換活性と共に高度な耐熱性を備えた酵素である。ところでDNAポリメラーゼによる鎖置換を伴う相補鎖合成反応は、1本鎖結合タンパク質(single strand binding protein)の添加によって促進されることが知られている(Paul M.Lizardi et al, Nature Genetics 19, 225-232, July,1998)。この作用を本発明に応用し、1本鎖結合タンパク質を添加することによって相補鎖合成の促進効果を期待することができる。Vent(Exo-)DNAポリメラーゼに対しては、1本鎖結合タンパク質としてT4 gene 32が有効である。
【0128】
なお3'-5'エクソヌクレアーゼ活性を持たないDNAポリメラーゼには、相補鎖合成が鋳型の5'末端に達した部分で停止せず、1塩基突出させた状態まで合成を進める現象が知られている。本発明では、相補鎖合成が末端に至ったときの3'末端の配列が次の相補鎖合成の開始につながるため、このような現象は望ましくない。しかし、DNAポリメラーゼによる3'末端への塩基の付加は、高い確率でAとなる。したがって、dATPが誤って1塩基付加しても問題とならないように、3'末端からの合成がAで開始するように配列を選択すれば良い。また、相補鎖合成時に3'末端がたとえ突出してしまっても、これを消化してblunt endとする3'→5'エクソヌクレアーゼ活性を利用することもできる。たとえば、天然型のVent DNAポリメラーゼはこの活性を持つことから、Vent(Exo-)DNAポリメラーゼと混合して利用することにより、この問題を回避することができる。
【0129】
これらのDNAポリメラーゼに対して、PCRなどで一般に用いられているTaqポリメラーゼ等のDNAポリメラーゼは、通常の条件では鎖置換作用は実質的に見られない。しかし、この種のDNAポリメラーゼであっても、鎖置換が可能な条件を与えることができる場合には、本発明に利用することができる。
【0130】
本発明においては、LAMP法の増幅効率を高めるためにループプライマーを利用することができる。ループプライマーとは、前記FAの伸長生成物におけるFAに由来する領域と、FAに対する任意の領域(つまりFAの5'末端に相補的な塩基配列からなる領域)の間において相補鎖合成の起点を与えることができるプライマーである。RAについても同様に、前記RAの伸長生成物におけるRAに由来する領域と、RAに対する任意の領域(つまりRAの5'末端に相補的な塩基配列からなる領域)の間において相補鎖合成の起点を与えることができるプライマーをループプライマーとして利用することができる。本発明においては、便宜上、FAに対するループプライマーをループプライマーF、RAに対するループプライマーをループプライマーRと記載する。ループプライマーは、LAMP法の生成物の中に、RAやFAがアニールすることができないループを含むものがあることに着目して考え出された。ループプライマーを利用したLAMP法について、本出願人は特許出願している(2000年9月19日出願、特願2000-283862)。ループプライマーをLAMP法に組み合わせることにより、その反応効率は著しく改善される。ループプライマーを利用するときには、ループプライマーFおよび/またはループプライマーRをRA、FA、そして必要に応じてアウタープライマーとともに加えて反応を開始する。ループプライマーのみを後から加えてもその効果を期待することはできるが、反応の効率化を目的とするのであるから、反応開始時より存在させておくのが合理的である。
【0131】
本発明に基づいて、前記本発明の反応を構成する成分を予め組み合わせてキットとすることができる。すなわち本発明は、2つのインナープライマーからなるプライマーセット、鎖置換を伴う相補鎖合成を触媒することができるDNAポリメラーゼ、およびヌクレオチド基質で構成され、前記プライマーセットを構成するインナープライマーの少なくとも1つがチェックプライマーである、変異および/または多型の検出用キットに関する。本発明のキットには、前記インナープライマーに対するアウタープライマーや、内部標準用の別のプライマーセットを組み合わせることができる。また、反応効率を改善するループプライマーを組み合わせることもできる。あるいは、陽性対照や陰性対照として用いる標準試料、取り扱い指示書などを添付することもできる。更に、増幅生成物を検出するための指示薬成分を組み合わせることもできる。指示薬としては、たとえばEtBrのような蛍光染料、あるいは増幅生成物の塩基配列を認識してシグナルを生成するプローブなどを用いることができる。
【0132】
また、前記インナープライマーからなるプライマーセットとして、野生型用および変異型用の2種類のプライマーセットを組み合わせることによって、ヘテロ/ホモのgenotyping用のキットとすることができる。genotypeが複数の変異型を含む場合には、変異型の種類に応じた数のプライマーセットを用いれば、あらゆるgenotypeのホモとヘテロを判定することができるキットとなる。ヘテロとホモの判定は、家系の解析や、genotypeに基づくphenotypeの予測において重要である。
【0133】
前記インナープライマーRAおよびFAを利用し、鎖置換活性を持ったDNAポリメラーゼと組み合わせて2本鎖の核酸を増幅する反応について、基本的な原理を図1−図4に基づいて以下に説明する。この例においては、インナープライマーであるRAおよびFAが増幅用プライマーのセットを構成しており、更にRAは2本鎖として存在する標的塩基配列におけるFAがアニールすべき領域を塩基対結合が可能な状態とするための任意のプライマーとしても作用する。本発明においては特定の領域、すなわちR1が予測された塩基配列で構成されている場合に、以下に述べるような増幅反応が進行する。一方、予測した塩基配列とは異なっていた場合には、R1に対して3'末端であるR1cがアニールを繰り返すたびに相補鎖合成反応が阻害され、原理的には増幅反応は進行しない。また、あるいは一定の確率でR1cを起点とする相補鎖合成が誤って生じたとしても、その生成物はわずかしか生じないので、最終的な結果に与える影響は実質的に無いと言える。
【0134】
上記任意のプライマー(図1-(1)におけるRA)は、まず鋳型となる2本鎖核酸におけるX2c(R2cに相当)にアニールし相補鎖合成の起点となる。このとき2本鎖核酸は不安定化する条件下に置かれており、2本鎖の核酸に対してプライマーが直接相補鎖合成反応の起点として機能する。図1-(2)においてはRAを起点として合成された相補鎖が、鋳型となった2本鎖核酸の一方の鎖を置換し、他方のインナープライマーであるFAがアニールする領域F2cが塩基対結合が可能な状態となっている(図1-(2))。
【0135】
得られた塩基対結合が可能となった領域F2cに対してFAをアニールさせて相補鎖合成を行う。この例においては、更にFAの3’側から相補鎖合成を開始するアウタープライマーF3がアニールする(図2-(4))。アウタープライマーは、各インナープライマーの3’側からの相補鎖合成を開始するように設計されており、しかもインナープライマーよりも低濃度で用いるので、高い確率でインナープライマーよりも低い確率で相補鎖合成を開始する。
【0136】
インナープライマーとしてRA、およびFAを用い、ループプライマーを組み合わせて本発明による変異の検出方法を実施するとき、チェック機構の厳しさは、主としてF1/F1cのTmに左右される。F1/F1cのTmを、許される範囲でできるだけ低く設定することにより、塩基配列の厳密なチェック機構を実現できる。ただしF1/F1cのTmが許容限度を越えて低く設定された場合には、特定の領域の塩基配列が予測された塩基配列であった場合であっても、効率的な増幅反応が期待できなくなる場合がある。たとえば後に述べる実施例においては、60℃の反応条件に対して、F1/F1cのTmが45℃という条件で、効率的な合成が起きている。Tmよりも15℃も高い反応温度は、一般的には、異なるポリヌクレオチド分子のハイブリダイズは期待できない。つまり、効率的な相補鎖合成は期待できない。しかし本発明においては、F1/F1cのアニールが同一分子内で起きるために、反応温度よりも多少低いTmでも、反応効率を犠牲にすることなく、十分な厳しさで塩基配列のチェックが実現できるのである。したがって、異なるポリヌクレオチド間ではハイブリダイズできないが、同一分子内であればハイブリダイズすることができるようにF1/F1c間のTmを設定することは、本発明における有利な条件と言うことができる。たとえば後に述べる実施例5で用いた各プライマーのTmは、以下のとおりである。
【0137】
アウタープライマーF3(R3):60℃
ループプライマーFL:56℃
ループプライマーRL:58℃
インナープライマーFAの3'側F2(またはRAの3'側R2):55℃
インナープライマーFAの5'側F1c(またはRAの5’側R1c):45℃。
【0138】
本発明においては、ループプライマーを組み合わせる場合、反応全体の効率が上がるので、F1c(R1c)のTmが低く設定されていても短時間で高度な増幅反応を期待することができる。つまり、それだけプライマーの長さを短くすることができる。
【0139】
アウタープライマーF3を起点とする相補鎖合成の結果、インナープライマーFAを起点として伸長した合成生成物が置換されて1本鎖となる(図2-(5))。この1本鎖を鋳型として、RA、およびRAに対するアウタープライマーR3が更にアニールと相補鎖合成を開始する(図3-(6))。その結果として生成するRAからの伸長生成物は、その3'末端F1を自身に対してアニールすることができる構造を備える(図3-(8))。
【0140】
なお図3-(6)においては5'末端が自身にアニールしている。しかし5'末端は相補鎖合成の起点とならないことから、この構造では増幅反応を開始することはできない。図3-(6)に対する相補鎖を合成し、更にその3'末端において自身にアニールすることができる構造(図3-(8))が実現して初めて、増幅反応がスタートする。ここまでの反応は、言わば、本発明に用いる増幅反応の準備段階と言える。
【0141】
続いて、本発明によって達成される核酸の増幅反応と特定の領域R1cを構成する塩基配列のチェック機構について、引き続き図面に基づいて具体的に説明する。自身にアニールした3'末端F1(図3-(8))は、相補鎖合成の起点となることができる。このとき3'末端へのアニールはF1/F1c間で生じるので、同じくF1cを持つFAと競合する可能性がある。しかし現実には、同一鎖の隣接する領域に存在する相補的な塩基配列F1/F1cは、優先的にアニールする。したがって、自身を鋳型とする相補鎖合成反応が優先的に始まる。この反応によって、標的塩基配列が1本鎖上に交互に連結された核酸が合成される。更に、3'末端F1の自身へのアニールによって形成されたループ形成領域には、インナープライマーFAがアニールすることができるF2cが存在しており、ここにFAがアニールして相補鎖合成反応が始まる(図3-(8))。ループ部分にアニールするインナープライマーFAの位置関係を図5に示した。ループにアニールしたFAからの相補鎖合成反応は、先に自身を鋳型として3'末端から開始した相補鎖合成反応の生成物を置換し、その3'末端R1を再び自身にアニール可能な状態とする(図4-(9))。この後は、3'末端を起点とする自身を鋳型とする相補鎖合成反応と、ループ部分を起点とするインナープライマーRAを起点とする相補鎖合成反応が交互に起きる。こうして、自身を鋳型として3'末端が繰り返し伸長する反応と、ループ部分からの新たなプライマーによる伸長とが繰り返し生じて、核酸の増幅反応が成立する。
【0142】
一方、自分自身を鋳型として伸長を継続する1本鎖の核酸に対して、そのループ部分にアニールするオリゴヌクレオチドを合成起点として相補鎖合成される核酸に注目すると、ここでも1本鎖上に相補的な塩基配列が交互に連結された核酸の合成が進行している。すなわち、ループ部分からの相補鎖合成は、たとえば図4−(9)においては、R1に達した時点で完了する。そして、この核酸の合成によって置換された3'末端を起点として補鎖合成が始まる(図4−(9))。すると、やがてその反応はかつて合成起点であったループ部分に達して再び置換が始まる。こうしてループ部分から合成を開始した核酸も置換され、その結果同一鎖上にアニールすることができる3'末端R1を得る(図4−(11))。この3'末端R1は同一鎖のR1cにアニールして相補鎖合成を開始する。さて、この反応のFとRを読みかえれば、図3−(8)で起きている反応と同じである。したがって図4−(11)に示す構造は、自身の伸長と新たな核酸の生成を継続する新しい核酸として機能することができる。
【0143】
以上のように、この方法においては、1つの核酸の伸長に伴って、これとは別に伸長を開始する新たな核酸を供給しつづける反応が進行する。更に鎖が伸長するのに従い、末端のみならず、同一鎖上に複数のループ形成配列がもたらされる。これらのループ形成配列は、鎖置換合成反応により塩基対形成可能な状態となると、インナープライマーがアニールし、新たな核酸の生成反応の基点となる。末端のみならず鎖の途中からの合成反応も組み合わされることにより、さらに効率のよい増幅反応が達成されるのである。
【0144】
更に本発明においては、RAに加えてFAもチェックプライマーとすることによって、チェック機構が働く機会を増やすことができる。あるいはRAを鋳型として生成した3'末端のみで特定の領域における塩基配列のチェックを行わせる場合であっても、特定の領域の塩基配列のチェックを経て相補鎖合成反応が進行する。その結果、特定の領域が予測される塩基配列であった場合に生成する相補鎖合成生成物の量と比較して、相違があった場合の生成物の量は大幅に減少する。したがって本発明による変異および/または多型の検出方法は、その原理上、たいへんS/N比に優れた検出方法を提供することができる。
【0145】
以上のように特定構造のプライマーの利用により、伸長とそれに伴う新たな核酸の生成が起きる。更に本発明においては、この新たに生成した核酸自身が伸長し、それに付随する更に新たな核酸の生成をもたらす。一連の反応は、理論的には永久に継続し、きわめて効率的な核酸の増幅を達成することができる。しかも本発明の方法は、すべての反応を等温条件のもとで行うことができる。
【0146】
本発明においてインナープライマーとしてRA、およびFAを用いるときは、一連の反応が常に複数の領域の位置関係を維持した状態でなければ進行しないことが重要な特徴である。更にアウタープライマーを組み合わせる態様においては、少なくとも6つの領域が反応に関与する。この特徴によって、非特異的な相補鎖合成に伴う非特異的な合成反応が効果的に防止できるのである。すなわち、たとえ何らかの非特異的な反応が起きたとしても、その生成物が以降の増幅工程に対して出発材料となる可能性を低く押さえることにつながるのである。
【0147】
またより多くの領域によって反応の進行が制御されているということは、類似した塩基配列の厳密な識別を可能とする検出系を自由に構成できる可能性をもたらす。ヒトCYP2C19のように相互に類似する塩基配列を含む遺伝子の間で、類似する塩基配列の中に存在するSNPsの検出は重要な課題である。しかしPCR法等の公知の遺伝子増幅技術や、あるいはInvader法のような公知のシグナル増幅技術に基づいて、類似する塩基配列中のわずかな変異を一回の増幅反応のみで検出することは困難である。本発明によれば、複数の領域が、予測した塩基配列を備え、しかも特定の位置関係にあるときに限り、高度な増幅反応が起きるようにプライマーを設計することができる。
【0148】
したがって本発明は、たとえばHLAや血小板同種抗原、あるいは病原微生物のタイピングのような、類似する塩基配列を含む複数の遺伝子間の微細な塩基配列の相違の検出に有用である。これらの形質を決定している遺伝子は、その大部分が共通であり、いくつかの領域における変異のパターンに基づいて、タイピングが行われる。複数の領域における塩基配列が予測されたとおりでなければ、一定レベルの増幅生成物を生じることができない本発明の方法は、このような解析に好適である。
【0149】
更に、本発明によれば特定の領域を構成する塩基配列が野生型の塩基配列であるときに増幅が起きるプライマーと、変異型であるときに増幅が起きるプライマーを組みあわせて同一検体のゲノムDNAを解析することにより、ヘテロとホモを明瞭に判定することができる。すなわちいずれか一方でのみ増幅が観察された場合には、被検体は野生型か変異型のいずれかをホモで有することを示している。他方、両方のプライマーで増幅が観察されるときには、変異型と野生型をヘテロで有することを示している。
【0150】
この他本発明は、テーラーメード医療を支える薬剤代謝遺伝子の解析技術としても有用である。薬剤代謝遺伝子は、薬剤に対する感受性を左右する重要な遺伝子である。その活性の違いは、その薬剤の代謝に関与する酵素をコードする遺伝子に見出されるわずかな塩基配列の相違に起因していると考えられている。ヒトゲノムプロジェクトの成果によって、標準的なヒト遺伝子の姿が明らかにされようとしている。この成果の実用的な応用として最も注目されているのが薬剤代謝遺伝子の解析である。したがって本発明は、ポストゲノム時代において高い有用性を持つ技術を提供するものである。
【0151】
なお本明細書において引用された全ての先行技術文献は、参照として本明細書に組み入れられる。
【実施例】
【0152】
以下、実施例に基づいて本発明を更に具体的に説明する。
【0153】
実施例1.ヒトCYP2C19遺伝子における変異の検出(1)
ヒトCYP2C19の遺伝子をPCRにより増幅し、SNPs部分を認識する制限酵素SmaIで消化し野生型(WT)か1塩基変異(m1)かのタイピングを行った。さらに、その結果に基づいてWTおよびm1と判定したPCR産物を、pBluescript IIのEcoRVにクローニングし、塩基配列を決定してSNPs部分の塩基配列を確認した。野生型の塩基配列は、配列番号:5に示した。m1では、配列番号:5の111番目がGではなくAとなっていた(図7)。
【0154】
続いて、本発明に基づいてヒトCYP2C19のWTとm1を識別するためのプライマーとして、次の塩基配列からなるプライマーを設計した。各プライマーと標的塩基配列の関係は、図7に示したとおりである。FAの5'末端が、変異を検出すべき部分を含んでいる。したがって、標的塩基配列のこの領域において予測される塩基配列が存在しない場合、相補鎖合成反応は阻害される。
【0155】
RA(R1+R2)/配列番号:1
5'-GGGAACCCATAACAAATTACTTAAAAACCTGTGTTCTTTTACTTTCTCCAAAATATC-3'
アウタープライマーR3/配列番号:2
5'-AGGGTTGTTGATGTCCATC-3'
FA(F1+F2)/配列番号:3
5'-CGGGAAATAATCAATGATAGTGGGAAAATATGCTTTTAATTTAATAAATTATTGTTTTCTCTTAG-3'
アウタープライマーF3/配列番号:4
5'-CCAGAGCTTGGCATATTGTATC-3'
上記塩基配列からなるプライマーを用い、WTあるいはm1を組み込んだpBluescript II(EcoRIで直鎖状にしたもの)10-19 mol/ tube(約60000分子)を鋳型とし、60℃で2時間反応させた。鋳型は2本鎖のまま反応させた。反応液の組成は次のとおりである。
【0156】
・反応液組成(25μL中)
20 mM Tris-HCl pH 8.8
10 mM KCl
10 mM (NH4)2SO4
4 mM MgSO4
1 M Betaine
0.1% Triton X-100
0.4 mM dNTP
8 U Bst DNA ポリメラーゼ (NEW ENGLAND BioLabs)
プライマー:
1600 nM FA
1600 nM RA
200 nM F3
200 nM R3
【0157】
上記反応液の5μLに5μLのloading bufferを添加し、2%アガロースゲル(0.5% TBE)を使って、0.5時間、100 Vで電気泳動した。泳動後のゲルをエチジウムブロマイド(EtBr)で染色して核酸を確認した。結果は図8に示すとおりである。テンプレート無しと、一塩基違いのm1をテンプレートとしたときは増幅反応が起きなかったが、WTをテンプレートとしたときは増幅生成物が確認された。本発明によって、1塩基の相違を明瞭に識別できることが確認された。
【0158】
実施例2.ヒトCYP2C19遺伝子における変異の検出(2)
実施例1と同じプライマーを用い、本発明に基づく変異の検出方法を実施した。標的塩基配列として、WT、およびm1を組み込んだpBluescript II(EcoRIで直鎖状にしたもの)10-21mol/ tube(約600分子)を用いる他は実施例1と同様の反応液組成とし、64℃で反応させた。反応液中には最終濃度0.25μg/mlになるようにEtBrを添加し、反応はABI Prism 7700(パーキンエルマ社)を用いて6時間追跡した。
【0159】
結果は図9に示した。6時間の反応中、テンプレート無しと一塩基違いのm1をテンプレートとしたときは増幅反応は起きなかった。WTをテンプレートとしたときには、増幅反応に伴う傾向強度の増強が観察された。本発明に基づいて、特定の領域における1塩基の相違を正確に識別できることが確認できた。また本発明に基づく変異の検出方法は、等温で実施することができ、しかも汎用の蛍光測定装置で反応追跡が可能であることが示された。
【0160】
なお、この実施例で用いたABI Prism 7700は、もともとPCR法のモニタリングを目的とする装置である。しかし本発明に基づく検出方法においてはPCR法のような温度サイクルは行っておらず、等温(64℃)でインキュベーションしたのみである。したがって、本実施例に基づく変異の検出方法は、インキュベーターを備えた蛍光測定装置でありさえすれば、実施することができる。
【0161】
実施例3.ヒトCYP2C19遺伝子における変異の検出(3)
本発明による塩基配列の変異検出方法の特異性を確認するために、以下の実験を行った。すなわち、特定の領域に予測される塩基配列を変異型とした場合と、野生型とした場合のそれぞれについてプライマーを設定し、本発明による変異の検出方法を試みた。用意したプライマーの塩基配列は次のとおりである。実施例1、2と同様にヒトCYP2C19遺伝子を鋳型とし、検出すべき変異に対して、変異がある場合(MUT)に増幅が起きるプライマーセット(予測される塩基配列が変異型)と、野生型(WT)の場合に増幅が起きるプライマーセット(予測される塩基配列が野生型)を用いた。各プライマーと標的塩基配列の関係は、図10に示したとおりである。FAおよびRAの両者の5'末端から2番目の塩基が、SNPsに相当する。
【0162】
野生型検出用プライマーセット
FA(F1+F2)/配列番号:6
: 5'-CCGGGAAATAATCAATGTAATTTAATAAATTATTGTTTTCTCTTAG-3'
RA(R1+R2) /配列番号:7
: 5'-CGGGAACCCATAACTGTTCTTTTACTTTCTCC-3'
変異型検出用プライマーセット
FA(F1+F2) /配列番号:8
: 5'-CAGGAACCCATAACAAATTACTTAGTGTTCTTTTACTTTCTC-3'
RA(R1+R2) /配列番号:9
: 5'-CAGGAACCCATAACAAATGTGTTCTTTTACTTTCTCC-3'
アウタープライマーR3には配列番号:2、アウタープライマーF3には配列番号:4に示す塩基配列からなるプライマーを用いた(実施例1と同じ)。
【0163】
上記塩基配列からなるプライマーを用い、WTあるいはm1を組み込んだpBluescript II(EcoRIで直鎖状にしたもの)6000分子/ tubeを鋳型とし、95℃で3分間処理後、下記の反応液に添加し反応液量を25μLとして60℃で3時間反応させた。反応液の組成は次のとおりである。
【0164】
・反応液組成(25μL中)
20mM Tris-HCl pH 8.8
10mM (NH4)2SO4
10mM KCl
3.5mM MgSO4
1M Betaine
0.1% Triton X-100
0.4mM dNTPs
8U Bst DNA ポリメラーゼ
1600nM FA
1600nM RA
200nM F3
200nM R3
反応液中には最終濃度0.25μg/mlになるようにEtBrを添加し、反応はABI Prism 7700(パーキンエルマー社)を用いて3時間追跡した。
【0165】
結果は図11に示した。また、反応後の上記反応液の5μLを実施例1と同じ操作で電気泳動した結果を図12に示した。3時間の反応中、野生型用プライマーセットおよび変異型プライマーセットのいずれも、鋳型が予測された塩基配列であった場合にのみ増幅反応が進行していることが確認できた。またわずか6000分子の鋳型を用いた実験であるにもかかわらず増幅反応は100分程度でプラトーに達し、本発明による検出方法の感度の高さが証明された。6000分子のDNAは、ちょうど血液1μLに含まれる白血球に由来するゲノムの数に相当する。成人の白血球数の正常値が4000〜8000と言われていることから、中間値6000がちょうど白血球の数に相当する。血液に含まれるDNAの大部分が白血球に由来するものであることから、白血球の数は血液中に存在するDNAの数を意味する。すなわち、6000分子のDNAを解析できる条件とは、1μLの血液を試料として遺伝子の解析ができることを意味している。
【0166】
一方で、鋳型の塩基配列が予測された塩基配列でなかった場合には、野生型用プライマーセット、変異型プライマーセットのいずれにおいても、3時間の反応で増幅は観察されなかった。本発明による変異検出方法が、わずかな試料によって信頼性の高い塩基配列のチェック機構を実現していることが示された。
【0167】
実施例4.ヒトp450CYP2C19遺伝子における特異性の検討
本発明による変異検出方法の特異性を検討するために、変異を検出すべき鋳型と類似する塩基配列からなる鋳型を100倍量で用いた実験を行った。変異を検出すべき鋳型としては実施例3と同じヒトp450CYP2C19遺伝子を用いた。一方、この遺伝子と塩基配列が類似する鋳型としては、ヒトp450CYP2C9遺伝子、およびヒトp450CYP2C18遺伝子を用いた。これらの遺伝子についても実施例1と同様にpBluescript IIにクローニングし塩基配列を確認した上で実験に用いた。
【0168】
ヒトp450CYP2C19を6000分子に代えて、600000分子のヒトp450CYP2C9遺伝子およびヒトp450CYP2C18遺伝子を鋳型としてチューブに加えた他は実施例3と同じ条件で反応させた。
【0169】
結果は図13に示したとおりである。野生型用プライマーセットでは、CYP2C19WT DNA 6000分子で増幅が見られたのに対して、CYP2C9、CYP2C18遺伝子では600000分子でも増幅は観察されなかった。同様に変異型用プライマーセットにおいても、CYP2C19MUT DNA 6000分子で増幅が見られたのに対して、CYP2C9、CYP2C18遺伝子では600000分子でも増幅は観察されなかった。以上の結果より、本発明による変異検出方法は、相互に類似する塩基配列からなる遺伝子群の中でも、目的とする塩基配列を類似する塩基配列から識別することができ、しかも目的とする変異は正確に検出できることが示された。
【0170】
図6にも示すように、p450CYP2C19、p450CYP2C9、およびp450CYP2C18の塩基配列は極めて類似性が高い。公知の塩基配列の検出法では、これほど類似性の高い塩基配列を識別し、同時に変異を検出することは不可能と言って良い。
【0171】
実施例5.ループプライマーを用いた検討1
−ヒトp450CYP2C19遺伝子におけるSNPs検出−
本出願人によって見出されたループプライマー(2000年9月19日出願、特願2000-283862)によるLAMP法の反応効率の改善効果が、本発明による変異検出方法においても有効であることを確認するために、以下の実験を行った。
【0172】
まず以下の塩基配列からなるプライマー、およびループプライマーを設計した。ループプライマーとは、FAの伸長生成物上のF2とF1の間において相補鎖合成の起点を与えることができるプライマーである。RAについても同様に、前記RAの伸長生成物におけるR2とR1の間において相補鎖合成の起点を与えることができるプライマーをループプライマーとして用いる。具体的には、以下の塩基配列からなるループプライマーを設定した。野生型(WT)用、変異型(MUT)用の各プライマーセットに対してループプライマーは共通である。反応に用いた各プライマーと標的塩基配列の関係を図14に示した。実施例3と同様に、FAおよびRAの両者の5'末端から2番目の塩基が、SNPsに相当する。
【0173】
野生型検出用プライマーセット
FA(F1+F2)/配列番号:10
: 5'- CCGGGAAATAATCTAATTTAATAAATTATTGTTTTCTCTTAG-3'
RA(R1+R2) /配列番号:11
: 5'-CGGGAACCCTGTTCTTTTACTTTCTCC-3'
変異型検出用プライマーセット
FA(F1+F2) /配列番号:12
: 5'-CTGGGAAATAATCATAATTTAATAAATTATTGTTTTCTCTTAG-3'
RA(R1+R2) /配列番号:13
: 5'-CAGGAACCCATATGTTCTTTTACTTTCTCC-3'
ループプライマーFL/配列番号:14
: 5'-GATAGTGGGAAAATTATTGC-3'
ループプライマーRL/配列番号:15
: 5'-CAAATTACTTAAAAACCTTGCTT-3'
アウタープライマーR3には配列番号:2、アウタープライマーF3には配列番号:4に示す塩基配列からなるプライマーを用いた(実施例1と同じ)。
【0174】
上記プライマーセットに、ループプライマーを組み合わせ、WTあるいはm1を組み込んだpBluescript II(EcoRIで直鎖状にしたもの)6000分子/ tubeを鋳型とし、95℃で3分間処理後、下記の反応液に添加し反応液量を25μLとして60℃で3時間反応させた。反応液の組成は次のとおりである。
【0175】
反応組成(25μL中)
20mM Tris-HCl pH 8.8
10mM (NH4)2SO4
10mM KCl
4.0mM MgSO4
1M Betaine
0.1% Triton X-100
0.5mM dNTPs
8U Bst DNA ポリメラーゼ
1600nM FA
1600nM RA
200nM F3
200nM R3
800nM FL
800nM RL
鋳型DNA 6000分子/ tube
反応液中には最終濃度0.25μg/mlになるようにEtBrを添加し、反応はABI Prism 7700(パーキンエルマー社)を用いて1時間追跡した。結果は図15に示した。
【0176】
ループプライマーを用いない反応では、WT用プライマーで反応開始後約70分からMUT用プライマーで約80分から増幅生成物による蛍光シグナルの増加が観察された(図11)た。一方、ループプライマーを用いた反応では野生型用、変異型用の両方のプライマーで、反応開始後約20分から増幅生成物による蛍光シグナルの増加が観察されている(図15)。ループプライマーの応用によって、反応速度が速くなることが確認された。
【0177】
一方、SNPsの識別においては、ループプライマーを用いてもループプライマーを用いない時と同様に、1塩基の違いを識別しながら増幅反応が起こっていることが確認された。ループプライマーの添加によって、特異性を犠牲にすることなく反応速度を大幅に向上させることが確認できた。
【0178】
実施例6.ループプライマーを用いた検討2
−ヒトp450CYP2C19遺伝子における特異性の検討−
鋳型として類似する塩基配列からなるDNAを100倍量用いて、ループプライマーを応用した場合の本発明による変異検出方法の特異性を検討した。ヒトp450CYP2C19を6000分子に代えて、600000分子のヒトp450CYP2C9遺伝子およびヒトp450CYP2C18遺伝子を鋳型としてチューブに加えた他は実施例5と同じ条件で反応させた。
【0179】
結果は図16に示したとおりである。野生型用プライマーセットでは、CYP2C19WT DNA 6000分子で増幅が見られたのに対して、CYP2C9、CYP2C18遺伝子では600000分子でも増幅は観察されなかった。同様に変異型用プライマーセットにおいても、CYP2C19MUT DNA 6000分子で増幅が見られたのに対して、CYP2C9、CYP2C18遺伝子では600000分子でも増幅は観察されなかった。以上の結果より、ループプライマーを応用した場合であっても、本発明による変異検出方法は、相互に類似する塩基配列からなる遺伝子群の中でも、目的とする塩基配列を類似する塩基配列から識別することができ、しかも目的とする変異は正確に検出できることが示された。
【0180】
実施例7.血液検体を用いた検討
ボランティアより提供された血液(35検体)から、QIAamp DNA Blood Kit (キアゲン)を用いてDNAを抽出した。抽出したDNAは、特開平10-14585に記載されているプライマー配列を用いてヒトp450CYP2C19遺伝子のm1領域をPCRにより増幅した。増幅は、Z-Taq ポリメラーゼ(宝酒造)を用いてZ-Taq用のプロトコールに準じて行った。
【0181】
得られたPCR産物をPCR-RFLPにより解析した。操作は以下のとおりである。まずPCR産物3μLを制限酵素Msp Iで37℃3時間消化し、4%アガロースゲル(Amplisize Agarose,BIO-RAD)で電気泳動した。泳動後、ゲルをSYBR-Green I(FMC)で染色し、DNAのバンドのパターンを検出することによりm1領域のタイピングを行った。
【0182】
このうち、m1領域について野生型ホモ(WT/WT)、野生型/変異型ヘテロ(WT/MUT)、および変異型ホモ(MUT/MUT)を各3検体、合計9検体について本発明に基づく変異の検出方法によって解析した。用いた9検体については、PCR産物の塩基配列を決定し、PCR-RFLPによるタイピング結果が正しい事を確認した。実施例5に記載のプロトコルにしたがって、本発明による変異の検出方法を実施した。ただし、検体DNAは計算上血液1μL分より抽出された量を用いた。すなわち、7mlの血液から抽出したDNAの1/7000を検体DNAとして加えた。
【0183】
その結果、本発明による変異の検出方法の結果は、9検体全てでPCR-RFLPの結果と一致した。このうち、検体No.10(PCR-RFLPの結果WT/WT)、検体No.11(PCR-RFLPの結果WT/MUT)、検体No.8(PCR-RFLPの結果MUT/MUT)についての反応を図17に示した。
【0184】
野生型ホモ(WT/WT)検体では野生型(WT)用プライマーセットでのみ増幅反応が起こり、変異型(MUT)用のプライマーでは増幅反応が起きなかった。ヘテロ(WT/MUT)検体では野生型(WT)用、変異型(MUT)用の両方のプライマーセットで同じ様に遺伝子が増幅された。変異型ホモ(MUT/MUT)検体では変異型(MUT)用のプライマーでのみ増幅反応が起き、野生型(WT)用プライマーでは増幅反応は起こらなかった。このことは、野生型用と変異型用のプライマーセットを組み合わせて反応させることによって、次のようなマトリクスに基づいて、ホモとヘテロを容易に判定できることを示している。
【0185】
野生型 変異型
野生型ホモ + −
変異型ホモ − +
ヘテロ + +
【0186】
さらに増幅された核酸については、塩基配列を決定し、CYP2C19遺伝子であることを確認した。血液に由来する検体DNA中では、CYP2C19遺伝子の他にCYP2C9、CYP2C18等の類似配列が多数混在するが、そのような類似配列存在下でも、目的とするCYP2C19遺伝子のみを特異的に増幅し、かつ、1塩基の違いを識別するという反応が一回の増幅反応でおこなえた。従って類似配列が多数存在する遺伝子のSNPタイピングが一回の増幅反応の有無のみで判定できる事が確認された。
【特許請求の範囲】
【請求項1】
以下の要素を含む、標的塩基配列における特定の領域の変異および/または多型の存在を、相補鎖合成反応生成物の有無により検出するためのプライマーセット。
1)以下の構成を含む、標的塩基配列における特定の領域の変異および/または多型の存在を、相補鎖合成反応生成物の有無により検出するための第1のプライマー:
i)前記標的塩基配列を構成する一方の鎖の3’側を規定する領域に対してアニールすることができ、相補鎖合成の起点を与える、3'末端の領域、および
ii)このプライマーを起点とする相補鎖合成反応生成物上の領域を構成し、前記特定の領域の塩基配列に相補的な塩基配列を備える、5'側の領域、
2)標的塩基配列の他方の鎖の3'側を規定する領域に対してアニールすることができ、相補鎖合成の起点を与える第2のプライマー、
3) 標的塩基配列における第1のプライマーがアニールすべき領域の3'側にアニールして相補鎖合成反応の起点を与える第3のプライマー、および、
4)標的塩基配列における第2のプライマーがアニールすべき領域の3'側にアニールして相補鎖合成反応の起点を与える第4のプライマー。
【請求項2】
さらに付加的に以下のプライマーを含む、請求項1に記載のプライマーセット。
5)第1のプライマーの伸長生成物における以下の2つの領域に挟まれた領域の塩基配列と相同な塩基配列において相補鎖合成の起点を与える第1のループプライマー。
i)第1のプライマーに由来する領域、
ii)第1のプライマーの5'側領域に相補的な領域。
【請求項3】
第2のプライマーが以下の構成を含むことを特徴とする、請求項1又は2に記載のプライマーセット。
1)標的塩基配列を構成する他方の鎖の3'側を規定する領域に対してアニールすることができ、相補鎖合成の起点を与える、3'末端の領域、および
2) このプライマーを起点とする相補鎖合成反応生成物上の領域を構成し、標的塩基配列の特定の領域の塩基配列に相補的な塩基配列を備える、5'側の領域。
【請求項4】
以下の要素を含む、標的塩基配列における特定の領域の変異および/または多型の存在を検出するためのキット。
1)請求項1又は2に記載のプライマーセット、
2)鎖置換型DNAポリメラーゼ、および、
3)ヌクレオチド基質。
【請求項5】
さらに融解温度調整剤を含む、請求項4に記載のキット。
【請求項1】
以下の要素を含む、標的塩基配列における特定の領域の変異および/または多型の存在を、相補鎖合成反応生成物の有無により検出するためのプライマーセット。
1)以下の構成を含む、標的塩基配列における特定の領域の変異および/または多型の存在を、相補鎖合成反応生成物の有無により検出するための第1のプライマー:
i)前記標的塩基配列を構成する一方の鎖の3’側を規定する領域に対してアニールすることができ、相補鎖合成の起点を与える、3'末端の領域、および
ii)このプライマーを起点とする相補鎖合成反応生成物上の領域を構成し、前記特定の領域の塩基配列に相補的な塩基配列を備える、5'側の領域、
2)標的塩基配列の他方の鎖の3'側を規定する領域に対してアニールすることができ、相補鎖合成の起点を与える第2のプライマー、
3) 標的塩基配列における第1のプライマーがアニールすべき領域の3'側にアニールして相補鎖合成反応の起点を与える第3のプライマー、および、
4)標的塩基配列における第2のプライマーがアニールすべき領域の3'側にアニールして相補鎖合成反応の起点を与える第4のプライマー。
【請求項2】
さらに付加的に以下のプライマーを含む、請求項1に記載のプライマーセット。
5)第1のプライマーの伸長生成物における以下の2つの領域に挟まれた領域の塩基配列と相同な塩基配列において相補鎖合成の起点を与える第1のループプライマー。
i)第1のプライマーに由来する領域、
ii)第1のプライマーの5'側領域に相補的な領域。
【請求項3】
第2のプライマーが以下の構成を含むことを特徴とする、請求項1又は2に記載のプライマーセット。
1)標的塩基配列を構成する他方の鎖の3'側を規定する領域に対してアニールすることができ、相補鎖合成の起点を与える、3'末端の領域、および
2) このプライマーを起点とする相補鎖合成反応生成物上の領域を構成し、標的塩基配列の特定の領域の塩基配列に相補的な塩基配列を備える、5'側の領域。
【請求項4】
以下の要素を含む、標的塩基配列における特定の領域の変異および/または多型の存在を検出するためのキット。
1)請求項1又は2に記載のプライマーセット、
2)鎖置換型DNAポリメラーゼ、および、
3)ヌクレオチド基質。
【請求項5】
さらに融解温度調整剤を含む、請求項4に記載のキット。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【公開番号】特開2013−31463(P2013−31463A)
【公開日】平成25年2月14日(2013.2.14)
【国際特許分類】
【出願番号】特願2012−253090(P2012−253090)
【出願日】平成24年11月19日(2012.11.19)
【分割の表示】特願2010−288207(P2010−288207)の分割
【原出願日】平成12年11月7日(2000.11.7)
【出願人】(000120456)栄研化学株式会社 (67)
【Fターム(参考)】
【公開日】平成25年2月14日(2013.2.14)
【国際特許分類】
【出願日】平成24年11月19日(2012.11.19)
【分割の表示】特願2010−288207(P2010−288207)の分割
【原出願日】平成12年11月7日(2000.11.7)
【出願人】(000120456)栄研化学株式会社 (67)
【Fターム(参考)】
[ Back to top ]

