弱塩基性薬物を含む組成物及び徐放性剤形
本発明は、弱塩基性薬物コアと、アルカリ性緩衝剤の層と、徐放性コーティングとを含有する微粒子を含む医薬組成物、及びかかる組成物の製造方法に関する。本発明はまた、口腔内崩壊錠、従来の錠剤、及びカプセルを含む医薬剤形、並びにその調製方法にも関する。
【発明の詳細な説明】
【技術分野】
【0001】
関連出願の相互参照
本願は、あらゆる目的から全体として参照により本明細書に援用される2008年4月15日出願の米国仮特許出願第61/045,170号明細書に対する優先権を主張する。
【背景技術】
【0002】
多くの治療剤は、吸収部位又はその近傍において一定の速度で利用可能になるときに最も有効となる。このように利用可能となる治療剤の吸収は、概して所望の血漿濃度をもたらすため、効力は最大となり、且つ中毒性の副作用は最小限となる。経口適用向けの浸透圧装置など、高度な薬物送達システムの開発に多大な注力がなされてきた。しかしながら、マトリックス錠剤などの、溶出速度を制御する高分子を含む単純な薬物送達システム、又は機能性高分子で被覆された単体若しくは複合粒子システムは、1日1回又は1日2回の投薬レジメンに好適な目的の薬物動態(PK)プロファイルを提供することができない場合もある。
【0003】
胃腸管から薬物を十分に吸収させるには、薬物はその剤形から放出され、吸収部位又はその近傍において溶液の形態で利用可能とならなければならない。薬物が溶解して剤形から放出される速度は、薬物吸収の動態にとって重要である。剤形、ひいては活性成分は、通過中、pH約1.2(絶食時の胃)から約7.0(胆管又は腸管)まで異なる様々なpHに曝露される。さらに、消化管の各部における剤形の通過時間は、剤形のサイズ及び消化管内の局所条件によって大きく異なり得る。薬物吸収に影響を及ぼす他の要因としては、pKa、溶解度、結晶エネルギー、及び比表面積などの薬物物質それ自体の物理化学的特性が挙げられる。重要な役割を果たす消化管内のそのときの局所条件としては、管腔の内容物の特性(pH、表面張力、容積、撹拌及び緩衝能)並びに食物摂取後の変化が挙げられる。従って、一定の速度で薬物放出を実現することは、多くの場合に困難であり、特に、極めて溶けやすい又は溶けやすい弱塩基性薬物の場合には、それが酸性pH条件下では急速に放出されるためにドーズダンピングが起こることから、困難である。持続放出プロファイルを実現するため、錠剤又は薬物を含むペレットコアに対して、水溶性高分子(例えば、ポビドン)、水不溶性高分子(例えば、エチルセルロース)、又は腸溶性高分子(例えば、胃抵抗性のフタル酸ヒプロメロース)などの合成高分子の好適な組み合わせを含む機能性高分子膜が塗布されているが、その効果は限られている。
【0004】
従来の錠剤及びカプセルに代わるものとして、より簡便で、且つ潜在的により安全であるため、口腔内崩壊性の剤形が徐々に広まりつつある。こうした速崩壊性の剤形は口腔内で崩壊し、水なしに飲み込むことが容易なものである。これは、従来の錠剤及びカプセルの嚥下が困難な人(高齢患者及び小児患者によく見られる);水を容易に入手できない人(例えば、寝たきりの、若しくは動くことのできない患者、又は外出の多い忙しい人);及び担当する患者が薬の服用を嫌がる介護者といった人口の50%にとって有益である。口腔内崩壊性剤形は、投与が容易で、場所を問わず目立たないように服用するのに好都合で、且つ一度投与すると吐き捨てることが困難であるため、経口投薬レジメンに伴う患者コンプライアンスの向上に役立つ。しかしながら、こうした剤形は、口腔内の唾液と接触したときに急速に崩壊する必要があるだけでなく、許容可能な官能特性(すなわち、美味である)と、特定の薬物及び治療病態に適した薬物動態特性(すなわち、薬物放出の速度及び持続時間)も有しなければならない。これらの特性は、互いに対立することが多い。従って、1日1回又は1日2回の投薬レジメンのための、1.2〜6.8の生理学的pH範囲に溶けやすい弱塩基性薬物を含有する口腔内崩壊錠(ODT)の開発は、特に難題である。
【0005】
弱塩基性薬物は、酸性条件下では急速に放出されるため、1日1回又は1日2回の投薬レジメンに好適な目的のPKプロファイルを提供できないことが多い。さらに、塩基性薬物は、胃から結腸まで通過すると溶解度が約1〜2桁低下するため、治療効果をもたらすために高用量が必要な場合には作用し難い。より低いpH範囲、すなわち、pH1.2〜6.8において薬物放出を持続させることを目的として極端に厚いコーティングを塗布すれば、薬物は、実際に有用となるには非常に遅い速度でコーティング膜を通じて拡散することにより放出される。
【0006】
双方とも2007年1月29日に出願された同時係属中の米国特許出願第11/668,167号明細書(米国特許出願公開第2007/0190145号明細書として公開)及び米国特許出願第11/668,408号明細書(米国特許出願公開第2007/0196491号明細書として公開)は、独立した層の弱塩基性薬物と有機酸とを含む医薬組成物を開示している。
【発明の概要】
【課題を解決するための手段】
【0007】
一実施形態において、本発明は、複数の徐放性粒子を含む医薬組成物に関し、ここで各粒子は、弱塩基性薬物を含むコアと;薬物コアを覆って配置されたアルカリ性緩衝層と;アルカリ性緩衝層を覆って配置された徐放性コーティングであって、水不溶性高分子を含む徐放性コーティングとを含む。
【0008】
一実施形態において、本発明は、複数の徐放性粒子を含む医薬組成物に関し、ここで各粒子は、pKaが約5〜約14で、室温の水溶液に対する溶解度がpH約1.2〜6.8では少なくとも200mg/mLで、且つpH8以上では溶解度が約10mg/mL以下の、少なくとも1つの窒素含有部分を含有する弱塩基性薬物を含むコアと;薬物コアを覆って配置されたアルカリ性緩衝層と;アルカリ性緩衝層を覆って配置された徐放性コーティングであって、水不溶性高分子を含む徐放性コーティングとを含む。
【0009】
別の実施形態において、本発明は医薬組成物の調製方法に関し、この方法は、(a)弱塩基性薬物を含むコアを調製するステップと;(b)ステップ(a)のコアを、アルカリ性緩衝剤を含む層で被覆するステップと;(c)ステップ(b)のアルカリ性緩衝層を有するコアを、徐放性層で被覆するステップとを含む。
【0010】
別の実施形態において、本発明は、複数の粒子を含む医薬剤形に関する。各粒子は、弱塩基性薬物を含むコアと;コアを覆って配置されたアルカリ性緩衝層と;アルカリ性緩衝層を覆って配置された徐放性コーティングであって、場合により腸溶性高分子又は水溶性高分子と組み合わせた水不溶性高分子を含む徐放性コーティングとを含む。
【0011】
さらに別の実施形態において、本発明は、少なくとも2つの薬物粒子集合を含む医薬剤形に関する。一つの薬物粒子集合は、弱塩基性薬物を含むコアを含み、一方、第2の薬物粒子集合は、弱塩基性薬物を含むコアと、薬物コアを覆って配置されたアルカリ性緩衝層と;アルカリ性緩衝層を覆って配置された徐放性コーティングであって、水不溶性高分子を単独で、又は腸溶性高分子と組み合わせて含む徐放性コーティングとを含む。
【0012】
さらに別の実施形態において、本発明は、少なくとも2つの薬物粒子集合を含む医薬剤形に関する。一つの薬物粒子集合は、弱塩基性薬物を含むコアを含み、一方、第2の薬物粒子集合は、弱塩基性薬物を含むコアと、薬物コアを覆って配置されたアルカリ性緩衝層と;アルカリ性緩衝層を覆って配置された徐放性コーティングであって、水不溶性高分子を単独で、又は水溶性高分子と組み合わせて含む徐放性コーティングとを含む。
【0013】
別の実施形態において、本発明は、医薬剤形の調製方法に関する。一実施形態において、医薬剤形は、本明細書に記載される微粒子を、崩壊剤と組み合わせたサッカリド及び/又は糖アルコールを含む速分散性顆粒と混合して圧縮ブレンドを形成し、そのブレンドを圧縮して錠剤にすることにより調製される。別の実施形態において、医薬剤形は、本明細書に記載される微粒子をカプセルに充填することにより調製される。
【図面の簡単な説明】
【0014】
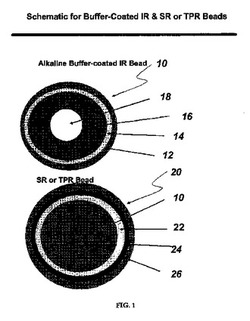
【図1】アルカリ性緩衝剤コートを有するIRビーズ(上図)と、本発明の特定の実施形態に従う弱塩基性薬物を含むアルカリ性緩衝剤コートを有するIRビーズを含むSR又はTPRビーズ(下図)との断面を示す。図1(上側の略図)では、アルカリ性緩衝剤コートを有するIRビーズ10は、保護シーラント層14を覆って配置されたアルカリ性緩衝層12を含み、保護シーラント層14は、糖、球状ラクトース、微結晶性セルロース、マンニトール−微結晶性セルロース、又は二酸化ケイ素を含む不活性コア18を覆って配置された弱塩基性薬物層16を覆って配置される。同じ図(下側の略図)において、SR又はTPRビーズ20は、徐放性コーティング(SR又はTPR層)24を覆って配置された圧縮性コーティング層26を含み、徐放性コーティング24はシーラント層22を覆って配置され、シーラント層22は、アルカリ性緩衝剤コートを有するIRビーズ10を覆って配置される。
【発明を実施するための形態】
【0015】
引用文献は全て、あらゆる目的から全体として参照により本明細書に援用される;いずれの文献の引用も、それが本発明に関する先行技術であることを認めるものと解釈されてはならない。
【0016】
用語「薬物」、「活性」又は「活性医薬成分」は、本明細書で使用されるとき、薬学的に許容可能で、且つ治療上有効な化合物、その薬学的に許容可能な塩、立体異性体及び立体異性体の混合物、溶媒和物(水和物を含む)、多形、及び/又はエステルを含む。本発明の様々な実施形態の記載において薬物というとき、その参照には、基本となる薬物、その薬学的に許容可能な塩、立体異性体及び立体異性体の混合物、溶媒和物(水和物を含む)、多形、及び/又はエステルが包含される。
【0017】
用語「口腔内崩壊錠」すなわち「ODT」は、投与後、例えば噛み砕く必要なしに患者の口腔内で急速に崩壊する錠剤を指す。崩壊速度は様々であり得るが、投与後直ちに嚥下することを意図した従来の固形剤形(すなわち、錠剤若しくはカプセル)又はチュアブル錠型の固形剤形の崩壊速度より速い。
【0018】
用語「約」は、本明細書で数量を参照して使用されるとき、「正確に」を含む。例えば、「約60秒」は、正確に60秒と、加えて60秒に近い値(例えば、50秒、55秒、59秒、61秒、65秒、70秒等)とを含む。
【0019】
用語「弱塩基性薬物」は、pKaが約5〜約14の範囲の、1個又は複数の窒素部分を含有する薬物であって、酸性及び中性pH条件下(すなわち約1.2から約6.8のpHに至るまでのpH)では極めて溶けやすい乃至溶けやすいが、pH6.8を上回ると難溶性となる薬物を包含する。溶解度を指す用語(例えば、「極めて溶けやすい」、「溶けやすい」、「難溶性」等)は、U.S.Pharmacopeia(第26巻、NF 21、2003年)の定義と同じ意味を有し、但し提供される溶解度の限度はおおよその限度を表すと理解されるものとする。例えば、「極めて溶けやすい」は、室温で規定のpHにおいて水又は水溶液1mL当たり約1g以上の溶質の溶解度を有することを意味し;「溶けやすい」は、室温で規定のpHにおいて水又は水溶液1mL当たり約100〜約1000mgの溶質の溶解度を有することを意味し;「難溶性」は、室温で水1mL当たり約100mg未満の溶質の溶解度を有することを意味する。
【0020】
本明細書で使用されるとき、用語「徐放性」コーティングは、徐放性コーティングで被覆された粒子からの薬物の放出を遅延させ、放出を延長し、放出を持続させ、放出を抑制し、及び/又は放出をその他の形で長引かせるコーティングを包含する。用語「徐放性」は、「持続放出」及び「時限パルス放出」を包含する。徐放性コーティングは、本明細書では「ラグタイム」コーティングとも称され得る。
【0021】
本明細書で使用されるとき、用語「即時放出コア」は、場合によりシーラント層を有するが、但し徐放性コーティングでは被覆されない、薬物を含有するコアを指す。「即時放出コア」は、薬物結晶(又は非晶質粒子)、1つ若しくは複数の賦形剤を有する薬物の顆粒、又は薬物層を重ねた不活性コア(例えば、球状糖)(及び任意の結合剤)と、保護シーラントコーティングと、任意のアルカリ性緩衝層とを含むことができる。「即時放出コア」は、本明細書に記載されるとおりの即時放出特性を有する。長期放出性の粒子(例えば、SR粒子、TPR粒子等)は、即時放出コアを長期放出性のコーティングで被覆することにより調製することができる。
【0022】
本明細書で使用されるとき、用語「即時放出」すなわちIRは、剤形の投与後約2時間以内、より詳細には約1時間以内に活性成分の約50%以上(特に口腔内崩壊性の剤形に取り込むため味マスキングが施されている場合)、好ましくは約75%超、より好ましくは約90%超、及び特定の実施形態に従えば約95%超が放出されることを指す。
【0023】
用語「TPR粒子」又は「TPRビーズ」は、TPR(「時限パルス放出」)コーティングで被覆された薬物含有粒子、例えば、薬物層を有するビーズ、薬物を含有する顆粒、又は薬物粒子を指す。TPRコーティングは、薬物の即時放出パルス又は持続性の薬物放出プロファイルを所定のラグタイム後にもたらす。用語「ラグタイム」は、薬物含有粒子の経口投与後、又は二段階溶出溶媒若しくは1つ以上の模擬体液への曝露後、薬物含有粒子から放出される薬物が約10%未満である期間を指す。一実施形態において、用語「ラグタイム」は、二段階溶出溶媒又は1つ以上の模擬体液への曝露後、粒子から薬物が実質的に放出されない期間を指す。いくつかの実施形態において、例えば、少なくとも1つの水不溶性高分子と少なくとも1つの腸溶性高分子との組み合わせ(例えば、エチルセルロースとフタル酸ヒプロメロースとの組み合わせ)で粒子を被覆することにより、少なくとも約1〜10時間のラグタイムが実現される。一実施形態において、ラグタイムは、約2〜約10時間の範囲である。TPR層は、場合により可塑剤を含有し得る。
【0024】
用語「持続放出性コーティング」すなわち「SRコーティング」は、持続放出特性をもたらすコーティング、例えば、薬物含有粒子からの薬物の放出を緩徐化し、但し感知され得る「ラグタイム」は提供しないコーティングを指す。一実施形態において、SRコーティングは水不溶性高分子と、場合により水溶性高分子とを含む。
【0025】
用語「実質的に崩壊する」は、ODT組成物の崩壊が少なくとも約50%、少なくとも約60%、少なくとも約70%、少なくとも約80%、少なくとも約90%、又は約100%の崩壊に達する崩壊レベルを意味する。
【0026】
IR粒子の味マスキング層(存在する場合)に関して、用語「味を実質的にマスキングする」は、患者の口腔内に苦味のある薬物が放出されるのを実質的に阻止する味マスキング層の能力を指す。薬物の味を「実質的にマスキングする」味マスキング層により、患者の口腔内に放出されるのは、典型的には薬物の約10%未満であり、他の実施形態では、薬物の約5%未満、約1%未満、約0.5%未満、約0.1%未満、約0.05%未満、約0.03%未満、約0.01%未満である。本発明の組成物の味マスキング層の味マスキング特性は、インビボで(例えば、当該技術分野において公知の従来の官能検査法を用いて)、又はインビトロで(例えば、本明細書に記載されるとおりの溶出試験を用いて)計測することができる。当業者は、薬物の味を「実質的にマスキングする」味マスキング層に関連する薬物放出量が、本明細書に明示的に開示される範囲に限られず、薬物の知覚される苦味、及び例えば組成物中の香料剤の存在などの他の要因によって変わり得ることを認識するであろう。
【0027】
用語「血漿濃度−時間プロファイル」、「Cmax」、「AUC」、「Tmax」、及び「排出半減期」は、「FDA Guidance for Industry:Bioavailability and Bioequivalence Studies for Orally Administered Drug Products」(2003年3月)に定義されるとおりの、それらの一般に認められている意味を有する。
【0028】
特に明記しない限り、本明細書に記載される様々なコーティング又は層の量(「コーティング重量」)は、被覆前の粒子又はビーズの初期重量に対する、乾燥後のコーティングによってもたらされる粒子又はビーズの重量増加百分率で表される。従って、10%のコーティング重量は、乾燥後に粒子の重量が10%増加するコーティングを指す。特に明記しない限り、比は重量で計算される。
【0029】
一実施形態において、本発明は、複数の徐放性粒子を含む医薬組成物に関し、ここで各粒子は、弱塩基性薬物を含むコアと;コアを覆って配置されたアルカリ性緩衝層と;アルカリ性緩衝層を覆って配置された徐放性コーティングとを含む。詳細な実施形態において、徐放性コーティングは水不溶性高分子を含む。本発明の特定の実施形態に従えば、本医薬組成物は、pKaが約5〜約14で、且つ室温の水溶液に対する溶解度がpH約1.2〜6.8では少なくとも約200mg/mLで、且つpH8以上では溶解度が約10mg/mL未満の、少なくとも1つの窒素含有部分を有する任意の弱塩基性薬物を包含する。薬物放出の制御機構の理論によって制約を受けるものではないが、弱塩基性薬物含有コアを覆って配置されたアルカリ性緩衝層は、薬物の界面にアルカリ性pHのミクロ環境を作り出し、そこでは、徐放性コートを有するビーズの外部が薬物の溶けやすい酸性であっても、薬物はよくて難溶性であり、従って経口投与時のドーズダンピングが回避される。
【0030】
いくつかの実施形態において、本発明の弱塩基性薬物は、以下の薬物クラスの非限定的な例から選択することができる:鎮痛薬、抗痙攣薬、抗糖尿病剤、抗感染剤、抗悪性腫瘍薬、抗パーキンソン病剤、抗リウマチ剤、心血管系薬剤、中枢神経系(CNS)刺激薬、ドパミン受容体作動薬、制吐薬、胃腸剤、精神治療剤(例えば、抗精神病剤)、オピオイド作動薬、オピオイド拮抗薬、抗てんかん薬、ヒスタミンH2拮抗薬、抗喘息薬、及び骨格筋弛緩薬。
【0031】
弱塩基性薬物の例としては、限定はされないが、窒素部分を含有するブチロフェノン誘導体、フェニルアミノイミダゾリン(例えば、クロニジン、抗高血圧剤)、ジヒドロキシフェニルイソプロピルアミノエタン(例えば、フェノテロール、気管支拡張剤)、フェノキシブチルアミノプロパノール(例えば、β−抗アドレナリン性ブニトロロール)、フェノキシアミノプロパン(例えば、抗不整脈性メキシレチン)、アミノエチルオキサゾロアゼピン(抗高血圧剤及び抗狭心症剤)又はその薬学的に許容可能な塩、溶媒和物、エステル、多形、若しくは混合物が挙げられる。いくつかの実施形態において、弱塩基性薬物は、排出半減期が約2時間〜約7時間である。
【0032】
用語「〜を覆って配置された」は、第2の材料が第1の材料を覆って堆積されることを意味し、ここで第2の材料は、第1の材料と物理的に接触していても、又は接触していなくともよい。従って、必ずしも必須ではないが、第1の材料と第2の材料との間に介在する材料を置くことが可能である。
【0033】
アルカリ性緩衝層は、徐放性粒子の内部の薬物界面にアルカリ性のミクロ環境を作り出すと考えられる。このミクロ環境では弱塩基性薬物は溶解度が低くなるため、アルカリ性緩衝層は胃腸管の酸性〜中性のpH条件、すなわち本来ならば薬物が急速に溶出するであろう条件下で薬物の放出を効果的に遅延させる。アルカリ性緩衝層を本発明の組成物に組み込むことにより、1日1回又は1日2回の投薬レジメンに好適な薬物動態特性を実現することが可能である。本発明の組成物に好適なアルカリ性緩衝剤の非限定的な例としては、水酸化ナトリウム、リン酸二水素一ナトリウム、リン酸水素二ナトリウム、リン酸三ナトリウム、酢酸ナトリウム、炭酸又は重炭酸ナトリウム、リン酸二水素一カリウム、リン酸水素二カリウム、リン酸三カリウム、酢酸カリウム、炭酸又は重炭酸カリウム、リン酸マグネシウム、酢酸マグネシウム、炭酸マグネシウム、酸化マグネシウム、水酸化マグネシウム、ケイ酸ナトリウム、ケイ酸カルシウム、複合体のメタケイ酸マグネシウムアルミニウム、及びこれらの混合物が挙げられる。アルカリ性緩衝層は、場合により高分子結合剤を含有する。高分子結合剤は、ヒドロキシプロピルセルロース、ポビドン、メチルセルロース、ヒドロキシプロピルメチルセルロース、カルボキシアルキルセルロース、ポリエチレンオキシド、及び多糖からなる群から選択することができる。
【0034】
徐放性粒子内で、アルカリ性緩衝層はシーラント層上に配置され、そのシーラント層はまた、弱塩基性薬物を含むコア上に配置される。一実施形態において、アルカリ性緩衝層は、必要であれば高分子結合剤を含み得る。好適な高分子結合剤の非限定的な例としては、ヒドロキシプロピルセルロース、ポビドン、メチルセルロース、ヒドロキシプロピルメチルセルロース、カルボキシアルキルセルロース、ポリエチレンオキシド、デンプン、及び多糖が挙げられる。いくつかの実施形態において、アルカリ性緩衝剤と弱塩基性薬物との比は、約5:1〜約1:5、例えば約3:1〜約1:3の範囲である。
【0035】
いくつかの実施形態において、本発明の組成物は、アルカリ性緩衝層の下層をなして薬物含有コア上に配置されたシーラント層を含むことができる。この保護シーラント層は、薬物含有コアとアルカリ性緩衝層とを隔てるもので、以下の利点のうちの1つ又は複数を提供し得る:加工又は保管中の薬物とアルカリ性緩衝剤との間の接触を防止する(又は最小限に抑える);静電気を防止する(又は最小限に抑える);粒子の摩滅を防止する(又は最小限に抑える);薬物の製造又は保管中に弱塩基性薬物とアルカリ性緩衝剤とが接近することによって引き起こされ得る潜在的な不安定性(例えば、薬物と緩衝剤との間での付加化合物の形成)を回避する;及び経口摂取後に剤形が溶出溶媒又は体液と接触するまで、アルカリ性緩衝剤と弱塩基性薬物とが直接接触しないことを確実にする。一実施形態において、シーラント層は、親水性高分子を含む。好適な親水性高分子の非限定的な例としては、親水性ヒドロキシプロピルセルロース(例えば、Klucel(登録商標)LF)、ヒドロキシプロピルメチルセルロース又はヒプロメロース(例えば、Opadry(登録商標)Clear又はPharmacoat(商標)603)、ビニルピロリドン−酢酸ビニル共重合体(例えば、BASFからのKollidon(登録商標)VA64)、及び低粘度エチルセルロース(例えば、ウベローデ粘度計を使用して計測したとき、25℃の80/20トルエン/アルコール中の5%溶液における粘度が10cps以下)が挙げられる。シーラント層は、シーラントコートを有する薬物含有コアの重量の約1%〜約20%、例えば約1%、約2%、約3%、約4%、約5%、約7%、約10%、約12%、約15%、約17%、又は約20%(それらの間のあらゆる範囲及び部分範囲を含む)を構成し得る。
【0036】
いくつかの実施形態において、本発明の微粒子は、アルカリ性緩衝層上に配置された、水不溶性高分子を含む徐放性コーティングを含む。いくつかの実施形態において、徐放性コーティングは、水溶性又は腸溶性高分子の不在下に水不溶性高分子を含む。この最後の実施形態では、徐放性コーティングは、二段階溶出法(最初の2時間は700mLの0.1NのHCl(塩酸)、その後200mLのpH調整剤を添加することにより得られるpH6.8の900mL中)で試験したとき、約8時間〜約20時間にわたり薬物の放出を持続し、1日1回又は1日2回の投薬レジメンに好適である。
【0037】
好適な水不溶性高分子の非限定的な例としては、エチルセルロース、酢酸セルロース、酢酸酪酸セルロース、ポリ酢酸ビニル、中性のメタクリル酸−メタクリル酸メチル共重合体、及びこれらの混合物が挙げられる。一実施形態において、水不溶性高分子はエチルセルロースを含む。別の実施形態において、水不溶性高分子は、ウベローデ粘度計により25℃で計測したとき、80/20トルエン/アルコール中の5%溶液における平均粘度が10cpsであるエチルセルロースを含む。持続放出性コーティングの水不溶性高分子は、約3%〜約30%、例えば、約3%、約5%、約7%、約10%、約12%、約15%、約17%、約20%、約22%、約25%、約27%、約30%、約35%、及び約40%(それらの間のあらゆる範囲及び部分範囲を含む)の重量増加をもたらす。一実施形態において、持続放出性微粒子は、可塑化された水不溶性高分子、例えばエチルセルロース(EC−10)の持続放出性コーティングを約5〜50重量%で有し、それにより薬物放出を約4〜20時間にわたり持続させ得る。
【0038】
一実施形態において、徐放性コーティングの水不溶性高分子は、可塑剤をさらに含む。好適な可塑剤の非限定的な例としては、トリアセチン、クエン酸トリブチル、クエン酸トリエチル、クエン酸アセチルトリ−n−ブチル、フタル酸ジエチル、ヒマシ油、セバシン酸ジブチル、モノアセチル化及びジアセチル化グリセリド(例えば、Myvacet(登録商標)9〜45)、及びこれらの混合物が挙げられる。本発明の実施形態で用いられるとき、可塑剤は、水不溶性高分子の約3重量%〜約30重量%を構成し得る。別の実施形態において、可塑剤は、水不溶性高分子の10重量%〜約25重量%を構成する。さらに他の実施形態において、水不溶性高分子の重量に対する可塑剤の量は、約3%、約5%、約7%、約10%、約12%、約15%、約17%、約20%、約22%、約25%、約27%、及び約30%(それらの間のあらゆる範囲及び部分範囲を含む)である。当業者は、1つ又は複数の可塑剤の1つ又は複数のタイプ及び1つ又は複数の量が、1つ又は複数の高分子及びコーティング系の性質(例えば、水性又は溶媒ベース、溶液又は分散体ベース、及び全固形物)に基づき選択され得ることを認識するであろう。一実施形態において、徐放性コーティングに可塑剤が用いられる場合、可塑剤はフタル酸塩を含まない。
【0039】
本発明の一実施形態では、可塑剤が存在する各被覆層において、1つ又は複数の可塑剤はフタル酸塩を含まない。
【0040】
いくつかの実施形態において、アルカリ性緩衝層上に配置される徐放性コーティングは、水溶性高分子と組み合わせた水不溶性高分子を含み、薬物の持続放出をもたらす。一実施形態において、水不溶性高分子と水溶性高分子との比は、約95/5〜約50/50の範囲、例えば約90/10〜約60/40の範囲である。別の実施形態において、水不溶性高分子と水溶性高分子とは、組み合わせで、被覆されたコアの約3重量%〜約50重量%、例えば、約10重量%〜約50重量%、約3重量%〜約30重量%、及び約5重量%〜約30重量%の範囲を構成する。他の実施形態において、水不溶性高分子と水溶性高分子とを組み合わせた量は、即時放出コアの重量の約3%、約5%、約7%、約10%、約12%、約15%、約17%、約20%、約22%、約25%、約27%、約30%、約35%、約40%、約45%、及び約50%(それらの間のあらゆる範囲及び部分範囲を含む)を構成する。
【0041】
本発明の特定の実施形態に従い用いられる水溶性高分子は、水溶性高分子を包含する。好適な水溶性高分子の非限定的な例としては、ポリビニルピロリドン(例えば、Povidone K−25)、ポリエチレングリコール(例えば、PEG 400)、ヒドロキシプロピルメチルセルロース、及びヒドロキシプロピルセルロースが挙げられる。一実施形態において、持続放出性コーティングは、二段階溶出法(最初の2時間は700mLの0.1NのHCl(塩酸)、その後200mLのpH調整剤を添加することにより得られるpH6.8の900mL中)で試験したとき、約12〜約16時間にわたり持続する薬物放出をもたらし、1日1回又は1日2回の投薬レジメンに好適である。
【0042】
別の実施形態において、徐放性コーティングは、胃溶性増孔剤と組み合わせた水不溶性高分子を含み、薬物の持続放出をもたらす。胃溶性増孔剤の例は、炭酸カルシウムである。他の好適な胃溶性増孔剤としては、塩化ナトリウム、炭酸カルシウム、リン酸カルシウム、カルシウムサッカリド、コハク酸カルシウム、酒石酸カルシウム、酢酸第二鉄、水酸化第二鉄、リン酸第二鉄、炭酸マグネシウム、クエン酸マグネシウム、水酸化マグネシウム、リン酸マグネシウム等が挙げられる。
【0043】
いくつかの実施形態において、徐放性コーティングは、腸溶性高分子と組み合わせた水不溶性高分子を含み、薬物の遅延放出又は時限パルス放出(TPR)をもたらす。このタイプの徐放性コーティング(すなわち、水不溶性高分子と腸溶性高分子との組み合わせ)は、本明細書では「ラグタイム」コーティングと称することができ、ラグタイムコーティングで被覆された微粒子は、本明細書ではTPR微粒子と称することができる。用語「ラグタイム」は、薬物含有粒子の経口投与後、又は二段階溶出溶媒若しくは1つ以上の模擬体液への曝露後、薬物含有粒子から放出される薬物が約10%未満である期間を指す。一実施形態において、用語「ラグタイム」は、二段階溶出溶媒又は1つ以上の模擬体液への曝露後、粒子から薬物が実質的に放出されない期間を指す。一実施形態において、ラグタイムコーティングは、アルカリ性緩衝層上に直接堆積される。別の実施形態において、ラグタイムコーティングは、アルカリ性緩衝層を被覆する1つ又は複数の層(例えば、シーラント層)上に直接堆積される。いくつかの実施形態において、水不溶性高分子と腸溶性高分子との比は、約10:1〜約1:4の範囲、例えば、約9:1〜約1:3及び約3:1〜約1:1の範囲である。他の実施形態において、水不溶性高分子と腸溶性高分子とは、組み合わせで、即時放出コアの約5重量%〜約60重量%、例えば、約10重量%〜約60重量%、及び約10重量%〜約50重量%の範囲を構成する。好適な腸溶性高分子の非限定的な例としては、酢酸フタル酸セルロース、フタル酸ヒドロキシプロピルメチルセルロース、酢酸コハク酸ヒドロキシプロピルメチルセルロース、ポリビニルアセテートフタレート、pH感受性のメタクリル酸−メタメタクリレート共重合体、シェラック、及びこれらの混合物が挙げられる(用語「pH感受性」は、pH依存性の溶解度を有する高分子を指す)。こうした腸溶性高分子は、乾燥粉末又は水性分散体として用いられ得る。用いることのできるいくつかの市販の材料は、Rohm Pharmaによって製造されているEudragit(L100、S100、L30D)、Eastman Chemical Co.からのCellacefate(酢酸フタル酸セルロース)、FMC Corp.からのAquateric(酢酸フタル酸セルロース水性分散体)、及び信越化学工業からのAqoat(酢酸コハク酸ヒドロキシプロピルメチルセルロース水性分散体)の商標で販売されているメタクリル酸共重合体である。一実施形態において、TPRコーティングは、水不溶性高分子としてエチルセルロース(例えば、EC−10)を、及び腸溶性高分子としてフタル酸ヒプロメロース(例えば、HP−55)を含む。
【0044】
一実施形態において、TPR微粒子は、約1時間〜約10時間のラグタイム、例えば、約2時間〜約7時間、約2時間〜約4時間(「より短いラグタイム」)、及び約7時間〜約8時間(「より長いラグタイム」)を提供し得る。別の実施形態において、TPR微粒子は、経口投与してから約1時間〜約10時間のラグタイムを経た後、胃腸管において約4時間〜約16時間の期間にわたり薬物を放出する。
【0045】
別の実施形態において、微粒子は、徐放性コーティング上に配置された外側のラグタイムコーティングを含む。このタイプの実施形態は、腸のより高いpHで薬物を放出し始め、続いて薬物の持続放出を行う。
【0046】
SR及びTPR微粒子の薬物放出プロファイルは、USP装置1又は2において二段階溶出溶媒を用いる溶出試験(最初の2時間は37℃で700mLの0.1NのHC1中、その後200mLのpH調整剤を添加することによって得られるpH6.8で溶出試験)を行うことにより決定することができる。時間に伴う薬物放出は、様々な方法を用いて、例えば特定の時点で採取した試料に対するHPLCにより測定することができる。
【0047】
SR又はTPRコーティングは、薬物界面における薬物溶出の制御、ひいては微粒子からの薬物放出に寄与する。実現可能なラグタイム又は持続放出時間は、組成物及び持続放出性コーティングの厚さ、及び/又は組成物及びラグタイムコーティングの厚さに依存する。最適な1日2回又は1日1回の投薬形態の実現に影響を及ぼし得る具体的な要因としては、限定はされないが、治療剤のpKa(及びその溶解性、すなわち、薬物が酸性及び中性pH条件下では溶けやすいが、pH8.0以上では難溶性であること)、排出半減期、及びアルカリ性緩衝剤によって作り出されるミクロなアルカリ性pH環境での溶解度の低下が挙げられる。
【0048】
別の実施形態において、微粒子は、徐放性コーティング上に配置された(又は徐放性コーティングがさらにTPRコーティングで被覆されている場合、最外側のコーティング上に配置された)圧縮性コーティングを含む。圧縮性コーティングは、親水性高分子を含む。一実施形態において、親水性高分子は、ヒドロキシプロピルセルロース、ポリ(酢酸ビニル−ビニルピロリドン)、ポリ酢酸ビニル、及び可塑化された低粘度のエチルセルロースラテックス分散体からなる群から選択される。このコーティングは、例えば、エチルセルロースの可塑化された水性分散体による流動層コーティングによって塗布され得る。その目的は、速分散性微粒剤と共に圧縮する間に膜の完全性を維持することである。
【0049】
微粒子コアは弱塩基性薬物を含む。いくつかの実施形態において、コアは、不活性ビーズ、微粒剤、又は薬物結晶の形態をとり得る。一実施形態において、コアは、弱塩基性薬物を含む薬物層で被覆された不活性ビーズを含む。不活性ビーズは、糖、微結晶性セルロース、マンニトール−微結晶性セルロース、二酸化ケイ素等を含み得る。コアは、平均粒径が400μm以下、又は別の実施形態では350μm以下である。一実施形態において、薬物層は高分子結合剤を含む。高分子結合剤は、ヒドロキシプロピルセルロース、ポビドン、メチルセルロース、ヒドロキシプロピルメチルセルロース、カルボキシアルキルセルロース、ポリエチレンオキシド、デンプン(例えば、コーンスターチ及びゼラチン化コーンスターチ)、並びに多糖からなる群から選択することができる。薬物と高分子結合剤との比は、約85:15〜約100:0(結合剤なし)の範囲であり得る。
【0050】
本明細書に記載される医薬組成物は、崩壊剤と組み合わせたサッカリド及び/又は糖アルコールを含む速崩壊性顆粒をさらに含み得る。崩壊剤は、クロスポビドン、デンプングリコール酸ナトリウム、架橋カルボキシメチルセルロースナトリウム、及び低置換度ヒドロキシプロピルセルロースからなる群から選択することができる。サッカリド及び/又は糖アルコールは、ラクトース、スクラロース、スクロース、マルトース、マンニトール、ソルビトール、キシリトール、及びマルチトールからなる群から選択され得る。速分散性微粒剤中における崩壊剤のサッカリド及び/又は糖アルコールに対する比は、(重量で)約1/99〜約10/90の範囲であり、いくつかの実施形態では約5/95である。いくつかの実施形態において、崩壊剤又はサッカリド及び/又は糖アルコール、又はその双方は、平均粒径が約30μm以下の微粒子の形態で存在し得る。薬物含有微粒子と速崩壊性顆粒との比は、約1:6〜約1:2の範囲であり得る。
【0051】
別の実施形態において、本発明は、本明細書に記載される微粒子を含む医薬剤形に関する。医薬剤形としては、口腔内崩壊錠(ODT)、従来の錠剤、及びカプセル(例えば、硬ゼラチン若しくはHPMCカプセル、多糖カプセル)が挙げられる。医薬剤形がODTの形態をとる場合、ODTは、口腔内の唾液又は模擬唾液との接触後、約60秒以内に実質的に崩壊する。別の実施形態において、ODTは、約30秒以内に実質的に崩壊する。崩壊は、USP 701崩壊試験に従い試験される。一実施形態において、ODTは治療上有効量の弱塩基性薬物を含み、ここでODTは、投与後、患者の口腔内で実質的に崩壊して、ザラザラした舌触り又は後味のない滑らかで嚥下が容易な懸濁液を形成し、1日1回又は1日2回の投薬レジメンに好適な前記弱塩基性薬物の目的のPKプロファイル(すなわち、血漿濃度対時間プロット)をもたらす。
【0052】
医薬剤形が錠剤のとき、それは好ましくは摩損度が約1%未満である。医薬剤形がODTのとき、錠剤はまた、圧縮性の希釈剤、充填剤、着色剤、及び場合により潤滑剤など、崩壊錠の製剤化に用いるのに好適な薬学的に許容可能な賦形剤も含み得る。
【0053】
いくつかの実施形態において、ODTの重量は、約2000mg以下;例えば、2000mg以下;1500mg以下;1000mg以下;500mg以下である。別の実施形態において、ODTの重量は約1600mg以下である。別の実施形態において、ODTの重量は約800mg以下である。別の実施形態において、ODTの重量は500mg以下である。
【0054】
ODTは、速崩壊性微粒子と組み合わせた、本明細書に記載されるSR微粒子の1つ以上の集合及び/又はTPR微粒子の1つ以上の集合、又はこれらの混合物を含む。ODTは、IR粒子をさらに含み得る。例えば、医薬剤形は、速崩壊性顆粒と組み合わせたSR微粒子;速崩壊性顆粒と組み合わせたTPR微粒子;IR微粒子、SR微粒子、及び速分散性顆粒;IR微粒子、TPR微粒子、及び速分散性顆粒;又は速分散性顆粒と組み合わせた、IR微粒子、SR微粒子、及び、同じ、若しくは異なるラグタイムを有し得る1つ以上のTPR微粒子集合(例えば、短いラグタイムのTPR微粒子及び長いラグタイムのTPR微粒子)を含み得る。微粒子をこのように種々に組み合わせることで、異なる所望の薬物放出プロファイルを実現することができる。例えば、排出半減期が約7時間の活性成分の1日1回の投薬形態は、即時放出パルスをもたらすIRビーズ集合と、より短いラグタイム(約2〜4時間)の、急速な持続放出プロファイルをもたらす第2のSRビーズ又はTPRビーズ集合と、より長いラグタイム(約7〜8時間)の、典型的には約8〜12時間にわたる遅延した持続放出プロファイルを可能にする第3のTPRビーズ集合との混合物を含み、それにより許容可能な血漿濃度が12〜24時間で維持され得る。
【0055】
医薬剤形にIR粒子が存在するとき、IR粒子とSR及び/又はTPR粒子との比は、約0:100(IR粒子なし)〜約50:50の範囲である。IR粒子は、粒子中に含まれる薬物の味を実質的にマスキングする味マスキング層を塗布することにより、味マスキングが施されてもよい。こうした味をマスキングされたIR粒子は、模擬唾液(pH約6.8)で溶出試験を行うと、3分(口腔内でODTについて予想される典型的な最長滞留時間)で約10%以下しか放出せず、それに対し0.1NのHCl中で溶出試験を行うと、約60分で用量の約75%以上を放出する。
【0056】
IR粒子は、味マスキング層を提供する水不溶性高分子(例えば、エチルセルロース)で場合により被覆された薬物含有コアを含む。水不溶性高分子のコーティングは可塑剤を含み得る。水不溶性高分子のコーティングは、さらに、例えば2005年8月26日に出願された同時係属中の米国特許出願第11/213,266号明細書(2006年5月18日に公開された米国特許出願公開第2006/0105038号明細書)の開示に従い、胃溶性増孔剤(例えば、炭酸カルシウム)を含むことができ、又は水不溶性高分子(例えば、平均粘度が10cpsのエチルセルロース)の単独での、若しくは、例えば2005年10月12日に出願された同時係属中の米国特許出願第11/248,596号明細書(2006年4月13日に公開された米国特許出願公開第2006/0078614号明細書)の開示に従い、胃溶性高分子(例えば、Eudragit E100又はEPO)との、若しくは、例えば2005年10月21日に出願された同時係属中の米国特許出願第11/256,653号明細書(2006年5月18日に公開された米国特許出願公開第2006/0105039号明細書)の開示に従い、胃溶性増孔剤(例えば、炭酸カルシウム)との組み合わせでの流動層コーティングによる。本明細書に示されるこれらの出願の各々は、あらゆる目的から全体として参照により援用される。
【0057】
本明細書に記載されるODTは、以下の利点のうちの1つ又は複数を有し得る:(i)口腔内で唾液と接触すると約60秒で崩壊して、滑らかで嚥下が容易な懸濁液であって、味マスキングが施され、及び/及び薬物を含有する粒子を含む懸濁液を形成する;(ii)<USP 701>崩壊試験により試験したとき、約30秒以内に崩壊する;(iii)味マスキングが施されたIR粒子が存在する場合、それは、胃に侵入すると、急速で実質的に完全な用量の放出をもたらす(例えば、典型的には約60分で約75%超);及び/又は(iv)SR粒子及び/又はTPR粒子は、胃腸管内での薬物の持続放出及び/又は遅延放出をもたらす。
【0058】
別の実施形態において、本発明は、本明細書に記載される微粒子の医薬組成物の調製方法に関する。一実施形態において、本方法は、(a)弱塩基性薬物を含むコアを調製するステップと;(b)ステップ(a)の薬物含有コアをシーラント層で被覆するステップと;(c)ステップ(b)のシーラント層を有するコアを、アルカリ性緩衝剤を含む層で被覆するステップと;(d)ステップ(c)のアルカリ性緩衝層を有するコアを、徐放性層で被覆して微粒子を提供するステップとを含む。コアを調製するステップは、当該技術分野において公知の方法のいずれによって達成してもよい;例えば、不活性ビーズ(例えば、糖、微結晶性セルロース、マンニトール−微結晶性セルロース、二酸化ケイ素等)に、薬物と、場合により高分子結合剤とを含む溶液の層を(例えば、流動層コーティング又はパンコーティングにより)重ねる;薬物を、適切な希釈剤(例えば、微結晶性セルロース及び/又はラクトース)と共に造粒する;薬物の混合物を押し出して球状化する;薬物を、直径約1〜2mmのミニ錠剤に圧縮する;又は単純に、所望の粒径(例えば、約50〜500μm、例えば100〜400μm)の薬物結晶を入手する。
【0059】
一実施形態において、本方法を用いて、持続放出性コーティングを有する微粒子が調製される。この実施形態において、ステップ(d)の徐放性コーティングは、約3%〜約30%の重量増加となるように水不溶性高分子と、場合により水溶性高分子とを含み、SR微粒子が得られる。別の実施形態において、本方法を用いて、時限パルス放出(TPR)コーティングを有する微粒子が調製される。この実施形態において、ステップ(d)の徐放性コーティングは、約10%〜約60%の重量増加となるように水不溶性高分子と腸溶性高分子とを含み、TPR微粒子が得られる。別の実施形態において、本方法を用いて、外側の時限パルス放出コーティングの下層に持続放出性コーティングを有する微粒子が調製される。この実施形態において、ステップ(d)の徐放性コーティングは、約3%〜約30%の重量増加となるように水不溶性高分子と、場合により水溶性高分子とを含み、持続放出性の微粒子が得られる。この持続放出性微粒子は、水不溶性高分子と腸溶性高分子とを含む層でさらに被覆され、SR/TPR微粒子が得られる。
【0060】
別の実施形態において、本発明は、医薬剤形の調製方法に関し、この方法は:本明細書に記載される微粒子を、崩壊剤と組み合わせたサッカリド及び/又は糖アルコールを含む速分散性顆粒と混合するステップと;得られた混合物を錠剤に圧縮してODTを提供するステップとを含む。さらに別の実施形態において、医薬剤形は、本明細書に記載される微粒子を硬ゼラチンカプセルに充填することによって調製され得る。
【0061】
一実施形態において、本方法は、
a)弱塩基性薬物粒子(平均粒径が50〜500μm、特に100〜400μm)、さらに特に100〜350μmの結晶、微粒剤、ビーズ、又はペレット)を調製し、薬物層を有するビーズ上に保護シールコートを塗布してIRビーズを生成するステップ;
b)必要であればIRビーズ上に高分子結合剤の溶液からアルカリ性緩衝層を塗布し、緩衝層上に保護シールコートを塗布するステップ;
c)約3%〜30%の重量増加となるように水不溶性高分子又は水溶性高分子と組み合わせた水不溶性高分子を含む持続放出性コーティングを塗布してSR粒子を生成するステップ;及び/又は
d)コートを有するビーズの約10重量%〜60重量%の重量増加となるように水不溶性と腸溶性高分子との約10:1〜1:4の重量比の組み合わせによりSR粒子又はアルカリ性緩衝層を有する粒子上にラグタイムコーティングを塗布してTPR粒子を生成するステップ;
e)場合によりSR層又はTPR層上に親水性高分子層を塗布するステップ;及び
f)IR粒子を有する、又は有しない適切な量のSR粒子又はTPR粒子を硬ゼラチンカプセルに充填するステップ;又は薬学的に許容可能な賦形剤及び1つ又は複数のビーズ集合(例えば、所望の比率のIRビーズ、SRビーズ及び/又はTPRビーズの組み合わせ)とブレンドした後、SR粒子又はTPR粒子を従来の錠剤又は口腔内崩壊錠剤(ODT)に圧縮するステップ、
を含む。
【0062】
Granurexを用いて制御して球状化することにより薬物層を有するペレットを調製し、同じGranurexでシールコートを有するIRペレットを覆って配置されるアルカリ性緩衝層を作成し、その後流動層機器で徐放性コーティングを塗布することにより、SR、ER又はTPRビーズを生成することが可能である。
【実施例】
【0063】
実施例1:
弱塩基性薬物についてのデコンボリューション後のインビトロ薬物放出プロファイル:
薬物動態学的評価を行い、弱塩基性薬物の1日1回又は1日2回の投薬形態を可能にし得る一連の理論的なインビトロ薬物放出プロファイルを同定することができる。単一用量を経口投与時又は定常状態での、及び/又は静脈内(IV)プロファイルに応じた(利用可能な場合)ヒトの血漿濃度−時間データを用いた、1又は2コンパートメント薬物動態(PK)モデル(例えば、2成分モデルが以下に概略的に示される))。経口(PO)及びIVデータの双方とも、同時にPKモデルにフィッティングすることができる。WinNonlinソフトウェアを使用してPKパラメータを推定し、PO及び/又はIVデータの予測を行うことで、シミュレートしたプロファイルの式が求まる。シミュレートした、すなわち、デコンボリューション後のインビトロプロファイルを模倣する、又は目標のプロファイルウィンドウを包含するインビトロ薬物放出プロファイルを有する製剤を開発する。次にPK試験で成人健常被験者において製剤を試験する。
【0064】
【表1】

【0065】
実施例2
2.A 弱塩基性薬物を含有するIRビーズ:
溶媒系(例えば、水、アセトン、エタノール又はこれらの混合物)に対し、結合剤高分子を徐々に添加して結合剤溶液を調製する。溶媒系に弱塩基性薬物を徐々に添加して溶解させる。次に薬物溶液に結合剤溶液を添加し、続いて混合する。或いは、結合剤及び薬物を順番に添加して溶解させる。流動層コーティング装置、例えば、Glatt GPCG 3(例えば、7インチボトムスプレーWurster 7 13/16インチカラム、200メッシュの生成物滞留スクリーンでカバーされた「C」空気分配ボトムプレートを装備)に、(例えば、60〜80メッシュの)球状糖を装入し、次にそれに結合剤/薬物溶液を噴霧する。次に被覆された球状糖を乾燥させて残留溶媒を(水分を含めて)除去し、篩別することにより(例えば、35及び80メッシュのスクリーンを使用)、過大な粒子及び微粉を取り除く。
【0066】
2.B 無水リン酸二ナトリウム(DPA)緩衝層の形成:
精製水に無水リン酸二ナトリウムを撹拌しながら添加し、溶解させる。流動層コーティング装置、例えば、Glatt GPCG 3(例えば、6インチボトムスプレーWurster 8インチカラム13及び200メッシュの生成物滞留スクリーンでカバーされた「C」分配プレート及び1.0mm口径ノズルを装備)に、IRビーズ(例えば、実施例2.Aのもの)を装入する。IRビーズに緩衝剤溶液を噴霧する。場合により緩衝剤コートを有するビーズを溶媒でリンスした後、約2重量%のシールコートを塗布する。乾燥させたIRビーズを篩別することにより(例えば、35及び80メッシュ篩を使用)、過大なビーズ及び微粉を取り除くことができる。
【0067】
2.C 弱塩基性薬物を含有するSRビーズ:
実施例2.Bの緩衝剤コートを有するビーズを、流動層コーティング装置において、場合により可塑化(例えば、エチルセルロースを10%w/wとしたクエン酸トリエチル)された水不溶性高分子(例えば、エチルセルロース)のSRコーティングで被覆する。緩衝剤コートを有するビーズに対し、溶媒中に溶解した圧縮性コーティング溶液(例えば、Klucel(登録商標)LFなどのヒドロキシプロピルセルロース)を約2重量%の重量増加となるように噴霧する。得られたSRビーズを乾燥させると、残留溶媒を除去することができる。
【0068】
2.D 速分散性微粒剤:
同時係属中の米国特許出願第10/827,106号明細書(2005年10月20日に米国特許出願公開第2005/0232988号明細書として公開、その内容は、あらゆる目的から参照により本明細書に援用される)に開示される手順に従い、速分散性微粒剤を調製する。平均粒径が約20μm以下のD−マンニトール(例えば、Roquette,仏国からのPearlitol 25)を、高剪断造粒機(VectorからのGMX 600)で8kgの架橋ポビドン(例えば、ISPからのCrospovidone XL−10)とブレンドし、精製水と共に造粒し、QuadroからのComilを使用して湿式粉砕し、トレイ上で乾燥させて約1%未満の乾燥減量(LOD)を得る。乾燥させた顆粒を篩別し、過大な材料を粉砕して、平均粒径が約175〜300μmの範囲の速分散性微粒剤を生成する。
【0069】
2.E SRビーズを含有する徐放性ODT:
速分散性微粒剤(約1200g)を、弱塩基性薬物のSRビーズ(約850g)並びに他の薬学的に許容可能な成分、例えば、香料(約25g)、甘味料(例えば、スクラロース、約10g)、さらなるクロスポビドン(約125g)、及び微結晶性セルロース(例えば、Avicel PH101、約250g)と、速分散性微粒剤とSRビーズとの比を約3:2としてツインシェルV形ブレンダで十分な時間にわたりブレンドし、圧縮するための均質に分散したブレンドを得る。外部潤滑システムを備えた生産規模の錠剤成形機を使用して、SRビーズとして50mgの弱塩基性薬物を含むODTを以下の条件で圧縮する:−工具:15mmの円形フラットフェース、ラジアスエッジ;圧縮力:16kN;平均重量:1000mg;平均硬度:46N;及び摩損度:0.28%。このように生成して得られたODT(50mg用量)は、口腔内で急速に崩壊して、被覆されたビーズを含む滑らかで嚥下が容易な懸濁液を生じ、1日1回の投薬レジメンに好適な、期待される薬物放出プロファイルをもたらす。
【0070】
実施例3
3.A 弱塩基性薬物を含有するIRビーズ:
溶媒系(例えば、水、アセトン、エタノール又はこれらの混合物)に対し、結合剤高分子を徐々に添加して結合剤溶液を調製する。その結合剤溶液に対し、弱塩基性薬物のクロニジン(フェニルアミノイミダゾリン誘導体)を徐々に添加し、混合しながら溶解させる。流動層コーティング装置、例えば、Glatt GPCG 3(例えば、7インチボトムスプレーWurster 7 13/16インチカラム、200メッシュの生成物滞留スクリーンでカバーされた「C」空気分配ボトムプレートを装備)に、球状微結晶性セルロース((例えば、GlattからのCellets 100)を装入し、次にそれに結合剤/薬物溶液を噴霧する。次にIRビーズを乾燥させて残留溶媒を(水分を含めて)除去し、篩別することにより(例えば、40及び100メッシュのスクリーンを通じて)、過大な粒子及び微粉を取り除くことができる。
【0071】
3.B 無水リン酸二ナトリウム(DPA)緩衝層:
精製水に無水リン酸二ナトリウムを撹拌しながら添加し、溶解させる。流動層コーティング装置、例えば、Glatt GPCG 3(例えば、6インチボトムスプレーWurster 8インチカラム13及び200メッシュの生成物滞留スクリーンでカバーされた「C」分配プレート及び1.0mm口径ノズルを装備)に、IRビーズ(例えば、実施例3.Aのもの)を装入する。IRビーズに緩衝剤溶液を噴霧する。場合により緩衝剤コートを有するビーズを溶媒でリンスした後、約2重量%のシールコートを塗布する。乾燥させたIRビーズを篩別すると(例えば、35及び80メッシュ篩を使用)、過大なビーズ及び微粉を取り除くことができる。
【0072】
3.C TPR層の形成:
実施例3.Bの緩衝剤コートを有するビーズを、流動層コーティング装置において、被覆されたビーズの30重量%の重量増加となるように90/10のアセトン/水中に溶解したエチルセルロース(Ethocel Premium 10cps)と、フタル酸ヒプロメロース(HP−55)と、TEC(クエン酸トリエチル)とを55/30/15の比で含むTPRコーティングで被覆する。緩衝剤コートを有するビーズに対し、溶媒中に溶解した圧縮性コーティング溶液(例えば、Klucel(登録商標)LFなどのヒドロキシプロピルセルロース)を、約2重量%の重量増加となるように噴霧する。得られたSRビーズを乾燥させると、残留溶媒を除去することができる。
【0073】
3.D TPRビーズを含有する徐放性ODT:
実施例2.Dの速分散性微粒剤を、実施例3.Cの弱塩基性薬物のTPRビーズ並びに他の薬学的に許容可能な成分、例えば、香料、甘味料(例えば、スクラロース)、さらなるクロスポビドン、及び微結晶性セルロース(例えば、Avicel PH101)と、速分散性微粒剤とTPRビーズとの比を約3:2としてツインシェルV形ブレンダで十分な時間にわたりブレンドし、圧縮するための均質に分散したブレンドを得る。TPRビーズとして50mgの弱塩基性薬物を含むODTを、外部潤滑システムを備えた生産規模の錠剤成形機を使用して圧縮する:このように生成して得られたODT(50mg用量)は、口腔内で急速に崩壊して、被覆されたビーズを含む滑らかで嚥下が容易な懸濁液を生じ、1日1回の投薬レジメンに好適な、期待される薬物放出プロファイルをもたらす。
【0074】
実施例4
4.A 弱塩基性薬物を含有するIRビーズ:
初めに高分子結合剤を添加して溶解させ、続いて弱塩基性薬物を添加することにより、適切な溶媒系中の薬物層形成溶液を調製する。次に、この溶液をCellets 100(平均粒径が100〜200μmの球状微結晶性セルロース)に塗布する。次に、得られたIRビーズを乾燥させて残留溶媒を(水分を含めて)除去し、篩別することにより(例えば、40及び100メッシュのスクリーンを通じて)、過大な粒子及び微粉を取り除く。
【0075】
4.B 酸化マグネシウム緩衝層の形成:
エタノールベースの溶媒系中の高分子結合剤溶液に対し、微粉化した酸化マグネシウムを撹拌しながら添加し、均質な分散を提供する。流動層コーティング装置、例えば、Glatt GPCG 3にIRビーズ(例えば、実施例4.Aのもの)を装入し、IRビーズに酸化マグネシウム/高分子結合剤溶液を噴霧する。場合により緩衝剤コートを有するビーズを溶媒でリンスした後、約2重量%のシールコートを塗布する。乾燥させたIRビーズを篩別すると、過大なビーズ及び微粉を取り除くことができる。
【0076】
4.C TPR層の形成:
実施例4.Bの緩衝剤コートを有するビーズを、流動層コーティング装置において、被覆されたビーズの10重量%の重量増加となるように95/5のアセトン/水中に溶解したエチルセルロース(EC−10)とTECとを90/10の比で含むSRコーティングで被覆する。SRコートを有するビーズを、約2重量%の重量増加となるように、EC−10とHP−55とTECとを60/30/10の比で含むTPRコーティング溶液、続いてKlucel(登録商標)LFによる圧縮性コーティングでさらに被覆する。得られたTPRビーズを乾燥させると、残留溶媒を除去することができる。
【0077】
4.D 味マスキングを施したIRビーズ
Glatt GPCG 3において、EC−10及びEudragit(登録商標)E100、TEC、並びにステアリン酸マグネシウムで約15重量%の重量増加となるように被覆することにより、実施例4.AのIRビーズに味マスキングを施す。
【0078】
4.E IR及びTPRビーズを含有する徐放性ODT:
実施例2.Dの速分散性微粒剤と、TPRビーズと、実施例4.Dの弱塩基性薬物の味マスキングを施したIRビーズとを2:1の比で、他の薬学的に許容可能な成分、例えば、香料、甘味料(例えば、スクラロース)、さらなるクロスポビドン、及び微結晶性セルロース(例えば、Avicel PH101)とブレンドする。TPRビーズ及び味マスキングを施したIRビーズを速分散性顆粒と、速分散性微粒剤と被覆されたビーズとの比を約3:2としてツインシェルV形ブレンダで十分な時間にわたり混和し、圧縮するための均質に分散したブレンドを得る。IR/TPRビーズとして50mgの弱塩基性薬物を含むODTを、外部潤滑システムを備えた生産規模の錠剤成形機を使用して圧縮する:このように生成して得られたODT(50mg用量)は、口腔内で急速に崩壊して、被覆されたビーズを含む滑らかで嚥下が容易な懸濁液を生じ、1日1回の投薬レジメンに好適な、期待される薬物放出プロファイルをもたらす。
【0079】
実施例5
5.A プロピベリンHClを含有するIRビーズ
精製水(2054.7g)に対し、プロピベリンHCl(308g)を撹拌しながら徐々に添加し、溶解させた。予熱したGlatt 3にCellets 100(900g)を装入し、4mL/分の速度で、12mL/分まで段階的に速めながら、且つ8CFMの吸入空気流量、50±2℃の生成物温度で薬物溶液を噴霧した。噴霧システムを40gの水でリンスした後、次にOpadry Clearの2%のシールコート(水中6%固形分)を塗布し、得られたIRビーズを乾燥させて残留溶媒を(水分を含めて)除去し、篩別することにより(例えば、40及び100メッシュのスクリーンを通じて)、過大な粒子及び微粉を取り除いた。
【0080】
5.B 二塩基性リン酸ナトリウム緩衝層の形成
高分子結合剤ポビドン(2.3g)の水溶液(2278gの水)に対し、二塩基性リン酸ナトリウム(113.9g)を撹拌しながら徐々に添加して溶解させた。予熱したGlatt GPCG 3にIRビーズ(例えば、実施例5.Aのもの;1000g)を装入し、実施例3.Bに開示されるとおりIRビーズに緩衝剤溶液を噴霧した。場合により噴霧システムを40gの水でリンスした後、Opadry Clearによる約2重量%のシールコートを塗布した。乾燥させたIRビーズを篩別すると、過大なビーズ及び微粉を取り除くことができる。
【0081】
5.C プロピベリンSRビーズ(30%のコーティング)
実施例5.Bの緩衝剤コートを有するビーズ(900g)を、予熱した流動層コーティング装置において、被覆されたビーズの30重量%の重量増加となるようにアセトン(3375g)/水(596g)中に溶解したエチルセルロース(357.4g)とTEC(39.7)とを90/10の比で含むSRコーティングで被覆した。SRコートを有するビーズを、約2重量%の重量増加となるようにKlucel(登録商標)LF(26.5g)による圧縮性コーティングでさらに被覆した。得られたSRビーズを乾燥させて残留溶媒を除去した。20重量%、25重量%及び30重量%のコーティングを有するSRビーズについて、二段階溶出法(USP装置2(パドル、50RPM、溶出溶媒:最初の2時間は700mLの0.1NのHCl、その後、37℃の緩衝調整剤を200mL添加することにより実現されるpH6.8))により溶出試験を行った。溶出データは、以下の表2に示す。この表から、コーティングレベルを大幅に低下させる必要があることは明らかである。
【0082】
【表2】

【0083】
実施例6
6.A プロピベリンHClを含有するIRビーズ
50/50のアセトン/水(各855g)に対し、プロピベリンHCl(256.5g)を撹拌しながら徐々に添加して溶解させ、次にステアリルフマル酸ナトリウム(PRUV;28.5g)を激しく撹拌しながら添加して、均等に分散させた。予熱したGlatt 3に45〜60メッシュの球状糖(972g)を装入し、薬物溶液を4mL/分の速度で8mL/分まで段階的に速めながら、且つ10CFMの吸入空気流量、45±2℃の生成物温度で噴霧した(噴霧中は引き続き撹拌した)。噴霧システムを40gのアセトンでリンスした後、次に、OpadryのClearの2%のシールコート(水中6%固形分)を塗布し、得られたIRビーズを乾燥させて残留溶媒を(水分を含めて)除去し、篩別することにより(例えば、40及び80メッシュのスクリーンを通じて)、過大な粒子及び微粉を取り除いた。
【0084】
6.B 二塩基性リン酸ナトリウム緩衝層の形成
IRビーズ(例えば、実施例5.Aのもの;1000g)に対し、予熱したGlatt GPCG 3において実施例5.Bに開示されるとおりの手順に従い二塩基性リン酸ナトリウム(113.9g)の層を重ねた。場合により噴霧システムを40gのアセトンでリンスした後、Opadry Clearによる約2重量%のシールコートを塗布した。乾燥させたIRビーズを篩別すると、過大なビーズ及び微粉を取り除くことができる。
【0085】
6.C プロピベリンSRビーズ(10%のコーティング)
実施例6.Bの緩衝剤コートを有するビーズ(850g)を、予熱した流動層コーティング装置において、被覆されたビーズの10重量%の重量増加となるようにアセトン(821g)/水(145g)中に溶解したエチルセルロース(86.9g)とTEC(9.7g)とを90/10の比で含むSRコーティングで被覆した。SRコートを有するビーズを、約2重量%の重量増加となるようにKlucel(登録商標)LF(19.3g)による圧縮性コーティングでさらに被覆した。得られたSRビーズを乾燥させて残留溶媒を除去した。
【0086】
6.D プロピベリンHCl ODT CR
実施例2.Dの速分散性微粒剤(43.68部)と、実施例6.CのプロピベリンHCl SRビーズ(34.97部)と、プレブレンド(微結晶性セルロース(Ceolus KG 802+Avicel PH101、各7.5部)、クロスポビドン(5部)、スクラロース(0.35部)、ペパーミント香料(1.0部)をブレンドし、40メッシュ篩に通過させて均質なブレンドを得た)とを、実施例4.Eに開示されるとおりV形ブレンダでブレンドした。SRビーズとして50mgプロピベリンHClを含むODT錠を、外部潤滑システムを備えた生産規模の錠剤成形機を使用して圧縮した:このように生成して得られたODT(50mg用量)は、口腔内で急速に崩壊して、被覆されたビーズを含む滑らかで嚥下が容易な懸濁液を生じるものであり、USP法<701>により試験したときの崩壊時間は30秒未満であった。
【0087】
実施例7
7.A 制御された球状化によるプロピベリンHClペレット
ポビドン(PVP K−30;111.1g)とプロピベリンHCl(粒径分布−D(0.1):2.6μm;D(0.5):10.38μm;D(0.9):42.52μm;1000g)とを共にブレンドし、Vector Corporation(Iowa,米国)からのGranurex GX−35の生成ボウルに装入する。回転している材料層に対し、制御された速度で精製水を噴霧する。最適化されたパラメータは、ペレット形成中−処理空気温度:約19〜20℃;生成物温度:16±2℃;ロータ回転数:425RPM;外部空気供給:150L/分;噴霧速度:15RPM(約8mL/分);スリットにわたる圧力降下:水中で1.3〜11mm;及びペレットの乾燥中−処理空気量:30CFM;処理空気温度:約60℃;生成物温度:35℃(乾燥を中止するまで);ロータ回転数:180RPM;スリット空気量:10CFM;処理時間:40分である。このように調製されたペレットは、約65%の粒子が40〜80メッシュの粒径範囲である。
【0088】
7.B 味マスキングを施したプロピベリンHCl IRペレット
実施例7.Aのペレット(970g)に、3%の重量増加となるようにアセトン/水中に溶解したKlucel LF(30g)によるシールコート(7.5%固形分)を施す。エチルセルロース(Dow ChemicalsからのEC−10、Ethocel Premium 10;159.1g)を、85/15のアセトン/水中に絶えず撹拌しながら徐々に添加し、溶解させる(10%固形分)。クエン酸トリエチル(TEC;15.9g)を徐々に添加して溶解させる。Glatt GPCG 3において、20%の重量増加となるように上記の溶液を塗布することにより、これらのIRペレットに味マスキングを施す。
【0089】
7.C 粉末層の形成によるプロピベリンペレットに対する酸化マグネシウム層の形成
精製水に対し、ポビドン(11.9g)を撹拌しながら徐々に添加して溶解させる(5%固形分)。Vector Corporation(Iowa,米国)からのGranurex GX−35の生成ボウルに、実施例7.Aのプロピベリンペレット(2000g)又は実施例7.Bのシールコートを有するプロピベリンペレット(2000g)を装入する。ポビドン溶液を回転している材料層に制御された速度で噴霧し、それと同時にユニット内に粉末層(K−Tron)により制御された速度で粉末(229.3gの酸化マグネシウム)を噴霧する。最適化されたパラメータは、粉末層の形成中−生成物温度:22〜25℃;ロータ回転数:300RPM;外部空気供給:150〜320L/分及び温度:100℃;スリットにわたる圧力降下:1〜2mmの水;溶液噴霧速度:3〜5mL/分(ノズル空気:20PSI);及び粉末噴霧速度:5g/分(空気圧力:12.5PSI)である。同じ結合剤溶液又はOpadry Clear溶液(5%固形分)を70CFMの処理空気量で噴霧することによりペレットをシールコートで被覆し、シールコートを有し、緩衝層を重ねたペレットを、ユニット内で約5分間乾燥させて、その水分含量を低下させる。
【0090】
粉砕した、又は微粉化した薬物物質を、コロイドシリカ又はステアリン酸マグネシウムなどの流動性促進剤とブレンドしてもよい。最高10%の結合剤を薬物粉末と部分的にブレンドし、噴霧液中に一部を溶解させてもよい。溶媒向けのGranurexユニットにおいて溶媒(例えば、アセトン、エタノール又は混合物)を用いてもよい。Klucel LF、ヒプロメロースなどの代替的な結合剤もまた用いることができる。Granurexそれ自体において、又は上記の実施例6.Bに開示されるとおり流動層コーターにおいて、球状化したペレットに、Opadry Clear、又はKlucel LFによる保護シールコートを塗布してもよい。
【0091】
7.D プロピベリンHCl CRペレット(25%TPR/10%SRコーティング)
実施例2.Cに開示されるとおり、実施例7.B(900g)の緩衝剤コートを有するプロピベリンペレットを、予熱した流動層コーターGPCG 3において、クエン酸トリエチル(14.3g)で可塑化したエチルセルロース(Ethocel Premium 10cps;128.6g)を含む10重量%のSRコーティングで被覆し、さらに、被覆されたペレットの25重量%の重量増加となるように85/15のアセトン/水中にエチルセルロース(214.3g)と、フタル酸ヒプロメロース(HP−55;107.2g)と、TEC(クエン酸トリエチル、35.7g)とを60/30/10の比で含むTPRコーティングで被覆する。TPRコートを有するペレットに対し、約2重量%の重量増加となるようにKlucel(登録商標)LF(7.5%固形分)の圧縮性コーティング溶液を噴霧する。得られたCRペレットをユニット内で5分間乾燥させて、残留溶媒を除去する。
【0092】
7.E プロピベリンHCl ODT CR、200mg
実施例2.Dの速分散性微粒剤(57.2部)と、実施例6.CのCRペレット(15.6部)と、実施例6.Bの味マスキングを施したIRペレット(12.8部)とを、他の薬学的に許容可能な成分、例えば、香料(1部)、甘味料(例えば、スクラロース;0.35部)、さらなるクロスポビドン(5部)、及び微結晶性セルロース(例えば、Avicel PH101;10部)を含むプレブレンドと共にブレンドし、外部潤滑システムを備えた生産規模の錠剤成形機を使用して、重量が約1250mgの200mgODT CR錠に圧縮する:このように生成して得られたODT(100mg用量)は、口腔内で急速に崩壊して、被覆されたビーズを含む滑らかで嚥下が容易な懸濁液を生じ、1日1回の投薬レジメンに好適な、期待される薬物放出プロファイルをもたらし得る。
【0093】
当業者は、適切な用量の弱塩基性薬物を提供するために上記の手順及び組成物を好適に修正し得ることを認識するであろう。
【技術分野】
【0001】
関連出願の相互参照
本願は、あらゆる目的から全体として参照により本明細書に援用される2008年4月15日出願の米国仮特許出願第61/045,170号明細書に対する優先権を主張する。
【背景技術】
【0002】
多くの治療剤は、吸収部位又はその近傍において一定の速度で利用可能になるときに最も有効となる。このように利用可能となる治療剤の吸収は、概して所望の血漿濃度をもたらすため、効力は最大となり、且つ中毒性の副作用は最小限となる。経口適用向けの浸透圧装置など、高度な薬物送達システムの開発に多大な注力がなされてきた。しかしながら、マトリックス錠剤などの、溶出速度を制御する高分子を含む単純な薬物送達システム、又は機能性高分子で被覆された単体若しくは複合粒子システムは、1日1回又は1日2回の投薬レジメンに好適な目的の薬物動態(PK)プロファイルを提供することができない場合もある。
【0003】
胃腸管から薬物を十分に吸収させるには、薬物はその剤形から放出され、吸収部位又はその近傍において溶液の形態で利用可能とならなければならない。薬物が溶解して剤形から放出される速度は、薬物吸収の動態にとって重要である。剤形、ひいては活性成分は、通過中、pH約1.2(絶食時の胃)から約7.0(胆管又は腸管)まで異なる様々なpHに曝露される。さらに、消化管の各部における剤形の通過時間は、剤形のサイズ及び消化管内の局所条件によって大きく異なり得る。薬物吸収に影響を及ぼす他の要因としては、pKa、溶解度、結晶エネルギー、及び比表面積などの薬物物質それ自体の物理化学的特性が挙げられる。重要な役割を果たす消化管内のそのときの局所条件としては、管腔の内容物の特性(pH、表面張力、容積、撹拌及び緩衝能)並びに食物摂取後の変化が挙げられる。従って、一定の速度で薬物放出を実現することは、多くの場合に困難であり、特に、極めて溶けやすい又は溶けやすい弱塩基性薬物の場合には、それが酸性pH条件下では急速に放出されるためにドーズダンピングが起こることから、困難である。持続放出プロファイルを実現するため、錠剤又は薬物を含むペレットコアに対して、水溶性高分子(例えば、ポビドン)、水不溶性高分子(例えば、エチルセルロース)、又は腸溶性高分子(例えば、胃抵抗性のフタル酸ヒプロメロース)などの合成高分子の好適な組み合わせを含む機能性高分子膜が塗布されているが、その効果は限られている。
【0004】
従来の錠剤及びカプセルに代わるものとして、より簡便で、且つ潜在的により安全であるため、口腔内崩壊性の剤形が徐々に広まりつつある。こうした速崩壊性の剤形は口腔内で崩壊し、水なしに飲み込むことが容易なものである。これは、従来の錠剤及びカプセルの嚥下が困難な人(高齢患者及び小児患者によく見られる);水を容易に入手できない人(例えば、寝たきりの、若しくは動くことのできない患者、又は外出の多い忙しい人);及び担当する患者が薬の服用を嫌がる介護者といった人口の50%にとって有益である。口腔内崩壊性剤形は、投与が容易で、場所を問わず目立たないように服用するのに好都合で、且つ一度投与すると吐き捨てることが困難であるため、経口投薬レジメンに伴う患者コンプライアンスの向上に役立つ。しかしながら、こうした剤形は、口腔内の唾液と接触したときに急速に崩壊する必要があるだけでなく、許容可能な官能特性(すなわち、美味である)と、特定の薬物及び治療病態に適した薬物動態特性(すなわち、薬物放出の速度及び持続時間)も有しなければならない。これらの特性は、互いに対立することが多い。従って、1日1回又は1日2回の投薬レジメンのための、1.2〜6.8の生理学的pH範囲に溶けやすい弱塩基性薬物を含有する口腔内崩壊錠(ODT)の開発は、特に難題である。
【0005】
弱塩基性薬物は、酸性条件下では急速に放出されるため、1日1回又は1日2回の投薬レジメンに好適な目的のPKプロファイルを提供できないことが多い。さらに、塩基性薬物は、胃から結腸まで通過すると溶解度が約1〜2桁低下するため、治療効果をもたらすために高用量が必要な場合には作用し難い。より低いpH範囲、すなわち、pH1.2〜6.8において薬物放出を持続させることを目的として極端に厚いコーティングを塗布すれば、薬物は、実際に有用となるには非常に遅い速度でコーティング膜を通じて拡散することにより放出される。
【0006】
双方とも2007年1月29日に出願された同時係属中の米国特許出願第11/668,167号明細書(米国特許出願公開第2007/0190145号明細書として公開)及び米国特許出願第11/668,408号明細書(米国特許出願公開第2007/0196491号明細書として公開)は、独立した層の弱塩基性薬物と有機酸とを含む医薬組成物を開示している。
【発明の概要】
【課題を解決するための手段】
【0007】
一実施形態において、本発明は、複数の徐放性粒子を含む医薬組成物に関し、ここで各粒子は、弱塩基性薬物を含むコアと;薬物コアを覆って配置されたアルカリ性緩衝層と;アルカリ性緩衝層を覆って配置された徐放性コーティングであって、水不溶性高分子を含む徐放性コーティングとを含む。
【0008】
一実施形態において、本発明は、複数の徐放性粒子を含む医薬組成物に関し、ここで各粒子は、pKaが約5〜約14で、室温の水溶液に対する溶解度がpH約1.2〜6.8では少なくとも200mg/mLで、且つpH8以上では溶解度が約10mg/mL以下の、少なくとも1つの窒素含有部分を含有する弱塩基性薬物を含むコアと;薬物コアを覆って配置されたアルカリ性緩衝層と;アルカリ性緩衝層を覆って配置された徐放性コーティングであって、水不溶性高分子を含む徐放性コーティングとを含む。
【0009】
別の実施形態において、本発明は医薬組成物の調製方法に関し、この方法は、(a)弱塩基性薬物を含むコアを調製するステップと;(b)ステップ(a)のコアを、アルカリ性緩衝剤を含む層で被覆するステップと;(c)ステップ(b)のアルカリ性緩衝層を有するコアを、徐放性層で被覆するステップとを含む。
【0010】
別の実施形態において、本発明は、複数の粒子を含む医薬剤形に関する。各粒子は、弱塩基性薬物を含むコアと;コアを覆って配置されたアルカリ性緩衝層と;アルカリ性緩衝層を覆って配置された徐放性コーティングであって、場合により腸溶性高分子又は水溶性高分子と組み合わせた水不溶性高分子を含む徐放性コーティングとを含む。
【0011】
さらに別の実施形態において、本発明は、少なくとも2つの薬物粒子集合を含む医薬剤形に関する。一つの薬物粒子集合は、弱塩基性薬物を含むコアを含み、一方、第2の薬物粒子集合は、弱塩基性薬物を含むコアと、薬物コアを覆って配置されたアルカリ性緩衝層と;アルカリ性緩衝層を覆って配置された徐放性コーティングであって、水不溶性高分子を単独で、又は腸溶性高分子と組み合わせて含む徐放性コーティングとを含む。
【0012】
さらに別の実施形態において、本発明は、少なくとも2つの薬物粒子集合を含む医薬剤形に関する。一つの薬物粒子集合は、弱塩基性薬物を含むコアを含み、一方、第2の薬物粒子集合は、弱塩基性薬物を含むコアと、薬物コアを覆って配置されたアルカリ性緩衝層と;アルカリ性緩衝層を覆って配置された徐放性コーティングであって、水不溶性高分子を単独で、又は水溶性高分子と組み合わせて含む徐放性コーティングとを含む。
【0013】
別の実施形態において、本発明は、医薬剤形の調製方法に関する。一実施形態において、医薬剤形は、本明細書に記載される微粒子を、崩壊剤と組み合わせたサッカリド及び/又は糖アルコールを含む速分散性顆粒と混合して圧縮ブレンドを形成し、そのブレンドを圧縮して錠剤にすることにより調製される。別の実施形態において、医薬剤形は、本明細書に記載される微粒子をカプセルに充填することにより調製される。
【図面の簡単な説明】
【0014】
【図1】アルカリ性緩衝剤コートを有するIRビーズ(上図)と、本発明の特定の実施形態に従う弱塩基性薬物を含むアルカリ性緩衝剤コートを有するIRビーズを含むSR又はTPRビーズ(下図)との断面を示す。図1(上側の略図)では、アルカリ性緩衝剤コートを有するIRビーズ10は、保護シーラント層14を覆って配置されたアルカリ性緩衝層12を含み、保護シーラント層14は、糖、球状ラクトース、微結晶性セルロース、マンニトール−微結晶性セルロース、又は二酸化ケイ素を含む不活性コア18を覆って配置された弱塩基性薬物層16を覆って配置される。同じ図(下側の略図)において、SR又はTPRビーズ20は、徐放性コーティング(SR又はTPR層)24を覆って配置された圧縮性コーティング層26を含み、徐放性コーティング24はシーラント層22を覆って配置され、シーラント層22は、アルカリ性緩衝剤コートを有するIRビーズ10を覆って配置される。
【発明を実施するための形態】
【0015】
引用文献は全て、あらゆる目的から全体として参照により本明細書に援用される;いずれの文献の引用も、それが本発明に関する先行技術であることを認めるものと解釈されてはならない。
【0016】
用語「薬物」、「活性」又は「活性医薬成分」は、本明細書で使用されるとき、薬学的に許容可能で、且つ治療上有効な化合物、その薬学的に許容可能な塩、立体異性体及び立体異性体の混合物、溶媒和物(水和物を含む)、多形、及び/又はエステルを含む。本発明の様々な実施形態の記載において薬物というとき、その参照には、基本となる薬物、その薬学的に許容可能な塩、立体異性体及び立体異性体の混合物、溶媒和物(水和物を含む)、多形、及び/又はエステルが包含される。
【0017】
用語「口腔内崩壊錠」すなわち「ODT」は、投与後、例えば噛み砕く必要なしに患者の口腔内で急速に崩壊する錠剤を指す。崩壊速度は様々であり得るが、投与後直ちに嚥下することを意図した従来の固形剤形(すなわち、錠剤若しくはカプセル)又はチュアブル錠型の固形剤形の崩壊速度より速い。
【0018】
用語「約」は、本明細書で数量を参照して使用されるとき、「正確に」を含む。例えば、「約60秒」は、正確に60秒と、加えて60秒に近い値(例えば、50秒、55秒、59秒、61秒、65秒、70秒等)とを含む。
【0019】
用語「弱塩基性薬物」は、pKaが約5〜約14の範囲の、1個又は複数の窒素部分を含有する薬物であって、酸性及び中性pH条件下(すなわち約1.2から約6.8のpHに至るまでのpH)では極めて溶けやすい乃至溶けやすいが、pH6.8を上回ると難溶性となる薬物を包含する。溶解度を指す用語(例えば、「極めて溶けやすい」、「溶けやすい」、「難溶性」等)は、U.S.Pharmacopeia(第26巻、NF 21、2003年)の定義と同じ意味を有し、但し提供される溶解度の限度はおおよその限度を表すと理解されるものとする。例えば、「極めて溶けやすい」は、室温で規定のpHにおいて水又は水溶液1mL当たり約1g以上の溶質の溶解度を有することを意味し;「溶けやすい」は、室温で規定のpHにおいて水又は水溶液1mL当たり約100〜約1000mgの溶質の溶解度を有することを意味し;「難溶性」は、室温で水1mL当たり約100mg未満の溶質の溶解度を有することを意味する。
【0020】
本明細書で使用されるとき、用語「徐放性」コーティングは、徐放性コーティングで被覆された粒子からの薬物の放出を遅延させ、放出を延長し、放出を持続させ、放出を抑制し、及び/又は放出をその他の形で長引かせるコーティングを包含する。用語「徐放性」は、「持続放出」及び「時限パルス放出」を包含する。徐放性コーティングは、本明細書では「ラグタイム」コーティングとも称され得る。
【0021】
本明細書で使用されるとき、用語「即時放出コア」は、場合によりシーラント層を有するが、但し徐放性コーティングでは被覆されない、薬物を含有するコアを指す。「即時放出コア」は、薬物結晶(又は非晶質粒子)、1つ若しくは複数の賦形剤を有する薬物の顆粒、又は薬物層を重ねた不活性コア(例えば、球状糖)(及び任意の結合剤)と、保護シーラントコーティングと、任意のアルカリ性緩衝層とを含むことができる。「即時放出コア」は、本明細書に記載されるとおりの即時放出特性を有する。長期放出性の粒子(例えば、SR粒子、TPR粒子等)は、即時放出コアを長期放出性のコーティングで被覆することにより調製することができる。
【0022】
本明細書で使用されるとき、用語「即時放出」すなわちIRは、剤形の投与後約2時間以内、より詳細には約1時間以内に活性成分の約50%以上(特に口腔内崩壊性の剤形に取り込むため味マスキングが施されている場合)、好ましくは約75%超、より好ましくは約90%超、及び特定の実施形態に従えば約95%超が放出されることを指す。
【0023】
用語「TPR粒子」又は「TPRビーズ」は、TPR(「時限パルス放出」)コーティングで被覆された薬物含有粒子、例えば、薬物層を有するビーズ、薬物を含有する顆粒、又は薬物粒子を指す。TPRコーティングは、薬物の即時放出パルス又は持続性の薬物放出プロファイルを所定のラグタイム後にもたらす。用語「ラグタイム」は、薬物含有粒子の経口投与後、又は二段階溶出溶媒若しくは1つ以上の模擬体液への曝露後、薬物含有粒子から放出される薬物が約10%未満である期間を指す。一実施形態において、用語「ラグタイム」は、二段階溶出溶媒又は1つ以上の模擬体液への曝露後、粒子から薬物が実質的に放出されない期間を指す。いくつかの実施形態において、例えば、少なくとも1つの水不溶性高分子と少なくとも1つの腸溶性高分子との組み合わせ(例えば、エチルセルロースとフタル酸ヒプロメロースとの組み合わせ)で粒子を被覆することにより、少なくとも約1〜10時間のラグタイムが実現される。一実施形態において、ラグタイムは、約2〜約10時間の範囲である。TPR層は、場合により可塑剤を含有し得る。
【0024】
用語「持続放出性コーティング」すなわち「SRコーティング」は、持続放出特性をもたらすコーティング、例えば、薬物含有粒子からの薬物の放出を緩徐化し、但し感知され得る「ラグタイム」は提供しないコーティングを指す。一実施形態において、SRコーティングは水不溶性高分子と、場合により水溶性高分子とを含む。
【0025】
用語「実質的に崩壊する」は、ODT組成物の崩壊が少なくとも約50%、少なくとも約60%、少なくとも約70%、少なくとも約80%、少なくとも約90%、又は約100%の崩壊に達する崩壊レベルを意味する。
【0026】
IR粒子の味マスキング層(存在する場合)に関して、用語「味を実質的にマスキングする」は、患者の口腔内に苦味のある薬物が放出されるのを実質的に阻止する味マスキング層の能力を指す。薬物の味を「実質的にマスキングする」味マスキング層により、患者の口腔内に放出されるのは、典型的には薬物の約10%未満であり、他の実施形態では、薬物の約5%未満、約1%未満、約0.5%未満、約0.1%未満、約0.05%未満、約0.03%未満、約0.01%未満である。本発明の組成物の味マスキング層の味マスキング特性は、インビボで(例えば、当該技術分野において公知の従来の官能検査法を用いて)、又はインビトロで(例えば、本明細書に記載されるとおりの溶出試験を用いて)計測することができる。当業者は、薬物の味を「実質的にマスキングする」味マスキング層に関連する薬物放出量が、本明細書に明示的に開示される範囲に限られず、薬物の知覚される苦味、及び例えば組成物中の香料剤の存在などの他の要因によって変わり得ることを認識するであろう。
【0027】
用語「血漿濃度−時間プロファイル」、「Cmax」、「AUC」、「Tmax」、及び「排出半減期」は、「FDA Guidance for Industry:Bioavailability and Bioequivalence Studies for Orally Administered Drug Products」(2003年3月)に定義されるとおりの、それらの一般に認められている意味を有する。
【0028】
特に明記しない限り、本明細書に記載される様々なコーティング又は層の量(「コーティング重量」)は、被覆前の粒子又はビーズの初期重量に対する、乾燥後のコーティングによってもたらされる粒子又はビーズの重量増加百分率で表される。従って、10%のコーティング重量は、乾燥後に粒子の重量が10%増加するコーティングを指す。特に明記しない限り、比は重量で計算される。
【0029】
一実施形態において、本発明は、複数の徐放性粒子を含む医薬組成物に関し、ここで各粒子は、弱塩基性薬物を含むコアと;コアを覆って配置されたアルカリ性緩衝層と;アルカリ性緩衝層を覆って配置された徐放性コーティングとを含む。詳細な実施形態において、徐放性コーティングは水不溶性高分子を含む。本発明の特定の実施形態に従えば、本医薬組成物は、pKaが約5〜約14で、且つ室温の水溶液に対する溶解度がpH約1.2〜6.8では少なくとも約200mg/mLで、且つpH8以上では溶解度が約10mg/mL未満の、少なくとも1つの窒素含有部分を有する任意の弱塩基性薬物を包含する。薬物放出の制御機構の理論によって制約を受けるものではないが、弱塩基性薬物含有コアを覆って配置されたアルカリ性緩衝層は、薬物の界面にアルカリ性pHのミクロ環境を作り出し、そこでは、徐放性コートを有するビーズの外部が薬物の溶けやすい酸性であっても、薬物はよくて難溶性であり、従って経口投与時のドーズダンピングが回避される。
【0030】
いくつかの実施形態において、本発明の弱塩基性薬物は、以下の薬物クラスの非限定的な例から選択することができる:鎮痛薬、抗痙攣薬、抗糖尿病剤、抗感染剤、抗悪性腫瘍薬、抗パーキンソン病剤、抗リウマチ剤、心血管系薬剤、中枢神経系(CNS)刺激薬、ドパミン受容体作動薬、制吐薬、胃腸剤、精神治療剤(例えば、抗精神病剤)、オピオイド作動薬、オピオイド拮抗薬、抗てんかん薬、ヒスタミンH2拮抗薬、抗喘息薬、及び骨格筋弛緩薬。
【0031】
弱塩基性薬物の例としては、限定はされないが、窒素部分を含有するブチロフェノン誘導体、フェニルアミノイミダゾリン(例えば、クロニジン、抗高血圧剤)、ジヒドロキシフェニルイソプロピルアミノエタン(例えば、フェノテロール、気管支拡張剤)、フェノキシブチルアミノプロパノール(例えば、β−抗アドレナリン性ブニトロロール)、フェノキシアミノプロパン(例えば、抗不整脈性メキシレチン)、アミノエチルオキサゾロアゼピン(抗高血圧剤及び抗狭心症剤)又はその薬学的に許容可能な塩、溶媒和物、エステル、多形、若しくは混合物が挙げられる。いくつかの実施形態において、弱塩基性薬物は、排出半減期が約2時間〜約7時間である。
【0032】
用語「〜を覆って配置された」は、第2の材料が第1の材料を覆って堆積されることを意味し、ここで第2の材料は、第1の材料と物理的に接触していても、又は接触していなくともよい。従って、必ずしも必須ではないが、第1の材料と第2の材料との間に介在する材料を置くことが可能である。
【0033】
アルカリ性緩衝層は、徐放性粒子の内部の薬物界面にアルカリ性のミクロ環境を作り出すと考えられる。このミクロ環境では弱塩基性薬物は溶解度が低くなるため、アルカリ性緩衝層は胃腸管の酸性〜中性のpH条件、すなわち本来ならば薬物が急速に溶出するであろう条件下で薬物の放出を効果的に遅延させる。アルカリ性緩衝層を本発明の組成物に組み込むことにより、1日1回又は1日2回の投薬レジメンに好適な薬物動態特性を実現することが可能である。本発明の組成物に好適なアルカリ性緩衝剤の非限定的な例としては、水酸化ナトリウム、リン酸二水素一ナトリウム、リン酸水素二ナトリウム、リン酸三ナトリウム、酢酸ナトリウム、炭酸又は重炭酸ナトリウム、リン酸二水素一カリウム、リン酸水素二カリウム、リン酸三カリウム、酢酸カリウム、炭酸又は重炭酸カリウム、リン酸マグネシウム、酢酸マグネシウム、炭酸マグネシウム、酸化マグネシウム、水酸化マグネシウム、ケイ酸ナトリウム、ケイ酸カルシウム、複合体のメタケイ酸マグネシウムアルミニウム、及びこれらの混合物が挙げられる。アルカリ性緩衝層は、場合により高分子結合剤を含有する。高分子結合剤は、ヒドロキシプロピルセルロース、ポビドン、メチルセルロース、ヒドロキシプロピルメチルセルロース、カルボキシアルキルセルロース、ポリエチレンオキシド、及び多糖からなる群から選択することができる。
【0034】
徐放性粒子内で、アルカリ性緩衝層はシーラント層上に配置され、そのシーラント層はまた、弱塩基性薬物を含むコア上に配置される。一実施形態において、アルカリ性緩衝層は、必要であれば高分子結合剤を含み得る。好適な高分子結合剤の非限定的な例としては、ヒドロキシプロピルセルロース、ポビドン、メチルセルロース、ヒドロキシプロピルメチルセルロース、カルボキシアルキルセルロース、ポリエチレンオキシド、デンプン、及び多糖が挙げられる。いくつかの実施形態において、アルカリ性緩衝剤と弱塩基性薬物との比は、約5:1〜約1:5、例えば約3:1〜約1:3の範囲である。
【0035】
いくつかの実施形態において、本発明の組成物は、アルカリ性緩衝層の下層をなして薬物含有コア上に配置されたシーラント層を含むことができる。この保護シーラント層は、薬物含有コアとアルカリ性緩衝層とを隔てるもので、以下の利点のうちの1つ又は複数を提供し得る:加工又は保管中の薬物とアルカリ性緩衝剤との間の接触を防止する(又は最小限に抑える);静電気を防止する(又は最小限に抑える);粒子の摩滅を防止する(又は最小限に抑える);薬物の製造又は保管中に弱塩基性薬物とアルカリ性緩衝剤とが接近することによって引き起こされ得る潜在的な不安定性(例えば、薬物と緩衝剤との間での付加化合物の形成)を回避する;及び経口摂取後に剤形が溶出溶媒又は体液と接触するまで、アルカリ性緩衝剤と弱塩基性薬物とが直接接触しないことを確実にする。一実施形態において、シーラント層は、親水性高分子を含む。好適な親水性高分子の非限定的な例としては、親水性ヒドロキシプロピルセルロース(例えば、Klucel(登録商標)LF)、ヒドロキシプロピルメチルセルロース又はヒプロメロース(例えば、Opadry(登録商標)Clear又はPharmacoat(商標)603)、ビニルピロリドン−酢酸ビニル共重合体(例えば、BASFからのKollidon(登録商標)VA64)、及び低粘度エチルセルロース(例えば、ウベローデ粘度計を使用して計測したとき、25℃の80/20トルエン/アルコール中の5%溶液における粘度が10cps以下)が挙げられる。シーラント層は、シーラントコートを有する薬物含有コアの重量の約1%〜約20%、例えば約1%、約2%、約3%、約4%、約5%、約7%、約10%、約12%、約15%、約17%、又は約20%(それらの間のあらゆる範囲及び部分範囲を含む)を構成し得る。
【0036】
いくつかの実施形態において、本発明の微粒子は、アルカリ性緩衝層上に配置された、水不溶性高分子を含む徐放性コーティングを含む。いくつかの実施形態において、徐放性コーティングは、水溶性又は腸溶性高分子の不在下に水不溶性高分子を含む。この最後の実施形態では、徐放性コーティングは、二段階溶出法(最初の2時間は700mLの0.1NのHCl(塩酸)、その後200mLのpH調整剤を添加することにより得られるpH6.8の900mL中)で試験したとき、約8時間〜約20時間にわたり薬物の放出を持続し、1日1回又は1日2回の投薬レジメンに好適である。
【0037】
好適な水不溶性高分子の非限定的な例としては、エチルセルロース、酢酸セルロース、酢酸酪酸セルロース、ポリ酢酸ビニル、中性のメタクリル酸−メタクリル酸メチル共重合体、及びこれらの混合物が挙げられる。一実施形態において、水不溶性高分子はエチルセルロースを含む。別の実施形態において、水不溶性高分子は、ウベローデ粘度計により25℃で計測したとき、80/20トルエン/アルコール中の5%溶液における平均粘度が10cpsであるエチルセルロースを含む。持続放出性コーティングの水不溶性高分子は、約3%〜約30%、例えば、約3%、約5%、約7%、約10%、約12%、約15%、約17%、約20%、約22%、約25%、約27%、約30%、約35%、及び約40%(それらの間のあらゆる範囲及び部分範囲を含む)の重量増加をもたらす。一実施形態において、持続放出性微粒子は、可塑化された水不溶性高分子、例えばエチルセルロース(EC−10)の持続放出性コーティングを約5〜50重量%で有し、それにより薬物放出を約4〜20時間にわたり持続させ得る。
【0038】
一実施形態において、徐放性コーティングの水不溶性高分子は、可塑剤をさらに含む。好適な可塑剤の非限定的な例としては、トリアセチン、クエン酸トリブチル、クエン酸トリエチル、クエン酸アセチルトリ−n−ブチル、フタル酸ジエチル、ヒマシ油、セバシン酸ジブチル、モノアセチル化及びジアセチル化グリセリド(例えば、Myvacet(登録商標)9〜45)、及びこれらの混合物が挙げられる。本発明の実施形態で用いられるとき、可塑剤は、水不溶性高分子の約3重量%〜約30重量%を構成し得る。別の実施形態において、可塑剤は、水不溶性高分子の10重量%〜約25重量%を構成する。さらに他の実施形態において、水不溶性高分子の重量に対する可塑剤の量は、約3%、約5%、約7%、約10%、約12%、約15%、約17%、約20%、約22%、約25%、約27%、及び約30%(それらの間のあらゆる範囲及び部分範囲を含む)である。当業者は、1つ又は複数の可塑剤の1つ又は複数のタイプ及び1つ又は複数の量が、1つ又は複数の高分子及びコーティング系の性質(例えば、水性又は溶媒ベース、溶液又は分散体ベース、及び全固形物)に基づき選択され得ることを認識するであろう。一実施形態において、徐放性コーティングに可塑剤が用いられる場合、可塑剤はフタル酸塩を含まない。
【0039】
本発明の一実施形態では、可塑剤が存在する各被覆層において、1つ又は複数の可塑剤はフタル酸塩を含まない。
【0040】
いくつかの実施形態において、アルカリ性緩衝層上に配置される徐放性コーティングは、水溶性高分子と組み合わせた水不溶性高分子を含み、薬物の持続放出をもたらす。一実施形態において、水不溶性高分子と水溶性高分子との比は、約95/5〜約50/50の範囲、例えば約90/10〜約60/40の範囲である。別の実施形態において、水不溶性高分子と水溶性高分子とは、組み合わせで、被覆されたコアの約3重量%〜約50重量%、例えば、約10重量%〜約50重量%、約3重量%〜約30重量%、及び約5重量%〜約30重量%の範囲を構成する。他の実施形態において、水不溶性高分子と水溶性高分子とを組み合わせた量は、即時放出コアの重量の約3%、約5%、約7%、約10%、約12%、約15%、約17%、約20%、約22%、約25%、約27%、約30%、約35%、約40%、約45%、及び約50%(それらの間のあらゆる範囲及び部分範囲を含む)を構成する。
【0041】
本発明の特定の実施形態に従い用いられる水溶性高分子は、水溶性高分子を包含する。好適な水溶性高分子の非限定的な例としては、ポリビニルピロリドン(例えば、Povidone K−25)、ポリエチレングリコール(例えば、PEG 400)、ヒドロキシプロピルメチルセルロース、及びヒドロキシプロピルセルロースが挙げられる。一実施形態において、持続放出性コーティングは、二段階溶出法(最初の2時間は700mLの0.1NのHCl(塩酸)、その後200mLのpH調整剤を添加することにより得られるpH6.8の900mL中)で試験したとき、約12〜約16時間にわたり持続する薬物放出をもたらし、1日1回又は1日2回の投薬レジメンに好適である。
【0042】
別の実施形態において、徐放性コーティングは、胃溶性増孔剤と組み合わせた水不溶性高分子を含み、薬物の持続放出をもたらす。胃溶性増孔剤の例は、炭酸カルシウムである。他の好適な胃溶性増孔剤としては、塩化ナトリウム、炭酸カルシウム、リン酸カルシウム、カルシウムサッカリド、コハク酸カルシウム、酒石酸カルシウム、酢酸第二鉄、水酸化第二鉄、リン酸第二鉄、炭酸マグネシウム、クエン酸マグネシウム、水酸化マグネシウム、リン酸マグネシウム等が挙げられる。
【0043】
いくつかの実施形態において、徐放性コーティングは、腸溶性高分子と組み合わせた水不溶性高分子を含み、薬物の遅延放出又は時限パルス放出(TPR)をもたらす。このタイプの徐放性コーティング(すなわち、水不溶性高分子と腸溶性高分子との組み合わせ)は、本明細書では「ラグタイム」コーティングと称することができ、ラグタイムコーティングで被覆された微粒子は、本明細書ではTPR微粒子と称することができる。用語「ラグタイム」は、薬物含有粒子の経口投与後、又は二段階溶出溶媒若しくは1つ以上の模擬体液への曝露後、薬物含有粒子から放出される薬物が約10%未満である期間を指す。一実施形態において、用語「ラグタイム」は、二段階溶出溶媒又は1つ以上の模擬体液への曝露後、粒子から薬物が実質的に放出されない期間を指す。一実施形態において、ラグタイムコーティングは、アルカリ性緩衝層上に直接堆積される。別の実施形態において、ラグタイムコーティングは、アルカリ性緩衝層を被覆する1つ又は複数の層(例えば、シーラント層)上に直接堆積される。いくつかの実施形態において、水不溶性高分子と腸溶性高分子との比は、約10:1〜約1:4の範囲、例えば、約9:1〜約1:3及び約3:1〜約1:1の範囲である。他の実施形態において、水不溶性高分子と腸溶性高分子とは、組み合わせで、即時放出コアの約5重量%〜約60重量%、例えば、約10重量%〜約60重量%、及び約10重量%〜約50重量%の範囲を構成する。好適な腸溶性高分子の非限定的な例としては、酢酸フタル酸セルロース、フタル酸ヒドロキシプロピルメチルセルロース、酢酸コハク酸ヒドロキシプロピルメチルセルロース、ポリビニルアセテートフタレート、pH感受性のメタクリル酸−メタメタクリレート共重合体、シェラック、及びこれらの混合物が挙げられる(用語「pH感受性」は、pH依存性の溶解度を有する高分子を指す)。こうした腸溶性高分子は、乾燥粉末又は水性分散体として用いられ得る。用いることのできるいくつかの市販の材料は、Rohm Pharmaによって製造されているEudragit(L100、S100、L30D)、Eastman Chemical Co.からのCellacefate(酢酸フタル酸セルロース)、FMC Corp.からのAquateric(酢酸フタル酸セルロース水性分散体)、及び信越化学工業からのAqoat(酢酸コハク酸ヒドロキシプロピルメチルセルロース水性分散体)の商標で販売されているメタクリル酸共重合体である。一実施形態において、TPRコーティングは、水不溶性高分子としてエチルセルロース(例えば、EC−10)を、及び腸溶性高分子としてフタル酸ヒプロメロース(例えば、HP−55)を含む。
【0044】
一実施形態において、TPR微粒子は、約1時間〜約10時間のラグタイム、例えば、約2時間〜約7時間、約2時間〜約4時間(「より短いラグタイム」)、及び約7時間〜約8時間(「より長いラグタイム」)を提供し得る。別の実施形態において、TPR微粒子は、経口投与してから約1時間〜約10時間のラグタイムを経た後、胃腸管において約4時間〜約16時間の期間にわたり薬物を放出する。
【0045】
別の実施形態において、微粒子は、徐放性コーティング上に配置された外側のラグタイムコーティングを含む。このタイプの実施形態は、腸のより高いpHで薬物を放出し始め、続いて薬物の持続放出を行う。
【0046】
SR及びTPR微粒子の薬物放出プロファイルは、USP装置1又は2において二段階溶出溶媒を用いる溶出試験(最初の2時間は37℃で700mLの0.1NのHC1中、その後200mLのpH調整剤を添加することによって得られるpH6.8で溶出試験)を行うことにより決定することができる。時間に伴う薬物放出は、様々な方法を用いて、例えば特定の時点で採取した試料に対するHPLCにより測定することができる。
【0047】
SR又はTPRコーティングは、薬物界面における薬物溶出の制御、ひいては微粒子からの薬物放出に寄与する。実現可能なラグタイム又は持続放出時間は、組成物及び持続放出性コーティングの厚さ、及び/又は組成物及びラグタイムコーティングの厚さに依存する。最適な1日2回又は1日1回の投薬形態の実現に影響を及ぼし得る具体的な要因としては、限定はされないが、治療剤のpKa(及びその溶解性、すなわち、薬物が酸性及び中性pH条件下では溶けやすいが、pH8.0以上では難溶性であること)、排出半減期、及びアルカリ性緩衝剤によって作り出されるミクロなアルカリ性pH環境での溶解度の低下が挙げられる。
【0048】
別の実施形態において、微粒子は、徐放性コーティング上に配置された(又は徐放性コーティングがさらにTPRコーティングで被覆されている場合、最外側のコーティング上に配置された)圧縮性コーティングを含む。圧縮性コーティングは、親水性高分子を含む。一実施形態において、親水性高分子は、ヒドロキシプロピルセルロース、ポリ(酢酸ビニル−ビニルピロリドン)、ポリ酢酸ビニル、及び可塑化された低粘度のエチルセルロースラテックス分散体からなる群から選択される。このコーティングは、例えば、エチルセルロースの可塑化された水性分散体による流動層コーティングによって塗布され得る。その目的は、速分散性微粒剤と共に圧縮する間に膜の完全性を維持することである。
【0049】
微粒子コアは弱塩基性薬物を含む。いくつかの実施形態において、コアは、不活性ビーズ、微粒剤、又は薬物結晶の形態をとり得る。一実施形態において、コアは、弱塩基性薬物を含む薬物層で被覆された不活性ビーズを含む。不活性ビーズは、糖、微結晶性セルロース、マンニトール−微結晶性セルロース、二酸化ケイ素等を含み得る。コアは、平均粒径が400μm以下、又は別の実施形態では350μm以下である。一実施形態において、薬物層は高分子結合剤を含む。高分子結合剤は、ヒドロキシプロピルセルロース、ポビドン、メチルセルロース、ヒドロキシプロピルメチルセルロース、カルボキシアルキルセルロース、ポリエチレンオキシド、デンプン(例えば、コーンスターチ及びゼラチン化コーンスターチ)、並びに多糖からなる群から選択することができる。薬物と高分子結合剤との比は、約85:15〜約100:0(結合剤なし)の範囲であり得る。
【0050】
本明細書に記載される医薬組成物は、崩壊剤と組み合わせたサッカリド及び/又は糖アルコールを含む速崩壊性顆粒をさらに含み得る。崩壊剤は、クロスポビドン、デンプングリコール酸ナトリウム、架橋カルボキシメチルセルロースナトリウム、及び低置換度ヒドロキシプロピルセルロースからなる群から選択することができる。サッカリド及び/又は糖アルコールは、ラクトース、スクラロース、スクロース、マルトース、マンニトール、ソルビトール、キシリトール、及びマルチトールからなる群から選択され得る。速分散性微粒剤中における崩壊剤のサッカリド及び/又は糖アルコールに対する比は、(重量で)約1/99〜約10/90の範囲であり、いくつかの実施形態では約5/95である。いくつかの実施形態において、崩壊剤又はサッカリド及び/又は糖アルコール、又はその双方は、平均粒径が約30μm以下の微粒子の形態で存在し得る。薬物含有微粒子と速崩壊性顆粒との比は、約1:6〜約1:2の範囲であり得る。
【0051】
別の実施形態において、本発明は、本明細書に記載される微粒子を含む医薬剤形に関する。医薬剤形としては、口腔内崩壊錠(ODT)、従来の錠剤、及びカプセル(例えば、硬ゼラチン若しくはHPMCカプセル、多糖カプセル)が挙げられる。医薬剤形がODTの形態をとる場合、ODTは、口腔内の唾液又は模擬唾液との接触後、約60秒以内に実質的に崩壊する。別の実施形態において、ODTは、約30秒以内に実質的に崩壊する。崩壊は、USP 701崩壊試験に従い試験される。一実施形態において、ODTは治療上有効量の弱塩基性薬物を含み、ここでODTは、投与後、患者の口腔内で実質的に崩壊して、ザラザラした舌触り又は後味のない滑らかで嚥下が容易な懸濁液を形成し、1日1回又は1日2回の投薬レジメンに好適な前記弱塩基性薬物の目的のPKプロファイル(すなわち、血漿濃度対時間プロット)をもたらす。
【0052】
医薬剤形が錠剤のとき、それは好ましくは摩損度が約1%未満である。医薬剤形がODTのとき、錠剤はまた、圧縮性の希釈剤、充填剤、着色剤、及び場合により潤滑剤など、崩壊錠の製剤化に用いるのに好適な薬学的に許容可能な賦形剤も含み得る。
【0053】
いくつかの実施形態において、ODTの重量は、約2000mg以下;例えば、2000mg以下;1500mg以下;1000mg以下;500mg以下である。別の実施形態において、ODTの重量は約1600mg以下である。別の実施形態において、ODTの重量は約800mg以下である。別の実施形態において、ODTの重量は500mg以下である。
【0054】
ODTは、速崩壊性微粒子と組み合わせた、本明細書に記載されるSR微粒子の1つ以上の集合及び/又はTPR微粒子の1つ以上の集合、又はこれらの混合物を含む。ODTは、IR粒子をさらに含み得る。例えば、医薬剤形は、速崩壊性顆粒と組み合わせたSR微粒子;速崩壊性顆粒と組み合わせたTPR微粒子;IR微粒子、SR微粒子、及び速分散性顆粒;IR微粒子、TPR微粒子、及び速分散性顆粒;又は速分散性顆粒と組み合わせた、IR微粒子、SR微粒子、及び、同じ、若しくは異なるラグタイムを有し得る1つ以上のTPR微粒子集合(例えば、短いラグタイムのTPR微粒子及び長いラグタイムのTPR微粒子)を含み得る。微粒子をこのように種々に組み合わせることで、異なる所望の薬物放出プロファイルを実現することができる。例えば、排出半減期が約7時間の活性成分の1日1回の投薬形態は、即時放出パルスをもたらすIRビーズ集合と、より短いラグタイム(約2〜4時間)の、急速な持続放出プロファイルをもたらす第2のSRビーズ又はTPRビーズ集合と、より長いラグタイム(約7〜8時間)の、典型的には約8〜12時間にわたる遅延した持続放出プロファイルを可能にする第3のTPRビーズ集合との混合物を含み、それにより許容可能な血漿濃度が12〜24時間で維持され得る。
【0055】
医薬剤形にIR粒子が存在するとき、IR粒子とSR及び/又はTPR粒子との比は、約0:100(IR粒子なし)〜約50:50の範囲である。IR粒子は、粒子中に含まれる薬物の味を実質的にマスキングする味マスキング層を塗布することにより、味マスキングが施されてもよい。こうした味をマスキングされたIR粒子は、模擬唾液(pH約6.8)で溶出試験を行うと、3分(口腔内でODTについて予想される典型的な最長滞留時間)で約10%以下しか放出せず、それに対し0.1NのHCl中で溶出試験を行うと、約60分で用量の約75%以上を放出する。
【0056】
IR粒子は、味マスキング層を提供する水不溶性高分子(例えば、エチルセルロース)で場合により被覆された薬物含有コアを含む。水不溶性高分子のコーティングは可塑剤を含み得る。水不溶性高分子のコーティングは、さらに、例えば2005年8月26日に出願された同時係属中の米国特許出願第11/213,266号明細書(2006年5月18日に公開された米国特許出願公開第2006/0105038号明細書)の開示に従い、胃溶性増孔剤(例えば、炭酸カルシウム)を含むことができ、又は水不溶性高分子(例えば、平均粘度が10cpsのエチルセルロース)の単独での、若しくは、例えば2005年10月12日に出願された同時係属中の米国特許出願第11/248,596号明細書(2006年4月13日に公開された米国特許出願公開第2006/0078614号明細書)の開示に従い、胃溶性高分子(例えば、Eudragit E100又はEPO)との、若しくは、例えば2005年10月21日に出願された同時係属中の米国特許出願第11/256,653号明細書(2006年5月18日に公開された米国特許出願公開第2006/0105039号明細書)の開示に従い、胃溶性増孔剤(例えば、炭酸カルシウム)との組み合わせでの流動層コーティングによる。本明細書に示されるこれらの出願の各々は、あらゆる目的から全体として参照により援用される。
【0057】
本明細書に記載されるODTは、以下の利点のうちの1つ又は複数を有し得る:(i)口腔内で唾液と接触すると約60秒で崩壊して、滑らかで嚥下が容易な懸濁液であって、味マスキングが施され、及び/及び薬物を含有する粒子を含む懸濁液を形成する;(ii)<USP 701>崩壊試験により試験したとき、約30秒以内に崩壊する;(iii)味マスキングが施されたIR粒子が存在する場合、それは、胃に侵入すると、急速で実質的に完全な用量の放出をもたらす(例えば、典型的には約60分で約75%超);及び/又は(iv)SR粒子及び/又はTPR粒子は、胃腸管内での薬物の持続放出及び/又は遅延放出をもたらす。
【0058】
別の実施形態において、本発明は、本明細書に記載される微粒子の医薬組成物の調製方法に関する。一実施形態において、本方法は、(a)弱塩基性薬物を含むコアを調製するステップと;(b)ステップ(a)の薬物含有コアをシーラント層で被覆するステップと;(c)ステップ(b)のシーラント層を有するコアを、アルカリ性緩衝剤を含む層で被覆するステップと;(d)ステップ(c)のアルカリ性緩衝層を有するコアを、徐放性層で被覆して微粒子を提供するステップとを含む。コアを調製するステップは、当該技術分野において公知の方法のいずれによって達成してもよい;例えば、不活性ビーズ(例えば、糖、微結晶性セルロース、マンニトール−微結晶性セルロース、二酸化ケイ素等)に、薬物と、場合により高分子結合剤とを含む溶液の層を(例えば、流動層コーティング又はパンコーティングにより)重ねる;薬物を、適切な希釈剤(例えば、微結晶性セルロース及び/又はラクトース)と共に造粒する;薬物の混合物を押し出して球状化する;薬物を、直径約1〜2mmのミニ錠剤に圧縮する;又は単純に、所望の粒径(例えば、約50〜500μm、例えば100〜400μm)の薬物結晶を入手する。
【0059】
一実施形態において、本方法を用いて、持続放出性コーティングを有する微粒子が調製される。この実施形態において、ステップ(d)の徐放性コーティングは、約3%〜約30%の重量増加となるように水不溶性高分子と、場合により水溶性高分子とを含み、SR微粒子が得られる。別の実施形態において、本方法を用いて、時限パルス放出(TPR)コーティングを有する微粒子が調製される。この実施形態において、ステップ(d)の徐放性コーティングは、約10%〜約60%の重量増加となるように水不溶性高分子と腸溶性高分子とを含み、TPR微粒子が得られる。別の実施形態において、本方法を用いて、外側の時限パルス放出コーティングの下層に持続放出性コーティングを有する微粒子が調製される。この実施形態において、ステップ(d)の徐放性コーティングは、約3%〜約30%の重量増加となるように水不溶性高分子と、場合により水溶性高分子とを含み、持続放出性の微粒子が得られる。この持続放出性微粒子は、水不溶性高分子と腸溶性高分子とを含む層でさらに被覆され、SR/TPR微粒子が得られる。
【0060】
別の実施形態において、本発明は、医薬剤形の調製方法に関し、この方法は:本明細書に記載される微粒子を、崩壊剤と組み合わせたサッカリド及び/又は糖アルコールを含む速分散性顆粒と混合するステップと;得られた混合物を錠剤に圧縮してODTを提供するステップとを含む。さらに別の実施形態において、医薬剤形は、本明細書に記載される微粒子を硬ゼラチンカプセルに充填することによって調製され得る。
【0061】
一実施形態において、本方法は、
a)弱塩基性薬物粒子(平均粒径が50〜500μm、特に100〜400μm)、さらに特に100〜350μmの結晶、微粒剤、ビーズ、又はペレット)を調製し、薬物層を有するビーズ上に保護シールコートを塗布してIRビーズを生成するステップ;
b)必要であればIRビーズ上に高分子結合剤の溶液からアルカリ性緩衝層を塗布し、緩衝層上に保護シールコートを塗布するステップ;
c)約3%〜30%の重量増加となるように水不溶性高分子又は水溶性高分子と組み合わせた水不溶性高分子を含む持続放出性コーティングを塗布してSR粒子を生成するステップ;及び/又は
d)コートを有するビーズの約10重量%〜60重量%の重量増加となるように水不溶性と腸溶性高分子との約10:1〜1:4の重量比の組み合わせによりSR粒子又はアルカリ性緩衝層を有する粒子上にラグタイムコーティングを塗布してTPR粒子を生成するステップ;
e)場合によりSR層又はTPR層上に親水性高分子層を塗布するステップ;及び
f)IR粒子を有する、又は有しない適切な量のSR粒子又はTPR粒子を硬ゼラチンカプセルに充填するステップ;又は薬学的に許容可能な賦形剤及び1つ又は複数のビーズ集合(例えば、所望の比率のIRビーズ、SRビーズ及び/又はTPRビーズの組み合わせ)とブレンドした後、SR粒子又はTPR粒子を従来の錠剤又は口腔内崩壊錠剤(ODT)に圧縮するステップ、
を含む。
【0062】
Granurexを用いて制御して球状化することにより薬物層を有するペレットを調製し、同じGranurexでシールコートを有するIRペレットを覆って配置されるアルカリ性緩衝層を作成し、その後流動層機器で徐放性コーティングを塗布することにより、SR、ER又はTPRビーズを生成することが可能である。
【実施例】
【0063】
実施例1:
弱塩基性薬物についてのデコンボリューション後のインビトロ薬物放出プロファイル:
薬物動態学的評価を行い、弱塩基性薬物の1日1回又は1日2回の投薬形態を可能にし得る一連の理論的なインビトロ薬物放出プロファイルを同定することができる。単一用量を経口投与時又は定常状態での、及び/又は静脈内(IV)プロファイルに応じた(利用可能な場合)ヒトの血漿濃度−時間データを用いた、1又は2コンパートメント薬物動態(PK)モデル(例えば、2成分モデルが以下に概略的に示される))。経口(PO)及びIVデータの双方とも、同時にPKモデルにフィッティングすることができる。WinNonlinソフトウェアを使用してPKパラメータを推定し、PO及び/又はIVデータの予測を行うことで、シミュレートしたプロファイルの式が求まる。シミュレートした、すなわち、デコンボリューション後のインビトロプロファイルを模倣する、又は目標のプロファイルウィンドウを包含するインビトロ薬物放出プロファイルを有する製剤を開発する。次にPK試験で成人健常被験者において製剤を試験する。
【0064】
【表1】

【0065】
実施例2
2.A 弱塩基性薬物を含有するIRビーズ:
溶媒系(例えば、水、アセトン、エタノール又はこれらの混合物)に対し、結合剤高分子を徐々に添加して結合剤溶液を調製する。溶媒系に弱塩基性薬物を徐々に添加して溶解させる。次に薬物溶液に結合剤溶液を添加し、続いて混合する。或いは、結合剤及び薬物を順番に添加して溶解させる。流動層コーティング装置、例えば、Glatt GPCG 3(例えば、7インチボトムスプレーWurster 7 13/16インチカラム、200メッシュの生成物滞留スクリーンでカバーされた「C」空気分配ボトムプレートを装備)に、(例えば、60〜80メッシュの)球状糖を装入し、次にそれに結合剤/薬物溶液を噴霧する。次に被覆された球状糖を乾燥させて残留溶媒を(水分を含めて)除去し、篩別することにより(例えば、35及び80メッシュのスクリーンを使用)、過大な粒子及び微粉を取り除く。
【0066】
2.B 無水リン酸二ナトリウム(DPA)緩衝層の形成:
精製水に無水リン酸二ナトリウムを撹拌しながら添加し、溶解させる。流動層コーティング装置、例えば、Glatt GPCG 3(例えば、6インチボトムスプレーWurster 8インチカラム13及び200メッシュの生成物滞留スクリーンでカバーされた「C」分配プレート及び1.0mm口径ノズルを装備)に、IRビーズ(例えば、実施例2.Aのもの)を装入する。IRビーズに緩衝剤溶液を噴霧する。場合により緩衝剤コートを有するビーズを溶媒でリンスした後、約2重量%のシールコートを塗布する。乾燥させたIRビーズを篩別することにより(例えば、35及び80メッシュ篩を使用)、過大なビーズ及び微粉を取り除くことができる。
【0067】
2.C 弱塩基性薬物を含有するSRビーズ:
実施例2.Bの緩衝剤コートを有するビーズを、流動層コーティング装置において、場合により可塑化(例えば、エチルセルロースを10%w/wとしたクエン酸トリエチル)された水不溶性高分子(例えば、エチルセルロース)のSRコーティングで被覆する。緩衝剤コートを有するビーズに対し、溶媒中に溶解した圧縮性コーティング溶液(例えば、Klucel(登録商標)LFなどのヒドロキシプロピルセルロース)を約2重量%の重量増加となるように噴霧する。得られたSRビーズを乾燥させると、残留溶媒を除去することができる。
【0068】
2.D 速分散性微粒剤:
同時係属中の米国特許出願第10/827,106号明細書(2005年10月20日に米国特許出願公開第2005/0232988号明細書として公開、その内容は、あらゆる目的から参照により本明細書に援用される)に開示される手順に従い、速分散性微粒剤を調製する。平均粒径が約20μm以下のD−マンニトール(例えば、Roquette,仏国からのPearlitol 25)を、高剪断造粒機(VectorからのGMX 600)で8kgの架橋ポビドン(例えば、ISPからのCrospovidone XL−10)とブレンドし、精製水と共に造粒し、QuadroからのComilを使用して湿式粉砕し、トレイ上で乾燥させて約1%未満の乾燥減量(LOD)を得る。乾燥させた顆粒を篩別し、過大な材料を粉砕して、平均粒径が約175〜300μmの範囲の速分散性微粒剤を生成する。
【0069】
2.E SRビーズを含有する徐放性ODT:
速分散性微粒剤(約1200g)を、弱塩基性薬物のSRビーズ(約850g)並びに他の薬学的に許容可能な成分、例えば、香料(約25g)、甘味料(例えば、スクラロース、約10g)、さらなるクロスポビドン(約125g)、及び微結晶性セルロース(例えば、Avicel PH101、約250g)と、速分散性微粒剤とSRビーズとの比を約3:2としてツインシェルV形ブレンダで十分な時間にわたりブレンドし、圧縮するための均質に分散したブレンドを得る。外部潤滑システムを備えた生産規模の錠剤成形機を使用して、SRビーズとして50mgの弱塩基性薬物を含むODTを以下の条件で圧縮する:−工具:15mmの円形フラットフェース、ラジアスエッジ;圧縮力:16kN;平均重量:1000mg;平均硬度:46N;及び摩損度:0.28%。このように生成して得られたODT(50mg用量)は、口腔内で急速に崩壊して、被覆されたビーズを含む滑らかで嚥下が容易な懸濁液を生じ、1日1回の投薬レジメンに好適な、期待される薬物放出プロファイルをもたらす。
【0070】
実施例3
3.A 弱塩基性薬物を含有するIRビーズ:
溶媒系(例えば、水、アセトン、エタノール又はこれらの混合物)に対し、結合剤高分子を徐々に添加して結合剤溶液を調製する。その結合剤溶液に対し、弱塩基性薬物のクロニジン(フェニルアミノイミダゾリン誘導体)を徐々に添加し、混合しながら溶解させる。流動層コーティング装置、例えば、Glatt GPCG 3(例えば、7インチボトムスプレーWurster 7 13/16インチカラム、200メッシュの生成物滞留スクリーンでカバーされた「C」空気分配ボトムプレートを装備)に、球状微結晶性セルロース((例えば、GlattからのCellets 100)を装入し、次にそれに結合剤/薬物溶液を噴霧する。次にIRビーズを乾燥させて残留溶媒を(水分を含めて)除去し、篩別することにより(例えば、40及び100メッシュのスクリーンを通じて)、過大な粒子及び微粉を取り除くことができる。
【0071】
3.B 無水リン酸二ナトリウム(DPA)緩衝層:
精製水に無水リン酸二ナトリウムを撹拌しながら添加し、溶解させる。流動層コーティング装置、例えば、Glatt GPCG 3(例えば、6インチボトムスプレーWurster 8インチカラム13及び200メッシュの生成物滞留スクリーンでカバーされた「C」分配プレート及び1.0mm口径ノズルを装備)に、IRビーズ(例えば、実施例3.Aのもの)を装入する。IRビーズに緩衝剤溶液を噴霧する。場合により緩衝剤コートを有するビーズを溶媒でリンスした後、約2重量%のシールコートを塗布する。乾燥させたIRビーズを篩別すると(例えば、35及び80メッシュ篩を使用)、過大なビーズ及び微粉を取り除くことができる。
【0072】
3.C TPR層の形成:
実施例3.Bの緩衝剤コートを有するビーズを、流動層コーティング装置において、被覆されたビーズの30重量%の重量増加となるように90/10のアセトン/水中に溶解したエチルセルロース(Ethocel Premium 10cps)と、フタル酸ヒプロメロース(HP−55)と、TEC(クエン酸トリエチル)とを55/30/15の比で含むTPRコーティングで被覆する。緩衝剤コートを有するビーズに対し、溶媒中に溶解した圧縮性コーティング溶液(例えば、Klucel(登録商標)LFなどのヒドロキシプロピルセルロース)を、約2重量%の重量増加となるように噴霧する。得られたSRビーズを乾燥させると、残留溶媒を除去することができる。
【0073】
3.D TPRビーズを含有する徐放性ODT:
実施例2.Dの速分散性微粒剤を、実施例3.Cの弱塩基性薬物のTPRビーズ並びに他の薬学的に許容可能な成分、例えば、香料、甘味料(例えば、スクラロース)、さらなるクロスポビドン、及び微結晶性セルロース(例えば、Avicel PH101)と、速分散性微粒剤とTPRビーズとの比を約3:2としてツインシェルV形ブレンダで十分な時間にわたりブレンドし、圧縮するための均質に分散したブレンドを得る。TPRビーズとして50mgの弱塩基性薬物を含むODTを、外部潤滑システムを備えた生産規模の錠剤成形機を使用して圧縮する:このように生成して得られたODT(50mg用量)は、口腔内で急速に崩壊して、被覆されたビーズを含む滑らかで嚥下が容易な懸濁液を生じ、1日1回の投薬レジメンに好適な、期待される薬物放出プロファイルをもたらす。
【0074】
実施例4
4.A 弱塩基性薬物を含有するIRビーズ:
初めに高分子結合剤を添加して溶解させ、続いて弱塩基性薬物を添加することにより、適切な溶媒系中の薬物層形成溶液を調製する。次に、この溶液をCellets 100(平均粒径が100〜200μmの球状微結晶性セルロース)に塗布する。次に、得られたIRビーズを乾燥させて残留溶媒を(水分を含めて)除去し、篩別することにより(例えば、40及び100メッシュのスクリーンを通じて)、過大な粒子及び微粉を取り除く。
【0075】
4.B 酸化マグネシウム緩衝層の形成:
エタノールベースの溶媒系中の高分子結合剤溶液に対し、微粉化した酸化マグネシウムを撹拌しながら添加し、均質な分散を提供する。流動層コーティング装置、例えば、Glatt GPCG 3にIRビーズ(例えば、実施例4.Aのもの)を装入し、IRビーズに酸化マグネシウム/高分子結合剤溶液を噴霧する。場合により緩衝剤コートを有するビーズを溶媒でリンスした後、約2重量%のシールコートを塗布する。乾燥させたIRビーズを篩別すると、過大なビーズ及び微粉を取り除くことができる。
【0076】
4.C TPR層の形成:
実施例4.Bの緩衝剤コートを有するビーズを、流動層コーティング装置において、被覆されたビーズの10重量%の重量増加となるように95/5のアセトン/水中に溶解したエチルセルロース(EC−10)とTECとを90/10の比で含むSRコーティングで被覆する。SRコートを有するビーズを、約2重量%の重量増加となるように、EC−10とHP−55とTECとを60/30/10の比で含むTPRコーティング溶液、続いてKlucel(登録商標)LFによる圧縮性コーティングでさらに被覆する。得られたTPRビーズを乾燥させると、残留溶媒を除去することができる。
【0077】
4.D 味マスキングを施したIRビーズ
Glatt GPCG 3において、EC−10及びEudragit(登録商標)E100、TEC、並びにステアリン酸マグネシウムで約15重量%の重量増加となるように被覆することにより、実施例4.AのIRビーズに味マスキングを施す。
【0078】
4.E IR及びTPRビーズを含有する徐放性ODT:
実施例2.Dの速分散性微粒剤と、TPRビーズと、実施例4.Dの弱塩基性薬物の味マスキングを施したIRビーズとを2:1の比で、他の薬学的に許容可能な成分、例えば、香料、甘味料(例えば、スクラロース)、さらなるクロスポビドン、及び微結晶性セルロース(例えば、Avicel PH101)とブレンドする。TPRビーズ及び味マスキングを施したIRビーズを速分散性顆粒と、速分散性微粒剤と被覆されたビーズとの比を約3:2としてツインシェルV形ブレンダで十分な時間にわたり混和し、圧縮するための均質に分散したブレンドを得る。IR/TPRビーズとして50mgの弱塩基性薬物を含むODTを、外部潤滑システムを備えた生産規模の錠剤成形機を使用して圧縮する:このように生成して得られたODT(50mg用量)は、口腔内で急速に崩壊して、被覆されたビーズを含む滑らかで嚥下が容易な懸濁液を生じ、1日1回の投薬レジメンに好適な、期待される薬物放出プロファイルをもたらす。
【0079】
実施例5
5.A プロピベリンHClを含有するIRビーズ
精製水(2054.7g)に対し、プロピベリンHCl(308g)を撹拌しながら徐々に添加し、溶解させた。予熱したGlatt 3にCellets 100(900g)を装入し、4mL/分の速度で、12mL/分まで段階的に速めながら、且つ8CFMの吸入空気流量、50±2℃の生成物温度で薬物溶液を噴霧した。噴霧システムを40gの水でリンスした後、次にOpadry Clearの2%のシールコート(水中6%固形分)を塗布し、得られたIRビーズを乾燥させて残留溶媒を(水分を含めて)除去し、篩別することにより(例えば、40及び100メッシュのスクリーンを通じて)、過大な粒子及び微粉を取り除いた。
【0080】
5.B 二塩基性リン酸ナトリウム緩衝層の形成
高分子結合剤ポビドン(2.3g)の水溶液(2278gの水)に対し、二塩基性リン酸ナトリウム(113.9g)を撹拌しながら徐々に添加して溶解させた。予熱したGlatt GPCG 3にIRビーズ(例えば、実施例5.Aのもの;1000g)を装入し、実施例3.Bに開示されるとおりIRビーズに緩衝剤溶液を噴霧した。場合により噴霧システムを40gの水でリンスした後、Opadry Clearによる約2重量%のシールコートを塗布した。乾燥させたIRビーズを篩別すると、過大なビーズ及び微粉を取り除くことができる。
【0081】
5.C プロピベリンSRビーズ(30%のコーティング)
実施例5.Bの緩衝剤コートを有するビーズ(900g)を、予熱した流動層コーティング装置において、被覆されたビーズの30重量%の重量増加となるようにアセトン(3375g)/水(596g)中に溶解したエチルセルロース(357.4g)とTEC(39.7)とを90/10の比で含むSRコーティングで被覆した。SRコートを有するビーズを、約2重量%の重量増加となるようにKlucel(登録商標)LF(26.5g)による圧縮性コーティングでさらに被覆した。得られたSRビーズを乾燥させて残留溶媒を除去した。20重量%、25重量%及び30重量%のコーティングを有するSRビーズについて、二段階溶出法(USP装置2(パドル、50RPM、溶出溶媒:最初の2時間は700mLの0.1NのHCl、その後、37℃の緩衝調整剤を200mL添加することにより実現されるpH6.8))により溶出試験を行った。溶出データは、以下の表2に示す。この表から、コーティングレベルを大幅に低下させる必要があることは明らかである。
【0082】
【表2】

【0083】
実施例6
6.A プロピベリンHClを含有するIRビーズ
50/50のアセトン/水(各855g)に対し、プロピベリンHCl(256.5g)を撹拌しながら徐々に添加して溶解させ、次にステアリルフマル酸ナトリウム(PRUV;28.5g)を激しく撹拌しながら添加して、均等に分散させた。予熱したGlatt 3に45〜60メッシュの球状糖(972g)を装入し、薬物溶液を4mL/分の速度で8mL/分まで段階的に速めながら、且つ10CFMの吸入空気流量、45±2℃の生成物温度で噴霧した(噴霧中は引き続き撹拌した)。噴霧システムを40gのアセトンでリンスした後、次に、OpadryのClearの2%のシールコート(水中6%固形分)を塗布し、得られたIRビーズを乾燥させて残留溶媒を(水分を含めて)除去し、篩別することにより(例えば、40及び80メッシュのスクリーンを通じて)、過大な粒子及び微粉を取り除いた。
【0084】
6.B 二塩基性リン酸ナトリウム緩衝層の形成
IRビーズ(例えば、実施例5.Aのもの;1000g)に対し、予熱したGlatt GPCG 3において実施例5.Bに開示されるとおりの手順に従い二塩基性リン酸ナトリウム(113.9g)の層を重ねた。場合により噴霧システムを40gのアセトンでリンスした後、Opadry Clearによる約2重量%のシールコートを塗布した。乾燥させたIRビーズを篩別すると、過大なビーズ及び微粉を取り除くことができる。
【0085】
6.C プロピベリンSRビーズ(10%のコーティング)
実施例6.Bの緩衝剤コートを有するビーズ(850g)を、予熱した流動層コーティング装置において、被覆されたビーズの10重量%の重量増加となるようにアセトン(821g)/水(145g)中に溶解したエチルセルロース(86.9g)とTEC(9.7g)とを90/10の比で含むSRコーティングで被覆した。SRコートを有するビーズを、約2重量%の重量増加となるようにKlucel(登録商標)LF(19.3g)による圧縮性コーティングでさらに被覆した。得られたSRビーズを乾燥させて残留溶媒を除去した。
【0086】
6.D プロピベリンHCl ODT CR
実施例2.Dの速分散性微粒剤(43.68部)と、実施例6.CのプロピベリンHCl SRビーズ(34.97部)と、プレブレンド(微結晶性セルロース(Ceolus KG 802+Avicel PH101、各7.5部)、クロスポビドン(5部)、スクラロース(0.35部)、ペパーミント香料(1.0部)をブレンドし、40メッシュ篩に通過させて均質なブレンドを得た)とを、実施例4.Eに開示されるとおりV形ブレンダでブレンドした。SRビーズとして50mgプロピベリンHClを含むODT錠を、外部潤滑システムを備えた生産規模の錠剤成形機を使用して圧縮した:このように生成して得られたODT(50mg用量)は、口腔内で急速に崩壊して、被覆されたビーズを含む滑らかで嚥下が容易な懸濁液を生じるものであり、USP法<701>により試験したときの崩壊時間は30秒未満であった。
【0087】
実施例7
7.A 制御された球状化によるプロピベリンHClペレット
ポビドン(PVP K−30;111.1g)とプロピベリンHCl(粒径分布−D(0.1):2.6μm;D(0.5):10.38μm;D(0.9):42.52μm;1000g)とを共にブレンドし、Vector Corporation(Iowa,米国)からのGranurex GX−35の生成ボウルに装入する。回転している材料層に対し、制御された速度で精製水を噴霧する。最適化されたパラメータは、ペレット形成中−処理空気温度:約19〜20℃;生成物温度:16±2℃;ロータ回転数:425RPM;外部空気供給:150L/分;噴霧速度:15RPM(約8mL/分);スリットにわたる圧力降下:水中で1.3〜11mm;及びペレットの乾燥中−処理空気量:30CFM;処理空気温度:約60℃;生成物温度:35℃(乾燥を中止するまで);ロータ回転数:180RPM;スリット空気量:10CFM;処理時間:40分である。このように調製されたペレットは、約65%の粒子が40〜80メッシュの粒径範囲である。
【0088】
7.B 味マスキングを施したプロピベリンHCl IRペレット
実施例7.Aのペレット(970g)に、3%の重量増加となるようにアセトン/水中に溶解したKlucel LF(30g)によるシールコート(7.5%固形分)を施す。エチルセルロース(Dow ChemicalsからのEC−10、Ethocel Premium 10;159.1g)を、85/15のアセトン/水中に絶えず撹拌しながら徐々に添加し、溶解させる(10%固形分)。クエン酸トリエチル(TEC;15.9g)を徐々に添加して溶解させる。Glatt GPCG 3において、20%の重量増加となるように上記の溶液を塗布することにより、これらのIRペレットに味マスキングを施す。
【0089】
7.C 粉末層の形成によるプロピベリンペレットに対する酸化マグネシウム層の形成
精製水に対し、ポビドン(11.9g)を撹拌しながら徐々に添加して溶解させる(5%固形分)。Vector Corporation(Iowa,米国)からのGranurex GX−35の生成ボウルに、実施例7.Aのプロピベリンペレット(2000g)又は実施例7.Bのシールコートを有するプロピベリンペレット(2000g)を装入する。ポビドン溶液を回転している材料層に制御された速度で噴霧し、それと同時にユニット内に粉末層(K−Tron)により制御された速度で粉末(229.3gの酸化マグネシウム)を噴霧する。最適化されたパラメータは、粉末層の形成中−生成物温度:22〜25℃;ロータ回転数:300RPM;外部空気供給:150〜320L/分及び温度:100℃;スリットにわたる圧力降下:1〜2mmの水;溶液噴霧速度:3〜5mL/分(ノズル空気:20PSI);及び粉末噴霧速度:5g/分(空気圧力:12.5PSI)である。同じ結合剤溶液又はOpadry Clear溶液(5%固形分)を70CFMの処理空気量で噴霧することによりペレットをシールコートで被覆し、シールコートを有し、緩衝層を重ねたペレットを、ユニット内で約5分間乾燥させて、その水分含量を低下させる。
【0090】
粉砕した、又は微粉化した薬物物質を、コロイドシリカ又はステアリン酸マグネシウムなどの流動性促進剤とブレンドしてもよい。最高10%の結合剤を薬物粉末と部分的にブレンドし、噴霧液中に一部を溶解させてもよい。溶媒向けのGranurexユニットにおいて溶媒(例えば、アセトン、エタノール又は混合物)を用いてもよい。Klucel LF、ヒプロメロースなどの代替的な結合剤もまた用いることができる。Granurexそれ自体において、又は上記の実施例6.Bに開示されるとおり流動層コーターにおいて、球状化したペレットに、Opadry Clear、又はKlucel LFによる保護シールコートを塗布してもよい。
【0091】
7.D プロピベリンHCl CRペレット(25%TPR/10%SRコーティング)
実施例2.Cに開示されるとおり、実施例7.B(900g)の緩衝剤コートを有するプロピベリンペレットを、予熱した流動層コーターGPCG 3において、クエン酸トリエチル(14.3g)で可塑化したエチルセルロース(Ethocel Premium 10cps;128.6g)を含む10重量%のSRコーティングで被覆し、さらに、被覆されたペレットの25重量%の重量増加となるように85/15のアセトン/水中にエチルセルロース(214.3g)と、フタル酸ヒプロメロース(HP−55;107.2g)と、TEC(クエン酸トリエチル、35.7g)とを60/30/10の比で含むTPRコーティングで被覆する。TPRコートを有するペレットに対し、約2重量%の重量増加となるようにKlucel(登録商標)LF(7.5%固形分)の圧縮性コーティング溶液を噴霧する。得られたCRペレットをユニット内で5分間乾燥させて、残留溶媒を除去する。
【0092】
7.E プロピベリンHCl ODT CR、200mg
実施例2.Dの速分散性微粒剤(57.2部)と、実施例6.CのCRペレット(15.6部)と、実施例6.Bの味マスキングを施したIRペレット(12.8部)とを、他の薬学的に許容可能な成分、例えば、香料(1部)、甘味料(例えば、スクラロース;0.35部)、さらなるクロスポビドン(5部)、及び微結晶性セルロース(例えば、Avicel PH101;10部)を含むプレブレンドと共にブレンドし、外部潤滑システムを備えた生産規模の錠剤成形機を使用して、重量が約1250mgの200mgODT CR錠に圧縮する:このように生成して得られたODT(100mg用量)は、口腔内で急速に崩壊して、被覆されたビーズを含む滑らかで嚥下が容易な懸濁液を生じ、1日1回の投薬レジメンに好適な、期待される薬物放出プロファイルをもたらし得る。
【0093】
当業者は、適切な用量の弱塩基性薬物を提供するために上記の手順及び組成物を好適に修正し得ることを認識するであろう。
【特許請求の範囲】
【請求項1】
複数の徐放性粒子を含む医薬組成物であって、前記粒子の少なくとも1つの集合が、
(a)弱塩基性薬物を含むコア、又はその薬学的に許容可能な塩、溶媒和物、及び/又はエステルと、
(b)前記コアを覆って配置されたアルカリ性緩衝層であって、アルカリ性緩衝剤を含むアルカリ性緩衝層と、
(c)前記アルカリ性緩衝層を覆って配置された徐放性コーティングであって、水不溶性高分子を含む徐放性コーティングと、
を含む、医薬組成物。
【請求項2】
前記弱塩基性薬物が少なくとも1個の窒素を含有し、且つそのpKaが約5〜約14で、室温の水溶液に対する溶解度がpH約1.2〜6.8では少なくとも約200g/mLで、室温の水溶液に対する溶解度が約6.8を上回るpHでは約10mg/mL未満である、請求項1に記載の医薬組成物。
【請求項3】
前記弱塩基性薬物が、鎮痛薬、抗痙攣薬、抗コリン薬、抗糖尿病剤、抗感染剤、抗悪性腫瘍薬、抗パーキンソン病剤、抗リウマチ剤、心血管系薬剤、中枢神経系刺激薬、ドパミン受容体作動薬、制吐薬、胃腸剤、精神治療剤、オピオイド作動薬、オピオイド拮抗薬、抗てんかん薬、ヒスタミンH2拮抗薬、抗喘息薬、及び骨格筋弛緩薬からなる群から選択される、請求項1に記載の医薬組成物。
【請求項4】
前記弱塩基性薬物が、窒素部分を含有するブチロフェノン誘導体、フェニルアミノイミダゾリン、ジヒドロキシフェニルイソプロピルアミノエタン、フェノキシブチルアミノプロパノール、フェノキシアミノプロパン、アミノエチルオキサゾロアゼピン、プロピベリン、その薬学的に許容可能な塩、溶媒和物、多形、エステル、及びこれらの混合物からなる群から選択される、請求項1に記載の医薬組成物。
【請求項5】
親水性高分子を含む少なくとも1つのシーラント層をさらに含む、請求項1に記載の医薬組成物。
【請求項6】
前記少なくとも1つのシーラント層が、前記弱塩基性薬物と前記アルカリ性緩衝層とを隔てる、請求項5に記載の医薬組成物。
【請求項7】
前記徐放性コーティング上に配置された圧縮性コーティングをさらに含む、請求項1に記載の医薬組成物。
【請求項8】
前記圧縮性コーティングが、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ポリ(酢酸ビニル−ビニルピロリドン)、ポリ酢酸ビニル、及びエチルセルロースからなる群から選択される高分子を含む、請求項7に記載の医薬組成物。
【請求項9】
前記水不溶性高分子が、エチルセルロース、酢酸セルロース、酢酸酪酸セルロース、ポリ酢酸ビニル、中性のメタクリル酸−メタクリル酸メチル共重合体、及びこれらの混合物からなる群から選択される、請求項1に記載の医薬組成物。
【請求項10】
前記水不溶性高分子が、エチルセルロースを含む、請求項1に記載の医薬組成物。
【請求項11】
前記徐放性コーティングが、可塑剤をさらに含む、請求項1に記載の医薬組成物。
【請求項12】
前記可塑剤が、トリアセチン、クエン酸トリブチル、クエン酸トリエチル、クエン酸アセチルトリ−n−ブチル、フタル酸ジエチル、ヒマシ油、セバシン酸ジブチル、モノアセチル化グリセリド、ジアセチル化グリセリド、及びこれらの混合物からなる群から選択される、請求項10に記載の医薬組成物。
【請求項13】
前記可塑剤がフタル酸塩を含まない、請求項11に記載の医薬組成物。
【請求項14】
前記親水性高分子が、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ビニル−ピロリドン−酢酸ビニル共重合体、低粘度エチルセルロース、及びヒドロキシプロピルセルロース/エチルセルロース混合物からなる群から選択される、請求項5に記載の医薬組成物。
【請求項15】
前記アルカリ性緩衝剤が、水酸化ナトリウム、リン酸二水素一ナトリウム、リン酸水素二ナトリウム、リン酸三ナトリウム、酢酸ナトリウム、炭酸ナトリウム、重炭酸ナトリウム、リン酸二水素一カリウム、リン酸水素二カリウム、リン酸三カリウム、酢酸カリウム、炭酸カリウム、重炭酸カリウム、リン酸マグネシウム、酢酸マグネシウム、ケイ酸カルシウム、複合体メタケイ酸マグネシウムアルミニウム、炭酸マグネシウム、酸化マグネシウム、水酸化マグネシウム、ケイ酸ナトリウム、及びこれらの混合物からなる群から選択される、請求項1に記載の医薬組成物。
【請求項16】
前記アルカリ性緩衝剤と前記弱塩基性薬物との比が、約5:1〜約1:5の範囲である、請求項1に記載の医薬組成物。
【請求項17】
前記徐放性コーティングが、水溶性高分子をさらに含む、請求項1に記載の医薬組成物。
【請求項18】
前記水溶性高分子が、ポビドン、ポリエチレングリコール、ヒドロキシプロピルメチルセルロース、及びヒドロキシプロピルセルロースからなる群から選択される、請求項17に記載の医薬組成物。
【請求項19】
前記水不溶性高分子と前記水溶性高分子との比が、約95:5〜約50:50の範囲である、請求項17に記載の医薬組成物。
【請求項20】
前記徐放性層が、腸溶性高分子をさらに含む、請求項1に記載の医薬組成物。
【請求項21】
前記腸溶性高分子が、フタル酸ヒドロキシプロピルメチルセルロース、酢酸フタル酸セルロース、酢酸コハク酸ヒドロキシプロピルメチルセルロース、ポリビニルアセテートフタレート、pH感受性のメタクリル酸−メタクリル酸メチル共重合体、シェラック、及びこれらの混合物からなる群から選択される、請求項20に記載の医薬組成物。
【請求項22】
前記水不溶性高分子と前記腸溶性高分子との比が、約9:1〜約1:3の範囲である、請求項20に記載の医薬組成物。
【請求項23】
前記徐放性コーティングを覆って配置された外側のラグタイムコーティングをさらに含む、請求項1に記載の医薬組成物。
【請求項24】
前記外側のラグタイムコーティングが、腸溶性高分子と組み合わせた水不溶性高分子を、前記水不溶性高分子と前記腸溶性高分子との比を約9:1〜約1:3の範囲として含む、請求項23に記載の医薬組成物。
【請求項25】
前記水不溶性高分子が、エチルセルロース、酢酸セルロース、酢酸酪酸セルロース、ポリ酢酸ビニル、中性のメタクリル酸−メタクリル酸メチル共重合体、及びこれらの混合物からなる群から選択され、及び前記腸溶性高分子が、フタル酸ヒドロキシプロピルメチルセルロース、酢酸フタル酸セルロース、酢酸コハク酸ヒドロキシプロピルメチルセルロース、ポリビニルアセテートフタレート、pH感受性のメタクリル酸−メタクリル酸メチル共重合体、シェラック、及びこれらの混合物からなる群から選択される、請求項24に記載の医薬組成物。
【請求項26】
前記水不溶性高分子がエチルセルロースであり、前記腸溶性高分子がフタル酸ヒドロキシプロピルメチルセルロースである、請求項24に記載の医薬組成物。
【請求項27】
前記コアが、弱塩基性薬物を含む薬物層で被覆された不活性ビーズを含む、請求項1に記載の医薬組成物。
【請求項28】
前記不活性ビーズが、糖、微結晶性セルロース、マンニトール−微結晶性セルロース、又は二酸化ケイ素を含む、請求項27に記載の医薬組成物。
【請求項29】
前記コアの平均粒径が約400μm以下である、請求項1に記載の医薬組成物。
【請求項30】
前記薬物層が、高分子結合剤をさらに含む、請求項27に記載の医薬組成物。
【請求項31】
前記高分子結合剤が、ヒドロキシプロピルセルロース、ポビドン、メチルセルロース、ヒドロキシプロピルメチルセルロース、カルボキシアルキルセルロース、ポリエチレンオキシド、デンプン、及び多糖からなる群から選択される、請求項30に記載の医薬組成物。
【請求項32】
前記薬物と前記高分子結合剤との比が、約85:15〜約100:0の範囲である、請求項30に記載の医薬組成物。
【請求項33】
前記アルカリ性緩衝層が、高分子結合剤をさらに含む、請求項1に記載の医薬組成物。
【請求項34】
前記高分子結合剤が、ヒドロキシプロピルセルロース、ポビドン、メチルセルロース、ヒドロキシプロピルメチルセルロース、カルボキシアルキルセルロース、ポリエチレンオキシド、デンプン、及び多糖からなる群から選択される、請求項33に記載の医薬組成物。
【請求項35】
崩壊剤と組み合わせたサッカリド及び/又は糖アルコールを含む速崩壊性顆粒をさらに含む、請求項1に記載の医薬組成物。
【請求項36】
前記崩壊剤が、クロスポビドン、デンプングリコール酸ナトリウム、架橋カルボキシメチルセルロースナトリウム、及び低置換度ヒドロキシプロピルセルロースからなる群から選択され、
前記サッカリド及び/又は糖アルコールが、スクラロース、ラクトース、スクロース、マルトース、マンニトール、ソルビトール、キシリトール、マルチトール、及びこれらの混合物からなる群から選択され、及び
前記崩壊剤と前記サッカリド及び/又は糖アルコールとの比が、約10:90〜約1:99の範囲である、
請求項35に記載の医薬組成物。
【請求項37】
前記崩壊剤並びに前記糖アルコール及び/又は前記サッカリドが、各々、平均粒径が約30μm以下の微粒子の形態で存在する、請求項35に記載の医薬組成物。
【請求項38】
前記徐放性粒子と前記速崩壊性顆粒との比が、約1:6〜約1:2の範囲である、請求項35に記載の医薬組成物。
【請求項39】
請求項1に記載の組成物を含む医薬剤形。
【請求項40】
請求項17に記載の組成物を含む医薬剤形。
【請求項41】
請求項20に記載の組成物を含む医薬剤形。
【請求項42】
請求項23に記載の組成物を含む医薬剤形。
【請求項43】
カプセルである、請求項39に記載の医薬剤形。
【請求項44】
錠剤の形態の、請求項39に記載の医薬剤形。
【請求項45】
口腔内崩壊錠である、請求項35に記載の医薬剤形。
【請求項46】
前記口腔内崩壊錠が、口腔内の唾液又は模擬唾液と接触した後、約30秒以内に実質的に崩壊する、請求項45に記載の医薬剤形。
【請求項47】
即時放出粒子であって、前記弱塩基性薬物を含むコアを含む即時放出粒子をさらに含む、請求項39に記載の医薬剤形。
【請求項48】
前記即時放出粒子と前記徐放性粒子との比が、約0:100〜約50:50の範囲である、請求項47に記載の医薬剤形。
【請求項49】
前記即時放出粒子が、USP装置1(バスケット、100rpm)又は装置2(パドル、50rpm)において900mLの0.1NのHCl中37℃で溶出試験を行ったとき、前記即時放出粒子内に含まれる薬物の少なくとも約85%を15分以内に放出する、請求項47に記載の医薬剤形。
【請求項50】
即時放出粒子であって、各々が、前記弱塩基性薬物を含むコアを含む即時放出粒子をさらに含む、請求項40に記載の医薬剤形。
【請求項51】
前記即時放出粒子が、USP装置1(バスケット、100rpm)又は装置2(パドル、50rpm)において900mLの0.1NのHCl中37℃で溶出試験を行ったとき、前記即時放出粒子内に含まれる薬物の少なくとも約85%を15分以内に放出する、請求項50に記載の医薬剤形。
【請求項52】
前記即時放出粒子と徐放性粒子との比が、約0:100〜約50:50の範囲である、請求項50に記載の医薬剤形。
【請求項53】
即時放出粒子であって、各々が、前記弱塩基性薬物を含むコアを含む即時放出粒子をさらに含む、請求項41に記載の医薬剤形。
【請求項54】
前記即時放出粒子と徐放性粒子との比が、約0:100〜約50:50の範囲である、請求項53に記載の医薬剤形。
【請求項55】
前記即時放出粒子が、USP装置1(バスケット、100rpm)又は装置2(パドル、50rpm)において900mLの0.1NのHCl中37℃で溶出試験を行ったとき、そこに含まれる前記弱塩基性薬物の少なくとも約85%を15分以内に放出する、請求項53に記載の医薬剤形。
【請求項56】
徐放性粒子の第2の集合であって、前記第2の集合の各徐放性粒子が、
(a)前記弱塩基性薬物を含む第2のコアと、
(b)前記第2のコアを覆って配置された第2のアルカリ性緩衝層であって、アルカリ性緩衝剤を含む第2のアルカリ性緩衝層と、
(c)前記第2のアルカリ性緩衝層を覆って配置された第2の徐放性コーティングであって、水不溶性高分子と腸溶性高分子とを含む第2の徐放性コーティングと、
を含む、第2の集合、
をさらに含む、請求項39に記載の医薬剤形。
【請求項57】
徐放性粒子の第2の集合であって、前記第2の集合の各粒子が、
(a)前記弱塩基性薬物を含む第2のコア、前記第2のコアを覆って配置された第2のアルカリ性緩衝層であって、アルカリ性緩衝剤を含む第2のアルカリ性緩衝層と、
(b)前記第2のアルカリ性緩衝層を覆って配置された第2の徐放性コーティングであって、水不溶性高分子と、場合により水溶性高分子又は腸溶性高分子とを含む第2の徐放性コーティングと、
を含む、第2の集合、
をさらに含む、請求項40に記載の医薬剤形。
【請求項58】
前記第1の徐放性粒子集合及び前記第2の徐放性粒子集合の前記徐放性コーティングが、各々、水不溶性高分子と腸溶性高分子とを含み、及び前記2つの徐放性粒子集合が異なるラグタイムを有する、請求項57に記載の医薬剤形。
【請求項59】
複数の徐放性粒子を含む医薬組成物の調製方法であって、
(a)弱塩基性薬物を含むコアを調製するステップと、
(b)ステップ(a)の薬物含有コアを、アルカリ性緩衝剤を含む層で被覆するステップと、
(c)ステップ(b)のアルカリ性緩衝剤層を有するコアを、水不溶性高分子を含む徐放性層で被覆するステップと、
を含む、方法。
【請求項60】
ステップ(a)が、親水性高分子を含むシーラント層を塗布するステップをさらに含む、請求項59に記載の方法。
【請求項61】
前記ステップ(a)が、不活性ビーズに、前記弱塩基性薬物と、場合により高分子結合剤とを含む溶液の層を重ねるステップを含む、請求項59に記載の方法。
【請求項62】
前記ステップ(c)における前記徐放性層が、水溶性高分子又は腸溶性高分子をさらに含む、請求項59に記載の方法。
【請求項63】
前記微粒子を、水不溶性高分子と、場合により水溶性高分子又は腸溶性高分子とを含む第2の徐放性層で被覆するステップをさらに含む、請求項59に記載の方法。
【請求項64】
(d)前記粒子を、崩壊剤と組み合わせたサッカリド及び/又は糖アルコールを含む速分散性顆粒と混合するステップであって、それにより圧縮ブレンドを形成するステップと、
(e)前記圧縮ブレンドを圧縮して口腔内崩壊錠にするステップと、
をさらに含む、請求項59に記載の方法。
【請求項65】
(d)前記粒子を、即時放出粒子であって、前記弱塩基性薬物を含むコアを含む即時放出粒子と;速分散性顆粒であって、崩壊剤と組み合わせたサッカリド及び/又は糖アルコールを含む速分散性顆粒と混合するステップであって、それにより圧縮ブレンドを形成するステップと、
(e)前記圧縮ブレンドを圧縮して口腔内崩壊錠を形成するステップと、
をさらに含み、
前記即時放出粒子と前記徐放性粒子とが異なる放出速度を有する、請求項59に記載の方法。
【請求項66】
(d)前記粒子を、即時放出粒子であって、前記弱塩基性薬物を含むコアを含む即時放出粒子と;速分散性顆粒であって、崩壊剤と組み合わせたサッカリド及び/又は糖アルコールを含む速分散性顆粒と混合するステップであって、それにより圧縮ブレンドを形成するステップと、
(e)前記圧縮ブレンドを圧縮して口腔内崩壊錠にするステップと、
をさらに含み、
ステップ(c)における前記徐放性層が腸溶性高分子をさらに含み、及び前記即時放出粒子と前記徐放性粒子とが異なるラグタイムを有する、請求項59に記載の方法。
【請求項67】
請求項1に記載の微粒子をカプセルに充填するステップを含む医薬剤形の調製方法。
【請求項68】
疾患又は病態の治療を必要とする患者に請求項1に記載の組成物を投与するステップを含む疾患又は病態の治療方法。
【請求項1】
複数の徐放性粒子を含む医薬組成物であって、前記粒子の少なくとも1つの集合が、
(a)弱塩基性薬物を含むコア、又はその薬学的に許容可能な塩、溶媒和物、及び/又はエステルと、
(b)前記コアを覆って配置されたアルカリ性緩衝層であって、アルカリ性緩衝剤を含むアルカリ性緩衝層と、
(c)前記アルカリ性緩衝層を覆って配置された徐放性コーティングであって、水不溶性高分子を含む徐放性コーティングと、
を含む、医薬組成物。
【請求項2】
前記弱塩基性薬物が少なくとも1個の窒素を含有し、且つそのpKaが約5〜約14で、室温の水溶液に対する溶解度がpH約1.2〜6.8では少なくとも約200g/mLで、室温の水溶液に対する溶解度が約6.8を上回るpHでは約10mg/mL未満である、請求項1に記載の医薬組成物。
【請求項3】
前記弱塩基性薬物が、鎮痛薬、抗痙攣薬、抗コリン薬、抗糖尿病剤、抗感染剤、抗悪性腫瘍薬、抗パーキンソン病剤、抗リウマチ剤、心血管系薬剤、中枢神経系刺激薬、ドパミン受容体作動薬、制吐薬、胃腸剤、精神治療剤、オピオイド作動薬、オピオイド拮抗薬、抗てんかん薬、ヒスタミンH2拮抗薬、抗喘息薬、及び骨格筋弛緩薬からなる群から選択される、請求項1に記載の医薬組成物。
【請求項4】
前記弱塩基性薬物が、窒素部分を含有するブチロフェノン誘導体、フェニルアミノイミダゾリン、ジヒドロキシフェニルイソプロピルアミノエタン、フェノキシブチルアミノプロパノール、フェノキシアミノプロパン、アミノエチルオキサゾロアゼピン、プロピベリン、その薬学的に許容可能な塩、溶媒和物、多形、エステル、及びこれらの混合物からなる群から選択される、請求項1に記載の医薬組成物。
【請求項5】
親水性高分子を含む少なくとも1つのシーラント層をさらに含む、請求項1に記載の医薬組成物。
【請求項6】
前記少なくとも1つのシーラント層が、前記弱塩基性薬物と前記アルカリ性緩衝層とを隔てる、請求項5に記載の医薬組成物。
【請求項7】
前記徐放性コーティング上に配置された圧縮性コーティングをさらに含む、請求項1に記載の医薬組成物。
【請求項8】
前記圧縮性コーティングが、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ポリ(酢酸ビニル−ビニルピロリドン)、ポリ酢酸ビニル、及びエチルセルロースからなる群から選択される高分子を含む、請求項7に記載の医薬組成物。
【請求項9】
前記水不溶性高分子が、エチルセルロース、酢酸セルロース、酢酸酪酸セルロース、ポリ酢酸ビニル、中性のメタクリル酸−メタクリル酸メチル共重合体、及びこれらの混合物からなる群から選択される、請求項1に記載の医薬組成物。
【請求項10】
前記水不溶性高分子が、エチルセルロースを含む、請求項1に記載の医薬組成物。
【請求項11】
前記徐放性コーティングが、可塑剤をさらに含む、請求項1に記載の医薬組成物。
【請求項12】
前記可塑剤が、トリアセチン、クエン酸トリブチル、クエン酸トリエチル、クエン酸アセチルトリ−n−ブチル、フタル酸ジエチル、ヒマシ油、セバシン酸ジブチル、モノアセチル化グリセリド、ジアセチル化グリセリド、及びこれらの混合物からなる群から選択される、請求項10に記載の医薬組成物。
【請求項13】
前記可塑剤がフタル酸塩を含まない、請求項11に記載の医薬組成物。
【請求項14】
前記親水性高分子が、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ビニル−ピロリドン−酢酸ビニル共重合体、低粘度エチルセルロース、及びヒドロキシプロピルセルロース/エチルセルロース混合物からなる群から選択される、請求項5に記載の医薬組成物。
【請求項15】
前記アルカリ性緩衝剤が、水酸化ナトリウム、リン酸二水素一ナトリウム、リン酸水素二ナトリウム、リン酸三ナトリウム、酢酸ナトリウム、炭酸ナトリウム、重炭酸ナトリウム、リン酸二水素一カリウム、リン酸水素二カリウム、リン酸三カリウム、酢酸カリウム、炭酸カリウム、重炭酸カリウム、リン酸マグネシウム、酢酸マグネシウム、ケイ酸カルシウム、複合体メタケイ酸マグネシウムアルミニウム、炭酸マグネシウム、酸化マグネシウム、水酸化マグネシウム、ケイ酸ナトリウム、及びこれらの混合物からなる群から選択される、請求項1に記載の医薬組成物。
【請求項16】
前記アルカリ性緩衝剤と前記弱塩基性薬物との比が、約5:1〜約1:5の範囲である、請求項1に記載の医薬組成物。
【請求項17】
前記徐放性コーティングが、水溶性高分子をさらに含む、請求項1に記載の医薬組成物。
【請求項18】
前記水溶性高分子が、ポビドン、ポリエチレングリコール、ヒドロキシプロピルメチルセルロース、及びヒドロキシプロピルセルロースからなる群から選択される、請求項17に記載の医薬組成物。
【請求項19】
前記水不溶性高分子と前記水溶性高分子との比が、約95:5〜約50:50の範囲である、請求項17に記載の医薬組成物。
【請求項20】
前記徐放性層が、腸溶性高分子をさらに含む、請求項1に記載の医薬組成物。
【請求項21】
前記腸溶性高分子が、フタル酸ヒドロキシプロピルメチルセルロース、酢酸フタル酸セルロース、酢酸コハク酸ヒドロキシプロピルメチルセルロース、ポリビニルアセテートフタレート、pH感受性のメタクリル酸−メタクリル酸メチル共重合体、シェラック、及びこれらの混合物からなる群から選択される、請求項20に記載の医薬組成物。
【請求項22】
前記水不溶性高分子と前記腸溶性高分子との比が、約9:1〜約1:3の範囲である、請求項20に記載の医薬組成物。
【請求項23】
前記徐放性コーティングを覆って配置された外側のラグタイムコーティングをさらに含む、請求項1に記載の医薬組成物。
【請求項24】
前記外側のラグタイムコーティングが、腸溶性高分子と組み合わせた水不溶性高分子を、前記水不溶性高分子と前記腸溶性高分子との比を約9:1〜約1:3の範囲として含む、請求項23に記載の医薬組成物。
【請求項25】
前記水不溶性高分子が、エチルセルロース、酢酸セルロース、酢酸酪酸セルロース、ポリ酢酸ビニル、中性のメタクリル酸−メタクリル酸メチル共重合体、及びこれらの混合物からなる群から選択され、及び前記腸溶性高分子が、フタル酸ヒドロキシプロピルメチルセルロース、酢酸フタル酸セルロース、酢酸コハク酸ヒドロキシプロピルメチルセルロース、ポリビニルアセテートフタレート、pH感受性のメタクリル酸−メタクリル酸メチル共重合体、シェラック、及びこれらの混合物からなる群から選択される、請求項24に記載の医薬組成物。
【請求項26】
前記水不溶性高分子がエチルセルロースであり、前記腸溶性高分子がフタル酸ヒドロキシプロピルメチルセルロースである、請求項24に記載の医薬組成物。
【請求項27】
前記コアが、弱塩基性薬物を含む薬物層で被覆された不活性ビーズを含む、請求項1に記載の医薬組成物。
【請求項28】
前記不活性ビーズが、糖、微結晶性セルロース、マンニトール−微結晶性セルロース、又は二酸化ケイ素を含む、請求項27に記載の医薬組成物。
【請求項29】
前記コアの平均粒径が約400μm以下である、請求項1に記載の医薬組成物。
【請求項30】
前記薬物層が、高分子結合剤をさらに含む、請求項27に記載の医薬組成物。
【請求項31】
前記高分子結合剤が、ヒドロキシプロピルセルロース、ポビドン、メチルセルロース、ヒドロキシプロピルメチルセルロース、カルボキシアルキルセルロース、ポリエチレンオキシド、デンプン、及び多糖からなる群から選択される、請求項30に記載の医薬組成物。
【請求項32】
前記薬物と前記高分子結合剤との比が、約85:15〜約100:0の範囲である、請求項30に記載の医薬組成物。
【請求項33】
前記アルカリ性緩衝層が、高分子結合剤をさらに含む、請求項1に記載の医薬組成物。
【請求項34】
前記高分子結合剤が、ヒドロキシプロピルセルロース、ポビドン、メチルセルロース、ヒドロキシプロピルメチルセルロース、カルボキシアルキルセルロース、ポリエチレンオキシド、デンプン、及び多糖からなる群から選択される、請求項33に記載の医薬組成物。
【請求項35】
崩壊剤と組み合わせたサッカリド及び/又は糖アルコールを含む速崩壊性顆粒をさらに含む、請求項1に記載の医薬組成物。
【請求項36】
前記崩壊剤が、クロスポビドン、デンプングリコール酸ナトリウム、架橋カルボキシメチルセルロースナトリウム、及び低置換度ヒドロキシプロピルセルロースからなる群から選択され、
前記サッカリド及び/又は糖アルコールが、スクラロース、ラクトース、スクロース、マルトース、マンニトール、ソルビトール、キシリトール、マルチトール、及びこれらの混合物からなる群から選択され、及び
前記崩壊剤と前記サッカリド及び/又は糖アルコールとの比が、約10:90〜約1:99の範囲である、
請求項35に記載の医薬組成物。
【請求項37】
前記崩壊剤並びに前記糖アルコール及び/又は前記サッカリドが、各々、平均粒径が約30μm以下の微粒子の形態で存在する、請求項35に記載の医薬組成物。
【請求項38】
前記徐放性粒子と前記速崩壊性顆粒との比が、約1:6〜約1:2の範囲である、請求項35に記載の医薬組成物。
【請求項39】
請求項1に記載の組成物を含む医薬剤形。
【請求項40】
請求項17に記載の組成物を含む医薬剤形。
【請求項41】
請求項20に記載の組成物を含む医薬剤形。
【請求項42】
請求項23に記載の組成物を含む医薬剤形。
【請求項43】
カプセルである、請求項39に記載の医薬剤形。
【請求項44】
錠剤の形態の、請求項39に記載の医薬剤形。
【請求項45】
口腔内崩壊錠である、請求項35に記載の医薬剤形。
【請求項46】
前記口腔内崩壊錠が、口腔内の唾液又は模擬唾液と接触した後、約30秒以内に実質的に崩壊する、請求項45に記載の医薬剤形。
【請求項47】
即時放出粒子であって、前記弱塩基性薬物を含むコアを含む即時放出粒子をさらに含む、請求項39に記載の医薬剤形。
【請求項48】
前記即時放出粒子と前記徐放性粒子との比が、約0:100〜約50:50の範囲である、請求項47に記載の医薬剤形。
【請求項49】
前記即時放出粒子が、USP装置1(バスケット、100rpm)又は装置2(パドル、50rpm)において900mLの0.1NのHCl中37℃で溶出試験を行ったとき、前記即時放出粒子内に含まれる薬物の少なくとも約85%を15分以内に放出する、請求項47に記載の医薬剤形。
【請求項50】
即時放出粒子であって、各々が、前記弱塩基性薬物を含むコアを含む即時放出粒子をさらに含む、請求項40に記載の医薬剤形。
【請求項51】
前記即時放出粒子が、USP装置1(バスケット、100rpm)又は装置2(パドル、50rpm)において900mLの0.1NのHCl中37℃で溶出試験を行ったとき、前記即時放出粒子内に含まれる薬物の少なくとも約85%を15分以内に放出する、請求項50に記載の医薬剤形。
【請求項52】
前記即時放出粒子と徐放性粒子との比が、約0:100〜約50:50の範囲である、請求項50に記載の医薬剤形。
【請求項53】
即時放出粒子であって、各々が、前記弱塩基性薬物を含むコアを含む即時放出粒子をさらに含む、請求項41に記載の医薬剤形。
【請求項54】
前記即時放出粒子と徐放性粒子との比が、約0:100〜約50:50の範囲である、請求項53に記載の医薬剤形。
【請求項55】
前記即時放出粒子が、USP装置1(バスケット、100rpm)又は装置2(パドル、50rpm)において900mLの0.1NのHCl中37℃で溶出試験を行ったとき、そこに含まれる前記弱塩基性薬物の少なくとも約85%を15分以内に放出する、請求項53に記載の医薬剤形。
【請求項56】
徐放性粒子の第2の集合であって、前記第2の集合の各徐放性粒子が、
(a)前記弱塩基性薬物を含む第2のコアと、
(b)前記第2のコアを覆って配置された第2のアルカリ性緩衝層であって、アルカリ性緩衝剤を含む第2のアルカリ性緩衝層と、
(c)前記第2のアルカリ性緩衝層を覆って配置された第2の徐放性コーティングであって、水不溶性高分子と腸溶性高分子とを含む第2の徐放性コーティングと、
を含む、第2の集合、
をさらに含む、請求項39に記載の医薬剤形。
【請求項57】
徐放性粒子の第2の集合であって、前記第2の集合の各粒子が、
(a)前記弱塩基性薬物を含む第2のコア、前記第2のコアを覆って配置された第2のアルカリ性緩衝層であって、アルカリ性緩衝剤を含む第2のアルカリ性緩衝層と、
(b)前記第2のアルカリ性緩衝層を覆って配置された第2の徐放性コーティングであって、水不溶性高分子と、場合により水溶性高分子又は腸溶性高分子とを含む第2の徐放性コーティングと、
を含む、第2の集合、
をさらに含む、請求項40に記載の医薬剤形。
【請求項58】
前記第1の徐放性粒子集合及び前記第2の徐放性粒子集合の前記徐放性コーティングが、各々、水不溶性高分子と腸溶性高分子とを含み、及び前記2つの徐放性粒子集合が異なるラグタイムを有する、請求項57に記載の医薬剤形。
【請求項59】
複数の徐放性粒子を含む医薬組成物の調製方法であって、
(a)弱塩基性薬物を含むコアを調製するステップと、
(b)ステップ(a)の薬物含有コアを、アルカリ性緩衝剤を含む層で被覆するステップと、
(c)ステップ(b)のアルカリ性緩衝剤層を有するコアを、水不溶性高分子を含む徐放性層で被覆するステップと、
を含む、方法。
【請求項60】
ステップ(a)が、親水性高分子を含むシーラント層を塗布するステップをさらに含む、請求項59に記載の方法。
【請求項61】
前記ステップ(a)が、不活性ビーズに、前記弱塩基性薬物と、場合により高分子結合剤とを含む溶液の層を重ねるステップを含む、請求項59に記載の方法。
【請求項62】
前記ステップ(c)における前記徐放性層が、水溶性高分子又は腸溶性高分子をさらに含む、請求項59に記載の方法。
【請求項63】
前記微粒子を、水不溶性高分子と、場合により水溶性高分子又は腸溶性高分子とを含む第2の徐放性層で被覆するステップをさらに含む、請求項59に記載の方法。
【請求項64】
(d)前記粒子を、崩壊剤と組み合わせたサッカリド及び/又は糖アルコールを含む速分散性顆粒と混合するステップであって、それにより圧縮ブレンドを形成するステップと、
(e)前記圧縮ブレンドを圧縮して口腔内崩壊錠にするステップと、
をさらに含む、請求項59に記載の方法。
【請求項65】
(d)前記粒子を、即時放出粒子であって、前記弱塩基性薬物を含むコアを含む即時放出粒子と;速分散性顆粒であって、崩壊剤と組み合わせたサッカリド及び/又は糖アルコールを含む速分散性顆粒と混合するステップであって、それにより圧縮ブレンドを形成するステップと、
(e)前記圧縮ブレンドを圧縮して口腔内崩壊錠を形成するステップと、
をさらに含み、
前記即時放出粒子と前記徐放性粒子とが異なる放出速度を有する、請求項59に記載の方法。
【請求項66】
(d)前記粒子を、即時放出粒子であって、前記弱塩基性薬物を含むコアを含む即時放出粒子と;速分散性顆粒であって、崩壊剤と組み合わせたサッカリド及び/又は糖アルコールを含む速分散性顆粒と混合するステップであって、それにより圧縮ブレンドを形成するステップと、
(e)前記圧縮ブレンドを圧縮して口腔内崩壊錠にするステップと、
をさらに含み、
ステップ(c)における前記徐放性層が腸溶性高分子をさらに含み、及び前記即時放出粒子と前記徐放性粒子とが異なるラグタイムを有する、請求項59に記載の方法。
【請求項67】
請求項1に記載の微粒子をカプセルに充填するステップを含む医薬剤形の調製方法。
【請求項68】
疾患又は病態の治療を必要とする患者に請求項1に記載の組成物を投与するステップを含む疾患又は病態の治療方法。
【図1】




【公表番号】特表2011−516611(P2011−516611A)
【公表日】平成23年5月26日(2011.5.26)
【国際特許分類】
【出願番号】特願2011−505155(P2011−505155)
【出願日】平成21年4月15日(2009.4.15)
【国際出願番号】PCT/US2009/040608
【国際公開番号】WO2009/129282
【国際公開日】平成21年10月22日(2009.10.22)
【出願人】(507362111)ユーランド,インコーポレイテッド (8)
【Fターム(参考)】
【公表日】平成23年5月26日(2011.5.26)
【国際特許分類】
【出願日】平成21年4月15日(2009.4.15)
【国際出願番号】PCT/US2009/040608
【国際公開番号】WO2009/129282
【国際公開日】平成21年10月22日(2009.10.22)
【出願人】(507362111)ユーランド,インコーポレイテッド (8)
【Fターム(参考)】
[ Back to top ]

