微生物の検出方法及びその装置
【課題】メタノサルシナ属など、メタノコンドロイチンなどからなる硬い細胞壁を持つ微生物を、CARD−FISH法等を用いて検出することができるメタノサルシナ等の微生物の検出方法及びその装置を提供する。
【解決手段】メタノサルシナ属など硬い細胞壁をもつ微生物を検出する方法において、微生物21を化学固定した後、その微生物21にせん断力を付与し、しかる後FISH法により蛍光染色させて微生物21を定量する。
【解決手段】メタノサルシナ属など硬い細胞壁をもつ微生物を検出する方法において、微生物21を化学固定した後、その微生物21にせん断力を付与し、しかる後FISH法により蛍光染色させて微生物21を定量する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、メタノサルシナ属に代表される細胞壁の硬い微生物を検出できるメタノサルシナ等の微生物の検出方法及びその装置に関するものである。
【背景技術】
【0002】
廃水処理プラント、メタン発酵プラント、生ゴミ処理装置等の微生物を利用した装置においては、その中で有効に働く微生物の種類や存在量が性能に大きく影響を及ぼすと考えられている。
【0003】
そのため、そのモニタリングは重要であり、過去より顕微鏡観察が行われてきた。プラント中で働く微生物は、細菌やアーキア(微生物)が主であり、その大きさは大体1〜10μmであり、近年ではFISH法等による微生物の検出、定量法が応用されてきた。
【0004】
例えば、メタン生成菌の1属であるメタノサルシナ属の微生物は酢酸やメタノールからメタンを生成するため、さまざまな廃水、産廃物においてキーとなって働いている場合が多い。そのため、定量ができるようになると、プラントの性能の向上や、トラブルの原因の追求等において主要なデータとなる。
【0005】
メタン発酵プラント等のサンプル中におけるこの菌の存在を確認するために、従来は、メタン生成菌の持つ補酵素F420の持つ青い自家蛍光を利用して蛍光顕微鏡下でメタン生成菌を可視化し、形態的にメタノサルシナに類似したものをメタノサルシナ属のメタン生成菌と仮定していた。
【0006】
一方、FISH法(Fluorescence in situ hybridization;蛍光染色法)にて、例えばメタノサルシナ等の標的微生物を検出するプローブを用いてそれのみを可視化することも可能である(非特許文献1)。
【0007】
ところが、FISH法の場合にはCy3等の赤い蛍光色素が発光効率の高さから最も多く用いられているが、サンプル中の有機物が多く赤い背景光が高くなってしまう場合には、メタノサルシナのFISHシグナルが埋もれてしまう。
【0008】
それらの理由から、上記いずれの方法を使うにせよ標的微生物の検出や定量をしようとする際には人間が顕微鏡で観察し、手作業で計数していくことが確実であった。
【0009】
しかし、自家蛍光を用いた蛍光顕微鏡観察の場合には、形態で判断しなければならないため、経験が必要である。また、菌体自体が弱い赤い蛍光を発する場合があるため、FISH法において確信を持って真のシグナルを見分けるためにも多くの労力が必要であり、定常的に行うには困難である場合が多い。またそのような分析においてはしばしば主観が入る恐れがある。
【0010】
近年、標的微生物に対して選択的蛍光染色を行う場合に、西洋わさびペルオキシダーゼ(HRP)、アルカリフォスターゼ等の酵素反応やPCR(ポリメラーゼ連鎖反応;酵素を使って特定の遺伝子を増殖させる手法)を応用して蛍光強度を増殖させる手法が開発されてきた。
【0011】
例えばCARD−FISH法(非特許文献2)ではHRPで標識したプローブを標的微生物内に結合させたあとに、HRPの基質となる過酸化水素とチラミン−蛍光色複合体とを加えることによって、チラミン−蛍光色素複合体がラジカル化され、細胞内のたんぱく質等に共有結合し、その結果、多数の蛍光色素が標的細胞内に沈着する。これによって、標的細胞の蛍光強度は通常のFISH法の数十倍以上になり、背景光と異なる色相の色素が、例え分子あたりの蛍光強度が弱くても十分実用可能になる。
【0012】
この手法により、多くのグラム陰性細菌についてすでに適用され、明確な輝度の違いによる検出と背景光に埋没する問題との両方の解決が可能となっている。
【0013】
しかし、微生物によっては細胞壁が厚く、酵素等の高分子はそのままでは細胞内に浸透して行かない。
【0014】
例えば、アクチノバクテリアはペプチドグリカンからなる厚い細胞壁を持つため、CARD−FISHを適用するためには、分子量約40kDaのHRPで標識されたプローブを細胞内に透過させるために、サンプルに対してリゾチームとアクロモペプチダーゼの両方の処理を行い細胞壁をある程度分解する必要があることがわかっている。
【先行技術文献】
【特許文献】
【0015】
【特許文献1】特開平05−68590号公報
【特許文献2】特開平05−84095号公報
【特許文献3】特開2002−119300号公報
【非特許文献】
【0016】
【非特許文献1】L.Raskin et al."Group-Specific 16S rRNA Hybridization ProbesTo Describe Natural Commuities of Methanogens" Applied and Environmental Microbiology,Vol.60.No.4,Apr,1994,p.1232-1240
【非特許文献2】A.Pernthaler et al."Fluorescence In Situ Hybridization and Catalyzed Reporter Deposition for the Identification of Marine Bacteria" Applied and Environmental Microbiology,Vol.68.No.6,June,2002,p.3094-3101
【非特許文献3】R.Sekar et al."An Improved Protocol for Quantification of Freshwater Actinobacteria by Fluorescence In Situ Hybridization" Applied and Environmental Microbiology,Vol.69.No.5,May,2003,p.2928-2935
【発明の概要】
【発明が解決しようとする課題】
【0017】
しかしながら、細胞壁の構造が特殊であるために、一般に手に入る酵素の処理が通じない微生物もまだ多く存在する。たとえばメタノサルシナの細胞壁はメタノコンドロイチンやタンパクから構成されていて丈夫であるため、酵素等の高分子はそのままでは細胞内に浸透していかないことがわかっている。
【0018】
細胞壁を形成する物質は、植物ではセルロースで、これはグルコース(ブドウ糖)がいくつもつながって出来ている糖鎖であり、他にもリグニンやペクチンのようなものがある。
【0019】
それゆえリゾチームやタンパク分解酵素で処理したとしても、メタノサルシナに対してCARD−FISHが機能しない(一部のメタノサルシナしか光らない)ことが本発明者等の実験によってもわかっている。
【0020】
メタノサルシナのみならず、メタノバクテリウム属等のアーキアの多くも、シュードムレインという、市販の酵素では分解できない物質を主成分とする細胞壁を持つため、CARD−FISH等による検出は難しい状況である。
【0021】
このシュードムレインと呼ばれる細胞壁は、メタン生成微生物に特徴的な細胞壁構造であり、その他にも、特殊な細胞壁を持つ微生物は多く存在し、それどころか多くの微生物の細胞壁成分はいまだ未知である状況であるため、今後多くの微生物についてCARD−FISHの適応が難しいことが明らかになってくる事は容易に予想できる。
【0022】
また、現在酵素処理によってCARD−FISH解析が可能な菌についても個々に異なる酵素や反応条件が異なる場合が考えられ、手法として煩雑になってくる。
【0023】
そのため何にでも対応できるユニバーサルな手法が必要とされている。
【0024】
そこで、本発明の目的は、上記課題を解決し、メタノサルシナ属など、メタノコンドロイチンと呼ばれる市販の酵素で処理できない細胞壁を持つ微生物を、CARD−FISH法等を用いて検出することができる微生物の検出方法及びその装置を提供することにある。
【課題を解決するための手段】
【0025】
上記目的を達成するために請求項1の発明は、細胞壁を持つ微生物を検出する方法において、前記微生物を化学固定した後、フィルターでろ過して微生物をフィルター上に固定し、そのフィルター上の微生物をフィルターごと挟んで微生物にせん断力を付与してその細胞壁に、FISH法のプローブおよびタンパク質分解酵素のいずれか一方または双方が透過できる隙間を形成し、しかる後FISH法により蛍光染色させて前記微生物を定量することを特徴とする微生物の検出方法である。
【0026】
請求項2の発明は、前記微生物の細胞壁に隙間を形成した後、微生物にタンパク分解酵素を加え、しかる後FISH法により蛍光染色させて微生物を定量する請求項1記載の微生物の検出方法である。
【0027】
請求項3の発明は、シュードムレイン又はメタノコンドロイチンを主成分とする細胞壁を持つ微生物が含まれたサンプルをパラホルムアルデヒド水溶液につけて化学固定を行った後、分散化処理を行い、これをフィルターでろ過して微生物をフィルター上に固定し、寒天で表面をカバーしてフィルターサンプルとし、そのフィルターサンプルを挟んで微生物にせん断力を付与してその細胞壁に、FISH法のプローブおよびタンパク質分解酵素のいずれか一方または双方が透過できる隙間を形成し、しかる後、ハイブリダイゼーションを行って微生物を定量する請求項1記載の微生物の検出方法である。
【0028】
請求項4の発明は、細胞壁を持つ微生物が含まれたサンプルをパラホルムアルデヒド水溶液につけて化学固定を行った後、分散化処理を行い、これをフィルターでろ過して微生物をフィルター上に固定し、寒天で表面をカバーしてフィルターサンプルとし、そのフィルターサンプル中の微生物をFISH法により検出する装置において、前記フィルターサンプルをせん断力付加装置で挟んで、前記フィルターサンプル上の微生物にせん断力を付与してその細胞壁に、FISH法のプローブおよびタンパク質分解酵素のいずれか一方または双方が透過できる隙間を形成することを特徴とする微生物の検出装置である。
【0029】
請求項5の発明は、せん断力付加装置は、先の広いピンセットからなり、前記フィルターサンプルを1kg/cm2の圧力をかけながら横方向に位置をずらしながらせん断力を付与する請求項4記載の微生物の検出装置である。
【0030】
請求項6の発明は、せん断力付加装置は、前記フィルターサンプルを上下から所定の圧力で挟む一対の金属片と、その金属片のいずれか一方にその金属片を横方向にずらす力を与えるハンマーとからなる請求項4記載の微生物の検出装置である。
【発明の効果】
【0031】
本発明によれば、シュードムレインなどからなる硬い細胞壁を持つ微生物でもCARD−FISH法により検出できるという優れた効果を発揮するものである。
【図面の簡単な説明】
【0032】
【図1】本発明の検出方法に用いるせん断力付加装置を示す図である。
【図2】図1のせん断力付加装置でせん断力を付与する状態を説明する図である。
【図3】本発明において、せん断力を付与したのちFISH法で蛍光色素を標的細胞に沈着させたときの顕微鏡写真を示す図である。
【図4】本発明において、せん断力を付与とタンパク分解酵素で処理したのちFISH法で蛍光色素を標的細胞に沈着させたときの顕微鏡写真を示す図である。
【図5】本発明の検出方法に用いるせん断力付加装置の他の例を示す図である。
【発明を実施するための形態】
【0033】
以下、本発明の好適な一実施の形態を添付図面に基づいて詳述する。
【0034】
先ず、メタノサルシナ属などメタノコンドロイチンなどからなる硬い細胞壁を持つ微生物は、CARD−FISH法により蛍光染色を施しても酵素つきのプローブが細胞壁によりブロックされて浸透せず、またタンパク分解酵素によっても細胞壁を分解することが出来ないため、そのままでは、CARD−FISH法で検出が出来ない。
【0035】
このため、本発明では、酵素のような選択性を持つ処理とは異なる物理的な処理による細胞の透過性向上を行った。
【0036】
その物理的な処理とは、細胞壁にせん断力を与えるということになるが、具体的にはFISH等の手法用に用意された微生物サンプル(しばしばフィルター上に固定した状態にある)に上下からたとえば小さな金属製の板のようなものではさみ圧力を加えた状態で一方の金属板を横にずらす。その際にサンプルに対してせん断力が与えられ、プローブの通過できる隙間が形成されると考えられる。
【0037】
この効果によってたとえば酵素による分解が困難な細胞壁を持つ微生物においてもCARD−FISHの適用が可能となる。
【0038】
この処理のあとにタンパク分解酵素等で処理することによってさらにプローブの透過性が向上し、明るい蛍光シグナルを得ることができる。
【0039】
これはせん断力の副次的効果として、タンパク分解酵素等も細胞壁を透過できるようになり、内側から細胞壁の分解に作用したと考えられる。
【0040】
CARD−FISH等の手法によって選択的にメタノサルシナ等の標的とする微生物を光らせることができ、また赤色以外の色素においても良好なシグナルが得られるため、従来以上に信頼性の高い標的微生物の同定、検出、定量が行える。 CARD−FISHの強力な蛍光はサンプルを選ばず、また、低倍率における顕微鏡観察でも容易に認識できるため、コンピューターによる画像処理をもちいて定量する場合に、どのようなサンプルでも殆どの場合解析可能で、広範囲を一枚の写真に収めることができ、定量値の信頼性が高くなる。また、コンピューターの自動画像処理機能を用いることによって作業効率が飛躍的に高くなる。
【0041】
次に、より具体的な実施の形態を説明する。
【0042】
廃棄物処理サンプルに含まれるメタノサルシナ属のアーキア(微生物)を検出するためにCARD−FISH法を行った。
【0043】
すなわち、公知のCARD−FISH法(非特許文献2、3)に基づいた以下の操作を行った。
【0044】
まずサンプルを終濃度4%のパラホルムアルデヒド水溶液につけ、4℃で一晩、化学固定を行った。
【0045】
次にサンプル中の微生物を分散させるために、ホモジナイズや1分間の超音波処理を行って分散化処理させ、その一部を外径25mm、孔径0.22μmのポリカーポネートフィルターでろ過し、微生物をフィルター表面に乗せる。
【0046】
その後、0.1%寒天につけ、乾燥させることで表面をカバーし、以降の処理中での微生物の剥離を防いだ。
【0047】
そのフィルターサンプルは1/12〜1/24位の大きさに3枚切り出し、せん断力の効果を見るために以下のA,B,Cの異なる処理を行った。
【0048】
A:無処理。
【0049】
B:せん断処理
65℃で5分間熱処理したフィルターサンプルに対して以下のせん断力付加装置で10回以上位置をずらしながらはさみ、せん断力を与えた。
【0050】
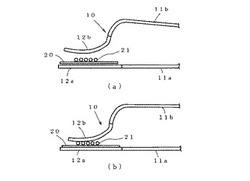
このせん断力付加装置は、効果的にせん断力を与えるために、図1(a)、図1(b)に示すように、先の広いピンセット10を加工して簡単にせん断力を与えられるよう作製した。
【0051】
すなわち、ピンセット10の一方の柄部11aと、その先の摘み部12aは、直線状とし、他方の柄部11bの先端部とその摘み部12bは、他方の摘み部12a側に湾曲させると共に摘み部12bを上方に湾曲させた形状とした。
【0052】
このピンセット10を図2(a)に示すように、下方の摘み部12a上にフィルターサンプル20を乗せ、図2(b)に示すように、他方の摘み部12bでフィルターサンプル20を挟み、その状態で、約1kg/cm2 の圧力をかけながら、ピンセット10又はフィルターサンプル20を横方向に約10回程度ずらすことで、縦方向の圧力とともに横方向へのずれが生じ、メタノサルシナなどの微生物21に、せん断力を与えることができる。
【0053】
C:せん断処理+タンパク分解酵素
Bと同様の処理後に、アクロモペプチダーゼ液中につけて室温で30分反応させ、水洗、エタノールによる脱水、乾燥をした。その後、各サンプルは0.0015%H2O2を含むメタノール中に30分つけた。
【0054】
次に、上述したA〜Cの処理を行ったフィルターサンプルに対して、ハイブリダイゼーション溶液(0.9M NaCl,20mM Tris−Cl(有機バッファの名称),35%formamide,2%Blocking reagentと0.02%SDS(ドデシル硫酸ナトリウム))300μlと、ブロープの水溶液(8pmo1/μl)2μlを混合した液にフィルターサンプルをいれ、45℃で2時間ハイブリダイゼーションを行った。
【0055】
その後、洗浄液(20mM Tris−Cl,80mM NaCl,5mM EDTA)と、0.01%SDSにフィルターサンプルを浸せきし(48℃、15分)余分なプローブを洗浄した。
【0056】
その後、フィルターサンプルは、10ml程度のPBS(8gのNaCl,0.2gのKCl,1.44gのNa2HPO4 と、0.24gのKH2PO4を1Lの超純水に溶かしpH7.4にする)に数分漬けたのち、反応液に15分間37℃で反応させ、蛍光色素を標的細胞内に沈着させた。
【0057】
反応液の組成は0.0015%H2O2,1%Blocking reagentのPBS溶液500μlと3μlの5,6−FAM(蛍光色素の名前)で標識したtyramide液の混合物である。
【0058】
反応後、約10mlのPBSで5分問、超純水で1分間洗浄後にエタノール中につけて脱水して乾燥した。そのフィルターサンプルはDNA染色試薬とグリセリンを含む液を用いてスライドグラスとカバーガラスの間に設置し、蛍光顕微鏡観察を行った。
【0059】
図3、4は、それぞれ処理B、Cのサンプルの蛍光顕微鏡写真である。
【0060】
各フィルターサンプル上には、ほぼ同様の量のメタノサルシナが存在すると仮定すると、処理Aでは、ほとんどシグナルが観察されなかったが(ほとんど何も写っていない写真になってしまうので写真は省略)、処理B,Cではシグナルが観察されるため、せん断力付加処理によって細胞壁にプローブが通り抜けられるひび、もしくは穴のようなものが形成されたと考えられる。
【0061】
C(図3)は、B(図2)よりもさらに明るく、細胞内全体からシグナルが観察される。
【0062】
これはタンパク分解酵素によって細胞壁成分が分解されて、さらにブローブの透過性が向上したためであると考えられる。
【0063】
この効果はせん断力を付加しないときには見られず、CARD−FISH法で用いるDNAプローブとしては、公知のメタノサルシナ検出用プローブを分子量約40kDaの西洋ワサビペルオキシダーゼで標識したもののほか、他の微生物をみるためには、例えば真正細菌には公知のEUB338プローブ、アーキアには公知のARC915を西洋ワサビペルオキシダーゼで標識したもの等、基本的にFISH用に設計されたプローブであれば使用可能である。
【0064】
せん断力を与えることによって細胞の少なくとも一部にひびが入ることでCARD−FISHのプローブが細胞内に入っていくことができるようになる。ただ圧力をかけただけでは効果は無かった。圧力とともに与える横方向のずれにより、効果的にひびが入ると考えられる。
【0065】
せん断力を与えたあとにタンパク分解酵素のような細胞壁成分を分解する酵素で処理Cすることによってこの効果は大きくなる。
【0066】
せん断力によってひびが入りタンパク分解酵素をも通しやすくなったためこの効果は得られると考えられる。
【0067】
上述の実施の形態では、ピンセット10でせん断力を付与する例で説明したが、ピンセット10でのせん断力付与では、個人差が生じやすいため、図5のようなせん断力付加装置を用いるのが好ましい。
【0068】
図5において下部支持板30に支柱31を介して上部支持板32を設け、その下部支持板30上に下部金属片33を保持し、上部支持板32に押圧用ネジ35にて上部金属片34を下部金属片33に対して所定の圧力を付与できるようにし、この二枚の金属片33,34にフィルターサンプル20を挟み、圧力を加えながら片方の金属片34にハンマー36で横方向へずらす力を与えるようにする。
【0069】
このせん断力付加装置は、押圧用ネジ35にて所定の押圧力を付与でき、またハンマー36で金属片34を所定の力で10回程度繰り返し殴打するため、微生物21に対して一定のせん断力を付与することができ、より再現性の高い検出が行える。
【符号の説明】
【0070】
10 ピンセット(せん断力付加装置)
20 サンプルフィルター
21 微生物
【技術分野】
【0001】
本発明は、メタノサルシナ属に代表される細胞壁の硬い微生物を検出できるメタノサルシナ等の微生物の検出方法及びその装置に関するものである。
【背景技術】
【0002】
廃水処理プラント、メタン発酵プラント、生ゴミ処理装置等の微生物を利用した装置においては、その中で有効に働く微生物の種類や存在量が性能に大きく影響を及ぼすと考えられている。
【0003】
そのため、そのモニタリングは重要であり、過去より顕微鏡観察が行われてきた。プラント中で働く微生物は、細菌やアーキア(微生物)が主であり、その大きさは大体1〜10μmであり、近年ではFISH法等による微生物の検出、定量法が応用されてきた。
【0004】
例えば、メタン生成菌の1属であるメタノサルシナ属の微生物は酢酸やメタノールからメタンを生成するため、さまざまな廃水、産廃物においてキーとなって働いている場合が多い。そのため、定量ができるようになると、プラントの性能の向上や、トラブルの原因の追求等において主要なデータとなる。
【0005】
メタン発酵プラント等のサンプル中におけるこの菌の存在を確認するために、従来は、メタン生成菌の持つ補酵素F420の持つ青い自家蛍光を利用して蛍光顕微鏡下でメタン生成菌を可視化し、形態的にメタノサルシナに類似したものをメタノサルシナ属のメタン生成菌と仮定していた。
【0006】
一方、FISH法(Fluorescence in situ hybridization;蛍光染色法)にて、例えばメタノサルシナ等の標的微生物を検出するプローブを用いてそれのみを可視化することも可能である(非特許文献1)。
【0007】
ところが、FISH法の場合にはCy3等の赤い蛍光色素が発光効率の高さから最も多く用いられているが、サンプル中の有機物が多く赤い背景光が高くなってしまう場合には、メタノサルシナのFISHシグナルが埋もれてしまう。
【0008】
それらの理由から、上記いずれの方法を使うにせよ標的微生物の検出や定量をしようとする際には人間が顕微鏡で観察し、手作業で計数していくことが確実であった。
【0009】
しかし、自家蛍光を用いた蛍光顕微鏡観察の場合には、形態で判断しなければならないため、経験が必要である。また、菌体自体が弱い赤い蛍光を発する場合があるため、FISH法において確信を持って真のシグナルを見分けるためにも多くの労力が必要であり、定常的に行うには困難である場合が多い。またそのような分析においてはしばしば主観が入る恐れがある。
【0010】
近年、標的微生物に対して選択的蛍光染色を行う場合に、西洋わさびペルオキシダーゼ(HRP)、アルカリフォスターゼ等の酵素反応やPCR(ポリメラーゼ連鎖反応;酵素を使って特定の遺伝子を増殖させる手法)を応用して蛍光強度を増殖させる手法が開発されてきた。
【0011】
例えばCARD−FISH法(非特許文献2)ではHRPで標識したプローブを標的微生物内に結合させたあとに、HRPの基質となる過酸化水素とチラミン−蛍光色複合体とを加えることによって、チラミン−蛍光色素複合体がラジカル化され、細胞内のたんぱく質等に共有結合し、その結果、多数の蛍光色素が標的細胞内に沈着する。これによって、標的細胞の蛍光強度は通常のFISH法の数十倍以上になり、背景光と異なる色相の色素が、例え分子あたりの蛍光強度が弱くても十分実用可能になる。
【0012】
この手法により、多くのグラム陰性細菌についてすでに適用され、明確な輝度の違いによる検出と背景光に埋没する問題との両方の解決が可能となっている。
【0013】
しかし、微生物によっては細胞壁が厚く、酵素等の高分子はそのままでは細胞内に浸透して行かない。
【0014】
例えば、アクチノバクテリアはペプチドグリカンからなる厚い細胞壁を持つため、CARD−FISHを適用するためには、分子量約40kDaのHRPで標識されたプローブを細胞内に透過させるために、サンプルに対してリゾチームとアクロモペプチダーゼの両方の処理を行い細胞壁をある程度分解する必要があることがわかっている。
【先行技術文献】
【特許文献】
【0015】
【特許文献1】特開平05−68590号公報
【特許文献2】特開平05−84095号公報
【特許文献3】特開2002−119300号公報
【非特許文献】
【0016】
【非特許文献1】L.Raskin et al."Group-Specific 16S rRNA Hybridization ProbesTo Describe Natural Commuities of Methanogens" Applied and Environmental Microbiology,Vol.60.No.4,Apr,1994,p.1232-1240
【非特許文献2】A.Pernthaler et al."Fluorescence In Situ Hybridization and Catalyzed Reporter Deposition for the Identification of Marine Bacteria" Applied and Environmental Microbiology,Vol.68.No.6,June,2002,p.3094-3101
【非特許文献3】R.Sekar et al."An Improved Protocol for Quantification of Freshwater Actinobacteria by Fluorescence In Situ Hybridization" Applied and Environmental Microbiology,Vol.69.No.5,May,2003,p.2928-2935
【発明の概要】
【発明が解決しようとする課題】
【0017】
しかしながら、細胞壁の構造が特殊であるために、一般に手に入る酵素の処理が通じない微生物もまだ多く存在する。たとえばメタノサルシナの細胞壁はメタノコンドロイチンやタンパクから構成されていて丈夫であるため、酵素等の高分子はそのままでは細胞内に浸透していかないことがわかっている。
【0018】
細胞壁を形成する物質は、植物ではセルロースで、これはグルコース(ブドウ糖)がいくつもつながって出来ている糖鎖であり、他にもリグニンやペクチンのようなものがある。
【0019】
それゆえリゾチームやタンパク分解酵素で処理したとしても、メタノサルシナに対してCARD−FISHが機能しない(一部のメタノサルシナしか光らない)ことが本発明者等の実験によってもわかっている。
【0020】
メタノサルシナのみならず、メタノバクテリウム属等のアーキアの多くも、シュードムレインという、市販の酵素では分解できない物質を主成分とする細胞壁を持つため、CARD−FISH等による検出は難しい状況である。
【0021】
このシュードムレインと呼ばれる細胞壁は、メタン生成微生物に特徴的な細胞壁構造であり、その他にも、特殊な細胞壁を持つ微生物は多く存在し、それどころか多くの微生物の細胞壁成分はいまだ未知である状況であるため、今後多くの微生物についてCARD−FISHの適応が難しいことが明らかになってくる事は容易に予想できる。
【0022】
また、現在酵素処理によってCARD−FISH解析が可能な菌についても個々に異なる酵素や反応条件が異なる場合が考えられ、手法として煩雑になってくる。
【0023】
そのため何にでも対応できるユニバーサルな手法が必要とされている。
【0024】
そこで、本発明の目的は、上記課題を解決し、メタノサルシナ属など、メタノコンドロイチンと呼ばれる市販の酵素で処理できない細胞壁を持つ微生物を、CARD−FISH法等を用いて検出することができる微生物の検出方法及びその装置を提供することにある。
【課題を解決するための手段】
【0025】
上記目的を達成するために請求項1の発明は、細胞壁を持つ微生物を検出する方法において、前記微生物を化学固定した後、フィルターでろ過して微生物をフィルター上に固定し、そのフィルター上の微生物をフィルターごと挟んで微生物にせん断力を付与してその細胞壁に、FISH法のプローブおよびタンパク質分解酵素のいずれか一方または双方が透過できる隙間を形成し、しかる後FISH法により蛍光染色させて前記微生物を定量することを特徴とする微生物の検出方法である。
【0026】
請求項2の発明は、前記微生物の細胞壁に隙間を形成した後、微生物にタンパク分解酵素を加え、しかる後FISH法により蛍光染色させて微生物を定量する請求項1記載の微生物の検出方法である。
【0027】
請求項3の発明は、シュードムレイン又はメタノコンドロイチンを主成分とする細胞壁を持つ微生物が含まれたサンプルをパラホルムアルデヒド水溶液につけて化学固定を行った後、分散化処理を行い、これをフィルターでろ過して微生物をフィルター上に固定し、寒天で表面をカバーしてフィルターサンプルとし、そのフィルターサンプルを挟んで微生物にせん断力を付与してその細胞壁に、FISH法のプローブおよびタンパク質分解酵素のいずれか一方または双方が透過できる隙間を形成し、しかる後、ハイブリダイゼーションを行って微生物を定量する請求項1記載の微生物の検出方法である。
【0028】
請求項4の発明は、細胞壁を持つ微生物が含まれたサンプルをパラホルムアルデヒド水溶液につけて化学固定を行った後、分散化処理を行い、これをフィルターでろ過して微生物をフィルター上に固定し、寒天で表面をカバーしてフィルターサンプルとし、そのフィルターサンプル中の微生物をFISH法により検出する装置において、前記フィルターサンプルをせん断力付加装置で挟んで、前記フィルターサンプル上の微生物にせん断力を付与してその細胞壁に、FISH法のプローブおよびタンパク質分解酵素のいずれか一方または双方が透過できる隙間を形成することを特徴とする微生物の検出装置である。
【0029】
請求項5の発明は、せん断力付加装置は、先の広いピンセットからなり、前記フィルターサンプルを1kg/cm2の圧力をかけながら横方向に位置をずらしながらせん断力を付与する請求項4記載の微生物の検出装置である。
【0030】
請求項6の発明は、せん断力付加装置は、前記フィルターサンプルを上下から所定の圧力で挟む一対の金属片と、その金属片のいずれか一方にその金属片を横方向にずらす力を与えるハンマーとからなる請求項4記載の微生物の検出装置である。
【発明の効果】
【0031】
本発明によれば、シュードムレインなどからなる硬い細胞壁を持つ微生物でもCARD−FISH法により検出できるという優れた効果を発揮するものである。
【図面の簡単な説明】
【0032】
【図1】本発明の検出方法に用いるせん断力付加装置を示す図である。
【図2】図1のせん断力付加装置でせん断力を付与する状態を説明する図である。
【図3】本発明において、せん断力を付与したのちFISH法で蛍光色素を標的細胞に沈着させたときの顕微鏡写真を示す図である。
【図4】本発明において、せん断力を付与とタンパク分解酵素で処理したのちFISH法で蛍光色素を標的細胞に沈着させたときの顕微鏡写真を示す図である。
【図5】本発明の検出方法に用いるせん断力付加装置の他の例を示す図である。
【発明を実施するための形態】
【0033】
以下、本発明の好適な一実施の形態を添付図面に基づいて詳述する。
【0034】
先ず、メタノサルシナ属などメタノコンドロイチンなどからなる硬い細胞壁を持つ微生物は、CARD−FISH法により蛍光染色を施しても酵素つきのプローブが細胞壁によりブロックされて浸透せず、またタンパク分解酵素によっても細胞壁を分解することが出来ないため、そのままでは、CARD−FISH法で検出が出来ない。
【0035】
このため、本発明では、酵素のような選択性を持つ処理とは異なる物理的な処理による細胞の透過性向上を行った。
【0036】
その物理的な処理とは、細胞壁にせん断力を与えるということになるが、具体的にはFISH等の手法用に用意された微生物サンプル(しばしばフィルター上に固定した状態にある)に上下からたとえば小さな金属製の板のようなものではさみ圧力を加えた状態で一方の金属板を横にずらす。その際にサンプルに対してせん断力が与えられ、プローブの通過できる隙間が形成されると考えられる。
【0037】
この効果によってたとえば酵素による分解が困難な細胞壁を持つ微生物においてもCARD−FISHの適用が可能となる。
【0038】
この処理のあとにタンパク分解酵素等で処理することによってさらにプローブの透過性が向上し、明るい蛍光シグナルを得ることができる。
【0039】
これはせん断力の副次的効果として、タンパク分解酵素等も細胞壁を透過できるようになり、内側から細胞壁の分解に作用したと考えられる。
【0040】
CARD−FISH等の手法によって選択的にメタノサルシナ等の標的とする微生物を光らせることができ、また赤色以外の色素においても良好なシグナルが得られるため、従来以上に信頼性の高い標的微生物の同定、検出、定量が行える。 CARD−FISHの強力な蛍光はサンプルを選ばず、また、低倍率における顕微鏡観察でも容易に認識できるため、コンピューターによる画像処理をもちいて定量する場合に、どのようなサンプルでも殆どの場合解析可能で、広範囲を一枚の写真に収めることができ、定量値の信頼性が高くなる。また、コンピューターの自動画像処理機能を用いることによって作業効率が飛躍的に高くなる。
【0041】
次に、より具体的な実施の形態を説明する。
【0042】
廃棄物処理サンプルに含まれるメタノサルシナ属のアーキア(微生物)を検出するためにCARD−FISH法を行った。
【0043】
すなわち、公知のCARD−FISH法(非特許文献2、3)に基づいた以下の操作を行った。
【0044】
まずサンプルを終濃度4%のパラホルムアルデヒド水溶液につけ、4℃で一晩、化学固定を行った。
【0045】
次にサンプル中の微生物を分散させるために、ホモジナイズや1分間の超音波処理を行って分散化処理させ、その一部を外径25mm、孔径0.22μmのポリカーポネートフィルターでろ過し、微生物をフィルター表面に乗せる。
【0046】
その後、0.1%寒天につけ、乾燥させることで表面をカバーし、以降の処理中での微生物の剥離を防いだ。
【0047】
そのフィルターサンプルは1/12〜1/24位の大きさに3枚切り出し、せん断力の効果を見るために以下のA,B,Cの異なる処理を行った。
【0048】
A:無処理。
【0049】
B:せん断処理
65℃で5分間熱処理したフィルターサンプルに対して以下のせん断力付加装置で10回以上位置をずらしながらはさみ、せん断力を与えた。
【0050】
このせん断力付加装置は、効果的にせん断力を与えるために、図1(a)、図1(b)に示すように、先の広いピンセット10を加工して簡単にせん断力を与えられるよう作製した。
【0051】
すなわち、ピンセット10の一方の柄部11aと、その先の摘み部12aは、直線状とし、他方の柄部11bの先端部とその摘み部12bは、他方の摘み部12a側に湾曲させると共に摘み部12bを上方に湾曲させた形状とした。
【0052】
このピンセット10を図2(a)に示すように、下方の摘み部12a上にフィルターサンプル20を乗せ、図2(b)に示すように、他方の摘み部12bでフィルターサンプル20を挟み、その状態で、約1kg/cm2 の圧力をかけながら、ピンセット10又はフィルターサンプル20を横方向に約10回程度ずらすことで、縦方向の圧力とともに横方向へのずれが生じ、メタノサルシナなどの微生物21に、せん断力を与えることができる。
【0053】
C:せん断処理+タンパク分解酵素
Bと同様の処理後に、アクロモペプチダーゼ液中につけて室温で30分反応させ、水洗、エタノールによる脱水、乾燥をした。その後、各サンプルは0.0015%H2O2を含むメタノール中に30分つけた。
【0054】
次に、上述したA〜Cの処理を行ったフィルターサンプルに対して、ハイブリダイゼーション溶液(0.9M NaCl,20mM Tris−Cl(有機バッファの名称),35%formamide,2%Blocking reagentと0.02%SDS(ドデシル硫酸ナトリウム))300μlと、ブロープの水溶液(8pmo1/μl)2μlを混合した液にフィルターサンプルをいれ、45℃で2時間ハイブリダイゼーションを行った。
【0055】
その後、洗浄液(20mM Tris−Cl,80mM NaCl,5mM EDTA)と、0.01%SDSにフィルターサンプルを浸せきし(48℃、15分)余分なプローブを洗浄した。
【0056】
その後、フィルターサンプルは、10ml程度のPBS(8gのNaCl,0.2gのKCl,1.44gのNa2HPO4 と、0.24gのKH2PO4を1Lの超純水に溶かしpH7.4にする)に数分漬けたのち、反応液に15分間37℃で反応させ、蛍光色素を標的細胞内に沈着させた。
【0057】
反応液の組成は0.0015%H2O2,1%Blocking reagentのPBS溶液500μlと3μlの5,6−FAM(蛍光色素の名前)で標識したtyramide液の混合物である。
【0058】
反応後、約10mlのPBSで5分問、超純水で1分間洗浄後にエタノール中につけて脱水して乾燥した。そのフィルターサンプルはDNA染色試薬とグリセリンを含む液を用いてスライドグラスとカバーガラスの間に設置し、蛍光顕微鏡観察を行った。
【0059】
図3、4は、それぞれ処理B、Cのサンプルの蛍光顕微鏡写真である。
【0060】
各フィルターサンプル上には、ほぼ同様の量のメタノサルシナが存在すると仮定すると、処理Aでは、ほとんどシグナルが観察されなかったが(ほとんど何も写っていない写真になってしまうので写真は省略)、処理B,Cではシグナルが観察されるため、せん断力付加処理によって細胞壁にプローブが通り抜けられるひび、もしくは穴のようなものが形成されたと考えられる。
【0061】
C(図3)は、B(図2)よりもさらに明るく、細胞内全体からシグナルが観察される。
【0062】
これはタンパク分解酵素によって細胞壁成分が分解されて、さらにブローブの透過性が向上したためであると考えられる。
【0063】
この効果はせん断力を付加しないときには見られず、CARD−FISH法で用いるDNAプローブとしては、公知のメタノサルシナ検出用プローブを分子量約40kDaの西洋ワサビペルオキシダーゼで標識したもののほか、他の微生物をみるためには、例えば真正細菌には公知のEUB338プローブ、アーキアには公知のARC915を西洋ワサビペルオキシダーゼで標識したもの等、基本的にFISH用に設計されたプローブであれば使用可能である。
【0064】
せん断力を与えることによって細胞の少なくとも一部にひびが入ることでCARD−FISHのプローブが細胞内に入っていくことができるようになる。ただ圧力をかけただけでは効果は無かった。圧力とともに与える横方向のずれにより、効果的にひびが入ると考えられる。
【0065】
せん断力を与えたあとにタンパク分解酵素のような細胞壁成分を分解する酵素で処理Cすることによってこの効果は大きくなる。
【0066】
せん断力によってひびが入りタンパク分解酵素をも通しやすくなったためこの効果は得られると考えられる。
【0067】
上述の実施の形態では、ピンセット10でせん断力を付与する例で説明したが、ピンセット10でのせん断力付与では、個人差が生じやすいため、図5のようなせん断力付加装置を用いるのが好ましい。
【0068】
図5において下部支持板30に支柱31を介して上部支持板32を設け、その下部支持板30上に下部金属片33を保持し、上部支持板32に押圧用ネジ35にて上部金属片34を下部金属片33に対して所定の圧力を付与できるようにし、この二枚の金属片33,34にフィルターサンプル20を挟み、圧力を加えながら片方の金属片34にハンマー36で横方向へずらす力を与えるようにする。
【0069】
このせん断力付加装置は、押圧用ネジ35にて所定の押圧力を付与でき、またハンマー36で金属片34を所定の力で10回程度繰り返し殴打するため、微生物21に対して一定のせん断力を付与することができ、より再現性の高い検出が行える。
【符号の説明】
【0070】
10 ピンセット(せん断力付加装置)
20 サンプルフィルター
21 微生物
【特許請求の範囲】
【請求項1】
細胞壁を持つ微生物を検出する方法において、前記微生物を化学固定した後、フィルターでろ過して微生物をフィルター上に固定し、そのフィルター上の微生物をフィルターごと挟んで微生物にせん断力を付与してその細胞壁に、FISH法のプローブおよびタンパク質分解酵素のいずれか一方または双方が透過できる隙間を形成し、しかる後FISH法により蛍光染色させて前記微生物を定量することを特徴とする微生物の検出方法。
【請求項2】
前記微生物の細胞壁に隙間を形成した後、微生物にタンパク分解酵素を加え、しかる後FISH法により蛍光染色させて微生物を定量する請求項1記載の微生物の検出方法。
【請求項3】
細胞壁を持つ微生物が含まれたサンプルをパラホルムアルデヒド水溶液につけて化学固定を行った後、分散化処理を行い、これをフィルターでろ過して微生物をフィルター上に固定し、寒天で表面をカバーしてフィルターサンプルとし、そのフィルターサンプルを挟んで微生物にせん断力を付与してその細胞壁に、FISH法のプローブおよびタンパク質分解酵素のいずれか一方または双方が透過できる隙間を形成し、しかる後、ハイブリダイゼーションを行って微生物を定量する請求項1記載の微生物の検出方法。
【請求項4】
細胞壁を持つ微生物が含まれたサンプルをパラホルムアルデヒド水溶液につけて化学固定を行った後、分散化処理を行い、これをフィルターでろ過して微生物をフィルター上に固定し、寒天で表面をカバーしてフィルターサンプルとし、そのフィルターサンプル中の微生物をFISH法により検出する装置において、前記フィルターサンプルをせん断力付加装置で挟んで、前記フィルターサンプル上の微生物にせん断力を付与してその細胞壁に、FISH法のプローブおよびタンパク質分解酵素のいずれか一方または双方が透過できる隙間を形成することを特徴とする微生物の検出装置。
【請求項5】
せん断力付加装置は、先の広いピンセットからなり、前記フィルターサンプルを1kg/cm2の圧力をかけながら横方向に位置をずらしながらせん断力を付与する請求項4記載の微生物の検出装置。
【請求項6】
せん断力付加装置は、前記フィルターサンプルを上下から所定の圧力で挟む一対の金属片と、その金属片のいずれか一方にその金属片を横方向にずらす力を与えるハンマーとからなる請求項4記載の微生物の検出装置。
【請求項1】
細胞壁を持つ微生物を検出する方法において、前記微生物を化学固定した後、フィルターでろ過して微生物をフィルター上に固定し、そのフィルター上の微生物をフィルターごと挟んで微生物にせん断力を付与してその細胞壁に、FISH法のプローブおよびタンパク質分解酵素のいずれか一方または双方が透過できる隙間を形成し、しかる後FISH法により蛍光染色させて前記微生物を定量することを特徴とする微生物の検出方法。
【請求項2】
前記微生物の細胞壁に隙間を形成した後、微生物にタンパク分解酵素を加え、しかる後FISH法により蛍光染色させて微生物を定量する請求項1記載の微生物の検出方法。
【請求項3】
細胞壁を持つ微生物が含まれたサンプルをパラホルムアルデヒド水溶液につけて化学固定を行った後、分散化処理を行い、これをフィルターでろ過して微生物をフィルター上に固定し、寒天で表面をカバーしてフィルターサンプルとし、そのフィルターサンプルを挟んで微生物にせん断力を付与してその細胞壁に、FISH法のプローブおよびタンパク質分解酵素のいずれか一方または双方が透過できる隙間を形成し、しかる後、ハイブリダイゼーションを行って微生物を定量する請求項1記載の微生物の検出方法。
【請求項4】
細胞壁を持つ微生物が含まれたサンプルをパラホルムアルデヒド水溶液につけて化学固定を行った後、分散化処理を行い、これをフィルターでろ過して微生物をフィルター上に固定し、寒天で表面をカバーしてフィルターサンプルとし、そのフィルターサンプル中の微生物をFISH法により検出する装置において、前記フィルターサンプルをせん断力付加装置で挟んで、前記フィルターサンプル上の微生物にせん断力を付与してその細胞壁に、FISH法のプローブおよびタンパク質分解酵素のいずれか一方または双方が透過できる隙間を形成することを特徴とする微生物の検出装置。
【請求項5】
せん断力付加装置は、先の広いピンセットからなり、前記フィルターサンプルを1kg/cm2の圧力をかけながら横方向に位置をずらしながらせん断力を付与する請求項4記載の微生物の検出装置。
【請求項6】
せん断力付加装置は、前記フィルターサンプルを上下から所定の圧力で挟む一対の金属片と、その金属片のいずれか一方にその金属片を横方向にずらす力を与えるハンマーとからなる請求項4記載の微生物の検出装置。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2013−74900(P2013−74900A)
【公開日】平成25年4月25日(2013.4.25)
【国際特許分類】
【出願番号】特願2012−284734(P2012−284734)
【出願日】平成24年12月27日(2012.12.27)
【分割の表示】特願2006−208704(P2006−208704)の分割
【原出願日】平成18年7月31日(2006.7.31)
【出願人】(000000099)株式会社IHI (5,014)
【Fターム(参考)】
【公開日】平成25年4月25日(2013.4.25)
【国際特許分類】
【出願日】平成24年12月27日(2012.12.27)
【分割の表示】特願2006−208704(P2006−208704)の分割
【原出願日】平成18年7月31日(2006.7.31)
【出願人】(000000099)株式会社IHI (5,014)
【Fターム(参考)】
[ Back to top ]

