抗トリパノソーマ剤およびトリパノソーマ症治療薬
【課題】 トリパノソーマ原虫に起因するトリパノソーマ症治療薬を提供する。
【解決手段】 式(I)で表される化合物またはその薬学的に許容される塩をトリパノソーマ症治療薬の有効成分とする。

式中、R1は炭素数1〜10のアルキルまたはフェニルを示し、R2は炭素数5〜10の鎖状アルキルを示し、Xはハロゲンあるいは水素を示す。
【解決手段】 式(I)で表される化合物またはその薬学的に許容される塩をトリパノソーマ症治療薬の有効成分とする。

式中、R1は炭素数1〜10のアルキルまたはフェニルを示し、R2は炭素数5〜10の鎖状アルキルを示し、Xはハロゲンあるいは水素を示す。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、抗トリパノソーマ剤およびそれを含むトリパノソーマ症治療薬に関する。
【背景技術】
【0002】
トリパノソーマ(Trypanosoma)はトリパノソーマ科に属する原生生物で、幅広い宿主(ヒトや家畜、他)に感染し、さまざまな病気(総称してトリパノソーマ症)を引き起こす寄生虫である。ヒトなどの脊椎動物に感染するトリパノソーマは、アフリカ睡眠病や南米シャーガス病を引き起こし、年間何万人もの犠牲者を出している。
南米シャーガス病はアメリカトリパノソーマTrypanosoma cruzi(T. cruzi)の感染により起こる疾患で、中南米で800万人以上が感染し、同地域の死因としてはマラリアを上回っている。T. cruziはサシガメとよばれる媒介昆虫の刺咬により感染し、鞭毛をもった血流型虫体(trypomastigote)が心筋や神経細胞に侵入し、細胞内型虫体(amastigote)に形態変化する(図1)。細胞内で分裂・増殖した後、再び血流型に変換し、宿主細胞を破壊して新たな細胞に侵入する。急性期では発熱などの症状がみられるが、成人では大多数が慢性期へと移行し、十数年という長い歳月の後に突然の心臓発作で亡くなる場合がある。また巨大食道、巨大結腸などの症状を引き起こす。
これまでに、いくつかのトリパノソーマ症治療薬が開発されているが、早期治療が大前提となるうえ、副作用の問題や耐性虫の出現も含め、未だ有効な治療薬・治療法は確立されていない。
【0003】
細胞性粘菌Dictyostelium discoideum(以後、粘菌)は、森の落ち葉の下などに生息する下等真核生物で、カビに良く似た子実体(胞子と柄から成る)を形成する。しかし、粘菌とカビ(真菌)類は、進化的にかけ離れた生物群であり、本発明者らは、真菌類と同様に「粘菌類=薬剤資源(抗生物質などの薬剤の宝庫)」と考え研究を進めており、実際に、いくつかの薬剤候補物質を報告してきた。
一方、粘菌の生活史(図2)は非常に単純で扱いが簡単なことから、粘菌は「発生生物学・細胞生物学のモデル生物」として、各種細胞機能の研究が進められている。胞子から発芽した粘菌細胞は、単細胞アメーバとして周囲のバクテリアをエサとして増殖する。エサが無くなると、それがシグナルとなって、細胞は集合し多細胞体(10万個ほどの細胞から成る)を形成し、最終的に子実体を形成する。図2中の低分子化合物は、粘菌の発生、分化を制御している生理活性因子の一部である。
【0004】
中でも、Differentiation-inducing factor-1 (DIF-1)は、粘菌の柄細胞分化誘導因子として単離、同定された低分子化合物である(非特許文献1、2)。同時に単離されたDIF-3は分化誘導活性が低く、DIF-1の分解産物であることがわかっている (非特許文献3、4、5)。
【化1】

【0005】
前述のように、DIF-1とDIF-3はもともと粘菌自身の柄細胞分化を誘導する粘菌の分化誘
導因子、そしてその分解産物として単離された化合物であるが、本発明者らはDIF-1、DIF-3およびそれらの誘導体(以下、これらをまとめてDIF関連化合物をいうことがある)が哺乳類細胞において、腫瘍細胞増殖阻害効果、糖代謝促進効果、インターロイキン-2産生制御効果等を有することを発見した(特許文献1,2、3)。
これらの成果より、DIF関連化合物が様々な薬理活性を有することが期待されるが、トリパノソーマ原虫に対する効果は検討されていなかった。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2006−340615号公報
【特許文献2】特開2006−290810号公報
【特許文献3】国際出願PCT/JP2010/057763号
【非特許文献】
【0007】
【非特許文献1】Morris et al. (1987) Nature 328: 811-814.
【非特許文献2】Morris et al. (1988) Biochem. J. 249: 903-906.
【非特許文献3】Masento et al. (1988) Biochem. J. 256: 23-28.
【非特許文献4】Wurster & Kay (1990) Dev. Biol. 140: 189-195.
【非特許文献5】Kay et al. (1999) Semin. Cell Dev. Biol. 10: 577-585.
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明は、新規な抗トリパノソーマ剤を提供することを課題とする。
【課題を解決するための手段】
【0009】
本発明者は上記課題を解決すべく、in vitro培養系におけるホスト細胞に対するトリパノソーマT. cruziの感染率、並びにホスト細胞内でのT. cruziの増殖に対する各種DIF関連化合物の作用を検討し、DIF-3及びその誘導体がT. cruziの感染と増殖を強く阻害することを見出した。
【0010】
さらに、ホスト細胞の増殖に対するDIF-3及びその誘導体の阻害効果と、ホスト細胞に対するDIF-3及びその誘導体の毒性を検討し、DIF-3及びその誘導体のホスト細胞に対する毒性は比較的小さいことを見出した。このことから、これらの化合物が抗トリパノソーマ剤として有用であることを見出し、本発明を完成するに至った。
【0011】
すなわち、本発明は下記式(I)で表される化合物またはその薬学的に許容される塩を有効成分とする抗トリパノソーマ剤に関する。
本発明はまた、前記抗トリパノソーマ剤を含む南米シャーガス病やアフリカ睡眠病の治療薬に関する。
【発明の効果】
【0012】
式(I)で表される化合物は、トリパノソーマのホストへの感染やホスト細胞内での増殖を阻害する薬剤として好適に用いることができる。また、トリパノソーマに起因する南米シャーガス病やアフリカ睡眠病などのトリパノソーマ症の治療薬としても好適に用いることができる。
【図面の簡単な説明】
【0013】
【図1】T. cruziの生活環を示す図。
【図2】粘菌の生活史を示す図。
【図3】A. DIF-1とDIF-3とDMPHの化学構造式。B.トリパノソーマの感染率と増殖に対するDIF-1とDIF-3とDMPHの効果を示す図。グラフの値は3回の実験の平均値と標準偏差。*はp<0.05 versus Control (by t-test)で有意差があることを示す。
【図4】A. Br-DIF-3とI-DIF-3の化学構造式。B.トリパノソーマの感染率と増殖に対するDIF誘導体の効果を示す図。グラフの値は3回の実験の平均値と標準偏差。*はp<0.05、**はp<0.01 versus Control (by t-test)で有意差があることを示す。
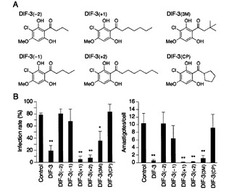
【図5】A.アルキル側鎖を改変したDIF誘導体の化学構造式。B.トリパノソーマの感染率と増殖に対するDIF誘導体の効果を示す図。グラフの値は3回の実験の平均値と標準偏差。*はp<0.05、**はp<0.01 versus Control (by t-test)で有意差があることを示す。
【図6】A.メトキシ基を改変したDIF誘導体の化学構造式。B.トリパノソーマの感染率と増殖に対するDIF誘導体の効果を示す図。グラフの値は3回の実験の平均値と標準偏差。*はp<0.05、**はp<0.01 versus Control (by t-test)で有意差があることを示す。
【図7】A. in vivoでのDIF-3とBu-DIF-3の抗トリパノソーマ活性を検討するスキーム。B. in vivoにおけるDIF-3とBu-DIF-3の抗トリパノソーマ活性のグラフ。グラフ中のバーは、それぞれのグループの平均値。
【発明を実施するための形態】
【0014】
以下に本発明を詳しく説明する。
本発明の抗トリパノソーマ剤は、式(I)で表される化合物またはその薬学的に許容される塩を有効成分とする。
【化2】

式中、R1は炭素数1〜10のアルキルまたはフェニルを示し、好ましくは炭素数1〜5のアルキル(鎖状でも環状でもよい)またはフェニルを示す。
R2は炭素数5〜10の鎖状アルキルを示し、好ましくは炭素数5〜7の鎖状アルキルを示す。
Xはハロゲン(Cl、Br、Iなど)あるいは水素を示す。
【0015】
本発明において「抗トリパノソーマ剤」とは、トリパノソーマ原虫数を減少させる薬剤、トリパノソーマ原虫数の増加(増殖)を抑制する薬剤、トリパノソーマ原虫を不活性化させる薬剤等が含まれる。本発明において「トリパノソーマ原虫を不活性化させる」とは、トリパノソーマ原虫が再生する能力を減少、抑制させることを含み、不活性化させる手段としては例えば殺すことが挙げられる。
【0016】
本発明の「抗トリパノソーマ剤」はトリパノソーマ症の治療薬として使用することができる。トリパノソーマ症とは、トリパノソーマ原虫による感染症であればよく、例えば、アフリカ睡眠病および南米シャーガス病が挙げられる。トリパノソーマ症の原因となるトリパノソーマ原虫としては、例えば、Trypanosoma cruzi、Trypanosoma brucei brucei、Trypanosoma brucei rhodensiense、Trypanosoma brucei gambiense、Trypanosoma evavsi、Trypanosoma hippicum等が挙げられる。
【0017】
式(I)の化合物では、抗トリパノソーマ剤としては、下記の化合物が好ましい。
【化3】

【0018】
上記式(I)の化合物はBiochem. Pharmacol. 2005, 70, 676-685.に記載された方法によって合成することができる。
【0019】
式(I)の化合物またはその薬学的に許容される塩は、トリパノソーマの感染や増殖を阻害する効果を有する。したがって、抗トリパノソーマ剤、アフリカ睡眠病や南米シャーガス病等のトリパノソーマ症の治療薬の有効成分として用いることができる。なお、本発明において、トリパノソーマ症治療薬とは、トリパノソーマ症の症状を根治する医薬のみならず、症状を改善する医薬や症状が出るのを防ぐ医薬も含む。
【0020】
式(I)の化合物の薬学的に許容される塩としては、ナトリウム、カリウム、マグネシウム、カルシウム等の金属塩、アンモニウム塩などが挙げられる。なお、式(I)の化合物は水和物であってもよい。
【0021】
式(I)の化合物またはその薬学的に許容される塩を含有してなる医薬は、医薬製剤の製造法で一般的に用いられている公知の手段に従って、該化合物またはその薬学的に許容される塩を、そのまま、あるいは薬理学的に許容される担体と混合して、例えば、錠剤(糖衣錠、フィルムコーティング錠を含む)、散剤、顆粒剤、カプセル剤、(ソフトカプセルを含む)、液剤、注射剤、坐剤、徐放剤等の医薬製剤として、経口的または非経口的(例、局所、直腸、静脈投与等)に安全に投与することができる。
【0022】
本発明の抗トリパノソーマ症治療薬を投与する対象は、トリパノソーマ原虫に感染した動物あるいはトリパノソーマ症を発症している動物である。そのような動物には、例えば、ヒトだけでなく、家畜、家禽、実験動物、ペット(愛玩動物)等の非ヒト動物も含まれる。例えば本発明の非ヒト動物としては、ウシ、ウマ、ブタ、ヤギ、ヒツジ等の家畜、ニワトリ、アヒル、ガチョウ、シチメンチョウ、ウズラ等の家禽、マウス、ラット、モルモット、イヌ、サル、魚類等の実験動物、イヌ、ネコ、トリ等のペットを挙げることができる。投与対象は、上述のようにトリパノソーマ原虫に感染した、あるいはトリパノソーマ症を発症した動物以外にも、トリパノソーマ原虫に感染する可能性のある動物に対して予防的に投与することもできる。
【0023】
式(I)の化合物またはその塩の抗トリパノーマ剤またはトリパノソーマ症治療薬中の含有量は、製剤全体の約0.01ないし約100重量%である。
式(I)の化合物またはその塩の投与量は、投与対象、対象臓器、症状、投与方法などにより異なり特に制限されないが、一般的に、患者(体重60kgとして)に対して、一日につき約0.1〜5g、好ましくは約0.1〜1g、より好ましくは約0.1〜0.5gである。
【0024】
薬理学的に許容される担体としては、例えば固形製剤における賦形剤、滑沢剤、結合剤及び崩壊剤、あるいは液状製剤における溶剤、溶解補助剤、懸濁化剤、等張化剤、緩衝剤及び無痛化剤等が挙げられる。更に必要に応じ、通常の防腐剤、抗酸化剤、着色剤、甘味剤、吸着剤、湿潤剤等の添加物を適宜、適量用いることもできる。賦形剤としては、例えば乳糖、白糖、D−マンニトール、デンプン、コーンスターチ、結晶セルロース、軽質無水ケイ酸等が挙げられる。滑沢剤としては、例えばステアリン酸マグネシウム、ステアリン酸カルシウム、タルク、コロイドシリカ等が挙げられる。結合剤としては、例えば結晶セルロース、白糖、D−マンニトール、デキストリン、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ポリビニルピロリドン、デンプン、ショ糖、ゼラチン、メチルセルロース、カルボキシメチルセルロースナトリウム等が挙げられる。崩壊剤としては、例えばデンプン、カルボキシメチルセルロース、カルボキシメチルセルロースカルシウム、カルボキシメチルスターチナトリウム、L−ヒドロキシプロピルセルロース等が挙げられる。溶剤としては、例えば注射用水、アルコール、プロピレングリコール、マクロゴール、ゴマ油、トウモロコシ油、オリーブ油等が挙げられる。溶解補助剤としては、例えばポリエチレングリコール、プロピレングリコール、D−マンニトール、安息香酸ベンジル、エタノール、トリスアミノメタン、コレステロール、トリエタノールアミン、炭酸ナトリウム、クエン酸ナトリウム等が挙げられる。懸濁化剤としては、例えばステアリルトリエタノールアミン、ラウリル硫酸ナトリウム、ラウリルアミノプロピオン酸、レシチン、塩化ベンザルコニウム、塩化ベンゼトニウム、モノステアリン酸グリセリン、等の界面活性剤;例えばポリビニルアルコール、ポリビニルピロリドン、カルボキシメチルセルロースナトリウム、メチルセルロース、ヒドロキシメチルセルロース、ヒドロキシエチルセルロース、ヒドロキシプロピルセルロース等の親水性高分子等が挙げられる。等張化剤としては、例えばブドウ糖、 D−ソルビトール、塩化ナトリウム、グリセリン、D−マンニトール等が挙げられる。緩衝剤としては、例えばリン酸塩、酢酸塩、炭酸塩、クエン酸塩等の緩衝液等が挙げられる。無痛化剤としては、例えばベンジルアルコール等が挙げられる。防腐剤としては、例えばパラヒドロキシ安息香酸エステル類、クロロブタノール、ベンジルアルコール、フェネチルアルコール、デヒドロ酢酸、ソルビン酸等が挙げられる。抗酸化剤としては、例えば亜硫酸塩、アスコルビン酸、α−トコフェロール等が挙げられる。
なお、本発明の抗トリパノソーマ剤はその他の薬剤と併用してもよい。
【実施例】
【0025】
以下に実施例を示し、本発明をさらに具体的に説明する。もっとも、本発明は下記実施例に限定されるものではない。
【0026】
(1)ヒト由来線維肉腫細胞HT1080のin vitro培養系におけるT. cruziの感染率と増殖に対する各種DIF関連化合物の効果
下記に示す方法で、T. cruziとHT1080細胞をEtOH (Control)、または10μMのDIF関連化合物存在下で3日間in vitro培養し、T. cruziの感染率(Infection rate)と増殖(原虫の数/ホスト細胞: Amastigotes/cell)を調べた。
【0027】
HT1080細胞(1x104cells)
↓
円形カバーガラスを入れた24穴プレートに播く
↓
37℃、5%CO2存在下で2日間培養する
↓
T. cruzi (1x106cells)を感染させる(図3の実験においてのみ、3×104 cells)
↓
DIF-1、DIF-3またはDIF-3誘導体を10μM添加する
↓
3日間培養する
↓
Diff-Quik(Sysmex社)で染色後、カバーガラスを取り出し封入する
光学顕微鏡下で感染率、細胞1個当たりの原虫数を測定する
【0028】
その結果、まず、DIF-1とDIF-3では、DIF-3の方が強力な抗トリパノソーマ活性を有することが判明した(図3)。DMPHも抗トリパノソーマ活性を有していたが、IC50値を比較検討した結果、DIF-3の活性の方が高かったため、以後、DIF-3の誘導体について詳細な検討を行った。
【0029】
次に、DIF-3のClを別のハロゲン(BrやI)に置き換えた誘導体Br-DIF-3とI-DIF-3の検討を行った結果、DIF-3がもっとも強力な抗トリパノソーマ活性を有することが明らかとなった(図4)。
【0030】
アシル基を改変したDIF-3誘導体について検討した結果、DIF-3(+1)とDIF-3(+2)が強力な抗トリパノソーマ活性を有することが明らかとなった(図5)。
【0031】
また、メトキシ基を改変したDIF-3誘導体につて検討した結果、TH-DIF-3を除くすべての誘導体Et-DIF-3, Bu-DIF-3, CP-DIF-3, Ph-DIF-3が強力な抗トリパノソーマ活性を有することが明らかとなった(図6)。
【0032】
以上の検討結果から、抗トリパノソーマ活性の強いDIF誘導体について、様々な濃度での抗トリパノソーマ活性を検討し、感染阻害と増殖阻害のIC50値を算定し、表1にまとめた。
【0033】
【表1】

【0034】
(2)ホスト細胞に対するDIF誘導体の毒性の検討。
さらに、下記の方法により、ホストHT1080細胞の増殖と細胞死(細胞毒性:LDHの放出を検出)に対するDIF誘導体のIC50とLD50をそれぞれ算定した。
【0035】
HT1080細胞に対する細胞毒性試験
[方法]
HT1080細胞(1x104ceIIs/weII)
↓
37℃、5%CO2、1日間培養
↓
DIF-3およぴ誘導体を添加
↓
37℃、5%CO2、1日間培養
↓
CytoTox-ONE(Promega社)を用いてLDH(乳酸デヒドロゲナーゼ)を測定
↓
Cytotoxicity(%)を算出
【0036】
その結果、表2に示すように、これらDIF-3及びその誘導体の抗トリパノソーマ活性を発揮する濃度は、ホスト細胞に対する毒性を発揮する濃度よりも数十倍低いことが明らかとなった。これらの結果は、DIF-3及びその誘導体の副作用の少なさを示唆している。
【0037】
【表2】

【0038】
(3)in vivoにおけるDIF-3及びその誘導体の抗トリパノソーマ活性の検討
次に、DIF-3とBu-DIF-3について、マウスを用いたin vivoでの抗トリパノソーマ活性の検討を行った(図7)。マウスにT. cruziを感染させ、0.1 mLの0.5%メチルセルロース溶液(Control)、あるいは0.1 mLの0.5%メチルセルロース溶液に懸濁したDIF-3あるいはBu-DIF-3を、50 mg/kgとなるよう、マウス(それぞれ4匹ずつ:n = 4)の腹腔内に投与し、14日後のマウス血中のT. cruziの数を調べた(図7A)。
【0039】
投与14日後のマウス血液中の原虫濃度をプロットした結果、図7B に示すように、DIF-3とBu-DIF-3は、in vivoにおいても抗トリパノソーマ活性を有することが明らかとなった。さらに、これらDIF-3誘導体をリード化合物として、新規な抗トリパノソーマ剤、トリパノソーマ症治療薬を開発できることが示唆された。
【産業上の利用可能性】
【0040】
本発明は医療等の分野で有用である。
【技術分野】
【0001】
本発明は、抗トリパノソーマ剤およびそれを含むトリパノソーマ症治療薬に関する。
【背景技術】
【0002】
トリパノソーマ(Trypanosoma)はトリパノソーマ科に属する原生生物で、幅広い宿主(ヒトや家畜、他)に感染し、さまざまな病気(総称してトリパノソーマ症)を引き起こす寄生虫である。ヒトなどの脊椎動物に感染するトリパノソーマは、アフリカ睡眠病や南米シャーガス病を引き起こし、年間何万人もの犠牲者を出している。
南米シャーガス病はアメリカトリパノソーマTrypanosoma cruzi(T. cruzi)の感染により起こる疾患で、中南米で800万人以上が感染し、同地域の死因としてはマラリアを上回っている。T. cruziはサシガメとよばれる媒介昆虫の刺咬により感染し、鞭毛をもった血流型虫体(trypomastigote)が心筋や神経細胞に侵入し、細胞内型虫体(amastigote)に形態変化する(図1)。細胞内で分裂・増殖した後、再び血流型に変換し、宿主細胞を破壊して新たな細胞に侵入する。急性期では発熱などの症状がみられるが、成人では大多数が慢性期へと移行し、十数年という長い歳月の後に突然の心臓発作で亡くなる場合がある。また巨大食道、巨大結腸などの症状を引き起こす。
これまでに、いくつかのトリパノソーマ症治療薬が開発されているが、早期治療が大前提となるうえ、副作用の問題や耐性虫の出現も含め、未だ有効な治療薬・治療法は確立されていない。
【0003】
細胞性粘菌Dictyostelium discoideum(以後、粘菌)は、森の落ち葉の下などに生息する下等真核生物で、カビに良く似た子実体(胞子と柄から成る)を形成する。しかし、粘菌とカビ(真菌)類は、進化的にかけ離れた生物群であり、本発明者らは、真菌類と同様に「粘菌類=薬剤資源(抗生物質などの薬剤の宝庫)」と考え研究を進めており、実際に、いくつかの薬剤候補物質を報告してきた。
一方、粘菌の生活史(図2)は非常に単純で扱いが簡単なことから、粘菌は「発生生物学・細胞生物学のモデル生物」として、各種細胞機能の研究が進められている。胞子から発芽した粘菌細胞は、単細胞アメーバとして周囲のバクテリアをエサとして増殖する。エサが無くなると、それがシグナルとなって、細胞は集合し多細胞体(10万個ほどの細胞から成る)を形成し、最終的に子実体を形成する。図2中の低分子化合物は、粘菌の発生、分化を制御している生理活性因子の一部である。
【0004】
中でも、Differentiation-inducing factor-1 (DIF-1)は、粘菌の柄細胞分化誘導因子として単離、同定された低分子化合物である(非特許文献1、2)。同時に単離されたDIF-3は分化誘導活性が低く、DIF-1の分解産物であることがわかっている (非特許文献3、4、5)。
【化1】

【0005】
前述のように、DIF-1とDIF-3はもともと粘菌自身の柄細胞分化を誘導する粘菌の分化誘
導因子、そしてその分解産物として単離された化合物であるが、本発明者らはDIF-1、DIF-3およびそれらの誘導体(以下、これらをまとめてDIF関連化合物をいうことがある)が哺乳類細胞において、腫瘍細胞増殖阻害効果、糖代謝促進効果、インターロイキン-2産生制御効果等を有することを発見した(特許文献1,2、3)。
これらの成果より、DIF関連化合物が様々な薬理活性を有することが期待されるが、トリパノソーマ原虫に対する効果は検討されていなかった。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2006−340615号公報
【特許文献2】特開2006−290810号公報
【特許文献3】国際出願PCT/JP2010/057763号
【非特許文献】
【0007】
【非特許文献1】Morris et al. (1987) Nature 328: 811-814.
【非特許文献2】Morris et al. (1988) Biochem. J. 249: 903-906.
【非特許文献3】Masento et al. (1988) Biochem. J. 256: 23-28.
【非特許文献4】Wurster & Kay (1990) Dev. Biol. 140: 189-195.
【非特許文献5】Kay et al. (1999) Semin. Cell Dev. Biol. 10: 577-585.
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明は、新規な抗トリパノソーマ剤を提供することを課題とする。
【課題を解決するための手段】
【0009】
本発明者は上記課題を解決すべく、in vitro培養系におけるホスト細胞に対するトリパノソーマT. cruziの感染率、並びにホスト細胞内でのT. cruziの増殖に対する各種DIF関連化合物の作用を検討し、DIF-3及びその誘導体がT. cruziの感染と増殖を強く阻害することを見出した。
【0010】
さらに、ホスト細胞の増殖に対するDIF-3及びその誘導体の阻害効果と、ホスト細胞に対するDIF-3及びその誘導体の毒性を検討し、DIF-3及びその誘導体のホスト細胞に対する毒性は比較的小さいことを見出した。このことから、これらの化合物が抗トリパノソーマ剤として有用であることを見出し、本発明を完成するに至った。
【0011】
すなわち、本発明は下記式(I)で表される化合物またはその薬学的に許容される塩を有効成分とする抗トリパノソーマ剤に関する。
本発明はまた、前記抗トリパノソーマ剤を含む南米シャーガス病やアフリカ睡眠病の治療薬に関する。
【発明の効果】
【0012】
式(I)で表される化合物は、トリパノソーマのホストへの感染やホスト細胞内での増殖を阻害する薬剤として好適に用いることができる。また、トリパノソーマに起因する南米シャーガス病やアフリカ睡眠病などのトリパノソーマ症の治療薬としても好適に用いることができる。
【図面の簡単な説明】
【0013】
【図1】T. cruziの生活環を示す図。
【図2】粘菌の生活史を示す図。
【図3】A. DIF-1とDIF-3とDMPHの化学構造式。B.トリパノソーマの感染率と増殖に対するDIF-1とDIF-3とDMPHの効果を示す図。グラフの値は3回の実験の平均値と標準偏差。*はp<0.05 versus Control (by t-test)で有意差があることを示す。
【図4】A. Br-DIF-3とI-DIF-3の化学構造式。B.トリパノソーマの感染率と増殖に対するDIF誘導体の効果を示す図。グラフの値は3回の実験の平均値と標準偏差。*はp<0.05、**はp<0.01 versus Control (by t-test)で有意差があることを示す。
【図5】A.アルキル側鎖を改変したDIF誘導体の化学構造式。B.トリパノソーマの感染率と増殖に対するDIF誘導体の効果を示す図。グラフの値は3回の実験の平均値と標準偏差。*はp<0.05、**はp<0.01 versus Control (by t-test)で有意差があることを示す。
【図6】A.メトキシ基を改変したDIF誘導体の化学構造式。B.トリパノソーマの感染率と増殖に対するDIF誘導体の効果を示す図。グラフの値は3回の実験の平均値と標準偏差。*はp<0.05、**はp<0.01 versus Control (by t-test)で有意差があることを示す。
【図7】A. in vivoでのDIF-3とBu-DIF-3の抗トリパノソーマ活性を検討するスキーム。B. in vivoにおけるDIF-3とBu-DIF-3の抗トリパノソーマ活性のグラフ。グラフ中のバーは、それぞれのグループの平均値。
【発明を実施するための形態】
【0014】
以下に本発明を詳しく説明する。
本発明の抗トリパノソーマ剤は、式(I)で表される化合物またはその薬学的に許容される塩を有効成分とする。
【化2】

式中、R1は炭素数1〜10のアルキルまたはフェニルを示し、好ましくは炭素数1〜5のアルキル(鎖状でも環状でもよい)またはフェニルを示す。
R2は炭素数5〜10の鎖状アルキルを示し、好ましくは炭素数5〜7の鎖状アルキルを示す。
Xはハロゲン(Cl、Br、Iなど)あるいは水素を示す。
【0015】
本発明において「抗トリパノソーマ剤」とは、トリパノソーマ原虫数を減少させる薬剤、トリパノソーマ原虫数の増加(増殖)を抑制する薬剤、トリパノソーマ原虫を不活性化させる薬剤等が含まれる。本発明において「トリパノソーマ原虫を不活性化させる」とは、トリパノソーマ原虫が再生する能力を減少、抑制させることを含み、不活性化させる手段としては例えば殺すことが挙げられる。
【0016】
本発明の「抗トリパノソーマ剤」はトリパノソーマ症の治療薬として使用することができる。トリパノソーマ症とは、トリパノソーマ原虫による感染症であればよく、例えば、アフリカ睡眠病および南米シャーガス病が挙げられる。トリパノソーマ症の原因となるトリパノソーマ原虫としては、例えば、Trypanosoma cruzi、Trypanosoma brucei brucei、Trypanosoma brucei rhodensiense、Trypanosoma brucei gambiense、Trypanosoma evavsi、Trypanosoma hippicum等が挙げられる。
【0017】
式(I)の化合物では、抗トリパノソーマ剤としては、下記の化合物が好ましい。
【化3】

【0018】
上記式(I)の化合物はBiochem. Pharmacol. 2005, 70, 676-685.に記載された方法によって合成することができる。
【0019】
式(I)の化合物またはその薬学的に許容される塩は、トリパノソーマの感染や増殖を阻害する効果を有する。したがって、抗トリパノソーマ剤、アフリカ睡眠病や南米シャーガス病等のトリパノソーマ症の治療薬の有効成分として用いることができる。なお、本発明において、トリパノソーマ症治療薬とは、トリパノソーマ症の症状を根治する医薬のみならず、症状を改善する医薬や症状が出るのを防ぐ医薬も含む。
【0020】
式(I)の化合物の薬学的に許容される塩としては、ナトリウム、カリウム、マグネシウム、カルシウム等の金属塩、アンモニウム塩などが挙げられる。なお、式(I)の化合物は水和物であってもよい。
【0021】
式(I)の化合物またはその薬学的に許容される塩を含有してなる医薬は、医薬製剤の製造法で一般的に用いられている公知の手段に従って、該化合物またはその薬学的に許容される塩を、そのまま、あるいは薬理学的に許容される担体と混合して、例えば、錠剤(糖衣錠、フィルムコーティング錠を含む)、散剤、顆粒剤、カプセル剤、(ソフトカプセルを含む)、液剤、注射剤、坐剤、徐放剤等の医薬製剤として、経口的または非経口的(例、局所、直腸、静脈投与等)に安全に投与することができる。
【0022】
本発明の抗トリパノソーマ症治療薬を投与する対象は、トリパノソーマ原虫に感染した動物あるいはトリパノソーマ症を発症している動物である。そのような動物には、例えば、ヒトだけでなく、家畜、家禽、実験動物、ペット(愛玩動物)等の非ヒト動物も含まれる。例えば本発明の非ヒト動物としては、ウシ、ウマ、ブタ、ヤギ、ヒツジ等の家畜、ニワトリ、アヒル、ガチョウ、シチメンチョウ、ウズラ等の家禽、マウス、ラット、モルモット、イヌ、サル、魚類等の実験動物、イヌ、ネコ、トリ等のペットを挙げることができる。投与対象は、上述のようにトリパノソーマ原虫に感染した、あるいはトリパノソーマ症を発症した動物以外にも、トリパノソーマ原虫に感染する可能性のある動物に対して予防的に投与することもできる。
【0023】
式(I)の化合物またはその塩の抗トリパノーマ剤またはトリパノソーマ症治療薬中の含有量は、製剤全体の約0.01ないし約100重量%である。
式(I)の化合物またはその塩の投与量は、投与対象、対象臓器、症状、投与方法などにより異なり特に制限されないが、一般的に、患者(体重60kgとして)に対して、一日につき約0.1〜5g、好ましくは約0.1〜1g、より好ましくは約0.1〜0.5gである。
【0024】
薬理学的に許容される担体としては、例えば固形製剤における賦形剤、滑沢剤、結合剤及び崩壊剤、あるいは液状製剤における溶剤、溶解補助剤、懸濁化剤、等張化剤、緩衝剤及び無痛化剤等が挙げられる。更に必要に応じ、通常の防腐剤、抗酸化剤、着色剤、甘味剤、吸着剤、湿潤剤等の添加物を適宜、適量用いることもできる。賦形剤としては、例えば乳糖、白糖、D−マンニトール、デンプン、コーンスターチ、結晶セルロース、軽質無水ケイ酸等が挙げられる。滑沢剤としては、例えばステアリン酸マグネシウム、ステアリン酸カルシウム、タルク、コロイドシリカ等が挙げられる。結合剤としては、例えば結晶セルロース、白糖、D−マンニトール、デキストリン、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ポリビニルピロリドン、デンプン、ショ糖、ゼラチン、メチルセルロース、カルボキシメチルセルロースナトリウム等が挙げられる。崩壊剤としては、例えばデンプン、カルボキシメチルセルロース、カルボキシメチルセルロースカルシウム、カルボキシメチルスターチナトリウム、L−ヒドロキシプロピルセルロース等が挙げられる。溶剤としては、例えば注射用水、アルコール、プロピレングリコール、マクロゴール、ゴマ油、トウモロコシ油、オリーブ油等が挙げられる。溶解補助剤としては、例えばポリエチレングリコール、プロピレングリコール、D−マンニトール、安息香酸ベンジル、エタノール、トリスアミノメタン、コレステロール、トリエタノールアミン、炭酸ナトリウム、クエン酸ナトリウム等が挙げられる。懸濁化剤としては、例えばステアリルトリエタノールアミン、ラウリル硫酸ナトリウム、ラウリルアミノプロピオン酸、レシチン、塩化ベンザルコニウム、塩化ベンゼトニウム、モノステアリン酸グリセリン、等の界面活性剤;例えばポリビニルアルコール、ポリビニルピロリドン、カルボキシメチルセルロースナトリウム、メチルセルロース、ヒドロキシメチルセルロース、ヒドロキシエチルセルロース、ヒドロキシプロピルセルロース等の親水性高分子等が挙げられる。等張化剤としては、例えばブドウ糖、 D−ソルビトール、塩化ナトリウム、グリセリン、D−マンニトール等が挙げられる。緩衝剤としては、例えばリン酸塩、酢酸塩、炭酸塩、クエン酸塩等の緩衝液等が挙げられる。無痛化剤としては、例えばベンジルアルコール等が挙げられる。防腐剤としては、例えばパラヒドロキシ安息香酸エステル類、クロロブタノール、ベンジルアルコール、フェネチルアルコール、デヒドロ酢酸、ソルビン酸等が挙げられる。抗酸化剤としては、例えば亜硫酸塩、アスコルビン酸、α−トコフェロール等が挙げられる。
なお、本発明の抗トリパノソーマ剤はその他の薬剤と併用してもよい。
【実施例】
【0025】
以下に実施例を示し、本発明をさらに具体的に説明する。もっとも、本発明は下記実施例に限定されるものではない。
【0026】
(1)ヒト由来線維肉腫細胞HT1080のin vitro培養系におけるT. cruziの感染率と増殖に対する各種DIF関連化合物の効果
下記に示す方法で、T. cruziとHT1080細胞をEtOH (Control)、または10μMのDIF関連化合物存在下で3日間in vitro培養し、T. cruziの感染率(Infection rate)と増殖(原虫の数/ホスト細胞: Amastigotes/cell)を調べた。
【0027】
HT1080細胞(1x104cells)
↓
円形カバーガラスを入れた24穴プレートに播く
↓
37℃、5%CO2存在下で2日間培養する
↓
T. cruzi (1x106cells)を感染させる(図3の実験においてのみ、3×104 cells)
↓
DIF-1、DIF-3またはDIF-3誘導体を10μM添加する
↓
3日間培養する
↓
Diff-Quik(Sysmex社)で染色後、カバーガラスを取り出し封入する
光学顕微鏡下で感染率、細胞1個当たりの原虫数を測定する
【0028】
その結果、まず、DIF-1とDIF-3では、DIF-3の方が強力な抗トリパノソーマ活性を有することが判明した(図3)。DMPHも抗トリパノソーマ活性を有していたが、IC50値を比較検討した結果、DIF-3の活性の方が高かったため、以後、DIF-3の誘導体について詳細な検討を行った。
【0029】
次に、DIF-3のClを別のハロゲン(BrやI)に置き換えた誘導体Br-DIF-3とI-DIF-3の検討を行った結果、DIF-3がもっとも強力な抗トリパノソーマ活性を有することが明らかとなった(図4)。
【0030】
アシル基を改変したDIF-3誘導体について検討した結果、DIF-3(+1)とDIF-3(+2)が強力な抗トリパノソーマ活性を有することが明らかとなった(図5)。
【0031】
また、メトキシ基を改変したDIF-3誘導体につて検討した結果、TH-DIF-3を除くすべての誘導体Et-DIF-3, Bu-DIF-3, CP-DIF-3, Ph-DIF-3が強力な抗トリパノソーマ活性を有することが明らかとなった(図6)。
【0032】
以上の検討結果から、抗トリパノソーマ活性の強いDIF誘導体について、様々な濃度での抗トリパノソーマ活性を検討し、感染阻害と増殖阻害のIC50値を算定し、表1にまとめた。
【0033】
【表1】

【0034】
(2)ホスト細胞に対するDIF誘導体の毒性の検討。
さらに、下記の方法により、ホストHT1080細胞の増殖と細胞死(細胞毒性:LDHの放出を検出)に対するDIF誘導体のIC50とLD50をそれぞれ算定した。
【0035】
HT1080細胞に対する細胞毒性試験
[方法]
HT1080細胞(1x104ceIIs/weII)
↓
37℃、5%CO2、1日間培養
↓
DIF-3およぴ誘導体を添加
↓
37℃、5%CO2、1日間培養
↓
CytoTox-ONE(Promega社)を用いてLDH(乳酸デヒドロゲナーゼ)を測定
↓
Cytotoxicity(%)を算出
【0036】
その結果、表2に示すように、これらDIF-3及びその誘導体の抗トリパノソーマ活性を発揮する濃度は、ホスト細胞に対する毒性を発揮する濃度よりも数十倍低いことが明らかとなった。これらの結果は、DIF-3及びその誘導体の副作用の少なさを示唆している。
【0037】
【表2】

【0038】
(3)in vivoにおけるDIF-3及びその誘導体の抗トリパノソーマ活性の検討
次に、DIF-3とBu-DIF-3について、マウスを用いたin vivoでの抗トリパノソーマ活性の検討を行った(図7)。マウスにT. cruziを感染させ、0.1 mLの0.5%メチルセルロース溶液(Control)、あるいは0.1 mLの0.5%メチルセルロース溶液に懸濁したDIF-3あるいはBu-DIF-3を、50 mg/kgとなるよう、マウス(それぞれ4匹ずつ:n = 4)の腹腔内に投与し、14日後のマウス血中のT. cruziの数を調べた(図7A)。
【0039】
投与14日後のマウス血液中の原虫濃度をプロットした結果、図7B に示すように、DIF-3とBu-DIF-3は、in vivoにおいても抗トリパノソーマ活性を有することが明らかとなった。さらに、これらDIF-3誘導体をリード化合物として、新規な抗トリパノソーマ剤、トリパノソーマ症治療薬を開発できることが示唆された。
【産業上の利用可能性】
【0040】
本発明は医療等の分野で有用である。
【特許請求の範囲】
【請求項1】
下記式(I)で表される化合物またはその薬学的に許容される塩を有効成分とする抗トリパノソーマ剤。
【化1】

式中、R1は炭素数1〜10のアルキルまたはフェニルを示し、R2は炭素数5〜10の鎖状アルキルを示し、Xはハロゲンあるいは水素を示す。
【請求項2】
化合物が下記のいずれかの化合物またはその塩である、請求項1に記載の抗トリパノソーマ剤。
【化2】

【請求項3】
請求項1または2に記載の抗トリパノソーマ剤を含むトリパノソーマ症治療薬。
【請求項4】
トリパノソーマ症が南米シャーガス病またはアフリカ睡眠病である、請求項3に記載のトリパノソーマ症治療薬。
【請求項1】
下記式(I)で表される化合物またはその薬学的に許容される塩を有効成分とする抗トリパノソーマ剤。
【化1】

式中、R1は炭素数1〜10のアルキルまたはフェニルを示し、R2は炭素数5〜10の鎖状アルキルを示し、Xはハロゲンあるいは水素を示す。
【請求項2】
化合物が下記のいずれかの化合物またはその塩である、請求項1に記載の抗トリパノソーマ剤。
【化2】

【請求項3】
請求項1または2に記載の抗トリパノソーマ剤を含むトリパノソーマ症治療薬。
【請求項4】
トリパノソーマ症が南米シャーガス病またはアフリカ睡眠病である、請求項3に記載のトリパノソーマ症治療薬。
【図3】


【図4】


【図5】


【図6】


【図7】


【図1】


【図2】




【図4】


【図5】


【図6】


【図7】


【図1】


【図2】


【公開番号】特開2012−25671(P2012−25671A)
【公開日】平成24年2月9日(2012.2.9)
【国際特許分類】
【出願番号】特願2010−163039(P2010−163039)
【出願日】平成22年7月20日(2010.7.20)
【出願人】(504145364)国立大学法人群馬大学 (352)
【Fターム(参考)】
【公開日】平成24年2月9日(2012.2.9)
【国際特許分類】
【出願日】平成22年7月20日(2010.7.20)
【出願人】(504145364)国立大学法人群馬大学 (352)
【Fターム(参考)】
[ Back to top ]

