抗NOTCH−1抗体
本発明は、Notch1と特異的に結合するモノクローナル抗体を対象とする。一実施形態では、この抗体は、少なくとも第1のエピトープおよび第2のエピトープと結合し、第1のエピトープはNotch1負の調節領域(NRR)のLinAドメイン内にあり、第2のエピトープはNotch1NRRのHD−Cドメイン内にある。


【発明の詳細な説明】
【技術分野】
【0001】
本出願は、その開示が全体で本明細書中に参照により組み込まれる、2009年6月18日に出願の米国仮特許出願第61/218,193号の優先権を主張するものである。
【0002】
本発明は、Notch−1の活性と拮抗する抗体、そのような抗体を生成する方法、そのような抗体をアッセイする方法、および癌の処置においてそのような抗体を使用する方法に関する。
【背景技術】
【0003】
Notchタンパク質は膜貫通受容体タンパク質である。哺乳動物ではそのようなnotch受容体が4つ存在する。受容体成熟中、哺乳動物notch受容体の細胞外ドメインはフューリン様(furin-like)プロテアーゼによってS1部位で切断されて、ヘテロ二量体化(HD)ドメインによって一緒に保たれる細胞外サブユニットおよび膜貫通サブユニットが得られる。細胞外サブユニットと会合しているHDドメインの部分はHD−Nと呼ばれ、HDの他の部分である膜貫通サブユニットの細胞外部分は、HD−Cと呼ばれる。細胞外サブユニットは、1つの大きな表皮成長因子(EGF)様反復領域および3つのLin12反復を含有する。EGF反復領域のリガンド結合は、HD−Cドメイン内のS2部位でのADAM型メタロプロテアーゼによるタンパク質分解による切断を誘導し、これは、続く部位S3でのγ−セクレターゼによる切断を誘発し、notchの細胞内部分を膜から放出させて、これが核内に移行して遺伝子転写を調節することを可能にする。(Gordon,W.R.ら、Nature Structural&Molecular Biology、2007、第14巻、295〜300)。
【0004】
リガンドに誘導される活性化の前、notchは、3つのLin12反復およびHDドメインからなる保存的な負の調節領域(NRR)によって休止メタロプロテアーゼ耐性コンフォメーションに維持されている。(Vardarら、Biochemistry、2003、41:7061〜7067、Sanchez−Irizarryら、Mol.Cell.Biol.、2004、24:9265〜9273、Gordon,W.R.ら、Nature Structural&Molecular Biology、2007、第14巻、295〜300)。また、notchタンパク質のNRRは、S1部位でのタンパク質分解的切断後にLin12反復およびN末端のHDドメイン(HD−N)のみからなると定義される場合もある。(Weng,A.P.ら、Science、2004、9265〜9273。)NRRドメインは、notch経路のリガンド非依存性タンパク質分解を防止する。
【0005】
Notch経路は、ハエおよび脊椎動物における神経発生に影響を与えるものを含めた、多様な発生的および生理的なプロセス中に機能する。一般に、notchシグナル伝達は、側方抑制、系統決定、および細胞群間の境界の確立に関与している。(Bray,S.J.、Nature Reviews、2006、678〜688)。
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかし、notch活性は、癌を含めた様々なヒト疾患にも関連している。たとえば、notch1の突然変異は、50%を超えるT細胞急性リンパ芽球性白血病で検出された。(Radtke,F、Nature Review,Cancer、2003、756〜767)。癌の処置に使用するための、notch−1シグナル伝達経路を調節する治療剤の同定が必要である。
【課題を解決するための手段】
【0007】
一実施形態では、本発明は、Notch−1と結合する単離された抗体またはその抗原結合部分であって、少なくとも第1のエピトープおよび第2のエピトープと結合し、第1のエピトープがNotch−1のLin−Aドメイン内にあり、第2のエピトープがNotch−1のHD−Cドメイン内にある、抗体または抗原結合部分を提供する。好ましくは、Notch−1はヒトNotch−1である。
【0008】
本実施形態の一態様では、第1のエピトープが主要エピトープである。好ましくは、第1のエピトープのアミノ酸残基のうちのいずれかの非保存的置換は、ヒトNotch1に対する抗体または抗原結合部分の結合親和性の、60%を超える、より好ましくは80%を超える、さらにより好ましくは90%を超える損失をもたらす。
【0009】
別の態様では、第2のエピトープが主要エピトープである。好ましくは、第2のエピトープのアミノ酸残基のうちのいずれかの非保存的置換は、ヒトNotch−1に対する抗体または抗原結合部分の結合親和性の、60%を超える、より好ましくは80%を超える、さらにより好ましくは90%を超える損失をもたらす。
【0010】
別の態様では、第1のエピトープおよび第2のエピトープの両方が主要エピトープである。好ましくは、第1のエピトープおよび第2のエピトープのアミノ酸残基のうちのいずれかの非保存的置換は、ヒトNotch−1に対する抗体または抗原結合部分の結合親和性の、60%を超える、より好ましくは80%を超える、さらにより好ましくは90%を超える損失をもたらす。
【0011】
本実施形態の別の態様では、Notch−1はヒトNotch−1である。本実施形態の別の態様では、Notch−1はマウスNotch−1である。
【0012】
本実施形態の別の態様では、抗体または抗原結合部分は、さらに1〜4個のエピトープと結合し、前記さらなるエピトープのそれぞれは、ヒトNotch−1のLin−AドメインまたはHD−Cドメインのいずれか内にある。
【0013】
本実施形態の別の態様では、抗体または抗原結合部分が結合する主要エピトープは第1のエピトープおよび第2のエピトープのみである。より詳細には、第1のエピトープは、ヒトNotch−1のLinAドメインの1463V、1465S、1466Lおよび1467Qから選択される1〜4個のアミノ酸残基を含む主要エピトープである。好ましくは、第1のエピトープは、ヒトNotch−1のLinAドメインの1463V、1465S、1466Lおよび1467Qから選択される4個のアミノ酸残基からなる主要エピトープである。また、より詳細には、第2のエピトープは、ヒトNotch−1のHD−Cドメインの1705G、1706A、1707L、1709Sおよび1710Lから選択される1〜5個のアミノ酸残基を含む主要エピトープである。好ましくは、第2のエピトープは、ヒトNotch−1のHD−Cドメインの1705G、1706A、1707L、1709Sおよび1710Lから選択される1〜5個のアミノ酸残基からなる主要エピトープである。さらにより詳細には、第1のエピトープまたは第2のエピトープのアミノ酸残基のうちのいずれかの非保存的置換は、ヒトNotch−1に対する抗体または抗原結合部分の結合親和性の、70%を超える、80%を超える、90%を超える、または95%を超える損失をもたらす。
【0014】
本実施形態の別の態様では、抗体または抗原結合部分は、ヒト化、ヒト、またはキメラである。好ましくは、抗体または抗原結合部分は、ヒト化抗体またはその抗原結合部分である。より好ましくは、抗体または抗原結合部分は、ヒト抗体またはその抗原結合部分である。
【0015】
本実施形態の別の態様では、抗体または抗原結合部分は、マウス抗体またはその抗原結合部分である。
【0016】
本実施形態の別の態様では、抗体または抗原結合部分は、1×10−5M以下のKDでヒトNotch−1と結合する。好ましくは、抗体または抗原結合部分は、1×10−6M以下、5×10−7M以下、2×10−7M以下、1×10−7M以下、5×10−8M以下、2×10−8M以下、または1×10−8M以下のKDでヒトNotch−1と結合する。
【0017】
別の実施形態では、本発明は、
(i)配列番号18に示すアミノ酸配列、または配列番号18の1〜4個の残基が改変されている、好ましくは3個の残基のみが改変されている、より好ましくは2個の残基のみが改変されている、さらにより好ましくは1個の残基のみが改変されている、その変異体を含む、重鎖可変領域CDR1、
(ii)配列番号19に示すアミノ酸配列、または配列番号19の1〜4個の残基が改変されている、好ましくは3個の残基のみが改変されている、より好ましくは2個の残基のみが改変されている、さらにより好ましくは1個の残基のみが改変されている、その変異体を含む、重鎖可変領域CDR2、および
(iii)配列番号20に示すアミノ酸配列、または配列番号20の1〜4個の残基が改変されている、好ましくは3個の残基のみが改変されている、より好ましくは2個の残基のみが改変されている、さらにより好ましくは1個の残基のみが改変されている、その変異体を有する、重鎖可変領域CDR3
を含む、ヒトNotch−1と特異的に結合する単離された抗体またはその抗原結合部分を提供する。
【0018】
本実施形態の一態様では、重鎖可変領域CDR1、CDR2およびCDR3の12個の可能なアミノ酸残基の改変(本実施形態中で上述のとおり)のうち、6個までの改変を除いて、改変のいずれかが、そのアミノ酸残基の保存的置換である。好ましくは、5個までの改変を除いて、重鎖可変領域CDR1、CDR2およびCDR3の前記改変のいずれかが、そのアミノ酸残基の保存的置換である。より好ましくは、4個までの改変を除いて、3個までの改変を除いて、2個までの改変を除いて、または1個の改変を除いて、重鎖可変領域CDR1、CDR2およびCDR3の前記改変のいずれかが、そのアミノ酸残基の保存的置換である。さらにより好ましくは、重鎖可変領域CDR1、CDR2およびCDR3のアミノ酸残基の改変のうちのいずれかが、そのアミノ酸残基の保存的置換である。
【0019】
本実施形態の別の態様では、重鎖可変領域CDR1、CDR2およびCDR3はいずれも改変されていない。
【0020】
別の実施形態では、本発明は、
(i)配列番号12に示すアミノ酸配列、または配列番号12の1〜4個の残基が改変されている、好ましくは3個の残基のみが改変されている、より好ましくは2個の残基のみが改変されている、さらにより好ましくは1個の残基のみが改変されている、その変異体を含む、軽鎖可変領域CDR1、
(ii)配列番号13に示すアミノ酸配列、または配列番号13の1〜4個の残基が改変されている、好ましくは3個の残基のみが改変されている、より好ましくは2個の残基のみが改変されている、さらにより好ましくは1個の残基のみが改変されている、その変異体を含む、軽鎖可変領域CDR2、および
(iii)配列番号14に示すアミノ酸配列、または配列番号14の1〜4個の残基が改変されている、好ましくは3個の残基のみが改変されている、より好ましくは2個の残基のみが改変されている、さらにより好ましくは1個の残基のみが改変されている、その変異体を含む、軽鎖可変領域CDR3
を含む、Notch−1と特異的に結合する単離された抗体またはその抗原結合部分を提供する。
【0021】
本実施形態の一態様では、軽鎖可変領域CDR1、CDR2およびCDR3の12個の可能なアミノ酸残基の改変(本実施形態中で上述)のうち、改変のうちの6個までを除いて、改変のうちのいずれかが、そのアミノ酸残基の保存的置換である。好ましくは、5個までの改変を除いて、軽鎖可変領域CDR1、CDR2およびCDR3の前記改変のいずれかが、そのアミノ酸残基の保存的置換である。より好ましくは、4個までの改変を除いて、3個までの改変を除いて、2個までの改変を除いて、または1個の改変を除いて、軽鎖可変領域CDR1、CDR2およびCDR3の前記改変のいずれかが、そのアミノ酸残基の保存的置換である。さらにより好ましくは、軽鎖可変領域CDR1、CDR2およびCDR3の前記改変のうちのいずれかが、そのアミノ酸残基の保存的置換である。
【0022】
本実施形態の別の態様では、軽鎖可変領域CDR1、CDR2およびCDR3はいずれも改変されていない。
【0023】
別の実施形態では、本発明は、
(i)配列番号18、または配列番号18の1〜4個の残基が改変されている、好ましくは3個の残基のみが改変されている、より好ましくは2個の残基のみが改変されている、さらにより好ましくは1個の残基のみが改変されているその変異体を含む、重鎖可変領域CDR1、
(ii)配列番号19、または配列番号19の1〜4個の残基が改変されている、好ましくは3個の残基のみが改変されている、より好ましくは2個の残基のみが改変されている、さらにより好ましくは1個の残基のみが改変されているその変異体を含む、重鎖可変領域CDR2、
(iii)配列番号20、または配列番号20の1〜4個の残基が改変されている、好ましくは3個の残基のみが改変されている、より好ましくは2個の残基のみが改変されている、さらにより好ましくは1個の残基のみが改変されているその変異体を含む、重鎖可変領域CDR3、
(iv)配列番号12、または配列番号12の1〜4個の残基が改変されている、好ましくは3個の残基のみが改変されている、より好ましくは2個の残基のみが改変されている、さらにより好ましくは1個の残基のみが改変されているその変異体を含む、軽鎖可変領域CDR1、
(v)配列番号13、または配列番号13の1〜4個の残基が改変されている、好ましくは3個の残基のみが改変されている、より好ましくは2個の残基のみが改変されている、さらにより好ましくは1個の残基のみが改変されているその変異体を含む、軽鎖可変領域CDR2、および
(vi)配列番号14、または配列番号14の1〜4個の残基が改変されている、好ましくは3個の残基のみが改変されている、より好ましくは2個の残基のみが改変されている、さらにより好ましくは1個の残基のみが改変されているその変異体を含む、軽鎖可変領域CDR3
を含む、Notch−1と特異的に結合する単離された抗体またはその抗原結合部分を提供する。
【0024】
本実施形態の一態様では、重鎖可変領域CDR1、CDR2およびCDR3ならびに軽鎖可変領域CDR1、CDR2およびCDR3の24個の可能なアミノ酸残基の改変(本実施形態中で上述)のうち、改変のうちの12個までを除いて、改変のうちのいずれかが、そのアミノ酸残基の保存的置換である。好ましくは、改変のうちの11個までを除いて、重鎖可変領域CDR1、CDR2およびCDR3ならびに軽鎖可変領域CDR1、CDR2およびCDR3の前記改変のうちのいずれかが、そのアミノ酸残基の保存的置換である。より好ましくは、10個までの改変を除いて、9個までの改変を除いて、8個までの改変を除いて、7個までの改変を除いて、6個までの改変を除いて、5個までの改変を除いて、4個までの改変を除いて、3個までの改変を除いて、2個までの改変を除いて、または1個の改変を除いて、重鎖可変領域CDR1、CDR2およびCDR3ならびに軽鎖可変領域CDR1、CDR2およびCDR3の前記改変のうちのいずれかが、そのアミノ酸残基の保存的置換である。さらにより好ましくは、重鎖可変領域CDR1、CDR2およびCDR3ならびに軽鎖可変領域CDR1、CDR2およびCDR3の前記改変のうちのいずれかが、そのアミノ酸残基の保存的置換である。
【0025】
本実施形態の別の態様では、軽鎖CDRおよび重鎖CDRはいずれも改変されていない。
【0026】
別の実施形態では、本発明は、ヒトNotch−1との結合について、
(a)配列番号6のアミノ酸配列を含む重鎖可変領域、および
(b)配列番号8のアミノ酸配列を含む軽鎖可変領域
を含む抗体と交差競合または競合する、単離されたモノクローナル抗体またはその抗原結合部分を提供する。
【0027】
別の実施形態では、本発明は、ヒトNotch−1との結合について、
(i)配列番号18を含む重鎖可変領域CDR1、
(ii)配列番号19を含む重鎖可変領域CDR2、
(iii)配列番号20を含む重鎖可変領域CDR3、
(iv)配列番号12を含む軽鎖可変領域CDR1、
(v)配列番号13を含む軽鎖可変領域CDR2、および
(vi)配列番号14を含む軽鎖可変領域CDR3
を含み、軽鎖CDRおよび重鎖CDRのそれぞれの1〜4個のアミノ残基が改変されていてもよい抗体と交差競合または競合する、単離されたモノクローナル抗体またはその抗原結合部分を提供する。好ましくは、軽鎖CDRおよび重鎖CDRの改変のうちのいずれかが、そのアミノ酸残基の保存的置換である。より好ましくは、軽鎖CDRおよび重鎖CDRはいずれも改変されていない。
【0028】
CDR領域の決定は、十分に当分野の技術範囲内にある。一部の実施形態では、CDRはKabatおよびChothia CDRの組合せであってもよいことが理解される(「組み合わせたCDR」または「拡張CDR」とも呼ばれる)。一部の実施形態では、CDRはKabat CDRである。他の実施形態では、CDRはChothia CDRである。言い換えれば、複数のCDRを用いる実施形態では、CDRは、Kabat、Chothia、組合せCDR、またはその組合せのうちのいずれかであり得る。
【0029】
実施形態の一態様では、抗体はヒト化抗体である。実施形態の別の態様では、抗体は完全ヒト抗体である。実施形態の別の態様では、抗体はキメラ抗体である。
【0030】
実施形態の別の態様では、抗体または抗原結合部分は、1×10−5M未満、好ましくは1×10−6M未満、好ましくは5×10−7M未満、好ましくは2×10−7M未満、好ましくは1×10−7M未満、またはさらにより好ましくは1×10−8M未満の平衡解離定数KDでヒトNotch−1と結合する。
【0031】
実施形態の別の態様では、抗体はマウス抗体である。本実施形態の別の態様では、抗体は、ヒト化、ヒト、またはキメラである。好ましくは、抗体はヒト化されている。より好ましくは、抗体は完全ヒト抗体である。
【0032】
本実施形態の別の態様では、抗体は、サブクラスIgG1、IgG2、IgG3またはIgG4のヒト完全長抗体である。本実施形態の別の態様では、抗体は、サブクラスIgG1、IgG2、IgG3またはIgG4のヒト化抗体である。さらに別の実施形態では、抗体は、サブクラスIgG1、IgG2、IgG3またはIgG4のキメラ抗体である。
【0033】
別の実施形態では、本発明は、本明細書中に開示する抗体または抗原結合部分のうちのいずれかを含む医薬組成物を提供する。
【0034】
別の実施形態では、本発明は、本明細書中に開示する抗体または抗原結合部分のうちのいずれかを組換えにより産生する細胞系を提供する。
【0035】
別の実施形態では、本発明は、本明細書中に開示する抗体または抗原結合部分のうちの任意のものの重鎖または軽鎖のいずれかをコードしているオリゴヌクレオチドを提供する。
【0036】
別の実施形態では、本発明は、対象に、治療上有効な量の本発明の抗体もしくは抗原結合部分、またはその医薬組成物を投与するステップを含む、癌を処置する方法を提供する。
【0037】
別の実施形態では、本発明は、癌の処置に使用するための、本明細書中に開示する抗体または抗原結合部分を提供する。
【0038】
別の実施形態では、本発明は、癌を処置する医薬品を調製するための、本明細書中に開示する抗体または抗原結合部分の使用を提供する。
【図面の簡単な説明】
【0039】
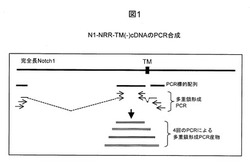
【図1】実施例1に記載する、ヒトNotch1免疫原プラスミドN1−NRR−TM(−)のcDNAのPCR合成を例示する図である。
【図2】やはり実施例1に記載する、別のヒトNotch1免疫原プラスミドN1−NRR−TM(+)のcDNAのPCR合成を例示する図である。
【図3】実施例3に示す、2つのモノクローナル抗体:mAb N248AおよびmAb−CのNotch−1依存性ルシフェラーゼレポーターアッセイの結果を例示する図である。
【図4】ルシフェラーゼレポーターアッセイにより、mAb N248AがJagged−1誘導性Notch1シグナル伝達を阻害することが示されることを例示する図である。Hela/Jagged1細胞およびN1dP−c16細胞をルシフェラーゼレポーターアッセイのために同時培養した。MIgGは対照マウス抗体である。Y軸の数値はルシフェラーゼレポーター活性の読取り値である。
【図5】ヒトNotch1とヒトNotch2との間のEGF、Lin−A、Lin−B、Lin−C、HD−NおよびHD−Cドメインの配列アラインメントを示す図である。
【図6A】HPB−ALL細胞においてNICD(Notch1細胞内ドメイン)のレベルがmAb N248Aによって低下されたことを例示する、ウエスタンブロット画像である。
【図6B】HPB−All細胞の成長がmAb N248Aによって阻害されることを例示する図である。
【図7】mAb N248AがそれぞれHes1mRNA(A)およびHes4mRNA(B)の発現を遮断することを例示する図である。
【図8】mAb N248AによるHPB−ALL異種移植腫瘍の成長阻害を例示する図である。腫瘍が150〜300mm3まで成長した後、図に示したようにマウスにmAbを投薬した。それぞれの群は、ランダム化された腫瘍の大きさを有する10匹のマウスを含有する。
【図9】マウスにおける5mg/kgの単一用量注射後の、血漿mAb N248A濃度の変化を例示する図である。それぞれのデータ点は3匹のマウスに基づいて計算した。T1/2は、マウス血清中でのN248Aの半減期である。
【図10】マウスにおける5mg/kgの単一用量注射後の、HBP−ALL異種移植腫瘍におけるNICDの阻害を例示する図である。対照抗体D16Aで処置した腫瘍のウエスタンブロットバンドを100%の強度として設定し、これは0%の阻害に等しい。
【発明を実施するための形態】
【0040】
本開示は、高い親和性でNotch−1と特異的に結合する、単離されたモノクローナル抗体、特にヒトモノクローナル抗体およびマウスモノクローナル抗体ならびにヒト/マウスのキメラ抗体に関する。本開示は、単離された抗体、そのような抗体を作製する方法、そのような抗体を含む免疫コンジュゲートおよび二重特異性分子、ならびに本開示の抗体、免疫コンジュゲート(immunconjugate)または二重特異性分子を含有する医薬組成物を提供する。また、本開示は、Notch−1の活性化を阻害するため、および異常細胞成長(たとえば癌)などのNotch−1の過剰活性化または過剰発現に関連する疾患を処置するため等の、抗体を使用する方法にも関する。したがって、本開示はまた、癌などの様々な種類の異常細胞成長を処置するための、抗Notch−1抗体またはその抗原結合部分を使用する方法も提供する。
【0041】
定義。
用語「Notch−1」または「Notch1」とは、互換性があるように使用され、ヒトNotch−1タンパク質の変異体、アイソフォームおよび種相同体が含まれる。たとえば、ネイティブヒトNotch−1タンパク質は、リーダーペプチド、大きな表皮成長因子(EGF)様反復領域、3つのLin12反復、N末端ヘテロ二量体化ドメイン(HD−N)、C末端ヘテロ二量体化ドメイン(HD−C)、膜貫通(TM)配列および細胞内ドメイン(NICD)から構成される。完全長ヒトNotch−1のNCBI/GenBank受託番号はNM_017617.2である。
【0042】
本明細書中で使用する用語「Notch−1負の調節領域」または「Notch−1NRR」とは、別段に示さない限りは、3つのLin12ドメイン、およびNotch−1の3つのLin12ドメインと膜貫通ドメインとの間に位置するアミノ酸配列または複数の配列からなる、Notch−1の任意のネイティブまたは合成のポリペプチド領域をいう。一実施形態では、「Notch−1NRR」には、3つのLin12ドメインならびに2つのヘテロ二量体化ドメインHD−NおよびHD−Cが含まれ、Notch−1のHD−NおよびHD−Cドメインは、共有結合しており、未だフューリン様プロテアーゼによって切断されていない(S1切断前)。別の実施形態では、「Notch−1NRR」には、3つのLin12ドメインならびに2つのヘテロ二量体化ドメインHD−NおよびHD−Cが含まれ、HD−NおよびHD−Cドメインは非共有的に結合している(S1切断後)。本実施形態の一態様では、HD−Cドメイン内のS2部位は、未だADAM型メタロプロテアーゼによって切断されていない。本実施形態の別の特定の態様では、HD−Cドメイン内のS2部位は、ADAM型メタロプロテアーゼによって切断されつつある、または既に切断されている。(Gordon,W.R.ら、Nature Structural&Molecular Biology、2007、第14巻、295〜300)。
【0043】
用語「免疫応答」とは、侵入病原体、病原体に感染した細胞もしくは組織、癌細胞、または、自己免疫性もしくは病理学的な炎症の場合は、正常なヒト細胞もしくは組織の、選択的な損傷、破壊、または人体からの排除をもたらす、たとえば、上記細胞または肝臓によって産生されるリンパ球、抗原提示細胞、食細胞、顆粒球、および可溶性巨大分子(抗体、サイトカイン、および補体が含まれる)の作用をいう。
【0044】
「シグナル伝達経路」とは、細胞の一部分から細胞の別の部分へのシグナルの伝達において役割を果たす様々なシグナル伝達分子間の生化学的な関係性をいう。本明細書中で使用する語句「細胞表面受容体」には、たとえば、シグナルを受信し、細胞の原形質膜を横切ってそのようなシグナルを伝達することができる、分子および分子の複合体が含まれる。本開示の「細胞表面受容体」の一例はNotch−1受容体である。
【0045】
本明細書中で言及する用語「抗体」には、抗体全体および任意の抗原結合断片(すなわち「抗原結合部分」)またはその単鎖が含まれる。「抗体」とは、ジスルフィド結合によって相互接続された少なくとも2本の重鎖(H)鎖および2本の軽鎖(L)鎖を含む糖タンパク質またはその抗原結合部分をいう。それぞれの重鎖は、重鎖可変領域(本明細書中でVHと略す)および重鎖定常領域からなる。重鎖定常領域は、3つのドメイン、CH1、CH2およびCH3からなる。それぞれの軽鎖は、軽鎖可変領域(本明細書中でVLと略す)および軽鎖定常領域からなる。軽鎖定常領域は、1つのドメイン、CLからなる。VHおよびVL領域は、フレームワーク領域(FR)と呼ばれるより保存的な領域が散在する、相補性決定領域(CDR)と呼ばれる超可変性の領域へとさらに細分することができる。CDR領域は、どちらも当業者に周知のKabatまたはChothiaの付番方式を用いて決定することができる。たとえば、Kabat,E.A.ら(1991)Sequences of Proteins of Immunological Interest、第5版、U.S.Department of Health and Human Services、NIH出版第91−3242号、ChothiaおよびLesk、J.Mol.Biol.、196:901〜917(1987)を参照されたい。それぞれのVHおよびVLは、3つのCDRおよび4つのFRから構成されており、アミノ末端からカルボキシ末端に、FR1、CDR1、FR2、CDR2、FR3、CDR3、FR4の順序で配置されている。重鎖および軽鎖の可変領域は、抗原と相互作用する結合ドメインを含有する。抗体の定常領域は、免疫グロブリンと、免疫系の様々な細胞(たとえばエフェクター細胞)および古典的補体系の第1構成成分(Clq)を含めた宿主の組織または因子との結合を媒介し得る。
【0046】
本明細書中で使用する用語、抗体の「抗原結合部分」(または単に「抗体部分」)とは、抗原(たとえばNotch−1)と特異的に結合する能力を保持している、抗体の1つまたは複数の断片をいう。抗体の抗原結合機能は、完全長抗体の断片によって行われることができることが示されている。抗体の用語「抗原結合部分」内に包含される結合断片の例には、(i)VL、VH、CLおよびCH1ドメインからなる一価断片であるFab断片、(ii)ヒンジ領域でジスルフィド橋によって連結された2つのFab断片を含む二価断片であるF(ab’)2断片、(iii)VHおよびCH1ドメインからなるFd断片、(iv)抗体の単一のアームのVLおよびVHドメインからなるFv断片、(v)VHドメインからなるdAb断片(Wardら、(1989)Nature、341:544〜546)、ならびに(vi)単離した相補性決定領域(CDR)が含まれる。さらに、Fv断片の2つのドメイン、VLおよびVHは別々の遺伝子によってコードされているが、これらは、組換え方法を用いて、これらが、VLおよびVH領域が対合した一価分子を形成する単一のタンパク質鎖として作製されることを可能にする合成リンカーによって、結合させることができる(単鎖Fv(scFv)として知られる、たとえば、Birdら(1988)Science、242:423〜426、およびHustonら(1988)Proc.Natl.Acad.Sci.USA、85:5879〜5883を参照)。そのような単鎖抗体も、用語、抗体の「抗原結合部分」内に包含されることを意図する。これらの抗体断片は、当業者に知られている従来の技術を含めた任意の適切な技法を用いて得られる場合があり、断片は、インタクトな抗体と同じように、有用性についてスクリーニングし得る。
【0047】
本明細書中で使用する「単離された抗体」とは、異なる抗原性特異性を有する他の抗体を実質的に含まない抗体をいうことを意図する(たとえば、Notch−1と特異的に結合する単離された抗体は、Notch−1以外の抗原と特異的に結合する抗体を実質的に含まない)。しかし、Notch−1と特異的に結合する単離された抗体は、他の種からのNotch−1分子などの他の抗原に対して交差反応性を有し得る。さらに、単離された抗体は、他の細胞物質および/または化学物質を実質的に含まない場合がある。
【0048】
本明細書中で使用する用語「モノクローナル抗体」または「モノクローナル抗体組成物」とは、単一分子組成の抗体分子の調製物をいう。モノクローナル抗体組成物は、特定のエピトープに対して単一の結合特異性および親和性を示す。
【0049】
用語「ヒト化抗体」とは、マウスなどの別の哺乳動物種の生殖系列に由来するCDR配列がヒトフレームワーク配列上に移植された抗体をいうことを意図する。さらなるフレームワーク領域の改変がヒトフレームワーク配列内でなされてもよい。
【0050】
用語「キメラ抗体」とは、可変領域配列がマウス抗体に由来し、定常領域配列がヒト抗体に由来する抗体などの、可変領域配列が1つの種に由来し、定常領域配列が別の種に由来する抗体をいうことを意図する。
【0051】
本明細書中で使用する用語「ヒト抗体」または「完全ヒト抗体」には、フレームワークおよびCDR領域がどちらもヒト生殖系列免疫グロブリン配列に由来する可変領域を有する抗体が含まれることを意図する。さらに、抗体が定常領域を含有する場合は、定常領域もヒト生殖系列免疫グロブリン配列に由来する。本開示のヒト抗体またはその抗原結合部分には、ヒト生殖系列免疫グロブリン配列によってコードされていないアミノ酸残基(たとえば、in vitroのランダムもしくは部位特異的突然変異誘発によって、またはin vivoの体細胞突然変異によって導入された突然変異)が含まれ得る。しかし、本明細書中で使用する用語「ヒト抗体」には、マウスなどの別の哺乳動物種の生殖系列に由来するCDR配列がヒトフレームワーク配列上に移植された抗体が含まれることを意図しない。
【0052】
用語「ヒトモノクローナル抗体」または「完全ヒトモノクローナル抗体」とは、フレームワークおよびCDR領域がどちらもヒト生殖系列免疫グロブリン配列に由来する可変領域を有する、単一の結合特異性を示す抗体をいう。一実施形態では、ヒトモノクローナル抗体は、不死化細胞と融合させた、ヒト重鎖導入遺伝子および軽鎖導入遺伝子を含むゲノムを有するトランスジェニック非ヒト動物、たとえばトランスジェニックマウスから得られたB細胞が含まれる、ハイブリドーマによって産生される。
【0053】
用語「ヒト抗体誘導体」とは、ヒト抗体の任意の改変された形態、たとえば、抗体と別の薬剤または抗体とのコンジュゲートをいう。
【0054】
本明細書中で使用する用語「組換えヒト抗体」には、(a)ヒト免疫グロブリン遺伝子についてトランスジェニック動物もしくは染色体導入動物(たとえばマウス)またはそれから調製したハイブリドーマ(以下に詳述)から単離された抗体、(b)たとえばトランスフェクトーマから、ヒト抗体を発現するように形質転換させた宿主細胞から単離された抗体、(c)組換えのコンビナトリアルヒト抗体ライブラリから単離された抗体、および(d)ヒト免疫グロブリン遺伝子配列の他のDNA配列へのスプライシングに関与する任意の他の手段によって調製、発現、作製または単離された抗体などの、組換え手段によって調製、発現、作製または単離したすべてのヒト抗体が含まれる。そのような組換えヒト抗体は、フレームワークおよびCDR領域がヒト生殖系列免疫グロブリン配列に由来する可変領域を有する。特定の実施形態では、しかし、そのような組換えヒト抗体は、in vitroの突然変異誘発(または、ヒトIg配列についてトランスジェニックな動物を使用する場合はin vivoの体細胞突然変異誘発)に供することができ、したがって、組換え抗体のVHおよびVL領域のアミノ酸配列は、ヒト生殖系列VHおよびVL配列に由来し、それに関連する配列である一方で、in vivoでヒト抗体生殖系列レパートリー内に天然に存在しないものである場合がある。
【0055】
抗体に関して本明細書中で使用する用語「競合する」とは、第1の抗体またはその抗原結合部分が、第2の抗体またはその抗原結合部分との結合について競合する場合をいい、第1の抗体とその同族エピトープとの結合は、第2の抗体の非存在下での第1の抗体の結合と比較して、第2の抗体の存在下において検出可能に減少している。第2の抗体とそのエピトープとの結合も第1の抗体の存在下で検出可能に減少しているという代替は、可能であるが、必ずしもそうでなくてもよい。すなわち、第1の抗体は、第2の抗体とそのエピトープとの結合を、その第2の抗体が第1の抗体とその各自のエピトープとの結合を阻害することなしに、阻害することができる。しかし、それぞれの抗体が、他の抗体とその同族エピトープまたはリガンドとの結合を、同じ、より高い、またはより低い度合であるかに関わらず検出可能に阻害する場合は、抗体は、その各自のエピトープ(複数可)の結合について互いに「交差競合する」と言われる。たとえば、交差競合抗体は、本明細書中に開示した抗体が結合するエピトープ、またはエピトープの一部分と結合することができる。競合および交差競合抗体のどちらの使用も本開示によって包含されている。そのような競合または交差競合が起こる機構に関わらず(たとえば、立体障害、コンホメーション変化、または共通エピトープもしくはその一部分との結合など)、当業者には、本明細書中に提供する教示に基づいて、そのような競合および/または交差競合抗体が包含されており、本明細書中に開示する方法に有用であり得ることを理解されよう。
【0056】
本明細書中で使用する「主要エピトープ」とは、エピトープのアミノ酸残基のうちの任意の1つをアラニンまたは非保存的置換によって置き換えた場合に、そのエピトープが属する抗原に対する抗体の結合親和性が50%を超えて減少する、エピトープをいう。
【0057】
本明細書中で使用する「アイソタイプ」または「クラス」とは、重鎖定常領域遺伝子によってコードされている抗体クラス(たとえば、IgMまたはIgG)をいう。抗体の定常ドメインは抗原との結合に関与していないが、様々なエフェクター機能を示す。重鎖定常領域のアミノ酸配列に応じて、所定のヒト抗体または免疫グロブリンを5つの主要な免疫グロブリンクラス、すなわち、IgA、IgD、IgE、IgG、およびIgMのうちの1つに割り当てることができる。様々な免疫グロブリンクラスの構造および三次元立体配置は周知である。様々なヒト免疫グロブリンクラスのうち、ヒトIgG1、IgG2、IgG3、IgG4、およびIgMのみが、補体を活性化させることが知られている。ヒトIgG1およびIgG3は、ヒトにおいてADCCを媒介することが知られている。
【0058】
本明細書中で使用する「サブクラス」とは、重鎖定常領域遺伝子のアイソタイプ内のさらなる特定、たとえば、IgGアイソタイプ内のIgG1、IgG2、IgG3、またはIgG4サブクラスなどをいう。
【0059】
本明細書中で使用する用語「化合物」または「医薬化合物」には、抗体、その抗原結合部分、免疫コンジュゲート、および二重特異性分子が含まれる。
【0060】
語句「抗原を認識する抗体」および「抗原に特異的な抗体」とは、本明細書中で用語「抗原と特異的に結合する抗体」と互換性があるように使用される。
【0061】
用語「Fc受容体」または「FcR」とは、抗体のFc領域と結合する受容体を説明するために使用する。たとえば、FcRはネイティブ配列ヒトFcRであってもよい。さらに、FcRはIgG抗体(ガンマ受容体)と結合するものであることができ、FcγRI、FcγRII、FcγRIII、およびFcγRIVサブクラスの受容体が含まれ、これには、これらの受容体の対立遺伝子変異体および選択的スプライシングされた形態が含まれる。FcγRII受容体には、FcγRIIA(「活性化受容体」)およびFcγRIIB(「阻害性受容体」)が含まれ、これらは、主にその細胞質ドメインが異なる、類似のアミノ酸配列を有する。活性化受容体FcγRIIAは、その細胞質ドメイン中に免疫受容体チロシンに基づく活性化モチーフ(ITAM)を含有する。阻害性受容体FcγRIIBは、その細胞質ドメイン中に免疫受容体チロシンに基づく阻害モチーフ(ITIM)を含有する(Daeron、Annu.Rev.Immunol.、15:203〜234(1997)を参照)。FcRは、RavetchおよびKinet、Annu.Rev.Immunol.、9:457〜92(1991)、Capelら、Immunomethods、4:25〜34(1994)、ならびにde Haasら、J.Lab.Clin.Med.、126:330〜41(1995)に総説されている。将来同定されるものを含めた他のFcRが、本明細書中で用語「FcR」によって包含される。また、この用語には、母系IgGを胎児に移行することを司っている新生児受容体FcRnも含まれる(Guyerら、Immunol.、117:587(1976)およびKimら、J.Immunol.、24:249(1994))。
【0062】
本明細書中で使用する「ヒトNotch−1と特異的に結合する」抗体とは、1×10−5M以下のKDでヒトNotch−1と結合する抗体をいうことを意図する。
【0063】
本明細書中で使用する用語「kon」とは、特定の抗体−抗原の相互作用のon速度、すなわち会合速度をいうことを意図し、他方で、本明細書中で使用する用語「koff」とは、特定の抗体−抗原の相互作用のオフ速度、すなわち解離速度をいうことを意図する。本明細書中で使用する用語「KD」とは、koff対konの比(すなわちkoff/kon)から得られる平衡解離定数をいうことを意図し、モル濃度(M)として表される。抗体のKD値は、当分野で十分に確立された方法を用いて決定することができる。抗体のKDを決定する一方法は、典型的にはBiacore(登録商標)システムなどのバイオセンサーシステムを用いた表面プラズモン共鳴を用いることによるものである。
【0064】
本明細書中で使用する用語、抗体に対する「高い親和性」とは、1×10−6M以下のKDを有する抗体をいう。
【0065】
本明細書中で使用する用語「対象」には、任意のヒトまたは非ヒト動物が含まれる。用語「非ヒト動物」には、すべての脊椎動物、たとえば、非ヒト霊長類、ヒツジ、イヌ、ネコ、ウマ、ウシ、ニワトリ、両生類、爬虫類などの哺乳動物および非哺乳動物が含まれる。
【0066】
ヒトNotch−1受容体
ヒトNotch1cDNAは、リーダーペプチド、36個のEGF様反復、負の調節領域(NRR)、膜貫通(TM)配列および細胞内ドメインからなる2556個のアミノ酸残基のタンパク質をコードしている。(Vardarら、Biochemistry、2003、41:7061〜7067、Sanchez−Irizarryら、Mol.Cell.Biol.、2004、24:9265〜9273、Gordon,W.R.ら、Nature Structural&Molecular Biology、2007、第14巻、295〜300)。Notch−1NRRは、アミノ酸残基1447から始まり、1734で終わる。Notch−1NRRは、LNR−A(Notch−1アミノ酸残基1447〜1483)、LNR−B(Notch−1アミノ酸残基1484〜1525)、LNR−C(Notch−1アミノ酸残基1526〜1565)、N末端ヘテロ二量体化ドメイン(HD−N、Notch−1アミノ酸残基1566〜1665)およびC末端ヘテロ二量体化ドメイン(HD−C、Notch−1アミノ酸残基1666〜1734)からなる。
【0067】
本開示の抗体は、抗体の特定の機能的特長または特性によって特徴づけられる。たとえば、抗体は、1×10−5M以下のKDでヒトNotch−1と特異的に結合する。好ましくは、本開示の抗体は、高い親和性、たとえば1×10−6M以下のKD、より好ましくは1×10−7M以下のKD、さらにより好ましくは1×10−8M以下のKDで、Notch−1と結合する。
【0068】
Notch−1に対する抗体の結合能力を評価するためのアッセイには、それだけには限定されないが、ELISA、ウエスタンブロット、RIA、およびフローサイトメトリー分析が含まれる。また、抗体の結合動力学(たとえば結合親和性)も、Biacore分析によってなど、当分野で知られているアッセイによって評価することができる。
【0069】
モノクローナル抗体mAb N248A。
本開示の1つの例示的な抗体は、実施例1〜3および8に記載のように作製、単離、試験および構造的に特徴づけた、マウスモノクローナル抗体N248Aである。表1は、mAb N248Aの様々な領域のアミノ酸配列および本明細書中に開示する他の配列を記載している。
【0070】
【表1−1】

【0071】
【表1−2】

【0072】
【表1−3】

【0073】
【表1−4】

【0074】
【表1−5】

【0075】
実施例4に示すように、mAb N248Aは0.33×10−6M未満のKDを有する。
【0076】
実施例5に示すように、mAb N248Aが少なくとも2つの区別可能なNotch−1エピトープと結合することが示され、一方のエピトープはLin−Aドメイン内にあり、他方のエピトープはHD−Cドメイン内にある。
【0077】
実施例6に示すように、mAb N248Aは、細胞培養物においてT細胞急性リンパ芽球性白血病(T−ALL)および乳癌細胞の成長をどちらも阻害する。
【0078】
実施例7に示すように、mAb N248Aは、マウス異種移植腫瘍モデルにおいてT細胞リンパ芽球性白血病も阻害する。
【0079】
Notch−1Lin−AドメインおよびNotch−1HD−Cドメイン中の少なくとも2つの区別されたエピトープと結合する抗Notch−1抗体。
高い親和性でNotch−1Lin−AおよびHD−Cドメインと結合する抗体はNotch−1シグナル伝達を低下させ、したがって、in vitroおよびin vivoで生物活性を実証して、癌細胞の成長、特にT−ALL癌細胞の成長を阻害し得ることが、本発明の企図内にある。そのような抗体は、当業者に知られている一般的な方法に従って生成し得る。一実施形態では、そのような抗体は、実施例1および2に示すように、マウスをNotch−1LinAドメインおよびNotch−1HD−Cドメインを含む免疫原で免疫化し、次いで、実施例2に示すように、そのようにして作製された抗体のハイブリドーマクローニング、およびELISAアッセイによるクローニングした抗体のアッセイを行うことによって、生成することができる。ELISAアッセイに従って選択された抗体のNotch−1結合親和性は、実施例4に示すように、表面プラズマ共鳴Biacore3000機器で測定することができる。
【0080】
本発明の抗Notch−1抗体は、Notch−1LinAドメインおよびNotch−1HD−Cドメインと結合する抗体であって、上記段落に記載のもの以外の、当分野で知られている任意の他の方法によって生成することができる。宿主動物の免疫化の経路およびスケジュールは、本明細書中にさらに記載するように、一般に、抗体の刺激および産生の確立された従来の技術に沿うものである。ヒトおよびマウス抗体を生成するための一般的な技法は、当分野で知られているおよび/または本明細書中に記載されている。
【0081】
ハイブリドーマ技術によって作製した抗Notch−1抗体。
ヒトを含めた任意の哺乳動物対象またはそれからの抗体産生細胞を、ヒトを含めた哺乳動物のハイブリドーマ細胞系を生じるための基礎として役割を果たすように操作できることが、本発明の企図内にある。典型的には、宿主動物に、本明細書中に記載のものを含めた一定量の免疫原を、腹腔内、筋肉内、経口、皮下、足底内、および/または皮内で接種する。
【0082】
ハイブリドーマは、リンパ球および不死化骨髄腫細胞から、Kohler,B.およびMilstein,C.(1975)Nature、256:495〜497の一般的な体細胞ハイブリダイゼーション技法またはBuck,D.W.ら、In Vitro、18:377〜381(1982)によって改変されたものを用いて調製することができる。それだけには限定されないが、X63−Ag8.653およびSalk Institute、Cell Distribution Center、米国カリフォルニア州San Diegoからのものを含めた入手可能な骨髄腫系を、ハイブリダイゼーションに使用し得る。一般に、この技法は、ポリエチレングリコールなどのフソゲンを用いて、または当業者に周知の電気的手段によって、骨髄腫細胞とリンパ球細胞とを融合させることを含む。融合後、細胞を融合培地から分離し、ハイブリダイズしていない親細胞を排除するために、ヒポキサンチン−アミノプテリン−チミジン(HAT)培地などの選択的成長培地中で成長させる。血清を添加したまたは添加していない、本明細書中に記載する培地のうちのいずれかを、モノクローナル抗体を分泌するハイブリドーマを培養するために使用できる。細胞融合技法の別の代替方法として、EBV不死化B細胞を使用して対象発明のNotch−1モノクローナル抗体を生成することができる。所望する場合はハイブリドーマを拡大およびサブクローニングし、従来の免疫アッセイ手順(たとえば、ラジオイムノアッセイ、酵素免疫アッセイ、または蛍光免疫アッセイ)によって上清を抗免疫原活性についてアッセイする。
【0083】
抗体源として使用し得るハイブリドーマには、Notch−1に特異的なモノクローナル抗体またはその一部分を産生する親ハイブリドーマのすべての誘導体、子孫細胞が包含される。
【0084】
そのような抗体を産生するハイブリドーマは、in vitroまたはin vivoで既知の手順を用いて成長させ得る。所望する場合は、モノクローナル抗体は、培養培地または体液から、硫安塩析、ゲル電気泳動、透析、クロマトグラフィー、および限外濾過などの従来の免疫グロブリン精製手順によって単離し得る。望ましくない活性が存在する場合は、これは、たとえば、固相に付着させた免疫原から作製された吸着剤上に調製物を流し、所望の抗体を免疫原から溶出または放出させることによって、除去することができる。宿主動物を、ヒトNotch−1、または、二官能性もしくは誘導化剤、たとえば、マレイミドベンゾイルスルホスクシンイミドエステル(システイン残基を介したコンジュゲート)、N−ヒドロキシスクシンイミド(リシン残基を介する)、グルタルアルデヒド、コハク酸無水物、SOCl2、もしくはR1N=C=NR[式中、RおよびR1は異なるアルキル基である]を用いて、免疫化する種において免疫原性であるタンパク質、たとえば、キーホールリンペットヘモシアニン、血清アルブミン、ウシサイログロブリン、またはダイズトリプシン阻害剤とコンジュゲートさせた標的アミノ酸配列を含有する断片を用いて免疫化することで、抗体(たとえばモノクローナル抗体)の集団を得ることができる。
【0085】
宿主動物における免疫化によって作製した抗Notch−1抗体のヒト化。
宿主動物における免疫化によって作製された本発明の抗Notch−1抗体は、その生物活性および医薬上の特性を増加させるために、多くの様式で操作できることが、本発明の企図内にある。そのような操作の一方法はヒト化である。
【0086】
モノクローナル抗体をヒト化するためには4つの一般的なステップが存在する。これらは、(1)開始抗体軽鎖および重鎖可変ドメインのヌクレオチドおよび予測されたアミノ酸配列を決定するステップ、(2)ヒト化抗体を設計する、すなわち、どの抗体フレームワーク領域をヒト化プロセス中に使用するかを判断するステップ、(3)実際のヒト化方法/技法のステップ、ならびに(4)ヒト化抗体を形質移入および発現させるステップである。たとえば、米国特許第4,816,567号、第5,807,715号、第5,866,692号、第6,331,415号、第5,530,101号、第5,693,761号、第5,693,762号、第5,585,089号、および第6,180,370号を参照されたい。
【0087】
非ヒト免疫グロブリンに由来する抗原結合部位を含むいくつかの「ヒト化」抗体分子が記載されており、げっ歯類または改変げっ歯類V領域およびヒト定常ドメインと融合したその関連するCDRを有するキメラ抗体が含まれる。たとえば、Winterら、Nature、349:293〜299(1991)、Lobuglioら、Proc.Nat.Acad.Sci.USA、86:4220〜4224(1989)、Shawら、J Immunol.、138:4534〜4538(1987)、およびBrownら、Cancer Res.、47:3577〜3583(1987)を参照されたい。他の参考文献は、適切なヒト抗体定常ドメインと融合させる前にヒト支持フレームワーク領域(FR)内に移植したげっ歯類CDRを記載している。たとえば、Riechmannら、Nature、332:323〜327(1988)、Verhoeyenら、Science、239:1534〜1536(1988)、およびJonesら、Nature、321:522〜525(1986)を参照されたい。別の参考文献は、組換え操作したげっ歯類フレームワーク領域によって支持されるげっ歯類CDRを記載している。たとえば欧州特許公開第0519596号を参照されたい。これらの「ヒト化」分子は、ヒトレシピエントにおけるこれらの部分の治療的応用の持続期間および有効性を制限する、げっ歯類抗ヒト抗体分子に対する望まない免疫学的応答を最小限にするために設計されている。たとえば、抗体定常領域は、これが免疫学的に不活性である(たとえば補体溶解を誘発しない)ように操作することができる。たとえば、PCT公開PCT/GB99/01441号、英国特許出願第9809951.8号を参照されたい。利用し得る抗体をヒト化する他の方法は、Daughertyら、Nucl.Acids Res.、19:2471〜2476(1991)ならびに米国特許第6,180,377号、第6,054,297号、第5,997,867号、第5,866,692号、第6,210,671号、第6,350,861号、およびPCT公開WO01/27160号にも開示されている。
【0088】
ヒト抗Notch−1抗体。
完全ヒト抗Notch−1抗体は、特定のヒト免疫グロブリンタンパク質を発現するように操作されている市販のマウスを用いることによって得られ得ることが、本発明の企図内にある。また、より望ましい(たとえば完全ヒト抗体)またはより強力な免疫応答を生じるように設計されたトランスジェニック動物も、ヒト化抗体またはヒト抗体の作製に使用し得る。そのような技術の例は、Abgenix,Inc.(カリフォルニア州Fremont)のXenomouse(商標)ならびにMedarex,Inc.(ニュージャージー州Princeton)のHuMAb−Mouse(登録商標)およびTC Mouse(商標)である。
【0089】
また、完全ヒト抗Notch−1抗体は、ファージディスプレイ技術の一般的な方法に従って組換えによって得られ得ることも、本発明の企図内にある。たとえば、米国特許第5,565,332号、第5,580,717号、第5,733,743号、および第6,265,150号、ならびにWinterら、Annu.Rev.Immunol.、12:433〜455(1994)を参照されたい。
【0090】
代替として、ファージディスプレイ技術(McCaffertyら、Nature、348:552〜553(1990))を用いて、ヒト抗体および抗体断片を、in vitroで、免疫化していないドナーからの免疫グロブリン可変(V)ドメイン遺伝子レパートリーから生じさせることができる。この技法によれば、抗体Vドメイン遺伝子をインフレームでM13またはfdなどの糸状バクテリオファージの主要または副コートタンパク質遺伝子のいずれか中にクローニングし、ファージ粒子の表面上に機能的抗体断片として表示させる。糸状粒子はファージゲノムの一本鎖DNAコピーを含有するため、抗体の機能的特性に基づく選択も、これらの特性を示す抗体をコードしている遺伝子の選択をもたらす。したがって、ファージはB細胞の特性の一部を模倣する。ファージディスプレイは様々な様式で行うことができる。総説には、たとえばJohnson,Kevin S.およびChiswell,David J.、Current Opinion in Structural Biology、3:564〜571(1993)を参照されたい。V遺伝子セグメントのいくつかの供給源をファージディスプレイに使用することができる。Clacksonら、Nature、352:624〜628(1991)は、抗オキサゾロン抗体の多様なアレイを、免疫化したマウスの脾臓に由来するV遺伝子の小さなランダムコンビナトリアルライブラリから単離した。免疫化していないヒトドナーからのV遺伝子のレパートリーを構築することができ、抗原(自己抗原が含まれる)の多様なアレイに対する抗体は、Markら、J.Mol.Biol.、222:581〜597(1991)またはGriffithら、EMBO J.、12:725〜734(1993)によって記載されている技法に本質的に従って単離することができる。天然の免疫応答では、抗体遺伝子は、高い確率で突然変異を蓄積する(体細胞超変異)。導入した変化の一部はより高い親和性を与え、高親和性の表面免疫グロブリンを示すB細胞が、続く抗原免疫誘発中に優先的に複製および分化される。この天然プロセスは、「鎖シャフリング」として知られる技法を用いることによって模倣することができる。(Marksら、Bio/Technol.、10:779〜783(1992))。この方法では、ファージディスプレイによって得られる「一次」ヒト抗体の親和性は、重鎖および軽鎖のV領域遺伝子を、免疫化していないドナーから得られたVドメイン遺伝子の天然に存在する変異体のレパートリー(レパートリー)で連続的に置き換えることによって、向上させることができる。この技法により、pM〜nMの範囲の親和性を有する抗体および抗体断片の生成が可能となる。非常に大きなファージ抗体レパートリー(「最大のライブラリ(the mother−of−all libraries)」としても知られる)を作製するための戦略は、Waterhouseら、Nucl.Acids Res.、21:2265〜2266(1993)によって記載されている。
【0091】
また、遺伝子シャフリングを用いてヒト抗体をげっ歯類抗体から誘導することもでき、ヒト抗体は開始げっ歯類抗体と類似の親和性および特異性を有する。「エピトープインプリント」とも呼ばれるこの方法によれば、ファージディスプレイ技法によって得られたげっ歯類抗体の重鎖または軽鎖Vドメイン遺伝子をヒトVドメイン遺伝子のレパートリーで置き換えて、げっ歯類−ヒトのキメラを作出する。抗原に対する選択により、機能的抗原結合部位を修復することができるヒト可変領域の単離がもたらされる、すなわち、エピトープがパートナーの選択を支配する(インプリント)。残りのげっ歯類Vドメインを置き換えるためにプロセスを繰り返した場合、ヒト抗体が得られる(PCT公開WO93/06213号を参照)。CDR移植によるげっ歯類抗体の伝統的なヒト化とは異なり、この技法は、げっ歯類起源のフレームワークまたはCDR残基をまったく有さない完全ヒト抗体を提供する。
【0092】
上記論考はヒト化抗体およびヒト抗体に関するが、論じた一般的な原理は、抗体を、たとえば、イヌ、ネコ、霊長類、ウマおよびウシにおいて使用するためにあつらえることに適用可能である。本明細書中に記載の抗体をヒト化する1つまたは複数の態様、たとえば、CDR移植、フレームワーク突然変異およびCDR突然変異を組み合わせ得る。
【0093】
組換えによって作製した、操作および改変した抗Notch−1抗体。
一般に、抗体は、所望の抗体のDNA配列を発現ベクター内に配置し、次いで、それだけには限定されないが、そうでなければ免疫グロブリンタンパク質を産生しない大腸菌(E.coli)細胞、サルCOS細胞、チャイニーズハムスター卵巣(CHO)細胞、または骨髄腫細胞を含めた宿主細胞中での形質移入および発現によって、組換えによって作製し得る。PCT特許公開WO87/04462号。トランスジェニック植物細胞またはトランスジェニック乳細胞などの他の宿主細胞も使用し得る。たとえば、Peetersら、Vaccine、19:2756(2001)、Lonberg,N.およびD.Huszar、Int.Rev.Immunol、13:65(1995)、ならびにPollockら、J Immunol Methods、231:147(1999)を参照されたい。
【0094】
また、抗体は、組換えによって改変もし得る。たとえば、ヒト重鎖および軽鎖定常領域のDNAをマウス抗体DNAの相同的なマウス配列、Morrisonら、Proc.Nat.Acad.Sci.、81:6851(1984)の代わりに、または免疫グロブリンコード配列に、非免疫グロブリンポリペプチドのコード配列の全体もしくは一部を共有結合させることによって使用してもよい。同様の様式で、本明細書中の抗Notch−1モノクローナル抗体の結合特異性を有する「キメラ」または「ハイブリッド」抗体を調製することができる。
【0095】
また、抗体可変領域は、CDR移植によっても改変することができる。CDR配列がほとんどの抗体−抗原の相互作用を司っているため、異なる特性を有する異なる抗体からのフレームワーク配列上に移植した、特定の天然に存在する抗体からのCDR配列が含まれる発現ベクターを構築することによって、特定の天然に存在する抗体の特性を模倣する組換え抗体を発現させることが可能である(たとえば、Riechmann,L.ら(1998)Nature、332:323〜327、Jones,P.ら(1986)Nature、321:522〜525、Queen,C.ら(1989)Proc.Natl.Acad.See.U.S.A.、86:10029〜10033、Winterの米国特許第5,225,539号、ならびにQueenらの米国特許第5,530,101号、第5,585,089号、第5,693,762号および6,180,370号を参照)
【0096】
したがって、本開示の別の態様は、それぞれ配列番号18、19および20からなる群から選択されるアミノ酸配列を含むCDR1、CDR2、およびCDR3の配列を含む重鎖可変領域、ならびにそれぞれ配列番号12、13および14からなる群から選択されるアミノ酸配列を含むCDR1、CDR2、およびCDR3の配列を含む軽鎖可変領域を含む、単離されたモノクローナル抗体またはその抗原結合部分に関する。したがって、そのような抗体は、モノクローナル抗体N248AのVHおよびVLのCDR配列を含有する一方で、これらの抗体からの異なるフレームワーク配列を含有し得る。そのようなフレームワーク配列は、生殖系列抗体遺伝子配列が含まれる公的DNAデータベースまたは公開参考文献から得ることができる。
【0097】
別の種類の可変領域の改変は、VHおよび/またはVLのCDR1、CDR2および/またはCDR3領域内のアミノ酸残基と突然変異させることによって、目的の抗体の1つまたは複数の結合特性(たとえば親和性)を向上させることである。部位特異的突然変異誘発またはPCR媒介性突然変異誘発を行って突然変異(複数可)を導入することができ、抗体結合、または他の目的の機能的特性に対する効果は、本明細書中に記載のようにin vitroまたはin vivoのアッセイで評価することができる。典型的には、保存的改変(以下に論じる)が導入される。突然変異は、アミノ酸の置換、付加または欠失であり得る。さらに、典型的には、CDR領域内の1個以下、2、3、4または5個の残基が変更される。
【0098】
保存的置換および抗体親和性成熟は、後の段落でより詳細に論じる。
【0099】
抗体が結合する抗原エピトープのマッピング。
抗原上のモノクローナル抗体の結合エピトープは、抗原−抗体の相互作用の種類に応じて、いくつかの方法によってマッピングし得る。
【0100】
抗体が、抗原中の連続的なアミノ酸残基からなる、その結合が抗原のコンホメーション変化によって通常は影響を受けない単一のエピトープと結合する場合、結合エピトープは直鎖エピトープと呼ばれる。直鎖結合エピトープを同定するために、ペプチド走査方法を一般的に使用し(Journal of Immunological Methods、第315巻、第1〜2号、11〜18ページ、2006年8月を参照)、これは、抗原配列の全長にわたる、一連の重複する10〜15量体ペプチドを合成することを要する。ペプチドを2つ組のドット方式でタンパク質架橋結合膜上にアレイ配置する。ペプチドアレイに対する抗体の結合親和性をELISAと同様に分析する。ペプチドをアレイ配置した膜を、非特異的結合を遮断するために5%のウシ胎児血清を含む1×PBST中で最初にインキュベーションし、その後、試験抗体または非特異的な対照抗体と共にインキュベーションし、次いで、HRPで標識した二次抗体と共にインキュベーションする。抗体の結合強度は、化学発光イメージング機器を用いて読み取る。
【0101】
代替として、直鎖結合エピトープは、酵母細胞表面上に表示された抗原タンパク質ドメインを用いて(Journal of Molecular Biology、365(1)、196〜200、2007年1月を参照)、または細菌細胞表面上に表示された抗原タンパク質断片を用いて(FEMS Microbiol.Lett.、226(2)、347〜353、2003年9月を参照、Nature Methods、5(12)、1039〜1045、2008年11月も参照)、次いでフローサイトメトリー分別、すなわちFACSで同定し得る。
【0102】
質量分析と組み合わせた、ペプチド抗原および抗体複合体の限定タンパク質分解が、直鎖結合エピトープを位置決定するための別の手法を提供し得る(Methods Mol.Biol.、524、87〜101、2009を参照)。抗原および抗体を混合し、結合複合体を形成するために適した条件でインキュベーションし、これを、制御された温度および時間のもとでプロテアーゼによって消化する。その後、結合した反応混合物をプロテインA親和性カラムに通して、抗原エピトープ断片と結合した抗体を保持させ、これを、カラムから溶出させた後に、質量分析によって分析する。
【0103】
コンホメーションエピトープのマッピングは、抗体とそのネイティブなコンホメーションの抗原との相互作用に依存する。いくつかの技法が、コンホメーションエピトープの決定において有用であることが報告されている。一般的に使用される方法の1つはアミノ酸突然変異誘発である。抗体と結合することが推測される抗原タンパク質中の個々のアミノ酸残基を突然変異させ、その後、突然変異した抗原タンパク質を発現させ、抗体結合分析に供して、結合親和性が損なわれたかどうかを決定する。しかし、完全抗原タンパク質配列にわたる系統的なアミノ酸突然変異誘発は労力がかかる。抗体と相互作用する抗原タンパク質の領域を絞り込むために、密に関連するタンパク質ドメインによる個々の抗原ドメインの置換が有用な方法である場合がある(J.Biol.chem.、274(14)9617〜9626、1999年4月を参照)。
【0104】
ショットガン突然変異誘発マッピングが、従来のアミノ酸突然変異誘発の欠点を克服するために開発された(J.American Chem.Soc、131、6952〜6954、2009を参照)。この方法では、抗原cDNAから作製した包括的な突然変異ライブラリを利用し、それぞれのプラスミドクローンは独特の点突然変異を含有し、突然変異ライブラリ全体が抗原コード領域のすべてのアミノ酸をカバーする。プラスミドクローンのライブラリをHEK−293Tまたは他のヒト細胞中に形質移入させ、その後、細胞を、384ウェルマイクロプレート中にアレイ配置させる。細胞をマイクロプレート上に固定した後に抗体の結合活性をアッセイする。アミノ酸の突然変異が反応性の損失をもたらす場合、これは抗体結合エピトープとして同定される。
【0105】
抗原−抗体の複合体の共結晶化、X線回折および構造解析により、抗原−抗体の相互作用の方向の可視化が与えられる。アミノ酸突然変異誘発と組み合わせた場合、この技術は抗体結合エピトープの強力な証拠および鮮明な描写を提供するであろう。しかし、共結晶化および構造解析が技術的に難しく、大量の精製した抗原および抗体を必要とし、時間のかかる試行錯誤プロセスとなる場合がある。
【0106】
1つのエピトープまたは指定したエピトープの組と結合する抗Notch−1抗体を作製するために、抗Notch−1抗体を作製し、その後、当分野で一般に知られている上記マッピング方法に従って、これらの抗体のそれぞれが結合するエピトープまたはエピトープの組を決定することができる。その後、特定のエピトープまたは特定のエピトープの組と結合する抗Notch−1抗体を選択することができる。
【0107】
保存的置換
既に論じたように、抗体は、抗体のアミノ酸残基のうちの1つもしくは複数の保存的置換によって、または抗体のアミノ酸への、アミノ酸の1つもしくは複数の欠失もしくは付加によって、組換えにより改変されてもよい。
【0108】
アミノ酸配列の挿入には、1個の残基から100個以上の残基を含有するポリペプチドの長さの範囲のアミノおよび/またはカルボキシル末端の融合体、ならびに単一または複数のアミノ酸残基の配列内挿入が含まれる。末端挿入の例には、N末端メチオニル残基を有する抗体またはエピトープタグと融合した抗体が含まれる。抗体分子の他の挿入変異体には、抗体のNまたはC末端と血液循環中の抗体の半減期を増加させる酵素またはポリペプチドとの融合が含まれる。
【0109】
置換変異体は、抗体分子中の少なくとも1つのアミノ酸残基が除去され、異なる残基がその代わりに挿入されている。最も関心が持たれる置換突然変異誘発の部位には超可変領域が含まれるが、FRの変更も企図される。保存的置換を表2に示す。そのような置換が生物活性の変化をもたらす場合は、表2中で「例示的な置換」と命名した、またはアミノ酸クラスを参照して以下にさらに記載した、より実質的な変化を導入し、生成物をスクリーニングし得る。
【0110】
【表2】

【0111】
抗体の生物学的特性の実質的な改変は、(a)置換領域中の、たとえばシートもしくはヘリックスコンホメーションとしてのポリペプチド主鎖の構造、(b)標的部位での分子の荷電もしくは疎水性、または(c)側鎖の嵩の維持におけるその効果が顕著に異なる置換を選択することによって、達成される。天然に存在する残基は、共通の側鎖特性に基づいて以下の群に分類される:
(1)非極性:ノルロイシン、Met、Ala、Val、Leu、Ile、
(2)極性、荷電なし:Cys、Ser、Thr、Asn、Gln、
(3)酸性(負荷電):Asp、Glu、
(4)塩基性(正荷電):Lys、Arg、
(5)鎖の配向に影響を与える残基:Gly、Pro、および
(6)芳香族:Trp、Tyr、Phe、His。
【0112】
非保存的置換は、これらのクラスのうちの1つのメンバーを別のクラスに交換することによって行う。
【0113】
また、抗体の適正のコンホメーションの維持に関与していない任意のシステイン残基も、一般にセリンで置換して、分子の酸化安定性を向上させ、異常な架橋結合を防止し得る。逆に、システイン結合(複数可)を、特に抗体がFv断片などの抗体断片である場合に、その安定性を向上させるために抗体に付加し得る。
【0114】
親和性成熟した抗Notch−1抗体
本発明には、親和性成熟した実施形態が含まれる。たとえば、親和性成熟した抗体は、当分野で知られている手順によって生成することができる(Marksら(1992)Bio/Technology、10:779〜783、Barbasら(1994)Proc Nat.Acad.Sci,USA、91:3809〜3813、Schierら(1995)Gene、169:147〜155、Yeltonら(1995)J.Immunol.、155:1994〜2004、Jacksonら(1995)J.Immunol.、154(7):3310〜9、Hawkinsら(1992)J.Mol.Biol.、226:889〜896、およびPCT公開WO2004/058184号)。
【0115】
以下の方法を、抗体の親和性の調整およびCDRの特徴づけに使用し得る。「ライブラリ走査突然変異誘発」と呼ばれる、抗体のCDRを特徴づけるおよび/または抗体などのポリペプチドの結合親和性を変更させる(向上させるなど)一方法。一般に、ライブラリ走査突然変異誘発は以下のように動作する。当分野で認識されている方法を用いて、CDR中の1つまたは複数のアミノ酸位置を2種類以上(3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、または20種類など)のアミノ酸で置き換える。これによりクローンの小ライブラリが作製され(一部の実施形態では、分析するそれぞれのアミノ酸位置について1つずつ)、そのそれぞれが2つ以上のメンバーの複雑さを有する(それぞれの位置で2種類以上のアミノ酸を置換する場合)。一般に、ライブラリには、ネイティブ(非置換)のアミノ酸を含むクローンも含まれる。それぞれのライブラリからの少数のクローン、たとえば約20〜80個のクローン(ライブラリの複雑さに依存する)を、標的ポリペプチド(または他の結合標的)に対する結合親和性についてスクリーニングし、増加した、同じ、減少した結合を有する、または結合しない候補を同定する。
【0116】
一部の実施形態では、当分野で認識されている突然変異誘発方法を用いて、CDR中のそれぞれのアミノ酸位置を、一部の実施形態では、1回に1個、20種類すべての天然アミノ酸で置き換える。これによりクローンの小ライブラリが作製され(一部の実施形態では、分析するそれぞれのアミノ酸位置について1つずつ)、そのそれぞれが20個のメンバーの複雑さを有する(それぞれの位置で20種類すべてのアミノ酸を置換する場合)。
【0117】
一部の実施形態では、スクリーニングするライブラリは、同じCDR中または2つ以上のCDR中であり得る2つ以上の位置での置換を含む。したがって、ライブラリは、1つのCDR中の2つ以上の位置での置換を含み得る。ライブラリは、2つ以上のCDR中の2つ以上の位置での置換を含み得る。ライブラリは、2、3、4、5または6個のCDR中に見つかる3、4、5、またはそれより多くの位置での置換を含み得る。置換は、冗長性の低いコドンを用いて調製し得る。たとえば、Balintら、(1993)Gene、137(1):109〜18)の表2を参照されたい。それぞれのCDRは、Kabat CDR、Chothia CDR、または拡張CDRであり得る。
【0118】
向上した結合を有する候補を配列決定し、それにより、「向上した」置換とも呼ばれる、向上した親和性をもたらすCDR置換突然変異体を同定し得る。また、結合する候補も配列決定し、それにより、結合を保持するCDR置換も同定し得る。
【0119】
複数回のスクリーニングを実施し得る。たとえば、それぞれが1つまたは複数のCDRの1つまたは複数の位置でアミノ酸置換を含む、向上した結合を有する候補は、それぞれの向上したCDR位置(すなわち、置換突然変異体が向上した結合を示したCDR中のアミノ酸位置)で少なくとも元のおよび置換されたアミノ酸を含有する第2のライブラリの設計にも有用である。このライブラリの調製、およびスクリーニングまたは選択を以下にさらに記述する。
【0120】
また、ライブラリ走査突然変異誘発は、向上した結合、同じ結合、減少した結合を有する、または結合しないクローンの頻度が、抗体−抗原の複合体の安定性のためにそれぞれのアミノ酸位置の重要性に関する情報も提供する限りは、CDRを特徴づけるための手段も提供する。たとえば、CDRのある位置が、20種類すべてのアミノ酸に変化させたときに結合を保持している場合、その位置は、抗原結合に必要である可能性が低い位置として同定される。逆に、あるCDRの位置が、置換の少ないパーセンテージのみで結合を保持している場合は、その位置は、CDR機能に重要な位置として同定される。したがって、ライブラリ走査突然変異誘発方法は、多くの異なるアミノ酸(20種類すべてのアミノ酸が含まれる)に変化させることができるCDR中の位置、および変化させることができないまたは少数のアミノ酸にのみ変化させることができるCDR中の位置に関する情報をもたらす。
【0121】
向上した親和性を有する候補は、向上したアミノ酸、その位置での元のアミノ酸が含まれ、所望されるライブラリの複雑さ次第で、または所望のスクリーニングもしくは選択の方法を用いて許容される、その位置での追加の置換がさらに含まれ得る、第2のライブラリ中で合わせ得る。さらに、所望する場合は、隣接アミノ酸位置を、少なくとも2種類以上のアミノ酸にランダム化することができる。隣接アミノ酸のランダム化は、突然変異体CDRにおけるさらなるコンホメーションの柔軟性を可能にする場合があり、これは、立ち代って、より多数の向上させる突然変異の導入を可能または容易にし得る。また、ライブラリは、第1の回目のスクリーニングで向上した親和性を示さなかった位置での置換も含み得る。
【0122】
Biacore表面プラズモン共鳴分析を用いたスクリーニング、ならびにファージディスプレイ、酵母ディスプレイ、およびリボソームディスプレイを含めた当分野で知られている選択のための任意の方法を用いた選択を含めた、当分野で知られている任意の方法を用いて、第2のライブラリを、向上したおよび/または変更された結合親和性を有するライブラリメンバーについてスクリーニングまたは選択する。
【0123】
抗Notch−1抗体の翻訳後修飾
また、抗体は、それだけには限定されないが、様々な糖でのグリコシル化、アセチル化、およびリン酸化を含めた翻訳後修飾によって修飾されることもできる。抗体は、その定常領域中の保存的な位置でグリコシル化される。免疫グロブリンのオリゴ糖側鎖は、タンパク質の機能(Boydら、1996、Mol.Immunol.、32:1311〜1318、WittweおよびHoward、1990、Biochem.、29:4175〜4180)、ならびにコンホメーションに影響を与える場合がある、糖タンパク質の部分間の分子内相互作用に影響を与え、糖タンパク質の三次元表面を提示した(JefferisおよびLund、上記、WyssおよびWagner、1996、Current Opin.Biotech.、7:409〜416)。また、オリゴ糖は、特異的な認識構造に基づいて所定の糖タンパク質を特定の分子に標的化する役割も果たし得る。また、抗体のグリコシル化は抗体依存性細胞性細胞傷害(ADCC)に影響を与えることも報告されている。具体的には、二分GlcNAcの形成を触媒するグリコシルトランスフェラーゼであるβ(1,4)−N−アセチルグルコサミニルトランスフェラーゼIII(GnTIII)のテトラサイクリン調節性発現を有するCHO細胞が、向上したADCC活性を有することが報告されている(Umanaら、1999、Mature Biotech.、17:176〜180)。
【0124】
抗体のグリコシル化は、典型的にはN−連結またはO−連結のいずれかである。N−連結とは、炭水化物部分の、アスパラギン残基の側鎖への付着をいう。トリペプチド配列アスパラギン−X−セリン、アスパラギン−X−スレオニン、およびアスパラギン−X−システイン[式中、Xはプロリン以外の任意のアミノ酸である]が、アスパラギン側鎖への炭水化物部分の酵素的付着の認識配列である。したがって、ポリペプチド中にこれらのトリペプチド配列のいずれかが存在することにより、潜在的なグリコシル化部位が作出される。O−連結グリコシル化とは、糖であるN−アセチルガラクトサミン、ガラクトース、またはキシロースのうちの1つの、ヒドロキシアミノ酸、最も一般的にはセリンまたはスレオニンへの付着をいうが、5−ヒドロキシプロリンまたは5−ヒドロキシリシンも使用し得る。
【0125】
抗体へのグリコシル化部位の付加は、上述のトリペプチド配列のうちの1つまたは複数を含有するようにアミノ酸配列を変更することによって、好都合に達成される(N−連結グリコシル化部位用)。また、変更は、元の抗体の配列に1つまたは複数のセリンまたはスレオニン残基を付加する、またはそれによって置換することによっても行い得る(O−連結グリコシル化部位用)。
【0126】
また、抗体のグリコシル化パターンは、根底にあるヌクレオチド配列を変更させずに変更し得る。グリコシル化は、抗体を発現させるために使用する宿主細胞に大きく依存する。潜在的な治療剤としての組換え糖タンパク質、たとえば抗体の発現に使用する細胞種がネイティブ細胞であることは稀なため、抗体のグリコシル化パターンが変動することを予測することができる(たとえばHseら(1997)J.Biol.Chem.、272:9062〜9070を参照)。
【0127】
宿主細胞の選択に加えて、抗体の組換え産生中のグリコシル化に影響を与える要因には、成長様式、培地配合、培養密度、酸素化、pH、精製スキームなどが含まれる。オリゴ糖の産生に関与している特定の酵素の導入または過剰発現を含めた様々な方法が、特定の宿主生物において達成されるグリコシル化パターンを変更するために提案されている(米国特許第5,047,335号、第5,510,261号および第5.278、299号)。グリコシル化、または特定の種類のグリコシル化を、糖タンパク質から、たとえば、エンドグリコシダーゼH(Endo H)、N−グリコシダーゼF、エンドグリコシダーゼF1、エンドグリコシダーゼF2、エンドグリコシダーゼF3を用いて、酵素的に除去することができる。さらに、組換え宿主細胞は、特定の種類の多糖のプロセッシングが欠損しているように遺伝子操作することができる。これらおよび類似の技法は当分野で周知である。
【0128】
翻訳後修飾の他の方法には、それだけには限定されないが、酵素的手段、酸化置換およびキレート化を含めた、当分野で知られているカップリング技法の使用が含まれる。修飾は、たとえば、免疫アッセイ用の標識を付着させるために使用することができる。
【0129】
改変された定常領域を有する抗Notch−1抗体
本発明の一部の実施形態では、抗体は、免疫学的に不活性もしくは部分的に不活性である、たとえば、補体媒介性の溶解を誘発しない、抗体依存性細胞媒介性細胞毒性(ADCC)を刺激しない、もしくはミクログリアを活性化させない、または、補体媒介性の溶解の始動、抗体依存性細胞媒介性細胞毒性(ADCC)の刺激もしくはミクログリアの活性化のうちの任意の1つもしくは複数において低下した活性を有する(改変されていない抗体と比較して)定常領域などの、改変された定常領域を含む。定常領域の様々な改変を使用して、エフェクター機能の最適なレベルおよび/または組合せを達成し得る。たとえば、Morganら、Immunology、86:319〜324(1995)、Lundら、J.Immunology、157:4963〜9、157:4963〜4969(1996)、Idusogieら、J.Immunology、164:4178〜4184(2000)、Taoら、J.Immunology、143:2595〜2601(1989)、およびJefferisら、Immunological Reviews、163:59〜76(1998)を参照されたい。一部の実施形態では、定常領域は、Eur.J.Immunol.(1999)29:2613〜2624、PCT出願PCT/GB99/01441号、および/または英国特許出願第9809951.8号に記載のように改変されている。他の実施形態では、抗体は、以下の突然変異:A330P331からS330S331(アミノ酸の付番は野生型IgG2配列を参照)を含むヒト重鎖IgG2定常領域を含む。Eur.J.Immunol.(1999)29:2613〜2624。さらに他の実施形態では、定常領域は、N−連結グリコシル化のためにアグリコシル化(aglycosylated)されている。一部の実施形態では、定常領域は、グリコシル化されたアミノ酸残基または定常領域中のN−グリコシル化認識配列の一部であるフランキング残基を突然変異させることによって、N−連結グリコシル化のために脱グリコシル化されている。たとえば、N−グリコシル化部位N297をA、Q、K、またはHに突然変異させ得る。Taoら、J.Immunology、143:2595〜2601(1989)、およびJefferisら、Immunological Reviews、163:59〜76(1998)を参照されたい。一部の実施形態では、定常領域は、N−連結グリコシル化のために脱グリコシル化されている。定常領域は、N−連結グリコシル化のために酵素的に(酵素PNGaseによって炭水化物を除去することなど)、またはグリコシル化欠損宿主細胞中での発現によって、脱グリコシル化されていてよい。
【0130】
Fc領域内の改変を典型的に使用して、血清半減期、補体固定、Fc受容体結合、および/または抗原依存性細胞毒性などの抗体の1つまたは複数の機能的特性を変更させることができる。さらに、本開示の抗体は、やはり抗体の1つまたは複数の機能的特性を変更させるために、化学修飾し得るか(たとえば1つもしくは複数の化学部分を抗体に付着させることができる)、そのグリコシル化パターンを変更させるために改変し得る。これらの態様のそれぞれは、以下にさらに詳述されている。Fc領域中の残基の付番は、KabatのEU指標のものである。
【0131】
一事例では、CH1のヒンジ領域は、ヒンジ領域中のシステイン残基の数が変更されている、たとえば増加または減少しているように改変されている。この手法は、米国特許第5,677,425号にさらに記載されている。CH1のヒンジ領域中のシステイン残基の数は、たとえば、軽鎖および重鎖のアセンブリを容易にするため、または抗体の安定性を増加もしくは減少させるために変更されている。
【0132】
別の事例では、抗体のFcヒンジ領域は、抗体の生物学的半減期を減少させるために突然変異されている。より詳細には、抗体が、ネイティブのFc−ヒンジドメインのSpA結合と比較して、損なわれたブドウ球菌プロテインA(SpA)の結合を有するように、1つまたは複数のアミノ酸突然変異をFc−ヒンジ断片のCH2−CH3のドメイン界面領域内に導入する。この手法は、米国特許第6,165,745号にさらに詳述されている。
【0133】
別の事例では、抗体は、その生物学的半減期を増加させるために改変されている。様々な手法が可能である。たとえば、米国特許第6,277,375号に記載のように、T252L、T254S、T256Fの突然変異のうちの1つまたは複数を導入することができる。あるいは、米国特許第5,869,046号および6,121,022号に記載のように、生物学的半減期を増加させるために、IgGのFc領域のCH2ドメインの2つのループから採った回収受容体結合エピトープが含有されるように、抗体をCH1またはCL領域内で変更することができる。
【0134】
さらに他の事例では、Fc領域は、抗体のエフェクター機能(複数可)を変更させるために、少なくとも1つのアミノ酸残基を異なるアミノ酸残基で置き換えることによって変更する。たとえば、抗体がエフェクターリガンドに対して変更された親和性を有するが、親抗体の抗原結合能力を保持しているように、アミノ酸残基234、235、236、237、297、318、320および322から選択される1つまたは複数のアミノ酸を異なるアミノ酸残基で置き換えることができる。親和性を変更させるエフェクターリガンドは、たとえば、補体のFc受容体またはC1構成成分であってもよい。この手法は、米国特許第5,624,821号および第5,648,260号にさらに詳述されている。
【0135】
別の事例では、抗体が変更されたC1q結合および/または低下もしくは消滅した補体依存性細胞傷害性(CDC)を有するように、アミノ酸残基329、331および322から選択される1つまたは複数のアミノ酸を異なるアミノ酸残基で置き換えることができる。この手法は、米国特許第6,194,551号にさらに詳述されている。
【0136】
別の例では、アミノ酸位置231および239内の1つまたは複数のアミノ酸残基を変更させることによって、補体を固定する抗体の能力を変更させる。この手法は、PCT公開WO94/29351号にさらに記載されている。
【0137】
さらに別の例では、Fc領域は、238、239、248、249、252、254、255、256、258、265、267、268、269、270、272、276、278、280、283、285、286、289、290、292、293、294、295、296、298、301、303、305、307、309、312、315、320、322、324、326、327、329、330、331、333、334、335、337、338、340、360、373、376、378、382、388、389、398、414、416、419、430、434、435、437、438または439の位置の1つまたは複数のアミノ酸を改変することによって、抗体依存性細胞性細胞傷害(ADCC)を媒介するおよび/またはFcγ受容体に対する抗体の親和性を増加させる抗体の能力を増加させるために改変されている。この手法は、PCT公開WO00/42072号にさらに記載されている。さらに、FcγR1、FcγRII、FcγRIIIおよびFcRnに対するヒトIgG1上の結合部位がマッピングされており、向上した結合を有する変異体が記載されている(Shieldsら、J.Biol.Chem.、276:6591〜6604(2001)を参照)。位置256、290、298、333、334および339での特定の突然変異は、FcγRIIIに対する結合を向上させることが示された。さらに、T256A/S298A、S298A/E333A、S298A/K224AおよびS298A/E333A/K334Aの組合せの突然変異体が、FcγRIIIの結合を向上させることが示された。
【0138】
さらに別の例では、抗体のグリコシル化は改変されている。たとえば、脱グリコシル化された抗体を作製することができる(すなわち、抗体がグリコシル化を欠く)。グリコシル化は、たとえば抗原に対する抗体の親和性を増加させるために変更することができる。そのような炭水化物の改変は、たとえば、抗体配列内の1つまたは複数のグリコシル化部位を変更することによって達成することができる。たとえば、1つまたは複数の可変領域のフレームワークのグリコシル化部位の排除をもたらすことによって、その部位でのグリコシル化を排除する、1つまたは複数のアミノ酸置換を行うことができる。そのようなアグリコシル化(aglycosylation)は、抗原に対する抗体の親和性を増加させ得る。そのような手法は、米国特許第5,714,350号および第6,350,861号にさらに詳述されている。
【0139】
さらに、またはそれに代わって、低下した量のフコシル残基を有する低フコシル化(hypofucosylated)抗体などの変更された種類のグリコシル化を有する抗体または増加した二分GlcNAc構造を有する抗体を作製することができる。そのような変更されたグリコシル化パターンは、抗体のADCC能力を増加させることが実証されている。そのような炭水化物の改変は、たとえば、変更されたグリコシル化機構を有する宿主細胞中で抗体を発現させることによって達成することができる。変更されたグリコシル化機構を有する細胞は当分野で記載されており、本開示の組換え抗体を発現させることによって、変更されたグリコシル化を有する抗体を産生させるための宿主細胞として使用することができる。たとえば、細胞系Ms704、Ms705、およびMs709は、Ms704、Ms705、およびMs709細胞系中で発現された抗体がその炭水化物上にフコースを欠くように、フコシルトランスフェラーゼ遺伝子、FUT8(アルファ(1,6)フコシルトランスフェラーゼ)を欠く。Ms704、Ms705、およびMs709 FUT8−/−細胞系は、2つの置き換えベクターを用いたCHO/DG44細胞中のFUT8遺伝子の標的破壊によって作製した(米国特許公開第2004−0110704号、およびYamane−Ohnukiら、Biotechnol Bioeng、87:614〜22(2004)を参照)。別の例として、欧州特許公開EP1,176,195号は、アルファ1,6結合関連の酵素を低下または排除することによって、そのような細胞系中で発現させた抗体が低フコシル化を示すように、フコシルトランスフェラーゼをコードしている機能を破壊したFUT8遺伝子を有する細胞系を記載している。また、EP1,176,195号は、抗体のFc領域と結合するN−アセチルグルコサミンにフコースを付加することに関して低い酵素活性を有する、または酵素活性を有さない細胞系、たとえばラット骨髄腫細胞系YB2/0(ATCC CRL1662)を記載している。PCT公開WO03/035835号は、フコースをAsn(297)−連結炭水化物に付着させる能力が低下しており、また、その宿主細胞中で発現される抗体の低フコシル化ももたらす、変異体CHO細胞系、Lec13細胞を記載している(Shieldsら、J.Biol.Chem.、277:26733〜26740(2002)も参照)。PCT公開WO99/54342は、操作した細胞系中で発現される抗体が、抗体の増加したADCC活性をもたらす増加した二分GlcNAc構造を示すように、糖タンパク質を改変するグリコシルトランスフェラーゼ(たとえばベータ(1,4)−N−アセチルグルコサミニルトランスフェラーゼIII(GnTIII))を発現するように操作した細胞系を記載している(Umanaら、Nat.Biotech.、17:176〜180(1999)も参照)。あるいは、抗体のフコース残基はフコシダーゼ酵素を用いて切断除去し得る。たとえば、フコシダーゼアルファ−L−フコシダーゼは、抗体からフコシル残基を除去する(Tarentinoら、(1975)Biochem.、14:5516〜23(1975))。
【0140】
本開示によって企図される本明細書中の抗体の別の改変はpeg化である。抗体は、たとえば、抗体の生物学的(たとえば血清)半減期を増加させるためにpeg化することができる。抗体をpeg化するためには、抗体またはその断片を、典型的にはPEGの反応性エステルまたはアルデヒド誘導体などのポリエチレングリコール(PEG)と、1つまたは複数のPEG基が抗体または抗体断片に付着される条件下で反応させる。典型的には、peg化は、反応性PEG分子(または類似の反応性水溶性ポリマー)と用いたアシル化反応またはアルキル化反応を介して実施する。本明細書中で使用する用語「ポリエチレングリコール」には、モノ(C1〜C10)アルコキシ−もしくはアリールオキシ−ポリエチレングリコールまたはポリエチレングリコール−マレイミドなどの他のタンパク質を誘導体化するために使用されている、PEGの任意の形態が包含されることを意図する。特定の事例では、peg化する抗体は脱グリコシル化されている抗体である。タンパク質をpeg化する方法は当分野で知られており、本開示の抗体に適用することができる。たとえば、欧州特許EP0154316B1号およびEP0401384B1号を参照されたい。
【0141】
他の抗体の改変には、PCT公開WO99/58572号に記載のように改変された抗体が含まれる。これらの抗体は、標的分子に向けられた結合ドメインに加えて、ヒト免疫グロブリン重鎖の定常ドメインの全体または一部に実質的に相同的なアミノ酸配列を有するエフェクタードメインを含む。これらの抗体は、標的の顕著な補体依存性溶解、または細胞媒介性破壊を誘発せずに、標的分子と結合することができる。一部の実施形態では、エフェクタードメインは、FcRnおよび/またはFcγRIIbと特異的に結合することができる。これらは、典型的には、2つ以上のヒト免疫グロブリン重鎖CH2ドメインに由来するキメラドメインに基づく。この様式で改変された抗体は、従来の抗体療法に対する炎症性および他の有害な反応を回避するために、慢性抗体療法における使用に特に適している。
【0142】
融合タンパク質
また、本発明には、本発明の抗体またはポリペプチドからの1つまたは複数の断片または領域を含む融合タンパク質も包含される。一実施形態では、本発明の抗体の可変軽鎖領域の少なくとも10個の連続的なアミノ酸および/または可変重鎖領域の少なくとも10個のアミノ酸を含む融合ポリペプチドが提供される。他の実施形態では、可変軽鎖領域の少なくとも約10個、少なくとも約15個、少なくとも約20個、少なくとも約25個、もしくは少なくとも約30個の連続的なアミノ酸および/または可変重鎖領域の少なくとも約10個、少なくとも約15個、少なくとも約20個、少なくとも約25個、もしくは少なくとも約30個の連続的なアミノ酸を含む融合ポリペプチドが提供される。別の実施形態では、融合ポリペプチドは、本発明の抗体の軽鎖可変領域および/または重鎖可変領域を含む。別の実施形態では、融合ポリペプチドは、本発明の抗体の1つまたは複数のCDRを含む。本発明の目的のために、融合タンパク質は、1つまたは複数の抗体およびそれがネイティブ分子中で付着していない別のアミノ酸配列、たとえば、異種配列または別の領域からの相同配列を含有する。例示的な異種配列には、それだけには限定されないが、FLAGタグまたは6Hisタグなどの「タグ」が含まれる。
【0143】
融合ポリペプチドは、当分野で知られている方法、たとえば、合成または組換えによって作出することができる。
【0144】
二重特異性分子
本開示の抗体またはその抗原結合部分を、誘導体化するか、または別の機能的分子、たとえば、別のペプチドもしくはタンパク質(たとえば、ある受容体に対する別の抗体もしくはリガンド)と連結させて、少なくとも2つの異なる結合部位または標的分子と結合する二重特異性分子を作製することができる。本開示の抗体は、実際には、誘導体化するか、複数の他の機能的分子と連結させて、2つ以上の異なる結合部位および/または標的分子と結合する多特異性分子を作製することができる。そのような多特異性分子も本明細書中で使用する用語「二重特異性分子」によって包含されることを意図する。本開示の二重特異性分子を作出するためには、二重特異性分子がもたらされるように、本開示の抗体を、別の抗体、抗体断片、ペプチドまたは結合模倣体などの1つまたは複数の他の結合分子と機能的に連結させることができる(たとえば、化学カップリング、遺伝子融合、非共有会合または別の方法によって)。
【0145】
抗Notch−1抗体をコードしているポリヌクレオチド
また、本発明は、本発明の抗体およびペプチドをコードしている単離したポリヌクレオチド、ならびにポリヌクレオチドを含むベクターおよび宿主細胞も提供する。
【0146】
一態様では、本発明は、本発明のポリヌクレオチドのうちのいずれかを含む、医薬組成物などの組成物を提供する。一部の実施形態では、組成物は、本発明の抗体をコードしているポリヌクレオチドを含む発現ベクターを含む。他の実施形態では、組成物は、本発明の抗体またはポリペプチドのうちのいずれかをコードしているポリヌクレオチドを含む発現ベクターを含む。
【0147】
別の態様では、本発明は、本明細書中に記載のポリヌクレオチドのうちのいずれかを作製する方法を提供する。
【0148】
また、任意のそのような配列に相補的なポリヌクレオチドも本発明によって包含される。ポリヌクレオチドは一本鎖(コードもしくはアンチセンス)または二本鎖であってよく、DNA(ゲノム、cDNAもしくは合成)またはRNA分子であってよい。RNA分子には、イントロンを含有し、1対1の様式でDNA分子に対応するHnRNA分子、およびイントロンを含有しないmRNA分子が含まれる。追加のコードまたは非コード配列が、必ずしもではないが本発明のポリヌクレオチド内に存在してもよく、ポリヌクレオチドは、必ずしもではないが、他の分子および/または支持物質と連結していてもよい。
【0149】
ポリヌクレオチドは、ネイティブ配列(すなわち、抗体もしくはその一部分をコードしている内在配列)を含み得るか、またはそのような配列の変異体を含み得る。ポリヌクレオチド変異体は、ネイティブの免疫反応性分子と比較して、コードされているポリペプチドの免疫反応性が消失しないように、1つまたは複数の置換、付加、欠失および/または挿入を含有する。コードされているポリペプチドの免疫反応性に対する効果は、一般に、本明細書中に記載のように評価し得る。変異体は、好ましくは、ネイティブ抗体またはその一部分をコードしているポリヌクレオチド配列に対して少なくとも約70%の同一性、より好ましくは少なくとも約80%の同一性、さらにより好ましくは少なくとも約90%の同一性、最も好ましくは少なくとも約95%の同一性を示す。
【0150】
2つのポリヌクレオチドまたはポリペプチド配列は、2つの配列中のヌクレオチドまたはアミノ酸の配列が、以下に記載のように最大一致についてアラインメントした際に同じである場合に、「同一」であるといわれる。2つの配列間の比較は、典型的には、配列を比較ウィンドウにわたって比較して、配列類似性の局所的領域を同定および比較することによって行う。本明細書中で使用する「比較ウィンドウ」とは、2つの配列を最適にアラインメントした後に、配列を同数の連続的な位置の参照配列と比較し得る、少なくとも約20個の連続的な位置、通常は30〜約75個、または40〜約50個のセグメントをいう。
【0151】
好ましくは、「配列同一性のパーセンテージ」は、2つの最適にアラインメントした配列を少なくとも20個の位置の比較のウィンドウにわたって比較することによって決定し、比較ウィンドウ中のポリヌクレオチドまたはポリペプチド配列の部分は、2つの配列の最適なアラインメントについて、参照配列(付加または欠失を含まない)と比較して20パーセント以下、通常は5〜15パーセント、または10〜12パーセントの付加または欠失(すなわちギャップ)を含み得る。パーセンテージは、同一の核酸塩基またはアミノ酸残基が両方の配列中に存在する位置の数を決定して一致した位置の数を得て、参照配列中の合計数(すなわちウィンドウの大きさ)で除算し、結果に100を乗算して配列同一性のパーセンテージを得ることによって、計算する。
【0152】
また、またはあるいは、変異体は、ネイティブ遺伝子またはその一部分もしくは相補体に実質的に相同的であり得る。そのようなポリヌクレオチド変異体は、中等度にストリンジェントな条件下で、ネイティブ抗体をコードしている天然に存在するDNA配列(または相補的配列)とハイブリダイズすることができる。
【0153】
適切な「中等度にストリンジェントな条件」には、5×SSC、0.5%のSDS、1.0mMのEDTA(pH8.0)の溶液中での予洗、50℃〜65℃、5×SSC、終夜でのハイブリダイズ、次いで、0.1%のSDSを含有する2×、0.5×および0.2×SSCのそれぞれを用いた65℃で20分間の2回の洗浄が含まれる。
【0154】
本明細書中で使用する「高度にストリンジェントな条件」または「高ストリンジェンシー条件」とは、(1)洗浄に低イオン強度および高温、たとえば、0.015Mの塩化ナトリウム/0.0015Mのクエン酸ナトリウム/0.1%のドデシル硫酸ナトリウム、50℃を用いるもの、(2)ハイブリダイゼーション中に、0.1%のウシ血清アルブミン/0.1%のFicoll/0.1%のポリビニルピロリドン/750mMの塩化ナトリウム、75mMのクエン酸ナトリウムを含む50mMのリン酸ナトリウム緩衝液、pH6.5と共に、42℃で、ホルムアミド、たとえば、50%(v/v)のホルムアミドなどの変性剤を用いるもの、または(3)50%のホルムアミド、5×SSC(0.75MのNaCl、0.075Mのクエン酸ナトリウム)、50mMのリン酸ナトリウム(pH6.8)、0.1%のピロリン酸ナトリウム、5×デンハート溶液、超音波処理したサケ精子DNA(50μg/ml)、0.1%のSDS、および10%の硫酸デキストラン、42℃、42℃で0.2×SSC(塩化ナトリウム/クエン酸ナトリウム)および55℃で50%のホルムアミドでの洗浄、次いで、EDTAを含有する0.1×SSC、55℃からなる高ストリンジェンシー洗浄を用いるものである。当業者には、必要に応じてプローブの長さなどの要因に順応するために、温度、イオン強度などを調整する方法が認識されるであろう。
【0155】
当業者には、遺伝暗号の縮重の結果、本明細書中に記載のポリペプチドをコードしているヌクレオチド配列が多く存在することが理解されるであろう。これらのポリヌクレオチドの一部は、任意のネイティブ遺伝子のヌクレオチド配列に対して最小限の相同性しか保有しない。それにも関わらず、コドン使用頻度の相違が原因で変動するポリヌクレオチドは、本発明によって具体的に企図される。さらに、本明細書中に提供されるポリヌクレオチド配列を含む遺伝子の対立遺伝子は本発明の範囲内にある。対立遺伝子とは、ヌクレオチドの欠失、付加および/または置換などの1つまたは複数の突然変異の結果として変更される、内在性の遺伝子である。生じるmRNAおよびタンパク質は、必ずしもではないが、変更された構造または機能を有し得る。対立遺伝子は、標準の技法(ハイブリダイゼーション、増幅および/またはデータベース配列比較など)を用いて同定し得る。
【0156】
本発明のポリヌクレオチドは、化学合成、組換え方法、またはPCRを用いて得ることができる。
【0157】
組換え方法を用いてポリヌクレオチドを調製するためには、本明細書中でさらに記述するように、所望の配列を含むポリヌクレオチドを適切なベクター内に挿入することができ、立ち代って、ベクターを複製および増幅のための適切な宿主細胞内に導入することができる。ポリヌクレオチドは、当分野で知られている任意の手段によって宿主細胞内に挿入し得る。細胞は、外因性ポリヌクレオチドを直接取り込み、エンドサイトーシス、形質移入、F接合または電気穿孔によって導入することによって形質転換させる。導入された後、外因性ポリヌクレオチドは、非組込みベクター(プラスミドなど)として細胞内に維持されるか、または宿主細胞ゲノム内に組み込まれることができる。そのようにして増幅したポリヌクレオチドは、当分野で周知の方法によって宿主細胞から単離することができる。たとえばSambrookら(1989)を参照されたい。
【0158】
代替として、PCRによりDNA配列の複製が可能となる。PCR技術は当分野で周知であり、米国特許第4,683,195号、第4,800,159号、第4,754,065号および第4,683,202号、ならびにPCR:The Polymerase Chain Reaction、Mullisら編、Birkauswer Press、Boston(1994)に記載されている。
【0159】
RNAは、単離したDNAを適切なベクター中で使用し、それを適切な宿主細胞内に挿入することによって得ることができる。細胞が複製され、DNAがRNAへと転写される際に、たとえばSambrookら、(1989)、上記に記載の当業者に周知の方法を用いて、RNAを単離することができる。
【0160】
適切なクローニングベクターは、標準の技法に従って構築し得るか、または当分野で利用可能な多数のクローニングベクターから選択され得る。選択されるクローニングベクターは使用を意図する宿主細胞に応じて変動し得るが、有用なクローニングベクターは、一般に、自己複製する能力を有し、特定の制限エンドヌクレアーゼの単一の標的を保有し得る、および/またはベクターを含有するクローンの選択に使用することができるマーカーの遺伝子を有し得る。適切な例には、プラスミドおよび細菌ウイルス、たとえば、pUC18、pUC19、Bluescript(たとえばpBS SK+)およびその誘導体、mp18、mp19、pBR322、pMB9、ColE1、pCR1、RP4、ファージDNA、ならびにpSA3およびpAT28などのシャトルベクターが含まれる。これらおよび多くの他のクローニングベクターが、BioRad、Strategene、およびInvitrogenなどの商業的供給業者から入手可能である。
【0161】
発現ベクターは、一般に、本発明によるポリヌクレオチドを含有する複製可能なポリヌクレオチド構築体である。発現ベクターは、エピソームとしてまたは染色体DNAの一体部分として宿主細胞中で複製可能でなければならないことが暗示されている。適切な発現ベクターには、それだけには限定されないが、プラスミド、アデノウイルス、アデノ関連ウイルス、レトロウイルスを含めたウイルスベクター、コスミド、およびPCT公開WO87/04462号に開示されている発現ベクターが含まれる。ベクター構成成分には、一般に、それだけには限定されないが、シグナル配列、複製起点、1つもしくは複数のマーカー遺伝子、適切な転写性制御要素(プロモーター、エンハンサーおよびターミネーターなど)のうちの1つまたは複数が含まれ得る。発現(すなわち翻訳)には、リボソーム結合部位、翻訳開始部位、およびストップコドンなどの1つまたは複数の翻訳制御要素も通常は必要である。
【0162】
目的のポリヌクレオチドを含有するベクターは、電気穿孔、塩化カルシウム、塩化ルビジウム、リン酸カルシウム、DEAE−デキストラン、または他の物質を用いた形質移入、微粒子銃、リポフェクション、および感染(たとえば、ベクターがワクシニアウイルスなどの感染性因子である場合)を含めたいくつかの適切な手段のうちのいずれかによって宿主細胞内に導入することができる。ベクターまたはポリヌクレオチドを導入する選択は、多くの場合、宿主細胞の特長に依存する。
【0163】
また、本発明は、本明細書中に記載のポリヌクレオチドのうちのいずれかを含む宿主細胞も提供する。異種DNAを過剰発現することができる任意の宿主細胞を、目的の抗体、ポリペプチドまたはタンパク質をコードしている遺伝子を単離する目的に使用することができる。哺乳動物宿主細胞の非限定的な例には、それだけには限定されないが、COS、HeLa、およびCHO細胞が含まれる。PCT公開WO87/04462号も参照されたい。適切な非哺乳動物宿主細胞には、原核生物(大腸菌(E.coli)または枯草菌(B.subtillis)など)および酵母(出芽酵母(S.cerevisae)、分裂酵母(S.pombe)、またはケー・ラクチス(K.lactis))が含まれる。好ましくは、宿主細胞は、宿主細胞中に存在する場合は対応する内在性抗体または目的のタンパク質よりも約5倍以上、より好ましくは、10倍以上、さらにより好ましくは、20倍以上のレベルでcDNAを発現する。宿主細胞をNotch−1またはNotch−1ドメインとの特異的結合についてスクリーニングすることは、免疫アッセイまたはFACSによって達成する。目的の抗体またはタンパク質を過剰発現する細胞を同定することができる。
【0164】
医薬組成物
別の態様では、本開示は、薬学的に許容できる担体と一緒に配合した、本開示のモノクローナル抗体またはその抗原結合部分(複数可)のうちの1つまたは組合せを含有する組成物、たとえば医薬組成物を提供する。そのような組成物には、本開示1つもしくは組合せの(たとえば2つ以上の異なる)抗体、または免疫コンジュゲートもしくは二重特異性分子が含まれ得る。たとえば、本開示の医薬組成物は、標的抗原上の異なるエピトープと結合する、または相補的活性を有する、抗体(または免疫コンジュゲートもしくは二重特異性抗体)の組合せを含むことができる。
【0165】
また、本開示の医薬組成物は、組合せ療法で、すなわち他の薬剤と組み合わせて投与することもできる。たとえば、組合せ療法には、少なくとも1つの他の抗炎症剤または免疫抑制剤と組み合わせた、本開示の抗Notch1抗体が含まれることができる。組合せ療法で使用することができる治療剤の例は、以下の本開示の抗体の使用のセクション中にさらに詳述されている。
【0166】
本明細書中で使用する「薬学的に許容できる担体」には、生理的に適合性のある任意かつすべての溶媒、分散媒、コーティング、抗細菌剤および抗真菌剤、等張化剤および吸収遅延剤などが含まれる。典型的には、担体は、静脈内、筋肉内、皮下、非経口、脊髄または表皮投与(たとえば、注射またはインフュージョンによる)に適している。投与経路に応じて、活性化合物、すなわち、抗体、その抗原結合部分、免疫コンジュゲート(immunoconjuage)、または二重特異性分子は、酸および化合物を失活させ得る他の天然条件の作用から化合物を保護するために、物質でコーティングし得る。
【0167】
特定の実施形態では、本開示の抗体は、中性の形態(双極性イオン形態が含まれる)または正もしくは負荷電の種として存在し得る。一部の事例では、抗体は、対イオンと複合して、薬学的に許容できる塩を形成し得る。したがって、本開示の医薬化合物には、1つまたは複数の薬学的に許容できる塩が含まれ得る。
【0168】
「薬学的に許容できる塩」とは、親化合物(たとえば抗体)の所望の生物活性を保持しており、かつ望ましくない毒性効果を与えない塩をいう(たとえばBerge,S.M.ら(1977)J.Pharm.Sci.、66:1〜19を参照)。たとえば、用語「薬学的に許容できる塩」には、1つまたは複数の抗体および1つまたは複数の対イオンを含む複合体が含まれ、対イオンは、薬学的に許容できる無機および有機の酸および塩基に由来する。
【0169】
そのような塩の例には、酸付加塩および塩基付加塩が含まれる。酸付加塩には、塩酸、硝酸、リン酸、硫酸、臭化水素酸、ヨウ化水素酸、リンなどの無毒性の無機酸、ならびに脂肪族モノおよびジカルボン酸、フェニル置換のアルカン酸、ヒドロキシアルカン酸、芳香族酸、脂肪族および芳香族のスルホン酸などの無毒性の有機酸に由来するものが含まれる。塩基付加塩には、ナトリウム、カリウム、マグネシウム、カルシウムなどのアルカリ土類金属、およびN,N’−ジベンジルエチレンジアミン、N−メチルグルカミン、クロロプロカイン、コリン、ジエタノールアミン、エチレンジアミン、プロカインなどの無毒性の有機アミンに由来するものが含まれる。
【0170】
さらに、薬学的に許容できる無機塩基には金属イオンが含まれる。金属イオンには、それだけには限定されないが、適切なアルカリ金属塩、アルカリ土類金属塩および他の生理学的に許容できる金属イオンが含まれる。無機塩基に由来する塩には、その通常の原子価のアルミニウム、アンモニウム、カルシウム、コバルト、ニッケル、モリブデン、バナジウム、マンガン、クロム、セレン、スズ、銅、三価鉄、二価鉄、リチウム、マグネシウム、第二マンガン塩、第一マンガン、カリウム、ルビジウム、ナトリウム、および亜鉛が含まれる。
【0171】
本開示の抗体の薬学的に許容できる酸付加塩は、それだけには限定されないが、ギ酸、酢酸、アセトアミド安息香酸、アジピン酸、アスコルビン酸、ホウ酸、プロピオン酸、安息香酸、ショウノウ酸、炭酸、シクラミン酸、デヒドロコール酸、マロン酸、エデト酸、エチル硫酸、フェンジゾ酸、メタリン酸、コハク酸、グリコール酸、グルコン酸、乳酸、リンゴ酸、酒石酸、タンニン酸、クエン酸、硝酸、アスコルビン酸、グルクロン酸、マレイン酸、葉酸、フマル酸、プロピオン酸、ピルビン酸、アスパラギン酸、グルタミン酸、安息香酸、塩酸、臭化水素酸、ヨウ化水素酸、リシン、イソクエン酸、トリフルオロ酢酸、パモン酸、プロピオン酸、アントラニル酸、メシル酸、オロト酸、シュウ酸、オキサロ酢酸、オレイン酸、ステアリン酸、サリチル酸、アミノサリチル酸、ケイ酸、p−ヒドロキシ安息香酸、ニコチン酸、フェニル酢酸、マンデル酸、エンボン酸、スルホン酸、メタンスルホン酸、リン酸、ホスホン酸、エタンスルホン酸、エタンジスルホン酸、アンモニウム、ベンゼンスルホン酸、パントテン酸、ナフタレンスルホン酸、トルエンスルホン酸、2−ヒドロキシエタンスルホン酸、スルファニル酸、硫酸、硝酸、亜硝酸、硫酸モノメチルエステル、シクロヘキシルアミノスルホン酸、β−ヒドロキシ酪酸、グリシン、グリシルグリシン、グルタミン酸、カコジル酸、ジアミノヘキサン酸、ショウノウスルホン酸、グルコン酸、チオシアン酸、オキソグルタル酸、ピリドキサル5−リン酸、クロロフェノキシ酢酸、ウンデカン酸、N−アセチル−L−アスパラギン酸、ガラクタル酸およびガラクツロン酸を含めた酸から調製することができる。
【0172】
薬学的に許容できる有機塩基には、トリメチルアミン、ジエチルアミン、N,N’−ジベンジルエチレンジアミン、クロロプロカイン、コリン、ジベンジルアミン、ジエタノールアミン、エチレンジアミン、メグルミン(N−メチルグルカミン)、プロカイン、環状アミン、第四級アンモニウム陽イオン、アルギニン、ベタイン、カフェイン、クレミゾール、2−エチルアミノエタノール、2−ジエチルアミノエタノール、2−ジメチルアミノエタノール、エタンジアミン、ブチルアミン、エタノールアミン、エチレンジアミン、N−エチルモルホリン、N−エチルピペリジン、エチルグルカミン、グルカミン、グルコサミン、ヒスチジン、ヒドラバミン、イミダゾール、イソプロピルアミン、メチルグルカミン、モルホリン、ピペラジン、ピリジン、ピリドキシン、ネオジム、ピペリジン、ポリアミン樹脂、プロカイン、プリン、テオブロミン、トリエチルアミン、トリプロピルアミン、トリエタノールアミン、トロメタミン、メチルアミン、タウリン、コレート、6−アミノ−2−メチル−2−ヘプタノール、2−アミノ−2−メチル−1,3−プロパンジオール、2−アミノ−2−メチル−1−プロパノール、脂肪族モノおよびジカルボン酸、フェニル置換のアルカン酸、ヒドロキシアルカン酸、芳香族酸、脂肪族および芳香族のスルホン酸、ストロンチウム、トリシン、ヒドラジン、フェニルシクロヘキシルアミン、2−(N−モルホリノ)エタンスルホン酸、ビス(2−ヒドロキシエチル)アミノ−トリス(ヒドロキシメチル)メタン、N−(2−アセトアミド)−2−アミノエタンスルホン酸、1,4−ピペラジンジエタンスルホン酸、3−モルホリノ−2−ヒドロキシプロパンスルホン酸、1,3−ビス[トリス(ヒドロキシメチル)メチルアミノ]プロパン、4−モルホリンプロパンスルホン酸、4−(2−ヒドロキシエチル)ピペラジン−1−エタンスルホン酸、2−[(2−ヒドロキシ−1,1−ビス(ヒドロキシメチル)エチル)アミノ]エタンスルホン酸、N,N−ビス(2−ヒドロキシエチル)−2−アミノエタンスルホン酸、4−(N−モルホリノ)ブタンスルホン酸、3−(N,N−ビス[2−ヒドロキシエチル]アミノ)−2−ヒドロキシプロパンスルホン酸、2−ヒドロキシ−3−[トリス(ヒドロキシメチル)メチルアミノ]−1−プロパンスルホン酸、4−(2−ヒドロキシエチル)ピペラジン−1−(2−ヒドロキシプロパンスルホン酸)、ピペラジン−1,4−ビス(2−ヒドロキシプロパンスルホン酸)二水和物、4−(2−ヒドロキシエチル)−1−ピペラジンプロパンスルホン酸、N,N−ビス(2−ヒドロキシエチル)グリシン、N−(2−ヒドロキシエチル)ピペラジン−N’−(4−ブタンスルホン酸)、N−[トリス(ヒドロキシメチル)メチル]−3−アミノプロパンスルホン酸、N−トリス(ヒドロキシメチル)メチル−4−アミノブタンスルホン酸、N−(1,1−ジメチル−2−ヒドロキシエチル)−3−アミノ−2−ヒドロキシプロパンスルホン酸、2−(シクロヘキシルアミノ)エタンスルホン酸、3−(シクロヘキシルアミノ)−2−ヒドロキシ−1−プロパンスルホン酸、3−(シクロヘキシルアミノ)−1−プロパンスルホン酸、N−(2−アセトアミド)イミノジ酢酸、4−(シクロヘキシルアミノ)−1−ブタンスルホン酸、N−[トリス(ヒドロキシメチル)メチル]グリシン、2−アミノ−2−(ヒドロキシメチル)−1,3−プロパンジオール、およびトロメタモールが含まれる。
【0173】
また、本開示の医薬組成物には薬学的に許容できる抗酸化剤も含まれ得る。薬学的に許容できる抗酸化剤の例には、(1)アスコルビン酸、塩酸システイン、硫酸水素ナトリウム、メタ亜硫酸水素ナトリウム、亜硫酸ナトリウムなどの水溶性抗酸化剤、(2)パルミチン酸アスコルビル、ブチル化ヒドロキシアニソール(BHA)、ブチル化ヒドロキシトルエン(BHT)、レシチン、没食子酸プロピル、アルファ−トコフェロールなどの油可溶性抗酸化剤、ならびに(3)クエン酸、エチレンジアミン四酢酸(EDTA)、ソルビトール、酒石酸、リン酸などの金属キレート化剤が含まれる。
【0174】
本開示の医薬組成物中で用い得る適切な水性および非水性の担体の例には、水、エタノール、ポリオール(グリセロール、プロピレングリコール、ポリエチレングリコールなど)、およびその適切な混合物、オリーブ油などの植物油、ならびにオレイン酸エチルなどの注射用有機エステルが含まれる。適切な流動性は、たとえば、レシチンなどのコーティング物質を使用することによって、分散液の場合は所要の粒子径を維持することによって、および界面活性剤を使用することによって、維持することができる。
【0175】
また、これらの組成物は、保存料、湿潤剤、乳化剤および分散剤などのアジュバントも含有し得る。微生物の存在の防止は、滅菌手順、上記によって、ならびに様々な抗細菌剤および抗真菌剤、たとえば、パラベン、クロロブタノール、フェノールソルビン酸などを含めることによって、確実にし得る。また、糖、塩化ナトリウムなどの等張化剤を組成物内に含めることも望ましい場合がある。さらに、注射用医薬形態の長期的吸収は、モノステアリン酸アルミニウムおよびゼラチンなどの、吸収を遅延させる薬剤を含めることによってもたらし得る。
【0176】
薬学的に許容できる担体には、無菌的な水溶液または分散液ならびに無菌的な注射用液剤または分散液を即時調製するための無菌的な粉末が含まれる。医薬上活性のある物質のためのそのような媒体および薬剤の使用は、当分野で知られている。任意の従来の媒体または薬剤が活性化合物と不適合である場合以外は、本開示の医薬組成物におけるその使用が企図される。また、補助的活性化合物も組成物内に組み込むことができる。
【0177】
治療的組成物は、典型的には、製造および貯蔵の条件下で無菌的かつ安定でなければならない。組成物は、溶液、マイクロエマルジョン、リポソーム、または高い薬物濃度に適した他の規則的な構造として配合することができる。担体は、たとえば、水、エタノール、ポリオール(たとえば、グリセロール、プロピレングリコール、および液体ポリエチレングリコールなど)、ならびにその適切な混合物を含有する溶媒または分散媒であってもよい。適正の流動性は、たとえば、レシチンなどのコーティングを使用することによって、分散液の場合は所要の粒子径を維持することによって、および界面活性剤を使用することによって、維持することができる。多くの場合、等張化剤、たとえば、糖、マンニトール、ソルビトールなどのポリアルコール、または塩化ナトリウムを組成物中に含めることが好ましい。注射用組成物の長期的吸収は、吸収を遅延させる薬剤、たとえば、モノステアリン酸塩およびゼラチンを組成物中に含めることによってもたらすことができる。
【0178】
無菌注射用液剤は、所要量の活性化合物を適切な溶媒中、必要に応じて上記に列挙した成分のうちの1つまたは組合せと共に取り込ませ、次いで滅菌精密濾過することによって、調製することができる。一般に、分散液は、活性化合物を、基本分散媒および上記に列挙したものからの所要の他の成分を含有する無菌的なビヒクル内に取り込ませることによって調製する。無菌的な注射用液剤を調製するための無菌的な粉末の場合、調製方法には、それだけには限定されないが、以前に滅菌濾過したその溶液からの活性成分および任意の追加の所望の成分の粉末を与える、真空乾燥および凍結乾燥(freeze−drying、lyophilization)が含まれる。
【0179】
担体物質と組み合わせて単一剤形を生じることができる活性成分の量は、処置する対象および具体的な投与様式に応じて変動する。担体物質と組み合わせて単一剤形を生じることができる活性成分の量は、一般に、治療効果を生じる組成物の量である。一般に、この量は、100パーセントのうち、薬学的に許容できる担体と組み合わせて約0.01パーセント〜約99パーセントの活性成分、好ましくは約0.1パーセント〜約70パーセント、最も好ましくは約1パーセント〜約30パーセントの活性成分の範囲となる。
【0180】
最適な所望の応答(たとえば治療反応)を提供するために投薬レジメンを調整する。たとえば、単一のボーラスを投与し得るか、いくつかの分割した用量を経時的に投与し得るか、または治療状況の急迫によって指示されるように用量を比例的に低下もしくは増加させ得る。投与の容易性および投薬の均質性のために、非経口組成物を単位剤形で配合することが特に有利である。本明細書中で使用する単位剤形とは、処置する対象の単位用量として適した物理的に別個の単位をいい、それぞれの単位は、所要の医薬担体と共同して所望の治療効果を生じるように計算された、事前に決定された量の活性化合物を含有する。本開示の単位剤形の仕様は、(a)活性化合物の独特の特徴および達成しようとする特定の治療効果、ならびに(b)個体において感受性を処置するための、そのような活性化合物を化合する分野に固有の制限によって指示され、それに直接依存する。
【0181】
抗体の投与には、用量は宿主の体重1kgあたり約0.0001〜100mg、より通常は0.01〜5mgの範囲である。たとえば、用量は、0.3mg/体重1kg、1mg/体重1kg、3mg/体重1kg、5mg/体重1kgもしくは10mg/体重1kg、または1〜10mg/kgの範囲内とすることができる。例示的な処置レジームは、週に1回、2週間に1回、3週間に1回、4週間に1回、月に1回、3カ月に1回、または3〜6カ月に1回の投与を必要とする。本開示の抗Notch−1抗体またはその抗原結合部分の投薬レジメンには、たとえば、静脈内投与による1mg/体重1kgまたは3mg/体重1kgが含まれ、抗体は、(i)4週間毎に6回の投薬、その後に3カ月毎、(ii)3週間毎、(iii)3mg/体重1kgを1回、次いで1mg/体重1kgを3週間毎の投薬スケジュールのうちの1つを用いて与える。
【0182】
一部の方法では、異なる結合特異性を有する2つ以上のモノクローナル抗体を同時に投与し、その場合、投与するそれぞれの抗体の用量は示した範囲内にある。抗体は、通常、複数回で投与する。単一投薬の間の間隔は、たとえば、週に1回、月に1回、3カ月毎または年に1回とすることができる。また、間隔は、患者中の標的抗原に対する抗体の血液レベルを測定することによって指示されるように、不規則であることもできる。一部の方法では約1〜1000μg/ml、一部の方法では約25〜300μg/mlの血漿抗体濃度が達成されるように、用量を調整する。
【0183】
代替として、抗体は持続放出配合物として投与することができ、その場合、より低い頻度の投与が必要である。用量および頻度は、患者における抗体の半減期に応じて変動する。一般に、ヒト抗体が最も長い半減期を示し、次いでヒト化抗体、キメラ抗体、および非ヒト抗体である。投与の用量および頻度は、処置が予防的または治療的であるかに応じて変動する場合がある。予防的な応用では、比較的低い用量を比較的低い頻度の間隔で長期的に投与する。一部の患者は、その残りの寿命の間、処置を受け続ける。治療的な応用では、比較的短い間隔の比較的高い用量が、疾患の進行が低減または終結するまで、好ましくは患者が疾患の症状の部分的または完全な改善を示すまで必要な場合がある。それ以降、患者に予防的レジームを投与することができる。
【0184】
本開示の医薬組成物中の活性成分の実際の用量レベルは、患者に対して毒性とならずに、特定の患者、組成物、および投与様式について所望の治療反応を達成するために有効な活性成分の量を得るために、変動させ得る。選択される用量レベルは、用いる本開示の特定の組成物、またはそのエステル、塩もしくはアミドの活性、投与経路、投与時間、用いる特定の化合物の排泄率、処置の持続期間、用いる特定の組成物と組み合わせて使用する他の薬物、化合物および/または物質、処置する患者の年齢、性別、重量、状態、全体的な健康および以前の病歴、ならびに医学分野で周知の同様の要因を含めた、様々な薬物動態学要因に依存する。
【0185】
本開示の抗Notch抗体の「治療上有効な用量」は、好ましくは、疾患の症状の重篤度の減少、疾患症状のない期間頻度および持続期間の増加、または疾患の罹患が原因の機能障害もしくは身体障害の予防をもたらす。たとえば、Notch−1−陽性腫瘍の処置には、「治療上有効な用量」は、非処置の対象と比較して、細胞成長または腫瘍増殖を好ましくは少なくとも約20%、より好ましくは少なくとも約40%、さらにより好ましくは少なくとも約60%、さらにより好ましくは少なくとも約80%阻害する。腫瘍増殖を阻害する化合物の能力は、ヒト腫瘍における有効性を予測する動物モデル系において評価することができる。あるいは、組成物のこの特性は、当業者に知られているアッセイによって、in vitroの阻害などの、化合物の阻害する能力を検査することによって、評価することができる。治療上有効な量の治療的化合物は、腫瘍の大きさを減少させるか、または対象における症状を他の形で改善することができる。当業者は、対象の大きさ、対象の症状の重篤度、および選択した特定の組成物または投与経路などの要因に基づいてそのような量を決定できるであろう。
【0186】
本開示の組成物は、1つまたは複数の投与経路を介して、当分野で知られている様々な方法のうちの1つまたは複数を用いて投与することができる。当業者によって理解されるように、経路および/または投与様式は所望の結果に応じて変動する。本開示の抗体またはその抗原結合部分のための投与経路には、静脈内、筋肉内、皮内、腹腔内、皮下、脊髄または他の非経口投与経路、たとえば注射または注入によるものが含まれる。本明細書中で使用する語句「非経口投与」とは、経腸および局所投与以外の投与様式、通常は注射によるものを意味し、それだけには限定されないが、静脈内、筋肉内、動脈内、くも膜下腔内、嚢内、眼窩内、心臓内、皮内、腹腔内、経気管、皮下、表皮下、関節内、被膜下、くも膜下、脊髄内、硬膜外および胸骨内の注射および注入が含まれる。
【0187】
代替として、本開示の抗体またはその抗原結合部分は、局所、表皮または粘膜の投与経路、たとえば、鼻腔内、経口、経膣、直腸、舌下または局所などの、非経口でない経路を介して投与することができる。
【0188】
活性化合物は、移植片、経皮パッチ、およびマイクロカプセル封入送達系を含めた徐放性配合物など、化合物を迅速な放出に対して保護する担体を用いて調製することができる。エチレン酢酸ビニル、ポリ酸無水物、ポリグリコール酸、コラーゲン、ポリオルトエステル、およびポリ乳酸などの、生分解性の生体適合性ポリマーを使用することができる。そのような配合物を調製するための多くの方法が、特許取得されている、または当業者に一般に知られている。たとえばSustained and Controlled Release Drug Delivery Systems、J.R.Robinson編、Marcel Dekker,Inc.、New York、1978を参照されたい。
【0189】
本開示の使用および方法
本開示の抗体、特にヒト抗体、抗体組成物および方法は、Notch−1媒介性の障害の診断および処置に関与する、数々のin vitroおよびin vivoの診断的および治療的な利用性を有する。たとえば、様々な障害を処置、予防および診断するために、これらの分子を、培養中の細胞にin vitroもしくはex vivoで、またはヒト対象にたとえばin vivoで投与することができる。本明細書中で使用する用語「対象」には、ヒトおよび非ヒト動物が含まれることが意図される。非ヒト動物には、すべての脊椎動物、たとえば、非ヒト霊長類、ヒツジ、イヌ、ネコ、ウシ、ウマ、ニワトリ、両生類、および爬虫類などの哺乳動物および非哺乳動物が含まれる。好ましい対象には、Notch−1活性によって媒介される障害を有するヒト患者が含まれる。この方法は、異常なNotch−1発現または活性化に関連する障害を有するヒト患者の処置に特に適している。Notch−1に対する抗体を別の薬剤と一緒に投与する場合、2つはいずれの順序で、または同時に投与することができる。
【0190】
Notch−1に対する本開示の抗体の特異的結合を考慮して、本開示の抗体は、細胞の表面上のNotch−1発現を特異的に検出するために使用することができ、さらに、免疫親和性精製によってNotch−1を精製するために使用することができる。
【0191】
さらに、本開示の抗体、抗体組成物および方法は、異常細胞成長、たとえば癌を有する対象を処置するために使用することができる。特定の一実施形態では、癌はT−ALLである。別の特定の実施形態では、癌は乳癌である。
【0192】
本発明の抗体によって処置し得る他の種類の異常細胞成長には、たとえば、中皮腫、肝胆道(肝管および胆管)、原発性もしくは続発性のCNS腫瘍、原発性もしくは続発性の脳腫瘍、肺癌(NSCLCおよびSCLC)、骨癌、膵癌、皮膚癌、頭部もしくは頚部の癌、皮膚もしくは眼内の黒色腫、卵巣癌、結腸癌、直腸癌、肛門部の癌、胃癌、胃腸管系(胃、結腸直腸、および十二指腸)、乳癌、子宮癌、輸卵管の癌腫、子宮内膜の癌腫、子宮頚部の癌腫、膣の癌腫、外陰部の癌腫、ホジキン病、食道の癌、小腸の癌、内分泌系の癌、甲状腺の癌、副甲状腺の癌、副腎の癌、軟組織の肉腫、尿道の癌、陰茎の癌、前立腺癌、精巣癌、慢性もしくは急性の白血病、慢性骨髄性白血病、リンパ球性リンパ腫、膀胱の癌、腎臓もしくは輸尿管の癌、腎細胞癌、腎盂の癌腫、中枢神経系(CNS)の新生物、原発性CNSリンパ腫、非ホジキンリンパ腫、脊髄軸腫瘍、脳幹神経膠腫、下垂体腺腫、副腎皮質癌、胆嚢癌、多発性骨髄腫、胆管癌、線維肉腫、神経芽細胞腫、網膜芽細胞腫、または前述の癌のうちの1つもしくは複数の組合せが含まれる。
【0193】
本開示の抗体組成物(たとえば、ヒトモノクローナル抗体、多特異性および二重特異性分子ならびに免疫コンジュゲート)またはその抗原結合部分をin vivoおよびin vitroで投与する適切な経路は当分野で周知であり、当業者によって選択されることができる。たとえば、抗体組成物は、注射(たとえば、静脈内または皮下)によって投与することができる。使用する分子の適切な用量は、対象の年齢および重量ならびに抗体組成物の濃度および/または配合に依存する。
【0194】
既に記載のように、本開示のヒト抗Notch−1抗体またはその抗原結合部分は、1つまたは他の複数の治療剤、たとえば、細胞毒性剤、放射性毒性剤または免疫抑制剤と共に同時投与することができる。抗体は、薬剤と連結させることができるか(免疫複合体として)、または薬剤とは分離して投与することができる。後者の場合(別々の投与)、抗体は、薬剤の前、後、もしくはそれと同時に投与することができるか、または他の既知の治療、たとえば抗癌治療、たとえば放射線と同時投与することができる。そのような治療剤には、とりわけ、それ自体では患者に対して毒性または準毒性なレベルでのみ有効な、ドキソルビシン(アドリアマイシン)、シスプラチン、硫酸ブレオマイシン、カルムスチン、クロラムブシル、およびシクロホスファミドヒドロキシ尿素などの抗新生物剤が含まれる。シスプラチンは、4週間に1回の100mg/用量として静脈内投与することができ、adriamycinは、21日に1回の60〜75mg/mlの用量として静脈内投与する。本開示のヒト抗Notch−1抗体またはその抗原結合断片と化学療法剤との同時投与は、異なる機構を介して作動する2つの抗癌剤を提供し、これにより、ヒト腫瘍細胞に対する細胞毒性効果が得られる。そのような同時投与は、薬物に対する耐性の発生、または、腫瘍細胞の、抗体に対するそれらの反応性を失わせる抗原性の変化が原因の問題を解決することができる。
【0195】
キット
また、本開示の抗体組成物(たとえば、ヒト抗体、二重特異性もしくは多特異性分子、または免疫コンジュゲート)および使用説明書を含むキットも、本開示の範囲内にある。キットは、1つもしくは複数の追加の試薬、たとえば、免疫抑制性試薬、細胞毒性剤もしくは放射性毒性剤、または本開示の1つもしくは複数の追加の抗体もしくはその抗原結合部分(たとえば、第1のヒト抗体とは明確に異なる、Notch−1抗原中のエピトープと結合する相補的活性を有するヒト抗体)をさらに含有することができる。
【0196】
したがって、本開示の抗体組成物で処置した患者に、ヒト抗体の治療効果を増強または増大させる、細胞毒性剤または放射性毒性剤などの別の治療剤をさらに投与することができる(本開示のヒト抗体を投与する前、それと同時に、またはその後)。
【0197】
本開示は、さらに限定すると解釈されるべきでない以下の実施例によって、さらに例示される。本出願中で言及するすべての図ならびにすべての参考文献、特許および公開特許出願の内容は、明白に本明細書中に参照により組み込まれる。
【実施例】
【0198】
(実施例1)
Notch1免疫原の作製および発現
Notch1免疫原発現構築体の作製
免疫原構築体は、モノクローナル抗体(mAb)を作製するための多重鎖形成PCR(図1)によって作製した。図1中に例示するように、Notch1免疫原のcDNAを、複数重複PCRによって、Notch1完全長cDNAクローンを鋳型として(OriGene、カタログ番号TC308883、メリーランド州Rockville)、およびHigh Fidelity PCR試薬システムを使用し、製造者のプロトコルに従って(Roche、インディアナ州Indianapolis)合成した。N末端リーダーペプチド、EGF様反復35〜36、NRR、(Lin A、BおよびCドメインならびにHDドメインが含まれる)ならびに細胞内配列の小さな一部分を含有する、組換えNotch1免疫原のcDNAを、Notch1免疫原をFc配列のN末端と融合させたFc融合タンパク質ベクター中にクローニングした。N1−NRR−TM(−)と呼ばれるNotch1免疫原プラスミドは、図11中の配列2(配列番号2)に示す免疫原タンパク質をコードしている図11中の配列1(配列番号1)に示されるcDNA挿入物を含有する。
【0199】
並行して、膜貫通(TM)配列(配列4中の最後の24個のアミノ酸残基)を使用してN1−NRR−TM(−)の細胞内配列(配列2中の最後の44個のアミノ酸残基)を置き換えた以外はN1−NRR−TM(−)と同じ配列を含有する、図2中に示す同様のプラスミドを構築した。このPCR増幅したNotch1免疫原のcDNAをpcDNA3.1D/V5−His(Invitrogen)中にクローニングした。このプラスミドはN1−NRR−TM(+)と呼ぶ。N1−NRR−TM(+)の核酸配列およびアミノ酸配列は、図12中に配列3(配列番号3)および4(配列番号4)として示す。
【0200】
Notch1免疫原タンパク質の発現および精製
N1−NRR−TM(−)を、Freestyle(商標)293−F細胞(Invitrogen,Inc.、カリフォルニア州Calsbad)中で、Freestyle(商標)Max試薬(Invitrogen)および製造者のプロトコルを使用した一過性の形質移入によって発現させ、ウエスタンブロット分析によって確認した。手短に述べると、1×107個の細胞を、30ミリリットル(ml)の293−F細胞成長培地(Invitrogen)を含有する組織培養振盪フラスコ中に播種した。0.5mlの馴化培地のアリコートを形質移入後の2日目から7日目まで24時間毎に取ることによって、分泌されたタンパク質を分析した。20マイクロリットル(ul)の馴化培地および2×タンパク質試料ローディング緩衝液(BioRad、カリフォルニア州Hercules)を合わせ、100℃で5分間加熱した。試料を電気泳動によって4〜12%の勾配のSDS−PAGE(Invitrogen)で分離した。タンパク質を、ドライブロット装置(Invitrogen)を用いてゲルからブロット膜へと移し、その後、膜を、PBST(0.05%のtween−20を含むPBS)中の5%の無脂肪乾燥乳溶液で1時間ブロッキングした。N1−MRRHD−TM(−)/Fc融合タンパク質の検出は、ヒトγFcに特異的な、HRPとコンジュゲートさせた抗体(Bethyl Lab.Inc.、テキサス州Montgomery)とのインキュベーションによって行った。膜をPBSTで3回洗浄した後、Supersignal化学発光基質(Pierce、イリノイ州Rockford)で展開させた。タンパク質発現の時間経過の研究により、5〜6日間の培養物の馴化培地が最多の分泌されたN1−NRR−TM(−)/Fc融合タンパク質を含有していたことが示された。したがって、N1−NRR−TM(−)/Fcタンパク質の発現を10リットルの培養体積にスケールアップし、プロテインG親和性カラム(Invitrogen)によってタンパク質を精製した。
【0201】
Notch1免疫原を発現する細胞系の確立
N1−NRR−TM(+)をマウス細胞系、L−929(ATCC、CCL−1、バージニア州Manassas)中に安定に形質移入させ、細胞表面膜固定タンパク質として発現させた。安定な細胞系はLipoFectamine(商標)2000(Invitrogen)を用いた形質移入によって確立され、細胞を、個々のコロニーが目に見えるまで約9〜15日間、1mg/mlのネオマイシン(G418)に対して選択し、クローン増殖のために拾った。N1−NRR−TM(+)/V5タンパク質の発現レベルは、それぞれの安定な形質移入クローンから作製したタンパク質抽出物を用いたウエスタンブロットによって評価した。より詳細には、それぞれのクローンの細胞を培養容器から取り出し、リン酸緩衝溶液(PBS)ですすぎ、上述のようにウエスタンブロット分析に供した。タンパク質は、HRPとコンジュゲートさせた抗V5抗体(Invitrogen)によって検出した。最も高いレベルのN1−NRR−TM(+)タンパク質を発現する細胞クローンを、免疫化および細胞に基づく抗体結合アッセイの使用のために選択した。
【0202】
(実施例2)
Notch1mAbの作製
免疫化およびハイブリドーマクローニング
Balb/cマウスを、ヒトNotch1免疫原、N1−NRR−TM(−)、および長い免疫化プロトコルを用いて免疫化した。第1の免疫化は、完全フロイントアジュバント(CFA)乳濁液中に混合した20マイクログラム(μg)の抗原を用いた皮下(sc)注射、次いで、それぞれが不完全フロイントアジュバント(IFA)乳濁液中に混合した20μgの抗原を送達する3回の隔週のsc注射によって与えた。4回目の抗原注射の1週間後に血清を採取して、抗体の力価をELISAによって確認した。高い応答力価を有するマウスを安楽死させ、ハイブリドーマクローニングのために脾臓を外科的に取り出した。
【0203】
脾臓細胞の単一の細胞懸濁液は、脾臓を、100ミクロンのステンレス鋼製スクリーン、その後、細胞濾過器に押し通し、30mlのRPMIで2回洗浄することによって調製した。脾臓細胞をSp2/0−Ag14細胞(Sigma、モンタナ州St.Louis)と3対1の比で混合し、50%のPEG−1500を加えて穏やかに攪拌することによって、細胞融合を促進した。細胞の混合物を遠心分離によって沈殿させ、RPMIで穏やかに洗浄し、次いで、20%のウシ胎児血清(FCS)を含むRPMI−1640培地中、37℃で30分間インキュベーションした。細胞を、20%のFCS、標準のHAT(ヒポキサンチン、アミノプテリンおよびチミジン)、25%の脾臓馴化培地、2mMのグルタミン酸ならびに100ug/mlのPen−Strip(Invitrogen、カリフォルニア州Calsbad)を含有するRPMI−1640中に懸濁させ、96ウェルプレートに分注し、37℃/5%CO2インキュベーター中で8〜20日間培養して、HAT耐性ハイブリドーマクローンを確立させた。それぞれのハイブリドーマクローンからの馴化培地をELISAスクリーニングに供した。
【0204】
モノクローナル抗体(mAb)のELISAスクリーニング
酵素結合免疫吸着アッセイ(ELISA)は、2組で調製したNunc(商標)MaxiSorp96ウェルプレート(ThermoFisher Scientific、ニューヨーク州Rochester)を用いて行った。陽性試験プレートは、それぞれウェルにおいて100ngのN1−NRR−TM(−)/Fcタンパク質で終夜コーティングし、陰性対照プレートは100ngのヒトFcタンパク質でコーティングした。ハイブリドーマクローンからの馴化培地を、N1−NRR−TM(−)/Fcタンパク質と結合するその能力についてスクリーニングした。100マイクロリットルのそれぞれのハイブリドーマ上清をコーティングしたプレートに加え、室温で1時間インキュベーションした。ウェルをPBST(0.05%のTween−20を含有する1×PBS)で3回洗浄した。西洋ワサビペルオキシダーゼ(HRP)とコンジュゲートさせたヤギ抗マウスFc抗体を加えて、抗原と結合したmAbを検出した。過剰のHRPを、PBSTを用いた3回の洗浄によって、それぞれの洗浄に200μl/ウェルで洗い流した。その後、ABTS(2,2’−アジノ−ビス−[3−エチルベンズチアゾリン−6−スルホン酸])溶液をHRP発色のための基質として加えた。反応を停止させ、プレートをプレートリーダーによって405nmで走査した。陽性ウェルを、N1−NRR−TM(−)/Fcタンパク質でコーティングしたプレートを用いて再度スクリーニングし、ヒトFcでコーティングしたプレートを用いて、上述と同じようにカウンタースクリーニングした。N1−NRR−TM(−)/Fcタンパク質のみと結合するがヒトFcとは結合しないハイブリドーマmAbが真のNotch1結合抗体であり、これらを選択して機能的スクリーニングに進んだ。
【0205】
(実施例3)
Notch1拮抗性mAbの同定および特徴づけ
ルシフェラーゼレポーターアッセイ細胞系の確立
ルシフェラーゼレポーターアッセイを一般的に使用して、様々な設定におけるNotch1受容体媒介性シグナル伝達および転写活性を評価した(Weng,A.P.ら、Science、2004、9265〜9273、Osipoら、Oncogene、2008、27(37):5019〜5032)。リガンド誘導性のNotch1活性化およびmAb阻害をアッセイするために、Notchシグナル伝達を増強させるためのツール細胞系を開発した。細胞内ドメインからなるNotch受容体の活性型が核へと転位置され、CSL[CBF1、Su(H)およびLAG−1から命名]結合因子1と複合体を形成し、これが遺伝子プロモーター領域中のCSL結合モチーフと呼ばれるコア配列と結合して、下流の遺伝子転写を活性化させることは、十分に確立されている(Bray、2006)。これらの発見に基づいて、Notch1媒介性ルシフェラーゼレポータープラスミドを作製した。手短に述べると、Tunら(Tunら、Nucleic Acids Res.、1994、22(6):965〜971)によって記載されている8個のCSL結合モチーフのコンカテマー(concatemer)を、pTA−Luc(BD Biosiences、カリフォルニア州Palo Alto)の複数のクローニング部位中に挿入した。ハイグロマイシン選択マーカー(次の段落を参照)をルシフェラーゼ遺伝子の下流に付加した。これにより、ルシフェラーゼレポータープラスミド、CSLucが得られた。
【0206】
完全長Notch1発現構築体をOriGene(メリーランド州Rockville)から入手し、配列決定によってNM_017617.2(NCBI/GenBank受託番号)と同一であると確認された。SV40プロモーターを有するハイグロマイシン選択マーカーをpcDNA3.1/ハイグロマイシン(Invitrogen)からPCR合成し、標準のPCR結合方法によってpcDNA5/RFT/V5−His(Invitrogen)からの成長ホルモン3’ポリAシグナル伝達配列に接続した。完成したハイグロマイシンマーカーをNotch1発現プラスミドのCla I部位中に挿入した。このプラスミドをNotch1/Hygと新たに命名した。Notch1活性を増強させるために、部位特異的突然変異誘発によってPEDTドメイン(Weng,A.P.ら、Science、2004、9265〜9273ら)をNotch1/Hygから欠失させた(Genewiz、ニュージャージー州South Plainfield)。生じたプラスミドをNotch1−dPESTと命名した。ヒトJagged1cDNAプラスミドをOpen Biosystems(アラバマ州Huntsville)から入手した。Jagged1コード領域をPCR合成し、pcDNA3.3−TOPO発現ベクター(Invitrogen)内に挿入した。
【0207】
Notch1依存性アッセイ細胞系は、LipoFectamine2000を用いて製造者のプロトコル(Invitrogen)に従って、Notch1/hygおよびCSLucプラスミドをU2−OS(ATCC番号HTB−96、バージニア州Manassas)細胞内に同時形質移入することによって、またはNotch1−dPESTおよびCSLucを293T(ATCC番号CRL−11268、バージニア州Manassas)細胞内に同時形質移入することによって作製した。安定に形質移入された細胞をDMEM成長培地(Invitrogen)中の200〜800μg/mlのハイグロマイシンに対してクローン選択し、細胞クローンを実施例1に記載のようにウエスタンブロット分析によって、および以下のセクションに記載のルシフェラーゼレポーターアッセイによってスクリーニングした。比較的高いレベルのNotch1発現(ウエスタンブロットに基づく)およびデルタ様−4(Dll4)誘導性のルシフェラーゼ活性を有する細胞系を、機能的アッセイで使用するために選択した。2つのそのような細胞系の例は、U2−OS/Notch1−CSLuc(ニックネームN1CU3)および293/Notch1−dPEST−CSLuc(ニックネームN1dP−c16)である。同様の手順によって、ヒトJagged1を安定に発現する細胞系を親細胞系であるHela(ATCC番号CCL−2)から作製した。細胞系はHela/JAG1として命名した。
【0208】
Notch1拮抗性ハイブリドーマクローンのルシフェラーゼレポーターアッセイおよび同定
Notch1阻害性ハイブリドーマクローンを同定するために、ルシフェラーゼレポーターアッセイを用いてN1CU3細胞におけるDll4誘導性のNotch1活性を評価した。96ウェル組織培養プレート(BD Bioscience)を50〜100ナノグラム(ng)の組換えDll4(R&D Systems、ミネソタ州Minneapolis)/ウェルでコーティングした。N1CU3細胞を、50,000個の細胞/ウェルで、Dll4またはBSAでコーティングしたプレートに播種し、30〜50ulのハイブリドーマクローンからの馴化培地を同時に加え、24〜40時間培養した。培養の終了後、すべての培地を除去した後に細胞を1×Passive溶解緩衝液(Promegaウィスコンシン州Madison)で直接溶解し、Bright−Glo(商標)ルシフェラーゼアッセイシステムを用いて製造者のプロトコル(Promegaウィスコンシン州Madison)に従って、およびMicroLumat Plus LB96Vルミノメーター(Berthhold Technologies、ドイツBad Wildbad)を用いて、ルシフェラーゼレポーター活性をアッセイした。Dll4誘導性のNotchレポーター活性に対する統計的に有意な阻害を有するハイブリドーマ上清を、タンパク質Gカラム(Pierce、イリノイ州Rockford)による、製造者のプロトコルに従った親和性精製に供した。精製したmAbをルシフェラーゼレポーターアッセイによってさらに分析し、Notch1依存性シグナル伝達に対する阻害機能が再度確認された。
【0209】
ルシフェラーゼレポーターアッセイによる抗Notch1mAbの特徴づけ
Notch1媒介性シグナル伝達を阻害するmAbのうち、1つのmAb(N248A)が最も強力な阻害活性を示し、これは、いくつかの異なるルシフェラーゼレポーターアッセイによって詳細に特徴づけられた。図3は、Notchシグナル伝達を誘導するためにDll4を培養プレートの表面上にコーティングした際に、mAb N248Aが、Dll4リガンド誘導性のNotch1シグナル伝達の阻害において、コンパニオンmAbであるmAb−Cよりもはるかに高い効力を有していたことを示す。293/Notch1−dPEST−CSLuc細胞をこのアッセイで使用した。Y軸の数値はルシフェラーゼレポーター活性の読取り値である。
【0210】
mAb N248Aが他のNotchリガンド誘導性のシグナル伝達を阻害することができるかどうかを評価するために、Hela/Jagged1細胞およびN1dP−c16細胞を同時培養し、上述のルシフェラーゼレポーターアッセイを行った。mAb N248Aは実際にJagged1誘導性のNotch1シグナル伝達を完全に阻害した(図4)。
【0211】
(実施例4)
抗体の結合親和性の決定
Notch1抗原に対する抗Notch1mAb N248Aの物理的結合親和性は、研究グレードのセンサーチップ(チップ型:CM5)を備えた表面プラズモン共鳴Biacore3000機器上で、HBSPランニング緩衝液(Biacore AB、スウェーデンUppsala、現在はGE Healthcare)+1mMのCaCl2を用いて測定した。標準のN−ヒドロキシスクシンイミド/エチルジメチルアミノプロピルカルボジイミド(NHS/EDC)化学を用いて、タンパク質Aを飽和レベルでチップ上にアミンカップリングさせた。3つすべてのフローセルにおいて、40、13、4ug/mlで、N1−NRR−TM(−)Fcタンパク質(実施例1に記載)をタンパク質Aによってチップ表面に捕捉させた。抗Notch1mAb N248Aを3倍系列で希釈し、1分間100μl/分で注入した。解離を20分間監視した。100mMのリン酸で2回の30秒間パルスを用いて、それぞれの滴定の最後の注入の後にチップを再生した。緩衝液サイクルによりデータの二重参照のためのブランクが提供され、その後、Biaevaluationソフトウェアv.4.1を用いてこれを単純な結合モデルに大域的に当てはめた。親和性は動力学速度定数の商から推定した(KD=koff/kon)。データは、mAb N248AがKon=5.19e−5(Ms)、Koff<1.7e−4(1/s)およびKD<0.33nMを有することを示している。密なKDは速いKonおよび非常に遅いKoffの両方によって寄与され、これは、本発明者らのアッセイによって解明されたものよりも遅い(5%ルール、Biacore3000のマニュアルを参照)。
【0212】
(実施例5)
Notch1拮抗性mAb結合エピトープの分析
ヒトNotch2とのドメインスワップによるmAb結合エピトープのマッピング
Notch1拮抗性mAbによる作用機構を理解するために、Notch1拮抗性mAbの結合エピトープをドメインスワップおよびELISA結合アッセイによって分析した。Notch1−NRR−TM(−)/Fcタンパク質を6つのドメイン、すなわち、EGF(EGF35〜36が含まれる)、Lin12−A(またはLin−A)、Lin−B、Lin−C、ヘテロ二量体化ドメイン−N(またはHD−N)およびHD−C(図5)に分割した。ドメインのそれぞれを、PCR合成によって、一連のキメラNotch1−NRR−TM(−)/Fc発現構築体において、ヒトNotch2に対応するものでスワップした。実施例1に上述したように、Freestyle(商標)Max試薬(Invitrogen)を用いてドメインスワッププラスミドをFreestyle(商標)293−F細胞(Invitrogen,Inc.、カリフォルニア州Calsbad)中に形質移入させた。3日間培養した後、馴化培地をウエスタンブロット分析およびNotch1mAbによるELISA結合アッセイに供した。ウエスタンブロット(方法は実施例1と同様)により、6個のうちの5個のドメインスワップ構築体が良好に発現されたが、Lin−B/Notch2のスワップは発現が少なかったことが示された。
【0213】
ELISAアッセイでは、100マイクロリットルの上記抗原プラスミドで形質移入した細胞培養物からの馴化培地を96ウェルプレートのそれぞれのウェルに載せ、プレートを室温で4時間または4℃で終夜インキュベーションした。その後、条件培地をコーティングしたプレートから除去した。一次抗体の結合には、100マイクロリットルのPBS中の300ngのそれぞれのmAb(表3)をコーティングしたウェルに加えた。ELISA手順の残りは、実施例2に記載のものと同じである。mAb N99a、N326AおよびN440Aは、mAb N248Aと同じ手順によって作製および単離した、Notch−1と結合するモノクローナル抗体であった。表3に示すように、mAb N248Aとキメラ抗原との結合は、Lin−AまたはHD−Cドメインを対応するNotch2ドメインでスワップした場合に完全に消滅した。他方で、EGF、Lin−CまたはHD−Cドメインのスワップはその結合に影響を与えなかった。mAb N326AおよびN440Aは、mAb N248Aとは明確に異なっていた。これら2つのmAbは、その結合活性にHD−NおよびHD−Cドメインを必要とする。N99Aは、その結合にLin−AおよびHD−Cドメインが必要であるという点で、mAb N248Aとやや似ている。しかし、HD−NドメインのスワップはN99Aの結合活性も低下させた。これらのデータは、mAb N248Aが少なくとも2つの区別可能な結合エピトープの組を、1つはLin−Aドメイン中、他方はHD−Cドメイン中に有するという結論を支持していしていた。Lin−Bドメイン中に別のエピトープが存在するかどうかは、別の実験で解明した。同様に、他の3つのすべてのNotch1拮抗性mAbは、2つの識別可能な結合エピトープの組を、一方はHD−Cドメイン中、他方はNotch1N末端サブユニットのドメイン中に有する。最近公開されたNotch1(Gordon,WRら、Blood、2009、第113巻、4381〜4390)およびNotch2(Gordonら、Nature Structure Molecular Biology、2007、第14巻、295〜300)のNRR領域の結晶構造に基づいて、3つのLin12ドメインはHDドメインの周りに巻きついており、ADAMプロテアーゼによるランダム切断および活性化を遮断しており、したがって、受容体を不活性またはサイレントな状態に維持する。mAb N248Aは2つの明確に異なるエピトープの組でNotch1と結合し、それにより、Notch1がサイレントコンホメーションに固定され、したがって、受容体がそのリガンドによって活性化されることが妨げられる。
【0214】
ほとんどが点突然変異であり、一部が小さな欠失および挿入であるNotch1遺伝子突然変異が、T−ALLの50%を超えるもので報告されている(Weng,A.P.ら、Science、2004、9265〜9273、Maleckiら、Molecular Cell Biology、2006、26(12):4642〜4651)。突然変異は、2つの領域、すなわち、一方は細胞内部分のC末端中、他方はHD−Nドメイン中にクラスタリングされている。これらの発見は、HD−NドメインスワップはmAb N248AとNotch1との結合に影響を与えなかった一方で、他の3つの結合には影響が与えられたことから、mAb N248Aが、T−ALLにおいて表3に記載した他の3つのmAbよりも良好な治療的有用性を有するであろうという考えを支持する(表3を参照)。
【0215】
【表3】

【0216】
N248AはヒトNotch1と結合するが、マウスNotch1とは結合しない
N248A1の結合エピトープを位置決定するために、本発明者らは、ヌクレオチド1〜99およびヌクレオチド4327〜5169のマウスNotch1cDNAコード領域(NCBI受託番号NM_008714)を含有するマウスNotch1−NRRHD発現プラスミドを作製し、一過性の形質移入およびELISA結合アッセイを行った(方法は実施例1および5の前のセクションに記載)。結果により、N248A1はマウスNotch1と結合せず、ヒトNotch1のみと結合することが示された(表4)。本発明者らは、ヒトNotch1−NRRHD配列(ヌクレオチド1〜129および4338〜5202、NCBI受託番号NM_017617)をフレームワークとして使用し、ヒトLin−A、Lin−BまたはHD−Cドメインを対応するマウスドメインで系統的に交換して、ドメインスワップキメラNotch1−NRRHD発現構築体をさらに作製した。このヒト/マウスドメインスワップタンパク質をベイトとして使用したELISA結合アッセイにより、Lin−Aドメインをマウス配列に交換した場合にN248A1とヒトNotch1抗原との結合が消滅するが、Lin−BまたはHD−Cドメインの交換は結合に影響を与えなかったことが実証された。対照的に、他の対照mAb、22F7は、Lin−Bをマウス配列に交換した場合にのみ結合を失う。したがって、N248A1がヒトNotch1のみと結合し、マウスとは結合しないかどうかを決定する結合エピトープは、Lin−Aドメイン中に位置する。
【0217】
【表4】

【0218】
Lin−Aドメイン中のN248A1の結合エピトープの同定
Lin−Aドメイン中のN248A1の結合エピトープを同定するために、本発明者らは、ヒトおよびマウスのLin−Aドメインの間で異なる2個のアミノ酸を突然変異した、すなわち、1457E/Aおよび1465S/N(表5)。ELISAの結果により、突然変異1457E/Aは結合に影響を与えなかったが、突然変異1465S/Nは結合を消滅させることが示され、マウスLin−A中のアミノ酸Asn(N)がN248A1とマウスNotch1との結合の遮断を担っている唯一のアミノ酸残基であることが示された。1465Sの周辺のいくつかのアミノ酸を、順次アラニンへと突然変異させた(表5)。1463V/A、1466L/Aまたは1467Q/Aの突然変異もN248A1結合を消滅させた。しかし、対照mAb A2は突然変異1463V/Aまたは1465S/Nによって影響を受けなかった(表5)。これらの実験により、Lin−A中のN248A1の結合エピトープが1463V、1465S、1466Lおよび1467Qを含むことが実証された。
【0219】
【表5】

【0220】
HD−Cドメイン中のN248A1の結合エピトープの同定
Notch1配列からのアミノ酸のクラスターをNotch2配列へと順次スワップすることによって、一連の5つのサブドメインスワップキメラ抗原を作製した(表6)。ELISAの結果により、サブドメインスワップ−1はN248A1結合を有意に低下させた一方で、他の4つのサブドメインスワップ抗原はN248A1結合に影響を与えないことが示された。他方で、並行対照mAb 19H7は、サブドメインスワップ1、3および5に対して有意な結合親和性の低下を示した(表6)。すべてのサブドメインスワップ抗原の馴化培地中での発現および分泌は、ウエスタンブロット分析によって確認した(方法は上記)。サブドメインスワップ5以外のすべてのサブドメインスワップ抗原は、ヒトNotch1−NRRHD(huN1−NRRHD)タンパク質以上の発現を有する。サブドメインスワップ5は、ウエスタンブロットバンドの強度の比較に基づいてhuN1−NRRHDの約50%のレベルで発現された(データ示さず)。これらの実験により、表6中に強調表示するように、HD−C中のN248A1の結合エピトープには5個のアミノ酸、1705G、1706A、1707L、1709Sおよび1710L(ヒトNotch1をコードしているcDNA配列、NCBI受託番号NM_017617)が含まれることが示された。
【0221】
【表6】

【0222】
(実施例6)
Notch1mAbは細胞培養物中の癌細胞の成長を阻害する
mAb N248Aによる、HPB−ALL白血病細胞の成長の阻害およびNICDの低下
T細胞急性リンパ芽球性白血病(T−ALL)細胞系、HPB−ALLは、幼児期T−ALLから誘導され(Morikawaら、Int J.Cancer、1978、21(2):166〜70)、DSMZ(ドイツBraunschweig)から入手した。この細胞系は、増強されたガンマセクレターゼ切断の結果、高レベルの、Notch1の活性型であるNotch1細胞内ドメイン(NICD)をもたらすNotch1突然変異を保有する。成長阻害アッセイには、HPB−ALL細胞を、96ウェルプレートに、10,000個の細胞/ウェルで、10%のFBSを添加したRPMI1640培地(Invitrogen)中で播種した。連続希釈したmAb N248AまたはD16Aを最初に加え、細胞を37℃で7日間培養した。培養の終了後、0.1mg/mlのリザズリン(Sigma−Aldrich、モンタナ州St.Louis)を含有するリン酸緩衝溶液(PBS)を細胞に加え、プレートを37℃で4時間インキュベーションした。蛍光シグナルを、二重フィルターを介して励起=560nmおよび発光=590nmを用いて読み取った。IC50値は、GraphPad Prism(GraphPad Software,Inc.、カリフォルニア州La Jolla)においてS字形用量応答(変動勾配)を用いて計算した。
【0223】
in vitroのNICD分析には、HPB−ALL細胞を6ウェルプレートに2×106個の細胞/ウェルで播種し、10%のFCSを有するRPMI1640(Invitrogen)中で培養した。mAb N248Aまたは対照抗体D16Aを、図6中に示す可変濃度で培養物に加えた。細胞を、抗体の存在下、37℃で24時間培養した。その後、これらを収集し、冷1×細胞溶解緩衝液(Cell Signaling Technologies、マサチューセッツ州Boston)に溶解した。13,000rpmで10分間、4℃で遠心分離することによって、タンパク質を細胞溶解液から抽出した。BCAアッセイ(Pierce、イリノイ州Rockford)を用いてタンパク質濃度を決定した。それぞれの試料中のNICDのレベルはウエスタンブロット分析によって決定した。
【0224】
それぞれのウエスタンブロット分析において、約50μgの溶解物をポリアクリルアミドゲル(BioRad Laboratories、カリフォルニア州Hercules)による電気泳動によって分離し、ニトロセルロース膜に移し、ウサギ抗NICD抗体(Cell Signaling Technology,Inc.、マサチューセッツ州Danvers)およびマウスαアクチン抗体(Sigma−Aldrich、モンタナ州St.Louis)を用いた免疫ブロット分析に供した。IRDye680または800とコンジュゲートさせた二次抗体(LI−COR Biosciences、ネブラスカ州Lincoln)を使用してウエスタンブロットバンドを可視化した。Odyssey赤外線イメージングシステム(LI−COR Biosciences、ネブラスカ州Lincoln)を用いて画像を分析した。
【0225】
結果により、mAb N248AによるHPB−ALL細胞成長の阻害がNICDレベルの低下と相関していることが実証された。24時間の処置で、mAb N248AはNICDレベルを用量依存的に低下させ、最大の低下は30μg/mLで観察された。7日間の処置の後、mAb N248Aは細胞成長の有意な阻害を引き起こした。細胞成長阻害のIC50値は約0.78μg/mlまたは約5.2nMである。
【0226】
乳癌細胞増殖の阻害
Notch1の発現が乳癌において異常に増加しており(Reedijkら、Cancer Research、2005、65(18):8530〜8537、Klinakisら、2006、Efstratiadisら、Cell Cycle、2007、6(4):418〜429)、これは低い生存率に関連する(Reedijkら、Cancer Research、2005、65(18):8530〜8537)ことが十分に文書で示されている。乳腺組織中で活性型のNotch1を発現するトランスジェニックマウスでは、ほぼすべてのマウスが1年で乳癌を発生した(Huら、American Journal of Pathology、2006、168(3):973〜990)。Notch1媒介性シグナル伝達を阻害することで乳癌細胞の増殖が遮断されるという仮説を試験するために、いくつかの乳癌細胞系を、10μg/mlのmAb N248A抗体、Herceptin(Genentech/Roche、カリフォルニア州South San Francisco)または対照マウス免疫グロブリンG(mIgG)の存在下で培養した。すべての細胞を、1%のFCSを含むRPMI1640(Invitrogen)中で2〜3日間培養した。生細胞をCell Titer Glow(商標)(Promega)によって定量し、MicroLumat Plus LB96Vルミノメーター(Berthhold Technologies、ドイツBad Wildbad)によって走査した。同じパネルの乳癌細胞において、細胞表面上のNotch1およびJagged1の発現をFACSによって分析した。結果により、mAb N248Aによる乳癌細胞の増殖阻害がNotch1およびJagged1の発現レベルにおおまかに相関していることが実証された。mAb N248Aは、比較的高いレベルのNotch1およびJagged1を発現するMDA−MB−231細胞に対して最も強い阻害を発揮する。興味深いことに、BT475細胞由来のHerceptin耐性細胞系、BT475HRは、親BT475細胞系と比較して増加したNotch1およびJagged1の発現を示した。mAb N248AはBT475HRの細胞増殖を阻害した一方で、Herceptinは阻害しなかった。データにより、Notch1の発現が増加した、または現在の薬物であるHerceptinに対する耐性を有するmAb N248Aの、乳癌の治療処置における潜在的な有用性が示された。
【0227】
表7.抗Notch1mAb、N248Aの腫瘍細胞増殖阻害アッセイ。発現指数は、乳癌細胞を抗Notch1または抗Jagged1抗体で免疫染色した後の、FACSの倍率増加の相乗平均を表す。相対的細胞増殖指数は、薬剤を加えずに並行で培養した対照細胞のパーセンテージを表す。BT−474HRは、BT−474(ATCC)から誘導したHerceptin耐性細胞系である。
【0228】
【表7】

【0229】
N248Aによる乳癌細胞の増殖阻害がNotchシグナル伝達の遮断によって媒介されることを確認するために、2つの周知のNotchの下流の標的遺伝子の発現を定量的逆転写酵素−ポリメラーゼ連鎖反応(QRT−PCR)によって評価した。MDA−MB−231細胞をN248Aまたは対照mAbの存在下で2日間培養し、その後、収集し、RNAeasy試薬キットおよびプロトコル(Qiagen)を用いて全RNAを単離した。結果により、mAb N248Aが実際にHES1およびHES4の発現を遮断したことが実証され(図7)、N248Aによる作用機構が確認された。
【0230】
(実施例7)
Notch1mAbはマウス異種移植腫瘍モデルにおいてT細胞急性リンパ芽球性白血病(T−ALL)を阻害する
Notch1mAbによるT−ALL腫瘍成長の阻害
マウスモデルT−ALL異種移植モデルを確立するために、免疫力が低下した無胸腺症の雌のヌード(Nu/Nu)マウス(平均は20グラム、6〜8週齢)をCharles River Laboratories(マサチューセッツ州Wilmington)から入手し、国際実験動物管理公認協会(the Association for the Assessment and Accreditation for Laboratory Animal Care,International)の指針に従って、特定病原体除去の状態で飼育した。動物には、無菌のげっ歯類飼料および水を自由に与えた。すべてのin vivo研究は、承認された施設の実験動物の飼育および使用のプロトコルの下で実施した。
【0231】
HBP−ALL細胞は、宿主マウス中に移植する前に新鮮な培養物から収集し、1回洗浄し、無菌の無血清培地中に再懸濁させた。細胞懸濁液を適切な密度に調整し、腫瘍取り込みを促進するために50%のMatrigel(BD Biosciences、カリフォルニア州San Jose)を添加した。200μL中の合計5〜10×106個の細胞をマウスの後側腹部の領域内に皮下移植し、指定した大きさまで成長させた後、それぞれの実験のために抗体を投与した。
【0232】
抗腫瘍有効性研究には、150〜300mm3の大きさのHPB−All腫瘍を保有する動物をランダム化し、N248Aをそれぞれ1mg、3mgおよび10mg/キログラム(kg)で投与されるか、または対照抗体D16Aを5mg/kgで投与される、4つの群に分けた。mAbを週に1回、2週間の間皮下注射した。動物の体重および腫瘍の測定値を2〜3日毎に得た。腫瘍体積(mm3)は、ノギスで測定し、式:長さ(mm)×幅(mm)×幅(mm)×0.4を用いて計算した。研究の最終日における薬物で処置したおよびビヒクルで処置したマウスの腫瘍体積を使用して、パーセント(%)阻害値を100−{1−[(処置最終日−処置1日目)/(対照最終日−対照1日目)]}として計算した。すべての腫瘍成長阻害(TGI)実験において、8〜10匹のマウス/用量群を使用した。スチューデントt検定を使用してPを決定した。
【0233】
図8中に示すように、Notch1mAb、N248Aは、このモデルにおいて、11日間の処置、すなわち2回の週に1回の用量の後に、強力な抗腫瘍活性を実証した。10mg/kg群対対照mAb群における平均腫瘍成長阻害(TGI)は77%を超えており、これは統計的観点から非常に有意である(P<0.01)。TGIは粗く用量依存性であったが、例外として、2つのより低い用量群、1mg/kgおよび3mg/kgは、区別するには近接しすぎていた。この観察の正確な原因は不明確であるが、このモデルの腫瘍の大きさの変動性が高いことが原因である可能性が高い。N248Aは、ヒトNotch1に特異的な阻害剤として、どの処置群においても有意な重量損失、罹患率または死亡率を引き起こさずに、マウスにおいて良好に耐容された。
【0234】
マウスにおけるNotch1mAbの薬物動態学および薬力学(PK/PD)
PK/PD研究には、300〜800mm3の範囲の大きさの腫瘍を保有するマウスに、単一用量のN248Aを5mg/kgで皮下注射によって投与した。N248Aを投与した後、6、16時間、および1、2、3、5日間の時点でマウスを安楽死させた。シリンジを用いて血液試料を左心室から採取し、ヘパリン硫酸でプライミングしたチューブに移した。その一方で、腫瘍を切除によって取り出し、スナップ凍結し、冷1×細胞溶解緩衝液(Cell Signaling Technologies、マサチューセッツ州Boston)中でホモジナイズした。タンパク質を腫瘍溶解物から抽出し、それぞれの腫瘍試料中のNICDのレベルを、上述のウエスタンブロット分析を用いて決定した。血液試料を遠心分離に供して血清を血液細胞から分離した。N248Aの血清レベルを、実施例2に記載のようにELISA方法によって評価した。最初に、ELISAプレートを、Notch1−NRR−TM(−)/Fc抗原を捕捉するヒトFcに特異的なmAbでコーティングした。立ち代って、Notch1抗原は血清中のNotch1mAb、N248Aと結合する。
【0235】
PK曲線により、N248A mAbはマウス血清中で注射の24時間後に最大濃度(約235nM)に達成したことが示された。推定される半減期は約4.5日間である(図9)。Notch1活性化の直接マーカー(すなわちNICD)の評価により、N248Aで処置したマウスから収集した腫瘍試料が強力なNICDの低下を有しており、これは投薬の5日後まで持続したことが示された(図10)。対照的に、対照mAb、D16AはNICDレベルを低下させなかった(データ示さず)。5mg/kgのN248AのNICDの最大阻害は約80%であった。
【0236】
(実施例8)
Notch1mAb、N248Aのクローニングおよび配列
mAb N248Aの可変領域の配列を決定した。抗体IgGサブタイプを、Isostripマウスモノクローナル抗体キット(Roche Diagnostics、インディアナ州Indianapolis)を用いて最初に評価した。結果により、N248AがIgG1重鎖およびラムダ軽鎖を有することが示された。mAb N248Aのクローニングおよび配列決定には、1×106個のハイブリドーマ細胞を収集し、溶解して、RNeasy Mini試薬キットおよび製造者のプロトコル(Qiagen、カリフォルニア州Valencia)を用いて全細胞性RNAを単離した。Superscript III逆転写酵素(InVitrogen)を用いて、第1鎖cDNAをRNA鋳型上で合成した。軽鎖および重鎖の可変領域のcDNAを、PCRによって、第1鎖cDNAから、マウスラムダ鎖コード配列の5’末端に相補的な縮重順方向プライマーおよび可変領域の3’末端に隣接する定常領域に一致する逆方向プライマーを用いて、またはマウスIgG1重鎖コード配列の5’末端に相補的な縮重順方向プライマーおよび対応するIgG1定常領域逆方向プライマーを用いて、増幅した。PCRサイクリング条件は、96℃で1分間を1サイクル、次いで、95℃で20秒間、50℃で20秒間、および72℃で30秒間を40サイクルであった。生じたPCR産物をpCR−4−TOPOベクター(Invitrogen)内にクローニングし、従来の方法によって配列決定、Vector NTI Advanceソフトウェア(InVitrogen)を用いて分析した。クローニングした抗体の配列は、質量分析によって決定される、精製したハイブリドーマに由来する抗体から得られたN末端配列との直接比較によって確認した(カリフォルニア大学Davis、分子構造学施設(Molecular Structure Facility))。コンパイルした配列の結果により、mAb N248A重鎖の可変領域は121個のアミノ酸残基を含有し、軽鎖は109個のアミノ酸残基を含有することが実証された。CDR領域決定のKabatシステムを用いたN248A mAbのVH配列およびVL配列のさらなる分析により、重鎖CDR1、CDR2およびCDR3および軽鎖CDR1、CDR2およびCDR3の描写がもたらされた。mAb N248Aの重鎖可変領域CDR1、CDR2およびCDR3のヌクレオチドおよびアミノ酸の配列は、図15中に配列15〜20として示す(配列番号15〜20)。mAb N248Aの軽鎖可変領域CDR1、CDR2およびCDR3のヌクレオチドおよびアミノ酸の配列は、図14中に配列9〜14として示す(配列番号9〜14)。mAb N248Aの重鎖可変領域および軽鎖可変領域のヌクレオチドおよびアミノ酸の配列は、図13中に配列5〜8として示す(配列番号5〜8)。
【受託番号】
【0237】
ATCC CRL1662
ATCC CCL−1
ATCC HTB−96
ATCC CRL−11268
ATCC CCL−2
ATCC BT−474
【技術分野】
【0001】
本出願は、その開示が全体で本明細書中に参照により組み込まれる、2009年6月18日に出願の米国仮特許出願第61/218,193号の優先権を主張するものである。
【0002】
本発明は、Notch−1の活性と拮抗する抗体、そのような抗体を生成する方法、そのような抗体をアッセイする方法、および癌の処置においてそのような抗体を使用する方法に関する。
【背景技術】
【0003】
Notchタンパク質は膜貫通受容体タンパク質である。哺乳動物ではそのようなnotch受容体が4つ存在する。受容体成熟中、哺乳動物notch受容体の細胞外ドメインはフューリン様(furin-like)プロテアーゼによってS1部位で切断されて、ヘテロ二量体化(HD)ドメインによって一緒に保たれる細胞外サブユニットおよび膜貫通サブユニットが得られる。細胞外サブユニットと会合しているHDドメインの部分はHD−Nと呼ばれ、HDの他の部分である膜貫通サブユニットの細胞外部分は、HD−Cと呼ばれる。細胞外サブユニットは、1つの大きな表皮成長因子(EGF)様反復領域および3つのLin12反復を含有する。EGF反復領域のリガンド結合は、HD−Cドメイン内のS2部位でのADAM型メタロプロテアーゼによるタンパク質分解による切断を誘導し、これは、続く部位S3でのγ−セクレターゼによる切断を誘発し、notchの細胞内部分を膜から放出させて、これが核内に移行して遺伝子転写を調節することを可能にする。(Gordon,W.R.ら、Nature Structural&Molecular Biology、2007、第14巻、295〜300)。
【0004】
リガンドに誘導される活性化の前、notchは、3つのLin12反復およびHDドメインからなる保存的な負の調節領域(NRR)によって休止メタロプロテアーゼ耐性コンフォメーションに維持されている。(Vardarら、Biochemistry、2003、41:7061〜7067、Sanchez−Irizarryら、Mol.Cell.Biol.、2004、24:9265〜9273、Gordon,W.R.ら、Nature Structural&Molecular Biology、2007、第14巻、295〜300)。また、notchタンパク質のNRRは、S1部位でのタンパク質分解的切断後にLin12反復およびN末端のHDドメイン(HD−N)のみからなると定義される場合もある。(Weng,A.P.ら、Science、2004、9265〜9273。)NRRドメインは、notch経路のリガンド非依存性タンパク質分解を防止する。
【0005】
Notch経路は、ハエおよび脊椎動物における神経発生に影響を与えるものを含めた、多様な発生的および生理的なプロセス中に機能する。一般に、notchシグナル伝達は、側方抑制、系統決定、および細胞群間の境界の確立に関与している。(Bray,S.J.、Nature Reviews、2006、678〜688)。
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかし、notch活性は、癌を含めた様々なヒト疾患にも関連している。たとえば、notch1の突然変異は、50%を超えるT細胞急性リンパ芽球性白血病で検出された。(Radtke,F、Nature Review,Cancer、2003、756〜767)。癌の処置に使用するための、notch−1シグナル伝達経路を調節する治療剤の同定が必要である。
【課題を解決するための手段】
【0007】
一実施形態では、本発明は、Notch−1と結合する単離された抗体またはその抗原結合部分であって、少なくとも第1のエピトープおよび第2のエピトープと結合し、第1のエピトープがNotch−1のLin−Aドメイン内にあり、第2のエピトープがNotch−1のHD−Cドメイン内にある、抗体または抗原結合部分を提供する。好ましくは、Notch−1はヒトNotch−1である。
【0008】
本実施形態の一態様では、第1のエピトープが主要エピトープである。好ましくは、第1のエピトープのアミノ酸残基のうちのいずれかの非保存的置換は、ヒトNotch1に対する抗体または抗原結合部分の結合親和性の、60%を超える、より好ましくは80%を超える、さらにより好ましくは90%を超える損失をもたらす。
【0009】
別の態様では、第2のエピトープが主要エピトープである。好ましくは、第2のエピトープのアミノ酸残基のうちのいずれかの非保存的置換は、ヒトNotch−1に対する抗体または抗原結合部分の結合親和性の、60%を超える、より好ましくは80%を超える、さらにより好ましくは90%を超える損失をもたらす。
【0010】
別の態様では、第1のエピトープおよび第2のエピトープの両方が主要エピトープである。好ましくは、第1のエピトープおよび第2のエピトープのアミノ酸残基のうちのいずれかの非保存的置換は、ヒトNotch−1に対する抗体または抗原結合部分の結合親和性の、60%を超える、より好ましくは80%を超える、さらにより好ましくは90%を超える損失をもたらす。
【0011】
本実施形態の別の態様では、Notch−1はヒトNotch−1である。本実施形態の別の態様では、Notch−1はマウスNotch−1である。
【0012】
本実施形態の別の態様では、抗体または抗原結合部分は、さらに1〜4個のエピトープと結合し、前記さらなるエピトープのそれぞれは、ヒトNotch−1のLin−AドメインまたはHD−Cドメインのいずれか内にある。
【0013】
本実施形態の別の態様では、抗体または抗原結合部分が結合する主要エピトープは第1のエピトープおよび第2のエピトープのみである。より詳細には、第1のエピトープは、ヒトNotch−1のLinAドメインの1463V、1465S、1466Lおよび1467Qから選択される1〜4個のアミノ酸残基を含む主要エピトープである。好ましくは、第1のエピトープは、ヒトNotch−1のLinAドメインの1463V、1465S、1466Lおよび1467Qから選択される4個のアミノ酸残基からなる主要エピトープである。また、より詳細には、第2のエピトープは、ヒトNotch−1のHD−Cドメインの1705G、1706A、1707L、1709Sおよび1710Lから選択される1〜5個のアミノ酸残基を含む主要エピトープである。好ましくは、第2のエピトープは、ヒトNotch−1のHD−Cドメインの1705G、1706A、1707L、1709Sおよび1710Lから選択される1〜5個のアミノ酸残基からなる主要エピトープである。さらにより詳細には、第1のエピトープまたは第2のエピトープのアミノ酸残基のうちのいずれかの非保存的置換は、ヒトNotch−1に対する抗体または抗原結合部分の結合親和性の、70%を超える、80%を超える、90%を超える、または95%を超える損失をもたらす。
【0014】
本実施形態の別の態様では、抗体または抗原結合部分は、ヒト化、ヒト、またはキメラである。好ましくは、抗体または抗原結合部分は、ヒト化抗体またはその抗原結合部分である。より好ましくは、抗体または抗原結合部分は、ヒト抗体またはその抗原結合部分である。
【0015】
本実施形態の別の態様では、抗体または抗原結合部分は、マウス抗体またはその抗原結合部分である。
【0016】
本実施形態の別の態様では、抗体または抗原結合部分は、1×10−5M以下のKDでヒトNotch−1と結合する。好ましくは、抗体または抗原結合部分は、1×10−6M以下、5×10−7M以下、2×10−7M以下、1×10−7M以下、5×10−8M以下、2×10−8M以下、または1×10−8M以下のKDでヒトNotch−1と結合する。
【0017】
別の実施形態では、本発明は、
(i)配列番号18に示すアミノ酸配列、または配列番号18の1〜4個の残基が改変されている、好ましくは3個の残基のみが改変されている、より好ましくは2個の残基のみが改変されている、さらにより好ましくは1個の残基のみが改変されている、その変異体を含む、重鎖可変領域CDR1、
(ii)配列番号19に示すアミノ酸配列、または配列番号19の1〜4個の残基が改変されている、好ましくは3個の残基のみが改変されている、より好ましくは2個の残基のみが改変されている、さらにより好ましくは1個の残基のみが改変されている、その変異体を含む、重鎖可変領域CDR2、および
(iii)配列番号20に示すアミノ酸配列、または配列番号20の1〜4個の残基が改変されている、好ましくは3個の残基のみが改変されている、より好ましくは2個の残基のみが改変されている、さらにより好ましくは1個の残基のみが改変されている、その変異体を有する、重鎖可変領域CDR3
を含む、ヒトNotch−1と特異的に結合する単離された抗体またはその抗原結合部分を提供する。
【0018】
本実施形態の一態様では、重鎖可変領域CDR1、CDR2およびCDR3の12個の可能なアミノ酸残基の改変(本実施形態中で上述のとおり)のうち、6個までの改変を除いて、改変のいずれかが、そのアミノ酸残基の保存的置換である。好ましくは、5個までの改変を除いて、重鎖可変領域CDR1、CDR2およびCDR3の前記改変のいずれかが、そのアミノ酸残基の保存的置換である。より好ましくは、4個までの改変を除いて、3個までの改変を除いて、2個までの改変を除いて、または1個の改変を除いて、重鎖可変領域CDR1、CDR2およびCDR3の前記改変のいずれかが、そのアミノ酸残基の保存的置換である。さらにより好ましくは、重鎖可変領域CDR1、CDR2およびCDR3のアミノ酸残基の改変のうちのいずれかが、そのアミノ酸残基の保存的置換である。
【0019】
本実施形態の別の態様では、重鎖可変領域CDR1、CDR2およびCDR3はいずれも改変されていない。
【0020】
別の実施形態では、本発明は、
(i)配列番号12に示すアミノ酸配列、または配列番号12の1〜4個の残基が改変されている、好ましくは3個の残基のみが改変されている、より好ましくは2個の残基のみが改変されている、さらにより好ましくは1個の残基のみが改変されている、その変異体を含む、軽鎖可変領域CDR1、
(ii)配列番号13に示すアミノ酸配列、または配列番号13の1〜4個の残基が改変されている、好ましくは3個の残基のみが改変されている、より好ましくは2個の残基のみが改変されている、さらにより好ましくは1個の残基のみが改変されている、その変異体を含む、軽鎖可変領域CDR2、および
(iii)配列番号14に示すアミノ酸配列、または配列番号14の1〜4個の残基が改変されている、好ましくは3個の残基のみが改変されている、より好ましくは2個の残基のみが改変されている、さらにより好ましくは1個の残基のみが改変されている、その変異体を含む、軽鎖可変領域CDR3
を含む、Notch−1と特異的に結合する単離された抗体またはその抗原結合部分を提供する。
【0021】
本実施形態の一態様では、軽鎖可変領域CDR1、CDR2およびCDR3の12個の可能なアミノ酸残基の改変(本実施形態中で上述)のうち、改変のうちの6個までを除いて、改変のうちのいずれかが、そのアミノ酸残基の保存的置換である。好ましくは、5個までの改変を除いて、軽鎖可変領域CDR1、CDR2およびCDR3の前記改変のいずれかが、そのアミノ酸残基の保存的置換である。より好ましくは、4個までの改変を除いて、3個までの改変を除いて、2個までの改変を除いて、または1個の改変を除いて、軽鎖可変領域CDR1、CDR2およびCDR3の前記改変のいずれかが、そのアミノ酸残基の保存的置換である。さらにより好ましくは、軽鎖可変領域CDR1、CDR2およびCDR3の前記改変のうちのいずれかが、そのアミノ酸残基の保存的置換である。
【0022】
本実施形態の別の態様では、軽鎖可変領域CDR1、CDR2およびCDR3はいずれも改変されていない。
【0023】
別の実施形態では、本発明は、
(i)配列番号18、または配列番号18の1〜4個の残基が改変されている、好ましくは3個の残基のみが改変されている、より好ましくは2個の残基のみが改変されている、さらにより好ましくは1個の残基のみが改変されているその変異体を含む、重鎖可変領域CDR1、
(ii)配列番号19、または配列番号19の1〜4個の残基が改変されている、好ましくは3個の残基のみが改変されている、より好ましくは2個の残基のみが改変されている、さらにより好ましくは1個の残基のみが改変されているその変異体を含む、重鎖可変領域CDR2、
(iii)配列番号20、または配列番号20の1〜4個の残基が改変されている、好ましくは3個の残基のみが改変されている、より好ましくは2個の残基のみが改変されている、さらにより好ましくは1個の残基のみが改変されているその変異体を含む、重鎖可変領域CDR3、
(iv)配列番号12、または配列番号12の1〜4個の残基が改変されている、好ましくは3個の残基のみが改変されている、より好ましくは2個の残基のみが改変されている、さらにより好ましくは1個の残基のみが改変されているその変異体を含む、軽鎖可変領域CDR1、
(v)配列番号13、または配列番号13の1〜4個の残基が改変されている、好ましくは3個の残基のみが改変されている、より好ましくは2個の残基のみが改変されている、さらにより好ましくは1個の残基のみが改変されているその変異体を含む、軽鎖可変領域CDR2、および
(vi)配列番号14、または配列番号14の1〜4個の残基が改変されている、好ましくは3個の残基のみが改変されている、より好ましくは2個の残基のみが改変されている、さらにより好ましくは1個の残基のみが改変されているその変異体を含む、軽鎖可変領域CDR3
を含む、Notch−1と特異的に結合する単離された抗体またはその抗原結合部分を提供する。
【0024】
本実施形態の一態様では、重鎖可変領域CDR1、CDR2およびCDR3ならびに軽鎖可変領域CDR1、CDR2およびCDR3の24個の可能なアミノ酸残基の改変(本実施形態中で上述)のうち、改変のうちの12個までを除いて、改変のうちのいずれかが、そのアミノ酸残基の保存的置換である。好ましくは、改変のうちの11個までを除いて、重鎖可変領域CDR1、CDR2およびCDR3ならびに軽鎖可変領域CDR1、CDR2およびCDR3の前記改変のうちのいずれかが、そのアミノ酸残基の保存的置換である。より好ましくは、10個までの改変を除いて、9個までの改変を除いて、8個までの改変を除いて、7個までの改変を除いて、6個までの改変を除いて、5個までの改変を除いて、4個までの改変を除いて、3個までの改変を除いて、2個までの改変を除いて、または1個の改変を除いて、重鎖可変領域CDR1、CDR2およびCDR3ならびに軽鎖可変領域CDR1、CDR2およびCDR3の前記改変のうちのいずれかが、そのアミノ酸残基の保存的置換である。さらにより好ましくは、重鎖可変領域CDR1、CDR2およびCDR3ならびに軽鎖可変領域CDR1、CDR2およびCDR3の前記改変のうちのいずれかが、そのアミノ酸残基の保存的置換である。
【0025】
本実施形態の別の態様では、軽鎖CDRおよび重鎖CDRはいずれも改変されていない。
【0026】
別の実施形態では、本発明は、ヒトNotch−1との結合について、
(a)配列番号6のアミノ酸配列を含む重鎖可変領域、および
(b)配列番号8のアミノ酸配列を含む軽鎖可変領域
を含む抗体と交差競合または競合する、単離されたモノクローナル抗体またはその抗原結合部分を提供する。
【0027】
別の実施形態では、本発明は、ヒトNotch−1との結合について、
(i)配列番号18を含む重鎖可変領域CDR1、
(ii)配列番号19を含む重鎖可変領域CDR2、
(iii)配列番号20を含む重鎖可変領域CDR3、
(iv)配列番号12を含む軽鎖可変領域CDR1、
(v)配列番号13を含む軽鎖可変領域CDR2、および
(vi)配列番号14を含む軽鎖可変領域CDR3
を含み、軽鎖CDRおよび重鎖CDRのそれぞれの1〜4個のアミノ残基が改変されていてもよい抗体と交差競合または競合する、単離されたモノクローナル抗体またはその抗原結合部分を提供する。好ましくは、軽鎖CDRおよび重鎖CDRの改変のうちのいずれかが、そのアミノ酸残基の保存的置換である。より好ましくは、軽鎖CDRおよび重鎖CDRはいずれも改変されていない。
【0028】
CDR領域の決定は、十分に当分野の技術範囲内にある。一部の実施形態では、CDRはKabatおよびChothia CDRの組合せであってもよいことが理解される(「組み合わせたCDR」または「拡張CDR」とも呼ばれる)。一部の実施形態では、CDRはKabat CDRである。他の実施形態では、CDRはChothia CDRである。言い換えれば、複数のCDRを用いる実施形態では、CDRは、Kabat、Chothia、組合せCDR、またはその組合せのうちのいずれかであり得る。
【0029】
実施形態の一態様では、抗体はヒト化抗体である。実施形態の別の態様では、抗体は完全ヒト抗体である。実施形態の別の態様では、抗体はキメラ抗体である。
【0030】
実施形態の別の態様では、抗体または抗原結合部分は、1×10−5M未満、好ましくは1×10−6M未満、好ましくは5×10−7M未満、好ましくは2×10−7M未満、好ましくは1×10−7M未満、またはさらにより好ましくは1×10−8M未満の平衡解離定数KDでヒトNotch−1と結合する。
【0031】
実施形態の別の態様では、抗体はマウス抗体である。本実施形態の別の態様では、抗体は、ヒト化、ヒト、またはキメラである。好ましくは、抗体はヒト化されている。より好ましくは、抗体は完全ヒト抗体である。
【0032】
本実施形態の別の態様では、抗体は、サブクラスIgG1、IgG2、IgG3またはIgG4のヒト完全長抗体である。本実施形態の別の態様では、抗体は、サブクラスIgG1、IgG2、IgG3またはIgG4のヒト化抗体である。さらに別の実施形態では、抗体は、サブクラスIgG1、IgG2、IgG3またはIgG4のキメラ抗体である。
【0033】
別の実施形態では、本発明は、本明細書中に開示する抗体または抗原結合部分のうちのいずれかを含む医薬組成物を提供する。
【0034】
別の実施形態では、本発明は、本明細書中に開示する抗体または抗原結合部分のうちのいずれかを組換えにより産生する細胞系を提供する。
【0035】
別の実施形態では、本発明は、本明細書中に開示する抗体または抗原結合部分のうちの任意のものの重鎖または軽鎖のいずれかをコードしているオリゴヌクレオチドを提供する。
【0036】
別の実施形態では、本発明は、対象に、治療上有効な量の本発明の抗体もしくは抗原結合部分、またはその医薬組成物を投与するステップを含む、癌を処置する方法を提供する。
【0037】
別の実施形態では、本発明は、癌の処置に使用するための、本明細書中に開示する抗体または抗原結合部分を提供する。
【0038】
別の実施形態では、本発明は、癌を処置する医薬品を調製するための、本明細書中に開示する抗体または抗原結合部分の使用を提供する。
【図面の簡単な説明】
【0039】
【図1】実施例1に記載する、ヒトNotch1免疫原プラスミドN1−NRR−TM(−)のcDNAのPCR合成を例示する図である。
【図2】やはり実施例1に記載する、別のヒトNotch1免疫原プラスミドN1−NRR−TM(+)のcDNAのPCR合成を例示する図である。
【図3】実施例3に示す、2つのモノクローナル抗体:mAb N248AおよびmAb−CのNotch−1依存性ルシフェラーゼレポーターアッセイの結果を例示する図である。
【図4】ルシフェラーゼレポーターアッセイにより、mAb N248AがJagged−1誘導性Notch1シグナル伝達を阻害することが示されることを例示する図である。Hela/Jagged1細胞およびN1dP−c16細胞をルシフェラーゼレポーターアッセイのために同時培養した。MIgGは対照マウス抗体である。Y軸の数値はルシフェラーゼレポーター活性の読取り値である。
【図5】ヒトNotch1とヒトNotch2との間のEGF、Lin−A、Lin−B、Lin−C、HD−NおよびHD−Cドメインの配列アラインメントを示す図である。
【図6A】HPB−ALL細胞においてNICD(Notch1細胞内ドメイン)のレベルがmAb N248Aによって低下されたことを例示する、ウエスタンブロット画像である。
【図6B】HPB−All細胞の成長がmAb N248Aによって阻害されることを例示する図である。
【図7】mAb N248AがそれぞれHes1mRNA(A)およびHes4mRNA(B)の発現を遮断することを例示する図である。
【図8】mAb N248AによるHPB−ALL異種移植腫瘍の成長阻害を例示する図である。腫瘍が150〜300mm3まで成長した後、図に示したようにマウスにmAbを投薬した。それぞれの群は、ランダム化された腫瘍の大きさを有する10匹のマウスを含有する。
【図9】マウスにおける5mg/kgの単一用量注射後の、血漿mAb N248A濃度の変化を例示する図である。それぞれのデータ点は3匹のマウスに基づいて計算した。T1/2は、マウス血清中でのN248Aの半減期である。
【図10】マウスにおける5mg/kgの単一用量注射後の、HBP−ALL異種移植腫瘍におけるNICDの阻害を例示する図である。対照抗体D16Aで処置した腫瘍のウエスタンブロットバンドを100%の強度として設定し、これは0%の阻害に等しい。
【発明を実施するための形態】
【0040】
本開示は、高い親和性でNotch−1と特異的に結合する、単離されたモノクローナル抗体、特にヒトモノクローナル抗体およびマウスモノクローナル抗体ならびにヒト/マウスのキメラ抗体に関する。本開示は、単離された抗体、そのような抗体を作製する方法、そのような抗体を含む免疫コンジュゲートおよび二重特異性分子、ならびに本開示の抗体、免疫コンジュゲート(immunconjugate)または二重特異性分子を含有する医薬組成物を提供する。また、本開示は、Notch−1の活性化を阻害するため、および異常細胞成長(たとえば癌)などのNotch−1の過剰活性化または過剰発現に関連する疾患を処置するため等の、抗体を使用する方法にも関する。したがって、本開示はまた、癌などの様々な種類の異常細胞成長を処置するための、抗Notch−1抗体またはその抗原結合部分を使用する方法も提供する。
【0041】
定義。
用語「Notch−1」または「Notch1」とは、互換性があるように使用され、ヒトNotch−1タンパク質の変異体、アイソフォームおよび種相同体が含まれる。たとえば、ネイティブヒトNotch−1タンパク質は、リーダーペプチド、大きな表皮成長因子(EGF)様反復領域、3つのLin12反復、N末端ヘテロ二量体化ドメイン(HD−N)、C末端ヘテロ二量体化ドメイン(HD−C)、膜貫通(TM)配列および細胞内ドメイン(NICD)から構成される。完全長ヒトNotch−1のNCBI/GenBank受託番号はNM_017617.2である。
【0042】
本明細書中で使用する用語「Notch−1負の調節領域」または「Notch−1NRR」とは、別段に示さない限りは、3つのLin12ドメイン、およびNotch−1の3つのLin12ドメインと膜貫通ドメインとの間に位置するアミノ酸配列または複数の配列からなる、Notch−1の任意のネイティブまたは合成のポリペプチド領域をいう。一実施形態では、「Notch−1NRR」には、3つのLin12ドメインならびに2つのヘテロ二量体化ドメインHD−NおよびHD−Cが含まれ、Notch−1のHD−NおよびHD−Cドメインは、共有結合しており、未だフューリン様プロテアーゼによって切断されていない(S1切断前)。別の実施形態では、「Notch−1NRR」には、3つのLin12ドメインならびに2つのヘテロ二量体化ドメインHD−NおよびHD−Cが含まれ、HD−NおよびHD−Cドメインは非共有的に結合している(S1切断後)。本実施形態の一態様では、HD−Cドメイン内のS2部位は、未だADAM型メタロプロテアーゼによって切断されていない。本実施形態の別の特定の態様では、HD−Cドメイン内のS2部位は、ADAM型メタロプロテアーゼによって切断されつつある、または既に切断されている。(Gordon,W.R.ら、Nature Structural&Molecular Biology、2007、第14巻、295〜300)。
【0043】
用語「免疫応答」とは、侵入病原体、病原体に感染した細胞もしくは組織、癌細胞、または、自己免疫性もしくは病理学的な炎症の場合は、正常なヒト細胞もしくは組織の、選択的な損傷、破壊、または人体からの排除をもたらす、たとえば、上記細胞または肝臓によって産生されるリンパ球、抗原提示細胞、食細胞、顆粒球、および可溶性巨大分子(抗体、サイトカイン、および補体が含まれる)の作用をいう。
【0044】
「シグナル伝達経路」とは、細胞の一部分から細胞の別の部分へのシグナルの伝達において役割を果たす様々なシグナル伝達分子間の生化学的な関係性をいう。本明細書中で使用する語句「細胞表面受容体」には、たとえば、シグナルを受信し、細胞の原形質膜を横切ってそのようなシグナルを伝達することができる、分子および分子の複合体が含まれる。本開示の「細胞表面受容体」の一例はNotch−1受容体である。
【0045】
本明細書中で言及する用語「抗体」には、抗体全体および任意の抗原結合断片(すなわち「抗原結合部分」)またはその単鎖が含まれる。「抗体」とは、ジスルフィド結合によって相互接続された少なくとも2本の重鎖(H)鎖および2本の軽鎖(L)鎖を含む糖タンパク質またはその抗原結合部分をいう。それぞれの重鎖は、重鎖可変領域(本明細書中でVHと略す)および重鎖定常領域からなる。重鎖定常領域は、3つのドメイン、CH1、CH2およびCH3からなる。それぞれの軽鎖は、軽鎖可変領域(本明細書中でVLと略す)および軽鎖定常領域からなる。軽鎖定常領域は、1つのドメイン、CLからなる。VHおよびVL領域は、フレームワーク領域(FR)と呼ばれるより保存的な領域が散在する、相補性決定領域(CDR)と呼ばれる超可変性の領域へとさらに細分することができる。CDR領域は、どちらも当業者に周知のKabatまたはChothiaの付番方式を用いて決定することができる。たとえば、Kabat,E.A.ら(1991)Sequences of Proteins of Immunological Interest、第5版、U.S.Department of Health and Human Services、NIH出版第91−3242号、ChothiaおよびLesk、J.Mol.Biol.、196:901〜917(1987)を参照されたい。それぞれのVHおよびVLは、3つのCDRおよび4つのFRから構成されており、アミノ末端からカルボキシ末端に、FR1、CDR1、FR2、CDR2、FR3、CDR3、FR4の順序で配置されている。重鎖および軽鎖の可変領域は、抗原と相互作用する結合ドメインを含有する。抗体の定常領域は、免疫グロブリンと、免疫系の様々な細胞(たとえばエフェクター細胞)および古典的補体系の第1構成成分(Clq)を含めた宿主の組織または因子との結合を媒介し得る。
【0046】
本明細書中で使用する用語、抗体の「抗原結合部分」(または単に「抗体部分」)とは、抗原(たとえばNotch−1)と特異的に結合する能力を保持している、抗体の1つまたは複数の断片をいう。抗体の抗原結合機能は、完全長抗体の断片によって行われることができることが示されている。抗体の用語「抗原結合部分」内に包含される結合断片の例には、(i)VL、VH、CLおよびCH1ドメインからなる一価断片であるFab断片、(ii)ヒンジ領域でジスルフィド橋によって連結された2つのFab断片を含む二価断片であるF(ab’)2断片、(iii)VHおよびCH1ドメインからなるFd断片、(iv)抗体の単一のアームのVLおよびVHドメインからなるFv断片、(v)VHドメインからなるdAb断片(Wardら、(1989)Nature、341:544〜546)、ならびに(vi)単離した相補性決定領域(CDR)が含まれる。さらに、Fv断片の2つのドメイン、VLおよびVHは別々の遺伝子によってコードされているが、これらは、組換え方法を用いて、これらが、VLおよびVH領域が対合した一価分子を形成する単一のタンパク質鎖として作製されることを可能にする合成リンカーによって、結合させることができる(単鎖Fv(scFv)として知られる、たとえば、Birdら(1988)Science、242:423〜426、およびHustonら(1988)Proc.Natl.Acad.Sci.USA、85:5879〜5883を参照)。そのような単鎖抗体も、用語、抗体の「抗原結合部分」内に包含されることを意図する。これらの抗体断片は、当業者に知られている従来の技術を含めた任意の適切な技法を用いて得られる場合があり、断片は、インタクトな抗体と同じように、有用性についてスクリーニングし得る。
【0047】
本明細書中で使用する「単離された抗体」とは、異なる抗原性特異性を有する他の抗体を実質的に含まない抗体をいうことを意図する(たとえば、Notch−1と特異的に結合する単離された抗体は、Notch−1以外の抗原と特異的に結合する抗体を実質的に含まない)。しかし、Notch−1と特異的に結合する単離された抗体は、他の種からのNotch−1分子などの他の抗原に対して交差反応性を有し得る。さらに、単離された抗体は、他の細胞物質および/または化学物質を実質的に含まない場合がある。
【0048】
本明細書中で使用する用語「モノクローナル抗体」または「モノクローナル抗体組成物」とは、単一分子組成の抗体分子の調製物をいう。モノクローナル抗体組成物は、特定のエピトープに対して単一の結合特異性および親和性を示す。
【0049】
用語「ヒト化抗体」とは、マウスなどの別の哺乳動物種の生殖系列に由来するCDR配列がヒトフレームワーク配列上に移植された抗体をいうことを意図する。さらなるフレームワーク領域の改変がヒトフレームワーク配列内でなされてもよい。
【0050】
用語「キメラ抗体」とは、可変領域配列がマウス抗体に由来し、定常領域配列がヒト抗体に由来する抗体などの、可変領域配列が1つの種に由来し、定常領域配列が別の種に由来する抗体をいうことを意図する。
【0051】
本明細書中で使用する用語「ヒト抗体」または「完全ヒト抗体」には、フレームワークおよびCDR領域がどちらもヒト生殖系列免疫グロブリン配列に由来する可変領域を有する抗体が含まれることを意図する。さらに、抗体が定常領域を含有する場合は、定常領域もヒト生殖系列免疫グロブリン配列に由来する。本開示のヒト抗体またはその抗原結合部分には、ヒト生殖系列免疫グロブリン配列によってコードされていないアミノ酸残基(たとえば、in vitroのランダムもしくは部位特異的突然変異誘発によって、またはin vivoの体細胞突然変異によって導入された突然変異)が含まれ得る。しかし、本明細書中で使用する用語「ヒト抗体」には、マウスなどの別の哺乳動物種の生殖系列に由来するCDR配列がヒトフレームワーク配列上に移植された抗体が含まれることを意図しない。
【0052】
用語「ヒトモノクローナル抗体」または「完全ヒトモノクローナル抗体」とは、フレームワークおよびCDR領域がどちらもヒト生殖系列免疫グロブリン配列に由来する可変領域を有する、単一の結合特異性を示す抗体をいう。一実施形態では、ヒトモノクローナル抗体は、不死化細胞と融合させた、ヒト重鎖導入遺伝子および軽鎖導入遺伝子を含むゲノムを有するトランスジェニック非ヒト動物、たとえばトランスジェニックマウスから得られたB細胞が含まれる、ハイブリドーマによって産生される。
【0053】
用語「ヒト抗体誘導体」とは、ヒト抗体の任意の改変された形態、たとえば、抗体と別の薬剤または抗体とのコンジュゲートをいう。
【0054】
本明細書中で使用する用語「組換えヒト抗体」には、(a)ヒト免疫グロブリン遺伝子についてトランスジェニック動物もしくは染色体導入動物(たとえばマウス)またはそれから調製したハイブリドーマ(以下に詳述)から単離された抗体、(b)たとえばトランスフェクトーマから、ヒト抗体を発現するように形質転換させた宿主細胞から単離された抗体、(c)組換えのコンビナトリアルヒト抗体ライブラリから単離された抗体、および(d)ヒト免疫グロブリン遺伝子配列の他のDNA配列へのスプライシングに関与する任意の他の手段によって調製、発現、作製または単離された抗体などの、組換え手段によって調製、発現、作製または単離したすべてのヒト抗体が含まれる。そのような組換えヒト抗体は、フレームワークおよびCDR領域がヒト生殖系列免疫グロブリン配列に由来する可変領域を有する。特定の実施形態では、しかし、そのような組換えヒト抗体は、in vitroの突然変異誘発(または、ヒトIg配列についてトランスジェニックな動物を使用する場合はin vivoの体細胞突然変異誘発)に供することができ、したがって、組換え抗体のVHおよびVL領域のアミノ酸配列は、ヒト生殖系列VHおよびVL配列に由来し、それに関連する配列である一方で、in vivoでヒト抗体生殖系列レパートリー内に天然に存在しないものである場合がある。
【0055】
抗体に関して本明細書中で使用する用語「競合する」とは、第1の抗体またはその抗原結合部分が、第2の抗体またはその抗原結合部分との結合について競合する場合をいい、第1の抗体とその同族エピトープとの結合は、第2の抗体の非存在下での第1の抗体の結合と比較して、第2の抗体の存在下において検出可能に減少している。第2の抗体とそのエピトープとの結合も第1の抗体の存在下で検出可能に減少しているという代替は、可能であるが、必ずしもそうでなくてもよい。すなわち、第1の抗体は、第2の抗体とそのエピトープとの結合を、その第2の抗体が第1の抗体とその各自のエピトープとの結合を阻害することなしに、阻害することができる。しかし、それぞれの抗体が、他の抗体とその同族エピトープまたはリガンドとの結合を、同じ、より高い、またはより低い度合であるかに関わらず検出可能に阻害する場合は、抗体は、その各自のエピトープ(複数可)の結合について互いに「交差競合する」と言われる。たとえば、交差競合抗体は、本明細書中に開示した抗体が結合するエピトープ、またはエピトープの一部分と結合することができる。競合および交差競合抗体のどちらの使用も本開示によって包含されている。そのような競合または交差競合が起こる機構に関わらず(たとえば、立体障害、コンホメーション変化、または共通エピトープもしくはその一部分との結合など)、当業者には、本明細書中に提供する教示に基づいて、そのような競合および/または交差競合抗体が包含されており、本明細書中に開示する方法に有用であり得ることを理解されよう。
【0056】
本明細書中で使用する「主要エピトープ」とは、エピトープのアミノ酸残基のうちの任意の1つをアラニンまたは非保存的置換によって置き換えた場合に、そのエピトープが属する抗原に対する抗体の結合親和性が50%を超えて減少する、エピトープをいう。
【0057】
本明細書中で使用する「アイソタイプ」または「クラス」とは、重鎖定常領域遺伝子によってコードされている抗体クラス(たとえば、IgMまたはIgG)をいう。抗体の定常ドメインは抗原との結合に関与していないが、様々なエフェクター機能を示す。重鎖定常領域のアミノ酸配列に応じて、所定のヒト抗体または免疫グロブリンを5つの主要な免疫グロブリンクラス、すなわち、IgA、IgD、IgE、IgG、およびIgMのうちの1つに割り当てることができる。様々な免疫グロブリンクラスの構造および三次元立体配置は周知である。様々なヒト免疫グロブリンクラスのうち、ヒトIgG1、IgG2、IgG3、IgG4、およびIgMのみが、補体を活性化させることが知られている。ヒトIgG1およびIgG3は、ヒトにおいてADCCを媒介することが知られている。
【0058】
本明細書中で使用する「サブクラス」とは、重鎖定常領域遺伝子のアイソタイプ内のさらなる特定、たとえば、IgGアイソタイプ内のIgG1、IgG2、IgG3、またはIgG4サブクラスなどをいう。
【0059】
本明細書中で使用する用語「化合物」または「医薬化合物」には、抗体、その抗原結合部分、免疫コンジュゲート、および二重特異性分子が含まれる。
【0060】
語句「抗原を認識する抗体」および「抗原に特異的な抗体」とは、本明細書中で用語「抗原と特異的に結合する抗体」と互換性があるように使用される。
【0061】
用語「Fc受容体」または「FcR」とは、抗体のFc領域と結合する受容体を説明するために使用する。たとえば、FcRはネイティブ配列ヒトFcRであってもよい。さらに、FcRはIgG抗体(ガンマ受容体)と結合するものであることができ、FcγRI、FcγRII、FcγRIII、およびFcγRIVサブクラスの受容体が含まれ、これには、これらの受容体の対立遺伝子変異体および選択的スプライシングされた形態が含まれる。FcγRII受容体には、FcγRIIA(「活性化受容体」)およびFcγRIIB(「阻害性受容体」)が含まれ、これらは、主にその細胞質ドメインが異なる、類似のアミノ酸配列を有する。活性化受容体FcγRIIAは、その細胞質ドメイン中に免疫受容体チロシンに基づく活性化モチーフ(ITAM)を含有する。阻害性受容体FcγRIIBは、その細胞質ドメイン中に免疫受容体チロシンに基づく阻害モチーフ(ITIM)を含有する(Daeron、Annu.Rev.Immunol.、15:203〜234(1997)を参照)。FcRは、RavetchおよびKinet、Annu.Rev.Immunol.、9:457〜92(1991)、Capelら、Immunomethods、4:25〜34(1994)、ならびにde Haasら、J.Lab.Clin.Med.、126:330〜41(1995)に総説されている。将来同定されるものを含めた他のFcRが、本明細書中で用語「FcR」によって包含される。また、この用語には、母系IgGを胎児に移行することを司っている新生児受容体FcRnも含まれる(Guyerら、Immunol.、117:587(1976)およびKimら、J.Immunol.、24:249(1994))。
【0062】
本明細書中で使用する「ヒトNotch−1と特異的に結合する」抗体とは、1×10−5M以下のKDでヒトNotch−1と結合する抗体をいうことを意図する。
【0063】
本明細書中で使用する用語「kon」とは、特定の抗体−抗原の相互作用のon速度、すなわち会合速度をいうことを意図し、他方で、本明細書中で使用する用語「koff」とは、特定の抗体−抗原の相互作用のオフ速度、すなわち解離速度をいうことを意図する。本明細書中で使用する用語「KD」とは、koff対konの比(すなわちkoff/kon)から得られる平衡解離定数をいうことを意図し、モル濃度(M)として表される。抗体のKD値は、当分野で十分に確立された方法を用いて決定することができる。抗体のKDを決定する一方法は、典型的にはBiacore(登録商標)システムなどのバイオセンサーシステムを用いた表面プラズモン共鳴を用いることによるものである。
【0064】
本明細書中で使用する用語、抗体に対する「高い親和性」とは、1×10−6M以下のKDを有する抗体をいう。
【0065】
本明細書中で使用する用語「対象」には、任意のヒトまたは非ヒト動物が含まれる。用語「非ヒト動物」には、すべての脊椎動物、たとえば、非ヒト霊長類、ヒツジ、イヌ、ネコ、ウマ、ウシ、ニワトリ、両生類、爬虫類などの哺乳動物および非哺乳動物が含まれる。
【0066】
ヒトNotch−1受容体
ヒトNotch1cDNAは、リーダーペプチド、36個のEGF様反復、負の調節領域(NRR)、膜貫通(TM)配列および細胞内ドメインからなる2556個のアミノ酸残基のタンパク質をコードしている。(Vardarら、Biochemistry、2003、41:7061〜7067、Sanchez−Irizarryら、Mol.Cell.Biol.、2004、24:9265〜9273、Gordon,W.R.ら、Nature Structural&Molecular Biology、2007、第14巻、295〜300)。Notch−1NRRは、アミノ酸残基1447から始まり、1734で終わる。Notch−1NRRは、LNR−A(Notch−1アミノ酸残基1447〜1483)、LNR−B(Notch−1アミノ酸残基1484〜1525)、LNR−C(Notch−1アミノ酸残基1526〜1565)、N末端ヘテロ二量体化ドメイン(HD−N、Notch−1アミノ酸残基1566〜1665)およびC末端ヘテロ二量体化ドメイン(HD−C、Notch−1アミノ酸残基1666〜1734)からなる。
【0067】
本開示の抗体は、抗体の特定の機能的特長または特性によって特徴づけられる。たとえば、抗体は、1×10−5M以下のKDでヒトNotch−1と特異的に結合する。好ましくは、本開示の抗体は、高い親和性、たとえば1×10−6M以下のKD、より好ましくは1×10−7M以下のKD、さらにより好ましくは1×10−8M以下のKDで、Notch−1と結合する。
【0068】
Notch−1に対する抗体の結合能力を評価するためのアッセイには、それだけには限定されないが、ELISA、ウエスタンブロット、RIA、およびフローサイトメトリー分析が含まれる。また、抗体の結合動力学(たとえば結合親和性)も、Biacore分析によってなど、当分野で知られているアッセイによって評価することができる。
【0069】
モノクローナル抗体mAb N248A。
本開示の1つの例示的な抗体は、実施例1〜3および8に記載のように作製、単離、試験および構造的に特徴づけた、マウスモノクローナル抗体N248Aである。表1は、mAb N248Aの様々な領域のアミノ酸配列および本明細書中に開示する他の配列を記載している。
【0070】
【表1−1】

【0071】
【表1−2】

【0072】
【表1−3】

【0073】
【表1−4】

【0074】
【表1−5】

【0075】
実施例4に示すように、mAb N248Aは0.33×10−6M未満のKDを有する。
【0076】
実施例5に示すように、mAb N248Aが少なくとも2つの区別可能なNotch−1エピトープと結合することが示され、一方のエピトープはLin−Aドメイン内にあり、他方のエピトープはHD−Cドメイン内にある。
【0077】
実施例6に示すように、mAb N248Aは、細胞培養物においてT細胞急性リンパ芽球性白血病(T−ALL)および乳癌細胞の成長をどちらも阻害する。
【0078】
実施例7に示すように、mAb N248Aは、マウス異種移植腫瘍モデルにおいてT細胞リンパ芽球性白血病も阻害する。
【0079】
Notch−1Lin−AドメインおよびNotch−1HD−Cドメイン中の少なくとも2つの区別されたエピトープと結合する抗Notch−1抗体。
高い親和性でNotch−1Lin−AおよびHD−Cドメインと結合する抗体はNotch−1シグナル伝達を低下させ、したがって、in vitroおよびin vivoで生物活性を実証して、癌細胞の成長、特にT−ALL癌細胞の成長を阻害し得ることが、本発明の企図内にある。そのような抗体は、当業者に知られている一般的な方法に従って生成し得る。一実施形態では、そのような抗体は、実施例1および2に示すように、マウスをNotch−1LinAドメインおよびNotch−1HD−Cドメインを含む免疫原で免疫化し、次いで、実施例2に示すように、そのようにして作製された抗体のハイブリドーマクローニング、およびELISAアッセイによるクローニングした抗体のアッセイを行うことによって、生成することができる。ELISAアッセイに従って選択された抗体のNotch−1結合親和性は、実施例4に示すように、表面プラズマ共鳴Biacore3000機器で測定することができる。
【0080】
本発明の抗Notch−1抗体は、Notch−1LinAドメインおよびNotch−1HD−Cドメインと結合する抗体であって、上記段落に記載のもの以外の、当分野で知られている任意の他の方法によって生成することができる。宿主動物の免疫化の経路およびスケジュールは、本明細書中にさらに記載するように、一般に、抗体の刺激および産生の確立された従来の技術に沿うものである。ヒトおよびマウス抗体を生成するための一般的な技法は、当分野で知られているおよび/または本明細書中に記載されている。
【0081】
ハイブリドーマ技術によって作製した抗Notch−1抗体。
ヒトを含めた任意の哺乳動物対象またはそれからの抗体産生細胞を、ヒトを含めた哺乳動物のハイブリドーマ細胞系を生じるための基礎として役割を果たすように操作できることが、本発明の企図内にある。典型的には、宿主動物に、本明細書中に記載のものを含めた一定量の免疫原を、腹腔内、筋肉内、経口、皮下、足底内、および/または皮内で接種する。
【0082】
ハイブリドーマは、リンパ球および不死化骨髄腫細胞から、Kohler,B.およびMilstein,C.(1975)Nature、256:495〜497の一般的な体細胞ハイブリダイゼーション技法またはBuck,D.W.ら、In Vitro、18:377〜381(1982)によって改変されたものを用いて調製することができる。それだけには限定されないが、X63−Ag8.653およびSalk Institute、Cell Distribution Center、米国カリフォルニア州San Diegoからのものを含めた入手可能な骨髄腫系を、ハイブリダイゼーションに使用し得る。一般に、この技法は、ポリエチレングリコールなどのフソゲンを用いて、または当業者に周知の電気的手段によって、骨髄腫細胞とリンパ球細胞とを融合させることを含む。融合後、細胞を融合培地から分離し、ハイブリダイズしていない親細胞を排除するために、ヒポキサンチン−アミノプテリン−チミジン(HAT)培地などの選択的成長培地中で成長させる。血清を添加したまたは添加していない、本明細書中に記載する培地のうちのいずれかを、モノクローナル抗体を分泌するハイブリドーマを培養するために使用できる。細胞融合技法の別の代替方法として、EBV不死化B細胞を使用して対象発明のNotch−1モノクローナル抗体を生成することができる。所望する場合はハイブリドーマを拡大およびサブクローニングし、従来の免疫アッセイ手順(たとえば、ラジオイムノアッセイ、酵素免疫アッセイ、または蛍光免疫アッセイ)によって上清を抗免疫原活性についてアッセイする。
【0083】
抗体源として使用し得るハイブリドーマには、Notch−1に特異的なモノクローナル抗体またはその一部分を産生する親ハイブリドーマのすべての誘導体、子孫細胞が包含される。
【0084】
そのような抗体を産生するハイブリドーマは、in vitroまたはin vivoで既知の手順を用いて成長させ得る。所望する場合は、モノクローナル抗体は、培養培地または体液から、硫安塩析、ゲル電気泳動、透析、クロマトグラフィー、および限外濾過などの従来の免疫グロブリン精製手順によって単離し得る。望ましくない活性が存在する場合は、これは、たとえば、固相に付着させた免疫原から作製された吸着剤上に調製物を流し、所望の抗体を免疫原から溶出または放出させることによって、除去することができる。宿主動物を、ヒトNotch−1、または、二官能性もしくは誘導化剤、たとえば、マレイミドベンゾイルスルホスクシンイミドエステル(システイン残基を介したコンジュゲート)、N−ヒドロキシスクシンイミド(リシン残基を介する)、グルタルアルデヒド、コハク酸無水物、SOCl2、もしくはR1N=C=NR[式中、RおよびR1は異なるアルキル基である]を用いて、免疫化する種において免疫原性であるタンパク質、たとえば、キーホールリンペットヘモシアニン、血清アルブミン、ウシサイログロブリン、またはダイズトリプシン阻害剤とコンジュゲートさせた標的アミノ酸配列を含有する断片を用いて免疫化することで、抗体(たとえばモノクローナル抗体)の集団を得ることができる。
【0085】
宿主動物における免疫化によって作製した抗Notch−1抗体のヒト化。
宿主動物における免疫化によって作製された本発明の抗Notch−1抗体は、その生物活性および医薬上の特性を増加させるために、多くの様式で操作できることが、本発明の企図内にある。そのような操作の一方法はヒト化である。
【0086】
モノクローナル抗体をヒト化するためには4つの一般的なステップが存在する。これらは、(1)開始抗体軽鎖および重鎖可変ドメインのヌクレオチドおよび予測されたアミノ酸配列を決定するステップ、(2)ヒト化抗体を設計する、すなわち、どの抗体フレームワーク領域をヒト化プロセス中に使用するかを判断するステップ、(3)実際のヒト化方法/技法のステップ、ならびに(4)ヒト化抗体を形質移入および発現させるステップである。たとえば、米国特許第4,816,567号、第5,807,715号、第5,866,692号、第6,331,415号、第5,530,101号、第5,693,761号、第5,693,762号、第5,585,089号、および第6,180,370号を参照されたい。
【0087】
非ヒト免疫グロブリンに由来する抗原結合部位を含むいくつかの「ヒト化」抗体分子が記載されており、げっ歯類または改変げっ歯類V領域およびヒト定常ドメインと融合したその関連するCDRを有するキメラ抗体が含まれる。たとえば、Winterら、Nature、349:293〜299(1991)、Lobuglioら、Proc.Nat.Acad.Sci.USA、86:4220〜4224(1989)、Shawら、J Immunol.、138:4534〜4538(1987)、およびBrownら、Cancer Res.、47:3577〜3583(1987)を参照されたい。他の参考文献は、適切なヒト抗体定常ドメインと融合させる前にヒト支持フレームワーク領域(FR)内に移植したげっ歯類CDRを記載している。たとえば、Riechmannら、Nature、332:323〜327(1988)、Verhoeyenら、Science、239:1534〜1536(1988)、およびJonesら、Nature、321:522〜525(1986)を参照されたい。別の参考文献は、組換え操作したげっ歯類フレームワーク領域によって支持されるげっ歯類CDRを記載している。たとえば欧州特許公開第0519596号を参照されたい。これらの「ヒト化」分子は、ヒトレシピエントにおけるこれらの部分の治療的応用の持続期間および有効性を制限する、げっ歯類抗ヒト抗体分子に対する望まない免疫学的応答を最小限にするために設計されている。たとえば、抗体定常領域は、これが免疫学的に不活性である(たとえば補体溶解を誘発しない)ように操作することができる。たとえば、PCT公開PCT/GB99/01441号、英国特許出願第9809951.8号を参照されたい。利用し得る抗体をヒト化する他の方法は、Daughertyら、Nucl.Acids Res.、19:2471〜2476(1991)ならびに米国特許第6,180,377号、第6,054,297号、第5,997,867号、第5,866,692号、第6,210,671号、第6,350,861号、およびPCT公開WO01/27160号にも開示されている。
【0088】
ヒト抗Notch−1抗体。
完全ヒト抗Notch−1抗体は、特定のヒト免疫グロブリンタンパク質を発現するように操作されている市販のマウスを用いることによって得られ得ることが、本発明の企図内にある。また、より望ましい(たとえば完全ヒト抗体)またはより強力な免疫応答を生じるように設計されたトランスジェニック動物も、ヒト化抗体またはヒト抗体の作製に使用し得る。そのような技術の例は、Abgenix,Inc.(カリフォルニア州Fremont)のXenomouse(商標)ならびにMedarex,Inc.(ニュージャージー州Princeton)のHuMAb−Mouse(登録商標)およびTC Mouse(商標)である。
【0089】
また、完全ヒト抗Notch−1抗体は、ファージディスプレイ技術の一般的な方法に従って組換えによって得られ得ることも、本発明の企図内にある。たとえば、米国特許第5,565,332号、第5,580,717号、第5,733,743号、および第6,265,150号、ならびにWinterら、Annu.Rev.Immunol.、12:433〜455(1994)を参照されたい。
【0090】
代替として、ファージディスプレイ技術(McCaffertyら、Nature、348:552〜553(1990))を用いて、ヒト抗体および抗体断片を、in vitroで、免疫化していないドナーからの免疫グロブリン可変(V)ドメイン遺伝子レパートリーから生じさせることができる。この技法によれば、抗体Vドメイン遺伝子をインフレームでM13またはfdなどの糸状バクテリオファージの主要または副コートタンパク質遺伝子のいずれか中にクローニングし、ファージ粒子の表面上に機能的抗体断片として表示させる。糸状粒子はファージゲノムの一本鎖DNAコピーを含有するため、抗体の機能的特性に基づく選択も、これらの特性を示す抗体をコードしている遺伝子の選択をもたらす。したがって、ファージはB細胞の特性の一部を模倣する。ファージディスプレイは様々な様式で行うことができる。総説には、たとえばJohnson,Kevin S.およびChiswell,David J.、Current Opinion in Structural Biology、3:564〜571(1993)を参照されたい。V遺伝子セグメントのいくつかの供給源をファージディスプレイに使用することができる。Clacksonら、Nature、352:624〜628(1991)は、抗オキサゾロン抗体の多様なアレイを、免疫化したマウスの脾臓に由来するV遺伝子の小さなランダムコンビナトリアルライブラリから単離した。免疫化していないヒトドナーからのV遺伝子のレパートリーを構築することができ、抗原(自己抗原が含まれる)の多様なアレイに対する抗体は、Markら、J.Mol.Biol.、222:581〜597(1991)またはGriffithら、EMBO J.、12:725〜734(1993)によって記載されている技法に本質的に従って単離することができる。天然の免疫応答では、抗体遺伝子は、高い確率で突然変異を蓄積する(体細胞超変異)。導入した変化の一部はより高い親和性を与え、高親和性の表面免疫グロブリンを示すB細胞が、続く抗原免疫誘発中に優先的に複製および分化される。この天然プロセスは、「鎖シャフリング」として知られる技法を用いることによって模倣することができる。(Marksら、Bio/Technol.、10:779〜783(1992))。この方法では、ファージディスプレイによって得られる「一次」ヒト抗体の親和性は、重鎖および軽鎖のV領域遺伝子を、免疫化していないドナーから得られたVドメイン遺伝子の天然に存在する変異体のレパートリー(レパートリー)で連続的に置き換えることによって、向上させることができる。この技法により、pM〜nMの範囲の親和性を有する抗体および抗体断片の生成が可能となる。非常に大きなファージ抗体レパートリー(「最大のライブラリ(the mother−of−all libraries)」としても知られる)を作製するための戦略は、Waterhouseら、Nucl.Acids Res.、21:2265〜2266(1993)によって記載されている。
【0091】
また、遺伝子シャフリングを用いてヒト抗体をげっ歯類抗体から誘導することもでき、ヒト抗体は開始げっ歯類抗体と類似の親和性および特異性を有する。「エピトープインプリント」とも呼ばれるこの方法によれば、ファージディスプレイ技法によって得られたげっ歯類抗体の重鎖または軽鎖Vドメイン遺伝子をヒトVドメイン遺伝子のレパートリーで置き換えて、げっ歯類−ヒトのキメラを作出する。抗原に対する選択により、機能的抗原結合部位を修復することができるヒト可変領域の単離がもたらされる、すなわち、エピトープがパートナーの選択を支配する(インプリント)。残りのげっ歯類Vドメインを置き換えるためにプロセスを繰り返した場合、ヒト抗体が得られる(PCT公開WO93/06213号を参照)。CDR移植によるげっ歯類抗体の伝統的なヒト化とは異なり、この技法は、げっ歯類起源のフレームワークまたはCDR残基をまったく有さない完全ヒト抗体を提供する。
【0092】
上記論考はヒト化抗体およびヒト抗体に関するが、論じた一般的な原理は、抗体を、たとえば、イヌ、ネコ、霊長類、ウマおよびウシにおいて使用するためにあつらえることに適用可能である。本明細書中に記載の抗体をヒト化する1つまたは複数の態様、たとえば、CDR移植、フレームワーク突然変異およびCDR突然変異を組み合わせ得る。
【0093】
組換えによって作製した、操作および改変した抗Notch−1抗体。
一般に、抗体は、所望の抗体のDNA配列を発現ベクター内に配置し、次いで、それだけには限定されないが、そうでなければ免疫グロブリンタンパク質を産生しない大腸菌(E.coli)細胞、サルCOS細胞、チャイニーズハムスター卵巣(CHO)細胞、または骨髄腫細胞を含めた宿主細胞中での形質移入および発現によって、組換えによって作製し得る。PCT特許公開WO87/04462号。トランスジェニック植物細胞またはトランスジェニック乳細胞などの他の宿主細胞も使用し得る。たとえば、Peetersら、Vaccine、19:2756(2001)、Lonberg,N.およびD.Huszar、Int.Rev.Immunol、13:65(1995)、ならびにPollockら、J Immunol Methods、231:147(1999)を参照されたい。
【0094】
また、抗体は、組換えによって改変もし得る。たとえば、ヒト重鎖および軽鎖定常領域のDNAをマウス抗体DNAの相同的なマウス配列、Morrisonら、Proc.Nat.Acad.Sci.、81:6851(1984)の代わりに、または免疫グロブリンコード配列に、非免疫グロブリンポリペプチドのコード配列の全体もしくは一部を共有結合させることによって使用してもよい。同様の様式で、本明細書中の抗Notch−1モノクローナル抗体の結合特異性を有する「キメラ」または「ハイブリッド」抗体を調製することができる。
【0095】
また、抗体可変領域は、CDR移植によっても改変することができる。CDR配列がほとんどの抗体−抗原の相互作用を司っているため、異なる特性を有する異なる抗体からのフレームワーク配列上に移植した、特定の天然に存在する抗体からのCDR配列が含まれる発現ベクターを構築することによって、特定の天然に存在する抗体の特性を模倣する組換え抗体を発現させることが可能である(たとえば、Riechmann,L.ら(1998)Nature、332:323〜327、Jones,P.ら(1986)Nature、321:522〜525、Queen,C.ら(1989)Proc.Natl.Acad.See.U.S.A.、86:10029〜10033、Winterの米国特許第5,225,539号、ならびにQueenらの米国特許第5,530,101号、第5,585,089号、第5,693,762号および6,180,370号を参照)
【0096】
したがって、本開示の別の態様は、それぞれ配列番号18、19および20からなる群から選択されるアミノ酸配列を含むCDR1、CDR2、およびCDR3の配列を含む重鎖可変領域、ならびにそれぞれ配列番号12、13および14からなる群から選択されるアミノ酸配列を含むCDR1、CDR2、およびCDR3の配列を含む軽鎖可変領域を含む、単離されたモノクローナル抗体またはその抗原結合部分に関する。したがって、そのような抗体は、モノクローナル抗体N248AのVHおよびVLのCDR配列を含有する一方で、これらの抗体からの異なるフレームワーク配列を含有し得る。そのようなフレームワーク配列は、生殖系列抗体遺伝子配列が含まれる公的DNAデータベースまたは公開参考文献から得ることができる。
【0097】
別の種類の可変領域の改変は、VHおよび/またはVLのCDR1、CDR2および/またはCDR3領域内のアミノ酸残基と突然変異させることによって、目的の抗体の1つまたは複数の結合特性(たとえば親和性)を向上させることである。部位特異的突然変異誘発またはPCR媒介性突然変異誘発を行って突然変異(複数可)を導入することができ、抗体結合、または他の目的の機能的特性に対する効果は、本明細書中に記載のようにin vitroまたはin vivoのアッセイで評価することができる。典型的には、保存的改変(以下に論じる)が導入される。突然変異は、アミノ酸の置換、付加または欠失であり得る。さらに、典型的には、CDR領域内の1個以下、2、3、4または5個の残基が変更される。
【0098】
保存的置換および抗体親和性成熟は、後の段落でより詳細に論じる。
【0099】
抗体が結合する抗原エピトープのマッピング。
抗原上のモノクローナル抗体の結合エピトープは、抗原−抗体の相互作用の種類に応じて、いくつかの方法によってマッピングし得る。
【0100】
抗体が、抗原中の連続的なアミノ酸残基からなる、その結合が抗原のコンホメーション変化によって通常は影響を受けない単一のエピトープと結合する場合、結合エピトープは直鎖エピトープと呼ばれる。直鎖結合エピトープを同定するために、ペプチド走査方法を一般的に使用し(Journal of Immunological Methods、第315巻、第1〜2号、11〜18ページ、2006年8月を参照)、これは、抗原配列の全長にわたる、一連の重複する10〜15量体ペプチドを合成することを要する。ペプチドを2つ組のドット方式でタンパク質架橋結合膜上にアレイ配置する。ペプチドアレイに対する抗体の結合親和性をELISAと同様に分析する。ペプチドをアレイ配置した膜を、非特異的結合を遮断するために5%のウシ胎児血清を含む1×PBST中で最初にインキュベーションし、その後、試験抗体または非特異的な対照抗体と共にインキュベーションし、次いで、HRPで標識した二次抗体と共にインキュベーションする。抗体の結合強度は、化学発光イメージング機器を用いて読み取る。
【0101】
代替として、直鎖結合エピトープは、酵母細胞表面上に表示された抗原タンパク質ドメインを用いて(Journal of Molecular Biology、365(1)、196〜200、2007年1月を参照)、または細菌細胞表面上に表示された抗原タンパク質断片を用いて(FEMS Microbiol.Lett.、226(2)、347〜353、2003年9月を参照、Nature Methods、5(12)、1039〜1045、2008年11月も参照)、次いでフローサイトメトリー分別、すなわちFACSで同定し得る。
【0102】
質量分析と組み合わせた、ペプチド抗原および抗体複合体の限定タンパク質分解が、直鎖結合エピトープを位置決定するための別の手法を提供し得る(Methods Mol.Biol.、524、87〜101、2009を参照)。抗原および抗体を混合し、結合複合体を形成するために適した条件でインキュベーションし、これを、制御された温度および時間のもとでプロテアーゼによって消化する。その後、結合した反応混合物をプロテインA親和性カラムに通して、抗原エピトープ断片と結合した抗体を保持させ、これを、カラムから溶出させた後に、質量分析によって分析する。
【0103】
コンホメーションエピトープのマッピングは、抗体とそのネイティブなコンホメーションの抗原との相互作用に依存する。いくつかの技法が、コンホメーションエピトープの決定において有用であることが報告されている。一般的に使用される方法の1つはアミノ酸突然変異誘発である。抗体と結合することが推測される抗原タンパク質中の個々のアミノ酸残基を突然変異させ、その後、突然変異した抗原タンパク質を発現させ、抗体結合分析に供して、結合親和性が損なわれたかどうかを決定する。しかし、完全抗原タンパク質配列にわたる系統的なアミノ酸突然変異誘発は労力がかかる。抗体と相互作用する抗原タンパク質の領域を絞り込むために、密に関連するタンパク質ドメインによる個々の抗原ドメインの置換が有用な方法である場合がある(J.Biol.chem.、274(14)9617〜9626、1999年4月を参照)。
【0104】
ショットガン突然変異誘発マッピングが、従来のアミノ酸突然変異誘発の欠点を克服するために開発された(J.American Chem.Soc、131、6952〜6954、2009を参照)。この方法では、抗原cDNAから作製した包括的な突然変異ライブラリを利用し、それぞれのプラスミドクローンは独特の点突然変異を含有し、突然変異ライブラリ全体が抗原コード領域のすべてのアミノ酸をカバーする。プラスミドクローンのライブラリをHEK−293Tまたは他のヒト細胞中に形質移入させ、その後、細胞を、384ウェルマイクロプレート中にアレイ配置させる。細胞をマイクロプレート上に固定した後に抗体の結合活性をアッセイする。アミノ酸の突然変異が反応性の損失をもたらす場合、これは抗体結合エピトープとして同定される。
【0105】
抗原−抗体の複合体の共結晶化、X線回折および構造解析により、抗原−抗体の相互作用の方向の可視化が与えられる。アミノ酸突然変異誘発と組み合わせた場合、この技術は抗体結合エピトープの強力な証拠および鮮明な描写を提供するであろう。しかし、共結晶化および構造解析が技術的に難しく、大量の精製した抗原および抗体を必要とし、時間のかかる試行錯誤プロセスとなる場合がある。
【0106】
1つのエピトープまたは指定したエピトープの組と結合する抗Notch−1抗体を作製するために、抗Notch−1抗体を作製し、その後、当分野で一般に知られている上記マッピング方法に従って、これらの抗体のそれぞれが結合するエピトープまたはエピトープの組を決定することができる。その後、特定のエピトープまたは特定のエピトープの組と結合する抗Notch−1抗体を選択することができる。
【0107】
保存的置換
既に論じたように、抗体は、抗体のアミノ酸残基のうちの1つもしくは複数の保存的置換によって、または抗体のアミノ酸への、アミノ酸の1つもしくは複数の欠失もしくは付加によって、組換えにより改変されてもよい。
【0108】
アミノ酸配列の挿入には、1個の残基から100個以上の残基を含有するポリペプチドの長さの範囲のアミノおよび/またはカルボキシル末端の融合体、ならびに単一または複数のアミノ酸残基の配列内挿入が含まれる。末端挿入の例には、N末端メチオニル残基を有する抗体またはエピトープタグと融合した抗体が含まれる。抗体分子の他の挿入変異体には、抗体のNまたはC末端と血液循環中の抗体の半減期を増加させる酵素またはポリペプチドとの融合が含まれる。
【0109】
置換変異体は、抗体分子中の少なくとも1つのアミノ酸残基が除去され、異なる残基がその代わりに挿入されている。最も関心が持たれる置換突然変異誘発の部位には超可変領域が含まれるが、FRの変更も企図される。保存的置換を表2に示す。そのような置換が生物活性の変化をもたらす場合は、表2中で「例示的な置換」と命名した、またはアミノ酸クラスを参照して以下にさらに記載した、より実質的な変化を導入し、生成物をスクリーニングし得る。
【0110】
【表2】

【0111】
抗体の生物学的特性の実質的な改変は、(a)置換領域中の、たとえばシートもしくはヘリックスコンホメーションとしてのポリペプチド主鎖の構造、(b)標的部位での分子の荷電もしくは疎水性、または(c)側鎖の嵩の維持におけるその効果が顕著に異なる置換を選択することによって、達成される。天然に存在する残基は、共通の側鎖特性に基づいて以下の群に分類される:
(1)非極性:ノルロイシン、Met、Ala、Val、Leu、Ile、
(2)極性、荷電なし:Cys、Ser、Thr、Asn、Gln、
(3)酸性(負荷電):Asp、Glu、
(4)塩基性(正荷電):Lys、Arg、
(5)鎖の配向に影響を与える残基:Gly、Pro、および
(6)芳香族:Trp、Tyr、Phe、His。
【0112】
非保存的置換は、これらのクラスのうちの1つのメンバーを別のクラスに交換することによって行う。
【0113】
また、抗体の適正のコンホメーションの維持に関与していない任意のシステイン残基も、一般にセリンで置換して、分子の酸化安定性を向上させ、異常な架橋結合を防止し得る。逆に、システイン結合(複数可)を、特に抗体がFv断片などの抗体断片である場合に、その安定性を向上させるために抗体に付加し得る。
【0114】
親和性成熟した抗Notch−1抗体
本発明には、親和性成熟した実施形態が含まれる。たとえば、親和性成熟した抗体は、当分野で知られている手順によって生成することができる(Marksら(1992)Bio/Technology、10:779〜783、Barbasら(1994)Proc Nat.Acad.Sci,USA、91:3809〜3813、Schierら(1995)Gene、169:147〜155、Yeltonら(1995)J.Immunol.、155:1994〜2004、Jacksonら(1995)J.Immunol.、154(7):3310〜9、Hawkinsら(1992)J.Mol.Biol.、226:889〜896、およびPCT公開WO2004/058184号)。
【0115】
以下の方法を、抗体の親和性の調整およびCDRの特徴づけに使用し得る。「ライブラリ走査突然変異誘発」と呼ばれる、抗体のCDRを特徴づけるおよび/または抗体などのポリペプチドの結合親和性を変更させる(向上させるなど)一方法。一般に、ライブラリ走査突然変異誘発は以下のように動作する。当分野で認識されている方法を用いて、CDR中の1つまたは複数のアミノ酸位置を2種類以上(3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、または20種類など)のアミノ酸で置き換える。これによりクローンの小ライブラリが作製され(一部の実施形態では、分析するそれぞれのアミノ酸位置について1つずつ)、そのそれぞれが2つ以上のメンバーの複雑さを有する(それぞれの位置で2種類以上のアミノ酸を置換する場合)。一般に、ライブラリには、ネイティブ(非置換)のアミノ酸を含むクローンも含まれる。それぞれのライブラリからの少数のクローン、たとえば約20〜80個のクローン(ライブラリの複雑さに依存する)を、標的ポリペプチド(または他の結合標的)に対する結合親和性についてスクリーニングし、増加した、同じ、減少した結合を有する、または結合しない候補を同定する。
【0116】
一部の実施形態では、当分野で認識されている突然変異誘発方法を用いて、CDR中のそれぞれのアミノ酸位置を、一部の実施形態では、1回に1個、20種類すべての天然アミノ酸で置き換える。これによりクローンの小ライブラリが作製され(一部の実施形態では、分析するそれぞれのアミノ酸位置について1つずつ)、そのそれぞれが20個のメンバーの複雑さを有する(それぞれの位置で20種類すべてのアミノ酸を置換する場合)。
【0117】
一部の実施形態では、スクリーニングするライブラリは、同じCDR中または2つ以上のCDR中であり得る2つ以上の位置での置換を含む。したがって、ライブラリは、1つのCDR中の2つ以上の位置での置換を含み得る。ライブラリは、2つ以上のCDR中の2つ以上の位置での置換を含み得る。ライブラリは、2、3、4、5または6個のCDR中に見つかる3、4、5、またはそれより多くの位置での置換を含み得る。置換は、冗長性の低いコドンを用いて調製し得る。たとえば、Balintら、(1993)Gene、137(1):109〜18)の表2を参照されたい。それぞれのCDRは、Kabat CDR、Chothia CDR、または拡張CDRであり得る。
【0118】
向上した結合を有する候補を配列決定し、それにより、「向上した」置換とも呼ばれる、向上した親和性をもたらすCDR置換突然変異体を同定し得る。また、結合する候補も配列決定し、それにより、結合を保持するCDR置換も同定し得る。
【0119】
複数回のスクリーニングを実施し得る。たとえば、それぞれが1つまたは複数のCDRの1つまたは複数の位置でアミノ酸置換を含む、向上した結合を有する候補は、それぞれの向上したCDR位置(すなわち、置換突然変異体が向上した結合を示したCDR中のアミノ酸位置)で少なくとも元のおよび置換されたアミノ酸を含有する第2のライブラリの設計にも有用である。このライブラリの調製、およびスクリーニングまたは選択を以下にさらに記述する。
【0120】
また、ライブラリ走査突然変異誘発は、向上した結合、同じ結合、減少した結合を有する、または結合しないクローンの頻度が、抗体−抗原の複合体の安定性のためにそれぞれのアミノ酸位置の重要性に関する情報も提供する限りは、CDRを特徴づけるための手段も提供する。たとえば、CDRのある位置が、20種類すべてのアミノ酸に変化させたときに結合を保持している場合、その位置は、抗原結合に必要である可能性が低い位置として同定される。逆に、あるCDRの位置が、置換の少ないパーセンテージのみで結合を保持している場合は、その位置は、CDR機能に重要な位置として同定される。したがって、ライブラリ走査突然変異誘発方法は、多くの異なるアミノ酸(20種類すべてのアミノ酸が含まれる)に変化させることができるCDR中の位置、および変化させることができないまたは少数のアミノ酸にのみ変化させることができるCDR中の位置に関する情報をもたらす。
【0121】
向上した親和性を有する候補は、向上したアミノ酸、その位置での元のアミノ酸が含まれ、所望されるライブラリの複雑さ次第で、または所望のスクリーニングもしくは選択の方法を用いて許容される、その位置での追加の置換がさらに含まれ得る、第2のライブラリ中で合わせ得る。さらに、所望する場合は、隣接アミノ酸位置を、少なくとも2種類以上のアミノ酸にランダム化することができる。隣接アミノ酸のランダム化は、突然変異体CDRにおけるさらなるコンホメーションの柔軟性を可能にする場合があり、これは、立ち代って、より多数の向上させる突然変異の導入を可能または容易にし得る。また、ライブラリは、第1の回目のスクリーニングで向上した親和性を示さなかった位置での置換も含み得る。
【0122】
Biacore表面プラズモン共鳴分析を用いたスクリーニング、ならびにファージディスプレイ、酵母ディスプレイ、およびリボソームディスプレイを含めた当分野で知られている選択のための任意の方法を用いた選択を含めた、当分野で知られている任意の方法を用いて、第2のライブラリを、向上したおよび/または変更された結合親和性を有するライブラリメンバーについてスクリーニングまたは選択する。
【0123】
抗Notch−1抗体の翻訳後修飾
また、抗体は、それだけには限定されないが、様々な糖でのグリコシル化、アセチル化、およびリン酸化を含めた翻訳後修飾によって修飾されることもできる。抗体は、その定常領域中の保存的な位置でグリコシル化される。免疫グロブリンのオリゴ糖側鎖は、タンパク質の機能(Boydら、1996、Mol.Immunol.、32:1311〜1318、WittweおよびHoward、1990、Biochem.、29:4175〜4180)、ならびにコンホメーションに影響を与える場合がある、糖タンパク質の部分間の分子内相互作用に影響を与え、糖タンパク質の三次元表面を提示した(JefferisおよびLund、上記、WyssおよびWagner、1996、Current Opin.Biotech.、7:409〜416)。また、オリゴ糖は、特異的な認識構造に基づいて所定の糖タンパク質を特定の分子に標的化する役割も果たし得る。また、抗体のグリコシル化は抗体依存性細胞性細胞傷害(ADCC)に影響を与えることも報告されている。具体的には、二分GlcNAcの形成を触媒するグリコシルトランスフェラーゼであるβ(1,4)−N−アセチルグルコサミニルトランスフェラーゼIII(GnTIII)のテトラサイクリン調節性発現を有するCHO細胞が、向上したADCC活性を有することが報告されている(Umanaら、1999、Mature Biotech.、17:176〜180)。
【0124】
抗体のグリコシル化は、典型的にはN−連結またはO−連結のいずれかである。N−連結とは、炭水化物部分の、アスパラギン残基の側鎖への付着をいう。トリペプチド配列アスパラギン−X−セリン、アスパラギン−X−スレオニン、およびアスパラギン−X−システイン[式中、Xはプロリン以外の任意のアミノ酸である]が、アスパラギン側鎖への炭水化物部分の酵素的付着の認識配列である。したがって、ポリペプチド中にこれらのトリペプチド配列のいずれかが存在することにより、潜在的なグリコシル化部位が作出される。O−連結グリコシル化とは、糖であるN−アセチルガラクトサミン、ガラクトース、またはキシロースのうちの1つの、ヒドロキシアミノ酸、最も一般的にはセリンまたはスレオニンへの付着をいうが、5−ヒドロキシプロリンまたは5−ヒドロキシリシンも使用し得る。
【0125】
抗体へのグリコシル化部位の付加は、上述のトリペプチド配列のうちの1つまたは複数を含有するようにアミノ酸配列を変更することによって、好都合に達成される(N−連結グリコシル化部位用)。また、変更は、元の抗体の配列に1つまたは複数のセリンまたはスレオニン残基を付加する、またはそれによって置換することによっても行い得る(O−連結グリコシル化部位用)。
【0126】
また、抗体のグリコシル化パターンは、根底にあるヌクレオチド配列を変更させずに変更し得る。グリコシル化は、抗体を発現させるために使用する宿主細胞に大きく依存する。潜在的な治療剤としての組換え糖タンパク質、たとえば抗体の発現に使用する細胞種がネイティブ細胞であることは稀なため、抗体のグリコシル化パターンが変動することを予測することができる(たとえばHseら(1997)J.Biol.Chem.、272:9062〜9070を参照)。
【0127】
宿主細胞の選択に加えて、抗体の組換え産生中のグリコシル化に影響を与える要因には、成長様式、培地配合、培養密度、酸素化、pH、精製スキームなどが含まれる。オリゴ糖の産生に関与している特定の酵素の導入または過剰発現を含めた様々な方法が、特定の宿主生物において達成されるグリコシル化パターンを変更するために提案されている(米国特許第5,047,335号、第5,510,261号および第5.278、299号)。グリコシル化、または特定の種類のグリコシル化を、糖タンパク質から、たとえば、エンドグリコシダーゼH(Endo H)、N−グリコシダーゼF、エンドグリコシダーゼF1、エンドグリコシダーゼF2、エンドグリコシダーゼF3を用いて、酵素的に除去することができる。さらに、組換え宿主細胞は、特定の種類の多糖のプロセッシングが欠損しているように遺伝子操作することができる。これらおよび類似の技法は当分野で周知である。
【0128】
翻訳後修飾の他の方法には、それだけには限定されないが、酵素的手段、酸化置換およびキレート化を含めた、当分野で知られているカップリング技法の使用が含まれる。修飾は、たとえば、免疫アッセイ用の標識を付着させるために使用することができる。
【0129】
改変された定常領域を有する抗Notch−1抗体
本発明の一部の実施形態では、抗体は、免疫学的に不活性もしくは部分的に不活性である、たとえば、補体媒介性の溶解を誘発しない、抗体依存性細胞媒介性細胞毒性(ADCC)を刺激しない、もしくはミクログリアを活性化させない、または、補体媒介性の溶解の始動、抗体依存性細胞媒介性細胞毒性(ADCC)の刺激もしくはミクログリアの活性化のうちの任意の1つもしくは複数において低下した活性を有する(改変されていない抗体と比較して)定常領域などの、改変された定常領域を含む。定常領域の様々な改変を使用して、エフェクター機能の最適なレベルおよび/または組合せを達成し得る。たとえば、Morganら、Immunology、86:319〜324(1995)、Lundら、J.Immunology、157:4963〜9、157:4963〜4969(1996)、Idusogieら、J.Immunology、164:4178〜4184(2000)、Taoら、J.Immunology、143:2595〜2601(1989)、およびJefferisら、Immunological Reviews、163:59〜76(1998)を参照されたい。一部の実施形態では、定常領域は、Eur.J.Immunol.(1999)29:2613〜2624、PCT出願PCT/GB99/01441号、および/または英国特許出願第9809951.8号に記載のように改変されている。他の実施形態では、抗体は、以下の突然変異:A330P331からS330S331(アミノ酸の付番は野生型IgG2配列を参照)を含むヒト重鎖IgG2定常領域を含む。Eur.J.Immunol.(1999)29:2613〜2624。さらに他の実施形態では、定常領域は、N−連結グリコシル化のためにアグリコシル化(aglycosylated)されている。一部の実施形態では、定常領域は、グリコシル化されたアミノ酸残基または定常領域中のN−グリコシル化認識配列の一部であるフランキング残基を突然変異させることによって、N−連結グリコシル化のために脱グリコシル化されている。たとえば、N−グリコシル化部位N297をA、Q、K、またはHに突然変異させ得る。Taoら、J.Immunology、143:2595〜2601(1989)、およびJefferisら、Immunological Reviews、163:59〜76(1998)を参照されたい。一部の実施形態では、定常領域は、N−連結グリコシル化のために脱グリコシル化されている。定常領域は、N−連結グリコシル化のために酵素的に(酵素PNGaseによって炭水化物を除去することなど)、またはグリコシル化欠損宿主細胞中での発現によって、脱グリコシル化されていてよい。
【0130】
Fc領域内の改変を典型的に使用して、血清半減期、補体固定、Fc受容体結合、および/または抗原依存性細胞毒性などの抗体の1つまたは複数の機能的特性を変更させることができる。さらに、本開示の抗体は、やはり抗体の1つまたは複数の機能的特性を変更させるために、化学修飾し得るか(たとえば1つもしくは複数の化学部分を抗体に付着させることができる)、そのグリコシル化パターンを変更させるために改変し得る。これらの態様のそれぞれは、以下にさらに詳述されている。Fc領域中の残基の付番は、KabatのEU指標のものである。
【0131】
一事例では、CH1のヒンジ領域は、ヒンジ領域中のシステイン残基の数が変更されている、たとえば増加または減少しているように改変されている。この手法は、米国特許第5,677,425号にさらに記載されている。CH1のヒンジ領域中のシステイン残基の数は、たとえば、軽鎖および重鎖のアセンブリを容易にするため、または抗体の安定性を増加もしくは減少させるために変更されている。
【0132】
別の事例では、抗体のFcヒンジ領域は、抗体の生物学的半減期を減少させるために突然変異されている。より詳細には、抗体が、ネイティブのFc−ヒンジドメインのSpA結合と比較して、損なわれたブドウ球菌プロテインA(SpA)の結合を有するように、1つまたは複数のアミノ酸突然変異をFc−ヒンジ断片のCH2−CH3のドメイン界面領域内に導入する。この手法は、米国特許第6,165,745号にさらに詳述されている。
【0133】
別の事例では、抗体は、その生物学的半減期を増加させるために改変されている。様々な手法が可能である。たとえば、米国特許第6,277,375号に記載のように、T252L、T254S、T256Fの突然変異のうちの1つまたは複数を導入することができる。あるいは、米国特許第5,869,046号および6,121,022号に記載のように、生物学的半減期を増加させるために、IgGのFc領域のCH2ドメインの2つのループから採った回収受容体結合エピトープが含有されるように、抗体をCH1またはCL領域内で変更することができる。
【0134】
さらに他の事例では、Fc領域は、抗体のエフェクター機能(複数可)を変更させるために、少なくとも1つのアミノ酸残基を異なるアミノ酸残基で置き換えることによって変更する。たとえば、抗体がエフェクターリガンドに対して変更された親和性を有するが、親抗体の抗原結合能力を保持しているように、アミノ酸残基234、235、236、237、297、318、320および322から選択される1つまたは複数のアミノ酸を異なるアミノ酸残基で置き換えることができる。親和性を変更させるエフェクターリガンドは、たとえば、補体のFc受容体またはC1構成成分であってもよい。この手法は、米国特許第5,624,821号および第5,648,260号にさらに詳述されている。
【0135】
別の事例では、抗体が変更されたC1q結合および/または低下もしくは消滅した補体依存性細胞傷害性(CDC)を有するように、アミノ酸残基329、331および322から選択される1つまたは複数のアミノ酸を異なるアミノ酸残基で置き換えることができる。この手法は、米国特許第6,194,551号にさらに詳述されている。
【0136】
別の例では、アミノ酸位置231および239内の1つまたは複数のアミノ酸残基を変更させることによって、補体を固定する抗体の能力を変更させる。この手法は、PCT公開WO94/29351号にさらに記載されている。
【0137】
さらに別の例では、Fc領域は、238、239、248、249、252、254、255、256、258、265、267、268、269、270、272、276、278、280、283、285、286、289、290、292、293、294、295、296、298、301、303、305、307、309、312、315、320、322、324、326、327、329、330、331、333、334、335、337、338、340、360、373、376、378、382、388、389、398、414、416、419、430、434、435、437、438または439の位置の1つまたは複数のアミノ酸を改変することによって、抗体依存性細胞性細胞傷害(ADCC)を媒介するおよび/またはFcγ受容体に対する抗体の親和性を増加させる抗体の能力を増加させるために改変されている。この手法は、PCT公開WO00/42072号にさらに記載されている。さらに、FcγR1、FcγRII、FcγRIIIおよびFcRnに対するヒトIgG1上の結合部位がマッピングされており、向上した結合を有する変異体が記載されている(Shieldsら、J.Biol.Chem.、276:6591〜6604(2001)を参照)。位置256、290、298、333、334および339での特定の突然変異は、FcγRIIIに対する結合を向上させることが示された。さらに、T256A/S298A、S298A/E333A、S298A/K224AおよびS298A/E333A/K334Aの組合せの突然変異体が、FcγRIIIの結合を向上させることが示された。
【0138】
さらに別の例では、抗体のグリコシル化は改変されている。たとえば、脱グリコシル化された抗体を作製することができる(すなわち、抗体がグリコシル化を欠く)。グリコシル化は、たとえば抗原に対する抗体の親和性を増加させるために変更することができる。そのような炭水化物の改変は、たとえば、抗体配列内の1つまたは複数のグリコシル化部位を変更することによって達成することができる。たとえば、1つまたは複数の可変領域のフレームワークのグリコシル化部位の排除をもたらすことによって、その部位でのグリコシル化を排除する、1つまたは複数のアミノ酸置換を行うことができる。そのようなアグリコシル化(aglycosylation)は、抗原に対する抗体の親和性を増加させ得る。そのような手法は、米国特許第5,714,350号および第6,350,861号にさらに詳述されている。
【0139】
さらに、またはそれに代わって、低下した量のフコシル残基を有する低フコシル化(hypofucosylated)抗体などの変更された種類のグリコシル化を有する抗体または増加した二分GlcNAc構造を有する抗体を作製することができる。そのような変更されたグリコシル化パターンは、抗体のADCC能力を増加させることが実証されている。そのような炭水化物の改変は、たとえば、変更されたグリコシル化機構を有する宿主細胞中で抗体を発現させることによって達成することができる。変更されたグリコシル化機構を有する細胞は当分野で記載されており、本開示の組換え抗体を発現させることによって、変更されたグリコシル化を有する抗体を産生させるための宿主細胞として使用することができる。たとえば、細胞系Ms704、Ms705、およびMs709は、Ms704、Ms705、およびMs709細胞系中で発現された抗体がその炭水化物上にフコースを欠くように、フコシルトランスフェラーゼ遺伝子、FUT8(アルファ(1,6)フコシルトランスフェラーゼ)を欠く。Ms704、Ms705、およびMs709 FUT8−/−細胞系は、2つの置き換えベクターを用いたCHO/DG44細胞中のFUT8遺伝子の標的破壊によって作製した(米国特許公開第2004−0110704号、およびYamane−Ohnukiら、Biotechnol Bioeng、87:614〜22(2004)を参照)。別の例として、欧州特許公開EP1,176,195号は、アルファ1,6結合関連の酵素を低下または排除することによって、そのような細胞系中で発現させた抗体が低フコシル化を示すように、フコシルトランスフェラーゼをコードしている機能を破壊したFUT8遺伝子を有する細胞系を記載している。また、EP1,176,195号は、抗体のFc領域と結合するN−アセチルグルコサミンにフコースを付加することに関して低い酵素活性を有する、または酵素活性を有さない細胞系、たとえばラット骨髄腫細胞系YB2/0(ATCC CRL1662)を記載している。PCT公開WO03/035835号は、フコースをAsn(297)−連結炭水化物に付着させる能力が低下しており、また、その宿主細胞中で発現される抗体の低フコシル化ももたらす、変異体CHO細胞系、Lec13細胞を記載している(Shieldsら、J.Biol.Chem.、277:26733〜26740(2002)も参照)。PCT公開WO99/54342は、操作した細胞系中で発現される抗体が、抗体の増加したADCC活性をもたらす増加した二分GlcNAc構造を示すように、糖タンパク質を改変するグリコシルトランスフェラーゼ(たとえばベータ(1,4)−N−アセチルグルコサミニルトランスフェラーゼIII(GnTIII))を発現するように操作した細胞系を記載している(Umanaら、Nat.Biotech.、17:176〜180(1999)も参照)。あるいは、抗体のフコース残基はフコシダーゼ酵素を用いて切断除去し得る。たとえば、フコシダーゼアルファ−L−フコシダーゼは、抗体からフコシル残基を除去する(Tarentinoら、(1975)Biochem.、14:5516〜23(1975))。
【0140】
本開示によって企図される本明細書中の抗体の別の改変はpeg化である。抗体は、たとえば、抗体の生物学的(たとえば血清)半減期を増加させるためにpeg化することができる。抗体をpeg化するためには、抗体またはその断片を、典型的にはPEGの反応性エステルまたはアルデヒド誘導体などのポリエチレングリコール(PEG)と、1つまたは複数のPEG基が抗体または抗体断片に付着される条件下で反応させる。典型的には、peg化は、反応性PEG分子(または類似の反応性水溶性ポリマー)と用いたアシル化反応またはアルキル化反応を介して実施する。本明細書中で使用する用語「ポリエチレングリコール」には、モノ(C1〜C10)アルコキシ−もしくはアリールオキシ−ポリエチレングリコールまたはポリエチレングリコール−マレイミドなどの他のタンパク質を誘導体化するために使用されている、PEGの任意の形態が包含されることを意図する。特定の事例では、peg化する抗体は脱グリコシル化されている抗体である。タンパク質をpeg化する方法は当分野で知られており、本開示の抗体に適用することができる。たとえば、欧州特許EP0154316B1号およびEP0401384B1号を参照されたい。
【0141】
他の抗体の改変には、PCT公開WO99/58572号に記載のように改変された抗体が含まれる。これらの抗体は、標的分子に向けられた結合ドメインに加えて、ヒト免疫グロブリン重鎖の定常ドメインの全体または一部に実質的に相同的なアミノ酸配列を有するエフェクタードメインを含む。これらの抗体は、標的の顕著な補体依存性溶解、または細胞媒介性破壊を誘発せずに、標的分子と結合することができる。一部の実施形態では、エフェクタードメインは、FcRnおよび/またはFcγRIIbと特異的に結合することができる。これらは、典型的には、2つ以上のヒト免疫グロブリン重鎖CH2ドメインに由来するキメラドメインに基づく。この様式で改変された抗体は、従来の抗体療法に対する炎症性および他の有害な反応を回避するために、慢性抗体療法における使用に特に適している。
【0142】
融合タンパク質
また、本発明には、本発明の抗体またはポリペプチドからの1つまたは複数の断片または領域を含む融合タンパク質も包含される。一実施形態では、本発明の抗体の可変軽鎖領域の少なくとも10個の連続的なアミノ酸および/または可変重鎖領域の少なくとも10個のアミノ酸を含む融合ポリペプチドが提供される。他の実施形態では、可変軽鎖領域の少なくとも約10個、少なくとも約15個、少なくとも約20個、少なくとも約25個、もしくは少なくとも約30個の連続的なアミノ酸および/または可変重鎖領域の少なくとも約10個、少なくとも約15個、少なくとも約20個、少なくとも約25個、もしくは少なくとも約30個の連続的なアミノ酸を含む融合ポリペプチドが提供される。別の実施形態では、融合ポリペプチドは、本発明の抗体の軽鎖可変領域および/または重鎖可変領域を含む。別の実施形態では、融合ポリペプチドは、本発明の抗体の1つまたは複数のCDRを含む。本発明の目的のために、融合タンパク質は、1つまたは複数の抗体およびそれがネイティブ分子中で付着していない別のアミノ酸配列、たとえば、異種配列または別の領域からの相同配列を含有する。例示的な異種配列には、それだけには限定されないが、FLAGタグまたは6Hisタグなどの「タグ」が含まれる。
【0143】
融合ポリペプチドは、当分野で知られている方法、たとえば、合成または組換えによって作出することができる。
【0144】
二重特異性分子
本開示の抗体またはその抗原結合部分を、誘導体化するか、または別の機能的分子、たとえば、別のペプチドもしくはタンパク質(たとえば、ある受容体に対する別の抗体もしくはリガンド)と連結させて、少なくとも2つの異なる結合部位または標的分子と結合する二重特異性分子を作製することができる。本開示の抗体は、実際には、誘導体化するか、複数の他の機能的分子と連結させて、2つ以上の異なる結合部位および/または標的分子と結合する多特異性分子を作製することができる。そのような多特異性分子も本明細書中で使用する用語「二重特異性分子」によって包含されることを意図する。本開示の二重特異性分子を作出するためには、二重特異性分子がもたらされるように、本開示の抗体を、別の抗体、抗体断片、ペプチドまたは結合模倣体などの1つまたは複数の他の結合分子と機能的に連結させることができる(たとえば、化学カップリング、遺伝子融合、非共有会合または別の方法によって)。
【0145】
抗Notch−1抗体をコードしているポリヌクレオチド
また、本発明は、本発明の抗体およびペプチドをコードしている単離したポリヌクレオチド、ならびにポリヌクレオチドを含むベクターおよび宿主細胞も提供する。
【0146】
一態様では、本発明は、本発明のポリヌクレオチドのうちのいずれかを含む、医薬組成物などの組成物を提供する。一部の実施形態では、組成物は、本発明の抗体をコードしているポリヌクレオチドを含む発現ベクターを含む。他の実施形態では、組成物は、本発明の抗体またはポリペプチドのうちのいずれかをコードしているポリヌクレオチドを含む発現ベクターを含む。
【0147】
別の態様では、本発明は、本明細書中に記載のポリヌクレオチドのうちのいずれかを作製する方法を提供する。
【0148】
また、任意のそのような配列に相補的なポリヌクレオチドも本発明によって包含される。ポリヌクレオチドは一本鎖(コードもしくはアンチセンス)または二本鎖であってよく、DNA(ゲノム、cDNAもしくは合成)またはRNA分子であってよい。RNA分子には、イントロンを含有し、1対1の様式でDNA分子に対応するHnRNA分子、およびイントロンを含有しないmRNA分子が含まれる。追加のコードまたは非コード配列が、必ずしもではないが本発明のポリヌクレオチド内に存在してもよく、ポリヌクレオチドは、必ずしもではないが、他の分子および/または支持物質と連結していてもよい。
【0149】
ポリヌクレオチドは、ネイティブ配列(すなわち、抗体もしくはその一部分をコードしている内在配列)を含み得るか、またはそのような配列の変異体を含み得る。ポリヌクレオチド変異体は、ネイティブの免疫反応性分子と比較して、コードされているポリペプチドの免疫反応性が消失しないように、1つまたは複数の置換、付加、欠失および/または挿入を含有する。コードされているポリペプチドの免疫反応性に対する効果は、一般に、本明細書中に記載のように評価し得る。変異体は、好ましくは、ネイティブ抗体またはその一部分をコードしているポリヌクレオチド配列に対して少なくとも約70%の同一性、より好ましくは少なくとも約80%の同一性、さらにより好ましくは少なくとも約90%の同一性、最も好ましくは少なくとも約95%の同一性を示す。
【0150】
2つのポリヌクレオチドまたはポリペプチド配列は、2つの配列中のヌクレオチドまたはアミノ酸の配列が、以下に記載のように最大一致についてアラインメントした際に同じである場合に、「同一」であるといわれる。2つの配列間の比較は、典型的には、配列を比較ウィンドウにわたって比較して、配列類似性の局所的領域を同定および比較することによって行う。本明細書中で使用する「比較ウィンドウ」とは、2つの配列を最適にアラインメントした後に、配列を同数の連続的な位置の参照配列と比較し得る、少なくとも約20個の連続的な位置、通常は30〜約75個、または40〜約50個のセグメントをいう。
【0151】
好ましくは、「配列同一性のパーセンテージ」は、2つの最適にアラインメントした配列を少なくとも20個の位置の比較のウィンドウにわたって比較することによって決定し、比較ウィンドウ中のポリヌクレオチドまたはポリペプチド配列の部分は、2つの配列の最適なアラインメントについて、参照配列(付加または欠失を含まない)と比較して20パーセント以下、通常は5〜15パーセント、または10〜12パーセントの付加または欠失(すなわちギャップ)を含み得る。パーセンテージは、同一の核酸塩基またはアミノ酸残基が両方の配列中に存在する位置の数を決定して一致した位置の数を得て、参照配列中の合計数(すなわちウィンドウの大きさ)で除算し、結果に100を乗算して配列同一性のパーセンテージを得ることによって、計算する。
【0152】
また、またはあるいは、変異体は、ネイティブ遺伝子またはその一部分もしくは相補体に実質的に相同的であり得る。そのようなポリヌクレオチド変異体は、中等度にストリンジェントな条件下で、ネイティブ抗体をコードしている天然に存在するDNA配列(または相補的配列)とハイブリダイズすることができる。
【0153】
適切な「中等度にストリンジェントな条件」には、5×SSC、0.5%のSDS、1.0mMのEDTA(pH8.0)の溶液中での予洗、50℃〜65℃、5×SSC、終夜でのハイブリダイズ、次いで、0.1%のSDSを含有する2×、0.5×および0.2×SSCのそれぞれを用いた65℃で20分間の2回の洗浄が含まれる。
【0154】
本明細書中で使用する「高度にストリンジェントな条件」または「高ストリンジェンシー条件」とは、(1)洗浄に低イオン強度および高温、たとえば、0.015Mの塩化ナトリウム/0.0015Mのクエン酸ナトリウム/0.1%のドデシル硫酸ナトリウム、50℃を用いるもの、(2)ハイブリダイゼーション中に、0.1%のウシ血清アルブミン/0.1%のFicoll/0.1%のポリビニルピロリドン/750mMの塩化ナトリウム、75mMのクエン酸ナトリウムを含む50mMのリン酸ナトリウム緩衝液、pH6.5と共に、42℃で、ホルムアミド、たとえば、50%(v/v)のホルムアミドなどの変性剤を用いるもの、または(3)50%のホルムアミド、5×SSC(0.75MのNaCl、0.075Mのクエン酸ナトリウム)、50mMのリン酸ナトリウム(pH6.8)、0.1%のピロリン酸ナトリウム、5×デンハート溶液、超音波処理したサケ精子DNA(50μg/ml)、0.1%のSDS、および10%の硫酸デキストラン、42℃、42℃で0.2×SSC(塩化ナトリウム/クエン酸ナトリウム)および55℃で50%のホルムアミドでの洗浄、次いで、EDTAを含有する0.1×SSC、55℃からなる高ストリンジェンシー洗浄を用いるものである。当業者には、必要に応じてプローブの長さなどの要因に順応するために、温度、イオン強度などを調整する方法が認識されるであろう。
【0155】
当業者には、遺伝暗号の縮重の結果、本明細書中に記載のポリペプチドをコードしているヌクレオチド配列が多く存在することが理解されるであろう。これらのポリヌクレオチドの一部は、任意のネイティブ遺伝子のヌクレオチド配列に対して最小限の相同性しか保有しない。それにも関わらず、コドン使用頻度の相違が原因で変動するポリヌクレオチドは、本発明によって具体的に企図される。さらに、本明細書中に提供されるポリヌクレオチド配列を含む遺伝子の対立遺伝子は本発明の範囲内にある。対立遺伝子とは、ヌクレオチドの欠失、付加および/または置換などの1つまたは複数の突然変異の結果として変更される、内在性の遺伝子である。生じるmRNAおよびタンパク質は、必ずしもではないが、変更された構造または機能を有し得る。対立遺伝子は、標準の技法(ハイブリダイゼーション、増幅および/またはデータベース配列比較など)を用いて同定し得る。
【0156】
本発明のポリヌクレオチドは、化学合成、組換え方法、またはPCRを用いて得ることができる。
【0157】
組換え方法を用いてポリヌクレオチドを調製するためには、本明細書中でさらに記述するように、所望の配列を含むポリヌクレオチドを適切なベクター内に挿入することができ、立ち代って、ベクターを複製および増幅のための適切な宿主細胞内に導入することができる。ポリヌクレオチドは、当分野で知られている任意の手段によって宿主細胞内に挿入し得る。細胞は、外因性ポリヌクレオチドを直接取り込み、エンドサイトーシス、形質移入、F接合または電気穿孔によって導入することによって形質転換させる。導入された後、外因性ポリヌクレオチドは、非組込みベクター(プラスミドなど)として細胞内に維持されるか、または宿主細胞ゲノム内に組み込まれることができる。そのようにして増幅したポリヌクレオチドは、当分野で周知の方法によって宿主細胞から単離することができる。たとえばSambrookら(1989)を参照されたい。
【0158】
代替として、PCRによりDNA配列の複製が可能となる。PCR技術は当分野で周知であり、米国特許第4,683,195号、第4,800,159号、第4,754,065号および第4,683,202号、ならびにPCR:The Polymerase Chain Reaction、Mullisら編、Birkauswer Press、Boston(1994)に記載されている。
【0159】
RNAは、単離したDNAを適切なベクター中で使用し、それを適切な宿主細胞内に挿入することによって得ることができる。細胞が複製され、DNAがRNAへと転写される際に、たとえばSambrookら、(1989)、上記に記載の当業者に周知の方法を用いて、RNAを単離することができる。
【0160】
適切なクローニングベクターは、標準の技法に従って構築し得るか、または当分野で利用可能な多数のクローニングベクターから選択され得る。選択されるクローニングベクターは使用を意図する宿主細胞に応じて変動し得るが、有用なクローニングベクターは、一般に、自己複製する能力を有し、特定の制限エンドヌクレアーゼの単一の標的を保有し得る、および/またはベクターを含有するクローンの選択に使用することができるマーカーの遺伝子を有し得る。適切な例には、プラスミドおよび細菌ウイルス、たとえば、pUC18、pUC19、Bluescript(たとえばpBS SK+)およびその誘導体、mp18、mp19、pBR322、pMB9、ColE1、pCR1、RP4、ファージDNA、ならびにpSA3およびpAT28などのシャトルベクターが含まれる。これらおよび多くの他のクローニングベクターが、BioRad、Strategene、およびInvitrogenなどの商業的供給業者から入手可能である。
【0161】
発現ベクターは、一般に、本発明によるポリヌクレオチドを含有する複製可能なポリヌクレオチド構築体である。発現ベクターは、エピソームとしてまたは染色体DNAの一体部分として宿主細胞中で複製可能でなければならないことが暗示されている。適切な発現ベクターには、それだけには限定されないが、プラスミド、アデノウイルス、アデノ関連ウイルス、レトロウイルスを含めたウイルスベクター、コスミド、およびPCT公開WO87/04462号に開示されている発現ベクターが含まれる。ベクター構成成分には、一般に、それだけには限定されないが、シグナル配列、複製起点、1つもしくは複数のマーカー遺伝子、適切な転写性制御要素(プロモーター、エンハンサーおよびターミネーターなど)のうちの1つまたは複数が含まれ得る。発現(すなわち翻訳)には、リボソーム結合部位、翻訳開始部位、およびストップコドンなどの1つまたは複数の翻訳制御要素も通常は必要である。
【0162】
目的のポリヌクレオチドを含有するベクターは、電気穿孔、塩化カルシウム、塩化ルビジウム、リン酸カルシウム、DEAE−デキストラン、または他の物質を用いた形質移入、微粒子銃、リポフェクション、および感染(たとえば、ベクターがワクシニアウイルスなどの感染性因子である場合)を含めたいくつかの適切な手段のうちのいずれかによって宿主細胞内に導入することができる。ベクターまたはポリヌクレオチドを導入する選択は、多くの場合、宿主細胞の特長に依存する。
【0163】
また、本発明は、本明細書中に記載のポリヌクレオチドのうちのいずれかを含む宿主細胞も提供する。異種DNAを過剰発現することができる任意の宿主細胞を、目的の抗体、ポリペプチドまたはタンパク質をコードしている遺伝子を単離する目的に使用することができる。哺乳動物宿主細胞の非限定的な例には、それだけには限定されないが、COS、HeLa、およびCHO細胞が含まれる。PCT公開WO87/04462号も参照されたい。適切な非哺乳動物宿主細胞には、原核生物(大腸菌(E.coli)または枯草菌(B.subtillis)など)および酵母(出芽酵母(S.cerevisae)、分裂酵母(S.pombe)、またはケー・ラクチス(K.lactis))が含まれる。好ましくは、宿主細胞は、宿主細胞中に存在する場合は対応する内在性抗体または目的のタンパク質よりも約5倍以上、より好ましくは、10倍以上、さらにより好ましくは、20倍以上のレベルでcDNAを発現する。宿主細胞をNotch−1またはNotch−1ドメインとの特異的結合についてスクリーニングすることは、免疫アッセイまたはFACSによって達成する。目的の抗体またはタンパク質を過剰発現する細胞を同定することができる。
【0164】
医薬組成物
別の態様では、本開示は、薬学的に許容できる担体と一緒に配合した、本開示のモノクローナル抗体またはその抗原結合部分(複数可)のうちの1つまたは組合せを含有する組成物、たとえば医薬組成物を提供する。そのような組成物には、本開示1つもしくは組合せの(たとえば2つ以上の異なる)抗体、または免疫コンジュゲートもしくは二重特異性分子が含まれ得る。たとえば、本開示の医薬組成物は、標的抗原上の異なるエピトープと結合する、または相補的活性を有する、抗体(または免疫コンジュゲートもしくは二重特異性抗体)の組合せを含むことができる。
【0165】
また、本開示の医薬組成物は、組合せ療法で、すなわち他の薬剤と組み合わせて投与することもできる。たとえば、組合せ療法には、少なくとも1つの他の抗炎症剤または免疫抑制剤と組み合わせた、本開示の抗Notch1抗体が含まれることができる。組合せ療法で使用することができる治療剤の例は、以下の本開示の抗体の使用のセクション中にさらに詳述されている。
【0166】
本明細書中で使用する「薬学的に許容できる担体」には、生理的に適合性のある任意かつすべての溶媒、分散媒、コーティング、抗細菌剤および抗真菌剤、等張化剤および吸収遅延剤などが含まれる。典型的には、担体は、静脈内、筋肉内、皮下、非経口、脊髄または表皮投与(たとえば、注射またはインフュージョンによる)に適している。投与経路に応じて、活性化合物、すなわち、抗体、その抗原結合部分、免疫コンジュゲート(immunoconjuage)、または二重特異性分子は、酸および化合物を失活させ得る他の天然条件の作用から化合物を保護するために、物質でコーティングし得る。
【0167】
特定の実施形態では、本開示の抗体は、中性の形態(双極性イオン形態が含まれる)または正もしくは負荷電の種として存在し得る。一部の事例では、抗体は、対イオンと複合して、薬学的に許容できる塩を形成し得る。したがって、本開示の医薬化合物には、1つまたは複数の薬学的に許容できる塩が含まれ得る。
【0168】
「薬学的に許容できる塩」とは、親化合物(たとえば抗体)の所望の生物活性を保持しており、かつ望ましくない毒性効果を与えない塩をいう(たとえばBerge,S.M.ら(1977)J.Pharm.Sci.、66:1〜19を参照)。たとえば、用語「薬学的に許容できる塩」には、1つまたは複数の抗体および1つまたは複数の対イオンを含む複合体が含まれ、対イオンは、薬学的に許容できる無機および有機の酸および塩基に由来する。
【0169】
そのような塩の例には、酸付加塩および塩基付加塩が含まれる。酸付加塩には、塩酸、硝酸、リン酸、硫酸、臭化水素酸、ヨウ化水素酸、リンなどの無毒性の無機酸、ならびに脂肪族モノおよびジカルボン酸、フェニル置換のアルカン酸、ヒドロキシアルカン酸、芳香族酸、脂肪族および芳香族のスルホン酸などの無毒性の有機酸に由来するものが含まれる。塩基付加塩には、ナトリウム、カリウム、マグネシウム、カルシウムなどのアルカリ土類金属、およびN,N’−ジベンジルエチレンジアミン、N−メチルグルカミン、クロロプロカイン、コリン、ジエタノールアミン、エチレンジアミン、プロカインなどの無毒性の有機アミンに由来するものが含まれる。
【0170】
さらに、薬学的に許容できる無機塩基には金属イオンが含まれる。金属イオンには、それだけには限定されないが、適切なアルカリ金属塩、アルカリ土類金属塩および他の生理学的に許容できる金属イオンが含まれる。無機塩基に由来する塩には、その通常の原子価のアルミニウム、アンモニウム、カルシウム、コバルト、ニッケル、モリブデン、バナジウム、マンガン、クロム、セレン、スズ、銅、三価鉄、二価鉄、リチウム、マグネシウム、第二マンガン塩、第一マンガン、カリウム、ルビジウム、ナトリウム、および亜鉛が含まれる。
【0171】
本開示の抗体の薬学的に許容できる酸付加塩は、それだけには限定されないが、ギ酸、酢酸、アセトアミド安息香酸、アジピン酸、アスコルビン酸、ホウ酸、プロピオン酸、安息香酸、ショウノウ酸、炭酸、シクラミン酸、デヒドロコール酸、マロン酸、エデト酸、エチル硫酸、フェンジゾ酸、メタリン酸、コハク酸、グリコール酸、グルコン酸、乳酸、リンゴ酸、酒石酸、タンニン酸、クエン酸、硝酸、アスコルビン酸、グルクロン酸、マレイン酸、葉酸、フマル酸、プロピオン酸、ピルビン酸、アスパラギン酸、グルタミン酸、安息香酸、塩酸、臭化水素酸、ヨウ化水素酸、リシン、イソクエン酸、トリフルオロ酢酸、パモン酸、プロピオン酸、アントラニル酸、メシル酸、オロト酸、シュウ酸、オキサロ酢酸、オレイン酸、ステアリン酸、サリチル酸、アミノサリチル酸、ケイ酸、p−ヒドロキシ安息香酸、ニコチン酸、フェニル酢酸、マンデル酸、エンボン酸、スルホン酸、メタンスルホン酸、リン酸、ホスホン酸、エタンスルホン酸、エタンジスルホン酸、アンモニウム、ベンゼンスルホン酸、パントテン酸、ナフタレンスルホン酸、トルエンスルホン酸、2−ヒドロキシエタンスルホン酸、スルファニル酸、硫酸、硝酸、亜硝酸、硫酸モノメチルエステル、シクロヘキシルアミノスルホン酸、β−ヒドロキシ酪酸、グリシン、グリシルグリシン、グルタミン酸、カコジル酸、ジアミノヘキサン酸、ショウノウスルホン酸、グルコン酸、チオシアン酸、オキソグルタル酸、ピリドキサル5−リン酸、クロロフェノキシ酢酸、ウンデカン酸、N−アセチル−L−アスパラギン酸、ガラクタル酸およびガラクツロン酸を含めた酸から調製することができる。
【0172】
薬学的に許容できる有機塩基には、トリメチルアミン、ジエチルアミン、N,N’−ジベンジルエチレンジアミン、クロロプロカイン、コリン、ジベンジルアミン、ジエタノールアミン、エチレンジアミン、メグルミン(N−メチルグルカミン)、プロカイン、環状アミン、第四級アンモニウム陽イオン、アルギニン、ベタイン、カフェイン、クレミゾール、2−エチルアミノエタノール、2−ジエチルアミノエタノール、2−ジメチルアミノエタノール、エタンジアミン、ブチルアミン、エタノールアミン、エチレンジアミン、N−エチルモルホリン、N−エチルピペリジン、エチルグルカミン、グルカミン、グルコサミン、ヒスチジン、ヒドラバミン、イミダゾール、イソプロピルアミン、メチルグルカミン、モルホリン、ピペラジン、ピリジン、ピリドキシン、ネオジム、ピペリジン、ポリアミン樹脂、プロカイン、プリン、テオブロミン、トリエチルアミン、トリプロピルアミン、トリエタノールアミン、トロメタミン、メチルアミン、タウリン、コレート、6−アミノ−2−メチル−2−ヘプタノール、2−アミノ−2−メチル−1,3−プロパンジオール、2−アミノ−2−メチル−1−プロパノール、脂肪族モノおよびジカルボン酸、フェニル置換のアルカン酸、ヒドロキシアルカン酸、芳香族酸、脂肪族および芳香族のスルホン酸、ストロンチウム、トリシン、ヒドラジン、フェニルシクロヘキシルアミン、2−(N−モルホリノ)エタンスルホン酸、ビス(2−ヒドロキシエチル)アミノ−トリス(ヒドロキシメチル)メタン、N−(2−アセトアミド)−2−アミノエタンスルホン酸、1,4−ピペラジンジエタンスルホン酸、3−モルホリノ−2−ヒドロキシプロパンスルホン酸、1,3−ビス[トリス(ヒドロキシメチル)メチルアミノ]プロパン、4−モルホリンプロパンスルホン酸、4−(2−ヒドロキシエチル)ピペラジン−1−エタンスルホン酸、2−[(2−ヒドロキシ−1,1−ビス(ヒドロキシメチル)エチル)アミノ]エタンスルホン酸、N,N−ビス(2−ヒドロキシエチル)−2−アミノエタンスルホン酸、4−(N−モルホリノ)ブタンスルホン酸、3−(N,N−ビス[2−ヒドロキシエチル]アミノ)−2−ヒドロキシプロパンスルホン酸、2−ヒドロキシ−3−[トリス(ヒドロキシメチル)メチルアミノ]−1−プロパンスルホン酸、4−(2−ヒドロキシエチル)ピペラジン−1−(2−ヒドロキシプロパンスルホン酸)、ピペラジン−1,4−ビス(2−ヒドロキシプロパンスルホン酸)二水和物、4−(2−ヒドロキシエチル)−1−ピペラジンプロパンスルホン酸、N,N−ビス(2−ヒドロキシエチル)グリシン、N−(2−ヒドロキシエチル)ピペラジン−N’−(4−ブタンスルホン酸)、N−[トリス(ヒドロキシメチル)メチル]−3−アミノプロパンスルホン酸、N−トリス(ヒドロキシメチル)メチル−4−アミノブタンスルホン酸、N−(1,1−ジメチル−2−ヒドロキシエチル)−3−アミノ−2−ヒドロキシプロパンスルホン酸、2−(シクロヘキシルアミノ)エタンスルホン酸、3−(シクロヘキシルアミノ)−2−ヒドロキシ−1−プロパンスルホン酸、3−(シクロヘキシルアミノ)−1−プロパンスルホン酸、N−(2−アセトアミド)イミノジ酢酸、4−(シクロヘキシルアミノ)−1−ブタンスルホン酸、N−[トリス(ヒドロキシメチル)メチル]グリシン、2−アミノ−2−(ヒドロキシメチル)−1,3−プロパンジオール、およびトロメタモールが含まれる。
【0173】
また、本開示の医薬組成物には薬学的に許容できる抗酸化剤も含まれ得る。薬学的に許容できる抗酸化剤の例には、(1)アスコルビン酸、塩酸システイン、硫酸水素ナトリウム、メタ亜硫酸水素ナトリウム、亜硫酸ナトリウムなどの水溶性抗酸化剤、(2)パルミチン酸アスコルビル、ブチル化ヒドロキシアニソール(BHA)、ブチル化ヒドロキシトルエン(BHT)、レシチン、没食子酸プロピル、アルファ−トコフェロールなどの油可溶性抗酸化剤、ならびに(3)クエン酸、エチレンジアミン四酢酸(EDTA)、ソルビトール、酒石酸、リン酸などの金属キレート化剤が含まれる。
【0174】
本開示の医薬組成物中で用い得る適切な水性および非水性の担体の例には、水、エタノール、ポリオール(グリセロール、プロピレングリコール、ポリエチレングリコールなど)、およびその適切な混合物、オリーブ油などの植物油、ならびにオレイン酸エチルなどの注射用有機エステルが含まれる。適切な流動性は、たとえば、レシチンなどのコーティング物質を使用することによって、分散液の場合は所要の粒子径を維持することによって、および界面活性剤を使用することによって、維持することができる。
【0175】
また、これらの組成物は、保存料、湿潤剤、乳化剤および分散剤などのアジュバントも含有し得る。微生物の存在の防止は、滅菌手順、上記によって、ならびに様々な抗細菌剤および抗真菌剤、たとえば、パラベン、クロロブタノール、フェノールソルビン酸などを含めることによって、確実にし得る。また、糖、塩化ナトリウムなどの等張化剤を組成物内に含めることも望ましい場合がある。さらに、注射用医薬形態の長期的吸収は、モノステアリン酸アルミニウムおよびゼラチンなどの、吸収を遅延させる薬剤を含めることによってもたらし得る。
【0176】
薬学的に許容できる担体には、無菌的な水溶液または分散液ならびに無菌的な注射用液剤または分散液を即時調製するための無菌的な粉末が含まれる。医薬上活性のある物質のためのそのような媒体および薬剤の使用は、当分野で知られている。任意の従来の媒体または薬剤が活性化合物と不適合である場合以外は、本開示の医薬組成物におけるその使用が企図される。また、補助的活性化合物も組成物内に組み込むことができる。
【0177】
治療的組成物は、典型的には、製造および貯蔵の条件下で無菌的かつ安定でなければならない。組成物は、溶液、マイクロエマルジョン、リポソーム、または高い薬物濃度に適した他の規則的な構造として配合することができる。担体は、たとえば、水、エタノール、ポリオール(たとえば、グリセロール、プロピレングリコール、および液体ポリエチレングリコールなど)、ならびにその適切な混合物を含有する溶媒または分散媒であってもよい。適正の流動性は、たとえば、レシチンなどのコーティングを使用することによって、分散液の場合は所要の粒子径を維持することによって、および界面活性剤を使用することによって、維持することができる。多くの場合、等張化剤、たとえば、糖、マンニトール、ソルビトールなどのポリアルコール、または塩化ナトリウムを組成物中に含めることが好ましい。注射用組成物の長期的吸収は、吸収を遅延させる薬剤、たとえば、モノステアリン酸塩およびゼラチンを組成物中に含めることによってもたらすことができる。
【0178】
無菌注射用液剤は、所要量の活性化合物を適切な溶媒中、必要に応じて上記に列挙した成分のうちの1つまたは組合せと共に取り込ませ、次いで滅菌精密濾過することによって、調製することができる。一般に、分散液は、活性化合物を、基本分散媒および上記に列挙したものからの所要の他の成分を含有する無菌的なビヒクル内に取り込ませることによって調製する。無菌的な注射用液剤を調製するための無菌的な粉末の場合、調製方法には、それだけには限定されないが、以前に滅菌濾過したその溶液からの活性成分および任意の追加の所望の成分の粉末を与える、真空乾燥および凍結乾燥(freeze−drying、lyophilization)が含まれる。
【0179】
担体物質と組み合わせて単一剤形を生じることができる活性成分の量は、処置する対象および具体的な投与様式に応じて変動する。担体物質と組み合わせて単一剤形を生じることができる活性成分の量は、一般に、治療効果を生じる組成物の量である。一般に、この量は、100パーセントのうち、薬学的に許容できる担体と組み合わせて約0.01パーセント〜約99パーセントの活性成分、好ましくは約0.1パーセント〜約70パーセント、最も好ましくは約1パーセント〜約30パーセントの活性成分の範囲となる。
【0180】
最適な所望の応答(たとえば治療反応)を提供するために投薬レジメンを調整する。たとえば、単一のボーラスを投与し得るか、いくつかの分割した用量を経時的に投与し得るか、または治療状況の急迫によって指示されるように用量を比例的に低下もしくは増加させ得る。投与の容易性および投薬の均質性のために、非経口組成物を単位剤形で配合することが特に有利である。本明細書中で使用する単位剤形とは、処置する対象の単位用量として適した物理的に別個の単位をいい、それぞれの単位は、所要の医薬担体と共同して所望の治療効果を生じるように計算された、事前に決定された量の活性化合物を含有する。本開示の単位剤形の仕様は、(a)活性化合物の独特の特徴および達成しようとする特定の治療効果、ならびに(b)個体において感受性を処置するための、そのような活性化合物を化合する分野に固有の制限によって指示され、それに直接依存する。
【0181】
抗体の投与には、用量は宿主の体重1kgあたり約0.0001〜100mg、より通常は0.01〜5mgの範囲である。たとえば、用量は、0.3mg/体重1kg、1mg/体重1kg、3mg/体重1kg、5mg/体重1kgもしくは10mg/体重1kg、または1〜10mg/kgの範囲内とすることができる。例示的な処置レジームは、週に1回、2週間に1回、3週間に1回、4週間に1回、月に1回、3カ月に1回、または3〜6カ月に1回の投与を必要とする。本開示の抗Notch−1抗体またはその抗原結合部分の投薬レジメンには、たとえば、静脈内投与による1mg/体重1kgまたは3mg/体重1kgが含まれ、抗体は、(i)4週間毎に6回の投薬、その後に3カ月毎、(ii)3週間毎、(iii)3mg/体重1kgを1回、次いで1mg/体重1kgを3週間毎の投薬スケジュールのうちの1つを用いて与える。
【0182】
一部の方法では、異なる結合特異性を有する2つ以上のモノクローナル抗体を同時に投与し、その場合、投与するそれぞれの抗体の用量は示した範囲内にある。抗体は、通常、複数回で投与する。単一投薬の間の間隔は、たとえば、週に1回、月に1回、3カ月毎または年に1回とすることができる。また、間隔は、患者中の標的抗原に対する抗体の血液レベルを測定することによって指示されるように、不規則であることもできる。一部の方法では約1〜1000μg/ml、一部の方法では約25〜300μg/mlの血漿抗体濃度が達成されるように、用量を調整する。
【0183】
代替として、抗体は持続放出配合物として投与することができ、その場合、より低い頻度の投与が必要である。用量および頻度は、患者における抗体の半減期に応じて変動する。一般に、ヒト抗体が最も長い半減期を示し、次いでヒト化抗体、キメラ抗体、および非ヒト抗体である。投与の用量および頻度は、処置が予防的または治療的であるかに応じて変動する場合がある。予防的な応用では、比較的低い用量を比較的低い頻度の間隔で長期的に投与する。一部の患者は、その残りの寿命の間、処置を受け続ける。治療的な応用では、比較的短い間隔の比較的高い用量が、疾患の進行が低減または終結するまで、好ましくは患者が疾患の症状の部分的または完全な改善を示すまで必要な場合がある。それ以降、患者に予防的レジームを投与することができる。
【0184】
本開示の医薬組成物中の活性成分の実際の用量レベルは、患者に対して毒性とならずに、特定の患者、組成物、および投与様式について所望の治療反応を達成するために有効な活性成分の量を得るために、変動させ得る。選択される用量レベルは、用いる本開示の特定の組成物、またはそのエステル、塩もしくはアミドの活性、投与経路、投与時間、用いる特定の化合物の排泄率、処置の持続期間、用いる特定の組成物と組み合わせて使用する他の薬物、化合物および/または物質、処置する患者の年齢、性別、重量、状態、全体的な健康および以前の病歴、ならびに医学分野で周知の同様の要因を含めた、様々な薬物動態学要因に依存する。
【0185】
本開示の抗Notch抗体の「治療上有効な用量」は、好ましくは、疾患の症状の重篤度の減少、疾患症状のない期間頻度および持続期間の増加、または疾患の罹患が原因の機能障害もしくは身体障害の予防をもたらす。たとえば、Notch−1−陽性腫瘍の処置には、「治療上有効な用量」は、非処置の対象と比較して、細胞成長または腫瘍増殖を好ましくは少なくとも約20%、より好ましくは少なくとも約40%、さらにより好ましくは少なくとも約60%、さらにより好ましくは少なくとも約80%阻害する。腫瘍増殖を阻害する化合物の能力は、ヒト腫瘍における有効性を予測する動物モデル系において評価することができる。あるいは、組成物のこの特性は、当業者に知られているアッセイによって、in vitroの阻害などの、化合物の阻害する能力を検査することによって、評価することができる。治療上有効な量の治療的化合物は、腫瘍の大きさを減少させるか、または対象における症状を他の形で改善することができる。当業者は、対象の大きさ、対象の症状の重篤度、および選択した特定の組成物または投与経路などの要因に基づいてそのような量を決定できるであろう。
【0186】
本開示の組成物は、1つまたは複数の投与経路を介して、当分野で知られている様々な方法のうちの1つまたは複数を用いて投与することができる。当業者によって理解されるように、経路および/または投与様式は所望の結果に応じて変動する。本開示の抗体またはその抗原結合部分のための投与経路には、静脈内、筋肉内、皮内、腹腔内、皮下、脊髄または他の非経口投与経路、たとえば注射または注入によるものが含まれる。本明細書中で使用する語句「非経口投与」とは、経腸および局所投与以外の投与様式、通常は注射によるものを意味し、それだけには限定されないが、静脈内、筋肉内、動脈内、くも膜下腔内、嚢内、眼窩内、心臓内、皮内、腹腔内、経気管、皮下、表皮下、関節内、被膜下、くも膜下、脊髄内、硬膜外および胸骨内の注射および注入が含まれる。
【0187】
代替として、本開示の抗体またはその抗原結合部分は、局所、表皮または粘膜の投与経路、たとえば、鼻腔内、経口、経膣、直腸、舌下または局所などの、非経口でない経路を介して投与することができる。
【0188】
活性化合物は、移植片、経皮パッチ、およびマイクロカプセル封入送達系を含めた徐放性配合物など、化合物を迅速な放出に対して保護する担体を用いて調製することができる。エチレン酢酸ビニル、ポリ酸無水物、ポリグリコール酸、コラーゲン、ポリオルトエステル、およびポリ乳酸などの、生分解性の生体適合性ポリマーを使用することができる。そのような配合物を調製するための多くの方法が、特許取得されている、または当業者に一般に知られている。たとえばSustained and Controlled Release Drug Delivery Systems、J.R.Robinson編、Marcel Dekker,Inc.、New York、1978を参照されたい。
【0189】
本開示の使用および方法
本開示の抗体、特にヒト抗体、抗体組成物および方法は、Notch−1媒介性の障害の診断および処置に関与する、数々のin vitroおよびin vivoの診断的および治療的な利用性を有する。たとえば、様々な障害を処置、予防および診断するために、これらの分子を、培養中の細胞にin vitroもしくはex vivoで、またはヒト対象にたとえばin vivoで投与することができる。本明細書中で使用する用語「対象」には、ヒトおよび非ヒト動物が含まれることが意図される。非ヒト動物には、すべての脊椎動物、たとえば、非ヒト霊長類、ヒツジ、イヌ、ネコ、ウシ、ウマ、ニワトリ、両生類、および爬虫類などの哺乳動物および非哺乳動物が含まれる。好ましい対象には、Notch−1活性によって媒介される障害を有するヒト患者が含まれる。この方法は、異常なNotch−1発現または活性化に関連する障害を有するヒト患者の処置に特に適している。Notch−1に対する抗体を別の薬剤と一緒に投与する場合、2つはいずれの順序で、または同時に投与することができる。
【0190】
Notch−1に対する本開示の抗体の特異的結合を考慮して、本開示の抗体は、細胞の表面上のNotch−1発現を特異的に検出するために使用することができ、さらに、免疫親和性精製によってNotch−1を精製するために使用することができる。
【0191】
さらに、本開示の抗体、抗体組成物および方法は、異常細胞成長、たとえば癌を有する対象を処置するために使用することができる。特定の一実施形態では、癌はT−ALLである。別の特定の実施形態では、癌は乳癌である。
【0192】
本発明の抗体によって処置し得る他の種類の異常細胞成長には、たとえば、中皮腫、肝胆道(肝管および胆管)、原発性もしくは続発性のCNS腫瘍、原発性もしくは続発性の脳腫瘍、肺癌(NSCLCおよびSCLC)、骨癌、膵癌、皮膚癌、頭部もしくは頚部の癌、皮膚もしくは眼内の黒色腫、卵巣癌、結腸癌、直腸癌、肛門部の癌、胃癌、胃腸管系(胃、結腸直腸、および十二指腸)、乳癌、子宮癌、輸卵管の癌腫、子宮内膜の癌腫、子宮頚部の癌腫、膣の癌腫、外陰部の癌腫、ホジキン病、食道の癌、小腸の癌、内分泌系の癌、甲状腺の癌、副甲状腺の癌、副腎の癌、軟組織の肉腫、尿道の癌、陰茎の癌、前立腺癌、精巣癌、慢性もしくは急性の白血病、慢性骨髄性白血病、リンパ球性リンパ腫、膀胱の癌、腎臓もしくは輸尿管の癌、腎細胞癌、腎盂の癌腫、中枢神経系(CNS)の新生物、原発性CNSリンパ腫、非ホジキンリンパ腫、脊髄軸腫瘍、脳幹神経膠腫、下垂体腺腫、副腎皮質癌、胆嚢癌、多発性骨髄腫、胆管癌、線維肉腫、神経芽細胞腫、網膜芽細胞腫、または前述の癌のうちの1つもしくは複数の組合せが含まれる。
【0193】
本開示の抗体組成物(たとえば、ヒトモノクローナル抗体、多特異性および二重特異性分子ならびに免疫コンジュゲート)またはその抗原結合部分をin vivoおよびin vitroで投与する適切な経路は当分野で周知であり、当業者によって選択されることができる。たとえば、抗体組成物は、注射(たとえば、静脈内または皮下)によって投与することができる。使用する分子の適切な用量は、対象の年齢および重量ならびに抗体組成物の濃度および/または配合に依存する。
【0194】
既に記載のように、本開示のヒト抗Notch−1抗体またはその抗原結合部分は、1つまたは他の複数の治療剤、たとえば、細胞毒性剤、放射性毒性剤または免疫抑制剤と共に同時投与することができる。抗体は、薬剤と連結させることができるか(免疫複合体として)、または薬剤とは分離して投与することができる。後者の場合(別々の投与)、抗体は、薬剤の前、後、もしくはそれと同時に投与することができるか、または他の既知の治療、たとえば抗癌治療、たとえば放射線と同時投与することができる。そのような治療剤には、とりわけ、それ自体では患者に対して毒性または準毒性なレベルでのみ有効な、ドキソルビシン(アドリアマイシン)、シスプラチン、硫酸ブレオマイシン、カルムスチン、クロラムブシル、およびシクロホスファミドヒドロキシ尿素などの抗新生物剤が含まれる。シスプラチンは、4週間に1回の100mg/用量として静脈内投与することができ、adriamycinは、21日に1回の60〜75mg/mlの用量として静脈内投与する。本開示のヒト抗Notch−1抗体またはその抗原結合断片と化学療法剤との同時投与は、異なる機構を介して作動する2つの抗癌剤を提供し、これにより、ヒト腫瘍細胞に対する細胞毒性効果が得られる。そのような同時投与は、薬物に対する耐性の発生、または、腫瘍細胞の、抗体に対するそれらの反応性を失わせる抗原性の変化が原因の問題を解決することができる。
【0195】
キット
また、本開示の抗体組成物(たとえば、ヒト抗体、二重特異性もしくは多特異性分子、または免疫コンジュゲート)および使用説明書を含むキットも、本開示の範囲内にある。キットは、1つもしくは複数の追加の試薬、たとえば、免疫抑制性試薬、細胞毒性剤もしくは放射性毒性剤、または本開示の1つもしくは複数の追加の抗体もしくはその抗原結合部分(たとえば、第1のヒト抗体とは明確に異なる、Notch−1抗原中のエピトープと結合する相補的活性を有するヒト抗体)をさらに含有することができる。
【0196】
したがって、本開示の抗体組成物で処置した患者に、ヒト抗体の治療効果を増強または増大させる、細胞毒性剤または放射性毒性剤などの別の治療剤をさらに投与することができる(本開示のヒト抗体を投与する前、それと同時に、またはその後)。
【0197】
本開示は、さらに限定すると解釈されるべきでない以下の実施例によって、さらに例示される。本出願中で言及するすべての図ならびにすべての参考文献、特許および公開特許出願の内容は、明白に本明細書中に参照により組み込まれる。
【実施例】
【0198】
(実施例1)
Notch1免疫原の作製および発現
Notch1免疫原発現構築体の作製
免疫原構築体は、モノクローナル抗体(mAb)を作製するための多重鎖形成PCR(図1)によって作製した。図1中に例示するように、Notch1免疫原のcDNAを、複数重複PCRによって、Notch1完全長cDNAクローンを鋳型として(OriGene、カタログ番号TC308883、メリーランド州Rockville)、およびHigh Fidelity PCR試薬システムを使用し、製造者のプロトコルに従って(Roche、インディアナ州Indianapolis)合成した。N末端リーダーペプチド、EGF様反復35〜36、NRR、(Lin A、BおよびCドメインならびにHDドメインが含まれる)ならびに細胞内配列の小さな一部分を含有する、組換えNotch1免疫原のcDNAを、Notch1免疫原をFc配列のN末端と融合させたFc融合タンパク質ベクター中にクローニングした。N1−NRR−TM(−)と呼ばれるNotch1免疫原プラスミドは、図11中の配列2(配列番号2)に示す免疫原タンパク質をコードしている図11中の配列1(配列番号1)に示されるcDNA挿入物を含有する。
【0199】
並行して、膜貫通(TM)配列(配列4中の最後の24個のアミノ酸残基)を使用してN1−NRR−TM(−)の細胞内配列(配列2中の最後の44個のアミノ酸残基)を置き換えた以外はN1−NRR−TM(−)と同じ配列を含有する、図2中に示す同様のプラスミドを構築した。このPCR増幅したNotch1免疫原のcDNAをpcDNA3.1D/V5−His(Invitrogen)中にクローニングした。このプラスミドはN1−NRR−TM(+)と呼ぶ。N1−NRR−TM(+)の核酸配列およびアミノ酸配列は、図12中に配列3(配列番号3)および4(配列番号4)として示す。
【0200】
Notch1免疫原タンパク質の発現および精製
N1−NRR−TM(−)を、Freestyle(商標)293−F細胞(Invitrogen,Inc.、カリフォルニア州Calsbad)中で、Freestyle(商標)Max試薬(Invitrogen)および製造者のプロトコルを使用した一過性の形質移入によって発現させ、ウエスタンブロット分析によって確認した。手短に述べると、1×107個の細胞を、30ミリリットル(ml)の293−F細胞成長培地(Invitrogen)を含有する組織培養振盪フラスコ中に播種した。0.5mlの馴化培地のアリコートを形質移入後の2日目から7日目まで24時間毎に取ることによって、分泌されたタンパク質を分析した。20マイクロリットル(ul)の馴化培地および2×タンパク質試料ローディング緩衝液(BioRad、カリフォルニア州Hercules)を合わせ、100℃で5分間加熱した。試料を電気泳動によって4〜12%の勾配のSDS−PAGE(Invitrogen)で分離した。タンパク質を、ドライブロット装置(Invitrogen)を用いてゲルからブロット膜へと移し、その後、膜を、PBST(0.05%のtween−20を含むPBS)中の5%の無脂肪乾燥乳溶液で1時間ブロッキングした。N1−MRRHD−TM(−)/Fc融合タンパク質の検出は、ヒトγFcに特異的な、HRPとコンジュゲートさせた抗体(Bethyl Lab.Inc.、テキサス州Montgomery)とのインキュベーションによって行った。膜をPBSTで3回洗浄した後、Supersignal化学発光基質(Pierce、イリノイ州Rockford)で展開させた。タンパク質発現の時間経過の研究により、5〜6日間の培養物の馴化培地が最多の分泌されたN1−NRR−TM(−)/Fc融合タンパク質を含有していたことが示された。したがって、N1−NRR−TM(−)/Fcタンパク質の発現を10リットルの培養体積にスケールアップし、プロテインG親和性カラム(Invitrogen)によってタンパク質を精製した。
【0201】
Notch1免疫原を発現する細胞系の確立
N1−NRR−TM(+)をマウス細胞系、L−929(ATCC、CCL−1、バージニア州Manassas)中に安定に形質移入させ、細胞表面膜固定タンパク質として発現させた。安定な細胞系はLipoFectamine(商標)2000(Invitrogen)を用いた形質移入によって確立され、細胞を、個々のコロニーが目に見えるまで約9〜15日間、1mg/mlのネオマイシン(G418)に対して選択し、クローン増殖のために拾った。N1−NRR−TM(+)/V5タンパク質の発現レベルは、それぞれの安定な形質移入クローンから作製したタンパク質抽出物を用いたウエスタンブロットによって評価した。より詳細には、それぞれのクローンの細胞を培養容器から取り出し、リン酸緩衝溶液(PBS)ですすぎ、上述のようにウエスタンブロット分析に供した。タンパク質は、HRPとコンジュゲートさせた抗V5抗体(Invitrogen)によって検出した。最も高いレベルのN1−NRR−TM(+)タンパク質を発現する細胞クローンを、免疫化および細胞に基づく抗体結合アッセイの使用のために選択した。
【0202】
(実施例2)
Notch1mAbの作製
免疫化およびハイブリドーマクローニング
Balb/cマウスを、ヒトNotch1免疫原、N1−NRR−TM(−)、および長い免疫化プロトコルを用いて免疫化した。第1の免疫化は、完全フロイントアジュバント(CFA)乳濁液中に混合した20マイクログラム(μg)の抗原を用いた皮下(sc)注射、次いで、それぞれが不完全フロイントアジュバント(IFA)乳濁液中に混合した20μgの抗原を送達する3回の隔週のsc注射によって与えた。4回目の抗原注射の1週間後に血清を採取して、抗体の力価をELISAによって確認した。高い応答力価を有するマウスを安楽死させ、ハイブリドーマクローニングのために脾臓を外科的に取り出した。
【0203】
脾臓細胞の単一の細胞懸濁液は、脾臓を、100ミクロンのステンレス鋼製スクリーン、その後、細胞濾過器に押し通し、30mlのRPMIで2回洗浄することによって調製した。脾臓細胞をSp2/0−Ag14細胞(Sigma、モンタナ州St.Louis)と3対1の比で混合し、50%のPEG−1500を加えて穏やかに攪拌することによって、細胞融合を促進した。細胞の混合物を遠心分離によって沈殿させ、RPMIで穏やかに洗浄し、次いで、20%のウシ胎児血清(FCS)を含むRPMI−1640培地中、37℃で30分間インキュベーションした。細胞を、20%のFCS、標準のHAT(ヒポキサンチン、アミノプテリンおよびチミジン)、25%の脾臓馴化培地、2mMのグルタミン酸ならびに100ug/mlのPen−Strip(Invitrogen、カリフォルニア州Calsbad)を含有するRPMI−1640中に懸濁させ、96ウェルプレートに分注し、37℃/5%CO2インキュベーター中で8〜20日間培養して、HAT耐性ハイブリドーマクローンを確立させた。それぞれのハイブリドーマクローンからの馴化培地をELISAスクリーニングに供した。
【0204】
モノクローナル抗体(mAb)のELISAスクリーニング
酵素結合免疫吸着アッセイ(ELISA)は、2組で調製したNunc(商標)MaxiSorp96ウェルプレート(ThermoFisher Scientific、ニューヨーク州Rochester)を用いて行った。陽性試験プレートは、それぞれウェルにおいて100ngのN1−NRR−TM(−)/Fcタンパク質で終夜コーティングし、陰性対照プレートは100ngのヒトFcタンパク質でコーティングした。ハイブリドーマクローンからの馴化培地を、N1−NRR−TM(−)/Fcタンパク質と結合するその能力についてスクリーニングした。100マイクロリットルのそれぞれのハイブリドーマ上清をコーティングしたプレートに加え、室温で1時間インキュベーションした。ウェルをPBST(0.05%のTween−20を含有する1×PBS)で3回洗浄した。西洋ワサビペルオキシダーゼ(HRP)とコンジュゲートさせたヤギ抗マウスFc抗体を加えて、抗原と結合したmAbを検出した。過剰のHRPを、PBSTを用いた3回の洗浄によって、それぞれの洗浄に200μl/ウェルで洗い流した。その後、ABTS(2,2’−アジノ−ビス−[3−エチルベンズチアゾリン−6−スルホン酸])溶液をHRP発色のための基質として加えた。反応を停止させ、プレートをプレートリーダーによって405nmで走査した。陽性ウェルを、N1−NRR−TM(−)/Fcタンパク質でコーティングしたプレートを用いて再度スクリーニングし、ヒトFcでコーティングしたプレートを用いて、上述と同じようにカウンタースクリーニングした。N1−NRR−TM(−)/Fcタンパク質のみと結合するがヒトFcとは結合しないハイブリドーマmAbが真のNotch1結合抗体であり、これらを選択して機能的スクリーニングに進んだ。
【0205】
(実施例3)
Notch1拮抗性mAbの同定および特徴づけ
ルシフェラーゼレポーターアッセイ細胞系の確立
ルシフェラーゼレポーターアッセイを一般的に使用して、様々な設定におけるNotch1受容体媒介性シグナル伝達および転写活性を評価した(Weng,A.P.ら、Science、2004、9265〜9273、Osipoら、Oncogene、2008、27(37):5019〜5032)。リガンド誘導性のNotch1活性化およびmAb阻害をアッセイするために、Notchシグナル伝達を増強させるためのツール細胞系を開発した。細胞内ドメインからなるNotch受容体の活性型が核へと転位置され、CSL[CBF1、Su(H)およびLAG−1から命名]結合因子1と複合体を形成し、これが遺伝子プロモーター領域中のCSL結合モチーフと呼ばれるコア配列と結合して、下流の遺伝子転写を活性化させることは、十分に確立されている(Bray、2006)。これらの発見に基づいて、Notch1媒介性ルシフェラーゼレポータープラスミドを作製した。手短に述べると、Tunら(Tunら、Nucleic Acids Res.、1994、22(6):965〜971)によって記載されている8個のCSL結合モチーフのコンカテマー(concatemer)を、pTA−Luc(BD Biosiences、カリフォルニア州Palo Alto)の複数のクローニング部位中に挿入した。ハイグロマイシン選択マーカー(次の段落を参照)をルシフェラーゼ遺伝子の下流に付加した。これにより、ルシフェラーゼレポータープラスミド、CSLucが得られた。
【0206】
完全長Notch1発現構築体をOriGene(メリーランド州Rockville)から入手し、配列決定によってNM_017617.2(NCBI/GenBank受託番号)と同一であると確認された。SV40プロモーターを有するハイグロマイシン選択マーカーをpcDNA3.1/ハイグロマイシン(Invitrogen)からPCR合成し、標準のPCR結合方法によってpcDNA5/RFT/V5−His(Invitrogen)からの成長ホルモン3’ポリAシグナル伝達配列に接続した。完成したハイグロマイシンマーカーをNotch1発現プラスミドのCla I部位中に挿入した。このプラスミドをNotch1/Hygと新たに命名した。Notch1活性を増強させるために、部位特異的突然変異誘発によってPEDTドメイン(Weng,A.P.ら、Science、2004、9265〜9273ら)をNotch1/Hygから欠失させた(Genewiz、ニュージャージー州South Plainfield)。生じたプラスミドをNotch1−dPESTと命名した。ヒトJagged1cDNAプラスミドをOpen Biosystems(アラバマ州Huntsville)から入手した。Jagged1コード領域をPCR合成し、pcDNA3.3−TOPO発現ベクター(Invitrogen)内に挿入した。
【0207】
Notch1依存性アッセイ細胞系は、LipoFectamine2000を用いて製造者のプロトコル(Invitrogen)に従って、Notch1/hygおよびCSLucプラスミドをU2−OS(ATCC番号HTB−96、バージニア州Manassas)細胞内に同時形質移入することによって、またはNotch1−dPESTおよびCSLucを293T(ATCC番号CRL−11268、バージニア州Manassas)細胞内に同時形質移入することによって作製した。安定に形質移入された細胞をDMEM成長培地(Invitrogen)中の200〜800μg/mlのハイグロマイシンに対してクローン選択し、細胞クローンを実施例1に記載のようにウエスタンブロット分析によって、および以下のセクションに記載のルシフェラーゼレポーターアッセイによってスクリーニングした。比較的高いレベルのNotch1発現(ウエスタンブロットに基づく)およびデルタ様−4(Dll4)誘導性のルシフェラーゼ活性を有する細胞系を、機能的アッセイで使用するために選択した。2つのそのような細胞系の例は、U2−OS/Notch1−CSLuc(ニックネームN1CU3)および293/Notch1−dPEST−CSLuc(ニックネームN1dP−c16)である。同様の手順によって、ヒトJagged1を安定に発現する細胞系を親細胞系であるHela(ATCC番号CCL−2)から作製した。細胞系はHela/JAG1として命名した。
【0208】
Notch1拮抗性ハイブリドーマクローンのルシフェラーゼレポーターアッセイおよび同定
Notch1阻害性ハイブリドーマクローンを同定するために、ルシフェラーゼレポーターアッセイを用いてN1CU3細胞におけるDll4誘導性のNotch1活性を評価した。96ウェル組織培養プレート(BD Bioscience)を50〜100ナノグラム(ng)の組換えDll4(R&D Systems、ミネソタ州Minneapolis)/ウェルでコーティングした。N1CU3細胞を、50,000個の細胞/ウェルで、Dll4またはBSAでコーティングしたプレートに播種し、30〜50ulのハイブリドーマクローンからの馴化培地を同時に加え、24〜40時間培養した。培養の終了後、すべての培地を除去した後に細胞を1×Passive溶解緩衝液(Promegaウィスコンシン州Madison)で直接溶解し、Bright−Glo(商標)ルシフェラーゼアッセイシステムを用いて製造者のプロトコル(Promegaウィスコンシン州Madison)に従って、およびMicroLumat Plus LB96Vルミノメーター(Berthhold Technologies、ドイツBad Wildbad)を用いて、ルシフェラーゼレポーター活性をアッセイした。Dll4誘導性のNotchレポーター活性に対する統計的に有意な阻害を有するハイブリドーマ上清を、タンパク質Gカラム(Pierce、イリノイ州Rockford)による、製造者のプロトコルに従った親和性精製に供した。精製したmAbをルシフェラーゼレポーターアッセイによってさらに分析し、Notch1依存性シグナル伝達に対する阻害機能が再度確認された。
【0209】
ルシフェラーゼレポーターアッセイによる抗Notch1mAbの特徴づけ
Notch1媒介性シグナル伝達を阻害するmAbのうち、1つのmAb(N248A)が最も強力な阻害活性を示し、これは、いくつかの異なるルシフェラーゼレポーターアッセイによって詳細に特徴づけられた。図3は、Notchシグナル伝達を誘導するためにDll4を培養プレートの表面上にコーティングした際に、mAb N248Aが、Dll4リガンド誘導性のNotch1シグナル伝達の阻害において、コンパニオンmAbであるmAb−Cよりもはるかに高い効力を有していたことを示す。293/Notch1−dPEST−CSLuc細胞をこのアッセイで使用した。Y軸の数値はルシフェラーゼレポーター活性の読取り値である。
【0210】
mAb N248Aが他のNotchリガンド誘導性のシグナル伝達を阻害することができるかどうかを評価するために、Hela/Jagged1細胞およびN1dP−c16細胞を同時培養し、上述のルシフェラーゼレポーターアッセイを行った。mAb N248Aは実際にJagged1誘導性のNotch1シグナル伝達を完全に阻害した(図4)。
【0211】
(実施例4)
抗体の結合親和性の決定
Notch1抗原に対する抗Notch1mAb N248Aの物理的結合親和性は、研究グレードのセンサーチップ(チップ型:CM5)を備えた表面プラズモン共鳴Biacore3000機器上で、HBSPランニング緩衝液(Biacore AB、スウェーデンUppsala、現在はGE Healthcare)+1mMのCaCl2を用いて測定した。標準のN−ヒドロキシスクシンイミド/エチルジメチルアミノプロピルカルボジイミド(NHS/EDC)化学を用いて、タンパク質Aを飽和レベルでチップ上にアミンカップリングさせた。3つすべてのフローセルにおいて、40、13、4ug/mlで、N1−NRR−TM(−)Fcタンパク質(実施例1に記載)をタンパク質Aによってチップ表面に捕捉させた。抗Notch1mAb N248Aを3倍系列で希釈し、1分間100μl/分で注入した。解離を20分間監視した。100mMのリン酸で2回の30秒間パルスを用いて、それぞれの滴定の最後の注入の後にチップを再生した。緩衝液サイクルによりデータの二重参照のためのブランクが提供され、その後、Biaevaluationソフトウェアv.4.1を用いてこれを単純な結合モデルに大域的に当てはめた。親和性は動力学速度定数の商から推定した(KD=koff/kon)。データは、mAb N248AがKon=5.19e−5(Ms)、Koff<1.7e−4(1/s)およびKD<0.33nMを有することを示している。密なKDは速いKonおよび非常に遅いKoffの両方によって寄与され、これは、本発明者らのアッセイによって解明されたものよりも遅い(5%ルール、Biacore3000のマニュアルを参照)。
【0212】
(実施例5)
Notch1拮抗性mAb結合エピトープの分析
ヒトNotch2とのドメインスワップによるmAb結合エピトープのマッピング
Notch1拮抗性mAbによる作用機構を理解するために、Notch1拮抗性mAbの結合エピトープをドメインスワップおよびELISA結合アッセイによって分析した。Notch1−NRR−TM(−)/Fcタンパク質を6つのドメイン、すなわち、EGF(EGF35〜36が含まれる)、Lin12−A(またはLin−A)、Lin−B、Lin−C、ヘテロ二量体化ドメイン−N(またはHD−N)およびHD−C(図5)に分割した。ドメインのそれぞれを、PCR合成によって、一連のキメラNotch1−NRR−TM(−)/Fc発現構築体において、ヒトNotch2に対応するものでスワップした。実施例1に上述したように、Freestyle(商標)Max試薬(Invitrogen)を用いてドメインスワッププラスミドをFreestyle(商標)293−F細胞(Invitrogen,Inc.、カリフォルニア州Calsbad)中に形質移入させた。3日間培養した後、馴化培地をウエスタンブロット分析およびNotch1mAbによるELISA結合アッセイに供した。ウエスタンブロット(方法は実施例1と同様)により、6個のうちの5個のドメインスワップ構築体が良好に発現されたが、Lin−B/Notch2のスワップは発現が少なかったことが示された。
【0213】
ELISAアッセイでは、100マイクロリットルの上記抗原プラスミドで形質移入した細胞培養物からの馴化培地を96ウェルプレートのそれぞれのウェルに載せ、プレートを室温で4時間または4℃で終夜インキュベーションした。その後、条件培地をコーティングしたプレートから除去した。一次抗体の結合には、100マイクロリットルのPBS中の300ngのそれぞれのmAb(表3)をコーティングしたウェルに加えた。ELISA手順の残りは、実施例2に記載のものと同じである。mAb N99a、N326AおよびN440Aは、mAb N248Aと同じ手順によって作製および単離した、Notch−1と結合するモノクローナル抗体であった。表3に示すように、mAb N248Aとキメラ抗原との結合は、Lin−AまたはHD−Cドメインを対応するNotch2ドメインでスワップした場合に完全に消滅した。他方で、EGF、Lin−CまたはHD−Cドメインのスワップはその結合に影響を与えなかった。mAb N326AおよびN440Aは、mAb N248Aとは明確に異なっていた。これら2つのmAbは、その結合活性にHD−NおよびHD−Cドメインを必要とする。N99Aは、その結合にLin−AおよびHD−Cドメインが必要であるという点で、mAb N248Aとやや似ている。しかし、HD−NドメインのスワップはN99Aの結合活性も低下させた。これらのデータは、mAb N248Aが少なくとも2つの区別可能な結合エピトープの組を、1つはLin−Aドメイン中、他方はHD−Cドメイン中に有するという結論を支持していしていた。Lin−Bドメイン中に別のエピトープが存在するかどうかは、別の実験で解明した。同様に、他の3つのすべてのNotch1拮抗性mAbは、2つの識別可能な結合エピトープの組を、一方はHD−Cドメイン中、他方はNotch1N末端サブユニットのドメイン中に有する。最近公開されたNotch1(Gordon,WRら、Blood、2009、第113巻、4381〜4390)およびNotch2(Gordonら、Nature Structure Molecular Biology、2007、第14巻、295〜300)のNRR領域の結晶構造に基づいて、3つのLin12ドメインはHDドメインの周りに巻きついており、ADAMプロテアーゼによるランダム切断および活性化を遮断しており、したがって、受容体を不活性またはサイレントな状態に維持する。mAb N248Aは2つの明確に異なるエピトープの組でNotch1と結合し、それにより、Notch1がサイレントコンホメーションに固定され、したがって、受容体がそのリガンドによって活性化されることが妨げられる。
【0214】
ほとんどが点突然変異であり、一部が小さな欠失および挿入であるNotch1遺伝子突然変異が、T−ALLの50%を超えるもので報告されている(Weng,A.P.ら、Science、2004、9265〜9273、Maleckiら、Molecular Cell Biology、2006、26(12):4642〜4651)。突然変異は、2つの領域、すなわち、一方は細胞内部分のC末端中、他方はHD−Nドメイン中にクラスタリングされている。これらの発見は、HD−NドメインスワップはmAb N248AとNotch1との結合に影響を与えなかった一方で、他の3つの結合には影響が与えられたことから、mAb N248Aが、T−ALLにおいて表3に記載した他の3つのmAbよりも良好な治療的有用性を有するであろうという考えを支持する(表3を参照)。
【0215】
【表3】

【0216】
N248AはヒトNotch1と結合するが、マウスNotch1とは結合しない
N248A1の結合エピトープを位置決定するために、本発明者らは、ヌクレオチド1〜99およびヌクレオチド4327〜5169のマウスNotch1cDNAコード領域(NCBI受託番号NM_008714)を含有するマウスNotch1−NRRHD発現プラスミドを作製し、一過性の形質移入およびELISA結合アッセイを行った(方法は実施例1および5の前のセクションに記載)。結果により、N248A1はマウスNotch1と結合せず、ヒトNotch1のみと結合することが示された(表4)。本発明者らは、ヒトNotch1−NRRHD配列(ヌクレオチド1〜129および4338〜5202、NCBI受託番号NM_017617)をフレームワークとして使用し、ヒトLin−A、Lin−BまたはHD−Cドメインを対応するマウスドメインで系統的に交換して、ドメインスワップキメラNotch1−NRRHD発現構築体をさらに作製した。このヒト/マウスドメインスワップタンパク質をベイトとして使用したELISA結合アッセイにより、Lin−Aドメインをマウス配列に交換した場合にN248A1とヒトNotch1抗原との結合が消滅するが、Lin−BまたはHD−Cドメインの交換は結合に影響を与えなかったことが実証された。対照的に、他の対照mAb、22F7は、Lin−Bをマウス配列に交換した場合にのみ結合を失う。したがって、N248A1がヒトNotch1のみと結合し、マウスとは結合しないかどうかを決定する結合エピトープは、Lin−Aドメイン中に位置する。
【0217】
【表4】

【0218】
Lin−Aドメイン中のN248A1の結合エピトープの同定
Lin−Aドメイン中のN248A1の結合エピトープを同定するために、本発明者らは、ヒトおよびマウスのLin−Aドメインの間で異なる2個のアミノ酸を突然変異した、すなわち、1457E/Aおよび1465S/N(表5)。ELISAの結果により、突然変異1457E/Aは結合に影響を与えなかったが、突然変異1465S/Nは結合を消滅させることが示され、マウスLin−A中のアミノ酸Asn(N)がN248A1とマウスNotch1との結合の遮断を担っている唯一のアミノ酸残基であることが示された。1465Sの周辺のいくつかのアミノ酸を、順次アラニンへと突然変異させた(表5)。1463V/A、1466L/Aまたは1467Q/Aの突然変異もN248A1結合を消滅させた。しかし、対照mAb A2は突然変異1463V/Aまたは1465S/Nによって影響を受けなかった(表5)。これらの実験により、Lin−A中のN248A1の結合エピトープが1463V、1465S、1466Lおよび1467Qを含むことが実証された。
【0219】
【表5】

【0220】
HD−Cドメイン中のN248A1の結合エピトープの同定
Notch1配列からのアミノ酸のクラスターをNotch2配列へと順次スワップすることによって、一連の5つのサブドメインスワップキメラ抗原を作製した(表6)。ELISAの結果により、サブドメインスワップ−1はN248A1結合を有意に低下させた一方で、他の4つのサブドメインスワップ抗原はN248A1結合に影響を与えないことが示された。他方で、並行対照mAb 19H7は、サブドメインスワップ1、3および5に対して有意な結合親和性の低下を示した(表6)。すべてのサブドメインスワップ抗原の馴化培地中での発現および分泌は、ウエスタンブロット分析によって確認した(方法は上記)。サブドメインスワップ5以外のすべてのサブドメインスワップ抗原は、ヒトNotch1−NRRHD(huN1−NRRHD)タンパク質以上の発現を有する。サブドメインスワップ5は、ウエスタンブロットバンドの強度の比較に基づいてhuN1−NRRHDの約50%のレベルで発現された(データ示さず)。これらの実験により、表6中に強調表示するように、HD−C中のN248A1の結合エピトープには5個のアミノ酸、1705G、1706A、1707L、1709Sおよび1710L(ヒトNotch1をコードしているcDNA配列、NCBI受託番号NM_017617)が含まれることが示された。
【0221】
【表6】

【0222】
(実施例6)
Notch1mAbは細胞培養物中の癌細胞の成長を阻害する
mAb N248Aによる、HPB−ALL白血病細胞の成長の阻害およびNICDの低下
T細胞急性リンパ芽球性白血病(T−ALL)細胞系、HPB−ALLは、幼児期T−ALLから誘導され(Morikawaら、Int J.Cancer、1978、21(2):166〜70)、DSMZ(ドイツBraunschweig)から入手した。この細胞系は、増強されたガンマセクレターゼ切断の結果、高レベルの、Notch1の活性型であるNotch1細胞内ドメイン(NICD)をもたらすNotch1突然変異を保有する。成長阻害アッセイには、HPB−ALL細胞を、96ウェルプレートに、10,000個の細胞/ウェルで、10%のFBSを添加したRPMI1640培地(Invitrogen)中で播種した。連続希釈したmAb N248AまたはD16Aを最初に加え、細胞を37℃で7日間培養した。培養の終了後、0.1mg/mlのリザズリン(Sigma−Aldrich、モンタナ州St.Louis)を含有するリン酸緩衝溶液(PBS)を細胞に加え、プレートを37℃で4時間インキュベーションした。蛍光シグナルを、二重フィルターを介して励起=560nmおよび発光=590nmを用いて読み取った。IC50値は、GraphPad Prism(GraphPad Software,Inc.、カリフォルニア州La Jolla)においてS字形用量応答(変動勾配)を用いて計算した。
【0223】
in vitroのNICD分析には、HPB−ALL細胞を6ウェルプレートに2×106個の細胞/ウェルで播種し、10%のFCSを有するRPMI1640(Invitrogen)中で培養した。mAb N248Aまたは対照抗体D16Aを、図6中に示す可変濃度で培養物に加えた。細胞を、抗体の存在下、37℃で24時間培養した。その後、これらを収集し、冷1×細胞溶解緩衝液(Cell Signaling Technologies、マサチューセッツ州Boston)に溶解した。13,000rpmで10分間、4℃で遠心分離することによって、タンパク質を細胞溶解液から抽出した。BCAアッセイ(Pierce、イリノイ州Rockford)を用いてタンパク質濃度を決定した。それぞれの試料中のNICDのレベルはウエスタンブロット分析によって決定した。
【0224】
それぞれのウエスタンブロット分析において、約50μgの溶解物をポリアクリルアミドゲル(BioRad Laboratories、カリフォルニア州Hercules)による電気泳動によって分離し、ニトロセルロース膜に移し、ウサギ抗NICD抗体(Cell Signaling Technology,Inc.、マサチューセッツ州Danvers)およびマウスαアクチン抗体(Sigma−Aldrich、モンタナ州St.Louis)を用いた免疫ブロット分析に供した。IRDye680または800とコンジュゲートさせた二次抗体(LI−COR Biosciences、ネブラスカ州Lincoln)を使用してウエスタンブロットバンドを可視化した。Odyssey赤外線イメージングシステム(LI−COR Biosciences、ネブラスカ州Lincoln)を用いて画像を分析した。
【0225】
結果により、mAb N248AによるHPB−ALL細胞成長の阻害がNICDレベルの低下と相関していることが実証された。24時間の処置で、mAb N248AはNICDレベルを用量依存的に低下させ、最大の低下は30μg/mLで観察された。7日間の処置の後、mAb N248Aは細胞成長の有意な阻害を引き起こした。細胞成長阻害のIC50値は約0.78μg/mlまたは約5.2nMである。
【0226】
乳癌細胞増殖の阻害
Notch1の発現が乳癌において異常に増加しており(Reedijkら、Cancer Research、2005、65(18):8530〜8537、Klinakisら、2006、Efstratiadisら、Cell Cycle、2007、6(4):418〜429)、これは低い生存率に関連する(Reedijkら、Cancer Research、2005、65(18):8530〜8537)ことが十分に文書で示されている。乳腺組織中で活性型のNotch1を発現するトランスジェニックマウスでは、ほぼすべてのマウスが1年で乳癌を発生した(Huら、American Journal of Pathology、2006、168(3):973〜990)。Notch1媒介性シグナル伝達を阻害することで乳癌細胞の増殖が遮断されるという仮説を試験するために、いくつかの乳癌細胞系を、10μg/mlのmAb N248A抗体、Herceptin(Genentech/Roche、カリフォルニア州South San Francisco)または対照マウス免疫グロブリンG(mIgG)の存在下で培養した。すべての細胞を、1%のFCSを含むRPMI1640(Invitrogen)中で2〜3日間培養した。生細胞をCell Titer Glow(商標)(Promega)によって定量し、MicroLumat Plus LB96Vルミノメーター(Berthhold Technologies、ドイツBad Wildbad)によって走査した。同じパネルの乳癌細胞において、細胞表面上のNotch1およびJagged1の発現をFACSによって分析した。結果により、mAb N248Aによる乳癌細胞の増殖阻害がNotch1およびJagged1の発現レベルにおおまかに相関していることが実証された。mAb N248Aは、比較的高いレベルのNotch1およびJagged1を発現するMDA−MB−231細胞に対して最も強い阻害を発揮する。興味深いことに、BT475細胞由来のHerceptin耐性細胞系、BT475HRは、親BT475細胞系と比較して増加したNotch1およびJagged1の発現を示した。mAb N248AはBT475HRの細胞増殖を阻害した一方で、Herceptinは阻害しなかった。データにより、Notch1の発現が増加した、または現在の薬物であるHerceptinに対する耐性を有するmAb N248Aの、乳癌の治療処置における潜在的な有用性が示された。
【0227】
表7.抗Notch1mAb、N248Aの腫瘍細胞増殖阻害アッセイ。発現指数は、乳癌細胞を抗Notch1または抗Jagged1抗体で免疫染色した後の、FACSの倍率増加の相乗平均を表す。相対的細胞増殖指数は、薬剤を加えずに並行で培養した対照細胞のパーセンテージを表す。BT−474HRは、BT−474(ATCC)から誘導したHerceptin耐性細胞系である。
【0228】
【表7】

【0229】
N248Aによる乳癌細胞の増殖阻害がNotchシグナル伝達の遮断によって媒介されることを確認するために、2つの周知のNotchの下流の標的遺伝子の発現を定量的逆転写酵素−ポリメラーゼ連鎖反応(QRT−PCR)によって評価した。MDA−MB−231細胞をN248Aまたは対照mAbの存在下で2日間培養し、その後、収集し、RNAeasy試薬キットおよびプロトコル(Qiagen)を用いて全RNAを単離した。結果により、mAb N248Aが実際にHES1およびHES4の発現を遮断したことが実証され(図7)、N248Aによる作用機構が確認された。
【0230】
(実施例7)
Notch1mAbはマウス異種移植腫瘍モデルにおいてT細胞急性リンパ芽球性白血病(T−ALL)を阻害する
Notch1mAbによるT−ALL腫瘍成長の阻害
マウスモデルT−ALL異種移植モデルを確立するために、免疫力が低下した無胸腺症の雌のヌード(Nu/Nu)マウス(平均は20グラム、6〜8週齢)をCharles River Laboratories(マサチューセッツ州Wilmington)から入手し、国際実験動物管理公認協会(the Association for the Assessment and Accreditation for Laboratory Animal Care,International)の指針に従って、特定病原体除去の状態で飼育した。動物には、無菌のげっ歯類飼料および水を自由に与えた。すべてのin vivo研究は、承認された施設の実験動物の飼育および使用のプロトコルの下で実施した。
【0231】
HBP−ALL細胞は、宿主マウス中に移植する前に新鮮な培養物から収集し、1回洗浄し、無菌の無血清培地中に再懸濁させた。細胞懸濁液を適切な密度に調整し、腫瘍取り込みを促進するために50%のMatrigel(BD Biosciences、カリフォルニア州San Jose)を添加した。200μL中の合計5〜10×106個の細胞をマウスの後側腹部の領域内に皮下移植し、指定した大きさまで成長させた後、それぞれの実験のために抗体を投与した。
【0232】
抗腫瘍有効性研究には、150〜300mm3の大きさのHPB−All腫瘍を保有する動物をランダム化し、N248Aをそれぞれ1mg、3mgおよび10mg/キログラム(kg)で投与されるか、または対照抗体D16Aを5mg/kgで投与される、4つの群に分けた。mAbを週に1回、2週間の間皮下注射した。動物の体重および腫瘍の測定値を2〜3日毎に得た。腫瘍体積(mm3)は、ノギスで測定し、式:長さ(mm)×幅(mm)×幅(mm)×0.4を用いて計算した。研究の最終日における薬物で処置したおよびビヒクルで処置したマウスの腫瘍体積を使用して、パーセント(%)阻害値を100−{1−[(処置最終日−処置1日目)/(対照最終日−対照1日目)]}として計算した。すべての腫瘍成長阻害(TGI)実験において、8〜10匹のマウス/用量群を使用した。スチューデントt検定を使用してPを決定した。
【0233】
図8中に示すように、Notch1mAb、N248Aは、このモデルにおいて、11日間の処置、すなわち2回の週に1回の用量の後に、強力な抗腫瘍活性を実証した。10mg/kg群対対照mAb群における平均腫瘍成長阻害(TGI)は77%を超えており、これは統計的観点から非常に有意である(P<0.01)。TGIは粗く用量依存性であったが、例外として、2つのより低い用量群、1mg/kgおよび3mg/kgは、区別するには近接しすぎていた。この観察の正確な原因は不明確であるが、このモデルの腫瘍の大きさの変動性が高いことが原因である可能性が高い。N248Aは、ヒトNotch1に特異的な阻害剤として、どの処置群においても有意な重量損失、罹患率または死亡率を引き起こさずに、マウスにおいて良好に耐容された。
【0234】
マウスにおけるNotch1mAbの薬物動態学および薬力学(PK/PD)
PK/PD研究には、300〜800mm3の範囲の大きさの腫瘍を保有するマウスに、単一用量のN248Aを5mg/kgで皮下注射によって投与した。N248Aを投与した後、6、16時間、および1、2、3、5日間の時点でマウスを安楽死させた。シリンジを用いて血液試料を左心室から採取し、ヘパリン硫酸でプライミングしたチューブに移した。その一方で、腫瘍を切除によって取り出し、スナップ凍結し、冷1×細胞溶解緩衝液(Cell Signaling Technologies、マサチューセッツ州Boston)中でホモジナイズした。タンパク質を腫瘍溶解物から抽出し、それぞれの腫瘍試料中のNICDのレベルを、上述のウエスタンブロット分析を用いて決定した。血液試料を遠心分離に供して血清を血液細胞から分離した。N248Aの血清レベルを、実施例2に記載のようにELISA方法によって評価した。最初に、ELISAプレートを、Notch1−NRR−TM(−)/Fc抗原を捕捉するヒトFcに特異的なmAbでコーティングした。立ち代って、Notch1抗原は血清中のNotch1mAb、N248Aと結合する。
【0235】
PK曲線により、N248A mAbはマウス血清中で注射の24時間後に最大濃度(約235nM)に達成したことが示された。推定される半減期は約4.5日間である(図9)。Notch1活性化の直接マーカー(すなわちNICD)の評価により、N248Aで処置したマウスから収集した腫瘍試料が強力なNICDの低下を有しており、これは投薬の5日後まで持続したことが示された(図10)。対照的に、対照mAb、D16AはNICDレベルを低下させなかった(データ示さず)。5mg/kgのN248AのNICDの最大阻害は約80%であった。
【0236】
(実施例8)
Notch1mAb、N248Aのクローニングおよび配列
mAb N248Aの可変領域の配列を決定した。抗体IgGサブタイプを、Isostripマウスモノクローナル抗体キット(Roche Diagnostics、インディアナ州Indianapolis)を用いて最初に評価した。結果により、N248AがIgG1重鎖およびラムダ軽鎖を有することが示された。mAb N248Aのクローニングおよび配列決定には、1×106個のハイブリドーマ細胞を収集し、溶解して、RNeasy Mini試薬キットおよび製造者のプロトコル(Qiagen、カリフォルニア州Valencia)を用いて全細胞性RNAを単離した。Superscript III逆転写酵素(InVitrogen)を用いて、第1鎖cDNAをRNA鋳型上で合成した。軽鎖および重鎖の可変領域のcDNAを、PCRによって、第1鎖cDNAから、マウスラムダ鎖コード配列の5’末端に相補的な縮重順方向プライマーおよび可変領域の3’末端に隣接する定常領域に一致する逆方向プライマーを用いて、またはマウスIgG1重鎖コード配列の5’末端に相補的な縮重順方向プライマーおよび対応するIgG1定常領域逆方向プライマーを用いて、増幅した。PCRサイクリング条件は、96℃で1分間を1サイクル、次いで、95℃で20秒間、50℃で20秒間、および72℃で30秒間を40サイクルであった。生じたPCR産物をpCR−4−TOPOベクター(Invitrogen)内にクローニングし、従来の方法によって配列決定、Vector NTI Advanceソフトウェア(InVitrogen)を用いて分析した。クローニングした抗体の配列は、質量分析によって決定される、精製したハイブリドーマに由来する抗体から得られたN末端配列との直接比較によって確認した(カリフォルニア大学Davis、分子構造学施設(Molecular Structure Facility))。コンパイルした配列の結果により、mAb N248A重鎖の可変領域は121個のアミノ酸残基を含有し、軽鎖は109個のアミノ酸残基を含有することが実証された。CDR領域決定のKabatシステムを用いたN248A mAbのVH配列およびVL配列のさらなる分析により、重鎖CDR1、CDR2およびCDR3および軽鎖CDR1、CDR2およびCDR3の描写がもたらされた。mAb N248Aの重鎖可変領域CDR1、CDR2およびCDR3のヌクレオチドおよびアミノ酸の配列は、図15中に配列15〜20として示す(配列番号15〜20)。mAb N248Aの軽鎖可変領域CDR1、CDR2およびCDR3のヌクレオチドおよびアミノ酸の配列は、図14中に配列9〜14として示す(配列番号9〜14)。mAb N248Aの重鎖可変領域および軽鎖可変領域のヌクレオチドおよびアミノ酸の配列は、図13中に配列5〜8として示す(配列番号5〜8)。
【受託番号】
【0237】
ATCC CRL1662
ATCC CCL−1
ATCC HTB−96
ATCC CRL−11268
ATCC CCL−2
ATCC BT−474
【特許請求の範囲】
【請求項1】
ヒトNotch−1と特異的に結合する単離された抗体またはその抗原結合部分であって、少なくとも第1のエピトープおよび第2のエピトープと結合し、第1のエピトープがヒトNotch−1のLin−Aドメイン内にあり、第2のエピトープがヒトNotch−1のHD−Cドメイン内にある、単離された抗体またはその抗原結合部分。
【請求項2】
第1のエピトープおよび第2のエピトープの両方と結合し、前記抗体または抗原結合部分が結合する主要エピトープが第1のエピトープおよび第2のエピトープのみである、請求項1に記載の抗体または抗原結合部分。
【請求項3】
第1のエピトープが、1463V、1465S、1466Lおよび1467Qから選択される1〜4個のアミノ酸残基を含む主要エピトープである、請求項2に記載の抗体または抗原結合部分。
【請求項4】
第2のエピトープが、1705G、1706A、1707L、1709Sおよび1710Lから選択される1〜5個のアミノ酸残基を含む主要エピトープである、請求項1、2および3のいずれかに記載の抗体または抗原結合部分。
【請求項5】
第1のエピトープのアミノ酸残基のうちのいずれかの非保存的置換が、ヒトNotch−1に対する前記抗体または抗原結合部分の結合親和性の80%を超える損失をもたらす、請求項3または請求項4に記載の抗体または抗原結合部分。
【請求項6】
ヒト化、ヒト、またはキメラである、請求項1から5のいずれかに記載の抗体または抗原結合部分。
【請求項7】
マウス抗体である、請求項1から5のいずれかに記載の抗体または抗原結合部分。
【請求項8】
1×10−4M以下のKDでヒトNotch−1と結合する、請求項6に記載の抗体または抗原結合部分。
【請求項9】
(i)配列番号18に示すアミノ酸配列、または配列番号18の1〜4個の残基が改変されているその変異体を含む、重鎖可変領域CDR1、
(ii)配列番号19に示すアミノ酸配列、または配列番号19の1〜4個の残基が改変されているその変異体を含む、重鎖可変領域CDR2、および
(iii)配列番号20に示すアミノ酸配列、または配列番号20の1〜4個の残基が改変されているその変異体を有する、重鎖可変領域CDR3
を含む、ヒトNotch−1と特異的に結合する単離されたモノクローナル抗体またはその抗原結合部分。
【請求項10】
重鎖可変領域CDR1、CDR2およびCDR3の改変のうちのいずれかが、そのアミノ酸残基の保存的置換である、請求項9に記載の抗体または抗原結合部分。
【請求項11】
重鎖可変領域CDR1、CDR2およびCDR3がいずれも改変されていない請求項9に記載の抗体または抗原結合部分。
【請求項12】
(i)配列番号12に示すアミノ酸配列、または配列番号12の1〜4個の残基が改変されているその変異体を含む、軽鎖可変領域CDR1、
(ii)配列番号13に示すアミノ酸配列、または配列番号13の1〜4個の残基が改変されているその変異体を含む、軽鎖可変領域CDR2、および
(iii)配列番号14に示すアミノ酸配列、または配列番号14の1〜4個の残基が改変されているその変異体を含む、軽鎖可変領域CDR3
を含む、ヒトNotch−1と特異的に結合する単離されたモノクローナル抗体またはその抗原結合部分。
【請求項13】
軽鎖可変領域CDR1、CDR2およびCDR3の改変のうちのいずれかが、そのアミノ酸残基の保存的置換である、請求項12に記載の抗体または抗原結合部分。
【請求項14】
軽鎖可変領域CDR1、CDR2およびCDR3がいずれも改変されていない、請求項12に記載の抗体または抗原結合部分。
【請求項15】
(i)配列番号18を含む重鎖可変領域CDR1、
(ii)配列番号19を含む重鎖可変領域CDR2、
(iii)配列番号20を含む重鎖可変領域CDR3、
(iv)配列番号12を含む軽鎖可変領域CDR1、
(v)配列番号13を含む軽鎖可変領域CDR2、および
(vi)配列番号14を含む軽鎖可変領域CDR3
を含み、前記軽鎖CDRおよび前記重鎖CDRのそれぞれの1〜4個のアミノ残基が改変されていてもよい、ヒトNotch−1と特異的に結合する単離された抗体またはその抗原結合部分。
【請求項16】
前記軽鎖CDRおよび前記重鎖CDRの改変のうちのいずれかが、そのアミノ酸残基の保存的置換である、請求項15に記載の抗体または抗原結合部分。
【請求項17】
前記軽鎖CDRおよび前記重鎖CDRがいずれも改変されていない、請求項15に記載の抗体または抗原結合部分。
【請求項18】
マウス抗体またはマウス抗体の抗原結合部分である、請求項8から17のいずれかに記載の抗体または抗原結合部分。
【請求項19】
ヒト化、ヒト、またはキメラである、請求項8から17のいずれかに記載の抗体または抗原結合部分。
【請求項20】
1×10−5M未満の平衡解離定数KDでヒトNotch−1と結合する、請求項8から17のいずれかに記載の抗体または抗原結合部分。
【請求項21】
2×10−5M未満の平衡解離定数KDでヒトNotch−1と結合する、請求項8から17のいずれかに記載の抗体または抗原結合部分。
【請求項22】
1×10−6M未満の平衡解離定数KDでヒトNotch−1と結合する、請求項8から17のいずれかに記載の抗体または抗原結合部分。
【請求項23】
2×10−6M未満の平衡解離定数KDでヒトNotch−1と結合する、請求項8から17のいずれかに記載の抗体または抗原結合部分。
【請求項24】
サブクラスIgG1、IgG2、IgG3またはIgG4のヒト完全長抗体である、請求項8から17のいずれかに記載の抗体。
【請求項25】
サブクラスIgG1、IgG2、IgG3またはIgG4のヒト化抗体である、請求項8から17のいずれかに記載の抗体。
【請求項26】
サブクラスIgG1、IgG2、IgG3またはIgG4のキメラ抗体である、請求項8から17のいずれかに記載の抗体。
【請求項27】
請求項1から26のいずれかに記載の抗体または抗原結合部分を含む医薬組成物。
【請求項28】
請求項1から26のいずれかに記載の抗体または抗原結合部分を組換えにより産生する細胞系。
【請求項29】
請求項1から26のいずれかに記載の抗体または抗原結合部分の重鎖または軽鎖のいずれかをコードしているオリゴヌクレオチド。
【請求項30】
対象に、治療上有効な量の請求項1から26のいずれかに記載の抗体もしくは抗原結合部分、またはその医薬組成物を投与することを含む、癌を処置する方法。
【請求項31】
癌の処置に使用するための、請求項1から26のいずれかに記載の抗体もしくはその抗原結合部分、またはその医薬組成物。
【請求項1】
ヒトNotch−1と特異的に結合する単離された抗体またはその抗原結合部分であって、少なくとも第1のエピトープおよび第2のエピトープと結合し、第1のエピトープがヒトNotch−1のLin−Aドメイン内にあり、第2のエピトープがヒトNotch−1のHD−Cドメイン内にある、単離された抗体またはその抗原結合部分。
【請求項2】
第1のエピトープおよび第2のエピトープの両方と結合し、前記抗体または抗原結合部分が結合する主要エピトープが第1のエピトープおよび第2のエピトープのみである、請求項1に記載の抗体または抗原結合部分。
【請求項3】
第1のエピトープが、1463V、1465S、1466Lおよび1467Qから選択される1〜4個のアミノ酸残基を含む主要エピトープである、請求項2に記載の抗体または抗原結合部分。
【請求項4】
第2のエピトープが、1705G、1706A、1707L、1709Sおよび1710Lから選択される1〜5個のアミノ酸残基を含む主要エピトープである、請求項1、2および3のいずれかに記載の抗体または抗原結合部分。
【請求項5】
第1のエピトープのアミノ酸残基のうちのいずれかの非保存的置換が、ヒトNotch−1に対する前記抗体または抗原結合部分の結合親和性の80%を超える損失をもたらす、請求項3または請求項4に記載の抗体または抗原結合部分。
【請求項6】
ヒト化、ヒト、またはキメラである、請求項1から5のいずれかに記載の抗体または抗原結合部分。
【請求項7】
マウス抗体である、請求項1から5のいずれかに記載の抗体または抗原結合部分。
【請求項8】
1×10−4M以下のKDでヒトNotch−1と結合する、請求項6に記載の抗体または抗原結合部分。
【請求項9】
(i)配列番号18に示すアミノ酸配列、または配列番号18の1〜4個の残基が改変されているその変異体を含む、重鎖可変領域CDR1、
(ii)配列番号19に示すアミノ酸配列、または配列番号19の1〜4個の残基が改変されているその変異体を含む、重鎖可変領域CDR2、および
(iii)配列番号20に示すアミノ酸配列、または配列番号20の1〜4個の残基が改変されているその変異体を有する、重鎖可変領域CDR3
を含む、ヒトNotch−1と特異的に結合する単離されたモノクローナル抗体またはその抗原結合部分。
【請求項10】
重鎖可変領域CDR1、CDR2およびCDR3の改変のうちのいずれかが、そのアミノ酸残基の保存的置換である、請求項9に記載の抗体または抗原結合部分。
【請求項11】
重鎖可変領域CDR1、CDR2およびCDR3がいずれも改変されていない請求項9に記載の抗体または抗原結合部分。
【請求項12】
(i)配列番号12に示すアミノ酸配列、または配列番号12の1〜4個の残基が改変されているその変異体を含む、軽鎖可変領域CDR1、
(ii)配列番号13に示すアミノ酸配列、または配列番号13の1〜4個の残基が改変されているその変異体を含む、軽鎖可変領域CDR2、および
(iii)配列番号14に示すアミノ酸配列、または配列番号14の1〜4個の残基が改変されているその変異体を含む、軽鎖可変領域CDR3
を含む、ヒトNotch−1と特異的に結合する単離されたモノクローナル抗体またはその抗原結合部分。
【請求項13】
軽鎖可変領域CDR1、CDR2およびCDR3の改変のうちのいずれかが、そのアミノ酸残基の保存的置換である、請求項12に記載の抗体または抗原結合部分。
【請求項14】
軽鎖可変領域CDR1、CDR2およびCDR3がいずれも改変されていない、請求項12に記載の抗体または抗原結合部分。
【請求項15】
(i)配列番号18を含む重鎖可変領域CDR1、
(ii)配列番号19を含む重鎖可変領域CDR2、
(iii)配列番号20を含む重鎖可変領域CDR3、
(iv)配列番号12を含む軽鎖可変領域CDR1、
(v)配列番号13を含む軽鎖可変領域CDR2、および
(vi)配列番号14を含む軽鎖可変領域CDR3
を含み、前記軽鎖CDRおよび前記重鎖CDRのそれぞれの1〜4個のアミノ残基が改変されていてもよい、ヒトNotch−1と特異的に結合する単離された抗体またはその抗原結合部分。
【請求項16】
前記軽鎖CDRおよび前記重鎖CDRの改変のうちのいずれかが、そのアミノ酸残基の保存的置換である、請求項15に記載の抗体または抗原結合部分。
【請求項17】
前記軽鎖CDRおよび前記重鎖CDRがいずれも改変されていない、請求項15に記載の抗体または抗原結合部分。
【請求項18】
マウス抗体またはマウス抗体の抗原結合部分である、請求項8から17のいずれかに記載の抗体または抗原結合部分。
【請求項19】
ヒト化、ヒト、またはキメラである、請求項8から17のいずれかに記載の抗体または抗原結合部分。
【請求項20】
1×10−5M未満の平衡解離定数KDでヒトNotch−1と結合する、請求項8から17のいずれかに記載の抗体または抗原結合部分。
【請求項21】
2×10−5M未満の平衡解離定数KDでヒトNotch−1と結合する、請求項8から17のいずれかに記載の抗体または抗原結合部分。
【請求項22】
1×10−6M未満の平衡解離定数KDでヒトNotch−1と結合する、請求項8から17のいずれかに記載の抗体または抗原結合部分。
【請求項23】
2×10−6M未満の平衡解離定数KDでヒトNotch−1と結合する、請求項8から17のいずれかに記載の抗体または抗原結合部分。
【請求項24】
サブクラスIgG1、IgG2、IgG3またはIgG4のヒト完全長抗体である、請求項8から17のいずれかに記載の抗体。
【請求項25】
サブクラスIgG1、IgG2、IgG3またはIgG4のヒト化抗体である、請求項8から17のいずれかに記載の抗体。
【請求項26】
サブクラスIgG1、IgG2、IgG3またはIgG4のキメラ抗体である、請求項8から17のいずれかに記載の抗体。
【請求項27】
請求項1から26のいずれかに記載の抗体または抗原結合部分を含む医薬組成物。
【請求項28】
請求項1から26のいずれかに記載の抗体または抗原結合部分を組換えにより産生する細胞系。
【請求項29】
請求項1から26のいずれかに記載の抗体または抗原結合部分の重鎖または軽鎖のいずれかをコードしているオリゴヌクレオチド。
【請求項30】
対象に、治療上有効な量の請求項1から26のいずれかに記載の抗体もしくは抗原結合部分、またはその医薬組成物を投与することを含む、癌を処置する方法。
【請求項31】
癌の処置に使用するための、請求項1から26のいずれかに記載の抗体もしくはその抗原結合部分、またはその医薬組成物。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【公表番号】特表2012−530487(P2012−530487A)
【公表日】平成24年12月6日(2012.12.6)
【国際特許分類】
【出願番号】特願2012−515616(P2012−515616)
【出願日】平成22年6月16日(2010.6.16)
【国際出願番号】PCT/IB2010/052711
【国際公開番号】WO2010/146550
【国際公開日】平成22年12月23日(2010.12.23)
【出願人】(593141953)ファイザー・インク (302)
【出願人】(505129415)ライナット ニューロサイエンス コーポレイション (33)
【Fターム(参考)】
【公表日】平成24年12月6日(2012.12.6)
【国際特許分類】
【出願日】平成22年6月16日(2010.6.16)
【国際出願番号】PCT/IB2010/052711
【国際公開番号】WO2010/146550
【国際公開日】平成22年12月23日(2010.12.23)
【出願人】(593141953)ファイザー・インク (302)
【出願人】(505129415)ライナット ニューロサイエンス コーポレイション (33)
【Fターム(参考)】
[ Back to top ]

