放射線治療情報生成装置
【課題】放射線治療において、放射線の過剰照射や過少照射を低減させるための放射線治療情報を生成することが可能な放射線治療情報生成装置を提供することである。
【解決手段】放射線治療情報生成装置は、領域特定手段及び計画評価手段を備える。領域特定手段は、腫瘍に関して定義された少なくとも1つの領域を診断画像データに対する解析処理によって特定する。計画評価手段は、前記領域及び放射線の線量期待値に基づいて算出された線量計画値についての評価情報を表示させる。
【解決手段】放射線治療情報生成装置は、領域特定手段及び計画評価手段を備える。領域特定手段は、腫瘍に関して定義された少なくとも1つの領域を診断画像データに対する解析処理によって特定する。計画評価手段は、前記領域及び放射線の線量期待値に基づいて算出された線量計画値についての評価情報を表示させる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明の実施形態は、放射線治療情報生成装置に関する。
【背景技術】
【0002】
従来、放射線を照射することによって腫瘍を治療する放射線治療が知られている。放射線治療は、主として画像診断装置による診断画像の撮像、放射線治療計画及び放射線治療装置による治療の3つのステップからなる。
【0003】
具体的には、放射線治療では、X線CT (computed tomography)装置、磁気共鳴イメージング(MRI: Magnetic Resonance Imaging)装置、陽電子放出コンピュータ断層(PET: positron emission computed tomography)装置や単光子放出コンピュータ断層(SPECT: single photon emission computed tomography)装置等の核医学診断装置によって腫瘍領域を特定するための医用画像が予め収集される。
【0004】
次に、放射線治療計画が実施される。すなわち、画像診断装置によって収集された医用画像から、治療対象となる腫瘍および放射線の照射が望ましくない正常組織が抽出され、抽出結果に基づいて放射線の照射範囲、照射方向及び照射強度等の照射条件が治療計画として策定される。特に、正常組織への放射線の照射が避けられないため、できるだけ副作用を発生させないような放射線の照射条件の計画が重要である。このため、放射線治療計画では、医用画像上に線量分布を表示させる視覚的な評価のみならず、治療効果や正常組織への副作用を推定するための線量体積ヒストグラム(DVH: Dose Volume Histogram)等の解析的な評価も必要である。DVHは、治療対象となる腫瘍組織と正常組織の各体積に対する放射線の線量をグラフとして表示させたものである。
【0005】
近年では、より綿密な条件を策定するために、放射線治療計画を支援する放射線治療計画システムが提案されている。従来の放射線治療計画システムでは、画像診断装置により収集された医用画像に基づいて解剖情報が定義され、定義された解剖情報に従って放射線の照射方向、照射位置及び線量分布等の照射条件が計算される。更に、計算された放射線の照射条件が適切であるか否かの評価が実施される。
【0006】
このような放射線の線量分布等の計画のために、従来、腫瘍領域に対して様々なマージンを付加した領域が定義されている。具体的には、肉眼的腫瘍体積(GTV: Gross Tumor Volume)、臨床標的体積(CTV: Clinical Target Volume)、内的標的体積(ITV: Internal Target Volume)、計画標的体積(PTV: Planning Target Volume)の4つの領域が定義されている。
【0007】
GTVは、医用画像の診断によって明らかに腫瘍が存在すると判断される領域である。腫瘍浸潤の疑われる部分も医用画像で認識される限りGTVに含められる。CTVは、医用画像では認識できない微小な浸潤部分をGTVに加えた領域である。ITVは、臓器の移動を考慮したマージン領域であるIM (Internal Margin)をCTVに加えた標的体積である。PTVは、患者およびビームの位置合わせに関する不正確度を考慮してSM (Setup Margin)をITVに三次元的に加えた領域である。
【0008】
そして、これらのマージンを付加した腫瘍領域ごとに適切な放射線の線量を算出することができる。例えば、CTVの99%以上に95%以上の十分な線量が照射されるように、放射線の照射条件を設定することができる。また、PTVに対するマージンを求めるモデル式も提案されている。例えば、90%の患者でCTVにおける最低線量が処方線量の95%を超えるようにするために必要なPTVへのマージンを求めるモデル式が知られている。尚、PTVの辺縁も95%の線量域に含めるためには,PTVにさらに5〜8×10-3[m]程度のマージンを付加して放射線の照射野を設定する必要がある。
【0009】
更に、腫瘍領域ごとの線量計算によって放射線の照射条件が放射線治療計画として策定されると、放射線治療装置を用いた放射線治療を実施することが可能となる。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】特開2004−230311号公報
【特許文献2】特開2007−253810号公報
【特許文献3】特開2002−134380号公報
【発明の概要】
【発明が解決しようとする課題】
【0011】
しかしながら、放射線治療計画の際、治療対象となる腫瘍領域に対して様々なマージンを付加した領域の設定が実施されるため、正常組織への副作用のリスクが増加するという問題がある。特に、根治治療や症状緩和等の治療目的に応じて、領域ごとに異なる線量を設定する必要がある。ところが、腫瘍の浸潤領域等の各領域は、概念的に定義されているのみであり、定量的に設定することができない。
【0012】
この結果、放射線治療計画の際に放射線の線量分布を表示させたとしても、浸潤領域を加味した定量的な放射線の過少照射領域及び過剰照射領域を時間的もしくは空間的に把握することが困難である。つまり、腫瘍の浸潤領域等の放射線の照射領域の定量的な特定が困難である結果、放射線の正常組織への過剰照射や治療対象への過少照射が発生するという問題がある。
【0013】
そこで、本発明は、放射線治療において、放射線の過剰照射や過少照射を低減させるための放射線治療情報を生成することが可能な放射線治療情報生成装置を提供することを目的とする。
【課題を解決するための手段】
【0014】
本発明の実施形態に係る放射線治療情報生成装置は、領域特定手段及び計画評価手段を備える。領域特定手段は、腫瘍に関して定義された少なくとも1つの領域を診断画像データに対する解析処理によって特定する。計画評価手段は、前記領域及び放射線の線量期待値に基づいて算出された線量計画値についての評価情報を表示させる。
【図面の簡単な説明】
【0015】
【図1】本発明の実施形態に係る放射線治療情報生成装置の機能ブロック図。
【図2】放射線治療において図1に示す放射線治療情報生成装置とともに用いられる医用機器及び放射線治療の流れを示す図。
【図3】図1に示す浸潤解析部において実施される浸潤解析の流れの一例を示すフローチャート。
【図4】図1に示す浸潤解析部において実施される浸潤解析の別の一例の解析結果を診断画像データとともに表示させた例を示す図。
【図5】図1に示すITV算出部において実施されるITVの算出方法の一例を概念的に示す図。
【図6】図1に示す放射線治療情報生成装置において特定される各腫瘍領域の関係を模式的に表した図。
【図7】図1に示す線量計算部に入力される放射線の線量期待値の一例を示す図。
【図8】図1に示す過剰・過少照射解析部において特定された過剰照射領域及び過少照射領域を時相ごとに表示させた例を示す図。
【図9】図1に示す過剰・過少照射解析部において特定された過剰照射領域及び過少照射領域を三次元的に表示させた例を示す図。
【図10】図1に示す過剰・過少照射解析部における過剰照射時相画像及び過少照射時相画像の特定方法の一例を説明する図。
【図11】図1に示す過剰・過少照射解析部により、過剰照射の度合いを把握して線量期待値を編集できるように複数の診断画像のサムネイル画像を時相方向にタイムライン表示させた例を示す図。
【図12】図1に示す過剰・過少照射解析部により、過少照射の度合いを把握して線量期待値を編集できるように複数の診断画像のサムネイル画像を時相方向にタイムライン表示させた例を示す図。
【図13】図1に示す過剰・過少照射解析部により、複数のスライス位置における複数の時相に対応する過剰照射領域及び過少照射領域の有無を表示させた例を示す図。
【図14】図1に示す過剰・過少照射解析部により、複数の画像又は図形を並べて表示させる場合に用いることが可能なスケールの表現の例を示す図。
【図15】図1に示すDVH算出部おいて算出されるDVHの一例を示すグラフ。
【図16】図1に示すDVH算出部おいて算出されたDVHを診断画像とともに表示させた例を示す図。
【発明を実施するための形態】
【0016】
本発明の実施形態に係る放射線治療情報生成装置について添付図面を参照して説明する。
【0017】
図1は本発明の実施形態に係る放射線治療情報生成装置の機能ブロック図であり、図2は、放射線治療において図1に示す放射線治療情報生成装置1とともに用いられる医用機器及び放射線治療の流れを示す図である。
【0018】
図2に示すように放射線治療のプロセスは、概略的には画像診断装置2による医用画像の収集、放射線治療計画の策定及び放射線治療装置3による放射線治療の3つのステップからなる。より具体的には、画像診断装置2において患者の腫瘍部位を含む医用画像の撮像が実行される。次に、収集された医用画像に基づく放射線治療計画が放射線治療情報生成装置1において実施される。すなわち、医用画像に基づく解剖情報の定義、定義された解剖情報に基づく放射線の線量分布の計算及び放射線治療計画として計算された線量分布の評価が行われる。そして、放射線治療計画において策定された線量分布を含む計画情報に従って放射線治療装置3を用いた患者の放射線治療が実施される。
【0019】
放射線治療情報生成装置1は、放射線治療における放射線治療計画を行うための放射線治療計画システムとしての機能を有する。ここでは、図1及び図2に示すように放射線治療情報生成装置1が画像診断装置2及び放射線治療装置3から独立した装置である場合について説明するが、放射線治療計画システムを画像診断装置2又は放射線治療装置3に内蔵することもできる。その場合には、放射線治療計画システムとしての機能を備えた画像診断装置2又は放射線治療装置3が放射線治療情報生成装置1となる。
【0020】
放射線治療情報生成装置1が画像診断装置2及び放射線治療装置3から独立した放射線治療計画システムである場合には、放射線治療情報生成装置1はネットワークを介して画像診断装置2及び放射線治療装置3と接続される。尚、画像診断装置2及び放射線治療装置3と医用画像サーバや医用画像処理装置等の医用機器を介して放射線治療情報生成装置1を接続してもよい。
【0021】
画像診断装置2は、放射線治療の対象となる腫瘍領域を含む患者の診断画像を放射線治療計画用に収集するために用いられる。放射線治療において用いられる画像診断装置2の例としては、X線CT装置、MRI装置、PET装置やSPECT装置等の核医学診断装置が挙げられる。尚、PET装置とX線CT装置のように複数の画像診断装置2で放射線治療計画用の診断画像を収集するようにしてもよい。また、PET/CT装置のような一体化した複数の画像診断装置2を用いてもよい。
【0022】
放射線治療情報生成装置1は、画像診断装置2により収集された腫瘍部位を含む診断画像データに基づいて、放射線の線量分布等の放射線の照射条件を放射線治療計画情報として作成する装置である。放射線治療情報生成装置1は、入力装置10A及び表示装置10Bを備えたコンピュータ10の演算装置10Cにプログラムを読み込ませて構築することができる。
【0023】
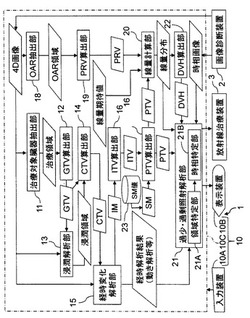
具体的には、放射線治療情報生成装置1の演算装置10Cは、治療対象臓器抽出部11、GTV算出部12、浸潤解析部13、CTV算出部14、経時変化解析部15、ITV算出部16、PTV算出部17、OAR抽出部18、PRV算出部19、線量計算部20、過剰・過少照射解析部21及びDVH算出部22として機能する。更に、過剰・過少照射解析部21は、領域特定部21A及び時相特定部21Bを有する。また、記憶装置を、SM値データベース23として機能させることができる。但し、これらの機能の一部又は全部を設けるために回路を用いて放射線治療情報生成装置1を構成してもよい。
【0024】
放射線治療装置3は、放射線治療情報生成装置1おいて作成された放射線の照射条件に従って放射線治療を行うための装置である。具体的には、患者である被検体にX線を照射するX線診断装置で放射線治療装置3を構成することができる。
【0025】
次に図1及び図2を参照して放射線治療情報生成装置1の詳細機能とともに放射線治療の流れについて説明する。
【0026】
まず、画像診断装置2の寝台に患者である被検体がセットされ、位置決め画像の収集を通じた被検体の位置決めが実施される。そして、被検体から腫瘍部位を含む診断画像データが収集される。放射線治療計画用の診断画像データの例としては、3次元(3D: three dimensional)X線CT画像データと3D TOF(time of flight)-PET画像データとの組合せ、4次元(4D: four dimensional)X線CT画像データと4D TOF-PET画像データとの組合せ及びMR画像データが挙げられる。
【0027】
4D-CT画像データと4D-PET画像データを収集する場合には、独立したX線CT装置とPET装置又は一体化されたPET/CT装置により被検体の撮像が行われる。独立したX線CT装置とPET装置とを用いて被検体の撮像を行う場合には、X線CT画像データとPET画像データとの間における剛体位置合わせ処理及び非剛体位置合わせ処理が必要となる。一方、PET/CT装置を用いれば、1回のスキャンでX線CT画像データ及びPET画像データの双方を収集することが可能である。PET/CT装置を用いる場合には、X線CT画像データとPET画像データとの間における位置合わせ処理が必ずしも必要でない。ただし、放射線治療計画においてより高精度に画像解析を行うために、非剛体位置合わせ処理によってX線CT画像データとPET画像データとの間における局所的な位置ずれを補正することが望ましい場合がある。
【0028】
放射線治療情報生成装置1の治療対象臓器抽出部11は、放射線治療計画のために画像診断装置2から直接又は医用画像サーバや医用画像処理装置を介して間接的に被検体の診断画像データを取得する。そして、治療対象臓器抽出部11は、放射線治療の対象として放射線を照射すべき臓器を診断画像データから抽出する。
【0029】
治療臓器の抽出は、臓器アトラスを参照した画素値に対する閾値処理や輪郭抽出処理等の公知の領域抽出処理によって自動的に行うことができる。また、入力装置10Aの操作によって自動抽出された治療臓器を調整することもできる。或いは、自動的に領域抽出することが困難な臓器が治療臓器である場合には、入力装置10Aから治療臓器を特定するための情報を入力することによって、治療臓器を手動又は半自動で特定することができる。この場合には、臓器の形態が描出されたX線CT画像データ等の診断画像データを参照し、診断画像データ上において臓器の形状や位置等の既知の解剖学的情報及び画像信号の値に基づいて治療臓器を特定することができる。
【0030】
次に、GTV算出部12は、治療対象臓器抽出部11において抽出された治療臓器に基づいてGTVを算出する。GTVは、診断画像データに基づいて明らかに腫瘍が存在すると判定される腫瘍領域である。例えば、治療対象となる臓器が占める領域をGTVとすることができる。また、治療対象臓器抽出部11において抽出された治療臓器の画素値に対する閾値処理によって腫瘍領域としてGTVを自動算出することもできる。或いは、表示装置10Bに表示された診断画像データを参照して腫瘍が確認された領域の特定情報を入力装置10AからGTV算出部12に入力し、腫瘍領域の特定情報に従ってGTV算出部12がGTVを決定するようにしてもよい。すなわち、GTVは画素値に対する閾値処理等の画像処理によって自動的に或いは入力装置10Aから入力された情報に従って手動で決定することができる。
【0031】
次に、浸潤解析部13は、画像診断装置2から互いに異なるコントラストを有する複数種の診断画像データ又は単一種類の診断画像データを取得し、複数種類又は単一種類の診断画像データの閾値処理を含む解析処理によって自動的に腫瘍の浸潤領域を特定する。浸潤領域は、診断画像データでは肉眼で認識できない腫瘍部分である。特に診断画像データが時系列のダイナミック画像データである場合には、各時相における浸潤領域を特定することができる。尚、浸潤領域の特定の際には、GTV算出部12において特定されたGTVを参照することができる。
【0032】
診断画像データの種類は、浸潤領域を閾値処理によって特定することが可能な画像データとされる。代表的には、4D-CT画像データとTOF-PET画像データの組合せ、X線CT装置で収集可能なDual Energy画像データ、MRIによって収集することが可能な縦緩和(T1)強調画像(T1WI: T1 weighted image)データ、横緩和(T2)強調画像(T2WI: T2 weighted image)データ及び/又は拡散強調画像(DWI: diffusion weighted image)データとPET画像データの組合せが挙げられる。尚、Dual Energy画像は、物質の減弱係数がX線の平均エネルギによって異なることを利用し、異なるX線エネルギ帯域に対する減弱係数の違いを画像化したものである。
【0033】
ここでは、一例として4D-X線CT画像データ及びTOF-PET画像データの組合せに基づいて時系列的な複数の浸潤領域を特定する場合について説明する。
【0034】
図3は、図1に示す浸潤解析部13において実施される浸潤解析の流れの一例を示すフローチャートである。
【0035】
まずステップS1において、X線CT装置により時系列の4D-CT画像データがダイナミック収集される。これにより複数の時相t1, t2, t3, ..., tnに対応する3D-CT画像データが順次収集される。
【0036】
一方、ステップS2では、PET装置により時系列のTOF-PET画像データが4D画像データとしてダイナミック収集される。これにより複数の時相t1, t2, t3, ..., tnに対応するn(nは自然数)個のTOF-PET画像データが順次収集される。
【0037】
次に、ステップS3では、X線CT装置により収集された4D-CT画像データとPET装置により収集されたTOF-PET画像データとの間における非剛体位置合わせ処理がX線CT装置及びPET装置のいずれかにおいて実行される。そして、非剛体位置合わせ処理の結果として、4D-CT画像データとTOF-PET画像データとの間における非線形な位置ずれ量が算出される。非線形な位置ずれ量は、平行移動と変形移動の組合せで表すことができる。また、変形移動の量は、特徴点抽出と抽出された特徴点間の距離に基づいて算出することができる。算出された位置ずれ量は、例えば、ベクトルの集合であるWarp Fieldと称するデータで表現することができる。
【0038】
次に、ステップS4では、非剛体位置合わせ処理の結果として得られた位置ずれ量であるWarp Fieldに基づいて、TOF-PET画像データの非線形位置ずれ補正処理が実行される。これにより複数の時相t1, t2, t3, ..., tnに対応する位置補正後のTOF-PET画像データが生成される。
【0039】
次に、ステップS5−1からステップS5−nでは、浸潤解析部13において、時相t1, t2, t3, ..., tnごとの3D-CT画像データ及び位置補正後のTOF-PET画像データに基づく画像解析が実行される。
【0040】
具体的には、ステップS6において浸潤解析部13が3D-CT画像データに対する閾値処理によって腫瘍領域を自動抽出する。次に、ステップS7において浸潤解析部13は、3D-CT画像データに対する閾値処理によって腫瘍な浸潤部分と考えられる腫瘍周辺における領域を抽出する。一方、ステップS8において浸潤解析部13は、TOF-PET画像データに対する閾値処理によって腫瘍領域を自動抽出する。次に、ステップS9において浸潤解析部13は、TOF-PET画像データに対する閾値処理によって腫瘍な浸潤部分と考えられる腫瘍周辺における領域を抽出する。
【0041】
これらの閾値処理のための閾値は、経験的な値又は学術的に報告されている値に設定することができる。尚、腫瘍領域は、GTV算出部12おいてGTVの特定のために抽出された腫瘍領域としてもよい。
【0042】
次に、ステップS10において浸潤解析部13は、3D-CT画像データから抽出された腫瘍領域及び腫瘍周辺領域と、TOF-PET画像データから抽出された腫瘍領域及び腫瘍周辺領域に基づいて腫瘍の浸潤領域を特定する。例えば、各腫瘍周辺領域を含む腫瘍領域の外側の領域、腫瘍領域の外側における各腫瘍周辺領域の共通の領域或いはこれらの領域の中間領域を浸潤領域として抽出することができる。
【0043】
ステップS6からステップS10までの画像解析は、各時相t1, t2, t3, ..., tnに対応する3D-CT画像データ及び位置補正後のTOF-PET画像データに基づいて、時相ごとに実行される。
【0044】
浸潤領域が特定されると、CTV算出部14は、GTV算出部12から取得したGTVに浸潤領域を加えることによってCTVを算出する。CTVは、診断画像において肉眼で認識できない微小な浸潤部分をGTVに加えた領域である。従って、CTVは、浸潤領域をマージンとして含む放射線の照射対象領域である。
【0045】
図3に示すように診断画像データとして時系列の画像データが収集されている場合には、複数の時相t1, t2, t3, ..., tnに対応する時系列のCTVが得られる。この場合、ステップS11においてCTV算出部14は、時系列のCTVを表示装置10Bに表示させることができる。
【0046】
一方、別の一例としてDWIデータ及びPET画像データに基づく浸潤領域の特定について説明する。
【0047】
図4は、図1に示す浸潤解析部13において実施される浸潤解析の別の一例の解析結果を診断画像データとともに表示させた例を示す図である。
【0048】
MRI装置において互いに異なる強度又は印加方向のMPG(motion probing gradient)パルスを印加して収集されたDWIを解析すると拡散テンソル画像(DTI: diffusion tensor image)データ及び2次元(2D: two dimensional)のパラメータ画像データとして拡散異方性(FA: Fractional Anisotropy)データが得られる。一方、PET装置において、放射線を放出する炭素C11を付加したメチオニンを投与して撮像すると11C-MET PET画像データが収集される。
【0049】
そして、浸潤解析部13において、FAデータ及び11C-MET PET画像データの各信号強度を2つの軸とする2Dマップを作成することができる。図4は、FAデータ及び11C-MET PET画像データの2Dマップを作成し、対応する複数の診断画像とともに表示装置10Bに表示させた例を示している。
【0050】
すなわち、診断画像としてMRI装置により収集されたT1WIとPET装置により収集された11C-MET PET画像が表示されている。尚、T1WIはガドリニウムを造影剤として投与して得られた造影MR画像である。T1WIは通常、グレースケールによって輝度表示されるが、11C-MET PET画像は、カラースケールを用いて画像信号値に応じたカラーで表示することができる。これらの診断画像上には、画像信号の信号値に応じて二点鎖線で示すような関心領域(ROI: region of interest)を設定することができる。
【0051】
そして、ROI内における画像信号を用いてFAデータ及び11C-MET PET画像データの2Dマップを作成すると、FAデータ及び11C-MET PET画像データの各信号強度の閾値処理によって2Dマップを視覚的に正常組織、浸潤領域及び腫瘍領域に分類することができる。つまり、FAデータとPET画像データとの組合せに基づいて腫瘍の浸潤領域を特定することができる。
【0052】
具体的には、FAデータに対して設定された閾値THFAよりも大きい画像信号を呈し、かつ11C-MET PET画像データ対して設定された閾値THPET以下の画像信号を呈する点群の領域を正常領域とすることができる。また、FAデータに対して設定された閾値THFA以下の画像信号を呈し、かつ11C-MET PET画像データ対して設定された閾値THPET以下の画像信号を呈する点群の領域を浸潤領域とすることができる。更に、FAデータに対して設定された閾値THFA以下の画像信号を呈し、かつ11C-MET PET画像データ対して設定された閾値THPETよりも大きい画像信号を呈する点群の領域を腫瘍領域とすることができる。
【0053】
すなわち、FAデータ及び11C-MET PET画像データの各信号強度に対する閾値処理によって、正常組織、浸潤領域及び腫瘍領域を特定することができる。分類された正常組織、浸潤領域及び腫瘍領域は、診断画像上に異なるカラーなどを用いて識別表示させることができる。図4は、正常組織、浸潤領域及び腫瘍領域をT1WI上に識別表示させた例を示している。
【0054】
そしてこのように特定された浸潤領域をCTV算出部14に与え、CTV算出部14においてGTVに浸潤領域を付加することによってCTVを算出することができる。
【0055】
一方、経時変化解析部15は、必要に応じて画像診断装置2から取得した時系列の4D診断画像データ及びCTV算出部14から取得したCTVに基づいて臓器の移動量に相当するマージン領域であるIMを自動的又は入力装置10Aからの情報を参照して半自動的に算出する。例えば、特定の時相におけるCTVの外側における他の時相におけるCTVの可動域をIMとすることができる。
【0056】
次に、ITV算出部16は、IMをCTVに加えた標的体積であるITVを自動的に算出する。例えば、時系列的な各時相におけるCTVの可動域をITVとして自動的に算出することができる。
【0057】
図5は、図1に示すITV算出部16において実施されるITVの算出方法の一例を概念的に示す図である。
【0058】
図5に示すようにGTV算出部12及びCTV算出部14により、各時相t1, t2, t3, ...,tnにおけるGTV及びCTVがそれぞれ算出される。図5に示すように時相間において治療対象となる臓器が移動及び変形するため、時相ごとにGTV及びCTVが異なる。そこで、GTV及びCTVの変形及び移動範囲をそれぞれ時相に依存しないGTV及びCTVとし、時相に依存しないCTV、つまりCTVの可動範囲をそのままITVとすることができる。
【0059】
この場合、例えば、各時相t1, t2, t3, ...,tnにおけるGTV及びCTVを時相方向に投影することによってそれぞれGTV及びCTVの可動域をIM及びIVTとして自動計算することができる。但し、時間軸方向への投影処理の他、非剛体位置合わせ処理によって動きベクトルの集合として算出されたWarp Fieldや心筋の壁運動解析(WMT: Wall Motion Tracking)等の動き解析の結果として得られた動き情報に基づいてIM及びIVTの少なくとも一方を自動計算するようにしてもよい。尚、WMTはねじれ解析により心筋の壁運動を解析する技術であり、MRI装置等の画像診断装置2において解析結果を得ることができる。
【0060】
但し、GTV及びCTVの可動範囲の大きさと正常部分との相対関係によっては、CTVの可動範囲をそのままITVとすると特定の時相において治療対象部位の外側の正常領域に過剰に放射線が照射される恐れがある。そこで、時間的に放射線の照射領域を調整可能なサイバーナイフ等の放射線治療装置3を用いた放射線治療計画を行う場合には、各時相に対応する時系列の複数のCTVをそのまま各時相に対応する時系列の複数のITVに設定してもよい。
【0061】
次に、PTV算出部17は、患者および放射線ビームの位置合わせの不正確度を表す指標として入力装置10Aから入力されたSMを、ITV算出部16において算出されたITVに付加する。これにより、ITVにSMを付加した体積として定義されているPTVが算出される。
【0062】
尚、SM値は、PTVを算出するまでの前処理の条件によって変化する。SM値に影響を与える条件としては、治療対象臓器の抽出に使用される臓器抽出アルゴリズム、治療対象となる臓器の種類、診断画像の収集に使用される画像診断装置2の種類等が挙げられる。そこで、これらの条件とSM値とを予め関連付けてSM値データベース23に保存しておくことができる。この場合、入力装置10Aの操作によって条件を選択すると、対応するSM値がPTV算出部17に入力されるようにすることができる。
【0063】
PTVの算出によって腫瘍について標準的に定義されている腫瘍領域の特定が完了する。各腫瘍領域GTV, CTV, ITV, PTVの間には、式(1-1)、式(1-2)及び式(1-3)の関係が成立する。
GTV ≦ CTV ≦ ITV < PTV (1-1)
ITV = CTV + IM (1-2)
PTV = ITV + SM (1-3)
【0064】
図6は、図1に示す放射線治療情報生成装置1において特定される各腫瘍領域の関係を模式的に表した図である。図6に示すように、PTVの内部にITVが、ITVの内部にCTVが、CTVの内部にGTVが設定されることとなる。
【0065】
一方、OAR抽出部18は、画像診断装置2から診断画像データを取得し、治療対象臓器の抽出のための画像処理と同様な画像処理を診断画像データに施すことによって、危険臓器(OAR: Organ at risk)を抽出する。
【0066】
次に、PRV算出部19は、OAR領域に基づいて、PTVの算出と同様な方法で計画リスク臓器体積(PRV: Planning organ at risk volume)を算出する。すなわち、OAR領域に経時的なOARの移動及び変形並びに不正確度を考慮したマージン領域を付加することによってPRVが算出される。
【0067】
次に、線量計算部20は、入力装置10Aから治療目的に応じて入力される各腫瘍領域に対する放射線の線量期待値、PRV及びPTVに基づいて線量計画値を算出する。
【0068】
図7は、図1に示す線量計算部20に入力される放射線の線量期待値の一例を示す図である。
【0069】
図7に示すように、放射線の線量期待値は治療目的及びマージンを含む治療領域ごとに異なる理想的な値に設定される。例えば、治療目的が根治治療であるか症状緩和治療であるかによって異なる線量期待値が設定される。また、PRVに対しても線量期待値を設定することができる。PTVは治療対象であるため十分線量が期待値として設定される。逆に、放射線の照射が望ましくないPRVに対しては、放射線が照射されないように或いは超低線量の期待値が設定される。
【0070】
このような線量期待値が線量計算部20に入力されると、線量計算部20は、モンテカルロ法を用いたシミュレーションや逆問題の解法等の公知の手法によって線量分布を算出する。但し、放射線治療装置3ごとに放射線を照射することが可能な方向や精度が異なる。従って、放射線治療に用いられる放射線治療装置3の特性を表すパラメータを入力装置10Aから線量計算部20に入力し、線量計算部20は、放射線治療装置3の特性を条件として線量分布を算出するようにすることが精度上望ましい。
【0071】
次に、過剰・過少照射解析部21は、線量計算部20によって線量計画値として算出された線量分布と線量期待値とを比較して、放射線の過剰照射領域、過少照射領域、過剰照射時相及び過少照射時相を特定する。すなわち、領域特定部21Aは、時相ごとに線量計画値と線量期待値とを比較することによって放射線の過剰照射領域及び過少照射領域を特定する。また、時相特定部21Bは、領域特定部21Aにおける比較結果に基づいて、過剰照射領域及び過少照射領域の少なくとも一方が存在する時相を過剰照射時相及び過少照射時相の一方又は双方として特定する。
【0072】
次に、過剰・過少照射解析部21は、放射線の線量計画値と線量期待値との差、過剰照射領域、過少照射領域、過剰照射時相及び過少照射時相の少なくとも1つを表示装置10Bに線量計画値に対する評価情報として表示させる。
【0073】
図8は、図1に示す過剰・過少照射解析部21において特定された過剰照射領域及び過少照射領域を時相ごとに表示させた例を示す図である。
【0074】
図8(A)に示すようなk枚のスライスS1, S2, S3, ...,Sk(kは自然数)の時系列のマルチスライス画像データから適切なi番目の1枚のスライスSiの2D画像データを抽出し、図8(B)に示すように同一のスライス位置における放射線の2D過剰照射領域及び2D過少照射領域を時系列に表示装置10Bに表示させることができる。
【0075】
図8(B)の例では、各時相t1, t2, t3, ..., tnにおける2D断層像上にGTV及び浸潤領域をマージンとして含むCTVの範囲とともに線量計画値と線量期待値との差が表示されている。線量計画値と線量期待値との差の2D分布は、例えばカラーを用いて視覚的に表示させることができる。更に、線量計画値と線量期待値との差に基づいて、放射線の過剰照射領域及び過少照射領域を、カラーなどを用いて強調表示させることができる。
【0076】
このため、GTV及びCTVにおける線量計画値として設定された線量分布の適否を容易に判断することができる。また、全ての腫瘍領域を表示させずに、GTVやCTV等の危険な部位を優先的に表示させることによって、過剰照射領域及び過少照射領域の把握を容易にすることができる。
【0077】
図8(B)では、2D断層像上にGTV、CTV、線量計画値と線量期待値との差、過剰照射領域及び過少照射領域が表示されているが、他の2D画像上に表示させてもよい。例えば、断面変換(MPR: multi planar reconstruction)画像、ボリューム・レンダリング(VR: volume rendering)画像、サーフェス・レンダリング(SR: surface rendering)画像、最大値投影(MIP: Maximum Intensity Projection)画像や最小値投影(MinIP: Minimum Intensity Projection)画像等の強度投影(IP: Intensity Projection)画像、Curved MPR画像のように一般的なボリューム画像データの表示用に用いられる2D画像上にGTV、CTV、過剰照射領域及び過少照射領域を重畳表示させることができる。更に、複数の画像診断装置2で収集された複数の医用画像を互いにFusion表示してもよい。
【0078】
また、図8に示すように、同一のスライスSiの複数の時相t1, t2, t3, ..., tnに対応する2D画像を、時相方向に投影することによって平均的な強度投影(Ave IP)画像を生成することができる。これにより、高い画像信号値を呈する臓器を強調表示することができるため、計画された線量分布と臓器の位置関係を容易に比較できるようになる場合がある。
【0079】
図9は、図1に示す過剰・過少照射解析部21において特定された過剰照射領域及び過少照射領域を三次元的に表示させた例を示す図である。
【0080】
図9に示すように、過剰照射領域及び過少照射領域を三次元的に表示させることもできる。図9は、治療部位の2D位置(X, Y)における放射線の強度を示すBeam's eye view上に過剰照射領域及び過少照射領域を識別表示させた例を示している。すなわち、線量期待値の3D分布と線量計画値の3D分布との差分を表示し、かつ放射線の過剰照射領域及び過少照射領域を、カラーなどを用いて強調表示させることができる。
【0081】
この他、非剛体位置合わせ処理の結果として取得されるWarp Fieldや心筋のWMT等の動態解析の結果を表す解析画像上にGTV、CTV、線量計画値と線量期待値との差、過剰照射領域及び過少照射領域を表示させることができる。この場合、ITVを表示させれば、ITVと線量分布との比較を容易に行うことが可能となる。
【0082】
このように過剰・過少照射解析部21の表示処理によって、表示装置10Bに参照画像として表示される2D画像上に、GTV等の腫瘍領域、浸潤領域等のマージン領域、OAR、PRV、線量分布、線量計画値と線量期待値との差、過剰照射領域及び過少照射領域等の所望の情報を2次元的又は3次元的に重畳表示させることができる。これにより、臓器の形態を確認しつつ、線量計画値の適否を判断することが可能となる。
【0083】
表示装置10Bに表示された画像は、放射線の照射条件の再設定のためのインターフェースとしても利用することができる。例えば、マウス等の入力装置10Aの利用によって領域を指定し、指定した領域における線量期待値を局所的に変えることができる。また、線量期待値自体も変更することが可能である。同様に、マージン領域やCTV等の腫瘍領域の調整を行うことも可能である。
【0084】
すなわち、過剰・過少照射解析部21は、代表的には線量期待値等の放射線の照射条件の編集画面としてGTV等の腫瘍領域、浸潤領域等のマージン領域、OAR、PRV、線量分布、線量計画値と線量期待値との差、過剰照射領域及び過少照射領域等の所望の情報を表示装置10Bに表示させることができる。
【0085】
表示装置10Bに表示された編集画面を通じて入力装置10Aから放射線の照射条件の変更指示情報が線量計算部20や過剰・過少照射解析部21等の対応する構成要素に入力されると、変更指示情報に従って新たな放射線の照射条件に基づいて線量分布等の値が自動的に再計算される。例えば、線量期待値はマージンを含む腫瘍領域ごとに設定されているため、線量期待値又は腫瘍領域の特定情報を編集すると、線量分布が線量計画値として再計算される。すなわち、線量計算部20及び過剰・過少照射解析部21は、編集画面に表示された線量計画値の評価情報を参照して入力された放射線の線量期待値の変更情報に基づいて評価情報を更新させて表示させる。
【0086】
ここまでは、過剰照射領域及び過少照射領域の表示例について説明したが、上述のように過剰照射時相及び過少照射時相を表示させることもできる。すなわち、過剰照射領域が存在する時相の画像を過剰照射時相画像として、過少照射領域が存在する時相の画像を過少照射時相画像として、それぞれ決定することができる。
【0087】
図10は、図1に示す過剰・過少照射解析部21における過剰照射時相画像及び過少照射時相画像の特定方法の一例を説明する図である。
【0088】
図10(A)に示すように過剰照射領域が存在するスライス画像データ及び過少照射領域が存在するスライス画像データを特定することができる。過剰照射領域が存在するスライス画像データを過剰照射スライス画像データとして定義する一方、過少照射領域が存在するスライス画像データを過少照射スライス画像データとして定義すると、図10(B)に示すように、3Dボリューム画像データ内において複数の過剰照射スライス画像データ又は複数の過少照射スライス画像データを特定することができる。そして、図10(C)に示すように、過剰照射スライス画像データが存在する時相の3Dボリューム画像データを3D過剰照射時相画像データとして特定する一方、過少照射スライス画像データが存在する時相の3Dボリューム画像データを3D過少照射時相画像データとして特定することができる。
【0089】
過剰照射領域が存在する時相及び過少照射領域が存在する時相が特定されると、異なる時相に対応する複数の診断画像データを時相方向に時系列的に並べてタイムライン表示させることができる。このとき、過剰照射及び過少照射の度合いを把握できるように診断画像データを表示させることができる。
【0090】
図11は、図1に示す過剰・過少照射解析部21により、過剰照射の度合いを把握して線量期待値を編集できるように複数の診断画像のサムネイル画像を時相方向にタイムライン表示させた例を示す図である。
【0091】
図11に示すように表示装置10Bには、編集エリアとサムネイル画像エリアとを表示させることができる。サムネイル画像エリアには、同一スライス位置における複数の時相t1. t2. t3, ...,tnの診断画像をサムネイル画像として時相方向に並べて表示させることができる。また、サムネイル画像エリアには、サムネイル画像を並べる方向となる時相tを示す横軸に加えて過剰照射の度合いを示す縦軸が設けられる。そして、各サムネイル画像は、過剰照射の度合いに応じて縦軸方向の対応する位置に表示される。
【0092】
このため、サムネイル画像の表示位置を確認することによって、放射線の過剰照射の度合いを把握することができる。更に、図11に示すように過剰照射の望ましい範囲又は許容範囲として閾値ラインを表示させれば、線量期待値の編集が必要となるサムネイル画像を容易に確認することができる。尚、表示位置に限らずカラー表示等の他の表示方法によって放射線の過剰照射の度合いを表示させるようにしてもよい。
【0093】
過剰照射の度合いは、線量計画値と線量期待値との差のみならず、領域の種類等の他の条件にも対応させて指標化することができる。例えば、浸潤領域における線量計画値と線量期待値との差を相対的に小さく見積もる一方、過剰照射が望ましくない正常領域における線量計画値と線量期待値との差を相対的に大きく見積もるようにすることができる。この場合には、線量計画値と線量期待値との差の領域間における重み付け加算値などを過剰照射の度合いを示す指標とすることができる。これは過少照射の度合いについても同様である。つまり、放射線の過剰照射領域、過少照射領域、過剰照射時相及び過少照射時相の少なくとも1つを、放射線の線量計画値と線量期待値との差のみならず、腫瘍に関して定義された領域の種類に基づいて算出することができる。
【0094】
また、マウス等の入力装置10Aの操作によってサムネイル画像を選択すると、編集エリアにサムネイル画像に対応する診断画像が表示されるようにすることができる。或いは、線量期待値と線量計画値との差が大きい時相順に、自動的に診断画像が編集エリアに表示されるようにしてもよい。図11は、過剰照射の度合いが最大となっている時相ti1に対応するサムネイル画像が自動的に選択されて、編集エリアに対応する診断画像が表示されている例を示している。
【0095】
編集エリアには、線量期待値等の放射線の照射条件の編集のために効果的に参照できる所望の情報を付加して診断画像を表示させることができる。図11に示す例では、時相ti1におけるGTV(ti1)、時相ti1におけるCTV(ti1)、ITV、線量計画値と線量期待値との差、過剰照射領域及び過少照射領域が診断画像に重畳表示されている。
【0096】
そして、編集エリアに表示された診断画像を通じて線量期待値等の放射線の照射条件を変更すると、過剰照射領域及び過少照射領域等の評価データが再計算される。このため、サムネイル画像の選択及び線量期待値等の変更を繰り返すことによって、全てのサムネイル画像に対応する過剰照射の度合いを閾値ライン以下にすることができる。
【0097】
この他、表示されている複数のサムネイル画像及び診断画像のスライス位置を示すこともできる。図11に示す例では、スライスS1からスライスSkのうちのスライスSiが選択されていることが確認できる。
【0098】
図12は、図1に示す過剰・過少照射解析部21により、過少照射の度合いを把握して線量期待値を編集できるように複数の診断画像のサムネイル画像を時相方向にタイムライン表示させた例を示す図である。
【0099】
図11に示す表示装置10Bの画面例と同様に、図12に示すように、過少照射の度合いを把握できるように複数の時相t1. t2. t3, ...,tnに対応するサムネイル画像をサムネイル画像エリアに表示させることができる。すなわち、時相t及び過少照射の度合いを示す2D位置に複数のサムネイル画像を配置し、閾値ラインを表示させることができる。
【0100】
また、編集エリアには、過少照射の度合いが最大となっている時相ti2に対応する診断画像などを選択し、時相ti2におけるGTV(ti2)、時相ti2におけるCTV(ti2)、ITV、線量計画値と線量期待値との差、過剰照射領域及び過少照射領域とともに表示させることができる。
【0101】
過少照射の度合いは、例えば、GTV(ti2)及びCTV(ti2)における線量計画値と線量期待値との差を相対的に大きく見積もる一方、その他の領域における線量計画値と線量期待値との差を相対的に小さく見積もるようにすることができる。これにより、十分な線量の放射線を照射することが望ましいGTV(ti2)及びCTV(ti2)における過少照射領域を低減させることができる。
【0102】
図8、図11及び図12に示す例では、単一のスライス位置における過剰照射領域及び過少照射領域を表示させたが、複数のスライス位置における複数の時相に対応する過剰照射領域及び過少照射領域を把握できるような画面情報を作成して表示させることもできる。
【0103】
図13は、図1に示す過剰・過少照射解析部21により、複数のスライス位置における複数の時相に対応する過剰照射領域及び過少照射領域の有無を表示させた例を示す図である。
【0104】
図13に示すように、縦軸をスライス番号Si(i = 1, 2, 3, ..., k)で特定されるスライス位置、横軸を時相t(t1, t2, t3, ..., tn)として、スライス画像を表す図形を2次元的に表示装置10Bの画面に表示させることができる。そして、過剰照射領域が存在する過剰照射スライス画像及び過少照射領域が存在する過少照射スライス画像に相当する図形を互いに異なるカラーなどで強調して識別表示させることができる。更に、スライス画像を表す図形内には、線量計画値と線量期待値との差である過剰照射量及び過少照射量を表示させることもできる。
【0105】
但し、図8、図11及び図12に示すように、実際には過剰照射領域及び過少照射領域の双方が1枚のスライス画像上に存在する場合が多い。この場合、スライス画像を過剰照射スライス画像及び過少照射スライス画像のいずれか一方に分類することができない。
【0106】
そこで、図13に示すように、スライス画像が過剰照射スライス画像であることを示す過剰照射スライスINDICATORと、スライス画像が過少照射スライス画像であることを示す過少照射スライスINDICATORを、共通のスライス画像を指し示すことができるように表示させることができる。更に、時相ti3におけるスライス画像の表示のように、過剰照射スライス画像及び過少照射スライス画像の双方に該当するスライス画像の図形には、過剰照射量及び過少照射量の双方を表示させることができる。
【0107】
このようなスライス画像の模式的な表示方法により、容易に過剰照射領域及び過少照射領域が存在するスライス位置を確認することができる。また、図13に示す矩形枠の図形を入力装置10Aの操作によって選択すると、図11及び図12に示すような編集エリアに、選択された図形に対応する詳細なスライス画像が表示されるようにしてもよい。
【0108】
上述の例の他、スライス位置を特定せずに、複数の時相に対応する診断画像をタイムライン表示させることもできる。例えば、VR画像等のスライス位置が特定されない3D画像やボリューム画像を表す図形を時相軸方向に並べて表示させることができる。
【0109】
但し、ボリューム画像やVR画像等の3D画像も過剰照射時相画像及び過少照射時相画像のいずれか一方に分類することができない場合がある。その場合には、図13に示すような過剰照射INDICATOR及び過少照射INDICATORを表示させたり、3D画像近傍に過剰照射量及び過少照射量の双方を表示させることによって、過剰照射時相画像及び過少照射時相画像を識別可能に表示させることができる。
【0110】
ところで、放射線治療においては、タイムライン表示のためのタイムスケールを様々な時間的表現にすることができる。従って、上述の例では、タイムスケールを時相tとしたが他の時間的表現をタイムスケールとすることができる。一方、位置スケールについてもスライス位置に限らず、他の位置的表現にすることができる。
【0111】
図14は、図1に示す過剰・過少照射解析部21により、複数の画像又は図形を並べて表示させる場合に用いることが可能なスケールの表現の例を示す図である。
【0112】
図14(A)に示すように放射線治療の全工程は、複数回の治療で構成される。従って、タイムスケールを治療回数J(J = 1, 2, 3, ..., L)として複数の画像や画像を表す図形をタイムライン表示させることができる。
【0113】
また、1回の放射線治療は、図14(B)に示すように複数の周期F(F = 1, 2, 3, ..., M)を単位として分けることができる。各周期Fでは、それぞれ4D画像データが収集される。つまり、周期Fは1回の撮像に相当する。従って、タイムスケールを周期Fとすることもできる。
【0114】
更に、1つの周期に対応する4D画像データは、図14(C)に示すように、複数の時相t(t = t1, t2, t3, ..., tn)に対応する複数の3D画像データからなる。よって、タイムスケールを時相tとすることができる。
【0115】
また、特定の時相tに対応する3D画像データは、図14(D)に示すように、複数の2Dスライス画像データからなる。そこで、スライス番号Si(i = 1, 2, 3, ..., k)で特定されるスライス位置を位置スケールとして複数のスライス画像を並べて表示させることができる。
【0116】
一方、図14(E)に示すように、特定の時相tに対応する3D画像データには、臓器、器官、腫瘍領域等の境界が特定された複数のオブジェクトが含まれている。そこで、オブジェクト番号P(P = P1, P2, P3, ..., Pe)で識別されるオブジェクトの代表位置を位置スケールとして、複数のオブジェクトが占める領域の2D画像又は3D画像を並べて表示させることができる。
【0117】
もちろん、全ての範囲におけるタイムスケール又は位置スケールを表示させてもよいし、局所的なタイムスケール及び位置スケールを抽出して表示させてもよい。また、スケールの意味の選択肢から所望の意味を選択できるようにしてもよい。
【0118】
一方、図1に示すDVH算出部22は、必要に応じてDVHを算出する。DVHは、放射線の線量期待値、線量計画値として算出された線量分布、PTV及びPRVに基づいて算出することができる。
【0119】
図15は、図1に示すDVH算出部22おいて算出されるDVHの一例を示すグラフである。
【0120】
図15において横軸は、計画されている放射線の線量[cGy]を示し、縦軸は、横軸で示される線量の放射線が照射される体積[%]を示す。また、図15中の二点鎖線はPTVに照射される放射線の線量の期待値PTVeを、点線はPTVに照射される放射線の線量の計画値PTVpを、一点鎖線はPRVに照射される放射線の線量の期待値PRVeを、破線はPRVに照射される放射線の線量の計画値PRVpを、それぞれ示す。
【0121】
図15に示すように、DVHは、治療対象領域に相当するPTVと正常組織に相当するPRVのそれぞれの体積に対する線量の強さをグラフ化したものである。理想的には、PTVは治療対象領域であるため、強い線量の放射線をPTVに照射することが重要である。逆に正常組織であるPRVに照射される放射線の線量は、可能な限り小さくすることが重要である。
【0122】
従って、PTVに対する線量は、線量の増加に伴って体積が非線形に減少する上に凸のカーブとなる。すなわち、図15に示すように、PTVに対する線量の期待値PTVeは右上に湾曲するカーブとなる。逆に、PRVに対する線量は、線量の増加に伴って体積が非線形に減少する下に凸のカーブとなる。すなわち、図15に示すように、PRVに対する線量の期待値PRVeは左下に湾曲するカーブとなる。
【0123】
そして、PTVに対する線量の計画値PTVpの変化率を局所的にする程、治療対象領域に十分な線量の放射線を照射することができる。同様に、PRVに対する線量の計画値PRVpの変化率を局所的にする程、過剰な線量の放射線の照射を回避することができる。
【0124】
しかしながら、PTVに対する線量を増加させて計画値PTVpを期待値PTVeに近づけようとすると、PRVにも強い線量の放射線が照射されることとなる。つまりPTVに対する線量を優先すると、PRVに対してより過剰な線量の放射線が照射される。逆にPRVに対する線量を減少させて計画値PRVpを期待値PRVeに近づけようとすると、PTVにも弱い線量の放射線が照射されることとなる。つまりPRVに対する線量を優先すると、PTVには十分な線量の放射線が照射されない。
【0125】
従って、トレードオフの関係にあるPTV及びPRVに対する線量のバランスを適切にとることが放射線治療計画において重要である。そこで、上述した過剰照射領域及び過少照射領域を重畳表示した診断画像のみならず、DVHを表示させることが好適である。その場合、DVH算出部22は、算出したDVHを、診断画像とともに線量計画値に対する評価情報として表示装置10Bの画面に表示させる。
【0126】
図16は、図1に示すDVH算出部22おいて算出されたDVHを診断画像とともに表示させた例を示す図である。
【0127】
図16に示すように任意の位置スケール又はタイムスケールを用いてスケール上の位置に対応する複数の診断画像とともに複数のDVHを並べて表示させることができる。図16は、時相tを示すタイムスケールを用いて複数の時相t(t1, t2, t3, ..., tn)に対応する複数のVR画像、スライス画像及びDVHを並列に表示させた例を示す図である。また、図16に示すように、1回の治療の合計を表すVR画像、スライス画像及びDVH並びに全治療工程の合計を表すVR画像、スライス画像及びDVHを表示させることもできる。
【0128】
このように、様々なタイムスケール及び位置スケールを用いて、過剰照射領域及び過少照射領域を重畳表示した診断画像及びDVHを表示させることができる。尚、DVH上の過剰照射領域及び過少照射領域に対応する部分を、視覚的に識別できるように強調表示してもよい。
【0129】
このような線量期待値の初期入力による線量分布の算出及び入力した線量期待値の編集を含む放射線治療計画が完了すると、治療計画に沿った放射線治療が可能となる。そして、図2に示すように治療計画に基づく放射線治療装置3による放射線治療が実施される。
【0130】
つまり以上のような、放射線治療情報生成装置1は、CTVや浸潤領域等の腫瘍に関して定義された領域を、診断画像データに対する画像処理によって解析的に特定するようにしたものである。更に、放射線治療情報生成装置1は、特定された各腫瘍領域と放射線の線量期待値に基づいて線量計画値として線量分布を自動計算し、線量期待値と線量計画値との差とともに放射線の過剰照射領域、過少照射領域、過剰照射時相、過少照射時相及びDVH等の評価情報を表示させるようにしたものである。
【0131】
このため、放射線治療情報生成装置1によれば、CTVや浸潤領域等の腫瘍に関して定義された領域を定量的に求めることができる。また治療対象となる臓器についても、診断画像に対する画像処理によって抽出することができる。この結果、臓器の抽出精度を向上させて、GTVの誤差を低減させることができる。更に、浸潤領域を解析的かつ定量的に特定できるため、浸潤領域の抽出精度を向上させてCTVに対する誤差を低減させることができる。
【0132】
一方、臓器の移動範囲についても動き解析の結果に基づいて解析的に算出することができる。これにより、臓器の可動範囲に相当するIM及びITVの精度も向上させることができる。
【0133】
加えて、定量的に特定された腫瘍の浸潤領域を含む各種の腫瘍領域に基づいて算出された放射線の過剰照射領域、過少照射領域、過剰照射時相、過少照射時相及びDVH等の評価情報を診断画像とともに視覚的に表示させることができる。この結果、線量計画を直観的に把握することが可能となる。更に、線量計画を容易に編集し、過剰又は過少な放射線の照射を低減させることができる。
(変形例)
【0134】
以上、特定の実施形態について記載したが、記載された実施形態は一例に過ぎず、発明の範囲を限定するものではない。ここに記載された新規な方法及び装置は、様々な他の様式で具現化することができる。また、ここに記載された方法及び装置の様式において、発明の要旨から逸脱しない範囲で、種々の省略、置換及び変更を行うことができる。添付された請求の範囲及びその均等物は、発明の範囲及び要旨に包含されているものとして、そのような種々の様式及び変形例を含んでいる。
【0135】
例えば、上述した実施形態では、放射線治療情報生成装置1のGTV算出部12、浸潤解析部13、CTV算出部14、経時変化解析部15、ITV算出部16、PTV算出部17、OAR抽出部18及びPRV算出部19等の構成要素が、腫瘍に関して定義された少なくとも1つの領域を診断画像データに対する解析処理によって特定する領域特定手段として機能する一方、線量計算部20及び過剰・過少照射解析部21が前記領域及び放射線の線量期待値に基づいて算出された線量計画値についての評価情報を表示させる計画評価手段として機能する例について説明したが、領域特定手段及び計画評価手段としての機能が備えられれば他の機能ブロック図で示される放射線治療情報生成装置を構成してもよい。
【符号の説明】
【0136】
1 放射線治療情報生成装置
2 画像診断装置
3 放射線治療装置
10コンピュータ
10A 入力装置
10B 表示装置
10C 演算装置
11 治療対象臓器抽出部
12 GTV算出部
13 浸潤解析部
14 CTV算出部
15 経時変化解析部
16 ITV算出部
17 PTV算出部
18 OAR抽出部
19 PRV算出部
20 線量計算部
21 過剰・過少照射解析部
21A 領域特定部
21B 時相特定部
22 DVH算出部
23 SM値データベース
【技術分野】
【0001】
本発明の実施形態は、放射線治療情報生成装置に関する。
【背景技術】
【0002】
従来、放射線を照射することによって腫瘍を治療する放射線治療が知られている。放射線治療は、主として画像診断装置による診断画像の撮像、放射線治療計画及び放射線治療装置による治療の3つのステップからなる。
【0003】
具体的には、放射線治療では、X線CT (computed tomography)装置、磁気共鳴イメージング(MRI: Magnetic Resonance Imaging)装置、陽電子放出コンピュータ断層(PET: positron emission computed tomography)装置や単光子放出コンピュータ断層(SPECT: single photon emission computed tomography)装置等の核医学診断装置によって腫瘍領域を特定するための医用画像が予め収集される。
【0004】
次に、放射線治療計画が実施される。すなわち、画像診断装置によって収集された医用画像から、治療対象となる腫瘍および放射線の照射が望ましくない正常組織が抽出され、抽出結果に基づいて放射線の照射範囲、照射方向及び照射強度等の照射条件が治療計画として策定される。特に、正常組織への放射線の照射が避けられないため、できるだけ副作用を発生させないような放射線の照射条件の計画が重要である。このため、放射線治療計画では、医用画像上に線量分布を表示させる視覚的な評価のみならず、治療効果や正常組織への副作用を推定するための線量体積ヒストグラム(DVH: Dose Volume Histogram)等の解析的な評価も必要である。DVHは、治療対象となる腫瘍組織と正常組織の各体積に対する放射線の線量をグラフとして表示させたものである。
【0005】
近年では、より綿密な条件を策定するために、放射線治療計画を支援する放射線治療計画システムが提案されている。従来の放射線治療計画システムでは、画像診断装置により収集された医用画像に基づいて解剖情報が定義され、定義された解剖情報に従って放射線の照射方向、照射位置及び線量分布等の照射条件が計算される。更に、計算された放射線の照射条件が適切であるか否かの評価が実施される。
【0006】
このような放射線の線量分布等の計画のために、従来、腫瘍領域に対して様々なマージンを付加した領域が定義されている。具体的には、肉眼的腫瘍体積(GTV: Gross Tumor Volume)、臨床標的体積(CTV: Clinical Target Volume)、内的標的体積(ITV: Internal Target Volume)、計画標的体積(PTV: Planning Target Volume)の4つの領域が定義されている。
【0007】
GTVは、医用画像の診断によって明らかに腫瘍が存在すると判断される領域である。腫瘍浸潤の疑われる部分も医用画像で認識される限りGTVに含められる。CTVは、医用画像では認識できない微小な浸潤部分をGTVに加えた領域である。ITVは、臓器の移動を考慮したマージン領域であるIM (Internal Margin)をCTVに加えた標的体積である。PTVは、患者およびビームの位置合わせに関する不正確度を考慮してSM (Setup Margin)をITVに三次元的に加えた領域である。
【0008】
そして、これらのマージンを付加した腫瘍領域ごとに適切な放射線の線量を算出することができる。例えば、CTVの99%以上に95%以上の十分な線量が照射されるように、放射線の照射条件を設定することができる。また、PTVに対するマージンを求めるモデル式も提案されている。例えば、90%の患者でCTVにおける最低線量が処方線量の95%を超えるようにするために必要なPTVへのマージンを求めるモデル式が知られている。尚、PTVの辺縁も95%の線量域に含めるためには,PTVにさらに5〜8×10-3[m]程度のマージンを付加して放射線の照射野を設定する必要がある。
【0009】
更に、腫瘍領域ごとの線量計算によって放射線の照射条件が放射線治療計画として策定されると、放射線治療装置を用いた放射線治療を実施することが可能となる。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】特開2004−230311号公報
【特許文献2】特開2007−253810号公報
【特許文献3】特開2002−134380号公報
【発明の概要】
【発明が解決しようとする課題】
【0011】
しかしながら、放射線治療計画の際、治療対象となる腫瘍領域に対して様々なマージンを付加した領域の設定が実施されるため、正常組織への副作用のリスクが増加するという問題がある。特に、根治治療や症状緩和等の治療目的に応じて、領域ごとに異なる線量を設定する必要がある。ところが、腫瘍の浸潤領域等の各領域は、概念的に定義されているのみであり、定量的に設定することができない。
【0012】
この結果、放射線治療計画の際に放射線の線量分布を表示させたとしても、浸潤領域を加味した定量的な放射線の過少照射領域及び過剰照射領域を時間的もしくは空間的に把握することが困難である。つまり、腫瘍の浸潤領域等の放射線の照射領域の定量的な特定が困難である結果、放射線の正常組織への過剰照射や治療対象への過少照射が発生するという問題がある。
【0013】
そこで、本発明は、放射線治療において、放射線の過剰照射や過少照射を低減させるための放射線治療情報を生成することが可能な放射線治療情報生成装置を提供することを目的とする。
【課題を解決するための手段】
【0014】
本発明の実施形態に係る放射線治療情報生成装置は、領域特定手段及び計画評価手段を備える。領域特定手段は、腫瘍に関して定義された少なくとも1つの領域を診断画像データに対する解析処理によって特定する。計画評価手段は、前記領域及び放射線の線量期待値に基づいて算出された線量計画値についての評価情報を表示させる。
【図面の簡単な説明】
【0015】
【図1】本発明の実施形態に係る放射線治療情報生成装置の機能ブロック図。
【図2】放射線治療において図1に示す放射線治療情報生成装置とともに用いられる医用機器及び放射線治療の流れを示す図。
【図3】図1に示す浸潤解析部において実施される浸潤解析の流れの一例を示すフローチャート。
【図4】図1に示す浸潤解析部において実施される浸潤解析の別の一例の解析結果を診断画像データとともに表示させた例を示す図。
【図5】図1に示すITV算出部において実施されるITVの算出方法の一例を概念的に示す図。
【図6】図1に示す放射線治療情報生成装置において特定される各腫瘍領域の関係を模式的に表した図。
【図7】図1に示す線量計算部に入力される放射線の線量期待値の一例を示す図。
【図8】図1に示す過剰・過少照射解析部において特定された過剰照射領域及び過少照射領域を時相ごとに表示させた例を示す図。
【図9】図1に示す過剰・過少照射解析部において特定された過剰照射領域及び過少照射領域を三次元的に表示させた例を示す図。
【図10】図1に示す過剰・過少照射解析部における過剰照射時相画像及び過少照射時相画像の特定方法の一例を説明する図。
【図11】図1に示す過剰・過少照射解析部により、過剰照射の度合いを把握して線量期待値を編集できるように複数の診断画像のサムネイル画像を時相方向にタイムライン表示させた例を示す図。
【図12】図1に示す過剰・過少照射解析部により、過少照射の度合いを把握して線量期待値を編集できるように複数の診断画像のサムネイル画像を時相方向にタイムライン表示させた例を示す図。
【図13】図1に示す過剰・過少照射解析部により、複数のスライス位置における複数の時相に対応する過剰照射領域及び過少照射領域の有無を表示させた例を示す図。
【図14】図1に示す過剰・過少照射解析部により、複数の画像又は図形を並べて表示させる場合に用いることが可能なスケールの表現の例を示す図。
【図15】図1に示すDVH算出部おいて算出されるDVHの一例を示すグラフ。
【図16】図1に示すDVH算出部おいて算出されたDVHを診断画像とともに表示させた例を示す図。
【発明を実施するための形態】
【0016】
本発明の実施形態に係る放射線治療情報生成装置について添付図面を参照して説明する。
【0017】
図1は本発明の実施形態に係る放射線治療情報生成装置の機能ブロック図であり、図2は、放射線治療において図1に示す放射線治療情報生成装置1とともに用いられる医用機器及び放射線治療の流れを示す図である。
【0018】
図2に示すように放射線治療のプロセスは、概略的には画像診断装置2による医用画像の収集、放射線治療計画の策定及び放射線治療装置3による放射線治療の3つのステップからなる。より具体的には、画像診断装置2において患者の腫瘍部位を含む医用画像の撮像が実行される。次に、収集された医用画像に基づく放射線治療計画が放射線治療情報生成装置1において実施される。すなわち、医用画像に基づく解剖情報の定義、定義された解剖情報に基づく放射線の線量分布の計算及び放射線治療計画として計算された線量分布の評価が行われる。そして、放射線治療計画において策定された線量分布を含む計画情報に従って放射線治療装置3を用いた患者の放射線治療が実施される。
【0019】
放射線治療情報生成装置1は、放射線治療における放射線治療計画を行うための放射線治療計画システムとしての機能を有する。ここでは、図1及び図2に示すように放射線治療情報生成装置1が画像診断装置2及び放射線治療装置3から独立した装置である場合について説明するが、放射線治療計画システムを画像診断装置2又は放射線治療装置3に内蔵することもできる。その場合には、放射線治療計画システムとしての機能を備えた画像診断装置2又は放射線治療装置3が放射線治療情報生成装置1となる。
【0020】
放射線治療情報生成装置1が画像診断装置2及び放射線治療装置3から独立した放射線治療計画システムである場合には、放射線治療情報生成装置1はネットワークを介して画像診断装置2及び放射線治療装置3と接続される。尚、画像診断装置2及び放射線治療装置3と医用画像サーバや医用画像処理装置等の医用機器を介して放射線治療情報生成装置1を接続してもよい。
【0021】
画像診断装置2は、放射線治療の対象となる腫瘍領域を含む患者の診断画像を放射線治療計画用に収集するために用いられる。放射線治療において用いられる画像診断装置2の例としては、X線CT装置、MRI装置、PET装置やSPECT装置等の核医学診断装置が挙げられる。尚、PET装置とX線CT装置のように複数の画像診断装置2で放射線治療計画用の診断画像を収集するようにしてもよい。また、PET/CT装置のような一体化した複数の画像診断装置2を用いてもよい。
【0022】
放射線治療情報生成装置1は、画像診断装置2により収集された腫瘍部位を含む診断画像データに基づいて、放射線の線量分布等の放射線の照射条件を放射線治療計画情報として作成する装置である。放射線治療情報生成装置1は、入力装置10A及び表示装置10Bを備えたコンピュータ10の演算装置10Cにプログラムを読み込ませて構築することができる。
【0023】
具体的には、放射線治療情報生成装置1の演算装置10Cは、治療対象臓器抽出部11、GTV算出部12、浸潤解析部13、CTV算出部14、経時変化解析部15、ITV算出部16、PTV算出部17、OAR抽出部18、PRV算出部19、線量計算部20、過剰・過少照射解析部21及びDVH算出部22として機能する。更に、過剰・過少照射解析部21は、領域特定部21A及び時相特定部21Bを有する。また、記憶装置を、SM値データベース23として機能させることができる。但し、これらの機能の一部又は全部を設けるために回路を用いて放射線治療情報生成装置1を構成してもよい。
【0024】
放射線治療装置3は、放射線治療情報生成装置1おいて作成された放射線の照射条件に従って放射線治療を行うための装置である。具体的には、患者である被検体にX線を照射するX線診断装置で放射線治療装置3を構成することができる。
【0025】
次に図1及び図2を参照して放射線治療情報生成装置1の詳細機能とともに放射線治療の流れについて説明する。
【0026】
まず、画像診断装置2の寝台に患者である被検体がセットされ、位置決め画像の収集を通じた被検体の位置決めが実施される。そして、被検体から腫瘍部位を含む診断画像データが収集される。放射線治療計画用の診断画像データの例としては、3次元(3D: three dimensional)X線CT画像データと3D TOF(time of flight)-PET画像データとの組合せ、4次元(4D: four dimensional)X線CT画像データと4D TOF-PET画像データとの組合せ及びMR画像データが挙げられる。
【0027】
4D-CT画像データと4D-PET画像データを収集する場合には、独立したX線CT装置とPET装置又は一体化されたPET/CT装置により被検体の撮像が行われる。独立したX線CT装置とPET装置とを用いて被検体の撮像を行う場合には、X線CT画像データとPET画像データとの間における剛体位置合わせ処理及び非剛体位置合わせ処理が必要となる。一方、PET/CT装置を用いれば、1回のスキャンでX線CT画像データ及びPET画像データの双方を収集することが可能である。PET/CT装置を用いる場合には、X線CT画像データとPET画像データとの間における位置合わせ処理が必ずしも必要でない。ただし、放射線治療計画においてより高精度に画像解析を行うために、非剛体位置合わせ処理によってX線CT画像データとPET画像データとの間における局所的な位置ずれを補正することが望ましい場合がある。
【0028】
放射線治療情報生成装置1の治療対象臓器抽出部11は、放射線治療計画のために画像診断装置2から直接又は医用画像サーバや医用画像処理装置を介して間接的に被検体の診断画像データを取得する。そして、治療対象臓器抽出部11は、放射線治療の対象として放射線を照射すべき臓器を診断画像データから抽出する。
【0029】
治療臓器の抽出は、臓器アトラスを参照した画素値に対する閾値処理や輪郭抽出処理等の公知の領域抽出処理によって自動的に行うことができる。また、入力装置10Aの操作によって自動抽出された治療臓器を調整することもできる。或いは、自動的に領域抽出することが困難な臓器が治療臓器である場合には、入力装置10Aから治療臓器を特定するための情報を入力することによって、治療臓器を手動又は半自動で特定することができる。この場合には、臓器の形態が描出されたX線CT画像データ等の診断画像データを参照し、診断画像データ上において臓器の形状や位置等の既知の解剖学的情報及び画像信号の値に基づいて治療臓器を特定することができる。
【0030】
次に、GTV算出部12は、治療対象臓器抽出部11において抽出された治療臓器に基づいてGTVを算出する。GTVは、診断画像データに基づいて明らかに腫瘍が存在すると判定される腫瘍領域である。例えば、治療対象となる臓器が占める領域をGTVとすることができる。また、治療対象臓器抽出部11において抽出された治療臓器の画素値に対する閾値処理によって腫瘍領域としてGTVを自動算出することもできる。或いは、表示装置10Bに表示された診断画像データを参照して腫瘍が確認された領域の特定情報を入力装置10AからGTV算出部12に入力し、腫瘍領域の特定情報に従ってGTV算出部12がGTVを決定するようにしてもよい。すなわち、GTVは画素値に対する閾値処理等の画像処理によって自動的に或いは入力装置10Aから入力された情報に従って手動で決定することができる。
【0031】
次に、浸潤解析部13は、画像診断装置2から互いに異なるコントラストを有する複数種の診断画像データ又は単一種類の診断画像データを取得し、複数種類又は単一種類の診断画像データの閾値処理を含む解析処理によって自動的に腫瘍の浸潤領域を特定する。浸潤領域は、診断画像データでは肉眼で認識できない腫瘍部分である。特に診断画像データが時系列のダイナミック画像データである場合には、各時相における浸潤領域を特定することができる。尚、浸潤領域の特定の際には、GTV算出部12において特定されたGTVを参照することができる。
【0032】
診断画像データの種類は、浸潤領域を閾値処理によって特定することが可能な画像データとされる。代表的には、4D-CT画像データとTOF-PET画像データの組合せ、X線CT装置で収集可能なDual Energy画像データ、MRIによって収集することが可能な縦緩和(T1)強調画像(T1WI: T1 weighted image)データ、横緩和(T2)強調画像(T2WI: T2 weighted image)データ及び/又は拡散強調画像(DWI: diffusion weighted image)データとPET画像データの組合せが挙げられる。尚、Dual Energy画像は、物質の減弱係数がX線の平均エネルギによって異なることを利用し、異なるX線エネルギ帯域に対する減弱係数の違いを画像化したものである。
【0033】
ここでは、一例として4D-X線CT画像データ及びTOF-PET画像データの組合せに基づいて時系列的な複数の浸潤領域を特定する場合について説明する。
【0034】
図3は、図1に示す浸潤解析部13において実施される浸潤解析の流れの一例を示すフローチャートである。
【0035】
まずステップS1において、X線CT装置により時系列の4D-CT画像データがダイナミック収集される。これにより複数の時相t1, t2, t3, ..., tnに対応する3D-CT画像データが順次収集される。
【0036】
一方、ステップS2では、PET装置により時系列のTOF-PET画像データが4D画像データとしてダイナミック収集される。これにより複数の時相t1, t2, t3, ..., tnに対応するn(nは自然数)個のTOF-PET画像データが順次収集される。
【0037】
次に、ステップS3では、X線CT装置により収集された4D-CT画像データとPET装置により収集されたTOF-PET画像データとの間における非剛体位置合わせ処理がX線CT装置及びPET装置のいずれかにおいて実行される。そして、非剛体位置合わせ処理の結果として、4D-CT画像データとTOF-PET画像データとの間における非線形な位置ずれ量が算出される。非線形な位置ずれ量は、平行移動と変形移動の組合せで表すことができる。また、変形移動の量は、特徴点抽出と抽出された特徴点間の距離に基づいて算出することができる。算出された位置ずれ量は、例えば、ベクトルの集合であるWarp Fieldと称するデータで表現することができる。
【0038】
次に、ステップS4では、非剛体位置合わせ処理の結果として得られた位置ずれ量であるWarp Fieldに基づいて、TOF-PET画像データの非線形位置ずれ補正処理が実行される。これにより複数の時相t1, t2, t3, ..., tnに対応する位置補正後のTOF-PET画像データが生成される。
【0039】
次に、ステップS5−1からステップS5−nでは、浸潤解析部13において、時相t1, t2, t3, ..., tnごとの3D-CT画像データ及び位置補正後のTOF-PET画像データに基づく画像解析が実行される。
【0040】
具体的には、ステップS6において浸潤解析部13が3D-CT画像データに対する閾値処理によって腫瘍領域を自動抽出する。次に、ステップS7において浸潤解析部13は、3D-CT画像データに対する閾値処理によって腫瘍な浸潤部分と考えられる腫瘍周辺における領域を抽出する。一方、ステップS8において浸潤解析部13は、TOF-PET画像データに対する閾値処理によって腫瘍領域を自動抽出する。次に、ステップS9において浸潤解析部13は、TOF-PET画像データに対する閾値処理によって腫瘍な浸潤部分と考えられる腫瘍周辺における領域を抽出する。
【0041】
これらの閾値処理のための閾値は、経験的な値又は学術的に報告されている値に設定することができる。尚、腫瘍領域は、GTV算出部12おいてGTVの特定のために抽出された腫瘍領域としてもよい。
【0042】
次に、ステップS10において浸潤解析部13は、3D-CT画像データから抽出された腫瘍領域及び腫瘍周辺領域と、TOF-PET画像データから抽出された腫瘍領域及び腫瘍周辺領域に基づいて腫瘍の浸潤領域を特定する。例えば、各腫瘍周辺領域を含む腫瘍領域の外側の領域、腫瘍領域の外側における各腫瘍周辺領域の共通の領域或いはこれらの領域の中間領域を浸潤領域として抽出することができる。
【0043】
ステップS6からステップS10までの画像解析は、各時相t1, t2, t3, ..., tnに対応する3D-CT画像データ及び位置補正後のTOF-PET画像データに基づいて、時相ごとに実行される。
【0044】
浸潤領域が特定されると、CTV算出部14は、GTV算出部12から取得したGTVに浸潤領域を加えることによってCTVを算出する。CTVは、診断画像において肉眼で認識できない微小な浸潤部分をGTVに加えた領域である。従って、CTVは、浸潤領域をマージンとして含む放射線の照射対象領域である。
【0045】
図3に示すように診断画像データとして時系列の画像データが収集されている場合には、複数の時相t1, t2, t3, ..., tnに対応する時系列のCTVが得られる。この場合、ステップS11においてCTV算出部14は、時系列のCTVを表示装置10Bに表示させることができる。
【0046】
一方、別の一例としてDWIデータ及びPET画像データに基づく浸潤領域の特定について説明する。
【0047】
図4は、図1に示す浸潤解析部13において実施される浸潤解析の別の一例の解析結果を診断画像データとともに表示させた例を示す図である。
【0048】
MRI装置において互いに異なる強度又は印加方向のMPG(motion probing gradient)パルスを印加して収集されたDWIを解析すると拡散テンソル画像(DTI: diffusion tensor image)データ及び2次元(2D: two dimensional)のパラメータ画像データとして拡散異方性(FA: Fractional Anisotropy)データが得られる。一方、PET装置において、放射線を放出する炭素C11を付加したメチオニンを投与して撮像すると11C-MET PET画像データが収集される。
【0049】
そして、浸潤解析部13において、FAデータ及び11C-MET PET画像データの各信号強度を2つの軸とする2Dマップを作成することができる。図4は、FAデータ及び11C-MET PET画像データの2Dマップを作成し、対応する複数の診断画像とともに表示装置10Bに表示させた例を示している。
【0050】
すなわち、診断画像としてMRI装置により収集されたT1WIとPET装置により収集された11C-MET PET画像が表示されている。尚、T1WIはガドリニウムを造影剤として投与して得られた造影MR画像である。T1WIは通常、グレースケールによって輝度表示されるが、11C-MET PET画像は、カラースケールを用いて画像信号値に応じたカラーで表示することができる。これらの診断画像上には、画像信号の信号値に応じて二点鎖線で示すような関心領域(ROI: region of interest)を設定することができる。
【0051】
そして、ROI内における画像信号を用いてFAデータ及び11C-MET PET画像データの2Dマップを作成すると、FAデータ及び11C-MET PET画像データの各信号強度の閾値処理によって2Dマップを視覚的に正常組織、浸潤領域及び腫瘍領域に分類することができる。つまり、FAデータとPET画像データとの組合せに基づいて腫瘍の浸潤領域を特定することができる。
【0052】
具体的には、FAデータに対して設定された閾値THFAよりも大きい画像信号を呈し、かつ11C-MET PET画像データ対して設定された閾値THPET以下の画像信号を呈する点群の領域を正常領域とすることができる。また、FAデータに対して設定された閾値THFA以下の画像信号を呈し、かつ11C-MET PET画像データ対して設定された閾値THPET以下の画像信号を呈する点群の領域を浸潤領域とすることができる。更に、FAデータに対して設定された閾値THFA以下の画像信号を呈し、かつ11C-MET PET画像データ対して設定された閾値THPETよりも大きい画像信号を呈する点群の領域を腫瘍領域とすることができる。
【0053】
すなわち、FAデータ及び11C-MET PET画像データの各信号強度に対する閾値処理によって、正常組織、浸潤領域及び腫瘍領域を特定することができる。分類された正常組織、浸潤領域及び腫瘍領域は、診断画像上に異なるカラーなどを用いて識別表示させることができる。図4は、正常組織、浸潤領域及び腫瘍領域をT1WI上に識別表示させた例を示している。
【0054】
そしてこのように特定された浸潤領域をCTV算出部14に与え、CTV算出部14においてGTVに浸潤領域を付加することによってCTVを算出することができる。
【0055】
一方、経時変化解析部15は、必要に応じて画像診断装置2から取得した時系列の4D診断画像データ及びCTV算出部14から取得したCTVに基づいて臓器の移動量に相当するマージン領域であるIMを自動的又は入力装置10Aからの情報を参照して半自動的に算出する。例えば、特定の時相におけるCTVの外側における他の時相におけるCTVの可動域をIMとすることができる。
【0056】
次に、ITV算出部16は、IMをCTVに加えた標的体積であるITVを自動的に算出する。例えば、時系列的な各時相におけるCTVの可動域をITVとして自動的に算出することができる。
【0057】
図5は、図1に示すITV算出部16において実施されるITVの算出方法の一例を概念的に示す図である。
【0058】
図5に示すようにGTV算出部12及びCTV算出部14により、各時相t1, t2, t3, ...,tnにおけるGTV及びCTVがそれぞれ算出される。図5に示すように時相間において治療対象となる臓器が移動及び変形するため、時相ごとにGTV及びCTVが異なる。そこで、GTV及びCTVの変形及び移動範囲をそれぞれ時相に依存しないGTV及びCTVとし、時相に依存しないCTV、つまりCTVの可動範囲をそのままITVとすることができる。
【0059】
この場合、例えば、各時相t1, t2, t3, ...,tnにおけるGTV及びCTVを時相方向に投影することによってそれぞれGTV及びCTVの可動域をIM及びIVTとして自動計算することができる。但し、時間軸方向への投影処理の他、非剛体位置合わせ処理によって動きベクトルの集合として算出されたWarp Fieldや心筋の壁運動解析(WMT: Wall Motion Tracking)等の動き解析の結果として得られた動き情報に基づいてIM及びIVTの少なくとも一方を自動計算するようにしてもよい。尚、WMTはねじれ解析により心筋の壁運動を解析する技術であり、MRI装置等の画像診断装置2において解析結果を得ることができる。
【0060】
但し、GTV及びCTVの可動範囲の大きさと正常部分との相対関係によっては、CTVの可動範囲をそのままITVとすると特定の時相において治療対象部位の外側の正常領域に過剰に放射線が照射される恐れがある。そこで、時間的に放射線の照射領域を調整可能なサイバーナイフ等の放射線治療装置3を用いた放射線治療計画を行う場合には、各時相に対応する時系列の複数のCTVをそのまま各時相に対応する時系列の複数のITVに設定してもよい。
【0061】
次に、PTV算出部17は、患者および放射線ビームの位置合わせの不正確度を表す指標として入力装置10Aから入力されたSMを、ITV算出部16において算出されたITVに付加する。これにより、ITVにSMを付加した体積として定義されているPTVが算出される。
【0062】
尚、SM値は、PTVを算出するまでの前処理の条件によって変化する。SM値に影響を与える条件としては、治療対象臓器の抽出に使用される臓器抽出アルゴリズム、治療対象となる臓器の種類、診断画像の収集に使用される画像診断装置2の種類等が挙げられる。そこで、これらの条件とSM値とを予め関連付けてSM値データベース23に保存しておくことができる。この場合、入力装置10Aの操作によって条件を選択すると、対応するSM値がPTV算出部17に入力されるようにすることができる。
【0063】
PTVの算出によって腫瘍について標準的に定義されている腫瘍領域の特定が完了する。各腫瘍領域GTV, CTV, ITV, PTVの間には、式(1-1)、式(1-2)及び式(1-3)の関係が成立する。
GTV ≦ CTV ≦ ITV < PTV (1-1)
ITV = CTV + IM (1-2)
PTV = ITV + SM (1-3)
【0064】
図6は、図1に示す放射線治療情報生成装置1において特定される各腫瘍領域の関係を模式的に表した図である。図6に示すように、PTVの内部にITVが、ITVの内部にCTVが、CTVの内部にGTVが設定されることとなる。
【0065】
一方、OAR抽出部18は、画像診断装置2から診断画像データを取得し、治療対象臓器の抽出のための画像処理と同様な画像処理を診断画像データに施すことによって、危険臓器(OAR: Organ at risk)を抽出する。
【0066】
次に、PRV算出部19は、OAR領域に基づいて、PTVの算出と同様な方法で計画リスク臓器体積(PRV: Planning organ at risk volume)を算出する。すなわち、OAR領域に経時的なOARの移動及び変形並びに不正確度を考慮したマージン領域を付加することによってPRVが算出される。
【0067】
次に、線量計算部20は、入力装置10Aから治療目的に応じて入力される各腫瘍領域に対する放射線の線量期待値、PRV及びPTVに基づいて線量計画値を算出する。
【0068】
図7は、図1に示す線量計算部20に入力される放射線の線量期待値の一例を示す図である。
【0069】
図7に示すように、放射線の線量期待値は治療目的及びマージンを含む治療領域ごとに異なる理想的な値に設定される。例えば、治療目的が根治治療であるか症状緩和治療であるかによって異なる線量期待値が設定される。また、PRVに対しても線量期待値を設定することができる。PTVは治療対象であるため十分線量が期待値として設定される。逆に、放射線の照射が望ましくないPRVに対しては、放射線が照射されないように或いは超低線量の期待値が設定される。
【0070】
このような線量期待値が線量計算部20に入力されると、線量計算部20は、モンテカルロ法を用いたシミュレーションや逆問題の解法等の公知の手法によって線量分布を算出する。但し、放射線治療装置3ごとに放射線を照射することが可能な方向や精度が異なる。従って、放射線治療に用いられる放射線治療装置3の特性を表すパラメータを入力装置10Aから線量計算部20に入力し、線量計算部20は、放射線治療装置3の特性を条件として線量分布を算出するようにすることが精度上望ましい。
【0071】
次に、過剰・過少照射解析部21は、線量計算部20によって線量計画値として算出された線量分布と線量期待値とを比較して、放射線の過剰照射領域、過少照射領域、過剰照射時相及び過少照射時相を特定する。すなわち、領域特定部21Aは、時相ごとに線量計画値と線量期待値とを比較することによって放射線の過剰照射領域及び過少照射領域を特定する。また、時相特定部21Bは、領域特定部21Aにおける比較結果に基づいて、過剰照射領域及び過少照射領域の少なくとも一方が存在する時相を過剰照射時相及び過少照射時相の一方又は双方として特定する。
【0072】
次に、過剰・過少照射解析部21は、放射線の線量計画値と線量期待値との差、過剰照射領域、過少照射領域、過剰照射時相及び過少照射時相の少なくとも1つを表示装置10Bに線量計画値に対する評価情報として表示させる。
【0073】
図8は、図1に示す過剰・過少照射解析部21において特定された過剰照射領域及び過少照射領域を時相ごとに表示させた例を示す図である。
【0074】
図8(A)に示すようなk枚のスライスS1, S2, S3, ...,Sk(kは自然数)の時系列のマルチスライス画像データから適切なi番目の1枚のスライスSiの2D画像データを抽出し、図8(B)に示すように同一のスライス位置における放射線の2D過剰照射領域及び2D過少照射領域を時系列に表示装置10Bに表示させることができる。
【0075】
図8(B)の例では、各時相t1, t2, t3, ..., tnにおける2D断層像上にGTV及び浸潤領域をマージンとして含むCTVの範囲とともに線量計画値と線量期待値との差が表示されている。線量計画値と線量期待値との差の2D分布は、例えばカラーを用いて視覚的に表示させることができる。更に、線量計画値と線量期待値との差に基づいて、放射線の過剰照射領域及び過少照射領域を、カラーなどを用いて強調表示させることができる。
【0076】
このため、GTV及びCTVにおける線量計画値として設定された線量分布の適否を容易に判断することができる。また、全ての腫瘍領域を表示させずに、GTVやCTV等の危険な部位を優先的に表示させることによって、過剰照射領域及び過少照射領域の把握を容易にすることができる。
【0077】
図8(B)では、2D断層像上にGTV、CTV、線量計画値と線量期待値との差、過剰照射領域及び過少照射領域が表示されているが、他の2D画像上に表示させてもよい。例えば、断面変換(MPR: multi planar reconstruction)画像、ボリューム・レンダリング(VR: volume rendering)画像、サーフェス・レンダリング(SR: surface rendering)画像、最大値投影(MIP: Maximum Intensity Projection)画像や最小値投影(MinIP: Minimum Intensity Projection)画像等の強度投影(IP: Intensity Projection)画像、Curved MPR画像のように一般的なボリューム画像データの表示用に用いられる2D画像上にGTV、CTV、過剰照射領域及び過少照射領域を重畳表示させることができる。更に、複数の画像診断装置2で収集された複数の医用画像を互いにFusion表示してもよい。
【0078】
また、図8に示すように、同一のスライスSiの複数の時相t1, t2, t3, ..., tnに対応する2D画像を、時相方向に投影することによって平均的な強度投影(Ave IP)画像を生成することができる。これにより、高い画像信号値を呈する臓器を強調表示することができるため、計画された線量分布と臓器の位置関係を容易に比較できるようになる場合がある。
【0079】
図9は、図1に示す過剰・過少照射解析部21において特定された過剰照射領域及び過少照射領域を三次元的に表示させた例を示す図である。
【0080】
図9に示すように、過剰照射領域及び過少照射領域を三次元的に表示させることもできる。図9は、治療部位の2D位置(X, Y)における放射線の強度を示すBeam's eye view上に過剰照射領域及び過少照射領域を識別表示させた例を示している。すなわち、線量期待値の3D分布と線量計画値の3D分布との差分を表示し、かつ放射線の過剰照射領域及び過少照射領域を、カラーなどを用いて強調表示させることができる。
【0081】
この他、非剛体位置合わせ処理の結果として取得されるWarp Fieldや心筋のWMT等の動態解析の結果を表す解析画像上にGTV、CTV、線量計画値と線量期待値との差、過剰照射領域及び過少照射領域を表示させることができる。この場合、ITVを表示させれば、ITVと線量分布との比較を容易に行うことが可能となる。
【0082】
このように過剰・過少照射解析部21の表示処理によって、表示装置10Bに参照画像として表示される2D画像上に、GTV等の腫瘍領域、浸潤領域等のマージン領域、OAR、PRV、線量分布、線量計画値と線量期待値との差、過剰照射領域及び過少照射領域等の所望の情報を2次元的又は3次元的に重畳表示させることができる。これにより、臓器の形態を確認しつつ、線量計画値の適否を判断することが可能となる。
【0083】
表示装置10Bに表示された画像は、放射線の照射条件の再設定のためのインターフェースとしても利用することができる。例えば、マウス等の入力装置10Aの利用によって領域を指定し、指定した領域における線量期待値を局所的に変えることができる。また、線量期待値自体も変更することが可能である。同様に、マージン領域やCTV等の腫瘍領域の調整を行うことも可能である。
【0084】
すなわち、過剰・過少照射解析部21は、代表的には線量期待値等の放射線の照射条件の編集画面としてGTV等の腫瘍領域、浸潤領域等のマージン領域、OAR、PRV、線量分布、線量計画値と線量期待値との差、過剰照射領域及び過少照射領域等の所望の情報を表示装置10Bに表示させることができる。
【0085】
表示装置10Bに表示された編集画面を通じて入力装置10Aから放射線の照射条件の変更指示情報が線量計算部20や過剰・過少照射解析部21等の対応する構成要素に入力されると、変更指示情報に従って新たな放射線の照射条件に基づいて線量分布等の値が自動的に再計算される。例えば、線量期待値はマージンを含む腫瘍領域ごとに設定されているため、線量期待値又は腫瘍領域の特定情報を編集すると、線量分布が線量計画値として再計算される。すなわち、線量計算部20及び過剰・過少照射解析部21は、編集画面に表示された線量計画値の評価情報を参照して入力された放射線の線量期待値の変更情報に基づいて評価情報を更新させて表示させる。
【0086】
ここまでは、過剰照射領域及び過少照射領域の表示例について説明したが、上述のように過剰照射時相及び過少照射時相を表示させることもできる。すなわち、過剰照射領域が存在する時相の画像を過剰照射時相画像として、過少照射領域が存在する時相の画像を過少照射時相画像として、それぞれ決定することができる。
【0087】
図10は、図1に示す過剰・過少照射解析部21における過剰照射時相画像及び過少照射時相画像の特定方法の一例を説明する図である。
【0088】
図10(A)に示すように過剰照射領域が存在するスライス画像データ及び過少照射領域が存在するスライス画像データを特定することができる。過剰照射領域が存在するスライス画像データを過剰照射スライス画像データとして定義する一方、過少照射領域が存在するスライス画像データを過少照射スライス画像データとして定義すると、図10(B)に示すように、3Dボリューム画像データ内において複数の過剰照射スライス画像データ又は複数の過少照射スライス画像データを特定することができる。そして、図10(C)に示すように、過剰照射スライス画像データが存在する時相の3Dボリューム画像データを3D過剰照射時相画像データとして特定する一方、過少照射スライス画像データが存在する時相の3Dボリューム画像データを3D過少照射時相画像データとして特定することができる。
【0089】
過剰照射領域が存在する時相及び過少照射領域が存在する時相が特定されると、異なる時相に対応する複数の診断画像データを時相方向に時系列的に並べてタイムライン表示させることができる。このとき、過剰照射及び過少照射の度合いを把握できるように診断画像データを表示させることができる。
【0090】
図11は、図1に示す過剰・過少照射解析部21により、過剰照射の度合いを把握して線量期待値を編集できるように複数の診断画像のサムネイル画像を時相方向にタイムライン表示させた例を示す図である。
【0091】
図11に示すように表示装置10Bには、編集エリアとサムネイル画像エリアとを表示させることができる。サムネイル画像エリアには、同一スライス位置における複数の時相t1. t2. t3, ...,tnの診断画像をサムネイル画像として時相方向に並べて表示させることができる。また、サムネイル画像エリアには、サムネイル画像を並べる方向となる時相tを示す横軸に加えて過剰照射の度合いを示す縦軸が設けられる。そして、各サムネイル画像は、過剰照射の度合いに応じて縦軸方向の対応する位置に表示される。
【0092】
このため、サムネイル画像の表示位置を確認することによって、放射線の過剰照射の度合いを把握することができる。更に、図11に示すように過剰照射の望ましい範囲又は許容範囲として閾値ラインを表示させれば、線量期待値の編集が必要となるサムネイル画像を容易に確認することができる。尚、表示位置に限らずカラー表示等の他の表示方法によって放射線の過剰照射の度合いを表示させるようにしてもよい。
【0093】
過剰照射の度合いは、線量計画値と線量期待値との差のみならず、領域の種類等の他の条件にも対応させて指標化することができる。例えば、浸潤領域における線量計画値と線量期待値との差を相対的に小さく見積もる一方、過剰照射が望ましくない正常領域における線量計画値と線量期待値との差を相対的に大きく見積もるようにすることができる。この場合には、線量計画値と線量期待値との差の領域間における重み付け加算値などを過剰照射の度合いを示す指標とすることができる。これは過少照射の度合いについても同様である。つまり、放射線の過剰照射領域、過少照射領域、過剰照射時相及び過少照射時相の少なくとも1つを、放射線の線量計画値と線量期待値との差のみならず、腫瘍に関して定義された領域の種類に基づいて算出することができる。
【0094】
また、マウス等の入力装置10Aの操作によってサムネイル画像を選択すると、編集エリアにサムネイル画像に対応する診断画像が表示されるようにすることができる。或いは、線量期待値と線量計画値との差が大きい時相順に、自動的に診断画像が編集エリアに表示されるようにしてもよい。図11は、過剰照射の度合いが最大となっている時相ti1に対応するサムネイル画像が自動的に選択されて、編集エリアに対応する診断画像が表示されている例を示している。
【0095】
編集エリアには、線量期待値等の放射線の照射条件の編集のために効果的に参照できる所望の情報を付加して診断画像を表示させることができる。図11に示す例では、時相ti1におけるGTV(ti1)、時相ti1におけるCTV(ti1)、ITV、線量計画値と線量期待値との差、過剰照射領域及び過少照射領域が診断画像に重畳表示されている。
【0096】
そして、編集エリアに表示された診断画像を通じて線量期待値等の放射線の照射条件を変更すると、過剰照射領域及び過少照射領域等の評価データが再計算される。このため、サムネイル画像の選択及び線量期待値等の変更を繰り返すことによって、全てのサムネイル画像に対応する過剰照射の度合いを閾値ライン以下にすることができる。
【0097】
この他、表示されている複数のサムネイル画像及び診断画像のスライス位置を示すこともできる。図11に示す例では、スライスS1からスライスSkのうちのスライスSiが選択されていることが確認できる。
【0098】
図12は、図1に示す過剰・過少照射解析部21により、過少照射の度合いを把握して線量期待値を編集できるように複数の診断画像のサムネイル画像を時相方向にタイムライン表示させた例を示す図である。
【0099】
図11に示す表示装置10Bの画面例と同様に、図12に示すように、過少照射の度合いを把握できるように複数の時相t1. t2. t3, ...,tnに対応するサムネイル画像をサムネイル画像エリアに表示させることができる。すなわち、時相t及び過少照射の度合いを示す2D位置に複数のサムネイル画像を配置し、閾値ラインを表示させることができる。
【0100】
また、編集エリアには、過少照射の度合いが最大となっている時相ti2に対応する診断画像などを選択し、時相ti2におけるGTV(ti2)、時相ti2におけるCTV(ti2)、ITV、線量計画値と線量期待値との差、過剰照射領域及び過少照射領域とともに表示させることができる。
【0101】
過少照射の度合いは、例えば、GTV(ti2)及びCTV(ti2)における線量計画値と線量期待値との差を相対的に大きく見積もる一方、その他の領域における線量計画値と線量期待値との差を相対的に小さく見積もるようにすることができる。これにより、十分な線量の放射線を照射することが望ましいGTV(ti2)及びCTV(ti2)における過少照射領域を低減させることができる。
【0102】
図8、図11及び図12に示す例では、単一のスライス位置における過剰照射領域及び過少照射領域を表示させたが、複数のスライス位置における複数の時相に対応する過剰照射領域及び過少照射領域を把握できるような画面情報を作成して表示させることもできる。
【0103】
図13は、図1に示す過剰・過少照射解析部21により、複数のスライス位置における複数の時相に対応する過剰照射領域及び過少照射領域の有無を表示させた例を示す図である。
【0104】
図13に示すように、縦軸をスライス番号Si(i = 1, 2, 3, ..., k)で特定されるスライス位置、横軸を時相t(t1, t2, t3, ..., tn)として、スライス画像を表す図形を2次元的に表示装置10Bの画面に表示させることができる。そして、過剰照射領域が存在する過剰照射スライス画像及び過少照射領域が存在する過少照射スライス画像に相当する図形を互いに異なるカラーなどで強調して識別表示させることができる。更に、スライス画像を表す図形内には、線量計画値と線量期待値との差である過剰照射量及び過少照射量を表示させることもできる。
【0105】
但し、図8、図11及び図12に示すように、実際には過剰照射領域及び過少照射領域の双方が1枚のスライス画像上に存在する場合が多い。この場合、スライス画像を過剰照射スライス画像及び過少照射スライス画像のいずれか一方に分類することができない。
【0106】
そこで、図13に示すように、スライス画像が過剰照射スライス画像であることを示す過剰照射スライスINDICATORと、スライス画像が過少照射スライス画像であることを示す過少照射スライスINDICATORを、共通のスライス画像を指し示すことができるように表示させることができる。更に、時相ti3におけるスライス画像の表示のように、過剰照射スライス画像及び過少照射スライス画像の双方に該当するスライス画像の図形には、過剰照射量及び過少照射量の双方を表示させることができる。
【0107】
このようなスライス画像の模式的な表示方法により、容易に過剰照射領域及び過少照射領域が存在するスライス位置を確認することができる。また、図13に示す矩形枠の図形を入力装置10Aの操作によって選択すると、図11及び図12に示すような編集エリアに、選択された図形に対応する詳細なスライス画像が表示されるようにしてもよい。
【0108】
上述の例の他、スライス位置を特定せずに、複数の時相に対応する診断画像をタイムライン表示させることもできる。例えば、VR画像等のスライス位置が特定されない3D画像やボリューム画像を表す図形を時相軸方向に並べて表示させることができる。
【0109】
但し、ボリューム画像やVR画像等の3D画像も過剰照射時相画像及び過少照射時相画像のいずれか一方に分類することができない場合がある。その場合には、図13に示すような過剰照射INDICATOR及び過少照射INDICATORを表示させたり、3D画像近傍に過剰照射量及び過少照射量の双方を表示させることによって、過剰照射時相画像及び過少照射時相画像を識別可能に表示させることができる。
【0110】
ところで、放射線治療においては、タイムライン表示のためのタイムスケールを様々な時間的表現にすることができる。従って、上述の例では、タイムスケールを時相tとしたが他の時間的表現をタイムスケールとすることができる。一方、位置スケールについてもスライス位置に限らず、他の位置的表現にすることができる。
【0111】
図14は、図1に示す過剰・過少照射解析部21により、複数の画像又は図形を並べて表示させる場合に用いることが可能なスケールの表現の例を示す図である。
【0112】
図14(A)に示すように放射線治療の全工程は、複数回の治療で構成される。従って、タイムスケールを治療回数J(J = 1, 2, 3, ..., L)として複数の画像や画像を表す図形をタイムライン表示させることができる。
【0113】
また、1回の放射線治療は、図14(B)に示すように複数の周期F(F = 1, 2, 3, ..., M)を単位として分けることができる。各周期Fでは、それぞれ4D画像データが収集される。つまり、周期Fは1回の撮像に相当する。従って、タイムスケールを周期Fとすることもできる。
【0114】
更に、1つの周期に対応する4D画像データは、図14(C)に示すように、複数の時相t(t = t1, t2, t3, ..., tn)に対応する複数の3D画像データからなる。よって、タイムスケールを時相tとすることができる。
【0115】
また、特定の時相tに対応する3D画像データは、図14(D)に示すように、複数の2Dスライス画像データからなる。そこで、スライス番号Si(i = 1, 2, 3, ..., k)で特定されるスライス位置を位置スケールとして複数のスライス画像を並べて表示させることができる。
【0116】
一方、図14(E)に示すように、特定の時相tに対応する3D画像データには、臓器、器官、腫瘍領域等の境界が特定された複数のオブジェクトが含まれている。そこで、オブジェクト番号P(P = P1, P2, P3, ..., Pe)で識別されるオブジェクトの代表位置を位置スケールとして、複数のオブジェクトが占める領域の2D画像又は3D画像を並べて表示させることができる。
【0117】
もちろん、全ての範囲におけるタイムスケール又は位置スケールを表示させてもよいし、局所的なタイムスケール及び位置スケールを抽出して表示させてもよい。また、スケールの意味の選択肢から所望の意味を選択できるようにしてもよい。
【0118】
一方、図1に示すDVH算出部22は、必要に応じてDVHを算出する。DVHは、放射線の線量期待値、線量計画値として算出された線量分布、PTV及びPRVに基づいて算出することができる。
【0119】
図15は、図1に示すDVH算出部22おいて算出されるDVHの一例を示すグラフである。
【0120】
図15において横軸は、計画されている放射線の線量[cGy]を示し、縦軸は、横軸で示される線量の放射線が照射される体積[%]を示す。また、図15中の二点鎖線はPTVに照射される放射線の線量の期待値PTVeを、点線はPTVに照射される放射線の線量の計画値PTVpを、一点鎖線はPRVに照射される放射線の線量の期待値PRVeを、破線はPRVに照射される放射線の線量の計画値PRVpを、それぞれ示す。
【0121】
図15に示すように、DVHは、治療対象領域に相当するPTVと正常組織に相当するPRVのそれぞれの体積に対する線量の強さをグラフ化したものである。理想的には、PTVは治療対象領域であるため、強い線量の放射線をPTVに照射することが重要である。逆に正常組織であるPRVに照射される放射線の線量は、可能な限り小さくすることが重要である。
【0122】
従って、PTVに対する線量は、線量の増加に伴って体積が非線形に減少する上に凸のカーブとなる。すなわち、図15に示すように、PTVに対する線量の期待値PTVeは右上に湾曲するカーブとなる。逆に、PRVに対する線量は、線量の増加に伴って体積が非線形に減少する下に凸のカーブとなる。すなわち、図15に示すように、PRVに対する線量の期待値PRVeは左下に湾曲するカーブとなる。
【0123】
そして、PTVに対する線量の計画値PTVpの変化率を局所的にする程、治療対象領域に十分な線量の放射線を照射することができる。同様に、PRVに対する線量の計画値PRVpの変化率を局所的にする程、過剰な線量の放射線の照射を回避することができる。
【0124】
しかしながら、PTVに対する線量を増加させて計画値PTVpを期待値PTVeに近づけようとすると、PRVにも強い線量の放射線が照射されることとなる。つまりPTVに対する線量を優先すると、PRVに対してより過剰な線量の放射線が照射される。逆にPRVに対する線量を減少させて計画値PRVpを期待値PRVeに近づけようとすると、PTVにも弱い線量の放射線が照射されることとなる。つまりPRVに対する線量を優先すると、PTVには十分な線量の放射線が照射されない。
【0125】
従って、トレードオフの関係にあるPTV及びPRVに対する線量のバランスを適切にとることが放射線治療計画において重要である。そこで、上述した過剰照射領域及び過少照射領域を重畳表示した診断画像のみならず、DVHを表示させることが好適である。その場合、DVH算出部22は、算出したDVHを、診断画像とともに線量計画値に対する評価情報として表示装置10Bの画面に表示させる。
【0126】
図16は、図1に示すDVH算出部22おいて算出されたDVHを診断画像とともに表示させた例を示す図である。
【0127】
図16に示すように任意の位置スケール又はタイムスケールを用いてスケール上の位置に対応する複数の診断画像とともに複数のDVHを並べて表示させることができる。図16は、時相tを示すタイムスケールを用いて複数の時相t(t1, t2, t3, ..., tn)に対応する複数のVR画像、スライス画像及びDVHを並列に表示させた例を示す図である。また、図16に示すように、1回の治療の合計を表すVR画像、スライス画像及びDVH並びに全治療工程の合計を表すVR画像、スライス画像及びDVHを表示させることもできる。
【0128】
このように、様々なタイムスケール及び位置スケールを用いて、過剰照射領域及び過少照射領域を重畳表示した診断画像及びDVHを表示させることができる。尚、DVH上の過剰照射領域及び過少照射領域に対応する部分を、視覚的に識別できるように強調表示してもよい。
【0129】
このような線量期待値の初期入力による線量分布の算出及び入力した線量期待値の編集を含む放射線治療計画が完了すると、治療計画に沿った放射線治療が可能となる。そして、図2に示すように治療計画に基づく放射線治療装置3による放射線治療が実施される。
【0130】
つまり以上のような、放射線治療情報生成装置1は、CTVや浸潤領域等の腫瘍に関して定義された領域を、診断画像データに対する画像処理によって解析的に特定するようにしたものである。更に、放射線治療情報生成装置1は、特定された各腫瘍領域と放射線の線量期待値に基づいて線量計画値として線量分布を自動計算し、線量期待値と線量計画値との差とともに放射線の過剰照射領域、過少照射領域、過剰照射時相、過少照射時相及びDVH等の評価情報を表示させるようにしたものである。
【0131】
このため、放射線治療情報生成装置1によれば、CTVや浸潤領域等の腫瘍に関して定義された領域を定量的に求めることができる。また治療対象となる臓器についても、診断画像に対する画像処理によって抽出することができる。この結果、臓器の抽出精度を向上させて、GTVの誤差を低減させることができる。更に、浸潤領域を解析的かつ定量的に特定できるため、浸潤領域の抽出精度を向上させてCTVに対する誤差を低減させることができる。
【0132】
一方、臓器の移動範囲についても動き解析の結果に基づいて解析的に算出することができる。これにより、臓器の可動範囲に相当するIM及びITVの精度も向上させることができる。
【0133】
加えて、定量的に特定された腫瘍の浸潤領域を含む各種の腫瘍領域に基づいて算出された放射線の過剰照射領域、過少照射領域、過剰照射時相、過少照射時相及びDVH等の評価情報を診断画像とともに視覚的に表示させることができる。この結果、線量計画を直観的に把握することが可能となる。更に、線量計画を容易に編集し、過剰又は過少な放射線の照射を低減させることができる。
(変形例)
【0134】
以上、特定の実施形態について記載したが、記載された実施形態は一例に過ぎず、発明の範囲を限定するものではない。ここに記載された新規な方法及び装置は、様々な他の様式で具現化することができる。また、ここに記載された方法及び装置の様式において、発明の要旨から逸脱しない範囲で、種々の省略、置換及び変更を行うことができる。添付された請求の範囲及びその均等物は、発明の範囲及び要旨に包含されているものとして、そのような種々の様式及び変形例を含んでいる。
【0135】
例えば、上述した実施形態では、放射線治療情報生成装置1のGTV算出部12、浸潤解析部13、CTV算出部14、経時変化解析部15、ITV算出部16、PTV算出部17、OAR抽出部18及びPRV算出部19等の構成要素が、腫瘍に関して定義された少なくとも1つの領域を診断画像データに対する解析処理によって特定する領域特定手段として機能する一方、線量計算部20及び過剰・過少照射解析部21が前記領域及び放射線の線量期待値に基づいて算出された線量計画値についての評価情報を表示させる計画評価手段として機能する例について説明したが、領域特定手段及び計画評価手段としての機能が備えられれば他の機能ブロック図で示される放射線治療情報生成装置を構成してもよい。
【符号の説明】
【0136】
1 放射線治療情報生成装置
2 画像診断装置
3 放射線治療装置
10コンピュータ
10A 入力装置
10B 表示装置
10C 演算装置
11 治療対象臓器抽出部
12 GTV算出部
13 浸潤解析部
14 CTV算出部
15 経時変化解析部
16 ITV算出部
17 PTV算出部
18 OAR抽出部
19 PRV算出部
20 線量計算部
21 過剰・過少照射解析部
21A 領域特定部
21B 時相特定部
22 DVH算出部
23 SM値データベース
【特許請求の範囲】
【請求項1】
腫瘍に関して定義された少なくとも1つの領域を診断画像データに対する解析処理によって特定する領域特定手段と、
前記領域及び放射線の線量期待値に基づいて算出された線量計画値についての評価情報を表示させる計画評価手段と、
を備える放射線治療情報生成装置。
【請求項2】
前記領域特定手段は、診断画像データに対する閾値処理を含む解析処理によって腫瘍の浸潤領域を特定するように構成される請求項1記載の放射線治療情報生成装置。
【請求項3】
前記計画評価手段は、放射線の線量計画値と線量期待値との差、過剰照射領域、過少照射領域、過剰照射時相及び過少照射時相の少なくとも1つを前記評価情報として表示させるように構成される請求項1又は2記載の放射線治療情報生成装置。
【請求項4】
前記計画評価手段は、前記放射線の過剰照射領域、過少照射領域、過剰照射時相及び過少照射時相の少なくとも1つを、前記放射線の線量計画値と線量期待値との差及び腫瘍に関して定義された領域の種類に基づいて算出するように構成される請求項3記載の放射線治療情報生成装置。
【請求項5】
前記計画評価手段は、前記評価情報を参照して入力された前記放射線の線量期待値の変更情報に基づいて前記評価情報を更新させて表示させるように構成される請求項1乃至4のいずれか1項に記載の放射線治療情報生成装置。
【請求項6】
前記領域特定手段は、腫瘍に関して定義された内的標的体積及び臓器の移動を考慮したマージン領域の少なくとも一方を投影処理又は動き解析の結果に基づいて特定するように構成される請求項1乃至5のいずれか1項に記載の放射線治療情報生成装置。
【請求項7】
前記領域特定手段は、X線CT画像データ又は拡散異方性とPET画像データとの組合せに基づいて前記腫瘍の浸潤領域を特定するように構成される請求項2記載の放射線治療情報生成装置。
【請求項8】
前記計画評価手段は、前記放射線の線量期待値、計画リスク臓器体積及び計画標的体積に基づいて算出された線量体積ヒストグラムを前記評価情報として表示させるように構成される請求項1乃至7のいずれか1項に記載の放射線治療情報生成装置。
【請求項1】
腫瘍に関して定義された少なくとも1つの領域を診断画像データに対する解析処理によって特定する領域特定手段と、
前記領域及び放射線の線量期待値に基づいて算出された線量計画値についての評価情報を表示させる計画評価手段と、
を備える放射線治療情報生成装置。
【請求項2】
前記領域特定手段は、診断画像データに対する閾値処理を含む解析処理によって腫瘍の浸潤領域を特定するように構成される請求項1記載の放射線治療情報生成装置。
【請求項3】
前記計画評価手段は、放射線の線量計画値と線量期待値との差、過剰照射領域、過少照射領域、過剰照射時相及び過少照射時相の少なくとも1つを前記評価情報として表示させるように構成される請求項1又は2記載の放射線治療情報生成装置。
【請求項4】
前記計画評価手段は、前記放射線の過剰照射領域、過少照射領域、過剰照射時相及び過少照射時相の少なくとも1つを、前記放射線の線量計画値と線量期待値との差及び腫瘍に関して定義された領域の種類に基づいて算出するように構成される請求項3記載の放射線治療情報生成装置。
【請求項5】
前記計画評価手段は、前記評価情報を参照して入力された前記放射線の線量期待値の変更情報に基づいて前記評価情報を更新させて表示させるように構成される請求項1乃至4のいずれか1項に記載の放射線治療情報生成装置。
【請求項6】
前記領域特定手段は、腫瘍に関して定義された内的標的体積及び臓器の移動を考慮したマージン領域の少なくとも一方を投影処理又は動き解析の結果に基づいて特定するように構成される請求項1乃至5のいずれか1項に記載の放射線治療情報生成装置。
【請求項7】
前記領域特定手段は、X線CT画像データ又は拡散異方性とPET画像データとの組合せに基づいて前記腫瘍の浸潤領域を特定するように構成される請求項2記載の放射線治療情報生成装置。
【請求項8】
前記計画評価手段は、前記放射線の線量期待値、計画リスク臓器体積及び計画標的体積に基づいて算出された線量体積ヒストグラムを前記評価情報として表示させるように構成される請求項1乃至7のいずれか1項に記載の放射線治療情報生成装置。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【公開番号】特開2013−59576(P2013−59576A)
【公開日】平成25年4月4日(2013.4.4)
【国際特許分類】
【出願番号】特願2011−201238(P2011−201238)
【出願日】平成23年9月15日(2011.9.15)
【出願人】(000003078)株式会社東芝 (54,554)
【出願人】(594164542)東芝メディカルシステムズ株式会社 (4,066)
【Fターム(参考)】
【公開日】平成25年4月4日(2013.4.4)
【国際特許分類】
【出願日】平成23年9月15日(2011.9.15)
【出願人】(000003078)株式会社東芝 (54,554)
【出願人】(594164542)東芝メディカルシステムズ株式会社 (4,066)
【Fターム(参考)】
[ Back to top ]

