新規膜タンパク質濃縮法
【課題】 細胞膜等に微量に含まれる膜タンパク質を、質量分析法等の解析方法で解析可能な濃度にまで濃縮、精製する方法を提供する。
【解決手段】 以下の(a)〜(c)の工程を含む、膜タンパク質を濃縮する方法:
(a)コレステロール誘導体、脂肪酸誘導体及び脂肪族アミンから選択される疎水性化合物が固定化された親水性樹脂からなる固相担体及び膜タンパク質を含む試料を接触させる工程;
(b)前記固相担体を洗浄する工程;及び
(c)前記固相担体に吸着した膜タンパク質を溶出させる工程。
【解決手段】 以下の(a)〜(c)の工程を含む、膜タンパク質を濃縮する方法:
(a)コレステロール誘導体、脂肪酸誘導体及び脂肪族アミンから選択される疎水性化合物が固定化された親水性樹脂からなる固相担体及び膜タンパク質を含む試料を接触させる工程;
(b)前記固相担体を洗浄する工程;及び
(c)前記固相担体に吸着した膜タンパク質を溶出させる工程。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、細胞膜に存在するタンパク質(膜タンパク質)の濃縮、解析方法に関する。
【背景技術】
【0002】
細胞膜上には、細胞内外の分子輸送、シグナル伝達や環境/薬物投与に対する応答等の重要な機能を担っている様々な膜タンパク質が発現している。また、市販されている医薬品の約半数は、細胞膜に存在するGPCR(Gタンパク質共役型受容体)と呼ばれる7回膜貫通型領域を持つ受容体ファミリーをターゲットとしている。このようなことから、疾患に罹患した患者の細胞において特異的に発現している膜タンパク質を見出すことは疾患の診断方法や治療薬の開発につながると期待されてきた。
しかしながら、一般に膜タンパク質は疎水性が高く、その存在量が極めて少ないために、精製や同定が困難であった。近年、質量分析(MS)の技術の発展により、超高感度の微量タンパク質の同定が可能となったが、膜タンパク質の解析は極めて困難であった。すなわち、従来は、細胞や組織からタンパク質を抽出した後、遠心分離機で分離した不溶性画分を、界面活性剤で可溶化後、電気泳動により分離し、質量分析計でタンパク質の同定を行っていたが、この方法では解析できる全タンパク質に占める膜タンパク質の割合は最大でも30%程度に過ぎず、微量の膜タンパク質が存在する割合は更に低いものであった。このことから、質量分析により同定可能な量の微量の膜タンパク質を効率的に集め、同定する方法が求められていた(非特許文献1を参照)。
一方、特定の膜タンパク質を精製する技術として、アフィニティーカラムクロマトグラフィーが知られている。アフィニティーカラムクロマトグラフィーは、特定のタンパク質と特異的に結合する抗体や低分子リガンドを担持させたアガロース系樹脂やメタクリレート系樹脂に、当該タンパク質を含む被験サンプルを担持(アプライ)させて、当該タンパク質のみを樹脂上に吸着させることによって精製する技術である。例えば、特許文献1には、リガンド及びキャッピング剤としてステアリン酸が固定化されたアフィニティーカラムクロマトグラフィー用の固相担体が報告されている。
しかしながら、アフィニティーカラムクロマトグラフィー用樹脂を用いて不特定多数の膜タンパク質を濃縮、同定する方法は知られていなかった。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】国際公開WO2006/80559号パンフレット
【非特許文献】
【0004】
【非特許文献1】Sandra Tan et al., Proteomics 2008, 8, p3924-3932
【発明の概要】
【発明が解決しようとする課題】
【0005】
本発明が解決しようとする課題は、組織、細胞等生体由来の試料から、微量膜タンパク質を質量分析やELISAまたはウェスタンブロッティングによる解析が可能な程度にまで濃縮する方法を提供することにある。
【課題を解決するための手段】
【0006】
本発明者らは、細胞膜に含まれる微量の膜タンパク質を探索する方法を開発すべく、鋭意検討を行った結果、樹脂上にコレステロール誘導体、脂肪酸誘導体及び脂肪族アミン等から選択される疎水性化合物を固定化した固相担体(擬似細胞膜樹脂)を用いることにより、生物材料由来の試料に含まれる膜タンパク質を濃縮し、微量であっても膜タンパク質を収率良く回収可能であることを見出した。
本発明は上記の知見により完成するに至ったものである。
【0007】
即ち本発明は、
〔1〕 以下の(a)〜(c)の工程を含む、膜タンパク質を濃縮する方法:
(a)コレステロール誘導体、脂肪酸誘導体及び脂肪族アミンから選択される少なくとも1種類の疎水性化合物が固定化された固相担体に膜タンパク質を含む試料を接触させる工程;
(b)前記固相担体を洗浄する工程;及び
(c)前記固相担体に吸着した膜タンパク質を溶出させる工程;
〔2〕 疎水性化合物が固定化された固相担体が、式(1):
【化1】

(式中、X1は樹脂上の官能基を表し、sは0又は1を表し、X2は単結合、又は樹脂上の官能基とポリエチレングリコール部分もしくは疎水性化合物を共有結合で連結する二価基を表し、Zは2つのポリエチレングリコール部分どうし、又は疎水性化合物と前記ポリエチレングリコール部分を共有結合で連結する二価基を表し、Yは1〜50個のエチレングリコールユニットを含むポリエチレングリコール部分を表す)
で表される〔1〕に記載の方法;
〔3〕 式(1)において、sが0を表し、X1が酸素原子又はNHを表し、X2が、式(2)〜(6):
(2) -X3-(CH2)m-X4-、
(3) -X3-(CH2)m-X5-(CH2)n-X4-、
(4) -X3-(CH2)m-X5-(CH2)n-X6-(CH2)o-X4-、
(5) -X3-(CH2)m-X5-(CH2)n-X6-(CH2)o-X7-(CH2)p-X4-、及び
(6) -CO-
(式中、X3は単結合又はCOを表し、X5、X6及びX7は独立してO、S、NR1、NHCO又はCONHを表し、X4は単結合、CO、NHCO又はO-COを表し、R1は水素原子又は炭素数1〜3のアルキル基を表し、m、n、o及びpは独立して1〜5の整数を表す)
のいずれかで表される二価基から選択され、疎水性化合物上の水酸基から水素原子が脱離した基がX2と結合していることを特徴とする、〔2〕に記載の方法;
〔4〕 式(1)において、sが0を表し、X1が酸素原子又はNHを表し、X2が、式(7)〜(11):
(7) -X3-(CH2)m-X8-、
(8) -X3-(CH2)m-X5-(CH2)n-X8-、
(9) -X3-(CH2)m-X5-(CH2)n-X6-(CH2)o-X8-、
(10) -X3-(CH2)m-X5-(CH2)n-X6-(CH2)o-X7-(CH2)p-X8-、及び
(11) 単結合
(式中、X3は単結合又はCOを表し、X5、X6及びX7は独立してO、S、NR1、NHCO又はCONHを表し、X8は単結合、酸素原子又はNHを表し、R1は水素原子又は炭素数1〜3のアルキル基を表し、m、n、o及びpは独立して1〜5の整数を表す)
のいずれかで表される二価基から選択され、疎水性化合物上のカルボキシ基から水酸基が脱離した基がX2と結合していることを特徴とする、〔2〕に記載の方法;
〔5〕 式(1)において、sが1を表し、X1が酸素原子又はNHを表し、X2が、
単結合及び式(12)〜(15):
(12) -X3-(CH2)m-X4-
(13) -X3-(CH2)m-X5-(CH2)n-X4-
(14) -X3-(CH2)m-X5-(CH2)n-X6-(CH2)o-X4-
(15) -X3-(CH2)m-X5-(CH2)n-X6-(CH2)o-X7-(CH2)p-X4-
(式中、X3は単結合又はCOを表し、X5、X6及びX7はO、S、NR1、NHCO又はCONHを表し、X4は酸素原子、NH又はCOを表し、R1は水素原子又は炭素数1〜3のアルキル基を表し、m、n、o及びpは独立して1〜5の整数を表す)
のいずれかで表される二価基から独立して選択されることを特徴とする、〔2〕に記載の方法;
〔6〕 式(1)において、sが1を表し、Zが、単結合、NH、CO、及び式(16):
(16) −Z3−(CH2)t−Z4−
(式中、Z3はNH又はCOを表し、Z4はNH、CO、NHCO、CONH、CO−O又はO−COを表し、tは1〜5の整数を表す)
で表される二価基から、独立して選択されることを特徴とする、〔2〕に記載の方法;
〔7〕 式(1)におけるYのエチレングリコールのユニット数が1〜15である、〔2〕、〔5〕及び〔6〕のいずれかに記載の方法;
〔8〕 式(1)におけるYが以下の式(17)〜(20):
【化2】

(a、c、f及びjは独立して2〜5の整数を表し、d、g、i及びlは独立して1〜5の整数を表し、b、e、h及びkは独立して1〜15の整数を表す)
から独立して選択される二価基、又は前記式(17)〜式(20)から独立して選択される同一もしくは異なる1又は複数の二価基がアミド結合を介して結合して形成される二価基である、〔2〕、〔5〕、〔6〕及び〔7〕のいずれかに記載の方法;
〔9〕 固相担体が、アガロース系樹脂又は親水性のメタクリレート系樹脂である、〔1〕〜〔8〕のいずれかに記載の方法;
〔10〕 試料が細胞又は組織由来の未精製膜画分を含有するものである、〔1〕〜〔9〕のいずれかに記載の方法;
〔11〕 細胞又は組織由来の微量膜タンパク質を、質量分析法で同定可能な濃度に濃縮することを特徴とする、〔1〕〜〔10〕のいずれかに記載の方法;
〔12〕 式(1):
【化3】

(式中、X1、X2、Y、Z及びsは〔2〕と同義である)
で表され、疎水性化合物がコレステロール誘導体であることを特徴とする固相担体;
〔13〕 式(1)において、sが0を表し、X1が酸素原子又はNHを表し、X2が、式(2)〜(6):
(2) -X3-(CH2)m-X4-、
(3) -X3-(CH2)m-X5-(CH2)n-X4-、
(4) -X3-(CH2)m-X5-(CH2)n-X6-(CH2)o-X4-、
(5) -X3-(CH2)m-X5-(CH2)n-X6-(CH2)o-X7-(CH2)p-X4-、及び
(6) -CO-
(式中、X3は単結合又はCOを表し、X5、X6及びX7は独立してO、S、NR1、NHCO又はCONHを表し、X4は単結合、CO、NHCO又はO-COを表し、R1は水素原子又は炭素数1〜3のアルキル基を表し、m、n、o及びpは独立して1〜5の整数を表す)
のいずれかで表される二価基から選択され、疎水性化合物上の水酸基から水素原子が脱離した基がX2と結合していることを特徴とする、〔12〕に記載の固相担体;
〔14〕 式(1)において、sが0を表し、X1が酸素原子又はNHを表し、X2が、単結合及び式(7)〜(11):
(7) -X3-(CH2)m-X8-、
(8) -X3-(CH2)m-X5-(CH2)n-X8-、
(9) -X3-(CH2)m-X5-(CH2)n-X6-(CH2)o-X8-、
(10) -X3-(CH2)m-X5-(CH2)n-X6-(CH2)o-X7-(CH2)p-X8-、及び
(11) 単結合
(式中、X3は単結合又はCOを表し、X5、X6及びX7は独立してO、S、NR1、NHCO又はCONHを表し、X8は単結合、酸素原子又はNHを表し、R1は水素原子又は炭素数1〜3のアルキル基を表し、m、n、o及びpは独立して1〜5の整数を表す)
のいずれかで表される二価基から選択され、疎水性化合物上のカルボキシ基から水酸基が脱離した基がX2と結合していることを特徴とする、〔12〕に記載の固相担体;
〔15〕 式(1)において、sが1を表し、X1が酸素原子又はNHを表し、X2が、
単結合及び式(12)〜(15):
(12) -X3-(CH2)m-X4-
(13) -X3-(CH2)m-X5-(CH2)n-X4-
(14) -X3-(CH2)m-X5-(CH2)n-X6-(CH2)o-X4-
(15) -X3-(CH2)m-X5-(CH2)n-X6-(CH2)o-X7-(CH2)p-X4-
(式中、X3は単結合又はCOを表し、X5、X6及びX7はO、S、NR1、NHCO又はCONHを表し、X4は酸素原子、NH又はCOを表し、R1は水素原子又は炭素数1〜3のアルキル基を表し、m、n、o及びpは独立して1〜5の整数を表す)
のいずれかで表される二価基から独立して選択されることを特徴とする、〔12〕に記載の固相担体;
〔16〕 式(1)において、sが1を表し、Zが、単結合、NH、CO、及び式(16):
(16) −Z3−(CH2)t−Z4−
(式中、Z3はNH又はCOを表し、Z4はNH、CO、NHCO、CONH、CO−O又はO−COを表し、tは1〜5の整数を表す)
で表される二価基から、独立して選択されることを特徴とする、〔12〕に記載の固相担体;
〔17〕 式(1)におけるYのエチレングリコールのユニット数が1〜15である、〔12〕、〔15〕及び〔16〕のいずれかに記載の固相担体;
〔18〕 式(1)におけるYが以下の式(17)〜(20):
【化4】

(a、c、f及びjは独立して2〜5の整数を表し、d、g、i及びlは独立して1〜5の整数を表し、b、e、h及びkは独立して1〜15の整数を表す)
から独立して選択される二価基、又は前記式(17)〜式(20)から独立して選択される同一もしくは異なる1又は複数の二価基がアミド結合を介して結合して形成される二価基である、〔12〕、〔15〕、〔16〕及び〔17〕のいずれかに記載の固相担体;及び
〔19〕 〔12〕〜〔18〕のいずれかに記載の固相担体の、プロテオーム解析用試料調製用試薬としての使用;
に関する。
【発明の効果】
【0008】
本発明により、細胞膜に微量に含まれる膜タンパク質を濃縮し、質量分析によるプロテオミクス法等で同定することが可能となった。
【図面の簡単な説明】
【0009】
【図1】実施例1で調製した固相担体を用いてマウス脳抽出物から膜タンパク質を濃縮して得られた画分をSDS-PAGEに付し、インゲルトリプシン消化後、得られたペプチドを抽出し、LC-MSで分析して得られたトータルイオンクロマトグラムを示す図である。
【図2】ライゼートをLC-MSで解析した場合と、本発明の固相担体:実施例1における、式(1−1)の固相担体(Affi-Chole)、式(1−2)の固相担体(TOYO-Chole)、式(1−3)の固相担体(Affi-C18)及び式(1−4)の固相担体(TOYO-C18)を用いてライゼートを濃縮して得られる画分をSDS-PAGEに付し、インゲルトリプシン消化後、得られたペプチドを抽出し、LC-MSで解析した場合にそれぞれ同定された膜タンパク質の総数を比較した図である。
【図3】ライゼートをLC-MSで解析した場合と、本発明の固相担体:実施例1における、式(1−1)の固相担体(Affi-Chole)、式(1−2)の固相担体(TOYO-Chole)、式(1−3)の固相担体(Affi-C18)及び式(1−4)の固相担体(TOYO-C18)を用いてライゼートを濃縮して得られる画分をSDS-PAGEに付し、インゲルトリプシン消化後、得られたペプチドを抽出し、LC-MSで解析した場合にそれぞれ同定された膜貫通型膜タンパク質の総数を比較した図である。
【図4】ライゼートをLC−MSで解析した場合と、本発明の固相担体:実施例1における式(1−3)の固相担体(Affi-C18)を用いてライゼートを濃縮して得られる画分をSDS-PAGEに付し、インゲルトリプシン消化後、得られたペプチドを抽出し、LC-MSで解析した場合にそれぞれ同定された膜貫通型膜タンパク質の数を、膜貫通回数により分類した図である。
【発明を実施するための形態】
【0010】
本明細書において、「膜タンパク質」とは、細胞または細胞小器官等の生体膜に付着しているタンパク質である。膜タンパク質としては、該生体膜に部分的に包含されているタンパク質、該生体膜を貫通しているタンパク質(膜貫通型タンパク質)、又はこれら内在性膜タンパク質と一時的に結合しているタンパク質が挙げられる。ここで生体膜としては、細胞膜、ミトコンドリア外膜、ミトコンドリア内膜、核膜、小胞体膜、ゴルジ体膜等が挙げられる。
これら膜タンパク質は、複数のタンパク質が会合して複合体を形成していても良い。膜タンパク質として、受容体、チャンネル、トランスポーター、ポンプ又は酵素等が挙げられる。膜タンパク質として、好ましくは、受容体、チャンネル又はトランスポーター等の膜貫通型タンパク質が挙げられる。
前記細胞として特に限定は無く、本発明の固相担体を用いたアフィニティーカラムクロマトグラフィーの試料に用いられる細胞として、具体的には、ラット、マウス、ヒト組織から調製された任意の細胞、細胞バンク等より入手可能な細胞株を培養したもの等が挙げられる。
前記細胞小器官としては、核、小胞体、ゴルジ体、エンドソーム、リソソーム、ミトコンドリア、ペルオキシソーム等が挙げられる。
本発明のアフィニティー樹脂により精製可能なタンパク質として、好ましくは分子量として5kDa〜500kDaの膜タンパク質が挙げられる。
【0011】
本明細書において、疎水性化合物を固定化された固相担体(擬似細胞膜樹脂)は、樹脂上の官能基に必要に応じてスペーサーを挿入して疎水性化合物が共有結合してなる固相担体であれば特に限定はないが、具体的にはアガロース系樹脂(アフィゲル(Affi-gel;登録商標)等)、メタクリレート系樹脂(トヨパール(TOYOPEARL;登録商標)等)、磁性ビーズ(ダイナビーズ(登録商標)等)等が挙げられる。
アガロース系樹脂としては、バイオラッド社製 アフィゲル(Affi-gel;登録商標。具体的にはアフィゲル10、アフィゲル102及びアフィゲル15が挙げられる)、シグマ社製のアガロース(登録商標)、アガロースビーズテクノロジー社(AGAROSE BEAD TECHNOLOGIES社)のLow Density Aminoethyl 6 BCL,Amine Reactive Agarose 等が挙げられる。
メタクリレート系樹脂としては、東ソー社製 トヨパール(TOYOPEARL;登録商標)、親水性スペーサー(国際公開第WO2004/025297号パンフレット)が組み込まれたメタクリレートモノマーを樹脂原料とし、それを重合反応に付すことにより得られるメタクリレート系の樹脂(国際公開第WO2005/37881号パンフレット)等が挙げられる。具体的にはTOYOPEARL AF-Amino-650、TOYOPEARL AF-Carboxy-650、アクアファームス(AQUAFIRMUS;商品名, Bioorg.Med.Chem.Let.,19(5), 1469-72(2009))が挙げられる。
また、上記樹脂は、中心部分に鉄等磁石に吸着可能な金属化合物を包含していてもよく、磁性ビーズとして、例えばダイナビーズ(登録商標);株式会社ベリタス等が挙げられる。
【0012】
疎水性化合物が「固定化される」とは、疎水性化合物に含まれるアミノ基、水酸基、カルボキシ基、チオール基、ホルミル基(CHO)等の官能基が、樹脂上の官能基と、必要であればスペーサーを介して共有結合していることを意味する。すなわち、疎水性化合物の官能基は、親水性樹脂もしくはスペーサーの官能基とエステル結合、エーテル結合、チオエーテル結合、ジスルフィド結合、アミン結合、アミド結合、ウレア結合又はウレタン結合等を介して共有結合している。
また、疎水性化合物は上記官能基へ変換可能な部分構造を有していても良く、当該官能基へ変換可能な部分構造としては、特に限定は無く、加水分解によりカルボキシ基へ変換可能なカルボン酸エステル、酸化反応により水酸基へ変換可能な炭素−炭素二重結合等が挙げられ、適宜当業者に周知の合成方法により官能基への変換反応を行えばよい。更に、反応性を上げるために上記官能基を適宜修飾して樹脂もしくはスペーサーとの反応に供してもよく、具体的にはカルボキシ基を酸クロリドや酸ブロミド等の酸ハライドとしたり、水酸基をメタンスルホニル化したりして、官能基の反応性を高めることができる。
疎水性化合物として、具体的には、コレステロール誘導体、脂肪酸誘導体又は脂肪族アミンが挙げられる。尚、異なる1又は複数の、好ましくは1〜3の疎水性化合物が固定化された固相担体も本発明に含まれる。
【0013】
コレステロール誘導体としては、ステロイド骨格を有するコレステロール誘導体であれば特に限定は無いが、具体的には、コレステロール(cholesterol)、6-ケトコレスタノール(6-Ketocholestanol)、スティグマスタノール(Stigmastanol)、5α-コレスタン-3β-オール (5α-cholestan-3β-ol)、5β-コレスタン-3α-オール(5β-cholestan-3α-ol)、5β-コレスタン-3β-オール(5β-cholestan-3β-ol)、α-コレスタノール(α-cholestanol)、5α-ヒドロキシコレスタノール(5α-hydroxycholestanol)、5α-コレスタン-3β,6α−ジオール(5α-cholestan-3β,6α-diol)、5β-コレスタン-3α,7α,12α-トリオール(5β-cholestan-3α,7α,12α-triol)、5α-コレスタン-24α-メチル-3β-オール(5α-cholestan-24α-methyl-3β-ol)、5α-コレスタン-3β-オール-6-オン 3-アセテート(5α-cholestan-3β-ol-6-one 3-acetate)、5α-コレスタン-3β,6β−ジオール(5α-cholestan-3β,6β-diol)、5α-コレスタン-3β,5α-ジオール-6-オン(5α-cholestan-3β,5α-diol-6-one)、5α-コレスタン-3β,5β,6β-トリオール(5α-cholestan-3β,5β,6β-triol)、5β-コレスタン-3β,6β-ジオール(5β-cholestan-3β,6β-diol)、5α-コレスタン-3β,7α-ジオール(5α-cholestan-3β,7α-diol)、5α-コレスタン-3β,7β-ジオール(5α-cholestan-3β,7β-diol)、20α-ヒドロキシコレステロール(20α-hydroxycholesterol)、β-シトステロール(β-sitosterol)、7-ケトコレステロール(7-ketocholesterol)、フコステロール(fucosterol)、デスモステロール(desmosterol)、22-ケトコレステロール(22-ketocholesterol)、25-ヒドロキシコレステロール(25-hydroxycholesterol)、3β-ヒドロキシ-δ5-コレニック アシッド(3β-hydroxy-δ5-cholenic acid)、22(R)-ヒドロキシコレステロール(22(R)-hydroxycholesterol)、エピコレステロール(epicholesterol)、5-コレニックアシッド-3β-オール メチルエーテル(5-cholenic acid-3β-ol methyl ether)、3-[3β-コレスト-5-エン-3-イルオキシ]-1-プロパナミン(3-[3β-cholest-5-en-3-yloxy]-1-propanamine)、5-コレステン-24α-エチル-3β-オール(5-cholesten-24α-ethyl-3β-ol)、24-ケトコレステロール(24-ketocholesterol)、又は7,5α-コレステン-24α-メチル-3β-オール(7,5α-cholesten-24α-methyl-3β-ol)、コール酸、デオキシコール酸、アロコール酸、5β-コラニックアシッド-3α,12α-ジオール ジアセテート、3α,12α-ジホルミルオキシデオキシコーリックアシッド、5β-コラニックアシッド-3α,12α-ジオール 7オン、5β-コラニックアシッド-3α,12α-ジオール 7オン ジアセテート、4-(3,12-ジハイドロキシ-10,13-ジメチル-ヘキサデカヒドロ-シクロペンタ[a]フェナントレン-17-イル)-ペンタノイックアシッド、7−ケト-3α,12α-ジハイドロキシ-5α−コラニックアシッド等を挙げることができ、コレステロール誘導体の水酸基はエステル結合、エーテル結合、ウレア結合又はウレタン結合を介して、樹脂もしくはスペーサーと結合している。あるいは、コレステロール誘導体がアミド結合、ウレア結合又はウレタン結合等を介して樹脂もしくはスペーサーと化学結合できるように、当該コレステロール誘導体にアミノ基、水酸基、カルボキシ基等の官能基を導入した誘導体を適宜用いることもできる。
【0014】
コレステロール誘導体は、適宜水酸基、アミノ基もしくはカルボキシ基等の官能基を修飾することによって、本発明の固相担体を製造するための中間体へと導くことができる。具体的には、コレステロール誘導体の水酸基とコハク酸等のジカルボン酸を反応させたカルボキシ基を有する化合物、コレステロール誘導体の水酸基をクロロフォルメートへ変換した化合物等が挙げられる。例えば5α-コレスタン-3α-オール ヘミスクシネート(5α-cholestan-3α-ol hemisuccinate)、5α-コレスタン-3β-オール ヘミスクシネート(5α-cholestan-3β-ol hemisuccinate)、3β,5α,6β-トリヒドロキシコレスタン 3-ヘミスクシネート(3β,5α,6β-trihydroxycholestan 3-hemisuccinate)、5β-コレスタン-3α-オール へミスクシネート(5β-cholestan-3α-ol hemisuccinate)、5β-コレスタン-3β-オール ヘミスクシネート(5β-cholestan-3β-ol hemisuccinate)、コレステリル ハイドロジェン スクシネート(cholesteryl hydrogen succinate)、5α-コレスタン-3α-オール ヘミスクシネート(5α-cholestan-3α-ol hemisuccinate)、5α-コレスタン-3β-オール ヘミスクシネート(5α-cholestan-3β-ol hemisuccinate)、3β,5α,6β-トリヒドロキシコレスタン 3-ヘミスクシネート(3β,5α,6β-trihydroxycholestane 3-hemisuccinate)、5β-コレスタン-3α-オール ヘミスクシネート(5β-cholestan-3α-ol hemisuccinate)、5β-コレスタン-3β-オール ヘミスクシネート(5β-cholestan-3β-ol hemisuccinate)、コレステリル ハイドロジェン スクシネート(cholesteryl hydrogen succinate)、25-ヒドロキシコレステロール 3-ヘミスクシネート(25-hydroxycholesterol 3-hemisuccinate)、25-ヒドロキシコレステロール 3-ヘミスクシネート(25-hydroxycholesterol 3-hemisuccinate)、5-コレステン-24α-エチル-3β-オール クロロフォルメート(5-cholesten-24α-ethyl-3β-ol chloroformate)、5α-コレスタン-3β-オール クロロフォルメート (5α-cholestan-3β-ol chloroformate)、コレステリル クロロフォルメート(cholesteryl chloroformate)、5-コレステン-24α-エチル-3β-オール クロロフォルメート(5-cholesten-24α-ethyl-3β-ol chloroformate)等を例示できる。
【0015】
脂肪酸誘導体としては、1〜6の不飽和結合(二重結合もしくは三重結合)を有していてもよい炭素数6〜30の直鎖もしくは分枝のカルボン酸、リン酸もしくはスルホン酸、又はこれらのエステルが挙げられる。具体的には、直鎖飽和脂肪酸(例えば、ラウリン酸、ミリスチン酸、パルミチン酸、ステアリン酸、アラキジン酸)、直鎖不飽和脂肪酸(オレイン酸、リノール酸、リノレン酸、DHA)、分枝飽和脂肪酸(例えば、19-メチルエイコサノイックアシッド(19-methyleicosanoic acid)、12-メチルテトラデカノイックアシッド(12-methyltetradecanoic acid)、イソステアリックアシッド(isostearic acid)等)、又は分枝不飽和脂肪酸(例えば、2-プロピル-2,4-ペンタジエノイックアシッド、2-メチルヘプタジエノイックアシッド、(6Z)-8−メチルノネノイックアシッド等)が挙げられる。好ましくは炭素数8〜24、更に好ましくは炭素数14〜20の飽和脂肪酸が挙げられる。
【0016】
脂肪族アミンとしては、1〜6の不飽和結合(二重結合もしくは三重結合)を有していてもよい炭素数6〜30の直鎖もしくは分枝の脂肪族アミンが挙げられ、好ましくは1級アミンが挙げられる。具体的にはアルキルアミン(例えば、ステアリルアミン、1-アミノデカン(1-aminodecane)、ミリスチルアミン(myristylamine)、オクタデシルアミン等)、アルケニルアミン(例えば、オレイルアミン(oleylamine)等)等が挙げられる。好ましくは炭素数8〜18のアルキルアミンが挙げられる。
【0017】
ここで疎水性化合物の樹脂表面上の官能基に対する結合率(これを固定化率という)は、特に限定はなく、0.1%〜100%程度の水酸基にコレステロール誘導体が結合していてもよい。
【0018】
本明細書において、「スペーサー」とは、疎水性化合物及び樹脂を連結している二価基を表し、化学的に安定な共有結合を形成可能な二価基であれば特に限定はなく、ポリエチレングリコール等の親水性ポリマーを含む二価基であってもよい。
疎水性化合物を樹脂に固定化するためのスペーサーとして具体的には、上記式(1)における「−X2−(Y−Z)s−」で表される二価基が挙げられる。
式(1)においてX2は単結合又は樹脂における官能基とポリエチレングリコール部分等のスペーサーもしくは疎水性化合物とを共有結合で連結する二価基を表す。
式(1)においてsが0を表す場合、すなわち疎水性化合物及び樹脂をつなぐスペーサーがポリエチレングリコール部分を含まない場合、X2は疎水性化合物が樹脂上の官能基と安定な共有結合を形成するための二価基を表す。すなわち、当該二価基として、任意のメチレン基が適宜酸素原子、硫黄原子、NR1(R1は前記と同義)、NHCO又はCONHで置換されていてもよい、化学的に安定な炭素数2〜25の直鎖アルキレンが挙げられる。具体的には、sが0を表し、疎水性化合物が官能基として水酸基もしくはアミノ基を有する場合、X2として前記式(2)〜式(6)のいずれかで表される二価基等が挙げられる。また、sが0を表し、疎水性化合物がカルボキシ基を有する場合、X2としては前記式(7)〜式(11)のいずれかで表される二価基が挙げられる。
式(1)においてsが1を表す場合、X2は単結合又は樹脂における官能基とポリエチレングリコール部分を共有結合で連結する二価基を表す。X2における二価基は、Yで表されるポリエチレングリコール部分の末端の官能基と樹脂における官能基を化学的に安定につなぐ二価基であれば特に限定はない。すなわち、当該二価基として、任意のメチレン基が適宜酸素原子、硫黄原子、NR1(R1は前記と同義)、NHCO又はCONHで置換されていてもよい、化学的に安定な炭素数2〜25の直鎖アルキレンが挙げられる。具体的には、前記式(12)〜式(15)のいずれかで表される二価基等が挙げられる。
【0019】
式(1)におけるYは、1〜50個のエチレングリコールユニットを含むポリエチレングリコール部分を表す。ここでポリエチレングリコール部分は、両端にX2もしくは樹脂における官能基、及びZと、それぞれエステル結合、エーテル結合、チオエーテル結合、ジスルフィド結合、アミン結合、アミド結合、ウレア結合又はウレタン結合を形成可能な官能基を有する。また、当該ポリエチレングリコール部分は、エチレングリコールユニットを1〜50個含んでいれば、個々のエチレングリコールユニット間の結合様式に特に限定は無く、エチレングリコールが1〜50個重合したポリエチレングリコールを形成しているか、あるいは、エチレングリコールが1〜50個、好ましくは2〜15個重合したポリエチレングリコールの両端に適宜炭素数1〜5個の直鎖アルキレンを介して官能基を有する同一もしくは異なる二価基が複数結合し、全体でエチレングリコールユニットを1〜50個含む二価基を形成していてもよい。具体的には、前記式(17)〜式(20)から選択される二価基、又は後述する式(17)〜式(20)から独立して選択される同一もしくは異なる二価基がアミド結合を介して結合して形成される二価基が挙げられる。
Yに含まれるエチレングリコールユニット数は好ましくは1〜6であり、更に好ましくは、1〜4である。
【0020】
式(1)におけるZは、ポリエチレングリコール部分と疎水性化合物とを、共有結合で連結する二価基を表す。Zにおける二価基は、ポリエチレングリコール部分の末端の官能基と疎水性化合物とを化学的に安定につなぐ二価基であれば特に限定はない。すなわち、当該二価基として、任意のメチレン基が適宜酸素原子、硫黄原子、NR1(R1は前記と同義)、NHCO又はCONHで置換されていてもよい、化学的に安定な炭素数1〜10、好ましくは炭素数1〜7の直鎖アルキレンが挙げられる。具体的には、前記式(16)で表される二価基が挙げられる。
疎水性化合物の官能基とスペーサーの官能基との縮合反応は当業者に周知の方法で行うことができる。すなわち、適宜スペーサーを介して官能基が導入された親水性樹脂と、前記官能基と共有結合を形成できる官能基が適宜スペーサーを介して導入された疎水性化合物を縮合すればよい。ここで疎水性化合物もしくはスペーサーの官能基は、適宜反応性の高い官能基に変換されていてもよい。例えばカルボキシ基をN-ヒドロキシコハク酸イミドエステル等との活性エステルとし、水酸基もしくはアミノ基との脱水縮合反応に用いることができる。また、チオール基を2-チオピリジルジスルフィドへ変換し、ジスルフィド結合を形成するために用いることができる。また、官能基としてアルデヒド基を有する化合物を、アミノ基を有する化合物と還元剤(例えばシアノ水素化ホウ素ナトリウム等のホウ素系還元剤等が挙げられる)の存在下で反応させることもできる。
式(1)のYにおけるポリエチレングリコール部分として、以下の式(17)〜(20):
【0021】
【化5】

(a、b、c、d、e、f、g、h、i、j、k及びlは前記と同義である)
で表される二価基が挙げられる。
【0022】
式(17)で表される二価基は、エチレングリコールユニットをb個有する二価基であって、両端にNHを有する。従って、当該二価基は式(1)におけるX2とアミド結合により結合することができる。従って、X2が前記式(12)〜式(15)のいずれかで表される二価基の場合、式(12)〜式(15)におけるX4はCOを表す。
また、式(17)で表される二価基が疎水性化合物と結合し、当該疎水性化合物がカルボキシ基を有する場合、アミド結合を介して結合できる。この場合、式(1)におけるZは単結合を表す。また、式(17)で表される二価基は、疎水性化合物が水酸基を有する場合、NHCOO結合を介して結合できる。この場合、式(1)におけるZはカルボニル基を表す。また、式(17)で表される二価基は、疎水性化合物がアミノ基を有する場合、NHCONH結合を介して結合できる。この場合、式(1)におけるZはカルボニル基を表す。
また、式(17)で表される二価基は、前記式(16)で表される二価基からなるスペーサーを介して疎水性化合物と結合してもよく、この場合式(1)におけるZは式(16)で表され、式(16)においてZ3はカルボニル基を表す。
【0023】
式(18)で表される二価基は、エチレングリコールユニットをe個有する二価基であって、両端にカルボニル基、及びNHをそれぞれ有する。従って、当該二価基は式(1)におけるX2とアミド結合により結合することができる。具体的には、X2が前記式(12)〜式(15)のいずれかで表される二価基の場合、式(12)〜式(15)におけるX4はNHを表す。
また、式(18)で表される二価基が疎水性化合物と結合し、当該疎水性化合物がカルボキシ基を有する場合、アミド結合を介して結合できる。この場合、式(1)におけるZは単結合を表す。また、式(18)で表される二価基は疎水性化合物が水酸基を有する場合、NHCOO結合を介して結合できる。この場合、式(1)におけるZはカルボニル基を表す。また、式(18)で表される二価基は疎水性化合物がアミノ基を有する場合、NHCONH結合を介して結合できる。この場合、式(1)におけるZはカルボニル基を表す。
また、式(18)で表される二価基は、前記式(16)で表される二価基からなるスペーサーを介して疎水性化合物と結合してもよく、この場合式(1)におけるZは式(16)で表され、式(16)においてZ3はカルボニル基を表す。
【0024】
式(19)で表される二価基は、エチレングリコールユニットをh個有する二価基であって、両端にカルボニル基を有する。従って、当該二価基は式(1)におけるX2とアミド結合により結合することができる。具体的には、X2が前記式(12)〜式(15)のいずれかで表される二価基の場合、X4はNHを表す。
また、式(19)で表される二価基が疎水性化合物と結合し、当該疎水性化合物がアミノ基もしくは水酸基を有する場合、アミド結合もしくはエステル結合を介して結合できる。この場合、式(1)におけるZは単結合を表す。
また、式(19)で表される二価基は、前記式(16)で表される二価基からなるスペーサーを介して疎水性化合物と結合してもよく、この場合式(1)におけるZは式(16)で表され、式(16)においてZ3はNH基を表す。
【0025】
式(20)で表される二価基は、エチレングリコールユニットをk個有する二価基であって、末端にNH及びカルボニル基を有する。従って、当該二価基は式(1)におけるX2とアミド結合により結合することができる。具体的には、X2が前記式(12)〜式(15)のいずれかで表される二価基の場合、式(12)〜式(15)におけるX4はカルボニル基を表す。
また、式(20)で表される二価基が疎水性化合物と結合し、当該疎水性化合物がアミノ基もしくは水酸基を有する場合に用いられ、アミド結合もしくはエステル結合を介して結合できる。この場合、式(1)におけるZは単結合を表す。
また、式(20)で表される二価基は、前記式(16)で表される二価基からなるスペーサーを介して疎水性化合物と結合してもよく、この場合式(1)におけるZ2は式(16)で表され、式(16)においてZ3はNH基を表す。
【0026】
尚、Yにおけるポリエチレングリコール部分として、エチレングリコールが1〜15個、好ましくは1〜6個重合したエチレングリコールオリゴマーの両端にカルボキシ基もしくはアミノ基を有する上記式(17)〜(20)のいずれかで表されるいずれかの二価基が、同一もしくは異なって1〜5個重合したものを用いることもできるが、この場合、当該二価基は相互にアミド結合を形成可能な任意の組み合わせから選択され得る。
また、式(1)におけるZが前記式(16)で表わされ、疎水性化合物がカルボキシ基を有する場合、式(16)におけるZ4はNHを表す。また、疎水性化合物が水酸基を有する場合、式(16)におけるZ4はカルボニル基もしくはNHCOを表す。疎水性化合物がアミノ基を有する場合、式(16)におけるZ4はカルボニル基もしくはNHCOを表す。
【0027】
官能基として水酸基を有する樹脂、具体的にはアガロース系樹脂とポリエチレングリコール部分の結合部位として、具体的には、以下の式:
【化6】

(qは2〜6の整数を表し、rは1〜6の整数を表す)
で表される部分構造等が挙げられる。
【0028】
式(1)で表される固相担体を製造するための原料となる樹脂としては、スペーサーの一部に相当する基又は活性エステル等の反応性の置換基が導入された、市販のアガロース系樹脂やメタクリレート系樹脂が挙げられる。以下に具体例を例示する。
例えばアフィゲル102は、アガロース系樹脂の水酸基に、カルボキシ基を有する化合物とアミド結合形成可能なスペーサーが導入されており、以下の式:
【化7】

で表される部分構造を有する。
また、アフィゲル10は、アフィゲル102を無水コハク酸で処理しカルボシ酸体とした後、N-ヒドロキシコハク酸イミドで活性エステルとした担体であり、アミノ基もしくは水酸基を有する化合物とアミド結合もしくはエステル結合形成可能な反応性置換基を有するスペーサーが導入されて以下の式:
【化8】

で表される。
また、アフィゲル15は以下の式:
【化9】

で表される部分構造、すなわち、スペーサー内に4級アミンを含む担体であり、アミノ基もしくは水酸基を有する化合物とアミド結合もしくはエステル結合等を形成可能である。
また、メタクリレート系樹脂であるAF-Amino-650の場合、樹脂上の官能基の末端にアミノ基を有しており、当該アミノ基の「NH」が式(1)におけるX1に相当する。また、メタクリレート系樹脂であるAF-Carboxy-650等の場合、樹脂上の官能基の末端にカルボキシメトキシ基(「O-CH2COOH」)を有しており、当該カルボキシメトキシ基におけるエーテルの酸素原子が式(1)におけるX1に相当する。
【0029】
本発明の固相担体は、適宜スペーサーを有していてもよい親水性樹脂を、適宜スペーサーを有していてもよい疎水性化合物と縮合することにより、当業者に周知の方法で製造することができる。
以下に本発明の固相単体の製造方法について、具体的に例示する。
〔製造方法1〕
式(1)において、sが1を表し、X1が酸素原子を表す場合、本発明に用いられる固相担体は、以下の工程で製造することができる:
【化10】

(式中、「−X2”−NHCO−X2’−」は式(1)における「−X2−」に相当する二価基であり、Y及びZは前記と同義である)。
すなわち、末端にアミノ基を有する樹脂、末端にカルボキシ基を有する疎水性化合物を適当な溶媒中で混合し、脱水縮合剤を用いてアミド化反応を行うことにより、本発明の固相担体を製造することができる。
ここで原料となるアミノ基を有する担体は、以下の工程で製造することができる:
【0030】
【化11】

(式中X2”は前記と同義であり、Lgは臭素原子等の脱離基を表し、Pgは保護基を表す)。
すなわち、1)アルキル化反応(Lgで表される脱離基が臭素原子やメタンスルホニルオキシ基等であり、担体とX2”がエーテル結合をしている場合)、又はジシクロヘキシルカルボジイミドもしくは1-エチル-3-(3'-ジメチルアミノプロピル)カルボジイミド(WSCD)等の縮合剤による脱水縮合反応(Lgで表される脱離基が水酸基であり、担体とX2”がエステル結合をしている場合)、2)アミノ基の保護基を除去する脱保護反応を経て製造することができる。
【0031】
また、末端にカルボキシ基を有する樹脂を用いて以下の工程で本発明の固相担体を製造することもできる:
【化12】

(式中、「−X2”−CONH−X2’−」は式(2)における「−X2−」に相当する二価基であり、Y及びZは前記と同義である)。
カルボキシ基を有する担体は、以下の工程で製造することができる:
【0032】
【化13】

(式中X2”は前記と同義であり、Lgは臭素原子等の脱離基を表し、Pgは保護基を表す)。
すなわち、1)アルキル化反応(Lgで表される脱離基が臭素原子やメタンスルホニルオキシ基等であり、担体とX2”がエーテル結合をしている場合)、又はジシクロヘキシルカルボジイミドもしくはWSCD等の縮合剤による脱水縮合反応(Lgで表される脱離基が水酸基であり、担体とX2”がエステル結合をしている場合)、2)カルボキシ基の保護基を除去する脱保護反応を経て製造することができる。
あるいは、X2”が−CO(CH2)2−を表す場合、無水コハク酸を用いてカルボキシ基を有する担体を製造することもできる。
【0033】
次いで、疎水性化合物にポリエチレングリコール部分を導入した中間体の製造方法について説明する。
疎水性化合物が水酸基を有する場合、疎水性化合物にポリエチレングリコール部分を導入した中間体は、例えば以下の工程で製造できる。
【0034】
【化14】

(式中Y2及びPgは前記と同義である)。
すなわち、疎水性化合物上の水酸基を、トリホスゲン等の試薬を用いてクロロ蟻酸化し、次いで塩基の存在下にPg-Y-Hで表される化合物のアミノ基もしくはヒドロキシ基と反応させた後保護基を脱保護する。
疎水性化合物がカルボキシ基を有する場合、疎水性化合物にポリエチレングリコール部分を導入した中間体は、例えば以下の工程で製造できる:
【0035】
【化15】

すなわち、疎水性化合物を、塩基及びジシクロヘキシルカルボジイミドもしくはWSCD等の脱水縮合剤の存在下にPg-Y-Hで表される化合物のアミノ基もしくはヒドロキシ基と、反応させた後、保護基を脱保護する。
疎水性化合物がアミノ基を有する場合、疎水性化合物にポリエチレングリコール部分を導入した中間体は、例えば以下の工程で製造できる:
【0036】
【化16】

(式中Y及びPgは前記と同義である)。
すなわち、疎水性化合物を、塩基及びジシクロヘキシルカルボジイミドもしくはWSCD等の脱水縮合剤の存在下にPg-Y-OHで表される化合物のカルボキシ基と、反応させた後、保護基を脱保護する。
尚、上記のアミド化(エステル化)反応及び脱保護反応を適宜繰り返すことにより、より高分子量のポリエチレングリコール部分を導入することができる。
【0037】
本発明の固相担体は、樹脂にポリエチレングリコール部分を導入した後、疎水性化合物を固定化することもできる。例えば、以下の式:
【0038】
【化17】

(式中、X2”、X2’、Y、Z及びPgは前記と同義である)
で示される方法で製造できる。
すなわち、上記と同様にアミド化反応及び脱保護反応を行うことにより、ポリエチレングリコール部分を有する樹脂を製造し、これに疎水性化合物を反応させることができる。
また、カルボキシ基を有する担体から出発して、同様の方法で本発明の固相担体を製造することもできる。
【0039】
〔製造方法2〕
式(1)において、sが0を表し、X1が酸素原子もしくは窒素原子を表す場合、本発明に用いられる固相担体は、以下の工程で製造することができる:
【化18】

(式中、「−CO−M1−」は式(1)における「−X2−」に相当する二価基である)。
すなわち、末端にアミノ基もしくは水酸基を有する樹脂、末端にカルボキシ基を有する疎水性化合物(適宜スペーサーを含んでいる)を、溶媒中で混合し、脱水縮合剤を用いてアミド化反応を行うことにより、本発明の固相担体を製造することができる。
ここで、カルボキシ基を有する疎水性化合物としては、公知化合物を用いることができる。又は、水酸基を有する疎水性化合物を出発原料として、例えば以下の方法等で調製することもできる:
【化19】

(式中、Lg及びPgは前記と同義であり、「−O−M1'−」は前記「−M1−」に相当し、「−O−CO−M1''−」は前記「−M1−」に相当する)。
また、水酸基を有する疎水性化合物をトリホスゲン等の試薬を用いてクロロギ酸エステルへ変換し、次いで塩基の存在下に水酸基もしくはアミノ基を有する樹脂と反応させることもできる。具体的には、以下の方法が挙げられる:
【化20】

(式中、X1は前記と同義である)。
また、以下の方法で、カルボキシ基を有するスペーサーが挿入された疎水性化合物を調製し、樹脂に固定化することもできる:
【化21】

(式中、X1、Pgは前記と同義であり、「−CO−M2−NHCO−」は、式(1)における「−X2−」に相当する)。
また、原料となる樹脂としては、修飾可能な官能基として予めアミノ基や水酸基が導入された市販の樹脂を用いることができる。また、カルボキシ基、アミノ基もしくは水酸基を有する樹脂を用いて、適宜スペーサーを介してアミノ基もしくは水酸基を有する樹脂を調製することもできる。
【0040】
また、末端にカルボキシ基を有する樹脂を用いて以下の工程で本発明の固相担体を製造することもできる:
【化22】

(式中、Q1は酸素原子もしくはNHを表し、「−M3−COQ1−M4−」は式(1)における「−X2−」に相当する二価基である)。
すなわち、末端にカルボキシを有する樹脂、末端にアミノ基もしくは水酸基を有する疎水性化合物(適宜スペーサーを含んでいてもよい)を、溶媒中で混合し、脱水縮合剤を用いてアミド化反応もしくはエステル化反応を行うことにより、本発明の固相担体を製造することができる。
ここで、アミノ基もしくは水酸基を有する疎水性化合物としては、公知化合物を用いることができる。又は、カルボキシ基を有する疎水性化合物を出発原料として、上述と同様に、適宜当業者に周知の方法でアミノ基もしくは水酸基を末端に有するスペーサーを導入することもできる。
【0041】
尚上記製造方法を説明するにあたり、便宜上疎水性化合物の部分構造である末端官能基を、以下の式:
【化23】

で表記している場合がある。
【0042】
本発明の態様として、上述の固相担体を用いて膜タンパク質を濃縮する方法が挙げられる。
すなわち、本発明は、以下の(a)〜(c)の工程を含む、膜タンパク質を濃縮する方法:
(a)疎水性化合物が固定化された親水性樹脂からなる固相担体及び膜タンパク質を含む試料を接触させる工程;
(b)前記固相担体を洗浄する工程;及び
(c)前記固相担体に吸着した膜タンパク質を溶出させる工程、
を包含する。
上記方法は、膜タンパク質を含む被験サンプルにおいて、被験サンプルに微量に含まれるタンパク質等、不特定の膜タンパク質を濃縮する場合に好適である。すなわち、上記精製方法に供される「被験サンプル」としては、膜タンパク質を含むサンプルであれば純度等に限定は無く、微量の膜タンパク質を含む細胞又は組織由来の生体由来サンプルが挙げられる。具体的には、ヒト、動物由来の生体組織、臓器由来の細胞膜画分を含むサンプル(粗精製物又は未精製物を含む)が挙げられる。
【0043】
以下に本発明の方法の各工程について詳細に説明する。
〔工程(a)〕
固相担体と被験サンプルは、通常緩衝液(バッファー)中で接触させる。ここで用いられるバッファーとしてはMESバッファー、HEPESバッファー、トリス(Tris)−塩酸バッファー、MOPSバッファー、リン酸(Phosphate)バッファー等が挙げられる。
上記バッファーのpHは5.0〜9.0に調整され、好ましくは6.0〜8.0に調整される。
固相担体と接触させる際の被験サンプルの濃度としては特に限定は無いが、タンパク質混合物(ライゼート)、すなわち組織、細胞から抽出したタンパク質混合物の場合、0.1mg/ml〜10mg/mlが好ましく、更に好ましくは0.5mg/ml〜5mg/mlである。
被験サンプル及び固相担体を接触させる時間に特に限定はないが、通常10分〜24時間接触させることにより、試料中に含まれる膜タンパク質を固相担体に吸着させることができる。また、通常4〜37℃下に接触させる。
被験サンプルを固相担体に吸着させた後、洗浄バッファーで固相担体を2〜20回洗浄する。洗浄バッファーとしては、通常試料を接触させる際に用いたものと同じものを用いる。
【0044】
〔工程(b)〕
膜タンパク質の溶出には、通常バッファーを用いることができる。適宜1〜70%の親水性有機溶媒(アセトニトリルやイソプロパノールが挙げられる)を添加してもよい。また、適宜1%〜5%のSDSや、0.1%〜10%の界面活性剤(例えばチャップス、チャプソー、オクチルグルコシド、ドデシルマルトシド、トリトン等)を添加してもよい。具体的には、0.1MTris−HCl(pH6.8),2%SDS, 20%グリセロール, 0.2%BPB、0.2M DTTからなる組成のバッファーを挙げることができる。
【0045】
あるいは、1%〜5%のSDSを含む水溶液もしくはバッファーや、0.1%〜10%の界面活性剤を含む水溶液を用いて吸着した膜タンパク質を溶出させることもできる。また、8Mウレアや6M塩酸グアニジン等を用いて溶出することも可能である。
溶出液のpHは特に限定は無く、酸性条件(pH2.0〜5.0)、アルカリ性条件(pH9-11)、中性条件(pH5-9)のいずれでもよい。好ましくは中性条件で溶出される。溶出温度は4℃〜95℃である。
溶出された膜タンパク質は、ウェスタンブロッティング等の当業者に公知の方法で検出することができる。すなわち、溶出されたタンパク質溶液をSDS-PAGEに付し、PVDF膜等にタンパク質をトランスファーし、抗体等を用いて得られたバンドを解析すればよい。または、質量スペクトル法にて解析することができる。すなわち、溶出されたタンパク質溶液をSDS−PAGEに付し、目的のバンドを切りだし、解析すればよい。具体的には、目的のバンドをゲルから切り出し、インゲルトリプシン消化法にて得られるペプチドを質量スペクトル法にて解析することができる。
あるいは、樹脂に結合している状態のタンパク質を溶出することなくトリプシン等の消化酵素で処理し、得られるペプチド断片を含む溶液を質量スペクトル解析することもできる。
【実施例】
【0046】
以下に、実施例を挙げて、本発明を更に具体的に説明するが、本発明は必ずしもこれらに限定されるものではない。
尚、本明細書で用いられる略号は以下のとおりである:
WSCD:水溶性カルボジイミド(1-エチル-3-(3'-ジメチルアミノプロピル)カルボジイミド)
HOBt:N-ヒドロキシベンゾトリアゾール
tBoc:tert−ブトキシカルボニル
HATU:2-(1H-7-アザベンゾトリアゾール-1-イル)-1,1,3,3-テトラメチルウロニウムヘキサフルオロフォスフェート メタナミニウム(2-(1H-7-Azabenzotriazol-1-yl)-1,1,3,3,-teramethyl uranium hexafluorophosphate Methanaminium)
実施例1
(1)Affi-Gel‐コレステロール-樹脂の合成
【化24】

Affi-Gel 102Gel (BIO-RAD, cat. No; 153-2401) (3ml,36μmol) (20%エタノール懸濁)に含まれるエタノールをDMFにて置換し、コハク酸水素コレステロール(東京化成、Cat.No.C0674)(70mg,144μmol)、WSCD(25μl, 144μmol)、 HOBt (19mg, 144μmol)、i-Pr2NEt (25μl, 144μmol)を加え、室温にて一昼夜攪拌した。樹脂をDMFにて洗浄後、ニンヒドリンテストを行い、担持量(100%)を確認した。引き続き、樹脂を20%無水酢酸DMF溶液にて置換し、室温にて一昼夜攪拌した。得られた樹脂をDMFにて洗浄後、引き続き20%エタノール水溶液にて洗浄し、目的の固相担体(Affi-Gel−100%コレステロール)(1-1;Affigel-Chole)を得た。
(2) TOYOPEARL‐コレステロール-樹脂の合成
【化25】

TOYOPEARL AF-Amino-650M(TOSOH, Part No. 08039)(1ml,100μmol) をDMFにて置換し、WSCD(35.1μl, 200μmol)、 HOBt (27.0mg, 200μmol)、i-Pr2NEt (34.8μl, 200μmol)を加え、室温にて30分攪拌した。さらに、反応液中にこはく酸水素コレステロール(東京化成、Cat.No.C0674)(97.4mg,200μmol)を加え、室温にて一昼夜攪拌した。樹脂をDMFにて洗浄後、ニンヒドリンテストを行い、目的の担持量(80%)を確認した。引き続き、樹脂を20%無水酢酸DMF溶液にて30分間室温にて攪拌した。得られた樹脂をDMFにて洗浄後、引き続き20%エタノール水溶液にて洗浄し、目的の固相担体(TOYOPEARL-80%コレステロール)(1-2)を得た。
(3) Affi-Gel‐C18-樹脂の合成
【化26】

Affi-Gel 102Gel (BIO-RAD, cat. No; 153-2401) (3ml,36μmol) をDMFにて置換し、ステアリン酸(ナカライテスク、Cat.No.32203-44)(41.0mg,144μmol)、HATU(60.2mg, 158μmol)、i-Pr2NEt (27.5μl, 158μmol)を加え、室温にて2時間攪拌した。樹脂をDMFにて洗浄後、ニンヒドリンテストを行い、担持量(100%)を確認した。引き続き、樹脂を20%無水酢酸DMF溶液にて置換し、室温にて30分攪拌した。得られた樹脂をDMFにて洗浄後、引き続き20%エタノール水溶液にて洗浄し、目的の固相担体(Affi-Gel−100%C18)(1-3;Affi−C18)を得た。
(4) TOYOPEARL‐C18-樹脂の合成
【化27】

TOYOPEARL AF-Amino-650M(TOSOH, Part No. 08039)(1ml,100μmol)をDMFにて置換し、ステアリン酸(ナカライテスク、Cat.No.32203-44)(41.0mg,144μmol)、HATU(60.2mg, 158μmol)、i-Pr2NEt (27.5μl, 158μmol)を加え、室温にて2時間攪拌した。樹脂をDMFにて洗浄後、ニンヒドリンテストを行い、担持量(100%)を確認した。引き続き、樹脂を20%無水酢酸DMF溶液にて置換し、室温にて30分攪拌した。得られた樹脂をDMFにて洗浄後、引き続き20%エタノール水溶液にて洗浄し、目的の固相担体(TOYOPEARL-100%C18)(1-4;Toyo-C18)を得た。
【0047】
実施例2
(1)マウス脳抽出物の作成
i) マウス全脳 (1g x 2個)を、20mlのバッファーA(subcellular buffer A) (50mM Tris pH7.5, 0.25M Sucrose, 2mM MgCl,100mM NaCl+proteaseinhibitor) 中でホモジナイズした。
ii)遠心分離した(回転数1000 x g, 10分間)。
iii) ii)で得られた上清を更に遠心分離した(回転数10,000 x g, 30分間)。
iv) iii)で得られた上清を更に遠心分離し(回転数100,000 x g, 60分間)、ペレットを得た(0.26g)。
v) 得られたペレット(0.26g)に、バッファーB(50mM Tris pH7.5, 0.25M Sucrose, 2mM MgCl,100mM NaCl+proteaseinhibitor,1%O.G)(2.6ml)を加えて懸濁し、氷冷下に60分間インキュベートした。4℃下に遠心分離(回転数100,000 x g, 20分間)し、上清をbufferBにて2倍希釈し、結合実験に使用した。
(2)結合実験
実施例1で調製したアフィニティー樹脂(1-1)(1.4μmol相当)を正確にはかり取り、(1)で得られたマウス脳ライゼート(200μl)と4℃にて一昼夜攪拌した。結合実験終了後、樹脂を12,000 x gにて遠心分離し、上澄みを捨て、残された樹脂をバッファーB(50mM Tris pH7.5, 0.25M Sucrose, 2mM MgCl,100mM NaCl+proteaseinhibitor,1%O.G)800μl にて2回洗浄した。樹脂にSDS-PAGE用ローディングバッファー40μlを加え、37℃にて30分間インキュベートした。こうして得られたサンプル液を市販のSDSゲル(BioRad ready Gel J, 5-20%SDS, cat. No; 161-J371V)で分離し、そのSDSゲルを解析した。
(3)インゲルトリプシン消化、MS解析
SDS-PAGEによって分離したタンパク質を切り出し、ゲル片をエッペンチューブへ移した。アセトニトリル(100μL)を加えソニケーションを行った。アセトニトリルを除去し、減圧下、遠心乾燥を行った。10mM DTT,100mM NH4HCO3(100μL)を加え、56℃で1時間インキュベートした後、室温にて溶媒を除去した。55mM ヨードアセトアミド,100mM NH4HCO3(100μL)加え、サンプルを遮光状態で、室温にて45分間インキュベートした。溶媒除去後、100mM NH4HCO3(100μL)を加え、室温にて10分間インキュベートし、再び溶媒除去後、アセトニトリル(100μL)加え、ソニケーションを行った。アセトニトリルを除去し減圧下、遠心乾燥を行った。0.1%RapiGest(Waters,Cat.no.186002123),25mM NH4HCO3(20μL)を加え、37℃にて10分間インキュベートした。余分な溶液を除去後、減圧下、遠心乾燥を行った。エッペンチューブを4℃で10分間インキュベート後、酵素溶液(12.5ng/μL トリプシン(Promega,cat.no.V5111),50mM NH4HCO3)(100μL)を加え、4℃にて45分間インキュベートした。溶媒除去後、50mM NH4HCO3(10μL)を加え、37℃で16時間インキュベートした。溶媒を抽出し、残ったゲルに50%アセトニトリル, 0.1%トリフルオロ酢酸水溶液30μLを加え、ペプチドを抽出した。同様の操作を再度実施した。得られたペプチド抽出液を遠心濃縮した。得られたサンプルに、0.5%トリフルオロ酢酸溶液30ulを加え37℃で30分インキュベートを行った。遠心濃縮により目的のサンプルを得た。
(4)Nano-LC-MS/MS 解析
(3)で得られたサンプルを0.1%蟻酸水溶液(20ul)に溶かし3分間ソニケーションを行った。そのうち5μlをLC-MSにて分析した。分析条件は以下のとおり。
(分析条件)
移動相濃度勾配(グラジュエント):5%メタノール/0.1%蟻酸水溶液(0 min)〜75%メタノール/0.1%蟻酸水溶液(90min) 〜95%メタノール/0.1%蟻酸水溶液(91min) 〜95%メタノール/0.1%蟻酸水溶液(99min) 〜5%メタノール/0.1%蟻酸水溶液(100min);
流速:500nL/min;
逆相HPLCカラム:0.1mm x 150mmのC18カラム(Agilent Technologies) ;Capillary温度:200℃;
Spray Voltage :200V
質量分析装置:LTQ-Orbitrap;Thermo Fisher Scientific, Bremen, Germany
得られたトータルイオンクロマトグラムの結果を図1に示す。
得られたデータをタンパク質同定ソフト(Mascot v2.2; Matrix Science, London, UK)を用い、MASCOT Score>20,Significance threshold p<0.05の条件設定で選択したペプチドをタンパク質データベースSwiss-Prot(www.uniprot.org)を用いて同定した。同様のデータベースPHENYX(Geneva Bioinformatics SA),X!TANDAM Spectrum Modeler (インターネットウェブサイト:http://www.thegpm.orgを参照)を用いて同定することも可能である。膜貫通領域はSwiss-Protを用いて確認をした。
解析結果を従来の方法(マウス脳ライゼートを直接SDS-PAGE用ローディングバッファーと混合し、SDS-PAGEにてタンパク質を分離し、ゲルを解析する方法)と比較した。
従来方法では584種の膜タンパク質(内、膜貫通型タンパク質355種)を同定した。一方、Affi-Gel-コレステロール樹脂結合サンプルでは626種の膜タンパク質(内、膜貫通型タンパク質392種)、Affi-Gel-C18樹脂結合サンプルでは696種の膜タンパク質(内、膜貫通型タンパク質460種)、TOYOPEARL-コレステロール樹脂結合サンプルでは497種の膜タンパク質(内、膜貫通型タンパク質317種)、TOYOPEARL-C18樹脂結合サンプルでは492種の膜タンパク質(内、膜貫通型タンパク質299種)を同定した。更に、4種類の樹脂を用いて得られた結果を総合すると樹脂結合サンプルでは1087種の膜タンパク質(内、膜貫通型タンパク質720種)を同定することができた。結果を図2、図3、に示す。また、一例として、式(1−3)の樹脂を用いて同定された膜貫通型タンパク質の一覧表を以下に示す。
【表1】

【表2】

【表3】

【表4】

【表5】

【表6】

【表7】

【表8】

【表9】

【表10】

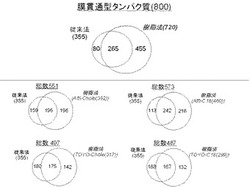
すなわち、従来法(ライゼートを解析)と樹脂法で解析できた膜タンパク質の総和は1225種であり、446種が従来方法と樹脂法との共通タンパク質であった。また、641種が樹脂法でのみで同定されており、同定膜タンパク質の種類を著しく増やし、従来同定することができなかったタンパク質を検出することが可能となった。(図2)
同様に、従来法(ライゼートを解析)と樹脂法で解析できた膜貫通型タンパク質の総和は800種であり、265種が従来方法と樹脂法との共通タンパク質であった。また、460種が樹脂法でのみで同定されており、同定膜貫通型タンパク質の種類を著しく増やすことが可能となった。(図3)
また、図4に、従来法とAffi-C18樹脂(1−3)で解析した膜貫通型タンパク質を膜貫通回数により比較した。(図4)
【0048】
実施例3
コレステロール-PEG(1)-NH2(3−4)の合成
【化28】

クロロぎ酸コレステロール(3−1)(東京化成、Cat.no.C0694;637mg,1.42mmol)をジクロロメタン60mlに溶かし、氷冷下攪拌した。Mono-N-t-Boc-amido-dPEG3TM-amine(3−2) (QUANTA BIODESIGN製; 500mg,1.56mmol) をジクロロメタン1mlに溶かし、ゆっくりと滴下した。ジイソプロピルエチルアミン(494μl, 2.84mmol) を加え、室温にて一昼夜攪拌した。減圧濃縮後、酢酸エチル200mlを加えた。酢酸エチル層を水100ml、飽和食塩水にて洗浄した。無水硫酸マグネシウムにて乾燥後、減圧濃縮し、シリカゲルカラムクロマトグラフィーにて精製した。目的のBoc体(3−3)(770mg)を収率74%にて得た。質量分析結果:MS(m/z): 733(MH+)。
得られたBoc体(3−3)(770mg, 1.05mmol) を酢酸エチル60mlに溶かし、4N-HCl/AcOEt (国産化学製;5ml) を加え、室温にて5時間攪拌した。反応完結後、溶媒を留去し、クロロホルム50mlを加え、減圧下溶媒を留去した。この操作を3回繰り返した。真空ポンプにて溶媒を完全に留去し、目的のアミノ体塩酸塩(3−4)(703mg)を定量的に得た。質量分析結果:MS(m/z): 633(MH+)。
以下に、製造した化合物の1H-NMRデータを示した。
式(3−3)の化合物:
1H-NMR (CDCl3) δ0.67(s, 3H), 0.86 (d, J=6.6Hz, 3H), 0.87 (d, J=6.6Hz, 3H), 0.91 (d, J=6.4Hz, 3H), 0.94-1.06 (m, 3H), 1.00 (s, 3H), 1.06-1.18 (m, 5H), 1.30-1.40 (m, 3H), 1.40-1.45 (m, 2H), 1.44 (s, 9H), 1.45-1.60 (m, 7H), 1.76 (m, 4H), 1.84 (m, 1H), 1.86 (m, 2H), 1.94 (m, 1H), 2.00 (m, 2H), 2.27 (br d, J=13.1, 5.1, 1.9Hz, 1H), 2.35 (ddd, J=13.1, 5.1, 1.9Hz, 1H), 3.22(br t, J=6.1Hz, 2H), 3.27 (m, 2H), 3.51-3.57(m, 4H), 3.57-3.62 (m, 4H), 3.62-3.66 (m, 4H), 4.48 (m, 1H), 5.36 (m, 1H), 4.95 (br s, 1H), 5.14 (br s, 1H);
HRMS-ESI (m/z): [M+H]+calcd. for C43H77O7N2, 733.5725; found, 733.5724.
式(3−4)の化合物:
1H-NMR (CDCl3) δ0.67 (s, 3H), 0.86 (d, J=6.6Hz, 3H), 0.87 (d, J=6.6Hz, 3H), 0.88-0.94 (m, 1H), 0.91 (d, J=6.6Hz, 3H), 0.94-1.06 (m, 3H), 1.00 (s, 3H), 1.04-1.20 (m, 5H), 1.20-1.40 (m, 4H), 1.40-1.60 (m, 6H), 1.76-1.90 (m, 4H), 1.80 (m, 2H), 1.92-2.12 (m, 3H), 2.06 (m, 2H), 2.29 (br dd, J=13.1, 2.3Hz, 1H), 2.34 (ddd, J=13.1, 5.2, 1.7Hz, 1H), 3.20-3-30 (m, 4H), 3.58 (m, 2H), 3.64 (m, 6H), 3.73 (m, 4H), 4.44 (m, 1H), 5.35 (m, 1H), 8.05-8.30 (m, 3H);
HRMS-ESI (m/z): [M+H]+calcd. for C38H69O5N2, 633.5201; found, 633.5192
【0049】
実施例4
コレステロール-PEG(0)-NH2(4−3)の合成
【化29】

クロロぎ酸コレステロール(3−1)(東京化成;637mg,1.42mmol)をジクロロメタン60mlに溶かし、氷冷下攪拌した。N-(2-アミノエチル)カルバミン酸tert-ブチル (4−1)(東京化成; 250mg,1.56mmol) をジクロロメタン1mlに溶かし、ゆっくりと滴下した。ジイソプロピルエチルアミン(494μl, 2.84mmol) を加え、室温にて一昼夜攪拌した。減圧濃縮後、酢酸エチル200mlを加えた。酢酸エチル層を水100ml、飽和食塩水にて洗浄した。無水硫酸マグネシウムにて乾燥後、減圧濃縮し、シリカゲルカラムクロマトグラフィーにて精製した。目的のBoc体(4−2)(645mg, 1.12mmol)を収率79%にて得た。質量分析結果:MS (m/z): 595(M+Na)。
得られたBoc体(4−2)(645mg, 1.12mmol) を酢酸エチル10ml−クロロホルム30mlの混合溶媒に溶かし、4M(N)-HCl/AcOEt (国産化学製; 3ml) を加え、室温にて3時間攪拌した。反応完結後、結晶を濾取し、結晶をクロロホルム2mlにて洗浄した。減圧下乾燥し、目的のアミノ体塩酸塩(4−3)(570mg)を定量的に得た。質量分析結果: MS (m/z):473(MH+)。
【0050】
実施例5
C18-PEG(1)-NH2(5−4)の合成
【化30】

ステアリン酸(404mg,1.42mmol)をジクロロメタン60mlに溶かし、氷冷下攪拌した。WSCD (343μl, 1.96mmol)、HOBt (264mg, 1.96mmol) をゆっくりと加え、室温にて60分間攪拌した。再度、4℃にて攪拌後、Mono-N-t-boc-amido-dPEG3TM-amine(5−2) (QUANTA BIODESIGN製; 500mg,1.56mmol) をジクロロメタン1mlに溶かし、ゆっくりと滴下した。ジイソプロピルエチルアミン(494μl, 2.84mmol) を加え、室温にて一昼夜攪拌した。減圧濃縮後、酢酸エチル200mlを加えた。酢酸エチル層を水100ml、飽和食塩水にて洗浄した。無水硫酸マグネシウムにて乾燥後、減圧濃縮し、シリカゲルカラムクロマトグラフィーにて精製した。目的のBoc体(5−3)(730mg)を収率87%にて得た。質量分析結果:HRMS-ESI (m/z):[M+H]+calcd.for C33H67O6N2, 587.4994; found, 587.4986。
得られたBoc体(700mg, 1.19mmol) を酢酸エチル60mlに溶かし、4N-HCl/AcOEt (国産化学製;5ml) を加え、室温にて5時間攪拌した。反応完結後、溶媒を留去し、クロロホルム50mlを加え、減圧下溶媒を留去した。この操作を3回繰り返した。真空ポンプにて溶媒を完全に留去し、目的のアミノ体塩酸塩(5−4)を得た。質量分析結果:HRMS-ESI(m/z):[M+H]+calcd.for C28H59O4N2, 487.4469; found, 487.4449 。
【0051】
実施例6
Affi−Gelの修飾(CholePEG(1))
【化31】

Affi-Gel 102Gel (BIO-RAD, cat. No; 153-2401) 12ml(144μmol)をDMFにて置換し、無水コハク酸(28.8mg, 288mol)、iPr2NEt (75μmol, 432μmol)を加え、室温にて一昼夜攪拌した。樹脂をDMFにて洗浄後、ニンヒドリンテストを行い、定量的に目的のカルボン酸体 (6−1)(144μmol)が得られたのを確認した。引き続き、樹脂を20%無水酢酸DMF溶液にて30分間室温で攪拌した。得られたカルボン酸樹脂(6−1)(36μmol)にDMF10mlを加え、WSCD(7.5μl, 43.2μmol), HOBt (5.8mg, 43.2μmol)を加え室温にて30分間攪拌した。化合物(3−4)(7.2mg, 10.8μmol), iPr2NEt (15μl, 86.4μmol)を加え、室温にて一昼夜攪拌した。樹脂をDMFにて洗浄後、引き続き20%エタノール水溶液にて洗浄し、目的の固相担体:コレステロール-PEG(1)(6−2)を得た。
【0052】
実施例7
コール酸-PEG(1)-NH2の合成
【化32】

コール酸(7-1)(ナカライ、Cat.no.08836-72;637mg,1.56mmol)をジクロロメタン60ml,DMF10mlに溶かし、攪拌した。Mono-N-t-Boc-amido-dPEG3TM-amine(7-2)) (QUANTA BIODESIGN製; 500mg,1.56mmol) をジクロロメタン1mlに溶かし、ゆっくりと滴下した。HATU(712mg,1.87mmol),ジイソプロピルエチルアミン(326μl, 1.87mmol) を加え、室温にて一昼夜攪拌した。酢酸エチル200mlを加えた。酢酸エチル層を水100ml、飽和食塩水100mlにて洗浄した。無水硫酸マグネシウムにて乾燥後、減圧濃縮し、シリカゲルカラムクロマトグラフィーにて精製した。目的のBoc体(7-3)(560mg)を収率64%にて得た。質量分析結果:HRMS-ESI(m/z):[M+H]+calcd.for C39H71O9N2, 711.5154; found, 711.5139 。
以下に、製造した化合物の1H-NMRデータを示した。
Boc体(7-3):1H-NMR (CDCl3) δ0.70(s, 3H), 0.90(s, 3H), 0.99(m, 1H), 1.00(d, J=6.3Hz, 3H), 1.14(m, 1H), 1.26-1.48(m, 1H), 1.26-1.48(m, 1H), 1.26-1.48(m, 1H), 1.26-1.48(m, 2H), 1.45(s, 9H), 1.48-1.57(m, 1H), 1.48-1.57(m, 1H), 1.57-1.65(m, 2H), 1.65-1.74(m, 1H), 1.65-1.74(m, 1H), 1.74-1.86(m, 1H), 1.74-1.86(m, 1H), 1.74-1.86(m, 1H), 1.74-1.86(m, 4H), 1.82-2.00(m, 1H), 1.82-2.00(m, 2H), 1.86-2.00(m , 1H), 2.04-2.15(m, 1H), 2.15-2.30(m, 1H), 2.15-2.30(m, 1H), 2.15-2.30(m, 1H), 3.22(m, 2H), 3.37(q, J=6.0Hz, 2H), 3.46(m, 1H), 3.54(t, J=6.0, 2H), 3.59-3.63(m, 6H), 3.63-3.68(m, 2H), 3.63-3.68(m, 2H), 3.85(m, 1H), 3.98(br t, J=2.7, 1H), 4.99(br s, 1H), 6.35(br s, 1H)。
【0053】
得られたBoc体(7-3)(273mg, 0.38mmol) を酢酸エチル60mlに溶かし、4N-HCl/AcOEt (国産化学製;5ml) を加え、室温にて5時間攪拌した。反応完結後、溶媒を留去し、クロロホルム50mlを加え、減圧下溶媒を留去した。この操作を3回繰り返した。真空ポンプにて溶媒を完全に留去し、目的のアミノ体塩酸塩(7-4)(220mg)を定量的に得た。質量分析結果:HRMS-ESI(m/z):[M+H]+calcd.for C34H63O7N2, 611.4630; found, 611.4620 。
【0054】
実施例8
デオキシコール酸-PEG(1)-NH2の合成
【化33】

デオキシコール酸(8−1)(WAKO、Cat.no.044-18812;613mg,1.56mmol)をジクロロメタン60ml,DMF10mlに溶かし、攪拌した。Mono-N-t-Boc-amido-dPEG3TM-amine(8−2) (QUANTA BIODESIGN製; 500mg,1.56mmol) をジクロロメタン1mlに溶かし、ゆっくりと滴下した。HATU(712mg,1.87mmol),ジイソプロピルエチルアミン(326μl, 1.87mmol) を加え、室温にて一昼夜攪拌した。酢酸エチル200mlを加えた。酢酸エチル層を水100ml、飽和食塩水100mlにて洗浄した。無水硫酸マグネシウムにて乾燥後、減圧濃縮し、シリカゲルカラムクロマトグラフィーにて精製した。目的のBoc体(8−3)(460mg)を収率42%にて得た。質量分析結果:HRMS-ESI(m/z):[M+H]+calcd.for C39H71O8N2, 695.5205; found, 695.5190 。
以下に、製造した化合物の1H-NMRデータを示した。
Boc体(8−3):1H-NMR (CDCl3) δ0.69(s, 3H), 0.92(s, 3H), 0.94-1.04(m, 1H), 0.99(d, J=6.1Hz,3H), 1.04-1.13(m, 1H), 1.11-1.48(m, 2H), 1.11-1.48(m, 1H), 1.11-1.48(m, 1H), 1.24-1.48(m, 1H), 1.24-1.48(m, 1H), 1.24-1.48(m, 1H), 1.24-1.48(m, 2H), 1.45(s, 9H), 1.48-1.67(m, 1H), 1.48-1.67(m, 1H), 1.48-1.67(m, 1H), 1.48-1.67(m, 2H), 1.67-1.94(m, 1H), 1.67-1.94(m, 1H), 1.67-1.94(m, 1H), 1.67-1.94(m, 2H), 1.67-1.94(m, 1H), 1.67-1.94(m, 1H), 1.67-1.94(m, 1H), 1.67-1.94(m, 4H), 2.08-2.18(m, 1H), 2.22-2.32(m, 1H), 3.22(t, J=6.5Hz, 2H), 3.39(q, J=5.8Hz, 2H), 3.54(t, J=6.1Hz, 2H), 3.56-3.68(m, 10H), 3.64-3.68(m, 1H), 3.98(t, J=2.9Hz, 1H), 4.98(br s, 1H), 6.46(br s, 1H)。
得られたBoc体(8−3)(250mg, 0.36mmol) を酢酸エチル60mlに溶かし、4N-HCl/AcOEt (国産化学製;5ml) を加え、室温にて5時間攪拌した。反応完結後、溶媒を留去し、クロロホルム50mlを加え、減圧下溶媒を留去した。この操作を3回繰り返した。真空ポンプにて溶媒を完全に留去し、目的のアミノ体塩酸塩(8−4)(210mg)を定量的に得た。質量分析結果:HRMS-ESI(m/z):[M+H]+calcd.for C34H63O6N2, 595.4681; found, 595.4679 。
【0055】
実施例9
Affi-Gelの修飾(コール酸-PEG(1)、デオキシコール酸-PEG(1))
実施例7で製造したアミノ体(7−4)及び実施例8で製造したアミノ体(8−4)を、実施例6と同様の方法で、Affi-Gel上に固定化することができる。
【産業上の利用可能性】
【0056】
本発明により、未だ同定されていない細胞膜等に微量に含まれる膜タンパク質を、質量分析法等の解析方法で解析可能な濃度にまで濃縮、精製することが可能になった。
【技術分野】
【0001】
本発明は、細胞膜に存在するタンパク質(膜タンパク質)の濃縮、解析方法に関する。
【背景技術】
【0002】
細胞膜上には、細胞内外の分子輸送、シグナル伝達や環境/薬物投与に対する応答等の重要な機能を担っている様々な膜タンパク質が発現している。また、市販されている医薬品の約半数は、細胞膜に存在するGPCR(Gタンパク質共役型受容体)と呼ばれる7回膜貫通型領域を持つ受容体ファミリーをターゲットとしている。このようなことから、疾患に罹患した患者の細胞において特異的に発現している膜タンパク質を見出すことは疾患の診断方法や治療薬の開発につながると期待されてきた。
しかしながら、一般に膜タンパク質は疎水性が高く、その存在量が極めて少ないために、精製や同定が困難であった。近年、質量分析(MS)の技術の発展により、超高感度の微量タンパク質の同定が可能となったが、膜タンパク質の解析は極めて困難であった。すなわち、従来は、細胞や組織からタンパク質を抽出した後、遠心分離機で分離した不溶性画分を、界面活性剤で可溶化後、電気泳動により分離し、質量分析計でタンパク質の同定を行っていたが、この方法では解析できる全タンパク質に占める膜タンパク質の割合は最大でも30%程度に過ぎず、微量の膜タンパク質が存在する割合は更に低いものであった。このことから、質量分析により同定可能な量の微量の膜タンパク質を効率的に集め、同定する方法が求められていた(非特許文献1を参照)。
一方、特定の膜タンパク質を精製する技術として、アフィニティーカラムクロマトグラフィーが知られている。アフィニティーカラムクロマトグラフィーは、特定のタンパク質と特異的に結合する抗体や低分子リガンドを担持させたアガロース系樹脂やメタクリレート系樹脂に、当該タンパク質を含む被験サンプルを担持(アプライ)させて、当該タンパク質のみを樹脂上に吸着させることによって精製する技術である。例えば、特許文献1には、リガンド及びキャッピング剤としてステアリン酸が固定化されたアフィニティーカラムクロマトグラフィー用の固相担体が報告されている。
しかしながら、アフィニティーカラムクロマトグラフィー用樹脂を用いて不特定多数の膜タンパク質を濃縮、同定する方法は知られていなかった。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】国際公開WO2006/80559号パンフレット
【非特許文献】
【0004】
【非特許文献1】Sandra Tan et al., Proteomics 2008, 8, p3924-3932
【発明の概要】
【発明が解決しようとする課題】
【0005】
本発明が解決しようとする課題は、組織、細胞等生体由来の試料から、微量膜タンパク質を質量分析やELISAまたはウェスタンブロッティングによる解析が可能な程度にまで濃縮する方法を提供することにある。
【課題を解決するための手段】
【0006】
本発明者らは、細胞膜に含まれる微量の膜タンパク質を探索する方法を開発すべく、鋭意検討を行った結果、樹脂上にコレステロール誘導体、脂肪酸誘導体及び脂肪族アミン等から選択される疎水性化合物を固定化した固相担体(擬似細胞膜樹脂)を用いることにより、生物材料由来の試料に含まれる膜タンパク質を濃縮し、微量であっても膜タンパク質を収率良く回収可能であることを見出した。
本発明は上記の知見により完成するに至ったものである。
【0007】
即ち本発明は、
〔1〕 以下の(a)〜(c)の工程を含む、膜タンパク質を濃縮する方法:
(a)コレステロール誘導体、脂肪酸誘導体及び脂肪族アミンから選択される少なくとも1種類の疎水性化合物が固定化された固相担体に膜タンパク質を含む試料を接触させる工程;
(b)前記固相担体を洗浄する工程;及び
(c)前記固相担体に吸着した膜タンパク質を溶出させる工程;
〔2〕 疎水性化合物が固定化された固相担体が、式(1):
【化1】

(式中、X1は樹脂上の官能基を表し、sは0又は1を表し、X2は単結合、又は樹脂上の官能基とポリエチレングリコール部分もしくは疎水性化合物を共有結合で連結する二価基を表し、Zは2つのポリエチレングリコール部分どうし、又は疎水性化合物と前記ポリエチレングリコール部分を共有結合で連結する二価基を表し、Yは1〜50個のエチレングリコールユニットを含むポリエチレングリコール部分を表す)
で表される〔1〕に記載の方法;
〔3〕 式(1)において、sが0を表し、X1が酸素原子又はNHを表し、X2が、式(2)〜(6):
(2) -X3-(CH2)m-X4-、
(3) -X3-(CH2)m-X5-(CH2)n-X4-、
(4) -X3-(CH2)m-X5-(CH2)n-X6-(CH2)o-X4-、
(5) -X3-(CH2)m-X5-(CH2)n-X6-(CH2)o-X7-(CH2)p-X4-、及び
(6) -CO-
(式中、X3は単結合又はCOを表し、X5、X6及びX7は独立してO、S、NR1、NHCO又はCONHを表し、X4は単結合、CO、NHCO又はO-COを表し、R1は水素原子又は炭素数1〜3のアルキル基を表し、m、n、o及びpは独立して1〜5の整数を表す)
のいずれかで表される二価基から選択され、疎水性化合物上の水酸基から水素原子が脱離した基がX2と結合していることを特徴とする、〔2〕に記載の方法;
〔4〕 式(1)において、sが0を表し、X1が酸素原子又はNHを表し、X2が、式(7)〜(11):
(7) -X3-(CH2)m-X8-、
(8) -X3-(CH2)m-X5-(CH2)n-X8-、
(9) -X3-(CH2)m-X5-(CH2)n-X6-(CH2)o-X8-、
(10) -X3-(CH2)m-X5-(CH2)n-X6-(CH2)o-X7-(CH2)p-X8-、及び
(11) 単結合
(式中、X3は単結合又はCOを表し、X5、X6及びX7は独立してO、S、NR1、NHCO又はCONHを表し、X8は単結合、酸素原子又はNHを表し、R1は水素原子又は炭素数1〜3のアルキル基を表し、m、n、o及びpは独立して1〜5の整数を表す)
のいずれかで表される二価基から選択され、疎水性化合物上のカルボキシ基から水酸基が脱離した基がX2と結合していることを特徴とする、〔2〕に記載の方法;
〔5〕 式(1)において、sが1を表し、X1が酸素原子又はNHを表し、X2が、
単結合及び式(12)〜(15):
(12) -X3-(CH2)m-X4-
(13) -X3-(CH2)m-X5-(CH2)n-X4-
(14) -X3-(CH2)m-X5-(CH2)n-X6-(CH2)o-X4-
(15) -X3-(CH2)m-X5-(CH2)n-X6-(CH2)o-X7-(CH2)p-X4-
(式中、X3は単結合又はCOを表し、X5、X6及びX7はO、S、NR1、NHCO又はCONHを表し、X4は酸素原子、NH又はCOを表し、R1は水素原子又は炭素数1〜3のアルキル基を表し、m、n、o及びpは独立して1〜5の整数を表す)
のいずれかで表される二価基から独立して選択されることを特徴とする、〔2〕に記載の方法;
〔6〕 式(1)において、sが1を表し、Zが、単結合、NH、CO、及び式(16):
(16) −Z3−(CH2)t−Z4−
(式中、Z3はNH又はCOを表し、Z4はNH、CO、NHCO、CONH、CO−O又はO−COを表し、tは1〜5の整数を表す)
で表される二価基から、独立して選択されることを特徴とする、〔2〕に記載の方法;
〔7〕 式(1)におけるYのエチレングリコールのユニット数が1〜15である、〔2〕、〔5〕及び〔6〕のいずれかに記載の方法;
〔8〕 式(1)におけるYが以下の式(17)〜(20):
【化2】

(a、c、f及びjは独立して2〜5の整数を表し、d、g、i及びlは独立して1〜5の整数を表し、b、e、h及びkは独立して1〜15の整数を表す)
から独立して選択される二価基、又は前記式(17)〜式(20)から独立して選択される同一もしくは異なる1又は複数の二価基がアミド結合を介して結合して形成される二価基である、〔2〕、〔5〕、〔6〕及び〔7〕のいずれかに記載の方法;
〔9〕 固相担体が、アガロース系樹脂又は親水性のメタクリレート系樹脂である、〔1〕〜〔8〕のいずれかに記載の方法;
〔10〕 試料が細胞又は組織由来の未精製膜画分を含有するものである、〔1〕〜〔9〕のいずれかに記載の方法;
〔11〕 細胞又は組織由来の微量膜タンパク質を、質量分析法で同定可能な濃度に濃縮することを特徴とする、〔1〕〜〔10〕のいずれかに記載の方法;
〔12〕 式(1):
【化3】

(式中、X1、X2、Y、Z及びsは〔2〕と同義である)
で表され、疎水性化合物がコレステロール誘導体であることを特徴とする固相担体;
〔13〕 式(1)において、sが0を表し、X1が酸素原子又はNHを表し、X2が、式(2)〜(6):
(2) -X3-(CH2)m-X4-、
(3) -X3-(CH2)m-X5-(CH2)n-X4-、
(4) -X3-(CH2)m-X5-(CH2)n-X6-(CH2)o-X4-、
(5) -X3-(CH2)m-X5-(CH2)n-X6-(CH2)o-X7-(CH2)p-X4-、及び
(6) -CO-
(式中、X3は単結合又はCOを表し、X5、X6及びX7は独立してO、S、NR1、NHCO又はCONHを表し、X4は単結合、CO、NHCO又はO-COを表し、R1は水素原子又は炭素数1〜3のアルキル基を表し、m、n、o及びpは独立して1〜5の整数を表す)
のいずれかで表される二価基から選択され、疎水性化合物上の水酸基から水素原子が脱離した基がX2と結合していることを特徴とする、〔12〕に記載の固相担体;
〔14〕 式(1)において、sが0を表し、X1が酸素原子又はNHを表し、X2が、単結合及び式(7)〜(11):
(7) -X3-(CH2)m-X8-、
(8) -X3-(CH2)m-X5-(CH2)n-X8-、
(9) -X3-(CH2)m-X5-(CH2)n-X6-(CH2)o-X8-、
(10) -X3-(CH2)m-X5-(CH2)n-X6-(CH2)o-X7-(CH2)p-X8-、及び
(11) 単結合
(式中、X3は単結合又はCOを表し、X5、X6及びX7は独立してO、S、NR1、NHCO又はCONHを表し、X8は単結合、酸素原子又はNHを表し、R1は水素原子又は炭素数1〜3のアルキル基を表し、m、n、o及びpは独立して1〜5の整数を表す)
のいずれかで表される二価基から選択され、疎水性化合物上のカルボキシ基から水酸基が脱離した基がX2と結合していることを特徴とする、〔12〕に記載の固相担体;
〔15〕 式(1)において、sが1を表し、X1が酸素原子又はNHを表し、X2が、
単結合及び式(12)〜(15):
(12) -X3-(CH2)m-X4-
(13) -X3-(CH2)m-X5-(CH2)n-X4-
(14) -X3-(CH2)m-X5-(CH2)n-X6-(CH2)o-X4-
(15) -X3-(CH2)m-X5-(CH2)n-X6-(CH2)o-X7-(CH2)p-X4-
(式中、X3は単結合又はCOを表し、X5、X6及びX7はO、S、NR1、NHCO又はCONHを表し、X4は酸素原子、NH又はCOを表し、R1は水素原子又は炭素数1〜3のアルキル基を表し、m、n、o及びpは独立して1〜5の整数を表す)
のいずれかで表される二価基から独立して選択されることを特徴とする、〔12〕に記載の固相担体;
〔16〕 式(1)において、sが1を表し、Zが、単結合、NH、CO、及び式(16):
(16) −Z3−(CH2)t−Z4−
(式中、Z3はNH又はCOを表し、Z4はNH、CO、NHCO、CONH、CO−O又はO−COを表し、tは1〜5の整数を表す)
で表される二価基から、独立して選択されることを特徴とする、〔12〕に記載の固相担体;
〔17〕 式(1)におけるYのエチレングリコールのユニット数が1〜15である、〔12〕、〔15〕及び〔16〕のいずれかに記載の固相担体;
〔18〕 式(1)におけるYが以下の式(17)〜(20):
【化4】

(a、c、f及びjは独立して2〜5の整数を表し、d、g、i及びlは独立して1〜5の整数を表し、b、e、h及びkは独立して1〜15の整数を表す)
から独立して選択される二価基、又は前記式(17)〜式(20)から独立して選択される同一もしくは異なる1又は複数の二価基がアミド結合を介して結合して形成される二価基である、〔12〕、〔15〕、〔16〕及び〔17〕のいずれかに記載の固相担体;及び
〔19〕 〔12〕〜〔18〕のいずれかに記載の固相担体の、プロテオーム解析用試料調製用試薬としての使用;
に関する。
【発明の効果】
【0008】
本発明により、細胞膜に微量に含まれる膜タンパク質を濃縮し、質量分析によるプロテオミクス法等で同定することが可能となった。
【図面の簡単な説明】
【0009】
【図1】実施例1で調製した固相担体を用いてマウス脳抽出物から膜タンパク質を濃縮して得られた画分をSDS-PAGEに付し、インゲルトリプシン消化後、得られたペプチドを抽出し、LC-MSで分析して得られたトータルイオンクロマトグラムを示す図である。
【図2】ライゼートをLC-MSで解析した場合と、本発明の固相担体:実施例1における、式(1−1)の固相担体(Affi-Chole)、式(1−2)の固相担体(TOYO-Chole)、式(1−3)の固相担体(Affi-C18)及び式(1−4)の固相担体(TOYO-C18)を用いてライゼートを濃縮して得られる画分をSDS-PAGEに付し、インゲルトリプシン消化後、得られたペプチドを抽出し、LC-MSで解析した場合にそれぞれ同定された膜タンパク質の総数を比較した図である。
【図3】ライゼートをLC-MSで解析した場合と、本発明の固相担体:実施例1における、式(1−1)の固相担体(Affi-Chole)、式(1−2)の固相担体(TOYO-Chole)、式(1−3)の固相担体(Affi-C18)及び式(1−4)の固相担体(TOYO-C18)を用いてライゼートを濃縮して得られる画分をSDS-PAGEに付し、インゲルトリプシン消化後、得られたペプチドを抽出し、LC-MSで解析した場合にそれぞれ同定された膜貫通型膜タンパク質の総数を比較した図である。
【図4】ライゼートをLC−MSで解析した場合と、本発明の固相担体:実施例1における式(1−3)の固相担体(Affi-C18)を用いてライゼートを濃縮して得られる画分をSDS-PAGEに付し、インゲルトリプシン消化後、得られたペプチドを抽出し、LC-MSで解析した場合にそれぞれ同定された膜貫通型膜タンパク質の数を、膜貫通回数により分類した図である。
【発明を実施するための形態】
【0010】
本明細書において、「膜タンパク質」とは、細胞または細胞小器官等の生体膜に付着しているタンパク質である。膜タンパク質としては、該生体膜に部分的に包含されているタンパク質、該生体膜を貫通しているタンパク質(膜貫通型タンパク質)、又はこれら内在性膜タンパク質と一時的に結合しているタンパク質が挙げられる。ここで生体膜としては、細胞膜、ミトコンドリア外膜、ミトコンドリア内膜、核膜、小胞体膜、ゴルジ体膜等が挙げられる。
これら膜タンパク質は、複数のタンパク質が会合して複合体を形成していても良い。膜タンパク質として、受容体、チャンネル、トランスポーター、ポンプ又は酵素等が挙げられる。膜タンパク質として、好ましくは、受容体、チャンネル又はトランスポーター等の膜貫通型タンパク質が挙げられる。
前記細胞として特に限定は無く、本発明の固相担体を用いたアフィニティーカラムクロマトグラフィーの試料に用いられる細胞として、具体的には、ラット、マウス、ヒト組織から調製された任意の細胞、細胞バンク等より入手可能な細胞株を培養したもの等が挙げられる。
前記細胞小器官としては、核、小胞体、ゴルジ体、エンドソーム、リソソーム、ミトコンドリア、ペルオキシソーム等が挙げられる。
本発明のアフィニティー樹脂により精製可能なタンパク質として、好ましくは分子量として5kDa〜500kDaの膜タンパク質が挙げられる。
【0011】
本明細書において、疎水性化合物を固定化された固相担体(擬似細胞膜樹脂)は、樹脂上の官能基に必要に応じてスペーサーを挿入して疎水性化合物が共有結合してなる固相担体であれば特に限定はないが、具体的にはアガロース系樹脂(アフィゲル(Affi-gel;登録商標)等)、メタクリレート系樹脂(トヨパール(TOYOPEARL;登録商標)等)、磁性ビーズ(ダイナビーズ(登録商標)等)等が挙げられる。
アガロース系樹脂としては、バイオラッド社製 アフィゲル(Affi-gel;登録商標。具体的にはアフィゲル10、アフィゲル102及びアフィゲル15が挙げられる)、シグマ社製のアガロース(登録商標)、アガロースビーズテクノロジー社(AGAROSE BEAD TECHNOLOGIES社)のLow Density Aminoethyl 6 BCL,Amine Reactive Agarose 等が挙げられる。
メタクリレート系樹脂としては、東ソー社製 トヨパール(TOYOPEARL;登録商標)、親水性スペーサー(国際公開第WO2004/025297号パンフレット)が組み込まれたメタクリレートモノマーを樹脂原料とし、それを重合反応に付すことにより得られるメタクリレート系の樹脂(国際公開第WO2005/37881号パンフレット)等が挙げられる。具体的にはTOYOPEARL AF-Amino-650、TOYOPEARL AF-Carboxy-650、アクアファームス(AQUAFIRMUS;商品名, Bioorg.Med.Chem.Let.,19(5), 1469-72(2009))が挙げられる。
また、上記樹脂は、中心部分に鉄等磁石に吸着可能な金属化合物を包含していてもよく、磁性ビーズとして、例えばダイナビーズ(登録商標);株式会社ベリタス等が挙げられる。
【0012】
疎水性化合物が「固定化される」とは、疎水性化合物に含まれるアミノ基、水酸基、カルボキシ基、チオール基、ホルミル基(CHO)等の官能基が、樹脂上の官能基と、必要であればスペーサーを介して共有結合していることを意味する。すなわち、疎水性化合物の官能基は、親水性樹脂もしくはスペーサーの官能基とエステル結合、エーテル結合、チオエーテル結合、ジスルフィド結合、アミン結合、アミド結合、ウレア結合又はウレタン結合等を介して共有結合している。
また、疎水性化合物は上記官能基へ変換可能な部分構造を有していても良く、当該官能基へ変換可能な部分構造としては、特に限定は無く、加水分解によりカルボキシ基へ変換可能なカルボン酸エステル、酸化反応により水酸基へ変換可能な炭素−炭素二重結合等が挙げられ、適宜当業者に周知の合成方法により官能基への変換反応を行えばよい。更に、反応性を上げるために上記官能基を適宜修飾して樹脂もしくはスペーサーとの反応に供してもよく、具体的にはカルボキシ基を酸クロリドや酸ブロミド等の酸ハライドとしたり、水酸基をメタンスルホニル化したりして、官能基の反応性を高めることができる。
疎水性化合物として、具体的には、コレステロール誘導体、脂肪酸誘導体又は脂肪族アミンが挙げられる。尚、異なる1又は複数の、好ましくは1〜3の疎水性化合物が固定化された固相担体も本発明に含まれる。
【0013】
コレステロール誘導体としては、ステロイド骨格を有するコレステロール誘導体であれば特に限定は無いが、具体的には、コレステロール(cholesterol)、6-ケトコレスタノール(6-Ketocholestanol)、スティグマスタノール(Stigmastanol)、5α-コレスタン-3β-オール (5α-cholestan-3β-ol)、5β-コレスタン-3α-オール(5β-cholestan-3α-ol)、5β-コレスタン-3β-オール(5β-cholestan-3β-ol)、α-コレスタノール(α-cholestanol)、5α-ヒドロキシコレスタノール(5α-hydroxycholestanol)、5α-コレスタン-3β,6α−ジオール(5α-cholestan-3β,6α-diol)、5β-コレスタン-3α,7α,12α-トリオール(5β-cholestan-3α,7α,12α-triol)、5α-コレスタン-24α-メチル-3β-オール(5α-cholestan-24α-methyl-3β-ol)、5α-コレスタン-3β-オール-6-オン 3-アセテート(5α-cholestan-3β-ol-6-one 3-acetate)、5α-コレスタン-3β,6β−ジオール(5α-cholestan-3β,6β-diol)、5α-コレスタン-3β,5α-ジオール-6-オン(5α-cholestan-3β,5α-diol-6-one)、5α-コレスタン-3β,5β,6β-トリオール(5α-cholestan-3β,5β,6β-triol)、5β-コレスタン-3β,6β-ジオール(5β-cholestan-3β,6β-diol)、5α-コレスタン-3β,7α-ジオール(5α-cholestan-3β,7α-diol)、5α-コレスタン-3β,7β-ジオール(5α-cholestan-3β,7β-diol)、20α-ヒドロキシコレステロール(20α-hydroxycholesterol)、β-シトステロール(β-sitosterol)、7-ケトコレステロール(7-ketocholesterol)、フコステロール(fucosterol)、デスモステロール(desmosterol)、22-ケトコレステロール(22-ketocholesterol)、25-ヒドロキシコレステロール(25-hydroxycholesterol)、3β-ヒドロキシ-δ5-コレニック アシッド(3β-hydroxy-δ5-cholenic acid)、22(R)-ヒドロキシコレステロール(22(R)-hydroxycholesterol)、エピコレステロール(epicholesterol)、5-コレニックアシッド-3β-オール メチルエーテル(5-cholenic acid-3β-ol methyl ether)、3-[3β-コレスト-5-エン-3-イルオキシ]-1-プロパナミン(3-[3β-cholest-5-en-3-yloxy]-1-propanamine)、5-コレステン-24α-エチル-3β-オール(5-cholesten-24α-ethyl-3β-ol)、24-ケトコレステロール(24-ketocholesterol)、又は7,5α-コレステン-24α-メチル-3β-オール(7,5α-cholesten-24α-methyl-3β-ol)、コール酸、デオキシコール酸、アロコール酸、5β-コラニックアシッド-3α,12α-ジオール ジアセテート、3α,12α-ジホルミルオキシデオキシコーリックアシッド、5β-コラニックアシッド-3α,12α-ジオール 7オン、5β-コラニックアシッド-3α,12α-ジオール 7オン ジアセテート、4-(3,12-ジハイドロキシ-10,13-ジメチル-ヘキサデカヒドロ-シクロペンタ[a]フェナントレン-17-イル)-ペンタノイックアシッド、7−ケト-3α,12α-ジハイドロキシ-5α−コラニックアシッド等を挙げることができ、コレステロール誘導体の水酸基はエステル結合、エーテル結合、ウレア結合又はウレタン結合を介して、樹脂もしくはスペーサーと結合している。あるいは、コレステロール誘導体がアミド結合、ウレア結合又はウレタン結合等を介して樹脂もしくはスペーサーと化学結合できるように、当該コレステロール誘導体にアミノ基、水酸基、カルボキシ基等の官能基を導入した誘導体を適宜用いることもできる。
【0014】
コレステロール誘導体は、適宜水酸基、アミノ基もしくはカルボキシ基等の官能基を修飾することによって、本発明の固相担体を製造するための中間体へと導くことができる。具体的には、コレステロール誘導体の水酸基とコハク酸等のジカルボン酸を反応させたカルボキシ基を有する化合物、コレステロール誘導体の水酸基をクロロフォルメートへ変換した化合物等が挙げられる。例えば5α-コレスタン-3α-オール ヘミスクシネート(5α-cholestan-3α-ol hemisuccinate)、5α-コレスタン-3β-オール ヘミスクシネート(5α-cholestan-3β-ol hemisuccinate)、3β,5α,6β-トリヒドロキシコレスタン 3-ヘミスクシネート(3β,5α,6β-trihydroxycholestan 3-hemisuccinate)、5β-コレスタン-3α-オール へミスクシネート(5β-cholestan-3α-ol hemisuccinate)、5β-コレスタン-3β-オール ヘミスクシネート(5β-cholestan-3β-ol hemisuccinate)、コレステリル ハイドロジェン スクシネート(cholesteryl hydrogen succinate)、5α-コレスタン-3α-オール ヘミスクシネート(5α-cholestan-3α-ol hemisuccinate)、5α-コレスタン-3β-オール ヘミスクシネート(5α-cholestan-3β-ol hemisuccinate)、3β,5α,6β-トリヒドロキシコレスタン 3-ヘミスクシネート(3β,5α,6β-trihydroxycholestane 3-hemisuccinate)、5β-コレスタン-3α-オール ヘミスクシネート(5β-cholestan-3α-ol hemisuccinate)、5β-コレスタン-3β-オール ヘミスクシネート(5β-cholestan-3β-ol hemisuccinate)、コレステリル ハイドロジェン スクシネート(cholesteryl hydrogen succinate)、25-ヒドロキシコレステロール 3-ヘミスクシネート(25-hydroxycholesterol 3-hemisuccinate)、25-ヒドロキシコレステロール 3-ヘミスクシネート(25-hydroxycholesterol 3-hemisuccinate)、5-コレステン-24α-エチル-3β-オール クロロフォルメート(5-cholesten-24α-ethyl-3β-ol chloroformate)、5α-コレスタン-3β-オール クロロフォルメート (5α-cholestan-3β-ol chloroformate)、コレステリル クロロフォルメート(cholesteryl chloroformate)、5-コレステン-24α-エチル-3β-オール クロロフォルメート(5-cholesten-24α-ethyl-3β-ol chloroformate)等を例示できる。
【0015】
脂肪酸誘導体としては、1〜6の不飽和結合(二重結合もしくは三重結合)を有していてもよい炭素数6〜30の直鎖もしくは分枝のカルボン酸、リン酸もしくはスルホン酸、又はこれらのエステルが挙げられる。具体的には、直鎖飽和脂肪酸(例えば、ラウリン酸、ミリスチン酸、パルミチン酸、ステアリン酸、アラキジン酸)、直鎖不飽和脂肪酸(オレイン酸、リノール酸、リノレン酸、DHA)、分枝飽和脂肪酸(例えば、19-メチルエイコサノイックアシッド(19-methyleicosanoic acid)、12-メチルテトラデカノイックアシッド(12-methyltetradecanoic acid)、イソステアリックアシッド(isostearic acid)等)、又は分枝不飽和脂肪酸(例えば、2-プロピル-2,4-ペンタジエノイックアシッド、2-メチルヘプタジエノイックアシッド、(6Z)-8−メチルノネノイックアシッド等)が挙げられる。好ましくは炭素数8〜24、更に好ましくは炭素数14〜20の飽和脂肪酸が挙げられる。
【0016】
脂肪族アミンとしては、1〜6の不飽和結合(二重結合もしくは三重結合)を有していてもよい炭素数6〜30の直鎖もしくは分枝の脂肪族アミンが挙げられ、好ましくは1級アミンが挙げられる。具体的にはアルキルアミン(例えば、ステアリルアミン、1-アミノデカン(1-aminodecane)、ミリスチルアミン(myristylamine)、オクタデシルアミン等)、アルケニルアミン(例えば、オレイルアミン(oleylamine)等)等が挙げられる。好ましくは炭素数8〜18のアルキルアミンが挙げられる。
【0017】
ここで疎水性化合物の樹脂表面上の官能基に対する結合率(これを固定化率という)は、特に限定はなく、0.1%〜100%程度の水酸基にコレステロール誘導体が結合していてもよい。
【0018】
本明細書において、「スペーサー」とは、疎水性化合物及び樹脂を連結している二価基を表し、化学的に安定な共有結合を形成可能な二価基であれば特に限定はなく、ポリエチレングリコール等の親水性ポリマーを含む二価基であってもよい。
疎水性化合物を樹脂に固定化するためのスペーサーとして具体的には、上記式(1)における「−X2−(Y−Z)s−」で表される二価基が挙げられる。
式(1)においてX2は単結合又は樹脂における官能基とポリエチレングリコール部分等のスペーサーもしくは疎水性化合物とを共有結合で連結する二価基を表す。
式(1)においてsが0を表す場合、すなわち疎水性化合物及び樹脂をつなぐスペーサーがポリエチレングリコール部分を含まない場合、X2は疎水性化合物が樹脂上の官能基と安定な共有結合を形成するための二価基を表す。すなわち、当該二価基として、任意のメチレン基が適宜酸素原子、硫黄原子、NR1(R1は前記と同義)、NHCO又はCONHで置換されていてもよい、化学的に安定な炭素数2〜25の直鎖アルキレンが挙げられる。具体的には、sが0を表し、疎水性化合物が官能基として水酸基もしくはアミノ基を有する場合、X2として前記式(2)〜式(6)のいずれかで表される二価基等が挙げられる。また、sが0を表し、疎水性化合物がカルボキシ基を有する場合、X2としては前記式(7)〜式(11)のいずれかで表される二価基が挙げられる。
式(1)においてsが1を表す場合、X2は単結合又は樹脂における官能基とポリエチレングリコール部分を共有結合で連結する二価基を表す。X2における二価基は、Yで表されるポリエチレングリコール部分の末端の官能基と樹脂における官能基を化学的に安定につなぐ二価基であれば特に限定はない。すなわち、当該二価基として、任意のメチレン基が適宜酸素原子、硫黄原子、NR1(R1は前記と同義)、NHCO又はCONHで置換されていてもよい、化学的に安定な炭素数2〜25の直鎖アルキレンが挙げられる。具体的には、前記式(12)〜式(15)のいずれかで表される二価基等が挙げられる。
【0019】
式(1)におけるYは、1〜50個のエチレングリコールユニットを含むポリエチレングリコール部分を表す。ここでポリエチレングリコール部分は、両端にX2もしくは樹脂における官能基、及びZと、それぞれエステル結合、エーテル結合、チオエーテル結合、ジスルフィド結合、アミン結合、アミド結合、ウレア結合又はウレタン結合を形成可能な官能基を有する。また、当該ポリエチレングリコール部分は、エチレングリコールユニットを1〜50個含んでいれば、個々のエチレングリコールユニット間の結合様式に特に限定は無く、エチレングリコールが1〜50個重合したポリエチレングリコールを形成しているか、あるいは、エチレングリコールが1〜50個、好ましくは2〜15個重合したポリエチレングリコールの両端に適宜炭素数1〜5個の直鎖アルキレンを介して官能基を有する同一もしくは異なる二価基が複数結合し、全体でエチレングリコールユニットを1〜50個含む二価基を形成していてもよい。具体的には、前記式(17)〜式(20)から選択される二価基、又は後述する式(17)〜式(20)から独立して選択される同一もしくは異なる二価基がアミド結合を介して結合して形成される二価基が挙げられる。
Yに含まれるエチレングリコールユニット数は好ましくは1〜6であり、更に好ましくは、1〜4である。
【0020】
式(1)におけるZは、ポリエチレングリコール部分と疎水性化合物とを、共有結合で連結する二価基を表す。Zにおける二価基は、ポリエチレングリコール部分の末端の官能基と疎水性化合物とを化学的に安定につなぐ二価基であれば特に限定はない。すなわち、当該二価基として、任意のメチレン基が適宜酸素原子、硫黄原子、NR1(R1は前記と同義)、NHCO又はCONHで置換されていてもよい、化学的に安定な炭素数1〜10、好ましくは炭素数1〜7の直鎖アルキレンが挙げられる。具体的には、前記式(16)で表される二価基が挙げられる。
疎水性化合物の官能基とスペーサーの官能基との縮合反応は当業者に周知の方法で行うことができる。すなわち、適宜スペーサーを介して官能基が導入された親水性樹脂と、前記官能基と共有結合を形成できる官能基が適宜スペーサーを介して導入された疎水性化合物を縮合すればよい。ここで疎水性化合物もしくはスペーサーの官能基は、適宜反応性の高い官能基に変換されていてもよい。例えばカルボキシ基をN-ヒドロキシコハク酸イミドエステル等との活性エステルとし、水酸基もしくはアミノ基との脱水縮合反応に用いることができる。また、チオール基を2-チオピリジルジスルフィドへ変換し、ジスルフィド結合を形成するために用いることができる。また、官能基としてアルデヒド基を有する化合物を、アミノ基を有する化合物と還元剤(例えばシアノ水素化ホウ素ナトリウム等のホウ素系還元剤等が挙げられる)の存在下で反応させることもできる。
式(1)のYにおけるポリエチレングリコール部分として、以下の式(17)〜(20):
【0021】
【化5】

(a、b、c、d、e、f、g、h、i、j、k及びlは前記と同義である)
で表される二価基が挙げられる。
【0022】
式(17)で表される二価基は、エチレングリコールユニットをb個有する二価基であって、両端にNHを有する。従って、当該二価基は式(1)におけるX2とアミド結合により結合することができる。従って、X2が前記式(12)〜式(15)のいずれかで表される二価基の場合、式(12)〜式(15)におけるX4はCOを表す。
また、式(17)で表される二価基が疎水性化合物と結合し、当該疎水性化合物がカルボキシ基を有する場合、アミド結合を介して結合できる。この場合、式(1)におけるZは単結合を表す。また、式(17)で表される二価基は、疎水性化合物が水酸基を有する場合、NHCOO結合を介して結合できる。この場合、式(1)におけるZはカルボニル基を表す。また、式(17)で表される二価基は、疎水性化合物がアミノ基を有する場合、NHCONH結合を介して結合できる。この場合、式(1)におけるZはカルボニル基を表す。
また、式(17)で表される二価基は、前記式(16)で表される二価基からなるスペーサーを介して疎水性化合物と結合してもよく、この場合式(1)におけるZは式(16)で表され、式(16)においてZ3はカルボニル基を表す。
【0023】
式(18)で表される二価基は、エチレングリコールユニットをe個有する二価基であって、両端にカルボニル基、及びNHをそれぞれ有する。従って、当該二価基は式(1)におけるX2とアミド結合により結合することができる。具体的には、X2が前記式(12)〜式(15)のいずれかで表される二価基の場合、式(12)〜式(15)におけるX4はNHを表す。
また、式(18)で表される二価基が疎水性化合物と結合し、当該疎水性化合物がカルボキシ基を有する場合、アミド結合を介して結合できる。この場合、式(1)におけるZは単結合を表す。また、式(18)で表される二価基は疎水性化合物が水酸基を有する場合、NHCOO結合を介して結合できる。この場合、式(1)におけるZはカルボニル基を表す。また、式(18)で表される二価基は疎水性化合物がアミノ基を有する場合、NHCONH結合を介して結合できる。この場合、式(1)におけるZはカルボニル基を表す。
また、式(18)で表される二価基は、前記式(16)で表される二価基からなるスペーサーを介して疎水性化合物と結合してもよく、この場合式(1)におけるZは式(16)で表され、式(16)においてZ3はカルボニル基を表す。
【0024】
式(19)で表される二価基は、エチレングリコールユニットをh個有する二価基であって、両端にカルボニル基を有する。従って、当該二価基は式(1)におけるX2とアミド結合により結合することができる。具体的には、X2が前記式(12)〜式(15)のいずれかで表される二価基の場合、X4はNHを表す。
また、式(19)で表される二価基が疎水性化合物と結合し、当該疎水性化合物がアミノ基もしくは水酸基を有する場合、アミド結合もしくはエステル結合を介して結合できる。この場合、式(1)におけるZは単結合を表す。
また、式(19)で表される二価基は、前記式(16)で表される二価基からなるスペーサーを介して疎水性化合物と結合してもよく、この場合式(1)におけるZは式(16)で表され、式(16)においてZ3はNH基を表す。
【0025】
式(20)で表される二価基は、エチレングリコールユニットをk個有する二価基であって、末端にNH及びカルボニル基を有する。従って、当該二価基は式(1)におけるX2とアミド結合により結合することができる。具体的には、X2が前記式(12)〜式(15)のいずれかで表される二価基の場合、式(12)〜式(15)におけるX4はカルボニル基を表す。
また、式(20)で表される二価基が疎水性化合物と結合し、当該疎水性化合物がアミノ基もしくは水酸基を有する場合に用いられ、アミド結合もしくはエステル結合を介して結合できる。この場合、式(1)におけるZは単結合を表す。
また、式(20)で表される二価基は、前記式(16)で表される二価基からなるスペーサーを介して疎水性化合物と結合してもよく、この場合式(1)におけるZ2は式(16)で表され、式(16)においてZ3はNH基を表す。
【0026】
尚、Yにおけるポリエチレングリコール部分として、エチレングリコールが1〜15個、好ましくは1〜6個重合したエチレングリコールオリゴマーの両端にカルボキシ基もしくはアミノ基を有する上記式(17)〜(20)のいずれかで表されるいずれかの二価基が、同一もしくは異なって1〜5個重合したものを用いることもできるが、この場合、当該二価基は相互にアミド結合を形成可能な任意の組み合わせから選択され得る。
また、式(1)におけるZが前記式(16)で表わされ、疎水性化合物がカルボキシ基を有する場合、式(16)におけるZ4はNHを表す。また、疎水性化合物が水酸基を有する場合、式(16)におけるZ4はカルボニル基もしくはNHCOを表す。疎水性化合物がアミノ基を有する場合、式(16)におけるZ4はカルボニル基もしくはNHCOを表す。
【0027】
官能基として水酸基を有する樹脂、具体的にはアガロース系樹脂とポリエチレングリコール部分の結合部位として、具体的には、以下の式:
【化6】

(qは2〜6の整数を表し、rは1〜6の整数を表す)
で表される部分構造等が挙げられる。
【0028】
式(1)で表される固相担体を製造するための原料となる樹脂としては、スペーサーの一部に相当する基又は活性エステル等の反応性の置換基が導入された、市販のアガロース系樹脂やメタクリレート系樹脂が挙げられる。以下に具体例を例示する。
例えばアフィゲル102は、アガロース系樹脂の水酸基に、カルボキシ基を有する化合物とアミド結合形成可能なスペーサーが導入されており、以下の式:
【化7】

で表される部分構造を有する。
また、アフィゲル10は、アフィゲル102を無水コハク酸で処理しカルボシ酸体とした後、N-ヒドロキシコハク酸イミドで活性エステルとした担体であり、アミノ基もしくは水酸基を有する化合物とアミド結合もしくはエステル結合形成可能な反応性置換基を有するスペーサーが導入されて以下の式:
【化8】

で表される。
また、アフィゲル15は以下の式:
【化9】

で表される部分構造、すなわち、スペーサー内に4級アミンを含む担体であり、アミノ基もしくは水酸基を有する化合物とアミド結合もしくはエステル結合等を形成可能である。
また、メタクリレート系樹脂であるAF-Amino-650の場合、樹脂上の官能基の末端にアミノ基を有しており、当該アミノ基の「NH」が式(1)におけるX1に相当する。また、メタクリレート系樹脂であるAF-Carboxy-650等の場合、樹脂上の官能基の末端にカルボキシメトキシ基(「O-CH2COOH」)を有しており、当該カルボキシメトキシ基におけるエーテルの酸素原子が式(1)におけるX1に相当する。
【0029】
本発明の固相担体は、適宜スペーサーを有していてもよい親水性樹脂を、適宜スペーサーを有していてもよい疎水性化合物と縮合することにより、当業者に周知の方法で製造することができる。
以下に本発明の固相単体の製造方法について、具体的に例示する。
〔製造方法1〕
式(1)において、sが1を表し、X1が酸素原子を表す場合、本発明に用いられる固相担体は、以下の工程で製造することができる:
【化10】

(式中、「−X2”−NHCO−X2’−」は式(1)における「−X2−」に相当する二価基であり、Y及びZは前記と同義である)。
すなわち、末端にアミノ基を有する樹脂、末端にカルボキシ基を有する疎水性化合物を適当な溶媒中で混合し、脱水縮合剤を用いてアミド化反応を行うことにより、本発明の固相担体を製造することができる。
ここで原料となるアミノ基を有する担体は、以下の工程で製造することができる:
【0030】
【化11】

(式中X2”は前記と同義であり、Lgは臭素原子等の脱離基を表し、Pgは保護基を表す)。
すなわち、1)アルキル化反応(Lgで表される脱離基が臭素原子やメタンスルホニルオキシ基等であり、担体とX2”がエーテル結合をしている場合)、又はジシクロヘキシルカルボジイミドもしくは1-エチル-3-(3'-ジメチルアミノプロピル)カルボジイミド(WSCD)等の縮合剤による脱水縮合反応(Lgで表される脱離基が水酸基であり、担体とX2”がエステル結合をしている場合)、2)アミノ基の保護基を除去する脱保護反応を経て製造することができる。
【0031】
また、末端にカルボキシ基を有する樹脂を用いて以下の工程で本発明の固相担体を製造することもできる:
【化12】

(式中、「−X2”−CONH−X2’−」は式(2)における「−X2−」に相当する二価基であり、Y及びZは前記と同義である)。
カルボキシ基を有する担体は、以下の工程で製造することができる:
【0032】
【化13】

(式中X2”は前記と同義であり、Lgは臭素原子等の脱離基を表し、Pgは保護基を表す)。
すなわち、1)アルキル化反応(Lgで表される脱離基が臭素原子やメタンスルホニルオキシ基等であり、担体とX2”がエーテル結合をしている場合)、又はジシクロヘキシルカルボジイミドもしくはWSCD等の縮合剤による脱水縮合反応(Lgで表される脱離基が水酸基であり、担体とX2”がエステル結合をしている場合)、2)カルボキシ基の保護基を除去する脱保護反応を経て製造することができる。
あるいは、X2”が−CO(CH2)2−を表す場合、無水コハク酸を用いてカルボキシ基を有する担体を製造することもできる。
【0033】
次いで、疎水性化合物にポリエチレングリコール部分を導入した中間体の製造方法について説明する。
疎水性化合物が水酸基を有する場合、疎水性化合物にポリエチレングリコール部分を導入した中間体は、例えば以下の工程で製造できる。
【0034】
【化14】

(式中Y2及びPgは前記と同義である)。
すなわち、疎水性化合物上の水酸基を、トリホスゲン等の試薬を用いてクロロ蟻酸化し、次いで塩基の存在下にPg-Y-Hで表される化合物のアミノ基もしくはヒドロキシ基と反応させた後保護基を脱保護する。
疎水性化合物がカルボキシ基を有する場合、疎水性化合物にポリエチレングリコール部分を導入した中間体は、例えば以下の工程で製造できる:
【0035】
【化15】

すなわち、疎水性化合物を、塩基及びジシクロヘキシルカルボジイミドもしくはWSCD等の脱水縮合剤の存在下にPg-Y-Hで表される化合物のアミノ基もしくはヒドロキシ基と、反応させた後、保護基を脱保護する。
疎水性化合物がアミノ基を有する場合、疎水性化合物にポリエチレングリコール部分を導入した中間体は、例えば以下の工程で製造できる:
【0036】
【化16】

(式中Y及びPgは前記と同義である)。
すなわち、疎水性化合物を、塩基及びジシクロヘキシルカルボジイミドもしくはWSCD等の脱水縮合剤の存在下にPg-Y-OHで表される化合物のカルボキシ基と、反応させた後、保護基を脱保護する。
尚、上記のアミド化(エステル化)反応及び脱保護反応を適宜繰り返すことにより、より高分子量のポリエチレングリコール部分を導入することができる。
【0037】
本発明の固相担体は、樹脂にポリエチレングリコール部分を導入した後、疎水性化合物を固定化することもできる。例えば、以下の式:
【0038】
【化17】

(式中、X2”、X2’、Y、Z及びPgは前記と同義である)
で示される方法で製造できる。
すなわち、上記と同様にアミド化反応及び脱保護反応を行うことにより、ポリエチレングリコール部分を有する樹脂を製造し、これに疎水性化合物を反応させることができる。
また、カルボキシ基を有する担体から出発して、同様の方法で本発明の固相担体を製造することもできる。
【0039】
〔製造方法2〕
式(1)において、sが0を表し、X1が酸素原子もしくは窒素原子を表す場合、本発明に用いられる固相担体は、以下の工程で製造することができる:
【化18】

(式中、「−CO−M1−」は式(1)における「−X2−」に相当する二価基である)。
すなわち、末端にアミノ基もしくは水酸基を有する樹脂、末端にカルボキシ基を有する疎水性化合物(適宜スペーサーを含んでいる)を、溶媒中で混合し、脱水縮合剤を用いてアミド化反応を行うことにより、本発明の固相担体を製造することができる。
ここで、カルボキシ基を有する疎水性化合物としては、公知化合物を用いることができる。又は、水酸基を有する疎水性化合物を出発原料として、例えば以下の方法等で調製することもできる:
【化19】

(式中、Lg及びPgは前記と同義であり、「−O−M1'−」は前記「−M1−」に相当し、「−O−CO−M1''−」は前記「−M1−」に相当する)。
また、水酸基を有する疎水性化合物をトリホスゲン等の試薬を用いてクロロギ酸エステルへ変換し、次いで塩基の存在下に水酸基もしくはアミノ基を有する樹脂と反応させることもできる。具体的には、以下の方法が挙げられる:
【化20】

(式中、X1は前記と同義である)。
また、以下の方法で、カルボキシ基を有するスペーサーが挿入された疎水性化合物を調製し、樹脂に固定化することもできる:
【化21】

(式中、X1、Pgは前記と同義であり、「−CO−M2−NHCO−」は、式(1)における「−X2−」に相当する)。
また、原料となる樹脂としては、修飾可能な官能基として予めアミノ基や水酸基が導入された市販の樹脂を用いることができる。また、カルボキシ基、アミノ基もしくは水酸基を有する樹脂を用いて、適宜スペーサーを介してアミノ基もしくは水酸基を有する樹脂を調製することもできる。
【0040】
また、末端にカルボキシ基を有する樹脂を用いて以下の工程で本発明の固相担体を製造することもできる:
【化22】

(式中、Q1は酸素原子もしくはNHを表し、「−M3−COQ1−M4−」は式(1)における「−X2−」に相当する二価基である)。
すなわち、末端にカルボキシを有する樹脂、末端にアミノ基もしくは水酸基を有する疎水性化合物(適宜スペーサーを含んでいてもよい)を、溶媒中で混合し、脱水縮合剤を用いてアミド化反応もしくはエステル化反応を行うことにより、本発明の固相担体を製造することができる。
ここで、アミノ基もしくは水酸基を有する疎水性化合物としては、公知化合物を用いることができる。又は、カルボキシ基を有する疎水性化合物を出発原料として、上述と同様に、適宜当業者に周知の方法でアミノ基もしくは水酸基を末端に有するスペーサーを導入することもできる。
【0041】
尚上記製造方法を説明するにあたり、便宜上疎水性化合物の部分構造である末端官能基を、以下の式:
【化23】

で表記している場合がある。
【0042】
本発明の態様として、上述の固相担体を用いて膜タンパク質を濃縮する方法が挙げられる。
すなわち、本発明は、以下の(a)〜(c)の工程を含む、膜タンパク質を濃縮する方法:
(a)疎水性化合物が固定化された親水性樹脂からなる固相担体及び膜タンパク質を含む試料を接触させる工程;
(b)前記固相担体を洗浄する工程;及び
(c)前記固相担体に吸着した膜タンパク質を溶出させる工程、
を包含する。
上記方法は、膜タンパク質を含む被験サンプルにおいて、被験サンプルに微量に含まれるタンパク質等、不特定の膜タンパク質を濃縮する場合に好適である。すなわち、上記精製方法に供される「被験サンプル」としては、膜タンパク質を含むサンプルであれば純度等に限定は無く、微量の膜タンパク質を含む細胞又は組織由来の生体由来サンプルが挙げられる。具体的には、ヒト、動物由来の生体組織、臓器由来の細胞膜画分を含むサンプル(粗精製物又は未精製物を含む)が挙げられる。
【0043】
以下に本発明の方法の各工程について詳細に説明する。
〔工程(a)〕
固相担体と被験サンプルは、通常緩衝液(バッファー)中で接触させる。ここで用いられるバッファーとしてはMESバッファー、HEPESバッファー、トリス(Tris)−塩酸バッファー、MOPSバッファー、リン酸(Phosphate)バッファー等が挙げられる。
上記バッファーのpHは5.0〜9.0に調整され、好ましくは6.0〜8.0に調整される。
固相担体と接触させる際の被験サンプルの濃度としては特に限定は無いが、タンパク質混合物(ライゼート)、すなわち組織、細胞から抽出したタンパク質混合物の場合、0.1mg/ml〜10mg/mlが好ましく、更に好ましくは0.5mg/ml〜5mg/mlである。
被験サンプル及び固相担体を接触させる時間に特に限定はないが、通常10分〜24時間接触させることにより、試料中に含まれる膜タンパク質を固相担体に吸着させることができる。また、通常4〜37℃下に接触させる。
被験サンプルを固相担体に吸着させた後、洗浄バッファーで固相担体を2〜20回洗浄する。洗浄バッファーとしては、通常試料を接触させる際に用いたものと同じものを用いる。
【0044】
〔工程(b)〕
膜タンパク質の溶出には、通常バッファーを用いることができる。適宜1〜70%の親水性有機溶媒(アセトニトリルやイソプロパノールが挙げられる)を添加してもよい。また、適宜1%〜5%のSDSや、0.1%〜10%の界面活性剤(例えばチャップス、チャプソー、オクチルグルコシド、ドデシルマルトシド、トリトン等)を添加してもよい。具体的には、0.1MTris−HCl(pH6.8),2%SDS, 20%グリセロール, 0.2%BPB、0.2M DTTからなる組成のバッファーを挙げることができる。
【0045】
あるいは、1%〜5%のSDSを含む水溶液もしくはバッファーや、0.1%〜10%の界面活性剤を含む水溶液を用いて吸着した膜タンパク質を溶出させることもできる。また、8Mウレアや6M塩酸グアニジン等を用いて溶出することも可能である。
溶出液のpHは特に限定は無く、酸性条件(pH2.0〜5.0)、アルカリ性条件(pH9-11)、中性条件(pH5-9)のいずれでもよい。好ましくは中性条件で溶出される。溶出温度は4℃〜95℃である。
溶出された膜タンパク質は、ウェスタンブロッティング等の当業者に公知の方法で検出することができる。すなわち、溶出されたタンパク質溶液をSDS-PAGEに付し、PVDF膜等にタンパク質をトランスファーし、抗体等を用いて得られたバンドを解析すればよい。または、質量スペクトル法にて解析することができる。すなわち、溶出されたタンパク質溶液をSDS−PAGEに付し、目的のバンドを切りだし、解析すればよい。具体的には、目的のバンドをゲルから切り出し、インゲルトリプシン消化法にて得られるペプチドを質量スペクトル法にて解析することができる。
あるいは、樹脂に結合している状態のタンパク質を溶出することなくトリプシン等の消化酵素で処理し、得られるペプチド断片を含む溶液を質量スペクトル解析することもできる。
【実施例】
【0046】
以下に、実施例を挙げて、本発明を更に具体的に説明するが、本発明は必ずしもこれらに限定されるものではない。
尚、本明細書で用いられる略号は以下のとおりである:
WSCD:水溶性カルボジイミド(1-エチル-3-(3'-ジメチルアミノプロピル)カルボジイミド)
HOBt:N-ヒドロキシベンゾトリアゾール
tBoc:tert−ブトキシカルボニル
HATU:2-(1H-7-アザベンゾトリアゾール-1-イル)-1,1,3,3-テトラメチルウロニウムヘキサフルオロフォスフェート メタナミニウム(2-(1H-7-Azabenzotriazol-1-yl)-1,1,3,3,-teramethyl uranium hexafluorophosphate Methanaminium)
実施例1
(1)Affi-Gel‐コレステロール-樹脂の合成
【化24】

Affi-Gel 102Gel (BIO-RAD, cat. No; 153-2401) (3ml,36μmol) (20%エタノール懸濁)に含まれるエタノールをDMFにて置換し、コハク酸水素コレステロール(東京化成、Cat.No.C0674)(70mg,144μmol)、WSCD(25μl, 144μmol)、 HOBt (19mg, 144μmol)、i-Pr2NEt (25μl, 144μmol)を加え、室温にて一昼夜攪拌した。樹脂をDMFにて洗浄後、ニンヒドリンテストを行い、担持量(100%)を確認した。引き続き、樹脂を20%無水酢酸DMF溶液にて置換し、室温にて一昼夜攪拌した。得られた樹脂をDMFにて洗浄後、引き続き20%エタノール水溶液にて洗浄し、目的の固相担体(Affi-Gel−100%コレステロール)(1-1;Affigel-Chole)を得た。
(2) TOYOPEARL‐コレステロール-樹脂の合成
【化25】

TOYOPEARL AF-Amino-650M(TOSOH, Part No. 08039)(1ml,100μmol) をDMFにて置換し、WSCD(35.1μl, 200μmol)、 HOBt (27.0mg, 200μmol)、i-Pr2NEt (34.8μl, 200μmol)を加え、室温にて30分攪拌した。さらに、反応液中にこはく酸水素コレステロール(東京化成、Cat.No.C0674)(97.4mg,200μmol)を加え、室温にて一昼夜攪拌した。樹脂をDMFにて洗浄後、ニンヒドリンテストを行い、目的の担持量(80%)を確認した。引き続き、樹脂を20%無水酢酸DMF溶液にて30分間室温にて攪拌した。得られた樹脂をDMFにて洗浄後、引き続き20%エタノール水溶液にて洗浄し、目的の固相担体(TOYOPEARL-80%コレステロール)(1-2)を得た。
(3) Affi-Gel‐C18-樹脂の合成
【化26】

Affi-Gel 102Gel (BIO-RAD, cat. No; 153-2401) (3ml,36μmol) をDMFにて置換し、ステアリン酸(ナカライテスク、Cat.No.32203-44)(41.0mg,144μmol)、HATU(60.2mg, 158μmol)、i-Pr2NEt (27.5μl, 158μmol)を加え、室温にて2時間攪拌した。樹脂をDMFにて洗浄後、ニンヒドリンテストを行い、担持量(100%)を確認した。引き続き、樹脂を20%無水酢酸DMF溶液にて置換し、室温にて30分攪拌した。得られた樹脂をDMFにて洗浄後、引き続き20%エタノール水溶液にて洗浄し、目的の固相担体(Affi-Gel−100%C18)(1-3;Affi−C18)を得た。
(4) TOYOPEARL‐C18-樹脂の合成
【化27】

TOYOPEARL AF-Amino-650M(TOSOH, Part No. 08039)(1ml,100μmol)をDMFにて置換し、ステアリン酸(ナカライテスク、Cat.No.32203-44)(41.0mg,144μmol)、HATU(60.2mg, 158μmol)、i-Pr2NEt (27.5μl, 158μmol)を加え、室温にて2時間攪拌した。樹脂をDMFにて洗浄後、ニンヒドリンテストを行い、担持量(100%)を確認した。引き続き、樹脂を20%無水酢酸DMF溶液にて置換し、室温にて30分攪拌した。得られた樹脂をDMFにて洗浄後、引き続き20%エタノール水溶液にて洗浄し、目的の固相担体(TOYOPEARL-100%C18)(1-4;Toyo-C18)を得た。
【0047】
実施例2
(1)マウス脳抽出物の作成
i) マウス全脳 (1g x 2個)を、20mlのバッファーA(subcellular buffer A) (50mM Tris pH7.5, 0.25M Sucrose, 2mM MgCl,100mM NaCl+proteaseinhibitor) 中でホモジナイズした。
ii)遠心分離した(回転数1000 x g, 10分間)。
iii) ii)で得られた上清を更に遠心分離した(回転数10,000 x g, 30分間)。
iv) iii)で得られた上清を更に遠心分離し(回転数100,000 x g, 60分間)、ペレットを得た(0.26g)。
v) 得られたペレット(0.26g)に、バッファーB(50mM Tris pH7.5, 0.25M Sucrose, 2mM MgCl,100mM NaCl+proteaseinhibitor,1%O.G)(2.6ml)を加えて懸濁し、氷冷下に60分間インキュベートした。4℃下に遠心分離(回転数100,000 x g, 20分間)し、上清をbufferBにて2倍希釈し、結合実験に使用した。
(2)結合実験
実施例1で調製したアフィニティー樹脂(1-1)(1.4μmol相当)を正確にはかり取り、(1)で得られたマウス脳ライゼート(200μl)と4℃にて一昼夜攪拌した。結合実験終了後、樹脂を12,000 x gにて遠心分離し、上澄みを捨て、残された樹脂をバッファーB(50mM Tris pH7.5, 0.25M Sucrose, 2mM MgCl,100mM NaCl+proteaseinhibitor,1%O.G)800μl にて2回洗浄した。樹脂にSDS-PAGE用ローディングバッファー40μlを加え、37℃にて30分間インキュベートした。こうして得られたサンプル液を市販のSDSゲル(BioRad ready Gel J, 5-20%SDS, cat. No; 161-J371V)で分離し、そのSDSゲルを解析した。
(3)インゲルトリプシン消化、MS解析
SDS-PAGEによって分離したタンパク質を切り出し、ゲル片をエッペンチューブへ移した。アセトニトリル(100μL)を加えソニケーションを行った。アセトニトリルを除去し、減圧下、遠心乾燥を行った。10mM DTT,100mM NH4HCO3(100μL)を加え、56℃で1時間インキュベートした後、室温にて溶媒を除去した。55mM ヨードアセトアミド,100mM NH4HCO3(100μL)加え、サンプルを遮光状態で、室温にて45分間インキュベートした。溶媒除去後、100mM NH4HCO3(100μL)を加え、室温にて10分間インキュベートし、再び溶媒除去後、アセトニトリル(100μL)加え、ソニケーションを行った。アセトニトリルを除去し減圧下、遠心乾燥を行った。0.1%RapiGest(Waters,Cat.no.186002123),25mM NH4HCO3(20μL)を加え、37℃にて10分間インキュベートした。余分な溶液を除去後、減圧下、遠心乾燥を行った。エッペンチューブを4℃で10分間インキュベート後、酵素溶液(12.5ng/μL トリプシン(Promega,cat.no.V5111),50mM NH4HCO3)(100μL)を加え、4℃にて45分間インキュベートした。溶媒除去後、50mM NH4HCO3(10μL)を加え、37℃で16時間インキュベートした。溶媒を抽出し、残ったゲルに50%アセトニトリル, 0.1%トリフルオロ酢酸水溶液30μLを加え、ペプチドを抽出した。同様の操作を再度実施した。得られたペプチド抽出液を遠心濃縮した。得られたサンプルに、0.5%トリフルオロ酢酸溶液30ulを加え37℃で30分インキュベートを行った。遠心濃縮により目的のサンプルを得た。
(4)Nano-LC-MS/MS 解析
(3)で得られたサンプルを0.1%蟻酸水溶液(20ul)に溶かし3分間ソニケーションを行った。そのうち5μlをLC-MSにて分析した。分析条件は以下のとおり。
(分析条件)
移動相濃度勾配(グラジュエント):5%メタノール/0.1%蟻酸水溶液(0 min)〜75%メタノール/0.1%蟻酸水溶液(90min) 〜95%メタノール/0.1%蟻酸水溶液(91min) 〜95%メタノール/0.1%蟻酸水溶液(99min) 〜5%メタノール/0.1%蟻酸水溶液(100min);
流速:500nL/min;
逆相HPLCカラム:0.1mm x 150mmのC18カラム(Agilent Technologies) ;Capillary温度:200℃;
Spray Voltage :200V
質量分析装置:LTQ-Orbitrap;Thermo Fisher Scientific, Bremen, Germany
得られたトータルイオンクロマトグラムの結果を図1に示す。
得られたデータをタンパク質同定ソフト(Mascot v2.2; Matrix Science, London, UK)を用い、MASCOT Score>20,Significance threshold p<0.05の条件設定で選択したペプチドをタンパク質データベースSwiss-Prot(www.uniprot.org)を用いて同定した。同様のデータベースPHENYX(Geneva Bioinformatics SA),X!TANDAM Spectrum Modeler (インターネットウェブサイト:http://www.thegpm.orgを参照)を用いて同定することも可能である。膜貫通領域はSwiss-Protを用いて確認をした。
解析結果を従来の方法(マウス脳ライゼートを直接SDS-PAGE用ローディングバッファーと混合し、SDS-PAGEにてタンパク質を分離し、ゲルを解析する方法)と比較した。
従来方法では584種の膜タンパク質(内、膜貫通型タンパク質355種)を同定した。一方、Affi-Gel-コレステロール樹脂結合サンプルでは626種の膜タンパク質(内、膜貫通型タンパク質392種)、Affi-Gel-C18樹脂結合サンプルでは696種の膜タンパク質(内、膜貫通型タンパク質460種)、TOYOPEARL-コレステロール樹脂結合サンプルでは497種の膜タンパク質(内、膜貫通型タンパク質317種)、TOYOPEARL-C18樹脂結合サンプルでは492種の膜タンパク質(内、膜貫通型タンパク質299種)を同定した。更に、4種類の樹脂を用いて得られた結果を総合すると樹脂結合サンプルでは1087種の膜タンパク質(内、膜貫通型タンパク質720種)を同定することができた。結果を図2、図3、に示す。また、一例として、式(1−3)の樹脂を用いて同定された膜貫通型タンパク質の一覧表を以下に示す。
【表1】

【表2】

【表3】

【表4】

【表5】

【表6】

【表7】

【表8】

【表9】

【表10】

すなわち、従来法(ライゼートを解析)と樹脂法で解析できた膜タンパク質の総和は1225種であり、446種が従来方法と樹脂法との共通タンパク質であった。また、641種が樹脂法でのみで同定されており、同定膜タンパク質の種類を著しく増やし、従来同定することができなかったタンパク質を検出することが可能となった。(図2)
同様に、従来法(ライゼートを解析)と樹脂法で解析できた膜貫通型タンパク質の総和は800種であり、265種が従来方法と樹脂法との共通タンパク質であった。また、460種が樹脂法でのみで同定されており、同定膜貫通型タンパク質の種類を著しく増やすことが可能となった。(図3)
また、図4に、従来法とAffi-C18樹脂(1−3)で解析した膜貫通型タンパク質を膜貫通回数により比較した。(図4)
【0048】
実施例3
コレステロール-PEG(1)-NH2(3−4)の合成
【化28】

クロロぎ酸コレステロール(3−1)(東京化成、Cat.no.C0694;637mg,1.42mmol)をジクロロメタン60mlに溶かし、氷冷下攪拌した。Mono-N-t-Boc-amido-dPEG3TM-amine(3−2) (QUANTA BIODESIGN製; 500mg,1.56mmol) をジクロロメタン1mlに溶かし、ゆっくりと滴下した。ジイソプロピルエチルアミン(494μl, 2.84mmol) を加え、室温にて一昼夜攪拌した。減圧濃縮後、酢酸エチル200mlを加えた。酢酸エチル層を水100ml、飽和食塩水にて洗浄した。無水硫酸マグネシウムにて乾燥後、減圧濃縮し、シリカゲルカラムクロマトグラフィーにて精製した。目的のBoc体(3−3)(770mg)を収率74%にて得た。質量分析結果:MS(m/z): 733(MH+)。
得られたBoc体(3−3)(770mg, 1.05mmol) を酢酸エチル60mlに溶かし、4N-HCl/AcOEt (国産化学製;5ml) を加え、室温にて5時間攪拌した。反応完結後、溶媒を留去し、クロロホルム50mlを加え、減圧下溶媒を留去した。この操作を3回繰り返した。真空ポンプにて溶媒を完全に留去し、目的のアミノ体塩酸塩(3−4)(703mg)を定量的に得た。質量分析結果:MS(m/z): 633(MH+)。
以下に、製造した化合物の1H-NMRデータを示した。
式(3−3)の化合物:
1H-NMR (CDCl3) δ0.67(s, 3H), 0.86 (d, J=6.6Hz, 3H), 0.87 (d, J=6.6Hz, 3H), 0.91 (d, J=6.4Hz, 3H), 0.94-1.06 (m, 3H), 1.00 (s, 3H), 1.06-1.18 (m, 5H), 1.30-1.40 (m, 3H), 1.40-1.45 (m, 2H), 1.44 (s, 9H), 1.45-1.60 (m, 7H), 1.76 (m, 4H), 1.84 (m, 1H), 1.86 (m, 2H), 1.94 (m, 1H), 2.00 (m, 2H), 2.27 (br d, J=13.1, 5.1, 1.9Hz, 1H), 2.35 (ddd, J=13.1, 5.1, 1.9Hz, 1H), 3.22(br t, J=6.1Hz, 2H), 3.27 (m, 2H), 3.51-3.57(m, 4H), 3.57-3.62 (m, 4H), 3.62-3.66 (m, 4H), 4.48 (m, 1H), 5.36 (m, 1H), 4.95 (br s, 1H), 5.14 (br s, 1H);
HRMS-ESI (m/z): [M+H]+calcd. for C43H77O7N2, 733.5725; found, 733.5724.
式(3−4)の化合物:
1H-NMR (CDCl3) δ0.67 (s, 3H), 0.86 (d, J=6.6Hz, 3H), 0.87 (d, J=6.6Hz, 3H), 0.88-0.94 (m, 1H), 0.91 (d, J=6.6Hz, 3H), 0.94-1.06 (m, 3H), 1.00 (s, 3H), 1.04-1.20 (m, 5H), 1.20-1.40 (m, 4H), 1.40-1.60 (m, 6H), 1.76-1.90 (m, 4H), 1.80 (m, 2H), 1.92-2.12 (m, 3H), 2.06 (m, 2H), 2.29 (br dd, J=13.1, 2.3Hz, 1H), 2.34 (ddd, J=13.1, 5.2, 1.7Hz, 1H), 3.20-3-30 (m, 4H), 3.58 (m, 2H), 3.64 (m, 6H), 3.73 (m, 4H), 4.44 (m, 1H), 5.35 (m, 1H), 8.05-8.30 (m, 3H);
HRMS-ESI (m/z): [M+H]+calcd. for C38H69O5N2, 633.5201; found, 633.5192
【0049】
実施例4
コレステロール-PEG(0)-NH2(4−3)の合成
【化29】

クロロぎ酸コレステロール(3−1)(東京化成;637mg,1.42mmol)をジクロロメタン60mlに溶かし、氷冷下攪拌した。N-(2-アミノエチル)カルバミン酸tert-ブチル (4−1)(東京化成; 250mg,1.56mmol) をジクロロメタン1mlに溶かし、ゆっくりと滴下した。ジイソプロピルエチルアミン(494μl, 2.84mmol) を加え、室温にて一昼夜攪拌した。減圧濃縮後、酢酸エチル200mlを加えた。酢酸エチル層を水100ml、飽和食塩水にて洗浄した。無水硫酸マグネシウムにて乾燥後、減圧濃縮し、シリカゲルカラムクロマトグラフィーにて精製した。目的のBoc体(4−2)(645mg, 1.12mmol)を収率79%にて得た。質量分析結果:MS (m/z): 595(M+Na)。
得られたBoc体(4−2)(645mg, 1.12mmol) を酢酸エチル10ml−クロロホルム30mlの混合溶媒に溶かし、4M(N)-HCl/AcOEt (国産化学製; 3ml) を加え、室温にて3時間攪拌した。反応完結後、結晶を濾取し、結晶をクロロホルム2mlにて洗浄した。減圧下乾燥し、目的のアミノ体塩酸塩(4−3)(570mg)を定量的に得た。質量分析結果: MS (m/z):473(MH+)。
【0050】
実施例5
C18-PEG(1)-NH2(5−4)の合成
【化30】

ステアリン酸(404mg,1.42mmol)をジクロロメタン60mlに溶かし、氷冷下攪拌した。WSCD (343μl, 1.96mmol)、HOBt (264mg, 1.96mmol) をゆっくりと加え、室温にて60分間攪拌した。再度、4℃にて攪拌後、Mono-N-t-boc-amido-dPEG3TM-amine(5−2) (QUANTA BIODESIGN製; 500mg,1.56mmol) をジクロロメタン1mlに溶かし、ゆっくりと滴下した。ジイソプロピルエチルアミン(494μl, 2.84mmol) を加え、室温にて一昼夜攪拌した。減圧濃縮後、酢酸エチル200mlを加えた。酢酸エチル層を水100ml、飽和食塩水にて洗浄した。無水硫酸マグネシウムにて乾燥後、減圧濃縮し、シリカゲルカラムクロマトグラフィーにて精製した。目的のBoc体(5−3)(730mg)を収率87%にて得た。質量分析結果:HRMS-ESI (m/z):[M+H]+calcd.for C33H67O6N2, 587.4994; found, 587.4986。
得られたBoc体(700mg, 1.19mmol) を酢酸エチル60mlに溶かし、4N-HCl/AcOEt (国産化学製;5ml) を加え、室温にて5時間攪拌した。反応完結後、溶媒を留去し、クロロホルム50mlを加え、減圧下溶媒を留去した。この操作を3回繰り返した。真空ポンプにて溶媒を完全に留去し、目的のアミノ体塩酸塩(5−4)を得た。質量分析結果:HRMS-ESI(m/z):[M+H]+calcd.for C28H59O4N2, 487.4469; found, 487.4449 。
【0051】
実施例6
Affi−Gelの修飾(CholePEG(1))
【化31】

Affi-Gel 102Gel (BIO-RAD, cat. No; 153-2401) 12ml(144μmol)をDMFにて置換し、無水コハク酸(28.8mg, 288mol)、iPr2NEt (75μmol, 432μmol)を加え、室温にて一昼夜攪拌した。樹脂をDMFにて洗浄後、ニンヒドリンテストを行い、定量的に目的のカルボン酸体 (6−1)(144μmol)が得られたのを確認した。引き続き、樹脂を20%無水酢酸DMF溶液にて30分間室温で攪拌した。得られたカルボン酸樹脂(6−1)(36μmol)にDMF10mlを加え、WSCD(7.5μl, 43.2μmol), HOBt (5.8mg, 43.2μmol)を加え室温にて30分間攪拌した。化合物(3−4)(7.2mg, 10.8μmol), iPr2NEt (15μl, 86.4μmol)を加え、室温にて一昼夜攪拌した。樹脂をDMFにて洗浄後、引き続き20%エタノール水溶液にて洗浄し、目的の固相担体:コレステロール-PEG(1)(6−2)を得た。
【0052】
実施例7
コール酸-PEG(1)-NH2の合成
【化32】

コール酸(7-1)(ナカライ、Cat.no.08836-72;637mg,1.56mmol)をジクロロメタン60ml,DMF10mlに溶かし、攪拌した。Mono-N-t-Boc-amido-dPEG3TM-amine(7-2)) (QUANTA BIODESIGN製; 500mg,1.56mmol) をジクロロメタン1mlに溶かし、ゆっくりと滴下した。HATU(712mg,1.87mmol),ジイソプロピルエチルアミン(326μl, 1.87mmol) を加え、室温にて一昼夜攪拌した。酢酸エチル200mlを加えた。酢酸エチル層を水100ml、飽和食塩水100mlにて洗浄した。無水硫酸マグネシウムにて乾燥後、減圧濃縮し、シリカゲルカラムクロマトグラフィーにて精製した。目的のBoc体(7-3)(560mg)を収率64%にて得た。質量分析結果:HRMS-ESI(m/z):[M+H]+calcd.for C39H71O9N2, 711.5154; found, 711.5139 。
以下に、製造した化合物の1H-NMRデータを示した。
Boc体(7-3):1H-NMR (CDCl3) δ0.70(s, 3H), 0.90(s, 3H), 0.99(m, 1H), 1.00(d, J=6.3Hz, 3H), 1.14(m, 1H), 1.26-1.48(m, 1H), 1.26-1.48(m, 1H), 1.26-1.48(m, 1H), 1.26-1.48(m, 2H), 1.45(s, 9H), 1.48-1.57(m, 1H), 1.48-1.57(m, 1H), 1.57-1.65(m, 2H), 1.65-1.74(m, 1H), 1.65-1.74(m, 1H), 1.74-1.86(m, 1H), 1.74-1.86(m, 1H), 1.74-1.86(m, 1H), 1.74-1.86(m, 4H), 1.82-2.00(m, 1H), 1.82-2.00(m, 2H), 1.86-2.00(m , 1H), 2.04-2.15(m, 1H), 2.15-2.30(m, 1H), 2.15-2.30(m, 1H), 2.15-2.30(m, 1H), 3.22(m, 2H), 3.37(q, J=6.0Hz, 2H), 3.46(m, 1H), 3.54(t, J=6.0, 2H), 3.59-3.63(m, 6H), 3.63-3.68(m, 2H), 3.63-3.68(m, 2H), 3.85(m, 1H), 3.98(br t, J=2.7, 1H), 4.99(br s, 1H), 6.35(br s, 1H)。
【0053】
得られたBoc体(7-3)(273mg, 0.38mmol) を酢酸エチル60mlに溶かし、4N-HCl/AcOEt (国産化学製;5ml) を加え、室温にて5時間攪拌した。反応完結後、溶媒を留去し、クロロホルム50mlを加え、減圧下溶媒を留去した。この操作を3回繰り返した。真空ポンプにて溶媒を完全に留去し、目的のアミノ体塩酸塩(7-4)(220mg)を定量的に得た。質量分析結果:HRMS-ESI(m/z):[M+H]+calcd.for C34H63O7N2, 611.4630; found, 611.4620 。
【0054】
実施例8
デオキシコール酸-PEG(1)-NH2の合成
【化33】

デオキシコール酸(8−1)(WAKO、Cat.no.044-18812;613mg,1.56mmol)をジクロロメタン60ml,DMF10mlに溶かし、攪拌した。Mono-N-t-Boc-amido-dPEG3TM-amine(8−2) (QUANTA BIODESIGN製; 500mg,1.56mmol) をジクロロメタン1mlに溶かし、ゆっくりと滴下した。HATU(712mg,1.87mmol),ジイソプロピルエチルアミン(326μl, 1.87mmol) を加え、室温にて一昼夜攪拌した。酢酸エチル200mlを加えた。酢酸エチル層を水100ml、飽和食塩水100mlにて洗浄した。無水硫酸マグネシウムにて乾燥後、減圧濃縮し、シリカゲルカラムクロマトグラフィーにて精製した。目的のBoc体(8−3)(460mg)を収率42%にて得た。質量分析結果:HRMS-ESI(m/z):[M+H]+calcd.for C39H71O8N2, 695.5205; found, 695.5190 。
以下に、製造した化合物の1H-NMRデータを示した。
Boc体(8−3):1H-NMR (CDCl3) δ0.69(s, 3H), 0.92(s, 3H), 0.94-1.04(m, 1H), 0.99(d, J=6.1Hz,3H), 1.04-1.13(m, 1H), 1.11-1.48(m, 2H), 1.11-1.48(m, 1H), 1.11-1.48(m, 1H), 1.24-1.48(m, 1H), 1.24-1.48(m, 1H), 1.24-1.48(m, 1H), 1.24-1.48(m, 2H), 1.45(s, 9H), 1.48-1.67(m, 1H), 1.48-1.67(m, 1H), 1.48-1.67(m, 1H), 1.48-1.67(m, 2H), 1.67-1.94(m, 1H), 1.67-1.94(m, 1H), 1.67-1.94(m, 1H), 1.67-1.94(m, 2H), 1.67-1.94(m, 1H), 1.67-1.94(m, 1H), 1.67-1.94(m, 1H), 1.67-1.94(m, 4H), 2.08-2.18(m, 1H), 2.22-2.32(m, 1H), 3.22(t, J=6.5Hz, 2H), 3.39(q, J=5.8Hz, 2H), 3.54(t, J=6.1Hz, 2H), 3.56-3.68(m, 10H), 3.64-3.68(m, 1H), 3.98(t, J=2.9Hz, 1H), 4.98(br s, 1H), 6.46(br s, 1H)。
得られたBoc体(8−3)(250mg, 0.36mmol) を酢酸エチル60mlに溶かし、4N-HCl/AcOEt (国産化学製;5ml) を加え、室温にて5時間攪拌した。反応完結後、溶媒を留去し、クロロホルム50mlを加え、減圧下溶媒を留去した。この操作を3回繰り返した。真空ポンプにて溶媒を完全に留去し、目的のアミノ体塩酸塩(8−4)(210mg)を定量的に得た。質量分析結果:HRMS-ESI(m/z):[M+H]+calcd.for C34H63O6N2, 595.4681; found, 595.4679 。
【0055】
実施例9
Affi-Gelの修飾(コール酸-PEG(1)、デオキシコール酸-PEG(1))
実施例7で製造したアミノ体(7−4)及び実施例8で製造したアミノ体(8−4)を、実施例6と同様の方法で、Affi-Gel上に固定化することができる。
【産業上の利用可能性】
【0056】
本発明により、未だ同定されていない細胞膜等に微量に含まれる膜タンパク質を、質量分析法等の解析方法で解析可能な濃度にまで濃縮、精製することが可能になった。
【特許請求の範囲】
【請求項1】
以下の(a)〜(c)の工程を含む、膜タンパク質を濃縮する方法:
(a)コレステロール誘導体、脂肪酸誘導体及び脂肪族アミンから選択される少なくとも1種類の疎水性化合物が固定化された固相担体に膜タンパク質を含む試料を接触させる工程;
(b)前記固相担体を洗浄する工程;及び
(c)前記固相担体に吸着した膜タンパク質を溶出させる工程。
【請求項2】
疎水性化合物が固定化された固相担体が、式(1):

(式中、X1は樹脂上の官能基を表し、sは0又は1を表し、X2は単結合、又は樹脂上の官能基とポリエチレングリコール部分もしくは疎水性化合物を共有結合で連結する二価基を表し、Zは2つのポリエチレングリコール部分どうし、又は疎水性化合物と前記ポリエチレングリコール部分を共有結合で連結する二価基を表し、Yは1〜50個のエチレングリコールユニットを含むポリエチレングリコール部分を表す)
で表される請求項1に記載の方法。
【請求項3】
式(1)において、sが0を表し、X1が酸素原子又はNHを表し、X2が、式(2)〜(6):
(2) -X3-(CH2)m-X4-、
(3) -X3-(CH2)m-X5-(CH2)n-X4-、
(4) -X3-(CH2)m-X5-(CH2)n-X6-(CH2)o-X4-、
(5) -X3-(CH2)m-X5-(CH2)n-X6-(CH2)o-X7-(CH2)p-X4-、及び
(6) -CO-
(式中、X3は単結合又はCOを表し、X5、X6及びX7は独立してO、S、NR1、NHCO又はCONHを表し、X4は単結合、CO、NHCO又はO-COを表し、R1は水素原子又は炭素数1〜3のアルキル基を表し、m、n、o及びpは独立して1〜5の整数を表す)
のいずれかで表される二価基から選択され、疎水性化合物上の水酸基から水素原子が脱離した基がX2と結合していることを特徴とする、請求項2に記載の方法。
【請求項4】
式(1)において、sが0を表し、X1が酸素原子又はNHを表し、X2が、式(7)〜(11):
(7) -X3-(CH2)m-X8-、
(8) -X3-(CH2)m-X5-(CH2)n-X8-、
(9) -X3-(CH2)m-X5-(CH2)n-X6-(CH2)o-X8-、
(10) -X3-(CH2)m-X5-(CH2)n-X6-(CH2)o-X7-(CH2)p-X8-、及び
(11) 単結合
(式中、X3は単結合又はCOを表し、X5、X6及びX7は独立してO、S、NR1、NHCO又はCONHを表し、X8は単結合、酸素原子又はNHを表し、R1は水素原子又は炭素数1〜3のアルキル基を表し、m、n、o及びpは独立して1〜5の整数を表す)
のいずれかで表される二価基から選択され、疎水性化合物上のカルボキシ基から水酸基が脱離した基がX2と結合していることを特徴とする、請求項2に記載の方法。
【請求項5】
式(1)において、sが1を表し、X1が酸素原子又はNHを表し、X2が、
単結合及び式(12)〜(15):
(12) -X3-(CH2)m-X4-
(13) -X3-(CH2)m-X5-(CH2)n-X4-
(14) -X3-(CH2)m-X5-(CH2)n-X6-(CH2)o-X4-
(15) -X3-(CH2)m-X5-(CH2)n-X6-(CH2)o-X7-(CH2)p-X4-
(式中、X3は単結合又はCOを表し、X5、X6及びX7はO、S、NR1、NHCO又はCONHを表し、X4は酸素原子、NH又はCOを表し、R1は水素原子又は炭素数1〜3のアルキル基を表し、m、n、o及びpは独立して1〜5の整数を表す)
のいずれかで表される二価基から独立して選択されることを特徴とする、請求項2に記載の方法。
【請求項6】
式(1)において、sが1を表し、Zが、単結合、NH、CO、及び式(16):
(16) −Z3−(CH2)t−Z4−
(式中、Z3はNH又はCOを表し、Z4はNH、CO、NHCO、CONH、CO−O又はO−COを表し、tは1〜5の整数を表す)
で表される二価基から、独立して選択されることを特徴とする、請求項2に記載の方法。
【請求項7】
式(1)におけるYのエチレングリコールのユニット数が1〜15である、請求項2、5及び6のいずれかに記載の方法。
【請求項8】
式(1)におけるYが以下の式(17)〜(20):

(a、c、f及びjは独立して2〜5の整数を表し、d、g、i及びlは独立して1〜5の整数を表し、b、e、h及びkは独立して1〜15の整数を表す)
から独立して選択される二価基、又は前記式(17)〜式(20)から独立して選択される同一もしくは異なる1又は複数の二価基がアミド結合を介して結合して形成される二価基である、請求項2、5、6及び7のいずれかに記載の方法。
【請求項9】
固相担体が、アガロース系樹脂又は親水性のメタクリレート系樹脂である、請求項1〜8のいずれかに記載の方法。
【請求項10】
試料が細胞又は組織由来の未精製膜画分を含有するものである、請求項1〜9のいずれかに記載の方法。
【請求項11】
細胞又は組織由来の微量膜タンパク質を、質量分析法で同定可能な濃度に濃縮することを特徴とする、請求項1〜10のいずれかに記載の方法。
【請求項12】
式(1):

(式中、X1、X2、Y、Z及びsは請求項2と同義である)
で表され、疎水性化合物がコレステロール誘導体であることを特徴とする固相担体。
【請求項13】
式(1)において、sが0を表し、X1が酸素原子又はNHを表し、X2が、式(2)〜(6):
(2) -X3-(CH2)m-X4-、
(3) -X3-(CH2)m-X5-(CH2)n-X4-、
(4) -X3-(CH2)m-X5-(CH2)n-X6-(CH2)o-X4-、
(5) -X3-(CH2)m-X5-(CH2)n-X6-(CH2)o-X7-(CH2)p-X4-、及び
(6) -CO-
(式中、X3は単結合又はCOを表し、X5、X6及びX7は独立してO、S、NR1、NHCO又はCONHを表し、X4は単結合、CO、NHCO又はO-COを表し、R1は水素原子又は炭素数1〜3のアルキル基を表し、m、n、o及びpは独立して1〜5の整数を表す)
のいずれかで表される二価基から選択され、疎水性化合物上の水酸基から水素原子が脱離した基がX2と結合していることを特徴とする、請求項12に記載の固相担体。
【請求項14】
式(1)において、sが0を表し、X1が酸素原子又はNHを表し、X2が、単結合及び式(7)〜(11):
(7) -X3-(CH2)m-X8-、
(8) -X3-(CH2)m-X5-(CH2)n-X8-、
(9) -X3-(CH2)m-X5-(CH2)n-X6-(CH2)o-X8-、
(10) -X3-(CH2)m-X5-(CH2)n-X6-(CH2)o-X7-(CH2)p-X8-、及び
(11) 単結合
(式中、X3は単結合又はCOを表し、X5、X6及びX7は独立してO、S、NR1、NHCO又はCONHを表し、X8は単結合、酸素原子又はNHを表し、R1は水素原子又は炭素数1〜3のアルキル基を表し、m、n、o及びpは独立して1〜5の整数を表す)
のいずれかで表される二価基から選択され、疎水性化合物上のカルボキシ基から水酸基が脱離した基がX2と結合していることを特徴とする、請求項12に記載の固相担体。
【請求項15】
式(1)において、sが1を表し、X1が酸素原子又はNHを表し、X2が、
単結合及び式(12)〜(15):
(12) -X3-(CH2)m-X4-
(13) -X3-(CH2)m-X5-(CH2)n-X4-
(14) -X3-(CH2)m-X5-(CH2)n-X6-(CH2)o-X4-
(15) -X3-(CH2)m-X5-(CH2)n-X6-(CH2)o-X7-(CH2)p-X4-
(式中、X3は単結合又はCOを表し、X5、X6及びX7はO、S、NR1、NHCO又はCONHを表し、X4は酸素原子、NH又はCOを表し、R1は水素原子又は炭素数1〜3のアルキル基を表し、m、n、o及びpは独立して1〜5の整数を表す)
のいずれかで表される二価基から独立して選択されることを特徴とする、請求項12に記載の固相担体。
【請求項16】
式(1)において、sが1を表し、Zが、単結合、NH、CO、及び式(16):
(16) −Z3−(CH2)t−Z4−
(式中、Z3はNH又はCOを表し、Z4はNH、CO、NHCO、CONH、CO−O又はO−COを表し、tは1〜5の整数を表す)
で表される二価基から、独立して選択されることを特徴とする、請求項12に記載の固相担体。
【請求項17】
式(1)におけるYのエチレングリコールのユニット数が1〜15である、請求項12、15及び16のいずれかに記載の固相担体。
【請求項18】
式(1)におけるYが以下の式(17)〜(20):

(a、c、f及びjは独立して2〜5の整数を表し、d、g、i及びlは独立して1〜5の整数を表し、b、e、h及びkは独立して1〜15の整数を表す)
から独立して選択される二価基、又は前記式(17)〜式(20)から独立して選択される同一もしくは異なる1又は複数の二価基がアミド結合を介して結合して形成される二価基である、請求項12、15、16及び17のいずれかに記載の固相担体。
【請求項19】
請求項12〜18のいずれかに記載の固相担体の、プロテオーム解析用試料調製用試薬としての使用。
【請求項1】
以下の(a)〜(c)の工程を含む、膜タンパク質を濃縮する方法:
(a)コレステロール誘導体、脂肪酸誘導体及び脂肪族アミンから選択される少なくとも1種類の疎水性化合物が固定化された固相担体に膜タンパク質を含む試料を接触させる工程;
(b)前記固相担体を洗浄する工程;及び
(c)前記固相担体に吸着した膜タンパク質を溶出させる工程。
【請求項2】
疎水性化合物が固定化された固相担体が、式(1):

(式中、X1は樹脂上の官能基を表し、sは0又は1を表し、X2は単結合、又は樹脂上の官能基とポリエチレングリコール部分もしくは疎水性化合物を共有結合で連結する二価基を表し、Zは2つのポリエチレングリコール部分どうし、又は疎水性化合物と前記ポリエチレングリコール部分を共有結合で連結する二価基を表し、Yは1〜50個のエチレングリコールユニットを含むポリエチレングリコール部分を表す)
で表される請求項1に記載の方法。
【請求項3】
式(1)において、sが0を表し、X1が酸素原子又はNHを表し、X2が、式(2)〜(6):
(2) -X3-(CH2)m-X4-、
(3) -X3-(CH2)m-X5-(CH2)n-X4-、
(4) -X3-(CH2)m-X5-(CH2)n-X6-(CH2)o-X4-、
(5) -X3-(CH2)m-X5-(CH2)n-X6-(CH2)o-X7-(CH2)p-X4-、及び
(6) -CO-
(式中、X3は単結合又はCOを表し、X5、X6及びX7は独立してO、S、NR1、NHCO又はCONHを表し、X4は単結合、CO、NHCO又はO-COを表し、R1は水素原子又は炭素数1〜3のアルキル基を表し、m、n、o及びpは独立して1〜5の整数を表す)
のいずれかで表される二価基から選択され、疎水性化合物上の水酸基から水素原子が脱離した基がX2と結合していることを特徴とする、請求項2に記載の方法。
【請求項4】
式(1)において、sが0を表し、X1が酸素原子又はNHを表し、X2が、式(7)〜(11):
(7) -X3-(CH2)m-X8-、
(8) -X3-(CH2)m-X5-(CH2)n-X8-、
(9) -X3-(CH2)m-X5-(CH2)n-X6-(CH2)o-X8-、
(10) -X3-(CH2)m-X5-(CH2)n-X6-(CH2)o-X7-(CH2)p-X8-、及び
(11) 単結合
(式中、X3は単結合又はCOを表し、X5、X6及びX7は独立してO、S、NR1、NHCO又はCONHを表し、X8は単結合、酸素原子又はNHを表し、R1は水素原子又は炭素数1〜3のアルキル基を表し、m、n、o及びpは独立して1〜5の整数を表す)
のいずれかで表される二価基から選択され、疎水性化合物上のカルボキシ基から水酸基が脱離した基がX2と結合していることを特徴とする、請求項2に記載の方法。
【請求項5】
式(1)において、sが1を表し、X1が酸素原子又はNHを表し、X2が、
単結合及び式(12)〜(15):
(12) -X3-(CH2)m-X4-
(13) -X3-(CH2)m-X5-(CH2)n-X4-
(14) -X3-(CH2)m-X5-(CH2)n-X6-(CH2)o-X4-
(15) -X3-(CH2)m-X5-(CH2)n-X6-(CH2)o-X7-(CH2)p-X4-
(式中、X3は単結合又はCOを表し、X5、X6及びX7はO、S、NR1、NHCO又はCONHを表し、X4は酸素原子、NH又はCOを表し、R1は水素原子又は炭素数1〜3のアルキル基を表し、m、n、o及びpは独立して1〜5の整数を表す)
のいずれかで表される二価基から独立して選択されることを特徴とする、請求項2に記載の方法。
【請求項6】
式(1)において、sが1を表し、Zが、単結合、NH、CO、及び式(16):
(16) −Z3−(CH2)t−Z4−
(式中、Z3はNH又はCOを表し、Z4はNH、CO、NHCO、CONH、CO−O又はO−COを表し、tは1〜5の整数を表す)
で表される二価基から、独立して選択されることを特徴とする、請求項2に記載の方法。
【請求項7】
式(1)におけるYのエチレングリコールのユニット数が1〜15である、請求項2、5及び6のいずれかに記載の方法。
【請求項8】
式(1)におけるYが以下の式(17)〜(20):

(a、c、f及びjは独立して2〜5の整数を表し、d、g、i及びlは独立して1〜5の整数を表し、b、e、h及びkは独立して1〜15の整数を表す)
から独立して選択される二価基、又は前記式(17)〜式(20)から独立して選択される同一もしくは異なる1又は複数の二価基がアミド結合を介して結合して形成される二価基である、請求項2、5、6及び7のいずれかに記載の方法。
【請求項9】
固相担体が、アガロース系樹脂又は親水性のメタクリレート系樹脂である、請求項1〜8のいずれかに記載の方法。
【請求項10】
試料が細胞又は組織由来の未精製膜画分を含有するものである、請求項1〜9のいずれかに記載の方法。
【請求項11】
細胞又は組織由来の微量膜タンパク質を、質量分析法で同定可能な濃度に濃縮することを特徴とする、請求項1〜10のいずれかに記載の方法。
【請求項12】
式(1):

(式中、X1、X2、Y、Z及びsは請求項2と同義である)
で表され、疎水性化合物がコレステロール誘導体であることを特徴とする固相担体。
【請求項13】
式(1)において、sが0を表し、X1が酸素原子又はNHを表し、X2が、式(2)〜(6):
(2) -X3-(CH2)m-X4-、
(3) -X3-(CH2)m-X5-(CH2)n-X4-、
(4) -X3-(CH2)m-X5-(CH2)n-X6-(CH2)o-X4-、
(5) -X3-(CH2)m-X5-(CH2)n-X6-(CH2)o-X7-(CH2)p-X4-、及び
(6) -CO-
(式中、X3は単結合又はCOを表し、X5、X6及びX7は独立してO、S、NR1、NHCO又はCONHを表し、X4は単結合、CO、NHCO又はO-COを表し、R1は水素原子又は炭素数1〜3のアルキル基を表し、m、n、o及びpは独立して1〜5の整数を表す)
のいずれかで表される二価基から選択され、疎水性化合物上の水酸基から水素原子が脱離した基がX2と結合していることを特徴とする、請求項12に記載の固相担体。
【請求項14】
式(1)において、sが0を表し、X1が酸素原子又はNHを表し、X2が、単結合及び式(7)〜(11):
(7) -X3-(CH2)m-X8-、
(8) -X3-(CH2)m-X5-(CH2)n-X8-、
(9) -X3-(CH2)m-X5-(CH2)n-X6-(CH2)o-X8-、
(10) -X3-(CH2)m-X5-(CH2)n-X6-(CH2)o-X7-(CH2)p-X8-、及び
(11) 単結合
(式中、X3は単結合又はCOを表し、X5、X6及びX7は独立してO、S、NR1、NHCO又はCONHを表し、X8は単結合、酸素原子又はNHを表し、R1は水素原子又は炭素数1〜3のアルキル基を表し、m、n、o及びpは独立して1〜5の整数を表す)
のいずれかで表される二価基から選択され、疎水性化合物上のカルボキシ基から水酸基が脱離した基がX2と結合していることを特徴とする、請求項12に記載の固相担体。
【請求項15】
式(1)において、sが1を表し、X1が酸素原子又はNHを表し、X2が、
単結合及び式(12)〜(15):
(12) -X3-(CH2)m-X4-
(13) -X3-(CH2)m-X5-(CH2)n-X4-
(14) -X3-(CH2)m-X5-(CH2)n-X6-(CH2)o-X4-
(15) -X3-(CH2)m-X5-(CH2)n-X6-(CH2)o-X7-(CH2)p-X4-
(式中、X3は単結合又はCOを表し、X5、X6及びX7はO、S、NR1、NHCO又はCONHを表し、X4は酸素原子、NH又はCOを表し、R1は水素原子又は炭素数1〜3のアルキル基を表し、m、n、o及びpは独立して1〜5の整数を表す)
のいずれかで表される二価基から独立して選択されることを特徴とする、請求項12に記載の固相担体。
【請求項16】
式(1)において、sが1を表し、Zが、単結合、NH、CO、及び式(16):
(16) −Z3−(CH2)t−Z4−
(式中、Z3はNH又はCOを表し、Z4はNH、CO、NHCO、CONH、CO−O又はO−COを表し、tは1〜5の整数を表す)
で表される二価基から、独立して選択されることを特徴とする、請求項12に記載の固相担体。
【請求項17】
式(1)におけるYのエチレングリコールのユニット数が1〜15である、請求項12、15及び16のいずれかに記載の固相担体。
【請求項18】
式(1)におけるYが以下の式(17)〜(20):

(a、c、f及びjは独立して2〜5の整数を表し、d、g、i及びlは独立して1〜5の整数を表し、b、e、h及びkは独立して1〜15の整数を表す)
から独立して選択される二価基、又は前記式(17)〜式(20)から独立して選択される同一もしくは異なる1又は複数の二価基がアミド結合を介して結合して形成される二価基である、請求項12、15、16及び17のいずれかに記載の固相担体。
【請求項19】
請求項12〜18のいずれかに記載の固相担体の、プロテオーム解析用試料調製用試薬としての使用。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2011−236132(P2011−236132A)
【公開日】平成23年11月24日(2011.11.24)
【国際特許分類】
【出願番号】特願2010−106590(P2010−106590)
【出願日】平成22年5月6日(2010.5.6)
【出願人】(000002912)大日本住友製薬株式会社 (332)
【出願人】(000002093)住友化学株式会社 (8,981)
【Fターム(参考)】
【公開日】平成23年11月24日(2011.11.24)
【国際特許分類】
【出願日】平成22年5月6日(2010.5.6)
【出願人】(000002912)大日本住友製薬株式会社 (332)
【出願人】(000002093)住友化学株式会社 (8,981)
【Fターム(参考)】
[ Back to top ]

