核酸の検出方法および核酸検出用キット
【課題】余分な経費を必要とせず、かつ非特異的プライミングおよびそれに伴う非標的核酸の増幅をおこさず、さらには検体中に多量の異なる型の核酸が混在している場合でも容易に特定の型の標的核酸を検出することができる核酸の検出方法および核酸検出用キットを提供する。
【解決手段】核酸の検出方法は、第1のプライマーおよび第2のプライマーを用いて検体における標的核酸を増幅し、増幅産物中の標的核酸の塩基配列とプローブとをハイブリダイズさせて、増幅産物中の標的核酸または標的核酸のいずれかの一本鎖塩基配列を検出する方法であって、プローブとハイブリダイズする側の標的核酸の塩基配列を複製する第1のプライマーまたは第2のプライマーの一方を、他方のプライマーに対し、3.5より大きく10倍量未満、検体を含む反応液に加えることを特徴とする。
【解決手段】核酸の検出方法は、第1のプライマーおよび第2のプライマーを用いて検体における標的核酸を増幅し、増幅産物中の標的核酸の塩基配列とプローブとをハイブリダイズさせて、増幅産物中の標的核酸または標的核酸のいずれかの一本鎖塩基配列を検出する方法であって、プローブとハイブリダイズする側の標的核酸の塩基配列を複製する第1のプライマーまたは第2のプライマーの一方を、他方のプライマーに対し、3.5より大きく10倍量未満、検体を含む反応液に加えることを特徴とする。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、核酸増幅産物にプローブをハイブリダイズさせたハイブリッド複合体を検出する技術に関する。
【背景技術】
【0002】
核酸増幅反応はよく知られており、検体中の標的核酸の濃度を増加させるために用いられる。標的核酸は典型的には検体中に低濃度で存在するため、それを増幅して検体中の標的核酸の濃度を増加させなければ容易に標的核酸を検出することができない。ポリメラーゼ連鎖反応(PCR)は、当該標的核酸の塩基配列を増幅するために、一般に用いられる核酸増幅反応の一つである。
【0003】
PCRの原理によると、標的核酸の塩基配列のコピーの合成を開始させるためにプライマーを使用する。適当な条件下におくことにより、プライマーは標的核酸の塩基配列に隣接するよう核酸の対向鎖にハイブリダイズする。ハイブリダイズ後、プライマーの塩基配列を伸長させて二本鎖を合成する酵素(例えば、DNAポリメラーゼ)等を使用し、それにより標的核酸の塩基配列のコピーを得る。次に、プライマーから伸長した塩基配列(標的核酸の塩基配列のコピー)を解離させて、追加的なプライマーが、元の標的核酸の塩基配列および標的核酸の塩基配列のコピーにハイブリダイズし得るようにし、前述の工程を繰り返す。その結果、標的核酸の更なるコピーが生成する。このように、標的核酸の多数のコピーを生成する。
【0004】
標的核酸の多数のコピーを生成させた後、プローブのシグナル等を用い、核酸増幅産物に標的核酸の特定の一本鎖塩基配列が検出されるか否かを確認する技術がある。核酸増幅産物の標的核酸の一本鎖塩基配列にプローブをハイブリダイズさせ、プローブとのハイブリッド複合体をTm解析等にて検出する技術である。このような増幅技術および検出技術について、核酸増幅用の第1および第2プライマーの混合比率を1.15:1〜3.5:1にして増幅し検出する方法が特許文献1に開示されている。このような混合比率での標的核酸の増幅を行うと、標的核酸の一本鎖塩基配列をプローブで検出する際の核酸増幅産物の濃度が増加するにつれて生じてしまうシグナルの横ばい、さらにはシグナルの停留状態が軽減され得ると記載されている。また、特許文献2には、一方のプライマーの濃度を著しく増加させることにより、標的核酸の一方の塩基配列を優先的に生成させる方法が開示されている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特許第4634608号公報
【特許文献2】米国特許第5066584号明細書
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかしながら、前述した特許文献1の増幅技術および検出技術では、例えば、ワイルドタイプ(野生型)とミュータントタイプ(変異型)のように、検体中に異なる型の核酸が混合している場合に、量が少ない型の核酸を標的核酸とし、ハイブリッド複合体を検出する際、シグナルが弱く、検出し難いという課題を有している。なお、ここでのミュータントタイプ(変異型)とは、ワイルドタイプ(野生型)の塩基配列の一部の塩基が置換、欠失、重複または挿入されることによって生じる新たな塩基配列を意味する。
【0007】
さらに、特許文献2の増幅技術および検出技術では、プライマーペアの一方のプライマーの濃度を著しく増加させなければならないため、余分な経費を必要とし得る。また、プライマー濃度を著しく増加させることは、実質的に、非特異的プライミングおよびそれに伴う非標的核酸の増幅の可能性が増すことになる。
【0008】
本発明は上記事情に鑑みてなされたものであり、余分な経費を必要とせず、かつ非特異的プライミングおよびそれに伴う非標的核酸の増幅をおこさず、さらには検体中に多量の異なる型の核酸が混在している場合でも容易に特定の型の標的核酸を検出することができる核酸の検出方法および核酸検出用キットを提供することを目的とする。
【課題を解決するための手段】
【0009】
本発明者らは、前述した特許文献1または特許文献2に記載の各々のプライマーの混合比率よりも、さらに高い反応性が得られ、上記目的を達し得るプライマーの混合比率を見出し、本発明を完成させるに至った。
【0010】
本発明の第1の観点に係る核酸の検出方法は、第1のプライマーおよび第2のプライマーを用いて検体における標的核酸を増幅し、増幅産物中の前記標的核酸の塩基配列とプローブとをハイブリダイズさせて、前記増幅産物中の前記標的核酸または前記標的核酸のいずれかの一本鎖塩基配列を検出する方法であって、
前記プローブとハイブリダイズする側の前記標的核酸の塩基配列を複製する前記第1のプライマーまたは前記第2のプライマーの一方を、他方のプライマーに対し、3.5より大きく10倍量未満前記検体を含む反応液に加えることを特徴とする。
【0011】
好ましくは、前記標的核酸の塩基配列を複製する前記第1のプライマーまたは前記第2のプライマーの一方を、他方のプライマーに対し、3.5ないし8倍量前記検体を含む反応液に加えることを特徴とする。
【0012】
より好ましくは、前記標的核酸の塩基配列を複製する前記第1のプライマーまたは前記第2のプライマーの一方を、他方のプライマーに対し、4ないし5倍量前記検体を含む反応液に加えることを特徴とする。
【0013】
さらに好ましくは、前記プローブは、前記標的核酸の塩基配列とハイブリダイズするとシグナルが変化するプローブであることを特徴とする。
【0014】
また、好ましくは、前記検体は、存在割合が異なる少なくとも二つ以上の野生型および/または変異型を含む異なる多型の核酸が含有されていることを特徴とする。
【0015】
本発明の第2の観点に係る核酸検出用キットは、第1のプライマーおよび第2のプライマーを用いて検体における標的核酸を増幅し、増幅産物中の前記標的核酸の塩基配列とプローブとをハイブリダイズさせて、前記増幅産物中の前記標的核酸または前記標的核酸のいずれかの一本鎖塩基配列の検出に用いる核酸検出用キットであって、
前記第1のプライマーと、前記第2のプライマーとを含み、
前記プローブとハイブリダイズする側の前記標的核酸の塩基配列を複製する前記第1のプライマーまたは前記第2のプライマーの一方は、他方のプライマーに対し、3.5より大きく10倍量未満含まれることを特徴とする。
【0016】
好ましくは、前記プローブとハイブリダイズする側の前記標的核酸の塩基配列を複製する前記第1のプライマーまたは前記第2のプライマーの一方は、他方のプライマーに対し、3.5ないし8倍量含まれることを特徴とする。
【0017】
より好ましくは、前記プローブとハイブリダイズする側の前記標的核酸の塩基配列を複製する前記第1のプライマーまたは前記第2のプライマーの一方は、他方のプライマーに対し、4ないし5倍量含まれることを特徴とする。
【0018】
また、好ましくは、核酸検出用キットは、さらに、前記プローブを含むことを特徴とする。
【発明の効果】
【0019】
本発明の核酸の検出方法および核酸検出用キットによれば、余分な経費を必要とせず、かつ非特異的プライミングおよびそれに伴う非標的核酸の増幅をおこさず、さらには検体中に多量の異なる型の核酸が混在している場合でも容易に特定の型の標的核酸を検出することができる。
【図面の簡単な説明】
【0020】
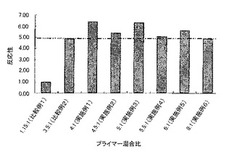
【図1】実施例1ないし6と比較例1および2に係る、第1のプライマーおよび第2のプライマーの総量を固定した場合のTm解析の反応性を示す図である。
【図2】実施例7ないし12と比較例3および4に係る、第2のプライマーの添加量を固定した場合のTm解析の反応性を示す図である。
【発明を実施するための形態】
【0021】
本発明において、「含む」および「有する」は、「からなる」および「から構成される」との意も含むものとする。本発明において、「相同性」とは、特定の塩基配列に80%以上、より好ましくは90%以上、最も好ましくは95%以上、塩基配列が同一であることをいい、5塩基、4塩基、3塩基、2塩基、または1塩基のみ異なる場合を含む。
【0022】
本発明において、検出対象となる試料中の試料核酸、プローブまたはプライマーの個々の配列に関して、これら互いの相補的な関係に基づいて記述された事項は、特に断らない限り、それぞれの配列と、各配列に対して相補的な配列とについても適用される。各配列に対して相補的な当該配列について本発明の事項を適用する際には、当該相補的な配列が認識する配列について、当業者にとっての技術常識の範囲内で、対応する本明細書に記載された配列に相補的な配列として、明細書全体を読み替えるものとする。
【0023】
本発明において、「Tm解析」とはTm値の計測であり、二本鎖核酸が隔離する温度(解離温度:Tm)の計測であって、一般に、260nmにおける吸光度が、吸光度全上昇分の50%に達した時の温度の計測と定義される。すなわち、二本鎖核酸、例えば、二本鎖DNAを含む溶液を加熱していくと、260nmにおける吸光度が上昇する。これは、二本鎖DNAにおける両鎖間の水素結合が加熱によってほどけ、一本鎖DNAに解離(DNAの融解)することが原因である。そして、全ての二本鎖DNAが解離して一本鎖DNAになると、その吸光度は加熱開始時の吸光度(二本鎖DNAのみの吸光度)の約1.5倍程度を示し、これによって融解が完了したと判断できる。Tm値は、この現象に基づき設定される。本発明におけるTm値は、特に断らない限り、50%の塩基が二本鎖を形成し、残る50%が一本鎖に融解する温度をいう。
【0024】
〈核酸の検出方法〉
本発明の実施の形態1は、核酸の検出方法に関する。詳細には、第1のプライマーおよび第2のプライマーを用いて検体における標的核酸を増幅し、増幅産物中の標的核酸の塩基配列とプローブとをハイブリダイズさせて、増幅産物中の標的核酸または標的核酸のいずれかの一本鎖塩基配列を検出する方法であって、プローブとハイブリダイズする側の標的核酸の塩基配列を複製する第1のプライマーまたは第2のプライマーを、他方のプライマーに対し、4ないし8倍量検体を含む反応液に加える核酸の検出方法に関する。
【0025】
本発明において、「第1のプライマー」または「第2のプライマー」は、典型的には塩基配列である。通常は、DNAまたはRNAである。これらのプライマーの塩基配列の長さおよびTm値はプライマーとして機能するのならば任意であるが、通常には、12mer〜40merおよび40度〜70度、好ましくは16mer〜30merおよび55度〜60度である。また、プライマーのペアの各プライマーの長さは同一でなくてもよいが、両プライマーのTm値は、ほぼ同一(または、Tm値の両プライマーでの差が5度以内)であることが好ましい。また、これらのプライマーの塩基配列は、所望の標的核酸の塩基配列にハイブリダイズするのに適した塩基配列と、相同性を有する。標的核酸に対し用いられるプライマーのペアは、当該技術分野においてよく知られているとおり、それらが標的核酸の塩基配列に隣接するように選択される。
【0026】
これらのプライマーは、天然または合成起源に由来するものであってもよく、現在利用可能な種々の技術を用い、常法により合成することが可能である。例えば、このようなプライマーは、通常のヌクレオチド合成のためのホスホルアミジット化学と、Perkin Elmer/ Applied Biosystems, Div.(Foster City, CA)またはPerceptive Biosystems, Inc. (Framingham, MA)から入手可能な装置とで合成することができる。
【0027】
本発明において、「検体」とは、標的核酸を含む可能性を有するものならば任意である。例えば、血液、眼水晶体液、脳脊髄液、乳、腹水液、滑液、腹膜液、羊水、組織、発酵ブロスまたは細胞培養液等の任意の生物学的に由来する、または由来し得るものを挙げることができる。検体は、これらから得られたままの状態において直接的に、またはこれらから得た後、前処理等を行って使用することが可能である。従って、例えば、血液から血漿を調製する、細胞もしくはウイルス粒子を破壊する、固体材料から液体を調製する、粘液を希釈する、液体をろ過する、液体を蒸留する、液体を濃縮する、阻害成分を不活性化する、試薬を加える、または、核酸を精製する等により、検体を使用前に前処理してもよい。
【0028】
本発明において、「標的核酸」とは、検体の中に存在し、第1プライマーおよび第2プライマーによって複製され、増幅され得る、または標識されたプローブによって検出され得る核酸または塩基配列を示す。すなわち、「標的核酸」は、二本鎖構造および一本鎖構造のいずれの構造も含む。
【0029】
本発明において、このような標的核酸の増幅および検出には、第1のプライマーおよび第2のプライマーを使用するのであれば、既知である任意の反応試薬を使用し、さらに既知である任意の反応工程にて行うことが可能である。反応試薬には、例えば、DNAポリメラーゼおよび/または逆転写活性を別々もしくは個々に有する酵素等が挙げられる。その他、例えば、マグネシウムもしくはマンガン、塩、ニコチンアミドアデニンジヌクレオチド(NAD)、デオキシヌクレオチド三リン酸(dNTP)またはその他適当なバッファーも含み得るが、これらのみに限定されない。
【0030】
これらの反応試薬等を用い、検体も含有させた反応混合物を調製した後、標的核酸の増幅を促進する条件に反応混合物を付すことにより、検体内の標的核酸を増幅する。本発明において「増幅条件」は、当該技術分野において既知である、それぞれの標的核酸の増幅反応に適した条件を示す。詳細には、標的核酸の二本鎖構造の解離、一本鎖構造に対するプライマーのハイブリッド形成、プライマーの塩基配列の伸長およびそれによる標的核酸のコピーの形成を促進する条件を含む。次いで、標的核酸のコピーを二本鎖構造から一本鎖構造へ解離させ、追加的なプライマーを、元の標的核酸の塩基配列と標的核酸のコピーの塩基配列との両方にハイブリッド形成させる。このように標的核酸の増幅の新たなサイクルを開始させる。増幅条件およびサイクル回数は任意であり、例えば、反応混合物を2〜100回、好ましくは30〜50回のサイクルに付す。
【0031】
その後、増幅した標的核酸を、プローブにて検出する。本実施の形態1では、ハイブリダイゼーションプローブを使用し、増幅した標的核酸の塩基配列を検出する。ハイブリダイゼーションプローブは、当該標的核酸の塩基配列にハイブリダイズし、ハイブリッド複合体を形成するプローブである。すなわち、二本鎖構造の標的核酸を解離条件下に配置し、生じた一本鎖構造の標的核酸の塩基配列を、プローブの存在下、かつハイブリダイゼーションの条件下に配置することにより、標的核酸の塩基配列とプローブとのハイブリッド複合体の形成を達成することができる。
【0032】
本発明において「解離条件」とは、一般に、二本鎖構造から一本鎖構造への塩基配列の解離を促進する条件と定義される。これらの条件には、高い温度および/または低いイオン強度が含まれ得る。本発明において「ハイブリダイゼーションの条件」とは、一般に、特定の塩基配列と、当該特定の塩基配列に相補的な塩基配列との一本鎖構造塩基配列同士の二本鎖構造形成(ハイブリダイゼーション)を促進する条件を示す。特定の塩基配列に相補的な塩基配列は、当該相補的な塩基配列に相同性を有する塩基配列でも構わない。ハイブリダイゼーションの条件は、温度、イオン強度、塩基配列の長さおよび塩基配列のGC含量等を含むいくつかのパラメーターに、ある程度予想され得る様態で依存することが、当該技術分野ではよく知られている。
【0033】
ハイブリダイゼーション(ハイブリダイズ)は、公知の方法あるいはそれに準じる方法、例えば、モレキュラー・クローニング(Molecular Cloning)2nd(J. Sambrook et al.,Cold Spring Harbor Lab.Prees,1989)に記載の方法等に従って行うことができる。ハイブリダイゼーションの条件には、ストリンジェントな条件を挙げることが可能で、例えば、ナトリウム濃度が約19mM〜約40mM、好ましくは約19mM〜約20mMで、温度が約50度〜約70度、好ましくは約60度〜約65度の条件を示す。特に、ナトリウム濃度が約19mMで温度が約65度の場合がもっとも好ましい。
【0034】
このように、プローブは、それぞれの標的核酸に適した任意の条件下において、第1のプライマーまたは第2のプライマーにて増幅されたいずれかの一本鎖構造の塩基配列と、ハイブリダイゼーションをおこす。ここで、前述のとおり、本実施の形態1では標的核酸の増幅の際、第1のプライマーと第2のプライマーの添加比率をある特定の範囲で以て行っている。特定の範囲とは、後にプローブとハイブリダイゼーションする方の標的核酸の塩基配列を複製するプライマーを、もう一方のプライマーの3.5より大きく10倍量未満検体を含有する反応液に加える。好ましくは、もう一方のプライマーの3.5ないし8倍量加える。より好ましくは、もう一方のプライマーの4ないし5倍量加える。
【0035】
なお、本発明において、「プローブ」とは、例えば蛍光標識等にて標識されうる、核酸または核酸類似体である。例えば、DNA、RNA、ペプチド核酸またはモルホリノ核酸等を挙げることができる。このようなプローブ上に用いる標識の選択は、当業者により行われるものであり、任意である。すなわち、本発明にて用いる「標識」との語は、検出され得る特性を有する任意の分子または部分等を意味する。具体的な検出例としては、プローブが標的核酸の塩基配列とハイブリダイズすると、当該プローブの発するシグナルが変化しそれを検出する方法を挙げることができる。
【0036】
標識の例としては、放射性同位体、発蛍光団、化学発光団、酵素、コロイド粒子、蛍光微粒子またはFRETペア等のように直接的に検出可能であるものを挙げることができる。また、特異的結合メンバーのように、間接的に検出可能であるものでもよい。
【0037】
このように、本実施の形態1では、特定の添加比率(混合比率)での第1のプライマーおよび第2のプライマーを用い、標的核酸を増幅し、プローブを以て検出する。その結果、第1のプライマーまたは第2のプライマーを著しく多く使用する必要がない。つまり、本実施の形態1では、余分な経費を費やしシグナルを強めるのではなく、適度な範囲でプライマーの濃度を増加させ、検出可能である適度な範囲までシグナル(反応性)を強めることができる。さらには、検体内に存在割合が異なる少なくとも二つ以上の型(タイプ、多型)の核酸が含まれている場合、少量しか含有されていない型の検出が容易に可能となる。
【0038】
〈核酸検出用キット〉
本発明の実施の形態2は、核酸検出用キットに関する。詳細には、第1のプライマーおよび第2のプライマーを用いて検体における標的核酸を増幅し、増幅産物中の標的核酸の塩基配列とプローブとをハイブリダイズさせて、増幅産物中の標的核酸または標的核酸のいずれかの一本鎖塩基配列の検出に用いる核酸検出用キットであって、第1のプライマーと、第2のプライマーとを含み、プローブとハイブリダイズする側の標的核酸の塩基配列を複製する第1のプライマーまたは第2のプライマーは、他方のプライマーに対し、3.5より大きく10倍量未満含まれる。好ましくは、他方のプライマーに対し、3.5ないし8倍量含まれる。より好ましくは、他方のプライマーに対し、4ないし5倍量含まれる。すなわち、本実施の形態2に係る核酸検出用キットを使用することにより、前述した実施の形態1に係る核酸の検出方法を実施できればよい。
【0039】
第1のプライマー、第2のプライマー、検体およびプローブ等の用語の定義については、前述の実施の形態1と同様である。また、本実施の形態2に係る核酸検出用キットに関しても、後にプローブの塩基配列とハイブリダイゼーションする方のプライマーは、好ましくはもう一方のプライマーに対し4ないし5倍量含まれる。
【0040】
また、当該プライマー以外にも、検出用プローブ(すなわち、第1のプライマーまたは第2のプライマーのうちのいずれか多量に含まれるプライマーの伸長した塩基配列にハイブリダイズするプローブ)が含まれていてもよい。さらには、実施の形態1において述べたような、例えば、DNAポリメラーゼおよび/または逆転写活性を別々もしくは個々に有する酵素等の反応試薬を含んでも構わない。その他、例えば、マグネシウムもしくはマンガン、塩、ニコチンアミドアデニンジヌクレオチド(NAD)、デオキシヌクレオチド三リン酸(dNTP)またはその他適当なバッファー等を含んでも構わない。このように、本実施の形態2に係る核酸検出用キットを使用することにより、前述した実施の形態1に係る核酸の検出方法を容易に実施することが可能となる。
【実施例】
【0041】
(実施例1ないし6)
本実施例1ないし6では、第1のプライマーと第2のプライマーとの種々の比率において、第1のプライマーおよび第2のプライマーの総量(μL)を固定し、KRAS(v−Ki−ras2 Kirsten rat sarcoma viral oncogene homolog)遺伝子(Homo sapiens、NCBIのGenBankにおけるアクセッション番号は、NC_000012)を増幅、および検出した実施例について説明する。
【0042】
検体には、1μL中にタイプ1(ある特定の型)の核酸を25コピー、タイプ2(他の型)の核酸を225コピー含むものを、1回の実験に4μL使用した。また、試薬処方には、第1のプライマーおよび第2のプライマーを除くと、蒸留水、10%NaN3、20%BSA、1M Tris−HCl(pH8.6)、1M MgCl2、1M KCl、10mM dNTP Mix、80% Glycerol、100μM プローブ、および、0.94U/μL DNAポリメラーゼを使用した。下記の表1にこれらの試薬の1回の実験当たりの使用量を示す。なお、下記の表1に示す蒸留水の添加量(μL)のxは、1回の実験当たりの試薬の合計量が、後に述べる第1のプライマーおよび第2のプライマーの量も含め、46μLとなる量に合わせた。すなわち、検体の量(4μL)も合わせ、全ての合計を50μLとして1回の実験を行った。
【表1】

【0043】
第1のプライマーおよび第2のプライマーは、いずれも100μMのものを用いた。それぞれの塩基配列を以下に示す。さらに、プローブの塩基配列についても以下に示す。
第1のプライマー、配列番号1
5’−ggtactggtggagtatttgatagtgt−3’
第2のプライマー、配列番号2
5’−cacaaaatgattctgaattagctgtatcg−3’
プローブ、配列番号3
5’−(BODIPY FL)−ctcttgcctacgccaccagctccaacttgctggctacgc−P−3’
【0044】
これらのプライマーを下記の表2に述べる種々の混合比および添加量(μL)にて、前述した1回の実験当たりの原材料と共に、反応条件下に置いた。
【表2】

【0045】
表2に示すように、種々の混合比のいずれの場合においても第1のプライマーと第2のプライマーとの添加量(μL)の合計が、0.75μLとなるように行った。PCRの反応条件は、95℃で60秒後、95℃1秒間と56℃15秒間とを50サイクル繰り返すことにより増幅を行った。次いで、40℃から95℃まで、1℃/3secにてTm解析を行った。励起波長は420〜485nmであり、検出波長は520〜555nmである。
【0046】
ここで、タイプ1のTm値は73℃、タイプ2のTm値は67℃と設定していたことから、Tm解析で73℃におけるタイプ1のピーク強度をTm解析における最大蛍光値で割った値を反応性として算出し、それぞれの混合比での反応性を評価した。また、これらの混合比の反応性を比較するために、比較例1および2として混合比以外の条件は全て前述と同様とし、混合比を1.15:1と3.5:1とする実験も同時に行った。当該1.15:1と3.5:1の混合比の場合の添加量(μL)を、下記の表3に示す。なお、この場合についても、第1のプライマーおよび第2のプライマーの総量(μL)を前述の実施例1ないし6と同様に0.75μLに固定した。
【表3】

【0047】
以下の表4に、実施例1ないし6、ならびに比較例1および2における、反応性(Tm73℃のピークの値/蛍光最大値×100)の結果を示す。なお、それぞれの条件において3回実施し(n1、n2、n3)、平均値(Ave)を算出した。
【表4】

【0048】
また、図1は、実施例1ないし6と比較例1および2に係る、第1のプライマーおよび第2のプライマーの総量を固定した場合のTm解析の反応性を示す図である。すなわち、表4における結果を図に示したものである。表4および図1に示すように、1.15:1と3.5:1の場合のプライマー混合比(比較例1および2)よりも、4:1、4.5:1、5:1、5.5:1および6:1の場合のプライマー混合比(実施例1ないし5)の方が高い反応性が得られた。特に、4:1〜5:1の場合のプライマー混合比が、より高い反応性、安定性、及び再現性を得られることが確認できた。また、1.15:1の場合のプライマー混合比(比較例1)の反応性を考慮すると、3.5:1〜4:1および8:1〜10:1の場合のプライマー混合比であっても高い反応性が得られうることが示唆される。
【0049】
(実施例7ないし12)
本実施例7ないし12では、第1のプライマーと第2のプライマーとの種々の比率において、第2のプライマーの量(μL)のみを固定し、KRAS遺伝子を増幅、および検出した実施例について説明する。
【0050】
検体、試薬処方およびTm解析と、第1のプライマー、第2のプライマーおよびプローブの塩基配列については、前述の実施例1ないし6と同様である。また、第1のプライマーおよび第2のプライマーの混合比についても、前述の実施例1ないし6と、本実施例7ないし12とが同混合比に対応している。本実施例7ないし12では、第2のプライマーの量(μL)のみを固定して実験した。すなわち、第1のプライマーおよび第2のプライマーの総量(μL)は、前述の実施例1ないし6とは異なる。下記の表5に、本実施例7ないし12に係る、第1のプライマーおよび第2のプライマーの混合比および添加量(μL)を示す。
【表5】

【0051】
表5に示すように、本実施例7ないし12では、第2のプライマーの添加量(μL)を0.10μLに固定した。当該第2のプライマーの添加量(μL)に合わせ、混合比が前述の実施例1ないし6と対応するよう第1のプライマーを添加した。さらに、実施例1ないし6と同様に、反応性を比較するため、比較例3および4として混合比以外の条件は全て同様とし混合比が1.15:1と3.5:1の場合における実験を行った。1.15:1と3.5:1の混合比の場合の添加量(μL)を、下記の表6に示す。この場合についても、第2のプライマーの添加量(μL)のみを0.10μLに固定した。
【表6】

【0052】
以下の表7に、実施例7ないし12、ならびに比較例3および4における、反応性(Tm73℃のピークの値/蛍光最大値×100)の結果を示す。なお、それぞれの条件において3回実施し(n1、n2、n3)、平均値(Ave)を算出した。
【表7】

【0053】
また、図2は、実施例7ないし12と比較例3および4に係る、第2のプライマーの添加量を固定した場合のTm解析の反応性を示す図である。すなわち、表7における結果を図に示したものである。表7および図2に示すように、1.15:1と3.5:1の場合のプライマー混合比(比較例3および4)よりも、4.5:1、5:1、5.5:1、6:1および8:1の場合のプライマー混合比(実施例8ないし12)の方がより高い反応性が得られた。また、1.15:1の場合のプライマー混合比(比較例1)の反応性を考慮すると、3.5:1〜4:1および8:1〜10:1の場合のプライマー混合比であっても高い反応性が得られうることが示唆される。
【0054】
このように、実施例1ないし12と比較例1ないし4の結果から、1.15:1〜3.5:1の場合のプライマー混合比よりも、3.5:1〜10:1の場合のプライマー混合比の方が高い反応性が得られ得るということが確認できた。さらに、実施例1ないし6と実施例7ないし12とを比較すると、実施例1ないし6の方が高い反応性が得られていることも確認できた。これは、第1プライマーおよび第2プライマーの総量を固定しているので、プライマー混合比が、例えば4:1〜8:1の場合でも、第1プライマーおよび第2プライマーの総量が増加することなく、非特異的プライミングの影響をある程度解消できるためと考えられる。
【0055】
本発明は、上記発明の実施の形態および実施例の説明に何ら限定されるものではない。特許請求の範囲の記載を逸脱せず、当業者が容易に想到できる範囲で種々の変形態様もこの発明に含まれる。
【0056】
本明細書の中で明示した公開特許公報の内容は、その全ての内容を援用によって引用することとする。
【産業上の利用可能性】
【0057】
本発明を利用することにより、検体中に異なる型(タイプ)の核酸が混在しており、かつ量が少ない型(タイプ)のハイブリッド複合体をプローブにて検出する際に、シグナルを弱めることなく検出することが可能となる。詳細には、一方のプライマーの濃度を著しく多く増加させ、余分な経費を使用しシグナルを強めるのではなく、適度な範囲でプライマーの濃度を増やし、検出可能である適度な範囲までシグナルを強めることができる。さらに、このような適度な範囲でのプライマーの濃度を使用するため、非特異的プライミングおよびそれに伴う非標的核酸の増幅の可能性を減少させることができ、標的核酸の塩基配列の検出の際における反応性を高めることができる。
【技術分野】
【0001】
本発明は、核酸増幅産物にプローブをハイブリダイズさせたハイブリッド複合体を検出する技術に関する。
【背景技術】
【0002】
核酸増幅反応はよく知られており、検体中の標的核酸の濃度を増加させるために用いられる。標的核酸は典型的には検体中に低濃度で存在するため、それを増幅して検体中の標的核酸の濃度を増加させなければ容易に標的核酸を検出することができない。ポリメラーゼ連鎖反応(PCR)は、当該標的核酸の塩基配列を増幅するために、一般に用いられる核酸増幅反応の一つである。
【0003】
PCRの原理によると、標的核酸の塩基配列のコピーの合成を開始させるためにプライマーを使用する。適当な条件下におくことにより、プライマーは標的核酸の塩基配列に隣接するよう核酸の対向鎖にハイブリダイズする。ハイブリダイズ後、プライマーの塩基配列を伸長させて二本鎖を合成する酵素(例えば、DNAポリメラーゼ)等を使用し、それにより標的核酸の塩基配列のコピーを得る。次に、プライマーから伸長した塩基配列(標的核酸の塩基配列のコピー)を解離させて、追加的なプライマーが、元の標的核酸の塩基配列および標的核酸の塩基配列のコピーにハイブリダイズし得るようにし、前述の工程を繰り返す。その結果、標的核酸の更なるコピーが生成する。このように、標的核酸の多数のコピーを生成する。
【0004】
標的核酸の多数のコピーを生成させた後、プローブのシグナル等を用い、核酸増幅産物に標的核酸の特定の一本鎖塩基配列が検出されるか否かを確認する技術がある。核酸増幅産物の標的核酸の一本鎖塩基配列にプローブをハイブリダイズさせ、プローブとのハイブリッド複合体をTm解析等にて検出する技術である。このような増幅技術および検出技術について、核酸増幅用の第1および第2プライマーの混合比率を1.15:1〜3.5:1にして増幅し検出する方法が特許文献1に開示されている。このような混合比率での標的核酸の増幅を行うと、標的核酸の一本鎖塩基配列をプローブで検出する際の核酸増幅産物の濃度が増加するにつれて生じてしまうシグナルの横ばい、さらにはシグナルの停留状態が軽減され得ると記載されている。また、特許文献2には、一方のプライマーの濃度を著しく増加させることにより、標的核酸の一方の塩基配列を優先的に生成させる方法が開示されている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特許第4634608号公報
【特許文献2】米国特許第5066584号明細書
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかしながら、前述した特許文献1の増幅技術および検出技術では、例えば、ワイルドタイプ(野生型)とミュータントタイプ(変異型)のように、検体中に異なる型の核酸が混合している場合に、量が少ない型の核酸を標的核酸とし、ハイブリッド複合体を検出する際、シグナルが弱く、検出し難いという課題を有している。なお、ここでのミュータントタイプ(変異型)とは、ワイルドタイプ(野生型)の塩基配列の一部の塩基が置換、欠失、重複または挿入されることによって生じる新たな塩基配列を意味する。
【0007】
さらに、特許文献2の増幅技術および検出技術では、プライマーペアの一方のプライマーの濃度を著しく増加させなければならないため、余分な経費を必要とし得る。また、プライマー濃度を著しく増加させることは、実質的に、非特異的プライミングおよびそれに伴う非標的核酸の増幅の可能性が増すことになる。
【0008】
本発明は上記事情に鑑みてなされたものであり、余分な経費を必要とせず、かつ非特異的プライミングおよびそれに伴う非標的核酸の増幅をおこさず、さらには検体中に多量の異なる型の核酸が混在している場合でも容易に特定の型の標的核酸を検出することができる核酸の検出方法および核酸検出用キットを提供することを目的とする。
【課題を解決するための手段】
【0009】
本発明者らは、前述した特許文献1または特許文献2に記載の各々のプライマーの混合比率よりも、さらに高い反応性が得られ、上記目的を達し得るプライマーの混合比率を見出し、本発明を完成させるに至った。
【0010】
本発明の第1の観点に係る核酸の検出方法は、第1のプライマーおよび第2のプライマーを用いて検体における標的核酸を増幅し、増幅産物中の前記標的核酸の塩基配列とプローブとをハイブリダイズさせて、前記増幅産物中の前記標的核酸または前記標的核酸のいずれかの一本鎖塩基配列を検出する方法であって、
前記プローブとハイブリダイズする側の前記標的核酸の塩基配列を複製する前記第1のプライマーまたは前記第2のプライマーの一方を、他方のプライマーに対し、3.5より大きく10倍量未満前記検体を含む反応液に加えることを特徴とする。
【0011】
好ましくは、前記標的核酸の塩基配列を複製する前記第1のプライマーまたは前記第2のプライマーの一方を、他方のプライマーに対し、3.5ないし8倍量前記検体を含む反応液に加えることを特徴とする。
【0012】
より好ましくは、前記標的核酸の塩基配列を複製する前記第1のプライマーまたは前記第2のプライマーの一方を、他方のプライマーに対し、4ないし5倍量前記検体を含む反応液に加えることを特徴とする。
【0013】
さらに好ましくは、前記プローブは、前記標的核酸の塩基配列とハイブリダイズするとシグナルが変化するプローブであることを特徴とする。
【0014】
また、好ましくは、前記検体は、存在割合が異なる少なくとも二つ以上の野生型および/または変異型を含む異なる多型の核酸が含有されていることを特徴とする。
【0015】
本発明の第2の観点に係る核酸検出用キットは、第1のプライマーおよび第2のプライマーを用いて検体における標的核酸を増幅し、増幅産物中の前記標的核酸の塩基配列とプローブとをハイブリダイズさせて、前記増幅産物中の前記標的核酸または前記標的核酸のいずれかの一本鎖塩基配列の検出に用いる核酸検出用キットであって、
前記第1のプライマーと、前記第2のプライマーとを含み、
前記プローブとハイブリダイズする側の前記標的核酸の塩基配列を複製する前記第1のプライマーまたは前記第2のプライマーの一方は、他方のプライマーに対し、3.5より大きく10倍量未満含まれることを特徴とする。
【0016】
好ましくは、前記プローブとハイブリダイズする側の前記標的核酸の塩基配列を複製する前記第1のプライマーまたは前記第2のプライマーの一方は、他方のプライマーに対し、3.5ないし8倍量含まれることを特徴とする。
【0017】
より好ましくは、前記プローブとハイブリダイズする側の前記標的核酸の塩基配列を複製する前記第1のプライマーまたは前記第2のプライマーの一方は、他方のプライマーに対し、4ないし5倍量含まれることを特徴とする。
【0018】
また、好ましくは、核酸検出用キットは、さらに、前記プローブを含むことを特徴とする。
【発明の効果】
【0019】
本発明の核酸の検出方法および核酸検出用キットによれば、余分な経費を必要とせず、かつ非特異的プライミングおよびそれに伴う非標的核酸の増幅をおこさず、さらには検体中に多量の異なる型の核酸が混在している場合でも容易に特定の型の標的核酸を検出することができる。
【図面の簡単な説明】
【0020】
【図1】実施例1ないし6と比較例1および2に係る、第1のプライマーおよび第2のプライマーの総量を固定した場合のTm解析の反応性を示す図である。
【図2】実施例7ないし12と比較例3および4に係る、第2のプライマーの添加量を固定した場合のTm解析の反応性を示す図である。
【発明を実施するための形態】
【0021】
本発明において、「含む」および「有する」は、「からなる」および「から構成される」との意も含むものとする。本発明において、「相同性」とは、特定の塩基配列に80%以上、より好ましくは90%以上、最も好ましくは95%以上、塩基配列が同一であることをいい、5塩基、4塩基、3塩基、2塩基、または1塩基のみ異なる場合を含む。
【0022】
本発明において、検出対象となる試料中の試料核酸、プローブまたはプライマーの個々の配列に関して、これら互いの相補的な関係に基づいて記述された事項は、特に断らない限り、それぞれの配列と、各配列に対して相補的な配列とについても適用される。各配列に対して相補的な当該配列について本発明の事項を適用する際には、当該相補的な配列が認識する配列について、当業者にとっての技術常識の範囲内で、対応する本明細書に記載された配列に相補的な配列として、明細書全体を読み替えるものとする。
【0023】
本発明において、「Tm解析」とはTm値の計測であり、二本鎖核酸が隔離する温度(解離温度:Tm)の計測であって、一般に、260nmにおける吸光度が、吸光度全上昇分の50%に達した時の温度の計測と定義される。すなわち、二本鎖核酸、例えば、二本鎖DNAを含む溶液を加熱していくと、260nmにおける吸光度が上昇する。これは、二本鎖DNAにおける両鎖間の水素結合が加熱によってほどけ、一本鎖DNAに解離(DNAの融解)することが原因である。そして、全ての二本鎖DNAが解離して一本鎖DNAになると、その吸光度は加熱開始時の吸光度(二本鎖DNAのみの吸光度)の約1.5倍程度を示し、これによって融解が完了したと判断できる。Tm値は、この現象に基づき設定される。本発明におけるTm値は、特に断らない限り、50%の塩基が二本鎖を形成し、残る50%が一本鎖に融解する温度をいう。
【0024】
〈核酸の検出方法〉
本発明の実施の形態1は、核酸の検出方法に関する。詳細には、第1のプライマーおよび第2のプライマーを用いて検体における標的核酸を増幅し、増幅産物中の標的核酸の塩基配列とプローブとをハイブリダイズさせて、増幅産物中の標的核酸または標的核酸のいずれかの一本鎖塩基配列を検出する方法であって、プローブとハイブリダイズする側の標的核酸の塩基配列を複製する第1のプライマーまたは第2のプライマーを、他方のプライマーに対し、4ないし8倍量検体を含む反応液に加える核酸の検出方法に関する。
【0025】
本発明において、「第1のプライマー」または「第2のプライマー」は、典型的には塩基配列である。通常は、DNAまたはRNAである。これらのプライマーの塩基配列の長さおよびTm値はプライマーとして機能するのならば任意であるが、通常には、12mer〜40merおよび40度〜70度、好ましくは16mer〜30merおよび55度〜60度である。また、プライマーのペアの各プライマーの長さは同一でなくてもよいが、両プライマーのTm値は、ほぼ同一(または、Tm値の両プライマーでの差が5度以内)であることが好ましい。また、これらのプライマーの塩基配列は、所望の標的核酸の塩基配列にハイブリダイズするのに適した塩基配列と、相同性を有する。標的核酸に対し用いられるプライマーのペアは、当該技術分野においてよく知られているとおり、それらが標的核酸の塩基配列に隣接するように選択される。
【0026】
これらのプライマーは、天然または合成起源に由来するものであってもよく、現在利用可能な種々の技術を用い、常法により合成することが可能である。例えば、このようなプライマーは、通常のヌクレオチド合成のためのホスホルアミジット化学と、Perkin Elmer/ Applied Biosystems, Div.(Foster City, CA)またはPerceptive Biosystems, Inc. (Framingham, MA)から入手可能な装置とで合成することができる。
【0027】
本発明において、「検体」とは、標的核酸を含む可能性を有するものならば任意である。例えば、血液、眼水晶体液、脳脊髄液、乳、腹水液、滑液、腹膜液、羊水、組織、発酵ブロスまたは細胞培養液等の任意の生物学的に由来する、または由来し得るものを挙げることができる。検体は、これらから得られたままの状態において直接的に、またはこれらから得た後、前処理等を行って使用することが可能である。従って、例えば、血液から血漿を調製する、細胞もしくはウイルス粒子を破壊する、固体材料から液体を調製する、粘液を希釈する、液体をろ過する、液体を蒸留する、液体を濃縮する、阻害成分を不活性化する、試薬を加える、または、核酸を精製する等により、検体を使用前に前処理してもよい。
【0028】
本発明において、「標的核酸」とは、検体の中に存在し、第1プライマーおよび第2プライマーによって複製され、増幅され得る、または標識されたプローブによって検出され得る核酸または塩基配列を示す。すなわち、「標的核酸」は、二本鎖構造および一本鎖構造のいずれの構造も含む。
【0029】
本発明において、このような標的核酸の増幅および検出には、第1のプライマーおよび第2のプライマーを使用するのであれば、既知である任意の反応試薬を使用し、さらに既知である任意の反応工程にて行うことが可能である。反応試薬には、例えば、DNAポリメラーゼおよび/または逆転写活性を別々もしくは個々に有する酵素等が挙げられる。その他、例えば、マグネシウムもしくはマンガン、塩、ニコチンアミドアデニンジヌクレオチド(NAD)、デオキシヌクレオチド三リン酸(dNTP)またはその他適当なバッファーも含み得るが、これらのみに限定されない。
【0030】
これらの反応試薬等を用い、検体も含有させた反応混合物を調製した後、標的核酸の増幅を促進する条件に反応混合物を付すことにより、検体内の標的核酸を増幅する。本発明において「増幅条件」は、当該技術分野において既知である、それぞれの標的核酸の増幅反応に適した条件を示す。詳細には、標的核酸の二本鎖構造の解離、一本鎖構造に対するプライマーのハイブリッド形成、プライマーの塩基配列の伸長およびそれによる標的核酸のコピーの形成を促進する条件を含む。次いで、標的核酸のコピーを二本鎖構造から一本鎖構造へ解離させ、追加的なプライマーを、元の標的核酸の塩基配列と標的核酸のコピーの塩基配列との両方にハイブリッド形成させる。このように標的核酸の増幅の新たなサイクルを開始させる。増幅条件およびサイクル回数は任意であり、例えば、反応混合物を2〜100回、好ましくは30〜50回のサイクルに付す。
【0031】
その後、増幅した標的核酸を、プローブにて検出する。本実施の形態1では、ハイブリダイゼーションプローブを使用し、増幅した標的核酸の塩基配列を検出する。ハイブリダイゼーションプローブは、当該標的核酸の塩基配列にハイブリダイズし、ハイブリッド複合体を形成するプローブである。すなわち、二本鎖構造の標的核酸を解離条件下に配置し、生じた一本鎖構造の標的核酸の塩基配列を、プローブの存在下、かつハイブリダイゼーションの条件下に配置することにより、標的核酸の塩基配列とプローブとのハイブリッド複合体の形成を達成することができる。
【0032】
本発明において「解離条件」とは、一般に、二本鎖構造から一本鎖構造への塩基配列の解離を促進する条件と定義される。これらの条件には、高い温度および/または低いイオン強度が含まれ得る。本発明において「ハイブリダイゼーションの条件」とは、一般に、特定の塩基配列と、当該特定の塩基配列に相補的な塩基配列との一本鎖構造塩基配列同士の二本鎖構造形成(ハイブリダイゼーション)を促進する条件を示す。特定の塩基配列に相補的な塩基配列は、当該相補的な塩基配列に相同性を有する塩基配列でも構わない。ハイブリダイゼーションの条件は、温度、イオン強度、塩基配列の長さおよび塩基配列のGC含量等を含むいくつかのパラメーターに、ある程度予想され得る様態で依存することが、当該技術分野ではよく知られている。
【0033】
ハイブリダイゼーション(ハイブリダイズ)は、公知の方法あるいはそれに準じる方法、例えば、モレキュラー・クローニング(Molecular Cloning)2nd(J. Sambrook et al.,Cold Spring Harbor Lab.Prees,1989)に記載の方法等に従って行うことができる。ハイブリダイゼーションの条件には、ストリンジェントな条件を挙げることが可能で、例えば、ナトリウム濃度が約19mM〜約40mM、好ましくは約19mM〜約20mMで、温度が約50度〜約70度、好ましくは約60度〜約65度の条件を示す。特に、ナトリウム濃度が約19mMで温度が約65度の場合がもっとも好ましい。
【0034】
このように、プローブは、それぞれの標的核酸に適した任意の条件下において、第1のプライマーまたは第2のプライマーにて増幅されたいずれかの一本鎖構造の塩基配列と、ハイブリダイゼーションをおこす。ここで、前述のとおり、本実施の形態1では標的核酸の増幅の際、第1のプライマーと第2のプライマーの添加比率をある特定の範囲で以て行っている。特定の範囲とは、後にプローブとハイブリダイゼーションする方の標的核酸の塩基配列を複製するプライマーを、もう一方のプライマーの3.5より大きく10倍量未満検体を含有する反応液に加える。好ましくは、もう一方のプライマーの3.5ないし8倍量加える。より好ましくは、もう一方のプライマーの4ないし5倍量加える。
【0035】
なお、本発明において、「プローブ」とは、例えば蛍光標識等にて標識されうる、核酸または核酸類似体である。例えば、DNA、RNA、ペプチド核酸またはモルホリノ核酸等を挙げることができる。このようなプローブ上に用いる標識の選択は、当業者により行われるものであり、任意である。すなわち、本発明にて用いる「標識」との語は、検出され得る特性を有する任意の分子または部分等を意味する。具体的な検出例としては、プローブが標的核酸の塩基配列とハイブリダイズすると、当該プローブの発するシグナルが変化しそれを検出する方法を挙げることができる。
【0036】
標識の例としては、放射性同位体、発蛍光団、化学発光団、酵素、コロイド粒子、蛍光微粒子またはFRETペア等のように直接的に検出可能であるものを挙げることができる。また、特異的結合メンバーのように、間接的に検出可能であるものでもよい。
【0037】
このように、本実施の形態1では、特定の添加比率(混合比率)での第1のプライマーおよび第2のプライマーを用い、標的核酸を増幅し、プローブを以て検出する。その結果、第1のプライマーまたは第2のプライマーを著しく多く使用する必要がない。つまり、本実施の形態1では、余分な経費を費やしシグナルを強めるのではなく、適度な範囲でプライマーの濃度を増加させ、検出可能である適度な範囲までシグナル(反応性)を強めることができる。さらには、検体内に存在割合が異なる少なくとも二つ以上の型(タイプ、多型)の核酸が含まれている場合、少量しか含有されていない型の検出が容易に可能となる。
【0038】
〈核酸検出用キット〉
本発明の実施の形態2は、核酸検出用キットに関する。詳細には、第1のプライマーおよび第2のプライマーを用いて検体における標的核酸を増幅し、増幅産物中の標的核酸の塩基配列とプローブとをハイブリダイズさせて、増幅産物中の標的核酸または標的核酸のいずれかの一本鎖塩基配列の検出に用いる核酸検出用キットであって、第1のプライマーと、第2のプライマーとを含み、プローブとハイブリダイズする側の標的核酸の塩基配列を複製する第1のプライマーまたは第2のプライマーは、他方のプライマーに対し、3.5より大きく10倍量未満含まれる。好ましくは、他方のプライマーに対し、3.5ないし8倍量含まれる。より好ましくは、他方のプライマーに対し、4ないし5倍量含まれる。すなわち、本実施の形態2に係る核酸検出用キットを使用することにより、前述した実施の形態1に係る核酸の検出方法を実施できればよい。
【0039】
第1のプライマー、第2のプライマー、検体およびプローブ等の用語の定義については、前述の実施の形態1と同様である。また、本実施の形態2に係る核酸検出用キットに関しても、後にプローブの塩基配列とハイブリダイゼーションする方のプライマーは、好ましくはもう一方のプライマーに対し4ないし5倍量含まれる。
【0040】
また、当該プライマー以外にも、検出用プローブ(すなわち、第1のプライマーまたは第2のプライマーのうちのいずれか多量に含まれるプライマーの伸長した塩基配列にハイブリダイズするプローブ)が含まれていてもよい。さらには、実施の形態1において述べたような、例えば、DNAポリメラーゼおよび/または逆転写活性を別々もしくは個々に有する酵素等の反応試薬を含んでも構わない。その他、例えば、マグネシウムもしくはマンガン、塩、ニコチンアミドアデニンジヌクレオチド(NAD)、デオキシヌクレオチド三リン酸(dNTP)またはその他適当なバッファー等を含んでも構わない。このように、本実施の形態2に係る核酸検出用キットを使用することにより、前述した実施の形態1に係る核酸の検出方法を容易に実施することが可能となる。
【実施例】
【0041】
(実施例1ないし6)
本実施例1ないし6では、第1のプライマーと第2のプライマーとの種々の比率において、第1のプライマーおよび第2のプライマーの総量(μL)を固定し、KRAS(v−Ki−ras2 Kirsten rat sarcoma viral oncogene homolog)遺伝子(Homo sapiens、NCBIのGenBankにおけるアクセッション番号は、NC_000012)を増幅、および検出した実施例について説明する。
【0042】
検体には、1μL中にタイプ1(ある特定の型)の核酸を25コピー、タイプ2(他の型)の核酸を225コピー含むものを、1回の実験に4μL使用した。また、試薬処方には、第1のプライマーおよび第2のプライマーを除くと、蒸留水、10%NaN3、20%BSA、1M Tris−HCl(pH8.6)、1M MgCl2、1M KCl、10mM dNTP Mix、80% Glycerol、100μM プローブ、および、0.94U/μL DNAポリメラーゼを使用した。下記の表1にこれらの試薬の1回の実験当たりの使用量を示す。なお、下記の表1に示す蒸留水の添加量(μL)のxは、1回の実験当たりの試薬の合計量が、後に述べる第1のプライマーおよび第2のプライマーの量も含め、46μLとなる量に合わせた。すなわち、検体の量(4μL)も合わせ、全ての合計を50μLとして1回の実験を行った。
【表1】

【0043】
第1のプライマーおよび第2のプライマーは、いずれも100μMのものを用いた。それぞれの塩基配列を以下に示す。さらに、プローブの塩基配列についても以下に示す。
第1のプライマー、配列番号1
5’−ggtactggtggagtatttgatagtgt−3’
第2のプライマー、配列番号2
5’−cacaaaatgattctgaattagctgtatcg−3’
プローブ、配列番号3
5’−(BODIPY FL)−ctcttgcctacgccaccagctccaacttgctggctacgc−P−3’
【0044】
これらのプライマーを下記の表2に述べる種々の混合比および添加量(μL)にて、前述した1回の実験当たりの原材料と共に、反応条件下に置いた。
【表2】

【0045】
表2に示すように、種々の混合比のいずれの場合においても第1のプライマーと第2のプライマーとの添加量(μL)の合計が、0.75μLとなるように行った。PCRの反応条件は、95℃で60秒後、95℃1秒間と56℃15秒間とを50サイクル繰り返すことにより増幅を行った。次いで、40℃から95℃まで、1℃/3secにてTm解析を行った。励起波長は420〜485nmであり、検出波長は520〜555nmである。
【0046】
ここで、タイプ1のTm値は73℃、タイプ2のTm値は67℃と設定していたことから、Tm解析で73℃におけるタイプ1のピーク強度をTm解析における最大蛍光値で割った値を反応性として算出し、それぞれの混合比での反応性を評価した。また、これらの混合比の反応性を比較するために、比較例1および2として混合比以外の条件は全て前述と同様とし、混合比を1.15:1と3.5:1とする実験も同時に行った。当該1.15:1と3.5:1の混合比の場合の添加量(μL)を、下記の表3に示す。なお、この場合についても、第1のプライマーおよび第2のプライマーの総量(μL)を前述の実施例1ないし6と同様に0.75μLに固定した。
【表3】

【0047】
以下の表4に、実施例1ないし6、ならびに比較例1および2における、反応性(Tm73℃のピークの値/蛍光最大値×100)の結果を示す。なお、それぞれの条件において3回実施し(n1、n2、n3)、平均値(Ave)を算出した。
【表4】

【0048】
また、図1は、実施例1ないし6と比較例1および2に係る、第1のプライマーおよび第2のプライマーの総量を固定した場合のTm解析の反応性を示す図である。すなわち、表4における結果を図に示したものである。表4および図1に示すように、1.15:1と3.5:1の場合のプライマー混合比(比較例1および2)よりも、4:1、4.5:1、5:1、5.5:1および6:1の場合のプライマー混合比(実施例1ないし5)の方が高い反応性が得られた。特に、4:1〜5:1の場合のプライマー混合比が、より高い反応性、安定性、及び再現性を得られることが確認できた。また、1.15:1の場合のプライマー混合比(比較例1)の反応性を考慮すると、3.5:1〜4:1および8:1〜10:1の場合のプライマー混合比であっても高い反応性が得られうることが示唆される。
【0049】
(実施例7ないし12)
本実施例7ないし12では、第1のプライマーと第2のプライマーとの種々の比率において、第2のプライマーの量(μL)のみを固定し、KRAS遺伝子を増幅、および検出した実施例について説明する。
【0050】
検体、試薬処方およびTm解析と、第1のプライマー、第2のプライマーおよびプローブの塩基配列については、前述の実施例1ないし6と同様である。また、第1のプライマーおよび第2のプライマーの混合比についても、前述の実施例1ないし6と、本実施例7ないし12とが同混合比に対応している。本実施例7ないし12では、第2のプライマーの量(μL)のみを固定して実験した。すなわち、第1のプライマーおよび第2のプライマーの総量(μL)は、前述の実施例1ないし6とは異なる。下記の表5に、本実施例7ないし12に係る、第1のプライマーおよび第2のプライマーの混合比および添加量(μL)を示す。
【表5】

【0051】
表5に示すように、本実施例7ないし12では、第2のプライマーの添加量(μL)を0.10μLに固定した。当該第2のプライマーの添加量(μL)に合わせ、混合比が前述の実施例1ないし6と対応するよう第1のプライマーを添加した。さらに、実施例1ないし6と同様に、反応性を比較するため、比較例3および4として混合比以外の条件は全て同様とし混合比が1.15:1と3.5:1の場合における実験を行った。1.15:1と3.5:1の混合比の場合の添加量(μL)を、下記の表6に示す。この場合についても、第2のプライマーの添加量(μL)のみを0.10μLに固定した。
【表6】

【0052】
以下の表7に、実施例7ないし12、ならびに比較例3および4における、反応性(Tm73℃のピークの値/蛍光最大値×100)の結果を示す。なお、それぞれの条件において3回実施し(n1、n2、n3)、平均値(Ave)を算出した。
【表7】

【0053】
また、図2は、実施例7ないし12と比較例3および4に係る、第2のプライマーの添加量を固定した場合のTm解析の反応性を示す図である。すなわち、表7における結果を図に示したものである。表7および図2に示すように、1.15:1と3.5:1の場合のプライマー混合比(比較例3および4)よりも、4.5:1、5:1、5.5:1、6:1および8:1の場合のプライマー混合比(実施例8ないし12)の方がより高い反応性が得られた。また、1.15:1の場合のプライマー混合比(比較例1)の反応性を考慮すると、3.5:1〜4:1および8:1〜10:1の場合のプライマー混合比であっても高い反応性が得られうることが示唆される。
【0054】
このように、実施例1ないし12と比較例1ないし4の結果から、1.15:1〜3.5:1の場合のプライマー混合比よりも、3.5:1〜10:1の場合のプライマー混合比の方が高い反応性が得られ得るということが確認できた。さらに、実施例1ないし6と実施例7ないし12とを比較すると、実施例1ないし6の方が高い反応性が得られていることも確認できた。これは、第1プライマーおよび第2プライマーの総量を固定しているので、プライマー混合比が、例えば4:1〜8:1の場合でも、第1プライマーおよび第2プライマーの総量が増加することなく、非特異的プライミングの影響をある程度解消できるためと考えられる。
【0055】
本発明は、上記発明の実施の形態および実施例の説明に何ら限定されるものではない。特許請求の範囲の記載を逸脱せず、当業者が容易に想到できる範囲で種々の変形態様もこの発明に含まれる。
【0056】
本明細書の中で明示した公開特許公報の内容は、その全ての内容を援用によって引用することとする。
【産業上の利用可能性】
【0057】
本発明を利用することにより、検体中に異なる型(タイプ)の核酸が混在しており、かつ量が少ない型(タイプ)のハイブリッド複合体をプローブにて検出する際に、シグナルを弱めることなく検出することが可能となる。詳細には、一方のプライマーの濃度を著しく多く増加させ、余分な経費を使用しシグナルを強めるのではなく、適度な範囲でプライマーの濃度を増やし、検出可能である適度な範囲までシグナルを強めることができる。さらに、このような適度な範囲でのプライマーの濃度を使用するため、非特異的プライミングおよびそれに伴う非標的核酸の増幅の可能性を減少させることができ、標的核酸の塩基配列の検出の際における反応性を高めることができる。
【特許請求の範囲】
【請求項1】
第1のプライマーおよび第2のプライマーを用いて検体における標的核酸を増幅し、増幅産物中の前記標的核酸の塩基配列とプローブとをハイブリダイズさせて、前記増幅産物中の前記標的核酸または前記標的核酸のいずれかの一本鎖塩基配列を検出する方法であって、
前記プローブとハイブリダイズする側の前記標的核酸の塩基配列を複製する前記第1のプライマーまたは前記第2のプライマーの一方を、他方のプライマーに対し、3.5より大きく10倍量未満前記検体を含む反応液に加えることを特徴とする、核酸の検出方法。
【請求項2】
前記標的核酸の塩基配列を複製する前記第1のプライマーまたは前記第2のプライマーの一方を、他方のプライマーに対し、3.5ないし8倍量前記検体を含む反応液に加えることを特徴とする、請求項1に記載の核酸の検出方法。
【請求項3】
前記標的核酸の塩基配列を複製する前記第1のプライマーまたは前記第2のプライマーの一方を、他方のプライマーに対し、4ないし5倍量前記検体を含む反応液に加えることを特徴とする、請求項1に記載の核酸の検出方法。
【請求項4】
前記プローブは、前記標的核酸の塩基配列とハイブリダイズするとシグナルが変化するプローブであることを特徴とする、請求項1ないし3のいずれか1項に記載の核酸の検出方法。
【請求項5】
前記検体は、存在割合が異なる少なくとも二つ以上の野生型および/または変異型を含む異なる多型の核酸が含有されていることを特徴とする、請求項1ないし4のいずれか1項に記載の核酸の検出方法。
【請求項6】
第1のプライマーおよび第2のプライマーを用いて検体における標的核酸を増幅し、増幅産物中の前記標的核酸の塩基配列とプローブとをハイブリダイズさせて、前記増幅産物中の前記標的核酸または前記標的核酸のいずれかの一本鎖塩基配列の検出に用いる核酸検出用キットであって、
前記第1のプライマーと、前記第2のプライマーとを含み、
前記プローブとハイブリダイズする側の前記標的核酸の塩基配列を複製する前記第1のプライマーまたは前記第2のプライマーの一方は、他方のプライマーに対し、3.5より大きく10倍量未満含まれることを特徴とする、核酸検出用キット。
【請求項7】
前記プローブとハイブリダイズする側の前記標的核酸の塩基配列を複製する前記第1のプライマーまたは前記第2のプライマーの一方は、他方のプライマーに対し、3.5ないし8倍量含まれることを特徴とする、請求項6に記載の核酸検出用キット。
【請求項8】
前記プローブとハイブリダイズする側の前記標的核酸の塩基配列を複製する前記第1のプライマーまたは前記第2のプライマーの一方は、他方のプライマーに対し、4ないし5倍量含まれることを特徴とする、請求項6に記載の核酸検出用キット。
【請求項9】
さらに、前記プローブを含むことを特徴とする、請求項6ないし8のいずれか1項に記載の核酸検出用キット。
【請求項1】
第1のプライマーおよび第2のプライマーを用いて検体における標的核酸を増幅し、増幅産物中の前記標的核酸の塩基配列とプローブとをハイブリダイズさせて、前記増幅産物中の前記標的核酸または前記標的核酸のいずれかの一本鎖塩基配列を検出する方法であって、
前記プローブとハイブリダイズする側の前記標的核酸の塩基配列を複製する前記第1のプライマーまたは前記第2のプライマーの一方を、他方のプライマーに対し、3.5より大きく10倍量未満前記検体を含む反応液に加えることを特徴とする、核酸の検出方法。
【請求項2】
前記標的核酸の塩基配列を複製する前記第1のプライマーまたは前記第2のプライマーの一方を、他方のプライマーに対し、3.5ないし8倍量前記検体を含む反応液に加えることを特徴とする、請求項1に記載の核酸の検出方法。
【請求項3】
前記標的核酸の塩基配列を複製する前記第1のプライマーまたは前記第2のプライマーの一方を、他方のプライマーに対し、4ないし5倍量前記検体を含む反応液に加えることを特徴とする、請求項1に記載の核酸の検出方法。
【請求項4】
前記プローブは、前記標的核酸の塩基配列とハイブリダイズするとシグナルが変化するプローブであることを特徴とする、請求項1ないし3のいずれか1項に記載の核酸の検出方法。
【請求項5】
前記検体は、存在割合が異なる少なくとも二つ以上の野生型および/または変異型を含む異なる多型の核酸が含有されていることを特徴とする、請求項1ないし4のいずれか1項に記載の核酸の検出方法。
【請求項6】
第1のプライマーおよび第2のプライマーを用いて検体における標的核酸を増幅し、増幅産物中の前記標的核酸の塩基配列とプローブとをハイブリダイズさせて、前記増幅産物中の前記標的核酸または前記標的核酸のいずれかの一本鎖塩基配列の検出に用いる核酸検出用キットであって、
前記第1のプライマーと、前記第2のプライマーとを含み、
前記プローブとハイブリダイズする側の前記標的核酸の塩基配列を複製する前記第1のプライマーまたは前記第2のプライマーの一方は、他方のプライマーに対し、3.5より大きく10倍量未満含まれることを特徴とする、核酸検出用キット。
【請求項7】
前記プローブとハイブリダイズする側の前記標的核酸の塩基配列を複製する前記第1のプライマーまたは前記第2のプライマーの一方は、他方のプライマーに対し、3.5ないし8倍量含まれることを特徴とする、請求項6に記載の核酸検出用キット。
【請求項8】
前記プローブとハイブリダイズする側の前記標的核酸の塩基配列を複製する前記第1のプライマーまたは前記第2のプライマーの一方は、他方のプライマーに対し、4ないし5倍量含まれることを特徴とする、請求項6に記載の核酸検出用キット。
【請求項9】
さらに、前記プローブを含むことを特徴とする、請求項6ないし8のいずれか1項に記載の核酸検出用キット。
【図1】


【図2】




【図2】


【公開番号】特開2013−94117(P2013−94117A)
【公開日】平成25年5月20日(2013.5.20)
【国際特許分類】
【出願番号】特願2011−239768(P2011−239768)
【出願日】平成23年10月31日(2011.10.31)
【出願人】(000141897)アークレイ株式会社 (288)
【Fターム(参考)】
【公開日】平成25年5月20日(2013.5.20)
【国際特許分類】
【出願日】平成23年10月31日(2011.10.31)
【出願人】(000141897)アークレイ株式会社 (288)
【Fターム(参考)】
[ Back to top ]

