核酸増幅反応用マイクロチップ及びその製造方法
【課題】簡便で精度の高い核酸増幅反応用マイクロチップの提供。
【解決手段】核酸増幅反応の反応場となるウェルの内面に、増幅反応に必要な物質の少なくとも一部が、ウェルの中心部に比して辺縁部に偏在した形状で予め固着されている、核酸増幅反応用マイクロチップを提供する。前記核酸増幅用マイクロチップにおいては、増幅対象の核酸鎖を含むサンプル溶液と、増幅反応に必要な残りの物質の導入のみで、核酸増幅反応の開始が可能となる。
【解決手段】核酸増幅反応の反応場となるウェルの内面に、増幅反応に必要な物質の少なくとも一部が、ウェルの中心部に比して辺縁部に偏在した形状で予め固着されている、核酸増幅反応用マイクロチップを提供する。前記核酸増幅用マイクロチップにおいては、増幅対象の核酸鎖を含むサンプル溶液と、増幅反応に必要な残りの物質の導入のみで、核酸増幅反応の開始が可能となる。
【発明の詳細な説明】
【技術分野】
【0001】
本技術は、核酸増幅反応用マイクロチップ及びその製造方法に関する。より詳しくは、核酸増幅反応の反応場となるウェル内に、反応に必要な1以上の成分を含む試薬が、所定の形状で固着化された核酸増幅反応用マイクロチップ等に関する。
【背景技術】
【0002】
近年、半導体産業における微細加工技術を応用し、シリコンやガラス製の基板上に化学的及び生物学的分析を行うためのウェルや流路を設けたマイクロチップが開発されてきている。これらのマイクロチップは、例えば、液体クロマトグラフィーの電気化学検出器や医療現場における小型の電気化学センサなどに利用され始めている。
【0003】
このようなマイクロチップを用いた分析システムは、μ−TAS(micro−Total−Analysis System)やラボ・オン・チップ、バイオチップ等と称され、化学的及び生物学的分析の高速化や高効率化、集積化あるいは、分析装置の小型化を可能にする技術として注目されている。μ−TASは、少量の試料で分析が可能なことや、マイクロチップのディスポーザブルユーズ(使い捨て)が可能なことから、特に貴重な微量試料や多数の検体を扱う生物学的分析への応用が期待されている。
【0004】
μ−TASの応用例として、マイクロチップ上に配設された複数の領域内に物質を導入し、該物質を化学的に検出する光学検出装置がある。このような光学検出装置としては、例えば、マイクロチップ上のウェル内で核酸増幅反応等の複数の物質間の反応を進行させ、生成する物質を光学的に検出する反応装置(例えばリアルタイムPCR装置)などがある。
【0005】
従来、マイクロチップ型の核酸増幅装置では、核酸増幅反応に必要な試薬及び鋳型DNAを予め全て混合し、この混合液をマイクロチップに配設された複数のウェル内に導入して反応を行う方法が取られてきた。しかし、この方法では、ウェル内に混合液が導入されるまでに一定の時間が必要であるため、その間に混合液内で反応が進行し、非特異的な増幅を容易にし、定量性を低下させてしまう問題が生じていた。
【0006】
前述の問題に対し、例えば特許文献1には、核酸増幅反応に必要な試薬の一部を予め固体状態で流路内に保持したマイクロチップが開示されている。しかし、特許文献1に開示のマイクロチップについて、固体状態の試薬の形状や、マイクロチップ内での詳細な配置について、記載はない。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開2007−43998号公報
【発明の概要】
【発明が解決しようとする課題】
【0008】
本技術は、簡便でかつ精度の高い核酸増幅反応用マイクロチップ及び核酸増幅反応用マイクロチップの製造を主な目的とする。
【課題を解決するための手段】
【0009】
本発明者らは、マイクロチップに内在させる核酸増幅反応に必要な試薬の、固着化における形状に着目し、検討を行った。その結果、試薬を固着させるマイクロチップのウェル内面に親水化処理を施し、核酸増幅反応に必要な物質を含む溶液をウェルに滴下した後乾燥することにより、試薬がウェル中心部に比して辺縁部に偏在した形状で固着化されることを見出した。固着化した試薬が、表面積の大きい、所定の形状に揃うことによって、核酸増幅反応の開始時にウェル内に固着した試薬が溶解し易く、ウェル間でのばらつきが抑えられる。
【0010】
すなわち本技術は、
核酸増幅反応の反応場であるウェルに、前記核酸増幅反応に必要な物質の少なくとも一部が前記ウェルの中心部に比して辺縁部に偏在した形状で固着された、核酸増幅反応用マイクロチップを提供する。
前記ウェルを構成する面が親水性である核酸増幅反応用マイクロチップが好適である。
また、前記物質が前記ウェルの辺縁部から中心部に向けて高さを減じたすり鉢形状で存在する、核酸増幅反応用マイクロチップが好適である。
前記物質が前記ウェルの中心部を除く領域に環状に存在する、核酸増幅反応用マイクロチップがより好適である。
本技術はまた、
核酸増幅反応の反応場となるウェルを形成した基板層の該ウェルを構成する面を親水化する工程と、前記核酸増幅反応に必要な物質の少なくとも一部を前記ウェル内に滴下する工程と、前記物質を乾燥させ前記ウェル内に固着化する工程と、を含む核酸増幅反応用マイクロチップの製造方法を提供する。
前記親水化する工程に、前記ウェルを構成する面をプラズマに曝露する工程を含む、核酸増幅反応用マイクロチップの製造方法が好適である。
また、前記固着化する工程に、前記ウェルに滴下された前記物質を凍結乾燥する工程を含む核酸増幅反応用マイクロチップの製造方法が好適である。
【発明の効果】
【0011】
本技術により、簡便で精度の高い核酸増幅反応用マイクロチップが提供される。
【図面の簡単な説明】
【0012】
【図1】本技術に係る核酸増幅反応用マイクロチップの上面模式図である。
【図2】ウェル内に固着化された試薬の形状を説明するための模式図である。
【図3】本技術に係る核酸増幅反応用マイクロチップの部分断面模式図(図1、P−P’断面)である。
【図4】本技術に係る核酸増幅反応用マイクロチップの製造方法を説明するためのフローチャートである。
【図5】実施例における核酸増幅反応用マイクロチップのウェル内に固着された試薬の形状を示す図面代用写真である。
【図6】実施例における核酸増幅反応用マイクロチップのウェル内に固着された試薬の溶解時の状態を示す図面代用写真である。
【発明を実施するための形態】
【0013】
以下、本技術を実施するための好適な形態について説明する。なお、以下に説明する実施形態は、本技術の代表的な実施形態の一例を示したものであり、これにより本技術の範囲が狭く解釈されることはない。説明は以下の順序で行う。
1.本技術に係る核酸増幅反応用マイクロチップについて
(1−1)核酸増幅反応用マイクロチップの構成
(1−2)核酸増幅反応用試薬
(1−3)分岐流路とウェルの連通部
2.本技術に係る核酸増幅反応用マイクロチップの製造方法
(2−1)基板層の成形
(2−2)ウェル内の親水化処理
(2−3)ウェル内への試薬の滴下
(2−4)ウェルへの試薬の固着化
(2−5)基板層の貼り合わせ
【0014】
1.本技術に係る核酸増幅反応用マイクロチップについて
本技術に係る核酸増幅反応用マイクロチップ(以下、「マイクロチップ」とも称する)について説明する。また、本技術に係るマイクロチップを用いて行う「核酸増幅反応」については、温度サイクルを実施する従来のPCR(Polymerase Chain Reaction)法や、温度サイクルを伴わない各種等温増幅法が含まれる。等温増幅法としては、例えばLAMP(Loop-Mediated Isothermal Amplification)法、SMAP(SMartAmplification Process)法、NASBA(Nucleic Acid Sequence-Based Amplification)法、ICAN(Isothermal and Chimeric primer-initiated Amplification of Nucleic acids)法(登録商標)、TRC(Transcription-Reverse transcription Concerted)法、SDA(Strand Displacement Amplification)法、TMA(Transcription-Mediated Amplification)法、RCA(Rolling Circle Amplification)法等が挙げられる。この他、「核酸増幅反応」には核酸の増幅を目的とする、変温あるいは等温による核酸増幅反応が広く包含されるものとする。また、これらの核酸増幅反応には、リアルタイムPCR法などの増幅核酸の定量を伴う反応も包含される。
【0015】
(1−1)核酸増幅反応用マイクロチップの構成
図1は、本技術に係るマイクロチップの上面模式図である。符号Aで示すマイクロチップは、外部からサンプル溶液が導入される導入口1と、核酸増幅反応の反応場となるウェル4と、一端において導入口1に、他の一端において排出口5に連通する主流路2と、主流路2から分岐しウェル4に連通する分岐流路3から構成されている。ここで述べるサンプル溶液とは、核酸増幅反応において増幅の対象となる鋳型核酸であるDNAやRNA等の核酸を含む溶液を指す。
【0016】
マイクロチップAは、複数の基板層から構成される。基板層の材質は、ガラスや各種プラスチップ(ポリプロピレン、ポリカーボネート、シクロオレフィンポリマー、ポリジメチルシロキサン等)とすることができる。ウェル4内で増幅された核酸鎖の検出又は定量を光学的に行う場合においては、基板層の材質は、光透過性を有し、自家蛍光が少なく波長分散が小さいことで光学誤差の少ない材料を選択することが望ましい。マイクロチップAを構成する基板層は複数であって、数は限定されない。また、ガラスからなる基板層にプラスチックの基板層を貼り合わせるといった複数の材質を貼り合わせて成るマイクロチップAとすることもできる。何れの材質を基板層として用いた場合であっても、基板層に設けられるウェル4の内面は、親水性であることが好ましい。ウェル4内面の親水化処理については、(2−2)に記載する。
【0017】
図1においては、マイクロチップAにウェル4を9つ配設する場合を例示しているが、1個のマイクロチップに配設されるウェル4の数は何れであっても良く、ウェル4の形状も円柱形状に限定されない。マイクロチップに形成される主流路2、分岐流路3についても、図1に示した様態に限定されない。1個のマイクロチップに複数の導入口1と複数の主流路2を形成した構成であっても良い。また、導入口1からマイクロチップAに導入されたサンプル溶液を外部に排出する排水口5は必須の構成ではなく、サンプル溶液が外部に排出されない構造とすることもできる。
【0018】
(1−2)核酸増幅反応用試薬
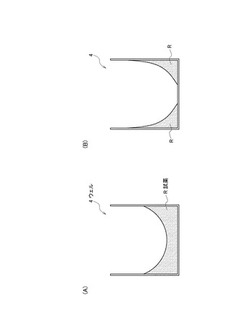
図2は、本技術に係るマイクロチップAのウェル4内における核酸増幅反応用試薬(以下「試薬」とも称する)の形状を模式的に示した図である。符号Rで示す試薬は、ウェル4の内面に、ウェル4の中心部に比して辺縁部に偏在した形状で固着されている。例えば偏在の形状は、図2(A)に示すように、ウェル4の辺縁部から中心部に向かって高さを減じた、すり鉢形状とできる。また、本技術に係る実施形態の変形例として図2(B)を示す。すり鉢形状である試薬Rが、ウェル4の辺縁部から中心部へ向かって嵩を減じ、ウェル4の中心部に到達するまでに、その嵩を失うと、(B)に図示するように、試薬Rはウェル4の中心部を除く領域に環状に配置される。
【0019】
ウェル4に固着化される試薬Rには、核酸増幅反応において増幅核酸鎖を得るために必要な物質の少なくとも一部が含まれている。具体的には、増幅の対象であるDNA、RNA等の塩基配列の少なくとも一部に相補的なオリゴヌクレオチドプライマー(以下「プライマー」とも称する」)、核酸モノマー(dNTPs)、酵素、反応緩衝液に含まれる成分などである。また、核酸増幅反応に直接必要ではないが、増幅した核酸を検出するための蛍光標識等の標識を備えたプローブや、二本鎖の核酸にインターカレートする検出用試薬なども、増幅核酸鎖の検出に必要な物質として、試薬Rに含まれる成分とできる。ウェル4に固着した試薬Rに含まれる成分は、これらの核酸増幅反応及び検出に必要な物質のうち1又は複数とすることができる。また、試薬Rに複数の成分が含まれる場合、複数の成分が均一に混合された一層からなる試薬Rとすることもできるが、複数の成分がウェル4内に順に積層された、層構造を有した試薬Rとすることもできる。
【0020】
ウェル4内に積層される試薬Rの、1つの層に含まれる物質の種類は、1又は複数として特に限定されず、1つのウェル4における試薬Rの層の数も限定されない。物質がウェル4内に積層されている順序も、任意の順序とできる。例えば「プライマー、dNTPs、酵素、反応緩衝液に含まれる成分」の順で4層からなる構成や、「反応緩衝液に含まれる成分、酵素、dNTPs及びプライマー」の順序で3層からなり、かつ1つの層には予め複数の核酸増幅反応に必要な物質が混合されている構成であっても良い。例えば、プライマーが含まれる層を下層に、他の試薬が含まれる層を上層に、ウェル4内に積層すると、核酸増幅反応の開始時に、プライマーを含む下層まで溶解されて初めて核酸増幅反応が開始されるため、核酸の非特異的増幅が防止され、好適である。また、1個のマイクロチップAに複数のウェル4を有する場合、ウェル4間で積層される試薬Rの種類や積層数が同一でなくても良く、例えば図1のマイクロチップAにおいて9つ設けられたウェル4に、核酸増幅反応に必要な1種類の物質のみを含む試薬R、反応に必要な物質が複数混合された一層からなる試薬R、反応に必要な複数の物質が順に積層されている試薬R等、各々異なる物質の構成や積層数から成る試薬Rが固着されていても良い。
【0021】
試薬Rを、核酸増幅反応に必要な複数の物質を含んだ層状構造とすることによって、単層に比べ、より多くの種類の反応に必要な物質をマイクロチップA内に分離した状態で保持でき、核酸増幅反応開始時に増幅対象の核酸を含むサンプル溶液に加える物質の種類を減らすことができる。この結果、本技術に係るマイクロチップAにおいて、より簡便な分析が可能となる。また、核酸増幅反応開始時まで、増幅反応に必要な物質の混合が避けられることによって、プライマーダイマー等の非特異的増幅が抑えられ、マイクロチップAを用いて、精度の高い分析が可能となる。
【0022】
(1−3)分岐流路とウェルの連通部
マイクロチップAにおいて、導入口1から導入されるサンプル溶液は、主流路2を経て分岐流路3で分岐し、ウェル4に至る。分岐流路3がウェル4に連通する部分は、ウェル4内に固着された試薬Rの容量にかかわらず、ウェル4の側面の何れの位置に設けることもできるが、本技術に係るマイクロチップAでは、分岐流路3とウェル4の連通部が、前記ウェル4内に固着された核酸増幅反応に必要な物質の最厚部における高さより高い位置に配設にされていることが好ましい。図3(A)及び(B)は、図1中P−P’断面に対応する部分断面模式図、及びその変形例であり、前記連通部の形状を例示する。
【0023】
図3(A)に示すP−P’の部分断面において、マイクロチップAは、分岐流路3及びウェル4が形成された基板層a1と、基板層a2とが貼り合わされた、2層の基板層で構成される。分岐流路3とウェル4の連通部は、ウェル4内に固着された試薬Rの最厚部の高さhよりも上方に、試薬Rが連通部を塞がない配置で、ウェル4の側面に設けられている。そのため、分岐流路3を通流したサンプル溶液が連通部からウェル4内に導入された際、サンプル溶液は、固着されている試薬Rの表面と接触する。試薬Rは、ウェル4内に中心部に比して辺縁部に偏在し、例えばすり鉢形状や環状であることにより、サンプル溶液との接触面積が大きくなるため、サンプル溶液導入時に素早く溶解される。図3においては、試薬Rの形状を、図2(A)に示す形状と同様にして示したが、試薬Rの形状は、図2(B)に示す形状の他、ウェル4の内面に中心部に比して辺縁部に偏在する形状であれば、何れであっても良い。
【0024】
図3(B)に示すP−P’の部分断面において、マイクロチップAは、ウェル4を構成する部分のみが刳り抜いて形成された基板層a2の一の面に、分岐流路3の底面が形成された基板層a1が貼り合わされ、更にもう一の面に基板層a3が貼り合わされた、3層の基板層で構成される。分岐流路3とウェル4の連通部は、ウェル4内に固着された試薬Rの最厚部の高さhよりも下方に、試薬Rが連通部を塞ぐ配置で、ウェル4の側面に設けられている。そのため、分岐流路3を通流したサンプル溶液は連通部において試薬Rを溶解しつつウェル4内に導入することとなる。サンプル溶液は連通部に到達し、試薬Rを貫通しウェル4中央部に到達した後は、(A)における混合と同様に試薬Rの表面と接触する。また、(B)の構成においては、連通部が試薬Rの最厚部の高さhよりも下方に設けられていることによる、サンプル溶液導入後のウェル4内からの反応液の分岐流路3への逆流を防止するために、分岐流路3とウェル4との連通部に逆止弁を設けることが好ましい。
【0025】
上述したマイクロチップの構成により、本技術に係るマイクロチップAにおいては、ウェル4内に固着されていない核酸増幅反応に必要な残りの物質と、増幅の対象である鋳型DNA又はRNAを含むサンプル溶液のみの導入によって、核酸増幅反応を開始することができる。また本技術に係るマイクロチップにおいては、ウェル4に固着された試薬Rの形状がすり鉢状、環状等、中心部に比して辺縁部に偏在する形状に統一されていることによって、反応開始時のウェル4間での試薬R等の混合状態のむらを解消できる。更にウェル4の中央部において試薬Rの厚みが薄い、又は中央部に試薬Rが存在しないというウェル4内に固着した試薬Rの形状は、表面積が大きく、サンプル溶液との混合時の溶解を容易にし、ウェル4中央部に溶け残りが生じることを抑える。そのため、例えば核酸の光学的検出を行う場合、試薬Rの溶け残りによってウェル4中央部に極端に高いシグナル強度が測定されることを回避できる。
【0026】
2.本技術に係る核酸増幅反応用マイクロチップの製造方法について
本技術に係る核酸増幅反応用マイクロチップ(以下「マイクロチップ」とも称する)の製造方法について、図4に示すフローチャートに則して説明する。
【0027】
(2−1)基板層の成形
図4中、符号S1は基板層の成形工程である。本工程では、基板層に、図1に示す導入口1、主流路2、分岐流路3、ウェル4及び排出口5を成形する。成形には、例えばガラス製基板層のウェットエッチングやドライエッチング、プラスチック製基板層のナノインプリントや射出成型、切削加工等の方法を用いることができる。ウェル4等の基板層への形成は、図3(A)に示すように基板層a1のみに成形する場合や、図3(B)に示すように複数の基板層に成形する場合の何れも可能であり、主流路2、分岐流路3やウェル4等の各構成要素のマイクロチップにおける配設位置に応じて選択すれば良い。
【0028】
(2−2)ウェル内の親水化処理
図4中、符号S2は、ウェル4を構成する、内面の親水化工程である。本工程では、前述の成形工程S1によって基板層に成形されたウェル4の内面に親水化処理を行う。親水化処理には、例えば親水性樹脂の塗布、光触媒作用を利用した表面処理、アルカリケイ酸塩等の無機系コート処理、エッチング処理、プラズマ処理等の方法を用いることができる。また、基板層の成形時にウェル4内面にエンボス(凹凸)形状をスタンパーで造りこみ、親水化処理としても良い。本技術に係るマイクロチップAにおいては、特にウェル4内面をプラズマに曝露する親水化処理方法が好適である。
【0029】
(2−3)ウェル内への試薬の滴下
図4中、符号S3は核酸増幅反応に必要な物質の少なくとも一部を含んだ試薬Rを、マイクロチップAのウェル4内へ滴下する工程である。本工程では、増幅反応に用いる物質を含んだ液状又はゲル状の試薬Rを、前述の親水化工程S2により親水化処理を施したウェル4に滴下する。ウェル4に滴下された試薬Rの液滴は、ウェル4を構成する面の親水化処理によってウェル4内で中心部に比して辺縁部に偏在した形状に留まる。ウェル4内面の親水性の程度や、試薬Rの量及び性質等に応じて、ウェル4内に偏在する試薬Rの形状は、例えば図2(A)に示す、すり鉢形状や、(B)に示す、環状となる。
【0030】
ウェル4へ試薬Rを滴下する工程には、必要に応じて試薬Rの滴下前に、試薬Rに含まれる成分に対して所定の処理を行う工程を含んでいても良い。例えばプライマーを含む試薬Rを滴下する場合、予め試薬Rを95℃程度の温度で処理し、プライマーを変性させ1本鎖にすることで、プライマーダイマーの発生を抑え、核酸増幅反応時に非特異的な核酸の増幅を低減することが可能となる。
【0031】
図4においては、ウェル4内へ試薬Rを滴下する工程S3を、基板層の成形工程S1とウェル4の内面の親水化工程S2に続く工程として示しているが、本技術に係るマイクロチップAの製造方法では、別途、ウェル4等が成形されて親水化処理を施された基板層を用意し、ウェル4内へ滴下する工程S3から行うことも可能である。
【0032】
(2−4)ウェルへの試薬の固着化
図4中、符号S4はウェル4内の試薬Rを乾燥させ、試薬Rをウェル4内面に固着化する工程である。前述の試薬Rを滴下する工程S3によってウェル4内に滴下された試薬Rは、ウェル4内面の親水化処理により、ウェル4内で中心部に比して辺縁部に偏在した形状に留まる。本工程では、試薬Rの該形状を保持したまま乾燥し、試薬Rをウェル4に固着化させる。乾燥方法としては、凍結乾燥が好適である。また、この凍結乾燥の工程の前に、予め試薬Rを十分に凍結するための冷却工程を設けても良い。ウェル4に滴下した試薬Rが、前記形状であることによって、滴下された試薬Rの表面積が大きくなり、冷却工程において試薬Rが均一に冷却される。また試薬Rの均一な冷却は、固着化の過程において試薬Rの形状を安定させる。この冷却工程と凍結乾燥工程とを組み合わせることにより、凍結乾燥時のウェル4における試薬Rの突沸等が予防され、滴下時のウェル4内における試薬Rの形状を、滴下以降の工程においても保持することが容易となる。
【0033】
マイクロチップAのウェル4内に固着化される試薬Rは、ウェル4内への試薬Rの滴下の工程S3と、ウェル4への試薬Rの固着化の工程S4とを繰り返して、核酸増幅反応に必要な物質の一部をウェル4内に積層させても良い。ウェル4において試薬Rの積層を行う際、滴下工程S3及び固着化工程S4の二巡目以降については、既にウェル4内に固着化された試薬Rの溶解を防ぐために、試薬Rの滴下時にマイクロチップAを低温に保持しておくことが好ましく、滴下後は、試薬Rを直ちに凍結させることが好ましい。
【0034】
(2−5)基板層の貼り合わせ
図4中、符号S5は基板層の貼り合わせ工程である。本工程では、前述の固着化工程S4によってウェル4内に試薬Rを保持した基板層と、他の基板層を貼り合わせる。基板層の貼り合わせには、例えば接着剤や粘着性を有したシートを用いる方法や、熱融着、陽極接合、超音波接合等の方法を用いることができる。また、基板層の表面を酸素プラズマ処理や真空紫外光処理により活性化して貼り合わせることも可能である。ポリジメチルシロキサン等のプラスチックの場合、ガラスとの親和性が高く、表面を前記処理によって活性化し接触させると、ダングリングボンドが反応して強固な共有結合であるSi−O−Siシラノール結合を形成し、十分な強度の接合が得られる。酸素プラズマ処理又は真空紫外光処理は、基板層の材質に応じて条件を設定すれば良い。
【0035】
上述の、本技術に係る核酸増幅反応用マイクロチップの製造方法によって作製されたマイクロチップAでは、ウェル4内に固着化された試薬Rが、ウェル4内面の親水化処理により一定の形状に揃う。そのため、マイクロチップA内に導入されるサンプル液との混合時に、固着された試薬Rの溶解の程度について、ウェル4間でのばらつきが抑えられる。また、試薬Rが、ウェル4辺縁部から中央部に向って嵩を減じて偏在した形状で固着されていることにより、試薬Rの表面積が大きくなる。このため、サンプル溶液との混合時に、試薬Rは溶解され易くなる。かつ固着化された試薬Rが前記の形状であるより、ウェル4中央部に試薬Rの溶け残りが生ずることが抑えられ、増幅核酸の光学的検出を行う場合、核酸増幅反応開始時におけるウェル4中央部での極端に強度が高いシグナルの検出を抑えることができる。従って、本技術に係る製造方法により作製されたマイクロチップを用いて、簡便で精度の高い核酸増幅反応を行うことが可能となる。
【0036】
なお本技術は、以下のような構成もとることができる。
(1)核酸増幅反応の反応場であるウェルに、前記核酸増幅反応に必要な物質の少なくとも一部が前記ウェルの中心部に比して辺縁部に偏在した形状で固着された、核酸増幅反応用マイクロチップ。
(2)前記ウェルを構成する面が親水性である、上記(1)に記載の核酸増幅反応用マイクロチップ。
(3)前記物質が前記ウェルの辺縁部から中心部に向けて高さを減じたすり鉢形状で存在する、上記(1)又は(2)に記載の核酸増幅反応用マイクロチップ。
(4)前記物質が前記ウェルの中心部を除く領域に環状に存在する、上記(1)から(3)の何れかに記載の核酸増幅反応用マイクロチップ。
(5)核酸増幅反応の反応場となるウェルを形成した基板層の該ウェルを構成する面を親水化する工程と、前記核酸増幅反応に必要な物質の少なくとも一部を前記ウェル内に滴下する工程と、前記物質を乾燥させ前記ウェル内に固着化する工程とを含む、核酸増幅反応用マイクロチップの製造方法。
(6)前記親水化する工程に、前記ウェルを構成する面をプラズマに曝露する工程を含む、上記(5)に記載の核酸増幅反応用マイクロチップの製造方法。
(7)前記固着化する工程に、前記ウェルに滴下された前記物質を凍結乾燥する工程を含む、上記(5)又は(6)に記載の核酸増幅反応用マイクロチップの製造方法。
【実施例】
【0037】
本技術に係るマイクロチップの作製方法に則してマイクロチップを作製し、ウェル内に固着化された試薬の形状及び試薬の溶解時の状態を観察した。
【0038】
<マイクロチップの材料及び作製方法>
マイクロチップの材料として、ポリジメチルシロキサン(PDMS)の基板層に、主流路、分岐流路、ウェルを成形した後、流路及びウェルを形成していない面のみを活性化し、ガラス板と貼り合わせた。次にメタルマスクによって流路等を保護し、ウェル内面のみ反応性イオンエッチング(10cc、50W、15秒)により、親水化処理を行った。上記工程により作製されたマイクロチップを、実施例とした。比較例としてウェル内面の親水化処理を除いた点以外は、全て実施例と同様に作製されたマイクロチップを用意した。実施例及び比較例のマイクロチップの各ウェルにプライマーを含む試薬液を滴下し、実施例については−28℃に置き、試薬を凍結させた。一方、比較例のマイクロチップは、2つの群に分け、1つの群は実施例と同様に−28℃に置き、滴下した試薬を凍結させた。もう1つの群については、室温での減圧乾燥(1000Pa)によって試薬をウェルに固着させた。−28℃における凍結処理を行った比較例の群を、比較例1とし、減圧乾燥を行った群を比較例2とする。実施例及び比較例1は、試薬の凍結後、凍結乾燥機(25Pa)において、試薬をウェル内に固着させた。プライマーを含む試薬液を固着させた実施例及び比較例1、2のマイクロチップの各ウェルには、次に酵素を含む試薬液を滴下し、固着化させた。滴下後の固着化の工程は、プライマーを含む試薬液の場合と同様に、実施例及び比較例1については凍結処理後、凍結乾燥を行い、比較例2については減圧乾燥を行った。
【0039】
<観察結果>
実施例及び比較例1、2のウェル内に固着化された試薬の形状について、マイクロチップ上面から観察した結果を図5に示す。(A)に示す実施例の各ウェルでは、試薬は中心部を除いて環状に固着化されている。また固着化された試薬の形状はウェル間で均一であった。(B)に示す比較例1では、ウェル内に固着化された試薬の形状は、ウェル内面の一方に集中し、ウェル間で不均一であった。(C)に示す比較例2においては、比較例1と同様にウェル内面の一方に試薬が偏って固着化される形状が観察されたが、いくつかのウェルにおいてはウェル中央部に試薬が集中している形状も観察された(図5(C)矢印)。
【0040】
実施例及び比較例1、2のウェル内に核酸増幅反応用緩衝液を加え、30秒後のウェル内の試薬の状態を観察した。マイクロチップ上面からウェル内を観察した結果を、図6に示す。(A)は実施例のウェルであり、(B)及び(C)は各々比較例1及び比較例2のウェルである。実施例、比較例1、2の何れにおいても固着化された試薬の溶け残りは観察されたが、比較例2において、特に大きい試薬の溶け残りがウェル中央部に観察された(図6(C)矢印)。
【0041】
本実施例の結果において、ウェル内面の親水化処理工程と乾燥処理前の試薬の十分な凍結は、マイクロチップのウェル内に固着された試薬の形状に影響することが示された。また、固着化した試薬の形状の違いによって、溶解時の溶け残りの発生に差が生じることが示された。
【産業上の利用可能性】
【0042】
本技術に係る核酸増幅反応用マイクロチップによれば、簡便な方法で高精度な分析を行うことができる。そのため、臨床における遺伝子型判定や感染病原体判定などのための核酸増幅装置として、本技術に係る核酸増幅反応用マイクロチップは用いられ得る。
【符号の説明】
【0043】
A:核酸増幅反応用マイクロチップ、a1、a2、a3:基板層、h:試薬の最厚部における高さ、R:試薬、1:導入口、2:主流路、3:分岐流路、4:ウェル、5:排出口
【技術分野】
【0001】
本技術は、核酸増幅反応用マイクロチップ及びその製造方法に関する。より詳しくは、核酸増幅反応の反応場となるウェル内に、反応に必要な1以上の成分を含む試薬が、所定の形状で固着化された核酸増幅反応用マイクロチップ等に関する。
【背景技術】
【0002】
近年、半導体産業における微細加工技術を応用し、シリコンやガラス製の基板上に化学的及び生物学的分析を行うためのウェルや流路を設けたマイクロチップが開発されてきている。これらのマイクロチップは、例えば、液体クロマトグラフィーの電気化学検出器や医療現場における小型の電気化学センサなどに利用され始めている。
【0003】
このようなマイクロチップを用いた分析システムは、μ−TAS(micro−Total−Analysis System)やラボ・オン・チップ、バイオチップ等と称され、化学的及び生物学的分析の高速化や高効率化、集積化あるいは、分析装置の小型化を可能にする技術として注目されている。μ−TASは、少量の試料で分析が可能なことや、マイクロチップのディスポーザブルユーズ(使い捨て)が可能なことから、特に貴重な微量試料や多数の検体を扱う生物学的分析への応用が期待されている。
【0004】
μ−TASの応用例として、マイクロチップ上に配設された複数の領域内に物質を導入し、該物質を化学的に検出する光学検出装置がある。このような光学検出装置としては、例えば、マイクロチップ上のウェル内で核酸増幅反応等の複数の物質間の反応を進行させ、生成する物質を光学的に検出する反応装置(例えばリアルタイムPCR装置)などがある。
【0005】
従来、マイクロチップ型の核酸増幅装置では、核酸増幅反応に必要な試薬及び鋳型DNAを予め全て混合し、この混合液をマイクロチップに配設された複数のウェル内に導入して反応を行う方法が取られてきた。しかし、この方法では、ウェル内に混合液が導入されるまでに一定の時間が必要であるため、その間に混合液内で反応が進行し、非特異的な増幅を容易にし、定量性を低下させてしまう問題が生じていた。
【0006】
前述の問題に対し、例えば特許文献1には、核酸増幅反応に必要な試薬の一部を予め固体状態で流路内に保持したマイクロチップが開示されている。しかし、特許文献1に開示のマイクロチップについて、固体状態の試薬の形状や、マイクロチップ内での詳細な配置について、記載はない。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開2007−43998号公報
【発明の概要】
【発明が解決しようとする課題】
【0008】
本技術は、簡便でかつ精度の高い核酸増幅反応用マイクロチップ及び核酸増幅反応用マイクロチップの製造を主な目的とする。
【課題を解決するための手段】
【0009】
本発明者らは、マイクロチップに内在させる核酸増幅反応に必要な試薬の、固着化における形状に着目し、検討を行った。その結果、試薬を固着させるマイクロチップのウェル内面に親水化処理を施し、核酸増幅反応に必要な物質を含む溶液をウェルに滴下した後乾燥することにより、試薬がウェル中心部に比して辺縁部に偏在した形状で固着化されることを見出した。固着化した試薬が、表面積の大きい、所定の形状に揃うことによって、核酸増幅反応の開始時にウェル内に固着した試薬が溶解し易く、ウェル間でのばらつきが抑えられる。
【0010】
すなわち本技術は、
核酸増幅反応の反応場であるウェルに、前記核酸増幅反応に必要な物質の少なくとも一部が前記ウェルの中心部に比して辺縁部に偏在した形状で固着された、核酸増幅反応用マイクロチップを提供する。
前記ウェルを構成する面が親水性である核酸増幅反応用マイクロチップが好適である。
また、前記物質が前記ウェルの辺縁部から中心部に向けて高さを減じたすり鉢形状で存在する、核酸増幅反応用マイクロチップが好適である。
前記物質が前記ウェルの中心部を除く領域に環状に存在する、核酸増幅反応用マイクロチップがより好適である。
本技術はまた、
核酸増幅反応の反応場となるウェルを形成した基板層の該ウェルを構成する面を親水化する工程と、前記核酸増幅反応に必要な物質の少なくとも一部を前記ウェル内に滴下する工程と、前記物質を乾燥させ前記ウェル内に固着化する工程と、を含む核酸増幅反応用マイクロチップの製造方法を提供する。
前記親水化する工程に、前記ウェルを構成する面をプラズマに曝露する工程を含む、核酸増幅反応用マイクロチップの製造方法が好適である。
また、前記固着化する工程に、前記ウェルに滴下された前記物質を凍結乾燥する工程を含む核酸増幅反応用マイクロチップの製造方法が好適である。
【発明の効果】
【0011】
本技術により、簡便で精度の高い核酸増幅反応用マイクロチップが提供される。
【図面の簡単な説明】
【0012】
【図1】本技術に係る核酸増幅反応用マイクロチップの上面模式図である。
【図2】ウェル内に固着化された試薬の形状を説明するための模式図である。
【図3】本技術に係る核酸増幅反応用マイクロチップの部分断面模式図(図1、P−P’断面)である。
【図4】本技術に係る核酸増幅反応用マイクロチップの製造方法を説明するためのフローチャートである。
【図5】実施例における核酸増幅反応用マイクロチップのウェル内に固着された試薬の形状を示す図面代用写真である。
【図6】実施例における核酸増幅反応用マイクロチップのウェル内に固着された試薬の溶解時の状態を示す図面代用写真である。
【発明を実施するための形態】
【0013】
以下、本技術を実施するための好適な形態について説明する。なお、以下に説明する実施形態は、本技術の代表的な実施形態の一例を示したものであり、これにより本技術の範囲が狭く解釈されることはない。説明は以下の順序で行う。
1.本技術に係る核酸増幅反応用マイクロチップについて
(1−1)核酸増幅反応用マイクロチップの構成
(1−2)核酸増幅反応用試薬
(1−3)分岐流路とウェルの連通部
2.本技術に係る核酸増幅反応用マイクロチップの製造方法
(2−1)基板層の成形
(2−2)ウェル内の親水化処理
(2−3)ウェル内への試薬の滴下
(2−4)ウェルへの試薬の固着化
(2−5)基板層の貼り合わせ
【0014】
1.本技術に係る核酸増幅反応用マイクロチップについて
本技術に係る核酸増幅反応用マイクロチップ(以下、「マイクロチップ」とも称する)について説明する。また、本技術に係るマイクロチップを用いて行う「核酸増幅反応」については、温度サイクルを実施する従来のPCR(Polymerase Chain Reaction)法や、温度サイクルを伴わない各種等温増幅法が含まれる。等温増幅法としては、例えばLAMP(Loop-Mediated Isothermal Amplification)法、SMAP(SMartAmplification Process)法、NASBA(Nucleic Acid Sequence-Based Amplification)法、ICAN(Isothermal and Chimeric primer-initiated Amplification of Nucleic acids)法(登録商標)、TRC(Transcription-Reverse transcription Concerted)法、SDA(Strand Displacement Amplification)法、TMA(Transcription-Mediated Amplification)法、RCA(Rolling Circle Amplification)法等が挙げられる。この他、「核酸増幅反応」には核酸の増幅を目的とする、変温あるいは等温による核酸増幅反応が広く包含されるものとする。また、これらの核酸増幅反応には、リアルタイムPCR法などの増幅核酸の定量を伴う反応も包含される。
【0015】
(1−1)核酸増幅反応用マイクロチップの構成
図1は、本技術に係るマイクロチップの上面模式図である。符号Aで示すマイクロチップは、外部からサンプル溶液が導入される導入口1と、核酸増幅反応の反応場となるウェル4と、一端において導入口1に、他の一端において排出口5に連通する主流路2と、主流路2から分岐しウェル4に連通する分岐流路3から構成されている。ここで述べるサンプル溶液とは、核酸増幅反応において増幅の対象となる鋳型核酸であるDNAやRNA等の核酸を含む溶液を指す。
【0016】
マイクロチップAは、複数の基板層から構成される。基板層の材質は、ガラスや各種プラスチップ(ポリプロピレン、ポリカーボネート、シクロオレフィンポリマー、ポリジメチルシロキサン等)とすることができる。ウェル4内で増幅された核酸鎖の検出又は定量を光学的に行う場合においては、基板層の材質は、光透過性を有し、自家蛍光が少なく波長分散が小さいことで光学誤差の少ない材料を選択することが望ましい。マイクロチップAを構成する基板層は複数であって、数は限定されない。また、ガラスからなる基板層にプラスチックの基板層を貼り合わせるといった複数の材質を貼り合わせて成るマイクロチップAとすることもできる。何れの材質を基板層として用いた場合であっても、基板層に設けられるウェル4の内面は、親水性であることが好ましい。ウェル4内面の親水化処理については、(2−2)に記載する。
【0017】
図1においては、マイクロチップAにウェル4を9つ配設する場合を例示しているが、1個のマイクロチップに配設されるウェル4の数は何れであっても良く、ウェル4の形状も円柱形状に限定されない。マイクロチップに形成される主流路2、分岐流路3についても、図1に示した様態に限定されない。1個のマイクロチップに複数の導入口1と複数の主流路2を形成した構成であっても良い。また、導入口1からマイクロチップAに導入されたサンプル溶液を外部に排出する排水口5は必須の構成ではなく、サンプル溶液が外部に排出されない構造とすることもできる。
【0018】
(1−2)核酸増幅反応用試薬
図2は、本技術に係るマイクロチップAのウェル4内における核酸増幅反応用試薬(以下「試薬」とも称する)の形状を模式的に示した図である。符号Rで示す試薬は、ウェル4の内面に、ウェル4の中心部に比して辺縁部に偏在した形状で固着されている。例えば偏在の形状は、図2(A)に示すように、ウェル4の辺縁部から中心部に向かって高さを減じた、すり鉢形状とできる。また、本技術に係る実施形態の変形例として図2(B)を示す。すり鉢形状である試薬Rが、ウェル4の辺縁部から中心部へ向かって嵩を減じ、ウェル4の中心部に到達するまでに、その嵩を失うと、(B)に図示するように、試薬Rはウェル4の中心部を除く領域に環状に配置される。
【0019】
ウェル4に固着化される試薬Rには、核酸増幅反応において増幅核酸鎖を得るために必要な物質の少なくとも一部が含まれている。具体的には、増幅の対象であるDNA、RNA等の塩基配列の少なくとも一部に相補的なオリゴヌクレオチドプライマー(以下「プライマー」とも称する」)、核酸モノマー(dNTPs)、酵素、反応緩衝液に含まれる成分などである。また、核酸増幅反応に直接必要ではないが、増幅した核酸を検出するための蛍光標識等の標識を備えたプローブや、二本鎖の核酸にインターカレートする検出用試薬なども、増幅核酸鎖の検出に必要な物質として、試薬Rに含まれる成分とできる。ウェル4に固着した試薬Rに含まれる成分は、これらの核酸増幅反応及び検出に必要な物質のうち1又は複数とすることができる。また、試薬Rに複数の成分が含まれる場合、複数の成分が均一に混合された一層からなる試薬Rとすることもできるが、複数の成分がウェル4内に順に積層された、層構造を有した試薬Rとすることもできる。
【0020】
ウェル4内に積層される試薬Rの、1つの層に含まれる物質の種類は、1又は複数として特に限定されず、1つのウェル4における試薬Rの層の数も限定されない。物質がウェル4内に積層されている順序も、任意の順序とできる。例えば「プライマー、dNTPs、酵素、反応緩衝液に含まれる成分」の順で4層からなる構成や、「反応緩衝液に含まれる成分、酵素、dNTPs及びプライマー」の順序で3層からなり、かつ1つの層には予め複数の核酸増幅反応に必要な物質が混合されている構成であっても良い。例えば、プライマーが含まれる層を下層に、他の試薬が含まれる層を上層に、ウェル4内に積層すると、核酸増幅反応の開始時に、プライマーを含む下層まで溶解されて初めて核酸増幅反応が開始されるため、核酸の非特異的増幅が防止され、好適である。また、1個のマイクロチップAに複数のウェル4を有する場合、ウェル4間で積層される試薬Rの種類や積層数が同一でなくても良く、例えば図1のマイクロチップAにおいて9つ設けられたウェル4に、核酸増幅反応に必要な1種類の物質のみを含む試薬R、反応に必要な物質が複数混合された一層からなる試薬R、反応に必要な複数の物質が順に積層されている試薬R等、各々異なる物質の構成や積層数から成る試薬Rが固着されていても良い。
【0021】
試薬Rを、核酸増幅反応に必要な複数の物質を含んだ層状構造とすることによって、単層に比べ、より多くの種類の反応に必要な物質をマイクロチップA内に分離した状態で保持でき、核酸増幅反応開始時に増幅対象の核酸を含むサンプル溶液に加える物質の種類を減らすことができる。この結果、本技術に係るマイクロチップAにおいて、より簡便な分析が可能となる。また、核酸増幅反応開始時まで、増幅反応に必要な物質の混合が避けられることによって、プライマーダイマー等の非特異的増幅が抑えられ、マイクロチップAを用いて、精度の高い分析が可能となる。
【0022】
(1−3)分岐流路とウェルの連通部
マイクロチップAにおいて、導入口1から導入されるサンプル溶液は、主流路2を経て分岐流路3で分岐し、ウェル4に至る。分岐流路3がウェル4に連通する部分は、ウェル4内に固着された試薬Rの容量にかかわらず、ウェル4の側面の何れの位置に設けることもできるが、本技術に係るマイクロチップAでは、分岐流路3とウェル4の連通部が、前記ウェル4内に固着された核酸増幅反応に必要な物質の最厚部における高さより高い位置に配設にされていることが好ましい。図3(A)及び(B)は、図1中P−P’断面に対応する部分断面模式図、及びその変形例であり、前記連通部の形状を例示する。
【0023】
図3(A)に示すP−P’の部分断面において、マイクロチップAは、分岐流路3及びウェル4が形成された基板層a1と、基板層a2とが貼り合わされた、2層の基板層で構成される。分岐流路3とウェル4の連通部は、ウェル4内に固着された試薬Rの最厚部の高さhよりも上方に、試薬Rが連通部を塞がない配置で、ウェル4の側面に設けられている。そのため、分岐流路3を通流したサンプル溶液が連通部からウェル4内に導入された際、サンプル溶液は、固着されている試薬Rの表面と接触する。試薬Rは、ウェル4内に中心部に比して辺縁部に偏在し、例えばすり鉢形状や環状であることにより、サンプル溶液との接触面積が大きくなるため、サンプル溶液導入時に素早く溶解される。図3においては、試薬Rの形状を、図2(A)に示す形状と同様にして示したが、試薬Rの形状は、図2(B)に示す形状の他、ウェル4の内面に中心部に比して辺縁部に偏在する形状であれば、何れであっても良い。
【0024】
図3(B)に示すP−P’の部分断面において、マイクロチップAは、ウェル4を構成する部分のみが刳り抜いて形成された基板層a2の一の面に、分岐流路3の底面が形成された基板層a1が貼り合わされ、更にもう一の面に基板層a3が貼り合わされた、3層の基板層で構成される。分岐流路3とウェル4の連通部は、ウェル4内に固着された試薬Rの最厚部の高さhよりも下方に、試薬Rが連通部を塞ぐ配置で、ウェル4の側面に設けられている。そのため、分岐流路3を通流したサンプル溶液は連通部において試薬Rを溶解しつつウェル4内に導入することとなる。サンプル溶液は連通部に到達し、試薬Rを貫通しウェル4中央部に到達した後は、(A)における混合と同様に試薬Rの表面と接触する。また、(B)の構成においては、連通部が試薬Rの最厚部の高さhよりも下方に設けられていることによる、サンプル溶液導入後のウェル4内からの反応液の分岐流路3への逆流を防止するために、分岐流路3とウェル4との連通部に逆止弁を設けることが好ましい。
【0025】
上述したマイクロチップの構成により、本技術に係るマイクロチップAにおいては、ウェル4内に固着されていない核酸増幅反応に必要な残りの物質と、増幅の対象である鋳型DNA又はRNAを含むサンプル溶液のみの導入によって、核酸増幅反応を開始することができる。また本技術に係るマイクロチップにおいては、ウェル4に固着された試薬Rの形状がすり鉢状、環状等、中心部に比して辺縁部に偏在する形状に統一されていることによって、反応開始時のウェル4間での試薬R等の混合状態のむらを解消できる。更にウェル4の中央部において試薬Rの厚みが薄い、又は中央部に試薬Rが存在しないというウェル4内に固着した試薬Rの形状は、表面積が大きく、サンプル溶液との混合時の溶解を容易にし、ウェル4中央部に溶け残りが生じることを抑える。そのため、例えば核酸の光学的検出を行う場合、試薬Rの溶け残りによってウェル4中央部に極端に高いシグナル強度が測定されることを回避できる。
【0026】
2.本技術に係る核酸増幅反応用マイクロチップの製造方法について
本技術に係る核酸増幅反応用マイクロチップ(以下「マイクロチップ」とも称する)の製造方法について、図4に示すフローチャートに則して説明する。
【0027】
(2−1)基板層の成形
図4中、符号S1は基板層の成形工程である。本工程では、基板層に、図1に示す導入口1、主流路2、分岐流路3、ウェル4及び排出口5を成形する。成形には、例えばガラス製基板層のウェットエッチングやドライエッチング、プラスチック製基板層のナノインプリントや射出成型、切削加工等の方法を用いることができる。ウェル4等の基板層への形成は、図3(A)に示すように基板層a1のみに成形する場合や、図3(B)に示すように複数の基板層に成形する場合の何れも可能であり、主流路2、分岐流路3やウェル4等の各構成要素のマイクロチップにおける配設位置に応じて選択すれば良い。
【0028】
(2−2)ウェル内の親水化処理
図4中、符号S2は、ウェル4を構成する、内面の親水化工程である。本工程では、前述の成形工程S1によって基板層に成形されたウェル4の内面に親水化処理を行う。親水化処理には、例えば親水性樹脂の塗布、光触媒作用を利用した表面処理、アルカリケイ酸塩等の無機系コート処理、エッチング処理、プラズマ処理等の方法を用いることができる。また、基板層の成形時にウェル4内面にエンボス(凹凸)形状をスタンパーで造りこみ、親水化処理としても良い。本技術に係るマイクロチップAにおいては、特にウェル4内面をプラズマに曝露する親水化処理方法が好適である。
【0029】
(2−3)ウェル内への試薬の滴下
図4中、符号S3は核酸増幅反応に必要な物質の少なくとも一部を含んだ試薬Rを、マイクロチップAのウェル4内へ滴下する工程である。本工程では、増幅反応に用いる物質を含んだ液状又はゲル状の試薬Rを、前述の親水化工程S2により親水化処理を施したウェル4に滴下する。ウェル4に滴下された試薬Rの液滴は、ウェル4を構成する面の親水化処理によってウェル4内で中心部に比して辺縁部に偏在した形状に留まる。ウェル4内面の親水性の程度や、試薬Rの量及び性質等に応じて、ウェル4内に偏在する試薬Rの形状は、例えば図2(A)に示す、すり鉢形状や、(B)に示す、環状となる。
【0030】
ウェル4へ試薬Rを滴下する工程には、必要に応じて試薬Rの滴下前に、試薬Rに含まれる成分に対して所定の処理を行う工程を含んでいても良い。例えばプライマーを含む試薬Rを滴下する場合、予め試薬Rを95℃程度の温度で処理し、プライマーを変性させ1本鎖にすることで、プライマーダイマーの発生を抑え、核酸増幅反応時に非特異的な核酸の増幅を低減することが可能となる。
【0031】
図4においては、ウェル4内へ試薬Rを滴下する工程S3を、基板層の成形工程S1とウェル4の内面の親水化工程S2に続く工程として示しているが、本技術に係るマイクロチップAの製造方法では、別途、ウェル4等が成形されて親水化処理を施された基板層を用意し、ウェル4内へ滴下する工程S3から行うことも可能である。
【0032】
(2−4)ウェルへの試薬の固着化
図4中、符号S4はウェル4内の試薬Rを乾燥させ、試薬Rをウェル4内面に固着化する工程である。前述の試薬Rを滴下する工程S3によってウェル4内に滴下された試薬Rは、ウェル4内面の親水化処理により、ウェル4内で中心部に比して辺縁部に偏在した形状に留まる。本工程では、試薬Rの該形状を保持したまま乾燥し、試薬Rをウェル4に固着化させる。乾燥方法としては、凍結乾燥が好適である。また、この凍結乾燥の工程の前に、予め試薬Rを十分に凍結するための冷却工程を設けても良い。ウェル4に滴下した試薬Rが、前記形状であることによって、滴下された試薬Rの表面積が大きくなり、冷却工程において試薬Rが均一に冷却される。また試薬Rの均一な冷却は、固着化の過程において試薬Rの形状を安定させる。この冷却工程と凍結乾燥工程とを組み合わせることにより、凍結乾燥時のウェル4における試薬Rの突沸等が予防され、滴下時のウェル4内における試薬Rの形状を、滴下以降の工程においても保持することが容易となる。
【0033】
マイクロチップAのウェル4内に固着化される試薬Rは、ウェル4内への試薬Rの滴下の工程S3と、ウェル4への試薬Rの固着化の工程S4とを繰り返して、核酸増幅反応に必要な物質の一部をウェル4内に積層させても良い。ウェル4において試薬Rの積層を行う際、滴下工程S3及び固着化工程S4の二巡目以降については、既にウェル4内に固着化された試薬Rの溶解を防ぐために、試薬Rの滴下時にマイクロチップAを低温に保持しておくことが好ましく、滴下後は、試薬Rを直ちに凍結させることが好ましい。
【0034】
(2−5)基板層の貼り合わせ
図4中、符号S5は基板層の貼り合わせ工程である。本工程では、前述の固着化工程S4によってウェル4内に試薬Rを保持した基板層と、他の基板層を貼り合わせる。基板層の貼り合わせには、例えば接着剤や粘着性を有したシートを用いる方法や、熱融着、陽極接合、超音波接合等の方法を用いることができる。また、基板層の表面を酸素プラズマ処理や真空紫外光処理により活性化して貼り合わせることも可能である。ポリジメチルシロキサン等のプラスチックの場合、ガラスとの親和性が高く、表面を前記処理によって活性化し接触させると、ダングリングボンドが反応して強固な共有結合であるSi−O−Siシラノール結合を形成し、十分な強度の接合が得られる。酸素プラズマ処理又は真空紫外光処理は、基板層の材質に応じて条件を設定すれば良い。
【0035】
上述の、本技術に係る核酸増幅反応用マイクロチップの製造方法によって作製されたマイクロチップAでは、ウェル4内に固着化された試薬Rが、ウェル4内面の親水化処理により一定の形状に揃う。そのため、マイクロチップA内に導入されるサンプル液との混合時に、固着された試薬Rの溶解の程度について、ウェル4間でのばらつきが抑えられる。また、試薬Rが、ウェル4辺縁部から中央部に向って嵩を減じて偏在した形状で固着されていることにより、試薬Rの表面積が大きくなる。このため、サンプル溶液との混合時に、試薬Rは溶解され易くなる。かつ固着化された試薬Rが前記の形状であるより、ウェル4中央部に試薬Rの溶け残りが生ずることが抑えられ、増幅核酸の光学的検出を行う場合、核酸増幅反応開始時におけるウェル4中央部での極端に強度が高いシグナルの検出を抑えることができる。従って、本技術に係る製造方法により作製されたマイクロチップを用いて、簡便で精度の高い核酸増幅反応を行うことが可能となる。
【0036】
なお本技術は、以下のような構成もとることができる。
(1)核酸増幅反応の反応場であるウェルに、前記核酸増幅反応に必要な物質の少なくとも一部が前記ウェルの中心部に比して辺縁部に偏在した形状で固着された、核酸増幅反応用マイクロチップ。
(2)前記ウェルを構成する面が親水性である、上記(1)に記載の核酸増幅反応用マイクロチップ。
(3)前記物質が前記ウェルの辺縁部から中心部に向けて高さを減じたすり鉢形状で存在する、上記(1)又は(2)に記載の核酸増幅反応用マイクロチップ。
(4)前記物質が前記ウェルの中心部を除く領域に環状に存在する、上記(1)から(3)の何れかに記載の核酸増幅反応用マイクロチップ。
(5)核酸増幅反応の反応場となるウェルを形成した基板層の該ウェルを構成する面を親水化する工程と、前記核酸増幅反応に必要な物質の少なくとも一部を前記ウェル内に滴下する工程と、前記物質を乾燥させ前記ウェル内に固着化する工程とを含む、核酸増幅反応用マイクロチップの製造方法。
(6)前記親水化する工程に、前記ウェルを構成する面をプラズマに曝露する工程を含む、上記(5)に記載の核酸増幅反応用マイクロチップの製造方法。
(7)前記固着化する工程に、前記ウェルに滴下された前記物質を凍結乾燥する工程を含む、上記(5)又は(6)に記載の核酸増幅反応用マイクロチップの製造方法。
【実施例】
【0037】
本技術に係るマイクロチップの作製方法に則してマイクロチップを作製し、ウェル内に固着化された試薬の形状及び試薬の溶解時の状態を観察した。
【0038】
<マイクロチップの材料及び作製方法>
マイクロチップの材料として、ポリジメチルシロキサン(PDMS)の基板層に、主流路、分岐流路、ウェルを成形した後、流路及びウェルを形成していない面のみを活性化し、ガラス板と貼り合わせた。次にメタルマスクによって流路等を保護し、ウェル内面のみ反応性イオンエッチング(10cc、50W、15秒)により、親水化処理を行った。上記工程により作製されたマイクロチップを、実施例とした。比較例としてウェル内面の親水化処理を除いた点以外は、全て実施例と同様に作製されたマイクロチップを用意した。実施例及び比較例のマイクロチップの各ウェルにプライマーを含む試薬液を滴下し、実施例については−28℃に置き、試薬を凍結させた。一方、比較例のマイクロチップは、2つの群に分け、1つの群は実施例と同様に−28℃に置き、滴下した試薬を凍結させた。もう1つの群については、室温での減圧乾燥(1000Pa)によって試薬をウェルに固着させた。−28℃における凍結処理を行った比較例の群を、比較例1とし、減圧乾燥を行った群を比較例2とする。実施例及び比較例1は、試薬の凍結後、凍結乾燥機(25Pa)において、試薬をウェル内に固着させた。プライマーを含む試薬液を固着させた実施例及び比較例1、2のマイクロチップの各ウェルには、次に酵素を含む試薬液を滴下し、固着化させた。滴下後の固着化の工程は、プライマーを含む試薬液の場合と同様に、実施例及び比較例1については凍結処理後、凍結乾燥を行い、比較例2については減圧乾燥を行った。
【0039】
<観察結果>
実施例及び比較例1、2のウェル内に固着化された試薬の形状について、マイクロチップ上面から観察した結果を図5に示す。(A)に示す実施例の各ウェルでは、試薬は中心部を除いて環状に固着化されている。また固着化された試薬の形状はウェル間で均一であった。(B)に示す比較例1では、ウェル内に固着化された試薬の形状は、ウェル内面の一方に集中し、ウェル間で不均一であった。(C)に示す比較例2においては、比較例1と同様にウェル内面の一方に試薬が偏って固着化される形状が観察されたが、いくつかのウェルにおいてはウェル中央部に試薬が集中している形状も観察された(図5(C)矢印)。
【0040】
実施例及び比較例1、2のウェル内に核酸増幅反応用緩衝液を加え、30秒後のウェル内の試薬の状態を観察した。マイクロチップ上面からウェル内を観察した結果を、図6に示す。(A)は実施例のウェルであり、(B)及び(C)は各々比較例1及び比較例2のウェルである。実施例、比較例1、2の何れにおいても固着化された試薬の溶け残りは観察されたが、比較例2において、特に大きい試薬の溶け残りがウェル中央部に観察された(図6(C)矢印)。
【0041】
本実施例の結果において、ウェル内面の親水化処理工程と乾燥処理前の試薬の十分な凍結は、マイクロチップのウェル内に固着された試薬の形状に影響することが示された。また、固着化した試薬の形状の違いによって、溶解時の溶け残りの発生に差が生じることが示された。
【産業上の利用可能性】
【0042】
本技術に係る核酸増幅反応用マイクロチップによれば、簡便な方法で高精度な分析を行うことができる。そのため、臨床における遺伝子型判定や感染病原体判定などのための核酸増幅装置として、本技術に係る核酸増幅反応用マイクロチップは用いられ得る。
【符号の説明】
【0043】
A:核酸増幅反応用マイクロチップ、a1、a2、a3:基板層、h:試薬の最厚部における高さ、R:試薬、1:導入口、2:主流路、3:分岐流路、4:ウェル、5:排出口
【特許請求の範囲】
【請求項1】
核酸増幅反応の反応場であるウェルに、
前記核酸増幅反応に必要な物質の少なくとも一部が前記ウェルの中心部に比して辺縁部に偏在した形状で固着された、
核酸増幅反応用マイクロチップ。
【請求項2】
前記ウェルを構成する面が親水性である、請求項1に記載の核酸増幅反応用マイクロチップ。
【請求項3】
前記物質が前記ウェルの辺縁部から中心部に向けて高さを減じたすり鉢形状で存在する、
請求項2に記載の核酸増幅反応用マイクロチップ。
【請求項4】
前記物質が前記ウェルの中心部を除く領域に環状に存在する、
請求項3に記載の核酸増幅反応用マイクロチップ。
【請求項5】
核酸増幅反応の反応場となるウェルを形成した基板層の該ウェルを構成する面を親水化する工程と、
前記核酸増幅反応に必要な物質の少なくとも一部を前記ウェル内に滴下する工程と、
前記物質を乾燥させ前記ウェル内に固着化する工程とを含む、
核酸増幅反応用マイクロチップの製造方法。
【請求項6】
前記親水化する工程に、前記ウェルを構成する面をプラズマに曝露する工程を含む、
請求項5に記載の核酸増幅反応用マイクロチップの製造方法。
【請求項7】
前記固着化する工程に、前記ウェルに滴下された前記物質を凍結乾燥する工程を含む、
請求項6に記載の核酸増幅反応用マイクロチップの製造方法。
【請求項1】
核酸増幅反応の反応場であるウェルに、
前記核酸増幅反応に必要な物質の少なくとも一部が前記ウェルの中心部に比して辺縁部に偏在した形状で固着された、
核酸増幅反応用マイクロチップ。
【請求項2】
前記ウェルを構成する面が親水性である、請求項1に記載の核酸増幅反応用マイクロチップ。
【請求項3】
前記物質が前記ウェルの辺縁部から中心部に向けて高さを減じたすり鉢形状で存在する、
請求項2に記載の核酸増幅反応用マイクロチップ。
【請求項4】
前記物質が前記ウェルの中心部を除く領域に環状に存在する、
請求項3に記載の核酸増幅反応用マイクロチップ。
【請求項5】
核酸増幅反応の反応場となるウェルを形成した基板層の該ウェルを構成する面を親水化する工程と、
前記核酸増幅反応に必要な物質の少なくとも一部を前記ウェル内に滴下する工程と、
前記物質を乾燥させ前記ウェル内に固着化する工程とを含む、
核酸増幅反応用マイクロチップの製造方法。
【請求項6】
前記親水化する工程に、前記ウェルを構成する面をプラズマに曝露する工程を含む、
請求項5に記載の核酸増幅反応用マイクロチップの製造方法。
【請求項7】
前記固着化する工程に、前記ウェルに滴下された前記物質を凍結乾燥する工程を含む、
請求項6に記載の核酸増幅反応用マイクロチップの製造方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2013−90586(P2013−90586A)
【公開日】平成25年5月16日(2013.5.16)
【国際特許分類】
【出願番号】特願2011−233681(P2011−233681)
【出願日】平成23年10月25日(2011.10.25)
【出願人】(000002185)ソニー株式会社 (34,172)
【Fターム(参考)】
【公開日】平成25年5月16日(2013.5.16)
【国際特許分類】
【出願日】平成23年10月25日(2011.10.25)
【出願人】(000002185)ソニー株式会社 (34,172)
【Fターム(参考)】
[ Back to top ]

