核酸増幅方法
【課題】そこで、本発明は、基材上にて核酸増幅反応を行うに際して、増幅された核酸断片を立体的に集積させ、単位面積あたりの核酸断片数を高める。
【解決手段】解析対象の核酸領域と核酸アプタマーに対応するアプタマー領域とを含む環状核酸を鋳型とし、当該核酸アプタマーと親和性を有する第1の物質が固定された基材上にてプライマーを起点とした鎖置換型のRCA反応を行い、アプタマー領域に対応する核酸アプタマー及び解析対象の核酸領域を含む一本鎖核酸分子を、当該核酸アプタマーと上記第1の物質との間の親和性により上記基材に固定する。
【解決手段】解析対象の核酸領域と核酸アプタマーに対応するアプタマー領域とを含む環状核酸を鋳型とし、当該核酸アプタマーと親和性を有する第1の物質が固定された基材上にてプライマーを起点とした鎖置換型のRCA反応を行い、アプタマー領域に対応する核酸アプタマー及び解析対象の核酸領域を含む一本鎖核酸分子を、当該核酸アプタマーと上記第1の物質との間の親和性により上記基材に固定する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、例えば核酸の塩基配列決定方法等に用いられる核酸増幅方法、当該核酸増幅方法に使用する核酸増幅キットに関する。
【背景技術】
【0002】
核酸増幅方法は、増幅目的の核酸を鋳型としてDNAポリメラーゼの酵素活性により当該核酸を増幅することを基本的な原理としている。核酸増幅方法には、鋳型となる核酸又はプライマーをビーズや基板等の基材に固定化し、当該基材上にて核酸増幅反応を実行するタイプがある。
【0003】
このような基材上にて核酸増幅反応を行う核酸増幅方法は、一例として、ゲノムDNAやトランスクリプトームの配列決定に利用される塩基配列決定方法に利用される。特に、近年では、試料となるDNA断片を基板に数多く固定して、これら数多くのDNA断片の塩基配列をパラレルに決定する方法が開発されている。これにより、塩基解析速度は飛躍的に向上した。これらの技術では、解析対象となる核酸断片を核酸増幅反応により増幅することで、増幅された核酸断片が束(クラスタ)として基板上に配置される。したがって、基板に固定されたDNA断片の数に対応して、数多くの核酸断片の束が基板上に配置されることとなる。
【0004】
例えば、非特許文献1では、基板上にプライマーを固定し、固定されたプライマーを用いて基板上でPCRを行うことで、基板上に増幅遺伝子断片のクラスタを形成している。また非特許文献2では、エマルジョンPCRを行い、所定の核酸断片を微粒子表面にて増幅・固定し、その後、微粒子を基板上に固定する。これにより、増幅した核酸断片の束(クラスタ)が平面上に複数配置されることとなる。
【0005】
このように、基板上に配置された核酸断片の束(クラスタ)について、いわゆるシーケンス反応を行うことで、当該束(クラスタ)毎に塩基配列を決定する。そして、基板上に配置された数多くの束(クラスタ)を二次元画像センサにて測定し、画像解析により蛍光を読み取ることで束(クラスタ)毎に塩基配列を決定する。このように、基板に固定された多数の束(クラスタ)を平行して解析している。
【0006】
このような塩基配列決定方法において、核酸断片の束(クラスタ)の形成は重要なステップである。すなわち、基板上に高密度で束(クラスタ)を配置することは、一度に画像センサから取得できる配列情報を増加させるため、ハイスループット化を達成できる。一方、1つの束(クラスタ)に含まれる核酸断片が多ければ多いほど、シーケンス反応における蛍光強度等の信号強度が向上することとなり、より信頼性の高い塩基配列分析及び検出系の簡素化を達成できる。
【0007】
しかしながら、基板上の束(クラスタ)を高密度化することと、各束(クラスタ)に含まれる核酸断片を多数化することは、一般に相反する関係にある。すなわち、束(クラスタ)の密度を高めることは、クラスタ一つの占める面積を少なくすることであり、そこに含まれる核酸断片数が減少してしまう関係にある。よって、基板上の束(クラスタ)を高密度化し、且つ、各束(クラスタ)に含まれる核酸断片を多数化する技術が求められている。
【0008】
換言すれば、基材上にて核酸増幅反応を行う核酸増幅方法において、核酸増幅反応により得られた、単位面積あたりの核酸断片数を高める手法の開発が望まれている。
【先行技術文献】
【非特許文献】
【0009】
【非特許文献1】Nucleic Acids Research, 2000, vol. 28, No. 20, e87
【非特許文献2】Science 2005, VOL. 309, pp.1728-1732
【発明の概要】
【発明が解決しようとする課題】
【0010】
そこで、本発明は、基材上にて核酸増幅反応を行うに際して、増幅された核酸断片を立体的に集積させ、単位面積あたりの核酸断片数を高めることができる核酸増幅方法及び当該核酸増幅方法に用いる核酸増幅キットを提供することを目的とする。また、本発明は、この核酸増幅方法を適用することで、一回の処理で読み取れる核酸断片の数を増加させることでハイスループット化を達成でき、且つSN比を向上させることで優れた信頼性を達成できる塩基配列決定方法を提供することを目的としている。
【課題を解決するための手段】
【0011】
上述した目的を達成するため、本発明者らは、鋭意研究の結果、解析対象の核酸領域とアプタマー領域と含む環状核酸を鋳型とした鎖置換型のローリングサークル増幅反応を行うことで、アプタマーが特異的に相互作用する物質を有する基材上において、増幅された核酸分子を立体的に集積させることができ、単位面積あたりの増幅対象の核酸領域の数を増加できることを見いだし、本発明を完成するに至った。
【0012】
すなわち、本発明に係る核酸増幅方法は、解析対象の核酸領域と核酸アプタマーに対応するアプタマー領域とを含む環状核酸を鋳型とし、当該核酸アプタマーと親和性を有する第1の物質が固定された基材上にてプライマーを起点とした鎖置換型のローリングサークル増幅反応を行う工程を含んでいる。本発明に係る核酸増幅方法によれば、上記アプタマー領域に対応する核酸アプタマー及び解析対象の核酸領域を含む一本鎖核酸分子を、当該核酸アプタマーと上記第1の物質との間の親和性により上記基材に固定することができる。
【0013】
本発明に係る核酸増幅方法において、上記プライマーは、上記基材上に固定された第2の物質に対して結合する能力を有する結合分子を導入したものを使用することができる。この場合、上記第2の物質と上記結合分子とが結合した状態で、上記ローリングサークル増幅反応が進行する。ここで、上記第1の物質と上記第2の物質とは同じ物質であってもよいし、異なる物質であっても良い。
【0014】
また、本発明に係る核酸増幅方法において、上記プライマーとして上記結合分子を導入したものを使用し、上記基材として上記第2の物質を固定したものを使用する場合、先ず、上記環状核酸と上記プライマーとの複合体を形成し、その後、上記第2の物質と上記結合分子とを結合させることで当該複合体を上記基材上に捕捉させる。その後、上記鎖置換型のローリングサークル増幅反応を実行することが好ましい。
【0015】
さらに、本発明に係る核酸増幅方法においては、上記第2の物質を所定の距離で離間して配置した基材を使用することが好ましい。このとき、上記第2の物質は、隣り合う第2の物質同士が所定の距離を有するよう、上記基材上にランダムに配置されても良いし、上記基材上に規則的なパターンで配置されてもよい。
【0016】
さらにまた、本発明に係る核酸増幅方法において、上記アプタマー領域は上記鎖置換型のローリングサークル増幅反応により上記核酸アプタマーの相補鎖が合成されるように設計されていてもよい。この場合、鎖置換型のローリングサークル増幅反応により合成された核酸分子を鋳型とする2回目の核酸増幅反応により、上記核酸アプタマーを含む上記一本鎖核酸分子が合成されることとなる。
【0017】
なお、上記鎖置換型のローリングサークル増幅反応は、鎖置換活性を有するポリメラーゼを使用しても良いし、鎖置換活性を有しないポリメラーゼとヘリカーゼを使用しても良い。また、上記基材は平面基板又はビーズのいずれであってもよい。
【0018】
ところで、本発明に係る核酸増幅キットは、解析対象の核酸領域を導入する部位と、核酸アプタマーに対応するアプタマー領域とを含む環状核酸と、上記環状核酸に含まれる所定の領域にアニールできるプライマーと、当該核酸アプタマーと親和性を有する第1の物質が固定された基材とを備えている。
【0019】
本発明に係る核酸増幅キットにおいて、上記プライマーは、上記基材上に固定された第2の物質に対して結合する能力を有する結合分子を導入したものであることを好ましい。ここで上記第1の物質と上記第2の物質とは同じ物質であってもよいし、異なる物質であっても良い。
【0020】
また、本発明に係る核酸増幅キットにおいて、上記基材は、上記第2の物質を離間して配置したものであることが好ましい。上記第2の物質は、隣り合う第2の物質同士が所定の距離を有するように、上記基材上にランダムに配置されも良いし、上記基材上に規則的なパターンで配置されてもよい。
【0021】
さらに、本発明に係る核酸増幅キットにおいて、環状核酸に含まれるアプタマー領域は、鎖置換型のローリングサークル増幅反応により上記核酸アプタマーの相補鎖が合成されるように設計されてもよい。
【0022】
さらにまた、本発明に係る核酸増幅キットは、鎖置換活性を有するポリメラーゼ又は鎖置換活性を有しないポリメラーゼとヘリカーゼを更に備えていても良い。なお、本発明に係る核酸増幅キットにおいて上記基材は平面基板又はビーズのいずれであっても良い。
【0023】
また、本発明では、増幅された核酸断片を立体的に集積させ、単位面積あたりの核酸断片数を高めた特徴的な核酸構築物を提供できる。すなわち、本発明に係る核酸構築物は、核酸アプタマー及び解析対象の核酸領域を含む一本鎖核酸分子と、上記核酸アプタマーと親和性を有する第1の物質が固定された基材とから構成される。本発明に係る核酸構築物では、上記核酸アプタマーと上記第1の物質との間の親和性により、上記一本鎖核酸分子が上記基材に固定される。
【0024】
また、本発明に係る核酸構築物において、上記基材上には、複数の上記一本鎖核酸分子が固定され、各一本鎖核酸分子はそれぞれクラスタを形成することができる。
【発明の効果】
【0025】
本発明によれば、基材上にて核酸増幅反応を行うに際して、増幅された核酸断片を立体的に集積させ、単位面積あたりの核酸断片数を高めることができる。また、本発明は、この核酸増幅方法を適用することで、一回の処理で読み取れる核酸断片の数を増加させることでハイスループット化を達成でき、且つSN比を向上させることで優れた信頼性を達成できる。
【図面の簡単な説明】
【0026】
【図1】本発明を適用した核酸増幅方法の一実施形態を説明するための概略構成図である。
【図2】本発明を適用した核酸増幅方法の他の実施形態を説明するための概略構成図である。
【図3−1】本発明を適用した核酸増幅方法の更に他の実施形態を説明するための概略構成図である。
【図3−2】図3−1に示した核酸増幅方法に使用する基板を作製する方法の一例を説明する概略構成図である。
【図4】本発明を適用した核酸増幅方法の更に他の実施形態を説明するための概略構成図である。
【図5】本発明を適用した核酸増幅方法の更に他の実施形態を説明するための概略構成図である。
【図6】本発明を適用した核酸増幅方法を実施する増幅遺伝子クラスタ作成装置を説明するための概略構成図である。
【図7】本発明を適用した核酸増幅方法を適用して形成されたクラスタの分析を行う核酸分析装置を説明するための概略構成図である。
【図8】本発明を適用した核酸増幅方法を適用して形成されたクラスタの分析を行う核酸分析装置の他の例を説明するための概略構成図である。
【発明を実施するための形態】
【0027】
以下、本発明の実施形態について、図面を参照して詳細に説明する。
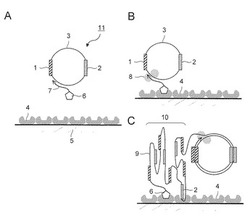
本発明に係る核酸増幅方法は、図1A〜Cに示すように、解析対象の核酸領域1とアプタマー領域2と含む環状核酸3を鋳型とした鎖置換型のローリングサークル増幅反応を行う方法である。核酸増幅方法では、アビジン様分子等といった特定の核酸アプタマーとの間で特異的に相互作用する第1の物質4を固定した基板5を使用する。
【0028】
また、図1A〜Cに示した核酸増幅方法では、第1の物質4に対して相互作用する結合分子6を5'末端に有するプライマー7を使用している。なお、一例として、第1の物質4がアビジン様分子である場合、結合分子6はビオチン分子となる。この結合分子6を有するプライマー7を使用することによって、鎖置換型のローリングサークル増幅反応は基板5の表面で進行する。
【0029】
また、鎖置換型のローリングサークル増幅反応は、一例としては鎖置換活性を有するポリメラーゼ8により、プライマー7の3'末端から進行する。この増幅反応は、環状核酸3を鋳型とした鎖置換型のローリングサークル増幅反応であるため、一本鎖の増幅核酸9を合成する。合成された一本鎖の増幅核酸9は、環状核酸3に対応して、解析対象の核酸領域1とアプタマー領域2と繰り返して含んでいる。合成された一本鎖核酸9は、複数のアプタマー領域2のうち少なくとも一部が基板5上に配置された第1の物質4と相互作用することで、立体的に集積されたクラスタ10を形成する。
【0030】
<<環状核酸3>>
ここで、環状核酸3について説明する。環状核酸3は、アプタマー領域2を含む母体となるベクターに、解析対象の核酸領域1を組み入れることで作製される。解析対象の核酸領域1としては、例えば、解析対象のゲノムDNAやトランスクリプトーム由来のcDNA等を断片化して得られる、例えば10〜1000bp、好ましくは50〜500bp、より好ましくは100〜250bpの長さにDNA断片とすることができる。DNA断片を母体となるベクターに挿入する手法は、特に限定されないが、例えば、DNA断片の両末端に所定の制限酵素の認識配列を有するアダプターを結合し、上記ベクターにおける同制限酵素認識部位に挿入する手法が挙げられる。
【0031】
アプタマー領域2とは、二本鎖の環状核酸3における、核酸アプタマーと呼称されるポリヌクレオチドに相当する領域である。核酸アプタマーとは、所定の塩基配列を有することで特定の物質に対して特異的な親和性を有する一本鎖の核酸分子を意味する。なお、環状核酸3は二本鎖の核酸分子であるため、アプタマー領域2が上記の特定の物質と相互作用することはない。
【0032】
核酸アプタマーとしては、例えば、下記の表1に示すものが知られている。なお、表1は、既知の核酸アプタマーの塩基配列と、当該核酸アプタマーが特異的に親和性を有する物質の種類とを対応付けて示している。
【0033】
【表1】

【0034】
また、核酸アプタマーとしては、例えば、Anal Chem. 2009 July 1; 81(13): 5490-5495やActa Biochim Biophys Sin (2009): 335-340に開示されたものを使用することもできる。
【0035】
さらに、環状核酸3は、複数の核酸アプタマーに対応する複数の異なるアプタマー領域2を有する構成であってもよい。このとき、複数の核酸アプタマーは、上記表に示す核酸アプタマーから任意に選択することができる。なかでも、核酸アプタマーとしては、5'-TATAACGCCCGTGTTGCTCGGTTAT-3'(配列番号4)、5'-CAAGAACTCCTAAGTATAATGTGAGGGATCCGAAATTCTGCTCTTATGTATGGCAAGATT-3'(配列番号3)、5'-GCGGGGTTGGGCGGGTGGGTTCGCTGGGCAGGGGGCGAGTG-3'(配列番号11)、 5'-CCCAGCAGCACTGGTAGTGAGGCAGTTCACCGGTGGGGCGGTGAGTTTGGCTGCTATTTAT-3'(配列番号19)、5'-GTACCAGCTTATTCAATTACAGATCGAGGGCAGCGATAGCTGGGCTAATAAGGTTAGCCCCATCGGTCCTGGACTTGGGACTAGATAGTATGTTCATCAG-3'(配列番号21)を使用することが好ましい。核酸アプタマーとしてストレプトアビジンに対するアプタマー配列(5'-TATAACGCCCGTGTTGCTCGGTTAT-3'(配列番号4)、5'-GTGATCGTCCAGCGACCGAGCAGGAAACTTATGTAACGACCCGAAATTCCTGCTTAGACT-3'(配列番号1))を使用した場合には、結合分子6としてビオチンを用いることで、基板5に固定する分子4をストレプトアビジン一種類で行うことができ、基板の製造が簡略化できるといった利点がある。また、核酸アプタマーとしてセルビオースに対するアプタマー配列(5'-GCGGGGTTGGGCGGGTGGGTTCGCTGGGCAGGGGGCGAGTG-3'(配列番号11)など表1参照)やキチンに対するアプタマー配列(5'-CCCAGCAGCACTGGTAGTGAGGCAGTTCACCGGTGGGGCGGTGAGTTTGGCTGCTATTTAT-3'(配列番号19))を使用した場合には、基板側に固定する分子が単純な糖類で良く、基板5の製造コストや保存性の点に優れるといった利点がある。また、セルビオースやコール酸などの低分子に対するアプタマー配列(それぞれ5'-GCGGGGTTGGGCGGGTGGGTTCGCTGGGCAGGGGGCGAGTG-3'(配列番号11)、5'-GTACCAGCTTATTCAATTACAGATCGAGGGCAGCGATAGCTGGGCTAATAAGGTTAGCCCCATCGGTCCTGGACTTGGGACTAGATAGTATGTTCATCAG-3'(配列番号21))を使用した場合、物質4の排除体積が小さいため基板5に物質4を高密度に固定することができ、結果アプタマー配列の結合を促進することが出来る。
【0036】
さらにまた、環状核酸3は、プライマー7が特異的にアニールする領域を有している。すなわち、環状核酸3は、プラマー7全体の塩基配列又はプライマー7の3'末端側領域の塩基配列に対して相補的な塩基配列からなるオリゴヌクレオチド領域を有している。ここで、プライマー7の3'末端側領域とは、プライマー7の3'末端の塩基を含む例えば5〜100bp、好ましくは10〜50bp、より好ましくは15〜30bpの領域である。この範囲であれば、プライマー7が環状核酸3に対して特異的にハイブリダイズすることができる。
【0037】
<<基板>>
次に、基板5について説明する。基板5は、例えば、ガラス基板,サファイア基板,シリコン基板などの無機物質からなる基板、ステンレスなどの金属からなる基板、ポリメタクリル酸メチル樹脂、ポリカーボネート樹脂、シクロオレフィン樹脂、ポリスチレン樹脂などの有機物質からなる基板を用いることができる。また、基板5は、単一の材料からなるものに限定されず、異なる材質の板状部材を貼り合わせたものや、各種の表面処理が施されたものであっても良い。また、図示した基板5は平板状を呈しているが、基板5の形状は特に限定されない。例えば、詳細を後述するが、所定の塩基配列決定装置に使用されるフローセルの一主面を基板5としても良い。
【0038】
基板5に配置されている第1の物質4は、上述した環状核酸3のアプタマー領域2が特異的に相互作用する物質である。すなわち、第1の物質4としては、上記表1に示した各種の物質を使用することができる。
【0039】
また、基板5と第1の物質4との間の結合は、特に限定されず、共有結合、静電相互作用、疎水相互作用などの如何なる結合でもよい。結合は、用いる基板5の材質と固定する第1の物質4に応じて適切なものを選択することができる。特に、基板5と第1の物質4との間の結合は安定性の観点から、共有結合とすることが望ましい。一例として、第1の物質4としてストレプトアビジンを使用し、基板5としてポリスチレン樹脂を使用する場合には以下のような手順に従って、ストレプトアビジンをポリスチレン樹脂からなる基板5の表面に固定することができる。すなわち、先ず、ポリスチレン樹脂からなる基板5の表面をVUV処理によって酸化させカルボキシル基を導入する。次に、このカルボキシル基を水溶性カルボジイミド(1-エチル-3-(3-ジメチルアミノプロピル)カルボジイミド塩酸塩)で活性化させる。次いで、この表面にストレプトアビジン溶液を接触させることで、ストレプトアビジン中のアミノ基とカルボキシル基との間でエステル結合を形成させる。これにより、ポリスチレン樹脂からなる基板5の表面にストレプトアビジンを共有結合により固定することができる。
【0040】
一方、基板5は、その表面にて核酸増幅反応を進行させるため、当該反応に使用するプライマー7を固定する手段を有している。図1に示した例では、第1の物質4がアプタマー領域2と相互作用する役割と、プライマー7を固定する手段としての役割を兼ねている。詳細には、プライマー7の5'末端には、第1の物質4に対して相互作用する結合分子6が結合している。例えば、第1の物質4がアビジン様分子である場合、結合分子6としてビオチン分子を使用することによって、プライマー7を基板5の表面に結合できる。
【0041】
なお、アビジン様分子としては、ビオチンに対する結合能を有するものであれば良く、その分子種まで限定されず、一般的に使用されている如何なる分子を使用しても良い。アビジン様分子としては、例えば、ストレプトアビジン、ニュートラビジン、アビジンなどを用いることができる。
【0042】
なお、プライマー7を固定する手段としては、第1の物質4に限定されず、プライマー7における5'末端側の塩基配列に相補的な塩基配列からなるオリゴヌクレオチドを使用することもできる。すなわち、このオリゴヌクレオチドを基板5の表面に導入しておき、プライマー7の5'末端側をオリゴヌクレオチドにハイブリダイズさせることで、プライマー7を基板5の表面に固定することもできる。
【0043】
また、プライマー7を固定する手段としては、一定以上の親和性を有する分子種の組み合わせであれば如何なる手段を採用しても良い。例えば、プライマー7を固定する手段としては抗体を使用することができる。すなわち、基板5の表面に抗体を固定し、抗原性を有する物質を結合させたプライマー7又は抗体に対する核酸アプタマーを有するプライマー7を使用する。このようにすれば、プライマー7は、抗原抗体反応又は核酸アプタマーと抗体との相互作用により基板5の表面に固定することができる。ビオチンとアビジン様分子との組み合わせ以外の他の選択肢を利用することで、サンプル調整等の増幅反応以外の工程に、ビオチンやアビジン様分子の特異的結合を利用することができる。
【0044】
<<核酸増幅反応>>
次に、上述した環状核酸3及び基板5を用いた核酸増幅反応工程について説明する。核酸増幅反応は、DNAポリメラーゼを用いた鎖置換型の反応である。鎖置換型の核酸合成反応は、鎖置換活性を有するDNAポリメラーゼを用いても良いし、鎖置換活性を有しないDNAポリメラーゼとヘリカーゼ(例えば、T7ヘリカーゼ)とを組み合わせて用いてもよい。より具体的に、鎖置換活性を有するDNAポリメラーゼとしては、例えばphi29ポリメラーゼを用いることができる。鎖置換活性を有するDNAポリメラーゼとしては、その他にBstポリメラーゼ、Csaポリメラーゼ、96-7ポリメラーゼ等が挙げられる。これらのポリメラーゼは、各々、反応至適温度・条件が異なっており、ハイブリダイゼーションさせるプライマー7のTm値・アプタマー領域2と第1の物質4との結合条件に応じて、適宜選択することができる。
【0045】
また、核酸増幅反応は、上述したDNAポリメラーゼの他に、Tris・HCl(pH 8.8)、KCl、MgSO4、(NH4)2SO4、Tween20、Betaine、dNTPs等といった核酸増幅反応に通常使用される各種物質を適切な濃度に調整した反応溶液にて実行する。本核酸増幅反応は、ローリングサークル増幅反応(RCA反応)で行うため、増幅のエラー(誤った塩基の取り込み)の蓄積がない。PCRのような増幅された遺伝子断片を更に鋳型とする増幅反応では、反応の初期にエラーが発生すると、以後その断片を鋳型とした増幅産物にもエラーが引き継がれ、エラーが蓄積する現象が知られている。これに対して、RCA反応では、増幅産物を鋳型としないため原理的にエラーの蓄積が生じ得ない。よって、合成された一本鎖の増幅核酸9は、正確な塩基配列を主とするクラスタ10を構成することとなる。なお、RCA反応においても、一定の確率でエラーが起こってしまうが、その出現はランダムでありクラスタ10全体としては、正しい配列情報を出力する。なお、鎖置換活性を有するDNAポリメラーゼのうち、特にphi29ポリメラーゼは増幅時にエラーを起こす確立が低いことが知られており、このポリメラーゼを用いることでより正確な情報を有したクラスタ10を形成することができる。
【0046】
さらに、核酸増幅反応に鎖置換活性を有しないDNAポリメラーゼとヘリカーゼとを組み合わせて用いた場合、DNAポリメラーゼとヘリカーゼとを任意の比率で反応させることができる。DNAやトランスポリメラーゼに対して過剰量のヘリカーゼを加えることで、解析対象の塩基配列のGC含量や高次構造に由来するクラスタ間の増幅倍率の差を平準化し、バイアスを軽減できる可能性がある。
【0047】
さて、上述した環状核酸3及び基板5を用いた核酸増幅反応では、先ず、第1の物質4を有する基板5に対して、プライマー7をアニールさせた環状核酸3を結合させる。すなわち、環状核酸3とプライマー7とを所定の条件下で溶液中に共存させることにより、環状核酸3の所定の領域にプライマー7がハイブリダイズする。このように形成されたプライマー-環状核酸複合体11を含む溶液を基板5に接触させると、プライマー7の結合分子6と第1の物質4とが結合し、プライマー-環状核酸複合体11が基板5の表面に結合する。
【0048】
次に、基板5の表面に、上述した鎖置換型のRCA反応に必要なDNAポリメラーゼ及び反応試薬を作用させ、適切な反応条件に晒す。これにより環状核酸3を鋳型としてRCA反応が起こり、一本鎖の増幅核酸9が合成される。この一本鎖の増幅核酸9は、解析対象となる核酸領域11とアプタマー領域2を繰り返し持つコンカテマー構造を示す。このとき、一本鎖の増幅核酸9に繰り返して存在する複数のアプタマー領域2が基板5上の第1の物質4との間に相互作用を形成する。これにより、一本鎖の増幅核酸9は、基板5の平面方向及び/又は垂直方向に広がらず、基板5の表面の所定の範囲に集積されることとなる。すなわち、上述した核酸増幅反応によれば、解析対象の核酸領域1を含む一本鎖の増幅核酸9が立体的に集積されたクラスタ10を形成することができる。
【0049】
このように、核酸増幅反応により合成された一本鎖の増幅核酸9が基板5条に集積した形を取るため、単位面積当たりに存在する解析対象の核酸領域1の数を高めることができる。したがって、このクラスタ10を対象としたシーケンス反応では、高い信号強度を得ることができるし、より数多くのクラスタ10を形成することでスループットを向上させることができる。これによって、塩基配列の精度の向上及び効率化を達成することができる。
【0050】
また、クラスタ10を構成する増幅核酸9は一本鎖であり、これに続くシーケンス反応時にプライマーがハイブリダイゼーションしやすく、シーケンス反応の効率が良い。例えば、illumina社のbridge PCR(Science 2005, VOL. 309, pp.1728-1732)方式では、固体表面に相補鎖も存在することになりシーケンス反応時にプライマーのハイブリダイゼーションを妨げる一因となる。また特に、ハイブリダイゼーションを繰り返し行いシーケンスを決定するsequence by ligation(Nucleic Acids Research, 2000, vol. 28, No. 20, e87)方式において、高いハイブリダイゼーション効率は非常に優れたメリットになる。したがって、上述した核酸増幅反応により形成したクラスタ10をこれら公知のシーケンス反応に応用することで、シーケンス反応の効率を改善することができ、配列情報の信号強度を高めることができる。
【0051】
仮に、アプタマー領域2を有しない環状核酸を用いてRCA反応を行った場合、合成された一本鎖DNAは、非常に長い分子量で空間的にも広がった構造となる。これに対して本例では、RCAの鋳型となる環状DNAにアプタマー配列を組み込むことで、反応によって生じる一本鎖の増幅核酸9にアプタマー領域2を出現させ、このアプタマー領域2と基板上の第1の物質4との相互作用で、一本鎖の増幅核酸9の空間的な広がりを抑制し、解析対象の核酸領域1の高密度化を達成している。また、空間的な広がりを抑えることで、一般的なRCA産物で起こる液の粘性上昇や、一本鎖DNAへの物理的な力によるせん断を防いでいる。粘度の上昇は、物質供給を妨げ、シーケンス反応の効率を低下させる。せん断による一本鎖DNAの切断は、クラスタ中の遺伝子断片数を低下させシーケンス反応時の信号強度を低下させる。本方法より合成された一本鎖の増幅核酸9は、アプタマー領域2とそれに対応した第1の物質4とを用いることにより、この点を回避している。
【0052】
なお、アプタマー領域2とそれに対応した第1の物質4との組み合わせは、上記表1に示すように数多く知られており、特に限定されることなく如何なる組み合わせを適用しても良い。特に、ポリメラーゼ反応を行う条件においては、アプタマー領域2と第1の物質4が相互作用せず、ポリメラーゼ反応を行う条件とは異なる条件(塩濃度条件や温度条件など)とすることで初めて相互作用するような組み合わせであっても良い。一方、アプタマー領域2と第1の物質4との組み合わせは、ポリメラーゼ反応を行う条件で相互作用するような組み合わせであっても良い。
【0053】
なお、コンカテマー構造の形状を制御することで、RCA反応後の液の粘度上昇とDNA鎖の切断を防ぐ既知の手法としては、DNA nanoball(nature biotechnology volume 28, 43-44)が知られている。このDNA nanoball技術を本発明に更に適用することもできる。すなわち、合成された一本鎖の増幅核酸9がDNA nanoballを形成するように環状核酸3の塩基配列を設計しても良い。詳細には、環状核酸3の母体となるベクターにおいて、アプタマー領域2以外の領域に、互いに相補的な塩基配列を有する少なくとも一対の領域を設計しておく。これら一対の領域は、一本鎖の増幅核酸9として合成されたときにハイブリダズできる。これにより、一本鎖の増幅核酸は、DNA nanoball様の高次構造を形成することができる。
【0054】
<<他の実施形態>>
次に、本発明の他の実施形態について説明する。以下の説明において、上述した実施形態と同一の構成・部材については同一の名称及び符号を付すことによって、その詳細な説明は省略する。
【0055】
本実施形態は、図2A〜Dに示すように、一本鎖の増幅核酸9に含まれるアプタマー領域2が結合する第1の物質4と、第1の物質4とは異なる物質であってプライマー7の結合分子6と結合する第2の物質20とを有する基板21を使用している。上述した実施形態では、第1の物質4が一本鎖の増幅核酸9に含まれるアプタマー領域2と結合するとともに、プライマー7の結合分子6と結合する役割を担っていた。本実施形態では、これら二種類の結合をそれぞれ異なる物質を用いることに特徴がある。
【0056】
本実施形態において、第2の物質20としては、第1の物質4とは異なる物質であって、結合分子6に特異的に結合する能力を有する物質を使用することができる。すなわち、第2の物質20としては、結合分子6との組み合わせを考慮して適宜選択することができる。第2の物質20としては、様々な分子を用いることが可能であり、例えば、上述した実施形態と同様にアビジン様分子も用いることができる。この場合、結合分子6はビオチン分子となる。ただし、この場合、第1の物質4としてはアビジン様分子以外の物質を使用し、アプタマー領域2としては当該アビジン様分子以外の物質に特異的に結合するオリゴヌクレオを選択する。このようなアビジン様分子以外の物質と当該物質に特異的に結合するオリゴヌクレオとの組み合わせは、上述した実施形態における表1のリストから適宜選択することができる。
【0057】
本実施形態においては、上述した実施形態と同様の手順及び試薬類によって、鎖置換型のローリングサークル増幅反応による核酸増幅反応を実施できる。すなわち、第1の物質4及び第2の物質20を有する基板21に、プライマー7をアニールさせた環状核酸3を結合させる。すなわち、プライマー-環状核酸複合体11を含む溶液を基板21に所定の条件下で接触させる。これにより、プライマー7の結合分子6が基板21条の第2の物質4と結合し、プライマー-環状核酸複合体11が基板21上に固定される。この状態で、上述した実施形態と同様に、鎖置換型のローリングサークル増幅反応による核酸増幅反応を進行させる。核酸増幅反応により、一本鎖の増幅核酸9が合成される。合成された一本鎖の増幅核酸9は、その内部に含まれるアプタマー領域2が基板21上の第1の物質4と結合することによって、基板21上に立体的に集積したクラスタ10を形成する。
【0058】
以上の説明から理解できるように、本実施形態では、プライマー-環状核酸複合体11を補足する第2の物質20とアプタマー領域2と結合する第1の物資4とを異なる物質としたため、クラスタ10間の距離を調節することが可能になる。すなわち、隣り合うクラスタ10間の距離は、基板21上に配置された隣り合う第2の物質20間の距離22に依存する。よって、第1の物質4及び第2の物質20を有する基板21を作製する際に、隣り合う第2の物質20を離間させれば隣り合うクラスタ10間の距離を大とすることができ、逆に、隣り合う第2の物質20を近接させれば隣り合うクラスタ10間の距離を小とすることができる。
【0059】
例えば、第1の物質4及び第2の物質20を共にタンパク質とした場合、上述した実施形態と同様に、これら第1の物質4及び第2の物質20を基板21の表面に導入することができる。このとき、第1の物質4及び第2の物質20を含有する溶液における両者の比率を調整することで、隣り合う第2の物質20の距離22を調整することができる。詳細には、溶液中の第2の物質20の比率を上げれば、隣り合う第2の物質20の距離22を小とすることができ、逆に溶液中の第2の物質20の比率を下げれば、隣り合う第2の物質20の距離22を大とすることができる。
【0060】
なお、隣り合う第2の物質20間の距離22は、光学的な分離が可能な距離が望ましい。より具体的にはシーケンス反応の観測波長をλとし、開口数NAの対物レンズを用いた工学検出系を使用した場合において、距離22はレイリーの定義〔(0.61xλ)/NA〕以上の距離であることが好ましく、数値としては200nm以上、より好ましくは400nm以上、更により好ましくは500nm以上とする。ただし、隣り合う第2の物質20間の距離22は、固定反応がランダムに起こるため確率的な分布を持っており、平均として光学的な分離が容易であれば良く、必ずしもすべての分子間距離がこの数字に従う必要はない。
【0061】
以上のように、核酸増幅反応においてプライマー-環状核酸複合体11を所望の距離で配置できるため、プライマー-環状核酸複合体11の量が大過剰に与えられた場合であっても、核酸増幅反応で形成されるクラスタ10間の距離を所望の距離とすることができる。一般に、基板上にて核酸増幅反応を進行させてクラスタを形成する場合、鋳型DNA分子を多量に加え過ぎてしまうと、クラスタ間の距離が密になりすぎて光学上クラスタの分離が不能になる「ホワイトアウト」という現象が知られている。ホワイトアウトを防ぐためには、従来、適当な濃度になるよう鋳型DNAを希釈し、基板上での核酸増幅反応を行っている。しかしながら、鋳型DNAの定量の精度などの問題から、必ずしも成功するわけではない。また、ホワイトアウトをより確実に防ぐため、クラスタ間の距離を十分に離そうとすると、必要以上にクラスタ密度が低下することとなり、スループット面での十分なパフォーマンスを発揮することができない。これに対して、本実施形態では、第2の物質20の固定密度を制御することで、クラスタ10の密度を所望に制御することができる。よって、本実施形態によれば、大過剰のプライマー-環状核酸複合体11を加えても、ホワイトアウト現象は起こりにくい。本実施形態では、従来のようにホワイトアウトを警戒して低濃度のサンプルを用いる必要がないため、実用上のスループットを確保することができる。また、サンプルの濃度に対する高精度に調整する手間を省くことができユーザーへの実験上の利便性を高める。このように、本実施形態によれば、例えば、検出する光学系に併せて隣り合うクラスタ10の距離を制御できるため、この「ホワイトアウト」を確実に防止できる。
【0062】
また、一般に、基板上にて核酸増幅反応を進行させてクラスタを形成する場合、一般に増幅対象の塩基配列CG含量など依存してクラスタのサイズが大きく異なる。例えば、成長の遅いクラスタが成長の早いクラスタに隣り合うと、成長の遅いクラスタ由来の信号が検出しにくい傾向がある。しかしながら、本実施形態によれば、隣り合うクラスタ10の距離を第2の物質20間の距離22で調整できるため、このような現象を起こりにくくできる。これによりシーケンスデータにおけるCGバイアスを低減できる。
【0063】
なお、隣り合うクラスタ10間の距離を離すためには、第2の物質20の結合箇所は一価であることが望ましく、アビジン様分子であれば複合体を形成しない変異体を用いることが好ましい。
【0064】
<<他の実施形態>>
次に、本発明の更に他の実施形態について説明する。以下の説明において、上述した実施形態と同一の構成・部材については同一の名称及び符号を付すことによって、その詳細な説明は省略する。
【0065】
本実施形態は、図3A〜Bに示すように、第2の物質20を規則的なパターンで配置した基板30を使用している。第2の物質20を規則的なパターンで配置するには、例えば、いわゆるマイクロコンタクトプリンティング工法を用いて実現することができる。一般に、マイクロコンタクトプリンティング工法で調製可能なスポットサイズは50nm程度であり、一箇所のスポットにおいて一分子の第2の物質20を配置することは困難である。すなわち、マイクロコンタクトプリンティング工法で第2の物質20を配置した場合、一箇所のスポットに複数の第2の物質20が固定される可能性がある。この場合、過剰のプライマー-環状核酸複合体11を加えると、一箇所のスポットに複数のプライマー-環状核酸複合体11が固定され、その結果、核酸増幅反応により一箇所のスポットに複数のクラスタ10が形成される虞がある。この場合、上述した「ホワイトアウト」の問題が生じる虞もある。
【0066】
この場合、プライマー-環状核酸複合体11の形状を大きくすることで、一箇所のスポットに対して1分子のプライマー-環状核酸複合体11しか固定できないように調整することが好ましい。プライマー-環状核酸複合体11の形状は、1分子のプライマー-環状核酸複合体11が一箇所のスポットを占有しうる形状であれば特に限定されない。例えば、プライマー-環状核酸複合体11の直径をスポットの直径の1/2以上、好ましくは3/5以上、より好ましくは2/3以上とすることで、1分子のプライマー-環状核酸複合体11が一箇所のスポットを占有できる。ここで、プライマー-環状核酸複合体11の直径とは、プライマー-環状核酸複合体11が第2の物質20に固定された状態で、基板21の表面を垂直方向から観察したときの、プライマー-環状核酸複合体11の直径を意味する。
【0067】
プライマー-環状核酸複合体11のサイズは、環状核酸3の大きさ(塩基長)の調整や、DNA nanoball(nature biotechnology volume 28, 43-44)構造により制御することができる。
【0068】
マイクロコンタクトプリント工法を用いた基板30の製造には、二通りの方法がある。すなわち、図3−2Aに示すように、凸型のナノピラー構造31を有するスタンパ32を利用する方法と、図3−2Bに示すように、ナノホール構造33を有するスタンパ34を利用する方法である。
【0069】
スタンパ32を利用する方法では、先ず、第2の物質20を凸型のナノピラー構造31の表面に固定する。次にスタンパ32を基板30の一主面に押し付け、凸型のナノピラー構造31の表面に固定された第2の物質20を基板30の一主面に転写する。次に、基板30の一主面に、上述した実施形態と同様にして、第1の物質4を固定する。
【0070】
スタンパ34を利用する方法では、先ず、スタンパ34の一主面におけるナノホール構造33以外の面に第1の物質4を固定する。次にスタンパ34を基板30の一主面に押し付け、ナノホール構造33以外の面に固定された第1の物質4を基板30の一主面に転写する。次に、基板30の一主面に、上述した実施形態と同様にして、第2の物質20を固定する。
【0071】
以上のように、規則的に配置された凸型のナノピラー構造31或いはナノホール構造33に応じて、第2の物質20を基板30上に規則的に配置することができる。特にナノピラー構造33を有するスタンパ34を利用した場合には、凸型のナノピラー構造31を有するスタンパ32を利用した場合と比較して、基板30への押し付けの際の圧力を分散できる面積が広いため、適正な転写圧力の許容範囲が広く、基板作製の歩留まりに優れるため好ましい。
【0072】
このように作製された基板30を利用することによって、核酸増幅反応により形成されたクラスタ10は、第2の物質20の配置に従って出現することになる。この第2の物質20の固定間隔35を制御することで、クラスタ10間の距離を調節できる。本実施形態によれば、クラスタ10は特定の位置に一定間隔の距離をおいて存在することになるため、画像情報からの輝点検出が容易となる。またクラスタ10間の距離を光学的に分離容易な距離にすることで、厳密な焦点調整を行わなくともシーケンス情報の取得が可能となる。これらは画像データの取得時間・処理時間を短縮と、それによるシーケンサーのスループットの向上をもたらす。
【0073】
一般に、隣接してしまったクラスタからの輝点分離には、正確な焦点で境界判別を行う必要がある。境界が不鮮明な画像からではクラスタの分離が困難であり高い計算コスト必要とし、不鮮明な焦点画像では隣接クラスタ間で光のクロストークが生じデータの信頼性も低下しやすいからである。本実施形態のように、クラスタ10間の距離が予め定まっている場合には、焦点調節に係る工数を削減することができ、画像取得・画像処理にかかる時間が短縮できるため、スループットの向上に貢献できる。
【0074】
なお、第2の物質20の固定間隔35は、上述した実施形態における距離22と同様に規定することができる。すなわち、第2の物質20の固定間隔35は光学的な分離が可能な距離以上とすることが好ましい。より具体的にはシーケンス反応の観測波長をλとし、開口数NAの対物レンズを用いた工学検出系を使用した場合において、固定間隔35はレイリーの定義〔(0.61xλ)/NA〕以上の距離であることが好ましく、数値としては200nm以上、より好ましくは400nm以上、更により好ましくは500nm以上とする。
【0075】
<<他の実施形態>>
次に、本発明の更に他の実施形態について説明する。以下の説明において、上述した実施形態と同一の構成・部材については同一の名称及び符号を付すことによって、その詳細な説明は省略する。
【0076】
本実施形態は、図4A〜Bに示すように、所定の塩基配列からなる核酸アプタマーについて相補鎖が読み取られるアプタマー領域40を有する環状核酸41を使用している。環状核酸41は、アプタマー領域40が所定の核酸アプタマーの逆鎖を読み取るように構成した以外は、上述した実施形態における環状核酸3と同じ構成である。
【0077】
本実施形態では、環状核酸41を鋳型として鎖置換型のRCA反応により合成された一本鎖の増幅核酸42が核酸アプタマーの相補鎖を有するようにする。ここで、核酸アプタマーは、所定の塩基配列からなる一本鎖核酸の状態で機能するが、相補鎖では機能しない。すなわち、RCA反応により合成された一本鎖の増幅核酸42は、核酸アプタマーとして機能する領域が存在せず、第1の物質4に結合することはできない。
【0078】
本実施形態では、鎖置換型のRCA反応により合成された一本鎖の増幅核酸42を鋳型として、更に鎖置換型の核酸増幅反応を実施する(以下、2回目の核酸増幅反応)。この2回目の核酸増幅反応は、一本鎖の増幅核酸42の一部の領域にハイブリダイズするプライマー43を使用する。一本鎖の増幅核酸42は、鎖置換型のRCA反応により合成されたものであるためプライマー43がアニールする箇所を複数有している。なお、2回目の核酸増幅反応で使用するプライマー43は、鎖置換型のRCA反応おいて使用したプライマー7の相補鎖とすることもできる。
【0079】
上述した他の実施形態と同様に、鎖置換型のRCA反応を行った後、2回目の核酸増幅反応は、一本鎖の増幅核酸42を鋳型とするため、RCA反応ではなく通常の鎖置換型の核酸増幅反応となる。このとき、一本鎖の増幅核酸42には、プライマー43がアニールする箇所を複数有しているため、増幅された核酸断片44は級数的に増幅することとなる。そして、核酸断片44は、核酸アプタマーとなる領域45を含む一本鎖核酸となる。このように一本鎖核酸である核酸断片44群は、基板5上に配置された第1の物質4と結合して、上述した実施形態と同様に立体的に集積された形状を呈することとなる。
【0080】
以上のように、本実施形態によれば、反応を二段階に分け一回目のプライマーと逆方向のプライマーを用いた2回目の核酸増幅反応を実施することにより、増幅効率が増し、短時間の処理でシーケンス反応の検出に必要な数の解析対象の核酸領域1を得ることができる。この核酸断片44はほとんどが一本鎖で構成されておりシーケンス反応の鋳型として適する。また核酸アプタマーとして機能する領域45を繰り返し持つため、上述した実施形態と同様に立体的に集積された形状を呈することとなる。
【0081】
<<他の実施形態>>
次に、本発明の更に他の実施形態について説明する。以下の説明において、上述した実施形態と同一の構成・部材については同一の名称及び符号を付すことによって、その詳細な説明は省略する。
【0082】
本実施形態は、図5A〜Cに示すように、上述した実施形態における基板5や基板21に代えてビーズ50(曲面)を使用している。すなわち、本発明は、平板状の基板5、21のみならず曲面状のビーズ50といった如何なる基材を使用しても実施可能である。
【0083】
図5Aに示すように、ビーズ50上にプライマー-環状核酸複合体11を固定し、環状核酸3を鋳型として鎖置換型のRCA反応を実行すると、上述した実施形態と同様に、一本鎖の増幅核酸9が合成される、合成された一本鎖の増幅核酸9は、アプタマー領域2が第1の物質4に結合することによって、ビーズ表面から放射状に散在するのではなく、ビーズ表面を覆うように存在する。すなわち、本実施形態では、一本鎖の増幅核酸9により覆われた核酸被覆ビーズ51が形成される。この核酸被覆ビーズ51は、表面に核酸を有しない裸ビーズ52とは電気的性質が大きく異なっている。すなわち、核酸被覆ビーズ51はマイナス電荷を帯びており、裸ビーズ52はプラス電荷を帯びている。したがって、核酸増幅反応の終了後、核酸被覆ビーズ51及び裸ビーズ52が混在する溶液に電場を与えることで、図5Bに示すように、核酸被覆ビーズ51及び裸ビーズ52を容易に分離して回収することができる。
【0084】
また核酸被覆ビーズ51は、多量のリン酸基を有しているため、たとえばジルコニアなどで被覆した基板53に結合することができる。よって、核酸被覆ビーズ51及び裸ビーズ52が混在する溶液をジルコニアなどで被覆した基板53に接触させることで、図5Cに示すように、核酸被覆ビーズ51及び裸ビーズ52を容易に分離して回収することができる。なお、基板53上に分離された核酸被覆ビーズ51は、そのままシーケンス反応に供することができる。
【0085】
一般的なビーズ上での遺伝子増幅反応は所謂エマルジョンPCRである。エマルジョンPCRでは、5’末端をビーズに固定したDNA断片をプライマーとして用いているため、遺伝子増幅反応の有無にかかわらず、一定量のDNA分子を最初からビーズ上に有している。このような状態では、図5Bや図5Cに示したような原理に基づいて、合成反応の起こったビーズと起こっていないビーズとを分離することは非常に困難である。これに対して、本実施形態によれば、図5Bや図5Cに示したような原理に基づいて核酸被覆ビーズ51及び裸ビーズ52を容易に分離しでき、ユーザーがサンプル処理にかける時間を短縮することができる。
【0086】
なお、本実施形態では、一般的なエマルジョンPCRと同じく、W/Oエマルジョンを微小反応場として用いて核酸増幅反応を実施しても良いが、エマルジョンを作製することなくビーズ上に遺伝子断片のクラスタ10を形成することができる。
【0087】
一般に、エマルジョンPCRにより、増幅断片を有するビーズを調製するには、ビーズに結合したプライマー、増幅対象となる遺伝子断片、ビーズに結合したプライマーとは逆向きのプライマーを用いて、W/Oエマルジョンを微小反応場としてPCRを行う。この時、PCRによって生じた核酸断片は二本鎖のうち一方のみが、ビーズと共有結合で結ばれている。一方、その相補鎖はビーズと直接結合しておらず、温度サイクルをかけることで引き剥がされ溶液中に遊離し、次のPCRの鋳型となる。この遊離した相補鎖が別のビーズ上で増幅しないよう、反応場を隔離する必要があり、エマルジョンによって空間的に閉じた反応容器内でPCRを行っている。この手法は、エマルジョンの作製や破壊を行わなくてはならず作業上煩雑である。また反応容器がエマルジョン中の水滴という非常に限られた空間であるため、核酸合成反応の基質・酵素の追加供給や合成によって生じた副反応物の除去を行うことができない。
【0088】
このようなエマルジョンPCRの諸問題に対して、本実施形態によれば、ビーズ50に対してプライマー-環状核酸複合体11を固定しているため、合成された一本鎖の増幅核酸9はビーズ表面から解離していない。よって、基本的には、増幅核酸9の分散は起こりにくく、増幅核酸9が繰り返し持つアプタマー領域2によってビーズ50に逐次絡めとられるため、空間的に広がりにくい。よって、一つのビーズ上で合成されたクラスタ10は、他のビーズ50に影響を及ぼさない。
【0089】
<<増幅遺伝子クラスタ作成装置>>
次に、以上で説明した本発明に係る核酸増幅方法を実行する増幅遺伝子クラスタ作成装置を説明する。増幅遺伝子クラスタ作成装置は、例えば図6に示すように、増幅したクラスタ10を形成する支持体60に、予め流路61を設けた反応チャンバー62を張り合わせ、フローセル63を備える。反応チャンバー62は、少なくとも、クラスタ10を形成する部分の部材が光透過性の材質から形成されていることが好ましい。反応チャンバー62は、例えば、流路61となる溝を予め掘ったPDMS(Polydimethylsiloxane)等の樹脂基体を用いる。
【0090】
また、増幅遺伝子クラスタ作成装置は、具体的に、核酸試料、反応酵素、バッファー、ヌクレオチド基質等を保存・温度管理する温調ユニット64、反応液を送り出す分注ユニット65、液の流れを制御するバルブ66,廃液タンク67から構成される。このように構成された増幅遺伝子クラスタ作成装置は、温調ユニット64における温調機を通じたフローセル63部分の温度制御と、反応基板(流路61)への溶液交換によって、上述した各種実施形態に示した核酸増幅反応を制御し、その結果、所望のクラスタ10を形成する。なお、反応終了時には、洗浄液が流路61を通じて供給され、廃液タンク67に収納される。
【0091】
<<核酸分析装置>>
次に、本発明を適用した核酸分析装置について説明する。核酸分析装置は、図7に示すように、反応デバイス70(反応部)に対して、ヌクレオチド、蛍光色素を有するヌクレオチド、核酸合成酵素、プライマー及び核酸試料からなる1種類以上の生体分子を供給する手段と、前記反応デバイス70に光を照射する手段と、前記反応デバイス70上の蛍光を測定する蛍光検出手段とを備える。
【0092】
具体的に、反応デバイス70は、カバープレート71と検出窓72と溶液交換用口である注入口73と排出口74とから構成される反応チャンバーに設置される。なお、カバープレート71と検出窓72の材質としては、光透過性を有するPDMS(Polydimethylsiloxane)を使用する。核酸分析装置は、図示しないが、上述した核酸増幅方法の実施形態で説明した手順にて核酸増幅反応が進行するように、鎖置換型のRCA反応を行う酵素、環状核酸3、プライマー7、酵素の基質となるヌクレオチド並びに蛍光色素を有するヌクレオチドを順次、注入口73を介して反応デバイス70に供給する分注ユニットを有している。
【0093】
また、核酸分析装置は、前記反応デバイス70に光を照射する手段として、YAGレーザ光源(波長532nm,出力20mW)76及びYAGレーザ光源(波長355nm,出力20mW)77と、これらYAGレーザ光源76及び77から出射したレーザ光78及び79の光軸上に配置されたダイクロイックミラー80(410nm以下を反射)と、同光軸上に配置された集光レンズ81と、プリズム82とを備えている。
【0094】
さらに、核酸分析装置は、前記反応デバイス70上の蛍光を測定する蛍光検出手段として、検出窓72に対応する位置に配設される対物レンズ83と、対物レンズ83により平行光束とされた光軸上に配設された光学フィルタ84と、同光軸上に配設された結像レンズ85と、2次元CCDカメラ86とを備えている。
【0095】
以上のように構成された核酸分析装置は、上述したように核酸増幅反応が反応デバイス70にて進行し、蛍光色素を取り込んだクラスタ10が反応デバイス70の基板表面に固定される。そして、YAGレーザ光源76及びYAGレーザ光源77から発振するレーザ光78及び79をダイクロイックミラー80により同軸になるよう調整した後、レンズ81によって集光し、その後、プリズム82を介して反応デバイス70へ臨界角以上で照射する。そして、検出窓72より出射される蛍光は、対物レンズ83により平行光束とされ、光学フィルタ84により背景光及び励起光が遮断され、結像レンズ85により2次元CCDカメラ86上に結像される。
【0096】
このように核酸分析装置によれば、本発明に係る核酸増幅方法を適用して基材上に形成された増幅核酸9のクラスタ10を検出することができる。このとき、本発明に係る核酸増幅方法によれば、クラスタ10を高密度化することができるとともに、各クラスタ10に含まれる核酸量を多くすることができる。よって、2次元CCDカメラ86を使用することで、より多くのクラスタ10を高感度に撮像することができる。
【0097】
なお、本発明に係る核酸増幅方法は、図7に示した核酸分析装置に限定されず、図8に示した核酸分析装置にも適用することができる。図8に示す核酸分析装置は、温調ユニット87と光ファイバー88を有する以外は、図7に示した核酸分析装置と同様に構成されている。
【0098】
ところで、本発明に係る核酸増幅方法により、一般鎖の増幅核酸9からなるクラスタ10を形成した後、このクラスタ10を用いて解析対象の核酸領域1の塩基配列を決定することができる。塩基配列の決定原理は、特に限定されないが、例えば、Science 2005, VOL. 309, pp.1728-1732に開示された手法を採用することができる。すなわち、
(1)アンカープライマーのハイブリダイゼーション
(2)蛍光プライマーのライゲーション、
(3)蛍光検出
(4)アンカープライマーと蛍光プライマーの除去
(5)上記(1)〜(4)の繰り返し
を行い、解析対象の核酸領域1の塩基配列を決定することができる。
【0099】
また、塩基配列の決定方法としては、上記ライゲーションによる方法以外に逐次反応方式を用いることができる。蛍光色素付きヌクレオチドとして、Acta Biochim Biophys Sin (2009): 335-340に開示されているような、リボースの3′OHの位置に3′-O-アリル基を保護基として入れ、また、ピリミジンの5位の位置にあるいはプリンの7位の位置にアリル基を介して蛍光色素と結びつけたものが使用できる。アリル基は光照射あるいはパラジウムと接触することで切断されるため、色素の消光と伸長反応の制御を同時に達成することができる。逐次反応方式でも、未反応のヌクレオチドを洗浄で除去する必要はない。
【0100】
さらに、本実施形態では、P.N.A.S. 2008, vol. 105, pp 1176-1181に開示されているような、洗浄工程が必要ないことからリアルタイムで伸長反応を計測することも可能である。図7及び8に示すような核酸分析装置を使用することで、洗浄工程を入れることなく、解析時間の短縮化、反応デバイス及び分析装置の簡便化が図れ、逐次反応方式のみならず、リアルタイムで塩基の伸長反応を計測することも可能となり、従来技術に対して大幅なスループットの改善が図れる。
【実施例】
【0101】
以下、実施例により本発明を更に詳細に説明するが、本発明の技術的範囲は以下の実施例に限定されるものではない。
【0102】
〔実施例1〕
<材料>
アプタマー配列として、ストレプトアビジンに対して親和性が報告されている配列(5'-TATAACGCCCGTGTTGCTCGGTTAT-3'(配列番号4))を用いた。この配列を含む核酸試料(5'-TAATACGACTCACTATAGCAATGGTACGGTACTTCCTATAACGCCCGTGTTGCTCGGTTATCAAAAGTGCACGCTACTTTG-3'(配列番号22))を合成し、二種類のプライマー(5'-ATCATTGGATCCTAATACGACTCACTATAGCAATGGTACGGTACTTCC-3'(配列番号23)、5'-ATCCATAAGCTTTTAGCAAAGTAGCGTGCACTTTTG-3'(配列番号24))を用いPCRで増幅した後、pSPT19のBamH I〜Hind IIIサイトに挿入し、プラスミド(pSPT19_AptB1)を得た。更にpSPT19_AptB1を鋳型として、二種類のプライマー(5'-GGCGTAGAGGATCTGGCTAGCGATGACCCTGCTGATTG-3'(配列番号25)、5'-CGATCCGATGCTAGCGTAAAACGACGGCCAGTGACCGTCTCCGGGAGCTGCATG-3'(配列番号26))を用いPCRを行った。得られた増幅断片を制限酵素処理し、電気泳動にて精製したものをライゲーションし、519bpからなる二本鎖環状DNA分子を得た。この二本鎖環状DNA分子をモデルとして用い本発明の検証を行った。基板にはストレプトアビジンを固定したガラス板を用いた。作製にはエステル活性化済みのガラス板(Hubbleスライドガラス、タカラバイオ)を用い、これを0.5mg/mlのストレプトアビジン(streptavidin TypeII、WAKO)溶液に室温・16時間浸漬し、ストレプトアビジンの固定反応を行った。
【0103】
<基板上増幅反応とクラスタの評価>
二本鎖環状DNA分子と5'ビオチン化プライマー(5'biotin-ACTGGCCGTCGTTTTAC-3'(配列番号27))を終濃度20nMになるよう混合し、95℃で5分間加熱した後、緩やかに室温に戻し、両者をアニールさせた。この溶液を希釈した(終濃度1nM)ものを基板に与え、飽和蒸気下で室温・1時間静置し、基板に二本鎖環状DNA分子とビオチン化プライマーの複合体を固定した。未結合の物質は、150mM NaClを含むTEバッファー(以降TENバッファーと呼称)で洗浄し除去した。
【0104】
次いで、鎖置換活性を有するポリメラーゼ(96-7ポリメラーゼ、ニッポンジーン)を含む溶液(8U/20μl)を与え、50℃にてRCA反応を行った。反応溶液には、メーカー添付のバッファーを用い、dNTP濃度は250μMで行った。4時間経過後に、EDTA(終濃度50mM)を添加した上で室温に戻し、反応停止とした。この基板をTENバッファーにて洗浄した後、5'末端をCy3標識したオリゴDNA(5'-Cy3 CTATAGTGTCACCTAAATCGTATG-3'(配列番号28))1μMを基板にかけ、室温にて約16時間反応させ、TENバッファーにて洗浄し、基板上に形成された増幅遺伝子断片のクラスタを蛍光顕微鏡にて観察した。この蛍光標識プローブの相補鎖は、コンカテマー構造の繰り返し回数分だけ出現するため、輝点の蛍光強度は、その輝点に含まれる増幅遺伝子断片の数を反映することになる。Cy3標識デンドリマーを用い蛍光分子数と輝点強度との検量線を作り、クラスタあたりの蛍光分子数を算出し、クラスタあたりの増幅遺伝子断片数とした。結果基板上に、直径約800nm程度の輝点が形成されており、そこに含まれる遺伝子断片数は800〜1000分子程度であった。この値から基板上で合成された塩基長は、およそ400〜500kbpと見積もられた。
【0105】
このような非常に長いDNA分子は、通常今回観測された輝点よりも大きな体積を占めており、アプタマー配列を有していない二本鎖環状DNA分子を鋳型として用いる場合には、クラスタのサイズが大きくなり、面積あたりの遺伝子断片数が減少することになる。
【0106】
〔実施例2〕
本実施例では、基板上での合成反応時に、まずアプタマー配列の相補鎖側を合成し、次いでその逆鎖(アプタマー配列側)の合成反応を行い、二段階目の反応で生じたアプタマー配列で産物を基板に固定し、短時間で高い増幅倍率を得る効果について検討した。
【0107】
<材料>
材料には、実施例1と同様の基板と二本鎖環状DNA分子を用いた。
【0108】
<増幅反応とクラスタの評価>
二本鎖環状DNA分子と5'ビオチン化プライマー(5'biotin-TAATACGACTCACTATAGG-3'(配列番号29))を終濃度20nMになるよう混合し、95℃で5分間加熱した後、緩やかに室温に戻し、両者をアニールさせた。この溶液を希釈したもの(終濃度1nM)を基板に与え、飽和蒸気下で室温・1時間静置し、基板に二本鎖環状DNA分子とビオチン化プライマーの複合体を固定した。
【0109】
次いで、鎖置換活性を有するポリメラーゼ(Csaポリメラーゼ、ニッポンジーン)を含む溶液(8U/20μl)を与え、60℃にて1時間RCA反応を行った。反応溶液には、メーカー添付のバッファーを用い、dNTP濃度は250μMで行った。反応後、基板をTENバッファーにて洗浄し、一回目の合成反応の終了とした。この基板にオリゴDNA(5'-ACTGGCCGTCGTTTTAC-3'(配列番号27))5μMを与え、熱処理(60℃15分)した後、ゆっくりと室温に戻し、コンカテマーにオリゴDNAをハイブリダイゼーションさせた。過剰量の(未結合の)オリゴDNAはTENバッファーにて洗浄し、除去した。
【0110】
次いで、基板に0.5U/μlのphi29ポリメラーゼ(Nxgen phi29、Lucigen社)を含む反応溶液(バッファー:メーカー添付、dNTP濃度:250μM)を与え、30℃にて2時間、反応を行った。終濃度50mMのEDTAを添加し、TENにて洗浄し、反応停止とした。以上の反応で形成されたクラスタに蛍光標識プローブ(5’-Cy3 CTATAGTGTCACCTAAATCGTATG-3’(配列番号28))をハイブリダイゼーションさせた後、実施例1と同様に輝点強度を観察した。
【0111】
観察の結果、基板上に直径約900nmの輝点が認められ、そこに含まれる遺伝子断片数は平均22890分子と求められた。この3時間で20000倍以上の増幅率は、合成速度に換算すると約1kbp/secとなり、一箇所の複製起点からの反応では到底説明できず、逆鎖の合成反応が起こりその産物がアプタマー配列によって基板に固定されたものと推定される。アプタマー配列を有しない二本鎖環状DNA分子を鋳型として用いた場合には、二段階目の合成反応で生じた産物が基板への固定されないため、輝点における遺伝子増幅断片数は、本実施例に比べ大幅に低下する。例えば実施例1は一方向の合成反応のみのため、4時間反応で1000倍程度と、実施例2に比べ20分の1以下の増幅速度であった。
【符号の説明】
【0112】
1…解析対象の核酸領域、2…アプタマー領域、3…環状核酸、4…第1の物質、5…基板、6…結合分子、7…プライマー、8…ポリメラーゼ、9…増幅核酸、10…クラスタ、11…プライマー-環状核酸複合体、20…第2の物質、21…基板、22…距離、30…基板、31…凸型のナノピラー構造、32…スタンパ、33…ナノホール構造、34…スタンパ、35…固定距離、40…アプタマー領域、41…環状核酸、42…増幅核酸、43…プライマー、44…核酸残片、45…領域、50…ビーズ、51…核酸被覆ビーズ、52…裸ビーズ、53…基板、60…支持体、61…流路、62…反応チャンバー、63…フローセル、64…温調ユニット、65…分注ユニット、66…バルブ、67…廃液タンク、70…反応デバイス、71…カバープレート、72…検出窓、73…注入口、74…排出口、76…YAGレーザ光源、77…YAGレーザ光源、78…レーザ光、79…レーザ光、80…ダイクロイックミラー、81…レンズ、82…プリズム、83…対物レンズ、84…光学フィルタ、85…結像レンズ、86…2次元CCDカメラ
【技術分野】
【0001】
本発明は、例えば核酸の塩基配列決定方法等に用いられる核酸増幅方法、当該核酸増幅方法に使用する核酸増幅キットに関する。
【背景技術】
【0002】
核酸増幅方法は、増幅目的の核酸を鋳型としてDNAポリメラーゼの酵素活性により当該核酸を増幅することを基本的な原理としている。核酸増幅方法には、鋳型となる核酸又はプライマーをビーズや基板等の基材に固定化し、当該基材上にて核酸増幅反応を実行するタイプがある。
【0003】
このような基材上にて核酸増幅反応を行う核酸増幅方法は、一例として、ゲノムDNAやトランスクリプトームの配列決定に利用される塩基配列決定方法に利用される。特に、近年では、試料となるDNA断片を基板に数多く固定して、これら数多くのDNA断片の塩基配列をパラレルに決定する方法が開発されている。これにより、塩基解析速度は飛躍的に向上した。これらの技術では、解析対象となる核酸断片を核酸増幅反応により増幅することで、増幅された核酸断片が束(クラスタ)として基板上に配置される。したがって、基板に固定されたDNA断片の数に対応して、数多くの核酸断片の束が基板上に配置されることとなる。
【0004】
例えば、非特許文献1では、基板上にプライマーを固定し、固定されたプライマーを用いて基板上でPCRを行うことで、基板上に増幅遺伝子断片のクラスタを形成している。また非特許文献2では、エマルジョンPCRを行い、所定の核酸断片を微粒子表面にて増幅・固定し、その後、微粒子を基板上に固定する。これにより、増幅した核酸断片の束(クラスタ)が平面上に複数配置されることとなる。
【0005】
このように、基板上に配置された核酸断片の束(クラスタ)について、いわゆるシーケンス反応を行うことで、当該束(クラスタ)毎に塩基配列を決定する。そして、基板上に配置された数多くの束(クラスタ)を二次元画像センサにて測定し、画像解析により蛍光を読み取ることで束(クラスタ)毎に塩基配列を決定する。このように、基板に固定された多数の束(クラスタ)を平行して解析している。
【0006】
このような塩基配列決定方法において、核酸断片の束(クラスタ)の形成は重要なステップである。すなわち、基板上に高密度で束(クラスタ)を配置することは、一度に画像センサから取得できる配列情報を増加させるため、ハイスループット化を達成できる。一方、1つの束(クラスタ)に含まれる核酸断片が多ければ多いほど、シーケンス反応における蛍光強度等の信号強度が向上することとなり、より信頼性の高い塩基配列分析及び検出系の簡素化を達成できる。
【0007】
しかしながら、基板上の束(クラスタ)を高密度化することと、各束(クラスタ)に含まれる核酸断片を多数化することは、一般に相反する関係にある。すなわち、束(クラスタ)の密度を高めることは、クラスタ一つの占める面積を少なくすることであり、そこに含まれる核酸断片数が減少してしまう関係にある。よって、基板上の束(クラスタ)を高密度化し、且つ、各束(クラスタ)に含まれる核酸断片を多数化する技術が求められている。
【0008】
換言すれば、基材上にて核酸増幅反応を行う核酸増幅方法において、核酸増幅反応により得られた、単位面積あたりの核酸断片数を高める手法の開発が望まれている。
【先行技術文献】
【非特許文献】
【0009】
【非特許文献1】Nucleic Acids Research, 2000, vol. 28, No. 20, e87
【非特許文献2】Science 2005, VOL. 309, pp.1728-1732
【発明の概要】
【発明が解決しようとする課題】
【0010】
そこで、本発明は、基材上にて核酸増幅反応を行うに際して、増幅された核酸断片を立体的に集積させ、単位面積あたりの核酸断片数を高めることができる核酸増幅方法及び当該核酸増幅方法に用いる核酸増幅キットを提供することを目的とする。また、本発明は、この核酸増幅方法を適用することで、一回の処理で読み取れる核酸断片の数を増加させることでハイスループット化を達成でき、且つSN比を向上させることで優れた信頼性を達成できる塩基配列決定方法を提供することを目的としている。
【課題を解決するための手段】
【0011】
上述した目的を達成するため、本発明者らは、鋭意研究の結果、解析対象の核酸領域とアプタマー領域と含む環状核酸を鋳型とした鎖置換型のローリングサークル増幅反応を行うことで、アプタマーが特異的に相互作用する物質を有する基材上において、増幅された核酸分子を立体的に集積させることができ、単位面積あたりの増幅対象の核酸領域の数を増加できることを見いだし、本発明を完成するに至った。
【0012】
すなわち、本発明に係る核酸増幅方法は、解析対象の核酸領域と核酸アプタマーに対応するアプタマー領域とを含む環状核酸を鋳型とし、当該核酸アプタマーと親和性を有する第1の物質が固定された基材上にてプライマーを起点とした鎖置換型のローリングサークル増幅反応を行う工程を含んでいる。本発明に係る核酸増幅方法によれば、上記アプタマー領域に対応する核酸アプタマー及び解析対象の核酸領域を含む一本鎖核酸分子を、当該核酸アプタマーと上記第1の物質との間の親和性により上記基材に固定することができる。
【0013】
本発明に係る核酸増幅方法において、上記プライマーは、上記基材上に固定された第2の物質に対して結合する能力を有する結合分子を導入したものを使用することができる。この場合、上記第2の物質と上記結合分子とが結合した状態で、上記ローリングサークル増幅反応が進行する。ここで、上記第1の物質と上記第2の物質とは同じ物質であってもよいし、異なる物質であっても良い。
【0014】
また、本発明に係る核酸増幅方法において、上記プライマーとして上記結合分子を導入したものを使用し、上記基材として上記第2の物質を固定したものを使用する場合、先ず、上記環状核酸と上記プライマーとの複合体を形成し、その後、上記第2の物質と上記結合分子とを結合させることで当該複合体を上記基材上に捕捉させる。その後、上記鎖置換型のローリングサークル増幅反応を実行することが好ましい。
【0015】
さらに、本発明に係る核酸増幅方法においては、上記第2の物質を所定の距離で離間して配置した基材を使用することが好ましい。このとき、上記第2の物質は、隣り合う第2の物質同士が所定の距離を有するよう、上記基材上にランダムに配置されても良いし、上記基材上に規則的なパターンで配置されてもよい。
【0016】
さらにまた、本発明に係る核酸増幅方法において、上記アプタマー領域は上記鎖置換型のローリングサークル増幅反応により上記核酸アプタマーの相補鎖が合成されるように設計されていてもよい。この場合、鎖置換型のローリングサークル増幅反応により合成された核酸分子を鋳型とする2回目の核酸増幅反応により、上記核酸アプタマーを含む上記一本鎖核酸分子が合成されることとなる。
【0017】
なお、上記鎖置換型のローリングサークル増幅反応は、鎖置換活性を有するポリメラーゼを使用しても良いし、鎖置換活性を有しないポリメラーゼとヘリカーゼを使用しても良い。また、上記基材は平面基板又はビーズのいずれであってもよい。
【0018】
ところで、本発明に係る核酸増幅キットは、解析対象の核酸領域を導入する部位と、核酸アプタマーに対応するアプタマー領域とを含む環状核酸と、上記環状核酸に含まれる所定の領域にアニールできるプライマーと、当該核酸アプタマーと親和性を有する第1の物質が固定された基材とを備えている。
【0019】
本発明に係る核酸増幅キットにおいて、上記プライマーは、上記基材上に固定された第2の物質に対して結合する能力を有する結合分子を導入したものであることを好ましい。ここで上記第1の物質と上記第2の物質とは同じ物質であってもよいし、異なる物質であっても良い。
【0020】
また、本発明に係る核酸増幅キットにおいて、上記基材は、上記第2の物質を離間して配置したものであることが好ましい。上記第2の物質は、隣り合う第2の物質同士が所定の距離を有するように、上記基材上にランダムに配置されも良いし、上記基材上に規則的なパターンで配置されてもよい。
【0021】
さらに、本発明に係る核酸増幅キットにおいて、環状核酸に含まれるアプタマー領域は、鎖置換型のローリングサークル増幅反応により上記核酸アプタマーの相補鎖が合成されるように設計されてもよい。
【0022】
さらにまた、本発明に係る核酸増幅キットは、鎖置換活性を有するポリメラーゼ又は鎖置換活性を有しないポリメラーゼとヘリカーゼを更に備えていても良い。なお、本発明に係る核酸増幅キットにおいて上記基材は平面基板又はビーズのいずれであっても良い。
【0023】
また、本発明では、増幅された核酸断片を立体的に集積させ、単位面積あたりの核酸断片数を高めた特徴的な核酸構築物を提供できる。すなわち、本発明に係る核酸構築物は、核酸アプタマー及び解析対象の核酸領域を含む一本鎖核酸分子と、上記核酸アプタマーと親和性を有する第1の物質が固定された基材とから構成される。本発明に係る核酸構築物では、上記核酸アプタマーと上記第1の物質との間の親和性により、上記一本鎖核酸分子が上記基材に固定される。
【0024】
また、本発明に係る核酸構築物において、上記基材上には、複数の上記一本鎖核酸分子が固定され、各一本鎖核酸分子はそれぞれクラスタを形成することができる。
【発明の効果】
【0025】
本発明によれば、基材上にて核酸増幅反応を行うに際して、増幅された核酸断片を立体的に集積させ、単位面積あたりの核酸断片数を高めることができる。また、本発明は、この核酸増幅方法を適用することで、一回の処理で読み取れる核酸断片の数を増加させることでハイスループット化を達成でき、且つSN比を向上させることで優れた信頼性を達成できる。
【図面の簡単な説明】
【0026】
【図1】本発明を適用した核酸増幅方法の一実施形態を説明するための概略構成図である。
【図2】本発明を適用した核酸増幅方法の他の実施形態を説明するための概略構成図である。
【図3−1】本発明を適用した核酸増幅方法の更に他の実施形態を説明するための概略構成図である。
【図3−2】図3−1に示した核酸増幅方法に使用する基板を作製する方法の一例を説明する概略構成図である。
【図4】本発明を適用した核酸増幅方法の更に他の実施形態を説明するための概略構成図である。
【図5】本発明を適用した核酸増幅方法の更に他の実施形態を説明するための概略構成図である。
【図6】本発明を適用した核酸増幅方法を実施する増幅遺伝子クラスタ作成装置を説明するための概略構成図である。
【図7】本発明を適用した核酸増幅方法を適用して形成されたクラスタの分析を行う核酸分析装置を説明するための概略構成図である。
【図8】本発明を適用した核酸増幅方法を適用して形成されたクラスタの分析を行う核酸分析装置の他の例を説明するための概略構成図である。
【発明を実施するための形態】
【0027】
以下、本発明の実施形態について、図面を参照して詳細に説明する。
本発明に係る核酸増幅方法は、図1A〜Cに示すように、解析対象の核酸領域1とアプタマー領域2と含む環状核酸3を鋳型とした鎖置換型のローリングサークル増幅反応を行う方法である。核酸増幅方法では、アビジン様分子等といった特定の核酸アプタマーとの間で特異的に相互作用する第1の物質4を固定した基板5を使用する。
【0028】
また、図1A〜Cに示した核酸増幅方法では、第1の物質4に対して相互作用する結合分子6を5'末端に有するプライマー7を使用している。なお、一例として、第1の物質4がアビジン様分子である場合、結合分子6はビオチン分子となる。この結合分子6を有するプライマー7を使用することによって、鎖置換型のローリングサークル増幅反応は基板5の表面で進行する。
【0029】
また、鎖置換型のローリングサークル増幅反応は、一例としては鎖置換活性を有するポリメラーゼ8により、プライマー7の3'末端から進行する。この増幅反応は、環状核酸3を鋳型とした鎖置換型のローリングサークル増幅反応であるため、一本鎖の増幅核酸9を合成する。合成された一本鎖の増幅核酸9は、環状核酸3に対応して、解析対象の核酸領域1とアプタマー領域2と繰り返して含んでいる。合成された一本鎖核酸9は、複数のアプタマー領域2のうち少なくとも一部が基板5上に配置された第1の物質4と相互作用することで、立体的に集積されたクラスタ10を形成する。
【0030】
<<環状核酸3>>
ここで、環状核酸3について説明する。環状核酸3は、アプタマー領域2を含む母体となるベクターに、解析対象の核酸領域1を組み入れることで作製される。解析対象の核酸領域1としては、例えば、解析対象のゲノムDNAやトランスクリプトーム由来のcDNA等を断片化して得られる、例えば10〜1000bp、好ましくは50〜500bp、より好ましくは100〜250bpの長さにDNA断片とすることができる。DNA断片を母体となるベクターに挿入する手法は、特に限定されないが、例えば、DNA断片の両末端に所定の制限酵素の認識配列を有するアダプターを結合し、上記ベクターにおける同制限酵素認識部位に挿入する手法が挙げられる。
【0031】
アプタマー領域2とは、二本鎖の環状核酸3における、核酸アプタマーと呼称されるポリヌクレオチドに相当する領域である。核酸アプタマーとは、所定の塩基配列を有することで特定の物質に対して特異的な親和性を有する一本鎖の核酸分子を意味する。なお、環状核酸3は二本鎖の核酸分子であるため、アプタマー領域2が上記の特定の物質と相互作用することはない。
【0032】
核酸アプタマーとしては、例えば、下記の表1に示すものが知られている。なお、表1は、既知の核酸アプタマーの塩基配列と、当該核酸アプタマーが特異的に親和性を有する物質の種類とを対応付けて示している。
【0033】
【表1】

【0034】
また、核酸アプタマーとしては、例えば、Anal Chem. 2009 July 1; 81(13): 5490-5495やActa Biochim Biophys Sin (2009): 335-340に開示されたものを使用することもできる。
【0035】
さらに、環状核酸3は、複数の核酸アプタマーに対応する複数の異なるアプタマー領域2を有する構成であってもよい。このとき、複数の核酸アプタマーは、上記表に示す核酸アプタマーから任意に選択することができる。なかでも、核酸アプタマーとしては、5'-TATAACGCCCGTGTTGCTCGGTTAT-3'(配列番号4)、5'-CAAGAACTCCTAAGTATAATGTGAGGGATCCGAAATTCTGCTCTTATGTATGGCAAGATT-3'(配列番号3)、5'-GCGGGGTTGGGCGGGTGGGTTCGCTGGGCAGGGGGCGAGTG-3'(配列番号11)、 5'-CCCAGCAGCACTGGTAGTGAGGCAGTTCACCGGTGGGGCGGTGAGTTTGGCTGCTATTTAT-3'(配列番号19)、5'-GTACCAGCTTATTCAATTACAGATCGAGGGCAGCGATAGCTGGGCTAATAAGGTTAGCCCCATCGGTCCTGGACTTGGGACTAGATAGTATGTTCATCAG-3'(配列番号21)を使用することが好ましい。核酸アプタマーとしてストレプトアビジンに対するアプタマー配列(5'-TATAACGCCCGTGTTGCTCGGTTAT-3'(配列番号4)、5'-GTGATCGTCCAGCGACCGAGCAGGAAACTTATGTAACGACCCGAAATTCCTGCTTAGACT-3'(配列番号1))を使用した場合には、結合分子6としてビオチンを用いることで、基板5に固定する分子4をストレプトアビジン一種類で行うことができ、基板の製造が簡略化できるといった利点がある。また、核酸アプタマーとしてセルビオースに対するアプタマー配列(5'-GCGGGGTTGGGCGGGTGGGTTCGCTGGGCAGGGGGCGAGTG-3'(配列番号11)など表1参照)やキチンに対するアプタマー配列(5'-CCCAGCAGCACTGGTAGTGAGGCAGTTCACCGGTGGGGCGGTGAGTTTGGCTGCTATTTAT-3'(配列番号19))を使用した場合には、基板側に固定する分子が単純な糖類で良く、基板5の製造コストや保存性の点に優れるといった利点がある。また、セルビオースやコール酸などの低分子に対するアプタマー配列(それぞれ5'-GCGGGGTTGGGCGGGTGGGTTCGCTGGGCAGGGGGCGAGTG-3'(配列番号11)、5'-GTACCAGCTTATTCAATTACAGATCGAGGGCAGCGATAGCTGGGCTAATAAGGTTAGCCCCATCGGTCCTGGACTTGGGACTAGATAGTATGTTCATCAG-3'(配列番号21))を使用した場合、物質4の排除体積が小さいため基板5に物質4を高密度に固定することができ、結果アプタマー配列の結合を促進することが出来る。
【0036】
さらにまた、環状核酸3は、プライマー7が特異的にアニールする領域を有している。すなわち、環状核酸3は、プラマー7全体の塩基配列又はプライマー7の3'末端側領域の塩基配列に対して相補的な塩基配列からなるオリゴヌクレオチド領域を有している。ここで、プライマー7の3'末端側領域とは、プライマー7の3'末端の塩基を含む例えば5〜100bp、好ましくは10〜50bp、より好ましくは15〜30bpの領域である。この範囲であれば、プライマー7が環状核酸3に対して特異的にハイブリダイズすることができる。
【0037】
<<基板>>
次に、基板5について説明する。基板5は、例えば、ガラス基板,サファイア基板,シリコン基板などの無機物質からなる基板、ステンレスなどの金属からなる基板、ポリメタクリル酸メチル樹脂、ポリカーボネート樹脂、シクロオレフィン樹脂、ポリスチレン樹脂などの有機物質からなる基板を用いることができる。また、基板5は、単一の材料からなるものに限定されず、異なる材質の板状部材を貼り合わせたものや、各種の表面処理が施されたものであっても良い。また、図示した基板5は平板状を呈しているが、基板5の形状は特に限定されない。例えば、詳細を後述するが、所定の塩基配列決定装置に使用されるフローセルの一主面を基板5としても良い。
【0038】
基板5に配置されている第1の物質4は、上述した環状核酸3のアプタマー領域2が特異的に相互作用する物質である。すなわち、第1の物質4としては、上記表1に示した各種の物質を使用することができる。
【0039】
また、基板5と第1の物質4との間の結合は、特に限定されず、共有結合、静電相互作用、疎水相互作用などの如何なる結合でもよい。結合は、用いる基板5の材質と固定する第1の物質4に応じて適切なものを選択することができる。特に、基板5と第1の物質4との間の結合は安定性の観点から、共有結合とすることが望ましい。一例として、第1の物質4としてストレプトアビジンを使用し、基板5としてポリスチレン樹脂を使用する場合には以下のような手順に従って、ストレプトアビジンをポリスチレン樹脂からなる基板5の表面に固定することができる。すなわち、先ず、ポリスチレン樹脂からなる基板5の表面をVUV処理によって酸化させカルボキシル基を導入する。次に、このカルボキシル基を水溶性カルボジイミド(1-エチル-3-(3-ジメチルアミノプロピル)カルボジイミド塩酸塩)で活性化させる。次いで、この表面にストレプトアビジン溶液を接触させることで、ストレプトアビジン中のアミノ基とカルボキシル基との間でエステル結合を形成させる。これにより、ポリスチレン樹脂からなる基板5の表面にストレプトアビジンを共有結合により固定することができる。
【0040】
一方、基板5は、その表面にて核酸増幅反応を進行させるため、当該反応に使用するプライマー7を固定する手段を有している。図1に示した例では、第1の物質4がアプタマー領域2と相互作用する役割と、プライマー7を固定する手段としての役割を兼ねている。詳細には、プライマー7の5'末端には、第1の物質4に対して相互作用する結合分子6が結合している。例えば、第1の物質4がアビジン様分子である場合、結合分子6としてビオチン分子を使用することによって、プライマー7を基板5の表面に結合できる。
【0041】
なお、アビジン様分子としては、ビオチンに対する結合能を有するものであれば良く、その分子種まで限定されず、一般的に使用されている如何なる分子を使用しても良い。アビジン様分子としては、例えば、ストレプトアビジン、ニュートラビジン、アビジンなどを用いることができる。
【0042】
なお、プライマー7を固定する手段としては、第1の物質4に限定されず、プライマー7における5'末端側の塩基配列に相補的な塩基配列からなるオリゴヌクレオチドを使用することもできる。すなわち、このオリゴヌクレオチドを基板5の表面に導入しておき、プライマー7の5'末端側をオリゴヌクレオチドにハイブリダイズさせることで、プライマー7を基板5の表面に固定することもできる。
【0043】
また、プライマー7を固定する手段としては、一定以上の親和性を有する分子種の組み合わせであれば如何なる手段を採用しても良い。例えば、プライマー7を固定する手段としては抗体を使用することができる。すなわち、基板5の表面に抗体を固定し、抗原性を有する物質を結合させたプライマー7又は抗体に対する核酸アプタマーを有するプライマー7を使用する。このようにすれば、プライマー7は、抗原抗体反応又は核酸アプタマーと抗体との相互作用により基板5の表面に固定することができる。ビオチンとアビジン様分子との組み合わせ以外の他の選択肢を利用することで、サンプル調整等の増幅反応以外の工程に、ビオチンやアビジン様分子の特異的結合を利用することができる。
【0044】
<<核酸増幅反応>>
次に、上述した環状核酸3及び基板5を用いた核酸増幅反応工程について説明する。核酸増幅反応は、DNAポリメラーゼを用いた鎖置換型の反応である。鎖置換型の核酸合成反応は、鎖置換活性を有するDNAポリメラーゼを用いても良いし、鎖置換活性を有しないDNAポリメラーゼとヘリカーゼ(例えば、T7ヘリカーゼ)とを組み合わせて用いてもよい。より具体的に、鎖置換活性を有するDNAポリメラーゼとしては、例えばphi29ポリメラーゼを用いることができる。鎖置換活性を有するDNAポリメラーゼとしては、その他にBstポリメラーゼ、Csaポリメラーゼ、96-7ポリメラーゼ等が挙げられる。これらのポリメラーゼは、各々、反応至適温度・条件が異なっており、ハイブリダイゼーションさせるプライマー7のTm値・アプタマー領域2と第1の物質4との結合条件に応じて、適宜選択することができる。
【0045】
また、核酸増幅反応は、上述したDNAポリメラーゼの他に、Tris・HCl(pH 8.8)、KCl、MgSO4、(NH4)2SO4、Tween20、Betaine、dNTPs等といった核酸増幅反応に通常使用される各種物質を適切な濃度に調整した反応溶液にて実行する。本核酸増幅反応は、ローリングサークル増幅反応(RCA反応)で行うため、増幅のエラー(誤った塩基の取り込み)の蓄積がない。PCRのような増幅された遺伝子断片を更に鋳型とする増幅反応では、反応の初期にエラーが発生すると、以後その断片を鋳型とした増幅産物にもエラーが引き継がれ、エラーが蓄積する現象が知られている。これに対して、RCA反応では、増幅産物を鋳型としないため原理的にエラーの蓄積が生じ得ない。よって、合成された一本鎖の増幅核酸9は、正確な塩基配列を主とするクラスタ10を構成することとなる。なお、RCA反応においても、一定の確率でエラーが起こってしまうが、その出現はランダムでありクラスタ10全体としては、正しい配列情報を出力する。なお、鎖置換活性を有するDNAポリメラーゼのうち、特にphi29ポリメラーゼは増幅時にエラーを起こす確立が低いことが知られており、このポリメラーゼを用いることでより正確な情報を有したクラスタ10を形成することができる。
【0046】
さらに、核酸増幅反応に鎖置換活性を有しないDNAポリメラーゼとヘリカーゼとを組み合わせて用いた場合、DNAポリメラーゼとヘリカーゼとを任意の比率で反応させることができる。DNAやトランスポリメラーゼに対して過剰量のヘリカーゼを加えることで、解析対象の塩基配列のGC含量や高次構造に由来するクラスタ間の増幅倍率の差を平準化し、バイアスを軽減できる可能性がある。
【0047】
さて、上述した環状核酸3及び基板5を用いた核酸増幅反応では、先ず、第1の物質4を有する基板5に対して、プライマー7をアニールさせた環状核酸3を結合させる。すなわち、環状核酸3とプライマー7とを所定の条件下で溶液中に共存させることにより、環状核酸3の所定の領域にプライマー7がハイブリダイズする。このように形成されたプライマー-環状核酸複合体11を含む溶液を基板5に接触させると、プライマー7の結合分子6と第1の物質4とが結合し、プライマー-環状核酸複合体11が基板5の表面に結合する。
【0048】
次に、基板5の表面に、上述した鎖置換型のRCA反応に必要なDNAポリメラーゼ及び反応試薬を作用させ、適切な反応条件に晒す。これにより環状核酸3を鋳型としてRCA反応が起こり、一本鎖の増幅核酸9が合成される。この一本鎖の増幅核酸9は、解析対象となる核酸領域11とアプタマー領域2を繰り返し持つコンカテマー構造を示す。このとき、一本鎖の増幅核酸9に繰り返して存在する複数のアプタマー領域2が基板5上の第1の物質4との間に相互作用を形成する。これにより、一本鎖の増幅核酸9は、基板5の平面方向及び/又は垂直方向に広がらず、基板5の表面の所定の範囲に集積されることとなる。すなわち、上述した核酸増幅反応によれば、解析対象の核酸領域1を含む一本鎖の増幅核酸9が立体的に集積されたクラスタ10を形成することができる。
【0049】
このように、核酸増幅反応により合成された一本鎖の増幅核酸9が基板5条に集積した形を取るため、単位面積当たりに存在する解析対象の核酸領域1の数を高めることができる。したがって、このクラスタ10を対象としたシーケンス反応では、高い信号強度を得ることができるし、より数多くのクラスタ10を形成することでスループットを向上させることができる。これによって、塩基配列の精度の向上及び効率化を達成することができる。
【0050】
また、クラスタ10を構成する増幅核酸9は一本鎖であり、これに続くシーケンス反応時にプライマーがハイブリダイゼーションしやすく、シーケンス反応の効率が良い。例えば、illumina社のbridge PCR(Science 2005, VOL. 309, pp.1728-1732)方式では、固体表面に相補鎖も存在することになりシーケンス反応時にプライマーのハイブリダイゼーションを妨げる一因となる。また特に、ハイブリダイゼーションを繰り返し行いシーケンスを決定するsequence by ligation(Nucleic Acids Research, 2000, vol. 28, No. 20, e87)方式において、高いハイブリダイゼーション効率は非常に優れたメリットになる。したがって、上述した核酸増幅反応により形成したクラスタ10をこれら公知のシーケンス反応に応用することで、シーケンス反応の効率を改善することができ、配列情報の信号強度を高めることができる。
【0051】
仮に、アプタマー領域2を有しない環状核酸を用いてRCA反応を行った場合、合成された一本鎖DNAは、非常に長い分子量で空間的にも広がった構造となる。これに対して本例では、RCAの鋳型となる環状DNAにアプタマー配列を組み込むことで、反応によって生じる一本鎖の増幅核酸9にアプタマー領域2を出現させ、このアプタマー領域2と基板上の第1の物質4との相互作用で、一本鎖の増幅核酸9の空間的な広がりを抑制し、解析対象の核酸領域1の高密度化を達成している。また、空間的な広がりを抑えることで、一般的なRCA産物で起こる液の粘性上昇や、一本鎖DNAへの物理的な力によるせん断を防いでいる。粘度の上昇は、物質供給を妨げ、シーケンス反応の効率を低下させる。せん断による一本鎖DNAの切断は、クラスタ中の遺伝子断片数を低下させシーケンス反応時の信号強度を低下させる。本方法より合成された一本鎖の増幅核酸9は、アプタマー領域2とそれに対応した第1の物質4とを用いることにより、この点を回避している。
【0052】
なお、アプタマー領域2とそれに対応した第1の物質4との組み合わせは、上記表1に示すように数多く知られており、特に限定されることなく如何なる組み合わせを適用しても良い。特に、ポリメラーゼ反応を行う条件においては、アプタマー領域2と第1の物質4が相互作用せず、ポリメラーゼ反応を行う条件とは異なる条件(塩濃度条件や温度条件など)とすることで初めて相互作用するような組み合わせであっても良い。一方、アプタマー領域2と第1の物質4との組み合わせは、ポリメラーゼ反応を行う条件で相互作用するような組み合わせであっても良い。
【0053】
なお、コンカテマー構造の形状を制御することで、RCA反応後の液の粘度上昇とDNA鎖の切断を防ぐ既知の手法としては、DNA nanoball(nature biotechnology volume 28, 43-44)が知られている。このDNA nanoball技術を本発明に更に適用することもできる。すなわち、合成された一本鎖の増幅核酸9がDNA nanoballを形成するように環状核酸3の塩基配列を設計しても良い。詳細には、環状核酸3の母体となるベクターにおいて、アプタマー領域2以外の領域に、互いに相補的な塩基配列を有する少なくとも一対の領域を設計しておく。これら一対の領域は、一本鎖の増幅核酸9として合成されたときにハイブリダズできる。これにより、一本鎖の増幅核酸は、DNA nanoball様の高次構造を形成することができる。
【0054】
<<他の実施形態>>
次に、本発明の他の実施形態について説明する。以下の説明において、上述した実施形態と同一の構成・部材については同一の名称及び符号を付すことによって、その詳細な説明は省略する。
【0055】
本実施形態は、図2A〜Dに示すように、一本鎖の増幅核酸9に含まれるアプタマー領域2が結合する第1の物質4と、第1の物質4とは異なる物質であってプライマー7の結合分子6と結合する第2の物質20とを有する基板21を使用している。上述した実施形態では、第1の物質4が一本鎖の増幅核酸9に含まれるアプタマー領域2と結合するとともに、プライマー7の結合分子6と結合する役割を担っていた。本実施形態では、これら二種類の結合をそれぞれ異なる物質を用いることに特徴がある。
【0056】
本実施形態において、第2の物質20としては、第1の物質4とは異なる物質であって、結合分子6に特異的に結合する能力を有する物質を使用することができる。すなわち、第2の物質20としては、結合分子6との組み合わせを考慮して適宜選択することができる。第2の物質20としては、様々な分子を用いることが可能であり、例えば、上述した実施形態と同様にアビジン様分子も用いることができる。この場合、結合分子6はビオチン分子となる。ただし、この場合、第1の物質4としてはアビジン様分子以外の物質を使用し、アプタマー領域2としては当該アビジン様分子以外の物質に特異的に結合するオリゴヌクレオを選択する。このようなアビジン様分子以外の物質と当該物質に特異的に結合するオリゴヌクレオとの組み合わせは、上述した実施形態における表1のリストから適宜選択することができる。
【0057】
本実施形態においては、上述した実施形態と同様の手順及び試薬類によって、鎖置換型のローリングサークル増幅反応による核酸増幅反応を実施できる。すなわち、第1の物質4及び第2の物質20を有する基板21に、プライマー7をアニールさせた環状核酸3を結合させる。すなわち、プライマー-環状核酸複合体11を含む溶液を基板21に所定の条件下で接触させる。これにより、プライマー7の結合分子6が基板21条の第2の物質4と結合し、プライマー-環状核酸複合体11が基板21上に固定される。この状態で、上述した実施形態と同様に、鎖置換型のローリングサークル増幅反応による核酸増幅反応を進行させる。核酸増幅反応により、一本鎖の増幅核酸9が合成される。合成された一本鎖の増幅核酸9は、その内部に含まれるアプタマー領域2が基板21上の第1の物質4と結合することによって、基板21上に立体的に集積したクラスタ10を形成する。
【0058】
以上の説明から理解できるように、本実施形態では、プライマー-環状核酸複合体11を補足する第2の物質20とアプタマー領域2と結合する第1の物資4とを異なる物質としたため、クラスタ10間の距離を調節することが可能になる。すなわち、隣り合うクラスタ10間の距離は、基板21上に配置された隣り合う第2の物質20間の距離22に依存する。よって、第1の物質4及び第2の物質20を有する基板21を作製する際に、隣り合う第2の物質20を離間させれば隣り合うクラスタ10間の距離を大とすることができ、逆に、隣り合う第2の物質20を近接させれば隣り合うクラスタ10間の距離を小とすることができる。
【0059】
例えば、第1の物質4及び第2の物質20を共にタンパク質とした場合、上述した実施形態と同様に、これら第1の物質4及び第2の物質20を基板21の表面に導入することができる。このとき、第1の物質4及び第2の物質20を含有する溶液における両者の比率を調整することで、隣り合う第2の物質20の距離22を調整することができる。詳細には、溶液中の第2の物質20の比率を上げれば、隣り合う第2の物質20の距離22を小とすることができ、逆に溶液中の第2の物質20の比率を下げれば、隣り合う第2の物質20の距離22を大とすることができる。
【0060】
なお、隣り合う第2の物質20間の距離22は、光学的な分離が可能な距離が望ましい。より具体的にはシーケンス反応の観測波長をλとし、開口数NAの対物レンズを用いた工学検出系を使用した場合において、距離22はレイリーの定義〔(0.61xλ)/NA〕以上の距離であることが好ましく、数値としては200nm以上、より好ましくは400nm以上、更により好ましくは500nm以上とする。ただし、隣り合う第2の物質20間の距離22は、固定反応がランダムに起こるため確率的な分布を持っており、平均として光学的な分離が容易であれば良く、必ずしもすべての分子間距離がこの数字に従う必要はない。
【0061】
以上のように、核酸増幅反応においてプライマー-環状核酸複合体11を所望の距離で配置できるため、プライマー-環状核酸複合体11の量が大過剰に与えられた場合であっても、核酸増幅反応で形成されるクラスタ10間の距離を所望の距離とすることができる。一般に、基板上にて核酸増幅反応を進行させてクラスタを形成する場合、鋳型DNA分子を多量に加え過ぎてしまうと、クラスタ間の距離が密になりすぎて光学上クラスタの分離が不能になる「ホワイトアウト」という現象が知られている。ホワイトアウトを防ぐためには、従来、適当な濃度になるよう鋳型DNAを希釈し、基板上での核酸増幅反応を行っている。しかしながら、鋳型DNAの定量の精度などの問題から、必ずしも成功するわけではない。また、ホワイトアウトをより確実に防ぐため、クラスタ間の距離を十分に離そうとすると、必要以上にクラスタ密度が低下することとなり、スループット面での十分なパフォーマンスを発揮することができない。これに対して、本実施形態では、第2の物質20の固定密度を制御することで、クラスタ10の密度を所望に制御することができる。よって、本実施形態によれば、大過剰のプライマー-環状核酸複合体11を加えても、ホワイトアウト現象は起こりにくい。本実施形態では、従来のようにホワイトアウトを警戒して低濃度のサンプルを用いる必要がないため、実用上のスループットを確保することができる。また、サンプルの濃度に対する高精度に調整する手間を省くことができユーザーへの実験上の利便性を高める。このように、本実施形態によれば、例えば、検出する光学系に併せて隣り合うクラスタ10の距離を制御できるため、この「ホワイトアウト」を確実に防止できる。
【0062】
また、一般に、基板上にて核酸増幅反応を進行させてクラスタを形成する場合、一般に増幅対象の塩基配列CG含量など依存してクラスタのサイズが大きく異なる。例えば、成長の遅いクラスタが成長の早いクラスタに隣り合うと、成長の遅いクラスタ由来の信号が検出しにくい傾向がある。しかしながら、本実施形態によれば、隣り合うクラスタ10の距離を第2の物質20間の距離22で調整できるため、このような現象を起こりにくくできる。これによりシーケンスデータにおけるCGバイアスを低減できる。
【0063】
なお、隣り合うクラスタ10間の距離を離すためには、第2の物質20の結合箇所は一価であることが望ましく、アビジン様分子であれば複合体を形成しない変異体を用いることが好ましい。
【0064】
<<他の実施形態>>
次に、本発明の更に他の実施形態について説明する。以下の説明において、上述した実施形態と同一の構成・部材については同一の名称及び符号を付すことによって、その詳細な説明は省略する。
【0065】
本実施形態は、図3A〜Bに示すように、第2の物質20を規則的なパターンで配置した基板30を使用している。第2の物質20を規則的なパターンで配置するには、例えば、いわゆるマイクロコンタクトプリンティング工法を用いて実現することができる。一般に、マイクロコンタクトプリンティング工法で調製可能なスポットサイズは50nm程度であり、一箇所のスポットにおいて一分子の第2の物質20を配置することは困難である。すなわち、マイクロコンタクトプリンティング工法で第2の物質20を配置した場合、一箇所のスポットに複数の第2の物質20が固定される可能性がある。この場合、過剰のプライマー-環状核酸複合体11を加えると、一箇所のスポットに複数のプライマー-環状核酸複合体11が固定され、その結果、核酸増幅反応により一箇所のスポットに複数のクラスタ10が形成される虞がある。この場合、上述した「ホワイトアウト」の問題が生じる虞もある。
【0066】
この場合、プライマー-環状核酸複合体11の形状を大きくすることで、一箇所のスポットに対して1分子のプライマー-環状核酸複合体11しか固定できないように調整することが好ましい。プライマー-環状核酸複合体11の形状は、1分子のプライマー-環状核酸複合体11が一箇所のスポットを占有しうる形状であれば特に限定されない。例えば、プライマー-環状核酸複合体11の直径をスポットの直径の1/2以上、好ましくは3/5以上、より好ましくは2/3以上とすることで、1分子のプライマー-環状核酸複合体11が一箇所のスポットを占有できる。ここで、プライマー-環状核酸複合体11の直径とは、プライマー-環状核酸複合体11が第2の物質20に固定された状態で、基板21の表面を垂直方向から観察したときの、プライマー-環状核酸複合体11の直径を意味する。
【0067】
プライマー-環状核酸複合体11のサイズは、環状核酸3の大きさ(塩基長)の調整や、DNA nanoball(nature biotechnology volume 28, 43-44)構造により制御することができる。
【0068】
マイクロコンタクトプリント工法を用いた基板30の製造には、二通りの方法がある。すなわち、図3−2Aに示すように、凸型のナノピラー構造31を有するスタンパ32を利用する方法と、図3−2Bに示すように、ナノホール構造33を有するスタンパ34を利用する方法である。
【0069】
スタンパ32を利用する方法では、先ず、第2の物質20を凸型のナノピラー構造31の表面に固定する。次にスタンパ32を基板30の一主面に押し付け、凸型のナノピラー構造31の表面に固定された第2の物質20を基板30の一主面に転写する。次に、基板30の一主面に、上述した実施形態と同様にして、第1の物質4を固定する。
【0070】
スタンパ34を利用する方法では、先ず、スタンパ34の一主面におけるナノホール構造33以外の面に第1の物質4を固定する。次にスタンパ34を基板30の一主面に押し付け、ナノホール構造33以外の面に固定された第1の物質4を基板30の一主面に転写する。次に、基板30の一主面に、上述した実施形態と同様にして、第2の物質20を固定する。
【0071】
以上のように、規則的に配置された凸型のナノピラー構造31或いはナノホール構造33に応じて、第2の物質20を基板30上に規則的に配置することができる。特にナノピラー構造33を有するスタンパ34を利用した場合には、凸型のナノピラー構造31を有するスタンパ32を利用した場合と比較して、基板30への押し付けの際の圧力を分散できる面積が広いため、適正な転写圧力の許容範囲が広く、基板作製の歩留まりに優れるため好ましい。
【0072】
このように作製された基板30を利用することによって、核酸増幅反応により形成されたクラスタ10は、第2の物質20の配置に従って出現することになる。この第2の物質20の固定間隔35を制御することで、クラスタ10間の距離を調節できる。本実施形態によれば、クラスタ10は特定の位置に一定間隔の距離をおいて存在することになるため、画像情報からの輝点検出が容易となる。またクラスタ10間の距離を光学的に分離容易な距離にすることで、厳密な焦点調整を行わなくともシーケンス情報の取得が可能となる。これらは画像データの取得時間・処理時間を短縮と、それによるシーケンサーのスループットの向上をもたらす。
【0073】
一般に、隣接してしまったクラスタからの輝点分離には、正確な焦点で境界判別を行う必要がある。境界が不鮮明な画像からではクラスタの分離が困難であり高い計算コスト必要とし、不鮮明な焦点画像では隣接クラスタ間で光のクロストークが生じデータの信頼性も低下しやすいからである。本実施形態のように、クラスタ10間の距離が予め定まっている場合には、焦点調節に係る工数を削減することができ、画像取得・画像処理にかかる時間が短縮できるため、スループットの向上に貢献できる。
【0074】
なお、第2の物質20の固定間隔35は、上述した実施形態における距離22と同様に規定することができる。すなわち、第2の物質20の固定間隔35は光学的な分離が可能な距離以上とすることが好ましい。より具体的にはシーケンス反応の観測波長をλとし、開口数NAの対物レンズを用いた工学検出系を使用した場合において、固定間隔35はレイリーの定義〔(0.61xλ)/NA〕以上の距離であることが好ましく、数値としては200nm以上、より好ましくは400nm以上、更により好ましくは500nm以上とする。
【0075】
<<他の実施形態>>
次に、本発明の更に他の実施形態について説明する。以下の説明において、上述した実施形態と同一の構成・部材については同一の名称及び符号を付すことによって、その詳細な説明は省略する。
【0076】
本実施形態は、図4A〜Bに示すように、所定の塩基配列からなる核酸アプタマーについて相補鎖が読み取られるアプタマー領域40を有する環状核酸41を使用している。環状核酸41は、アプタマー領域40が所定の核酸アプタマーの逆鎖を読み取るように構成した以外は、上述した実施形態における環状核酸3と同じ構成である。
【0077】
本実施形態では、環状核酸41を鋳型として鎖置換型のRCA反応により合成された一本鎖の増幅核酸42が核酸アプタマーの相補鎖を有するようにする。ここで、核酸アプタマーは、所定の塩基配列からなる一本鎖核酸の状態で機能するが、相補鎖では機能しない。すなわち、RCA反応により合成された一本鎖の増幅核酸42は、核酸アプタマーとして機能する領域が存在せず、第1の物質4に結合することはできない。
【0078】
本実施形態では、鎖置換型のRCA反応により合成された一本鎖の増幅核酸42を鋳型として、更に鎖置換型の核酸増幅反応を実施する(以下、2回目の核酸増幅反応)。この2回目の核酸増幅反応は、一本鎖の増幅核酸42の一部の領域にハイブリダイズするプライマー43を使用する。一本鎖の増幅核酸42は、鎖置換型のRCA反応により合成されたものであるためプライマー43がアニールする箇所を複数有している。なお、2回目の核酸増幅反応で使用するプライマー43は、鎖置換型のRCA反応おいて使用したプライマー7の相補鎖とすることもできる。
【0079】
上述した他の実施形態と同様に、鎖置換型のRCA反応を行った後、2回目の核酸増幅反応は、一本鎖の増幅核酸42を鋳型とするため、RCA反応ではなく通常の鎖置換型の核酸増幅反応となる。このとき、一本鎖の増幅核酸42には、プライマー43がアニールする箇所を複数有しているため、増幅された核酸断片44は級数的に増幅することとなる。そして、核酸断片44は、核酸アプタマーとなる領域45を含む一本鎖核酸となる。このように一本鎖核酸である核酸断片44群は、基板5上に配置された第1の物質4と結合して、上述した実施形態と同様に立体的に集積された形状を呈することとなる。
【0080】
以上のように、本実施形態によれば、反応を二段階に分け一回目のプライマーと逆方向のプライマーを用いた2回目の核酸増幅反応を実施することにより、増幅効率が増し、短時間の処理でシーケンス反応の検出に必要な数の解析対象の核酸領域1を得ることができる。この核酸断片44はほとんどが一本鎖で構成されておりシーケンス反応の鋳型として適する。また核酸アプタマーとして機能する領域45を繰り返し持つため、上述した実施形態と同様に立体的に集積された形状を呈することとなる。
【0081】
<<他の実施形態>>
次に、本発明の更に他の実施形態について説明する。以下の説明において、上述した実施形態と同一の構成・部材については同一の名称及び符号を付すことによって、その詳細な説明は省略する。
【0082】
本実施形態は、図5A〜Cに示すように、上述した実施形態における基板5や基板21に代えてビーズ50(曲面)を使用している。すなわち、本発明は、平板状の基板5、21のみならず曲面状のビーズ50といった如何なる基材を使用しても実施可能である。
【0083】
図5Aに示すように、ビーズ50上にプライマー-環状核酸複合体11を固定し、環状核酸3を鋳型として鎖置換型のRCA反応を実行すると、上述した実施形態と同様に、一本鎖の増幅核酸9が合成される、合成された一本鎖の増幅核酸9は、アプタマー領域2が第1の物質4に結合することによって、ビーズ表面から放射状に散在するのではなく、ビーズ表面を覆うように存在する。すなわち、本実施形態では、一本鎖の増幅核酸9により覆われた核酸被覆ビーズ51が形成される。この核酸被覆ビーズ51は、表面に核酸を有しない裸ビーズ52とは電気的性質が大きく異なっている。すなわち、核酸被覆ビーズ51はマイナス電荷を帯びており、裸ビーズ52はプラス電荷を帯びている。したがって、核酸増幅反応の終了後、核酸被覆ビーズ51及び裸ビーズ52が混在する溶液に電場を与えることで、図5Bに示すように、核酸被覆ビーズ51及び裸ビーズ52を容易に分離して回収することができる。
【0084】
また核酸被覆ビーズ51は、多量のリン酸基を有しているため、たとえばジルコニアなどで被覆した基板53に結合することができる。よって、核酸被覆ビーズ51及び裸ビーズ52が混在する溶液をジルコニアなどで被覆した基板53に接触させることで、図5Cに示すように、核酸被覆ビーズ51及び裸ビーズ52を容易に分離して回収することができる。なお、基板53上に分離された核酸被覆ビーズ51は、そのままシーケンス反応に供することができる。
【0085】
一般的なビーズ上での遺伝子増幅反応は所謂エマルジョンPCRである。エマルジョンPCRでは、5’末端をビーズに固定したDNA断片をプライマーとして用いているため、遺伝子増幅反応の有無にかかわらず、一定量のDNA分子を最初からビーズ上に有している。このような状態では、図5Bや図5Cに示したような原理に基づいて、合成反応の起こったビーズと起こっていないビーズとを分離することは非常に困難である。これに対して、本実施形態によれば、図5Bや図5Cに示したような原理に基づいて核酸被覆ビーズ51及び裸ビーズ52を容易に分離しでき、ユーザーがサンプル処理にかける時間を短縮することができる。
【0086】
なお、本実施形態では、一般的なエマルジョンPCRと同じく、W/Oエマルジョンを微小反応場として用いて核酸増幅反応を実施しても良いが、エマルジョンを作製することなくビーズ上に遺伝子断片のクラスタ10を形成することができる。
【0087】
一般に、エマルジョンPCRにより、増幅断片を有するビーズを調製するには、ビーズに結合したプライマー、増幅対象となる遺伝子断片、ビーズに結合したプライマーとは逆向きのプライマーを用いて、W/Oエマルジョンを微小反応場としてPCRを行う。この時、PCRによって生じた核酸断片は二本鎖のうち一方のみが、ビーズと共有結合で結ばれている。一方、その相補鎖はビーズと直接結合しておらず、温度サイクルをかけることで引き剥がされ溶液中に遊離し、次のPCRの鋳型となる。この遊離した相補鎖が別のビーズ上で増幅しないよう、反応場を隔離する必要があり、エマルジョンによって空間的に閉じた反応容器内でPCRを行っている。この手法は、エマルジョンの作製や破壊を行わなくてはならず作業上煩雑である。また反応容器がエマルジョン中の水滴という非常に限られた空間であるため、核酸合成反応の基質・酵素の追加供給や合成によって生じた副反応物の除去を行うことができない。
【0088】
このようなエマルジョンPCRの諸問題に対して、本実施形態によれば、ビーズ50に対してプライマー-環状核酸複合体11を固定しているため、合成された一本鎖の増幅核酸9はビーズ表面から解離していない。よって、基本的には、増幅核酸9の分散は起こりにくく、増幅核酸9が繰り返し持つアプタマー領域2によってビーズ50に逐次絡めとられるため、空間的に広がりにくい。よって、一つのビーズ上で合成されたクラスタ10は、他のビーズ50に影響を及ぼさない。
【0089】
<<増幅遺伝子クラスタ作成装置>>
次に、以上で説明した本発明に係る核酸増幅方法を実行する増幅遺伝子クラスタ作成装置を説明する。増幅遺伝子クラスタ作成装置は、例えば図6に示すように、増幅したクラスタ10を形成する支持体60に、予め流路61を設けた反応チャンバー62を張り合わせ、フローセル63を備える。反応チャンバー62は、少なくとも、クラスタ10を形成する部分の部材が光透過性の材質から形成されていることが好ましい。反応チャンバー62は、例えば、流路61となる溝を予め掘ったPDMS(Polydimethylsiloxane)等の樹脂基体を用いる。
【0090】
また、増幅遺伝子クラスタ作成装置は、具体的に、核酸試料、反応酵素、バッファー、ヌクレオチド基質等を保存・温度管理する温調ユニット64、反応液を送り出す分注ユニット65、液の流れを制御するバルブ66,廃液タンク67から構成される。このように構成された増幅遺伝子クラスタ作成装置は、温調ユニット64における温調機を通じたフローセル63部分の温度制御と、反応基板(流路61)への溶液交換によって、上述した各種実施形態に示した核酸増幅反応を制御し、その結果、所望のクラスタ10を形成する。なお、反応終了時には、洗浄液が流路61を通じて供給され、廃液タンク67に収納される。
【0091】
<<核酸分析装置>>
次に、本発明を適用した核酸分析装置について説明する。核酸分析装置は、図7に示すように、反応デバイス70(反応部)に対して、ヌクレオチド、蛍光色素を有するヌクレオチド、核酸合成酵素、プライマー及び核酸試料からなる1種類以上の生体分子を供給する手段と、前記反応デバイス70に光を照射する手段と、前記反応デバイス70上の蛍光を測定する蛍光検出手段とを備える。
【0092】
具体的に、反応デバイス70は、カバープレート71と検出窓72と溶液交換用口である注入口73と排出口74とから構成される反応チャンバーに設置される。なお、カバープレート71と検出窓72の材質としては、光透過性を有するPDMS(Polydimethylsiloxane)を使用する。核酸分析装置は、図示しないが、上述した核酸増幅方法の実施形態で説明した手順にて核酸増幅反応が進行するように、鎖置換型のRCA反応を行う酵素、環状核酸3、プライマー7、酵素の基質となるヌクレオチド並びに蛍光色素を有するヌクレオチドを順次、注入口73を介して反応デバイス70に供給する分注ユニットを有している。
【0093】
また、核酸分析装置は、前記反応デバイス70に光を照射する手段として、YAGレーザ光源(波長532nm,出力20mW)76及びYAGレーザ光源(波長355nm,出力20mW)77と、これらYAGレーザ光源76及び77から出射したレーザ光78及び79の光軸上に配置されたダイクロイックミラー80(410nm以下を反射)と、同光軸上に配置された集光レンズ81と、プリズム82とを備えている。
【0094】
さらに、核酸分析装置は、前記反応デバイス70上の蛍光を測定する蛍光検出手段として、検出窓72に対応する位置に配設される対物レンズ83と、対物レンズ83により平行光束とされた光軸上に配設された光学フィルタ84と、同光軸上に配設された結像レンズ85と、2次元CCDカメラ86とを備えている。
【0095】
以上のように構成された核酸分析装置は、上述したように核酸増幅反応が反応デバイス70にて進行し、蛍光色素を取り込んだクラスタ10が反応デバイス70の基板表面に固定される。そして、YAGレーザ光源76及びYAGレーザ光源77から発振するレーザ光78及び79をダイクロイックミラー80により同軸になるよう調整した後、レンズ81によって集光し、その後、プリズム82を介して反応デバイス70へ臨界角以上で照射する。そして、検出窓72より出射される蛍光は、対物レンズ83により平行光束とされ、光学フィルタ84により背景光及び励起光が遮断され、結像レンズ85により2次元CCDカメラ86上に結像される。
【0096】
このように核酸分析装置によれば、本発明に係る核酸増幅方法を適用して基材上に形成された増幅核酸9のクラスタ10を検出することができる。このとき、本発明に係る核酸増幅方法によれば、クラスタ10を高密度化することができるとともに、各クラスタ10に含まれる核酸量を多くすることができる。よって、2次元CCDカメラ86を使用することで、より多くのクラスタ10を高感度に撮像することができる。
【0097】
なお、本発明に係る核酸増幅方法は、図7に示した核酸分析装置に限定されず、図8に示した核酸分析装置にも適用することができる。図8に示す核酸分析装置は、温調ユニット87と光ファイバー88を有する以外は、図7に示した核酸分析装置と同様に構成されている。
【0098】
ところで、本発明に係る核酸増幅方法により、一般鎖の増幅核酸9からなるクラスタ10を形成した後、このクラスタ10を用いて解析対象の核酸領域1の塩基配列を決定することができる。塩基配列の決定原理は、特に限定されないが、例えば、Science 2005, VOL. 309, pp.1728-1732に開示された手法を採用することができる。すなわち、
(1)アンカープライマーのハイブリダイゼーション
(2)蛍光プライマーのライゲーション、
(3)蛍光検出
(4)アンカープライマーと蛍光プライマーの除去
(5)上記(1)〜(4)の繰り返し
を行い、解析対象の核酸領域1の塩基配列を決定することができる。
【0099】
また、塩基配列の決定方法としては、上記ライゲーションによる方法以外に逐次反応方式を用いることができる。蛍光色素付きヌクレオチドとして、Acta Biochim Biophys Sin (2009): 335-340に開示されているような、リボースの3′OHの位置に3′-O-アリル基を保護基として入れ、また、ピリミジンの5位の位置にあるいはプリンの7位の位置にアリル基を介して蛍光色素と結びつけたものが使用できる。アリル基は光照射あるいはパラジウムと接触することで切断されるため、色素の消光と伸長反応の制御を同時に達成することができる。逐次反応方式でも、未反応のヌクレオチドを洗浄で除去する必要はない。
【0100】
さらに、本実施形態では、P.N.A.S. 2008, vol. 105, pp 1176-1181に開示されているような、洗浄工程が必要ないことからリアルタイムで伸長反応を計測することも可能である。図7及び8に示すような核酸分析装置を使用することで、洗浄工程を入れることなく、解析時間の短縮化、反応デバイス及び分析装置の簡便化が図れ、逐次反応方式のみならず、リアルタイムで塩基の伸長反応を計測することも可能となり、従来技術に対して大幅なスループットの改善が図れる。
【実施例】
【0101】
以下、実施例により本発明を更に詳細に説明するが、本発明の技術的範囲は以下の実施例に限定されるものではない。
【0102】
〔実施例1〕
<材料>
アプタマー配列として、ストレプトアビジンに対して親和性が報告されている配列(5'-TATAACGCCCGTGTTGCTCGGTTAT-3'(配列番号4))を用いた。この配列を含む核酸試料(5'-TAATACGACTCACTATAGCAATGGTACGGTACTTCCTATAACGCCCGTGTTGCTCGGTTATCAAAAGTGCACGCTACTTTG-3'(配列番号22))を合成し、二種類のプライマー(5'-ATCATTGGATCCTAATACGACTCACTATAGCAATGGTACGGTACTTCC-3'(配列番号23)、5'-ATCCATAAGCTTTTAGCAAAGTAGCGTGCACTTTTG-3'(配列番号24))を用いPCRで増幅した後、pSPT19のBamH I〜Hind IIIサイトに挿入し、プラスミド(pSPT19_AptB1)を得た。更にpSPT19_AptB1を鋳型として、二種類のプライマー(5'-GGCGTAGAGGATCTGGCTAGCGATGACCCTGCTGATTG-3'(配列番号25)、5'-CGATCCGATGCTAGCGTAAAACGACGGCCAGTGACCGTCTCCGGGAGCTGCATG-3'(配列番号26))を用いPCRを行った。得られた増幅断片を制限酵素処理し、電気泳動にて精製したものをライゲーションし、519bpからなる二本鎖環状DNA分子を得た。この二本鎖環状DNA分子をモデルとして用い本発明の検証を行った。基板にはストレプトアビジンを固定したガラス板を用いた。作製にはエステル活性化済みのガラス板(Hubbleスライドガラス、タカラバイオ)を用い、これを0.5mg/mlのストレプトアビジン(streptavidin TypeII、WAKO)溶液に室温・16時間浸漬し、ストレプトアビジンの固定反応を行った。
【0103】
<基板上増幅反応とクラスタの評価>
二本鎖環状DNA分子と5'ビオチン化プライマー(5'biotin-ACTGGCCGTCGTTTTAC-3'(配列番号27))を終濃度20nMになるよう混合し、95℃で5分間加熱した後、緩やかに室温に戻し、両者をアニールさせた。この溶液を希釈した(終濃度1nM)ものを基板に与え、飽和蒸気下で室温・1時間静置し、基板に二本鎖環状DNA分子とビオチン化プライマーの複合体を固定した。未結合の物質は、150mM NaClを含むTEバッファー(以降TENバッファーと呼称)で洗浄し除去した。
【0104】
次いで、鎖置換活性を有するポリメラーゼ(96-7ポリメラーゼ、ニッポンジーン)を含む溶液(8U/20μl)を与え、50℃にてRCA反応を行った。反応溶液には、メーカー添付のバッファーを用い、dNTP濃度は250μMで行った。4時間経過後に、EDTA(終濃度50mM)を添加した上で室温に戻し、反応停止とした。この基板をTENバッファーにて洗浄した後、5'末端をCy3標識したオリゴDNA(5'-Cy3 CTATAGTGTCACCTAAATCGTATG-3'(配列番号28))1μMを基板にかけ、室温にて約16時間反応させ、TENバッファーにて洗浄し、基板上に形成された増幅遺伝子断片のクラスタを蛍光顕微鏡にて観察した。この蛍光標識プローブの相補鎖は、コンカテマー構造の繰り返し回数分だけ出現するため、輝点の蛍光強度は、その輝点に含まれる増幅遺伝子断片の数を反映することになる。Cy3標識デンドリマーを用い蛍光分子数と輝点強度との検量線を作り、クラスタあたりの蛍光分子数を算出し、クラスタあたりの増幅遺伝子断片数とした。結果基板上に、直径約800nm程度の輝点が形成されており、そこに含まれる遺伝子断片数は800〜1000分子程度であった。この値から基板上で合成された塩基長は、およそ400〜500kbpと見積もられた。
【0105】
このような非常に長いDNA分子は、通常今回観測された輝点よりも大きな体積を占めており、アプタマー配列を有していない二本鎖環状DNA分子を鋳型として用いる場合には、クラスタのサイズが大きくなり、面積あたりの遺伝子断片数が減少することになる。
【0106】
〔実施例2〕
本実施例では、基板上での合成反応時に、まずアプタマー配列の相補鎖側を合成し、次いでその逆鎖(アプタマー配列側)の合成反応を行い、二段階目の反応で生じたアプタマー配列で産物を基板に固定し、短時間で高い増幅倍率を得る効果について検討した。
【0107】
<材料>
材料には、実施例1と同様の基板と二本鎖環状DNA分子を用いた。
【0108】
<増幅反応とクラスタの評価>
二本鎖環状DNA分子と5'ビオチン化プライマー(5'biotin-TAATACGACTCACTATAGG-3'(配列番号29))を終濃度20nMになるよう混合し、95℃で5分間加熱した後、緩やかに室温に戻し、両者をアニールさせた。この溶液を希釈したもの(終濃度1nM)を基板に与え、飽和蒸気下で室温・1時間静置し、基板に二本鎖環状DNA分子とビオチン化プライマーの複合体を固定した。
【0109】
次いで、鎖置換活性を有するポリメラーゼ(Csaポリメラーゼ、ニッポンジーン)を含む溶液(8U/20μl)を与え、60℃にて1時間RCA反応を行った。反応溶液には、メーカー添付のバッファーを用い、dNTP濃度は250μMで行った。反応後、基板をTENバッファーにて洗浄し、一回目の合成反応の終了とした。この基板にオリゴDNA(5'-ACTGGCCGTCGTTTTAC-3'(配列番号27))5μMを与え、熱処理(60℃15分)した後、ゆっくりと室温に戻し、コンカテマーにオリゴDNAをハイブリダイゼーションさせた。過剰量の(未結合の)オリゴDNAはTENバッファーにて洗浄し、除去した。
【0110】
次いで、基板に0.5U/μlのphi29ポリメラーゼ(Nxgen phi29、Lucigen社)を含む反応溶液(バッファー:メーカー添付、dNTP濃度:250μM)を与え、30℃にて2時間、反応を行った。終濃度50mMのEDTAを添加し、TENにて洗浄し、反応停止とした。以上の反応で形成されたクラスタに蛍光標識プローブ(5’-Cy3 CTATAGTGTCACCTAAATCGTATG-3’(配列番号28))をハイブリダイゼーションさせた後、実施例1と同様に輝点強度を観察した。
【0111】
観察の結果、基板上に直径約900nmの輝点が認められ、そこに含まれる遺伝子断片数は平均22890分子と求められた。この3時間で20000倍以上の増幅率は、合成速度に換算すると約1kbp/secとなり、一箇所の複製起点からの反応では到底説明できず、逆鎖の合成反応が起こりその産物がアプタマー配列によって基板に固定されたものと推定される。アプタマー配列を有しない二本鎖環状DNA分子を鋳型として用いた場合には、二段階目の合成反応で生じた産物が基板への固定されないため、輝点における遺伝子増幅断片数は、本実施例に比べ大幅に低下する。例えば実施例1は一方向の合成反応のみのため、4時間反応で1000倍程度と、実施例2に比べ20分の1以下の増幅速度であった。
【符号の説明】
【0112】
1…解析対象の核酸領域、2…アプタマー領域、3…環状核酸、4…第1の物質、5…基板、6…結合分子、7…プライマー、8…ポリメラーゼ、9…増幅核酸、10…クラスタ、11…プライマー-環状核酸複合体、20…第2の物質、21…基板、22…距離、30…基板、31…凸型のナノピラー構造、32…スタンパ、33…ナノホール構造、34…スタンパ、35…固定距離、40…アプタマー領域、41…環状核酸、42…増幅核酸、43…プライマー、44…核酸残片、45…領域、50…ビーズ、51…核酸被覆ビーズ、52…裸ビーズ、53…基板、60…支持体、61…流路、62…反応チャンバー、63…フローセル、64…温調ユニット、65…分注ユニット、66…バルブ、67…廃液タンク、70…反応デバイス、71…カバープレート、72…検出窓、73…注入口、74…排出口、76…YAGレーザ光源、77…YAGレーザ光源、78…レーザ光、79…レーザ光、80…ダイクロイックミラー、81…レンズ、82…プリズム、83…対物レンズ、84…光学フィルタ、85…結像レンズ、86…2次元CCDカメラ
【特許請求の範囲】
【請求項1】
解析対象の核酸領域と核酸アプタマーに対応するアプタマー領域とを含む環状核酸を鋳型とし、当該核酸アプタマーと親和性を有する第1の物質が固定された基材上にてプライマーを起点とした鎖置換型のローリングサークル増幅反応を行う工程を含み、
上記アプタマー領域に対応する核酸アプタマー及び解析対象の核酸領域を含む一本鎖核酸分子を、当該核酸アプタマーと上記第1の物質との間の親和性により上記基材に固定することを特徴とする核酸増幅方法。
【請求項2】
上記プライマーは、上記基材上に固定された第2の物質に対して結合する能力を有する結合分子を導入したものであり、上記第2の物質と上記結合分子とが結合した状態で、上記ローリングサークル増幅反応が進行することを特徴とする請求項1記載の核酸増幅方法。
【請求項3】
上記第1の物質と上記第2の物質とは同じ物質であることを特徴とする請求項2記載の核酸増幅方法。
【請求項4】
上記第1の物質と上記第2の物質とは異なる物質であることを特徴とする請求項2記載の核酸増幅方法。
【請求項5】
上記環状核酸と上記プライマーとの複合体を形成し、上記第2の物質と上記結合分子とが結合することで当該複合体を上記基材上に捕捉させた後、上記鎖置換型のローリングサークル増幅反応を実行することを特徴とする請求項2記載の核酸増幅方法。
【請求項6】
上記第2の物質を基材上に離間して配置することで、上記増幅反応により合成された上記一本鎖核酸分子を離間させて上記基材上に配置することを特徴とする請求項2記載の核酸増幅方法。
【請求項7】
上記第2の物質は、隣り合う第2の物質同士が所定の距離を有するように上記基材上にランダムに配置されたことを特徴とする請求項2記載の核酸増幅方法。
【請求項8】
上記第2の物質は、隣り合う第2の物質同士が所定の距離を有するように上記基材上に規則的なパターンで配置されたことを特徴とする請求項2記載の核酸増幅方法。
【請求項9】
上記アプタマー領域は上記鎖置換型のローリングサークル増幅反応により上記核酸アプタマーの相補鎖が合成されるように設計され、鎖置換型のローリングサークル増幅反応により合成された核酸分子を鋳型とする2回目の核酸増幅反応により、上記核酸アプタマーを含む上記一本鎖核酸分子を合成することを特徴とする請求項1記載の核酸増幅方法。
【請求項10】
上記鎖置換型のローリングサークル増幅反応は、鎖置換活性を有するポリメラーゼを使用することを特徴とする請求項1記載の核酸増幅方法。
【請求項11】
上記鎖置換型のローリングサークル増幅反応は、鎖置換活性を有しないポリメラーゼとヘリカーゼを使用することを特徴とする請求項1記載の核酸増幅方法。
【請求項12】
上記基材は平面基板又はビーズであることを特徴とする請求項1記載の核酸増幅方法。
【請求項13】
解析対象の核酸領域を導入する部位と、核酸アプタマーに対応するアプタマー領域とを含む環状核酸と、
上記環状核酸に含まれる所定の領域にアニールできるプライマーと、
当該核酸アプタマーと親和性を有する第1の物質が固定された基材とを備える核酸増幅キット。
【請求項14】
上記プライマーは、上記基材上に固定された第2の物質に対して結合する能力を有する結合分子を導入したものであることを特徴とする請求項13記載の核酸増幅キット。
【請求項15】
上記第1の物質と上記第2の物質とは同じ物質であることを特徴とする請求項14記載の核酸増幅キット。
【請求項16】
上記第1の物質と上記第2の物質とは異なる物質であることを特徴とする請求項14記載の核酸増幅キット。
【請求項17】
上記基材は、上記第2の物質を離間して配置したものであることを特徴とする請求項14記載の核酸増幅キット。
【請求項18】
上記第2の物質は、隣り合う第2の物質同士が所定の距離を有するように上記基材上にランダムに配置されたことを特徴とする請求項14記載の核酸増幅キット。
【請求項19】
上記第2の物質は、隣り合う第2の物質同士が所定の距離を有するように上記基材上に規則的なパターンで配置されたことを特徴とする請求項14記載の核酸増幅キット。
【請求項20】
上記アプタマー領域は、鎖置換型のローリングサークル増幅反応により上記核酸アプタマーの相補鎖が合成されるように設計されたことを特徴とする請求項13記載の核酸増幅キット。
【請求項21】
鎖置換活性を有するポリメラーゼを更に含むことを特徴とする請求項13載の核酸増幅キット。
【請求項22】
鎖置換活性を有しないポリメラーゼとヘリカーゼを更に含むことを特徴とする請求項13記載の核酸増幅キット。
【請求項23】
上記基材は平面基板又はビーズであることを特徴とする請求項13記載の核酸増幅キット。
【請求項24】
核酸アプタマー及び解析対象の核酸領域を含む一本鎖核酸分子と、
上記核酸アプタマーと親和性を有する第1の物質が固定された基材とから構成され、
上記核酸アプタマーと上記第1の物質との間の親和性により、上記一本鎖核酸分子が上記基材に固定されたことを特徴とする核酸構築物。
【請求項25】
上記基材上には、複数の上記一本鎖核酸分子が固定され、各一本鎖核酸分子はそれぞれクラスタを形成していることを特徴とする請求項24記載の上記基材上にてクラスタを形成していることを特徴とする増幅構築物。
【請求項26】
解析対象の核酸領域と核酸アプタマーに対応するアプタマー領域とを含む環状核酸を鋳型とし、当該核酸アプタマーと親和性を有する第1の物質が固定された基材上にてプライマーを起点とした鎖置換型のローリングサークル増幅反応を行う反応部と、
上記反応部に対して励起光を照射する光照射手段と、
上記反応部上の蛍光を測定する蛍光検出手段とを備え、
上記反応部において上記基板上に合成された増幅核酸からなるクラスタを用いて上記解析対象の核酸領域の塩基配列を決定する塩基配列決定装置。
【請求項1】
解析対象の核酸領域と核酸アプタマーに対応するアプタマー領域とを含む環状核酸を鋳型とし、当該核酸アプタマーと親和性を有する第1の物質が固定された基材上にてプライマーを起点とした鎖置換型のローリングサークル増幅反応を行う工程を含み、
上記アプタマー領域に対応する核酸アプタマー及び解析対象の核酸領域を含む一本鎖核酸分子を、当該核酸アプタマーと上記第1の物質との間の親和性により上記基材に固定することを特徴とする核酸増幅方法。
【請求項2】
上記プライマーは、上記基材上に固定された第2の物質に対して結合する能力を有する結合分子を導入したものであり、上記第2の物質と上記結合分子とが結合した状態で、上記ローリングサークル増幅反応が進行することを特徴とする請求項1記載の核酸増幅方法。
【請求項3】
上記第1の物質と上記第2の物質とは同じ物質であることを特徴とする請求項2記載の核酸増幅方法。
【請求項4】
上記第1の物質と上記第2の物質とは異なる物質であることを特徴とする請求項2記載の核酸増幅方法。
【請求項5】
上記環状核酸と上記プライマーとの複合体を形成し、上記第2の物質と上記結合分子とが結合することで当該複合体を上記基材上に捕捉させた後、上記鎖置換型のローリングサークル増幅反応を実行することを特徴とする請求項2記載の核酸増幅方法。
【請求項6】
上記第2の物質を基材上に離間して配置することで、上記増幅反応により合成された上記一本鎖核酸分子を離間させて上記基材上に配置することを特徴とする請求項2記載の核酸増幅方法。
【請求項7】
上記第2の物質は、隣り合う第2の物質同士が所定の距離を有するように上記基材上にランダムに配置されたことを特徴とする請求項2記載の核酸増幅方法。
【請求項8】
上記第2の物質は、隣り合う第2の物質同士が所定の距離を有するように上記基材上に規則的なパターンで配置されたことを特徴とする請求項2記載の核酸増幅方法。
【請求項9】
上記アプタマー領域は上記鎖置換型のローリングサークル増幅反応により上記核酸アプタマーの相補鎖が合成されるように設計され、鎖置換型のローリングサークル増幅反応により合成された核酸分子を鋳型とする2回目の核酸増幅反応により、上記核酸アプタマーを含む上記一本鎖核酸分子を合成することを特徴とする請求項1記載の核酸増幅方法。
【請求項10】
上記鎖置換型のローリングサークル増幅反応は、鎖置換活性を有するポリメラーゼを使用することを特徴とする請求項1記載の核酸増幅方法。
【請求項11】
上記鎖置換型のローリングサークル増幅反応は、鎖置換活性を有しないポリメラーゼとヘリカーゼを使用することを特徴とする請求項1記載の核酸増幅方法。
【請求項12】
上記基材は平面基板又はビーズであることを特徴とする請求項1記載の核酸増幅方法。
【請求項13】
解析対象の核酸領域を導入する部位と、核酸アプタマーに対応するアプタマー領域とを含む環状核酸と、
上記環状核酸に含まれる所定の領域にアニールできるプライマーと、
当該核酸アプタマーと親和性を有する第1の物質が固定された基材とを備える核酸増幅キット。
【請求項14】
上記プライマーは、上記基材上に固定された第2の物質に対して結合する能力を有する結合分子を導入したものであることを特徴とする請求項13記載の核酸増幅キット。
【請求項15】
上記第1の物質と上記第2の物質とは同じ物質であることを特徴とする請求項14記載の核酸増幅キット。
【請求項16】
上記第1の物質と上記第2の物質とは異なる物質であることを特徴とする請求項14記載の核酸増幅キット。
【請求項17】
上記基材は、上記第2の物質を離間して配置したものであることを特徴とする請求項14記載の核酸増幅キット。
【請求項18】
上記第2の物質は、隣り合う第2の物質同士が所定の距離を有するように上記基材上にランダムに配置されたことを特徴とする請求項14記載の核酸増幅キット。
【請求項19】
上記第2の物質は、隣り合う第2の物質同士が所定の距離を有するように上記基材上に規則的なパターンで配置されたことを特徴とする請求項14記載の核酸増幅キット。
【請求項20】
上記アプタマー領域は、鎖置換型のローリングサークル増幅反応により上記核酸アプタマーの相補鎖が合成されるように設計されたことを特徴とする請求項13記載の核酸増幅キット。
【請求項21】
鎖置換活性を有するポリメラーゼを更に含むことを特徴とする請求項13載の核酸増幅キット。
【請求項22】
鎖置換活性を有しないポリメラーゼとヘリカーゼを更に含むことを特徴とする請求項13記載の核酸増幅キット。
【請求項23】
上記基材は平面基板又はビーズであることを特徴とする請求項13記載の核酸増幅キット。
【請求項24】
核酸アプタマー及び解析対象の核酸領域を含む一本鎖核酸分子と、
上記核酸アプタマーと親和性を有する第1の物質が固定された基材とから構成され、
上記核酸アプタマーと上記第1の物質との間の親和性により、上記一本鎖核酸分子が上記基材に固定されたことを特徴とする核酸構築物。
【請求項25】
上記基材上には、複数の上記一本鎖核酸分子が固定され、各一本鎖核酸分子はそれぞれクラスタを形成していることを特徴とする請求項24記載の上記基材上にてクラスタを形成していることを特徴とする増幅構築物。
【請求項26】
解析対象の核酸領域と核酸アプタマーに対応するアプタマー領域とを含む環状核酸を鋳型とし、当該核酸アプタマーと親和性を有する第1の物質が固定された基材上にてプライマーを起点とした鎖置換型のローリングサークル増幅反応を行う反応部と、
上記反応部に対して励起光を照射する光照射手段と、
上記反応部上の蛍光を測定する蛍光検出手段とを備え、
上記反応部において上記基板上に合成された増幅核酸からなるクラスタを用いて上記解析対象の核酸領域の塩基配列を決定する塩基配列決定装置。
【図1】


【図2】


【図3−1】


【図3−2】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3−1】


【図3−2】


【図4】


【図5】


【図6】


【図7】


【図8】


【公開番号】特開2013−94067(P2013−94067A)
【公開日】平成25年5月20日(2013.5.20)
【国際特許分類】
【出願番号】特願2011−236822(P2011−236822)
【出願日】平成23年10月28日(2011.10.28)
【出願人】(501387839)株式会社日立ハイテクノロジーズ (4,325)
【Fターム(参考)】
【公開日】平成25年5月20日(2013.5.20)
【国際特許分類】
【出願日】平成23年10月28日(2011.10.28)
【出願人】(501387839)株式会社日立ハイテクノロジーズ (4,325)
【Fターム(参考)】
[ Back to top ]

