活性薬の経皮又は経粘膜適用のための使用及び製剤
活性薬が必要な被験者に活性薬を経皮又は経粘膜送達するための使用法及び製剤。本製剤及び方法は、性腺機能低下症、女性の性欲障害、女性の閉経期障害、及び副腎不全を含むホルモン障害の症候を治療する。
【発明の詳細な説明】
【発明の詳細な説明】
【0001】
(発明の背景)
発明の分野
本発明は、一般的に被験者に活性薬を経皮又は経粘膜送達する製剤及び方法に関する。特に、本発明は、性腺機能低下症、女性の閉経期症候、女性の性欲障害、機能減退性性障害及び副腎不全の症候を治療するための製剤及び方法に関する。
背景技術
ヒトの内因性ステロイドホルモンのレベル低下は、種々の望ましくない臨床症候につながることが多い。例えば、低テストステロンレベル(性腺機能低下症)の男性は、インポテンス、性欲の欠如、筋衰弱、及び骨粗しょう症を含む臨床症候になりうる。同様に、女性では、テストステロン及び/又はエストロゲンのレベル低下は、性欲の欠如、覚醒又は喜びの欠如、低エネルギー、幸福感の低減、及び骨粗しょう症のような臨床症候を含む女性の性的障害をもたらしうる。更に、閉経期に起因する場合のような女性のエストロゲン及び/又はプロゲステロンのレベル低下は、のぼせ、寝汗、膣萎縮、性欲低下、及び骨粗しょう症を含む臨床症候につながることが多い。
上述したような内因性ステロイドホルモンのレベル低下に加え、副腎不全は、男女のデヒドロエピアンドロステロン(DHEA)のレベル低下をもたらす。副腎は、DHEA及びエストロゲンやテストステロンのような性ホルモンを含む体内の多くのホルモンの生産にも関与している。結果として、副腎不全は、上述した臨床症候をもたらしうるDHEA及び性ホルモンのレベル低下につながりうる。
【0002】
ホルモン補充療法によってステロイドホルモン濃度は正常又は近正常レベルに回復しうるが、現在の治療形態(すなわち、経口、筋肉内、皮下、経皮パッチ及び局所製剤形態)にはいくつかの欠点がある。例えば、経口投与したテストステロンは肝臓内で大部分分解されるので、テストステロンは体循環に達することができず、ホルモン補充の実行可能な選択肢でない。更に、分解を減らすように改良したテストステロンの類似体(例えば、メチルテストステロン及びメタンドロステノロン(methandrostenolone))は、肝臓酵素及び抱合型ビリルビンの上昇のような肝不全に至る異常性に関係している。注入されたテストステロンはテストステロン濃度の幅広ピーク対最低値変化を生じさせ、テストステロンの正常な変動を模倣せず、血漿内での生理レベルの維持を困難にする。テストステロン注射は、気分変動及び血清脂質レベル増加にも関係する。注射は筋肉内送達用の大きい針を必要とし、不快感のため患者のコンプライアンスの低減につながる。一般に、エストロゲンは経口投与されることが多い。この投与経路は、ホルモン代謝に関連した合併症とも関係しており、循環性ホルモンの不十分レベルという結果になる。更に、経口エストロゲンの使用で見られる副作用として胆石及び血餅が挙げられる。これらの問題を克服するため、より患者フレンドリーな様式で治療効果を果たすべく経皮送達アプローチが開発されている。
有利には、活性薬の経皮及び/又は経粘膜送達は、被験者への活性薬の簡便、無痛、かつ非侵襲性投与方法を提供する。更に、皮膚又は粘膜表面を通じた活性薬の投与は、活性薬の経口投与で遭遇する“初回通過効果”に関連した十分な資料の裏付けのある問題を回避する。
【0003】
活性薬の経皮及び/又は経粘膜送達は、上述したような活性薬の経口投与に関連するいくつかの問題を克服するが、それ自体にも欠点がある。問題は、経皮薬物送達システムが通常低分子量薬物及び適切な親油性/親水性バランスを有する構造の薬物に限定されることである。多くの場合、高分子量薬物、又は高すぎるか若しくは低すぎる親水性バランスの薬物を、角質層を通り抜けられないその不浸透性を克服するために十分高い濃度で現在の経皮システムに組み入れることができない。特に、極性薬物は皮膚に緩徐にしか浸透せず、大部分の薬物は極性の性質をもつので、この制限は重大である。
当該技術では、皮膚のバリヤー性を化学的に変えて、特定薬の浸透を可能にし(拡散は主に角質層を通じて制御されるので)、送達される活性薬の効力を高め、送達回数を増やし、送達する用量を減らし、種々の送達法由来の副作用を減らし、患者の反応を減らす等の努力が為されている。
この点に関して、浸透エンハンサーを用いて皮膚表面の薬物への浸透を高めており、多くの場合、浸透エンハンサーはジメチルスルホキシド(DMSO)及びジメチルアセトアミドのようなプロトン受容性溶媒である。研究され、かつ有効と報告されている他の浸透エンハンサーとして、2-ピロリジン、N,N-ジエチル-m-トルアミド(Deet)、1-ドデカル-アザシクロヘプタン-2-オン、N,N-ジメチルホルムアミド、N-メチル-2-ピロリジン、チオグリコール酸カルシウム、ヘキサノール、脂肪酸及びエステル、ピロリドン誘導体、1,3-ジオキサン及び1,3-ジオキソランの誘導体、1-N-ドデシル-2-ピロリドン-5-カルボン酸、2-ペンチル-2-オキソ-ピロリジン酢酸、2-ドデシル-2-オキソ-1-ピロリジン酢酸、1-アザシクロヘプタン-2-オン-2-ドデシル酢酸、及びとりわけ1,3-ジオキサンの誘導体を含むアミノアルコール誘導体が挙げられる。
しかし、ほとんどの一般的な浸透エンハンサーは毒性、刺激性、油性、悪臭、又はアレルギー性である。具体的には、ステロイドホルモンのような活性薬を経皮送達するために用いられ、また必要と考えられる浸透エンハンサー、すなわちオレイン酸のような長鎖脂肪酸、ラウリルアルコールのような脂肪アルコール及びミリスチン酸イソプロピルのような長鎖脂肪エステルのような化合物は、脂肪族基を含み、かつその製剤を油性かつ悪臭にする傾向がある。
例えば、米国特許第5,891,462号は、エストラジオール及び酢酸ノルエチンドロンの浸透エンハンサーとしてラウリルアルコールの使用を教示している。このような製剤は、使用者にも使用者に近いだれにもアピールしない。この特定の特許は、ラウリルアルコール成分のないエストラジオール又は酢酸ノルエチンドロン製剤の3種の例を開示しているが、該製剤は被験者にエストラジオールと組み合わせて酢酸ノルエチンドロンを経皮送達するためにはラウリルアルコールのような長鎖脂肪アルコールが必要であるという長く維持されている状態を説明することを意図した比較例である。
更に、例えば、既知のテストステロンゲル製剤FORTIGEL(登録商標)及びTOSTRELLE(登録商標)(Cellegy Pharma, South San Francisco, CA)は、両方ともエタノール、プロパノール、プロピレングリコール、カルボマー、トリエタノールアミン、純水、及び浸透エンハンサーとしてオレイン酸を含み、この浸透エンハンサーがこれら製剤の刺激及び汚臭特性の原因である。また、TESTIM(登録商標)(Auxilium Pharmaceuticals, Norristown, PA)は1%テストステロンゲルであり、ペンタデカラクトン、アクリレート、グリセリン、ポリエチレングリコール(PEG)、及び浸透エンハンサーとしてペンタデカラクトンを含む。これは非常に悪臭のある化合物である。また、TESTIM(登録商標)は、皮膚がよく耐えない望ましくない量のグリセリンを含有するので望ましくない。
【0004】
(発明の概要)
本発明は、一般的に、被験者への少なくとも1種の活性薬の経皮又は経粘膜送達のための製剤及び方法に関する。本発明は、更に活性薬の経皮又は経粘膜投与によってホルモン障害を治療する方法に関する。
本発明の一局面では、少なくとも1種の活性薬の投与用経皮又は経粘膜製剤が提供される。本製剤は、少なくとも1種の活性薬と、アルカノール、多価アルコール、及び哺乳類の皮膚又は粘膜表面を貫く活性薬の浸透性を高めるために十分な量の浸透エンハンサーを含む送達媒体とを含む。この特定実施形態では、活性薬はテストステロン単独でなく、かつ活性薬がエストロゲン又はプロゲスチンを含む場合、該製剤は、それぞれ治療的に有効な量のエストロゲン又はプロゲスチンを含まない。有利には、本製剤は、実質的に長鎖アルコール、長鎖脂肪酸、又は長鎖脂肪エステルがなく、このような化合物によって引き起こされる該製剤の使用中の望ましくない臭い及び刺激を回避する。
【0005】
本発明の別の局面では、本製剤は、活性薬と、アルカノール、多価アルコール、及び浸透エンハンサーのテトラグリコールフロールを含む送達媒体とを含む。浸透エンハンサーは、哺乳類の皮膚又は粘膜表面を貫く活性薬の浸透性を高めるために十分な量で存在する。好ましい浸透エンハンサーはグリコフロールである。
本発明の別の局面は、被験者のホルモン障害を治療する方法を提供する。本方法は、このような治療が必要な被験者に、少なくとも1種の活性薬と、アルカノール、多価アルコール、及び哺乳類の皮膚又は粘膜表面を貫く活性薬の浸透性を高めるために十分な量の浸透エンハンサーを含む送達媒体とを含んでなる製剤を投与することを含む。有利には、本製剤は、のぼせ、寝汗、性欲減退、膣萎縮、及び骨粗しょう症のようなホルモン障害の少なくとも1つの症候の頻度を低減する。更に、少なくとも1種の活性薬は、アンドロゲン、エストロゲン、プロゲスチン、又はその組合せから選択することができる。本製剤は、同時に投与される一次及び二次活性薬を含んでよい。
本発明の別の局面では、本方法は、治療が必要な被験者に、少なくとも1種の活性薬と、脂肪族アルコール、多価アルコール、及び皮膚又は粘膜表面を貫く活性薬の浸透性を高めるために十分な量の浸透エンハンサーのテトラグリコールフロールを含む送達媒体とを含んでなる製剤を投与することを含む。好ましくは、脂肪族アルコールは送達媒体の約5〜80質量%の量で存在し、多価アルコールと浸透エンハンサーは、送達媒体のそれぞれ約1%〜30%の量で存在し、浸透エンハンサーはグリコフロールであり、かつ任意に媒体中に水が存在しうる。
【0006】
本発明の別の局面では、ホルモン障害の治療方法は、治療が必要な被験者に、少なくとも1種の活性薬(該活性薬はテストステロン単独でなく、かつ活性薬がエストロゲン又はプロゲスチンの場合、製剤中にそれぞれ治療的に有効な量のプロゲスチン又はエストロゲンが存在しないという条件で)を含む製剤を投与することを含む。送達媒体は、脂肪族アルコール、多価アルコール、及び皮膚又は粘膜表面を貫く活性薬の浸透性を高めるために十分な量の浸透エンハンサーを含む。本製剤は、実質的に長鎖脂肪アルコール、長鎖脂肪酸、及び長鎖脂肪エステルがなく、このような化合物に起因する望ましくない臭い、刺激、及び脂っこいテクスチャーを回避する。
本発明の別の実施形態は、被験者のホルモン障害を治療するための、有効用量の少なくとも1種の活性薬と、アルカノール、多価アルコール、及び浸透エンハンサーを含む送達媒体とを含んでなる製剤の使用方法を含む。ここで、浸透エンハンサーは、哺乳類の皮膚又は粘膜表面を貫く活性薬の浸透性を高めるために十分な量で存在する。本明細書で開示されるいずれの製剤もこの方法で使用することができる。
別の実施形態は、哺乳類の皮膚又は粘膜表面を貫く有効用量の少なくとも1種の活性薬の浸透性を高めるための浸透エンハンサーの使用であって、該浸透エンハンサーを製剤用送達媒体に添加することを特徴とする使用に関する。被験者のホルモン障害を治療するために有効な用量を使用し、好ましくは本明細書で開示するような浸透エンハンサー及び製剤である。
本発明の更に別の実施形態は、被験者のホルモン障害の治療用薬物の製造のための本明細書で開示するいずれかの製剤の使用に関する。
本発明の製剤は、ゲル、ローション、クリーム、スプレー、エアゾール、軟膏、懸濁液、リポソーム系、ラッカー、パッチ、絆創膏、又は密封包帯などの形態でよい。
本発明は、更に上述した製剤、及びその使用説明書を含むキットを包含する。キットは、一般的に製剤を保持する容器を含み、かつ必要時に所定用量又は所定体積の製剤を放出又は適用するディスペンサーを含む。ディスペンサーは使用者による作動によって所定用量又は体積の組成物を自動的に放出することもできる。
本発明の特徴及び利益は、以下の例示実施形態の詳細な説明及び添付図面の精査によって更に明らかになるだろう。
【0007】
(好ましい実施形態の詳細な説明)
本発明の製剤は、清澄で、水で洗え、触ると冷たく、速乾性で、塗り広げられ及び/又は脂っこくない、ゲルのような製剤でよい。本発明の他の局面では、本製剤は、スプレー、軟膏、エアゾール、パッチ、バッカル錠及び舌下錠、座剤、膣剤形、又は皮膚又は粘膜表面を通じた吸収用の他の受動的又は活性な経皮デバイスでよい。本発明の好ましい製剤は、例えば、限定するものではないが、ゲル、軟膏、又はクリームによってのように皮膚に直接、或いはパッチ、絆創膏、又は他の密閉包帯を介して間接的に適用することができる。
有利には、長鎖脂肪アルコール及び長鎖脂肪酸の省略が、先行技術製剤の不快な臭いのない製剤を与える。従って、本発明の製剤は、より多くの患者コンプライアンスに帰着する。本発明の製剤は、このようなアルコール及び脂肪酸が実質的にないので、それら化合物に関連する臭いが製剤から発しない。この点に関して、“実質的にない”とは、1メートルの距離で製剤から知覚できる臭いを与えない量を意味する。このような製剤は実質的に臭いもないと考えられる。実例及び説明の目的では、製剤の約0.04質量%未満の量で脂肪アルコール、脂肪酸及び/又は脂肪エステルを含む製剤は実質的に臭いがない。
【0008】
本発明は、一般的に、活性薬を被験者に与えるための製剤に関する。更に本発明は、悪臭の長鎖脂肪アルコール及び長鎖脂肪酸が実質的にない、活性薬の経皮又は経粘膜投与用製剤に関する。驚くべきことに、本発明の製剤は、現在まで使用されている長鎖脂肪アルコール及び長鎖脂肪酸を含めずに、血清中で循環する有効用量の選択活性薬をもたらすために十分な吸収を達成することができる。
本発明の製剤は、少なくとも1種又組合せの活性薬を含みうる。本明細書では、“活性薬”は、生物(ヒト又は動物)に投与すると、局所及び/又は全身作用によって、所望の薬理学的及び/又は生理学的効果を誘発する物質又は物質の配合若しくは組合せ又は物質の配合物を指すために使用する。
本発明の送達媒体は、C2〜C4アルカノールのような脂肪族アルコール、多価アルコール、哺乳類の皮膚又は粘膜表面を貫く活性薬の浸透性を高めるために十分な量の浸透エンハンサーであるジエチレングリコールのモノアルキルエーテル又はテトラグリコールフロールを含み、任意に水を含みうる。
【0009】
例えば、ジエチレングリコールのモノアルキルエーテルは、ジエチレングリコールモノメチルエーテル又はジエチレングリコールモノエチルエーテル又はその混合物である。テトラグリコールフロールは下記式で表される。
【化1】

【0010】
好ましい化合物はグリコフロールとして知られる。また、例えば、好ましい多価アルコールとして、プロピレングリコール、ジプロピレングリコール又はその混合物が挙げられる。
好ましくは、多価アルコールは、媒体の約1%〜30%の量で存在し;かつ浸透エンハンサーは、媒体の約0.2%〜30%の量で存在する。好ましくは、多価アルコールと浸透エンハンサーは、2:1〜1:1の質量比、又は1.25:1〜1.2:1の質量比で存在する。
説明の目的であり、かつ限定するものではないが、脂肪族アルコールは、エタノール、イソプロパノール、及びn-プロパノールのようなC2〜C4アルカノールを含む群から選択される。アルカノールは好ましくはエタノールである。
好ましくは、アルカノールは、約5〜約80%w/w;好ましくは約15〜約65%w/w;更に好ましくは20〜55%w/wの量で存在する。
技術的に周知なように、製剤のアルコール成分の量を選択して、活性薬自体又は製剤の望ましい特性に対するいずれの負の影響も最小限にしながら、皮膚を貫く活性薬の拡散を最大にすることができる。
本発明はホルモンの病気、障害、又は状態の治療が必要な患者の治療方法にも関する。本方法は、一般的に、有効用量の少なくとも1種の活性薬と、送達媒体とを含んでなる製剤を被験者に投与することを含む。
本発明の1つの好ましい実施形態では、本方法は、性腺機能低下症、女性の性障害、機能減退性性障害、及び副腎不全から成る群より選択されるホルモン障害を治療することを含み、本方法は、該治療が必要な患者に、少なくとも1種の活性薬と、アルカノール、多価アルコール、及び哺乳類の皮膚又は粘膜表面を貫く活性薬の浸透性を高めるために十分な量の浸透エンハンサーを含む送達媒体とを含んでなる製剤を投与することを含む。製剤の投与は、治療するホルモン障害の臨床症候の少なくとも1つの頻度を減らす。例えば、製剤の投与は、少し例を挙げると、のぼせ、寝汗、性欲減退、及び骨粗しょう症のような症候の頻度の低減に役立つ。
【0011】
別の好ましい実施形態では、ホルモン障害の被験者を治療する方法であって、そのような治療が必要な被験者に、少なくとも1種の活性薬と、脂肪族アルコール、多価アルコール、及び皮膚又は粘膜表面を貫く活性薬の浸透性を高めるために十分な量の浸透エンハンサーのテトラグリコールフロールを含む送達媒体とを投与することを含む方法が提供される。好ましくは、テトラグリコールフロールはグリコフロールである。
好ましくは、被験者に投与する製剤は、実質的に長鎖脂肪アルコール、長鎖脂肪酸、及び長鎖脂肪エステルがなく、製剤の使用中の望ましくない臭い及び刺激を回避する。
治療が必要な被験者は男性でも女性でもよい。従って、製剤や治療方法のために選択する活性薬のタイプ、及びその活性薬の有効用量は、部分的に、治療する被験者、及び治療するホルモン障害のタイプによって決まる。
【0012】
説明の目的のため、かつ限定でなく、本発明によれば、例えば、治療を受ける女性は、妊娠可能年齢以上の自然閉経、外科的手順、放射線、化学的卵巣切除若しくは摘出、又は早発卵巣不全のどれかのため卵巣エストロゲン、プロゲステロン及び/又はアンドロゲン生産が中断されている女性でよい。自然閉経及び加齢に加え、テストステロン欠乏につながる総循環性アンドロゲンの減少は、副腎アンドロゲン分泌を抑制する状態(すなわち、急性ストレス、拒食症、クッシング症候群、及び下垂体腎不全)、卵巣アンドロゲン分泌を減らしうる状態(すなわち、卵巣不全及び薬理学的用量のグルココルチコイドの使用)、及び後天性免疫不全症候群(AIDS)のような筋衰弱疾患のような慢性病に起因しうる。従って、本明細書では、用語“ホルモン障害”は、被験者のホルモン分泌の抑制又は減少を引き起こすいずれの状態をも意味する。
加齢及び上述したような他の因子による女性閉経期症候群の女性被験者の治療に加え、女性のアンドロゲン(及びエストロゲン)のレベル低下は女性の性機能不全(FSD)につながり、結果として性欲、覚醒又は喜びの欠如;低エネルギー、幸福感の減少及び骨粗しょう症となりうる。本発明の製剤を用いて女性のFSDを治療する好ましい結果は、エネルギー上昇、幸福感の増加、骨からのカルシウム損失の減少、性的活動及び願望の増加の1つ以上が挙げられる。
【0013】
閉経期前の女性では、総血漿テストステロン濃度が一般的に15〜65ng/dL(閉経期前の女性の遊離テストステロンは約1.5〜7pg/mlである)の範囲であり、月経周期の間に、該周期の排卵前期と黄体期の血漿エストロゲン濃度のピークに対応するアンドロゲン濃度のピークによって変動する。閉経後転移につながる年代に、卵巣及び副腎の両分泌の年齢に関連した減少の結果として循環性アンドロゲンのレベルが減少し始める。40歳代の閉経期前の正常な女性の24時間の平均血漿テストステロンがその20歳代初期の女性の半分であるという研究が報告されている。しかし、一般的に、アンドロゲン欠乏の女性は、総テストステロンレベル<25ng/dL(<50歳)又は20mg/dL(≧50歳)を有するが、卵巣摘出した女性は、総テストステロンレベル<10ng/dLを有しうる。
この点に関して、本方法は、女性被験者に、24時間毎に約1mg〜約3mgの治療的に有効な用量のテストステロンを投与することを含みうる。従って、本製剤は、好ましくは少なくとも約(>30ng/dL)15〜約55ng/dLのテストステロンの総血清濃度を被験者に与え、又は約2〜約7pg/mLのテストステロンの遊離血清濃度を与える。
【0014】
更に、研究は、エストロゲン補充療法(“ERT”)と併用したテストステロン補充が、ERT単独に対して性機能及び幸福のパラメーターを改善することを示した。性交率の低下及び少ない性的思考や空想は、エストラジオール及びテストステロンの有意な減少に関係している。テストステロンの減少は、性交の頻度減少にも関係している。卵巣摘出した女性のエストラジオール治療のみでも血管運動症候群、膣乾燥、及び通常の幸福感を改善したが、性欲の改善はほとんど観察されなかった。テストステロン-エナンテート注射によって、子宮摘出及び卵巣摘出した女性で、ERTのみで観察された以上の性欲、覚醒、及び性的空想の頻度の増加が観察された。従って、本発明の方法により、活性薬としてエストラジオールだけを含んでなる製剤を投与することを含む女性被験者の治療のみならず、アンドロゲン、好ましくはテストステロンとエストロゲンの両者を含む活性薬を含んでなる製剤の投与を含む女性被験者の治療が提供される。
自然に、又は4カ月間以上の不十分なERTで外科的に閉経した女性の別の研究は、プラセボ又はエストロゲン治療だけに対してアンドロゲン/エストロゲン治療の4及び8週間後の性的感覚及び願望の有意な改善を示した。外科的に閉経した女性の研究で、アンドロゲン/エストロゲン療法で性的願望、覚醒、幸福、及びエネルギーレベルが向上した。閉経後の女性における皮下エストロゲン移植と併用した皮下テストステロン移植による性欲改善の結果も報告されている。卵巣摘出及び子宮摘出を受けた女性では、経皮テストステロンが性機能及び生理的幸福を向上させた。性欲の点から良い応答を達成するためには、血漿テストステロンレベルを、若い排卵する女性で観察される正常な生理的範囲の少なくともほぼ上限に回復させる必要がある。
従って、少なくとも上述した好ましい結果を達成するため、エストロゲンを含む別個又は同一組成物による治療が望ましいだろう。閉経前の女性被験者は、一般的に約30〜100pg/mLのエストラジオールの血清濃度を有するが、正常な閉経後レベルは20pg/mL未満である。
更に、加齢のためのような女性のエストロゲン(及びプロゲスチン)のレベル低下が閉経につながり、その結果のぼせや寝汗、膣萎縮、性欲減退、心臓病や骨粗しょう症の危険増加のような臨床症候となる。本発明の組成物使用の好ましい結果として、以下の1つ以上が挙げられる:のぼせや寝汗の発生率と重症度の低減、骨からのカルシウム損失の減少、虚血性心臓病由来の死亡の危険減少、膣粘膜や尿路の血管分布と健康の上昇、及び性的活動や願望の増加。従って、別の好ましい実施形態では、本方法は、治療が必要な女性被験者に、活性薬としてエストロゲンとプロゲスチンを組み合わせて両方を含んでなる製剤を投与することを含む。
【0015】
上述したように、本方法は、ホルモン障害の男性被験者の治療を含む。例えば、性腺機能低下症(低テストステロンレベル)の男性を治療する。男性の性腺機能低下症は、インポテンス、性欲の欠如、筋衰弱及び骨粗しょう症を含む臨床症候をもたらしうる。男性の性腺機能低下症を治療するための本発明の組成物使用の好ましい結果として以下の1つ以上が挙げられる:インポテンスの発生率と重症度の低減、骨からのカルシウム損失の減少、筋力上昇、及び性的活動や願望の増加。
正常な男性被験者は、一般的に約300〜1050ng/dLのテストステロンの総血清濃度を有するが、性腺機能低下症の男性は、300ng/dL未満のレベルを有する。従って、本発明の組成物を用いて、被験者に約50mg/日のテストステロンの治療的に有効な用量を与えうる。従って、本組成物を用いて、好ましくは少なくとも約300〜1000ng/dLのテストステロンの遊離血清濃度を被験者に与える。
【0016】
更に別の好ましい実施形態では、被験者のホルモン障害の治療方法が提供され、本方法は、被験者に少なくとも1種の活性薬(該活性薬はテストステロンのみではなく、かつ該活性薬がエストロゲン又はプロゲスチンの場合、製剤中にそれぞれ治療的に有効量のプロゲスチン又はエストロゲンが存在しないという条件で)と、脂肪族アルコール、多価アルコール、及び皮膚又は粘膜表面を貫く前記活性薬の浸透性を高めるために十分な量の浸透エンハンサーを含んでなる送達媒体とを含む製剤を投与することを含み;該製剤は、実質的に長鎖脂肪アルコール、長鎖脂肪酸、及び長鎖脂肪エステルがなく、望ましくない臭いと刺激を回避する。
本発明の方法により、男女両者でデヒドロエピアンドロステロン(DHEA)のレベル低下をもたらす副腎不全の被験者を治療する。副腎は、DHEA及びエストロゲンやテストステロンのような性ホルモンを含む体内の多くのホルモンの生産に関与する。結果として、DHEAのレベル低下は、上述した症候につながりうる。従って、本発明によれば、本方法は、有効用量のDHEAと、上述したような送達媒体とを含んでなる製剤を被験者に投与することを含む。
正常な女性被験者は、一般的に約550〜980ng/dlのDHEAの遊離血清濃度を有し、正常な男性被験者は、約750〜1250ng/dlのDHEAの遊離血清濃度を有する。従って、本発明の組成物を用いて、約50〜200mg/日の治療的に有効な用量のデヒドロエピアンドロステロンを被験者に与えうる。従って、本発明を用いて、患者の性によって、好ましくは少なくとも約550から1250ng/mlまでのデヒドロエピアンドロステロンの血清濃度を被験者に与える。
【0017】
好ましい用量単位は、有効量の選択活性薬、好ましくはステロイドホルモンを約24時間にわたって送達することができる。“有効”又は“治療的に有効”量の活性薬は、無毒であるが、所望効果を与えるために十分な薬剤の量を意味する。
本発明の他の局面では、活性薬と送達媒体を含んでなる製剤が提供される。
本製剤の活性薬は、アンドロゲン、プロゲストーゲン、抗-エストロゲン、抗-プロゲストーゲン、抗-アンドロゲン、アドレナリンアゴニスト、鎮痛薬、鎮静薬、アミド、アリールピペラジン、神経薬、抗腫瘍薬、抗炎症薬、抗コリン薬、抗けいれん薬、抗うつ薬、抗てんかん薬、抗ヒスタミン薬、抗高血圧薬、筋弛緩薬、利尿薬、気管支拡張薬、及びグルココルチコイドを含む群から選択しうる。代わりに、哺乳類被験者の治療クールによって、他のいずれの適切な活性薬も使用しうる。以下の活性薬のリストは純粋に例示であり、限定とみなすべきでない。
【0018】
ホルモン。本発明の一実施形態では、活性薬は、限定するものではないが、デヒドロエピアンドロステロン(DHEA)、アンドロゲン、エストロゲン及びプロゲスチン(プロゲストーゲンとも呼ばれる)を含むステロイド又は非ステロイドホルモン、その前駆体、誘導体及び類似体、そのエステル及び塩のいずれか1つ又は組合せを含む。例えば、ホルモンの組合せとして、アンドロゲンとエストロゲン、アンドロゲンとプロゲストーゲン、又はアンドロゲンとエストロゲンとプロゲストーゲンが挙げられる。
この発明で使用しうるアンドロゲンの例としてテストステロン(17-β-ヒドロキシアンドロステノン)、及びテストステロンエナンテート、テストステロンプロピオネート、テストステロンシピオネート(cypionate)のようなテストステロンエステルが挙げられる。上記テストステロンエステルは商業的に入手可能であり、或いは当業者に周知又は適切な文献に記載されている方法で容易に調製することができる。また、テストステロン及び4-ジヒドロテストステロンの薬学的に許容しうるエステル、典型的にC-17位にあるヒドロキシル基から形成されるエステル(エナンテート、プロピオネート、シピオネート、フェニルアセテート、アセテート、イソブチレート、ブシクレート(buciclate)、ヘプタノエート、デカノエート、ウンデカノエート、カプレート(caprate)及びイソカプレートエステルのような);及びメチルテストステロン、テストラクトン、オキシメトロン及びフルオキシメステロンのような薬学的に許容しうるテストステロンの誘導体を使用しうる。
本発明の製剤で使用しうる他の適切なアンドロゲン薬として、限定するものではないが、アンドロステロン、アンドロステロンアセテート、アンドロステロンプロピオネート、アンドロステロンベンゾエート、アンドロステンジオール、アンドロステンジオール-3-アセテート、アンドロステンジオール-17-アセテート、アンドロステンジオール-3,17-ジアセテート、アンドロステンジオール-17-ベンゾエート、アンドロステンジオール-3-アセテート-17-ベンゾエート、アンドロステンジオン、デヒドロエピアンドロステロン硫酸ナトリウム、4-ジヒドロテストステロン(dht)、5アジヒドロテストステロン(5 adihydorotestosterone)、ドロモスタノロン、ドロモスタノロンプロピオネート、エチルエストレノール、ナンドロロン(nandrolone)フェンプロピオネート、ナンドロロンデカノエート、ナンドロロンフリルプロピオネート、ナンドロロンシクロヘキサンプロピオネート、ナンドロロンベンゾエート、ナンドロロンシクロヘキサンカルボキシレート、オキサンドロロン、スタノゾロールを含む内因性アンドロゲン、その前駆体及び誘導体が挙げられる。
【0019】
この発明で有用なエストロゲン及びプロゲストーゲンの例として、17-β-エストラジオール、エストラジオール、エストロゲンベンゾエート、エストラジオール-17-β-シピオネート、エストリオール、エストロン、エチニルエストラジオール、メストラノール、モキセストロール(moxestrol)、ミタトリエンジオール(mytatrienediol)、リン酸ポリエストラジオール、キネストラジオール(quinestradiol)、キネストロール(quinestrol)のようなエストロゲン;アリルエストレノール、アナゲストン、酢酸クロルマジノン、酢酸デルマジノン(delmadinone acetate)、デメゲストン(demegestone)、デソゲストレル(desogestrel)、ジメチステロン、ジドロゲステロン(dydrogesterone)、エチニルエストレノール、エチステロン、エチノジオール、二酢酸エチノジオール、酢酸フルロゲストン、ゲストデン(gestodene)、カプロン酸ゲストノロン(gestonorone caproate)、ハロプロゲステロン、17-ヒドロキシ-16-メチレン-プロゲステロン、17-α-ヒドロキシプロゲステロン、カプロン酸17-α-ヒドロキシゲステロン、リネストレノール、メドロゲストン、メドロキシプロゲステロン、酢酸メゲストロール、メレンゲストロール、ノルエチンドロン、酢酸ノルエチンドロン、ノルエチノドレル、ノルゲステロン、ノルゲスチメート(norgestimate)、ノルゲストレル、ノルゲストリエノン(norgestrienone)、19-ノルプロゲステロン、ノルビニステロン(norvinisterone)、ペンタゲストロン(pentagestrone)、プロゲステロン、天然プロゲステロン、プロメゲストン(promegestone)、キンゲストロン(quingestrone)、トレンゲストン(trengestone)のようなプロゲストーゲンが挙げられる。
他の活性薬。他の好適な活性薬として、限定するものではないが、タモキシフェン、4-OHタモキシフェンのような抗エストロゲン、抗プロゲストーゲン及び抗アンドロゲン;ブドララジン、クロニジン、エピネフリン、フェノクサゾリン(fenoxazoline)、ナファゾリン、フェニレフリン、フェニルプロパノールアミンのようなα-アドレナリン作動性アゴニスト;フォルモテロール、メトキシフェナミンのようなβ-アドレナリン作動性アゴニスト;ドキサゾシン、プラゾシン(prazosin)、テラゾシン、トリマゾシン(trimazosin)、ヨヒンビンのようなα-アドレナリン作動性ブロッカー;アテノロール、ビソプロロール、カルテオロール、カルベジロール(carvedilol)、メトプロロール、ナドロール(nadolol)、ペンブトロールのようなβ-アドレナリン作動性ブロッカー;ブプレノルフィン、ジヒドロモルヒネ、メタゾシン(metazocine)、メサドン、モルヒネ、モルヒネ誘導体、ニコモルヒネ、オキシモルホンのような鎮痛薬(麻薬又は非麻薬)が挙げられる。
【0020】
沈静薬。アミド。アリールピペラジン。他の好適な活性薬として、沈静薬及び抗不安薬(anxyolitics)、例えばアルプラゾラム、ブロマゼパム、フルタゾラム、ケタゾラム、ロラゼパム、プラゼパムのようなベンゾジアゼピン誘導体;ブトクタミド、ジエチルブロモアセトアミド、イブロタミド(ibrotamide)、イソバレリルジエチルアミン、ニアプラジン(niaprazine)、トリセタミド(tricetamide)、トリメトジン(trimetozine)、ゾルピデム(zolpidem)、ゾピクロンのようなアミド;ブスピロンのようなアリールピペラジンが挙げられる。
神経薬。抗腫瘍薬。抗炎症薬。他の好適な活性薬として、ニコチン、クエン酸ニコチン及び酒石酸ニコチンのような禁煙用神経薬;5-フルオロウラシルのような抗腫瘍薬;抗炎症薬;麻酔薬;抗狭心症薬;抗コリン作動薬;抗けいれん薬;抗うつ薬;抗てんかん薬;抗エストロゲン;抗ヒスタミン薬;抗パーキンソン病薬;気管支拡張薬;利尿薬;グルココルチコイド;筋弛緩薬;麻薬アンタゴニスト;レボチロキシン、甲状腺、チロキシンのような抗甲状腺機能低下症薬;抗高血圧症薬、例えばカプトプリル、シラザプリル、エナラプリル、リジノプリル(lisinopril)、ペリンドプリル(perindopril)、ラミプリル(ramipril)のようなベンゾチアジアジン誘導体;グアネチジンのようなグアニジン誘導体;アルフゾシン(alfuzosin)のようなキナゾリン誘導体;レセルピンのようなレセルピン誘導体;フロセミド(furosemide)のようなスルホンアミド誘導体;ミノキシジル、アムロジピン、ドキサゾシンメシラート、フェロジピン、モキソニジン(moxonidine)、塩酸ニカルジピン、ニフェジピン、塩酸プラゾシン等のようなその他の活性薬及びアリールアルキルアミンのようなカルシウムチャンネルブロッカー、例えばベプリジル(bepridil)、ジチアゼム(ditiazem)、フェンジリン(fendiline)、ガロパミル(gallopamil)、テロジリン、ベラパミル;フェロジピン、イスラジピン、ニカルジピン、ニフェジピン、ニルバジピン、ニモジピン、ニソルジピン、ニトレンジピンのようなジヒドロピリジン誘導体;フルナリジンのようなピペラジン誘導体;ペルヘキシリンのようなその他;カルシフェジオール(calcifediol)、カルシトニン、カルシトリオール、クロドロン酸(clodronic acid)、ジヒドロタキステロール、エルカトニン、エチドロン酸、イプリフラボン、パミドロン酸、副甲状腺ホルモン、酢酸テリパラチド(teriparatide acetate)のようなカルシウム調節薬が挙げられる。
【0021】
本製剤は、更に製剤の粘度を変えるために十分な量で存在する増粘剤又はゲル化剤を含みうる。ゲル化剤は、以下:Carbopol 980又は940 NF、981又は941 NF、1382又は1342 NF、5984又は934 NF、ETD 2020、2050、934P NF、971P NF、974P NF、Noveon AA-1 USPのようなカルボマー、カルボキシエチレン又はポリアクリル酸;エチルセルロース、ヒドロキシプロピルメチルセルロース(HPMC)、エチルヒドロキシエチルセルロース(EHEC)、カルボキシメチルセルロース(CMC)、ヒドロキシプロピルセルロース(HPC)(Klucel種々グレード)、ヒドロキシエチルセルロース(HEC)(Natrosolグレード)、HPMCP 55、Methocelグレードのようなセルロース誘導体;アラビア、キサンタン、ガーゴム、アルギナートのような天然ゴム;Kollidonグレードのようなポリビニルピロリドン誘導体;Lutrol Fグレード68、127のようなポリオキシエチレンポリオキシプロピレンコポリマー;を含む群より選択することができる。他のゲル化剤として、キトサン、ポリビニルアルコール、ペクチン、ビーゴム(veegum)グレードが挙げられる。
好ましくは、ゲル化剤は、Lutrol Fグレード及びCarbopolグレードである。ゲル化剤は、ポリマーのタイプによって約0.2〜約30.0%w/wで存在する。更に好ましくは、ゲル化剤は約0.5〜5質量%の増粘剤を含む。
製剤中のゲル化剤の量を選択して所望の製品のコンシステンシー及び/又は粘度を与えて、皮膚への適用を容易にすることができる。
【0022】
保存剤。本製剤は、更に、限定するものではないが、塩化ベンザルコニウム及び誘導体、安息香酸、ベンジルアルコール及び誘導体、ブロノポール、パラベン、セントリミデド(centrimide)、クロルヘキシジン、クレゾール及び誘導体、イミドウレア(imidurea)、フェノール、フェノキシエタノール、フェニルエチルアルコール、フェニル第二水銀塩、チメロサール、ソルビン酸及び誘導体のような保存剤を含みうる。保存剤は、化合物のタイプによって、製剤の約0.01〜10.0%w/w存在する。
抗酸化剤。製剤は、任意に、限定するものではないが、トコフェロール及び誘導体、アスコルビン酸及び誘導体、ブチル化ヒドロキシアニソール、ブチル化ヒドロキシトルエン、フマル酸、マレイン酸、プロピルガレート、メタ重硫酸塩(metabisulfates)及び誘導体のような抗酸化剤を含むことができる。抗酸化剤は、化合物のタイプによって、製剤の約0.001〜約5.0%w/w存在する。
緩衝剤。製剤は、更に炭酸塩緩衝液、クエン酸塩緩衝液、リン酸塩緩衝液、酢酸塩緩衝液、塩酸、乳酸、酒石酸、ジエチルアミン、トリエチルアミン、ジイソプロピルアミン、アミノメチルアミンのような緩衝剤を含みうる。他の技術的に既知の緩衝剤も含むことができる。緩衝剤は、製剤中の水の100%まで置き換えることができる。
保湿剤。製剤は、更に、限定するものではないが、グリセリン、プロピレン、グリコール、ソルビトール、トリアセチンのような保湿剤を含みうる。保湿剤は、化合物のタイプによって、製剤の約1〜10%w/w存在する。
金属イオン封鎖剤。製剤は、更に、エデト酸の金属イオン封鎖剤を含みうる。金属イオン封鎖剤は、化合物のタイプによって、製剤の約0.001〜約5%w/w存在する。
界面活性剤。製剤は、更に、アニオン性、非イオン性又はカチオン性界面活性剤を含みうる。界面活性剤は、化合物のタイプによって、製剤の約0.1%〜約30%w/w存在する。
pH調整剤。任意に、製剤はpH調整剤、一般的に中和剤を含んでよく、任意に架橋機能を有していてもよい。例として、かつ限定するものではないが、pH調整剤として、トリエタノールアミンのような三元アミン、トロメタミン、テトラヒドロキシプロピルエチレンジアミン、NaOH溶液が挙げられる。pH調整剤は、製剤中に約0.05〜約2%w/w存在する。
湿潤剤及び緩和剤。任意に、製剤は、皮膚を軟らかくし及び滑らかにし、或いは水分を維持及び保持するために湿潤剤及び/又は緩和剤を含むことができる。例として、かつ限定するものではないが、湿潤剤及び緩和剤として、コレステロール、レシチン、軽鉱油、ワセリン、及び尿素が挙げられる。
【0023】
いずれの特定製剤でも、活性薬及び他の成分を選択して所望の薬物送達プロファイル及び所望の浸透量を達成することができる。最適なpHを決めることもでき、例えば、ホルモンの性質、塩基、及び必要な流度によって決まる。
本発明の特定の好ましい実施形態では、本製剤は、以下の処方を有しうる。
【0024】
【表1】

【0025】
【表2】

【0026】
【表3】

【0027】
【表4】

【0028】
【表5】

【0029】
本発明の製剤は、少なくとも以下の理由のため有利である。まず、本発明の製剤は、長鎖アルコール、長鎖脂肪酸、及び長鎖脂肪エステルが実質的にない。驚くべきことに、本製剤は、使用者に有効用量の所望活性薬を送達するために十分な皮膚浸透力を示す。このことは、有効用量の活性薬が皮膚を貫通できるように皮膚浸透力を高めるためには長鎖脂肪アルコール、長鎖脂肪酸、及び長鎖脂肪エステルが必要であると一般的に理解されていたので、当業者が容易には発見しないであろう予想外の利点である。
第2に、本製剤は、通常局所用ゲル中に含まれる脂肪酸のような脂肪族酸基を含まないので、現在利用可能なゲル中のような当該成分に関係する臭いや油っこいテクスチャーを有さない。第3に、長鎖脂肪アルコール、長鎖脂肪酸、及び長鎖脂肪エステルの実質的な非存在は、刺激の可能性が少なく、かつ化合物が相互作用する機会が少ないことを意味し、製剤中の抗酸化剤又は保存剤の必要を減らす。Tanojo H. Boelsma E, Junginger HE, Ponec M, Bodde HE, "In vivo human skin barrier modulation by topical application of fatty acids," Skin Pharmacol Appl. Skin Physiol. 1998 Mar- Apr; 11 (2) 87-97を参照せよ。しかし、このような保存剤が望ましい場合、本発明は抗酸化剤又は保存剤を含む製剤を包含することを理解すべきである。成分数の減少は、少なくとも製造コスト、皮膚刺激の可能性を低減することで有利である。多くの研究がオレイン酸のような不飽和脂肪酸の刺激を引き起こす可能性を認めている。更に、成分数の減少は、成分が送達される前に相互作用する機会を減らすことによって、製剤の貯蔵安定性を高める。しかし、このことは、特に美的及び/又は機能的効果のために製剤中に添加成分を含められないことを意味しない。例えば、本製剤は、皮膚に水分補給するための湿潤剤或いは皮膚を軟らかにし、また滑らかにするための緩和剤を任意に1種以上含んでもよい。グリセリンはこのような好適な湿潤添加剤の例である。
【0030】
本製剤は、1日1回、又は患者の状態によって1日に複数回適用しうる。本発明の製剤は、大腿、腹部、肩、及び上腕のような体のいずれかの部分に局所的に適用することができる。一実施形態では、ゲル形態の製剤を皮膚の約12.7cm×12.7cm(5インチ×5インチ)の部位に適用する。適用するごとに、適用する体の部位を交替しうる。例えば、最初の適用ではゲルを大腿に適用し、第2の適用では上腕、第3適用で大腿に戻すことができる。このとは、製剤の成分への反復暴露に対する皮膚のいずれの感受性も軽減するという点で有利である。
本発明は、上述した製剤の、被験者内における活性薬の循環レベルを高めるために被験者を治療するための使用を包含する。
好ましい用量単位は、有効量の選択活性薬を約24時間にわたって送達できる。“有効”又は“治療的に有効”量の活性薬とは、無毒であるが、所望効果を与えるために十分な量の薬剤を意味する。
しかし、当業者には、所望用量が特定の活性薬並びに他の因子によって決まることが分かるだろう。当然に、各活性薬の最小有効用量は、選択した活性薬の治療に係る副作用を最小限にすることが好ましい。規則的に時間を決めて本製剤を適用して、活性薬の投与が実質的に持続することが好ましい。
【0031】
(実施例)
以下の実施例は説明であり、限定と解釈すべきでない。
実施例1.本発明の製剤の一実施形態は、テストステロン1.25%w/w、ポリエチレングリコール5.95%w/w、エチルアルコール45.46%w/w、蒸留水45.67%w/w、カルボマー(Carbopol 980 NF)1.21%w/w、トリエタノールアミン0.39%w/w、二ナトリウムEDTA0.06%w/wを有する局所用ゲルである。
実施例2.本発明の製剤の一実施形態は、テストステロン1.00%w/w、ジエチレングリコールモノエチルエーテル5.00%w/w、プロピレングリコール6.00%w/w、エタノール47.52%w/w、純水38.87%w/w、カルボマー(CARBOPOLTM 980 NF)1.20%w/w、トリエタノールアミン0.35%w/w、二ナトリウムEDTA0.06%w/wによって構成されるゲルである。
実施例3.本発明の製剤の一実施形態は、活性成分として1%のテストステロンを有する局所用ヒドロアルコール性ゲル製剤である。この製剤は、第I/II相複数用量で、女性の用量増大臨床調査で研究された。この研究を行って、低テストステロンレベルの外科的閉経期の女性を含む被験者における機能減退性性的願望障害(hypoactive sexual desire disorder)(“HSDD”)に対する本製剤の有効性を決定した。
この研究は、7日間毎日約0.22g〜約0.88gの製剤を投与するテストステロンゲル(2.2〜8.8mg/日のテストステロン)が、閉経期前の女性の正常範囲内又は正常範囲をいくらか超える平均の総及び遊離テストステロン血清濃度をもたらすことを示した。
実施例4.インビトロ研究を行い、上表5のテストステロン製剤(ラウリルアルコールを含有しない、“1%T+0%LA”)を用いて外科的に皮膚を切除したヒトのテストステロンの浸透性プロファイルを、1%〜2%のラウリルアルコールを含有する他のテストステロン製剤(“1%T+1%又は2%LA”)と比較して決定した。これら研究の結果を、下表6、7及び8に提示する。
【0032】
第1研究では、切除したヒトの皮膚片をFranz Vertical Diffusion Cells(Hansen Research Inc.)内で標本にした。約10mgのテストステロン/cm2(1%T+0、1又は2%LA)を皮膚上の装填チャンバー内に装填し、35℃で維持した。装填後、選択した間隔で受容体溶液のサンプリングを行った。浸透性研究におけるテストステロン流量と蓄積量を下表6に示す。
【表6】

【0033】
約1.25%のテストステロン、5.00%のトランスクトール(Transcutol)、5.95%のプロピレングリコール、43.09%のエチルアルコール、43.07%の蒸留水を含むゲルのテストステロン流量と蓄積量を下表7及び8に示す。
【表7】

*(浸透した薬物の蓄積量対時間(12〜24時間)の傾き)
【0034】
【表8】

【0035】
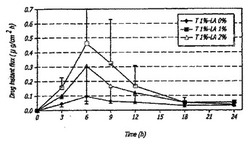
図1は、装填チャンバー内、ヒトの切除した皮膚と10mgのテストステロン/cm2を用いたインビトロモデルにおける種々量のラウリルアルコール(LA)を含む製剤のテストステロンの経時的な薬物流量を示すグラフである(n=3-4±SD)。1%T+0%LAのプロファイルは、ラウリルアルコールを含有する製剤と異なる。このプロファイルは6時間で2%LA製剤の約4倍少ないが、全体的には一貫している。全プロファイルは、おそらく薬物消耗のため、浸透の6時間後にテストステロン流量の減少を示した。
【0036】
皮膚上の装填チャンバー内に約50mgのテストステロン/cm2を装填したことを以外は上記方法を用いて別の浸透研究を行った。装填後、選択した間隔で受容体溶液のサンプリングを行った。この浸透性研究のテストステロン流量と蓄積量を以下に示す。
【表9】

【0037】
図2は、装填チャンバー内、ヒトの切除した皮膚と50mgのテストステロン/cm2を用いたインビトロモデルにおける種々量のラウリルアルコール(LA)を含む製剤のテストステロンの経時的な薬物流量を示すグラフである(n=3-4±SD)。
この研究は、1%T+0%LAが低い浸透率を有することを示す。しかし、この浸透プロファイルはほとんど不変であり、テストステロンレベルは狭い範囲内で滴定しなければならないので、女性で使うために非常に望ましい。従って、これらインビトロ研究によって、当該技術の当業者は、ホルモンの適切な循環レベルを達成するためには製剤中にラウリルアルコールを含める必要があると考えるようになった。しかし、出願人らは、予想外にも、有効用量の循環性活性薬浸透を達成するために局所製剤にラウリルアルコールを含める必要がないことを見いだした。このことは、必要なテストステロン血漿レベルが性腺機能低下症を治療するために観察されるテストステロン治療的血漿レベルより低い女性の性的機能不全では特に真実である。
【0038】
実施例5.ゲル製剤及び経皮パッチによる経験は、一般的にゲルによる低率の穏やかな経皮毒性とパッチによる広範囲の皮膚反応を示し、おそらく使用添加剤又はパッチの閉塞性に関連する。例えば、テストステロンの局所用ゲル製剤で、数人の患者に皮膚反応があったが、治療又は薬物の中断を要しなかった。対照的に、経皮パッチで治療した患者の過半数で一過性の穏やか〜中程度の紅斑が観察され、水疱、壊死、及び潰瘍形成を含む、より重度の反応がある患者もいた。例えば、Gelas B, Thebault J, Roux I, Herbrecht F, Zartarian M., "Comparative study of the acceptability of a new estradiol Tx 11323 (A) gel and a transdermal matrix system," Contraception, fertilite, sexualite 1997年6月; 25 (6):470-474)参照。
【0039】
実施例6.この研究の目的は、閉経後の女性における1%T+0%LA塩酸塩ゲルの複数用量の安全性と薬物速度論プロファイルを評価することだった。研究の最初の7日間、被験者は毎日、0.22gの1%T+0%LA含有製剤(2.2mg/日のテストステロン)の局所適用を受けた。日8〜14に、被験者は0.44gの1%T+0%LA含有製剤(4.4mg/日のテストステロン)を受け、かつ日15〜21に、被験者は0.88gの1%T+0%LA含有製剤(8.8mg/日のテストステロン)を受けた。各用量増大の前、洗い流しはしなかった。総、遊離及び生物利用可能テストステロンの薬物速度論結果を以下に示す。
【0040】
【表10】

【0041】
図3A〜3Cは、サンプリング期間中の1、7、14、及び21日目における1%T+0%LAのインビボ投与後のそれぞれメジアン総、遊離及び生物利用可能テストステロン血清濃度を示すグラフである。
平均ベースライオンの総テストステロン及び遊離テストステロン濃度は、それぞれ21.0ng/dL及び2.6pg/mLだった。1%T+0%LAの0.22gの毎日投与の1週間後、平均総テストステロン及び遊離テストステロン濃度は、それぞれ56.0ng/dL及び7.0pg/mLだった。1週間の毎日0.44g用量の1%T+0%LAは、平均総テストステロン及び遊離テストステロン濃度をそれぞれ92.0ng/dL及び11.1pg/mLに増やした。0.88gの1%T+0%LAの7日間毎日投与は、7人の被験者で平均総テストステロン及び遊離テストステロン濃度をそれぞれ141.5ng/dL及び16.7pgmLに増やした。
図3D〜3Fは、サンプリング期間中の1、7、14、及び21日目における1%T+2%LAインビボ投与後のそれぞれメジアン総、遊離及び生物利用可能テストステロン血清濃度を示すグラフである。テストステロン投与量のように比較すると、このデータは、ラウリルアルコールを含めることによってインビボテストステロンレベルは実質的に変わらないことを示す。従って、インビトロ知見とは異なり、ラウリルアルコールは有効なインビボ血清レベルの達成に必要なかった。
この研究は、1%T+0%LAが低内因性テストステロン生産の女性の遊離テストステロン濃度を高める可能性を有することを実証した。2.2mgのテストステロンに相当する0.22g用量は、正常の上限に近い平均遊離テストステロン濃度をもたらした。0.44g用量では、平均遊離テストステロン濃度は正常の上限の1.6倍であり、0.88g用量の平均遊離テストステロン濃度は正常の上限の約2.4倍だった。
更に、ある第I/II相研究で1%T+0%LA製剤を毎日のテストステロン用量2.2、4.4、及び8.8mgで投与した(0.22g/日、0.44g/日、及び0.88g/日の用量、それぞれ7日間投与)。この研究で、本製剤はよく耐えられた。重度又は有意な副作用は報告されなかった。いずれの治療群でも臨床検査室変量、生命徴候、ECGパラメーター又は理学的所見の有意な変化は検出されなかった。
【0042】
実施例7.この研究の主目的は、閉経後の女性被験者における内因性エストラジオール濃度に関係及び無関係なPK変量AUC及びCmaxの見地から、エストラジオールゲル含有の2種の異なった複数局所投与の安全性、耐容性、及び薬物速度論プロファイルを評価することだった。各被験者は14連日間2種のエストラジオール治療;1.25gのエストラジオールゲル0.06%(0.75mgのエストラジオール/日)又は2.5gのエストラジオールゲル0.06%(1.5mgのエストラジオール/日)のどちらか一方を受けた。
0.75mgのE2/日の複数用量は2.4ng/dl(24pg/ml)の平均濃度(=AUCτ/24)を維持した。1.5mgのE2/日の2回用量の結果、平均濃度5.3ng/dl(53pg/ml)となった。値は、Estraderm(登録商標)のような経皮パッチ後に観察される値と非常によく一致した。公称送達速度25μg/日でパッチを用いた場合、23pg/mlの平均維持濃度が報告された。送達速度50μg/日又は100μg/日のパッチでは、それぞれ40pg/ml及び75pg/mlの平均濃度が報告された。Estraderm(登録商標)は、のぼせの低減を含む閉経後障害、及び骨粗しょう症予防に有効であるとして欧州共同体と米国で登録されている。従って、E2ゲル製剤は、のぼせの低減、及び骨粗しょう症予防を含む閉経期症候の治療で安全かつ有効であると予測される。
単用量(日1)後のエストラジオール濃度時間データ(0〜24時間)。図4Aは、E2+0%LAゲル(a=0.75mg E2;b=1.50mg E2)の単用量投与後のエストラジオール(E2)の平均血清濃度を示すグラフである。低用量(処置a)の投与後、濃度-時間プロファイルは、E2濃度の増加が観察されたことを実証する。平均して、E2濃度は基線値の0時間の0.4ng/dlのE2から24時間の2.1ng/dlのE2に増加した。高用量(処置b)の投与後、基線0時間の0.5ng/dlのE2から24時間の3.0ng/dlのE2への増加が観察された。
エストラジオールの最低値濃度データ(1〜20日)。図4BはE2+0%LAゲルの反復投与後のE2の平均最低値濃度を経時的に示すグラフである。平均して、適用後約24時間まで(日2の投与前)最低値濃度は上昇した。その後、濃度のプラトーが観察され、最後の用量を投与した後の日(336時間=日15、0時間)、24時間で2.1ng/dl〜2.4ng/dlのE2でレベルが変動した。このサンプリング間隔内で、最低値濃度は可変であり、48時間(3日目の投与前)で観察された最小1.3ng/dlのE2から336時間(15日目、0時間)の最大2.4ng/dlまで変動した。最終投与後、平均E2濃度は0.8ng/dlに減少し、456時間(20日目、0時間;薬物投与中断後5日)でほぼ投与前基線レベル(0.6ng/dl)だった。
【0043】
図4Dは、両用量のE2+0%LAゲルの反復投与後の経時的なE2の個々の最低値濃度を示すグラフである。平均して、E2濃度は約240時間(日11の投与前)まで増加し続けた。濃度は、基線(0時間)の0.5ng/dlから240時間の8.7ng/dlまで増加した。
メジアン最低値も調べると、これらは投与後96時間(日5の投与前)でほぼ5.1ng/dlのE2のプラトーに達した。その後、最低値濃度は可変かつ最小4.2ng/dlのE2(288時間、13日目の投与前のメジアン)から336時間(15日目、0時間)の最大5.3ng/dlまで変動した。最終投与後、平均E2濃度は0.8ng/dlに減少し、456時間(20日目、0時間;薬物投与中断後5日)でほぼ基線レベル(0.5ng/dl)だった。メジアン最低値濃度の調査は、E2ゲル1.25g及び2.5g用量でそれぞれ4及び5日までに定常状態E2濃度に達することを示す。
14用量(14日目)後のエストラジオール濃度時間データ(0〜24時間)。図4Eは、E2+0%LAゲルの複数用量投与後のE2の平均血清濃度を示すグラフである。日14のプロファイルは、14日(312時間)までに定常状態E2濃度に達したことを実証する。この区間の最初(処置a:2.0ng/dlのE2、処置b:5.0ng/dlのE2)とこのサンプリング区間の最後(処置a:2.4ng/dlのE2、処置b:5.5ng/dlのE2)の平均E2濃度は似通っていた。平均最大E2濃度は、それぞれ3.7ng/dl及び8.8ng/dlだった(14日データ)。
【0044】
1日及び14日目のエストラジオール薬物速度論パラメーター。1.25g及び2.5gのBio-E-ゲルの単適用及び複数適用後のE2の薬物速度論パラメーターを表10aに示す。無補正及び基線調整した薬物速度論パラメーターの記述的概要をそれぞれ表10c及び10dに示す。
1.25gのE2ゲルの単投与後、1日目の最大濃度(Cmax)は2.3ng/dlだった。平均して、最大濃度に対する時間、tmaxは17.67時間までに達した。AUCτで測定されるE2への暴露は27.5ng/dl*Hだった。複数投与後、Cmax濃度は日14の3.7ng/dlに増加した。tmax推定値は、約日14の16時間であり、1日目に観察された値と似通っていた。E2への暴露は、14日目で57.0ng/dl*Hであり、1日目で観察された値より高く、反復投与後の血清中のE2の蓄積を実証している。
2.5gのE2ゲルの単投与後、1日目の最大濃度(Cmax)は3.7ng/dlだった。平均して、最大濃度に対する時間、tmaxは18時間までに達した。AUCτで測定されるE2への暴露は49.7ng/dl*Hだった。複数投与後、Cmax濃度は14日目の8.8ng/dlに増加した。tmax推定値は約14日目の18時間であり、1日目に観察された値と似通っていた。E2への暴露は、14日目で128.2ng/dl*Hであり、1日目に観察された値より高く、反復投与後の血清中のE2の蓄積を実証している。
E2ゲル2.5g/1.25gの幾何平均の比を用いて、E2ゲルの2用量後のE2の用量比例性を評価した。単用量投与後、平均AUC比(E2ゲル2.5g/1.25g)は38.4/19.2=2.0であり、複数用量後は117.6/51.9=2.3であり、用量比例性を示している。
【0045】
【表11】

【0046】
基線調整した1日目及び14日目のエストラジオール薬物速度論パラメーター。E2の基線濃度は両群で同様であり、1.25g及び2.5gのE2ゲルでそれぞれ0.5ng/dl及び0.4ng/dlと計算された。内因性E2濃度について補正するため、基線E2濃度(E2ゲル1.25g:0.5ng/dl及び2.5g:0.4ng/dl)を投与後の総濃度から減算し、AUCτ及びCmaxは基線調整した濃度に基づいて再計算した。基線調整した薬物速度論変量を表10bにまとめた。基線調整したCmax推定値は、1.25g及び2.5gのE2ゲルの単投与後それぞれ1.8ng/dl及び3.4ng/dlだった。AUCτについては、基線調整値は、1.25g及び2.5gのE2ゲルでそれぞれ14.9ng/dL*H及び41.4ng/dl*Hだった。反復投与後、Cmax推定値は3.1ng/dl及び8.4ng/dlに上昇し、AUCτ推定値は1.25g及び2.5gのE2ゲルでそれぞれ44.2ng/dl*H及び119.6ng/dl*Hに増加した。これらの増加は、ゲルの反復投与後の血清中の薬物の蓄積を反映している。
E2の最終排出半減期(t1/2)は、最終投与(312時間、日14の投与前)後の基線調整した濃度から、対数変換濃度-時間プロットの線形部分からの対数-線形回帰によって計算した。1.25g及び2.5gのE2ゲルの投与後の半減期の個々及び平均推定値を表10dに示す。メジアン半減期は、E2ゲル1.25gで22.15時間(範囲:13.11〜76.71)、2.5gで35.58時間(範囲:26.60〜51.59)だった。両処置の半減期の推定値は似通っていた。
【0047】
【表12】

【0048】
単用量(1日目)後のエストロン濃度時間データ(0〜24時間)。図4Fは、E2+0%LAゲルの単用量投与後のエストロン(E1)の平均血清濃度を示すグラフである。平均して、E1濃度は0時間の基線値2.4ng/dlのE1から24時間の3.4ng/dlのE1に増加した。高用量(処置b)の投与後、基線(0時間)の2.4ng/dlのE1から24時間の4.0ng/dlのE1の増加が観察された。
エストロン最低値濃度データ(1〜20日目)。図4Gは、E2+0%LAゲルの反復投与後のE1の平均最低値濃度を示すグラフである。平均して、最低値濃度は投与後約72時間(4日の投与前)まで上昇した。その後、濃度のプラトーが観察され、レベルは72時間の4.3ng/dlのE1と最終用量を投与した後の日(336時間=15日、0時間)の5.2ng/dlのE1の間で変動した。このサンプリング区間内では、最低値濃度は可変であり、96時間(日5の投与前)で観察される最小4.1ng/dlのE1と288時間(13日の投与前)の最大5.3ng/dlの間で変動した。最終投与後、平均E1濃度は3.0ng/dlに減少し、456時間(20日、0時間;薬物投与中断後5日)でほぼ基線レベル(2.4ng/dl)だった。
Bio-E-ゲル2.5gの反復投与後の平均E1最低値濃度も図4Gに示す。平均して、E1濃度は、約240時間(11日の投与前)まで増え続けた。濃度は基線(0時間)の2.4ng/dlから240時間の10.4ng/dlに上昇した。その後、最低値濃度は可変であり、9.1ng/dlのE1(288時間=13日の投与前)と336時間(15日、0時間)の7.8ng/dlの間で変動した。最終投与後、平均E1濃度は3.1ng/dlに減少し、456時間(20日、0時間;薬物投与中断後5日)でほぼ投与前基線レベル(4.0ng/dl)だった。平均最低値濃度の調査は、Bio-E-ゲル2.5g及び1.25g用量では、それぞれ11及び13日までに定常状態E1濃度に達することを示す。
14用量(14日)後のエストロン濃度時間データ(0〜24時間)。図4Hは、E2+0%LAゲルの複数用量投与後のE1の平均血清濃度を示すグラフである。14日のプロファイルは、定常状態のE1濃度が14日(312時間)までに達成されることを実証している。この区間の最初のE1濃度(処置a:4.8ng/dl、処置b:8.2ng/dl)とこのサンプリング区間の最後のE1濃度(処置a:5.2ng/dl、処置b:7.8ng/dl)は似通っていた。14日(312〜336時間)の平均最大E1濃度は、それぞれ6.0ng/dl及び9.2ng/dlだった。
1日及び14日のエストロンの薬物速度論パラメーター。1.25gのE2ゲルの単投与後、1日の最大濃度(Cmax)は3.6ng/dlだった。平均して、最大濃度に対する時間tmaxは12.67時間までに達した。AUCτで測定されるE1への暴露は56.2ng/dl*Hだった。複数投与後、Cmax濃度は14日で6.0ng/dlに上昇した。tmax推定値は約14日の11時間であり、1日で観察された推定値と似通っていた。E1への暴露は14日で111.4ng/dl*Hであり、1日に観察されるた値より高く、反復投与後の血清中のE1の蓄積を実証している。
2.5gのE2ゲルの単投与後、1日の最大濃度(Cmax)は4.1ng/dlだった。平均して、最大濃度に対する時間tmaxは21時間までに達した。AUCτで測定されるE1への暴露は62.2ng/dl*Hだった。複数投与後、Cmax濃度は14日に9.2ng/dlに上昇した。tmax推定値は日14の約2時間であり、1日に観察された値より低かった。E1への暴露は14日で179.7ng/dl*Hであり、1日で観察された値より高く、反復投与後の血清中のE1の蓄積を実証している。
【0049】
【表13】

【0050】
1日及び14日の基線調整したエストロン薬物速度論パラメーター。両群でE1の基線濃度は同様であり、1.25g及び2.5gのE2ゲルでそれぞれ1.8ng/dl及び2.0ng/dlと計算された。内因性E1濃度について補正するため、投与後に測定された総濃度から基線E1濃度(E2ゲル1.25g:1.8ng/dl及びE2ゲル2.5g:2.0ng/dl)を減算し、AUCτ及びCmaxは、基線調整した濃度に基づいて再計算した。基線調整した薬物速度論変量の結果を10dにまとめた。基線調整したCmax推定値は、1.25g及び2.5gのE2ゲルの単投与後それぞれ1.8ng/dl及び2.0ng/dlだった。AUCτについては、基線調整した値は1.25g及び2.5gのE2ゲルでそれぞれ14.5ng/dL*H及び17.9ng/dl*Hだった。反復投与後、1.25g及び2.5gのE2ゲルで、Cmax推定値はそれぞれ4.2ng/dl及び7.2ng/dl、AUCτ推定値はそれぞれ67.1ng/dl*H及び131.2ng/dl*Hに増加した。これらの増加は、ゲルの反復投与後の血清中の薬物の蓄積を反映している。
【0051】
【表14】

【0052】
単用量(1日)後のエストロン-スルフェート濃度時間データ(0〜24時間)。図4Iは、E2+0%LAゲル(a=0.75mg E2;b=1.50mg E2)の単用量投与後のエストロン-スルフェート(E1-スルフェート)の平均血清濃度を示すグラフである。平均して、E1-S濃度は、0時間の基線値45.8ng/dlのE1から24時間の79.0ng/dl E1-Sに増加した。高用量(処置b)の投与後、0時間の基線の34.7ng/dlのE1-Sから24時間の70.7ng/dlのE1-Sへの増加が観察された。
エストロゲン-スルフェート最低値濃度データ(1〜20日)。図4Jは、E2+0%LAゲル(a=0.75mg E2;b=1.50mg E2)の複数用量投与後のE1-スルフェートの平均最低値濃度を示すグラフである。平均して、反復投与で最低値濃度は増加し続けたが、平均プロットは約192時間(9日の投与前)まで増加率の変化を示唆した。E1-S血清濃度は192時間の133.8ng/dlと、最終用量を投与した後の日(336時間; 15日、0時間)の117.8ng/dlのE1-Sとの間で変動した。最終投与後、平均E1-S濃度は77.0ng/dlに減少し、456時間(20日、0時間;薬物投与中断後5日)の投与前基線値(45.8ng/dl)より高かった。
平均して、E1-S濃度は約312時間(14日の投与前)まで増え続けたが、約40時間(11日の投与前)で増加率の変化が明白だった。濃度は基線(0時間)の34.7ng/dlから240時間の193.5ng/dlに増加した。その後、最低値濃度は可変であり、193.5ng/dlのE1(240時間)から336時間(15日、0時間)の155.7ng/dlに変動した。最終投与後、平均E1-S濃度は60.3ng/dlに減少し、456時間(20日、0時間;薬物投与中断後5日)の投与前基線レベル(34.7ng/dl)より高かった。平均最低値濃度の調査は、E2ゲル1.25g及び2.5g用量ではそれぞれ13及び14日までに定常状態E1-スルフェート濃度に達することを示す。
14用量(14日)後のエストロン-スルフェート濃度時間データ(0〜24時間)。図4Kは、E2+0%LAゲルの複数用量投与後のE1-スルフェートの平均血清濃度を示すグラフである。日14のプロファイルは、本質的に14日(312時間)までに定常状態E1-S濃度に達したことを実証している。この区間の最初の平均E1-S濃度(処置a:130.7ng/dl、処置b:200.3ng/dl)と、このサンプリング区間の最後の平均E1-S濃度(処置a:117.8 ng/dl、処置b:155.7ng/dl)はわずかに異なった。しかし、それによって重複した値の範囲は結果の類似性を示唆している。14日の平均最大E1-S濃度は、E2ゲル1.25gで163.5ng/dlのE1-S、E2ゲル2.5gで253.8ng/dlのE1-Sだった。
1日及び14日のエストロン-スルフェート薬物速度論パラメーター。1.25g及び2.5gのE2ゲルの単投与及び複数投与後のE1-Sの薬物速度論パラメーターを表10eに示す。無補正及び基線調整した薬物速度論パラメーターの記述的概要をそれぞれ表10c及び10dAに示す。 1.25gのE2ゲルの単投与後、1日の最大濃度(Cmax)は80.2ng/dlだった。平均して、最大濃度に対する時間tmaxは20.67時間までに達した。AUCτで測定されるE1-Sへの暴露は1359.2ng/dl*Hだった。複数投与後、Cmax濃度は14日の163.5ng/dlに増加した。tmax推定値はほぼ14日の5時間であり、1日に観察された値より低かった。E1-Sへの暴露は14日で2834.1ng/dl*Hであり、1日に観察された値より高く、反復投与後の血清中のE1-Sの蓄積を実証している。
2.5gのE2ゲルの単投与後、1日の最大濃度(Cmax)は74.7ng/dlだった。平均して、最大濃度に対する時間tmaxに20時間までに達した。AUCτで測定されるE1-Sへの暴露は1207.4ng/dl*Hだった。複数投与後、Cmax濃度は14日の253.8ng/dlに増加した。tmax推定値は、ほぼ14日の3時間であり、1日に観察される値より低かった。E1-Sへの暴露は日14で4079.2ng/dl*Hであり、1日に観察される値より高く、反復投与後の血清中のE1-Sの蓄積を実証している。
【0053】
【表15】

【0054】
基線調整したエストロン-スルフェートの1日及び14日の薬物速度論パラメーター。E1-Sの基線濃度は両群で同様であり、1.25g及び2.5gのE2ゲルでそれぞれ51.3ng/dl及び36.9ng/dlと測定された。内因性E1-S濃度について補正するため、投与後に測定した総濃度から基線E1-S濃度(E2ゲル1.25g:51.3ng/dl及びBio-E-ゲル2.5g:36.9ng/dl)を減算し、この基線調整した濃度に基づいてAUCτ及びCmaxを再計算した。基線調整したCmax推定値は、1.25g及び2.5gのE2ゲルの単用量投与後それぞれ28.8ng/dl及び37.7ng/dlだった。AUCτについては、基線調整値は1.25g及び2.5gのE2ゲルでそれぞれ165.7ng/dL*H及び325.5ng/dl*Hだった。反復投与後、1.25g及び2.5gのE2ゲルについてそれぞれCmax推定値は112.2ng/dl及び216.9ng/dlに、AUCτ推定値は1602.1ng/dl*H及び3192.5ng/dl*Hに増加した。これら増加は、ゲルの反復投与後の血清中の薬物の蓄積を反映している。
【0055】
【表16】

【0056】
性ホルモン結合グロブリン(SHBG)。次の表中のSHBG濃度は、研究プロトコルに加え、特に被験者04の予想外のE2の蓄積の解釈を可能にするために決定した。データを表10gに示す。一般に、平均SHBG濃度は時間と共に上昇し、E2ゲル1.25g後、0時間の平均72.5nmol/lから80.17nmol/lを超え84.00nmol/lまで、E2ゲル2.5g後、0時間の平均72.5nmol/lから77.83nmol/lを超え88.83nmol/lまで上昇した。E2ゲル2.5gを受けた被験者04は同様のパターンを示した。処置前SHBG-濃度はそれぞれ58nmol/l及び53nmol/lだった。第1投与後192時間(9日の投与前)でSHBG濃度は58nmol/lであり、360時間(16日、0時間)後に71nmol/lに増加した。このように被験者04は他の被験者と異なるとは思われず、SHBG濃度はこの被験者の過剰なE2濃度を説明しない。
【0057】
【表17】

【0058】
薬物速度論の結論。効力の評価の代わりに薬物速度論特性を計算した。0.75mgと1.5mgのE2ゲルの複数用量は、それぞれ約2.4ng/dlのE2及び5.3ng/dlのE2という平均血清濃度をもたらした。これら値は1日25及び50μgのE2という送達速度の経皮パッチ後に得られ、のぼせの減少を含む閉経後障害で承認されている値より大きい。
安全性の結論。8つの有害事象が観察され:そのうちの7つは(おそらく)本研究処置に関連すると分類した:1.25g及び2.5gのE2ゲルでそれぞれ3及び4つの事象がある。両処置レジメは優れた皮膚耐容性を示した。重症でない、重篤でない、又は有意でない有害事象が起こった。落伍者は観察されなかった。生命徴候、ECG、臨床検査室変量又は理学的所見の有意な変化はなかった。本研究投薬はよく耐えられた。調査した2種の処置の安全性プロファイルに関係のある差異はなかった。
結論。1.25g及び2.5gのE2ゲルによるE2、E1及びE1-Sの平均及び個々の血清濃度-時間プロファイルは、2種の処置が測定基線レベルより高い薬物濃度を与えることを示した。ゲル製品の薬物速度論は、反復投与によって、通常、薬物レベルのプラトーが達成されることを実証している。更に、薬物を中断すると、薬物レベルは5日以内で基線レベル又はその近傍に戻る。E2、E1及びE1-Sの薬物速度論は、1.25及び2.5gゲル製品の用量比例性を示唆した。1日及び14日における2.5g処置群の平均パラメーター推定値は、1.25処置群の推定値のほぼ2倍だった。
tmaxの推定値は両処置群で可変だった。14日の定常状態では、tmaxのいくつかの推定値は投与区間の最初に生じた。この場合、以前に投与した用量由来の薬物の持続した存在のため、投与後即座に血清濃度が上昇し続けた可能性がある。両処置の投与後最大濃度までの時間は、第1投与後16〜20時間以内で生じた。
定常状態の達成は、主にグラフ法で評価した。両処置群のE2の平均最低値濃度は非常に可変だったが、研究期間中、有意な増加傾向を示さなかった。メジアン最低値濃度プロットは、両処置群で5日までにE2について定常状態に達することを示唆した。この研究で得られたE2のt1/2の推定値(約33時間)に基づくと、投与のほぼ9〜10日後に定常状態に達するだろう。この知見はグラフ解析の結果と一致する。従って、14日に行った薬物速度論の測定は定常状態の典型だろう。E1及びE1-Sについて同様の結果が観察されたが、この2つの分析物では濃度は更に可変であり、かつ変動が大きいようだった。
効力の評価の代わりに薬物速度論特性を計算した。0.75mg及び1.5mgのE2ゲルの複数用量はそれぞれ約2.4ng/dlのE2及び5.3ng/dlのE2という平均血清濃度をもたらした。これら値は、1日25及び50μgのE2という送達速度の経皮パッチ後に得られ、のぼせ及び骨粗しょう症の低減を含む閉経後障害で承認されている値より大きい。従って、E2ゲルは、のぼせ及び骨粗しょう症の低減を含む閉経期症候の治療で安全かつ有効であると予測される。
【0059】
実施例8.閉経後の女性の血管運動症候の治療のための局所E2ゲル対プラセボの安全及び効力の研究。この研究の目的は、閉経後の女性の血管運動症候の治療におけるプラセボゲルと比較した場合の毎日レジメとして投与されるE2の安全性と効力を評価し、かつ最低有効用量を決定することだった。適格被験者を均等に4つの処置腕の1つにランダム化した:E2ゲル0.625/日(0.375mgのエストラジオール)、E2ゲル1.25g/日(0.75mgのエストラジオール)、E2ゲル2.5g/日(1.5mgのエストラジオール)又は釣り合うプラセボゲル。適格被験者は、エストラジオールレベルが20pg/mL未満の健康な閉経後の女性であり、毎日7回以上の中程度から重度ののぼせを示し、或いはスクリーニングの7日間全部で60回以上の中程度から重度ののぼせを示した。
E2ゲルは、単用量サシエ剤(sachets)で供給されるヒドロアルコール性ゲル製剤中の0.06%のエストラジオールから成り:E2ゲル0.625g/日(0.375mg/日のE2)、E2ゲル1.25g/日(0.75mg/日のE2)、又はE2ゲル2.5g/日(1.5mg/日のE2)。被験者の大腿上に毎日E2ゲルの局所適用で投与した。
パラメーターをのぼせ発症率と重症度で評価した。有害事象、安全性検査室試験、生命徴候、体重、身体検査、胸部検査、皮膚刺激を評価した。
共-一次効力指標(endpoints)の一次解析の結果は、閉経後の女性の血管運動症候の治療のE2ゲルの最低有効用量がE2ゲル2.5g/日(1.5mg/日のE2)であることを示す。E2ゲル2.5g/日処置群では、4週で中程度から重度ののぼせ発症率の基線からの平均変化で約2.7というプラセボとの差が臨床的に有意(すなわち、≧2.0)であり、毎日ののぼせの平均重症度の基線からの平均変化でプラセボに対して好意的な優位性がある(プラセボ約0.6;E2ゲル2.5g/日、約0.9)。他のE2ゲル用量群の毎日ののぼせ発症率のプラセボからの類似の差は臨床的に意味がなかった(E2ゲル0.625g/日、約0.7;E2ゲル1.25g/日、0.0)。
【0060】
【表18】

【0061】
一次効力解析におけるように、4週で毎日の中程度から重度ののぼせ発症率が90%以上減少した被験者の割合に関する処置群の比較は、E2ゲル2.5g/日群(55%の被験者)で有効性を示すが、他のE2ゲル用量群はプラセボと同様に機能した(27%から35%)。更に、E2ゲル2.5g/日の用量群の4週におけるメジアンエストラジオール濃度(33pg/mL)は予想した治療範囲の下限内であり、メジアン濃度は他のE2ゲル用量群(E2ゲル0.625g/日、12pg/mL;E2ゲル1.25g/日、23pg/mL)の範囲未満になった。
効力の解析。プラセボと比較したE2ゲル0.625g/日(0.375mg E2)、E2ゲル1.25g/日(0.75mg E2)、及びE2ゲル2.5g/日(1.5mg E2)の臨床効率の一次効力評価を、4週における毎日の(中程度から重度の)のぼせ発症率の基線からの変化、及びITT LOCFデータセットで評価される4週における毎日ののぼせの平均重症度の基線からの変化を決定した。これら解析で用いる基線測定値はスクリーニング期間解析の間に得たダータに基づき、プラセボリードイン期間中に得たデータに基づく基線測定値は含めなかった。
毎日ののぼせの平均重症度の基線からの変化の一次解析は、因子として処置を有するワンウェイANOVAモデルからの無調整平均を基礎とした。しかし、毎日ののぼせ発症率のみならず見かけの処置による部位相互作用(treatment-by-site interaction)の平均基線についての処置群を越えた相違点を考慮する場合、毎日ののぼせ発症率の基線からの変化の一次解析は、処置、部位、及び処置による部位相互作用の因子を有し、共変量として基線のぼせ発症率を有するANCOVAモデルから誘導される最小二乗平均を基礎とした。これら一次解析結果のみについて検討する。
二次効力解析として、上述した2つの共-一次指標の解析を評価可能被験者のLOCFデータセットについて行った。追加解析は、4週で毎日の中程度から重度ののぼせ発症率が基線から50%以上、60%以上、70%以上、80%以上、90%以上、95%以上又は100%低減した被験者の割合を含み、ITT LOCFデータセット及び評価可能被験者のLOCFデータセットについて行った。ITTデータセットについて、これら割合の解析結果を本文の表に提示する。
2つの共-一次指標の記述的解析を1週、2週、3週、及び4週におけるITT観察事例データセット及び評価可能被験者の観察事例データセットについて行った。4人の被験者だけ治療を永久に中止したので、これらデータセットに関する観察事例解析の結果はLOCF解析からのデータセットとほぼ同一なので、この報告では明白に議論しない。
毎日の中程度から重度ののぼせ発症率の基線からの平均変化。治療を意図したデータセット−LOCF解析。ITTデータセットのLOCF解析では、毎日の中程度から重度ののぼせ発症率の基線からの平均減少をすべての4処置群について観察し、E2ゲル2.5g/日の用量群でより顕著な減少が観察された(表11a及び図5a参照)。
4週における毎日ののぼせ発症率の平均減少のE2ゲル2.5g/日群とプラセボとの間で臨床的に有意な差異(すなわち≧2.0)が観察されたが(群間の差異=約2.7)、2つのより低用量のE2ゲルはプラセボからの臨床的に有意な差異を示さなかった。従って、この2つの低いE2ゲル用量は有効でなく、E2ゲル2.5g/日の用量が、中程度から重度ののぼせの治療の最低有効用量であることが実証される。
図5Aは、種々用量のエストラジオール投与後の毎日の中程度から重度ののぼせ発症率の基線からの平均変化を示すグラフである(ITT-LOCF)。
【0062】
【表19】

【0063】
評価可能被験者のデータセット−LOCF解析。評価可能被験者のデータセットのLOCF解析では、すべての4処置群について毎日の中程度から重度ののぼせ発症率の基線からの平均減少を観察し、E2ゲル2.5g/日用量群で、より顕著な減少が観察された(表11b及び図5b参照)。4週における毎日ののぼせ発症率の平均減少のE2ゲル2.5g/日群とプラセボとの間で臨床的に有意な差異(すなわち≧2.0)が観察されたが(群間の差異=約3.2)、2つのより低用量のE2ゲルはプラセボからの臨床的に有意な差異を示さなかった。
図5Bは、種々用量のエストラジオール投与後の毎日の中程度から重度ののぼせ発症率の基線からの平均変化を示すグラフである(評価可能-LOCF)。
【0064】
【表20】

【0065】
4週における毎日の中程度から重度ののぼせ発症率が90%以上又は100%減少した被験者の割合。治療を意図したデータセット-LOCF解析。ITTデータセットのLOCF解析では、E2ゲル2.5g/日用量群の過半数(55%、21/38)の被験者が4週における毎日の中程度から重度ののぼせ発症率の90%以上の減少を経験し、これに比し、プラセボ及びより低いE2ゲル用量群ではほぼ1/3の被験者が経験した(表11c参照)。E2ゲル2.5g/日用量群の24%の被験者は、4週で100%減少した(すなわち、中程度から重度ののぼせなし)。
【0066】
【表21】

【0067】
のぼせの基線重症度からの平均変化。ITTデータセットのLOCF解析では、基線の毎日ののぼせ平均重症度からの平均低減をすべての4処置群について観察し、E2ゲル2.5g/日用量群で顕著な低減が観察され、E2ゲル1.25g/日用量群では、より低度だった(表11d及び図5c参照)。E2ゲル2.5g/日用量群の毎日ののぼせ平均重症度の経時的な低減は、毎日ののぼせ発症率の平均減少の4周で見られるプラセボからの臨床的に意味のある差異に好意的である。
図5Cは、種々の用量のエストラジオール投与後の毎日ののぼせ平均重症度の基線からの平均変化を示すグラフである(ITT-LOCF)。
【0068】
【表22】

【0069】
薬物用量、薬物濃度、及び応答に対する関係。エストラジオール、エストロン、及びエストロンスルフェート。日1の投与前と、エストラジオール、エストロン、及びエストロンスルフェート濃度の決定についての研究完了時の最低値血清試料を得た。まとめると、5pg/mLの検出限界未満のすべての分析結果を限界値に等しく設定した(すなわち、5pg/mLの値を割り当てた)。1日及び4週におけるエストラジオール、エストロン、及びエストロンスルフェートの最低値濃度は処置群内で非常に可変だった(表11e参照)。可変性及び中程度の試料サイズを考慮してメジアン値について論じる。
すべての処置群にまたがり、1日におけるエストラジオール(5pg/mL)、エストロン(18.5〜22.0pg/mL)、及びエストラジオール対エストロン比(0.29対0.42)のメジアン値は閉経後のプロファイルと一致した(表11e)。しかし、1日でこの基準を満たし損ねたスクリーニングで20pg/mL未満のエストラジオールという基準に包含される被験者もいることに留意せよ。分析固有の可変性とは別に、この推測される理由は、その前年内に閉経期が開始した被験者のホルモンレベルの不安定性、50歳未満の被験者における卵巣摘出しない子宮摘出、或いはスクリーニング期間中のエストロン製品の使用に関して報告されない非コンプライアンスがありうる。
E2ゲルで治療後、4週におけるメジアンエストラジオール、エストロン、及びエストロンスルフェート濃度は、E2ゲル用量投与に応じた処置群間の分別を示した(表11e参照)。4週におけるメジアンエストラジオール値は、E2ゲル0.625g/日、1.25g/日、及び2.5g/日用量群でそれぞれ12pg/mL、23pg/mL、及び33pg/mLだった。
【0070】
【表23】


【0071】
安全性の結論。約4週間0.625〜2.5gのE2ゲル(0.375〜1.5mgのエストラジオール)の毎日適用は安全であり、かつこの集団の閉経後の女性でよく耐えられた。E2ゲル群の中で処置創発性有害事象の全体的発生率は用量レベルによっては上昇せず(各用量群で約50%)、かつプラセボ群(40%)の発生率にかなり匹敵した。生殖器系及び乳房障害に関する有害事象は、この分類の薬物で予測されるように、プラセボ(5%)に対してE2ゲル群ではより高頻度に報告された(0.625g/日、1.25g/日、及び2.5g/日のE2ゲル群でそれぞれ10%、18%、及び13%)。2人以上のE2ゲル被験者で報告されたこれら事象として、乳房圧痛、子宮出血(膣発疹)、乳頭痛、子宮けいれん、及び帯下が挙げられる。これら事象の発生率とE2ゲル用量又はエストラジオールレベルとの間の関係は明かでなかった。これら事象のため研究を中断した被験者はいなかった。
乳房検査は、1人の被験者を除いてすべての最終評価でE2ゲルの影響を示さなかった:この被験者(E2ゲル2.5g/日)について観察された変化は、穏やかな乳房圧痛という報告された有害事象の1つに対応し、最後の研究の薬物投与後1週間で消散した。
研究中、死亡及び重度の有害事象は起こらなかった。2人の被験者(両者ともE2ゲル1.25g/日)は有害事象のため二重盲検処置を中断し、その1人だけがめまいに関係すると考えられ;両被験者は回復した。
基線から4週評価までの平均変化の解析では、臨床検査室結果に関する臨床的に意味のあるE2ゲルの影響は観察されなかった。4週において正常基線から異常レベルへのシフトのある被験者の割合は、E2ゲル群中の正常値を超えるコレステロールレベルへのシフトの高発生率と、正常を超えるBUNレベルへのシフトの見かけのE2ゲル用量に関連して上昇する発生率を示したが、群当たり約10人の被験者だけがコレステロール比較に含まれ(大部分の被験者は正常基線コレステロールレベルを超えていた)、かつBUNシフトは、他の腎臓機能指標又は腎不全の臨床症状で対応するシフトに関連しなかった。
生命徴候、体重、身体検査、又は皮膚刺激評価で、臨床的に重要なE2ゲルの影響は観察されなかった。
結論。経皮ETは、皮膚を介してエストラジオールを直接体循環内に送達するので、経口ETで起こる初回通過肝臓代謝を回避し、かつ経口ETで見られる肝胆道系に及ぼす影響を回避する。基線から4週の評価までの平均変化で注目される統計的に有意又は臨床的に意味のある変化はいずれの肝機能パラメーターでも観察されなかった。E2ゲル0.625g/日用量群の1人の被験者は、研究者が臨床的に有意であると感じたASTの上昇を経験し;また、この被験者は、基線で高いALT(44u/L)を有し、最終評価では70u/Lに増加した。E2ゲル1.25g/日又はE2ゲル2.5g/日用量群では肝機能試験で臨床的に有意な増加のある被験者は観察されなかった。
【0072】
研究ゲルの局所適用に関連する有害事象は最小限であり、かつE2ゲル1.25g/日用量群でより頻繁に報告された。適用部位の乾燥皮膚が、研究薬物の適用に関連して最も頻繁に報告された事象で、2人の被験者で起こった。これら事象は穏やかと考えられ、研究薬物について2週間を越えてから発生し、この事象は7日より長くは続かなかった。報告された他の皮膚関連事象として、適用部位におけるバーニング又はかゆみが挙げられ、各事象について1人の被験者で生じた。適用部位の処置創発性紅斑は生じなかった。
経口ETは胆汁コレステロール飽和指標の上昇を生じさせることが示されており、胆石病のリスク増加に関連するが、この効果は経皮ETでは明かでないようだ。ビリルビンレベルの臨床的に有意な変化が注目されたE2ゲル用量群の被験者はなく、コレステロール上昇、ビリルビン血症、又は胆石に関連する有害事象は報告されなかった。
最初は、経皮ETの使用は、経口ETで見られる血清脂質及びリポタンパク質の増加を回避するだろうと考えられたが、研究は、経口ETによるよりも遅く発生かつ進行するが、血清脂質及びリポタンパク質の変化が生じることを示した。この4週間の研究では、これらパラメーターで臨床的に意味のある平均変化は観察されなかったが、ちょうど4週の持続期間の処置では全体的変化は予想されないだろう。E2ゲル2.5g/日用量群の1人の被験者は、トリグリセリドに基線からの臨床的に有意な変化があったが、被験者の最終検査室血液採取は空腹時でなかった。なお、この被験者の基線コレステロールは287mg/dL、LDLは172mg/dLだった。
この研究の結果は、毎日0.625〜2.5g/日の用量で4週間投与されるE2ゲルは安全かつ良く耐えられることを示す。
【0073】
本発明により、上述した製剤と、その使用説明書を含むキットで製剤を提供することができる。キットは、一般的に製剤を保持する容器を含み、かつ要求に応じて製剤の所定薬用量又は所定体積を放出又は適用するためのディスペンサーを有する。このディスペンサーは、使用者による作動によって組成物の所定薬用量又は体積を自動的に放出することもできる。
本発明のキットは、パウチ、チューブ、ボトル、又は他の適切ないずれかの容器内に製剤を含みうる。キットは、各日使用者が活性成分の薬用量としてサシェ剤中に含まれた量の組成物を開けて適用するように、個々のサシェ剤中に詰めた単用量の製剤を含むことができる。キットは、容器に詰めた複数用量の組成物を含んでもよい。使用中、被験者に、皮膚に適用するための容器から所定量(“10セント銀貨量”などのような)の組成物を分配するように指導することができる。この発明の組成物の貯蔵は、アルミニウムチューブ内約25℃かつ60%の相対湿度のみならず40℃かつ75%の相対湿度で少なくとも約6週間でよい。
容器は、既知体積又は薬用量の製剤をディスペンサーの各作動で使用者によって分配されるように、計量ディスペンサーを含むことができる。一例では、製剤を計量用量ポンプボトル内で供給することができる。供給する製剤は、ポンプ上で各押し下げから特定重量又は体積(0.87gのような)が分配され、かつ3回のような複数回のポンプの作動によって被験者による適用のための所望薬用量の製剤を分配できるような濃度でよい。一例では、キットは、オリオン(Orion)計量用量ポンプボトルのような容器内に含まれたゲル製剤を含む。しかし、ポンプボトル型容器以外の容器、例えばスティック又はロールオン容器などを使用しうる。上述した本発明の特定の実施形態は本発明を限定するものではなく、当業者は、本発明の追加の実施形態及び特徴が添付の特許請求の範囲及びその均等範囲内であることを容易に決定することができる。
【0074】
本明細書は本発明の特定の実施形態について述べるが、当業者は本発明概念から逸脱することなく本発明の変形を創出することができる。従って、本明細書で開示した特定の実施形態は本発明の数局面の例示として意図したものなので、本明細書で記載かつ請求した発明は、これら実施形態による範囲に限定されるものではない。いずれの均等の実施形態も本発明の範囲内であることを意図する。実際、本明細書で示し、かつ記載した実施形態に加え、前記説明から本発明の種々の変形が明らかになるだろう。このような変形も添付の特許請求の範囲内であることを意図する。
【図面の簡単な説明】
【0075】
【図1】装填チャンバー内、ヒトの切除した皮膚と10mgのテストステロン/cm2を用いたインビトロモデルにおける種々量のラウリルアルコール(LA)を含む製剤中のテストステロンの経時的な薬物流量を示すグラフである(n=3-4±SD)。
【図2】装填チャンバー内、ヒトの切除した皮膚と50mgのテストステロン/cm2を用いたインビトロモデルにおける種々量のラウリルアルコール(LA)を含む製剤中のテストステロンの経時的な薬物流量を示すグラフである(n=3-4±SD)。
【図3A】1%T+0%LAゲルのインビボ投与後の1、7、14及び21日目におけるサンプリング期間中のメジアン総テストステロン血清濃度を示すグラフである。
【図3B】1%T+0%LAゲルのインビボ投与後の1、7、14及び21日目におけるサンプリング期間中のメジアン遊離テストステロン血清濃度を示すグラフである。
【図3C】1%T+0%LAゲルのインビボ投与後の1、7、14及び21日目におけるサンプリング期間中のメジアン生物利用可能テストステロン血清濃度を示すグラフである。
【図3D】1%T+2%LAゲルによる異なった用量レジメとインビボ処置後の1、7、14日目におけるサンプリング期間中の平均総テストステロン血清濃度を示すグラフである。
【図3E】1%T+2%LAゲルによる異なった用量レジメとインビボ処置後の1、7、14日目におけるサンプリング期間中の平均生物利用可能テストステロン血清濃度を示すグラフである。
【図3F】1%T+2%LAゲルによる異なった用量レジメとインビボ処置後の1、7、14日目におけるサンプリング期間中の平均遊離テストステロン血清濃度を示すグラフである。
【図4A】E2+0%LAゲルの単用量投与後のエストラジオール(E2)の平均血清濃度を示すグラフである(a=0.75mg E2;b=1.50mg E2)。
【図4B】E2+0%LAゲルの反復投与後の経時的なE2の平均最低値濃度を示すグラフである(a=0.75mg E2;b=1.50mg E2)。
【図4C】ある被験者におけるE2+0%LAゲルの反復投与後の経時的なE2の平均最低値濃度を示すグラフである(2.5g;±SD;スケールからはずれた240.0H-値(28.0ng/dl))。
【図4D】両用量でのE2+0%LAゲルの反復投与後の経時的なE2の個々の最低値濃度を示すグラフである。
【図4E】E2+0%LAゲルの複数用量投与後のE2の平均血清濃度を示すグラフである(a=0.75mg E2;b=1.50mg E2)。
【図4F】E2+0%LAゲルの単用量投与後のエストロン(E1)の平均血清濃度を示すグラフである(a=0.75mg E2;b=1.50mg E2)。
【図4G】E2+0%LAゲルの反復投与後のE1の平均最低値血清濃度を示すグラフである(a=0.75mg E2;b=1.50mg E2)。
【図4H】E2+0%LAゲルの複数用量投与後のE1の平均血清濃度を示すグラフである(a=0.75mg E2;b=1.50mg E2)。
【図4I】E2+0%LAゲルの単用量投与後のエストロン-スルフェート(E1-スルフェート)の平均血清濃度を示すグラフである(a=0.75mg E2;b=1.50mg E2)。
【図4J】E2+0%LAゲルの複数用量投与後のE1-スルフェートの平均最低値濃度を示すグラフである(a=0.75mg E2;b=1.50mg E2)。
【図4K】E2+0%LAゲルの複数用量投与後のE1-スルフェートの平均血清濃度を示すグラフである(a=0.75mg E2;b=1.50mg E2)。
【図5A】種々用量のE2+0%LAゲル投与後の中程度から重症度ののぼせの毎日の基線からの平均変化を示すグラフである(治療を意図した効力集団(Intent-to-treat efficacy population)(“ITT”);早期に中断した被験者のために早めて行った最後の観察の方法(Method of last observation carried forward for subjects who discontinued early )(“LOCF”))。
【図5B】種々用量のE2+0%LAゲル投与後の中程度から重症度ののぼせの毎日の基線からの平均変化を示すグラフである。
【図5C】種々用量のE2+0%LAゲル投与後の毎日ののぼせ平均重症度基線からの平均変化を示すグラフである(ITT-LOCF)。
【発明の詳細な説明】
【0001】
(発明の背景)
発明の分野
本発明は、一般的に被験者に活性薬を経皮又は経粘膜送達する製剤及び方法に関する。特に、本発明は、性腺機能低下症、女性の閉経期症候、女性の性欲障害、機能減退性性障害及び副腎不全の症候を治療するための製剤及び方法に関する。
背景技術
ヒトの内因性ステロイドホルモンのレベル低下は、種々の望ましくない臨床症候につながることが多い。例えば、低テストステロンレベル(性腺機能低下症)の男性は、インポテンス、性欲の欠如、筋衰弱、及び骨粗しょう症を含む臨床症候になりうる。同様に、女性では、テストステロン及び/又はエストロゲンのレベル低下は、性欲の欠如、覚醒又は喜びの欠如、低エネルギー、幸福感の低減、及び骨粗しょう症のような臨床症候を含む女性の性的障害をもたらしうる。更に、閉経期に起因する場合のような女性のエストロゲン及び/又はプロゲステロンのレベル低下は、のぼせ、寝汗、膣萎縮、性欲低下、及び骨粗しょう症を含む臨床症候につながることが多い。
上述したような内因性ステロイドホルモンのレベル低下に加え、副腎不全は、男女のデヒドロエピアンドロステロン(DHEA)のレベル低下をもたらす。副腎は、DHEA及びエストロゲンやテストステロンのような性ホルモンを含む体内の多くのホルモンの生産にも関与している。結果として、副腎不全は、上述した臨床症候をもたらしうるDHEA及び性ホルモンのレベル低下につながりうる。
【0002】
ホルモン補充療法によってステロイドホルモン濃度は正常又は近正常レベルに回復しうるが、現在の治療形態(すなわち、経口、筋肉内、皮下、経皮パッチ及び局所製剤形態)にはいくつかの欠点がある。例えば、経口投与したテストステロンは肝臓内で大部分分解されるので、テストステロンは体循環に達することができず、ホルモン補充の実行可能な選択肢でない。更に、分解を減らすように改良したテストステロンの類似体(例えば、メチルテストステロン及びメタンドロステノロン(methandrostenolone))は、肝臓酵素及び抱合型ビリルビンの上昇のような肝不全に至る異常性に関係している。注入されたテストステロンはテストステロン濃度の幅広ピーク対最低値変化を生じさせ、テストステロンの正常な変動を模倣せず、血漿内での生理レベルの維持を困難にする。テストステロン注射は、気分変動及び血清脂質レベル増加にも関係する。注射は筋肉内送達用の大きい針を必要とし、不快感のため患者のコンプライアンスの低減につながる。一般に、エストロゲンは経口投与されることが多い。この投与経路は、ホルモン代謝に関連した合併症とも関係しており、循環性ホルモンの不十分レベルという結果になる。更に、経口エストロゲンの使用で見られる副作用として胆石及び血餅が挙げられる。これらの問題を克服するため、より患者フレンドリーな様式で治療効果を果たすべく経皮送達アプローチが開発されている。
有利には、活性薬の経皮及び/又は経粘膜送達は、被験者への活性薬の簡便、無痛、かつ非侵襲性投与方法を提供する。更に、皮膚又は粘膜表面を通じた活性薬の投与は、活性薬の経口投与で遭遇する“初回通過効果”に関連した十分な資料の裏付けのある問題を回避する。
【0003】
活性薬の経皮及び/又は経粘膜送達は、上述したような活性薬の経口投与に関連するいくつかの問題を克服するが、それ自体にも欠点がある。問題は、経皮薬物送達システムが通常低分子量薬物及び適切な親油性/親水性バランスを有する構造の薬物に限定されることである。多くの場合、高分子量薬物、又は高すぎるか若しくは低すぎる親水性バランスの薬物を、角質層を通り抜けられないその不浸透性を克服するために十分高い濃度で現在の経皮システムに組み入れることができない。特に、極性薬物は皮膚に緩徐にしか浸透せず、大部分の薬物は極性の性質をもつので、この制限は重大である。
当該技術では、皮膚のバリヤー性を化学的に変えて、特定薬の浸透を可能にし(拡散は主に角質層を通じて制御されるので)、送達される活性薬の効力を高め、送達回数を増やし、送達する用量を減らし、種々の送達法由来の副作用を減らし、患者の反応を減らす等の努力が為されている。
この点に関して、浸透エンハンサーを用いて皮膚表面の薬物への浸透を高めており、多くの場合、浸透エンハンサーはジメチルスルホキシド(DMSO)及びジメチルアセトアミドのようなプロトン受容性溶媒である。研究され、かつ有効と報告されている他の浸透エンハンサーとして、2-ピロリジン、N,N-ジエチル-m-トルアミド(Deet)、1-ドデカル-アザシクロヘプタン-2-オン、N,N-ジメチルホルムアミド、N-メチル-2-ピロリジン、チオグリコール酸カルシウム、ヘキサノール、脂肪酸及びエステル、ピロリドン誘導体、1,3-ジオキサン及び1,3-ジオキソランの誘導体、1-N-ドデシル-2-ピロリドン-5-カルボン酸、2-ペンチル-2-オキソ-ピロリジン酢酸、2-ドデシル-2-オキソ-1-ピロリジン酢酸、1-アザシクロヘプタン-2-オン-2-ドデシル酢酸、及びとりわけ1,3-ジオキサンの誘導体を含むアミノアルコール誘導体が挙げられる。
しかし、ほとんどの一般的な浸透エンハンサーは毒性、刺激性、油性、悪臭、又はアレルギー性である。具体的には、ステロイドホルモンのような活性薬を経皮送達するために用いられ、また必要と考えられる浸透エンハンサー、すなわちオレイン酸のような長鎖脂肪酸、ラウリルアルコールのような脂肪アルコール及びミリスチン酸イソプロピルのような長鎖脂肪エステルのような化合物は、脂肪族基を含み、かつその製剤を油性かつ悪臭にする傾向がある。
例えば、米国特許第5,891,462号は、エストラジオール及び酢酸ノルエチンドロンの浸透エンハンサーとしてラウリルアルコールの使用を教示している。このような製剤は、使用者にも使用者に近いだれにもアピールしない。この特定の特許は、ラウリルアルコール成分のないエストラジオール又は酢酸ノルエチンドロン製剤の3種の例を開示しているが、該製剤は被験者にエストラジオールと組み合わせて酢酸ノルエチンドロンを経皮送達するためにはラウリルアルコールのような長鎖脂肪アルコールが必要であるという長く維持されている状態を説明することを意図した比較例である。
更に、例えば、既知のテストステロンゲル製剤FORTIGEL(登録商標)及びTOSTRELLE(登録商標)(Cellegy Pharma, South San Francisco, CA)は、両方ともエタノール、プロパノール、プロピレングリコール、カルボマー、トリエタノールアミン、純水、及び浸透エンハンサーとしてオレイン酸を含み、この浸透エンハンサーがこれら製剤の刺激及び汚臭特性の原因である。また、TESTIM(登録商標)(Auxilium Pharmaceuticals, Norristown, PA)は1%テストステロンゲルであり、ペンタデカラクトン、アクリレート、グリセリン、ポリエチレングリコール(PEG)、及び浸透エンハンサーとしてペンタデカラクトンを含む。これは非常に悪臭のある化合物である。また、TESTIM(登録商標)は、皮膚がよく耐えない望ましくない量のグリセリンを含有するので望ましくない。
【0004】
(発明の概要)
本発明は、一般的に、被験者への少なくとも1種の活性薬の経皮又は経粘膜送達のための製剤及び方法に関する。本発明は、更に活性薬の経皮又は経粘膜投与によってホルモン障害を治療する方法に関する。
本発明の一局面では、少なくとも1種の活性薬の投与用経皮又は経粘膜製剤が提供される。本製剤は、少なくとも1種の活性薬と、アルカノール、多価アルコール、及び哺乳類の皮膚又は粘膜表面を貫く活性薬の浸透性を高めるために十分な量の浸透エンハンサーを含む送達媒体とを含む。この特定実施形態では、活性薬はテストステロン単独でなく、かつ活性薬がエストロゲン又はプロゲスチンを含む場合、該製剤は、それぞれ治療的に有効な量のエストロゲン又はプロゲスチンを含まない。有利には、本製剤は、実質的に長鎖アルコール、長鎖脂肪酸、又は長鎖脂肪エステルがなく、このような化合物によって引き起こされる該製剤の使用中の望ましくない臭い及び刺激を回避する。
【0005】
本発明の別の局面では、本製剤は、活性薬と、アルカノール、多価アルコール、及び浸透エンハンサーのテトラグリコールフロールを含む送達媒体とを含む。浸透エンハンサーは、哺乳類の皮膚又は粘膜表面を貫く活性薬の浸透性を高めるために十分な量で存在する。好ましい浸透エンハンサーはグリコフロールである。
本発明の別の局面は、被験者のホルモン障害を治療する方法を提供する。本方法は、このような治療が必要な被験者に、少なくとも1種の活性薬と、アルカノール、多価アルコール、及び哺乳類の皮膚又は粘膜表面を貫く活性薬の浸透性を高めるために十分な量の浸透エンハンサーを含む送達媒体とを含んでなる製剤を投与することを含む。有利には、本製剤は、のぼせ、寝汗、性欲減退、膣萎縮、及び骨粗しょう症のようなホルモン障害の少なくとも1つの症候の頻度を低減する。更に、少なくとも1種の活性薬は、アンドロゲン、エストロゲン、プロゲスチン、又はその組合せから選択することができる。本製剤は、同時に投与される一次及び二次活性薬を含んでよい。
本発明の別の局面では、本方法は、治療が必要な被験者に、少なくとも1種の活性薬と、脂肪族アルコール、多価アルコール、及び皮膚又は粘膜表面を貫く活性薬の浸透性を高めるために十分な量の浸透エンハンサーのテトラグリコールフロールを含む送達媒体とを含んでなる製剤を投与することを含む。好ましくは、脂肪族アルコールは送達媒体の約5〜80質量%の量で存在し、多価アルコールと浸透エンハンサーは、送達媒体のそれぞれ約1%〜30%の量で存在し、浸透エンハンサーはグリコフロールであり、かつ任意に媒体中に水が存在しうる。
【0006】
本発明の別の局面では、ホルモン障害の治療方法は、治療が必要な被験者に、少なくとも1種の活性薬(該活性薬はテストステロン単独でなく、かつ活性薬がエストロゲン又はプロゲスチンの場合、製剤中にそれぞれ治療的に有効な量のプロゲスチン又はエストロゲンが存在しないという条件で)を含む製剤を投与することを含む。送達媒体は、脂肪族アルコール、多価アルコール、及び皮膚又は粘膜表面を貫く活性薬の浸透性を高めるために十分な量の浸透エンハンサーを含む。本製剤は、実質的に長鎖脂肪アルコール、長鎖脂肪酸、及び長鎖脂肪エステルがなく、このような化合物に起因する望ましくない臭い、刺激、及び脂っこいテクスチャーを回避する。
本発明の別の実施形態は、被験者のホルモン障害を治療するための、有効用量の少なくとも1種の活性薬と、アルカノール、多価アルコール、及び浸透エンハンサーを含む送達媒体とを含んでなる製剤の使用方法を含む。ここで、浸透エンハンサーは、哺乳類の皮膚又は粘膜表面を貫く活性薬の浸透性を高めるために十分な量で存在する。本明細書で開示されるいずれの製剤もこの方法で使用することができる。
別の実施形態は、哺乳類の皮膚又は粘膜表面を貫く有効用量の少なくとも1種の活性薬の浸透性を高めるための浸透エンハンサーの使用であって、該浸透エンハンサーを製剤用送達媒体に添加することを特徴とする使用に関する。被験者のホルモン障害を治療するために有効な用量を使用し、好ましくは本明細書で開示するような浸透エンハンサー及び製剤である。
本発明の更に別の実施形態は、被験者のホルモン障害の治療用薬物の製造のための本明細書で開示するいずれかの製剤の使用に関する。
本発明の製剤は、ゲル、ローション、クリーム、スプレー、エアゾール、軟膏、懸濁液、リポソーム系、ラッカー、パッチ、絆創膏、又は密封包帯などの形態でよい。
本発明は、更に上述した製剤、及びその使用説明書を含むキットを包含する。キットは、一般的に製剤を保持する容器を含み、かつ必要時に所定用量又は所定体積の製剤を放出又は適用するディスペンサーを含む。ディスペンサーは使用者による作動によって所定用量又は体積の組成物を自動的に放出することもできる。
本発明の特徴及び利益は、以下の例示実施形態の詳細な説明及び添付図面の精査によって更に明らかになるだろう。
【0007】
(好ましい実施形態の詳細な説明)
本発明の製剤は、清澄で、水で洗え、触ると冷たく、速乾性で、塗り広げられ及び/又は脂っこくない、ゲルのような製剤でよい。本発明の他の局面では、本製剤は、スプレー、軟膏、エアゾール、パッチ、バッカル錠及び舌下錠、座剤、膣剤形、又は皮膚又は粘膜表面を通じた吸収用の他の受動的又は活性な経皮デバイスでよい。本発明の好ましい製剤は、例えば、限定するものではないが、ゲル、軟膏、又はクリームによってのように皮膚に直接、或いはパッチ、絆創膏、又は他の密閉包帯を介して間接的に適用することができる。
有利には、長鎖脂肪アルコール及び長鎖脂肪酸の省略が、先行技術製剤の不快な臭いのない製剤を与える。従って、本発明の製剤は、より多くの患者コンプライアンスに帰着する。本発明の製剤は、このようなアルコール及び脂肪酸が実質的にないので、それら化合物に関連する臭いが製剤から発しない。この点に関して、“実質的にない”とは、1メートルの距離で製剤から知覚できる臭いを与えない量を意味する。このような製剤は実質的に臭いもないと考えられる。実例及び説明の目的では、製剤の約0.04質量%未満の量で脂肪アルコール、脂肪酸及び/又は脂肪エステルを含む製剤は実質的に臭いがない。
【0008】
本発明は、一般的に、活性薬を被験者に与えるための製剤に関する。更に本発明は、悪臭の長鎖脂肪アルコール及び長鎖脂肪酸が実質的にない、活性薬の経皮又は経粘膜投与用製剤に関する。驚くべきことに、本発明の製剤は、現在まで使用されている長鎖脂肪アルコール及び長鎖脂肪酸を含めずに、血清中で循環する有効用量の選択活性薬をもたらすために十分な吸収を達成することができる。
本発明の製剤は、少なくとも1種又組合せの活性薬を含みうる。本明細書では、“活性薬”は、生物(ヒト又は動物)に投与すると、局所及び/又は全身作用によって、所望の薬理学的及び/又は生理学的効果を誘発する物質又は物質の配合若しくは組合せ又は物質の配合物を指すために使用する。
本発明の送達媒体は、C2〜C4アルカノールのような脂肪族アルコール、多価アルコール、哺乳類の皮膚又は粘膜表面を貫く活性薬の浸透性を高めるために十分な量の浸透エンハンサーであるジエチレングリコールのモノアルキルエーテル又はテトラグリコールフロールを含み、任意に水を含みうる。
【0009】
例えば、ジエチレングリコールのモノアルキルエーテルは、ジエチレングリコールモノメチルエーテル又はジエチレングリコールモノエチルエーテル又はその混合物である。テトラグリコールフロールは下記式で表される。
【化1】

【0010】
好ましい化合物はグリコフロールとして知られる。また、例えば、好ましい多価アルコールとして、プロピレングリコール、ジプロピレングリコール又はその混合物が挙げられる。
好ましくは、多価アルコールは、媒体の約1%〜30%の量で存在し;かつ浸透エンハンサーは、媒体の約0.2%〜30%の量で存在する。好ましくは、多価アルコールと浸透エンハンサーは、2:1〜1:1の質量比、又は1.25:1〜1.2:1の質量比で存在する。
説明の目的であり、かつ限定するものではないが、脂肪族アルコールは、エタノール、イソプロパノール、及びn-プロパノールのようなC2〜C4アルカノールを含む群から選択される。アルカノールは好ましくはエタノールである。
好ましくは、アルカノールは、約5〜約80%w/w;好ましくは約15〜約65%w/w;更に好ましくは20〜55%w/wの量で存在する。
技術的に周知なように、製剤のアルコール成分の量を選択して、活性薬自体又は製剤の望ましい特性に対するいずれの負の影響も最小限にしながら、皮膚を貫く活性薬の拡散を最大にすることができる。
本発明はホルモンの病気、障害、又は状態の治療が必要な患者の治療方法にも関する。本方法は、一般的に、有効用量の少なくとも1種の活性薬と、送達媒体とを含んでなる製剤を被験者に投与することを含む。
本発明の1つの好ましい実施形態では、本方法は、性腺機能低下症、女性の性障害、機能減退性性障害、及び副腎不全から成る群より選択されるホルモン障害を治療することを含み、本方法は、該治療が必要な患者に、少なくとも1種の活性薬と、アルカノール、多価アルコール、及び哺乳類の皮膚又は粘膜表面を貫く活性薬の浸透性を高めるために十分な量の浸透エンハンサーを含む送達媒体とを含んでなる製剤を投与することを含む。製剤の投与は、治療するホルモン障害の臨床症候の少なくとも1つの頻度を減らす。例えば、製剤の投与は、少し例を挙げると、のぼせ、寝汗、性欲減退、及び骨粗しょう症のような症候の頻度の低減に役立つ。
【0011】
別の好ましい実施形態では、ホルモン障害の被験者を治療する方法であって、そのような治療が必要な被験者に、少なくとも1種の活性薬と、脂肪族アルコール、多価アルコール、及び皮膚又は粘膜表面を貫く活性薬の浸透性を高めるために十分な量の浸透エンハンサーのテトラグリコールフロールを含む送達媒体とを投与することを含む方法が提供される。好ましくは、テトラグリコールフロールはグリコフロールである。
好ましくは、被験者に投与する製剤は、実質的に長鎖脂肪アルコール、長鎖脂肪酸、及び長鎖脂肪エステルがなく、製剤の使用中の望ましくない臭い及び刺激を回避する。
治療が必要な被験者は男性でも女性でもよい。従って、製剤や治療方法のために選択する活性薬のタイプ、及びその活性薬の有効用量は、部分的に、治療する被験者、及び治療するホルモン障害のタイプによって決まる。
【0012】
説明の目的のため、かつ限定でなく、本発明によれば、例えば、治療を受ける女性は、妊娠可能年齢以上の自然閉経、外科的手順、放射線、化学的卵巣切除若しくは摘出、又は早発卵巣不全のどれかのため卵巣エストロゲン、プロゲステロン及び/又はアンドロゲン生産が中断されている女性でよい。自然閉経及び加齢に加え、テストステロン欠乏につながる総循環性アンドロゲンの減少は、副腎アンドロゲン分泌を抑制する状態(すなわち、急性ストレス、拒食症、クッシング症候群、及び下垂体腎不全)、卵巣アンドロゲン分泌を減らしうる状態(すなわち、卵巣不全及び薬理学的用量のグルココルチコイドの使用)、及び後天性免疫不全症候群(AIDS)のような筋衰弱疾患のような慢性病に起因しうる。従って、本明細書では、用語“ホルモン障害”は、被験者のホルモン分泌の抑制又は減少を引き起こすいずれの状態をも意味する。
加齢及び上述したような他の因子による女性閉経期症候群の女性被験者の治療に加え、女性のアンドロゲン(及びエストロゲン)のレベル低下は女性の性機能不全(FSD)につながり、結果として性欲、覚醒又は喜びの欠如;低エネルギー、幸福感の減少及び骨粗しょう症となりうる。本発明の製剤を用いて女性のFSDを治療する好ましい結果は、エネルギー上昇、幸福感の増加、骨からのカルシウム損失の減少、性的活動及び願望の増加の1つ以上が挙げられる。
【0013】
閉経期前の女性では、総血漿テストステロン濃度が一般的に15〜65ng/dL(閉経期前の女性の遊離テストステロンは約1.5〜7pg/mlである)の範囲であり、月経周期の間に、該周期の排卵前期と黄体期の血漿エストロゲン濃度のピークに対応するアンドロゲン濃度のピークによって変動する。閉経後転移につながる年代に、卵巣及び副腎の両分泌の年齢に関連した減少の結果として循環性アンドロゲンのレベルが減少し始める。40歳代の閉経期前の正常な女性の24時間の平均血漿テストステロンがその20歳代初期の女性の半分であるという研究が報告されている。しかし、一般的に、アンドロゲン欠乏の女性は、総テストステロンレベル<25ng/dL(<50歳)又は20mg/dL(≧50歳)を有するが、卵巣摘出した女性は、総テストステロンレベル<10ng/dLを有しうる。
この点に関して、本方法は、女性被験者に、24時間毎に約1mg〜約3mgの治療的に有効な用量のテストステロンを投与することを含みうる。従って、本製剤は、好ましくは少なくとも約(>30ng/dL)15〜約55ng/dLのテストステロンの総血清濃度を被験者に与え、又は約2〜約7pg/mLのテストステロンの遊離血清濃度を与える。
【0014】
更に、研究は、エストロゲン補充療法(“ERT”)と併用したテストステロン補充が、ERT単独に対して性機能及び幸福のパラメーターを改善することを示した。性交率の低下及び少ない性的思考や空想は、エストラジオール及びテストステロンの有意な減少に関係している。テストステロンの減少は、性交の頻度減少にも関係している。卵巣摘出した女性のエストラジオール治療のみでも血管運動症候群、膣乾燥、及び通常の幸福感を改善したが、性欲の改善はほとんど観察されなかった。テストステロン-エナンテート注射によって、子宮摘出及び卵巣摘出した女性で、ERTのみで観察された以上の性欲、覚醒、及び性的空想の頻度の増加が観察された。従って、本発明の方法により、活性薬としてエストラジオールだけを含んでなる製剤を投与することを含む女性被験者の治療のみならず、アンドロゲン、好ましくはテストステロンとエストロゲンの両者を含む活性薬を含んでなる製剤の投与を含む女性被験者の治療が提供される。
自然に、又は4カ月間以上の不十分なERTで外科的に閉経した女性の別の研究は、プラセボ又はエストロゲン治療だけに対してアンドロゲン/エストロゲン治療の4及び8週間後の性的感覚及び願望の有意な改善を示した。外科的に閉経した女性の研究で、アンドロゲン/エストロゲン療法で性的願望、覚醒、幸福、及びエネルギーレベルが向上した。閉経後の女性における皮下エストロゲン移植と併用した皮下テストステロン移植による性欲改善の結果も報告されている。卵巣摘出及び子宮摘出を受けた女性では、経皮テストステロンが性機能及び生理的幸福を向上させた。性欲の点から良い応答を達成するためには、血漿テストステロンレベルを、若い排卵する女性で観察される正常な生理的範囲の少なくともほぼ上限に回復させる必要がある。
従って、少なくとも上述した好ましい結果を達成するため、エストロゲンを含む別個又は同一組成物による治療が望ましいだろう。閉経前の女性被験者は、一般的に約30〜100pg/mLのエストラジオールの血清濃度を有するが、正常な閉経後レベルは20pg/mL未満である。
更に、加齢のためのような女性のエストロゲン(及びプロゲスチン)のレベル低下が閉経につながり、その結果のぼせや寝汗、膣萎縮、性欲減退、心臓病や骨粗しょう症の危険増加のような臨床症候となる。本発明の組成物使用の好ましい結果として、以下の1つ以上が挙げられる:のぼせや寝汗の発生率と重症度の低減、骨からのカルシウム損失の減少、虚血性心臓病由来の死亡の危険減少、膣粘膜や尿路の血管分布と健康の上昇、及び性的活動や願望の増加。従って、別の好ましい実施形態では、本方法は、治療が必要な女性被験者に、活性薬としてエストロゲンとプロゲスチンを組み合わせて両方を含んでなる製剤を投与することを含む。
【0015】
上述したように、本方法は、ホルモン障害の男性被験者の治療を含む。例えば、性腺機能低下症(低テストステロンレベル)の男性を治療する。男性の性腺機能低下症は、インポテンス、性欲の欠如、筋衰弱及び骨粗しょう症を含む臨床症候をもたらしうる。男性の性腺機能低下症を治療するための本発明の組成物使用の好ましい結果として以下の1つ以上が挙げられる:インポテンスの発生率と重症度の低減、骨からのカルシウム損失の減少、筋力上昇、及び性的活動や願望の増加。
正常な男性被験者は、一般的に約300〜1050ng/dLのテストステロンの総血清濃度を有するが、性腺機能低下症の男性は、300ng/dL未満のレベルを有する。従って、本発明の組成物を用いて、被験者に約50mg/日のテストステロンの治療的に有効な用量を与えうる。従って、本組成物を用いて、好ましくは少なくとも約300〜1000ng/dLのテストステロンの遊離血清濃度を被験者に与える。
【0016】
更に別の好ましい実施形態では、被験者のホルモン障害の治療方法が提供され、本方法は、被験者に少なくとも1種の活性薬(該活性薬はテストステロンのみではなく、かつ該活性薬がエストロゲン又はプロゲスチンの場合、製剤中にそれぞれ治療的に有効量のプロゲスチン又はエストロゲンが存在しないという条件で)と、脂肪族アルコール、多価アルコール、及び皮膚又は粘膜表面を貫く前記活性薬の浸透性を高めるために十分な量の浸透エンハンサーを含んでなる送達媒体とを含む製剤を投与することを含み;該製剤は、実質的に長鎖脂肪アルコール、長鎖脂肪酸、及び長鎖脂肪エステルがなく、望ましくない臭いと刺激を回避する。
本発明の方法により、男女両者でデヒドロエピアンドロステロン(DHEA)のレベル低下をもたらす副腎不全の被験者を治療する。副腎は、DHEA及びエストロゲンやテストステロンのような性ホルモンを含む体内の多くのホルモンの生産に関与する。結果として、DHEAのレベル低下は、上述した症候につながりうる。従って、本発明によれば、本方法は、有効用量のDHEAと、上述したような送達媒体とを含んでなる製剤を被験者に投与することを含む。
正常な女性被験者は、一般的に約550〜980ng/dlのDHEAの遊離血清濃度を有し、正常な男性被験者は、約750〜1250ng/dlのDHEAの遊離血清濃度を有する。従って、本発明の組成物を用いて、約50〜200mg/日の治療的に有効な用量のデヒドロエピアンドロステロンを被験者に与えうる。従って、本発明を用いて、患者の性によって、好ましくは少なくとも約550から1250ng/mlまでのデヒドロエピアンドロステロンの血清濃度を被験者に与える。
【0017】
好ましい用量単位は、有効量の選択活性薬、好ましくはステロイドホルモンを約24時間にわたって送達することができる。“有効”又は“治療的に有効”量の活性薬は、無毒であるが、所望効果を与えるために十分な薬剤の量を意味する。
本発明の他の局面では、活性薬と送達媒体を含んでなる製剤が提供される。
本製剤の活性薬は、アンドロゲン、プロゲストーゲン、抗-エストロゲン、抗-プロゲストーゲン、抗-アンドロゲン、アドレナリンアゴニスト、鎮痛薬、鎮静薬、アミド、アリールピペラジン、神経薬、抗腫瘍薬、抗炎症薬、抗コリン薬、抗けいれん薬、抗うつ薬、抗てんかん薬、抗ヒスタミン薬、抗高血圧薬、筋弛緩薬、利尿薬、気管支拡張薬、及びグルココルチコイドを含む群から選択しうる。代わりに、哺乳類被験者の治療クールによって、他のいずれの適切な活性薬も使用しうる。以下の活性薬のリストは純粋に例示であり、限定とみなすべきでない。
【0018】
ホルモン。本発明の一実施形態では、活性薬は、限定するものではないが、デヒドロエピアンドロステロン(DHEA)、アンドロゲン、エストロゲン及びプロゲスチン(プロゲストーゲンとも呼ばれる)を含むステロイド又は非ステロイドホルモン、その前駆体、誘導体及び類似体、そのエステル及び塩のいずれか1つ又は組合せを含む。例えば、ホルモンの組合せとして、アンドロゲンとエストロゲン、アンドロゲンとプロゲストーゲン、又はアンドロゲンとエストロゲンとプロゲストーゲンが挙げられる。
この発明で使用しうるアンドロゲンの例としてテストステロン(17-β-ヒドロキシアンドロステノン)、及びテストステロンエナンテート、テストステロンプロピオネート、テストステロンシピオネート(cypionate)のようなテストステロンエステルが挙げられる。上記テストステロンエステルは商業的に入手可能であり、或いは当業者に周知又は適切な文献に記載されている方法で容易に調製することができる。また、テストステロン及び4-ジヒドロテストステロンの薬学的に許容しうるエステル、典型的にC-17位にあるヒドロキシル基から形成されるエステル(エナンテート、プロピオネート、シピオネート、フェニルアセテート、アセテート、イソブチレート、ブシクレート(buciclate)、ヘプタノエート、デカノエート、ウンデカノエート、カプレート(caprate)及びイソカプレートエステルのような);及びメチルテストステロン、テストラクトン、オキシメトロン及びフルオキシメステロンのような薬学的に許容しうるテストステロンの誘導体を使用しうる。
本発明の製剤で使用しうる他の適切なアンドロゲン薬として、限定するものではないが、アンドロステロン、アンドロステロンアセテート、アンドロステロンプロピオネート、アンドロステロンベンゾエート、アンドロステンジオール、アンドロステンジオール-3-アセテート、アンドロステンジオール-17-アセテート、アンドロステンジオール-3,17-ジアセテート、アンドロステンジオール-17-ベンゾエート、アンドロステンジオール-3-アセテート-17-ベンゾエート、アンドロステンジオン、デヒドロエピアンドロステロン硫酸ナトリウム、4-ジヒドロテストステロン(dht)、5アジヒドロテストステロン(5 adihydorotestosterone)、ドロモスタノロン、ドロモスタノロンプロピオネート、エチルエストレノール、ナンドロロン(nandrolone)フェンプロピオネート、ナンドロロンデカノエート、ナンドロロンフリルプロピオネート、ナンドロロンシクロヘキサンプロピオネート、ナンドロロンベンゾエート、ナンドロロンシクロヘキサンカルボキシレート、オキサンドロロン、スタノゾロールを含む内因性アンドロゲン、その前駆体及び誘導体が挙げられる。
【0019】
この発明で有用なエストロゲン及びプロゲストーゲンの例として、17-β-エストラジオール、エストラジオール、エストロゲンベンゾエート、エストラジオール-17-β-シピオネート、エストリオール、エストロン、エチニルエストラジオール、メストラノール、モキセストロール(moxestrol)、ミタトリエンジオール(mytatrienediol)、リン酸ポリエストラジオール、キネストラジオール(quinestradiol)、キネストロール(quinestrol)のようなエストロゲン;アリルエストレノール、アナゲストン、酢酸クロルマジノン、酢酸デルマジノン(delmadinone acetate)、デメゲストン(demegestone)、デソゲストレル(desogestrel)、ジメチステロン、ジドロゲステロン(dydrogesterone)、エチニルエストレノール、エチステロン、エチノジオール、二酢酸エチノジオール、酢酸フルロゲストン、ゲストデン(gestodene)、カプロン酸ゲストノロン(gestonorone caproate)、ハロプロゲステロン、17-ヒドロキシ-16-メチレン-プロゲステロン、17-α-ヒドロキシプロゲステロン、カプロン酸17-α-ヒドロキシゲステロン、リネストレノール、メドロゲストン、メドロキシプロゲステロン、酢酸メゲストロール、メレンゲストロール、ノルエチンドロン、酢酸ノルエチンドロン、ノルエチノドレル、ノルゲステロン、ノルゲスチメート(norgestimate)、ノルゲストレル、ノルゲストリエノン(norgestrienone)、19-ノルプロゲステロン、ノルビニステロン(norvinisterone)、ペンタゲストロン(pentagestrone)、プロゲステロン、天然プロゲステロン、プロメゲストン(promegestone)、キンゲストロン(quingestrone)、トレンゲストン(trengestone)のようなプロゲストーゲンが挙げられる。
他の活性薬。他の好適な活性薬として、限定するものではないが、タモキシフェン、4-OHタモキシフェンのような抗エストロゲン、抗プロゲストーゲン及び抗アンドロゲン;ブドララジン、クロニジン、エピネフリン、フェノクサゾリン(fenoxazoline)、ナファゾリン、フェニレフリン、フェニルプロパノールアミンのようなα-アドレナリン作動性アゴニスト;フォルモテロール、メトキシフェナミンのようなβ-アドレナリン作動性アゴニスト;ドキサゾシン、プラゾシン(prazosin)、テラゾシン、トリマゾシン(trimazosin)、ヨヒンビンのようなα-アドレナリン作動性ブロッカー;アテノロール、ビソプロロール、カルテオロール、カルベジロール(carvedilol)、メトプロロール、ナドロール(nadolol)、ペンブトロールのようなβ-アドレナリン作動性ブロッカー;ブプレノルフィン、ジヒドロモルヒネ、メタゾシン(metazocine)、メサドン、モルヒネ、モルヒネ誘導体、ニコモルヒネ、オキシモルホンのような鎮痛薬(麻薬又は非麻薬)が挙げられる。
【0020】
沈静薬。アミド。アリールピペラジン。他の好適な活性薬として、沈静薬及び抗不安薬(anxyolitics)、例えばアルプラゾラム、ブロマゼパム、フルタゾラム、ケタゾラム、ロラゼパム、プラゼパムのようなベンゾジアゼピン誘導体;ブトクタミド、ジエチルブロモアセトアミド、イブロタミド(ibrotamide)、イソバレリルジエチルアミン、ニアプラジン(niaprazine)、トリセタミド(tricetamide)、トリメトジン(trimetozine)、ゾルピデム(zolpidem)、ゾピクロンのようなアミド;ブスピロンのようなアリールピペラジンが挙げられる。
神経薬。抗腫瘍薬。抗炎症薬。他の好適な活性薬として、ニコチン、クエン酸ニコチン及び酒石酸ニコチンのような禁煙用神経薬;5-フルオロウラシルのような抗腫瘍薬;抗炎症薬;麻酔薬;抗狭心症薬;抗コリン作動薬;抗けいれん薬;抗うつ薬;抗てんかん薬;抗エストロゲン;抗ヒスタミン薬;抗パーキンソン病薬;気管支拡張薬;利尿薬;グルココルチコイド;筋弛緩薬;麻薬アンタゴニスト;レボチロキシン、甲状腺、チロキシンのような抗甲状腺機能低下症薬;抗高血圧症薬、例えばカプトプリル、シラザプリル、エナラプリル、リジノプリル(lisinopril)、ペリンドプリル(perindopril)、ラミプリル(ramipril)のようなベンゾチアジアジン誘導体;グアネチジンのようなグアニジン誘導体;アルフゾシン(alfuzosin)のようなキナゾリン誘導体;レセルピンのようなレセルピン誘導体;フロセミド(furosemide)のようなスルホンアミド誘導体;ミノキシジル、アムロジピン、ドキサゾシンメシラート、フェロジピン、モキソニジン(moxonidine)、塩酸ニカルジピン、ニフェジピン、塩酸プラゾシン等のようなその他の活性薬及びアリールアルキルアミンのようなカルシウムチャンネルブロッカー、例えばベプリジル(bepridil)、ジチアゼム(ditiazem)、フェンジリン(fendiline)、ガロパミル(gallopamil)、テロジリン、ベラパミル;フェロジピン、イスラジピン、ニカルジピン、ニフェジピン、ニルバジピン、ニモジピン、ニソルジピン、ニトレンジピンのようなジヒドロピリジン誘導体;フルナリジンのようなピペラジン誘導体;ペルヘキシリンのようなその他;カルシフェジオール(calcifediol)、カルシトニン、カルシトリオール、クロドロン酸(clodronic acid)、ジヒドロタキステロール、エルカトニン、エチドロン酸、イプリフラボン、パミドロン酸、副甲状腺ホルモン、酢酸テリパラチド(teriparatide acetate)のようなカルシウム調節薬が挙げられる。
【0021】
本製剤は、更に製剤の粘度を変えるために十分な量で存在する増粘剤又はゲル化剤を含みうる。ゲル化剤は、以下:Carbopol 980又は940 NF、981又は941 NF、1382又は1342 NF、5984又は934 NF、ETD 2020、2050、934P NF、971P NF、974P NF、Noveon AA-1 USPのようなカルボマー、カルボキシエチレン又はポリアクリル酸;エチルセルロース、ヒドロキシプロピルメチルセルロース(HPMC)、エチルヒドロキシエチルセルロース(EHEC)、カルボキシメチルセルロース(CMC)、ヒドロキシプロピルセルロース(HPC)(Klucel種々グレード)、ヒドロキシエチルセルロース(HEC)(Natrosolグレード)、HPMCP 55、Methocelグレードのようなセルロース誘導体;アラビア、キサンタン、ガーゴム、アルギナートのような天然ゴム;Kollidonグレードのようなポリビニルピロリドン誘導体;Lutrol Fグレード68、127のようなポリオキシエチレンポリオキシプロピレンコポリマー;を含む群より選択することができる。他のゲル化剤として、キトサン、ポリビニルアルコール、ペクチン、ビーゴム(veegum)グレードが挙げられる。
好ましくは、ゲル化剤は、Lutrol Fグレード及びCarbopolグレードである。ゲル化剤は、ポリマーのタイプによって約0.2〜約30.0%w/wで存在する。更に好ましくは、ゲル化剤は約0.5〜5質量%の増粘剤を含む。
製剤中のゲル化剤の量を選択して所望の製品のコンシステンシー及び/又は粘度を与えて、皮膚への適用を容易にすることができる。
【0022】
保存剤。本製剤は、更に、限定するものではないが、塩化ベンザルコニウム及び誘導体、安息香酸、ベンジルアルコール及び誘導体、ブロノポール、パラベン、セントリミデド(centrimide)、クロルヘキシジン、クレゾール及び誘導体、イミドウレア(imidurea)、フェノール、フェノキシエタノール、フェニルエチルアルコール、フェニル第二水銀塩、チメロサール、ソルビン酸及び誘導体のような保存剤を含みうる。保存剤は、化合物のタイプによって、製剤の約0.01〜10.0%w/w存在する。
抗酸化剤。製剤は、任意に、限定するものではないが、トコフェロール及び誘導体、アスコルビン酸及び誘導体、ブチル化ヒドロキシアニソール、ブチル化ヒドロキシトルエン、フマル酸、マレイン酸、プロピルガレート、メタ重硫酸塩(metabisulfates)及び誘導体のような抗酸化剤を含むことができる。抗酸化剤は、化合物のタイプによって、製剤の約0.001〜約5.0%w/w存在する。
緩衝剤。製剤は、更に炭酸塩緩衝液、クエン酸塩緩衝液、リン酸塩緩衝液、酢酸塩緩衝液、塩酸、乳酸、酒石酸、ジエチルアミン、トリエチルアミン、ジイソプロピルアミン、アミノメチルアミンのような緩衝剤を含みうる。他の技術的に既知の緩衝剤も含むことができる。緩衝剤は、製剤中の水の100%まで置き換えることができる。
保湿剤。製剤は、更に、限定するものではないが、グリセリン、プロピレン、グリコール、ソルビトール、トリアセチンのような保湿剤を含みうる。保湿剤は、化合物のタイプによって、製剤の約1〜10%w/w存在する。
金属イオン封鎖剤。製剤は、更に、エデト酸の金属イオン封鎖剤を含みうる。金属イオン封鎖剤は、化合物のタイプによって、製剤の約0.001〜約5%w/w存在する。
界面活性剤。製剤は、更に、アニオン性、非イオン性又はカチオン性界面活性剤を含みうる。界面活性剤は、化合物のタイプによって、製剤の約0.1%〜約30%w/w存在する。
pH調整剤。任意に、製剤はpH調整剤、一般的に中和剤を含んでよく、任意に架橋機能を有していてもよい。例として、かつ限定するものではないが、pH調整剤として、トリエタノールアミンのような三元アミン、トロメタミン、テトラヒドロキシプロピルエチレンジアミン、NaOH溶液が挙げられる。pH調整剤は、製剤中に約0.05〜約2%w/w存在する。
湿潤剤及び緩和剤。任意に、製剤は、皮膚を軟らかくし及び滑らかにし、或いは水分を維持及び保持するために湿潤剤及び/又は緩和剤を含むことができる。例として、かつ限定するものではないが、湿潤剤及び緩和剤として、コレステロール、レシチン、軽鉱油、ワセリン、及び尿素が挙げられる。
【0023】
いずれの特定製剤でも、活性薬及び他の成分を選択して所望の薬物送達プロファイル及び所望の浸透量を達成することができる。最適なpHを決めることもでき、例えば、ホルモンの性質、塩基、及び必要な流度によって決まる。
本発明の特定の好ましい実施形態では、本製剤は、以下の処方を有しうる。
【0024】
【表1】

【0025】
【表2】

【0026】
【表3】

【0027】
【表4】

【0028】
【表5】

【0029】
本発明の製剤は、少なくとも以下の理由のため有利である。まず、本発明の製剤は、長鎖アルコール、長鎖脂肪酸、及び長鎖脂肪エステルが実質的にない。驚くべきことに、本製剤は、使用者に有効用量の所望活性薬を送達するために十分な皮膚浸透力を示す。このことは、有効用量の活性薬が皮膚を貫通できるように皮膚浸透力を高めるためには長鎖脂肪アルコール、長鎖脂肪酸、及び長鎖脂肪エステルが必要であると一般的に理解されていたので、当業者が容易には発見しないであろう予想外の利点である。
第2に、本製剤は、通常局所用ゲル中に含まれる脂肪酸のような脂肪族酸基を含まないので、現在利用可能なゲル中のような当該成分に関係する臭いや油っこいテクスチャーを有さない。第3に、長鎖脂肪アルコール、長鎖脂肪酸、及び長鎖脂肪エステルの実質的な非存在は、刺激の可能性が少なく、かつ化合物が相互作用する機会が少ないことを意味し、製剤中の抗酸化剤又は保存剤の必要を減らす。Tanojo H. Boelsma E, Junginger HE, Ponec M, Bodde HE, "In vivo human skin barrier modulation by topical application of fatty acids," Skin Pharmacol Appl. Skin Physiol. 1998 Mar- Apr; 11 (2) 87-97を参照せよ。しかし、このような保存剤が望ましい場合、本発明は抗酸化剤又は保存剤を含む製剤を包含することを理解すべきである。成分数の減少は、少なくとも製造コスト、皮膚刺激の可能性を低減することで有利である。多くの研究がオレイン酸のような不飽和脂肪酸の刺激を引き起こす可能性を認めている。更に、成分数の減少は、成分が送達される前に相互作用する機会を減らすことによって、製剤の貯蔵安定性を高める。しかし、このことは、特に美的及び/又は機能的効果のために製剤中に添加成分を含められないことを意味しない。例えば、本製剤は、皮膚に水分補給するための湿潤剤或いは皮膚を軟らかにし、また滑らかにするための緩和剤を任意に1種以上含んでもよい。グリセリンはこのような好適な湿潤添加剤の例である。
【0030】
本製剤は、1日1回、又は患者の状態によって1日に複数回適用しうる。本発明の製剤は、大腿、腹部、肩、及び上腕のような体のいずれかの部分に局所的に適用することができる。一実施形態では、ゲル形態の製剤を皮膚の約12.7cm×12.7cm(5インチ×5インチ)の部位に適用する。適用するごとに、適用する体の部位を交替しうる。例えば、最初の適用ではゲルを大腿に適用し、第2の適用では上腕、第3適用で大腿に戻すことができる。このとは、製剤の成分への反復暴露に対する皮膚のいずれの感受性も軽減するという点で有利である。
本発明は、上述した製剤の、被験者内における活性薬の循環レベルを高めるために被験者を治療するための使用を包含する。
好ましい用量単位は、有効量の選択活性薬を約24時間にわたって送達できる。“有効”又は“治療的に有効”量の活性薬とは、無毒であるが、所望効果を与えるために十分な量の薬剤を意味する。
しかし、当業者には、所望用量が特定の活性薬並びに他の因子によって決まることが分かるだろう。当然に、各活性薬の最小有効用量は、選択した活性薬の治療に係る副作用を最小限にすることが好ましい。規則的に時間を決めて本製剤を適用して、活性薬の投与が実質的に持続することが好ましい。
【0031】
(実施例)
以下の実施例は説明であり、限定と解釈すべきでない。
実施例1.本発明の製剤の一実施形態は、テストステロン1.25%w/w、ポリエチレングリコール5.95%w/w、エチルアルコール45.46%w/w、蒸留水45.67%w/w、カルボマー(Carbopol 980 NF)1.21%w/w、トリエタノールアミン0.39%w/w、二ナトリウムEDTA0.06%w/wを有する局所用ゲルである。
実施例2.本発明の製剤の一実施形態は、テストステロン1.00%w/w、ジエチレングリコールモノエチルエーテル5.00%w/w、プロピレングリコール6.00%w/w、エタノール47.52%w/w、純水38.87%w/w、カルボマー(CARBOPOLTM 980 NF)1.20%w/w、トリエタノールアミン0.35%w/w、二ナトリウムEDTA0.06%w/wによって構成されるゲルである。
実施例3.本発明の製剤の一実施形態は、活性成分として1%のテストステロンを有する局所用ヒドロアルコール性ゲル製剤である。この製剤は、第I/II相複数用量で、女性の用量増大臨床調査で研究された。この研究を行って、低テストステロンレベルの外科的閉経期の女性を含む被験者における機能減退性性的願望障害(hypoactive sexual desire disorder)(“HSDD”)に対する本製剤の有効性を決定した。
この研究は、7日間毎日約0.22g〜約0.88gの製剤を投与するテストステロンゲル(2.2〜8.8mg/日のテストステロン)が、閉経期前の女性の正常範囲内又は正常範囲をいくらか超える平均の総及び遊離テストステロン血清濃度をもたらすことを示した。
実施例4.インビトロ研究を行い、上表5のテストステロン製剤(ラウリルアルコールを含有しない、“1%T+0%LA”)を用いて外科的に皮膚を切除したヒトのテストステロンの浸透性プロファイルを、1%〜2%のラウリルアルコールを含有する他のテストステロン製剤(“1%T+1%又は2%LA”)と比較して決定した。これら研究の結果を、下表6、7及び8に提示する。
【0032】
第1研究では、切除したヒトの皮膚片をFranz Vertical Diffusion Cells(Hansen Research Inc.)内で標本にした。約10mgのテストステロン/cm2(1%T+0、1又は2%LA)を皮膚上の装填チャンバー内に装填し、35℃で維持した。装填後、選択した間隔で受容体溶液のサンプリングを行った。浸透性研究におけるテストステロン流量と蓄積量を下表6に示す。
【表6】

【0033】
約1.25%のテストステロン、5.00%のトランスクトール(Transcutol)、5.95%のプロピレングリコール、43.09%のエチルアルコール、43.07%の蒸留水を含むゲルのテストステロン流量と蓄積量を下表7及び8に示す。
【表7】

*(浸透した薬物の蓄積量対時間(12〜24時間)の傾き)
【0034】
【表8】

【0035】
図1は、装填チャンバー内、ヒトの切除した皮膚と10mgのテストステロン/cm2を用いたインビトロモデルにおける種々量のラウリルアルコール(LA)を含む製剤のテストステロンの経時的な薬物流量を示すグラフである(n=3-4±SD)。1%T+0%LAのプロファイルは、ラウリルアルコールを含有する製剤と異なる。このプロファイルは6時間で2%LA製剤の約4倍少ないが、全体的には一貫している。全プロファイルは、おそらく薬物消耗のため、浸透の6時間後にテストステロン流量の減少を示した。
【0036】
皮膚上の装填チャンバー内に約50mgのテストステロン/cm2を装填したことを以外は上記方法を用いて別の浸透研究を行った。装填後、選択した間隔で受容体溶液のサンプリングを行った。この浸透性研究のテストステロン流量と蓄積量を以下に示す。
【表9】

【0037】
図2は、装填チャンバー内、ヒトの切除した皮膚と50mgのテストステロン/cm2を用いたインビトロモデルにおける種々量のラウリルアルコール(LA)を含む製剤のテストステロンの経時的な薬物流量を示すグラフである(n=3-4±SD)。
この研究は、1%T+0%LAが低い浸透率を有することを示す。しかし、この浸透プロファイルはほとんど不変であり、テストステロンレベルは狭い範囲内で滴定しなければならないので、女性で使うために非常に望ましい。従って、これらインビトロ研究によって、当該技術の当業者は、ホルモンの適切な循環レベルを達成するためには製剤中にラウリルアルコールを含める必要があると考えるようになった。しかし、出願人らは、予想外にも、有効用量の循環性活性薬浸透を達成するために局所製剤にラウリルアルコールを含める必要がないことを見いだした。このことは、必要なテストステロン血漿レベルが性腺機能低下症を治療するために観察されるテストステロン治療的血漿レベルより低い女性の性的機能不全では特に真実である。
【0038】
実施例5.ゲル製剤及び経皮パッチによる経験は、一般的にゲルによる低率の穏やかな経皮毒性とパッチによる広範囲の皮膚反応を示し、おそらく使用添加剤又はパッチの閉塞性に関連する。例えば、テストステロンの局所用ゲル製剤で、数人の患者に皮膚反応があったが、治療又は薬物の中断を要しなかった。対照的に、経皮パッチで治療した患者の過半数で一過性の穏やか〜中程度の紅斑が観察され、水疱、壊死、及び潰瘍形成を含む、より重度の反応がある患者もいた。例えば、Gelas B, Thebault J, Roux I, Herbrecht F, Zartarian M., "Comparative study of the acceptability of a new estradiol Tx 11323 (A) gel and a transdermal matrix system," Contraception, fertilite, sexualite 1997年6月; 25 (6):470-474)参照。
【0039】
実施例6.この研究の目的は、閉経後の女性における1%T+0%LA塩酸塩ゲルの複数用量の安全性と薬物速度論プロファイルを評価することだった。研究の最初の7日間、被験者は毎日、0.22gの1%T+0%LA含有製剤(2.2mg/日のテストステロン)の局所適用を受けた。日8〜14に、被験者は0.44gの1%T+0%LA含有製剤(4.4mg/日のテストステロン)を受け、かつ日15〜21に、被験者は0.88gの1%T+0%LA含有製剤(8.8mg/日のテストステロン)を受けた。各用量増大の前、洗い流しはしなかった。総、遊離及び生物利用可能テストステロンの薬物速度論結果を以下に示す。
【0040】
【表10】

【0041】
図3A〜3Cは、サンプリング期間中の1、7、14、及び21日目における1%T+0%LAのインビボ投与後のそれぞれメジアン総、遊離及び生物利用可能テストステロン血清濃度を示すグラフである。
平均ベースライオンの総テストステロン及び遊離テストステロン濃度は、それぞれ21.0ng/dL及び2.6pg/mLだった。1%T+0%LAの0.22gの毎日投与の1週間後、平均総テストステロン及び遊離テストステロン濃度は、それぞれ56.0ng/dL及び7.0pg/mLだった。1週間の毎日0.44g用量の1%T+0%LAは、平均総テストステロン及び遊離テストステロン濃度をそれぞれ92.0ng/dL及び11.1pg/mLに増やした。0.88gの1%T+0%LAの7日間毎日投与は、7人の被験者で平均総テストステロン及び遊離テストステロン濃度をそれぞれ141.5ng/dL及び16.7pgmLに増やした。
図3D〜3Fは、サンプリング期間中の1、7、14、及び21日目における1%T+2%LAインビボ投与後のそれぞれメジアン総、遊離及び生物利用可能テストステロン血清濃度を示すグラフである。テストステロン投与量のように比較すると、このデータは、ラウリルアルコールを含めることによってインビボテストステロンレベルは実質的に変わらないことを示す。従って、インビトロ知見とは異なり、ラウリルアルコールは有効なインビボ血清レベルの達成に必要なかった。
この研究は、1%T+0%LAが低内因性テストステロン生産の女性の遊離テストステロン濃度を高める可能性を有することを実証した。2.2mgのテストステロンに相当する0.22g用量は、正常の上限に近い平均遊離テストステロン濃度をもたらした。0.44g用量では、平均遊離テストステロン濃度は正常の上限の1.6倍であり、0.88g用量の平均遊離テストステロン濃度は正常の上限の約2.4倍だった。
更に、ある第I/II相研究で1%T+0%LA製剤を毎日のテストステロン用量2.2、4.4、及び8.8mgで投与した(0.22g/日、0.44g/日、及び0.88g/日の用量、それぞれ7日間投与)。この研究で、本製剤はよく耐えられた。重度又は有意な副作用は報告されなかった。いずれの治療群でも臨床検査室変量、生命徴候、ECGパラメーター又は理学的所見の有意な変化は検出されなかった。
【0042】
実施例7.この研究の主目的は、閉経後の女性被験者における内因性エストラジオール濃度に関係及び無関係なPK変量AUC及びCmaxの見地から、エストラジオールゲル含有の2種の異なった複数局所投与の安全性、耐容性、及び薬物速度論プロファイルを評価することだった。各被験者は14連日間2種のエストラジオール治療;1.25gのエストラジオールゲル0.06%(0.75mgのエストラジオール/日)又は2.5gのエストラジオールゲル0.06%(1.5mgのエストラジオール/日)のどちらか一方を受けた。
0.75mgのE2/日の複数用量は2.4ng/dl(24pg/ml)の平均濃度(=AUCτ/24)を維持した。1.5mgのE2/日の2回用量の結果、平均濃度5.3ng/dl(53pg/ml)となった。値は、Estraderm(登録商標)のような経皮パッチ後に観察される値と非常によく一致した。公称送達速度25μg/日でパッチを用いた場合、23pg/mlの平均維持濃度が報告された。送達速度50μg/日又は100μg/日のパッチでは、それぞれ40pg/ml及び75pg/mlの平均濃度が報告された。Estraderm(登録商標)は、のぼせの低減を含む閉経後障害、及び骨粗しょう症予防に有効であるとして欧州共同体と米国で登録されている。従って、E2ゲル製剤は、のぼせの低減、及び骨粗しょう症予防を含む閉経期症候の治療で安全かつ有効であると予測される。
単用量(日1)後のエストラジオール濃度時間データ(0〜24時間)。図4Aは、E2+0%LAゲル(a=0.75mg E2;b=1.50mg E2)の単用量投与後のエストラジオール(E2)の平均血清濃度を示すグラフである。低用量(処置a)の投与後、濃度-時間プロファイルは、E2濃度の増加が観察されたことを実証する。平均して、E2濃度は基線値の0時間の0.4ng/dlのE2から24時間の2.1ng/dlのE2に増加した。高用量(処置b)の投与後、基線0時間の0.5ng/dlのE2から24時間の3.0ng/dlのE2への増加が観察された。
エストラジオールの最低値濃度データ(1〜20日)。図4BはE2+0%LAゲルの反復投与後のE2の平均最低値濃度を経時的に示すグラフである。平均して、適用後約24時間まで(日2の投与前)最低値濃度は上昇した。その後、濃度のプラトーが観察され、最後の用量を投与した後の日(336時間=日15、0時間)、24時間で2.1ng/dl〜2.4ng/dlのE2でレベルが変動した。このサンプリング間隔内で、最低値濃度は可変であり、48時間(3日目の投与前)で観察された最小1.3ng/dlのE2から336時間(15日目、0時間)の最大2.4ng/dlまで変動した。最終投与後、平均E2濃度は0.8ng/dlに減少し、456時間(20日目、0時間;薬物投与中断後5日)でほぼ投与前基線レベル(0.6ng/dl)だった。
【0043】
図4Dは、両用量のE2+0%LAゲルの反復投与後の経時的なE2の個々の最低値濃度を示すグラフである。平均して、E2濃度は約240時間(日11の投与前)まで増加し続けた。濃度は、基線(0時間)の0.5ng/dlから240時間の8.7ng/dlまで増加した。
メジアン最低値も調べると、これらは投与後96時間(日5の投与前)でほぼ5.1ng/dlのE2のプラトーに達した。その後、最低値濃度は可変かつ最小4.2ng/dlのE2(288時間、13日目の投与前のメジアン)から336時間(15日目、0時間)の最大5.3ng/dlまで変動した。最終投与後、平均E2濃度は0.8ng/dlに減少し、456時間(20日目、0時間;薬物投与中断後5日)でほぼ基線レベル(0.5ng/dl)だった。メジアン最低値濃度の調査は、E2ゲル1.25g及び2.5g用量でそれぞれ4及び5日までに定常状態E2濃度に達することを示す。
14用量(14日目)後のエストラジオール濃度時間データ(0〜24時間)。図4Eは、E2+0%LAゲルの複数用量投与後のE2の平均血清濃度を示すグラフである。日14のプロファイルは、14日(312時間)までに定常状態E2濃度に達したことを実証する。この区間の最初(処置a:2.0ng/dlのE2、処置b:5.0ng/dlのE2)とこのサンプリング区間の最後(処置a:2.4ng/dlのE2、処置b:5.5ng/dlのE2)の平均E2濃度は似通っていた。平均最大E2濃度は、それぞれ3.7ng/dl及び8.8ng/dlだった(14日データ)。
【0044】
1日及び14日目のエストラジオール薬物速度論パラメーター。1.25g及び2.5gのBio-E-ゲルの単適用及び複数適用後のE2の薬物速度論パラメーターを表10aに示す。無補正及び基線調整した薬物速度論パラメーターの記述的概要をそれぞれ表10c及び10dに示す。
1.25gのE2ゲルの単投与後、1日目の最大濃度(Cmax)は2.3ng/dlだった。平均して、最大濃度に対する時間、tmaxは17.67時間までに達した。AUCτで測定されるE2への暴露は27.5ng/dl*Hだった。複数投与後、Cmax濃度は日14の3.7ng/dlに増加した。tmax推定値は、約日14の16時間であり、1日目に観察された値と似通っていた。E2への暴露は、14日目で57.0ng/dl*Hであり、1日目で観察された値より高く、反復投与後の血清中のE2の蓄積を実証している。
2.5gのE2ゲルの単投与後、1日目の最大濃度(Cmax)は3.7ng/dlだった。平均して、最大濃度に対する時間、tmaxは18時間までに達した。AUCτで測定されるE2への暴露は49.7ng/dl*Hだった。複数投与後、Cmax濃度は14日目の8.8ng/dlに増加した。tmax推定値は約14日目の18時間であり、1日目に観察された値と似通っていた。E2への暴露は、14日目で128.2ng/dl*Hであり、1日目に観察された値より高く、反復投与後の血清中のE2の蓄積を実証している。
E2ゲル2.5g/1.25gの幾何平均の比を用いて、E2ゲルの2用量後のE2の用量比例性を評価した。単用量投与後、平均AUC比(E2ゲル2.5g/1.25g)は38.4/19.2=2.0であり、複数用量後は117.6/51.9=2.3であり、用量比例性を示している。
【0045】
【表11】

【0046】
基線調整した1日目及び14日目のエストラジオール薬物速度論パラメーター。E2の基線濃度は両群で同様であり、1.25g及び2.5gのE2ゲルでそれぞれ0.5ng/dl及び0.4ng/dlと計算された。内因性E2濃度について補正するため、基線E2濃度(E2ゲル1.25g:0.5ng/dl及び2.5g:0.4ng/dl)を投与後の総濃度から減算し、AUCτ及びCmaxは基線調整した濃度に基づいて再計算した。基線調整した薬物速度論変量を表10bにまとめた。基線調整したCmax推定値は、1.25g及び2.5gのE2ゲルの単投与後それぞれ1.8ng/dl及び3.4ng/dlだった。AUCτについては、基線調整値は、1.25g及び2.5gのE2ゲルでそれぞれ14.9ng/dL*H及び41.4ng/dl*Hだった。反復投与後、Cmax推定値は3.1ng/dl及び8.4ng/dlに上昇し、AUCτ推定値は1.25g及び2.5gのE2ゲルでそれぞれ44.2ng/dl*H及び119.6ng/dl*Hに増加した。これらの増加は、ゲルの反復投与後の血清中の薬物の蓄積を反映している。
E2の最終排出半減期(t1/2)は、最終投与(312時間、日14の投与前)後の基線調整した濃度から、対数変換濃度-時間プロットの線形部分からの対数-線形回帰によって計算した。1.25g及び2.5gのE2ゲルの投与後の半減期の個々及び平均推定値を表10dに示す。メジアン半減期は、E2ゲル1.25gで22.15時間(範囲:13.11〜76.71)、2.5gで35.58時間(範囲:26.60〜51.59)だった。両処置の半減期の推定値は似通っていた。
【0047】
【表12】

【0048】
単用量(1日目)後のエストロン濃度時間データ(0〜24時間)。図4Fは、E2+0%LAゲルの単用量投与後のエストロン(E1)の平均血清濃度を示すグラフである。平均して、E1濃度は0時間の基線値2.4ng/dlのE1から24時間の3.4ng/dlのE1に増加した。高用量(処置b)の投与後、基線(0時間)の2.4ng/dlのE1から24時間の4.0ng/dlのE1の増加が観察された。
エストロン最低値濃度データ(1〜20日目)。図4Gは、E2+0%LAゲルの反復投与後のE1の平均最低値濃度を示すグラフである。平均して、最低値濃度は投与後約72時間(4日の投与前)まで上昇した。その後、濃度のプラトーが観察され、レベルは72時間の4.3ng/dlのE1と最終用量を投与した後の日(336時間=15日、0時間)の5.2ng/dlのE1の間で変動した。このサンプリング区間内では、最低値濃度は可変であり、96時間(日5の投与前)で観察される最小4.1ng/dlのE1と288時間(13日の投与前)の最大5.3ng/dlの間で変動した。最終投与後、平均E1濃度は3.0ng/dlに減少し、456時間(20日、0時間;薬物投与中断後5日)でほぼ基線レベル(2.4ng/dl)だった。
Bio-E-ゲル2.5gの反復投与後の平均E1最低値濃度も図4Gに示す。平均して、E1濃度は、約240時間(11日の投与前)まで増え続けた。濃度は基線(0時間)の2.4ng/dlから240時間の10.4ng/dlに上昇した。その後、最低値濃度は可変であり、9.1ng/dlのE1(288時間=13日の投与前)と336時間(15日、0時間)の7.8ng/dlの間で変動した。最終投与後、平均E1濃度は3.1ng/dlに減少し、456時間(20日、0時間;薬物投与中断後5日)でほぼ投与前基線レベル(4.0ng/dl)だった。平均最低値濃度の調査は、Bio-E-ゲル2.5g及び1.25g用量では、それぞれ11及び13日までに定常状態E1濃度に達することを示す。
14用量(14日)後のエストロン濃度時間データ(0〜24時間)。図4Hは、E2+0%LAゲルの複数用量投与後のE1の平均血清濃度を示すグラフである。14日のプロファイルは、定常状態のE1濃度が14日(312時間)までに達成されることを実証している。この区間の最初のE1濃度(処置a:4.8ng/dl、処置b:8.2ng/dl)とこのサンプリング区間の最後のE1濃度(処置a:5.2ng/dl、処置b:7.8ng/dl)は似通っていた。14日(312〜336時間)の平均最大E1濃度は、それぞれ6.0ng/dl及び9.2ng/dlだった。
1日及び14日のエストロンの薬物速度論パラメーター。1.25gのE2ゲルの単投与後、1日の最大濃度(Cmax)は3.6ng/dlだった。平均して、最大濃度に対する時間tmaxは12.67時間までに達した。AUCτで測定されるE1への暴露は56.2ng/dl*Hだった。複数投与後、Cmax濃度は14日で6.0ng/dlに上昇した。tmax推定値は約14日の11時間であり、1日で観察された推定値と似通っていた。E1への暴露は14日で111.4ng/dl*Hであり、1日に観察されるた値より高く、反復投与後の血清中のE1の蓄積を実証している。
2.5gのE2ゲルの単投与後、1日の最大濃度(Cmax)は4.1ng/dlだった。平均して、最大濃度に対する時間tmaxは21時間までに達した。AUCτで測定されるE1への暴露は62.2ng/dl*Hだった。複数投与後、Cmax濃度は14日に9.2ng/dlに上昇した。tmax推定値は日14の約2時間であり、1日に観察された値より低かった。E1への暴露は14日で179.7ng/dl*Hであり、1日で観察された値より高く、反復投与後の血清中のE1の蓄積を実証している。
【0049】
【表13】

【0050】
1日及び14日の基線調整したエストロン薬物速度論パラメーター。両群でE1の基線濃度は同様であり、1.25g及び2.5gのE2ゲルでそれぞれ1.8ng/dl及び2.0ng/dlと計算された。内因性E1濃度について補正するため、投与後に測定された総濃度から基線E1濃度(E2ゲル1.25g:1.8ng/dl及びE2ゲル2.5g:2.0ng/dl)を減算し、AUCτ及びCmaxは、基線調整した濃度に基づいて再計算した。基線調整した薬物速度論変量の結果を10dにまとめた。基線調整したCmax推定値は、1.25g及び2.5gのE2ゲルの単投与後それぞれ1.8ng/dl及び2.0ng/dlだった。AUCτについては、基線調整した値は1.25g及び2.5gのE2ゲルでそれぞれ14.5ng/dL*H及び17.9ng/dl*Hだった。反復投与後、1.25g及び2.5gのE2ゲルで、Cmax推定値はそれぞれ4.2ng/dl及び7.2ng/dl、AUCτ推定値はそれぞれ67.1ng/dl*H及び131.2ng/dl*Hに増加した。これらの増加は、ゲルの反復投与後の血清中の薬物の蓄積を反映している。
【0051】
【表14】

【0052】
単用量(1日)後のエストロン-スルフェート濃度時間データ(0〜24時間)。図4Iは、E2+0%LAゲル(a=0.75mg E2;b=1.50mg E2)の単用量投与後のエストロン-スルフェート(E1-スルフェート)の平均血清濃度を示すグラフである。平均して、E1-S濃度は、0時間の基線値45.8ng/dlのE1から24時間の79.0ng/dl E1-Sに増加した。高用量(処置b)の投与後、0時間の基線の34.7ng/dlのE1-Sから24時間の70.7ng/dlのE1-Sへの増加が観察された。
エストロゲン-スルフェート最低値濃度データ(1〜20日)。図4Jは、E2+0%LAゲル(a=0.75mg E2;b=1.50mg E2)の複数用量投与後のE1-スルフェートの平均最低値濃度を示すグラフである。平均して、反復投与で最低値濃度は増加し続けたが、平均プロットは約192時間(9日の投与前)まで増加率の変化を示唆した。E1-S血清濃度は192時間の133.8ng/dlと、最終用量を投与した後の日(336時間; 15日、0時間)の117.8ng/dlのE1-Sとの間で変動した。最終投与後、平均E1-S濃度は77.0ng/dlに減少し、456時間(20日、0時間;薬物投与中断後5日)の投与前基線値(45.8ng/dl)より高かった。
平均して、E1-S濃度は約312時間(14日の投与前)まで増え続けたが、約40時間(11日の投与前)で増加率の変化が明白だった。濃度は基線(0時間)の34.7ng/dlから240時間の193.5ng/dlに増加した。その後、最低値濃度は可変であり、193.5ng/dlのE1(240時間)から336時間(15日、0時間)の155.7ng/dlに変動した。最終投与後、平均E1-S濃度は60.3ng/dlに減少し、456時間(20日、0時間;薬物投与中断後5日)の投与前基線レベル(34.7ng/dl)より高かった。平均最低値濃度の調査は、E2ゲル1.25g及び2.5g用量ではそれぞれ13及び14日までに定常状態E1-スルフェート濃度に達することを示す。
14用量(14日)後のエストロン-スルフェート濃度時間データ(0〜24時間)。図4Kは、E2+0%LAゲルの複数用量投与後のE1-スルフェートの平均血清濃度を示すグラフである。日14のプロファイルは、本質的に14日(312時間)までに定常状態E1-S濃度に達したことを実証している。この区間の最初の平均E1-S濃度(処置a:130.7ng/dl、処置b:200.3ng/dl)と、このサンプリング区間の最後の平均E1-S濃度(処置a:117.8 ng/dl、処置b:155.7ng/dl)はわずかに異なった。しかし、それによって重複した値の範囲は結果の類似性を示唆している。14日の平均最大E1-S濃度は、E2ゲル1.25gで163.5ng/dlのE1-S、E2ゲル2.5gで253.8ng/dlのE1-Sだった。
1日及び14日のエストロン-スルフェート薬物速度論パラメーター。1.25g及び2.5gのE2ゲルの単投与及び複数投与後のE1-Sの薬物速度論パラメーターを表10eに示す。無補正及び基線調整した薬物速度論パラメーターの記述的概要をそれぞれ表10c及び10dAに示す。 1.25gのE2ゲルの単投与後、1日の最大濃度(Cmax)は80.2ng/dlだった。平均して、最大濃度に対する時間tmaxは20.67時間までに達した。AUCτで測定されるE1-Sへの暴露は1359.2ng/dl*Hだった。複数投与後、Cmax濃度は14日の163.5ng/dlに増加した。tmax推定値はほぼ14日の5時間であり、1日に観察された値より低かった。E1-Sへの暴露は14日で2834.1ng/dl*Hであり、1日に観察された値より高く、反復投与後の血清中のE1-Sの蓄積を実証している。
2.5gのE2ゲルの単投与後、1日の最大濃度(Cmax)は74.7ng/dlだった。平均して、最大濃度に対する時間tmaxに20時間までに達した。AUCτで測定されるE1-Sへの暴露は1207.4ng/dl*Hだった。複数投与後、Cmax濃度は14日の253.8ng/dlに増加した。tmax推定値は、ほぼ14日の3時間であり、1日に観察される値より低かった。E1-Sへの暴露は日14で4079.2ng/dl*Hであり、1日に観察される値より高く、反復投与後の血清中のE1-Sの蓄積を実証している。
【0053】
【表15】

【0054】
基線調整したエストロン-スルフェートの1日及び14日の薬物速度論パラメーター。E1-Sの基線濃度は両群で同様であり、1.25g及び2.5gのE2ゲルでそれぞれ51.3ng/dl及び36.9ng/dlと測定された。内因性E1-S濃度について補正するため、投与後に測定した総濃度から基線E1-S濃度(E2ゲル1.25g:51.3ng/dl及びBio-E-ゲル2.5g:36.9ng/dl)を減算し、この基線調整した濃度に基づいてAUCτ及びCmaxを再計算した。基線調整したCmax推定値は、1.25g及び2.5gのE2ゲルの単用量投与後それぞれ28.8ng/dl及び37.7ng/dlだった。AUCτについては、基線調整値は1.25g及び2.5gのE2ゲルでそれぞれ165.7ng/dL*H及び325.5ng/dl*Hだった。反復投与後、1.25g及び2.5gのE2ゲルについてそれぞれCmax推定値は112.2ng/dl及び216.9ng/dlに、AUCτ推定値は1602.1ng/dl*H及び3192.5ng/dl*Hに増加した。これら増加は、ゲルの反復投与後の血清中の薬物の蓄積を反映している。
【0055】
【表16】

【0056】
性ホルモン結合グロブリン(SHBG)。次の表中のSHBG濃度は、研究プロトコルに加え、特に被験者04の予想外のE2の蓄積の解釈を可能にするために決定した。データを表10gに示す。一般に、平均SHBG濃度は時間と共に上昇し、E2ゲル1.25g後、0時間の平均72.5nmol/lから80.17nmol/lを超え84.00nmol/lまで、E2ゲル2.5g後、0時間の平均72.5nmol/lから77.83nmol/lを超え88.83nmol/lまで上昇した。E2ゲル2.5gを受けた被験者04は同様のパターンを示した。処置前SHBG-濃度はそれぞれ58nmol/l及び53nmol/lだった。第1投与後192時間(9日の投与前)でSHBG濃度は58nmol/lであり、360時間(16日、0時間)後に71nmol/lに増加した。このように被験者04は他の被験者と異なるとは思われず、SHBG濃度はこの被験者の過剰なE2濃度を説明しない。
【0057】
【表17】

【0058】
薬物速度論の結論。効力の評価の代わりに薬物速度論特性を計算した。0.75mgと1.5mgのE2ゲルの複数用量は、それぞれ約2.4ng/dlのE2及び5.3ng/dlのE2という平均血清濃度をもたらした。これら値は1日25及び50μgのE2という送達速度の経皮パッチ後に得られ、のぼせの減少を含む閉経後障害で承認されている値より大きい。
安全性の結論。8つの有害事象が観察され:そのうちの7つは(おそらく)本研究処置に関連すると分類した:1.25g及び2.5gのE2ゲルでそれぞれ3及び4つの事象がある。両処置レジメは優れた皮膚耐容性を示した。重症でない、重篤でない、又は有意でない有害事象が起こった。落伍者は観察されなかった。生命徴候、ECG、臨床検査室変量又は理学的所見の有意な変化はなかった。本研究投薬はよく耐えられた。調査した2種の処置の安全性プロファイルに関係のある差異はなかった。
結論。1.25g及び2.5gのE2ゲルによるE2、E1及びE1-Sの平均及び個々の血清濃度-時間プロファイルは、2種の処置が測定基線レベルより高い薬物濃度を与えることを示した。ゲル製品の薬物速度論は、反復投与によって、通常、薬物レベルのプラトーが達成されることを実証している。更に、薬物を中断すると、薬物レベルは5日以内で基線レベル又はその近傍に戻る。E2、E1及びE1-Sの薬物速度論は、1.25及び2.5gゲル製品の用量比例性を示唆した。1日及び14日における2.5g処置群の平均パラメーター推定値は、1.25処置群の推定値のほぼ2倍だった。
tmaxの推定値は両処置群で可変だった。14日の定常状態では、tmaxのいくつかの推定値は投与区間の最初に生じた。この場合、以前に投与した用量由来の薬物の持続した存在のため、投与後即座に血清濃度が上昇し続けた可能性がある。両処置の投与後最大濃度までの時間は、第1投与後16〜20時間以内で生じた。
定常状態の達成は、主にグラフ法で評価した。両処置群のE2の平均最低値濃度は非常に可変だったが、研究期間中、有意な増加傾向を示さなかった。メジアン最低値濃度プロットは、両処置群で5日までにE2について定常状態に達することを示唆した。この研究で得られたE2のt1/2の推定値(約33時間)に基づくと、投与のほぼ9〜10日後に定常状態に達するだろう。この知見はグラフ解析の結果と一致する。従って、14日に行った薬物速度論の測定は定常状態の典型だろう。E1及びE1-Sについて同様の結果が観察されたが、この2つの分析物では濃度は更に可変であり、かつ変動が大きいようだった。
効力の評価の代わりに薬物速度論特性を計算した。0.75mg及び1.5mgのE2ゲルの複数用量はそれぞれ約2.4ng/dlのE2及び5.3ng/dlのE2という平均血清濃度をもたらした。これら値は、1日25及び50μgのE2という送達速度の経皮パッチ後に得られ、のぼせ及び骨粗しょう症の低減を含む閉経後障害で承認されている値より大きい。従って、E2ゲルは、のぼせ及び骨粗しょう症の低減を含む閉経期症候の治療で安全かつ有効であると予測される。
【0059】
実施例8.閉経後の女性の血管運動症候の治療のための局所E2ゲル対プラセボの安全及び効力の研究。この研究の目的は、閉経後の女性の血管運動症候の治療におけるプラセボゲルと比較した場合の毎日レジメとして投与されるE2の安全性と効力を評価し、かつ最低有効用量を決定することだった。適格被験者を均等に4つの処置腕の1つにランダム化した:E2ゲル0.625/日(0.375mgのエストラジオール)、E2ゲル1.25g/日(0.75mgのエストラジオール)、E2ゲル2.5g/日(1.5mgのエストラジオール)又は釣り合うプラセボゲル。適格被験者は、エストラジオールレベルが20pg/mL未満の健康な閉経後の女性であり、毎日7回以上の中程度から重度ののぼせを示し、或いはスクリーニングの7日間全部で60回以上の中程度から重度ののぼせを示した。
E2ゲルは、単用量サシエ剤(sachets)で供給されるヒドロアルコール性ゲル製剤中の0.06%のエストラジオールから成り:E2ゲル0.625g/日(0.375mg/日のE2)、E2ゲル1.25g/日(0.75mg/日のE2)、又はE2ゲル2.5g/日(1.5mg/日のE2)。被験者の大腿上に毎日E2ゲルの局所適用で投与した。
パラメーターをのぼせ発症率と重症度で評価した。有害事象、安全性検査室試験、生命徴候、体重、身体検査、胸部検査、皮膚刺激を評価した。
共-一次効力指標(endpoints)の一次解析の結果は、閉経後の女性の血管運動症候の治療のE2ゲルの最低有効用量がE2ゲル2.5g/日(1.5mg/日のE2)であることを示す。E2ゲル2.5g/日処置群では、4週で中程度から重度ののぼせ発症率の基線からの平均変化で約2.7というプラセボとの差が臨床的に有意(すなわち、≧2.0)であり、毎日ののぼせの平均重症度の基線からの平均変化でプラセボに対して好意的な優位性がある(プラセボ約0.6;E2ゲル2.5g/日、約0.9)。他のE2ゲル用量群の毎日ののぼせ発症率のプラセボからの類似の差は臨床的に意味がなかった(E2ゲル0.625g/日、約0.7;E2ゲル1.25g/日、0.0)。
【0060】
【表18】

【0061】
一次効力解析におけるように、4週で毎日の中程度から重度ののぼせ発症率が90%以上減少した被験者の割合に関する処置群の比較は、E2ゲル2.5g/日群(55%の被験者)で有効性を示すが、他のE2ゲル用量群はプラセボと同様に機能した(27%から35%)。更に、E2ゲル2.5g/日の用量群の4週におけるメジアンエストラジオール濃度(33pg/mL)は予想した治療範囲の下限内であり、メジアン濃度は他のE2ゲル用量群(E2ゲル0.625g/日、12pg/mL;E2ゲル1.25g/日、23pg/mL)の範囲未満になった。
効力の解析。プラセボと比較したE2ゲル0.625g/日(0.375mg E2)、E2ゲル1.25g/日(0.75mg E2)、及びE2ゲル2.5g/日(1.5mg E2)の臨床効率の一次効力評価を、4週における毎日の(中程度から重度の)のぼせ発症率の基線からの変化、及びITT LOCFデータセットで評価される4週における毎日ののぼせの平均重症度の基線からの変化を決定した。これら解析で用いる基線測定値はスクリーニング期間解析の間に得たダータに基づき、プラセボリードイン期間中に得たデータに基づく基線測定値は含めなかった。
毎日ののぼせの平均重症度の基線からの変化の一次解析は、因子として処置を有するワンウェイANOVAモデルからの無調整平均を基礎とした。しかし、毎日ののぼせ発症率のみならず見かけの処置による部位相互作用(treatment-by-site interaction)の平均基線についての処置群を越えた相違点を考慮する場合、毎日ののぼせ発症率の基線からの変化の一次解析は、処置、部位、及び処置による部位相互作用の因子を有し、共変量として基線のぼせ発症率を有するANCOVAモデルから誘導される最小二乗平均を基礎とした。これら一次解析結果のみについて検討する。
二次効力解析として、上述した2つの共-一次指標の解析を評価可能被験者のLOCFデータセットについて行った。追加解析は、4週で毎日の中程度から重度ののぼせ発症率が基線から50%以上、60%以上、70%以上、80%以上、90%以上、95%以上又は100%低減した被験者の割合を含み、ITT LOCFデータセット及び評価可能被験者のLOCFデータセットについて行った。ITTデータセットについて、これら割合の解析結果を本文の表に提示する。
2つの共-一次指標の記述的解析を1週、2週、3週、及び4週におけるITT観察事例データセット及び評価可能被験者の観察事例データセットについて行った。4人の被験者だけ治療を永久に中止したので、これらデータセットに関する観察事例解析の結果はLOCF解析からのデータセットとほぼ同一なので、この報告では明白に議論しない。
毎日の中程度から重度ののぼせ発症率の基線からの平均変化。治療を意図したデータセット−LOCF解析。ITTデータセットのLOCF解析では、毎日の中程度から重度ののぼせ発症率の基線からの平均減少をすべての4処置群について観察し、E2ゲル2.5g/日の用量群でより顕著な減少が観察された(表11a及び図5a参照)。
4週における毎日ののぼせ発症率の平均減少のE2ゲル2.5g/日群とプラセボとの間で臨床的に有意な差異(すなわち≧2.0)が観察されたが(群間の差異=約2.7)、2つのより低用量のE2ゲルはプラセボからの臨床的に有意な差異を示さなかった。従って、この2つの低いE2ゲル用量は有効でなく、E2ゲル2.5g/日の用量が、中程度から重度ののぼせの治療の最低有効用量であることが実証される。
図5Aは、種々用量のエストラジオール投与後の毎日の中程度から重度ののぼせ発症率の基線からの平均変化を示すグラフである(ITT-LOCF)。
【0062】
【表19】

【0063】
評価可能被験者のデータセット−LOCF解析。評価可能被験者のデータセットのLOCF解析では、すべての4処置群について毎日の中程度から重度ののぼせ発症率の基線からの平均減少を観察し、E2ゲル2.5g/日用量群で、より顕著な減少が観察された(表11b及び図5b参照)。4週における毎日ののぼせ発症率の平均減少のE2ゲル2.5g/日群とプラセボとの間で臨床的に有意な差異(すなわち≧2.0)が観察されたが(群間の差異=約3.2)、2つのより低用量のE2ゲルはプラセボからの臨床的に有意な差異を示さなかった。
図5Bは、種々用量のエストラジオール投与後の毎日の中程度から重度ののぼせ発症率の基線からの平均変化を示すグラフである(評価可能-LOCF)。
【0064】
【表20】

【0065】
4週における毎日の中程度から重度ののぼせ発症率が90%以上又は100%減少した被験者の割合。治療を意図したデータセット-LOCF解析。ITTデータセットのLOCF解析では、E2ゲル2.5g/日用量群の過半数(55%、21/38)の被験者が4週における毎日の中程度から重度ののぼせ発症率の90%以上の減少を経験し、これに比し、プラセボ及びより低いE2ゲル用量群ではほぼ1/3の被験者が経験した(表11c参照)。E2ゲル2.5g/日用量群の24%の被験者は、4週で100%減少した(すなわち、中程度から重度ののぼせなし)。
【0066】
【表21】

【0067】
のぼせの基線重症度からの平均変化。ITTデータセットのLOCF解析では、基線の毎日ののぼせ平均重症度からの平均低減をすべての4処置群について観察し、E2ゲル2.5g/日用量群で顕著な低減が観察され、E2ゲル1.25g/日用量群では、より低度だった(表11d及び図5c参照)。E2ゲル2.5g/日用量群の毎日ののぼせ平均重症度の経時的な低減は、毎日ののぼせ発症率の平均減少の4周で見られるプラセボからの臨床的に意味のある差異に好意的である。
図5Cは、種々の用量のエストラジオール投与後の毎日ののぼせ平均重症度の基線からの平均変化を示すグラフである(ITT-LOCF)。
【0068】
【表22】

【0069】
薬物用量、薬物濃度、及び応答に対する関係。エストラジオール、エストロン、及びエストロンスルフェート。日1の投与前と、エストラジオール、エストロン、及びエストロンスルフェート濃度の決定についての研究完了時の最低値血清試料を得た。まとめると、5pg/mLの検出限界未満のすべての分析結果を限界値に等しく設定した(すなわち、5pg/mLの値を割り当てた)。1日及び4週におけるエストラジオール、エストロン、及びエストロンスルフェートの最低値濃度は処置群内で非常に可変だった(表11e参照)。可変性及び中程度の試料サイズを考慮してメジアン値について論じる。
すべての処置群にまたがり、1日におけるエストラジオール(5pg/mL)、エストロン(18.5〜22.0pg/mL)、及びエストラジオール対エストロン比(0.29対0.42)のメジアン値は閉経後のプロファイルと一致した(表11e)。しかし、1日でこの基準を満たし損ねたスクリーニングで20pg/mL未満のエストラジオールという基準に包含される被験者もいることに留意せよ。分析固有の可変性とは別に、この推測される理由は、その前年内に閉経期が開始した被験者のホルモンレベルの不安定性、50歳未満の被験者における卵巣摘出しない子宮摘出、或いはスクリーニング期間中のエストロン製品の使用に関して報告されない非コンプライアンスがありうる。
E2ゲルで治療後、4週におけるメジアンエストラジオール、エストロン、及びエストロンスルフェート濃度は、E2ゲル用量投与に応じた処置群間の分別を示した(表11e参照)。4週におけるメジアンエストラジオール値は、E2ゲル0.625g/日、1.25g/日、及び2.5g/日用量群でそれぞれ12pg/mL、23pg/mL、及び33pg/mLだった。
【0070】
【表23】


【0071】
安全性の結論。約4週間0.625〜2.5gのE2ゲル(0.375〜1.5mgのエストラジオール)の毎日適用は安全であり、かつこの集団の閉経後の女性でよく耐えられた。E2ゲル群の中で処置創発性有害事象の全体的発生率は用量レベルによっては上昇せず(各用量群で約50%)、かつプラセボ群(40%)の発生率にかなり匹敵した。生殖器系及び乳房障害に関する有害事象は、この分類の薬物で予測されるように、プラセボ(5%)に対してE2ゲル群ではより高頻度に報告された(0.625g/日、1.25g/日、及び2.5g/日のE2ゲル群でそれぞれ10%、18%、及び13%)。2人以上のE2ゲル被験者で報告されたこれら事象として、乳房圧痛、子宮出血(膣発疹)、乳頭痛、子宮けいれん、及び帯下が挙げられる。これら事象の発生率とE2ゲル用量又はエストラジオールレベルとの間の関係は明かでなかった。これら事象のため研究を中断した被験者はいなかった。
乳房検査は、1人の被験者を除いてすべての最終評価でE2ゲルの影響を示さなかった:この被験者(E2ゲル2.5g/日)について観察された変化は、穏やかな乳房圧痛という報告された有害事象の1つに対応し、最後の研究の薬物投与後1週間で消散した。
研究中、死亡及び重度の有害事象は起こらなかった。2人の被験者(両者ともE2ゲル1.25g/日)は有害事象のため二重盲検処置を中断し、その1人だけがめまいに関係すると考えられ;両被験者は回復した。
基線から4週評価までの平均変化の解析では、臨床検査室結果に関する臨床的に意味のあるE2ゲルの影響は観察されなかった。4週において正常基線から異常レベルへのシフトのある被験者の割合は、E2ゲル群中の正常値を超えるコレステロールレベルへのシフトの高発生率と、正常を超えるBUNレベルへのシフトの見かけのE2ゲル用量に関連して上昇する発生率を示したが、群当たり約10人の被験者だけがコレステロール比較に含まれ(大部分の被験者は正常基線コレステロールレベルを超えていた)、かつBUNシフトは、他の腎臓機能指標又は腎不全の臨床症状で対応するシフトに関連しなかった。
生命徴候、体重、身体検査、又は皮膚刺激評価で、臨床的に重要なE2ゲルの影響は観察されなかった。
結論。経皮ETは、皮膚を介してエストラジオールを直接体循環内に送達するので、経口ETで起こる初回通過肝臓代謝を回避し、かつ経口ETで見られる肝胆道系に及ぼす影響を回避する。基線から4週の評価までの平均変化で注目される統計的に有意又は臨床的に意味のある変化はいずれの肝機能パラメーターでも観察されなかった。E2ゲル0.625g/日用量群の1人の被験者は、研究者が臨床的に有意であると感じたASTの上昇を経験し;また、この被験者は、基線で高いALT(44u/L)を有し、最終評価では70u/Lに増加した。E2ゲル1.25g/日又はE2ゲル2.5g/日用量群では肝機能試験で臨床的に有意な増加のある被験者は観察されなかった。
【0072】
研究ゲルの局所適用に関連する有害事象は最小限であり、かつE2ゲル1.25g/日用量群でより頻繁に報告された。適用部位の乾燥皮膚が、研究薬物の適用に関連して最も頻繁に報告された事象で、2人の被験者で起こった。これら事象は穏やかと考えられ、研究薬物について2週間を越えてから発生し、この事象は7日より長くは続かなかった。報告された他の皮膚関連事象として、適用部位におけるバーニング又はかゆみが挙げられ、各事象について1人の被験者で生じた。適用部位の処置創発性紅斑は生じなかった。
経口ETは胆汁コレステロール飽和指標の上昇を生じさせることが示されており、胆石病のリスク増加に関連するが、この効果は経皮ETでは明かでないようだ。ビリルビンレベルの臨床的に有意な変化が注目されたE2ゲル用量群の被験者はなく、コレステロール上昇、ビリルビン血症、又は胆石に関連する有害事象は報告されなかった。
最初は、経皮ETの使用は、経口ETで見られる血清脂質及びリポタンパク質の増加を回避するだろうと考えられたが、研究は、経口ETによるよりも遅く発生かつ進行するが、血清脂質及びリポタンパク質の変化が生じることを示した。この4週間の研究では、これらパラメーターで臨床的に意味のある平均変化は観察されなかったが、ちょうど4週の持続期間の処置では全体的変化は予想されないだろう。E2ゲル2.5g/日用量群の1人の被験者は、トリグリセリドに基線からの臨床的に有意な変化があったが、被験者の最終検査室血液採取は空腹時でなかった。なお、この被験者の基線コレステロールは287mg/dL、LDLは172mg/dLだった。
この研究の結果は、毎日0.625〜2.5g/日の用量で4週間投与されるE2ゲルは安全かつ良く耐えられることを示す。
【0073】
本発明により、上述した製剤と、その使用説明書を含むキットで製剤を提供することができる。キットは、一般的に製剤を保持する容器を含み、かつ要求に応じて製剤の所定薬用量又は所定体積を放出又は適用するためのディスペンサーを有する。このディスペンサーは、使用者による作動によって組成物の所定薬用量又は体積を自動的に放出することもできる。
本発明のキットは、パウチ、チューブ、ボトル、又は他の適切ないずれかの容器内に製剤を含みうる。キットは、各日使用者が活性成分の薬用量としてサシェ剤中に含まれた量の組成物を開けて適用するように、個々のサシェ剤中に詰めた単用量の製剤を含むことができる。キットは、容器に詰めた複数用量の組成物を含んでもよい。使用中、被験者に、皮膚に適用するための容器から所定量(“10セント銀貨量”などのような)の組成物を分配するように指導することができる。この発明の組成物の貯蔵は、アルミニウムチューブ内約25℃かつ60%の相対湿度のみならず40℃かつ75%の相対湿度で少なくとも約6週間でよい。
容器は、既知体積又は薬用量の製剤をディスペンサーの各作動で使用者によって分配されるように、計量ディスペンサーを含むことができる。一例では、製剤を計量用量ポンプボトル内で供給することができる。供給する製剤は、ポンプ上で各押し下げから特定重量又は体積(0.87gのような)が分配され、かつ3回のような複数回のポンプの作動によって被験者による適用のための所望薬用量の製剤を分配できるような濃度でよい。一例では、キットは、オリオン(Orion)計量用量ポンプボトルのような容器内に含まれたゲル製剤を含む。しかし、ポンプボトル型容器以外の容器、例えばスティック又はロールオン容器などを使用しうる。上述した本発明の特定の実施形態は本発明を限定するものではなく、当業者は、本発明の追加の実施形態及び特徴が添付の特許請求の範囲及びその均等範囲内であることを容易に決定することができる。
【0074】
本明細書は本発明の特定の実施形態について述べるが、当業者は本発明概念から逸脱することなく本発明の変形を創出することができる。従って、本明細書で開示した特定の実施形態は本発明の数局面の例示として意図したものなので、本明細書で記載かつ請求した発明は、これら実施形態による範囲に限定されるものではない。いずれの均等の実施形態も本発明の範囲内であることを意図する。実際、本明細書で示し、かつ記載した実施形態に加え、前記説明から本発明の種々の変形が明らかになるだろう。このような変形も添付の特許請求の範囲内であることを意図する。
【図面の簡単な説明】
【0075】
【図1】装填チャンバー内、ヒトの切除した皮膚と10mgのテストステロン/cm2を用いたインビトロモデルにおける種々量のラウリルアルコール(LA)を含む製剤中のテストステロンの経時的な薬物流量を示すグラフである(n=3-4±SD)。
【図2】装填チャンバー内、ヒトの切除した皮膚と50mgのテストステロン/cm2を用いたインビトロモデルにおける種々量のラウリルアルコール(LA)を含む製剤中のテストステロンの経時的な薬物流量を示すグラフである(n=3-4±SD)。
【図3A】1%T+0%LAゲルのインビボ投与後の1、7、14及び21日目におけるサンプリング期間中のメジアン総テストステロン血清濃度を示すグラフである。
【図3B】1%T+0%LAゲルのインビボ投与後の1、7、14及び21日目におけるサンプリング期間中のメジアン遊離テストステロン血清濃度を示すグラフである。
【図3C】1%T+0%LAゲルのインビボ投与後の1、7、14及び21日目におけるサンプリング期間中のメジアン生物利用可能テストステロン血清濃度を示すグラフである。
【図3D】1%T+2%LAゲルによる異なった用量レジメとインビボ処置後の1、7、14日目におけるサンプリング期間中の平均総テストステロン血清濃度を示すグラフである。
【図3E】1%T+2%LAゲルによる異なった用量レジメとインビボ処置後の1、7、14日目におけるサンプリング期間中の平均生物利用可能テストステロン血清濃度を示すグラフである。
【図3F】1%T+2%LAゲルによる異なった用量レジメとインビボ処置後の1、7、14日目におけるサンプリング期間中の平均遊離テストステロン血清濃度を示すグラフである。
【図4A】E2+0%LAゲルの単用量投与後のエストラジオール(E2)の平均血清濃度を示すグラフである(a=0.75mg E2;b=1.50mg E2)。
【図4B】E2+0%LAゲルの反復投与後の経時的なE2の平均最低値濃度を示すグラフである(a=0.75mg E2;b=1.50mg E2)。
【図4C】ある被験者におけるE2+0%LAゲルの反復投与後の経時的なE2の平均最低値濃度を示すグラフである(2.5g;±SD;スケールからはずれた240.0H-値(28.0ng/dl))。
【図4D】両用量でのE2+0%LAゲルの反復投与後の経時的なE2の個々の最低値濃度を示すグラフである。
【図4E】E2+0%LAゲルの複数用量投与後のE2の平均血清濃度を示すグラフである(a=0.75mg E2;b=1.50mg E2)。
【図4F】E2+0%LAゲルの単用量投与後のエストロン(E1)の平均血清濃度を示すグラフである(a=0.75mg E2;b=1.50mg E2)。
【図4G】E2+0%LAゲルの反復投与後のE1の平均最低値血清濃度を示すグラフである(a=0.75mg E2;b=1.50mg E2)。
【図4H】E2+0%LAゲルの複数用量投与後のE1の平均血清濃度を示すグラフである(a=0.75mg E2;b=1.50mg E2)。
【図4I】E2+0%LAゲルの単用量投与後のエストロン-スルフェート(E1-スルフェート)の平均血清濃度を示すグラフである(a=0.75mg E2;b=1.50mg E2)。
【図4J】E2+0%LAゲルの複数用量投与後のE1-スルフェートの平均最低値濃度を示すグラフである(a=0.75mg E2;b=1.50mg E2)。
【図4K】E2+0%LAゲルの複数用量投与後のE1-スルフェートの平均血清濃度を示すグラフである(a=0.75mg E2;b=1.50mg E2)。
【図5A】種々用量のE2+0%LAゲル投与後の中程度から重症度ののぼせの毎日の基線からの平均変化を示すグラフである(治療を意図した効力集団(Intent-to-treat efficacy population)(“ITT”);早期に中断した被験者のために早めて行った最後の観察の方法(Method of last observation carried forward for subjects who discontinued early )(“LOCF”))。
【図5B】種々用量のE2+0%LAゲル投与後の中程度から重症度ののぼせの毎日の基線からの平均変化を示すグラフである。
【図5C】種々用量のE2+0%LAゲル投与後の毎日ののぼせ平均重症度基線からの平均変化を示すグラフである(ITT-LOCF)。
【特許請求の範囲】
【請求項1】
活性薬の経皮又は経粘膜投与用製剤であって、以下の成分:
少なくとも1種の活性薬であって、該活性薬はテストステロン単独ではなく、かつ該活性薬がエストロゲン又はプロゲスチンの場合、該製剤中にそれぞれ治療的に有効な量のプロゲスチン又はエストロゲンは存在しない活性薬;及び
アルカノールと、多価アルコールと、哺乳類の皮膚又は粘膜表面を通して前記活性薬の浸透性を高めるために十分な量の浸透エンハンサーとを含む送達媒体;
を含み、
該製剤は、実質的に長鎖脂肪アルコール、長鎖脂肪酸及び長鎖脂肪エステルがなく、該製剤の使用中の望ましくない臭い及び刺激を回避することを特徴とする製剤。
【請求項2】
前記送達媒体が皮膚又は粘膜表面による前記少なくとも1種の活性薬の吸収を促進して、該表面からの前記製剤の移動又は除去を最小限にするように、前記アルカノールが前記送達媒体の約5〜80質量%の量で存在し、前記多価アルコールが前記送達媒体の約1〜30質量%の量で存在し、かつ前記浸透エンハンサーが前記送達媒体の約0.2〜30質量%の量で存在する、請求項1の製剤。
【請求項3】
前記アルカノールを水と組み合わせてヒドロアルコール性混合物を形成し、このヒドロアルコール性混合物が前記送達媒体の約40〜約98質量%の量で存在し、かつ前記アルカノールが前記混合物の約5〜80質量%の量で存在し、かつ前記水が前記混合物の約20〜95質量%の量で存在する、請求項2の製剤。
【請求項4】
前記活性薬が、該製剤の約0.01%〜2%の量で存在するエストラジオールであり;前記アルカノールが該製剤の約20〜65%の量で存在し;前記多価アルコールが、該製剤の約1%〜15%の量で存在するプロピレングリコールであり;前記浸透エンハンサーが、該製剤の約1%〜15%の量で存在するジエチレングリコールモノエチルエーテルであり;かつ更に該製剤が、該製剤の0.05%〜約4%の量で存在するゲル化剤と、該製剤の約0.05%〜1%の量で存在する中和剤と、該製剤の約20%〜65%の量で存在する水とを含む、請求項2の製剤。
【請求項5】
更に金属イオン封鎖剤を含む、請求項4の製剤。
【請求項6】
前記多価アルコールと前記浸透エンハンサーが、2:1〜1:1の質量比で存在する、請求項2の製剤。
【請求項7】
前記アルカノールが、エタノール、イソプロパノール、及びn-プロパノールから成る群より選択されるC2〜C4アルコールであり、前記多価アルコールがポリプロピレングリコールであり、かつ前記浸透エンハンサーがテトラグリコールフロール又はジエチレンエーテルのモノアルキルエーテルである、請求項1の製剤。
【請求項8】
前記活性薬が、アンドロゲン、エストロゲン、プロゲスチン、又はその組合せである、請求項1の製剤。
【請求項9】
前記アンドロゲンが、テストステロン、17-β-ヒドロキシアンドロステノン、テストステロンエステル、メチルテストステロン、テストラクトン、オキシメトロン、フルオキシメステロン、アンドロステロン、アンドロステロンアセテート、アンドロステロンプロピオネート、アンドロステロンベンゾエート、アンドロステンジオール、アンドロステンジオール-3-アセテート、アンドロステンジオール-17-アセテート、アンドロステンジオール-3,17-ジアセテート、アンドロステンジオール-17-ベンゾエート、アンドロステンジオール-3-アセテート-17-ベンゾエート、アンドロステンジオン、デヒドロエピアンドロステロン硫酸ナトリウム、4-ジヒドロテストステロン、5アジヒドロテストステロン、ドロモスタノロン、ドロモスタノロンプロピオネート、エチルエストレノール、ナンドロロンフェンプロピオネート、ナンドロロンデカノエート、ナンドロロンフリルプロピオネート、ナンドロロンシクロヘキサンプロピオネート、ナンドロロンベンゾエート、ナンドロロンシクロヘキサンカルボキシレート、オキサンドロロン、及びスタノゾロール又はそのいずれかの組合せから成る群より選択される、請求項8の製剤。
【請求項10】
前記エストロゲンが、17-β-エストラジオール、エストラジオール、エストラジオールベンゾエート、エストラジオール-17-β-シピオネート、エストリオール、エストロン、エチニルエストラジオール、メストラノール、モキセストロール、ミタトリエンジオール、リン酸ポリエストラジオール、キネストラジオール、及びキネストロール又はそのいずれかの組合せから成る群より選択される、請求項8の製剤。
【請求項11】
該製剤が、更に少なくとも1種のゲル化剤、中和剤、緩衝剤、湿潤剤、保湿剤、界面活性剤、抗酸化剤、緩和剤、又は緩衝液を含む、請求項1の製剤。
【請求項12】
該製剤が、ゲル、ローション、クリーム、スプレー、エアゾール、軟膏、エマルジョン、懸濁液、リポソーム系、ラッカー、パッチ、絆創膏、又は密封包帯の形態である、請求項1の製剤。
【請求項13】
被験者のホルモン障害の治療方法であって、該治療が必要な被験者に、有効量の少なくとも1種の活性薬と、アルカノール、多価アルコール及び前記活性薬の哺乳類の皮膚及び粘膜表面を通して浸透性を高めるために十分な量の浸透エンハンサーを含む送達媒体とを含む製剤を投与することを含み;前記ホルモン障害が、性腺機能低下症、女性の閉経期症候、女性の性的機能不全、機能減退性性欲障害、及び副腎不全から成る群より選択され、かつ前記製剤の投与が、前記ホルモン障害の少なくとも1つの臨床症候の頻度を低減することを特徴とする方法。
【請求項14】
前記製剤が、実質的に長鎖脂肪アルコール、長鎖脂肪酸、及び長鎖脂肪エステルがなく、該製剤の使用中の望ましくない臭い及び刺激を回避する請求項13の方法。
【請求項15】
前記活性薬が、アンドロゲン、エストロゲン、プロゲスチン、又はその組合せである、請求項13の方法。
【請求項16】
前記アンドロゲンが、テストステロン、17-β-ヒドロキシアンドロステノン、テストステロンエステル、メチルテストステロン、テストラクトン、オキシメトロン、フルオキシメステロン、アンドロステロン、アンドロステロンアセテート、アンドロステロンプロピオネート、アンドロステロンベンゾエート、アンドロステンジオール、アンドロステンジオール-3-アセテート、アンドロステンジオール-17-アセテート、アンドロステンジオール-3,17-ジアセテート、アンドロステンジオール-17-ベンゾエート、アンドロステンジオール-3-アセテート-17-ベンゾエート、アンドロステンジオン、デヒドロエピアンドロステロン硫酸ナトリウム、4-ジヒドロテストステロン、5アジヒドロテストステロン、ドロモスタノロン、ドロモスタノロンプロピオネート、エチルエストレノール、ナンドロロンフェンプロピオネート、ナンドロロンデカノエート、ナンドロロンフリルプロピオネート、ナンドロロンシクロヘキサンプロピオネート、ナンドロロンベンゾエート、ナンドロロンシクロヘキサンカルボキシレート、オキサンドロロン、及びスタノゾロール又はそのいずれかの組合せから成る群より選択される、請求項15の方法。
【請求項17】
前記活性薬が、該製剤の約0.05%〜10%の量で存在するテストステロンであり;前記アルカノールが該製剤の約20〜65%の量で存在し;前記多価アルコールが、該製剤の約1%〜15%の量で存在するプロピレングリコールであり;前記浸透エンハンサーが、該製剤の約1%〜15%の量で存在するジエチレングリコールモノエチルエーテルであり;かつ更に該製剤が、該製剤の0.01%〜約4%の量で存在するゲル化剤と、該製剤の約0.05%〜1%の量で存在する中和剤と、該製剤の約20%〜65%で存在する水とを含む、請求項16の方法。
【請求項18】
前記製剤が、更に金属イオン封鎖剤を含む、請求項17の方法。
【請求項19】
前記被験者が女性被験者であり、前記活性薬がテストステロンであり、かつテストステロンの治療的に有効な用量が24時間毎に約2.2ミリグラム〜約0.88グラムである、請求項16の方法。
【請求項20】
前記被験者が女性被験者であり、前記活性薬がテストステロンであり、かつ更に該方法が、テストステロンの血清レベルを約142ナノグラム/デシリットルに上昇させる、請求項16の方法。
【請求項21】
前記被験者が女性被験者であり、前記活性薬がテストステロンであり、かつ更に該方法が、テストステロンの血清レベルを約17ピコグラム/ミリリットルに上昇させる、請求項16の方法。
【請求項22】
前記エストロゲンが、17-β-エストラジオール、エストラジオール、エストラジオールベンゾエート、エストラジオール-17-β-シピオネート、エストリオール、エストロン、エチニルエストラジオール、メストラノール、モキセストロール、ミタトリエンジオール、リン酸ポリエストラジオール、キネストラジオール、及びキネストロール又はそのいずれかの組合せから成る群より選択される、請求項15の方法。
【請求項23】
前記被験者が女性被験者であり、前記活性薬がエストラジオールであり、かつエストラジオールの治療的に有効な用量が24時間毎に約0.375〜約1.5ミリグラムである、請求項22の方法。
【請求項24】
前記被験者が女性被験者であり、前記活性薬がエストラジオールであり、かつエストラジオールの遊離血清濃度が約8.8ナノグラムに上昇する、請求項22の方法。
【請求項25】
前記被験者が女性被験者であり、前記活性薬がエストラジオールであり、かつ更に該方法が、エストロンの血清レベルを約10.4ナノグラム/デシリットルに上昇させる、請求項22の方法。
【請求項26】
前記被験者が女性被験者であり、前記活性薬がエストラジオールであり、かつ更に該方法が、エストロンの血清レベルを約193ナノグラム/デシリットルに上昇させる、請求項22の方法。
【請求項27】
前記プロゲスチンが、アリルエストレノール、アナゲストン、酢酸クロルマジノン、酢酸デルマジノン、デメゲストン、デソゲストレル、ジメチステロン、ジドロゲステロン、エチニルエストレノール、エチステロン、エチノジオール、二酢酸エチノジオール、酢酸フルロゲストン、ゲストデン、カプロン酸ゲストノロン、ハロプロゲステロン、17-ヒドロキシ-16-メチレン-プロゲステロン、17-α-ヒドロキシプロゲステロン、カプロン酸17-α-ヒドロキシゲステロン、リネストレノール、メドロゲストン、メドロキシプロゲステロン、酢酸メゲストロール、メレンゲストロール、ノルエチンドロン、酢酸ノルエチンドロン、ノルエチノドレル、ノルゲステロン、ノルゲスチメート、ノルゲストレル、ノルゲストリエノン、19-ノルプロゲステロン、ノルビニステロン、ペンタゲストロン、プロゲステロン、天然プロゲステロン、プロメゲストン、キンゲストロン、及びトレンゲストン又はそのいずれかの組合せから成る群より選択される、請求項15の方法。
【請求項28】
前記活性薬が、同時に投与される2種の異なる活性薬の組合せである、請求項13の方法。
【請求項29】
女性被験者を性腺機能低下症、女性の閉経期症候、又は女性の性的障害について治療し、かつ前記製剤が、テストステロンと、更にエストロゲン、エストラジオール、17-β-エストラジオール、エチニルエストラジオール、エストリオール、スクシネート、エストリオールジヘキサネート及びエストリオールスルファメートから成る群より選択される活性薬とを組み合わせて含む、請求項15の方法。
【請求項30】
女性被験者を性腺機能低下症又は女性の閉経期症候について治療し、かつ前記活性薬がエストラジオールとプロゲスチンを組み合わせて含む、請求項15の方法。
【請求項31】
男性被験者を性腺機能低下症について治療し、かつ前記活性薬が少なくとも1種のアンドロゲンを含む、請求項16の方法。
【請求項32】
前記少なくとも1種のアンドロゲンが、メチル-テストステロンとメタンドロステノレートを組み合わせて含む、請求項31の方法。
【請求項33】
該方法が副腎不全の患者を治療することを含み、かつ前記活性薬がデヒドロエピアンドロステロン(DHEA)を含む、請求項13の方法。
【請求項34】
前記アルカノールが、エタノール、イソプロパノール、及びn-プロパノールから成る群より選択され、前記多価アルコールがプロピレングリコールであり、かつ前記浸透エンハンサーがジエチレングリコールのモノアルキルエーテル又はテトラグリコールフロールであり、前記アルカノールが水との混合物状態であり、この混合物が前記送達媒体の約40〜約98%の量で存在する、請求項13の方法。
【請求項35】
前記製剤が、ゲル、ローション、クリーム、スプレー、エアゾール、軟膏、エマルジョン、懸濁液、リポソーム系、ラッカー、パッチ、絆創膏、又は密封包帯の形態である、請求項13の方法。
【請求項36】
被験者のホルモン障害の治療方法であって、該治療が必要な被験者に、少なくとも1種の活性薬であって、テストステロン単独ではなく、かつ該活性薬がエストロゲン又はプロゲスチンの場合、該製剤中にそれぞれ治療的に有効な量のプロゲスチン又はエストロゲンは存在しない活性薬、及び脂肪族アルコールと、多価アルコールと、皮膚又は粘膜表面を通しての前記活性薬の浸透性を高めるために十分な量の浸透エンハンサーとを含む送達媒体を含む製剤を投与することを含み;
前記製剤が、実質的に長鎖脂肪アルコール、長鎖脂肪酸、及び長鎖脂肪エステルがなく、望ましくない臭い及び刺激を回避することを特徴とする方法。
【請求項37】
前記送達媒体が、衣類又は他の存在するものへの前記製剤の移動を低減又は防止するために十分な量で存在し、それによって前記製剤による衣類の汚染を最小限にする、請求項36の方法。
【請求項38】
前記多価アルコールが、前記媒体の約1%〜30%の量で存在し、前記脂肪族アルコールが、前記媒体の約5〜約80質量%の量で存在し、前記浸透エンハンサーが、前記媒体の約1%〜30%の量で存在し、かつ任意に前記媒体中に水が存在してよい、請求項36の方法。
【請求項39】
以下の成分:
少なくとも1種の活性薬;及び
アルカノールと、多価アルコールと、哺乳類の皮膚又は粘膜表面を通して前記活性薬の浸透性を高めるために十分な量のテトラグリコールフロール浸透エンハンサーとを含む送達媒体;
を含むことを特徴とする経皮又は経粘膜投与用製剤。
【請求項40】
前記製剤が、実質的に長鎖脂肪アルコール、長鎖脂肪酸、及び長鎖脂肪エステルがなく、該製剤の使用中の望ましくない臭い及び刺激を回避することを特徴とする請求項39の製剤。
【請求項41】
前記送達媒体が、皮膚又は粘膜表面による前記少なくとも1種の活性薬の吸収を促進して、該表面からの前記製剤の移動又は除去を最小限にするように、前記アルカノールが前記送達媒体の約5〜80質量%の量で存在し、前記多価アルコールが前記送達媒体の約1〜30質量%の量で存在し、かつ前記浸透エンハンサーがグルコフロールであり、前記送達媒体の約1〜30質量%の量で存在する、請求項39の製剤。
【請求項42】
前記アルカノールが水と結合してヒドロアルコール性混合物を形成し、このヒドロアルコール性混合物が前記送達媒体の約40〜約98質量%の量で存在し、かつ前記アルカノールが前記混合物の約5〜80質量%の量で存在し、かつ前記水が前記混合物の約20〜95質量%の量で存在する、請求項41の製剤。
【請求項43】
前記多価アルコールと前記浸透エンハンサーが、2:1〜1:1の質量比で存在する、請求項41の製剤。
【請求項44】
前記アルカノールが、エタノール、イソプロパノール、及びn-プロパノールから成る群より選択されるC2〜C4アルコールであり、かつ前記多価アルコールがポリプロピレングリコールである、請求項41の製剤。
【請求項45】
前記活性薬がアンドロゲン、エストロゲン、プロゲスチン、又はその組合せである、請求項39の製剤。
【請求項46】
前記アンドロゲンが、テストステロン、17-β-ヒドロキシアンドロステノン、テストステロンエステル、メチルテストステロン、テストラクトン、オキシメトロン、フルオキシメステロン、アンドロステロン、アンドロステロンアセテート、アンドロステロンプロピオネート、アンドロステロンベンゾエート、アンドロステンジオール、アンドロステンジオール-3-アセテート、アンドロステンジオール-17-アセテート、アンドロステンジオール-3,17-ジアセテート、アンドロステンジオール-17-ベンゾエート、アンドロステンジオール-3-アセテート-17-ベンゾエート、アンドロステンジオン、デヒドロエピアンドロステロン硫酸ナトリウム、4-ジヒドロテストステロン、5アジヒドロテストステロン、ドロモスタノロン、ドロモスタノロンプロピオネート、エチルエストレノール、ナンドロロンフェンプロピオネート、ナンドロロンデカノエート、ナンドロロンフリルプロピオネート、ナンドロロンシクロヘキサンプロピオネート、ナンドロロンベンゾエート、ナンドロロンシクロヘキサンカルボキシレート、オキサンドロロン、及びスタノゾロール又はそのいずれかの組合せから成る群より選択される、請求項45の製剤。
【請求項47】
前記エストロゲンが、17-β-エストラジオール、エストラジオール、エストラジオールベンゾエート、エストラジオール-17-β-シピオネート、エストリオール、エストロン、エチニルエストラジオール、メストラノール、モキセストロール、ミタトリエンジオール、リン酸ポリエストラジオール、キネストラジオール、及びキネストロール又はそのいずれかの組合せから成る群より選択される、請求項45の製剤。
【請求項48】
該製剤が、更に少なくとも1種のゲル化剤、中和剤、緩衝剤、湿潤剤、保湿剤、界面活性剤、抗酸化剤、緩和剤、又は緩衝液を含む、請求項39の製剤。
【請求項49】
該製剤が、ゲル、ローション、クリーム、スプレー、エアゾール、軟膏、エマルジョン、懸濁液、リポソーム系、ラッカー、パッチ、絆創膏、又は密封包帯の形態である、請求項39の製剤。
【請求項50】
被験者のホルモン障害の治療方法であって、該治療が必要な被験者に、少なくとも1種の活性薬及び脂肪族アルコールと、多価アルコールと、皮膚又は粘膜表面を貫く前記活性薬の浸透性を高めるために十分な量のテトラグリコールフロール浸透エンハンサーとを含む送達媒体を含んでなる製剤を投与することを含む方法。
【請求項51】
前記製剤が、実質的に長鎖脂肪アルコール、長鎖脂肪酸、及び長鎖脂肪エステルがなく、望ましくない臭い及び刺激を回避することを特徴とする50の方法。
【請求項52】
前記活性薬が、アンドロゲン、エストロゲン、プロゲスチン、又はその組合せである、請求項50の方法。
【請求項53】
前記製剤の投与が、前記ホルモン障害の少なくとも1つの臨床症候の頻度を低減する、請求項50の方法。
【請求項54】
前記ホルモン障害が、性腺機能低下症、女性の閉経期症候、女性の性的機能不全、機能減退性性欲障害、及び副腎不全を含む、請求項50の方法。
【請求項55】
前記製剤の投与が、のぼせ、寝汗、膣萎縮、性欲減退、及び骨粗しょう症、インポテンス、筋衰弱を含む少なくとも1つの臨床症候の頻度を低減する、請求項54の方法。
【請求項56】
前記多価アルコールが、前記媒体の約1%〜30%の量で存在し、前記脂肪族アルコールが、前記媒体の約5〜80質量%の量で存在し、前記浸透エンハンサーが、前記媒体の約1%〜30%の量で存在し、かつ前記媒体中に任意に水が存在してよい、請求項50の方法。
【請求項57】
前記製剤が、クリーム、軟膏、ゲル又はローションの形態である、請求項50の方法。
【請求項58】
請求項1〜12又は39〜49のいずれか1項に記載の製剤の、被験者のホルモン障害治療用薬物製造のための使用。
【請求項59】
前記ホルモン障害が、性腺機能低下症、女性の閉経期症候、女性の性的機能不全、機能減退性性欲障害、及び副腎不全から成る群より選択される、請求項58に記載の使用。
【請求項60】
前記活性薬が、アンドロゲン、エストロゲン、プロゲスチン、又はその組合せである、請求項58又は59に記載の使用。
【請求項61】
前記アンドロゲンが、テストステロン、17-β-ヒドロキシアンドロステノン、テストステロンエステル、メチルテストステロン、テストラクトン、オキシメトロン、フルオキシメステロン、アンドロステロン、アンドロステロンアセテート、アンドロステロンプロピオネート、アンドロステロンベンゾエート、アンドロステンジオール、アンドロステンジオール-3-アセテート、アンドロステンジオール-17-アセテート、アンドロステンジオール-3,17-ジアセテート、アンドロステンジオール-17-ベンゾエート、アンドロステンジオール-3-アセテート-17-ベンゾエート、アンドロステンジオン、デヒドロエピアンドロステロン硫酸ナトリウム、4-ジヒドロテストステロン、5アジヒドロテストステロン、ドロモスタノロン、ドロモスタノロンプロピオネート、エチルエストレノール、ナンドロロンフェンプロピオネート、ナンドロロンデカノエート、ナンドロロンフリルプロピオネート、ナンドロロンシクロヘキサンプロピオネート、ナンドロロンベンゾエート、ナンドロロンシクロヘキサンカルボキシレート、オキサンドロロン、及びスタノゾロール又はそのいずれかの組合せから成る群より選択される、請求項60に記載の使用。
【請求項62】
前記エストロゲンが、17-β-エストラジオール、エストラジオール、エストラジオールベンゾエート、エストラジオール-17-β-シピオネート、エストリオール、エストロン、エチニルエストラジオール、メストラノール、モキセストロール、ミタトリエンジオール、リン酸ポリエストラジオール、キネストラジオール、及びキネストロール又はそのいずれかの組合せから成る群より選択される、請求項60に記載の使用。
【請求項63】
前記プロゲスチンが、アリルエストレノール、アナゲストン、酢酸クロルマジノン、酢酸デルマジノン、デメゲストン、デソゲストレル、ジメチステロン、ジドロゲステロン、エチニルエストレノール、エチステロン、エチノジオール、二酢酸エチノジオール、酢酸フルロゲストン、ゲストデン、カプロン酸ゲストノロン、ハロプロゲステロン、17-ヒドロキシ-16-メチレン-プロゲステロン、17-α-ヒドロキシプロゲステロン、カプロン酸17-α-ヒドロキシゲステロン、リネストレノール、メドロゲストン、メドロキシプロゲステロン、酢酸メゲストロール、メレンゲストロール、ノルエチンドロン、酢酸ノルエチンドロン、ノルエチノドレル、ノルゲステロン、ノルゲスチメート、ノルゲストレル、ノルゲストリエノン、19-ノルプロゲステロン、ノルビニステロン、ペンタゲストロン、プロゲステロン、天然プロゲステロン、プロメゲストン、キンゲストロン、及びトレンゲストン又はそのいずれかの組合せから成る群より選択される、請求項60に記載の使用。
【請求項64】
有効用量の少なくとも1種の活性薬の哺乳類の皮膚又は粘膜表面を貫く浸透性を高めるための浸透エンハンサーの使用であって、前記浸透エンハンサーを、被験者のホルモン障害の治療を意図した製剤の、アルカノールと多価アルコールを含む送達媒体に添加し;前記ホルモン障害が、性腺機能低下症、女性の閉経期症候、女性の性的機能不全、機能減退性性欲障害、及び副腎不全から成る群より選択され、かつ前記製剤の投与が、前記ホルモン障害の少なくとも1つの臨床症候の頻度を低減することを特徴とする使用。
【請求項65】
有効用量の少なくとも1種の活性薬の哺乳類の皮膚又は粘膜表面を通しての浸透性を高めるための浸透エンハンサーの使用であって、前記浸透エンハンサーを、アルカノールと多価アルコールを含む送達媒体に添加し、該製剤は実質的に長鎖脂肪アルコール、長鎖脂肪酸、及び長鎖脂肪エステルがなく、望ましくない臭い及び刺激を回避し、かつ前記活性薬はテストステロン単独ではなく、かつ該活性薬がエストロゲン又はプロゲスチンの場合、該製剤中にそれぞれ治療的に有効な量のプロゲスチン又はエストロゲンは存在しないという条件を特徴とする使用。
【請求項66】
有効用量の少なくとも1種の活性薬の哺乳類の皮膚又は粘膜表面を通しての浸透性を高めるための浸透エンハンサーの使用であって、前記浸透エンハンサーを、アルカノールと多価アルコールを含む送達媒体に添加し、かつ前記浸透エンハンサーがテトラグリコールフロールで、かつ皮膚又は粘膜表面を貫く前記活性薬の浸透性を高めるために十分な量で製剤中に存在することを特徴とする使用。
【請求項67】
被験者内の活性薬の血清レベルを高めるために被験者を治療するためのキットであって、以下の要素:少なくとも1種の活性薬及びアルカノールと、多価アルコールと、皮膚又は粘膜表面を通して前記活性薬の浸透性を高めるために十分な量の浸透エンハンサーとを含む送達媒体を含む製剤であって、実質的に長鎖脂肪アルコール、長鎖脂肪酸及び長鎖脂肪エステルがなく、その使用中のこのような化合物由来の望ましくない臭い及び刺激を回避する製剤、及び
前記製剤を保持し、かつ必要に応じて前記製剤の所定用量又は体積を放出又は適用するためのディスペンサーを含む容器、
を含むことを特徴とするキット。
【請求項68】
前記ディスペンサーが、使用者の作動によって自動的に所定用量又は体積を放出する、請求項67のキット。
【請求項69】
前記ディスペンサーがポンプである、請求項67のキット。
【請求項70】
活性薬の経皮又は経粘膜投与用製剤であって、以下の成分:
デヒドロエピアンドロステロン(DHEA)を含む少なくとも1種の活性薬;及び
アルカノールと、多価アルコールと、哺乳類の皮膚又は粘膜表面を貫く前記活性薬の浸透性を高めるために十分な量の浸透エンハンサーとを含む送達媒体;
を含んでなる製剤。
【請求項1】
活性薬の経皮又は経粘膜投与用製剤であって、以下の成分:
少なくとも1種の活性薬であって、該活性薬はテストステロン単独ではなく、かつ該活性薬がエストロゲン又はプロゲスチンの場合、該製剤中にそれぞれ治療的に有効な量のプロゲスチン又はエストロゲンは存在しない活性薬;及び
アルカノールと、多価アルコールと、哺乳類の皮膚又は粘膜表面を通して前記活性薬の浸透性を高めるために十分な量の浸透エンハンサーとを含む送達媒体;
を含み、
該製剤は、実質的に長鎖脂肪アルコール、長鎖脂肪酸及び長鎖脂肪エステルがなく、該製剤の使用中の望ましくない臭い及び刺激を回避することを特徴とする製剤。
【請求項2】
前記送達媒体が皮膚又は粘膜表面による前記少なくとも1種の活性薬の吸収を促進して、該表面からの前記製剤の移動又は除去を最小限にするように、前記アルカノールが前記送達媒体の約5〜80質量%の量で存在し、前記多価アルコールが前記送達媒体の約1〜30質量%の量で存在し、かつ前記浸透エンハンサーが前記送達媒体の約0.2〜30質量%の量で存在する、請求項1の製剤。
【請求項3】
前記アルカノールを水と組み合わせてヒドロアルコール性混合物を形成し、このヒドロアルコール性混合物が前記送達媒体の約40〜約98質量%の量で存在し、かつ前記アルカノールが前記混合物の約5〜80質量%の量で存在し、かつ前記水が前記混合物の約20〜95質量%の量で存在する、請求項2の製剤。
【請求項4】
前記活性薬が、該製剤の約0.01%〜2%の量で存在するエストラジオールであり;前記アルカノールが該製剤の約20〜65%の量で存在し;前記多価アルコールが、該製剤の約1%〜15%の量で存在するプロピレングリコールであり;前記浸透エンハンサーが、該製剤の約1%〜15%の量で存在するジエチレングリコールモノエチルエーテルであり;かつ更に該製剤が、該製剤の0.05%〜約4%の量で存在するゲル化剤と、該製剤の約0.05%〜1%の量で存在する中和剤と、該製剤の約20%〜65%の量で存在する水とを含む、請求項2の製剤。
【請求項5】
更に金属イオン封鎖剤を含む、請求項4の製剤。
【請求項6】
前記多価アルコールと前記浸透エンハンサーが、2:1〜1:1の質量比で存在する、請求項2の製剤。
【請求項7】
前記アルカノールが、エタノール、イソプロパノール、及びn-プロパノールから成る群より選択されるC2〜C4アルコールであり、前記多価アルコールがポリプロピレングリコールであり、かつ前記浸透エンハンサーがテトラグリコールフロール又はジエチレンエーテルのモノアルキルエーテルである、請求項1の製剤。
【請求項8】
前記活性薬が、アンドロゲン、エストロゲン、プロゲスチン、又はその組合せである、請求項1の製剤。
【請求項9】
前記アンドロゲンが、テストステロン、17-β-ヒドロキシアンドロステノン、テストステロンエステル、メチルテストステロン、テストラクトン、オキシメトロン、フルオキシメステロン、アンドロステロン、アンドロステロンアセテート、アンドロステロンプロピオネート、アンドロステロンベンゾエート、アンドロステンジオール、アンドロステンジオール-3-アセテート、アンドロステンジオール-17-アセテート、アンドロステンジオール-3,17-ジアセテート、アンドロステンジオール-17-ベンゾエート、アンドロステンジオール-3-アセテート-17-ベンゾエート、アンドロステンジオン、デヒドロエピアンドロステロン硫酸ナトリウム、4-ジヒドロテストステロン、5アジヒドロテストステロン、ドロモスタノロン、ドロモスタノロンプロピオネート、エチルエストレノール、ナンドロロンフェンプロピオネート、ナンドロロンデカノエート、ナンドロロンフリルプロピオネート、ナンドロロンシクロヘキサンプロピオネート、ナンドロロンベンゾエート、ナンドロロンシクロヘキサンカルボキシレート、オキサンドロロン、及びスタノゾロール又はそのいずれかの組合せから成る群より選択される、請求項8の製剤。
【請求項10】
前記エストロゲンが、17-β-エストラジオール、エストラジオール、エストラジオールベンゾエート、エストラジオール-17-β-シピオネート、エストリオール、エストロン、エチニルエストラジオール、メストラノール、モキセストロール、ミタトリエンジオール、リン酸ポリエストラジオール、キネストラジオール、及びキネストロール又はそのいずれかの組合せから成る群より選択される、請求項8の製剤。
【請求項11】
該製剤が、更に少なくとも1種のゲル化剤、中和剤、緩衝剤、湿潤剤、保湿剤、界面活性剤、抗酸化剤、緩和剤、又は緩衝液を含む、請求項1の製剤。
【請求項12】
該製剤が、ゲル、ローション、クリーム、スプレー、エアゾール、軟膏、エマルジョン、懸濁液、リポソーム系、ラッカー、パッチ、絆創膏、又は密封包帯の形態である、請求項1の製剤。
【請求項13】
被験者のホルモン障害の治療方法であって、該治療が必要な被験者に、有効量の少なくとも1種の活性薬と、アルカノール、多価アルコール及び前記活性薬の哺乳類の皮膚及び粘膜表面を通して浸透性を高めるために十分な量の浸透エンハンサーを含む送達媒体とを含む製剤を投与することを含み;前記ホルモン障害が、性腺機能低下症、女性の閉経期症候、女性の性的機能不全、機能減退性性欲障害、及び副腎不全から成る群より選択され、かつ前記製剤の投与が、前記ホルモン障害の少なくとも1つの臨床症候の頻度を低減することを特徴とする方法。
【請求項14】
前記製剤が、実質的に長鎖脂肪アルコール、長鎖脂肪酸、及び長鎖脂肪エステルがなく、該製剤の使用中の望ましくない臭い及び刺激を回避する請求項13の方法。
【請求項15】
前記活性薬が、アンドロゲン、エストロゲン、プロゲスチン、又はその組合せである、請求項13の方法。
【請求項16】
前記アンドロゲンが、テストステロン、17-β-ヒドロキシアンドロステノン、テストステロンエステル、メチルテストステロン、テストラクトン、オキシメトロン、フルオキシメステロン、アンドロステロン、アンドロステロンアセテート、アンドロステロンプロピオネート、アンドロステロンベンゾエート、アンドロステンジオール、アンドロステンジオール-3-アセテート、アンドロステンジオール-17-アセテート、アンドロステンジオール-3,17-ジアセテート、アンドロステンジオール-17-ベンゾエート、アンドロステンジオール-3-アセテート-17-ベンゾエート、アンドロステンジオン、デヒドロエピアンドロステロン硫酸ナトリウム、4-ジヒドロテストステロン、5アジヒドロテストステロン、ドロモスタノロン、ドロモスタノロンプロピオネート、エチルエストレノール、ナンドロロンフェンプロピオネート、ナンドロロンデカノエート、ナンドロロンフリルプロピオネート、ナンドロロンシクロヘキサンプロピオネート、ナンドロロンベンゾエート、ナンドロロンシクロヘキサンカルボキシレート、オキサンドロロン、及びスタノゾロール又はそのいずれかの組合せから成る群より選択される、請求項15の方法。
【請求項17】
前記活性薬が、該製剤の約0.05%〜10%の量で存在するテストステロンであり;前記アルカノールが該製剤の約20〜65%の量で存在し;前記多価アルコールが、該製剤の約1%〜15%の量で存在するプロピレングリコールであり;前記浸透エンハンサーが、該製剤の約1%〜15%の量で存在するジエチレングリコールモノエチルエーテルであり;かつ更に該製剤が、該製剤の0.01%〜約4%の量で存在するゲル化剤と、該製剤の約0.05%〜1%の量で存在する中和剤と、該製剤の約20%〜65%で存在する水とを含む、請求項16の方法。
【請求項18】
前記製剤が、更に金属イオン封鎖剤を含む、請求項17の方法。
【請求項19】
前記被験者が女性被験者であり、前記活性薬がテストステロンであり、かつテストステロンの治療的に有効な用量が24時間毎に約2.2ミリグラム〜約0.88グラムである、請求項16の方法。
【請求項20】
前記被験者が女性被験者であり、前記活性薬がテストステロンであり、かつ更に該方法が、テストステロンの血清レベルを約142ナノグラム/デシリットルに上昇させる、請求項16の方法。
【請求項21】
前記被験者が女性被験者であり、前記活性薬がテストステロンであり、かつ更に該方法が、テストステロンの血清レベルを約17ピコグラム/ミリリットルに上昇させる、請求項16の方法。
【請求項22】
前記エストロゲンが、17-β-エストラジオール、エストラジオール、エストラジオールベンゾエート、エストラジオール-17-β-シピオネート、エストリオール、エストロン、エチニルエストラジオール、メストラノール、モキセストロール、ミタトリエンジオール、リン酸ポリエストラジオール、キネストラジオール、及びキネストロール又はそのいずれかの組合せから成る群より選択される、請求項15の方法。
【請求項23】
前記被験者が女性被験者であり、前記活性薬がエストラジオールであり、かつエストラジオールの治療的に有効な用量が24時間毎に約0.375〜約1.5ミリグラムである、請求項22の方法。
【請求項24】
前記被験者が女性被験者であり、前記活性薬がエストラジオールであり、かつエストラジオールの遊離血清濃度が約8.8ナノグラムに上昇する、請求項22の方法。
【請求項25】
前記被験者が女性被験者であり、前記活性薬がエストラジオールであり、かつ更に該方法が、エストロンの血清レベルを約10.4ナノグラム/デシリットルに上昇させる、請求項22の方法。
【請求項26】
前記被験者が女性被験者であり、前記活性薬がエストラジオールであり、かつ更に該方法が、エストロンの血清レベルを約193ナノグラム/デシリットルに上昇させる、請求項22の方法。
【請求項27】
前記プロゲスチンが、アリルエストレノール、アナゲストン、酢酸クロルマジノン、酢酸デルマジノン、デメゲストン、デソゲストレル、ジメチステロン、ジドロゲステロン、エチニルエストレノール、エチステロン、エチノジオール、二酢酸エチノジオール、酢酸フルロゲストン、ゲストデン、カプロン酸ゲストノロン、ハロプロゲステロン、17-ヒドロキシ-16-メチレン-プロゲステロン、17-α-ヒドロキシプロゲステロン、カプロン酸17-α-ヒドロキシゲステロン、リネストレノール、メドロゲストン、メドロキシプロゲステロン、酢酸メゲストロール、メレンゲストロール、ノルエチンドロン、酢酸ノルエチンドロン、ノルエチノドレル、ノルゲステロン、ノルゲスチメート、ノルゲストレル、ノルゲストリエノン、19-ノルプロゲステロン、ノルビニステロン、ペンタゲストロン、プロゲステロン、天然プロゲステロン、プロメゲストン、キンゲストロン、及びトレンゲストン又はそのいずれかの組合せから成る群より選択される、請求項15の方法。
【請求項28】
前記活性薬が、同時に投与される2種の異なる活性薬の組合せである、請求項13の方法。
【請求項29】
女性被験者を性腺機能低下症、女性の閉経期症候、又は女性の性的障害について治療し、かつ前記製剤が、テストステロンと、更にエストロゲン、エストラジオール、17-β-エストラジオール、エチニルエストラジオール、エストリオール、スクシネート、エストリオールジヘキサネート及びエストリオールスルファメートから成る群より選択される活性薬とを組み合わせて含む、請求項15の方法。
【請求項30】
女性被験者を性腺機能低下症又は女性の閉経期症候について治療し、かつ前記活性薬がエストラジオールとプロゲスチンを組み合わせて含む、請求項15の方法。
【請求項31】
男性被験者を性腺機能低下症について治療し、かつ前記活性薬が少なくとも1種のアンドロゲンを含む、請求項16の方法。
【請求項32】
前記少なくとも1種のアンドロゲンが、メチル-テストステロンとメタンドロステノレートを組み合わせて含む、請求項31の方法。
【請求項33】
該方法が副腎不全の患者を治療することを含み、かつ前記活性薬がデヒドロエピアンドロステロン(DHEA)を含む、請求項13の方法。
【請求項34】
前記アルカノールが、エタノール、イソプロパノール、及びn-プロパノールから成る群より選択され、前記多価アルコールがプロピレングリコールであり、かつ前記浸透エンハンサーがジエチレングリコールのモノアルキルエーテル又はテトラグリコールフロールであり、前記アルカノールが水との混合物状態であり、この混合物が前記送達媒体の約40〜約98%の量で存在する、請求項13の方法。
【請求項35】
前記製剤が、ゲル、ローション、クリーム、スプレー、エアゾール、軟膏、エマルジョン、懸濁液、リポソーム系、ラッカー、パッチ、絆創膏、又は密封包帯の形態である、請求項13の方法。
【請求項36】
被験者のホルモン障害の治療方法であって、該治療が必要な被験者に、少なくとも1種の活性薬であって、テストステロン単独ではなく、かつ該活性薬がエストロゲン又はプロゲスチンの場合、該製剤中にそれぞれ治療的に有効な量のプロゲスチン又はエストロゲンは存在しない活性薬、及び脂肪族アルコールと、多価アルコールと、皮膚又は粘膜表面を通しての前記活性薬の浸透性を高めるために十分な量の浸透エンハンサーとを含む送達媒体を含む製剤を投与することを含み;
前記製剤が、実質的に長鎖脂肪アルコール、長鎖脂肪酸、及び長鎖脂肪エステルがなく、望ましくない臭い及び刺激を回避することを特徴とする方法。
【請求項37】
前記送達媒体が、衣類又は他の存在するものへの前記製剤の移動を低減又は防止するために十分な量で存在し、それによって前記製剤による衣類の汚染を最小限にする、請求項36の方法。
【請求項38】
前記多価アルコールが、前記媒体の約1%〜30%の量で存在し、前記脂肪族アルコールが、前記媒体の約5〜約80質量%の量で存在し、前記浸透エンハンサーが、前記媒体の約1%〜30%の量で存在し、かつ任意に前記媒体中に水が存在してよい、請求項36の方法。
【請求項39】
以下の成分:
少なくとも1種の活性薬;及び
アルカノールと、多価アルコールと、哺乳類の皮膚又は粘膜表面を通して前記活性薬の浸透性を高めるために十分な量のテトラグリコールフロール浸透エンハンサーとを含む送達媒体;
を含むことを特徴とする経皮又は経粘膜投与用製剤。
【請求項40】
前記製剤が、実質的に長鎖脂肪アルコール、長鎖脂肪酸、及び長鎖脂肪エステルがなく、該製剤の使用中の望ましくない臭い及び刺激を回避することを特徴とする請求項39の製剤。
【請求項41】
前記送達媒体が、皮膚又は粘膜表面による前記少なくとも1種の活性薬の吸収を促進して、該表面からの前記製剤の移動又は除去を最小限にするように、前記アルカノールが前記送達媒体の約5〜80質量%の量で存在し、前記多価アルコールが前記送達媒体の約1〜30質量%の量で存在し、かつ前記浸透エンハンサーがグルコフロールであり、前記送達媒体の約1〜30質量%の量で存在する、請求項39の製剤。
【請求項42】
前記アルカノールが水と結合してヒドロアルコール性混合物を形成し、このヒドロアルコール性混合物が前記送達媒体の約40〜約98質量%の量で存在し、かつ前記アルカノールが前記混合物の約5〜80質量%の量で存在し、かつ前記水が前記混合物の約20〜95質量%の量で存在する、請求項41の製剤。
【請求項43】
前記多価アルコールと前記浸透エンハンサーが、2:1〜1:1の質量比で存在する、請求項41の製剤。
【請求項44】
前記アルカノールが、エタノール、イソプロパノール、及びn-プロパノールから成る群より選択されるC2〜C4アルコールであり、かつ前記多価アルコールがポリプロピレングリコールである、請求項41の製剤。
【請求項45】
前記活性薬がアンドロゲン、エストロゲン、プロゲスチン、又はその組合せである、請求項39の製剤。
【請求項46】
前記アンドロゲンが、テストステロン、17-β-ヒドロキシアンドロステノン、テストステロンエステル、メチルテストステロン、テストラクトン、オキシメトロン、フルオキシメステロン、アンドロステロン、アンドロステロンアセテート、アンドロステロンプロピオネート、アンドロステロンベンゾエート、アンドロステンジオール、アンドロステンジオール-3-アセテート、アンドロステンジオール-17-アセテート、アンドロステンジオール-3,17-ジアセテート、アンドロステンジオール-17-ベンゾエート、アンドロステンジオール-3-アセテート-17-ベンゾエート、アンドロステンジオン、デヒドロエピアンドロステロン硫酸ナトリウム、4-ジヒドロテストステロン、5アジヒドロテストステロン、ドロモスタノロン、ドロモスタノロンプロピオネート、エチルエストレノール、ナンドロロンフェンプロピオネート、ナンドロロンデカノエート、ナンドロロンフリルプロピオネート、ナンドロロンシクロヘキサンプロピオネート、ナンドロロンベンゾエート、ナンドロロンシクロヘキサンカルボキシレート、オキサンドロロン、及びスタノゾロール又はそのいずれかの組合せから成る群より選択される、請求項45の製剤。
【請求項47】
前記エストロゲンが、17-β-エストラジオール、エストラジオール、エストラジオールベンゾエート、エストラジオール-17-β-シピオネート、エストリオール、エストロン、エチニルエストラジオール、メストラノール、モキセストロール、ミタトリエンジオール、リン酸ポリエストラジオール、キネストラジオール、及びキネストロール又はそのいずれかの組合せから成る群より選択される、請求項45の製剤。
【請求項48】
該製剤が、更に少なくとも1種のゲル化剤、中和剤、緩衝剤、湿潤剤、保湿剤、界面活性剤、抗酸化剤、緩和剤、又は緩衝液を含む、請求項39の製剤。
【請求項49】
該製剤が、ゲル、ローション、クリーム、スプレー、エアゾール、軟膏、エマルジョン、懸濁液、リポソーム系、ラッカー、パッチ、絆創膏、又は密封包帯の形態である、請求項39の製剤。
【請求項50】
被験者のホルモン障害の治療方法であって、該治療が必要な被験者に、少なくとも1種の活性薬及び脂肪族アルコールと、多価アルコールと、皮膚又は粘膜表面を貫く前記活性薬の浸透性を高めるために十分な量のテトラグリコールフロール浸透エンハンサーとを含む送達媒体を含んでなる製剤を投与することを含む方法。
【請求項51】
前記製剤が、実質的に長鎖脂肪アルコール、長鎖脂肪酸、及び長鎖脂肪エステルがなく、望ましくない臭い及び刺激を回避することを特徴とする50の方法。
【請求項52】
前記活性薬が、アンドロゲン、エストロゲン、プロゲスチン、又はその組合せである、請求項50の方法。
【請求項53】
前記製剤の投与が、前記ホルモン障害の少なくとも1つの臨床症候の頻度を低減する、請求項50の方法。
【請求項54】
前記ホルモン障害が、性腺機能低下症、女性の閉経期症候、女性の性的機能不全、機能減退性性欲障害、及び副腎不全を含む、請求項50の方法。
【請求項55】
前記製剤の投与が、のぼせ、寝汗、膣萎縮、性欲減退、及び骨粗しょう症、インポテンス、筋衰弱を含む少なくとも1つの臨床症候の頻度を低減する、請求項54の方法。
【請求項56】
前記多価アルコールが、前記媒体の約1%〜30%の量で存在し、前記脂肪族アルコールが、前記媒体の約5〜80質量%の量で存在し、前記浸透エンハンサーが、前記媒体の約1%〜30%の量で存在し、かつ前記媒体中に任意に水が存在してよい、請求項50の方法。
【請求項57】
前記製剤が、クリーム、軟膏、ゲル又はローションの形態である、請求項50の方法。
【請求項58】
請求項1〜12又は39〜49のいずれか1項に記載の製剤の、被験者のホルモン障害治療用薬物製造のための使用。
【請求項59】
前記ホルモン障害が、性腺機能低下症、女性の閉経期症候、女性の性的機能不全、機能減退性性欲障害、及び副腎不全から成る群より選択される、請求項58に記載の使用。
【請求項60】
前記活性薬が、アンドロゲン、エストロゲン、プロゲスチン、又はその組合せである、請求項58又は59に記載の使用。
【請求項61】
前記アンドロゲンが、テストステロン、17-β-ヒドロキシアンドロステノン、テストステロンエステル、メチルテストステロン、テストラクトン、オキシメトロン、フルオキシメステロン、アンドロステロン、アンドロステロンアセテート、アンドロステロンプロピオネート、アンドロステロンベンゾエート、アンドロステンジオール、アンドロステンジオール-3-アセテート、アンドロステンジオール-17-アセテート、アンドロステンジオール-3,17-ジアセテート、アンドロステンジオール-17-ベンゾエート、アンドロステンジオール-3-アセテート-17-ベンゾエート、アンドロステンジオン、デヒドロエピアンドロステロン硫酸ナトリウム、4-ジヒドロテストステロン、5アジヒドロテストステロン、ドロモスタノロン、ドロモスタノロンプロピオネート、エチルエストレノール、ナンドロロンフェンプロピオネート、ナンドロロンデカノエート、ナンドロロンフリルプロピオネート、ナンドロロンシクロヘキサンプロピオネート、ナンドロロンベンゾエート、ナンドロロンシクロヘキサンカルボキシレート、オキサンドロロン、及びスタノゾロール又はそのいずれかの組合せから成る群より選択される、請求項60に記載の使用。
【請求項62】
前記エストロゲンが、17-β-エストラジオール、エストラジオール、エストラジオールベンゾエート、エストラジオール-17-β-シピオネート、エストリオール、エストロン、エチニルエストラジオール、メストラノール、モキセストロール、ミタトリエンジオール、リン酸ポリエストラジオール、キネストラジオール、及びキネストロール又はそのいずれかの組合せから成る群より選択される、請求項60に記載の使用。
【請求項63】
前記プロゲスチンが、アリルエストレノール、アナゲストン、酢酸クロルマジノン、酢酸デルマジノン、デメゲストン、デソゲストレル、ジメチステロン、ジドロゲステロン、エチニルエストレノール、エチステロン、エチノジオール、二酢酸エチノジオール、酢酸フルロゲストン、ゲストデン、カプロン酸ゲストノロン、ハロプロゲステロン、17-ヒドロキシ-16-メチレン-プロゲステロン、17-α-ヒドロキシプロゲステロン、カプロン酸17-α-ヒドロキシゲステロン、リネストレノール、メドロゲストン、メドロキシプロゲステロン、酢酸メゲストロール、メレンゲストロール、ノルエチンドロン、酢酸ノルエチンドロン、ノルエチノドレル、ノルゲステロン、ノルゲスチメート、ノルゲストレル、ノルゲストリエノン、19-ノルプロゲステロン、ノルビニステロン、ペンタゲストロン、プロゲステロン、天然プロゲステロン、プロメゲストン、キンゲストロン、及びトレンゲストン又はそのいずれかの組合せから成る群より選択される、請求項60に記載の使用。
【請求項64】
有効用量の少なくとも1種の活性薬の哺乳類の皮膚又は粘膜表面を貫く浸透性を高めるための浸透エンハンサーの使用であって、前記浸透エンハンサーを、被験者のホルモン障害の治療を意図した製剤の、アルカノールと多価アルコールを含む送達媒体に添加し;前記ホルモン障害が、性腺機能低下症、女性の閉経期症候、女性の性的機能不全、機能減退性性欲障害、及び副腎不全から成る群より選択され、かつ前記製剤の投与が、前記ホルモン障害の少なくとも1つの臨床症候の頻度を低減することを特徴とする使用。
【請求項65】
有効用量の少なくとも1種の活性薬の哺乳類の皮膚又は粘膜表面を通しての浸透性を高めるための浸透エンハンサーの使用であって、前記浸透エンハンサーを、アルカノールと多価アルコールを含む送達媒体に添加し、該製剤は実質的に長鎖脂肪アルコール、長鎖脂肪酸、及び長鎖脂肪エステルがなく、望ましくない臭い及び刺激を回避し、かつ前記活性薬はテストステロン単独ではなく、かつ該活性薬がエストロゲン又はプロゲスチンの場合、該製剤中にそれぞれ治療的に有効な量のプロゲスチン又はエストロゲンは存在しないという条件を特徴とする使用。
【請求項66】
有効用量の少なくとも1種の活性薬の哺乳類の皮膚又は粘膜表面を通しての浸透性を高めるための浸透エンハンサーの使用であって、前記浸透エンハンサーを、アルカノールと多価アルコールを含む送達媒体に添加し、かつ前記浸透エンハンサーがテトラグリコールフロールで、かつ皮膚又は粘膜表面を貫く前記活性薬の浸透性を高めるために十分な量で製剤中に存在することを特徴とする使用。
【請求項67】
被験者内の活性薬の血清レベルを高めるために被験者を治療するためのキットであって、以下の要素:少なくとも1種の活性薬及びアルカノールと、多価アルコールと、皮膚又は粘膜表面を通して前記活性薬の浸透性を高めるために十分な量の浸透エンハンサーとを含む送達媒体を含む製剤であって、実質的に長鎖脂肪アルコール、長鎖脂肪酸及び長鎖脂肪エステルがなく、その使用中のこのような化合物由来の望ましくない臭い及び刺激を回避する製剤、及び
前記製剤を保持し、かつ必要に応じて前記製剤の所定用量又は体積を放出又は適用するためのディスペンサーを含む容器、
を含むことを特徴とするキット。
【請求項68】
前記ディスペンサーが、使用者の作動によって自動的に所定用量又は体積を放出する、請求項67のキット。
【請求項69】
前記ディスペンサーがポンプである、請求項67のキット。
【請求項70】
活性薬の経皮又は経粘膜投与用製剤であって、以下の成分:
デヒドロエピアンドロステロン(DHEA)を含む少なくとも1種の活性薬;及び
アルカノールと、多価アルコールと、哺乳類の皮膚又は粘膜表面を貫く前記活性薬の浸透性を高めるために十分な量の浸透エンハンサーとを含む送達媒体;
を含んでなる製剤。
【図1】


【図2】


























【図2】
























【公表番号】特表2007−524589(P2007−524589A)
【公表日】平成19年8月30日(2007.8.30)
【国際特許分類】
【出願番号】特願2006−507034(P2006−507034)
【出願日】平成16年3月11日(2004.3.11)
【国際出願番号】PCT/US2004/007291
【国際公開番号】WO2004/080413
【国際公開日】平成16年9月23日(2004.9.23)
【出願人】(505343929)アンタレス ファルマ イーペーエル アクチェンゲゼルシャフト (3)
【Fターム(参考)】
【公表日】平成19年8月30日(2007.8.30)
【国際特許分類】
【出願日】平成16年3月11日(2004.3.11)
【国際出願番号】PCT/US2004/007291
【国際公開番号】WO2004/080413
【国際公開日】平成16年9月23日(2004.9.23)
【出願人】(505343929)アンタレス ファルマ イーペーエル アクチェンゲゼルシャフト (3)
【Fターム(参考)】
[ Back to top ]

