溶融亜鉛めっき浴中の酸化亜鉛の分析方法
【課題】溶融亜鉛めっき浴中に生成した酸化亜鉛を簡便に、精度よく定量分析する。
【解決手段】溶融亜鉛めっき浴中から採取し、冷却凝固させた試料を塩化鉄(III)水溶液に浸漬して溶解し、溶解した亜鉛量と還元された鉄(III)量を測定し、還元された鉄(III)量から鉄(III)還元亜鉛量を求め、溶解した亜鉛量と鉄(III)還元亜鉛量から溶融亜鉛めっき浴中の酸化亜鉛量を求めることを特徴とする溶融亜鉛めっき浴中の酸化亜鉛の分析方法。前記塩化鉄(III)水溶液が、クエン酸、酒石酸、リンゴ酸、サリチル酸、スルホサリチル酸、アセチルアセトン、トリエタノールアミンの中から選ばれる1種または2種以上を含有する。
【解決手段】溶融亜鉛めっき浴中から採取し、冷却凝固させた試料を塩化鉄(III)水溶液に浸漬して溶解し、溶解した亜鉛量と還元された鉄(III)量を測定し、還元された鉄(III)量から鉄(III)還元亜鉛量を求め、溶解した亜鉛量と鉄(III)還元亜鉛量から溶融亜鉛めっき浴中の酸化亜鉛量を求めることを特徴とする溶融亜鉛めっき浴中の酸化亜鉛の分析方法。前記塩化鉄(III)水溶液が、クエン酸、酒石酸、リンゴ酸、サリチル酸、スルホサリチル酸、アセチルアセトン、トリエタノールアミンの中から選ばれる1種または2種以上を含有する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、溶融亜鉛めっき鋼板を製造する際に用いる溶融亜鉛めっき浴中に生成する酸化亜鉛を分析する方法に関する。
【背景技術】
【0002】
溶融亜鉛めっき鋼板は、鋼板を溶融亜鉛めっき浴に浸漬し、溶融亜鉛めっきを施して製造される。溶融亜鉛めっき浴中には、品質制御のためにアルミニウムが添加されており、めっきの際に鋼板から溶出した鉄が混入する。そのため、亜鉛と鉄とアルミニウムの金属間化合物が生成され、亜鉛よりも比重が軽いアルミニウムの含有率の高い金属間化合物は、トップドロスとして浴面に浮上し、亜鉛より比重が重い鉄の含有率の高い金属間化合物はボトムドロスとしてめっき浴の底に沈降する。まためっき浴の表層では攪拌により空気との酸化によって酸化亜鉛が生成しトップドロスの一部を形成する。ドロスは浴の対流によって分散し、通板時に鋼板表面に付着し、表面欠陥の原因になるので、浴中ドロスの低減は鋼板表面の清浄化のためには必須の課題である。浴中ドロスの低減効果を定量的に把握するためにはドロスを形態別に定量することが必要である。アルミニウムの含有率の高い金属間化合物、鉄の含有率の高い金属間化合物の定量分析方法は種々提案されているが、亜鉛めっき浴中の酸化亜鉛を精度よく定量分析できる方法はこれまで提案されていない。
【0003】
例えば、溶融亜鉛めっき浴中のドロスの定量的な評価方法としては、特許文献1に溶融亜鉛とドロスの比重差を利用し、遠心分離後、亜鉛とドロスの境界によってドロス量を評価する方法が提示されている。
【0004】
また鉄−アルミニウム、鉄−亜鉛の金属間化合物を分離定量する方法として、特許文献2には濃度及び温度を制御した酸溶液に浸漬溶解し、溶解速度の差を利用してドロスを分別定量する方法が提示され、また非特許文献1には電解法を用いて、溶融亜鉛の試料から鉄と亜鉛の金属間化合物ドロスを分離し観察した結果が報告されている。
【0005】
しかし、特許文献1、2及び非特許文献1に記載の分析方法では、ドロス抽出時に酸化亜鉛の一部あるいは全量が溶解してしまうため酸化亜鉛を定量的に分析できない。
【0006】
一方、特許文献3には、亜鉛基合金中の酸化亜鉛の形状や分布状態を観察するために、Zn基合金を非水溶媒中で電解し、酸化亜鉛を抽出する方法が提案されている。
【0007】
また従来から行われている亜鉛中の酸化亜鉛の分析法としては、金属亜鉛と酸化亜鉛の蒸気圧の差を利用して金属亜鉛だけを加熱気化し、残分を重量測定する方法(以下蒸発法と記載する)、金属亜鉛と酸化亜鉛の化学溶解性の差を利用してNH4Cl溶液に酸化亜鉛のみを溶解して溶液中の金属亜鉛を定量する方法(以下抽出法と記載する)、酸化亜鉛を水素で還元して反応時に生成する水分量を測定して酸化亜鉛量に換算する方法(以下還元法と記載する)などがある。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特開平6-287732号公報
【特許文献2】特開2000-131314号公報
【特許文献3】特開平5-10861号公報
【非特許文献】
【0009】
【非特許文献1】鉄と鋼、81(1995)、p.815-820
【発明の概要】
【発明が解決しようとする課題】
【0010】
しかしながら、特許文献3の方法は、非水溶媒系での定電位電解のため操作が煩雑なのに加えて、酸化亜鉛の定量が困難である。蒸発法では一定温度(840℃)で金属亜鉛を蒸発する際に、酸化亜鉛も連続的に蒸発してしまうために安定した分析値が得られない。抽出法でも酸化亜鉛といっしょに金属亜鉛も一部溶解してしまう。また還元法は、水素気流中での還元と微量の水分の定量が必要で、操作が煩雑な上に定量のばらつきが大きく実用的に用いるのは困難である。
【0011】
本発明は、上記実情に鑑みて考案されたものであり、溶融亜鉛めっき浴中に生成した酸化亜鉛を簡便に、精度よく定量分析する方法を提供することを目的とする。
【課題を解決するための手段】
【0012】
本発明は、上記目的を達成するためになされたもので、その手段は下記のとおりである。
【0013】
(1)溶融亜鉛めっき浴中から採取し、冷却凝固させた試料を塩化鉄(III)水溶液に浸漬して溶解し、溶解した亜鉛量と還元された鉄(III)量を測定し、還元された鉄(III)量から鉄(III)還元亜鉛量を求め、溶解した亜鉛量と鉄(III)還元亜鉛量から溶融亜鉛めっき浴中の酸化亜鉛量を求めることを特徴とする溶融亜鉛めっき浴中の酸化亜鉛の分析方法。
【0014】
(2)前記塩化鉄(III)水溶液が、クエン酸、酒石酸、リンゴ酸、サリチル酸、スルホサリチル酸、アセチルアセトン、トリエタノールアミンの中から選ばれる鉄(III)の錯形成材の1種または2種以上を含有することを特徴とする前記(1)記載の溶融亜鉛めっき浴中の酸化亜鉛の分析方法。
【0015】
(3)前記塩化鉄(III)水溶液に前記(2)記載の鉄(III)の錯形成材を含有させて、冷却凝固させた試料を溶解し、溶解した亜鉛量と還元された鉄(III)量を測定し、還元された鉄(III)量から鉄(III)還元亜鉛量を求める際に、冷却凝固させた試料の溶解条件と同様の条件で、鉄(III)の錯形成材を含有する塩化鉄(III)水溶液に、異なる量の金属亜鉛を溶解し、溶解した金属亜鉛量と鉄(II)生成量の関係を求め、この関係を用いて、冷却凝固させた試料を溶解して求めた還元された鉄(III)量(生成した鉄(II)量)から鉄(III)還元亜鉛量を補正して求めることを特徴とする前記(2)記載の溶融亜鉛めっき浴中の酸化亜鉛の分析方法。
【0016】
(4)前記試料を溶解する際の液温を40℃以下に制御することを特徴とする前記(1)〜(3)のいずれかに記載の溶融亜鉛めっき浴中の酸化亜鉛の分析方法。
【0017】
(5)前記塩化鉄(III)水溶液は、塩化鉄(III)濃度が1.5mass%以上20mass%以下であることを特徴とする前記(1)〜(4)のいずれかに記載の溶融亜鉛めっき浴中の酸化亜鉛の分析方法。
【発明の効果】
【0018】
本発明によれば、亜鉛浴中に生成する酸化亜鉛を簡便に精度よく定量分析することが可能になる。この分析結果に基づいて溶融亜鉛めっき鋼板製造プロセスの最適化や高度な品質管理・プロセス管理が可能になる。
【図面の簡単な説明】
【0019】
【図1】塩化鉄(III)溶液に金属亜鉛を溶解したときの、溶解した亜鉛量と鉄(II)定量値の関係を示す図である。
【発明を実施するための形態】
【0020】
本発明は、めっき浴の主成分である金属亜鉛(金属間化合物を形成した亜鉛を含む)とドロス中の酸化亜鉛の塩化鉄(III)水溶液中における化学的性質の差異に着目したものである。塩化鉄(III)水溶液中において金属亜鉛が溶液中の鉄(III)を鉄(II)に還元する反応は、金属亜鉛の特徴的な還元作用を示す反応としてよく知られている。本発明者らは、塩化鉄(III)水溶液中で金属間化合物を形成した亜鉛が溶解すると溶液中の鉄(III)を鉄(II)に還元する反応を伴い、一方、塩化鉄(III)水溶液中での酸化亜鉛の溶解は酸化還元反応を伴わないこと、さらに、塩化鉄(III)水溶液では酸化亜鉛が金属亜鉛よりも容易に溶解することを見出した。本発明では、前記知見に基づき、塩化鉄(III)水溶液を用いて以下の手順によって、塩化鉄(III)水溶液に溶解した亜鉛量と還元された鉄(III)量(=鉄(II)量)から求めた亜鉛量(=鉄(III)還元亜鉛量)から、溶融亜鉛めっき浴中の酸化亜鉛を定量する。
【0021】
[1]めっき浴から採取し、冷却凝固した試料(試料質量:Z0)を、塩化鉄(III)水溶液に浸漬して、試料を全量溶解する。金属亜鉛、金属間化合物が溶解するときに鉄(III)の鉄(II)への還元反応が起こる。酸化亜鉛が溶解するときは鉄(III)の鉄(II)への還元反応は起こらない。
【0022】
[2]溶解液中の亜鉛量(Z1)を定量する。Z1は、金属亜鉛、金属間化合物に由来する亜鉛及び酸化亜鉛に由来する亜鉛の全量である。
【0023】
[3]金属亜鉛の溶解によって生成した溶解液中の鉄(II)を定量し、金属亜鉛量(Z2)に換算する。Z2は、金属亜鉛、金属間化合物に由来する亜鉛の合計量である。鉄(II)量は、金属亜鉛、金属間化合物に由来する亜鉛の溶解反応で還元された鉄(III)量である。化学量論的には鉄(II)量のモル数は、金属亜鉛量(Z2)のモル数の2倍と等しいので、溶解液中の鉄(II)量から金属亜鉛量(Z2)を求めることができる。Z2は、鉄(III)還元亜鉛量である。
【0024】
[4] [2]の亜鉛分析値(Z1)から[3]の金属亜鉛分析値(Z2)を差し引き、亜鉛量Z3(=Z1-Z2)を求める。Z3は、酸化亜鉛に由来する亜鉛量である。Z3を酸化亜鉛に換算して酸化亜鉛量(Z4)を求める。Z4/Z0×100(mass%)から、試料中の酸化亜鉛含有率(mass%)が求められる。
【0025】
溶解に用いる塩化鉄(III)の濃度は、試料量と用いる溶液量によって変化するので特に規定するものではないが、上記の金属亜鉛の酸化反応が円滑に進み、めっき浴試料の溶解が迅速に進行する濃度としては、1.5mass%以上が好ましく、より好ましくは2mass%以上である。一方塩化鉄(III)の濃度が高すぎると鉄(II)量を求める際の酸化還元滴定に要する酸化剤(ニクロム酸塩や過マンガン酸塩等)の量が多くなりすぎて、分析に長時間を要したり、分析精度を低下させる原因になる。また塩化鉄(III)水溶液調製時に空気との不均化反応により水酸化鉄を生成、沈殿する場合もあるため、分析に影響が出ない範囲として20mass%以下とすることが望ましい。
【0026】
なお、試料溶解時に塩化鉄(III)溶液中で生じる反応は以下の通りである。
Zn + 2Fe3+ → Zn2+ + 2Fe2+ …(1)
Zn 2+ + 2e = Zn、E = -0.7628V vs.SCE …(2)
Fe3+ + e = Fe2+、E = 0.771V vs.SCE …(3)
ここで式(2)と式(3)のEは、標準電極電位を示す。なお、試料中に酸化亜鉛が多量に含まれる場合には、溶解時に下記式(4)のような反応を伴うため、溶液がアルカリ性に移行し、鉄(III)の一部が水酸化鉄になって試料表面に沈殿し、試料の溶解が遅くなるだけでなく、さらに、沈殿が生じる結果、鉄(II)の酸化還元滴定が正確に行なえなくなる。
【0027】
ZnO + 2H+ → Zn2++ H2O …(4)
そこで、試料表面に水酸化鉄が沈殿するのを防止するため、塩化鉄(III)水溶液中に、クエン酸、酒石酸、リンゴ酸、サリチル酸、スルホサリチル酸、アセチルアセトン、トリエタノールアミンの中から選ばれる鉄(III)の錯形成材の1種または2種以上を添加することが好ましい。これらは、鉄(III)と安定な錯体を形成し、水酸化鉄の生成を抑制し、亜鉛、酸化亜鉛の迅速な溶解と、生成した鉄(II)の高精度な定量が可能になる。鉄(III)の錯形成材の中でも特にクエン酸は好適で、シュウ酸やヘテロポリ酸のように反応途中で、反応生成物や錯形成材に起因する沈殿物が生じることがなく、精度のよい分析が可能になる。
【0028】
上記のように分析しようとする試料に酸化亜鉛が多量に存在する場合も考えると、前記の鉄(III)の錯形成材を添加することが好ましいが、発明者らの検討により以下のことが明らかとなった。つまり、本発明の金属亜鉛の溶解は、式(1)のように、鉄(III)と金属亜鉛量の酸化還元反応によって生じているので、本来は、ほぼ、生成した鉄(II):金属亜鉛=2:1(モル比)となり、金属亜鉛量と生成した鉄(II)量はほぼ直線関係になるため、本来検量線が不要なはずであるが、錯形成材を添加すると、この比率がずれてしまうことを見出した。これは錯形成材(例えばクエン酸)の水酸基が鉄(II)定量に用いるニクロム酸カリウムなどの酸化剤によって酸化されて見かけ上、ニクロム酸カリウムなどの酸化剤の消費量が増大したことによると推察されるが、上記の直線関係からの乖離は金属亜鉛を添加しない場合(空試験)には生じないことから、金属亜鉛の溶解によって生じた亜鉛(II)あるいは鉄(II)が触媒となって反応を促進した可能性も示唆され、錯形成材の干渉の要因は未だ明確にはなっていない。また、さらに、試料を溶解させる時の温度によっては、金属亜鉛量と生成した鉄(II)量が直線関係にならなくなることを見出した。詳細な機構はわからないが、原因としては錯形成材自体が試料の溶解に寄与しているためと考えられる。
【0029】
従って本発明においては、鉄(III)の錯形成材を添加する際に、本来検量線が不要なはずの酸化還元滴定において、検量線で金属亜鉛量(Z2)の補正を行なうことが、より好ましい形態になる。
【0030】
上述したように、クエン酸の添加は、[1]の反応で生じる鉄(II)量の定量値を増大させる。図1は後記実施例5でニクロム酸カリウムを用いた酸化還元滴定で求めた鉄(II)量を、溶解した金属亜鉛量に対してプロットした結果を示す。クエン酸を添加した塩化鉄(III)水溶液で液温を一定に制御したものはクエン酸無添加時と同様、鉄(II)量と金属亜鉛量には良好な直線関係の相関があるが、その関係は化学量論的ではなく、クエン酸添加により、化学量論的に期待される比率(金属亜鉛1モルに対し鉄(II)2モル)よりも対応する鉄(II)の量が増大する。鉄(II)量は還元された鉄(III)量である。そのため、秤取り量を変化させた金属亜鉛を、クエン酸を添加した塩化鉄(III)水溶液で実試料(冷却凝固させた試料)を溶解する条件と同様の条件で溶解した際の金属亜鉛量と鉄(II)生成量の関係をプロットした関係線を検量線として用い、実試料溶解で得られた鉄(II)生成量から対応する金属亜鉛量を導出し、これを鉄(III)還元亜鉛量(Z2)とする。そして、通常の方法で求めた全亜鉛量(金属亜鉛、金属間化合物に由来する亜鉛及び酸化亜鉛:Z1)と上記方法で求めた金属亜鉛量(Z2)との差より酸化亜鉛に由来する亜鉛量(Z3)を求める。Z3を酸化亜鉛に換算して酸化亜鉛量(Z4)を求める。これによって、精確な酸化亜鉛の定量が可能になる。
【0031】
ここで「試料を溶解する条件と同様の条件」とは、塩化鉄(III)溶液濃度、塩化鉄(III)溶液量、錯形成材添加量、液温をすべて試料溶解時と同一とした条件である。
【0032】
添加する鉄(III)の錯形成材のモル濃度は、溶液中の鉄(III)のモル濃度以上とすることが好ましいが、塩化鉄(III)量に対する金属亜鉛、及び酸化亜鉛量が少なく、水酸化鉄の沈殿が生じない場合にはこの限りではない。但し、過剰の錯形成剤の添加は、Fe3+の酸化還元電位を低下させてZn2+との酸化還元反応を起り難くする場合があるため、該当酸化還元反応の進み方を見て添加量を決定することが望ましい。
【0033】
なお、塩化鉄(III)−錯形成材水溶液中への試料の溶解時に、通常は溶解反応により発熱が起こり溶液の温度が上昇するが、前述したように、溶液の温度が上昇すると錯形成材自体が試料の溶解に寄与し、分析値に負の誤差を与えるため、溶解液の温度が上がりすぎないよう制御することが好ましい。反応時間や溶解試料量にも依存するが、40℃以下に制御することにより精確な分析値を得ることが可能になる。
【0034】
溶解した塩化鉄(III)溶液中の亜鉛の定量には、通常の溶液中の亜鉛定量に用いられるすべての方法が適用可能であり、例えばICP発光分析法や原子吸光法、吸光光度法などが適用できる。
【0035】
また金属亜鉛の溶解によって生成した鉄(II)の定量には、例えばニクロム酸塩や過マンガン酸塩を用いた酸化還元滴定法によって求めるのが好適であるが、鉄(III)共存下で鉄(II)の定量が可能な方法であれば、いずれの方法を適用することも可能である。
【実施例1】
【0036】
常温(20℃)の1mass%塩化鉄(III)水溶液100mlに、金属亜鉛100mg、酸化亜鉛5.0mgとクエン酸2gを添加し、栓をして、反応容器を20℃に制御した恒温水槽中に浸漬させて20分間超音波攪拌し試料を溶解した。試料溶解中、水溶液の液温は20〜23℃の範囲であった。硫酸+リン酸9ml、塩酸15mlを加えて、水で300mlに希釈した。この溶液(S)から2つの分析用溶液を分取した。一方は希釈してICP発光分析法により溶液(S)中の全亜鉛量(Z1)を求めた。もう一方は、ジフェニルアミンスルホン酸ナトリウム溶液を指示薬としてニクロム酸カリウム標準溶液で滴定し、消費した標準溶液の量から溶液(S)中の鉄(II)の量を算出し、図1の検量線を用いて金属亜鉛量(Z2)に換算した。全亜鉛量(Z1)から金属亜鉛量(Z2)を差し引き、酸化亜鉛量(Z4)に換算した。分析結果を表1に示す。
【0037】
【表1】

【0038】
表1から、本発明法による酸化亜鉛の分析方法の精度(=再現性)、正確さ(=真値とのズレ)が良好であることが確認できた。
【実施例2】
【0039】
溶融亜鉛めっき浴から採取し冷却凝固させた試料100mg(塊状:採取時期が異なるもの2種の内、目視にて酸化亜鉛が多いと判断した試料を試料1、少ないと判断した試料を試料2とする)を、クエン酸2gと共に、常温(20℃)の1mass%塩化鉄(III)水溶液100mlに浸漬し、栓をして、反応容器を20℃に制御した恒温水槽中に浸漬させて20分間超音波攪拌し試料を溶解した。試料溶解中、水溶液の液温は20〜22℃の範囲であった。以下、実施例1と同様の方法により、全亜鉛量と金属亜鉛量を求め、さらに酸化亜鉛量を求め、酸化亜鉛の含有率を算出した。分析結果を表2に示す。
【0040】
【表2】

【0041】
この結果から、採取時期の異なる(ドロス組成の異なる)浴試料を本発明法により分析して、酸化亜鉛の含有率について精度(=再現性)の良い分析結果が得られ、目視による判断結果と同様の結果が得られ、さらに2種の試料の酸化亜鉛の含有率の差が明確になった。
【実施例3】
【0042】
実施例2で使用した試料1:100mg(塊状)を、クエン酸2gと共に、常温(20℃)の1.0、1.5、5.0、10、20mass%塩化鉄(III)水溶液100mlに浸漬し、栓をして、反応容器を20℃に制御した恒温水槽中に浸漬させて、超音波攪拌し、試料が完全に溶解するまでの時間を測定した。試料溶解中、水溶液の液温は20〜22℃の範囲であった。結果を表3に示す。実施例2と同様の方法で求めた酸化亜鉛の定量値も併せて表3に示す。
【0043】
【表3】

【0044】
酸化亜鉛の定量値は、どの濃度の塩化鉄(III)水溶液を用いた場合でも同一の値が得られるが、溶解時間は1.0mass%塩化鉄(III)水溶液では、1.5mass%塩化鉄(III)水溶液の2倍以上の時間がかかり、試料量を増やした場合にはさらにその差は顕著になる。一方、塩化鉄(III)水溶液濃度が20mass%を超える場合には試料調製時に空気酸化による水酸化鉄の沈殿が生成し、定量に用いるのは困難であった。
【実施例4】
【0045】
実施例3で使用した試料1:100mg(塊状)を、クエン酸、シュウ酸、ヘテロポリ酸であるEDTA塩(2種)をそれぞれ添加した常温(20℃)の1mass%塩化鉄(III)水溶液100mlに浸漬し、栓をして、反応容器を20℃に制御した恒温水槽中に浸漬させて20分間超音波攪拌し溶解した。試料溶解中、水溶液の液温は20〜23℃の範囲であった。溶解状況を表4に示す。クエン酸を添加した場合には、実施例1〜3と同様、試料は迅速に溶解するが、シュウ酸は、0.5g添加時には水酸化鉄が沈殿し、1g以上添加すると、今度はシュウ酸亜鉛の白色沈殿が生成してマスキングの効果が得られなかった。またEDTAはナトリウム塩、アンモニウム塩のどちらを用いてもEDTA自体が塩化鉄(III)溶液に完全に溶解できないため適用できなかった。
【0046】
【表4】

【実施例5】
【0047】
塩化鉄(III)水溶液に、金属亜鉛を添加、溶解し、溶液に投入した金属亜鉛の定量を3通りの方法で行なった。金属亜鉛の添加量は、10.0〜100.0mgの範囲で変化させ、それぞれ実験を行なった。
(A法)常温(20℃)の1mass%塩化鉄(III)水溶液100mlに、クエン酸2gと金属亜鉛を添加後、栓をして、20℃に制御した恒温水槽中に反応容器を浸漬させて、20分間超音波攪拌し金属亜鉛を溶解した。反応溶液の温度は溶解終了まで20〜23℃の範囲であった。
(B法)A法と同様の金属亜鉛の溶解を、温度制御をせずに、20分間超音波攪拌した。攪拌終了後の温度は金属亜鉛を100.0mg添加した場合、50℃であった。
(C法)A法と同様の実験を、クエン酸を添加せずに行なった。反応溶液の温度は溶解終了まで20〜23℃の範囲であった。
【0048】
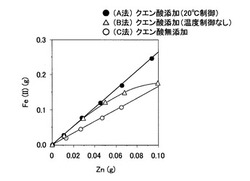
上記方法で得られた溶液それぞれに、硫酸+リン酸9ml、塩酸15mlを加えて、水で300mlに希釈した。ジフェニルアミンスルホン酸ナトリウム溶液を指示薬としてニクロム酸カリウム標準溶液で滴定し、消費した標準溶液の量から溶液中の鉄(II)の量を算出した。反応容器に入れた金属亜鉛量を横軸に、滴定によって得られた溶液中の鉄(II)の量を縦軸にプロットし、A法、B法、C法それぞれの金属亜鉛量と鉄(II)量との相関図を作成した。相関図を図1に示す。
【0049】
クエン酸の添加により、金属亜鉛の溶解によって生成する鉄(II)の量は見かけ上増大している。クエン酸を添加した塩化鉄(III)水溶液で温度を一定温度(20℃)に制御したものは、金属亜鉛量と鉄(II)量とは直線性のよい相関を示し、再現性も良好である。そのため、このような方法で作成した相関図を検量線として用い、鉄(II)測定値をこの関係線を用いて金属亜鉛量に換算することによって精確な金属亜鉛の定量値(Z2)を得ることが可能になる。また、クエン酸を添加せずに行なったものは温度制御をせずとも金属亜鉛量と鉄(II)量とは直線性のよい相関を示し、再現性も良好である。
【0050】
クエン酸を添加した塩化鉄(III)水溶液で温度制御せずに反応させた場合には、亜鉛量が増大すると、鉄(II)量の増加傾向が鈍化する。これは金属亜鉛量の増大により反応溶液の温度が上昇し、クエン酸が金属亜鉛の一部を溶解するものと推測される。金属亜鉛0.1g添加時の液温は50℃に上昇していた。反応容器の制御温度を20〜50℃に変化させて金属亜鉛0.1gの溶解を行ったところ、40℃までは金属亜鉛量と鉄(II)量に良好な相関関係が得られたが、40℃超になると鉄(II)が低い値を示すことが確認された。
【0051】
次に、金属亜鉛と酸化亜鉛を混合した3種類の試料を準備した。試料1は、金属亜鉛10.0mgと酸化亜鉛90.0mgの混合物、試料2は、金属亜鉛50.0mgと酸化亜鉛50.0mgの混合物、試料3は、金属亜鉛90.0mgと酸化亜鉛10.0mgの混合物である。塩化鉄(III)水溶液に、前記の試料1〜3を添加し、それぞれ前記A法、B法、C法の3通りの方法で溶解した。A法、C法では、反応溶液の温度は溶解終了まで20〜23℃の範囲であった。B法では、攪拌終了後の温度は試料3を添加した場合、49℃であった。
【0052】
上記方法で得られた溶液(S)それぞれに、硫酸+リン酸9ml、塩酸15mlを加えて、水で300mlに希釈した。この溶液からそれぞれ2つの分析用溶液を分取した。一方は希釈してICP発光分析法により溶液(S)中の全亜鉛量(Z1)を求めた。もう一方は、ジフェニルアミンスルホン酸ナトリウム溶液を指示薬としてニクロム酸カリウム標準溶液で滴定し、消費した標準溶液の量から溶液(S)中の鉄(II)の量を算出し、それぞれの定量方法において図1の検量線を用いて、対応する金属亜鉛の量(Z2)を求め、さらに、全亜鉛量(Z1)と金属亜鉛量(Z2)との差より酸化亜鉛に由来する亜鉛量(Z3)を求め、Z3から酸化亜鉛量(Z4)を求めた。ただし、試料1をC法で溶解したものに関しては、溶解の際に沈殿が発生して滴定ができなくなりZ2の定量ができなかったため、試料溶解の後に、酸添加後、水3000mlを加え希釈した。その溶液を用いて滴定を行い、Z2を求め、Z1とZ2との差よりZ3を求め、Z3から酸化亜鉛量(Z4)を算出した。
【0053】
【表5】

【0054】
A法においては金属亜鉛と酸化亜鉛の比の大小を問わず、精度良い定量結果が得られている。一方、B法では金属亜鉛添加量が大きくなると定量値の誤差が大きくなっている。これは図1に示したようにB法においては金属亜鉛量と鉄(II)量との関係が直線性をもたず、金属亜鉛量が多くなるほど誤差が大きくなるためと考えられる。また、C法においては、酸化亜鉛量が少ない場合は良い定量結果が得られているが、酸化亜鉛量が多くなると試料溶解時に沈殿が生じてしまい滴定困難となったため溶解・滴定する溶液をかなり希釈する必要があった。このため、滴定の対象となるFe(II)の濃度がかなり小さくなり、その結果、Fe(II)の定量値、ひいては検量線を用いて求めた金属亜鉛量、ひいては酸化亜鉛量の定量値の誤差が大きくなったと考えられる。また、実施の際には前述の本実施例で求めた検量線より低濃度側の検量線を作成する必要があった。
【産業上の利用可能性】
【0055】
本発明によれば、亜鉛浴中に生成する酸化亜鉛を簡便に精度よく定量が可能であり、この分析結果を元にめっき鋼板製造プロセスの最適化や高度な品質管理・プロセス管理が可能になる。
【技術分野】
【0001】
本発明は、溶融亜鉛めっき鋼板を製造する際に用いる溶融亜鉛めっき浴中に生成する酸化亜鉛を分析する方法に関する。
【背景技術】
【0002】
溶融亜鉛めっき鋼板は、鋼板を溶融亜鉛めっき浴に浸漬し、溶融亜鉛めっきを施して製造される。溶融亜鉛めっき浴中には、品質制御のためにアルミニウムが添加されており、めっきの際に鋼板から溶出した鉄が混入する。そのため、亜鉛と鉄とアルミニウムの金属間化合物が生成され、亜鉛よりも比重が軽いアルミニウムの含有率の高い金属間化合物は、トップドロスとして浴面に浮上し、亜鉛より比重が重い鉄の含有率の高い金属間化合物はボトムドロスとしてめっき浴の底に沈降する。まためっき浴の表層では攪拌により空気との酸化によって酸化亜鉛が生成しトップドロスの一部を形成する。ドロスは浴の対流によって分散し、通板時に鋼板表面に付着し、表面欠陥の原因になるので、浴中ドロスの低減は鋼板表面の清浄化のためには必須の課題である。浴中ドロスの低減効果を定量的に把握するためにはドロスを形態別に定量することが必要である。アルミニウムの含有率の高い金属間化合物、鉄の含有率の高い金属間化合物の定量分析方法は種々提案されているが、亜鉛めっき浴中の酸化亜鉛を精度よく定量分析できる方法はこれまで提案されていない。
【0003】
例えば、溶融亜鉛めっき浴中のドロスの定量的な評価方法としては、特許文献1に溶融亜鉛とドロスの比重差を利用し、遠心分離後、亜鉛とドロスの境界によってドロス量を評価する方法が提示されている。
【0004】
また鉄−アルミニウム、鉄−亜鉛の金属間化合物を分離定量する方法として、特許文献2には濃度及び温度を制御した酸溶液に浸漬溶解し、溶解速度の差を利用してドロスを分別定量する方法が提示され、また非特許文献1には電解法を用いて、溶融亜鉛の試料から鉄と亜鉛の金属間化合物ドロスを分離し観察した結果が報告されている。
【0005】
しかし、特許文献1、2及び非特許文献1に記載の分析方法では、ドロス抽出時に酸化亜鉛の一部あるいは全量が溶解してしまうため酸化亜鉛を定量的に分析できない。
【0006】
一方、特許文献3には、亜鉛基合金中の酸化亜鉛の形状や分布状態を観察するために、Zn基合金を非水溶媒中で電解し、酸化亜鉛を抽出する方法が提案されている。
【0007】
また従来から行われている亜鉛中の酸化亜鉛の分析法としては、金属亜鉛と酸化亜鉛の蒸気圧の差を利用して金属亜鉛だけを加熱気化し、残分を重量測定する方法(以下蒸発法と記載する)、金属亜鉛と酸化亜鉛の化学溶解性の差を利用してNH4Cl溶液に酸化亜鉛のみを溶解して溶液中の金属亜鉛を定量する方法(以下抽出法と記載する)、酸化亜鉛を水素で還元して反応時に生成する水分量を測定して酸化亜鉛量に換算する方法(以下還元法と記載する)などがある。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特開平6-287732号公報
【特許文献2】特開2000-131314号公報
【特許文献3】特開平5-10861号公報
【非特許文献】
【0009】
【非特許文献1】鉄と鋼、81(1995)、p.815-820
【発明の概要】
【発明が解決しようとする課題】
【0010】
しかしながら、特許文献3の方法は、非水溶媒系での定電位電解のため操作が煩雑なのに加えて、酸化亜鉛の定量が困難である。蒸発法では一定温度(840℃)で金属亜鉛を蒸発する際に、酸化亜鉛も連続的に蒸発してしまうために安定した分析値が得られない。抽出法でも酸化亜鉛といっしょに金属亜鉛も一部溶解してしまう。また還元法は、水素気流中での還元と微量の水分の定量が必要で、操作が煩雑な上に定量のばらつきが大きく実用的に用いるのは困難である。
【0011】
本発明は、上記実情に鑑みて考案されたものであり、溶融亜鉛めっき浴中に生成した酸化亜鉛を簡便に、精度よく定量分析する方法を提供することを目的とする。
【課題を解決するための手段】
【0012】
本発明は、上記目的を達成するためになされたもので、その手段は下記のとおりである。
【0013】
(1)溶融亜鉛めっき浴中から採取し、冷却凝固させた試料を塩化鉄(III)水溶液に浸漬して溶解し、溶解した亜鉛量と還元された鉄(III)量を測定し、還元された鉄(III)量から鉄(III)還元亜鉛量を求め、溶解した亜鉛量と鉄(III)還元亜鉛量から溶融亜鉛めっき浴中の酸化亜鉛量を求めることを特徴とする溶融亜鉛めっき浴中の酸化亜鉛の分析方法。
【0014】
(2)前記塩化鉄(III)水溶液が、クエン酸、酒石酸、リンゴ酸、サリチル酸、スルホサリチル酸、アセチルアセトン、トリエタノールアミンの中から選ばれる鉄(III)の錯形成材の1種または2種以上を含有することを特徴とする前記(1)記載の溶融亜鉛めっき浴中の酸化亜鉛の分析方法。
【0015】
(3)前記塩化鉄(III)水溶液に前記(2)記載の鉄(III)の錯形成材を含有させて、冷却凝固させた試料を溶解し、溶解した亜鉛量と還元された鉄(III)量を測定し、還元された鉄(III)量から鉄(III)還元亜鉛量を求める際に、冷却凝固させた試料の溶解条件と同様の条件で、鉄(III)の錯形成材を含有する塩化鉄(III)水溶液に、異なる量の金属亜鉛を溶解し、溶解した金属亜鉛量と鉄(II)生成量の関係を求め、この関係を用いて、冷却凝固させた試料を溶解して求めた還元された鉄(III)量(生成した鉄(II)量)から鉄(III)還元亜鉛量を補正して求めることを特徴とする前記(2)記載の溶融亜鉛めっき浴中の酸化亜鉛の分析方法。
【0016】
(4)前記試料を溶解する際の液温を40℃以下に制御することを特徴とする前記(1)〜(3)のいずれかに記載の溶融亜鉛めっき浴中の酸化亜鉛の分析方法。
【0017】
(5)前記塩化鉄(III)水溶液は、塩化鉄(III)濃度が1.5mass%以上20mass%以下であることを特徴とする前記(1)〜(4)のいずれかに記載の溶融亜鉛めっき浴中の酸化亜鉛の分析方法。
【発明の効果】
【0018】
本発明によれば、亜鉛浴中に生成する酸化亜鉛を簡便に精度よく定量分析することが可能になる。この分析結果に基づいて溶融亜鉛めっき鋼板製造プロセスの最適化や高度な品質管理・プロセス管理が可能になる。
【図面の簡単な説明】
【0019】
【図1】塩化鉄(III)溶液に金属亜鉛を溶解したときの、溶解した亜鉛量と鉄(II)定量値の関係を示す図である。
【発明を実施するための形態】
【0020】
本発明は、めっき浴の主成分である金属亜鉛(金属間化合物を形成した亜鉛を含む)とドロス中の酸化亜鉛の塩化鉄(III)水溶液中における化学的性質の差異に着目したものである。塩化鉄(III)水溶液中において金属亜鉛が溶液中の鉄(III)を鉄(II)に還元する反応は、金属亜鉛の特徴的な還元作用を示す反応としてよく知られている。本発明者らは、塩化鉄(III)水溶液中で金属間化合物を形成した亜鉛が溶解すると溶液中の鉄(III)を鉄(II)に還元する反応を伴い、一方、塩化鉄(III)水溶液中での酸化亜鉛の溶解は酸化還元反応を伴わないこと、さらに、塩化鉄(III)水溶液では酸化亜鉛が金属亜鉛よりも容易に溶解することを見出した。本発明では、前記知見に基づき、塩化鉄(III)水溶液を用いて以下の手順によって、塩化鉄(III)水溶液に溶解した亜鉛量と還元された鉄(III)量(=鉄(II)量)から求めた亜鉛量(=鉄(III)還元亜鉛量)から、溶融亜鉛めっき浴中の酸化亜鉛を定量する。
【0021】
[1]めっき浴から採取し、冷却凝固した試料(試料質量:Z0)を、塩化鉄(III)水溶液に浸漬して、試料を全量溶解する。金属亜鉛、金属間化合物が溶解するときに鉄(III)の鉄(II)への還元反応が起こる。酸化亜鉛が溶解するときは鉄(III)の鉄(II)への還元反応は起こらない。
【0022】
[2]溶解液中の亜鉛量(Z1)を定量する。Z1は、金属亜鉛、金属間化合物に由来する亜鉛及び酸化亜鉛に由来する亜鉛の全量である。
【0023】
[3]金属亜鉛の溶解によって生成した溶解液中の鉄(II)を定量し、金属亜鉛量(Z2)に換算する。Z2は、金属亜鉛、金属間化合物に由来する亜鉛の合計量である。鉄(II)量は、金属亜鉛、金属間化合物に由来する亜鉛の溶解反応で還元された鉄(III)量である。化学量論的には鉄(II)量のモル数は、金属亜鉛量(Z2)のモル数の2倍と等しいので、溶解液中の鉄(II)量から金属亜鉛量(Z2)を求めることができる。Z2は、鉄(III)還元亜鉛量である。
【0024】
[4] [2]の亜鉛分析値(Z1)から[3]の金属亜鉛分析値(Z2)を差し引き、亜鉛量Z3(=Z1-Z2)を求める。Z3は、酸化亜鉛に由来する亜鉛量である。Z3を酸化亜鉛に換算して酸化亜鉛量(Z4)を求める。Z4/Z0×100(mass%)から、試料中の酸化亜鉛含有率(mass%)が求められる。
【0025】
溶解に用いる塩化鉄(III)の濃度は、試料量と用いる溶液量によって変化するので特に規定するものではないが、上記の金属亜鉛の酸化反応が円滑に進み、めっき浴試料の溶解が迅速に進行する濃度としては、1.5mass%以上が好ましく、より好ましくは2mass%以上である。一方塩化鉄(III)の濃度が高すぎると鉄(II)量を求める際の酸化還元滴定に要する酸化剤(ニクロム酸塩や過マンガン酸塩等)の量が多くなりすぎて、分析に長時間を要したり、分析精度を低下させる原因になる。また塩化鉄(III)水溶液調製時に空気との不均化反応により水酸化鉄を生成、沈殿する場合もあるため、分析に影響が出ない範囲として20mass%以下とすることが望ましい。
【0026】
なお、試料溶解時に塩化鉄(III)溶液中で生じる反応は以下の通りである。
Zn + 2Fe3+ → Zn2+ + 2Fe2+ …(1)
Zn 2+ + 2e = Zn、E = -0.7628V vs.SCE …(2)
Fe3+ + e = Fe2+、E = 0.771V vs.SCE …(3)
ここで式(2)と式(3)のEは、標準電極電位を示す。なお、試料中に酸化亜鉛が多量に含まれる場合には、溶解時に下記式(4)のような反応を伴うため、溶液がアルカリ性に移行し、鉄(III)の一部が水酸化鉄になって試料表面に沈殿し、試料の溶解が遅くなるだけでなく、さらに、沈殿が生じる結果、鉄(II)の酸化還元滴定が正確に行なえなくなる。
【0027】
ZnO + 2H+ → Zn2++ H2O …(4)
そこで、試料表面に水酸化鉄が沈殿するのを防止するため、塩化鉄(III)水溶液中に、クエン酸、酒石酸、リンゴ酸、サリチル酸、スルホサリチル酸、アセチルアセトン、トリエタノールアミンの中から選ばれる鉄(III)の錯形成材の1種または2種以上を添加することが好ましい。これらは、鉄(III)と安定な錯体を形成し、水酸化鉄の生成を抑制し、亜鉛、酸化亜鉛の迅速な溶解と、生成した鉄(II)の高精度な定量が可能になる。鉄(III)の錯形成材の中でも特にクエン酸は好適で、シュウ酸やヘテロポリ酸のように反応途中で、反応生成物や錯形成材に起因する沈殿物が生じることがなく、精度のよい分析が可能になる。
【0028】
上記のように分析しようとする試料に酸化亜鉛が多量に存在する場合も考えると、前記の鉄(III)の錯形成材を添加することが好ましいが、発明者らの検討により以下のことが明らかとなった。つまり、本発明の金属亜鉛の溶解は、式(1)のように、鉄(III)と金属亜鉛量の酸化還元反応によって生じているので、本来は、ほぼ、生成した鉄(II):金属亜鉛=2:1(モル比)となり、金属亜鉛量と生成した鉄(II)量はほぼ直線関係になるため、本来検量線が不要なはずであるが、錯形成材を添加すると、この比率がずれてしまうことを見出した。これは錯形成材(例えばクエン酸)の水酸基が鉄(II)定量に用いるニクロム酸カリウムなどの酸化剤によって酸化されて見かけ上、ニクロム酸カリウムなどの酸化剤の消費量が増大したことによると推察されるが、上記の直線関係からの乖離は金属亜鉛を添加しない場合(空試験)には生じないことから、金属亜鉛の溶解によって生じた亜鉛(II)あるいは鉄(II)が触媒となって反応を促進した可能性も示唆され、錯形成材の干渉の要因は未だ明確にはなっていない。また、さらに、試料を溶解させる時の温度によっては、金属亜鉛量と生成した鉄(II)量が直線関係にならなくなることを見出した。詳細な機構はわからないが、原因としては錯形成材自体が試料の溶解に寄与しているためと考えられる。
【0029】
従って本発明においては、鉄(III)の錯形成材を添加する際に、本来検量線が不要なはずの酸化還元滴定において、検量線で金属亜鉛量(Z2)の補正を行なうことが、より好ましい形態になる。
【0030】
上述したように、クエン酸の添加は、[1]の反応で生じる鉄(II)量の定量値を増大させる。図1は後記実施例5でニクロム酸カリウムを用いた酸化還元滴定で求めた鉄(II)量を、溶解した金属亜鉛量に対してプロットした結果を示す。クエン酸を添加した塩化鉄(III)水溶液で液温を一定に制御したものはクエン酸無添加時と同様、鉄(II)量と金属亜鉛量には良好な直線関係の相関があるが、その関係は化学量論的ではなく、クエン酸添加により、化学量論的に期待される比率(金属亜鉛1モルに対し鉄(II)2モル)よりも対応する鉄(II)の量が増大する。鉄(II)量は還元された鉄(III)量である。そのため、秤取り量を変化させた金属亜鉛を、クエン酸を添加した塩化鉄(III)水溶液で実試料(冷却凝固させた試料)を溶解する条件と同様の条件で溶解した際の金属亜鉛量と鉄(II)生成量の関係をプロットした関係線を検量線として用い、実試料溶解で得られた鉄(II)生成量から対応する金属亜鉛量を導出し、これを鉄(III)還元亜鉛量(Z2)とする。そして、通常の方法で求めた全亜鉛量(金属亜鉛、金属間化合物に由来する亜鉛及び酸化亜鉛:Z1)と上記方法で求めた金属亜鉛量(Z2)との差より酸化亜鉛に由来する亜鉛量(Z3)を求める。Z3を酸化亜鉛に換算して酸化亜鉛量(Z4)を求める。これによって、精確な酸化亜鉛の定量が可能になる。
【0031】
ここで「試料を溶解する条件と同様の条件」とは、塩化鉄(III)溶液濃度、塩化鉄(III)溶液量、錯形成材添加量、液温をすべて試料溶解時と同一とした条件である。
【0032】
添加する鉄(III)の錯形成材のモル濃度は、溶液中の鉄(III)のモル濃度以上とすることが好ましいが、塩化鉄(III)量に対する金属亜鉛、及び酸化亜鉛量が少なく、水酸化鉄の沈殿が生じない場合にはこの限りではない。但し、過剰の錯形成剤の添加は、Fe3+の酸化還元電位を低下させてZn2+との酸化還元反応を起り難くする場合があるため、該当酸化還元反応の進み方を見て添加量を決定することが望ましい。
【0033】
なお、塩化鉄(III)−錯形成材水溶液中への試料の溶解時に、通常は溶解反応により発熱が起こり溶液の温度が上昇するが、前述したように、溶液の温度が上昇すると錯形成材自体が試料の溶解に寄与し、分析値に負の誤差を与えるため、溶解液の温度が上がりすぎないよう制御することが好ましい。反応時間や溶解試料量にも依存するが、40℃以下に制御することにより精確な分析値を得ることが可能になる。
【0034】
溶解した塩化鉄(III)溶液中の亜鉛の定量には、通常の溶液中の亜鉛定量に用いられるすべての方法が適用可能であり、例えばICP発光分析法や原子吸光法、吸光光度法などが適用できる。
【0035】
また金属亜鉛の溶解によって生成した鉄(II)の定量には、例えばニクロム酸塩や過マンガン酸塩を用いた酸化還元滴定法によって求めるのが好適であるが、鉄(III)共存下で鉄(II)の定量が可能な方法であれば、いずれの方法を適用することも可能である。
【実施例1】
【0036】
常温(20℃)の1mass%塩化鉄(III)水溶液100mlに、金属亜鉛100mg、酸化亜鉛5.0mgとクエン酸2gを添加し、栓をして、反応容器を20℃に制御した恒温水槽中に浸漬させて20分間超音波攪拌し試料を溶解した。試料溶解中、水溶液の液温は20〜23℃の範囲であった。硫酸+リン酸9ml、塩酸15mlを加えて、水で300mlに希釈した。この溶液(S)から2つの分析用溶液を分取した。一方は希釈してICP発光分析法により溶液(S)中の全亜鉛量(Z1)を求めた。もう一方は、ジフェニルアミンスルホン酸ナトリウム溶液を指示薬としてニクロム酸カリウム標準溶液で滴定し、消費した標準溶液の量から溶液(S)中の鉄(II)の量を算出し、図1の検量線を用いて金属亜鉛量(Z2)に換算した。全亜鉛量(Z1)から金属亜鉛量(Z2)を差し引き、酸化亜鉛量(Z4)に換算した。分析結果を表1に示す。
【0037】
【表1】

【0038】
表1から、本発明法による酸化亜鉛の分析方法の精度(=再現性)、正確さ(=真値とのズレ)が良好であることが確認できた。
【実施例2】
【0039】
溶融亜鉛めっき浴から採取し冷却凝固させた試料100mg(塊状:採取時期が異なるもの2種の内、目視にて酸化亜鉛が多いと判断した試料を試料1、少ないと判断した試料を試料2とする)を、クエン酸2gと共に、常温(20℃)の1mass%塩化鉄(III)水溶液100mlに浸漬し、栓をして、反応容器を20℃に制御した恒温水槽中に浸漬させて20分間超音波攪拌し試料を溶解した。試料溶解中、水溶液の液温は20〜22℃の範囲であった。以下、実施例1と同様の方法により、全亜鉛量と金属亜鉛量を求め、さらに酸化亜鉛量を求め、酸化亜鉛の含有率を算出した。分析結果を表2に示す。
【0040】
【表2】

【0041】
この結果から、採取時期の異なる(ドロス組成の異なる)浴試料を本発明法により分析して、酸化亜鉛の含有率について精度(=再現性)の良い分析結果が得られ、目視による判断結果と同様の結果が得られ、さらに2種の試料の酸化亜鉛の含有率の差が明確になった。
【実施例3】
【0042】
実施例2で使用した試料1:100mg(塊状)を、クエン酸2gと共に、常温(20℃)の1.0、1.5、5.0、10、20mass%塩化鉄(III)水溶液100mlに浸漬し、栓をして、反応容器を20℃に制御した恒温水槽中に浸漬させて、超音波攪拌し、試料が完全に溶解するまでの時間を測定した。試料溶解中、水溶液の液温は20〜22℃の範囲であった。結果を表3に示す。実施例2と同様の方法で求めた酸化亜鉛の定量値も併せて表3に示す。
【0043】
【表3】

【0044】
酸化亜鉛の定量値は、どの濃度の塩化鉄(III)水溶液を用いた場合でも同一の値が得られるが、溶解時間は1.0mass%塩化鉄(III)水溶液では、1.5mass%塩化鉄(III)水溶液の2倍以上の時間がかかり、試料量を増やした場合にはさらにその差は顕著になる。一方、塩化鉄(III)水溶液濃度が20mass%を超える場合には試料調製時に空気酸化による水酸化鉄の沈殿が生成し、定量に用いるのは困難であった。
【実施例4】
【0045】
実施例3で使用した試料1:100mg(塊状)を、クエン酸、シュウ酸、ヘテロポリ酸であるEDTA塩(2種)をそれぞれ添加した常温(20℃)の1mass%塩化鉄(III)水溶液100mlに浸漬し、栓をして、反応容器を20℃に制御した恒温水槽中に浸漬させて20分間超音波攪拌し溶解した。試料溶解中、水溶液の液温は20〜23℃の範囲であった。溶解状況を表4に示す。クエン酸を添加した場合には、実施例1〜3と同様、試料は迅速に溶解するが、シュウ酸は、0.5g添加時には水酸化鉄が沈殿し、1g以上添加すると、今度はシュウ酸亜鉛の白色沈殿が生成してマスキングの効果が得られなかった。またEDTAはナトリウム塩、アンモニウム塩のどちらを用いてもEDTA自体が塩化鉄(III)溶液に完全に溶解できないため適用できなかった。
【0046】
【表4】

【実施例5】
【0047】
塩化鉄(III)水溶液に、金属亜鉛を添加、溶解し、溶液に投入した金属亜鉛の定量を3通りの方法で行なった。金属亜鉛の添加量は、10.0〜100.0mgの範囲で変化させ、それぞれ実験を行なった。
(A法)常温(20℃)の1mass%塩化鉄(III)水溶液100mlに、クエン酸2gと金属亜鉛を添加後、栓をして、20℃に制御した恒温水槽中に反応容器を浸漬させて、20分間超音波攪拌し金属亜鉛を溶解した。反応溶液の温度は溶解終了まで20〜23℃の範囲であった。
(B法)A法と同様の金属亜鉛の溶解を、温度制御をせずに、20分間超音波攪拌した。攪拌終了後の温度は金属亜鉛を100.0mg添加した場合、50℃であった。
(C法)A法と同様の実験を、クエン酸を添加せずに行なった。反応溶液の温度は溶解終了まで20〜23℃の範囲であった。
【0048】
上記方法で得られた溶液それぞれに、硫酸+リン酸9ml、塩酸15mlを加えて、水で300mlに希釈した。ジフェニルアミンスルホン酸ナトリウム溶液を指示薬としてニクロム酸カリウム標準溶液で滴定し、消費した標準溶液の量から溶液中の鉄(II)の量を算出した。反応容器に入れた金属亜鉛量を横軸に、滴定によって得られた溶液中の鉄(II)の量を縦軸にプロットし、A法、B法、C法それぞれの金属亜鉛量と鉄(II)量との相関図を作成した。相関図を図1に示す。
【0049】
クエン酸の添加により、金属亜鉛の溶解によって生成する鉄(II)の量は見かけ上増大している。クエン酸を添加した塩化鉄(III)水溶液で温度を一定温度(20℃)に制御したものは、金属亜鉛量と鉄(II)量とは直線性のよい相関を示し、再現性も良好である。そのため、このような方法で作成した相関図を検量線として用い、鉄(II)測定値をこの関係線を用いて金属亜鉛量に換算することによって精確な金属亜鉛の定量値(Z2)を得ることが可能になる。また、クエン酸を添加せずに行なったものは温度制御をせずとも金属亜鉛量と鉄(II)量とは直線性のよい相関を示し、再現性も良好である。
【0050】
クエン酸を添加した塩化鉄(III)水溶液で温度制御せずに反応させた場合には、亜鉛量が増大すると、鉄(II)量の増加傾向が鈍化する。これは金属亜鉛量の増大により反応溶液の温度が上昇し、クエン酸が金属亜鉛の一部を溶解するものと推測される。金属亜鉛0.1g添加時の液温は50℃に上昇していた。反応容器の制御温度を20〜50℃に変化させて金属亜鉛0.1gの溶解を行ったところ、40℃までは金属亜鉛量と鉄(II)量に良好な相関関係が得られたが、40℃超になると鉄(II)が低い値を示すことが確認された。
【0051】
次に、金属亜鉛と酸化亜鉛を混合した3種類の試料を準備した。試料1は、金属亜鉛10.0mgと酸化亜鉛90.0mgの混合物、試料2は、金属亜鉛50.0mgと酸化亜鉛50.0mgの混合物、試料3は、金属亜鉛90.0mgと酸化亜鉛10.0mgの混合物である。塩化鉄(III)水溶液に、前記の試料1〜3を添加し、それぞれ前記A法、B法、C法の3通りの方法で溶解した。A法、C法では、反応溶液の温度は溶解終了まで20〜23℃の範囲であった。B法では、攪拌終了後の温度は試料3を添加した場合、49℃であった。
【0052】
上記方法で得られた溶液(S)それぞれに、硫酸+リン酸9ml、塩酸15mlを加えて、水で300mlに希釈した。この溶液からそれぞれ2つの分析用溶液を分取した。一方は希釈してICP発光分析法により溶液(S)中の全亜鉛量(Z1)を求めた。もう一方は、ジフェニルアミンスルホン酸ナトリウム溶液を指示薬としてニクロム酸カリウム標準溶液で滴定し、消費した標準溶液の量から溶液(S)中の鉄(II)の量を算出し、それぞれの定量方法において図1の検量線を用いて、対応する金属亜鉛の量(Z2)を求め、さらに、全亜鉛量(Z1)と金属亜鉛量(Z2)との差より酸化亜鉛に由来する亜鉛量(Z3)を求め、Z3から酸化亜鉛量(Z4)を求めた。ただし、試料1をC法で溶解したものに関しては、溶解の際に沈殿が発生して滴定ができなくなりZ2の定量ができなかったため、試料溶解の後に、酸添加後、水3000mlを加え希釈した。その溶液を用いて滴定を行い、Z2を求め、Z1とZ2との差よりZ3を求め、Z3から酸化亜鉛量(Z4)を算出した。
【0053】
【表5】

【0054】
A法においては金属亜鉛と酸化亜鉛の比の大小を問わず、精度良い定量結果が得られている。一方、B法では金属亜鉛添加量が大きくなると定量値の誤差が大きくなっている。これは図1に示したようにB法においては金属亜鉛量と鉄(II)量との関係が直線性をもたず、金属亜鉛量が多くなるほど誤差が大きくなるためと考えられる。また、C法においては、酸化亜鉛量が少ない場合は良い定量結果が得られているが、酸化亜鉛量が多くなると試料溶解時に沈殿が生じてしまい滴定困難となったため溶解・滴定する溶液をかなり希釈する必要があった。このため、滴定の対象となるFe(II)の濃度がかなり小さくなり、その結果、Fe(II)の定量値、ひいては検量線を用いて求めた金属亜鉛量、ひいては酸化亜鉛量の定量値の誤差が大きくなったと考えられる。また、実施の際には前述の本実施例で求めた検量線より低濃度側の検量線を作成する必要があった。
【産業上の利用可能性】
【0055】
本発明によれば、亜鉛浴中に生成する酸化亜鉛を簡便に精度よく定量が可能であり、この分析結果を元にめっき鋼板製造プロセスの最適化や高度な品質管理・プロセス管理が可能になる。
【特許請求の範囲】
【請求項1】
溶融亜鉛めっき浴中から採取し、冷却凝固させた試料を塩化鉄(III)水溶液に浸漬して溶解し、溶解した亜鉛量と還元された鉄(III)量を測定し、還元された鉄(III)量から鉄(III)還元亜鉛量を求め、溶解した亜鉛量と鉄(III)還元亜鉛量から溶融亜鉛めっき浴中の酸化亜鉛量を求めることを特徴とする溶融亜鉛めっき浴中の酸化亜鉛の分析方法。
【請求項2】
前記塩化鉄(III)水溶液が、クエン酸、酒石酸、リンゴ酸、サリチル酸、スルホサリチル酸、アセチルアセトン、トリエタノールアミンの中から選ばれる鉄(III)の錯形成材の1種または2種以上を含有することを特徴とする請求項1記載の溶融亜鉛めっき浴中の酸化亜鉛の分析方法。
【請求項3】
前記塩化鉄(III)水溶液に請求項2記載の鉄(III)の錯形成材を含有させて、冷却凝固させた試料を溶解し、溶解した亜鉛量と還元された鉄(III)量を測定し、還元された鉄(III)量から鉄(III)還元亜鉛量を求める際に、冷却凝固させた試料の溶解条件と同様の条件で、鉄(III)の錯形成材を含有する塩化鉄(III)水溶液に、異なる量の金属亜鉛を溶解し、溶解した金属亜鉛量と鉄(II)生成量の関係を求め、この関係を用いて、冷却凝固させた試料を溶解して求めた還元された鉄(III)量(生成した鉄(II)量)から鉄(III)還元亜鉛量を補正して求めることを特徴とする請求項2記載の溶融亜鉛めっき浴中の酸化亜鉛の分析方法。
【請求項4】
前記試料を溶解する際の液温を40℃以下に制御することを特徴とする請求項1〜3のいずれかに記載の溶融亜鉛めっき浴中の酸化亜鉛の分析方法。
【請求項5】
前記塩化鉄(III)水溶液は、塩化鉄(III)濃度が1.5mass%以上20mass%以下であることを特徴とする請求項1〜4のいずれかに記載の溶融亜鉛めっき浴中の酸化亜鉛の分析方法。
【請求項1】
溶融亜鉛めっき浴中から採取し、冷却凝固させた試料を塩化鉄(III)水溶液に浸漬して溶解し、溶解した亜鉛量と還元された鉄(III)量を測定し、還元された鉄(III)量から鉄(III)還元亜鉛量を求め、溶解した亜鉛量と鉄(III)還元亜鉛量から溶融亜鉛めっき浴中の酸化亜鉛量を求めることを特徴とする溶融亜鉛めっき浴中の酸化亜鉛の分析方法。
【請求項2】
前記塩化鉄(III)水溶液が、クエン酸、酒石酸、リンゴ酸、サリチル酸、スルホサリチル酸、アセチルアセトン、トリエタノールアミンの中から選ばれる鉄(III)の錯形成材の1種または2種以上を含有することを特徴とする請求項1記載の溶融亜鉛めっき浴中の酸化亜鉛の分析方法。
【請求項3】
前記塩化鉄(III)水溶液に請求項2記載の鉄(III)の錯形成材を含有させて、冷却凝固させた試料を溶解し、溶解した亜鉛量と還元された鉄(III)量を測定し、還元された鉄(III)量から鉄(III)還元亜鉛量を求める際に、冷却凝固させた試料の溶解条件と同様の条件で、鉄(III)の錯形成材を含有する塩化鉄(III)水溶液に、異なる量の金属亜鉛を溶解し、溶解した金属亜鉛量と鉄(II)生成量の関係を求め、この関係を用いて、冷却凝固させた試料を溶解して求めた還元された鉄(III)量(生成した鉄(II)量)から鉄(III)還元亜鉛量を補正して求めることを特徴とする請求項2記載の溶融亜鉛めっき浴中の酸化亜鉛の分析方法。
【請求項4】
前記試料を溶解する際の液温を40℃以下に制御することを特徴とする請求項1〜3のいずれかに記載の溶融亜鉛めっき浴中の酸化亜鉛の分析方法。
【請求項5】
前記塩化鉄(III)水溶液は、塩化鉄(III)濃度が1.5mass%以上20mass%以下であることを特徴とする請求項1〜4のいずれかに記載の溶融亜鉛めっき浴中の酸化亜鉛の分析方法。
【図1】




【公開番号】特開2012−237742(P2012−237742A)
【公開日】平成24年12月6日(2012.12.6)
【国際特許分類】
【出願番号】特願2012−71377(P2012−71377)
【出願日】平成24年3月27日(2012.3.27)
【出願人】(000001258)JFEスチール株式会社 (8,589)
【Fターム(参考)】
【公開日】平成24年12月6日(2012.12.6)
【国際特許分類】
【出願日】平成24年3月27日(2012.3.27)
【出願人】(000001258)JFEスチール株式会社 (8,589)
【Fターム(参考)】
[ Back to top ]

