熱ショックタンパク質の発現誘導剤
【課題】効果的な熱ショックタンパク質の発現誘導剤を提供する。
【解決手段】
アルニカというキク科の植物、サルビアというシソ科の植物、及びマジョラムというシソ科の植物が、熱ショックタンパク質の発現を誘導するという、本発明者らが初めて見出した知見に基づき、アルニカを含有する熱ショックタンパク質発現誘導剤、サルビアを含有する熱ショックタンパク質の発現誘導剤、及びマジョラムを含有する熱ショックタンパク質の発現誘導剤を提供する。
【解決手段】
アルニカというキク科の植物、サルビアというシソ科の植物、及びマジョラムというシソ科の植物が、熱ショックタンパク質の発現を誘導するという、本発明者らが初めて見出した知見に基づき、アルニカを含有する熱ショックタンパク質発現誘導剤、サルビアを含有する熱ショックタンパク質の発現誘導剤、及びマジョラムを含有する熱ショックタンパク質の発現誘導剤を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、生命工学に係り、熱ショックタンパク質の発現誘導剤に関する。
【背景技術】
【0002】
人体の細胞、組織、あるいは器官が、一般的な生理的温度より3℃以上高い温度に晒されると、生体の防御システムの一つとして、一群の特異的タンパク質が発現することが知られている。これら一群の特異的タンパク質は、SDS−PAGE(ドデシル硫酸ナトリウム−ポリアクリルアミドゲル電気泳動法)によって測定した場合、10〜110KDaの分子量を有し、熱ショックタンパク質(Heat Shock Proteins、以下、「HSP」と称する場合もある。)と呼ばれる。
【0003】
HSPは、分子量の相違により、HSP90ファミリー(分子量:90kDa以上110kDa以下)、HSP70ファミリー(分子量:70kDa以上80kDa未満)、HSP60ファミリー(分子量:60kDa以上70kDa未満)、及び低分子量HSPファミリー(分子量:60kDa未満)に分類されている。
【0004】
HSPの機能は多岐にわたる。例えば、HSP70及びHSP60ファミリーは、変性タンパク質に結合して、変性タンパク質を天然のフォールディング(高次構造・折り畳み構造)に巻き戻す作用や、第三のタンパク質や核酸との会合、細胞内での局在化や膜透過への関与など、いわゆる分子シャペロンと呼ばれる機能を担っている(例えば、非特許文献1及び非特許文献2参照。)。そこで、HSPの発現を誘導する生薬抽出物を含有する熱ショックタンパク質誘導剤が提案されている(例えば、特許文献1参照。)。さらに、水生プランクトンであるアルテミアの孵化直前の耐久卵から水抽出した活性エキス(アルテミアエキス)成分が、ヒト皮膚細胞においてHSP70の発現を誘発することが見出されている。そこで、アルテミアエキス成分を含有する抗皮膚ストレス(ストレス防御)用化粧料も提案されている(例えば、特許文献2参照。)。
【0005】
また、人の皮膚が紫外線を吸収すると、身体を紫外線から守るために、皮膚基底層にあるメラノサイトにおいてメラニン合成の律速酵素であるチロシナーゼが活性化し、メラニンが産生される。すなわち、メラニンは、皮膚に日光が当たることで産生される色素であり、紫外線を吸収したり散乱したりすることにより、強い紫外線から細胞や皮膚を守る働きを有している。その一方、皮膚のシミの発生は、メラニンの部分的な異常増加が原因であると考えられている。
【0006】
ここで、HSPは、紫外線、放射線、及び外的傷害等の外界からのストレスに晒された場合にも、発現が誘導される。これらのストレスは、細胞のタンパク質を変性させ、不溶性沈殿を形成して細胞にダメージを与える。しかし、HSPの発現により、ストレスによる細胞へのダメージを抑制することが可能となる。
【先行技術文献】
【非特許文献】
【0007】
【非特許文献1】Hendrick, J. P. & Hartl, F. −U., Ann. Rev. Biochem., 62, 349−384 (1993)
【非特許文献2】Georgopoulos, C. & Welch. W. J., Ann. Rev. Cell Biol., 9, 601−634 (1993)
【特許文献】
【0008】
【特許文献1】特開2008−127296号公報
【特許文献2】特開2004−238297号公報
【発明の概要】
【発明が解決しようとする課題】
【0009】
そこで本発明は、生体内におけるHSPの発現に伴う有利な効果に鑑み、効果的なHSPの発現誘導剤を提供することを課題とする。
【課題を解決するための手段】
【0010】
本発明者らは、アルニカというキク科の植物、サルビアというシソ科の植物、及びマジョラムというシソ科の植物が、HSPの発現を誘導することを初めて見出した。そこで、本発明の態様は、アルニカを含有するHSPの発現誘導剤であることを要旨とする。本発明の他の態様は、サルビアを含有するHSPの発現誘導剤であることを要旨とする。また、本発明の他の態様は、マジョラムを含有するHSPの発現誘導剤であることを要旨とする。本発明の態様に係るHSPの発現誘導剤は、例えば、ローション剤、乳剤、ゲル剤、クリーム剤、軟膏剤、及び貼付剤等の皮膚外用剤として提供されてもよい。
【0011】
本発明の態様に係るHSPの発現誘導剤を人体に内用又は外用することにより、HSPの発現を誘導し、抗細胞死作用、抗炎症作用、細胞保護作用、及び胃粘膜保護作用等を得ることが可能となる。
【0012】
さらに、本発明者らは、HSPの生体防御機能に着目し、その作用を種々検討した結果、HSPのなかでも、HSP70ファミリー(SDS−PAGEによる測定で、分子量:70kDa以上80kDa未満)が、シミの発生原因とされるメラニンの発現を効果的に抑制し、皮膚美白作用があることを見出した。さらに、アルニカ、サルビア、及びマジョラムは、HSP70の発現を誘導することも見出した。したがって、本発明の態様に係るHSPの発現誘導剤は、メラニンの発現を抑制し、皮膚美白作用をも奏する。
【発明の効果】
【0013】
本発明によれば、効果的なHSPの発現誘導剤を提供可能である。
【図面の簡単な説明】
【0014】
【図1】実施例1の結果を示す図であり、B16細胞における熱ショックによるHSP70の誘導の結果を示す。
【図2】実施例1の結果を示す図であり、3−isobutyl−1−methylxanthine(IBMX:Sigma社)によるメラニン誘導に対する熱ショックの影響を示す。
【図3】実施例1における、熱ショックによる種々のHSPの発現誘導の結果を示す。
【図4】実施例1の結果を示す図であり、HSP70過剰発現株におけるHSP70の誘導の結果を示す。
【図5】実施例1の結果を示す図であり、IBMXによるメラニン誘導に対するHSP70の過剰発現の影響を示す。
【図6】実施例1の結果を示す図であり、IBMXによるチロシナーゼの発現誘導に対するHSP70の影響を示す。
【図7】実施例1の結果を示す図であり、IBMXによるチロシナーゼの発現誘導に対するHSP70の影響を示す。
【図8】実施例3に係るウエスタン・ブロットの結果を示す図である。
【図9】実施例4に係るウエスタン・ブロットの結果を示す図である。
【図10】実施例5に係るウエスタン・ブロットの結果を示す図である。
【図11】実施例6に係るウエスタン・ブロットの結果を示す図である。
【図12】実施例7に係るチロシナーゼ活性の測定結果を示すグラフである。
【図13】実施例8に係るメラニン量の測定結果を示すグラフである。
【図14】実施例9に係るメラニン量の測定結果を示すグラフである。
【図15】実施例10に係るメラニン量の測定結果を示すグラフである。
【図16】実施例11に係るチロシナーゼmRNAの相対発現量の測定結果を示すグラフである。
【図17】実施例12に係るウエスタン・ブロットの結果を示す図である。
【図18】実施例13に係るウエスタン・ブロットの結果を示す図である。
【図19】実施例14に係るウエスタン・ブロットの結果を示す図である。
【発明を実施するための形態】
【0015】
以下、本発明の実施の形態について詳細に説明する。なお、本発明は、以下の実施の形態に限定されるものではなく、その要旨の範囲内で種々変形して実施することができる。ここで、本発明の実施の形態に係るHSPの発現誘導剤、メラニン産生抑制剤、皮膚外用剤、及び美白化粧料は、それぞれアルニカ、サルビア、及びマジョラムの少なくとも一つを含有する。アルニカ、サルビア、又はマジョラムを含有するHSPの発現誘導剤を内用又は外用することにより、アルニカ、サルビア、又はマジョラムによりHSPの発現を誘導される。そのため、抗細胞死作用、抗炎症作用、細胞保護作用、及び胃粘膜保護作用等を得ることが可能となる。また、アルニカ、サルビア、又はマジョラムを含有するメラニン産生抑制剤を内用又は外用することにより、HSPの発現が誘導され、発現したHSPによってチロシナーゼの発現が抑制される。チロシナーゼの活性は、メラニンの発現に関与しているため、チロシナーゼの発現を抑制することにより、メラニンの発現をも抑制することが可能となる。さらにアルニカ、サルビア、又はマジョラムを含有する美白化粧料を内用又は外用することにより、メラニンの発現が抑制され、結果として美白作用がもたらされる。
【0016】
本発明者らは、HSP70が、メラニンの発現に関与するチロシナーゼの働きを抑制し、その結果、メラニンの発現が抑制されることを見出した。その結果、美白作用を効果的に得ることが可能となる。
【0017】
実施の形態に係るHSPの発現誘導剤、メラニン産生抑制剤、皮膚外用剤、及び美白化粧料に含有されるアルニカ、サルビア、又はマジョラムは、抽出物であることが好ましい。アルニカ、サルビア、又はマジョラムの抽出物の調製は、植物の抽出分画を得る一般的な方法を採用することができ、その抽出方法は特に限定されない。また、抽出に際してアルニカ、サルビア、又はマジョラムはそのまま粉砕して用いてもよく、また、乾燥品を粉砕して用いることができる。抽出に使用する抽出溶媒は、これらに限定されないが、水、あるいは適当な有機溶媒を用いて抽出することができる。抽出したアルニカ、サルビア、又はマジョラムの抽出液は、そのまま使用してもよく、また効果を高めるために濃縮して用いることもでき、さらに得られた濃縮液を凍結乾燥し、粉末状のものを使用することもできる。
【0018】
実施の形態に係るアルニカ、サルビア、又はマジョラムを含有する皮膚外用剤は、ローション剤、乳剤、ゲル剤、クリーム剤、軟膏剤、粉末剤、顆粒剤、及び貼付剤等の剤型をとることができる。また、皮膚外用剤は、必要に応じて薬理学的及び製剤学的に許容しうる添加物を含有し得る。添加物としては、例えば、賦形剤、崩壊剤又は崩壊補助剤、結合剤、滑沢剤、コーティング剤、色素、希釈剤、基剤、溶解剤又は溶解補助剤、等張化剤、pH調節剤、安定化剤、噴射剤、粘着剤、並びに湿潤剤など、一般的に皮膚外用剤の調製に使用されるものが使用可能である。
【0019】
実施の形態に係る化粧料は、具体的には、化粧水、乳液、クリーム、美容液、及びパック等の皮膚化粧料、メイクアップベースローション、及びメイクアップベースクリーム等の下地化粧料、乳液剤、油性、固形状等の各剤型のファンデーション、アイカラー、及びチークカラー等のメイクアップ化粧料、並びにハンドクリーム、レッグクリーム、ネッククリーム、及びボディローション等の形態をとり得る。実施の形態に係る皮膚外用剤及び美白化粧料のそれぞれは、アルニカ、サルビア、又はマジョラムを有機又は無機の担体と共に含有していてもよい。担体としては、乳糖、でんぷん等の賦形剤、並びに植物性又は動物性の脂肪や油脂等が使用可能である。担体に対するアルニカの重量比率は、例えば0.01〜100重量%であるが、これに限定されない。
【0020】
また、実施の形態に係る美白化粧料におけるアルニカ、サルビア、又はマジョラムの配合量は、シミの予防・改善の目的、用いる人の性別、体重、年齢、剤型、シミの種類や程度、使用部位、使用回数などの種々の条件により決定される。例えば、皮膚に塗布する場合には、0.1μg〜10mg(アルニカ活性成分乾燥重量)/kg/日で、一日1回から数回に分けて適用することができるが、使用量はこの範囲に限定されるものではない。
【0021】
実施の形態に係る美白化粧料を内用又は外用することにより、メラニンの発現を抑制することが可能となり、その結果、シミの予防・改善作用をもたらすことが可能となる。実施の形態に係る美白化粧料は、紫外線による直接的な肌への刺激、或いは心身ストレス、ホルモンバランス等の異常に起因するシミなどの発生を抑制することも可能である。
【実施例】
【0022】
以下に本発明の実施の形態を、HSP70の発現の誘導、それによるメラニン産生抑制等の作用を説明しながら、より詳細に説明していく。
【0023】
なお、以下の実施例に示す材料、使用量、割合、処理内容、処理手順等は、本発明の実施の形態の趣旨を逸脱しない限り、適宜、変更することができる。したがって、本発明の範囲は以下に示す具体例に限定されるものではない。
【0024】
(実施例1:細胞培養法におけるHSP70の効果の確認)
<細胞培養法及びHSP過剰発現株の作成>
マウスメラノーマ由来のB16細胞(理研バイオリソースセンター)を、DMEM培地(10%の牛胎児血清、100U/mLのペニシリン、100U/mLのストレプトマイシン)で、5%炭酸ガス雰囲気下37℃で培養した。次に、リポフェクタミン(TM2000:Invitrogen社)を用いて、pcDNA3.1−human HSP70、又はpcDNA3.1をB16細胞に導入した後、200μg/mLのG418(Sigma社)を用いて、G418耐性クローンであるHSP70過剰発現株を選択した。また、HSP70の発現は、イムノブロット法により調べた。
【0025】
<薬剤添加法、及び熱ショック処理法>
メラニン発現を誘導する作用のあるIBMXをDMSOに溶解した。次に、IBMXをDMEM培地に100μmol/Lで希釈した後、培地交換を行い、5%炭酸ガス雰囲気下37℃で各時間、B16細胞を培養した。熱ショック処理は、5%炭酸ガス雰囲気下42℃にて1時間、B16細胞を培養することにより行った。さらに5%炭酸ガス雰囲気下37℃で6時間、B16細胞を培養した後、B16細胞を実験に用いた。
【0026】
<イムノブロット法>
熱ショックを1時間行い、更に6時間培養した後、又はIBMX 100μmol/L存在下、48時間培養した後、細胞を遠心して回収した。次に、回収物をPBS(リン酸緩衝生理食塩水:137mmol/L NaCl, 2.7mmol/L KCl, 1.5mmol/L KH2PO4, 4.3mmol/L NaHPO4)で洗った後、RIPA buffer [50mmol/L Tris−HCl (pH 7.2), 150mmol/L NaCl, 1% NP−40, 1% Sodium, deoxycolate, 0.05% SDS]に溶解し、遠心後の上清を全細胞抽出液として実験に用いた。
【0027】
各サンプルのタンパク質量を、Bio−Rad protein assay kit (bradford法:Bio Rad社)により求め、同量のタンパク質量に揃えた後、実験に使用した。サンプルはポリアクリルアミドを用いてSDS−PAGEを行い、PVDF膜にトランスファーした。その後、1次抗体 (against HSP70、HSP25、HSP47、HSP90 (Stressgen社)、 1:1000 dilution、 against actin、Tyrosinase (Santa Cruz Biothechnology社)、 1:1000 dilution)、及び2次抗体で免疫ブロットし、SuperSignal WestDura(化学発光法:Pierce社)により目的のバンドをLAS−3000 miniを用いて検出した。
【0028】
<メラニン定量法>
IBMX 100μmol/L存在下、72時間培養した後、細胞を遠心して回収しPBSで洗った後、1N NaOHに溶解し、100℃/30分加熱した。遠心後の上清を全細胞抽出液として実験に用いた。各サンプルのタンパク質量を、Bio−Rad protein assay kitにより求め、同量のタンパク質量に揃えた後、490nmの吸光度を、プレートリーダー(Fluostar Galaxy社)により測定した。
【0029】
<Real−time RT−PCR法>
IBMX 100μmol/L存在下、48時間培養した後、RNeasy kit(Qiagen社)を用いて細胞から全RNAを抽出した。
RNA 2.5μgを、first−strand cDNA synthesis kit(TAKARA Bio社)を用いて逆転写し、cDNAを合成した。合成したcDNAは、iQ SYBR GREEN Supermix(Bio Rad社)を用いてreal−time RT−PCRに利用し、Opticon Monitor Softwareを用いて解析した。PCR反応は、50℃で2分、90℃で10分の後に、95℃で30秒、63℃で60秒のサイクルを、45サイクルという条件で行った。特異性は、反応生成物をテンプレート(−)及び逆転写(−)のコントロールと一緒にアガロースゲル電気泳動を行って確認した。それぞれの反応において、GAPDH遺伝子を内部標準として用いた。
【0030】
プライマーは、Primer3 Web site(http://frodo.wi.mit.edu/cgi−bin/primer3/primer3_ www.cgi)により設計した。プライマーの配列を以下に記載する。
【0031】
Tyrosinase 5'-ctcctggcagatcatttgt-3' 5'-ggttttggctttgtcatggt-3'
GAPDH 5'-aactttggcattgtggaagg-3' 5'-acacattgggggtaggaaca-'
【0032】
<統計学的的解析>
以下の実施例を含め、すべての値は、平均値±標準偏差[standard deviation (SD)]で示している。有意差検定は、Tukey's testを用い
た。pの値が0.05未満になったとき有意な差があると判定した。
【0033】
<結果>
その結果を、図1乃至図7に示す。
図1は、B16細胞の熱ショックによるHSP70の発現誘導を示す結果であり、図2は、IBMXによるメラニン産生誘導に対する熱ショックの影響を示す結果である。
図1及び図2に示す結果から判明するように、熱ショックによりHSP70が発現誘導されており、IBMXによるメラニンの産生誘導の抑制にHSP70が関与していることが示された。
【0034】
図3は、熱ショックによる種々のHSPの発現誘導を示す結果である。熱ショックにより、HSP70だけでなく、HSP25等も発現誘導されていることが判明した。
【0035】
図4は、HSP70過剰発現株におけるHSP70の誘導を示す結果である。図5は、HSP70過剰発現株におけるIBMXによるメラニン誘導に対するHSP70の影響を示す結果である。
以上の図1〜図5に示す結果から、HSP70過剰発現株においても同様にIBMXによるメラニンの発現誘導が抑制されることが見られ、特に図4及び図5の結果からは、HSP70が単独でも、IBMXによるメラニンの発現誘導を抑制することに関与していることが示された。
【0036】
図6乃至図7は、HSP70過剰発現株において、IBMXによるチロシナーゼのタンパク質の発現誘導、及びチロシナーゼmRNAの発現誘導が抑制されたことを示す。
図6は、チロシナーゼのタンパク質の発現結果を、図7は、チロシナーゼのmRNAの発現結果を示すものである。
図中に示す結果より、IBMXによるチロシナーゼの発現誘導をHSP70が抑制することが示された。すなわち、HSP70は、チロシナーゼの発現を抑制することで、メラニンの産生を抑制していることが示された。
【0037】
以上の実施例1の結果から、HSP70の発現誘導が、メラニンの産生を抑制することが確認された。そこで、アルニカ、サルビア、及びマジョラムがHSP70の合成を誘導するか否か、以下の実施例2以降で検討した。
【0038】
(実施例2:アルニカ抽出物、サルビア抽出物、及びマジョラム抽出物の調製)
HSP70発現誘導剤を構成するアルニカ抽出物は、以下のように調整した。まず、生のアルニカ(丸善製薬)を粉砕した後、凍結乾燥し、ミキサーでさらに粉砕した。なお、乾燥したアルニカを用意した場合は、アルニカを水に戻した後、アルニカをミキサーにより粉砕した。その後、粉砕したアルニカを凍結乾燥し、ミキサーでさらに粉砕した。次に、凍結乾燥した粉砕物にエタノールを加え、3時間抽出し、濾過して濾液を得た。その後、濾液を乾燥状態になるまで濃縮し、アルニカ抽出物を得た。サルビア抽出物及びマジョラム抽出物も、同様の方法により得た。
【0039】
(実施例3:アルニカ抽出物によるHSP70発現誘導の確認)
培養液を満たした直径100mmの培養皿に、4×105個のメラノーマ細胞B16(理研バイオリソースセンター)を播種し、5%炭酸ガス雰囲気下に37℃にて24時間培養した。この培養液に、実施例2で得たアルニカ抽出物を、濃度2.5×10-2mg/mL、5.0×10-2mg/mL、7.5×10-2mg/mL、又は10.0×10-2mg/mLで添加し、さらに12時間又は24時間培養した。なお、コントロールとして、アルニカ抽出物を添加しなかった細胞も、12時間又は24時間培養した。
【0040】
次に、細胞培養液をSDS−PAGE電気泳動にかけた後、抗HSP70抗体を用いたウエスタン・ブロット法によりHSP70の発現量を測定した。その結果、図8に示すように、10.0×10-2mg/mLのアルニカ抽出物を添加した細胞培養液からは、HSP70のバンドが明確に確認された。12時間培養した場合と、24時間培養した場合とで、有意な差は認められなかった。
【0041】
これに対し、アルニカ抽出物を添加しなかった細胞培養液からは、HSP70のバンドは確認されなかった。なお、アルニカ抽出物の濃度が7.5×10-2mg/mL以下の場合も、HSP70のバンドは確認されなかった。したがって、適切な濃度のアルニカ抽出物は、HSP70の誘導発現作用を有することが示された。
【0042】
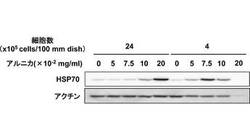
(実施例4:アルニカ抽出物によるHSP70発現誘導の確認)
培養液を満たした直径100mmの培養皿に、4×105個又は24×105個の表皮細胞PAM212を播種し、5%炭酸ガス雰囲気下に37℃にて24時間培養した。この培養液に、実施例2で得たアルニカ抽出物を、濃度5.0×10-2mg/mL、7.5×10-2mg/mL、10.0×10-2mg/mL、又は20.0×10-2mg/mLで添加し、さらに24時間培養した。なお、コントロールとして、アルニカ抽出物を添加しなかった細胞も、24時間培養した。
【0043】
次に、細胞培養液をSDS−PAGE電気泳動にかけた後、抗HSP70抗体を用いたウエスタン・ブロット法によりHSP70の発現量を測定した。その結果、4×105個の表皮細胞PAM212を播種した場合は、図9に示すように、7.5×10-2mg/mLのアルニカ抽出物を添加した細胞培養液から、HSP70のバンドが明確に確認された。また、5.0×10-2mg/mL及び10.0×10-2mg/mLのアルニカ抽出物を添加した細胞培養液からも、HSP70のバンドが確認された。
【0044】
24×105個の表皮細胞PAM212を播種した場合は、20.0×10-2mg/mLのアルニカ抽出物を添加した細胞培養液から、HSP70のバンドが明確に確認された。また、10.0×10-2mg/mLのアルニカ抽出物を添加した細胞培養液からも、HSP70のバンドが確認された。
【0045】
これに対し、アルニカ抽出物を添加しなかった細胞培養液からは、HSP70のバンドは確認されなかった。なお、24×105個の表皮細胞PAM212を播種した場合、アルニカ抽出物の濃度が7.5×10-2mg/mL以下であると、HSP70のバンドは確認されなかった。したがって、適切な濃度のアルニカ抽出物は、HSP70の誘導発現作用を有することが示された。
【0046】
(実施例5:サルビア抽出物によるHSP70発現誘導の確認)
培養液を満たした直径100mmの培養皿に、4×105個のメラノーマ細胞B16を播種し、5%炭酸ガス雰囲気下に37℃にて24時間培養した。この培養液に、実施例2で得たサルビア抽出物を、濃度50×10-2mg/mL、70×10-2mg/mL、80×10-2mg/mL、又は100×10-2mg/mLで添加し、さらに24時間培養した。なお、コントロールとして、サルビア抽出物を添加しなかった細胞も、24時間培養した。
【0047】
次に、細胞培養液をSDS−PAGE電気泳動にかけた後、抗HSP70抗体を用いたウエスタン・ブロット法によりHSP70の発現量を測定した。その結果、図10に示すように、80×10-2mg/mL以上のサルビア抽出物を添加した細胞培養液から、HSP70のバンドが明確に確認された。
【0048】
これに対し、サルビア抽出物を添加しなかった細胞培養液からは、HSP70のバンドは確認されなかった。したがって、適切な濃度のサルビア抽出物は、HSP70の誘導発現作用を有することが示された。
【0049】
(実施例6:マジョラム抽出物によるHSP70発現誘導の確認)
培養液を満たした直径100mmの培養皿に、4×105個のメラノーマ細胞B16を播種し、5%炭酸ガス雰囲気下に37℃にて24時間培養した。この培養液に、実施例2で得たマジョラム抽出物を、濃度40×10-2mg/mL、50×10-2mg/mL、60×10-2mg/mL、又は70×10-2mg/mLで添加し、さらに24時間培養した。なお、コントロールとして、マジョラム抽出物を添加しなかった細胞も、24時間培養した。
【0050】
次に、細胞培養液をSDS−PAGE電気泳動にかけた後、抗HSP70抗体を用いたウエスタン・ブロット法によりHSP70の発現量を測定した。その結果、図11に示すように、60×10-2mg/mL以上のマジョラム抽出物を添加した細胞培養液から、HSP70のバンドが明確に確認された。
【0051】
これに対し、マジョラム抽出物を添加しなかった細胞培養液からは、HSP70のバンドは確認されなかった。したがって、適切な濃度のマジョラム抽出物は、HSP70の誘導発現作用を有することが示された。
【0052】
(実施例7:アルニカ抽出物によるチロシナーゼ活性の抑制)
培養液を満たした直径100mmの培養皿に、4×105個のメラノーマ細胞B16を播種し、5%炭酸ガス雰囲気下に37℃にて24時間培養した。次に、培養液に、実施例2で得たアルニカ抽出物を、2.5×10-2mg/mL、5.0×10-2mg/mL、7.5×10-2mg/mL、又は10.0×10-2mg/mLの濃度で添加し、24時間培養した。なお、コントロールとして、アルニカ抽出物を添加しなかった細胞も、24時間培養した。
【0053】
さらに、メラニン発現を誘導する作用のあるIBMXを、濃度が100μmol/Lとなるよう培養液に添加し、48時間培養した。なお、コントロールとして、IBMXを添加しなかった細胞も、48時間培養した。細胞を回収し、0.1%Triton-X100(Sigma社)含有PBS100μLでサスペンドした後、30分間超音波処理した。基質となるL−DOPA200μLを96well plateに添加し、あらかじめ37度に保温しておいた。サンプルのタンパク質量をBradford法により求め、0.1%Triton-X100含有PBSでタンパク濃度100μg/50μLに調整した後、保温しておいたL−DOPAに50μL添加し、37度で1時間定温放置しながら490nmにおける吸光度の変化を測定した。ここで、図12に示すように、アルニカ抽出物及びIBMXを添加しなかった場合のチロシナーゼ活性を100%とすると、アルニカ抽出物を添加せず、IBMXを100μmol/L添加した場合のチロシナーゼ活性は約380%近くまで上昇した。しかし、IBMXに加えてアルニカ抽出物を添加した場合のチロシナーゼ活性は、アルニカ抽出物を添加しなかった場合と比較して、顕著に減少した。よって、アルニカ抽出物にチロシナーゼ活性の抑制能があることが示された。
【0054】
(実施例8:アルニカ抽出物によるメラニン発現の抑制)
培養液を満たした直径100mmの培養皿に、4×105個のメラノーマ細胞B16を播種し、5%炭酸ガス雰囲気下に37℃にて24時間培養した。次に、培養液に、実施例2で得たアルニカ抽出物を、2.5×10-2mg/mL、5.0×10-2mg/mL、7.5×10-2mg/mL、又は10.0×10-2mg/mLの濃度で添加し、24時間培養した。なお、コントロールとして、アルニカ抽出物を添加しなかった細胞も、24時間培養した。
【0055】
また、アルニカ抽出物を添加して24時間培養した後、さらに、メラニン発現を誘導する作用のあるIBMXを、濃度が100μmol/Lとなるよう培養液に添加し、72時間培養した。なお、コントロールとして、IBMXを添加しなかった細胞も、72時間培養した。
【0056】
その後、実施例1と同様の方法により、メラニンの発現量を測定した。ここで、アルニカ抽出物及びIBMXを添加しなかった場合のメラニン量を100%とすると、図13に示すように、IBMXを添加せず、アルニカ抽出物を添加した場合のメラニン量は、アルニカ抽出物及びIBMXの両方を添加しなかった場合と比較して、顕著に減少した。
【0057】
また、アルニカ抽出物を加えず、IBMXを100μmol/L添加した場合のメラニンの発現量は約170%近くまで上昇した。しかし、IBMXに加えてアルニカ抽出物を添加した場合のメラニン量は、アルニカ抽出物を添加しなかった場合と比較して、顕著に減少した。よって、アルニカ抽出物に、メラニン発現の抑制能があることが示された。
【0058】
(実施例9:サルビア抽出物によるメラニン発現の抑制)
培養液を満たした直径100mmの培養皿に、4×105個のメラノーマ細胞B16を播種し、5%炭酸ガス雰囲気下に37℃にて24時間培養した。次に、培養液に、実施例2で得たサルビア抽出物を、25×10-2mg/mL、50×10-2mg/mL、75×10-2mg/mL、又は100×10-2mg/mLの濃度で添加し、24時間培養した。なお、コントロールとして、サルビア抽出物を添加しなかった細胞も、24時間培養した。
【0059】
また、サルビア抽出物を添加して24時間培養した後、さらに、メラニン発現を誘導する作用のあるIBMXを、濃度が100μmol/Lとなるよう培養液に添加し、72時間培養した。なお、コントロールとして、IBMXを添加しなかった細胞も、72時間培養した。
【0060】
その後、実施例1と同様の方法によりに、メラニンの発現量を測定した。ここで、サルビア抽出物及びIBMXを添加しなかった場合のメラニン量を100%とすると、図14に示すように、IBMXを添加せず、サルビア抽出物を添加した場合のメラニンの発現量は、サルビア抽出物及びIBMXの両方を添加しなかった場合と比較して、顕著に減少した。
【0061】
また、サルビア抽出物を加えず、IBMXを100μmol/L添加した場合のメラニンの発現量は約170%近くまで上昇した。しかし、IBMXに加えてサルビア抽出物を添加した場合のメラニンの発現量は、サルビア抽出物を添加しなかった場合と比較して、顕著に減少した。よって、サルビア抽出物に、メラニン発現の抑制能があることが示された。
【0062】
(実施例10:マジョラム抽出物によるメラニン発現の抑制)
培養液を満たした直径100mmの培養皿に、4×105個のメラノーマ細胞B16を播種し、5%炭酸ガス雰囲気下に37℃にて24時間培養した。次に、培養液に、実施例2で得たマジョラム抽出物を、10×10-2mg/mL、20×10-2mg/mL、30×10-2mg/mL、又は50×10-2mg/mLの濃度で添加し、24時間培養した。なお、コントロールとして、マジョラム抽出物を添加しなかった細胞も、24時間培養した。
【0063】
また、マジョラム抽出物を添加して24時間培養した後、さらに、メラニン発現を誘導する作用のあるIBMXを、濃度が100μmol/Lとなるよう培養液に添加し、72時間培養した。なお、コントロールとして、IBMXを添加しなかった細胞も、72時間培養した。
【0064】
その後、実施例1と同様の方法によりに、メラニンの発現量を測定した。ここで、マジョラム抽出物及びIBMXを添加しなかった場合のメラニンの発現量を100%とすると、図15に示すように、IBMXを添加せず、マジョラム抽出物を添加した場合のメラニンの発現量は、マジョラム抽出物及びIBMXの両方を添加しなかった場合と比較して、顕著に減少した。
【0065】
また、マジョラム抽出物を加えず、IBMXを100μmol/L添加した場合のメラニンの発現量は約175%近くまで上昇した。しかし、IBMXに加えてマジョラム抽出物を添加した場合のメラニンの発現量は、マジョラム抽出物を添加しなかった場合と比較して、顕著に減少した。よって、マジョラム抽出物に、メラニン発現の抑制能があることが示された。
【0066】
(実施例11:アルニカ抽出物によるチロシナーゼmRNA発現の抑制)
培養液を満たした直径100mmの培養皿に、4×105個のメラノーマ細胞B16を播種し、5%炭酸ガス雰囲気下に37℃にて24時間培養した。次に、培養液に、実施例2で得たアルニカ抽出物を、2.5×10-2mg/mL、5.0×10-2mg/mL、7.5×10-2mg/mL、又は10.0×10-2mg/mLの濃度で添加し、24時間培養した。なお、コントロールとして、アルニカ抽出物を添加しなかった細胞も、24時間培養した。
【0067】
アルニカ抽出物を添加して24時間培養した後、さらに、メラニン発現を誘導する作用のあるIBMXを、濃度が100μmol/Lとなるよう培養液に添加し、24時間培養した。なお、コントロールとして、IBMXを添加しなかった細胞も、24時間培養した。その後、mRNAを抽出し、アルニカ抽出物及びIBMXを添加しなかった場合のチロシナーゼmRNAの相対発現量を1とすると、図16に示すように、IBMXを添加せず、7.5×10-2mg/mL及び10.0×10-2mg/mLのアルニカ抽出物を添加した場合のチロシナーゼmRNAの相対発現量は、アルニカ抽出物及びIBMXを添加しなかった場合と比較して、わずかに低下した。
【0068】
また、アルニカ抽出物を加えず、IBMXを100μmol/L添加した場合のチロシナーゼmRNAの相対発現量は約2.0近くまで上昇した。しかし、IBMXに加えてアルニカ抽出物を添加した場合のチロシナーゼmRNAの相対発現量は、アルニカ抽出物を添加しなかった場合と比較して、顕著に減少した。
【0069】
(実施例12:アルニカ抽出物によるチロシナーゼ発現の抑制)
培養液を満たした直径100mmの培養皿に、4×105個のメラノーマ細胞B16を播種し、5%炭酸ガス雰囲気下に37℃にて24時間培養した。この培養液に、実施例2で得たアルニカ抽出物を、濃度1.0×10-2mg/mL、2.5×10-2mg/mL、5.0×10-2mg/mL、又は10.0×10-2mg/mLで添加し、さらに24時間培養した。なお、コントロールとして、アルニカ抽出物を添加しなかった細胞も、24時間培養した。
【0070】
次に、メラニン発現を誘導する作用のあるIBMXを、濃度が100μmol/Lとなるよう培養液に添加し、48時間培養した。なお、コントロールとして、IBMXを添加しなかった細胞も、48時間培養した。その後、細胞培養液をSDS−PAGE電気泳動にかけた後、抗チロシナーゼ抗体を用いたウエスタン・ブロット法により成熟型チロシナーゼ及び未成熟型チロシナーゼの発現量を測定した。その結果、図17に示すように、アルニカ抽出物の未成熟型チロシナーゼの発現量への影響は確認されなかったものの、添加したアルニカ抽出物の濃度が上昇するにつれて、成熟型チロシナーゼの発現量が低下したことが示された。よって、アルニカ抽出物は、成熟型チロシナーゼの発現を抑制することが示された。
【0071】
(実施例13:サルビア抽出物によるチロシナーゼ発現の抑制)
培養液を満たした直径100mmの培養皿に、4×105個のメラノーマ細胞B16を播種し、5%炭酸ガス雰囲気下に37℃にて24時間培養した。この培養液に、実施例2で得たサルビア抽出物を、濃度25×10-2mg/mL、50×10-2mg/mL、75×10-2mg/mL、又は100×10-2mg/mLで添加し、さらに24時間培養した。なお、コントロールとして、サルビア抽出物を添加しなかった細胞も、24時間培養した。
【0072】
次に、メラニン発現を誘導する作用のあるIBMXを、濃度が100μmol/Lとなるよう培養液に添加し、48時間培養した。なお、コントロールとして、IBMXを添加しなかった細胞も、48時間培養した。その後、細胞培養液をSDS−PAGE電気泳動にかけた後、抗チロシナーゼ抗体を用いたウエスタン・ブロット法により成熟型チロシナーゼ及び未成熟型チロシナーゼの発現量を測定した。その結果、図18に示すように、サルビア抽出物の未成熟型チロシナーゼの発現量への影響は確認されなかったものの、添加したサルビア抽出物の濃度が上昇するにつれて、成熟型チロシナーゼの発現量が低下したことが示された。よって、サルビア抽出物は、成熟型チロシナーゼの発現を抑制することが示された。
【0073】
(実施例14:マジョラム抽出物によるチロシナーゼ発現の抑制)
培養液を満たした直径100mmの培養皿に、4×105個のメラノーマ細胞B16を播種し、5%炭酸ガス雰囲気下に37℃にて24時間培養した。この培養液に、実施例2で得たマジョラム抽出物を、濃度10×10-2mg/mL、20×10-2mg/mL、30×10-2mg/mL、又は50×10-2mg/mLで添加し、さらに24時間培養した。なお、コントロールとして、マジョラム抽出物を添加しなかった細胞も、24時間培養した。
【0074】
次に、メラニン発現を誘導する作用のあるIBMXを、濃度が100μmol/Lとなるよう培養液に添加し、48時間培養した。なお、コントロールとして、IBMXを添加しなかった細胞も、48時間培養した。その後、細胞培養液をSDS−PAGE電気泳動にかけた後、抗チロシナーゼ抗体を用いたウエスタン・ブロット法により成熟型チロシナーゼ及び未成熟型チロシナーゼの発現量を測定した。その結果、図19に示すように、マジョラム抽出物の未成熟型チロシナーゼの発現量への影響は確認されなかったものの、添加したマジョラム抽出物の濃度が上昇するにつれて、成熟型チロシナーゼの発現量が低下したことが示された。よって、マジョラム抽出物は、成熟型チロシナーゼの発現を抑制することが示された。
【0075】
(実施例15:皮膚外用剤)
以下の処方により、皮膚外用剤(クリーム剤)を得た。
スクワラン 20重量%
ミツロウ 5
精製ホホバ油 5
グリセリンモノステアレート 2
ソルビタンモノステアレート 2
ポリオキシエチレン(20)ソルビタンモノステアレート 2
グリセリン 5
アルニカ抽出物 1
精製水 100とする残部
【0076】
(実施例16:美白化粧料)
(1)ローション
以下の処方により、ローションを得た。
ソルビット 2重量%
1,3−ブチレングリコール 2
ポリエチレングリコール1000 1
ポリオキシエチレンオレイルエーテル(25EO) 2
エタノール 10
テプレノン 1
防腐剤 適量
精製水 100とする残部
【0077】
(2)乳液
以下の処方により、乳液を得た。
スクワラン 1重量%
グリセリン 1
ステアリルアルコール 0.3
ソルビタンモノステアレート 1.5
ポリオキシエチレン(20)ソルビタンモノステアレート 2
1,3−ブチレングリコール 5
アルニカ抽出物 1
精製水 100とする残部
【産業上の利用可能性】
【0078】
本発明の実施の形態に係る熱ショックタンパク質の発現誘導剤は、HSP70ファミリーの発現を誘導し、抗細胞死作用、抗炎症作用、細胞保護作用、及び胃粘膜保護作用等をもたらす。また、本発明の実施の形態に係る熱ショックタンパク質の発現誘導剤は、HSP70ファミリーの発現を誘導し、紫外線による直接的な肌への刺激、或いは心身ストレス、ホルモンバランス等の異常に起因するシミなどの発生に対処可能である。そのため、本発明の実施の形態に係る熱ショックタンパク質の発現誘導剤は、医薬品産業及び化粧品産業に利用可能である。
【技術分野】
【0001】
本発明は、生命工学に係り、熱ショックタンパク質の発現誘導剤に関する。
【背景技術】
【0002】
人体の細胞、組織、あるいは器官が、一般的な生理的温度より3℃以上高い温度に晒されると、生体の防御システムの一つとして、一群の特異的タンパク質が発現することが知られている。これら一群の特異的タンパク質は、SDS−PAGE(ドデシル硫酸ナトリウム−ポリアクリルアミドゲル電気泳動法)によって測定した場合、10〜110KDaの分子量を有し、熱ショックタンパク質(Heat Shock Proteins、以下、「HSP」と称する場合もある。)と呼ばれる。
【0003】
HSPは、分子量の相違により、HSP90ファミリー(分子量:90kDa以上110kDa以下)、HSP70ファミリー(分子量:70kDa以上80kDa未満)、HSP60ファミリー(分子量:60kDa以上70kDa未満)、及び低分子量HSPファミリー(分子量:60kDa未満)に分類されている。
【0004】
HSPの機能は多岐にわたる。例えば、HSP70及びHSP60ファミリーは、変性タンパク質に結合して、変性タンパク質を天然のフォールディング(高次構造・折り畳み構造)に巻き戻す作用や、第三のタンパク質や核酸との会合、細胞内での局在化や膜透過への関与など、いわゆる分子シャペロンと呼ばれる機能を担っている(例えば、非特許文献1及び非特許文献2参照。)。そこで、HSPの発現を誘導する生薬抽出物を含有する熱ショックタンパク質誘導剤が提案されている(例えば、特許文献1参照。)。さらに、水生プランクトンであるアルテミアの孵化直前の耐久卵から水抽出した活性エキス(アルテミアエキス)成分が、ヒト皮膚細胞においてHSP70の発現を誘発することが見出されている。そこで、アルテミアエキス成分を含有する抗皮膚ストレス(ストレス防御)用化粧料も提案されている(例えば、特許文献2参照。)。
【0005】
また、人の皮膚が紫外線を吸収すると、身体を紫外線から守るために、皮膚基底層にあるメラノサイトにおいてメラニン合成の律速酵素であるチロシナーゼが活性化し、メラニンが産生される。すなわち、メラニンは、皮膚に日光が当たることで産生される色素であり、紫外線を吸収したり散乱したりすることにより、強い紫外線から細胞や皮膚を守る働きを有している。その一方、皮膚のシミの発生は、メラニンの部分的な異常増加が原因であると考えられている。
【0006】
ここで、HSPは、紫外線、放射線、及び外的傷害等の外界からのストレスに晒された場合にも、発現が誘導される。これらのストレスは、細胞のタンパク質を変性させ、不溶性沈殿を形成して細胞にダメージを与える。しかし、HSPの発現により、ストレスによる細胞へのダメージを抑制することが可能となる。
【先行技術文献】
【非特許文献】
【0007】
【非特許文献1】Hendrick, J. P. & Hartl, F. −U., Ann. Rev. Biochem., 62, 349−384 (1993)
【非特許文献2】Georgopoulos, C. & Welch. W. J., Ann. Rev. Cell Biol., 9, 601−634 (1993)
【特許文献】
【0008】
【特許文献1】特開2008−127296号公報
【特許文献2】特開2004−238297号公報
【発明の概要】
【発明が解決しようとする課題】
【0009】
そこで本発明は、生体内におけるHSPの発現に伴う有利な効果に鑑み、効果的なHSPの発現誘導剤を提供することを課題とする。
【課題を解決するための手段】
【0010】
本発明者らは、アルニカというキク科の植物、サルビアというシソ科の植物、及びマジョラムというシソ科の植物が、HSPの発現を誘導することを初めて見出した。そこで、本発明の態様は、アルニカを含有するHSPの発現誘導剤であることを要旨とする。本発明の他の態様は、サルビアを含有するHSPの発現誘導剤であることを要旨とする。また、本発明の他の態様は、マジョラムを含有するHSPの発現誘導剤であることを要旨とする。本発明の態様に係るHSPの発現誘導剤は、例えば、ローション剤、乳剤、ゲル剤、クリーム剤、軟膏剤、及び貼付剤等の皮膚外用剤として提供されてもよい。
【0011】
本発明の態様に係るHSPの発現誘導剤を人体に内用又は外用することにより、HSPの発現を誘導し、抗細胞死作用、抗炎症作用、細胞保護作用、及び胃粘膜保護作用等を得ることが可能となる。
【0012】
さらに、本発明者らは、HSPの生体防御機能に着目し、その作用を種々検討した結果、HSPのなかでも、HSP70ファミリー(SDS−PAGEによる測定で、分子量:70kDa以上80kDa未満)が、シミの発生原因とされるメラニンの発現を効果的に抑制し、皮膚美白作用があることを見出した。さらに、アルニカ、サルビア、及びマジョラムは、HSP70の発現を誘導することも見出した。したがって、本発明の態様に係るHSPの発現誘導剤は、メラニンの発現を抑制し、皮膚美白作用をも奏する。
【発明の効果】
【0013】
本発明によれば、効果的なHSPの発現誘導剤を提供可能である。
【図面の簡単な説明】
【0014】
【図1】実施例1の結果を示す図であり、B16細胞における熱ショックによるHSP70の誘導の結果を示す。
【図2】実施例1の結果を示す図であり、3−isobutyl−1−methylxanthine(IBMX:Sigma社)によるメラニン誘導に対する熱ショックの影響を示す。
【図3】実施例1における、熱ショックによる種々のHSPの発現誘導の結果を示す。
【図4】実施例1の結果を示す図であり、HSP70過剰発現株におけるHSP70の誘導の結果を示す。
【図5】実施例1の結果を示す図であり、IBMXによるメラニン誘導に対するHSP70の過剰発現の影響を示す。
【図6】実施例1の結果を示す図であり、IBMXによるチロシナーゼの発現誘導に対するHSP70の影響を示す。
【図7】実施例1の結果を示す図であり、IBMXによるチロシナーゼの発現誘導に対するHSP70の影響を示す。
【図8】実施例3に係るウエスタン・ブロットの結果を示す図である。
【図9】実施例4に係るウエスタン・ブロットの結果を示す図である。
【図10】実施例5に係るウエスタン・ブロットの結果を示す図である。
【図11】実施例6に係るウエスタン・ブロットの結果を示す図である。
【図12】実施例7に係るチロシナーゼ活性の測定結果を示すグラフである。
【図13】実施例8に係るメラニン量の測定結果を示すグラフである。
【図14】実施例9に係るメラニン量の測定結果を示すグラフである。
【図15】実施例10に係るメラニン量の測定結果を示すグラフである。
【図16】実施例11に係るチロシナーゼmRNAの相対発現量の測定結果を示すグラフである。
【図17】実施例12に係るウエスタン・ブロットの結果を示す図である。
【図18】実施例13に係るウエスタン・ブロットの結果を示す図である。
【図19】実施例14に係るウエスタン・ブロットの結果を示す図である。
【発明を実施するための形態】
【0015】
以下、本発明の実施の形態について詳細に説明する。なお、本発明は、以下の実施の形態に限定されるものではなく、その要旨の範囲内で種々変形して実施することができる。ここで、本発明の実施の形態に係るHSPの発現誘導剤、メラニン産生抑制剤、皮膚外用剤、及び美白化粧料は、それぞれアルニカ、サルビア、及びマジョラムの少なくとも一つを含有する。アルニカ、サルビア、又はマジョラムを含有するHSPの発現誘導剤を内用又は外用することにより、アルニカ、サルビア、又はマジョラムによりHSPの発現を誘導される。そのため、抗細胞死作用、抗炎症作用、細胞保護作用、及び胃粘膜保護作用等を得ることが可能となる。また、アルニカ、サルビア、又はマジョラムを含有するメラニン産生抑制剤を内用又は外用することにより、HSPの発現が誘導され、発現したHSPによってチロシナーゼの発現が抑制される。チロシナーゼの活性は、メラニンの発現に関与しているため、チロシナーゼの発現を抑制することにより、メラニンの発現をも抑制することが可能となる。さらにアルニカ、サルビア、又はマジョラムを含有する美白化粧料を内用又は外用することにより、メラニンの発現が抑制され、結果として美白作用がもたらされる。
【0016】
本発明者らは、HSP70が、メラニンの発現に関与するチロシナーゼの働きを抑制し、その結果、メラニンの発現が抑制されることを見出した。その結果、美白作用を効果的に得ることが可能となる。
【0017】
実施の形態に係るHSPの発現誘導剤、メラニン産生抑制剤、皮膚外用剤、及び美白化粧料に含有されるアルニカ、サルビア、又はマジョラムは、抽出物であることが好ましい。アルニカ、サルビア、又はマジョラムの抽出物の調製は、植物の抽出分画を得る一般的な方法を採用することができ、その抽出方法は特に限定されない。また、抽出に際してアルニカ、サルビア、又はマジョラムはそのまま粉砕して用いてもよく、また、乾燥品を粉砕して用いることができる。抽出に使用する抽出溶媒は、これらに限定されないが、水、あるいは適当な有機溶媒を用いて抽出することができる。抽出したアルニカ、サルビア、又はマジョラムの抽出液は、そのまま使用してもよく、また効果を高めるために濃縮して用いることもでき、さらに得られた濃縮液を凍結乾燥し、粉末状のものを使用することもできる。
【0018】
実施の形態に係るアルニカ、サルビア、又はマジョラムを含有する皮膚外用剤は、ローション剤、乳剤、ゲル剤、クリーム剤、軟膏剤、粉末剤、顆粒剤、及び貼付剤等の剤型をとることができる。また、皮膚外用剤は、必要に応じて薬理学的及び製剤学的に許容しうる添加物を含有し得る。添加物としては、例えば、賦形剤、崩壊剤又は崩壊補助剤、結合剤、滑沢剤、コーティング剤、色素、希釈剤、基剤、溶解剤又は溶解補助剤、等張化剤、pH調節剤、安定化剤、噴射剤、粘着剤、並びに湿潤剤など、一般的に皮膚外用剤の調製に使用されるものが使用可能である。
【0019】
実施の形態に係る化粧料は、具体的には、化粧水、乳液、クリーム、美容液、及びパック等の皮膚化粧料、メイクアップベースローション、及びメイクアップベースクリーム等の下地化粧料、乳液剤、油性、固形状等の各剤型のファンデーション、アイカラー、及びチークカラー等のメイクアップ化粧料、並びにハンドクリーム、レッグクリーム、ネッククリーム、及びボディローション等の形態をとり得る。実施の形態に係る皮膚外用剤及び美白化粧料のそれぞれは、アルニカ、サルビア、又はマジョラムを有機又は無機の担体と共に含有していてもよい。担体としては、乳糖、でんぷん等の賦形剤、並びに植物性又は動物性の脂肪や油脂等が使用可能である。担体に対するアルニカの重量比率は、例えば0.01〜100重量%であるが、これに限定されない。
【0020】
また、実施の形態に係る美白化粧料におけるアルニカ、サルビア、又はマジョラムの配合量は、シミの予防・改善の目的、用いる人の性別、体重、年齢、剤型、シミの種類や程度、使用部位、使用回数などの種々の条件により決定される。例えば、皮膚に塗布する場合には、0.1μg〜10mg(アルニカ活性成分乾燥重量)/kg/日で、一日1回から数回に分けて適用することができるが、使用量はこの範囲に限定されるものではない。
【0021】
実施の形態に係る美白化粧料を内用又は外用することにより、メラニンの発現を抑制することが可能となり、その結果、シミの予防・改善作用をもたらすことが可能となる。実施の形態に係る美白化粧料は、紫外線による直接的な肌への刺激、或いは心身ストレス、ホルモンバランス等の異常に起因するシミなどの発生を抑制することも可能である。
【実施例】
【0022】
以下に本発明の実施の形態を、HSP70の発現の誘導、それによるメラニン産生抑制等の作用を説明しながら、より詳細に説明していく。
【0023】
なお、以下の実施例に示す材料、使用量、割合、処理内容、処理手順等は、本発明の実施の形態の趣旨を逸脱しない限り、適宜、変更することができる。したがって、本発明の範囲は以下に示す具体例に限定されるものではない。
【0024】
(実施例1:細胞培養法におけるHSP70の効果の確認)
<細胞培養法及びHSP過剰発現株の作成>
マウスメラノーマ由来のB16細胞(理研バイオリソースセンター)を、DMEM培地(10%の牛胎児血清、100U/mLのペニシリン、100U/mLのストレプトマイシン)で、5%炭酸ガス雰囲気下37℃で培養した。次に、リポフェクタミン(TM2000:Invitrogen社)を用いて、pcDNA3.1−human HSP70、又はpcDNA3.1をB16細胞に導入した後、200μg/mLのG418(Sigma社)を用いて、G418耐性クローンであるHSP70過剰発現株を選択した。また、HSP70の発現は、イムノブロット法により調べた。
【0025】
<薬剤添加法、及び熱ショック処理法>
メラニン発現を誘導する作用のあるIBMXをDMSOに溶解した。次に、IBMXをDMEM培地に100μmol/Lで希釈した後、培地交換を行い、5%炭酸ガス雰囲気下37℃で各時間、B16細胞を培養した。熱ショック処理は、5%炭酸ガス雰囲気下42℃にて1時間、B16細胞を培養することにより行った。さらに5%炭酸ガス雰囲気下37℃で6時間、B16細胞を培養した後、B16細胞を実験に用いた。
【0026】
<イムノブロット法>
熱ショックを1時間行い、更に6時間培養した後、又はIBMX 100μmol/L存在下、48時間培養した後、細胞を遠心して回収した。次に、回収物をPBS(リン酸緩衝生理食塩水:137mmol/L NaCl, 2.7mmol/L KCl, 1.5mmol/L KH2PO4, 4.3mmol/L NaHPO4)で洗った後、RIPA buffer [50mmol/L Tris−HCl (pH 7.2), 150mmol/L NaCl, 1% NP−40, 1% Sodium, deoxycolate, 0.05% SDS]に溶解し、遠心後の上清を全細胞抽出液として実験に用いた。
【0027】
各サンプルのタンパク質量を、Bio−Rad protein assay kit (bradford法:Bio Rad社)により求め、同量のタンパク質量に揃えた後、実験に使用した。サンプルはポリアクリルアミドを用いてSDS−PAGEを行い、PVDF膜にトランスファーした。その後、1次抗体 (against HSP70、HSP25、HSP47、HSP90 (Stressgen社)、 1:1000 dilution、 against actin、Tyrosinase (Santa Cruz Biothechnology社)、 1:1000 dilution)、及び2次抗体で免疫ブロットし、SuperSignal WestDura(化学発光法:Pierce社)により目的のバンドをLAS−3000 miniを用いて検出した。
【0028】
<メラニン定量法>
IBMX 100μmol/L存在下、72時間培養した後、細胞を遠心して回収しPBSで洗った後、1N NaOHに溶解し、100℃/30分加熱した。遠心後の上清を全細胞抽出液として実験に用いた。各サンプルのタンパク質量を、Bio−Rad protein assay kitにより求め、同量のタンパク質量に揃えた後、490nmの吸光度を、プレートリーダー(Fluostar Galaxy社)により測定した。
【0029】
<Real−time RT−PCR法>
IBMX 100μmol/L存在下、48時間培養した後、RNeasy kit(Qiagen社)を用いて細胞から全RNAを抽出した。
RNA 2.5μgを、first−strand cDNA synthesis kit(TAKARA Bio社)を用いて逆転写し、cDNAを合成した。合成したcDNAは、iQ SYBR GREEN Supermix(Bio Rad社)を用いてreal−time RT−PCRに利用し、Opticon Monitor Softwareを用いて解析した。PCR反応は、50℃で2分、90℃で10分の後に、95℃で30秒、63℃で60秒のサイクルを、45サイクルという条件で行った。特異性は、反応生成物をテンプレート(−)及び逆転写(−)のコントロールと一緒にアガロースゲル電気泳動を行って確認した。それぞれの反応において、GAPDH遺伝子を内部標準として用いた。
【0030】
プライマーは、Primer3 Web site(http://frodo.wi.mit.edu/cgi−bin/primer3/primer3_ www.cgi)により設計した。プライマーの配列を以下に記載する。
【0031】
Tyrosinase 5'-ctcctggcagatcatttgt-3' 5'-ggttttggctttgtcatggt-3'
GAPDH 5'-aactttggcattgtggaagg-3' 5'-acacattgggggtaggaaca-'
【0032】
<統計学的的解析>
以下の実施例を含め、すべての値は、平均値±標準偏差[standard deviation (SD)]で示している。有意差検定は、Tukey's testを用い
た。pの値が0.05未満になったとき有意な差があると判定した。
【0033】
<結果>
その結果を、図1乃至図7に示す。
図1は、B16細胞の熱ショックによるHSP70の発現誘導を示す結果であり、図2は、IBMXによるメラニン産生誘導に対する熱ショックの影響を示す結果である。
図1及び図2に示す結果から判明するように、熱ショックによりHSP70が発現誘導されており、IBMXによるメラニンの産生誘導の抑制にHSP70が関与していることが示された。
【0034】
図3は、熱ショックによる種々のHSPの発現誘導を示す結果である。熱ショックにより、HSP70だけでなく、HSP25等も発現誘導されていることが判明した。
【0035】
図4は、HSP70過剰発現株におけるHSP70の誘導を示す結果である。図5は、HSP70過剰発現株におけるIBMXによるメラニン誘導に対するHSP70の影響を示す結果である。
以上の図1〜図5に示す結果から、HSP70過剰発現株においても同様にIBMXによるメラニンの発現誘導が抑制されることが見られ、特に図4及び図5の結果からは、HSP70が単独でも、IBMXによるメラニンの発現誘導を抑制することに関与していることが示された。
【0036】
図6乃至図7は、HSP70過剰発現株において、IBMXによるチロシナーゼのタンパク質の発現誘導、及びチロシナーゼmRNAの発現誘導が抑制されたことを示す。
図6は、チロシナーゼのタンパク質の発現結果を、図7は、チロシナーゼのmRNAの発現結果を示すものである。
図中に示す結果より、IBMXによるチロシナーゼの発現誘導をHSP70が抑制することが示された。すなわち、HSP70は、チロシナーゼの発現を抑制することで、メラニンの産生を抑制していることが示された。
【0037】
以上の実施例1の結果から、HSP70の発現誘導が、メラニンの産生を抑制することが確認された。そこで、アルニカ、サルビア、及びマジョラムがHSP70の合成を誘導するか否か、以下の実施例2以降で検討した。
【0038】
(実施例2:アルニカ抽出物、サルビア抽出物、及びマジョラム抽出物の調製)
HSP70発現誘導剤を構成するアルニカ抽出物は、以下のように調整した。まず、生のアルニカ(丸善製薬)を粉砕した後、凍結乾燥し、ミキサーでさらに粉砕した。なお、乾燥したアルニカを用意した場合は、アルニカを水に戻した後、アルニカをミキサーにより粉砕した。その後、粉砕したアルニカを凍結乾燥し、ミキサーでさらに粉砕した。次に、凍結乾燥した粉砕物にエタノールを加え、3時間抽出し、濾過して濾液を得た。その後、濾液を乾燥状態になるまで濃縮し、アルニカ抽出物を得た。サルビア抽出物及びマジョラム抽出物も、同様の方法により得た。
【0039】
(実施例3:アルニカ抽出物によるHSP70発現誘導の確認)
培養液を満たした直径100mmの培養皿に、4×105個のメラノーマ細胞B16(理研バイオリソースセンター)を播種し、5%炭酸ガス雰囲気下に37℃にて24時間培養した。この培養液に、実施例2で得たアルニカ抽出物を、濃度2.5×10-2mg/mL、5.0×10-2mg/mL、7.5×10-2mg/mL、又は10.0×10-2mg/mLで添加し、さらに12時間又は24時間培養した。なお、コントロールとして、アルニカ抽出物を添加しなかった細胞も、12時間又は24時間培養した。
【0040】
次に、細胞培養液をSDS−PAGE電気泳動にかけた後、抗HSP70抗体を用いたウエスタン・ブロット法によりHSP70の発現量を測定した。その結果、図8に示すように、10.0×10-2mg/mLのアルニカ抽出物を添加した細胞培養液からは、HSP70のバンドが明確に確認された。12時間培養した場合と、24時間培養した場合とで、有意な差は認められなかった。
【0041】
これに対し、アルニカ抽出物を添加しなかった細胞培養液からは、HSP70のバンドは確認されなかった。なお、アルニカ抽出物の濃度が7.5×10-2mg/mL以下の場合も、HSP70のバンドは確認されなかった。したがって、適切な濃度のアルニカ抽出物は、HSP70の誘導発現作用を有することが示された。
【0042】
(実施例4:アルニカ抽出物によるHSP70発現誘導の確認)
培養液を満たした直径100mmの培養皿に、4×105個又は24×105個の表皮細胞PAM212を播種し、5%炭酸ガス雰囲気下に37℃にて24時間培養した。この培養液に、実施例2で得たアルニカ抽出物を、濃度5.0×10-2mg/mL、7.5×10-2mg/mL、10.0×10-2mg/mL、又は20.0×10-2mg/mLで添加し、さらに24時間培養した。なお、コントロールとして、アルニカ抽出物を添加しなかった細胞も、24時間培養した。
【0043】
次に、細胞培養液をSDS−PAGE電気泳動にかけた後、抗HSP70抗体を用いたウエスタン・ブロット法によりHSP70の発現量を測定した。その結果、4×105個の表皮細胞PAM212を播種した場合は、図9に示すように、7.5×10-2mg/mLのアルニカ抽出物を添加した細胞培養液から、HSP70のバンドが明確に確認された。また、5.0×10-2mg/mL及び10.0×10-2mg/mLのアルニカ抽出物を添加した細胞培養液からも、HSP70のバンドが確認された。
【0044】
24×105個の表皮細胞PAM212を播種した場合は、20.0×10-2mg/mLのアルニカ抽出物を添加した細胞培養液から、HSP70のバンドが明確に確認された。また、10.0×10-2mg/mLのアルニカ抽出物を添加した細胞培養液からも、HSP70のバンドが確認された。
【0045】
これに対し、アルニカ抽出物を添加しなかった細胞培養液からは、HSP70のバンドは確認されなかった。なお、24×105個の表皮細胞PAM212を播種した場合、アルニカ抽出物の濃度が7.5×10-2mg/mL以下であると、HSP70のバンドは確認されなかった。したがって、適切な濃度のアルニカ抽出物は、HSP70の誘導発現作用を有することが示された。
【0046】
(実施例5:サルビア抽出物によるHSP70発現誘導の確認)
培養液を満たした直径100mmの培養皿に、4×105個のメラノーマ細胞B16を播種し、5%炭酸ガス雰囲気下に37℃にて24時間培養した。この培養液に、実施例2で得たサルビア抽出物を、濃度50×10-2mg/mL、70×10-2mg/mL、80×10-2mg/mL、又は100×10-2mg/mLで添加し、さらに24時間培養した。なお、コントロールとして、サルビア抽出物を添加しなかった細胞も、24時間培養した。
【0047】
次に、細胞培養液をSDS−PAGE電気泳動にかけた後、抗HSP70抗体を用いたウエスタン・ブロット法によりHSP70の発現量を測定した。その結果、図10に示すように、80×10-2mg/mL以上のサルビア抽出物を添加した細胞培養液から、HSP70のバンドが明確に確認された。
【0048】
これに対し、サルビア抽出物を添加しなかった細胞培養液からは、HSP70のバンドは確認されなかった。したがって、適切な濃度のサルビア抽出物は、HSP70の誘導発現作用を有することが示された。
【0049】
(実施例6:マジョラム抽出物によるHSP70発現誘導の確認)
培養液を満たした直径100mmの培養皿に、4×105個のメラノーマ細胞B16を播種し、5%炭酸ガス雰囲気下に37℃にて24時間培養した。この培養液に、実施例2で得たマジョラム抽出物を、濃度40×10-2mg/mL、50×10-2mg/mL、60×10-2mg/mL、又は70×10-2mg/mLで添加し、さらに24時間培養した。なお、コントロールとして、マジョラム抽出物を添加しなかった細胞も、24時間培養した。
【0050】
次に、細胞培養液をSDS−PAGE電気泳動にかけた後、抗HSP70抗体を用いたウエスタン・ブロット法によりHSP70の発現量を測定した。その結果、図11に示すように、60×10-2mg/mL以上のマジョラム抽出物を添加した細胞培養液から、HSP70のバンドが明確に確認された。
【0051】
これに対し、マジョラム抽出物を添加しなかった細胞培養液からは、HSP70のバンドは確認されなかった。したがって、適切な濃度のマジョラム抽出物は、HSP70の誘導発現作用を有することが示された。
【0052】
(実施例7:アルニカ抽出物によるチロシナーゼ活性の抑制)
培養液を満たした直径100mmの培養皿に、4×105個のメラノーマ細胞B16を播種し、5%炭酸ガス雰囲気下に37℃にて24時間培養した。次に、培養液に、実施例2で得たアルニカ抽出物を、2.5×10-2mg/mL、5.0×10-2mg/mL、7.5×10-2mg/mL、又は10.0×10-2mg/mLの濃度で添加し、24時間培養した。なお、コントロールとして、アルニカ抽出物を添加しなかった細胞も、24時間培養した。
【0053】
さらに、メラニン発現を誘導する作用のあるIBMXを、濃度が100μmol/Lとなるよう培養液に添加し、48時間培養した。なお、コントロールとして、IBMXを添加しなかった細胞も、48時間培養した。細胞を回収し、0.1%Triton-X100(Sigma社)含有PBS100μLでサスペンドした後、30分間超音波処理した。基質となるL−DOPA200μLを96well plateに添加し、あらかじめ37度に保温しておいた。サンプルのタンパク質量をBradford法により求め、0.1%Triton-X100含有PBSでタンパク濃度100μg/50μLに調整した後、保温しておいたL−DOPAに50μL添加し、37度で1時間定温放置しながら490nmにおける吸光度の変化を測定した。ここで、図12に示すように、アルニカ抽出物及びIBMXを添加しなかった場合のチロシナーゼ活性を100%とすると、アルニカ抽出物を添加せず、IBMXを100μmol/L添加した場合のチロシナーゼ活性は約380%近くまで上昇した。しかし、IBMXに加えてアルニカ抽出物を添加した場合のチロシナーゼ活性は、アルニカ抽出物を添加しなかった場合と比較して、顕著に減少した。よって、アルニカ抽出物にチロシナーゼ活性の抑制能があることが示された。
【0054】
(実施例8:アルニカ抽出物によるメラニン発現の抑制)
培養液を満たした直径100mmの培養皿に、4×105個のメラノーマ細胞B16を播種し、5%炭酸ガス雰囲気下に37℃にて24時間培養した。次に、培養液に、実施例2で得たアルニカ抽出物を、2.5×10-2mg/mL、5.0×10-2mg/mL、7.5×10-2mg/mL、又は10.0×10-2mg/mLの濃度で添加し、24時間培養した。なお、コントロールとして、アルニカ抽出物を添加しなかった細胞も、24時間培養した。
【0055】
また、アルニカ抽出物を添加して24時間培養した後、さらに、メラニン発現を誘導する作用のあるIBMXを、濃度が100μmol/Lとなるよう培養液に添加し、72時間培養した。なお、コントロールとして、IBMXを添加しなかった細胞も、72時間培養した。
【0056】
その後、実施例1と同様の方法により、メラニンの発現量を測定した。ここで、アルニカ抽出物及びIBMXを添加しなかった場合のメラニン量を100%とすると、図13に示すように、IBMXを添加せず、アルニカ抽出物を添加した場合のメラニン量は、アルニカ抽出物及びIBMXの両方を添加しなかった場合と比較して、顕著に減少した。
【0057】
また、アルニカ抽出物を加えず、IBMXを100μmol/L添加した場合のメラニンの発現量は約170%近くまで上昇した。しかし、IBMXに加えてアルニカ抽出物を添加した場合のメラニン量は、アルニカ抽出物を添加しなかった場合と比較して、顕著に減少した。よって、アルニカ抽出物に、メラニン発現の抑制能があることが示された。
【0058】
(実施例9:サルビア抽出物によるメラニン発現の抑制)
培養液を満たした直径100mmの培養皿に、4×105個のメラノーマ細胞B16を播種し、5%炭酸ガス雰囲気下に37℃にて24時間培養した。次に、培養液に、実施例2で得たサルビア抽出物を、25×10-2mg/mL、50×10-2mg/mL、75×10-2mg/mL、又は100×10-2mg/mLの濃度で添加し、24時間培養した。なお、コントロールとして、サルビア抽出物を添加しなかった細胞も、24時間培養した。
【0059】
また、サルビア抽出物を添加して24時間培養した後、さらに、メラニン発現を誘導する作用のあるIBMXを、濃度が100μmol/Lとなるよう培養液に添加し、72時間培養した。なお、コントロールとして、IBMXを添加しなかった細胞も、72時間培養した。
【0060】
その後、実施例1と同様の方法によりに、メラニンの発現量を測定した。ここで、サルビア抽出物及びIBMXを添加しなかった場合のメラニン量を100%とすると、図14に示すように、IBMXを添加せず、サルビア抽出物を添加した場合のメラニンの発現量は、サルビア抽出物及びIBMXの両方を添加しなかった場合と比較して、顕著に減少した。
【0061】
また、サルビア抽出物を加えず、IBMXを100μmol/L添加した場合のメラニンの発現量は約170%近くまで上昇した。しかし、IBMXに加えてサルビア抽出物を添加した場合のメラニンの発現量は、サルビア抽出物を添加しなかった場合と比較して、顕著に減少した。よって、サルビア抽出物に、メラニン発現の抑制能があることが示された。
【0062】
(実施例10:マジョラム抽出物によるメラニン発現の抑制)
培養液を満たした直径100mmの培養皿に、4×105個のメラノーマ細胞B16を播種し、5%炭酸ガス雰囲気下に37℃にて24時間培養した。次に、培養液に、実施例2で得たマジョラム抽出物を、10×10-2mg/mL、20×10-2mg/mL、30×10-2mg/mL、又は50×10-2mg/mLの濃度で添加し、24時間培養した。なお、コントロールとして、マジョラム抽出物を添加しなかった細胞も、24時間培養した。
【0063】
また、マジョラム抽出物を添加して24時間培養した後、さらに、メラニン発現を誘導する作用のあるIBMXを、濃度が100μmol/Lとなるよう培養液に添加し、72時間培養した。なお、コントロールとして、IBMXを添加しなかった細胞も、72時間培養した。
【0064】
その後、実施例1と同様の方法によりに、メラニンの発現量を測定した。ここで、マジョラム抽出物及びIBMXを添加しなかった場合のメラニンの発現量を100%とすると、図15に示すように、IBMXを添加せず、マジョラム抽出物を添加した場合のメラニンの発現量は、マジョラム抽出物及びIBMXの両方を添加しなかった場合と比較して、顕著に減少した。
【0065】
また、マジョラム抽出物を加えず、IBMXを100μmol/L添加した場合のメラニンの発現量は約175%近くまで上昇した。しかし、IBMXに加えてマジョラム抽出物を添加した場合のメラニンの発現量は、マジョラム抽出物を添加しなかった場合と比較して、顕著に減少した。よって、マジョラム抽出物に、メラニン発現の抑制能があることが示された。
【0066】
(実施例11:アルニカ抽出物によるチロシナーゼmRNA発現の抑制)
培養液を満たした直径100mmの培養皿に、4×105個のメラノーマ細胞B16を播種し、5%炭酸ガス雰囲気下に37℃にて24時間培養した。次に、培養液に、実施例2で得たアルニカ抽出物を、2.5×10-2mg/mL、5.0×10-2mg/mL、7.5×10-2mg/mL、又は10.0×10-2mg/mLの濃度で添加し、24時間培養した。なお、コントロールとして、アルニカ抽出物を添加しなかった細胞も、24時間培養した。
【0067】
アルニカ抽出物を添加して24時間培養した後、さらに、メラニン発現を誘導する作用のあるIBMXを、濃度が100μmol/Lとなるよう培養液に添加し、24時間培養した。なお、コントロールとして、IBMXを添加しなかった細胞も、24時間培養した。その後、mRNAを抽出し、アルニカ抽出物及びIBMXを添加しなかった場合のチロシナーゼmRNAの相対発現量を1とすると、図16に示すように、IBMXを添加せず、7.5×10-2mg/mL及び10.0×10-2mg/mLのアルニカ抽出物を添加した場合のチロシナーゼmRNAの相対発現量は、アルニカ抽出物及びIBMXを添加しなかった場合と比較して、わずかに低下した。
【0068】
また、アルニカ抽出物を加えず、IBMXを100μmol/L添加した場合のチロシナーゼmRNAの相対発現量は約2.0近くまで上昇した。しかし、IBMXに加えてアルニカ抽出物を添加した場合のチロシナーゼmRNAの相対発現量は、アルニカ抽出物を添加しなかった場合と比較して、顕著に減少した。
【0069】
(実施例12:アルニカ抽出物によるチロシナーゼ発現の抑制)
培養液を満たした直径100mmの培養皿に、4×105個のメラノーマ細胞B16を播種し、5%炭酸ガス雰囲気下に37℃にて24時間培養した。この培養液に、実施例2で得たアルニカ抽出物を、濃度1.0×10-2mg/mL、2.5×10-2mg/mL、5.0×10-2mg/mL、又は10.0×10-2mg/mLで添加し、さらに24時間培養した。なお、コントロールとして、アルニカ抽出物を添加しなかった細胞も、24時間培養した。
【0070】
次に、メラニン発現を誘導する作用のあるIBMXを、濃度が100μmol/Lとなるよう培養液に添加し、48時間培養した。なお、コントロールとして、IBMXを添加しなかった細胞も、48時間培養した。その後、細胞培養液をSDS−PAGE電気泳動にかけた後、抗チロシナーゼ抗体を用いたウエスタン・ブロット法により成熟型チロシナーゼ及び未成熟型チロシナーゼの発現量を測定した。その結果、図17に示すように、アルニカ抽出物の未成熟型チロシナーゼの発現量への影響は確認されなかったものの、添加したアルニカ抽出物の濃度が上昇するにつれて、成熟型チロシナーゼの発現量が低下したことが示された。よって、アルニカ抽出物は、成熟型チロシナーゼの発現を抑制することが示された。
【0071】
(実施例13:サルビア抽出物によるチロシナーゼ発現の抑制)
培養液を満たした直径100mmの培養皿に、4×105個のメラノーマ細胞B16を播種し、5%炭酸ガス雰囲気下に37℃にて24時間培養した。この培養液に、実施例2で得たサルビア抽出物を、濃度25×10-2mg/mL、50×10-2mg/mL、75×10-2mg/mL、又は100×10-2mg/mLで添加し、さらに24時間培養した。なお、コントロールとして、サルビア抽出物を添加しなかった細胞も、24時間培養した。
【0072】
次に、メラニン発現を誘導する作用のあるIBMXを、濃度が100μmol/Lとなるよう培養液に添加し、48時間培養した。なお、コントロールとして、IBMXを添加しなかった細胞も、48時間培養した。その後、細胞培養液をSDS−PAGE電気泳動にかけた後、抗チロシナーゼ抗体を用いたウエスタン・ブロット法により成熟型チロシナーゼ及び未成熟型チロシナーゼの発現量を測定した。その結果、図18に示すように、サルビア抽出物の未成熟型チロシナーゼの発現量への影響は確認されなかったものの、添加したサルビア抽出物の濃度が上昇するにつれて、成熟型チロシナーゼの発現量が低下したことが示された。よって、サルビア抽出物は、成熟型チロシナーゼの発現を抑制することが示された。
【0073】
(実施例14:マジョラム抽出物によるチロシナーゼ発現の抑制)
培養液を満たした直径100mmの培養皿に、4×105個のメラノーマ細胞B16を播種し、5%炭酸ガス雰囲気下に37℃にて24時間培養した。この培養液に、実施例2で得たマジョラム抽出物を、濃度10×10-2mg/mL、20×10-2mg/mL、30×10-2mg/mL、又は50×10-2mg/mLで添加し、さらに24時間培養した。なお、コントロールとして、マジョラム抽出物を添加しなかった細胞も、24時間培養した。
【0074】
次に、メラニン発現を誘導する作用のあるIBMXを、濃度が100μmol/Lとなるよう培養液に添加し、48時間培養した。なお、コントロールとして、IBMXを添加しなかった細胞も、48時間培養した。その後、細胞培養液をSDS−PAGE電気泳動にかけた後、抗チロシナーゼ抗体を用いたウエスタン・ブロット法により成熟型チロシナーゼ及び未成熟型チロシナーゼの発現量を測定した。その結果、図19に示すように、マジョラム抽出物の未成熟型チロシナーゼの発現量への影響は確認されなかったものの、添加したマジョラム抽出物の濃度が上昇するにつれて、成熟型チロシナーゼの発現量が低下したことが示された。よって、マジョラム抽出物は、成熟型チロシナーゼの発現を抑制することが示された。
【0075】
(実施例15:皮膚外用剤)
以下の処方により、皮膚外用剤(クリーム剤)を得た。
スクワラン 20重量%
ミツロウ 5
精製ホホバ油 5
グリセリンモノステアレート 2
ソルビタンモノステアレート 2
ポリオキシエチレン(20)ソルビタンモノステアレート 2
グリセリン 5
アルニカ抽出物 1
精製水 100とする残部
【0076】
(実施例16:美白化粧料)
(1)ローション
以下の処方により、ローションを得た。
ソルビット 2重量%
1,3−ブチレングリコール 2
ポリエチレングリコール1000 1
ポリオキシエチレンオレイルエーテル(25EO) 2
エタノール 10
テプレノン 1
防腐剤 適量
精製水 100とする残部
【0077】
(2)乳液
以下の処方により、乳液を得た。
スクワラン 1重量%
グリセリン 1
ステアリルアルコール 0.3
ソルビタンモノステアレート 1.5
ポリオキシエチレン(20)ソルビタンモノステアレート 2
1,3−ブチレングリコール 5
アルニカ抽出物 1
精製水 100とする残部
【産業上の利用可能性】
【0078】
本発明の実施の形態に係る熱ショックタンパク質の発現誘導剤は、HSP70ファミリーの発現を誘導し、抗細胞死作用、抗炎症作用、細胞保護作用、及び胃粘膜保護作用等をもたらす。また、本発明の実施の形態に係る熱ショックタンパク質の発現誘導剤は、HSP70ファミリーの発現を誘導し、紫外線による直接的な肌への刺激、或いは心身ストレス、ホルモンバランス等の異常に起因するシミなどの発生に対処可能である。そのため、本発明の実施の形態に係る熱ショックタンパク質の発現誘導剤は、医薬品産業及び化粧品産業に利用可能である。
【特許請求の範囲】
【請求項1】
アルニカを含有する熱ショックタンパク質の発現誘導剤。
【請求項2】
前記熱ショックタンパク質が熱ショックタンパク質70ファミリーに属する、請求項1に記載の発現誘導剤。
【請求項3】
請求項1又は2に記載の熱ショックタンパク質の発現誘導剤を含有する皮膚外用剤。
【請求項4】
ローション剤、乳剤、ゲル剤、クリーム剤、軟膏剤、又は貼付剤である、請求項3に記載の皮膚外用剤。
【請求項5】
サルビアを含有する熱ショックタンパク質の発現誘導剤。
【請求項6】
前記熱ショックタンパク質が熱ショックタンパク質70ファミリーに属する、請求項5に記載の発現誘導剤。
【請求項7】
請求項5又は6に記載の熱ショックタンパク質の発現誘導剤を含有する皮膚外用剤。
【請求項8】
ローション剤、乳剤、ゲル剤、クリーム剤、軟膏剤、又は貼付剤である、請求項7に記載の皮膚外用剤。
【請求項9】
マジョラムを含有する熱ショックタンパク質の発現誘導剤。
【請求項10】
前記熱ショックタンパク質が熱ショックタンパク質70ファミリーに属する、請求項9に記載の発現誘導剤。
【請求項11】
請求項9又は10に記載の熱ショックタンパク質の発現誘導剤を含有する皮膚外用剤。
【請求項12】
ローション剤、乳剤、ゲル剤、クリーム剤、軟膏剤、又は貼付剤である、請求項11に記載の皮膚外用剤。
【請求項1】
アルニカを含有する熱ショックタンパク質の発現誘導剤。
【請求項2】
前記熱ショックタンパク質が熱ショックタンパク質70ファミリーに属する、請求項1に記載の発現誘導剤。
【請求項3】
請求項1又は2に記載の熱ショックタンパク質の発現誘導剤を含有する皮膚外用剤。
【請求項4】
ローション剤、乳剤、ゲル剤、クリーム剤、軟膏剤、又は貼付剤である、請求項3に記載の皮膚外用剤。
【請求項5】
サルビアを含有する熱ショックタンパク質の発現誘導剤。
【請求項6】
前記熱ショックタンパク質が熱ショックタンパク質70ファミリーに属する、請求項5に記載の発現誘導剤。
【請求項7】
請求項5又は6に記載の熱ショックタンパク質の発現誘導剤を含有する皮膚外用剤。
【請求項8】
ローション剤、乳剤、ゲル剤、クリーム剤、軟膏剤、又は貼付剤である、請求項7に記載の皮膚外用剤。
【請求項9】
マジョラムを含有する熱ショックタンパク質の発現誘導剤。
【請求項10】
前記熱ショックタンパク質が熱ショックタンパク質70ファミリーに属する、請求項9に記載の発現誘導剤。
【請求項11】
請求項9又は10に記載の熱ショックタンパク質の発現誘導剤を含有する皮膚外用剤。
【請求項12】
ローション剤、乳剤、ゲル剤、クリーム剤、軟膏剤、又は貼付剤である、請求項11に記載の皮膚外用剤。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【公開番号】特開2011−190200(P2011−190200A)
【公開日】平成23年9月29日(2011.9.29)
【国際特許分類】
【出願番号】特願2010−56523(P2010−56523)
【出願日】平成22年3月12日(2010.3.12)
【出願人】(399088289)株式会社再春館製薬所 (6)
【Fターム(参考)】
【公開日】平成23年9月29日(2011.9.29)
【国際特許分類】
【出願日】平成22年3月12日(2010.3.12)
【出願人】(399088289)株式会社再春館製薬所 (6)
【Fターム(参考)】
[ Back to top ]

