特定のグリカン構造を含有する分子を生成する方法
本発明は、その糖部分上において、フコースを欠いている、低減したフコース量を有する、又は他の非定型糖を有する分子を生成するための細胞に関する。本発明は、上記細胞を用いて、その糖部分上において、フコースを欠いている、低減したフコース量を有する、又は他の非定型糖を有する分子を生成する方法、及び上記方法で入手可能な分子にも関する。本発明は更に、人工のグリコシル化パターンを有する分子に関する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、その糖部分上において、フコースを欠いている、低減したフコース量を有する、又は他の非定型糖を有する分子を生成するための細胞に関する。本発明は、上記細胞を用いて、その糖部分上において、フコースを欠いている、低減したフコース量を有する、又は他の非定型糖を有する分子を生成する方法、及び上記方法で入手可能な分子にも関する。本発明は更に、人工のグリコシル化パターンを有する分子に関する。
【背景技術】
【0002】
ヒトでの使用を目的とする治療用グリコシル化分子は、ヒトで見られるものと類似の複雑なグリコシル化パターンを有するものとする。そのため、グリコシル化分子が複雑なヒト様グリコシル化パターンを有することが望まれる場合、治療用グリコシル化分子、例えばタンパク質又は脂質を生成するのに一般的に動物細胞が使用される。グリカンの構造及び複雑性は、半減期、受容体の結合の変調、免疫反応の誘導又は抑制により生体分子のin vivo機能に重大な影響を与える。
【0003】
糖脂質の糖鎖は複雑であり、かつ相当量のフコースを含有する可能性がある(非特許文献1)。糖タンパク質の糖鎖は、タンパク質部分との結合形態に基づきおおまかに2つのタイプ、すなわちアスパラギンと結合する糖鎖(N−グリコシド連結型糖鎖)と、セリン、トレオニン等の他のアミノ酸と結合する糖鎖(O−グリコシド連結型糖鎖)とに分けられる。
【0004】
N−グリコシド連結型糖鎖は様々な構造を有する(非特許文献2)が、基本的な共通のコア構造を有することが知られている。アスパラギンと結合する糖鎖末端は還元末端と呼ばれ、反対側は非還元末端と呼ばれる。N−グリコシド連結型糖鎖には、マンノースが単独でコア構造の非還元末端と結合する高マンノース型と、トリマンノースのコアの非還元末端側が通常、2つの(1,3及び1,6)マンノース結合手(arms)のそれぞれに結合した少なくとも1つのガラクトース−N−アセチルグルコサミン(以下、Gal−GlcNAcと称される)を有する複合型とが含まれる。Gal−GlcNAcの非還元末端側はガラクトース及びシアル酸、バイセクティング(bisecting)N−アセチルグルコサミン等を含有することがある。混成型では、コア構造の非還元末端側が高マンノース型及び複合型両方の分岐を有する。脊椎動物細胞由来のグリカンでは、フコースは、α1,3連結を介して分岐型(antennary)GlcNAcに(末端フコース)、又はα1,6連結を介してアスパラギン連結型GlcNAcに(コアフコース)結合することができる。昆虫細胞は1,3連結したコアフコースを含有し得るグリカンを生成する。
【0005】
初めにN−グリコシル化タンパク質のオリゴ糖部分が脂質連結型オリゴ糖から生合成され、Glc3Man9GlcNAc2−ピロホスホリル−ドリコールが生成され、それからそれが小胞体(ER)におけるタンパク質のトリペプチド配列Asn−X−Ser又はThr(ここでXはProを除く任意のアミノ酸であり得る)にあるアスパラギンへと転移する。その後、該タンパク質はゴルジ装置へと輸送され、そこでオリゴ糖部分が以下の順番で更にプロセシングされる:まず3つ全てのグルコース(Glc)残基がグルコシダーゼI及びグルコシダーゼIIにより取り除かれ、Man9GlcNAc2−タンパク質が生じる。Man9GlcNAc2構造は、多数のマンノース(Man)残基を取り除くことにより、更にプロセシングされ得る。初めに、4つのα−1,2連結型マンノースが取り除かれ、Man5GlcNAc2−タンパク質が生じた後、N−アセチルグルコサミン(GlcNAc)残基の付加により伸長する。この新たな構造、GlcNAcMan5GlcNAc2−タンパク質はα−1,3連結型マンノース及びα−1,6連結型マンノースを取り除くマンノシダーゼIIに対する基質である。その後、他の糖、GlcNAc、ガラクトース、フコース及びシアル酸が連続して付加され、N−グリコシル化タンパク質でよく見られる複合型の構造が生じる。
【0006】
IgG分子は例えば、Fc領域におけるCH2ドメインのうちのそれぞれの保存されたAsn297で共有結合したN連結型オリゴ糖を含有する。血清IgGのFc領域で見られるオリゴ糖は複合型のほとんどが二分岐の(biantennary)グリカンである。IgGグリコシル化パターンの変形には、コア構造:2×N−アセチルグルコサミン(GlcNAc)及び3×マンノース(Man)(GlcNAc2Man3)への末端シアル酸(NeuAc)、第3のGlcNac結合手(バイセクティングGlcNAc)の結合、末端のガラクトシル化(G)、及びα−1,6連結型のコアのフコシル化(F)が含まれる。グリコシル化の正確なパターンはIgGサブコンポーネント、特にCH2ドメイン及びCH3ドメインの構造特性によって決まる(非特許文献3)。
【0007】
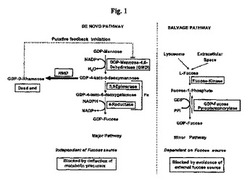
動物細胞及びヒト細胞は、タンパク質上のN−グリカンの還元末端でGlcNAc残基に、又は糖脂質上の他の新生糖構造にフコース残基を付加するフコシルトランスフェラーゼを有する。タンパク質と結合した糖部分又は脂質と結合した糖部分のフコシル化には、ドナーとしてヌクレオチド糖であるGDP−L−フコース、またフコシル残基をドナーからアクセプタ分子へと転移させる特定のフコシルトランスフェラーゼの存在が要求される(非特許文献4)。真核細胞では、GDP−L−フコースを2つの異なる経路、すなわち主要な(more prominent)フコースde novo経路又は副次的な(minor)サルベージ経路のいずれかにより合成することができる(非特許文献4)。サルベージ経路又は「スカベンジャー」経路はGDP−L−フコースの副次的な供給源(およそ10%)であり、培養培地からの遊離フコース及びフコシル化糖タンパク質の排除により容易に遮断することができる。サルベージ経路は細胞外フコースから開始し、該細胞外フコースはフコース特異的な原形質膜輸送体により細胞質コンパートメントへと輸送され得る。代替的に、取り込まれた(endocytosed)糖タンパク質から切断したフコースは細胞質へと侵入し得る。細胞質L−フコースはフコキナーゼによりリン酸化されてフコース−1−ホスフェートとなり、それからGDP−フコースピロホスホリラーゼによりGDP−L−フコースへと変換される(図1、右側のパネル)。細胞培養実験により、サルベージ経路が細胞質のGDP−L−フコースプールには比較的僅かしか寄与しないことが示唆されている(非特許文献4)。
【0008】
主要なフコースde novo経路は、GDP−D−マンノースから開始し、ともに細胞質に位置するGDP−マンノースデヒドラターゼ(GMD)及びGDP−ケト−デオキシ−マンノース−エピメラーゼ/GDP−ケト−デオキシ−ガラクトース−レダクターゼ(GMER、ヒトではFxとしても知られる)からなり、協働してGDP−マンノースをGDP−L−フコースに変換する(図1、左側のパネル)。その後、GDP−L−フコースはゴルジ装置の膜に位置するGDP−フコース輸送体により、ゴルジ体内へと輸送される。GDP−L−フコースがゴルジ体の内腔コンパートメントに侵入すると、フコシルトランスフェラーゼはGDP−L−フコースをゴルジ体内の新生糖部分と共有的に連結させることができる。特に、フコシルトランスフェラーゼ(Fut8)はフコース残基を1,6連結によりN−グリカンの還元末端におけるGlcNAc残基の6位へと転移させる。
【0009】
糖タンパク質上でフコースを欠いていることが、特に有利であることが分かっている。例えば、モノクローナル抗体、免疫グロブリン及び関連分子では、免疫グロブリンのFc部分(CH2ドメイン)のAsn297に結合するN−グリカン由来のコアフコース糖がないことにより、Fc受容体との免疫グロブリンの結合が増大又は変化することが分かっている。異なるタイプの定常領域は異なるFc受容体と結合する。例としては、IgG1 FcドメインとコグネートFc受容体CD16(FcγRIII)、CD32(FcγRII−B1及びFcγRII−B2)又はCD64(FcγRI)との結合、IgA FcドメインとコグネートFc受容体CD89(FcαRI)との結合、及びIgEドメインとコグネートFc受容体FcεFR1又はCD23との結合が挙げられる。NK細胞の表面上に存在する(which)FcγRIIIとの結合が強く増大する(非特許文献5)。
【0010】
治療抗体の主な作用機序は抗体依存性の細胞毒性(以下、「ADCC活性」と称される)である。Fab部分により標的細胞(腫瘍細胞又は病原体に感染した細胞)と結合する抗体は、エフェクター細胞、通常NK細胞のFc受容体によりそのFc部分で認識される。結合すると、エフェクター細胞はIFN−γ等のサイトカイン、及びパーフォリンを含有する細胞毒性顆粒、及び標的細胞へと入り細胞死を誘導するグランザイムを放出する。FcγRIIIとの結合親和性は、ATCCを通じて作用する抗体に重要である。受容体の低親和性対立遺伝子のキャリアは、リツキシマブ等の治療抗体とはほとんど反応しない(非特許文献6)。
【0011】
結果として、Fcグリカン上のコアフコースの非存在により媒介されるFcγRIIIに対するより高い親和性により、主に臨床的利点及びコストの意味合いで生物治療製品の効力を増大させるか、又は有効用量を低減させることができる。
【0012】
生成される糖タンパク質の糖鎖構造を修飾するために、1)糖鎖の修飾に関連する酵素に対する阻害剤の適用、2)糖合成又は糖転移に関与する遺伝子のホモ接合型(homozygous)ノックアウト、3)突然変異体の選択、4)糖鎖の修飾に関連する酵素をコードする遺伝子の導入等の様々な方法が試みられている。具体例を以下に記載する。
【0013】
糖鎖の修飾に関連する酵素に対する阻害剤の例としては、グリコシダーゼIの阻害剤であるカスタノスペルミン及びN−メチル−1−デオキシノジリマイシン、グリコシダーゼIIの阻害剤であるブロモコンズリトール、マンノシダーゼIの阻害剤である1−デオキシノジリマイシン及び1,4−ジオキシ−1,4−イミノ−D−マンニトール、マンノシダーゼIIの阻害剤であるスワインソニン等が挙げられる。グリコシルトランスフェラーゼに特異的な阻害剤の例としては、N−アセチルグルコサミントランスフェラーゼV(GnTV)に対する基質のデオキシ誘導体等が挙げられる。
【0014】
糖鎖の修飾に関連する酵素の突然変異体は主に、レクチン耐性細胞株から選択及び入手されている。例えば、CHO細胞の突然変異体は、WGA(タチジャコウソウ(T. vulgaris)から誘導されるコムギ胚芽凝集素)、ConA(タチナタマメ(C.ensiformis)から誘導されるコンカナバリン(concanavalin)A)、RIC(トウゴマ(R. communis)から誘導される毒素)、L−PHA(インゲンマメ(P.vulgaris)から誘導される白血球凝集素)、LCA(レンズマメ(L. culinaris)から誘導されるレンティル凝集素)、PSA(エンドウマメ(P. sativum)から誘導されるエンドウレクチン(pea lectin))等のレクチンを用いて、レクチン耐性細胞株から入手されている。
【0015】
さらに、フコースを欠いている組換え抗体を産生する方法が幾つか報告されている。N−糖部分のコアフコシル化を可能にする最も重要な酵素の1つがα−1,6−フコシルトランスフェラーゼ8(Fut8)である。上記酵素は、複合型N−グリカンのN−グリコシド連結型糖鎖のペンタコア(pentacore)におけるα結合を介した、フコースのN−アセチルグルコサミンの還元末端での6位への結合を触媒する(特許文献1)。フコーストランスポーター遺伝子の発現が人工的に抑制された細胞を用いることで、低減したフコース含量を有する抗体も実現されている(特許文献2)。α−1,6−フコシルトランスフェラーゼの機能を抑制可能なRNAの導入も説明されており、これによりフコースを欠いている抗体分子の産生がもたらされる(特許文献3)。
【0016】
治療適応症に使用することができる変化したグリコシル化パターンを有する分子を生成するために提案された細胞又は方法の多くが、重大な欠点を有する。例えば、グリコシル化を除去する酵素、例えばフコース残基を除去するフコシダーゼによる抗体の処理は、費用及び時間がかかり、また潜在的に重大な経済的リスク及び薬物に一貫した(drug consistency)リスクのある(which)付加的な製造工程を伴う。さらに、糖タンパク質の合成に関与する重要な酵素をノックアウトするための細胞株の分子工学的手法は面倒で、費用がかかり、また成功が約束されているわけではない。加えて、上記細胞株には、治療上の使用に関する有効性及び安全性を最適化するのに、多様なADCC効力又はCDC効力を有する分子の「調整可能な(tunable)」生成ができないという欠点がある。糖タンパク質の合成に関与する重要な酵素のレベルをノックダウンするためのRNAi又はアンチセンス分子による細胞株の処理は予期せぬオフターゲットな(off-target)影響を与える可能性があり、費用がかかり、また製造規模での実施には向かないと考えられる。
【先行技術文献】
【特許文献】
【0017】
【特許文献1】国際公開第00/61739号
【特許文献2】米国特許出願公開第20090061485号
【特許文献3】欧州特許出願公開第1 792 987号
【非特許文献】
【0018】
【非特許文献1】PNAS 1985; 82: 3045-3049.
【非特許文献2】糖蛋白質糖鎖研究法(生物化学実験法23)(学会出版センター(GakujutsuShuppan Center))、高橋礼子編(1989)
【非特許文献3】Lund et al. (2000) Eur. J. Biochem., 267:7246-7257
【非特許文献4】Becker and Lowe, 1999
【非特許文献5】Shields et al. JBC 277 (30): 26733. (2002)
【非特許文献6】Cartron et al. Blood 99: 754-758
【発明の概要】
【発明が解決しようとする課題】
【0019】
このため、治療上の使用に関して改善した特性を有する、変化したグリコシル化パターンを有する分子の生成のための新規の有益な細胞及び方法が必要とされている。
【課題を解決するための手段】
【0020】
本発明は、変化したグリコシル化パターンを有する分子、すなわちそのグリカン構造上でフコースを欠いている、低減したフコース量を有する、又は他の非定型糖を有する分子の生成のための細胞を提供する。本発明は、上記細胞を用いて、変化したグリコシル化パターンを有する分子、すなわちそのグリカン構造上でフコースを欠いている、低減したフコース量を有する、又は他の人工糖を有する分子を生成する方法も提供する。上記分子は治療上の使用に関して改善した特性、例えば増大したADCC活性又はCDC活性、向上したシグナル伝達事象の阻害能、増大したアポトーシスの誘導能、及び/又は増大した免疫療法の効力(ability)を有する。加えて、本発明により提供される細胞及び方法により、変化したグリコシル化パターンを有する分子、すなわちそのグリカン構造上でフコースを欠いている、低減したフコース量を有する、又は他の人工糖を有する分子の、調整可能で、信頼性があり、費用がかからず単純な生成が可能になる。さらに本発明は、製造のスケールアップに好適な方法を提供する。
【0021】
多くの場合、所望のレベルで対象となる導入遺伝子を発現する効果的な産生細胞株を生成及び開発するために、かなりの時間が費やされるとともに、多大な労力が注がれてきた。対象となる導入遺伝子がADCCエフェクター機能の向上による利益を受けることができる治療抗体である場合、高産生細胞がN−糖部分にコア−フコースを結合することができない、又はN−糖部分に人工糖を結合することができるように産生細胞株を更に操作することが望ましいであろう。
【0022】
本発明は、例えば向上したADCC活性を有する抗体を産生するために、糖タンパク質の新生糖構造にフコースを結合することができなくする、又は糖タンパク質の新生糖構造にフコース以外の他の人工糖を結合することができるように、既存の遺伝子操作された細胞に容易に適用することができる発現単位を提供する。
【0023】
発明の概要
第1の態様では、本発明は、自然状態ではその糖部分上において、フコースを含むが、その糖部分上において、フコースを欠いている又は低減したフコース量を有する分子を生成するための脊椎動物細胞であって、基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用するが、GDP−6−デオキシ−D−リキソ−4−ヘキスロースをGDP−L−フコースに変換する反応を触媒しない酵素を少なくとも1つ含む、自然状態ではその糖部分上において、フコースを含むが、その糖部分上において、フコースを欠いている又は低減したフコース量を有する分子を生成するための脊椎動物細胞に関する。
【0024】
第2の態様では、本発明は、自然状態ではその糖部分上において、フコースを含むが、その糖部分上において、フコースを欠いている又は低減したフコース量を有する分子を生成する方法であって、
i)第1の態様による脊椎動物細胞を準備する工程と、
ii)i)における該細胞からフコシルトランスフェラーゼに対する基質となることができる分子、好ましくはタンパク質又は脂質を単離する工程と、
を含む、自然状態ではその糖部分上において、フコースを含むが、その糖部分上において、フコースを欠いている又は低減したフコース量を有する分子を生成する方法に関する。
【0025】
第3の態様では、本発明は、第2の態様の方法により入手可能な、その糖部分上において、フコースを欠いている又は低減したフコース量を有する分子に関する。
【0026】
第4の態様では、本発明は、第2の態様の方法により入手可能な、D−ラムノース、D−ペロサミン、デオキシ−D−タロース、6−デオキシ−D−アルトロース、4−ケト−3,6−ジデオキシ−D−マンノース、及び/又はL−コリトースを含有する糖部分を含む分子に関する。
【0027】
第5の態様では、本発明は、
i)70%〜95%のG0−GlcNac、G0、G1及び/又はG2の複合型N−グリカンと、
ii)5%〜30%の高マンノース型N−グリカンと、
を含む糖タンパク質を含む組成物であって、該複合型N−グリカンがフコースを含まない、又はフコースを実質的に含まない、糖タンパク質を含む組成物に関する。
【0028】
第6の態様では、本発明は、D−ラムノース、D−ペロサミン、デオキシ−D−タロース、6−デオキシ−D−アルトロース、4−ケト−3,6−ジデオキシ−D−マンノース、及び/又はL−コリトースを含有する糖部分を含む、タンパク質又は脂質に関する。
【0029】
第7の態様では、本発明は、
i)1つ又は複数の脊椎動物発現制御配列と、
ii)基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用する酵素をコードする核酸配列を含むポリヌクレオチドと、
を含む発現単位であって、該酵素がGDP−6−デオキシ−D−リキソ−4−ヘキスロースをGDP−L−フコースに変換する反応を触媒しない、発現単位に関する。
【0030】
第8の態様では、本発明は、通常その糖部分上において、フコースを含むが、その糖部分上において、フコースを欠いている又は低減したフコース量を有するタンパク質を生成するための真核細胞であって、
i)基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用する酵素をコードする核酸配列を含む第1のポリヌクレオチドと、
ii)タンパク質をコードする核酸配列を含む第2のポリヌクレオチドと、
を含み、該酵素がGDP−6−デオキシ−D−リキソ−4−ヘキスロースをGDP−L−フコースに変換する反応を触媒しない、通常その糖部分上において、フコースを含むが、その糖部分上において、フコースを欠いている又は低減したフコース量を有するタンパク質を生成するための真核細胞に関する。
【0031】
第9の態様では、本発明は、通常その糖部分上において、フコースを含むが、その糖部分上において、フコースを欠いている又は低減したフコース量を有するタンパク質を生成する方法であって、
i)第8の態様による真核細胞を準備することと、
ii)上記細胞において該第1のポリヌクレオチドによりコードされる該酵素及び該第2のポリヌクレオチドによりコードされる該タンパク質を発現することと、
iii)上記細胞から該タンパク質を単離することと、
を含む、通常その糖部分上において、フコースを含むが、その糖部分上において、フコースを欠いている又は低減したフコース量を有するタンパク質を生成する方法に関する。
【0032】
第10の態様では、本発明は、第9の態様の方法により入手可能な、その糖部分上において、フコースを欠いている又は低減したフコース量を有するタンパク質に関する。
【0033】
発明の詳細な説明
本発明を以下で詳細に説明する前に、本明細書中で説明する特定の方法論、プロトコル及び試薬は変動し得るので、本発明はこれらに限定されないと理解すべきである。本明細書中で使用される専門用語は、特定の実施の形態を説明するためのものにすぎず、添付した特許請求の範囲のみによって限定される本発明の範囲を限定することは意図されないことも理解すべきである。他に規定のない限り、本明細書中で使用される全ての技術用語及び科学用語は、当業者により一般的に理解される意味と同じ意味を有する。
【0034】
好ましくは、本明細書中で使用される用語は、"A multilingual glossary ofbiotechnological terms: (IUPAC Recommendations)", Leuenberger, H.G.W,Nagel, B. and Koelbl, H. eds.(1995), Helvetica Chimica Acta, CH-4010 Basel,Switzerlandに記載されているように規定される。
【0035】
以下の本明細書及び添付の特許請求の範囲を通じて、文脈上他の要求がなされる場合以外は、「を含む(comprise)」という単語、並びに「を含む(comprises)」及び「を含む(comprising)」等の変化形は、記載の整数若しくは工程又は整数若しくは工程の群を包含することを示唆するが、任意の他の整数若しくは工程又は整数若しくは工程の群を除外することを示唆しないと理解される。
【0036】
複数の文書が、本明細書の文章を通じて引用される。本明細書中で引用される文書(全ての特許、特許出願、科学的刊行物、製造業者の仕様書、取扱説明書、GenBankアクセッション番号配列寄託(submissions)等を含む)の各々が、上記のものであるか又は下記のものであるかに関わらず、その全体が参照により本明細書に援用される。本明細書のどの記載も、本発明が先行発明に基づくこのような開示に先行する権利を有しないことを認めるものと解釈すべきではない。
【0037】
以下では、本発明の要素を記載する。これらの要素を特定の実施の形態とともに列挙するが、任意の様式及び任意の数でこれらを組み合わせて、更なる実施の形態を作り出すことができることを理解すべきである。様々に記載される実施例及び好ましい実施の形態を、明示的に記載される実施の形態にのみ本発明を限定するものと解釈すべきではない。この記載を、明示的に記載される実施の形態を任意の数の開示される及び/又は好ましい要素と組み合わせた実施の形態を支持及び包含するものと理解すべきである。さらに、本出願において記載される全ての要素の任意の置換及び組合せが、文脈上他に示されない限り、本出願の記載により開示されるものと考えるべきである。
【0038】
本発明による「を含む(comprise)」という用語、又は「を含む(comprises)」若しくは「を含む(comprising)」等の変化形は、記載の整数又は整数の群を包含することを意味するが、任意の他の整数又は整数の群を除外することを意味しない。本発明による「から本質的になる」という用語は、記載の整数又は整数の群を包含するが、記載の整数に実質的に影響を与える又は記載の整数を実質的に変化させる変更値又は他の整数を除外することを意味する。本発明による「からなる(consisting of)」という用語、又は「からなる(consists of)」等の変化形は、記載の整数又は整数の群を包含すること、及び任意の他の整数又は整数の群を排除することを意味する。
【0039】
本発明との関連では、「オリゴペプチド」という用語は、アミノ酸、例えば典型的には約50アミノ酸長未満、より典型的には約30アミノ酸長未満のアミノ酸の短いペプチド連結鎖を表す。
【0040】
「ポリペプチド」及び「タンパク質」という用語は、本発明との関連では区別なく使用され、アミノ酸、例えば典型的に50アミノ酸長又は50アミノ酸長を超えるアミノ酸の長いペプチド連結鎖を表す。
【0041】
「ポリペプチド断片」という用語は本発明との関連で使用される場合、全長ポリペプチドと比較して欠失、例えばアミノ末端の欠失、及び/又はカルボキシ末端の欠失、及び/又は内部欠失を有するポリペプチドを表す。
【0042】
本発明との関連では、「融合タンパク質」という用語は、異種アミノ酸配列と連結したポリペプチド又はポリペプチド断片を含むポリペプチドを表す。融合タンパク質は2つ以上の異なるタンパク質からの2つ以上の所望の機能要素を含有するように構築することができるため、有用である。
【0043】
「抗体」、「免疫グロブリン」、「Ig」及び「Ig分子」という用語は本発明との関連では区別なく使用される。各重鎖のCH2ドメインは、アスパラギン残基でのN連結型グリコシル化に関する単一部位を含有し、通常Asn−297残基でN−グリカンと抗体分子とが連結する(Kabat et al., Sequence of proteins of immunological interest, FifthEd.、米国保健社会福祉省、NIH刊行番号91−3242)。この用語の範囲内には、Ig群、すなわちIgG、IgA、IgE、IgM及びIgDが含まれる。この用語の範囲内には、IgGのサブタイプ、すなわちIgG1、IgG2、IgG3及びIgG4も含まれる。この用語は最も広い意味で使用され、モノクローナル抗体(全長モノクローナル抗体を含む)、ポリクローナル抗体、一本鎖抗体及び多重特異的抗体(例えば二重特異的抗体)を含む。
【0044】
「抗体断片」という用語は本発明との関連で使用される場合、CH2ドメインのN連結型グリコシル化部位を含む重鎖免疫グロブリン定常領域のCH2ドメインの少なくとも一部を含有し、抗原と特異的に結合することができる抗体の断片、すなわち少なくとも1つのVL鎖及び/若しくはVH鎖を有する鎖又はその結合部分を表す。
【0045】
「Fcドメイン」及び「Fc領域」という用語は、Fc受容体と呼ばれる細胞表面受容体及び補体系の幾つかのタンパク質と相互作用する抗体重鎖のC末端部を表す。この特性により、抗体が免疫系を活性化させることが可能になる。
【0046】
本発明との関連では、「糖タンパク質」という用語は、ポリペプチド側鎖に共有結合したオリゴ糖鎖(グリカン)を含有するタンパク質を表す。炭水化物は翻訳時修飾又は翻訳後修飾においてタンパク質に結合する。このプロセスはN−グリコシル化又はO−グリコシル化等のグリコシル化として知られる。
【0047】
「N−グリコシル化」はアスパラギンの側鎖上のアミド窒素への糖鎖の付加を意味する。「O−グリコシル化」はヒドロキシリシン、ヒドロキシプロリン、セリン又はスレオニンの側鎖上のヒドロキシル酸素への糖鎖の付加を意味する。
【0048】
「糖脂質」という用語は本発明との関連で使用される場合、炭水化物と結合した脂質を表す。糖脂質は、炭水化物の鎖が細胞膜の外形質(exoplasmic)表面上のリン脂質と結び付くと生じる。炭水化物は全ての真核細胞膜の外表面上に見られる。糖脂質の炭水化物構造は、脂質を付加するグリコシルトランスフェラーゼ及び付加後にグリカンを修飾するグリコシルヒドロラーゼにより制御される。糖脂質は、弱毒化生ワクチンとして使用されるウイルスを含むエンベロープウイルスの表面上にも生じる。
【0049】
「グリカン」又は「糖部分」という用語は、多糖又はオリゴ糖を表すのに本発明との関連では区別なく使用される。「オリゴ糖」という用語は、少数(典型的には3個〜10個)の構成糖(単純な糖又は単糖としても知られる)を含有するサッカリド重合体を意味する。「多糖」という用語は、グリコシド結合により結合した反復単位(典型的に10個を超える単糖又は二糖)から構成される炭水化物の重合体構造を意味する。グリカンは、糖タンパク質のようにタンパク質に結合して、又は糖脂質のように脂質に結合して見出されることがある。この用語は、N−グリカン、例えば高マンノース型N−グリカン、複合型N−グリカン又は混成型のN−グリカン、O−グリカンを包含する。
【0050】
本発明との関連では、以下の単糖を以下のように省略する:グルコース=Glc、ガラクトース=Gal、マンノース=Man、フコース=Fuc若しくはF、N−アセチルガラクトサミン=GalNAc、又はN−アセチルグルコサミン=GlcNAc。
【0051】
「N−グリカン」はN連結型の多糖又はオリゴ糖を意味する。N連結型オリゴ糖は例えば、タンパク質におけるアスパラギン残基のアミド窒素に連結したN−アセチルグルコサミン残基により結合している又は結合していたものである。N−糖タンパク質で見られる主要糖は、グルコース、ガラクトース、マンノース、フコース、N−アセチルガラクトサミン(GalNAc)、N−アセチルグルコサミン(GlcNAc)及びシアル酸(例えばN−アセチル−ノイラミン酸(NANA))である。糖類のプロセシングはERの内腔で翻訳時に起こり、N連結型糖タンパク質ではゴルジ装置でも継続する。N−グリカンはMan3GlcNAc2(「Man」はマンノースを表し、「Glc」はグルコースを表し、「NAc」はN−アセチルを表し、GlcNAcはN−アセチルグルコサミンを表す)の共通の五糖コアを有する。N−グリカンは、Man3GlcNAc2コア構造(「トリマンノースコア」、「五糖コア」又は「パウチマンノースコア」とも称される)に付加される周辺糖(例えばGlcNAc、ガラクトース、フコース及びシアル酸)を含む分岐(アンテナ)の数が異なる。N−グリカンは分岐の(branched)構成要素に応じて分類される(例えば高マンノース型、複合型又は混成型)。
【0052】
「高マンノース型N−グリカン」は、5個のマンノース残基(Man5)又はより多くのマンノース残基(例えばMan6、Man7又はMan8)を有するN連結型の多糖又はオリゴ糖を意味する。
【0053】
「複合型N−グリカン」は、典型的に「トリマンノース」コアの1,3マンノース結合手に結合した少なくとも1つのGlcNAcと、1,6マンノース結合手に結合した少なくとも1つのGlcNAcとを有するN連結型の多糖又はオリゴ糖を意味する。複合型N−グリカンは、任意でシアル酸又は誘導体(例えば「NANA」又は「NeuAc」(ここで「Neu」はノイラミン酸を表し、「Ac」はアセチルを表す)で修飾されたガラクトース(「Gal」)残基又はN−アセチルガラクトサミン(「GalNAc」)残基も有し得る。複合型N−グリカンは、「バイセクティング」GlcNAcとコアフコース(「Fuc」)とを含む鎖内置換も有し得る。複合型N−グリカンは本発明との関連では、0個(G0)、1個(G1)又は2個(G2)のガラクトースと、還元末端上の第1のGlcNAcに結合した1個のフコースとを含有し得る(それぞれG0F、G1F、G2Fと示される)。
【0054】
「混成型N−グリカン」は、トリマンノースコアの1,3マンノース結合手の末端上に少なくとも1つのGlcNAcと、トリマンノースコアの1,6マンノース結合手に0個以上(zero or more)のマンノースとを有するN連結型の多糖又はオリゴ糖を意味する。
【0055】
糖構造を説明するのに本発明との関連で使用される略語は以下のように規定される:
コア=Man3GlcNAc2
G0=GlcNAc2Man3GlcNAc2
G0−GlcNAc=1個のGlcNAcを欠くG0構造(すなわちGlcNAcMan3GlcNAc2)
G1=1個の更なるガラクトース残基を含有するG0構造(すなわちGalGlcNAc2Man3GlcNAc2)
G2=2個の更なるガラクトース残基を含有するG0構造(すなわちGal2GlcNAc2Man3GlcNAc2)
G0F=五糖コアの第1のGlcNAc残基に結び付いた1個の更なるフコース残基を含有するG0構造(すなわちGlcNAc2Man3GlcNAc2Fuc)
G0F−GlcNAc=五糖コアの第1のGlcNAc残基に結び付いた1個の更なるフコース残基を含有するG0−GlcNAc構造(すなわちGlcNAcMan3GlcNAc2Fuc)
G1F=五糖コアの第1のGlcNAc残基に結び付いた1個の更なるフコース残基を含有するG1構造(すなわちGalGlcNAc2Man3GlcNAc2Fuc)
G2F=五糖コアの第1のGlcNAc残基に結び付いた1個の更なるフコース残基を含有するG2構造(すなわちGal2GlcNAc2Man3GlcNAc2Fuc)
Man4=1個の更なるマンノース残基を含有するコア構造(すなわちManMan3GlcNAc2)
Man5=2個の更なるマンノース残基を含有するコア構造(すなわちMan2Man3GlcNAc2)
Man6=3個の更なるマンノース残基を含有するコア構造(すなわちMan3Man3GlcNAc2)
Man7=4個の更なるマンノース残基を含有するコア構造(すなわちMan4Man3GlcNAc2)
Man8=5個の更なるマンノース残基を含有するコア構造(すなわちMan5Man3GlcNAc2)
【0056】
「O−グリカン」はO連結型の多糖又はオリゴ糖を意味する。O連結型グリカンは通常、セリン残基又はトレオニン残基を介してペプチド鎖に結合する。O連結型グリコシル化は、ゴルジ装置で起こり、コンセンサス配列を必要としない真性の翻訳後事象であり、オリゴ糖前駆体はタンパク質転移に必要ではない。最も一般的なタイプのO連結型グリカンは最初のGalNAc残基(又はTnエピトープ)を含有し、これらは一般的にムチン型グリカンと称される。他のO連結型グリカンは、Ser/Thr残基と結合する最初の糖としてグルコサミン、キシロース、ガラクトース、フコース又はマンノース(mannose)を含む。O連結型糖タンパク質は通常、一般的にN−グリカンと比較して分岐がより少ない二分岐の巨大タンパク質(>200kDa)である。
【0057】
「自然状態ではその糖部分上において、フコースを含む分子」という用語は本発明との関連で使用される場合、糖部分にフコースを付加することが可能な、すなわち糖部分にフコースを付加する能力が変わらない真核細胞、好ましくは脊椎動物細胞における生成によると、少なくとも1つのフコース残基を含む糖部分を含む任意の化合物を表す。このような分子は、グリカン転移酵素によって認識される、例えばAsp残基、Ser残基又はThr残基、好ましくはトリペプチド配列Asn−X−Ser/Thr(ここでXはProを除く任意のアミノ酸である)を含む少なくとも1つ又は複数の配列モチーフを含む。フコースを有する糖部分を含む分子を生成する真核細胞(例えば脊椎動物細胞)の好ましい例は、CHO、AGE1.HN、AGE1.CR、AGE1.CR.PIX又はAGE1.CSである。好ましくはかかる化合物は、タンパク質、融合タンパク質又は脂質である。好ましくはタンパク質は、真核生物起源、好ましくは脊椎動物起源、最も好ましくは哺乳類起源のものであるか、又はそれらから誘導される。
【0058】
「その糖部分上において、フコースを欠いている分子」という用語は本発明との関連では、自然状態ではその糖部分上において、フコースを含む分子上に、検出可能な量のフコースが存在しないことを意味する。純度に関して表すと、「その糖部分上において、フコースを欠いている分子」は、自然状態ではその糖部分上において、フコースを含む分子がその糖部分上において、糖残基であるフコースを100%含んでいないことを意味する。
【0059】
「その糖部分上において、低減したフコース量を有する分子」という用語は、糖部分上において、フコース量が、糖部分にフコースを付加することが可能な、すなわち糖部分にフコースを付加する能力が変わらない細胞において発現される場合の数(n)から低減した分子を表す。このため、低減状態はn−x(ここで、nは上記の意味を有し、xは1〜(n−1)の整数である)である。好ましくは、自然状態でnが2である場合、n−xは1まで低減する。同様に、自然状態でnが3である場合、n−xは好ましくは2若しくは1まで低減し、自然状態でnが4である場合、n−xは好ましくは3、2若しくは1まで低減し、自然状態でnが5である場合、n−xは好ましくは4、3、2若しくは1まで低減し、又は自然状態でnが6である場合、n−xは好ましくは5、4、3、2若しくは1まで低減する。
【0060】
「その糖部分上において、低減したフコース量を有する分子の組成物」という用語は本発明との関連では、自然状態ではその糖部分上において、フコースを含む組成物の分子の、その糖部分上において、フコース数が低減したことを示すのに使用される。かかる比較は上記の細胞株により生成される分子を用いて行うのが好ましい。低減に関して表すと、この用語は、組成物の一定数の分子、好ましくは組成物の1pmol、10pmol、100pmol又は1000pmolの分子のうち、フコース残基数が10%〜95%、好ましくは約15%、約20%、約25%、約30%、約35%、40%、約45%、約50%、約55%、約60%、約65%、約70%、約75%、約80%、約85%、約86%、約87%、約88%、約89%、約90%、約91%、約92%、約93%又は約94%低減することを意味する。低減全体は、組成物におけるその糖部分上において、フコースを欠いている及び/又はその糖部分上において、フコース量が低減した組成物における分子の増大に起因するものであり得る。
【0061】
「その糖部分上において、フコースを実質的に含まない分子の組成物」という用語は本発明との関連では、自然状態ではその糖部分上において、フコースを含む組成物の分子が、その糖部分上において、糖残基であるフコースを本質的に欠いていることを示すのに使用される。純度に関して表すと、「その糖部分上において、フコースを実質的に含まない分子の組成物」という用語は、組成物の一定数の分子、好ましくは組成物の1pmol、10pmol、100pmol又は1000pmolの分子のうち、上記の分子の少なくとも約95%、約96%、約97%、約98%、約99%、約99.1%、約99.2%、約99.3%、約99.4%、約99.5%、約99.6%、約99.7%、約99.8%又は少なくとも約99.9%がその糖部分上において、糖残基であるフコースを含まないことを意味する。
【0062】
当業者は、(i)対象となる分子を生成する条件下で本発明の細胞を培養することと、(ii)上記分子を上記細胞から単離することと、(iii)その糖部分に結合したフコース残基に関して、上記分子の糖鎖構造を分析するとともに、上記分子の糖鎖構造に存在するフコース残基の平均値を算出することと、(iv)該結果を、該分子をフコースが低減していないグリコシル化パターンで産生する細胞で産生される同じ分子、例えば抗体分子の結果と比較することとにより、特定の分子、例えば抗体分子の糖部分上において、低減したフコース量を実験により容易に決定することができる。好ましくは、2つの実験に用いられる細胞は同一であるが、一方の細胞が基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用するが、GDP−6−デオキシ−D−リキソ−4−ヘキスロースをGDP−L−フコースに変換する反応を触媒しない酵素を少なくとも1つ含むという違いがある。好ましくは、両方の細胞を同一の培養条件下で培養し、培養条件の違いに起因し得るフコシル化の変化を排除する。
【0063】
分子、例えば抗体分子における糖鎖構造を、二次元糖鎖マッピング法(Anal. Biochem., 171,73 (1988)、非特許文献2)により簡単に分析することができる。二次元糖鎖マッピング法により推定される構造を、各糖鎖のMALDI(マトリックス支援レーザ脱離イオン化)−TOF−MS等の質量分析法を行うことにより決定することができる。
【0064】
真核細胞(例えば脊椎動物細胞)において糖部分を含む分子、例えばタンパク質又は脂質のフコシル化には、ドナーとしてのヌクレオチド糖、GDP−L−フコースと、更にドナーからアクセプタ分子へとフコシル残基を転移させる特定のフコシルトランスフェラーゼの存在とが要求される。真核細胞(例えば脊椎動物細胞)では、GDP−L−フコースを2つの異なる経路、主要なフコースde novo経路又は副次的なサルベージ経路のいずれかにより合成することができる。
【0065】
本発明者らは、真核細胞(例えば脊椎動物細胞)における基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを効率的に利用するが、GDP−6−デオキシ−D−リキソ−4−ヘキスロースをGDP−L−フコースへと変換する反応を触媒しない酵素(偏向(deflecting)酵素)の存在により、その糖部分上において、フコースを欠いている又は低減したフコース量を有する分子、例えばタンパク質又は脂質の生成がもたらされることを見出した。「GDP−6−デオキシ−D−リキソ−4−ヘキスロース」という用語は「GDP−4−ケト−6−デオキシ−D−マンノース」という用語と同義である。両方の用語は本明細書で区別なく使用される。
【0066】
このため第1の態様では、本発明は、自然状態ではその糖部分上において、フコースを含むが、その糖部分上において、フコースを欠いている又は低減したフコース量を有する分子を生成するための(改変)脊椎動物細胞であって、基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用するが、GDP−6−デオキシ−D−リキソ−4−ヘキスロースをGDP−L−フコースへと変換する反応を触媒しない酵素を少なくとも1つ含む、(改変)脊椎動物細胞を提供する。
【0067】
本発明の第1の態様の脊椎動物細胞に存在する酵素は、基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用する任意の酵素であり得るが、上記酵素はGDP−6−デオキシ−D−リキソ−4−ヘキスロースをGDP−L−フコースへと変換する反応を触媒しないものとする。それどころか上記酵素は、GDP−6−デオキシ−D−リキソ−4−ヘキスロースを、脊椎動物細胞におけるGDP−L−フコース合成にもはや利用することができない生成物へと変換する。
【0068】
本発明の第1の態様の脊椎動物細胞に含まれる酵素は、脊椎動物細胞には通常存在しない酵素、すなわち異種又は人工の酵素、例えば別の界の生物、例えば原核生物、好ましくは細菌由来の酵素である。代替的には、上記酵素は、通常脊椎動物細胞に存在するが、例えば突然変異の存在により基質GDP−6−デオキシ−D−リキソ−4−ヘキスロースをGDP−L−フコースに変換せず、異なる生成物へと変換する酵素であってもよい。
【0069】
本発明の第1の態様の脊椎動物細胞に存在する酵素を、例えばタンパク質マイクロインジェクション、タンパク質エレクトロポレーション又はタンパク質リポフェクションにより、脊椎動物細胞へと導入している。例えばDNAマイクロインジェクション、DNAエレクトロポレーション又はDNAリポフェクションにより、好ましくは発現ベクターに組み込まれた、酵素をコードする核酸配列を脊椎動物細胞に導入した後、脊椎動物細胞において各タンパク質へと転写及び翻訳することも可能である。当業者は、タンパク質又はタンパク質をコードする核酸配列を脊椎動物細胞に導入するための分子生物学技法、例えばマイクロインジェクション、エレクトロポレーション又はリポフェクションについての十分な情報を有し、これらの技法を実行する方法を知っている。
【0070】
基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用するが、GDP−6−デオキシ−D−リキソ−4−ヘキスロースのGDP−L−フコースへの変換を触媒しない2個以上、すなわち2個、3個、4個、5個、6個又は7個の酵素が脊椎動物細胞に存在し、上記細胞においてフコースde novo経路を効率的に遮断することが好ましい。
【0071】
好ましくは、基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用する酵素は、GDP−6−デオキシ−D−リキソ−4−ヘキスロースレダクターゼ(GDP−4−ケト−6−デオキシ−D−マンノースレダクターゼと同義であり、RMDと略される)、GDP−ペロサミンシンテターゼ(Per)、GDP−6−デオキシ−D−タロースシンテターゼ(GTS)、GDP−フコースシンテターゼCys109Ser(GFS−Cys109Ser)突然変異体、GDP−4−ケト−6−デオキシマンノース−3−デヒドラターゼ(ColD)、好ましくはGDP−L−コリトースシンターゼ(ColC)と組み合わせたGDP−4−ケト−6−デオキシマンノース−3−デヒドラターゼ(ColD)、及びその変異体からなる群から選択され、好ましくは酵素は細菌由来であるか、又はかかる細菌酵素から誘導される。より好ましくは、基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用する酵素はGDP−6−デオキシ−D−リキソ−4−ヘキスロースレダクターゼ(RMD)、GDP−フコースシンテターゼCys109Ser(GFS−Cys109Ser)突然変異体、及び/又はGDP−ペロサミンシンテターゼ(Per)である。
【0072】
GDP−6−デオキシ−D−リキソ−4−ヘキスロースレダクターゼ(RMD)は基質GDP−6−デオキシ−D−リキソ−4−ヘキスロースをGDP−D−ラムノースへと還元する。GDP−D−ラムノースは、細菌におけるD−ラムノシル化のためのヌクレオチド糖ドナーであり、脊椎動物では発生しない。脊椎動物細胞は特定のラムノシルトランスフェラーゼも欠いており、そのためGDP−D−ラムノースを脊椎動物細胞内の糖タンパク質又は糖脂質の新生糖構造に組み込むことができない。
【0073】
酵素GDP−6−デオキシ−D−タロースシンテターゼ(GTS)は基質GDP−6−デオキシ−D−リキソ−4−ヘキスロースをGDP−デオキシ−D−タロースへと還元する。GDP−デオキシ−D−タロースは、細菌における6−デオキシ−D−タロシル化のためのヌクレオチド糖ドナーであり、脊椎動物では発生しない。脊椎動物細胞は特定のデオキシタロシルトランスフェラーゼも欠いており、そのためGDP−デオキシ−D−タロースを脊椎動物細胞内の新生糖構造に組み込むことができない。
【0074】
さらに、酵素GDP−ペロサミンシンテターゼ(Per)は基質GDP−6−デオキシ−D−リキソ−4−ヘキスロースを還元し、アミノ基転移を行い、GDP−D−ペロサミンにする。GDP−D−ペロサミンは細菌、例えば大腸菌におけるペロサミニル化(perosaminylation)のためのヌクレオチド糖ドナーである。GDP−D−ペロサミンは通常、脊椎動物細胞には存在しない。脊椎動物細胞は特定のペロサミニルトランスフェラーゼも欠いており、そのためGDP−D−ペロサミンは脊椎動物細胞内で新生糖構造に結合することができない。
【0075】
そのため、異種酵素GTS及び/又はPerは、(i)脊椎動物細胞において基質GDP−6−デオキシ−D−リキソ−4−ヘキスロースを枯渇させ、(ii)GDP−L−フコース合成にもはや利用することができない人工生成物(すなわちGTSの場合、GDP−デオキシ−D−タロース、及びPerの場合、GDP−D−ペロサミン)の合成をもたらす。したがってGTS及び/又はPerを含む脊椎動物細胞で生成される、通常その糖部分にフコースを含む分子は、その糖部分上において、フコースを欠くか、又はフコース量が低減している。
【0076】
酵素GDP−4−ケト−6−デオキシマンノース−3−デヒドラターゼ(ColD)は、基質GDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用して、それをGDP−4−ケト−3,6−ジデオキシ−D−マンノースへと変換する。中間体GDP−4−ケト−3,6−ジデオキシ−D−マンノースは脊椎動物細胞では不安定であり得るため、ColDを酵素GDP−L−コリトースシンターゼ(ColC)と併用するのが好ましい。酵素ColCはGDP−4−デヒドロ−6−デオキシ−D−マンノースエピメラーゼ/レダクターゼの群に属する。酵素ColCは、中間体GDP−4−ケト−3,6−ジデオキシ−D−マンノースを安定した最終生成物であるGDP−L−コリトースへと更に変換する。生成物は両方とも、上記細胞がGDP−4−ケト−3,6−ジデオキシ−D−マンノース及び/又はGDP−L−コリトースを上記細胞に存在する分子の糖部分へと転移させるそれぞれのグリコシルトランスフェラーゼを欠いているため、脊椎動物細胞内の新生糖構造へと組み込むことはできない。このため、ColDがColCとともに脊椎動物細胞に存在するのが好ましい。
【0077】
酵素GDP−フコースシンテターゼ(GFS)(GDP−4−ケト−6−デオキシ−D−マンノースエピメラーゼ/レダクターゼ、GMERとしても知られる)は、脊椎動物細胞においてGDP−4−ケト−6−デオキシ−D−マンノースをGDP−L−フコースへと変換する。GFS反応はC−3''及びC−5''の両方でのエピマー化、その後のC−4でのカルボニルのNADPH依存性の還元を伴う。活性部位の突然変異体、好ましくはGFS−Cys109Serを本発明に使用し、これはGDP−4−ケト−6−デオキシ−D−マンノースをGDP−L−フコースとは異なる生成物、すなわちGDP−6−デオキシ−D−アルトロースへと変換する(Lau S.T.B., Tanner, M.E. 2008. Mechanism and active site residues ofGDP-Fucose Synthase, Journal of the American Chemical Society, Vol. 130, No.51, pp. 17593-17602を参照されたい)。
【0078】
好ましくは、GDP−6−デオキシ−D−リキソ−4−ヘキスロースレダクターゼ(RMD)、GDP−ペロサミンシンテターゼ(Per)、GDP−6−デオキシ−D−タロースシンテターゼ(GTS)、GDP−フコースシンテターゼCys109Ser(GFS−Cys109Ser)突然変異体、GDP−4−ケト−6−デオキシマンノース−3−デヒドラターゼ(ColD)、好ましくはGDP−L−コリトースシンターゼ(ColC)と組み合せたGDP−4−ケト−6−デオキシマンノース−3−デヒドラターゼ(ColD)、及びそれらの変異体からなる群から選択される2個以上、すなわち2個、3個、4個、5個、6個又は7個の酵素が脊椎動物細胞に存在する。
【0079】
本発明で好ましいRMD酵素、Per酵素、GTS酵素、GFS−Cys109Ser酵素、ColD酵素又はColC酵素の変異体は、アミノ酸配列における最大150個(すなわち最大1個、2個、3個、4個、5個、6個、7個、8個、9個、10個、11個、12個、13個、15個、16個、17個、18個、19個、20個、21個、22個、23個、24個、25個、26個、27個、28個、29個、30個、35個、40個、45個、50個、55個、60個、65個、70個、75個、80個、85個、90個、95個、100個、110個、120個、130個、140個又は150個)のアミノ酸の変化(すなわち交換、挿入、欠失、N末端切断及び/又はC末端切断)により誘導されるという点でRMD酵素、Per酵素、GTS酵素、GFS−Cys109Ser酵素、ColD酵素又はColC酵素とは異なる。アミノ酸の交換は保存的又は非保存的であり得る。本発明で好ましいRMD酵素、Per酵素、GTS酵素、GFS−Cys109Ser酵素、ColD酵素又はColC酵素の変異体は、代替的に又は付加的に、誘導元であるRMD酵素、Per酵素、GTS酵素、GFS−Cys109Ser酵素、ColD酵素又はColC酵素との或る特定の程度の配列同一性を特徴とすることができる。このため、本発明で好ましいRMD酵素、Per酵素、GTS酵素、GFS−Cys109Ser酵素、ColD酵素又はColC酵素の変異体は、それぞれの参照となるRMD酵素、Per酵素、GTS酵素、GFS−Cys109Ser酵素、ColD酵素又はColC酵素に対して少なくとも80%、少なくとも81%、少なくとも82%、少なくとも83%、少なくとも84%、少なくとも85%、少なくとも86%、少なくとも87%、少なくとも88%、少なくとも89%、少なくとも90%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%又は少なくとも99%の配列同一性を有する。好ましくは配列同一性は、それぞれの参照となるRMD酵素、Per酵素、GTS酵素、GFS−Cys109Ser酵素、ColD酵素又はColC酵素の40個、45個、50個、60個、70個、80個、90個、100個、150個、200個、250個、300又はそれ以上のアミノ酸の連続ストレッチにわたる、好ましくは全長にわたるものである。配列同一性が、それぞれの参照となるRMD酵素、Per酵素、GTS酵素、GFS−Cys109Ser酵素、ColD酵素又はColC酵素の全長にわたって少なくとも80%であり、全長にわたって少なくとも85%であり、全長にわたって少なくとも90%であり、全長にわたって少なくとも95%であり、全長にわたって少なくとも98%であり、又は全長にわたって少なくとも99.5%であるのが特に好ましい。配列同一性が、それぞれの参照となるRMD酵素、Per酵素、GTS酵素、GFS−Cys109Ser酵素、ColD酵素又はColC酵素の少なくとも200個若しくは250個のアミノ酸にわたって少なくとも80%であり、少なくとも200個若しくは250個のアミノ酸にわたって少なくとも85%であり、少なくとも200個若しくは250個のアミノ酸にわたって少なくとも90%であり、少なくとも200個若しくは250個のアミノ酸にわたって少なくとも95%であり、少なくとも200個若しくは250個のアミノ酸にわたって少なくとも98%であり、又は少なくとも200個若しくは250個のアミノ酸にわたって少なくとも99.5%であることも特に好ましい。
【0080】
RMD酵素、Per酵素、GTS酵素、GFS−Cys109Ser酵素、ColD酵素又はColC酵素の断片(すなわち欠失変異体)は、そのN末端及び/又はそのC末端及び/又はその内部に最大1個、2個、3個、4個、5個、6個、7個、8個、9個、10個、15個、20個、25個、30個、35個、40個、45個、50個、55個、60個、65個、70個、75個、80個、85個、90個、95個、100個、110個、120個、130個、140個又は150個のアミノ酸の欠失を有するのが好ましい。
【0081】
さらに、参照酵素に対して上記に示される程度の関連性を有するRMD酵素、Per酵素、GTS酵素、GFS−Cys109Ser酵素、ColD酵素又はColC酵素は、それぞれの参照酵素の活性の少なくとも30%程度まで関連の生体活性を示す場合にのみ変異体とみなされる。本発明との関連では、関連の「生体活性」は、「酵素活性」、すなわち基質GDP−6−デオキシ−D−リキソ−4−ヘキスロースを利用し、それをそれぞれGDP−D−ラムノース、GDP−D−ペロサミン、GDP−デオキシ−D−タロース、GDP−6−デオキシ−D−アルトロース、GDP−4−ケト−3,6−ジデオキシ−D−マンノース又はGDP−L−コリトースに変換するRMD酵素、Per酵素、GTS酵素、GFS−Cys109Ser酵素、ColD酵素又はColC酵素の変異体の活性である。当業者は、RMD酵素、Per酵素、GTS酵素、GFS−Cys109Ser酵素、ColD酵素又はColC酵素の変異体が、それぞれの参照となるRMD酵素、Per酵素、GTS酵素、GFS−Cys109Ser酵素、ColD酵素又はColC酵素の酵素活性のうちの少なくとも30%の酵素活性を有するかを容易に評価することができる。それぞれの参照酵素の酵素活性と比較した酵素変異体の「酵素活性」を決定するのに好適なアッセイ、例えば酵素活性アッセイが当業者にとって既知である。
【0082】
好ましくは、GDP−6−デオキシ−D−リキソ−4−ヘキスロースレダクターゼ(RMD)酵素は緑膿菌(Pseudomonasaeruginosa)由来である(配列番号1)。GDP−6−デオキシ−D−タロースシンテターゼ(GTS)酵素はアクチノバチルス・アクチノミセテムコミタンス(Actinobacillus actinomycetemcomitans)由来であるのが好ましい(配列番号2)。GDP−ペロサミンシンテターゼ(Per)酵素がコレラ菌(Vibrio cholerae)由来であるのが好ましい(配列番号3)。好ましくは、GDP−4−ケト−6−デオキシマンノース−3−デヒドラターゼ(ColD)が大腸菌由来である(配列番号4)。大腸菌由来のGDP−L−コリトースシンターゼ(ColC)の使用も好ましい(配列番号7)。野生型GDP−フコースシンテターゼ(GFS)はクリセツラス・グリセウス(Cricetulus griseus)(チャイニーズハムスター)由来である(配列番号5)。クリセツラス・グリセウス(チャイニーズハムスター)由来のGDP−フコースシンテターゼCys109Ser(GFS−Cys109Ser)突然変異体は配列番号6のアミノ酸配列を有する。
【0083】
上述のように、本発明は、基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用する酵素の変異体を包含する。このため本発明は、上述の配列の識別番号の変異体、すなわち配列番号1の変異体、配列番号2の変異体、配列番号3の変異体、配列番号3の変異体、配列番号4の変異体、配列番号5の変異体、配列番号6の変異体及び配列番号7の変異体も包含する。上記変異体の構造的定義及び/又は機能的定義については、上述の段落を参照する。
【0084】
好ましくは、RMD、Per、GTS、ColD、ColC又はGFS−Cys109Serの核酸配列はコドン最適化されている(codon-optimized)。「コドン最適化」という用語は本発明との関連で使用する場合、例えば、内部のTataボックス、chi部位、リボソーム侵入部位、RNA不安定性モチーフ、反復配列、強いRNA二次構造及び潜在スプライス部位の除去と、真核(例えば脊椎動物)細胞において利用度(utilization)がより高いコドン又は真核(例えば脊椎動物)細胞において高度に発現した遺伝子の使用とを意味する。
【0085】
さらに脊椎動物細胞においてフコースサルベージ経路が遮断されることが更に好ましい。このため、本発明の細胞を培養する際に、フコース及びフコシル化糖タンパク質を含まない成長培地を使用することが好ましい。
【0086】
脊椎動物細胞は該酵素に加えて又は該酵素の代わりに、GDP−L−フコース合成を阻害又は防止するためGDP−D−ラムノース、GDP−D−ペロサミン、GDP−デオキシ−D−タロース、GDP−6−デオキシ−D−アルトロース、GDP−4−ケト−3,6−ジデオキシ−D−マンノース及び/又はGDP−L−コリトースを含むが、これは思いがけず本発明者らが、人工糖GDP−D−ラムノース、GDP−D−ペロサミン、GDP−デオキシ−D−タロース、GDP−6−デオキシ−D−アルトロース、GDP−4−ケト−3,6−ジデオキシ−D−マンノース及び/又はGDP−L−コリトースの補充、特に細胞質補充(例えば細胞質内注入による)が脊椎動物細胞におけるフコース転移の阻害にプラスに寄与することに気が付いたためである。人工糖(複数も可)GDP−6−デオキシ−D−アルトロース、GDP−D−ラムノース及び/又はGDP−D−ペロサミンの補充が特に好ましい。
【0087】
基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用するが、GDP−6−デオキシ−D−リキソ−4−ヘキスロースをGDP−L−フコースに変換する反応を触媒しない酵素がエピソーム的に又は染色体的に脊椎動物細胞に一時的に存在する又は安定して維持される核酸配列から発現されることが好ましい。
【0088】
酵素、好ましくはGDP−6−デオキシ−D−リキソ−4−ヘキスロースレダクターゼ(RMD)、GDP−ペロサミンシンテターゼ(Per)、GDP−6−デオキシ−D−タロースシンテターゼ(GTS)、GDP−フコースシンテターゼCys109Ser(GFS−Cys109Ser)突然変異体、GDP−4−ケト−6−デオキシマンノース−3−デヒドラターゼ(ColD)又はGDP−L−コリトースシンターゼ(ColC)をコードする核酸配列が、細胞を形質転換するのに使用される発現ベクターに組み込まれる。
【0089】
好適な発現ベクターはプラスミド、コスミド、細菌人工染色体(BAC)及びウイルスベクターを含む。好ましくは、非ウイルス性の発現ベクターが使用される。
【0090】
酵素をコードする核酸の発現は発現制御配列により制御される。
【0091】
「発現制御配列」という用語は、真核細胞(例えば脊椎動物細胞)における操作可能に連結したコード配列の発現に影響を与えるヌクレオチド配列を表す。発現制御配列は、核酸配列の転写を制御する配列、例えばプロモーター、TATAボックス、エンハンサー;転写後事象、例えばポリアデニル化を制御する配列;及び翻訳を制御する配列である。
【0092】
好ましいプロモーターは、サイトメガロウイルスのhCMV前初期遺伝子プロモーター、SV40の初期若しくは後期プロモーターを含む構成的プロモーター、又はCUP−1プロモーター、例えばtet−onシステム若しくはtet−offシステムで利用されるtetリプレッサー、3−ホスホグリセリン酸キナーゼ(PGK)に関するプロモーター、酸ホスファターゼのプロモーター、及び酵母のα接合因子若しくはa接合因子のプロモーターを含む調節性プロモーター、例えば構成的CMV前初期遺伝子プロモーター、初期又は後期SV40プロモーター、ポリヘドリンプロモーター、レトロウイルスLTR、PGKプロモーター、伸長因子1−α(EF1−α)、EF2及びホスホエノールピルビン酸カルボキシキナーゼ(PEPCK)である。特に好ましいプロモーターは、潜在的な毒性問題を避けるための酵素の中程度の(intermediate)又は弱い発現のみを支持するプロモーターである。所定のプロモーターの発現強度は、該発現を内因性GAPDHの発現を目的とする強い構成的プロモーターの発現強度と比較することにより正規化することができる。GAPDHの10%〜1%の強度での酵素の発現を目的とするプロモーターが、中程度の発現を目的とするプロモーターとみなされ、1%未満の強度での酵素の発現を目的とするプロモーターが弱いプロモーターとみなされる。発現強度を、例えばリアルタイムPCRを含む当該技術分野で既知の方法により評価することができる。
【0093】
マーカータグも本発明の実施の形態で使用することができる。好ましくは、マーカータグの核酸配列が、タグ付されるタンパク質(例えば酵素、抗体)をコードする核酸配列に操作可能に連結する。好ましくは、マーカータグはGFP及びその変異体からなる群から選択される蛍光タンパク質(GFPを含むがこれに限定されない)である。本明細書で使用される場合、「操作可能に連結した」は、フレームシフト又は終止コドンを避けた対応する融合タンパク質のインフレーム発現が影響を受け得るように、1つの核酸が第2の核酸と連結していることを意味する。これらの用語は、対象となるコード核酸配列(例えば酵素、抗体)の発現を効果的に制御するための上記配列への発現制御配列の連結も意味する。これらの用語は、対象となるコード核酸配列(例えば酵素、抗体)との親和性タグ又はマーカータグをコードする核酸配列の連結も表す。
【0094】
発現ベクターにおける酵素RMD、Per、GTS、GFS−Cys109Ser、ColD又はColCをコードする核酸配列が、脊椎動物特異的な発現制御配列と操作可能に連結する(linked)ことにより、脊椎動物細胞において酵素RMD、Per、GTS、GFS−Cys109Ser、ColD又はColCをコードする核酸配列の発現が可能になることが好ましい。
【0095】
結果として、酵素(複数も可)RMD、Per、GTS、GFS−Cys109Ser及び/又はColD、好ましくはColCと組み合わせたColDが、所望の効果に最適な収率で本発明の脊椎動物細胞において発現される。酵素の性質及び発現に使用される細胞に応じて、これらの収率は高くても、中程度であっても、又は低くてもよい。当業者が高い、中程度の又は低いレベルの発現を得るために適切な脊椎動物特異的な発現制御配列を選択することは容易である。
【0096】
脊椎動物細胞における酵素(複数も可)RMD、Per、GTS、GFS−Cys109Ser及び/又はColD、好ましくはColCと組み合わせたColDの発現には、GDP−L−フコース合成を効果的に阻止し、これにより自然状態ではその糖部分上において、フコースを含むが、それらの発現によりその糖部分上において、フコースを欠いている、又は低減したフコース量を有する分子の生成がもたらされる効果がある。
【0097】
組換えタンパク質の長期的な高収率の生成のために、安定した発現が好ましい。例えば、基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用するが、GDP−6−デオキシ−D−リキソ−4−ヘキスロースをGDP−L−フコースへと変換する反応を触媒しない酵素、及びタンパク質、例えば抗体をコードする核酸を安定して発現する真核細胞(例えば脊椎動物細胞)を改変することができる。ウイルスの複製起点を含有する発現ベクターを使用することなく、真核細胞(例えば脊椎動物細胞)を適切な発現制御配列(例えばプロモーター、エンハンサー、配列、転写ターミネーター、ポリアデニル化部位等)によって制御されるベクターと、任意で選択可能なマーカーとを用いて形質転換することができる。外来DNAの導入後に、形質転換した細胞を、このような細胞由来の核酸を分析することにより、発現の効果(例えばレクチン結合を用いたフコースを欠くこと)を検出することにより検出することができ、又は形質転換した細胞を、選択圧を加えることにより選択することができる。好適な選択系は当該技術分野で既知である。
【0098】
好ましくは、脊椎動物細胞は、フコシルトランスフェラーゼに対する基質となることができる少なくとも1つの(アクセプタ)分子を更に含む。「フコシルトランスフェラーゼに対する基質となることができる(アクセプタ)分子」という用語は本発明の関連で使用される場合、フコシル化活性が変わらない細胞で生成される場合、少なくとも1つのフコース残基が結合した糖部分を有する又は含む、対象となる任意の化合物、例えばタンパク質、ポリペプチド、オリゴペプチド、脂質、脂質断片又は融合タンパク質を表す。かかる化合物はフコシルトランスフェラーゼに関する好適な基質である。したがって好ましいアクセプタ分子は、糖タンパク質、糖ポリペプチド、糖オリゴペプチド、糖脂質、糖脂質断片又はグリコシル化融合タンパク質である。「フコシルトランスフェラーゼに対する基質となることができる(アクセプタ)分子」という用語は本発明の関連で使用される場合、少なくとも1つのフコース残基が結合することができるプロスペクティブ(prospective)糖タンパク質又は糖脂質、すなわち脊椎動物細胞による生成後にフコシルトランスフェラーゼにより、フコースが結合することができる単糖を含むオリゴ糖構造が連結したタンパク質又は脂質である限りにおいて、いずれのタンパク質又は脂質をも表す。好ましくはタンパク質は原核生物起源のものではない。タンパク質が哺乳類タンパク質である又はそれから誘導されるのが特に好ましい。
【0099】
本発明の脊椎動物細胞におけるフコシルトランスフェラーゼに対する基質となることができる分子、例えば少なくとも1つのフコース残基が結合することができる糖部分を含むタンパク質又は脂質の存在により、フコース残基が結合することができるにもかかわらずその糖部分上において、フコースを含まない、又はその糖部分上において、低減したフコース量を有するこの分子が生成される。
【0100】
フコシルトランスフェラーゼに対する基質となることができる分子はタンパク質、好ましくは内因性又は外因性のタンパク質であるのが好ましい。「外因性タンパク質」という用語は、各細胞の外側由来のものであるか、又は各細胞へと導入される核酸により細胞内において発現される任意のタンパク質を意味する。「内因性タンパク質」という用語は、細胞のゲノムによりコードされる任意のタンパク質を表す。好ましくは対象となるタンパク質、すなわちプロスペクティブ糖タンパク質は組換えによって脊椎動物細胞で発現される。上記タンパク質は脊椎動物細胞に一時的に存在する又は安定して維持される核酸配列から発現されるのが好ましい。好適な発現ベクター及び発現制御配列は酵素に関して上記されている。これらは対象となるタンパク質をコードする核酸の発現に関して同様に使用することができる。
【0101】
このため本発明の好ましい実施の形態では、脊椎動物細胞は、
(i)脊椎動物特異的な発現制御配列(それぞれの酵素をコードする核酸配列の発現を可能とする)に操作可能に連結した、酵素GDP−6−デオキシ−D−リキソ−4−ヘキスロースレダクターゼ(RMD)、GDP−ペロサミンシンテターゼ(Per)、GDP−6−デオキシ−D−タロースシンテターゼ(GTS)、GDP−フコースシンテターゼCys109Ser(GFS−Cys109Ser)突然変異体、GDP−4−ケト−6−デオキシマンノース−3−デヒドラターゼ(ColD)又はGDP−L−コリトースシンターゼ(ColC)をコードする核酸配列を含む少なくとも1つのポリヌクレオチドと、
(ii)脊椎動物特異的な発現制御配列(上記細胞において対象となるタンパク質、例えばIgG1のような抗体をコードする核酸配列の発現をもたらす)に操作可能に連結した、対象となるタンパク質、すなわちプロスペクティブ糖タンパク質、例えばIgG1のような抗体をコードする核酸配列を含む少なくとも1つのポリヌクレオチドと、
を含む。
【0102】
結果として、(i)酵素(複数も可)RMD、Per、GTS、GFS−Cys109Ser及び/又はColD、好ましくはColCと組み合わせたColDと、(ii)対象となるタンパク質(複数も可)、すなわちプロスペクティブ糖タンパク質(複数も可)、例えばIgG1のような抗体とが本発明の脊椎動物細胞において発現される。
【0103】
好ましくは、本発明の第1の態様では、タンパク質は抗体、抗体断片、融合タンパク質、ウイルスタンパク質、ウイルスタンパク質断片、抗原又はホルモンである。最も好ましくは、抗体又は抗体断片は、IgG、好ましくはIgG1、IgG2、IgG3、IgG4、IgM、IgA、IgD及びIgEからなる群から選択される。最も好ましくは、融合タンパク質は、抗体のFc領域、例えばIgGのFc領域、例えばIgG1、IgG2、IgG3、IgG4、IgM、IgA、IgD又はIgEのFc領域を含む。最も好ましくは、ホルモンは卵胞刺激ホルモン(FSH)、性腺刺激ホルモン、甲状腺刺激ホルモン、インターロイキン−2、インターロイキン−6、インターロイキン−10、インターロイキン−11、可溶性インターロイキン−4、エリスロポエチン又はトロンボポエチンである。好ましくは、ウイルスタンパク質又はウイルスタンパク質断片はエンベロープウイルスのエンベロープ膜に含まれる。ウイルスタンパク質が呼吸器合胞体ウイルス由来のGタンパク質又はFタンパク質であり、かつウイルスタンパク質断片が上記タンパク質の細胞外断片であるのが特に好ましい。
【0104】
本発明の更なる態様は、上記のウイルスタンパク質又はウイルスタンパク質断片を含むウイルスである。
【0105】
フコシルトランスフェラーゼに対する基質となることができる分子は脂質であるのが好ましい。好ましくは、脂質はグリセロ糖脂質、最も好ましくはガラクト脂質、スルホ脂質(SQDG)又はスフィンゴ糖脂質、最も好ましくはセレブロシド(例えばガラクトセレブロシド又はグルコセレブロシド)、ガングリオシド、グロボシド、スルファチド又はホスホスフィンゴ糖脂質である。脂質はエンベロープウイルスのエンベロープ膜に含まれるのが特に好ましい。
【0106】
スフィンゴ糖脂質(GSL)が特に好ましい。スフィンゴ糖脂質は疎水性セラミドアンカーであるN−アシルスフィンゴシンと、サッカリドから構成される親水性ヘッド基とを含有する。スフィンゴ糖脂質は通常、細胞膜の外表面に見られる。サッカリド部分の組成は細胞型に特有のものであり、生物の発生段階に応じて様々であり、又は細胞の発がん状態とともに変化し得る。
【0107】
最も好ましくは、ウイルスタンパク質及び/又は脂質がエンベロープウイルスのエンベロープに含まれる。
【0108】
既に上述したように、タンパク質はエンベロープウイルスのエンベロープ膜に含まれるウイルスタンパク質であり得る。脂質はエンベロープウイルスのエンベロープ膜に含まれる脂質でもあり得る。
【0109】
本発明の更なる態様は上記脂質を含むウイルスである。
【0110】
上述のウイルスをウイルス感染により脊椎動物細胞に導入することができる。ウイルスを、産生されるウイルスの全て又は一部をコードする核酸を導入することによって、脊椎動物細胞に導入することもできる。複製、例えばアセンブリ(assembly:集合化)に要求されるタンパク質を提供する必要がある場合、このことは通常、1つ又は複数のウイルスタンパク質を発現することが可能なウイルス産生細胞株を使用することにより達成される。例えばHEK293細胞、Per.C6細胞及びAGE1.HN細胞がアデノウイルスE1Aタンパク質を発現し、そのためE1コード領域を欠くDNAを補完することが可能である。
【0111】
好ましくは、脊椎動物細胞は哺乳類細胞、魚類細胞、両生類細胞、爬虫類細胞又は鳥類細胞である。
【0112】
i)哺乳類細胞がヒト細胞、ハムスター細胞、イヌ細胞若しくはサル細胞、好ましくはチャイニーズハムスター卵巣細胞(CHO)、アフリカミドリザル腎臓細胞(VERO−76)(ATCC CRL−1587)、ヒト子宮頸癌細胞(HeLa)(ATCC CCL 2)、メイディンダービー(Darby)イヌ腎臓細胞(MDCK)(ATCC CCL 34)、ヒトPER.C6細胞(Crucell(Leiden, The Netherlands)の市販細胞)、若しくはヒト(ホモ・サピエンス(homo sapiens))AGE1.HN細胞(ProBioGen(Berlin, Germany)の市販細胞)であり、
ii)魚類細胞がアメリカナマズ(Ictalurus punctatus)(チャネル・キャットフィッシュ)卵巣(CCO)細胞(ATCC CRL−2772)であり、
iii)両生類細胞がアフリカツメガエル(Xenopus laevis)腎臓細胞(ATCC CCL−102)であり、
iv)爬虫類細胞がグリーンイグアナ(Iguana iguana)心臓細胞(IgH−2)(ATCC CCL−108)であり、又は
v)鳥類細胞がトリ網膜細胞AGE1.CR、若しくはAGE1.CR.PIX、若しくはトリ体節細胞AGE1.CS(全ての細胞がノバリケン(Muscovy duck)(カイリナ・モスチャタ(Cairina moschata))から誘導される)であることが特に好ましい。
【0113】
これらの細胞株は全て、ProBioGen AGから市販されている。
【0114】
細胞株AGE1.CR.PIX(17a11b)は、DSMZ-Deutsche Sammlung vonMikroorganismen und Zellkulturen GmbH(Mascheroder Weg1b, 38124 Braunschweig, Germany)にProBioGen AG(Goethestr. 54, 13086 Berlin, Germany)によって2005年11月24日にアクセッション番号DSM ACC2749で寄託された。細胞株AGE1.HN(NC5T11#34)は、DSMZ-Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH(Mascheroder Weg 1b, 38124 Braunschweig, Germany)にProBioGen AG(Goethestr. 54, 13086 Berlin,Germany)によって2005年11月4日にアクセッション番号DSM ACC2744で寄託された。細胞株AGE1.CR.PIX(17a11b)はノバリケン(カイリナ・モスチャタ)の胚性網膜細胞から誘導される。細胞株AGE1.HN(NC5T11#34)はヒト(ホモ・サピエンス)胎児の脳室周囲の神経領域から誘導される。両方の細胞株をアデノウイルスE1A及びE1Bタンパク質の安定した組込み及び発現により不死化させる。
【0115】
別の好ましい脊椎動物細胞はVIVALIS(Nantes, France)の市販細胞である鳥類EB14細胞である。他の好ましい脊椎動物細胞は以下の表1に要約される。
【0116】
【表1】

表1中の英語
細胞株
寄託番号
起源
誘導体
野生型
ATCCによる寄託なし
マウス骨髄腫
幼ハムスターの腎臓(Kidney)
チャイニーズハムスターの卵巣
クリセツラス・グリセウス
ヒトの胚腎臓
【0117】
脊椎動物細胞は、GDP−D−ラムノース、GDP−D−ペロサミン、GDP−デオキシ−D−タロース、GDP−6−デオキシ−D−アルトロース、GDP−4−ケト−3,6−ジデオキシ−D−マンノース又はGDP−L−コリトースが通常、脊椎動物細胞において合成されない又は存在しないため、上記糖に対するグリコシルトランスフェラーゼを自然状態では含まない。このためたとえ人工糖GDP−D−ラムノース、GDP−D−ペロサミン、GDP−デオキシ−D−タロース、GDP−6−デオキシ−D−アルトロース、GDP−4−ケト−3,6−ジデオキシ−D−マンノース又はGDP−L−コリトースが本発明の第1の態様による脊椎動物細胞において不自然に生成されたとしても、上記糖をタンパク質又は脂質の新生糖構造に組み込むことはできない。
【0118】
しかしながら本発明者らは、それぞれの異種グリコシルトランスフェラーゼ、及び任意でさらにそれぞれの異種GDP−デオキシヘキソース糖ヌクレオチド輸送体が脊椎動物細胞に存在していれば、人工糖GDP−D−ラムノース、GDP−D−ペロサミン、GDP−デオキシ−D−タロース、GDP−6−デオキシ−D−アルトロース、GDP−4−ケト−3,6−ジデオキシ−D−マンノース又はGDP−L−コリトースをタンパク質又は脂質のグリカン構造に組み込むことができることを予期せず発見した。
【0119】
したがって好ましい実施の形態では、本発明の第1の態様による脊椎動物細胞は、好ましくは脊椎動物細胞に含まれ、脊椎動物特異的な発現制御配列に操作可能に連結した核酸によりコードされる、GDP−D−ラムノース、GDP−D−ペロサミン、GDP−デオキシ−D−タロース、GDP−6−デオキシ−D−アルトロース、GDP−4−ケト−3,6−ジデオキシ−D−マンノース又はGDP−L−コリトースに対する少なくとも1つのグリコシルトランスフェラーゼ(該発現制御配列により上記核酸配列の発現が可能になる)と、任意で好ましくは脊椎動物細胞に含まれ、脊椎動物特異的な発現制御配列に操作可能に連結した核酸によりコードされる、GDP−D−ラムノース、GDP−D−ペロサミン、GDP−デオキシ−D−タロース、GDP−6−デオキシ−D−アルトロース、GDP−4−ケト−3,6−ジデオキシ−D−マンノース又はGDP−L−コリトースに対する少なくとも1つのGDP−デオキシヘキソース糖ヌクレオチド輸送体(該発現制御配列により上記核酸配列の発現が可能になる)とを更に含む。より好ましい実施の形態では、本発明の第1の態様による脊椎動物細胞は、GDP−D−ラムノース、GDP−D−ペロサミン及び/又はGDP−6−デオキシ−D−アルトロースに対するグリコシルトランスフェラーゼを更に含む。
【0120】
2個以上、例えば2個、3個、4個、5個、6個又は7個の上述のグリコシルトランスフェラーゼと、任意で2個以上、例えば2個、3個、4個、5個、6個又は7個の上述のGDP−デオキシヘキソース糖ヌクレオチド輸送体が脊椎動物細胞、例えば真核細胞に存在することが特に好ましい。
【0121】
かかる核酸の一時的な又は安定した発現のための好適なシステムは、当業者に既知であるが、好ましいものが上記されており、グリコシルトランスフェラーゼ及び任意でGDP−デオキシヘキソース糖ヌクレオチド輸送体を発現することに関して同じように使用することができる。
【0122】
好ましくは、GDP−D−ラムノース、GDP−D−ペロサミン、GDP−デオキシ−D−タロース、GDP−6−デオキシ−D−アルトロース、GDP−4−ケト−3,6−ジデオキシ−D−マンノース又はGDP−L−コリトースに対するグリコシルトランスフェラーゼが組換えによって脊椎動物細胞で発現される。GDP−D−ラムノース、GDP−D−ペロサミン、GDP−デオキシ−D−タロース、GDP−6−デオキシ−D−アルトロース、GDP−4−ケト−3,6−ジデオキシ−D−マンノース又はGDP−L−コリトースに対するグリコシルトランスフェラーゼを脊椎動物細胞に一時的に存在する又は安定して維持される核酸配列から発現することができる。上述のGDP−デオキシヘキソース糖ヌクレオチド輸送体が組換えによって脊椎動物細胞で発現されることも好ましい。上記GDP−デオキシヘキソース糖ヌクレオチド輸送体を脊椎動物細胞に一時的に存在する又は安定して維持される核酸配列から発現することができる。
【0123】
このため本発明の別の好ましい実施の形態では、脊椎動物細胞は、
(i)脊椎動物特異的な発現制御配列に操作可能に連結した、酵素GDP−6−デオキシ−D−リキソ−4−ヘキスロースレダクターゼ(RMD)、GDP−ペロサミンシンテターゼ(Per)、GDP−6−デオキシ−D−タロースシンテターゼ(GTS)、GDP−フコースシンテターゼCys109Ser(GFS−Cys109Ser)突然変異体、GDP−4−ケト−6−デオキシマンノース−3−デヒドラターゼ(ColD)又はGDP−L−コリトースシンターゼ(ColC)をコードする核酸配列を含む少なくとも1つのポリヌクレオチドと、
(ii)脊椎動物特異的な発現制御配列に操作可能に連結した、対象となるタンパク質、すなわちプロスペクティブ糖タンパク質、例えばIgG1のような抗体をコードする核酸配列を含む少なくとも1つのポリヌクレオチド(該発現制御配列により上記細胞において上記タンパク質をコードする核酸配列の発現が可能になる)と、
(iii)脊椎動物特異的な発現制御配列に操作可能に連結した、GDP−D−ラムノース、GDP−D−ペロサミン、GDP−デオキシ−D−タロース、GDP−6−デオキシ−D−アルトロース、GDP−4−ケト−3,6−ジデオキシ−D−マンノース又はGDP−L−コリトースに対するグリコシルトランスフェラーゼをコードする核酸配列を含む少なくとも1つのポリヌクレオチド(該発現制御配列により上記細胞において上記タンパク質をコードする核酸配列の発現が可能になる)と、任意で
(iv)脊椎動物特異的な発現制御配列に操作可能に連結した、GDP−D−ラムノース、GDP−D−ペロサミン、GDP−デオキシ−D−タロース、GDP−6−デオキシ−D−アルトロース、GDP−4−ケト−3,6−ジデオキシ−D−マンノース又はGDP−L−コリトースに対するGDP−デオキシヘキソース糖ヌクレオチド輸送体をコードする核酸配列を含む少なくとも1つのポリヌクレオチド(該発現制御配列により上記細胞において上記タンパク質をコードする核酸配列の発現が可能になる)と、
を含む。
【0124】
結果として、(i)酵素(複数も可)と、(ii)対象となるタンパク質(複数も可)と、(iii)グリコシルトランスフェラーゼ(複数も可)と、任意で(iv)GDP−デオキシヘキソース糖ヌクレオチド輸送体とが本発明の脊椎動物細胞において過剰発現される。
【0125】
上記タンパク質(複数も可)は、酵素(複数も可)の最終生成物(複数も可)、すなわちGDP−D−ラムノース、GDP−D−ペロサミン、GDP−デオキシ−D−タロース、GDP−6−デオキシ−D−アルトロース、GDP−4−ケト−3,6−ジデオキシ−D−マンノース及び/又はGDP−L−コリトースを利用し、それらをその糖部分上において、フコースを欠いている又は低減したフコース量を有するタンパク質(複数も可)の糖構造に組み込む同時発現したグリコシルトランスフェラーゼ(複数も可)により、更に修飾される。これにより、その糖部分上において、D−ラムノース、D−ペロサミン、デオキシ−D−タロース、6−デオキシ−D−アルトロース、4−ケト−3,6−ジデオキシ−D−マンノース及び/又はL−コリトースを含む新たな人工タンパク質(複数も可)が生成される。
【0126】
好ましくは、上述のGDP−デオキシヘキソース糖ヌクレオチド輸送体は、ゴルジ体のGDP−デオキシヘキソース糖ヌクレオチド輸送体、すなわち脊椎動物細胞、例えば真核細胞のゴルジ膜を介した上述のヌクレオチド糖の輸送を可能にする輸送体である。
【0127】
本発明による(改変)脊椎動物細胞を使用して、その糖部分上において、フコースを有しない又はその糖部分上において、低減したフコース量を有する、エンベロープ表面の糖タンパク質又は糖脂質を含む、エンベロープウイルスを産生することができる。
【0128】
好ましくは、エンベロープウイルスを、完全に又は部分的にウイルスワクチンの活性成分として使用する。「ウイルスワクチン」という用語は、投与するとウイルスに対する抗体産生又は細胞性免疫を刺激するが、重大な感染を引き起こす能力のない弱毒化又は死滅ウイルスの製剤を意味する。
【0129】
本発明による(改変)脊椎動物細胞を使用して、その糖部分上において、D−ラムノース、D−ペロサミン、デオキシ−D−タロース、6−デオキシ−D−アルトロース、4−ケト−3,6−ジデオキシ−D−マンノース及び/又はL−コリトースを含む、エンベロープ表面の糖タンパク質又は糖脂質を含む、エンベロープウイルスを産生することもできる。
【0130】
第2の態様では、本発明は、自然状態ではその糖部分上において、フコースを含むが、その糖部分上において、フコースを欠いている又は低減したフコース量を有する分子を生成する方法であって、
i)第1の態様による脊椎動物細胞を準備する工程と、
ii)i)における該細胞からフコシルトランスフェラーゼに対する基質となることができる分子、好ましくはタンパク質又は脂質を単離する工程と、
を含む、自然状態ではその糖部分上において、フコースを含むが、その糖部分上において、フコースを欠いている又は低減したフコース量を有する分子を生成する方法に関する。
【0131】
好ましくは、工程i)では、フコシルトランスフェラーゼに対する基質となることができる分子、例えばタンパク質がi)における細胞で発現する。
【0132】
上記分子、例えばその糖部分上において、フコースを欠いている又は低減したフコース量を有するタンパク質又は脂質を工程ii)において脊椎動物細胞から容易に単離することができる。
【0133】
修飾分子、例えばその糖部分上において、フコースを欠いている若しくは低減したフコース量を有するタンパク質を含む、真核細胞(例えば脊椎動物細胞)内に包まれる又はかかる細胞から分泌される分子に関して様々な単離法が当該技術分野で既知である。かかる方法は通常、細胞内分子の場合、細胞の収集、分解及び分画/精製と、細胞を含まない培養上清の生成、その後の分泌された分子の精製とを伴う。
【0134】
本発明に有用な抽出法は単離対象の修飾分子に妨害されない。例えば抽出を、強い洗浄剤及び還元剤又はタンパク質変性を誘導することができる任意の作用物質の非存在下で行うのが好ましい。
【0135】
第3の態様では、本発明は、第2の態様の方法により入手可能な、その糖部分上において、フコースを欠いている又は低減したフコース量を有する分子を提供する。好ましくは、この分子は脂質又はタンパク質である。
【0136】
第1の態様に関して上記されたように、タンパク質は抗体、ホルモン、抗原又はウイルスタンパク質であるのが特に好ましい。
【0137】
脂質はグリセロ糖脂質、最も好ましくはガラクト脂質、スルホ脂質(SQDG)又はスフィンゴ糖脂質、最も好ましくはセレブロシド(例えばガラクトセレブロシド又はグルコセレブロシド)、ガングリオシド、グロボシド、スルファチド又はホスホスフィンゴ糖脂質であるのが特に好ましい。好ましくは脂質、例えばガングリオシドはエンベロープウイルスの膜に含まれる。
【0138】
最も好ましくは、ウイルスタンパク質及び/又は脂質がエンベロープウイルスのエンベロープに含まれる。
【0139】
更なる態様では、本発明は、第3の態様による分子の組成物を提供する。
【0140】
第4の態様では、本発明は、第2の態様の方法により入手可能な、D−ラムノース、D−ペロサミン、デオキシ−D−タロース、6−デオキシ−D−アルトロース、4−ケト−3,6−ジデオキシ−D−マンノース、及び/又はL−コリトースを含有する糖部分を含む分子を提供する。
【0141】
この分子はその糖部分上において、L−フコースを含まない、又はL−フコース量が低減しているのが好ましい。好ましくは、この分子は脂質又はタンパク質である。さらにかかる修飾分子、好ましくは脂質及び/又はタンパク質を発現する脊椎動物細胞、好ましくは腫瘍細胞が提供される。D−ラムノースを含むグリカンを含有する腫瘍細胞が特に好ましい。D−ラムノースは、ガノデルマ・ルシダム(Ganoderma lucidum:霊芝)多糖の構成要素である。これらの多糖は免疫エフェクター細胞の活性を高める伝統的な漢方薬に使用されている:NK細胞及びリンホカイン活性化キラー細胞を活性化させ、マクロファージの貪食及び細胞毒性を増大させる(Zhu et al., 2007, Journal of Ethnopharmacology 111 (2), 219-226)。かかる細胞を使用して、例えば活性な免疫化アプローチのように、所定の腫瘍細胞に対する免疫応答を増大させることができる。
【0142】
更なる態様では、本発明は第4の態様による分子の組成物を提供する。
【0143】
第5の態様では、本発明は、
i)70%〜95%、すなわち70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%及び95%、好ましくは80%のG0−GlcNac、G0、G1及び/又はG2の複合型N−グリカンと、
ii)5%〜30%、すなわち5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、26%、27%、28%、29%及び30%、好ましくは20%の高マンノース型N−グリカンと、
を含む糖タンパク質を含む組成物であって、該糖タンパク質の該複合型N−グリカンがフコースを含まない、又はフコースを実質的に含まない、糖タンパク質を含む組成物を提供する。好ましくは、該組成物の糖タンパク質は上記の好ましい糖タンパク質、特に抗体である。
【0144】
該組成物内で複合型N−グリカンの70%〜80%、好ましくは約75%がG0の複合型N−グリカンであり、20%〜30%、好ましくは約25%がG0−GlcNac、G1及び/若しくはG2の複合型N−グリカンであり、並びに/又は高マンノース型N−グリカンの45%〜55%、好ましくは約50%がman5グリカンであり、45%〜55%、好ましくは約50%がman6、man7及び/若しくはman8 N−グリカンであるのが特に好ましい。それぞれの場合の数字は合計で100%になることが理解される。
【0145】
また、該組成物内で複合型N−グリカンの70%〜90%、好ましくは約80%がG0の複合型N−グリカンであり、10%〜30%、好ましくは約20%がG0−GlcNac、G1及び/若しくはG2の複合型N−グリカンであり、並びに/又は高マンノース型N−グリカンの60%〜85%、好ましくは約70%がman5グリカンであり、15%〜40%、好ましくは約30%がman6、man7及び/若しくはman8 N−グリカンであるのが特に好ましい。それぞれの場合の数字は合計で100%になることが理解される。
【0146】
糖タンパク質は本発明の第1の態様との関連で好ましいとして示されたもの、特に抗体、例えばIgG1、IgG2、IgG3又はIgG4であるのが好ましく、これらの抗体は非改変の親細胞(例えば脊椎動物細胞のような真核細胞)で産生される抗体組成物よりも高いADCC活性を有するのが好ましい。
【0147】
ADCCは腫瘍(がん)細胞に指向性を有する抗体がその効果を発揮する主要な機構である。ADCCを使用して、自己免疫疾患における発病を妨げるために特定の免疫細胞を取り除くこともできる。
【0148】
ウイルス感染症及び細菌感染症を含む様々な疾患を、本発明による高いADCC活性を有する抗体を使用してウイルス又は細菌に感染した細胞の増殖を抑制することにより予防及び治療することができる。
【0149】
第6の態様では、本発明は、D−ラムノース、D−ペロサミン、デオキシ−D−タロース、6−デオキシ−D−アルトロース、4−ケト−3,6−ジデオキシ−D−マンノース及び/又はL−コリトースを含有する糖部分を含む、タンパク質、好ましくは非原核生物タンパク質、好ましくはウイルス若しくは哺乳類のタンパク質、又は脂質、好ましくは非原核生物脂質、例えばスフィンゴ糖脂質を提供する。好ましくは、ウイルスタンパク質及び/又は脂質がエンベロープウイルスのエンベロープに含まれる。代替的には、かかるタンパク質及び/又は脂質を含む、真核細胞、好ましくは脊椎動物細胞、より好ましくは哺乳類細胞、最も好ましくはヒト細胞(同種又は自己の腫瘍細胞)が提供される。
【0150】
好ましくは、タンパク質又は脂質は、その糖部分上において、D−ラムノース、D−ペロサミン、デオキシ−D−タロース、6−デオキシ−D−アルトロース、4−ケト−3,6−ジデオキシ−D−マンノース及び/又はL−コリトース、より好ましくはD−ラムノース及び/又はD−ペロサミンを含み、かつその糖部分上において、L−フコースを含まない又はL−フコース量が低減している。第6の態様のタンパク質がまた、本発明の方法の好ましい態様及び特に好ましい態様を用いた結果として起こる全ての特性を有し得ることは明らかである。
【0151】
人工糖、例えばD−ラムノース、D−ペロサミン、デオキシ−D−タロース、6−デオキシ−D−アルトロース、4−ケト−3,6−ジデオキシ−D−マンノース及び/又はL−コリトースが、例えば細菌表面上の電荷を中和することにより、カチオン性ペプチド、例えばポリミキシンB、ディフェンシン等に対する耐性を付与することが知られている(Breazeale et al., 2003, The Journal of Biological Chemistry, 278,24731-24739を参照されたい)。
【0152】
ディフェンシンは、例えば真核生物(例えば脊椎動物)に見られる低分子の高システインカチオン性タンパク質である。ディフェンシンは、細菌、真菌、並びに多くのエンベロープウイルス及び非エンベロープウイルスに対して活性がある。ディフェンシンは、6個(脊椎動物では)〜8個の保存されたシステイン残基を含む18個〜45個のアミノ酸からなる。免疫系の真核(例えば脊椎動物)細胞が、例えば好中性顆粒球及びほとんど全ての上皮細胞において貪食された細菌を死滅させるのを助けるためにこれらのペプチドを含有する。
【0153】
このため、その糖部分上において、D−ラムノース、D−ペロサミン、デオキシ−D−タロース、6−デオキシ−D−アルトロース、4−ケト−3,6−ジデオキシ−D−マンノース及び/又はL−コリトース、好ましくはカチオン性アミノ糖であるD−ペロサミンを含有するウイルスタンパク質を含む、エンベロープウイルスの確立は、これらのウイルスがディフェンシン及び先天性免疫防御の他のカチオン性ペプチドの攻撃に対して耐性であるため、例えばベクターとして遺伝子療法において極めて有用である。その糖部分上において、糖残基D−ラムノース、D−ペロサミン、デオキシ−D−タロース、6−デオキシ−D−アルトロース、4−ケト−3,6−ジデオキシ−D−マンノース及び/又はL−コリトースを1つ又は複数含有するウイルス又はウイルス糖タンパク質の産生は優れた免疫応答を誘導するのに極めて有用である。これらの糖残基は自然状態で哺乳類の糖タンパク質には存在しない。しかしながらこれらの糖残基は、細菌の糖タンパク質及びリポ多糖には存在することが多い。RMD配列の供給源である緑膿菌は、免疫不全宿主及び嚢胞性線維症(CF)の患者で見られる最も重要な細菌性病原体の1つである。
【0154】
特に、糖残基D−ペロサミンを含有するタンパク質又は糖残基D−ペロサミンを含有するウイルスタンパク質を含むエンベロープウイルスの確立が、D−ペロサミンのカチオン性(cationicity)のために好まれる。そのエンベロープに糖残基D−ペロサミンを含有する糖タンパク質を含むウイルスはカチオン性の表面電荷を有し、これにより上記ウイルスを先天性免疫防御から保護することができる。
【0155】
第7の態様では、本発明は、基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用するが、GDP−6−デオキシ−D−リキソ−4−ヘキスロースをGDP−L−フコースへと変換する反応を触媒しない酵素をコードする核酸配列を含む(第1の)ポリヌクレオチドに操作可能に連結した脊椎動物の発現制御配列を1つ又は複数含む発現単位を提供する。
【0156】
発現単位は、1つ又は複数の脊椎動物の発現制御配列及び基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用する酵素をコードする核酸配列を含む(第1の)ポリヌクレオチドを組み込むことができる当業者に既知の任意の発現系、例えばプラスミド、コスミド、ウイルス等であり得る。
【0157】
好ましくは、発現単位に含まれる1つ又は複数の脊椎動物の発現制御配列は、基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用する酵素をコードする核酸配列を含む(第1の)ポリヌクレオチドと操作可能に連結することにより、脊椎動物細胞、例えばCHO細胞又はHeLa細胞において基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用する酵素をコードする核酸配列の発現が可能になる。
【0158】
好ましくは、発現ベクター、例えばプラスミドベクターにより、脊椎動物細胞の細胞質における基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用する酵素をコードする核酸配列の一時的な発現が可能になる、又は上記細胞のゲノムにおける上記配列の組込み後の脊椎動物細胞において基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用する酵素をコードする核酸配列の安定した発現が可能になる。
【0159】
基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用する酵素は、GDP−6−デオキシ−D−リキソ−4−ヘキスロースレダクターゼ(RMD)、GDP−ペロサミンシンテターゼ(Per)、GDP−6−デオキシ−D−タロースシンテターゼ(GTS)、GDP−フコースシンテターゼCys109Ser(GFS−Cys109Ser)突然変異体、GDP−4−ケト−6−デオキシマンノース−3−デヒドラターゼ(ColD)、好ましくはGDP−L−コリトースシンターゼ(ColC)と組み合わせたGDP−4−ケト−6−デオキシマンノース−3−デヒドラターゼ(ColD)、及びその変異体からなる群から選択されるのが特に好ましい。
【0160】
好ましくは、発現単位は、好ましくは1つ又は複数の脊椎動物の発現制御要素、例えばプロモーターと操作可能に連結し、好ましくは発現ベクター、例えばプラスミドベクターに含まれることにより、脊椎動物細胞、例えばCHO細胞、HeLa細胞又は腫瘍細胞、好ましくは自己腫瘍細胞においてグリコシルトランスフェラーゼをコードする核酸配列の発現が可能になる、GDP−D−ラムノース、GDP−D−ペロサミン、GDP−デオキシ−D−タロース、GDP−6−デオキシ−D−アルトロース、GDP−4−ケト−3,6−ジデオキシ−D−マンノース又はGDP−L−コリトースに対する上記グリコシルトランスフェラーゼをコードする核酸配列を含む(第2の)ポリヌクレオチドと、任意で、好ましくは1つ又は複数の脊椎動物の発現制御要素、例えばプロモーターと操作可能に連結し、好ましくは発現ベクター、例えばプラスミドベクターに含まれることにより、脊椎動物細胞、例えばCHO細胞、HeLa細胞又は腫瘍細胞、好ましくは自己腫瘍細胞においてGDP−デオキシヘキソース糖ヌクレオチド輸送体をコードする核酸配列の発現が可能になる、GDP−D−ラムノース、GDP−D−ペロサミン、GDP−デオキシ−D−タロース、GDP−6−デオキシ−D−アルトロース、GDP−4−ケト−3,6−ジデオキシ−D−マンノース又はGDP−L−コリトースに対する上記GDP−デオキシヘキソース糖ヌクレオチド輸送体をコードする核酸配列を含む(第3の)ポリヌクレオチドとを更に含む。
【0161】
上記の第1の、第2の、及び任意で第3のポリヌクレオチドを発現ベクター、例えば一時的な発現ベクター又は細胞のゲノムに組み込むベクターに別々に組み込むことができる。代替的に、上記の第1の、第2の、及び任意で第3のポリヌクレオチドは1つの発現ベクターに含まれ得る。発現は1つのプロモーター、2つのプロモーター又は3つのプロモーターから駆動され得る。前者の場合、第1の、第2の、及び任意で第3のポリヌクレオチドによりコードされるタンパク質が単一の転写産物として転写され、IRESでのみ分離されるのが好ましい。
【0162】
本発明の好ましい実施の形態では、発現単位は、好ましくはそれぞれ1つの発現ベクターに、2つの発現ベクターに、又は3つの発現ベクターに含まれる、酵素RMDをコードする核酸配列を含む第1のポリヌクレオチドに操作可能に連結した1つ又は複数の脊椎動物の発現制御配列と、GDP−D−ラムノースに対するグリコシルトランスフェラーゼをコードする核酸配列を含む第2のポリヌクレオチドに操作可能に連結した1つ又は複数の脊椎動物の発現制御配列と、任意に、GDP−D−ラムノースに対するGDP−デオキシヘキソース糖ヌクレオチド輸送体をコードする核酸配列を含む第3のポリヌクレオチドに操作可能に連結した1つ又は複数の脊椎動物の発現制御配列とを含む。
【0163】
本発明の別の好ましい実施の形態では、発現単位は、第1のポリヌクレオチド内に含まれる酵素RMDをコードする核酸配列の発現を制御する1つ又は複数の脊椎動物の発現制御配列と、第2のポリヌクレオチド内に含まれるGDP−D−ラムノースに対するグリコシルトランスフェラーゼをコードする核酸配列と、任意で、第3のポリヌクレオチド内のGDP−D−ラムノースに対するGDP−デオキシヘキソース糖ヌクレオチド輸送体をコードする核酸配列とを含み、第1の、第2の、及び任意で第3のポリヌクレオチドは、IRESで互いに分離され、好ましくは発現ベクターに含まれる。
【0164】
本発明の第7の態様による発現単位は医薬に、特に免疫刺激から利益を受ける疾患、特に腫瘍の治療法又は予防法に関するワクチンの調製に使用することもできる。
【0165】
さらに第7の態様との関連では、特に発現される様々な核酸、例えばGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用する酵素の中程度又は低い発現を誘導する発現制御要素を含むポリヌクレオチドに関する、本発明の第1の態様の更なる好ましい実施の形態及び特に好ましい実施の形態は全て、第7の態様との関連で等しく好ましい。
【0166】
多くの場合、対象となる導入遺伝子を所望のレベルで発現する効果的な薬学的な産生細胞株を生成及び開発するのに、生物医薬品企業はかなりの時間を費やし、多大な努力が為されてきた。対象となる導入遺伝子がADCCエフェクター機能の向上からの利益を受けることができる治療抗体である場合、高産生細胞がN−糖部分へとコア−フコースを結合することができない、又はN−糖部分へと人工糖を結合することができるように、産生細胞株を更に操作することが強く望まれる。
【0167】
好ましくは、既に上述のように、発現単位は、GDP−D−ラムノース、GDP−D−ペロサミン、GDP−デオキシ−D−タロース、GDP−6−デオキシ−D−アルトロース、GDP−4−ケト−3,6−ジデオキシ−D−マンノース又はGDP−L−コリトースに対するグリコシルトランスフェラーゼをコードする核酸配列を含む第2のポリヌクレオチドと、任意でGDP−D−ラムノース、GDP−D−ペロサミン、GDP−デオキシ−D−タロース、GDP−6−デオキシ−D−アルトロース、GDP−4−ケト−3,6−ジデオキシ−D−マンノース又はGDP−L−コリトースに対するGDP−デオキシヘキソース糖ヌクレオチド輸送体をコードする核酸配列を含む第3のポリヌクレオチドとを更に含む。
GDP−D−ラムノース、GDP−D−ペロサミン、GDP−デオキシ−D−タロース、GDP−6−デオキシ−D−アルトロース、GDP−4−ケト−3,6−ジデオキシ−D−マンノース又はGDP−L−コリトースに対するグリコシルトランスフェラーゼをコードする核酸配列を含む第2のポリヌクレオチドが、1つ又は複数の脊椎動物の発現制御配列に操作可能に連結することにより、脊椎動物細胞、例えばHeLa細胞又はCHO細胞において上記グリコシルトランスフェラーゼをコードする核酸配列の発現が可能になることが好ましい。GDP−D−ラムノース、GDP−D−ペロサミン、GDP−デオキシ−D−タロース、GDP−6−デオキシ−D−アルトロース、GDP−4−ケト−3,6−ジデオキシ−D−マンノース又はGDP−L−コリトースに対するGDP−デオキシヘキソース糖ヌクレオチド輸送体をコードする核酸配列を含む第3のポリヌクレオチドが、1つ又は複数の脊椎動物の発現制御配列に操作可能に連結することにより、脊椎動物細胞、例えばHeLa細胞又はCHO細胞において上記GDP−デオキシヘキソース糖ヌクレオチド輸送体をコードする核酸配列の発現が可能になることも好ましい。
【0168】
異なる核酸配列の互いに対する発現の比は脊椎動物細胞のゲノムにおけるコピー数及び組込み部位の両方に応じて変わる。標準的なスクリーニングプロセスにより、所望の比で個々の遺伝子産物を発現する細胞クローンを単離することが可能である。
【0169】
上記の好ましい発現単位を、糖タンパク質又は糖脂質の新生糖構造へとフコース以外の人工糖(例えばD−ラムノース、D−ペロサミン、デオキシ−D−タロース又は6−デオキシ−D−アルトロース)を結合することが可能になるように、既存の細胞株(例えばCHO、HeLa)に容易に適用することができる。この発現単位を、糖タンパク質の新生糖構造へとフコース以外の人工糖(例えばD−ラムノース)を結合することが可能になるように、例えば人工グリコシル化構造を有する抗体、例えばIgG1/+D−ラムノースを産生するために、予め遺伝子操作された細胞株(例えばIgG1産生CHO細胞)に容易に適用することもできる。
【0170】
好ましくは、発現単位は対象となるタンパク質、例えばIgG1をコードする核酸配列を含む更なるポリヌクレオチドを(第2の、第3の又は第4のポリヌクレオチドのいずれかとして)含む。対象となるタンパク質、例えばIgG1をコードする核酸を含む更なるポリヌクレオチドが、発現制御配列に操作可能に連結することにより、脊椎動物細胞、例えばHeLa細胞又はCHO細胞において上記タンパク質をコードする核酸配列の発現が可能になることが好ましい。
【0171】
本発明の第7の態様の発現単位との関連では、本発明の第1の及び第2の態様に教示される、全ての要素、好ましくは酵素をコードする核酸、発現制御要素、基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用するが、GDP−6−デオキシ−D−リキソ−4−ヘキスロースをGDP−L−フコースへと変換する反応を触媒しない酵素をコードする核酸配列が同様に好ましい。
【0172】
第8の(eighth)態様では、本発明は、通常その糖部分上において、フコースを含むが、その糖部分上において、フコースを欠いている又は低減したフコース量を有するタンパク質を生成するための(改変)真核細胞であって、
i)基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用する酵素をコードする核酸配列を含む第1のポリヌクレオチドと、
ii)タンパク質をコードする核酸配列を含む第2のポリヌクレオチドと、
を含み、該酵素がGDP−6−デオキシ−D−リキソ−4−ヘキスロースをGDP−L−フコースに変換する反応を触媒しない、通常その糖部分上において、フコースを含むが、その糖部分上において、フコースを欠いている又は低減したフコース量を有するタンパク質を生成するための(改変)真核細胞に関する。
【0173】
真核細胞に関しては、本発明の第1の態様の脊椎動物細胞との関連でこれまでに記載された好ましい実施の形態及び特に好ましい実施の形態が全て、同様に好ましい。
【0174】
好ましくは、真核細胞は、好ましくは本発明の第1の態様に関して上記で概説されたような、脊椎動物細胞、例えば哺乳類細胞、魚類細胞、両生類細胞、爬虫類細胞若しくは鳥類細胞、又は昆虫細胞である。バキュロウイルス発現系とともに使用される昆虫細胞、例えばSf9細胞又はHi5細胞が、高い収率及び速度のために糖タンパク質を産生するのに好ましい。しかしながら、昆虫細胞由来の糖タンパク質はコアα1,3−フコースを含有し得る。糖残基は昆虫由来糖タンパク質に対する広範な(amajor extend to)抗体、特にIgE抗体に寄与する。糖残基は昆虫の糖タンパク質に対するアレルギー反応の基盤である。
【0175】
基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用するが、GDP−6−デオキシ−D−リキソ−4−ヘキスロースをGDP−L−フコースへと変換する反応を触媒しない酵素を少なくとも1つ含む昆虫細胞はそのグリカン上でフコースを欠いている又はフコースが低減している。これにより、かかる糖タンパク質(glycoproteins)に対するアレルギー反応が低減する又は取り除かれる。
【0176】
上述の(改変)真核細胞は、基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用する酵素をコードする核酸配列を含む2つ以上のポリヌクレオチド、例えば基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用する異なる酵素をコードする複数の核酸配列を含む複数のポリヌクレオチドを含んでいてもよい(本発明の第1の態様を参照されたい)。
【0177】
第9の態様では、本発明は、通常その糖部分上において、フコースを含むが、その糖部分上において、フコースを欠いている又は低減したフコース量を有するタンパク質を生成する方法であって、
i)第8の態様による真核細胞を準備する工程と、
ii)上記細胞において該第1のポリヌクレオチドによりコードされる該酵素及び該第2のポリヌクレオチドによりコードされる該タンパク質を発現する工程と、
iii)上記細胞から該タンパク質を単離する工程と、
を含む、通常その糖部分上において、フコースを含むが、その糖部分上において、フコースを欠いている又は低減したフコース量を有するタンパク質を生成する方法に関する。
【0178】
本発明の真核細胞を使用する方法に関しては、本発明の第1の態様の脊椎動物細胞及び本発明の第2の態様の方法に関してこれまでに記載された好ましい実施の形態及び特に好ましい実施の形態は全て、本発明の第9の態様に関しても同様に好ましい。
【0179】
第10の態様では、本発明は、第9の態様の方法により入手可能な、その糖部分上において、フコースを欠いている又は(or)低減したフコース量を有するタンパク質に関する。
【0180】
本発明の様々な変更形態及び変形形態が、本発明の範囲を逸脱することなく当業者に明らかである。本発明を特定の好ましい実施の形態に関連して説明したが、特許請求される発明はそのような特定の実施の形態に不当に限定されないことが理解されよう。実際に、関連分野の当業者に明らかな本発明を実施する記載の形態の様々な変更形態は、本発明に包含されることが意図される。
【0181】
以下の図面及び実施例は本発明の一例にすぎず、添付の特許請求の範囲によって示される本発明の範囲を限定するものとは決して解釈すべきではない。
【図面の簡単な説明】
【0182】
【図1】真核細胞(例えば脊椎動物(vertebrate)細胞)におけるフコースのサルベージ経路及びde novo経路の概略図である。フコースの非存在下では、細胞はサルベージ経路を介してGDP−フコースを合成することができない(右側のパネルを参照されたい)。de novo経路は中間体GDP−4−ケト−6−デオキシマンノースの通常脊椎動物細胞では生じない終末(dead end)生成物への酵素的変換により遮断することができる(左側のパネル)。例えば偏向酵素がRMDである場合、終末生成物はGDP−D−ラムノースである。GDP−D−ラムノース等のGDP−デオキシヘキソースはGMD酵素に対してフィードバック阻害を示すことにより、フコースde novo経路、及び代替的なGDP−ラムノース合成を更に遮断することができる。
【図2】RMD導入遺伝子を安定して過剰発現するRMD−CHO−IgG細胞のGFP蛍光を示す図である。
【図3】RMD導入遺伝子を発現するクローンのRT−PCR分析を示す図である。レーンM=bp−DNAマーカー、レーン1:RMD−CHO−IgGクローン1;レーン2:RMD−CHO−IgGクローン2;レーン3:RMD−CHO−IgGクローン3;レーン4:RMD−CHO−IgGクローン4;レーン5:RMD−CHO−IgGクローン5;レーン6:RMD−CHO−IgGクローン6;レーン7:CHO−IgG親クローン;レーン8:陰性PCR対照。RMDバンドは全てのRMDをトランスフェクトしたクローンで見ることができる。
【図4】CHO−IgG細胞(B)及びRMD−CHO−IgG細胞(A)のIgG1から放出される過メチル化N−グリカンのMALDI MSプロファイルの総観的比較を示す図である。PNGase F消化により放出される抗体Fcのオリゴ糖を、smartbeam−II(商標)レーザを備えたUltraFlex III TOF/TOF質量分析計を使用して分析した。m/z値ピークはナトリウムと結合した(associated)オリゴ糖イオンに対応する。全ての標識化[M+Na]+分子イオンシグナルを注釈したように割り当てることができた。パネルAに示されるMALDIスペクトルにおける主なm/zピークの164Daシフトはフコースの喪失を示している。各ピークのオリゴ糖構造図はそれぞれの注釈付きピークの上に示す。RMD導入遺伝子を安定して過剰発現するRMD−CHO−IgG細胞で発現した治療用IgG1抗体から得られたN−糖構造は、MALDIピーク相対強度に基づくと、結合したフコース残基が完全になく、相対的により大量の高マンノース構造を含有する(パネルA;主要な高マンノース構造を丸で囲った)が、非改変CHO−IgG親細胞で発現した治療用IgG1抗体から得られたN−糖構造はコア−フコシル化されており、高マンノース構造の含有量は顕著に少ない(フコース残基=丸で囲った黒色の三角;パネルB)。
【図5−1】(A)WT CHO細胞;(B)RMD−CHOクローンH1;(C)RMD−CHOクローンH2;(D)RMD−CHOクローンH3を使用して産生した脱シアル化IgG N−グリカンのMALDI−TOFスペクトルを示す図である。全ての分子イオンはナトリウム化(sodiated)[M+Na+]形態又はカリウム化(potassiated)[M+K+]形態(黒色の十字型)のいずれかで存在する。暗灰色の円、Man;明灰色の円、Gal;黒色の四角、GlcNAc;黒色の三角、Fuc;白色の十字型、いずれの炭水化物材料も含有しない。
【図5−2】C)RMD−CHOクローンH2;(D)RMD−CHOクローンH3を使用して産生した脱シアル化IgG N−グリカンのMALDI−TOFスペクトルを示す図である。
【図6】(A)血漿の非存在下でのWT IgG及び非フコシル化IgGに対するFcgRIIIa−His(Phe158)の結合曲線を示す図である。FcγRIIIa結合を、捕捉試薬としてFcγRIIIa−His、検出試薬として抗ヒトIgGペルオキシダーゼ結合抗体、及び発色基質としてテトラメチルベンジジン(TMB)を使用するELISAにより検出した。点は450nmでペルオキシダーゼと反応したTMBの吸光度の中央値(n=2)を示す。バーはSDを示す。白丸=野生型のフコシル化IgG(WT)、黒丸=クローンH1由来の非フコシル化IgG(H1);黒四角=クローンH2由来の非フコシル化IgG(H2);上向きの黒三角=クローンH3由来の非フコシル化IgG(H3)。(B)WT IgGに対する非フコシル化IgGのFcγRIII結合の相対的な増加倍率を示す図である。FcγRIII結合の相対的な増加倍率を、EC50値から算出した。WT、野生型フコシル化IgG;H1、クローンH1由来の非フコシル化IgG;H2、クローンH2由来の非フコシル化IgG;H3、クローンH3由来の非フコシル化IgG。
【図7】ADCC活性アッセイに関するNK細胞の調製及び分析を示す図である。(A)ADCCアッセイに使用される単離した初代NK細胞の純度レベルを示すドットプロット。初代NK細胞を電磁ビーズ分離により健常なヒトドナーの全血から単離した。それから単離したNK細胞を、NK細胞マーカーCD16及びCD56に対する抗体を使用するフローサイトメトリにより純度に関して分析した。(B)単離したNK細胞の性能。単離したNK細胞の細胞溶解活性を決定するために、カルセインAMで染色したK562標的細胞を単独で、NK細胞とともに、又は細胞溶解剤サポニンとともに4時間インキュベートした。インキュベートした標的細胞から放出される平均蛍光強度(MFI)は細胞溶解の程度を間接的に示す。自発的細胞溶解で得られたMFIから減算したNK媒介性の細胞溶解で観察されるMFIは、ADCCアッセイで観察される可能な最大限の比MFIを示す。NK媒介性の溶解は総溶解から得られるMFIレベルに完全には達しないことに留意する。
【図8】CHO及びRMD−CHO由来の非フコシル化及びフコシル化IgGのin vitroでのADCC活性を示す図である。点は所定のIgG濃度(%)での特異的細胞溶解の平均(n=4)(%)を示す。バーは±SDを示す。野生型IgG(白四角)、クローンH1由来の非フコシル化IgG(黒丸)、クローンH2由来の非フコシル化IgG(下向きの黒三角)及びクローンH3由来の非フコシル化IgG(上向きの黒三角)。比較データをSK−BR−3細胞を標的細胞として使用して得た(データは示さず)。
【図9】(A)非改変CHO細胞及び(C)RMD−CHOクローンH2の細胞質画分から加水分解した単糖のHPAEC−PADプロファイルを示す図である。(B)は10pmol/μlのL−ラムノースを加えた(A)であり、(D)は10pmol/μlのL−ラムノースを加えた(C)である。単糖はTFA加水分解後に再N−アセチル化されなかったので、GlcNAcはGlcNH2として測定した。選択された条件下で、L−ラムノースのピークはおよそ15.5分の保持時間で溶出する。改変クローンH2由来の細胞溶解物のHPAEC−PADクロマトグラムではフコースのピークが存在しないことに留意されたい。
【図10】(A)WT CHO細胞及び(C)改変RMD−CHOクローンH2由来のIgG N−グリカンから放出された単糖のHPAEC−PADプロファイルを示す図である。(B)は10pmol/μlのL−ラムノースを加えた(A)であり、(D)は10pmol/μlのL−ラムノースを加えた(C)である。単糖はTFA加水分解後に再N−アセチル化されなかったので、GlcNAcはGlcNH2として測定した。選択された条件下で、L−ラムノースのピークはおよそ15.5分の保持時間で溶出する。RMD−CHOクローンH2由来のIgG N−グリカン試料のHPAEC−PADクロマトグラムではフコースのピークが存在しないことに留意されたい。 なお、図面中の訳の意味は以下である;図1DE NOVO PATHWAY de novo経路Putative feedback inhibition 推定フィードバック阻害GDP-Mannose GDP−マンノースGDP-Mannose-4,6-Dehydratase GDP−マンノース−4,6−デヒドラターゼGDP-4-keto-6-deoxymannose GDP−4−ケト−6−デオキシマンノース3,5-Epimerase 3,5−エピメラーゼGDP-4-keto-6-deoxygalactose GDP−4−ケト−6−デオキシガラクトース4-Reductase 4−レダクターゼGDP-Fucose GDP−フコースGDP-D-Rhamnose GDP−D−ラムノースDead end 終末Major Pathway 主要経路Independent of Fucose source フコース供給源には非依存的Blocked by deflection of metabolic precursor 代謝前駆体の偏向により遮断されるSALVAGE PATHWAY サルベージ経路Lysosome リソソームExtracellular Space 細胞外空間L-Fucose L−フコースFucose-Kinase フコースキナーゼFucose-1-Phosphate フコース−1−ホスフェートGDP-Fucose Pyrophosphorylase GDP−フコースピロホスホリラーゼMinor Pathway 副次的な経路dependent of Fucose source フコース供給源に依存的Blocked by avoidance of external fucose source 外部フコース供給源の回避により遮断される図5Intensity 強度図6Absorption 吸光度Concentration 濃度X-fold increase over WT WTに対するX倍増大図7Gate ゲートspontaneous lysis 自発的溶解NK-mediated lysis NK媒介性の溶解Total lysis 総溶解Control 対照図8specific cell lysis 特異的細胞溶解conc 濃度図9PAD response PAD応答Deoxyribose デオキシリボースtime[min] 時間(分)図10PAD response PAD応答Deoxyribose デオキシリボースtime[min] 時間(分)
【発明を実施するための形態】
【実施例】
【0183】
1.実験部
1.1 材料及び方法
1.1.1 細胞株
組換えCHO/DG44細胞株CHO−IgGは、ジヒドロ葉酸レダクターゼ欠損CHO細胞株、CHO/DG44(Urlaubet al., 1986, Proc Natl Acad Sci USA. 83 (2): 337-341)の、治療用モノクローナル抗体(トラスツズマブ(ハーセプチン(商標))の軽鎖及び重鎖をコードするヌクレオチド配列を含む抗体発現カセットを含有する発現ベクターを用いる安定したトランスフェクションにより本発明者らの研究所で以前に樹立された。細胞株RMD−CHO−IgGの生成は既存のCHO−IgG細胞株から始めた。両方の細胞株が血清無含有培地で維持された。
【0184】
1.1.2 遺伝子最適化及び合成
オキシドレダクターゼRmdに関するアミノ酸配列(緑膿菌PAO1;304個のアミノ酸)(GenBankアクセッション番号GenBank:AAG08839.1)を逆翻訳し、得られたヌクレオチド配列を、CHO細胞(クリセツラス・グリセウス)の要件に適合するように、潜在スプライス部位及びRNA不安定化配列要素のノックアウト、RNA安定性の増大に関する最適化、並びにコドン使用頻度の適応により最適化した。
【0185】
1.1.3 RMD発現プラスミドの構築
合成したRMD構築物をEcoRI及びBgl IIにより切断し、ウシ腸ホスファターゼにより脱リン酸化した(dephosphorylated)。消化及び脱リン酸化した挿入物を事前に消化させた2シストロン性の発現ベクターへとライゲートし、それにより2シストロン性のメッセージからのRMDと緑色蛍光タンパク質(gfp)との協調した同時発現が可能になる。発現プラスミドは2シストロン性の発現カセットを安定して組み込んだ細胞の直接選択を可能にするネオマイシン耐性遺伝子を備える。発現プラスミドを構築するための一般的手順は、Sambrook, J., E.F. Fritsch and T. Maniatis: Cloning I/II/III, ALaboratory Manual New York/Cold Spring Harbor Laboratory Press, 1989, SecondEditionに記載されている。
【0186】
1.1.4 抗体産生CHO−IgG細胞の非フコシル化抗体を分泌する細胞への変換
IgG1型の治療抗体トラスツズマブを安定して発現するCHO−IgG細胞を、製造業者の取扱説明書(MicroPorator,PEQLAB Biotech, Germany)に従ってエレクトロポレーションによりRMD−gfp導入遺伝子を用いて安定にトランスフェクトした。エレクトロポレーションの24時間後、トランスフェクタントを、抗生物質G418を含有するα−MEMにおいて選択した。それからG418耐性クローンを限界希釈クローニングにより単離した。すなわちG418耐性クローンを、この選択培地中で再懸濁し、ポアソン統計に基づき単一の細胞からコロニーが得られる尤度が95%を超える希釈率で96ウェルプレートに播種した。確実に単クローン性にするために、96ウェル内で成長させた細胞を単離し、限界希釈率で96ウェルプレートに再び播種した。これらの2回の単一細胞のクローニング後、幾つかの単離された単一細胞のクローンをより大きい容量へと増殖させた。その後、それらを懸濁状態での成長に適合させた。培養皿におけるgfp蛍光分布から評価されるように、記載のエレクトロポレーションプロトコルを用いて、2×106個のエレクトロポレーションを行った細胞あたりおよそ2000個という形質転換効率が達成された(図2)。
【0187】
1.1.5 蛍光顕微鏡検査によるクローンのスクリーニング
単一細胞のクローンを96ウェルプレートに播種し、cmountアダプタを取り付けたOlympus IX−50(OlympusOptical Co., Europe)を用いたGFP蛍光のモニタリングにより、RMD組込みの成功に関してスクリーニングした。GFPスキャンに関して、200倍の倍率(extension)で蛍光フィルタを位相差に対して使用した。画像をViewfinder liteの適用により編集した。さらに、RMD導入遺伝子のmRNA発現をRT−PCR分析により確認した。RMD導入遺伝子の発現の成功を、RMD特異的なプライマーセットを使用したRT−PCRにより確認した(図3)。
【0188】
1.1.6 振盪管中の血清無含有バッチ培養による非修飾の糖鎖改変した(glycoengineered)IgG1の産生
RMDについて改変したCHO産生クローンにより産生される抗体(RMD−CHO−IgG)の糖構造を、非改変CHO抗体産生細胞から分泌されるIgG1型抗体(CHO−IgG)の糖構造と比較するために、両方の細胞株を使用して、培養上清においてIgG1抗体を産生した。RMD−CHO−IgG抗体産生クローン及びCHO−IgG抗体産生クローンをフコース欠損成長培地において1mlあたり2×105個の細胞で接種した。振盪管を180rpm、37℃、7.5% pCO2下でインキュベートした。細胞が依然として80%を超える生存率(vitality)を示していた場合には7日後に培養を停止させた。生存細胞密度を、トリパンブルー除去法を使用して自動細胞計数器Vi−CELL(商標)XR(Beckman Coulter, Fullerton, CA)により測定した。流加バッチアッセイの期間中の生存率の低下パターン及び流加バッチ振盪器アッセイの3日〜10日の比生産性(specific productivity)(qp)の平均は2つの異なるクローン間で同程度に維持された。それから細胞を10分間、5000rpmの遠心分離によりペレット状にし、上清を別々のバイアルに移した。RMD−CHO IgG細胞及び非改変CHOIgG細胞を同様に培養した。培養上清中の抗体濃度をヒトIgG1に特異的なサンドイッチイムノアッセイによりGyrolab Workstation(Gyros AB, Sweden)で測定した。両方のクローンが対数的に成長し、それぞれのサンプリングデータで同程度のIgG力価が得られ、同程度の初期倍増時間を有していた。両方のクローンがチャイニーズハムスター卵巣細胞に特有の形態を保持していた。
【0189】
1.1.7 プロテインAアフィニティクロマトグラフィによるIgG1の精製
0.2μmのフィルタによる滅菌ろ過後に、上清をプロテインA−セファロースミニカラムに充填した。総容量が10mgのカラム支持材料0.5mlを使用した。カラムは重力流で5カラム体積の20mMのリン酸ナトリウム(pH7.0)で平衡化した。緩やかな流速でのタンパク質結合の後、カラムを平衡化バッファーで2回洗浄した。それから抗体を重力流で4カラム体積の0.1Mのグリシンバッファー(pH3.0)によって溶出した。画分1mlを回収し、1MのTris−HCl(pH9)によってすぐに中和した。それぞれの精製IgG1の完全性及び純度を還元型SDS−PAGE分析により確認した。溶出した抗体の純度は90%を超え、溶出した抗体の組込みは、還元型SDS−PAGE分析により確認した。
【0190】
1.1.8 抗体由来のN連結型オリゴ糖の調製
各抗体100μgをN連結型オリゴ糖の質量分析による特性化に使用した。タンパク質をトリプシンで消化した(0:2mg/ml、37℃、16時間)後、N−グリカンを37℃で18時間の1単位のペプチド−N−グリコシダーゼF(PNGaseF、Roche Diagnostics)とのインキュベーションにより放出させた。放出されたN−グリカンを、RP−(Sep−Pak C18−)カラム、その後のcarbograph抽出除去カラム上での二段階クロマトグラフィにより回収した(Wuhrer et al., 2006, Glycobiology 16 (2006), pp. 991-1006)。Ciucanu and Kerekにより記載されたように(Ciucanu andKerek, 1984, Carbohydr Res. 1984: 131 :209)、各N−グリカンプールの50%が37℃で18時間の10mUのノイラミニダーゼにより消化され、50%がヨウ化メチルにより過メチル化した。
【0191】
1.1.9 MALDI−TOF−MSによるN連結型オリゴ糖の分析
それぞれの精製したIgG1から放出されるN−グリカンをsmartbeam−II(商標)レーザを備えたUltraFlex III TOF/TOF質量分析計(Bruker Daltonik GmbH, Bremen, Germany)により分析した。測定を陽イオンモードで行った。陽イオンを25kVの加速電圧及び10nsの遅延引き出し(extraction delay)に供し、リフレクトロンモードで分析した。分析のために、脱シアル化グリカンをH2Oに溶解し、過メチル化グリカンを70%(v/v)アセトニトリルに溶解した。試料0.5μlを標的上で80% EtOHに溶解したアラビノサゾン(Arabinosazone)(2mg/ml)と1:1(v/v)で混合し、室温で乾燥させた。デキストランラダーによる外部較正を使用した。スペクトルをGlyco−peakfinder(Maas et al., 2007, Proteomics 7, 4435-4444)を用いて分析した。同定したグリカン構造はGlyco Workbenchソフトウェア(Ceroni et al., 2008, J. Proteome Res. 7(4) 1650-1659)を用いて構築した。最終培養培地から精製された生成物のオリゴ糖プロファイル分析により、生成物のN連結型Fcオリゴ糖が高マンノース型及び二分岐複合型のものであること、並びにRMD−CHO−IgGクローンから分泌されたIgG1生成物がコアのフコシル化を完全に欠いていることが確認された。糖構造の分析により、親CHO−IgGクローンのものと比較して、RMDを同時発現するクローンにより産生される抗体の非フコシル化オリゴ糖の割合がそれぞれの場合で、顕著に増大すること(すなわち最大99%、95%、97%及び98%)が示された(図4)。MALDI−Peak相対強度に基づくと、RMD−CHO−IgG細胞で発現されるIgG1抗体産物から得られたN−糖構造には、結合したフコース残基がほぼ完全になく、相対的により大量の高マンノース構造を含有する(図4、パネルA;主要な高マンノース構造を丸で囲った)が、非改変CHO−IgG細胞で発現した治療用IgG1抗体から得られたN糖構造はコア−フコシル化されており、高マンノース構造の含有量は顕著に少ない(フコース残基=丸で囲った三角;図4、パネルB)。
【0192】
2.実験部
2.2 材料及び方法
2.2.1 細胞株、遺伝子最適化及び合成、RMD発現プラスミドの構築、抗体産生CHO−IgG細胞の非フコシル化抗体を分泌する細胞への変換、蛍光顕微鏡検査及びRT−PCRによるクローンのスクリーニング
RMD−CHO−IgG細胞株を産生するために使用されるCHO−IgG細胞株、RMDの遺伝子最適化及び合成、RMD発現プラスミドの構築、抗体産生CHO−IgG細胞の非フコシル化抗体を分泌する細胞への変換、RMD組込みの成功に関する蛍光顕微鏡検査及びRMD導入遺伝子のmRNA発現の成功に関するRT−PCRによるクローンのスクリーニングに関しては、上述の1.1.1項〜1.1.5項を参照する(1.実験部)。
【0193】
2.2.2 流加バッチ培養
N−グリカン構造を比較するためにCHO細胞及びRMD−CHO細胞(クローンH1、H2及びH3)の両方を用いてIgGを産生した。4mMのグルタミンを加えたが、抗生物質又はMTXを有しない血清無含有培地(ProBioGenのカスタム製剤;SAFC Bioscience, Lenexa, KA)100mlの入った500ml容の振盪フラスコに細胞を1mlあたり4×105個の細胞で播種した。培養物を180rpm、37℃及び7.5% CO2下でかき混ぜた。培養4日目に細胞に100mlの培養量あたり1.75mlのPBG−Feed Mixを与えた。細胞密度及び細胞生存率を自動ViCell細胞定量システム(Beckman Coulter, Brea, CA)を使用してトリパンブルー除去法により決定した。IgG濃度を決定するために、一定量の細胞培養上清を3日目、5日目及び7日目に回収し、これらをGyrolabサンドイッチイムノアッセイにより測定した。細胞が依然として80%を超える生存率を示していた場合には7日後に培養を停止させた。細胞培養上清を回収し、滅菌ろ過した。
【0194】
2.2.3 IgG1特異的なGyrolabサンドイッチイムノアッセイ
IgG1濃度をGyrolab Workstation(Gyros AB, Uppsala, Sweden)で行われるサンドイッチイムノアッセイにより決定した。このアッセイには、ビオチン化捕捉抗体(IgGのFc部分上のエピトープを認識する)、細胞培養上清試料又はポリクローナルヒトIgG参照基準、及びAlexa Fluor 647標識化検出抗体(IgGのFabドメインにおいてエピトープに結合する)の連続添加が含まれた。試料及び基準を三連で測定した。平均OD、標準偏差(SD)及び変動係数%(%CV)を、それぞれの測定の後に、Gyrolab evaluatorソフトウェアにより自動算出した。記載のIgG1 Gyrolabサンドイッチイムノアッセイは、それぞれの較正基準に対する余り(residuals)が20%の相対誤差(RE)の許容限界を満たすという前提に基づき事前に正当性が認められた。
【0195】
2.2.4. プロテインAアフィニティクロマトグラフィを用いたIgG精製
細胞培養上清を、20mMのリン酸ナトリウム(pH7.0)で予め平衡化した0.5mlのプロテインA−セファロースカラムに充填した。2ベッド体積の平衡化バッファーでカラムを洗浄した後、抗体を4カラム体積の0.1Mのグリシン(pH3.0)で溶出した。画分を回収し、すぐに1MのTris−HCl(pH9)で中和した。それぞれの精製IgG1の完全性及び純度を還元型SDS−PAGE分析により確認した。精製IgGのタンパク質濃度をGyrolabサンドイッチイムノアッセイにより決定した。
【0196】
2.2.5 IgGのN−グリカンのプロセシング
IgG(100μg)をトリプシンにより37℃で16時間消化した。95℃で5分間試料を加熱することにより反応を終結させた。抗体を1UのPNGase Fにより37℃で18時間更に消化した。放出されるN−グリカンを、逆相Sep−Pak C18カートリッジ、その後のcarbograph抽出除去カラム上で単離するとともに、脱塩処理した。それぞれのN−グリカンプールを、10mUのノイラミニダーゼにより37℃で18時間消化した。
【0197】
2.2.6 質量分析法
N−グリカンをsmartbeam−II(商標)レーザ及びLIFT−MS/MS設備を備えたUltraFlex III TOF/TOF質量分析計(Bruker Daltonik GmbH, Bremen, Germany)により分析した。スペクトルを25kVの加速電圧及び10nsの遅延引き出しでリフレクターモードで記録した。測定を陽イオンモードで行った。デキストランラダーを使用して外部較正を行った。脱シアル化N−グリカンをH2Oに溶解した。試料0.5μlをスチール標的上で70%エタノール水溶液に溶解したD−アラビノサゾン(5mg/ml)と1:1(v/v)で混合した(Chen et al. 1997)。スペクトルをGlyco−Peakfinderを用いて分析した(Maas et al., 2007)。同定したグリカン構造はGlyco Workbenchソフトウェアを用いて構築した(Ceroni et al., 2008)。
【0198】
2.2.7 Fc−γ受容体IIIA(FcγRIIIA)特異的な結合アッセイ
IgG試料のFcγRIIIA結合活性を、少し変更を加えたNiwaet al., 2004に記載のようなFcγRIIIA特異的な結合アッセイにより分析した。ヒスチジン(HIS)タグを付したFcγRIIIA(F158)(22kDa;158F;R&D Systems,Minneapolis, MN)を、受容体結合のために抗テトラHISモノクローナル抗体(Qiagen,Hilden, Germany)とともに使用した。イムノプレート(Maxisorp、Thermo,Waltham, MA)に抗テトラHIS抗体をコーティングし、ブロッキング試薬(RocheDiagnostics, Penzberg, Germany)を用いてブロッキングした。その後、組換えHISタグ付きFcγRIIIAをイムノプレートに加えた。それからコーティングしたプレートを段階的な試料希釈液及び対照とともにインキュベートし、それにより固定化FcγRIIIA受容体に結合させることができる。洗浄工程後、結合したIgGを抗ヒトIgGペルオキシダーゼ結合mAb(Dianova, Hamburg, Germany)により検出し、結合したIgGの量をペルオキシダーゼ活性により定量化した。各インキュベーション工程の後、イムノプレートを0.2% Tween−20を含有するPBSで3回洗浄した。テトラメチルベンジジン(TMB;Seramun, Heidesee, Germany)を発色基質として使用し、反応を1Mの硫酸を用いて終結させ、最後に吸光度を450nmで検出した(Infinite F200リーダー、Tecan, Crailsheim, Germany)。濃度依存的な吸光度データに基づき、十分な曲線の適合を、4パラメータロジスティック曲線モデル(Magellanソフトウェア6.1、Tecan)を用いて行った。このFcγRIIIA結合アッセイに関する系列内(intra-serial)正確性を、15% CV以内であると決定した。
【0199】
2.2.8 抗体依存的な細胞毒性(ADCC)アッセイ
初代ヒトNK細胞を末梢血単核細胞(PBMC)から単離した。PBMCを、密度勾配遠心分離により健常なヒトドナーの全血から分離し、続いてNK細胞を負電磁ビーズ分離により単離した(Miltenyi, Bergisch Gladbach, Germany)。単離したNK細胞の純度を、フローサイトメトリ(PE結合CD16抗体及びAlexa488結合CD56抗体、BD, San Jose, CA)により確認した。細胞株BT−474(Lasfargueset al., 1978、ヒトの乳房の浸潤性腺管癌、CLS、Eppelheim, Germany)及びSK−BR−3(Zabrecky et al., 1991、ヒトの乳房の腺癌、ATCC、Manassas,VA)を標的細胞として使用した。両方の細胞株がフローサイトメトリによりHer2/neuマーカーに対して陽性であることが確認された(データは示さず)。標的細胞株は接種の3日前にresearch cell bankで再活性化させた。抗体依存的なNK細胞により誘導された標的細胞の溶解を、生体染色の放出により定量化した(Calcein AM, Life Technologies, Carlsbad, CA)。標的細胞を製造業者のプロトコルに従い染色し、96ウェルマイクロタイタープレートにおいて、50μL RPMI 1640(Life Technologies)+10% FCS(Biochrom, Berlin, Germany)中、1つのウェルあたり2×104個の生存細胞で播種した。RPMI 1640+10% FCS中で抗体の1:3段階希釈液を調製した。50μL/ウェルのそれぞれの希釈液をn=3でピペッティングし、NK細胞接種前に、37℃で30分間、標的細胞とともにプレインキュベートした。抗体のプレインキュベーションの終了時に、エフェクター細胞を5:1のエフェクター細胞対標的細胞の比(E:T)で播種した。続いてプレートを200gで3分間遠心分離し、37℃で4時間、5% CO2下でインキュベートした。それぞれの細胞株に対して、自発的標的細胞溶解対照(NK細胞なし)、抗体非依存的な標的細胞溶解対照(NK細胞あり)及び総標的細胞溶解対照(サポニンにより誘導される)が誘導された。対照ウェルにおいて総溶解は、インキュベーション期間の終了の15分前にRPMI 1640+10% FCS中、1つのウェルあたり15μLの0.1mg/mLのサポニンを添加することにより誘導された。全ての他のウェルでは、15μLのRPMI 1640+10% FCSを加えた。カルセインAMの放出を培養上清における蛍光検出により定量化した。プレートを遠心分離し(150g、3分)、各ウェルから上清100μLを96ウェルの黒色の蛍光プレート(Thermo)に移した。平均蛍光強度(MFI)をInfinite F200リーダー(Tecan、485nm/535nm 励起/発光フィルタ)を用いて検出した。曲線の適合を、4パラメータロジスティック容量応答モデル(Magellanソフトウェアバージョン6.1)を用いて行った。特異的細胞溶解を以下のように算出した:特異的細胞溶解[%]=[MFI(試料)−MFI(自発的)]/[MFI(総)−MFI(自発的)]×100。MFI(試料)が特異的標的細胞溶解により放出される平均蛍光強度であり、MFI(自発的)が標的細胞による蛍光色素の段階的な放出であり、MFI(総)が洗浄剤により誘導される総標的細胞溶解後に得られた平均蛍光強度である。
【0200】
2.2.9 単糖分析及びラムノース測定
細胞(3×107個)を上清から100gで5分間の遠心分離により分離した。続いて細胞を3回の凍結融解サイクルにより溶解させた。それから細胞膜を細胞質画分から4℃で30分間、21000gで分離した。細胞培養上清、細胞膜、細胞質画分及びIgG N−グリカンを100℃で4時間、2NのTFAにおいて加水分解した。還元雰囲気下での蒸発の後に、試料をDionexのICS−3000を用いてPA−1カラム上でHPAEC−PADにより分析し、2−デオキシリボースを内部標準として使用した。中性の単糖を2.25mMのNaOHを用いた定組成溶出により分離した。200mMのNaOHのポストカラム添加により、アンペロメトリ検出が可能になった。HPAEC−PADでは、エナンチオマー同一性を評価することができない(Horton, D. 2004)ため、L−ラムノースを標準として用いて、D−ラムノースで予測される保持時間を求めた。ラムノースに関するLODを、分析手順のバリデーションのためのICHの三極共通ガイドライン(harmonized tripartite guideline)(ICHQ2(R1))の第6.3章に記載のように求めた。
【0201】
2.3 結果
2.3.1 RMD導入遺伝子の異種発現
分泌されたIgGのフコシル化レベルに対するRMD導入遺伝子発現の効果を評価するために、GDP−6−デオキシ−D−リキソ−4−ヘキスロースレダクターゼ(RMD)及び緑色蛍光タンパク質(gfp)に関する遺伝子を含む2シストロン性の発現カセットを備えたベクターを生成し、バイオシミラー(biosimilar:後発生物製剤)バージョンのIgG1型治療抗体トラスツズマブ(ハーセプチン(商標)、Roche)の過剰発現及び分泌のために事前に改変されたCHO/DG44クローンに導入した。導入遺伝子を発現するG418耐性クローンをそのgfp媒介性の緑色蛍光により同定し、トランスフェクションの2週間以内に現れた。gfp蛍光分布から評価されるように、エレクトロポレーションによりおよそ80%の形質転換効率が達成された(データは示していないが、図2に示されるデータと同じようなものである)。RMD導入遺伝子の発現の成功を、RMD特異的なプライマーセットを使用したRT−PCRにより確認した(データは示していないが、図3に示されるデータと同じようなものである)。RMD導入遺伝子を発現する改変CHO細胞はRMD−CHOと呼ばれる。
【0202】
2.3.2 CHO抗体産生細胞及びRMD−CHO抗体産生細胞の血清無含有流加バッチ培養
非改変の親CHO細胞及びIgGを産生するトランスフェクトしたRMD−CHO細胞の血清無含有流加バッチ培養を、L−グルタミンを加えたフコース欠損成長培地の入った50ml容のバイオリアクター管において行った。バイオリアクター管を1mlあたり4×105個の細胞の出発細胞密度で接種し、その後180rpm、37℃、7.5% pCO2下でインキュベートした。流加バッチ培養の性能を14日間モニタリングし、並べて比較した。CHO細胞及びRMD−CHO細胞の並行した流加バッチ培養の比較分析では、14日間で顕著な偏差は示されなかった。それぞれのサンプリング日での初期倍増速度、増殖速度及びIgG力価は両方の細胞株で一致していた。両方のクローンはCHO細胞に特有の形態を保持していた。流加バッチアッセイの期間中の生存率の低下パターン及び流加バッチ振盪器アッセイの3日〜10日の比生産性(qp)の平均は2つの異なるクローン間で同程度に維持された(データは示さず)。
【0203】
2.3.3 CHO細胞及びRMD−CHO細胞から産生されたIgGのN−グリカン分析
CHO細胞及びRMD−CHO細胞をバッチ培養で成長させた。IgGを産生する3つの異なるRMD−CHOクローン、すなわちH1、H2及びH3を使用した。細胞を1mLあたり4×105個の細胞の出発細胞密度で接種し、180rpm、37℃、7.5% pCO2下でバイオリアクター管において7日間成長させた。上清を7日目に収集し、IgG試料をプロテインAアフィニティクロマトグラフィにより精製した。溶出した抗体の純度及び完全性を還元型SDS−PAGEにより確認した。PNGase Fを用いて放出させたN−グリカンを脱シアル化し、続いてMALDI−TOF−MSにより分析した。N−グリカンのシグナル強度の相対的定量化を、クロマトグラフ方法と比較してより信頼性のある結果を得られることが以前に実証されたように行った(Wada et al., 2007)。高マンノース型及び複合型の二分岐(diantennary)N−グリカン構造を全ての試料で検出した(図5)。モノフコシル化された非ガラクトシル化/モノガラクトシル化/ジガラクトシル化二分岐N−グリカンは、野生型(WT)IgGで見られる3つの最も豊富なN−グリカン構造であった(図5A)。これらのピーク、すなわちm/z1485.4、1647.4及び1809.4でのコア−フコースの存在が、MALDI−TOF/TOFにより確認された。診断用の断片イオンdHex1HexNAc2は、いずれのスペクトルにおいてもm/z592.8で観察された。RMD−CHO細胞から産生されたIgG試料において、最大でN−グリカンプール全体の2%を表す(試料H2)、ごく微量のフコースが観察された(図5B、図5C、図5D)。同時に、試料H2はWT IgGよりも大量の高マンノース構造を含有していた。
【0204】
2.3.4 CHO細胞及びRMD−CHO細胞から産生されたIgGのIgG1−Fc結合活性
IgG1とそのコグネートFc受容体FcγRIIIaとの間の比較的弱い相互作用(Kd 約1μM)がADCCエフェクター機能に寄与する主な因子の1つであるため(Sondermannet al., 2000)、FcγRIIIa結合アッセイはIgG1モノクローナル抗体試料のADCC活性を予測する間接的な評価基準である。RMD−CHO細胞から分泌される非フコシル化IgGのFcγRIIIa結合は、野生型CHO細胞から分泌されるフコシル化IgGと比較して大きく増大しており、約16倍少ないタンパク質でFcγRIIIa−158Fと同等に結合する(図6A、図6B)。データは、参照としてフコシル化IgGを用いた、非フコシル化IgGの結合の相対的な増加倍率として図6Bに報告される。
【0205】
2.3.5 RMD−CHO細胞を用いて産生された非フコシル化IgGのADCC活性
ADCC活性を分析するために、単離したNK細胞及びHER2を発現する標的細胞を、非フコシル化IgG及びフコシル化IgGの段階希釈液とともに同時インキュベートした。アッセイの必要条件として、NK細胞を73%の純度レベルで全血試料から単離した(図7)。技術的な(technical)NK細胞の細胞毒性対照は、ADCCアッセイに使用されるドナー材料に対して77%の特異的溶解活性を示した(図7)。HER2を発現する標的細胞株BT−474(ヒトの乳房の浸潤性腺管癌から単離した)をADCCアッセイに使用した。BT−474標的細胞株は、ADCC以外の機構によってもNK細胞により攻撃を受ける。BT−474細胞は平均値16%の抗体非依存的な細胞溶解を示す(データは示さず)。IgG試料により誘導される特異的細胞溶解に関するデータを図8に示す。3つ全ての非フコシル化IgG試料(H1〜H3)はWT抗体と比較してADCC応答の増大を誘導した(図8)。非フコシル化IgG試料H2は最大のADCC応答を誘導した(図8)。SK−BR−3細胞(乳房のHER2陽性腺癌)を該アッセイにおいて標的細胞として使用した場合に、同様の結果が得られた。BT−474細胞及びSK−BR−3細胞とともにインキュベートした非フコシル化IgG試料及びフコシル化IgG試料に関して算出されたEC50値を表2に要約する(下記を参照されたい)。野生型IgGと変異体H1〜H3との間で観察されるEC50シフトは、ADCCアッセイで使用される標的細胞株に関係なく同程度のままであった(図8)。HER2陽性のBT474標的細胞株及びSK−BR−3標的細胞株、並びに精製NK細胞の存在下で、非フコシル化IgGは0.443μg/ml及び0.00817μg/mlの平均EC50値で平均16倍の抗体媒介性の標的細胞枯渇活性を示し、このことはフコシル化IgGと比較してはるかに高い有効性を示していた。FcγRIIIa結合活性の増大を示した非フコシル化IgG試料が、WT IgGと比較してより高いADCC応答も誘導したことに留意されたい。
【0206】
表2:異なる抗原提示標的細胞(BT−474、SK−BR−3)とともにインキュベートした非フコシル化(H1〜H3)IgG及びフコシル化(WT)IgGのADCCエフェクター機能の結果の要約。算出されたEC50(フコシル化)/EC50(非フコシル化)比はADCCエフェクター機能の向上を示す。
【表2】

試料名
比
【0207】
2.3.6 単糖分析−細胞溶解物における及びIgG N−グリカンにおける検出可能な量のD−ラムノースの非存在
細胞膜、培養上清及び細胞質画分をRMD−CHO細胞から単離した。続いて単糖を放出させ、HPAEC−PADにより分析した。予想通り、フコースはCHO細胞に存在し、RMD−CHO細胞には存在しなかった。検出限界(LOD)を超えるレベルのラムノースは細胞質画分では観察されなかった(図9)。較正曲線のy切片及び傾きの標準偏差に基づくと、LODは10μlの試料注入容量あたりラムノース及びフコースに対してそれぞれ1.2pmol及び1.1pmolであった。同様に、RMD−CHO細胞を用いて産生される精製抗体から放出されたN−グリカンをTFAによって加水分解し、得られる単糖をHPAEC−PADにより分析した。TFAで加水分解したN−グリカンは、LODを超えるラムノースピークを全く生じなかった(図10)。結論として、RMD−CHO細胞も分泌された抗体も検出可能な量のラムノースを含有してない。
【0208】
2.4 備考(Final Remarks)
本発明者らは、細胞質のフコースde novo合成経路由来の重要な代謝中間体の連続除去のために改変された細胞株からのフコース欠損mAbの分泌を達成するための糖鎖改変アプローチを評価した(図1)。本発明者らのデータは、異種細菌酵素のトランスジェニック発現が、新生糖タンパク質N−グリカン上でのフコースの合成の所望の阻止を引き起こすことをはっきりと示している。この方法によるフコース枯渇の程度は、培養培地からのフコースの排除がサルベージ経路(遮断されなければ(otherwise)細胞質のGDP−フコースの代替供給源として働くことのできる)を完全に遮断するのに十分であったことも示している。
【0209】
本発明者らのアプローチにおける重要な代謝標的は、細菌において例えばGDP−L−フコース、GDP−4−デオキシ−D−タロース、GDP−コリトース及びGDP−D−ペロサミンを含む幾つかの異なるGDP−モノデオキシヘキソースの合成の共通の中間体であるGDP−4−ケト−6−デオキシ−D−マンノースであった。さらに、GDP−フコースシンターゼの活性部位Cys109Ser突然変異体はGDP−フコースの代わりにGDP−6−デオキシ−D−アルトロースを生成する(Lau and Tanner, 2008)。
【0210】
本発明者が本発明者らのアプローチで例として選択した特定の原核生物酵素は、GDP−6−デオキシ−D−リキソ−4−ヘキスロースレダクターゼ(GDP−4−ケト−6−デオキシ−D−マンノースレダクターゼと同義であり、RMDと略される)であった(Kneidinger et al., 2001; Maeki et al., 2002)。ここで本発明者らは、細胞質内での原核生物酵素GDP−6−デオキシ−D−リキソ−4−ヘキスロースレダクターゼ(RMD)の異種発現が効率的にフコースde novo経路を偏向させることができることを実証した。上記酵素は水素ドナーとしてNADH及びNADPHを利用し、フコース経路の中間体GDP−4−ケト−6−デオキシ−D−マンノースの4−ケト基の標的化還元を触媒することにより、GDP−D−ラムノースを得る。逆反応が検出されなかったことから(Kneidinger et al., 2001)、RMDによるGDP−4−ケト−6−デオキシ−D−マンノースのGDP−D−ラムノースへの変換は定量的に進行すると考えられる。
【0211】
本発明者らのデータは、或る特定の細菌の複合糖質でのみ見出されるが、動物では見出されない6−デオキシヘキソースであるGDP−ラムノース(Webb et al., 2004)が脊椎動物の細胞質との関連内において終末生成物であることも示している。非改変脊椎動物細胞はラムノシルトランスフェラーゼを欠いており(Webb et al., 2004)、また膜輸送体を欠いており、このためGDP−D−ラムノースの新生グリカンへの組込みが脊椎動物細胞内で起こる可能性は非常に低い。本発明者らのデータにより、これを確認することができた。本発明者らのデータは、人工D−ラムノースが、細胞内において、分泌されたIgGに又はその他の箇所に組み込まれなかったことをはっきりと示している(図9及び図10)。
【0212】
グルカン構造上でフコースを欠くことに加えて、遺伝子操作されたクローンから分泌されるIgGは、より高いレベルの高マンノース構造を示した。これはGDP−D−ラムノースによるGMDのフィードバック阻害により生じ得る。GDP−マンノースに関する代替的な代謝シンクとしてのGMD活性を欠くことは細胞質GDP−D−マンノースのプールの上昇に寄与する可能性があり、これによりRMD改変宿主細胞から分泌される生成物で観察される高マンノース構造の増加が引き起こされた可能性がある(図4及び図5)。
【0213】
FcγRIII結合アッセイ及びin vitroでのADCCアッセイに関する本発明者らの結果は、非フコシル化IgGがFcγRIIIaに対する顕著に高い結合活性及び向上したADCC応答を有することも示す。観察されたEC50シフト及び標的細胞枯渇活性の倍増(表2、図8)は、アッセイを全血、血清又は血漿の存在下で行った場合、更に高いであろう。興味深いことに本発明者らは、最大レベルの高マンノース構造を有する非フコシル化IgG試料H2が、アッセイに使用される標的細胞(BT474又はSK−BR−3)に関係なく最大のADCC活性も示すことを観察した(表2)。
【0214】
まとめると、この研究により、脊椎動物宿主細胞におけるRMDの過剰発現が、細胞質GDP−フコースの合成のための重要な主要中間体(GDP−4−ケト−6−デオキシ−D−マンノース)の枯渇を引き起こすことが実証される。このアプローチにより、代謝的に改変された細胞株の生成が可能になり、また既存の抗体を発現する細胞クローンをフコース枯渇治療法のための産生細胞に変換する非常に有力な新たな戦略も与える。既に存在する細胞株においてフコースの欠損を確実に改変する能力は、次世代のモノクローナル抗体のための薬物開発を促進させるのに役立ち得る。
【0215】
3.略称
ACN、アセトニトリル;CHO、チャイニーズハムスター卵巣;CV、変動係数;dHex、デオキシヘキソース;EC50、50%最大有効濃度(すなわち、基準線応答と最大応答との中間の応答を誘起するアゴニストの濃度)、Fuc、フコース;Gal、ガラクトース;GalNAc、N−アセチルガラクトサミン;GlcNAc、N−アセチルグルコサミン;GMER、GDP−4−ケト−6−デオキシ−D−マンノース−3,5−エピメラーゼ/4−レダクターゼ;HPLC、高速液体クロマトグラフィ;HPAEC−PAD、パルスアンペロメトリ検出を伴う高pHアニオン交換クロマトグラフィ;LOD、検出限界;mAb、モノクローナル抗体;MALDI−TOF−MS、マトリックス支援レーザ脱離イオン化飛行時間型質量分析法;MEM、変法イーグル培地;PBMC、末梢血単核細胞;PBS、リン酸バッファー生理食塩水;PNGase F、ペプチド−N4−(N−アセチル−β−グルコサミニル)アスパラギンアミダーゼF;Rha、ラムノース;RMD、GDP−6−デオキシ−D−リキソ−4−ヘキスロースレダクターゼ;SDS、ドデシル硫酸ナトリウム;TFA、トリフルオロ酢酸。
【0216】
参考文献
Ceroni, A., Maass, K., Geyer, H., Geyer, R., Dell, A., Haslam, S.M. 2008. GlycoWorkbench: A Tool for the Computer-Assisted Annotation of Mass Spectra ofGlycans, Journal of Proteome Research, 7 (4), 1650-1659.
Chen, P, Baker AG, Novotny MV. 1997. The use of osazones as matrices for thematrix-assisted laser desorption/ionization mass spectrometry of carbohydrates.Anal Biochem. 244(1):144-51.
Horton, D 2004 Advances in Carbohydrate Chemistry and Biochemistry. D. Horton,Editor, Elsevier Academic Press, Amsterdam and San Diego, Vol. 59, p.11.
ICH Q2(R1): ICH Harmonized Tripartite Guideline: Validation of AnalyticalProcedures: Text and Methodology Q2(R1) Current Step 4 version, ParentGuideline dated 27 October 1994.
Kneidinger B, Graninger M, Adam G, Puchberger M, Kosma P, Zayni S, Messner P.2001. Identification of two GDP-6-deoxy-D-lyxo-4-hexulose reductasessynthesizing GDP-D-rhamnose in Aneurinibacillus thermoaerophilus L420-91T. JBiol Chem. Feb 23;276(8):5577-83.
Lasfargues EY, Coutinho WG and Redfield ES. 1978. Isolation of two human tumorepithelial cell lines from solid breast carcinomas. J Natl Cancer Inst.;61(4):967-78.
Lau S.T.B., Tanner, M.E. 2008. Mechanism and Active Site Residues of GDP-FucoseSynthase, Journal of the American Chemical Society, vol. 130, no51, pp.17593-17602
Maeki M, Jaervinen N, Raebinae J, Roos C, Maaheimo H, Renkonen R; Pirkko;Mattila. 2002. Functional expression of Pseudomonas aeruginosaGDP-4-keto-6-deoxy-D-mannose reductase which synthesizes GDP-rhamnose. Eur JBiochem. Jan;269(2):593-601.
Niwa R, Shoji-Hosaka E, Sakurada M, Shinkawa T, Uchida K, Nakamura K,Matsushima K, Ueda R, Hanai N, Shitara K. 2004. Defucosylated anti-CC chemokinereceptor 4 IgG1 with enhanced antibody-dependent cellular cytotoxicity showspotent therapeutic activity to T cell leukemia and lymphoma. Cancer Res,64:2127-2133.
Niwa R, Hatanaka S, Shoji-Hosaka E, Sakurada M, Kobayashi Y, Uehara A, Yokoi H,Nakamura K, Shitara K. 2004. Enhancement of the antibody-dependent cellularcytotoxicity of low-fucose IgG1 is independent of FcgammaRIIIa functionalpolymorphism. Clin Cancer Res, 10:6248-6255.
Shields RL, Lai J, Keck R, O'Connell LY, Hong K, Meng YG, Weikert SH, PrestaLG. 2002. Lack of fucose on human IgG1 N-linked oligosaccharide improvesbinding to human FcgammaRIII and antibody-dependent cellular toxicity. J BiolChem, 277:26733-26740.
Sondermann, P., Huber, R., Oosthuizen, V., and Jacob, U. 2000. The 3.2-Acrystal structure of the human IgG1 Fc fragment-Fc gammaRIII complex. Nature406, 267-273.
Urlaub G, Kaes E, Carothers AM, Chasin LA. Deletion of the diploiddihydrofolate reductase locus from cultured mammalian cells. Cell. 1983Jun;33(2):405-12.
Urlaub G, Mitchell PJ, Kas E, Chasin LA, Funanage VL, Myoda TT, Hamlin J. 1986.Effect of gamma rays at the dihydrofolate reductase locus: Deletions andinversions. Somatic Cell Mol Genet, 12:555-556.
Wada, Y.; Azadi, P.; Costello, C. E.; Dell, A.; Dwek, R. A.; Geyer, H.; Geyer,R.; Kakehi, K.; Karlsson, N. G.; Kato, K.; Kawasaki, N.; Khoo, K. H.; Kim, S.;Kondo, A.; Lattova, E.; Mechref, Y.; Miyoshi, E.; Nakamura, K.; Narimatsu, H.;Novotny, M. V.; Packer, N. H.; Perreault, H.; Peter-Katalinic, J.; Pohlentz,G.; Reinhold, V. N.; Rudd, P. M.; Suzuki, A.; Taniguchi, N. 2007. Comparison ofthe methods for profiling glycoprotein glycans--HUPO Human DiseaseGlycomics/Proteome Initiative multi-institutional study. Glycobiology;17(4):411-22.
Webb NA, Mulichak AM, Lam JS, Rocchetta HL, Garavito RM. 2004. Crystalstructure of a tetrameric GDP-D-mannose 4,6-dehydratase from a bacterialGDP-D-rhamnose biosynthetic pathway. Protein Sci. Feb;13(2):529-39.
Zabrecky JR, Lam T, McKenzie SJ and Carney W . 1991. The extracellular domainof p185/neu is released from the surface of human breast carcinoma cells,SK-BR-3. J Biol Chem.; 266(3):1716-20.
【0217】
(寄託情報)


【技術分野】
【0001】
本発明は、その糖部分上において、フコースを欠いている、低減したフコース量を有する、又は他の非定型糖を有する分子を生成するための細胞に関する。本発明は、上記細胞を用いて、その糖部分上において、フコースを欠いている、低減したフコース量を有する、又は他の非定型糖を有する分子を生成する方法、及び上記方法で入手可能な分子にも関する。本発明は更に、人工のグリコシル化パターンを有する分子に関する。
【背景技術】
【0002】
ヒトでの使用を目的とする治療用グリコシル化分子は、ヒトで見られるものと類似の複雑なグリコシル化パターンを有するものとする。そのため、グリコシル化分子が複雑なヒト様グリコシル化パターンを有することが望まれる場合、治療用グリコシル化分子、例えばタンパク質又は脂質を生成するのに一般的に動物細胞が使用される。グリカンの構造及び複雑性は、半減期、受容体の結合の変調、免疫反応の誘導又は抑制により生体分子のin vivo機能に重大な影響を与える。
【0003】
糖脂質の糖鎖は複雑であり、かつ相当量のフコースを含有する可能性がある(非特許文献1)。糖タンパク質の糖鎖は、タンパク質部分との結合形態に基づきおおまかに2つのタイプ、すなわちアスパラギンと結合する糖鎖(N−グリコシド連結型糖鎖)と、セリン、トレオニン等の他のアミノ酸と結合する糖鎖(O−グリコシド連結型糖鎖)とに分けられる。
【0004】
N−グリコシド連結型糖鎖は様々な構造を有する(非特許文献2)が、基本的な共通のコア構造を有することが知られている。アスパラギンと結合する糖鎖末端は還元末端と呼ばれ、反対側は非還元末端と呼ばれる。N−グリコシド連結型糖鎖には、マンノースが単独でコア構造の非還元末端と結合する高マンノース型と、トリマンノースのコアの非還元末端側が通常、2つの(1,3及び1,6)マンノース結合手(arms)のそれぞれに結合した少なくとも1つのガラクトース−N−アセチルグルコサミン(以下、Gal−GlcNAcと称される)を有する複合型とが含まれる。Gal−GlcNAcの非還元末端側はガラクトース及びシアル酸、バイセクティング(bisecting)N−アセチルグルコサミン等を含有することがある。混成型では、コア構造の非還元末端側が高マンノース型及び複合型両方の分岐を有する。脊椎動物細胞由来のグリカンでは、フコースは、α1,3連結を介して分岐型(antennary)GlcNAcに(末端フコース)、又はα1,6連結を介してアスパラギン連結型GlcNAcに(コアフコース)結合することができる。昆虫細胞は1,3連結したコアフコースを含有し得るグリカンを生成する。
【0005】
初めにN−グリコシル化タンパク質のオリゴ糖部分が脂質連結型オリゴ糖から生合成され、Glc3Man9GlcNAc2−ピロホスホリル−ドリコールが生成され、それからそれが小胞体(ER)におけるタンパク質のトリペプチド配列Asn−X−Ser又はThr(ここでXはProを除く任意のアミノ酸であり得る)にあるアスパラギンへと転移する。その後、該タンパク質はゴルジ装置へと輸送され、そこでオリゴ糖部分が以下の順番で更にプロセシングされる:まず3つ全てのグルコース(Glc)残基がグルコシダーゼI及びグルコシダーゼIIにより取り除かれ、Man9GlcNAc2−タンパク質が生じる。Man9GlcNAc2構造は、多数のマンノース(Man)残基を取り除くことにより、更にプロセシングされ得る。初めに、4つのα−1,2連結型マンノースが取り除かれ、Man5GlcNAc2−タンパク質が生じた後、N−アセチルグルコサミン(GlcNAc)残基の付加により伸長する。この新たな構造、GlcNAcMan5GlcNAc2−タンパク質はα−1,3連結型マンノース及びα−1,6連結型マンノースを取り除くマンノシダーゼIIに対する基質である。その後、他の糖、GlcNAc、ガラクトース、フコース及びシアル酸が連続して付加され、N−グリコシル化タンパク質でよく見られる複合型の構造が生じる。
【0006】
IgG分子は例えば、Fc領域におけるCH2ドメインのうちのそれぞれの保存されたAsn297で共有結合したN連結型オリゴ糖を含有する。血清IgGのFc領域で見られるオリゴ糖は複合型のほとんどが二分岐の(biantennary)グリカンである。IgGグリコシル化パターンの変形には、コア構造:2×N−アセチルグルコサミン(GlcNAc)及び3×マンノース(Man)(GlcNAc2Man3)への末端シアル酸(NeuAc)、第3のGlcNac結合手(バイセクティングGlcNAc)の結合、末端のガラクトシル化(G)、及びα−1,6連結型のコアのフコシル化(F)が含まれる。グリコシル化の正確なパターンはIgGサブコンポーネント、特にCH2ドメイン及びCH3ドメインの構造特性によって決まる(非特許文献3)。
【0007】
動物細胞及びヒト細胞は、タンパク質上のN−グリカンの還元末端でGlcNAc残基に、又は糖脂質上の他の新生糖構造にフコース残基を付加するフコシルトランスフェラーゼを有する。タンパク質と結合した糖部分又は脂質と結合した糖部分のフコシル化には、ドナーとしてヌクレオチド糖であるGDP−L−フコース、またフコシル残基をドナーからアクセプタ分子へと転移させる特定のフコシルトランスフェラーゼの存在が要求される(非特許文献4)。真核細胞では、GDP−L−フコースを2つの異なる経路、すなわち主要な(more prominent)フコースde novo経路又は副次的な(minor)サルベージ経路のいずれかにより合成することができる(非特許文献4)。サルベージ経路又は「スカベンジャー」経路はGDP−L−フコースの副次的な供給源(およそ10%)であり、培養培地からの遊離フコース及びフコシル化糖タンパク質の排除により容易に遮断することができる。サルベージ経路は細胞外フコースから開始し、該細胞外フコースはフコース特異的な原形質膜輸送体により細胞質コンパートメントへと輸送され得る。代替的に、取り込まれた(endocytosed)糖タンパク質から切断したフコースは細胞質へと侵入し得る。細胞質L−フコースはフコキナーゼによりリン酸化されてフコース−1−ホスフェートとなり、それからGDP−フコースピロホスホリラーゼによりGDP−L−フコースへと変換される(図1、右側のパネル)。細胞培養実験により、サルベージ経路が細胞質のGDP−L−フコースプールには比較的僅かしか寄与しないことが示唆されている(非特許文献4)。
【0008】
主要なフコースde novo経路は、GDP−D−マンノースから開始し、ともに細胞質に位置するGDP−マンノースデヒドラターゼ(GMD)及びGDP−ケト−デオキシ−マンノース−エピメラーゼ/GDP−ケト−デオキシ−ガラクトース−レダクターゼ(GMER、ヒトではFxとしても知られる)からなり、協働してGDP−マンノースをGDP−L−フコースに変換する(図1、左側のパネル)。その後、GDP−L−フコースはゴルジ装置の膜に位置するGDP−フコース輸送体により、ゴルジ体内へと輸送される。GDP−L−フコースがゴルジ体の内腔コンパートメントに侵入すると、フコシルトランスフェラーゼはGDP−L−フコースをゴルジ体内の新生糖部分と共有的に連結させることができる。特に、フコシルトランスフェラーゼ(Fut8)はフコース残基を1,6連結によりN−グリカンの還元末端におけるGlcNAc残基の6位へと転移させる。
【0009】
糖タンパク質上でフコースを欠いていることが、特に有利であることが分かっている。例えば、モノクローナル抗体、免疫グロブリン及び関連分子では、免疫グロブリンのFc部分(CH2ドメイン)のAsn297に結合するN−グリカン由来のコアフコース糖がないことにより、Fc受容体との免疫グロブリンの結合が増大又は変化することが分かっている。異なるタイプの定常領域は異なるFc受容体と結合する。例としては、IgG1 FcドメインとコグネートFc受容体CD16(FcγRIII)、CD32(FcγRII−B1及びFcγRII−B2)又はCD64(FcγRI)との結合、IgA FcドメインとコグネートFc受容体CD89(FcαRI)との結合、及びIgEドメインとコグネートFc受容体FcεFR1又はCD23との結合が挙げられる。NK細胞の表面上に存在する(which)FcγRIIIとの結合が強く増大する(非特許文献5)。
【0010】
治療抗体の主な作用機序は抗体依存性の細胞毒性(以下、「ADCC活性」と称される)である。Fab部分により標的細胞(腫瘍細胞又は病原体に感染した細胞)と結合する抗体は、エフェクター細胞、通常NK細胞のFc受容体によりそのFc部分で認識される。結合すると、エフェクター細胞はIFN−γ等のサイトカイン、及びパーフォリンを含有する細胞毒性顆粒、及び標的細胞へと入り細胞死を誘導するグランザイムを放出する。FcγRIIIとの結合親和性は、ATCCを通じて作用する抗体に重要である。受容体の低親和性対立遺伝子のキャリアは、リツキシマブ等の治療抗体とはほとんど反応しない(非特許文献6)。
【0011】
結果として、Fcグリカン上のコアフコースの非存在により媒介されるFcγRIIIに対するより高い親和性により、主に臨床的利点及びコストの意味合いで生物治療製品の効力を増大させるか、又は有効用量を低減させることができる。
【0012】
生成される糖タンパク質の糖鎖構造を修飾するために、1)糖鎖の修飾に関連する酵素に対する阻害剤の適用、2)糖合成又は糖転移に関与する遺伝子のホモ接合型(homozygous)ノックアウト、3)突然変異体の選択、4)糖鎖の修飾に関連する酵素をコードする遺伝子の導入等の様々な方法が試みられている。具体例を以下に記載する。
【0013】
糖鎖の修飾に関連する酵素に対する阻害剤の例としては、グリコシダーゼIの阻害剤であるカスタノスペルミン及びN−メチル−1−デオキシノジリマイシン、グリコシダーゼIIの阻害剤であるブロモコンズリトール、マンノシダーゼIの阻害剤である1−デオキシノジリマイシン及び1,4−ジオキシ−1,4−イミノ−D−マンニトール、マンノシダーゼIIの阻害剤であるスワインソニン等が挙げられる。グリコシルトランスフェラーゼに特異的な阻害剤の例としては、N−アセチルグルコサミントランスフェラーゼV(GnTV)に対する基質のデオキシ誘導体等が挙げられる。
【0014】
糖鎖の修飾に関連する酵素の突然変異体は主に、レクチン耐性細胞株から選択及び入手されている。例えば、CHO細胞の突然変異体は、WGA(タチジャコウソウ(T. vulgaris)から誘導されるコムギ胚芽凝集素)、ConA(タチナタマメ(C.ensiformis)から誘導されるコンカナバリン(concanavalin)A)、RIC(トウゴマ(R. communis)から誘導される毒素)、L−PHA(インゲンマメ(P.vulgaris)から誘導される白血球凝集素)、LCA(レンズマメ(L. culinaris)から誘導されるレンティル凝集素)、PSA(エンドウマメ(P. sativum)から誘導されるエンドウレクチン(pea lectin))等のレクチンを用いて、レクチン耐性細胞株から入手されている。
【0015】
さらに、フコースを欠いている組換え抗体を産生する方法が幾つか報告されている。N−糖部分のコアフコシル化を可能にする最も重要な酵素の1つがα−1,6−フコシルトランスフェラーゼ8(Fut8)である。上記酵素は、複合型N−グリカンのN−グリコシド連結型糖鎖のペンタコア(pentacore)におけるα結合を介した、フコースのN−アセチルグルコサミンの還元末端での6位への結合を触媒する(特許文献1)。フコーストランスポーター遺伝子の発現が人工的に抑制された細胞を用いることで、低減したフコース含量を有する抗体も実現されている(特許文献2)。α−1,6−フコシルトランスフェラーゼの機能を抑制可能なRNAの導入も説明されており、これによりフコースを欠いている抗体分子の産生がもたらされる(特許文献3)。
【0016】
治療適応症に使用することができる変化したグリコシル化パターンを有する分子を生成するために提案された細胞又は方法の多くが、重大な欠点を有する。例えば、グリコシル化を除去する酵素、例えばフコース残基を除去するフコシダーゼによる抗体の処理は、費用及び時間がかかり、また潜在的に重大な経済的リスク及び薬物に一貫した(drug consistency)リスクのある(which)付加的な製造工程を伴う。さらに、糖タンパク質の合成に関与する重要な酵素をノックアウトするための細胞株の分子工学的手法は面倒で、費用がかかり、また成功が約束されているわけではない。加えて、上記細胞株には、治療上の使用に関する有効性及び安全性を最適化するのに、多様なADCC効力又はCDC効力を有する分子の「調整可能な(tunable)」生成ができないという欠点がある。糖タンパク質の合成に関与する重要な酵素のレベルをノックダウンするためのRNAi又はアンチセンス分子による細胞株の処理は予期せぬオフターゲットな(off-target)影響を与える可能性があり、費用がかかり、また製造規模での実施には向かないと考えられる。
【先行技術文献】
【特許文献】
【0017】
【特許文献1】国際公開第00/61739号
【特許文献2】米国特許出願公開第20090061485号
【特許文献3】欧州特許出願公開第1 792 987号
【非特許文献】
【0018】
【非特許文献1】PNAS 1985; 82: 3045-3049.
【非特許文献2】糖蛋白質糖鎖研究法(生物化学実験法23)(学会出版センター(GakujutsuShuppan Center))、高橋礼子編(1989)
【非特許文献3】Lund et al. (2000) Eur. J. Biochem., 267:7246-7257
【非特許文献4】Becker and Lowe, 1999
【非特許文献5】Shields et al. JBC 277 (30): 26733. (2002)
【非特許文献6】Cartron et al. Blood 99: 754-758
【発明の概要】
【発明が解決しようとする課題】
【0019】
このため、治療上の使用に関して改善した特性を有する、変化したグリコシル化パターンを有する分子の生成のための新規の有益な細胞及び方法が必要とされている。
【課題を解決するための手段】
【0020】
本発明は、変化したグリコシル化パターンを有する分子、すなわちそのグリカン構造上でフコースを欠いている、低減したフコース量を有する、又は他の非定型糖を有する分子の生成のための細胞を提供する。本発明は、上記細胞を用いて、変化したグリコシル化パターンを有する分子、すなわちそのグリカン構造上でフコースを欠いている、低減したフコース量を有する、又は他の人工糖を有する分子を生成する方法も提供する。上記分子は治療上の使用に関して改善した特性、例えば増大したADCC活性又はCDC活性、向上したシグナル伝達事象の阻害能、増大したアポトーシスの誘導能、及び/又は増大した免疫療法の効力(ability)を有する。加えて、本発明により提供される細胞及び方法により、変化したグリコシル化パターンを有する分子、すなわちそのグリカン構造上でフコースを欠いている、低減したフコース量を有する、又は他の人工糖を有する分子の、調整可能で、信頼性があり、費用がかからず単純な生成が可能になる。さらに本発明は、製造のスケールアップに好適な方法を提供する。
【0021】
多くの場合、所望のレベルで対象となる導入遺伝子を発現する効果的な産生細胞株を生成及び開発するために、かなりの時間が費やされるとともに、多大な労力が注がれてきた。対象となる導入遺伝子がADCCエフェクター機能の向上による利益を受けることができる治療抗体である場合、高産生細胞がN−糖部分にコア−フコースを結合することができない、又はN−糖部分に人工糖を結合することができるように産生細胞株を更に操作することが望ましいであろう。
【0022】
本発明は、例えば向上したADCC活性を有する抗体を産生するために、糖タンパク質の新生糖構造にフコースを結合することができなくする、又は糖タンパク質の新生糖構造にフコース以外の他の人工糖を結合することができるように、既存の遺伝子操作された細胞に容易に適用することができる発現単位を提供する。
【0023】
発明の概要
第1の態様では、本発明は、自然状態ではその糖部分上において、フコースを含むが、その糖部分上において、フコースを欠いている又は低減したフコース量を有する分子を生成するための脊椎動物細胞であって、基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用するが、GDP−6−デオキシ−D−リキソ−4−ヘキスロースをGDP−L−フコースに変換する反応を触媒しない酵素を少なくとも1つ含む、自然状態ではその糖部分上において、フコースを含むが、その糖部分上において、フコースを欠いている又は低減したフコース量を有する分子を生成するための脊椎動物細胞に関する。
【0024】
第2の態様では、本発明は、自然状態ではその糖部分上において、フコースを含むが、その糖部分上において、フコースを欠いている又は低減したフコース量を有する分子を生成する方法であって、
i)第1の態様による脊椎動物細胞を準備する工程と、
ii)i)における該細胞からフコシルトランスフェラーゼに対する基質となることができる分子、好ましくはタンパク質又は脂質を単離する工程と、
を含む、自然状態ではその糖部分上において、フコースを含むが、その糖部分上において、フコースを欠いている又は低減したフコース量を有する分子を生成する方法に関する。
【0025】
第3の態様では、本発明は、第2の態様の方法により入手可能な、その糖部分上において、フコースを欠いている又は低減したフコース量を有する分子に関する。
【0026】
第4の態様では、本発明は、第2の態様の方法により入手可能な、D−ラムノース、D−ペロサミン、デオキシ−D−タロース、6−デオキシ−D−アルトロース、4−ケト−3,6−ジデオキシ−D−マンノース、及び/又はL−コリトースを含有する糖部分を含む分子に関する。
【0027】
第5の態様では、本発明は、
i)70%〜95%のG0−GlcNac、G0、G1及び/又はG2の複合型N−グリカンと、
ii)5%〜30%の高マンノース型N−グリカンと、
を含む糖タンパク質を含む組成物であって、該複合型N−グリカンがフコースを含まない、又はフコースを実質的に含まない、糖タンパク質を含む組成物に関する。
【0028】
第6の態様では、本発明は、D−ラムノース、D−ペロサミン、デオキシ−D−タロース、6−デオキシ−D−アルトロース、4−ケト−3,6−ジデオキシ−D−マンノース、及び/又はL−コリトースを含有する糖部分を含む、タンパク質又は脂質に関する。
【0029】
第7の態様では、本発明は、
i)1つ又は複数の脊椎動物発現制御配列と、
ii)基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用する酵素をコードする核酸配列を含むポリヌクレオチドと、
を含む発現単位であって、該酵素がGDP−6−デオキシ−D−リキソ−4−ヘキスロースをGDP−L−フコースに変換する反応を触媒しない、発現単位に関する。
【0030】
第8の態様では、本発明は、通常その糖部分上において、フコースを含むが、その糖部分上において、フコースを欠いている又は低減したフコース量を有するタンパク質を生成するための真核細胞であって、
i)基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用する酵素をコードする核酸配列を含む第1のポリヌクレオチドと、
ii)タンパク質をコードする核酸配列を含む第2のポリヌクレオチドと、
を含み、該酵素がGDP−6−デオキシ−D−リキソ−4−ヘキスロースをGDP−L−フコースに変換する反応を触媒しない、通常その糖部分上において、フコースを含むが、その糖部分上において、フコースを欠いている又は低減したフコース量を有するタンパク質を生成するための真核細胞に関する。
【0031】
第9の態様では、本発明は、通常その糖部分上において、フコースを含むが、その糖部分上において、フコースを欠いている又は低減したフコース量を有するタンパク質を生成する方法であって、
i)第8の態様による真核細胞を準備することと、
ii)上記細胞において該第1のポリヌクレオチドによりコードされる該酵素及び該第2のポリヌクレオチドによりコードされる該タンパク質を発現することと、
iii)上記細胞から該タンパク質を単離することと、
を含む、通常その糖部分上において、フコースを含むが、その糖部分上において、フコースを欠いている又は低減したフコース量を有するタンパク質を生成する方法に関する。
【0032】
第10の態様では、本発明は、第9の態様の方法により入手可能な、その糖部分上において、フコースを欠いている又は低減したフコース量を有するタンパク質に関する。
【0033】
発明の詳細な説明
本発明を以下で詳細に説明する前に、本明細書中で説明する特定の方法論、プロトコル及び試薬は変動し得るので、本発明はこれらに限定されないと理解すべきである。本明細書中で使用される専門用語は、特定の実施の形態を説明するためのものにすぎず、添付した特許請求の範囲のみによって限定される本発明の範囲を限定することは意図されないことも理解すべきである。他に規定のない限り、本明細書中で使用される全ての技術用語及び科学用語は、当業者により一般的に理解される意味と同じ意味を有する。
【0034】
好ましくは、本明細書中で使用される用語は、"A multilingual glossary ofbiotechnological terms: (IUPAC Recommendations)", Leuenberger, H.G.W,Nagel, B. and Koelbl, H. eds.(1995), Helvetica Chimica Acta, CH-4010 Basel,Switzerlandに記載されているように規定される。
【0035】
以下の本明細書及び添付の特許請求の範囲を通じて、文脈上他の要求がなされる場合以外は、「を含む(comprise)」という単語、並びに「を含む(comprises)」及び「を含む(comprising)」等の変化形は、記載の整数若しくは工程又は整数若しくは工程の群を包含することを示唆するが、任意の他の整数若しくは工程又は整数若しくは工程の群を除外することを示唆しないと理解される。
【0036】
複数の文書が、本明細書の文章を通じて引用される。本明細書中で引用される文書(全ての特許、特許出願、科学的刊行物、製造業者の仕様書、取扱説明書、GenBankアクセッション番号配列寄託(submissions)等を含む)の各々が、上記のものであるか又は下記のものであるかに関わらず、その全体が参照により本明細書に援用される。本明細書のどの記載も、本発明が先行発明に基づくこのような開示に先行する権利を有しないことを認めるものと解釈すべきではない。
【0037】
以下では、本発明の要素を記載する。これらの要素を特定の実施の形態とともに列挙するが、任意の様式及び任意の数でこれらを組み合わせて、更なる実施の形態を作り出すことができることを理解すべきである。様々に記載される実施例及び好ましい実施の形態を、明示的に記載される実施の形態にのみ本発明を限定するものと解釈すべきではない。この記載を、明示的に記載される実施の形態を任意の数の開示される及び/又は好ましい要素と組み合わせた実施の形態を支持及び包含するものと理解すべきである。さらに、本出願において記載される全ての要素の任意の置換及び組合せが、文脈上他に示されない限り、本出願の記載により開示されるものと考えるべきである。
【0038】
本発明による「を含む(comprise)」という用語、又は「を含む(comprises)」若しくは「を含む(comprising)」等の変化形は、記載の整数又は整数の群を包含することを意味するが、任意の他の整数又は整数の群を除外することを意味しない。本発明による「から本質的になる」という用語は、記載の整数又は整数の群を包含するが、記載の整数に実質的に影響を与える又は記載の整数を実質的に変化させる変更値又は他の整数を除外することを意味する。本発明による「からなる(consisting of)」という用語、又は「からなる(consists of)」等の変化形は、記載の整数又は整数の群を包含すること、及び任意の他の整数又は整数の群を排除することを意味する。
【0039】
本発明との関連では、「オリゴペプチド」という用語は、アミノ酸、例えば典型的には約50アミノ酸長未満、より典型的には約30アミノ酸長未満のアミノ酸の短いペプチド連結鎖を表す。
【0040】
「ポリペプチド」及び「タンパク質」という用語は、本発明との関連では区別なく使用され、アミノ酸、例えば典型的に50アミノ酸長又は50アミノ酸長を超えるアミノ酸の長いペプチド連結鎖を表す。
【0041】
「ポリペプチド断片」という用語は本発明との関連で使用される場合、全長ポリペプチドと比較して欠失、例えばアミノ末端の欠失、及び/又はカルボキシ末端の欠失、及び/又は内部欠失を有するポリペプチドを表す。
【0042】
本発明との関連では、「融合タンパク質」という用語は、異種アミノ酸配列と連結したポリペプチド又はポリペプチド断片を含むポリペプチドを表す。融合タンパク質は2つ以上の異なるタンパク質からの2つ以上の所望の機能要素を含有するように構築することができるため、有用である。
【0043】
「抗体」、「免疫グロブリン」、「Ig」及び「Ig分子」という用語は本発明との関連では区別なく使用される。各重鎖のCH2ドメインは、アスパラギン残基でのN連結型グリコシル化に関する単一部位を含有し、通常Asn−297残基でN−グリカンと抗体分子とが連結する(Kabat et al., Sequence of proteins of immunological interest, FifthEd.、米国保健社会福祉省、NIH刊行番号91−3242)。この用語の範囲内には、Ig群、すなわちIgG、IgA、IgE、IgM及びIgDが含まれる。この用語の範囲内には、IgGのサブタイプ、すなわちIgG1、IgG2、IgG3及びIgG4も含まれる。この用語は最も広い意味で使用され、モノクローナル抗体(全長モノクローナル抗体を含む)、ポリクローナル抗体、一本鎖抗体及び多重特異的抗体(例えば二重特異的抗体)を含む。
【0044】
「抗体断片」という用語は本発明との関連で使用される場合、CH2ドメインのN連結型グリコシル化部位を含む重鎖免疫グロブリン定常領域のCH2ドメインの少なくとも一部を含有し、抗原と特異的に結合することができる抗体の断片、すなわち少なくとも1つのVL鎖及び/若しくはVH鎖を有する鎖又はその結合部分を表す。
【0045】
「Fcドメイン」及び「Fc領域」という用語は、Fc受容体と呼ばれる細胞表面受容体及び補体系の幾つかのタンパク質と相互作用する抗体重鎖のC末端部を表す。この特性により、抗体が免疫系を活性化させることが可能になる。
【0046】
本発明との関連では、「糖タンパク質」という用語は、ポリペプチド側鎖に共有結合したオリゴ糖鎖(グリカン)を含有するタンパク質を表す。炭水化物は翻訳時修飾又は翻訳後修飾においてタンパク質に結合する。このプロセスはN−グリコシル化又はO−グリコシル化等のグリコシル化として知られる。
【0047】
「N−グリコシル化」はアスパラギンの側鎖上のアミド窒素への糖鎖の付加を意味する。「O−グリコシル化」はヒドロキシリシン、ヒドロキシプロリン、セリン又はスレオニンの側鎖上のヒドロキシル酸素への糖鎖の付加を意味する。
【0048】
「糖脂質」という用語は本発明との関連で使用される場合、炭水化物と結合した脂質を表す。糖脂質は、炭水化物の鎖が細胞膜の外形質(exoplasmic)表面上のリン脂質と結び付くと生じる。炭水化物は全ての真核細胞膜の外表面上に見られる。糖脂質の炭水化物構造は、脂質を付加するグリコシルトランスフェラーゼ及び付加後にグリカンを修飾するグリコシルヒドロラーゼにより制御される。糖脂質は、弱毒化生ワクチンとして使用されるウイルスを含むエンベロープウイルスの表面上にも生じる。
【0049】
「グリカン」又は「糖部分」という用語は、多糖又はオリゴ糖を表すのに本発明との関連では区別なく使用される。「オリゴ糖」という用語は、少数(典型的には3個〜10個)の構成糖(単純な糖又は単糖としても知られる)を含有するサッカリド重合体を意味する。「多糖」という用語は、グリコシド結合により結合した反復単位(典型的に10個を超える単糖又は二糖)から構成される炭水化物の重合体構造を意味する。グリカンは、糖タンパク質のようにタンパク質に結合して、又は糖脂質のように脂質に結合して見出されることがある。この用語は、N−グリカン、例えば高マンノース型N−グリカン、複合型N−グリカン又は混成型のN−グリカン、O−グリカンを包含する。
【0050】
本発明との関連では、以下の単糖を以下のように省略する:グルコース=Glc、ガラクトース=Gal、マンノース=Man、フコース=Fuc若しくはF、N−アセチルガラクトサミン=GalNAc、又はN−アセチルグルコサミン=GlcNAc。
【0051】
「N−グリカン」はN連結型の多糖又はオリゴ糖を意味する。N連結型オリゴ糖は例えば、タンパク質におけるアスパラギン残基のアミド窒素に連結したN−アセチルグルコサミン残基により結合している又は結合していたものである。N−糖タンパク質で見られる主要糖は、グルコース、ガラクトース、マンノース、フコース、N−アセチルガラクトサミン(GalNAc)、N−アセチルグルコサミン(GlcNAc)及びシアル酸(例えばN−アセチル−ノイラミン酸(NANA))である。糖類のプロセシングはERの内腔で翻訳時に起こり、N連結型糖タンパク質ではゴルジ装置でも継続する。N−グリカンはMan3GlcNAc2(「Man」はマンノースを表し、「Glc」はグルコースを表し、「NAc」はN−アセチルを表し、GlcNAcはN−アセチルグルコサミンを表す)の共通の五糖コアを有する。N−グリカンは、Man3GlcNAc2コア構造(「トリマンノースコア」、「五糖コア」又は「パウチマンノースコア」とも称される)に付加される周辺糖(例えばGlcNAc、ガラクトース、フコース及びシアル酸)を含む分岐(アンテナ)の数が異なる。N−グリカンは分岐の(branched)構成要素に応じて分類される(例えば高マンノース型、複合型又は混成型)。
【0052】
「高マンノース型N−グリカン」は、5個のマンノース残基(Man5)又はより多くのマンノース残基(例えばMan6、Man7又はMan8)を有するN連結型の多糖又はオリゴ糖を意味する。
【0053】
「複合型N−グリカン」は、典型的に「トリマンノース」コアの1,3マンノース結合手に結合した少なくとも1つのGlcNAcと、1,6マンノース結合手に結合した少なくとも1つのGlcNAcとを有するN連結型の多糖又はオリゴ糖を意味する。複合型N−グリカンは、任意でシアル酸又は誘導体(例えば「NANA」又は「NeuAc」(ここで「Neu」はノイラミン酸を表し、「Ac」はアセチルを表す)で修飾されたガラクトース(「Gal」)残基又はN−アセチルガラクトサミン(「GalNAc」)残基も有し得る。複合型N−グリカンは、「バイセクティング」GlcNAcとコアフコース(「Fuc」)とを含む鎖内置換も有し得る。複合型N−グリカンは本発明との関連では、0個(G0)、1個(G1)又は2個(G2)のガラクトースと、還元末端上の第1のGlcNAcに結合した1個のフコースとを含有し得る(それぞれG0F、G1F、G2Fと示される)。
【0054】
「混成型N−グリカン」は、トリマンノースコアの1,3マンノース結合手の末端上に少なくとも1つのGlcNAcと、トリマンノースコアの1,6マンノース結合手に0個以上(zero or more)のマンノースとを有するN連結型の多糖又はオリゴ糖を意味する。
【0055】
糖構造を説明するのに本発明との関連で使用される略語は以下のように規定される:
コア=Man3GlcNAc2
G0=GlcNAc2Man3GlcNAc2
G0−GlcNAc=1個のGlcNAcを欠くG0構造(すなわちGlcNAcMan3GlcNAc2)
G1=1個の更なるガラクトース残基を含有するG0構造(すなわちGalGlcNAc2Man3GlcNAc2)
G2=2個の更なるガラクトース残基を含有するG0構造(すなわちGal2GlcNAc2Man3GlcNAc2)
G0F=五糖コアの第1のGlcNAc残基に結び付いた1個の更なるフコース残基を含有するG0構造(すなわちGlcNAc2Man3GlcNAc2Fuc)
G0F−GlcNAc=五糖コアの第1のGlcNAc残基に結び付いた1個の更なるフコース残基を含有するG0−GlcNAc構造(すなわちGlcNAcMan3GlcNAc2Fuc)
G1F=五糖コアの第1のGlcNAc残基に結び付いた1個の更なるフコース残基を含有するG1構造(すなわちGalGlcNAc2Man3GlcNAc2Fuc)
G2F=五糖コアの第1のGlcNAc残基に結び付いた1個の更なるフコース残基を含有するG2構造(すなわちGal2GlcNAc2Man3GlcNAc2Fuc)
Man4=1個の更なるマンノース残基を含有するコア構造(すなわちManMan3GlcNAc2)
Man5=2個の更なるマンノース残基を含有するコア構造(すなわちMan2Man3GlcNAc2)
Man6=3個の更なるマンノース残基を含有するコア構造(すなわちMan3Man3GlcNAc2)
Man7=4個の更なるマンノース残基を含有するコア構造(すなわちMan4Man3GlcNAc2)
Man8=5個の更なるマンノース残基を含有するコア構造(すなわちMan5Man3GlcNAc2)
【0056】
「O−グリカン」はO連結型の多糖又はオリゴ糖を意味する。O連結型グリカンは通常、セリン残基又はトレオニン残基を介してペプチド鎖に結合する。O連結型グリコシル化は、ゴルジ装置で起こり、コンセンサス配列を必要としない真性の翻訳後事象であり、オリゴ糖前駆体はタンパク質転移に必要ではない。最も一般的なタイプのO連結型グリカンは最初のGalNAc残基(又はTnエピトープ)を含有し、これらは一般的にムチン型グリカンと称される。他のO連結型グリカンは、Ser/Thr残基と結合する最初の糖としてグルコサミン、キシロース、ガラクトース、フコース又はマンノース(mannose)を含む。O連結型糖タンパク質は通常、一般的にN−グリカンと比較して分岐がより少ない二分岐の巨大タンパク質(>200kDa)である。
【0057】
「自然状態ではその糖部分上において、フコースを含む分子」という用語は本発明との関連で使用される場合、糖部分にフコースを付加することが可能な、すなわち糖部分にフコースを付加する能力が変わらない真核細胞、好ましくは脊椎動物細胞における生成によると、少なくとも1つのフコース残基を含む糖部分を含む任意の化合物を表す。このような分子は、グリカン転移酵素によって認識される、例えばAsp残基、Ser残基又はThr残基、好ましくはトリペプチド配列Asn−X−Ser/Thr(ここでXはProを除く任意のアミノ酸である)を含む少なくとも1つ又は複数の配列モチーフを含む。フコースを有する糖部分を含む分子を生成する真核細胞(例えば脊椎動物細胞)の好ましい例は、CHO、AGE1.HN、AGE1.CR、AGE1.CR.PIX又はAGE1.CSである。好ましくはかかる化合物は、タンパク質、融合タンパク質又は脂質である。好ましくはタンパク質は、真核生物起源、好ましくは脊椎動物起源、最も好ましくは哺乳類起源のものであるか、又はそれらから誘導される。
【0058】
「その糖部分上において、フコースを欠いている分子」という用語は本発明との関連では、自然状態ではその糖部分上において、フコースを含む分子上に、検出可能な量のフコースが存在しないことを意味する。純度に関して表すと、「その糖部分上において、フコースを欠いている分子」は、自然状態ではその糖部分上において、フコースを含む分子がその糖部分上において、糖残基であるフコースを100%含んでいないことを意味する。
【0059】
「その糖部分上において、低減したフコース量を有する分子」という用語は、糖部分上において、フコース量が、糖部分にフコースを付加することが可能な、すなわち糖部分にフコースを付加する能力が変わらない細胞において発現される場合の数(n)から低減した分子を表す。このため、低減状態はn−x(ここで、nは上記の意味を有し、xは1〜(n−1)の整数である)である。好ましくは、自然状態でnが2である場合、n−xは1まで低減する。同様に、自然状態でnが3である場合、n−xは好ましくは2若しくは1まで低減し、自然状態でnが4である場合、n−xは好ましくは3、2若しくは1まで低減し、自然状態でnが5である場合、n−xは好ましくは4、3、2若しくは1まで低減し、又は自然状態でnが6である場合、n−xは好ましくは5、4、3、2若しくは1まで低減する。
【0060】
「その糖部分上において、低減したフコース量を有する分子の組成物」という用語は本発明との関連では、自然状態ではその糖部分上において、フコースを含む組成物の分子の、その糖部分上において、フコース数が低減したことを示すのに使用される。かかる比較は上記の細胞株により生成される分子を用いて行うのが好ましい。低減に関して表すと、この用語は、組成物の一定数の分子、好ましくは組成物の1pmol、10pmol、100pmol又は1000pmolの分子のうち、フコース残基数が10%〜95%、好ましくは約15%、約20%、約25%、約30%、約35%、40%、約45%、約50%、約55%、約60%、約65%、約70%、約75%、約80%、約85%、約86%、約87%、約88%、約89%、約90%、約91%、約92%、約93%又は約94%低減することを意味する。低減全体は、組成物におけるその糖部分上において、フコースを欠いている及び/又はその糖部分上において、フコース量が低減した組成物における分子の増大に起因するものであり得る。
【0061】
「その糖部分上において、フコースを実質的に含まない分子の組成物」という用語は本発明との関連では、自然状態ではその糖部分上において、フコースを含む組成物の分子が、その糖部分上において、糖残基であるフコースを本質的に欠いていることを示すのに使用される。純度に関して表すと、「その糖部分上において、フコースを実質的に含まない分子の組成物」という用語は、組成物の一定数の分子、好ましくは組成物の1pmol、10pmol、100pmol又は1000pmolの分子のうち、上記の分子の少なくとも約95%、約96%、約97%、約98%、約99%、約99.1%、約99.2%、約99.3%、約99.4%、約99.5%、約99.6%、約99.7%、約99.8%又は少なくとも約99.9%がその糖部分上において、糖残基であるフコースを含まないことを意味する。
【0062】
当業者は、(i)対象となる分子を生成する条件下で本発明の細胞を培養することと、(ii)上記分子を上記細胞から単離することと、(iii)その糖部分に結合したフコース残基に関して、上記分子の糖鎖構造を分析するとともに、上記分子の糖鎖構造に存在するフコース残基の平均値を算出することと、(iv)該結果を、該分子をフコースが低減していないグリコシル化パターンで産生する細胞で産生される同じ分子、例えば抗体分子の結果と比較することとにより、特定の分子、例えば抗体分子の糖部分上において、低減したフコース量を実験により容易に決定することができる。好ましくは、2つの実験に用いられる細胞は同一であるが、一方の細胞が基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用するが、GDP−6−デオキシ−D−リキソ−4−ヘキスロースをGDP−L−フコースに変換する反応を触媒しない酵素を少なくとも1つ含むという違いがある。好ましくは、両方の細胞を同一の培養条件下で培養し、培養条件の違いに起因し得るフコシル化の変化を排除する。
【0063】
分子、例えば抗体分子における糖鎖構造を、二次元糖鎖マッピング法(Anal. Biochem., 171,73 (1988)、非特許文献2)により簡単に分析することができる。二次元糖鎖マッピング法により推定される構造を、各糖鎖のMALDI(マトリックス支援レーザ脱離イオン化)−TOF−MS等の質量分析法を行うことにより決定することができる。
【0064】
真核細胞(例えば脊椎動物細胞)において糖部分を含む分子、例えばタンパク質又は脂質のフコシル化には、ドナーとしてのヌクレオチド糖、GDP−L−フコースと、更にドナーからアクセプタ分子へとフコシル残基を転移させる特定のフコシルトランスフェラーゼの存在とが要求される。真核細胞(例えば脊椎動物細胞)では、GDP−L−フコースを2つの異なる経路、主要なフコースde novo経路又は副次的なサルベージ経路のいずれかにより合成することができる。
【0065】
本発明者らは、真核細胞(例えば脊椎動物細胞)における基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを効率的に利用するが、GDP−6−デオキシ−D−リキソ−4−ヘキスロースをGDP−L−フコースへと変換する反応を触媒しない酵素(偏向(deflecting)酵素)の存在により、その糖部分上において、フコースを欠いている又は低減したフコース量を有する分子、例えばタンパク質又は脂質の生成がもたらされることを見出した。「GDP−6−デオキシ−D−リキソ−4−ヘキスロース」という用語は「GDP−4−ケト−6−デオキシ−D−マンノース」という用語と同義である。両方の用語は本明細書で区別なく使用される。
【0066】
このため第1の態様では、本発明は、自然状態ではその糖部分上において、フコースを含むが、その糖部分上において、フコースを欠いている又は低減したフコース量を有する分子を生成するための(改変)脊椎動物細胞であって、基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用するが、GDP−6−デオキシ−D−リキソ−4−ヘキスロースをGDP−L−フコースへと変換する反応を触媒しない酵素を少なくとも1つ含む、(改変)脊椎動物細胞を提供する。
【0067】
本発明の第1の態様の脊椎動物細胞に存在する酵素は、基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用する任意の酵素であり得るが、上記酵素はGDP−6−デオキシ−D−リキソ−4−ヘキスロースをGDP−L−フコースへと変換する反応を触媒しないものとする。それどころか上記酵素は、GDP−6−デオキシ−D−リキソ−4−ヘキスロースを、脊椎動物細胞におけるGDP−L−フコース合成にもはや利用することができない生成物へと変換する。
【0068】
本発明の第1の態様の脊椎動物細胞に含まれる酵素は、脊椎動物細胞には通常存在しない酵素、すなわち異種又は人工の酵素、例えば別の界の生物、例えば原核生物、好ましくは細菌由来の酵素である。代替的には、上記酵素は、通常脊椎動物細胞に存在するが、例えば突然変異の存在により基質GDP−6−デオキシ−D−リキソ−4−ヘキスロースをGDP−L−フコースに変換せず、異なる生成物へと変換する酵素であってもよい。
【0069】
本発明の第1の態様の脊椎動物細胞に存在する酵素を、例えばタンパク質マイクロインジェクション、タンパク質エレクトロポレーション又はタンパク質リポフェクションにより、脊椎動物細胞へと導入している。例えばDNAマイクロインジェクション、DNAエレクトロポレーション又はDNAリポフェクションにより、好ましくは発現ベクターに組み込まれた、酵素をコードする核酸配列を脊椎動物細胞に導入した後、脊椎動物細胞において各タンパク質へと転写及び翻訳することも可能である。当業者は、タンパク質又はタンパク質をコードする核酸配列を脊椎動物細胞に導入するための分子生物学技法、例えばマイクロインジェクション、エレクトロポレーション又はリポフェクションについての十分な情報を有し、これらの技法を実行する方法を知っている。
【0070】
基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用するが、GDP−6−デオキシ−D−リキソ−4−ヘキスロースのGDP−L−フコースへの変換を触媒しない2個以上、すなわち2個、3個、4個、5個、6個又は7個の酵素が脊椎動物細胞に存在し、上記細胞においてフコースde novo経路を効率的に遮断することが好ましい。
【0071】
好ましくは、基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用する酵素は、GDP−6−デオキシ−D−リキソ−4−ヘキスロースレダクターゼ(GDP−4−ケト−6−デオキシ−D−マンノースレダクターゼと同義であり、RMDと略される)、GDP−ペロサミンシンテターゼ(Per)、GDP−6−デオキシ−D−タロースシンテターゼ(GTS)、GDP−フコースシンテターゼCys109Ser(GFS−Cys109Ser)突然変異体、GDP−4−ケト−6−デオキシマンノース−3−デヒドラターゼ(ColD)、好ましくはGDP−L−コリトースシンターゼ(ColC)と組み合わせたGDP−4−ケト−6−デオキシマンノース−3−デヒドラターゼ(ColD)、及びその変異体からなる群から選択され、好ましくは酵素は細菌由来であるか、又はかかる細菌酵素から誘導される。より好ましくは、基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用する酵素はGDP−6−デオキシ−D−リキソ−4−ヘキスロースレダクターゼ(RMD)、GDP−フコースシンテターゼCys109Ser(GFS−Cys109Ser)突然変異体、及び/又はGDP−ペロサミンシンテターゼ(Per)である。
【0072】
GDP−6−デオキシ−D−リキソ−4−ヘキスロースレダクターゼ(RMD)は基質GDP−6−デオキシ−D−リキソ−4−ヘキスロースをGDP−D−ラムノースへと還元する。GDP−D−ラムノースは、細菌におけるD−ラムノシル化のためのヌクレオチド糖ドナーであり、脊椎動物では発生しない。脊椎動物細胞は特定のラムノシルトランスフェラーゼも欠いており、そのためGDP−D−ラムノースを脊椎動物細胞内の糖タンパク質又は糖脂質の新生糖構造に組み込むことができない。
【0073】
酵素GDP−6−デオキシ−D−タロースシンテターゼ(GTS)は基質GDP−6−デオキシ−D−リキソ−4−ヘキスロースをGDP−デオキシ−D−タロースへと還元する。GDP−デオキシ−D−タロースは、細菌における6−デオキシ−D−タロシル化のためのヌクレオチド糖ドナーであり、脊椎動物では発生しない。脊椎動物細胞は特定のデオキシタロシルトランスフェラーゼも欠いており、そのためGDP−デオキシ−D−タロースを脊椎動物細胞内の新生糖構造に組み込むことができない。
【0074】
さらに、酵素GDP−ペロサミンシンテターゼ(Per)は基質GDP−6−デオキシ−D−リキソ−4−ヘキスロースを還元し、アミノ基転移を行い、GDP−D−ペロサミンにする。GDP−D−ペロサミンは細菌、例えば大腸菌におけるペロサミニル化(perosaminylation)のためのヌクレオチド糖ドナーである。GDP−D−ペロサミンは通常、脊椎動物細胞には存在しない。脊椎動物細胞は特定のペロサミニルトランスフェラーゼも欠いており、そのためGDP−D−ペロサミンは脊椎動物細胞内で新生糖構造に結合することができない。
【0075】
そのため、異種酵素GTS及び/又はPerは、(i)脊椎動物細胞において基質GDP−6−デオキシ−D−リキソ−4−ヘキスロースを枯渇させ、(ii)GDP−L−フコース合成にもはや利用することができない人工生成物(すなわちGTSの場合、GDP−デオキシ−D−タロース、及びPerの場合、GDP−D−ペロサミン)の合成をもたらす。したがってGTS及び/又はPerを含む脊椎動物細胞で生成される、通常その糖部分にフコースを含む分子は、その糖部分上において、フコースを欠くか、又はフコース量が低減している。
【0076】
酵素GDP−4−ケト−6−デオキシマンノース−3−デヒドラターゼ(ColD)は、基質GDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用して、それをGDP−4−ケト−3,6−ジデオキシ−D−マンノースへと変換する。中間体GDP−4−ケト−3,6−ジデオキシ−D−マンノースは脊椎動物細胞では不安定であり得るため、ColDを酵素GDP−L−コリトースシンターゼ(ColC)と併用するのが好ましい。酵素ColCはGDP−4−デヒドロ−6−デオキシ−D−マンノースエピメラーゼ/レダクターゼの群に属する。酵素ColCは、中間体GDP−4−ケト−3,6−ジデオキシ−D−マンノースを安定した最終生成物であるGDP−L−コリトースへと更に変換する。生成物は両方とも、上記細胞がGDP−4−ケト−3,6−ジデオキシ−D−マンノース及び/又はGDP−L−コリトースを上記細胞に存在する分子の糖部分へと転移させるそれぞれのグリコシルトランスフェラーゼを欠いているため、脊椎動物細胞内の新生糖構造へと組み込むことはできない。このため、ColDがColCとともに脊椎動物細胞に存在するのが好ましい。
【0077】
酵素GDP−フコースシンテターゼ(GFS)(GDP−4−ケト−6−デオキシ−D−マンノースエピメラーゼ/レダクターゼ、GMERとしても知られる)は、脊椎動物細胞においてGDP−4−ケト−6−デオキシ−D−マンノースをGDP−L−フコースへと変換する。GFS反応はC−3''及びC−5''の両方でのエピマー化、その後のC−4でのカルボニルのNADPH依存性の還元を伴う。活性部位の突然変異体、好ましくはGFS−Cys109Serを本発明に使用し、これはGDP−4−ケト−6−デオキシ−D−マンノースをGDP−L−フコースとは異なる生成物、すなわちGDP−6−デオキシ−D−アルトロースへと変換する(Lau S.T.B., Tanner, M.E. 2008. Mechanism and active site residues ofGDP-Fucose Synthase, Journal of the American Chemical Society, Vol. 130, No.51, pp. 17593-17602を参照されたい)。
【0078】
好ましくは、GDP−6−デオキシ−D−リキソ−4−ヘキスロースレダクターゼ(RMD)、GDP−ペロサミンシンテターゼ(Per)、GDP−6−デオキシ−D−タロースシンテターゼ(GTS)、GDP−フコースシンテターゼCys109Ser(GFS−Cys109Ser)突然変異体、GDP−4−ケト−6−デオキシマンノース−3−デヒドラターゼ(ColD)、好ましくはGDP−L−コリトースシンターゼ(ColC)と組み合せたGDP−4−ケト−6−デオキシマンノース−3−デヒドラターゼ(ColD)、及びそれらの変異体からなる群から選択される2個以上、すなわち2個、3個、4個、5個、6個又は7個の酵素が脊椎動物細胞に存在する。
【0079】
本発明で好ましいRMD酵素、Per酵素、GTS酵素、GFS−Cys109Ser酵素、ColD酵素又はColC酵素の変異体は、アミノ酸配列における最大150個(すなわち最大1個、2個、3個、4個、5個、6個、7個、8個、9個、10個、11個、12個、13個、15個、16個、17個、18個、19個、20個、21個、22個、23個、24個、25個、26個、27個、28個、29個、30個、35個、40個、45個、50個、55個、60個、65個、70個、75個、80個、85個、90個、95個、100個、110個、120個、130個、140個又は150個)のアミノ酸の変化(すなわち交換、挿入、欠失、N末端切断及び/又はC末端切断)により誘導されるという点でRMD酵素、Per酵素、GTS酵素、GFS−Cys109Ser酵素、ColD酵素又はColC酵素とは異なる。アミノ酸の交換は保存的又は非保存的であり得る。本発明で好ましいRMD酵素、Per酵素、GTS酵素、GFS−Cys109Ser酵素、ColD酵素又はColC酵素の変異体は、代替的に又は付加的に、誘導元であるRMD酵素、Per酵素、GTS酵素、GFS−Cys109Ser酵素、ColD酵素又はColC酵素との或る特定の程度の配列同一性を特徴とすることができる。このため、本発明で好ましいRMD酵素、Per酵素、GTS酵素、GFS−Cys109Ser酵素、ColD酵素又はColC酵素の変異体は、それぞれの参照となるRMD酵素、Per酵素、GTS酵素、GFS−Cys109Ser酵素、ColD酵素又はColC酵素に対して少なくとも80%、少なくとも81%、少なくとも82%、少なくとも83%、少なくとも84%、少なくとも85%、少なくとも86%、少なくとも87%、少なくとも88%、少なくとも89%、少なくとも90%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%又は少なくとも99%の配列同一性を有する。好ましくは配列同一性は、それぞれの参照となるRMD酵素、Per酵素、GTS酵素、GFS−Cys109Ser酵素、ColD酵素又はColC酵素の40個、45個、50個、60個、70個、80個、90個、100個、150個、200個、250個、300又はそれ以上のアミノ酸の連続ストレッチにわたる、好ましくは全長にわたるものである。配列同一性が、それぞれの参照となるRMD酵素、Per酵素、GTS酵素、GFS−Cys109Ser酵素、ColD酵素又はColC酵素の全長にわたって少なくとも80%であり、全長にわたって少なくとも85%であり、全長にわたって少なくとも90%であり、全長にわたって少なくとも95%であり、全長にわたって少なくとも98%であり、又は全長にわたって少なくとも99.5%であるのが特に好ましい。配列同一性が、それぞれの参照となるRMD酵素、Per酵素、GTS酵素、GFS−Cys109Ser酵素、ColD酵素又はColC酵素の少なくとも200個若しくは250個のアミノ酸にわたって少なくとも80%であり、少なくとも200個若しくは250個のアミノ酸にわたって少なくとも85%であり、少なくとも200個若しくは250個のアミノ酸にわたって少なくとも90%であり、少なくとも200個若しくは250個のアミノ酸にわたって少なくとも95%であり、少なくとも200個若しくは250個のアミノ酸にわたって少なくとも98%であり、又は少なくとも200個若しくは250個のアミノ酸にわたって少なくとも99.5%であることも特に好ましい。
【0080】
RMD酵素、Per酵素、GTS酵素、GFS−Cys109Ser酵素、ColD酵素又はColC酵素の断片(すなわち欠失変異体)は、そのN末端及び/又はそのC末端及び/又はその内部に最大1個、2個、3個、4個、5個、6個、7個、8個、9個、10個、15個、20個、25個、30個、35個、40個、45個、50個、55個、60個、65個、70個、75個、80個、85個、90個、95個、100個、110個、120個、130個、140個又は150個のアミノ酸の欠失を有するのが好ましい。
【0081】
さらに、参照酵素に対して上記に示される程度の関連性を有するRMD酵素、Per酵素、GTS酵素、GFS−Cys109Ser酵素、ColD酵素又はColC酵素は、それぞれの参照酵素の活性の少なくとも30%程度まで関連の生体活性を示す場合にのみ変異体とみなされる。本発明との関連では、関連の「生体活性」は、「酵素活性」、すなわち基質GDP−6−デオキシ−D−リキソ−4−ヘキスロースを利用し、それをそれぞれGDP−D−ラムノース、GDP−D−ペロサミン、GDP−デオキシ−D−タロース、GDP−6−デオキシ−D−アルトロース、GDP−4−ケト−3,6−ジデオキシ−D−マンノース又はGDP−L−コリトースに変換するRMD酵素、Per酵素、GTS酵素、GFS−Cys109Ser酵素、ColD酵素又はColC酵素の変異体の活性である。当業者は、RMD酵素、Per酵素、GTS酵素、GFS−Cys109Ser酵素、ColD酵素又はColC酵素の変異体が、それぞれの参照となるRMD酵素、Per酵素、GTS酵素、GFS−Cys109Ser酵素、ColD酵素又はColC酵素の酵素活性のうちの少なくとも30%の酵素活性を有するかを容易に評価することができる。それぞれの参照酵素の酵素活性と比較した酵素変異体の「酵素活性」を決定するのに好適なアッセイ、例えば酵素活性アッセイが当業者にとって既知である。
【0082】
好ましくは、GDP−6−デオキシ−D−リキソ−4−ヘキスロースレダクターゼ(RMD)酵素は緑膿菌(Pseudomonasaeruginosa)由来である(配列番号1)。GDP−6−デオキシ−D−タロースシンテターゼ(GTS)酵素はアクチノバチルス・アクチノミセテムコミタンス(Actinobacillus actinomycetemcomitans)由来であるのが好ましい(配列番号2)。GDP−ペロサミンシンテターゼ(Per)酵素がコレラ菌(Vibrio cholerae)由来であるのが好ましい(配列番号3)。好ましくは、GDP−4−ケト−6−デオキシマンノース−3−デヒドラターゼ(ColD)が大腸菌由来である(配列番号4)。大腸菌由来のGDP−L−コリトースシンターゼ(ColC)の使用も好ましい(配列番号7)。野生型GDP−フコースシンテターゼ(GFS)はクリセツラス・グリセウス(Cricetulus griseus)(チャイニーズハムスター)由来である(配列番号5)。クリセツラス・グリセウス(チャイニーズハムスター)由来のGDP−フコースシンテターゼCys109Ser(GFS−Cys109Ser)突然変異体は配列番号6のアミノ酸配列を有する。
【0083】
上述のように、本発明は、基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用する酵素の変異体を包含する。このため本発明は、上述の配列の識別番号の変異体、すなわち配列番号1の変異体、配列番号2の変異体、配列番号3の変異体、配列番号3の変異体、配列番号4の変異体、配列番号5の変異体、配列番号6の変異体及び配列番号7の変異体も包含する。上記変異体の構造的定義及び/又は機能的定義については、上述の段落を参照する。
【0084】
好ましくは、RMD、Per、GTS、ColD、ColC又はGFS−Cys109Serの核酸配列はコドン最適化されている(codon-optimized)。「コドン最適化」という用語は本発明との関連で使用する場合、例えば、内部のTataボックス、chi部位、リボソーム侵入部位、RNA不安定性モチーフ、反復配列、強いRNA二次構造及び潜在スプライス部位の除去と、真核(例えば脊椎動物)細胞において利用度(utilization)がより高いコドン又は真核(例えば脊椎動物)細胞において高度に発現した遺伝子の使用とを意味する。
【0085】
さらに脊椎動物細胞においてフコースサルベージ経路が遮断されることが更に好ましい。このため、本発明の細胞を培養する際に、フコース及びフコシル化糖タンパク質を含まない成長培地を使用することが好ましい。
【0086】
脊椎動物細胞は該酵素に加えて又は該酵素の代わりに、GDP−L−フコース合成を阻害又は防止するためGDP−D−ラムノース、GDP−D−ペロサミン、GDP−デオキシ−D−タロース、GDP−6−デオキシ−D−アルトロース、GDP−4−ケト−3,6−ジデオキシ−D−マンノース及び/又はGDP−L−コリトースを含むが、これは思いがけず本発明者らが、人工糖GDP−D−ラムノース、GDP−D−ペロサミン、GDP−デオキシ−D−タロース、GDP−6−デオキシ−D−アルトロース、GDP−4−ケト−3,6−ジデオキシ−D−マンノース及び/又はGDP−L−コリトースの補充、特に細胞質補充(例えば細胞質内注入による)が脊椎動物細胞におけるフコース転移の阻害にプラスに寄与することに気が付いたためである。人工糖(複数も可)GDP−6−デオキシ−D−アルトロース、GDP−D−ラムノース及び/又はGDP−D−ペロサミンの補充が特に好ましい。
【0087】
基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用するが、GDP−6−デオキシ−D−リキソ−4−ヘキスロースをGDP−L−フコースに変換する反応を触媒しない酵素がエピソーム的に又は染色体的に脊椎動物細胞に一時的に存在する又は安定して維持される核酸配列から発現されることが好ましい。
【0088】
酵素、好ましくはGDP−6−デオキシ−D−リキソ−4−ヘキスロースレダクターゼ(RMD)、GDP−ペロサミンシンテターゼ(Per)、GDP−6−デオキシ−D−タロースシンテターゼ(GTS)、GDP−フコースシンテターゼCys109Ser(GFS−Cys109Ser)突然変異体、GDP−4−ケト−6−デオキシマンノース−3−デヒドラターゼ(ColD)又はGDP−L−コリトースシンターゼ(ColC)をコードする核酸配列が、細胞を形質転換するのに使用される発現ベクターに組み込まれる。
【0089】
好適な発現ベクターはプラスミド、コスミド、細菌人工染色体(BAC)及びウイルスベクターを含む。好ましくは、非ウイルス性の発現ベクターが使用される。
【0090】
酵素をコードする核酸の発現は発現制御配列により制御される。
【0091】
「発現制御配列」という用語は、真核細胞(例えば脊椎動物細胞)における操作可能に連結したコード配列の発現に影響を与えるヌクレオチド配列を表す。発現制御配列は、核酸配列の転写を制御する配列、例えばプロモーター、TATAボックス、エンハンサー;転写後事象、例えばポリアデニル化を制御する配列;及び翻訳を制御する配列である。
【0092】
好ましいプロモーターは、サイトメガロウイルスのhCMV前初期遺伝子プロモーター、SV40の初期若しくは後期プロモーターを含む構成的プロモーター、又はCUP−1プロモーター、例えばtet−onシステム若しくはtet−offシステムで利用されるtetリプレッサー、3−ホスホグリセリン酸キナーゼ(PGK)に関するプロモーター、酸ホスファターゼのプロモーター、及び酵母のα接合因子若しくはa接合因子のプロモーターを含む調節性プロモーター、例えば構成的CMV前初期遺伝子プロモーター、初期又は後期SV40プロモーター、ポリヘドリンプロモーター、レトロウイルスLTR、PGKプロモーター、伸長因子1−α(EF1−α)、EF2及びホスホエノールピルビン酸カルボキシキナーゼ(PEPCK)である。特に好ましいプロモーターは、潜在的な毒性問題を避けるための酵素の中程度の(intermediate)又は弱い発現のみを支持するプロモーターである。所定のプロモーターの発現強度は、該発現を内因性GAPDHの発現を目的とする強い構成的プロモーターの発現強度と比較することにより正規化することができる。GAPDHの10%〜1%の強度での酵素の発現を目的とするプロモーターが、中程度の発現を目的とするプロモーターとみなされ、1%未満の強度での酵素の発現を目的とするプロモーターが弱いプロモーターとみなされる。発現強度を、例えばリアルタイムPCRを含む当該技術分野で既知の方法により評価することができる。
【0093】
マーカータグも本発明の実施の形態で使用することができる。好ましくは、マーカータグの核酸配列が、タグ付されるタンパク質(例えば酵素、抗体)をコードする核酸配列に操作可能に連結する。好ましくは、マーカータグはGFP及びその変異体からなる群から選択される蛍光タンパク質(GFPを含むがこれに限定されない)である。本明細書で使用される場合、「操作可能に連結した」は、フレームシフト又は終止コドンを避けた対応する融合タンパク質のインフレーム発現が影響を受け得るように、1つの核酸が第2の核酸と連結していることを意味する。これらの用語は、対象となるコード核酸配列(例えば酵素、抗体)の発現を効果的に制御するための上記配列への発現制御配列の連結も意味する。これらの用語は、対象となるコード核酸配列(例えば酵素、抗体)との親和性タグ又はマーカータグをコードする核酸配列の連結も表す。
【0094】
発現ベクターにおける酵素RMD、Per、GTS、GFS−Cys109Ser、ColD又はColCをコードする核酸配列が、脊椎動物特異的な発現制御配列と操作可能に連結する(linked)ことにより、脊椎動物細胞において酵素RMD、Per、GTS、GFS−Cys109Ser、ColD又はColCをコードする核酸配列の発現が可能になることが好ましい。
【0095】
結果として、酵素(複数も可)RMD、Per、GTS、GFS−Cys109Ser及び/又はColD、好ましくはColCと組み合わせたColDが、所望の効果に最適な収率で本発明の脊椎動物細胞において発現される。酵素の性質及び発現に使用される細胞に応じて、これらの収率は高くても、中程度であっても、又は低くてもよい。当業者が高い、中程度の又は低いレベルの発現を得るために適切な脊椎動物特異的な発現制御配列を選択することは容易である。
【0096】
脊椎動物細胞における酵素(複数も可)RMD、Per、GTS、GFS−Cys109Ser及び/又はColD、好ましくはColCと組み合わせたColDの発現には、GDP−L−フコース合成を効果的に阻止し、これにより自然状態ではその糖部分上において、フコースを含むが、それらの発現によりその糖部分上において、フコースを欠いている、又は低減したフコース量を有する分子の生成がもたらされる効果がある。
【0097】
組換えタンパク質の長期的な高収率の生成のために、安定した発現が好ましい。例えば、基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用するが、GDP−6−デオキシ−D−リキソ−4−ヘキスロースをGDP−L−フコースへと変換する反応を触媒しない酵素、及びタンパク質、例えば抗体をコードする核酸を安定して発現する真核細胞(例えば脊椎動物細胞)を改変することができる。ウイルスの複製起点を含有する発現ベクターを使用することなく、真核細胞(例えば脊椎動物細胞)を適切な発現制御配列(例えばプロモーター、エンハンサー、配列、転写ターミネーター、ポリアデニル化部位等)によって制御されるベクターと、任意で選択可能なマーカーとを用いて形質転換することができる。外来DNAの導入後に、形質転換した細胞を、このような細胞由来の核酸を分析することにより、発現の効果(例えばレクチン結合を用いたフコースを欠くこと)を検出することにより検出することができ、又は形質転換した細胞を、選択圧を加えることにより選択することができる。好適な選択系は当該技術分野で既知である。
【0098】
好ましくは、脊椎動物細胞は、フコシルトランスフェラーゼに対する基質となることができる少なくとも1つの(アクセプタ)分子を更に含む。「フコシルトランスフェラーゼに対する基質となることができる(アクセプタ)分子」という用語は本発明の関連で使用される場合、フコシル化活性が変わらない細胞で生成される場合、少なくとも1つのフコース残基が結合した糖部分を有する又は含む、対象となる任意の化合物、例えばタンパク質、ポリペプチド、オリゴペプチド、脂質、脂質断片又は融合タンパク質を表す。かかる化合物はフコシルトランスフェラーゼに関する好適な基質である。したがって好ましいアクセプタ分子は、糖タンパク質、糖ポリペプチド、糖オリゴペプチド、糖脂質、糖脂質断片又はグリコシル化融合タンパク質である。「フコシルトランスフェラーゼに対する基質となることができる(アクセプタ)分子」という用語は本発明の関連で使用される場合、少なくとも1つのフコース残基が結合することができるプロスペクティブ(prospective)糖タンパク質又は糖脂質、すなわち脊椎動物細胞による生成後にフコシルトランスフェラーゼにより、フコースが結合することができる単糖を含むオリゴ糖構造が連結したタンパク質又は脂質である限りにおいて、いずれのタンパク質又は脂質をも表す。好ましくはタンパク質は原核生物起源のものではない。タンパク質が哺乳類タンパク質である又はそれから誘導されるのが特に好ましい。
【0099】
本発明の脊椎動物細胞におけるフコシルトランスフェラーゼに対する基質となることができる分子、例えば少なくとも1つのフコース残基が結合することができる糖部分を含むタンパク質又は脂質の存在により、フコース残基が結合することができるにもかかわらずその糖部分上において、フコースを含まない、又はその糖部分上において、低減したフコース量を有するこの分子が生成される。
【0100】
フコシルトランスフェラーゼに対する基質となることができる分子はタンパク質、好ましくは内因性又は外因性のタンパク質であるのが好ましい。「外因性タンパク質」という用語は、各細胞の外側由来のものであるか、又は各細胞へと導入される核酸により細胞内において発現される任意のタンパク質を意味する。「内因性タンパク質」という用語は、細胞のゲノムによりコードされる任意のタンパク質を表す。好ましくは対象となるタンパク質、すなわちプロスペクティブ糖タンパク質は組換えによって脊椎動物細胞で発現される。上記タンパク質は脊椎動物細胞に一時的に存在する又は安定して維持される核酸配列から発現されるのが好ましい。好適な発現ベクター及び発現制御配列は酵素に関して上記されている。これらは対象となるタンパク質をコードする核酸の発現に関して同様に使用することができる。
【0101】
このため本発明の好ましい実施の形態では、脊椎動物細胞は、
(i)脊椎動物特異的な発現制御配列(それぞれの酵素をコードする核酸配列の発現を可能とする)に操作可能に連結した、酵素GDP−6−デオキシ−D−リキソ−4−ヘキスロースレダクターゼ(RMD)、GDP−ペロサミンシンテターゼ(Per)、GDP−6−デオキシ−D−タロースシンテターゼ(GTS)、GDP−フコースシンテターゼCys109Ser(GFS−Cys109Ser)突然変異体、GDP−4−ケト−6−デオキシマンノース−3−デヒドラターゼ(ColD)又はGDP−L−コリトースシンターゼ(ColC)をコードする核酸配列を含む少なくとも1つのポリヌクレオチドと、
(ii)脊椎動物特異的な発現制御配列(上記細胞において対象となるタンパク質、例えばIgG1のような抗体をコードする核酸配列の発現をもたらす)に操作可能に連結した、対象となるタンパク質、すなわちプロスペクティブ糖タンパク質、例えばIgG1のような抗体をコードする核酸配列を含む少なくとも1つのポリヌクレオチドと、
を含む。
【0102】
結果として、(i)酵素(複数も可)RMD、Per、GTS、GFS−Cys109Ser及び/又はColD、好ましくはColCと組み合わせたColDと、(ii)対象となるタンパク質(複数も可)、すなわちプロスペクティブ糖タンパク質(複数も可)、例えばIgG1のような抗体とが本発明の脊椎動物細胞において発現される。
【0103】
好ましくは、本発明の第1の態様では、タンパク質は抗体、抗体断片、融合タンパク質、ウイルスタンパク質、ウイルスタンパク質断片、抗原又はホルモンである。最も好ましくは、抗体又は抗体断片は、IgG、好ましくはIgG1、IgG2、IgG3、IgG4、IgM、IgA、IgD及びIgEからなる群から選択される。最も好ましくは、融合タンパク質は、抗体のFc領域、例えばIgGのFc領域、例えばIgG1、IgG2、IgG3、IgG4、IgM、IgA、IgD又はIgEのFc領域を含む。最も好ましくは、ホルモンは卵胞刺激ホルモン(FSH)、性腺刺激ホルモン、甲状腺刺激ホルモン、インターロイキン−2、インターロイキン−6、インターロイキン−10、インターロイキン−11、可溶性インターロイキン−4、エリスロポエチン又はトロンボポエチンである。好ましくは、ウイルスタンパク質又はウイルスタンパク質断片はエンベロープウイルスのエンベロープ膜に含まれる。ウイルスタンパク質が呼吸器合胞体ウイルス由来のGタンパク質又はFタンパク質であり、かつウイルスタンパク質断片が上記タンパク質の細胞外断片であるのが特に好ましい。
【0104】
本発明の更なる態様は、上記のウイルスタンパク質又はウイルスタンパク質断片を含むウイルスである。
【0105】
フコシルトランスフェラーゼに対する基質となることができる分子は脂質であるのが好ましい。好ましくは、脂質はグリセロ糖脂質、最も好ましくはガラクト脂質、スルホ脂質(SQDG)又はスフィンゴ糖脂質、最も好ましくはセレブロシド(例えばガラクトセレブロシド又はグルコセレブロシド)、ガングリオシド、グロボシド、スルファチド又はホスホスフィンゴ糖脂質である。脂質はエンベロープウイルスのエンベロープ膜に含まれるのが特に好ましい。
【0106】
スフィンゴ糖脂質(GSL)が特に好ましい。スフィンゴ糖脂質は疎水性セラミドアンカーであるN−アシルスフィンゴシンと、サッカリドから構成される親水性ヘッド基とを含有する。スフィンゴ糖脂質は通常、細胞膜の外表面に見られる。サッカリド部分の組成は細胞型に特有のものであり、生物の発生段階に応じて様々であり、又は細胞の発がん状態とともに変化し得る。
【0107】
最も好ましくは、ウイルスタンパク質及び/又は脂質がエンベロープウイルスのエンベロープに含まれる。
【0108】
既に上述したように、タンパク質はエンベロープウイルスのエンベロープ膜に含まれるウイルスタンパク質であり得る。脂質はエンベロープウイルスのエンベロープ膜に含まれる脂質でもあり得る。
【0109】
本発明の更なる態様は上記脂質を含むウイルスである。
【0110】
上述のウイルスをウイルス感染により脊椎動物細胞に導入することができる。ウイルスを、産生されるウイルスの全て又は一部をコードする核酸を導入することによって、脊椎動物細胞に導入することもできる。複製、例えばアセンブリ(assembly:集合化)に要求されるタンパク質を提供する必要がある場合、このことは通常、1つ又は複数のウイルスタンパク質を発現することが可能なウイルス産生細胞株を使用することにより達成される。例えばHEK293細胞、Per.C6細胞及びAGE1.HN細胞がアデノウイルスE1Aタンパク質を発現し、そのためE1コード領域を欠くDNAを補完することが可能である。
【0111】
好ましくは、脊椎動物細胞は哺乳類細胞、魚類細胞、両生類細胞、爬虫類細胞又は鳥類細胞である。
【0112】
i)哺乳類細胞がヒト細胞、ハムスター細胞、イヌ細胞若しくはサル細胞、好ましくはチャイニーズハムスター卵巣細胞(CHO)、アフリカミドリザル腎臓細胞(VERO−76)(ATCC CRL−1587)、ヒト子宮頸癌細胞(HeLa)(ATCC CCL 2)、メイディンダービー(Darby)イヌ腎臓細胞(MDCK)(ATCC CCL 34)、ヒトPER.C6細胞(Crucell(Leiden, The Netherlands)の市販細胞)、若しくはヒト(ホモ・サピエンス(homo sapiens))AGE1.HN細胞(ProBioGen(Berlin, Germany)の市販細胞)であり、
ii)魚類細胞がアメリカナマズ(Ictalurus punctatus)(チャネル・キャットフィッシュ)卵巣(CCO)細胞(ATCC CRL−2772)であり、
iii)両生類細胞がアフリカツメガエル(Xenopus laevis)腎臓細胞(ATCC CCL−102)であり、
iv)爬虫類細胞がグリーンイグアナ(Iguana iguana)心臓細胞(IgH−2)(ATCC CCL−108)であり、又は
v)鳥類細胞がトリ網膜細胞AGE1.CR、若しくはAGE1.CR.PIX、若しくはトリ体節細胞AGE1.CS(全ての細胞がノバリケン(Muscovy duck)(カイリナ・モスチャタ(Cairina moschata))から誘導される)であることが特に好ましい。
【0113】
これらの細胞株は全て、ProBioGen AGから市販されている。
【0114】
細胞株AGE1.CR.PIX(17a11b)は、DSMZ-Deutsche Sammlung vonMikroorganismen und Zellkulturen GmbH(Mascheroder Weg1b, 38124 Braunschweig, Germany)にProBioGen AG(Goethestr. 54, 13086 Berlin, Germany)によって2005年11月24日にアクセッション番号DSM ACC2749で寄託された。細胞株AGE1.HN(NC5T11#34)は、DSMZ-Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH(Mascheroder Weg 1b, 38124 Braunschweig, Germany)にProBioGen AG(Goethestr. 54, 13086 Berlin,Germany)によって2005年11月4日にアクセッション番号DSM ACC2744で寄託された。細胞株AGE1.CR.PIX(17a11b)はノバリケン(カイリナ・モスチャタ)の胚性網膜細胞から誘導される。細胞株AGE1.HN(NC5T11#34)はヒト(ホモ・サピエンス)胎児の脳室周囲の神経領域から誘導される。両方の細胞株をアデノウイルスE1A及びE1Bタンパク質の安定した組込み及び発現により不死化させる。
【0115】
別の好ましい脊椎動物細胞はVIVALIS(Nantes, France)の市販細胞である鳥類EB14細胞である。他の好ましい脊椎動物細胞は以下の表1に要約される。
【0116】
【表1】

表1中の英語
細胞株
寄託番号
起源
誘導体
野生型
ATCCによる寄託なし
マウス骨髄腫
幼ハムスターの腎臓(Kidney)
チャイニーズハムスターの卵巣
クリセツラス・グリセウス
ヒトの胚腎臓
【0117】
脊椎動物細胞は、GDP−D−ラムノース、GDP−D−ペロサミン、GDP−デオキシ−D−タロース、GDP−6−デオキシ−D−アルトロース、GDP−4−ケト−3,6−ジデオキシ−D−マンノース又はGDP−L−コリトースが通常、脊椎動物細胞において合成されない又は存在しないため、上記糖に対するグリコシルトランスフェラーゼを自然状態では含まない。このためたとえ人工糖GDP−D−ラムノース、GDP−D−ペロサミン、GDP−デオキシ−D−タロース、GDP−6−デオキシ−D−アルトロース、GDP−4−ケト−3,6−ジデオキシ−D−マンノース又はGDP−L−コリトースが本発明の第1の態様による脊椎動物細胞において不自然に生成されたとしても、上記糖をタンパク質又は脂質の新生糖構造に組み込むことはできない。
【0118】
しかしながら本発明者らは、それぞれの異種グリコシルトランスフェラーゼ、及び任意でさらにそれぞれの異種GDP−デオキシヘキソース糖ヌクレオチド輸送体が脊椎動物細胞に存在していれば、人工糖GDP−D−ラムノース、GDP−D−ペロサミン、GDP−デオキシ−D−タロース、GDP−6−デオキシ−D−アルトロース、GDP−4−ケト−3,6−ジデオキシ−D−マンノース又はGDP−L−コリトースをタンパク質又は脂質のグリカン構造に組み込むことができることを予期せず発見した。
【0119】
したがって好ましい実施の形態では、本発明の第1の態様による脊椎動物細胞は、好ましくは脊椎動物細胞に含まれ、脊椎動物特異的な発現制御配列に操作可能に連結した核酸によりコードされる、GDP−D−ラムノース、GDP−D−ペロサミン、GDP−デオキシ−D−タロース、GDP−6−デオキシ−D−アルトロース、GDP−4−ケト−3,6−ジデオキシ−D−マンノース又はGDP−L−コリトースに対する少なくとも1つのグリコシルトランスフェラーゼ(該発現制御配列により上記核酸配列の発現が可能になる)と、任意で好ましくは脊椎動物細胞に含まれ、脊椎動物特異的な発現制御配列に操作可能に連結した核酸によりコードされる、GDP−D−ラムノース、GDP−D−ペロサミン、GDP−デオキシ−D−タロース、GDP−6−デオキシ−D−アルトロース、GDP−4−ケト−3,6−ジデオキシ−D−マンノース又はGDP−L−コリトースに対する少なくとも1つのGDP−デオキシヘキソース糖ヌクレオチド輸送体(該発現制御配列により上記核酸配列の発現が可能になる)とを更に含む。より好ましい実施の形態では、本発明の第1の態様による脊椎動物細胞は、GDP−D−ラムノース、GDP−D−ペロサミン及び/又はGDP−6−デオキシ−D−アルトロースに対するグリコシルトランスフェラーゼを更に含む。
【0120】
2個以上、例えば2個、3個、4個、5個、6個又は7個の上述のグリコシルトランスフェラーゼと、任意で2個以上、例えば2個、3個、4個、5個、6個又は7個の上述のGDP−デオキシヘキソース糖ヌクレオチド輸送体が脊椎動物細胞、例えば真核細胞に存在することが特に好ましい。
【0121】
かかる核酸の一時的な又は安定した発現のための好適なシステムは、当業者に既知であるが、好ましいものが上記されており、グリコシルトランスフェラーゼ及び任意でGDP−デオキシヘキソース糖ヌクレオチド輸送体を発現することに関して同じように使用することができる。
【0122】
好ましくは、GDP−D−ラムノース、GDP−D−ペロサミン、GDP−デオキシ−D−タロース、GDP−6−デオキシ−D−アルトロース、GDP−4−ケト−3,6−ジデオキシ−D−マンノース又はGDP−L−コリトースに対するグリコシルトランスフェラーゼが組換えによって脊椎動物細胞で発現される。GDP−D−ラムノース、GDP−D−ペロサミン、GDP−デオキシ−D−タロース、GDP−6−デオキシ−D−アルトロース、GDP−4−ケト−3,6−ジデオキシ−D−マンノース又はGDP−L−コリトースに対するグリコシルトランスフェラーゼを脊椎動物細胞に一時的に存在する又は安定して維持される核酸配列から発現することができる。上述のGDP−デオキシヘキソース糖ヌクレオチド輸送体が組換えによって脊椎動物細胞で発現されることも好ましい。上記GDP−デオキシヘキソース糖ヌクレオチド輸送体を脊椎動物細胞に一時的に存在する又は安定して維持される核酸配列から発現することができる。
【0123】
このため本発明の別の好ましい実施の形態では、脊椎動物細胞は、
(i)脊椎動物特異的な発現制御配列に操作可能に連結した、酵素GDP−6−デオキシ−D−リキソ−4−ヘキスロースレダクターゼ(RMD)、GDP−ペロサミンシンテターゼ(Per)、GDP−6−デオキシ−D−タロースシンテターゼ(GTS)、GDP−フコースシンテターゼCys109Ser(GFS−Cys109Ser)突然変異体、GDP−4−ケト−6−デオキシマンノース−3−デヒドラターゼ(ColD)又はGDP−L−コリトースシンターゼ(ColC)をコードする核酸配列を含む少なくとも1つのポリヌクレオチドと、
(ii)脊椎動物特異的な発現制御配列に操作可能に連結した、対象となるタンパク質、すなわちプロスペクティブ糖タンパク質、例えばIgG1のような抗体をコードする核酸配列を含む少なくとも1つのポリヌクレオチド(該発現制御配列により上記細胞において上記タンパク質をコードする核酸配列の発現が可能になる)と、
(iii)脊椎動物特異的な発現制御配列に操作可能に連結した、GDP−D−ラムノース、GDP−D−ペロサミン、GDP−デオキシ−D−タロース、GDP−6−デオキシ−D−アルトロース、GDP−4−ケト−3,6−ジデオキシ−D−マンノース又はGDP−L−コリトースに対するグリコシルトランスフェラーゼをコードする核酸配列を含む少なくとも1つのポリヌクレオチド(該発現制御配列により上記細胞において上記タンパク質をコードする核酸配列の発現が可能になる)と、任意で
(iv)脊椎動物特異的な発現制御配列に操作可能に連結した、GDP−D−ラムノース、GDP−D−ペロサミン、GDP−デオキシ−D−タロース、GDP−6−デオキシ−D−アルトロース、GDP−4−ケト−3,6−ジデオキシ−D−マンノース又はGDP−L−コリトースに対するGDP−デオキシヘキソース糖ヌクレオチド輸送体をコードする核酸配列を含む少なくとも1つのポリヌクレオチド(該発現制御配列により上記細胞において上記タンパク質をコードする核酸配列の発現が可能になる)と、
を含む。
【0124】
結果として、(i)酵素(複数も可)と、(ii)対象となるタンパク質(複数も可)と、(iii)グリコシルトランスフェラーゼ(複数も可)と、任意で(iv)GDP−デオキシヘキソース糖ヌクレオチド輸送体とが本発明の脊椎動物細胞において過剰発現される。
【0125】
上記タンパク質(複数も可)は、酵素(複数も可)の最終生成物(複数も可)、すなわちGDP−D−ラムノース、GDP−D−ペロサミン、GDP−デオキシ−D−タロース、GDP−6−デオキシ−D−アルトロース、GDP−4−ケト−3,6−ジデオキシ−D−マンノース及び/又はGDP−L−コリトースを利用し、それらをその糖部分上において、フコースを欠いている又は低減したフコース量を有するタンパク質(複数も可)の糖構造に組み込む同時発現したグリコシルトランスフェラーゼ(複数も可)により、更に修飾される。これにより、その糖部分上において、D−ラムノース、D−ペロサミン、デオキシ−D−タロース、6−デオキシ−D−アルトロース、4−ケト−3,6−ジデオキシ−D−マンノース及び/又はL−コリトースを含む新たな人工タンパク質(複数も可)が生成される。
【0126】
好ましくは、上述のGDP−デオキシヘキソース糖ヌクレオチド輸送体は、ゴルジ体のGDP−デオキシヘキソース糖ヌクレオチド輸送体、すなわち脊椎動物細胞、例えば真核細胞のゴルジ膜を介した上述のヌクレオチド糖の輸送を可能にする輸送体である。
【0127】
本発明による(改変)脊椎動物細胞を使用して、その糖部分上において、フコースを有しない又はその糖部分上において、低減したフコース量を有する、エンベロープ表面の糖タンパク質又は糖脂質を含む、エンベロープウイルスを産生することができる。
【0128】
好ましくは、エンベロープウイルスを、完全に又は部分的にウイルスワクチンの活性成分として使用する。「ウイルスワクチン」という用語は、投与するとウイルスに対する抗体産生又は細胞性免疫を刺激するが、重大な感染を引き起こす能力のない弱毒化又は死滅ウイルスの製剤を意味する。
【0129】
本発明による(改変)脊椎動物細胞を使用して、その糖部分上において、D−ラムノース、D−ペロサミン、デオキシ−D−タロース、6−デオキシ−D−アルトロース、4−ケト−3,6−ジデオキシ−D−マンノース及び/又はL−コリトースを含む、エンベロープ表面の糖タンパク質又は糖脂質を含む、エンベロープウイルスを産生することもできる。
【0130】
第2の態様では、本発明は、自然状態ではその糖部分上において、フコースを含むが、その糖部分上において、フコースを欠いている又は低減したフコース量を有する分子を生成する方法であって、
i)第1の態様による脊椎動物細胞を準備する工程と、
ii)i)における該細胞からフコシルトランスフェラーゼに対する基質となることができる分子、好ましくはタンパク質又は脂質を単離する工程と、
を含む、自然状態ではその糖部分上において、フコースを含むが、その糖部分上において、フコースを欠いている又は低減したフコース量を有する分子を生成する方法に関する。
【0131】
好ましくは、工程i)では、フコシルトランスフェラーゼに対する基質となることができる分子、例えばタンパク質がi)における細胞で発現する。
【0132】
上記分子、例えばその糖部分上において、フコースを欠いている又は低減したフコース量を有するタンパク質又は脂質を工程ii)において脊椎動物細胞から容易に単離することができる。
【0133】
修飾分子、例えばその糖部分上において、フコースを欠いている若しくは低減したフコース量を有するタンパク質を含む、真核細胞(例えば脊椎動物細胞)内に包まれる又はかかる細胞から分泌される分子に関して様々な単離法が当該技術分野で既知である。かかる方法は通常、細胞内分子の場合、細胞の収集、分解及び分画/精製と、細胞を含まない培養上清の生成、その後の分泌された分子の精製とを伴う。
【0134】
本発明に有用な抽出法は単離対象の修飾分子に妨害されない。例えば抽出を、強い洗浄剤及び還元剤又はタンパク質変性を誘導することができる任意の作用物質の非存在下で行うのが好ましい。
【0135】
第3の態様では、本発明は、第2の態様の方法により入手可能な、その糖部分上において、フコースを欠いている又は低減したフコース量を有する分子を提供する。好ましくは、この分子は脂質又はタンパク質である。
【0136】
第1の態様に関して上記されたように、タンパク質は抗体、ホルモン、抗原又はウイルスタンパク質であるのが特に好ましい。
【0137】
脂質はグリセロ糖脂質、最も好ましくはガラクト脂質、スルホ脂質(SQDG)又はスフィンゴ糖脂質、最も好ましくはセレブロシド(例えばガラクトセレブロシド又はグルコセレブロシド)、ガングリオシド、グロボシド、スルファチド又はホスホスフィンゴ糖脂質であるのが特に好ましい。好ましくは脂質、例えばガングリオシドはエンベロープウイルスの膜に含まれる。
【0138】
最も好ましくは、ウイルスタンパク質及び/又は脂質がエンベロープウイルスのエンベロープに含まれる。
【0139】
更なる態様では、本発明は、第3の態様による分子の組成物を提供する。
【0140】
第4の態様では、本発明は、第2の態様の方法により入手可能な、D−ラムノース、D−ペロサミン、デオキシ−D−タロース、6−デオキシ−D−アルトロース、4−ケト−3,6−ジデオキシ−D−マンノース、及び/又はL−コリトースを含有する糖部分を含む分子を提供する。
【0141】
この分子はその糖部分上において、L−フコースを含まない、又はL−フコース量が低減しているのが好ましい。好ましくは、この分子は脂質又はタンパク質である。さらにかかる修飾分子、好ましくは脂質及び/又はタンパク質を発現する脊椎動物細胞、好ましくは腫瘍細胞が提供される。D−ラムノースを含むグリカンを含有する腫瘍細胞が特に好ましい。D−ラムノースは、ガノデルマ・ルシダム(Ganoderma lucidum:霊芝)多糖の構成要素である。これらの多糖は免疫エフェクター細胞の活性を高める伝統的な漢方薬に使用されている:NK細胞及びリンホカイン活性化キラー細胞を活性化させ、マクロファージの貪食及び細胞毒性を増大させる(Zhu et al., 2007, Journal of Ethnopharmacology 111 (2), 219-226)。かかる細胞を使用して、例えば活性な免疫化アプローチのように、所定の腫瘍細胞に対する免疫応答を増大させることができる。
【0142】
更なる態様では、本発明は第4の態様による分子の組成物を提供する。
【0143】
第5の態様では、本発明は、
i)70%〜95%、すなわち70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%及び95%、好ましくは80%のG0−GlcNac、G0、G1及び/又はG2の複合型N−グリカンと、
ii)5%〜30%、すなわち5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、26%、27%、28%、29%及び30%、好ましくは20%の高マンノース型N−グリカンと、
を含む糖タンパク質を含む組成物であって、該糖タンパク質の該複合型N−グリカンがフコースを含まない、又はフコースを実質的に含まない、糖タンパク質を含む組成物を提供する。好ましくは、該組成物の糖タンパク質は上記の好ましい糖タンパク質、特に抗体である。
【0144】
該組成物内で複合型N−グリカンの70%〜80%、好ましくは約75%がG0の複合型N−グリカンであり、20%〜30%、好ましくは約25%がG0−GlcNac、G1及び/若しくはG2の複合型N−グリカンであり、並びに/又は高マンノース型N−グリカンの45%〜55%、好ましくは約50%がman5グリカンであり、45%〜55%、好ましくは約50%がman6、man7及び/若しくはman8 N−グリカンであるのが特に好ましい。それぞれの場合の数字は合計で100%になることが理解される。
【0145】
また、該組成物内で複合型N−グリカンの70%〜90%、好ましくは約80%がG0の複合型N−グリカンであり、10%〜30%、好ましくは約20%がG0−GlcNac、G1及び/若しくはG2の複合型N−グリカンであり、並びに/又は高マンノース型N−グリカンの60%〜85%、好ましくは約70%がman5グリカンであり、15%〜40%、好ましくは約30%がman6、man7及び/若しくはman8 N−グリカンであるのが特に好ましい。それぞれの場合の数字は合計で100%になることが理解される。
【0146】
糖タンパク質は本発明の第1の態様との関連で好ましいとして示されたもの、特に抗体、例えばIgG1、IgG2、IgG3又はIgG4であるのが好ましく、これらの抗体は非改変の親細胞(例えば脊椎動物細胞のような真核細胞)で産生される抗体組成物よりも高いADCC活性を有するのが好ましい。
【0147】
ADCCは腫瘍(がん)細胞に指向性を有する抗体がその効果を発揮する主要な機構である。ADCCを使用して、自己免疫疾患における発病を妨げるために特定の免疫細胞を取り除くこともできる。
【0148】
ウイルス感染症及び細菌感染症を含む様々な疾患を、本発明による高いADCC活性を有する抗体を使用してウイルス又は細菌に感染した細胞の増殖を抑制することにより予防及び治療することができる。
【0149】
第6の態様では、本発明は、D−ラムノース、D−ペロサミン、デオキシ−D−タロース、6−デオキシ−D−アルトロース、4−ケト−3,6−ジデオキシ−D−マンノース及び/又はL−コリトースを含有する糖部分を含む、タンパク質、好ましくは非原核生物タンパク質、好ましくはウイルス若しくは哺乳類のタンパク質、又は脂質、好ましくは非原核生物脂質、例えばスフィンゴ糖脂質を提供する。好ましくは、ウイルスタンパク質及び/又は脂質がエンベロープウイルスのエンベロープに含まれる。代替的には、かかるタンパク質及び/又は脂質を含む、真核細胞、好ましくは脊椎動物細胞、より好ましくは哺乳類細胞、最も好ましくはヒト細胞(同種又は自己の腫瘍細胞)が提供される。
【0150】
好ましくは、タンパク質又は脂質は、その糖部分上において、D−ラムノース、D−ペロサミン、デオキシ−D−タロース、6−デオキシ−D−アルトロース、4−ケト−3,6−ジデオキシ−D−マンノース及び/又はL−コリトース、より好ましくはD−ラムノース及び/又はD−ペロサミンを含み、かつその糖部分上において、L−フコースを含まない又はL−フコース量が低減している。第6の態様のタンパク質がまた、本発明の方法の好ましい態様及び特に好ましい態様を用いた結果として起こる全ての特性を有し得ることは明らかである。
【0151】
人工糖、例えばD−ラムノース、D−ペロサミン、デオキシ−D−タロース、6−デオキシ−D−アルトロース、4−ケト−3,6−ジデオキシ−D−マンノース及び/又はL−コリトースが、例えば細菌表面上の電荷を中和することにより、カチオン性ペプチド、例えばポリミキシンB、ディフェンシン等に対する耐性を付与することが知られている(Breazeale et al., 2003, The Journal of Biological Chemistry, 278,24731-24739を参照されたい)。
【0152】
ディフェンシンは、例えば真核生物(例えば脊椎動物)に見られる低分子の高システインカチオン性タンパク質である。ディフェンシンは、細菌、真菌、並びに多くのエンベロープウイルス及び非エンベロープウイルスに対して活性がある。ディフェンシンは、6個(脊椎動物では)〜8個の保存されたシステイン残基を含む18個〜45個のアミノ酸からなる。免疫系の真核(例えば脊椎動物)細胞が、例えば好中性顆粒球及びほとんど全ての上皮細胞において貪食された細菌を死滅させるのを助けるためにこれらのペプチドを含有する。
【0153】
このため、その糖部分上において、D−ラムノース、D−ペロサミン、デオキシ−D−タロース、6−デオキシ−D−アルトロース、4−ケト−3,6−ジデオキシ−D−マンノース及び/又はL−コリトース、好ましくはカチオン性アミノ糖であるD−ペロサミンを含有するウイルスタンパク質を含む、エンベロープウイルスの確立は、これらのウイルスがディフェンシン及び先天性免疫防御の他のカチオン性ペプチドの攻撃に対して耐性であるため、例えばベクターとして遺伝子療法において極めて有用である。その糖部分上において、糖残基D−ラムノース、D−ペロサミン、デオキシ−D−タロース、6−デオキシ−D−アルトロース、4−ケト−3,6−ジデオキシ−D−マンノース及び/又はL−コリトースを1つ又は複数含有するウイルス又はウイルス糖タンパク質の産生は優れた免疫応答を誘導するのに極めて有用である。これらの糖残基は自然状態で哺乳類の糖タンパク質には存在しない。しかしながらこれらの糖残基は、細菌の糖タンパク質及びリポ多糖には存在することが多い。RMD配列の供給源である緑膿菌は、免疫不全宿主及び嚢胞性線維症(CF)の患者で見られる最も重要な細菌性病原体の1つである。
【0154】
特に、糖残基D−ペロサミンを含有するタンパク質又は糖残基D−ペロサミンを含有するウイルスタンパク質を含むエンベロープウイルスの確立が、D−ペロサミンのカチオン性(cationicity)のために好まれる。そのエンベロープに糖残基D−ペロサミンを含有する糖タンパク質を含むウイルスはカチオン性の表面電荷を有し、これにより上記ウイルスを先天性免疫防御から保護することができる。
【0155】
第7の態様では、本発明は、基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用するが、GDP−6−デオキシ−D−リキソ−4−ヘキスロースをGDP−L−フコースへと変換する反応を触媒しない酵素をコードする核酸配列を含む(第1の)ポリヌクレオチドに操作可能に連結した脊椎動物の発現制御配列を1つ又は複数含む発現単位を提供する。
【0156】
発現単位は、1つ又は複数の脊椎動物の発現制御配列及び基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用する酵素をコードする核酸配列を含む(第1の)ポリヌクレオチドを組み込むことができる当業者に既知の任意の発現系、例えばプラスミド、コスミド、ウイルス等であり得る。
【0157】
好ましくは、発現単位に含まれる1つ又は複数の脊椎動物の発現制御配列は、基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用する酵素をコードする核酸配列を含む(第1の)ポリヌクレオチドと操作可能に連結することにより、脊椎動物細胞、例えばCHO細胞又はHeLa細胞において基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用する酵素をコードする核酸配列の発現が可能になる。
【0158】
好ましくは、発現ベクター、例えばプラスミドベクターにより、脊椎動物細胞の細胞質における基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用する酵素をコードする核酸配列の一時的な発現が可能になる、又は上記細胞のゲノムにおける上記配列の組込み後の脊椎動物細胞において基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用する酵素をコードする核酸配列の安定した発現が可能になる。
【0159】
基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用する酵素は、GDP−6−デオキシ−D−リキソ−4−ヘキスロースレダクターゼ(RMD)、GDP−ペロサミンシンテターゼ(Per)、GDP−6−デオキシ−D−タロースシンテターゼ(GTS)、GDP−フコースシンテターゼCys109Ser(GFS−Cys109Ser)突然変異体、GDP−4−ケト−6−デオキシマンノース−3−デヒドラターゼ(ColD)、好ましくはGDP−L−コリトースシンターゼ(ColC)と組み合わせたGDP−4−ケト−6−デオキシマンノース−3−デヒドラターゼ(ColD)、及びその変異体からなる群から選択されるのが特に好ましい。
【0160】
好ましくは、発現単位は、好ましくは1つ又は複数の脊椎動物の発現制御要素、例えばプロモーターと操作可能に連結し、好ましくは発現ベクター、例えばプラスミドベクターに含まれることにより、脊椎動物細胞、例えばCHO細胞、HeLa細胞又は腫瘍細胞、好ましくは自己腫瘍細胞においてグリコシルトランスフェラーゼをコードする核酸配列の発現が可能になる、GDP−D−ラムノース、GDP−D−ペロサミン、GDP−デオキシ−D−タロース、GDP−6−デオキシ−D−アルトロース、GDP−4−ケト−3,6−ジデオキシ−D−マンノース又はGDP−L−コリトースに対する上記グリコシルトランスフェラーゼをコードする核酸配列を含む(第2の)ポリヌクレオチドと、任意で、好ましくは1つ又は複数の脊椎動物の発現制御要素、例えばプロモーターと操作可能に連結し、好ましくは発現ベクター、例えばプラスミドベクターに含まれることにより、脊椎動物細胞、例えばCHO細胞、HeLa細胞又は腫瘍細胞、好ましくは自己腫瘍細胞においてGDP−デオキシヘキソース糖ヌクレオチド輸送体をコードする核酸配列の発現が可能になる、GDP−D−ラムノース、GDP−D−ペロサミン、GDP−デオキシ−D−タロース、GDP−6−デオキシ−D−アルトロース、GDP−4−ケト−3,6−ジデオキシ−D−マンノース又はGDP−L−コリトースに対する上記GDP−デオキシヘキソース糖ヌクレオチド輸送体をコードする核酸配列を含む(第3の)ポリヌクレオチドとを更に含む。
【0161】
上記の第1の、第2の、及び任意で第3のポリヌクレオチドを発現ベクター、例えば一時的な発現ベクター又は細胞のゲノムに組み込むベクターに別々に組み込むことができる。代替的に、上記の第1の、第2の、及び任意で第3のポリヌクレオチドは1つの発現ベクターに含まれ得る。発現は1つのプロモーター、2つのプロモーター又は3つのプロモーターから駆動され得る。前者の場合、第1の、第2の、及び任意で第3のポリヌクレオチドによりコードされるタンパク質が単一の転写産物として転写され、IRESでのみ分離されるのが好ましい。
【0162】
本発明の好ましい実施の形態では、発現単位は、好ましくはそれぞれ1つの発現ベクターに、2つの発現ベクターに、又は3つの発現ベクターに含まれる、酵素RMDをコードする核酸配列を含む第1のポリヌクレオチドに操作可能に連結した1つ又は複数の脊椎動物の発現制御配列と、GDP−D−ラムノースに対するグリコシルトランスフェラーゼをコードする核酸配列を含む第2のポリヌクレオチドに操作可能に連結した1つ又は複数の脊椎動物の発現制御配列と、任意に、GDP−D−ラムノースに対するGDP−デオキシヘキソース糖ヌクレオチド輸送体をコードする核酸配列を含む第3のポリヌクレオチドに操作可能に連結した1つ又は複数の脊椎動物の発現制御配列とを含む。
【0163】
本発明の別の好ましい実施の形態では、発現単位は、第1のポリヌクレオチド内に含まれる酵素RMDをコードする核酸配列の発現を制御する1つ又は複数の脊椎動物の発現制御配列と、第2のポリヌクレオチド内に含まれるGDP−D−ラムノースに対するグリコシルトランスフェラーゼをコードする核酸配列と、任意で、第3のポリヌクレオチド内のGDP−D−ラムノースに対するGDP−デオキシヘキソース糖ヌクレオチド輸送体をコードする核酸配列とを含み、第1の、第2の、及び任意で第3のポリヌクレオチドは、IRESで互いに分離され、好ましくは発現ベクターに含まれる。
【0164】
本発明の第7の態様による発現単位は医薬に、特に免疫刺激から利益を受ける疾患、特に腫瘍の治療法又は予防法に関するワクチンの調製に使用することもできる。
【0165】
さらに第7の態様との関連では、特に発現される様々な核酸、例えばGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用する酵素の中程度又は低い発現を誘導する発現制御要素を含むポリヌクレオチドに関する、本発明の第1の態様の更なる好ましい実施の形態及び特に好ましい実施の形態は全て、第7の態様との関連で等しく好ましい。
【0166】
多くの場合、対象となる導入遺伝子を所望のレベルで発現する効果的な薬学的な産生細胞株を生成及び開発するのに、生物医薬品企業はかなりの時間を費やし、多大な努力が為されてきた。対象となる導入遺伝子がADCCエフェクター機能の向上からの利益を受けることができる治療抗体である場合、高産生細胞がN−糖部分へとコア−フコースを結合することができない、又はN−糖部分へと人工糖を結合することができるように、産生細胞株を更に操作することが強く望まれる。
【0167】
好ましくは、既に上述のように、発現単位は、GDP−D−ラムノース、GDP−D−ペロサミン、GDP−デオキシ−D−タロース、GDP−6−デオキシ−D−アルトロース、GDP−4−ケト−3,6−ジデオキシ−D−マンノース又はGDP−L−コリトースに対するグリコシルトランスフェラーゼをコードする核酸配列を含む第2のポリヌクレオチドと、任意でGDP−D−ラムノース、GDP−D−ペロサミン、GDP−デオキシ−D−タロース、GDP−6−デオキシ−D−アルトロース、GDP−4−ケト−3,6−ジデオキシ−D−マンノース又はGDP−L−コリトースに対するGDP−デオキシヘキソース糖ヌクレオチド輸送体をコードする核酸配列を含む第3のポリヌクレオチドとを更に含む。
GDP−D−ラムノース、GDP−D−ペロサミン、GDP−デオキシ−D−タロース、GDP−6−デオキシ−D−アルトロース、GDP−4−ケト−3,6−ジデオキシ−D−マンノース又はGDP−L−コリトースに対するグリコシルトランスフェラーゼをコードする核酸配列を含む第2のポリヌクレオチドが、1つ又は複数の脊椎動物の発現制御配列に操作可能に連結することにより、脊椎動物細胞、例えばHeLa細胞又はCHO細胞において上記グリコシルトランスフェラーゼをコードする核酸配列の発現が可能になることが好ましい。GDP−D−ラムノース、GDP−D−ペロサミン、GDP−デオキシ−D−タロース、GDP−6−デオキシ−D−アルトロース、GDP−4−ケト−3,6−ジデオキシ−D−マンノース又はGDP−L−コリトースに対するGDP−デオキシヘキソース糖ヌクレオチド輸送体をコードする核酸配列を含む第3のポリヌクレオチドが、1つ又は複数の脊椎動物の発現制御配列に操作可能に連結することにより、脊椎動物細胞、例えばHeLa細胞又はCHO細胞において上記GDP−デオキシヘキソース糖ヌクレオチド輸送体をコードする核酸配列の発現が可能になることも好ましい。
【0168】
異なる核酸配列の互いに対する発現の比は脊椎動物細胞のゲノムにおけるコピー数及び組込み部位の両方に応じて変わる。標準的なスクリーニングプロセスにより、所望の比で個々の遺伝子産物を発現する細胞クローンを単離することが可能である。
【0169】
上記の好ましい発現単位を、糖タンパク質又は糖脂質の新生糖構造へとフコース以外の人工糖(例えばD−ラムノース、D−ペロサミン、デオキシ−D−タロース又は6−デオキシ−D−アルトロース)を結合することが可能になるように、既存の細胞株(例えばCHO、HeLa)に容易に適用することができる。この発現単位を、糖タンパク質の新生糖構造へとフコース以外の人工糖(例えばD−ラムノース)を結合することが可能になるように、例えば人工グリコシル化構造を有する抗体、例えばIgG1/+D−ラムノースを産生するために、予め遺伝子操作された細胞株(例えばIgG1産生CHO細胞)に容易に適用することもできる。
【0170】
好ましくは、発現単位は対象となるタンパク質、例えばIgG1をコードする核酸配列を含む更なるポリヌクレオチドを(第2の、第3の又は第4のポリヌクレオチドのいずれかとして)含む。対象となるタンパク質、例えばIgG1をコードする核酸を含む更なるポリヌクレオチドが、発現制御配列に操作可能に連結することにより、脊椎動物細胞、例えばHeLa細胞又はCHO細胞において上記タンパク質をコードする核酸配列の発現が可能になることが好ましい。
【0171】
本発明の第7の態様の発現単位との関連では、本発明の第1の及び第2の態様に教示される、全ての要素、好ましくは酵素をコードする核酸、発現制御要素、基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用するが、GDP−6−デオキシ−D−リキソ−4−ヘキスロースをGDP−L−フコースへと変換する反応を触媒しない酵素をコードする核酸配列が同様に好ましい。
【0172】
第8の(eighth)態様では、本発明は、通常その糖部分上において、フコースを含むが、その糖部分上において、フコースを欠いている又は低減したフコース量を有するタンパク質を生成するための(改変)真核細胞であって、
i)基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用する酵素をコードする核酸配列を含む第1のポリヌクレオチドと、
ii)タンパク質をコードする核酸配列を含む第2のポリヌクレオチドと、
を含み、該酵素がGDP−6−デオキシ−D−リキソ−4−ヘキスロースをGDP−L−フコースに変換する反応を触媒しない、通常その糖部分上において、フコースを含むが、その糖部分上において、フコースを欠いている又は低減したフコース量を有するタンパク質を生成するための(改変)真核細胞に関する。
【0173】
真核細胞に関しては、本発明の第1の態様の脊椎動物細胞との関連でこれまでに記載された好ましい実施の形態及び特に好ましい実施の形態が全て、同様に好ましい。
【0174】
好ましくは、真核細胞は、好ましくは本発明の第1の態様に関して上記で概説されたような、脊椎動物細胞、例えば哺乳類細胞、魚類細胞、両生類細胞、爬虫類細胞若しくは鳥類細胞、又は昆虫細胞である。バキュロウイルス発現系とともに使用される昆虫細胞、例えばSf9細胞又はHi5細胞が、高い収率及び速度のために糖タンパク質を産生するのに好ましい。しかしながら、昆虫細胞由来の糖タンパク質はコアα1,3−フコースを含有し得る。糖残基は昆虫由来糖タンパク質に対する広範な(amajor extend to)抗体、特にIgE抗体に寄与する。糖残基は昆虫の糖タンパク質に対するアレルギー反応の基盤である。
【0175】
基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用するが、GDP−6−デオキシ−D−リキソ−4−ヘキスロースをGDP−L−フコースへと変換する反応を触媒しない酵素を少なくとも1つ含む昆虫細胞はそのグリカン上でフコースを欠いている又はフコースが低減している。これにより、かかる糖タンパク質(glycoproteins)に対するアレルギー反応が低減する又は取り除かれる。
【0176】
上述の(改変)真核細胞は、基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用する酵素をコードする核酸配列を含む2つ以上のポリヌクレオチド、例えば基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用する異なる酵素をコードする複数の核酸配列を含む複数のポリヌクレオチドを含んでいてもよい(本発明の第1の態様を参照されたい)。
【0177】
第9の態様では、本発明は、通常その糖部分上において、フコースを含むが、その糖部分上において、フコースを欠いている又は低減したフコース量を有するタンパク質を生成する方法であって、
i)第8の態様による真核細胞を準備する工程と、
ii)上記細胞において該第1のポリヌクレオチドによりコードされる該酵素及び該第2のポリヌクレオチドによりコードされる該タンパク質を発現する工程と、
iii)上記細胞から該タンパク質を単離する工程と、
を含む、通常その糖部分上において、フコースを含むが、その糖部分上において、フコースを欠いている又は低減したフコース量を有するタンパク質を生成する方法に関する。
【0178】
本発明の真核細胞を使用する方法に関しては、本発明の第1の態様の脊椎動物細胞及び本発明の第2の態様の方法に関してこれまでに記載された好ましい実施の形態及び特に好ましい実施の形態は全て、本発明の第9の態様に関しても同様に好ましい。
【0179】
第10の態様では、本発明は、第9の態様の方法により入手可能な、その糖部分上において、フコースを欠いている又は(or)低減したフコース量を有するタンパク質に関する。
【0180】
本発明の様々な変更形態及び変形形態が、本発明の範囲を逸脱することなく当業者に明らかである。本発明を特定の好ましい実施の形態に関連して説明したが、特許請求される発明はそのような特定の実施の形態に不当に限定されないことが理解されよう。実際に、関連分野の当業者に明らかな本発明を実施する記載の形態の様々な変更形態は、本発明に包含されることが意図される。
【0181】
以下の図面及び実施例は本発明の一例にすぎず、添付の特許請求の範囲によって示される本発明の範囲を限定するものとは決して解釈すべきではない。
【図面の簡単な説明】
【0182】
【図1】真核細胞(例えば脊椎動物(vertebrate)細胞)におけるフコースのサルベージ経路及びde novo経路の概略図である。フコースの非存在下では、細胞はサルベージ経路を介してGDP−フコースを合成することができない(右側のパネルを参照されたい)。de novo経路は中間体GDP−4−ケト−6−デオキシマンノースの通常脊椎動物細胞では生じない終末(dead end)生成物への酵素的変換により遮断することができる(左側のパネル)。例えば偏向酵素がRMDである場合、終末生成物はGDP−D−ラムノースである。GDP−D−ラムノース等のGDP−デオキシヘキソースはGMD酵素に対してフィードバック阻害を示すことにより、フコースde novo経路、及び代替的なGDP−ラムノース合成を更に遮断することができる。
【図2】RMD導入遺伝子を安定して過剰発現するRMD−CHO−IgG細胞のGFP蛍光を示す図である。
【図3】RMD導入遺伝子を発現するクローンのRT−PCR分析を示す図である。レーンM=bp−DNAマーカー、レーン1:RMD−CHO−IgGクローン1;レーン2:RMD−CHO−IgGクローン2;レーン3:RMD−CHO−IgGクローン3;レーン4:RMD−CHO−IgGクローン4;レーン5:RMD−CHO−IgGクローン5;レーン6:RMD−CHO−IgGクローン6;レーン7:CHO−IgG親クローン;レーン8:陰性PCR対照。RMDバンドは全てのRMDをトランスフェクトしたクローンで見ることができる。
【図4】CHO−IgG細胞(B)及びRMD−CHO−IgG細胞(A)のIgG1から放出される過メチル化N−グリカンのMALDI MSプロファイルの総観的比較を示す図である。PNGase F消化により放出される抗体Fcのオリゴ糖を、smartbeam−II(商標)レーザを備えたUltraFlex III TOF/TOF質量分析計を使用して分析した。m/z値ピークはナトリウムと結合した(associated)オリゴ糖イオンに対応する。全ての標識化[M+Na]+分子イオンシグナルを注釈したように割り当てることができた。パネルAに示されるMALDIスペクトルにおける主なm/zピークの164Daシフトはフコースの喪失を示している。各ピークのオリゴ糖構造図はそれぞれの注釈付きピークの上に示す。RMD導入遺伝子を安定して過剰発現するRMD−CHO−IgG細胞で発現した治療用IgG1抗体から得られたN−糖構造は、MALDIピーク相対強度に基づくと、結合したフコース残基が完全になく、相対的により大量の高マンノース構造を含有する(パネルA;主要な高マンノース構造を丸で囲った)が、非改変CHO−IgG親細胞で発現した治療用IgG1抗体から得られたN−糖構造はコア−フコシル化されており、高マンノース構造の含有量は顕著に少ない(フコース残基=丸で囲った黒色の三角;パネルB)。
【図5−1】(A)WT CHO細胞;(B)RMD−CHOクローンH1;(C)RMD−CHOクローンH2;(D)RMD−CHOクローンH3を使用して産生した脱シアル化IgG N−グリカンのMALDI−TOFスペクトルを示す図である。全ての分子イオンはナトリウム化(sodiated)[M+Na+]形態又はカリウム化(potassiated)[M+K+]形態(黒色の十字型)のいずれかで存在する。暗灰色の円、Man;明灰色の円、Gal;黒色の四角、GlcNAc;黒色の三角、Fuc;白色の十字型、いずれの炭水化物材料も含有しない。
【図5−2】C)RMD−CHOクローンH2;(D)RMD−CHOクローンH3を使用して産生した脱シアル化IgG N−グリカンのMALDI−TOFスペクトルを示す図である。
【図6】(A)血漿の非存在下でのWT IgG及び非フコシル化IgGに対するFcgRIIIa−His(Phe158)の結合曲線を示す図である。FcγRIIIa結合を、捕捉試薬としてFcγRIIIa−His、検出試薬として抗ヒトIgGペルオキシダーゼ結合抗体、及び発色基質としてテトラメチルベンジジン(TMB)を使用するELISAにより検出した。点は450nmでペルオキシダーゼと反応したTMBの吸光度の中央値(n=2)を示す。バーはSDを示す。白丸=野生型のフコシル化IgG(WT)、黒丸=クローンH1由来の非フコシル化IgG(H1);黒四角=クローンH2由来の非フコシル化IgG(H2);上向きの黒三角=クローンH3由来の非フコシル化IgG(H3)。(B)WT IgGに対する非フコシル化IgGのFcγRIII結合の相対的な増加倍率を示す図である。FcγRIII結合の相対的な増加倍率を、EC50値から算出した。WT、野生型フコシル化IgG;H1、クローンH1由来の非フコシル化IgG;H2、クローンH2由来の非フコシル化IgG;H3、クローンH3由来の非フコシル化IgG。
【図7】ADCC活性アッセイに関するNK細胞の調製及び分析を示す図である。(A)ADCCアッセイに使用される単離した初代NK細胞の純度レベルを示すドットプロット。初代NK細胞を電磁ビーズ分離により健常なヒトドナーの全血から単離した。それから単離したNK細胞を、NK細胞マーカーCD16及びCD56に対する抗体を使用するフローサイトメトリにより純度に関して分析した。(B)単離したNK細胞の性能。単離したNK細胞の細胞溶解活性を決定するために、カルセインAMで染色したK562標的細胞を単独で、NK細胞とともに、又は細胞溶解剤サポニンとともに4時間インキュベートした。インキュベートした標的細胞から放出される平均蛍光強度(MFI)は細胞溶解の程度を間接的に示す。自発的細胞溶解で得られたMFIから減算したNK媒介性の細胞溶解で観察されるMFIは、ADCCアッセイで観察される可能な最大限の比MFIを示す。NK媒介性の溶解は総溶解から得られるMFIレベルに完全には達しないことに留意する。
【図8】CHO及びRMD−CHO由来の非フコシル化及びフコシル化IgGのin vitroでのADCC活性を示す図である。点は所定のIgG濃度(%)での特異的細胞溶解の平均(n=4)(%)を示す。バーは±SDを示す。野生型IgG(白四角)、クローンH1由来の非フコシル化IgG(黒丸)、クローンH2由来の非フコシル化IgG(下向きの黒三角)及びクローンH3由来の非フコシル化IgG(上向きの黒三角)。比較データをSK−BR−3細胞を標的細胞として使用して得た(データは示さず)。
【図9】(A)非改変CHO細胞及び(C)RMD−CHOクローンH2の細胞質画分から加水分解した単糖のHPAEC−PADプロファイルを示す図である。(B)は10pmol/μlのL−ラムノースを加えた(A)であり、(D)は10pmol/μlのL−ラムノースを加えた(C)である。単糖はTFA加水分解後に再N−アセチル化されなかったので、GlcNAcはGlcNH2として測定した。選択された条件下で、L−ラムノースのピークはおよそ15.5分の保持時間で溶出する。改変クローンH2由来の細胞溶解物のHPAEC−PADクロマトグラムではフコースのピークが存在しないことに留意されたい。
【図10】(A)WT CHO細胞及び(C)改変RMD−CHOクローンH2由来のIgG N−グリカンから放出された単糖のHPAEC−PADプロファイルを示す図である。(B)は10pmol/μlのL−ラムノースを加えた(A)であり、(D)は10pmol/μlのL−ラムノースを加えた(C)である。単糖はTFA加水分解後に再N−アセチル化されなかったので、GlcNAcはGlcNH2として測定した。選択された条件下で、L−ラムノースのピークはおよそ15.5分の保持時間で溶出する。RMD−CHOクローンH2由来のIgG N−グリカン試料のHPAEC−PADクロマトグラムではフコースのピークが存在しないことに留意されたい。 なお、図面中の訳の意味は以下である;図1DE NOVO PATHWAY de novo経路Putative feedback inhibition 推定フィードバック阻害GDP-Mannose GDP−マンノースGDP-Mannose-4,6-Dehydratase GDP−マンノース−4,6−デヒドラターゼGDP-4-keto-6-deoxymannose GDP−4−ケト−6−デオキシマンノース3,5-Epimerase 3,5−エピメラーゼGDP-4-keto-6-deoxygalactose GDP−4−ケト−6−デオキシガラクトース4-Reductase 4−レダクターゼGDP-Fucose GDP−フコースGDP-D-Rhamnose GDP−D−ラムノースDead end 終末Major Pathway 主要経路Independent of Fucose source フコース供給源には非依存的Blocked by deflection of metabolic precursor 代謝前駆体の偏向により遮断されるSALVAGE PATHWAY サルベージ経路Lysosome リソソームExtracellular Space 細胞外空間L-Fucose L−フコースFucose-Kinase フコースキナーゼFucose-1-Phosphate フコース−1−ホスフェートGDP-Fucose Pyrophosphorylase GDP−フコースピロホスホリラーゼMinor Pathway 副次的な経路dependent of Fucose source フコース供給源に依存的Blocked by avoidance of external fucose source 外部フコース供給源の回避により遮断される図5Intensity 強度図6Absorption 吸光度Concentration 濃度X-fold increase over WT WTに対するX倍増大図7Gate ゲートspontaneous lysis 自発的溶解NK-mediated lysis NK媒介性の溶解Total lysis 総溶解Control 対照図8specific cell lysis 特異的細胞溶解conc 濃度図9PAD response PAD応答Deoxyribose デオキシリボースtime[min] 時間(分)図10PAD response PAD応答Deoxyribose デオキシリボースtime[min] 時間(分)
【発明を実施するための形態】
【実施例】
【0183】
1.実験部
1.1 材料及び方法
1.1.1 細胞株
組換えCHO/DG44細胞株CHO−IgGは、ジヒドロ葉酸レダクターゼ欠損CHO細胞株、CHO/DG44(Urlaubet al., 1986, Proc Natl Acad Sci USA. 83 (2): 337-341)の、治療用モノクローナル抗体(トラスツズマブ(ハーセプチン(商標))の軽鎖及び重鎖をコードするヌクレオチド配列を含む抗体発現カセットを含有する発現ベクターを用いる安定したトランスフェクションにより本発明者らの研究所で以前に樹立された。細胞株RMD−CHO−IgGの生成は既存のCHO−IgG細胞株から始めた。両方の細胞株が血清無含有培地で維持された。
【0184】
1.1.2 遺伝子最適化及び合成
オキシドレダクターゼRmdに関するアミノ酸配列(緑膿菌PAO1;304個のアミノ酸)(GenBankアクセッション番号GenBank:AAG08839.1)を逆翻訳し、得られたヌクレオチド配列を、CHO細胞(クリセツラス・グリセウス)の要件に適合するように、潜在スプライス部位及びRNA不安定化配列要素のノックアウト、RNA安定性の増大に関する最適化、並びにコドン使用頻度の適応により最適化した。
【0185】
1.1.3 RMD発現プラスミドの構築
合成したRMD構築物をEcoRI及びBgl IIにより切断し、ウシ腸ホスファターゼにより脱リン酸化した(dephosphorylated)。消化及び脱リン酸化した挿入物を事前に消化させた2シストロン性の発現ベクターへとライゲートし、それにより2シストロン性のメッセージからのRMDと緑色蛍光タンパク質(gfp)との協調した同時発現が可能になる。発現プラスミドは2シストロン性の発現カセットを安定して組み込んだ細胞の直接選択を可能にするネオマイシン耐性遺伝子を備える。発現プラスミドを構築するための一般的手順は、Sambrook, J., E.F. Fritsch and T. Maniatis: Cloning I/II/III, ALaboratory Manual New York/Cold Spring Harbor Laboratory Press, 1989, SecondEditionに記載されている。
【0186】
1.1.4 抗体産生CHO−IgG細胞の非フコシル化抗体を分泌する細胞への変換
IgG1型の治療抗体トラスツズマブを安定して発現するCHO−IgG細胞を、製造業者の取扱説明書(MicroPorator,PEQLAB Biotech, Germany)に従ってエレクトロポレーションによりRMD−gfp導入遺伝子を用いて安定にトランスフェクトした。エレクトロポレーションの24時間後、トランスフェクタントを、抗生物質G418を含有するα−MEMにおいて選択した。それからG418耐性クローンを限界希釈クローニングにより単離した。すなわちG418耐性クローンを、この選択培地中で再懸濁し、ポアソン統計に基づき単一の細胞からコロニーが得られる尤度が95%を超える希釈率で96ウェルプレートに播種した。確実に単クローン性にするために、96ウェル内で成長させた細胞を単離し、限界希釈率で96ウェルプレートに再び播種した。これらの2回の単一細胞のクローニング後、幾つかの単離された単一細胞のクローンをより大きい容量へと増殖させた。その後、それらを懸濁状態での成長に適合させた。培養皿におけるgfp蛍光分布から評価されるように、記載のエレクトロポレーションプロトコルを用いて、2×106個のエレクトロポレーションを行った細胞あたりおよそ2000個という形質転換効率が達成された(図2)。
【0187】
1.1.5 蛍光顕微鏡検査によるクローンのスクリーニング
単一細胞のクローンを96ウェルプレートに播種し、cmountアダプタを取り付けたOlympus IX−50(OlympusOptical Co., Europe)を用いたGFP蛍光のモニタリングにより、RMD組込みの成功に関してスクリーニングした。GFPスキャンに関して、200倍の倍率(extension)で蛍光フィルタを位相差に対して使用した。画像をViewfinder liteの適用により編集した。さらに、RMD導入遺伝子のmRNA発現をRT−PCR分析により確認した。RMD導入遺伝子の発現の成功を、RMD特異的なプライマーセットを使用したRT−PCRにより確認した(図3)。
【0188】
1.1.6 振盪管中の血清無含有バッチ培養による非修飾の糖鎖改変した(glycoengineered)IgG1の産生
RMDについて改変したCHO産生クローンにより産生される抗体(RMD−CHO−IgG)の糖構造を、非改変CHO抗体産生細胞から分泌されるIgG1型抗体(CHO−IgG)の糖構造と比較するために、両方の細胞株を使用して、培養上清においてIgG1抗体を産生した。RMD−CHO−IgG抗体産生クローン及びCHO−IgG抗体産生クローンをフコース欠損成長培地において1mlあたり2×105個の細胞で接種した。振盪管を180rpm、37℃、7.5% pCO2下でインキュベートした。細胞が依然として80%を超える生存率(vitality)を示していた場合には7日後に培養を停止させた。生存細胞密度を、トリパンブルー除去法を使用して自動細胞計数器Vi−CELL(商標)XR(Beckman Coulter, Fullerton, CA)により測定した。流加バッチアッセイの期間中の生存率の低下パターン及び流加バッチ振盪器アッセイの3日〜10日の比生産性(specific productivity)(qp)の平均は2つの異なるクローン間で同程度に維持された。それから細胞を10分間、5000rpmの遠心分離によりペレット状にし、上清を別々のバイアルに移した。RMD−CHO IgG細胞及び非改変CHOIgG細胞を同様に培養した。培養上清中の抗体濃度をヒトIgG1に特異的なサンドイッチイムノアッセイによりGyrolab Workstation(Gyros AB, Sweden)で測定した。両方のクローンが対数的に成長し、それぞれのサンプリングデータで同程度のIgG力価が得られ、同程度の初期倍増時間を有していた。両方のクローンがチャイニーズハムスター卵巣細胞に特有の形態を保持していた。
【0189】
1.1.7 プロテインAアフィニティクロマトグラフィによるIgG1の精製
0.2μmのフィルタによる滅菌ろ過後に、上清をプロテインA−セファロースミニカラムに充填した。総容量が10mgのカラム支持材料0.5mlを使用した。カラムは重力流で5カラム体積の20mMのリン酸ナトリウム(pH7.0)で平衡化した。緩やかな流速でのタンパク質結合の後、カラムを平衡化バッファーで2回洗浄した。それから抗体を重力流で4カラム体積の0.1Mのグリシンバッファー(pH3.0)によって溶出した。画分1mlを回収し、1MのTris−HCl(pH9)によってすぐに中和した。それぞれの精製IgG1の完全性及び純度を還元型SDS−PAGE分析により確認した。溶出した抗体の純度は90%を超え、溶出した抗体の組込みは、還元型SDS−PAGE分析により確認した。
【0190】
1.1.8 抗体由来のN連結型オリゴ糖の調製
各抗体100μgをN連結型オリゴ糖の質量分析による特性化に使用した。タンパク質をトリプシンで消化した(0:2mg/ml、37℃、16時間)後、N−グリカンを37℃で18時間の1単位のペプチド−N−グリコシダーゼF(PNGaseF、Roche Diagnostics)とのインキュベーションにより放出させた。放出されたN−グリカンを、RP−(Sep−Pak C18−)カラム、その後のcarbograph抽出除去カラム上での二段階クロマトグラフィにより回収した(Wuhrer et al., 2006, Glycobiology 16 (2006), pp. 991-1006)。Ciucanu and Kerekにより記載されたように(Ciucanu andKerek, 1984, Carbohydr Res. 1984: 131 :209)、各N−グリカンプールの50%が37℃で18時間の10mUのノイラミニダーゼにより消化され、50%がヨウ化メチルにより過メチル化した。
【0191】
1.1.9 MALDI−TOF−MSによるN連結型オリゴ糖の分析
それぞれの精製したIgG1から放出されるN−グリカンをsmartbeam−II(商標)レーザを備えたUltraFlex III TOF/TOF質量分析計(Bruker Daltonik GmbH, Bremen, Germany)により分析した。測定を陽イオンモードで行った。陽イオンを25kVの加速電圧及び10nsの遅延引き出し(extraction delay)に供し、リフレクトロンモードで分析した。分析のために、脱シアル化グリカンをH2Oに溶解し、過メチル化グリカンを70%(v/v)アセトニトリルに溶解した。試料0.5μlを標的上で80% EtOHに溶解したアラビノサゾン(Arabinosazone)(2mg/ml)と1:1(v/v)で混合し、室温で乾燥させた。デキストランラダーによる外部較正を使用した。スペクトルをGlyco−peakfinder(Maas et al., 2007, Proteomics 7, 4435-4444)を用いて分析した。同定したグリカン構造はGlyco Workbenchソフトウェア(Ceroni et al., 2008, J. Proteome Res. 7(4) 1650-1659)を用いて構築した。最終培養培地から精製された生成物のオリゴ糖プロファイル分析により、生成物のN連結型Fcオリゴ糖が高マンノース型及び二分岐複合型のものであること、並びにRMD−CHO−IgGクローンから分泌されたIgG1生成物がコアのフコシル化を完全に欠いていることが確認された。糖構造の分析により、親CHO−IgGクローンのものと比較して、RMDを同時発現するクローンにより産生される抗体の非フコシル化オリゴ糖の割合がそれぞれの場合で、顕著に増大すること(すなわち最大99%、95%、97%及び98%)が示された(図4)。MALDI−Peak相対強度に基づくと、RMD−CHO−IgG細胞で発現されるIgG1抗体産物から得られたN−糖構造には、結合したフコース残基がほぼ完全になく、相対的により大量の高マンノース構造を含有する(図4、パネルA;主要な高マンノース構造を丸で囲った)が、非改変CHO−IgG細胞で発現した治療用IgG1抗体から得られたN糖構造はコア−フコシル化されており、高マンノース構造の含有量は顕著に少ない(フコース残基=丸で囲った三角;図4、パネルB)。
【0192】
2.実験部
2.2 材料及び方法
2.2.1 細胞株、遺伝子最適化及び合成、RMD発現プラスミドの構築、抗体産生CHO−IgG細胞の非フコシル化抗体を分泌する細胞への変換、蛍光顕微鏡検査及びRT−PCRによるクローンのスクリーニング
RMD−CHO−IgG細胞株を産生するために使用されるCHO−IgG細胞株、RMDの遺伝子最適化及び合成、RMD発現プラスミドの構築、抗体産生CHO−IgG細胞の非フコシル化抗体を分泌する細胞への変換、RMD組込みの成功に関する蛍光顕微鏡検査及びRMD導入遺伝子のmRNA発現の成功に関するRT−PCRによるクローンのスクリーニングに関しては、上述の1.1.1項〜1.1.5項を参照する(1.実験部)。
【0193】
2.2.2 流加バッチ培養
N−グリカン構造を比較するためにCHO細胞及びRMD−CHO細胞(クローンH1、H2及びH3)の両方を用いてIgGを産生した。4mMのグルタミンを加えたが、抗生物質又はMTXを有しない血清無含有培地(ProBioGenのカスタム製剤;SAFC Bioscience, Lenexa, KA)100mlの入った500ml容の振盪フラスコに細胞を1mlあたり4×105個の細胞で播種した。培養物を180rpm、37℃及び7.5% CO2下でかき混ぜた。培養4日目に細胞に100mlの培養量あたり1.75mlのPBG−Feed Mixを与えた。細胞密度及び細胞生存率を自動ViCell細胞定量システム(Beckman Coulter, Brea, CA)を使用してトリパンブルー除去法により決定した。IgG濃度を決定するために、一定量の細胞培養上清を3日目、5日目及び7日目に回収し、これらをGyrolabサンドイッチイムノアッセイにより測定した。細胞が依然として80%を超える生存率を示していた場合には7日後に培養を停止させた。細胞培養上清を回収し、滅菌ろ過した。
【0194】
2.2.3 IgG1特異的なGyrolabサンドイッチイムノアッセイ
IgG1濃度をGyrolab Workstation(Gyros AB, Uppsala, Sweden)で行われるサンドイッチイムノアッセイにより決定した。このアッセイには、ビオチン化捕捉抗体(IgGのFc部分上のエピトープを認識する)、細胞培養上清試料又はポリクローナルヒトIgG参照基準、及びAlexa Fluor 647標識化検出抗体(IgGのFabドメインにおいてエピトープに結合する)の連続添加が含まれた。試料及び基準を三連で測定した。平均OD、標準偏差(SD)及び変動係数%(%CV)を、それぞれの測定の後に、Gyrolab evaluatorソフトウェアにより自動算出した。記載のIgG1 Gyrolabサンドイッチイムノアッセイは、それぞれの較正基準に対する余り(residuals)が20%の相対誤差(RE)の許容限界を満たすという前提に基づき事前に正当性が認められた。
【0195】
2.2.4. プロテインAアフィニティクロマトグラフィを用いたIgG精製
細胞培養上清を、20mMのリン酸ナトリウム(pH7.0)で予め平衡化した0.5mlのプロテインA−セファロースカラムに充填した。2ベッド体積の平衡化バッファーでカラムを洗浄した後、抗体を4カラム体積の0.1Mのグリシン(pH3.0)で溶出した。画分を回収し、すぐに1MのTris−HCl(pH9)で中和した。それぞれの精製IgG1の完全性及び純度を還元型SDS−PAGE分析により確認した。精製IgGのタンパク質濃度をGyrolabサンドイッチイムノアッセイにより決定した。
【0196】
2.2.5 IgGのN−グリカンのプロセシング
IgG(100μg)をトリプシンにより37℃で16時間消化した。95℃で5分間試料を加熱することにより反応を終結させた。抗体を1UのPNGase Fにより37℃で18時間更に消化した。放出されるN−グリカンを、逆相Sep−Pak C18カートリッジ、その後のcarbograph抽出除去カラム上で単離するとともに、脱塩処理した。それぞれのN−グリカンプールを、10mUのノイラミニダーゼにより37℃で18時間消化した。
【0197】
2.2.6 質量分析法
N−グリカンをsmartbeam−II(商標)レーザ及びLIFT−MS/MS設備を備えたUltraFlex III TOF/TOF質量分析計(Bruker Daltonik GmbH, Bremen, Germany)により分析した。スペクトルを25kVの加速電圧及び10nsの遅延引き出しでリフレクターモードで記録した。測定を陽イオンモードで行った。デキストランラダーを使用して外部較正を行った。脱シアル化N−グリカンをH2Oに溶解した。試料0.5μlをスチール標的上で70%エタノール水溶液に溶解したD−アラビノサゾン(5mg/ml)と1:1(v/v)で混合した(Chen et al. 1997)。スペクトルをGlyco−Peakfinderを用いて分析した(Maas et al., 2007)。同定したグリカン構造はGlyco Workbenchソフトウェアを用いて構築した(Ceroni et al., 2008)。
【0198】
2.2.7 Fc−γ受容体IIIA(FcγRIIIA)特異的な結合アッセイ
IgG試料のFcγRIIIA結合活性を、少し変更を加えたNiwaet al., 2004に記載のようなFcγRIIIA特異的な結合アッセイにより分析した。ヒスチジン(HIS)タグを付したFcγRIIIA(F158)(22kDa;158F;R&D Systems,Minneapolis, MN)を、受容体結合のために抗テトラHISモノクローナル抗体(Qiagen,Hilden, Germany)とともに使用した。イムノプレート(Maxisorp、Thermo,Waltham, MA)に抗テトラHIS抗体をコーティングし、ブロッキング試薬(RocheDiagnostics, Penzberg, Germany)を用いてブロッキングした。その後、組換えHISタグ付きFcγRIIIAをイムノプレートに加えた。それからコーティングしたプレートを段階的な試料希釈液及び対照とともにインキュベートし、それにより固定化FcγRIIIA受容体に結合させることができる。洗浄工程後、結合したIgGを抗ヒトIgGペルオキシダーゼ結合mAb(Dianova, Hamburg, Germany)により検出し、結合したIgGの量をペルオキシダーゼ活性により定量化した。各インキュベーション工程の後、イムノプレートを0.2% Tween−20を含有するPBSで3回洗浄した。テトラメチルベンジジン(TMB;Seramun, Heidesee, Germany)を発色基質として使用し、反応を1Mの硫酸を用いて終結させ、最後に吸光度を450nmで検出した(Infinite F200リーダー、Tecan, Crailsheim, Germany)。濃度依存的な吸光度データに基づき、十分な曲線の適合を、4パラメータロジスティック曲線モデル(Magellanソフトウェア6.1、Tecan)を用いて行った。このFcγRIIIA結合アッセイに関する系列内(intra-serial)正確性を、15% CV以内であると決定した。
【0199】
2.2.8 抗体依存的な細胞毒性(ADCC)アッセイ
初代ヒトNK細胞を末梢血単核細胞(PBMC)から単離した。PBMCを、密度勾配遠心分離により健常なヒトドナーの全血から分離し、続いてNK細胞を負電磁ビーズ分離により単離した(Miltenyi, Bergisch Gladbach, Germany)。単離したNK細胞の純度を、フローサイトメトリ(PE結合CD16抗体及びAlexa488結合CD56抗体、BD, San Jose, CA)により確認した。細胞株BT−474(Lasfargueset al., 1978、ヒトの乳房の浸潤性腺管癌、CLS、Eppelheim, Germany)及びSK−BR−3(Zabrecky et al., 1991、ヒトの乳房の腺癌、ATCC、Manassas,VA)を標的細胞として使用した。両方の細胞株がフローサイトメトリによりHer2/neuマーカーに対して陽性であることが確認された(データは示さず)。標的細胞株は接種の3日前にresearch cell bankで再活性化させた。抗体依存的なNK細胞により誘導された標的細胞の溶解を、生体染色の放出により定量化した(Calcein AM, Life Technologies, Carlsbad, CA)。標的細胞を製造業者のプロトコルに従い染色し、96ウェルマイクロタイタープレートにおいて、50μL RPMI 1640(Life Technologies)+10% FCS(Biochrom, Berlin, Germany)中、1つのウェルあたり2×104個の生存細胞で播種した。RPMI 1640+10% FCS中で抗体の1:3段階希釈液を調製した。50μL/ウェルのそれぞれの希釈液をn=3でピペッティングし、NK細胞接種前に、37℃で30分間、標的細胞とともにプレインキュベートした。抗体のプレインキュベーションの終了時に、エフェクター細胞を5:1のエフェクター細胞対標的細胞の比(E:T)で播種した。続いてプレートを200gで3分間遠心分離し、37℃で4時間、5% CO2下でインキュベートした。それぞれの細胞株に対して、自発的標的細胞溶解対照(NK細胞なし)、抗体非依存的な標的細胞溶解対照(NK細胞あり)及び総標的細胞溶解対照(サポニンにより誘導される)が誘導された。対照ウェルにおいて総溶解は、インキュベーション期間の終了の15分前にRPMI 1640+10% FCS中、1つのウェルあたり15μLの0.1mg/mLのサポニンを添加することにより誘導された。全ての他のウェルでは、15μLのRPMI 1640+10% FCSを加えた。カルセインAMの放出を培養上清における蛍光検出により定量化した。プレートを遠心分離し(150g、3分)、各ウェルから上清100μLを96ウェルの黒色の蛍光プレート(Thermo)に移した。平均蛍光強度(MFI)をInfinite F200リーダー(Tecan、485nm/535nm 励起/発光フィルタ)を用いて検出した。曲線の適合を、4パラメータロジスティック容量応答モデル(Magellanソフトウェアバージョン6.1)を用いて行った。特異的細胞溶解を以下のように算出した:特異的細胞溶解[%]=[MFI(試料)−MFI(自発的)]/[MFI(総)−MFI(自発的)]×100。MFI(試料)が特異的標的細胞溶解により放出される平均蛍光強度であり、MFI(自発的)が標的細胞による蛍光色素の段階的な放出であり、MFI(総)が洗浄剤により誘導される総標的細胞溶解後に得られた平均蛍光強度である。
【0200】
2.2.9 単糖分析及びラムノース測定
細胞(3×107個)を上清から100gで5分間の遠心分離により分離した。続いて細胞を3回の凍結融解サイクルにより溶解させた。それから細胞膜を細胞質画分から4℃で30分間、21000gで分離した。細胞培養上清、細胞膜、細胞質画分及びIgG N−グリカンを100℃で4時間、2NのTFAにおいて加水分解した。還元雰囲気下での蒸発の後に、試料をDionexのICS−3000を用いてPA−1カラム上でHPAEC−PADにより分析し、2−デオキシリボースを内部標準として使用した。中性の単糖を2.25mMのNaOHを用いた定組成溶出により分離した。200mMのNaOHのポストカラム添加により、アンペロメトリ検出が可能になった。HPAEC−PADでは、エナンチオマー同一性を評価することができない(Horton, D. 2004)ため、L−ラムノースを標準として用いて、D−ラムノースで予測される保持時間を求めた。ラムノースに関するLODを、分析手順のバリデーションのためのICHの三極共通ガイドライン(harmonized tripartite guideline)(ICHQ2(R1))の第6.3章に記載のように求めた。
【0201】
2.3 結果
2.3.1 RMD導入遺伝子の異種発現
分泌されたIgGのフコシル化レベルに対するRMD導入遺伝子発現の効果を評価するために、GDP−6−デオキシ−D−リキソ−4−ヘキスロースレダクターゼ(RMD)及び緑色蛍光タンパク質(gfp)に関する遺伝子を含む2シストロン性の発現カセットを備えたベクターを生成し、バイオシミラー(biosimilar:後発生物製剤)バージョンのIgG1型治療抗体トラスツズマブ(ハーセプチン(商標)、Roche)の過剰発現及び分泌のために事前に改変されたCHO/DG44クローンに導入した。導入遺伝子を発現するG418耐性クローンをそのgfp媒介性の緑色蛍光により同定し、トランスフェクションの2週間以内に現れた。gfp蛍光分布から評価されるように、エレクトロポレーションによりおよそ80%の形質転換効率が達成された(データは示していないが、図2に示されるデータと同じようなものである)。RMD導入遺伝子の発現の成功を、RMD特異的なプライマーセットを使用したRT−PCRにより確認した(データは示していないが、図3に示されるデータと同じようなものである)。RMD導入遺伝子を発現する改変CHO細胞はRMD−CHOと呼ばれる。
【0202】
2.3.2 CHO抗体産生細胞及びRMD−CHO抗体産生細胞の血清無含有流加バッチ培養
非改変の親CHO細胞及びIgGを産生するトランスフェクトしたRMD−CHO細胞の血清無含有流加バッチ培養を、L−グルタミンを加えたフコース欠損成長培地の入った50ml容のバイオリアクター管において行った。バイオリアクター管を1mlあたり4×105個の細胞の出発細胞密度で接種し、その後180rpm、37℃、7.5% pCO2下でインキュベートした。流加バッチ培養の性能を14日間モニタリングし、並べて比較した。CHO細胞及びRMD−CHO細胞の並行した流加バッチ培養の比較分析では、14日間で顕著な偏差は示されなかった。それぞれのサンプリング日での初期倍増速度、増殖速度及びIgG力価は両方の細胞株で一致していた。両方のクローンはCHO細胞に特有の形態を保持していた。流加バッチアッセイの期間中の生存率の低下パターン及び流加バッチ振盪器アッセイの3日〜10日の比生産性(qp)の平均は2つの異なるクローン間で同程度に維持された(データは示さず)。
【0203】
2.3.3 CHO細胞及びRMD−CHO細胞から産生されたIgGのN−グリカン分析
CHO細胞及びRMD−CHO細胞をバッチ培養で成長させた。IgGを産生する3つの異なるRMD−CHOクローン、すなわちH1、H2及びH3を使用した。細胞を1mLあたり4×105個の細胞の出発細胞密度で接種し、180rpm、37℃、7.5% pCO2下でバイオリアクター管において7日間成長させた。上清を7日目に収集し、IgG試料をプロテインAアフィニティクロマトグラフィにより精製した。溶出した抗体の純度及び完全性を還元型SDS−PAGEにより確認した。PNGase Fを用いて放出させたN−グリカンを脱シアル化し、続いてMALDI−TOF−MSにより分析した。N−グリカンのシグナル強度の相対的定量化を、クロマトグラフ方法と比較してより信頼性のある結果を得られることが以前に実証されたように行った(Wada et al., 2007)。高マンノース型及び複合型の二分岐(diantennary)N−グリカン構造を全ての試料で検出した(図5)。モノフコシル化された非ガラクトシル化/モノガラクトシル化/ジガラクトシル化二分岐N−グリカンは、野生型(WT)IgGで見られる3つの最も豊富なN−グリカン構造であった(図5A)。これらのピーク、すなわちm/z1485.4、1647.4及び1809.4でのコア−フコースの存在が、MALDI−TOF/TOFにより確認された。診断用の断片イオンdHex1HexNAc2は、いずれのスペクトルにおいてもm/z592.8で観察された。RMD−CHO細胞から産生されたIgG試料において、最大でN−グリカンプール全体の2%を表す(試料H2)、ごく微量のフコースが観察された(図5B、図5C、図5D)。同時に、試料H2はWT IgGよりも大量の高マンノース構造を含有していた。
【0204】
2.3.4 CHO細胞及びRMD−CHO細胞から産生されたIgGのIgG1−Fc結合活性
IgG1とそのコグネートFc受容体FcγRIIIaとの間の比較的弱い相互作用(Kd 約1μM)がADCCエフェクター機能に寄与する主な因子の1つであるため(Sondermannet al., 2000)、FcγRIIIa結合アッセイはIgG1モノクローナル抗体試料のADCC活性を予測する間接的な評価基準である。RMD−CHO細胞から分泌される非フコシル化IgGのFcγRIIIa結合は、野生型CHO細胞から分泌されるフコシル化IgGと比較して大きく増大しており、約16倍少ないタンパク質でFcγRIIIa−158Fと同等に結合する(図6A、図6B)。データは、参照としてフコシル化IgGを用いた、非フコシル化IgGの結合の相対的な増加倍率として図6Bに報告される。
【0205】
2.3.5 RMD−CHO細胞を用いて産生された非フコシル化IgGのADCC活性
ADCC活性を分析するために、単離したNK細胞及びHER2を発現する標的細胞を、非フコシル化IgG及びフコシル化IgGの段階希釈液とともに同時インキュベートした。アッセイの必要条件として、NK細胞を73%の純度レベルで全血試料から単離した(図7)。技術的な(technical)NK細胞の細胞毒性対照は、ADCCアッセイに使用されるドナー材料に対して77%の特異的溶解活性を示した(図7)。HER2を発現する標的細胞株BT−474(ヒトの乳房の浸潤性腺管癌から単離した)をADCCアッセイに使用した。BT−474標的細胞株は、ADCC以外の機構によってもNK細胞により攻撃を受ける。BT−474細胞は平均値16%の抗体非依存的な細胞溶解を示す(データは示さず)。IgG試料により誘導される特異的細胞溶解に関するデータを図8に示す。3つ全ての非フコシル化IgG試料(H1〜H3)はWT抗体と比較してADCC応答の増大を誘導した(図8)。非フコシル化IgG試料H2は最大のADCC応答を誘導した(図8)。SK−BR−3細胞(乳房のHER2陽性腺癌)を該アッセイにおいて標的細胞として使用した場合に、同様の結果が得られた。BT−474細胞及びSK−BR−3細胞とともにインキュベートした非フコシル化IgG試料及びフコシル化IgG試料に関して算出されたEC50値を表2に要約する(下記を参照されたい)。野生型IgGと変異体H1〜H3との間で観察されるEC50シフトは、ADCCアッセイで使用される標的細胞株に関係なく同程度のままであった(図8)。HER2陽性のBT474標的細胞株及びSK−BR−3標的細胞株、並びに精製NK細胞の存在下で、非フコシル化IgGは0.443μg/ml及び0.00817μg/mlの平均EC50値で平均16倍の抗体媒介性の標的細胞枯渇活性を示し、このことはフコシル化IgGと比較してはるかに高い有効性を示していた。FcγRIIIa結合活性の増大を示した非フコシル化IgG試料が、WT IgGと比較してより高いADCC応答も誘導したことに留意されたい。
【0206】
表2:異なる抗原提示標的細胞(BT−474、SK−BR−3)とともにインキュベートした非フコシル化(H1〜H3)IgG及びフコシル化(WT)IgGのADCCエフェクター機能の結果の要約。算出されたEC50(フコシル化)/EC50(非フコシル化)比はADCCエフェクター機能の向上を示す。
【表2】

試料名
比
【0207】
2.3.6 単糖分析−細胞溶解物における及びIgG N−グリカンにおける検出可能な量のD−ラムノースの非存在
細胞膜、培養上清及び細胞質画分をRMD−CHO細胞から単離した。続いて単糖を放出させ、HPAEC−PADにより分析した。予想通り、フコースはCHO細胞に存在し、RMD−CHO細胞には存在しなかった。検出限界(LOD)を超えるレベルのラムノースは細胞質画分では観察されなかった(図9)。較正曲線のy切片及び傾きの標準偏差に基づくと、LODは10μlの試料注入容量あたりラムノース及びフコースに対してそれぞれ1.2pmol及び1.1pmolであった。同様に、RMD−CHO細胞を用いて産生される精製抗体から放出されたN−グリカンをTFAによって加水分解し、得られる単糖をHPAEC−PADにより分析した。TFAで加水分解したN−グリカンは、LODを超えるラムノースピークを全く生じなかった(図10)。結論として、RMD−CHO細胞も分泌された抗体も検出可能な量のラムノースを含有してない。
【0208】
2.4 備考(Final Remarks)
本発明者らは、細胞質のフコースde novo合成経路由来の重要な代謝中間体の連続除去のために改変された細胞株からのフコース欠損mAbの分泌を達成するための糖鎖改変アプローチを評価した(図1)。本発明者らのデータは、異種細菌酵素のトランスジェニック発現が、新生糖タンパク質N−グリカン上でのフコースの合成の所望の阻止を引き起こすことをはっきりと示している。この方法によるフコース枯渇の程度は、培養培地からのフコースの排除がサルベージ経路(遮断されなければ(otherwise)細胞質のGDP−フコースの代替供給源として働くことのできる)を完全に遮断するのに十分であったことも示している。
【0209】
本発明者らのアプローチにおける重要な代謝標的は、細菌において例えばGDP−L−フコース、GDP−4−デオキシ−D−タロース、GDP−コリトース及びGDP−D−ペロサミンを含む幾つかの異なるGDP−モノデオキシヘキソースの合成の共通の中間体であるGDP−4−ケト−6−デオキシ−D−マンノースであった。さらに、GDP−フコースシンターゼの活性部位Cys109Ser突然変異体はGDP−フコースの代わりにGDP−6−デオキシ−D−アルトロースを生成する(Lau and Tanner, 2008)。
【0210】
本発明者が本発明者らのアプローチで例として選択した特定の原核生物酵素は、GDP−6−デオキシ−D−リキソ−4−ヘキスロースレダクターゼ(GDP−4−ケト−6−デオキシ−D−マンノースレダクターゼと同義であり、RMDと略される)であった(Kneidinger et al., 2001; Maeki et al., 2002)。ここで本発明者らは、細胞質内での原核生物酵素GDP−6−デオキシ−D−リキソ−4−ヘキスロースレダクターゼ(RMD)の異種発現が効率的にフコースde novo経路を偏向させることができることを実証した。上記酵素は水素ドナーとしてNADH及びNADPHを利用し、フコース経路の中間体GDP−4−ケト−6−デオキシ−D−マンノースの4−ケト基の標的化還元を触媒することにより、GDP−D−ラムノースを得る。逆反応が検出されなかったことから(Kneidinger et al., 2001)、RMDによるGDP−4−ケト−6−デオキシ−D−マンノースのGDP−D−ラムノースへの変換は定量的に進行すると考えられる。
【0211】
本発明者らのデータは、或る特定の細菌の複合糖質でのみ見出されるが、動物では見出されない6−デオキシヘキソースであるGDP−ラムノース(Webb et al., 2004)が脊椎動物の細胞質との関連内において終末生成物であることも示している。非改変脊椎動物細胞はラムノシルトランスフェラーゼを欠いており(Webb et al., 2004)、また膜輸送体を欠いており、このためGDP−D−ラムノースの新生グリカンへの組込みが脊椎動物細胞内で起こる可能性は非常に低い。本発明者らのデータにより、これを確認することができた。本発明者らのデータは、人工D−ラムノースが、細胞内において、分泌されたIgGに又はその他の箇所に組み込まれなかったことをはっきりと示している(図9及び図10)。
【0212】
グルカン構造上でフコースを欠くことに加えて、遺伝子操作されたクローンから分泌されるIgGは、より高いレベルの高マンノース構造を示した。これはGDP−D−ラムノースによるGMDのフィードバック阻害により生じ得る。GDP−マンノースに関する代替的な代謝シンクとしてのGMD活性を欠くことは細胞質GDP−D−マンノースのプールの上昇に寄与する可能性があり、これによりRMD改変宿主細胞から分泌される生成物で観察される高マンノース構造の増加が引き起こされた可能性がある(図4及び図5)。
【0213】
FcγRIII結合アッセイ及びin vitroでのADCCアッセイに関する本発明者らの結果は、非フコシル化IgGがFcγRIIIaに対する顕著に高い結合活性及び向上したADCC応答を有することも示す。観察されたEC50シフト及び標的細胞枯渇活性の倍増(表2、図8)は、アッセイを全血、血清又は血漿の存在下で行った場合、更に高いであろう。興味深いことに本発明者らは、最大レベルの高マンノース構造を有する非フコシル化IgG試料H2が、アッセイに使用される標的細胞(BT474又はSK−BR−3)に関係なく最大のADCC活性も示すことを観察した(表2)。
【0214】
まとめると、この研究により、脊椎動物宿主細胞におけるRMDの過剰発現が、細胞質GDP−フコースの合成のための重要な主要中間体(GDP−4−ケト−6−デオキシ−D−マンノース)の枯渇を引き起こすことが実証される。このアプローチにより、代謝的に改変された細胞株の生成が可能になり、また既存の抗体を発現する細胞クローンをフコース枯渇治療法のための産生細胞に変換する非常に有力な新たな戦略も与える。既に存在する細胞株においてフコースの欠損を確実に改変する能力は、次世代のモノクローナル抗体のための薬物開発を促進させるのに役立ち得る。
【0215】
3.略称
ACN、アセトニトリル;CHO、チャイニーズハムスター卵巣;CV、変動係数;dHex、デオキシヘキソース;EC50、50%最大有効濃度(すなわち、基準線応答と最大応答との中間の応答を誘起するアゴニストの濃度)、Fuc、フコース;Gal、ガラクトース;GalNAc、N−アセチルガラクトサミン;GlcNAc、N−アセチルグルコサミン;GMER、GDP−4−ケト−6−デオキシ−D−マンノース−3,5−エピメラーゼ/4−レダクターゼ;HPLC、高速液体クロマトグラフィ;HPAEC−PAD、パルスアンペロメトリ検出を伴う高pHアニオン交換クロマトグラフィ;LOD、検出限界;mAb、モノクローナル抗体;MALDI−TOF−MS、マトリックス支援レーザ脱離イオン化飛行時間型質量分析法;MEM、変法イーグル培地;PBMC、末梢血単核細胞;PBS、リン酸バッファー生理食塩水;PNGase F、ペプチド−N4−(N−アセチル−β−グルコサミニル)アスパラギンアミダーゼF;Rha、ラムノース;RMD、GDP−6−デオキシ−D−リキソ−4−ヘキスロースレダクターゼ;SDS、ドデシル硫酸ナトリウム;TFA、トリフルオロ酢酸。
【0216】
参考文献
Ceroni, A., Maass, K., Geyer, H., Geyer, R., Dell, A., Haslam, S.M. 2008. GlycoWorkbench: A Tool for the Computer-Assisted Annotation of Mass Spectra ofGlycans, Journal of Proteome Research, 7 (4), 1650-1659.
Chen, P, Baker AG, Novotny MV. 1997. The use of osazones as matrices for thematrix-assisted laser desorption/ionization mass spectrometry of carbohydrates.Anal Biochem. 244(1):144-51.
Horton, D 2004 Advances in Carbohydrate Chemistry and Biochemistry. D. Horton,Editor, Elsevier Academic Press, Amsterdam and San Diego, Vol. 59, p.11.
ICH Q2(R1): ICH Harmonized Tripartite Guideline: Validation of AnalyticalProcedures: Text and Methodology Q2(R1) Current Step 4 version, ParentGuideline dated 27 October 1994.
Kneidinger B, Graninger M, Adam G, Puchberger M, Kosma P, Zayni S, Messner P.2001. Identification of two GDP-6-deoxy-D-lyxo-4-hexulose reductasessynthesizing GDP-D-rhamnose in Aneurinibacillus thermoaerophilus L420-91T. JBiol Chem. Feb 23;276(8):5577-83.
Lasfargues EY, Coutinho WG and Redfield ES. 1978. Isolation of two human tumorepithelial cell lines from solid breast carcinomas. J Natl Cancer Inst.;61(4):967-78.
Lau S.T.B., Tanner, M.E. 2008. Mechanism and Active Site Residues of GDP-FucoseSynthase, Journal of the American Chemical Society, vol. 130, no51, pp.17593-17602
Maeki M, Jaervinen N, Raebinae J, Roos C, Maaheimo H, Renkonen R; Pirkko;Mattila. 2002. Functional expression of Pseudomonas aeruginosaGDP-4-keto-6-deoxy-D-mannose reductase which synthesizes GDP-rhamnose. Eur JBiochem. Jan;269(2):593-601.
Niwa R, Shoji-Hosaka E, Sakurada M, Shinkawa T, Uchida K, Nakamura K,Matsushima K, Ueda R, Hanai N, Shitara K. 2004. Defucosylated anti-CC chemokinereceptor 4 IgG1 with enhanced antibody-dependent cellular cytotoxicity showspotent therapeutic activity to T cell leukemia and lymphoma. Cancer Res,64:2127-2133.
Niwa R, Hatanaka S, Shoji-Hosaka E, Sakurada M, Kobayashi Y, Uehara A, Yokoi H,Nakamura K, Shitara K. 2004. Enhancement of the antibody-dependent cellularcytotoxicity of low-fucose IgG1 is independent of FcgammaRIIIa functionalpolymorphism. Clin Cancer Res, 10:6248-6255.
Shields RL, Lai J, Keck R, O'Connell LY, Hong K, Meng YG, Weikert SH, PrestaLG. 2002. Lack of fucose on human IgG1 N-linked oligosaccharide improvesbinding to human FcgammaRIII and antibody-dependent cellular toxicity. J BiolChem, 277:26733-26740.
Sondermann, P., Huber, R., Oosthuizen, V., and Jacob, U. 2000. The 3.2-Acrystal structure of the human IgG1 Fc fragment-Fc gammaRIII complex. Nature406, 267-273.
Urlaub G, Kaes E, Carothers AM, Chasin LA. Deletion of the diploiddihydrofolate reductase locus from cultured mammalian cells. Cell. 1983Jun;33(2):405-12.
Urlaub G, Mitchell PJ, Kas E, Chasin LA, Funanage VL, Myoda TT, Hamlin J. 1986.Effect of gamma rays at the dihydrofolate reductase locus: Deletions andinversions. Somatic Cell Mol Genet, 12:555-556.
Wada, Y.; Azadi, P.; Costello, C. E.; Dell, A.; Dwek, R. A.; Geyer, H.; Geyer,R.; Kakehi, K.; Karlsson, N. G.; Kato, K.; Kawasaki, N.; Khoo, K. H.; Kim, S.;Kondo, A.; Lattova, E.; Mechref, Y.; Miyoshi, E.; Nakamura, K.; Narimatsu, H.;Novotny, M. V.; Packer, N. H.; Perreault, H.; Peter-Katalinic, J.; Pohlentz,G.; Reinhold, V. N.; Rudd, P. M.; Suzuki, A.; Taniguchi, N. 2007. Comparison ofthe methods for profiling glycoprotein glycans--HUPO Human DiseaseGlycomics/Proteome Initiative multi-institutional study. Glycobiology;17(4):411-22.
Webb NA, Mulichak AM, Lam JS, Rocchetta HL, Garavito RM. 2004. Crystalstructure of a tetrameric GDP-D-mannose 4,6-dehydratase from a bacterialGDP-D-rhamnose biosynthetic pathway. Protein Sci. Feb;13(2):529-39.
Zabrecky JR, Lam T, McKenzie SJ and Carney W . 1991. The extracellular domainof p185/neu is released from the surface of human breast carcinoma cells,SK-BR-3. J Biol Chem.; 266(3):1716-20.
【0217】
(寄託情報)


【特許請求の範囲】
【請求項1】
自然状態ではその糖部分上において、フコースを含むが、その糖部分上において、フコースを欠いている又は低減したフコース量を有する分子を生成するための脊椎動物細胞であって、
基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用するが、GDP−6−デオキシ−D−リキソ−4−ヘキスロースをGDP−L−フコースに変換する反応を触媒しない酵素を少なくとも1つ含む、自然状態ではその糖部分上において、フコースを含むが、その糖部分上において、フコースを欠いている又は低減したフコース量を有する分子を生成するための脊椎動物細胞。
【請求項2】
基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用する該酵素が、GDP−6−デオキシ−D−リキソ−4−ヘキスロースレダクターゼ(RMD)、GDP−ペロサミンシンテターゼ(Per)、GDP−6−デオキシ−D−タロースシンテターゼ(GTS)、GDP−フコースシンテターゼCys109Ser(GFS−Cys109Ser)突然変異体、GDP−4−ケト−6−デオキシマンノース−3−デヒドラターゼ(ColD)、又はGDP−L−コリトースシンターゼ(ColC)と組み合わせたGDP−4−ケト−6−デオキシマンノース−3−デヒドラターゼ(ColD)、及びそれらの変異体からなる群から選択される、請求項1に記載の脊椎動物細胞。
【請求項3】
GDP−6−デオキシ−D−リキソ−4−ヘキスロースレダクターゼ(RMD)が緑膿菌由来(配列番号1)である、請求項2に記載の脊椎動物細胞。
【請求項4】
GDP−D−ラムノース、GDP−D−ペロサミン、GDP−デオキシ−D−タロース、GDP−6−デオキシ−D−アルトロース、GDP−4−ケト−3,6−ジデオキシ−D−マンノース、及び/又はGDP−L−コリトースを更に含む、請求項1〜3のいずれか一項に記載の脊椎動物細胞。
【請求項5】
前記細胞に一時的に存在する又は安定して維持される核酸から該酵素が発現される、請求項1〜4のいずれか一項に記載の脊椎動物細胞。
【請求項6】
フコシルトランスフェラーゼに対する基質となることができる少なくとも1つの分子を更に含む、請求項1〜5のいずれか一項に記載の脊椎動物細胞。
【請求項7】
分子がタンパク質又は脂質である、請求項6に記載の脊椎動物細胞。
【請求項8】
タンパク質が内因性タンパク質又は外因性タンパク質である、請求項7に記載の脊椎動物細胞。
【請求項9】
タンパク質が、抗体、若しくはIgG1抗体、抗体断片、若しくは抗体のFc領域を含む抗体断片、融合タンパク質、若しくは抗体のFc領域を含む融合タンパク質、ウイルスタンパク質、ウイルスタンパク質断片、抗原、又はホルモンである、請求項7又は8に記載の脊椎動物細胞。
【請求項10】
哺乳類細胞、魚類細胞、両生類細胞、爬虫類細胞又は鳥類細胞である、請求項1〜9のいずれか一項に記載の脊椎動物細胞。
【請求項11】
i)哺乳類細胞がヒト細胞、ハムスター細胞、イヌ細胞若しくはサル細胞、若しくはチャイニーズハムスター卵巣細胞(CHO)、アフリカミドリザル腎臓細胞(VERO−76)(ATCC CRL−1587)、ヒト子宮頸癌細胞(HELA)(ATCC CCL 2)、メイディンダービーイヌ腎臓細胞(MDCK)(ATCC CCL 34)、ヒトPER.C6細胞、若しくはヒトAGE1.HN細胞であり、
ii)魚類細胞がアメリカナマズ(チャネル・キャットフィッシュ)卵巣(CCO)細胞(ATCC CRL−2772)であり、
iii)両生類細胞がアフリカツメガエル腎臓細胞(ATCC CCL−102)であり、
iv)爬虫類細胞がグリーンイグアナ心臓細胞(IgH−2)(ATCC CCL−108)であり、又は
v)鳥類細胞がトリ網膜細胞、若しくはAGE1.CR.PIX細胞、若しくはトリ体節細胞である、請求項10に記載の脊椎動物細胞。
【請求項12】
GDP−D−ラムノース、GDP−D−ペロサミン、GDP−デオキシ−D−タロース、GDP−6−デオキシ−D−アルトロース、GDP−4−ケト−3,6−ジデオキシ−D−マンノース又はGDP−L−コリトースに対する少なくとも1つのグリコシルトランスフェラーゼを更に含む、請求項1〜11のいずれか一項に記載の脊椎動物細胞。
【請求項13】
自然状態ではその糖部分上において、フコースを含むが、その糖部分上において、フコースを欠いている又は低減したフコース量を有する分子を生成する方法であって、
i)請求項1〜12のいずれか一項に記載の脊椎動物細胞を準備する工程と、
ii)i)における該細胞からフコシルトランスフェラーゼに対する基質となることができる分子、又はタンパク質若しくは脂質を単離する工程と、
を含む、自然状態ではその糖部分上において、フコースを含むが、その糖部分上において、フコースを欠いている又は低減したフコース量を有する分子を生成する方法。
【請求項14】
請求項13に記載の方法により入手可能な、その糖部分上において、フコースを欠いている又は低減したフコース量を有する分子。
【請求項15】
請求項14に記載の分子の組成物。
【請求項16】
i)70%〜95%のG0−GlcNac、G0、G1及び/又はG2の複合型N−グリカンと、
ii)5%〜30%の高マンノース型N−グリカンと、
を含む糖タンパク質を含む組成物であって、該糖タンパク質の該複合型N−グリカンがフコースを含まない、又はフコースを実質的に含まない、糖タンパク質を含む組成物。
【請求項17】
複合型N−グリカンの75%がG0の複合型N−グリカンであり、25%がG0−GlcNac、G1及び/又はG2の複合型N−グリカンである、請求項16に記載の組成物。
【請求項18】
高マンノース型N−グリカンの50%がman5グリカンであり、50%がman6、man7及び/又はman8のN−グリカンである、請求項16に記載の組成物。
【請求項19】
糖タンパク質が抗体、又はIgG1である、請求項16〜18のいずれか一項に記載の組成物。
【請求項20】
D−ラムノース、D−ペロサミン、デオキシ−D−タロース、6−デオキシ−D−アルトロース、4−ケト−3,6−ジデオキシ−D−マンノース及び/又はL−コリトースを含有する糖部分を含む、タンパク質又は脂質。
【請求項21】
基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用するが、GDP−6−デオキシ−D−リキソ−4−ヘキスロースをGDP−L−フコースに変換する反応を触媒しない酵素をコードする核酸配列を含むポリヌクレオチドに操作可能に連結した脊椎動物の発現制御配列を1つ又は複数含む発現単位。
【請求項22】
基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用する該酵素が、GDP−6−デオキシ−D−リキソ−4−ヘキスロースレダクターゼ(RMD)、GDP−ペロサミンシンテターゼ(Per)、GDP−6−デオキシ−D−タロースシンテターゼ(GTS)、GDP−フコースシンテターゼCys109Ser(GFS−Cys109Ser)突然変異体、GDP−4−ケト−6−デオキシマンノース−3−デヒドラターゼ(ColD)、又はGDP−L−コリトースシンターゼ(ColC)と組み合わせたGDP−4−ケト−6−デオキシマンノース−3−デヒドラターゼ(ColD)、及びそれらの変異体からなる群から選択される、請求項21に記載の発現単位。
【請求項23】
通常その糖部分上において、フコースを含むが、その糖部分上において、フコースを欠いている又は低減したフコース量を有するタンパク質を生成するための真核細胞であって、
i)基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用する酵素をコードする核酸配列を含む第1のポリヌクレオチドと、
ii)タンパク質をコードする核酸配列を含む第2のポリヌクレオチドと、
を含み、該酵素がGDP−6−デオキシ−D−リキソ−4−ヘキスロースをGDP−L−フコースに変換する反応を触媒しない、通常その糖部分上において、フコースを含むが、その糖部分上において、フコースを欠いている又は低減したフコース量を有するタンパク質を生成するための真核細胞。
【請求項24】
基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用する該酵素が、GDP−6−デオキシ−D−リキソ−4−ヘキスロースレダクターゼ(RMD)、GDP−ペロサミンシンテターゼ(Per)、GDP−6−デオキシ−D−タロースシンテターゼ(GTS)、GDP−フコースシンテターゼCys109Ser(GFS−Cys109Ser)突然変異体、GDP−4−ケト−6−デオキシマンノース−3−デヒドラターゼ(ColD)、又はGDP−L−コリトースシンターゼ(ColC)と組み合わせたGDP−4−ケト−6−デオキシマンノース−3−デヒドラターゼ(ColD)、及びそれらの変異体からなる群から選択される、請求項23に記載の真核細胞。
【請求項25】
タンパク質が、抗体、若しくはIgG1抗体、抗体断片、若しくは抗体のFc領域を含む抗体断片、抗体のFc領域を含む融合タンパク質、ウイルスタンパク質、ウイルスタンパク質断片、抗原、又はホルモンである、請求項23又は24に記載の真核細胞。
【請求項26】
通常その糖部分上において、フコースを含むが、その糖部分上において、フコースを欠いている又は低減したフコース量を有するタンパク質を生成する方法であって、
i)請求項23〜25のいずれか一項に記載の真核細胞を準備する工程と、
ii)前記細胞において該第1のポリヌクレオチドによりコードされる該酵素及び該第2のポリヌクレオチドによりコードされる該タンパク質を発現する工程と、
iii)前記細胞から該タンパク質を単離する工程と、
を含む、通常その糖部分上において、フコースを含むが、その糖部分上において、フコースを欠いている又は低減したフコース量を有するタンパク質を生成する方法。
【請求項27】
請求項26に記載の方法により入手可能な、その糖部分上において、フコースを欠いている又は低減したフコース量を有するタンパク質。
【請求項1】
自然状態ではその糖部分上において、フコースを含むが、その糖部分上において、フコースを欠いている又は低減したフコース量を有する分子を生成するための脊椎動物細胞であって、
基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用するが、GDP−6−デオキシ−D−リキソ−4−ヘキスロースをGDP−L−フコースに変換する反応を触媒しない酵素を少なくとも1つ含む、自然状態ではその糖部分上において、フコースを含むが、その糖部分上において、フコースを欠いている又は低減したフコース量を有する分子を生成するための脊椎動物細胞。
【請求項2】
基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用する該酵素が、GDP−6−デオキシ−D−リキソ−4−ヘキスロースレダクターゼ(RMD)、GDP−ペロサミンシンテターゼ(Per)、GDP−6−デオキシ−D−タロースシンテターゼ(GTS)、GDP−フコースシンテターゼCys109Ser(GFS−Cys109Ser)突然変異体、GDP−4−ケト−6−デオキシマンノース−3−デヒドラターゼ(ColD)、又はGDP−L−コリトースシンターゼ(ColC)と組み合わせたGDP−4−ケト−6−デオキシマンノース−3−デヒドラターゼ(ColD)、及びそれらの変異体からなる群から選択される、請求項1に記載の脊椎動物細胞。
【請求項3】
GDP−6−デオキシ−D−リキソ−4−ヘキスロースレダクターゼ(RMD)が緑膿菌由来(配列番号1)である、請求項2に記載の脊椎動物細胞。
【請求項4】
GDP−D−ラムノース、GDP−D−ペロサミン、GDP−デオキシ−D−タロース、GDP−6−デオキシ−D−アルトロース、GDP−4−ケト−3,6−ジデオキシ−D−マンノース、及び/又はGDP−L−コリトースを更に含む、請求項1〜3のいずれか一項に記載の脊椎動物細胞。
【請求項5】
前記細胞に一時的に存在する又は安定して維持される核酸から該酵素が発現される、請求項1〜4のいずれか一項に記載の脊椎動物細胞。
【請求項6】
フコシルトランスフェラーゼに対する基質となることができる少なくとも1つの分子を更に含む、請求項1〜5のいずれか一項に記載の脊椎動物細胞。
【請求項7】
分子がタンパク質又は脂質である、請求項6に記載の脊椎動物細胞。
【請求項8】
タンパク質が内因性タンパク質又は外因性タンパク質である、請求項7に記載の脊椎動物細胞。
【請求項9】
タンパク質が、抗体、若しくはIgG1抗体、抗体断片、若しくは抗体のFc領域を含む抗体断片、融合タンパク質、若しくは抗体のFc領域を含む融合タンパク質、ウイルスタンパク質、ウイルスタンパク質断片、抗原、又はホルモンである、請求項7又は8に記載の脊椎動物細胞。
【請求項10】
哺乳類細胞、魚類細胞、両生類細胞、爬虫類細胞又は鳥類細胞である、請求項1〜9のいずれか一項に記載の脊椎動物細胞。
【請求項11】
i)哺乳類細胞がヒト細胞、ハムスター細胞、イヌ細胞若しくはサル細胞、若しくはチャイニーズハムスター卵巣細胞(CHO)、アフリカミドリザル腎臓細胞(VERO−76)(ATCC CRL−1587)、ヒト子宮頸癌細胞(HELA)(ATCC CCL 2)、メイディンダービーイヌ腎臓細胞(MDCK)(ATCC CCL 34)、ヒトPER.C6細胞、若しくはヒトAGE1.HN細胞であり、
ii)魚類細胞がアメリカナマズ(チャネル・キャットフィッシュ)卵巣(CCO)細胞(ATCC CRL−2772)であり、
iii)両生類細胞がアフリカツメガエル腎臓細胞(ATCC CCL−102)であり、
iv)爬虫類細胞がグリーンイグアナ心臓細胞(IgH−2)(ATCC CCL−108)であり、又は
v)鳥類細胞がトリ網膜細胞、若しくはAGE1.CR.PIX細胞、若しくはトリ体節細胞である、請求項10に記載の脊椎動物細胞。
【請求項12】
GDP−D−ラムノース、GDP−D−ペロサミン、GDP−デオキシ−D−タロース、GDP−6−デオキシ−D−アルトロース、GDP−4−ケト−3,6−ジデオキシ−D−マンノース又はGDP−L−コリトースに対する少なくとも1つのグリコシルトランスフェラーゼを更に含む、請求項1〜11のいずれか一項に記載の脊椎動物細胞。
【請求項13】
自然状態ではその糖部分上において、フコースを含むが、その糖部分上において、フコースを欠いている又は低減したフコース量を有する分子を生成する方法であって、
i)請求項1〜12のいずれか一項に記載の脊椎動物細胞を準備する工程と、
ii)i)における該細胞からフコシルトランスフェラーゼに対する基質となることができる分子、又はタンパク質若しくは脂質を単離する工程と、
を含む、自然状態ではその糖部分上において、フコースを含むが、その糖部分上において、フコースを欠いている又は低減したフコース量を有する分子を生成する方法。
【請求項14】
請求項13に記載の方法により入手可能な、その糖部分上において、フコースを欠いている又は低減したフコース量を有する分子。
【請求項15】
請求項14に記載の分子の組成物。
【請求項16】
i)70%〜95%のG0−GlcNac、G0、G1及び/又はG2の複合型N−グリカンと、
ii)5%〜30%の高マンノース型N−グリカンと、
を含む糖タンパク質を含む組成物であって、該糖タンパク質の該複合型N−グリカンがフコースを含まない、又はフコースを実質的に含まない、糖タンパク質を含む組成物。
【請求項17】
複合型N−グリカンの75%がG0の複合型N−グリカンであり、25%がG0−GlcNac、G1及び/又はG2の複合型N−グリカンである、請求項16に記載の組成物。
【請求項18】
高マンノース型N−グリカンの50%がman5グリカンであり、50%がman6、man7及び/又はman8のN−グリカンである、請求項16に記載の組成物。
【請求項19】
糖タンパク質が抗体、又はIgG1である、請求項16〜18のいずれか一項に記載の組成物。
【請求項20】
D−ラムノース、D−ペロサミン、デオキシ−D−タロース、6−デオキシ−D−アルトロース、4−ケト−3,6−ジデオキシ−D−マンノース及び/又はL−コリトースを含有する糖部分を含む、タンパク質又は脂質。
【請求項21】
基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用するが、GDP−6−デオキシ−D−リキソ−4−ヘキスロースをGDP−L−フコースに変換する反応を触媒しない酵素をコードする核酸配列を含むポリヌクレオチドに操作可能に連結した脊椎動物の発現制御配列を1つ又は複数含む発現単位。
【請求項22】
基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用する該酵素が、GDP−6−デオキシ−D−リキソ−4−ヘキスロースレダクターゼ(RMD)、GDP−ペロサミンシンテターゼ(Per)、GDP−6−デオキシ−D−タロースシンテターゼ(GTS)、GDP−フコースシンテターゼCys109Ser(GFS−Cys109Ser)突然変異体、GDP−4−ケト−6−デオキシマンノース−3−デヒドラターゼ(ColD)、又はGDP−L−コリトースシンターゼ(ColC)と組み合わせたGDP−4−ケト−6−デオキシマンノース−3−デヒドラターゼ(ColD)、及びそれらの変異体からなる群から選択される、請求項21に記載の発現単位。
【請求項23】
通常その糖部分上において、フコースを含むが、その糖部分上において、フコースを欠いている又は低減したフコース量を有するタンパク質を生成するための真核細胞であって、
i)基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用する酵素をコードする核酸配列を含む第1のポリヌクレオチドと、
ii)タンパク質をコードする核酸配列を含む第2のポリヌクレオチドと、
を含み、該酵素がGDP−6−デオキシ−D−リキソ−4−ヘキスロースをGDP−L−フコースに変換する反応を触媒しない、通常その糖部分上において、フコースを含むが、その糖部分上において、フコースを欠いている又は低減したフコース量を有するタンパク質を生成するための真核細胞。
【請求項24】
基質としてGDP−6−デオキシ−D−リキソ−4−ヘキスロースを使用する該酵素が、GDP−6−デオキシ−D−リキソ−4−ヘキスロースレダクターゼ(RMD)、GDP−ペロサミンシンテターゼ(Per)、GDP−6−デオキシ−D−タロースシンテターゼ(GTS)、GDP−フコースシンテターゼCys109Ser(GFS−Cys109Ser)突然変異体、GDP−4−ケト−6−デオキシマンノース−3−デヒドラターゼ(ColD)、又はGDP−L−コリトースシンターゼ(ColC)と組み合わせたGDP−4−ケト−6−デオキシマンノース−3−デヒドラターゼ(ColD)、及びそれらの変異体からなる群から選択される、請求項23に記載の真核細胞。
【請求項25】
タンパク質が、抗体、若しくはIgG1抗体、抗体断片、若しくは抗体のFc領域を含む抗体断片、抗体のFc領域を含む融合タンパク質、ウイルスタンパク質、ウイルスタンパク質断片、抗原、又はホルモンである、請求項23又は24に記載の真核細胞。
【請求項26】
通常その糖部分上において、フコースを含むが、その糖部分上において、フコースを欠いている又は低減したフコース量を有するタンパク質を生成する方法であって、
i)請求項23〜25のいずれか一項に記載の真核細胞を準備する工程と、
ii)前記細胞において該第1のポリヌクレオチドによりコードされる該酵素及び該第2のポリヌクレオチドによりコードされる該タンパク質を発現する工程と、
iii)前記細胞から該タンパク質を単離する工程と、
を含む、通常その糖部分上において、フコースを含むが、その糖部分上において、フコースを欠いている又は低減したフコース量を有するタンパク質を生成する方法。
【請求項27】
請求項26に記載の方法により入手可能な、その糖部分上において、フコースを欠いている又は低減したフコース量を有するタンパク質。
【図1】


【図4】


【図5−1】


【図5−2】


【図6】


【図8】


【図9】


【図10】


【図2】


【図3】


【図7】




【図4】


【図5−1】


【図5−2】


【図6】


【図8】


【図9】


【図10】


【図2】


【図3】


【図7】


【公表番号】特表2013−505028(P2013−505028A)
【公表日】平成25年2月14日(2013.2.14)
【国際特許分類】
【出願番号】特願2012−530159(P2012−530159)
【出願日】平成22年9月21日(2010.9.21)
【国際出願番号】PCT/EP2010/005772
【国際公開番号】WO2011/035884
【国際公開日】平成23年3月31日(2011.3.31)
【出願人】(512073688)
【Fターム(参考)】
【公表日】平成25年2月14日(2013.2.14)
【国際特許分類】
【出願日】平成22年9月21日(2010.9.21)
【国際出願番号】PCT/EP2010/005772
【国際公開番号】WO2011/035884
【国際公開日】平成23年3月31日(2011.3.31)
【出願人】(512073688)

【Fターム(参考)】
[ Back to top ]

