生体液のプロテオーム分析
【課題】IAI及び他の病的な母体/胎児の状態の初期及び正確な診断を可能にする新規なアプローチを提供する。
【解決手段】本発明は、生体液のプロテオームの同定、胎児起源の母体状態、染色体異数性、及び胎児の成長及び成熟に関連する胎児の疾患を含む、母体/胎児の状態の状況の決定におけるそれらの使用に関する。特定的には、本発明は、羊膜液のプロテオーム同定(複数のタンパク質は羊膜液の組成を表す)及び正常なプロテオームにおける特性変化と種々の病的な母体/胎児の状態、例えば羊膜内感染、又は染色体不全との相関に関する。本発明は、生体液のプロテオミクス分析による、病的な胎児/母体の状態を初期診断、予後のための、及び監視するための、非侵襲及び感受性の方法を提供する。
【解決手段】本発明は、生体液のプロテオームの同定、胎児起源の母体状態、染色体異数性、及び胎児の成長及び成熟に関連する胎児の疾患を含む、母体/胎児の状態の状況の決定におけるそれらの使用に関する。特定的には、本発明は、羊膜液のプロテオーム同定(複数のタンパク質は羊膜液の組成を表す)及び正常なプロテオームにおける特性変化と種々の病的な母体/胎児の状態、例えば羊膜内感染、又は染色体不全との相関に関する。本発明は、生体液のプロテオミクス分析による、病的な胎児/母体の状態を初期診断、予後のための、及び監視するための、非侵襲及び感受性の方法を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
(発明の背景)
(発明の分野)
本発明は、生体液のプロテオームの同定、胎児起源の母体状態、染色体異数性、及び胎児の成長及び成熟に関連する胎児の疾患を含む、母体/胎児の状態の状況の決定におけるそれらの使用に関する。特定的には、本発明は、羊水のプロテオーム同定(複数のタンパク質は羊水の組成を表す)及び正常なプロテオームにおける特性変化と種々の病的な母体/胎児の状態、例えば羊膜内感染、又は染色体不全との相関に関する。
【背景技術】
【0002】
(関連技術の記載)
プロテオミクス
タンパク質発現パターンの大スケール分析は、現在のDNA クローニング及び遺伝子プロファイリングアプローチに対する重要かつ必要な相補体として現れた(Pandey and Mann,Nature 405:837−46(2000))。DNA配列情報は、ホモロジー方法に基づくいくつかの構造的及び潜在的なタンパク質改質を推定するのに役立つが、翻訳後改質、タンパク分解又は区画化を介するタンパク質機能の制御についての情報を与えない。
伝統的なゲルベースの方法、例えば、一次元及び二次元ゲル電気泳動は、小スケールのタンパク質(<1,000タンパク質)検出に有用であるが、これらは大量のサンプルを必要とする(Lilley KS,Razzaq A,Dupree P:Two−dimensional gel electrophoresis:recent advances in sample preparation,detection and quantitation.Curr Opin Chem Biol.6(1):46−50,2002)。この制限を克服するためのアプローチとしては、サンプル中のタンパク質の質量を示すプロフィールを正確に作成するマトリックス支援又は表面増強レーザー脱離/イオン化(MALDIまたはSELDI)飛行時間質量分析計が挙げられる。これらのパターン又はプロフィールは、種々の疾患を同定及び監視するために使用することができる。同定の第2のレベルは、ペプチドフラグメントからアミノ酸配列情報を作成するためにカップリングペプチドマッピングからタンデム質量分析に由来する。これは、四極飛行時間MS(Qq−TOF MS)にMALDI/SELDI又はESIをカップリングすることによって達成可能である。後者の方法はさらに、特定のペプチドの定量に使用することができる(ICAT技術)。
【0003】
(病的な母体/胎児の状態の診断)
母体及び/又は胎児又は新生児の健康を含むか、又はいくつかの場合には、母体及び/又は胎児又は新生児の生命を脅かす、妊娠中に進行し得る多くの病的な母体及び胎児の状態、例えば、羊膜内感染(IAI)、子かん前症、早期出産及び早期分娩、及び染色体異数性が存在する。このような状態の初期診断は、適切な時期の処置及び介入を可能にするのに必須である。残念なことに、心象的な徴候及び症状は遅く表れ、しばしば非特異的で一致しないため、これらの状態のほとんどの初期診断は困難である。例えば、IAIの臨床的症状としては、典型的には、母体の発熱及び白血球増加症が挙げられるが、これらの症状はしばしば後で起こり、鋭敏でもなく特異的でもない。このように、Gravett et al.,Am.J.Obstet.Gynecol.171:1660−7(1994)は非ヒト霊長類モデルを利用し、グループBの連鎖球菌を用いた実験的羊膜内感染の後、熱及び白血球増加症が、実験的感染の28時間〜40時間後に生じる感染により誘発される早期分娩が発症時には50%しか存在しないことを示した。それ故に、診断の遅れを避けるために、疑惑の高い指標及び補助的な実験室的試験の適切な使用が保証される。IAIを診断するために通常使用される臨床的基準としては、以下の症状の2つ以上を伴う母体の発熱(≧37.8℃)が挙げられる:母体白血球増加症(315,000/mm3)、母体又は胎児の心急搏症、子宮圧痛、又は羊水の悪臭。
【0004】
臨床的特長が整合しないため、IAIの診断を補助するために他の補助的な実験室的試験が利用されてきた。これらの試験としては以下のものが挙げられる:母体のC−反応性タンパク質の測定、グラム染色に対して白血球又は微生物、羊水培養物について羊膜の直接試験、羊水のグルコース濃度の測定、羊水白血球エステラーゼの検出、気−液クロマトグラフィーによる微生物の有機酸の検出、種々の羊水又は膣のサイトカインの測定(例えば、インターロイキン2、4、6、顆粒球コロニー刺激因子、及び腫瘍壊死因子−α)、マトリックスメタロプロテアーゼ−9、ラクトフェリン、及び超音波検査法による胎児活性の評価(生物物理学的プロフィール)。サイトカイン又は他の生化学因子の測定は高価であり、一般的に臨床的に入手可能ではなく、主に研究ツールである。さらに、これらの試験の試験効率は、羊水グラム染色及び培養物、羊水グルコース濃度、及び羊水白血球エステラーゼの検出のようなより容易に利用可能な従来の試験よりも整合性があるわけではない。これらの試験の効率は、以前に広くまとめられている(Ohlsson,A. and Wang,E.:An analysis of antenatal tests to detect infection at preterm rupture of the membranes.American Journal of Obstetrics and Gynecology 162:809,1990)。全て合理的な感受性及び特異性を有するが、予想される値は、IAIの診断における臨床的特長を独立して利用するために十分感受性又は特異的ではない。
【0005】
それ故に、IAI及び他の病的な母体/胎児の状態の初期及び正確な診断を可能にする新規なアプローチの必要性が非常に存在する。
【0006】
染色体異数性を診断するための新規な、有効かつ信頼性のある非侵襲方法を開発することが特に望ましい。現在、母体の血清スクリーニング及び超音波による染色体異数性の絶対的診断は、ミッド−トリメスターの遺伝子羊膜穿刺を必要とする。これは、妊娠の損失のリスクの0.5%に関連する侵襲手順である。さらに、羊水細胞の染色体分析は、労働集約的であり、2週間までかかる時間のかかる手順である。それ故に、信頼できる試験は、母体血清又は他の生体液から染色体異数性の検出を高め、母体スクリーニングの陽性率の受容できない高い誤り率を減らし、羊膜穿刺後の羊水からの診断の速度及び効率を高めるために必要である。他の病的な(patahologic)異数性状態、例えば、クラインフェルター症候群及びターナー症候群は、超音波検査法又は従来の母体血清スクリーニングを用いたスクリーニングによっては完全に見落とされる場合がある。
【発明の概要】
【課題を解決するための手段】
【0007】
(発明の要旨)
本発明は、生体液のプロテオミクス分析による、病的な胎児/母体の状態を初期診断、予後のための、及び監視するための、非侵襲及び感受性の方法を提供する。
【0008】
本発明はさらに、限定されないが、羊膜内感染(IAI)、染色体異数性、及び胎児の在胎齢及び成熟度に関連する胎児の疾患を含む病的な胎児/母体の状態を初期診断、予後のための、及び監視することが可能な生体液、例えば、羊水及び母体血清のプロテオミクスプロフィールを提供する。特定的には、本発明は、IAI及び染色体異数性のための正常及び病的なプロテオミクスプロフィールを提供する。問題となる胎児/母体状態を排除する(陰性の診断)ことを可能にし、患者が不必要で潜在的に危険な処置又は介入を受ける必要性を排除するため、正常なプロテオミクスプロフィールの決定は非常に重要である。
【0009】
本発明はさらに、生体的、例えば、羊水又は母体血清中で異なって発現する種々の胎児又は母体の状態、例えば、IAI及び染色体異数性のような病的な状態が存在する場合、これらの存在及び状況のための特定のバイオマーカーを提供する。このようなバイオマーカー及びこのようなバイオマーカーに結合する抗体は、例えば、タンパク質又は抗体アレイ上に存在してもよく、単純な非侵襲診断アッセイにおける利用が見出されている。
【0010】
1つの局面では、本発明は、哺乳動物被検体から得られる生体液の試験サンプルのプロテオミクスプロフィールと正常サンプルのプロテオミクスプロフィール又は上記状態に特徴的な少なくとも1つの固有の発現サインを含む参照プロテオミクスプロフィールとを比較する工程を含む、母体又は胎児の状態を決定するための方法に関する。
【0011】
本方法の一実施形態では、哺乳動物被検体は妊娠したメスであり、好ましくは霊長類又はヒトである。
【0012】
別の実施形態では、母体の状態は、子宮内感染、子かん前症、及び早期分娩からなる群から選択される。
【0013】
さらなる実施形態では、胎児の状態は、染色体異数性、先天性奇形、在胎齢及び胎児成熟度からなる群から選択され、ここで、染色体異数性は、例えば、ダウン症候群、トリソミー−13、トリソミー−18、ターナー症候群、又はクラインフェルター症候群であることができる。
【0014】
任意の生体液は、限定されないが、羊水、血清、血漿、尿、脳脊髄液、母乳、粘液、及び唾液、好ましくは、羊水又は母体血清を含む、本発明の実行において使用することができる。
【0015】
さらなる実施形態では、試験サンプルのプロテオミクスプロフィールは、少なくとも2つのタンパク質の情報、又は少なくとも5つのタンパク質の情報、又は少なくとも10つのタンパク質の情報、又は少なくとも20つのタンパク質の情報、又は少なくとも50つのタンパク質の情報を含む。
【0016】
特定の実施形態では、プロテオミクスプロフィールはマススペクトルである。
【0017】
別の実施形態では、マススペクトルは、マススペクトルの3〜5kDa範囲で少なくとも1つの固有の発現サインを含む。
【0018】
なお別の実施形態では、マススペクトルの10〜12kDa範囲で少なくとも1つの固有の発現サインを含む。
【0019】
さらなる実施形態では、上記母体状態が羊膜内感染であり、上記固有の発現サインが前記試験サンプル中の10〜11kDa分子量範囲における余剰ピークであり、これが羊膜内感染の指標である。
【0020】
異なる実施形態では、プロテオミクスプロフィールはWesternブロット分析によって作成される。
【0021】
別の実施形態では、生体液は、ヒトの生体液であり、プロテオミクスプロフィールが以下:マクロファージキャッピングタンパク質、好中球ゼラチナーゼ関連リポカリン、ミエロペルオキシダーゼ;L−プラスチン;アズロシジン;抗菌性タンパク質FALL−39;Gp340改変タンパク質;Ebner唾液腺タンパク質ホモログ(GenBank受託番号355392);白血球エラスターゼインヒビター;カルグラヌリンA;カルグラヌリンB;コフィリン;モエシン;プロフィリンI、クロニン(cronin)様タンパク質p57;アネキシンII、フィブロネクチン;グリアから誘導されるネキシン;アンチトロンビン−III;扁平上皮細胞癌腫抗原1、扁平上皮細胞癌腫抗原2;セルピン12;シスタチンA;シスタチンB;シスタチンC;IGFBP−1;ビタミンD−結合タンパク質;アポリポタンパク質A−I;14−3−3タンパク質シグマ;14−3−3タンパク質ゼータ/デルタ;ゲルゾリン;ラクトトランスフェリン;ホスホグリセレートキナーゼ1;ホスホグリセレートムターゼ1;及びトランスケトラーゼ;又はそれらのフラグメント、前駆体、又は天然に生じる改変体からなる群から選択される1つ以上のタンパク質の発現情報を含む。
【0022】
さらなる実施形態では、プロテオミクスプロフィールは、マクロファージキャッピングタンパク質;好中球ゼラチナーゼ関連リポカリン;ミエロペルオキシダーゼ;L−プラスチン;アズロシジン;抗菌性タンパク質FALL−39;白血球エラスターゼインヒビター;カルグラヌリンA;カルグラヌリンB;プロフィリンI、グリアから誘導されるネキシン;セルピン12;シスタチンA;及びIGFBP−1;又はそれらのフラグメント、前駆体、又は天然に生じる改変体からなる群から選択される1つ以上のタンパク質の情報を含む。
【0023】
上述の方法は、限定されないが、羊膜内感染、臓器系、筋骨格奇形の不全を含む発育不全、及び染色体異数性から生じる状態、例えば、ダウン症候群、トリソミー−13、トリソミー−18、ターナー症候群、又はクラインフェルター症候群を含む、種々の胎児及び母体の状態の診断のために好適である。
【0024】
試験サンプルのプロテオミクスプロフィールが本質的に正常サンプルのプロテオミクスプロフィールと同じである場合、被検体は上記の母体又は胎児の状態を有していないと決定される。
【0025】
上記プロテオミクスプロフィールが疾患サンプルと本質的に同じ固有の発現サインを含有する場合、患者は対応する母体又は胎児の状態と診断される。
【0026】
別の局面では、本発明は、羊膜内感染を診断するための方法であって、
(a)妊娠したメスの哺乳動物から得られる生体液の試験サンプルのプロテオミクスプロフィールと正常サンプルのプロテオミクスプロフィール又は参照プロテオミクスプロフィールとを比較する工程であって、上記プロテオミクスプロフィールが上記サンプル中に存在するタンパク質又はそれらのタンパク分解性のフラグメントの量の情報を与える、工程;及び
(b)上記試験サンプルのプロテオミクスプロフィールが3〜5kDa及び/又は10〜12kDa分子量範囲で固有の発現サインを示す場合、上記哺乳動物を羊膜内感染であると診断する工程を含む方法に関する。
【0027】
さらなる局面では、本発明は、羊膜内感染を診断するための方法であって、
(a)妊娠したメスの哺乳動物から得られる生体液の試験サンプルのプロテオミクスプロフィールと正常サンプルのプロテオミクスプロフィールとを比較する工程;及び
(b)IGFB−1、プロフィリン、セルロプラスミン、及びL−プラスチン、カルグラヌリン、又はそれらのフラグメント、前駆体、又は天然に生じる改変体からなる群から選択される少なくとも1つのタンパク質が上記正常サンプルと比較して上記試験サンプルにおいて異なって発現される場合に上記哺乳動物を羊膜内感染であると診断する工程を含む、方法に関する。
【0028】
特定の実施形態では、IGFBP−1、プロフィリン、セルロプラスミン、及びカルグラヌリン、又はそれらのフラグメント、前駆体、又は天然に生じる改変体のうち少なくとも1つが、正常サンプルと比較して試験サンプルにおいて過剰発現する。
【0029】
別の実施形態では、L−プラスチンが、正常サンプルと比較して試験サンプルにおいて過剰発現する。
【0030】
なお別の実施形態では、IGFBP−1の存在が図12に示されるタンパク分解性のフラグメント又はそれらのフラグメントを同定することによって検出される。
【0031】
別の局面では、本発明は、染色体異数性を診断するための方法であって、
(a)妊娠したメスの哺乳動物から得られる生体液の試験サンプルのプロテオミクスプロフィールと正常サンプルのプロテオミクスプロフィール又は参照プロテオミクスプロフィールとを比較する工程であって、上記プロテオミクスプロフィールが上記サンプル中に存在するタンパク質又はそれらのタンパク分解性のフラグメントの量の情報を与える、工程;及び
(b)上記試験サンプルのプロテオミクスプロフィールが4〜15kDa分子量範囲で固有の発現サインを示す場合、上記哺乳動物を染色体異数性であると診断する工程を含む方法に関する。
【0032】
異なる局面では、本発明は、胎児の発育不全を診断するための方法であって、
(a)妊娠したメスの哺乳動物から得られる生体液の試験サンプルのプロテオミクスプロフィールと正常サンプルのプロテオミクスプロフィール又は参照プロテオミクスプロフィールとを比較する工程;及び
(b)少なくとも1つのアクチン調整タンパク質、又はそれらのフラグメント、前駆体、又は天然に生じる改変体が前記正常サンプルと比較して上記試験サンプルにおいて異なって発現する場合、上記発育不全の存在を確認する工程を含む方法に関する。
【0033】
本方法の特定の実施形態では、アクチン調整タンパク質は、モエシン、p57、ゲルゾリン、及び14−3−3タンパク質からなる群から選択される。
【0034】
さらなる局面では、本発明は、母体又は胎児の感染又は免疫応答に関連する障害を診断するための方法であって、
(a)妊娠したメスの哺乳動物から得られる生体液の試験サンプルのプロテオミクスプロフィールと正常サンプルのプロテオミクスプロフィール又は参照プロテオミクスプロフィールとを比較する工程;及び
(b)マクロファージキャッピングタンパク質(MCP)、白血球エラスターゼ、好中球ゼラチナーゼ関連リポカルシン(lipcalcin)(NGAL)、ミエロペルオキシダーゼ、L−プラスチン、カルグラヌリン(calgranulin)、FALL−39、アジロシジン(azyrocidin)(CAPS7)、プロテアーゼ及びプロテアーゼインヒビターからなる群から選択される少なくとも1つのタンパク質が上記正常サンプルと比較して上記試験サンプルにおいて異なって発現する場合、上記母体又は胎児の感染又は免疫応答に関連する障害を確認する工程を含む方法に関する。
【0035】
なおさらなる局面では、本発明は、妊娠したメス哺乳動物から得られる生体液のプロテオミクスプロフィール中でGp−340の存在を検出する工程を含む、新生児セプシスを診断するための方法に関する。
【0036】
なお別の局面では、本発明は、マクロファージキャッピングタンパク質、好中球ゼラチナーゼ関連リポカリン、ミエロペルオキシダーゼ;L−プラスチン;アズロシジン;抗菌性タンパク質FALL−39;Gp340改変体タンパク質;Ebner唾液腺タンパク質ホモログ(GenBank受託番号(GenBank Accession No.)355392);白血球エラスターゼインヒビター;カルグラヌリン(calgranulin)A;カルグラヌリン(calgranulin)B;コフィリン;モエシン;プロフィリンI、クロニン(cronin)様タンパク質p57;アネキシンII、フィブロネクチン;グリアから誘導されるネキシン;アンチトロンビン−III;扁平上皮細胞癌腫抗原1、扁平上皮細胞癌腫抗原2;セルピン12;シスタチンA;シスタチンB;シスタチンC;IGFBP−1;ビタミンD−結合タンパク質;アポリポタンパク質A−I;14−3−3タンパク質シグマ;14−3−3タンパク質ゼータ/デルタ;ゲルゾリン;ラクトトランスフェリン;ホスホグリセレートキナーゼ1;ホスホグリセレートムターゼ1;及びトランスケトラーゼ;又はそれらのフラグメント、前駆体、又は天然に生じる改変体からなる群から選択される1つ以上のタンパク質情報を含む生体液のプロテオミクスプロフィールに関する。
【0037】
さなる局面では、本発明は、マクロファージキャッピングタンパク質;好中球ゼラチナーゼ関連リポカリン;ミエロペルオキシダーゼ;L−プラスチン;アズロシジン;抗菌性タンパク質FALL−39;白血球エラスターゼインヒビター;カルグラヌリン(calgranulin)A;カルグラヌリン(calgranulin)B;プロフィリンI、グリアから誘導されるネキシン;セルピン12;シスタチンA;及びIGFBP−1;又はそれらのフラグメント、前駆体、又は天然に生じる改変体からなる群から選択される1つ以上のタンパク質情報を含む生体液のプロテオミクスプロフィールに関する。
【0038】
本発明はさらに、IGFB−1,プロフィリン、セルロプラスミン、L−プラスチン、及びカルグラヌリン(calgranulin)からなる群から選択されるタンパク質の存在を確認する情報を含む、羊膜内感染に特徴的な生体液のプロテオミクスプロフィールに関する。
【0039】
別の局面では、本発明は、上記生体液中に存在するタンパク質又はそれらのフラグメントの分子量情報を提供する形態で表され、3〜5KDa及び/又は10〜12KDa分子量範囲で固有の発現サインを含む、羊膜内感染に特徴的な生体液のプロテオミクスプロフィールに関する。
【0040】
さらなる局面では、本発明は、図1A〜1Cのいずれか1つに本質的に示されるようなプロテオミクスプロフィール、又は図2A〜Cのいずれか1つに本質的に示されるようなプロテオミクスプロフィール、又は図3A〜Cのいずれか1つに本質的に示されるようなプロテオミクスプロフィール、又は図4A又は4Bのいずれか1つに本質的に示されるようなプロテオミクスプロフィール、又は図6〜10のいずれか1つに本質的に示されるようなプロテオミクスプロフィールに関する。
【0041】
特定の実施形態では、上記プロテオミクスプロフィールはマイクロアレイフォーマットにおいて分析される。
本発明はまた、以下の項目を提供する。
(項目1)
母体又は胎児の状態を決定するための方法であって、
哺乳動物被検体から得られる生体液の試験サンプルのプロテオミクスプロフィールと正常サンプルのプロテオミクスプロフィール又は上記状態に特徴的な少なくとも1つの固有の発現サインを含む参照プロテオミクスプロフィールとを比較する工程と、
上記母体又は胎児の状態を決定する工程とを含む、
方法。
(項目2)
上記哺乳動物被検体が妊娠したメスである、項目1に記載の方法。
(項目3)
上記妊娠したメスがヒトである、項目2に記載の方法。
(項目4)
上記母体の状態が、羊膜内感染、子かん前症、及び早期陣痛からなる群から選択される、項目3に記載の方法。
(項目5)
上記胎児の状態が、染色体異数性、先天性奇形、在胎齢及び成熟度からなる群から選択される、項目3に記載の方法。
(項目6)
上記生体液が、羊膜液、血清、血漿、尿、脳脊髄液、母乳、粘液、及び唾液からなる群から選択される、項目1に記載の方法。
(項目7)
上記生体液が羊膜液又は母体の血清である、項目3に記載の方法。
(項目8)
上記試験サンプルのプロテオミクスプロフィールが、少なくとも2つのタンパク質の情報を含む、項目1に記載の方法。
(項目9)
上記プロテオミクスプロフィールがマススペクトルである、項目1に記載の方法。
(項目10)
上記プロテオミクスプロフィールが、マススペクトルの3〜5kDa範囲で少なくとも1つの固有の発現サインを含む、項目9に記載の方法。
(項目11)
上記プロテオミクスプロフィールが、マススペクトルの10〜12kDa範囲で少なくとも1つの固有の発現サインを含む、項目9に記載の方法。
(項目12)
上記母体状態が羊膜内感染であり、上記固有の発現サインが上記試験サンプル中の10〜12kDa分子量範囲における余剰ピークであり、これが羊膜内感染の指標である、項目9に記載の方法。
(項目13)
上記生体液が羊膜液又は母体の血清である、項目12に記載の方法。
(項目14)
上記プロテオミクスプロフィールがWesternブロット分析によって生成される、項目1に記載の方法。
(項目15)
上記生体液がヒトの生体液であり、プロテオミクスプロフィールが以下:マクロファージキャッピングタンパク質、好中球ゼラチナーゼ関連リポカリン、ミエロペルオキシダーゼ;L−プラスチン;アズロシジン;抗菌性タンパク質FALL−39;Gp340改変タンパク質;Ebner唾液腺タンパク質ホモログ(GenBank受託番号355392);白血球エラスターゼインヒビター;カルグラヌリンA;カルグラヌリンB;コフィリン;モエシン;プロフィリンI、クロニン様タンパク質p57;アネキシンII、フィブロネクチン;グリアから誘導されるネキシン;アンチトロンビン−III;扁平上皮細胞癌腫抗原1、扁平上皮細胞癌腫抗原2;セルピン12;シスタチンA;シスタチンB;シスタチンC;IGFBP−1;ビタミンD−結合タンパク質;アポリポタンパク質A−I;14−3−3タンパク質シグマ;14−3−3タンパク質ゼータ/デルタ;ゲルゾリン;ラクトトランスフェリン;ホスホグリセレートキナーゼ1;ホスホグリセレートムターゼ1;及びトランスケトラーゼ;又はそれらのフラグメント、前駆体、又は天然に生じる改変体からなる群から選択される1つ以上のタンパク質の発現情報を含む、項目1に記載の方法。
(項目16)
上記プロテオミクスプロフィールが上記タンパク質の2つ以上の発現情報を含む、項目15に記載の方法。
(項目17)
上記プロテオミクスプロフィールが上記タンパク質の全ての発現情報を含む、項目15に記載の方法。
(項目18)
上記生体液が羊膜液である、項目15に記載の方法。
(項目19)
上記プロテオミクスプロフィールが正常サンプルのプロテオミクスプロフィールである、項目15に記載の方法。
(項目20)
上記プロテオミクスプロフィールが上記試験サンプル又は参照サンプルのプロテオミクスプロフィールである、項目15に記載の方法。
(項目21)
上記タンパク質の1つ以上が、上記正常サンプルと比較して上記試験サンプルにおいて異なって発現される、項目15に記載の方法。
(項目22)
上記プロテオミクスプロフィールが以下:マクロファージキャッピングタンパク質;好中球ゼラチナーゼ関連リポカリン;ミエロペルオキシダーゼ;L−プラスチン;アズロシジン;抗菌性タンパク質FALL−39;白血球エラスターゼインヒビター;カルグラヌリンA;カルグラヌリンB;プロフィリンI,グリアから誘導されるネキシン;セルピン12;シスタチンA;及びIGFBP−1;又はそれらのフラグメント、前駆体、又は天然に生じる改変体からなる群から選択される1つ以上のタンパク質の発現情報を含む、項目21に記載の方法。
(項目23)
上記プロテオミクスプロフィールが上記タンパク質の2つ以上の発現情報を含む、項目22に記載の方法。
(項目24)
上記プロテオミクスプロフィールが上記タンパク質の全ての発現情報を含む、項目22に記載の方法。
(項目25)
上記被検体が羊膜感染と診断される、項目22に記載の方法。
(項目26)
上記患者が発育不全であると診断される、項目22に記載の方法。
(項目27)
上記発育不全が臓器系の発育における不全である、項目26に記載の方法。
(項目28)
上記臓器系が中枢神経系又は心臓血管系である、項目27に記載の方法。
(項目29)
上記発育不全が筋骨格の奇形である、項目28に記載の方法。
(項目30)
上記発育不全が染色体の異数性から生じる、項目28に記載の方法。
(項目31)
上記試験サンプルのプロテオミクスプロフィールが上記正常サンプルのプロテオミクスプロフィールと本質的に同じであり、上記被検体が上記母体又は胎児の状態を有さないと決定される、項目22に記載の方法。
(項目32)
上記プロテオミクスプロフィールが、表3及び4に列挙されるタンパク質からなる群から選択される1つ以上のタンパク質の発現情報を含む、項目22に記載の方法。
(項目33)
上記プロテオミクスプロフィールが、上記参照サンプルと同じ固有の発現サインを含む、項目22に記載の方法。
(項目34)
上記固有の発現サインが羊膜内感染に特徴的である、項目32に記載の方法。
(項目35)
上記被検体が羊膜内感染であると診断される、項目34に記載の方法。
(項目36)
羊膜内感染を診断するための方法であって、
(a)妊娠したメスの哺乳動物から得られる生体液の試験サンプルのプロテオミクスプロフィールと、正常サンプルのプロテオミクスプロフィール又は参照プロテオミクスプロフィールとを比較する工程であって、上記プロテオミクスプロフィールが上記サンプル中に存在するタンパク質又はそれらのタンパク分解性のフラグメントの量の情報を与える、工程;及び
(b)上記試験サンプルのプロテオミクスプロフィールが3〜5KDa及び/又は10〜12KDa分子量範囲で固有の発現サインを示す場合、上記哺乳動物を羊膜内感染であると診断する工程
を含む方法。
(項目37)
上記プロテオミクスプロフィールがマススペクトルの形態で表される、項目36に記載の方法。
(項目38)
上記哺乳動物が霊長類である、項目37に記載の方法。
(項目39)
上記霊長類がヒトである、項目38に記載の方法。
(項目40)
上記羊膜内感染の推移を監視する工程をさらに含む、項目39に記載の方法。
(項目41)
上記生体液が羊膜液又は母体の血清である、項目39に記載の方法。
(項目42)
羊膜内感染を診断するための方法であって、
(a)妊娠したメスの哺乳動物から得られる生体液の試験サンプルのプロテオミクスプロフィールと、正常サンプルのプロテオミクスプロフィールとを比較する工程;及び
(b)IGFB−1、カルグラヌリン、アズロシジン、プロフィリン、セルロプラスミン、及びL−プラスチン、又はそれらのフラグメント、前駆体、又は天然に生じる改変体からなる群から選択される少なくとも1つのタンパク質が上記正常サンプルと比較して上記試験サンプルにおいて異なって発現される場合に上記哺乳動物を羊膜内感染であると診断する工程
を含む、方法。
(項目43)
上記哺乳動物が霊長類である、項目42に記載の方法。
(項目44)
上記霊長類がヒトである、項目43に記載の方法。
(項目45)
上記生体液が羊膜液又は母体の血清である、項目44に記載の方法。
(項目46)
IGFBP−1、カルグラヌリン、アズロシジン、プロフィリン、及びセルロプラスミン、又はそれらのフラグメント、前駆体、又は天然に生じる改変体の少なくとも1つが上記正常サンプルと比較して上記試験サンプルにおいて過剰発現する、項目42に記載の方法。
(項目47)
L−プラスチンが上記正常サンプルと比較して上記試験サンプルにおいて過剰発現する、項目42に記載の方法。
(項目48)
IGFBP−1の存在が図12に示されるタンパク分解性のフラグメント又はそれらのフラグメントを同定することによって検出される、項目46に記載の方法。
(項目49)
上記羊膜内感染の状況を監視する工程をさらに含む、項目48に記載の方法。
(項目50)
染色体異数性を診断するための方法であって、
(a)妊娠したメスの哺乳動物から得られる生体液の試験サンプルのプロテオミクスプロフィールと、正常サンプルのプロテオミクスプロフィール又は参照プロテオミクスプロフィールとを比較する工程であって、上記プロテオミクスプロフィールが上記サンプル中に存在するタンパク質又はそれらのタンパク分解性のフラグメントの量の情報を与える、工程;及び
(b)上記試験サンプルのプロテオミクスプロフィールが4〜15KDa分子量範囲で固有の発現サインを示す場合、上記哺乳動物を染色体異数性であると診断する工程
を含む方法。
(項目51)
上記染色体異数性がダウン症候群である、項目50に記載の方法。
(項目52)
胎児の発育不全を診断するための方法であって、
(a)妊娠したメスの哺乳動物から得られる生体液の試験サンプルのプロテオミクスプロフィールと、正常サンプルのプロテオミクスプロフィール又は参照プロテオミクスプロフィールとを比較する工程;及び
(b)少なくとも1つのアクチン調整タンパク質、又はそれらのフラグメント、前駆体、又は天然に生じる改変体が上記正常サンプルと比較して上記試験サンプルにおいて異なって発現する場合、上記発育不全の存在を確認する工程
を含む方法。
(項目53)
上記アクチン調整タンパク質がモエシン、p57、ゲルソリン、及び14−3−3タンパク質からなる群から選択される、項目52に記載の方法。
(項目54)
母体又は胎児の感染又は免疫応答に関連する障害を診断するための方法であって、
(a)妊娠したメスの哺乳動物から得られる生体液の試験サンプルのプロテオミクスプロフィールと、正常サンプルのプロテオミクスプロフィール又は参照プロテオミクスプロフィールとを比較する工程;及び
(b)マクロファージキャッピングタンパク質(MCP)、白血球エラスターゼ、好中球ゼラチナーゼ関連リポカルシン(lipcalcin)(NGAL)、ミエロペルオキシダーゼ、L−プラスチン、カルグラヌリン、FALL−39、アジロシジン(azyrocidin)(CAP37)、プロテアーゼ及びプロテアーゼインヒビターからなる群から選択される少なくとも1つのタンパク質が上記正常サンプルと比較して上記試験サンプルにおいて異なって発現する場合、上記母体又は胎児の感染又は免疫応答に関連する障害の存在を確認する工程
を含む方法。
(項目55)
新生児セプシスを診断するための方法であって、妊娠したメス哺乳動物から得られる生体液のプロテオミクスプロフィールにおいてGp−340の存在を検出する工程を含む方法。
(項目56)
マクロファージキャッピングタンパク質、好中球ゼラチナーゼ関連リポカリン、ミエロペルオキシダーゼ;L−プラスチン;アズロシジン;抗菌性タンパク質FALL−39;Gp340改変体タンパク質;Ebner唾液腺タンパク質ホモログ(GenBank受託番号355392);白血球エラスターゼインヒビター;カルグラヌリンA;カルグラヌリンB;コフィリン;モエシン;プロフィリンI、クロニン様タンパク質p57;アネキシンII、フィブロネクチン;グリアから誘導されるネキシン;アンチトロンビン−III;扁平上皮細胞癌腫抗原1、扁平上皮細胞癌腫抗原2;セルピン12;シスタチンA;シスタチンB;シスタチンC;IGFBP−1;ビタミンD−結合タンパク質;アポリポタンパク質A−I;14−3−3タンパク質シグマ;14−3−3タンパク質ゼータ/デルタ;ゲルゾリン;ラクトトランスフェリン;ホスホグリセレートキナーゼ1;ホスホグリセレートムターゼ1;及びトランスケトラーゼ;又はそれらのフラグメント、前駆体、又は天然に生じる改変体からなる群から選択される1つ以上のタンパク質の発現情報を含む、生体液のプロテオミクスプロフィール。
(項目57)
マクロファージキャッピングタンパク質;好中球ゼラチナーゼ関連リポカリン;ミエロペルオキシダーゼ;L−プラスチン;アズロシジン;抗菌性タンパク質FALL−39;白血球エラスターゼインヒビター;カルグラヌリンA;カルグラヌリンB;プロフィリンI、グリアから誘導されるネキシン;セルピン12;シスタチンA;及びIGFBP−1;又はそれらのフラグメント、前駆体、又は天然に生じる改変体からなる群から選択される1つ以上のタンパク質の発現情報を含む、生体液のプロテオミクスプロフィール。
(項目58)
表3及び4に列挙されるタンパク質からなる群から選択される1つ以上のタンパク質の情報を含む、生体サンプルのプロテオミクスプロフィール。
(項目59)
上記1つ以上のタンパク質、又はそれらのフラグメント、前駆体、又は天然に生じる改変体の存在を確認する、項目56〜58のいずれか1項に記載のプロテオミクスプロフィール。
(項目60)
IGFB−1,プロフィリン、セルロプラスミン、L−プラスチン、及びカルグラヌリンからなる群から選択されるタンパク質の存在を確認する情報を含む、羊膜内感染に特徴的な生体液のプロテオミクスプロフィール。
(項目61)
上記生体液中に存在するタンパク質又はそれらのタンパク質分解性フラグメントの分子量の情報を提供する形態で表され、3〜5KDa及び/又は10〜12KDa分子量範囲で固有の発現サインを含む、羊膜内感染に特徴的な生体液のプロテオミクスプロフィール。
(項目62)
マススペクトルとして表される、項目60に記載のプロテオミクスプロフィール。
(項目63)
上記生体液が羊膜液又は母体血清である、項目61に記載のプロテオミクスプロフィール。
(項目64)
図1A〜1Cのいずれか1つに本質的に示されるようなプロテオミクスプロフィール。
(項目65)
図2A〜Cのいずれか1つに本質的に示されるようなプロテオミクスプロフィール。
(項目66)
図3A〜Cのいずれか1つに本質的に示されるようなプロテオミクスプロフィール。
(項目67)
図4A又は4Bに本質的に示されるようなプロテオミクスプロフィール。
(項目68)
図6〜10のいずれか1つに本質的に示されるようなプロテオミクスプロフィール。
(項目69)
マイクロアレイフォーマットにおいて分析される、項目63〜67のいずれか1項に記載のプロテオミクスプロフィール。
(項目70)
固体支持体上に固定された表2〜4に列挙されるタンパク質から選択される1つ以上のタンパク質を含む、タンパク質アレイ。
(項目71)
固体支持体上に固定された表2〜4に列挙される1つ以上のタンパク質に特異的に結合する抗体を含む、抗体アレイ。
【図面の簡単な説明】
【0042】
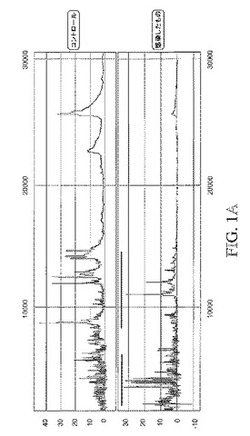
【図1A】図1A。霊長類の羊水中の感染を誘発する示差タンパク質の発現。化学的に定義されたNormal Phaseチップアレイに結合する羊水抽出物のSELDI−TOF分析。(A)ピーク強度において差異を示す235レーザー強度で集められた全スペクトル。
【図1B】図1B。霊長類の羊水中の感染を誘発する示差タンパク質の発現。化学的に定義されたNormal Phaseチップアレイに結合する羊水抽出物のSELDI−TOF分析。(B)コントロールと感染したものとの間で約10〜12KDaにおける差異を示す詳細なスペクトル。
【図1C】図1C。霊長類の羊水中の感染を誘発する示差タンパク質の発現。化学的に定義されたNormal Phaseチップアレイに結合する羊水抽出物のSELDI−TOF分析。(C)コントロールと感染したものとの間で約3〜5KDaにおける差異を示す詳細なスペクトル。実線は、診断試験を開発するために使用される、発現(固有の発現サイン)において有意な差を示すために使用された。
【図2】図2A〜C。感染に応答する霊長類羊水の時間推移分析(GBS)。以下に記載されるように、バクテリアの接種前で感染後に羊水を集め、SELDI−TOF分析を行った。図2A:感染前;2B:感染12時間後;2C:感染36時間後。
【図3A】図3A。ヒト羊水において感染を誘発する示差タンパク質発現。化学的に定義されたNormal Phaseチップアレイに結合する羊水抽出物のSELDI−TOF分析。(A)ピーク強度において差異を示す235レーザー強度で集められた全スペクトル。
【図3B】図3B。ヒト羊水において感染を誘発する示差タンパク質発現。化学的に定義されたNormal Phaseチップアレイに結合する羊水抽出物のSELDI−TOF分析。(B)コントロールと感染したものとの間で約10〜12KDaにおける差異を示す詳細なスペクトル。
【図3C】図3C。ヒト羊水において感染を誘発する示差タンパク質発現。化学的に定義されたNormal Phaseチップアレイに結合する羊水抽出物のSELDI−TOF分析。(C)コントロールと感染したものとの間で約3〜5KDaにおける差異を示す詳細なスペクトル。
【図4A】図4A。ヒト由来の羊水を用いた遺伝子MALDI−TOF質量分析計で達成されるマススペクトル。(A)コントロール、子宮内感染なし。
【図4B】図4B。ヒト由来の羊水を用いた遺伝子MALDI−TOF質量分析計で達成されるマススペクトル。(B)サンプル、子宮内感染あり。
【図5】図5。SDS−PAGE Coomassie Blue染色されたゲル。(A)プールされた4つのヒトコントロールAFサンプル;(B)個々のコントロールAFサンプル;(C)プールされた4つのヒトの感染AFサンプル;(D)個々の感染したAFサンプル。
【図6】図6。ヒト羊水中の示差タンパク質発現の検出。(A)コントロールAFサンプル(プールされた);(B)感染したAFサンプル(プールされた)。
【図7】図7。ヒト羊水中の示差タンパク質発現の検出。(A)コントロールAFサンプル(プールされた;(B)感染したAFサンプル(プールされた)。
【図8】図8は、ヒト羊水及び母体血清中の示差タンパク質発現の検出を示す。(A)コントロールサンプル(プールされた);(B)感染したサンプル(プールされた)。
【図9】図9は、タンパク質アレイを用いた、母体血清中で示差発現されたタンパク質の検出を示す。(1)対応するタンパク質とそれらの抗体との結合を示すタンパク質アレイの擬似色画像;(2)アレイの拡大された領域;(3)カルグラヌリン(calgranulin)IPのWesternブロット。
【図10】図10は、トリソミーを識別するための固有のプロフィールを用いた、母体血清中の示差タンパク質発現パターンを示す。
【図11】図ll。羊水タンパク質PRO1_ヒト(P07737)プロフィリンI(SEQ ID NO:5〜11)のタンパク質のデノボ配列同定の概要図。
【図12】図12。IGFBP−1 デノボタンパク質同定及びタンパク分解性のフラグメント配列(SEQ ID NO:1)。Ms/MSを用いたサンプル0426se_Hl_12及び0425se_Hl_13中に見いだされるペプチド配列が下側の枠内に示される(SEQ ID NO:2及び3)。これらは、トリプシン染色した1−Dゲルバンドで試験し、MS/MS分析にかけた場合、感染した羊水から得られた。1−Dゲル中で検出したIGF−BP−1のタンパク分解性のフラグメント(低分子量範囲、図5)、感染した羊水由来のトリプシン消化した約10.5〜12KDaバンドのWesternブロット(図6)及びMS/MS分析(図13)を下線を引いた配列の領域中に表す(SEQ ID NO:4)。
【図13】図13。感染した羊水由来の10.5〜11kD 1Dゲルバンドのトリプシン消化物のLCQ−MSプロフィール。親イオンを示すLCQ−MSはサンプル中に存在する潜在的なタンパク質を表す。
【図14】図14。図13に示される保持時間17.55〜18.21分のピークについてのマススペクトル。
【図15】図15。図14に示される434.9ピークの親イオンについてのMS/MSスペクトル。
【図16】図16。IAIに対するバイオマーカーの免疫検出。(16a)霊長類コントロール(−)及び感染した(+)AF。(16b)ヒトコントロール(−)及び感染した(+)AF。(16c)ヒトコントロール(−)及び感染した(+)AF。ビタミンD結合タンパク質(VDBP)制御されていないコントロールマーカー。IGFBP−1バンドはインタクトなタンパク質(約30kDa)及びタンパク分解性のフラグメント(約11kDa)を表す。(16d)免疫沈降物由来のプールされた母体血清中のIGFBP1の検出。コントロール(−)及び感染した(+)血清。(16e)免疫沈降物由来のプールされた母体血清中のカルグラヌリン(calgranulin)Bの検出。コントロール(−)及び感染した(+)血清。
【発明を実施するための形態】
【0043】
(好ましい実施形態の詳細な記載)
A.定義
他に定義されない限り、本明細書中で使用される技術用語及び科学用語は、本発明が属する分野の当業者によって通常理解される意味と同じ意味を有する。Singleton et al.,Dictionary of Microbiology and Molecular Biology 2nd ed.,J.Wiley & Sons(New York,NY 1994)は、本出願中で使用される用語の多くに対する一般的なガイドを当業者に提供する。
【0044】
用語「プロテオーム」は、所与の時間で生物学的サンプル中のタンパク質の有意な部分を記載するために本明細書中で使用される。プロテオームの概念は、ゲノムとは基本的に異なる。ゲノムは事実上静的であるが、プロテオームは内部事象及び外部事象に応答して連続的に変化する。
【0045】
用語「プロテオミクスプロフィール」は、生物学的サンプル中、例えば、所与の時間での生体液中の複数のタンパク質の発現パターンの代表例を示すために本明細書中で使用される。プロテオミクスプロフィールは、例えば、マススペクトルとして表すことができるが、タンパク質の物理化学的性質又は生化学的性質のいずれかに基づく他の代表例も含まれる。従って、プロテオミクスプロフィールは、例えば、二次元ゲル電気泳動、例えば、2−D PAGEによって決定されるようなタンパク質の電気泳動性における差に基づいてもよく、例えば、二次元電気泳動ゲル中の複数のスポットとして表すことができる。示差発現プロフィールは、特定の同定されたタンパク質の非存在下でさえ、重要な診断値を有してもよい。次いで、例えば、イムノブロッティングによって単一のタンパク質スポットを検出することができ、タンパク質マイクロアレイを用いた複数のスポット又はタンパク質を検出することができる。プロテオミクスプロフィールは、典型的には、いくつかのピークから50以上のピークを表す複雑なプロフィールまでの範囲にある情報を表すか又は含有する。従って、例えば、プロテオミクスプロフィールは、少なくとも2、又は少なくとも5、又は少なくとも10、又は少なくとも15、又は少なくとも20、又は少なくとも25、又は少なくとも30、又は少なくとも35、又は少なくとも40、又は少なくとも45、又は少なくとも50タンパク質を含有するか又は表してもよい。
【0046】
用語「病的な状態」は、最も広い意味において使用され、被検体の健康を危うくする全ての変化及び現象をカバーする。病的な母体の状態とは、限定されないが、羊膜内感染、胎児又は母体起源の状態、例えば、子かん前症、及び早期分娩及び早期分娩が挙げられる。病的な胎児の状態とは、限定されないが、染色体不全(異数性)、例えば、ダウン症候群、及び在胎齢及び胎児の成熟度における全ての異常が挙げられる。
【0047】
用語「病的な[母体又は胎児]状態の状況」は、最も広い意味において使用され、病的な状態の非存在、存在、程度、段階、性質、成長又は抑制を指す。
【0048】
用語「固有の発現サイン」は、統計学的に有意な様式で、対応する正常な生物学的サンプル(同じ種類の起源、例えば生体液から得られる)とは異なる生物学的サンプル(例えば、参照サンプル)のプロテオミクスプロフィール内の固有の特徴又はモチーフを記載するために使用される。
【0049】
用語「羊膜内感染(IAI)」、「羊水感染」、「羊膜炎」及び「臨床的絨毛羊膜炎は、相互に交換可能に使用され、妊娠中の羊水及び子宮内成分の細菌に限定されないものを含む、急性感染を指す。
【0050】
「患者応答」は、限定されないが、(1)病的な状態の、少なくともある程度までの阻害、(2)病的な状態の予防、(3)病的な状態に関連する1つ以上の症状の、少なくともある程度までの軽減;(4)処置後の生存時間の増加;及び/又は(5)処置後の所与の時間点での死亡率の減少を含む、患者に対する利益を示す任意の終点を用いて評価することができる。
【0051】
用語「処置」は、治療的処置及び予防又は防止測定を指し、この目的は、標的とされる病的な状態又は障害を防ぐか又は遅らせる(減らす)ことである。処置を必要とするものとしては、障害を既に有しているもの、及び障害を有すると考えられるもの又は障害を防ぐと思われるものが挙げられる。
【0052】
「先天性奇形」は、遺伝性ではないが出世時に存在する異常である。
【0053】
B.詳細な記載
本発明は、母体又は胎児の生体液のプロテオミクスプロフィールに基づく、母体及び胎児の状態の初期の、信頼性のある非侵襲試験のための方法及び手段に関する。本発明は、例えば、以下の文献に記載されるような当該技術において公知のプロテオミクス技術を利用する(これらの内容は参考としてここに組み込まれる):Proteome Research: New Frontiers in Functional Genomics(Principles and Practice).M.R.Wilkins et al., eds.,Springer Verlag,1007;2−D Proteome Analysis Protocols,Andrew L Link,editor, Humana Press,1999;Proteome Research:Two−Dimensional Gel Electrophoresis and Identification Methods(Principles and Practice),T.Rabilloud editor,Springer Verlag,2000;Proteome Research:Mass Spectrometry(Principles and Practice).P.James editor,Springer Verlag,2001;Introduction to Ploteomics.D.C.Liebler editor,Humana Press,2002;Ploteomics in Practice:A Laboratory Manual of Ploteome Analysis.R.Westermeier et al., eds.,John Wiley & Sons,2002。
【0054】
当業者は、本発明の実施において使用することが可能な、本明細書中に記載されるものと類似又は等価の多くの方法及び物質を認識する。実際に、本発明は、いかなる様式でも記載される方法及び物質に限定されない。
【0055】
1.生体液中で発現するタンパク質及びポリペプチドの同定
本発明によれば、生体液のプロテオミクス分析は、当該技術分野で公知の種々の方法を用いて行うことができる。
【0056】
典型的には、異なる起源、例えば、正常な生体液(正常サンプル)及び試験生体液(試験サンプル)由来のサンプルのタンパク質パターン(プロテオームマップ)は、疾患において上方調整又は下方調整されるタンパク質を検出するために比較される。次いで、これらのタンパク質を、例えば、ペプチド−マスフィンガープリンティング及び/又は質量分析法及び配列決定方法を用いて、同定及び完全な特徴決定のために切除することができるか、又は正常及び/又は疾患特異的なプロテオームマップを目的の疾患の診断のために直接的に使用することができるか、又は疾患の存在又は非存在下を確認するために直接的に使用することができる。
【0057】
比較分析において、タンパク質の相対量を正確に表すために、及び正確な結果を得るために、正常サンプル及び試験サンプルを同じ様式で実際に処置することが重要である。全タンパク質の要求される量は、使用される分析技術に依存し、当業者によって容易に決定することができる。生物学的サンプル中に存在するタンパク質は、典型的には、それらのpI及び分子量に従って二次元ゲル電気泳動(2−DE)によって分離される。タンパク質は、等電集束法(一次元電気泳動)を用いて最初にそれらの電荷によって分離される。この工程は、例えば、市販の固定化pH−勾配(IPG)片を用いて行うことができる。二次元は通常のSDS−PAGE分析であり、集束されたIPG片をサンプルとして使用する。2−DE分離後、タンパク質は従来の染料、Coomassie Blue又は銀染色を用いて視覚化することができ、公知の技術及び装置、例えば、Bio−Rad GS800デンシトメーター及びPDQUESTソフトウェア(両方市販されている)を用いて画像化する。次いで、個々のスポットをゲルから切断し、脱色し、トリプシン消化を行う。ペプチド混合物を質量分析計(MS)によって分析することができる。又は、例えばキャピラリー高圧液体クロマトグラフィー(HPLC)によって、ペプチドを分離することができ、個々にMSによって、又はプールにおいて分析することができる。
【0058】
質量分析計は、イオン源、質量分析器、イオン検出器及びデータ取得ユニットからなる。最初に、ペプチドをイオン源中でイオン化する。次いで、イオン化されたペプチドをそれらの質量 対 電荷比に従って質量分析器中で分離し、分離したイオンを検出する。質量分析法は、特に、マトリックス支援レーザー脱離イオン化/飛行時間(MALDI−TOF)及び電子噴霧イオン化(ESI)方法の発明で、タンパク質分析に広く使用されている。例えば、MALDI−TOF及び三極又は四極−TOFを含む質量分析器、又はESIに結合したイオン捕捉質量分析器のいくつかのバージョンが存在する。従って、例えば、Q−Tof−2質量分析器は、全マススペクトル範囲にわたってイオンの同時検出を可能にする直交飛行時間分析器を利用する。さらなる詳細については、例えば、e.g.Chemusevich et al,J.Mass Spectrom.36:849−865(2001)。
【0059】
所望な場合、ペプチドフラグメント及びそれらから結果として誘導されるタンパク質のアミノ酸配列は、当該技術分野で公知の技術、例えば、質量分析法又はEdman分解の特定の改変によって決定することができる。
【0060】
2.初期及び非侵襲の診断から利益を受ける胎児−母体の状態
a.羊膜内感染
羊膜内感染(IAI)は、妊娠中の羊水及び子宮内成分の急性バクテリア感染である。予想試験は、IAIが全ての分娩の4〜10%生じることを示す(Newton,E.R.,Prihoda,T.J., and Gibbs,R.S.:Logistic regression Analysis of risk factors for intraamniotic infection.Obstet.Gynecol.73:571,1989;Soper,D.E.,Mayhall,C.G.,and Dalton,H.P.:Risk factors for intraamniotic infection:a prospective epidemicologic study。American Journal of Obstetrics and Gynecology 161:562,1989;and Lopez−Zeno,J.A.,Peaceman,A.M.,Adashek,J.A.,and Socol,M.L.:A controlled trial of a program for the active management of labor.N.Engl J.Med.326:450,1992)。IAIを記載するために使用される他の用語としては、羊水感染、羊膜炎、及び臨床的絨毛羊膜炎が挙げられる。羊膜内感染は、母体の発熱、子宮圧痛、白血球増加症、及び胎児心急搏症によって臨床的に診断され、組織学的な絨毛羊膜炎とは区別されるべきである。羊膜内感染は、母体及び新生児の罹患率の重要な原因である。羊膜内感染は、産褥期における発熱性罹患率の原因の10〜40%を占め、初期新生児セプシス及び肺炎の原因の20〜40%に関連する(Newton,E.R.:Qiorioamnionitis and intraamniotic infection.Clin.Obstet.Gynecol.36:795,1993)。母体菌血症は、IAIを患う患者の2〜6%に生じ、産褥感染の罹患率は増加する。IAIを患う患者の間で、不完全な分娩及び帝王切開による分娩のリスクが増加する。Duffらは、分娩中に進行した羊膜内感染をもつ患者の中で、不完全な分娩の発生率が75%であり、帝王切開による分娩の発生率が34%であることを報告した(Duff,P.,Sanders,R. and Gibbs,R.S.:The course of labor in term pregnancies with chorioarnnionitis.American Journal of Obstetrics and Gynecology 147:391, 1983)。羊膜内感染はさらに、特に早期新生児の間で、早期進行した新生児罹患率及び死亡率と関連する。概して、母体のIAIに対して生まれる低体重新生児の中では、周産期死亡率が3〜4倍増加する(Gibbs,R.S.,Castillo,M.A., and Rodgers,P.J.:Management of acute chorioarnnionitis.American Journal of Obstetrics and Gynecology 136:709,1980;Gilstrap,L.C.,III,Leveno,K.J.,Cox,S.M.,Bums,J.S.,Mashburn,M., and Rosenfeld,C.R.:Intrapartum treatment of acute chorioarnnionitis:impact on neonatal sepsis.Am.J.Obstet.Gynecol.159:579,1988)。呼吸困難症候群、心室内出血、及び新生児セプシスの増加も存在する。Morales,W.J.:The effect of chorioarnnionitis on the developmental outcome of preterm infants at one year。Obstetrics and Gynecology 70:183,1987)。近年、IAIは、新生児脳室周囲白質軟化症及び脳性小児麻痺に関係があるとされており;大脳白室損傷及び脳性小児麻痺のリスクは、羊膜内感染の背景において9倍高まる。Bejar,R.,Wozniak,P.,Allard,M.,Benirschke,K.,Vaucher,Y.,Coen,R.,Berry,C.,Schragg,P.,Villegas,I., and Resnik,R.:Antenatal origin of neurologic damage in newborn infants.I.Preterm infants.Am.J.Obstet.Gynecol.159:357,1988;Grether,J.K. and Nelson,K.B.:Maternal infection and cerebral palsy in infants of normal birth weight. JAMA 278:207,1997)。最後に、潜伏性IAIは、インタクトな胚膜をもつ早期分娩の女性の少なくとも10%に見出され、このことは、IAIが未熟児の、重要な潜在的に予防可能な原因であることを示唆する(Romero,R.,Avila,C.,Brekus,C.A., and Morotti,R.:The role of systemic and intrauterine infection in preterm parturition.Annuals of the New York Academy of Sciences 622:355,1991)。Newtonによってまとめられた文献は、27週よりも低い在胎齢で臨床的なAIAの発生率が41%であり、27〜37週の在胎齢で15%の発生率であり、妊娠38週以上では2%であることを示した(Newton et al.,前出)。下部生殖路(lower genital
tract)に対する既存のバクテリアはさらに、臨床的な羊膜内感染の徴候なくインタクトな胚膜をもつ早期分娩において全ての女性の10〜20%の羊水から回収され(Romero et al.,前出)、23〜24週で妊娠を終了する早期分娩の女性の67%までの羊水から回収された(Watts,D.H.,Krohn,M.A.,Hillier,S.L., and Eschenbach,D.A.:The association of occult amniotic fluid infection with gestational age and neonatal outcome among women in preterm labor。Obstet Gynecol 79:351,1992)。これらの患者のほとんどは迅速に分娩し、臨床的に明らかなIAIが多くにおいて進んでいる。これらの観察結果は、仮新構成の初期の潜伏性の子宮内感染が早期分娩に先行し、極端な早期分娩の重要な原因となる場合があるという説を支持する。
【0061】
b.子かん前症
子かん前症(タンパク尿、水腫、又はその両方を伴う母体の高血圧として定義される)は、最初のトリメスターにおいて妊娠が中断しない妊娠の7%に生じる。原因は知られていないが、妊娠可能年齢の極値の母体の糖尿病、多胎妊娠を有する妊娠、及び既に存在していた母体の腎臓疾患又は高血圧において、さらによく見られる。子かん前症は、周産期死亡率の増加と関連し、子かんを生じる場合があり、母体の発作によって特徴付けられ、母体の死亡率を高める。現在、子かん前症のための治療の主要な方法は、分娩及び硫酸マグネシウムを用いた抗痙攣薬による予防である。硫酸マグネシウム治療が出現する前には、観察された母体死亡率は20〜30%であった。しかし、迅速な診断と共に、硫酸マグネシウムを用いた抗痙攣薬、抗高血圧在による治療及び分娩により、母体の死亡率はほぼ0%にまで減った。
【0062】
不幸なことに、通常認識される症状及び徴候に基づく子かん前症の診断はしばしば困難であり、疾患の経緯において後期に生じる。しばしば、胎児の成長又は健康がおびやかされることは、子かん前症の最初の認識される症状発現である。子かん前症の実験的なマーカーとしては、タンパク尿の量、及び尿酸又はクレアチニンの血清濃度の上昇が挙げられる。初期子かん前症のための血清マーカー又は子かん前症が進行する女性を同定するマーカーは現時点で利用不可能である。近年、レプチン及び尿酸を含む予想血清マーカーが、1つの研究において、後に続く子かん前症と関連していた(Gursoy T et al., Preeclampsicia disrupts the normal physiology of leptin:Am J Perinatol.l9(6):303−10,2002)が、これらの発見を確認するためには多くの作業が必要である。子かん前症のための初期及び信頼できるマーカーの開発は、新生児及び母体のための結果を最適化するための治療及び介入を無条件で可能にする。
【0063】
c.早期分娩及び早産
早期出産は、妊娠が完結する37週の前に出生することと定義される。アメリカ合衆国での早期出生の発生率は、全ての生きた状態での出生の10〜11%であり、早期分娩の積極的な処置にもかかわらず増加している。全体として、未成熟及びその結果は、先天性奇形をもたらさない周産期の脂肪の80%の原因となり、国のヘルスケア予算に年間約50億ドルが追加される。早期出生のためのリスク因子としては、白人でないこと、年齢が若いこと、社会的なステイタスが低いこと、母体の体重が55kg未満であること、未経産であること、最初のトリメスター出血であること、多胎妊娠であることが挙げられる(Meis PJ,Michielutte R,Peters TJ et al., Factors associated with preterm birth in Cardiff,Wales:H Indicated and spontaneous preterm birth.Am J Obstet Gynecol 173:597−602,1995)
不幸なことに、自然発生的な早期出生のリスクを持つ患者の予測は一般的に期待はずれである(Creasy RK,lams JD.Preterm labor and delivery.In Maternal−Fetal Medicine.Creasy RK,Resnik R(eds.).W.B.Saunders Company,Philadelphia,PA 4th edition,1999.Page 498−531)。早期出生の最も大きなリスクをもつ集団を定義し、それによって初期介入からの潜在的な利益を得ようとする以前の試みは、リスクスコアリング指標(risk−scoring indices)、胎児フィブロネクチンの生化学的検出、頚部の長さの超音波測定、及ぶ生息地となる子宮の活性の監視を含んでいた。これらのプログラムは、高価であり、患者が初期の介入又は予防から利益を受ける程度の正確性を持って予測することができなかったということによって阻まれていた。全ては、約30%のわずかに陽性の予想値を持ち、患者の大多数が満期での分娩の「リスク保持者(at risk)」であると定義された。子宮収縮を阻害するための薬理学的処置を含む介入は有効であるが、早期分娩の初期の信頼できる診断に依存する。それ故に、早期出生の最も大きなリスクを持つ患者を同定するための初期の信頼できるマーカーは、早期出生に関連する莫大なコスト及び新生児死亡率及び罹患率を減らすために必要である。
【0064】
d.染色体異数性
染色体異常は、周産期罹患率及び死亡率の頻度の高い原因である。染色体異常は、200人の生児出生あたり1の発生率で生じる。これらの異常の主な原因は染色体異数性であり、染色体の異常の多くは親からの遺伝である。最も頻繁な染色体異数性の1つはトリソミー−21(ダウン症候群)であり、800人の生児出生あたり1の発生率を有する(Hook EB,Hamerton JL:The frequency of chromosome abnormalities detected in consecutive newborn studies:Differences between
studies:Results by sex and by severity of phenotypic involvement.In Hook EB,Porter IH(eds.):Population Cytogenetics, pp 63−79.New York,Academic Press,1978)。トリソミー−21の一次リスク因子は、母体の年齢が35歳を超えていることであるが、トリソミー−21をもつ子供の80%は、35歳より若い女性から生まれている。他の一般的な異数体状態としてはトリソミー13及び18、ターナー症候群及びクラインフェルター症候群が挙げられる。
【0065】
トリソミー−21をもつ子供の80%が35歳より若い女性から生まれているため、母体年齢のみに基づいて設計されている出生前診断スクリーニングプログラムでは不十分である。それ故に、出生前スクリーニングプログラムは、胎児染色体異数性と関連する母体血清スクリーニング、超音波又はそれら両方の組み合わせと組み合わせられている。広く利用されている候補血清マーカーとしては、α−フェトタンパク質(AFP)、未接合エストリオール、ヒトコリオゴナドトロフィック(choriogonadotrophic)ホルモン(hHCG)、及びインヒビン−Aが挙げられる。しかし、スクリーニングの陽性率2〜5%で、トリソミー−21及び他の異数性の検出率は期待はずれであり、検出率は70〜86%である(Cuckle H.Biochemical screening for Down syndrome.Eur J Obstet Gynecol Reprod Biol.92(1):97−101,2000)。さらに、試験の真の陽性率、すなわち、スクリーニング陽性試験の中でのこれらの中のトリソミー−21の率はわずか1〜2%であり、98%を超えて最終的な陽性率は誤りを生じている。
【0066】
染色体異数性の確定的な診断の後、母体血清スクリーニング及び超音波は、ミッド−トリメスター遺伝子羊膜穿刺を必要とする。これは、妊娠を中断させるリスクの0.5%に関連する侵襲手順である。さらに、羊水細胞の染色体分析は、労働集約的であり、2週間までかかる時間のかかる手順である。それ故に、母体の血清から染色体異数性の検出を向上させ、母体スクリーニングの受け入れられないほど誤って高い陽性率を減らし、羊膜穿刺後の羊水からの診断の速度及び効率を高めるために、信頼性の高い試験が必要とされている。
【0067】
3.生体液のプロテオミクスプロフィールを用いた母体/胎児の状態の診断
本発明は、生体液、例えば、羊水、血清、血漿、尿、能脊髄液、母乳、粘液、又は唾液のプロテオミクスプロフィールによって上述及び他の類似の母体/胎児の状態を診断するための、初期及び信頼できる、非侵襲方法を提供する。
【0068】
上に注記されたように、本発明の本文において、用語「プロテオミクスプロフィール」は、生物学的サンプル中、例えば、所与の時間での生体液中の複数のタンパク質の発現パターンの代表例を示すために使用される。プロテオミクスプロフィールは、例えば、マススペクトルとして表すことができるが、タンパク質の物理化学的性質又は生化学的性質のいずれかに基づく他の代表例も含まれる。生体液のプロテオーム中に存在するタンパク質の全て又はいくつかを同定し、配列決定することが可能であるが、このことは本発明に従って作成されるプロテオミクスプロフィールの診断使用には必要ではない。特定の疾患の診断は、診断される疾患又は病的な状態が存在する場合に、正常なプロテオミクスプロフィールと同じ状況下で得られた生体液のプロテオミクスプロフィールとの特徴的な差異(固有の発現サイン)に基づくことができる。固有の発現サインは、統計学的に有意な様式で、同じ種類の供給源から得られる対応する正常な生物学的サンプルのプロテオミクスプロフィールとは異なる、試験又は参照生物学的サンプルのプロテオミクスプロフィール内の任意の固有の特徴又はモチーフであることができる。例えば、プロテオミクスプロフィールがマススペクトルの形態で存在する場合、固有の発現サインは、典型的には、対応する正常サンプルのマススペクトルとは定性的又は定量的に異なるピーク又はピークの組み合わせである。従って、マススペクトルにおいて新たなピーク又は新たなピークの組み合わせの出現、又はマススペクトルにおいて既存のピーク又は既存のピークの組み合わせの振幅又は形状における任意の統計学的に有意な変化を、固有の発現サインであるとみなすことができる。哺乳動物被検体から得られた試験サンプルのプロテオミクスプロフィールは、病的な母体又は胎児の状態に特徴的な固有の発現サインを含む参照サンプルのプロテオミクスプロフィールと比較され、参照サンプルと共通の固有の発現サインを有している場合、哺乳動物被検体はこのような病的な状態であると診断される。
【0069】
特定の病的な母体/胎児の状態は、診断される被検体から得られる生体液のプロテオミクスプロフィールと、同じ様式で得て、診断された同じ種類の正常な生体液のプロテオミクスプロフィールとを比較することによって診断することができる。試験サンプルのプロテオミクスプロフィールが正常サンプルのプロテオミクスプロフィールと本質的に同じである場合、被検体は、被検体の病的な母体/胎児の状態を有していないとみなされる。試験サンプルのプロテオミクスプロフィールが正常サンプルのプロテオミクスプロフィールと比較して固有の発現サインを示す場合、被検体は、問題となる母体/胎児の状態と診断される。
【0070】
それに代えて又はそれに加えて、試験サンプルのプロテオミクスプロフィールは、問題となる病的な母体/胎児の状態と独立して診断された被検体の生体液から得られた参照サンプルのプロテオミクスプロフィールと比較されてもよい。この場合には、被検体は、試験サンプルのプロテオミクスプロフィールと参照サンプルのプロテオミクスプロフィールとが、固有の発現サインを表す少なくとも1つの特徴又は特徴の組み合わせを共通して持っている場合、病的な状態と診断される。
【0071】
本発明の方法では、正常な生物学的サンプルのプロテオミクスプロフィールは診断において重要な役割を果たす。上に議論されたように、試験サンプルのプロテオミクスプロフィールが正常な生物学的サンプルのプロテオミクスプロフィールと本質的に同じである場合、患者は、同定される病的な母体/胎児の状態を有していないと診断される。患者が、潜在的に副作用があり得るか、又はそうでなくても患者、胎児又は新生児を危険な状態に置き得る、不必要な処置又は介入を受ける必要性を排除するため、この「陰性」診断は、非常に重要性が高い。このデータは、その差異が統計学的に有意であるか否かを決定するために分析される。
【0072】
本発明の診断方法の感度は、従来のタンパク質分離方法を用いて、本質的に同じ発現レベルで正常プロテオーム及び疾患プロテオームの両方に見出されるタンパク質(一般的なタンパク質、例えば、アルブミン及び免疫グロブリン)を分析の前に除去することによって高めることができる。固有の発現サインの一部分ではないこのような一般的なタンパク質の除去により、改良された感度及び診断の精度が得られる。それに代えて又はそれに加えて、一般的なタンパク質の発現サインは、診断を呼び出すために、典型的には、機械が配置されているスペクトル選択アルゴリズムを用いた結果のコンピューター分析の間に排除できる(か又はシグナルを除去することができる)。以下の実施例に詳細に記載される結果は、統計学的に有意な様式で、羊水の正常プロテオミクスプロフィールとは異なる、羊膜内感染(IAI)に特徴的なプロテオミクスプロフィールを表す。それに加えて、実施例はそれぞれ、IAI及びダウン症候群に特徴的な発現マーカー及び固有の発現サインを表す。
【0073】
プロテオミクスプロフィールを比較するための統計学的方法は当該技術分野で周知である。例えば、マススペクトルの場合には、プロテオミクスプロフィールは、スペクトルの平行軸に沿った、キーとなる質量/電荷(M/Z)位置でのピーク振幅値によって定義される。それ故に、特徴的なプロテオミクスプロフィールは、例えば、与えられたM/Z値のスペクトル振幅の組み合わせによって形成されるパターンによって特徴付けることができる。特徴的な発現サインの存在又は非存在、又は2つのプロフィールの実質的な同定は、試験サンプルのプロテオミクスプロフィール(パターン)と参照サンプル又は正常サンプルのプロテオミクスプロフィール(パターン)とを適切なアルゴリズムで照合することによって決定することができる。プロテオミクスパターンを分析するための統計学的方法は、例えば、Petricoin III et al.,The Lancet 359:572−77(2002).;Issaq et al.,Biochem Biophys Commun 292:587−92(2002);Ball et al.,Bioinformatics 18:395−404(2002);and Li et al.,Clinical Chemistry Journal,48:1296−1304(2002)に開示される。
【0074】
特定の実施形態では、患者から得られたサンプルは、タンパク質チップに適用され、プロテオミクスパターンは質量分析法によって作成される。スペクトル内のピークのパターンは、上述のように、好適なバイオインフォマテクスソフトウェアによって分析することができる。
【0075】
4.スクリーニングアッセイ
本発明のプロテオミクスプロフィールはさらに、特定の母体/胎児の状態の処置のために、候補薬物を同定するためのスクリーニングアッセイにおいてさらなる有用性を見出す。このようなスクリーニングアッセイは、試験分子が、処置される母体/胎児の状態に特徴的な発現サインを含有するプロテオミクスプロフィールを発現サインを欠いたプロテオミクスプロフィールに変換する能力に基づく。1つの特定の実施形態では、試験化合物が病的な発現プロフィールを正常な発現プロフィールに変換する能力が試験され、別の実施形態では、スクリーニングアッセイは、試験化合物が、病的な状態に特徴的な固有の発現サインを対応する正常な発現サインに変換する能力を試験する。このようなスクリーニングアッセイは、疾患の生物学的サンプルを処置し、処置前と処置後のプロテオミクス発現プロフィールを比較することによって、インビトロで行うことができる。それに代えて又はそれに加えて、標的の病的な母体/胎児の状態を示す実験動物を試験化合物で処置し、処置前及び処置後の動物の生体液を採取し、2つのサンプルのプロテオミクスプロフィールを比較することによって、薬物スクリーニングを行うことができる。このアッセイでは、生体液のサンプルを処置後の種々の時間点で、及び処置後の時間推移に沿って採取することも可能である。これらの方法論は、薬学的薬剤の毒性を特徴決定するため、及び特定の治療のための最適候補物を同定するために適用してもよい。
【0076】
試験化合物は、例えば、ペプチド、非ペプチド有機低分子、タンパク質、ポリペプチド、抗体(抗体フラグメントを含む)、アンチセンス分子、オリゴヌクレオチドデコイ、及び薬物又は候補薬物として以前に使用された任意の他の種類の分子であることができる。
【0077】
生体液は、例えば、羊水、血清(例えば、母体血清)、血漿、尿、脳脊髄液、母乳、粘液、又は唾液であることができる。
【0078】
同定された治療的に活性な化合物は、従来の薬学的配合物中に配合することができる。当該技術分野で公知の配合物の要約は、Remington’s Pharmaceutical Sciences,latest edition,Mack Publishing Company,Easton,PAに見出される。このマニュアルの参照は当該技術分野で通常のことである。
【0079】
5.タンパク質及び抗体アレイ
上に議論される診断アッセイ及びスクリーニングアッセイの両方は、タンパク質アレイを用いて行うことができる。近年、タンパク質アレイは、タンパク質を検出し、それらの発現レベルを監視し、タンパク質相互作用及び機能を観察するための強力な手段として広く認識されている。それらは、自動化手段を用いて多くの数の決定を同時に行うことができる場合、高スループットタンパク質分析を可能にする。DNAアレイのために元々開発されたマイクロアレイ又はチップフォーマットでは、大量のデータを作成しつつ最小限の物質の使用でこのような決定を行うことができる。
【0080】
上述のような2Dゲル電気泳動及び質量分析法によるプロテオーム分析は非常に効果的ではあるが、常に高い感度を提供するわけではなく、低い発生量で発現する多くのタンパク質を分析できない場合がある。タンパク質マイクロアレイは、それらの高い効率に加えて、改良された感度を提供する。タンパク質アレイは、当該技術分野で周知の種々の共有結合又は非共有結合の化学を用いて、固体表面上、例えば、ガラス、シリコン、マイクロウェル、ニトロセルロース、PVDF膜、及びマイクロビーズ上にタンパク質を固定することによって形成される。固体支持体は、カップリング手順の前及び後に化学的に安定であり、良好なスポット形態を可能にし、非特異的結合を最少にするべきであり、検出システムにおけるバックグラウンドに影響をあたえないべきであり、異なる検出システムと適合性であるべきである。
【0081】
概して、タンパク質マイクロアレイは、DNAアレイの読みのために一般的に使用されるものと同じ検出方法を使用する。同様に、DNAマイクロアレイの読みのために使用されるものと同じ装置はたんぱく質アレイに適用可能である。
【0082】
従って、捕捉アレイ(例えば、抗体アレイ)は、2つの異なる供給源、例えば正常性体液及び疾患性体液由来の蛍光標識されたタンパク質を用いてプローブ化することができる。この場合では、読み出しは、標的タンパク質の発現レベルにおける変化を反映するものとして蛍光シグナルにおける変化に基づく。代替的な読み出しとしては、限定されないが、蛍光共鳴エネルギー転移、表面プラズモン共鳴、ローリングサークルDNA増幅、質量分析法、共鳴光分散、及び原子力顕微鏡が挙げられる。
【0083】
さらなる詳細のために、例えば、Zhou H et al.,Trends Biotechnol.19:S34−9(2001);Zhu et al.,Current Opin.Chem.Biol.5:40−45−(2001);Wilson and Nock,Angew Chem Int Ed Engl 42:494−500(2003);and Schweitzer and Kingsmore,Curr Opin Biotechnol 13:14−9(2002)を参照。生体分子アレイはさらに、米国特許第6,406,921号(2002年6月18日に登録)にも開示され、その開示全体は、ここで参考として明らかに組み込まれる。
【0084】
本発明のさらなる詳細は、以下の非限定的な実施例から明らかである。
【実施例】
【0085】
実施例1
一般的なプロトコル
羊膜内感染の霊長類モデル
このプロトコルは、Institutional Animal Care Utilization Committee of the Oregon National Primate Research Centerによって承認され、ヒトのケアのためのガイドラインに従った。時間通りの妊娠状態の19匹の妊娠したアカゲザル(Macaca mulatta)を、慢性的にカテーテル挿入し、以前に記載されているとおりに手術後に維持した(Haluska GJ,et al.,Temporal changes in uterine activity and prostaglandin response to RU 486 in rhesus macaques in late gestation.,Am J Obstet Gynecol 157:1487−95(1987);and Gravett MG,et al.,An experimental model for intra−anmiotic infection and preterm labor in rhesus monkeys.Am J Obstet Gynecol 171:1660−7(1994))。
【0086】
簡潔に述べると、妊娠約110日(期間は167日である)に、妊娠した動物をジャケット内及び綱システムで慣らした(Ducssay CA,et al.,Simplified vest and tether system for maintenance of chronically catheterized pregnant rhesus monkeys.Lab.Anim Sci 38:343−4(1988))。慣らした後、一般的な麻酔下で妊娠119日〜126日に子宮内手術を行った。母体の大腿動脈及び静脈カテーテル、胎児の動脈及び静脈カテーテル、2つの開口末端を有する羊膜内圧力カテーテル、子宮筋層の筋電法の電極、及び胎児の筋電法の電力を外科的に移植した。手術後1〜5日間、子宮の非刺激性を制御するために全ての動物に硫酸テルブタリン(1日に2回、3〜5時間にわたって1mgを静脈投与)を与えた。動物にさらにセファゾリン(12時間ごとに250mgを静脈投与)を与え、バクテリアの接種前少なくとも48時間に投与をやめた。
【0087】
8〜13日間(妊娠126〜138日)操作後に安定させた後、(a)生理食塩水中に懸濁させたグループB連鎖球菌(タイプIII)の106コロニー形成単位(cfu)(n=7)、(b)10B培地に懸濁させたUreaplasma parvum 107cfu(正式にはUreaplasma urealyticum、血液型亜型1)(n=6)、又は(c)10%のショ糖及び2%の内毒素の存在しない胎児子ウシ血清を含むリン酸緩衝化食塩水に懸濁させたMycoplasma hominis106〜107cfu(n=6)を羊膜内接種することによって実験的な羊膜内感染(IAI)を確立させた。グループB連鎖球菌単離物は、髄膜炎をもつ新生児からもともと回収した。Ureaplasma parvumは、絨毛羊膜炎及び新生児セプシスをもつ患者の胎盤及び膜から低継代させた臨床単離物由来であった。Mycoplasma hominisは、postmartum子宮内筋層炎をもつ患者由来の子宮内膜単離物であった。
【0088】
試験期間中(接種前は毎日、接種後は4時間〜12時間ごと)、定量的なバクテリア培養物、血球計算板による白血球細胞分析、及びサイトカイン濃度及びプロスタグランジン濃度のために(以前に報告されたGravett MG et al.,An experimental model for intra−amniotic infection and preterm labor in rhesus monkeys.Am J Obstet Gynecol 171:1660−7(1994))、及びプロテオミクス分析のために、全ての動物から羊水サンプルを順次集めた。
【0089】
胎児の心電図及び子宮活性(心電図及び羊膜内の圧力)を、手術から分娩まで連続して記録した。時間あたりの収縮曲線の下の面積として子宮の収縮を記録し、ある時間の収縮面積(HCA)(mmHg/時間(秒))として表した。
【0090】
母体の頚を感染前に膣から触診し、その後も順次触診した。一致性、消失、及び膨張を各触診ごとに記録した。1匹の動物を除いて帝王切開によって分娩させ、1匹の動物においては膣から分娩させた後、感染を確認するために胎児、子宮脱落膜、胎盤、及び内膜のバクテリア培養物を得て、絨毛羊膜炎の証拠を出すために組織病理学的な研究を行った。
【0091】
感染は上述のように行われた羊膜内接種の後、迅速に確立されていた。子宮絨毛羊膜炎が基本レベル100から10,000mmHg×sec/hrよりも大きなレベルまでの増加が、平均でグループB連鎖球菌を用いて接種した33+9時間後、Ureaplasma parvumを用いて接種した43±14時間後;及びMycoplasma hominisを用いて接種した62±14時間後に生じた。子宮収縮は進行性の頚部の膨張をもたらし、全ての場合において消失した。子宮収縮の増加は、以前に報告されているように、炎症前サイトカインTNF−α、IL−1β、IL−6、及びIL−8、プロスタグランジンE2及びF2αにおける顕著な増加に先行した(Gravett et al., Am J. Obstet Gynecol 171:1660−7(1994))。陣痛の発生前にIAIの臨床的な徴候を示した動物はいなかった。絨毛羊膜炎を全ての場合において確認した。
【0092】
ヒトの研究(女性における潜伏的なIAI)
以前に記載されるように、University of Washington Medical Center又はシアトルの関連病院で1991年6月25日〜1997年6月30日まで、インタクトな胚膜を持つ妊娠22〜34週での早期分娩で入院した309人の女性から研究集団を抜き出した(Hitti J,et al.,Amniotic fluid tumor necrosis factor−α and the risk of respiratory distress syndrome among preterm infants.Am J Obstet Gynecol 177:50−6(1997))。全ての女性は、書面によるインフォームドコンセントを受けておリ、試験プロトコルは、全ての参加病院についてInstitutional Review Boardsによって承認された。全ての参加者は、研究登録時にインタクトな胚膜を有していた。早期分娩は、>1cmの頚部の変化又は頚部の膨張又は>50%の頚部成熟度のいずれかを伴って、≦10分の頻度での規則的な子宮収縮として定義された。
【0093】
潜伏的なIAIは、陽性のAF微生物培養物及び/又はAFインターロイキン−6(IL−6)濃度>2ng/ml、絨毛羊膜炎の組織学的証拠(10の隣接しない部分において400倍の部分あたり、≧10の多形核の白血球の存在によって定義される)及び子宮圧痛又は発熱の非存在によって定義された。本発明者らは以前に、報告した。AF IL−6濃度>2ng/mlは試験集団全体について75パーセンタイル以上であり、ポリメラーゼ連鎖反応によるバクテリアの検出と相関関係にあることを報告した(Hittiet al.,Clin Infect Dis 24:1228−32(1997))。入院時に>4cmの頚部膨張又は破壊された膜を持つ女性は排除した。多胎妊娠、頚部セルクラージュ、前置胎盤、常位胎盤早期剥離、糖尿病、高血圧、及び子かん前症の女性は、他の基準を満たせば適格とみなした。
【0094】
経腹壁的な羊膜穿刺を全ての試験参加者について超音波による誘導の下で行い、登録時に静脈穿刺によって母体の静脈血を集めた。この研究集団から、部分集合(表1A及び1B)は、ここで報告されるようなプロテオミクス分析について遡及的に同定した。この部分集合は、それぞれ11人の患者の3つのグループを含んでいた:グループI−上に定義されるような潜伏性のIAIの証拠を有する患者;グループI−記録された子宮内感染を有さないが、34週以下の妊娠期間での早期出産をした患者のランダムに選択された部分集合、及びグループIII−感染しておらず、早期分娩を有したが早産防止薬に反応して、後でほぼ所定期間に近い期間(妊娠>35週)で後に分娩した患者。これら3つのグループ間で母体の年齢、人種、又は経産に差異はなかった(表1A及び1B)。しかし、子宮内感染を有する患者は、登録時にはいくらか在胎齢が早くにみられ(p=0.10)、感染なしに早期出産した患者又は所定の期間で分娩した患者よりも顕著に早い在胎齢で分娩した(それぞれ、27.3±0.9週 対 29.8±1.0及び37.0±0.9週、p<0.000l)。それに加えて、子宮内感染を有する患者は、登録から分娩まで顕著に短い時間を有していた(他の2つのグループの8.4±6.3日及び46.9±5.6日と比較して、2.1±5.6日、p<0.0001)。子宮内感染を有する患者の91%が、登録の7日以内に分娩した。分析までサンプルを−20℃で保存し、2回を超えては解凍しないようにした。
【0095】
感染を有する11人の患者の中で、4人から(大腸菌を有する2人、カンジダアルビカンスを有する1人、及び混合嫌気菌を有する1人)微生物を回収し;これらの患者の全ては7日以内に分娩した。他の7人の患者は、2,000pg/mlより大きな羊水IL−6濃度に基づいて同定した。インターロイキン−6の平均羊水濃度は、感染なく早期出産をした患者の中の0.68±0.20ng/ml及び早期分娩があり、所定期間に分娩した患者の中の0.25±0.13ng/mlと比較して、これらの患者の中で27.7±7.8ng/mlであった(p<0.01)。
(表1A)
試験集合の特性
【0096】
【表1A】

データは、平均、標準偏差で示した。連続データについてのANOVAによる分析及びカテゴリーデータについてのカイ二乗分析として表された。省略語:PMD,早期分娩<35週;IUI、子宮内感染;PML、分娩なしの早産。
(表1B)
スクリーニング結果
【0097】
【表1B】

*このプール中の2つの陽性サンプルは、PCR手順によって陽性の、2つの被検体のAFが低レベルのバクテリアを示したことから、潜伏性感染を表す。このことは、タンパク質プロファイリングが潜伏性羊膜内感染を同定するのに使用可能であることを示す。
【0098】
上述の表では、データは、平均、標準偏差で示した。連続データについてのANOVAによる分析及びカテゴリーデータについてのカイ二乗分析として表された。省略語:PMD,早期分娩<35週;IUI、子宮内感染;PML、分娩なしの早産。
(表1C)
試験結果をスクリーニングするためのFisher試験の有意性値
【0099】
【表1C】

不顕性のIAIをもつ11人の患者のうち4人は、回収された微生物を有していた(大腸菌を有する2人、カンジダアルビカンスを有する1人、及び混合嫌気菌を有する1人)。感染している他の7人の患者は、>2ng/mlの顕著に高いAF IL−6濃度をもとに同定した。IL−6の平均AF濃度は、感染なく早期出産をした患者の中の0.68±0.20ng/ml及び早産があるが、所定期間に分娩したグループIIIの患者の中の0.25±0.13ng/mlと比較して、これらの患者の中で27.7±7.8ng/mlであった(p<0.01)。
【0100】
羊水のプロテオミクス分析
LC−MS/MS分析によるタンパク質同定
コントロールサンプル及び感染サンプル由来の羊水100μgを、ヨードアセトアミドで還元し、15% SDS−PAGEゲルで分離した。80Vで電気泳動を行ない、サンプル中のタンパク質を分離した。電気泳動の後、ゲルをCoomassie blue R−250で染色し、画像をBio−Rad GS800デンシトメーター及びPDQUESTソフトウェアで集めた。各レーンからの個々のバンドをゲルから切断し、脱色し、Courchesne及びPatterson(Methods Mol Biol 112:487−511(1999))の方法を用いて、ゲル中でトリプシンで37℃で24〜48時間消化した。ペプチドを0.1%TFAで抽出し、スピードバキューム(speedvac)中で乾燥した。抽出物を0.1%TFAに溶解し、Zip Tipc18ピペットチップ(Milliporeから)を用いて、CapLC(Waters,Inc)に接続したQ−Tof−2質量分析計(Micromass,UK)を用いて、及び/又は110 キャピラリーLCシステム(Agilent Technologies,Foster City,CA)に接続したイオン捕捉(LCQ,ThermoFinnigan,San Jose,CA)を用いて、精製した(Marvin L.,et al.Identificaton of proteins from one−dimensional sodium dodecyl sulfate−polyacrylamide gel electrophoresis using electrospray quadrupole−time−of−flight tandem mass spectrometry.Rapid Commun Mass Spectrom.14(14):1287−92,2000)。
【0101】
2−次元(2−D)ゲル電気泳動
羊水(400〜2000μg)(アルブミンを含むものと含まないもの)をIEFバッファーに溶解し、IPG片(pH3〜10)24cmに室温で12時間再水和させた。再水和後、IPG片を70〜90kVhrsで1次元電気泳動にかけた。次いで、IPG片をDTT平衡バッファーI及びIAA平衡バッファーIIを用いて順次15分間平衡化させ、その後2次元SDS−PAGE分析を行った。次いで、IPG片を4〜20%SDS−PAGEゲルに入れ、120Vで12時間ゲル電気泳動し、2次元でタンパク質を分離した。ゲルをCoomassie Blue R−250で染色し、Bio−Rad GS800デンシトメーター及びPDQUESTソフトウェアを用いて画像化した。個々のスポットをゲルから切断し、脱色し、ゲル中でトリプシンで37℃で24〜48時間消化した。ペプチドを0.1%TFAで抽出し、Zip Tipc18ピペットチップ(Milliporeから)を用いて精製した(2−D Proteome analysis protocols:Methods in Molecular Biology:112,1999)。
【0102】
HPLC分画
アルブミン及びIgGを除去した後のヒト羊水サンプル(1〜15mgタンパク質)を20mM Tris−HCl(pH7.5)に溶解した。オートサンプラー及びUV吸収検出器を取り付けたWaters 1525 HPLC上でTSKゲルDEAE−5PWカラムを用いてアニオン交換クロマトグラフィーを行った。直線的な塩溶離勾配を用いてタンパク質を分画した。フラクションを1分ごとに集めた。フラクションをプールし、トリプシンで消化し、ペプチド混合物を質量分析計(Q−Tof−2)を用いて分析した。
【0103】
質量分析計による分析
(1)Q−Tof−2
ゲル中で消化した後のサンプルをMicromass CapLCに接続したMicromass Q−Tof−2質量分析計で分析した。Q−Tof−2に規則的なZ−スプレー又はナノスプレー源を取り付け、Integrafrit C18 75um ID×15cm石英ガラスキャピラリーカラムに接続した。Windows(登録商標) NT及びMassLynx3.5ソフトウェアを入れたCompaqワークステーションで、装置を制御し、データを得た。CapLC内に直接注入又は注射することによってQ−Tof−2をGlu1Fibrinopeptide Bを用いて較正した。MS/MSMS調査方法を使用して、MS/MSMSスペクトルを得た。MS調査について質量400〜1500をスキャンし、MSMSについて質量50〜1900をスキャンした。Windows(登録商標)2000及びSEQUEST(バージョン1.3)及び/又はLUTEFISKを入れたPCで一次データ分析を行った。ピークピッキングのためのビルトイン自動化機能を用い、各ピークについて質量中心−フィッティングを適用して、ピークリストを作成した。
【0104】
(2)LCQ−MS
乾燥したCoomassie blue染色したゲルからのタンパク質スポットを切除し、20mM炭酸水素アンモニウム、50%アセトニトリル溶液0.5ml中で30分間再水和/洗浄した。次いで、ゲル領域を真空遠心分離によって乾燥し、Courchesne及びPatterson,Identification of proteins by matrix−assisted laser desorption/ionization masses,Methods Mol.Biol.112:487−511(1999)の方法を用いて、20nMシーケンスグレード改変トリプシン(ProMega,Madison,WI,USA)中で再水和させることによって系中で消化した。次いで、トリプシン消化物を真空遠心分離によって濃縮し、逆相クロマトグラフィーによって分離し、ペプチドをモデルLCQイオン捕捉質量分析計(ThermoFinnigan,San Jose,CA)によって分析した。サンプルを、10μLmin−1流速及び勾配0〜40%B(水中の75%アセトニトリル)を1時間かけて、Zorbax C−18 0.5mm×150mmミクロボア(microbore)カラムを用いて、1100キャピラリーLCシステム(Agilent Technologies,Foster City,CA)を用いて分離した。標準的なThermoFinnigan電気スプレー源にペプチドを直接導入した。標準的なLCQソフトウェアを用いて自動化様式でMS/MSスペクトルを得て、次いで、SEQUEST(ThermoFinnigan)を用いてさらに分析した。さらなる詳細のために、Courchesne,P.L.and Patterson,S.D.(前出)を参照。
【0105】
データ分析
(1)Sequest及びDTASelect SEQUESTソフトウェア(ThermoFinnigan)を用いて、Yates et al.,Methods Mol.Biol.112:553−69(1999)に記載されるように、タンデムマススペクトル(MS/MS)の自動化分析を行った。SEQUESTは、データベースペプチド配列に対して連続的なタンデムマススペクトルを一致させる。索引付きの重複のないProtein Information Resource(公開日)及びSwissProt(公開日)から得られたタンパク質配列のデータベースを組み合わせて使用して、デフォルトパラメーターを用いてサーチを行った。Xcalibur Database Manager(ThermoFinnigan)を用いてデータベースを構築した。S−カルボキシアミド化システインは、単なる改変であるとみなされた。
【0106】
Sequestの結果をDTASelect(The Scripps Research Institute,Tabb,2002)を用いてさらに分析した。DTASelectはSEQUEST同定物を系統立て、ふるい分ける。以下のものを除いてデフォルトパラメーターを使用した:(1)タンパク質の記載中に列「ケラチン」を含む任意のデータベースマッチは排除され、(2)LCQ質量分析計からのスペクトルを二重に荷電したイオンについて2.4の交さ相関スコアカットオフでふるい分けられた。DTASelectによって選択された各スペクトル及び提案された配列対を視覚的に観察し、管理のために最終的な結果をスプレッドシート(Microsoft Excel)又はデータベース(Microsoft Access)にインプットした。
【0107】
さらなる詳細については、Tabb DL,et al.,DTASelect and Contrast:Tools for Assembling and Comparing Protein Identifications from Shotgun Proteomics.J.Proteome Res.1:21−26(2002)も参照。
【0108】
(2)Lutefisk コンピュータープログラムLutefisk 1900 v1.2.5(Taylor JA,Johnson RS.Implementation and uses of automated de novo peptide sequencing by tandem mass spectrometry Anal Chem 73(11):2594−604(2001)を用いて、全てのスペクトルの自動化デノボ配列決定を行った。Lutefiskは、ホモロジー−ベースの配列サーチのために十分詳細であるスペクトルについてペプチド配列を作成する。改質、アクリルアミド、カルバミドメチル化、及びリン酸化を考慮した。
【0109】
MALDI検出プロトコル及びパラメーター
二段階遅延抽出源を備えた特注の飛行時間反射質量分析計(Jensen ON,et al.,Direct observation of UV−crosslinked protein−nucleic acid complexes by matrix−assisted laser desorption ionization mass spectrometry.Rapid Commun Mass Spectrom 7(6):496−501(1993))を用いて、MALDI質量分析法を行った。約1μLのサンプル溶液を1μlのSA(60:40水/アセトニトリル 0.1%TFA最終濃度中のシナピン酸)と混合した。この検体/マトリックス溶液の1.0μLの液滴をマトリックス前結晶化サンプルプローブ上に付着させ、空気中で乾燥させた。(355nm)Nd:YAGレーザー(Spectra Physics)を用いてサンプルを照射し、23kVで700ns/1.0kVの遅延を有したイオン源を操作することによって、マススペクトルを作成した。20の連続したスペクトルの合計として各マススペクトルを記録し、それぞれ光子の単独のパルスによって作成された。追加した標準からのイオンを質量較正に使用した。
【0110】
羊水のSELDI分析
羊水サンプルからの全0.5〜3.0ugタンパク質でNormal Phase NP20(SiO2表面)、Reverse Phase H4(疎水性表面:C−16(長鎖脂肪族)、又は固定化ニッケル(IMAC)SELDIタンパク質Chip(登録商標)アレイ(Ciphergen Biosystems,Inc.Fremont,CA)上に点を付けた。室温で1時間インキュベーションした後、NP1及びH4チップを5ulの水洗浄液にさらし、結合していないタンパク質及び干渉物質(すなわち、バッファー、塩、洗剤)を除去した。2〜3分空気乾燥した後、50%アセトニトリル(v/v)中のシナピン酸の飽和溶液0.5ulを2回適用し、0.5%トリフルオロ酢酸(v/v)を添加し、Ciphergen Protein Biology System II(PBSII),Issaq,J.H,et al.:The SELDI−TOF MS Approach to proteomics:Protein Profiling and Biomarker Identification。Biochem Biophys Res Commun.5;292(3):587−92,2000中の飛行時間質量分析計によって質量分析を行った。
【0111】
ポリクローナル抗体及びWesternイムノブロッティング
対応するタンパク質由来の免疫抗原性のペプチドを使用してウサギポリクローナル抗体(DSL Laboratories,Webster,TX)を作成し、次いで、アフィニティー精製した抗体をWesternブロットのために使用した。100μgのAFタンパク質を4−20%SDS−PAGEで分離し、PVDF膜に移した。母体血清から、300μgのタンパク質をIGFBP1モノクローナル抗体(DSLLaboratories)を用いた免疫沈降のために使用し、生成物をWesternブロットした。母体血清中のカルグラヌリン(calgranulin)Bの検出のために、150μgのアルブミンを除去した母体血清をWesternブロットのために使用した。PBST中の5%脂肪除去牛乳を用いて室温で45分間、膜をブロックし、1μg/mlの一次抗体(IGFBP−1、アズロシジン、ビタミン−D結合タンパク質及びカルグラヌリン(calgranulin)−B、DSL Inc., Santa Cruz,CAから)を用いて4℃で一晩インキュベートした。TBSTで3回洗浄した後、IgG−HRP二次抗体(シグマ)を用いて膜をインキュベートし、高められた化学ルミネセンスを用いて視覚化した。
【0112】
実施例2
羊水中で発現したタンパク質及びポリペプチドの同定
実施例1に記載された物質及び方法を用いて、正常羊水及び感染羊水中で発現したタンパク質及びポリペプチドを同定した。ヒト及び霊長類の羊水サンプル(プールしたもの及び個々のもの)を、実施例1に記載されるようなタンパク質分離技術で分離した(1−D、2−D及びHPLC分画)。分離したタンパク質(ゲルバンド、スポット及びフラクション)をトリプシンで消化して、ペプチドプールを作成した。ペプチドプールをタンデムMSを用いて分析して、それらのアミノ酸配列及び組成を解読した。
【0113】
スペクトル検証プログラムを用いて5000のMSスペクトルを選択した。デノボ配列決定プログラム(Lutefisk,Peaks)を用いてこれらのスペクトルファイルを分析し、各ペプチドに対応するアミノ酸配列を作成した。ペプチドプールから作成されたデノボ配列を使用して、実施例1に記載されるようにタンパク質及びDNAデータベースをサーチした。
【0114】
ホモロジーマップ及び配列検証を用いて、種々のタンパク質の発現を羊水中で発見した。検出したタンパク質を、既知の構造類似性(配列ホモロジーマップ)に基づいて潜在的な機能について分析した。広範囲の疾患にかかわる重要な機能分類に属するタンパク質が発見された。ヒト羊水中で最初に発見されたタンパク質及びポリペプチドをこれらの潜在的な機能カテゴリーのもとで以下の表2に列挙する。
【0115】
免疫アッセイにおいて示差的に発現することが示されたタンパク質、及び感染した羊水中でより豊富に又は固有に現れるタンパク質は別個に表示する。この内容において、相対的な量は、参照サンプルと比較して、試験サンプル中の特定のポリペプチド又はタンパク質を表すペプチドの量として定義される。それ故に、同じタンパク質から誘導されるより多くのペプチドが、羊水の感染していない参照サンプルよりも感染した羊水中に存在する場合、タンパク質は、感染した羊水中でより豊富に現れる。
【0116】
表3は、羊水中に存在する以前に知られたタンパク質及びポリペプチドを列挙し、これらの存在は、本アッセイによって再確認された。感染に関連する事象のための既知のマーカーであるタンパク質は、別個に示される。
(表2)
ヒト羊水中で最初に発見されたタンパク質及びポリペプチド
【0117】
【表2】

【0118】
【表2A】

・タンパク質は免疫アッセイでも示差的に発現することが示される
#これらのタンパク質を表すペプチドは、感染した羊水中でより豊富であるか、又は固有に検出される。
(表3)
人羊水中に存在することが以前に知られており、デノボ配列決定を用いて同定されたタンパク質及びポリペプチド
【0119】
【表3】

*感染に関連する事象についての既知のマーカー
羊水中で初めて発見されたさらなるタンパク質が以下の表4に表される。
(表4)
【0120】
【表4】

【0121】
【表4A】

【0122】
【表4B】

【0123】
【表4C】

【0124】
【表4D】

【0125】
【表4E】

IPI=国際タンパク質指数
子宮内の状態のための診断マーカー:
上の表に列挙されたたんぱく質は、子宮内状態を検出し監視するための有望な候補である。このような状態及び対応するタンパク質マーカーのいくつかの例を以下でさらに詳細に議論する。
【0126】
発育不全のマーカーとしてのアクチン調整及び関連タンパク質:
表2の構造タンパク質の中に列挙されるモエシン(膜を組織化する伸長スパイクタンパク質)は、膜貫通タンパク質のアクチン細胞骨格に対する結合に関与し、種々の細胞シグナル伝達経路に関係していることが知られている(Speck O,et al.:Moesin functions antagonistically to the Rho pathway to maintain epithelial integrity.Nature 2;421(6918):83−7,2003)。Rho−ファミリーGTPase及びそれらのエフェクターが、アクチン改変分子、例えばコフィリン及びプロフィリン(これらも表2の構造タンパク質として列挙されている)の活性を調整し、その結果、増殖の円錐伸長又は収縮に関連する細胞骨格に変化を生じることが知られていた(Tang BL.Inhibitors of neuronal regeneration:mediators and signaling mechanisms.Neurochem Int,42(3):189−203,2003)。コロニン様タンパク質p57(表2において列挙される別の構造タンパク質)はさらに、アクチン架橋及びキャッピングに関与し(Weitzdoerfer R et al.:Reduction of acrin−related protein complex 2/3 in fetal Down syndrome.Biochem Biophys res Commun.293:836,2002)、既知の発育不全において調節異常を示す。別のアクチン調整タンパク質であるゲルゾリン(表2中のトランスポーター/結合タンパク質の列挙されるゲルゾリン前駆体を参照)はさらに、発育において制御され、臓器系において重要であることが知られている(Arai M,Kwiatkowski DJ.Differential developmentally regulated expression of gelsolin family members in the mouse.Dev Dyn,215,297,1999)。14−3−3タンパク質はさらに、シグナル伝達及び分化経路にかかわる既知の上皮マーカーであり、脳及び他の生体臓器の正常な発育に必須である(Wu C,Muslin AJ.Role of 14−3−3 proteins in early Xenopus development.Mech Dev,119,45,2002)。
【0127】
それ故に、発育中に重要な役割を有する列挙されたアクチン調整タンパク質及び他の関連分子は、ヒト羊水中で最初に同定され、種々の臓器系の発育不全、例えば、染色体異数性から生じ得る、例えば、中枢神経系、心臓血管系及び他の筋骨格の奇形を検出するために使用可能であった。このことは、感染した羊水中で示差的に発現することが示され、その示差発現が免疫アッセイによって確認される、プロファイリングIにとって特に正しい。
【0128】
感染及び免疫応答関連障害のマーカー:
マクロファージキャッピングタンパク質、白血球エラスターゼ、好中球ゲラテナーゼ関連リポカリン(lipocalicn)、ミエロペルオキシダーゼ(myleoperoxidase)、L−プラスチン(リンパ球サイトゾルタンパク質)及びカルグラヌリン(calgranulin)(表2中の免疫応答関連遺伝子の列挙を参照)の感染した羊水での本発明の検出は、最初にこれらのタンパク質の羊膜内感染における存在および調整を示す。これらのタンパク質のいくつかは、感染、炎症及びストレスに対する応答において免疫細胞の既知のレスポンダーである。マクロファージキャッピングタンパク質(MCP)は、アクチンフィラメントを調整し、炎症プロセスに関与するCa(2+)−感受性タンパク質である(Dabiri GA,Molecular cloning of human macrophage capping protein cDNA.A unique member of the gelsolin/villin family expressed primarily in macrophages J Biol Chem 15;267(23):16545−52,1992)。同様に、カルグラヌリン(calgranulin)は、外傷及び創傷治癒において役割を果たすことが知られているカルシウム結合タンパク質である(Thorey IS.et al. The Ca2+−binding protein S100A8 and S100A9 are encoded by novel injury−regulated genes.J Biol Chem 21;276(38):35818−25,2001)。白血球エラスターゼ及び好中球ゼラチナーゼに関連するリポカルシン(NGAL)は、静菌機構及び溶菌機構に関与する(Goetz DH.et al.The neutrophil lipocalin NGAL is a bacteriostatic agent that interferes with siderophore−mediated iron acquisition.:Mol Cell 10(5):1033−43,2002)。
【0129】
上述の免疫調整剤に加えて、本発明者らはさらに、感染した羊水中に2つの抗菌性タンパク質Fall−39及びアズロシジンを最初に発見した。抗菌性タンパク質Fall−39(LL−37)はバクテリアリポ多糖類(1ps)に結合し、骨髄、精巣及び好中球中で発現する。Fall−39は肥満細胞の脱顆粒を刺激し、肥満細胞の強力な化学走性因子である。その抗菌活性のほかに、Fall−39は、肥満細胞を炎症病巣に動員する能力を有している場合がある。基本培地Eの存在下で、合成FALL−39は、大腸菌D21及びBacillus megaterium Bm11に対して非常に活性であった。皮膚のバリアの保全性が破壊された場合、Fall39が最初の防御線に参加し、局所的な感染及び微生物の全身侵襲を防ぐという防御的な役割が提案された(Agerberth B,et al.:FALL−39, a putative human peptide antibiotic, is cystein−free and expressed in bone marrow and testis.Proc Natl Acad Sci USA,3;92(1):195−9,1995)。
【0130】
アズロシジン(CAP37)は、ヒト好中球から単離されたカチオン性抗菌タンパク質であり、宿主防御及び炎症において重要な関係を有する。アズロシジンは、炎症中に放出され、単核球/マクロファージ機能、例えば、化学走性、生存の増加、及び分化を調整する(Pereira HA. CAP3 7, a neutrophil−derived multifunctional inflammatory mediator.J Leukoc Biol;57(6):805−12,1995)。
【0131】
プロテアーゼ及びプロテアーゼインヒビターは、タンパク質制御において鍵となる役割を果たし、いくつかの鍵となる生理学的機構を制御する。本発明者らは、羊膜内感染を含むヒト羊水中で初めてプロテアーゼのセルピンファミリー(セルピン、扁平上皮細胞癌腫抗原1及び2、グリア誘導ネキシン)の発現を同定した。セリンプロテアーゼインヒビターのセルピンスーパーファミリーは、多くの生物学的経路において、プロテアーゼの制御において中心的な役割を有し、例えば、アミロイドーシス、プリオン脳障害及びハンチントン病及びアルツハイマー病のような構造的な疾患にかかわる。(Lomas DA,Carrell RW,Serpinopathies and the conformational dementias.Nat Rev Genet;3:759,2002)。
【0132】
さらに、羊膜内感染において、本願発明者らは、免疫制御に関与する周知のプロテアーゼインヒビターであるシスタチンの発現を同定した(Vray B,Hartmann S,Hoebeke J. Immunomodulatory properties of cystatins.Cell Mol Life Sci;59(9):1503−12,2002)。
【0133】
列挙されたタンパク質は、感染及び/又は免疫応答関連障害の有望なマーカーである。
【0134】
マクロファージキャッピングタンパク質、好中球ゼラチナーゼ関連リポカリン、ミエロペルオキシダーゼ前駆体、L−プラスチン、アズロシジン、抗菌性タンパク質Fall−39、カルグラヌリン(calgranulin)A、プロフィリンI、グリアから誘導されるネキシン、セルピンI2、及びシスタチンAを表すペプチドが、正常な羊水と比較して感染した羊水中でさらに豊富に又は固有に検出され、免疫アッセイにおいて示差発現を示したことは注記すべきことである。
【0135】
それ故に、これらのタンパク質は、羊膜内感染及び/又は免疫応答関連障害のマーカーとして特に重要である。
【0136】
ヒト羊水中で検出された他の疾患(感染)に特異的なタンパク質
表2に列挙されたGp−340改変体タンパク質は、ヒトの感染羊水中で検出され、肺において以前に同定されたスカベンジャーレセプターである。このタンパク質は、バクテリア(連鎖球菌及び改変体)に結合することが知られている。感染した羊水におけるこのタンパク質の検出は、IAIのためのバイオマーカーを同定するための本発明の感受性のプロテオミクスアプローチを補完する。従って、感染した羊水中で同定されたGp−340改変体タンパク質は、それ自身で新生児セプシスを検出するのに有用である)。
【0137】
IGFBP−1(タンパク分解性のフラグメント)
表2に示されるように、IGFBP−1は、感染した羊水中で示差的に発現することが示された。インスリン様増殖因子(IGF)系は、胎児及び胎盤の成長に決定的に関与し、自己分泌/パラ分泌機構を介する子宮内膜中のステロイドホルモン作用を調整する。IGF−I及びIGF−IIは、増殖及び分化を刺激し、インビトロでいくつかの細胞種において分化した細胞機能を維持した。子宮内膜間質細胞はIGF−I及びIGF−IIを産生し、さらに高アフィニティーのIGF結合タンパク質(IGFBP)を産生する。IGF作用を調整可能な6つの高アフィニティーIGFBPのmRNAは、ヒト子宮内膜中で発現される。ヒト子宮内膜中で最も豊富なIGFBPはIGFBP−1であり、これは、後期分泌段階及び妊娠中において、前脱落膜化/脱落膜化子宮内膜間質細胞によって分泌される。このことは、臨床的な産科学及び婦人科学について示唆を有し、ここに子かん前症、子宮内成長阻害、多嚢胞性卵巣症候群及び栄養芽細胞及び子宮内膜の新生物におけるIGFBP−1の病態生理学的な役割の証拠が存在する。
【0138】
ヒト羊水中及び母体血清中のIGFBP−1タンパク分解性のフラグメントの存在及び調整は、妊娠に関連する子宮内及び母体状態を監視するための新しい道筋を開く。
【0139】
さらなる詳細については、以下の実施例12も参照されたい。
【0140】
実施例3
子宮内感染後の霊長類及びヒト羊水のタンパク質発現プロフィール
化学的に定義された正常相のチップアレイに結合したAF抽出物の235レーザー強度で集めた全スペクトルSELDI−TOF MS分析において、3〜5kDa及び11〜12kDa領域において、感染及び非感染の霊長類及びヒトのAF間でいくつかのピーク強度が異なることがわかった
対応する正常な発現プロフィールと比較した場合の子宮内感染後の霊長類羊水のタンパク質発現プロフィールを図1A〜Cに示す。図1A〜Cに示されるように、コントロール及び感染羊水の全体的なタンパク質発現プロフィールは異なる。小さな質量範囲における羊水プロフィールの詳細なスペクトル(図1B及び1C)は、約3〜5kDa及び10〜12kDa範囲において、コントロールと感染サンプルとのタンパク質発現プロフィールが別個のものであり、特徴的に異なることを示す。このことは、子宮内感染に応答するタンパク質発現の全体的な調整を示し、子宮内感染を診断する固有の発現サインを検出する能力を示す。
【0141】
図2は、感染(GBS)に応答する霊長類羊水の時間推移分析を示す。バクテリア接種の前及び感染後に順次羊水を集め、実施例1に示されるようなSELDI−TOF分析を行った。図2Aは感染前のタンパク質発現プロフィールを示し、図2Bは感染12時間後のタンパク質発現プロフィールを示し、図2Cは感染36時間後のタンパク質発現プロフィールを示す。
【0142】
図2Cに示されるように、子宮内感染の診断ピーク(10〜11kDa)のうちの1つは、急性感染の36時間以内に、明らかに高いレベルの発現レベルに到達する。このことは、診断タンパク質プロフィールを、疾患の状況及び処置に対する応答を監視するために使用できることを示す。
【0143】
図3は、化学的に定義された正常相チップアレイに結合したヒト羊水抽出物のSELDI−TOF分析の結果を示す。図3Aは、235レーザー強度での全スペクトルを示す。図3Bは、10〜12kDa領域における感染サンプル及びコントロールサンプルの間の差異を示す詳細なスペクトルである。図3は、3〜5kDa領域において感染サンプル及びコントロールサンプルの間の特徴的な差異を示す詳細なスペクトルである。
【0144】
図3A〜Cに示されるように、コントロール羊水及び感染羊水の全体的なタンパク質発現 プロフィールは異なっている。さらに小さな質量範囲における羊水プロフィールの詳細なスペクトル(図3B及びC)は、コントロールサンプルと感染サンプルとの間でタンパク質が異なって過剰発現している(3〜5KDa及び10〜12kDa範囲)ことを示す。タンパク質ピークの相対強度分析は、2つの異なる診断クラスター(10〜12kDa及び3〜5kDa範囲)の存在を示唆する。このことは、子宮内感染に応答したタンパク質発現の全体的な調整を示し、ヒト及び霊長類モデルの両方における子宮内感染の診断に固有の発現サインを検出する能力を示す。
【0145】
ヒト羊水の診断パターンは、霊長類の羊水の診断パターンと良好に一致することは注記すべきことである(実施例3及び4)。
【0146】
実施例4
示差質量分析計を用いた診断プロフィールの作成
診断タンパク質発現プロフィールは、異なる種類の質量分析計を用いて検出することができる。異なる質量分析計が類似の診断プロフィールを作成するか否かを試験した。診断プロフィールが実質的に質量分析計の種類に依存しない場合、羊水中で検出された示差的なタンパク質発現は、子宮内感染の診断サインを与えることができる。
【0147】
図4は、ヒトコントロール由来の羊水(子宮内感染なし)(A)、及び子宮内感染ありのサンプル(B)を用いて、一般的なMALDI−TOF質量分析計で得たマススペクトルを示す(Jensen ON,et al.,Direct observation of UV−crosslinked protein−nucleic acid
complexes by matrix−assisted laser desorption ionization mass spectrometry.Rapid Common Mass Spectrom 7(6):496−501(1993))。
【0148】
図4A及びBに示されるように、10〜12kDa範囲における子宮内感染の診断プロフィールは、代替の質量分析計を用いて検出され、SELDI−TOF機を用いて検出したプロフィールと類似である。このことは、示差的なタンパク質発現プロフィールが確固たるものであり、広範囲の現在の質量分析計を用いて検出できることを示す。
【0149】
まとめると、羊水タンパク質及びポリペプチドが、疾患の状況を診断する示差的な発現パターンを示すことがわかった。ここに示された結果は、疾患に特異的な診断パターンが複数の質量分析計アプローチを用いて検出可能であることを示す。パターン又はタンパク質発現プロフィールは、ヒト及び霊長類の間で比較可能である。プロフィールを使用して、時間が推移した場合の効果(感染又は処置)を監視することができる。
【0150】
実施例5
診断的及び予防的に監視するための羊水におけるタンパク質及びポリペプチド発現の定量
SDS−PAGE:
多量の塩を含有するヒト羊水(AF)由来のタンパク質をアセトンで沈殿させた。100μgの羊水タンパク質を15%SDS−PAGEにかけた。ゲルをCoomassie Blue R−250で染色した。ゲル画像をBio−RadゲルScannerでスキャンした。
【0151】
図5は、SDS−Coomassie Blue染色したゲルを示す。(A)プールした4つのヒトコントロールAFサンプル;(B)個々のコントロールAFサンプル;(C)プールした4つのヒト感染AFサンプル;及び(D)個々の感染AFサンプル。
【0152】
図5は、10〜15kDa範囲におけるコントロールタンパク質及び感染タンパク質の間の発現レベルの顕著な違いを示す。質量分析計を用いて質量検出されたこの質量におけるタンパク質及びタンパク分解性のフラグメントのいくつかが、タンパク質発現レベルを反映した診断プロフィールに関係することと、診断的有用性及び予後的有用性を有することが結論付けられた。
【0153】
実施例6
子宮内感染由来の羊水のWesternブロット分析
100μgのAFタンパク質を4〜20%SDS−PAGEに200Vで60分かけ、PVDF膜に90mMで75分移した。膜を5%ミルクPBSTで室温で45分間ブロックし、1μg/mlの一次抗体(Santa Cruz and Dako)で4℃で一晩インキュベートした。TBSTで3回洗浄した後、膜を二次抗体IgG−HRP(シグマ)で室温で90分間インキュベートし、ECL(Pierce)で視覚化した。
【0154】
この結果を図6に示す:(A)コントロールAFサンプル(プールした);(B)感染したAFサンプル(プールした)。図6は、IGFBP1(11kDa)、プロフィリン及びセルロプラスミン(130kDa)が、感染していないAFと比較して感染したAFでさらに高いレベルで発現していることを示す。L−プラスチンレベルは、感染していないAFと比較して感染したサンプルにおいて、さらに低かった。これらのタンパク質をさらに、MSアプローチを用いてヒトの感染サンプルから同定し(デノボ配列決定)、上の実施例2に列挙した。
【0155】
実施例7
子宮内感染由来の羊水の免疫沈降分析
2μgの一次抗体を600μgのAFタンパク質と混合し、4℃で一晩インキュベートした。15μlのタンパク質G Sepharoseビーズを追加し、シェーカー上で室温で60分インキュベートした。ビーズをIPバッファーで6回洗浄した。
【0156】
結果を図7に示す。ここで、(A)はコントロール羊水サンプル(プールされた)を示し、及び(B)は感染した羊水サンプルを示す。図7は、セルロプラスミン(約130kDa)及びカルグラヌリン(calgranulin)(約16KDa)がコントロール羊水よりも感染した羊水においてさらに高いレベルで発現していることを示す。
【0157】
実施例8
ヒト羊水及び母体血清における示差的なタンパク質発現の検出
羊水中で示差的に発現するタンパク質を、母体血清における同様のタンパク質を測定するための手がかりとして使用することができるか否かを試験した。これにより、診断及び監視のための迅速な非侵襲試験を開発することが可能になる。結果を図8に示す。ここで、(A)はコントロールサンプル(プールされた)であり、(B)は感染サンプルである(プールされた)。
【0158】
図8は、IGFBP−1のより小さなタンパク分解性のフラグメントが、子宮内感染に応答して、AF及び母体血清の両方で一致して示差的に発現することを示す。
【0159】
実施例9
子宮内感染由来の羊水のタンパク質マイクロアレイ分析
抗体:IGFBP−1(DSL);補体C3、Desmin、好中球エラスターゼ、NSE抗体(DAKO);カルグラヌリン(calgranulin)、セルロプラスミン、TIMP−1、プラスチン及びプロファイリング(Santa Cruz)。
【0160】
抗体スポッティング:抗体を40%グリセロール、60%PBS、pH7.5に100μg/mlの濃度で溶解し、Arrayer(Cartesian)を用いてアルデヒドスライドの上にスポッティングした。
【0161】
湿潤チャンバー中室温で3時間インキュベートした後、スライドを1%BSA(w/v)を含有するPBS溶液(pH7.5)中で室温で穏やかに攪拌しながら1時間インキュベートした。
【0162】
タンパク質のビオチン化:Biotin−NHSをDD水に50mg/lで溶解した。この溶液10ulを母体血清タンパク質溶液(10mM PB(pH8.5)中5mg/ml)に添加し、シェーカー上で3時間インキュベートした。5ulのエタノールアミンを添加し反応を停止させた。ビオチン化タンパク質を200ulのTNBバッファーで希釈し、抗体アレイを添加し、4℃で一晩インキュベートした。TNTバッファーで3回洗浄した後、ストレプトアビジン−HRPを添加し、室温で30分インキュベートした。Cy5−チラミド蛍光を用いて抗原−抗体相互作用を検出した。定量のためにスライドをPE蛍光スキャナーでスキャンした。コントロール及び感染したスライドの画像を画像分析プログラムで重ね、相対量について擬似色で表した。結果を図9に示す。ここで、タンパク質アレイの擬似色画像は、対応するタンパク質とそれらの抗体との結合を示す。緑色は感染したサンプルを表し、赤色はコントロールサンプルを表す。部分IIは、カルグラヌリン(calgranulin)発現(緑色)が感染血清サンプルよりも高いことを示すアレイの拡大領域である。部分IIIは、感染羊水サンプル中で同様に多く発現していることを示すカルグラヌリン(calgranulin)IPのWesternブロットである。
【0163】
実施例10
感染した羊水の固有の診断サイン中に表されるタンパク質のさらなる分析
コントロール及び感染した羊水のSELDI−TOFプロフィールが、陽性に感染したサンプルの代表例で、10〜12KDaの質量範囲で固有のサインを示すことが示された(図1、2及び3)。コントロール及び感染した羊水を1−Dゲルで分離し(図5)、プールされたか又は独立した感染羊水サンプル中でさらに豊富な、10〜12KDaの質量範囲におけるバンドを示す。これらの1−Dゲルバンドの単離及び図13に示すようなLCQ−MSを用いたさらなる分析により、IGF−BR−1及びS−100カルシウム結合タンパク質の代表例であるペプチドを同定した。
【0164】
図8に示されるような抗−IGF−BP1抗体を用いたコントロール及び感染した羊水のWesternブロット分析はさらに、感染においてタンパク分解性のフラグメント(約11KDa)の示差的な発現を示す。
【0165】
羊水ポリペプチドの配列決定はさらに、感染した羊水中のIGF−BP1及びカルグラヌリン(calgranulin)の存在を同定した(表3)。
【0166】
IGFBP−1の同定した新規なタンパク分解性のフラグメント配列を図12に示す(SEQ ID NO:1)。図において、感染した羊水の1−Dゲル電気泳動、トリプシン消化及びMS/MS分析後にサンプル中に見出されるペプチド配列「0426seq_HI_12」及び「0425seq_HI−113」を下の枠中に示す(SEQ
ID NO:2及び3)。感染羊水由来のトリプシン消化した約10.5〜12kDaバンドの1−Dゲル中で検出されたIGF−BP−1のタンパク分解性のフラグメント(低分子量範囲、図5)、Westernブロット(図6)、及びMS/MS分析(図13)は、下線を引いた配列の領域で現される(SEQ ID NO:4)。
【0167】
実際に、MS/MS分析及び配列サーチの結果は、図13に示されるマススペクトル中の親イオン434.89がIGF−BP−1配列(RSPGSPEIR)を表すことを示し、IGF−BP−1タンパク分解性のフラグメントの配列マップが図12に示される。親イオン1082.97は、S−100カルシウム結合タンパク質(すなわち、カルグラヌリン(calgranulin)A及びB)を表し、AFのデノボ配列決定によっても独立して同定される(表2及び3)。
【0168】
図14は、図13に示される保持時間17.55〜18.21分のピークのマススペクトルを示す。強く出てくるピークは質量434.9であることが明らかである。図15は、図14に示される434.9ピークの親イオンのMS/MSスペクトルを示す。データベースサーチに基づいて、親イオンはIGFBP−1の部分配列に対応する。
【0169】
実施例11
IAIバイオマーカーの免疫検出
IAIにおいて同定されるタンパク質の示差発現を確認するために、全体的なタンパク質発現分析において同定された11−kDa SELDI−TOF MSプロフィール(カルグラヌリン(calgranulin)B及びIGFBP−1)、1つの免疫制御分子(アズロシジン)、及び制御されていないタンパク質(ビタミンD結合タンパク質)から2つのマーカーを選択した。図16に示されるように、Westernブロット分析は、全ての3つのバイオマーカーが、IAI羊水で行われたタンパク質同定実験と一致する示差的な発現を示すことを確認した。
【0170】
IGFBP−1及びカルグラヌリン(calgranulin)Bに対して開発した特異的抗体を利用することによって、羊水中で示差的に発現したタンパク質が、血清が入手可能な限定された数の患者(n=5)由来のプールされた母体血清中で同定できるか否かを観察した。この限定された分析において、感染羊水とコントロール羊水との間で示差的に存在する11kDaピークに対応する11kDaのタンパク分解性のIGFBP−1及びカルグラヌリン(calgranulin)Bのフラグメントはさらに、IAIに応答して母体血清中で検出された(図16d及びe)。アズロシジンは母体血清中で検出されなかった。
【0171】
実施例12
染色体異数性に特徴的な診断プロフィール
母体血清スクリーニングを用いてトリソミー−21をより正確に同定するためにプロテオームプロファイリングの有用性を試験した。この研究は、パネル(コントロール(n=6)、トリソミー−21(n=6)及びトリソミー−18(n=4)、十分に特徴決定された母体血清サンプル(同じ症例についての羊水サンプルのマッチングは、標準的な染色体マッピング方法及び陽性確認されたトリソミーの存在により試験した)で行ない、子宮内感染モデルについて上に記載されるようなSELDI−TOF方法論を用いて分析した。
【0172】
図10は、トリソミーを区別するための固有のプロフィールを有する母体血清における示差的なタンパク質発現パターンを示す。1μgの母体血清(タンパク質分離カラム(BioRad technologies)でアルブミン及び免疫アルブミンを除去した後)を使用して、上に記載されるように、化学的に定義されたNormal Phaseチップアレイに結合した母体血清抽出物のSELDI−TOF分析を行った。235レーザー強度で集めた全スペクトルは、ピーク強度における差異を示す。(A)コントロール血清;(B)トリソミー−21(ダウンの)血清;(C)トリソミー−18血清。詳細なスペクトルは、4〜15KDa範囲において差異を示し、それぞれの症例について固有である。矢印は、診断スクリーニング試験を開発するためのアルゴリズムを処方するための組み合わせにおいて使用可能な診断ピークを示す。このことはさらに、種々の生体液(例えば母体血清)のタンパク質発現パターンの検出が、胎児−母体の状態を非侵襲アプローチでさらに正確に同定可能であることを示す。
【0173】
臨床的に関連する微生物を利用した実験的な霊長類モデルにおける、および異なる微生物に感染したメスにおける、IAIの設定でのSELDI−TOF MSにおける有意に過剰発現した11kDaピークの検出は、広範囲の病原体によって生じるIAIのこのサインに特定的であることを確認した。この過剰発現したクラスターは、急性炎症をおこした組織中のマクロファージ及び上皮細胞によって発現する、この固有のクラスター中で同定された1セットのタンパク質、すなわち、カルグラヌリン(calgranulin)は、S−100カルシウム結合タンパク質ファミリーのメンバーであるため、感染に対する基本的な子宮内免疫応答を表し得る。このクラスターからの第2の候補は、IGFBP−1の特異的なタンパク分解性のフラグメントであり、感染に応答する潜在的なプロテアーゼ関連機構を示す。インタクトなIGFBP−1は、AFにおいて見出される主要なIGFBPであり、胚膜及び母体の脱落膜の両方によって合成される。IGFBPのタンパク分解性の開裂は、十分に特徴決定された現象であるが(Maile et al.IGF binding protein hydrolysis in various clinical states.In:The IGF System,Li:Rosenfeld CR,Roberts C,Jr.,eds.Totowa,NJ:Humana Press,1999)、本試験において記載される特定のフラグメントは以前に記載されていない。
【0174】
第2のアプローチでは、コントロール及びIAIにおいてAF中で発現するタンパク質のLC−MS/MSを用いた特徴決定により、IAIにおいて感染及び免疫応答に関連する顕著な量の分子を初めて同定した。マクロファージキャッピングタンパク質(MCP)は、アクチンフィラメントを調整し、炎症プロセスに関与するCa+2−感受性タンパク質である(Dabri et al..J Biol Chem 267:16545−52(1992))。白血球エラスターゼ及び好中球ゼラチナーゼに関連するリポカルシン(NGAL)は、静菌機構及び溶菌機構に関与する(Goetz et al.,Mol Cell l):1033−43(2002))。
【0175】
上述の免疫調整剤に加えて、感染に応答するAF中の抗菌性タンパク質Fall−39及びアズロシジンの検出は、子宮内免疫応答における新しい洞察を与える。抗菌性タンパク質Fall−39(LL−37)はバクテリアリポ多糖類に結合し、肥満細胞に対する強力な化学走性因子であり、微生物の局所感染及び全身侵襲を防ぐための最初の防御線として働く(Agerberth et al.,Proc Natl Acad SCI usa 92:195−9(1995))。アズロシジン(CAP37)は、宿主保護及び炎症において重要な関与を有するヒト好中球から単離されたカチオン性抗菌タンパク質である(pEREIRA,j.1EUKQC blOL 57:805−12(1995))。Gp−340改変体タンパク質は、肺において以前に同定されたバクテリアに結合するスカベンジャーレセプターである(Prakobhol et al.,J Biol Chem 275:39860−6(2000))。これらのタンパク質の同定は、IAIのためのバイオマーカーを同定するために使用される感受性のプロテオミクスアプローチを補完する。
【0176】
現在利用可能な実験的な試験を利用して、母体のC−反応性タンパク質の測定、白血球又はグラム染色についてのAFの直接の検査、AF微生物培養又はPCR、AFグルコース及びIL−6濃度の測定、及びAF白血球エステラーゼの検出を含む、IAIの診断を確認した。羊水の微生物培養物及び広い範囲のスペクトルバクテリアrDNAポリメラーゼ連鎖反応のみが、IAIに感受性で特異的であるように思われる。しかし、生殖器マイコプラスマについての微生物培養又はPCRに基づく試験は、広範囲に利用することができず、羊膜穿刺は羊水を得ることが必要である。プロテオミクスに基づくアプローチの1つの利点は、候補ペプチドバイオマーカーによってそれ自身で迅速な作用時点での発育を知ることができ、コスト的にも有効な診断免疫アッセイであることである。他のAF及び血清スクリーニング試験(例えば、神経管不全についてα−フェトタンパク質)と類似して、感染した羊水内で同定されるペプチドは、母体血清中で検出可能であり、非侵襲診断試験における有用性が見出される。上述の実施例において表されるデータ、特にプールされた母体血清を利用するデータは、IGFBP−1制限フラグメント及びカルグラヌリン(calgranulin)Bが、IAI中にAF及び母体の血液中に現れる2つのバイオマーカーであるが、感染の非存在下ではそうではないこのアプローチの容易性を示す。
【0177】
まとめると、プロテオミクスに基づくAFの分析は、実験的な非ヒト霊長類モデル及び早産及び潜伏性のIAIをもつ女性のコホートの両方において、IAIについてのバイオマーカーを同定するために使用された。診断タンパク質発現プロフィールを、IAIの検出において感受性で特異的なSELDI−TOF MSプロファイリングによって同定した。AF中で発現したタンパク質の高スループット分析によって、いくつかの免疫制御分子の発現を初めて同定した。診断11kDaピークにおいて検出されるタンパク質(IGFBP−1及びカルグラヌリン(calgranulin)B)の免疫検出は、IAI中の羊水中及び母体血液中のこれらのバイオマーカーの存在及び示差的な発現を確認した。本明細書中で示されるデータは、妊娠中の潜伏性のIAIを検出する迅速で非侵襲アッセイの基礎として役立つ。このことは、特異的な介入及び治療トライアルにおいて、臨床医及び観察者が早期分娩について高いリスクを有する女性の特定のサブグループを標的にすることができるため、重要なブレークスルーである。最後に、これらの試験は、感染及び炎症プロセス及び概して妊娠の病態生理学についての特定のバイオメーカー及び診断プロフィールを同定するためのプロテオミクスに基づくアプローチの有用性を示す。それ故に、本明細書中で示されるデータは、羊水及び他の生体液(例えば血清)中のタンパク質の示差的な発現を示し、迅速な、非侵襲及び正確な種々の母体/胎児の状態及び染色体異数性の診断、予後及び監視のための有効なアプローチを示す。
【0178】
上述の記載を通して、本発明は、特定の実施形態を参照して議論されるが、それらに限定されない。実際に、本明細書中に示され記載されるものに加えて、本発明の種々の改変は、上述の記載から当業者に明らかであり、添付の特許請求の範囲内のものである。
【0179】
記載全体で引用される全ての参考文献、及び本明細書中で引用される参考文献は、本明細書中にその全体が参考として組み込まれる。
【技術分野】
【0001】
(発明の背景)
(発明の分野)
本発明は、生体液のプロテオームの同定、胎児起源の母体状態、染色体異数性、及び胎児の成長及び成熟に関連する胎児の疾患を含む、母体/胎児の状態の状況の決定におけるそれらの使用に関する。特定的には、本発明は、羊水のプロテオーム同定(複数のタンパク質は羊水の組成を表す)及び正常なプロテオームにおける特性変化と種々の病的な母体/胎児の状態、例えば羊膜内感染、又は染色体不全との相関に関する。
【背景技術】
【0002】
(関連技術の記載)
プロテオミクス
タンパク質発現パターンの大スケール分析は、現在のDNA クローニング及び遺伝子プロファイリングアプローチに対する重要かつ必要な相補体として現れた(Pandey and Mann,Nature 405:837−46(2000))。DNA配列情報は、ホモロジー方法に基づくいくつかの構造的及び潜在的なタンパク質改質を推定するのに役立つが、翻訳後改質、タンパク分解又は区画化を介するタンパク質機能の制御についての情報を与えない。
伝統的なゲルベースの方法、例えば、一次元及び二次元ゲル電気泳動は、小スケールのタンパク質(<1,000タンパク質)検出に有用であるが、これらは大量のサンプルを必要とする(Lilley KS,Razzaq A,Dupree P:Two−dimensional gel electrophoresis:recent advances in sample preparation,detection and quantitation.Curr Opin Chem Biol.6(1):46−50,2002)。この制限を克服するためのアプローチとしては、サンプル中のタンパク質の質量を示すプロフィールを正確に作成するマトリックス支援又は表面増強レーザー脱離/イオン化(MALDIまたはSELDI)飛行時間質量分析計が挙げられる。これらのパターン又はプロフィールは、種々の疾患を同定及び監視するために使用することができる。同定の第2のレベルは、ペプチドフラグメントからアミノ酸配列情報を作成するためにカップリングペプチドマッピングからタンデム質量分析に由来する。これは、四極飛行時間MS(Qq−TOF MS)にMALDI/SELDI又はESIをカップリングすることによって達成可能である。後者の方法はさらに、特定のペプチドの定量に使用することができる(ICAT技術)。
【0003】
(病的な母体/胎児の状態の診断)
母体及び/又は胎児又は新生児の健康を含むか、又はいくつかの場合には、母体及び/又は胎児又は新生児の生命を脅かす、妊娠中に進行し得る多くの病的な母体及び胎児の状態、例えば、羊膜内感染(IAI)、子かん前症、早期出産及び早期分娩、及び染色体異数性が存在する。このような状態の初期診断は、適切な時期の処置及び介入を可能にするのに必須である。残念なことに、心象的な徴候及び症状は遅く表れ、しばしば非特異的で一致しないため、これらの状態のほとんどの初期診断は困難である。例えば、IAIの臨床的症状としては、典型的には、母体の発熱及び白血球増加症が挙げられるが、これらの症状はしばしば後で起こり、鋭敏でもなく特異的でもない。このように、Gravett et al.,Am.J.Obstet.Gynecol.171:1660−7(1994)は非ヒト霊長類モデルを利用し、グループBの連鎖球菌を用いた実験的羊膜内感染の後、熱及び白血球増加症が、実験的感染の28時間〜40時間後に生じる感染により誘発される早期分娩が発症時には50%しか存在しないことを示した。それ故に、診断の遅れを避けるために、疑惑の高い指標及び補助的な実験室的試験の適切な使用が保証される。IAIを診断するために通常使用される臨床的基準としては、以下の症状の2つ以上を伴う母体の発熱(≧37.8℃)が挙げられる:母体白血球増加症(315,000/mm3)、母体又は胎児の心急搏症、子宮圧痛、又は羊水の悪臭。
【0004】
臨床的特長が整合しないため、IAIの診断を補助するために他の補助的な実験室的試験が利用されてきた。これらの試験としては以下のものが挙げられる:母体のC−反応性タンパク質の測定、グラム染色に対して白血球又は微生物、羊水培養物について羊膜の直接試験、羊水のグルコース濃度の測定、羊水白血球エステラーゼの検出、気−液クロマトグラフィーによる微生物の有機酸の検出、種々の羊水又は膣のサイトカインの測定(例えば、インターロイキン2、4、6、顆粒球コロニー刺激因子、及び腫瘍壊死因子−α)、マトリックスメタロプロテアーゼ−9、ラクトフェリン、及び超音波検査法による胎児活性の評価(生物物理学的プロフィール)。サイトカイン又は他の生化学因子の測定は高価であり、一般的に臨床的に入手可能ではなく、主に研究ツールである。さらに、これらの試験の試験効率は、羊水グラム染色及び培養物、羊水グルコース濃度、及び羊水白血球エステラーゼの検出のようなより容易に利用可能な従来の試験よりも整合性があるわけではない。これらの試験の効率は、以前に広くまとめられている(Ohlsson,A. and Wang,E.:An analysis of antenatal tests to detect infection at preterm rupture of the membranes.American Journal of Obstetrics and Gynecology 162:809,1990)。全て合理的な感受性及び特異性を有するが、予想される値は、IAIの診断における臨床的特長を独立して利用するために十分感受性又は特異的ではない。
【0005】
それ故に、IAI及び他の病的な母体/胎児の状態の初期及び正確な診断を可能にする新規なアプローチの必要性が非常に存在する。
【0006】
染色体異数性を診断するための新規な、有効かつ信頼性のある非侵襲方法を開発することが特に望ましい。現在、母体の血清スクリーニング及び超音波による染色体異数性の絶対的診断は、ミッド−トリメスターの遺伝子羊膜穿刺を必要とする。これは、妊娠の損失のリスクの0.5%に関連する侵襲手順である。さらに、羊水細胞の染色体分析は、労働集約的であり、2週間までかかる時間のかかる手順である。それ故に、信頼できる試験は、母体血清又は他の生体液から染色体異数性の検出を高め、母体スクリーニングの陽性率の受容できない高い誤り率を減らし、羊膜穿刺後の羊水からの診断の速度及び効率を高めるために必要である。他の病的な(patahologic)異数性状態、例えば、クラインフェルター症候群及びターナー症候群は、超音波検査法又は従来の母体血清スクリーニングを用いたスクリーニングによっては完全に見落とされる場合がある。
【発明の概要】
【課題を解決するための手段】
【0007】
(発明の要旨)
本発明は、生体液のプロテオミクス分析による、病的な胎児/母体の状態を初期診断、予後のための、及び監視するための、非侵襲及び感受性の方法を提供する。
【0008】
本発明はさらに、限定されないが、羊膜内感染(IAI)、染色体異数性、及び胎児の在胎齢及び成熟度に関連する胎児の疾患を含む病的な胎児/母体の状態を初期診断、予後のための、及び監視することが可能な生体液、例えば、羊水及び母体血清のプロテオミクスプロフィールを提供する。特定的には、本発明は、IAI及び染色体異数性のための正常及び病的なプロテオミクスプロフィールを提供する。問題となる胎児/母体状態を排除する(陰性の診断)ことを可能にし、患者が不必要で潜在的に危険な処置又は介入を受ける必要性を排除するため、正常なプロテオミクスプロフィールの決定は非常に重要である。
【0009】
本発明はさらに、生体的、例えば、羊水又は母体血清中で異なって発現する種々の胎児又は母体の状態、例えば、IAI及び染色体異数性のような病的な状態が存在する場合、これらの存在及び状況のための特定のバイオマーカーを提供する。このようなバイオマーカー及びこのようなバイオマーカーに結合する抗体は、例えば、タンパク質又は抗体アレイ上に存在してもよく、単純な非侵襲診断アッセイにおける利用が見出されている。
【0010】
1つの局面では、本発明は、哺乳動物被検体から得られる生体液の試験サンプルのプロテオミクスプロフィールと正常サンプルのプロテオミクスプロフィール又は上記状態に特徴的な少なくとも1つの固有の発現サインを含む参照プロテオミクスプロフィールとを比較する工程を含む、母体又は胎児の状態を決定するための方法に関する。
【0011】
本方法の一実施形態では、哺乳動物被検体は妊娠したメスであり、好ましくは霊長類又はヒトである。
【0012】
別の実施形態では、母体の状態は、子宮内感染、子かん前症、及び早期分娩からなる群から選択される。
【0013】
さらなる実施形態では、胎児の状態は、染色体異数性、先天性奇形、在胎齢及び胎児成熟度からなる群から選択され、ここで、染色体異数性は、例えば、ダウン症候群、トリソミー−13、トリソミー−18、ターナー症候群、又はクラインフェルター症候群であることができる。
【0014】
任意の生体液は、限定されないが、羊水、血清、血漿、尿、脳脊髄液、母乳、粘液、及び唾液、好ましくは、羊水又は母体血清を含む、本発明の実行において使用することができる。
【0015】
さらなる実施形態では、試験サンプルのプロテオミクスプロフィールは、少なくとも2つのタンパク質の情報、又は少なくとも5つのタンパク質の情報、又は少なくとも10つのタンパク質の情報、又は少なくとも20つのタンパク質の情報、又は少なくとも50つのタンパク質の情報を含む。
【0016】
特定の実施形態では、プロテオミクスプロフィールはマススペクトルである。
【0017】
別の実施形態では、マススペクトルは、マススペクトルの3〜5kDa範囲で少なくとも1つの固有の発現サインを含む。
【0018】
なお別の実施形態では、マススペクトルの10〜12kDa範囲で少なくとも1つの固有の発現サインを含む。
【0019】
さらなる実施形態では、上記母体状態が羊膜内感染であり、上記固有の発現サインが前記試験サンプル中の10〜11kDa分子量範囲における余剰ピークであり、これが羊膜内感染の指標である。
【0020】
異なる実施形態では、プロテオミクスプロフィールはWesternブロット分析によって作成される。
【0021】
別の実施形態では、生体液は、ヒトの生体液であり、プロテオミクスプロフィールが以下:マクロファージキャッピングタンパク質、好中球ゼラチナーゼ関連リポカリン、ミエロペルオキシダーゼ;L−プラスチン;アズロシジン;抗菌性タンパク質FALL−39;Gp340改変タンパク質;Ebner唾液腺タンパク質ホモログ(GenBank受託番号355392);白血球エラスターゼインヒビター;カルグラヌリンA;カルグラヌリンB;コフィリン;モエシン;プロフィリンI、クロニン(cronin)様タンパク質p57;アネキシンII、フィブロネクチン;グリアから誘導されるネキシン;アンチトロンビン−III;扁平上皮細胞癌腫抗原1、扁平上皮細胞癌腫抗原2;セルピン12;シスタチンA;シスタチンB;シスタチンC;IGFBP−1;ビタミンD−結合タンパク質;アポリポタンパク質A−I;14−3−3タンパク質シグマ;14−3−3タンパク質ゼータ/デルタ;ゲルゾリン;ラクトトランスフェリン;ホスホグリセレートキナーゼ1;ホスホグリセレートムターゼ1;及びトランスケトラーゼ;又はそれらのフラグメント、前駆体、又は天然に生じる改変体からなる群から選択される1つ以上のタンパク質の発現情報を含む。
【0022】
さらなる実施形態では、プロテオミクスプロフィールは、マクロファージキャッピングタンパク質;好中球ゼラチナーゼ関連リポカリン;ミエロペルオキシダーゼ;L−プラスチン;アズロシジン;抗菌性タンパク質FALL−39;白血球エラスターゼインヒビター;カルグラヌリンA;カルグラヌリンB;プロフィリンI、グリアから誘導されるネキシン;セルピン12;シスタチンA;及びIGFBP−1;又はそれらのフラグメント、前駆体、又は天然に生じる改変体からなる群から選択される1つ以上のタンパク質の情報を含む。
【0023】
上述の方法は、限定されないが、羊膜内感染、臓器系、筋骨格奇形の不全を含む発育不全、及び染色体異数性から生じる状態、例えば、ダウン症候群、トリソミー−13、トリソミー−18、ターナー症候群、又はクラインフェルター症候群を含む、種々の胎児及び母体の状態の診断のために好適である。
【0024】
試験サンプルのプロテオミクスプロフィールが本質的に正常サンプルのプロテオミクスプロフィールと同じである場合、被検体は上記の母体又は胎児の状態を有していないと決定される。
【0025】
上記プロテオミクスプロフィールが疾患サンプルと本質的に同じ固有の発現サインを含有する場合、患者は対応する母体又は胎児の状態と診断される。
【0026】
別の局面では、本発明は、羊膜内感染を診断するための方法であって、
(a)妊娠したメスの哺乳動物から得られる生体液の試験サンプルのプロテオミクスプロフィールと正常サンプルのプロテオミクスプロフィール又は参照プロテオミクスプロフィールとを比較する工程であって、上記プロテオミクスプロフィールが上記サンプル中に存在するタンパク質又はそれらのタンパク分解性のフラグメントの量の情報を与える、工程;及び
(b)上記試験サンプルのプロテオミクスプロフィールが3〜5kDa及び/又は10〜12kDa分子量範囲で固有の発現サインを示す場合、上記哺乳動物を羊膜内感染であると診断する工程を含む方法に関する。
【0027】
さらなる局面では、本発明は、羊膜内感染を診断するための方法であって、
(a)妊娠したメスの哺乳動物から得られる生体液の試験サンプルのプロテオミクスプロフィールと正常サンプルのプロテオミクスプロフィールとを比較する工程;及び
(b)IGFB−1、プロフィリン、セルロプラスミン、及びL−プラスチン、カルグラヌリン、又はそれらのフラグメント、前駆体、又は天然に生じる改変体からなる群から選択される少なくとも1つのタンパク質が上記正常サンプルと比較して上記試験サンプルにおいて異なって発現される場合に上記哺乳動物を羊膜内感染であると診断する工程を含む、方法に関する。
【0028】
特定の実施形態では、IGFBP−1、プロフィリン、セルロプラスミン、及びカルグラヌリン、又はそれらのフラグメント、前駆体、又は天然に生じる改変体のうち少なくとも1つが、正常サンプルと比較して試験サンプルにおいて過剰発現する。
【0029】
別の実施形態では、L−プラスチンが、正常サンプルと比較して試験サンプルにおいて過剰発現する。
【0030】
なお別の実施形態では、IGFBP−1の存在が図12に示されるタンパク分解性のフラグメント又はそれらのフラグメントを同定することによって検出される。
【0031】
別の局面では、本発明は、染色体異数性を診断するための方法であって、
(a)妊娠したメスの哺乳動物から得られる生体液の試験サンプルのプロテオミクスプロフィールと正常サンプルのプロテオミクスプロフィール又は参照プロテオミクスプロフィールとを比較する工程であって、上記プロテオミクスプロフィールが上記サンプル中に存在するタンパク質又はそれらのタンパク分解性のフラグメントの量の情報を与える、工程;及び
(b)上記試験サンプルのプロテオミクスプロフィールが4〜15kDa分子量範囲で固有の発現サインを示す場合、上記哺乳動物を染色体異数性であると診断する工程を含む方法に関する。
【0032】
異なる局面では、本発明は、胎児の発育不全を診断するための方法であって、
(a)妊娠したメスの哺乳動物から得られる生体液の試験サンプルのプロテオミクスプロフィールと正常サンプルのプロテオミクスプロフィール又は参照プロテオミクスプロフィールとを比較する工程;及び
(b)少なくとも1つのアクチン調整タンパク質、又はそれらのフラグメント、前駆体、又は天然に生じる改変体が前記正常サンプルと比較して上記試験サンプルにおいて異なって発現する場合、上記発育不全の存在を確認する工程を含む方法に関する。
【0033】
本方法の特定の実施形態では、アクチン調整タンパク質は、モエシン、p57、ゲルゾリン、及び14−3−3タンパク質からなる群から選択される。
【0034】
さらなる局面では、本発明は、母体又は胎児の感染又は免疫応答に関連する障害を診断するための方法であって、
(a)妊娠したメスの哺乳動物から得られる生体液の試験サンプルのプロテオミクスプロフィールと正常サンプルのプロテオミクスプロフィール又は参照プロテオミクスプロフィールとを比較する工程;及び
(b)マクロファージキャッピングタンパク質(MCP)、白血球エラスターゼ、好中球ゼラチナーゼ関連リポカルシン(lipcalcin)(NGAL)、ミエロペルオキシダーゼ、L−プラスチン、カルグラヌリン(calgranulin)、FALL−39、アジロシジン(azyrocidin)(CAPS7)、プロテアーゼ及びプロテアーゼインヒビターからなる群から選択される少なくとも1つのタンパク質が上記正常サンプルと比較して上記試験サンプルにおいて異なって発現する場合、上記母体又は胎児の感染又は免疫応答に関連する障害を確認する工程を含む方法に関する。
【0035】
なおさらなる局面では、本発明は、妊娠したメス哺乳動物から得られる生体液のプロテオミクスプロフィール中でGp−340の存在を検出する工程を含む、新生児セプシスを診断するための方法に関する。
【0036】
なお別の局面では、本発明は、マクロファージキャッピングタンパク質、好中球ゼラチナーゼ関連リポカリン、ミエロペルオキシダーゼ;L−プラスチン;アズロシジン;抗菌性タンパク質FALL−39;Gp340改変体タンパク質;Ebner唾液腺タンパク質ホモログ(GenBank受託番号(GenBank Accession No.)355392);白血球エラスターゼインヒビター;カルグラヌリン(calgranulin)A;カルグラヌリン(calgranulin)B;コフィリン;モエシン;プロフィリンI、クロニン(cronin)様タンパク質p57;アネキシンII、フィブロネクチン;グリアから誘導されるネキシン;アンチトロンビン−III;扁平上皮細胞癌腫抗原1、扁平上皮細胞癌腫抗原2;セルピン12;シスタチンA;シスタチンB;シスタチンC;IGFBP−1;ビタミンD−結合タンパク質;アポリポタンパク質A−I;14−3−3タンパク質シグマ;14−3−3タンパク質ゼータ/デルタ;ゲルゾリン;ラクトトランスフェリン;ホスホグリセレートキナーゼ1;ホスホグリセレートムターゼ1;及びトランスケトラーゼ;又はそれらのフラグメント、前駆体、又は天然に生じる改変体からなる群から選択される1つ以上のタンパク質情報を含む生体液のプロテオミクスプロフィールに関する。
【0037】
さなる局面では、本発明は、マクロファージキャッピングタンパク質;好中球ゼラチナーゼ関連リポカリン;ミエロペルオキシダーゼ;L−プラスチン;アズロシジン;抗菌性タンパク質FALL−39;白血球エラスターゼインヒビター;カルグラヌリン(calgranulin)A;カルグラヌリン(calgranulin)B;プロフィリンI、グリアから誘導されるネキシン;セルピン12;シスタチンA;及びIGFBP−1;又はそれらのフラグメント、前駆体、又は天然に生じる改変体からなる群から選択される1つ以上のタンパク質情報を含む生体液のプロテオミクスプロフィールに関する。
【0038】
本発明はさらに、IGFB−1,プロフィリン、セルロプラスミン、L−プラスチン、及びカルグラヌリン(calgranulin)からなる群から選択されるタンパク質の存在を確認する情報を含む、羊膜内感染に特徴的な生体液のプロテオミクスプロフィールに関する。
【0039】
別の局面では、本発明は、上記生体液中に存在するタンパク質又はそれらのフラグメントの分子量情報を提供する形態で表され、3〜5KDa及び/又は10〜12KDa分子量範囲で固有の発現サインを含む、羊膜内感染に特徴的な生体液のプロテオミクスプロフィールに関する。
【0040】
さらなる局面では、本発明は、図1A〜1Cのいずれか1つに本質的に示されるようなプロテオミクスプロフィール、又は図2A〜Cのいずれか1つに本質的に示されるようなプロテオミクスプロフィール、又は図3A〜Cのいずれか1つに本質的に示されるようなプロテオミクスプロフィール、又は図4A又は4Bのいずれか1つに本質的に示されるようなプロテオミクスプロフィール、又は図6〜10のいずれか1つに本質的に示されるようなプロテオミクスプロフィールに関する。
【0041】
特定の実施形態では、上記プロテオミクスプロフィールはマイクロアレイフォーマットにおいて分析される。
本発明はまた、以下の項目を提供する。
(項目1)
母体又は胎児の状態を決定するための方法であって、
哺乳動物被検体から得られる生体液の試験サンプルのプロテオミクスプロフィールと正常サンプルのプロテオミクスプロフィール又は上記状態に特徴的な少なくとも1つの固有の発現サインを含む参照プロテオミクスプロフィールとを比較する工程と、
上記母体又は胎児の状態を決定する工程とを含む、
方法。
(項目2)
上記哺乳動物被検体が妊娠したメスである、項目1に記載の方法。
(項目3)
上記妊娠したメスがヒトである、項目2に記載の方法。
(項目4)
上記母体の状態が、羊膜内感染、子かん前症、及び早期陣痛からなる群から選択される、項目3に記載の方法。
(項目5)
上記胎児の状態が、染色体異数性、先天性奇形、在胎齢及び成熟度からなる群から選択される、項目3に記載の方法。
(項目6)
上記生体液が、羊膜液、血清、血漿、尿、脳脊髄液、母乳、粘液、及び唾液からなる群から選択される、項目1に記載の方法。
(項目7)
上記生体液が羊膜液又は母体の血清である、項目3に記載の方法。
(項目8)
上記試験サンプルのプロテオミクスプロフィールが、少なくとも2つのタンパク質の情報を含む、項目1に記載の方法。
(項目9)
上記プロテオミクスプロフィールがマススペクトルである、項目1に記載の方法。
(項目10)
上記プロテオミクスプロフィールが、マススペクトルの3〜5kDa範囲で少なくとも1つの固有の発現サインを含む、項目9に記載の方法。
(項目11)
上記プロテオミクスプロフィールが、マススペクトルの10〜12kDa範囲で少なくとも1つの固有の発現サインを含む、項目9に記載の方法。
(項目12)
上記母体状態が羊膜内感染であり、上記固有の発現サインが上記試験サンプル中の10〜12kDa分子量範囲における余剰ピークであり、これが羊膜内感染の指標である、項目9に記載の方法。
(項目13)
上記生体液が羊膜液又は母体の血清である、項目12に記載の方法。
(項目14)
上記プロテオミクスプロフィールがWesternブロット分析によって生成される、項目1に記載の方法。
(項目15)
上記生体液がヒトの生体液であり、プロテオミクスプロフィールが以下:マクロファージキャッピングタンパク質、好中球ゼラチナーゼ関連リポカリン、ミエロペルオキシダーゼ;L−プラスチン;アズロシジン;抗菌性タンパク質FALL−39;Gp340改変タンパク質;Ebner唾液腺タンパク質ホモログ(GenBank受託番号355392);白血球エラスターゼインヒビター;カルグラヌリンA;カルグラヌリンB;コフィリン;モエシン;プロフィリンI、クロニン様タンパク質p57;アネキシンII、フィブロネクチン;グリアから誘導されるネキシン;アンチトロンビン−III;扁平上皮細胞癌腫抗原1、扁平上皮細胞癌腫抗原2;セルピン12;シスタチンA;シスタチンB;シスタチンC;IGFBP−1;ビタミンD−結合タンパク質;アポリポタンパク質A−I;14−3−3タンパク質シグマ;14−3−3タンパク質ゼータ/デルタ;ゲルゾリン;ラクトトランスフェリン;ホスホグリセレートキナーゼ1;ホスホグリセレートムターゼ1;及びトランスケトラーゼ;又はそれらのフラグメント、前駆体、又は天然に生じる改変体からなる群から選択される1つ以上のタンパク質の発現情報を含む、項目1に記載の方法。
(項目16)
上記プロテオミクスプロフィールが上記タンパク質の2つ以上の発現情報を含む、項目15に記載の方法。
(項目17)
上記プロテオミクスプロフィールが上記タンパク質の全ての発現情報を含む、項目15に記載の方法。
(項目18)
上記生体液が羊膜液である、項目15に記載の方法。
(項目19)
上記プロテオミクスプロフィールが正常サンプルのプロテオミクスプロフィールである、項目15に記載の方法。
(項目20)
上記プロテオミクスプロフィールが上記試験サンプル又は参照サンプルのプロテオミクスプロフィールである、項目15に記載の方法。
(項目21)
上記タンパク質の1つ以上が、上記正常サンプルと比較して上記試験サンプルにおいて異なって発現される、項目15に記載の方法。
(項目22)
上記プロテオミクスプロフィールが以下:マクロファージキャッピングタンパク質;好中球ゼラチナーゼ関連リポカリン;ミエロペルオキシダーゼ;L−プラスチン;アズロシジン;抗菌性タンパク質FALL−39;白血球エラスターゼインヒビター;カルグラヌリンA;カルグラヌリンB;プロフィリンI,グリアから誘導されるネキシン;セルピン12;シスタチンA;及びIGFBP−1;又はそれらのフラグメント、前駆体、又は天然に生じる改変体からなる群から選択される1つ以上のタンパク質の発現情報を含む、項目21に記載の方法。
(項目23)
上記プロテオミクスプロフィールが上記タンパク質の2つ以上の発現情報を含む、項目22に記載の方法。
(項目24)
上記プロテオミクスプロフィールが上記タンパク質の全ての発現情報を含む、項目22に記載の方法。
(項目25)
上記被検体が羊膜感染と診断される、項目22に記載の方法。
(項目26)
上記患者が発育不全であると診断される、項目22に記載の方法。
(項目27)
上記発育不全が臓器系の発育における不全である、項目26に記載の方法。
(項目28)
上記臓器系が中枢神経系又は心臓血管系である、項目27に記載の方法。
(項目29)
上記発育不全が筋骨格の奇形である、項目28に記載の方法。
(項目30)
上記発育不全が染色体の異数性から生じる、項目28に記載の方法。
(項目31)
上記試験サンプルのプロテオミクスプロフィールが上記正常サンプルのプロテオミクスプロフィールと本質的に同じであり、上記被検体が上記母体又は胎児の状態を有さないと決定される、項目22に記載の方法。
(項目32)
上記プロテオミクスプロフィールが、表3及び4に列挙されるタンパク質からなる群から選択される1つ以上のタンパク質の発現情報を含む、項目22に記載の方法。
(項目33)
上記プロテオミクスプロフィールが、上記参照サンプルと同じ固有の発現サインを含む、項目22に記載の方法。
(項目34)
上記固有の発現サインが羊膜内感染に特徴的である、項目32に記載の方法。
(項目35)
上記被検体が羊膜内感染であると診断される、項目34に記載の方法。
(項目36)
羊膜内感染を診断するための方法であって、
(a)妊娠したメスの哺乳動物から得られる生体液の試験サンプルのプロテオミクスプロフィールと、正常サンプルのプロテオミクスプロフィール又は参照プロテオミクスプロフィールとを比較する工程であって、上記プロテオミクスプロフィールが上記サンプル中に存在するタンパク質又はそれらのタンパク分解性のフラグメントの量の情報を与える、工程;及び
(b)上記試験サンプルのプロテオミクスプロフィールが3〜5KDa及び/又は10〜12KDa分子量範囲で固有の発現サインを示す場合、上記哺乳動物を羊膜内感染であると診断する工程
を含む方法。
(項目37)
上記プロテオミクスプロフィールがマススペクトルの形態で表される、項目36に記載の方法。
(項目38)
上記哺乳動物が霊長類である、項目37に記載の方法。
(項目39)
上記霊長類がヒトである、項目38に記載の方法。
(項目40)
上記羊膜内感染の推移を監視する工程をさらに含む、項目39に記載の方法。
(項目41)
上記生体液が羊膜液又は母体の血清である、項目39に記載の方法。
(項目42)
羊膜内感染を診断するための方法であって、
(a)妊娠したメスの哺乳動物から得られる生体液の試験サンプルのプロテオミクスプロフィールと、正常サンプルのプロテオミクスプロフィールとを比較する工程;及び
(b)IGFB−1、カルグラヌリン、アズロシジン、プロフィリン、セルロプラスミン、及びL−プラスチン、又はそれらのフラグメント、前駆体、又は天然に生じる改変体からなる群から選択される少なくとも1つのタンパク質が上記正常サンプルと比較して上記試験サンプルにおいて異なって発現される場合に上記哺乳動物を羊膜内感染であると診断する工程
を含む、方法。
(項目43)
上記哺乳動物が霊長類である、項目42に記載の方法。
(項目44)
上記霊長類がヒトである、項目43に記載の方法。
(項目45)
上記生体液が羊膜液又は母体の血清である、項目44に記載の方法。
(項目46)
IGFBP−1、カルグラヌリン、アズロシジン、プロフィリン、及びセルロプラスミン、又はそれらのフラグメント、前駆体、又は天然に生じる改変体の少なくとも1つが上記正常サンプルと比較して上記試験サンプルにおいて過剰発現する、項目42に記載の方法。
(項目47)
L−プラスチンが上記正常サンプルと比較して上記試験サンプルにおいて過剰発現する、項目42に記載の方法。
(項目48)
IGFBP−1の存在が図12に示されるタンパク分解性のフラグメント又はそれらのフラグメントを同定することによって検出される、項目46に記載の方法。
(項目49)
上記羊膜内感染の状況を監視する工程をさらに含む、項目48に記載の方法。
(項目50)
染色体異数性を診断するための方法であって、
(a)妊娠したメスの哺乳動物から得られる生体液の試験サンプルのプロテオミクスプロフィールと、正常サンプルのプロテオミクスプロフィール又は参照プロテオミクスプロフィールとを比較する工程であって、上記プロテオミクスプロフィールが上記サンプル中に存在するタンパク質又はそれらのタンパク分解性のフラグメントの量の情報を与える、工程;及び
(b)上記試験サンプルのプロテオミクスプロフィールが4〜15KDa分子量範囲で固有の発現サインを示す場合、上記哺乳動物を染色体異数性であると診断する工程
を含む方法。
(項目51)
上記染色体異数性がダウン症候群である、項目50に記載の方法。
(項目52)
胎児の発育不全を診断するための方法であって、
(a)妊娠したメスの哺乳動物から得られる生体液の試験サンプルのプロテオミクスプロフィールと、正常サンプルのプロテオミクスプロフィール又は参照プロテオミクスプロフィールとを比較する工程;及び
(b)少なくとも1つのアクチン調整タンパク質、又はそれらのフラグメント、前駆体、又は天然に生じる改変体が上記正常サンプルと比較して上記試験サンプルにおいて異なって発現する場合、上記発育不全の存在を確認する工程
を含む方法。
(項目53)
上記アクチン調整タンパク質がモエシン、p57、ゲルソリン、及び14−3−3タンパク質からなる群から選択される、項目52に記載の方法。
(項目54)
母体又は胎児の感染又は免疫応答に関連する障害を診断するための方法であって、
(a)妊娠したメスの哺乳動物から得られる生体液の試験サンプルのプロテオミクスプロフィールと、正常サンプルのプロテオミクスプロフィール又は参照プロテオミクスプロフィールとを比較する工程;及び
(b)マクロファージキャッピングタンパク質(MCP)、白血球エラスターゼ、好中球ゼラチナーゼ関連リポカルシン(lipcalcin)(NGAL)、ミエロペルオキシダーゼ、L−プラスチン、カルグラヌリン、FALL−39、アジロシジン(azyrocidin)(CAP37)、プロテアーゼ及びプロテアーゼインヒビターからなる群から選択される少なくとも1つのタンパク質が上記正常サンプルと比較して上記試験サンプルにおいて異なって発現する場合、上記母体又は胎児の感染又は免疫応答に関連する障害の存在を確認する工程
を含む方法。
(項目55)
新生児セプシスを診断するための方法であって、妊娠したメス哺乳動物から得られる生体液のプロテオミクスプロフィールにおいてGp−340の存在を検出する工程を含む方法。
(項目56)
マクロファージキャッピングタンパク質、好中球ゼラチナーゼ関連リポカリン、ミエロペルオキシダーゼ;L−プラスチン;アズロシジン;抗菌性タンパク質FALL−39;Gp340改変体タンパク質;Ebner唾液腺タンパク質ホモログ(GenBank受託番号355392);白血球エラスターゼインヒビター;カルグラヌリンA;カルグラヌリンB;コフィリン;モエシン;プロフィリンI、クロニン様タンパク質p57;アネキシンII、フィブロネクチン;グリアから誘導されるネキシン;アンチトロンビン−III;扁平上皮細胞癌腫抗原1、扁平上皮細胞癌腫抗原2;セルピン12;シスタチンA;シスタチンB;シスタチンC;IGFBP−1;ビタミンD−結合タンパク質;アポリポタンパク質A−I;14−3−3タンパク質シグマ;14−3−3タンパク質ゼータ/デルタ;ゲルゾリン;ラクトトランスフェリン;ホスホグリセレートキナーゼ1;ホスホグリセレートムターゼ1;及びトランスケトラーゼ;又はそれらのフラグメント、前駆体、又は天然に生じる改変体からなる群から選択される1つ以上のタンパク質の発現情報を含む、生体液のプロテオミクスプロフィール。
(項目57)
マクロファージキャッピングタンパク質;好中球ゼラチナーゼ関連リポカリン;ミエロペルオキシダーゼ;L−プラスチン;アズロシジン;抗菌性タンパク質FALL−39;白血球エラスターゼインヒビター;カルグラヌリンA;カルグラヌリンB;プロフィリンI、グリアから誘導されるネキシン;セルピン12;シスタチンA;及びIGFBP−1;又はそれらのフラグメント、前駆体、又は天然に生じる改変体からなる群から選択される1つ以上のタンパク質の発現情報を含む、生体液のプロテオミクスプロフィール。
(項目58)
表3及び4に列挙されるタンパク質からなる群から選択される1つ以上のタンパク質の情報を含む、生体サンプルのプロテオミクスプロフィール。
(項目59)
上記1つ以上のタンパク質、又はそれらのフラグメント、前駆体、又は天然に生じる改変体の存在を確認する、項目56〜58のいずれか1項に記載のプロテオミクスプロフィール。
(項目60)
IGFB−1,プロフィリン、セルロプラスミン、L−プラスチン、及びカルグラヌリンからなる群から選択されるタンパク質の存在を確認する情報を含む、羊膜内感染に特徴的な生体液のプロテオミクスプロフィール。
(項目61)
上記生体液中に存在するタンパク質又はそれらのタンパク質分解性フラグメントの分子量の情報を提供する形態で表され、3〜5KDa及び/又は10〜12KDa分子量範囲で固有の発現サインを含む、羊膜内感染に特徴的な生体液のプロテオミクスプロフィール。
(項目62)
マススペクトルとして表される、項目60に記載のプロテオミクスプロフィール。
(項目63)
上記生体液が羊膜液又は母体血清である、項目61に記載のプロテオミクスプロフィール。
(項目64)
図1A〜1Cのいずれか1つに本質的に示されるようなプロテオミクスプロフィール。
(項目65)
図2A〜Cのいずれか1つに本質的に示されるようなプロテオミクスプロフィール。
(項目66)
図3A〜Cのいずれか1つに本質的に示されるようなプロテオミクスプロフィール。
(項目67)
図4A又は4Bに本質的に示されるようなプロテオミクスプロフィール。
(項目68)
図6〜10のいずれか1つに本質的に示されるようなプロテオミクスプロフィール。
(項目69)
マイクロアレイフォーマットにおいて分析される、項目63〜67のいずれか1項に記載のプロテオミクスプロフィール。
(項目70)
固体支持体上に固定された表2〜4に列挙されるタンパク質から選択される1つ以上のタンパク質を含む、タンパク質アレイ。
(項目71)
固体支持体上に固定された表2〜4に列挙される1つ以上のタンパク質に特異的に結合する抗体を含む、抗体アレイ。
【図面の簡単な説明】
【0042】
【図1A】図1A。霊長類の羊水中の感染を誘発する示差タンパク質の発現。化学的に定義されたNormal Phaseチップアレイに結合する羊水抽出物のSELDI−TOF分析。(A)ピーク強度において差異を示す235レーザー強度で集められた全スペクトル。
【図1B】図1B。霊長類の羊水中の感染を誘発する示差タンパク質の発現。化学的に定義されたNormal Phaseチップアレイに結合する羊水抽出物のSELDI−TOF分析。(B)コントロールと感染したものとの間で約10〜12KDaにおける差異を示す詳細なスペクトル。
【図1C】図1C。霊長類の羊水中の感染を誘発する示差タンパク質の発現。化学的に定義されたNormal Phaseチップアレイに結合する羊水抽出物のSELDI−TOF分析。(C)コントロールと感染したものとの間で約3〜5KDaにおける差異を示す詳細なスペクトル。実線は、診断試験を開発するために使用される、発現(固有の発現サイン)において有意な差を示すために使用された。
【図2】図2A〜C。感染に応答する霊長類羊水の時間推移分析(GBS)。以下に記載されるように、バクテリアの接種前で感染後に羊水を集め、SELDI−TOF分析を行った。図2A:感染前;2B:感染12時間後;2C:感染36時間後。
【図3A】図3A。ヒト羊水において感染を誘発する示差タンパク質発現。化学的に定義されたNormal Phaseチップアレイに結合する羊水抽出物のSELDI−TOF分析。(A)ピーク強度において差異を示す235レーザー強度で集められた全スペクトル。
【図3B】図3B。ヒト羊水において感染を誘発する示差タンパク質発現。化学的に定義されたNormal Phaseチップアレイに結合する羊水抽出物のSELDI−TOF分析。(B)コントロールと感染したものとの間で約10〜12KDaにおける差異を示す詳細なスペクトル。
【図3C】図3C。ヒト羊水において感染を誘発する示差タンパク質発現。化学的に定義されたNormal Phaseチップアレイに結合する羊水抽出物のSELDI−TOF分析。(C)コントロールと感染したものとの間で約3〜5KDaにおける差異を示す詳細なスペクトル。
【図4A】図4A。ヒト由来の羊水を用いた遺伝子MALDI−TOF質量分析計で達成されるマススペクトル。(A)コントロール、子宮内感染なし。
【図4B】図4B。ヒト由来の羊水を用いた遺伝子MALDI−TOF質量分析計で達成されるマススペクトル。(B)サンプル、子宮内感染あり。
【図5】図5。SDS−PAGE Coomassie Blue染色されたゲル。(A)プールされた4つのヒトコントロールAFサンプル;(B)個々のコントロールAFサンプル;(C)プールされた4つのヒトの感染AFサンプル;(D)個々の感染したAFサンプル。
【図6】図6。ヒト羊水中の示差タンパク質発現の検出。(A)コントロールAFサンプル(プールされた);(B)感染したAFサンプル(プールされた)。
【図7】図7。ヒト羊水中の示差タンパク質発現の検出。(A)コントロールAFサンプル(プールされた;(B)感染したAFサンプル(プールされた)。
【図8】図8は、ヒト羊水及び母体血清中の示差タンパク質発現の検出を示す。(A)コントロールサンプル(プールされた);(B)感染したサンプル(プールされた)。
【図9】図9は、タンパク質アレイを用いた、母体血清中で示差発現されたタンパク質の検出を示す。(1)対応するタンパク質とそれらの抗体との結合を示すタンパク質アレイの擬似色画像;(2)アレイの拡大された領域;(3)カルグラヌリン(calgranulin)IPのWesternブロット。
【図10】図10は、トリソミーを識別するための固有のプロフィールを用いた、母体血清中の示差タンパク質発現パターンを示す。
【図11】図ll。羊水タンパク質PRO1_ヒト(P07737)プロフィリンI(SEQ ID NO:5〜11)のタンパク質のデノボ配列同定の概要図。
【図12】図12。IGFBP−1 デノボタンパク質同定及びタンパク分解性のフラグメント配列(SEQ ID NO:1)。Ms/MSを用いたサンプル0426se_Hl_12及び0425se_Hl_13中に見いだされるペプチド配列が下側の枠内に示される(SEQ ID NO:2及び3)。これらは、トリプシン染色した1−Dゲルバンドで試験し、MS/MS分析にかけた場合、感染した羊水から得られた。1−Dゲル中で検出したIGF−BP−1のタンパク分解性のフラグメント(低分子量範囲、図5)、感染した羊水由来のトリプシン消化した約10.5〜12KDaバンドのWesternブロット(図6)及びMS/MS分析(図13)を下線を引いた配列の領域中に表す(SEQ ID NO:4)。
【図13】図13。感染した羊水由来の10.5〜11kD 1Dゲルバンドのトリプシン消化物のLCQ−MSプロフィール。親イオンを示すLCQ−MSはサンプル中に存在する潜在的なタンパク質を表す。
【図14】図14。図13に示される保持時間17.55〜18.21分のピークについてのマススペクトル。
【図15】図15。図14に示される434.9ピークの親イオンについてのMS/MSスペクトル。
【図16】図16。IAIに対するバイオマーカーの免疫検出。(16a)霊長類コントロール(−)及び感染した(+)AF。(16b)ヒトコントロール(−)及び感染した(+)AF。(16c)ヒトコントロール(−)及び感染した(+)AF。ビタミンD結合タンパク質(VDBP)制御されていないコントロールマーカー。IGFBP−1バンドはインタクトなタンパク質(約30kDa)及びタンパク分解性のフラグメント(約11kDa)を表す。(16d)免疫沈降物由来のプールされた母体血清中のIGFBP1の検出。コントロール(−)及び感染した(+)血清。(16e)免疫沈降物由来のプールされた母体血清中のカルグラヌリン(calgranulin)Bの検出。コントロール(−)及び感染した(+)血清。
【発明を実施するための形態】
【0043】
(好ましい実施形態の詳細な記載)
A.定義
他に定義されない限り、本明細書中で使用される技術用語及び科学用語は、本発明が属する分野の当業者によって通常理解される意味と同じ意味を有する。Singleton et al.,Dictionary of Microbiology and Molecular Biology 2nd ed.,J.Wiley & Sons(New York,NY 1994)は、本出願中で使用される用語の多くに対する一般的なガイドを当業者に提供する。
【0044】
用語「プロテオーム」は、所与の時間で生物学的サンプル中のタンパク質の有意な部分を記載するために本明細書中で使用される。プロテオームの概念は、ゲノムとは基本的に異なる。ゲノムは事実上静的であるが、プロテオームは内部事象及び外部事象に応答して連続的に変化する。
【0045】
用語「プロテオミクスプロフィール」は、生物学的サンプル中、例えば、所与の時間での生体液中の複数のタンパク質の発現パターンの代表例を示すために本明細書中で使用される。プロテオミクスプロフィールは、例えば、マススペクトルとして表すことができるが、タンパク質の物理化学的性質又は生化学的性質のいずれかに基づく他の代表例も含まれる。従って、プロテオミクスプロフィールは、例えば、二次元ゲル電気泳動、例えば、2−D PAGEによって決定されるようなタンパク質の電気泳動性における差に基づいてもよく、例えば、二次元電気泳動ゲル中の複数のスポットとして表すことができる。示差発現プロフィールは、特定の同定されたタンパク質の非存在下でさえ、重要な診断値を有してもよい。次いで、例えば、イムノブロッティングによって単一のタンパク質スポットを検出することができ、タンパク質マイクロアレイを用いた複数のスポット又はタンパク質を検出することができる。プロテオミクスプロフィールは、典型的には、いくつかのピークから50以上のピークを表す複雑なプロフィールまでの範囲にある情報を表すか又は含有する。従って、例えば、プロテオミクスプロフィールは、少なくとも2、又は少なくとも5、又は少なくとも10、又は少なくとも15、又は少なくとも20、又は少なくとも25、又は少なくとも30、又は少なくとも35、又は少なくとも40、又は少なくとも45、又は少なくとも50タンパク質を含有するか又は表してもよい。
【0046】
用語「病的な状態」は、最も広い意味において使用され、被検体の健康を危うくする全ての変化及び現象をカバーする。病的な母体の状態とは、限定されないが、羊膜内感染、胎児又は母体起源の状態、例えば、子かん前症、及び早期分娩及び早期分娩が挙げられる。病的な胎児の状態とは、限定されないが、染色体不全(異数性)、例えば、ダウン症候群、及び在胎齢及び胎児の成熟度における全ての異常が挙げられる。
【0047】
用語「病的な[母体又は胎児]状態の状況」は、最も広い意味において使用され、病的な状態の非存在、存在、程度、段階、性質、成長又は抑制を指す。
【0048】
用語「固有の発現サイン」は、統計学的に有意な様式で、対応する正常な生物学的サンプル(同じ種類の起源、例えば生体液から得られる)とは異なる生物学的サンプル(例えば、参照サンプル)のプロテオミクスプロフィール内の固有の特徴又はモチーフを記載するために使用される。
【0049】
用語「羊膜内感染(IAI)」、「羊水感染」、「羊膜炎」及び「臨床的絨毛羊膜炎は、相互に交換可能に使用され、妊娠中の羊水及び子宮内成分の細菌に限定されないものを含む、急性感染を指す。
【0050】
「患者応答」は、限定されないが、(1)病的な状態の、少なくともある程度までの阻害、(2)病的な状態の予防、(3)病的な状態に関連する1つ以上の症状の、少なくともある程度までの軽減;(4)処置後の生存時間の増加;及び/又は(5)処置後の所与の時間点での死亡率の減少を含む、患者に対する利益を示す任意の終点を用いて評価することができる。
【0051】
用語「処置」は、治療的処置及び予防又は防止測定を指し、この目的は、標的とされる病的な状態又は障害を防ぐか又は遅らせる(減らす)ことである。処置を必要とするものとしては、障害を既に有しているもの、及び障害を有すると考えられるもの又は障害を防ぐと思われるものが挙げられる。
【0052】
「先天性奇形」は、遺伝性ではないが出世時に存在する異常である。
【0053】
B.詳細な記載
本発明は、母体又は胎児の生体液のプロテオミクスプロフィールに基づく、母体及び胎児の状態の初期の、信頼性のある非侵襲試験のための方法及び手段に関する。本発明は、例えば、以下の文献に記載されるような当該技術において公知のプロテオミクス技術を利用する(これらの内容は参考としてここに組み込まれる):Proteome Research: New Frontiers in Functional Genomics(Principles and Practice).M.R.Wilkins et al., eds.,Springer Verlag,1007;2−D Proteome Analysis Protocols,Andrew L Link,editor, Humana Press,1999;Proteome Research:Two−Dimensional Gel Electrophoresis and Identification Methods(Principles and Practice),T.Rabilloud editor,Springer Verlag,2000;Proteome Research:Mass Spectrometry(Principles and Practice).P.James editor,Springer Verlag,2001;Introduction to Ploteomics.D.C.Liebler editor,Humana Press,2002;Ploteomics in Practice:A Laboratory Manual of Ploteome Analysis.R.Westermeier et al., eds.,John Wiley & Sons,2002。
【0054】
当業者は、本発明の実施において使用することが可能な、本明細書中に記載されるものと類似又は等価の多くの方法及び物質を認識する。実際に、本発明は、いかなる様式でも記載される方法及び物質に限定されない。
【0055】
1.生体液中で発現するタンパク質及びポリペプチドの同定
本発明によれば、生体液のプロテオミクス分析は、当該技術分野で公知の種々の方法を用いて行うことができる。
【0056】
典型的には、異なる起源、例えば、正常な生体液(正常サンプル)及び試験生体液(試験サンプル)由来のサンプルのタンパク質パターン(プロテオームマップ)は、疾患において上方調整又は下方調整されるタンパク質を検出するために比較される。次いで、これらのタンパク質を、例えば、ペプチド−マスフィンガープリンティング及び/又は質量分析法及び配列決定方法を用いて、同定及び完全な特徴決定のために切除することができるか、又は正常及び/又は疾患特異的なプロテオームマップを目的の疾患の診断のために直接的に使用することができるか、又は疾患の存在又は非存在下を確認するために直接的に使用することができる。
【0057】
比較分析において、タンパク質の相対量を正確に表すために、及び正確な結果を得るために、正常サンプル及び試験サンプルを同じ様式で実際に処置することが重要である。全タンパク質の要求される量は、使用される分析技術に依存し、当業者によって容易に決定することができる。生物学的サンプル中に存在するタンパク質は、典型的には、それらのpI及び分子量に従って二次元ゲル電気泳動(2−DE)によって分離される。タンパク質は、等電集束法(一次元電気泳動)を用いて最初にそれらの電荷によって分離される。この工程は、例えば、市販の固定化pH−勾配(IPG)片を用いて行うことができる。二次元は通常のSDS−PAGE分析であり、集束されたIPG片をサンプルとして使用する。2−DE分離後、タンパク質は従来の染料、Coomassie Blue又は銀染色を用いて視覚化することができ、公知の技術及び装置、例えば、Bio−Rad GS800デンシトメーター及びPDQUESTソフトウェア(両方市販されている)を用いて画像化する。次いで、個々のスポットをゲルから切断し、脱色し、トリプシン消化を行う。ペプチド混合物を質量分析計(MS)によって分析することができる。又は、例えばキャピラリー高圧液体クロマトグラフィー(HPLC)によって、ペプチドを分離することができ、個々にMSによって、又はプールにおいて分析することができる。
【0058】
質量分析計は、イオン源、質量分析器、イオン検出器及びデータ取得ユニットからなる。最初に、ペプチドをイオン源中でイオン化する。次いで、イオン化されたペプチドをそれらの質量 対 電荷比に従って質量分析器中で分離し、分離したイオンを検出する。質量分析法は、特に、マトリックス支援レーザー脱離イオン化/飛行時間(MALDI−TOF)及び電子噴霧イオン化(ESI)方法の発明で、タンパク質分析に広く使用されている。例えば、MALDI−TOF及び三極又は四極−TOFを含む質量分析器、又はESIに結合したイオン捕捉質量分析器のいくつかのバージョンが存在する。従って、例えば、Q−Tof−2質量分析器は、全マススペクトル範囲にわたってイオンの同時検出を可能にする直交飛行時間分析器を利用する。さらなる詳細については、例えば、e.g.Chemusevich et al,J.Mass Spectrom.36:849−865(2001)。
【0059】
所望な場合、ペプチドフラグメント及びそれらから結果として誘導されるタンパク質のアミノ酸配列は、当該技術分野で公知の技術、例えば、質量分析法又はEdman分解の特定の改変によって決定することができる。
【0060】
2.初期及び非侵襲の診断から利益を受ける胎児−母体の状態
a.羊膜内感染
羊膜内感染(IAI)は、妊娠中の羊水及び子宮内成分の急性バクテリア感染である。予想試験は、IAIが全ての分娩の4〜10%生じることを示す(Newton,E.R.,Prihoda,T.J., and Gibbs,R.S.:Logistic regression Analysis of risk factors for intraamniotic infection.Obstet.Gynecol.73:571,1989;Soper,D.E.,Mayhall,C.G.,and Dalton,H.P.:Risk factors for intraamniotic infection:a prospective epidemicologic study。American Journal of Obstetrics and Gynecology 161:562,1989;and Lopez−Zeno,J.A.,Peaceman,A.M.,Adashek,J.A.,and Socol,M.L.:A controlled trial of a program for the active management of labor.N.Engl J.Med.326:450,1992)。IAIを記載するために使用される他の用語としては、羊水感染、羊膜炎、及び臨床的絨毛羊膜炎が挙げられる。羊膜内感染は、母体の発熱、子宮圧痛、白血球増加症、及び胎児心急搏症によって臨床的に診断され、組織学的な絨毛羊膜炎とは区別されるべきである。羊膜内感染は、母体及び新生児の罹患率の重要な原因である。羊膜内感染は、産褥期における発熱性罹患率の原因の10〜40%を占め、初期新生児セプシス及び肺炎の原因の20〜40%に関連する(Newton,E.R.:Qiorioamnionitis and intraamniotic infection.Clin.Obstet.Gynecol.36:795,1993)。母体菌血症は、IAIを患う患者の2〜6%に生じ、産褥感染の罹患率は増加する。IAIを患う患者の間で、不完全な分娩及び帝王切開による分娩のリスクが増加する。Duffらは、分娩中に進行した羊膜内感染をもつ患者の中で、不完全な分娩の発生率が75%であり、帝王切開による分娩の発生率が34%であることを報告した(Duff,P.,Sanders,R. and Gibbs,R.S.:The course of labor in term pregnancies with chorioarnnionitis.American Journal of Obstetrics and Gynecology 147:391, 1983)。羊膜内感染はさらに、特に早期新生児の間で、早期進行した新生児罹患率及び死亡率と関連する。概して、母体のIAIに対して生まれる低体重新生児の中では、周産期死亡率が3〜4倍増加する(Gibbs,R.S.,Castillo,M.A., and Rodgers,P.J.:Management of acute chorioarnnionitis.American Journal of Obstetrics and Gynecology 136:709,1980;Gilstrap,L.C.,III,Leveno,K.J.,Cox,S.M.,Bums,J.S.,Mashburn,M., and Rosenfeld,C.R.:Intrapartum treatment of acute chorioarnnionitis:impact on neonatal sepsis.Am.J.Obstet.Gynecol.159:579,1988)。呼吸困難症候群、心室内出血、及び新生児セプシスの増加も存在する。Morales,W.J.:The effect of chorioarnnionitis on the developmental outcome of preterm infants at one year。Obstetrics and Gynecology 70:183,1987)。近年、IAIは、新生児脳室周囲白質軟化症及び脳性小児麻痺に関係があるとされており;大脳白室損傷及び脳性小児麻痺のリスクは、羊膜内感染の背景において9倍高まる。Bejar,R.,Wozniak,P.,Allard,M.,Benirschke,K.,Vaucher,Y.,Coen,R.,Berry,C.,Schragg,P.,Villegas,I., and Resnik,R.:Antenatal origin of neurologic damage in newborn infants.I.Preterm infants.Am.J.Obstet.Gynecol.159:357,1988;Grether,J.K. and Nelson,K.B.:Maternal infection and cerebral palsy in infants of normal birth weight. JAMA 278:207,1997)。最後に、潜伏性IAIは、インタクトな胚膜をもつ早期分娩の女性の少なくとも10%に見出され、このことは、IAIが未熟児の、重要な潜在的に予防可能な原因であることを示唆する(Romero,R.,Avila,C.,Brekus,C.A., and Morotti,R.:The role of systemic and intrauterine infection in preterm parturition.Annuals of the New York Academy of Sciences 622:355,1991)。Newtonによってまとめられた文献は、27週よりも低い在胎齢で臨床的なAIAの発生率が41%であり、27〜37週の在胎齢で15%の発生率であり、妊娠38週以上では2%であることを示した(Newton et al.,前出)。下部生殖路(lower genital
tract)に対する既存のバクテリアはさらに、臨床的な羊膜内感染の徴候なくインタクトな胚膜をもつ早期分娩において全ての女性の10〜20%の羊水から回収され(Romero et al.,前出)、23〜24週で妊娠を終了する早期分娩の女性の67%までの羊水から回収された(Watts,D.H.,Krohn,M.A.,Hillier,S.L., and Eschenbach,D.A.:The association of occult amniotic fluid infection with gestational age and neonatal outcome among women in preterm labor。Obstet Gynecol 79:351,1992)。これらの患者のほとんどは迅速に分娩し、臨床的に明らかなIAIが多くにおいて進んでいる。これらの観察結果は、仮新構成の初期の潜伏性の子宮内感染が早期分娩に先行し、極端な早期分娩の重要な原因となる場合があるという説を支持する。
【0061】
b.子かん前症
子かん前症(タンパク尿、水腫、又はその両方を伴う母体の高血圧として定義される)は、最初のトリメスターにおいて妊娠が中断しない妊娠の7%に生じる。原因は知られていないが、妊娠可能年齢の極値の母体の糖尿病、多胎妊娠を有する妊娠、及び既に存在していた母体の腎臓疾患又は高血圧において、さらによく見られる。子かん前症は、周産期死亡率の増加と関連し、子かんを生じる場合があり、母体の発作によって特徴付けられ、母体の死亡率を高める。現在、子かん前症のための治療の主要な方法は、分娩及び硫酸マグネシウムを用いた抗痙攣薬による予防である。硫酸マグネシウム治療が出現する前には、観察された母体死亡率は20〜30%であった。しかし、迅速な診断と共に、硫酸マグネシウムを用いた抗痙攣薬、抗高血圧在による治療及び分娩により、母体の死亡率はほぼ0%にまで減った。
【0062】
不幸なことに、通常認識される症状及び徴候に基づく子かん前症の診断はしばしば困難であり、疾患の経緯において後期に生じる。しばしば、胎児の成長又は健康がおびやかされることは、子かん前症の最初の認識される症状発現である。子かん前症の実験的なマーカーとしては、タンパク尿の量、及び尿酸又はクレアチニンの血清濃度の上昇が挙げられる。初期子かん前症のための血清マーカー又は子かん前症が進行する女性を同定するマーカーは現時点で利用不可能である。近年、レプチン及び尿酸を含む予想血清マーカーが、1つの研究において、後に続く子かん前症と関連していた(Gursoy T et al., Preeclampsicia disrupts the normal physiology of leptin:Am J Perinatol.l9(6):303−10,2002)が、これらの発見を確認するためには多くの作業が必要である。子かん前症のための初期及び信頼できるマーカーの開発は、新生児及び母体のための結果を最適化するための治療及び介入を無条件で可能にする。
【0063】
c.早期分娩及び早産
早期出産は、妊娠が完結する37週の前に出生することと定義される。アメリカ合衆国での早期出生の発生率は、全ての生きた状態での出生の10〜11%であり、早期分娩の積極的な処置にもかかわらず増加している。全体として、未成熟及びその結果は、先天性奇形をもたらさない周産期の脂肪の80%の原因となり、国のヘルスケア予算に年間約50億ドルが追加される。早期出生のためのリスク因子としては、白人でないこと、年齢が若いこと、社会的なステイタスが低いこと、母体の体重が55kg未満であること、未経産であること、最初のトリメスター出血であること、多胎妊娠であることが挙げられる(Meis PJ,Michielutte R,Peters TJ et al., Factors associated with preterm birth in Cardiff,Wales:H Indicated and spontaneous preterm birth.Am J Obstet Gynecol 173:597−602,1995)
不幸なことに、自然発生的な早期出生のリスクを持つ患者の予測は一般的に期待はずれである(Creasy RK,lams JD.Preterm labor and delivery.In Maternal−Fetal Medicine.Creasy RK,Resnik R(eds.).W.B.Saunders Company,Philadelphia,PA 4th edition,1999.Page 498−531)。早期出生の最も大きなリスクをもつ集団を定義し、それによって初期介入からの潜在的な利益を得ようとする以前の試みは、リスクスコアリング指標(risk−scoring indices)、胎児フィブロネクチンの生化学的検出、頚部の長さの超音波測定、及ぶ生息地となる子宮の活性の監視を含んでいた。これらのプログラムは、高価であり、患者が初期の介入又は予防から利益を受ける程度の正確性を持って予測することができなかったということによって阻まれていた。全ては、約30%のわずかに陽性の予想値を持ち、患者の大多数が満期での分娩の「リスク保持者(at risk)」であると定義された。子宮収縮を阻害するための薬理学的処置を含む介入は有効であるが、早期分娩の初期の信頼できる診断に依存する。それ故に、早期出生の最も大きなリスクを持つ患者を同定するための初期の信頼できるマーカーは、早期出生に関連する莫大なコスト及び新生児死亡率及び罹患率を減らすために必要である。
【0064】
d.染色体異数性
染色体異常は、周産期罹患率及び死亡率の頻度の高い原因である。染色体異常は、200人の生児出生あたり1の発生率で生じる。これらの異常の主な原因は染色体異数性であり、染色体の異常の多くは親からの遺伝である。最も頻繁な染色体異数性の1つはトリソミー−21(ダウン症候群)であり、800人の生児出生あたり1の発生率を有する(Hook EB,Hamerton JL:The frequency of chromosome abnormalities detected in consecutive newborn studies:Differences between
studies:Results by sex and by severity of phenotypic involvement.In Hook EB,Porter IH(eds.):Population Cytogenetics, pp 63−79.New York,Academic Press,1978)。トリソミー−21の一次リスク因子は、母体の年齢が35歳を超えていることであるが、トリソミー−21をもつ子供の80%は、35歳より若い女性から生まれている。他の一般的な異数体状態としてはトリソミー13及び18、ターナー症候群及びクラインフェルター症候群が挙げられる。
【0065】
トリソミー−21をもつ子供の80%が35歳より若い女性から生まれているため、母体年齢のみに基づいて設計されている出生前診断スクリーニングプログラムでは不十分である。それ故に、出生前スクリーニングプログラムは、胎児染色体異数性と関連する母体血清スクリーニング、超音波又はそれら両方の組み合わせと組み合わせられている。広く利用されている候補血清マーカーとしては、α−フェトタンパク質(AFP)、未接合エストリオール、ヒトコリオゴナドトロフィック(choriogonadotrophic)ホルモン(hHCG)、及びインヒビン−Aが挙げられる。しかし、スクリーニングの陽性率2〜5%で、トリソミー−21及び他の異数性の検出率は期待はずれであり、検出率は70〜86%である(Cuckle H.Biochemical screening for Down syndrome.Eur J Obstet Gynecol Reprod Biol.92(1):97−101,2000)。さらに、試験の真の陽性率、すなわち、スクリーニング陽性試験の中でのこれらの中のトリソミー−21の率はわずか1〜2%であり、98%を超えて最終的な陽性率は誤りを生じている。
【0066】
染色体異数性の確定的な診断の後、母体血清スクリーニング及び超音波は、ミッド−トリメスター遺伝子羊膜穿刺を必要とする。これは、妊娠を中断させるリスクの0.5%に関連する侵襲手順である。さらに、羊水細胞の染色体分析は、労働集約的であり、2週間までかかる時間のかかる手順である。それ故に、母体の血清から染色体異数性の検出を向上させ、母体スクリーニングの受け入れられないほど誤って高い陽性率を減らし、羊膜穿刺後の羊水からの診断の速度及び効率を高めるために、信頼性の高い試験が必要とされている。
【0067】
3.生体液のプロテオミクスプロフィールを用いた母体/胎児の状態の診断
本発明は、生体液、例えば、羊水、血清、血漿、尿、能脊髄液、母乳、粘液、又は唾液のプロテオミクスプロフィールによって上述及び他の類似の母体/胎児の状態を診断するための、初期及び信頼できる、非侵襲方法を提供する。
【0068】
上に注記されたように、本発明の本文において、用語「プロテオミクスプロフィール」は、生物学的サンプル中、例えば、所与の時間での生体液中の複数のタンパク質の発現パターンの代表例を示すために使用される。プロテオミクスプロフィールは、例えば、マススペクトルとして表すことができるが、タンパク質の物理化学的性質又は生化学的性質のいずれかに基づく他の代表例も含まれる。生体液のプロテオーム中に存在するタンパク質の全て又はいくつかを同定し、配列決定することが可能であるが、このことは本発明に従って作成されるプロテオミクスプロフィールの診断使用には必要ではない。特定の疾患の診断は、診断される疾患又は病的な状態が存在する場合に、正常なプロテオミクスプロフィールと同じ状況下で得られた生体液のプロテオミクスプロフィールとの特徴的な差異(固有の発現サイン)に基づくことができる。固有の発現サインは、統計学的に有意な様式で、同じ種類の供給源から得られる対応する正常な生物学的サンプルのプロテオミクスプロフィールとは異なる、試験又は参照生物学的サンプルのプロテオミクスプロフィール内の任意の固有の特徴又はモチーフであることができる。例えば、プロテオミクスプロフィールがマススペクトルの形態で存在する場合、固有の発現サインは、典型的には、対応する正常サンプルのマススペクトルとは定性的又は定量的に異なるピーク又はピークの組み合わせである。従って、マススペクトルにおいて新たなピーク又は新たなピークの組み合わせの出現、又はマススペクトルにおいて既存のピーク又は既存のピークの組み合わせの振幅又は形状における任意の統計学的に有意な変化を、固有の発現サインであるとみなすことができる。哺乳動物被検体から得られた試験サンプルのプロテオミクスプロフィールは、病的な母体又は胎児の状態に特徴的な固有の発現サインを含む参照サンプルのプロテオミクスプロフィールと比較され、参照サンプルと共通の固有の発現サインを有している場合、哺乳動物被検体はこのような病的な状態であると診断される。
【0069】
特定の病的な母体/胎児の状態は、診断される被検体から得られる生体液のプロテオミクスプロフィールと、同じ様式で得て、診断された同じ種類の正常な生体液のプロテオミクスプロフィールとを比較することによって診断することができる。試験サンプルのプロテオミクスプロフィールが正常サンプルのプロテオミクスプロフィールと本質的に同じである場合、被検体は、被検体の病的な母体/胎児の状態を有していないとみなされる。試験サンプルのプロテオミクスプロフィールが正常サンプルのプロテオミクスプロフィールと比較して固有の発現サインを示す場合、被検体は、問題となる母体/胎児の状態と診断される。
【0070】
それに代えて又はそれに加えて、試験サンプルのプロテオミクスプロフィールは、問題となる病的な母体/胎児の状態と独立して診断された被検体の生体液から得られた参照サンプルのプロテオミクスプロフィールと比較されてもよい。この場合には、被検体は、試験サンプルのプロテオミクスプロフィールと参照サンプルのプロテオミクスプロフィールとが、固有の発現サインを表す少なくとも1つの特徴又は特徴の組み合わせを共通して持っている場合、病的な状態と診断される。
【0071】
本発明の方法では、正常な生物学的サンプルのプロテオミクスプロフィールは診断において重要な役割を果たす。上に議論されたように、試験サンプルのプロテオミクスプロフィールが正常な生物学的サンプルのプロテオミクスプロフィールと本質的に同じである場合、患者は、同定される病的な母体/胎児の状態を有していないと診断される。患者が、潜在的に副作用があり得るか、又はそうでなくても患者、胎児又は新生児を危険な状態に置き得る、不必要な処置又は介入を受ける必要性を排除するため、この「陰性」診断は、非常に重要性が高い。このデータは、その差異が統計学的に有意であるか否かを決定するために分析される。
【0072】
本発明の診断方法の感度は、従来のタンパク質分離方法を用いて、本質的に同じ発現レベルで正常プロテオーム及び疾患プロテオームの両方に見出されるタンパク質(一般的なタンパク質、例えば、アルブミン及び免疫グロブリン)を分析の前に除去することによって高めることができる。固有の発現サインの一部分ではないこのような一般的なタンパク質の除去により、改良された感度及び診断の精度が得られる。それに代えて又はそれに加えて、一般的なタンパク質の発現サインは、診断を呼び出すために、典型的には、機械が配置されているスペクトル選択アルゴリズムを用いた結果のコンピューター分析の間に排除できる(か又はシグナルを除去することができる)。以下の実施例に詳細に記載される結果は、統計学的に有意な様式で、羊水の正常プロテオミクスプロフィールとは異なる、羊膜内感染(IAI)に特徴的なプロテオミクスプロフィールを表す。それに加えて、実施例はそれぞれ、IAI及びダウン症候群に特徴的な発現マーカー及び固有の発現サインを表す。
【0073】
プロテオミクスプロフィールを比較するための統計学的方法は当該技術分野で周知である。例えば、マススペクトルの場合には、プロテオミクスプロフィールは、スペクトルの平行軸に沿った、キーとなる質量/電荷(M/Z)位置でのピーク振幅値によって定義される。それ故に、特徴的なプロテオミクスプロフィールは、例えば、与えられたM/Z値のスペクトル振幅の組み合わせによって形成されるパターンによって特徴付けることができる。特徴的な発現サインの存在又は非存在、又は2つのプロフィールの実質的な同定は、試験サンプルのプロテオミクスプロフィール(パターン)と参照サンプル又は正常サンプルのプロテオミクスプロフィール(パターン)とを適切なアルゴリズムで照合することによって決定することができる。プロテオミクスパターンを分析するための統計学的方法は、例えば、Petricoin III et al.,The Lancet 359:572−77(2002).;Issaq et al.,Biochem Biophys Commun 292:587−92(2002);Ball et al.,Bioinformatics 18:395−404(2002);and Li et al.,Clinical Chemistry Journal,48:1296−1304(2002)に開示される。
【0074】
特定の実施形態では、患者から得られたサンプルは、タンパク質チップに適用され、プロテオミクスパターンは質量分析法によって作成される。スペクトル内のピークのパターンは、上述のように、好適なバイオインフォマテクスソフトウェアによって分析することができる。
【0075】
4.スクリーニングアッセイ
本発明のプロテオミクスプロフィールはさらに、特定の母体/胎児の状態の処置のために、候補薬物を同定するためのスクリーニングアッセイにおいてさらなる有用性を見出す。このようなスクリーニングアッセイは、試験分子が、処置される母体/胎児の状態に特徴的な発現サインを含有するプロテオミクスプロフィールを発現サインを欠いたプロテオミクスプロフィールに変換する能力に基づく。1つの特定の実施形態では、試験化合物が病的な発現プロフィールを正常な発現プロフィールに変換する能力が試験され、別の実施形態では、スクリーニングアッセイは、試験化合物が、病的な状態に特徴的な固有の発現サインを対応する正常な発現サインに変換する能力を試験する。このようなスクリーニングアッセイは、疾患の生物学的サンプルを処置し、処置前と処置後のプロテオミクス発現プロフィールを比較することによって、インビトロで行うことができる。それに代えて又はそれに加えて、標的の病的な母体/胎児の状態を示す実験動物を試験化合物で処置し、処置前及び処置後の動物の生体液を採取し、2つのサンプルのプロテオミクスプロフィールを比較することによって、薬物スクリーニングを行うことができる。このアッセイでは、生体液のサンプルを処置後の種々の時間点で、及び処置後の時間推移に沿って採取することも可能である。これらの方法論は、薬学的薬剤の毒性を特徴決定するため、及び特定の治療のための最適候補物を同定するために適用してもよい。
【0076】
試験化合物は、例えば、ペプチド、非ペプチド有機低分子、タンパク質、ポリペプチド、抗体(抗体フラグメントを含む)、アンチセンス分子、オリゴヌクレオチドデコイ、及び薬物又は候補薬物として以前に使用された任意の他の種類の分子であることができる。
【0077】
生体液は、例えば、羊水、血清(例えば、母体血清)、血漿、尿、脳脊髄液、母乳、粘液、又は唾液であることができる。
【0078】
同定された治療的に活性な化合物は、従来の薬学的配合物中に配合することができる。当該技術分野で公知の配合物の要約は、Remington’s Pharmaceutical Sciences,latest edition,Mack Publishing Company,Easton,PAに見出される。このマニュアルの参照は当該技術分野で通常のことである。
【0079】
5.タンパク質及び抗体アレイ
上に議論される診断アッセイ及びスクリーニングアッセイの両方は、タンパク質アレイを用いて行うことができる。近年、タンパク質アレイは、タンパク質を検出し、それらの発現レベルを監視し、タンパク質相互作用及び機能を観察するための強力な手段として広く認識されている。それらは、自動化手段を用いて多くの数の決定を同時に行うことができる場合、高スループットタンパク質分析を可能にする。DNAアレイのために元々開発されたマイクロアレイ又はチップフォーマットでは、大量のデータを作成しつつ最小限の物質の使用でこのような決定を行うことができる。
【0080】
上述のような2Dゲル電気泳動及び質量分析法によるプロテオーム分析は非常に効果的ではあるが、常に高い感度を提供するわけではなく、低い発生量で発現する多くのタンパク質を分析できない場合がある。タンパク質マイクロアレイは、それらの高い効率に加えて、改良された感度を提供する。タンパク質アレイは、当該技術分野で周知の種々の共有結合又は非共有結合の化学を用いて、固体表面上、例えば、ガラス、シリコン、マイクロウェル、ニトロセルロース、PVDF膜、及びマイクロビーズ上にタンパク質を固定することによって形成される。固体支持体は、カップリング手順の前及び後に化学的に安定であり、良好なスポット形態を可能にし、非特異的結合を最少にするべきであり、検出システムにおけるバックグラウンドに影響をあたえないべきであり、異なる検出システムと適合性であるべきである。
【0081】
概して、タンパク質マイクロアレイは、DNAアレイの読みのために一般的に使用されるものと同じ検出方法を使用する。同様に、DNAマイクロアレイの読みのために使用されるものと同じ装置はたんぱく質アレイに適用可能である。
【0082】
従って、捕捉アレイ(例えば、抗体アレイ)は、2つの異なる供給源、例えば正常性体液及び疾患性体液由来の蛍光標識されたタンパク質を用いてプローブ化することができる。この場合では、読み出しは、標的タンパク質の発現レベルにおける変化を反映するものとして蛍光シグナルにおける変化に基づく。代替的な読み出しとしては、限定されないが、蛍光共鳴エネルギー転移、表面プラズモン共鳴、ローリングサークルDNA増幅、質量分析法、共鳴光分散、及び原子力顕微鏡が挙げられる。
【0083】
さらなる詳細のために、例えば、Zhou H et al.,Trends Biotechnol.19:S34−9(2001);Zhu et al.,Current Opin.Chem.Biol.5:40−45−(2001);Wilson and Nock,Angew Chem Int Ed Engl 42:494−500(2003);and Schweitzer and Kingsmore,Curr Opin Biotechnol 13:14−9(2002)を参照。生体分子アレイはさらに、米国特許第6,406,921号(2002年6月18日に登録)にも開示され、その開示全体は、ここで参考として明らかに組み込まれる。
【0084】
本発明のさらなる詳細は、以下の非限定的な実施例から明らかである。
【実施例】
【0085】
実施例1
一般的なプロトコル
羊膜内感染の霊長類モデル
このプロトコルは、Institutional Animal Care Utilization Committee of the Oregon National Primate Research Centerによって承認され、ヒトのケアのためのガイドラインに従った。時間通りの妊娠状態の19匹の妊娠したアカゲザル(Macaca mulatta)を、慢性的にカテーテル挿入し、以前に記載されているとおりに手術後に維持した(Haluska GJ,et al.,Temporal changes in uterine activity and prostaglandin response to RU 486 in rhesus macaques in late gestation.,Am J Obstet Gynecol 157:1487−95(1987);and Gravett MG,et al.,An experimental model for intra−anmiotic infection and preterm labor in rhesus monkeys.Am J Obstet Gynecol 171:1660−7(1994))。
【0086】
簡潔に述べると、妊娠約110日(期間は167日である)に、妊娠した動物をジャケット内及び綱システムで慣らした(Ducssay CA,et al.,Simplified vest and tether system for maintenance of chronically catheterized pregnant rhesus monkeys.Lab.Anim Sci 38:343−4(1988))。慣らした後、一般的な麻酔下で妊娠119日〜126日に子宮内手術を行った。母体の大腿動脈及び静脈カテーテル、胎児の動脈及び静脈カテーテル、2つの開口末端を有する羊膜内圧力カテーテル、子宮筋層の筋電法の電極、及び胎児の筋電法の電力を外科的に移植した。手術後1〜5日間、子宮の非刺激性を制御するために全ての動物に硫酸テルブタリン(1日に2回、3〜5時間にわたって1mgを静脈投与)を与えた。動物にさらにセファゾリン(12時間ごとに250mgを静脈投与)を与え、バクテリアの接種前少なくとも48時間に投与をやめた。
【0087】
8〜13日間(妊娠126〜138日)操作後に安定させた後、(a)生理食塩水中に懸濁させたグループB連鎖球菌(タイプIII)の106コロニー形成単位(cfu)(n=7)、(b)10B培地に懸濁させたUreaplasma parvum 107cfu(正式にはUreaplasma urealyticum、血液型亜型1)(n=6)、又は(c)10%のショ糖及び2%の内毒素の存在しない胎児子ウシ血清を含むリン酸緩衝化食塩水に懸濁させたMycoplasma hominis106〜107cfu(n=6)を羊膜内接種することによって実験的な羊膜内感染(IAI)を確立させた。グループB連鎖球菌単離物は、髄膜炎をもつ新生児からもともと回収した。Ureaplasma parvumは、絨毛羊膜炎及び新生児セプシスをもつ患者の胎盤及び膜から低継代させた臨床単離物由来であった。Mycoplasma hominisは、postmartum子宮内筋層炎をもつ患者由来の子宮内膜単離物であった。
【0088】
試験期間中(接種前は毎日、接種後は4時間〜12時間ごと)、定量的なバクテリア培養物、血球計算板による白血球細胞分析、及びサイトカイン濃度及びプロスタグランジン濃度のために(以前に報告されたGravett MG et al.,An experimental model for intra−amniotic infection and preterm labor in rhesus monkeys.Am J Obstet Gynecol 171:1660−7(1994))、及びプロテオミクス分析のために、全ての動物から羊水サンプルを順次集めた。
【0089】
胎児の心電図及び子宮活性(心電図及び羊膜内の圧力)を、手術から分娩まで連続して記録した。時間あたりの収縮曲線の下の面積として子宮の収縮を記録し、ある時間の収縮面積(HCA)(mmHg/時間(秒))として表した。
【0090】
母体の頚を感染前に膣から触診し、その後も順次触診した。一致性、消失、及び膨張を各触診ごとに記録した。1匹の動物を除いて帝王切開によって分娩させ、1匹の動物においては膣から分娩させた後、感染を確認するために胎児、子宮脱落膜、胎盤、及び内膜のバクテリア培養物を得て、絨毛羊膜炎の証拠を出すために組織病理学的な研究を行った。
【0091】
感染は上述のように行われた羊膜内接種の後、迅速に確立されていた。子宮絨毛羊膜炎が基本レベル100から10,000mmHg×sec/hrよりも大きなレベルまでの増加が、平均でグループB連鎖球菌を用いて接種した33+9時間後、Ureaplasma parvumを用いて接種した43±14時間後;及びMycoplasma hominisを用いて接種した62±14時間後に生じた。子宮収縮は進行性の頚部の膨張をもたらし、全ての場合において消失した。子宮収縮の増加は、以前に報告されているように、炎症前サイトカインTNF−α、IL−1β、IL−6、及びIL−8、プロスタグランジンE2及びF2αにおける顕著な増加に先行した(Gravett et al., Am J. Obstet Gynecol 171:1660−7(1994))。陣痛の発生前にIAIの臨床的な徴候を示した動物はいなかった。絨毛羊膜炎を全ての場合において確認した。
【0092】
ヒトの研究(女性における潜伏的なIAI)
以前に記載されるように、University of Washington Medical Center又はシアトルの関連病院で1991年6月25日〜1997年6月30日まで、インタクトな胚膜を持つ妊娠22〜34週での早期分娩で入院した309人の女性から研究集団を抜き出した(Hitti J,et al.,Amniotic fluid tumor necrosis factor−α and the risk of respiratory distress syndrome among preterm infants.Am J Obstet Gynecol 177:50−6(1997))。全ての女性は、書面によるインフォームドコンセントを受けておリ、試験プロトコルは、全ての参加病院についてInstitutional Review Boardsによって承認された。全ての参加者は、研究登録時にインタクトな胚膜を有していた。早期分娩は、>1cmの頚部の変化又は頚部の膨張又は>50%の頚部成熟度のいずれかを伴って、≦10分の頻度での規則的な子宮収縮として定義された。
【0093】
潜伏的なIAIは、陽性のAF微生物培養物及び/又はAFインターロイキン−6(IL−6)濃度>2ng/ml、絨毛羊膜炎の組織学的証拠(10の隣接しない部分において400倍の部分あたり、≧10の多形核の白血球の存在によって定義される)及び子宮圧痛又は発熱の非存在によって定義された。本発明者らは以前に、報告した。AF IL−6濃度>2ng/mlは試験集団全体について75パーセンタイル以上であり、ポリメラーゼ連鎖反応によるバクテリアの検出と相関関係にあることを報告した(Hittiet al.,Clin Infect Dis 24:1228−32(1997))。入院時に>4cmの頚部膨張又は破壊された膜を持つ女性は排除した。多胎妊娠、頚部セルクラージュ、前置胎盤、常位胎盤早期剥離、糖尿病、高血圧、及び子かん前症の女性は、他の基準を満たせば適格とみなした。
【0094】
経腹壁的な羊膜穿刺を全ての試験参加者について超音波による誘導の下で行い、登録時に静脈穿刺によって母体の静脈血を集めた。この研究集団から、部分集合(表1A及び1B)は、ここで報告されるようなプロテオミクス分析について遡及的に同定した。この部分集合は、それぞれ11人の患者の3つのグループを含んでいた:グループI−上に定義されるような潜伏性のIAIの証拠を有する患者;グループI−記録された子宮内感染を有さないが、34週以下の妊娠期間での早期出産をした患者のランダムに選択された部分集合、及びグループIII−感染しておらず、早期分娩を有したが早産防止薬に反応して、後でほぼ所定期間に近い期間(妊娠>35週)で後に分娩した患者。これら3つのグループ間で母体の年齢、人種、又は経産に差異はなかった(表1A及び1B)。しかし、子宮内感染を有する患者は、登録時にはいくらか在胎齢が早くにみられ(p=0.10)、感染なしに早期出産した患者又は所定の期間で分娩した患者よりも顕著に早い在胎齢で分娩した(それぞれ、27.3±0.9週 対 29.8±1.0及び37.0±0.9週、p<0.000l)。それに加えて、子宮内感染を有する患者は、登録から分娩まで顕著に短い時間を有していた(他の2つのグループの8.4±6.3日及び46.9±5.6日と比較して、2.1±5.6日、p<0.0001)。子宮内感染を有する患者の91%が、登録の7日以内に分娩した。分析までサンプルを−20℃で保存し、2回を超えては解凍しないようにした。
【0095】
感染を有する11人の患者の中で、4人から(大腸菌を有する2人、カンジダアルビカンスを有する1人、及び混合嫌気菌を有する1人)微生物を回収し;これらの患者の全ては7日以内に分娩した。他の7人の患者は、2,000pg/mlより大きな羊水IL−6濃度に基づいて同定した。インターロイキン−6の平均羊水濃度は、感染なく早期出産をした患者の中の0.68±0.20ng/ml及び早期分娩があり、所定期間に分娩した患者の中の0.25±0.13ng/mlと比較して、これらの患者の中で27.7±7.8ng/mlであった(p<0.01)。
(表1A)
試験集合の特性
【0096】
【表1A】

データは、平均、標準偏差で示した。連続データについてのANOVAによる分析及びカテゴリーデータについてのカイ二乗分析として表された。省略語:PMD,早期分娩<35週;IUI、子宮内感染;PML、分娩なしの早産。
(表1B)
スクリーニング結果
【0097】
【表1B】

*このプール中の2つの陽性サンプルは、PCR手順によって陽性の、2つの被検体のAFが低レベルのバクテリアを示したことから、潜伏性感染を表す。このことは、タンパク質プロファイリングが潜伏性羊膜内感染を同定するのに使用可能であることを示す。
【0098】
上述の表では、データは、平均、標準偏差で示した。連続データについてのANOVAによる分析及びカテゴリーデータについてのカイ二乗分析として表された。省略語:PMD,早期分娩<35週;IUI、子宮内感染;PML、分娩なしの早産。
(表1C)
試験結果をスクリーニングするためのFisher試験の有意性値
【0099】
【表1C】

不顕性のIAIをもつ11人の患者のうち4人は、回収された微生物を有していた(大腸菌を有する2人、カンジダアルビカンスを有する1人、及び混合嫌気菌を有する1人)。感染している他の7人の患者は、>2ng/mlの顕著に高いAF IL−6濃度をもとに同定した。IL−6の平均AF濃度は、感染なく早期出産をした患者の中の0.68±0.20ng/ml及び早産があるが、所定期間に分娩したグループIIIの患者の中の0.25±0.13ng/mlと比較して、これらの患者の中で27.7±7.8ng/mlであった(p<0.01)。
【0100】
羊水のプロテオミクス分析
LC−MS/MS分析によるタンパク質同定
コントロールサンプル及び感染サンプル由来の羊水100μgを、ヨードアセトアミドで還元し、15% SDS−PAGEゲルで分離した。80Vで電気泳動を行ない、サンプル中のタンパク質を分離した。電気泳動の後、ゲルをCoomassie blue R−250で染色し、画像をBio−Rad GS800デンシトメーター及びPDQUESTソフトウェアで集めた。各レーンからの個々のバンドをゲルから切断し、脱色し、Courchesne及びPatterson(Methods Mol Biol 112:487−511(1999))の方法を用いて、ゲル中でトリプシンで37℃で24〜48時間消化した。ペプチドを0.1%TFAで抽出し、スピードバキューム(speedvac)中で乾燥した。抽出物を0.1%TFAに溶解し、Zip Tipc18ピペットチップ(Milliporeから)を用いて、CapLC(Waters,Inc)に接続したQ−Tof−2質量分析計(Micromass,UK)を用いて、及び/又は110 キャピラリーLCシステム(Agilent Technologies,Foster City,CA)に接続したイオン捕捉(LCQ,ThermoFinnigan,San Jose,CA)を用いて、精製した(Marvin L.,et al.Identificaton of proteins from one−dimensional sodium dodecyl sulfate−polyacrylamide gel electrophoresis using electrospray quadrupole−time−of−flight tandem mass spectrometry.Rapid Commun Mass Spectrom.14(14):1287−92,2000)。
【0101】
2−次元(2−D)ゲル電気泳動
羊水(400〜2000μg)(アルブミンを含むものと含まないもの)をIEFバッファーに溶解し、IPG片(pH3〜10)24cmに室温で12時間再水和させた。再水和後、IPG片を70〜90kVhrsで1次元電気泳動にかけた。次いで、IPG片をDTT平衡バッファーI及びIAA平衡バッファーIIを用いて順次15分間平衡化させ、その後2次元SDS−PAGE分析を行った。次いで、IPG片を4〜20%SDS−PAGEゲルに入れ、120Vで12時間ゲル電気泳動し、2次元でタンパク質を分離した。ゲルをCoomassie Blue R−250で染色し、Bio−Rad GS800デンシトメーター及びPDQUESTソフトウェアを用いて画像化した。個々のスポットをゲルから切断し、脱色し、ゲル中でトリプシンで37℃で24〜48時間消化した。ペプチドを0.1%TFAで抽出し、Zip Tipc18ピペットチップ(Milliporeから)を用いて精製した(2−D Proteome analysis protocols:Methods in Molecular Biology:112,1999)。
【0102】
HPLC分画
アルブミン及びIgGを除去した後のヒト羊水サンプル(1〜15mgタンパク質)を20mM Tris−HCl(pH7.5)に溶解した。オートサンプラー及びUV吸収検出器を取り付けたWaters 1525 HPLC上でTSKゲルDEAE−5PWカラムを用いてアニオン交換クロマトグラフィーを行った。直線的な塩溶離勾配を用いてタンパク質を分画した。フラクションを1分ごとに集めた。フラクションをプールし、トリプシンで消化し、ペプチド混合物を質量分析計(Q−Tof−2)を用いて分析した。
【0103】
質量分析計による分析
(1)Q−Tof−2
ゲル中で消化した後のサンプルをMicromass CapLCに接続したMicromass Q−Tof−2質量分析計で分析した。Q−Tof−2に規則的なZ−スプレー又はナノスプレー源を取り付け、Integrafrit C18 75um ID×15cm石英ガラスキャピラリーカラムに接続した。Windows(登録商標) NT及びMassLynx3.5ソフトウェアを入れたCompaqワークステーションで、装置を制御し、データを得た。CapLC内に直接注入又は注射することによってQ−Tof−2をGlu1Fibrinopeptide Bを用いて較正した。MS/MSMS調査方法を使用して、MS/MSMSスペクトルを得た。MS調査について質量400〜1500をスキャンし、MSMSについて質量50〜1900をスキャンした。Windows(登録商標)2000及びSEQUEST(バージョン1.3)及び/又はLUTEFISKを入れたPCで一次データ分析を行った。ピークピッキングのためのビルトイン自動化機能を用い、各ピークについて質量中心−フィッティングを適用して、ピークリストを作成した。
【0104】
(2)LCQ−MS
乾燥したCoomassie blue染色したゲルからのタンパク質スポットを切除し、20mM炭酸水素アンモニウム、50%アセトニトリル溶液0.5ml中で30分間再水和/洗浄した。次いで、ゲル領域を真空遠心分離によって乾燥し、Courchesne及びPatterson,Identification of proteins by matrix−assisted laser desorption/ionization masses,Methods Mol.Biol.112:487−511(1999)の方法を用いて、20nMシーケンスグレード改変トリプシン(ProMega,Madison,WI,USA)中で再水和させることによって系中で消化した。次いで、トリプシン消化物を真空遠心分離によって濃縮し、逆相クロマトグラフィーによって分離し、ペプチドをモデルLCQイオン捕捉質量分析計(ThermoFinnigan,San Jose,CA)によって分析した。サンプルを、10μLmin−1流速及び勾配0〜40%B(水中の75%アセトニトリル)を1時間かけて、Zorbax C−18 0.5mm×150mmミクロボア(microbore)カラムを用いて、1100キャピラリーLCシステム(Agilent Technologies,Foster City,CA)を用いて分離した。標準的なThermoFinnigan電気スプレー源にペプチドを直接導入した。標準的なLCQソフトウェアを用いて自動化様式でMS/MSスペクトルを得て、次いで、SEQUEST(ThermoFinnigan)を用いてさらに分析した。さらなる詳細のために、Courchesne,P.L.and Patterson,S.D.(前出)を参照。
【0105】
データ分析
(1)Sequest及びDTASelect SEQUESTソフトウェア(ThermoFinnigan)を用いて、Yates et al.,Methods Mol.Biol.112:553−69(1999)に記載されるように、タンデムマススペクトル(MS/MS)の自動化分析を行った。SEQUESTは、データベースペプチド配列に対して連続的なタンデムマススペクトルを一致させる。索引付きの重複のないProtein Information Resource(公開日)及びSwissProt(公開日)から得られたタンパク質配列のデータベースを組み合わせて使用して、デフォルトパラメーターを用いてサーチを行った。Xcalibur Database Manager(ThermoFinnigan)を用いてデータベースを構築した。S−カルボキシアミド化システインは、単なる改変であるとみなされた。
【0106】
Sequestの結果をDTASelect(The Scripps Research Institute,Tabb,2002)を用いてさらに分析した。DTASelectはSEQUEST同定物を系統立て、ふるい分ける。以下のものを除いてデフォルトパラメーターを使用した:(1)タンパク質の記載中に列「ケラチン」を含む任意のデータベースマッチは排除され、(2)LCQ質量分析計からのスペクトルを二重に荷電したイオンについて2.4の交さ相関スコアカットオフでふるい分けられた。DTASelectによって選択された各スペクトル及び提案された配列対を視覚的に観察し、管理のために最終的な結果をスプレッドシート(Microsoft Excel)又はデータベース(Microsoft Access)にインプットした。
【0107】
さらなる詳細については、Tabb DL,et al.,DTASelect and Contrast:Tools for Assembling and Comparing Protein Identifications from Shotgun Proteomics.J.Proteome Res.1:21−26(2002)も参照。
【0108】
(2)Lutefisk コンピュータープログラムLutefisk 1900 v1.2.5(Taylor JA,Johnson RS.Implementation and uses of automated de novo peptide sequencing by tandem mass spectrometry Anal Chem 73(11):2594−604(2001)を用いて、全てのスペクトルの自動化デノボ配列決定を行った。Lutefiskは、ホモロジー−ベースの配列サーチのために十分詳細であるスペクトルについてペプチド配列を作成する。改質、アクリルアミド、カルバミドメチル化、及びリン酸化を考慮した。
【0109】
MALDI検出プロトコル及びパラメーター
二段階遅延抽出源を備えた特注の飛行時間反射質量分析計(Jensen ON,et al.,Direct observation of UV−crosslinked protein−nucleic acid complexes by matrix−assisted laser desorption ionization mass spectrometry.Rapid Commun Mass Spectrom 7(6):496−501(1993))を用いて、MALDI質量分析法を行った。約1μLのサンプル溶液を1μlのSA(60:40水/アセトニトリル 0.1%TFA最終濃度中のシナピン酸)と混合した。この検体/マトリックス溶液の1.0μLの液滴をマトリックス前結晶化サンプルプローブ上に付着させ、空気中で乾燥させた。(355nm)Nd:YAGレーザー(Spectra Physics)を用いてサンプルを照射し、23kVで700ns/1.0kVの遅延を有したイオン源を操作することによって、マススペクトルを作成した。20の連続したスペクトルの合計として各マススペクトルを記録し、それぞれ光子の単独のパルスによって作成された。追加した標準からのイオンを質量較正に使用した。
【0110】
羊水のSELDI分析
羊水サンプルからの全0.5〜3.0ugタンパク質でNormal Phase NP20(SiO2表面)、Reverse Phase H4(疎水性表面:C−16(長鎖脂肪族)、又は固定化ニッケル(IMAC)SELDIタンパク質Chip(登録商標)アレイ(Ciphergen Biosystems,Inc.Fremont,CA)上に点を付けた。室温で1時間インキュベーションした後、NP1及びH4チップを5ulの水洗浄液にさらし、結合していないタンパク質及び干渉物質(すなわち、バッファー、塩、洗剤)を除去した。2〜3分空気乾燥した後、50%アセトニトリル(v/v)中のシナピン酸の飽和溶液0.5ulを2回適用し、0.5%トリフルオロ酢酸(v/v)を添加し、Ciphergen Protein Biology System II(PBSII),Issaq,J.H,et al.:The SELDI−TOF MS Approach to proteomics:Protein Profiling and Biomarker Identification。Biochem Biophys Res Commun.5;292(3):587−92,2000中の飛行時間質量分析計によって質量分析を行った。
【0111】
ポリクローナル抗体及びWesternイムノブロッティング
対応するタンパク質由来の免疫抗原性のペプチドを使用してウサギポリクローナル抗体(DSL Laboratories,Webster,TX)を作成し、次いで、アフィニティー精製した抗体をWesternブロットのために使用した。100μgのAFタンパク質を4−20%SDS−PAGEで分離し、PVDF膜に移した。母体血清から、300μgのタンパク質をIGFBP1モノクローナル抗体(DSLLaboratories)を用いた免疫沈降のために使用し、生成物をWesternブロットした。母体血清中のカルグラヌリン(calgranulin)Bの検出のために、150μgのアルブミンを除去した母体血清をWesternブロットのために使用した。PBST中の5%脂肪除去牛乳を用いて室温で45分間、膜をブロックし、1μg/mlの一次抗体(IGFBP−1、アズロシジン、ビタミン−D結合タンパク質及びカルグラヌリン(calgranulin)−B、DSL Inc., Santa Cruz,CAから)を用いて4℃で一晩インキュベートした。TBSTで3回洗浄した後、IgG−HRP二次抗体(シグマ)を用いて膜をインキュベートし、高められた化学ルミネセンスを用いて視覚化した。
【0112】
実施例2
羊水中で発現したタンパク質及びポリペプチドの同定
実施例1に記載された物質及び方法を用いて、正常羊水及び感染羊水中で発現したタンパク質及びポリペプチドを同定した。ヒト及び霊長類の羊水サンプル(プールしたもの及び個々のもの)を、実施例1に記載されるようなタンパク質分離技術で分離した(1−D、2−D及びHPLC分画)。分離したタンパク質(ゲルバンド、スポット及びフラクション)をトリプシンで消化して、ペプチドプールを作成した。ペプチドプールをタンデムMSを用いて分析して、それらのアミノ酸配列及び組成を解読した。
【0113】
スペクトル検証プログラムを用いて5000のMSスペクトルを選択した。デノボ配列決定プログラム(Lutefisk,Peaks)を用いてこれらのスペクトルファイルを分析し、各ペプチドに対応するアミノ酸配列を作成した。ペプチドプールから作成されたデノボ配列を使用して、実施例1に記載されるようにタンパク質及びDNAデータベースをサーチした。
【0114】
ホモロジーマップ及び配列検証を用いて、種々のタンパク質の発現を羊水中で発見した。検出したタンパク質を、既知の構造類似性(配列ホモロジーマップ)に基づいて潜在的な機能について分析した。広範囲の疾患にかかわる重要な機能分類に属するタンパク質が発見された。ヒト羊水中で最初に発見されたタンパク質及びポリペプチドをこれらの潜在的な機能カテゴリーのもとで以下の表2に列挙する。
【0115】
免疫アッセイにおいて示差的に発現することが示されたタンパク質、及び感染した羊水中でより豊富に又は固有に現れるタンパク質は別個に表示する。この内容において、相対的な量は、参照サンプルと比較して、試験サンプル中の特定のポリペプチド又はタンパク質を表すペプチドの量として定義される。それ故に、同じタンパク質から誘導されるより多くのペプチドが、羊水の感染していない参照サンプルよりも感染した羊水中に存在する場合、タンパク質は、感染した羊水中でより豊富に現れる。
【0116】
表3は、羊水中に存在する以前に知られたタンパク質及びポリペプチドを列挙し、これらの存在は、本アッセイによって再確認された。感染に関連する事象のための既知のマーカーであるタンパク質は、別個に示される。
(表2)
ヒト羊水中で最初に発見されたタンパク質及びポリペプチド
【0117】
【表2】

【0118】
【表2A】

・タンパク質は免疫アッセイでも示差的に発現することが示される
#これらのタンパク質を表すペプチドは、感染した羊水中でより豊富であるか、又は固有に検出される。
(表3)
人羊水中に存在することが以前に知られており、デノボ配列決定を用いて同定されたタンパク質及びポリペプチド
【0119】
【表3】

*感染に関連する事象についての既知のマーカー
羊水中で初めて発見されたさらなるタンパク質が以下の表4に表される。
(表4)
【0120】
【表4】

【0121】
【表4A】

【0122】
【表4B】

【0123】
【表4C】

【0124】
【表4D】

【0125】
【表4E】

IPI=国際タンパク質指数
子宮内の状態のための診断マーカー:
上の表に列挙されたたんぱく質は、子宮内状態を検出し監視するための有望な候補である。このような状態及び対応するタンパク質マーカーのいくつかの例を以下でさらに詳細に議論する。
【0126】
発育不全のマーカーとしてのアクチン調整及び関連タンパク質:
表2の構造タンパク質の中に列挙されるモエシン(膜を組織化する伸長スパイクタンパク質)は、膜貫通タンパク質のアクチン細胞骨格に対する結合に関与し、種々の細胞シグナル伝達経路に関係していることが知られている(Speck O,et al.:Moesin functions antagonistically to the Rho pathway to maintain epithelial integrity.Nature 2;421(6918):83−7,2003)。Rho−ファミリーGTPase及びそれらのエフェクターが、アクチン改変分子、例えばコフィリン及びプロフィリン(これらも表2の構造タンパク質として列挙されている)の活性を調整し、その結果、増殖の円錐伸長又は収縮に関連する細胞骨格に変化を生じることが知られていた(Tang BL.Inhibitors of neuronal regeneration:mediators and signaling mechanisms.Neurochem Int,42(3):189−203,2003)。コロニン様タンパク質p57(表2において列挙される別の構造タンパク質)はさらに、アクチン架橋及びキャッピングに関与し(Weitzdoerfer R et al.:Reduction of acrin−related protein complex 2/3 in fetal Down syndrome.Biochem Biophys res Commun.293:836,2002)、既知の発育不全において調節異常を示す。別のアクチン調整タンパク質であるゲルゾリン(表2中のトランスポーター/結合タンパク質の列挙されるゲルゾリン前駆体を参照)はさらに、発育において制御され、臓器系において重要であることが知られている(Arai M,Kwiatkowski DJ.Differential developmentally regulated expression of gelsolin family members in the mouse.Dev Dyn,215,297,1999)。14−3−3タンパク質はさらに、シグナル伝達及び分化経路にかかわる既知の上皮マーカーであり、脳及び他の生体臓器の正常な発育に必須である(Wu C,Muslin AJ.Role of 14−3−3 proteins in early Xenopus development.Mech Dev,119,45,2002)。
【0127】
それ故に、発育中に重要な役割を有する列挙されたアクチン調整タンパク質及び他の関連分子は、ヒト羊水中で最初に同定され、種々の臓器系の発育不全、例えば、染色体異数性から生じ得る、例えば、中枢神経系、心臓血管系及び他の筋骨格の奇形を検出するために使用可能であった。このことは、感染した羊水中で示差的に発現することが示され、その示差発現が免疫アッセイによって確認される、プロファイリングIにとって特に正しい。
【0128】
感染及び免疫応答関連障害のマーカー:
マクロファージキャッピングタンパク質、白血球エラスターゼ、好中球ゲラテナーゼ関連リポカリン(lipocalicn)、ミエロペルオキシダーゼ(myleoperoxidase)、L−プラスチン(リンパ球サイトゾルタンパク質)及びカルグラヌリン(calgranulin)(表2中の免疫応答関連遺伝子の列挙を参照)の感染した羊水での本発明の検出は、最初にこれらのタンパク質の羊膜内感染における存在および調整を示す。これらのタンパク質のいくつかは、感染、炎症及びストレスに対する応答において免疫細胞の既知のレスポンダーである。マクロファージキャッピングタンパク質(MCP)は、アクチンフィラメントを調整し、炎症プロセスに関与するCa(2+)−感受性タンパク質である(Dabiri GA,Molecular cloning of human macrophage capping protein cDNA.A unique member of the gelsolin/villin family expressed primarily in macrophages J Biol Chem 15;267(23):16545−52,1992)。同様に、カルグラヌリン(calgranulin)は、外傷及び創傷治癒において役割を果たすことが知られているカルシウム結合タンパク質である(Thorey IS.et al. The Ca2+−binding protein S100A8 and S100A9 are encoded by novel injury−regulated genes.J Biol Chem 21;276(38):35818−25,2001)。白血球エラスターゼ及び好中球ゼラチナーゼに関連するリポカルシン(NGAL)は、静菌機構及び溶菌機構に関与する(Goetz DH.et al.The neutrophil lipocalin NGAL is a bacteriostatic agent that interferes with siderophore−mediated iron acquisition.:Mol Cell 10(5):1033−43,2002)。
【0129】
上述の免疫調整剤に加えて、本発明者らはさらに、感染した羊水中に2つの抗菌性タンパク質Fall−39及びアズロシジンを最初に発見した。抗菌性タンパク質Fall−39(LL−37)はバクテリアリポ多糖類(1ps)に結合し、骨髄、精巣及び好中球中で発現する。Fall−39は肥満細胞の脱顆粒を刺激し、肥満細胞の強力な化学走性因子である。その抗菌活性のほかに、Fall−39は、肥満細胞を炎症病巣に動員する能力を有している場合がある。基本培地Eの存在下で、合成FALL−39は、大腸菌D21及びBacillus megaterium Bm11に対して非常に活性であった。皮膚のバリアの保全性が破壊された場合、Fall39が最初の防御線に参加し、局所的な感染及び微生物の全身侵襲を防ぐという防御的な役割が提案された(Agerberth B,et al.:FALL−39, a putative human peptide antibiotic, is cystein−free and expressed in bone marrow and testis.Proc Natl Acad Sci USA,3;92(1):195−9,1995)。
【0130】
アズロシジン(CAP37)は、ヒト好中球から単離されたカチオン性抗菌タンパク質であり、宿主防御及び炎症において重要な関係を有する。アズロシジンは、炎症中に放出され、単核球/マクロファージ機能、例えば、化学走性、生存の増加、及び分化を調整する(Pereira HA. CAP3 7, a neutrophil−derived multifunctional inflammatory mediator.J Leukoc Biol;57(6):805−12,1995)。
【0131】
プロテアーゼ及びプロテアーゼインヒビターは、タンパク質制御において鍵となる役割を果たし、いくつかの鍵となる生理学的機構を制御する。本発明者らは、羊膜内感染を含むヒト羊水中で初めてプロテアーゼのセルピンファミリー(セルピン、扁平上皮細胞癌腫抗原1及び2、グリア誘導ネキシン)の発現を同定した。セリンプロテアーゼインヒビターのセルピンスーパーファミリーは、多くの生物学的経路において、プロテアーゼの制御において中心的な役割を有し、例えば、アミロイドーシス、プリオン脳障害及びハンチントン病及びアルツハイマー病のような構造的な疾患にかかわる。(Lomas DA,Carrell RW,Serpinopathies and the conformational dementias.Nat Rev Genet;3:759,2002)。
【0132】
さらに、羊膜内感染において、本願発明者らは、免疫制御に関与する周知のプロテアーゼインヒビターであるシスタチンの発現を同定した(Vray B,Hartmann S,Hoebeke J. Immunomodulatory properties of cystatins.Cell Mol Life Sci;59(9):1503−12,2002)。
【0133】
列挙されたタンパク質は、感染及び/又は免疫応答関連障害の有望なマーカーである。
【0134】
マクロファージキャッピングタンパク質、好中球ゼラチナーゼ関連リポカリン、ミエロペルオキシダーゼ前駆体、L−プラスチン、アズロシジン、抗菌性タンパク質Fall−39、カルグラヌリン(calgranulin)A、プロフィリンI、グリアから誘導されるネキシン、セルピンI2、及びシスタチンAを表すペプチドが、正常な羊水と比較して感染した羊水中でさらに豊富に又は固有に検出され、免疫アッセイにおいて示差発現を示したことは注記すべきことである。
【0135】
それ故に、これらのタンパク質は、羊膜内感染及び/又は免疫応答関連障害のマーカーとして特に重要である。
【0136】
ヒト羊水中で検出された他の疾患(感染)に特異的なタンパク質
表2に列挙されたGp−340改変体タンパク質は、ヒトの感染羊水中で検出され、肺において以前に同定されたスカベンジャーレセプターである。このタンパク質は、バクテリア(連鎖球菌及び改変体)に結合することが知られている。感染した羊水におけるこのタンパク質の検出は、IAIのためのバイオマーカーを同定するための本発明の感受性のプロテオミクスアプローチを補完する。従って、感染した羊水中で同定されたGp−340改変体タンパク質は、それ自身で新生児セプシスを検出するのに有用である)。
【0137】
IGFBP−1(タンパク分解性のフラグメント)
表2に示されるように、IGFBP−1は、感染した羊水中で示差的に発現することが示された。インスリン様増殖因子(IGF)系は、胎児及び胎盤の成長に決定的に関与し、自己分泌/パラ分泌機構を介する子宮内膜中のステロイドホルモン作用を調整する。IGF−I及びIGF−IIは、増殖及び分化を刺激し、インビトロでいくつかの細胞種において分化した細胞機能を維持した。子宮内膜間質細胞はIGF−I及びIGF−IIを産生し、さらに高アフィニティーのIGF結合タンパク質(IGFBP)を産生する。IGF作用を調整可能な6つの高アフィニティーIGFBPのmRNAは、ヒト子宮内膜中で発現される。ヒト子宮内膜中で最も豊富なIGFBPはIGFBP−1であり、これは、後期分泌段階及び妊娠中において、前脱落膜化/脱落膜化子宮内膜間質細胞によって分泌される。このことは、臨床的な産科学及び婦人科学について示唆を有し、ここに子かん前症、子宮内成長阻害、多嚢胞性卵巣症候群及び栄養芽細胞及び子宮内膜の新生物におけるIGFBP−1の病態生理学的な役割の証拠が存在する。
【0138】
ヒト羊水中及び母体血清中のIGFBP−1タンパク分解性のフラグメントの存在及び調整は、妊娠に関連する子宮内及び母体状態を監視するための新しい道筋を開く。
【0139】
さらなる詳細については、以下の実施例12も参照されたい。
【0140】
実施例3
子宮内感染後の霊長類及びヒト羊水のタンパク質発現プロフィール
化学的に定義された正常相のチップアレイに結合したAF抽出物の235レーザー強度で集めた全スペクトルSELDI−TOF MS分析において、3〜5kDa及び11〜12kDa領域において、感染及び非感染の霊長類及びヒトのAF間でいくつかのピーク強度が異なることがわかった
対応する正常な発現プロフィールと比較した場合の子宮内感染後の霊長類羊水のタンパク質発現プロフィールを図1A〜Cに示す。図1A〜Cに示されるように、コントロール及び感染羊水の全体的なタンパク質発現プロフィールは異なる。小さな質量範囲における羊水プロフィールの詳細なスペクトル(図1B及び1C)は、約3〜5kDa及び10〜12kDa範囲において、コントロールと感染サンプルとのタンパク質発現プロフィールが別個のものであり、特徴的に異なることを示す。このことは、子宮内感染に応答するタンパク質発現の全体的な調整を示し、子宮内感染を診断する固有の発現サインを検出する能力を示す。
【0141】
図2は、感染(GBS)に応答する霊長類羊水の時間推移分析を示す。バクテリア接種の前及び感染後に順次羊水を集め、実施例1に示されるようなSELDI−TOF分析を行った。図2Aは感染前のタンパク質発現プロフィールを示し、図2Bは感染12時間後のタンパク質発現プロフィールを示し、図2Cは感染36時間後のタンパク質発現プロフィールを示す。
【0142】
図2Cに示されるように、子宮内感染の診断ピーク(10〜11kDa)のうちの1つは、急性感染の36時間以内に、明らかに高いレベルの発現レベルに到達する。このことは、診断タンパク質プロフィールを、疾患の状況及び処置に対する応答を監視するために使用できることを示す。
【0143】
図3は、化学的に定義された正常相チップアレイに結合したヒト羊水抽出物のSELDI−TOF分析の結果を示す。図3Aは、235レーザー強度での全スペクトルを示す。図3Bは、10〜12kDa領域における感染サンプル及びコントロールサンプルの間の差異を示す詳細なスペクトルである。図3は、3〜5kDa領域において感染サンプル及びコントロールサンプルの間の特徴的な差異を示す詳細なスペクトルである。
【0144】
図3A〜Cに示されるように、コントロール羊水及び感染羊水の全体的なタンパク質発現 プロフィールは異なっている。さらに小さな質量範囲における羊水プロフィールの詳細なスペクトル(図3B及びC)は、コントロールサンプルと感染サンプルとの間でタンパク質が異なって過剰発現している(3〜5KDa及び10〜12kDa範囲)ことを示す。タンパク質ピークの相対強度分析は、2つの異なる診断クラスター(10〜12kDa及び3〜5kDa範囲)の存在を示唆する。このことは、子宮内感染に応答したタンパク質発現の全体的な調整を示し、ヒト及び霊長類モデルの両方における子宮内感染の診断に固有の発現サインを検出する能力を示す。
【0145】
ヒト羊水の診断パターンは、霊長類の羊水の診断パターンと良好に一致することは注記すべきことである(実施例3及び4)。
【0146】
実施例4
示差質量分析計を用いた診断プロフィールの作成
診断タンパク質発現プロフィールは、異なる種類の質量分析計を用いて検出することができる。異なる質量分析計が類似の診断プロフィールを作成するか否かを試験した。診断プロフィールが実質的に質量分析計の種類に依存しない場合、羊水中で検出された示差的なタンパク質発現は、子宮内感染の診断サインを与えることができる。
【0147】
図4は、ヒトコントロール由来の羊水(子宮内感染なし)(A)、及び子宮内感染ありのサンプル(B)を用いて、一般的なMALDI−TOF質量分析計で得たマススペクトルを示す(Jensen ON,et al.,Direct observation of UV−crosslinked protein−nucleic acid
complexes by matrix−assisted laser desorption ionization mass spectrometry.Rapid Common Mass Spectrom 7(6):496−501(1993))。
【0148】
図4A及びBに示されるように、10〜12kDa範囲における子宮内感染の診断プロフィールは、代替の質量分析計を用いて検出され、SELDI−TOF機を用いて検出したプロフィールと類似である。このことは、示差的なタンパク質発現プロフィールが確固たるものであり、広範囲の現在の質量分析計を用いて検出できることを示す。
【0149】
まとめると、羊水タンパク質及びポリペプチドが、疾患の状況を診断する示差的な発現パターンを示すことがわかった。ここに示された結果は、疾患に特異的な診断パターンが複数の質量分析計アプローチを用いて検出可能であることを示す。パターン又はタンパク質発現プロフィールは、ヒト及び霊長類の間で比較可能である。プロフィールを使用して、時間が推移した場合の効果(感染又は処置)を監視することができる。
【0150】
実施例5
診断的及び予防的に監視するための羊水におけるタンパク質及びポリペプチド発現の定量
SDS−PAGE:
多量の塩を含有するヒト羊水(AF)由来のタンパク質をアセトンで沈殿させた。100μgの羊水タンパク質を15%SDS−PAGEにかけた。ゲルをCoomassie Blue R−250で染色した。ゲル画像をBio−RadゲルScannerでスキャンした。
【0151】
図5は、SDS−Coomassie Blue染色したゲルを示す。(A)プールした4つのヒトコントロールAFサンプル;(B)個々のコントロールAFサンプル;(C)プールした4つのヒト感染AFサンプル;及び(D)個々の感染AFサンプル。
【0152】
図5は、10〜15kDa範囲におけるコントロールタンパク質及び感染タンパク質の間の発現レベルの顕著な違いを示す。質量分析計を用いて質量検出されたこの質量におけるタンパク質及びタンパク分解性のフラグメントのいくつかが、タンパク質発現レベルを反映した診断プロフィールに関係することと、診断的有用性及び予後的有用性を有することが結論付けられた。
【0153】
実施例6
子宮内感染由来の羊水のWesternブロット分析
100μgのAFタンパク質を4〜20%SDS−PAGEに200Vで60分かけ、PVDF膜に90mMで75分移した。膜を5%ミルクPBSTで室温で45分間ブロックし、1μg/mlの一次抗体(Santa Cruz and Dako)で4℃で一晩インキュベートした。TBSTで3回洗浄した後、膜を二次抗体IgG−HRP(シグマ)で室温で90分間インキュベートし、ECL(Pierce)で視覚化した。
【0154】
この結果を図6に示す:(A)コントロールAFサンプル(プールした);(B)感染したAFサンプル(プールした)。図6は、IGFBP1(11kDa)、プロフィリン及びセルロプラスミン(130kDa)が、感染していないAFと比較して感染したAFでさらに高いレベルで発現していることを示す。L−プラスチンレベルは、感染していないAFと比較して感染したサンプルにおいて、さらに低かった。これらのタンパク質をさらに、MSアプローチを用いてヒトの感染サンプルから同定し(デノボ配列決定)、上の実施例2に列挙した。
【0155】
実施例7
子宮内感染由来の羊水の免疫沈降分析
2μgの一次抗体を600μgのAFタンパク質と混合し、4℃で一晩インキュベートした。15μlのタンパク質G Sepharoseビーズを追加し、シェーカー上で室温で60分インキュベートした。ビーズをIPバッファーで6回洗浄した。
【0156】
結果を図7に示す。ここで、(A)はコントロール羊水サンプル(プールされた)を示し、及び(B)は感染した羊水サンプルを示す。図7は、セルロプラスミン(約130kDa)及びカルグラヌリン(calgranulin)(約16KDa)がコントロール羊水よりも感染した羊水においてさらに高いレベルで発現していることを示す。
【0157】
実施例8
ヒト羊水及び母体血清における示差的なタンパク質発現の検出
羊水中で示差的に発現するタンパク質を、母体血清における同様のタンパク質を測定するための手がかりとして使用することができるか否かを試験した。これにより、診断及び監視のための迅速な非侵襲試験を開発することが可能になる。結果を図8に示す。ここで、(A)はコントロールサンプル(プールされた)であり、(B)は感染サンプルである(プールされた)。
【0158】
図8は、IGFBP−1のより小さなタンパク分解性のフラグメントが、子宮内感染に応答して、AF及び母体血清の両方で一致して示差的に発現することを示す。
【0159】
実施例9
子宮内感染由来の羊水のタンパク質マイクロアレイ分析
抗体:IGFBP−1(DSL);補体C3、Desmin、好中球エラスターゼ、NSE抗体(DAKO);カルグラヌリン(calgranulin)、セルロプラスミン、TIMP−1、プラスチン及びプロファイリング(Santa Cruz)。
【0160】
抗体スポッティング:抗体を40%グリセロール、60%PBS、pH7.5に100μg/mlの濃度で溶解し、Arrayer(Cartesian)を用いてアルデヒドスライドの上にスポッティングした。
【0161】
湿潤チャンバー中室温で3時間インキュベートした後、スライドを1%BSA(w/v)を含有するPBS溶液(pH7.5)中で室温で穏やかに攪拌しながら1時間インキュベートした。
【0162】
タンパク質のビオチン化:Biotin−NHSをDD水に50mg/lで溶解した。この溶液10ulを母体血清タンパク質溶液(10mM PB(pH8.5)中5mg/ml)に添加し、シェーカー上で3時間インキュベートした。5ulのエタノールアミンを添加し反応を停止させた。ビオチン化タンパク質を200ulのTNBバッファーで希釈し、抗体アレイを添加し、4℃で一晩インキュベートした。TNTバッファーで3回洗浄した後、ストレプトアビジン−HRPを添加し、室温で30分インキュベートした。Cy5−チラミド蛍光を用いて抗原−抗体相互作用を検出した。定量のためにスライドをPE蛍光スキャナーでスキャンした。コントロール及び感染したスライドの画像を画像分析プログラムで重ね、相対量について擬似色で表した。結果を図9に示す。ここで、タンパク質アレイの擬似色画像は、対応するタンパク質とそれらの抗体との結合を示す。緑色は感染したサンプルを表し、赤色はコントロールサンプルを表す。部分IIは、カルグラヌリン(calgranulin)発現(緑色)が感染血清サンプルよりも高いことを示すアレイの拡大領域である。部分IIIは、感染羊水サンプル中で同様に多く発現していることを示すカルグラヌリン(calgranulin)IPのWesternブロットである。
【0163】
実施例10
感染した羊水の固有の診断サイン中に表されるタンパク質のさらなる分析
コントロール及び感染した羊水のSELDI−TOFプロフィールが、陽性に感染したサンプルの代表例で、10〜12KDaの質量範囲で固有のサインを示すことが示された(図1、2及び3)。コントロール及び感染した羊水を1−Dゲルで分離し(図5)、プールされたか又は独立した感染羊水サンプル中でさらに豊富な、10〜12KDaの質量範囲におけるバンドを示す。これらの1−Dゲルバンドの単離及び図13に示すようなLCQ−MSを用いたさらなる分析により、IGF−BR−1及びS−100カルシウム結合タンパク質の代表例であるペプチドを同定した。
【0164】
図8に示されるような抗−IGF−BP1抗体を用いたコントロール及び感染した羊水のWesternブロット分析はさらに、感染においてタンパク分解性のフラグメント(約11KDa)の示差的な発現を示す。
【0165】
羊水ポリペプチドの配列決定はさらに、感染した羊水中のIGF−BP1及びカルグラヌリン(calgranulin)の存在を同定した(表3)。
【0166】
IGFBP−1の同定した新規なタンパク分解性のフラグメント配列を図12に示す(SEQ ID NO:1)。図において、感染した羊水の1−Dゲル電気泳動、トリプシン消化及びMS/MS分析後にサンプル中に見出されるペプチド配列「0426seq_HI_12」及び「0425seq_HI−113」を下の枠中に示す(SEQ
ID NO:2及び3)。感染羊水由来のトリプシン消化した約10.5〜12kDaバンドの1−Dゲル中で検出されたIGF−BP−1のタンパク分解性のフラグメント(低分子量範囲、図5)、Westernブロット(図6)、及びMS/MS分析(図13)は、下線を引いた配列の領域で現される(SEQ ID NO:4)。
【0167】
実際に、MS/MS分析及び配列サーチの結果は、図13に示されるマススペクトル中の親イオン434.89がIGF−BP−1配列(RSPGSPEIR)を表すことを示し、IGF−BP−1タンパク分解性のフラグメントの配列マップが図12に示される。親イオン1082.97は、S−100カルシウム結合タンパク質(すなわち、カルグラヌリン(calgranulin)A及びB)を表し、AFのデノボ配列決定によっても独立して同定される(表2及び3)。
【0168】
図14は、図13に示される保持時間17.55〜18.21分のピークのマススペクトルを示す。強く出てくるピークは質量434.9であることが明らかである。図15は、図14に示される434.9ピークの親イオンのMS/MSスペクトルを示す。データベースサーチに基づいて、親イオンはIGFBP−1の部分配列に対応する。
【0169】
実施例11
IAIバイオマーカーの免疫検出
IAIにおいて同定されるタンパク質の示差発現を確認するために、全体的なタンパク質発現分析において同定された11−kDa SELDI−TOF MSプロフィール(カルグラヌリン(calgranulin)B及びIGFBP−1)、1つの免疫制御分子(アズロシジン)、及び制御されていないタンパク質(ビタミンD結合タンパク質)から2つのマーカーを選択した。図16に示されるように、Westernブロット分析は、全ての3つのバイオマーカーが、IAI羊水で行われたタンパク質同定実験と一致する示差的な発現を示すことを確認した。
【0170】
IGFBP−1及びカルグラヌリン(calgranulin)Bに対して開発した特異的抗体を利用することによって、羊水中で示差的に発現したタンパク質が、血清が入手可能な限定された数の患者(n=5)由来のプールされた母体血清中で同定できるか否かを観察した。この限定された分析において、感染羊水とコントロール羊水との間で示差的に存在する11kDaピークに対応する11kDaのタンパク分解性のIGFBP−1及びカルグラヌリン(calgranulin)Bのフラグメントはさらに、IAIに応答して母体血清中で検出された(図16d及びe)。アズロシジンは母体血清中で検出されなかった。
【0171】
実施例12
染色体異数性に特徴的な診断プロフィール
母体血清スクリーニングを用いてトリソミー−21をより正確に同定するためにプロテオームプロファイリングの有用性を試験した。この研究は、パネル(コントロール(n=6)、トリソミー−21(n=6)及びトリソミー−18(n=4)、十分に特徴決定された母体血清サンプル(同じ症例についての羊水サンプルのマッチングは、標準的な染色体マッピング方法及び陽性確認されたトリソミーの存在により試験した)で行ない、子宮内感染モデルについて上に記載されるようなSELDI−TOF方法論を用いて分析した。
【0172】
図10は、トリソミーを区別するための固有のプロフィールを有する母体血清における示差的なタンパク質発現パターンを示す。1μgの母体血清(タンパク質分離カラム(BioRad technologies)でアルブミン及び免疫アルブミンを除去した後)を使用して、上に記載されるように、化学的に定義されたNormal Phaseチップアレイに結合した母体血清抽出物のSELDI−TOF分析を行った。235レーザー強度で集めた全スペクトルは、ピーク強度における差異を示す。(A)コントロール血清;(B)トリソミー−21(ダウンの)血清;(C)トリソミー−18血清。詳細なスペクトルは、4〜15KDa範囲において差異を示し、それぞれの症例について固有である。矢印は、診断スクリーニング試験を開発するためのアルゴリズムを処方するための組み合わせにおいて使用可能な診断ピークを示す。このことはさらに、種々の生体液(例えば母体血清)のタンパク質発現パターンの検出が、胎児−母体の状態を非侵襲アプローチでさらに正確に同定可能であることを示す。
【0173】
臨床的に関連する微生物を利用した実験的な霊長類モデルにおける、および異なる微生物に感染したメスにおける、IAIの設定でのSELDI−TOF MSにおける有意に過剰発現した11kDaピークの検出は、広範囲の病原体によって生じるIAIのこのサインに特定的であることを確認した。この過剰発現したクラスターは、急性炎症をおこした組織中のマクロファージ及び上皮細胞によって発現する、この固有のクラスター中で同定された1セットのタンパク質、すなわち、カルグラヌリン(calgranulin)は、S−100カルシウム結合タンパク質ファミリーのメンバーであるため、感染に対する基本的な子宮内免疫応答を表し得る。このクラスターからの第2の候補は、IGFBP−1の特異的なタンパク分解性のフラグメントであり、感染に応答する潜在的なプロテアーゼ関連機構を示す。インタクトなIGFBP−1は、AFにおいて見出される主要なIGFBPであり、胚膜及び母体の脱落膜の両方によって合成される。IGFBPのタンパク分解性の開裂は、十分に特徴決定された現象であるが(Maile et al.IGF binding protein hydrolysis in various clinical states.In:The IGF System,Li:Rosenfeld CR,Roberts C,Jr.,eds.Totowa,NJ:Humana Press,1999)、本試験において記載される特定のフラグメントは以前に記載されていない。
【0174】
第2のアプローチでは、コントロール及びIAIにおいてAF中で発現するタンパク質のLC−MS/MSを用いた特徴決定により、IAIにおいて感染及び免疫応答に関連する顕著な量の分子を初めて同定した。マクロファージキャッピングタンパク質(MCP)は、アクチンフィラメントを調整し、炎症プロセスに関与するCa+2−感受性タンパク質である(Dabri et al..J Biol Chem 267:16545−52(1992))。白血球エラスターゼ及び好中球ゼラチナーゼに関連するリポカルシン(NGAL)は、静菌機構及び溶菌機構に関与する(Goetz et al.,Mol Cell l):1033−43(2002))。
【0175】
上述の免疫調整剤に加えて、感染に応答するAF中の抗菌性タンパク質Fall−39及びアズロシジンの検出は、子宮内免疫応答における新しい洞察を与える。抗菌性タンパク質Fall−39(LL−37)はバクテリアリポ多糖類に結合し、肥満細胞に対する強力な化学走性因子であり、微生物の局所感染及び全身侵襲を防ぐための最初の防御線として働く(Agerberth et al.,Proc Natl Acad SCI usa 92:195−9(1995))。アズロシジン(CAP37)は、宿主保護及び炎症において重要な関与を有するヒト好中球から単離されたカチオン性抗菌タンパク質である(pEREIRA,j.1EUKQC blOL 57:805−12(1995))。Gp−340改変体タンパク質は、肺において以前に同定されたバクテリアに結合するスカベンジャーレセプターである(Prakobhol et al.,J Biol Chem 275:39860−6(2000))。これらのタンパク質の同定は、IAIのためのバイオマーカーを同定するために使用される感受性のプロテオミクスアプローチを補完する。
【0176】
現在利用可能な実験的な試験を利用して、母体のC−反応性タンパク質の測定、白血球又はグラム染色についてのAFの直接の検査、AF微生物培養又はPCR、AFグルコース及びIL−6濃度の測定、及びAF白血球エステラーゼの検出を含む、IAIの診断を確認した。羊水の微生物培養物及び広い範囲のスペクトルバクテリアrDNAポリメラーゼ連鎖反応のみが、IAIに感受性で特異的であるように思われる。しかし、生殖器マイコプラスマについての微生物培養又はPCRに基づく試験は、広範囲に利用することができず、羊膜穿刺は羊水を得ることが必要である。プロテオミクスに基づくアプローチの1つの利点は、候補ペプチドバイオマーカーによってそれ自身で迅速な作用時点での発育を知ることができ、コスト的にも有効な診断免疫アッセイであることである。他のAF及び血清スクリーニング試験(例えば、神経管不全についてα−フェトタンパク質)と類似して、感染した羊水内で同定されるペプチドは、母体血清中で検出可能であり、非侵襲診断試験における有用性が見出される。上述の実施例において表されるデータ、特にプールされた母体血清を利用するデータは、IGFBP−1制限フラグメント及びカルグラヌリン(calgranulin)Bが、IAI中にAF及び母体の血液中に現れる2つのバイオマーカーであるが、感染の非存在下ではそうではないこのアプローチの容易性を示す。
【0177】
まとめると、プロテオミクスに基づくAFの分析は、実験的な非ヒト霊長類モデル及び早産及び潜伏性のIAIをもつ女性のコホートの両方において、IAIについてのバイオマーカーを同定するために使用された。診断タンパク質発現プロフィールを、IAIの検出において感受性で特異的なSELDI−TOF MSプロファイリングによって同定した。AF中で発現したタンパク質の高スループット分析によって、いくつかの免疫制御分子の発現を初めて同定した。診断11kDaピークにおいて検出されるタンパク質(IGFBP−1及びカルグラヌリン(calgranulin)B)の免疫検出は、IAI中の羊水中及び母体血液中のこれらのバイオマーカーの存在及び示差的な発現を確認した。本明細書中で示されるデータは、妊娠中の潜伏性のIAIを検出する迅速で非侵襲アッセイの基礎として役立つ。このことは、特異的な介入及び治療トライアルにおいて、臨床医及び観察者が早期分娩について高いリスクを有する女性の特定のサブグループを標的にすることができるため、重要なブレークスルーである。最後に、これらの試験は、感染及び炎症プロセス及び概して妊娠の病態生理学についての特定のバイオメーカー及び診断プロフィールを同定するためのプロテオミクスに基づくアプローチの有用性を示す。それ故に、本明細書中で示されるデータは、羊水及び他の生体液(例えば血清)中のタンパク質の示差的な発現を示し、迅速な、非侵襲及び正確な種々の母体/胎児の状態及び染色体異数性の診断、予後及び監視のための有効なアプローチを示す。
【0178】
上述の記載を通して、本発明は、特定の実施形態を参照して議論されるが、それらに限定されない。実際に、本明細書中に示され記載されるものに加えて、本発明の種々の改変は、上述の記載から当業者に明らかであり、添付の特許請求の範囲内のものである。
【0179】
記載全体で引用される全ての参考文献、及び本明細書中で引用される参考文献は、本明細書中にその全体が参考として組み込まれる。
【特許請求の範囲】
【請求項1】
明細書中に記載の発明。
【請求項1】
明細書中に記載の発明。
【図1A】


【図1B】


【図1C】


【図2】


【図3A】


【図3B】


【図3C】


【図4A】


【図4B】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】




【図1B】


【図1C】


【図2】


【図3A】


【図3B】


【図3C】


【図4A】


【図4B】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【公開番号】特開2010−122238(P2010−122238A)
【公開日】平成22年6月3日(2010.6.3)
【国際特許分類】
【出願番号】特願2010−44772(P2010−44772)
【出願日】平成22年3月1日(2010.3.1)
【分割の表示】特願2006−507518(P2006−507518)の分割
【原出願日】平成16年3月23日(2004.3.23)
【出願人】(505359229)プロテオジェニックス, インコーポレイテッド (4)
【Fターム(参考)】
【公開日】平成22年6月3日(2010.6.3)
【国際特許分類】
【出願日】平成22年3月1日(2010.3.1)
【分割の表示】特願2006−507518(P2006−507518)の分割
【原出願日】平成16年3月23日(2004.3.23)
【出願人】(505359229)プロテオジェニックス, インコーポレイテッド (4)
【Fターム(参考)】
[ Back to top ]

