疎水性固体支持体を利用した細胞分離方法
【課題】迅速で簡便な細胞またはウイルスの分離方法を提供する。
【解決手段】水接触角が70〜90°である疎水性固体支持体に、細胞またはウイルスを含む溶液を接触させる段階を含む疎水性固体支持体を利用した細胞またはウイルスの分離方法である。ウイルスは、バクテリア、バクテリオファージ、植物細胞、動物細胞、植物ウイルス、および動物ウイルスから構成される群から選択、疎水性固体支持体は、平面構造、ピラー構造、ビーズ構造、および篩構造から構成される群から選択。
【解決手段】水接触角が70〜90°である疎水性固体支持体に、細胞またはウイルスを含む溶液を接触させる段階を含む疎水性固体支持体を利用した細胞またはウイルスの分離方法である。ウイルスは、バクテリア、バクテリオファージ、植物細胞、動物細胞、植物ウイルス、および動物ウイルスから構成される群から選択、疎水性固体支持体は、平面構造、ピラー構造、ビーズ構造、および篩構造から構成される群から選択。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、疎水性固体支持体を利用した細胞分離方法に関する。
【背景技術】
【0002】
不純物を含む混合物からの細胞の分離は、当業界で重要な問題である。特に、高効率で細胞を捕獲したり、実質的に全ての細胞をそのまま捕獲する必要がある場合、または細胞が培養培地、生物学的試料などの複雑な混合物中に存在する場合に重要である。つまり、細胞濃縮および分離段階に利用された試薬は、多様な範囲の濃度の細胞を非常に効率的に捕獲しなければならない。また、利用された試薬は、細胞を利用し、前記細胞から核酸を回収し、前記核酸を加工するような下流(downstream)段階を妨害してはならない。
【0003】
固体支持体への細胞の結合は、任意の公知の方法により達成されうる。例えば、支持体への細胞の非特異的な結合は、固体支持体の性質および周囲の条件、例えば、固体支持体の表面の化学的または物理的性質(例えば、疎水性または電荷)、分離用媒質のpHまたは組成など、の適当な選択により達成されうる。標的細胞の性質もまた重要である。例えば、特定の疎水性細胞は、疎水性表面に非特異的に容易に結合できる。一方、親水性細胞は、親水性表面に容易に結合できる。また、Bリンパ球のような負に荷電した細胞は、弱く正に荷電した表面に高度に非特異的な結合をする。したがって、所望の型の細胞を結合するために、適当に荷電された表面を有する固体支持体が利用されうる。固体支持体および試料が適当な媒質に接触し、細胞の結合のための適当な条件を達成するために、適当な緩衝液が細胞分離用媒質として利用されうる。適当な電荷、浸透圧を有する緩衝液が固体支持体と接触する前に、または同時に、または接触後に、簡便に添加されうる。
【0004】
特許文献1には、細胞結合モイエティでコーティングされた固体支持体上に、試料中の細胞を結合させるステップと、分離された細胞を溶解するステップとを含む、細胞試料から核酸を分離する方法が記載されている。特許文献1では、固体支持体としてグリシジル−ヒスチジン修飾された磁気ビーズを利用している。
【0005】
特許文献2には、細胞と、ポリアミンまたは陽イオン性界面活性剤であり、細胞を凝集できる凝集剤を含む混合物を、細胞を結合できる固相と接触させるステップと、固相を利用して前記混合物から凝集された細胞を分離するステップと、前記細胞から標的核酸を精製するステップとを含む、標的核酸を含む細胞を分離する方法が記載されている。特許文献2では、固相として磁気ビーズを利用している。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】米国特許第6,617,105号明細書
【特許文献2】国際公開03/102184号パンフレット
【発明の概要】
【発明が解決しようとする課題】
【0007】
しかしながら、例えばバクテリアやウイルスから核酸を精製するとき、バクテリアまたはウイルスの初期濃度が非常に低いときには濃縮が必要であるが、特に、ラボオンチップ(LOC:Lab−on−a−chip)のような小型化されたチップを利用する場合には、試料の体積がどうしても小さくなってしまうので、前記のような従来技術では、細胞またはウイルスの分離および濃縮を行うことは困難である。したがって、迅速であり、簡単な、効率のよい細胞分離のために、さらなる研究が要求されている。
【課題を解決するための手段】
【0008】
本発明の発明者らは、細胞またはウイルスの分離方法を研究していたところ、特定の水接触角を有する疎水性固体支持体を利用することにより、迅速であり、かつ効率的に細胞またはウイルスを分離できることを発見して本発明を完成するに至った。
【0009】
本発明は、水接触角が70〜90°である疎水性固体支持体に、細胞またはウイルスを含む溶液を接触させる段階を含む疎水性固体支持体を利用した細胞またはウイルスの分離方法を提供する。
【0010】
さらに、本発明は、水接触角が70〜90°である疎水性固体支持体を含む試料内の細胞またはウイルスを分離するための装置を提供する。
【発明の効果】
【0011】
本発明によれば、疎水性固体基板に、単に細胞またはウイルスを吸着させることによって細胞またはウイルスを分離できるので、迅速であり、かつ簡単に細胞またはウイルス分離効率を上昇させることができる。また、三次元マイクロ構造を利用して細胞分離効率を顕著に向上させることができ、流体制御システム下で数分以内に細胞分離が可能である。さらに、唾液のような試料から細胞分離が可能であり、LOCでの試料製造に応用可能である。
【図面の簡単な説明】
【0012】
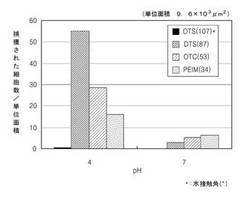
【図1】pH4およびpH7で多様な水接触角を有する固体支持体に捕獲された大腸菌細胞の数を表したグラフである。
【図2】pH4およびpH7で、親水性であるアルミナ基板(水接触角20°未満を有する)には、大腸菌細胞が全く捕獲できないということを示す顕微鏡写真である。
【図3】流体制御システムで、本発明の固体支持体に捕獲された大腸菌細胞を示す顕微鏡写真ある。
【図4】流体制御システムで、本発明の固体支持体に捕獲されたグラム陰性菌であるシュードモナス・プチダおよび大腸菌(BL21)細胞を示す顕微鏡写真である。
【図5】流体制御システムで、本発明の固体支持体に捕獲されたグラム陽性菌であるストレプトコッカス・ミュータンスおよびスタフィロコッカス・エピデルミディス細胞を示す顕微鏡写真である。
【図6】アルコールのような添加物により、本発明の固体支持体に捕獲される細胞の数が増加することを示すグラム陽性菌であるスタフィロコッカス・エピデルミディスの顕微鏡写真である。
【図7】アルコールのような添加物により、本発明の固体支持体に捕獲される細胞の数が増加することを示すグラム陰性菌である大腸菌(BL21)の顕微鏡写真である。
【図8】デザインされた菱形および櫛目形ピラーの配列を上から見た模式図である。
【図9】シリコン基板上にSAMコーティング方法で作られた菱形および櫛目形ピラーの配列を有するチップのSEMイメージある。
【図10】SU−8を利用して製造された菱形ピラーの配列を有するチップのSEMイメージである。
【図11】本発明の三次構造の疎水性固体支持体であるピラー配列を有するチップに捕獲されたグラム陽性および陰性菌の顕微鏡写真である。
【発明を実施するための形態】
【0013】
本発明の目的を達成するために、本発明は、水接触角が70〜90°である疎水性固体支持体に、細胞またはウイルスを含む溶液を接触させる段階を含む疎水性固体支持体を利用した細胞またはウイルスの分離方法に関する。
【0014】
本発明は、疎水性固体支持体を利用して細胞を捕獲する方法に係り、具体的には、特定のpH範囲で特定の範囲の水接触角を有する固体支持体を利用して細胞を捕獲する方法に関する。前記方法で、細胞凝集や沈殿を誘導しうる添加物を添加すれば、細胞捕獲の効率を上げることができる。
【0015】
小型化されたチップ上で具現可能な細胞捕獲/分離方法のうちの一つが固体支持体を利用することである。固体支持体を利用することは、LOCを具現できる長所を有し、細胞と固体支持体との間の物理的な相互作用を利用して細胞を捕獲できる。前記相互作用には、静電吸着および疎水性相互作用があるが、前者は、一般的に、細胞表面が負電荷であるため、静電的に正電荷を有するアルミナのような物質を利用して細胞を分離できる。本発明に該当する後者は、細胞および固体支持体の表面の自由エネルギーから発生する物理的相互作用により起こる細胞付着であり、これは、表面熱力学法則により支配される。細胞および固体支持体の表面の疎水性は、周辺環境のpHにより変わりうるために、pH条件が重要な因子になりうる。固体支持体表面の疎水性の程度を知る代表的な方法が水接触角を測定することである。固体表面の水接触角が大きいほど疎水性の程度が大きい。
【0016】
細胞またはウイルスを含む溶液を水接触角が70〜90°である疎水性固体支持体と接触させれば、細胞またはウイルスは、疎水性固体支持体との疎水性相互作用などにより固体支持体に結合される。親水性の固体支持体は、下記実施例で示すように、細胞またはウイルスとほとんど結合しない。また、疎水性固体支持体のうちでも、水接触角が前記範囲を外れれば、細胞またはウイルスが疎水性固体支持体に結合する程度が低下する。
【0017】
前記細胞またはウイルスと疎水性固体支持体との接触は、pH2.5〜7、望ましくは、pH2.5〜4で行われうる。細胞またはウイルスを含む溶液が前記pH範囲を外れれば、疎水性固体支持体に対する細胞またはウイルスの結合効率が顕著に低下するためである。
【0018】
本発明の一具現例で、本発明の方法は、前記細胞またはウイルスが結合した疎水性固体支持体を洗浄する段階をさらに含むことができる。細胞またはウイルスの結合した疎水性固体支持体をリン酸塩緩衝液(PB)のような洗浄液を利用して洗浄すれば、疎水性固体支持体に結合されていない物質は、除去され、疎水性固体支持体には、標的物質である細胞またはウイルスが主に結合することとなる。従って、細胞またはウイルスを含む溶液から細胞またはウイルスを選択的に分離でき、これにより、細胞またはウイルスが濃縮されるという効果も得られる。
【0019】
本発明の方法で、前記細胞またはウイルスを含む溶液は、唾液、血液、尿、緩衝液またはこれらの混合液でありうるが、それらに限定されるものではない。
【0020】
本発明の方法で、前記細胞またはウイルスを含む溶液を接触させる段階は、静的または流体状態で行うことができる。流体制御システムにおいて、前記疎水性固体支持体は、平面構造またはピラー構造、ビーズ構造または篩構造のような三次元構造を取りうる。前記三次元構造は、細胞またはウイルスと疎水性固体支持体との接触表面積を増やし、それによって、さらに多くの細胞またはウイルスを捕獲できるようになる。
【0021】
本発明の方法で、前記ピラーの縦横比は、1:1〜20:1であることが望ましい。縦横比は、ピラーの高さ対幅の比率を意味するものであり、各ピラーの縦横比が前記範囲を外れれば、細胞またはウイルスが疎水性固体支持体に結合される効率が低下してしまうおそれがある。
【0022】
本発明の方法で、前記ピラーは、ピラーの高さ(H)とピラー間の距離(D)との比率が1:1〜25:1であることが望ましい。ピラーの高さ(H)のピラー間の距離(D)に対する比率が1未満である場合には、細胞またはウイルスを捕獲する効率が低下してしまうという問題点が発生しうる。
【0023】
本発明の方法で、前記ピラーは、ピラー間の距離(D)が5μm〜100μmであることが望ましい。ピラー間の距離(D)は、各ピラー間の距離を意味するものであり、ピラー間の距離が前記範囲未満ならば、シリコン表面のような固体支持体上にこれを製作し難く、前記範囲を超えれば、同じ面積のチップ上でピラーの数が減少してしまうので、細胞またはウイルスを捕獲する効率が低下してしまうおそれがある。
【0024】
本発明の方法で、前記疎水性固体支持体は、特に制限されないが、基板、粒子、シート、ゲル、フィルタ、膜、ファイバ、毛細管、チューブ、プレートまたはウェルの形態を有することができる。前記疎水性固体支持体は、細胞またはウイルスを捕獲できるものであるならば、特別に制限されるものではないが、細胞またはウイルスを含む溶液中に溶解されてはならない。
【0025】
前記支持体は、例えば、ガラス、シリカ、ラテックスまたは重合体性物質で簡便に製造されうる。細胞を結合する大きい表面積を提供する物質が望ましい。前記支持体は、一般的に、平面でない表面を有することができ、例えば、多孔性または微粒子でありうる。前記疎水性固体支持体は、例えば、オクタデシルトリクロロシラン(OTS)、トリデカフルオロオクチルトリメトキシシラン(DTS)、塩化オクタデシルジメチル(3−トリメトキシシリルプロピル)アンモニウム(OTC)、ポリエチレンイミントリメトキシシラン(PEIM)のような物質を用いて調製されうる。前記物質の構造式は、下記の通りである。
【0026】
【化1】

【0027】
前記物質は、固体支持体に所望の疎水性を提供できる物質であり、細胞またはウイルスを捕獲できる物質ならば、特別に制限されるものではない。
【0028】
本発明の方法で、前記細胞またはウイルスは、好ましくは、バクテリア、バクテリオファージ、植物細胞、動物細胞、植物ウイルス、動物ウイルスなどを含むことができる。バクテリアは、グラム陽性および陰性バクテリアのいずれもが疎水性固体支持体に結合され、例えばエタノールのようなバクテリア細胞間の凝集または沈殿を誘発しうる物質を添加することにより、疎水性固体支持体にバクテリアが結合する効率をさらに上昇させることができる。
【0029】
本発明の方法で、前記細胞またはウイルスを含む溶液と疎水性固体支持体との接触段階において、前記溶液にはアルコールまたは塩が添加されうる。このようなアルコールまたは塩の添加によって、細胞間の凝集または固体支持体上への沈殿が誘発され、固体支持体上への細胞の結合の効率が上昇する。上述のアルコールまたは塩の添加は、例えば、細胞をアルコールまたは塩の存在下で支持体と接触させることによって達成できる。沈殿のような分離および精製の操作におけるアルコールまたは塩の利用は一般的であり、上記の操作に利用される任意のアルコールまたは塩が利用されうる。この際、アルコールは、任意のアルコールであり、イソプロパノールおよびエタノールのような低級アルコールが適している。その他に適したアルコールには、メタノールおよびn−ブタノールなどが含まれる。
【0030】
塩は、任意の便利な供給源、例えば、ナトリウムもしくはカリウムの塩化物もしくはアセテートまたはアンモニウムアセテートにより提供されうる。アルコールおよび塩の適当な濃度は、用いられる系および試薬によって決定されうる。一般的に、試料に対して0.5ないし3体積のアルコール、例えば、1体積のアルコールが適している。アルコールは、50〜100%(w/v)の濃度で利用されうる。塩の濃度は、細胞またはウイルスを含む溶液に対して、0.01ないし10.0M、望ましくは、0.01ないし7.0M、さらに望ましくは、0.01ないし2.0Mが適し、塩は、前記濃度でアルコール溶液中に含まれうる。それにより、いわゆる所望の濃度のアルコールおよび塩を含む「細胞結合緩衝液」が調製されうる。塩およびアルコールは、別個に添加されてもよい。
【0031】
本発明による細胞に対する沈殿剤としてのアルコールの利用は、臨床診断への応用に有効であるが、それは、臨床試料を保存するためのアルコールの利用が一般的であるためである。患者から採取した試料は、アルコールを含む細胞結合のための緩衝液に加えられ、同時に試料が保存される。
【0032】
塩/アルコールを利用して細胞を沈殿させるかわりに、塩および/またはアルコールと組み合わせて、または単独でポリエチレングリコール(PEG)または類似の性質を有する高分子量重合体のような、その他の沈殿剤が利用されうる。前記重合体の濃度は、具体的な系、例えば、重合体および細胞の型に依存して変わりうるが、一般的に、1ないし50%(w/v)、例えば、2ないし30%でありうる。
【0033】
食作用活性(phagocytic activity)を有する細胞は、例えば、ビーズのような粒子状の固相を結合または貪食する能力により捕獲でき、容易に分離されうる。その場合、細胞を含む試料は単に適当な条件の下に固相との接触またはインキュベーションを行えばよい。かかる種類の細胞捕獲は、特異的な結合に依存しない。
【0034】
最終的に、前述のように、荷電した、疎水性または親水性表面を有する固体支持体に対する細胞結合は、結合に適したpH条件を達成するために、しばしば塩と組み合わされた緩衝液を利用することによって達成されうる。具体的な緩衝液および条件は、細胞の型、固体支持体などに依存して変わりうる。
【0035】
溶液の成分が混合された後、細胞が支持体に結合するように適当な時間放置される。支持体は、支持体の特性に依存する任意の手段により溶液から除去され、試料の上澄み液から支持体を除去するか、またはこれと反対に支持体を除去するあらゆる形態、例えば、遠心分離、ピペットの操作などの手段が用いられうる。
【0036】
前記結合および分離の条件は、特に制限されないが、例えば、固相の存在下に、単に試料と「細胞結合緩衝液」とを混合し、分離前に室温で5ないし30分、例えば、20分間放置できる。前述のように、反応時間は特に制限されず、5分程度でもよい。しかし、さらに長い時間、例えば、20分ないし3時間、または1日が利用されうる。混合は、例えば、撹拌またはボルテキシングを含む任意の手段により行われうる。また、必要ならば、高温または低温で行われうる。
【0037】
本発明によれば、細胞の疎水性固体支持体に対する吸着が望ましいが、核酸を含む所望の細胞の選択的な捕獲ができるように修飾された固体支持体を利用することも可能である。それにより、例えば、所望の細胞の型に対して特異的な抗体、またはレクチンのようなその他の結合蛋白質を有する支持体が利用されうる。この場合、混合物内の所望の標的由来の核酸のみが分離されうるために、核酸の分離に高度な選択性を導入できる。上述のような選択的な細胞捕獲マトリックスの製造は当業界に周知である。
【0038】
本発明の他の目的を達成するために、本発明は、水接触角が70〜90°である疎水性固体支持体を含む試料内細胞またはウイルスを分離するための装置を提供する。
【0039】
前記疎水性固体支持体は、水接触角が70〜90°であり、細胞またはウイルスと疎水性固体支持体との接触はpH2.5〜7、望ましくは、pH2.5〜4で行われうる。前記疎水性固体支持体は、例えば、基板、粒子、シート、ゲル、フィルタ、膜、ファイバ、毛細管、チューブ、プレートまたはウェルの形態を有することができる。前記疎水性固体支持体は、細胞またはウイルスを捕獲できるものであるならば、特別に制限されるものではないが、細胞またはウイルスを含む溶液中に溶解されてはならない。
【0040】
前記支持体は、例えば、ガラス、シリカ、ラテックスまたは重合体性物質で製造されうる。細胞を結合する大きい表面積を提供する物質が望ましい。前記支持体は、一般的に平面ではない表面を有することができ、例えば、多孔性または微粒子でありうる。前記疎水性固体支持体は、例えば、OTS、DTS、OTC、PEIMのような物質で製造されうる。前記物質は、固体支持体に所望の疎水性を提供できる物質であり、細胞またはウイルスを捕獲できる物質ならば、特別に制限されるものではない。
【0041】
本発明の装置で、前記疎水性固体支持体は、例えば、平面構造、ピラー構造、ビーズ構造、篩構造を有することができる。流体制御システムで、疎水性固体支持体は、平面構造またはピラー、ビーズまたは篩のような三次元構造を取りうる。前記三次元構造は、細胞またはウイルスと疎水性固体支持体との接触表面積を増やし、さらに多くの細胞またはウイルスを捕獲できる。
【0042】
本発明の装置で、前記ピラーの縦横比は、1:1〜20:1であることが望ましい。縦横比は、ピラーの高さ対幅の比率を意味するものであり、各ピラーの縦横比が前記範囲を外れれば、細胞またはウイルスが疎水性固体支持体に結合される効率が低下してしまうおそれがある。
【0043】
本発明の装置で、前記ピラーは、ピラーの高さ(H)とピラー間の距離(D)との比率が1:1〜25:1であることが望ましい。ピラーの高さ(H)のピラー間の距離(D)に対する比率が1未満である場合には、細胞またはウイルスを捕獲する効率が低下してしまうという問題点が発生しうる。
【0044】
本発明の装置で、前記それぞれのピラーは、ピラー間の距離(D)が5μm〜100μmであることが望ましい。ピラー間の距離(D)は、各ピラー間の距離を意味するものであり、ピラー間の距離が前記範囲未満ならば、シリコン表面のような固体支持体にこれを製作し難く、前記範囲を超えれば、同じ面積のチップ上でピラーの数が減少するようになるので、細胞またはウイルスを捕獲する効率が低下してしまうおそれがある。
【0045】
本発明の装置は、細胞またはウイルス含有溶液を含むチャンバをさらに含むことができる。前記チャンバはマイクロチャンバでありうる。また、前記装置は、細胞またはウイルス含有溶液を含むこともできる。
【0046】
前記細胞またはウイルス含有溶液は、例えば、唾液、血液、尿、緩衝液またはこれらの混合液でありうるが、それらに限定されるものではない。
【実施例】
【0047】
以下、実施例を介して本発明をさらに詳細に説明する。それら実施例は、単に本発明を例示するためのものであり、本発明の範囲がそれら実施例により制限されるものと解釈されるものではない。
【0048】
<実施例1:本発明の疎水性固体基板を利用した大腸菌細胞の分離>
本発明の方法によりバクテリア細胞を効率的に分離できることを確認するために、グラム陰性細胞である大腸菌株(Escherichia coli HB101)を利用した。実験に利用された固体基板としては、OTS、DTS、OTC、PEIMを用いて調製された基板を利用した。
【0049】
1)細胞培養
大腸菌細胞を一般的な手順により、37℃で対数期まで一晩培養した。
【0050】
2)細胞溶液準備
一晩培養した大腸菌細胞を800×gで5分間遠心分離して細胞を沈殿させた。次に、1×PBS(リン酸緩衝生理食塩水、pH7.4、Invitrogen corporation)5mlを利用して3回洗浄した。洗浄は、1×PBSに沈殿した大腸菌細胞を再懸濁した後、再懸濁された大腸菌細胞を800×gで5分間遠心分離する過程を反復することによって行った。洗浄の完了した大腸菌細胞を0.1Mのリン酸ナトリウム緩衝液(pH4)および0.1Mのリン酸ナトリウム緩衝液(pH7)5mlにそれぞれ懸濁した。懸濁された大腸菌細胞の初期量を、UV分光計でOD(Optical Density)値を測定することによって求めた。大腸菌細胞の初期量は、0.1Mのリン酸ナトリウム緩衝液(pH4)の場合に、600nmでOD値が0.475であり、これは、細胞懸濁液60μlに対して1.43×107細胞であり、0.1Mのリン酸ナトリウム緩衝液(pH7)の場合には、0.454であり、これは、60μlに対して1.36×107細胞ほどの量と推定される(一般的に、600nmで1のOD値は、大腸菌の場合、5.0×108細胞/mlほどの濃度に対応する)。
【0051】
3)固体基板の調製
固体基板の調製は、SAM(Self Assembled Monolayer)法を利用した。詳細な製造過程は、下記の通りである。
【0052】
(1)ガラス洗浄
ピラニア溶液にウェーハを2時間以上浸漬させた後、ガラスを1枚ずつスピン乾燥させる。
【0053】
(2)コーティング液の調製
最終濃度がそれぞれ100mMになるように前記OTSおよびDTSをそれぞれトルエンと混合し、前記OTCおよびPEIMをそれぞれエタノールと混合した後、1時間撹拌する。
【0054】
(3)ガラス浸漬
前記(2)で調製したそれぞれの溶液に、(1)で洗浄したガラスを入れ、4時間浸漬する。
【0055】
(4)ガラス洗浄
前記浸漬されたガラスをエタノールでそれぞれ10分ずつ3回洗浄した後、真空乾燥させる。
【0056】
(5)インキュベーション
前記乾燥されたガラスを120℃で1時間インキュベーションする。
【0057】
4)細胞結合
60μlパッチを上記で製造した固体基板上に付着した後、細胞懸濁液を60μl塗布した。次に、室温で5分間インキュベーションした後、0.1Mのリン酸ナトリウム緩衝液(pH4)および0.1Mのリン酸ナトリウム緩衝液(pH7)30mlでそれぞれ10分間1回洗浄した。洗浄手順は、前記と同一に行った。
【0058】
5)測定
固体基板に結合された大腸菌細胞を染色するために、当業界に公知の大腸菌細胞用グラム染色液で大腸菌細胞を染色した。まず、クリスタルバイオレット溶液を細胞が結合された部位を十分に覆うほどの量を加えた後で1分間待った後、流水で洗浄した。次に、グラムヨード液、グラム脱色剤、グラムサフラニン溶液を同じ方法で処理してグラム染色を完成した。グラム染色後、固体基板を常温で自然乾燥させた。その後、光学顕微鏡を利用して2,000倍で3ポイントのイメージを撮影して単位面積当たり捕獲された細胞数を測定した。
【0059】
図1は、それぞれpH4およびpH7で、多様な水接触角を有する固体支持体に捕獲された大腸菌細胞の数を表したグラフである。単位面積は、9.6×103μm2であり、括弧内の数字は、水接触角(°)を表す。左側のパネルは、pH4で捕獲された細胞数を表し、右側のパネルは、pH7で捕獲された細胞数を表す。図1に示すように、pH7の緩衝液を利用した場合には、pH4の場合に比べて、結合される大腸菌細胞が少ないということが分かる。従って、細胞またはウイルスを固体基板に接触させるときのpHが非常に重要であるということが分かる。
【0060】
また、四種の固体基板のうち、DTSで調製された固体基板が細胞結合効率が最も高いということが分かる。DTSで調製された固体基板は、水接触角が87°であり、他の水接触角を有する固体基板より細胞捕獲効率が高い。したがって、水接触角が細胞捕獲効率に非常に重要であるということが分かる。
【0061】
<比較例1:アルミナ基板を利用した大腸菌細胞の分離>
実施例1に利用された固体基板の代わりに、水接触角が14.6°であるアルミナ基板を利用したことを除いては、実施例1と同様の方法で実験を行った。図2は、それぞれpH4およびpH7での、親水性であるアルミナ基板(水接触角20°未満を有する)の顕微鏡写真を表したものである。図2で、「1」と表示されたパネルは、pH4の場合であり、「2」と表示されたパネルは、pH7の場合である。図2で示すように、pH4およびpH7の場合のいずれも大腸菌細胞がほとんど結合されていないということが分かる。すなわち、水接触角が30°以下である親水性のアルミナでは、大腸菌細胞がほとんど結合されない。
【0062】
<実施例2:流体制御下の大腸菌細胞の分離>
流体制御システムにおいて、基板に対する大腸菌結合能を知るために、固体基板の表面として水接触角75°のCRS(Charge Reversible Surface、大韓民国特許出願第2005−0030286号参照)を利用した。シリンジポンプ(HARVARD、PHD2000)を利用し、流速を0.3cm/秒(900μl/分)とした。表面の総面積は、5mm×17.3mmであり、断面積は、5mm2(縦5mm×横1.05mm)であり、断面の縦横比が5以上であった。バクテリア細胞として、大腸菌HB101 200μl、pH4(バクテリア濃度が1.0×105細胞/μl)を利用した。上述の流速で、バクテリア細胞200μlを、表面を一回通過させた。流速900μl/分でリン酸ナトリウム緩衝液(pH4、0.1M)1mlを一回流して洗浄した。残りの過程は、実施例1と同じように行った。
【0063】
図3は、流体制御システムで、本発明の固体支持体に捕獲された大腸菌細胞の顕微鏡写真を表したものである。表面1および2は、複数回の実験の結果である。図3に示すように、倍率450倍では、固体基板に結合された大腸菌細胞の判別が明確ではないが、倍率2,000倍では、桿状の大腸菌細胞が観察されるということが分かる。従って、固定されたシステムと同じように、流体制御システム下でも大腸菌細胞が、本発明の方法によって、基板に効率的に結合されるということが分かる。
【0064】
<実施例3:流体制御の下での四種の異なる細胞の分離>
実施例2で、大腸菌細胞HB101の代わりにグラム陰性菌である大腸菌BL21細胞およびシュードモナス・プチダ(Pseudomonas putida)、並びにグラム陽性菌であるストレプトコッカス・ミュータンス(Streptococcus mutans)およびスタフィロコッカス・エピデルミディス(Staphylococcus epidermidis)を利用したことを除いては、実施例2と同様に実験を行った。
【0065】
図4は、流体制御システムで、本発明の固体支持体に捕獲されたグラム陰性菌であるシュードモナス・プチダおよび大腸菌(BL21)細胞の顕微鏡写真を表したものである。上段に表記された6、7(1)、7(2)、8および15、16、17は、試料番号を表す。図4に示すように、グラム陰性菌であるシュードモナス・プチダおよび大腸菌BL21細胞は、固体基板の表面に比較的均一に付着が良好になされているということが分かる。また、試料7(1)のように、細胞が高密度にまとまって付着しているところも発見された。従って、グラム陰性菌であるシュードモナス・プチダおよび大腸菌BL21細胞は、流体制御システムで、本発明の方法によって、固体基板に効率的に結合するということが分かる。
【0066】
図5は、流体制御システムで、本発明の固体支持体に捕獲されたグラム陽性菌であるストレプトコッカス・ミュータンスおよびスタフィロコッカス・エピデルミディス細胞の顕微鏡写真を表したものである。上段に表記された9、10および11は、ストレプトコッカス・ミュータンスの試料番号を表し、12、13および14は、スタフィロコッカス・エピデルミディスの試料番号を表す。図5に示すように、グラム陽性菌であるストレプトコッカス・ミュータンスおよびスタフィロコッカス・エピデルミディス細胞は、固体基板の表面に付着しているということを観察できるが、その効率が図4で示したグラム陰性菌のものより顕著に低いということが分かる。
【0067】
グラム陰性菌である大腸菌BL21細胞およびシュードモナス・プチダ細胞が本発明の方法によって、固体基板に付着している程度を下記表1に要約した。
【0068】
【表1】

【0069】
<実施例4:添加剤を利用した細胞の分離>
流体制御システムで、アルコールおよび/または塩の添加による本発明の基板に対する細胞結合能を知るために、固体基板の表面として、水接触角70°のエチルトリメトキシシランを利用した。シリンジポンプ(HARVARD、PHD2000)を利用し、流速は、0.6cm/秒(900μl/分)であった。表面の総面積は、5mm×17.3mmであり、断面積は、2.5mm2(縦5mm×横0.5mm)であり、縦横比が10以上であった。バクテリア細胞は、それぞれ大腸菌BL21、スタフィロコッカス・エピデルミディス200μl(2.0×107細胞)を利用した。
【0070】
細胞懸濁培地に添加した添加剤は、0.1Mのリン酸塩緩衝液(pH4)中のPEG 10,000(w/v20%)(図6で、「PEG」と表示される)、0.1Mのリン酸塩緩衝液(pH4)中のエタノール(v/v50%)(図6で、「EtOH」と表示される)、3Mの塩化ナトリウム(pH4)中のイソプロピルアルコール(IPA)(v/v25%)(図6で、「IPA」と表示される)を利用し、対照群として、0.1Mのリン酸塩緩衝液(pH4)を利用した。上記流速で、バクテリア細胞200μlを、表面を一回通過させた。流速900μl/分でリン酸ナトリウム緩衝液(pH4)1mlを一回流して洗浄した。残りの過程は実施例1と同じように行った。
【0071】
図6は、固体支持体に捕獲されたグラム陽性菌であるスタフィロコッカス・エピデルミディスの1,000倍の倍率で撮影した顕微鏡写真を表したものである。図6に示すように、グラム陽性菌であるスタフィロコッカス・エピデルミディスは、対照群として0.1Mのリン酸塩緩衝液(pH4)を利用した場合には、細胞がほとんど基板に結合しておらず、PEGを添加した場合にも、細胞がほとんど基板に結合していない。しかし、IPAおよびEtOHの場合には、相当量の細胞が固体基板に結合しているということが分かる。従って、グラム陽性菌の場合にも、アルコールおよび/または塩がない場合には、疎水性固体基板に結合される程度がかなり低いが、アルコールおよび/または塩を添加した場合には、疎水性固体基板に結合する程度がかなり上昇するということが分かる。
【0072】
図7は、アルコールのような添加物により、固体支持体に捕獲されたグラム陰性菌である大腸菌(BL21)の1,000倍の倍率で撮影した顕微鏡写真を表したものである。単位面積(6×104μm2)に結合した大腸菌BL21細胞の数は、対照群の場合には、33個の細胞、PEGの場合には、23個の細胞、IPAの場合には、123個の細胞、およびEtOHの場合には、145個の細胞であった。図7に示すように、グラム陰性菌であるBL21は、対照群として0.1Mのリン酸塩緩衝液(pH4)を利用した場合およびPEGを添加した場合にも細胞が基板に結合するが、IPAおよびEtOHの場合に、さらに多くの細胞が固体基板に結合するということが分かる。従って、グラム陰性菌の場合にも、アルコールおよび/または塩がない場合に比べ、アルコールおよび/または塩を添加した場合には、疎水性固体基板に細胞がさらに多く結合するということが分かる。
【0073】
<実施例5:三次元構造の疎水性固体支持体を有するマイクロチップの製作>
二次元構造である平面の固体基板を利用した実施例2とは異なり、三次元構造の疎水性固体支持体を有するマイクロチップを利用し、流体制御システムで大腸菌結合能を調べた。二種のマイクロチップを製作した。一方は、シリコン基材チップ(Si/SiO2/SAM)であり、他方は、SU−8チップである。
【0074】
まず、シリコン基材チップ(Si/SiO2/SAM)の作製過程は下記のようである。
【0075】
(1)ウェーハ洗浄
ピラニア溶液(H2SO4:H2O2=3:1、120℃)で15分間処理し、流水で洗浄後に乾燥する。
【0076】
(2)HMDSコーティング
洗浄の完了したウェーハをスピンコーティングでヘキサメチルジシラザン(HMDS)を5ml塗布後、500rpmで5秒、4,000rpmで40秒コーティングを行い、120℃で2分間ホットプレートでベーキングする。
【0077】
(3)PRコーティング
フォトレジスト(PR)(GXR 601)を5ml塗布後、500rpmで5秒、4,000rpmで40秒コーティングを行う。
【0078】
(4)ソフトベーキング
ホットプレートを利用して95℃で2分間ベーキングを行う。
【0079】
(5)UV露光
UV aligner(i−line)にピラー製作マスクを装着後、250mJのUVを照射する。
【0080】
(6)現像
MIF 300現像器を利用して現像を行う。
【0081】
(7)ハードベーキング
現像されたウェーハを115℃で2分間ハードベーキングを行う。
【0082】
(8)Deep RIE
STS ICP−RIE機器を利用し、100μmのSiエッチング工程を行う。
【0083】
(9)除去
Asher装備を利用し、フォトレジストを除去する。
【0084】
(10)PRストリップ
残存するPR除去および洗浄のために、ピラニア溶液で5分間処理して洗浄および乾燥する。
【0085】
(11)HF処理
希釈されたHFを1分間処理し、自然酸化物を除去する。
【0086】
(12)Si酸化
SiO2成長のために、水蒸気を利用した熱湿式酸化を行い、1,000Åの厚さに成長させる。
【0087】
(13)ウェーハ洗浄
ピラニア溶液で5分間処理し、洗浄および乾燥する。
【0088】
(14)SAMコーティング
エタノール中の200mMのOTCに1時間浸漬し、エタノールで3回洗浄/乾燥する。110℃で40分間ベーキング工程を進める。
【0089】
次に、SU−8チップの作製過程は、下記の通りである。
【0090】
(1)ウェーハ洗浄
ピラニア溶液で15分間処理し、希釈されたHFを3分間処理後、洗浄および乾燥する。200℃のホットプレートで20分間処理する。
【0091】
(2)SU−8コーティング
SU8 2100(Microchem社製)を8mlほどのウェーハに注いだ後、500rpmで30秒、3,000rpmで30秒スピンコーティングを行う。
【0092】
(3)ソフトベーキング
SU8コーティングされたウェーハをホットプレートで65℃、5分および95℃、20分間処理する。
【0093】
(4)UV露光
UV aligner(i−line)にピラー製作マスクを装着後、320mJのUVを照射する。
【0094】
(5)露光後のベーキング
前記ウェーハを65℃、1分および95℃、20分間処理する。
【0095】
(6)現像
SU8現像器(Microchem社製)を利用し、30分間現像を行う。
【0096】
(7)洗浄
2−プロパノールで洗浄を行い、窒素で乾燥する。
【0097】
前記チップの三次元形態は、ピラー構造であり、チャンバ体積は、10μlであり、ピラー高さは、100μmであった。ピラーの型は、菱形四種と櫛目形二種を下記表2のように作製した。
【0098】
【表2】

【0099】
図8は、デザインされた菱形および櫛目形ピラーの配列を、上から見た模式図を表したものである。上記の型のチップを製作して走査電子顕微鏡(SEM)で観察した。図9は、シリコン基板上にSAMコーティング方法で設けられた菱形および櫛目形のピラーの配列を有するチップのSEMイメージを表したものである。図9に示すように、ピラーチップのSEMイメージから所望のサイズの菱形または櫛目形チップが製作されているということが分かった。図10は、SU−8を利用して製造された菱形ピラーの配列を有するチップのSEMイメージを表したものである。図10に示すように、ピラーチップのSEMイメージから所望のサイズの菱形チップが製作されているということが分かった。
【0100】
<実施例6:三次元マイクロチップを利用した大腸菌細胞の分離>
平面の固体基板を利用した実施例2とは異なり、前記実施例5で製作した三次元のマイクロチップを利用し、流体制御システムで、本発明のマイクロチップに対する大腸菌結合能を調べた。大腸菌細胞は、1.0×108細胞/mlの大腸菌BL21を利用し、流速は、400μl/分であり、大腸菌細胞は、コロニー数測定方法で、マイクロチップに結合した大腸菌数を測定した。残りの過程は、実施例2と同じように行った。
【0101】
表3は、チップの型を変化させたときの大腸菌捕獲効率を表したものである。「平面」は、実施例2の平面の固体基板を利用したものである。
【0102】
【表3】

【0103】
前記表3から分かるように、ピラーの表面積が最も大きいチップ3の大腸菌捕獲効率が最も高い。これは、表面が平面である場合(約1%の捕獲効率)に比べて数十倍以上の大腸菌捕獲効率を達成する。従って、本発明のチップのピラー構造は、大腸菌との接触の表面積を増加させ、平面構造に比べてはるかに効率的に大腸菌を捕獲できる。
【0104】
<実施例7:三次元マイクロチップを利用した低濃度のバクテリア細胞およびバクテリア種の細胞の分離>
本実施例では、実施例6とは異なり、低濃度の大腸菌細胞およびその他のバクテリア細胞を利用し、本発明の三次元マイクロチップの細胞の捕獲効率を調べた。大腸菌細胞としては、1.0×103細胞/mlおよび1.0×105細胞/mlの大腸菌BL21を利用し、その他のバクテリア細胞は、それぞれ1.0×108細胞/mlのシュードモナス・プチダ、スタフィロコッカス・エピデルミディスおよびストレプトコッカス・ミュータンス細胞を利用し、チップ10を利用したことを除いては、実施例6と同様に行った。
【0105】
表4は、バクテリア細胞の種類による細胞捕獲効率の変化を表したものである。
【0106】
【表4】

【0107】
前記表4で、シュードモナス・プチダ細胞は、捕獲効率を測定できなかったが、これは、前記細胞は、pH4ではマイクロチップ上で成長せずに測定できなかったためである。しかしながら、顕微鏡イメージから、前記細胞が前記マイクロチップ上に捕獲されるということを確認することができた。
【0108】
前記表4から、大腸菌BL21の場合には、低濃度でも捕獲効率が高く、大腸菌以外のバクテリア細胞でも、捕獲効率が非常に高いということが分かった。従って、本発明によるチップのピラー構造は、ほとんどのバクテリア細胞を効率的に捕獲できる。
【0109】
本発明のチップに捕獲されたバクテリアを観察するために、捕獲されたバクテリア細胞を一般的な染色手順によって染色した後で電子顕微鏡で観察した。図11は、本発明の三次元構造の疎水性固体支持体であるピラー配列を有するチップに捕獲されたグラム陽性および陰性菌の顕微鏡写真を表したものである。図11から、それぞれのバクテリア細胞は、ピラーに効率的に捕獲されているということが分かった。
【0110】
<実施例8:三次元マイクロチップを利用した実際の試料に含まれた大腸菌細胞の分離>
本実施例では、実際の試料に含まれたバクテリア細胞の捕獲効率を知るために、唾液試料とバクテリア細胞との懸濁液を調製した。バクテリア細胞は、SYTO−9蛍光染料で染色された大腸菌BL21を利用し、唾液試料の前処理は、0.01Mのジチオスレイトール(DTT)で15分以上処理し、遠心分離後に0.1Mのリン酸ナトリウム緩衝液(pH4)で再懸濁し、初期の唾液試料の濃度の1/4に希釈した。収得された前処理された唾液溶液に、SYTO−9染色されたバクテリアを懸濁した。流速は、400μl/分であり、バクテリアの捕獲効率は、蛍光光度計を用いて測定した。残りの過程は、前記実施例6と同じように行った。
【0111】
下記表5は、実際の試料に含まれた大腸菌細胞の捕獲効率を表したものである。
【0112】
【表5】

【0113】
前記表5から分かるように、Si/SiO2/SAMおよびSU−8チップはいずれもバクテリア細胞の捕獲効率が非常に高い。従って、実際の試料に含まれるバクテリア細胞が微量であっても、バクテリア細胞を効率的に捕獲できるということが分かる。
【0114】
<実施例9:三次元構造における緩衝液のpHによる影響>
平面構造では、pH4近辺で良好な細胞捕獲効率を示した(実施例1参照)。作製された三次元マイクロチップ(実施例6のチップ3)を利用し、100mMのリン酸ナトリウム緩衝液のpH効果をさらに検証した。大腸菌をpH4およびpH7のリン酸ナトリウム緩衝液に懸濁させて細胞捕獲効率を比較した。300μl/分で懸濁液を流して三回の試験を行った。構造物の効果により、平面構造に比べてpHの影響が小さくなることが分かった(表6参照)。すなわち、広いpH範囲で使用可能である。
【0115】
【表6】

【0116】
<実施例10:ビーズを利用した尿に存在する細胞の分離>
ガラスビーズにOTCを利用し、実施例6のようにSAMコーティングを行った。尿を採取し、いかなる前処理もなしに、既知の濃度(5×106細胞/ml、リン酸ナトリウム、100mM、pH3)の大腸菌を含む溶液と1:1の比率で混合した。0.2gのビーズを前記混合サンプルに投入して混合した。ビーズに吸着された細胞をコロニー計数測定法を用いて定量した。ビーズとサンプルとの混合時間を1分、15分、30分(表7参照)に変化させた。尿の場合には、いかなる前処理過程もなしに、15分で50%のバクテリア細胞捕獲効率を得られた。
【0117】
【表7】

【産業上の利用可能性】
【0118】
本発明の疎水性固体支持体を利用した細胞分離方法は、例えば、細胞分離関連の技術分野に効果的に適用可能である。
【技術分野】
【0001】
本発明は、疎水性固体支持体を利用した細胞分離方法に関する。
【背景技術】
【0002】
不純物を含む混合物からの細胞の分離は、当業界で重要な問題である。特に、高効率で細胞を捕獲したり、実質的に全ての細胞をそのまま捕獲する必要がある場合、または細胞が培養培地、生物学的試料などの複雑な混合物中に存在する場合に重要である。つまり、細胞濃縮および分離段階に利用された試薬は、多様な範囲の濃度の細胞を非常に効率的に捕獲しなければならない。また、利用された試薬は、細胞を利用し、前記細胞から核酸を回収し、前記核酸を加工するような下流(downstream)段階を妨害してはならない。
【0003】
固体支持体への細胞の結合は、任意の公知の方法により達成されうる。例えば、支持体への細胞の非特異的な結合は、固体支持体の性質および周囲の条件、例えば、固体支持体の表面の化学的または物理的性質(例えば、疎水性または電荷)、分離用媒質のpHまたは組成など、の適当な選択により達成されうる。標的細胞の性質もまた重要である。例えば、特定の疎水性細胞は、疎水性表面に非特異的に容易に結合できる。一方、親水性細胞は、親水性表面に容易に結合できる。また、Bリンパ球のような負に荷電した細胞は、弱く正に荷電した表面に高度に非特異的な結合をする。したがって、所望の型の細胞を結合するために、適当に荷電された表面を有する固体支持体が利用されうる。固体支持体および試料が適当な媒質に接触し、細胞の結合のための適当な条件を達成するために、適当な緩衝液が細胞分離用媒質として利用されうる。適当な電荷、浸透圧を有する緩衝液が固体支持体と接触する前に、または同時に、または接触後に、簡便に添加されうる。
【0004】
特許文献1には、細胞結合モイエティでコーティングされた固体支持体上に、試料中の細胞を結合させるステップと、分離された細胞を溶解するステップとを含む、細胞試料から核酸を分離する方法が記載されている。特許文献1では、固体支持体としてグリシジル−ヒスチジン修飾された磁気ビーズを利用している。
【0005】
特許文献2には、細胞と、ポリアミンまたは陽イオン性界面活性剤であり、細胞を凝集できる凝集剤を含む混合物を、細胞を結合できる固相と接触させるステップと、固相を利用して前記混合物から凝集された細胞を分離するステップと、前記細胞から標的核酸を精製するステップとを含む、標的核酸を含む細胞を分離する方法が記載されている。特許文献2では、固相として磁気ビーズを利用している。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】米国特許第6,617,105号明細書
【特許文献2】国際公開03/102184号パンフレット
【発明の概要】
【発明が解決しようとする課題】
【0007】
しかしながら、例えばバクテリアやウイルスから核酸を精製するとき、バクテリアまたはウイルスの初期濃度が非常に低いときには濃縮が必要であるが、特に、ラボオンチップ(LOC:Lab−on−a−chip)のような小型化されたチップを利用する場合には、試料の体積がどうしても小さくなってしまうので、前記のような従来技術では、細胞またはウイルスの分離および濃縮を行うことは困難である。したがって、迅速であり、簡単な、効率のよい細胞分離のために、さらなる研究が要求されている。
【課題を解決するための手段】
【0008】
本発明の発明者らは、細胞またはウイルスの分離方法を研究していたところ、特定の水接触角を有する疎水性固体支持体を利用することにより、迅速であり、かつ効率的に細胞またはウイルスを分離できることを発見して本発明を完成するに至った。
【0009】
本発明は、水接触角が70〜90°である疎水性固体支持体に、細胞またはウイルスを含む溶液を接触させる段階を含む疎水性固体支持体を利用した細胞またはウイルスの分離方法を提供する。
【0010】
さらに、本発明は、水接触角が70〜90°である疎水性固体支持体を含む試料内の細胞またはウイルスを分離するための装置を提供する。
【発明の効果】
【0011】
本発明によれば、疎水性固体基板に、単に細胞またはウイルスを吸着させることによって細胞またはウイルスを分離できるので、迅速であり、かつ簡単に細胞またはウイルス分離効率を上昇させることができる。また、三次元マイクロ構造を利用して細胞分離効率を顕著に向上させることができ、流体制御システム下で数分以内に細胞分離が可能である。さらに、唾液のような試料から細胞分離が可能であり、LOCでの試料製造に応用可能である。
【図面の簡単な説明】
【0012】
【図1】pH4およびpH7で多様な水接触角を有する固体支持体に捕獲された大腸菌細胞の数を表したグラフである。
【図2】pH4およびpH7で、親水性であるアルミナ基板(水接触角20°未満を有する)には、大腸菌細胞が全く捕獲できないということを示す顕微鏡写真である。
【図3】流体制御システムで、本発明の固体支持体に捕獲された大腸菌細胞を示す顕微鏡写真ある。
【図4】流体制御システムで、本発明の固体支持体に捕獲されたグラム陰性菌であるシュードモナス・プチダおよび大腸菌(BL21)細胞を示す顕微鏡写真である。
【図5】流体制御システムで、本発明の固体支持体に捕獲されたグラム陽性菌であるストレプトコッカス・ミュータンスおよびスタフィロコッカス・エピデルミディス細胞を示す顕微鏡写真である。
【図6】アルコールのような添加物により、本発明の固体支持体に捕獲される細胞の数が増加することを示すグラム陽性菌であるスタフィロコッカス・エピデルミディスの顕微鏡写真である。
【図7】アルコールのような添加物により、本発明の固体支持体に捕獲される細胞の数が増加することを示すグラム陰性菌である大腸菌(BL21)の顕微鏡写真である。
【図8】デザインされた菱形および櫛目形ピラーの配列を上から見た模式図である。
【図9】シリコン基板上にSAMコーティング方法で作られた菱形および櫛目形ピラーの配列を有するチップのSEMイメージある。
【図10】SU−8を利用して製造された菱形ピラーの配列を有するチップのSEMイメージである。
【図11】本発明の三次構造の疎水性固体支持体であるピラー配列を有するチップに捕獲されたグラム陽性および陰性菌の顕微鏡写真である。
【発明を実施するための形態】
【0013】
本発明の目的を達成するために、本発明は、水接触角が70〜90°である疎水性固体支持体に、細胞またはウイルスを含む溶液を接触させる段階を含む疎水性固体支持体を利用した細胞またはウイルスの分離方法に関する。
【0014】
本発明は、疎水性固体支持体を利用して細胞を捕獲する方法に係り、具体的には、特定のpH範囲で特定の範囲の水接触角を有する固体支持体を利用して細胞を捕獲する方法に関する。前記方法で、細胞凝集や沈殿を誘導しうる添加物を添加すれば、細胞捕獲の効率を上げることができる。
【0015】
小型化されたチップ上で具現可能な細胞捕獲/分離方法のうちの一つが固体支持体を利用することである。固体支持体を利用することは、LOCを具現できる長所を有し、細胞と固体支持体との間の物理的な相互作用を利用して細胞を捕獲できる。前記相互作用には、静電吸着および疎水性相互作用があるが、前者は、一般的に、細胞表面が負電荷であるため、静電的に正電荷を有するアルミナのような物質を利用して細胞を分離できる。本発明に該当する後者は、細胞および固体支持体の表面の自由エネルギーから発生する物理的相互作用により起こる細胞付着であり、これは、表面熱力学法則により支配される。細胞および固体支持体の表面の疎水性は、周辺環境のpHにより変わりうるために、pH条件が重要な因子になりうる。固体支持体表面の疎水性の程度を知る代表的な方法が水接触角を測定することである。固体表面の水接触角が大きいほど疎水性の程度が大きい。
【0016】
細胞またはウイルスを含む溶液を水接触角が70〜90°である疎水性固体支持体と接触させれば、細胞またはウイルスは、疎水性固体支持体との疎水性相互作用などにより固体支持体に結合される。親水性の固体支持体は、下記実施例で示すように、細胞またはウイルスとほとんど結合しない。また、疎水性固体支持体のうちでも、水接触角が前記範囲を外れれば、細胞またはウイルスが疎水性固体支持体に結合する程度が低下する。
【0017】
前記細胞またはウイルスと疎水性固体支持体との接触は、pH2.5〜7、望ましくは、pH2.5〜4で行われうる。細胞またはウイルスを含む溶液が前記pH範囲を外れれば、疎水性固体支持体に対する細胞またはウイルスの結合効率が顕著に低下するためである。
【0018】
本発明の一具現例で、本発明の方法は、前記細胞またはウイルスが結合した疎水性固体支持体を洗浄する段階をさらに含むことができる。細胞またはウイルスの結合した疎水性固体支持体をリン酸塩緩衝液(PB)のような洗浄液を利用して洗浄すれば、疎水性固体支持体に結合されていない物質は、除去され、疎水性固体支持体には、標的物質である細胞またはウイルスが主に結合することとなる。従って、細胞またはウイルスを含む溶液から細胞またはウイルスを選択的に分離でき、これにより、細胞またはウイルスが濃縮されるという効果も得られる。
【0019】
本発明の方法で、前記細胞またはウイルスを含む溶液は、唾液、血液、尿、緩衝液またはこれらの混合液でありうるが、それらに限定されるものではない。
【0020】
本発明の方法で、前記細胞またはウイルスを含む溶液を接触させる段階は、静的または流体状態で行うことができる。流体制御システムにおいて、前記疎水性固体支持体は、平面構造またはピラー構造、ビーズ構造または篩構造のような三次元構造を取りうる。前記三次元構造は、細胞またはウイルスと疎水性固体支持体との接触表面積を増やし、それによって、さらに多くの細胞またはウイルスを捕獲できるようになる。
【0021】
本発明の方法で、前記ピラーの縦横比は、1:1〜20:1であることが望ましい。縦横比は、ピラーの高さ対幅の比率を意味するものであり、各ピラーの縦横比が前記範囲を外れれば、細胞またはウイルスが疎水性固体支持体に結合される効率が低下してしまうおそれがある。
【0022】
本発明の方法で、前記ピラーは、ピラーの高さ(H)とピラー間の距離(D)との比率が1:1〜25:1であることが望ましい。ピラーの高さ(H)のピラー間の距離(D)に対する比率が1未満である場合には、細胞またはウイルスを捕獲する効率が低下してしまうという問題点が発生しうる。
【0023】
本発明の方法で、前記ピラーは、ピラー間の距離(D)が5μm〜100μmであることが望ましい。ピラー間の距離(D)は、各ピラー間の距離を意味するものであり、ピラー間の距離が前記範囲未満ならば、シリコン表面のような固体支持体上にこれを製作し難く、前記範囲を超えれば、同じ面積のチップ上でピラーの数が減少してしまうので、細胞またはウイルスを捕獲する効率が低下してしまうおそれがある。
【0024】
本発明の方法で、前記疎水性固体支持体は、特に制限されないが、基板、粒子、シート、ゲル、フィルタ、膜、ファイバ、毛細管、チューブ、プレートまたはウェルの形態を有することができる。前記疎水性固体支持体は、細胞またはウイルスを捕獲できるものであるならば、特別に制限されるものではないが、細胞またはウイルスを含む溶液中に溶解されてはならない。
【0025】
前記支持体は、例えば、ガラス、シリカ、ラテックスまたは重合体性物質で簡便に製造されうる。細胞を結合する大きい表面積を提供する物質が望ましい。前記支持体は、一般的に、平面でない表面を有することができ、例えば、多孔性または微粒子でありうる。前記疎水性固体支持体は、例えば、オクタデシルトリクロロシラン(OTS)、トリデカフルオロオクチルトリメトキシシラン(DTS)、塩化オクタデシルジメチル(3−トリメトキシシリルプロピル)アンモニウム(OTC)、ポリエチレンイミントリメトキシシラン(PEIM)のような物質を用いて調製されうる。前記物質の構造式は、下記の通りである。
【0026】
【化1】

【0027】
前記物質は、固体支持体に所望の疎水性を提供できる物質であり、細胞またはウイルスを捕獲できる物質ならば、特別に制限されるものではない。
【0028】
本発明の方法で、前記細胞またはウイルスは、好ましくは、バクテリア、バクテリオファージ、植物細胞、動物細胞、植物ウイルス、動物ウイルスなどを含むことができる。バクテリアは、グラム陽性および陰性バクテリアのいずれもが疎水性固体支持体に結合され、例えばエタノールのようなバクテリア細胞間の凝集または沈殿を誘発しうる物質を添加することにより、疎水性固体支持体にバクテリアが結合する効率をさらに上昇させることができる。
【0029】
本発明の方法で、前記細胞またはウイルスを含む溶液と疎水性固体支持体との接触段階において、前記溶液にはアルコールまたは塩が添加されうる。このようなアルコールまたは塩の添加によって、細胞間の凝集または固体支持体上への沈殿が誘発され、固体支持体上への細胞の結合の効率が上昇する。上述のアルコールまたは塩の添加は、例えば、細胞をアルコールまたは塩の存在下で支持体と接触させることによって達成できる。沈殿のような分離および精製の操作におけるアルコールまたは塩の利用は一般的であり、上記の操作に利用される任意のアルコールまたは塩が利用されうる。この際、アルコールは、任意のアルコールであり、イソプロパノールおよびエタノールのような低級アルコールが適している。その他に適したアルコールには、メタノールおよびn−ブタノールなどが含まれる。
【0030】
塩は、任意の便利な供給源、例えば、ナトリウムもしくはカリウムの塩化物もしくはアセテートまたはアンモニウムアセテートにより提供されうる。アルコールおよび塩の適当な濃度は、用いられる系および試薬によって決定されうる。一般的に、試料に対して0.5ないし3体積のアルコール、例えば、1体積のアルコールが適している。アルコールは、50〜100%(w/v)の濃度で利用されうる。塩の濃度は、細胞またはウイルスを含む溶液に対して、0.01ないし10.0M、望ましくは、0.01ないし7.0M、さらに望ましくは、0.01ないし2.0Mが適し、塩は、前記濃度でアルコール溶液中に含まれうる。それにより、いわゆる所望の濃度のアルコールおよび塩を含む「細胞結合緩衝液」が調製されうる。塩およびアルコールは、別個に添加されてもよい。
【0031】
本発明による細胞に対する沈殿剤としてのアルコールの利用は、臨床診断への応用に有効であるが、それは、臨床試料を保存するためのアルコールの利用が一般的であるためである。患者から採取した試料は、アルコールを含む細胞結合のための緩衝液に加えられ、同時に試料が保存される。
【0032】
塩/アルコールを利用して細胞を沈殿させるかわりに、塩および/またはアルコールと組み合わせて、または単独でポリエチレングリコール(PEG)または類似の性質を有する高分子量重合体のような、その他の沈殿剤が利用されうる。前記重合体の濃度は、具体的な系、例えば、重合体および細胞の型に依存して変わりうるが、一般的に、1ないし50%(w/v)、例えば、2ないし30%でありうる。
【0033】
食作用活性(phagocytic activity)を有する細胞は、例えば、ビーズのような粒子状の固相を結合または貪食する能力により捕獲でき、容易に分離されうる。その場合、細胞を含む試料は単に適当な条件の下に固相との接触またはインキュベーションを行えばよい。かかる種類の細胞捕獲は、特異的な結合に依存しない。
【0034】
最終的に、前述のように、荷電した、疎水性または親水性表面を有する固体支持体に対する細胞結合は、結合に適したpH条件を達成するために、しばしば塩と組み合わされた緩衝液を利用することによって達成されうる。具体的な緩衝液および条件は、細胞の型、固体支持体などに依存して変わりうる。
【0035】
溶液の成分が混合された後、細胞が支持体に結合するように適当な時間放置される。支持体は、支持体の特性に依存する任意の手段により溶液から除去され、試料の上澄み液から支持体を除去するか、またはこれと反対に支持体を除去するあらゆる形態、例えば、遠心分離、ピペットの操作などの手段が用いられうる。
【0036】
前記結合および分離の条件は、特に制限されないが、例えば、固相の存在下に、単に試料と「細胞結合緩衝液」とを混合し、分離前に室温で5ないし30分、例えば、20分間放置できる。前述のように、反応時間は特に制限されず、5分程度でもよい。しかし、さらに長い時間、例えば、20分ないし3時間、または1日が利用されうる。混合は、例えば、撹拌またはボルテキシングを含む任意の手段により行われうる。また、必要ならば、高温または低温で行われうる。
【0037】
本発明によれば、細胞の疎水性固体支持体に対する吸着が望ましいが、核酸を含む所望の細胞の選択的な捕獲ができるように修飾された固体支持体を利用することも可能である。それにより、例えば、所望の細胞の型に対して特異的な抗体、またはレクチンのようなその他の結合蛋白質を有する支持体が利用されうる。この場合、混合物内の所望の標的由来の核酸のみが分離されうるために、核酸の分離に高度な選択性を導入できる。上述のような選択的な細胞捕獲マトリックスの製造は当業界に周知である。
【0038】
本発明の他の目的を達成するために、本発明は、水接触角が70〜90°である疎水性固体支持体を含む試料内細胞またはウイルスを分離するための装置を提供する。
【0039】
前記疎水性固体支持体は、水接触角が70〜90°であり、細胞またはウイルスと疎水性固体支持体との接触はpH2.5〜7、望ましくは、pH2.5〜4で行われうる。前記疎水性固体支持体は、例えば、基板、粒子、シート、ゲル、フィルタ、膜、ファイバ、毛細管、チューブ、プレートまたはウェルの形態を有することができる。前記疎水性固体支持体は、細胞またはウイルスを捕獲できるものであるならば、特別に制限されるものではないが、細胞またはウイルスを含む溶液中に溶解されてはならない。
【0040】
前記支持体は、例えば、ガラス、シリカ、ラテックスまたは重合体性物質で製造されうる。細胞を結合する大きい表面積を提供する物質が望ましい。前記支持体は、一般的に平面ではない表面を有することができ、例えば、多孔性または微粒子でありうる。前記疎水性固体支持体は、例えば、OTS、DTS、OTC、PEIMのような物質で製造されうる。前記物質は、固体支持体に所望の疎水性を提供できる物質であり、細胞またはウイルスを捕獲できる物質ならば、特別に制限されるものではない。
【0041】
本発明の装置で、前記疎水性固体支持体は、例えば、平面構造、ピラー構造、ビーズ構造、篩構造を有することができる。流体制御システムで、疎水性固体支持体は、平面構造またはピラー、ビーズまたは篩のような三次元構造を取りうる。前記三次元構造は、細胞またはウイルスと疎水性固体支持体との接触表面積を増やし、さらに多くの細胞またはウイルスを捕獲できる。
【0042】
本発明の装置で、前記ピラーの縦横比は、1:1〜20:1であることが望ましい。縦横比は、ピラーの高さ対幅の比率を意味するものであり、各ピラーの縦横比が前記範囲を外れれば、細胞またはウイルスが疎水性固体支持体に結合される効率が低下してしまうおそれがある。
【0043】
本発明の装置で、前記ピラーは、ピラーの高さ(H)とピラー間の距離(D)との比率が1:1〜25:1であることが望ましい。ピラーの高さ(H)のピラー間の距離(D)に対する比率が1未満である場合には、細胞またはウイルスを捕獲する効率が低下してしまうという問題点が発生しうる。
【0044】
本発明の装置で、前記それぞれのピラーは、ピラー間の距離(D)が5μm〜100μmであることが望ましい。ピラー間の距離(D)は、各ピラー間の距離を意味するものであり、ピラー間の距離が前記範囲未満ならば、シリコン表面のような固体支持体にこれを製作し難く、前記範囲を超えれば、同じ面積のチップ上でピラーの数が減少するようになるので、細胞またはウイルスを捕獲する効率が低下してしまうおそれがある。
【0045】
本発明の装置は、細胞またはウイルス含有溶液を含むチャンバをさらに含むことができる。前記チャンバはマイクロチャンバでありうる。また、前記装置は、細胞またはウイルス含有溶液を含むこともできる。
【0046】
前記細胞またはウイルス含有溶液は、例えば、唾液、血液、尿、緩衝液またはこれらの混合液でありうるが、それらに限定されるものではない。
【実施例】
【0047】
以下、実施例を介して本発明をさらに詳細に説明する。それら実施例は、単に本発明を例示するためのものであり、本発明の範囲がそれら実施例により制限されるものと解釈されるものではない。
【0048】
<実施例1:本発明の疎水性固体基板を利用した大腸菌細胞の分離>
本発明の方法によりバクテリア細胞を効率的に分離できることを確認するために、グラム陰性細胞である大腸菌株(Escherichia coli HB101)を利用した。実験に利用された固体基板としては、OTS、DTS、OTC、PEIMを用いて調製された基板を利用した。
【0049】
1)細胞培養
大腸菌細胞を一般的な手順により、37℃で対数期まで一晩培養した。
【0050】
2)細胞溶液準備
一晩培養した大腸菌細胞を800×gで5分間遠心分離して細胞を沈殿させた。次に、1×PBS(リン酸緩衝生理食塩水、pH7.4、Invitrogen corporation)5mlを利用して3回洗浄した。洗浄は、1×PBSに沈殿した大腸菌細胞を再懸濁した後、再懸濁された大腸菌細胞を800×gで5分間遠心分離する過程を反復することによって行った。洗浄の完了した大腸菌細胞を0.1Mのリン酸ナトリウム緩衝液(pH4)および0.1Mのリン酸ナトリウム緩衝液(pH7)5mlにそれぞれ懸濁した。懸濁された大腸菌細胞の初期量を、UV分光計でOD(Optical Density)値を測定することによって求めた。大腸菌細胞の初期量は、0.1Mのリン酸ナトリウム緩衝液(pH4)の場合に、600nmでOD値が0.475であり、これは、細胞懸濁液60μlに対して1.43×107細胞であり、0.1Mのリン酸ナトリウム緩衝液(pH7)の場合には、0.454であり、これは、60μlに対して1.36×107細胞ほどの量と推定される(一般的に、600nmで1のOD値は、大腸菌の場合、5.0×108細胞/mlほどの濃度に対応する)。
【0051】
3)固体基板の調製
固体基板の調製は、SAM(Self Assembled Monolayer)法を利用した。詳細な製造過程は、下記の通りである。
【0052】
(1)ガラス洗浄
ピラニア溶液にウェーハを2時間以上浸漬させた後、ガラスを1枚ずつスピン乾燥させる。
【0053】
(2)コーティング液の調製
最終濃度がそれぞれ100mMになるように前記OTSおよびDTSをそれぞれトルエンと混合し、前記OTCおよびPEIMをそれぞれエタノールと混合した後、1時間撹拌する。
【0054】
(3)ガラス浸漬
前記(2)で調製したそれぞれの溶液に、(1)で洗浄したガラスを入れ、4時間浸漬する。
【0055】
(4)ガラス洗浄
前記浸漬されたガラスをエタノールでそれぞれ10分ずつ3回洗浄した後、真空乾燥させる。
【0056】
(5)インキュベーション
前記乾燥されたガラスを120℃で1時間インキュベーションする。
【0057】
4)細胞結合
60μlパッチを上記で製造した固体基板上に付着した後、細胞懸濁液を60μl塗布した。次に、室温で5分間インキュベーションした後、0.1Mのリン酸ナトリウム緩衝液(pH4)および0.1Mのリン酸ナトリウム緩衝液(pH7)30mlでそれぞれ10分間1回洗浄した。洗浄手順は、前記と同一に行った。
【0058】
5)測定
固体基板に結合された大腸菌細胞を染色するために、当業界に公知の大腸菌細胞用グラム染色液で大腸菌細胞を染色した。まず、クリスタルバイオレット溶液を細胞が結合された部位を十分に覆うほどの量を加えた後で1分間待った後、流水で洗浄した。次に、グラムヨード液、グラム脱色剤、グラムサフラニン溶液を同じ方法で処理してグラム染色を完成した。グラム染色後、固体基板を常温で自然乾燥させた。その後、光学顕微鏡を利用して2,000倍で3ポイントのイメージを撮影して単位面積当たり捕獲された細胞数を測定した。
【0059】
図1は、それぞれpH4およびpH7で、多様な水接触角を有する固体支持体に捕獲された大腸菌細胞の数を表したグラフである。単位面積は、9.6×103μm2であり、括弧内の数字は、水接触角(°)を表す。左側のパネルは、pH4で捕獲された細胞数を表し、右側のパネルは、pH7で捕獲された細胞数を表す。図1に示すように、pH7の緩衝液を利用した場合には、pH4の場合に比べて、結合される大腸菌細胞が少ないということが分かる。従って、細胞またはウイルスを固体基板に接触させるときのpHが非常に重要であるということが分かる。
【0060】
また、四種の固体基板のうち、DTSで調製された固体基板が細胞結合効率が最も高いということが分かる。DTSで調製された固体基板は、水接触角が87°であり、他の水接触角を有する固体基板より細胞捕獲効率が高い。したがって、水接触角が細胞捕獲効率に非常に重要であるということが分かる。
【0061】
<比較例1:アルミナ基板を利用した大腸菌細胞の分離>
実施例1に利用された固体基板の代わりに、水接触角が14.6°であるアルミナ基板を利用したことを除いては、実施例1と同様の方法で実験を行った。図2は、それぞれpH4およびpH7での、親水性であるアルミナ基板(水接触角20°未満を有する)の顕微鏡写真を表したものである。図2で、「1」と表示されたパネルは、pH4の場合であり、「2」と表示されたパネルは、pH7の場合である。図2で示すように、pH4およびpH7の場合のいずれも大腸菌細胞がほとんど結合されていないということが分かる。すなわち、水接触角が30°以下である親水性のアルミナでは、大腸菌細胞がほとんど結合されない。
【0062】
<実施例2:流体制御下の大腸菌細胞の分離>
流体制御システムにおいて、基板に対する大腸菌結合能を知るために、固体基板の表面として水接触角75°のCRS(Charge Reversible Surface、大韓民国特許出願第2005−0030286号参照)を利用した。シリンジポンプ(HARVARD、PHD2000)を利用し、流速を0.3cm/秒(900μl/分)とした。表面の総面積は、5mm×17.3mmであり、断面積は、5mm2(縦5mm×横1.05mm)であり、断面の縦横比が5以上であった。バクテリア細胞として、大腸菌HB101 200μl、pH4(バクテリア濃度が1.0×105細胞/μl)を利用した。上述の流速で、バクテリア細胞200μlを、表面を一回通過させた。流速900μl/分でリン酸ナトリウム緩衝液(pH4、0.1M)1mlを一回流して洗浄した。残りの過程は、実施例1と同じように行った。
【0063】
図3は、流体制御システムで、本発明の固体支持体に捕獲された大腸菌細胞の顕微鏡写真を表したものである。表面1および2は、複数回の実験の結果である。図3に示すように、倍率450倍では、固体基板に結合された大腸菌細胞の判別が明確ではないが、倍率2,000倍では、桿状の大腸菌細胞が観察されるということが分かる。従って、固定されたシステムと同じように、流体制御システム下でも大腸菌細胞が、本発明の方法によって、基板に効率的に結合されるということが分かる。
【0064】
<実施例3:流体制御の下での四種の異なる細胞の分離>
実施例2で、大腸菌細胞HB101の代わりにグラム陰性菌である大腸菌BL21細胞およびシュードモナス・プチダ(Pseudomonas putida)、並びにグラム陽性菌であるストレプトコッカス・ミュータンス(Streptococcus mutans)およびスタフィロコッカス・エピデルミディス(Staphylococcus epidermidis)を利用したことを除いては、実施例2と同様に実験を行った。
【0065】
図4は、流体制御システムで、本発明の固体支持体に捕獲されたグラム陰性菌であるシュードモナス・プチダおよび大腸菌(BL21)細胞の顕微鏡写真を表したものである。上段に表記された6、7(1)、7(2)、8および15、16、17は、試料番号を表す。図4に示すように、グラム陰性菌であるシュードモナス・プチダおよび大腸菌BL21細胞は、固体基板の表面に比較的均一に付着が良好になされているということが分かる。また、試料7(1)のように、細胞が高密度にまとまって付着しているところも発見された。従って、グラム陰性菌であるシュードモナス・プチダおよび大腸菌BL21細胞は、流体制御システムで、本発明の方法によって、固体基板に効率的に結合するということが分かる。
【0066】
図5は、流体制御システムで、本発明の固体支持体に捕獲されたグラム陽性菌であるストレプトコッカス・ミュータンスおよびスタフィロコッカス・エピデルミディス細胞の顕微鏡写真を表したものである。上段に表記された9、10および11は、ストレプトコッカス・ミュータンスの試料番号を表し、12、13および14は、スタフィロコッカス・エピデルミディスの試料番号を表す。図5に示すように、グラム陽性菌であるストレプトコッカス・ミュータンスおよびスタフィロコッカス・エピデルミディス細胞は、固体基板の表面に付着しているということを観察できるが、その効率が図4で示したグラム陰性菌のものより顕著に低いということが分かる。
【0067】
グラム陰性菌である大腸菌BL21細胞およびシュードモナス・プチダ細胞が本発明の方法によって、固体基板に付着している程度を下記表1に要約した。
【0068】
【表1】

【0069】
<実施例4:添加剤を利用した細胞の分離>
流体制御システムで、アルコールおよび/または塩の添加による本発明の基板に対する細胞結合能を知るために、固体基板の表面として、水接触角70°のエチルトリメトキシシランを利用した。シリンジポンプ(HARVARD、PHD2000)を利用し、流速は、0.6cm/秒(900μl/分)であった。表面の総面積は、5mm×17.3mmであり、断面積は、2.5mm2(縦5mm×横0.5mm)であり、縦横比が10以上であった。バクテリア細胞は、それぞれ大腸菌BL21、スタフィロコッカス・エピデルミディス200μl(2.0×107細胞)を利用した。
【0070】
細胞懸濁培地に添加した添加剤は、0.1Mのリン酸塩緩衝液(pH4)中のPEG 10,000(w/v20%)(図6で、「PEG」と表示される)、0.1Mのリン酸塩緩衝液(pH4)中のエタノール(v/v50%)(図6で、「EtOH」と表示される)、3Mの塩化ナトリウム(pH4)中のイソプロピルアルコール(IPA)(v/v25%)(図6で、「IPA」と表示される)を利用し、対照群として、0.1Mのリン酸塩緩衝液(pH4)を利用した。上記流速で、バクテリア細胞200μlを、表面を一回通過させた。流速900μl/分でリン酸ナトリウム緩衝液(pH4)1mlを一回流して洗浄した。残りの過程は実施例1と同じように行った。
【0071】
図6は、固体支持体に捕獲されたグラム陽性菌であるスタフィロコッカス・エピデルミディスの1,000倍の倍率で撮影した顕微鏡写真を表したものである。図6に示すように、グラム陽性菌であるスタフィロコッカス・エピデルミディスは、対照群として0.1Mのリン酸塩緩衝液(pH4)を利用した場合には、細胞がほとんど基板に結合しておらず、PEGを添加した場合にも、細胞がほとんど基板に結合していない。しかし、IPAおよびEtOHの場合には、相当量の細胞が固体基板に結合しているということが分かる。従って、グラム陽性菌の場合にも、アルコールおよび/または塩がない場合には、疎水性固体基板に結合される程度がかなり低いが、アルコールおよび/または塩を添加した場合には、疎水性固体基板に結合する程度がかなり上昇するということが分かる。
【0072】
図7は、アルコールのような添加物により、固体支持体に捕獲されたグラム陰性菌である大腸菌(BL21)の1,000倍の倍率で撮影した顕微鏡写真を表したものである。単位面積(6×104μm2)に結合した大腸菌BL21細胞の数は、対照群の場合には、33個の細胞、PEGの場合には、23個の細胞、IPAの場合には、123個の細胞、およびEtOHの場合には、145個の細胞であった。図7に示すように、グラム陰性菌であるBL21は、対照群として0.1Mのリン酸塩緩衝液(pH4)を利用した場合およびPEGを添加した場合にも細胞が基板に結合するが、IPAおよびEtOHの場合に、さらに多くの細胞が固体基板に結合するということが分かる。従って、グラム陰性菌の場合にも、アルコールおよび/または塩がない場合に比べ、アルコールおよび/または塩を添加した場合には、疎水性固体基板に細胞がさらに多く結合するということが分かる。
【0073】
<実施例5:三次元構造の疎水性固体支持体を有するマイクロチップの製作>
二次元構造である平面の固体基板を利用した実施例2とは異なり、三次元構造の疎水性固体支持体を有するマイクロチップを利用し、流体制御システムで大腸菌結合能を調べた。二種のマイクロチップを製作した。一方は、シリコン基材チップ(Si/SiO2/SAM)であり、他方は、SU−8チップである。
【0074】
まず、シリコン基材チップ(Si/SiO2/SAM)の作製過程は下記のようである。
【0075】
(1)ウェーハ洗浄
ピラニア溶液(H2SO4:H2O2=3:1、120℃)で15分間処理し、流水で洗浄後に乾燥する。
【0076】
(2)HMDSコーティング
洗浄の完了したウェーハをスピンコーティングでヘキサメチルジシラザン(HMDS)を5ml塗布後、500rpmで5秒、4,000rpmで40秒コーティングを行い、120℃で2分間ホットプレートでベーキングする。
【0077】
(3)PRコーティング
フォトレジスト(PR)(GXR 601)を5ml塗布後、500rpmで5秒、4,000rpmで40秒コーティングを行う。
【0078】
(4)ソフトベーキング
ホットプレートを利用して95℃で2分間ベーキングを行う。
【0079】
(5)UV露光
UV aligner(i−line)にピラー製作マスクを装着後、250mJのUVを照射する。
【0080】
(6)現像
MIF 300現像器を利用して現像を行う。
【0081】
(7)ハードベーキング
現像されたウェーハを115℃で2分間ハードベーキングを行う。
【0082】
(8)Deep RIE
STS ICP−RIE機器を利用し、100μmのSiエッチング工程を行う。
【0083】
(9)除去
Asher装備を利用し、フォトレジストを除去する。
【0084】
(10)PRストリップ
残存するPR除去および洗浄のために、ピラニア溶液で5分間処理して洗浄および乾燥する。
【0085】
(11)HF処理
希釈されたHFを1分間処理し、自然酸化物を除去する。
【0086】
(12)Si酸化
SiO2成長のために、水蒸気を利用した熱湿式酸化を行い、1,000Åの厚さに成長させる。
【0087】
(13)ウェーハ洗浄
ピラニア溶液で5分間処理し、洗浄および乾燥する。
【0088】
(14)SAMコーティング
エタノール中の200mMのOTCに1時間浸漬し、エタノールで3回洗浄/乾燥する。110℃で40分間ベーキング工程を進める。
【0089】
次に、SU−8チップの作製過程は、下記の通りである。
【0090】
(1)ウェーハ洗浄
ピラニア溶液で15分間処理し、希釈されたHFを3分間処理後、洗浄および乾燥する。200℃のホットプレートで20分間処理する。
【0091】
(2)SU−8コーティング
SU8 2100(Microchem社製)を8mlほどのウェーハに注いだ後、500rpmで30秒、3,000rpmで30秒スピンコーティングを行う。
【0092】
(3)ソフトベーキング
SU8コーティングされたウェーハをホットプレートで65℃、5分および95℃、20分間処理する。
【0093】
(4)UV露光
UV aligner(i−line)にピラー製作マスクを装着後、320mJのUVを照射する。
【0094】
(5)露光後のベーキング
前記ウェーハを65℃、1分および95℃、20分間処理する。
【0095】
(6)現像
SU8現像器(Microchem社製)を利用し、30分間現像を行う。
【0096】
(7)洗浄
2−プロパノールで洗浄を行い、窒素で乾燥する。
【0097】
前記チップの三次元形態は、ピラー構造であり、チャンバ体積は、10μlであり、ピラー高さは、100μmであった。ピラーの型は、菱形四種と櫛目形二種を下記表2のように作製した。
【0098】
【表2】

【0099】
図8は、デザインされた菱形および櫛目形ピラーの配列を、上から見た模式図を表したものである。上記の型のチップを製作して走査電子顕微鏡(SEM)で観察した。図9は、シリコン基板上にSAMコーティング方法で設けられた菱形および櫛目形のピラーの配列を有するチップのSEMイメージを表したものである。図9に示すように、ピラーチップのSEMイメージから所望のサイズの菱形または櫛目形チップが製作されているということが分かった。図10は、SU−8を利用して製造された菱形ピラーの配列を有するチップのSEMイメージを表したものである。図10に示すように、ピラーチップのSEMイメージから所望のサイズの菱形チップが製作されているということが分かった。
【0100】
<実施例6:三次元マイクロチップを利用した大腸菌細胞の分離>
平面の固体基板を利用した実施例2とは異なり、前記実施例5で製作した三次元のマイクロチップを利用し、流体制御システムで、本発明のマイクロチップに対する大腸菌結合能を調べた。大腸菌細胞は、1.0×108細胞/mlの大腸菌BL21を利用し、流速は、400μl/分であり、大腸菌細胞は、コロニー数測定方法で、マイクロチップに結合した大腸菌数を測定した。残りの過程は、実施例2と同じように行った。
【0101】
表3は、チップの型を変化させたときの大腸菌捕獲効率を表したものである。「平面」は、実施例2の平面の固体基板を利用したものである。
【0102】
【表3】

【0103】
前記表3から分かるように、ピラーの表面積が最も大きいチップ3の大腸菌捕獲効率が最も高い。これは、表面が平面である場合(約1%の捕獲効率)に比べて数十倍以上の大腸菌捕獲効率を達成する。従って、本発明のチップのピラー構造は、大腸菌との接触の表面積を増加させ、平面構造に比べてはるかに効率的に大腸菌を捕獲できる。
【0104】
<実施例7:三次元マイクロチップを利用した低濃度のバクテリア細胞およびバクテリア種の細胞の分離>
本実施例では、実施例6とは異なり、低濃度の大腸菌細胞およびその他のバクテリア細胞を利用し、本発明の三次元マイクロチップの細胞の捕獲効率を調べた。大腸菌細胞としては、1.0×103細胞/mlおよび1.0×105細胞/mlの大腸菌BL21を利用し、その他のバクテリア細胞は、それぞれ1.0×108細胞/mlのシュードモナス・プチダ、スタフィロコッカス・エピデルミディスおよびストレプトコッカス・ミュータンス細胞を利用し、チップ10を利用したことを除いては、実施例6と同様に行った。
【0105】
表4は、バクテリア細胞の種類による細胞捕獲効率の変化を表したものである。
【0106】
【表4】

【0107】
前記表4で、シュードモナス・プチダ細胞は、捕獲効率を測定できなかったが、これは、前記細胞は、pH4ではマイクロチップ上で成長せずに測定できなかったためである。しかしながら、顕微鏡イメージから、前記細胞が前記マイクロチップ上に捕獲されるということを確認することができた。
【0108】
前記表4から、大腸菌BL21の場合には、低濃度でも捕獲効率が高く、大腸菌以外のバクテリア細胞でも、捕獲効率が非常に高いということが分かった。従って、本発明によるチップのピラー構造は、ほとんどのバクテリア細胞を効率的に捕獲できる。
【0109】
本発明のチップに捕獲されたバクテリアを観察するために、捕獲されたバクテリア細胞を一般的な染色手順によって染色した後で電子顕微鏡で観察した。図11は、本発明の三次元構造の疎水性固体支持体であるピラー配列を有するチップに捕獲されたグラム陽性および陰性菌の顕微鏡写真を表したものである。図11から、それぞれのバクテリア細胞は、ピラーに効率的に捕獲されているということが分かった。
【0110】
<実施例8:三次元マイクロチップを利用した実際の試料に含まれた大腸菌細胞の分離>
本実施例では、実際の試料に含まれたバクテリア細胞の捕獲効率を知るために、唾液試料とバクテリア細胞との懸濁液を調製した。バクテリア細胞は、SYTO−9蛍光染料で染色された大腸菌BL21を利用し、唾液試料の前処理は、0.01Mのジチオスレイトール(DTT)で15分以上処理し、遠心分離後に0.1Mのリン酸ナトリウム緩衝液(pH4)で再懸濁し、初期の唾液試料の濃度の1/4に希釈した。収得された前処理された唾液溶液に、SYTO−9染色されたバクテリアを懸濁した。流速は、400μl/分であり、バクテリアの捕獲効率は、蛍光光度計を用いて測定した。残りの過程は、前記実施例6と同じように行った。
【0111】
下記表5は、実際の試料に含まれた大腸菌細胞の捕獲効率を表したものである。
【0112】
【表5】

【0113】
前記表5から分かるように、Si/SiO2/SAMおよびSU−8チップはいずれもバクテリア細胞の捕獲効率が非常に高い。従って、実際の試料に含まれるバクテリア細胞が微量であっても、バクテリア細胞を効率的に捕獲できるということが分かる。
【0114】
<実施例9:三次元構造における緩衝液のpHによる影響>
平面構造では、pH4近辺で良好な細胞捕獲効率を示した(実施例1参照)。作製された三次元マイクロチップ(実施例6のチップ3)を利用し、100mMのリン酸ナトリウム緩衝液のpH効果をさらに検証した。大腸菌をpH4およびpH7のリン酸ナトリウム緩衝液に懸濁させて細胞捕獲効率を比較した。300μl/分で懸濁液を流して三回の試験を行った。構造物の効果により、平面構造に比べてpHの影響が小さくなることが分かった(表6参照)。すなわち、広いpH範囲で使用可能である。
【0115】
【表6】

【0116】
<実施例10:ビーズを利用した尿に存在する細胞の分離>
ガラスビーズにOTCを利用し、実施例6のようにSAMコーティングを行った。尿を採取し、いかなる前処理もなしに、既知の濃度(5×106細胞/ml、リン酸ナトリウム、100mM、pH3)の大腸菌を含む溶液と1:1の比率で混合した。0.2gのビーズを前記混合サンプルに投入して混合した。ビーズに吸着された細胞をコロニー計数測定法を用いて定量した。ビーズとサンプルとの混合時間を1分、15分、30分(表7参照)に変化させた。尿の場合には、いかなる前処理過程もなしに、15分で50%のバクテリア細胞捕獲効率を得られた。
【0117】
【表7】

【産業上の利用可能性】
【0118】
本発明の疎水性固体支持体を利用した細胞分離方法は、例えば、細胞分離関連の技術分野に効果的に適用可能である。
【特許請求の範囲】
【請求項1】
水接触角が70〜90°である疎水性固体支持体に、細胞またはウイルスを含む溶液を接触させる段階を含む疎水性固体支持体を利用した細胞またはウイルスの分離方法。
【請求項2】
前記接触させる段階は、静的または流体状態で行うことを特徴とする請求項1に記載の方法。
【請求項3】
前記細胞またはウイルスを含む溶液は、pH2.5〜7であることを特徴とする請求項1または2に記載の方法。
【請求項4】
前記細胞またはウイルスを含む溶液は、pH2.5〜4であることを特徴とする請求項1または2に記載の方法。
【請求項5】
前記細胞またはウイルスを含む溶液は、唾液、血液、尿、緩衝液またはこれらの混合液であることを特徴とする請求項1〜4のいずれか1項に記載の方法。
【請求項6】
前記疎水性固体支持体は、平面構造、ピラー構造、ビーズ構造、または篩構造により構成されることを特徴とする請求項1〜5のいずれか1項に記載の方法。
【請求項7】
前記ピラー構造の縦横比は、1:1ないし20:1であることを特徴とする請求項6に記載の方法。
【請求項8】
前記ピラー構造は、ピラー高さ(H)とピラー間の距離(D)との比率が1:1〜25:1であることを特徴とする請求項6または7に記載の方法。
【請求項9】
前記ピラー構造は、ピラー間の距離(D)が5μm〜100μmであることを特徴とする請求項6〜8のいずれか1項に記載の方法。
【請求項10】
前記細胞またはウイルスは、バクテリア、バクテリオファージ、植物細胞、動物細胞、植物ウイルス、および動物ウイルスから構成される群から選択されることを特徴とする請求項1〜9のいずれか1項に記載の方法。
【請求項11】
前記接触させる段階において、前記溶液にアルコールおよび/または塩をさらに添加することを特徴とする請求項1〜10のいずれか1項に記載の方法。
【請求項12】
前記塩の濃度は、0.01M〜2Mであることを特徴とする請求項11に記載の方法。
【請求項13】
前記アルコールは、エタノール、イソプロパノール、メタノールおよびn−ブタノールから構成される群から選択されることを特徴とする請求項11または12に記載の方法。
【請求項14】
前記接触させる段階の後、前記細胞またはウイルスの結合された疎水性固体支持体を洗浄する段階をさらに含むことを特徴とする請求項1〜13のいずれか1項に記載の方法。
【請求項15】
水接触角が70〜90°である疎水性固体支持体を含む試料内の細胞またはウイルスを分離するための装置。
【請求項16】
前記疎水性固体支持体は、平面構造、ピラー構造、ビーズ構造、および篩構造から構成される群から選択されることを特徴とする請求項15に記載の装置。
【請求項17】
前記ピラー構造の縦横比は、1:1〜20:1であることを特徴とする請求項16に記載の装置。
【請求項18】
前記ピラー構造は、ピラー高さ(H)とピラー間の距離(D)との比率が1:1〜25:1であることを特徴とする請求項16または17に記載の装置。
【請求項19】
前記ピラー構造は、ピラー間の距離(D)が5μm〜100μmであることを特徴とする請求項16〜18のいずれか1項に記載の装置。
【請求項20】
試料チャンバをさらに含むことを特徴とする、請求項15〜19のいずれか1項に記載の装置。
【請求項1】
水接触角が70〜90°である疎水性固体支持体に、細胞またはウイルスを含む溶液を接触させる段階を含む疎水性固体支持体を利用した細胞またはウイルスの分離方法。
【請求項2】
前記接触させる段階は、静的または流体状態で行うことを特徴とする請求項1に記載の方法。
【請求項3】
前記細胞またはウイルスを含む溶液は、pH2.5〜7であることを特徴とする請求項1または2に記載の方法。
【請求項4】
前記細胞またはウイルスを含む溶液は、pH2.5〜4であることを特徴とする請求項1または2に記載の方法。
【請求項5】
前記細胞またはウイルスを含む溶液は、唾液、血液、尿、緩衝液またはこれらの混合液であることを特徴とする請求項1〜4のいずれか1項に記載の方法。
【請求項6】
前記疎水性固体支持体は、平面構造、ピラー構造、ビーズ構造、または篩構造により構成されることを特徴とする請求項1〜5のいずれか1項に記載の方法。
【請求項7】
前記ピラー構造の縦横比は、1:1ないし20:1であることを特徴とする請求項6に記載の方法。
【請求項8】
前記ピラー構造は、ピラー高さ(H)とピラー間の距離(D)との比率が1:1〜25:1であることを特徴とする請求項6または7に記載の方法。
【請求項9】
前記ピラー構造は、ピラー間の距離(D)が5μm〜100μmであることを特徴とする請求項6〜8のいずれか1項に記載の方法。
【請求項10】
前記細胞またはウイルスは、バクテリア、バクテリオファージ、植物細胞、動物細胞、植物ウイルス、および動物ウイルスから構成される群から選択されることを特徴とする請求項1〜9のいずれか1項に記載の方法。
【請求項11】
前記接触させる段階において、前記溶液にアルコールおよび/または塩をさらに添加することを特徴とする請求項1〜10のいずれか1項に記載の方法。
【請求項12】
前記塩の濃度は、0.01M〜2Mであることを特徴とする請求項11に記載の方法。
【請求項13】
前記アルコールは、エタノール、イソプロパノール、メタノールおよびn−ブタノールから構成される群から選択されることを特徴とする請求項11または12に記載の方法。
【請求項14】
前記接触させる段階の後、前記細胞またはウイルスの結合された疎水性固体支持体を洗浄する段階をさらに含むことを特徴とする請求項1〜13のいずれか1項に記載の方法。
【請求項15】
水接触角が70〜90°である疎水性固体支持体を含む試料内の細胞またはウイルスを分離するための装置。
【請求項16】
前記疎水性固体支持体は、平面構造、ピラー構造、ビーズ構造、および篩構造から構成される群から選択されることを特徴とする請求項15に記載の装置。
【請求項17】
前記ピラー構造の縦横比は、1:1〜20:1であることを特徴とする請求項16に記載の装置。
【請求項18】
前記ピラー構造は、ピラー高さ(H)とピラー間の距離(D)との比率が1:1〜25:1であることを特徴とする請求項16または17に記載の装置。
【請求項19】
前記ピラー構造は、ピラー間の距離(D)が5μm〜100μmであることを特徴とする請求項16〜18のいずれか1項に記載の装置。
【請求項20】
試料チャンバをさらに含むことを特徴とする、請求項15〜19のいずれか1項に記載の装置。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【公開番号】特開2010−178750(P2010−178750A)
【公開日】平成22年8月19日(2010.8.19)
【国際特許分類】
【出願番号】特願2010−83048(P2010−83048)
【出願日】平成22年3月31日(2010.3.31)
【分割の表示】特願2006−113753(P2006−113753)の分割
【原出願日】平成18年4月17日(2006.4.17)
【出願人】(390019839)三星電子株式会社 (8,520)
【氏名又は名称原語表記】SAMSUNG ELECTRONICS CO.,LTD.
【住所又は居所原語表記】416,Maetan−dong,Yeongtong−gu,Suwon−si,Gyeonggi−do 442−742(KR)
【Fターム(参考)】
【公開日】平成22年8月19日(2010.8.19)
【国際特許分類】
【出願日】平成22年3月31日(2010.3.31)
【分割の表示】特願2006−113753(P2006−113753)の分割
【原出願日】平成18年4月17日(2006.4.17)
【出願人】(390019839)三星電子株式会社 (8,520)
【氏名又は名称原語表記】SAMSUNG ELECTRONICS CO.,LTD.
【住所又は居所原語表記】416,Maetan−dong,Yeongtong−gu,Suwon−si,Gyeonggi−do 442−742(KR)
【Fターム(参考)】
[ Back to top ]

