糖ペプチドイオンを効率的に選択可能な質量分析方法及び装置
【課題】物質の構造に関する情報の取得効率を向上し、測定及び物質同定の時間を短縮することのできる質量分析方法を提供する。
【解決手段】質量分析でのプリカーサイオン選択過程において、MS1スペクトルで検出された任意のイオンと他のイオンとの分子量差を算出し、分子量差が修飾物組み合わせ理論値と一致するイオン群からプリカーサイオンを選択することを特徴とする質量分析方法を提供する。
【解決手段】質量分析でのプリカーサイオン選択過程において、MS1スペクトルで検出された任意のイオンと他のイオンとの分子量差を算出し、分子量差が修飾物組み合わせ理論値と一致するイオン群からプリカーサイオンを選択することを特徴とする質量分析方法を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、質量分析における効率的なイオン選択技術に関する。本発明は、例えば翻訳後修飾された生体高分子を効率的にイオン解離分析することができる技術に関する。
【背景技術】
【0002】
ヒトにはおよそ数万種のタンパク質が存在すると言われている。タンパク質の機能は、プロテアーゼによる切断、糖鎖やリン酸基等の付加による活性・相互作用調節など、様々な翻訳後修飾により巧妙な調節を受けている。特に真核生物においては、遺伝子配列に基づいて合成されたタンパク質がそのままの状態で機能を発揮することはまれであり、例えばリボソーム上での合成後その場で、又は細胞内での最終的な局在が決まるまでの様々な段階で、多種多様な修飾を受ける。リン酸化修飾は、通常、タンパク質のセリン、スレオニン、チロシン残基に起きる。糖鎖修飾は、アスパラギン、セリン、スレオニン残基に起き、単糖がグリコシド結合によって鎖状に連結した構造、あるいは分岐した構造を持つ。また、同じタンパク質の同一アミノ酸であっても、修飾される糖鎖構造は様々である(非特許文献1)。これらの翻訳後修飾は疾患と深い関わりがあり、翻訳後修飾されたタンパク質の分析は近年特に注目されている。翻訳後修飾の構造解析では「どんな翻訳後修飾が」、「どのタンパク質の」、「どのアミノ酸に」修飾されているかを決定することが求められる。しかしながら、タンパク質の構造は、単にゲノム情報のみでは決定することができない上、タンパク質を増幅する技術も存在しないことからタンパク質を直接解析する必要がある。
【0003】
タンパク質の構造解析手段の1つとして、質量分析法(mass spectrometry: MS)は広く普及している。質量分析法を用いれば、アミノ酸がペプチド結合でつながったポリペプチド(ペプチドやタンパク質)の配列情報や翻訳後修飾情報を得ることができる。通常、分子量に比例して質量分析や解析が困難になるため、タンパク質は酵素を用いてペプチドに断片化される。ペプチドに断片化された試料は、複雑な混合物であるため、液体クロマトグラフィー(Liquid chromatography :LC)装置等に代表される試料を分離する前処理手段で分離され、カラム出口から質量分析装置に直接導入される。一般的な2時間以内のLC分離条件では、各ペプチドは数十秒から1分程度の短いバンドとして検出されるため、高速分析が可能な質量分析装置が使用される。特に高周波電場を用いたイオントラップや四重極質量フィルターを用いた質量分析法や飛行時間型質量分析法(Time-of-Flight mass spectrometer : TOF-MS)は高速分析が可能なため、LCとの結合性が良い。そのため、これらの高速質量分析法は、多種類の試料を連続解析することが求められるプロテオーム解析等の目的に合致しており、幅広く利用されている。
【0004】
一般に質量分析法では、試料分子をイオン化して真空中に導入し(又は真空中でイオン化し)、電磁場中におけるそのイオンの運動を測定することにより、対象とする分子イオンの質量電荷比(m/z)が測定される。取得されたデータをMS1スペクトルと呼ぶ。得られる情報が質量と電荷の比という巨視的な量であるため、質量分析操作を単に1回実行するだけでは、その内部構造情報までは得ることができない。そこで、タンデム質量分析法と呼ばれる方法が用いられる。
【0005】
タンデム質量分析法では、まず1回目の質量分析操作において、試料分子イオンを特定する又は単離する。特定又は単離されたイオンを「プリカーサイオン」と呼ぶ。続いて、プリカーサイオンを何らかの手法で解離する。解離したイオンを「フラグメントイオン」と呼ぶ。このフラグメントイオンを更に質量分析すると、フラグメントイオンの生成パターンの情報が得られる(MS/MSスペクトルと呼ぶ)。解離手法により、解離パターンの法則性があるため、プリカーサイオンの構造を推定することが可能となる。特にアミノ酸を骨格とする生体分子の分析では、イオン解離手法として衝突励起解離(Collision-Induced-Dissociation:CID)法、赤外多光子吸収解離(Infra-Red-Multi-Photon-Dissociation:IRMPD)法、電子捕獲解離(Electron-Capture-Dissociation:ECD)法、電子移動解離(Electron-Transfer-Dissociation:ETD)法、電子脱離解離(Electron-Detachment-Dissociation :EDD)法が用いられる。なお、MS/MSスペクトルで検出されるフラグメントイオン強度が高いほど高精度な構造解析が可能なため、プリカーサイオンはイオン強度順に選択されるのが一般的である。場合により価数や質量電荷比の値が考慮されることもある。
【0006】
タンパク質の解析において、現在もっとも広く使われている手法は、プリカーサイオンに運動エネルギーを与えてガスと衝突させるCID法である。CID法では、ガスとの衝突によりプリカーサイオンの分子振動が励起され、分子鎖の切れやすい部分で解離が起こる。
【0007】
また、最近使われるようになった方法が、プリカーサイオンに赤外レーザ光を照射して多数の光子を吸収させるIRMPD(Infrared Multi-Photon Dissociation)法である。IRMPD法では、プリカーサイオンの分子振動が励起され、分子鎖の切れやすい部位で解離が起こる。ポリペプチドの解離部位を図2に示す。図中のa、b、cは、NH2 末端側を含む分子、x,y,zはCOOH末端側を含む分子である。
【0008】
CID法やIRMPD法で切れ易い部位は、アミノ酸配列からなる主鎖のうち、b−yで命名されている部位であるが、翻訳後修飾を受けた生体高分子をCID法やIRMPD法で解離した場合、アミノ酸の側鎖に存在する修飾物質が優先的に解離し、アミノ酸配列主鎖は解離しないことが多い。一方、ECD法やETD法で切れ易い部位は、アミノ酸配列の主鎖上のc−z命名されている部位である。ECD法やETD法はアミノ酸の側鎖に存在する修飾物質を切断し難いという特徴をもっているので、翻訳後修飾を受けた生体高分子でもアミノ酸配列や修飾位置を同定することができる。なお、正に帯電したプリカーサイオンと電子を反応させる手法はECD法と呼ばれ、正に帯電したプリカーサイオンと負に帯電したイオンを反応させ、電子の授受を経由して、ECD法と同様の解離を引き起こす手法はETD法と呼ばれる。
【0009】
例えば糖鎖修飾されたペプチド(糖ペプチド)をCID法やIRMPD法で分析した場合、糖鎖が優先的に解離するため糖鎖構造を推定(場合により決定)できるが、アミノ酸配列と修飾されていたアミノ酸は決定できない。一方、糖ペプチドをECD法やETD法で分析した場合、ポリペプチドが優先的に解離するため、アミノ酸配列と修飾されていたアミノ酸を決定できるが、糖鎖構造は決定できない(非特許文献2)。糖ペプチドの例のように翻訳後修飾分析においては、CID法(あるいはIRMPD法)とECD法(あるいはETD法)は相補的な解離手段として知られている。
【0010】
先述したようにポリペプチドを体系的に分析するプロテオーム解析では、LCの利用により、試料を分離する必要がある。その分離手段として逆相クロマトグラフィーが広く利用されている。逆相クロマトグラフィーでは極性の高い(あるいは疎水性の低い)物質から溶出される。ここで逆相クロマトグラフィーを用いたLC−MSの分析例を図3に示す。
【0011】
糖タンパク質であるヒトトランスフェリンをリジルエンドペプチダーゼで消化した試料を逆相クロマトグラフィーで分離し、質量分析した。試料分離は60分のリニアグラジエント(4%アセトニトリルから40%アセトニトリル)で行われ、35分から45分の間のクロマトグラフを示している。トランスフェリンは3か所糖鎖修飾されることが知られており、主要な糖鎖構造は決定されている(非特許文献3)。
【0012】
図中、(A)に示すグラフは、全イオンクロマトグラフと呼ばれ、MS1スペクトルで検出されたイオンのイオン強度の合算値をプロットしている。(B)に示すグラフ(XIC(921.1))は、CGLVPVLAENYNKにバイアンテナ型(構造は図中に表記)と呼ばれる糖鎖が修飾した糖ペプチドの4価イオンであるm/zが921.1のイオン強度をプロットしたマスクロマトグラフである。(C)に示すグラフ(XIC(1085.2))は、CGLVPVLAENYNKにトリアンテナ型(構造は図中に表記)と呼ばれる糖鎖が修飾した糖ペプチドの4価イオンであるm/zが1085.2のマスクロマトグラフである。(D)に示すグラフ(XIC(1110.3))は、ILRQQQHLFGSNVTDCSGNFCLFRSETK にバイアンテナ型糖鎖が修飾した 糖ペプチドの5価イオンであるm/zが1110.3のマスクロマトグラフである。(E)に示すグラフ(XIC(1241.5))は、ILRQQQHLFGSNVTDCSGNFCLFRSETKにトリアンテナ型糖鎖が修飾した糖ペプチドの5価イオンであるm/zが1241.5のマスクロマトグラフである。(F)に示すグラフ(XIC(657.2))は、糖鎖NeuAcHexHexNAcの1価イオンであるm/zが657.2のマスクロマトグラフである。NeuAcは、α-N-Acetylneuraminic acidを表し、Hexはβ-D-Glucose(Glc)、β-D-Mannose(Man)、β-D-Galactose(Gal)を表し、HexNAcはβ-D-N-Acetylglucosamine(GlcNAc)、β-D-N-Acetylgalactosamine(GalNAc)を表す。
【0013】
図3の結果から逆相クロマトグラフィーを用いて糖ペプチドを分離した場合、アミノ酸配列に依存して分離し、糖鎖構造の影響が小さいことがわかる。また、糖ペプチドがイオン化される際に糖鎖が解離する現象(インソースディケイ)によって、MS1スペクトルから糖鎖イオンが観察され、糖鎖イオンが観察される時間帯と糖ペプチドが観察される時間帯は一致していることがわかる。
【0014】
図4に保持時間42.4分に観察されたMS1スペクトルを示す。図より、ILRQQQHLFGSNVTDCSGNFCLFRSETKに対し、バイアンテナ型、トリアンテナ型、トリアンテナ型(Deoxyhexose付加)糖鎖が修飾した糖ペプチドが同時に検出されていることがわかる。
【0015】
糖ペプチドは、未修飾ペプチドよりも大幅に感度が低いことが知られている。しかも多量の未修飾ペプチドと同時にイオン化されると検出感度は著しく低下する(非特許文献4)。さらに糖鎖構造の不均一性によってスペクトルは複雑化することが知られている。
【0016】
図5にILRQQQHLFGSNVTDCSGNFCLFRSETK にバイアンテナ型糖鎖が修飾した5価イオンであるm/zが1110.3のECDスペクトルを示す。一般的なECDスペクトルでは、プリカーサイオン([M+5H]5+)、チャージリデューススピーシーズ( [M+5H]4+;電子と反応したが解離しなかったプリカーサイオン)、フラグメントイオンが観察される。ECDやETDでは、CIDやIRMPDと異なり、全てのプリカーサイオンがフラグメントイオンに変換されるわけではない(残存プリカーサイオンやチャージリデューススピーシーズが残る)。このため、CIDスペクトルで観察されるフラグメントイオンよりも微弱なフラグメントイオンとなる。高精度にアミノ酸配列や修飾位置を同定するには、S/Nの高いMS/MSスペクトル(ECDスペクトル)を取得することが求められる。
【先行技術文献】
【非特許文献】
【0017】
【非特許文献1】Takegawa. Y. et al ; J Sep Sci, 2008, 31, 1585-1593.
【非特許文献2】Deguchi, K. et al ; Rapid Commun Mass Spectrom, 2007, 21, 691-698.
【非特許文献3】Satomi, Y. et al ; FEBS Lett, 2004, 576, 51-56.
【非特許文献4】Annesly, T.M. et al ; Clin Chem, 2003, 49, 1041-1044.
【発明の概要】
【発明が解決しようとする課題】
【0018】
糖鎖修飾を受けたタンパク質やペプチドの定性解析では、アミノ酸配列の同定だけでなく、糖鎖修飾の種類や糖鎖の構造又は修飾位置の同定が求められる。通常タンパク質は質量分析・解析を容易にするため、酵素でタンパク質を切断した消化物を試料とする。しかし、これらの試料は多種類のペプチド混合物であるため、逆相クロマトグラフィー等のLCと結合して質量分析される。試料は貴重であるため、少量の試料からできるだけ多くの糖ペプチドの構造を同定することが求められる。糖ペプチドを優先的に分析したい場合、各イオンの質量電荷比や価数情報から糖ペプチドを特定することはできず、実際にCID(あるいは、IRMPD)で解離してみて初めて糖ペプチドであることが確認できる。さらに、一般的にプリカーサイオンはイオン強度順に選択されるが、糖ペプチドはイオン化効率が低いことや、糖鎖構造の不均一性によって、未修飾ペプチドよりも相対的に検出されにくいため、プリカーサイオンとして選択されにくい。
【0019】
また、特にECD(あるいは、ETD)による同定では、S/Nの高いフラグメントイオンで構成されるスペクトルを取得する必要がある。しかし、糖ペプチドは未修飾ペプチドよりもイオン強度が低くなる傾向があるため、未修飾ペプチドと同様の条件でMS/MS測定を行った場合、未修飾ペプチドよりもS/Nの低いスペクトルを取得することとなる。
【0020】
そこで、本発明は、以上説明した技術的な課題を解決し、物質の構造に関する情報の取得効率を向上させる質量分析方法及び装置を提供することを目的とする。
【課題を解決するための手段】
【0021】
本発明による質量分析方法は、分離された試料をイオン源によりイオン化する工程と、生成された試料イオンの質量スペクトルを取得する工程と、検出されたイオン情報をピークリストに格納する工程と、ピークリストに記載されたイオンから任意の1イオンを選択し、当該イオンと他のイオンとの質量差を算出する工程と、算出された質量差から修飾構造を推定する工程と、修飾構造が推定されたイオンからプリカーサイオンを選択する工程と、選択されたプリカーサイオンの強度情報に基づきデータ取得時間を設定する工程を有する。
【発明の効果】
【0022】
本発明により、実時間で所望の修飾物質を保持したイオンを推定することが可能であり、所望のイオンを優先的に分析することが可能となる。また、プリカーサイオン強度情報に基づきデータ取得時間を設定することにより、S/Nの高いデータを取得することが可能になる。これにより、質量分析による物質の同定において、物質の構造に関する情報を取得する効率が向上し、測定及び物質同定の時間が短縮する。また、同定精度が向上する。上記した以外の課題、構成及び効果は、以下の実施形態の説明により明らかにされる。
【図面の簡単な説明】
【0023】
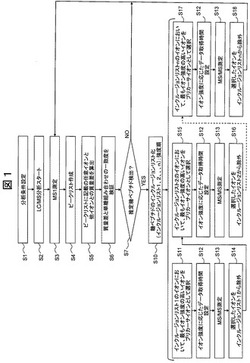
【図1】発明の実施の形態1における制御フローを説明する図。
【図2】ポリペプチドの解離パターンを説明する図。
【図3】トランスフェリン消化物のLC−MS分析実験図。全イオンクロマトグラフ(A)、糖ペプチドイオンm/z:921.1のマスクロマトグラフ(B)、糖ペプチドイオンm/z:1085.2のマスクロマトグラフ(C)、糖ペプチドイオンm/z:1110.3のマスクロマトグラフ(D)、糖ペプチドイオンm/z:1241.5のマスクロマトグラフ(E)、糖鎖イオンm/z:657.2のマスクロマトグラフ(F)
【図4】図3の保持時間42.4分に観察されたMS1スペクトル実験図。
【図5】糖ペプチドILRQQQHLFGSNVTDCSGNFCLFRSETKにバイアンテナ型糖鎖が修飾した5価イオンであるm/z:1110.3のECDスペクトルを示す実験図。
【図6】発明の実施の形態1に基づく質量分析システムの構成例を示す図。
【図7】MS1スペクトルの模式図。
【図8】ピークリスト例を示す図。
【図9】分子量情報を含むピークリスト例を示す図。
【図10】質量差情報を含むピークリスト例を示す図。
【図11】質量差算出において任意イオンの選び方を説明する図。
【図12】推定糖鎖構造情報を含むピークリスト例を示す図。
【図13】インクルージョンリスト例を示す図。
【図14】実施の形態1による制御フローを動作した結果、推定された糖鎖構造情報が記載されているMS1スペクトルの模式図。
【図15】発明の実施の形態1における分析条件設定画面例を示す図。
【図16】単糖組み合わせ質量ファイル例を示す図。
【図17】イオンピークを説明する模式図。
【図18】分析終了後に表示されるインクルージョンリストを示す図。
【図19A】発明の実施の形態2における制御フローを説明する図(1/2)。
【図19B】発明の実施の形態2における制御フローを説明する図(2/2)。
【図20】発明の実施の形態2における分析条件設定画面例を示す図。
【図21】発明の実施の形態3における制御フローを説明する図。
【図22】糖ペプチドイオンのMS/MSスペクトルの模式図。
【図23】発明の実施の形態4における制御フローを説明する図。
【図24A】発明の実施の形態5における制御フローを説明する図(1/2)。
【図24B】発明の実施の形態5における制御フローを説明する図(2/2)。
【図25】イクスクルージョンリストにおける排除時間内イオンの有無を説明する図。
【図26】排除時間内イオンを用いて糖鎖構造を推定した場合の糖鎖構造情報を含むピークリスト例を示す図。
【図27】発明の実施の形態5による制御フローを動作した結果、情報が更新されたイクスクルージョンリストを示す図。
【発明を実施するための形態】
【0024】
以下、図面を参照して、本発明の実施の形態を説明する。なお、後述する本発明の実施の形態は一例であって、公知又は周知の技術との組み合わせや置換によって他の形態を実現することもできる。また、修飾物質として糖鎖を例として説明するが、他の修飾物でもかまわない。
【0025】
(A)実施の形態1
本形態例においては、プリカーサイオン強度に基づいてデータ取得時間を設定する方法について説明する。
【0026】
(質量分析システムの構成)
図6に、イオン解離法としてCID法、あるいは、ECD法を用いる質量分析システムの構成例を示す。分析対象となる試料21は、試料分離装置22(図では、液体クロマトグラフィー(LC))の前処理により分離される。なお、試料分離装置22には、ガスクロマトグラフィー(GC)を用いることもできる。
【0027】
分離された試料は、イオン源23においてイオン化され、質量分析装置に導入される。MS1スペクトル取得の場合、導入されたイオンは、リニアイオントラップ(LIT)24で蓄積され、排出される。排出されたイオンは、Qディフレクター25を経由し、TOF検出器28で検出される。TOF検出器28の前段には高分解能であるTOF27が存在する。
【0028】
CIDによるMS/MSスペクトル取得の場合、質量分析システムに導入されたイオンはLIT24で蓄積され、ある特定のイオンが単離された後、LIT24内でCIDによって解離される。解離したイオンはLIT24から排出され、Qディフレクター25を経由し、TOF27でイオンの質量電荷比m/zに応じて分離される。イオン解離方法としてCID法を用いているが、IRMPD法を用いても良い。
【0029】
ECDによるMS/MSスペクトル取得の場合、質量分析システムに導入されたイオンはLIT24で蓄積され、ある特定のイオンが単離された状態で排出される。排出されたイオンはQディフレクター25を経由し、ECDセル26に入る。ここで、イオンは電子と反応し、フラグメントイオンは排出される。排出されたフラグメントイオンは再びQディフレクター25を経由し、TOF27でイオンの質量電荷比m/zに応じて分離される。
【0030】
イオン源23は、エレクトロスプレイイオン源、大気圧化学イオン化によるイオン源、マトリックス支援レーザ脱離イオン源、電気衝撃イオン源、化学イオン化によるイオン源、フィールドイオン化によるイオン源から選択される。
【0031】
LIT24は多くのイオンが蓄積できるため、高感度検出が可能であるが、三次元四重極イオントラップ、四重極質量フィルター、コリジョンセル、フーリエ変換イオンサイクロトロン共鳴質量分離部でも構わない。
【0032】
ECDセル26は、LIT、三次元四重極イオントラップ、コリジョンセル、四重極質量フィルター、フーリエ変換イオンサイクロトロン共鳴質量分析部の中から選択される。また、本装置構成では、イオン解離方法としてECD法を用いているが、ETD法やEDD法を用いても良い。EDD法の場合、イオン化は負イオンモードで実施する。
【0033】
TOF27は高分解能で質量精度も高いので好ましいが、四重極質量フィルター、イオントラップ、磁場型質量分析器、フーリエ変換イオンサイクロトロン共鳴質量分析器、オービトラップ型分析器でも構わない。
【0034】
TOF検出器28で検出された各イオン情報は、全体処理部30に与えられる。全体処理部30は、後述するようなデータ整理及び又はデータ処理を実行する。なお、全体処理部30は、ハードウェア的な回路構造を有する場合だけでなく、コンピュータシステム上で動作するプログラムの処理機能を通じても実現することができる。全体処理部30の一部であるプリカーサイオン選択部31は、データ格納部41とソフトウエア部32によって構成される。データ格納部41は、ピークリスト38、単糖組み合わせ質量ファイル47、インクルージョンリスト39、データ取得時間設定テーブル40で構成され、ソフトウエア部32は、分子量算出部33、質量差算出部34、糖ペプチド推定部35、イオン分類部36、プリカーサイオン決定部37で構成される。
【0035】
ピークリスト38はMS1スペクトルで検出されたイオン情報を格納し、例えば質量電荷比、価数、イオン強度、LC保持時間等の情報を含む。分子量算出部33ではピークリスト38に格納されている各イオンの質量電荷比と価数からイオンごとの分子量を算出する。質量差算出部34ではピークリスト38に格納されている任意の1イオンとその他のイオンとの質量差を算出する。糖ペプチド推定部35では質量差算出部34で算出された質量差と単糖組み合わせ質量ファイル47とのマッチングを行う。マッチしたイオンペアはイオン分類部36によってインクルージョンリスト39に格納される。インクルージョンリスト39には、質量電荷比、価数、イオン強度、LC保持時間等の情報を含む。プリカーサイオン決定部37は、インクルージョンリスト39に格納されているイオンからプリカーサイオンを選択し、選択したイオンのイオン強度情報とデータ取得時間設定テーブル40を用いて設定すべきデータ取得時間情報を入手する。入手した情報はプリカーサイオン決定部37から質量分析装置内にある制御部29を介してLIT24、Qディフレクター25、ECDセル26に伝達される。全体処理部30が、特許請求の範囲における「計算処理部」に対応する。
【0036】
MS1スペクトル、MS/MSスペクトル、質量電荷比、価数、イオン強度、LC保持時間、任意イオンとの質量差、推定された修飾構造、CID解離強度、ECD解離強度、LIT24の制御パラメータ、試料分離装置22の溶媒混合比、流量等はデータ表示部42に表示される。全体処理部30に対する所望の修飾情報、マッチング誤差、MS/MSターゲット数等は、パラメータ入力部43を通じて入力する。
【0037】
(処理動作の概要)
図1に、実施の形態1に基づく制御フローを示す。分析前には分析条件設定を行い(ステップ1)、LC/MS分析をスタートさせる(ステップ2)。分析条件設定(ステップ1)の詳細は後述する。LC/MS分析では、複数物質の混合物である試料21を試料分離装置22に導入する。クロマトグラフィーには、物質の性質によって分離させるための分離カラムが装着されており、分離カラムを通過した試料は、成分ごとに異なる時間に溶出する。溶出した試料の各成分は、イオン源23にてイオン化される。イオンは質量分析装置内のLIT24に導入されて蓄積され、排出口から排出される。排出されたイオンはTOF検出器28において検出され、横軸をm/z、縦軸をイオン強度とするMS1スペクトルを得る(ステップ3)。MS1スペクトルの模式図を図7に示す(ここではA〜Iのイオンが検出される)。なお、横軸はm/zであり、縦軸はイオン強度である。
【0038】
次に、MS1スペクトルの情報(質量電荷比、価数、イオン強度、LC保持時間等)は、プリカーサイオン選択部31中のピークリスト38に格納される(ステップ4)。一定イオン強度以上のイオンのみをピークリスト38に格納してもよい。また多くの場合、ペプチドイオンは2価以上になるため、1価イオンはピークリスト38に格納しなくてもよい。ピークリスト38の一例を図8に示す。Chargeは価数、Intensityはイオン強度、RTは液体クロマトグラフィーの保持時間を示す。分子量算出部33によってピークリスト38に格納されている各イオンの質量電荷比と価数から分子量が算出され、得られた分子量情報はピークリスト38に追加される。分子量計算後、一定値以内(例えば0.05Da以内)のイオンは、同一分子量イオンと判断してもよい。分子量情報が追加されたピークリストの一例を図9に示す。M.W.が分子量を示す。ここでは、分子量情報をピークリスト38に追加したが、別ファイルとして保持してもよい。分子量算出動作の詳細については後述する。次に、質量差算出部34によってピークリスト38に格納されている任意の1イオンとその他のイオンとの質量差を算出する(ステップ5)。質量差情報が追加されたピークリスト38の一例を図10に示す。ここでは、任意の1イオンとしてEイオンを選択し、Eイオンとその他のイオンとの質量差を求めている。Delta mass(E)がこれにあたる。質量差情報は複数個排出されるので、個別ファイルとして保持するのが望ましい。ここでは、説明のため、ピークリスト38に質量差情報を追加している。任意の1イオンの選択方法を図11に示す。(A)に示すグラフは、全てのイオンを任意の1イオンとする場合であり、ピークリスト38に格納されているイオンの数だけ質量差リストを作成する。図8のピークリストでは9つ差分リストを作成することとなる。(B)に示すグラフは、一定以上のイオン強度をもつイオンを任意の1イオンとする場合であり、計算処理時間を低減することができる。多くの場合、ペプチドイオンは2価以上になるため、1価イオンは質量差計算するイオン候補から除外してもよい。次に、糖ペプチド推定部35は算出された質量差が単糖組み合わせ質量ファイル47に存在するかを検証する(ステップ6)。検証の際、単糖組み合わせ理論質量にある一定の誤差を設けることが望ましい。
【0039】
検証結果の一例を図12に示す。質量差が糖鎖組み合わせと一致するイオンが存在する場合(ステップ7で肯定結果の場合)は、糖ペプチドのインクルージョンリスト化を実施する(ステップ10)。ここでは、インクルージョンリスト1、インクルージョンリスト2、インクルージョンリストnに分類されたと想定する。図12の例では、D、E、F、Gイオンが一つのインクルージョンリストに格納される。インクルージョンリストの一例を図13に示す。インクルージョンリスト39に一旦格納されたイオンは、質量差算出におけるイオン候補から除外してもよい。この除外により、計算処理時間を低減することができる。プリカーサイオン決定部37は、インクルージョンリスト39の中から最もイオン強度の高いイオンをプリカーサイオンとして選択し(ステップ11)、選択したプリカーサイオン強度とデータ取得時間設定テーブル40を用いてデータ取得時間を決定する(ステップ12)。プリカーサイオンは、イオン強度順に選択されるのが一般的であるが、価数や分子量を考慮に入れて選択しても良い。プリカーサイオンの質量電荷比、データ取得時間の情報は、プリカーサイオン決定部37によって質量分析装置内部の制御部29を介して、LIT24、Qディフレクター25、ECDセル26に伝達され、MS/MS測定(ステップ13)を実施する。分析されたイオンは、インクルージョンリスト39から除去される(ステップ14)。通常、質量分析前には、MS/MSターゲット数を設定する(後述する図15のMaximum MS/MS target numberがこれに当たる)。インクルージョンリスト数(1、2、、n)がMS/MSターゲット数を下回った場合、再度インクルージョンリストからプリカーサイオンを選択することが可能である。この場合、すでに分析したイオンをMS/MS分析する必要はないため、インクルージョンリスト39から除去した。また、ここではMS/MS分析したイオンだけをインクルージョンリスト39から除去したが、格納されている全てのイオンを除去してもよい。この場合、一度プリカーサイオンが選択されたインクルージョンリストから再度プリカーサイオンが選択され、MS/MS測定(ステップ13)されることはない。別のインクルージョンリストが存在する場合は、そのインクルージョンリスト39の中からプリカーサイオンを選択し(ステップ15、17)、イオン強度に応じたデータ取得時間を設定し(ステップ12)、MS/MS測定(ステップ13)を実施する。分析されたイオンは、インクルージョンリスト37から除去され(ステップ16、18)、MS1測定(ステップ3)に戻る。図14に、MS1スペクトルで観察されたイオンに推定構造を表示した。Eイオンに特定の糖鎖を付加、あるいは、除去したイオンがD、F、Gイオンであることが推定されている。
【0040】
従来法では、糖ペプチドを優先的に分析したい場合であっても、単に各イオンの質量電荷比や価数やイオン強度情報から糖ペプチドを特定することはできない。そのため、イオン強度順にプリカーサイオンは選択される。しかし、本形態例では、各イオンの分子量差から糖ペプチドを推定することが可能であり、糖ペプチドを優先的に分析することが可能になる。さらに、本発明では、糖鎖構造が推定できるイオン群のうち1イオン(あるいは1部のイオン)にターゲットを絞り、MS/MS測定(ステップ13)を行うことで、アミノ酸配列の異なる糖ペプチドを網羅的に分析することができる。
【0041】
また、従来法のようにどのイオンに対しても同一条件でMS/MS測定をする場合、イオン強度の低いプリカーサイオンでは、S/Nの低いスペクトルとなり、同定できないことも想定される。本発明では、イオン強度に応じてデータ取得時間を制御することで、どのプリカーサイオンに対しても一定基準以上のスペクトルを取得することができる。
【0042】
本形態例では、ある保持時間に検出されたイオンのみで質量差計算を行っているが、以前の保持時間に検出されたイオン、構造が推定されたイオン、あるいは別分析で得られたイオンと質量差計算を行ってもよい。
【0043】
本形態例では、イオン解離手段としてCIDを用いているが、IRMPD、ECD、ETD、EDDあるいはその他の解離手段でもよい。
【0044】
なお、全体処理部30による、分子量算出、質量差算出、修飾構造推定、プリカーサイオンの決定は、いずれも分析を妨げないように、実時間で実施される必要がある。
【0045】
(分析条件設定)
設定画面の一例を図15に示す。ユーザーは分析する対象となる修飾の種類を選択する。ここでは、糖鎖(Glycosylation)を選択している。分析取得方法によりモードを選択する。例えば本形態例を動作させる場合は、モード1を選択した。まず、想定される単糖の種類を選択する。サンプルの由来から単糖の種類を絞り込むことが可能な場合がある。また、すでに糖鎖解析を実施している場合は、糖鎖の種類や各単糖の範囲を指定することも可能である。この表示例では、Hex、HexNAc、NeuAcで構成される糖鎖修飾が想定され、その個数範囲はそれぞれ3−7、2−6、1−4としている。これらの組み合わせ、及び分子量の表をプログラムの処理機能を通じて分析前に作成しておくことが望ましい。この表が単糖組み合わせ質量ファイル47に相当する。単糖組み合わせ質量ファイル47の作成方法は後述する。
【0046】
質量差算出部34によって算出された各質量差は単糖組み合わせ質量ファイル47と照らし合わせ、ユーザー指定の誤差範囲で一致する修飾物を探索する。この誤差範囲を指定するのが、Verification accuracyである。図中では、±0.3Daが入力されている。
【0047】
ユーザーはMS/MSターゲットの上限を指定するのが望ましい。図中では、Maximum MS/MS target number がこれにあたる。一回のシークエンス(MS1+MS/MS分析×n回)で最大3イオンをMS/MS分析に進める(nが最大3を意味する)。あるいは、MS/MS測定を特定回数実施する条件でもよい。
【0048】
ユーザーはイオン強度に応じたデータ取得時間を設定する。図中では、プリカーサイオンのイオン強度が1000以下の場合は、7秒間MS/MS分析を行い、1000〜3000の場合は、5秒間MS/MS分析を行い、3000〜6000の場合は、5秒間MS/MS分析を行い、6000〜8000の場合は、4秒間MS/MS分析を行い、8000以上の場合は、3秒間MS/MS分析を行うことを示す。
【0049】
(単糖組み合わせ質量ファイル作成方法)
ここでは、単糖組み合わせ質量ファイルの作成方法を説明する。分析条件設定画面設定したユーザー所望の単糖種類と個数から全ての単糖組み合わせと分子量を算出し、単糖組み合わせ質量ファイル7を作成する。一例を図16に示す。例えば、[Hex]3[HexNAc]2の組み合わせの場合、Hexの分子量180.063×3=540.189とHexNAcの分子量221.09×2=442.180との和982.369から5つのグリコシド結合で失われる水の分子量90.052(18.01×5)を差し引き、分子量892.317となる。グリコシド結合の数は糖鎖の個数と一致する。
【0050】
(価数と分子量の算出)
ここでは、イオンの価数と分子量の算出方法について説明する。図17に、質量分析で観測されるプロトン化[H+]したイオンピークの模式図を示す。縦軸はイオン強度であり、横軸はm/zである。タンパク質の構成原子は主に炭素、水素、酸素、窒素である。自然界の炭素には質量数12の12Cの他に、約1%質量数13の13Cが存在する。そのため、タンパク質は、12Cと一定の割合で13Cを含有する混合物である。質量分析では、12Cのみで構成されるモノアイソトピックピーク400のほかに13Cが混合した同位体が存在する。13Cを1つ含む同位体、13Cを2つ含む同位体、13Cを3つ含む同位体はそれぞれ12C体分子量+1、12C体分子量+2、12C体分子量+3となり、同位体ピーク401と呼ばれている。
【0051】
プロトン化イオンの場合、プロトン付加数が価数zに対応する。質量分析では、m/zで表示される。このため、モノアイソトピックピーク400のm/z値は12C体の分子量をMとすると、(M+z)/z、同位体ピーク401のm/z値はそれぞれ(M+1+z)/z、(M+2+z)/z、(M+3+z)/zとなる。これらのピークの差は1/zとなる。つまり、1価の場合のピーク間隔は1、2価の場合のピーク間隔は0.5となる。従って、ピークの間隔から価数を判定することが可能である。また、価数が判明すれば、価数とm/z値から分子量を算出することが可能である。
【0052】
(実施の形態の効果)
前述した実施の形態に係る質量分析方法の適用により、糖鎖構造だけが異なる同一アミノ酸配をもったグループのうちの一部だけをMS/MS分析することで、アミノ酸配列の異なる糖ペプチドを網羅的に分析することができる。さらにMS/MS分析では、プリカーサイオン強度に合わせて分析時間を調節することで、常にS/Nの高いデータを取得することができる。これにより微弱なピークの検出ができ、同定精度を向上することができる。また、分析終了後に分析中に検出されたイオンのイオン情報(質量電荷比、価数、イオン強度、LC保持時間等)と分析中に推定された構造を合わせて表示することができる。一例を図18に示す。これらの情報は、次に分析をする場合、プリカーサイオン選択の基準となり得る。例えば、所望の単糖を含む糖ペプチドを優先的にECD分析することや所望のイオンのみをプリカーサイオンとして選択し、優先的に分析することも可能である。
【0053】
(B)実施の形態2
次に、MS/MS分析の結果に基づいてプリカーサイオンを選択する方法について説明する。
【0054】
図19A及びBに、実施の形態2に基づく制御フローを示す。なお、図19A及びBには、図1との対応部分に同一符号を付して示している。
【0055】
前述した実施の形態1では、プリカーサイオン強度に基づいてデータ取得時間を設定したが、本実施の形態では、プリカーサイオン強度に関わらず一定のデータ取得時間でMS/MS分析を行い、MS/MSスペクトルのフラグメントイオン強度合算値がユーザー所望の閾値以上の場合は、S/Nの高いスペクトルが取得できたと判断し、別のプリカーサイオンの分析を行い、MS/MSスペクトルのフラグメントイオン強度合算値がユーザー所望の閾値以下の場合は、再度同じプリカーサイオンのMS/MSスペクトルを取得する。
【0056】
分析前には分析条件設定する(ステップ1)。分析条件設定画面の一例を図20に示す。本形態例を動作させる場合は、モード2を選択した。本形態例では、データ取得時間を設定する。図中では、data acquisition timeがこれに当たる。次に、MS/MSスペクトルのフラグメントイオン強度の合算値(Sum of fragment ion intensity)を入力する。MS/MSスペクトルのフラグメントイオン強度の合算値を算出し、算出した値がSum of fragment ionsの値を上回った場合は、充分なS/Nのスペクトルが得られたと判断する。図20のその他のパラメータは実施の形態1と同様である。
【0057】
糖ペプチドのインクルージョンリスト化を実施する(ステップ10)。インクルージョンリスト1のイオンにおいて、最もイオン強度の高いイオンをプリカーサイオンとして選択する(ステップ11)。プリカーサイオンはイオン強度順に選択されるのが一般的であるが、価数や分子量を考慮に入れて選択しても良い。選択されたプリカーサイオンは一定の測定時間だけMS/MS測定(ステップ13)を実施する。次に、同一プリカーサイオンの既取得MS/MSスペクトルが他にも存在するか否かを判定する(ステップS20)。ここで、同一プリカーサイオンの既取得MS/MSスペクトルが他にも存在する場合(ステップS20で肯定結果の場合)、同一プリカーサイオンのMS/MSスペクトルを積算し(ステップ21)、全フラグメントイオン量を算出する(ステップ22)。一方、同一プリカーサイオンの既取得MS/MSスペクトルが他には存在しない場合(ステップS20で否定結果の場合)、MS/MS測定(ステップ13)で所得したスペクトルから全フラグメントイオン量を算出する(ステップ22)。次に全フラグメントイオン量がユーザー所望の閾値以上であるか判断する(ステップ23)。閾値以上の場合(ステップ23で肯定結果の場合)、S/Nの高いスペクトルが取得できたと判断し、分析されたイオンはインクルージョンリスト39から除外される(ステップ14)。ここではMS/MS分析したイオンだけをインクルージョンリスト39から排除したが、格納されている全てのイオンを除外してもよい。別のインクルージョンリストが存在する場合は、そのインクルージョンリスト39の中からプリカーサイオンを選択し(ステップ15、17)、一定の測定時間だけMS/MS測定(ステップ13)を実施する。前述したように得られたMS/MSスペクトルを積算してから全フラグメントイオン量を算出し、ユーザー所望の閾値以上であるか判断する(ステップ23)。閾値以下の場合(ステップ23で否定結果の場合)、再度同じプリカーサイオンのMS/MSスペクトルを取得する。閾値以上の場合(ステップ23で肯定結果の場合)、S/Nの高いスペクトルが取得できたと判断し、分析されたイオンはインクルージョンリスト39から除外される(ステップ16、18)。ECDによって得られたMS/MSスペクトルのフラグメントイオン強度の計算には、プリカーサイオンやチャージリデューススピーシーズは含めなくてもよい。その他の制御フローは実施の形態1と同様である。
【0058】
(C)実施の形態3
ここでは、インクルージョンリスト作成後、CIDで糖ペプチドであることを確認する方法について説明する。
【0059】
図21に、実施の形態3に基づく制御フローを示す。なお、図21には、図1との対応部分に同一符号を付して示している。
【0060】
前述した実施の形態1では、実験で得られたイオン分子量の差分と単糖組み合わせ理論分子量を用いて糖ペプチドを推定している。しかし、形態1の方法では、糖ペプチド推定の結果として未修飾ペプチドが糖ペプチドに偶然に振り分けられる可能性がある。そこで、本形態3では、インクルージョンリスト作成後に、代表的な1イオンに対してCIDを実施し、糖ペプチドであることを確認することで、未修飾ペプチドをMS/MS分析してしまう時間を低減させる。
【0061】
以下では、糖ペプチドのインクルージョンリスト化(ステップ10)を実施する時点から説明する。インクルージョンリスト1のイオンにおいて、最もイオン強度の高いイオンをプリカーサイオンとして選択する(ステップ11)。ここでは、最もイオン強度の高いイオンをプリカーサイオンとして選択したが、価数や分子量を考慮に入れて選択しても良い。選択されたプリカーサイオンはCID測定(ステップ30)を実施する。CIDの代わりにIRMPDを用いてもよい。次に、得られたCIDスペクトルに糖鎖関連イオンが存在するかを検証する(ステップ31)。検証の際、糖鎖関連イオンのイオン強度や、理論分子量と測定分子量との誤差に閾値を設けることが望ましい。糖鎖関連イオンとは、糖鎖イオンやニュートラルロスイオンを指す。糖ペプチドイオンのCIDスペクトルの模式図を図22に示す。CIDによって、HexNAcイオン200、HexHexNAcイオン201、糖ペプチドイオンからHexNAcが失われたイオン202、糖ペプチドイオンからHexHexNAcが失われたイオン203が検出されている。HexNAcイオン200、HexHexNAcイオン201のように糖鎖のみで構成されるイオンをここでは糖鎖イオンと呼び、糖ペプチドイオンからHexNAcが失われたイオン202、糖ペプチドイオンからHexHexNAcが失われたイオン203のようにペプチドを含むイオンをここではニュートラルロスイオンと呼ぶ。ユーザー所望の糖鎖関連イオンがCIDスペクトルに存在しない場合(ステップ31で否定結果の場合)、インクルージョンリストに格納されているイオンは糖ペプチドではなかったと判定し、インスクルージョンリスト1を削除し(ステップ32)、別のインクルージョンリストの分析へと進む。ここでは、インスクルージョンリスト1を削除することによりインクルージョンリスト1に格納されているイオンがプリカーサイオンとして選択されることを回避させた。インクルージョンリスト1からプリカーサイオンが選択されなければ、他の手法を用いてもよい。ユーザー所望の糖鎖関連イオンがCIDスペクトルに存在した場合(ステップ31で肯定結果の場合)、インクルージョンリスト1のイオンにおいて、最もイオン強度の高いイオンをプリカーサイオンとして選択し(ステップ11)、選択したプリカーサイオン強度とデータ取得時間設定テーブル40を用いてデータ取得時間を決定した後(ステップ12)、MS/MS測定を実施する(ステップ13)。プリカーサイオンはイオン強度順に選択されるのが一般的であるが、価数や分子量を考慮に入れて選択しても良い。また、CID測定(ステップ30)を行うイオンとMS/MS測定(ステップ13)を行うイオンは同一であることが望ましい。MS/MS分析されたイオンはインクルージョンリスト1から除外される(ステップ14)。ここではMS/MS分析したイオンだけをインクルージョンリスト39から排除したが、格納されている全てのイオンを除外してもよい。別のインクルージョンリストが存在する場合は、そのインクルージョンリストの分析(ステップ17)へと進む。その他の制御フローは実施の形態1と同様である。
【0062】
本形態例では、糖鎖関連イオンが検出された場合(ステップ31で肯定結果の場合)、実施の形態1と同様に動作させているが、実施の形態2と同様に動作させてもよい。
【0063】
(D)実施の形態4
ここでは、MS1で糖鎖イオンが観察された時間帯のみ、糖ペプチド推定を行う方法について説明する。
【0064】
図23に、本発明の実施の形態4に基づく制御フローを示す。なお、図23には、図1との対応部分に同一符号を付して示している。
【0065】
実施の形態1〜3では、MS1測定(ステップ3)からピークリスト38を作成し(ステップ4)、ピークリスト38に格納されている任意の1イオンとその他のイオンとの質量差が単糖組み合わせ質量ファイル47に存在するかを分析中絶えず検証している(ステップ6)。しかし、糖ペプチドがイオン化される際に、糖ペプチドから糖鎖が解離する現象(インソースディケイ)が観察されることがあり、MS1スペクトルからMS1スペクトルに糖ペプチドが存在するかを判定することが可能である。例えば糖ペプチドがインソースディケイによってHexHexNAcが糖ペプチドから解離した場合、1価のHexHexNAcイオンであるm/z:366が観察される。
【0066】
そこで、ピークリスト38の作成後、糖鎖イオンが検出されるかを判定する(ステップ40)。ピークリスト38に閾値以上の糖鎖イオンが存在した場合(ステップ40で肯定結果の場合)、任意の1イオンとその他のイオンとの質量差を算出し(ステップ5)、算出された質量差が単糖組み合わせ質量ファイル47に存在するかを検証する(ステップ6)。以降の動作は実施の形態1と同様である。ピークリスト38に閾値以上の糖鎖イオンが存在しない場合(ステップ40で否定結果の場合)、MS1測定(ステップ3)に戻る。ここでは、ピークリスト38に閾値以上の糖鎖イオンが存在しない場合(ステップ40で否定結果の場合)、MS1測定(ステップ3)に戻ったが、任意のイオンについてMS/MS分析を行ってもよい。糖鎖イオンは分析前にユーザーが指定するのが望ましい。その他の制御フローは実施の形態1と同様である。また、糖ペプチドのインクルージョンリスト化(ステップ10)以降は、実施の形態2と同様に動作させてもよい。本形態例では、インソースディケイによって糖鎖イオンが観察される時間帯のみ糖ペプチドのインクルージョンリスト化の作成を行ったが、MS1測定(ステップ3)の代わりに全イオンに対してCIDやIRMPDを行い、積極的に糖鎖イオンが観察される条件で分析してもよい。
【0067】
(E)実施の形態5
ここでは、MS/MS分析したイオンをイクスクルージョンリストに追加する方法について説明する。
【0068】
図24A及びBに、本発明の実施の形態5に基づく制御フローを示す。なお、図24A及びBには、図1との対応部分に同一符号を付して示している。
【0069】
実施の形態1〜4では、MS/MS分析したイオンはインクルージョンリストから除外することにより、一回のシークエンスで同一イオンが重複分析されることを回避した。しかし、次のシークエンスのMS1測定(ステップ3)の結果、類似のMS1スペクトル(検出されるイオン種が同じ)が取得された場合、ほぼ同様のインクルージョンリストが作成され、既にMS/MS分析を実施したイオンに対し、再度MS/MS分析を行うこととなる。MS/MS分析したイオンをイクスクルージョンリストに格納することで、既にデータ取得したイオンに対するMS/MS測定を回避することができる。
【0070】
まず、糖ペプチドのインクルージョンリスト化を実施する(ステップ10)。インクルージョンリスト1のイオンにおいて、最もイオン強度の高いイオンをプリカーサイオンとして選択する(ステップ11)。プリカーサイオンは、イオン強度順に選択されるのが一般的であるが、価数や分子量を考慮に入れて選択しても良い。選択されたプリカーサイオンは、イオン強度に応じたデータ取得時間を設定し(ステップ12)、MS/MS測定(ステップ13)を実施する。MS/MS測定(ステップ13)したイオンは、イクスクルージョンリスト1に追加される(ステップ60)。別のインクルージョンリストが存在する場合は、前述と同様にように動作させる。ここでは、MS/MS測定(ステップ13)したイオンのみをイクスクルージョンリストに追加したが、インクルージョンリスト1に格納されている全てのイオンをイクスクルージョンリストに追加してもよい。イクスクルージョンリストに格納されているイオンは再度MS/MS分析をする必要のないイオンであり、プリカーサイオンとして選択しない。しかし、イクスクルージョンリストに格納されたイオンと同じの質量電荷比と価数をもったイオンを分析終了まで同一イオンと判断されてしまうと、偶然に質量電荷比と価数が一致したイオンをMS/MS測定することができなくなる。多くのペプチドイオンは数十秒から1分間程度のバンドとして検出されることを考慮し、イクスクルージョンリストに格納されている各イオンには排除時間を設定することが望ましい。ここでいう排除時間とは、あるイオンが検出されてから排除時間内に質量電荷比と価数が一致したイオンが再度検出された場合は、同一イオンであると判断し、分析対象とはしないことを意味する。
【0071】
そこで、ピークリスト38が作成されると(ステップ4)、イクスクルージョンリストに格納されている各イオンが排除時間内であるかを判定する(ステップ50)。イクスクルージョンリストに排除時間のイオンが存在しない場合(ステップ50で否定結果の場合)、ピークリストに記載の任意の1イオンと他イオンとの質量差を算出し(ステップ5)、質量差と単糖組み合わせの一致度を検証し(ステップ6)、質量差が糖鎖組み合わせと一致するイオンが存在する場合(ステップ7で肯定結果の場合)には糖ペプチドのインクルージョンリスト化(ステップ10)へ進む。イクスクルージョンリストに排除時間内のイオンが存在した場合(ステップ50で肯定結果の場合)、そのイオンが格納されているイクスクルージョンリストから任意の1イオンを選択する。イクスクルージョンリストの一例を図25に示す。保持時間31分のMS1測定(ステップ3)でピークリスト38が作成されたとする(図25右図)。排除時間(Exclusion time)が3分の条件では、イクスクルージョンリストに記載されたイオンのうち保持時間28分以降に検出されたイオンは排除の対象となる。ここでは、F、Gイオンがこれに当たる。つまり、Exclusion list#のD、E、F、Gイオンから任意の1イオンを選択する。次に、選択したイオンとピークリスト記載イオンとの質量差を算出し(ステップ52)、質量差と単糖組み合わせの一致度を検証する(ステップ6)。ここで、推定糖ペプチドが検出されない場合(ステップ53で否定結果の場合)、ピークリストに記載の任意の1イオンと他イオンとの質量差の算出(ステップ5)へと進む。一方、推定糖ペプチドが検出された場合(ステップ53で肯定結果の場合)、質量差算出に用いた選択イオンに糖鎖を付加、あるいは除去した糖ペプチドだと推定されるので、質量差算出に用いた選択イオンが格納されているイクスクルージョンリストに追加する(ステップ54)。このとき、保持時間情報も格納してもよい。
【0072】
ここで、図26を用いて前述のフローを説明する。イクスクルージョンリストからEイオンを任意のイオンとして選択し、保持時間31分のピークリストに記載イオンとの質量差を算出した(Delta mass(E)の列)。この質量差からL、M、N、O、PイオンがEイオンと同一イオン(Nイオン)、あるいは、Eイオンに糖鎖が付加(O、Pイオン)、あるいは、除去(L、Mイオン)した構造だと推定された。これらのイオンはイクスクルージョンリスト#に格納され、プリカーサイオンとして選択しない。更新されたイクスクルージョンリスト#を図27に示す。このとき、保持時間の情報を追加することで、分析終了後に各イオン検出範囲の情報を表示することができる。イクスクルージョンリストに排除時間内のイオンが存在した場合(ステップ50で肯定結果の場合)、そのイオンが格納されているイクスクルージョンリストから任意の1イオンを選択する。このとき、どのイオンを選択しても、糖ペプチドの推定は可能である。その他の制御フローは実施の形態1と同様である。
【0073】
もっとも、糖ペプチドのインクルージョンリスト化(ステップ10)以降は実施の形態2と同様に動作させてもよい。また、糖ペプチドのインクルージョンリスト化(ステップ10)以降を、実施の形態3及び4の組み合わせとしてもよい。
【符号の説明】
【0074】
21…試料、22…試料分離装置(LC又はGC)、23…イオン源、24…リニアイオントラップ、25…Qディフレクター、26…ECDセル、27…TOF、28…TOF検出器、29…制御部、30…全体処理部、31…プリカーサイオン選択部、32…ソフトウエア部、33…分子量算出部、34…質量差算出部、35…糖ペプチド推定部、36…イオン分類部、37…プリカーサイオン決定部、38…ピークリスト、39…インクルージョンリスト、40…データ取得時間設定テーブル、41…データ格納部、42…データ表示部、43…パラメータ入力部、47…単糖組み合わせ質量ファイル、200…HexNAcイオン、201…HexHexNAcイオン、202…EイオンからHexNAcが失われたイオン、203…EイオンからHexHexNAcが失われたイオン、400…モノアイソトピックピーク、401…同位体イオンシリーズ、
【技術分野】
【0001】
本発明は、質量分析における効率的なイオン選択技術に関する。本発明は、例えば翻訳後修飾された生体高分子を効率的にイオン解離分析することができる技術に関する。
【背景技術】
【0002】
ヒトにはおよそ数万種のタンパク質が存在すると言われている。タンパク質の機能は、プロテアーゼによる切断、糖鎖やリン酸基等の付加による活性・相互作用調節など、様々な翻訳後修飾により巧妙な調節を受けている。特に真核生物においては、遺伝子配列に基づいて合成されたタンパク質がそのままの状態で機能を発揮することはまれであり、例えばリボソーム上での合成後その場で、又は細胞内での最終的な局在が決まるまでの様々な段階で、多種多様な修飾を受ける。リン酸化修飾は、通常、タンパク質のセリン、スレオニン、チロシン残基に起きる。糖鎖修飾は、アスパラギン、セリン、スレオニン残基に起き、単糖がグリコシド結合によって鎖状に連結した構造、あるいは分岐した構造を持つ。また、同じタンパク質の同一アミノ酸であっても、修飾される糖鎖構造は様々である(非特許文献1)。これらの翻訳後修飾は疾患と深い関わりがあり、翻訳後修飾されたタンパク質の分析は近年特に注目されている。翻訳後修飾の構造解析では「どんな翻訳後修飾が」、「どのタンパク質の」、「どのアミノ酸に」修飾されているかを決定することが求められる。しかしながら、タンパク質の構造は、単にゲノム情報のみでは決定することができない上、タンパク質を増幅する技術も存在しないことからタンパク質を直接解析する必要がある。
【0003】
タンパク質の構造解析手段の1つとして、質量分析法(mass spectrometry: MS)は広く普及している。質量分析法を用いれば、アミノ酸がペプチド結合でつながったポリペプチド(ペプチドやタンパク質)の配列情報や翻訳後修飾情報を得ることができる。通常、分子量に比例して質量分析や解析が困難になるため、タンパク質は酵素を用いてペプチドに断片化される。ペプチドに断片化された試料は、複雑な混合物であるため、液体クロマトグラフィー(Liquid chromatography :LC)装置等に代表される試料を分離する前処理手段で分離され、カラム出口から質量分析装置に直接導入される。一般的な2時間以内のLC分離条件では、各ペプチドは数十秒から1分程度の短いバンドとして検出されるため、高速分析が可能な質量分析装置が使用される。特に高周波電場を用いたイオントラップや四重極質量フィルターを用いた質量分析法や飛行時間型質量分析法(Time-of-Flight mass spectrometer : TOF-MS)は高速分析が可能なため、LCとの結合性が良い。そのため、これらの高速質量分析法は、多種類の試料を連続解析することが求められるプロテオーム解析等の目的に合致しており、幅広く利用されている。
【0004】
一般に質量分析法では、試料分子をイオン化して真空中に導入し(又は真空中でイオン化し)、電磁場中におけるそのイオンの運動を測定することにより、対象とする分子イオンの質量電荷比(m/z)が測定される。取得されたデータをMS1スペクトルと呼ぶ。得られる情報が質量と電荷の比という巨視的な量であるため、質量分析操作を単に1回実行するだけでは、その内部構造情報までは得ることができない。そこで、タンデム質量分析法と呼ばれる方法が用いられる。
【0005】
タンデム質量分析法では、まず1回目の質量分析操作において、試料分子イオンを特定する又は単離する。特定又は単離されたイオンを「プリカーサイオン」と呼ぶ。続いて、プリカーサイオンを何らかの手法で解離する。解離したイオンを「フラグメントイオン」と呼ぶ。このフラグメントイオンを更に質量分析すると、フラグメントイオンの生成パターンの情報が得られる(MS/MSスペクトルと呼ぶ)。解離手法により、解離パターンの法則性があるため、プリカーサイオンの構造を推定することが可能となる。特にアミノ酸を骨格とする生体分子の分析では、イオン解離手法として衝突励起解離(Collision-Induced-Dissociation:CID)法、赤外多光子吸収解離(Infra-Red-Multi-Photon-Dissociation:IRMPD)法、電子捕獲解離(Electron-Capture-Dissociation:ECD)法、電子移動解離(Electron-Transfer-Dissociation:ETD)法、電子脱離解離(Electron-Detachment-Dissociation :EDD)法が用いられる。なお、MS/MSスペクトルで検出されるフラグメントイオン強度が高いほど高精度な構造解析が可能なため、プリカーサイオンはイオン強度順に選択されるのが一般的である。場合により価数や質量電荷比の値が考慮されることもある。
【0006】
タンパク質の解析において、現在もっとも広く使われている手法は、プリカーサイオンに運動エネルギーを与えてガスと衝突させるCID法である。CID法では、ガスとの衝突によりプリカーサイオンの分子振動が励起され、分子鎖の切れやすい部分で解離が起こる。
【0007】
また、最近使われるようになった方法が、プリカーサイオンに赤外レーザ光を照射して多数の光子を吸収させるIRMPD(Infrared Multi-Photon Dissociation)法である。IRMPD法では、プリカーサイオンの分子振動が励起され、分子鎖の切れやすい部位で解離が起こる。ポリペプチドの解離部位を図2に示す。図中のa、b、cは、NH2 末端側を含む分子、x,y,zはCOOH末端側を含む分子である。
【0008】
CID法やIRMPD法で切れ易い部位は、アミノ酸配列からなる主鎖のうち、b−yで命名されている部位であるが、翻訳後修飾を受けた生体高分子をCID法やIRMPD法で解離した場合、アミノ酸の側鎖に存在する修飾物質が優先的に解離し、アミノ酸配列主鎖は解離しないことが多い。一方、ECD法やETD法で切れ易い部位は、アミノ酸配列の主鎖上のc−z命名されている部位である。ECD法やETD法はアミノ酸の側鎖に存在する修飾物質を切断し難いという特徴をもっているので、翻訳後修飾を受けた生体高分子でもアミノ酸配列や修飾位置を同定することができる。なお、正に帯電したプリカーサイオンと電子を反応させる手法はECD法と呼ばれ、正に帯電したプリカーサイオンと負に帯電したイオンを反応させ、電子の授受を経由して、ECD法と同様の解離を引き起こす手法はETD法と呼ばれる。
【0009】
例えば糖鎖修飾されたペプチド(糖ペプチド)をCID法やIRMPD法で分析した場合、糖鎖が優先的に解離するため糖鎖構造を推定(場合により決定)できるが、アミノ酸配列と修飾されていたアミノ酸は決定できない。一方、糖ペプチドをECD法やETD法で分析した場合、ポリペプチドが優先的に解離するため、アミノ酸配列と修飾されていたアミノ酸を決定できるが、糖鎖構造は決定できない(非特許文献2)。糖ペプチドの例のように翻訳後修飾分析においては、CID法(あるいはIRMPD法)とECD法(あるいはETD法)は相補的な解離手段として知られている。
【0010】
先述したようにポリペプチドを体系的に分析するプロテオーム解析では、LCの利用により、試料を分離する必要がある。その分離手段として逆相クロマトグラフィーが広く利用されている。逆相クロマトグラフィーでは極性の高い(あるいは疎水性の低い)物質から溶出される。ここで逆相クロマトグラフィーを用いたLC−MSの分析例を図3に示す。
【0011】
糖タンパク質であるヒトトランスフェリンをリジルエンドペプチダーゼで消化した試料を逆相クロマトグラフィーで分離し、質量分析した。試料分離は60分のリニアグラジエント(4%アセトニトリルから40%アセトニトリル)で行われ、35分から45分の間のクロマトグラフを示している。トランスフェリンは3か所糖鎖修飾されることが知られており、主要な糖鎖構造は決定されている(非特許文献3)。
【0012】
図中、(A)に示すグラフは、全イオンクロマトグラフと呼ばれ、MS1スペクトルで検出されたイオンのイオン強度の合算値をプロットしている。(B)に示すグラフ(XIC(921.1))は、CGLVPVLAENYNKにバイアンテナ型(構造は図中に表記)と呼ばれる糖鎖が修飾した糖ペプチドの4価イオンであるm/zが921.1のイオン強度をプロットしたマスクロマトグラフである。(C)に示すグラフ(XIC(1085.2))は、CGLVPVLAENYNKにトリアンテナ型(構造は図中に表記)と呼ばれる糖鎖が修飾した糖ペプチドの4価イオンであるm/zが1085.2のマスクロマトグラフである。(D)に示すグラフ(XIC(1110.3))は、ILRQQQHLFGSNVTDCSGNFCLFRSETK にバイアンテナ型糖鎖が修飾した 糖ペプチドの5価イオンであるm/zが1110.3のマスクロマトグラフである。(E)に示すグラフ(XIC(1241.5))は、ILRQQQHLFGSNVTDCSGNFCLFRSETKにトリアンテナ型糖鎖が修飾した糖ペプチドの5価イオンであるm/zが1241.5のマスクロマトグラフである。(F)に示すグラフ(XIC(657.2))は、糖鎖NeuAcHexHexNAcの1価イオンであるm/zが657.2のマスクロマトグラフである。NeuAcは、α-N-Acetylneuraminic acidを表し、Hexはβ-D-Glucose(Glc)、β-D-Mannose(Man)、β-D-Galactose(Gal)を表し、HexNAcはβ-D-N-Acetylglucosamine(GlcNAc)、β-D-N-Acetylgalactosamine(GalNAc)を表す。
【0013】
図3の結果から逆相クロマトグラフィーを用いて糖ペプチドを分離した場合、アミノ酸配列に依存して分離し、糖鎖構造の影響が小さいことがわかる。また、糖ペプチドがイオン化される際に糖鎖が解離する現象(インソースディケイ)によって、MS1スペクトルから糖鎖イオンが観察され、糖鎖イオンが観察される時間帯と糖ペプチドが観察される時間帯は一致していることがわかる。
【0014】
図4に保持時間42.4分に観察されたMS1スペクトルを示す。図より、ILRQQQHLFGSNVTDCSGNFCLFRSETKに対し、バイアンテナ型、トリアンテナ型、トリアンテナ型(Deoxyhexose付加)糖鎖が修飾した糖ペプチドが同時に検出されていることがわかる。
【0015】
糖ペプチドは、未修飾ペプチドよりも大幅に感度が低いことが知られている。しかも多量の未修飾ペプチドと同時にイオン化されると検出感度は著しく低下する(非特許文献4)。さらに糖鎖構造の不均一性によってスペクトルは複雑化することが知られている。
【0016】
図5にILRQQQHLFGSNVTDCSGNFCLFRSETK にバイアンテナ型糖鎖が修飾した5価イオンであるm/zが1110.3のECDスペクトルを示す。一般的なECDスペクトルでは、プリカーサイオン([M+5H]5+)、チャージリデューススピーシーズ( [M+5H]4+;電子と反応したが解離しなかったプリカーサイオン)、フラグメントイオンが観察される。ECDやETDでは、CIDやIRMPDと異なり、全てのプリカーサイオンがフラグメントイオンに変換されるわけではない(残存プリカーサイオンやチャージリデューススピーシーズが残る)。このため、CIDスペクトルで観察されるフラグメントイオンよりも微弱なフラグメントイオンとなる。高精度にアミノ酸配列や修飾位置を同定するには、S/Nの高いMS/MSスペクトル(ECDスペクトル)を取得することが求められる。
【先行技術文献】
【非特許文献】
【0017】
【非特許文献1】Takegawa. Y. et al ; J Sep Sci, 2008, 31, 1585-1593.
【非特許文献2】Deguchi, K. et al ; Rapid Commun Mass Spectrom, 2007, 21, 691-698.
【非特許文献3】Satomi, Y. et al ; FEBS Lett, 2004, 576, 51-56.
【非特許文献4】Annesly, T.M. et al ; Clin Chem, 2003, 49, 1041-1044.
【発明の概要】
【発明が解決しようとする課題】
【0018】
糖鎖修飾を受けたタンパク質やペプチドの定性解析では、アミノ酸配列の同定だけでなく、糖鎖修飾の種類や糖鎖の構造又は修飾位置の同定が求められる。通常タンパク質は質量分析・解析を容易にするため、酵素でタンパク質を切断した消化物を試料とする。しかし、これらの試料は多種類のペプチド混合物であるため、逆相クロマトグラフィー等のLCと結合して質量分析される。試料は貴重であるため、少量の試料からできるだけ多くの糖ペプチドの構造を同定することが求められる。糖ペプチドを優先的に分析したい場合、各イオンの質量電荷比や価数情報から糖ペプチドを特定することはできず、実際にCID(あるいは、IRMPD)で解離してみて初めて糖ペプチドであることが確認できる。さらに、一般的にプリカーサイオンはイオン強度順に選択されるが、糖ペプチドはイオン化効率が低いことや、糖鎖構造の不均一性によって、未修飾ペプチドよりも相対的に検出されにくいため、プリカーサイオンとして選択されにくい。
【0019】
また、特にECD(あるいは、ETD)による同定では、S/Nの高いフラグメントイオンで構成されるスペクトルを取得する必要がある。しかし、糖ペプチドは未修飾ペプチドよりもイオン強度が低くなる傾向があるため、未修飾ペプチドと同様の条件でMS/MS測定を行った場合、未修飾ペプチドよりもS/Nの低いスペクトルを取得することとなる。
【0020】
そこで、本発明は、以上説明した技術的な課題を解決し、物質の構造に関する情報の取得効率を向上させる質量分析方法及び装置を提供することを目的とする。
【課題を解決するための手段】
【0021】
本発明による質量分析方法は、分離された試料をイオン源によりイオン化する工程と、生成された試料イオンの質量スペクトルを取得する工程と、検出されたイオン情報をピークリストに格納する工程と、ピークリストに記載されたイオンから任意の1イオンを選択し、当該イオンと他のイオンとの質量差を算出する工程と、算出された質量差から修飾構造を推定する工程と、修飾構造が推定されたイオンからプリカーサイオンを選択する工程と、選択されたプリカーサイオンの強度情報に基づきデータ取得時間を設定する工程を有する。
【発明の効果】
【0022】
本発明により、実時間で所望の修飾物質を保持したイオンを推定することが可能であり、所望のイオンを優先的に分析することが可能となる。また、プリカーサイオン強度情報に基づきデータ取得時間を設定することにより、S/Nの高いデータを取得することが可能になる。これにより、質量分析による物質の同定において、物質の構造に関する情報を取得する効率が向上し、測定及び物質同定の時間が短縮する。また、同定精度が向上する。上記した以外の課題、構成及び効果は、以下の実施形態の説明により明らかにされる。
【図面の簡単な説明】
【0023】
【図1】発明の実施の形態1における制御フローを説明する図。
【図2】ポリペプチドの解離パターンを説明する図。
【図3】トランスフェリン消化物のLC−MS分析実験図。全イオンクロマトグラフ(A)、糖ペプチドイオンm/z:921.1のマスクロマトグラフ(B)、糖ペプチドイオンm/z:1085.2のマスクロマトグラフ(C)、糖ペプチドイオンm/z:1110.3のマスクロマトグラフ(D)、糖ペプチドイオンm/z:1241.5のマスクロマトグラフ(E)、糖鎖イオンm/z:657.2のマスクロマトグラフ(F)
【図4】図3の保持時間42.4分に観察されたMS1スペクトル実験図。
【図5】糖ペプチドILRQQQHLFGSNVTDCSGNFCLFRSETKにバイアンテナ型糖鎖が修飾した5価イオンであるm/z:1110.3のECDスペクトルを示す実験図。
【図6】発明の実施の形態1に基づく質量分析システムの構成例を示す図。
【図7】MS1スペクトルの模式図。
【図8】ピークリスト例を示す図。
【図9】分子量情報を含むピークリスト例を示す図。
【図10】質量差情報を含むピークリスト例を示す図。
【図11】質量差算出において任意イオンの選び方を説明する図。
【図12】推定糖鎖構造情報を含むピークリスト例を示す図。
【図13】インクルージョンリスト例を示す図。
【図14】実施の形態1による制御フローを動作した結果、推定された糖鎖構造情報が記載されているMS1スペクトルの模式図。
【図15】発明の実施の形態1における分析条件設定画面例を示す図。
【図16】単糖組み合わせ質量ファイル例を示す図。
【図17】イオンピークを説明する模式図。
【図18】分析終了後に表示されるインクルージョンリストを示す図。
【図19A】発明の実施の形態2における制御フローを説明する図(1/2)。
【図19B】発明の実施の形態2における制御フローを説明する図(2/2)。
【図20】発明の実施の形態2における分析条件設定画面例を示す図。
【図21】発明の実施の形態3における制御フローを説明する図。
【図22】糖ペプチドイオンのMS/MSスペクトルの模式図。
【図23】発明の実施の形態4における制御フローを説明する図。
【図24A】発明の実施の形態5における制御フローを説明する図(1/2)。
【図24B】発明の実施の形態5における制御フローを説明する図(2/2)。
【図25】イクスクルージョンリストにおける排除時間内イオンの有無を説明する図。
【図26】排除時間内イオンを用いて糖鎖構造を推定した場合の糖鎖構造情報を含むピークリスト例を示す図。
【図27】発明の実施の形態5による制御フローを動作した結果、情報が更新されたイクスクルージョンリストを示す図。
【発明を実施するための形態】
【0024】
以下、図面を参照して、本発明の実施の形態を説明する。なお、後述する本発明の実施の形態は一例であって、公知又は周知の技術との組み合わせや置換によって他の形態を実現することもできる。また、修飾物質として糖鎖を例として説明するが、他の修飾物でもかまわない。
【0025】
(A)実施の形態1
本形態例においては、プリカーサイオン強度に基づいてデータ取得時間を設定する方法について説明する。
【0026】
(質量分析システムの構成)
図6に、イオン解離法としてCID法、あるいは、ECD法を用いる質量分析システムの構成例を示す。分析対象となる試料21は、試料分離装置22(図では、液体クロマトグラフィー(LC))の前処理により分離される。なお、試料分離装置22には、ガスクロマトグラフィー(GC)を用いることもできる。
【0027】
分離された試料は、イオン源23においてイオン化され、質量分析装置に導入される。MS1スペクトル取得の場合、導入されたイオンは、リニアイオントラップ(LIT)24で蓄積され、排出される。排出されたイオンは、Qディフレクター25を経由し、TOF検出器28で検出される。TOF検出器28の前段には高分解能であるTOF27が存在する。
【0028】
CIDによるMS/MSスペクトル取得の場合、質量分析システムに導入されたイオンはLIT24で蓄積され、ある特定のイオンが単離された後、LIT24内でCIDによって解離される。解離したイオンはLIT24から排出され、Qディフレクター25を経由し、TOF27でイオンの質量電荷比m/zに応じて分離される。イオン解離方法としてCID法を用いているが、IRMPD法を用いても良い。
【0029】
ECDによるMS/MSスペクトル取得の場合、質量分析システムに導入されたイオンはLIT24で蓄積され、ある特定のイオンが単離された状態で排出される。排出されたイオンはQディフレクター25を経由し、ECDセル26に入る。ここで、イオンは電子と反応し、フラグメントイオンは排出される。排出されたフラグメントイオンは再びQディフレクター25を経由し、TOF27でイオンの質量電荷比m/zに応じて分離される。
【0030】
イオン源23は、エレクトロスプレイイオン源、大気圧化学イオン化によるイオン源、マトリックス支援レーザ脱離イオン源、電気衝撃イオン源、化学イオン化によるイオン源、フィールドイオン化によるイオン源から選択される。
【0031】
LIT24は多くのイオンが蓄積できるため、高感度検出が可能であるが、三次元四重極イオントラップ、四重極質量フィルター、コリジョンセル、フーリエ変換イオンサイクロトロン共鳴質量分離部でも構わない。
【0032】
ECDセル26は、LIT、三次元四重極イオントラップ、コリジョンセル、四重極質量フィルター、フーリエ変換イオンサイクロトロン共鳴質量分析部の中から選択される。また、本装置構成では、イオン解離方法としてECD法を用いているが、ETD法やEDD法を用いても良い。EDD法の場合、イオン化は負イオンモードで実施する。
【0033】
TOF27は高分解能で質量精度も高いので好ましいが、四重極質量フィルター、イオントラップ、磁場型質量分析器、フーリエ変換イオンサイクロトロン共鳴質量分析器、オービトラップ型分析器でも構わない。
【0034】
TOF検出器28で検出された各イオン情報は、全体処理部30に与えられる。全体処理部30は、後述するようなデータ整理及び又はデータ処理を実行する。なお、全体処理部30は、ハードウェア的な回路構造を有する場合だけでなく、コンピュータシステム上で動作するプログラムの処理機能を通じても実現することができる。全体処理部30の一部であるプリカーサイオン選択部31は、データ格納部41とソフトウエア部32によって構成される。データ格納部41は、ピークリスト38、単糖組み合わせ質量ファイル47、インクルージョンリスト39、データ取得時間設定テーブル40で構成され、ソフトウエア部32は、分子量算出部33、質量差算出部34、糖ペプチド推定部35、イオン分類部36、プリカーサイオン決定部37で構成される。
【0035】
ピークリスト38はMS1スペクトルで検出されたイオン情報を格納し、例えば質量電荷比、価数、イオン強度、LC保持時間等の情報を含む。分子量算出部33ではピークリスト38に格納されている各イオンの質量電荷比と価数からイオンごとの分子量を算出する。質量差算出部34ではピークリスト38に格納されている任意の1イオンとその他のイオンとの質量差を算出する。糖ペプチド推定部35では質量差算出部34で算出された質量差と単糖組み合わせ質量ファイル47とのマッチングを行う。マッチしたイオンペアはイオン分類部36によってインクルージョンリスト39に格納される。インクルージョンリスト39には、質量電荷比、価数、イオン強度、LC保持時間等の情報を含む。プリカーサイオン決定部37は、インクルージョンリスト39に格納されているイオンからプリカーサイオンを選択し、選択したイオンのイオン強度情報とデータ取得時間設定テーブル40を用いて設定すべきデータ取得時間情報を入手する。入手した情報はプリカーサイオン決定部37から質量分析装置内にある制御部29を介してLIT24、Qディフレクター25、ECDセル26に伝達される。全体処理部30が、特許請求の範囲における「計算処理部」に対応する。
【0036】
MS1スペクトル、MS/MSスペクトル、質量電荷比、価数、イオン強度、LC保持時間、任意イオンとの質量差、推定された修飾構造、CID解離強度、ECD解離強度、LIT24の制御パラメータ、試料分離装置22の溶媒混合比、流量等はデータ表示部42に表示される。全体処理部30に対する所望の修飾情報、マッチング誤差、MS/MSターゲット数等は、パラメータ入力部43を通じて入力する。
【0037】
(処理動作の概要)
図1に、実施の形態1に基づく制御フローを示す。分析前には分析条件設定を行い(ステップ1)、LC/MS分析をスタートさせる(ステップ2)。分析条件設定(ステップ1)の詳細は後述する。LC/MS分析では、複数物質の混合物である試料21を試料分離装置22に導入する。クロマトグラフィーには、物質の性質によって分離させるための分離カラムが装着されており、分離カラムを通過した試料は、成分ごとに異なる時間に溶出する。溶出した試料の各成分は、イオン源23にてイオン化される。イオンは質量分析装置内のLIT24に導入されて蓄積され、排出口から排出される。排出されたイオンはTOF検出器28において検出され、横軸をm/z、縦軸をイオン強度とするMS1スペクトルを得る(ステップ3)。MS1スペクトルの模式図を図7に示す(ここではA〜Iのイオンが検出される)。なお、横軸はm/zであり、縦軸はイオン強度である。
【0038】
次に、MS1スペクトルの情報(質量電荷比、価数、イオン強度、LC保持時間等)は、プリカーサイオン選択部31中のピークリスト38に格納される(ステップ4)。一定イオン強度以上のイオンのみをピークリスト38に格納してもよい。また多くの場合、ペプチドイオンは2価以上になるため、1価イオンはピークリスト38に格納しなくてもよい。ピークリスト38の一例を図8に示す。Chargeは価数、Intensityはイオン強度、RTは液体クロマトグラフィーの保持時間を示す。分子量算出部33によってピークリスト38に格納されている各イオンの質量電荷比と価数から分子量が算出され、得られた分子量情報はピークリスト38に追加される。分子量計算後、一定値以内(例えば0.05Da以内)のイオンは、同一分子量イオンと判断してもよい。分子量情報が追加されたピークリストの一例を図9に示す。M.W.が分子量を示す。ここでは、分子量情報をピークリスト38に追加したが、別ファイルとして保持してもよい。分子量算出動作の詳細については後述する。次に、質量差算出部34によってピークリスト38に格納されている任意の1イオンとその他のイオンとの質量差を算出する(ステップ5)。質量差情報が追加されたピークリスト38の一例を図10に示す。ここでは、任意の1イオンとしてEイオンを選択し、Eイオンとその他のイオンとの質量差を求めている。Delta mass(E)がこれにあたる。質量差情報は複数個排出されるので、個別ファイルとして保持するのが望ましい。ここでは、説明のため、ピークリスト38に質量差情報を追加している。任意の1イオンの選択方法を図11に示す。(A)に示すグラフは、全てのイオンを任意の1イオンとする場合であり、ピークリスト38に格納されているイオンの数だけ質量差リストを作成する。図8のピークリストでは9つ差分リストを作成することとなる。(B)に示すグラフは、一定以上のイオン強度をもつイオンを任意の1イオンとする場合であり、計算処理時間を低減することができる。多くの場合、ペプチドイオンは2価以上になるため、1価イオンは質量差計算するイオン候補から除外してもよい。次に、糖ペプチド推定部35は算出された質量差が単糖組み合わせ質量ファイル47に存在するかを検証する(ステップ6)。検証の際、単糖組み合わせ理論質量にある一定の誤差を設けることが望ましい。
【0039】
検証結果の一例を図12に示す。質量差が糖鎖組み合わせと一致するイオンが存在する場合(ステップ7で肯定結果の場合)は、糖ペプチドのインクルージョンリスト化を実施する(ステップ10)。ここでは、インクルージョンリスト1、インクルージョンリスト2、インクルージョンリストnに分類されたと想定する。図12の例では、D、E、F、Gイオンが一つのインクルージョンリストに格納される。インクルージョンリストの一例を図13に示す。インクルージョンリスト39に一旦格納されたイオンは、質量差算出におけるイオン候補から除外してもよい。この除外により、計算処理時間を低減することができる。プリカーサイオン決定部37は、インクルージョンリスト39の中から最もイオン強度の高いイオンをプリカーサイオンとして選択し(ステップ11)、選択したプリカーサイオン強度とデータ取得時間設定テーブル40を用いてデータ取得時間を決定する(ステップ12)。プリカーサイオンは、イオン強度順に選択されるのが一般的であるが、価数や分子量を考慮に入れて選択しても良い。プリカーサイオンの質量電荷比、データ取得時間の情報は、プリカーサイオン決定部37によって質量分析装置内部の制御部29を介して、LIT24、Qディフレクター25、ECDセル26に伝達され、MS/MS測定(ステップ13)を実施する。分析されたイオンは、インクルージョンリスト39から除去される(ステップ14)。通常、質量分析前には、MS/MSターゲット数を設定する(後述する図15のMaximum MS/MS target numberがこれに当たる)。インクルージョンリスト数(1、2、、n)がMS/MSターゲット数を下回った場合、再度インクルージョンリストからプリカーサイオンを選択することが可能である。この場合、すでに分析したイオンをMS/MS分析する必要はないため、インクルージョンリスト39から除去した。また、ここではMS/MS分析したイオンだけをインクルージョンリスト39から除去したが、格納されている全てのイオンを除去してもよい。この場合、一度プリカーサイオンが選択されたインクルージョンリストから再度プリカーサイオンが選択され、MS/MS測定(ステップ13)されることはない。別のインクルージョンリストが存在する場合は、そのインクルージョンリスト39の中からプリカーサイオンを選択し(ステップ15、17)、イオン強度に応じたデータ取得時間を設定し(ステップ12)、MS/MS測定(ステップ13)を実施する。分析されたイオンは、インクルージョンリスト37から除去され(ステップ16、18)、MS1測定(ステップ3)に戻る。図14に、MS1スペクトルで観察されたイオンに推定構造を表示した。Eイオンに特定の糖鎖を付加、あるいは、除去したイオンがD、F、Gイオンであることが推定されている。
【0040】
従来法では、糖ペプチドを優先的に分析したい場合であっても、単に各イオンの質量電荷比や価数やイオン強度情報から糖ペプチドを特定することはできない。そのため、イオン強度順にプリカーサイオンは選択される。しかし、本形態例では、各イオンの分子量差から糖ペプチドを推定することが可能であり、糖ペプチドを優先的に分析することが可能になる。さらに、本発明では、糖鎖構造が推定できるイオン群のうち1イオン(あるいは1部のイオン)にターゲットを絞り、MS/MS測定(ステップ13)を行うことで、アミノ酸配列の異なる糖ペプチドを網羅的に分析することができる。
【0041】
また、従来法のようにどのイオンに対しても同一条件でMS/MS測定をする場合、イオン強度の低いプリカーサイオンでは、S/Nの低いスペクトルとなり、同定できないことも想定される。本発明では、イオン強度に応じてデータ取得時間を制御することで、どのプリカーサイオンに対しても一定基準以上のスペクトルを取得することができる。
【0042】
本形態例では、ある保持時間に検出されたイオンのみで質量差計算を行っているが、以前の保持時間に検出されたイオン、構造が推定されたイオン、あるいは別分析で得られたイオンと質量差計算を行ってもよい。
【0043】
本形態例では、イオン解離手段としてCIDを用いているが、IRMPD、ECD、ETD、EDDあるいはその他の解離手段でもよい。
【0044】
なお、全体処理部30による、分子量算出、質量差算出、修飾構造推定、プリカーサイオンの決定は、いずれも分析を妨げないように、実時間で実施される必要がある。
【0045】
(分析条件設定)
設定画面の一例を図15に示す。ユーザーは分析する対象となる修飾の種類を選択する。ここでは、糖鎖(Glycosylation)を選択している。分析取得方法によりモードを選択する。例えば本形態例を動作させる場合は、モード1を選択した。まず、想定される単糖の種類を選択する。サンプルの由来から単糖の種類を絞り込むことが可能な場合がある。また、すでに糖鎖解析を実施している場合は、糖鎖の種類や各単糖の範囲を指定することも可能である。この表示例では、Hex、HexNAc、NeuAcで構成される糖鎖修飾が想定され、その個数範囲はそれぞれ3−7、2−6、1−4としている。これらの組み合わせ、及び分子量の表をプログラムの処理機能を通じて分析前に作成しておくことが望ましい。この表が単糖組み合わせ質量ファイル47に相当する。単糖組み合わせ質量ファイル47の作成方法は後述する。
【0046】
質量差算出部34によって算出された各質量差は単糖組み合わせ質量ファイル47と照らし合わせ、ユーザー指定の誤差範囲で一致する修飾物を探索する。この誤差範囲を指定するのが、Verification accuracyである。図中では、±0.3Daが入力されている。
【0047】
ユーザーはMS/MSターゲットの上限を指定するのが望ましい。図中では、Maximum MS/MS target number がこれにあたる。一回のシークエンス(MS1+MS/MS分析×n回)で最大3イオンをMS/MS分析に進める(nが最大3を意味する)。あるいは、MS/MS測定を特定回数実施する条件でもよい。
【0048】
ユーザーはイオン強度に応じたデータ取得時間を設定する。図中では、プリカーサイオンのイオン強度が1000以下の場合は、7秒間MS/MS分析を行い、1000〜3000の場合は、5秒間MS/MS分析を行い、3000〜6000の場合は、5秒間MS/MS分析を行い、6000〜8000の場合は、4秒間MS/MS分析を行い、8000以上の場合は、3秒間MS/MS分析を行うことを示す。
【0049】
(単糖組み合わせ質量ファイル作成方法)
ここでは、単糖組み合わせ質量ファイルの作成方法を説明する。分析条件設定画面設定したユーザー所望の単糖種類と個数から全ての単糖組み合わせと分子量を算出し、単糖組み合わせ質量ファイル7を作成する。一例を図16に示す。例えば、[Hex]3[HexNAc]2の組み合わせの場合、Hexの分子量180.063×3=540.189とHexNAcの分子量221.09×2=442.180との和982.369から5つのグリコシド結合で失われる水の分子量90.052(18.01×5)を差し引き、分子量892.317となる。グリコシド結合の数は糖鎖の個数と一致する。
【0050】
(価数と分子量の算出)
ここでは、イオンの価数と分子量の算出方法について説明する。図17に、質量分析で観測されるプロトン化[H+]したイオンピークの模式図を示す。縦軸はイオン強度であり、横軸はm/zである。タンパク質の構成原子は主に炭素、水素、酸素、窒素である。自然界の炭素には質量数12の12Cの他に、約1%質量数13の13Cが存在する。そのため、タンパク質は、12Cと一定の割合で13Cを含有する混合物である。質量分析では、12Cのみで構成されるモノアイソトピックピーク400のほかに13Cが混合した同位体が存在する。13Cを1つ含む同位体、13Cを2つ含む同位体、13Cを3つ含む同位体はそれぞれ12C体分子量+1、12C体分子量+2、12C体分子量+3となり、同位体ピーク401と呼ばれている。
【0051】
プロトン化イオンの場合、プロトン付加数が価数zに対応する。質量分析では、m/zで表示される。このため、モノアイソトピックピーク400のm/z値は12C体の分子量をMとすると、(M+z)/z、同位体ピーク401のm/z値はそれぞれ(M+1+z)/z、(M+2+z)/z、(M+3+z)/zとなる。これらのピークの差は1/zとなる。つまり、1価の場合のピーク間隔は1、2価の場合のピーク間隔は0.5となる。従って、ピークの間隔から価数を判定することが可能である。また、価数が判明すれば、価数とm/z値から分子量を算出することが可能である。
【0052】
(実施の形態の効果)
前述した実施の形態に係る質量分析方法の適用により、糖鎖構造だけが異なる同一アミノ酸配をもったグループのうちの一部だけをMS/MS分析することで、アミノ酸配列の異なる糖ペプチドを網羅的に分析することができる。さらにMS/MS分析では、プリカーサイオン強度に合わせて分析時間を調節することで、常にS/Nの高いデータを取得することができる。これにより微弱なピークの検出ができ、同定精度を向上することができる。また、分析終了後に分析中に検出されたイオンのイオン情報(質量電荷比、価数、イオン強度、LC保持時間等)と分析中に推定された構造を合わせて表示することができる。一例を図18に示す。これらの情報は、次に分析をする場合、プリカーサイオン選択の基準となり得る。例えば、所望の単糖を含む糖ペプチドを優先的にECD分析することや所望のイオンのみをプリカーサイオンとして選択し、優先的に分析することも可能である。
【0053】
(B)実施の形態2
次に、MS/MS分析の結果に基づいてプリカーサイオンを選択する方法について説明する。
【0054】
図19A及びBに、実施の形態2に基づく制御フローを示す。なお、図19A及びBには、図1との対応部分に同一符号を付して示している。
【0055】
前述した実施の形態1では、プリカーサイオン強度に基づいてデータ取得時間を設定したが、本実施の形態では、プリカーサイオン強度に関わらず一定のデータ取得時間でMS/MS分析を行い、MS/MSスペクトルのフラグメントイオン強度合算値がユーザー所望の閾値以上の場合は、S/Nの高いスペクトルが取得できたと判断し、別のプリカーサイオンの分析を行い、MS/MSスペクトルのフラグメントイオン強度合算値がユーザー所望の閾値以下の場合は、再度同じプリカーサイオンのMS/MSスペクトルを取得する。
【0056】
分析前には分析条件設定する(ステップ1)。分析条件設定画面の一例を図20に示す。本形態例を動作させる場合は、モード2を選択した。本形態例では、データ取得時間を設定する。図中では、data acquisition timeがこれに当たる。次に、MS/MSスペクトルのフラグメントイオン強度の合算値(Sum of fragment ion intensity)を入力する。MS/MSスペクトルのフラグメントイオン強度の合算値を算出し、算出した値がSum of fragment ionsの値を上回った場合は、充分なS/Nのスペクトルが得られたと判断する。図20のその他のパラメータは実施の形態1と同様である。
【0057】
糖ペプチドのインクルージョンリスト化を実施する(ステップ10)。インクルージョンリスト1のイオンにおいて、最もイオン強度の高いイオンをプリカーサイオンとして選択する(ステップ11)。プリカーサイオンはイオン強度順に選択されるのが一般的であるが、価数や分子量を考慮に入れて選択しても良い。選択されたプリカーサイオンは一定の測定時間だけMS/MS測定(ステップ13)を実施する。次に、同一プリカーサイオンの既取得MS/MSスペクトルが他にも存在するか否かを判定する(ステップS20)。ここで、同一プリカーサイオンの既取得MS/MSスペクトルが他にも存在する場合(ステップS20で肯定結果の場合)、同一プリカーサイオンのMS/MSスペクトルを積算し(ステップ21)、全フラグメントイオン量を算出する(ステップ22)。一方、同一プリカーサイオンの既取得MS/MSスペクトルが他には存在しない場合(ステップS20で否定結果の場合)、MS/MS測定(ステップ13)で所得したスペクトルから全フラグメントイオン量を算出する(ステップ22)。次に全フラグメントイオン量がユーザー所望の閾値以上であるか判断する(ステップ23)。閾値以上の場合(ステップ23で肯定結果の場合)、S/Nの高いスペクトルが取得できたと判断し、分析されたイオンはインクルージョンリスト39から除外される(ステップ14)。ここではMS/MS分析したイオンだけをインクルージョンリスト39から排除したが、格納されている全てのイオンを除外してもよい。別のインクルージョンリストが存在する場合は、そのインクルージョンリスト39の中からプリカーサイオンを選択し(ステップ15、17)、一定の測定時間だけMS/MS測定(ステップ13)を実施する。前述したように得られたMS/MSスペクトルを積算してから全フラグメントイオン量を算出し、ユーザー所望の閾値以上であるか判断する(ステップ23)。閾値以下の場合(ステップ23で否定結果の場合)、再度同じプリカーサイオンのMS/MSスペクトルを取得する。閾値以上の場合(ステップ23で肯定結果の場合)、S/Nの高いスペクトルが取得できたと判断し、分析されたイオンはインクルージョンリスト39から除外される(ステップ16、18)。ECDによって得られたMS/MSスペクトルのフラグメントイオン強度の計算には、プリカーサイオンやチャージリデューススピーシーズは含めなくてもよい。その他の制御フローは実施の形態1と同様である。
【0058】
(C)実施の形態3
ここでは、インクルージョンリスト作成後、CIDで糖ペプチドであることを確認する方法について説明する。
【0059】
図21に、実施の形態3に基づく制御フローを示す。なお、図21には、図1との対応部分に同一符号を付して示している。
【0060】
前述した実施の形態1では、実験で得られたイオン分子量の差分と単糖組み合わせ理論分子量を用いて糖ペプチドを推定している。しかし、形態1の方法では、糖ペプチド推定の結果として未修飾ペプチドが糖ペプチドに偶然に振り分けられる可能性がある。そこで、本形態3では、インクルージョンリスト作成後に、代表的な1イオンに対してCIDを実施し、糖ペプチドであることを確認することで、未修飾ペプチドをMS/MS分析してしまう時間を低減させる。
【0061】
以下では、糖ペプチドのインクルージョンリスト化(ステップ10)を実施する時点から説明する。インクルージョンリスト1のイオンにおいて、最もイオン強度の高いイオンをプリカーサイオンとして選択する(ステップ11)。ここでは、最もイオン強度の高いイオンをプリカーサイオンとして選択したが、価数や分子量を考慮に入れて選択しても良い。選択されたプリカーサイオンはCID測定(ステップ30)を実施する。CIDの代わりにIRMPDを用いてもよい。次に、得られたCIDスペクトルに糖鎖関連イオンが存在するかを検証する(ステップ31)。検証の際、糖鎖関連イオンのイオン強度や、理論分子量と測定分子量との誤差に閾値を設けることが望ましい。糖鎖関連イオンとは、糖鎖イオンやニュートラルロスイオンを指す。糖ペプチドイオンのCIDスペクトルの模式図を図22に示す。CIDによって、HexNAcイオン200、HexHexNAcイオン201、糖ペプチドイオンからHexNAcが失われたイオン202、糖ペプチドイオンからHexHexNAcが失われたイオン203が検出されている。HexNAcイオン200、HexHexNAcイオン201のように糖鎖のみで構成されるイオンをここでは糖鎖イオンと呼び、糖ペプチドイオンからHexNAcが失われたイオン202、糖ペプチドイオンからHexHexNAcが失われたイオン203のようにペプチドを含むイオンをここではニュートラルロスイオンと呼ぶ。ユーザー所望の糖鎖関連イオンがCIDスペクトルに存在しない場合(ステップ31で否定結果の場合)、インクルージョンリストに格納されているイオンは糖ペプチドではなかったと判定し、インスクルージョンリスト1を削除し(ステップ32)、別のインクルージョンリストの分析へと進む。ここでは、インスクルージョンリスト1を削除することによりインクルージョンリスト1に格納されているイオンがプリカーサイオンとして選択されることを回避させた。インクルージョンリスト1からプリカーサイオンが選択されなければ、他の手法を用いてもよい。ユーザー所望の糖鎖関連イオンがCIDスペクトルに存在した場合(ステップ31で肯定結果の場合)、インクルージョンリスト1のイオンにおいて、最もイオン強度の高いイオンをプリカーサイオンとして選択し(ステップ11)、選択したプリカーサイオン強度とデータ取得時間設定テーブル40を用いてデータ取得時間を決定した後(ステップ12)、MS/MS測定を実施する(ステップ13)。プリカーサイオンはイオン強度順に選択されるのが一般的であるが、価数や分子量を考慮に入れて選択しても良い。また、CID測定(ステップ30)を行うイオンとMS/MS測定(ステップ13)を行うイオンは同一であることが望ましい。MS/MS分析されたイオンはインクルージョンリスト1から除外される(ステップ14)。ここではMS/MS分析したイオンだけをインクルージョンリスト39から排除したが、格納されている全てのイオンを除外してもよい。別のインクルージョンリストが存在する場合は、そのインクルージョンリストの分析(ステップ17)へと進む。その他の制御フローは実施の形態1と同様である。
【0062】
本形態例では、糖鎖関連イオンが検出された場合(ステップ31で肯定結果の場合)、実施の形態1と同様に動作させているが、実施の形態2と同様に動作させてもよい。
【0063】
(D)実施の形態4
ここでは、MS1で糖鎖イオンが観察された時間帯のみ、糖ペプチド推定を行う方法について説明する。
【0064】
図23に、本発明の実施の形態4に基づく制御フローを示す。なお、図23には、図1との対応部分に同一符号を付して示している。
【0065】
実施の形態1〜3では、MS1測定(ステップ3)からピークリスト38を作成し(ステップ4)、ピークリスト38に格納されている任意の1イオンとその他のイオンとの質量差が単糖組み合わせ質量ファイル47に存在するかを分析中絶えず検証している(ステップ6)。しかし、糖ペプチドがイオン化される際に、糖ペプチドから糖鎖が解離する現象(インソースディケイ)が観察されることがあり、MS1スペクトルからMS1スペクトルに糖ペプチドが存在するかを判定することが可能である。例えば糖ペプチドがインソースディケイによってHexHexNAcが糖ペプチドから解離した場合、1価のHexHexNAcイオンであるm/z:366が観察される。
【0066】
そこで、ピークリスト38の作成後、糖鎖イオンが検出されるかを判定する(ステップ40)。ピークリスト38に閾値以上の糖鎖イオンが存在した場合(ステップ40で肯定結果の場合)、任意の1イオンとその他のイオンとの質量差を算出し(ステップ5)、算出された質量差が単糖組み合わせ質量ファイル47に存在するかを検証する(ステップ6)。以降の動作は実施の形態1と同様である。ピークリスト38に閾値以上の糖鎖イオンが存在しない場合(ステップ40で否定結果の場合)、MS1測定(ステップ3)に戻る。ここでは、ピークリスト38に閾値以上の糖鎖イオンが存在しない場合(ステップ40で否定結果の場合)、MS1測定(ステップ3)に戻ったが、任意のイオンについてMS/MS分析を行ってもよい。糖鎖イオンは分析前にユーザーが指定するのが望ましい。その他の制御フローは実施の形態1と同様である。また、糖ペプチドのインクルージョンリスト化(ステップ10)以降は、実施の形態2と同様に動作させてもよい。本形態例では、インソースディケイによって糖鎖イオンが観察される時間帯のみ糖ペプチドのインクルージョンリスト化の作成を行ったが、MS1測定(ステップ3)の代わりに全イオンに対してCIDやIRMPDを行い、積極的に糖鎖イオンが観察される条件で分析してもよい。
【0067】
(E)実施の形態5
ここでは、MS/MS分析したイオンをイクスクルージョンリストに追加する方法について説明する。
【0068】
図24A及びBに、本発明の実施の形態5に基づく制御フローを示す。なお、図24A及びBには、図1との対応部分に同一符号を付して示している。
【0069】
実施の形態1〜4では、MS/MS分析したイオンはインクルージョンリストから除外することにより、一回のシークエンスで同一イオンが重複分析されることを回避した。しかし、次のシークエンスのMS1測定(ステップ3)の結果、類似のMS1スペクトル(検出されるイオン種が同じ)が取得された場合、ほぼ同様のインクルージョンリストが作成され、既にMS/MS分析を実施したイオンに対し、再度MS/MS分析を行うこととなる。MS/MS分析したイオンをイクスクルージョンリストに格納することで、既にデータ取得したイオンに対するMS/MS測定を回避することができる。
【0070】
まず、糖ペプチドのインクルージョンリスト化を実施する(ステップ10)。インクルージョンリスト1のイオンにおいて、最もイオン強度の高いイオンをプリカーサイオンとして選択する(ステップ11)。プリカーサイオンは、イオン強度順に選択されるのが一般的であるが、価数や分子量を考慮に入れて選択しても良い。選択されたプリカーサイオンは、イオン強度に応じたデータ取得時間を設定し(ステップ12)、MS/MS測定(ステップ13)を実施する。MS/MS測定(ステップ13)したイオンは、イクスクルージョンリスト1に追加される(ステップ60)。別のインクルージョンリストが存在する場合は、前述と同様にように動作させる。ここでは、MS/MS測定(ステップ13)したイオンのみをイクスクルージョンリストに追加したが、インクルージョンリスト1に格納されている全てのイオンをイクスクルージョンリストに追加してもよい。イクスクルージョンリストに格納されているイオンは再度MS/MS分析をする必要のないイオンであり、プリカーサイオンとして選択しない。しかし、イクスクルージョンリストに格納されたイオンと同じの質量電荷比と価数をもったイオンを分析終了まで同一イオンと判断されてしまうと、偶然に質量電荷比と価数が一致したイオンをMS/MS測定することができなくなる。多くのペプチドイオンは数十秒から1分間程度のバンドとして検出されることを考慮し、イクスクルージョンリストに格納されている各イオンには排除時間を設定することが望ましい。ここでいう排除時間とは、あるイオンが検出されてから排除時間内に質量電荷比と価数が一致したイオンが再度検出された場合は、同一イオンであると判断し、分析対象とはしないことを意味する。
【0071】
そこで、ピークリスト38が作成されると(ステップ4)、イクスクルージョンリストに格納されている各イオンが排除時間内であるかを判定する(ステップ50)。イクスクルージョンリストに排除時間のイオンが存在しない場合(ステップ50で否定結果の場合)、ピークリストに記載の任意の1イオンと他イオンとの質量差を算出し(ステップ5)、質量差と単糖組み合わせの一致度を検証し(ステップ6)、質量差が糖鎖組み合わせと一致するイオンが存在する場合(ステップ7で肯定結果の場合)には糖ペプチドのインクルージョンリスト化(ステップ10)へ進む。イクスクルージョンリストに排除時間内のイオンが存在した場合(ステップ50で肯定結果の場合)、そのイオンが格納されているイクスクルージョンリストから任意の1イオンを選択する。イクスクルージョンリストの一例を図25に示す。保持時間31分のMS1測定(ステップ3)でピークリスト38が作成されたとする(図25右図)。排除時間(Exclusion time)が3分の条件では、イクスクルージョンリストに記載されたイオンのうち保持時間28分以降に検出されたイオンは排除の対象となる。ここでは、F、Gイオンがこれに当たる。つまり、Exclusion list#のD、E、F、Gイオンから任意の1イオンを選択する。次に、選択したイオンとピークリスト記載イオンとの質量差を算出し(ステップ52)、質量差と単糖組み合わせの一致度を検証する(ステップ6)。ここで、推定糖ペプチドが検出されない場合(ステップ53で否定結果の場合)、ピークリストに記載の任意の1イオンと他イオンとの質量差の算出(ステップ5)へと進む。一方、推定糖ペプチドが検出された場合(ステップ53で肯定結果の場合)、質量差算出に用いた選択イオンに糖鎖を付加、あるいは除去した糖ペプチドだと推定されるので、質量差算出に用いた選択イオンが格納されているイクスクルージョンリストに追加する(ステップ54)。このとき、保持時間情報も格納してもよい。
【0072】
ここで、図26を用いて前述のフローを説明する。イクスクルージョンリストからEイオンを任意のイオンとして選択し、保持時間31分のピークリストに記載イオンとの質量差を算出した(Delta mass(E)の列)。この質量差からL、M、N、O、PイオンがEイオンと同一イオン(Nイオン)、あるいは、Eイオンに糖鎖が付加(O、Pイオン)、あるいは、除去(L、Mイオン)した構造だと推定された。これらのイオンはイクスクルージョンリスト#に格納され、プリカーサイオンとして選択しない。更新されたイクスクルージョンリスト#を図27に示す。このとき、保持時間の情報を追加することで、分析終了後に各イオン検出範囲の情報を表示することができる。イクスクルージョンリストに排除時間内のイオンが存在した場合(ステップ50で肯定結果の場合)、そのイオンが格納されているイクスクルージョンリストから任意の1イオンを選択する。このとき、どのイオンを選択しても、糖ペプチドの推定は可能である。その他の制御フローは実施の形態1と同様である。
【0073】
もっとも、糖ペプチドのインクルージョンリスト化(ステップ10)以降は実施の形態2と同様に動作させてもよい。また、糖ペプチドのインクルージョンリスト化(ステップ10)以降を、実施の形態3及び4の組み合わせとしてもよい。
【符号の説明】
【0074】
21…試料、22…試料分離装置(LC又はGC)、23…イオン源、24…リニアイオントラップ、25…Qディフレクター、26…ECDセル、27…TOF、28…TOF検出器、29…制御部、30…全体処理部、31…プリカーサイオン選択部、32…ソフトウエア部、33…分子量算出部、34…質量差算出部、35…糖ペプチド推定部、36…イオン分類部、37…プリカーサイオン決定部、38…ピークリスト、39…インクルージョンリスト、40…データ取得時間設定テーブル、41…データ格納部、42…データ表示部、43…パラメータ入力部、47…単糖組み合わせ質量ファイル、200…HexNAcイオン、201…HexHexNAcイオン、202…EイオンからHexNAcが失われたイオン、203…EイオンからHexHexNAcが失われたイオン、400…モノアイソトピックピーク、401…同位体イオンシリーズ、
【特許請求の範囲】
【請求項1】
試料を分離する分離部と、試料をイオン化するイオン源と、特定の質量電荷比を有するイオンを単離するイオン単離部と、イオンを解離するイオン解離部と、イオンを質量分析する質量分析部と、イオンの単離を制御する制御部と、計算処理部を有する質量分析装置を用いた質量分析方法であって、
イオンの質量スペクトルを取得する工程と、
前記計算処理部において、前記質量スペクトルで検出されたイオン情報をピークリストに格納する工程と、
前記計算処理部において、前記ピークリストに記載されたイオンから任意の1イオンを選択する工程と、
前記計算処理部において、選択したイオンとピークリストに記載されたその他の各イオンとの質量差を算出する工程と、
前記計算処理部において、質量差が所望分子の組み合わせ合計値と一致した場合、前記選択したイオンと質量差が所望分子の組み合わせ合計値と一致した全てのイオンをインクルージョンリストに実時間で格納する工程と、
前記計算処理部において、インクルージョンリストの中からプリカーサイオンを選択する工程と、
前記計算処理部において、選択したプリカーサイオンを解離させた質量スペクトルを取得する工程と、
前記計算処理部において、質量差が所望分子の組み合わせ合計値と一致しなかった場合、イオンを解離させることなく質量スペクトルを取得する工程と
を有する質量分析方法。
【請求項2】
分析前に前記所望分子及び/又はその分子量を設定する
ことを特徴とする請求項1に記載の質量分析方法。
【請求項3】
分析前に修飾分子及び/又はその分子数範囲を設定する
ことを特徴とする請求項1又は2に記載の質量分析方法。
【請求項4】
前記分離部は、液体クロマトグラフィー又はガスクロマトグラフィーを用いる
ことを特徴とする請求項1に記載の質量分析方法。
【請求項5】
前記ピークリストから選択されたイオンごとにインクルージョンリストを作成する
ことを特徴とする請求項1に記載の質量分析方法。
【請求項6】
プリカーサイオンとして選択されたイオン、又はプリカーサイオンが格納されていたインクルージョンリストに記載の全てのイオンをインクルージョンリストから除外する
ことを特徴とする請求項1に記載の質量分析方法。
【請求項7】
プリカーサイオン強度情報に基づいてデータ取得時間を設定する
ことを特徴とする請求項1に記載の質量分析方法。
【請求項8】
第1のインクルージョンリストから選択された第1のプリカーサイオンを解離させた質量スペクトルからフラグメントイオンの積算量を算出する工程と、
フラグメントイオンの前記積算量が閾値以上の場合、第2のインクルージョンリストからプリカーサイオンを選択し、第2のプリカーサイオンを解離させた質量スペクトルを取得する工程と、
フラグメントイオンの前記積算量が閾値以下の場合、前記第1のプリカーサイオンを解離させた質量スペクトルを再取得し、前記第1のプリカーサイオンについて前回取得された質量スペクトルに加算し、フラグメントイオンの前記積算量を再算出する工程と
を実行することを特徴とする請求項1に記載の質量分析方法。
【請求項9】
インクルージョンリストから選択した任意のプリカーサイオンを衝突誘起解離、又は赤外多光子吸収解離で解離し、所望のイオンが観察された場合、インクルージョンリストの中からプリカーサイオンを選択し、イオンを解離させた質量スペクトルを取得する
ことを特徴とする請求項1に記載の質量分析方法。
【請求項10】
ピークリストに所望のイオンが観察された場合、ピークリストに記載されたイオンの中から任意の1イオンを選択し、ピークリストに所望のイオンが観察されなかった場合、イオンの質量スペクトルを取得する
ことを特徴とする請求項1に記載の質量分析方法。
【請求項11】
全イオンを衝突誘起解離、又は赤外多光子吸収解離で解離する
ことを特徴とする請求項10に記載の質量分析方法。
【請求項12】
プリカーサイオン候補から除外されたイオンを任意の1イオンとして選択する
ことを特徴とする請求項1に記載の質量分析方法。
【請求項13】
質量差が所望分子の組み合わせ合計値と一致したイオンは分析中又は分析後に分子組み合わせ構造を表示する
ことを特徴とする請求項1に記載の質量分析方法。
【請求項14】
試料を分離する分離部と、
試料をイオン化するイオン源と、
特定の質量電荷比を有するイオンを単離するイオン単離部と、
イオンを解離するイオン解離部と、
イオンを質量分析する質量分析部と、
イオンの単離を制御する制御部と、
イオンから取得された質量スペクトルで検出されたイオン情報をピークリストに格納する機能と、前記ピークリストに記載されたイオンから任意の1イオンを選択する機能と、選択したイオンと前記ピークリストに記載されたその他の各イオンとの質量差を算出する機能と、算出された質量差が所望分子の組み合わせ合計値と一致した場合、前記選択したイオンと質量差が所望分子の組み合わせ合計値と一致した全てのイオンをインクルージョンリストに実時間で格納する機能と、前記インクルージョンリストの中からプリカーサイオンを選択する機能と、選択したプリカーサイオンを解離させた質量スペクトルを取得させる機能と、算出された質量差が所望分子の組み合わせ合計値と一致しなかった場合、イオンを解離させることなく質量スペクトルを取得させる機能とを含む計算処理部と
を有する質量分析装置。
【請求項1】
試料を分離する分離部と、試料をイオン化するイオン源と、特定の質量電荷比を有するイオンを単離するイオン単離部と、イオンを解離するイオン解離部と、イオンを質量分析する質量分析部と、イオンの単離を制御する制御部と、計算処理部を有する質量分析装置を用いた質量分析方法であって、
イオンの質量スペクトルを取得する工程と、
前記計算処理部において、前記質量スペクトルで検出されたイオン情報をピークリストに格納する工程と、
前記計算処理部において、前記ピークリストに記載されたイオンから任意の1イオンを選択する工程と、
前記計算処理部において、選択したイオンとピークリストに記載されたその他の各イオンとの質量差を算出する工程と、
前記計算処理部において、質量差が所望分子の組み合わせ合計値と一致した場合、前記選択したイオンと質量差が所望分子の組み合わせ合計値と一致した全てのイオンをインクルージョンリストに実時間で格納する工程と、
前記計算処理部において、インクルージョンリストの中からプリカーサイオンを選択する工程と、
前記計算処理部において、選択したプリカーサイオンを解離させた質量スペクトルを取得する工程と、
前記計算処理部において、質量差が所望分子の組み合わせ合計値と一致しなかった場合、イオンを解離させることなく質量スペクトルを取得する工程と
を有する質量分析方法。
【請求項2】
分析前に前記所望分子及び/又はその分子量を設定する
ことを特徴とする請求項1に記載の質量分析方法。
【請求項3】
分析前に修飾分子及び/又はその分子数範囲を設定する
ことを特徴とする請求項1又は2に記載の質量分析方法。
【請求項4】
前記分離部は、液体クロマトグラフィー又はガスクロマトグラフィーを用いる
ことを特徴とする請求項1に記載の質量分析方法。
【請求項5】
前記ピークリストから選択されたイオンごとにインクルージョンリストを作成する
ことを特徴とする請求項1に記載の質量分析方法。
【請求項6】
プリカーサイオンとして選択されたイオン、又はプリカーサイオンが格納されていたインクルージョンリストに記載の全てのイオンをインクルージョンリストから除外する
ことを特徴とする請求項1に記載の質量分析方法。
【請求項7】
プリカーサイオン強度情報に基づいてデータ取得時間を設定する
ことを特徴とする請求項1に記載の質量分析方法。
【請求項8】
第1のインクルージョンリストから選択された第1のプリカーサイオンを解離させた質量スペクトルからフラグメントイオンの積算量を算出する工程と、
フラグメントイオンの前記積算量が閾値以上の場合、第2のインクルージョンリストからプリカーサイオンを選択し、第2のプリカーサイオンを解離させた質量スペクトルを取得する工程と、
フラグメントイオンの前記積算量が閾値以下の場合、前記第1のプリカーサイオンを解離させた質量スペクトルを再取得し、前記第1のプリカーサイオンについて前回取得された質量スペクトルに加算し、フラグメントイオンの前記積算量を再算出する工程と
を実行することを特徴とする請求項1に記載の質量分析方法。
【請求項9】
インクルージョンリストから選択した任意のプリカーサイオンを衝突誘起解離、又は赤外多光子吸収解離で解離し、所望のイオンが観察された場合、インクルージョンリストの中からプリカーサイオンを選択し、イオンを解離させた質量スペクトルを取得する
ことを特徴とする請求項1に記載の質量分析方法。
【請求項10】
ピークリストに所望のイオンが観察された場合、ピークリストに記載されたイオンの中から任意の1イオンを選択し、ピークリストに所望のイオンが観察されなかった場合、イオンの質量スペクトルを取得する
ことを特徴とする請求項1に記載の質量分析方法。
【請求項11】
全イオンを衝突誘起解離、又は赤外多光子吸収解離で解離する
ことを特徴とする請求項10に記載の質量分析方法。
【請求項12】
プリカーサイオン候補から除外されたイオンを任意の1イオンとして選択する
ことを特徴とする請求項1に記載の質量分析方法。
【請求項13】
質量差が所望分子の組み合わせ合計値と一致したイオンは分析中又は分析後に分子組み合わせ構造を表示する
ことを特徴とする請求項1に記載の質量分析方法。
【請求項14】
試料を分離する分離部と、
試料をイオン化するイオン源と、
特定の質量電荷比を有するイオンを単離するイオン単離部と、
イオンを解離するイオン解離部と、
イオンを質量分析する質量分析部と、
イオンの単離を制御する制御部と、
イオンから取得された質量スペクトルで検出されたイオン情報をピークリストに格納する機能と、前記ピークリストに記載されたイオンから任意の1イオンを選択する機能と、選択したイオンと前記ピークリストに記載されたその他の各イオンとの質量差を算出する機能と、算出された質量差が所望分子の組み合わせ合計値と一致した場合、前記選択したイオンと質量差が所望分子の組み合わせ合計値と一致した全てのイオンをインクルージョンリストに実時間で格納する機能と、前記インクルージョンリストの中からプリカーサイオンを選択する機能と、選択したプリカーサイオンを解離させた質量スペクトルを取得させる機能と、算出された質量差が所望分子の組み合わせ合計値と一致しなかった場合、イオンを解離させることなく質量スペクトルを取得させる機能とを含む計算処理部と
を有する質量分析装置。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19A】


【図19B】


【図20】


【図21】


【図22】


【図23】


【図24A】


【図24B】


【図25】


【図26】


【図27】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19A】


【図19B】


【図20】


【図21】


【図22】


【図23】


【図24A】


【図24B】


【図25】


【図26】


【図27】


【公開番号】特開2013−92495(P2013−92495A)
【公開日】平成25年5月16日(2013.5.16)
【国際特許分類】
【出願番号】特願2011−235856(P2011−235856)
【出願日】平成23年10月27日(2011.10.27)
【出願人】(000005108)株式会社日立製作所 (27,607)
【Fターム(参考)】
【公開日】平成25年5月16日(2013.5.16)
【国際特許分類】
【出願日】平成23年10月27日(2011.10.27)
【出願人】(000005108)株式会社日立製作所 (27,607)
【Fターム(参考)】
[ Back to top ]

