経口不活化ワクチン及びそれを提供するための方法
【課題】微生物による粘膜表層の異常なコロニー形成に対して防御的な粘膜免疫反応を誘発するための経口不活化ワクチンで使用するための単細胞の微生物の分離体を選択するための方法を提供する。
【解決手段】抗原反応性細胞を活性化する微生物の複数の異なる分離体の能力を評価すること、各微生物の分離体におけるクリアランスデータを提供するために微生物による粘膜表層の感染を減じる分離体の効果を評価することを含む。さらにまた、粘膜表層の異常な微生物のコロニー形成に対して、経口不活化ワクチンを提供する方法が開示され、該方法は、抗原反応性細胞でIL−10及びIL−12の発現を誘発する微生物の複数の異なる分離体の能力を評価することを含む。ワクチンで活用するために、他の各分離体と互いにそれぞれ比較して、IL−10と相関するIL−12の最適な発現を誘発する、少なくとも一つの分離体が選択される。
【解決手段】抗原反応性細胞を活性化する微生物の複数の異なる分離体の能力を評価すること、各微生物の分離体におけるクリアランスデータを提供するために微生物による粘膜表層の感染を減じる分離体の効果を評価することを含む。さらにまた、粘膜表層の異常な微生物のコロニー形成に対して、経口不活化ワクチンを提供する方法が開示され、該方法は、抗原反応性細胞でIL−10及びIL−12の発現を誘発する微生物の複数の異なる分離体の能力を評価することを含む。ワクチンで活用するために、他の各分離体と互いにそれぞれ比較して、IL−10と相関するIL−12の最適な発現を誘発する、少なくとも一つの分離体が選択される。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、微生物による粘膜表層の異常なコロニー形成に対して防御的な粘膜免疫反応を誘発するための経口不活化ワクチンで使用するための単細胞の微生物の分離体を選択するための方法に関する。また、このような感染症の予防または治療のための経口不活化ワクチンが提供される
【背景技術】
【0002】
抗菌ワクチンは公知技術であり、実施例は破傷風の毒素タンパク質が接合している細菌多糖類から成るインフルエンザ菌Bワクチンを含む。また、予防または消化器官の感染症の治療のための死菌ワクチンは知られており、腸チフスのための死菌ワクチンは市販されている。これらのワクチンが全身抗体反応を刺激して疾患の予防を提供するようにすることを意図するという点で、これらのワクチンは主に注射によって、もしそうでなければ投与されて、古典的なワクチンとして役立つ。
【0003】
経口投与される抗原は、全身リンパ組織とは異なって、腸管関連リンパ組織(GALT)によって処理される。目的論的に、これは、粘膜炎症にダメージを与えることを犠牲にすることなく、環境抗原が除外されることを必要とする粘膜生理学に関して理解されることができる。したがって、このような抗原に対する免疫反応に潜在的にダメージを与えることを最小にするために、強力な抑制メカニズムが存在する。この概念は、最初は、全身免疫反応(つまり、抗体の生成によって介される)が粘膜抗体反応(寛容)を検出することができないことに関連する、「スプリット トレランス(split tolerance)」として同定された。経口的に投与した不活化インフルエンザ ウィルスを活用する研究は、狭い範囲の抗原用量を超えて、抗体反応が刺激されることを示す。この免疫「領域」は、高低「領域」寛容がある。領域でも、同じ概念は細胞性免疫に適用し、抗体反応がなく起こっている防御については、より広い範囲で、Tリンパ球を介する反応が刺激されることができる。GALTとの抗原相互作用の結果は、感染の遠い粘膜部位に対する、B及びTリンパ球の選択的な移動であり、そこでは、B及びTリンパ球が防御を仲介する。
【0004】
また、無莢膜型インフルエンザ菌(NTHi)による感染に対する経口死菌ワクチンが公知である。NTHiは、慢性肺疾患を有する患者の鼻および気管支でのコロニー形成と関連がある、最も一般的な細菌であって、これらの患者の急性気管支炎発症と関連がある。このような患者の急性気管支炎の発症における重要な要因は、コロニーを作っている細菌に応答する気管支ルーメンへの好中球の抑制されていない不適切な移動である。気管支内の好中球の蓄積した(neurophil-laden)流体の蓄積は、化膿した痰に結果としてなる。居合わせた患者による感染の獲得によって評価されるように、経口NTHi死菌ワクチンの活用は、化膿した痰生産、高レベルの気道の細菌コロニー形成および細菌の環境での広がりから防御することを示した。このNTHiワクチンは、GALTの活性後の一般の粘膜システム、より詳しくは、腸のパイエル板を刺激する。
【0005】
特に長期慢性肺疾患の患者に粘膜免疫を提供するための死菌を含む経口のノン−アドジュべネイテッド(non-adjuvenated)な単細胞細菌のワクチンが、国際出願番号PCT/AU86/00071に記載されている。特に、その応用では、ワクチンの免疫化効能がアジュバントの不在に起因することを示している。通常、アジュバントは、免疫反応を促進するために、このようなワクチン処方に含まれる。アジュバントがない場合の免疫反応の発生は、評価される患者の肺の有力なサプレッサーT細胞群を引きこすために不十分な死菌によって誘発される反応によると結論された。
【先行技術文献】
【非特許文献】
【0006】
【非特許文献1】Dunkley et al, Immunol. (1994)83, pp.362-369
【非特許文献1】Remington. “The Science and Practice of Pharmacy.” (Mack Publishing Co., 1995)
【発明の概要】
【発明が解決しようとする課題】
【0007】
広義的に述べると、本発明は、異常な微生物のコロニー形成から守るための経口不活化ワクチンの供給に関し、個体群の遺伝的変異を反映する、異種交配された個体群の経口不活化ワクチンによって誘発される、このような感染症のクリアランスに著しい変化があるという認識から生じる。従来技術の経口死菌ワクチンの活用に関連した粘膜免疫の変化は、抗原提示細胞およびTリンパ球を活性化する微生物の異なる分離体の能力の重要な変化を認めることを見逃すことで、ワクチンのより最適でないか、またはランダムに選ばれる微生物の分離体の活用に起因すると考えられている。変化が観察され、分離体の選択は、異種交配された個体群の異なる個体の一般的な粘膜システムの活性化の程度を最適化するために重要である。本発明の一つ以上の実施例において提供される方法論は、経口不活化ワクチンを最適化するための分離体の選択を可能にする。
【課題を解決するための手段】
【0008】
より詳細には、本発明の一つの態様において、粘膜表層の異常な微生物コロニー形成に対する経口不活化ワクチンのための微生物の分離体を選択する方法が提供され、当該方法は、各微生物の分離体における活性化データを提供するために、抗原反応性細胞を活性化する単細胞微生物の複数の異なる分離体の能力を評価することと、各微生物の分離体におけるクリアランスデータを提供するために微生物による粘膜表層の感染を減じる分離体の効果を評価することと、微生物の分離体から、活性化データとクリアランスデータが相関し、他の各分離体と互いに比較して微生物に対して粘膜免疫を発生させるために最適である分離体を選択するか、または、さらにワクチンの処方で活用するため他の各分離体と互いにそれぞれ比較して、活性化データが最適であり、なおかつ、さらにクリアランスデータが最適である分離体を選択することよりなる。
【0009】
本発明の別の態様において、粘膜表層の異常な微生物コロニー形成に対して経口不活化ワクチンを提供するための方法が提供され、当該方法は、各微生物の分離体における活性化データを提供するために抗原反応性細胞を活性化する単細胞微生物の複数の異なる分離体の能力を評価することと、各微生物の分離体におけるクリアランスデータを提供するために微生物による粘膜表層の感染を減じる抽出物の効果を評価することと、複数の分離体から、活性化データとクリアランスデータが相関し、他の各分離体と互いに比較して微生物に対して粘膜免疫を発生させるために最適である分離体を選択するか、または、さらにワクチンの処方で活用するため他の各分離体と互いにそれぞれ比較して、活性化データが最適であり、なおかつ、さらにクリアランスデータが最適である分離体を選択することと、選択された分離体(複数可)を用いてワクチンを処方することよりなる。
【0010】
概して、活性化データとクリアランスデータが他の分離体と比較して最適である分離体が選択される。
【0011】
好ましくは、粘膜免疫は、主に細胞性免疫反応からなる。
【0012】
好ましくは、活性化及びクリアランスデータを提供するために活用される分離体は、微生物の不活化された分離体である。しかしながら、本発明はこれに限定されず、活性化およびクリアランスデータは、ワクチンで活用するための生の分離体と、その後不活化される選択された分離物から得られてもよい。
【0013】
分離体によって活性化された抗原反応性細胞は、一般的に、抗原提示細胞とTリンパ球の一つ又は両者からなり、好ましくは、両タイプの細胞からなる。概して、抗原提示細胞は、マクロファージからなる。最適には、Tリンパ球はTh1細胞である。抗原反応性細胞の活性化は、分離体によって直接のおよび/または間接的な活性化を含むように、最も広義に解される。直接の活性化は、例えば、微生物の分離体が抗原反応性細胞と結合されるかまたはそれらによって食菌される際に、細胞と接触することによって、分離体が少なくとも幾つかの抗原反応性細胞を活性化することを意味する。間接的な活性化は、例えば、分離体と接触するマクロファージなどの細胞と相互作用することによって、又はサイトカイン若しくは分離体により誘導されるか、誘発される放出物の他の化学的な伝達物質によって、あるいは分離体によって分泌される毒素若しくは抗原などの物質によって、あるいは前述した可能性の組み合わせによって、少なくとも幾つかの抗原反応性細胞が活性化されることを意味する。
【0014】
抗原反応性細胞の活性化レベルは、細胞の活性化と関連する1つ以上のパラメーターを測定することによって評価できる。好ましくは、抗原提示細胞とTリンパ球を活性化する分離体の能力が評価される。特に好ましい実施態様において、各分離体によって達成される抗原反応性細胞の活性化は、抗原提示細胞の活性化レベルを表す、少なくとも一つのパラメーターと、Tリンパ球の活性化レベルを表す、少なくとも他の一つのパラメーターとを測定することによって評価される。最適には、他の試験された分離体と比較して、抗原提示細胞とTリンパ球を活性化するために適切な活性化データの分離体が、経口不活化ワクチンの調製に活用されるために選択される。
【0015】
好ましくは、分離体(活性化データは、IL−10:IL−12の比率が約30以下であることによって特徴とされるサイトカイン反応を誘導する分離体の能力を表す)は、経口不活化ワクチンの処方に活用するために選択される。
【0016】
したがって、本発明の別の実施態様において、粘膜表層の異常な微生物コロニー形成に対する経口不活化ワクチンのための微生物の分離体を選択するための方法が提供され、該方法は、抗原反応性細胞でIL−10及びIL−12の発現を誘発する単細胞微生物の複数の異なる分離体の能力を評価することと、ワクチンの処方に活用するために、他の各分離体と互いにそれぞれ比較して、IL−10と相関するIL−12の最適な発現を誘発する、微生物の分離体から少なくとも一つの分離体を選択することよりなる。
【0017】
本発明のさらに別の態様において、粘膜表層の異常な微生物コロニー形成に対する経口不活化ワクチンを提供するための方法が提供され、該方法は、抗原反応性細胞でIL−10及びIL−12の発現を誘発する単細胞微生物の複数の異なる分離体の能力を評価することと、ワクチンの処方に活用するために、他の各分離体と互いにそれぞれ比較して、IL−10と相関するIL−12の最適な発現を誘発する、微生物の分離体から少なくとも一つの分離体を選択することと、及び分離体を利用してワクチンを処方することよりなる。
【0018】
単細胞微生物は、哺乳類の粘膜表層にコロニーを形成する能力を有する、任意の種類の微生物であり得、例えば、細菌、菌類および酵母からなる群から選択されてよい。概して、微生物は細菌であり、したがって、ワクチンは経口死菌ワクチンである。好ましくは、選択された分離体は、不活化全生物体(whole killed organisms)として、本発明のワクチンに使用される。しかしながら、本発明は、不活化全生物体の活用に制限されるものではなく、ワクチンは、選択された分離体の外側の細胞膜に由来する粒子状物質を含んで提供されてよい。
【0019】
また、別の態様において、本発明は、本発明の方法によって提供される、経口不活化ワクチンに関する。
【0020】
本発明のワクチンは、慢性および急性の感染症を含む粘膜部位の感染症に対して導かれる。感染症は、通常は、粘膜部位にコロニーを形成しない微生物病原体に対する一時的な露出の結果であり得るか、または、粘膜部位で通常に見られる微生物叢に起因する日和見性の感染であり得る。
【0021】
したがって、別の態様において、単細胞微生物による哺乳類の粘膜表層の感染症の予防または治療のための方法が提供され、該方法は、微生物に対して粘膜免疫を発生させるための本発明の経口不活化ワクチンの有効量を哺乳類に投与することよりなる。
【0022】
哺乳類は、本発明の経口不活化ワクチンで処置できる哺乳類であってよく、例えば、霊長類、ラット、マウスのような齧歯目系統の部類、またはウシの部類、豚、羊または馬の系統であってもよい。しかしながら、好ましくは、哺乳類はヒトである。
【0023】
本明細書の記載において、「有する」、またはその表現の変形としての「含む」、「よりなる」は、他のいかなる要素、整数若しくはステップまたは要素、整数若しくはステップの群の除外でなく、記載された要素、整数若しくはステップまたは要素、整数若しくはステップの群の包含を意味することが理解される。
【0024】
本明細書で言及したすべての刊行物は、参照としてここに組み込まれる。本明細書に含まれる、いかなる文書の記載、作用、物質、装置、物品等は、単に、本願明細書における関係を提供するためにある。これらのいかなる事項若しくは全ての事項が従来技術の基礎の一部を形成するか、または、本出願の各請求項の優先日前にオーストラリアか他の地域で、本発明に関連する分野の共通の一般知識であったということが承認されるように解されない。
【0025】
さらに、本発明の特徴及び利点は、下記の好ましい実施態様の記載から明白となる。
【図面の簡単な説明】
【0026】
【図1】経口投与された細菌の不活化全菌体の異なる分離体によって、BALB/cマウスの鼻でS.アウレウスのコロニー形成の減少を示すグラフである。
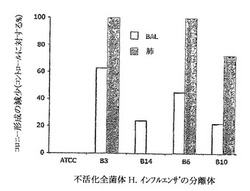
【図2】経口投与された細菌の不活化全菌体の異なる分離体によって、BALB/cマウスの気道でNTHiコロニー形成の減少を示すグラフである。
【発明を実施するための形態】
【0027】
本発明によって具体化されたワクチンは、肺および上気道感染症の予防または治療における特定の応用を見出す。しかしながら、本発明はこれに限定されるものではなく、一般の粘膜システムの活性化から生じる粘膜免疫は、口、鼻、口咽頭、咽頭、消化管、膣、眼関連、および尿粘膜表層などの感染を含む、体の他の粘膜部位での感染に対する防御または治療を含んでよい。ワクチンは、例えば、クラミジア属種、ヘモフィルス属種、無莢膜型ヘモフィルス属種、シュードモナス属種、ストレプトコッカス属種、スタフィロコッカス属種、エシェリヒア コリ、マイコプラズマ属種、及びヘリコバクター属種、他にその他から選択される細菌を含むか、細菌の異なる属、または他の単細胞微生物の組み合わせを組み込んでよい。本発明による経口不活化ワクチンで利用されることができる細菌以外の微生物は、カンジダ・アルビカンスなどのカンジダ属種と、サッカロミセス属種のような酵母とを含む。本発明によって具体化される、特に好ましい経口死菌ワクチンは、無莢膜型ヘモフィルス インフルエンザ(NTHi)、S.アウレウス(aureus)、Ps.エルギノーサ(aeruginosa)、S.ニューモニエ(pneumoniae)及びこれらの組み合わせからなる群から選択される細菌による粘膜感染の予防または治療のためのワクチンである。
【0028】
本発明によって具体化されるワクチンの主な応用は、ワクチンが提供される特定の細菌の感染に対して粘膜免疫を発生させることであり、そして、それはさまざまな粘膜部位で起こることができるが、ワクチンはまた、感染症によって悪化する疾患または症状の治療若しくは予防のために用いられることができる。
【0029】
例えば、P.エルギノーサは、気道にコロニーを形成するだけでなく、目粘膜と耳腔に影響を与える。無莢膜型ヘモフィルス インフルエンザ(NTHi)は、また、中耳炎を含んでいる伝染性の状況の範囲において、そして、肺炎および慢性気管支炎の悪化において関係している。したがって、それらの細菌の1つ以上の不活化された分離体を含有するワクチンは、予防またはこの種の関連する状況の治療のために投与されてよい。同様に、不活化インフルエンザ菌、S.ニューモニエ又はP.エルギノーサを含む本発明のワクチンは、気管支炎または肺炎、嚢胞性線維症および慢性閉塞性気道疾患の急性感染症、洞疾患、易感染性の肺機能、並びに他の肺および気道疾患障害の予防と治療において利用されることができる。また、特に年輩者で、これらのワクチンは、インフルエンザ ウイルスまたは他のウイルスによる感染で生じる対応する細菌による二重感染の予防または治療における特定の応用で見られる。
【0030】
本発明のワクチンにおいて不活化全菌体の分離体(whole killed isolates)(複数可)を用いることが好ましいが、その分離体(複数可)の表面抗原を含む特定の細胞表面物質を不活化全生物体に代わって、同様に活用してもよい。特に好ましい実施態様において、生物の外側の細胞膜分画が活用される。粒子状物質は、超音波処理または他の適切な技術により、不活化若しくは生の選択された分離体を崩壊させることによって、さらに必要に応じて、従来技術において公知の遠心分離、濾過および/または他の適切な技術により、他の細胞構成要素から必要な分画を切り離すことによって、調製されることができる。細胞崩壊の必要なレベルを達成する任意の適切な方法は、超音波処理ならびに適切な界面活性剤および攪拌を利用する分解を含むことを用いる。超音波処理が採用される場合、細胞の崩壊の必要とされる度合い、または望ましい大きさの粒子状物質の生成を得るために、分離体は多くの超音波ステップを受ける。利用される粒子状物質の分画は、抗原応答性細胞の反応を分離体(複数可)の異なる分画と比較して、かつ、細胞による免疫反応を最大にする分画を選択することによって選択されることができる。
【0031】
抗原反応性細胞を活性化する微生物の分離体またはその粒子状物質の性能を評価するために、細胞の活性化レベルを表す、任意のパラメーターが評価される。特に、好ましいパラメーターは、細胞増殖、細胞表面抗原の発現、細胞エフェクター機能の測定、およびサイトカイン生産の一つ以上を含む。
【0032】
細胞増殖、特にT細胞増殖は、細胞数、3H−チミジン取り込み及び/又はMTT分析によって便利に評価されることができる。
【0033】
サイトカインの発現は、キャプチャー(capture)若しくはサンドイッチ酵素結合免疫吸着検定法(ELISA)によって直接的に測定されるか、又は感心のあるサイトカインが成長因子若しくは阻害剤として作用する細胞成長アッセイによって間接的に測定される。同様に、サイトカインの発現はまた、逆転写酵素ポリメラーゼ連鎖反応(RT−PCR)、又は、従来技術において周知である、単一細胞及び特定のオリゴヌクレオチドプローブを活用する、in-situハイブリダイゼーションプロトコールを採用することにより、サイトカインをコードするmRNAの発現レベルを決定することによって評価される。
【0034】
概して、ワクチンによって生じる防御免疫反応は、主に、IL−12及びIFN−γの存在で増殖するCD4+T−リンパ球から分化する、Th1Tリンパ球によって介される。IL−12は、活性化の初期段階で、抗原提示細胞によって生成される。Th1Tリンパ球は、IFN−γの分泌とマクロファージによって発現されるCD40レセプターを有するTh1細胞によって発現されるCD40リガンドの相互作用により、感染したマクロファージを刺激する。より広義には、Th1細胞は、食細胞(例えば、好中球及びマクロファージ)の抗菌性機能を刺激し、このような食細胞を感染の部位に引きつける、サイトカインを放出する。加えて、典型的には、IFN−γ、Th1細胞は、IL−12及びTNF−βを分泌する。
【0035】
Th1とTh2の両細胞がIL−3、GM−CSF、例えば、TNF−αを分泌する一方で、Th1及びTh2細胞における全体のサイトカインのプロファイルは異なる。より詳細には、Th2細胞の活性化は、主に、活性化されたB細胞によってB-リンパ球の活性および抗体の生成によって特徴とされる体液の免疫反応に結果としてなり、その一方で、Th1細胞は、主に、非抗体細胞免疫反応を仲介する。免疫反応を導く、Th2細胞に特有のサイトカインは、IL−4、IL−5、IL−10、IL−13及びTGF−βを含む。したがって、IL−12、IFN−γ、または活性化された抗原提示細胞及びTh1がコミットされたCD4+T−リンパ球(Th1 commited CD4+T−lymphocytes)に特有の他のサイトカインの1つ以上の分泌の検出は、共通の粘膜システムを活性化するために与えられた微生物の分離体の能力の評価において有用である。好ましくは、IL−12の分泌レベルは、評価される微生物の分離体による抗原提示細胞の活性化の度合いの徴候を提供するために測定される。同様に、IFN−γ分泌のレベルは、概して、微生物の分離体により活性化されたTリンパ球の活性化レベルの徴候を提供するために測定される。
【0036】
特に好ましい実施態様において、活性化データは、IL−12と比較してIL−10の発現を示している比率を含む。IL−10は、マクロファージによってIL−12などのサイトカインの放出を阻害し、Th1細胞の活性化を阻害する。したがって、比率は、微生物の分離体によって誘発されるTh1リンパ球の反応レベルを表す。このように、抗原反応性細胞を活性化するために選択された分離体は、望ましくは、IFN−γの高い発現ではなく、低いIL−10:IL−12の比率によって特徴とされるサイトカイン反応を誘発する。好ましくは、比率は30未満であり、より好ましくは、20、15、10、5未満であり、さらに4未満である。
【0037】
ワクチンは、概して、ワクチン組成の約5%乃至約80%w/wの量の選択された細菌の分離体を含む。認識されるように、ワクチンの各々の分離体の数は、有効用量がワクチンの送達および性質の提案された方法を考慮して、一般の粘膜システムの活性化のために哺乳類に送達されるようなものである(例えば、粉末、液体、エアゾール送達など)。投与される細菌の分離体又は各投与される細菌の分離体の用量は、概して、それぞれ、約109乃至約1012、より好ましくは、約1010乃至約1011cfuの範囲である。選択された細菌の分離体の最適用量は、その後各々のグループの動物を対応する生菌の病原体に感染させる前に、試験哺乳類の異なるグループに対して、分離体の異なる用量を投与し、熟練した対象者に十分理解されるような病原体の満足なクリアランスを達成するために必要とされる用量レベルを決定することによって決定できる。
【0038】
ワクチン自体は、フリーズドライにされることができるか、または生理的に受け入れられるバッファー若しくは流体を利用して後の還元のために凍結乾燥されることができる。また、ワクチンは、1つ以上の反固まっている剤、等張性剤、チメロサールのような防腐剤、アミノ酸および砂糖部位のような安定剤、蔗糖、ラクトースまたはサッカリンなどの甘味料、水酸化ナトリウム、塩酸、一ナトリウム・リン酸塩および/またはリン酸ナトリウムのpH調整剤、生理食塩水、適切なバッファー、溶媒、分散媒体及び等張性剤のような薬学的に許容可能なキャリアを含むことができる。薬学的に活性な物質及びワクチンのためのそのような成分及び媒体の使用は、公知技術である。任意の従来の媒体または薬剤が細菌の分離体と適合しないこと以外は、本発明のワクチンにおけるそれらの使用は、特異的に含まれる。また、望ましくは、免疫反応(特に、γ−IFN、IL−12およびTNF−βのようなTh1反応に特有のサイトカイン)を促進するための一つ以上のサイトカインのような補助的な活性剤は、ワクチンに取り入れられることができる。
【0039】
加えて、本発明により具体化されたワクチンは、また、一つ以上のアジュバントを含むことができる。本発明のワクチン組成で有用な適切なアジュバント、薬学的に許容可能なキャリア及び成分の組み合わせは、例えば、「Remington: The Science and Practice of pharmacy (Mack Publishing Co., 1995)」(この内容は、その全体がここで参照として組み込まれている)などの熟練した対象者にとって知られているハンドブック及びテキストで見ることができる。
【0040】
経口死菌ワクチンは、乾燥粉末又は液状で投与されてよい。例えば、投与は、投薬液体としてエアゾール吸入によって、またはスプレーとして滴下によって、達成されることができる。経口ワクチンの送達を容易にするための装置が当該技術分野で知られており、メータード ドース インハラー(metered dose inhalers)(MDIs)、乾燥粉末吸入器(DPIs)及び超音波エネルギー、または圧縮空気、または原子化を達成する他の推進体を使用するものを含むネブライザー(nebulisers)を含む。MDIsにおいて用いられることができる推進体は、例えば、クロロフルオロカーボン類(CFCs)(例えばトリクロロフルオロカーボン(CFC−11)およびジクロロジフルオロカーボン(CFC−12)およびハイドロ・フルオロ・アルカンを含む。
【0041】
本発明の性質がより明らかに理解されるために、それの好ましい形態は、下記の制限されない実施例を参照して記載される。
【実施例】
【0042】
実施例1:不活化されたPs.エルギノーサの経口ワクチンでの経口免疫後のTリンパ球の活性化の変化
研究は、死菌の選択されない分離体を認識し、反応するレシピエントT細胞の能力の変わりやすさを実証するために実行された。気管支拡張症を訴える9人のヒトの被験者の一団は、2コースの不活化されたPs. エルギノーサ(Ps.a)経口ワクチンを与えられた。3日間において、各コースは、1日につき2錠の投与(各錠剤は、1011の死菌を含んだ)からなり、第二のコースは28日に開始する。使用したPs.エルギノーサの分離体は、動物モデルでの一般の粘膜システムを活性化できることを示す以外は選択されなかった。
【0043】
末梢血単核細胞は、抗原がプライムされたT細胞(antigen-primed T cell)の源として使用され、フィコール/パキュー・デンシティ・グラディエント(Ficoll/Paque density gradient)において、ヘパリンで凝血防止された血液から分離された。遠心分離(200g、4℃で20分間)の後、細胞はプラズマ:フィコールの界面から収集されて、PBS(pH7.4)で二回洗浄されて、ペニシリン(100U/mL)、ストレプトマイシン(100μg/mL)及び2−メルカプトエタノール(5x10−5M)を含有するAIM−V媒体(2x206細胞数/mL)で再懸濁された。細胞は、総量200μLのAIM−V媒体でPs抗原(1μg/mL)若しくはPHA−P(2μg/mL)の有無において、96穴のフラットボトムのマイクロタイタープレートのウェルで培養された。CO2インキュベーターで37℃、4日間のインキュベーションの後、培養組織は、セルハーベスターを用いてガラスファイバーフィルター上でハーベストする前の最後の8時間において、H3-チミジンの0.5μCiでウェルごとにパルスされた。乾燥後、フィルターは、シンチレーションカウンターでカウントされた。結果は、平均cpm±SEとして表された。表1は、経口免疫後の平均カウント(H3-チミジンの取り込みが、抗原が誘発した増殖を表す)および平均(個々の反応の変化を表す)からの標準誤差(SE)を示す
【0044】
表1:ヒトにおけるT細胞Ps.a抗原誘発型増殖
【表1】

【0045】
結果は、一貫して小さい標準エラーによって、一貫した平均の刺激が、古典的に非特異的なT細胞マイトジェンPHAによって研究の全体にわたって誘発されて、比較的類似した増殖的な反応を反映したことを示す。経口免疫前のPs.a抗原の刺激で、標準誤差(SE)はそれがPHAで見られる場合と同じオーダーである。しかしながら、経口免疫後の28日および56日で、反応における著しい変化が強調された(64および42のSE)。これらの結果は、ほとんどのレシピエントのT細胞レセプターを嵌入する分離体が選択できなかったことを反映するin vivoでのT細胞反応における相当な変化を示す。
【0046】
コントロールとして、DAラット(1グループにつき4)が、Ps.aの同じ分離体を用いて経口的に免疫された。簡単に言えば、二週間にわたって、一週間につき5日間において、ラットは、5x108のパラホルムアルデヒドで不活化されたシュードモナス エルギノーサ(Pseudomonas aeruginosa)(PBS中)が毎日与えられた。末梢血が抽出されて、H3-チミジンの取り込みが上記の記載のように評価された。結果は表2に示される。
【0047】
表2:先天的なラットにおけるT細胞Ps.a抗原誘発型増殖
【表2】

【0048】
13の低いSEは、先天的なDAラットで見られた(つまり、低い遺伝子の変動性を反映する)。ヒトの反応における大きいSE(つまり、個々の変化の程度を反映する)は、主に、選択されないワクチンの候補による、抗原提示細胞Tリンパ球ユニットの嵌入機序(engagement)での変化によるものとして結論される。この変化は、31日で決定される、細菌のコロニー形成(痰の細菌数で測定される)および痰化膿(白血球細胞の総数として測定される)での減少に高レベルの変化によって反映される、ヒトの研究の個人間で観察される保護レベルの相当な差異と相関する。特に、細菌のカウント数は3人の被験者で減少(1、3.0、1.0 log)し、5人の被験者では変化がなく、一人の被験者で増加した(2 logs)。痰白血球細胞数は、50%のSEで40%減少の平均によって減少した。したがって、T細胞(それは、次の細菌クリアランスで気管支ルーメンへの白血球補充の原因となる。例えば、Dunkley et al (1994) A role for CD4+ T cells from orally immunized rats in enhanced clearance of Ps. aeruginosa from the lung. Immunol 83, 362-369を参照)の活性化も変動であり、活用された死菌の分離体が、一般的なヒトの集団において経口死菌ワクチンとしての利用における最適な分離体でないことを示している。
【0049】
実施例2:サイトカインの放出を誘発するための最適な分離体の選択
通常のヒトの被験者から得られたS.アウレウスおよび無莢膜型H.インフルエンザ分離体は、リン酸塩緩衝液(PBS)で溶解した2%パラホルムアルデヒドで処理することによって不活化された。室温1時間のインキュベーション後、処理された細菌はPBSで徹底的に洗浄され、次いで、マンニット食塩寒天培地または馬血液寒天培地プレート上で培養することによって生存度を試験された。不活化された細菌は、吸光度対CFU(absorbance versus CFU)の標準回帰曲線(standard regression curve)からインターポレーション(interpolation)によって2x109cfu/mLに調整された。培養刺激での利用のために、各分離体からの細菌は、ペニシリン(100U/mL)、ストレプトマイシン(100μg/mL)及び2−メルカプトエタノール(2−ME、5x10−5M)を含有する無血清のAIM−V媒体で終濃度2x108cfu/mLに調整された。
【0050】
S.アウレウスの分離体において、オスのBALB/cマウスのグループは、生菌のS.アウレウスで鼻腔内に投与される前に、2週間にわたって週につき2日ごと5x109の不活化全菌体を鼻腔内に投与された。用量は、可変的な経口的な投薬を試験する同様の研究に基づいて決定された。コントロールマウス(n=5)は、PBSのみを与えられた。鼻におけるコロニー形成の減少が、投与後24−48時間で決定された。NTHi分離体において、オスのBALB/cマウスのグループは、生菌のNTHiでの鼻腔内投与を伴い、2週間にわたって週につき2日ごと5x109の不活化全菌体を胃内に投与された。コントロールマウスは、再度PBSのみを与えられた。NTHiコロニー形成の減少が、生菌投与後4時間で、気管支肺胞の洗浄(bronchoalveolar washings)(BAL)および肺ホモジネート(lung homogenates)で決定された。
【0051】
ヒトの末梢血単核細胞(PBMNC)は、フィコール/パキュー・デンシティ・グラディエント(Ficoll/Paque density gradient)において、遠心分離によってヘパリンで凝血防止された血液から分離された。遠心分離による洗浄後、PBMNCは、96穴のフラットボトム(flat-bottomed)のマイクロタイタープレートのウェルに、総量300μLの2x106/mLまたは2x108/mL CFUの死菌で、ウェルごと2x105細胞数でAIM−V媒体において培養された。37℃で空気中5%CO2の条件で3日間のインキュベーション後、培養上清は回収されて、ELISAによるサイトカインアッセイまで−20℃で保存された。
【0052】
サイトカインの生成を刺激する個々のS.アウレウスおよびHTHi分離体の性能は、抗原提示細胞−T細胞培養組織系を用いて試験された。要するに、APCおよびT細胞を含有するPBMNC(2x106/mL)は、CO2インキュベーターで37℃において3日間にわたり96穴プレートのフラットボトムのウェル内で、死菌の段階的な用量で刺激された。培養上清は回収されて、ELISAによりIL−12およびIFN−γがアッセイされた。
【0053】
表3は、IL−12およびIFN−γの生成を刺激する、S.アウレウス分離体(A2、A3、A8、A15、A28、A19、A20)の能力を試験した結果を示す。結果は、標準化された中央値であり、コントロールのパーセンテージとして表される。IL−12およびIFN−γの可変的な刺激が観察された。分離体A2、A8、A28およびA19は、分離体A15、A20およびA3よりもIL−12およびIFN−γの生成のより大きなスティミュレーター(stimulator)であった。他の分離体と比較して、分離体A28での刺激は、4−10倍のIL−12および/またはIFN−γの生成をもたらした。
【0054】
表3:細胞全体を不活化したS.aureus分離体の異なる用量で刺激した末梢血単核細胞の培養組織におけるIL−12およびIFN−γの生成
【表3】

【0055】
分離体A2、A8およびA28が5人の健常な被験者からのPBMNCを用いて培養組織で試験される場合、すべての被験者において、分離体A2およびA28だけがIL−12およびIFN−γの相当量を刺激することが可能であった(表4および表5)。それらの結果は、分離体A2およびA28が免疫調節性サイトカインの強力なスティミュレーターであり、したがって、候補の免疫スティミュレーター(ほとんどのレシピエントの防御的に粘膜免疫を仲介するような)として適切であることを示す。
【0056】
表4:細胞全体を不活化したS.アウレウス分離体で刺激した健常な被験者からのヒト末梢血単核細胞の培養組織におけるIL−12の生成
【表4】

【0057】
表5:健常な被験者からのヒト末梢血単核細胞の培養組織において細胞全体を不活化したS.アウレウス分離体で刺激したIFN−γの生成
【表5】

【0058】
試験したすべてのNTHi分離体(B3、B4、B6、B10およびB14)は、培養組織の刺激で用いた細菌の可変量の用量にかかわりなく、IL−12およびIFN−γの生成の刺激が可能であることが分かった(表6)。分離体B3およびB6は、他のNTHi分離体に比べて、IL−12およびIFN−γの多量の発生を刺激した。結果は、中央値であり、コントロールのパーセンテージとして表される。
【0059】
表6:細胞全体を不活化した無莢膜型H.インフルエンザ分離体で刺激した末梢血単核細胞(PBMNC)の培養組織におけるIL−12およびIFN−γの生成
【表6】

【0060】
実施例3:粘膜コロニー形成を減ずる免疫スティミュレーターとしての細菌の最適な分離体の選択
2匹のマウスの粘膜コロニー形成のモデルは、鼻腔でのS.アウレウスのコロニー形成の減少と、生菌で投与した後の肺における無莢膜型H.インフルエンザのコロニー形成の減少を決定するために用いられた。
【0061】
モデル1において、8週齢のオスのSPF BALB/cマウス(n=5)は、2週間にわたって週につき2日ごと300μlのPBSに溶解された、不活化されたS.アウレウスの全菌体(5x109/マウス)を胃内に投与された。コントロールマウスは、PBSのみを受けた。分離体A2、A28、A3、A15、A19およびA20からのパラホルムアルデヒドで不活化された細菌は、参照としてのATCC株(ATCC49247)を含んで、それぞれ試験された。最終的に服用した1日後、マウスは、各鼻孔に生のS.アウレウス(5x109細菌数/ml)10μlを投与された。投与後24−48時間において、マウスは犠牲にされて、鼻組織を削除した。組織はPBSで均質にされてホモジネートが回収され、次いで、マンニット食塩寒天培地プレート上でホモジネートを10倍で連続して希釈を培養することによって細菌濃度をアッセイした。37℃で24時間インキュベーションした後、CFU数が決定された。
【0062】
図1は、コントロールと比較して、分離体A19、A20、A28、A2、A3、A8およびA15から調製された死菌を受けたマウスのコロニー形成の減少を示す。生成レベルは選択された分離体に依存し、効果はA28>A2>A8>A3>A15>A20>A19であった。さらに、高レベルの防御は、ヒトPBMNCの培養組織で高レベルのIL−12およびIFN−γを刺激する分離体A28、A2およびA8の能力と相関して達成される(表2および3参照)。
【0063】
モデル2において、マウス(n=5)は、PBSに溶解した生菌(5x109/ml)10μlで鼻腔内に投与される前に、2週間にわたって週につき2日ごと300μlのPBSに溶解された、NTHiの不活化全菌体(5x109/マウス)を胃内に投与された。分離体B3、B14、B16およびB10から調製されたパラホルムアルデヒドで不活化された細菌は、それぞれ試験された。生菌投与の4時間後、細菌のクリアランスに関するコロニー形成の減少は、処理されたマウスおよびコントロールマウスからの気管支肺胞洗浄液(BAL)および肺のホモジネートで決定された。図2に示されるように、試験された分離体において、参照とするATCC株および分離体14と比較して、B3、B16およびB10が最良のクリアランス率となった。IL−12およびIFN−γ生成のin vitro刺激において比較する場合、B3およびB6分離体はコロニー形成の減少に最良な相関関係を与えた(表4参照)。
【0064】
実施例4:in vitroの最適なサイトカイン反応およびin vivo防御に基づくワクチン候補としての細菌の最適な分離体の選択
末梢血単核細胞(PBMNC)は、フィコール/パキュー・デンシティ・グラディエント(Ficoll/Paque density gradient)溶液において、遠心分離によって健常な被験者のヘパリンで凝血防止された血液から分離された。細胞はプラズマ:フィコールの界面から収集されて、15分間・4℃の遠心分離(200g)によってPBSで三回洗浄された。培養前に、細胞は、無血清のAIM−V媒体(2x206細胞数/mL)で再懸濁されて、生存度は、トリパンブルー除外試験(trypan-blue exclusion test)によって決定された。細胞懸濁の100マイクロリットルのアリコートが、二重で等量の死菌の段階的な濃度を含有するか、またはフラットボトムの96穴マイクロタイタープレートのウェルに培地だけを含有するAIM−V媒体に添加された。培養組織は、5%CO2の空気のインキュベーターにおいて、37℃・3日間インキュベーションされた。インキュベーション後、上澄みが回収されてプールされ、アッセイまで−20℃で保存された。
【0065】
培養組織の上澄みのIL−10、IL−12およびIFN−γは、基準として組換えタンパク質を有するモノクローナル抗体を用いるELISAによって測定された。要約すると、フラットボトムのマイクロタイタープレートのウェルは、キャプチャー抗体で4℃・オーバーナイトにわたってコーティングされた。洗浄後、細胞は、PBSに溶解した2%BSA溶液で室温(RT)・60分間にわたってブロックされ、PBS/Tweenでの洗浄を伴う。100マイクロリットルの上澄みは、各ウェルに添加された。室温で90分間のインキュベーションに続き、ウェルは洗浄され、次いで、100μlのビオチン化検出抗体が添加された。90分間のインキュベーション後、HRPが接合したストレプトアビジン溶液が30分間にわたって添加された。次いで、ウェルが洗浄され、TMB基質溶液が20分間添加された。カラー展開(colour development)の後、ELISAプレートリーダーで450nmにおいて読み込む前に、反応は硫黄溶液で停止された。培養組織の上澄みで分泌されたサイトカイン量は、標準曲線を用いてインターポレーションで計算され、結果はpg/mLとして表された。
【0066】
表7は、マウスモデルのコロニー形成の高い防御レベルと相関する、S.アウレウス(分離体A28)およびNTHi(分離体B6)で刺激した末梢血単核細胞によって生成された高レベルのIFN−γおよびIL−12を示す。対照的に、低レベルのサイトカインと高レベルの防御を刺激された分離体間(A3とB10)では相関性がない。逆に、高レベルのサイトカインと低レベルの防御を刺激された分離体間(A19とB14)で相関性は観察されなかった。この結果は、最適なサイトカイン反応およびin vivo防御が、気道において、粘膜免疫を増大し、コロニー形成を減じるための経口ワクチンまたは免疫スティミュレーターの候補として、細菌の最適な分離体の選択におけるマーカーであることを実証する。
【0067】
表7:in vivo細菌クリアランスとin vitroサイトカイン生成との相関性
【表7】

【0068】
実施例5:IL−10およびIL−12の異なる生成に基づく最適な分離体の選択、並びにIFN−γ生成およびin vivo防御を増強する能力
異なる分離体による培養組織のPBMNCの刺激は、IL−10およびIL−12の異なる量を生じて、その比率がIFN−γおよびin vivo防御のレベルと相関した。表8に示されるように、IL−10/IL−12の低比率のNTHi分離体(B3、B6)は、コントロールと比較して、不活化ウイルスの分離体で経口免疫されたマウスの気道において、IFN−γの最大の生成および細菌の減じられたコロニー形成によって特徴とされるTh1反応の良好なスティミュレーターである。逆に、IL−10/IL−12の高比率の分離体(B4、B10およびB14)は、IFN−γの低い生成および高レベルのコロニー形成と相関性がある。これはまた、高レベルのIFN−γが、IL−10/IL−12の低比率および低い率のコロニー形成と相関する際のS.アウレウス分離体においても言える(表9)。共に、結果は、細菌の最適な分離体が、IL−10/IL−12の低比率、高いIFN−γ、およびin vivo増強した防御に基づいて候補ワクチンとして選択できることを示す。このように、これらの結果に基づき、最適な分離体は、試験された全ての健常な被験者(最低でも3人の被験者)における15未満のIL−10/IL−12の比率およびIFN−γの高い生成(NTHiでは786pg/ml、S.アウレウスでは500pg/mlより高いレベル)の区分値と関係している。
【0069】
表8:IL−10/IL−12の比率、IFN−γの生成およびin vivo防御に基づいた無莢膜型H.インフルエンザ分離体の選択
【表8】

*不活化全菌体の分離体で経口免疫されたマウス(n=10)またはPBSのみが与えられたマウス(コントロール)の気道におけるコロニー形成
【0070】
表9:IL−10/IL−12の比率、IFN−γの生成およびin vivo防御に基づいたS.アウレウス分離体の選択
【表9】

*不活化全菌体の分離体で経口免疫されたマウス(n=10)またはPBSのみが与えられたマウス(コントロール)の鼻におけるコロニー形成
【0071】
実施例6:無莢膜型H.インフルエンザ分離体NTHi164による末梢血単核細胞の刺激
不活化全菌体NTHi164は、通常に健常なコントロールからのPBMNCで培養されて、IFN−γが評価された。その結果は表10に示される。
【0072】
表10:不活化全菌体NTHi164で刺激されたPBMNCでのIFN−γの刺激
【表10】

【0073】
実施例2の表6と比較して、NTHi164は、RCにおいてIFNγの相当レベルを表し、PCにおいてNTHi分離体B3またはB6によって誘発されるよりも、高いレベルのIFNγを表した。また、NTHi分離体の粒子分画が調製され、IFN−γ生成を刺激する分画の能力が評価された。その結果を表11に示す。要約すると、NTHi164は、−80℃の保存からチョコレート寒天プレート上へ回復され、次いで、チョコレート寒天に二次培養された。細菌は収穫され、ペレットにされて、PBSで1010/mlに再懸濁された。懸濁液は、30秒のオン(on)および60秒のオフ(off)の10サイクルを使用して、6μの振幅において超音波で破壊された。この懸濁は7000gで遠心分離され、上澄みが回収され、無菌濾過されて、タンパク質の含有量がPierceBCAプロテインアッセイによって決定された。アリコートは、使用するまで−20℃で凍結保存された。
【0074】
表11:不活化全菌体NTHi164分離体のPBMNC粒子抗原でのIFN−γ生成の刺激
【表11】

【0075】
表10および11は、不活化全菌体NTHi164およびその分離体の粒子抗原の抽出物が、IFN−γを生成するために末梢血単核細胞を刺激することを示す。IFN−γの生成は、IL−12に依存する。
【0076】
以上、本発明の好ましい実施例について詳述したが、本発明はかかる特定の実施形態に限定されるものではなく、特許請求の範囲に記載された本発明の要旨の範囲内において、種々の変形・変更が可能である。
【技術分野】
【0001】
本発明は、微生物による粘膜表層の異常なコロニー形成に対して防御的な粘膜免疫反応を誘発するための経口不活化ワクチンで使用するための単細胞の微生物の分離体を選択するための方法に関する。また、このような感染症の予防または治療のための経口不活化ワクチンが提供される
【背景技術】
【0002】
抗菌ワクチンは公知技術であり、実施例は破傷風の毒素タンパク質が接合している細菌多糖類から成るインフルエンザ菌Bワクチンを含む。また、予防または消化器官の感染症の治療のための死菌ワクチンは知られており、腸チフスのための死菌ワクチンは市販されている。これらのワクチンが全身抗体反応を刺激して疾患の予防を提供するようにすることを意図するという点で、これらのワクチンは主に注射によって、もしそうでなければ投与されて、古典的なワクチンとして役立つ。
【0003】
経口投与される抗原は、全身リンパ組織とは異なって、腸管関連リンパ組織(GALT)によって処理される。目的論的に、これは、粘膜炎症にダメージを与えることを犠牲にすることなく、環境抗原が除外されることを必要とする粘膜生理学に関して理解されることができる。したがって、このような抗原に対する免疫反応に潜在的にダメージを与えることを最小にするために、強力な抑制メカニズムが存在する。この概念は、最初は、全身免疫反応(つまり、抗体の生成によって介される)が粘膜抗体反応(寛容)を検出することができないことに関連する、「スプリット トレランス(split tolerance)」として同定された。経口的に投与した不活化インフルエンザ ウィルスを活用する研究は、狭い範囲の抗原用量を超えて、抗体反応が刺激されることを示す。この免疫「領域」は、高低「領域」寛容がある。領域でも、同じ概念は細胞性免疫に適用し、抗体反応がなく起こっている防御については、より広い範囲で、Tリンパ球を介する反応が刺激されることができる。GALTとの抗原相互作用の結果は、感染の遠い粘膜部位に対する、B及びTリンパ球の選択的な移動であり、そこでは、B及びTリンパ球が防御を仲介する。
【0004】
また、無莢膜型インフルエンザ菌(NTHi)による感染に対する経口死菌ワクチンが公知である。NTHiは、慢性肺疾患を有する患者の鼻および気管支でのコロニー形成と関連がある、最も一般的な細菌であって、これらの患者の急性気管支炎発症と関連がある。このような患者の急性気管支炎の発症における重要な要因は、コロニーを作っている細菌に応答する気管支ルーメンへの好中球の抑制されていない不適切な移動である。気管支内の好中球の蓄積した(neurophil-laden)流体の蓄積は、化膿した痰に結果としてなる。居合わせた患者による感染の獲得によって評価されるように、経口NTHi死菌ワクチンの活用は、化膿した痰生産、高レベルの気道の細菌コロニー形成および細菌の環境での広がりから防御することを示した。このNTHiワクチンは、GALTの活性後の一般の粘膜システム、より詳しくは、腸のパイエル板を刺激する。
【0005】
特に長期慢性肺疾患の患者に粘膜免疫を提供するための死菌を含む経口のノン−アドジュべネイテッド(non-adjuvenated)な単細胞細菌のワクチンが、国際出願番号PCT/AU86/00071に記載されている。特に、その応用では、ワクチンの免疫化効能がアジュバントの不在に起因することを示している。通常、アジュバントは、免疫反応を促進するために、このようなワクチン処方に含まれる。アジュバントがない場合の免疫反応の発生は、評価される患者の肺の有力なサプレッサーT細胞群を引きこすために不十分な死菌によって誘発される反応によると結論された。
【先行技術文献】
【非特許文献】
【0006】
【非特許文献1】Dunkley et al, Immunol. (1994)83, pp.362-369
【非特許文献1】Remington. “The Science and Practice of Pharmacy.” (Mack Publishing Co., 1995)
【発明の概要】
【発明が解決しようとする課題】
【0007】
広義的に述べると、本発明は、異常な微生物のコロニー形成から守るための経口不活化ワクチンの供給に関し、個体群の遺伝的変異を反映する、異種交配された個体群の経口不活化ワクチンによって誘発される、このような感染症のクリアランスに著しい変化があるという認識から生じる。従来技術の経口死菌ワクチンの活用に関連した粘膜免疫の変化は、抗原提示細胞およびTリンパ球を活性化する微生物の異なる分離体の能力の重要な変化を認めることを見逃すことで、ワクチンのより最適でないか、またはランダムに選ばれる微生物の分離体の活用に起因すると考えられている。変化が観察され、分離体の選択は、異種交配された個体群の異なる個体の一般的な粘膜システムの活性化の程度を最適化するために重要である。本発明の一つ以上の実施例において提供される方法論は、経口不活化ワクチンを最適化するための分離体の選択を可能にする。
【課題を解決するための手段】
【0008】
より詳細には、本発明の一つの態様において、粘膜表層の異常な微生物コロニー形成に対する経口不活化ワクチンのための微生物の分離体を選択する方法が提供され、当該方法は、各微生物の分離体における活性化データを提供するために、抗原反応性細胞を活性化する単細胞微生物の複数の異なる分離体の能力を評価することと、各微生物の分離体におけるクリアランスデータを提供するために微生物による粘膜表層の感染を減じる分離体の効果を評価することと、微生物の分離体から、活性化データとクリアランスデータが相関し、他の各分離体と互いに比較して微生物に対して粘膜免疫を発生させるために最適である分離体を選択するか、または、さらにワクチンの処方で活用するため他の各分離体と互いにそれぞれ比較して、活性化データが最適であり、なおかつ、さらにクリアランスデータが最適である分離体を選択することよりなる。
【0009】
本発明の別の態様において、粘膜表層の異常な微生物コロニー形成に対して経口不活化ワクチンを提供するための方法が提供され、当該方法は、各微生物の分離体における活性化データを提供するために抗原反応性細胞を活性化する単細胞微生物の複数の異なる分離体の能力を評価することと、各微生物の分離体におけるクリアランスデータを提供するために微生物による粘膜表層の感染を減じる抽出物の効果を評価することと、複数の分離体から、活性化データとクリアランスデータが相関し、他の各分離体と互いに比較して微生物に対して粘膜免疫を発生させるために最適である分離体を選択するか、または、さらにワクチンの処方で活用するため他の各分離体と互いにそれぞれ比較して、活性化データが最適であり、なおかつ、さらにクリアランスデータが最適である分離体を選択することと、選択された分離体(複数可)を用いてワクチンを処方することよりなる。
【0010】
概して、活性化データとクリアランスデータが他の分離体と比較して最適である分離体が選択される。
【0011】
好ましくは、粘膜免疫は、主に細胞性免疫反応からなる。
【0012】
好ましくは、活性化及びクリアランスデータを提供するために活用される分離体は、微生物の不活化された分離体である。しかしながら、本発明はこれに限定されず、活性化およびクリアランスデータは、ワクチンで活用するための生の分離体と、その後不活化される選択された分離物から得られてもよい。
【0013】
分離体によって活性化された抗原反応性細胞は、一般的に、抗原提示細胞とTリンパ球の一つ又は両者からなり、好ましくは、両タイプの細胞からなる。概して、抗原提示細胞は、マクロファージからなる。最適には、Tリンパ球はTh1細胞である。抗原反応性細胞の活性化は、分離体によって直接のおよび/または間接的な活性化を含むように、最も広義に解される。直接の活性化は、例えば、微生物の分離体が抗原反応性細胞と結合されるかまたはそれらによって食菌される際に、細胞と接触することによって、分離体が少なくとも幾つかの抗原反応性細胞を活性化することを意味する。間接的な活性化は、例えば、分離体と接触するマクロファージなどの細胞と相互作用することによって、又はサイトカイン若しくは分離体により誘導されるか、誘発される放出物の他の化学的な伝達物質によって、あるいは分離体によって分泌される毒素若しくは抗原などの物質によって、あるいは前述した可能性の組み合わせによって、少なくとも幾つかの抗原反応性細胞が活性化されることを意味する。
【0014】
抗原反応性細胞の活性化レベルは、細胞の活性化と関連する1つ以上のパラメーターを測定することによって評価できる。好ましくは、抗原提示細胞とTリンパ球を活性化する分離体の能力が評価される。特に好ましい実施態様において、各分離体によって達成される抗原反応性細胞の活性化は、抗原提示細胞の活性化レベルを表す、少なくとも一つのパラメーターと、Tリンパ球の活性化レベルを表す、少なくとも他の一つのパラメーターとを測定することによって評価される。最適には、他の試験された分離体と比較して、抗原提示細胞とTリンパ球を活性化するために適切な活性化データの分離体が、経口不活化ワクチンの調製に活用されるために選択される。
【0015】
好ましくは、分離体(活性化データは、IL−10:IL−12の比率が約30以下であることによって特徴とされるサイトカイン反応を誘導する分離体の能力を表す)は、経口不活化ワクチンの処方に活用するために選択される。
【0016】
したがって、本発明の別の実施態様において、粘膜表層の異常な微生物コロニー形成に対する経口不活化ワクチンのための微生物の分離体を選択するための方法が提供され、該方法は、抗原反応性細胞でIL−10及びIL−12の発現を誘発する単細胞微生物の複数の異なる分離体の能力を評価することと、ワクチンの処方に活用するために、他の各分離体と互いにそれぞれ比較して、IL−10と相関するIL−12の最適な発現を誘発する、微生物の分離体から少なくとも一つの分離体を選択することよりなる。
【0017】
本発明のさらに別の態様において、粘膜表層の異常な微生物コロニー形成に対する経口不活化ワクチンを提供するための方法が提供され、該方法は、抗原反応性細胞でIL−10及びIL−12の発現を誘発する単細胞微生物の複数の異なる分離体の能力を評価することと、ワクチンの処方に活用するために、他の各分離体と互いにそれぞれ比較して、IL−10と相関するIL−12の最適な発現を誘発する、微生物の分離体から少なくとも一つの分離体を選択することと、及び分離体を利用してワクチンを処方することよりなる。
【0018】
単細胞微生物は、哺乳類の粘膜表層にコロニーを形成する能力を有する、任意の種類の微生物であり得、例えば、細菌、菌類および酵母からなる群から選択されてよい。概して、微生物は細菌であり、したがって、ワクチンは経口死菌ワクチンである。好ましくは、選択された分離体は、不活化全生物体(whole killed organisms)として、本発明のワクチンに使用される。しかしながら、本発明は、不活化全生物体の活用に制限されるものではなく、ワクチンは、選択された分離体の外側の細胞膜に由来する粒子状物質を含んで提供されてよい。
【0019】
また、別の態様において、本発明は、本発明の方法によって提供される、経口不活化ワクチンに関する。
【0020】
本発明のワクチンは、慢性および急性の感染症を含む粘膜部位の感染症に対して導かれる。感染症は、通常は、粘膜部位にコロニーを形成しない微生物病原体に対する一時的な露出の結果であり得るか、または、粘膜部位で通常に見られる微生物叢に起因する日和見性の感染であり得る。
【0021】
したがって、別の態様において、単細胞微生物による哺乳類の粘膜表層の感染症の予防または治療のための方法が提供され、該方法は、微生物に対して粘膜免疫を発生させるための本発明の経口不活化ワクチンの有効量を哺乳類に投与することよりなる。
【0022】
哺乳類は、本発明の経口不活化ワクチンで処置できる哺乳類であってよく、例えば、霊長類、ラット、マウスのような齧歯目系統の部類、またはウシの部類、豚、羊または馬の系統であってもよい。しかしながら、好ましくは、哺乳類はヒトである。
【0023】
本明細書の記載において、「有する」、またはその表現の変形としての「含む」、「よりなる」は、他のいかなる要素、整数若しくはステップまたは要素、整数若しくはステップの群の除外でなく、記載された要素、整数若しくはステップまたは要素、整数若しくはステップの群の包含を意味することが理解される。
【0024】
本明細書で言及したすべての刊行物は、参照としてここに組み込まれる。本明細書に含まれる、いかなる文書の記載、作用、物質、装置、物品等は、単に、本願明細書における関係を提供するためにある。これらのいかなる事項若しくは全ての事項が従来技術の基礎の一部を形成するか、または、本出願の各請求項の優先日前にオーストラリアか他の地域で、本発明に関連する分野の共通の一般知識であったということが承認されるように解されない。
【0025】
さらに、本発明の特徴及び利点は、下記の好ましい実施態様の記載から明白となる。
【図面の簡単な説明】
【0026】
【図1】経口投与された細菌の不活化全菌体の異なる分離体によって、BALB/cマウスの鼻でS.アウレウスのコロニー形成の減少を示すグラフである。
【図2】経口投与された細菌の不活化全菌体の異なる分離体によって、BALB/cマウスの気道でNTHiコロニー形成の減少を示すグラフである。
【発明を実施するための形態】
【0027】
本発明によって具体化されたワクチンは、肺および上気道感染症の予防または治療における特定の応用を見出す。しかしながら、本発明はこれに限定されるものではなく、一般の粘膜システムの活性化から生じる粘膜免疫は、口、鼻、口咽頭、咽頭、消化管、膣、眼関連、および尿粘膜表層などの感染を含む、体の他の粘膜部位での感染に対する防御または治療を含んでよい。ワクチンは、例えば、クラミジア属種、ヘモフィルス属種、無莢膜型ヘモフィルス属種、シュードモナス属種、ストレプトコッカス属種、スタフィロコッカス属種、エシェリヒア コリ、マイコプラズマ属種、及びヘリコバクター属種、他にその他から選択される細菌を含むか、細菌の異なる属、または他の単細胞微生物の組み合わせを組み込んでよい。本発明による経口不活化ワクチンで利用されることができる細菌以外の微生物は、カンジダ・アルビカンスなどのカンジダ属種と、サッカロミセス属種のような酵母とを含む。本発明によって具体化される、特に好ましい経口死菌ワクチンは、無莢膜型ヘモフィルス インフルエンザ(NTHi)、S.アウレウス(aureus)、Ps.エルギノーサ(aeruginosa)、S.ニューモニエ(pneumoniae)及びこれらの組み合わせからなる群から選択される細菌による粘膜感染の予防または治療のためのワクチンである。
【0028】
本発明によって具体化されるワクチンの主な応用は、ワクチンが提供される特定の細菌の感染に対して粘膜免疫を発生させることであり、そして、それはさまざまな粘膜部位で起こることができるが、ワクチンはまた、感染症によって悪化する疾患または症状の治療若しくは予防のために用いられることができる。
【0029】
例えば、P.エルギノーサは、気道にコロニーを形成するだけでなく、目粘膜と耳腔に影響を与える。無莢膜型ヘモフィルス インフルエンザ(NTHi)は、また、中耳炎を含んでいる伝染性の状況の範囲において、そして、肺炎および慢性気管支炎の悪化において関係している。したがって、それらの細菌の1つ以上の不活化された分離体を含有するワクチンは、予防またはこの種の関連する状況の治療のために投与されてよい。同様に、不活化インフルエンザ菌、S.ニューモニエ又はP.エルギノーサを含む本発明のワクチンは、気管支炎または肺炎、嚢胞性線維症および慢性閉塞性気道疾患の急性感染症、洞疾患、易感染性の肺機能、並びに他の肺および気道疾患障害の予防と治療において利用されることができる。また、特に年輩者で、これらのワクチンは、インフルエンザ ウイルスまたは他のウイルスによる感染で生じる対応する細菌による二重感染の予防または治療における特定の応用で見られる。
【0030】
本発明のワクチンにおいて不活化全菌体の分離体(whole killed isolates)(複数可)を用いることが好ましいが、その分離体(複数可)の表面抗原を含む特定の細胞表面物質を不活化全生物体に代わって、同様に活用してもよい。特に好ましい実施態様において、生物の外側の細胞膜分画が活用される。粒子状物質は、超音波処理または他の適切な技術により、不活化若しくは生の選択された分離体を崩壊させることによって、さらに必要に応じて、従来技術において公知の遠心分離、濾過および/または他の適切な技術により、他の細胞構成要素から必要な分画を切り離すことによって、調製されることができる。細胞崩壊の必要なレベルを達成する任意の適切な方法は、超音波処理ならびに適切な界面活性剤および攪拌を利用する分解を含むことを用いる。超音波処理が採用される場合、細胞の崩壊の必要とされる度合い、または望ましい大きさの粒子状物質の生成を得るために、分離体は多くの超音波ステップを受ける。利用される粒子状物質の分画は、抗原応答性細胞の反応を分離体(複数可)の異なる分画と比較して、かつ、細胞による免疫反応を最大にする分画を選択することによって選択されることができる。
【0031】
抗原反応性細胞を活性化する微生物の分離体またはその粒子状物質の性能を評価するために、細胞の活性化レベルを表す、任意のパラメーターが評価される。特に、好ましいパラメーターは、細胞増殖、細胞表面抗原の発現、細胞エフェクター機能の測定、およびサイトカイン生産の一つ以上を含む。
【0032】
細胞増殖、特にT細胞増殖は、細胞数、3H−チミジン取り込み及び/又はMTT分析によって便利に評価されることができる。
【0033】
サイトカインの発現は、キャプチャー(capture)若しくはサンドイッチ酵素結合免疫吸着検定法(ELISA)によって直接的に測定されるか、又は感心のあるサイトカインが成長因子若しくは阻害剤として作用する細胞成長アッセイによって間接的に測定される。同様に、サイトカインの発現はまた、逆転写酵素ポリメラーゼ連鎖反応(RT−PCR)、又は、従来技術において周知である、単一細胞及び特定のオリゴヌクレオチドプローブを活用する、in-situハイブリダイゼーションプロトコールを採用することにより、サイトカインをコードするmRNAの発現レベルを決定することによって評価される。
【0034】
概して、ワクチンによって生じる防御免疫反応は、主に、IL−12及びIFN−γの存在で増殖するCD4+T−リンパ球から分化する、Th1Tリンパ球によって介される。IL−12は、活性化の初期段階で、抗原提示細胞によって生成される。Th1Tリンパ球は、IFN−γの分泌とマクロファージによって発現されるCD40レセプターを有するTh1細胞によって発現されるCD40リガンドの相互作用により、感染したマクロファージを刺激する。より広義には、Th1細胞は、食細胞(例えば、好中球及びマクロファージ)の抗菌性機能を刺激し、このような食細胞を感染の部位に引きつける、サイトカインを放出する。加えて、典型的には、IFN−γ、Th1細胞は、IL−12及びTNF−βを分泌する。
【0035】
Th1とTh2の両細胞がIL−3、GM−CSF、例えば、TNF−αを分泌する一方で、Th1及びTh2細胞における全体のサイトカインのプロファイルは異なる。より詳細には、Th2細胞の活性化は、主に、活性化されたB細胞によってB-リンパ球の活性および抗体の生成によって特徴とされる体液の免疫反応に結果としてなり、その一方で、Th1細胞は、主に、非抗体細胞免疫反応を仲介する。免疫反応を導く、Th2細胞に特有のサイトカインは、IL−4、IL−5、IL−10、IL−13及びTGF−βを含む。したがって、IL−12、IFN−γ、または活性化された抗原提示細胞及びTh1がコミットされたCD4+T−リンパ球(Th1 commited CD4+T−lymphocytes)に特有の他のサイトカインの1つ以上の分泌の検出は、共通の粘膜システムを活性化するために与えられた微生物の分離体の能力の評価において有用である。好ましくは、IL−12の分泌レベルは、評価される微生物の分離体による抗原提示細胞の活性化の度合いの徴候を提供するために測定される。同様に、IFN−γ分泌のレベルは、概して、微生物の分離体により活性化されたTリンパ球の活性化レベルの徴候を提供するために測定される。
【0036】
特に好ましい実施態様において、活性化データは、IL−12と比較してIL−10の発現を示している比率を含む。IL−10は、マクロファージによってIL−12などのサイトカインの放出を阻害し、Th1細胞の活性化を阻害する。したがって、比率は、微生物の分離体によって誘発されるTh1リンパ球の反応レベルを表す。このように、抗原反応性細胞を活性化するために選択された分離体は、望ましくは、IFN−γの高い発現ではなく、低いIL−10:IL−12の比率によって特徴とされるサイトカイン反応を誘発する。好ましくは、比率は30未満であり、より好ましくは、20、15、10、5未満であり、さらに4未満である。
【0037】
ワクチンは、概して、ワクチン組成の約5%乃至約80%w/wの量の選択された細菌の分離体を含む。認識されるように、ワクチンの各々の分離体の数は、有効用量がワクチンの送達および性質の提案された方法を考慮して、一般の粘膜システムの活性化のために哺乳類に送達されるようなものである(例えば、粉末、液体、エアゾール送達など)。投与される細菌の分離体又は各投与される細菌の分離体の用量は、概して、それぞれ、約109乃至約1012、より好ましくは、約1010乃至約1011cfuの範囲である。選択された細菌の分離体の最適用量は、その後各々のグループの動物を対応する生菌の病原体に感染させる前に、試験哺乳類の異なるグループに対して、分離体の異なる用量を投与し、熟練した対象者に十分理解されるような病原体の満足なクリアランスを達成するために必要とされる用量レベルを決定することによって決定できる。
【0038】
ワクチン自体は、フリーズドライにされることができるか、または生理的に受け入れられるバッファー若しくは流体を利用して後の還元のために凍結乾燥されることができる。また、ワクチンは、1つ以上の反固まっている剤、等張性剤、チメロサールのような防腐剤、アミノ酸および砂糖部位のような安定剤、蔗糖、ラクトースまたはサッカリンなどの甘味料、水酸化ナトリウム、塩酸、一ナトリウム・リン酸塩および/またはリン酸ナトリウムのpH調整剤、生理食塩水、適切なバッファー、溶媒、分散媒体及び等張性剤のような薬学的に許容可能なキャリアを含むことができる。薬学的に活性な物質及びワクチンのためのそのような成分及び媒体の使用は、公知技術である。任意の従来の媒体または薬剤が細菌の分離体と適合しないこと以外は、本発明のワクチンにおけるそれらの使用は、特異的に含まれる。また、望ましくは、免疫反応(特に、γ−IFN、IL−12およびTNF−βのようなTh1反応に特有のサイトカイン)を促進するための一つ以上のサイトカインのような補助的な活性剤は、ワクチンに取り入れられることができる。
【0039】
加えて、本発明により具体化されたワクチンは、また、一つ以上のアジュバントを含むことができる。本発明のワクチン組成で有用な適切なアジュバント、薬学的に許容可能なキャリア及び成分の組み合わせは、例えば、「Remington: The Science and Practice of pharmacy (Mack Publishing Co., 1995)」(この内容は、その全体がここで参照として組み込まれている)などの熟練した対象者にとって知られているハンドブック及びテキストで見ることができる。
【0040】
経口死菌ワクチンは、乾燥粉末又は液状で投与されてよい。例えば、投与は、投薬液体としてエアゾール吸入によって、またはスプレーとして滴下によって、達成されることができる。経口ワクチンの送達を容易にするための装置が当該技術分野で知られており、メータード ドース インハラー(metered dose inhalers)(MDIs)、乾燥粉末吸入器(DPIs)及び超音波エネルギー、または圧縮空気、または原子化を達成する他の推進体を使用するものを含むネブライザー(nebulisers)を含む。MDIsにおいて用いられることができる推進体は、例えば、クロロフルオロカーボン類(CFCs)(例えばトリクロロフルオロカーボン(CFC−11)およびジクロロジフルオロカーボン(CFC−12)およびハイドロ・フルオロ・アルカンを含む。
【0041】
本発明の性質がより明らかに理解されるために、それの好ましい形態は、下記の制限されない実施例を参照して記載される。
【実施例】
【0042】
実施例1:不活化されたPs.エルギノーサの経口ワクチンでの経口免疫後のTリンパ球の活性化の変化
研究は、死菌の選択されない分離体を認識し、反応するレシピエントT細胞の能力の変わりやすさを実証するために実行された。気管支拡張症を訴える9人のヒトの被験者の一団は、2コースの不活化されたPs. エルギノーサ(Ps.a)経口ワクチンを与えられた。3日間において、各コースは、1日につき2錠の投与(各錠剤は、1011の死菌を含んだ)からなり、第二のコースは28日に開始する。使用したPs.エルギノーサの分離体は、動物モデルでの一般の粘膜システムを活性化できることを示す以外は選択されなかった。
【0043】
末梢血単核細胞は、抗原がプライムされたT細胞(antigen-primed T cell)の源として使用され、フィコール/パキュー・デンシティ・グラディエント(Ficoll/Paque density gradient)において、ヘパリンで凝血防止された血液から分離された。遠心分離(200g、4℃で20分間)の後、細胞はプラズマ:フィコールの界面から収集されて、PBS(pH7.4)で二回洗浄されて、ペニシリン(100U/mL)、ストレプトマイシン(100μg/mL)及び2−メルカプトエタノール(5x10−5M)を含有するAIM−V媒体(2x206細胞数/mL)で再懸濁された。細胞は、総量200μLのAIM−V媒体でPs抗原(1μg/mL)若しくはPHA−P(2μg/mL)の有無において、96穴のフラットボトムのマイクロタイタープレートのウェルで培養された。CO2インキュベーターで37℃、4日間のインキュベーションの後、培養組織は、セルハーベスターを用いてガラスファイバーフィルター上でハーベストする前の最後の8時間において、H3-チミジンの0.5μCiでウェルごとにパルスされた。乾燥後、フィルターは、シンチレーションカウンターでカウントされた。結果は、平均cpm±SEとして表された。表1は、経口免疫後の平均カウント(H3-チミジンの取り込みが、抗原が誘発した増殖を表す)および平均(個々の反応の変化を表す)からの標準誤差(SE)を示す
【0044】
表1:ヒトにおけるT細胞Ps.a抗原誘発型増殖
【表1】

【0045】
結果は、一貫して小さい標準エラーによって、一貫した平均の刺激が、古典的に非特異的なT細胞マイトジェンPHAによって研究の全体にわたって誘発されて、比較的類似した増殖的な反応を反映したことを示す。経口免疫前のPs.a抗原の刺激で、標準誤差(SE)はそれがPHAで見られる場合と同じオーダーである。しかしながら、経口免疫後の28日および56日で、反応における著しい変化が強調された(64および42のSE)。これらの結果は、ほとんどのレシピエントのT細胞レセプターを嵌入する分離体が選択できなかったことを反映するin vivoでのT細胞反応における相当な変化を示す。
【0046】
コントロールとして、DAラット(1グループにつき4)が、Ps.aの同じ分離体を用いて経口的に免疫された。簡単に言えば、二週間にわたって、一週間につき5日間において、ラットは、5x108のパラホルムアルデヒドで不活化されたシュードモナス エルギノーサ(Pseudomonas aeruginosa)(PBS中)が毎日与えられた。末梢血が抽出されて、H3-チミジンの取り込みが上記の記載のように評価された。結果は表2に示される。
【0047】
表2:先天的なラットにおけるT細胞Ps.a抗原誘発型増殖
【表2】

【0048】
13の低いSEは、先天的なDAラットで見られた(つまり、低い遺伝子の変動性を反映する)。ヒトの反応における大きいSE(つまり、個々の変化の程度を反映する)は、主に、選択されないワクチンの候補による、抗原提示細胞Tリンパ球ユニットの嵌入機序(engagement)での変化によるものとして結論される。この変化は、31日で決定される、細菌のコロニー形成(痰の細菌数で測定される)および痰化膿(白血球細胞の総数として測定される)での減少に高レベルの変化によって反映される、ヒトの研究の個人間で観察される保護レベルの相当な差異と相関する。特に、細菌のカウント数は3人の被験者で減少(1、3.0、1.0 log)し、5人の被験者では変化がなく、一人の被験者で増加した(2 logs)。痰白血球細胞数は、50%のSEで40%減少の平均によって減少した。したがって、T細胞(それは、次の細菌クリアランスで気管支ルーメンへの白血球補充の原因となる。例えば、Dunkley et al (1994) A role for CD4+ T cells from orally immunized rats in enhanced clearance of Ps. aeruginosa from the lung. Immunol 83, 362-369を参照)の活性化も変動であり、活用された死菌の分離体が、一般的なヒトの集団において経口死菌ワクチンとしての利用における最適な分離体でないことを示している。
【0049】
実施例2:サイトカインの放出を誘発するための最適な分離体の選択
通常のヒトの被験者から得られたS.アウレウスおよび無莢膜型H.インフルエンザ分離体は、リン酸塩緩衝液(PBS)で溶解した2%パラホルムアルデヒドで処理することによって不活化された。室温1時間のインキュベーション後、処理された細菌はPBSで徹底的に洗浄され、次いで、マンニット食塩寒天培地または馬血液寒天培地プレート上で培養することによって生存度を試験された。不活化された細菌は、吸光度対CFU(absorbance versus CFU)の標準回帰曲線(standard regression curve)からインターポレーション(interpolation)によって2x109cfu/mLに調整された。培養刺激での利用のために、各分離体からの細菌は、ペニシリン(100U/mL)、ストレプトマイシン(100μg/mL)及び2−メルカプトエタノール(2−ME、5x10−5M)を含有する無血清のAIM−V媒体で終濃度2x108cfu/mLに調整された。
【0050】
S.アウレウスの分離体において、オスのBALB/cマウスのグループは、生菌のS.アウレウスで鼻腔内に投与される前に、2週間にわたって週につき2日ごと5x109の不活化全菌体を鼻腔内に投与された。用量は、可変的な経口的な投薬を試験する同様の研究に基づいて決定された。コントロールマウス(n=5)は、PBSのみを与えられた。鼻におけるコロニー形成の減少が、投与後24−48時間で決定された。NTHi分離体において、オスのBALB/cマウスのグループは、生菌のNTHiでの鼻腔内投与を伴い、2週間にわたって週につき2日ごと5x109の不活化全菌体を胃内に投与された。コントロールマウスは、再度PBSのみを与えられた。NTHiコロニー形成の減少が、生菌投与後4時間で、気管支肺胞の洗浄(bronchoalveolar washings)(BAL)および肺ホモジネート(lung homogenates)で決定された。
【0051】
ヒトの末梢血単核細胞(PBMNC)は、フィコール/パキュー・デンシティ・グラディエント(Ficoll/Paque density gradient)において、遠心分離によってヘパリンで凝血防止された血液から分離された。遠心分離による洗浄後、PBMNCは、96穴のフラットボトム(flat-bottomed)のマイクロタイタープレートのウェルに、総量300μLの2x106/mLまたは2x108/mL CFUの死菌で、ウェルごと2x105細胞数でAIM−V媒体において培養された。37℃で空気中5%CO2の条件で3日間のインキュベーション後、培養上清は回収されて、ELISAによるサイトカインアッセイまで−20℃で保存された。
【0052】
サイトカインの生成を刺激する個々のS.アウレウスおよびHTHi分離体の性能は、抗原提示細胞−T細胞培養組織系を用いて試験された。要するに、APCおよびT細胞を含有するPBMNC(2x106/mL)は、CO2インキュベーターで37℃において3日間にわたり96穴プレートのフラットボトムのウェル内で、死菌の段階的な用量で刺激された。培養上清は回収されて、ELISAによりIL−12およびIFN−γがアッセイされた。
【0053】
表3は、IL−12およびIFN−γの生成を刺激する、S.アウレウス分離体(A2、A3、A8、A15、A28、A19、A20)の能力を試験した結果を示す。結果は、標準化された中央値であり、コントロールのパーセンテージとして表される。IL−12およびIFN−γの可変的な刺激が観察された。分離体A2、A8、A28およびA19は、分離体A15、A20およびA3よりもIL−12およびIFN−γの生成のより大きなスティミュレーター(stimulator)であった。他の分離体と比較して、分離体A28での刺激は、4−10倍のIL−12および/またはIFN−γの生成をもたらした。
【0054】
表3:細胞全体を不活化したS.aureus分離体の異なる用量で刺激した末梢血単核細胞の培養組織におけるIL−12およびIFN−γの生成
【表3】

【0055】
分離体A2、A8およびA28が5人の健常な被験者からのPBMNCを用いて培養組織で試験される場合、すべての被験者において、分離体A2およびA28だけがIL−12およびIFN−γの相当量を刺激することが可能であった(表4および表5)。それらの結果は、分離体A2およびA28が免疫調節性サイトカインの強力なスティミュレーターであり、したがって、候補の免疫スティミュレーター(ほとんどのレシピエントの防御的に粘膜免疫を仲介するような)として適切であることを示す。
【0056】
表4:細胞全体を不活化したS.アウレウス分離体で刺激した健常な被験者からのヒト末梢血単核細胞の培養組織におけるIL−12の生成
【表4】

【0057】
表5:健常な被験者からのヒト末梢血単核細胞の培養組織において細胞全体を不活化したS.アウレウス分離体で刺激したIFN−γの生成
【表5】

【0058】
試験したすべてのNTHi分離体(B3、B4、B6、B10およびB14)は、培養組織の刺激で用いた細菌の可変量の用量にかかわりなく、IL−12およびIFN−γの生成の刺激が可能であることが分かった(表6)。分離体B3およびB6は、他のNTHi分離体に比べて、IL−12およびIFN−γの多量の発生を刺激した。結果は、中央値であり、コントロールのパーセンテージとして表される。
【0059】
表6:細胞全体を不活化した無莢膜型H.インフルエンザ分離体で刺激した末梢血単核細胞(PBMNC)の培養組織におけるIL−12およびIFN−γの生成
【表6】

【0060】
実施例3:粘膜コロニー形成を減ずる免疫スティミュレーターとしての細菌の最適な分離体の選択
2匹のマウスの粘膜コロニー形成のモデルは、鼻腔でのS.アウレウスのコロニー形成の減少と、生菌で投与した後の肺における無莢膜型H.インフルエンザのコロニー形成の減少を決定するために用いられた。
【0061】
モデル1において、8週齢のオスのSPF BALB/cマウス(n=5)は、2週間にわたって週につき2日ごと300μlのPBSに溶解された、不活化されたS.アウレウスの全菌体(5x109/マウス)を胃内に投与された。コントロールマウスは、PBSのみを受けた。分離体A2、A28、A3、A15、A19およびA20からのパラホルムアルデヒドで不活化された細菌は、参照としてのATCC株(ATCC49247)を含んで、それぞれ試験された。最終的に服用した1日後、マウスは、各鼻孔に生のS.アウレウス(5x109細菌数/ml)10μlを投与された。投与後24−48時間において、マウスは犠牲にされて、鼻組織を削除した。組織はPBSで均質にされてホモジネートが回収され、次いで、マンニット食塩寒天培地プレート上でホモジネートを10倍で連続して希釈を培養することによって細菌濃度をアッセイした。37℃で24時間インキュベーションした後、CFU数が決定された。
【0062】
図1は、コントロールと比較して、分離体A19、A20、A28、A2、A3、A8およびA15から調製された死菌を受けたマウスのコロニー形成の減少を示す。生成レベルは選択された分離体に依存し、効果はA28>A2>A8>A3>A15>A20>A19であった。さらに、高レベルの防御は、ヒトPBMNCの培養組織で高レベルのIL−12およびIFN−γを刺激する分離体A28、A2およびA8の能力と相関して達成される(表2および3参照)。
【0063】
モデル2において、マウス(n=5)は、PBSに溶解した生菌(5x109/ml)10μlで鼻腔内に投与される前に、2週間にわたって週につき2日ごと300μlのPBSに溶解された、NTHiの不活化全菌体(5x109/マウス)を胃内に投与された。分離体B3、B14、B16およびB10から調製されたパラホルムアルデヒドで不活化された細菌は、それぞれ試験された。生菌投与の4時間後、細菌のクリアランスに関するコロニー形成の減少は、処理されたマウスおよびコントロールマウスからの気管支肺胞洗浄液(BAL)および肺のホモジネートで決定された。図2に示されるように、試験された分離体において、参照とするATCC株および分離体14と比較して、B3、B16およびB10が最良のクリアランス率となった。IL−12およびIFN−γ生成のin vitro刺激において比較する場合、B3およびB6分離体はコロニー形成の減少に最良な相関関係を与えた(表4参照)。
【0064】
実施例4:in vitroの最適なサイトカイン反応およびin vivo防御に基づくワクチン候補としての細菌の最適な分離体の選択
末梢血単核細胞(PBMNC)は、フィコール/パキュー・デンシティ・グラディエント(Ficoll/Paque density gradient)溶液において、遠心分離によって健常な被験者のヘパリンで凝血防止された血液から分離された。細胞はプラズマ:フィコールの界面から収集されて、15分間・4℃の遠心分離(200g)によってPBSで三回洗浄された。培養前に、細胞は、無血清のAIM−V媒体(2x206細胞数/mL)で再懸濁されて、生存度は、トリパンブルー除外試験(trypan-blue exclusion test)によって決定された。細胞懸濁の100マイクロリットルのアリコートが、二重で等量の死菌の段階的な濃度を含有するか、またはフラットボトムの96穴マイクロタイタープレートのウェルに培地だけを含有するAIM−V媒体に添加された。培養組織は、5%CO2の空気のインキュベーターにおいて、37℃・3日間インキュベーションされた。インキュベーション後、上澄みが回収されてプールされ、アッセイまで−20℃で保存された。
【0065】
培養組織の上澄みのIL−10、IL−12およびIFN−γは、基準として組換えタンパク質を有するモノクローナル抗体を用いるELISAによって測定された。要約すると、フラットボトムのマイクロタイタープレートのウェルは、キャプチャー抗体で4℃・オーバーナイトにわたってコーティングされた。洗浄後、細胞は、PBSに溶解した2%BSA溶液で室温(RT)・60分間にわたってブロックされ、PBS/Tweenでの洗浄を伴う。100マイクロリットルの上澄みは、各ウェルに添加された。室温で90分間のインキュベーションに続き、ウェルは洗浄され、次いで、100μlのビオチン化検出抗体が添加された。90分間のインキュベーション後、HRPが接合したストレプトアビジン溶液が30分間にわたって添加された。次いで、ウェルが洗浄され、TMB基質溶液が20分間添加された。カラー展開(colour development)の後、ELISAプレートリーダーで450nmにおいて読み込む前に、反応は硫黄溶液で停止された。培養組織の上澄みで分泌されたサイトカイン量は、標準曲線を用いてインターポレーションで計算され、結果はpg/mLとして表された。
【0066】
表7は、マウスモデルのコロニー形成の高い防御レベルと相関する、S.アウレウス(分離体A28)およびNTHi(分離体B6)で刺激した末梢血単核細胞によって生成された高レベルのIFN−γおよびIL−12を示す。対照的に、低レベルのサイトカインと高レベルの防御を刺激された分離体間(A3とB10)では相関性がない。逆に、高レベルのサイトカインと低レベルの防御を刺激された分離体間(A19とB14)で相関性は観察されなかった。この結果は、最適なサイトカイン反応およびin vivo防御が、気道において、粘膜免疫を増大し、コロニー形成を減じるための経口ワクチンまたは免疫スティミュレーターの候補として、細菌の最適な分離体の選択におけるマーカーであることを実証する。
【0067】
表7:in vivo細菌クリアランスとin vitroサイトカイン生成との相関性
【表7】

【0068】
実施例5:IL−10およびIL−12の異なる生成に基づく最適な分離体の選択、並びにIFN−γ生成およびin vivo防御を増強する能力
異なる分離体による培養組織のPBMNCの刺激は、IL−10およびIL−12の異なる量を生じて、その比率がIFN−γおよびin vivo防御のレベルと相関した。表8に示されるように、IL−10/IL−12の低比率のNTHi分離体(B3、B6)は、コントロールと比較して、不活化ウイルスの分離体で経口免疫されたマウスの気道において、IFN−γの最大の生成および細菌の減じられたコロニー形成によって特徴とされるTh1反応の良好なスティミュレーターである。逆に、IL−10/IL−12の高比率の分離体(B4、B10およびB14)は、IFN−γの低い生成および高レベルのコロニー形成と相関性がある。これはまた、高レベルのIFN−γが、IL−10/IL−12の低比率および低い率のコロニー形成と相関する際のS.アウレウス分離体においても言える(表9)。共に、結果は、細菌の最適な分離体が、IL−10/IL−12の低比率、高いIFN−γ、およびin vivo増強した防御に基づいて候補ワクチンとして選択できることを示す。このように、これらの結果に基づき、最適な分離体は、試験された全ての健常な被験者(最低でも3人の被験者)における15未満のIL−10/IL−12の比率およびIFN−γの高い生成(NTHiでは786pg/ml、S.アウレウスでは500pg/mlより高いレベル)の区分値と関係している。
【0069】
表8:IL−10/IL−12の比率、IFN−γの生成およびin vivo防御に基づいた無莢膜型H.インフルエンザ分離体の選択
【表8】

*不活化全菌体の分離体で経口免疫されたマウス(n=10)またはPBSのみが与えられたマウス(コントロール)の気道におけるコロニー形成
【0070】
表9:IL−10/IL−12の比率、IFN−γの生成およびin vivo防御に基づいたS.アウレウス分離体の選択
【表9】

*不活化全菌体の分離体で経口免疫されたマウス(n=10)またはPBSのみが与えられたマウス(コントロール)の鼻におけるコロニー形成
【0071】
実施例6:無莢膜型H.インフルエンザ分離体NTHi164による末梢血単核細胞の刺激
不活化全菌体NTHi164は、通常に健常なコントロールからのPBMNCで培養されて、IFN−γが評価された。その結果は表10に示される。
【0072】
表10:不活化全菌体NTHi164で刺激されたPBMNCでのIFN−γの刺激
【表10】

【0073】
実施例2の表6と比較して、NTHi164は、RCにおいてIFNγの相当レベルを表し、PCにおいてNTHi分離体B3またはB6によって誘発されるよりも、高いレベルのIFNγを表した。また、NTHi分離体の粒子分画が調製され、IFN−γ生成を刺激する分画の能力が評価された。その結果を表11に示す。要約すると、NTHi164は、−80℃の保存からチョコレート寒天プレート上へ回復され、次いで、チョコレート寒天に二次培養された。細菌は収穫され、ペレットにされて、PBSで1010/mlに再懸濁された。懸濁液は、30秒のオン(on)および60秒のオフ(off)の10サイクルを使用して、6μの振幅において超音波で破壊された。この懸濁は7000gで遠心分離され、上澄みが回収され、無菌濾過されて、タンパク質の含有量がPierceBCAプロテインアッセイによって決定された。アリコートは、使用するまで−20℃で凍結保存された。
【0074】
表11:不活化全菌体NTHi164分離体のPBMNC粒子抗原でのIFN−γ生成の刺激
【表11】

【0075】
表10および11は、不活化全菌体NTHi164およびその分離体の粒子抗原の抽出物が、IFN−γを生成するために末梢血単核細胞を刺激することを示す。IFN−γの生成は、IL−12に依存する。
【0076】
以上、本発明の好ましい実施例について詳述したが、本発明はかかる特定の実施形態に限定されるものではなく、特許請求の範囲に記載された本発明の要旨の範囲内において、種々の変形・変更が可能である。
【特許請求の範囲】
【請求項1】
粘膜表層の微生物コロニー形成に対する経口不活化ワクチンの製造に使用される少なくとも一つの単細胞微生物の分離体(カンジダ・アルビカンスの分離体を除く)であって、
当該分離体は、当該分離体の第1の能力に基づいて前記微生物の分離体の群から選択され、前記第1の能力は、前記群のその他の分離体と比較して、抗原反応性細胞を最適に活性化し、前記微生物による粘膜表層の感染を取り除く能力であり、前記第1の能力は、IL−10:IL−12の比率によって特徴づけられるサイトカイン生産を評価することによって、及び、当該分離体によって達成されるin vivoでの粘膜表層の感染の減少のレベルを評価することによって決定されるか、又は、
1つの分離体が、該分離体の第2の能力に基づいて分離体の群から選択され、前記第2の能力は、前記群のその他の分離体と比較して、前記抗原反応性細胞を最適に活性化する能力であり、前記第2の能力は、IL−10:IL−12の比率によって特徴づけられるサイトカイン生産を評価することによって決定され、さらに、さらなる分離体が、該さらなる分離体の第3の能力に基づいて前記群から選択され、前記第3の能力は、前記群のその他の分離体と比較して、前記微生物による前記粘膜表層の感染を最適に取り除く能力であり、前記第3の能力は、当該さらなる分離体によって達成されるin vivoでの粘膜表層の感染の減少のレベルを評価することによって決定される、分離体。
【請求項2】
前記微生物の分離体が、死菌の分離体である、請求項1に記載の分離体。
【請求項3】
前記その他の分離体と比較して、前記活性化も前記取り除きも最良である分離体が選択される、請求項1に記載の分離体。
【請求項4】
前記その他の分離体と比較して、前記活性化が最良である分離体、さらに、前記取り除きが最良であるさらなる分離体が選択される、請求項1に記載の分離体。
【請求項5】
粘膜免疫が、主に細胞性免疫反応を含む、請求項1に記載の分離体。
【請求項6】
前記抗原反応性細胞が、抗原提示細胞とTリンパ球からなる群から選択される1又は複数の細胞タイプを含む、請求項1に記載の分離体。
【請求項7】
前記抗原反応性細胞が、抗原提示細胞もTリンパ球も含む、請求項6に記載の分離体。
【請求項8】
前記抗原提示細胞がマクロファージを含む、請求項6に記載の分離体。
【請求項9】
前記Tリンパ球が、Th1リンパ球又はTh1がコミットされたTリンパ球である、請求項7に記載の分離体。
【請求項10】
前記活性化が、抗原提示細胞を活性化する能力、及び、Tリンパ球を活性化するさらなる能力を含み、さらに、前記抗原提示細胞を活性化する能力と前記Tリンパ球を活性化するさらなる能力が相関する、請求項1に記載の分離体。
【請求項11】
前記抗原提示細胞を活性化する能力が、前記抗原反応性細胞によるIL−12発現を誘発する能力を含む、請求項10に記載の分離体。
【請求項12】
前記抗原提示細胞を活性化する能力が、前記抗原反応性細胞によるIL−12の発現及びIL−10の発現を誘発する能力を含む、請求項11に記載の分離体。
【請求項13】
30以下のIL−10発現:IL−12発現の比率によって特徴とされるサイトカイン反応を誘発する能力を含む分離体が、前記ワクチンに使用するために選択される、請求項12に記載の分離体。
【請求項14】
前記Tリンパ球を活性化するさらなる能力が、前記抗原反応性細胞によるIFN−γの発現を誘発する能力を含む、請求項10に記載の分離体。
【請求項15】
前記粘膜表層の感染を減じる前記分離体の効果が、in vivoで前記粘膜表層の感染を減じる前記分離体の能力を決定することによって評価される、請求項1に記載の分離体。
【請求項16】
前記微生物が、細菌、酵母、又は菌類からなる群から選択される、請求項1に記載の分離体。
【請求項17】
前記微生物が、クラミジア属種、ヘモフィルス属種、無莢膜型ヘモフィルス属種、シュードモナス属種、ストレプトコッカス属種、スタフィロコッカス属種、エシェリヒア コリ、マイコプラズマ属種、ヘリコバクター属種、カンジダ属種(カンジダ・アルビカンスを除く)、及びサッカロミセス属種からなる群から選択される微生物種から選択される、請求項16に記載の分離体。
【請求項18】
前記微生物が、無莢膜型H.インフルエンザ、S.アウレウス、Ps.エルギノーサ、及びS.ニューモニエから選択される、請求項17に記載の分離体。
【請求項19】
粘膜表層の微生物コロニー形成に対する経口不活化ワクチンの製造に使用される少なくとも一つの単細胞微生物の分離体(カンジダ・アルビカンスの分離体を除く)であって、当該分離体が、前記分離体の能力に基づいて前記微生物の分離体の群から選択され、前記分離体の能力は、前記群のその他の分離体と比較して、IL−12に対するIL−10の低い比率にてIL−12及びIL−10の発現を抗原反応性細胞に誘発する能力である、分離体。
【請求項20】
前記選択された分離体が、IL−12に対するIL−10の比率が30以下で、前記IL−10及びIL−12の発現を誘発する、請求項19に記載の分離体。
【請求項21】
前記比率が15以下である、請求項20に記載の分離体。
【請求項22】
前記分離体が、前記抗原反応性細胞によるγ−IFNの発現をさらに誘発する、請求項19に記載の分離体。
【請求項23】
前記分離体によるγ−IFNの発現が、前記その他の分離体と比較して最良である、請求項22に記載の分離体。
【請求項24】
前記抗原反応性細胞が末梢血単核細胞を含む、請求項19に記載の分離体。
【請求項25】
前記抗原反応性細胞が、抗原提示細胞及びTリンパ球を含む、請求項19に記載の分離体。
【請求項26】
前記微生物が、クラミジア属種、ヘモフィルス属種、無莢膜型ヘモフィルス属種、シュードモナス属種、ストレプトコッカス属種、スタフィロコッカス属種、エシェリヒア コリ、マイコプラズマ属種、ヘリコバクター属種、カンジダ属種(カンジダ・アルビカンスを除く)、及びサッカロミセス属種からなる群から選択される微生物種から選択される、請求項19に記載の分離体。
【請求項27】
前記微生物が、無莢膜型H.インフルエンザ、S.アウレウス、Ps.エルギノーサ、及びS.ニューモニエから選択される、請求項26に記載の分離体。
【請求項1】
粘膜表層の微生物コロニー形成に対する経口不活化ワクチンの製造に使用される少なくとも一つの単細胞微生物の分離体(カンジダ・アルビカンスの分離体を除く)であって、
当該分離体は、当該分離体の第1の能力に基づいて前記微生物の分離体の群から選択され、前記第1の能力は、前記群のその他の分離体と比較して、抗原反応性細胞を最適に活性化し、前記微生物による粘膜表層の感染を取り除く能力であり、前記第1の能力は、IL−10:IL−12の比率によって特徴づけられるサイトカイン生産を評価することによって、及び、当該分離体によって達成されるin vivoでの粘膜表層の感染の減少のレベルを評価することによって決定されるか、又は、
1つの分離体が、該分離体の第2の能力に基づいて分離体の群から選択され、前記第2の能力は、前記群のその他の分離体と比較して、前記抗原反応性細胞を最適に活性化する能力であり、前記第2の能力は、IL−10:IL−12の比率によって特徴づけられるサイトカイン生産を評価することによって決定され、さらに、さらなる分離体が、該さらなる分離体の第3の能力に基づいて前記群から選択され、前記第3の能力は、前記群のその他の分離体と比較して、前記微生物による前記粘膜表層の感染を最適に取り除く能力であり、前記第3の能力は、当該さらなる分離体によって達成されるin vivoでの粘膜表層の感染の減少のレベルを評価することによって決定される、分離体。
【請求項2】
前記微生物の分離体が、死菌の分離体である、請求項1に記載の分離体。
【請求項3】
前記その他の分離体と比較して、前記活性化も前記取り除きも最良である分離体が選択される、請求項1に記載の分離体。
【請求項4】
前記その他の分離体と比較して、前記活性化が最良である分離体、さらに、前記取り除きが最良であるさらなる分離体が選択される、請求項1に記載の分離体。
【請求項5】
粘膜免疫が、主に細胞性免疫反応を含む、請求項1に記載の分離体。
【請求項6】
前記抗原反応性細胞が、抗原提示細胞とTリンパ球からなる群から選択される1又は複数の細胞タイプを含む、請求項1に記載の分離体。
【請求項7】
前記抗原反応性細胞が、抗原提示細胞もTリンパ球も含む、請求項6に記載の分離体。
【請求項8】
前記抗原提示細胞がマクロファージを含む、請求項6に記載の分離体。
【請求項9】
前記Tリンパ球が、Th1リンパ球又はTh1がコミットされたTリンパ球である、請求項7に記載の分離体。
【請求項10】
前記活性化が、抗原提示細胞を活性化する能力、及び、Tリンパ球を活性化するさらなる能力を含み、さらに、前記抗原提示細胞を活性化する能力と前記Tリンパ球を活性化するさらなる能力が相関する、請求項1に記載の分離体。
【請求項11】
前記抗原提示細胞を活性化する能力が、前記抗原反応性細胞によるIL−12発現を誘発する能力を含む、請求項10に記載の分離体。
【請求項12】
前記抗原提示細胞を活性化する能力が、前記抗原反応性細胞によるIL−12の発現及びIL−10の発現を誘発する能力を含む、請求項11に記載の分離体。
【請求項13】
30以下のIL−10発現:IL−12発現の比率によって特徴とされるサイトカイン反応を誘発する能力を含む分離体が、前記ワクチンに使用するために選択される、請求項12に記載の分離体。
【請求項14】
前記Tリンパ球を活性化するさらなる能力が、前記抗原反応性細胞によるIFN−γの発現を誘発する能力を含む、請求項10に記載の分離体。
【請求項15】
前記粘膜表層の感染を減じる前記分離体の効果が、in vivoで前記粘膜表層の感染を減じる前記分離体の能力を決定することによって評価される、請求項1に記載の分離体。
【請求項16】
前記微生物が、細菌、酵母、又は菌類からなる群から選択される、請求項1に記載の分離体。
【請求項17】
前記微生物が、クラミジア属種、ヘモフィルス属種、無莢膜型ヘモフィルス属種、シュードモナス属種、ストレプトコッカス属種、スタフィロコッカス属種、エシェリヒア コリ、マイコプラズマ属種、ヘリコバクター属種、カンジダ属種(カンジダ・アルビカンスを除く)、及びサッカロミセス属種からなる群から選択される微生物種から選択される、請求項16に記載の分離体。
【請求項18】
前記微生物が、無莢膜型H.インフルエンザ、S.アウレウス、Ps.エルギノーサ、及びS.ニューモニエから選択される、請求項17に記載の分離体。
【請求項19】
粘膜表層の微生物コロニー形成に対する経口不活化ワクチンの製造に使用される少なくとも一つの単細胞微生物の分離体(カンジダ・アルビカンスの分離体を除く)であって、当該分離体が、前記分離体の能力に基づいて前記微生物の分離体の群から選択され、前記分離体の能力は、前記群のその他の分離体と比較して、IL−12に対するIL−10の低い比率にてIL−12及びIL−10の発現を抗原反応性細胞に誘発する能力である、分離体。
【請求項20】
前記選択された分離体が、IL−12に対するIL−10の比率が30以下で、前記IL−10及びIL−12の発現を誘発する、請求項19に記載の分離体。
【請求項21】
前記比率が15以下である、請求項20に記載の分離体。
【請求項22】
前記分離体が、前記抗原反応性細胞によるγ−IFNの発現をさらに誘発する、請求項19に記載の分離体。
【請求項23】
前記分離体によるγ−IFNの発現が、前記その他の分離体と比較して最良である、請求項22に記載の分離体。
【請求項24】
前記抗原反応性細胞が末梢血単核細胞を含む、請求項19に記載の分離体。
【請求項25】
前記抗原反応性細胞が、抗原提示細胞及びTリンパ球を含む、請求項19に記載の分離体。
【請求項26】
前記微生物が、クラミジア属種、ヘモフィルス属種、無莢膜型ヘモフィルス属種、シュードモナス属種、ストレプトコッカス属種、スタフィロコッカス属種、エシェリヒア コリ、マイコプラズマ属種、ヘリコバクター属種、カンジダ属種(カンジダ・アルビカンスを除く)、及びサッカロミセス属種からなる群から選択される微生物種から選択される、請求項19に記載の分離体。
【請求項27】
前記微生物が、無莢膜型H.インフルエンザ、S.アウレウス、Ps.エルギノーサ、及びS.ニューモニエから選択される、請求項26に記載の分離体。
【図1】


【図2】




【図2】


【公開番号】特開2013−55945(P2013−55945A)
【公開日】平成25年3月28日(2013.3.28)
【国際特許分類】
【出願番号】特願2012−235222(P2012−235222)
【出願日】平成24年10月25日(2012.10.25)
【分割の表示】特願2007−526121(P2007−526121)の分割
【原出願日】平成17年8月17日(2005.8.17)
【出願人】(507052245)ハンター イムノロジー リミテッド (3)
【Fターム(参考)】
【公開日】平成25年3月28日(2013.3.28)
【国際特許分類】
【出願日】平成24年10月25日(2012.10.25)
【分割の表示】特願2007−526121(P2007−526121)の分割
【原出願日】平成17年8月17日(2005.8.17)
【出願人】(507052245)ハンター イムノロジー リミテッド (3)
【Fターム(参考)】
[ Back to top ]

