繊維状構造体、および、繊維状構造体製造方法
【課題】特定部位に選択的に高効率にウイルスを導入することができる繊維状構造体、および、繊維状構造体製造方法を提供することを目的とする。
【解決手段】本発明の繊維状構造体は、繊維に、ウイルスとの結合親和性を有するヘパリンを結合させたことを特徴とし、本発明の繊維状構造体製造方法は、繊維にヘパリン結合処理を施す第一工程と、上記第一工程にてヘパリンが結合した上記繊維にウイルスを添加する第二工程と、上記第二工程にて上記ウイルスが添加された上記繊維を洗浄することにより、上記ヘパリンを介して上記ウイルスが結合した繊維状構造体を生成する第三工程と、を含むことを特徴とする。
【解決手段】本発明の繊維状構造体は、繊維に、ウイルスとの結合親和性を有するヘパリンを結合させたことを特徴とし、本発明の繊維状構造体製造方法は、繊維にヘパリン結合処理を施す第一工程と、上記第一工程にてヘパリンが結合した上記繊維にウイルスを添加する第二工程と、上記第二工程にて上記ウイルスが添加された上記繊維を洗浄することにより、上記ヘパリンを介して上記ウイルスが結合した繊維状構造体を生成する第三工程と、を含むことを特徴とする。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、繊維状構造体、および、繊維状構造体製造方法に関する。
【背景技術】
【0002】
従来、遺伝子を組み込んだウイルスを用いて、標的となる細胞や組織、臓器等に、遺伝子を発現させる遺伝子導入方法が開発されている。
【0003】
例えば、遺伝子を組み込んだウイルスを、血管内に注入して血流によって標的臓器に移行させる方法や、注射器等で直接、標的臓器にウイルスを注入する方法などが開発されている。
【0004】
ここで、非特許文献1には、ヘパリンを結合させたカラムに、アデノ随伴ウイルスの粗精製サンプルを添加することにより、高精製のアデノ随伴ウイルスを調製する方法が開示されている。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】E Burova and E Ioffe,“Chromatographic purification of recombinant adenoviral and adeno−associated viral vectors: methods and implications”,Gene Therapy (2005) 12, p5−p17
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかしながら、従来の遺伝子導入方法では、ウイルス注入部位をある程度コントロールできるものの、注入されたウイルスは短時間で体内を拡散していくため、非選択的で非効率な遺伝子導入方法であった。
【0007】
すなわち、非特許文献1に記載のように高精製のウイルスを調製しても、体内の特定部位において、希釈されずに高濃度でウイルスを安定的に局在させ、高効率にウイルスを導入する方法はなかった。
【0008】
本発明は、上記問題点に鑑みてなされたもので、特定部位に選択的に高効率にウイルスを導入することができる繊維状構造体、および、繊維状構造体製造方法を提供することを目的とする。
【課題を解決するための手段】
【0009】
このような目的を達成するため、本発明の繊維状構造体は、繊維に、ウイルスとの結合親和性を有するヘパリンを結合させたことを特徴とする。
【0010】
また、本発明の繊維状構造体は、上記記載の繊維状構造体において、上記ウイルスは、遺伝子導入用ベクタを含むアデノ随伴ウイルスであることを特徴とする。
【0011】
また、本発明の繊維状構造体は、上記記載の繊維状構造体において、上記繊維は、ポリ乳酸、ポリグリコール酸、ポリラクトン、ポリビニルアルコール、ナイロン、その他の化学繊維、絹、木綿、コラーゲン、ゼラチン、その他の天然繊維、または、磁性ナノワイヤ、その他の金属繊維であることを特徴とする。
【0012】
また、本発明の繊維状構造体は、上記記載の繊維状構造体において、上記繊維は、生体分解性を有することを特徴とする。
【0013】
また、本発明の繊維状構造体は、上記記載の繊維状構造体において、上記繊維は、糸状、網状、布状、球状、またはスポンジ状に成型されたことを特徴とする。
【0014】
また、本発明の繊維状構造体は、上記記載の繊維状構造体において、上記ヘパリンに、ラミニン、その他のヘパリン結合性接着分子、または、ケモカイン、その他のヘパリン結合性液性因子を結合させたことを特徴する。
【0015】
また、本発明の繊維状構造体は、上記記載の繊維状構造体において、上記繊維の直径は、0.1〜5000μmであることを特徴とする。
【0016】
また、本発明の繊維状構造体製造方法は、繊維にヘパリン結合処理を施す第一工程と、上記第一工程にてヘパリンが結合した上記繊維にウイルスを添加する第二工程と、上記第二工程にて上記ウイルスが添加された上記繊維を洗浄することにより、上記ヘパリンを介して上記ウイルスが結合した繊維状構造体を生成する第三工程と、を含むことを特徴とする。
【発明の効果】
【0017】
この発明の繊維状構造体によれば、繊維に、ウイルスとの結合親和性を有するヘパリンを結合させたので、特定部位において選択的に高効率にウイルスを導入することができる、という効果を奏する。具体的には、ウイルスはヘパリンを介して繊維状構造体に結合し、ウイルスが破壊されることなく安定した結合が長期間組織中で維持でき、繊維状構造体に接触した細胞が選択的にウイルスに感染するため、体内の特定部位において、選択的かつ効率的にウイルスを導入することが可能となる。また、体内(in vivo)に限らず、培養皿等の細胞培養系中(in vitro)の、特定部位(繊維状構造体に接触した特定の細胞)にウイルスを感染させるので、特定部位に選択的に目的遺伝子を発現させることが可能となる。
【0018】
また、本発明の繊維状構造体によれば、ウイルスは、遺伝子導入用ベクタを含むアデノ随伴ウイルスであるので、アデノ随伴ウイルスに感染しやすい細胞、例えば、神経細胞(ニューロン)に特異的に遺伝子を導入し、長期間安定して導入遺伝子を発現させることができる、という効果を奏する。
【0019】
また、本発明の繊維状構造体によれば、繊維は、ポリ乳酸、ポリグリコール酸、ポリラクトン、ポリビニルアルコール、ナイロン、その他の化学繊維、絹、木綿、コラーゲン、ゼラチン、その他の天然繊維、または、磁性ナノワイヤ、その他の金属繊維であるので、目的に応じて様々な繊維をウイルス導入のために適用することができる、という効果を奏する。
【0020】
また、本発明の繊維状構造体によれば、繊維は、生体分解性を有するので、体内での作用時間を自由に制御することができる、という効果を奏する。
【0021】
また、本発明の繊維状構造体によれば、繊維は、糸状、網状、布状、球状、またはスポンジ状に成型されるので、ウイルス導入対象の組織や細胞に応じて、適切な足場等を提供する等により、効率よくウイルスを導入することができる、という効果を奏する。
【0022】
また、本発明の繊維状構造体によれば、ヘパリンに、ラミニン、その他のヘパリン結合性接着分子、または、ケモカイン、その他のヘパリン結合性液性因子を結合させるので、液性因子等を使って、特定の細胞を誘引もしくは活性化、または、ラミニン等の接着因子で細胞を接着させる等により細胞とウイルスとの接触機会を増やして、ウイルスの感染効率を高めることが可能となる、という効果を奏する。
【0023】
また、本発明の繊維状構造体によれば、繊維の直径は、0.1〜5000μmであるので、細胞の接触に適切な大きさの繊維を用いて、効率よくウイルスを導入することができる、という効果を奏する。
【0024】
また、本発明の繊維状構造体製造方法によれば、繊維にヘパリン結合処理を施す第一工程と、第一工程にてヘパリンが結合した繊維にウイルスを添加する第二工程と、第二工程にてウイルスが添加された繊維を洗浄することにより、ヘパリンを介してウイルスが結合した繊維状構造体を生成する第三工程と、を含むので、特定部位において選択的に高効率にウイルスを導入することができる繊維状構造体を製造することができる、という効果を奏する。
【図面の簡単な説明】
【0025】
【図1】図1は、本発明の実施の形態の繊維状構造体の構造を一例として示す図である。
【図2】図2は、繊維状構造体の製造方法の一例を示すフローチャートである。
【図3】図3は、繊維状構造体を磁力により移動・局在化させる繊維状構造体注入制御システムを一例として示した図である。
【図4】図4は、293細胞上に置いたGFP/AAV2−ワイヤ複合体の写真図である。
【図5】図5は、FITCフィルタにより293細胞が発現したGFPの蛍光を観察した蛍光顕微鏡写真図である。
【図6】図6は、GFP/AAV2−ワイヤ複合体のワイヤ上のラット海馬ニューロンが発現したGFPの蛍光を観察した蛍光顕微鏡写真図である。
【発明を実施するための形態】
【0026】
以下に、本発明にかかる繊維状構造体の実施の形態を図面に基づいて詳細に説明する。なお、この実施の形態によりこの発明が限定されるものではない。特に、以下の実施の形態においては、本発明の繊維状構造体を、神経機能の改善等のために臨床応用した例について説明することがあるが、本実施の形態はこれに限られず、新たなドラッグデリバリーシステムや、新薬スクリーニングや脳機能解析等の基礎研究に用いてもよいものである。
【0027】
[本発明の実施の形態の概要]
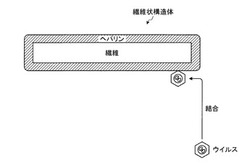
以下、本発明の実施の形態の概要について図1を参照して説明する。図1は、本発明の実施の形態の繊維状構造体の構造を一例として示す図である。
【0028】
図1に示すように、本発明の繊維状構造体は、合成繊維や天然繊維等の繊維(例えば、直径0.1〜5000μm)に、ウイルスとの結合親和性を有するヘパリンを結合させたことを特徴とする。ここで、ヘパリンに結合親和性を有するウイルスは、例えば、遺伝子導入用ベクタを含むアデノ随伴ウイルス(Adeno−associated virus)(以下「AAVウイルス」と呼ぶ。)であってもよい。AAVウイルスは、ヘパリン結合部位を有しているので、ウイルスを繊維状構造体に可逆的かつ強固に固定することができる。なお、これに限らず、ウイルスは、レトロウイルスやセンダイウイルスやアデノウイルス等であってもよい。また、遺伝子導入用のベクタは、治療効果が期待される外来遺伝子等の発現させたい遺伝子等に応じて自由に設計可能であるが、例えば、特定の細胞を誘引するケモカインや、特定の細胞を増殖させる栄養因子(GDNF、HGF等)、細胞外マトリックス、ラミニン、フィブロネクチン、NCAM、ネクチン、カドヘリン、ケモカイン、サイトカイン等の遺伝子をコードしたベクタが挙げられる。なお、ヘパリンは、ヘパリン様分子であってもよい。
【0029】
また、ここで、「繊維」とは、樹脂等の細長い構造体であって、例えば、ポリ乳酸(PLA)、ポリグリコール酸(PGA)、ポリラクトン、ポリビニルアルコール(PVA)、ナイロン等の化学繊維であってもよく、絹、木綿、コラーゲン、ゼラチン等の天然繊維であってもよく、磁性ナノワイヤ等の金属繊維であってもよい。金属繊維の材質としては、例えば、鉄、金、銅、鉛、ニッケル、白金等の金属が挙げられる。また、繊維は、生体分解性を有するものでもよく、例えば、構造体として体内で溶解する素材や糸(例えば、ポリビニルアルコール(PVA)、ポリ乳酸繊維、ポリグリコール酸繊維、コラーゲン繊維、ゼラチン)を用いることにより、体内での作用時間を自由に制御できるものでもよい。
【0030】
また、繊維は、糸状、網状、布状、球状、またはスポンジ状に成型されてもよい。例えば、繊維状構造体は、繊維を引き揃えて撚りをかけることにより糸状に成型したものでもよく、繊維を格子状に編み込むことにより網状に成型したものでもよく、繊維を、織機や編機等を用いて織物、編み物、レース、不織布等の布状に成型したものでもよく、ポリラクトンやポリ乳酸やゼラチンビーズやポリスチレン等を用いて球状やスポンジ状構造体に成型したものでもよい。
【0031】
また、このほか繊維状構造体の表面には、一例として、蛋白(接着分子、栄養因子、抗体、成長因子等)や、ホルモン、ペプチド、薬物、免疫抑制剤、有機化合物(薬物放出速度制御用物質、可視化用色素、蛍光色素、磁性体安定化薬)、遺伝子(ウイルスベクタ、DNA、RNA)、糖質、多糖類(ポリ乳酸など)、脂質、糖脂質、金属(白金、金、鉄、チタンなど、組織内での安全性・安定性・磁性制御用物質等)等を結合させてもよい。
【0032】
また、繊維状構造体上のヘパリンには、AAVウイルス等のウイルスの他に、ラミニン、その他のヘパリン結合性接着分子や、ケモカイン、その他のヘパリン結合性液性因子等を結合させてもよい。
【0033】
以上で、本発明の実施の形態の概要の説明を終える。
【0034】
[繊維状構造体の製造方法]
以下に、繊維状構造体の製造方法の一例について説明する。ここで、図2は、繊維状構造体の製造方法の一例を示すフローチャートである。
【0035】
図2に示すように、合成繊維や天然繊維や金属繊維等の繊維を準備する(ステップSA−1)。なお、繊維は、糸状、網状、布状、球状、またはスポンジ状に既に成型されたもの(例えば、市販の糸、布、手術糸等)でもよく、本ステップSA−1または以下のステップSA−2のヘパリン結合処理の後に成型(例えば、編機による編みこみ)を行ってもよい。
【0036】
そして、準備した繊維に対し、ヘパリン結合処理を行う(ステップSA−2)。ヘパリン結合処理としては、ヘパリンを有機化合物等に結合させる市販の試薬等を用いて化学処理により結合させる等の、公知のヘパリン結合処理手法を用いることができる。
【0037】
そして、ヘパリンを結合させた繊維に、AAVウイルスを添加する(ステップSA−3)。例えば、非特許文献1に記載のように、ヘパリンを結合させた繊維をカラムに入れ、ウイルス粗精製サンプルを添加することにより、ヘパリンを介してウイルスが結合した繊維状構造体を得ることができる。なお、AAVウイルスベクタの構築方法やウイルスの精製方法については、市販の試薬を用いる等により、非特許文献1等に記載の公知の手法で行うことができる。なお、AAVウイルスに限らず、AAVウイルス亜種やその他のウイルスについても、公知の手法を用いることにより同様にベクタ構築とウイルス精製が可能である。
【0038】
なお、任意の付加的事項として、ウイルス以外にも、ヘパリン結合性の接着分子(ラミニン等)、液性因子(ケモカイン等の誘導・栄養・刺激因子等)を添加することにより、ウイルスと混合して、ヘパリンに結合させてもよい。これにより、液性因子等を使って、特定の細胞を誘引もしくは活性化、または、ラミニン等の接着因子で細胞を接着させる等により細胞とウイルスとの接触機会を増やして、AAVウイルス等のウイルスの感染効率(遺伝子発現効率)を高めることが可能となる。
【0039】
なお、当該ステップSA−3において、接着分子や栄養因子等のヘパリン結合性タンパクを結合させない場合であっても、繊維状構造体表面にはウイルス未結合のヘパリン残基が存在しているので、繊維状構造体を脳内等の組織内に導入すれば、組織内のヘパリン結合性タンパクは速やかに結合することとなり、ウイルスの感染効率を高める効果がある。
【0040】
最後に、結合しなかったウイルスを洗浄し(ステップSA−4)、繊維状構造体を完成させる。以上が、繊維状構造体の製造方法の一例である。
【0041】
[繊維状構造体の注入方法]
つづいて、以上のように製造された繊維状構造体を、体内に注入する方法について説明する。
【0042】
(1.注射器またはカテーテルによる注入)
例えば、心臓カテーテル検査治療時に用いる場合、ステントとして構成した繊維状構造体(ヘパリンを介してAAVウイルス結合状態)を、心臓カテーテルを通して、血管狭窄部分に位置させる。なお、AAVウイルスのウイルスベクタには、血管狭窄を抑制するタンパク質がコードされており、当該タンパク質を持続的に発現させる(1ヶ月程度)。その後は、通常の血管拡張ステントとして機能する。
【0043】
また、固形ガン(肝臓、子宮、前立腺、肉腫、腎臓、卵巣、脳)治療に用いる場合、癌抑制遺伝子や転移抑制因子等を組み込んだウイルスを結合させた、線状あるいは球状の繊維状構造体を、注射器やカテーテル等を用いて、ガン組織内の複数場所に挿入する。
【0044】
(2.血管内への注入)
ウイルスを導入したい所望の特定部位が、ヘパリン結合性を有する細胞や組織等の場合には、注射器等を用いて血管内に注入することにより、選択的に遺伝子を発現させることができる。なお、繊維状構造体として体内で溶解する素材や糸(例えば、ポリビニルアルコール(PVA)、ポリ乳酸繊維、ポリグリコール酸繊維、コラーゲン繊維、ゼラチン)等を用いて、体内での作用時間を自由に制御してもよい。
【0045】
(3.磁力による移動・局在化)
繊維状構造体が、ナノワイヤ等の金属繊維などのように磁性体でできている場合、組織表面から繊維状構造体を磁力により移動・局在化させることも可能である。ここで、図3は、繊維状構造体を磁力により移動・局在化させる繊維状構造体注入制御システムを一例として示した図である。
【0046】
図3に示すように、繊維状構造体注入制御システムは、繊維状構造体注入装置100と磁場制御装置200により構成される。繊維状構造体注入装置100は、繊維状構造体の直径よりも大きな内径の孔を有し、光透過性のある非磁性体の管状の繊維状構造体充填用筒と、繊維状構造体充填用筒の先端付近の断面を横断する光を検出する光検出装置と、繊維状構造体充填用筒の孔の開閉制御を行うシャッタと、繊維状構造体充填用筒を装着してカートリッジ式に着脱できるように孔が形成された機構であるアプリケータから構成される。なお、繊維状構造体が繊維状構造体充填用筒の内側に固着しないように、人工脊髄液またはこれに滑剤を添加したものに繊維状構造体をサスペンドした状態で繊維状構造体充填用筒に充填してもよい。
【0047】
また、図3に示すように、磁場制御装置200は、誘導針50と、制御部60と、磁石70から構成される。ここで、磁石70は、繊維状構造体を誘導する磁場を発生させる磁場発生体である。また、誘導針50は、先端部分において、磁石70から発生された磁場による磁束密度を高める針であり、誘導針50先端で最も磁場を高める。また、制御部60は、磁石70と誘導針50との間の磁場を制御する制御部である。例えば、制御部60の磁性体部分が磁石70と誘導針50の間にある状態では、磁石70から発生した磁場を誘導針50に到達させるため、誘導針50の先端で強力な磁場が生じるが、制御部60の磁性体部分が磁場制御装置200の長軸方向に対して垂直方向にスライドして磁石70と誘導針50の間から離れると、磁石70から発生した磁場が誘導針50に到達しなくなるため、誘導針50の先端で磁場が発生しなくなる。これにより、誘導針50を組織から抜去あるいは除去する場合でも、誘導針50の先端で磁場が発生しないので、組織内を磁場勾配に従って移動してきた繊維状構造体の組織内の位置がずれることがなくなる。
【0048】
次に、このように構成された本実施の形態における繊維状構造体注入制御システムの処理の一例について、以下に説明を行う。まず、図3に示すように、予め、受傷部等の注入予定部位(脳や脊髄、肝臓、心臓、腎臓、腫瘍組織等の組織)の表面に繊維状構造体注入装置100のアプリケータおよびシャッタを接触させ、注入予定部位から繊維状構造体を移動させたい方向に応じて所望の位置に誘導針50を刺入ないし表面接触させておく。
【0049】
そして、所望の位置に設置された誘導針50に、制御部60を非誘導状態とした磁場制御装置200を結合させた後、制御部60を磁場誘導状態として、繊維状構造体を目的部位に配列させるために必要な磁場を発生させる。
【0050】
そして、シャッタを閉状態にした繊維状構造体注入装置100に繊維状構造体充填用筒を装着し、シャッタに接続されたコンピュータ等の制御により、繊維状構造体を格納した繊維状構造体充填用筒の孔を所望の位置で開状態とする。これにより、繊維状構造体は自ら組織に侵入して、磁場勾配に沿って目的部位に配列される。
【0051】
なお、繊維状構造体注入装置100の光検出装置により、繊維状構造体の注入状況はモニタリングされており、注入が完了したことを確認することができる。また、繊維状構造体の組織内の位置は、手術用CT・ナビゲータで確認してもよい。以上が、繊維状構造体注入制御システムにより、繊維状構造体を磁力により移動・局在化させる方法の一例である。
【0052】
(4.脳・脊髄組織への導入)
ヘパリンは、生体分子(多糖類)であり、特に腸管壁に多く存在し、蓄積毒性はない。また、ヘパリンは、脳内にも、ヘパラン硫酸など主にグリカンの形をとって大量に存在している。ヘパリンは、例えば脳塞栓患者に対する動脈内塞栓の溶解治療のため、血液凝固を抑制する薬物として日常臨床で広く使用されている。なお、脳塞栓患者では、脳血管関門(blood−brain−barrier)が破綻しているため、投与されたヘパリンは脳組織に浸透していくが、特記すべき脳障害は認められない。
【0053】
本繊維状構造体を脳・脊髄組織へ導入した場合、ヘパリンは脳内において、種々の接着分子(例えばラミニン)と安定に結合するので、脳内に投与されたヘパリンは速やかにラミニンなどのヘパリン結合性分子と結合すると考えられる。ウイルスを結合させていない繊維状構造体(ヘパリンを結合したワイヤ)を脳内に留置しても脳障害(麻痺や痙攣などの神経症状)が認められないこと、および、培養中の神経細胞に繊維状構造体を1ヶ月間暴露しても神経細胞は障害されないことが確認された(以下の実施例も参照のこと)。
【0054】
以上で、本実施の形態の説明を終える。
【0055】
[実施例]
つづいて、上述した実施の形態における実施例について、図4〜図6を参照して説明する。ここで、まず、本実施例の繊維状構造体が開発された背景について説明する。
【0056】
近年、遺伝子治療は将来の治療技術として期待されているが、遺伝子を組み込んだウイルス(ウイルスベクタ)を、標的臓器中の特定部位に正確かつ長期にわたって配列維持する方法は確立していなかった。
【0057】
ここで、現在までに、生体(in vivo)において検討されてきたウイルスベクタ投与方法として、以下のものがある。1)遺伝子を組み込んだウイルスを血管内に注入し、血流によって標的臓器に移行させる方法。2)標的臓器に注射器などで直接ウイルスを注入する方法。
【0058】
しかし、上述のいずれも非選択的かつ非効率なウイルス導入方法であり、特定部位のみにピンポイントでウイルスを配置させることは不可能であった。また、注入したウイルスは短時間で組織内に拡散していくため、特定部位にウイルスを長期にわたって高濃度で維持することは不可能であり、ウイルス感染効率は時間と共に低下していく、という問題があった。また、目的外の部位にウイルスが拡散していけば、予定しない細胞あるいは臓器に、ウイルス組み込み遺伝子が発現してしまい、予期せぬ副作用を招く危険があった。
【0059】
特に脳・脊髄組織を標的とする従来の遺伝子導入方法においては、神経組織の特定部位にのみウイルスベクタを一定の時間(数日〜数週間)高濃度に維持する方法はなかった。また、正確に標的部位に注射できたとしても、標的部位の周囲にウイルスが拡散していくために標的部位でのウイルス濃度が減少して効果発現が困難となる(治療効果の得られるほどの遺伝子発現を得にくい)という問題があった。特に、脳脊髄組織では、拡散による目的部位以外の場所でウイルスが発現すれば、重篤な神経障害や精神症状発生の危険が大きい、という問題があった。そのため、脳神経疾患において、ウイルスベクタを用いた臨床治療は困難なままであった。
【0060】
本実施例の繊維状構造体は、上記種々の問題点に鑑みて本願発明者らによる鋭意検討の結果開発されたものである。本実施例では、アデノ随伴ウイルス(adeno−associated virus)ベクタを使用する。AAVウイルスは、ヘパリン(ヘパラン硫酸などの多糖類)に対する受容体を有し、ヘパリン(ヘパラン硫酸などの多糖類)に高い結合親和性を有している。そのため、ヘパリンを構造体(金属ワイヤや糸(手術用糸等)などの線状構造体、あるいは球状構造体)に均一に結合させれば、ヘパリンが結合した構造物の表面に、AAVウイルスが活性を保持したまま安定結合することができる。このAAVウイルスは、ヘパリン結合構造体から脱落拡散することなく、長期間結合可能であり、例えば、水溶液(培養液)中に4週間放置してもAAVウイルスは構造体から脱落しないので、遺伝子発現ベクタを含むAAVウイルスがヘパリン結合構造体に結合した複合体は、目的臓器中の特定部位に正確かつ長期間局在させることが可能となる。
【0061】
AAVウイルスを利用することによって、1)神経細胞(ニューロン)への親和性(感染力)が高いこと(神経選択性)、2)グリア細胞にはほとんど発現しないこと、3)神経細胞(ニューロン)への障害や毒性が無いこと(現在までに報告は無い)、4)AAVウイルスを感染した神経細胞はウイルスベクタに組み込まれた外来遺伝子を長期にわたり安定して高い発現レベルを維持できること等の利点がある。なお、神経細胞に限らず、AAVウイルスへの受容体を発現するすべての細胞に応用可能である(腎臓、神経細胞、血管内皮細胞など)。また、ウイルスベクタに組み込む遺伝子の種類は目的に応じて任意であり制限はなく、いかなるAAVウイルス亜種においても使用できる。なお、以下の本実施例においては、遺伝子導入の確認のためGFP(Green Fluorescent Protein)を組み込んだAAV2ウイルスを用いた(AAV2ベクタに組み込み可能なサイズ2000bps以下)。
【0062】
また、繊維状構造体は、直径100μmのステンレスワイヤを基本骨格として、ヘパリンを化学処理により結合させたものを用いた。なお、本実施例では、ステンレスワイヤを手で網状に成型した。そして、この繊維状構造体に対し、上記のGFP発現ベクタを含むAAV2ウイルスを、ヘパリンを介して結合させた(以下、「GFP/AAV2−ワイヤ複合体」と呼ぶ)。ここで、図4は、293細胞上に置いたGFP/AAV2−ワイヤ複合体の写真図である。
【0063】
腎臓由来293細胞は、AAVウイルス感染効率が極めて高い細胞であり、低濃度のAAVウイルス条件であってもウイルスベクタを高い効率で増幅し発現する細胞であるため、AAVウイルスやウイルスベクタの複製・増幅に使用されている。本実施例では、293細胞を用いて、GFP/AAV2−ワイヤ複合体による遺伝子導入の効率を検証した。図4に示すように、293細胞は、培養皿全面にコンフルエントな状態で敷き詰め、この上にGFP/AAV2−ワイヤ複合体を置き、2週間培養した。なお、GFP/AAV2−ワイヤ複合体は、磁性を有するので磁石で培養皿に固定した。培養後、GFPを発現した293細胞の緑色蛍光を観察した。ここで、図5は、FITCフィルタにより293細胞が発現したGFPの蛍光を観察した蛍光顕微鏡写真図である。
【0064】
図5に示すように、GFP/AAV2−ワイヤ複合体のワイヤ網に接着した細胞のみが緑色蛍光を示していた。すなわち、ワイヤ網に接着しなかった細胞では、GFP遺伝子は発現しておらず、このことは、AAV2ウイルスが培養中、ワイヤ網に持続的に結合しており、培養液中に溶出しなかったことを証明するものである。また、この結果は、AAV2ウイルスがワイヤ表面において生物活性(ウイルスベクタ組み込み遺伝子の発現)を保持したまま結合していることを示している。なお、図5の写真右下に、ワイヤから少し離れた場所の細胞が緑色蛍光を発しているが、これはワイヤとの接触後に細胞が移動したものと考察される。
【0065】
つづいて、腎臓由来293細胞以外での感染能力を確かめるために、移植ニューロン感染シミュレーションを行った。このシミュレーションでは、GFP遺伝子を組み込んだウイルスベクタを含むAAV2ウイルス溶液中に、ヘパリンを結合させた磁性ワイヤを浸し、AAV2ウイルスをワイヤに結合させた繊維状構造体(GFP/AAV2−ワイヤ複合体)を用いた。
【0066】
そして、ラット海馬ニューロンを、GFP/AAV2−ワイヤ複合体のワイヤ上に載せて、14日間培養し、蛍光顕微鏡にてGFPの観察を行った。ここで、図6は、GFP/AAV2−ワイヤ複合体のワイヤ上のラット海馬ニューロンが発現したGFPの蛍光を観察した蛍光顕微鏡写真図である。
【0067】
図6に示すように、神経細胞(ニューロン)の細胞体や神経線維が緑色蛍光を発しており、GFP遺伝子が神経細胞でも発現したことがわかる。また、神経細胞の形態異常は認められず、神経細胞への毒性は無いと考察された。また、別の実験にて、ワイヤ上に神経細胞の一部でも接触(コンタクト)すれば、神経細胞全体においてGFP蛍光が認められることも明らかになった。すなわち、もし、AAVウイルス受容体を発現する細胞(神経細胞など)とAAVウイルスが一部でも接触すれば、AAVウイルスはワイヤを離れて、活性を保持したまま細胞内に取り込まれ、ウイルスベクタに組み込まれた遺伝子を発現することが明らかになった。以上が、本実施例による実験結果である。
【0068】
以上、本実施例によれば、目的遺伝子の発現ベクタを組み込んだAAVウイルスを、脳脊髄組織等の特定部位に正確に配置することにより、特定部位のみにおいて外来遺伝子を発現させて治療効果を発揮させることができる。また、ウイルスの持つ外来遺伝子発現活性を維持しつつ(ウイルスの生物活性を維持しつつ)、AAVウイルスを磁性ワイヤに安定・長期間結合することができ、AAVウイルスが結合した磁性ワイヤに接触した細胞(神経細胞など)がAAVウイルスを細胞内に効率よく取り込み、AAVウイルスベクタに組み込まれた外来遺伝子(例として、GFP)を高い効率で発現させることができる。なお、実施例で用いた磁性ワイヤに接着した神経細胞への急性毒性は認められず、組織内(液体中)でのウイルス粒子の拡散も認められなかったので、目的部位に高濃度でAAVウイルスが留まり、標的神経細胞以外へのウイルス暴露が最小限となること(予期せぬ副作用の防止)が期待できる。
【0069】
[他の実施の形態]
さて、これまで本発明の実施の形態について説明したが、本発明は、上述した実施の形態以外にも、特許請求の範囲に記載した技術的思想の範囲内において種々の異なる実施の形態にて実施されてよいものである。
【0070】
例えば、実施の形態において説明した各処理のうち、自動的に行われるものとして説明した処理の全部または一部を手動的に行うこともでき、あるいは、手動的に行われるものとして説明した処理の全部または一部を公知の方法で自動的に行うこともできる。
【0071】
このほか、上記文献中や図面中で示した処理手順、制御手順、具体的名称、各処理の登録データ等のパラメータを含む情報、画面例については、特記する場合を除いて任意に変更することができる。また、図示の各構成要素は、機能概念的なものであり、必ずしも物理的に図示の如く構成されていることを要しない。
【0072】
更に、装置の分散・統合の具体的形態は図示するものに限られず、その全部または一部を、各種の付加等に応じて、または、機能負荷に応じて、任意の単位で機能的または物理的に分散・統合して構成することができる。すなわち、上述した実施形態を任意に組み合わせて実施してもよく、実施形態を選択的に実施してもよい。
【産業上の利用可能性】
【0073】
以上詳述に説明したように、本発明の繊維状構造体および繊維状構造体製造方法によれば、特定部位において選択的に高効率にウイルスを導入することができる繊維状構造体および繊維状構造体製造方法を提供することができるので、医療や製薬や創薬や生物学研究、ナノテクノロジーや臨床検査などの様々な分野において極めて有用である。
【符号の説明】
【0074】
100 繊維状構造体注入装置
200 磁場制御装置
50 誘導針
60 制御部
70 磁石
【技術分野】
【0001】
本発明は、繊維状構造体、および、繊維状構造体製造方法に関する。
【背景技術】
【0002】
従来、遺伝子を組み込んだウイルスを用いて、標的となる細胞や組織、臓器等に、遺伝子を発現させる遺伝子導入方法が開発されている。
【0003】
例えば、遺伝子を組み込んだウイルスを、血管内に注入して血流によって標的臓器に移行させる方法や、注射器等で直接、標的臓器にウイルスを注入する方法などが開発されている。
【0004】
ここで、非特許文献1には、ヘパリンを結合させたカラムに、アデノ随伴ウイルスの粗精製サンプルを添加することにより、高精製のアデノ随伴ウイルスを調製する方法が開示されている。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】E Burova and E Ioffe,“Chromatographic purification of recombinant adenoviral and adeno−associated viral vectors: methods and implications”,Gene Therapy (2005) 12, p5−p17
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかしながら、従来の遺伝子導入方法では、ウイルス注入部位をある程度コントロールできるものの、注入されたウイルスは短時間で体内を拡散していくため、非選択的で非効率な遺伝子導入方法であった。
【0007】
すなわち、非特許文献1に記載のように高精製のウイルスを調製しても、体内の特定部位において、希釈されずに高濃度でウイルスを安定的に局在させ、高効率にウイルスを導入する方法はなかった。
【0008】
本発明は、上記問題点に鑑みてなされたもので、特定部位に選択的に高効率にウイルスを導入することができる繊維状構造体、および、繊維状構造体製造方法を提供することを目的とする。
【課題を解決するための手段】
【0009】
このような目的を達成するため、本発明の繊維状構造体は、繊維に、ウイルスとの結合親和性を有するヘパリンを結合させたことを特徴とする。
【0010】
また、本発明の繊維状構造体は、上記記載の繊維状構造体において、上記ウイルスは、遺伝子導入用ベクタを含むアデノ随伴ウイルスであることを特徴とする。
【0011】
また、本発明の繊維状構造体は、上記記載の繊維状構造体において、上記繊維は、ポリ乳酸、ポリグリコール酸、ポリラクトン、ポリビニルアルコール、ナイロン、その他の化学繊維、絹、木綿、コラーゲン、ゼラチン、その他の天然繊維、または、磁性ナノワイヤ、その他の金属繊維であることを特徴とする。
【0012】
また、本発明の繊維状構造体は、上記記載の繊維状構造体において、上記繊維は、生体分解性を有することを特徴とする。
【0013】
また、本発明の繊維状構造体は、上記記載の繊維状構造体において、上記繊維は、糸状、網状、布状、球状、またはスポンジ状に成型されたことを特徴とする。
【0014】
また、本発明の繊維状構造体は、上記記載の繊維状構造体において、上記ヘパリンに、ラミニン、その他のヘパリン結合性接着分子、または、ケモカイン、その他のヘパリン結合性液性因子を結合させたことを特徴する。
【0015】
また、本発明の繊維状構造体は、上記記載の繊維状構造体において、上記繊維の直径は、0.1〜5000μmであることを特徴とする。
【0016】
また、本発明の繊維状構造体製造方法は、繊維にヘパリン結合処理を施す第一工程と、上記第一工程にてヘパリンが結合した上記繊維にウイルスを添加する第二工程と、上記第二工程にて上記ウイルスが添加された上記繊維を洗浄することにより、上記ヘパリンを介して上記ウイルスが結合した繊維状構造体を生成する第三工程と、を含むことを特徴とする。
【発明の効果】
【0017】
この発明の繊維状構造体によれば、繊維に、ウイルスとの結合親和性を有するヘパリンを結合させたので、特定部位において選択的に高効率にウイルスを導入することができる、という効果を奏する。具体的には、ウイルスはヘパリンを介して繊維状構造体に結合し、ウイルスが破壊されることなく安定した結合が長期間組織中で維持でき、繊維状構造体に接触した細胞が選択的にウイルスに感染するため、体内の特定部位において、選択的かつ効率的にウイルスを導入することが可能となる。また、体内(in vivo)に限らず、培養皿等の細胞培養系中(in vitro)の、特定部位(繊維状構造体に接触した特定の細胞)にウイルスを感染させるので、特定部位に選択的に目的遺伝子を発現させることが可能となる。
【0018】
また、本発明の繊維状構造体によれば、ウイルスは、遺伝子導入用ベクタを含むアデノ随伴ウイルスであるので、アデノ随伴ウイルスに感染しやすい細胞、例えば、神経細胞(ニューロン)に特異的に遺伝子を導入し、長期間安定して導入遺伝子を発現させることができる、という効果を奏する。
【0019】
また、本発明の繊維状構造体によれば、繊維は、ポリ乳酸、ポリグリコール酸、ポリラクトン、ポリビニルアルコール、ナイロン、その他の化学繊維、絹、木綿、コラーゲン、ゼラチン、その他の天然繊維、または、磁性ナノワイヤ、その他の金属繊維であるので、目的に応じて様々な繊維をウイルス導入のために適用することができる、という効果を奏する。
【0020】
また、本発明の繊維状構造体によれば、繊維は、生体分解性を有するので、体内での作用時間を自由に制御することができる、という効果を奏する。
【0021】
また、本発明の繊維状構造体によれば、繊維は、糸状、網状、布状、球状、またはスポンジ状に成型されるので、ウイルス導入対象の組織や細胞に応じて、適切な足場等を提供する等により、効率よくウイルスを導入することができる、という効果を奏する。
【0022】
また、本発明の繊維状構造体によれば、ヘパリンに、ラミニン、その他のヘパリン結合性接着分子、または、ケモカイン、その他のヘパリン結合性液性因子を結合させるので、液性因子等を使って、特定の細胞を誘引もしくは活性化、または、ラミニン等の接着因子で細胞を接着させる等により細胞とウイルスとの接触機会を増やして、ウイルスの感染効率を高めることが可能となる、という効果を奏する。
【0023】
また、本発明の繊維状構造体によれば、繊維の直径は、0.1〜5000μmであるので、細胞の接触に適切な大きさの繊維を用いて、効率よくウイルスを導入することができる、という効果を奏する。
【0024】
また、本発明の繊維状構造体製造方法によれば、繊維にヘパリン結合処理を施す第一工程と、第一工程にてヘパリンが結合した繊維にウイルスを添加する第二工程と、第二工程にてウイルスが添加された繊維を洗浄することにより、ヘパリンを介してウイルスが結合した繊維状構造体を生成する第三工程と、を含むので、特定部位において選択的に高効率にウイルスを導入することができる繊維状構造体を製造することができる、という効果を奏する。
【図面の簡単な説明】
【0025】
【図1】図1は、本発明の実施の形態の繊維状構造体の構造を一例として示す図である。
【図2】図2は、繊維状構造体の製造方法の一例を示すフローチャートである。
【図3】図3は、繊維状構造体を磁力により移動・局在化させる繊維状構造体注入制御システムを一例として示した図である。
【図4】図4は、293細胞上に置いたGFP/AAV2−ワイヤ複合体の写真図である。
【図5】図5は、FITCフィルタにより293細胞が発現したGFPの蛍光を観察した蛍光顕微鏡写真図である。
【図6】図6は、GFP/AAV2−ワイヤ複合体のワイヤ上のラット海馬ニューロンが発現したGFPの蛍光を観察した蛍光顕微鏡写真図である。
【発明を実施するための形態】
【0026】
以下に、本発明にかかる繊維状構造体の実施の形態を図面に基づいて詳細に説明する。なお、この実施の形態によりこの発明が限定されるものではない。特に、以下の実施の形態においては、本発明の繊維状構造体を、神経機能の改善等のために臨床応用した例について説明することがあるが、本実施の形態はこれに限られず、新たなドラッグデリバリーシステムや、新薬スクリーニングや脳機能解析等の基礎研究に用いてもよいものである。
【0027】
[本発明の実施の形態の概要]
以下、本発明の実施の形態の概要について図1を参照して説明する。図1は、本発明の実施の形態の繊維状構造体の構造を一例として示す図である。
【0028】
図1に示すように、本発明の繊維状構造体は、合成繊維や天然繊維等の繊維(例えば、直径0.1〜5000μm)に、ウイルスとの結合親和性を有するヘパリンを結合させたことを特徴とする。ここで、ヘパリンに結合親和性を有するウイルスは、例えば、遺伝子導入用ベクタを含むアデノ随伴ウイルス(Adeno−associated virus)(以下「AAVウイルス」と呼ぶ。)であってもよい。AAVウイルスは、ヘパリン結合部位を有しているので、ウイルスを繊維状構造体に可逆的かつ強固に固定することができる。なお、これに限らず、ウイルスは、レトロウイルスやセンダイウイルスやアデノウイルス等であってもよい。また、遺伝子導入用のベクタは、治療効果が期待される外来遺伝子等の発現させたい遺伝子等に応じて自由に設計可能であるが、例えば、特定の細胞を誘引するケモカインや、特定の細胞を増殖させる栄養因子(GDNF、HGF等)、細胞外マトリックス、ラミニン、フィブロネクチン、NCAM、ネクチン、カドヘリン、ケモカイン、サイトカイン等の遺伝子をコードしたベクタが挙げられる。なお、ヘパリンは、ヘパリン様分子であってもよい。
【0029】
また、ここで、「繊維」とは、樹脂等の細長い構造体であって、例えば、ポリ乳酸(PLA)、ポリグリコール酸(PGA)、ポリラクトン、ポリビニルアルコール(PVA)、ナイロン等の化学繊維であってもよく、絹、木綿、コラーゲン、ゼラチン等の天然繊維であってもよく、磁性ナノワイヤ等の金属繊維であってもよい。金属繊維の材質としては、例えば、鉄、金、銅、鉛、ニッケル、白金等の金属が挙げられる。また、繊維は、生体分解性を有するものでもよく、例えば、構造体として体内で溶解する素材や糸(例えば、ポリビニルアルコール(PVA)、ポリ乳酸繊維、ポリグリコール酸繊維、コラーゲン繊維、ゼラチン)を用いることにより、体内での作用時間を自由に制御できるものでもよい。
【0030】
また、繊維は、糸状、網状、布状、球状、またはスポンジ状に成型されてもよい。例えば、繊維状構造体は、繊維を引き揃えて撚りをかけることにより糸状に成型したものでもよく、繊維を格子状に編み込むことにより網状に成型したものでもよく、繊維を、織機や編機等を用いて織物、編み物、レース、不織布等の布状に成型したものでもよく、ポリラクトンやポリ乳酸やゼラチンビーズやポリスチレン等を用いて球状やスポンジ状構造体に成型したものでもよい。
【0031】
また、このほか繊維状構造体の表面には、一例として、蛋白(接着分子、栄養因子、抗体、成長因子等)や、ホルモン、ペプチド、薬物、免疫抑制剤、有機化合物(薬物放出速度制御用物質、可視化用色素、蛍光色素、磁性体安定化薬)、遺伝子(ウイルスベクタ、DNA、RNA)、糖質、多糖類(ポリ乳酸など)、脂質、糖脂質、金属(白金、金、鉄、チタンなど、組織内での安全性・安定性・磁性制御用物質等)等を結合させてもよい。
【0032】
また、繊維状構造体上のヘパリンには、AAVウイルス等のウイルスの他に、ラミニン、その他のヘパリン結合性接着分子や、ケモカイン、その他のヘパリン結合性液性因子等を結合させてもよい。
【0033】
以上で、本発明の実施の形態の概要の説明を終える。
【0034】
[繊維状構造体の製造方法]
以下に、繊維状構造体の製造方法の一例について説明する。ここで、図2は、繊維状構造体の製造方法の一例を示すフローチャートである。
【0035】
図2に示すように、合成繊維や天然繊維や金属繊維等の繊維を準備する(ステップSA−1)。なお、繊維は、糸状、網状、布状、球状、またはスポンジ状に既に成型されたもの(例えば、市販の糸、布、手術糸等)でもよく、本ステップSA−1または以下のステップSA−2のヘパリン結合処理の後に成型(例えば、編機による編みこみ)を行ってもよい。
【0036】
そして、準備した繊維に対し、ヘパリン結合処理を行う(ステップSA−2)。ヘパリン結合処理としては、ヘパリンを有機化合物等に結合させる市販の試薬等を用いて化学処理により結合させる等の、公知のヘパリン結合処理手法を用いることができる。
【0037】
そして、ヘパリンを結合させた繊維に、AAVウイルスを添加する(ステップSA−3)。例えば、非特許文献1に記載のように、ヘパリンを結合させた繊維をカラムに入れ、ウイルス粗精製サンプルを添加することにより、ヘパリンを介してウイルスが結合した繊維状構造体を得ることができる。なお、AAVウイルスベクタの構築方法やウイルスの精製方法については、市販の試薬を用いる等により、非特許文献1等に記載の公知の手法で行うことができる。なお、AAVウイルスに限らず、AAVウイルス亜種やその他のウイルスについても、公知の手法を用いることにより同様にベクタ構築とウイルス精製が可能である。
【0038】
なお、任意の付加的事項として、ウイルス以外にも、ヘパリン結合性の接着分子(ラミニン等)、液性因子(ケモカイン等の誘導・栄養・刺激因子等)を添加することにより、ウイルスと混合して、ヘパリンに結合させてもよい。これにより、液性因子等を使って、特定の細胞を誘引もしくは活性化、または、ラミニン等の接着因子で細胞を接着させる等により細胞とウイルスとの接触機会を増やして、AAVウイルス等のウイルスの感染効率(遺伝子発現効率)を高めることが可能となる。
【0039】
なお、当該ステップSA−3において、接着分子や栄養因子等のヘパリン結合性タンパクを結合させない場合であっても、繊維状構造体表面にはウイルス未結合のヘパリン残基が存在しているので、繊維状構造体を脳内等の組織内に導入すれば、組織内のヘパリン結合性タンパクは速やかに結合することとなり、ウイルスの感染効率を高める効果がある。
【0040】
最後に、結合しなかったウイルスを洗浄し(ステップSA−4)、繊維状構造体を完成させる。以上が、繊維状構造体の製造方法の一例である。
【0041】
[繊維状構造体の注入方法]
つづいて、以上のように製造された繊維状構造体を、体内に注入する方法について説明する。
【0042】
(1.注射器またはカテーテルによる注入)
例えば、心臓カテーテル検査治療時に用いる場合、ステントとして構成した繊維状構造体(ヘパリンを介してAAVウイルス結合状態)を、心臓カテーテルを通して、血管狭窄部分に位置させる。なお、AAVウイルスのウイルスベクタには、血管狭窄を抑制するタンパク質がコードされており、当該タンパク質を持続的に発現させる(1ヶ月程度)。その後は、通常の血管拡張ステントとして機能する。
【0043】
また、固形ガン(肝臓、子宮、前立腺、肉腫、腎臓、卵巣、脳)治療に用いる場合、癌抑制遺伝子や転移抑制因子等を組み込んだウイルスを結合させた、線状あるいは球状の繊維状構造体を、注射器やカテーテル等を用いて、ガン組織内の複数場所に挿入する。
【0044】
(2.血管内への注入)
ウイルスを導入したい所望の特定部位が、ヘパリン結合性を有する細胞や組織等の場合には、注射器等を用いて血管内に注入することにより、選択的に遺伝子を発現させることができる。なお、繊維状構造体として体内で溶解する素材や糸(例えば、ポリビニルアルコール(PVA)、ポリ乳酸繊維、ポリグリコール酸繊維、コラーゲン繊維、ゼラチン)等を用いて、体内での作用時間を自由に制御してもよい。
【0045】
(3.磁力による移動・局在化)
繊維状構造体が、ナノワイヤ等の金属繊維などのように磁性体でできている場合、組織表面から繊維状構造体を磁力により移動・局在化させることも可能である。ここで、図3は、繊維状構造体を磁力により移動・局在化させる繊維状構造体注入制御システムを一例として示した図である。
【0046】
図3に示すように、繊維状構造体注入制御システムは、繊維状構造体注入装置100と磁場制御装置200により構成される。繊維状構造体注入装置100は、繊維状構造体の直径よりも大きな内径の孔を有し、光透過性のある非磁性体の管状の繊維状構造体充填用筒と、繊維状構造体充填用筒の先端付近の断面を横断する光を検出する光検出装置と、繊維状構造体充填用筒の孔の開閉制御を行うシャッタと、繊維状構造体充填用筒を装着してカートリッジ式に着脱できるように孔が形成された機構であるアプリケータから構成される。なお、繊維状構造体が繊維状構造体充填用筒の内側に固着しないように、人工脊髄液またはこれに滑剤を添加したものに繊維状構造体をサスペンドした状態で繊維状構造体充填用筒に充填してもよい。
【0047】
また、図3に示すように、磁場制御装置200は、誘導針50と、制御部60と、磁石70から構成される。ここで、磁石70は、繊維状構造体を誘導する磁場を発生させる磁場発生体である。また、誘導針50は、先端部分において、磁石70から発生された磁場による磁束密度を高める針であり、誘導針50先端で最も磁場を高める。また、制御部60は、磁石70と誘導針50との間の磁場を制御する制御部である。例えば、制御部60の磁性体部分が磁石70と誘導針50の間にある状態では、磁石70から発生した磁場を誘導針50に到達させるため、誘導針50の先端で強力な磁場が生じるが、制御部60の磁性体部分が磁場制御装置200の長軸方向に対して垂直方向にスライドして磁石70と誘導針50の間から離れると、磁石70から発生した磁場が誘導針50に到達しなくなるため、誘導針50の先端で磁場が発生しなくなる。これにより、誘導針50を組織から抜去あるいは除去する場合でも、誘導針50の先端で磁場が発生しないので、組織内を磁場勾配に従って移動してきた繊維状構造体の組織内の位置がずれることがなくなる。
【0048】
次に、このように構成された本実施の形態における繊維状構造体注入制御システムの処理の一例について、以下に説明を行う。まず、図3に示すように、予め、受傷部等の注入予定部位(脳や脊髄、肝臓、心臓、腎臓、腫瘍組織等の組織)の表面に繊維状構造体注入装置100のアプリケータおよびシャッタを接触させ、注入予定部位から繊維状構造体を移動させたい方向に応じて所望の位置に誘導針50を刺入ないし表面接触させておく。
【0049】
そして、所望の位置に設置された誘導針50に、制御部60を非誘導状態とした磁場制御装置200を結合させた後、制御部60を磁場誘導状態として、繊維状構造体を目的部位に配列させるために必要な磁場を発生させる。
【0050】
そして、シャッタを閉状態にした繊維状構造体注入装置100に繊維状構造体充填用筒を装着し、シャッタに接続されたコンピュータ等の制御により、繊維状構造体を格納した繊維状構造体充填用筒の孔を所望の位置で開状態とする。これにより、繊維状構造体は自ら組織に侵入して、磁場勾配に沿って目的部位に配列される。
【0051】
なお、繊維状構造体注入装置100の光検出装置により、繊維状構造体の注入状況はモニタリングされており、注入が完了したことを確認することができる。また、繊維状構造体の組織内の位置は、手術用CT・ナビゲータで確認してもよい。以上が、繊維状構造体注入制御システムにより、繊維状構造体を磁力により移動・局在化させる方法の一例である。
【0052】
(4.脳・脊髄組織への導入)
ヘパリンは、生体分子(多糖類)であり、特に腸管壁に多く存在し、蓄積毒性はない。また、ヘパリンは、脳内にも、ヘパラン硫酸など主にグリカンの形をとって大量に存在している。ヘパリンは、例えば脳塞栓患者に対する動脈内塞栓の溶解治療のため、血液凝固を抑制する薬物として日常臨床で広く使用されている。なお、脳塞栓患者では、脳血管関門(blood−brain−barrier)が破綻しているため、投与されたヘパリンは脳組織に浸透していくが、特記すべき脳障害は認められない。
【0053】
本繊維状構造体を脳・脊髄組織へ導入した場合、ヘパリンは脳内において、種々の接着分子(例えばラミニン)と安定に結合するので、脳内に投与されたヘパリンは速やかにラミニンなどのヘパリン結合性分子と結合すると考えられる。ウイルスを結合させていない繊維状構造体(ヘパリンを結合したワイヤ)を脳内に留置しても脳障害(麻痺や痙攣などの神経症状)が認められないこと、および、培養中の神経細胞に繊維状構造体を1ヶ月間暴露しても神経細胞は障害されないことが確認された(以下の実施例も参照のこと)。
【0054】
以上で、本実施の形態の説明を終える。
【0055】
[実施例]
つづいて、上述した実施の形態における実施例について、図4〜図6を参照して説明する。ここで、まず、本実施例の繊維状構造体が開発された背景について説明する。
【0056】
近年、遺伝子治療は将来の治療技術として期待されているが、遺伝子を組み込んだウイルス(ウイルスベクタ)を、標的臓器中の特定部位に正確かつ長期にわたって配列維持する方法は確立していなかった。
【0057】
ここで、現在までに、生体(in vivo)において検討されてきたウイルスベクタ投与方法として、以下のものがある。1)遺伝子を組み込んだウイルスを血管内に注入し、血流によって標的臓器に移行させる方法。2)標的臓器に注射器などで直接ウイルスを注入する方法。
【0058】
しかし、上述のいずれも非選択的かつ非効率なウイルス導入方法であり、特定部位のみにピンポイントでウイルスを配置させることは不可能であった。また、注入したウイルスは短時間で組織内に拡散していくため、特定部位にウイルスを長期にわたって高濃度で維持することは不可能であり、ウイルス感染効率は時間と共に低下していく、という問題があった。また、目的外の部位にウイルスが拡散していけば、予定しない細胞あるいは臓器に、ウイルス組み込み遺伝子が発現してしまい、予期せぬ副作用を招く危険があった。
【0059】
特に脳・脊髄組織を標的とする従来の遺伝子導入方法においては、神経組織の特定部位にのみウイルスベクタを一定の時間(数日〜数週間)高濃度に維持する方法はなかった。また、正確に標的部位に注射できたとしても、標的部位の周囲にウイルスが拡散していくために標的部位でのウイルス濃度が減少して効果発現が困難となる(治療効果の得られるほどの遺伝子発現を得にくい)という問題があった。特に、脳脊髄組織では、拡散による目的部位以外の場所でウイルスが発現すれば、重篤な神経障害や精神症状発生の危険が大きい、という問題があった。そのため、脳神経疾患において、ウイルスベクタを用いた臨床治療は困難なままであった。
【0060】
本実施例の繊維状構造体は、上記種々の問題点に鑑みて本願発明者らによる鋭意検討の結果開発されたものである。本実施例では、アデノ随伴ウイルス(adeno−associated virus)ベクタを使用する。AAVウイルスは、ヘパリン(ヘパラン硫酸などの多糖類)に対する受容体を有し、ヘパリン(ヘパラン硫酸などの多糖類)に高い結合親和性を有している。そのため、ヘパリンを構造体(金属ワイヤや糸(手術用糸等)などの線状構造体、あるいは球状構造体)に均一に結合させれば、ヘパリンが結合した構造物の表面に、AAVウイルスが活性を保持したまま安定結合することができる。このAAVウイルスは、ヘパリン結合構造体から脱落拡散することなく、長期間結合可能であり、例えば、水溶液(培養液)中に4週間放置してもAAVウイルスは構造体から脱落しないので、遺伝子発現ベクタを含むAAVウイルスがヘパリン結合構造体に結合した複合体は、目的臓器中の特定部位に正確かつ長期間局在させることが可能となる。
【0061】
AAVウイルスを利用することによって、1)神経細胞(ニューロン)への親和性(感染力)が高いこと(神経選択性)、2)グリア細胞にはほとんど発現しないこと、3)神経細胞(ニューロン)への障害や毒性が無いこと(現在までに報告は無い)、4)AAVウイルスを感染した神経細胞はウイルスベクタに組み込まれた外来遺伝子を長期にわたり安定して高い発現レベルを維持できること等の利点がある。なお、神経細胞に限らず、AAVウイルスへの受容体を発現するすべての細胞に応用可能である(腎臓、神経細胞、血管内皮細胞など)。また、ウイルスベクタに組み込む遺伝子の種類は目的に応じて任意であり制限はなく、いかなるAAVウイルス亜種においても使用できる。なお、以下の本実施例においては、遺伝子導入の確認のためGFP(Green Fluorescent Protein)を組み込んだAAV2ウイルスを用いた(AAV2ベクタに組み込み可能なサイズ2000bps以下)。
【0062】
また、繊維状構造体は、直径100μmのステンレスワイヤを基本骨格として、ヘパリンを化学処理により結合させたものを用いた。なお、本実施例では、ステンレスワイヤを手で網状に成型した。そして、この繊維状構造体に対し、上記のGFP発現ベクタを含むAAV2ウイルスを、ヘパリンを介して結合させた(以下、「GFP/AAV2−ワイヤ複合体」と呼ぶ)。ここで、図4は、293細胞上に置いたGFP/AAV2−ワイヤ複合体の写真図である。
【0063】
腎臓由来293細胞は、AAVウイルス感染効率が極めて高い細胞であり、低濃度のAAVウイルス条件であってもウイルスベクタを高い効率で増幅し発現する細胞であるため、AAVウイルスやウイルスベクタの複製・増幅に使用されている。本実施例では、293細胞を用いて、GFP/AAV2−ワイヤ複合体による遺伝子導入の効率を検証した。図4に示すように、293細胞は、培養皿全面にコンフルエントな状態で敷き詰め、この上にGFP/AAV2−ワイヤ複合体を置き、2週間培養した。なお、GFP/AAV2−ワイヤ複合体は、磁性を有するので磁石で培養皿に固定した。培養後、GFPを発現した293細胞の緑色蛍光を観察した。ここで、図5は、FITCフィルタにより293細胞が発現したGFPの蛍光を観察した蛍光顕微鏡写真図である。
【0064】
図5に示すように、GFP/AAV2−ワイヤ複合体のワイヤ網に接着した細胞のみが緑色蛍光を示していた。すなわち、ワイヤ網に接着しなかった細胞では、GFP遺伝子は発現しておらず、このことは、AAV2ウイルスが培養中、ワイヤ網に持続的に結合しており、培養液中に溶出しなかったことを証明するものである。また、この結果は、AAV2ウイルスがワイヤ表面において生物活性(ウイルスベクタ組み込み遺伝子の発現)を保持したまま結合していることを示している。なお、図5の写真右下に、ワイヤから少し離れた場所の細胞が緑色蛍光を発しているが、これはワイヤとの接触後に細胞が移動したものと考察される。
【0065】
つづいて、腎臓由来293細胞以外での感染能力を確かめるために、移植ニューロン感染シミュレーションを行った。このシミュレーションでは、GFP遺伝子を組み込んだウイルスベクタを含むAAV2ウイルス溶液中に、ヘパリンを結合させた磁性ワイヤを浸し、AAV2ウイルスをワイヤに結合させた繊維状構造体(GFP/AAV2−ワイヤ複合体)を用いた。
【0066】
そして、ラット海馬ニューロンを、GFP/AAV2−ワイヤ複合体のワイヤ上に載せて、14日間培養し、蛍光顕微鏡にてGFPの観察を行った。ここで、図6は、GFP/AAV2−ワイヤ複合体のワイヤ上のラット海馬ニューロンが発現したGFPの蛍光を観察した蛍光顕微鏡写真図である。
【0067】
図6に示すように、神経細胞(ニューロン)の細胞体や神経線維が緑色蛍光を発しており、GFP遺伝子が神経細胞でも発現したことがわかる。また、神経細胞の形態異常は認められず、神経細胞への毒性は無いと考察された。また、別の実験にて、ワイヤ上に神経細胞の一部でも接触(コンタクト)すれば、神経細胞全体においてGFP蛍光が認められることも明らかになった。すなわち、もし、AAVウイルス受容体を発現する細胞(神経細胞など)とAAVウイルスが一部でも接触すれば、AAVウイルスはワイヤを離れて、活性を保持したまま細胞内に取り込まれ、ウイルスベクタに組み込まれた遺伝子を発現することが明らかになった。以上が、本実施例による実験結果である。
【0068】
以上、本実施例によれば、目的遺伝子の発現ベクタを組み込んだAAVウイルスを、脳脊髄組織等の特定部位に正確に配置することにより、特定部位のみにおいて外来遺伝子を発現させて治療効果を発揮させることができる。また、ウイルスの持つ外来遺伝子発現活性を維持しつつ(ウイルスの生物活性を維持しつつ)、AAVウイルスを磁性ワイヤに安定・長期間結合することができ、AAVウイルスが結合した磁性ワイヤに接触した細胞(神経細胞など)がAAVウイルスを細胞内に効率よく取り込み、AAVウイルスベクタに組み込まれた外来遺伝子(例として、GFP)を高い効率で発現させることができる。なお、実施例で用いた磁性ワイヤに接着した神経細胞への急性毒性は認められず、組織内(液体中)でのウイルス粒子の拡散も認められなかったので、目的部位に高濃度でAAVウイルスが留まり、標的神経細胞以外へのウイルス暴露が最小限となること(予期せぬ副作用の防止)が期待できる。
【0069】
[他の実施の形態]
さて、これまで本発明の実施の形態について説明したが、本発明は、上述した実施の形態以外にも、特許請求の範囲に記載した技術的思想の範囲内において種々の異なる実施の形態にて実施されてよいものである。
【0070】
例えば、実施の形態において説明した各処理のうち、自動的に行われるものとして説明した処理の全部または一部を手動的に行うこともでき、あるいは、手動的に行われるものとして説明した処理の全部または一部を公知の方法で自動的に行うこともできる。
【0071】
このほか、上記文献中や図面中で示した処理手順、制御手順、具体的名称、各処理の登録データ等のパラメータを含む情報、画面例については、特記する場合を除いて任意に変更することができる。また、図示の各構成要素は、機能概念的なものであり、必ずしも物理的に図示の如く構成されていることを要しない。
【0072】
更に、装置の分散・統合の具体的形態は図示するものに限られず、その全部または一部を、各種の付加等に応じて、または、機能負荷に応じて、任意の単位で機能的または物理的に分散・統合して構成することができる。すなわち、上述した実施形態を任意に組み合わせて実施してもよく、実施形態を選択的に実施してもよい。
【産業上の利用可能性】
【0073】
以上詳述に説明したように、本発明の繊維状構造体および繊維状構造体製造方法によれば、特定部位において選択的に高効率にウイルスを導入することができる繊維状構造体および繊維状構造体製造方法を提供することができるので、医療や製薬や創薬や生物学研究、ナノテクノロジーや臨床検査などの様々な分野において極めて有用である。
【符号の説明】
【0074】
100 繊維状構造体注入装置
200 磁場制御装置
50 誘導針
60 制御部
70 磁石
【特許請求の範囲】
【請求項1】
繊維に、ウイルスとの結合親和性を有するヘパリンを結合させたことを特徴とする繊維状構造体。
【請求項2】
請求項1に記載の繊維状構造体において、
上記ウイルスは、遺伝子導入用ベクタを含むアデノ随伴ウイルスであることを特徴とする繊維状構造体。
【請求項3】
請求項1または2に記載の繊維状構造体において、
上記繊維は、ポリ乳酸、ポリグリコール酸、ポリラクトン、ポリビニルアルコール、ナイロン、その他の化学繊維、絹、木綿、コラーゲン、ゼラチン、その他の天然繊維、または、磁性ナノワイヤ、その他の金属繊維であることを特徴とする繊維状構造体。
【請求項4】
請求項1または2に記載の繊維状構造体において、
上記繊維は、生体分解性を有することを特徴とする繊維状構造体。
【請求項5】
請求項1乃至4のいずれか一つに記載の繊維状構造体において、
上記繊維は、糸状、網状、布状、球状、またはスポンジ状に成型されたことを特徴とする繊維状構造体。
【請求項6】
請求項1乃至5のいずれか一つに記載の繊維状構造体において、
上記ヘパリンに、ラミニン、その他のヘパリン結合性接着分子、または、ケモカイン、その他のヘパリン結合性液性因子を結合させたことを特徴する繊維状構造体。
【請求項7】
請求項1乃至6のいずれか一つに記載の繊維状構造体において、
上記繊維の直径は、0.1〜5000μmであることを特徴とする繊維状構造体。
【請求項8】
繊維にヘパリン結合処理を施す第一工程と、
上記第一工程にてヘパリンが結合した上記繊維にウイルスを添加する第二工程と、
上記第二工程にて上記ウイルスが添加された上記繊維を洗浄することにより、上記ヘパリンを介して上記ウイルスが結合した繊維状構造体を生成する第三工程と、
を含むことを特徴とする繊維状構造体製造方法。
【請求項1】
繊維に、ウイルスとの結合親和性を有するヘパリンを結合させたことを特徴とする繊維状構造体。
【請求項2】
請求項1に記載の繊維状構造体において、
上記ウイルスは、遺伝子導入用ベクタを含むアデノ随伴ウイルスであることを特徴とする繊維状構造体。
【請求項3】
請求項1または2に記載の繊維状構造体において、
上記繊維は、ポリ乳酸、ポリグリコール酸、ポリラクトン、ポリビニルアルコール、ナイロン、その他の化学繊維、絹、木綿、コラーゲン、ゼラチン、その他の天然繊維、または、磁性ナノワイヤ、その他の金属繊維であることを特徴とする繊維状構造体。
【請求項4】
請求項1または2に記載の繊維状構造体において、
上記繊維は、生体分解性を有することを特徴とする繊維状構造体。
【請求項5】
請求項1乃至4のいずれか一つに記載の繊維状構造体において、
上記繊維は、糸状、網状、布状、球状、またはスポンジ状に成型されたことを特徴とする繊維状構造体。
【請求項6】
請求項1乃至5のいずれか一つに記載の繊維状構造体において、
上記ヘパリンに、ラミニン、その他のヘパリン結合性接着分子、または、ケモカイン、その他のヘパリン結合性液性因子を結合させたことを特徴する繊維状構造体。
【請求項7】
請求項1乃至6のいずれか一つに記載の繊維状構造体において、
上記繊維の直径は、0.1〜5000μmであることを特徴とする繊維状構造体。
【請求項8】
繊維にヘパリン結合処理を施す第一工程と、
上記第一工程にてヘパリンが結合した上記繊維にウイルスを添加する第二工程と、
上記第二工程にて上記ウイルスが添加された上記繊維を洗浄することにより、上記ヘパリンを介して上記ウイルスが結合した繊維状構造体を生成する第三工程と、
を含むことを特徴とする繊維状構造体製造方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2011−201793(P2011−201793A)
【公開日】平成23年10月13日(2011.10.13)
【国際特許分類】
【出願番号】特願2010−68869(P2010−68869)
【出願日】平成22年3月24日(2010.3.24)
【出願人】(504136993)独立行政法人国立病院機構 (37)
【Fターム(参考)】
【公開日】平成23年10月13日(2011.10.13)
【国際特許分類】
【出願日】平成22年3月24日(2010.3.24)
【出願人】(504136993)独立行政法人国立病院機構 (37)
【Fターム(参考)】
[ Back to top ]

