脂肪の減少のための方法および関連組成物
【課題】脂肪吸引のような外科的な手技を必要としないで、下眼瞼脂肪ヘルニア、脂肪異栄養、セルライトに関連した格子状の脂肪沈着物を含む局所的な脂肪の蓄積を処置する組成物の提供。
【解決手段】デオキシコール酸塩、コール酸塩、ケノデオキシコール酸塩、7-α-デヒドロキシレート(dehydroxylate)塩、ケノデオキシコール酸塩、リトコール酸塩、ウルソデオキシコール酸塩、ジヒドロキシ胆汁酸塩、およびトリヒドロキシ胆汁酸塩からなる群より選択される薬理活性胆汁酸塩のような薬理活性界面活性剤を含有する組成物。更に、該組成物は、抗炎症剤、鎮痛剤、分散剤または浸透増強剤を含み得る。
【解決手段】デオキシコール酸塩、コール酸塩、ケノデオキシコール酸塩、7-α-デヒドロキシレート(dehydroxylate)塩、ケノデオキシコール酸塩、リトコール酸塩、ウルソデオキシコール酸塩、ジヒドロキシ胆汁酸塩、およびトリヒドロキシ胆汁酸塩からなる群より選択される薬理活性胆汁酸塩のような薬理活性界面活性剤を含有する組成物。更に、該組成物は、抗炎症剤、鎮痛剤、分散剤または浸透増強剤を含み得る。
【発明の詳細な説明】
【技術分野】
【0001】
発明の領域
本発明は、局所的な脂肪蓄積の非外科的な除去に有用な組成物および方法に関する。特に、本発明は、外科的介入の必要のない、脂肪除去を必要とする患者の処置部位へと直接注射するのに適している、薬理活性界面活性剤組成物に関する。なお、本願は、参照により本明細書に完全に組み入れられる2004年5月19日出願の米国仮出願第60/572,879号に基づく優先権を主張する。
【背景技術】
【0002】
発明の背景
文末に括弧内に出現する数字は、本明細書の末尾部分に引用された特定の参照をさす。
【0003】
ホスファチジルコリンおよび胆汁酸塩を含有している製剤(ホスファチジルコリン胆汁酸塩製剤、PBF)は、局所的な脂肪蓄積を処置するために利用されることが増えてきている(1〜8)。いくつかの非盲検臨床研究は、下眼瞼脂肪ヘルニアおよび「バッファロー瘤」脂肪異栄養を含む局所的な脂肪蓄積の処置のため、PBFの注射を使用して、有望な結果を報告した(1〜3)。
【0004】
ホスファチジルコリンは、細胞膜の必須成分であり、正常な細胞膜の組成および修復にとって重要な天然リン脂質である。ホスファチジルコリンは、必須栄養素コリンの主要な輸送形態でもある。コリン自体は、神経伝達物質アセチルコリン、メチル供与体ベタイン、ならびに、とりわけホスファチジルコリンおよびスフィンゴミエリンを含むリン脂質の合成における前駆物質である。ホスファチジルコリンは、超低密度リポタンパク質の肝臓搬出にも関与している。
【0005】
胆汁酸塩は、ホスファチジルコリンの水溶性を改良するため、そしてより最近では、アンホテリシンB、Taxol(登録商標)、およびジアゼパムのような薬の水溶性を改良するため、使用されている(9〜14)。高度に精製されたホスファチジルコリンは、迅速に滅菌され、静脈内投与のため使用され得る安定な混合ミセル調製物が形成されるよう、二次胆汁酸塩であるデオキシコール酸ナトリウム、抗微生物薬、ベンジルアルコール、および水と組み合わせられ得る(12)。Essentiale(登録商標)およびLipostabil(登録商標)として公知のこの混合物の薬学的調製物は、それぞれ肝疾患および高脂血症の処置のため他の国々で販売されている(12、15)。
【0006】
Rittesが、皮下脂肪へのPBFの注射が、眼窩下脂肪ヘルニアを減少させることを最初に報告した(1)。それ以来、医師らは、下眼瞼脂肪ヘルニア、ならびに大腿、腹部、背部上部、顎、および腕の脂肪沈着物を処置するために、薬学的調製物または類似の調合PBFを使用してきた(2、3、5)。これらのPBFは、Essentiale(登録商標)およびLipostabil(登録商標)において様々に見出されるdl-α-トコフェロール(ビタミンE)、ビタミンB、およびアデノシン一リン酸をしばしば欠いている(2、16)。
【0007】
ホスファチジルコリン製剤は、局所的な灼熱感、紅斑、一過性のじん麻疹、および様々な程度のそう痒に関連しているが、これらは全て一般的に数日で消散する。潰瘍形成および疼痛という、より重篤な結果も見られている。ある患者の大腿においては、複数回のホスファチジルコリン注射の部位における感染性肉芽腫反応が報告された(7)。注射されるホスファチジルコリンの増加した投薬量は、大用量のLipostabil(登録商標)の経口製剤および静脈内製剤で見られる平行した副作用を有しており、悪心、下痢、腹痛、および失神を含む。
【0008】
ホスファチジルコリンを含有している製剤が、皮下脂肪沈着物の減少を引き起こすメカニズムは未知であるが、いくつかのメカニズムが提唱されている(4)。第一は、ホスファチジルコリンが、リパーゼ活性を刺激することにより、脂肪細胞のサイズを減少させ得るというものである。または、PBFは脂肪細胞の細胞膜を乳化する界面活性剤として機能するという仮説が立てられている。界面活性剤は、特に、硬化療法において一般的に使用される硬化剤として、数十年間、医学において使用されてきた(American College of Phlebology,2003)。界面活性剤は、界面における表面張力を減少させることにより不溶性物質の乳化を促進する、独特の極性化学特性および無極性化学特性を保有している(17)。実際、Triton(登録商標)X-100およびEmpigen(登録商標)BBのような実験用界面活性剤は、細胞膜の脂質二重層を破壊するために一般的に使用されている(10、18〜21)。PBFの二つの主成分であるホスファチジルコリンおよびデオキシコール酸ナトリウムは、これらの独特の化学特性を有しており、従って、界面活性剤または乳化剤として独立に使用されている(9、18、20〜25)。
【0009】
外観を改良するための外科的および非外科的な手技は、集団が加齢し、体重を増すにつれ、普及率が増加した。脂肪吸引は、最も人気のある美容外科手技のうちの一つであり、吸引を使用し、任意で、脂肪除去を補助する溶液によって補助された、脂肪沈着物の外科的な除去を含む。脂肪形成術または吸引脂肪組織切除としても公知の脂肪吸引は、カニューレが挿入された皮膚内の切開部を通して脂肪を除去する外科的手技である。カニューレが吸引源に接続され、不要な脂肪がカニューレを通して吸い出され、廃棄される。脂肪吸引は、除去すべき脂肪の量および位置に依って、全身麻酔または局所麻酔の下で実施される。
【0010】
脂肪吸引の最も一般的に使用されている型は、塩、麻酔剤、および血管収縮剤の混合物を含有している医用溶液が、脂肪組織の吸い出しの前に処置部位へと注入される、液体注射方法論をさらに使用する。その医用溶液は、脂肪がより容易に除去されるのを助け、失血を減少させ、術中および術後の麻酔を提供する。
【0011】
脂肪吸引のための補助溶液の一例として、CapellaおよびCapellaによって1997年4月22日に出願され、1999年4月6日に米国特許第5,891,083号として発行された米国特許は、皮下脂肪を除去するための脂肪吸引および改良された外科的手技のための化合物を含有している担体溶液を教示している。一つの態様において、Capella特許は、化合物が、酵素、特にリパーゼまたはコリパーゼであることを開示している。酵素は、脂肪分解溶液を提供するため、生理食塩水溶液のような担体に添加される。その発明のもう一つの態様において、Capellaは、胆汁酸塩のような乳化剤も、組み合わせられて、または溶液に添加される主要な活性化合物として、有益であるかもしれないことを教示している。Capella発明の全ての態様において、脂肪分解溶液は、溶液が脂肪組織に浸潤することを可能にするため、脂肪吸引の前に、一定期間、投与される。Capellaにおいては、身体から脂肪を除去するための非外科的な手段としての脂肪分解溶液単独の使用は全く開示されていない。Capellaにおいて開示された全ての例および特定の態様において、脂肪吸引が脂肪除去のための外科的手技として使用されており、リパーゼおよび胆汁酸塩は脂肪吸引のための補助剤として提供されている。
【0012】
しかしながら、脂肪吸引およびその他の外科的な脂肪除去法は、一時的な挫傷形成、膨潤、無感覚、圧痛、および灼熱感、感染のリスク、色素沈着の変化;肺に移動し死を引き起こし得る脂肪塊もしくは血塊の形成、ショックに至るかもしれない過度の体液喪失または排液されなければならない体液蓄積、摩擦熱傷もしくはその他の皮膚もしくは神経の傷害、または生命に関わる器官の穿孔傷を含む、重大な有害事象に関連している。さらに、脂肪吸引は、患者が働くことができないか、またはある種の日々の活動を成し遂げることができない、1〜2週間の回復時間を必要とする。さらに、脂肪吸引のような外科的手技は、局所麻酔、時には全身麻酔を必要とするため、重大な麻酔関連リスクが外科的な脂肪除去には関連している。
【0013】
従って、手術または長期の回復時間を必要とせず、現在利用可能な方法より少ない有害副作用を有している、局所的な脂肪蓄積を除去する方法を有することが、望ましいであろう。
【発明の概要】
【0014】
本発明は、皮下脂肪沈着物を減少させるための方法およびキットを提供する。一つの局面において、本発明は、手術の使用なしに哺乳動物における皮下脂肪沈着物を減少させるための、薬理活性界面活性剤および5%w/v未満のホスファチジルコリンを含む第一の容器、ならびに説明書を有するキットを企図する。好ましくは、本明細書中のキットは、例えば、ヒト、ウマ、イヌ、またはネコのような多様な哺乳動物において脂肪沈着物を減少させるために使用され得る。いくつかの態様において、哺乳動物はヒトである。
【0015】
いくつかの好ましい態様において、第一の容器は、500ml未満の全容量を有し、かつ/または注射可能製剤として提供される。その他の好ましい態様において、第一の容器は、ホスファチジルコリンの%w/vより大きい%w/vの界面活性剤を含有しているかもしれないし、またはホスファチジルコリンを含有していないかもしれない。一つの好ましい態様において、本発明は、その臨界ミセル濃度(CMC)を超える濃度の界面活性剤を提供する。キットは、例えば、親油性界面活性剤、親水性界面活性剤、イオン界面活性剤、非イオン界面活性剤、グリセリド、胆汁酸塩、および両性イオン界面活性剤のような多様な薬理活性界面活性剤を含み得る。より好ましい態様において、活性界面活性剤は胆汁酸塩であり、最も好ましくはデオキシコール酸ナトリウムである。本明細書中のキットの中の第一の容器は、いくつかの態様において、3g未満の界面活性剤を含む。その他の態様において、本明細書中のキットの中の第一の容器は、0.0002g超の界面活性剤を含み得る。本明細書中のいずれの態様においても、第一の容器は、第二の界面活性剤をさらに含み得る。
【0016】
好ましくは、第一の容器は、例えば、抗微生物剤、血管収縮剤、抗血栓剤、抗凝固剤、起泡抑制剤、抗炎症剤、鎮痛剤、分散剤、抗分散剤、浸透増強剤、ステロイド、精神安定剤、筋弛緩剤、および止痢剤のような第二の治療剤をさらに含み得る。いくつかの態様において、第二の治療剤は、鎮痛剤、抗微生物剤、または抗炎症剤である。より好ましくは、第二の治療剤は鎮痛剤であり、または最も好ましくはリドカインである。もう一つの態様において、キットは、本明細書に記載されるような第二の治療剤を含む第二の容器を提供する。
【0017】
本発明の一つの態様は、哺乳動物の目、顎、または腕の下、および殿部、腓、背部、大腿、足首、または胃部の脂肪沈着物を減少させるための本明細書中のキットを企図する。もう一つの態様において、キットは、例えば、眼瞼脂肪ヘルニア、脂肪腫、脂肪異栄養、バッファロー瘤脂肪異栄養、またはセルライトに関連した脂肪沈着物のような特定の型の脂肪沈着物を減少させ得る。
【0018】
第二の局面において、本発明は、有効量の薬理活性界面活性剤および5%w/v未満のホスファチジルコリンを含む単位用量を投与することにより、手術なしに、哺乳動物における皮下脂肪沈着物を減少させる方法を提供する。一つの態様において、その方法は、界面活性剤を積極的に除去する工程を含まない。その方法は、本明細書に記載されるような多様な哺乳動物において脂肪沈着物を減少させるために使用され得る。
【0019】
もう一つの態様において、その方法は、有効量の界面活性剤および5%w/v未満のホスファチジルコリンを含む溶液500ml未満を投与する工程を含む。いくつかの好ましい態様において、単位用量は局所投与され、かつ/または少なくとも2回繰り返される。その他の好ましい態様において、単位用量は、ホスファチジルコリンの%w/vより大きい%w/vの界面活性剤を有し、かつ/またはそのCMCを超える濃度の界面活性剤を有する。その方法は、本明細書に記載されるような多様な薬理活性界面活性剤を使用し得る。より好ましい態様において、単位用量の中の活性界面活性剤は、胆汁酸塩であり、最も好ましくはデオキシコール酸ナトリウムである。
【0020】
好ましくは、本明細書中の方法は、第二の界面活性剤および/または第二の治療剤の投与をさらに含み得る。その方法は、本明細書に記載されるような多様な第二の治療剤の投与を含み得る。より好ましくは、第二の治療剤は、鎮痛剤であり、最も好ましくはリドカインである。
【0021】
他の一つの態様は、哺乳動物の目、顎、または腕の下、および殿部、腓、背部、大腿、足首、または胃部の脂肪沈着物を減少させるための、本明細書に記載された一つまたは複数の方法を企図する。もう一つの態様において、その方法は、例えば、眼瞼脂肪ヘルニア、脂肪腫、脂肪異栄養、バッファロー瘤脂肪異栄養、またはセルライトに関連した脂肪沈着物のような特定の型の脂肪沈着物を減少させ得る。
【図面の簡単な説明】
【0022】
【図1】(a)ホスファチジルコリン、(b)デオキシコール酸ナトリウム、および(c)ベンジルアルコールの分子構造を示す。
【図2】本発明の教示による培養細胞生存率に対するホスファチジルコリン胆汁製剤(PC処方、PBF)およびデオキシコール酸ナトリウム単独の効果を示す:(a)PC処方およびデオキシコール酸ナトリウム単独に曝されたケラチノサイトの生存率を測定するMTSアッセイ;(b)PC処方およびデオキシコール酸ナトリウム単独に曝された細胞によるLDH放出を測定する乳酸デヒドロゲナーゼ(LDH)アッセイ。
【図3】本発明の教示による初代ブタ脂肪組織に対するPBFおよびデオキシコール酸ナトリウム単独の効果を示す:(a)陰性対照としてのPBS緩衝液(-対照)、デオキシコール酸ナトリウム単独(DC)、PBF(PC)、および陽性対照としてのTriton(登録商標)界面活性剤(+対照)で処置された脂肪標本における、生存細胞を示す紫色素を生ずるMTSアッセイ;(b)異なる処置間の脂肪細胞生存率の比較。
【図4】本発明の教示によるデオキシコール酸ナトリウム単独(DC)、PBF(PC)、陽性対照としてのTriton(登録商標)界面活性剤(+対照)、および陰性対照としてのPBS緩衝液(-対照)で処置された脂肪標本におけるカルセイン蛍光を示す。
【図5】(a)対照脂肪細胞および(b)PBF注射後の脂肪細胞(H&E、元の拡大率、×20);(c)対照脂肪細胞および(d)デオキシコール酸ナトリウム単独の注射後の脂肪細胞(H&E、元の拡大率、×10);(e)対照筋肉および(f)ホスファチジルコリン単独の注射後の筋肉(H&E、元の拡大率、×10);(g)Empigen(登録商標)界面活性剤の注射後の脂肪(H&E、元の拡大率、×20)を明らかにする、本発明の教示に従って作成された組成物による処置後のブタ皮膚生検試料の光学顕微鏡検を示す。
【図6】本発明の教示によるデオキシコール酸の注射の2日後に患者から除去された脂肪腫を示す:(a)肉眼的病理学および(b)組織学(H&E、元の拡大率、×20)。
【図7】皮下脂肪蓄積を減少させるためのキットを示す。
【発明を実施するための形態】
【0023】
発明の詳細な説明
本発明は、脂肪を可溶化する濃度の一つまたは複数の界面活性剤を含む薬学的に許容される製剤の投与によって脂肪沈着物を減少させる非外科的な方法を提供することにより、哺乳動物における局所的な脂肪蓄積の問題を解決する。
【0024】
ホスファチジルコリンの胆汁中の乳化剤としての役割、および高脂血症の処置におけるその使用に基づき、ホスファチジルコリンがPBF中の活性成分であるとの仮説が立てられている(1、2、21、25、27)。これらの先行技術の組成物の中の胆汁酸塩のような界面活性剤は、推定活性成分であるPCを分散または可溶化するためだけに添加された。しかしながら、現在まで、この理論を支持する報告は発表されていない。本発明者らは、予想外にも、実際には、胆汁酸塩が局所的な脂肪の乳化のための活性薬剤であることを証明した。
【0025】
文末に括弧内に出現する数字は、本明細書の末尾部分に引用された特定の参照をさす。本明細書において引用された参照は、全て、参照により全ての目的のため完全に本明細書に組み入れられる。
【0026】
ホスファチジルコリンは、細胞膜の必須成分であり、正常な細胞膜の組成および修復にとって重要な天然リン脂質である。ホスファチジルコリンは、必須栄養素コリンの主要な輸送形態でもある。コリン自体は、神経伝達物質アセチルコリン、メチル供与体ベタイン、ならびに、とりわけホスファチジルコリンおよびスフィンゴミエリンを含むリン脂質の合成における前駆物質である。ホスファチジルコリンは、超低密度リポタンパク質の肝臓搬出にも関与している。
【0027】
胆汁酸塩は、ホスファチジルコリンの水溶性を改良するため、そしてより最近では、アンホテリシンB、Taxol(商標)、およびジアゼパムのような薬の水溶性を改良するため、使用されている(9〜14)。高度に精製されたホスファチジルコリンは、迅速に滅菌され、静脈内投与のため使用され得る安定な混合ミセル調製物が形成されるよう、二次胆汁酸塩デオキシコール酸ナトリウム、抗微生物薬、ベンジルアルコール、および水と組み合わせられ得る(12)。Essentiale(登録商標)およびLipostabil(登録商標)として公知のこの混合物の薬学的調製物は、それぞれ肝疾患および高脂血症の処置のため他の国々で販売されている(12、15)。
【0028】
医師らは、下眼瞼脂肪ヘルニア、ならびに大腿、腹部、背部上部、顎、および腕の脂肪沈着物を処置するために、薬学的調製物または類似の調合PBFを使用してきた(2、3、5)。これらのPBFは、Essentiale(登録商標)およびLipostabil(登録商標)において様々に見出されるdl-α-トコフェロール(ビタミンE)、ビタミンB、およびアデノシン一リン酸をしばしば欠いている(2、16)。
【0029】
脂肪吸引は、最も人気のある美容外科手技のうちの一つであり、吸引を使用し、任意で、脂肪除去を補助する溶液によって補助された、脂肪沈着物の外科的な除去を含む。脂肪形成術または吸引脂肪組織切除としても公知の脂肪吸引は、カニューレが挿入された皮膚内の切開部を通して脂肪を減少させる外科的手技である。カニューレが吸引源に接続され、不要な脂肪がカニューレを通して吸い出され、廃棄される。脂肪吸引は、除去すべき脂肪の量および位置に依って、全身麻酔または局所麻酔の下で実施される。そのような注入は、多量の溶液からなり、しばしば脂肪吸引手技の前または途中に患者から引き出される。特許第5,891,083号を参照のこと。
【0030】
脂肪吸引および/またはその他の外科的な脂肪除去法の使用は、一時的な挫傷形成、膨潤、無感覚、圧痛、および灼熱感、感染のリスク、色素沈着の変化;肺に移動し死を引き起こし得る脂肪塊もしくは血塊の形成、ショックに至るかもしれない過度の体液喪失もしくは排液されなければならない体液蓄積、摩擦熱傷もしくはその他の皮膚もしくは神経の傷害、または生命に関わる器官への穿孔傷を含む重大な有害事象に関連している。さらに、脂肪吸引は、患者が働くことができないか、またはある種の日々の活動を成し遂げることができない、1〜2週間の回復時間を必要とする。さらに、脂肪吸引のような外科的手技は、局所麻酔、時には全身麻酔を必要とするため、重大な麻酔関連リスクが外科的な脂肪除去には関連している。
【0031】
従来の技術および組成物は、ある程度の成功を果たしているが、ある種の制限に遭遇している。従って、手術または長期の回復時間を必要とせず、現在利用可能な方法より少ない有害副作用を有している、局所的な脂肪蓄積を減少させる方法を有することが、望ましいであろう。
【0032】
本発明は、標的部位へとそのような製剤を局所投与することにより、哺乳動物における皮下脂肪蓄積を減少させるための、一つまたは複数の薬理活性界面活性剤(例えば、胆汁酸塩)の使用に関する。
【0033】
界面活性剤の中でも、胆汁酸塩は、特に強力な脂質二重膜の可溶化剤である(9、20、21、23、28)。全ての生物学的細胞膜は、同じ二重脂質(bilipid)構造から構成されており、従って、界面活性剤による可溶化を受ける(10、19、34)。界面活性剤による細胞膜の可溶化は、脂質二重層の間への界面活性剤の分配、二重層の不安定化、崩壊、およびその後の(界面活性剤および細胞膜脂質から構成された)混合ミセルの形成を含む(10、19、21)。胆汁酸塩およびその他の界面活性剤は、非混和性材料の境界における表面張力を低下させ、大きな凝集物のより小さい粒子への分解を可能にする。組織において、これらの薬剤は、細胞膜を溶解させ、細胞溶解を引き起こす。炎症応答が起こり、界面活性剤により可溶化された材料が身体によって除去される。
【0034】
この理由のため、本発明者らは、細胞生存率を測定する単純な定量的アッセイを使用して、デオキシコール酸ナトリウムを完全PBFと比較した(図2a)。ホスファチジルコリンは、胆汁酸塩のような物質と組み合わせない限り、水性溶液に不溶性であるため、純粋なホスファチジルコリンを単離し試験することは不可能である(12)。ホスファチジルコリンは、エタノール、メタノール、クロロホルム、およびその他の有機溶媒に高度に可溶性であるが、これらの薬剤は脂質二重層に傷害を与える場合がある(29〜31)。予備実験において、純粋な単離されたPCと、それを溶解させるために使用されたエタノールとの間に、細胞溶解および組織学の差は存在しなかった。PC処方の成分のうちの一つであるベンジルアルコールは、細胞膜の流動性に影響を与えることが示されているが、それは界面活性剤ではなく、従って、処方中のその限定された量は、細胞膜に対して無視し得る程度の溶解効果しか及ぼさない(32、33)。
【0035】
無傷の組織への浸透が限定因子である可能性が高いため、細胞培養物を使用して、細胞に影響を与えるのに必要な試薬(PBFおよびデオキシコール酸塩)の希釈率を決定した。デオキシコール酸は、完全PBFにほぼ等しい培養細胞の生存率を大きく減少させた(図2a)。この所見は、ブタ脂肪をPBFおよびデオキシコール酸塩に曝すことにより、組織において再現された(図3)。これらの結果は、デオキシコール酸ナトリウムがPBFの中で主要な活性な役割を果たしているという予想外の観察を支持している。
【0036】
本発明は、皮下脂肪沈着物を減少させるための、細胞膜を破壊する界面活性剤の作用の使用に基づく。培養細胞における膜溶解を、乳酸デヒドロゲナーゼ(LDH)アッセイを使用して測定し、組織における膜溶解を、無傷の細胞膜を有する細胞において保持される蛍光マーカーであるカルセインを使用して測定した。LDHアッセイは、細胞が溶解した場合に放出されるサイトゾル酵素であるLDHの活性を測定する。PBFで処置された細胞培養物およびデオキシコール酸塩で処置された細胞培養物は、いずれも、細胞溶解の濃度依存的な増加を示した(図2b)。さらに、これらの薬剤で処置された培養細胞において観察された直接的な溶解効果は、内因性リパーゼと無関係の活性を示唆している。カルセインは、PBF、デオキシコール酸塩、および公知の実験用界面活性剤であるTriton(登録商標)X-100に曝された脂肪標本において失われた(図4)。この所見は、PBFに曝された新鮮な組織においても、デオキシコール酸塩に曝された新鮮な組織においても、細胞膜の破壊が起こることを確認した。
【0037】
細胞培養物においてPBFの効果をデオキシコール酸塩と比較したところ、デオキシコール酸は、類似した細胞生存率の欠損を引き起こすが、より少ない細胞溶解を引き起こすという驚くべき結果が得られた。これらの差は濃度依存性であるかもしれないし、または処方内にはホスファチジルコリンとデオキシコール酸との相乗効果が存在するのかもしれない。にも関わらず、データは、臨床的に使用されているものに類似した濃度で、デオキシコール酸およびPBFが、組織の組織学および細胞生存率に対して類似した効果を及ぼすことを証明している。総合すると、これらのデータは、予想外にも、デオキシコール酸が、先行技術のPBFの中の活性成分として作用していることを証明している。
【0038】
組織の組織学に対する界面活性剤の効果を例示するため、新鮮なブタ皮膚に、PBF、デオキシコール酸塩、およびよく特徴決定されている実験用界面活性剤を注射した(図5)。全ての試薬が、PBS注射(対照)と比較して有意な脂肪細胞組織化の破壊を引き起こした。これらの結果は、筋肉および結合組織においても同様に観察された。テスト物質による細胞境界の急速な溶解、およびよく特徴決定されている界面活性剤とのそれらの効果の類似性は、PBFおよびデオキシコール酸塩が界面活性剤として機能していることを実証している。この実験モデルの限界は、生存組織への注射後に起こる真の結果を明らかにしていないということである。紅斑および浮腫として顕在化する活発な炎症応答が注射後に起こることは、臨床報告から明白である(1〜3)。反復的な炎症は、特に複数回の注射の後、繊維症を引き起こす可能性がある。繊維症は、PBF投与後に注射部位に堅い結節を発症した数人の患者において報告されており、それらは最終的には数ヶ月かけて消散した(35)。
【0039】
組織学的所見は、注射可能なPBFおよびデオキシコール酸塩単独が、脂肪および筋肉においては機構破壊を引き起こすが、表皮、真皮、または付属器には明白な影響を及ぼさないことを明らかにしている(図5)。しかしながら、強力な実験用界面活性剤であるEmpigen(登録商標)BBは、皮膚コラーゲン(結合組織)に対して顕著な組織学的効果を及ぼした。または、脂肪および筋肉は、(臨床実務において使用されているものに類似している)試験された濃度において、これらの他の構造より界面活性剤処置に対する感受性が高いのかもしれない。
【0040】
新鮮な組織標本および細胞培養物を利用した一連の実験室における実験を通して、本発明者らは、脂肪溶解のための皮下注射において頻用されている先行技術PBFが、主として、細胞膜の非特異的な溶解を引き起こすことにより奏功することを証明した。細胞膜は、全ての組織型の構成要素であり;特に、本発明者は、これらの界面活性剤が、脂肪、筋肉、および結合組織の可溶化を引き起こすことを証明した。従って、本発明者らは、ホスファチジルコリンを溶解させるために使用されている処方の胆汁酸塩成分であるデオキシコール酸ナトリウムが、これらの先行技術製剤の主要な活性成分であるとの結論を下した。この結論は、胆汁酸塩のような薬理活性界面活性剤が、細胞膜の強力な可溶化剤であるという事実により支持される。さらに、脂肪溶解におけるPBFおよびデオキシコール酸ナトリウムのメカニズムは、界面活性作用である可能性が高い。
【0041】
組成物
本発明の態様において、生物学的に適合性の界面活性剤の医学的組成物は、水性媒体の中に一つまたは複数の薬理活性界面活性剤および薬学的に許容される賦形剤を含む。特に、胆汁酸塩を含む薬理活性界面活性剤が、脂肪を溶解させるために使用されることは、本発明の範囲内である。
【0042】
一つの態様において、本発明は、皮下脂肪を減少させるために有効な量の一つまたは複数の薬理活性界面活性剤を含むか、から本質的になるか、またはからなる組成物に関する。
【0043】
本発明の態様において使用され得る薬理活性界面活性剤には、親油性界面活性剤(イオン性であっても非イオン性であってもよい)、親水性界面活性剤(イオン性であっても非イオン性であってもよい)、イオン界面活性剤、非イオン界面活性剤、両性イオン界面活性剤、グリセリド、および胆汁酸塩が含まれるが、これらに制限はされない。
【0044】
親油性界面活性剤の非制限的な例には、とりわけ、アルコール;ポリオキシエチレン・アルキルエーテル;脂肪酸、胆汁酸;グリセロール脂肪酸エステル;アセチル化グリセロール脂肪酸エステル;低級アルコール脂肪酸エステル;ポリエチレン・グリコール脂肪酸エステル;ポリエチレン・グリコール・グリセロール脂肪酸エステル;ポリプロピレン・グリコール脂肪酸エステル;ポリオキシエチレン・グリセリド;モノ/ジグリセリドの乳酸誘導体;プロピレン・グリコール・ジグリセリド;ソルビタン脂肪酸エステル;ポリオキシエチレン・ソルビタン脂肪酸エステル;ポリオキシエチレン−ポリオキシプロピレン・ブロック・コポリマー;トランスエステル化植物油;ステロール;ステロール誘導体;糖エステル;糖エーテル;スクログリセリド(sucroglycerides);ポリオキシエチレン植物油;ポリオキシエチレン水素化植物油;ポリオールと、脂肪酸、グリセリド、植物油、水素化植物油、およびステロールからなる群の少なくとも一つのメンバーとの反応混合物;ならびにそれらの混合物が含まれる。
【0045】
非イオン親油性界面活性剤の非制限的な例には、とりわけ、アルキルグルコシド;アルキルマルトシド;アルキルチオグルコシド;ラウリル・マクロゴールグリセリド;ポリオキシエチレン・アルキル・エーテル;ポリオキシエチレン・アルキルフェノール;ポリエチレン・グリコール脂肪酸エステル、ポリエチレン・グリコール・グリセロール脂肪酸エステル;ポリオキシエチレン・ソルビタン脂肪酸エステル;ポリオキシエチレン−ポリオキシプロピレン・ブロック・コポリマー;ポリグリセロール脂肪酸エステル;ポリオキシエチレン・グリセリド;ポリオキシエチレン・ステロール、それらの誘導体およびアナログ;ポリオキシエチレン植物油;ポリオキシエチレン水素化植物油;ポリオールと、脂肪酸、グリセリド、植物油、水素化植物油、およびステロールからなる群の少なくとも一つのメンバーとの反応混合物;トコフェロール・ポリエチレン・グリコール・スクシネート;糖エステル;糖エーテル;スクログリセリド;ならびにそれらの混合物が含まれる。
【0046】
イオン親水性界面活性剤の非制限的な例には、とりわけ、アルキル・アンモニウム塩、胆汁酸、ならびにそれらの塩、アナログ、および誘導体;アミノ酸、カルニチン、オリゴペプチド、およびポリペプチドの脂肪酸誘導体;アミノ酸、オリゴペプチド、およびポリペプチドのグリセリド誘導体;アシル・ラクチレート(lactylates);モノグリセリド、ジグリセリドのモノアセチル化、ジアセチル化された酒石酸エステル;スクシノイル化(succinoylated)モノグリセリド;モノグリセリド、ジグリセリドのクエン酸エステル;アルギン酸塩;プロピレン・グリコール・アルギネート;レシチンおよび水素化レシチン;リゾレシチンおよび水素化リゾレシチン;リゾリン脂質およびそれらの誘導体、リン脂質およびそれらの誘導体;アルキルスルフェートの塩;脂肪酸の塩;ナトリウム・ドクセート(sodium docusate);ならびにそれらの混合物が含まれる。
【0047】
イオン界面活性剤の非制限的な例には、コール酸塩、デオキシコール酸ナトリウム、ドデシル硫酸ナトリウム、およびC-16 TABが含まれるが、これらに制限はされない。好ましい態様において、本発明の態様において有用なイオン界面活性剤の非制限的な例は、デオキシコール酸ナトリウムである。
【0048】
非イオン界面活性剤の非制限的な例には、Brij 35、ポリオキシエチレン(20)セチル・エーテルのようなn-アルキルPEOモノエーテル、Lubrol PX、Lubrol WX、ノニデット(nonidet)P-40、オクチルフェノールポリ(エチレングリコールエーテル)n10およびオクチルフェノールポリ(エチレングリコールエーテル)n7のようなn-アルキル・フェニルPEO、テトラメチルブチルフェニルPEO、n-オクチルグルコシド、オクチル・チオグルコピラノシド、トゥイーン(tween)-80およびトゥイーン-20、ならびにアルキルアリール・ポリエーテル・アルコール(Triton(登録商標)X-100)が含まれるが、これらに制限はされない。
【0049】
両性イオン界面活性剤の非制限的な例には、3-[(3-コラミドプロピル)ジメチルアンモニオ]プロパン-スルホネート(CHAPS)、N-テトラデシル-N,N-ジメチル-3-アンモニオ-1-プロパンスルホネート、コール酸スルホベタイン、ラウリルジメチルベタイン(Empigen(登録商標)BB)、およびzwittergent 3-14が含まれるが、これらに制限はされない。
【0050】
グリセリドの非制限的な例には、とりわけ、モノグリセリド、ジグリセリド、またはトリグリセリドが含まれる。そのようなトリグリセリドには、とりわけ、植物油、魚油、動物脂肪、水素化植物油、部分水素化植物油、合成トリグリセリド、修飾されたトリグリセリド、分画されたトリグリセリド、およびそれらの混合物が含まれる。
【0051】
胆汁酸塩の非制限的な例には、グリシンまたはタウリンと接合していてもよい、1〜3個のヒドロキシル基およびカルボキシル基で終わる5炭素原子側鎖を有するステロイドが含まれる。
【0052】
胆汁酸塩の付加的な例には、コール酸、デオキシコール酸、コール酸、ケノデオキシコール酸、7-α-デヒドロキシレート(dehydroxylate)、ケノデオキシコール酸、リトコール酸、ウルソデオキシコール酸の塩、これらのいずれかのジヒドロキシおよびトリヒドロキシ・コンジュゲートならびにタウリンまたはグリシン・コンジュゲートが含まれる。好ましくは、本発明の胆汁酸塩は、デオキシコール酸ナトリウムである。
【0053】
下記表1は、本発明により企図されるいくつかの界面活性剤、モノマーとしてのこれらの界面活性剤のモノマー分子量、および界面活性剤が主としてミセルの形態で存在する最小濃度である臨界ミセル濃度(CMC)を例示する。
【0054】
(表1)

【0055】
好ましくは、本明細書中の組成物の中の一つまたは複数の薬理活性界面活性剤の濃度は、ほぼCMC濃度(すなわち、+/-5mM)であるか、またはCMCレベルを超える濃度、例えば、CMC濃度レベルを1%、5%、10%、15%、20%、25%、30%、35%、40%、50%、55%、60%、65%、70%、75%、80%、85%、90%、99%、150%、200%、400%、800%、1600%、3200%、6800%、13,600%、27,200%、または54,400%超える濃度であるようなものである。
【0056】
いくつかの態様において、組成物中の薬理活性界面活性剤のうちの一つまたは複数の濃度は、w/w、w/v、またはv/vで、20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、0.5%、0.4%、0.3%、0.2%、0.1%、0.09%、0.08%、0.07%、0.06%、0.05%、0.04%、0.03%、0.02%、0.01%、0.009%、0.008%、0.007%、0.006%、0.005%、0.004%、0.003%、0.002%、0.001%、0.0009%、0.0008%、0.0007%、0.0006%、0.0005%、0.0004%、0.0003%、0.0002%、または0.0001%未満である。
【0057】
いくつかの態様において、組成物中の薬理活性界面活性剤のうちの一つまたは複数の濃度は、w/w、w/v、またはv/vで、20%、19.75%、19.50%、19.25% 19%、18.75%、18.50%、18.25% 18%、17.75%、17.50%、17.25% 17%、16.75%、16.50%、16.25% 16%、15.75%、15.50%、15.25% 15%、14.75%、14.50%、14.25% 14%、13.75%、13.50%、13.25% 13%、12.75%、12.50%、12.25% 12%、11.75%、11.50%、11.25% 11%、10.75%、10.50%、10.25% 10%、9.75%、9.50%、9.25% 9%、8.75%、8.50%、8.25% 8%、7.75%、7.50%、7.25% 7%、6.75%、6.50%、6.25% 6%、5.75%、5.50%、5.25% 5%、4.75%、4.50%、4.25%、4%、3.75%、3.50%、3.25%、3%、2.75%、2.50%、2.25%、2%、1.75%、1.50%、125%、1%、0.5%、0.4%、0.3%、0.2%、0.1%、0.09%、0.08%、0.07%、0.06%、0.05%、0.04%、0.03%、0.02%、0.01%、0.009%、0.008%、0.007%、0.006%、0.005%、0.004%、0.003%、0.002%、0.001%、0.0009%、0.0008%、0.0007%、0.0006%、0.0005%、0.0004%、0.0003%、0.0002%、または0.0001%より大きい。
【0058】
いくつかの態様において、組成物中の薬理活性界面活性剤のうちの一つまたは複数の濃度は、w/w、w/v、またはv/vで、およそ0.001%〜およそ50%、およそ0.001%〜およそ40%、およそ0.01%〜およそ30%、およそ0.02%〜およそ29%、およそ0.03%〜およそ28%、およそ0.04%〜およそ27%、およそ0.05%〜およそ26%、およそ0.06%〜およそ25%、およそ0.07%〜およそ24%、およそ0.08%〜およそ23%、およそ0.09%〜およそ22%、およそ0.1%〜およそ21%、およそ0.2%〜およそ20%、およそ0.3%〜およそ19%、およそ0.4%〜およそ18%、およそ0.5%〜およそ17%、およそ0.6%〜およそ16%、およそ0.7%〜およそ15%、およそ0.8%〜およそ14%、およそ0.9%〜およそ12%、およそ1%〜およそ10%の範囲内にある。最終濃度は、標的部位の位置およびサイズを含む(がこれらに制限はされない)当業者に公知の多くの要因に依存することが理解される。
【0059】
いくつかの態様において、本発明の組成物は、10g、9.5g、9.0g、8.5g、8.0g、7.5g、7.0g、6.5g、6.0g、5.5g、5.0g、4.5g、4.0g、3.5g、3.0g、2.5g、2.0g、1.5g、1.0g、0.95g、0.9g、0.85g、0.8g、0.75g、0.7g、0.65g、0.6g、0.55g、0.5g、0.45g、0.4g、0.35g、0.3g、0.25g、0.2g、0.15g、0.1g、0.09g、0.08g、0.07g、0.06g、0.05g、0.04g、0.03g、0.02g、0.01g、0.009g、0.008g、0.007g、0.006g、0.005g、0.004g、0.003g、0.002g、0.001g、0.0009g、0.0008g、0.0007g、0.0006g、0.0005g、0.0004g、0.0003g、0.0002g、または0.0001g未満の一つまたは複数の本明細書中の薬理活性界面活性剤を含むか、から本質的になるか、またはからなる。
【0060】
いくつかの態様において、本明細書中の組成物は、0.0001g、0.0002g、0.0003g、0.0004g、0.0005g、0.0006g、0.0007g、0.0008g、0.0009g、0.001g、0.0015g、0.002g、0.0025g、0.003g、0.0035g、0.004g、0.0045g、0.005g、0.0055g、0.006g、0.0065g、0.007g、0.0075g、0.008g、0.0085g、0.009g、0.0095g、0.01g、0.015g、0.02g、0.025g、0.03g、0.035g、0.04g、0.045g、0.05g、0.055g、0.06g、0.065g、0.07g、0.075g、0.08g、0.085g、0.09g、0.095g、0.1g、0.15g、0.2g、0.25g、0.3g、0.35g、0.4g、0.45g、0.5g、0.55g、0.6g、0.65g、0.7g、0.75g、0.8g、0.85g、0.9g、0.95g、1g、1.5g、2g、2.5、3g、3.5、4g、4.5g、5g、5.5g、6g、6.5g、7g、7.5g、8g、8.5g、9g、9.5g、または10g超の一つまたは複数の本明細書中の薬理活性界面活性剤を含むか、から本質的になるか、またはからなる。
【0061】
いくつかの態様において、本明細書中の組成物は、0.0001〜10g、0.0005〜9g、0.001〜8g、0.005〜7g、0.01〜6g、0.05〜5g、0.1〜4g、0.5〜4g、または1〜3gの一つまたは複数の本明細書中の薬理活性界面活性剤を含むか、から本質的になるか、またはからなる。
【0062】
本明細書中のいずれの態様においても、組成物は、少なくとも2、3、4、5、6、7、8、9、または10個の界面活性剤を含むか、から本質的になるか、またはからなることができる。
【0063】
本明細書中のいずれの態様においても、組成物は、一つまたは複数のリン脂質(例えば、ホスファチジルコリン)を含み得る。好ましくは、本明細書中の組成物/単位用量の中のリン脂質の量は、w/w、w/v、またはv/vで、組成物または単位用量の50%、40%、30%、20%、15%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、0.95%、0.9%、0.85%、0.8%、0.75%、0.7%、0.65%、0.6%、0.55%、0.5%、0.45%、0.4%、0.35%、0.3%、0.25%、0.2%、0.15%、0.1%、0.09%、0.08%、0.07%、0.06%、0.05%、0.04%、0.03%、0.02%、0.01%、0.009%、0.008%、0.007%、0.006%、0.005%、0.004%、0.003%、0.002%、0.001%、0.0009%、0.0008%、0.0007%、0.0006%、0.0005%、0.0004%、0.0003%、0.0002%、または0.0001%未満の濃度である。好ましい態様において、組成物中のリン脂質の量は、w/w、w/v、またはv/vで5%未満の濃度である。
【0064】
本発明の一つの態様において、少なくとも一つの薬理活性界面活性剤を含み、任意で、少なくとも一つの薬学的に許容される賦形剤を含み、任意で、少なくとも一つの付加的な活性成分を含み、w/w、w/v、もしくはv/vで、20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、0.5%、0.4%、0.3%、0.2%、0.1%、0.09%、0.08%、0.07%、0.06%、0.05%、0.04%、0.03%、0.02%、0.01%、0.009%、0.008%、0.007%、0.006%、0.005%、0.004%、0.003%、0.002%、0.001%、0.0009%、0.0008%、0.0007%、0.0006%、0.0005%、0.0004%、0.0003%、0.0002%、もしくは0.0001%未満の(ホスファチジルコリンのような)リン脂質を含有しているか、またはより好ましくはホスファチジルコリンのようなリン脂質を含有していない、患者における局所的な脂肪沈着物の非外科的な減少のための医学的組成物が提供される。「未満」という用語は、本明細書において使用されるように、ある程度のホスファチジルコリンを含有している組成物を一般にさすが、いくつかの態様においては、0%ホスファチジルコリンをさす。
【0065】
本発明の一つの態様において、薬理活性界面活性剤組成物は、少なくとも一つの薬理活性界面活性剤を含有しており、任意で、少なくとも一つの薬学的に許容される賦形剤を含有しており、任意で、少なくとも一つの付加的な活性成分を含有しており、w/w、w/v、もしくはv/vで、20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、0.5%、0.4%、0.3%、0.2%、0.1%、0.09%、0.08%、0.07%、0.06%、0.05%、0.04%、0.03%、0.02%、0.01%、0.009%、0.008%、0.007%、0.006%、0.005%、0.004%、0.003%、0.002%、0.001%、0.0009%、0.0008%、0.0007%、0.0006%、0.0005%、0.0004%、0.0003%、0.0002%、もしくは0.0001%未満の(ホスファチジルコリンのような)リン脂質を含有しているか、またはより好ましくはホスファチジルコリンのようなリン脂質を含有していない。
【0066】
本発明の態様において、薬理活性界面活性剤組成物は、脂肪組織へと直接皮下注射により投与される。
【0067】
本発明の一つの態様において、局所的な脂肪蓄積は、下眼瞼脂肪ヘルニア、脂肪腫、脂肪異栄養、バッファロー瘤脂肪異栄養、またはセルライトに関連した脂肪沈着物である。局所的な脂肪蓄積は、目の下、顎の下、腕の下、殿部、腓、足首、背部、大腿、または胃部に存在し得る。従って、本発明は、脂肪腫、ダーカム病、マーデルング頸、脂肪浮腫、圧力原性結節、眼瞼黄板症、脂肪異栄養、およびセルライトのような脂肪組織障害の処置を企図する。
【0068】
本発明のもう一つの態様において、脂肪を可溶化する量のデオキシコール酸を含み、w/w、w/v、もしくはv/vで、20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、0.5%、0.4%、0.3%、0.2%、0.1%、0.09%、0.08%、0.07%、0.06%、0.05%、0.04%、0.03%、0.02%、0.01%、0.009%、0.008%、0.007%、0.006%、0.005%、0.004%、0.003%、0.002%、0.001%、0.0009%、0.0008%、0.0007%、0.0006%、0.0005%、0.0004%、0.0003%、0.0002%、もしくは0.0001%未満の(ホスファチジルコリンのような)リン脂質を含有しているか、またはより好ましくはホスファチジルコリンのようなリン脂質を含有していない、下眼瞼脂肪ヘルニアを有する患者における局所的な脂肪の蓄積を減少させるための医学的組成物が提供される。
【0069】
本発明の一つの態様において、少なくとも一つの薬理活性界面活性剤、任意での少なくとも一つの薬学的に許容される賦形剤および任意での少なくとも一つの付加的な活性成分から本質的になり、好ましくは、w/w、w/v、もしくはv/vで、20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、0.5%、0.4%、0.3%、0.2%、0.1%、0.09%、0.08%、0.07%、0.06%、0.05%、0.04%、0.03%、0.02%、0.01%、0.009%、0.008%、0.007%、0.006%、0.005%、0.004%、0.003%、0.002%、0.001%、0.0009%、0.0008%、0.0007%、0.0006%、0.0005%、0.0004%、0.0003%、0.0002%、もしくは0.0001%未満の(ホスファチジルコリンのような)リン脂質を含有しているか、またはより好ましくはホスファチジルコリンのようなリン脂質を含有していない薬理活性界面活性剤組成物の非外科的な投与を含む、患者における局所的な脂肪沈着物の非外科的な減少のための脂肪吸引以外の方法が提供される。
【0070】
本明細書中のいずれの組成物においても、界面活性剤とリン脂質との比率は、質量でリン脂質より多い界面活性剤が存在するようなものである。例えば、界面活性剤とリン脂質との質量比は、1:0.5、1:0.05、1.0.005等であり得る。いくつかの態様において、リン脂質(例えば、ホスファチジルコリン)の%w/v濃度は、界面活性剤の%w/v濃度未満である。例えば、組成物は、5%w/vのデオキシコール酸ナトリウムおよび4%w/vのホスファチジルコリンを有し得る。
【0071】
単位用量
本発明は、本明細書中の組成物の単位用量も企図する。そのような単位用量は、例えば、500mL、400mL、300mL、200mL、100mL、90mL、80mL、70mL、60mL、50mL、40mL、30mL、20mL、10mL、9mL、8mL、7mL、6mL、5mL、4mL、3mL、2mL、1mL、0.9mL、0.8mL、0.7mL、0.6mL、0.5mL、0.4mL、0.3mL、0.2mL、0.1mL、0.09mL、0.08mL、0.07mL、0.06mL、0.05mL、0.04mL、0.03mL、0.02mL、0.01mL、0.009mL、0.008mL、0.007mL、0.006mL、0.005mL、0.004mL、0.003mL、0.002mL、0.001mL、0.0009mL、0.0008mL、0.0007mL、0.0006mL、0.0005mL、0.0004mL、0.0003mL、0.0002mL、または0.0001mL未満の全容量を有し得る。いくつかの態様において、そのような単位用量は、0.2mL超かつ500mL未満の全容量を有する。いくつかの態様において、そのような単位用量は、0.1mL未満の全容量を有する。いくつかの態様において、そのような単位用量は、0.1mL未満の全容量を有する。いくつかの態様において、そのような単位用量は、0.1〜0.2mL(0.1mLおよび0.2mLを含む)の全容量を有する。いくつかの態様において、そのような単位用量は、0.1未満および0.2超の全容量を有する。
【0072】
いくつかの態様において、本発明は、0.0001mL、0.0005mL、0.001mL、0.005mL、0.01mL、0.05mL、0.1mL、0.5mL、1mL、5mL、10mL、50mL、100mL超の全容量である組成物または単位用量の標的部位への投与を企図する。
【0073】
いくつかの態様において、本発明は、一標的部位当たり0.0001〜500mL、0.0005〜400mL、0.001〜300mL、0.005〜200mL、0.01〜100mL、0.05〜90mL、0.06〜80mL、0.07〜70mL、0.08〜60mL、0.09〜50mL、0.1〜40mL、0.2〜30mL、0.3〜29mL、0.4〜28mL、0.5〜27mL、0.6〜26mL、0.7〜25mL、0.8〜24mL、0.9〜23mL、10〜22mL、11〜21mL、12〜20mL、13〜19mL、14〜18mL、または15〜17mLの範囲の全容量を有する単位用量の投与を企図する。
【0074】
その他の態様は、一標的部位当たり0.01〜30mL、0.02〜20mL、0.03〜10mLの範囲の全容量の組成物の投与を企図する。その他の態様は、標的部位への0.2〜500mLの全溶液、標的部位への0.1〜0.2mLの全溶液、0.1mL未満(任意で一標的部位当たり0.03mLおよび0.05mLを除く)の投与を企図する。
【0075】
単位用量は、本明細書の組成物において開示されたような量の一つまたは複数の薬理活性界面活性剤を含むか、から本質的になるか、またはからなることができる。単位用量は、さらに、上記の組成物セクションにおいて同定された濃度および単位でホスファチジルコリンのようなリン脂質を含み得る。例えば、好ましい単位用量は、5g未満の薬理活性界面活性剤および/または5%未満のホスファチジルコリンのようなリン脂質を有する。
【0076】
好ましい態様において、単位用量は、注射可能製剤の中に一つまたは複数の薬理活性界面活性剤を含むか、から本質的になるか、またはからなり、かつ500mL未満かつ0.2mL超の全容量を有する。そのような単位用量は、w/w、w/v、またはv/vで5%未満のリン脂質(例えば、ホスファチジルコリン)を有し得る。
【0077】
いくつかの態様において、単位用量は、w/w、w/v、またはv/vで0.1%超の一つまたは複数の本明細書中の界面活性剤を含み、かつ0.2mL超かつ500mL未満の全容量を有する。いくつかの態様において、単位用量は、w/w、w/v、またはv/vで0.1%超の一つまたは複数の本明細書中の界面活性剤を含み、かつ任意で0.03mLおよび0.05mLを除く0.1mL未満の全容量を有する。
【0078】
いくつかの態様において、単位用量は、0.01g未満の一つまたは複数の界面活性剤を含み、かつ500mL未満の全容量を有する。
【0079】
例えば、いくつかの態様において、単位用量は重量で0.1%または0.01%未満の一つまたは複数の本明細書中の界面活性剤を含む。
【0080】
いくつかの態様において、単位用量は、0.9%w/w未満または13%w/w超の一つまたは複数の本明細書中の界面活性剤を有し、かつ0.1〜0.2mLの全容量を有する。
【0081】
単位用量は、標的区域、脂肪の量、および所望の結果に一部依るであろう。
【0082】
塩およびエステル
本発明は、本明細書中の界面活性剤の薬学的に許容される塩およびエステルも企図する。そのような塩およびエステルは、正当な医学的判断の範囲内で、ヒトおよび動物の組織と接触させて使用するのに適しており、過度の毒性、刺激、アレルギー応答等がなく、合理的な利益/リスク比と相応しており、かつ意図された使用のために有効な塩およびエステルであることを意味する。
【0083】
より一般的な薬学的に許容される塩およびエステルには、アセテート、エストレート(estolate)(プロピオン酸エステルのラウリル硫酸塩)、コハク酸エチル、グルセプテート(gluceptate)(グルコヘプトネート(glucoheptonate))、ラクトビオネート(lactobionate)、ステアレート、および塩酸塩型が含まれる。本明細書において企図されるその他の酸性塩は、以下の通りである:アジピン酸塩、アルギン酸塩、アスパラギン酸塩、安息香酸塩、ベンゼンスルホン酸塩、重硫酸塩、酪酸塩、クエン酸塩、ショウノウ酸塩、ショウノウスルホン酸塩、シクロペンタンプロピオン酸塩、ジグルコン酸塩、ドデシル硫酸塩、エタンスルホン酸塩、フマル酸塩、グルコン酸塩、グリセロリン酸塩、ヘミスルフェート(hemisulfate)、ヘプトン酸塩、ヘキサン酸塩、臭化水素酸塩、ヨウ化水素酸塩、2-ヒドロキシ・エタンスルホン酸塩、乳酸塩、マレイン酸塩、メタンスルホン酸塩、2-ナフタレンスルホン酸塩、ニコチン酸塩、シュウ酸塩、パモ酸塩、パントテン酸塩、ペクチニン酸塩(pectinate)、過硫酸塩、3-フェニルプロピオン酸塩、ピクリン酸塩、ピバル酸塩、プロピオン酸塩、コハク酸塩、酒石酸塩、チオシアン酸塩、トシル酸塩、およびウンデカン酸塩。
【0084】
塩基性窒素含有基は、メチル、エチル、プロピル、およびブチルの塩化物、臭化物、およびヨウ化物のような低級アルキル・ハロゲン化物;ジメチル、ジエチル、ジブチル、およびジアミルの硫酸塩のようなジアルキル硫酸塩;デシル、ラウリル、ミリスチル、およびステアリルの塩化物、臭化物、およびヨウ化物のような長鎖ハロゲン化物;ベンジルおよびフェネチルの臭化物のようなアラルキル・ハロゲン化物等のような薬剤で第四級化され得る。
【0085】
好ましい態様において、本明細書中の界面活性剤のうちの一つ以上は、胆汁酸塩である。本明細書中の胆汁酸塩は、無機塩基、アンモニア、有機塩基、無機酸、有機酸、塩基性アミノ酸、ハロゲン・イオン等により形成されたもの、および内部塩であり得る。無機塩基の例には、アルカリ金属(例えば、NaおよびK)およびアルカリ土類金属(例えば、Mg)が含まれる。有機塩基の例には、プロカイン、2-フェニルエチルベンジルアミン、ジベンジルエチレンジアミン、エタノールアミン、ジエタノールアミン、トリス(ヒドロキシメチル)アミノメタン、ポリヒドロキシアルキルアミン、およびN-メチルグルコサミンが含まれる。無機酸の例には、塩酸、臭化水素酸、硫酸、硝酸、およびリン酸が含まれる。有機酸の例には、p-トルエンスルホン酸、メタンスルホン酸、ギ酸、トリフルオロ酢酸、およびマレイン酸が含まれる。塩基性アミノ酸の例には、リジン、アルギニン、オルニチン、およびヒスチジンが含まれる。
【0086】
胆汁酸は、それらのエステル、例えば、以下に制限はされないが、置換されていてもよいC1-C6アルキル、C2-C6アルケニル、C3-C10シクロアルキル、C3-C10シクロアルキル(C1-C6)アルキル、置換されていてもよいC6-C10アリール、置換されていてもよいC7-C12アラルキル、ジ(C6-C10)アリールメチル、トリ(C6-C10)アリールメチル、および置換されたシリルとして存在してもよい。
【0087】
置換されていてもよいC1-6アルキルの例には、例えば、各々、ベンジルオキシ、C1-4アルキルスルホニル(例えば、メタンスルホニル)、トリメチルシリル、ハロゲン(例えば、F、Cl、およびBr)、アセチル、ニトロベンゾイル、メシルベンゾイル、フタルイミド、スクシノイルイミド、ベンゼンスルホニル、フェニルチオ、ジ-C1-4アルキルアミノ(例えば、ジメチルアミド)、ピリジル、C1-4アルキルスルフィニル(例えば、メタンスルフィニル)、シアノ等で置換されていてもよい、メチル、エチル、n-プロピル、n-ブチル、t-ブチル、n-ペンチル、およびn-ヘキシルが含まれる。そのような置換されたC1-6アルキルには、例えば、ベンジルオキシメチル、2-メタンスルホニルエチル、2-トリメチルシリルエチル、2,2,2-トリクロロエチル、2-ヨードエチル、アセチルメチル、p-ニトロベンゾイルメチル、p-メシルベンゾイルメチル、フタルイミドメチル、スクシノイルイミドメチル、ベンゼンスルホニルメチル、フェニルチオメチル、および1-ジメチルアミノエチルが含まれる。上記のC2-6アルケニルには、例えば、ビニル、アリール、1-プロペニル、イソプロペニル、1-ブテニル、2-ブテニル、1,1-ジメチルアリール、3-メチル、および3-ブテニルが含まれる。上記のC3-10シクロアルキルには、例えば、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、シクロヘプチル、ノルボルニル、およびアダマンチルが含まれる。上記のC3-10シクロアルキル(C1-6)アルキルには、例えば、シクロプロピルメチル、シクロペンチルメチル、およびシクロヘキシルメチルが含まれる。上記のC6-10アリールには、例えば、各々、ニトロ、ハロゲン(例えば、F、Cl、およびBr)等で置換されていてもよい、フェニル、α-ナフチル、8-ナフチル、およびビフェニルが含まれ、そのような置換されたアリールには、例えば、p-ニトロフェニルおよびp-クロロフェニルが含まれる。上記の置換されていてもよいC7-12アラルキルには、例えば、各々、ニトロ、C1-4アルコキシ(例えば、メトキシ)、C1-4アルキル(例えば、メチル、エチル)、ヒドロキシ等で置換されていてもよい、ベンジル、1-フェニルエチル、2-フェニルエチル、フェニルプロピル、およびナフチルメチルが含まれる。そのような置換された基は、p-ニトロベンジル、p-メトキシベンジル(PMB)、または3,5-ジ-t-ブチル-4-ヒドロキシベンジルにより例証される。上記のジ(C6-10アリール)メチルには、ベンズヒドリルが含まれ、C6-10アリールメチルには、トリチルが含まれ、置換されたシリルには、トリメチルシリルおよびtert-ブチルジメチルシリルが含まれる。活性エステルの例には、有機リン酸エステル(例えば、ジエトキシ・リン酸エステルおよびジフェノキシ・リン酸エステル)、シアノメチル・エステルが含まれ、活性チオエステルには、芳香族ヘテロ環式チオ化合物により形成されたエステル(例えば、2-ピリジルチオ・エステル)が含まれる。
【0088】
胆汁酸のその他の反応性誘導体の例には、酸ハロゲン化物、酸アジ化物、酸無水物、混合酸無水物、活性アミド、および活性チオエステルが含まれる。例えば、酸ハロゲン化物には酸塩化物および酸臭化物が含まれ;混合酸無水物には混合モノアルキルカルボン酸無水物、混合脂肪族カルボン酸無水物、芳香族カルボン酸無水物、有機スルホン酸無水物が含まれ、活性アミドには、N原子を含有している複素環式化合物により形成されたアミドが含まれる。
【0089】
ミセル
胆汁酸を含む界面活性剤は、ミセル形成化合物である。ミセルの存在は、疎水性部分を水性溶媒(例えば、水)から遠ざけて埋め込むことにより、通常は水に可溶性でない疎水性分子(例えば、細胞膜を構成する脂質)の可溶性を有意に増加させると信じられている。当業者により認識されるように、ミセルとは、分子の極性親水性部分が外側に伸び、無極性疎水性部分が内側に伸びている両親媒性分子のコロイド性凝集物である。
【0090】
いくつかの態様において、本発明は、同質ミセル(単一の界面活性剤により生成したミセル)を企図し、その他の態様において、本発明は、混合ミセルの形成(二つ以上の化合物(そのうちの一つは界面活性剤である)により生成したミセル)を企図する。
【0091】
いくつかの態様において、本発明の組成物の中のミセルの平均粒子サイズは、1ナノメートル〜100マイクロメートル、10ナノメートル〜50マイクロメートル、100ナノメートル〜1マイクロメートル等の範囲にあるものと企図される。さらに、ミセルの形状は、変動することができ、例えば、偏長、偏平、または球状であり得;球状のミセルが最も典型的である。
【0092】
いくつかの態様において、本明細書中の組成物の中の界面活性剤の少なくとも10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%が、ミセルを形成している。その他の態様において、本明細書中の組成物の中の界面活性剤の90%、80%、70%、60%、50%、40%、30%、20%、10%、または5%未満が、ミセルを形成している。その他の態様において、本明細書中の組成物の界面活性剤の約10〜90%、20〜80%、30〜70%、40〜60%、または約50%が、ミセルを形成している。
【0093】
いくつかの態様において、本明細書中の組成物の中のミセルの平均サイズは、10-5、10-6、10-7、10-8、10-9未満であり得る。いくつかの態様において、本発明の組成物の中のミセルの平均サイズは、10-5、10-6、10-7、10-8、10-9超であり得る。いくつかの態様において、本明細書中の組成物の中のミセルの平均サイズは、1×10-5〜9×10-5;1×10-6〜9×10-6;1×10-7〜9×10-7;1×10-8〜9×10-8;1×10-9〜9×10-9の範囲内であり得る。
【0094】
いくつかの態様において、本発明の組成物の中のミセルの平均分子量は、100,000ダルトン、50,000ダルトン、40,000ダルトン、30,000ダルトン、20,000ダルトン、10,000ダルトン、9,000ダルトン、8,000ダルトン、7,000ダルトン、6,000ダルトン、5,000ダルトン、4,000ダルトン、3,000ダルトン、2,000ダルトン、1,000ダルトン、または500ダルトン未満であり得る。いくつかの態様において、本発明の組成物の中のミセルの平均分子量は、500ダルトン、1,000ダルトン、1,500ダルトン、2,000ダルトン、2,500ダルトン、3,000ダルトン、3,500ダルトン、4,000ダルトン、4,500ダルトン、5,000ダルトン、5,500ダルトン、6,000ダルトン、6,500ダルトン、7,000ダルトン、7,500ダルトン、8,000ダルトン、8,500ダルトン、9,000ダルトン、9,500ダルトン、10,000ダルトン、または15,000ダルトン超であり得る。いくつかの態様において、本発明の組成物の中のミセルの平均分子量は、100〜20,000ダルトン、1,000〜10,000ダルトン、2,000〜1,000ダルトン、または3,000〜5,000ダルトンの範囲内であり得る。
【0095】
第二の治療剤
本発明のさらにもう一つの態様において、本明細書中の組成物は、第二の治療剤と共製剤化(co-formulated)され、共投与(co-administered)され、かつ/または共販売(co-marketed)され得る。
【0096】
第二の治療剤の非制限的な例には、抗微生物剤、血管収縮剤、抗血栓剤、抗凝固剤、起泡抑制剤、抗炎症剤、鎮痛剤、分散剤、抗分散剤、浸透増強剤、ステロイド、精神安定剤、筋弛緩剤、および止痢剤が含まれる。
【0097】
本明細書中の組成物、方法、およびキットと共に使用するのに適している抗微生物剤は、抗菌剤、抗真菌剤、抗ウイルス剤等を含むが、これらに制限はされず、好ましくは、広域の微生物に対して有効である。
【0098】
抗菌剤の例には、塩化ベンザルコニウム、安息香酸、ベンズオキソニウム・クロリド(benzoxonium chloride)、ベンジル・アルコール、2-ブロモ-2-ニトロプロパン-1,3-ジオール、5-ブロモ-5-ニトロ-1,3-ジオキサン、ブロモクロロフェン、ショウノウ・ベンザルコニウム・メトスルフェート(camphor benzalkonium methosulfate)、キャプタン、臭化セトリモニウム、塩化セトリモニウム、塩化セチルピリジニウム、クリンバゾール(climbazol)、クロルアセトアミド、クロルヘキシジンおよびその塩、p-クロロ-m-クレゾール、クロルフェネシン、クロロキシレノール、クロロフェン、クロロブタノール、o-シメン-5-オール、デヒドロ酢酸、ジブロモジシアノブタン、ジブロモヘキサミジン、ジブロモプロパミジン(dibromopropamidin)、ジクロロベンジル・アルコール、ジクロロフェニル・イミダゾールジオキソラン、ジメチルオキサゾリジン、DMDMヒダントイン、酢酸ドデシルグアニジン、ヘキサミジン・ジイソチオネート、ヘキサクロロフェン、ヘキセチジン(hexetidin)、ヨードプロピニル・ブチルカルバメート、ラウリル・イソキノリニウム・ブロミド、メチルジブロモ・グルタロニトリル(methyldibromo glutaronitrile)、メチロールクロルアセトアミド(methylolchloracetamide)、フェネチル・アルコール、フェノキシエタノール、フェノキシプロパノール、o-フェニルフェノール、ピロクトン・オラミン(pirocton olamine)、ポリアミノプロピル・ビグアニド(biguanide)、ソルビン酸カリウム、カリウム・ウンデシレノイル加水分解コラーゲン(potassium undecylenoyl hydrolyzed collagen)、クオタニウム(quaternium)-15、サリチル酸、安息香酸ナトリウム、デヒドロ酢酸ナトリウム、ナトリウム・ヒドロキシメチルグリシネート、ナトリウムo-フェニルフェネート(phenylphenate)、ソルビン酸、トリクロカルバン(triclocarban)、トリクロサン(triclosan)、ウンデシレン酸およびその誘導体、システイン酸亜鉛(zinc cysteate)、グルコン酸亜鉛、ピリチオン亜鉛、または硫酸亜鉛が含まれるが、これらに制限はされない。抗微生物剤として有用なウンデシレン酸誘導体は、例えば、メチル・エステル、イソプロピル・エステル、グリセリル・エステル、エトキシル化大豆ステロール・エステル、もしくはエトキシル化PHBエステルのようなエステル、またはモノエタノールアミド、モノエタノールアミド(MEA)スルホスクシネート塩のようなモノエタノールアミド誘導体、ジエタノールアミド、タンパク質縮合物、例えば、カリウム・ウンデシレノイル加水分解動物コラーゲン、および第四級化された3-アミノプロピル-アミド、例えば、ウンデシレンアミドプロピルトリモニウム・メトスルフェート(undecylenamidopropyltrimonium methosulfate)のようなアミドである。適当な殺真菌/静真菌剤の具体例には、非制限的に、ジチオカーバメート、フタルイミド、ジカルボキシミド、有機リン酸、ベンゾイミダゾール、カルボキシアニリド、フェニルアミド、亜リン酸塩等が含まれる。
【0099】
抗菌剤のその他の例には、エリスロマイシン、クラリスロマイシン、ペニシリン、セファロスポリン、アミノグリコシド、スルホンアミド、マクロライド、テトラサイクリン、リンコシド(lincosides)、キノロン、クロラムフェニコール、バンコマイシン、メトロニダゾール、リファンピン、イソニアジド、スペクチノマイシン、トリメトプリム、スルファメトキサゾール、ペネム、カルバペネム、モノバクタム、ムピロシン、硫酸ネオマイシン、バシトラシン、ポリミクシンB、1-オフロキサシン、テトラサイクリン(塩酸クロルテトラサイクリン、塩酸オキシテトラサイクリン、および塩酸テトラサイクリン)、リン酸クリンダマイシン、硫酸ゲンタマイシン、塩化ベンザルコニウム、塩化ベンゼトニウム、ヘキシルレゾルシノール、塩化メチルベンゼトニウム、フェノール、第四級アンモニウム化合物、トリクロカーボン(triclocarbon)、トリクロサン、チャノキ油、およびそれらの薬学的に許容される塩、ならびにそれらの薬学的に許容される塩およびエステルが含まれるが、これらに制限はされない。
【0100】
抗菌剤のその他の例には、アクロフロキサシン(Acrofloxacin)、アモキシシリン・クラブロン酸合剤(Amoxicillin plus clavulonic)(すなわち、Augmentin)、アミカシン、アンピシリン、アパルシリン(Apalcillin)、アプラマイシン(Apramycin)、アストロマイシン、アルベカシン(Arbekacin)、アスポキシシリン(Aspoxicillin)、アジドジリン(Azidozillin)、アジスロマイシン(Azithromycin)、アズロシリン(Azlocillin)、バシトラシン、ベンザチン(Benzathine)・ペニシリン、ベンジルペニシリン、カルベニシリン、セファクロル、セファドロキシル、セファレキシン、セファマンドール、セファパリン(Cefaparin)、セファトリジン、セファゾリン、セフブペラゾン、セフカペン(Cefcapene)、セフジニル(Cefdinir)、セフジトレン(Cefditoren)、セフェピム(Cefepime)、セフェタメット(Cefetamet)、セフィキシム(Cefixime)、セフメタゾール、セフミノクス(Cefminox)、セフォペラゾン、セフォラニド(Ceforanide)、セフォタキシム、セフォテタン、セフォチアム、セフォキシチン、セフピミゾール(Cefpimizole)、セフピラミド、セフポドキシム(Cefpodoxime)、セフプロジル(Cefprozil)、セフラジン、セフロキサジン、セフスロジン、セフタジジム、セフトリアキソン(Ceftriaxone)、セフロキシム、クロラムフェニコール、クロルテトラサイクリン、シクラシリン、シノキサシン、シプロフロキサシン(Ciprofloxacin)、クラリスロマイシン(Clarithromycin)、クレミゾール・ペニシリン、クリンダマイシン、クロキサシリン、ダプトマイシン(Daptomycin)、デメクロサイクリン、デスキノロン(Desquinolone)、ジベカシン、ジクロキサシリン、ジリスロマイシン(Dirithromycin)、ドキシサイクリン、エノキサシン、エピシリン、エリスロマイシン、エタンブトール、フレロキサシン(Fleroxacin)、フロモキセフ(Flomoxef)、フルクロキサシリン、フルメキン(Flumequine)、フルリスロマイシン(Flurithromycin)、ホスホマイシン、ホスミドマイシン(Fosmidomycin)、フシジン酸、ガチフロキサシン(Gatifloxacin)、ゲミフロキサシン(Gemifloxaxin)、ゲンタマイシン、イミペネム(Imipenem)、イミペネム・シラスタチンの組み合わせ、イセパマイシン(Isepamicin)、イソニアジド、ジョサマイシン、カナマイシン、カスガマイシン、キタサマイシン、ラタモキセフ、レボフロキサシン(Levofloxacin)、リンコマイシン、リネゾリド(Linezolid)、ロメフロキサシン(Lomefloxacin)、ロラカルベフ、リメサイクリン、メシリナム、メロペネム(Meropenem)、メタサイクリン、メチシリン、メトロニダゾール、メズロシリン、ミデカマイシン、ミノサイクリン、ミオカマイシン、モキシフロキサシン(Moxifloxacin)、ナフシリン、ナフシリン、ナリジキシン酸(Nalidixic acid)、ネオマイシン、ネチルマイシン、ノルフロキサシン、ノボビオシン、オフロキサシン、オレアンドマイシン、オキサシリン、オキソリン酸、オキシテトラサイクリン、パロマイシン、パズフロキサシン(Pazufloxacin)、ペフロキサシン(Pefloxacin)、ペニシリンG、ペニシリンV、フェネチシリン、フェノキシメチル・ペニシリン、ピペミド酸、ピペラシリン、ピペラシリンおよびタゾバクタム(Tazobactam)の組み合わせ、ピロミド酸、プロカイン・ペニシリン、プロピシリン、ピリメタミン、リファブチン(Rifabutin)、リファミド(Rifamide)、リファンピシン、リファマイシンSV、リファペンチン、ロキタマイシン(Rokitamycin)、ロリテトラサイクリン、ロキシスロマイシン(Roxithromycin)、ルフロキサシン(Rufloxacin)、シタフロキサシン(Sitafloxacin)、スパルフロキサシン(Sparfloxacin)、スペクチノマイシン、スピラマイシン、スルファジアジン、スルファドキシン、スルファメトキサゾール、シソマイシン(Sisomicin)、ストレプトマイシン、スルファメトキサゾール、スルフィソキサゾール、シナーシド(Synercid)(キヌプリスチン-ダルフォプリスチンの組み合わせ)、テイコプラニン(Teicoplanin)、テリスロマイシン(Telithromycin)、テモシリン(Temocillin)、テトラサイクリン、テトロキソプリム(Tetroxoprim)、チアンフェニコール、チカルシリン、チゲサイクリン(Tigecycline)、トブラマイシン、トスフロキサシン(Tosufloxacin)、トリメトプリム、トリメトレキサート(Trimetrexate)、トロバフロキサシン(Trovafloxacin)、バンコマイシン、ならびにベルダマイシン(Verdamicin)が含まれるが、これらに制限はされない。
【0101】
本発明の組成物と共に使用するのに適している血管収縮剤には、例えば、ジヒドロエルゴタミン、エルゴタミン、およびメチルセルジド、それらの薬学的に許容される塩が含まれ得る。
【0102】
本発明の組成物と共に使用するのに適している抗血栓剤には、例えば、アルガトロバン、イロプロスト、ラミフィバン(lamifiban)、タプロステン(taprostene)、チロフィバン、組織プラスミノーゲン・アクチベーター(天然または組換え)、テネクテプラーゼ(tenecteplase)(TNK)、およびラノテプラーゼ(lanoteplase)(nPA);第VIIa因子阻害剤;第Xa因子阻害剤;(ヒルジンおよびアルガトロバンのような)トロンビン阻害剤;PAI-1阻害剤(すなわち、組織プラスミノーゲン・アクチベーター阻害剤の不活化剤);α2-アンチプラスミン阻害剤;ストレプトキナーゼ、ウロキナーゼ、およびプロウロキナーゼ;ならびにアニソイル化(anisoylated)プラスミノーゲン・ストレプトキナーゼ・アクチベーター複合体、抗凝固剤(例えば、ヒルジン、ヘパリン等)、プラスミノーゲン・アクチベーター(例えば、t-PA、ウロキナーゼ等)、繊維素溶解酵素(例えば、プラスミン、サブチリシン等)、抗血小板凝集剤(例えば、プロスタシクリン、アスピリン等)等が含まれ得る。
【0103】
本発明の組成物と共に使用するのに適している抗凝固剤には、例えば、シロスタゾール(cilostazol)(PLETAL(登録商標)、Otsuka)、クロピドグレル(clopidogrel)(PLAVIX(登録商標)、Sanofi)、チクロピジン(ticlopidine)(TICLID(登録商標)、Syntex)、チロフィバン(tirofiban)(AGGRASTAT(登録商標)、Merck)、エプチフィバチド(eptifibatide)(INTEGRILIN(登録商標)、COR Therapeutics)、アブシキシマブ(abciximab)(REOPRO(登録商標)、EIi LiIIy)、アナグレリド(anagrelide)(AGRYLIN(登録商標)、Roberts)、ジピリダモール(dipyridamole)(PERSANTIN(登録商標)、Boehringer Ingelheim)、アスピリン(ECOTR(登録商標)他)、ジピリダモール/アスピリン(AGGRENOX(登録商標)、Boehringer Ingelheim)、ダルテパリン(dalteparin)(FRAGMIN(登録商標)、Pharmacia)、エノキサパリン(enoxaparin)(LOVENOX(登録商標)、Aventis)、チンザパリン(tinzaparin)(INNOHE(登録商標)、DuPont)、ヘパリン(種々)、ダナパロイド(danaparoid)(ORGANON(登録商標)、Organon)、アンチトロンビンIII(THROMBATE(登録商標)、Bayer)、レピルジン(lepirudin)(REFLUDAN(登録商標)、Hoechst-Marion Roussel)、アルガトロバン(argatroban)(ACOVA(登録商標)、SmithKlineBeecham)、ビバリルジン(bivalirudin)(ANGIOMAX(登録商標)、Medicines Company)、ワルファリン(COUMADIN(登録商標)、DuPont)アニシジオン(anisidione)(MIRADON(登録商標)、Schering)、アルテプラーゼ(alteplase)(ACTIVASE(登録商標)、Genetech)、レテプラーゼ(reteplase)(RETAVASE(登録商標)、Boehringer Mannheim)、テネクテプラーゼ(tenecteplase)(TNKASE(登録商標)、Genentech)、ドロトレコギン(drotrecogin)(XIGRIS(登録商標)、EIi Lilly)、アニストレプラーゼ(anistreplase)(EMINASE(登録商標)、Roberts)、ストレプトキナーゼ(STREPTASE(登録商標)、Astra)、ウロキナーゼ(ABBOKINASE(登録商標)、Abbott)、およびそれらの組み合わせが含まれ得る。
【0104】
本発明の組成物、方法、およびキットと共に使用するのに適している起泡抑制剤には、例えば、モノカルボキシル脂肪酸およびその可溶性塩が含まれ得る。抑泡剤として使用されるモノカルボキシル脂肪酸およびそれらの塩は、炭素原子1〜約50個、炭素原子約10〜約24個、または炭素原子12個〜約18個のヒドロカルビル鎖を有し得る。適当な塩には、ナトリウム塩、カリウム塩、およびリチウム塩のようなアルカリ金属塩、並びにアンモニウム塩およびアルカノールアンモニウム塩が含まれる。付加的な起泡抑制剤には、例えば、パラフィン、脂肪酸エステル(例えば、脂肪酸トリグリセリド)、1価アルコールの脂肪酸エステル、脂肪族C18-C40ケトン(例えば、ステアロン)等のような高分子量炭化水素が含まれる。その他の起泡抑制剤には、炭素原子1〜24個を含有している2または3モルの第一級または第二級アミンにより塩化シアヌルの生成物として形成されたトリ〜ヘキサ-アルキルメラミンまたはジ〜テトラ-アルキルジアミン・クロルトリアジンのようなN-アルキル化アミノ・トリアジン、プロピレン/オキシド、ならびにモノステアリル・アルコール・リン酸エステルおよびモノステアリル・ジアルカリ金属(例えば、K、Na、およびLi)ホスフェートおよびリン酸エステルのようなモノステアリル・ホスフェートが含まれる。パラフィンおよびハロパラフィンのような炭化水素は、液状で利用され得る。好ましくは、約100℃未満の融点を有しているロウ状炭化水素を利用することも既知である。炭化水素は、界面活性剤組成物のための抑泡剤の好ましいカテゴリーを構成する。したがって、炭化水素には、脂肪族、脂環式、芳香族、および複素環式の飽和または不飽和の炭素原子約12〜約70個を有する炭化水素が含まれる。「パラフィン」という用語には、この抑泡剤の考察において使用されるように、真のパラフィンおよび環式炭化水素の混合物が含まれるものとする。
【0105】
抑泡剤のもう一つの例には、シリコン抑泡剤が含まれる。このカテゴリーには、ポリジメチルシロキサンのようなポリオルガノシロキサン油、ポリオルガノシロキサン油または樹脂の分散物または乳濁物、およびポリオルガノシロキサンがシリカへ化学吸着または融合しているポリオルガノシロキサンとシリカ粒子との組み合わせの使用が含まれる。例には、シリコンおよびシリカ−シリコン混合物も含まれるが、これらに制限はされない。シリコンは、一般にアルキル化ポリシロキサン材料により代表され得、シリカは、シリカのエアロゲルおよびキセロゲルならびに様々な型の疎水性シリカにより例証される、微細に粉砕された形態で通常使用される。シロキサン−グリコール・コポリマーであるシリコン泡制御剤DC-544は、Dow Corningより市販されている。その他の好ましい泡制御剤は、シリコン油および2-アルキル-アルカノールの混合物を含む抑泡系である。適当な2-アルキル-アルカノールは、商標lsofol 12(商標)の下で市販されている2-ブチル-オクタノール、およびAerosil(商標)のような溶融非多孔性シリカと組み合わせられたシリコン/シリカ混合物である。
【0106】
抗分散剤の例には、ショ糖、グリセロール、およびグリセリンが含まれるが、これらに制限はされない。
【0107】
本発明の組成物と共に使用するのに適しているステロイドには、例えば、任意で、純粋な異性体型(そのような型が存在する場合)、および薬学的に許容される塩の形態であってもよい、ベタメタゾン、クロロプレドニゾン、クロコルトロン(clocortolone)、コルチゾン、デソニド(desonide)、デキサメタゾン、デスオキシメタゾン(desoximetasone)、ジフルプレドネート(difluprednate)、エストラジオール、フルドロコルチゾン(fludrocortisone)、フルメタゾン、フルニソリド(flunisolide)、フルオコルトロン(fluocortolone)、フルプレドニゾロン(fluprednisolone)、ヒドロコルチゾン、メプレドニゾン(meprednisone)、メチルプレドニゾロン、パラメタゾン、プレドニゾロン、プレドニゾン、プレグナン-3-α-オール-20-オン、テストステロン、およびトリアムシノロン、エストラジオール、エストロン、エストリオール、ポリエストラジオール、ポリエストリオール(polyestriol)、ジエネストロール(dienestrol)、ジエチルスチルベストロール、ジヒドロエルゴステロン(dihydroergosterone)、シプロテロン(cyproteron)、ダナゾール(danazol)、テストステロン、プロゲステロン、ノルエチンドロン(norethindrone)、レボノルゲストロール(levonorgestrol)、エチノジオール(ethynodiol)、ノルゲスチメート(norgestimate)、ゲスタニン(gestanin)、3-ケトン-デソゲストレル(desogestrel)、デメゲストン(demegestone)、プロメトエストロール(promethoestrol)、テストステロン、スピロノラクトン、およびそれらのエステル、ブデソニド(budesonide)、ロフレポニド(rofleponide)、パルミチン酸ロフレポニド、シクレソニド(ciclesonide)、フロ酸モメタゾン(momethasone furoate)、プロピオン酸フルチカゾン、チプレダン(tipredane)、フルオシノロン(fluocinolone)アセトニド、フルニソリド(flunisolide)、フルメタゾン、デキサメタゾン、プロピオン酸ベクロメタゾン(beclomethasone dipropionate)、デフラザコルト(deflazacort)、コルチバゾール(cortivazol)、コルチゾールおよび/またはヒドロコルチゾール、プレドニゾン、酢酸フルオロメトロン(fluorometholone acetate)、デキサメタゾン・リン酸ナトリウム(dexamethasone sodium phosphate)、スプロフェン(suprofen)、フルオロメトロン(fluorometholone)、ならびにメドリゾン(medrysone)が含まれ得る。
【0108】
本発明の組成物と共に使用するのに適している抗炎症剤には、ステロイド性抗炎症剤および非ステロイド性抗炎症剤の両方が含まれ得る。適当なステロイド性抗炎症剤には、ヒドロコルチゾン、ヒドロキシルトリアムシノロン・αメチル・デキサメタゾン(hydroxyltriamcinolone alphamethyl dexamethasone)、リン酸デキサメタゾン、プロピオン酸ベクロメタゾン、吉草酸クロベタゾール、デソニド、デスオキシメタゾン、酢酸デオキシコルチコステロン、デキサメタゾン、ジクロリゾン(dichlorisone)、酢酸ジフロラゾン(diflorasone diacetate)、吉草酸ジフルコルトロン(diflucortolone)、フルアドレノロン(fluadrenolone)、フルクラロロン・アセトニド(fluclarolone acetonide)、フルドロコルチゾン、ピバル酸フルメタゾン、フルオシノロン・アセトニド、フルオシノニド(fluocinonide)、フルコルチン・ブチルエステル(flucortine butylester)、フルオコルトロン、酢酸フルプレドニデン(fluprednidene)(フルプレドニリデン(fluprednylidene))、フルランドレノロン(flurandrenolone)、ハルシノニド(halcinonide)、酢酸ヒドロコルチゾン、酪酸ヒドロコルチゾン、メチルプレドニゾロン、トリアムシノロン・アセトニド、コルチゾン、コルトドキソン(cortodoxone)、フルセトニド(flucetonide)、フルドロコルチゾン、酢酸ジフルオロゾン(difluorosone diacetate)、フルラドレナロン・アセトニド(fluradrenalone acetonide)、メドリゾン、アムシアフェル(amciafel)、アムシナフィド(amcinafide)、ベタメタゾンおよびそのエステルのバランス、クロルプレドニゾン(chlorprednisone)、酢酸クロルプレドニゾン、クロコルテロン(clocortelone)、クレシノロン(clescinolone)、ジクロリゾン(dichlorisone)、ジフルプレドネート、フルクロロニド(flucloronide)、フルニゾリド(flunisolide)、フルオロメタロン(fluoromethalone)、フルペロロン(fluperolone)、フルプレドニゾロン(fluprednisolone)、吉草酸ヒドロコルチゾン、シクロペンチルプロピオン酸ヒドロコルチゾン(hydrocortisone cyclopentylproprionate)、ヒドロコルタメート(hydrocortamate)、メプレドニゾン、パラメタゾン、プレドニゾロン、プレドニゾン、プロピオン酸ベクロメタゾン、プロピオン酸ベタメタゾン、トリアムシノロン、およびそれらの混合物のような副腎皮質ステロイドが含まれ得るが、これらに制限はされない。
【0109】
本発明の組成物において有用な抗炎症剤の第二のクラスには、非ステロイド性抗炎症剤が含まれる。この群に包含される多様な化合物は、当業者に周知である。本発明の組成物において有用な適当な非ステロイド性抗炎症剤には、ピロキシカム(piroxicam)、イソキシカム(isoxicam)、トネキシカム(tonexicam)、スドキシカム(sudoxicam)、およびCP-14,304のようなオキシカム;サリチル酸、アスピリン、ジサルシド(disalcid)、ベノリレート(benorylate)、トリリセート(trilisate)、サファプリン(safapryn)、ソルプリン(solprin)、ジフルニサル(diflunisal)、およびフェンドサル(fendosal)のようなサリチレート;ジクロフェナク、フェンクロフェナク(fenclofenac)、インドメタシン、スリンダク、トルメチン(tolmetin)、イソキセパク(isoxepac)、フロフェナク(furofenac)、チオピナク(tiopinac)、ジドメタシン(zidometacin)、アセマタシン(acematacin)、フェンチアザク(fentiazac)、ゾメピラクト(zomepiract)、クリダナク(clidanac)、オキセピナク(oxepinac)、およびフェルビナク(felbinac)のような酢酸誘導体;メフェナム酸、メクロフェナム(meclofenamic)酸、フルフェナム(flufenamic)酸、ニフルム(niflumic)酸、およびトルフェナム(tolfenamic)酸のようなフェナメート;イブプロフェン、ナプロキセン、ベノキサプロフェン(benoxaprofen)、フルルビプロフェン、ケトプロフェン、フェノプロフェン、フェンブフェン、インドプロフェン(indoprofen)、ピルプロフェン(pirprofen)、カルプロフェン(carprofen)、オキサプロジン、プラノプロフェン、ミロプロフェン(miroprofen)、チオキサプロフェン(tioxaprofen)、スプロフェン(suprofen)、アルミノプロフェン(alminoprofen)、およびチアプロフェン酸(tiaprofenic)のようなプロピオン酸誘導体;ならびにフェニブタゾン(phenybutazone)、オキシフェンブタゾン、フェプラゾン(feprazone)、アザプロパゾン(azapropazone)、およびトリメタゾン(trimethazone)のようなピラゾールが含まれるが、これらに制限はされない。これらの非ステロイド性抗炎症剤の混合物、ならびにこれらの薬剤の薬学的に許容される塩およびエステルも利用され得る。
【0110】
本発明の製剤の皮下注射後の炎症による不快症状を減少させるため、本発明の薬理活性界面活性剤組成物と共に使用するのに適している鎮痛剤には、注射可能な局所的なアミンおよびエステル麻酔剤が含まれるが、これらに制限はされない。鎮痛剤の非制限的な例には、リドカイン、メピバカイン、ブピバカイン、プロカイン、クロロプロカイン、エチドカイン、プリロカイン、ジクロニン、ヘキシルカイン(hexylcaine)、プロカイン、コカイン、ケタミン、プラモキシン(pramoxine)、プロポフォール(propophol)、フェノール、およびテトラカインが含まれる。これらの鎮痛剤の混合物、ならびにこれらの薬剤の薬学的に許容される塩およびエステルも利用され得る。鎮痛剤のその他の例には、オピオイドが含まれる。オピオイドの例には、モルフィン、または硫酸塩、塩化物、もしくは塩酸塩のようなその塩が含まれる。本発明において使用され得るその他の1,4-ヒドロキシモルフィナン(hydroxymorphinan)オピオイド鎮痛剤には、ナロキソン、メペリジン、ブトルファノール、もしくはペンタゾシンのようなもの、またはモルフィン-6-グルノロニド、コデイン、ジヒドロコデイン、ジアモルフィン(diamorphine)、デキストロプロポキシフェン(dextropropoxyphene)、ペチジン、フェンタニル、アルフェンタニル、アルファプロジン、ブプレノルフィン、デキストロモラミド(dextromoramide)、ジフェノキシレート、ジピパノン(dipipanone)、ヘロイン(ジアセチルモルフィン)、ヒドロコドン(ジヒドロコデイノン(dihydrocodeinone))、ヒドロモルフォン(hydromorphone)(ジヒドロモルフィノン(dihydromorphinone))、レボルファノール(levorphanol)、メプタジノール(meptazinol)、メサドン、メトポン(metopon)(メチルジヒドロモルフィノン)、ナルブフィン、オキシコドン(ジヒドロヒドロキシコデイノン(dihydrohydroxycodeinone))、オキシモルフォン(ジヒドロヒドロキシモルフィノン(dihydrohydroxymorphinone))、フェナドキソン(phenadoxone)、フェナゾシン、レミフェンタニル、トラマドール、またはこれらのいずれかの塩が含まれる。本発明の方法において使用されるオピオイドには、上記化合物の任意の組み合わせも含まれ得る。ナロキソンも、オピオイドの定義に含まれる。使用され得る特に好ましい鎮痛剤には、ヒドロモルフォン、オキシコドン、モルフィン、例えば、硫酸モルフィン、およびフェンタニル、ならびに/または薬学的に許容されるそれらの塩が含まれる。
【0111】
本発明のキットまたは組成物に含まれ得る適当な精神安定剤および鎮静薬には、クロルジアゼポキシド(chlordiazepoxide)、ベナクチジン(benactyzine)、ベンズキナミド(benzquinamide)、フルラゼパム(flurazepam)、ヒドロキシジン(hydroxyzine)、ロキサピン(loxapine)、プロマジン(promazine)、ならびに/またはそれらの許容される塩およびエステルが含まれ得る。
【0112】
本発明のキットまたは組成物に含まれ得る適当な筋弛緩剤には、シンナメドリン(cinnamedrine)、シクロベンザプリン(cyclobenzaprine)、フラボキサート(flavoxate)、オルフェナドリン(orphenadrine)、パパベリン(papaverine)、メベベリン(mebeverine)、イダベリン(idaverine)、リトドリン(ritodrine)、デフェノキシラート(dephenoxylate)、ダントロレン(dantrolene)、アズモレン(azumolene)、および/またはそれらの薬学的に許容される塩が含まれ得る。
【0113】
本発明のキットまたは組成物に含まれ得る適当な止痢薬には、例えば、ロペラミド(loperamide)および/またはその薬学的に許容される塩が含まれ得る。
【0114】
第二の治療剤は、一つまたは複数の本明細書中の薬理活性界面活性剤と共製剤化され、かつ/または共投与され得る。そのような共製剤において、第二の治療剤は、w/w、w/v、またはv/vで、20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、0.5%、0.4%、0.3%、0.2%、0.1%、0.09%、0.08%、0.07%、0.06%、0.05%、0.04%、0.03%、0.02%、0.01%、0.009%、0.008%、0.007%、0.006%、0.005%、0.004%、0.003%、0.002%、0.001%、0.0009%、0.0008%、0.0007%、0.0006%、0.0005%、0.0004%、0.0003%、0.0002%、または0.0001%未満の濃度で存在し得る。
【0115】
いくつかの態様において、第二の治療剤は、一つまたは複数の本明細書中の薬理活性界面活性剤と共製剤化され得る。そのような共製剤において、第二の治療剤は、w/w、w/v、またはv/vで、20%、19.75%、19.50%、19.25% 19%、18.75%、18.50%、18.25% 18%、17.75%、17.50%、17.25% 17%、16.75%、16.50%、16.25% 16%、15.75%、15.50%、15.25% 15%、14.75%、14.50%、14.25% 14%、13.75%、13.50%、13.25% 13%、12.75%、12.50%、12.25% 12%、11.75%、11.50%、11.25% 11%、10.75%、10.50%、10.25% 10%、9.75%、9.50%、9.25% 9%、8.75%、8.50%、8.25% 8%、7.75%、7.50%、7.25% 7%、6.75%、6.50%、6.25% 6%、5.75%、5.50%、5.25% 5%、4.75%、4.50%、4.25%、4%、3.75%、3.50%、3.25%、3%、2.75%、2.50%、2.25%、2%、1.75%、1.50%、125%、1%、0.5%、0.4%、0.3%、0.2%、0.1%、0.09%、0.08%、0.07%、0.06%、0.05%、0.04%、0.03%、0.02%、0.01%、0.009%、0.008%、0.007%、0.006%、0.005%、0.004%、0.003%、0.002%、0.001%、0.0009%、0.0008%、0.0007%、0.0006%、0.0005%、0.0004%、0.0003%、0.0002%、または0.0001%超の濃度で存在し得る。
【0116】
いくつかの態様において、第二の治療剤は、最終製剤が、w/w、w/v、またはv/vで、およそ0.001%〜およそ50%、およそ0.001%〜およそ40%、およそ0.01%〜およそ30%、およそ0.02%〜およそ29%、およそ0.03%〜およそ28%、およそ0.04%〜およそ27%、およそ0.05%〜およそ26%、およそ0.06%〜およそ25%、およそ0.07%〜およそ24%、およそ0.08%〜およそ23%、およそ0.09%〜およそ22%、およそ0.1%〜およそ21%、およそ0.2%〜およそ20%、およそ0.3%〜およそ19%、およそ0.4%〜およそ18%、およそ0.5%〜およそ17%、およそ0.6%〜およそ16%、およそ0.7%〜およそ15%、およそ0.8%〜およそ14%、およそ0.9%〜およそ12%、およそ1%〜およそ10%の範囲内にある濃度の第二の治療剤を有するよう、一つまたは複数の本明細書中の薬理活性界面活性剤と共製剤化され得る。最終濃度は、標的部位の位置およびサイズを含む(がこれらに制限はされない)当業者に公知の多くの要因に依存することが理解される。
【0117】
いくつかの態様において、本明細書中の組成物は、10g、9.5g、9.0g、8.5g、8.0g、7.5g、7.0g、6.5g、6.0g、5.5g、5.0g、4.5g、4.0g、3.5g、3.0g、2.5g、2.0g、1.5g、1.0g、0.95g、0.9g、0.85g、0.8g、0.75g、0.7g、0.65g、0.6g、0.55g、0.5g、0.45g、0.4g、0.35g、0.3g、0.25g、0.2g、0.15g、0.1g、0.09g、0.08g、0.07g、0.06g、0.05g、0.04g、0.03g、0.02g、0.01g、0.009g、0.008g、0.007g、0.006g、0.005g、0.004g、0.003g、0.002g、0.001g、0.0009g、0.0008g、0.0007g、0.0006g、0.0005g、0.0004g、0.0003g、0.0002g、または0.0001g未満の一つまたは複数の本明細書中の第二の治療剤を含むか、から本質的になるか、またはからなる。
【0118】
いくつかの態様において、本明細書中の組成物は、0.0001g、0.0002g、0.0003g、0.0004g、0.0005g、0.0006g、0.0007g、0.0008g、0.0009g、0.001g、0.0015g、0.002g、0.0025g、0.003g、0.0035g、0.004g、0.0045g、0.005g、0.0055g、0.006g、0.0065g、0.007g、0.0075g、0.008g、0.0085g、0.009g、0.0095g、0.01g、0.015g、0.02g、0.025g、0.03g、0.035g、0.04g、0.045g、0.05g、0.055g、0.06g、0.065g、0.07g、0.075g、0.08g、0.085g、0.09g、0.095g、0.1g、0.15g、0.2g、0.25g、0.3g、0.35g、0.4g、0.45g、0.5g、0.55g、0.6g、0.65g、0.7g、0.75g、0.8g、0.85g、0.9g、0.95g、1g、1.5g、2g、2.5、3g、3.5、4g、4.5g、5g、5.5g、6g、6.5g、7g、7.5g、8g、8.5g、9g、9.5g、または10g超の一つまたは複数の本明細書中の第二の治療剤を含むか、から本質的になるか、またはからなる。
【0119】
いくつかの態様において、本明細書中の組成物は、0.0001〜10g、0.0005〜9g、0.001〜8g、0.005〜7g、0.01〜6g、0.05〜5g、0.1〜4g、0.5〜4g、または1〜3gの一つまたは複数の本明細書中の第二の治療剤を含むか、から本質的になるか、またはからなる。
【0120】
薬学的製剤
本発明の組成物のための薬理学的に許容される水性媒体には、例えば、界面活性剤を溶解させることができ、製剤を受容する特定の個体に対して毒性でない任意の液体溶液が含まれ得る。薬学的に許容される水性媒体の例には、非制限的に、生理食塩水、水、および酢酸が含まれる。典型的には、薬学的に許容される水性媒体は、無菌である。
【0121】
本発明の態様において有用な薬理活性界面活性剤組成物は、局所的な脂肪沈着物の非外科的な減少のため製剤化される。本明細書において使用されるように、「非外科的な」とは、切開を必要としない医学的な手技をさす。注射は、非外科的な手技の例である。脂肪吸引は、外科的な手技である。
【0122】
本発明の一つの態様において、薬理活性界面活性剤組成物は、注射、例えば、ボーラス注射により投与される。有効であるためには、界面活性剤組成物は、如何にして注入されるかに関わらず、脂肪組織と直接接触しなければならない。界面活性剤製剤は、皮下注射されるか、または脂肪に直接注入され得る。注射用の製剤は、単位剤形、例えば、アンプルで、または保存剤が添加された多重用量(multi-dose)容器で提示され得る。組成物は、油性または水性の媒体による懸濁物、溶液、または乳濁剤のような形態をとることができ、懸濁化剤、安定剤、および/または分散剤のような製剤化用の薬剤を含有していてもよい。
【0123】
「薬学的に許容される賦形剤」が本明細書において使用され得、それは、一般に安全で、非毒性で、生物学的にも他の面からも有害でない、薬学的組成物の調製において有用な化合物をさし、獣医学的使用またはヒトにおける薬学的使用のために許容される賦形剤を含む。本明細書および特許請求の範囲において使用されるように、薬学的に許容される賦形剤には、一つのそのような賦形剤および複数のそのような賦形剤の両方が含まれる。適当な賦形剤のいくつかの例には、乳糖、デキストロース、ショ糖、ソルビトール、マンニトール、デンプン、アラビアゴム、リン酸カルシウム、アルギン酸塩、トラガカントゴム、ゼラチン、ケイ酸カルシウム、微晶質セルロース、ポリビニルピロリドン、ホスファチジルコリン、セルロース、滅菌水、シロップ、およびメチル・セルロースが含まれる。製剤は、さらに、以下のものを含み得る:タルク、ステアリン酸マグネシウム、および鉱油のような滑択剤;湿潤剤;乳化剤および懸濁化剤;ならびに安息香酸メチルおよびヒドロキシ安息香酸プロピルおよびベンジルアルコールのような保存剤。本発明の組成物は、当技術分野において既知の手法を利用することにより、患者への投与後の活性成分の迅速な放出、持続的な放出、または遅延型の放出を提供するよう製剤化され得る。
【0124】
本発明の界面活性剤組成物と共に製剤化するのに適している付加的な賦形剤には、浸透増強剤および分散剤が含まれる。組織における薬物の分散を可能にする分散剤の非制限的な例には、ヒアルロニダーゼおよびコラゲナーゼが含まれる。ヒアルロニダーゼは、他の薬物の組織透過性および拡散または分散を強化するよう機能する。コラゲナーゼは、皮下脂肪から脂肪細胞を単離するために使用されており、脂肪細胞自体に対しては溶解効果を及ぼさない。さらに、ヒアルロニダーゼおよびコラゲナーゼは、本発明の界面活性剤製剤による処置後の壊死組織の減少を加速することにより、治癒を促進することができる。
【0125】
本発明の薬理活性界面活性剤組成物は、下眼瞼脂肪ヘルニア、腰部、股関節部、およびその他の化粧区域の蓄積、眼瞼黄板症、脂肪腫、および「バッファロー瘤」脂肪異栄養を含む脂肪異栄養を含むが、これらに制限はされない、局所的な脂肪蓄積を処置するのに有用である(3)。もう一つの態様において、本発明の界面活性剤組成物は、セルライトに関連した脂肪沈着物を処置するのに有用である。
【0126】
方法
本発明は、哺乳動物における皮下脂肪沈着物を減少させる方法にも関する。そのような方法は、本明細書中の組成物または用量単位のうちの一つまたは複数を哺乳動物における脂肪沈着物へと局所投与することを含むか、から本質的になるか、またはからなる。例えば、一つの態様において、500mL未満の溶液が、減少させるべき脂肪沈着物へと局所送達される。その溶液は、本明細書に開示されたもののような薬理活性界面活性剤(好ましくは、デオキシコール酸ナトリウムのような胆汁酸塩)を含むか、から本質的になるか、またはからなる。その溶液は、好ましくは、5%w/v未満のホスファチジルコリンを含むか、またはより好ましくはホスファチジルコリンを含まない。
【0127】
本発明のいくつかの態様において、上記の方法は、患者における一つまたは複数の局所的な脂肪沈着物の非外科的な除去のため提供される。例えば、一つの態様において、本明細書中の非外科的な方法は、脂肪吸引を含まない。いくつかの態様において、本明細書中の方法は、脂肪を減少させるための非侵襲的な手段、例えば、超音波処理も排除する。その他の態様において、非侵襲的な手段が、本明細書中の組成物と共に使用されてもよい。
【0128】
処置される患者は、好ましくは、哺乳動物である。そのような哺乳動物は、ヒト、または霊長類(例えば、サル、チンパンジー等)、家畜(例えば、イヌ、ネコ、ウマ等)、養殖動物(例えば、ヤギ、ヒツジ、ブタ、ウシ等)、もしくは実験動物(例えば、マウス、ラット等)のような動物であり得る。好ましくは、処置される患者は、ヒト、ウマ、イヌ、またはネコである。
【0129】
本明細書中の組成物は、例えば、脂肪腫、ヘルニア、ダーカム病、マーデルング頸、脂肪浮腫、圧力原性結節、眼瞼黄板症、脂肪異栄養、およびセルライトのような障害を含む患者における任意の脂肪状態を処置するために使用され得る。その他の態様において、本明細書中の組成物は、哺乳動物の目の下、顎の下、腕の下、殿部、腓、背部、大腿、足首、または胃部に局在する脂肪沈着物のような区域における脂肪状態を処置するために使用され得る。
【0130】
本明細書中の脂肪可溶化組成物は、好ましくは、局所注射を介して投与される。しかしながら、本明細書中の組成物を投与するその他の手段も企図される。例えば、本明細書中の組成物は、皮膚パッチまたは皮下デポー(depot)を介して投与され得る。
【0131】
一般に、投与される処置の全容量、単位用量、および数は、標的部位における脂肪の量、標的部位の位置、脂肪組成の型、および所望の結果に依って変動するであろう。一般に、処置される脂肪の量が多いほど、投与される用量も多くなる。本明細書中の組成物および単位投薬量は、処置計画の一部として個体に投与され得るが、処置計画の一部として個体から除去されないことに注意するべきである。
【0132】
従って、本発明は、一つまたは複数の薬理活性界面活性剤を含むか、から本質的になるか、またはからなる脂肪可溶化組成物を、有効量、哺乳動物に投与することにより、哺乳動物における皮下脂肪の量を減少させる方法を企図する。上記のものは、好ましくは、経皮的にまたは皮下に、例えば、注射器を使用した皮下注射を介して、標的部位へと投与される。標的部位は、例えば、0.1cm×0.1cm〜約5cm×5cmであり得る。本明細書中の組成物は、本明細書に開示されたような様々な間隔、投薬量、容量で、同一の、隣接した、または近傍の標的部位へと投与され得る。
【0133】
本発明は、哺乳動物における局所的な脂肪沈着物の非外科的な減少のための組成物および方法を提供する。一つの態様において、本明細書中の方法は、脂肪を可溶化する濃度の一つまたは複数の薬理活性界面活性剤を含む薬学的に許容される注射可能溶液の投与を含む。本発明の目的のため、非外科的な脂肪減少の方法は、脂肪吸引、脂肪形成術、または吸引脂肪組織切除を含まない。
【0134】
好ましくは、本明細書中の方法は、(例えば、吸引を介した)薬理活性界面活性剤の非積極的な除去を排除する。
【0135】
上記の方法は、いずれも、患者に第二の治療剤をさらに投与することにより補足され得る。第二の治療剤は、別々に、または本明細書中の組成物と組み合わせて投与され得る。第二の治療剤は、局所投与または全身投与され得る。いくつかの態様において、第二の治療剤は、界面活性剤と共製剤化され、本明細書中の界面活性剤と同時に投与される。他において、第二の治療剤のうちの一つまたは複数は、本明細書中の界面活性剤の投与より前に投与される。
【0136】
上記のものは、1回または複数回、標的部位へと投与され得る。いくつかの態様において、本明細書中の組成物は、少なくとも1、2、3、4、5、6、7、8、9、または10回、標的部位へと投与される。複数回の投与は、1時間以内、1日以内、1週間以内、1ヶ月以内、または1年以内に行われ得る。好ましくは、単一標的部位への複数回投与は、1年に10、9、8、7、6、5、4、3、もしくは2回未満、1ヶ月に10、9、8、7、6、5、4、3、もしくは2回未満、1週間に10、9、8、7、6、5、4、3、もしくは2回未満、1日に10、9、8、7、6、5、4、3、または2回未満、または1時間に10、9、8、7、6、5、4、3、もしくは2回未満、行われ得る。いくつかの態様において、患者は、一つの標的部位において1〜100回、2〜50回、3〜30回、4〜20回、または5〜10回の注射を受ける。この回数の注射が、1年、6ヶ月、5ヶ月、4ヶ月、3ヶ月、2ヶ月、1ヶ月、3週間、2週間、もしくは1週間、またはそれ未満の期間にわたり行われ得る。
【0137】
組成物は、例えば、真皮の0.1〜4インチ下、0.5〜3インチ下、1〜2インチ下を含む、真皮下の様々なレベルに投与され得る。
【0138】
組成物は、様々な容量で投与され得るが、好ましくは、注射1回当たり50mL、40mL、30mL、20mL、10mL、9mL、8mL、7mL、6mL、5mL、4mL、3mL、2mL、1mL、0.1mL、0.01mL未満の全容量で投与され得る。
【0139】
キット
図7は、脂肪吸引を使用しない哺乳動物における皮下脂肪蓄積の減少のためのキット101の例示である。キットは、一つまたは複数の第一の容器102を含む。第一の容器102は、本明細書中の組成物のうちのいずれかを含むか、から本質的になるか、またはからなる。例えば、第一の容器は、薬理活性界面活性剤および5%未満のw/vホスファチジルコリンを含むか、から本質的になるか、またはからなることができる。
【0140】
上記のものは、溶液で、またはより好ましくは注射可能溶液で調製され得る。そのような溶液を含む第一の容器102は、一つまたは複数の単位用量を保持するために十分な容量を有し得る。例えば、第一の容器102は、500mL、100mL、20mL、10mL、または5mL未満の溶液を保持するよう適合化され得る。いくつかの態様において、第一の容器102は、約0.01ml〜約100ml、約0.1ml〜約90ml、約0.5ml〜約80ml、約1ml〜約70ml、約2ml〜約60ml、約3ml〜約50ml、約4ml〜約40ml、約5ml〜約30ml、約6ml〜約20ml、ならびに約7ml〜約10mlの容量を保持する。より好ましい態様において、第一の容器102は、約10〜約20mlの容積を有するアンプルである。
【0141】
いくつかの態様において、界面活性剤およびオプション・ホスファチジルコリンは、徐放のための皮膚パッチまたはデポーへと製剤化される。パッチまたはデポーにおける投薬量は、本明細書に記述されたものと同様であり得る。
【0142】
第一の容器102は、任意で、一つまたは複数の第二の治療剤を含み得る。好ましくは、第一の容器102は、鎮痛剤、抗微生物剤、または抗炎症剤を含む。第一の容器102は、第二の界面活性剤を含んでいてもよい。界面活性剤の例は、本明細書に記載されている。
【0143】
第一の容器102は、好ましくは、5%w/v未満のホスファチジルコリンのようなリン脂質を有する。いくつかの態様において、第一の容器102は、リン脂質またはホスファチジルコリンを含有していない。
【0144】
第一の容器102は、好ましくは、w/w、w/v、またはv/vで0.01%、0.1%、1.0%、2.0%、3.0%、4.0%、または5.0%超の薬理活性界面活性剤を有する。好ましくは、第一の容器102の中の薬理活性界面活性剤の濃度は、そのミセル濃度を超えている。いくつかの態様において、該薬理活性界面活性剤の%w/v濃度は、該リン脂質またはホスファチジルコリンの%w/v濃度より大きい。
【0145】
容器102の溶液は、使用説明103に従って投与される。使用説明103は、例えば、標的部位、処置される哺乳動物、所望の結果、標的部位の位置、溶液の濃度、脂肪沈着のサイズに依って異なる、投薬のための説明を提供することができる。好ましくは、使用説明103は、ヒト、イヌ、ネコ、またはウマのような哺乳動物の処置のためのものである。使用説明103は、その他の家畜および/または養殖動物の処置のための情報も含み得る。
【0146】
使用説明103は、例えば、哺乳動物の目の下、顎の下、腕の下、殿部、腓、背部、大腿、足首、または胃部に局在する脂肪沈着物のような特定の標的部位を処置するための本明細書中の組成物の使用についての情報も含み得る。いくつかの態様において、使用説明103は、瞼脂肪ヘルニア、脂肪腫、脂肪異栄養、バッファロー瘤脂肪異栄養、またはセルライトに関連した脂肪沈着物である脂肪沈着物を処置するための本明細書中の組成物の使用のための説明を詳述する。
【0147】
使用説明103は、第一の容器102および/または第二の容器105の希釈(もしあれば)のための適切な希釈剤および容量に関する情報を含むかもしれない。使用説明103は、投与の頻度および投薬量のような、本明細書中の組成物の適切な投与に関する情報も提供するかもしれない。
【0148】
キット101は、第一の容器102の中の組成物を皮下脂肪蓄積領域へと送達するための、注射器またはその他の適当な送達デバイス(例えば、パッチ、皮下デポー)104をさらに含み得る。いくつかの態様において、注射器または送達デバイス104には、単位用量の本発明の溶液が予め負荷されていてもよい。
【0149】
キット101は、第二の活性薬剤を含む第二の容器105をさらに含み得る。第二の治療剤の例には、例えば、抗微生物剤、抗血栓剤、抗凝固剤、起泡抑制剤、抗炎症剤、鎮痛剤、麻酔剤、抗分散剤、分散剤、浸透増強剤、ステロイド、精神安定剤、筋弛緩剤、および止痢剤が含まれる。
【0150】
以下の実施例は、本発明の組成物および方法をより正確に定義し可能にするために提供される。この明細書および実施例を参照し理解した後には、多数のその他の態様および本発明を使用する方法が、当業者にとって明白な態様となるであろうことが理解される。以下の実施例は、本発明の一つまたは複数の態様を例示するためのものであって、本発明を下記のものへと制限するためのものではない。
【実施例】
【0151】
実施例1
デオキシコール酸ナトリウムおよびホスファチジルコリンの製剤
ホスファチジルコリン胆汁酸塩製剤(PBF)(5.0%高度精製大豆由来PC、4.75%デオキシコール酸ナトリウム、および0.9%ベンジルアルコールを含む滅菌水、表2)は、Hopewell Pharmacy,Hopewell,NJから入手された。デオキシコール酸ナトリウムおよびTriton(登録商標)X-100界面活性剤(Triton(登録商標)、アルキルアリール・ポリエーテル・アルコール)は、Sigma-Aldrich Corp.(St.Louis,MO)から入手された。Empigen(登録商標)BB界面活性剤(Empigen(登録商標)、ラウリルジメチルベタイン、Calbiochem,Biosciences,Inc.,La JoIIa,CA)。ストック試薬(5%希釈)をPBS緩衝液で調製した。
【0152】
(a)ホスファチジルコリン、(b)デオキシコール酸ナトリウム、および(c)ベンジルアルコールの分子構造は、図1に図示される。
【0153】
(表2)注射可能PBF

【0154】
実施例2
培養細胞におけるデオキシコール酸ナトリウムおよびホスファチジルコリンの溶液の効果
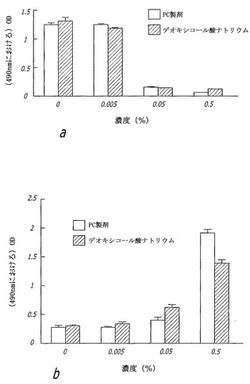
界面活性剤処置後の細胞生存率を測定するため、HaCaTヒト・ケラチノサイト細胞を、10%ウシ胎仔血清、ペニシリン、およびストレプトマイシンが補足されたDMEM(ダルベッコ改変イーグル培地)で培養した。HaCaT細胞を6穴プレートで培養し、37℃で30分間、0%、0.005%、0.050%、または0.500%のPBF(PC処方)またはデオキシコール酸ナトリウムと共にインキュベートした後、代謝活性を有する細胞により生物還元(bioreduced)された場合に色の変化を生ずるテトラゾリウム化合物を使用するMTSアッセイ(CellTiter 96(登録商標)AQueous Non-Radioactive Cell Proliferation Assay,Promega,Corp.Madison,WI)を使用して、細胞生存率を決定した。細胞生存率は、37℃においてアッセイと共に4時間インキュベートした後、(490nmで)吸光度分光光度計により決定された。新鮮な組織における細胞生存率を決定するため、脂肪標本を、ストック試薬およびMTSアッセイと共に24穴プレートで4時間インキュベートした。次いで、組織標本を色変化について可視化し、それらの上清中のMTSの量を(490nmにおける)吸光度により測定した。全ての研究をトリプリケートで実施した。490nmにおける吸光度(OD 490)は、培養物中の生存細胞の数に比例する。対照におけるOD 490と、0.005%希釈の両化合物におけるOD 490は比較可能であり(図2a)、このことから、この濃度においては、これらの物質の細胞生存率に対する効果はほとんどないことが示された。細胞生存率は、両溶液の0.05%および0.5%の濃度では次第に減少した。
【0155】
界面活性剤処置に応答して起こる細胞溶解を、37℃で30分間、示された細胞希釈率で試薬と共にインキュベートされたHaCaT細胞において決定した。乳酸デヒドロゲナーゼ放出を、製造業者により推奨されるようにして、LDHアッセイ(CytoTox 96(登録商標)Non-Radioactive Cytotoxicity Assay,Promega)と共に1時間インキュベートした後、(490nmにおける)吸光度により測定した。全ての研究をトリプリケートで実施した。LDH放出は、490nmにおける吸光度(OD 490)に直接比例する。対照細胞、および0.005%希釈の両化合物と共にインキュベートされた細胞からは最小のLDH放出が存在した(図2b)。PBFおよびデオキシコール酸塩の0.05%および0.5%では、次第に多くのLDHが放出された。
【0156】
実施例3
ブタ組織におけるデオキシコール酸ナトリウムおよびホスファチジルコリンの溶液の効果
ブタ組織を屠殺直後に入手し、体毛を剃り、最大4時間、氷上に置いた後、使用した。パンチ生検材料の表皮および真皮をメスにより除去することにより脂肪標本を入手し、切り取った。Calcein-AM(Sigma)と共に37℃で1時間インキュベートすることにより、脂肪標本にカルセイン色素を負荷した。ストック試薬を脂肪標本に添加し、温和に撹拌しながら37℃で30分間インキュベートした。紫色(411nm)光を使用した組織蛍光、および放射フィルターを使用した放射された緑色(500nm)光の視覚的観察により、カルセイン保持を決定した。
【0157】
1.0mLの注射器および30ゲージ、0.5インチの針を用いて、完全な厚さのブタ皮膚の様々なレベル(表皮、真皮、および皮下組織)へとストック試薬溶液(0.5mL)を注射することにより、組織学を実施した。標的組織を飽和させることを意図して、針の深さを、ブタ組織の端に沿って可視化した。37℃におけるPBSとのインキュベーションの1時間後に、複数の5.0mmの生検標本を、注射された部位から入手した(各条件をトリプリケートで実施した)。組織をホルムアルデヒドで固定し、パラフィン包埋し、ヘマトキシリン−エオシンにより染色した。委員会により承認された、処置プロトコルを承知していない皮膚病理学者が、標本を評価した。
【0158】
新鮮なブタ皮膚を使用して、培養細胞に対するこれらの界面活性物質の効果が、組織においても類似しているか否かを決定した。図3aは、MTSアッセイを使用した、PBS緩衝液(陰性対照)により処置された脂肪組織における濃紫色素の生成(生存可能細胞を示す)を示している。PBF、ならびにデオキシコール酸およびTriton(登録商標)界面活性剤(陽性対照)の5%溶液は、処置された脂肪標本における紫色素の比較可能な欠損(細胞死を示す)を示した。溶液間の脂肪細胞生存率の差を、処置された脂肪標本から収集された上清の(490における)吸光度を測定することにより定量化した(図3b)。全ての試薬が、新鮮な組織の脂肪細胞生存率に対して有意な効果を及ぼした。
【0159】
細胞溶解をカルセイン色素放出アッセイを使用して確認した。カルセインは加水分解後に蛍光性になり、無傷の細胞膜を有する細胞において保持される。それは死細胞を標識せず、細胞溶解を引き起こす条件の下では失われるため、色素カルセインが負荷された脂肪組織試料における緑色蛍光の欠損は、細胞溶解を示す(図4)。デオキシコール酸塩、PBF、およびTriton(登録商標)界面活性剤(陽性対照)により処置された試料は、類似した蛍光の欠損を示した。
【0160】
PBF、デオキシコール酸塩、およびEmpigen(登録商標)の注射に起因する組織学的変化は、図5に示される。ホスファチジルコリン胆汁酸塩製剤(図5b)およびデオキシコール酸塩(図5d)は、二つのよく特徴決定されている実験用界面活性剤Empigen(登録商標)(図5g)およびTriton(登録商標)(示されない)により引き起こされたものに類似した組織学的効果を生じた。これらの変化は、脂肪および筋肉の両方において明白であった。正常な小葉状構造の破壊による脂肪細胞の細胞膜の著しい不鮮明化および溶解が、PBF(図5b)およびデオキシコール酸塩(図5d)両方の注射の後に見られた。図5fは、PBF注射後の筋繊維の混乱および萎縮を示している。筋肉組織における類似した変化が、デオキシコール酸塩ならびにTriton(登録商標)およびEmpigen(登録商標)界面活性剤により処理された標本において可視であった。繊維芽細胞核染色の欠損および皮膚コラーゲンのヒアリン化を引き起こしたEmpigen(登録商標)を例外として、試薬の注射後、表皮、真皮、または付属構造には変化は存在しなかった。
【0161】
実施例4
デオキシコール酸ナトリウム組成物を用いた臨床的経験
脂肪腫(良性、脂肪組織の単離された集団)を有する患者に、ホスファチジルコリンを含まないデオキシコール酸ナトリウム(DC)溶液を脂肪腫に直接注射した。この研究の結果は、動物組織における脂肪に対して見られたデオキシコール酸塩の界面活性剤効果が、ヒトにおいて臨床的に再現可能であることを証明している。多様な濃度のデオキシコール酸塩による少なくとも1回の処置の後、注射された脂肪腫のサイズが全て減少した(表3)。1%DCを注射された1人の患者からの脂肪腫を、処置後に切除し、病理学的および組織学的な分析を実施した。切除された脂肪腫においては、壊死が肉眼で可視であり(図6a)、脂肪腫脂肪の中央へと延びている、外端部のよく画定された出血および壊死の区域が、より明るい色の正常な脂肪腫脂肪と対照をなしている。組織学的分析(図6b)は、隣接した正常な丸形の明らかな脂肪細胞と対照をなす、明確な出血および壊死脂肪ならびに有意な炎症反応の区域を明らかにしている。
【0162】
(表3)DC処置後の脂肪腫のサイズの減少

【0163】
他に示されない限り、明細書および特許請求の範囲において使用された成分の量、分子量のような特性、反応条件等を表す全ての数が、全ての場合に「約」という用語によって修飾されているものと理解されたい。従って、反対のことが示されない限り、以下の明細書および添付の特許請求の範囲において示される数的パラメーターは、本発明によって入手されることが求められる所望の特性に依って変動し得る近似である。少なくとも、そして特許請求の範囲の範囲への均等論の適用を制限する試みとしてではなく、各数的パラメーターは、少なくとも、報告された有効数字の数を考慮して、そして通常の丸め技術を適用することにより解釈されるべきである。本発明の広い範囲を示す数的な範囲およびパラメーターは近似であるにも関わらず、特定の実施例において示された数値サイズ(cm)は、可能な限り正確に報告されている。しかしながら、いかなる数値も、それぞれの試験測定において見出される標準偏差に必然的に起因するある種の誤差を本質的に含有している。
【0164】
本発明の記載に関して(特に、特許請求の範囲に関して)使用される「一つの(a)」および「一つの(an)」および「該、その(the)」という用語ならびに類似した指示対象は、本明細書において他に示されない限り、または情況により明白に否定されない限り、単数および複数の両方を包含するものと解釈されたい。本明細書における値の範囲の列挙は、単に、範囲内に入る別々の各値を個々にさす略記法として用いられているものとする。本明細書において他に示されない限り、個々の値は、各々、あたかも個々に本発明に列挙されたかのごとく、本明細書に組み入れられる。本明細書において他に示されない限り、または情況により明白に否定されない限り、本明細書に記載された全ての方法は、任意の適当な順序で実施され得る。本明細書に提供された全ての任意の例、または例証的な語(例えば、「のような」)の使用は、本発明をよりよく説明するためのものに過ぎず、別途特許請求の範囲に記載される本発明の範囲に制限をかけるものではない。本明細書中の語は、本発明の実施にとって不可欠な任意の特許請求の範囲に記載されていない要素を示すものと解釈されるべきではない。
【0165】
本明細書に開示された本発明の代替的な要素または態様のグループ分けは、制限として解釈されるべきではない。グループの各メンバーは、個々に、またはグループの他のメンバーもしくは本明細書に見出される他の要素と任意に組み合わせられて、言及され、特許請求の範囲に記載され得る。グループの一つまたは複数のメンバーが、便宜および/または特許可能性の理由で、あるグループに含まれてもよいし、または削除されてもよいことが期待される。そのような内含または削除が行われる場合、本明細書は、そのようにして修飾されたグループを含有しており、添付の特許請求の範囲において使用された全てのマーカッシュ・グループの記載を満たすと見なされる。
【0166】
本発明を実施するための、本発明者らが知る最良の形態を含む、本発明の好ましい態様が、本明細書に記載される。当然、これらの好ましい態様の変動は、上記の記載を参照することにより、当業者に明白になるであろう。本発明者は、当業者が、適宜、そのような変動を利用することを予想しており、本発明者らは、本明細書に具体的に記載されたもの以外にも本発明が実施されることを意図している。従って、本発明は、適用可能な法律により許容されるように、本明細書に添付された特許請求の範囲において列挙された主題の全ての修飾および等価物を含む。さらに、本明細書において他に示されない限り、または情況により明白に否定されない限り、全ての可能な変動における上記の要素の任意の組み合わせが、本発明に包含される。
【0167】
さらに、本明細書の全体にわたり、特許および印刷刊行物が多数言及された。上に引用された参照および印刷刊行物は、各々、参照により完全に個々に本明細書に組み入れられる。
【0168】
末尾として、本明細書に開示された本発明の態様は、本発明の原理を例示するものであることを理解されたい。利用され得るその他の修飾は、本発明の範囲内である。従って、制限ではなく例として、本発明の別の配置が、本明細書の教示に従って利用され得る。従って、本発明は、示され記載された通りのものへと制限されない。
【0169】
参考文献


【技術分野】
【0001】
発明の領域
本発明は、局所的な脂肪蓄積の非外科的な除去に有用な組成物および方法に関する。特に、本発明は、外科的介入の必要のない、脂肪除去を必要とする患者の処置部位へと直接注射するのに適している、薬理活性界面活性剤組成物に関する。なお、本願は、参照により本明細書に完全に組み入れられる2004年5月19日出願の米国仮出願第60/572,879号に基づく優先権を主張する。
【背景技術】
【0002】
発明の背景
文末に括弧内に出現する数字は、本明細書の末尾部分に引用された特定の参照をさす。
【0003】
ホスファチジルコリンおよび胆汁酸塩を含有している製剤(ホスファチジルコリン胆汁酸塩製剤、PBF)は、局所的な脂肪蓄積を処置するために利用されることが増えてきている(1〜8)。いくつかの非盲検臨床研究は、下眼瞼脂肪ヘルニアおよび「バッファロー瘤」脂肪異栄養を含む局所的な脂肪蓄積の処置のため、PBFの注射を使用して、有望な結果を報告した(1〜3)。
【0004】
ホスファチジルコリンは、細胞膜の必須成分であり、正常な細胞膜の組成および修復にとって重要な天然リン脂質である。ホスファチジルコリンは、必須栄養素コリンの主要な輸送形態でもある。コリン自体は、神経伝達物質アセチルコリン、メチル供与体ベタイン、ならびに、とりわけホスファチジルコリンおよびスフィンゴミエリンを含むリン脂質の合成における前駆物質である。ホスファチジルコリンは、超低密度リポタンパク質の肝臓搬出にも関与している。
【0005】
胆汁酸塩は、ホスファチジルコリンの水溶性を改良するため、そしてより最近では、アンホテリシンB、Taxol(登録商標)、およびジアゼパムのような薬の水溶性を改良するため、使用されている(9〜14)。高度に精製されたホスファチジルコリンは、迅速に滅菌され、静脈内投与のため使用され得る安定な混合ミセル調製物が形成されるよう、二次胆汁酸塩であるデオキシコール酸ナトリウム、抗微生物薬、ベンジルアルコール、および水と組み合わせられ得る(12)。Essentiale(登録商標)およびLipostabil(登録商標)として公知のこの混合物の薬学的調製物は、それぞれ肝疾患および高脂血症の処置のため他の国々で販売されている(12、15)。
【0006】
Rittesが、皮下脂肪へのPBFの注射が、眼窩下脂肪ヘルニアを減少させることを最初に報告した(1)。それ以来、医師らは、下眼瞼脂肪ヘルニア、ならびに大腿、腹部、背部上部、顎、および腕の脂肪沈着物を処置するために、薬学的調製物または類似の調合PBFを使用してきた(2、3、5)。これらのPBFは、Essentiale(登録商標)およびLipostabil(登録商標)において様々に見出されるdl-α-トコフェロール(ビタミンE)、ビタミンB、およびアデノシン一リン酸をしばしば欠いている(2、16)。
【0007】
ホスファチジルコリン製剤は、局所的な灼熱感、紅斑、一過性のじん麻疹、および様々な程度のそう痒に関連しているが、これらは全て一般的に数日で消散する。潰瘍形成および疼痛という、より重篤な結果も見られている。ある患者の大腿においては、複数回のホスファチジルコリン注射の部位における感染性肉芽腫反応が報告された(7)。注射されるホスファチジルコリンの増加した投薬量は、大用量のLipostabil(登録商標)の経口製剤および静脈内製剤で見られる平行した副作用を有しており、悪心、下痢、腹痛、および失神を含む。
【0008】
ホスファチジルコリンを含有している製剤が、皮下脂肪沈着物の減少を引き起こすメカニズムは未知であるが、いくつかのメカニズムが提唱されている(4)。第一は、ホスファチジルコリンが、リパーゼ活性を刺激することにより、脂肪細胞のサイズを減少させ得るというものである。または、PBFは脂肪細胞の細胞膜を乳化する界面活性剤として機能するという仮説が立てられている。界面活性剤は、特に、硬化療法において一般的に使用される硬化剤として、数十年間、医学において使用されてきた(American College of Phlebology,2003)。界面活性剤は、界面における表面張力を減少させることにより不溶性物質の乳化を促進する、独特の極性化学特性および無極性化学特性を保有している(17)。実際、Triton(登録商標)X-100およびEmpigen(登録商標)BBのような実験用界面活性剤は、細胞膜の脂質二重層を破壊するために一般的に使用されている(10、18〜21)。PBFの二つの主成分であるホスファチジルコリンおよびデオキシコール酸ナトリウムは、これらの独特の化学特性を有しており、従って、界面活性剤または乳化剤として独立に使用されている(9、18、20〜25)。
【0009】
外観を改良するための外科的および非外科的な手技は、集団が加齢し、体重を増すにつれ、普及率が増加した。脂肪吸引は、最も人気のある美容外科手技のうちの一つであり、吸引を使用し、任意で、脂肪除去を補助する溶液によって補助された、脂肪沈着物の外科的な除去を含む。脂肪形成術または吸引脂肪組織切除としても公知の脂肪吸引は、カニューレが挿入された皮膚内の切開部を通して脂肪を除去する外科的手技である。カニューレが吸引源に接続され、不要な脂肪がカニューレを通して吸い出され、廃棄される。脂肪吸引は、除去すべき脂肪の量および位置に依って、全身麻酔または局所麻酔の下で実施される。
【0010】
脂肪吸引の最も一般的に使用されている型は、塩、麻酔剤、および血管収縮剤の混合物を含有している医用溶液が、脂肪組織の吸い出しの前に処置部位へと注入される、液体注射方法論をさらに使用する。その医用溶液は、脂肪がより容易に除去されるのを助け、失血を減少させ、術中および術後の麻酔を提供する。
【0011】
脂肪吸引のための補助溶液の一例として、CapellaおよびCapellaによって1997年4月22日に出願され、1999年4月6日に米国特許第5,891,083号として発行された米国特許は、皮下脂肪を除去するための脂肪吸引および改良された外科的手技のための化合物を含有している担体溶液を教示している。一つの態様において、Capella特許は、化合物が、酵素、特にリパーゼまたはコリパーゼであることを開示している。酵素は、脂肪分解溶液を提供するため、生理食塩水溶液のような担体に添加される。その発明のもう一つの態様において、Capellaは、胆汁酸塩のような乳化剤も、組み合わせられて、または溶液に添加される主要な活性化合物として、有益であるかもしれないことを教示している。Capella発明の全ての態様において、脂肪分解溶液は、溶液が脂肪組織に浸潤することを可能にするため、脂肪吸引の前に、一定期間、投与される。Capellaにおいては、身体から脂肪を除去するための非外科的な手段としての脂肪分解溶液単独の使用は全く開示されていない。Capellaにおいて開示された全ての例および特定の態様において、脂肪吸引が脂肪除去のための外科的手技として使用されており、リパーゼおよび胆汁酸塩は脂肪吸引のための補助剤として提供されている。
【0012】
しかしながら、脂肪吸引およびその他の外科的な脂肪除去法は、一時的な挫傷形成、膨潤、無感覚、圧痛、および灼熱感、感染のリスク、色素沈着の変化;肺に移動し死を引き起こし得る脂肪塊もしくは血塊の形成、ショックに至るかもしれない過度の体液喪失または排液されなければならない体液蓄積、摩擦熱傷もしくはその他の皮膚もしくは神経の傷害、または生命に関わる器官の穿孔傷を含む、重大な有害事象に関連している。さらに、脂肪吸引は、患者が働くことができないか、またはある種の日々の活動を成し遂げることができない、1〜2週間の回復時間を必要とする。さらに、脂肪吸引のような外科的手技は、局所麻酔、時には全身麻酔を必要とするため、重大な麻酔関連リスクが外科的な脂肪除去には関連している。
【0013】
従って、手術または長期の回復時間を必要とせず、現在利用可能な方法より少ない有害副作用を有している、局所的な脂肪蓄積を除去する方法を有することが、望ましいであろう。
【発明の概要】
【0014】
本発明は、皮下脂肪沈着物を減少させるための方法およびキットを提供する。一つの局面において、本発明は、手術の使用なしに哺乳動物における皮下脂肪沈着物を減少させるための、薬理活性界面活性剤および5%w/v未満のホスファチジルコリンを含む第一の容器、ならびに説明書を有するキットを企図する。好ましくは、本明細書中のキットは、例えば、ヒト、ウマ、イヌ、またはネコのような多様な哺乳動物において脂肪沈着物を減少させるために使用され得る。いくつかの態様において、哺乳動物はヒトである。
【0015】
いくつかの好ましい態様において、第一の容器は、500ml未満の全容量を有し、かつ/または注射可能製剤として提供される。その他の好ましい態様において、第一の容器は、ホスファチジルコリンの%w/vより大きい%w/vの界面活性剤を含有しているかもしれないし、またはホスファチジルコリンを含有していないかもしれない。一つの好ましい態様において、本発明は、その臨界ミセル濃度(CMC)を超える濃度の界面活性剤を提供する。キットは、例えば、親油性界面活性剤、親水性界面活性剤、イオン界面活性剤、非イオン界面活性剤、グリセリド、胆汁酸塩、および両性イオン界面活性剤のような多様な薬理活性界面活性剤を含み得る。より好ましい態様において、活性界面活性剤は胆汁酸塩であり、最も好ましくはデオキシコール酸ナトリウムである。本明細書中のキットの中の第一の容器は、いくつかの態様において、3g未満の界面活性剤を含む。その他の態様において、本明細書中のキットの中の第一の容器は、0.0002g超の界面活性剤を含み得る。本明細書中のいずれの態様においても、第一の容器は、第二の界面活性剤をさらに含み得る。
【0016】
好ましくは、第一の容器は、例えば、抗微生物剤、血管収縮剤、抗血栓剤、抗凝固剤、起泡抑制剤、抗炎症剤、鎮痛剤、分散剤、抗分散剤、浸透増強剤、ステロイド、精神安定剤、筋弛緩剤、および止痢剤のような第二の治療剤をさらに含み得る。いくつかの態様において、第二の治療剤は、鎮痛剤、抗微生物剤、または抗炎症剤である。より好ましくは、第二の治療剤は鎮痛剤であり、または最も好ましくはリドカインである。もう一つの態様において、キットは、本明細書に記載されるような第二の治療剤を含む第二の容器を提供する。
【0017】
本発明の一つの態様は、哺乳動物の目、顎、または腕の下、および殿部、腓、背部、大腿、足首、または胃部の脂肪沈着物を減少させるための本明細書中のキットを企図する。もう一つの態様において、キットは、例えば、眼瞼脂肪ヘルニア、脂肪腫、脂肪異栄養、バッファロー瘤脂肪異栄養、またはセルライトに関連した脂肪沈着物のような特定の型の脂肪沈着物を減少させ得る。
【0018】
第二の局面において、本発明は、有効量の薬理活性界面活性剤および5%w/v未満のホスファチジルコリンを含む単位用量を投与することにより、手術なしに、哺乳動物における皮下脂肪沈着物を減少させる方法を提供する。一つの態様において、その方法は、界面活性剤を積極的に除去する工程を含まない。その方法は、本明細書に記載されるような多様な哺乳動物において脂肪沈着物を減少させるために使用され得る。
【0019】
もう一つの態様において、その方法は、有効量の界面活性剤および5%w/v未満のホスファチジルコリンを含む溶液500ml未満を投与する工程を含む。いくつかの好ましい態様において、単位用量は局所投与され、かつ/または少なくとも2回繰り返される。その他の好ましい態様において、単位用量は、ホスファチジルコリンの%w/vより大きい%w/vの界面活性剤を有し、かつ/またはそのCMCを超える濃度の界面活性剤を有する。その方法は、本明細書に記載されるような多様な薬理活性界面活性剤を使用し得る。より好ましい態様において、単位用量の中の活性界面活性剤は、胆汁酸塩であり、最も好ましくはデオキシコール酸ナトリウムである。
【0020】
好ましくは、本明細書中の方法は、第二の界面活性剤および/または第二の治療剤の投与をさらに含み得る。その方法は、本明細書に記載されるような多様な第二の治療剤の投与を含み得る。より好ましくは、第二の治療剤は、鎮痛剤であり、最も好ましくはリドカインである。
【0021】
他の一つの態様は、哺乳動物の目、顎、または腕の下、および殿部、腓、背部、大腿、足首、または胃部の脂肪沈着物を減少させるための、本明細書に記載された一つまたは複数の方法を企図する。もう一つの態様において、その方法は、例えば、眼瞼脂肪ヘルニア、脂肪腫、脂肪異栄養、バッファロー瘤脂肪異栄養、またはセルライトに関連した脂肪沈着物のような特定の型の脂肪沈着物を減少させ得る。
【図面の簡単な説明】
【0022】
【図1】(a)ホスファチジルコリン、(b)デオキシコール酸ナトリウム、および(c)ベンジルアルコールの分子構造を示す。
【図2】本発明の教示による培養細胞生存率に対するホスファチジルコリン胆汁製剤(PC処方、PBF)およびデオキシコール酸ナトリウム単独の効果を示す:(a)PC処方およびデオキシコール酸ナトリウム単独に曝されたケラチノサイトの生存率を測定するMTSアッセイ;(b)PC処方およびデオキシコール酸ナトリウム単独に曝された細胞によるLDH放出を測定する乳酸デヒドロゲナーゼ(LDH)アッセイ。
【図3】本発明の教示による初代ブタ脂肪組織に対するPBFおよびデオキシコール酸ナトリウム単独の効果を示す:(a)陰性対照としてのPBS緩衝液(-対照)、デオキシコール酸ナトリウム単独(DC)、PBF(PC)、および陽性対照としてのTriton(登録商標)界面活性剤(+対照)で処置された脂肪標本における、生存細胞を示す紫色素を生ずるMTSアッセイ;(b)異なる処置間の脂肪細胞生存率の比較。
【図4】本発明の教示によるデオキシコール酸ナトリウム単独(DC)、PBF(PC)、陽性対照としてのTriton(登録商標)界面活性剤(+対照)、および陰性対照としてのPBS緩衝液(-対照)で処置された脂肪標本におけるカルセイン蛍光を示す。
【図5】(a)対照脂肪細胞および(b)PBF注射後の脂肪細胞(H&E、元の拡大率、×20);(c)対照脂肪細胞および(d)デオキシコール酸ナトリウム単独の注射後の脂肪細胞(H&E、元の拡大率、×10);(e)対照筋肉および(f)ホスファチジルコリン単独の注射後の筋肉(H&E、元の拡大率、×10);(g)Empigen(登録商標)界面活性剤の注射後の脂肪(H&E、元の拡大率、×20)を明らかにする、本発明の教示に従って作成された組成物による処置後のブタ皮膚生検試料の光学顕微鏡検を示す。
【図6】本発明の教示によるデオキシコール酸の注射の2日後に患者から除去された脂肪腫を示す:(a)肉眼的病理学および(b)組織学(H&E、元の拡大率、×20)。
【図7】皮下脂肪蓄積を減少させるためのキットを示す。
【発明を実施するための形態】
【0023】
発明の詳細な説明
本発明は、脂肪を可溶化する濃度の一つまたは複数の界面活性剤を含む薬学的に許容される製剤の投与によって脂肪沈着物を減少させる非外科的な方法を提供することにより、哺乳動物における局所的な脂肪蓄積の問題を解決する。
【0024】
ホスファチジルコリンの胆汁中の乳化剤としての役割、および高脂血症の処置におけるその使用に基づき、ホスファチジルコリンがPBF中の活性成分であるとの仮説が立てられている(1、2、21、25、27)。これらの先行技術の組成物の中の胆汁酸塩のような界面活性剤は、推定活性成分であるPCを分散または可溶化するためだけに添加された。しかしながら、現在まで、この理論を支持する報告は発表されていない。本発明者らは、予想外にも、実際には、胆汁酸塩が局所的な脂肪の乳化のための活性薬剤であることを証明した。
【0025】
文末に括弧内に出現する数字は、本明細書の末尾部分に引用された特定の参照をさす。本明細書において引用された参照は、全て、参照により全ての目的のため完全に本明細書に組み入れられる。
【0026】
ホスファチジルコリンは、細胞膜の必須成分であり、正常な細胞膜の組成および修復にとって重要な天然リン脂質である。ホスファチジルコリンは、必須栄養素コリンの主要な輸送形態でもある。コリン自体は、神経伝達物質アセチルコリン、メチル供与体ベタイン、ならびに、とりわけホスファチジルコリンおよびスフィンゴミエリンを含むリン脂質の合成における前駆物質である。ホスファチジルコリンは、超低密度リポタンパク質の肝臓搬出にも関与している。
【0027】
胆汁酸塩は、ホスファチジルコリンの水溶性を改良するため、そしてより最近では、アンホテリシンB、Taxol(商標)、およびジアゼパムのような薬の水溶性を改良するため、使用されている(9〜14)。高度に精製されたホスファチジルコリンは、迅速に滅菌され、静脈内投与のため使用され得る安定な混合ミセル調製物が形成されるよう、二次胆汁酸塩デオキシコール酸ナトリウム、抗微生物薬、ベンジルアルコール、および水と組み合わせられ得る(12)。Essentiale(登録商標)およびLipostabil(登録商標)として公知のこの混合物の薬学的調製物は、それぞれ肝疾患および高脂血症の処置のため他の国々で販売されている(12、15)。
【0028】
医師らは、下眼瞼脂肪ヘルニア、ならびに大腿、腹部、背部上部、顎、および腕の脂肪沈着物を処置するために、薬学的調製物または類似の調合PBFを使用してきた(2、3、5)。これらのPBFは、Essentiale(登録商標)およびLipostabil(登録商標)において様々に見出されるdl-α-トコフェロール(ビタミンE)、ビタミンB、およびアデノシン一リン酸をしばしば欠いている(2、16)。
【0029】
脂肪吸引は、最も人気のある美容外科手技のうちの一つであり、吸引を使用し、任意で、脂肪除去を補助する溶液によって補助された、脂肪沈着物の外科的な除去を含む。脂肪形成術または吸引脂肪組織切除としても公知の脂肪吸引は、カニューレが挿入された皮膚内の切開部を通して脂肪を減少させる外科的手技である。カニューレが吸引源に接続され、不要な脂肪がカニューレを通して吸い出され、廃棄される。脂肪吸引は、除去すべき脂肪の量および位置に依って、全身麻酔または局所麻酔の下で実施される。そのような注入は、多量の溶液からなり、しばしば脂肪吸引手技の前または途中に患者から引き出される。特許第5,891,083号を参照のこと。
【0030】
脂肪吸引および/またはその他の外科的な脂肪除去法の使用は、一時的な挫傷形成、膨潤、無感覚、圧痛、および灼熱感、感染のリスク、色素沈着の変化;肺に移動し死を引き起こし得る脂肪塊もしくは血塊の形成、ショックに至るかもしれない過度の体液喪失もしくは排液されなければならない体液蓄積、摩擦熱傷もしくはその他の皮膚もしくは神経の傷害、または生命に関わる器官への穿孔傷を含む重大な有害事象に関連している。さらに、脂肪吸引は、患者が働くことができないか、またはある種の日々の活動を成し遂げることができない、1〜2週間の回復時間を必要とする。さらに、脂肪吸引のような外科的手技は、局所麻酔、時には全身麻酔を必要とするため、重大な麻酔関連リスクが外科的な脂肪除去には関連している。
【0031】
従来の技術および組成物は、ある程度の成功を果たしているが、ある種の制限に遭遇している。従って、手術または長期の回復時間を必要とせず、現在利用可能な方法より少ない有害副作用を有している、局所的な脂肪蓄積を減少させる方法を有することが、望ましいであろう。
【0032】
本発明は、標的部位へとそのような製剤を局所投与することにより、哺乳動物における皮下脂肪蓄積を減少させるための、一つまたは複数の薬理活性界面活性剤(例えば、胆汁酸塩)の使用に関する。
【0033】
界面活性剤の中でも、胆汁酸塩は、特に強力な脂質二重膜の可溶化剤である(9、20、21、23、28)。全ての生物学的細胞膜は、同じ二重脂質(bilipid)構造から構成されており、従って、界面活性剤による可溶化を受ける(10、19、34)。界面活性剤による細胞膜の可溶化は、脂質二重層の間への界面活性剤の分配、二重層の不安定化、崩壊、およびその後の(界面活性剤および細胞膜脂質から構成された)混合ミセルの形成を含む(10、19、21)。胆汁酸塩およびその他の界面活性剤は、非混和性材料の境界における表面張力を低下させ、大きな凝集物のより小さい粒子への分解を可能にする。組織において、これらの薬剤は、細胞膜を溶解させ、細胞溶解を引き起こす。炎症応答が起こり、界面活性剤により可溶化された材料が身体によって除去される。
【0034】
この理由のため、本発明者らは、細胞生存率を測定する単純な定量的アッセイを使用して、デオキシコール酸ナトリウムを完全PBFと比較した(図2a)。ホスファチジルコリンは、胆汁酸塩のような物質と組み合わせない限り、水性溶液に不溶性であるため、純粋なホスファチジルコリンを単離し試験することは不可能である(12)。ホスファチジルコリンは、エタノール、メタノール、クロロホルム、およびその他の有機溶媒に高度に可溶性であるが、これらの薬剤は脂質二重層に傷害を与える場合がある(29〜31)。予備実験において、純粋な単離されたPCと、それを溶解させるために使用されたエタノールとの間に、細胞溶解および組織学の差は存在しなかった。PC処方の成分のうちの一つであるベンジルアルコールは、細胞膜の流動性に影響を与えることが示されているが、それは界面活性剤ではなく、従って、処方中のその限定された量は、細胞膜に対して無視し得る程度の溶解効果しか及ぼさない(32、33)。
【0035】
無傷の組織への浸透が限定因子である可能性が高いため、細胞培養物を使用して、細胞に影響を与えるのに必要な試薬(PBFおよびデオキシコール酸塩)の希釈率を決定した。デオキシコール酸は、完全PBFにほぼ等しい培養細胞の生存率を大きく減少させた(図2a)。この所見は、ブタ脂肪をPBFおよびデオキシコール酸塩に曝すことにより、組織において再現された(図3)。これらの結果は、デオキシコール酸ナトリウムがPBFの中で主要な活性な役割を果たしているという予想外の観察を支持している。
【0036】
本発明は、皮下脂肪沈着物を減少させるための、細胞膜を破壊する界面活性剤の作用の使用に基づく。培養細胞における膜溶解を、乳酸デヒドロゲナーゼ(LDH)アッセイを使用して測定し、組織における膜溶解を、無傷の細胞膜を有する細胞において保持される蛍光マーカーであるカルセインを使用して測定した。LDHアッセイは、細胞が溶解した場合に放出されるサイトゾル酵素であるLDHの活性を測定する。PBFで処置された細胞培養物およびデオキシコール酸塩で処置された細胞培養物は、いずれも、細胞溶解の濃度依存的な増加を示した(図2b)。さらに、これらの薬剤で処置された培養細胞において観察された直接的な溶解効果は、内因性リパーゼと無関係の活性を示唆している。カルセインは、PBF、デオキシコール酸塩、および公知の実験用界面活性剤であるTriton(登録商標)X-100に曝された脂肪標本において失われた(図4)。この所見は、PBFに曝された新鮮な組織においても、デオキシコール酸塩に曝された新鮮な組織においても、細胞膜の破壊が起こることを確認した。
【0037】
細胞培養物においてPBFの効果をデオキシコール酸塩と比較したところ、デオキシコール酸は、類似した細胞生存率の欠損を引き起こすが、より少ない細胞溶解を引き起こすという驚くべき結果が得られた。これらの差は濃度依存性であるかもしれないし、または処方内にはホスファチジルコリンとデオキシコール酸との相乗効果が存在するのかもしれない。にも関わらず、データは、臨床的に使用されているものに類似した濃度で、デオキシコール酸およびPBFが、組織の組織学および細胞生存率に対して類似した効果を及ぼすことを証明している。総合すると、これらのデータは、予想外にも、デオキシコール酸が、先行技術のPBFの中の活性成分として作用していることを証明している。
【0038】
組織の組織学に対する界面活性剤の効果を例示するため、新鮮なブタ皮膚に、PBF、デオキシコール酸塩、およびよく特徴決定されている実験用界面活性剤を注射した(図5)。全ての試薬が、PBS注射(対照)と比較して有意な脂肪細胞組織化の破壊を引き起こした。これらの結果は、筋肉および結合組織においても同様に観察された。テスト物質による細胞境界の急速な溶解、およびよく特徴決定されている界面活性剤とのそれらの効果の類似性は、PBFおよびデオキシコール酸塩が界面活性剤として機能していることを実証している。この実験モデルの限界は、生存組織への注射後に起こる真の結果を明らかにしていないということである。紅斑および浮腫として顕在化する活発な炎症応答が注射後に起こることは、臨床報告から明白である(1〜3)。反復的な炎症は、特に複数回の注射の後、繊維症を引き起こす可能性がある。繊維症は、PBF投与後に注射部位に堅い結節を発症した数人の患者において報告されており、それらは最終的には数ヶ月かけて消散した(35)。
【0039】
組織学的所見は、注射可能なPBFおよびデオキシコール酸塩単独が、脂肪および筋肉においては機構破壊を引き起こすが、表皮、真皮、または付属器には明白な影響を及ぼさないことを明らかにしている(図5)。しかしながら、強力な実験用界面活性剤であるEmpigen(登録商標)BBは、皮膚コラーゲン(結合組織)に対して顕著な組織学的効果を及ぼした。または、脂肪および筋肉は、(臨床実務において使用されているものに類似している)試験された濃度において、これらの他の構造より界面活性剤処置に対する感受性が高いのかもしれない。
【0040】
新鮮な組織標本および細胞培養物を利用した一連の実験室における実験を通して、本発明者らは、脂肪溶解のための皮下注射において頻用されている先行技術PBFが、主として、細胞膜の非特異的な溶解を引き起こすことにより奏功することを証明した。細胞膜は、全ての組織型の構成要素であり;特に、本発明者は、これらの界面活性剤が、脂肪、筋肉、および結合組織の可溶化を引き起こすことを証明した。従って、本発明者らは、ホスファチジルコリンを溶解させるために使用されている処方の胆汁酸塩成分であるデオキシコール酸ナトリウムが、これらの先行技術製剤の主要な活性成分であるとの結論を下した。この結論は、胆汁酸塩のような薬理活性界面活性剤が、細胞膜の強力な可溶化剤であるという事実により支持される。さらに、脂肪溶解におけるPBFおよびデオキシコール酸ナトリウムのメカニズムは、界面活性作用である可能性が高い。
【0041】
組成物
本発明の態様において、生物学的に適合性の界面活性剤の医学的組成物は、水性媒体の中に一つまたは複数の薬理活性界面活性剤および薬学的に許容される賦形剤を含む。特に、胆汁酸塩を含む薬理活性界面活性剤が、脂肪を溶解させるために使用されることは、本発明の範囲内である。
【0042】
一つの態様において、本発明は、皮下脂肪を減少させるために有効な量の一つまたは複数の薬理活性界面活性剤を含むか、から本質的になるか、またはからなる組成物に関する。
【0043】
本発明の態様において使用され得る薬理活性界面活性剤には、親油性界面活性剤(イオン性であっても非イオン性であってもよい)、親水性界面活性剤(イオン性であっても非イオン性であってもよい)、イオン界面活性剤、非イオン界面活性剤、両性イオン界面活性剤、グリセリド、および胆汁酸塩が含まれるが、これらに制限はされない。
【0044】
親油性界面活性剤の非制限的な例には、とりわけ、アルコール;ポリオキシエチレン・アルキルエーテル;脂肪酸、胆汁酸;グリセロール脂肪酸エステル;アセチル化グリセロール脂肪酸エステル;低級アルコール脂肪酸エステル;ポリエチレン・グリコール脂肪酸エステル;ポリエチレン・グリコール・グリセロール脂肪酸エステル;ポリプロピレン・グリコール脂肪酸エステル;ポリオキシエチレン・グリセリド;モノ/ジグリセリドの乳酸誘導体;プロピレン・グリコール・ジグリセリド;ソルビタン脂肪酸エステル;ポリオキシエチレン・ソルビタン脂肪酸エステル;ポリオキシエチレン−ポリオキシプロピレン・ブロック・コポリマー;トランスエステル化植物油;ステロール;ステロール誘導体;糖エステル;糖エーテル;スクログリセリド(sucroglycerides);ポリオキシエチレン植物油;ポリオキシエチレン水素化植物油;ポリオールと、脂肪酸、グリセリド、植物油、水素化植物油、およびステロールからなる群の少なくとも一つのメンバーとの反応混合物;ならびにそれらの混合物が含まれる。
【0045】
非イオン親油性界面活性剤の非制限的な例には、とりわけ、アルキルグルコシド;アルキルマルトシド;アルキルチオグルコシド;ラウリル・マクロゴールグリセリド;ポリオキシエチレン・アルキル・エーテル;ポリオキシエチレン・アルキルフェノール;ポリエチレン・グリコール脂肪酸エステル、ポリエチレン・グリコール・グリセロール脂肪酸エステル;ポリオキシエチレン・ソルビタン脂肪酸エステル;ポリオキシエチレン−ポリオキシプロピレン・ブロック・コポリマー;ポリグリセロール脂肪酸エステル;ポリオキシエチレン・グリセリド;ポリオキシエチレン・ステロール、それらの誘導体およびアナログ;ポリオキシエチレン植物油;ポリオキシエチレン水素化植物油;ポリオールと、脂肪酸、グリセリド、植物油、水素化植物油、およびステロールからなる群の少なくとも一つのメンバーとの反応混合物;トコフェロール・ポリエチレン・グリコール・スクシネート;糖エステル;糖エーテル;スクログリセリド;ならびにそれらの混合物が含まれる。
【0046】
イオン親水性界面活性剤の非制限的な例には、とりわけ、アルキル・アンモニウム塩、胆汁酸、ならびにそれらの塩、アナログ、および誘導体;アミノ酸、カルニチン、オリゴペプチド、およびポリペプチドの脂肪酸誘導体;アミノ酸、オリゴペプチド、およびポリペプチドのグリセリド誘導体;アシル・ラクチレート(lactylates);モノグリセリド、ジグリセリドのモノアセチル化、ジアセチル化された酒石酸エステル;スクシノイル化(succinoylated)モノグリセリド;モノグリセリド、ジグリセリドのクエン酸エステル;アルギン酸塩;プロピレン・グリコール・アルギネート;レシチンおよび水素化レシチン;リゾレシチンおよび水素化リゾレシチン;リゾリン脂質およびそれらの誘導体、リン脂質およびそれらの誘導体;アルキルスルフェートの塩;脂肪酸の塩;ナトリウム・ドクセート(sodium docusate);ならびにそれらの混合物が含まれる。
【0047】
イオン界面活性剤の非制限的な例には、コール酸塩、デオキシコール酸ナトリウム、ドデシル硫酸ナトリウム、およびC-16 TABが含まれるが、これらに制限はされない。好ましい態様において、本発明の態様において有用なイオン界面活性剤の非制限的な例は、デオキシコール酸ナトリウムである。
【0048】
非イオン界面活性剤の非制限的な例には、Brij 35、ポリオキシエチレン(20)セチル・エーテルのようなn-アルキルPEOモノエーテル、Lubrol PX、Lubrol WX、ノニデット(nonidet)P-40、オクチルフェノールポリ(エチレングリコールエーテル)n10およびオクチルフェノールポリ(エチレングリコールエーテル)n7のようなn-アルキル・フェニルPEO、テトラメチルブチルフェニルPEO、n-オクチルグルコシド、オクチル・チオグルコピラノシド、トゥイーン(tween)-80およびトゥイーン-20、ならびにアルキルアリール・ポリエーテル・アルコール(Triton(登録商標)X-100)が含まれるが、これらに制限はされない。
【0049】
両性イオン界面活性剤の非制限的な例には、3-[(3-コラミドプロピル)ジメチルアンモニオ]プロパン-スルホネート(CHAPS)、N-テトラデシル-N,N-ジメチル-3-アンモニオ-1-プロパンスルホネート、コール酸スルホベタイン、ラウリルジメチルベタイン(Empigen(登録商標)BB)、およびzwittergent 3-14が含まれるが、これらに制限はされない。
【0050】
グリセリドの非制限的な例には、とりわけ、モノグリセリド、ジグリセリド、またはトリグリセリドが含まれる。そのようなトリグリセリドには、とりわけ、植物油、魚油、動物脂肪、水素化植物油、部分水素化植物油、合成トリグリセリド、修飾されたトリグリセリド、分画されたトリグリセリド、およびそれらの混合物が含まれる。
【0051】
胆汁酸塩の非制限的な例には、グリシンまたはタウリンと接合していてもよい、1〜3個のヒドロキシル基およびカルボキシル基で終わる5炭素原子側鎖を有するステロイドが含まれる。
【0052】
胆汁酸塩の付加的な例には、コール酸、デオキシコール酸、コール酸、ケノデオキシコール酸、7-α-デヒドロキシレート(dehydroxylate)、ケノデオキシコール酸、リトコール酸、ウルソデオキシコール酸の塩、これらのいずれかのジヒドロキシおよびトリヒドロキシ・コンジュゲートならびにタウリンまたはグリシン・コンジュゲートが含まれる。好ましくは、本発明の胆汁酸塩は、デオキシコール酸ナトリウムである。
【0053】
下記表1は、本発明により企図されるいくつかの界面活性剤、モノマーとしてのこれらの界面活性剤のモノマー分子量、および界面活性剤が主としてミセルの形態で存在する最小濃度である臨界ミセル濃度(CMC)を例示する。
【0054】
(表1)

【0055】
好ましくは、本明細書中の組成物の中の一つまたは複数の薬理活性界面活性剤の濃度は、ほぼCMC濃度(すなわち、+/-5mM)であるか、またはCMCレベルを超える濃度、例えば、CMC濃度レベルを1%、5%、10%、15%、20%、25%、30%、35%、40%、50%、55%、60%、65%、70%、75%、80%、85%、90%、99%、150%、200%、400%、800%、1600%、3200%、6800%、13,600%、27,200%、または54,400%超える濃度であるようなものである。
【0056】
いくつかの態様において、組成物中の薬理活性界面活性剤のうちの一つまたは複数の濃度は、w/w、w/v、またはv/vで、20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、0.5%、0.4%、0.3%、0.2%、0.1%、0.09%、0.08%、0.07%、0.06%、0.05%、0.04%、0.03%、0.02%、0.01%、0.009%、0.008%、0.007%、0.006%、0.005%、0.004%、0.003%、0.002%、0.001%、0.0009%、0.0008%、0.0007%、0.0006%、0.0005%、0.0004%、0.0003%、0.0002%、または0.0001%未満である。
【0057】
いくつかの態様において、組成物中の薬理活性界面活性剤のうちの一つまたは複数の濃度は、w/w、w/v、またはv/vで、20%、19.75%、19.50%、19.25% 19%、18.75%、18.50%、18.25% 18%、17.75%、17.50%、17.25% 17%、16.75%、16.50%、16.25% 16%、15.75%、15.50%、15.25% 15%、14.75%、14.50%、14.25% 14%、13.75%、13.50%、13.25% 13%、12.75%、12.50%、12.25% 12%、11.75%、11.50%、11.25% 11%、10.75%、10.50%、10.25% 10%、9.75%、9.50%、9.25% 9%、8.75%、8.50%、8.25% 8%、7.75%、7.50%、7.25% 7%、6.75%、6.50%、6.25% 6%、5.75%、5.50%、5.25% 5%、4.75%、4.50%、4.25%、4%、3.75%、3.50%、3.25%、3%、2.75%、2.50%、2.25%、2%、1.75%、1.50%、125%、1%、0.5%、0.4%、0.3%、0.2%、0.1%、0.09%、0.08%、0.07%、0.06%、0.05%、0.04%、0.03%、0.02%、0.01%、0.009%、0.008%、0.007%、0.006%、0.005%、0.004%、0.003%、0.002%、0.001%、0.0009%、0.0008%、0.0007%、0.0006%、0.0005%、0.0004%、0.0003%、0.0002%、または0.0001%より大きい。
【0058】
いくつかの態様において、組成物中の薬理活性界面活性剤のうちの一つまたは複数の濃度は、w/w、w/v、またはv/vで、およそ0.001%〜およそ50%、およそ0.001%〜およそ40%、およそ0.01%〜およそ30%、およそ0.02%〜およそ29%、およそ0.03%〜およそ28%、およそ0.04%〜およそ27%、およそ0.05%〜およそ26%、およそ0.06%〜およそ25%、およそ0.07%〜およそ24%、およそ0.08%〜およそ23%、およそ0.09%〜およそ22%、およそ0.1%〜およそ21%、およそ0.2%〜およそ20%、およそ0.3%〜およそ19%、およそ0.4%〜およそ18%、およそ0.5%〜およそ17%、およそ0.6%〜およそ16%、およそ0.7%〜およそ15%、およそ0.8%〜およそ14%、およそ0.9%〜およそ12%、およそ1%〜およそ10%の範囲内にある。最終濃度は、標的部位の位置およびサイズを含む(がこれらに制限はされない)当業者に公知の多くの要因に依存することが理解される。
【0059】
いくつかの態様において、本発明の組成物は、10g、9.5g、9.0g、8.5g、8.0g、7.5g、7.0g、6.5g、6.0g、5.5g、5.0g、4.5g、4.0g、3.5g、3.0g、2.5g、2.0g、1.5g、1.0g、0.95g、0.9g、0.85g、0.8g、0.75g、0.7g、0.65g、0.6g、0.55g、0.5g、0.45g、0.4g、0.35g、0.3g、0.25g、0.2g、0.15g、0.1g、0.09g、0.08g、0.07g、0.06g、0.05g、0.04g、0.03g、0.02g、0.01g、0.009g、0.008g、0.007g、0.006g、0.005g、0.004g、0.003g、0.002g、0.001g、0.0009g、0.0008g、0.0007g、0.0006g、0.0005g、0.0004g、0.0003g、0.0002g、または0.0001g未満の一つまたは複数の本明細書中の薬理活性界面活性剤を含むか、から本質的になるか、またはからなる。
【0060】
いくつかの態様において、本明細書中の組成物は、0.0001g、0.0002g、0.0003g、0.0004g、0.0005g、0.0006g、0.0007g、0.0008g、0.0009g、0.001g、0.0015g、0.002g、0.0025g、0.003g、0.0035g、0.004g、0.0045g、0.005g、0.0055g、0.006g、0.0065g、0.007g、0.0075g、0.008g、0.0085g、0.009g、0.0095g、0.01g、0.015g、0.02g、0.025g、0.03g、0.035g、0.04g、0.045g、0.05g、0.055g、0.06g、0.065g、0.07g、0.075g、0.08g、0.085g、0.09g、0.095g、0.1g、0.15g、0.2g、0.25g、0.3g、0.35g、0.4g、0.45g、0.5g、0.55g、0.6g、0.65g、0.7g、0.75g、0.8g、0.85g、0.9g、0.95g、1g、1.5g、2g、2.5、3g、3.5、4g、4.5g、5g、5.5g、6g、6.5g、7g、7.5g、8g、8.5g、9g、9.5g、または10g超の一つまたは複数の本明細書中の薬理活性界面活性剤を含むか、から本質的になるか、またはからなる。
【0061】
いくつかの態様において、本明細書中の組成物は、0.0001〜10g、0.0005〜9g、0.001〜8g、0.005〜7g、0.01〜6g、0.05〜5g、0.1〜4g、0.5〜4g、または1〜3gの一つまたは複数の本明細書中の薬理活性界面活性剤を含むか、から本質的になるか、またはからなる。
【0062】
本明細書中のいずれの態様においても、組成物は、少なくとも2、3、4、5、6、7、8、9、または10個の界面活性剤を含むか、から本質的になるか、またはからなることができる。
【0063】
本明細書中のいずれの態様においても、組成物は、一つまたは複数のリン脂質(例えば、ホスファチジルコリン)を含み得る。好ましくは、本明細書中の組成物/単位用量の中のリン脂質の量は、w/w、w/v、またはv/vで、組成物または単位用量の50%、40%、30%、20%、15%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、0.95%、0.9%、0.85%、0.8%、0.75%、0.7%、0.65%、0.6%、0.55%、0.5%、0.45%、0.4%、0.35%、0.3%、0.25%、0.2%、0.15%、0.1%、0.09%、0.08%、0.07%、0.06%、0.05%、0.04%、0.03%、0.02%、0.01%、0.009%、0.008%、0.007%、0.006%、0.005%、0.004%、0.003%、0.002%、0.001%、0.0009%、0.0008%、0.0007%、0.0006%、0.0005%、0.0004%、0.0003%、0.0002%、または0.0001%未満の濃度である。好ましい態様において、組成物中のリン脂質の量は、w/w、w/v、またはv/vで5%未満の濃度である。
【0064】
本発明の一つの態様において、少なくとも一つの薬理活性界面活性剤を含み、任意で、少なくとも一つの薬学的に許容される賦形剤を含み、任意で、少なくとも一つの付加的な活性成分を含み、w/w、w/v、もしくはv/vで、20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、0.5%、0.4%、0.3%、0.2%、0.1%、0.09%、0.08%、0.07%、0.06%、0.05%、0.04%、0.03%、0.02%、0.01%、0.009%、0.008%、0.007%、0.006%、0.005%、0.004%、0.003%、0.002%、0.001%、0.0009%、0.0008%、0.0007%、0.0006%、0.0005%、0.0004%、0.0003%、0.0002%、もしくは0.0001%未満の(ホスファチジルコリンのような)リン脂質を含有しているか、またはより好ましくはホスファチジルコリンのようなリン脂質を含有していない、患者における局所的な脂肪沈着物の非外科的な減少のための医学的組成物が提供される。「未満」という用語は、本明細書において使用されるように、ある程度のホスファチジルコリンを含有している組成物を一般にさすが、いくつかの態様においては、0%ホスファチジルコリンをさす。
【0065】
本発明の一つの態様において、薬理活性界面活性剤組成物は、少なくとも一つの薬理活性界面活性剤を含有しており、任意で、少なくとも一つの薬学的に許容される賦形剤を含有しており、任意で、少なくとも一つの付加的な活性成分を含有しており、w/w、w/v、もしくはv/vで、20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、0.5%、0.4%、0.3%、0.2%、0.1%、0.09%、0.08%、0.07%、0.06%、0.05%、0.04%、0.03%、0.02%、0.01%、0.009%、0.008%、0.007%、0.006%、0.005%、0.004%、0.003%、0.002%、0.001%、0.0009%、0.0008%、0.0007%、0.0006%、0.0005%、0.0004%、0.0003%、0.0002%、もしくは0.0001%未満の(ホスファチジルコリンのような)リン脂質を含有しているか、またはより好ましくはホスファチジルコリンのようなリン脂質を含有していない。
【0066】
本発明の態様において、薬理活性界面活性剤組成物は、脂肪組織へと直接皮下注射により投与される。
【0067】
本発明の一つの態様において、局所的な脂肪蓄積は、下眼瞼脂肪ヘルニア、脂肪腫、脂肪異栄養、バッファロー瘤脂肪異栄養、またはセルライトに関連した脂肪沈着物である。局所的な脂肪蓄積は、目の下、顎の下、腕の下、殿部、腓、足首、背部、大腿、または胃部に存在し得る。従って、本発明は、脂肪腫、ダーカム病、マーデルング頸、脂肪浮腫、圧力原性結節、眼瞼黄板症、脂肪異栄養、およびセルライトのような脂肪組織障害の処置を企図する。
【0068】
本発明のもう一つの態様において、脂肪を可溶化する量のデオキシコール酸を含み、w/w、w/v、もしくはv/vで、20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、0.5%、0.4%、0.3%、0.2%、0.1%、0.09%、0.08%、0.07%、0.06%、0.05%、0.04%、0.03%、0.02%、0.01%、0.009%、0.008%、0.007%、0.006%、0.005%、0.004%、0.003%、0.002%、0.001%、0.0009%、0.0008%、0.0007%、0.0006%、0.0005%、0.0004%、0.0003%、0.0002%、もしくは0.0001%未満の(ホスファチジルコリンのような)リン脂質を含有しているか、またはより好ましくはホスファチジルコリンのようなリン脂質を含有していない、下眼瞼脂肪ヘルニアを有する患者における局所的な脂肪の蓄積を減少させるための医学的組成物が提供される。
【0069】
本発明の一つの態様において、少なくとも一つの薬理活性界面活性剤、任意での少なくとも一つの薬学的に許容される賦形剤および任意での少なくとも一つの付加的な活性成分から本質的になり、好ましくは、w/w、w/v、もしくはv/vで、20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、0.5%、0.4%、0.3%、0.2%、0.1%、0.09%、0.08%、0.07%、0.06%、0.05%、0.04%、0.03%、0.02%、0.01%、0.009%、0.008%、0.007%、0.006%、0.005%、0.004%、0.003%、0.002%、0.001%、0.0009%、0.0008%、0.0007%、0.0006%、0.0005%、0.0004%、0.0003%、0.0002%、もしくは0.0001%未満の(ホスファチジルコリンのような)リン脂質を含有しているか、またはより好ましくはホスファチジルコリンのようなリン脂質を含有していない薬理活性界面活性剤組成物の非外科的な投与を含む、患者における局所的な脂肪沈着物の非外科的な減少のための脂肪吸引以外の方法が提供される。
【0070】
本明細書中のいずれの組成物においても、界面活性剤とリン脂質との比率は、質量でリン脂質より多い界面活性剤が存在するようなものである。例えば、界面活性剤とリン脂質との質量比は、1:0.5、1:0.05、1.0.005等であり得る。いくつかの態様において、リン脂質(例えば、ホスファチジルコリン)の%w/v濃度は、界面活性剤の%w/v濃度未満である。例えば、組成物は、5%w/vのデオキシコール酸ナトリウムおよび4%w/vのホスファチジルコリンを有し得る。
【0071】
単位用量
本発明は、本明細書中の組成物の単位用量も企図する。そのような単位用量は、例えば、500mL、400mL、300mL、200mL、100mL、90mL、80mL、70mL、60mL、50mL、40mL、30mL、20mL、10mL、9mL、8mL、7mL、6mL、5mL、4mL、3mL、2mL、1mL、0.9mL、0.8mL、0.7mL、0.6mL、0.5mL、0.4mL、0.3mL、0.2mL、0.1mL、0.09mL、0.08mL、0.07mL、0.06mL、0.05mL、0.04mL、0.03mL、0.02mL、0.01mL、0.009mL、0.008mL、0.007mL、0.006mL、0.005mL、0.004mL、0.003mL、0.002mL、0.001mL、0.0009mL、0.0008mL、0.0007mL、0.0006mL、0.0005mL、0.0004mL、0.0003mL、0.0002mL、または0.0001mL未満の全容量を有し得る。いくつかの態様において、そのような単位用量は、0.2mL超かつ500mL未満の全容量を有する。いくつかの態様において、そのような単位用量は、0.1mL未満の全容量を有する。いくつかの態様において、そのような単位用量は、0.1mL未満の全容量を有する。いくつかの態様において、そのような単位用量は、0.1〜0.2mL(0.1mLおよび0.2mLを含む)の全容量を有する。いくつかの態様において、そのような単位用量は、0.1未満および0.2超の全容量を有する。
【0072】
いくつかの態様において、本発明は、0.0001mL、0.0005mL、0.001mL、0.005mL、0.01mL、0.05mL、0.1mL、0.5mL、1mL、5mL、10mL、50mL、100mL超の全容量である組成物または単位用量の標的部位への投与を企図する。
【0073】
いくつかの態様において、本発明は、一標的部位当たり0.0001〜500mL、0.0005〜400mL、0.001〜300mL、0.005〜200mL、0.01〜100mL、0.05〜90mL、0.06〜80mL、0.07〜70mL、0.08〜60mL、0.09〜50mL、0.1〜40mL、0.2〜30mL、0.3〜29mL、0.4〜28mL、0.5〜27mL、0.6〜26mL、0.7〜25mL、0.8〜24mL、0.9〜23mL、10〜22mL、11〜21mL、12〜20mL、13〜19mL、14〜18mL、または15〜17mLの範囲の全容量を有する単位用量の投与を企図する。
【0074】
その他の態様は、一標的部位当たり0.01〜30mL、0.02〜20mL、0.03〜10mLの範囲の全容量の組成物の投与を企図する。その他の態様は、標的部位への0.2〜500mLの全溶液、標的部位への0.1〜0.2mLの全溶液、0.1mL未満(任意で一標的部位当たり0.03mLおよび0.05mLを除く)の投与を企図する。
【0075】
単位用量は、本明細書の組成物において開示されたような量の一つまたは複数の薬理活性界面活性剤を含むか、から本質的になるか、またはからなることができる。単位用量は、さらに、上記の組成物セクションにおいて同定された濃度および単位でホスファチジルコリンのようなリン脂質を含み得る。例えば、好ましい単位用量は、5g未満の薬理活性界面活性剤および/または5%未満のホスファチジルコリンのようなリン脂質を有する。
【0076】
好ましい態様において、単位用量は、注射可能製剤の中に一つまたは複数の薬理活性界面活性剤を含むか、から本質的になるか、またはからなり、かつ500mL未満かつ0.2mL超の全容量を有する。そのような単位用量は、w/w、w/v、またはv/vで5%未満のリン脂質(例えば、ホスファチジルコリン)を有し得る。
【0077】
いくつかの態様において、単位用量は、w/w、w/v、またはv/vで0.1%超の一つまたは複数の本明細書中の界面活性剤を含み、かつ0.2mL超かつ500mL未満の全容量を有する。いくつかの態様において、単位用量は、w/w、w/v、またはv/vで0.1%超の一つまたは複数の本明細書中の界面活性剤を含み、かつ任意で0.03mLおよび0.05mLを除く0.1mL未満の全容量を有する。
【0078】
いくつかの態様において、単位用量は、0.01g未満の一つまたは複数の界面活性剤を含み、かつ500mL未満の全容量を有する。
【0079】
例えば、いくつかの態様において、単位用量は重量で0.1%または0.01%未満の一つまたは複数の本明細書中の界面活性剤を含む。
【0080】
いくつかの態様において、単位用量は、0.9%w/w未満または13%w/w超の一つまたは複数の本明細書中の界面活性剤を有し、かつ0.1〜0.2mLの全容量を有する。
【0081】
単位用量は、標的区域、脂肪の量、および所望の結果に一部依るであろう。
【0082】
塩およびエステル
本発明は、本明細書中の界面活性剤の薬学的に許容される塩およびエステルも企図する。そのような塩およびエステルは、正当な医学的判断の範囲内で、ヒトおよび動物の組織と接触させて使用するのに適しており、過度の毒性、刺激、アレルギー応答等がなく、合理的な利益/リスク比と相応しており、かつ意図された使用のために有効な塩およびエステルであることを意味する。
【0083】
より一般的な薬学的に許容される塩およびエステルには、アセテート、エストレート(estolate)(プロピオン酸エステルのラウリル硫酸塩)、コハク酸エチル、グルセプテート(gluceptate)(グルコヘプトネート(glucoheptonate))、ラクトビオネート(lactobionate)、ステアレート、および塩酸塩型が含まれる。本明細書において企図されるその他の酸性塩は、以下の通りである:アジピン酸塩、アルギン酸塩、アスパラギン酸塩、安息香酸塩、ベンゼンスルホン酸塩、重硫酸塩、酪酸塩、クエン酸塩、ショウノウ酸塩、ショウノウスルホン酸塩、シクロペンタンプロピオン酸塩、ジグルコン酸塩、ドデシル硫酸塩、エタンスルホン酸塩、フマル酸塩、グルコン酸塩、グリセロリン酸塩、ヘミスルフェート(hemisulfate)、ヘプトン酸塩、ヘキサン酸塩、臭化水素酸塩、ヨウ化水素酸塩、2-ヒドロキシ・エタンスルホン酸塩、乳酸塩、マレイン酸塩、メタンスルホン酸塩、2-ナフタレンスルホン酸塩、ニコチン酸塩、シュウ酸塩、パモ酸塩、パントテン酸塩、ペクチニン酸塩(pectinate)、過硫酸塩、3-フェニルプロピオン酸塩、ピクリン酸塩、ピバル酸塩、プロピオン酸塩、コハク酸塩、酒石酸塩、チオシアン酸塩、トシル酸塩、およびウンデカン酸塩。
【0084】
塩基性窒素含有基は、メチル、エチル、プロピル、およびブチルの塩化物、臭化物、およびヨウ化物のような低級アルキル・ハロゲン化物;ジメチル、ジエチル、ジブチル、およびジアミルの硫酸塩のようなジアルキル硫酸塩;デシル、ラウリル、ミリスチル、およびステアリルの塩化物、臭化物、およびヨウ化物のような長鎖ハロゲン化物;ベンジルおよびフェネチルの臭化物のようなアラルキル・ハロゲン化物等のような薬剤で第四級化され得る。
【0085】
好ましい態様において、本明細書中の界面活性剤のうちの一つ以上は、胆汁酸塩である。本明細書中の胆汁酸塩は、無機塩基、アンモニア、有機塩基、無機酸、有機酸、塩基性アミノ酸、ハロゲン・イオン等により形成されたもの、および内部塩であり得る。無機塩基の例には、アルカリ金属(例えば、NaおよびK)およびアルカリ土類金属(例えば、Mg)が含まれる。有機塩基の例には、プロカイン、2-フェニルエチルベンジルアミン、ジベンジルエチレンジアミン、エタノールアミン、ジエタノールアミン、トリス(ヒドロキシメチル)アミノメタン、ポリヒドロキシアルキルアミン、およびN-メチルグルコサミンが含まれる。無機酸の例には、塩酸、臭化水素酸、硫酸、硝酸、およびリン酸が含まれる。有機酸の例には、p-トルエンスルホン酸、メタンスルホン酸、ギ酸、トリフルオロ酢酸、およびマレイン酸が含まれる。塩基性アミノ酸の例には、リジン、アルギニン、オルニチン、およびヒスチジンが含まれる。
【0086】
胆汁酸は、それらのエステル、例えば、以下に制限はされないが、置換されていてもよいC1-C6アルキル、C2-C6アルケニル、C3-C10シクロアルキル、C3-C10シクロアルキル(C1-C6)アルキル、置換されていてもよいC6-C10アリール、置換されていてもよいC7-C12アラルキル、ジ(C6-C10)アリールメチル、トリ(C6-C10)アリールメチル、および置換されたシリルとして存在してもよい。
【0087】
置換されていてもよいC1-6アルキルの例には、例えば、各々、ベンジルオキシ、C1-4アルキルスルホニル(例えば、メタンスルホニル)、トリメチルシリル、ハロゲン(例えば、F、Cl、およびBr)、アセチル、ニトロベンゾイル、メシルベンゾイル、フタルイミド、スクシノイルイミド、ベンゼンスルホニル、フェニルチオ、ジ-C1-4アルキルアミノ(例えば、ジメチルアミド)、ピリジル、C1-4アルキルスルフィニル(例えば、メタンスルフィニル)、シアノ等で置換されていてもよい、メチル、エチル、n-プロピル、n-ブチル、t-ブチル、n-ペンチル、およびn-ヘキシルが含まれる。そのような置換されたC1-6アルキルには、例えば、ベンジルオキシメチル、2-メタンスルホニルエチル、2-トリメチルシリルエチル、2,2,2-トリクロロエチル、2-ヨードエチル、アセチルメチル、p-ニトロベンゾイルメチル、p-メシルベンゾイルメチル、フタルイミドメチル、スクシノイルイミドメチル、ベンゼンスルホニルメチル、フェニルチオメチル、および1-ジメチルアミノエチルが含まれる。上記のC2-6アルケニルには、例えば、ビニル、アリール、1-プロペニル、イソプロペニル、1-ブテニル、2-ブテニル、1,1-ジメチルアリール、3-メチル、および3-ブテニルが含まれる。上記のC3-10シクロアルキルには、例えば、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、シクロヘプチル、ノルボルニル、およびアダマンチルが含まれる。上記のC3-10シクロアルキル(C1-6)アルキルには、例えば、シクロプロピルメチル、シクロペンチルメチル、およびシクロヘキシルメチルが含まれる。上記のC6-10アリールには、例えば、各々、ニトロ、ハロゲン(例えば、F、Cl、およびBr)等で置換されていてもよい、フェニル、α-ナフチル、8-ナフチル、およびビフェニルが含まれ、そのような置換されたアリールには、例えば、p-ニトロフェニルおよびp-クロロフェニルが含まれる。上記の置換されていてもよいC7-12アラルキルには、例えば、各々、ニトロ、C1-4アルコキシ(例えば、メトキシ)、C1-4アルキル(例えば、メチル、エチル)、ヒドロキシ等で置換されていてもよい、ベンジル、1-フェニルエチル、2-フェニルエチル、フェニルプロピル、およびナフチルメチルが含まれる。そのような置換された基は、p-ニトロベンジル、p-メトキシベンジル(PMB)、または3,5-ジ-t-ブチル-4-ヒドロキシベンジルにより例証される。上記のジ(C6-10アリール)メチルには、ベンズヒドリルが含まれ、C6-10アリールメチルには、トリチルが含まれ、置換されたシリルには、トリメチルシリルおよびtert-ブチルジメチルシリルが含まれる。活性エステルの例には、有機リン酸エステル(例えば、ジエトキシ・リン酸エステルおよびジフェノキシ・リン酸エステル)、シアノメチル・エステルが含まれ、活性チオエステルには、芳香族ヘテロ環式チオ化合物により形成されたエステル(例えば、2-ピリジルチオ・エステル)が含まれる。
【0088】
胆汁酸のその他の反応性誘導体の例には、酸ハロゲン化物、酸アジ化物、酸無水物、混合酸無水物、活性アミド、および活性チオエステルが含まれる。例えば、酸ハロゲン化物には酸塩化物および酸臭化物が含まれ;混合酸無水物には混合モノアルキルカルボン酸無水物、混合脂肪族カルボン酸無水物、芳香族カルボン酸無水物、有機スルホン酸無水物が含まれ、活性アミドには、N原子を含有している複素環式化合物により形成されたアミドが含まれる。
【0089】
ミセル
胆汁酸を含む界面活性剤は、ミセル形成化合物である。ミセルの存在は、疎水性部分を水性溶媒(例えば、水)から遠ざけて埋め込むことにより、通常は水に可溶性でない疎水性分子(例えば、細胞膜を構成する脂質)の可溶性を有意に増加させると信じられている。当業者により認識されるように、ミセルとは、分子の極性親水性部分が外側に伸び、無極性疎水性部分が内側に伸びている両親媒性分子のコロイド性凝集物である。
【0090】
いくつかの態様において、本発明は、同質ミセル(単一の界面活性剤により生成したミセル)を企図し、その他の態様において、本発明は、混合ミセルの形成(二つ以上の化合物(そのうちの一つは界面活性剤である)により生成したミセル)を企図する。
【0091】
いくつかの態様において、本発明の組成物の中のミセルの平均粒子サイズは、1ナノメートル〜100マイクロメートル、10ナノメートル〜50マイクロメートル、100ナノメートル〜1マイクロメートル等の範囲にあるものと企図される。さらに、ミセルの形状は、変動することができ、例えば、偏長、偏平、または球状であり得;球状のミセルが最も典型的である。
【0092】
いくつかの態様において、本明細書中の組成物の中の界面活性剤の少なくとも10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%が、ミセルを形成している。その他の態様において、本明細書中の組成物の中の界面活性剤の90%、80%、70%、60%、50%、40%、30%、20%、10%、または5%未満が、ミセルを形成している。その他の態様において、本明細書中の組成物の界面活性剤の約10〜90%、20〜80%、30〜70%、40〜60%、または約50%が、ミセルを形成している。
【0093】
いくつかの態様において、本明細書中の組成物の中のミセルの平均サイズは、10-5、10-6、10-7、10-8、10-9未満であり得る。いくつかの態様において、本発明の組成物の中のミセルの平均サイズは、10-5、10-6、10-7、10-8、10-9超であり得る。いくつかの態様において、本明細書中の組成物の中のミセルの平均サイズは、1×10-5〜9×10-5;1×10-6〜9×10-6;1×10-7〜9×10-7;1×10-8〜9×10-8;1×10-9〜9×10-9の範囲内であり得る。
【0094】
いくつかの態様において、本発明の組成物の中のミセルの平均分子量は、100,000ダルトン、50,000ダルトン、40,000ダルトン、30,000ダルトン、20,000ダルトン、10,000ダルトン、9,000ダルトン、8,000ダルトン、7,000ダルトン、6,000ダルトン、5,000ダルトン、4,000ダルトン、3,000ダルトン、2,000ダルトン、1,000ダルトン、または500ダルトン未満であり得る。いくつかの態様において、本発明の組成物の中のミセルの平均分子量は、500ダルトン、1,000ダルトン、1,500ダルトン、2,000ダルトン、2,500ダルトン、3,000ダルトン、3,500ダルトン、4,000ダルトン、4,500ダルトン、5,000ダルトン、5,500ダルトン、6,000ダルトン、6,500ダルトン、7,000ダルトン、7,500ダルトン、8,000ダルトン、8,500ダルトン、9,000ダルトン、9,500ダルトン、10,000ダルトン、または15,000ダルトン超であり得る。いくつかの態様において、本発明の組成物の中のミセルの平均分子量は、100〜20,000ダルトン、1,000〜10,000ダルトン、2,000〜1,000ダルトン、または3,000〜5,000ダルトンの範囲内であり得る。
【0095】
第二の治療剤
本発明のさらにもう一つの態様において、本明細書中の組成物は、第二の治療剤と共製剤化(co-formulated)され、共投与(co-administered)され、かつ/または共販売(co-marketed)され得る。
【0096】
第二の治療剤の非制限的な例には、抗微生物剤、血管収縮剤、抗血栓剤、抗凝固剤、起泡抑制剤、抗炎症剤、鎮痛剤、分散剤、抗分散剤、浸透増強剤、ステロイド、精神安定剤、筋弛緩剤、および止痢剤が含まれる。
【0097】
本明細書中の組成物、方法、およびキットと共に使用するのに適している抗微生物剤は、抗菌剤、抗真菌剤、抗ウイルス剤等を含むが、これらに制限はされず、好ましくは、広域の微生物に対して有効である。
【0098】
抗菌剤の例には、塩化ベンザルコニウム、安息香酸、ベンズオキソニウム・クロリド(benzoxonium chloride)、ベンジル・アルコール、2-ブロモ-2-ニトロプロパン-1,3-ジオール、5-ブロモ-5-ニトロ-1,3-ジオキサン、ブロモクロロフェン、ショウノウ・ベンザルコニウム・メトスルフェート(camphor benzalkonium methosulfate)、キャプタン、臭化セトリモニウム、塩化セトリモニウム、塩化セチルピリジニウム、クリンバゾール(climbazol)、クロルアセトアミド、クロルヘキシジンおよびその塩、p-クロロ-m-クレゾール、クロルフェネシン、クロロキシレノール、クロロフェン、クロロブタノール、o-シメン-5-オール、デヒドロ酢酸、ジブロモジシアノブタン、ジブロモヘキサミジン、ジブロモプロパミジン(dibromopropamidin)、ジクロロベンジル・アルコール、ジクロロフェニル・イミダゾールジオキソラン、ジメチルオキサゾリジン、DMDMヒダントイン、酢酸ドデシルグアニジン、ヘキサミジン・ジイソチオネート、ヘキサクロロフェン、ヘキセチジン(hexetidin)、ヨードプロピニル・ブチルカルバメート、ラウリル・イソキノリニウム・ブロミド、メチルジブロモ・グルタロニトリル(methyldibromo glutaronitrile)、メチロールクロルアセトアミド(methylolchloracetamide)、フェネチル・アルコール、フェノキシエタノール、フェノキシプロパノール、o-フェニルフェノール、ピロクトン・オラミン(pirocton olamine)、ポリアミノプロピル・ビグアニド(biguanide)、ソルビン酸カリウム、カリウム・ウンデシレノイル加水分解コラーゲン(potassium undecylenoyl hydrolyzed collagen)、クオタニウム(quaternium)-15、サリチル酸、安息香酸ナトリウム、デヒドロ酢酸ナトリウム、ナトリウム・ヒドロキシメチルグリシネート、ナトリウムo-フェニルフェネート(phenylphenate)、ソルビン酸、トリクロカルバン(triclocarban)、トリクロサン(triclosan)、ウンデシレン酸およびその誘導体、システイン酸亜鉛(zinc cysteate)、グルコン酸亜鉛、ピリチオン亜鉛、または硫酸亜鉛が含まれるが、これらに制限はされない。抗微生物剤として有用なウンデシレン酸誘導体は、例えば、メチル・エステル、イソプロピル・エステル、グリセリル・エステル、エトキシル化大豆ステロール・エステル、もしくはエトキシル化PHBエステルのようなエステル、またはモノエタノールアミド、モノエタノールアミド(MEA)スルホスクシネート塩のようなモノエタノールアミド誘導体、ジエタノールアミド、タンパク質縮合物、例えば、カリウム・ウンデシレノイル加水分解動物コラーゲン、および第四級化された3-アミノプロピル-アミド、例えば、ウンデシレンアミドプロピルトリモニウム・メトスルフェート(undecylenamidopropyltrimonium methosulfate)のようなアミドである。適当な殺真菌/静真菌剤の具体例には、非制限的に、ジチオカーバメート、フタルイミド、ジカルボキシミド、有機リン酸、ベンゾイミダゾール、カルボキシアニリド、フェニルアミド、亜リン酸塩等が含まれる。
【0099】
抗菌剤のその他の例には、エリスロマイシン、クラリスロマイシン、ペニシリン、セファロスポリン、アミノグリコシド、スルホンアミド、マクロライド、テトラサイクリン、リンコシド(lincosides)、キノロン、クロラムフェニコール、バンコマイシン、メトロニダゾール、リファンピン、イソニアジド、スペクチノマイシン、トリメトプリム、スルファメトキサゾール、ペネム、カルバペネム、モノバクタム、ムピロシン、硫酸ネオマイシン、バシトラシン、ポリミクシンB、1-オフロキサシン、テトラサイクリン(塩酸クロルテトラサイクリン、塩酸オキシテトラサイクリン、および塩酸テトラサイクリン)、リン酸クリンダマイシン、硫酸ゲンタマイシン、塩化ベンザルコニウム、塩化ベンゼトニウム、ヘキシルレゾルシノール、塩化メチルベンゼトニウム、フェノール、第四級アンモニウム化合物、トリクロカーボン(triclocarbon)、トリクロサン、チャノキ油、およびそれらの薬学的に許容される塩、ならびにそれらの薬学的に許容される塩およびエステルが含まれるが、これらに制限はされない。
【0100】
抗菌剤のその他の例には、アクロフロキサシン(Acrofloxacin)、アモキシシリン・クラブロン酸合剤(Amoxicillin plus clavulonic)(すなわち、Augmentin)、アミカシン、アンピシリン、アパルシリン(Apalcillin)、アプラマイシン(Apramycin)、アストロマイシン、アルベカシン(Arbekacin)、アスポキシシリン(Aspoxicillin)、アジドジリン(Azidozillin)、アジスロマイシン(Azithromycin)、アズロシリン(Azlocillin)、バシトラシン、ベンザチン(Benzathine)・ペニシリン、ベンジルペニシリン、カルベニシリン、セファクロル、セファドロキシル、セファレキシン、セファマンドール、セファパリン(Cefaparin)、セファトリジン、セファゾリン、セフブペラゾン、セフカペン(Cefcapene)、セフジニル(Cefdinir)、セフジトレン(Cefditoren)、セフェピム(Cefepime)、セフェタメット(Cefetamet)、セフィキシム(Cefixime)、セフメタゾール、セフミノクス(Cefminox)、セフォペラゾン、セフォラニド(Ceforanide)、セフォタキシム、セフォテタン、セフォチアム、セフォキシチン、セフピミゾール(Cefpimizole)、セフピラミド、セフポドキシム(Cefpodoxime)、セフプロジル(Cefprozil)、セフラジン、セフロキサジン、セフスロジン、セフタジジム、セフトリアキソン(Ceftriaxone)、セフロキシム、クロラムフェニコール、クロルテトラサイクリン、シクラシリン、シノキサシン、シプロフロキサシン(Ciprofloxacin)、クラリスロマイシン(Clarithromycin)、クレミゾール・ペニシリン、クリンダマイシン、クロキサシリン、ダプトマイシン(Daptomycin)、デメクロサイクリン、デスキノロン(Desquinolone)、ジベカシン、ジクロキサシリン、ジリスロマイシン(Dirithromycin)、ドキシサイクリン、エノキサシン、エピシリン、エリスロマイシン、エタンブトール、フレロキサシン(Fleroxacin)、フロモキセフ(Flomoxef)、フルクロキサシリン、フルメキン(Flumequine)、フルリスロマイシン(Flurithromycin)、ホスホマイシン、ホスミドマイシン(Fosmidomycin)、フシジン酸、ガチフロキサシン(Gatifloxacin)、ゲミフロキサシン(Gemifloxaxin)、ゲンタマイシン、イミペネム(Imipenem)、イミペネム・シラスタチンの組み合わせ、イセパマイシン(Isepamicin)、イソニアジド、ジョサマイシン、カナマイシン、カスガマイシン、キタサマイシン、ラタモキセフ、レボフロキサシン(Levofloxacin)、リンコマイシン、リネゾリド(Linezolid)、ロメフロキサシン(Lomefloxacin)、ロラカルベフ、リメサイクリン、メシリナム、メロペネム(Meropenem)、メタサイクリン、メチシリン、メトロニダゾール、メズロシリン、ミデカマイシン、ミノサイクリン、ミオカマイシン、モキシフロキサシン(Moxifloxacin)、ナフシリン、ナフシリン、ナリジキシン酸(Nalidixic acid)、ネオマイシン、ネチルマイシン、ノルフロキサシン、ノボビオシン、オフロキサシン、オレアンドマイシン、オキサシリン、オキソリン酸、オキシテトラサイクリン、パロマイシン、パズフロキサシン(Pazufloxacin)、ペフロキサシン(Pefloxacin)、ペニシリンG、ペニシリンV、フェネチシリン、フェノキシメチル・ペニシリン、ピペミド酸、ピペラシリン、ピペラシリンおよびタゾバクタム(Tazobactam)の組み合わせ、ピロミド酸、プロカイン・ペニシリン、プロピシリン、ピリメタミン、リファブチン(Rifabutin)、リファミド(Rifamide)、リファンピシン、リファマイシンSV、リファペンチン、ロキタマイシン(Rokitamycin)、ロリテトラサイクリン、ロキシスロマイシン(Roxithromycin)、ルフロキサシン(Rufloxacin)、シタフロキサシン(Sitafloxacin)、スパルフロキサシン(Sparfloxacin)、スペクチノマイシン、スピラマイシン、スルファジアジン、スルファドキシン、スルファメトキサゾール、シソマイシン(Sisomicin)、ストレプトマイシン、スルファメトキサゾール、スルフィソキサゾール、シナーシド(Synercid)(キヌプリスチン-ダルフォプリスチンの組み合わせ)、テイコプラニン(Teicoplanin)、テリスロマイシン(Telithromycin)、テモシリン(Temocillin)、テトラサイクリン、テトロキソプリム(Tetroxoprim)、チアンフェニコール、チカルシリン、チゲサイクリン(Tigecycline)、トブラマイシン、トスフロキサシン(Tosufloxacin)、トリメトプリム、トリメトレキサート(Trimetrexate)、トロバフロキサシン(Trovafloxacin)、バンコマイシン、ならびにベルダマイシン(Verdamicin)が含まれるが、これらに制限はされない。
【0101】
本発明の組成物と共に使用するのに適している血管収縮剤には、例えば、ジヒドロエルゴタミン、エルゴタミン、およびメチルセルジド、それらの薬学的に許容される塩が含まれ得る。
【0102】
本発明の組成物と共に使用するのに適している抗血栓剤には、例えば、アルガトロバン、イロプロスト、ラミフィバン(lamifiban)、タプロステン(taprostene)、チロフィバン、組織プラスミノーゲン・アクチベーター(天然または組換え)、テネクテプラーゼ(tenecteplase)(TNK)、およびラノテプラーゼ(lanoteplase)(nPA);第VIIa因子阻害剤;第Xa因子阻害剤;(ヒルジンおよびアルガトロバンのような)トロンビン阻害剤;PAI-1阻害剤(すなわち、組織プラスミノーゲン・アクチベーター阻害剤の不活化剤);α2-アンチプラスミン阻害剤;ストレプトキナーゼ、ウロキナーゼ、およびプロウロキナーゼ;ならびにアニソイル化(anisoylated)プラスミノーゲン・ストレプトキナーゼ・アクチベーター複合体、抗凝固剤(例えば、ヒルジン、ヘパリン等)、プラスミノーゲン・アクチベーター(例えば、t-PA、ウロキナーゼ等)、繊維素溶解酵素(例えば、プラスミン、サブチリシン等)、抗血小板凝集剤(例えば、プロスタシクリン、アスピリン等)等が含まれ得る。
【0103】
本発明の組成物と共に使用するのに適している抗凝固剤には、例えば、シロスタゾール(cilostazol)(PLETAL(登録商標)、Otsuka)、クロピドグレル(clopidogrel)(PLAVIX(登録商標)、Sanofi)、チクロピジン(ticlopidine)(TICLID(登録商標)、Syntex)、チロフィバン(tirofiban)(AGGRASTAT(登録商標)、Merck)、エプチフィバチド(eptifibatide)(INTEGRILIN(登録商標)、COR Therapeutics)、アブシキシマブ(abciximab)(REOPRO(登録商標)、EIi LiIIy)、アナグレリド(anagrelide)(AGRYLIN(登録商標)、Roberts)、ジピリダモール(dipyridamole)(PERSANTIN(登録商標)、Boehringer Ingelheim)、アスピリン(ECOTR(登録商標)他)、ジピリダモール/アスピリン(AGGRENOX(登録商標)、Boehringer Ingelheim)、ダルテパリン(dalteparin)(FRAGMIN(登録商標)、Pharmacia)、エノキサパリン(enoxaparin)(LOVENOX(登録商標)、Aventis)、チンザパリン(tinzaparin)(INNOHE(登録商標)、DuPont)、ヘパリン(種々)、ダナパロイド(danaparoid)(ORGANON(登録商標)、Organon)、アンチトロンビンIII(THROMBATE(登録商標)、Bayer)、レピルジン(lepirudin)(REFLUDAN(登録商標)、Hoechst-Marion Roussel)、アルガトロバン(argatroban)(ACOVA(登録商標)、SmithKlineBeecham)、ビバリルジン(bivalirudin)(ANGIOMAX(登録商標)、Medicines Company)、ワルファリン(COUMADIN(登録商標)、DuPont)アニシジオン(anisidione)(MIRADON(登録商標)、Schering)、アルテプラーゼ(alteplase)(ACTIVASE(登録商標)、Genetech)、レテプラーゼ(reteplase)(RETAVASE(登録商標)、Boehringer Mannheim)、テネクテプラーゼ(tenecteplase)(TNKASE(登録商標)、Genentech)、ドロトレコギン(drotrecogin)(XIGRIS(登録商標)、EIi Lilly)、アニストレプラーゼ(anistreplase)(EMINASE(登録商標)、Roberts)、ストレプトキナーゼ(STREPTASE(登録商標)、Astra)、ウロキナーゼ(ABBOKINASE(登録商標)、Abbott)、およびそれらの組み合わせが含まれ得る。
【0104】
本発明の組成物、方法、およびキットと共に使用するのに適している起泡抑制剤には、例えば、モノカルボキシル脂肪酸およびその可溶性塩が含まれ得る。抑泡剤として使用されるモノカルボキシル脂肪酸およびそれらの塩は、炭素原子1〜約50個、炭素原子約10〜約24個、または炭素原子12個〜約18個のヒドロカルビル鎖を有し得る。適当な塩には、ナトリウム塩、カリウム塩、およびリチウム塩のようなアルカリ金属塩、並びにアンモニウム塩およびアルカノールアンモニウム塩が含まれる。付加的な起泡抑制剤には、例えば、パラフィン、脂肪酸エステル(例えば、脂肪酸トリグリセリド)、1価アルコールの脂肪酸エステル、脂肪族C18-C40ケトン(例えば、ステアロン)等のような高分子量炭化水素が含まれる。その他の起泡抑制剤には、炭素原子1〜24個を含有している2または3モルの第一級または第二級アミンにより塩化シアヌルの生成物として形成されたトリ〜ヘキサ-アルキルメラミンまたはジ〜テトラ-アルキルジアミン・クロルトリアジンのようなN-アルキル化アミノ・トリアジン、プロピレン/オキシド、ならびにモノステアリル・アルコール・リン酸エステルおよびモノステアリル・ジアルカリ金属(例えば、K、Na、およびLi)ホスフェートおよびリン酸エステルのようなモノステアリル・ホスフェートが含まれる。パラフィンおよびハロパラフィンのような炭化水素は、液状で利用され得る。好ましくは、約100℃未満の融点を有しているロウ状炭化水素を利用することも既知である。炭化水素は、界面活性剤組成物のための抑泡剤の好ましいカテゴリーを構成する。したがって、炭化水素には、脂肪族、脂環式、芳香族、および複素環式の飽和または不飽和の炭素原子約12〜約70個を有する炭化水素が含まれる。「パラフィン」という用語には、この抑泡剤の考察において使用されるように、真のパラフィンおよび環式炭化水素の混合物が含まれるものとする。
【0105】
抑泡剤のもう一つの例には、シリコン抑泡剤が含まれる。このカテゴリーには、ポリジメチルシロキサンのようなポリオルガノシロキサン油、ポリオルガノシロキサン油または樹脂の分散物または乳濁物、およびポリオルガノシロキサンがシリカへ化学吸着または融合しているポリオルガノシロキサンとシリカ粒子との組み合わせの使用が含まれる。例には、シリコンおよびシリカ−シリコン混合物も含まれるが、これらに制限はされない。シリコンは、一般にアルキル化ポリシロキサン材料により代表され得、シリカは、シリカのエアロゲルおよびキセロゲルならびに様々な型の疎水性シリカにより例証される、微細に粉砕された形態で通常使用される。シロキサン−グリコール・コポリマーであるシリコン泡制御剤DC-544は、Dow Corningより市販されている。その他の好ましい泡制御剤は、シリコン油および2-アルキル-アルカノールの混合物を含む抑泡系である。適当な2-アルキル-アルカノールは、商標lsofol 12(商標)の下で市販されている2-ブチル-オクタノール、およびAerosil(商標)のような溶融非多孔性シリカと組み合わせられたシリコン/シリカ混合物である。
【0106】
抗分散剤の例には、ショ糖、グリセロール、およびグリセリンが含まれるが、これらに制限はされない。
【0107】
本発明の組成物と共に使用するのに適しているステロイドには、例えば、任意で、純粋な異性体型(そのような型が存在する場合)、および薬学的に許容される塩の形態であってもよい、ベタメタゾン、クロロプレドニゾン、クロコルトロン(clocortolone)、コルチゾン、デソニド(desonide)、デキサメタゾン、デスオキシメタゾン(desoximetasone)、ジフルプレドネート(difluprednate)、エストラジオール、フルドロコルチゾン(fludrocortisone)、フルメタゾン、フルニソリド(flunisolide)、フルオコルトロン(fluocortolone)、フルプレドニゾロン(fluprednisolone)、ヒドロコルチゾン、メプレドニゾン(meprednisone)、メチルプレドニゾロン、パラメタゾン、プレドニゾロン、プレドニゾン、プレグナン-3-α-オール-20-オン、テストステロン、およびトリアムシノロン、エストラジオール、エストロン、エストリオール、ポリエストラジオール、ポリエストリオール(polyestriol)、ジエネストロール(dienestrol)、ジエチルスチルベストロール、ジヒドロエルゴステロン(dihydroergosterone)、シプロテロン(cyproteron)、ダナゾール(danazol)、テストステロン、プロゲステロン、ノルエチンドロン(norethindrone)、レボノルゲストロール(levonorgestrol)、エチノジオール(ethynodiol)、ノルゲスチメート(norgestimate)、ゲスタニン(gestanin)、3-ケトン-デソゲストレル(desogestrel)、デメゲストン(demegestone)、プロメトエストロール(promethoestrol)、テストステロン、スピロノラクトン、およびそれらのエステル、ブデソニド(budesonide)、ロフレポニド(rofleponide)、パルミチン酸ロフレポニド、シクレソニド(ciclesonide)、フロ酸モメタゾン(momethasone furoate)、プロピオン酸フルチカゾン、チプレダン(tipredane)、フルオシノロン(fluocinolone)アセトニド、フルニソリド(flunisolide)、フルメタゾン、デキサメタゾン、プロピオン酸ベクロメタゾン(beclomethasone dipropionate)、デフラザコルト(deflazacort)、コルチバゾール(cortivazol)、コルチゾールおよび/またはヒドロコルチゾール、プレドニゾン、酢酸フルオロメトロン(fluorometholone acetate)、デキサメタゾン・リン酸ナトリウム(dexamethasone sodium phosphate)、スプロフェン(suprofen)、フルオロメトロン(fluorometholone)、ならびにメドリゾン(medrysone)が含まれ得る。
【0108】
本発明の組成物と共に使用するのに適している抗炎症剤には、ステロイド性抗炎症剤および非ステロイド性抗炎症剤の両方が含まれ得る。適当なステロイド性抗炎症剤には、ヒドロコルチゾン、ヒドロキシルトリアムシノロン・αメチル・デキサメタゾン(hydroxyltriamcinolone alphamethyl dexamethasone)、リン酸デキサメタゾン、プロピオン酸ベクロメタゾン、吉草酸クロベタゾール、デソニド、デスオキシメタゾン、酢酸デオキシコルチコステロン、デキサメタゾン、ジクロリゾン(dichlorisone)、酢酸ジフロラゾン(diflorasone diacetate)、吉草酸ジフルコルトロン(diflucortolone)、フルアドレノロン(fluadrenolone)、フルクラロロン・アセトニド(fluclarolone acetonide)、フルドロコルチゾン、ピバル酸フルメタゾン、フルオシノロン・アセトニド、フルオシノニド(fluocinonide)、フルコルチン・ブチルエステル(flucortine butylester)、フルオコルトロン、酢酸フルプレドニデン(fluprednidene)(フルプレドニリデン(fluprednylidene))、フルランドレノロン(flurandrenolone)、ハルシノニド(halcinonide)、酢酸ヒドロコルチゾン、酪酸ヒドロコルチゾン、メチルプレドニゾロン、トリアムシノロン・アセトニド、コルチゾン、コルトドキソン(cortodoxone)、フルセトニド(flucetonide)、フルドロコルチゾン、酢酸ジフルオロゾン(difluorosone diacetate)、フルラドレナロン・アセトニド(fluradrenalone acetonide)、メドリゾン、アムシアフェル(amciafel)、アムシナフィド(amcinafide)、ベタメタゾンおよびそのエステルのバランス、クロルプレドニゾン(chlorprednisone)、酢酸クロルプレドニゾン、クロコルテロン(clocortelone)、クレシノロン(clescinolone)、ジクロリゾン(dichlorisone)、ジフルプレドネート、フルクロロニド(flucloronide)、フルニゾリド(flunisolide)、フルオロメタロン(fluoromethalone)、フルペロロン(fluperolone)、フルプレドニゾロン(fluprednisolone)、吉草酸ヒドロコルチゾン、シクロペンチルプロピオン酸ヒドロコルチゾン(hydrocortisone cyclopentylproprionate)、ヒドロコルタメート(hydrocortamate)、メプレドニゾン、パラメタゾン、プレドニゾロン、プレドニゾン、プロピオン酸ベクロメタゾン、プロピオン酸ベタメタゾン、トリアムシノロン、およびそれらの混合物のような副腎皮質ステロイドが含まれ得るが、これらに制限はされない。
【0109】
本発明の組成物において有用な抗炎症剤の第二のクラスには、非ステロイド性抗炎症剤が含まれる。この群に包含される多様な化合物は、当業者に周知である。本発明の組成物において有用な適当な非ステロイド性抗炎症剤には、ピロキシカム(piroxicam)、イソキシカム(isoxicam)、トネキシカム(tonexicam)、スドキシカム(sudoxicam)、およびCP-14,304のようなオキシカム;サリチル酸、アスピリン、ジサルシド(disalcid)、ベノリレート(benorylate)、トリリセート(trilisate)、サファプリン(safapryn)、ソルプリン(solprin)、ジフルニサル(diflunisal)、およびフェンドサル(fendosal)のようなサリチレート;ジクロフェナク、フェンクロフェナク(fenclofenac)、インドメタシン、スリンダク、トルメチン(tolmetin)、イソキセパク(isoxepac)、フロフェナク(furofenac)、チオピナク(tiopinac)、ジドメタシン(zidometacin)、アセマタシン(acematacin)、フェンチアザク(fentiazac)、ゾメピラクト(zomepiract)、クリダナク(clidanac)、オキセピナク(oxepinac)、およびフェルビナク(felbinac)のような酢酸誘導体;メフェナム酸、メクロフェナム(meclofenamic)酸、フルフェナム(flufenamic)酸、ニフルム(niflumic)酸、およびトルフェナム(tolfenamic)酸のようなフェナメート;イブプロフェン、ナプロキセン、ベノキサプロフェン(benoxaprofen)、フルルビプロフェン、ケトプロフェン、フェノプロフェン、フェンブフェン、インドプロフェン(indoprofen)、ピルプロフェン(pirprofen)、カルプロフェン(carprofen)、オキサプロジン、プラノプロフェン、ミロプロフェン(miroprofen)、チオキサプロフェン(tioxaprofen)、スプロフェン(suprofen)、アルミノプロフェン(alminoprofen)、およびチアプロフェン酸(tiaprofenic)のようなプロピオン酸誘導体;ならびにフェニブタゾン(phenybutazone)、オキシフェンブタゾン、フェプラゾン(feprazone)、アザプロパゾン(azapropazone)、およびトリメタゾン(trimethazone)のようなピラゾールが含まれるが、これらに制限はされない。これらの非ステロイド性抗炎症剤の混合物、ならびにこれらの薬剤の薬学的に許容される塩およびエステルも利用され得る。
【0110】
本発明の製剤の皮下注射後の炎症による不快症状を減少させるため、本発明の薬理活性界面活性剤組成物と共に使用するのに適している鎮痛剤には、注射可能な局所的なアミンおよびエステル麻酔剤が含まれるが、これらに制限はされない。鎮痛剤の非制限的な例には、リドカイン、メピバカイン、ブピバカイン、プロカイン、クロロプロカイン、エチドカイン、プリロカイン、ジクロニン、ヘキシルカイン(hexylcaine)、プロカイン、コカイン、ケタミン、プラモキシン(pramoxine)、プロポフォール(propophol)、フェノール、およびテトラカインが含まれる。これらの鎮痛剤の混合物、ならびにこれらの薬剤の薬学的に許容される塩およびエステルも利用され得る。鎮痛剤のその他の例には、オピオイドが含まれる。オピオイドの例には、モルフィン、または硫酸塩、塩化物、もしくは塩酸塩のようなその塩が含まれる。本発明において使用され得るその他の1,4-ヒドロキシモルフィナン(hydroxymorphinan)オピオイド鎮痛剤には、ナロキソン、メペリジン、ブトルファノール、もしくはペンタゾシンのようなもの、またはモルフィン-6-グルノロニド、コデイン、ジヒドロコデイン、ジアモルフィン(diamorphine)、デキストロプロポキシフェン(dextropropoxyphene)、ペチジン、フェンタニル、アルフェンタニル、アルファプロジン、ブプレノルフィン、デキストロモラミド(dextromoramide)、ジフェノキシレート、ジピパノン(dipipanone)、ヘロイン(ジアセチルモルフィン)、ヒドロコドン(ジヒドロコデイノン(dihydrocodeinone))、ヒドロモルフォン(hydromorphone)(ジヒドロモルフィノン(dihydromorphinone))、レボルファノール(levorphanol)、メプタジノール(meptazinol)、メサドン、メトポン(metopon)(メチルジヒドロモルフィノン)、ナルブフィン、オキシコドン(ジヒドロヒドロキシコデイノン(dihydrohydroxycodeinone))、オキシモルフォン(ジヒドロヒドロキシモルフィノン(dihydrohydroxymorphinone))、フェナドキソン(phenadoxone)、フェナゾシン、レミフェンタニル、トラマドール、またはこれらのいずれかの塩が含まれる。本発明の方法において使用されるオピオイドには、上記化合物の任意の組み合わせも含まれ得る。ナロキソンも、オピオイドの定義に含まれる。使用され得る特に好ましい鎮痛剤には、ヒドロモルフォン、オキシコドン、モルフィン、例えば、硫酸モルフィン、およびフェンタニル、ならびに/または薬学的に許容されるそれらの塩が含まれる。
【0111】
本発明のキットまたは組成物に含まれ得る適当な精神安定剤および鎮静薬には、クロルジアゼポキシド(chlordiazepoxide)、ベナクチジン(benactyzine)、ベンズキナミド(benzquinamide)、フルラゼパム(flurazepam)、ヒドロキシジン(hydroxyzine)、ロキサピン(loxapine)、プロマジン(promazine)、ならびに/またはそれらの許容される塩およびエステルが含まれ得る。
【0112】
本発明のキットまたは組成物に含まれ得る適当な筋弛緩剤には、シンナメドリン(cinnamedrine)、シクロベンザプリン(cyclobenzaprine)、フラボキサート(flavoxate)、オルフェナドリン(orphenadrine)、パパベリン(papaverine)、メベベリン(mebeverine)、イダベリン(idaverine)、リトドリン(ritodrine)、デフェノキシラート(dephenoxylate)、ダントロレン(dantrolene)、アズモレン(azumolene)、および/またはそれらの薬学的に許容される塩が含まれ得る。
【0113】
本発明のキットまたは組成物に含まれ得る適当な止痢薬には、例えば、ロペラミド(loperamide)および/またはその薬学的に許容される塩が含まれ得る。
【0114】
第二の治療剤は、一つまたは複数の本明細書中の薬理活性界面活性剤と共製剤化され、かつ/または共投与され得る。そのような共製剤において、第二の治療剤は、w/w、w/v、またはv/vで、20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、0.5%、0.4%、0.3%、0.2%、0.1%、0.09%、0.08%、0.07%、0.06%、0.05%、0.04%、0.03%、0.02%、0.01%、0.009%、0.008%、0.007%、0.006%、0.005%、0.004%、0.003%、0.002%、0.001%、0.0009%、0.0008%、0.0007%、0.0006%、0.0005%、0.0004%、0.0003%、0.0002%、または0.0001%未満の濃度で存在し得る。
【0115】
いくつかの態様において、第二の治療剤は、一つまたは複数の本明細書中の薬理活性界面活性剤と共製剤化され得る。そのような共製剤において、第二の治療剤は、w/w、w/v、またはv/vで、20%、19.75%、19.50%、19.25% 19%、18.75%、18.50%、18.25% 18%、17.75%、17.50%、17.25% 17%、16.75%、16.50%、16.25% 16%、15.75%、15.50%、15.25% 15%、14.75%、14.50%、14.25% 14%、13.75%、13.50%、13.25% 13%、12.75%、12.50%、12.25% 12%、11.75%、11.50%、11.25% 11%、10.75%、10.50%、10.25% 10%、9.75%、9.50%、9.25% 9%、8.75%、8.50%、8.25% 8%、7.75%、7.50%、7.25% 7%、6.75%、6.50%、6.25% 6%、5.75%、5.50%、5.25% 5%、4.75%、4.50%、4.25%、4%、3.75%、3.50%、3.25%、3%、2.75%、2.50%、2.25%、2%、1.75%、1.50%、125%、1%、0.5%、0.4%、0.3%、0.2%、0.1%、0.09%、0.08%、0.07%、0.06%、0.05%、0.04%、0.03%、0.02%、0.01%、0.009%、0.008%、0.007%、0.006%、0.005%、0.004%、0.003%、0.002%、0.001%、0.0009%、0.0008%、0.0007%、0.0006%、0.0005%、0.0004%、0.0003%、0.0002%、または0.0001%超の濃度で存在し得る。
【0116】
いくつかの態様において、第二の治療剤は、最終製剤が、w/w、w/v、またはv/vで、およそ0.001%〜およそ50%、およそ0.001%〜およそ40%、およそ0.01%〜およそ30%、およそ0.02%〜およそ29%、およそ0.03%〜およそ28%、およそ0.04%〜およそ27%、およそ0.05%〜およそ26%、およそ0.06%〜およそ25%、およそ0.07%〜およそ24%、およそ0.08%〜およそ23%、およそ0.09%〜およそ22%、およそ0.1%〜およそ21%、およそ0.2%〜およそ20%、およそ0.3%〜およそ19%、およそ0.4%〜およそ18%、およそ0.5%〜およそ17%、およそ0.6%〜およそ16%、およそ0.7%〜およそ15%、およそ0.8%〜およそ14%、およそ0.9%〜およそ12%、およそ1%〜およそ10%の範囲内にある濃度の第二の治療剤を有するよう、一つまたは複数の本明細書中の薬理活性界面活性剤と共製剤化され得る。最終濃度は、標的部位の位置およびサイズを含む(がこれらに制限はされない)当業者に公知の多くの要因に依存することが理解される。
【0117】
いくつかの態様において、本明細書中の組成物は、10g、9.5g、9.0g、8.5g、8.0g、7.5g、7.0g、6.5g、6.0g、5.5g、5.0g、4.5g、4.0g、3.5g、3.0g、2.5g、2.0g、1.5g、1.0g、0.95g、0.9g、0.85g、0.8g、0.75g、0.7g、0.65g、0.6g、0.55g、0.5g、0.45g、0.4g、0.35g、0.3g、0.25g、0.2g、0.15g、0.1g、0.09g、0.08g、0.07g、0.06g、0.05g、0.04g、0.03g、0.02g、0.01g、0.009g、0.008g、0.007g、0.006g、0.005g、0.004g、0.003g、0.002g、0.001g、0.0009g、0.0008g、0.0007g、0.0006g、0.0005g、0.0004g、0.0003g、0.0002g、または0.0001g未満の一つまたは複数の本明細書中の第二の治療剤を含むか、から本質的になるか、またはからなる。
【0118】
いくつかの態様において、本明細書中の組成物は、0.0001g、0.0002g、0.0003g、0.0004g、0.0005g、0.0006g、0.0007g、0.0008g、0.0009g、0.001g、0.0015g、0.002g、0.0025g、0.003g、0.0035g、0.004g、0.0045g、0.005g、0.0055g、0.006g、0.0065g、0.007g、0.0075g、0.008g、0.0085g、0.009g、0.0095g、0.01g、0.015g、0.02g、0.025g、0.03g、0.035g、0.04g、0.045g、0.05g、0.055g、0.06g、0.065g、0.07g、0.075g、0.08g、0.085g、0.09g、0.095g、0.1g、0.15g、0.2g、0.25g、0.3g、0.35g、0.4g、0.45g、0.5g、0.55g、0.6g、0.65g、0.7g、0.75g、0.8g、0.85g、0.9g、0.95g、1g、1.5g、2g、2.5、3g、3.5、4g、4.5g、5g、5.5g、6g、6.5g、7g、7.5g、8g、8.5g、9g、9.5g、または10g超の一つまたは複数の本明細書中の第二の治療剤を含むか、から本質的になるか、またはからなる。
【0119】
いくつかの態様において、本明細書中の組成物は、0.0001〜10g、0.0005〜9g、0.001〜8g、0.005〜7g、0.01〜6g、0.05〜5g、0.1〜4g、0.5〜4g、または1〜3gの一つまたは複数の本明細書中の第二の治療剤を含むか、から本質的になるか、またはからなる。
【0120】
薬学的製剤
本発明の組成物のための薬理学的に許容される水性媒体には、例えば、界面活性剤を溶解させることができ、製剤を受容する特定の個体に対して毒性でない任意の液体溶液が含まれ得る。薬学的に許容される水性媒体の例には、非制限的に、生理食塩水、水、および酢酸が含まれる。典型的には、薬学的に許容される水性媒体は、無菌である。
【0121】
本発明の態様において有用な薬理活性界面活性剤組成物は、局所的な脂肪沈着物の非外科的な減少のため製剤化される。本明細書において使用されるように、「非外科的な」とは、切開を必要としない医学的な手技をさす。注射は、非外科的な手技の例である。脂肪吸引は、外科的な手技である。
【0122】
本発明の一つの態様において、薬理活性界面活性剤組成物は、注射、例えば、ボーラス注射により投与される。有効であるためには、界面活性剤組成物は、如何にして注入されるかに関わらず、脂肪組織と直接接触しなければならない。界面活性剤製剤は、皮下注射されるか、または脂肪に直接注入され得る。注射用の製剤は、単位剤形、例えば、アンプルで、または保存剤が添加された多重用量(multi-dose)容器で提示され得る。組成物は、油性または水性の媒体による懸濁物、溶液、または乳濁剤のような形態をとることができ、懸濁化剤、安定剤、および/または分散剤のような製剤化用の薬剤を含有していてもよい。
【0123】
「薬学的に許容される賦形剤」が本明細書において使用され得、それは、一般に安全で、非毒性で、生物学的にも他の面からも有害でない、薬学的組成物の調製において有用な化合物をさし、獣医学的使用またはヒトにおける薬学的使用のために許容される賦形剤を含む。本明細書および特許請求の範囲において使用されるように、薬学的に許容される賦形剤には、一つのそのような賦形剤および複数のそのような賦形剤の両方が含まれる。適当な賦形剤のいくつかの例には、乳糖、デキストロース、ショ糖、ソルビトール、マンニトール、デンプン、アラビアゴム、リン酸カルシウム、アルギン酸塩、トラガカントゴム、ゼラチン、ケイ酸カルシウム、微晶質セルロース、ポリビニルピロリドン、ホスファチジルコリン、セルロース、滅菌水、シロップ、およびメチル・セルロースが含まれる。製剤は、さらに、以下のものを含み得る:タルク、ステアリン酸マグネシウム、および鉱油のような滑択剤;湿潤剤;乳化剤および懸濁化剤;ならびに安息香酸メチルおよびヒドロキシ安息香酸プロピルおよびベンジルアルコールのような保存剤。本発明の組成物は、当技術分野において既知の手法を利用することにより、患者への投与後の活性成分の迅速な放出、持続的な放出、または遅延型の放出を提供するよう製剤化され得る。
【0124】
本発明の界面活性剤組成物と共に製剤化するのに適している付加的な賦形剤には、浸透増強剤および分散剤が含まれる。組織における薬物の分散を可能にする分散剤の非制限的な例には、ヒアルロニダーゼおよびコラゲナーゼが含まれる。ヒアルロニダーゼは、他の薬物の組織透過性および拡散または分散を強化するよう機能する。コラゲナーゼは、皮下脂肪から脂肪細胞を単離するために使用されており、脂肪細胞自体に対しては溶解効果を及ぼさない。さらに、ヒアルロニダーゼおよびコラゲナーゼは、本発明の界面活性剤製剤による処置後の壊死組織の減少を加速することにより、治癒を促進することができる。
【0125】
本発明の薬理活性界面活性剤組成物は、下眼瞼脂肪ヘルニア、腰部、股関節部、およびその他の化粧区域の蓄積、眼瞼黄板症、脂肪腫、および「バッファロー瘤」脂肪異栄養を含む脂肪異栄養を含むが、これらに制限はされない、局所的な脂肪蓄積を処置するのに有用である(3)。もう一つの態様において、本発明の界面活性剤組成物は、セルライトに関連した脂肪沈着物を処置するのに有用である。
【0126】
方法
本発明は、哺乳動物における皮下脂肪沈着物を減少させる方法にも関する。そのような方法は、本明細書中の組成物または用量単位のうちの一つまたは複数を哺乳動物における脂肪沈着物へと局所投与することを含むか、から本質的になるか、またはからなる。例えば、一つの態様において、500mL未満の溶液が、減少させるべき脂肪沈着物へと局所送達される。その溶液は、本明細書に開示されたもののような薬理活性界面活性剤(好ましくは、デオキシコール酸ナトリウムのような胆汁酸塩)を含むか、から本質的になるか、またはからなる。その溶液は、好ましくは、5%w/v未満のホスファチジルコリンを含むか、またはより好ましくはホスファチジルコリンを含まない。
【0127】
本発明のいくつかの態様において、上記の方法は、患者における一つまたは複数の局所的な脂肪沈着物の非外科的な除去のため提供される。例えば、一つの態様において、本明細書中の非外科的な方法は、脂肪吸引を含まない。いくつかの態様において、本明細書中の方法は、脂肪を減少させるための非侵襲的な手段、例えば、超音波処理も排除する。その他の態様において、非侵襲的な手段が、本明細書中の組成物と共に使用されてもよい。
【0128】
処置される患者は、好ましくは、哺乳動物である。そのような哺乳動物は、ヒト、または霊長類(例えば、サル、チンパンジー等)、家畜(例えば、イヌ、ネコ、ウマ等)、養殖動物(例えば、ヤギ、ヒツジ、ブタ、ウシ等)、もしくは実験動物(例えば、マウス、ラット等)のような動物であり得る。好ましくは、処置される患者は、ヒト、ウマ、イヌ、またはネコである。
【0129】
本明細書中の組成物は、例えば、脂肪腫、ヘルニア、ダーカム病、マーデルング頸、脂肪浮腫、圧力原性結節、眼瞼黄板症、脂肪異栄養、およびセルライトのような障害を含む患者における任意の脂肪状態を処置するために使用され得る。その他の態様において、本明細書中の組成物は、哺乳動物の目の下、顎の下、腕の下、殿部、腓、背部、大腿、足首、または胃部に局在する脂肪沈着物のような区域における脂肪状態を処置するために使用され得る。
【0130】
本明細書中の脂肪可溶化組成物は、好ましくは、局所注射を介して投与される。しかしながら、本明細書中の組成物を投与するその他の手段も企図される。例えば、本明細書中の組成物は、皮膚パッチまたは皮下デポー(depot)を介して投与され得る。
【0131】
一般に、投与される処置の全容量、単位用量、および数は、標的部位における脂肪の量、標的部位の位置、脂肪組成の型、および所望の結果に依って変動するであろう。一般に、処置される脂肪の量が多いほど、投与される用量も多くなる。本明細書中の組成物および単位投薬量は、処置計画の一部として個体に投与され得るが、処置計画の一部として個体から除去されないことに注意するべきである。
【0132】
従って、本発明は、一つまたは複数の薬理活性界面活性剤を含むか、から本質的になるか、またはからなる脂肪可溶化組成物を、有効量、哺乳動物に投与することにより、哺乳動物における皮下脂肪の量を減少させる方法を企図する。上記のものは、好ましくは、経皮的にまたは皮下に、例えば、注射器を使用した皮下注射を介して、標的部位へと投与される。標的部位は、例えば、0.1cm×0.1cm〜約5cm×5cmであり得る。本明細書中の組成物は、本明細書に開示されたような様々な間隔、投薬量、容量で、同一の、隣接した、または近傍の標的部位へと投与され得る。
【0133】
本発明は、哺乳動物における局所的な脂肪沈着物の非外科的な減少のための組成物および方法を提供する。一つの態様において、本明細書中の方法は、脂肪を可溶化する濃度の一つまたは複数の薬理活性界面活性剤を含む薬学的に許容される注射可能溶液の投与を含む。本発明の目的のため、非外科的な脂肪減少の方法は、脂肪吸引、脂肪形成術、または吸引脂肪組織切除を含まない。
【0134】
好ましくは、本明細書中の方法は、(例えば、吸引を介した)薬理活性界面活性剤の非積極的な除去を排除する。
【0135】
上記の方法は、いずれも、患者に第二の治療剤をさらに投与することにより補足され得る。第二の治療剤は、別々に、または本明細書中の組成物と組み合わせて投与され得る。第二の治療剤は、局所投与または全身投与され得る。いくつかの態様において、第二の治療剤は、界面活性剤と共製剤化され、本明細書中の界面活性剤と同時に投与される。他において、第二の治療剤のうちの一つまたは複数は、本明細書中の界面活性剤の投与より前に投与される。
【0136】
上記のものは、1回または複数回、標的部位へと投与され得る。いくつかの態様において、本明細書中の組成物は、少なくとも1、2、3、4、5、6、7、8、9、または10回、標的部位へと投与される。複数回の投与は、1時間以内、1日以内、1週間以内、1ヶ月以内、または1年以内に行われ得る。好ましくは、単一標的部位への複数回投与は、1年に10、9、8、7、6、5、4、3、もしくは2回未満、1ヶ月に10、9、8、7、6、5、4、3、もしくは2回未満、1週間に10、9、8、7、6、5、4、3、もしくは2回未満、1日に10、9、8、7、6、5、4、3、または2回未満、または1時間に10、9、8、7、6、5、4、3、もしくは2回未満、行われ得る。いくつかの態様において、患者は、一つの標的部位において1〜100回、2〜50回、3〜30回、4〜20回、または5〜10回の注射を受ける。この回数の注射が、1年、6ヶ月、5ヶ月、4ヶ月、3ヶ月、2ヶ月、1ヶ月、3週間、2週間、もしくは1週間、またはそれ未満の期間にわたり行われ得る。
【0137】
組成物は、例えば、真皮の0.1〜4インチ下、0.5〜3インチ下、1〜2インチ下を含む、真皮下の様々なレベルに投与され得る。
【0138】
組成物は、様々な容量で投与され得るが、好ましくは、注射1回当たり50mL、40mL、30mL、20mL、10mL、9mL、8mL、7mL、6mL、5mL、4mL、3mL、2mL、1mL、0.1mL、0.01mL未満の全容量で投与され得る。
【0139】
キット
図7は、脂肪吸引を使用しない哺乳動物における皮下脂肪蓄積の減少のためのキット101の例示である。キットは、一つまたは複数の第一の容器102を含む。第一の容器102は、本明細書中の組成物のうちのいずれかを含むか、から本質的になるか、またはからなる。例えば、第一の容器は、薬理活性界面活性剤および5%未満のw/vホスファチジルコリンを含むか、から本質的になるか、またはからなることができる。
【0140】
上記のものは、溶液で、またはより好ましくは注射可能溶液で調製され得る。そのような溶液を含む第一の容器102は、一つまたは複数の単位用量を保持するために十分な容量を有し得る。例えば、第一の容器102は、500mL、100mL、20mL、10mL、または5mL未満の溶液を保持するよう適合化され得る。いくつかの態様において、第一の容器102は、約0.01ml〜約100ml、約0.1ml〜約90ml、約0.5ml〜約80ml、約1ml〜約70ml、約2ml〜約60ml、約3ml〜約50ml、約4ml〜約40ml、約5ml〜約30ml、約6ml〜約20ml、ならびに約7ml〜約10mlの容量を保持する。より好ましい態様において、第一の容器102は、約10〜約20mlの容積を有するアンプルである。
【0141】
いくつかの態様において、界面活性剤およびオプション・ホスファチジルコリンは、徐放のための皮膚パッチまたはデポーへと製剤化される。パッチまたはデポーにおける投薬量は、本明細書に記述されたものと同様であり得る。
【0142】
第一の容器102は、任意で、一つまたは複数の第二の治療剤を含み得る。好ましくは、第一の容器102は、鎮痛剤、抗微生物剤、または抗炎症剤を含む。第一の容器102は、第二の界面活性剤を含んでいてもよい。界面活性剤の例は、本明細書に記載されている。
【0143】
第一の容器102は、好ましくは、5%w/v未満のホスファチジルコリンのようなリン脂質を有する。いくつかの態様において、第一の容器102は、リン脂質またはホスファチジルコリンを含有していない。
【0144】
第一の容器102は、好ましくは、w/w、w/v、またはv/vで0.01%、0.1%、1.0%、2.0%、3.0%、4.0%、または5.0%超の薬理活性界面活性剤を有する。好ましくは、第一の容器102の中の薬理活性界面活性剤の濃度は、そのミセル濃度を超えている。いくつかの態様において、該薬理活性界面活性剤の%w/v濃度は、該リン脂質またはホスファチジルコリンの%w/v濃度より大きい。
【0145】
容器102の溶液は、使用説明103に従って投与される。使用説明103は、例えば、標的部位、処置される哺乳動物、所望の結果、標的部位の位置、溶液の濃度、脂肪沈着のサイズに依って異なる、投薬のための説明を提供することができる。好ましくは、使用説明103は、ヒト、イヌ、ネコ、またはウマのような哺乳動物の処置のためのものである。使用説明103は、その他の家畜および/または養殖動物の処置のための情報も含み得る。
【0146】
使用説明103は、例えば、哺乳動物の目の下、顎の下、腕の下、殿部、腓、背部、大腿、足首、または胃部に局在する脂肪沈着物のような特定の標的部位を処置するための本明細書中の組成物の使用についての情報も含み得る。いくつかの態様において、使用説明103は、瞼脂肪ヘルニア、脂肪腫、脂肪異栄養、バッファロー瘤脂肪異栄養、またはセルライトに関連した脂肪沈着物である脂肪沈着物を処置するための本明細書中の組成物の使用のための説明を詳述する。
【0147】
使用説明103は、第一の容器102および/または第二の容器105の希釈(もしあれば)のための適切な希釈剤および容量に関する情報を含むかもしれない。使用説明103は、投与の頻度および投薬量のような、本明細書中の組成物の適切な投与に関する情報も提供するかもしれない。
【0148】
キット101は、第一の容器102の中の組成物を皮下脂肪蓄積領域へと送達するための、注射器またはその他の適当な送達デバイス(例えば、パッチ、皮下デポー)104をさらに含み得る。いくつかの態様において、注射器または送達デバイス104には、単位用量の本発明の溶液が予め負荷されていてもよい。
【0149】
キット101は、第二の活性薬剤を含む第二の容器105をさらに含み得る。第二の治療剤の例には、例えば、抗微生物剤、抗血栓剤、抗凝固剤、起泡抑制剤、抗炎症剤、鎮痛剤、麻酔剤、抗分散剤、分散剤、浸透増強剤、ステロイド、精神安定剤、筋弛緩剤、および止痢剤が含まれる。
【0150】
以下の実施例は、本発明の組成物および方法をより正確に定義し可能にするために提供される。この明細書および実施例を参照し理解した後には、多数のその他の態様および本発明を使用する方法が、当業者にとって明白な態様となるであろうことが理解される。以下の実施例は、本発明の一つまたは複数の態様を例示するためのものであって、本発明を下記のものへと制限するためのものではない。
【実施例】
【0151】
実施例1
デオキシコール酸ナトリウムおよびホスファチジルコリンの製剤
ホスファチジルコリン胆汁酸塩製剤(PBF)(5.0%高度精製大豆由来PC、4.75%デオキシコール酸ナトリウム、および0.9%ベンジルアルコールを含む滅菌水、表2)は、Hopewell Pharmacy,Hopewell,NJから入手された。デオキシコール酸ナトリウムおよびTriton(登録商標)X-100界面活性剤(Triton(登録商標)、アルキルアリール・ポリエーテル・アルコール)は、Sigma-Aldrich Corp.(St.Louis,MO)から入手された。Empigen(登録商標)BB界面活性剤(Empigen(登録商標)、ラウリルジメチルベタイン、Calbiochem,Biosciences,Inc.,La JoIIa,CA)。ストック試薬(5%希釈)をPBS緩衝液で調製した。
【0152】
(a)ホスファチジルコリン、(b)デオキシコール酸ナトリウム、および(c)ベンジルアルコールの分子構造は、図1に図示される。
【0153】
(表2)注射可能PBF

【0154】
実施例2
培養細胞におけるデオキシコール酸ナトリウムおよびホスファチジルコリンの溶液の効果
界面活性剤処置後の細胞生存率を測定するため、HaCaTヒト・ケラチノサイト細胞を、10%ウシ胎仔血清、ペニシリン、およびストレプトマイシンが補足されたDMEM(ダルベッコ改変イーグル培地)で培養した。HaCaT細胞を6穴プレートで培養し、37℃で30分間、0%、0.005%、0.050%、または0.500%のPBF(PC処方)またはデオキシコール酸ナトリウムと共にインキュベートした後、代謝活性を有する細胞により生物還元(bioreduced)された場合に色の変化を生ずるテトラゾリウム化合物を使用するMTSアッセイ(CellTiter 96(登録商標)AQueous Non-Radioactive Cell Proliferation Assay,Promega,Corp.Madison,WI)を使用して、細胞生存率を決定した。細胞生存率は、37℃においてアッセイと共に4時間インキュベートした後、(490nmで)吸光度分光光度計により決定された。新鮮な組織における細胞生存率を決定するため、脂肪標本を、ストック試薬およびMTSアッセイと共に24穴プレートで4時間インキュベートした。次いで、組織標本を色変化について可視化し、それらの上清中のMTSの量を(490nmにおける)吸光度により測定した。全ての研究をトリプリケートで実施した。490nmにおける吸光度(OD 490)は、培養物中の生存細胞の数に比例する。対照におけるOD 490と、0.005%希釈の両化合物におけるOD 490は比較可能であり(図2a)、このことから、この濃度においては、これらの物質の細胞生存率に対する効果はほとんどないことが示された。細胞生存率は、両溶液の0.05%および0.5%の濃度では次第に減少した。
【0155】
界面活性剤処置に応答して起こる細胞溶解を、37℃で30分間、示された細胞希釈率で試薬と共にインキュベートされたHaCaT細胞において決定した。乳酸デヒドロゲナーゼ放出を、製造業者により推奨されるようにして、LDHアッセイ(CytoTox 96(登録商標)Non-Radioactive Cytotoxicity Assay,Promega)と共に1時間インキュベートした後、(490nmにおける)吸光度により測定した。全ての研究をトリプリケートで実施した。LDH放出は、490nmにおける吸光度(OD 490)に直接比例する。対照細胞、および0.005%希釈の両化合物と共にインキュベートされた細胞からは最小のLDH放出が存在した(図2b)。PBFおよびデオキシコール酸塩の0.05%および0.5%では、次第に多くのLDHが放出された。
【0156】
実施例3
ブタ組織におけるデオキシコール酸ナトリウムおよびホスファチジルコリンの溶液の効果
ブタ組織を屠殺直後に入手し、体毛を剃り、最大4時間、氷上に置いた後、使用した。パンチ生検材料の表皮および真皮をメスにより除去することにより脂肪標本を入手し、切り取った。Calcein-AM(Sigma)と共に37℃で1時間インキュベートすることにより、脂肪標本にカルセイン色素を負荷した。ストック試薬を脂肪標本に添加し、温和に撹拌しながら37℃で30分間インキュベートした。紫色(411nm)光を使用した組織蛍光、および放射フィルターを使用した放射された緑色(500nm)光の視覚的観察により、カルセイン保持を決定した。
【0157】
1.0mLの注射器および30ゲージ、0.5インチの針を用いて、完全な厚さのブタ皮膚の様々なレベル(表皮、真皮、および皮下組織)へとストック試薬溶液(0.5mL)を注射することにより、組織学を実施した。標的組織を飽和させることを意図して、針の深さを、ブタ組織の端に沿って可視化した。37℃におけるPBSとのインキュベーションの1時間後に、複数の5.0mmの生検標本を、注射された部位から入手した(各条件をトリプリケートで実施した)。組織をホルムアルデヒドで固定し、パラフィン包埋し、ヘマトキシリン−エオシンにより染色した。委員会により承認された、処置プロトコルを承知していない皮膚病理学者が、標本を評価した。
【0158】
新鮮なブタ皮膚を使用して、培養細胞に対するこれらの界面活性物質の効果が、組織においても類似しているか否かを決定した。図3aは、MTSアッセイを使用した、PBS緩衝液(陰性対照)により処置された脂肪組織における濃紫色素の生成(生存可能細胞を示す)を示している。PBF、ならびにデオキシコール酸およびTriton(登録商標)界面活性剤(陽性対照)の5%溶液は、処置された脂肪標本における紫色素の比較可能な欠損(細胞死を示す)を示した。溶液間の脂肪細胞生存率の差を、処置された脂肪標本から収集された上清の(490における)吸光度を測定することにより定量化した(図3b)。全ての試薬が、新鮮な組織の脂肪細胞生存率に対して有意な効果を及ぼした。
【0159】
細胞溶解をカルセイン色素放出アッセイを使用して確認した。カルセインは加水分解後に蛍光性になり、無傷の細胞膜を有する細胞において保持される。それは死細胞を標識せず、細胞溶解を引き起こす条件の下では失われるため、色素カルセインが負荷された脂肪組織試料における緑色蛍光の欠損は、細胞溶解を示す(図4)。デオキシコール酸塩、PBF、およびTriton(登録商標)界面活性剤(陽性対照)により処置された試料は、類似した蛍光の欠損を示した。
【0160】
PBF、デオキシコール酸塩、およびEmpigen(登録商標)の注射に起因する組織学的変化は、図5に示される。ホスファチジルコリン胆汁酸塩製剤(図5b)およびデオキシコール酸塩(図5d)は、二つのよく特徴決定されている実験用界面活性剤Empigen(登録商標)(図5g)およびTriton(登録商標)(示されない)により引き起こされたものに類似した組織学的効果を生じた。これらの変化は、脂肪および筋肉の両方において明白であった。正常な小葉状構造の破壊による脂肪細胞の細胞膜の著しい不鮮明化および溶解が、PBF(図5b)およびデオキシコール酸塩(図5d)両方の注射の後に見られた。図5fは、PBF注射後の筋繊維の混乱および萎縮を示している。筋肉組織における類似した変化が、デオキシコール酸塩ならびにTriton(登録商標)およびEmpigen(登録商標)界面活性剤により処理された標本において可視であった。繊維芽細胞核染色の欠損および皮膚コラーゲンのヒアリン化を引き起こしたEmpigen(登録商標)を例外として、試薬の注射後、表皮、真皮、または付属構造には変化は存在しなかった。
【0161】
実施例4
デオキシコール酸ナトリウム組成物を用いた臨床的経験
脂肪腫(良性、脂肪組織の単離された集団)を有する患者に、ホスファチジルコリンを含まないデオキシコール酸ナトリウム(DC)溶液を脂肪腫に直接注射した。この研究の結果は、動物組織における脂肪に対して見られたデオキシコール酸塩の界面活性剤効果が、ヒトにおいて臨床的に再現可能であることを証明している。多様な濃度のデオキシコール酸塩による少なくとも1回の処置の後、注射された脂肪腫のサイズが全て減少した(表3)。1%DCを注射された1人の患者からの脂肪腫を、処置後に切除し、病理学的および組織学的な分析を実施した。切除された脂肪腫においては、壊死が肉眼で可視であり(図6a)、脂肪腫脂肪の中央へと延びている、外端部のよく画定された出血および壊死の区域が、より明るい色の正常な脂肪腫脂肪と対照をなしている。組織学的分析(図6b)は、隣接した正常な丸形の明らかな脂肪細胞と対照をなす、明確な出血および壊死脂肪ならびに有意な炎症反応の区域を明らかにしている。
【0162】
(表3)DC処置後の脂肪腫のサイズの減少

【0163】
他に示されない限り、明細書および特許請求の範囲において使用された成分の量、分子量のような特性、反応条件等を表す全ての数が、全ての場合に「約」という用語によって修飾されているものと理解されたい。従って、反対のことが示されない限り、以下の明細書および添付の特許請求の範囲において示される数的パラメーターは、本発明によって入手されることが求められる所望の特性に依って変動し得る近似である。少なくとも、そして特許請求の範囲の範囲への均等論の適用を制限する試みとしてではなく、各数的パラメーターは、少なくとも、報告された有効数字の数を考慮して、そして通常の丸め技術を適用することにより解釈されるべきである。本発明の広い範囲を示す数的な範囲およびパラメーターは近似であるにも関わらず、特定の実施例において示された数値サイズ(cm)は、可能な限り正確に報告されている。しかしながら、いかなる数値も、それぞれの試験測定において見出される標準偏差に必然的に起因するある種の誤差を本質的に含有している。
【0164】
本発明の記載に関して(特に、特許請求の範囲に関して)使用される「一つの(a)」および「一つの(an)」および「該、その(the)」という用語ならびに類似した指示対象は、本明細書において他に示されない限り、または情況により明白に否定されない限り、単数および複数の両方を包含するものと解釈されたい。本明細書における値の範囲の列挙は、単に、範囲内に入る別々の各値を個々にさす略記法として用いられているものとする。本明細書において他に示されない限り、個々の値は、各々、あたかも個々に本発明に列挙されたかのごとく、本明細書に組み入れられる。本明細書において他に示されない限り、または情況により明白に否定されない限り、本明細書に記載された全ての方法は、任意の適当な順序で実施され得る。本明細書に提供された全ての任意の例、または例証的な語(例えば、「のような」)の使用は、本発明をよりよく説明するためのものに過ぎず、別途特許請求の範囲に記載される本発明の範囲に制限をかけるものではない。本明細書中の語は、本発明の実施にとって不可欠な任意の特許請求の範囲に記載されていない要素を示すものと解釈されるべきではない。
【0165】
本明細書に開示された本発明の代替的な要素または態様のグループ分けは、制限として解釈されるべきではない。グループの各メンバーは、個々に、またはグループの他のメンバーもしくは本明細書に見出される他の要素と任意に組み合わせられて、言及され、特許請求の範囲に記載され得る。グループの一つまたは複数のメンバーが、便宜および/または特許可能性の理由で、あるグループに含まれてもよいし、または削除されてもよいことが期待される。そのような内含または削除が行われる場合、本明細書は、そのようにして修飾されたグループを含有しており、添付の特許請求の範囲において使用された全てのマーカッシュ・グループの記載を満たすと見なされる。
【0166】
本発明を実施するための、本発明者らが知る最良の形態を含む、本発明の好ましい態様が、本明細書に記載される。当然、これらの好ましい態様の変動は、上記の記載を参照することにより、当業者に明白になるであろう。本発明者は、当業者が、適宜、そのような変動を利用することを予想しており、本発明者らは、本明細書に具体的に記載されたもの以外にも本発明が実施されることを意図している。従って、本発明は、適用可能な法律により許容されるように、本明細書に添付された特許請求の範囲において列挙された主題の全ての修飾および等価物を含む。さらに、本明細書において他に示されない限り、または情況により明白に否定されない限り、全ての可能な変動における上記の要素の任意の組み合わせが、本発明に包含される。
【0167】
さらに、本明細書の全体にわたり、特許および印刷刊行物が多数言及された。上に引用された参照および印刷刊行物は、各々、参照により完全に個々に本明細書に組み入れられる。
【0168】
末尾として、本明細書に開示された本発明の態様は、本発明の原理を例示するものであることを理解されたい。利用され得るその他の修飾は、本発明の範囲内である。従って、制限ではなく例として、本発明の別の配置が、本明細書の教示に従って利用され得る。従って、本発明は、示され記載された通りのものへと制限されない。
【0169】
参考文献


【特許請求の範囲】
【請求項1】
少なくとも一つの薬理活性界面活性剤を含み、任意で、少なくとも一つの薬学的に許容される賦形剤を含み、かつ任意で、少なくとも一つの付加的な活性成分を含む、患者における局所的な脂肪沈着物の非外科的な除去のための医学的組成物であって、ホスファチジルコリンを含まない、医学的組成物。
【請求項2】
薬理活性界面活性剤が、イオン界面活性剤、非イオン界面活性剤、および両性イオン界面活性剤からなる群より選択される、請求項1記載の医学的組成物。
【請求項3】
イオン界面活性剤が少なくとも一つの薬理活性胆汁酸塩である、請求項2記載の医学的組成物。
【請求項4】
少なくとも一つの薬理活性胆汁酸塩が、デオキシコール酸塩、コール酸塩、ケノデオキシコール酸塩、7-α-デヒドロキシレート(dehydroxylate)塩、ケノデオキシコール酸塩、リトコール酸塩、ウルソデオキシコール酸塩、ジヒドロキシ胆汁酸塩、およびトリヒドロキシ胆汁酸塩からなる群より選択される、請求項3記載の医学的組成物。
【請求項5】
少なくとも一つの薬理活性胆汁酸塩がデオキシコール酸ナトリウムである、請求項4記載の医学的組成物。
【請求項6】
少なくとも一つの付加的な活性成分が、抗炎症剤、鎮痛剤、分散剤、および浸透増強剤からなる群より選択される、請求項1記載の医学的組成物。
【請求項7】
脂肪を可溶化する量の薬理活性界面活性剤組成物を投与する工程を含む、局所的な脂肪蓄積を有する患者における局所的な脂肪沈着物の非外科的な除去のための方法であって、該薬理活性界面活性剤組成物がホスファチジルコリンを含まない、方法。
【請求項8】
投与工程が皮下注射を含む、請求項7記載の方法。
【請求項9】
薬理活性界面活性剤組成物が、少なくとも一つの薬理活性界面活性剤を含み、任意で、少なくとも一つの薬学的に許容される賦形剤を含み、かつ任意で、少なくとも一つの付加的な活性成分を含み、ホスファチジルコリンを含まない、請求項7記載の方法。
【請求項10】
薬理活性界面活性剤が、イオン界面活性剤、非イオン界面活性剤、および両性イオン界面活性剤からなる群より選択される、請求項9記載の方法。
【請求項11】
イオン界面活性剤が少なくとも一つの薬理活性胆汁酸塩である、請求項10記載の方法。
【請求項12】
少なくとも一つの薬理活性胆汁酸塩が、デオキシコール酸塩、コール酸塩、ケノデオキシコール酸塩、7-α-デヒドロキシレート塩、ケノデオキシコール酸塩、リトコール酸塩、ウルソデオキシコール酸塩、ジヒドロキシ胆汁酸塩、およびトリヒドロキシ胆汁酸塩からなる群より選択される、請求項11記載の方法。
【請求項13】
少なくとも一つの薬理活性胆汁酸塩がデオキシコール酸ナトリウムである、請求項12記載の方法。
【請求項14】
少なくとも一つの付加的な活性成分が、抗炎症剤、鎮痛剤、分散剤、および浸透増強剤からなる群より選択される、請求項7記載の方法。
【請求項15】
局所的な脂肪蓄積が、下眼瞼脂肪ヘルニア、脂肪腫、脂肪異栄養、セルライトに関連した脂肪沈着物からなる群より選択される、請求項7記載の方法。
【請求項16】
少なくとも一つの薬理活性界面活性剤、任意での少なくとも一つの薬学的に許容される賦形剤、および任意での少なくとも一つの付加的な活性成分から本質的になる、薬理活性界面活性剤組成物の非外科的な投与を含む、患者における局所的な脂肪沈着物の非外科的な除去のための脂肪吸引以外の方法であって、該医学的組成物がホスファチジルコリンを含まない、方法。
【請求項17】
以下を含む、キット:
(a)以下を含む、第一の容器:
(i)薬理活性界面活性剤;および
(ii)5%w/v未満のホスファチジルコリン;ならびに
(b)手術を用いずに哺乳動物における皮下脂肪沈着物を減少させるための組成物の使用説明書。
【請求項18】
薬理活性界面活性剤が、注射可能製剤の中にある、請求項17記載のキット。
【請求項19】
第一の容器の全容量が500mL未満である、請求項17記載のキット。
【請求項20】
哺乳動物がヒトである、請求項17記載のキット。
【請求項21】
薬理活性界面活性剤のパーセントw/v濃度が、ホスファチジルコリンのパーセントw/v濃度より大きい、請求項17記載のキット。
【請求項22】
第一の容器の量がホスファチジルコリンを含まない、請求項17記載のキット。
【請求項23】
薬理活性界面活性剤がそのCMCを超える濃度である、請求項17記載のキット。
【請求項24】
第一の容器が第二の界面活性剤をさらに含む、請求項17記載のキット。
【請求項25】
薬理活性界面活性剤が、親油性界面活性剤、親水性界面活性剤、イオン界面活性剤、非イオン界面活性剤、グリセリド、胆汁酸塩、および両性イオン界面活性剤からなる群より選択される、請求項17記載のキット。
【請求項26】
薬理活性界面活性剤が、少なくとも一つの薬理活性胆汁酸塩である、請求項25記載のキット。
【請求項27】
薬理活性界面活性剤がデオキシコール酸ナトリウムである、請求項26記載のキット。
【請求項28】
第一の容器が、抗微生物剤、抗血栓剤、抗凝固剤、起泡抑制剤、抗炎症剤、麻酔剤、鎮痛剤、ステロイド、精神安定剤、抗分散剤、および筋弛緩剤からなる群より選択される第二の治療剤をさらに含む、請求項17記載のキット。
【請求項29】
抗微生物剤、抗血栓剤、抗凝固剤、起泡抑制剤、抗炎症剤、麻酔剤、鎮痛剤、ステロイド、精神安定剤、抗分散剤、および筋弛緩剤からなる群より選択される第二の治療剤を含む第二の容器をさらに含む、請求項17記載のキット。
【請求項30】
脂肪沈着物が、哺乳動物の目の下、顎の下、腕の下、殿部、腓、背部、大腿、足首、または胃部に局在している、請求項17記載のキット。
【請求項31】
脂肪沈着物が、眼瞼脂肪ヘルニア、脂肪腫、脂肪異栄養、バッファロー瘤脂肪異栄養、またはセルライトに関連した脂肪沈着物である、請求項17記載のキット。
【請求項32】
第一の容器が、抗微生物剤、抗炎症剤、および鎮痛剤からなる群より選択される第二の治療剤をさらに含む、請求項17記載のキット。
【請求項33】
第一の容器が.0002g超の界面活性剤を含む、請求項17記載のキット。
【請求項34】
第一の容器が3g未満の界面活性剤を含む、請求項17記載のキット。
【請求項35】
脂肪を可溶化するのに有効な量の薬理活性界面活性剤および5%未満のホスファチジルコリンを含む単位用量を該哺乳動物に投与する工程を含む、哺乳動物における皮下脂肪沈着物を減少させるための方法であって、該皮下脂肪を外科的に除去する工程を含まない、方法。
【請求項36】
脂肪を可溶化するのに有効な量の薬理活性界面活性剤および5%未満のホスファチジルコリンを含む単位用量を該哺乳動物に投与する工程を含む、哺乳動物における皮下脂肪沈着物を減少させるための方法であって、該界面活性剤を積極的に除去する工程を含まない、方法。
【請求項37】
500mL未満の単位用量の溶液を脂肪沈着物へと局所投与する工程を含む、哺乳動物における皮下脂肪沈着物を減少させるための方法であって、該溶液が、脂肪を可溶化するのに有効な量の薬理活性界面活性剤および5%未満のホスファチジルコリンを含む、方法。
【請求項38】
単位用量が局所注射によって投与される、請求項35、36、または37のいずれか一項記載の方法。
【請求項39】
薬理活性界面活性剤が胆汁酸塩である、請求項35、36、または37のいずれか一項記載の方法。
【請求項40】
投与工程が少なくとも2回繰り返される、請求項35、36、または37のいずれか一項記載の方法。
【請求項41】
ホスファチジルコリンが投与されない、請求項35、36、または37のいずれか一項記載の方法。
【請求項42】
薬理活性界面活性剤の%w/v濃度が、ホスファチジルコリンの%w/v濃度より大きい、請求項35、36、または37のいずれか一項記載の方法。
【請求項43】
薬理活性界面活性剤が、その臨界ミセル濃度を超える濃度である、請求項35、36、または37のいずれか一項記載の方法。
【請求項44】
第二の界面活性剤を哺乳動物に投与する工程をさらに含む、請求項35、36、または37のいずれか一項記載の方法。
【請求項45】
第二の治療剤を哺乳動物に投与する工程をさらに含む、請求項35、36、または37のいずれか一項記載の方法。
【請求項46】
薬理活性界面活性剤が、親油性界面活性剤、親水性界面活性剤、イオン界面活性剤、非イオン界面活性剤、グリセリド、胆汁酸塩、および両性イオン界面活性剤からなる群より選択される、請求項35、36、または37のいずれか一項記載の方法。
【請求項47】
少なくとも一つの薬理活性界面活性剤が胆汁酸塩である、請求項46記載の方法。
【請求項48】
胆汁酸塩がデオキシコール酸ナトリウムである、請求項47記載の方法。
【請求項49】
哺乳動物がヒトである、請求項35、36、または37のいずれか一項記載の方法。
【請求項50】
抗微生物剤、抗血栓剤、抗凝固剤、起泡抑制剤、抗炎症剤、麻酔剤、鎮痛剤、ステロイド、精神安定剤、抗分散剤、止痢剤、および筋弛緩剤からなる群より選択される第二の治療剤を哺乳動物に投与する工程をさらに含む、請求項35、36、または37のいずれか一項記載の方法。
【請求項51】
第二の治療剤が、一つまたは複数の薬理活性界面活性剤と共製剤化(co-formulated)される、請求項50記載の方法。
【請求項52】
脂肪沈着物が、哺乳動物の目の下、顎の下、腕の下、殿部、腓、背部、大腿、または胃部に局在している、請求項35、36、または37のいずれか一項記載の方法。
【請求項53】
脂肪沈着物が、眼瞼脂肪ヘルニア、脂肪腫、脂肪異栄養、バッファロー瘤脂肪異栄養、またはセルライトに関連した脂肪沈着物である、請求項35、36、または37のいずれか一項記載の方法。
【請求項1】
少なくとも一つの薬理活性界面活性剤を含み、任意で、少なくとも一つの薬学的に許容される賦形剤を含み、かつ任意で、少なくとも一つの付加的な活性成分を含む、患者における局所的な脂肪沈着物の非外科的な除去のための医学的組成物であって、ホスファチジルコリンを含まない、医学的組成物。
【請求項2】
薬理活性界面活性剤が、イオン界面活性剤、非イオン界面活性剤、および両性イオン界面活性剤からなる群より選択される、請求項1記載の医学的組成物。
【請求項3】
イオン界面活性剤が少なくとも一つの薬理活性胆汁酸塩である、請求項2記載の医学的組成物。
【請求項4】
少なくとも一つの薬理活性胆汁酸塩が、デオキシコール酸塩、コール酸塩、ケノデオキシコール酸塩、7-α-デヒドロキシレート(dehydroxylate)塩、ケノデオキシコール酸塩、リトコール酸塩、ウルソデオキシコール酸塩、ジヒドロキシ胆汁酸塩、およびトリヒドロキシ胆汁酸塩からなる群より選択される、請求項3記載の医学的組成物。
【請求項5】
少なくとも一つの薬理活性胆汁酸塩がデオキシコール酸ナトリウムである、請求項4記載の医学的組成物。
【請求項6】
少なくとも一つの付加的な活性成分が、抗炎症剤、鎮痛剤、分散剤、および浸透増強剤からなる群より選択される、請求項1記載の医学的組成物。
【請求項7】
脂肪を可溶化する量の薬理活性界面活性剤組成物を投与する工程を含む、局所的な脂肪蓄積を有する患者における局所的な脂肪沈着物の非外科的な除去のための方法であって、該薬理活性界面活性剤組成物がホスファチジルコリンを含まない、方法。
【請求項8】
投与工程が皮下注射を含む、請求項7記載の方法。
【請求項9】
薬理活性界面活性剤組成物が、少なくとも一つの薬理活性界面活性剤を含み、任意で、少なくとも一つの薬学的に許容される賦形剤を含み、かつ任意で、少なくとも一つの付加的な活性成分を含み、ホスファチジルコリンを含まない、請求項7記載の方法。
【請求項10】
薬理活性界面活性剤が、イオン界面活性剤、非イオン界面活性剤、および両性イオン界面活性剤からなる群より選択される、請求項9記載の方法。
【請求項11】
イオン界面活性剤が少なくとも一つの薬理活性胆汁酸塩である、請求項10記載の方法。
【請求項12】
少なくとも一つの薬理活性胆汁酸塩が、デオキシコール酸塩、コール酸塩、ケノデオキシコール酸塩、7-α-デヒドロキシレート塩、ケノデオキシコール酸塩、リトコール酸塩、ウルソデオキシコール酸塩、ジヒドロキシ胆汁酸塩、およびトリヒドロキシ胆汁酸塩からなる群より選択される、請求項11記載の方法。
【請求項13】
少なくとも一つの薬理活性胆汁酸塩がデオキシコール酸ナトリウムである、請求項12記載の方法。
【請求項14】
少なくとも一つの付加的な活性成分が、抗炎症剤、鎮痛剤、分散剤、および浸透増強剤からなる群より選択される、請求項7記載の方法。
【請求項15】
局所的な脂肪蓄積が、下眼瞼脂肪ヘルニア、脂肪腫、脂肪異栄養、セルライトに関連した脂肪沈着物からなる群より選択される、請求項7記載の方法。
【請求項16】
少なくとも一つの薬理活性界面活性剤、任意での少なくとも一つの薬学的に許容される賦形剤、および任意での少なくとも一つの付加的な活性成分から本質的になる、薬理活性界面活性剤組成物の非外科的な投与を含む、患者における局所的な脂肪沈着物の非外科的な除去のための脂肪吸引以外の方法であって、該医学的組成物がホスファチジルコリンを含まない、方法。
【請求項17】
以下を含む、キット:
(a)以下を含む、第一の容器:
(i)薬理活性界面活性剤;および
(ii)5%w/v未満のホスファチジルコリン;ならびに
(b)手術を用いずに哺乳動物における皮下脂肪沈着物を減少させるための組成物の使用説明書。
【請求項18】
薬理活性界面活性剤が、注射可能製剤の中にある、請求項17記載のキット。
【請求項19】
第一の容器の全容量が500mL未満である、請求項17記載のキット。
【請求項20】
哺乳動物がヒトである、請求項17記載のキット。
【請求項21】
薬理活性界面活性剤のパーセントw/v濃度が、ホスファチジルコリンのパーセントw/v濃度より大きい、請求項17記載のキット。
【請求項22】
第一の容器の量がホスファチジルコリンを含まない、請求項17記載のキット。
【請求項23】
薬理活性界面活性剤がそのCMCを超える濃度である、請求項17記載のキット。
【請求項24】
第一の容器が第二の界面活性剤をさらに含む、請求項17記載のキット。
【請求項25】
薬理活性界面活性剤が、親油性界面活性剤、親水性界面活性剤、イオン界面活性剤、非イオン界面活性剤、グリセリド、胆汁酸塩、および両性イオン界面活性剤からなる群より選択される、請求項17記載のキット。
【請求項26】
薬理活性界面活性剤が、少なくとも一つの薬理活性胆汁酸塩である、請求項25記載のキット。
【請求項27】
薬理活性界面活性剤がデオキシコール酸ナトリウムである、請求項26記載のキット。
【請求項28】
第一の容器が、抗微生物剤、抗血栓剤、抗凝固剤、起泡抑制剤、抗炎症剤、麻酔剤、鎮痛剤、ステロイド、精神安定剤、抗分散剤、および筋弛緩剤からなる群より選択される第二の治療剤をさらに含む、請求項17記載のキット。
【請求項29】
抗微生物剤、抗血栓剤、抗凝固剤、起泡抑制剤、抗炎症剤、麻酔剤、鎮痛剤、ステロイド、精神安定剤、抗分散剤、および筋弛緩剤からなる群より選択される第二の治療剤を含む第二の容器をさらに含む、請求項17記載のキット。
【請求項30】
脂肪沈着物が、哺乳動物の目の下、顎の下、腕の下、殿部、腓、背部、大腿、足首、または胃部に局在している、請求項17記載のキット。
【請求項31】
脂肪沈着物が、眼瞼脂肪ヘルニア、脂肪腫、脂肪異栄養、バッファロー瘤脂肪異栄養、またはセルライトに関連した脂肪沈着物である、請求項17記載のキット。
【請求項32】
第一の容器が、抗微生物剤、抗炎症剤、および鎮痛剤からなる群より選択される第二の治療剤をさらに含む、請求項17記載のキット。
【請求項33】
第一の容器が.0002g超の界面活性剤を含む、請求項17記載のキット。
【請求項34】
第一の容器が3g未満の界面活性剤を含む、請求項17記載のキット。
【請求項35】
脂肪を可溶化するのに有効な量の薬理活性界面活性剤および5%未満のホスファチジルコリンを含む単位用量を該哺乳動物に投与する工程を含む、哺乳動物における皮下脂肪沈着物を減少させるための方法であって、該皮下脂肪を外科的に除去する工程を含まない、方法。
【請求項36】
脂肪を可溶化するのに有効な量の薬理活性界面活性剤および5%未満のホスファチジルコリンを含む単位用量を該哺乳動物に投与する工程を含む、哺乳動物における皮下脂肪沈着物を減少させるための方法であって、該界面活性剤を積極的に除去する工程を含まない、方法。
【請求項37】
500mL未満の単位用量の溶液を脂肪沈着物へと局所投与する工程を含む、哺乳動物における皮下脂肪沈着物を減少させるための方法であって、該溶液が、脂肪を可溶化するのに有効な量の薬理活性界面活性剤および5%未満のホスファチジルコリンを含む、方法。
【請求項38】
単位用量が局所注射によって投与される、請求項35、36、または37のいずれか一項記載の方法。
【請求項39】
薬理活性界面活性剤が胆汁酸塩である、請求項35、36、または37のいずれか一項記載の方法。
【請求項40】
投与工程が少なくとも2回繰り返される、請求項35、36、または37のいずれか一項記載の方法。
【請求項41】
ホスファチジルコリンが投与されない、請求項35、36、または37のいずれか一項記載の方法。
【請求項42】
薬理活性界面活性剤の%w/v濃度が、ホスファチジルコリンの%w/v濃度より大きい、請求項35、36、または37のいずれか一項記載の方法。
【請求項43】
薬理活性界面活性剤が、その臨界ミセル濃度を超える濃度である、請求項35、36、または37のいずれか一項記載の方法。
【請求項44】
第二の界面活性剤を哺乳動物に投与する工程をさらに含む、請求項35、36、または37のいずれか一項記載の方法。
【請求項45】
第二の治療剤を哺乳動物に投与する工程をさらに含む、請求項35、36、または37のいずれか一項記載の方法。
【請求項46】
薬理活性界面活性剤が、親油性界面活性剤、親水性界面活性剤、イオン界面活性剤、非イオン界面活性剤、グリセリド、胆汁酸塩、および両性イオン界面活性剤からなる群より選択される、請求項35、36、または37のいずれか一項記載の方法。
【請求項47】
少なくとも一つの薬理活性界面活性剤が胆汁酸塩である、請求項46記載の方法。
【請求項48】
胆汁酸塩がデオキシコール酸ナトリウムである、請求項47記載の方法。
【請求項49】
哺乳動物がヒトである、請求項35、36、または37のいずれか一項記載の方法。
【請求項50】
抗微生物剤、抗血栓剤、抗凝固剤、起泡抑制剤、抗炎症剤、麻酔剤、鎮痛剤、ステロイド、精神安定剤、抗分散剤、止痢剤、および筋弛緩剤からなる群より選択される第二の治療剤を哺乳動物に投与する工程をさらに含む、請求項35、36、または37のいずれか一項記載の方法。
【請求項51】
第二の治療剤が、一つまたは複数の薬理活性界面活性剤と共製剤化(co-formulated)される、請求項50記載の方法。
【請求項52】
脂肪沈着物が、哺乳動物の目の下、顎の下、腕の下、殿部、腓、背部、大腿、または胃部に局在している、請求項35、36、または37のいずれか一項記載の方法。
【請求項53】
脂肪沈着物が、眼瞼脂肪ヘルニア、脂肪腫、脂肪異栄養、バッファロー瘤脂肪異栄養、またはセルライトに関連した脂肪沈着物である、請求項35、36、または37のいずれか一項記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公開番号】特開2012−176966(P2012−176966A)
【公開日】平成24年9月13日(2012.9.13)
【国際特許分類】
【出願番号】特願2012−105708(P2012−105708)
【出願日】平成24年5月7日(2012.5.7)
【分割の表示】特願2007−527519(P2007−527519)の分割
【原出願日】平成17年5月19日(2005.5.19)
【出願人】(592130699)ザ リージェンツ オブ ザ ユニバーシティ オブ カリフォルニア (364)
【氏名又は名称原語表記】The Regents of The University of California
【出願人】(502170175)ロサンゼルス バイオメディカル リサーチ インスティテュート アット ハーバー− ユーシーエルエー メディカル センター (11)
【Fターム(参考)】
【公開日】平成24年9月13日(2012.9.13)
【国際特許分類】
【出願日】平成24年5月7日(2012.5.7)
【分割の表示】特願2007−527519(P2007−527519)の分割
【原出願日】平成17年5月19日(2005.5.19)
【出願人】(592130699)ザ リージェンツ オブ ザ ユニバーシティ オブ カリフォルニア (364)
【氏名又は名称原語表記】The Regents of The University of California
【出願人】(502170175)ロサンゼルス バイオメディカル リサーチ インスティテュート アット ハーバー− ユーシーエルエー メディカル センター (11)
【Fターム(参考)】
[ Back to top ]

