蛋白質濃度評価方法、分析用具、及び分析装置
【課題】蛋白質指示薬を使用し、精度が高い評価が可能な蛋白質濃度評価方法の提供。
【解決手段】測定対象試料と蛋白質指示薬とを接触させた後の呈色を光学分析すること、測定対象試料のpHを測定すること、並びに、前記光学分析の結果及び前記測定されたpHと蛋白質濃度評価用データとに基づいて前記試料の蛋白質濃度を評価することを含み、前記蛋白質指示薬は、pH及び蛋白質濃度によって発色が変化する蛋白質指示薬であり、前記蛋白質濃度評価用データは、前記測定されたpHに対応した前記光学分析結果の評価の仕方を示す情報を含む蛋白質濃度評価方法。
【解決手段】測定対象試料と蛋白質指示薬とを接触させた後の呈色を光学分析すること、測定対象試料のpHを測定すること、並びに、前記光学分析の結果及び前記測定されたpHと蛋白質濃度評価用データとに基づいて前記試料の蛋白質濃度を評価することを含み、前記蛋白質指示薬は、pH及び蛋白質濃度によって発色が変化する蛋白質指示薬であり、前記蛋白質濃度評価用データは、前記測定されたpHに対応した前記光学分析結果の評価の仕方を示す情報を含む蛋白質濃度評価方法。
【発明の詳細な説明】
【技術分野】
【0001】
本開示は、蛋白質濃度評価方法、分析用具、及び分析装置に関する。
【背景技術】
【0002】
尿のような蛋白質が溶存する水溶液試料の蛋白質濃度を簡便に測定する方法として、蛋白質が結合することによって色遷移を生じるpH指示色素を蛋白質の指示試薬として利用する方法が知られている(特許文献1)。これらの蛋白質指示薬は、元来pHによっても色が変化するが、pHが一定に維持されれば、色の変化を蛋白質の濃度と関連付けすることができる。このような蛋白質指示薬としては、テトラブロモフェノールブルー(TBPB)や、テトラクロロフェノール−3,4,5,6−テトラブロモスルホフタレインが挙げられる。また、pHが変化すると蛋白質の濃度に依存せずに色が変化するため、これらの蛋白質指示薬を使用する場合にはpHを一定にするためにバッファーが適宜併用される(特許文献1及び2)。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】特開平5-249122号公報
【特許文献2】米国特許3,485,587号
【発明の概要】
【発明が解決しようとする課題】
【0004】
しかしながら、尿などの試料がバッファー効果を超えて所定のpHと異なるpHを示す場合、前記蛋白質指示薬のみを使用して得られる蛋白質濃度は、前記試料中の実際の蛋白質濃度とは異なることとなり、疾患等の判定において偽陽性や偽陰性をまねくという問題がある。
【0005】
そこで、本開示は、前記蛋白質指示薬を使用して試料中の蛋白質濃度を評価(assay)する方法であって、精度が高い評価が可能な蛋白質濃度評価方法を提供する。
【課題を解決するための手段】
【0006】
本開示は、一態様として、試料の蛋白質濃度を評価する方法であって、
前記試料と蛋白質指示薬とを接触させた後の呈色を光学分析すること、
前記試料のpHを測定すること、並びに、
前記光学分析の結果及び前記測定されたpHと、蛋白質濃度評価用データとに基づいて前記試料の蛋白質濃度を評価することを含み、
前記蛋白質指示薬は、pH及び蛋白質濃度によって発色が変化する蛋白質指示薬であり、
前記蛋白質濃度評価用データは、前記測定されたpHに対応した前記光学分析結果の評価の仕方を示す情報を含む、蛋白質濃度評価方法に関する。
【0007】
本開示は、その他の態様として、基板の上に複数の試薬層が形成された分析用具であって、pH及び蛋白質濃度によって発色が変化する蛋白質指示薬を含有する試薬層A、及び、pH指示薬を含有する試薬層Bを備え、前記試薬層A及び前記試薬層Bは、同じバッファー条件となるように緩衝剤を含む、分析用具に関する。
【0008】
本開示は、さらにその他の態様として、前記試料と蛋白質指示薬とを接触させた後の呈色を光学分析する測定部と、前記試料のpHを測定する測定部と、前記光学分析の結果及び前記測定されたpHと蛋白質濃度評価用データとに基づいて前記試料の蛋白質濃度を評価する評価部と、評価後のデータを出力する出力部とを備え、前記蛋白質指示薬は、pH及び蛋白質濃度によって発色が変化する蛋白質指示薬であり、前記蛋白質濃度評価用データは、前記測定されたpHに対応した前記光学分析結果の評価の仕方を示す情報を含む分析装置に関する。
【発明の効果】
【0009】
本開示によれば、一又は複数の実施形態において蛋白質指示薬を使用した蛋白質濃度評価の精度を向上でき、さらなる一又は複数の実施形態において、偽陽性や偽陰性の発生を抑制できる。
【図面の簡単な説明】
【0010】
【図1】図1は、一実施形態における分析用具10の側面図(A)及び上面図(B)である。
【図2】図2は、一実施形態における分析装置の構成例を示す機能ブロック図である。
【図3】図3は、一実施形態における分析装置のその他の構成例を示す機能ブロック図である。
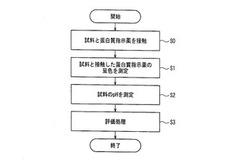
【図4】図4は、一実施形態における分析装置の動作の一例を示すフローチャートである。
【図5】図5は、一実施形態における分析装置の動作のその他の例を示すフローチャートである。
【図6】図6は、一実施形態における尿分析装置を採用した全自動尿化学分析装置の外観斜視図である。
【図7】図7は、溶液中の蛋白質濃度に影響を受けにくいpH指示薬を用いて様々な蛋白質濃度下でpHを測定した結果の一例を示すグラフである。
【発明を実施するための形態】
【0011】
尿に含まれる蛋白質は一般に尿タンパクとも呼ばれる。尿タンパクの濃度は、正常個体の場合、平均して約10〜20mg/dLであるが、腎臓、尿管、膀胱等に異常があるとこの濃度が変化する(上昇する)ことが知られている。したがって、尿タンパクの測定はこれらの疾患の指標となる点で重要である。
【0012】
尿タンパク測定用等の分析用具で使用される蛋白質指示薬は、一般にpH指示薬としても使用できるものでもあって、pHの影響を非常に受けやすい。そのため、従来、このような蛋白質指示薬は使用時にpHを一定に維持するためのバッファーと組み合わせて使用されることが多い。しかしながら、測定対象試料によっては、バッファー効果を超えてpHが変動してしまう場合もある。想定されるpH値とは異なるpHの試料を前記蛋白質指示薬のみで測定すると、測定精度を欠くこととなり、ひいては、疾患の有無等の判断において偽陽性や偽陰性の原因となりうる。
【0013】
本開示は、前記蛋白質指示薬と測定対象試料との接触時における測定対象試料のpHを用いて、前記蛋白質指示薬の光学分析結果を適宜修正すれば、蛋白質濃度評価の精度を向上させることができ、偽陽性や偽陰性の発生をより一層抑制できる、という知見に基づく。
【0014】
すなわち、本開示は、一態様において、試料の蛋白質濃度を評価する方法であって、前記試料と蛋白質指示薬とを接触させた後の呈色を光学分析すること、前記試料のpHを測定すること、並びに、前記光学分析の結果及び前記測定されたpH値と、予め作成された蛋白質濃度評価用データとに基づいて前記試料の蛋白質濃度を評価することを含み、前記蛋白質指示薬は、pH及び蛋白質濃度によって発色が変化する蛋白質指示薬であり、前記蛋白質濃度評価用データは、前記測定されたpH値に対応した前記光学分析結果の評価方法を含む、蛋白質濃度評価方法(以下、「本開示の評価方法」ともいう。)に関する。
【0015】
[蛋白質指示薬]
本明細書において「蛋白質指示薬」とは、pH及び蛋白質濃度によって発色が変化するものをいう。前記蛋白質指示薬は、一又は複数の実施形態において、溶液中の蛋白質と接触すると色遷移を呈し、前記溶液中の蛋白質の存在の検出及び/又は濃度の測定を可能とするものいう。前記蛋白質指示薬としては、pHの変化に応じて色が変化するものが多く知られている。本明細書においても、特に言及がない場合、前記蛋白質指示薬は、pHの変化に応じて色が変化しうるものをいう。前記蛋白質指示薬としては、従来公知の及び/又は今後開発されるものが使用でき、例えば、特許文献1等に開示されるものが使用でき、オクタハロスルホフタレイン型色素、オクタハロフェノールフタレイン型色素、又はそれらの組み合わせが挙げられる。より具体的には、前記蛋白質指示薬としては、テトラブロモフェノールブルー、テトラクロロフェノールブルー、3′,3″,5,5″−テトラヨード−3,4,5,6−テトラブロモフェノールスルホフタレイン、3,3″−ジヨード−5,5″,3,4,5,6−ヘキサブロモフェノールスルホフタレイン、メチルイエロー(4−ジメチルアミノアゾベンゼン)及びそれらの組み合わせからなる群から選択されるものが挙げられる。これらの中でも、感度及び/又は精度の観点から、テトラブロモフェノールブルーが好ましい。
【0016】
本開示において、「試料と蛋白質指示薬とを接触させ(る)」とは、例えば、液体試料と前記蛋白質指示薬の溶液とを混合すること、乾燥状態の前記蛋白質指示薬を含む試薬パッド(試薬層)を備える試薬片(ストリップ)を液体試料中にディップすること等を含みうるが、接触の形態はこれらに限定されなくてよく、従来公知の及び/又は今後開発される形態をとり得る。
【0017】
本明細書において「光学分析する」とは、特に制限されず、例えば、分光器等を用いて対象物の透過光又は散乱光から対象物に関する情報を取得することを含む分光分析をすることが挙げられる。光学分析の結果として、例えば、所望の波長における、対象物体の吸光度、透過率、又は反射率等が得られる。一例として、試料と接触させた蛋白質指示薬又はpH指示薬の透過光又は散乱光を検出し、検出した光から、蛋白質指示薬又はpH指示薬の吸光度、透過率又は反射率等の光学的な特徴を示す値を算出することを光学分析とすることができる。なお、光学分析の形態は、これらに限定されない。その他の光学的方法及び/又は分光法を用いた測定も光学分析に含まれる。
【0018】
本明細書において「試料と蛋白質指示薬とを接触させた後の呈色を光学分析すること」とは、例えば、前記接触が、液体試料と前記蛋白質指示薬溶液との混合であれば、その混合液について光学分析することをいい、前記接触が、液体試料への乾燥状態の前記蛋白質指示薬を含む試薬パッド(試薬層)の浸漬であれば、浸漬後の前記試薬パッドについての光学分析をすることをいうが、これらの形態に限定されなくてよく、従来公知の形態をとり得る。また、本明細書において「呈色」は、無色から発色した色、及び、他の色から色遷移をした色を含みうる。
【0019】
本明細書において「試料」は、蛋白質を含有しうるものであって、本開示の評価方法によって蛋白質濃度が評価される対象をいい、以下「評価対象試料」とも呼ぶ。本開示の評価方法において評価対象試料は、蛋白質指示薬を使用した蛋白質濃度評価の精度向上の観点から、液体であることが好ましく、より好ましくは水性液体である。評価対象の蛋白質は、同様の観点から、前記液体に溶解していることが好ましい。
【0020】
本開示の評価方法において、評価対象試料に接触させる前記蛋白質指示薬としては、評価対象試料1mLに対して0.01mg〜1mgとすることが一般的であり、蛋白質指示薬を使用した蛋白質濃度評価の精度向上及び経済性の観念から、評価対象試料1mLに対して0.02mg〜0.5mgが好ましい。
【0021】
[緩衝剤]
前記蛋白質指示薬を使用した蛋白質濃度の測定方法では、通常、pHを一定に維持するため、評価対象試料と混合させる際に緩衝剤が使用されることが多い。本開示の評価方法における前記蛋白指示薬と評価対象試料との接触時においても、緩衝剤を使用してもよい。緩衝剤としては、従来と同様のものを使用でき、維持させたいpHに応じて適宜選択できる。具体例としては、例えば、クエン酸緩衝剤、フマル酸緩衝剤、酒石酸、グリシン、及びリンゴ酸が挙げられ、これらの中でも、蛋白質指示薬を使用した蛋白質濃度評価の精度向上の観点から、リンゴ酸が好ましい。前記緩衝剤の使用量としては、評価対象試料1mLに対して0.01mg〜1mgとすることが一般的であり、蛋白質指示薬を使用した蛋白質濃度評価の精度向上及び経済性の観点から、評価対象試料1mLに対して0.02mg〜0.5mgが好ましい。なお、後述するとおり、評価対象試料のpH測定は、蛋白質指示薬を使用した蛋白質濃度評価の精度向上の観点から、前記蛋白指示薬と評価対象試料との接触時におけるバッファー条件と同様のバッファー条件下で行うことが好ましい。
【0022】
[pH測定]
本開示の評価方法は、評価対象試料のpHを測定すること含む。評価対象試料のpHの測定方法は特に制限されず、公知の方法を採用しうる。例えば、pH指示薬を用いた方法でもよく、或いは、pHメーターを用いた方法でもよい。前記pH測定は、蛋白質指示薬を使用した蛋白質濃度評価の精度向上の観点から、前記蛋白質指示薬と評価対象試料との接触時のバッファー条件と同じバッファー条件下で行われることが好ましい。例えば、前記蛋白質指示薬と評価対象試料との接触に際して緩衝剤を添加する場合には、pH測定の際にも評価対象試料に同じ緩衝剤を同じ濃度となるように添加することが好ましい。なお、特に言及しない限り、本明細書におけるpHは、25℃におけるpHをいう。
【0023】
[pH指示薬]
評価対象試料のpHをpH指示薬を用いて行う場合、前記pH指示薬は、蛋白質指示薬を使用した蛋白質濃度評価の精度向上の観点から、溶液中の蛋白質濃度に影響されにくいpH指示薬であることが好ましい。そのようなpH指示薬としては、これに限定されないが、エチルオレンジ(ethyl orange)が好ましい。
【0024】
pH指示薬を用いた評価対象試料のpH測定は、従来と同様に、例えば、評価対象試料と蛋白質指示薬とを接触させた後の呈色を光学分析することにより行うことができる。具体的な態様としては、上述した蛋白質指示薬の光学分析と同様に行うことができる。評価対象試料に接触させる前記pH指示薬としては、評価対象試料1mLに対して0.01mg〜1mgとすることが一般的であり、蛋白質指示薬を使用した蛋白質濃度評価の精度向上及び経済性の観念から、評価対象試料1mLに対して0.02mg〜0.5mgが好ましい。
【0025】
[蛋白質濃度評価]
本明細書において「蛋白質濃度の評価」とは、評価対象試料の蛋白質濃度の評価であって、例えば、評価対象試料の蛋白質濃度を具体的に決定すること(例えば、評価対象試料の蛋白質濃度はxxμg/mLである、と評価すること)、評価対象試料の蛋白質濃度を有る範囲内であると決定すること(例えば、評価対象試料の蛋白質濃度はxx〜yyμg/mLである、と評価すること)、評価対象試料の蛋白質濃度が所定の閾値を超えるか否か決定すること(例えば、評価対象試料の蛋白質濃度は閾値xxμg/mL以上(未満)である、と評価すること)、或いは、評価対象試料の蛋白質濃度が所定の基準値に基づき設定された陽性と陰性のいずれかに該当するか決定すること(例えば、評価対象試料は陽性(陰性)である、と評価すること)を含み、これらに限定されない。
【0026】
本開示の評価方法における「蛋白質濃度の評価」は、一実施形態において、評価対象試料と蛋白質指示薬とを接触させた後の呈色を光学分析した結果を、評価対象試料のpH測定結果に基づき必要に応じて修正することが挙げられる。前記光学分析の結果の、前記測定されたpH値に基づく修正は、予め前記蛋白質指示薬及びテスト試料を使用して作成された蛋白質濃度評価用データに従ってすることができる。
【0027】
[蛋白質濃度評価用データ]
本明細書において「蛋白質濃度評価用データ」とは、試料のpHに応じた、蛋白質濃度の評価の仕方を示す情報を含むデータである。評価の仕方には、評価方法や評価基準が含まれる。評価方法は、例えば、測定値を光学分析の評価値又は濃度値に変換する式やその係数を示すデータで表すことができる。評価基準は、例えば、評価の基準となる、測定値若しくは濃度値の範囲又は閾値を示すデータにより表すことができる。蛋白質濃度評価用データには、蛋白質指示薬の光学分析結果、又は当該光学分析結果から得られる蛋白質濃度の評価を、測定対象溶液のpHに基づいて修正するためのデータが含まれる。すなわち、測定対象試料のpHによっては実際の蛋白質濃度とは誤差のある呈色をしてしまう蛋白質指示薬の分析結果をpHに基づいて修正するのに、蛋白質濃度評価用データを用いることができる。蛋白質濃度評価用データの一実施形態として、所定のpH範囲ごとに、蛋白質指示薬により得られた光学分析の結果の校正方法や評価基準など設定されているデータが挙げられる。例えば、光学分析の結果として得られた値(例えば、試料と接触した蛋白質指示薬の吸光度等)を前記試料の蛋白質濃度又はその評価値に変換するのに用いられる値(例えば、変換係数等)であって、所定のpH範囲ごとに設定された値を、蛋白質濃度評価用データに含めることができる。このような蛋白質濃度評価用データは、予め作成しておくことができる。
【0028】
蛋白質濃度評価用データの実施形態として、前記光学分析結果から前記試料の蛋白質濃度を算出する際に用いられるデータであって、前記試料のpHに応じて設定されたデータが挙げられる。より詳細には、前記測定されたpH値及び前記光学分析結果からなる2つのパラメータを少なくとも使用して前記試料の蛋白質濃度を算出する方法を定義するデータを、蛋白質濃度評価用データとすることができる。本実施形態の具体例として、所定のpH範囲ごとに、蛋白質指示薬により得られた蛋白質濃度を校正する方法(例えば、校正式)が設定されているデータが挙げられる(下記表1)。本実施形態では、校正後の評価対象試料の蛋白質濃度が評価としてアウトプットされうる。なお、下記表1の数値は、一例であって、本開示を何ら限定するものではない。
【0029】
【表1】

【0030】
上記表1に示す例では、光学分析結果から得られる蛋白質濃度の値を補正するための係数が、複数のpH範囲それぞれに対応付けられて記録される。このように、pHに応じた補正係数を記録しておくことで、pHの違いを考慮した、より正確な蛋白質濃度の評価が可能になる。上記形態の変形例として、例えば、光学分析結果から蛋白質濃度を計算するために用いる校正データ(例えば、検量線を示すデータ等)を、pH範囲ごとに記録することもできる。
【0031】
蛋白質濃度評価用データの他の実施形態として、前記光学分析結果に基づいて評価値を算出する際に基準となるデータであって、前記試料のpHに応じて設定されたデータが挙げられる。より詳細には、前記測定されたpH値及び前記光学分析結果からなる2つのパラメータを少なくとも使用して前記試料の蛋白質濃度が所定の濃度範囲か否かを判断する際の基準となるデータを、蛋白質濃度評価用データとすることができる。本実施形態の具体例として、所定のpH範囲ごとに定義された、蛋白質濃度の陽性/陰性の判断基準となる吸光度(蛋白質指示薬)の値を含むデータが挙げられる(下記表2)。本実施形態では、前記定義されたデータに従って、評価対象試料の陽性又は陰性の判定が評価としてアウトプットされうる。また、本実施形態では、蛋白質指示薬から得られる光学分析値(吸光度)を蛋白質濃度に換算しなくても評価対象試料の蛋白質濃度を評価できる。なお、下記表2の数値は、一例であって、本開示を何ら限定するものではない。
【0032】
【表2】

【0033】
上記表2に示す例では、陽性と判断される光学分析の結果(例えば、吸光度)の範囲を示す情報と、陰性と判断される光学分析の結果(例えば、吸光度)の範囲を示す情報が、複数のpH範囲それぞれに対応付けられて記録される。このように、陽性/陰性を判断するための閾値を、pHの範囲を示すデータと対応づけて記録しておくことで、試料のpHに応じて蛋白質濃度を適切に評価することが可能になる。
【0034】
一実施形態として、蛋白質濃度評価用データは、pH値の正常範囲を定義するデータを含んでもよい。これにより、測定された試料のpHの値が、正確な評価ができる範囲を超えているか否かを判断することが可能になる。より詳細には、蛋白質濃度評価用データは、前記測定されたpH値の所定の低値及び/又は高値を異常なpHと定義するデータを含むことができる。具体例として、所定のpH範囲を示す評価対象試料のpHが酸性側又はアルカリ側に異常であることを示すデータが挙げられる(下記表3)。このようなデータを用いることにより、評価対象試料の異常性が評価としてアウトプットされうる。このような評価とすることで、例えば、生体試料を扱う場合にpHが異常な試料も同時に検出することができる。本実施形態は、上述の2つの実施形態と組み合わせることができる。なお、下記表3の数値は、一例であって、本開示を何ら限定するものではない。
【0035】
【表3】

【0036】
蛋白質濃度評価用データは、評価目的に応じて作成することができる。なお、蛋白質濃度評価用データに用いるパラメータは、前記測定されたpH値及び前記光学分析結果の少なくとも2つを含めばよい。また、これらのパラメータの他のパラメータも含めて3つ以上のパラメータを蛋白質濃度評価用データとして使用してもよい。
【0037】
上記のような蛋白質濃度評価用データを予め作成し、分析装置などに記録しておくことで、pH値に応じた試料の蛋白質濃度評価が可能になる。蛋白質濃度評価用データは、例えば、蛋白質濃度が既に分かっている標準試料を、さまざまなpHの条件化で光学分析して得られる値を基に、作成することができる。例えば、複数のpH値又はpH範囲それぞれについて、標準試料を光学分析して得られる結果(例えば吸光度)と標準試料の蛋白質濃度との関連を示す値を算出し、この値を、蛋白質濃度評価用データとすることができる。すなわち、蛋白質指示試薬の光学分析による測定値を蛋白質濃度値又は蛋白質濃度評価値に変換するためのデータを、複数のpH又はpH範囲について生成し、蛋白質濃度評価用データとして記録しておくことができる。なお、蛋白質濃度評価用データは、上記例に限られない。
【0038】
[評価対象試料]
本開示の評価方法の評価対象試料としては、特に制限されず、生体試料、生化学試料、環境試料等が挙げられる。前記生体試料としては、体液、尿、血液、唾液等があげられる。
【0039】
[分析用具]
本開示の評価方法において、測定対象試料と蛋白質指示薬との接触と、測定対象試料のpH指示薬を用いたpH測定とは、上述のとおり、ともに、試薬ストリップ上の試薬層にて行うことができる。したがって、本開示は、その他の態様において、基板上に、蛋白質指示薬を含む試薬層及びpH指示薬を含む試薬層を備える分析用具(以下、「本開示の分析用具」ともいう。)に関する。本開示の分析用具を用いて、本開示の評価方法を行うことができる。
【0040】
本開示の分析用具において、蛋白質指示薬を含む試薬層とpH指示薬を含む試薬層とは、別個の2つの試薬層であってもよい。また、蛋白質指示薬とpH指示薬とを同一の試薬層に配置してもよい。この場合、蛋白質指示薬の呈色とpH指示薬の呈色とを、それぞれ異なる波長において、光学分析により検出することができる。そのため、蛋白質指示薬の呈色とpH指示薬の呈色の波長は異なり、互いに与える影響が小さいことが好ましい。
【0041】
したがって、本開示の分析用具の第1の実施態様として、基板の上に複数の試薬層が形成された分析用具であって、pH及び蛋白質濃度によって発色が変化する蛋白質指示薬を含有する試薬層A、及び、pH指示薬を含有する試薬層Bを備え、前記試薬層A及び前記試薬層Bは、同じバッファー条件となるように緩衝剤をそれぞれ含む分析用具、が挙げられる。また、本開示の第2の実施態様として、基板の上に、試薬層が形成された分析用具であって、pH及び蛋白質濃度によって発色が変化する蛋白質指示薬、及び、pH指示薬を含有する試薬層を備える分析用具、が挙げられる。このように、蛋白質指示薬及びpH指示薬を含有する試薬層を備えることで、試薬層の数を少なくすることができ、分析用具がコンパクトになる。なお、上記第1及び第2の実施形態において、pH指示薬は、溶液中の蛋白質濃度に影響されにくいものを用いることが好ましい。
【0042】
第1及び第2の実施形態の分析用具において、「pH及び蛋白質濃度によって発色が変化する蛋白質指示薬」、「溶液中の蛋白質濃度に影響されにくいpH指示薬」及び「緩衝剤」は、本開示の評価方法で説明したものをそれぞれ使用できる。
【0043】
本開示の分析用具は、蛋白質指示薬を含む試薬層とpH指示薬を含む試薬層以外の試薬層を備えていてもよい。前記試薬層の数は、特に制限されず、例えば、1〜15個であり、好ましくは1〜10個であり、より好ましくは1〜8個である。本開示の分析用具は、従来公知の光学分析装置にて分析でき、また、後述する本開示の分析装置にて本開示の評価方法を行うことができる。
【0044】
本開示の分析用具の一例を図1に示す。図1Aは側面図であり、図1Bは上面図である。図1A及びBにおいて、同一部分には同一符号を付している。この検体分析用具10は、短冊状の基板1の上に、6個の試薬層2が形成されている。前記基板の材質は特に制限されず、例えば、樹脂、金属、ガラスなどがある。基板の色は、特に制限されず、白色、灰色、黒色、有彩色、透明のいずれであってもよい。前記基板の大きさは、特に制限されず、検査項目、使用する分析装置の規格等により適宜決定され、例えば、長さ50〜150mm、幅2〜10mm、厚み0.1〜1.0mmである。各試薬層2は、検査項目に対応した所定の試薬を含浸させたパッドを前記基板1上に貼着することにより形成されている。前記パッドの材質としては、例えば、ろ紙、ガラス繊維ろ紙、編物、織物、不織布、メンブランフィルター、多孔質樹脂シートなどがある。また、各試薬層2(パッド)の形は特に制限されず、正方形、長方形、円形、楕円形などがある。各試薬層2(パッド)の大きさは、特に制限されず、形状が正方形状の場合、例えば、縦と横2〜10mm、厚み0.05〜1.0mmである。前記試薬層2の数は、検査項目に応じ増減可能である。これらの試薬層2は、一定のピッチで6個の試薬層を直列に配置されている。このピッチは、特に制限されないが、例えば、1.0〜100mmである。この検体分析用具の基板1の一方の端(同図において右側端部)では、試薬層2を設けないことにより、スペースを確保し、この部分(把持部)を指先で摘まんで取り扱えるようにしている。
【0045】
本開示の分析用具の第1の実施態様の場合、図1において、例えば、試薬層3を蛋白質指示薬を含有する試薬層A、試薬層4をpH指示薬を含有する試薬層Bとすることができる。また、本開示の分析用具の第2の実施態様の場合、図1において、例えば、試薬層3又は4を、蛋白質指示薬及びpH指示薬を含有する試薬層とすることができる。但し、試薬層A及びB、又は、蛋白質指示薬及びpH指示薬を含有する試薬層の位置は、図1に限定されない。
【0046】
[分析装置]
本開示は、また、その他の態様において、本開示の評価方法を行い得る分析装置(以下、「本開示の分析装置」ともいう)に関する。本開示の分析装置の一実施態様として、
試料と蛋白質指示薬とを接触させた後の呈色を光学分析する測定部と、
前記試料のpHを測定する測定部と、
前記光学分析の結果及び前記測定されたpHと、蛋白質濃度評価用データとに基づいて前記試料の蛋白質濃度を評価する評価部と、
評価後のデータを出力する出力部とを備え、
前記蛋白質指示薬は、pH及び蛋白質濃度によって発色が変化する蛋白質指示薬であり、
前記蛋白質濃度評価用データは、前記測定されたpH値に対応した前記光学分析結果の評価の仕方を示す情報を含む、分析装置が挙げられる。
【0047】
本実施形態の分析装置において、「pH及び蛋白質濃度によって発色が変化する蛋白質指示薬」及び「蛋白質濃度評価用データ」は、本開示の評価方法で説明したものをそれぞれ使用できる。
【0048】
本実施態様の分析装置において、前記pHを測定する測定部は、測定対象試料のpHをpHメーターで測定する測定部であってもよく、或いは、pH指示薬の光学分析を行う測定部であってもよい。後者の場合は、蛋白質指示薬を光学分析する測定部とpH指示薬の光学分析を行う測定部とは同一の測定部とすることができる。
【0049】
本実施態様の分析装置において、蛋白質指示薬を光学分析する測定部とpH指示薬の光学分析を行う測定部とは同一の測定部とすることができる。また、蛋白質指示薬を光学分析する測定部及びpH指示薬の光学分析を行う測定部は、液体の光学分析を行うものであっても、或いは、分析用具の試薬層の光学分析を行うものであってもよい。したがって、本開示の分析装置は、その他の実施形態において、本開示の分析用具を使用して本開示の評価方法を行う分析装置である。
【0050】
図2は、本開示の分析装置の一実施形態における構成例を示す機能ブロック図である。図2に示す分析装置20は、蛋白質指示薬及びpHの測定と蛋白質濃度の評価を行う装置である。分析装置20は、測定部21と評価部22と出力部23を備え、さらに、記録部24を備える。測定部21は、蛋白質指示薬の測定部211とpH測定部212とを備える。測定部211では、蛋白質指示薬の光学分析を行う。上述したとおり、pH測定部212における測定が光学分析法によるものであれば、測定部211と212は1つの測定部としてもよい。測定部21で得られた蛋白質指示薬の光学分析結果及びpH測定値は、記録部24に保存されてもよい。評価部22では、測定部21で得られた蛋白質指示薬の光学分析結果及びpH測定値、及び、記録部24に記録されている蛋白質濃度評価用データに従って評価が行われる。ここで、蛋白質濃度評価用データは、予め作成し記録部24に記録しておくことができる。評価の結果は、記録部24に記録され、及び/又は出力部23に出力される。出力部23としては、例えば、表示部、印刷する印刷部、外部に送信する送信部などが挙げられる。
【0051】
(測定部)
図2に示す例では、蛋白質指示薬の測定部211とpHの測定部212は1つの測定部として構成されている。この場合、測定部21は、例えば、図1に示すような分析用具の各試薬層2の透過光又は散乱光を検出することで、吸光度、反射率又は透過率等を測定する。例えば、蛋白質指示薬を含む試薬層とpH指示薬を含む試薬層に、それぞれ試料を滴下し、これらの吸光度を測定することにより、試料を接触させた蛋白質指示薬及び、試料のpHを測定することができる。また、蛋白質指示薬とpH指示薬が1つの試薬層に含まれている場合、測定部21は、1つの試薬層の透過光又は散乱光を基に、蛋白質指示薬に対応する波長(又は帯域)及び、pH指示薬に対応する波長(又は帯域)それぞれについて、吸光度、透過率又は反射率を測定することができる。このように、1つの試薬層について、蛋白指示薬及びpH指示薬それぞれに対応する波長又は帯域の光を光学分析することにより、試料の蛋白質及び試料のpHに関する情報を得ることができる。
【0052】
(評価部)
評価部22における、蛋白質濃度評価用データを使用した評価の方法は、本開示の評価方法で説明したように行われうる。一実施形態として、前記蛋白質濃度評価用データが、前記光学分析結果から前記試料の蛋白質濃度を算出する際に用いられる算出用データであって、前記試料のpHに応じて設定された算出用データを含み(例えば、上記表1参照)、前記評価部が、前記測定されたpH値及び前記光学分析結果を用いて、前記算出用データに基づき試料の蛋白質濃度を算出することができる。評価部は、例えば、前記試料のpHがいずれのpH範囲に属するかを判断し、試料のpHの属する範囲に対応する補正係数を算出用データとして取得することができる。この場合、評価部は、補正係数又は当該補正係数を含む式を用いて、光学分析結果から得られる蛋白質濃度を修正することができる。これにより、試料のpHによる光学分析結果の変動を考慮した、より正確な蛋白質濃度の評価が可能になる。
【0053】
その他の実施形態として、前記蛋白質濃度評価用データは、前記光学分析結果に基づいて評価値を算出する際に基準となる基準データであって、前記試料のpHに応じて設定された基準データを含み(例えば、上記表2参照)、前記評価部が、前記測定されたpH値及び前記光学分析結果に基づき、前記基準データを基準に前記評価値を算出することができる。評価部は、例えば、前記試料のpHがいずれのpH範囲に属するかを判断し、試料のpHの属する範囲に対応する、陰性/陽性の判断の閾値を基準データとして取得することができる。この場合、評価部は、光学分析結果として得られる吸光度等の値と、陰性/陽性の判断の閾値とを比較することにより、試料の蛋白質濃度が陰性か陽性かを判断する。これにより、試料のpHによる光学分析結果の変動を考慮した、より正確な蛋白質濃度の評価が可能になる。
【0054】
さらに、前記蛋白質濃度評価用データは、前記測定されたpHの正常範囲を定義するデータを含み(例えば、上記表3参照)、前記評価部が、前記測定されたpH値に基づき前記定義に従った評価を行うことができる。前記評価部は、例えば、前記試料のpHが、蛋白質濃度評価用データが示すpHが正常範囲にないと判断した場合、正確な評価ができない旨、又は、評価結果の信頼性が低い旨の応答を出力することができる。これにより、試料のpHの異常を検出し出力することができる。但し、評価部22における評価はこれらに限定されない。
【0055】
(測定部の変形例)
図3は、図2に示す分析装置20の変形例の構成を表す機能ブロック図である。図3に示す分析装置20aでは、蛋白質指示薬の測定部211と、pH測定部212が、それぞれ独立して設けられる。図3に示す例では、測定部211は、図2に示す分析装置20の測定部211と同様に光学分析により呈色を測定する測定器とし、測定部212は、pHメーターとすることができる。このように、蛋白質指示薬の測定系と試料のpHの測定系を別個に設けることにより、pH測定の信頼性を向上させることができる。測定部212のpHメーターとしては、例えば、ガラス電極と比較電極を備えたガラス電極法を用いたpH測定器が挙げられるが、pHメーターの構造は、特に限定されない。
【0056】
図2及び図3における分析装置20、20aにおいて、測定部211、測定部212、評価部22、出力部23、及び記録部24のそれぞれが独立し接続された構成であってもよく、或いは、これらの全部又は一部が一体となった構成であってもよい。また、評価部22は、分析装置20、20aが備えるコンピュータにより実現することができる。例えば、分析装置20、20aのプロセッサが所定のプログラムを実行することで、評価部22の機能を実現することができる。記録部24は、分析装置20、20aが備えるメモリなどの記録媒体又は分析装置20、20aからアクセス可能なストレージにより実現することができる。
【0057】
(動作例)
図4は、図2又は図3に示す上記分析装置20、又は20a(以下、単に分析装置と称する)の動作例を示すフローチャートである。図4に示す例では、まず、分析装置のプロセッサが測定部211を制御し、試料と蛋白質指示薬を接触させる(S0)。測定部211は、試料と接触した蛋白質指示薬の呈色を光学分析により測定する(S1)。例えば、測定部211は、図1に示した分析用具の蛋白質指示薬を含む試薬層に試料を滴下することで接触させることができる。この場合測定部211は、試薬層の吸光度、反射率又は透過率を測定することで、試料と接触した蛋白質指示薬の呈色を光学分析することができる。測定部211による光学分析結果(例えば、吸光度等)は、評価部22に送信される。
【0058】
S2において、分析装置のプロセッサは、測定部212を制御し、試料のpHを測定する。図2に示す分析装置20は、測定部212が、試料が滴下されたpH指示薬を含む試薬層から光を光学分析することで試料のpHを測定することができる。図3に示す分析装置20aは、pH測定部212にて、例えば、ガラス電極法を用いた測定により試料のpHを得ることができる。測定された試料のpHは、評価部22へ送られる。
【0059】
評価部22は、S1で測定された蛋白質指示薬の光学分析結果と、S2で測定された試料のpHと、記録部24に記録された蛋白質濃度評価用データを用いて、試料のpHに応じた蛋白質濃度の評価処理を実行する(S3)。具体的には、評価部22は、S2で測定された試料のpHに対応する蛋白質濃度評価用データを記録部24から取得し、蛋白質濃度評価用データを用いて、S1で測定された蛋白質指示薬の光学分析結果又は光学分析結果から得られる蛋白質濃度の情報に対してpHに応じた修正を施す。評価部22は、修正後の光学分析結果又は蛋白質濃度の情報を評価結果としてもよいし、光学分析結果又は蛋白質濃度を基にした評価値(例えば、陽性か陰性かを示す値等)を評価結果として生成することができる。評価部22は、例えば、試料の蛋白質濃度そのもの、蛋白質濃度が属する範囲、蛋白質濃度と所定の閾値との比較結果、陽性か陰性かを示す情報、等を評価結果として計算する。出力部23は、評価部22が生成した評価結果を、出力する。出力は、例えば、分析装置が備えるディスプレイへの表示、プリンタでの印刷、スピーカからの音声出力、又は、ネットワークを介したデータの送信、もしくはこれらの組み合わせの形態で行うことができる。
【0060】
図5は、図4のS3における評価部22の動作例を示すフローチャートの一例である。評価部22は、前記蛋白質指示薬の光学分析(吸光度)の測定値及びpH測定値を取得する(S301)。次に、評価部22において、まず、測定されたpH値に対応する適用すべき評価定義が選択される(S311から315)。ここでは、一例として、記録部24に記録された蛋白質濃度評価用データが定義する評価の仕方(評価方法又は評価基準)から、測定されたpHに対応するものを抽出する。下記表4は、蛋白質濃度評価用データが定義する評価の仕方の一例を示す表である。下記表4では、評価の仕方がpH範囲に対応付けて記録される。
【0061】
【表4】

【0062】
例えば、pHが3.3未満の場合(S311でYes)には、評価部22は、蛋白質濃度評価用データから、評価の仕方を示すデータとして、pH値異常(酸性)を示すデータを抽出し、これを評価結果として出力する。pHが3.3以上3.8未満の場合(S312でYes)、評価部22は、蛋白質濃度評価用データから基準値X1を抽出し、蛋白質指示薬の光学分析結果である吸光度とX1とを比較する(S321)。評価部22は、例えば、吸光度がX1より大きい場合は陰性、吸光度がX1を超えない場合は陽性と判断することができる。同様にして、評価部22は、pHが3.8以上4.2未満の場合(S313でYes)は、X2を基準に陰性/陽性を判断し(S322)、pHが4.2以上4.6未満の場合(S314でYes)は、X3を基準に陰性/陽性を判断(S323)する。pHが4.6以上である場合、評価部22は、蛋白質濃度評価用データの「pH値異常(アルカリ」を示すデータに基づいて、pHが異常値を示す試料として評価し(S324)、出力する(S330)。このように、評価部22は、S312〜S315で測定されたpHがいずれの範囲に属するかを判断し、その判断結果に基づいて、評価基準を決定し、pHの異常の有無(S324)及び、陽性か陰性かを判断する(S321〜S323)。判断結果は、評価結果として、出力される(S330)。
【0063】
上記動作例によれば、測定された試料のpHに応じて適切な評価の仕方が選択されるので、pHに応じて適切に修正された評価結果を得ることができる。なお、本開示に係る分析装置の動作は上記図4、図5に示した例に限られない。例えば、図4において、S1とS2の実行の順序は逆になってもよい。また、図5のS321〜S323では、吸光度と基準値との比較により陰性又は陽性を判断する処理に代えて、もしくは加えて、蛋白質濃度を測定されたpHに応じた計算方法で算出する処理とすることもできる。
【0064】
なお、評価対象試料の評価の出力を行うコンピュータに処理を実行させる評価プログラムであって、蛋白質指示薬の光学分析結果及び前記評価対象試料のpHを取得する処理と、前記蛋白質濃度評価用データを予め記録した記録部にアクセスし、前記蛋白質指示薬の光学分析結果及び前記測定されたpH値に対応する評価方法又は評価基準を選択して評価する処理と、得られた評価を出力する処理とをコンピュータに実行させるプログラムも、本願発明に含まれる。また、該プログラムを記録した非一時的な(non-transitory)記録媒体、該プログラムを実装した分析装置も本願発明に含まれる。
【0065】
例えば、試料の蛋白質濃度を評価する処理をコンピュータに実行させる蛋白質濃度評価プログラムであって、前記試料と蛋白質指示薬とを接触させた後の呈色を光学分析の結果と、測定された前記試料のpHとを入力する処理と、前記光学分析の結果及び前記測定されたpHと、蛋白質濃度評価用データとに基づいて前記試料の蛋白質濃度を評価する処理をコンピュータに実行させ、前記蛋白質濃度評価用データは、前記測定されたpHに対応した前記光学分析結果の評価の仕方を示す情報を含む、蛋白質濃度評価プログラムも本願発明の実施形態の1つである。
【0066】
また、分析装置を制御するプログラムであって、分析装置の測定部に、試料と蛋白質指示薬とを接触させた後の呈色を光学分析させる処理と、分析装置の測定部にpHを測定させる処理と、前記光学分析の結果及び前記測定されたpHと蛋白質濃度評価用データとに基づいて前記試料の蛋白質濃度を評価する評価処理と、評価後のデータを出力する出力処理と分析装置に実行させ、前記蛋白質濃度評価用データは、前記測定されたpHに対応した前記光学分析結果の評価の仕方を示す情報を含む、プログラムも本願発明の実施形態の1つである。
【0067】
(分析装置の具体例)
図6は、分析装置20の具体例である尿分析装置を採用した全自動尿化学分析装置の外観斜視図である。図6に示す全自動尿化学分析装置は、本体部61、試験紙供給部62、試料供給部63、及びボトルユニット64を備えている。本体部61には、表示部65、操作部66、及びプリンタ部67が設けられている。
【0068】
本体部61には、移動可能なノズルが配置されており、このノズルは、試料供給部63に載置された検体(試料)としての尿を収容する容器から尿を吸引し、本体部61の内部の所定の位置に移送された試験紙(分析用具の一例)に設置された複数の試薬パッド(試薬層の一例)に尿を滴下すなわち点着する。
【0069】
尿を滴下された試薬パッドは、本体部61の内部に設置された光学系(測定部に相当)により色などを測定され、その測定結果に基づいて検査結果が判定されて、検査結果はプリンタ部67により印字出力される。試薬パッドの1つに、蛋白質指示薬及びpH指示薬が含まれている、測定部は、蛋白質指示薬に対応する波長における光学分析及びpH指示薬に対応する波長における光学分析を実行し、蛋白質指示薬及びpH指示薬それぞれについて測定結果を得ることができる。これにより、尿のpHに応じて、尿中の蛋白質の測定値又は評価値を適切な値に修正することができる。
【0070】
図示しないが、全自動尿化学分析装置は、CPU、メモリ(例えば、ROM(read only memory)、RAM(random access memory)、HD(Hard Disk)等を含む)、モータ駆動部、バルブ駆動部を備えることができる。CPUはメモリに記録されたプログラムにしたがって動作する。また、メモリには、上記の蛋白質濃度評価用データが記録される。CPUは、モータ駆動部、バルブ駆動部を制御する。モータ駆動部は、CPUにより制御されて、ノズルによる吸引や洗浄を行うための複数のポンプを駆動する。バルブ駆動部は、CPUにより制御されて、ノズルによる吸引や洗浄を行うための複数のバルブを駆動する。
【0071】
このように、分析装置は、試薬を設置する手段、試料を設置する手段、試薬の一つである蛋白質指示薬に試料を接触させる手段、試料のpHを測定する手段、試料と接触させた試薬の色を測定する手段、測定結果を解析する手段、及びこれらを制御する手段を含む構成とすることができる。なお、分析装置は上記例に限られない。例えば、試料である尿のpHを測定するpHメーターが設けられてもよい。pHメーターは、一例として、pHメーターのガラス電極と比較電極を試料である尿に挿入し、これらの電極間の電圧を測定することで、試料のpHを計測する構成とすることができる。
【0072】
以下、本開示が限定されない実施例を用いて、本開示をさらに説明する。
【実施例】
【0073】
[BSA溶液のタンパク質濃度評価:実施例1及び比較例1]
蛋白質指示薬としてテトラブロモフェノールブルーを用い、下記12種類のBSA溶液を作成した。これらのBSA溶液の吸光度(620nm)を分光光度計(日本分光社製)で測定した。その結果を下記表5に示す。
【0074】
〔pHの調整と測定〕
pHの調整は、NaOH(5規定)を用いて調整した。また、pHは、測定対象が25℃の状態で、pHメータ(堀場製作所製、商品名:F23)を用いて測定した。以下の実施例・比較例でも同様である。
【0075】
〔BSA溶液組成〕
0.1M リンゴ酸(pH3.7/4.1/4.5)
1.5mg/dL テトラブロモフェノールブルー(ナカライテスク社製)
BSA(ウシ血清アルブミン、シグマアルドリッチ社製)(0/10/25/50 mg/dL)
【0076】
【表5】

【0077】
〔比較例1〕
表5に示されたテトラブロモフェノールブルーの吸光度のみに基づいた下記の評価用データに従って、表5に示されたBSA溶液の蛋白質濃度につき、陽性か陰性かを評価した。なお、前記評価が陽性とは、蛋白質濃度が10mg/dL以上であることと設定し、前記評価が陰性とは、蛋白質濃度が10mg/dL未満であることと設定した。その結果を下記表6に示す。
【0078】
評価用データ:
吸光度が0.54未満で陰性、0.54以上で陽性。
(「0.54」は、pH3.7、BSA 0mg/dLの溶液の吸光度と、pH3.7、BSA 10mg/dLの溶液の吸光度との中間値である。)
【0079】
【表6】

【0080】
上記表6に示す通り、pH4.1及びpH4.5においては、蛋白質濃度が0mg/dLであっても、蛋白質指示薬の吸光度が高く、pH3.7での吸光度を基準に評価すると、本来陰性であるはずが、陽性と評価されてしまった(偽陽性が発生した)。
【0081】
〔実施例1〕
表5に示されたテトラブロモフェノールブルーの吸光度と、BSA溶液のpHとに基づいた下記の評価用データとに従って、表5に示されたBSA溶液の蛋白質濃度につき、陽性か陰性かを評価した。なお、比較例1と同様に、前記評価が陽性とは、蛋白質濃度が10mg/dL以上であることと設定し、前記評価が陰性とは、蛋白質濃度が10mg/dL未満であることを設定した。その結果を下記表7に示す。
【0082】
評価用データ:
pH3.7では、吸光度が0.54未満で陰性、0.54以上で陽性。
(「0.54」は、pH3.7、BSA 0mg/dLの溶液の吸光度と、pH3.7、BSA 10mg/dLの溶液の吸光度との中間値である。)
pH4.1では、吸光度が0.62未満で陰性、0.62以上で陽性。
(「0.62」は、pH4.1、BSA 0mg/dLの溶液の吸光度と、pH4.1、BSA 10mg/dLの溶液の吸光度との中間値である。)
pH4.5では、吸光度が0.70未満で陰性、0.70以上で陽性。
(「0.70」は、pH4.5、BSA 0mg/dLの溶液の吸光度と、pH4.5、BSA 10mg/dLの溶液の吸光度との中間値である。)
【0083】
【表7】

【0084】
上記表7に示す通り、pHを考慮して評価することで、比較例1で発生したpH4.1及びpH4.5における偽陽性は発生せず、精度が高い蛋白質濃度の評価ができた。
【0085】
[BSA添加尿試料のタンパク質濃度評価:実施例2及び比較例2]
尿にBSAを添加して下記のBSA添加尿試料を調製した。また、リンゴ酸とテトラブロモフェノールブルーの溶液である下記の蛋白質指示薬溶液を調製した。前記BSA添加尿試料と前記蛋白質指示薬溶液とを1:1で混合し、15種類の混合試料液を調製した。この混合試料液の吸光度(620nm)を分光光度計(日本分光社製)で測定した。その結果を下記表8に示す。
【0086】
〔BSA添加尿試料組成〕
尿試料にBSA(ウシ血清アルブミン、シグマアルドリッチ社製)(0/5/10/15/20 mg/dL)を添加
〔蛋白質指示薬溶液組成〕
0.2M リンゴ酸(pH3.7/4.1/4.5)
3.0mg/dL テトラブロモフェノール(ナカライテスク社製)
【0087】
【表8】

【0088】
〔比較例2〕
表8に示されたテトラブロモフェノールブルーの吸光度のみに基づいた下記の評価用データに従って、表8に示された混合試料液の蛋白質濃度につき、陽性か陰性かを評価した。なお、前記評価が陽性とは、蛋白質濃度が10mg/dL以上であることと設定し、前記評価が陰性とは、蛋白質濃度が10mg/dL未満であることを設定した。その結果を下記表9に示す。
【0089】
評価用データ:
吸光度が0.53未満で陰性、0.53以上で陽性と定義。
(「0.53」は、pH3.7、BSA 7.5mg/dLの溶液の吸光度と、pH3.7、BSA 10mg/dLの溶液の吸光度との中間値である。)
【0090】
【表9】

【0091】
上記表9に示す通り、pH4.5においては、蛋白質濃度が7.5mg/dLの場合に、本来陰性であるはずが、陽性と評価されてしまった(偽陽性が発生した)。
【0092】
〔実施例2〕
表8に示されたテトラブロモフェノールブルーの吸光度と、混合試料液のpHとに基づいた下記の評価用データに従って、表8に示された混合試料液の蛋白質濃度につき、陽性か陰性かを評価した。なお、比較例2と同様に、前記評価が陽性とは、蛋白質濃度が10mg/dL以上であることと設定し、前記評価が陰性とは、蛋白質濃度が10mg/dL未満であることを設定した。その結果を下記表10に示す。
【0093】
評価用データ:
pH3.7では、吸光度が0.53未満で陰性、0.53以上で陽性と定義。
(「0.53」は、pH3.7、BSA 7.5mg/dLの溶液の吸光度と、pH3.7、BSA 10mg/dLの溶液の吸光度との中間値である。)
pH4.1では、吸光度が0.55未満で陰性、0.55以上で陽性と定義。
(「0.55」は、pH4.1、BSA 7.5mg/dLの溶液の吸光度と、pH4.1、BSA 10mg/dLの溶液の吸光度との中間値である。)
pH4.5では、吸光度が0.59未満で陰性、0.59以上で陽性と定義。
(「0.59」は、pH4.5、BSA 7.5mg/dLの溶液の吸光度と、pH4.5、BSA 10mg/dLの溶液の吸光度との中間値である。)
【0094】
【表10】

【0095】
上記表10に示す通り、pHを考慮して評価することで、比較例2で発生したpH4.5における偽陽性は発生せず、精度が高い蛋白質濃度の評価ができた。
【0096】
[溶液中の蛋白質に影響を受けにくいpH指示薬:参考例1]
尿にBSAを添加して下記のBSA添加尿試料を調製した。また、リンゴ酸とエチルオレンジの溶液である下記のpH指示薬溶液を調製した。前記BSA添加尿試料と前記pH指示薬溶液とを1:1で混合し、15種類の混合試料液を調製した。この混合試料液の吸光度(480nm)を分光光度計(日本分光社製)で測定した。その結果を図7及び下記表11に示す。
【0097】
〔BSA添加尿試料組成〕
尿試料にBSA(ウシ血清アルブミン、シグマアルドリッチ社製)(0/5/10/15/20 mg/dL)を添加
〔pH指示薬溶液組成〕
0.2M リンゴ酸(pH3.7/4.1/4.5)
2.0mg/dL エチルオレンジ(東京化成工業社製)
【0098】
【表11】

【0099】
図7及び上記表11に示す通り、エチルオレンジの吸光度は、蛋白質濃度に影響されず、pHに応じて吸光度が変化した。また、近似直線が、y=0.20x-0.15 あることから、pH=(吸光度+0.15)/0.20 の計算式で吸光度からpHを求めることが可能であることが示された。上記表11の吸光度から、pH=(吸光度+0.15)/0.20 の計算式でpHを算出すると下記表12のようになる。
【0100】
【表12】

【0101】
[pH指示薬から算出されたpHを利用した評価:実施例3]
表8(実施例2及び比較例2)に示されたテトラブロモフェノールブルーの吸光度と、pH指示薬から算出されたpH(上記表12)とに基づいた下記の評価用データに従って、表8に示された混合試料液の蛋白質濃度につき、陽性か陰性かを評価した。なお、実施例2及び比較例2と同様に、前記評価が陽性とは、蛋白質濃度が10mg/dL以上であることと設定し、前記評価が陰性とは、蛋白質濃度が10mg/dL未満であることを設定した。その結果を下記表13に示す。
【0102】
評価用データ:
pH3.6以下は要注意(酸性)と定義。
pH3.7では、0.53未満で陰性、0.53以上で陽性と定義。
pH3.8、3.9では、0.54未満で陰性、0.54以上で陽性と定義。
pH4.0、4.1では、0.55未満で陰性、0.55以上で陽性と定義。
pH4.2では、0.56未満で陰性、0.56以上で陽性と定義。
pH4.3では、0.57未満で陰性、0.57以上で陽性と定義。
pH4.4では、0.58未満で陰性、0.58以上で陽性と定義。
pH4.5では、0.59未満で陰性、0.59以上で陽性と定義。
pH4.6以上は要注意(アルカリ)と定義。
【0103】
【表13】

【0104】
上記表13に示すとおり、pH指示薬から算出したpH値を用いて評価することで、比較例2で発生した偽陽性を排除できた。また、評価対象試料のpHを測定することとなるから、極端な酸性又はアルカリ性に変化した試料を容易に検知することができた。
【産業上の利用可能性】
【0105】
本開示は、例えば、医療及び臨床検査等の分野において有用である。
【符号の説明】
【0106】
1 基板
2 試薬層
3 試薬層
4 試薬層
10 分析用具
【技術分野】
【0001】
本開示は、蛋白質濃度評価方法、分析用具、及び分析装置に関する。
【背景技術】
【0002】
尿のような蛋白質が溶存する水溶液試料の蛋白質濃度を簡便に測定する方法として、蛋白質が結合することによって色遷移を生じるpH指示色素を蛋白質の指示試薬として利用する方法が知られている(特許文献1)。これらの蛋白質指示薬は、元来pHによっても色が変化するが、pHが一定に維持されれば、色の変化を蛋白質の濃度と関連付けすることができる。このような蛋白質指示薬としては、テトラブロモフェノールブルー(TBPB)や、テトラクロロフェノール−3,4,5,6−テトラブロモスルホフタレインが挙げられる。また、pHが変化すると蛋白質の濃度に依存せずに色が変化するため、これらの蛋白質指示薬を使用する場合にはpHを一定にするためにバッファーが適宜併用される(特許文献1及び2)。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】特開平5-249122号公報
【特許文献2】米国特許3,485,587号
【発明の概要】
【発明が解決しようとする課題】
【0004】
しかしながら、尿などの試料がバッファー効果を超えて所定のpHと異なるpHを示す場合、前記蛋白質指示薬のみを使用して得られる蛋白質濃度は、前記試料中の実際の蛋白質濃度とは異なることとなり、疾患等の判定において偽陽性や偽陰性をまねくという問題がある。
【0005】
そこで、本開示は、前記蛋白質指示薬を使用して試料中の蛋白質濃度を評価(assay)する方法であって、精度が高い評価が可能な蛋白質濃度評価方法を提供する。
【課題を解決するための手段】
【0006】
本開示は、一態様として、試料の蛋白質濃度を評価する方法であって、
前記試料と蛋白質指示薬とを接触させた後の呈色を光学分析すること、
前記試料のpHを測定すること、並びに、
前記光学分析の結果及び前記測定されたpHと、蛋白質濃度評価用データとに基づいて前記試料の蛋白質濃度を評価することを含み、
前記蛋白質指示薬は、pH及び蛋白質濃度によって発色が変化する蛋白質指示薬であり、
前記蛋白質濃度評価用データは、前記測定されたpHに対応した前記光学分析結果の評価の仕方を示す情報を含む、蛋白質濃度評価方法に関する。
【0007】
本開示は、その他の態様として、基板の上に複数の試薬層が形成された分析用具であって、pH及び蛋白質濃度によって発色が変化する蛋白質指示薬を含有する試薬層A、及び、pH指示薬を含有する試薬層Bを備え、前記試薬層A及び前記試薬層Bは、同じバッファー条件となるように緩衝剤を含む、分析用具に関する。
【0008】
本開示は、さらにその他の態様として、前記試料と蛋白質指示薬とを接触させた後の呈色を光学分析する測定部と、前記試料のpHを測定する測定部と、前記光学分析の結果及び前記測定されたpHと蛋白質濃度評価用データとに基づいて前記試料の蛋白質濃度を評価する評価部と、評価後のデータを出力する出力部とを備え、前記蛋白質指示薬は、pH及び蛋白質濃度によって発色が変化する蛋白質指示薬であり、前記蛋白質濃度評価用データは、前記測定されたpHに対応した前記光学分析結果の評価の仕方を示す情報を含む分析装置に関する。
【発明の効果】
【0009】
本開示によれば、一又は複数の実施形態において蛋白質指示薬を使用した蛋白質濃度評価の精度を向上でき、さらなる一又は複数の実施形態において、偽陽性や偽陰性の発生を抑制できる。
【図面の簡単な説明】
【0010】
【図1】図1は、一実施形態における分析用具10の側面図(A)及び上面図(B)である。
【図2】図2は、一実施形態における分析装置の構成例を示す機能ブロック図である。
【図3】図3は、一実施形態における分析装置のその他の構成例を示す機能ブロック図である。
【図4】図4は、一実施形態における分析装置の動作の一例を示すフローチャートである。
【図5】図5は、一実施形態における分析装置の動作のその他の例を示すフローチャートである。
【図6】図6は、一実施形態における尿分析装置を採用した全自動尿化学分析装置の外観斜視図である。
【図7】図7は、溶液中の蛋白質濃度に影響を受けにくいpH指示薬を用いて様々な蛋白質濃度下でpHを測定した結果の一例を示すグラフである。
【発明を実施するための形態】
【0011】
尿に含まれる蛋白質は一般に尿タンパクとも呼ばれる。尿タンパクの濃度は、正常個体の場合、平均して約10〜20mg/dLであるが、腎臓、尿管、膀胱等に異常があるとこの濃度が変化する(上昇する)ことが知られている。したがって、尿タンパクの測定はこれらの疾患の指標となる点で重要である。
【0012】
尿タンパク測定用等の分析用具で使用される蛋白質指示薬は、一般にpH指示薬としても使用できるものでもあって、pHの影響を非常に受けやすい。そのため、従来、このような蛋白質指示薬は使用時にpHを一定に維持するためのバッファーと組み合わせて使用されることが多い。しかしながら、測定対象試料によっては、バッファー効果を超えてpHが変動してしまう場合もある。想定されるpH値とは異なるpHの試料を前記蛋白質指示薬のみで測定すると、測定精度を欠くこととなり、ひいては、疾患の有無等の判断において偽陽性や偽陰性の原因となりうる。
【0013】
本開示は、前記蛋白質指示薬と測定対象試料との接触時における測定対象試料のpHを用いて、前記蛋白質指示薬の光学分析結果を適宜修正すれば、蛋白質濃度評価の精度を向上させることができ、偽陽性や偽陰性の発生をより一層抑制できる、という知見に基づく。
【0014】
すなわち、本開示は、一態様において、試料の蛋白質濃度を評価する方法であって、前記試料と蛋白質指示薬とを接触させた後の呈色を光学分析すること、前記試料のpHを測定すること、並びに、前記光学分析の結果及び前記測定されたpH値と、予め作成された蛋白質濃度評価用データとに基づいて前記試料の蛋白質濃度を評価することを含み、前記蛋白質指示薬は、pH及び蛋白質濃度によって発色が変化する蛋白質指示薬であり、前記蛋白質濃度評価用データは、前記測定されたpH値に対応した前記光学分析結果の評価方法を含む、蛋白質濃度評価方法(以下、「本開示の評価方法」ともいう。)に関する。
【0015】
[蛋白質指示薬]
本明細書において「蛋白質指示薬」とは、pH及び蛋白質濃度によって発色が変化するものをいう。前記蛋白質指示薬は、一又は複数の実施形態において、溶液中の蛋白質と接触すると色遷移を呈し、前記溶液中の蛋白質の存在の検出及び/又は濃度の測定を可能とするものいう。前記蛋白質指示薬としては、pHの変化に応じて色が変化するものが多く知られている。本明細書においても、特に言及がない場合、前記蛋白質指示薬は、pHの変化に応じて色が変化しうるものをいう。前記蛋白質指示薬としては、従来公知の及び/又は今後開発されるものが使用でき、例えば、特許文献1等に開示されるものが使用でき、オクタハロスルホフタレイン型色素、オクタハロフェノールフタレイン型色素、又はそれらの組み合わせが挙げられる。より具体的には、前記蛋白質指示薬としては、テトラブロモフェノールブルー、テトラクロロフェノールブルー、3′,3″,5,5″−テトラヨード−3,4,5,6−テトラブロモフェノールスルホフタレイン、3,3″−ジヨード−5,5″,3,4,5,6−ヘキサブロモフェノールスルホフタレイン、メチルイエロー(4−ジメチルアミノアゾベンゼン)及びそれらの組み合わせからなる群から選択されるものが挙げられる。これらの中でも、感度及び/又は精度の観点から、テトラブロモフェノールブルーが好ましい。
【0016】
本開示において、「試料と蛋白質指示薬とを接触させ(る)」とは、例えば、液体試料と前記蛋白質指示薬の溶液とを混合すること、乾燥状態の前記蛋白質指示薬を含む試薬パッド(試薬層)を備える試薬片(ストリップ)を液体試料中にディップすること等を含みうるが、接触の形態はこれらに限定されなくてよく、従来公知の及び/又は今後開発される形態をとり得る。
【0017】
本明細書において「光学分析する」とは、特に制限されず、例えば、分光器等を用いて対象物の透過光又は散乱光から対象物に関する情報を取得することを含む分光分析をすることが挙げられる。光学分析の結果として、例えば、所望の波長における、対象物体の吸光度、透過率、又は反射率等が得られる。一例として、試料と接触させた蛋白質指示薬又はpH指示薬の透過光又は散乱光を検出し、検出した光から、蛋白質指示薬又はpH指示薬の吸光度、透過率又は反射率等の光学的な特徴を示す値を算出することを光学分析とすることができる。なお、光学分析の形態は、これらに限定されない。その他の光学的方法及び/又は分光法を用いた測定も光学分析に含まれる。
【0018】
本明細書において「試料と蛋白質指示薬とを接触させた後の呈色を光学分析すること」とは、例えば、前記接触が、液体試料と前記蛋白質指示薬溶液との混合であれば、その混合液について光学分析することをいい、前記接触が、液体試料への乾燥状態の前記蛋白質指示薬を含む試薬パッド(試薬層)の浸漬であれば、浸漬後の前記試薬パッドについての光学分析をすることをいうが、これらの形態に限定されなくてよく、従来公知の形態をとり得る。また、本明細書において「呈色」は、無色から発色した色、及び、他の色から色遷移をした色を含みうる。
【0019】
本明細書において「試料」は、蛋白質を含有しうるものであって、本開示の評価方法によって蛋白質濃度が評価される対象をいい、以下「評価対象試料」とも呼ぶ。本開示の評価方法において評価対象試料は、蛋白質指示薬を使用した蛋白質濃度評価の精度向上の観点から、液体であることが好ましく、より好ましくは水性液体である。評価対象の蛋白質は、同様の観点から、前記液体に溶解していることが好ましい。
【0020】
本開示の評価方法において、評価対象試料に接触させる前記蛋白質指示薬としては、評価対象試料1mLに対して0.01mg〜1mgとすることが一般的であり、蛋白質指示薬を使用した蛋白質濃度評価の精度向上及び経済性の観念から、評価対象試料1mLに対して0.02mg〜0.5mgが好ましい。
【0021】
[緩衝剤]
前記蛋白質指示薬を使用した蛋白質濃度の測定方法では、通常、pHを一定に維持するため、評価対象試料と混合させる際に緩衝剤が使用されることが多い。本開示の評価方法における前記蛋白指示薬と評価対象試料との接触時においても、緩衝剤を使用してもよい。緩衝剤としては、従来と同様のものを使用でき、維持させたいpHに応じて適宜選択できる。具体例としては、例えば、クエン酸緩衝剤、フマル酸緩衝剤、酒石酸、グリシン、及びリンゴ酸が挙げられ、これらの中でも、蛋白質指示薬を使用した蛋白質濃度評価の精度向上の観点から、リンゴ酸が好ましい。前記緩衝剤の使用量としては、評価対象試料1mLに対して0.01mg〜1mgとすることが一般的であり、蛋白質指示薬を使用した蛋白質濃度評価の精度向上及び経済性の観点から、評価対象試料1mLに対して0.02mg〜0.5mgが好ましい。なお、後述するとおり、評価対象試料のpH測定は、蛋白質指示薬を使用した蛋白質濃度評価の精度向上の観点から、前記蛋白指示薬と評価対象試料との接触時におけるバッファー条件と同様のバッファー条件下で行うことが好ましい。
【0022】
[pH測定]
本開示の評価方法は、評価対象試料のpHを測定すること含む。評価対象試料のpHの測定方法は特に制限されず、公知の方法を採用しうる。例えば、pH指示薬を用いた方法でもよく、或いは、pHメーターを用いた方法でもよい。前記pH測定は、蛋白質指示薬を使用した蛋白質濃度評価の精度向上の観点から、前記蛋白質指示薬と評価対象試料との接触時のバッファー条件と同じバッファー条件下で行われることが好ましい。例えば、前記蛋白質指示薬と評価対象試料との接触に際して緩衝剤を添加する場合には、pH測定の際にも評価対象試料に同じ緩衝剤を同じ濃度となるように添加することが好ましい。なお、特に言及しない限り、本明細書におけるpHは、25℃におけるpHをいう。
【0023】
[pH指示薬]
評価対象試料のpHをpH指示薬を用いて行う場合、前記pH指示薬は、蛋白質指示薬を使用した蛋白質濃度評価の精度向上の観点から、溶液中の蛋白質濃度に影響されにくいpH指示薬であることが好ましい。そのようなpH指示薬としては、これに限定されないが、エチルオレンジ(ethyl orange)が好ましい。
【0024】
pH指示薬を用いた評価対象試料のpH測定は、従来と同様に、例えば、評価対象試料と蛋白質指示薬とを接触させた後の呈色を光学分析することにより行うことができる。具体的な態様としては、上述した蛋白質指示薬の光学分析と同様に行うことができる。評価対象試料に接触させる前記pH指示薬としては、評価対象試料1mLに対して0.01mg〜1mgとすることが一般的であり、蛋白質指示薬を使用した蛋白質濃度評価の精度向上及び経済性の観念から、評価対象試料1mLに対して0.02mg〜0.5mgが好ましい。
【0025】
[蛋白質濃度評価]
本明細書において「蛋白質濃度の評価」とは、評価対象試料の蛋白質濃度の評価であって、例えば、評価対象試料の蛋白質濃度を具体的に決定すること(例えば、評価対象試料の蛋白質濃度はxxμg/mLである、と評価すること)、評価対象試料の蛋白質濃度を有る範囲内であると決定すること(例えば、評価対象試料の蛋白質濃度はxx〜yyμg/mLである、と評価すること)、評価対象試料の蛋白質濃度が所定の閾値を超えるか否か決定すること(例えば、評価対象試料の蛋白質濃度は閾値xxμg/mL以上(未満)である、と評価すること)、或いは、評価対象試料の蛋白質濃度が所定の基準値に基づき設定された陽性と陰性のいずれかに該当するか決定すること(例えば、評価対象試料は陽性(陰性)である、と評価すること)を含み、これらに限定されない。
【0026】
本開示の評価方法における「蛋白質濃度の評価」は、一実施形態において、評価対象試料と蛋白質指示薬とを接触させた後の呈色を光学分析した結果を、評価対象試料のpH測定結果に基づき必要に応じて修正することが挙げられる。前記光学分析の結果の、前記測定されたpH値に基づく修正は、予め前記蛋白質指示薬及びテスト試料を使用して作成された蛋白質濃度評価用データに従ってすることができる。
【0027】
[蛋白質濃度評価用データ]
本明細書において「蛋白質濃度評価用データ」とは、試料のpHに応じた、蛋白質濃度の評価の仕方を示す情報を含むデータである。評価の仕方には、評価方法や評価基準が含まれる。評価方法は、例えば、測定値を光学分析の評価値又は濃度値に変換する式やその係数を示すデータで表すことができる。評価基準は、例えば、評価の基準となる、測定値若しくは濃度値の範囲又は閾値を示すデータにより表すことができる。蛋白質濃度評価用データには、蛋白質指示薬の光学分析結果、又は当該光学分析結果から得られる蛋白質濃度の評価を、測定対象溶液のpHに基づいて修正するためのデータが含まれる。すなわち、測定対象試料のpHによっては実際の蛋白質濃度とは誤差のある呈色をしてしまう蛋白質指示薬の分析結果をpHに基づいて修正するのに、蛋白質濃度評価用データを用いることができる。蛋白質濃度評価用データの一実施形態として、所定のpH範囲ごとに、蛋白質指示薬により得られた光学分析の結果の校正方法や評価基準など設定されているデータが挙げられる。例えば、光学分析の結果として得られた値(例えば、試料と接触した蛋白質指示薬の吸光度等)を前記試料の蛋白質濃度又はその評価値に変換するのに用いられる値(例えば、変換係数等)であって、所定のpH範囲ごとに設定された値を、蛋白質濃度評価用データに含めることができる。このような蛋白質濃度評価用データは、予め作成しておくことができる。
【0028】
蛋白質濃度評価用データの実施形態として、前記光学分析結果から前記試料の蛋白質濃度を算出する際に用いられるデータであって、前記試料のpHに応じて設定されたデータが挙げられる。より詳細には、前記測定されたpH値及び前記光学分析結果からなる2つのパラメータを少なくとも使用して前記試料の蛋白質濃度を算出する方法を定義するデータを、蛋白質濃度評価用データとすることができる。本実施形態の具体例として、所定のpH範囲ごとに、蛋白質指示薬により得られた蛋白質濃度を校正する方法(例えば、校正式)が設定されているデータが挙げられる(下記表1)。本実施形態では、校正後の評価対象試料の蛋白質濃度が評価としてアウトプットされうる。なお、下記表1の数値は、一例であって、本開示を何ら限定するものではない。
【0029】
【表1】

【0030】
上記表1に示す例では、光学分析結果から得られる蛋白質濃度の値を補正するための係数が、複数のpH範囲それぞれに対応付けられて記録される。このように、pHに応じた補正係数を記録しておくことで、pHの違いを考慮した、より正確な蛋白質濃度の評価が可能になる。上記形態の変形例として、例えば、光学分析結果から蛋白質濃度を計算するために用いる校正データ(例えば、検量線を示すデータ等)を、pH範囲ごとに記録することもできる。
【0031】
蛋白質濃度評価用データの他の実施形態として、前記光学分析結果に基づいて評価値を算出する際に基準となるデータであって、前記試料のpHに応じて設定されたデータが挙げられる。より詳細には、前記測定されたpH値及び前記光学分析結果からなる2つのパラメータを少なくとも使用して前記試料の蛋白質濃度が所定の濃度範囲か否かを判断する際の基準となるデータを、蛋白質濃度評価用データとすることができる。本実施形態の具体例として、所定のpH範囲ごとに定義された、蛋白質濃度の陽性/陰性の判断基準となる吸光度(蛋白質指示薬)の値を含むデータが挙げられる(下記表2)。本実施形態では、前記定義されたデータに従って、評価対象試料の陽性又は陰性の判定が評価としてアウトプットされうる。また、本実施形態では、蛋白質指示薬から得られる光学分析値(吸光度)を蛋白質濃度に換算しなくても評価対象試料の蛋白質濃度を評価できる。なお、下記表2の数値は、一例であって、本開示を何ら限定するものではない。
【0032】
【表2】

【0033】
上記表2に示す例では、陽性と判断される光学分析の結果(例えば、吸光度)の範囲を示す情報と、陰性と判断される光学分析の結果(例えば、吸光度)の範囲を示す情報が、複数のpH範囲それぞれに対応付けられて記録される。このように、陽性/陰性を判断するための閾値を、pHの範囲を示すデータと対応づけて記録しておくことで、試料のpHに応じて蛋白質濃度を適切に評価することが可能になる。
【0034】
一実施形態として、蛋白質濃度評価用データは、pH値の正常範囲を定義するデータを含んでもよい。これにより、測定された試料のpHの値が、正確な評価ができる範囲を超えているか否かを判断することが可能になる。より詳細には、蛋白質濃度評価用データは、前記測定されたpH値の所定の低値及び/又は高値を異常なpHと定義するデータを含むことができる。具体例として、所定のpH範囲を示す評価対象試料のpHが酸性側又はアルカリ側に異常であることを示すデータが挙げられる(下記表3)。このようなデータを用いることにより、評価対象試料の異常性が評価としてアウトプットされうる。このような評価とすることで、例えば、生体試料を扱う場合にpHが異常な試料も同時に検出することができる。本実施形態は、上述の2つの実施形態と組み合わせることができる。なお、下記表3の数値は、一例であって、本開示を何ら限定するものではない。
【0035】
【表3】

【0036】
蛋白質濃度評価用データは、評価目的に応じて作成することができる。なお、蛋白質濃度評価用データに用いるパラメータは、前記測定されたpH値及び前記光学分析結果の少なくとも2つを含めばよい。また、これらのパラメータの他のパラメータも含めて3つ以上のパラメータを蛋白質濃度評価用データとして使用してもよい。
【0037】
上記のような蛋白質濃度評価用データを予め作成し、分析装置などに記録しておくことで、pH値に応じた試料の蛋白質濃度評価が可能になる。蛋白質濃度評価用データは、例えば、蛋白質濃度が既に分かっている標準試料を、さまざまなpHの条件化で光学分析して得られる値を基に、作成することができる。例えば、複数のpH値又はpH範囲それぞれについて、標準試料を光学分析して得られる結果(例えば吸光度)と標準試料の蛋白質濃度との関連を示す値を算出し、この値を、蛋白質濃度評価用データとすることができる。すなわち、蛋白質指示試薬の光学分析による測定値を蛋白質濃度値又は蛋白質濃度評価値に変換するためのデータを、複数のpH又はpH範囲について生成し、蛋白質濃度評価用データとして記録しておくことができる。なお、蛋白質濃度評価用データは、上記例に限られない。
【0038】
[評価対象試料]
本開示の評価方法の評価対象試料としては、特に制限されず、生体試料、生化学試料、環境試料等が挙げられる。前記生体試料としては、体液、尿、血液、唾液等があげられる。
【0039】
[分析用具]
本開示の評価方法において、測定対象試料と蛋白質指示薬との接触と、測定対象試料のpH指示薬を用いたpH測定とは、上述のとおり、ともに、試薬ストリップ上の試薬層にて行うことができる。したがって、本開示は、その他の態様において、基板上に、蛋白質指示薬を含む試薬層及びpH指示薬を含む試薬層を備える分析用具(以下、「本開示の分析用具」ともいう。)に関する。本開示の分析用具を用いて、本開示の評価方法を行うことができる。
【0040】
本開示の分析用具において、蛋白質指示薬を含む試薬層とpH指示薬を含む試薬層とは、別個の2つの試薬層であってもよい。また、蛋白質指示薬とpH指示薬とを同一の試薬層に配置してもよい。この場合、蛋白質指示薬の呈色とpH指示薬の呈色とを、それぞれ異なる波長において、光学分析により検出することができる。そのため、蛋白質指示薬の呈色とpH指示薬の呈色の波長は異なり、互いに与える影響が小さいことが好ましい。
【0041】
したがって、本開示の分析用具の第1の実施態様として、基板の上に複数の試薬層が形成された分析用具であって、pH及び蛋白質濃度によって発色が変化する蛋白質指示薬を含有する試薬層A、及び、pH指示薬を含有する試薬層Bを備え、前記試薬層A及び前記試薬層Bは、同じバッファー条件となるように緩衝剤をそれぞれ含む分析用具、が挙げられる。また、本開示の第2の実施態様として、基板の上に、試薬層が形成された分析用具であって、pH及び蛋白質濃度によって発色が変化する蛋白質指示薬、及び、pH指示薬を含有する試薬層を備える分析用具、が挙げられる。このように、蛋白質指示薬及びpH指示薬を含有する試薬層を備えることで、試薬層の数を少なくすることができ、分析用具がコンパクトになる。なお、上記第1及び第2の実施形態において、pH指示薬は、溶液中の蛋白質濃度に影響されにくいものを用いることが好ましい。
【0042】
第1及び第2の実施形態の分析用具において、「pH及び蛋白質濃度によって発色が変化する蛋白質指示薬」、「溶液中の蛋白質濃度に影響されにくいpH指示薬」及び「緩衝剤」は、本開示の評価方法で説明したものをそれぞれ使用できる。
【0043】
本開示の分析用具は、蛋白質指示薬を含む試薬層とpH指示薬を含む試薬層以外の試薬層を備えていてもよい。前記試薬層の数は、特に制限されず、例えば、1〜15個であり、好ましくは1〜10個であり、より好ましくは1〜8個である。本開示の分析用具は、従来公知の光学分析装置にて分析でき、また、後述する本開示の分析装置にて本開示の評価方法を行うことができる。
【0044】
本開示の分析用具の一例を図1に示す。図1Aは側面図であり、図1Bは上面図である。図1A及びBにおいて、同一部分には同一符号を付している。この検体分析用具10は、短冊状の基板1の上に、6個の試薬層2が形成されている。前記基板の材質は特に制限されず、例えば、樹脂、金属、ガラスなどがある。基板の色は、特に制限されず、白色、灰色、黒色、有彩色、透明のいずれであってもよい。前記基板の大きさは、特に制限されず、検査項目、使用する分析装置の規格等により適宜決定され、例えば、長さ50〜150mm、幅2〜10mm、厚み0.1〜1.0mmである。各試薬層2は、検査項目に対応した所定の試薬を含浸させたパッドを前記基板1上に貼着することにより形成されている。前記パッドの材質としては、例えば、ろ紙、ガラス繊維ろ紙、編物、織物、不織布、メンブランフィルター、多孔質樹脂シートなどがある。また、各試薬層2(パッド)の形は特に制限されず、正方形、長方形、円形、楕円形などがある。各試薬層2(パッド)の大きさは、特に制限されず、形状が正方形状の場合、例えば、縦と横2〜10mm、厚み0.05〜1.0mmである。前記試薬層2の数は、検査項目に応じ増減可能である。これらの試薬層2は、一定のピッチで6個の試薬層を直列に配置されている。このピッチは、特に制限されないが、例えば、1.0〜100mmである。この検体分析用具の基板1の一方の端(同図において右側端部)では、試薬層2を設けないことにより、スペースを確保し、この部分(把持部)を指先で摘まんで取り扱えるようにしている。
【0045】
本開示の分析用具の第1の実施態様の場合、図1において、例えば、試薬層3を蛋白質指示薬を含有する試薬層A、試薬層4をpH指示薬を含有する試薬層Bとすることができる。また、本開示の分析用具の第2の実施態様の場合、図1において、例えば、試薬層3又は4を、蛋白質指示薬及びpH指示薬を含有する試薬層とすることができる。但し、試薬層A及びB、又は、蛋白質指示薬及びpH指示薬を含有する試薬層の位置は、図1に限定されない。
【0046】
[分析装置]
本開示は、また、その他の態様において、本開示の評価方法を行い得る分析装置(以下、「本開示の分析装置」ともいう)に関する。本開示の分析装置の一実施態様として、
試料と蛋白質指示薬とを接触させた後の呈色を光学分析する測定部と、
前記試料のpHを測定する測定部と、
前記光学分析の結果及び前記測定されたpHと、蛋白質濃度評価用データとに基づいて前記試料の蛋白質濃度を評価する評価部と、
評価後のデータを出力する出力部とを備え、
前記蛋白質指示薬は、pH及び蛋白質濃度によって発色が変化する蛋白質指示薬であり、
前記蛋白質濃度評価用データは、前記測定されたpH値に対応した前記光学分析結果の評価の仕方を示す情報を含む、分析装置が挙げられる。
【0047】
本実施形態の分析装置において、「pH及び蛋白質濃度によって発色が変化する蛋白質指示薬」及び「蛋白質濃度評価用データ」は、本開示の評価方法で説明したものをそれぞれ使用できる。
【0048】
本実施態様の分析装置において、前記pHを測定する測定部は、測定対象試料のpHをpHメーターで測定する測定部であってもよく、或いは、pH指示薬の光学分析を行う測定部であってもよい。後者の場合は、蛋白質指示薬を光学分析する測定部とpH指示薬の光学分析を行う測定部とは同一の測定部とすることができる。
【0049】
本実施態様の分析装置において、蛋白質指示薬を光学分析する測定部とpH指示薬の光学分析を行う測定部とは同一の測定部とすることができる。また、蛋白質指示薬を光学分析する測定部及びpH指示薬の光学分析を行う測定部は、液体の光学分析を行うものであっても、或いは、分析用具の試薬層の光学分析を行うものであってもよい。したがって、本開示の分析装置は、その他の実施形態において、本開示の分析用具を使用して本開示の評価方法を行う分析装置である。
【0050】
図2は、本開示の分析装置の一実施形態における構成例を示す機能ブロック図である。図2に示す分析装置20は、蛋白質指示薬及びpHの測定と蛋白質濃度の評価を行う装置である。分析装置20は、測定部21と評価部22と出力部23を備え、さらに、記録部24を備える。測定部21は、蛋白質指示薬の測定部211とpH測定部212とを備える。測定部211では、蛋白質指示薬の光学分析を行う。上述したとおり、pH測定部212における測定が光学分析法によるものであれば、測定部211と212は1つの測定部としてもよい。測定部21で得られた蛋白質指示薬の光学分析結果及びpH測定値は、記録部24に保存されてもよい。評価部22では、測定部21で得られた蛋白質指示薬の光学分析結果及びpH測定値、及び、記録部24に記録されている蛋白質濃度評価用データに従って評価が行われる。ここで、蛋白質濃度評価用データは、予め作成し記録部24に記録しておくことができる。評価の結果は、記録部24に記録され、及び/又は出力部23に出力される。出力部23としては、例えば、表示部、印刷する印刷部、外部に送信する送信部などが挙げられる。
【0051】
(測定部)
図2に示す例では、蛋白質指示薬の測定部211とpHの測定部212は1つの測定部として構成されている。この場合、測定部21は、例えば、図1に示すような分析用具の各試薬層2の透過光又は散乱光を検出することで、吸光度、反射率又は透過率等を測定する。例えば、蛋白質指示薬を含む試薬層とpH指示薬を含む試薬層に、それぞれ試料を滴下し、これらの吸光度を測定することにより、試料を接触させた蛋白質指示薬及び、試料のpHを測定することができる。また、蛋白質指示薬とpH指示薬が1つの試薬層に含まれている場合、測定部21は、1つの試薬層の透過光又は散乱光を基に、蛋白質指示薬に対応する波長(又は帯域)及び、pH指示薬に対応する波長(又は帯域)それぞれについて、吸光度、透過率又は反射率を測定することができる。このように、1つの試薬層について、蛋白指示薬及びpH指示薬それぞれに対応する波長又は帯域の光を光学分析することにより、試料の蛋白質及び試料のpHに関する情報を得ることができる。
【0052】
(評価部)
評価部22における、蛋白質濃度評価用データを使用した評価の方法は、本開示の評価方法で説明したように行われうる。一実施形態として、前記蛋白質濃度評価用データが、前記光学分析結果から前記試料の蛋白質濃度を算出する際に用いられる算出用データであって、前記試料のpHに応じて設定された算出用データを含み(例えば、上記表1参照)、前記評価部が、前記測定されたpH値及び前記光学分析結果を用いて、前記算出用データに基づき試料の蛋白質濃度を算出することができる。評価部は、例えば、前記試料のpHがいずれのpH範囲に属するかを判断し、試料のpHの属する範囲に対応する補正係数を算出用データとして取得することができる。この場合、評価部は、補正係数又は当該補正係数を含む式を用いて、光学分析結果から得られる蛋白質濃度を修正することができる。これにより、試料のpHによる光学分析結果の変動を考慮した、より正確な蛋白質濃度の評価が可能になる。
【0053】
その他の実施形態として、前記蛋白質濃度評価用データは、前記光学分析結果に基づいて評価値を算出する際に基準となる基準データであって、前記試料のpHに応じて設定された基準データを含み(例えば、上記表2参照)、前記評価部が、前記測定されたpH値及び前記光学分析結果に基づき、前記基準データを基準に前記評価値を算出することができる。評価部は、例えば、前記試料のpHがいずれのpH範囲に属するかを判断し、試料のpHの属する範囲に対応する、陰性/陽性の判断の閾値を基準データとして取得することができる。この場合、評価部は、光学分析結果として得られる吸光度等の値と、陰性/陽性の判断の閾値とを比較することにより、試料の蛋白質濃度が陰性か陽性かを判断する。これにより、試料のpHによる光学分析結果の変動を考慮した、より正確な蛋白質濃度の評価が可能になる。
【0054】
さらに、前記蛋白質濃度評価用データは、前記測定されたpHの正常範囲を定義するデータを含み(例えば、上記表3参照)、前記評価部が、前記測定されたpH値に基づき前記定義に従った評価を行うことができる。前記評価部は、例えば、前記試料のpHが、蛋白質濃度評価用データが示すpHが正常範囲にないと判断した場合、正確な評価ができない旨、又は、評価結果の信頼性が低い旨の応答を出力することができる。これにより、試料のpHの異常を検出し出力することができる。但し、評価部22における評価はこれらに限定されない。
【0055】
(測定部の変形例)
図3は、図2に示す分析装置20の変形例の構成を表す機能ブロック図である。図3に示す分析装置20aでは、蛋白質指示薬の測定部211と、pH測定部212が、それぞれ独立して設けられる。図3に示す例では、測定部211は、図2に示す分析装置20の測定部211と同様に光学分析により呈色を測定する測定器とし、測定部212は、pHメーターとすることができる。このように、蛋白質指示薬の測定系と試料のpHの測定系を別個に設けることにより、pH測定の信頼性を向上させることができる。測定部212のpHメーターとしては、例えば、ガラス電極と比較電極を備えたガラス電極法を用いたpH測定器が挙げられるが、pHメーターの構造は、特に限定されない。
【0056】
図2及び図3における分析装置20、20aにおいて、測定部211、測定部212、評価部22、出力部23、及び記録部24のそれぞれが独立し接続された構成であってもよく、或いは、これらの全部又は一部が一体となった構成であってもよい。また、評価部22は、分析装置20、20aが備えるコンピュータにより実現することができる。例えば、分析装置20、20aのプロセッサが所定のプログラムを実行することで、評価部22の機能を実現することができる。記録部24は、分析装置20、20aが備えるメモリなどの記録媒体又は分析装置20、20aからアクセス可能なストレージにより実現することができる。
【0057】
(動作例)
図4は、図2又は図3に示す上記分析装置20、又は20a(以下、単に分析装置と称する)の動作例を示すフローチャートである。図4に示す例では、まず、分析装置のプロセッサが測定部211を制御し、試料と蛋白質指示薬を接触させる(S0)。測定部211は、試料と接触した蛋白質指示薬の呈色を光学分析により測定する(S1)。例えば、測定部211は、図1に示した分析用具の蛋白質指示薬を含む試薬層に試料を滴下することで接触させることができる。この場合測定部211は、試薬層の吸光度、反射率又は透過率を測定することで、試料と接触した蛋白質指示薬の呈色を光学分析することができる。測定部211による光学分析結果(例えば、吸光度等)は、評価部22に送信される。
【0058】
S2において、分析装置のプロセッサは、測定部212を制御し、試料のpHを測定する。図2に示す分析装置20は、測定部212が、試料が滴下されたpH指示薬を含む試薬層から光を光学分析することで試料のpHを測定することができる。図3に示す分析装置20aは、pH測定部212にて、例えば、ガラス電極法を用いた測定により試料のpHを得ることができる。測定された試料のpHは、評価部22へ送られる。
【0059】
評価部22は、S1で測定された蛋白質指示薬の光学分析結果と、S2で測定された試料のpHと、記録部24に記録された蛋白質濃度評価用データを用いて、試料のpHに応じた蛋白質濃度の評価処理を実行する(S3)。具体的には、評価部22は、S2で測定された試料のpHに対応する蛋白質濃度評価用データを記録部24から取得し、蛋白質濃度評価用データを用いて、S1で測定された蛋白質指示薬の光学分析結果又は光学分析結果から得られる蛋白質濃度の情報に対してpHに応じた修正を施す。評価部22は、修正後の光学分析結果又は蛋白質濃度の情報を評価結果としてもよいし、光学分析結果又は蛋白質濃度を基にした評価値(例えば、陽性か陰性かを示す値等)を評価結果として生成することができる。評価部22は、例えば、試料の蛋白質濃度そのもの、蛋白質濃度が属する範囲、蛋白質濃度と所定の閾値との比較結果、陽性か陰性かを示す情報、等を評価結果として計算する。出力部23は、評価部22が生成した評価結果を、出力する。出力は、例えば、分析装置が備えるディスプレイへの表示、プリンタでの印刷、スピーカからの音声出力、又は、ネットワークを介したデータの送信、もしくはこれらの組み合わせの形態で行うことができる。
【0060】
図5は、図4のS3における評価部22の動作例を示すフローチャートの一例である。評価部22は、前記蛋白質指示薬の光学分析(吸光度)の測定値及びpH測定値を取得する(S301)。次に、評価部22において、まず、測定されたpH値に対応する適用すべき評価定義が選択される(S311から315)。ここでは、一例として、記録部24に記録された蛋白質濃度評価用データが定義する評価の仕方(評価方法又は評価基準)から、測定されたpHに対応するものを抽出する。下記表4は、蛋白質濃度評価用データが定義する評価の仕方の一例を示す表である。下記表4では、評価の仕方がpH範囲に対応付けて記録される。
【0061】
【表4】

【0062】
例えば、pHが3.3未満の場合(S311でYes)には、評価部22は、蛋白質濃度評価用データから、評価の仕方を示すデータとして、pH値異常(酸性)を示すデータを抽出し、これを評価結果として出力する。pHが3.3以上3.8未満の場合(S312でYes)、評価部22は、蛋白質濃度評価用データから基準値X1を抽出し、蛋白質指示薬の光学分析結果である吸光度とX1とを比較する(S321)。評価部22は、例えば、吸光度がX1より大きい場合は陰性、吸光度がX1を超えない場合は陽性と判断することができる。同様にして、評価部22は、pHが3.8以上4.2未満の場合(S313でYes)は、X2を基準に陰性/陽性を判断し(S322)、pHが4.2以上4.6未満の場合(S314でYes)は、X3を基準に陰性/陽性を判断(S323)する。pHが4.6以上である場合、評価部22は、蛋白質濃度評価用データの「pH値異常(アルカリ」を示すデータに基づいて、pHが異常値を示す試料として評価し(S324)、出力する(S330)。このように、評価部22は、S312〜S315で測定されたpHがいずれの範囲に属するかを判断し、その判断結果に基づいて、評価基準を決定し、pHの異常の有無(S324)及び、陽性か陰性かを判断する(S321〜S323)。判断結果は、評価結果として、出力される(S330)。
【0063】
上記動作例によれば、測定された試料のpHに応じて適切な評価の仕方が選択されるので、pHに応じて適切に修正された評価結果を得ることができる。なお、本開示に係る分析装置の動作は上記図4、図5に示した例に限られない。例えば、図4において、S1とS2の実行の順序は逆になってもよい。また、図5のS321〜S323では、吸光度と基準値との比較により陰性又は陽性を判断する処理に代えて、もしくは加えて、蛋白質濃度を測定されたpHに応じた計算方法で算出する処理とすることもできる。
【0064】
なお、評価対象試料の評価の出力を行うコンピュータに処理を実行させる評価プログラムであって、蛋白質指示薬の光学分析結果及び前記評価対象試料のpHを取得する処理と、前記蛋白質濃度評価用データを予め記録した記録部にアクセスし、前記蛋白質指示薬の光学分析結果及び前記測定されたpH値に対応する評価方法又は評価基準を選択して評価する処理と、得られた評価を出力する処理とをコンピュータに実行させるプログラムも、本願発明に含まれる。また、該プログラムを記録した非一時的な(non-transitory)記録媒体、該プログラムを実装した分析装置も本願発明に含まれる。
【0065】
例えば、試料の蛋白質濃度を評価する処理をコンピュータに実行させる蛋白質濃度評価プログラムであって、前記試料と蛋白質指示薬とを接触させた後の呈色を光学分析の結果と、測定された前記試料のpHとを入力する処理と、前記光学分析の結果及び前記測定されたpHと、蛋白質濃度評価用データとに基づいて前記試料の蛋白質濃度を評価する処理をコンピュータに実行させ、前記蛋白質濃度評価用データは、前記測定されたpHに対応した前記光学分析結果の評価の仕方を示す情報を含む、蛋白質濃度評価プログラムも本願発明の実施形態の1つである。
【0066】
また、分析装置を制御するプログラムであって、分析装置の測定部に、試料と蛋白質指示薬とを接触させた後の呈色を光学分析させる処理と、分析装置の測定部にpHを測定させる処理と、前記光学分析の結果及び前記測定されたpHと蛋白質濃度評価用データとに基づいて前記試料の蛋白質濃度を評価する評価処理と、評価後のデータを出力する出力処理と分析装置に実行させ、前記蛋白質濃度評価用データは、前記測定されたpHに対応した前記光学分析結果の評価の仕方を示す情報を含む、プログラムも本願発明の実施形態の1つである。
【0067】
(分析装置の具体例)
図6は、分析装置20の具体例である尿分析装置を採用した全自動尿化学分析装置の外観斜視図である。図6に示す全自動尿化学分析装置は、本体部61、試験紙供給部62、試料供給部63、及びボトルユニット64を備えている。本体部61には、表示部65、操作部66、及びプリンタ部67が設けられている。
【0068】
本体部61には、移動可能なノズルが配置されており、このノズルは、試料供給部63に載置された検体(試料)としての尿を収容する容器から尿を吸引し、本体部61の内部の所定の位置に移送された試験紙(分析用具の一例)に設置された複数の試薬パッド(試薬層の一例)に尿を滴下すなわち点着する。
【0069】
尿を滴下された試薬パッドは、本体部61の内部に設置された光学系(測定部に相当)により色などを測定され、その測定結果に基づいて検査結果が判定されて、検査結果はプリンタ部67により印字出力される。試薬パッドの1つに、蛋白質指示薬及びpH指示薬が含まれている、測定部は、蛋白質指示薬に対応する波長における光学分析及びpH指示薬に対応する波長における光学分析を実行し、蛋白質指示薬及びpH指示薬それぞれについて測定結果を得ることができる。これにより、尿のpHに応じて、尿中の蛋白質の測定値又は評価値を適切な値に修正することができる。
【0070】
図示しないが、全自動尿化学分析装置は、CPU、メモリ(例えば、ROM(read only memory)、RAM(random access memory)、HD(Hard Disk)等を含む)、モータ駆動部、バルブ駆動部を備えることができる。CPUはメモリに記録されたプログラムにしたがって動作する。また、メモリには、上記の蛋白質濃度評価用データが記録される。CPUは、モータ駆動部、バルブ駆動部を制御する。モータ駆動部は、CPUにより制御されて、ノズルによる吸引や洗浄を行うための複数のポンプを駆動する。バルブ駆動部は、CPUにより制御されて、ノズルによる吸引や洗浄を行うための複数のバルブを駆動する。
【0071】
このように、分析装置は、試薬を設置する手段、試料を設置する手段、試薬の一つである蛋白質指示薬に試料を接触させる手段、試料のpHを測定する手段、試料と接触させた試薬の色を測定する手段、測定結果を解析する手段、及びこれらを制御する手段を含む構成とすることができる。なお、分析装置は上記例に限られない。例えば、試料である尿のpHを測定するpHメーターが設けられてもよい。pHメーターは、一例として、pHメーターのガラス電極と比較電極を試料である尿に挿入し、これらの電極間の電圧を測定することで、試料のpHを計測する構成とすることができる。
【0072】
以下、本開示が限定されない実施例を用いて、本開示をさらに説明する。
【実施例】
【0073】
[BSA溶液のタンパク質濃度評価:実施例1及び比較例1]
蛋白質指示薬としてテトラブロモフェノールブルーを用い、下記12種類のBSA溶液を作成した。これらのBSA溶液の吸光度(620nm)を分光光度計(日本分光社製)で測定した。その結果を下記表5に示す。
【0074】
〔pHの調整と測定〕
pHの調整は、NaOH(5規定)を用いて調整した。また、pHは、測定対象が25℃の状態で、pHメータ(堀場製作所製、商品名:F23)を用いて測定した。以下の実施例・比較例でも同様である。
【0075】
〔BSA溶液組成〕
0.1M リンゴ酸(pH3.7/4.1/4.5)
1.5mg/dL テトラブロモフェノールブルー(ナカライテスク社製)
BSA(ウシ血清アルブミン、シグマアルドリッチ社製)(0/10/25/50 mg/dL)
【0076】
【表5】

【0077】
〔比較例1〕
表5に示されたテトラブロモフェノールブルーの吸光度のみに基づいた下記の評価用データに従って、表5に示されたBSA溶液の蛋白質濃度につき、陽性か陰性かを評価した。なお、前記評価が陽性とは、蛋白質濃度が10mg/dL以上であることと設定し、前記評価が陰性とは、蛋白質濃度が10mg/dL未満であることと設定した。その結果を下記表6に示す。
【0078】
評価用データ:
吸光度が0.54未満で陰性、0.54以上で陽性。
(「0.54」は、pH3.7、BSA 0mg/dLの溶液の吸光度と、pH3.7、BSA 10mg/dLの溶液の吸光度との中間値である。)
【0079】
【表6】

【0080】
上記表6に示す通り、pH4.1及びpH4.5においては、蛋白質濃度が0mg/dLであっても、蛋白質指示薬の吸光度が高く、pH3.7での吸光度を基準に評価すると、本来陰性であるはずが、陽性と評価されてしまった(偽陽性が発生した)。
【0081】
〔実施例1〕
表5に示されたテトラブロモフェノールブルーの吸光度と、BSA溶液のpHとに基づいた下記の評価用データとに従って、表5に示されたBSA溶液の蛋白質濃度につき、陽性か陰性かを評価した。なお、比較例1と同様に、前記評価が陽性とは、蛋白質濃度が10mg/dL以上であることと設定し、前記評価が陰性とは、蛋白質濃度が10mg/dL未満であることを設定した。その結果を下記表7に示す。
【0082】
評価用データ:
pH3.7では、吸光度が0.54未満で陰性、0.54以上で陽性。
(「0.54」は、pH3.7、BSA 0mg/dLの溶液の吸光度と、pH3.7、BSA 10mg/dLの溶液の吸光度との中間値である。)
pH4.1では、吸光度が0.62未満で陰性、0.62以上で陽性。
(「0.62」は、pH4.1、BSA 0mg/dLの溶液の吸光度と、pH4.1、BSA 10mg/dLの溶液の吸光度との中間値である。)
pH4.5では、吸光度が0.70未満で陰性、0.70以上で陽性。
(「0.70」は、pH4.5、BSA 0mg/dLの溶液の吸光度と、pH4.5、BSA 10mg/dLの溶液の吸光度との中間値である。)
【0083】
【表7】

【0084】
上記表7に示す通り、pHを考慮して評価することで、比較例1で発生したpH4.1及びpH4.5における偽陽性は発生せず、精度が高い蛋白質濃度の評価ができた。
【0085】
[BSA添加尿試料のタンパク質濃度評価:実施例2及び比較例2]
尿にBSAを添加して下記のBSA添加尿試料を調製した。また、リンゴ酸とテトラブロモフェノールブルーの溶液である下記の蛋白質指示薬溶液を調製した。前記BSA添加尿試料と前記蛋白質指示薬溶液とを1:1で混合し、15種類の混合試料液を調製した。この混合試料液の吸光度(620nm)を分光光度計(日本分光社製)で測定した。その結果を下記表8に示す。
【0086】
〔BSA添加尿試料組成〕
尿試料にBSA(ウシ血清アルブミン、シグマアルドリッチ社製)(0/5/10/15/20 mg/dL)を添加
〔蛋白質指示薬溶液組成〕
0.2M リンゴ酸(pH3.7/4.1/4.5)
3.0mg/dL テトラブロモフェノール(ナカライテスク社製)
【0087】
【表8】

【0088】
〔比較例2〕
表8に示されたテトラブロモフェノールブルーの吸光度のみに基づいた下記の評価用データに従って、表8に示された混合試料液の蛋白質濃度につき、陽性か陰性かを評価した。なお、前記評価が陽性とは、蛋白質濃度が10mg/dL以上であることと設定し、前記評価が陰性とは、蛋白質濃度が10mg/dL未満であることを設定した。その結果を下記表9に示す。
【0089】
評価用データ:
吸光度が0.53未満で陰性、0.53以上で陽性と定義。
(「0.53」は、pH3.7、BSA 7.5mg/dLの溶液の吸光度と、pH3.7、BSA 10mg/dLの溶液の吸光度との中間値である。)
【0090】
【表9】

【0091】
上記表9に示す通り、pH4.5においては、蛋白質濃度が7.5mg/dLの場合に、本来陰性であるはずが、陽性と評価されてしまった(偽陽性が発生した)。
【0092】
〔実施例2〕
表8に示されたテトラブロモフェノールブルーの吸光度と、混合試料液のpHとに基づいた下記の評価用データに従って、表8に示された混合試料液の蛋白質濃度につき、陽性か陰性かを評価した。なお、比較例2と同様に、前記評価が陽性とは、蛋白質濃度が10mg/dL以上であることと設定し、前記評価が陰性とは、蛋白質濃度が10mg/dL未満であることを設定した。その結果を下記表10に示す。
【0093】
評価用データ:
pH3.7では、吸光度が0.53未満で陰性、0.53以上で陽性と定義。
(「0.53」は、pH3.7、BSA 7.5mg/dLの溶液の吸光度と、pH3.7、BSA 10mg/dLの溶液の吸光度との中間値である。)
pH4.1では、吸光度が0.55未満で陰性、0.55以上で陽性と定義。
(「0.55」は、pH4.1、BSA 7.5mg/dLの溶液の吸光度と、pH4.1、BSA 10mg/dLの溶液の吸光度との中間値である。)
pH4.5では、吸光度が0.59未満で陰性、0.59以上で陽性と定義。
(「0.59」は、pH4.5、BSA 7.5mg/dLの溶液の吸光度と、pH4.5、BSA 10mg/dLの溶液の吸光度との中間値である。)
【0094】
【表10】

【0095】
上記表10に示す通り、pHを考慮して評価することで、比較例2で発生したpH4.5における偽陽性は発生せず、精度が高い蛋白質濃度の評価ができた。
【0096】
[溶液中の蛋白質に影響を受けにくいpH指示薬:参考例1]
尿にBSAを添加して下記のBSA添加尿試料を調製した。また、リンゴ酸とエチルオレンジの溶液である下記のpH指示薬溶液を調製した。前記BSA添加尿試料と前記pH指示薬溶液とを1:1で混合し、15種類の混合試料液を調製した。この混合試料液の吸光度(480nm)を分光光度計(日本分光社製)で測定した。その結果を図7及び下記表11に示す。
【0097】
〔BSA添加尿試料組成〕
尿試料にBSA(ウシ血清アルブミン、シグマアルドリッチ社製)(0/5/10/15/20 mg/dL)を添加
〔pH指示薬溶液組成〕
0.2M リンゴ酸(pH3.7/4.1/4.5)
2.0mg/dL エチルオレンジ(東京化成工業社製)
【0098】
【表11】

【0099】
図7及び上記表11に示す通り、エチルオレンジの吸光度は、蛋白質濃度に影響されず、pHに応じて吸光度が変化した。また、近似直線が、y=0.20x-0.15 あることから、pH=(吸光度+0.15)/0.20 の計算式で吸光度からpHを求めることが可能であることが示された。上記表11の吸光度から、pH=(吸光度+0.15)/0.20 の計算式でpHを算出すると下記表12のようになる。
【0100】
【表12】

【0101】
[pH指示薬から算出されたpHを利用した評価:実施例3]
表8(実施例2及び比較例2)に示されたテトラブロモフェノールブルーの吸光度と、pH指示薬から算出されたpH(上記表12)とに基づいた下記の評価用データに従って、表8に示された混合試料液の蛋白質濃度につき、陽性か陰性かを評価した。なお、実施例2及び比較例2と同様に、前記評価が陽性とは、蛋白質濃度が10mg/dL以上であることと設定し、前記評価が陰性とは、蛋白質濃度が10mg/dL未満であることを設定した。その結果を下記表13に示す。
【0102】
評価用データ:
pH3.6以下は要注意(酸性)と定義。
pH3.7では、0.53未満で陰性、0.53以上で陽性と定義。
pH3.8、3.9では、0.54未満で陰性、0.54以上で陽性と定義。
pH4.0、4.1では、0.55未満で陰性、0.55以上で陽性と定義。
pH4.2では、0.56未満で陰性、0.56以上で陽性と定義。
pH4.3では、0.57未満で陰性、0.57以上で陽性と定義。
pH4.4では、0.58未満で陰性、0.58以上で陽性と定義。
pH4.5では、0.59未満で陰性、0.59以上で陽性と定義。
pH4.6以上は要注意(アルカリ)と定義。
【0103】
【表13】

【0104】
上記表13に示すとおり、pH指示薬から算出したpH値を用いて評価することで、比較例2で発生した偽陽性を排除できた。また、評価対象試料のpHを測定することとなるから、極端な酸性又はアルカリ性に変化した試料を容易に検知することができた。
【産業上の利用可能性】
【0105】
本開示は、例えば、医療及び臨床検査等の分野において有用である。
【符号の説明】
【0106】
1 基板
2 試薬層
3 試薬層
4 試薬層
10 分析用具
【特許請求の範囲】
【請求項1】
試料の蛋白質濃度を評価する方法であって、
前記試料と蛋白質指示薬とを接触させた後の呈色を光学分析すること、
前記試料のpHを測定すること、並びに、
前記光学分析の結果及び前記測定されたpHと、蛋白質濃度評価用データとに基づいて前記試料の蛋白質濃度を評価することを含み、
前記蛋白質指示薬は、pH及び蛋白質濃度によって発色が変化する蛋白質指示薬であり、
前記蛋白質濃度評価用データは、前記測定されたpHに対応した前記光学分析結果の評価の仕方を示す情報を含む、蛋白質濃度評価方法。
【請求項2】
前記試料のpH測定が、前記蛋白質指示薬と試料との接触時のバッファー条件と同じバッファー条件下で行われる、請求項1記載の蛋白質濃度評価方法。
【請求項3】
前記蛋白質指示薬が、オクタハロスルホフタレイン型色素、オクタハロフェノールフタレイン型色素、又はそれらの組み合わせである、請求項1又は2に記載の蛋白質濃度評価方法。
【請求項4】
前記蛋白質指示薬が、テトラブロモフェノールブルー、テトラクロロフェノールブルー、3′,3″,5,5″−テトラヨード−3,4,5,6−テトラブロモフェノールスルホフタレイン、3,3″−ジヨード−5,5″,3,4,5,6−ヘキサブロモフェノールスルホフタレイン、及びそれらの組み合わせからなる群から選択される、請求項1から3のいずれかに記載の蛋白質濃度評価方法。
【請求項5】
前記pH指示薬が、エチルオレンジである、請求項4記載の蛋白質濃度評価方法。
【請求項6】
前記蛋白質濃度評価用データは、前記光学分析結果から前記試料の蛋白質濃度を算出する際に用いられるデータであって、前記試料のpHに応じて設定されたデータを含む、請求項1から5のいずれかに記載の蛋白質濃度評価方法。
【請求項7】
前記蛋白質濃度評価用データは、前記光学分析結果に基づいて評価値を算出する際に基準となるデータであって、前記試料のpHに応じて設定されたデータを含む、請求項1から6のいずれかに記載の蛋白質濃度評価方法。
【請求項8】
前記蛋白質濃度評価用データは、前記測定されたpHの正常範囲を定義するデータを含む、請求項1から7のいずれかに記載の蛋白質濃度評価方法。
【請求項9】
試料が尿である、請求項1から8のいずれかに記載の蛋白質濃度評価方法。
【請求項10】
基板の上に複数の試薬層が形成された分析用具であって、
pH及び蛋白質濃度によって発色が変化する蛋白質指示薬を含有する試薬層A、及び、pH指示薬を含有する試薬層Bを備え、
前記試薬層A及び前記試薬層Bは、同じバッファー条件となるように緩衝剤を含む、分析用具。
【請求項11】
請求項1から9のいずれかに記載の蛋白質濃度評価方法を行うための、請求項10に記載の分析用具。
【請求項12】
試料と蛋白質指示薬とを接触させた後の呈色を光学分析する測定部と、
前記試料のpHを測定する測定部と、
前記光学分析の結果及び前記測定されたpHと蛋白質濃度評価用データとに基づいて前記試料の蛋白質濃度を評価する評価部と、
評価後のデータを出力する出力部とを備え、
前記蛋白質指示薬は、pH及び蛋白質濃度によって発色が変化する蛋白質指示薬であり、
前記蛋白質濃度評価用データは、前記測定されたpHに対応した前記光学分析結果の評価の仕方を示す情報を含む、分析装置。
【請求項13】
請求項1から9のいずれかに記載の蛋白質濃度評価方法を行うための、請求項12記載の分析装置。
【請求項14】
請求項10又は11に記載の分析用具を用いて分析を行うための、請求項12又は13に記載の分析装置。
【請求項1】
試料の蛋白質濃度を評価する方法であって、
前記試料と蛋白質指示薬とを接触させた後の呈色を光学分析すること、
前記試料のpHを測定すること、並びに、
前記光学分析の結果及び前記測定されたpHと、蛋白質濃度評価用データとに基づいて前記試料の蛋白質濃度を評価することを含み、
前記蛋白質指示薬は、pH及び蛋白質濃度によって発色が変化する蛋白質指示薬であり、
前記蛋白質濃度評価用データは、前記測定されたpHに対応した前記光学分析結果の評価の仕方を示す情報を含む、蛋白質濃度評価方法。
【請求項2】
前記試料のpH測定が、前記蛋白質指示薬と試料との接触時のバッファー条件と同じバッファー条件下で行われる、請求項1記載の蛋白質濃度評価方法。
【請求項3】
前記蛋白質指示薬が、オクタハロスルホフタレイン型色素、オクタハロフェノールフタレイン型色素、又はそれらの組み合わせである、請求項1又は2に記載の蛋白質濃度評価方法。
【請求項4】
前記蛋白質指示薬が、テトラブロモフェノールブルー、テトラクロロフェノールブルー、3′,3″,5,5″−テトラヨード−3,4,5,6−テトラブロモフェノールスルホフタレイン、3,3″−ジヨード−5,5″,3,4,5,6−ヘキサブロモフェノールスルホフタレイン、及びそれらの組み合わせからなる群から選択される、請求項1から3のいずれかに記載の蛋白質濃度評価方法。
【請求項5】
前記pH指示薬が、エチルオレンジである、請求項4記載の蛋白質濃度評価方法。
【請求項6】
前記蛋白質濃度評価用データは、前記光学分析結果から前記試料の蛋白質濃度を算出する際に用いられるデータであって、前記試料のpHに応じて設定されたデータを含む、請求項1から5のいずれかに記載の蛋白質濃度評価方法。
【請求項7】
前記蛋白質濃度評価用データは、前記光学分析結果に基づいて評価値を算出する際に基準となるデータであって、前記試料のpHに応じて設定されたデータを含む、請求項1から6のいずれかに記載の蛋白質濃度評価方法。
【請求項8】
前記蛋白質濃度評価用データは、前記測定されたpHの正常範囲を定義するデータを含む、請求項1から7のいずれかに記載の蛋白質濃度評価方法。
【請求項9】
試料が尿である、請求項1から8のいずれかに記載の蛋白質濃度評価方法。
【請求項10】
基板の上に複数の試薬層が形成された分析用具であって、
pH及び蛋白質濃度によって発色が変化する蛋白質指示薬を含有する試薬層A、及び、pH指示薬を含有する試薬層Bを備え、
前記試薬層A及び前記試薬層Bは、同じバッファー条件となるように緩衝剤を含む、分析用具。
【請求項11】
請求項1から9のいずれかに記載の蛋白質濃度評価方法を行うための、請求項10に記載の分析用具。
【請求項12】
試料と蛋白質指示薬とを接触させた後の呈色を光学分析する測定部と、
前記試料のpHを測定する測定部と、
前記光学分析の結果及び前記測定されたpHと蛋白質濃度評価用データとに基づいて前記試料の蛋白質濃度を評価する評価部と、
評価後のデータを出力する出力部とを備え、
前記蛋白質指示薬は、pH及び蛋白質濃度によって発色が変化する蛋白質指示薬であり、
前記蛋白質濃度評価用データは、前記測定されたpHに対応した前記光学分析結果の評価の仕方を示す情報を含む、分析装置。
【請求項13】
請求項1から9のいずれかに記載の蛋白質濃度評価方法を行うための、請求項12記載の分析装置。
【請求項14】
請求項10又は11に記載の分析用具を用いて分析を行うための、請求項12又は13に記載の分析装置。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公開番号】特開2013−101102(P2013−101102A)
【公開日】平成25年5月23日(2013.5.23)
【国際特許分類】
【出願番号】特願2012−219077(P2012−219077)
【出願日】平成24年10月1日(2012.10.1)
【出願人】(000141897)アークレイ株式会社 (288)
【Fターム(参考)】
【公開日】平成25年5月23日(2013.5.23)
【国際特許分類】
【出願日】平成24年10月1日(2012.10.1)
【出願人】(000141897)アークレイ株式会社 (288)
【Fターム(参考)】
[ Back to top ]

