蛍光検出装置および生化学反応分析装置と蛍光検出方法
【課題】検出可能な蛍光の輝度の範囲を広げ、使用可能な対象物の範囲を広げられる蛍光検出装置および方法を提供する。
【解決手段】1回目の蛍光検出を行った後に検出条件を変えて(光電変換増幅率を低くして)2回目の蛍光検出を行う。全エリアの中に、2回の検出データがいずれも許容範囲内であるドットが1つでもあれば、その2つの検出データから蛍光変化率(蛍光褪色率)を求める。1回目の検出データが許容範囲内であるエリアは、その検出データをそのまま蛍光特性値とする。1回目の検出データが許容範囲外であるエリアは、2回目の検出データを蛍光変化率で補正した値を蛍光特性値とする。2回の検出データがいずれも許容範囲内であるドットがない場合には、全エリアの中の少なくとも1つのドットで、許容範囲内の2つの検出データが得られるまで、検出条件をその都度変えながら蛍光検出を繰り返す。
【解決手段】1回目の蛍光検出を行った後に検出条件を変えて(光電変換増幅率を低くして)2回目の蛍光検出を行う。全エリアの中に、2回の検出データがいずれも許容範囲内であるドットが1つでもあれば、その2つの検出データから蛍光変化率(蛍光褪色率)を求める。1回目の検出データが許容範囲内であるエリアは、その検出データをそのまま蛍光特性値とする。1回目の検出データが許容範囲外であるエリアは、2回目の検出データを蛍光変化率で補正した値を蛍光特性値とする。2回の検出データがいずれも許容範囲内であるドットがない場合には、全エリアの中の少なくとも1つのドットで、許容範囲内の2つの検出データが得られるまで、検出条件をその都度変えながら蛍光検出を繰り返す。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、例えば、検体中の細胞、微生物、染色体、核酸等のサンプルを抗原抗体反応や核酸ハイブリダイゼーション反応等の生化学反応を利用して検出するための蛍光検出装置および生化学反応分析装置と蛍光検出方法に関する。
【背景技術】
【0002】
血液等の検体を分析する分析装置には、抗原抗体反応を利用した免疫学的な方法や、核酸ハイブリダイゼーションを利用する方法がある。免疫学的な方法の一例では、被検出物質と特異的に結合する抗体または抗原等のタンパク質をプローブとして用いる。プローブを微粒子、ビーズ、またはガラス板等の固相表面に固定して、検体中の被検出物質との抗原抗体反応を行わせる。核酸ハイブリダイゼーションを利用する方法の一例では、一本鎖の核酸をプローブとして用い、微粒子、ビーズ、ガラス板等の固相表面に固定して、検体中の被検出物質と核酸ハイブリダイゼーションを行わせる。これらの方法は、酵素、蛍光物質、または発光性物質等の、検知感度の高い標識物質を担持した特異的な相互作用を有する標識化物質である標識化抗体、標識化抗原、または標識化核酸等を用いる。そして、抗原抗体化合物またはハイブリダイズされた二本鎖の核酸を検出して、被検出物質(ターゲット)の有無の検出やその定量を行う。
【0003】
これらの技術を発展させたものとして、例えば特許文献1には、互いに異なる塩基配列を有する多数のDNA(デオキシリボ核酸)プローブを、基板上にアレイ状に並べた、いわゆるDNAアレイが開示されている。
【0004】
また、非特許文献1には、多種類のタンパク質をメンブレンフィルタ上に並べ、DNAアレイと同様な構成のタンパク質アレイを作製する方法が開示されている。このように、DNAアレイやタンパク質アレイ等を用いることによって、極めて多数の項目の検査を一度に行うことが可能になってきている。
【0005】
また、様々な検体分析における、検体による汚染の軽減、反応の効率化、装置の小型化、作業の簡便化等の目的で、内部で生化学反応を行わせる使い捨て可能な生化学反応カートリッジが提案されている。例えば、特許文献2においては、DNAアレイを含む生化学反応カートリッジ内に複数のチャンバを配設する構成が開示されている。この生化学反応カートリッジによると、圧力差を利用して溶液を各チャンバへ移動させることにより検体中のDNAの抽出、増幅、またはハイブリダイゼーション等の反応を内部で行わせることが可能である。
【0006】
そして、このような生化学反応カートリッジ内に外部から溶液を注入する方法としては、外部の電動シリンジポンプや真空ポンプを利用する方法がある。また、生化学反応カートリッジ内部で溶液を移動する方法としては、圧力差以外にも、重力や毛細管現象や電気泳動を利用する方法が知られている。さらに、生化学反応カートリッジの内部に配設できる小型のマイクロポンプとして、特許文献2にはダイアフラムポンプ、特許文献3には発熱素子を利用したポンプ、特許文献4には圧電素子を利用したポンプがそれぞれ開示されている。
【0007】
生化学反応カートリッジとして、またはその一部として用いられるDNAチップに、情報記憶用のICを設け、このICに記憶された同定情報を利用してDNAの同定を行う構成がある。具体的には、特許文献5に、DNAチップの塩基配列情報や検体の情報を情報記憶用ICに書き込むことが開示されている。
【0008】
また、DNAチップ上のサンプルのハイブリダイゼーション状態を検知するために、サンプルに付着した蛍光物質(蛍光標識)を読み取る方法がある。具体的には、特許文献6に、蛍光物質を読み取ってターゲットの検出を行うために、蛍光を発生させるようにDNAチップに照射する励起光を適宜に較正する方法が開示されている。
【0009】
さらに、特許文献7には、生化学解析用カセットに化学発光基質を2度に分けて投入することで2回の化学発光を生じさせ、それらの化学発光によるそれぞれの輝度データを求める方法が開示されている。特許文献7では、こうして求めた2つの輝度データを比較することでダイナミックレンジを広げることができる。
【特許文献1】米国特許第5445934号明細書
【特許文献2】特表平11−509094号公報
【特許文献3】特許第2832117号明細書
【特許文献4】特開2000−274375号公報
【特許文献5】特開2001−147231号公報
【特許文献6】特表2002−538427号公報
【特許文献7】特許第3710752号明細書
【非特許文献1】アンジェリカ ロイキング(Angelika Lueking)他5名、「プロテイン マイクロアレイズ フォー ジーン エクスプレッション アンド アンチボディ スクリーニング(Protein Microarrays for Gene Expression and Antibody Screening)」、アナリティカル バイオケミストリー(Analytical Biochemistry) Vol.270(1)、アカデミック プレス(Academic Press)、1999年5月15日、p.103〜111
【発明の開示】
【発明が解決しようとする課題】
【0010】
生化学反応を生じさせるために様々な溶液を内蔵し、検体が供給される生化学反応カートリッジは、二次感染や汚染の防止と、使い勝手の観点から、使い捨てにすることが好ましい。しかし、マイクロポンプを内蔵した生化学反応カートリッジは高価であるという問題がある。したがって、ポンプを内蔵せずに外部のポンプの作用で溶液を移動し、検体注入後は溶液を外部に流出させずに一連の生化学反応を進められる構造の、使い捨ての生化学反応カートリッジが一般に利用されている。
【0011】
個々のDNAチップは、ハイブリダイゼーションという単独の生化学反応のみを行うためのものである。しかし、DNAチップを内蔵する生化学反応カートリッジは、各種の生化学反応を連続的に行い、最後に検出工程を行う場合がある。この検出工程は、例えばCMOSセンサやCCDセンサを含む蛍光検出部を用いて、標識物質が発する蛍光を検出している。しかし、これらの蛍光検出部は、検出して分析可能な蛍光の輝度のダイナミックレンジが狭く、場合によっては輝度の検出が正確にできないことがある。
【0012】
そこで本発明の目的は、検出して分析可能な蛍光の輝度のダイナミックレンジを広げることにより、使用可能な対象物の範囲を広げることができる蛍光検出装置および生化学反応分析装置と蛍光検出方法を提供することにある。
【課題を解決するための手段】
【0013】
本発明の蛍光検出装置は、対象物から発せられる蛍光を検出する蛍光検出部を含み、蛍光検出部による対象物に対する蛍光検出の際に、対象物の情報に基づいて検出条件が設定されるものである。
【0014】
本発明の、対象物から発せられる蛍光を検出する蛍光検出方法において、蛍光検出は対象物の検出領域の全域に対して行い、検出領域を分割した複数のエリアのそれぞれの検出データの集合を求めるものである。そして、対象物に対して、少なくとも1つの検出条件を変えて2回の蛍光検出を行い、検出領域内の全エリアの中に、2回の蛍光検出時の検出データがいずれも許容範囲内に入っているドットが存在するか否かを調べる。その2回の蛍光検出時の検出データがいずれも許容範囲内に入っているドットが存在する場合には、当該2回の蛍光検出時の検出データの集合に基づいて各エリアの蛍光特性値を決定する。その2回の蛍光検出時の検出データがいずれも許容範囲内に入っているドットが存在しない場合には、検出領域内の全エリアの中のいずれかのドットにおいて許容範囲内に入っている2つの検出データが得られるまで、検出条件をその都度変えて蛍光検出を繰り返す。そして、当該2つの検出データが得られた際のそれぞれの蛍光検出時の検出データの集合に基づいて各エリアの蛍光特性値を決定する。
【発明の効果】
【0015】
本発明によると、少なくとも1つの検出条件を変えながら複数回の蛍光検出を行って、それらの検出データに基づいて蛍光特性値を決定することができる。例えば、複数回の蛍光検出の結果、少なくとも1つのドットにおいて許容範囲内に入っている2つの検出データが得られれば、その2つの検出データに基づいて蛍光変化率を求めることができる。そして、その蛍光変化率に基づいて、他の位置の検出データを補正することによって、蛍光特性値を求めることができる。その結果、対象物の検出領域の各エリアの蛍光特性値を求める信頼性が高くなる。
【0016】
なお、本発明の蛍光検出装置では、対象物の情報に基づいて検出条件が設定可能なので、予め予測される許容範囲に合わせて適切な検出条件が設定できるならば、1回の蛍光検出で蛍光特性値を求めることも可能である。
【発明を実施するための最良の形態】
【0017】
以下、本発明の実施の形態について図面を参照して説明する。
【0018】
[第1の実施形態]
図1には、本発明の一実施形態における生化学反応分析装置が概略的に示されている。この生化学反応分析装置の処理装置は、本実施形態において反応場となるチャンバを含む生化学反応カートリッジ1(図7参照)が載置されるテーブル13を有している。テーブル13上には、電磁石14と、ペルチェ素子15,16と、第1の通信部26が配置され、これらは、処理装置全体を制御する制御部17に接続されている。電磁石14は、生化学反応カートリッジ1内に電磁力を作用させるものである。ペルチェ素子15,16は、生化学反応カートリッジ1の温度を制御するものである。具体的には、ペルチェ素子15は、後述するPCR(ポリメラーゼ連鎖反応)によるDNA増幅時に温度制御するためのものである。一方、ペルチェ素子16は、後述する、増幅した検体のDNAとDNAプローブ37とのハイブリダイゼーション時に温度制御するとともに、ハイブリダイゼーションしなかった検体DNAの洗浄時に温度制御するためのものである。第1の通信部26は、処理装置のデータを、後述する生化学反応カートリッジ1内のICチップ25(図7参照)に記憶させるために、ICチップ25に対して電力の送信や信号の送受信を行うものである。
【0019】
テーブル13の両側には、電動シリンジポンプ18,19と、これらのポンプ18,19によって空気を排出または吸引するための出入口であり、それぞれ10個ずつのポンプノズル20,21を有するポンプブロック22,23とが配置されている。電動シリンジポンプ18,19とポンプノズル20,21の間には、図示しない複数の電動切換バルブが配置されている。図示しない電動切換バルブとポンプ18,19は制御部17に接続されている。
【0020】
制御部17は検査者が入力を行う入力部24に接続されている。この制御部17は、ポンプノズル20,21を1個ずつ独立して開閉して電動シリンジポンプ18,19に対する接続および遮断を制御する。制御部17は、全てのポンプノズル20,21を同時に開閉するなどの制御を行うことができる。また、制御部17は、電磁石14およびペルチェ素子15,16を適宜に作動させることによって、生化学反応カートリッジ1内での生化学反応を実行させる。
【0021】
テーブル13およびポンプブロック22,23の外部に、検出部28が設けられている。この検出部28は、生化学反応カートリッジ1のDNAチップ12のハイブリダイゼーション状態を検知するため、すなわち蛍光物質を検出するために設けられている。このDNAチップ12が蛍光検出の対象物である。
【0022】
検出部28には、ステージ29と、蛍光検出ユニット30と、第2の通信部31が設けられており、これらも制御部17に接続されている。ここでは、蛍光検出ユニット30と、制御部17の少なくとも一部の機能部分(蛍光検出に関する機能部分)とを総称して、「蛍光検出装置」と言う。なお、本実施形態では、制御部17は蛍光検出以外の様々な動作の制御も行うものである。
【0023】
ステージ29は、生化学反応カートリッジ1を保持するものである。蛍光検出ユニット30の詳細な構成については後述するが、主に光学機器で構成され、蛍光体を励起させて発生させた蛍光の強度を検出データとして測定可能なものである。また、蛍光検出ユニット30は、励起光の強度を適宜に調整することもできる。第2の通信部31は、生化学反応カートリッジ1内のICチップ25に対して、電力の送信や信号の送受信を行うものである。
【0024】
さらに、制御部17の指令によって生化学反応カートリッジ1をテーブル13上から検出部28へ搬送するカートリッジ搬送部27が設けられ、制御部17に接続されている。
【0025】
次に、蛍光検出ユニット30の構成について、図2を参照して説明する。蛍光検出ユニット30は、主に、レーザ光発生器(励起光発生部)38と、エクスパンダ32と、ビームホモジナイザ33と、蛍光フィルタ34と、レンズ群35と、蛍光検出部36とを有している。
【0026】
レーザ光発生器38は、レーザ光(励起光)を照射して、生化学反応カートリッジ1のDNAチップ12に位置する検体中の蛍光物質を励起して蛍光を発生させるためのレーザ光源である。エクスパンダ32は、レーザ光発生器38からのレーザ光をDNAチップ12の測定領域の範囲に広げるものである。ビームホモジナイザ33は、エクスパンダ32によって広げられたレーザ光の強度を、全域にわたって一様にするものである。蛍光フィルタ34は、DNAチップ12からの蛍光を透過させるが、レーザ光のDNAチップ12による反射光を遮断するものである。レンズ群35は、DNAチップ12からの蛍光を蛍光検出部36に集光させる。蛍光検出部36は、レンズ群35により集光された光が入射され、その入射光を検出するものである。
【0027】
蛍光検出部36は、図示しないが、蛍光検出の対象物であるDNAチップ12の検出領域に対応する検出部を有するCMOSエリアセンサを含み、その検出部が2次元的に分割された各エリアごとに、入射された蛍光を光電変換して電荷として蓄積する。さらにCMOSエリアセンサは、電荷を電圧に変換する際の光電変換増幅率を、制御部17からの指示に従って変更することができる。すなわち、蛍光検出部36のCMOSエリアセンサは、蛍光検出の1つの検出条件である光電変換増幅率を、対象物の情報に基づいて設定および変更することができる条件設定機能を有している。ここで言う対象物の情報とは、例えば、ICチップに記憶されている情報、または、前回のスキャン(蛍光検出)時に求められた情報である。なお、CMOSセンサの代わりにCCDセンサを用いることもできる。
【0028】
蛍光検出部36は、図示しないが、AD変換部とメモリとをさらに有している。そして、蛍光検出に伴う電荷の蓄積終了時に、CMOSエリアセンサの各エリアの個々の電荷の増幅後の電圧値を、アナログ−デジタル変換した上で、蛍光輝度を表すデジタル値としてメモリに記憶する。このデジタル値(検出データ)は制御部17に転送され、2回目以降の蛍光検出における蛍光検出値とともに、制御部17による結果の算出に利用される。なお、ここで言う「検出データ」とは測定した数値そのものである。一方、後述する「蛍光特性値」とは、測定した検出データに基づき、その一部を加工するなどして、対象物の特性を表す指標として最終的に決定した数値を意味する。ここでは、「検出データ」も「蛍光特性値」も蛍光の輝度値で表される。
【0029】
次に、この蛍光検出ユニット30の動作について詳細に説明する。
【0030】
後述するが、本実施形態では、前段階の処理工程において、例えばDNAのハイブリダイゼーション反応などの生化学反応を生化学反応カートリッジ1内で行わせる。そして、本実施形態では、このような生化学反応の処理が行われた生化学反応カートリッジ1が、検査部28に搬送されて蛍光検出ユニット30により蛍光検出される。
【0031】
蛍光検出工程に先立って、生化学反応カートリッジ1のICチップ25から制御部17に情報が送られ、この生化学反応カートリッジ1の用途に基づいて予想される輝度の許容範囲が設定される。後述する蛍光検出工程において求められた検出データは、この許容範囲と適宜比較される。
【0032】
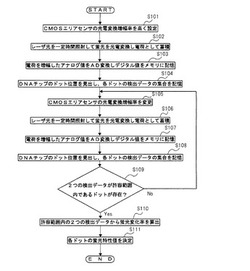
図3に示すフローチャートを参照して、蛍光検出工程についてより詳しく説明する。まず、ステップS101において、蛍光検出部36のCMOSエリアセンサの光電変換増幅率を高く設定する。そして、ステップS102において、レーザ光発生器38を作動させる。これにより、励起光であるレーザ光が、生化学反応カートリッジ1のDNAチップ12に照射される。すると、前段階の処理工程にて生化学反応カートリッジ1内でハイブリダイゼーション反応が起こることによりDNAチップ12内に捕捉された蛍光標識が、レーザ光に励起されて蛍光を発する。蛍光標識が発した蛍光は、蛍光フィルタ34とレンズ群35を通過して、蛍光検出部36のCMOSエリアセンサに到達する。そして、CMOSエリアセンサによって蛍光が光電変換されて電荷として蓄積される。この電荷の蓄積は、レーザ光発生器38が所定時間だけ作動させられた後に停止するまで継続する。こうしてCMOSエリアセンサの個々のエリアに蓄積された電荷はそれぞれ、ステップS101において高く設定された光電変換増幅率で増幅されたアナログ電圧値となる。さらに、ステップS103において、これらのアナログ電圧値はそれぞれ、AD変換部においてデジタル値に変換されてメモリに記憶される。便宜上、このデジタル値を「検出データ(輝度データ)」という。
【0033】
ステップS104において、蛍光検出部36のメモリに記憶された各エリア(対象物であるDNAチップ12を分割した複数のエリアの各々)の検出データ(デジタル値)の集合が、制御部17に転送される。制御部17は、画像処理によりDNAチップ12の検出領域のどこに蛍光を発するドットが存在するかを導き出す。そして、そのドットの中心付近のエリアの検出データの平均を算出し、それをそのエリアの検出データとする。全エリアについてこのようにしてそれぞれ決定された検出データの集合を、1回目の検出データの集合としてメモリに記憶する。
【0034】
次に、ステップS105において、蛍光検出部36のCMOSエリアセンサの光電変換増幅率を低く設定し直す。これが検出条件の変更である。そして、ステップS102〜104と同様に、ステップS106において、レーザ光発生器38を作動させ、レーザ光を生化学反応カートリッジ1のDNAチップ12に照射する。DNAチップ12内に捕捉された蛍光標識がレーザ光を受けて蛍光を発し、この蛍光が蛍光フィルタ34とレンズ群35を介してCMOSエリアセンサにより受光される。所定時間だけレーザ光発生器38が作動させられた後に停止させられ、その間にCMOSエリアセンサの各エリアに蓄積された電荷は、ステップS107において、低く設定された光電変換増幅率で増幅される。そして、アナログ電圧値からデジタル値(検出データ)に変換されメモリに記憶される。さらに、ステップS108において、メモリに記憶された各エリアのデジタル値(検出データ)の集合が制御部17に転送される。そして、DNAチップ12の検出領域内の蛍光を発するドットが求められ、そのドットの中心付近のエリアの検出データの平均を算出し、それをそのエリアの検出データとする。全エリアについてこのようにしてそれぞれ決定された検出データの集合を、2回目の検出データの集合としてメモリに記憶する。
【0035】
このようにして記憶された1回目の検出データの集合と2回目の検出データの集合を、ステップS109において、制御部17が、予め記憶されている許容範囲と比較する。すなわち、個々の検出データが、生化学反応分析用のデータとして使用できる許容範囲の下限値より大きく上限値より小さいか否かを判定する。1回目の検出データの集合と2回目の検出データの集合とを対比して、DNAチップ12の検出領域内に、1回目と2回目の両方の検出データがいずれも許容範囲内に入っているドット(例えば図4のドットB)が存在するか否かを確認する。そのようなドットが存在する場合には、レーザ光の照射はそれ以上繰り返さず、これらの2回の検出データ(輝度データ)の集合に基づいてDNAチップ12の蛍光特性値(輝度値)を以下の通り決定する。
【0036】
ステップS109において、2回の蛍光検出の検出データがいずれも許容範囲内に入っているドット(ドットB)が存在すると確認された場合には、ステップS110において、制御部17が蛍光変化率(蛍光褪色率)Tを算出する。
T={B2×(R1÷R2)}÷B1
ここで、ドットBの1回目の検出データがB1、2回目の検出データがB2、1回目の蛍光検出時の光電変換増幅率がR1、2回目の蛍光検出時の光電変換増幅率がR2である。
【0037】
続いて、ステップS111において、制御部17が各ドットの輝度値(蛍光特性値)を決定する。1回目の検出データが、許容範囲内であったドット(例えばドットAおよびドットB)に関しては、1回目の検出データをそのままドットの輝度値として決定する。一方、1回目の蛍光検出時の検出データが許容範囲の上限値より大きく2回目の蛍光検出時の検出データが許容範囲の上限値以下であったドット(例えばドットC)に関しては、次の計算式で輝度値Kを決定する。
K={(C2×(R1÷R2)}÷T
C2は、ドットCにおける2回目の蛍光検出時の検出データである。
【0038】
このように、1回目の検出データが許容範囲外であったドットCの輝度値は、2回目の検出データを、ドットBの2つの検出データに基づいて算出された蛍光褪色率を用いて補正することによって決定される。
【0039】
なお、前記した条件に当てはまらないドット、例えば、2回の蛍光検出時の輝度データがいずれも許容範囲外であったドットが存在する場合には、それは輝度値不明のドットとみなす。
【0040】
このようにしてDNAチップ12の各ドットの蛍光特性値(輝度値)をそれぞれ決定する。こうして決定された各エリアの蛍光特性値が、後述する生化学反応分析時に用いられる。
【0041】
ところで、ステップS109において、2回の蛍光検出の検出データがいずれも許容範囲内に入っているドットが存在しないと確認された場合(図5参照)には、検出条件を変えて、レーザ光の照射および蛍光の受光を繰り返す。すなわち、ステップS105において蛍光検出部36のCMOSエリアセンサの光電変換増幅率を変更する。なお、光電変換増幅率をさらに低くしてもよいが、高くしてもよい。これは、2回の蛍光検出時の検出データが概ね許容範囲の上限値よりも高かったか、あるいは下限値よりも低かったかに基づいて決めればよい。
【0042】
その後、前記したのと同様に、ステップS106において、レーザ光発生器38を作動させ、DNAチップ12内に捕捉された蛍光標識からの蛍光をCMOSエリアセンサにより受光する。その際のCMOSエリアセンサの各エリアに蓄積された電荷を、ステップS107において、新たな光電変換増幅率で増幅し、デジタル値(検出データ)に変換してメモリに記憶する。さらに、ステップS108において、全エリアの検出データの集合を求め、3回目の検出データの集合としてメモリに記憶する。
【0043】
それから、ステップS109において、1〜3回目の検出データの集合を、制御部17に記憶されている許容範囲と比較し、1〜3回目の検出データのうち2つの検出データが許容範囲内に入っているドットが存在するか否かを確認する。そのようなドットが存在する場合には、レーザ光の照射はそれ以上繰り返さず、それらの2回の検出データの集合に基づいてDNAチップ12の各エリアの蛍光特性値(輝度値)を決定する。例えば、図6に示す例では、ドットBとドットCにおいて2回目の検出データと3回目の検出データがいずれも許容範囲内に入っている。従って、2回目の検出データの集合と3回目の検出データの集合に基づいて、蛍光変化率(蛍光褪色率)を求め、全エリアの輝度値(蛍光特性値)をそれぞれ決定する。これらのステップS110〜S111は前記したのと実質的に同じであるから、説明は省略する。
【0044】
ステップS109において、1〜3回目の検出データのうち2つの検出データが許容範囲内に入っているドットが存在していない場合には、検出条件(光電変換増幅率)を順次変えながら、ステップS105〜S109を繰り返す。このステップS105〜S109は、検出領域内の少なくとも1つのドットにおいて許容範囲内に入っている2つの検出データが得られるまで繰り返す。少なくとも1つのドットにおいて許容範囲内に入っている2つの検出データが得られたら、ステップS110〜S111によって、その2つの検出データから蛍光変化率を求め、全エリアの蛍光特性値を決定する。なお、ステップS105〜S111は、複数回繰り返される場合であっても、何回目の蛍光検出の検出データを取り扱うかという点のみが異なり、実質的には同じである。
【0045】
次に、前記した蛍光検出工程の前段階の処理の反応場となる生化学反応カートリッジ1について詳細に説明する。
【0046】
生化学反応カートリッジ1の本体(筐体)は、透明または半透明の合成樹脂から構成されている。図7に示すように、生化学反応カートリッジ1の上部の検体入口がゴムキャップ2により封止されている。生化学反応カートリッジ1の側面には複数のノズル入口3a〜3jが設けられ、ゴムキャップ3により封止されている。カートリッジ1の両側面とも同様の構成になっている。
【0047】
生化学反応カートリッジ1には、不揮発性の記憶部と通信部を有するICチップ25が設けられている。ICチップ25の記憶部には、生化学反応カートリッジ1を識別するための識別情報(ID)、生化学反応カートリッジ1の種別、処理工程の手順、生化学反応の結果を分析するための情報などが書き込まれている。
【0048】
図8は生化学反応カートリッジ1の平面断面図を示している。前記したように片側の側面には10個のノズル入口3a〜3jが設けられ、反対側の側面にも10個のノズル入口3k〜3tが設けられている。ノズル入口3a〜3jは流路4a〜4jを介してチャンバ5a〜5jに連通している。反対側のノズル入口3k,3l,3m,3o,3r,3tは、それぞれ流路4k,4l,4m,4o,4r,4tを介してチャンバ5k,5l,5m,5o,5r,5tに連通している。ノズル入口3n,3p,3q,3sはチャンバに連通しておらず予備になっており、使用されない。
【0049】
検体入口はチャンバ7に連通し、チャンバ7は流路6a,6b,6c,6kを介してチャンバ5a,5b,5c,5kに連通するとともに、流路10を介してチャンバ8に連通している。チャンバ8は流路6g,6oを介してチャンバ5g,5oに連通するとともに、流路11を介してチャンバ9に連通している。チャンバ9は流路6h,6i,6j,6r,6tを介してチャンバ5h,5i,5j,5r,5tに連通している。流路10は流路6d,6e,6f,6l,6mを介してチャンバ5d,5e,5f,5l,5mに連通している。
【0050】
チャンバ9の底面に設けられた角孔に、DNAチップ12が、プローブ面を上にして貼り付けられている。DNAチップ12は、1平方インチ(約645mm2)程度の大きさのガラス板の固相表面に、数十〜数十万種類の異なるDNAプローブ37が高密度に並べられたものである。本実施形態では、このDNAチップ12を用いて、検体中のDNAとハイブリダイゼーション反応を行わせることによって、一度に数多くの遺伝子を検査できる。これらのDNAプローブ37はマトリックス状に規則正しく並べられており、それぞれのDNAプローブ37のアドレス(何行・何列と示される位置)を、情報として容易に取り出すことができる。なお、検査の対象となる遺伝子としては、感染症ウィルス、細菌、疾患関連遺伝子、各個人の遺伝子多型等がある。
【0051】
ここで、本実施形態において検体の処理を行うための、各チャンバ5a〜5tのセッティングの一例を示す。チャンバ5aには、細胞壁を破壊するEDTA(エチレンジアミン四酢酸)を含む第1の溶血剤が、チャンバ5bには、界面活性剤等のタンパク質変性剤を含む第2の溶血剤がそれぞれ収容されている。チャンバ5cには、DNAが吸着するシリカコーティングされた磁性体粒子が収容されている。チャンバ5l、チャンバ5mには、DNAの抽出の際にDNAの精製を行うために用いられる第1、第2の抽出洗浄剤がそれぞれ収容されている。
【0052】
チャンバ5dには、DNAを磁性体粒子から溶出する低濃度塩のバッファからなる溶出液が収容されている。チャンバ5gには、PCRに必要な薬剤、すなわち、プライマ、ポリメラーゼ、dNTP溶液、バッファ、蛍光剤を含むCy3−dUTP(アマシャム バイオサイエンス株式会社製の蛍光標識)等の混合液が収容されている。チャンバ5h,5jには、ハイブリダイゼーションしなかった蛍光物質(蛍光標識)付きの検体DNAと蛍光物質(蛍光標識)とを洗浄するための界面活性剤を含む洗浄剤が収容されている。チャンバ5iには、DNAチップ12を含むチャンバ9内を乾燥させるためのアルコールが収容されている。
【0053】
なお、チャンバ5eは血液のDNA以外の塵埃を溜めるためのチャンバである。チャンバ5fは、チャンバ5l,5mからの第1、第2の抽出洗浄剤の廃液を溜めるためのチャンバである。チャンバ5rは第1、第2の洗浄剤の廃液を溜めるためのチャンバである。チャンバ5k,5o,5tは、溶液がノズル入口に流れ込まないようにするために設けられたブランクのチャンバである。
【0054】
本実施形態では、この生化学反応カートリッジ1に血液等の液体状の検体を注入して、前記した処理装置(図1参照)にセットする。そして、生化学反応カートリッジ1の内部で、DNA等の抽出および増幅を行わせ、増幅された検体DNAと生化学反応カートリッジ1の内部にあるDNAチップ12のDNAプローブ37との間で、ハイブリダイゼーションを行わせる。一方、ハイブリダイゼーションしなかった蛍光物質(蛍光標識)付きの検体DNAと蛍光物質(蛍光標識)の洗浄を行うことができる。
【0055】
このような処理装置および生化学反応カートリッジ1を用いて、本実施形態において検体の生化学反応を生化学反応カートリッジ1内にて生じさせる方法について具体的に説明する。
【0056】
まず、検査者が、図示しない注射器等を用いて、血液を検体入口からチャンバ7に注入する。その後に、検査者は生化学反応カートリッジ1をテーブル13上に置く。そして、ポンプブロック22,23を図1の矢印の方向に移動させると、ポンプノズル20,21が、生化学反応カートリッジ1の両側部のノズル入口3a〜3tに、ゴムキャップ3を貫通して挿入される。
【0057】
検査者が、入力部24から実験開始の命令を入力すると処理が始まる。図9は生化学反応およびその後処理の手順を説明するフローチャートである。
【0058】
まず、ステップS1で、制御部17が、ポンプノズル20,21を制御してノズル入口3a,3kのみを開にし、電動シリンジポンプ18から空気を噴出し、電動シリンジポンプ19から空気を吸引する。それによって、チャンバ5a内の第1の溶血剤を、血液の入ったチャンバ7に流し込む。この様子が、チャンバ5a,7,5kを通る断面図である図10に示されている。
【0059】
本実施形態では、空気の供給および吸引のタイミングをずらすことによって各チャンバへの加圧および減圧を制御して、カートリッジ1内を、溶液を円滑に流すことができる。また、ノズル入口3a,3oのみを開にして、電動シリンジポンプ18,19によって空気の噴出および吸引を交互に繰り返して、チャンバ7の溶液を流路10に流し、その後に戻す動作を繰り返して攪拌を行う。あるいは、電動シリンジポンプ19から空気を連続して噴出することによって、気泡を発生させながら攪拌を行う。
【0060】
次に、ステップS2において、ノズル入口3b,3kのみを開にして、ステップS1と同様の原理でチャンバ5b内の第2の溶血剤をチャンバ7に流し込む。そして、ステップS1と同様の攪拌を行う。
【0061】
さらに、ステップS3において、ノズル入口3c,3kのみを開にして、ステップS1,S2と同様の原理でチャンバ5c内の磁性体粒子をチャンバ7に流し込む。そして、ステップS1と同様の攪拌を行う。このステップS3によって、ステップS1,S2において細胞が溶解して得られたDNAが磁性体粒子に付着する。
【0062】
そして、ステップS4で電磁石14をオンにし、ノズル入口3e,3kのみを開にし、電動シリンジポンプ19から空気を噴出し、電動シリンジポンプ18から空気を吸引して、チャンバ7内の溶液をチャンバ5eに移動させる。この移動の際に、磁性体粒子およびDNAを、流路10の電磁石14の上方位置で捕捉する。
【0063】
このように、ステップS1〜S4にて、幅1〜2mm程度で高さ0.2〜1mm程度の小さい流路10上で、流動状態のDNAを、磁性体粒子を利用して極めて効率良く捕捉する。なお、仮に、捕捉ターゲット物質がDNAではなく、RNAまたはタンパク質の場合にも同様に効率の良い捕捉が行える。
【0064】
次に、ステップS5において電磁石14をオフにし、ノズル入口3f,3lのみを開とする。そして、電動シリンジポンプ19から空気を噴出し、電動シリンジポンプ18から空気を吸引して、チャンバ5l内の第1の抽出洗浄液をチャンバ5fに移動させる。この際に、ステップS4で捕捉された磁性体粒子およびDNAが、抽出洗浄液と共に移動して洗浄が行われる。さらに、電磁石14をオンにして、ステップS4と同様の原理で磁性体粒子およびDNAと抽出洗浄液とをチャンバ5l内とチャンバ5fの間を2回往復させる。それによって、洗浄された磁性体粒子およびDNAを流路10の電磁石14の上方位置に回収し、第1の抽出洗浄液をチャンバ5lに戻す。
【0065】
ステップS6において、ノズル入口3f,3mのみを開いてステップS5と同様の工程を行う。すなわち、チャンバ5m内の第2の抽出洗浄液と、磁性体粒子およびDNAとを移動させて、磁性体粒子およびDNAをさらに洗浄してから電磁石14の上方位置に回収し、第2の抽出洗浄液をチャンバ5mに戻す。
【0066】
続いて、ステップS7において電磁石14をオンにしたまま、ノズル入口3d,3oのみを開にし、電動シリンジポンプ18から空気を噴出し、電動シリンジポンプ19から空気を吸引する。それによって、チャンバ5d内の溶出液をチャンバ8に移動させる。この溶出液の作用によって、磁性体粒子とDNAが分離し、DNAのみが溶出液とともにチャンバ8に移動し、磁性体粒子は流路10内に残る。
【0067】
このステップS7において、DNAの抽出および精製が行われる。本実施形態では、抽出洗浄液を収容するチャンバ5l,5mと、洗浄後の廃液を溜めるためのチャンバ5fが用意されているので、カートリッジ1内でDNAの抽出および精製を行うことが可能である。
【0068】
次に、ステップS8において、ノズル入口3g,3oのみを開にし、電動シリンジポンプ18から空気を噴出し、電動シリンジポンプ19から空気を吸引する。それによって、チャンバ5g内の前記したPCR用薬剤をチャンバ8に流し込む。さらに、ノズル入口3g,3tのみを開にし、電動シリンジポンプ18,19による空気の噴出および吸引を交互に繰り返し、チャンバ8の溶液の攪拌を行う。そして、ペルチェ素子15を制御して、チャンバ8内の溶液を96℃の温度に10分保持した後に、96℃・10秒、55℃・10秒、72℃・1分のサイクルを30回繰り返してPCRを行い、溶出されたDNAを増幅する。
【0069】
ステップS9でノズル入口3g,3tのみを開にし、電動シリンジポンプ18から空気を噴出し、電動シリンジポンプ19から空気を吸引して、チャンバ8内の溶液をチャンバ9に移動させる。さらに、ペルチェ素子16を制御して、チャンバ9内の溶液を45℃で2時間保持し、ハイブリダイゼーションを行わせる。この時、電動シリンジポンプ18,19による空気の噴出および吸引を交互に繰り返して、チャンバ9内の溶液の攪拌を行いながら、ハイブリダイゼーションを進める。このように、本実施形態では、チャンバ9がハイブリダイゼーションの反応場になっている。
【0070】
次にステップS10において、同じく45℃に保持したまま、今度はノズル入口3h、3rのみを開にし、電動シリンジポンプ18から空気を噴出し、電動シリンジポンプ19から空気を吸引する。それによって、チャンバ9内の溶液をチャンバ5rに移動させるとともに、チャンバ5h内の第1の洗浄液を、チャンバ9を通してチャンバ5rに流し込む。このように、ノズル入口3hにポンプノズル20を挿入し空気を噴出して加圧し、ノズル入口3rにポンプノズル21を挿入し空気を吸引して減圧することによって、チャンバ5h内の第1の洗浄液が、チャンバ9を通してチャンバ5r内に流れ込む。この様子が、チャンバ5h,9,5rを通る断面図である図11に示されている。電動シリンジポンプ18,19の吸引および噴出を交互に繰り返して、この溶液をチャンバ5h,9,5rの間を2回往復させ、最後にチャンバ5hに戻す。このようにして、ハイブリダイゼーションしなかった蛍光標識付きの検体DNAと蛍光標識とが洗浄される。
【0071】
さらに、ステップS11において、同じく45℃に保持したまま、ノズル入口3j、3rのみを開いて、ステップS10と同様の工程を行う。すなわち、チャンバ5j内の第2の洗浄液をチャンバ9を通してチャンバ5rに流し込んでDNAの洗浄をさらに行い、最後に溶液をチャンバ5jに戻す。
【0072】
本実施形態では、第1、第2の洗浄液を収容するチャンバ5h,5jと、洗浄後の廃液を溜めるためのチャンバ5rが用意されているので、前記の通り生化学反応カートリッジ1内でDNAチップ12の洗浄を行うことが可能である。
【0073】
ステップS12で、ノズル入口3i,3rのみを開にし、電動シリンジポンプ18から空気を噴出し、電動シリンジポンプ19から空気を吸引して、チャンバ5i内のアルコールを、チャンバ9を通してチャンバ5rに移動させる。その後に、ノズル入口3i,3tのみを開にし、電動シリンジポンプ18から空気を噴出し、電動シリンジポンプ19から空気を吸引してチャンバ9内を乾燥させる。
【0074】
以上述べたステップS1〜S12によって、検体の生化学反応(例えばDNAのハイブリダイゼーション)を生化学反応カートリッジ1内で行わせることができる。
【0075】
詳述しないが、前記した各ステップS1〜S12が完了する度に、第1の通信部26からICチップ25の通信部(図示せず)に向けて、その都度、信号を送信している。この信号は、各ステップの完了と、その工程の各種条件と、終了時刻とを表すものであり、ICチップ25の記憶部(図示せず)に記憶される。
【0076】
以上説明した処理工程(ステップS1〜S12)の後に、ステップS13において、ポンプブロック22,23を生化学反応カートリッジ1から離れる方向に移動させる。それによって、ポンプノズル20,21が生化学反応カートリッジ1のノズル入口3a〜3tから外れる。そして、ステップS14において、カートリッジ搬送部27(図1参照)を用いて、生化学反応カートリッジ1をテーブル13から検出部28に搬送する。ステップS15において、DNAチップ12に捕捉された、ハイブリダイゼーションされたDNAを蛍光検出ユニット30によって検出する。検出結果は、第2の通信部31から、ICチップ25の通信部(図示せず)に向けて送信され、ICチップ25の記憶部(図示せず)に記憶される。こうして、ステップS1〜S12の各工程の(時間経過を含む)推移および各種条件と、その各工程を経たDNAチップ12の検出結果とが、生化学反応カートリッジ1のICチップ25に記憶される。この蛍光検出工程(ステップS15)の詳細については、前述したステップS101〜S111(図3参照)の通りである。
【0077】
この蛍光検出工程が終わった後、ステップS16において、制御部17が、蛍光検出したパターンを分析する。なお、生化学反応カートリッジ1が、予め処理装置に記憶されていない種別である場合には、検出パターンの分析にあたって、ICチップ25に書き込まれている分析用情報を読み込み、その分析用情報に基づいて分析を行う。
【0078】
ここで、本実施形態における蛍光検出と分析の原理について説明する。例えば、生化学反応カートリッジ1およびDNAチップ12が感染症検出用のものである場合には、DNAプローブ37の設定の仕方によって、いくつかの感染症が一度に検出できる。DNAプローブ37が5×5のマトリックス状に配置されたDNAチップ12を例にとって考えると、感染症A〜Eがそれぞれ単独で検出されたときのパターンが図12(a)〜(e)に示す5通りとなるように設定できる。なお、図12(a)〜(e)において、黒丸は、ターゲットがDNAプローブ37とハイブリダイゼーションして捕捉されており、ターゲットに付着した蛍光物質(蛍光標識)が蛍光を発している状態を示す。一方、白丸は、ターゲットがDNAプローブ37とハイブリダイゼーションせず捕捉されずに、蛍光標識が存在しない状態を示している。
【0079】
図12(a)〜(e)に示す例では、同一列に含まれるDNAプローブ37は全て、同じ感染症に感染したときに存在するDNAとハイブリダイゼーションするように設定されている。そして、各列毎に異なる感染症のDNAに対応するように設定されている。従って、図12(a)のパターンの検出結果が得られた場合には、感染症Aへの感染が認められ、同様に、図12(b)〜(e)のパターンの検出結果が得られた場合には、それぞれ感染症B〜Eへの感染が認められる。このような検出パターンに基づく感染判断方法は、制御部17に予め記憶されている分析用情報に含まれている。
【0080】
このように、蛍光物質が付着したDNAプローブ37の配列パターンに基づいて、目的とする検体分析を精度良く行うためには、ステップS15において、蛍光検出を精度良く行うことが重要である。
【0081】
[第2の実施形態]
次に、本発明の第2の実施形態について説明する。第1の実施形態と実質的に同一の構成および同一のステップについては、同一の符号を付与して説明を省略する。また、以下の説明では、主に第1の実施形態と相違する点についてのみ述べており、第1の実施形態と同じ内容(例えば生化学反応分析装置全体の構成や生化学カートリッジの構成や処理工程等)については説明を繰り返さない。
【0082】
本実施形態では、図13に示す蛍光検出ユニット40の蛍光検出部46のCMOSエリアセンサが、一定の光電変換増幅率で電荷を電圧に変換する。すなわち、蛍光検出時の検出条件の1つである光電変換増幅率は一定である。その代わり、他の検出条件であるレーザ光発生器48の作動時間が変えられる。レーザ光発生器48の作動時間は、レーザ光のDNAチップ12への照射時間であり、光電変換継続時間であると言える。
【0083】
本実施形態では、図14に示すように、ステップS201において、レーザ光発生器48を作動させ、レーザ光を生化学反応カートリッジ1のDNAチップ12に照射し、励起された蛍光を蛍光検出部46のCMOSエリアセンサにて受光する。このレーザ光の照射時間、すなわちレーザ光発生器48の作動時間をL1とする。ステップS103において、CMOSエリアセンサに蓄積された電荷を増幅したアナログ電圧値をAD変換したデジタル値を、「検出データ(輝度データ)」としてメモリに記憶する。さらに、ステップS104において、各エリアの検出データ(デジタル値)の集合から、蛍光を発するドットの位置を導き出す。そして、全エリアの検出データの集合を、1回目の検出データの集合としてメモリに記憶する。
【0084】
次に、ステップS202において、レーザ光発生器48を再び作動させ、レーザ光をDNAチップ12に照射し、蛍光を蛍光検出部46のCMOSエリアセンサにて受光する。この時、レーザ光の照射時間、すなわちレーザ光発生器48の作動時間を、ステップS201における作動時間L1よりも短いL2にする。その後、前記したのと同様に、ステップS107において検出データをメモリに記憶し、ステップS108において、各エリアの検出データの集合から、蛍光を発するドットの位置を導き出す。そして、全エリアの検出データの集合を、2回目の検出データの集合として記憶する。光電変換継続時間が変わっているため、当然、1回目の検出データと2回目の検出データは異なるものである。
【0085】
そして、ステップS109において、1回目の検出データの集合と2回目の検出データの集合を許容範囲と比較する。DNAチップ12の検出領域内に、1回目と2回目の両方の検出データがいずれも許容範囲内に入っているドット(例えば図15のドットB)が存在するか否かを確認する。
【0086】
ステップS109において、2回の蛍光検出の検出データがいずれも許容範囲内に入っているドット(ドットB)が存在すると確認された場合には、ステップS203において、制御部17が蛍光変化率(蛍光褪色率)Tを算出する。
T={B2×(L1÷L2)}÷B1
ここで、ドットBの1回目の検出データがB1、2回目の検出データがB2である。
【0087】
続いて、ステップS204において、制御部17が各ドットの輝度値(蛍光特性値)を決定する。1回目の蛍光検出時の検出データが、許容範囲内であったドット(例えばドットAおよびドットB)に関しては、1回目の検出データをそのままドットの輝度値として決定する。一方、1回目の蛍光検出時の検出データが許容範囲の上限値より大きく2回目の蛍光検出時の検出データが許容範囲の上限値以下であったドット(例えばドットC)に関しては、次の計算式で輝度値Kを決定する。
K={(C2×(L1÷L2)}÷T
C2は、ドットCにおける2回目の蛍光検出時の検出データである。
【0088】
このように、1回目の蛍光検出時の検出データが許容範囲外であったドットCの輝度値は、2回目の蛍光検出時の検出データを、ドットBの2つの検出データに基づいて算出された蛍光褪色率を用いて補正することによって決定される。
【0089】
なお、前記した条件に当てはまらないドット、例えば、2回の蛍光検出時の輝度データがいずれも許容範囲外であったドットは、輝度値不明のドットとみなす。
【0090】
このようにしてDNAチップ12の各ドットの輝度値(蛍光特性値)をそれぞれ決定する。
【0091】
ステップS109において、2回の蛍光検出の検出データがいずれも許容範囲内に入っているドットが存在しないと確認された場合(図16参照)には、レーザ光発生器48の作動時間を変えて、レーザ光の照射および蛍光の受光を繰り返す。すなわち、ステップS202において、レーザ光の照射時間、すなわちレーザ光発生器48の作動時間を変更する。作動時間をさらに短くするか長くするかは、2回の蛍光検出時の検出データが概ね許容範囲の上限値よりも高かったか、下限値よりも低かったかに基づいて決めればよい。
【0092】
このように、ステップS202において、変更された作動時間だけレーザ光発生器38を作動させ、蛍光をCMOSエリアセンサにより受光し、CMOSエリアセンサの各エリアで電荷を蓄積する。そして、前記したのと同様に、ステップS107において、電荷を増幅しデジタル値(検出データ)に変換してメモリに記憶する。さらに、ステップS108において、全エリアの検出データの集合を求め、3回目の検出データの集合として記憶する。
【0093】
それから、ステップS109において、1〜3回目の検出データの集合を、制御部17に記憶されている許容範囲と比較し、1〜3回目の検出データのうち2つの検出データが許容範囲内に入っているドットが存在するか否かを確認する。そのようなドットが存在する場合には、レーザ光の照射はそれ以上繰り返さず、それらの2回の検出データの集合に基づいてDNAチップ12の蛍光特性値(輝度値)を決定する。例えば、図17に示す例では、ドットBとドットCにおいて2回目の検出データと3回目の検出データがいずれも許容範囲内に入っている。従って、2回目の検出データの集合と3回目の検出データの集合に基づいて、蛍光変化率(蛍光褪色率)を求め、全エリアの輝度値(蛍光特性値)を決定する。これらのステップS203〜S204は前記したのと実質的に同じであるから、説明は省略する。
【0094】
ステップS109において、1〜3回目の検出データのうち2つの検出データが許容範囲内に入っているドットが存在していない場合には、検出条件(レーザ光発生器48の作動時間)を順次変えながら、ステップS105〜S109を繰り返す。このステップS105〜S109は、検出領域内の少なくとも1つのドットにおいて許容範囲内に入っている2つの検出データが得られるまで繰り返す。少なくとも1つのドットにおいて許容範囲内に入っている2つの検出データが得られたら、ステップS203〜S204によって、その2つの検出データから蛍光変化率を求め、全エリアの蛍光特性値を決定する。なお、ステップS202からS204までは、複数回繰り返される場合であっても、何回目の蛍光検出の検出データを取り扱うかという点のみが異なり、実質的には同じである。
【0095】
[第3の実施形態]
図示しないが、本発明の第3の実施形態では、CMOSエリアセンサの光電変換増幅率およびレーザ光発生器の作動時間は一定である。そして、レーザ光発生器から照射される励起光であるレーザ光の強度、すなわちレーザ光発生器の出力パワーを、蛍光検出の度に変更可能である。すなわち、1回目の蛍光検出時のレーザ光の強度(レーザ光発生器の出力パワー)と異なる強度のレーザ光で、2回目の蛍光検出を行う。そして、2回の蛍光検出時の検出データがいずれも許容範囲内であるドットの有無を調べる。第1および第2の実施形態と同様に、そのようなドットが存在した場合には、両検出データから蛍光変化率(蛍光褪色率)を求め、全エリアの輝度値(蛍光特性値)を決定する。そのようなドットが存在しない場合には、検出領域内の少なくとも1つのドットにおいて許容範囲内に入っている2つの検出データが得られるまで、レーザ光の強度をその都度変えながら蛍光検出を繰り返す。その他の具体的な構成およびステップは、第1および第2の実施形態と同様であるため説明を省略する。
【0096】
[第4の実施形態]
図示しないが、本発明の第4の実施形態では、CMOSエリアセンサの光電変換増幅率、レーザ光発生器の作動時間、レーザ光の強度(レーザ光発生器の出力パワー)は一定である。そして、蛍光フィルタによる蛍光透過率を、蛍光検出の度に変更可能である。例えば、蛍光透過率が異なる複数の蛍光フィルタを、DNAチップ12からの蛍光の光路内に選択的に挿入可能な構成にしておき、1回目の蛍光検出時と2回目の蛍光検出時で異なる蛍光フィルタを用いる。それによって、1回目の蛍光検出時の蛍光透過率と異なる蛍光透過率で、2回目の蛍光検出を行う。そして、2回の蛍光検出時の検出データがいずれも許容範囲内であるドットの有無を調べる。第1および第2の実施形態と同様に、そのようなドットが存在した場合には、両検出データから蛍光変化率(蛍光褪色率)を求め、全エリアの輝度値(蛍光特性値)を決定する。そのようなドットが存在しない場合には、検出領域内の少なくとも1つのドットにおいて許容範囲内に入っている2つの検出データが得られるまで、蛍光透過率をその都度変えながら蛍光検出を繰り返す。その他の具体的な構成およびステップは、第1〜3の実施形態と同様であるため説明を省略する。
【0097】
[第5の実施形態]
図示しないが、本発明の第5の実施形態では、CMOSエリアセンサの光電変換増幅率、レーザ光発生器の作動時間、レーザ光の強度(レーザ光発生器の出力パワー)、蛍光フィルタの蛍光透過率は一定である。そして、CMOSエリアセンサの光電変換増幅における零レベルのオフセットを、蛍光検出の度に変更可能である。すなわち、CMOSエリアセンサの光電変換時の増幅率自体は一定であるが、その増幅の基準となる零レベルが変えられることにより、検出データに違いが生じる。そこで、1回目の蛍光検出時の光電変換増幅の零レベルと異なる零レベルにて、2回目の蛍光検出を行う。そして、2回の蛍光検出時の検出データがいずれも許容範囲内であるドットの有無を調べる。第1および第2の実施形態と同様に、そのようなドットが存在した場合には、両検出データから蛍光変化率(蛍光褪色率)を求め、全エリアの輝度値(蛍光特性値)を決定する。そのようなドットが存在しない場合には、検出領域内の少なくとも1つのドットにおいて許容範囲内に入っている2つの検出データが得られるまで、光電変換増幅における零レベルをその都度変えながら蛍光検出を繰り返す。その他の具体的な構成およびステップは、第1〜4の実施形態と同様であるため説明を省略する。
【0098】
以上説明した通り、本発明によると、蛍光検出とそれを利用した生化学反応分析が、信頼性高く行えるようになる。
【0099】
従来は、蛍光検出時の検出データが、蛍光検出およびそれに付随する分析を行える許容範囲を外れていた場合には、蛍光検出およびそれに付随する分析が行えない場合があった。1回の蛍光検出で対象物の検出領域内の全エリアにおいて許容範囲内の検出データが得られるように検出条件を設定することは至難の業であった。特に、1つの対象物中に高輝度の部分と低輝度の部分が混在している場合には、対象物の全域に亘って蛍光特性値を求めることが非常に困難であった。
【0100】
これに対し、本発明では、少なくとも2回の蛍光検出のデータを利用しており、少なくとも1つの検出条件が違う状態で少なくとも2回の蛍光検出を行う。そして、2つの検出データがいずれも許容範囲内に入っている箇所(ドット)が、検出領域内の全エリアの中に1つでもあれば、そのドットの2つの検出データによって、蛍光変化率(例えば蛍光褪色率)を導き出す。この蛍光変化率を補正データとして利用して、他の箇所の検出データを補正することによって、各エリアの蛍光特性値を決定する。仮に、2回の蛍光検出では2つの検出データがいずれも許容範囲内に入っている箇所(ドット)が存在しない場合には、そのようなドットが見つかるまで、検出条件をその都度変えながら蛍光検出を繰り返せばよい。
【0101】
このように、本発明によると、蛍光変化率を算出できるように、2つの検出データがいずれも許容範囲内に入っている箇所(ドット)が見つかるまで、検出条件をその都度変えながら蛍光検出を繰り返す。そして、この蛍光変化率を補正データとして用いて蛍光特性値を求める。従って、様々な対象物に関して、ほぼ確実に蛍光特性値を求めることができ、従来のように対象物の種類によっては蛍光特性値が容易に求められないという事態を、ほとんどなくすことができる。言い換えると、1度の蛍光検出ではカバーできない輝度のダイナミックレンジの広い対象物に対しても、容易に蛍光検出可能である。
【0102】
ただし、この蛍光検出および生化学分析が、感染症の判定や各種がんの判定等の用途に用いられる場合には、その対象物の輝度の許容範囲は予め予測できる。したがって、予測される許容範囲を生化学反応カートリッジ1のICチップ25に記憶させておくことができる。その場合、本発明の蛍光検出装置において、ICチップ25に記憶されている許容範囲に応じた検出条件の設定を行うことができれば、蛍光検出を複数回ではなく1回のみ行うだけで済むこともある。
【図面の簡単な説明】
【0103】
【図1】本発明の第1の実施形態の生化学反応分析装置の構成を示すブロック図である。
【図2】図1に示す生化学反応分析装置の蛍光検出装置の要部を示す概略側面図である。
【図3】図2に示す蛍光検出装置の蛍光検出工程を示すフローチャートである。
【図4】図3に示す蛍光検出工程の、3つのドットにおける1回目の検出データと2回目の検出データの一例を示すグラフである。
【図5】図3に示す蛍光検出工程の、3つのドットにおける1回目の検出データと2回目の検出データの他の例を示すグラフである。
【図6】図5に示す3つのドットにおける2回目の検出データと3回目の検出データの一例を示すグラフである。
【図7】図1に示す生化学反応分析装置の生化学反応カートリッジの斜視図である。
【図8】図7に示す生化学反応カートリッジの平面断面図である。
【図9】図1に示す生化学反応分析装置における処理工程を示すフローチャートである。
【図10】図7,8に示す生化学反応カートリッジのチャンバの一部を通る縦断面図である。
【図11】図7,8に示す生化学反応カートリッジの他のチャンバを通る縦断面図である。
【図12】(a)〜(e)は、DNAチップの蛍光検出パターンの例を示す模式図である。
【図13】図1に示す生化学反応分析装置の蛍光検出装置の他の例を示す概略側面図である。
【図14】図13に示す蛍光検出装置の蛍光検出工程を示すフローチャートである。
【図15】図13に示す蛍光検出工程の、3つのドットにおける1回目の検出データと2回目の検出データの一例を示すグラフである。
【図16】図13に示す蛍光検出工程の、3つのドットにおける1回目の検出データと2回目の検出データの他の例を示すグラフである。
【図17】図16に示す3つのドットにおける2回目の検出データと3回目の検出データの一例を示すグラフである。
【符号の説明】
【0104】
1 生化学反応カートリッジ
12 DNAチップ(対象物)
17 制御部(蛍光検出装置)
30,40 蛍光検出ユニット(蛍光検出装置)
38,48 レーザ光発生器(励起光発生部)
36,46 蛍光検出部
【技術分野】
【0001】
本発明は、例えば、検体中の細胞、微生物、染色体、核酸等のサンプルを抗原抗体反応や核酸ハイブリダイゼーション反応等の生化学反応を利用して検出するための蛍光検出装置および生化学反応分析装置と蛍光検出方法に関する。
【背景技術】
【0002】
血液等の検体を分析する分析装置には、抗原抗体反応を利用した免疫学的な方法や、核酸ハイブリダイゼーションを利用する方法がある。免疫学的な方法の一例では、被検出物質と特異的に結合する抗体または抗原等のタンパク質をプローブとして用いる。プローブを微粒子、ビーズ、またはガラス板等の固相表面に固定して、検体中の被検出物質との抗原抗体反応を行わせる。核酸ハイブリダイゼーションを利用する方法の一例では、一本鎖の核酸をプローブとして用い、微粒子、ビーズ、ガラス板等の固相表面に固定して、検体中の被検出物質と核酸ハイブリダイゼーションを行わせる。これらの方法は、酵素、蛍光物質、または発光性物質等の、検知感度の高い標識物質を担持した特異的な相互作用を有する標識化物質である標識化抗体、標識化抗原、または標識化核酸等を用いる。そして、抗原抗体化合物またはハイブリダイズされた二本鎖の核酸を検出して、被検出物質(ターゲット)の有無の検出やその定量を行う。
【0003】
これらの技術を発展させたものとして、例えば特許文献1には、互いに異なる塩基配列を有する多数のDNA(デオキシリボ核酸)プローブを、基板上にアレイ状に並べた、いわゆるDNAアレイが開示されている。
【0004】
また、非特許文献1には、多種類のタンパク質をメンブレンフィルタ上に並べ、DNAアレイと同様な構成のタンパク質アレイを作製する方法が開示されている。このように、DNAアレイやタンパク質アレイ等を用いることによって、極めて多数の項目の検査を一度に行うことが可能になってきている。
【0005】
また、様々な検体分析における、検体による汚染の軽減、反応の効率化、装置の小型化、作業の簡便化等の目的で、内部で生化学反応を行わせる使い捨て可能な生化学反応カートリッジが提案されている。例えば、特許文献2においては、DNAアレイを含む生化学反応カートリッジ内に複数のチャンバを配設する構成が開示されている。この生化学反応カートリッジによると、圧力差を利用して溶液を各チャンバへ移動させることにより検体中のDNAの抽出、増幅、またはハイブリダイゼーション等の反応を内部で行わせることが可能である。
【0006】
そして、このような生化学反応カートリッジ内に外部から溶液を注入する方法としては、外部の電動シリンジポンプや真空ポンプを利用する方法がある。また、生化学反応カートリッジ内部で溶液を移動する方法としては、圧力差以外にも、重力や毛細管現象や電気泳動を利用する方法が知られている。さらに、生化学反応カートリッジの内部に配設できる小型のマイクロポンプとして、特許文献2にはダイアフラムポンプ、特許文献3には発熱素子を利用したポンプ、特許文献4には圧電素子を利用したポンプがそれぞれ開示されている。
【0007】
生化学反応カートリッジとして、またはその一部として用いられるDNAチップに、情報記憶用のICを設け、このICに記憶された同定情報を利用してDNAの同定を行う構成がある。具体的には、特許文献5に、DNAチップの塩基配列情報や検体の情報を情報記憶用ICに書き込むことが開示されている。
【0008】
また、DNAチップ上のサンプルのハイブリダイゼーション状態を検知するために、サンプルに付着した蛍光物質(蛍光標識)を読み取る方法がある。具体的には、特許文献6に、蛍光物質を読み取ってターゲットの検出を行うために、蛍光を発生させるようにDNAチップに照射する励起光を適宜に較正する方法が開示されている。
【0009】
さらに、特許文献7には、生化学解析用カセットに化学発光基質を2度に分けて投入することで2回の化学発光を生じさせ、それらの化学発光によるそれぞれの輝度データを求める方法が開示されている。特許文献7では、こうして求めた2つの輝度データを比較することでダイナミックレンジを広げることができる。
【特許文献1】米国特許第5445934号明細書
【特許文献2】特表平11−509094号公報
【特許文献3】特許第2832117号明細書
【特許文献4】特開2000−274375号公報
【特許文献5】特開2001−147231号公報
【特許文献6】特表2002−538427号公報
【特許文献7】特許第3710752号明細書
【非特許文献1】アンジェリカ ロイキング(Angelika Lueking)他5名、「プロテイン マイクロアレイズ フォー ジーン エクスプレッション アンド アンチボディ スクリーニング(Protein Microarrays for Gene Expression and Antibody Screening)」、アナリティカル バイオケミストリー(Analytical Biochemistry) Vol.270(1)、アカデミック プレス(Academic Press)、1999年5月15日、p.103〜111
【発明の開示】
【発明が解決しようとする課題】
【0010】
生化学反応を生じさせるために様々な溶液を内蔵し、検体が供給される生化学反応カートリッジは、二次感染や汚染の防止と、使い勝手の観点から、使い捨てにすることが好ましい。しかし、マイクロポンプを内蔵した生化学反応カートリッジは高価であるという問題がある。したがって、ポンプを内蔵せずに外部のポンプの作用で溶液を移動し、検体注入後は溶液を外部に流出させずに一連の生化学反応を進められる構造の、使い捨ての生化学反応カートリッジが一般に利用されている。
【0011】
個々のDNAチップは、ハイブリダイゼーションという単独の生化学反応のみを行うためのものである。しかし、DNAチップを内蔵する生化学反応カートリッジは、各種の生化学反応を連続的に行い、最後に検出工程を行う場合がある。この検出工程は、例えばCMOSセンサやCCDセンサを含む蛍光検出部を用いて、標識物質が発する蛍光を検出している。しかし、これらの蛍光検出部は、検出して分析可能な蛍光の輝度のダイナミックレンジが狭く、場合によっては輝度の検出が正確にできないことがある。
【0012】
そこで本発明の目的は、検出して分析可能な蛍光の輝度のダイナミックレンジを広げることにより、使用可能な対象物の範囲を広げることができる蛍光検出装置および生化学反応分析装置と蛍光検出方法を提供することにある。
【課題を解決するための手段】
【0013】
本発明の蛍光検出装置は、対象物から発せられる蛍光を検出する蛍光検出部を含み、蛍光検出部による対象物に対する蛍光検出の際に、対象物の情報に基づいて検出条件が設定されるものである。
【0014】
本発明の、対象物から発せられる蛍光を検出する蛍光検出方法において、蛍光検出は対象物の検出領域の全域に対して行い、検出領域を分割した複数のエリアのそれぞれの検出データの集合を求めるものである。そして、対象物に対して、少なくとも1つの検出条件を変えて2回の蛍光検出を行い、検出領域内の全エリアの中に、2回の蛍光検出時の検出データがいずれも許容範囲内に入っているドットが存在するか否かを調べる。その2回の蛍光検出時の検出データがいずれも許容範囲内に入っているドットが存在する場合には、当該2回の蛍光検出時の検出データの集合に基づいて各エリアの蛍光特性値を決定する。その2回の蛍光検出時の検出データがいずれも許容範囲内に入っているドットが存在しない場合には、検出領域内の全エリアの中のいずれかのドットにおいて許容範囲内に入っている2つの検出データが得られるまで、検出条件をその都度変えて蛍光検出を繰り返す。そして、当該2つの検出データが得られた際のそれぞれの蛍光検出時の検出データの集合に基づいて各エリアの蛍光特性値を決定する。
【発明の効果】
【0015】
本発明によると、少なくとも1つの検出条件を変えながら複数回の蛍光検出を行って、それらの検出データに基づいて蛍光特性値を決定することができる。例えば、複数回の蛍光検出の結果、少なくとも1つのドットにおいて許容範囲内に入っている2つの検出データが得られれば、その2つの検出データに基づいて蛍光変化率を求めることができる。そして、その蛍光変化率に基づいて、他の位置の検出データを補正することによって、蛍光特性値を求めることができる。その結果、対象物の検出領域の各エリアの蛍光特性値を求める信頼性が高くなる。
【0016】
なお、本発明の蛍光検出装置では、対象物の情報に基づいて検出条件が設定可能なので、予め予測される許容範囲に合わせて適切な検出条件が設定できるならば、1回の蛍光検出で蛍光特性値を求めることも可能である。
【発明を実施するための最良の形態】
【0017】
以下、本発明の実施の形態について図面を参照して説明する。
【0018】
[第1の実施形態]
図1には、本発明の一実施形態における生化学反応分析装置が概略的に示されている。この生化学反応分析装置の処理装置は、本実施形態において反応場となるチャンバを含む生化学反応カートリッジ1(図7参照)が載置されるテーブル13を有している。テーブル13上には、電磁石14と、ペルチェ素子15,16と、第1の通信部26が配置され、これらは、処理装置全体を制御する制御部17に接続されている。電磁石14は、生化学反応カートリッジ1内に電磁力を作用させるものである。ペルチェ素子15,16は、生化学反応カートリッジ1の温度を制御するものである。具体的には、ペルチェ素子15は、後述するPCR(ポリメラーゼ連鎖反応)によるDNA増幅時に温度制御するためのものである。一方、ペルチェ素子16は、後述する、増幅した検体のDNAとDNAプローブ37とのハイブリダイゼーション時に温度制御するとともに、ハイブリダイゼーションしなかった検体DNAの洗浄時に温度制御するためのものである。第1の通信部26は、処理装置のデータを、後述する生化学反応カートリッジ1内のICチップ25(図7参照)に記憶させるために、ICチップ25に対して電力の送信や信号の送受信を行うものである。
【0019】
テーブル13の両側には、電動シリンジポンプ18,19と、これらのポンプ18,19によって空気を排出または吸引するための出入口であり、それぞれ10個ずつのポンプノズル20,21を有するポンプブロック22,23とが配置されている。電動シリンジポンプ18,19とポンプノズル20,21の間には、図示しない複数の電動切換バルブが配置されている。図示しない電動切換バルブとポンプ18,19は制御部17に接続されている。
【0020】
制御部17は検査者が入力を行う入力部24に接続されている。この制御部17は、ポンプノズル20,21を1個ずつ独立して開閉して電動シリンジポンプ18,19に対する接続および遮断を制御する。制御部17は、全てのポンプノズル20,21を同時に開閉するなどの制御を行うことができる。また、制御部17は、電磁石14およびペルチェ素子15,16を適宜に作動させることによって、生化学反応カートリッジ1内での生化学反応を実行させる。
【0021】
テーブル13およびポンプブロック22,23の外部に、検出部28が設けられている。この検出部28は、生化学反応カートリッジ1のDNAチップ12のハイブリダイゼーション状態を検知するため、すなわち蛍光物質を検出するために設けられている。このDNAチップ12が蛍光検出の対象物である。
【0022】
検出部28には、ステージ29と、蛍光検出ユニット30と、第2の通信部31が設けられており、これらも制御部17に接続されている。ここでは、蛍光検出ユニット30と、制御部17の少なくとも一部の機能部分(蛍光検出に関する機能部分)とを総称して、「蛍光検出装置」と言う。なお、本実施形態では、制御部17は蛍光検出以外の様々な動作の制御も行うものである。
【0023】
ステージ29は、生化学反応カートリッジ1を保持するものである。蛍光検出ユニット30の詳細な構成については後述するが、主に光学機器で構成され、蛍光体を励起させて発生させた蛍光の強度を検出データとして測定可能なものである。また、蛍光検出ユニット30は、励起光の強度を適宜に調整することもできる。第2の通信部31は、生化学反応カートリッジ1内のICチップ25に対して、電力の送信や信号の送受信を行うものである。
【0024】
さらに、制御部17の指令によって生化学反応カートリッジ1をテーブル13上から検出部28へ搬送するカートリッジ搬送部27が設けられ、制御部17に接続されている。
【0025】
次に、蛍光検出ユニット30の構成について、図2を参照して説明する。蛍光検出ユニット30は、主に、レーザ光発生器(励起光発生部)38と、エクスパンダ32と、ビームホモジナイザ33と、蛍光フィルタ34と、レンズ群35と、蛍光検出部36とを有している。
【0026】
レーザ光発生器38は、レーザ光(励起光)を照射して、生化学反応カートリッジ1のDNAチップ12に位置する検体中の蛍光物質を励起して蛍光を発生させるためのレーザ光源である。エクスパンダ32は、レーザ光発生器38からのレーザ光をDNAチップ12の測定領域の範囲に広げるものである。ビームホモジナイザ33は、エクスパンダ32によって広げられたレーザ光の強度を、全域にわたって一様にするものである。蛍光フィルタ34は、DNAチップ12からの蛍光を透過させるが、レーザ光のDNAチップ12による反射光を遮断するものである。レンズ群35は、DNAチップ12からの蛍光を蛍光検出部36に集光させる。蛍光検出部36は、レンズ群35により集光された光が入射され、その入射光を検出するものである。
【0027】
蛍光検出部36は、図示しないが、蛍光検出の対象物であるDNAチップ12の検出領域に対応する検出部を有するCMOSエリアセンサを含み、その検出部が2次元的に分割された各エリアごとに、入射された蛍光を光電変換して電荷として蓄積する。さらにCMOSエリアセンサは、電荷を電圧に変換する際の光電変換増幅率を、制御部17からの指示に従って変更することができる。すなわち、蛍光検出部36のCMOSエリアセンサは、蛍光検出の1つの検出条件である光電変換増幅率を、対象物の情報に基づいて設定および変更することができる条件設定機能を有している。ここで言う対象物の情報とは、例えば、ICチップに記憶されている情報、または、前回のスキャン(蛍光検出)時に求められた情報である。なお、CMOSセンサの代わりにCCDセンサを用いることもできる。
【0028】
蛍光検出部36は、図示しないが、AD変換部とメモリとをさらに有している。そして、蛍光検出に伴う電荷の蓄積終了時に、CMOSエリアセンサの各エリアの個々の電荷の増幅後の電圧値を、アナログ−デジタル変換した上で、蛍光輝度を表すデジタル値としてメモリに記憶する。このデジタル値(検出データ)は制御部17に転送され、2回目以降の蛍光検出における蛍光検出値とともに、制御部17による結果の算出に利用される。なお、ここで言う「検出データ」とは測定した数値そのものである。一方、後述する「蛍光特性値」とは、測定した検出データに基づき、その一部を加工するなどして、対象物の特性を表す指標として最終的に決定した数値を意味する。ここでは、「検出データ」も「蛍光特性値」も蛍光の輝度値で表される。
【0029】
次に、この蛍光検出ユニット30の動作について詳細に説明する。
【0030】
後述するが、本実施形態では、前段階の処理工程において、例えばDNAのハイブリダイゼーション反応などの生化学反応を生化学反応カートリッジ1内で行わせる。そして、本実施形態では、このような生化学反応の処理が行われた生化学反応カートリッジ1が、検査部28に搬送されて蛍光検出ユニット30により蛍光検出される。
【0031】
蛍光検出工程に先立って、生化学反応カートリッジ1のICチップ25から制御部17に情報が送られ、この生化学反応カートリッジ1の用途に基づいて予想される輝度の許容範囲が設定される。後述する蛍光検出工程において求められた検出データは、この許容範囲と適宜比較される。
【0032】
図3に示すフローチャートを参照して、蛍光検出工程についてより詳しく説明する。まず、ステップS101において、蛍光検出部36のCMOSエリアセンサの光電変換増幅率を高く設定する。そして、ステップS102において、レーザ光発生器38を作動させる。これにより、励起光であるレーザ光が、生化学反応カートリッジ1のDNAチップ12に照射される。すると、前段階の処理工程にて生化学反応カートリッジ1内でハイブリダイゼーション反応が起こることによりDNAチップ12内に捕捉された蛍光標識が、レーザ光に励起されて蛍光を発する。蛍光標識が発した蛍光は、蛍光フィルタ34とレンズ群35を通過して、蛍光検出部36のCMOSエリアセンサに到達する。そして、CMOSエリアセンサによって蛍光が光電変換されて電荷として蓄積される。この電荷の蓄積は、レーザ光発生器38が所定時間だけ作動させられた後に停止するまで継続する。こうしてCMOSエリアセンサの個々のエリアに蓄積された電荷はそれぞれ、ステップS101において高く設定された光電変換増幅率で増幅されたアナログ電圧値となる。さらに、ステップS103において、これらのアナログ電圧値はそれぞれ、AD変換部においてデジタル値に変換されてメモリに記憶される。便宜上、このデジタル値を「検出データ(輝度データ)」という。
【0033】
ステップS104において、蛍光検出部36のメモリに記憶された各エリア(対象物であるDNAチップ12を分割した複数のエリアの各々)の検出データ(デジタル値)の集合が、制御部17に転送される。制御部17は、画像処理によりDNAチップ12の検出領域のどこに蛍光を発するドットが存在するかを導き出す。そして、そのドットの中心付近のエリアの検出データの平均を算出し、それをそのエリアの検出データとする。全エリアについてこのようにしてそれぞれ決定された検出データの集合を、1回目の検出データの集合としてメモリに記憶する。
【0034】
次に、ステップS105において、蛍光検出部36のCMOSエリアセンサの光電変換増幅率を低く設定し直す。これが検出条件の変更である。そして、ステップS102〜104と同様に、ステップS106において、レーザ光発生器38を作動させ、レーザ光を生化学反応カートリッジ1のDNAチップ12に照射する。DNAチップ12内に捕捉された蛍光標識がレーザ光を受けて蛍光を発し、この蛍光が蛍光フィルタ34とレンズ群35を介してCMOSエリアセンサにより受光される。所定時間だけレーザ光発生器38が作動させられた後に停止させられ、その間にCMOSエリアセンサの各エリアに蓄積された電荷は、ステップS107において、低く設定された光電変換増幅率で増幅される。そして、アナログ電圧値からデジタル値(検出データ)に変換されメモリに記憶される。さらに、ステップS108において、メモリに記憶された各エリアのデジタル値(検出データ)の集合が制御部17に転送される。そして、DNAチップ12の検出領域内の蛍光を発するドットが求められ、そのドットの中心付近のエリアの検出データの平均を算出し、それをそのエリアの検出データとする。全エリアについてこのようにしてそれぞれ決定された検出データの集合を、2回目の検出データの集合としてメモリに記憶する。
【0035】
このようにして記憶された1回目の検出データの集合と2回目の検出データの集合を、ステップS109において、制御部17が、予め記憶されている許容範囲と比較する。すなわち、個々の検出データが、生化学反応分析用のデータとして使用できる許容範囲の下限値より大きく上限値より小さいか否かを判定する。1回目の検出データの集合と2回目の検出データの集合とを対比して、DNAチップ12の検出領域内に、1回目と2回目の両方の検出データがいずれも許容範囲内に入っているドット(例えば図4のドットB)が存在するか否かを確認する。そのようなドットが存在する場合には、レーザ光の照射はそれ以上繰り返さず、これらの2回の検出データ(輝度データ)の集合に基づいてDNAチップ12の蛍光特性値(輝度値)を以下の通り決定する。
【0036】
ステップS109において、2回の蛍光検出の検出データがいずれも許容範囲内に入っているドット(ドットB)が存在すると確認された場合には、ステップS110において、制御部17が蛍光変化率(蛍光褪色率)Tを算出する。
T={B2×(R1÷R2)}÷B1
ここで、ドットBの1回目の検出データがB1、2回目の検出データがB2、1回目の蛍光検出時の光電変換増幅率がR1、2回目の蛍光検出時の光電変換増幅率がR2である。
【0037】
続いて、ステップS111において、制御部17が各ドットの輝度値(蛍光特性値)を決定する。1回目の検出データが、許容範囲内であったドット(例えばドットAおよびドットB)に関しては、1回目の検出データをそのままドットの輝度値として決定する。一方、1回目の蛍光検出時の検出データが許容範囲の上限値より大きく2回目の蛍光検出時の検出データが許容範囲の上限値以下であったドット(例えばドットC)に関しては、次の計算式で輝度値Kを決定する。
K={(C2×(R1÷R2)}÷T
C2は、ドットCにおける2回目の蛍光検出時の検出データである。
【0038】
このように、1回目の検出データが許容範囲外であったドットCの輝度値は、2回目の検出データを、ドットBの2つの検出データに基づいて算出された蛍光褪色率を用いて補正することによって決定される。
【0039】
なお、前記した条件に当てはまらないドット、例えば、2回の蛍光検出時の輝度データがいずれも許容範囲外であったドットが存在する場合には、それは輝度値不明のドットとみなす。
【0040】
このようにしてDNAチップ12の各ドットの蛍光特性値(輝度値)をそれぞれ決定する。こうして決定された各エリアの蛍光特性値が、後述する生化学反応分析時に用いられる。
【0041】
ところで、ステップS109において、2回の蛍光検出の検出データがいずれも許容範囲内に入っているドットが存在しないと確認された場合(図5参照)には、検出条件を変えて、レーザ光の照射および蛍光の受光を繰り返す。すなわち、ステップS105において蛍光検出部36のCMOSエリアセンサの光電変換増幅率を変更する。なお、光電変換増幅率をさらに低くしてもよいが、高くしてもよい。これは、2回の蛍光検出時の検出データが概ね許容範囲の上限値よりも高かったか、あるいは下限値よりも低かったかに基づいて決めればよい。
【0042】
その後、前記したのと同様に、ステップS106において、レーザ光発生器38を作動させ、DNAチップ12内に捕捉された蛍光標識からの蛍光をCMOSエリアセンサにより受光する。その際のCMOSエリアセンサの各エリアに蓄積された電荷を、ステップS107において、新たな光電変換増幅率で増幅し、デジタル値(検出データ)に変換してメモリに記憶する。さらに、ステップS108において、全エリアの検出データの集合を求め、3回目の検出データの集合としてメモリに記憶する。
【0043】
それから、ステップS109において、1〜3回目の検出データの集合を、制御部17に記憶されている許容範囲と比較し、1〜3回目の検出データのうち2つの検出データが許容範囲内に入っているドットが存在するか否かを確認する。そのようなドットが存在する場合には、レーザ光の照射はそれ以上繰り返さず、それらの2回の検出データの集合に基づいてDNAチップ12の各エリアの蛍光特性値(輝度値)を決定する。例えば、図6に示す例では、ドットBとドットCにおいて2回目の検出データと3回目の検出データがいずれも許容範囲内に入っている。従って、2回目の検出データの集合と3回目の検出データの集合に基づいて、蛍光変化率(蛍光褪色率)を求め、全エリアの輝度値(蛍光特性値)をそれぞれ決定する。これらのステップS110〜S111は前記したのと実質的に同じであるから、説明は省略する。
【0044】
ステップS109において、1〜3回目の検出データのうち2つの検出データが許容範囲内に入っているドットが存在していない場合には、検出条件(光電変換増幅率)を順次変えながら、ステップS105〜S109を繰り返す。このステップS105〜S109は、検出領域内の少なくとも1つのドットにおいて許容範囲内に入っている2つの検出データが得られるまで繰り返す。少なくとも1つのドットにおいて許容範囲内に入っている2つの検出データが得られたら、ステップS110〜S111によって、その2つの検出データから蛍光変化率を求め、全エリアの蛍光特性値を決定する。なお、ステップS105〜S111は、複数回繰り返される場合であっても、何回目の蛍光検出の検出データを取り扱うかという点のみが異なり、実質的には同じである。
【0045】
次に、前記した蛍光検出工程の前段階の処理の反応場となる生化学反応カートリッジ1について詳細に説明する。
【0046】
生化学反応カートリッジ1の本体(筐体)は、透明または半透明の合成樹脂から構成されている。図7に示すように、生化学反応カートリッジ1の上部の検体入口がゴムキャップ2により封止されている。生化学反応カートリッジ1の側面には複数のノズル入口3a〜3jが設けられ、ゴムキャップ3により封止されている。カートリッジ1の両側面とも同様の構成になっている。
【0047】
生化学反応カートリッジ1には、不揮発性の記憶部と通信部を有するICチップ25が設けられている。ICチップ25の記憶部には、生化学反応カートリッジ1を識別するための識別情報(ID)、生化学反応カートリッジ1の種別、処理工程の手順、生化学反応の結果を分析するための情報などが書き込まれている。
【0048】
図8は生化学反応カートリッジ1の平面断面図を示している。前記したように片側の側面には10個のノズル入口3a〜3jが設けられ、反対側の側面にも10個のノズル入口3k〜3tが設けられている。ノズル入口3a〜3jは流路4a〜4jを介してチャンバ5a〜5jに連通している。反対側のノズル入口3k,3l,3m,3o,3r,3tは、それぞれ流路4k,4l,4m,4o,4r,4tを介してチャンバ5k,5l,5m,5o,5r,5tに連通している。ノズル入口3n,3p,3q,3sはチャンバに連通しておらず予備になっており、使用されない。
【0049】
検体入口はチャンバ7に連通し、チャンバ7は流路6a,6b,6c,6kを介してチャンバ5a,5b,5c,5kに連通するとともに、流路10を介してチャンバ8に連通している。チャンバ8は流路6g,6oを介してチャンバ5g,5oに連通するとともに、流路11を介してチャンバ9に連通している。チャンバ9は流路6h,6i,6j,6r,6tを介してチャンバ5h,5i,5j,5r,5tに連通している。流路10は流路6d,6e,6f,6l,6mを介してチャンバ5d,5e,5f,5l,5mに連通している。
【0050】
チャンバ9の底面に設けられた角孔に、DNAチップ12が、プローブ面を上にして貼り付けられている。DNAチップ12は、1平方インチ(約645mm2)程度の大きさのガラス板の固相表面に、数十〜数十万種類の異なるDNAプローブ37が高密度に並べられたものである。本実施形態では、このDNAチップ12を用いて、検体中のDNAとハイブリダイゼーション反応を行わせることによって、一度に数多くの遺伝子を検査できる。これらのDNAプローブ37はマトリックス状に規則正しく並べられており、それぞれのDNAプローブ37のアドレス(何行・何列と示される位置)を、情報として容易に取り出すことができる。なお、検査の対象となる遺伝子としては、感染症ウィルス、細菌、疾患関連遺伝子、各個人の遺伝子多型等がある。
【0051】
ここで、本実施形態において検体の処理を行うための、各チャンバ5a〜5tのセッティングの一例を示す。チャンバ5aには、細胞壁を破壊するEDTA(エチレンジアミン四酢酸)を含む第1の溶血剤が、チャンバ5bには、界面活性剤等のタンパク質変性剤を含む第2の溶血剤がそれぞれ収容されている。チャンバ5cには、DNAが吸着するシリカコーティングされた磁性体粒子が収容されている。チャンバ5l、チャンバ5mには、DNAの抽出の際にDNAの精製を行うために用いられる第1、第2の抽出洗浄剤がそれぞれ収容されている。
【0052】
チャンバ5dには、DNAを磁性体粒子から溶出する低濃度塩のバッファからなる溶出液が収容されている。チャンバ5gには、PCRに必要な薬剤、すなわち、プライマ、ポリメラーゼ、dNTP溶液、バッファ、蛍光剤を含むCy3−dUTP(アマシャム バイオサイエンス株式会社製の蛍光標識)等の混合液が収容されている。チャンバ5h,5jには、ハイブリダイゼーションしなかった蛍光物質(蛍光標識)付きの検体DNAと蛍光物質(蛍光標識)とを洗浄するための界面活性剤を含む洗浄剤が収容されている。チャンバ5iには、DNAチップ12を含むチャンバ9内を乾燥させるためのアルコールが収容されている。
【0053】
なお、チャンバ5eは血液のDNA以外の塵埃を溜めるためのチャンバである。チャンバ5fは、チャンバ5l,5mからの第1、第2の抽出洗浄剤の廃液を溜めるためのチャンバである。チャンバ5rは第1、第2の洗浄剤の廃液を溜めるためのチャンバである。チャンバ5k,5o,5tは、溶液がノズル入口に流れ込まないようにするために設けられたブランクのチャンバである。
【0054】
本実施形態では、この生化学反応カートリッジ1に血液等の液体状の検体を注入して、前記した処理装置(図1参照)にセットする。そして、生化学反応カートリッジ1の内部で、DNA等の抽出および増幅を行わせ、増幅された検体DNAと生化学反応カートリッジ1の内部にあるDNAチップ12のDNAプローブ37との間で、ハイブリダイゼーションを行わせる。一方、ハイブリダイゼーションしなかった蛍光物質(蛍光標識)付きの検体DNAと蛍光物質(蛍光標識)の洗浄を行うことができる。
【0055】
このような処理装置および生化学反応カートリッジ1を用いて、本実施形態において検体の生化学反応を生化学反応カートリッジ1内にて生じさせる方法について具体的に説明する。
【0056】
まず、検査者が、図示しない注射器等を用いて、血液を検体入口からチャンバ7に注入する。その後に、検査者は生化学反応カートリッジ1をテーブル13上に置く。そして、ポンプブロック22,23を図1の矢印の方向に移動させると、ポンプノズル20,21が、生化学反応カートリッジ1の両側部のノズル入口3a〜3tに、ゴムキャップ3を貫通して挿入される。
【0057】
検査者が、入力部24から実験開始の命令を入力すると処理が始まる。図9は生化学反応およびその後処理の手順を説明するフローチャートである。
【0058】
まず、ステップS1で、制御部17が、ポンプノズル20,21を制御してノズル入口3a,3kのみを開にし、電動シリンジポンプ18から空気を噴出し、電動シリンジポンプ19から空気を吸引する。それによって、チャンバ5a内の第1の溶血剤を、血液の入ったチャンバ7に流し込む。この様子が、チャンバ5a,7,5kを通る断面図である図10に示されている。
【0059】
本実施形態では、空気の供給および吸引のタイミングをずらすことによって各チャンバへの加圧および減圧を制御して、カートリッジ1内を、溶液を円滑に流すことができる。また、ノズル入口3a,3oのみを開にして、電動シリンジポンプ18,19によって空気の噴出および吸引を交互に繰り返して、チャンバ7の溶液を流路10に流し、その後に戻す動作を繰り返して攪拌を行う。あるいは、電動シリンジポンプ19から空気を連続して噴出することによって、気泡を発生させながら攪拌を行う。
【0060】
次に、ステップS2において、ノズル入口3b,3kのみを開にして、ステップS1と同様の原理でチャンバ5b内の第2の溶血剤をチャンバ7に流し込む。そして、ステップS1と同様の攪拌を行う。
【0061】
さらに、ステップS3において、ノズル入口3c,3kのみを開にして、ステップS1,S2と同様の原理でチャンバ5c内の磁性体粒子をチャンバ7に流し込む。そして、ステップS1と同様の攪拌を行う。このステップS3によって、ステップS1,S2において細胞が溶解して得られたDNAが磁性体粒子に付着する。
【0062】
そして、ステップS4で電磁石14をオンにし、ノズル入口3e,3kのみを開にし、電動シリンジポンプ19から空気を噴出し、電動シリンジポンプ18から空気を吸引して、チャンバ7内の溶液をチャンバ5eに移動させる。この移動の際に、磁性体粒子およびDNAを、流路10の電磁石14の上方位置で捕捉する。
【0063】
このように、ステップS1〜S4にて、幅1〜2mm程度で高さ0.2〜1mm程度の小さい流路10上で、流動状態のDNAを、磁性体粒子を利用して極めて効率良く捕捉する。なお、仮に、捕捉ターゲット物質がDNAではなく、RNAまたはタンパク質の場合にも同様に効率の良い捕捉が行える。
【0064】
次に、ステップS5において電磁石14をオフにし、ノズル入口3f,3lのみを開とする。そして、電動シリンジポンプ19から空気を噴出し、電動シリンジポンプ18から空気を吸引して、チャンバ5l内の第1の抽出洗浄液をチャンバ5fに移動させる。この際に、ステップS4で捕捉された磁性体粒子およびDNAが、抽出洗浄液と共に移動して洗浄が行われる。さらに、電磁石14をオンにして、ステップS4と同様の原理で磁性体粒子およびDNAと抽出洗浄液とをチャンバ5l内とチャンバ5fの間を2回往復させる。それによって、洗浄された磁性体粒子およびDNAを流路10の電磁石14の上方位置に回収し、第1の抽出洗浄液をチャンバ5lに戻す。
【0065】
ステップS6において、ノズル入口3f,3mのみを開いてステップS5と同様の工程を行う。すなわち、チャンバ5m内の第2の抽出洗浄液と、磁性体粒子およびDNAとを移動させて、磁性体粒子およびDNAをさらに洗浄してから電磁石14の上方位置に回収し、第2の抽出洗浄液をチャンバ5mに戻す。
【0066】
続いて、ステップS7において電磁石14をオンにしたまま、ノズル入口3d,3oのみを開にし、電動シリンジポンプ18から空気を噴出し、電動シリンジポンプ19から空気を吸引する。それによって、チャンバ5d内の溶出液をチャンバ8に移動させる。この溶出液の作用によって、磁性体粒子とDNAが分離し、DNAのみが溶出液とともにチャンバ8に移動し、磁性体粒子は流路10内に残る。
【0067】
このステップS7において、DNAの抽出および精製が行われる。本実施形態では、抽出洗浄液を収容するチャンバ5l,5mと、洗浄後の廃液を溜めるためのチャンバ5fが用意されているので、カートリッジ1内でDNAの抽出および精製を行うことが可能である。
【0068】
次に、ステップS8において、ノズル入口3g,3oのみを開にし、電動シリンジポンプ18から空気を噴出し、電動シリンジポンプ19から空気を吸引する。それによって、チャンバ5g内の前記したPCR用薬剤をチャンバ8に流し込む。さらに、ノズル入口3g,3tのみを開にし、電動シリンジポンプ18,19による空気の噴出および吸引を交互に繰り返し、チャンバ8の溶液の攪拌を行う。そして、ペルチェ素子15を制御して、チャンバ8内の溶液を96℃の温度に10分保持した後に、96℃・10秒、55℃・10秒、72℃・1分のサイクルを30回繰り返してPCRを行い、溶出されたDNAを増幅する。
【0069】
ステップS9でノズル入口3g,3tのみを開にし、電動シリンジポンプ18から空気を噴出し、電動シリンジポンプ19から空気を吸引して、チャンバ8内の溶液をチャンバ9に移動させる。さらに、ペルチェ素子16を制御して、チャンバ9内の溶液を45℃で2時間保持し、ハイブリダイゼーションを行わせる。この時、電動シリンジポンプ18,19による空気の噴出および吸引を交互に繰り返して、チャンバ9内の溶液の攪拌を行いながら、ハイブリダイゼーションを進める。このように、本実施形態では、チャンバ9がハイブリダイゼーションの反応場になっている。
【0070】
次にステップS10において、同じく45℃に保持したまま、今度はノズル入口3h、3rのみを開にし、電動シリンジポンプ18から空気を噴出し、電動シリンジポンプ19から空気を吸引する。それによって、チャンバ9内の溶液をチャンバ5rに移動させるとともに、チャンバ5h内の第1の洗浄液を、チャンバ9を通してチャンバ5rに流し込む。このように、ノズル入口3hにポンプノズル20を挿入し空気を噴出して加圧し、ノズル入口3rにポンプノズル21を挿入し空気を吸引して減圧することによって、チャンバ5h内の第1の洗浄液が、チャンバ9を通してチャンバ5r内に流れ込む。この様子が、チャンバ5h,9,5rを通る断面図である図11に示されている。電動シリンジポンプ18,19の吸引および噴出を交互に繰り返して、この溶液をチャンバ5h,9,5rの間を2回往復させ、最後にチャンバ5hに戻す。このようにして、ハイブリダイゼーションしなかった蛍光標識付きの検体DNAと蛍光標識とが洗浄される。
【0071】
さらに、ステップS11において、同じく45℃に保持したまま、ノズル入口3j、3rのみを開いて、ステップS10と同様の工程を行う。すなわち、チャンバ5j内の第2の洗浄液をチャンバ9を通してチャンバ5rに流し込んでDNAの洗浄をさらに行い、最後に溶液をチャンバ5jに戻す。
【0072】
本実施形態では、第1、第2の洗浄液を収容するチャンバ5h,5jと、洗浄後の廃液を溜めるためのチャンバ5rが用意されているので、前記の通り生化学反応カートリッジ1内でDNAチップ12の洗浄を行うことが可能である。
【0073】
ステップS12で、ノズル入口3i,3rのみを開にし、電動シリンジポンプ18から空気を噴出し、電動シリンジポンプ19から空気を吸引して、チャンバ5i内のアルコールを、チャンバ9を通してチャンバ5rに移動させる。その後に、ノズル入口3i,3tのみを開にし、電動シリンジポンプ18から空気を噴出し、電動シリンジポンプ19から空気を吸引してチャンバ9内を乾燥させる。
【0074】
以上述べたステップS1〜S12によって、検体の生化学反応(例えばDNAのハイブリダイゼーション)を生化学反応カートリッジ1内で行わせることができる。
【0075】
詳述しないが、前記した各ステップS1〜S12が完了する度に、第1の通信部26からICチップ25の通信部(図示せず)に向けて、その都度、信号を送信している。この信号は、各ステップの完了と、その工程の各種条件と、終了時刻とを表すものであり、ICチップ25の記憶部(図示せず)に記憶される。
【0076】
以上説明した処理工程(ステップS1〜S12)の後に、ステップS13において、ポンプブロック22,23を生化学反応カートリッジ1から離れる方向に移動させる。それによって、ポンプノズル20,21が生化学反応カートリッジ1のノズル入口3a〜3tから外れる。そして、ステップS14において、カートリッジ搬送部27(図1参照)を用いて、生化学反応カートリッジ1をテーブル13から検出部28に搬送する。ステップS15において、DNAチップ12に捕捉された、ハイブリダイゼーションされたDNAを蛍光検出ユニット30によって検出する。検出結果は、第2の通信部31から、ICチップ25の通信部(図示せず)に向けて送信され、ICチップ25の記憶部(図示せず)に記憶される。こうして、ステップS1〜S12の各工程の(時間経過を含む)推移および各種条件と、その各工程を経たDNAチップ12の検出結果とが、生化学反応カートリッジ1のICチップ25に記憶される。この蛍光検出工程(ステップS15)の詳細については、前述したステップS101〜S111(図3参照)の通りである。
【0077】
この蛍光検出工程が終わった後、ステップS16において、制御部17が、蛍光検出したパターンを分析する。なお、生化学反応カートリッジ1が、予め処理装置に記憶されていない種別である場合には、検出パターンの分析にあたって、ICチップ25に書き込まれている分析用情報を読み込み、その分析用情報に基づいて分析を行う。
【0078】
ここで、本実施形態における蛍光検出と分析の原理について説明する。例えば、生化学反応カートリッジ1およびDNAチップ12が感染症検出用のものである場合には、DNAプローブ37の設定の仕方によって、いくつかの感染症が一度に検出できる。DNAプローブ37が5×5のマトリックス状に配置されたDNAチップ12を例にとって考えると、感染症A〜Eがそれぞれ単独で検出されたときのパターンが図12(a)〜(e)に示す5通りとなるように設定できる。なお、図12(a)〜(e)において、黒丸は、ターゲットがDNAプローブ37とハイブリダイゼーションして捕捉されており、ターゲットに付着した蛍光物質(蛍光標識)が蛍光を発している状態を示す。一方、白丸は、ターゲットがDNAプローブ37とハイブリダイゼーションせず捕捉されずに、蛍光標識が存在しない状態を示している。
【0079】
図12(a)〜(e)に示す例では、同一列に含まれるDNAプローブ37は全て、同じ感染症に感染したときに存在するDNAとハイブリダイゼーションするように設定されている。そして、各列毎に異なる感染症のDNAに対応するように設定されている。従って、図12(a)のパターンの検出結果が得られた場合には、感染症Aへの感染が認められ、同様に、図12(b)〜(e)のパターンの検出結果が得られた場合には、それぞれ感染症B〜Eへの感染が認められる。このような検出パターンに基づく感染判断方法は、制御部17に予め記憶されている分析用情報に含まれている。
【0080】
このように、蛍光物質が付着したDNAプローブ37の配列パターンに基づいて、目的とする検体分析を精度良く行うためには、ステップS15において、蛍光検出を精度良く行うことが重要である。
【0081】
[第2の実施形態]
次に、本発明の第2の実施形態について説明する。第1の実施形態と実質的に同一の構成および同一のステップについては、同一の符号を付与して説明を省略する。また、以下の説明では、主に第1の実施形態と相違する点についてのみ述べており、第1の実施形態と同じ内容(例えば生化学反応分析装置全体の構成や生化学カートリッジの構成や処理工程等)については説明を繰り返さない。
【0082】
本実施形態では、図13に示す蛍光検出ユニット40の蛍光検出部46のCMOSエリアセンサが、一定の光電変換増幅率で電荷を電圧に変換する。すなわち、蛍光検出時の検出条件の1つである光電変換増幅率は一定である。その代わり、他の検出条件であるレーザ光発生器48の作動時間が変えられる。レーザ光発生器48の作動時間は、レーザ光のDNAチップ12への照射時間であり、光電変換継続時間であると言える。
【0083】
本実施形態では、図14に示すように、ステップS201において、レーザ光発生器48を作動させ、レーザ光を生化学反応カートリッジ1のDNAチップ12に照射し、励起された蛍光を蛍光検出部46のCMOSエリアセンサにて受光する。このレーザ光の照射時間、すなわちレーザ光発生器48の作動時間をL1とする。ステップS103において、CMOSエリアセンサに蓄積された電荷を増幅したアナログ電圧値をAD変換したデジタル値を、「検出データ(輝度データ)」としてメモリに記憶する。さらに、ステップS104において、各エリアの検出データ(デジタル値)の集合から、蛍光を発するドットの位置を導き出す。そして、全エリアの検出データの集合を、1回目の検出データの集合としてメモリに記憶する。
【0084】
次に、ステップS202において、レーザ光発生器48を再び作動させ、レーザ光をDNAチップ12に照射し、蛍光を蛍光検出部46のCMOSエリアセンサにて受光する。この時、レーザ光の照射時間、すなわちレーザ光発生器48の作動時間を、ステップS201における作動時間L1よりも短いL2にする。その後、前記したのと同様に、ステップS107において検出データをメモリに記憶し、ステップS108において、各エリアの検出データの集合から、蛍光を発するドットの位置を導き出す。そして、全エリアの検出データの集合を、2回目の検出データの集合として記憶する。光電変換継続時間が変わっているため、当然、1回目の検出データと2回目の検出データは異なるものである。
【0085】
そして、ステップS109において、1回目の検出データの集合と2回目の検出データの集合を許容範囲と比較する。DNAチップ12の検出領域内に、1回目と2回目の両方の検出データがいずれも許容範囲内に入っているドット(例えば図15のドットB)が存在するか否かを確認する。
【0086】
ステップS109において、2回の蛍光検出の検出データがいずれも許容範囲内に入っているドット(ドットB)が存在すると確認された場合には、ステップS203において、制御部17が蛍光変化率(蛍光褪色率)Tを算出する。
T={B2×(L1÷L2)}÷B1
ここで、ドットBの1回目の検出データがB1、2回目の検出データがB2である。
【0087】
続いて、ステップS204において、制御部17が各ドットの輝度値(蛍光特性値)を決定する。1回目の蛍光検出時の検出データが、許容範囲内であったドット(例えばドットAおよびドットB)に関しては、1回目の検出データをそのままドットの輝度値として決定する。一方、1回目の蛍光検出時の検出データが許容範囲の上限値より大きく2回目の蛍光検出時の検出データが許容範囲の上限値以下であったドット(例えばドットC)に関しては、次の計算式で輝度値Kを決定する。
K={(C2×(L1÷L2)}÷T
C2は、ドットCにおける2回目の蛍光検出時の検出データである。
【0088】
このように、1回目の蛍光検出時の検出データが許容範囲外であったドットCの輝度値は、2回目の蛍光検出時の検出データを、ドットBの2つの検出データに基づいて算出された蛍光褪色率を用いて補正することによって決定される。
【0089】
なお、前記した条件に当てはまらないドット、例えば、2回の蛍光検出時の輝度データがいずれも許容範囲外であったドットは、輝度値不明のドットとみなす。
【0090】
このようにしてDNAチップ12の各ドットの輝度値(蛍光特性値)をそれぞれ決定する。
【0091】
ステップS109において、2回の蛍光検出の検出データがいずれも許容範囲内に入っているドットが存在しないと確認された場合(図16参照)には、レーザ光発生器48の作動時間を変えて、レーザ光の照射および蛍光の受光を繰り返す。すなわち、ステップS202において、レーザ光の照射時間、すなわちレーザ光発生器48の作動時間を変更する。作動時間をさらに短くするか長くするかは、2回の蛍光検出時の検出データが概ね許容範囲の上限値よりも高かったか、下限値よりも低かったかに基づいて決めればよい。
【0092】
このように、ステップS202において、変更された作動時間だけレーザ光発生器38を作動させ、蛍光をCMOSエリアセンサにより受光し、CMOSエリアセンサの各エリアで電荷を蓄積する。そして、前記したのと同様に、ステップS107において、電荷を増幅しデジタル値(検出データ)に変換してメモリに記憶する。さらに、ステップS108において、全エリアの検出データの集合を求め、3回目の検出データの集合として記憶する。
【0093】
それから、ステップS109において、1〜3回目の検出データの集合を、制御部17に記憶されている許容範囲と比較し、1〜3回目の検出データのうち2つの検出データが許容範囲内に入っているドットが存在するか否かを確認する。そのようなドットが存在する場合には、レーザ光の照射はそれ以上繰り返さず、それらの2回の検出データの集合に基づいてDNAチップ12の蛍光特性値(輝度値)を決定する。例えば、図17に示す例では、ドットBとドットCにおいて2回目の検出データと3回目の検出データがいずれも許容範囲内に入っている。従って、2回目の検出データの集合と3回目の検出データの集合に基づいて、蛍光変化率(蛍光褪色率)を求め、全エリアの輝度値(蛍光特性値)を決定する。これらのステップS203〜S204は前記したのと実質的に同じであるから、説明は省略する。
【0094】
ステップS109において、1〜3回目の検出データのうち2つの検出データが許容範囲内に入っているドットが存在していない場合には、検出条件(レーザ光発生器48の作動時間)を順次変えながら、ステップS105〜S109を繰り返す。このステップS105〜S109は、検出領域内の少なくとも1つのドットにおいて許容範囲内に入っている2つの検出データが得られるまで繰り返す。少なくとも1つのドットにおいて許容範囲内に入っている2つの検出データが得られたら、ステップS203〜S204によって、その2つの検出データから蛍光変化率を求め、全エリアの蛍光特性値を決定する。なお、ステップS202からS204までは、複数回繰り返される場合であっても、何回目の蛍光検出の検出データを取り扱うかという点のみが異なり、実質的には同じである。
【0095】
[第3の実施形態]
図示しないが、本発明の第3の実施形態では、CMOSエリアセンサの光電変換増幅率およびレーザ光発生器の作動時間は一定である。そして、レーザ光発生器から照射される励起光であるレーザ光の強度、すなわちレーザ光発生器の出力パワーを、蛍光検出の度に変更可能である。すなわち、1回目の蛍光検出時のレーザ光の強度(レーザ光発生器の出力パワー)と異なる強度のレーザ光で、2回目の蛍光検出を行う。そして、2回の蛍光検出時の検出データがいずれも許容範囲内であるドットの有無を調べる。第1および第2の実施形態と同様に、そのようなドットが存在した場合には、両検出データから蛍光変化率(蛍光褪色率)を求め、全エリアの輝度値(蛍光特性値)を決定する。そのようなドットが存在しない場合には、検出領域内の少なくとも1つのドットにおいて許容範囲内に入っている2つの検出データが得られるまで、レーザ光の強度をその都度変えながら蛍光検出を繰り返す。その他の具体的な構成およびステップは、第1および第2の実施形態と同様であるため説明を省略する。
【0096】
[第4の実施形態]
図示しないが、本発明の第4の実施形態では、CMOSエリアセンサの光電変換増幅率、レーザ光発生器の作動時間、レーザ光の強度(レーザ光発生器の出力パワー)は一定である。そして、蛍光フィルタによる蛍光透過率を、蛍光検出の度に変更可能である。例えば、蛍光透過率が異なる複数の蛍光フィルタを、DNAチップ12からの蛍光の光路内に選択的に挿入可能な構成にしておき、1回目の蛍光検出時と2回目の蛍光検出時で異なる蛍光フィルタを用いる。それによって、1回目の蛍光検出時の蛍光透過率と異なる蛍光透過率で、2回目の蛍光検出を行う。そして、2回の蛍光検出時の検出データがいずれも許容範囲内であるドットの有無を調べる。第1および第2の実施形態と同様に、そのようなドットが存在した場合には、両検出データから蛍光変化率(蛍光褪色率)を求め、全エリアの輝度値(蛍光特性値)を決定する。そのようなドットが存在しない場合には、検出領域内の少なくとも1つのドットにおいて許容範囲内に入っている2つの検出データが得られるまで、蛍光透過率をその都度変えながら蛍光検出を繰り返す。その他の具体的な構成およびステップは、第1〜3の実施形態と同様であるため説明を省略する。
【0097】
[第5の実施形態]
図示しないが、本発明の第5の実施形態では、CMOSエリアセンサの光電変換増幅率、レーザ光発生器の作動時間、レーザ光の強度(レーザ光発生器の出力パワー)、蛍光フィルタの蛍光透過率は一定である。そして、CMOSエリアセンサの光電変換増幅における零レベルのオフセットを、蛍光検出の度に変更可能である。すなわち、CMOSエリアセンサの光電変換時の増幅率自体は一定であるが、その増幅の基準となる零レベルが変えられることにより、検出データに違いが生じる。そこで、1回目の蛍光検出時の光電変換増幅の零レベルと異なる零レベルにて、2回目の蛍光検出を行う。そして、2回の蛍光検出時の検出データがいずれも許容範囲内であるドットの有無を調べる。第1および第2の実施形態と同様に、そのようなドットが存在した場合には、両検出データから蛍光変化率(蛍光褪色率)を求め、全エリアの輝度値(蛍光特性値)を決定する。そのようなドットが存在しない場合には、検出領域内の少なくとも1つのドットにおいて許容範囲内に入っている2つの検出データが得られるまで、光電変換増幅における零レベルをその都度変えながら蛍光検出を繰り返す。その他の具体的な構成およびステップは、第1〜4の実施形態と同様であるため説明を省略する。
【0098】
以上説明した通り、本発明によると、蛍光検出とそれを利用した生化学反応分析が、信頼性高く行えるようになる。
【0099】
従来は、蛍光検出時の検出データが、蛍光検出およびそれに付随する分析を行える許容範囲を外れていた場合には、蛍光検出およびそれに付随する分析が行えない場合があった。1回の蛍光検出で対象物の検出領域内の全エリアにおいて許容範囲内の検出データが得られるように検出条件を設定することは至難の業であった。特に、1つの対象物中に高輝度の部分と低輝度の部分が混在している場合には、対象物の全域に亘って蛍光特性値を求めることが非常に困難であった。
【0100】
これに対し、本発明では、少なくとも2回の蛍光検出のデータを利用しており、少なくとも1つの検出条件が違う状態で少なくとも2回の蛍光検出を行う。そして、2つの検出データがいずれも許容範囲内に入っている箇所(ドット)が、検出領域内の全エリアの中に1つでもあれば、そのドットの2つの検出データによって、蛍光変化率(例えば蛍光褪色率)を導き出す。この蛍光変化率を補正データとして利用して、他の箇所の検出データを補正することによって、各エリアの蛍光特性値を決定する。仮に、2回の蛍光検出では2つの検出データがいずれも許容範囲内に入っている箇所(ドット)が存在しない場合には、そのようなドットが見つかるまで、検出条件をその都度変えながら蛍光検出を繰り返せばよい。
【0101】
このように、本発明によると、蛍光変化率を算出できるように、2つの検出データがいずれも許容範囲内に入っている箇所(ドット)が見つかるまで、検出条件をその都度変えながら蛍光検出を繰り返す。そして、この蛍光変化率を補正データとして用いて蛍光特性値を求める。従って、様々な対象物に関して、ほぼ確実に蛍光特性値を求めることができ、従来のように対象物の種類によっては蛍光特性値が容易に求められないという事態を、ほとんどなくすことができる。言い換えると、1度の蛍光検出ではカバーできない輝度のダイナミックレンジの広い対象物に対しても、容易に蛍光検出可能である。
【0102】
ただし、この蛍光検出および生化学分析が、感染症の判定や各種がんの判定等の用途に用いられる場合には、その対象物の輝度の許容範囲は予め予測できる。したがって、予測される許容範囲を生化学反応カートリッジ1のICチップ25に記憶させておくことができる。その場合、本発明の蛍光検出装置において、ICチップ25に記憶されている許容範囲に応じた検出条件の設定を行うことができれば、蛍光検出を複数回ではなく1回のみ行うだけで済むこともある。
【図面の簡単な説明】
【0103】
【図1】本発明の第1の実施形態の生化学反応分析装置の構成を示すブロック図である。
【図2】図1に示す生化学反応分析装置の蛍光検出装置の要部を示す概略側面図である。
【図3】図2に示す蛍光検出装置の蛍光検出工程を示すフローチャートである。
【図4】図3に示す蛍光検出工程の、3つのドットにおける1回目の検出データと2回目の検出データの一例を示すグラフである。
【図5】図3に示す蛍光検出工程の、3つのドットにおける1回目の検出データと2回目の検出データの他の例を示すグラフである。
【図6】図5に示す3つのドットにおける2回目の検出データと3回目の検出データの一例を示すグラフである。
【図7】図1に示す生化学反応分析装置の生化学反応カートリッジの斜視図である。
【図8】図7に示す生化学反応カートリッジの平面断面図である。
【図9】図1に示す生化学反応分析装置における処理工程を示すフローチャートである。
【図10】図7,8に示す生化学反応カートリッジのチャンバの一部を通る縦断面図である。
【図11】図7,8に示す生化学反応カートリッジの他のチャンバを通る縦断面図である。
【図12】(a)〜(e)は、DNAチップの蛍光検出パターンの例を示す模式図である。
【図13】図1に示す生化学反応分析装置の蛍光検出装置の他の例を示す概略側面図である。
【図14】図13に示す蛍光検出装置の蛍光検出工程を示すフローチャートである。
【図15】図13に示す蛍光検出工程の、3つのドットにおける1回目の検出データと2回目の検出データの一例を示すグラフである。
【図16】図13に示す蛍光検出工程の、3つのドットにおける1回目の検出データと2回目の検出データの他の例を示すグラフである。
【図17】図16に示す3つのドットにおける2回目の検出データと3回目の検出データの一例を示すグラフである。
【符号の説明】
【0104】
1 生化学反応カートリッジ
12 DNAチップ(対象物)
17 制御部(蛍光検出装置)
30,40 蛍光検出ユニット(蛍光検出装置)
38,48 レーザ光発生器(励起光発生部)
36,46 蛍光検出部
【特許請求の範囲】
【請求項1】
対象物から発せられる蛍光を検出する蛍光検出部を含み、前記蛍光検出部による前記対象物に対する蛍光検出の際に、前記対象物の情報に基づいて検出条件が設定される、蛍光検出装置。
【請求項2】
前記蛍光検出部は、同一の前記対象物に対する複数回の蛍光検出を、少なくとも1つの検出条件が異なる状態で行うものである、請求項1に記載の蛍光検出装置。
【請求項3】
前記蛍光検出部が、前記検出条件として、光電変換増幅率、または光電変換増幅における零レベルのオフセットを変えることができる、請求項1または2に記載の蛍光検出装置。
【請求項4】
前記蛍光検出部はCMOSセンサまたはCCDセンサを含む、請求項3に記載の蛍光検出装置。
【請求項5】
前記対象物に励起光を照射する励起光発生部を有し、
該励起光発生部が、前記検出条件として、前記励起光の照射時間を変えることによって光電変換継続時間を変えることができる、または、前記励起光の強度を変えることができる、請求項1に記載の蛍光検出装置。
【請求項6】
前記励起光発生部はレーザ光発生器である、請求項5に記載の蛍光検出装置。
【請求項7】
前記蛍光検出部は、前記対象物の検出領域の全域に対して蛍光検出を行い、前記検出領域を分割した複数のエリアのそれぞれの検出データの集合を求めるものであり、
前記蛍光検出部に、前記対象物に対して、少なくとも1つの検出条件を変えて2回の蛍光検出を行なわせ、前記検出領域内の前記全エリアの中に、前記2回の蛍光検出時の検出データがいずれも許容範囲内に入っているドットが存在するか否かを調べ、前記2回の蛍光検出時の検出データがいずれも許容範囲内に入っているドットが存在する場合には、当該2回の蛍光検出時の検出データの集合に基づいて前記各エリアの蛍光特性値を決定し、前記2回の蛍光検出時の検出データがいずれも許容範囲内に入っているドットが存在しない場合には、前記検出領域内の前記全エリアの中のいずれかのドットにおいて前記許容範囲内に入っている2つの検出データが得られるまで、前記検出条件をその都度変えて蛍光検出を繰り返し、当該2つの検出データが得られた際のそれぞれの蛍光検出時の検出データの集合に基づいて前記各エリアの蛍光特性値を決定する制御部をさらに有する、
請求項1から6のいずれか1項に記載の蛍光検出装置。
【請求項8】
前記制御部は、前記検出領域内の前記全エリアの中の少なくとも1つのドットにおいて前記許容範囲内に入っている2つの検出データが得られたら、該2つの検出データから蛍光変化率を求め、前記検出領域内の、前記許容範囲内に入っている2つの検出データが得られたドットが存在しないエリアに関しては、前記蛍光変化率を用いて検出データを補正して蛍光特性値を決定する、請求項7に記載の蛍光検出装置。
【請求項9】
請求項1から8のいずれか1項に記載の蛍光検出装置と、生化学反応の反応場となるチャンバを含む生化学反応カートリッジとを有する、生化学反応分析装置。
【請求項10】
対象物から発せられる蛍光を検出する蛍光検出方法において、
蛍光検出は前記対象物の検出領域の全域に対して行い、前記検出領域を分割した複数のエリアのそれぞれの検出データの集合を求めるものであり、
前記対象物に対して、少なくとも1つの検出条件を変えて2回の前記蛍光検出を行い、前記検出領域内の前記全エリアの中に、前記2回の蛍光検出時の検出データがいずれも許容範囲内に入っているドットが存在するか否かを調べ、
前記2回の蛍光検出時の検出データがいずれも許容範囲内に入っているドットが存在する場合には、当該2回の蛍光検出時の検出データの集合に基づいて前記各エリアの蛍光特性値を決定し、
前記2回の蛍光検出時の検出データがいずれも許容範囲内に入っているドットが存在しない場合には、前記検出領域内の前記全エリアの中のいずれかのドットにおいて前記許容範囲内に入っている2つの検出データが得られるまで、前記検出条件をその都度変えて蛍光検出を繰り返し、当該2つの検出データが得られた際のそれぞれの蛍光検出時の検出データの集合に基づいて前記各エリアの蛍光特性値を決定する
ことを特徴とする蛍光検出方法。
【請求項11】
前記検出領域内の前記全エリアの中の少なくとも1つのドットにおいて前記許容範囲内に入っている2つの検出データが得られたら、該2つの検出データから蛍光変化率を求め、前記検出領域内の、前記許容範囲内に入っている2つの検出データが得られたドットが存在しないエリアに関しては、前記蛍光変化率を用いて検出データを補正して蛍光特性値を決定する、請求項10に記載の蛍光検出方法。
【請求項12】
前記少なくとも1つの検出条件は、光電変換増幅率、光電変換継続時間、または前記対象物に照射する励起光の強度である、請求項10または11に記載の蛍光検出方法。
【請求項13】
前記検出データは輝度データであり前記蛍光特性値は輝度値である、請求項10から12のいずれか1項に記載の蛍光検出方法。
【請求項1】
対象物から発せられる蛍光を検出する蛍光検出部を含み、前記蛍光検出部による前記対象物に対する蛍光検出の際に、前記対象物の情報に基づいて検出条件が設定される、蛍光検出装置。
【請求項2】
前記蛍光検出部は、同一の前記対象物に対する複数回の蛍光検出を、少なくとも1つの検出条件が異なる状態で行うものである、請求項1に記載の蛍光検出装置。
【請求項3】
前記蛍光検出部が、前記検出条件として、光電変換増幅率、または光電変換増幅における零レベルのオフセットを変えることができる、請求項1または2に記載の蛍光検出装置。
【請求項4】
前記蛍光検出部はCMOSセンサまたはCCDセンサを含む、請求項3に記載の蛍光検出装置。
【請求項5】
前記対象物に励起光を照射する励起光発生部を有し、
該励起光発生部が、前記検出条件として、前記励起光の照射時間を変えることによって光電変換継続時間を変えることができる、または、前記励起光の強度を変えることができる、請求項1に記載の蛍光検出装置。
【請求項6】
前記励起光発生部はレーザ光発生器である、請求項5に記載の蛍光検出装置。
【請求項7】
前記蛍光検出部は、前記対象物の検出領域の全域に対して蛍光検出を行い、前記検出領域を分割した複数のエリアのそれぞれの検出データの集合を求めるものであり、
前記蛍光検出部に、前記対象物に対して、少なくとも1つの検出条件を変えて2回の蛍光検出を行なわせ、前記検出領域内の前記全エリアの中に、前記2回の蛍光検出時の検出データがいずれも許容範囲内に入っているドットが存在するか否かを調べ、前記2回の蛍光検出時の検出データがいずれも許容範囲内に入っているドットが存在する場合には、当該2回の蛍光検出時の検出データの集合に基づいて前記各エリアの蛍光特性値を決定し、前記2回の蛍光検出時の検出データがいずれも許容範囲内に入っているドットが存在しない場合には、前記検出領域内の前記全エリアの中のいずれかのドットにおいて前記許容範囲内に入っている2つの検出データが得られるまで、前記検出条件をその都度変えて蛍光検出を繰り返し、当該2つの検出データが得られた際のそれぞれの蛍光検出時の検出データの集合に基づいて前記各エリアの蛍光特性値を決定する制御部をさらに有する、
請求項1から6のいずれか1項に記載の蛍光検出装置。
【請求項8】
前記制御部は、前記検出領域内の前記全エリアの中の少なくとも1つのドットにおいて前記許容範囲内に入っている2つの検出データが得られたら、該2つの検出データから蛍光変化率を求め、前記検出領域内の、前記許容範囲内に入っている2つの検出データが得られたドットが存在しないエリアに関しては、前記蛍光変化率を用いて検出データを補正して蛍光特性値を決定する、請求項7に記載の蛍光検出装置。
【請求項9】
請求項1から8のいずれか1項に記載の蛍光検出装置と、生化学反応の反応場となるチャンバを含む生化学反応カートリッジとを有する、生化学反応分析装置。
【請求項10】
対象物から発せられる蛍光を検出する蛍光検出方法において、
蛍光検出は前記対象物の検出領域の全域に対して行い、前記検出領域を分割した複数のエリアのそれぞれの検出データの集合を求めるものであり、
前記対象物に対して、少なくとも1つの検出条件を変えて2回の前記蛍光検出を行い、前記検出領域内の前記全エリアの中に、前記2回の蛍光検出時の検出データがいずれも許容範囲内に入っているドットが存在するか否かを調べ、
前記2回の蛍光検出時の検出データがいずれも許容範囲内に入っているドットが存在する場合には、当該2回の蛍光検出時の検出データの集合に基づいて前記各エリアの蛍光特性値を決定し、
前記2回の蛍光検出時の検出データがいずれも許容範囲内に入っているドットが存在しない場合には、前記検出領域内の前記全エリアの中のいずれかのドットにおいて前記許容範囲内に入っている2つの検出データが得られるまで、前記検出条件をその都度変えて蛍光検出を繰り返し、当該2つの検出データが得られた際のそれぞれの蛍光検出時の検出データの集合に基づいて前記各エリアの蛍光特性値を決定する
ことを特徴とする蛍光検出方法。
【請求項11】
前記検出領域内の前記全エリアの中の少なくとも1つのドットにおいて前記許容範囲内に入っている2つの検出データが得られたら、該2つの検出データから蛍光変化率を求め、前記検出領域内の、前記許容範囲内に入っている2つの検出データが得られたドットが存在しないエリアに関しては、前記蛍光変化率を用いて検出データを補正して蛍光特性値を決定する、請求項10に記載の蛍光検出方法。
【請求項12】
前記少なくとも1つの検出条件は、光電変換増幅率、光電変換継続時間、または前記対象物に照射する励起光の強度である、請求項10または11に記載の蛍光検出方法。
【請求項13】
前記検出データは輝度データであり前記蛍光特性値は輝度値である、請求項10から12のいずれか1項に記載の蛍光検出方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【公開番号】特開2009−8603(P2009−8603A)
【公開日】平成21年1月15日(2009.1.15)
【国際特許分類】
【出願番号】特願2007−172157(P2007−172157)
【出願日】平成19年6月29日(2007.6.29)
【出願人】(000001007)キヤノン株式会社 (59,756)
【Fターム(参考)】
【公開日】平成21年1月15日(2009.1.15)
【国際特許分類】
【出願日】平成19年6月29日(2007.6.29)
【出願人】(000001007)キヤノン株式会社 (59,756)
【Fターム(参考)】
[ Back to top ]

