血液分析装置および血液分析方法
【課題】試薬価格において、ユーザーに負担がかからない白血球の分類及びヘモグロビン濃度を測定できる血液分析装置及び血液分析方法を提供する。
【解決手段】血液分析装置は、血液試料と標識物質を含まない溶血剤とから、標識物質を含まない測定試料を調製する試料調製部と、測定試料から蛍光情報と少なくとも2種類の散乱光情報とを生成する光情報生成部と、蛍光情報と2種類の散乱光情報とに基づいて、測定試料中の白血球を、少なくとも、単球と、好中球と、好酸球と、他の集団との4つに第1分類する制御部とを備える。
【解決手段】血液分析装置は、血液試料と標識物質を含まない溶血剤とから、標識物質を含まない測定試料を調製する試料調製部と、測定試料から蛍光情報と少なくとも2種類の散乱光情報とを生成する光情報生成部と、蛍光情報と2種類の散乱光情報とに基づいて、測定試料中の白血球を、少なくとも、単球と、好中球と、好酸球と、他の集団との4つに第1分類する制御部とを備える。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、血液分析装置および血液分析方法に関する。
【背景技術】
【0002】
従来、白血球分類を行う血液分析装置が知られている。このような血液分析装置は、たとえば、特開2003−83960号公報および特開2005−257450号公報に開示されている。
【0003】
上記特開2003−83960号公報に記載の血液分析装置は、血液試料と試薬とから調製された測定試料中の白血球を検出する電気抵抗式検出部を備え、電気抵抗式検出部による検出結果に基づいて測定試料中の白血球を3つに分類するように構成されている。
【0004】
上記特開2005−257450号公報に記載の血液分析装置は、血液試料と試薬とから測定試料を調製する試料調製部と、前方散乱光、側方散乱光および蛍光を検出する光学系検出部とを備え、光学系検出部による検出結果に基づいて測定試料中の白血球を4つに分類するように構成されている。また、この光学系検出部では、蛍光標識された白血球の蛍光を検出している。
【0005】
しかしながら、上記特開2003−83960号公報の血液分析装置では、測定試料中の白血球を4つ以上に分類することができないという問題点がある。
【0006】
また、上記特開2005−257450号公報の血液分析装置では、血液試料中の白血球を4つに分類することが可能である一方、測定試料中の白血球に対して蛍光標識を行う必要があるので、標識物質を含む高価な試薬を用いる必要があるという不都合がある。このため、白血球を4つ以上に分類可能で、かつ、標識物質を含む試薬を用いる必要がない血液分析装置が望まれる。
【0007】
また、従来、白血球を分類し、ヘモグロビン濃度を取得する血液分析装置が知られている。このような血液分析装置は、たとえば、特開2006−292738号公報に開示されている。
【0008】
上記特開2006−292738号公報に記載の血液分析装置は、血液試料および白血球分類用試薬を含む測定試料を用いて、前方散乱光、側方散乱光および蛍光を測定し、測定試料中の白血球を4つに分類するように構成されている。また、この血液分析装置は、血液試料、および、白血球分類用試薬とは組成が異なる専用のヘモグロビン測定用試薬を含む測定試料を用いて、透過光を検出し、測定試料中のヘモグロビン濃度を取得するように構成されている。
【0009】
しかしながら、上記特開2006−292738号公報の血液分析装置では、白血球分類用試薬を用いて白血球を分類し、白血球分類用試薬とは組成が異なる専用のヘモグロビン測定用試薬を用いてヘモグロビン濃度を取得するので、白血球の分類およびヘモグロビン濃度の取得を行うために組成の異なる2種類の試薬を別々に開発する必要があり、その結果、試薬の価格が高騰し、ユーザに負担がかかるという問題点がある。
【発明の概要】
【0010】
この発明の第1の局面による血液分析装置は、血液試料および溶血剤を含む第1測定試料と、血液試料および溶血剤と同じ溶血剤を含む第2測定試料とを調製する試料調製部と、第1測定試料から、蛍光情報と、少なくとも2種類の散乱光情報とを生成する第1光情報生成部と、第2測定試料から、透過光情報または散乱光情報の少なくとも一方を生成する第2光情報生成部と、第1光情報生成部により生成された蛍光情報と2種類の散乱光情報とに基づいて、第1測定試料中の白血球を、少なくとも、単球と、好中球と、好酸球と、他の集団との4つに第1分類し、第2光情報生成部により生成された透過光情報または散乱光情報の少なくとも一方に基づいて、第2測定試料中のヘモグロビン濃度を取得する制御部とを備える。
【0011】
上記第1の局面による血液分析装置において、好ましくは、第2測定試料から、試料の電気情報を生成する電気情報生成部をさらに備え、制御部は、電気情報生成部により生成された電気情報に基づいて、第2測定試料中の白血球を少なくともリンパ球とリンパ球以外の集団とに第2分類するとともに、第1分類および第2分類の分類結果に基づいて、測定試料中の白血球を、少なくとも、リンパ球と、好塩基球と、単球と、好中球と、好酸球との5つに分類するように構成されている。
【0012】
この場合、好ましくは、試料調製部は、血液試料から第3測定試料をさらに調製し、電気情報生成部は、第3測定試料から、試料の電気情報を生成し、制御部は、電気情報生成部により第3測定試料から生成された電気情報に基づいて、第3測定試料中の赤血球数および血小板数を算出するように構成されている。
【0013】
上記第1の局面による血液分析装置において、好ましくは、第2測定試料における溶血剤の希釈倍率は、第1測定試料における溶血剤の希釈倍率と異なる。
【0014】
この場合、好ましくは、第2測定試料における溶血剤の希釈倍率は、第1測定試料における溶血剤の希釈倍率よりも小さい。
【0015】
上記第1の局面による血液分析装置において、好ましくは、試料調製部は、血液試料、所定の試薬容器に収容された溶血剤、および、所定量の希釈液を混合することにより第1測定試料を調製し、血液試料、所定の試薬容器に収容された溶血剤、および、所定量よりも少ない量の希釈液とを混合することにより第2測定試料を調製するように構成されている。
【0016】
この場合、好ましくは、試料調製部は、希釈液と血液試料とを混合した状態で、溶血剤を混合することにより第2測定試料を調製するように構成されている。
【0017】
上記第1の局面による血液分析装置において、好ましくは、試料調製部は、少なくとも血液試料、および、第1測定試料に用いられる溶血剤が収容された第1試薬容器とは異なる第2試薬容器に収容された溶血剤を混合することにより第2測定試料を調製するように構成されている。
【0018】
上記第1の局面による血液分析装置において、好ましくは、溶血剤は、カチオン性界面活性剤を含む。
【0019】
上記第1の局面による血液分析装置において、好ましくは、第1光情報生成部は、蛍光情報として、少なくとも、測定試料中の好酸球の自家蛍光の強度に応じた蛍光情報を生成するように構成されている。
【0020】
上記第1の局面による血液分析装置において、好ましくは、第1光情報生成部は、光源と、光源から測定試料に光が照射されることにより生じる蛍光を受光し、受光強度に応じた蛍光情報を生成する蛍光受光部と、光源から測定試料に光が照射されることにより生じる散乱光を受光し、受光強度に応じた散乱光情報を生成する散乱光受光部とを含む。
【0021】
上記第1光情報生成部が蛍光受光部と散乱光受光部とを含む構成において、好ましくは、散乱光受光部は、測定試料に光が照射されることにより光源から照射された光の進行方向に沿って生じる前方散乱光を受光し、受光強度に応じた前方散乱光情報を、散乱光情報のうちの第1情報として生成する第1受光部と、測定試料に光が照射されることにより光源から照射された光の進行方向に略垂直な方向に沿って生じる側方散乱光を受光し、受光強度に応じた側方散乱光情報を、散乱光情報のうちの第2情報として生成する第2受光部とを有する。
【0022】
この場合、好ましくは、制御部は、前方散乱光情報と蛍光情報とに基づいて、測定試料中の白血球を、少なくとも好酸球と好酸球以外の集団とに分類するように構成されている。
【0023】
上記第1光情報生成部が蛍光受光部と散乱光受光部とを含む構成において、好ましくは、光源は、350nm以上500nm以下の波長を有する光を照射するように構成されている。
【0024】
上記光源が所定範囲内の波長を有する光を照射する構成において、好ましくは、光源は、青紫色半導体レーザ素子を有する。
【0025】
この発明の第2の局面による血液分析方法は、血液試料および溶血剤を含む第1測定試料と、血液試料および溶血剤と同じ溶血剤を含む第2測定試料とを調製するステップと、第1測定試料から、蛍光情報と、少なくとも2種類の散乱光情報とを生成するステップと、第2測定試料から、透過光情報または散乱光情報の少なくとも一方を生成するステップと、第1測定試料から生成された蛍光情報と2種類の散乱光情報とに基づいて、第1測定試料中の白血球を、少なくとも、単球と、好中球と、好酸球と、他の集団との4つに分類するステップと、第2測定試料から生成された透過光情報または散乱光情報の少なくとも一方に基づいて、第2測定試料中のヘモグロビン濃度を取得するステップとを備える。
【図面の簡単な説明】
【0026】
【図1】本発明の一実施形態による血液分析装置の概略構成を示す正面図である。
【図2】図1に示した一実施形態による血液分析装置の構成を示すブロック図である。
【図3】図1に示した一実施形態による血液分析装置の測定ユニットを示す斜視図である。
【図4】図1に示した一実施形態による血液分析装置の測定ユニットの内部構造を示す斜視図である。
【図5】図1に示した一実施形態による血液分析装置の測定ユニットの内部構造を示す側面図である。
【図6】図1に示した一実施形態による血液分析装置の測定ユニットに設けられたフローセルの構成を模式的に示す斜視図である。
【図7】図1に示した一実施形態による血液分析装置の測定ユニットに設けられたWBC分類測定部の構成を示す概略図である。
【図8】図1に示した一実施形態による血液分析装置の測定ユニットに設けられたDC測定部の構成を模式的に示す斜視図である。
【図9】図1に示した一実施形態による血液分析装置の測定ユニットに設けられたHGB測定部の構成を模式的に示す斜視図である。
【図10】図1に示した一実施形態による血液分析装置に用いられる溶血剤の組成を示す図である。
【図11】図1に示した一実施形態による血液分析装置に用いられるマラリア検出用の染色液の組成を示す図である。
【図12】図1に示した一実施形態による血液分析装置における試料分析処理を示すフローチャートである。
【図13】図1に示した一実施形態による血液分析装置に用いられる第3測定試料および第2測定試料の作成工程を説明するための図である。
【図14】図1に示した一実施形態による血液分析装置において作成される白血球の粒度分布図である。
【図15】図1に示した一実施形態による血液分析装置において作成される白血球分類用のスキャッタグラムである。
【図16】図1に示した一実施形態による血液分析装置において作成される白血球分類用のスキャッタグラムである。
【図17】図1に示した一実施形態による血液分析装置において作成されるマラリア分類用のスキャッタグラムである。
【図18】図1に示した一実施形態による血液分析装置において、カチオン性界面活性剤のWBC(分類用)測定試料における濃度が2.15mMである溶血剤を用いた場合の実験結果を示した図である。
【図19】図1に示した一実施形態による血液分析装置において、カチオン性界面活性剤のWBC(分類用)測定試料における濃度が2.15mMである溶血剤を用いた場合の実験結果を示した図である。
【図20】図1に示した一実施形態による血液分析装置において、カチオン性界面活性剤のWBC(分類用)測定試料における濃度が0.62mMである溶血剤を用いた場合の実験結果を示した図である。
【図21】図1に示した一実施形態による血液分析装置において、カチオン性界面活性剤のWBC(分類用)測定試料における濃度が0.62mMである溶血剤を用いた場合の実験結果を示した図である。
【図22】図1に示した一実施形態による血液分析装置において、図10に示した溶血剤を用いた場合の実験結果を示した図である。
【図23】図1に示した一実施形態による血液分析装置において、図10に示した溶血剤を用いた場合の実験結果を示した図である。
【図24】複数の血液試料について、後述の実施形態に記載の方法(試薬は、後述の実施形態に記載の試薬と同様のものを使用した)により得られた測定結果と、同じ検体について、多項目自動血液分析装置XE−2100(シスメックス株式会社)により得られた測定結果との相関を示すヘモグロビンについての相関図である。
【図25】複数の血液試料について、後述の実施形態に記載の方法(試薬は、後述の実施形態に記載の試薬と同様のものを使用した)により得られた測定結果と、同じ検体について、多項目自動血液分析装置XE−2100(シスメックス株式会社)により得られた測定結果との相関を示すリンパ球と好塩基球との集団についての相関図である。
【図26】複数の血液試料について、後述の実施形態に記載の方法(試薬は、後述の実施形態に記載の試薬と同様のものを使用した)により得られた測定結果と、同じ検体について、多項目自動血液分析装置XE−2100(シスメックス株式会社)により得られた測定結果との相関を示す単球についての相関図である。
【図27】複数の血液試料について、後述の実施形態に記載の方法(試薬は、後述の実施形態に記載の試薬と同様のものを使用した)により得られた測定結果と、同じ検体について、多項目自動血液分析装置XE−2100(シスメックス株式会社)により得られた測定結果との相関を示す好中球についての相関図である。
【図28】複数の血液試料について、後述の実施形態に記載の方法(試薬は、後述の実施形態に記載の試薬と同様のものを使用した)により得られた測定結果と、同じ検体について、多項目自動血液分析装置XE−2100(シスメックス株式会社)により得られた測定結果との相関を示す好酸球についての相関図である。
【発明を実施するための形態】
【0027】
以下、本発明の実施形態を図面に基づいて説明する。
【0028】
まず、図1〜図11を参照して、本発明の一実施形態による血液分析装置1の構成について説明する。
【0029】
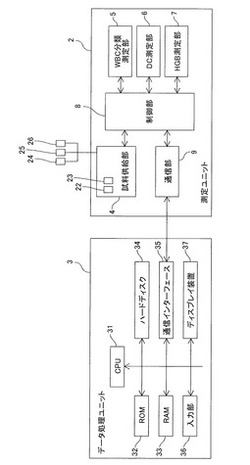
本実施形態による血液分析装置1は、図1に示すように、血液検査に使用される装置であり、測定ユニット2と、データ処理ユニット3とによって主として構成されている。また、血液分析装置1は、たとえば、病院または病理検査施設などの医療機関の施設内に設置されている。また、血液分析装置1では、測定ユニット2により血液試料中に含まれる成分について所定の測定を行い、この測定データをデータ処理ユニット3で受信して分析処理を行っている。そして、測定ユニット2とデータ処理ユニット3とは、互いにデータ通信可能なように、データ伝送ケーブル3aにより接続されている。なお、測定ユニット2とデータ処理ユニット3とは、データ伝送ケーブル3aにより直接接続される構成であってもよいし、たとえば、電話回線を使用した専用回線、LANまたはインターネットなどの通信ネットワークを介して接続されていてもよい。
【0030】
測定ユニット2は、図2に示すように、試料供給部4と、WBC分類測定部5と、DC測定部6と、HGB測定部7と、制御部8と、通信部9とを含んでいる。また、図3に示すように、測定ユニット2の正面右下部分には、血液試料を収容した採血管20をセット可能に構成された採血管セット部2aが設けられている。この採血管セット部2aは、その近傍に設けられたボタンスイッチ2bをユーザが押下することにより、手前方向に迫り出すように構成されている。ユーザは、採血管セット部2aが迫り出した状態で採血管20をセットすることが可能である。そして、採血管20をセットした後、ユーザが再度ボタンスイッチ2bを押下することにより、採血管セット部2aは測定ユニット2の内部に戻されるように構成されている。
【0031】
測定ユニット2の内部には、図4および図5に示すように、測定試料を吸引するピペット21、および、血液試料と試薬とを混合調製するためのチャンバ22、23(図5参照)などが設けられている。ピペット21は、上下方向に延びた管状に形成されており、その先端は鋭く尖っている。また、ピペット21は、図示しないシリンジポンプに連結されており、このシリンジポンプの動作によって液体を所定量だけ吸引するとともに、吐出することが可能なように構成されている。また、ピペット21は、移動機構に接続されており、上下方向および前後方向にそれぞれ移動可能に構成されている。また、ピペット21は、採血管20を密閉するゴム製のキャップ20aに、鋭利な先端を穿刺することにより、採血管20に収容された血液試料を吸引するように構成されている。また、ピペット21は、血液試料を吸引した後、移動機構により所定の位置まで移動され、チャンバ22および23内に血液試料を供給するように構成されている。
【0032】
試料供給部4は、チャンバ22および23、複数の電磁弁、ダイヤフラムポンプなどを有する流体ユニットである。チャンバ22は、赤血球、血小板の測定、およびヘモグロビン濃度の測定に用いられる測定試料を調製するために設けられている。また、チャンバ23は、白血球の測定に用いられる測定試料を調製するために設けられている。また、試料供給部4により構成される流体ユニットには、試薬容器が接続されている。具体的には、希釈液を収容するための希釈液容器24、溶血剤100を収容するための溶血剤容器25およびマラリア検出用の測定試料に用いられる染色液を収容するための染色液容器26が流体ユニットに接続されている。これにより、希釈液および溶血剤100をチャンバ22に供給することが可能であるとともに、希釈液、溶血剤100および染色液をチャンバ23に供給することが可能である。
【0033】
WBC分類測定部5は、光学式のフローサイトメータであり、半導体レーザ光を用いたフローサイトメトリー法により、白血球分類検出およびマラリア検出を行うために設けられている。また、WBC分類測定部5は、測定試料の液流を形成するフローセル51(図6参照)を有している。フローセル51は、透光性を有する石英、ガラス、合成樹脂などの材料によって管状に構成されており、その内部が測定試料およびシース液(希釈液)が通流する流路となっている。このフローセル51には、内部空間が他の部分よりも細く絞り込まれたオリフィス51aが設けられている。また、オリフィス51aの入口付近は二重管構造となっており、その内側管部分は試料ノズル51bとなっている。また、試料ノズル51bの外側の空間はシース液(希釈液)が通流する流路51cであり、シース液(希釈液)は、流路51cを通流し、オリフィス51aに導入される。このようにフローセル51に供給されたシース液(希釈液)は、試料ノズル51bから吐出された測定試料を取り囲むように流れる。そして、オリフィス51aによって測定試料の流れが細く絞り込まれ、測定試料に含まれる白血球、赤血球などの粒子がシース液(希釈液)に取り囲まれて1つずつオリフィス51aを通過する。
【0034】
また、WBC分類測定部5には、半導体レーザ光源52が、フローセル51のオリフィス51aへ向けてレーザ光を出射するように配置されている。この半導体レーザ光源52は、青紫色半導体レーザ素子52aを有し、波長が約405nmの青紫色レーザ光を出射することが可能なように構成されている。半導体レーザ光源52に青紫色半導体レーザ素子52aを設けることによって、容易に、短波長(約405nm)の光を測定試料に照射することが可能となる。また、半導体レーザ光源52とフローセル51との間には、複数のレンズからなる照射レンズ系53が配置されている。この照射レンズ系53によって、半導体レーザ光源52から出射された平行ビームがビームスポットに集束されるようになっている。また、半導体レーザ光源52から直線的に延びた光軸上には、フローセル51を挟んで照射レンズ系53に対向するように、ビームストッパ54aが設けられており、ビームストッパ54aは、半導体レーザ光源52からの直接光を遮光するように構成されている。
【0035】
また、ビームストッパ54aのさらに光軸下流側には、フォトダイオード54が配置されている。フォトダイオード54は、フローセル51を流れる測定試料により生じるレーザ光の散乱光を受光するように構成されている。具体的には、半導体レーザ光源52から直線的に延びた光軸に沿って進行する光のうち、半導体レーザ光源52の直接光はビームストッパ54aによって遮断されるので、フォトダイオード54は、概ね光軸方向に沿って進行する散乱光(以下、前方散乱光という)のみを受光するように構成されている。また、フォトダイオード54は、フローセル51から発せられた前方散乱光を光電変換し、これによって生じた電気信号(以下、前方散乱光信号という)をアンプ54bに伝達するように構成されている。そして、アンプ54bは、伝達された前方散乱光信号を増幅し、制御部8に出力するように構成されている。
【0036】
また、フローセル51の側方であって、半導体レーザ光源52からフォトダイオード54へ直線的に延びる光軸に対して直交する方向には、側方集光レンズ55が配置されており、この側方集光レンズ55は、フローセル51内を通過する血球にレーザ光を照射したときに発生する側方光(前記光軸に対して交差する方向へ出射される光)を集光するように構成されている。側方集光レンズ55の下流側にはダイクロイックミラー56が設けられており、ダイクロイックミラー56は、側方集光レンズ55から送られる信号光を散乱光成分と蛍光成分とに分けるように構成されている。ダイクロイックミラー56の側方(側方集光レンズ55とダイクロイックミラー56とを結ぶ光軸方向に交差する方向)には、側方散乱光受光用のフォトダイオード57が設けられており、ダイクロイックミラー56の光軸下流側には、光学フィルタ58aおよびアバランシェフォトダイオード58が設けられている。また、フォトダイオード57は、ダイクロイックミラー56で分けられた側方散乱光成分を光電変換し、これによって生じた電気信号(以下、側方散乱光信号という)をアンプ57aに伝達するように構成されている。そして、アンプ57aは、伝達された側方散乱光信号を増幅し、制御部8に出力するように構成されている。
【0037】
また、アバランシェフォトダイオード58は、光学フィルタ58aにより波長選択された後の側方蛍光成分を光電変換し、これによって生じた電気信号(側方蛍光信号)をアンプ58bに伝達するように構成されている。そして、アンプ58bは、伝達された側方蛍光信号を増幅し、制御部8に出力するように構成されている。
【0038】
DC測定部6は、シースフローDC検出法により、赤血球数(RBC)および血小板数(PLT)を測定することが可能なように構成されている。また、DC測定部6は、赤血球パルス波高値検出法により、ヘマトクリット値(HCT)を算出するための測定データも得ることが可能に構成されている。さらに、DC測定部6は、リンパ球比率を算出するための白血球数(WBC)検出にも用いられる。このようにDC測定部6を、赤血球数および血小板数の測定と、ヘマトクリット値(HCT)を算出するための測定データの取得と、リンパ球比率を算出するための白血球数(WBC)検出とに共通に用いることによって、これらの項目を測定するために別々の測定部を設ける必要がない。また、DC測定部6は、フローセルを有しており、このフローセルにチャンバ22から測定試料が移送されるようになっている。たとえば、赤血球数および血小板数の測定を行う場合には、図8に示すように、チャンバ22において血液試料と希釈液とが混合調製された測定試料が、シース液(希釈液)とともに試料供給部4からフローセルに移送される。そして、フローセル内では、測定試料がシース液(希釈液)によって取り囲まれた状態の液流が形成される。
【0039】
HGB測定部7は、メトヘモグロビン法により、血色素量(HGB)を測定するように構成されている。HGB測定部7は、図9に示すように、希釈試料を収容するセルを有しており、このセルにチャンバ22から測定試料が移送されるようになっている。そして、HGB測定部7は、波長が約555nmの光を照射する発光ダイオードを有しており、上記セル中の測定試料に発光ダイオードからの光を照射することによって、その吸光度を測定するように構成されている。なお、ヘモグロビンの測定を行う場合には、チャンバ22において、血液試料、希釈液および溶血剤100が混合され測定試料が調製される。
【0040】
制御部8は、CPU、ROM、RAMなどから構成されており、測定ユニット2の各部の動作制御を行うように構成されている。
【0041】
通信部9は、たとえば、RS−232Cインタフェース、USBインタフェース、Ethernet(登録商標)インタフェースであり、データ処理ユニット3との間でデータの送受信を行うことが可能なように構成されている。
【0042】
データ処理ユニット3は、図2に示すように、CPU31、ROM32、RAM33、ハードディスク34、通信インタフェース35、キーボードおよびマウスなどの入力部36、およびディスプレイ装置37を備えるコンピュータによって構成されている。データ処理ユニット3のハードディスク34には、オペレーティングシステムと、測定ユニット2から受信した測定データを分析処理するためのアプリケーションプログラムがインストールされている。
【0043】
ここで、本実施形態では、データ処理ユニット3のCPU31は、このアプリケーションプログラムを実行することにより、測定データを分析処理し、白血球数(WBC)、赤血球数(RBC)、血色素量(HGB)、ヘマトクリット値(HCT)、平均赤血球容積(MCV)、平均赤血球血色素量(MCH)、平均赤血球血色素濃度(MCHC)、血小板数(PLT)を算出するように構成されている。さらに、CPU31は、前方散乱光信号、側方散乱光信号、側方蛍光信号を用いてスキャッタグラムを作成して、白血球を好中球(Neut)、リンパ球、単球(Mono)、好酸球(EO)、好塩基球(BASO)の5つに分類するように構成されている。
【0044】
通信インタフェース35は、たとえば、RS−232Cインタフェース、USBインタフェース、Ethernet(登録商標)インタフェースであり、測定ユニット2との間でデータの送受信を行うことが可能に構成されている。
【0045】
また、本実施形態における溶血剤100は、図10に示すように、カチオン性界面活性剤(ラウリルトリメチルアンモニウムクロライド;34.1mM、ステアリルトリメチルアンモニウムクロライド;1.7mM)を含み、かつ、標識物質を含んでいない。標識物質とは、測定対象となる細胞に選択的に付与され、測定のための標識となる物質であり、たとえば、測定対象の細胞の核酸を染色する蛍光色素が該当する。また、この溶血剤100は、血液中のヘモグロビンをメトヘモグロビンへと転化する性質を有している。また、後述するように、各測定に用いられる各測定試料は、それぞれ、溶血剤100の希釈倍率、および、血液試料の希釈倍率が異なっている。このようにカチオン性界面活性剤を用いることによって、組成が異なる2種類以上の溶血剤を用いることなく希釈倍率を変えるだけで、測定試料中の白血球を4つに分類し、かつ、測定試料中のヘモグロビン濃度を取得することが可能である。また、染色液は、図11に示す化学式の構造を有する蛍光色素(たとえば、Invitrogen社のヘキスト34580)と、図11に示すノニオン界面活性剤群のうちの1つとを含有している。この蛍光色素は、半導体レーザ光源52aから出射される青紫色レーザ光(波長が約405nm)により励起可能である。
【0046】
次に、図12〜図17を参照して、本発明の一実施形態による血液分析装置1における試料分析処理について説明する。
【0047】
まず、血液分析装置1が起動されると、アプリケーションプログラムなどの初期化が行われた後、ステップS1において、データ処理ユニット3のCPU31により、ユーザからの測定開始指示があったか否かが判断され、指示があるまでこの判断が繰り返される。そして、測定開始指示があった場合には、ステップS2において、データ処理ユニット3から測定ユニット2に測定開始指示信号が送信される。
【0048】
そして、ステップS21において、測定ユニット2の制御部8により、測定開始指示信号が受信されたか否かが判断され、受信するまでこの判断が繰り返される。測定ユニット2が測定開始指示信号を受信すると、ステップS22において、ピペット21により、採血管セット部2aにセットされた採血管20から血液試料が吸引される。
【0049】
そして、ステップS23において、試料供給部4により、RBC/PLT測定試料(以下、第3測定試料という)が調製される。具体的には、図13に示すように、希釈液容器24から所定量(たとえば、2.0mL)の希釈液、および、ピペット21により採血管20から吸引された所定量(たとえば、6μL)の血液試料がチャンバ22に供給され、攪拌される。これにより、所定量(たとえば、2.0mL)の第3測定試料が調製される。その後、ステップS24において、チャンバ22内の第3測定試料の一部(たとえば、1mL)が、シース液(希釈液)とともにDC測定部6に移送されるとともに、DC測定部6により、第3測定試料のRBCおよびPLT検出が行われる。
【0050】
次に、ステップS25において、試料供給部4により、WBC(DC検出用)・HGB測定試料(以下、第2測定試料という)が調製される。具体的には、図13に示すように、所定量(たとえば、1mL)の第3測定試料が残存するチャンバ22に、溶血剤容器25から所定量(たとえば、0.5mL)の溶血剤100が供給され、攪拌される。すなわち、チャンバ22において血液試料と希釈液とが混合された後、溶血剤100が混合されて第2測定試料が調製される。これにより、溶血剤は希釈液により希釈された状態で血液試料に混合されるので、血液試料が所望の濃度よりも高い濃度の溶血剤と混合されるのを抑制することが可能である。このように溶血剤100が3倍に希釈(溶血剤/希釈液=1/2)され、血液試料が500倍に希釈された第2測定試料が調製される。また、これにより、赤血球が溶血されるとともに、ヘモグロビンがメトヘモグロビンへと転化される。また、第2測定試料における溶血剤100の希釈倍率(3倍)を、後述する第1測定試料における溶血剤100の希釈倍率(25倍)よりも小さくすることによって、測定試料中の赤血球を確実に溶血することができるので、精度よくヘモグロビン濃度を取得することが可能となる。その後、ステップS26において、チャンバ22内の第2測定試料がDC測定部6に移送されて、第2測定試料のWBC測定が行われる。また、ステップS27において、第2測定試料がHGB測定部7に移送されて、第2測定試料のHGB検出が行われる。
【0051】
そして、ステップS28において、試料供給部4により、WBC(分類用)測定試料(以下、第1測定試料という)が調製される。具体的には、上記した第2測定試料に含まれるのと同じ溶血剤100が25倍に希釈(溶血剤/希釈液=1/24)された所定量(たとえば、1mL)の希釈溶血剤、および、採血管20から吸引された所定量(たとえば、10μL)の血液試料がチャンバ23に供給され、攪拌される。これにより、血液試料が100倍に希釈された第1測定試料が調製される。また、これにより、溶血剤容器25に収容された共通の溶血剤100を用いて、第1測定試料および第2測定試料を調製することが可能となる。その後、ステップS29において、チャンバ23内の第1測定試料が、シース液(希釈液)とともにWBC分類測定部5に移送されるとともに、WBC分類測定部5により、第1測定試料のWBC検出が行われる。
【0052】
次に、ステップS30において、試料供給部4により、マラリア測定試料(以下、第4測定試料という)が調製される。具体的には、溶血剤100が9倍希釈(溶血剤/希釈液=1/8)された所定量(たとえば、1mL)の希釈溶血剤、採血管20から吸引された所定量(たとえば、10μL)の血液試料、および、染色液容器26から所定量(たとえば、10μL)の染色液がチャンバ23に供給され、攪拌される。これにより、血液試料が100倍に希釈された第4測定試料が調製される。その後、ステップS31において、チャンバ23内の第4測定試料が、シース液(希釈液)とともにWBC分類測定部5に移送されるとともに、WBC分類測定部5により、第4測定試料のマラリア検出が行われる。そして、ステップS32において、各検出部において測定された測定データが、測定ユニット2からデータ処理ユニット3に送信される。
【0053】
データ処理ユニット3では、ステップS3において、測定ユニット2が送信した測定データが受信されたか否かが判断され、受信するまでこの判断が繰り返される。そして、測定データを受信すると、ステップS4において、CPU31により、ステップS26で測定されたWBC検出による測定データに基づいて、白血球数(WBC)が算出される。また、ステップS5において、CPU31により、WBC検出による測定データに基づいて、図14に示すように、白血球の粒度分布図が作成され、白血球数(WBC)に対するリンパ球比率が算出される。なお、リンパ球は、粒度分布図において、左から1つ目の山(集団)として現れる。
【0054】
次に、ステップS6において、CPU31により、ステップS29で測定されたWBC分類検出による測定データに基づいて、白血球がリンパ球と好塩基球との集団、単球および顆粒球(好中球と好酸球との集団)の3つに分類される。具体的には、CPU31は、前方散乱光信号および側方散乱光信号を用いて、図15に示すように、スキャッタグラムを作成し、このスキャッタグラムから、リンパ球と好塩基球との集団、単球および顆粒球(好中球と好酸球との集団)のそれぞれの白血球数(WBC)に対する比率を算出する。ここで、図22には、実際に被験者から採取した血液試料を、本実施形態における溶血剤100(図10参照)を用いて測定し、その結果得られた前方散乱光信号および側方散乱光信号によるスキャッタグラムを示す。図22に示すように、実際の測定結果においても、スキャッタグラム上で、白血球をリンパ球と好塩基球との集団、単球および顆粒球(好中球と好酸球との集団)の3つに分類することが可能であることが分かる。
【0055】
そして、ステップS7において、CPU31により、WBC分類検出による測定データに基づいて、白血球が好酸球および好酸球以外の集団の2つに分類される。具体的には、CPU31は、前方散乱光信号および側方蛍光信号を用いて、図16に示すように、スキャッタグラムを作成し、このスキャッタグラムから、白血球数(WBC)に対する好酸球比率を算出する。この側方蛍光信号は、半導体レーザ光源52から出射された青紫色レーザ光(波長が約405nm)により励起された白血球の自家蛍光に基づくものであり、好酸球は、白血球の好酸球以外の集団よりも強い蛍光強度を有している。このように本実施形態では、標識物質を用いることなく、白血球を好酸球と好酸球以外の集団とに分類することが可能である。なお、CPU31は、側方散乱光信号および側方蛍光信号によるスキャッタグラムから、白血球数(WBC)に対する好酸球比率を算出することも可能である。ここで、図23には、実際に被験者から採取した血液試料を、本実施形態における溶血剤100(図10参照)を用いて測定し、その結果得られた前方散乱光信号および側方蛍光信号によるスキャッタグラムを示す。図23に示すように、実際の測定結果においても、スキャッタグラム上で、好酸球と好酸球以外の集団とに分類することが可能であることが分かる。
【0056】
その後、ステップS8において、CPU31により、ステップS6で算出された顆粒球(好中球と好酸球との集団)比率から、ステップS7で算出された好酸球比率を差し引くことによって、白血球数(WBC)に対する好中球比率が算出される。これにより、白血球がリンパ球と好塩基球との集団、単球、好中球および好酸球の4つに分類される。そして、ステップS9において、CPU31により、リンパ球と好塩基球との集団の比率から、ステップS5で算出されたリンパ球比率を差し引くことによって、白血球数(WBC)に対する好塩基球比率が算出される。これにより、白血球がリンパ球、好塩基球、単球、好中球および好酸球の5つに分類される。
【0057】
そして、ステップS10において、CPU31により、ステップS31で測定されたマラリア検出による測定データに基づいて、マラリア原虫感染赤血球がマラリア原虫感染赤血球以外の集団から分類される。具体的には、CPU31は、前方散乱光信号および側方蛍光信号を用いて、図17に示すように、スキャッタグラムを作成し、このスキャッタグラムから、マラリア原虫感染赤血球をマラリア原虫感染赤血球以外の集団から分類する。これにより、マラリア感染の有無を判断することが可能となる。
【0058】
次に、ステップS11において、CPU31により、ステップS24で測定されたRBC/PLT検出による測定データに基づいて、赤血球数(RBC)、血小板数(PLT)およびヘマトクリット値(HCT)が算出される。
【0059】
ここで、本実施形態では、ステップS12において、CPU31により、ステップS27で測定されたHGB検出による測定データに基づいて、血色素量(HGB)が算出される。すなわち、SLSヘモグロビン法を用いたHGB検出により得られた吸光度に基づいて、ヘモグロビン濃度が算出される。
【0060】
その後、ステップS13において、上記のように算出された赤血球数(RBC)、ヘマトクリット値(HCT)および血色素量(HGB)から、CPU31により、平均赤血球容積(MCV)、平均赤血球血色素量(MCH)および平均赤血球血色素濃度(MCHC)が算出される。各値の算出式をそれぞれ以下の式(1)〜(3)に示す。
【0061】
MCV=(HCT/RBC)×1000・・・・・(1)
上記式(1)において、MCVは平均赤血球容積(fL)、HCTはヘマトクリット値(%)、RBCは赤血球数(×104/μL)をそれぞれ表す。
【0062】
MCH=(HGB/RBC)×1000・・・・・(2)
上記式(2)において、MCHは平均赤血球血色素量(pg)、HGBは血色素量(g/dL)、RBCは赤血球数(×104/μL)をそれぞれ表す。
【0063】
MCHC=(HGB/HCT)×100・・・・・(3)
上記式(3)において、MCHCは平均赤血球血色素濃度(g/dL)、HGBは血色素量(g/dL)、HCTはヘマトクリット値(%)をそれぞれ表す。
【0064】
そして、ステップS14において、上記のように算出された、白血球数(WBC)、赤血球数(RBC)、血色素量(HGB)、ヘマトクリット値(HCT)、平均赤血球容積(MCV)、平均赤血球血色素量(MCH)、平均赤血球血色素濃度(MCHC)、血小板数(PLT)の算出結果がディスプレイ装置37に出力される。さらに、白血球数(WBC)に対する好中球比率、リンパ球比率、単球比率、好酸球比率および好塩基球比率がディスプレイ装置37に出力されるとともに、マラリア検出の結果も出力される。なお、白血球数(WBC)に対する各血球比率に加えて、白血球数(WBC)および各血球比率に基づいて算出された好中球数、リンパ球数、単球数、好酸球数および好塩基球数が出力される。
【0065】
その後、ステップS15において、ユーザからのシャットダウン指示の有無が判断され、指示がない場合には、ステップS1に移行される。シャットダウン指示があった場合には、血液分析装置1における試料分析処理のデータ処理ユニット3の動作が終了される。また、測定ユニット2側では、ステップS32で測定データをデータ処理ユニット3に送信した後、ステップS33において、ユーザからのシャットダウン指示があったか否かが判断され、指示がない場合には、ステップS21に移行される。シャットダウン指示があった場合には、血液分析装置1における試料分析処理の測定ユニット2の動作が終了される。
【0066】
本実施形態では、上記のように、血液試料と標識物質を含まない溶血剤100とから調製された測定試料から、側方蛍光信号、前方散乱光信号および側方散乱光信号を生成するWBC分類測定部5を設けることによって、測定試料に対して標識を行うことなく、測定試料中の好酸球の自家蛍光を利用して、側方蛍光信号、前方散乱光信号および側方散乱光信号を得ることができる。また、側方蛍光信号、前方散乱光信号および側方散乱光信号に基づいて、測定試料中の白血球を、単球、好中球、好酸球、および、リンパ球と好塩基球との集団の4つに分類するCPU31を設けることによって、標識物質を用いることなく白血球を4つに分類することができるので、溶血剤100に標識物質を含める必要がない。これにより、標識物質を含まない簡易な組成の溶血剤100を用いて測定試料中の白血球を4つに分類することができる。
【0067】
また、本実施形態では、シースフローDC検出法により血球測定を行うDC測定部6を設け、CPU31を、DC測定部6による測定データに基づいて、測定試料中の白血球をリンパ球とリンパ球以外の集団とに分類するとともに、この分類結果と側方蛍光信号、前方散乱光信号および側方散乱光信号とに基づく分類結果とから、白血球をリンパ球、好塩基球、単球、好中球および好酸球の5つに分類するように構成することによって、標識物質を含まない簡易な組成の溶血剤100を用いながら、測定試料中の白血球を5つに分類することができる。
【0068】
また、本実施形態による血液分析方法では、上記のように、標識物質を含まない測定試料から、側方蛍光信号、前方散乱光信号および側方散乱光信号を生成するステップを設けることによって、測定試料に対して標識を行うことなく、測定試料中の好酸球の自家蛍光を利用して、側方蛍光信号、前方散乱光信号および側方散乱光信号を得ることができる。また、側方蛍光信号、前方散乱光信号および側方散乱光信号に基づいて、測定試料中の白血球を、単球、好中球、好酸球、および、リンパ球と好塩基球との集団の4つに分類するステップを設けることによって、標識物質を用いることなく白血球を4つに分類することができるので、溶血剤100に標識物質を含める必要がない。これにより、標識物質を含まない簡易な組成の溶血剤100を用いて測定試料中の白血球を4つに分類することができる。
【0069】
また、本実施形態による溶血剤100を用いる血液分析方法に、標識物質を含まない測定試料から、側方蛍光信号、前方散乱光信号および側方散乱光信号を生成するステップを設けることによって、測定試料に対して標識を行うことなく、測定試料中の好酸球の自家蛍光を利用して、側方蛍光信号、前方散乱光信号および側方散乱光信号を得ることができる。また、当該溶血剤100を用いる血液分析方法に、側方蛍光信号、前方散乱光信号および側方散乱光信号に基づいて、測定試料中の白血球を、単球、好中球、好酸球、および、リンパ球と好塩基球との集団の4つに分類するステップを設けることによって、標識物質を用いることなく白血球を4つに分類することができるので、溶血剤100に標識物質を含める必要がない。このように、標識物質を含まない簡易な組成の溶血剤100を用いて、測定試料中の白血球を4つに分類することができる。
【0070】
また、本実施形態による標識物質を含まない溶血剤100を、上記のように、側方蛍光信号、前方散乱光信号および側方散乱光信号を用いて白血球を単球、好中球、好酸球、および、リンパ球と好塩基球との集団の4つに分類するために用いることによって、標識物質を用いることなく白血球を4つに分類することができるので、溶血剤100に標識物質を含める必要がない。すなわち、標識物質を含まない簡易な組成の溶血剤100を用いて、測定試料中の白血球を4つに分類することができる。
【0071】
また、本実施形態では、上記のように、WBC分類測定部5により血液試料および溶血剤100を含む第1測定試料から生成された側方蛍光信号、前方散乱光信号および側方散乱光信号に基づいて、第1測定試料中の白血球を、少なくとも、単球と、好中球と、好酸球と、他の集団との4つに分類し、HGB測定部7により血液試料および前記溶血剤100と同じ溶血剤100を含む第2測定試料から測定された吸光度に基づいて、第2測定試料中のヘモグロビン濃度を取得するCPU31とを設けることによって、白血球を4つに分類するための溶血剤とヘモグロビン濃度を取得するための溶血剤とを共通化することができるので、白血球分類およびヘモグロビン濃度取得を行うために組成の異なる2種類以上の溶血剤(試薬)を開発する必要がない。これにより、試薬の開発に起因するユーザへの負担を軽減しながら、測定試料中の白血球を4つに分類し、かつ、測定試料中のヘモグロビン濃度を取得することができる。
【0072】
また、本実施形態では、DC測定部6により得られた測定データに基づいて、第2測定試料中の白血球をリンパ球とリンパ球以外の集団とに分類するとともに、この分類結果と上記した白血球の4分類の分類結果とに基づいて、測定試料中の白血球を、少なくとも、リンパ球と、好塩基球と、単球と、好中球と、好酸球との5つに分類するようにCPU31を構成することによって、DC測定部6により、ヘモグロビン濃度を取得するために用いる測定試料と同じ第2測定試料を用いて、白血球をリンパ球とリンパ球以外の集団とに分類することができるので、組成の異なる測定試料を別途調製することなく、白血球を5つに分類することができる。
【0073】
また、本実施形態による血液分析方法では、上記のように、WBC分類測定部5により血液試料および溶血剤100を含む第1測定試料から生成された側方蛍光信号、前方散乱光信号および側方散乱光信号に基づいて、第1測定試料中の白血球を、少なくとも、単球と、好中球と、好酸球と、他の集団との4つに分類するステップと、HGB測定部7により血液試料および前記溶血剤100と同じ溶血剤100を含む第2測定試料から測定された吸光度に基づいて、第2測定試料中のヘモグロビン濃度を取得するステップとを設けることによって、白血球を4つに分類するための溶血剤とヘモグロビン濃度を取得するための溶血剤とを共通化することができるので、白血球分類およびヘモグロビン濃度取得を行うために組成の異なる2種類以上の溶血剤(試薬)を開発する必要がない。これにより、試薬の開発に起因するユーザへの負担を軽減しながら、測定試料中の白血球を4つに分類し、かつ、測定試料中のヘモグロビン濃度を取得することができる。
【0074】
また、本実施形態による溶血剤を、上記のように、WBC分類測定部5により血液試料および溶血剤100を含む第1測定試料から生成された側方蛍光信号、前方散乱光信号および側方散乱光信号に基づいて、第1測定試料中の白血球を、少なくとも、単球と、好中球と、好酸球と、他の集団との4つに分類するステップと、HGB測定部7により血液試料および前記溶血剤100と同じ溶血剤100を含む第2測定試料から測定された吸光度に基づいて、第2測定試料中のヘモグロビン濃度を取得するステップとを備える血液分析方法に用いることによって、白血球を4つに分類するための溶血剤とヘモグロビン濃度を取得するための溶血剤とを共通化することができるので、白血球分類およびヘモグロビン濃度取得を行うために組成の異なる2種類以上の溶血剤(試薬)を開発する必要がない。これにより、試薬の開発に起因するユーザへの負担を軽減しながら、測定試料中の白血球を4つに分類し、かつ、測定試料中のヘモグロビン濃度を取得することができる。
【0075】
また、本実施形態による溶血剤を、上記のように、カチオン性界面活性剤を含み、ヘモグロビン濃度を測定するために用いるとともに、白血球を少なくとも、リンパ球と、好塩基球と、単球と、好中球と、好酸球とに分類するために用いることによって、白血球を4つに分類するための溶血剤とヘモグロビン濃度を取得するための溶血剤とを共通化することができるので、白血球分類およびヘモグロビン濃度取得を行うために組成の異なる2種類以上の溶血剤(試薬)を開発する必要がない。これにより、試薬の開発に起因するユーザへの負担を軽減しながら、測定試料中の白血球を4つに分類し、かつ、測定試料中のヘモグロビン濃度を取得することができる。
【0076】
(実施例)
次に、図24〜図28を参照して、上記実施形態に記載の方法により得られた測定結果と、多項目自動血液分析装置XE−2100(シスメックス株式会社)により得られた測定結果との相関についての検証結果について説明する。上記実施形態に記載の方法による測定と多項目自動血液分析装置XE−2100による測定とは、複数の血液試料について、同じ検体について行った。なお、図24〜図28は、それぞれ、ヘモグロビン、リンパ球と好塩基球との集団、単球、好中球、および好酸球の測定結果の相関図を示している。また、図24〜図28では、それぞれ、縦軸に上記実施形態に記載の方法により得られた測定結果を、横軸に多項目自動血球分析装置XE−2100により得られた測定結果を示している。これらの図に示すように、相関係数rは、ヘモグロビンについては0.992、リンパ球と好塩基球との集団については0.968、単球については0.796、好中球については0.946、および、好酸球については0.892であり、いずれも高い相関を示す結果となった。
【0077】
なお、今回開示された実施形態は、全ての点で例示であって制限的なものではないと考えられるべきである。本発明の範囲は、上記した実施形態の説明ではなく特許請求の範囲によって示され、さらに特許請求の範囲と均等の意味および範囲内での全ての変更が含まれる。
【0078】
たとえば、上記実施形態では、WBC検出、HGB検出、WBC分類検出およびマラリア検出のために用いられる溶血剤を1つの溶血剤容器に収容する例を示したが、第1〜第4の局面による発明はこれに限らず、各検出用にそれぞれ別々の溶血剤を用意し、各溶血剤をそれぞれ別々の溶血剤容器に収容するようにしてもよい。この際、各検出に用いられる溶血剤は異なる種類の溶血剤であってもよい。また、各溶血剤容器に収容する溶血剤を、それぞれ予め所定の希釈倍率に希釈していてもよい。
【0079】
また、上記実施形態では、光源の一例として、青紫色半導体レーザ素子を有する半導体レーザ光源を示したが、本発明はこれに限らず、青色半導体レーザ素子またはアルゴンレーザ素子など、青紫色半導体レーザ素子以外のレーザ素子を有する光源であってもよい。
【0080】
また、上記実施形態では、光源の一例として、波長が約405nmの青紫色レーザ光を出射する半導体レーザ光源を示したが、第1〜第4の局面による発明はこれに限らず、350nm以上500nm以下の波長を有する光を出射する光源であれば、半導体レーザ光源以外の他の光源であってもよい。このように構成すれば、好酸球の自家蛍光に基づく蛍光情報を取得可能な短波長域の光を測定試料に照射することができる。
【0081】
また、上記実施形態では、試料分析処理において、早いものからRBC/PLT検出、WBC検出、HGB検出、WBC分類検出およびマラリア検出の順序で各検出処理を行う例を示したが、本発明はこれに限らず、試料分析処理において、上記以外の順序で各検出処理を行ってもよい。また、試料分析処理における、白血球分類処理、マラリア分類処理、赤血球数・血小板数算出処理、および、血色素量算出処理の順序も適宜変更可能である。
【0082】
また、上記実施形態では、WBC検出、HGB検出、WBC分類検出およびマラリア検出に共通に用いられる溶血剤を収容する1つの、試薬容器としての溶血剤容器を試料供給部に接続する例を示したが、第5〜第8の局面による発明はこれに限らず、各検出に用いる溶血剤をそれぞれ別々に収容するように4つの溶血剤容器を試料供給部に接続してもよいし、上記4つの検出のうち、いずれかに用いる溶血剤を共通の溶血剤容器に収容し、2つまたは3つの溶血剤容器を試料供給部に接続してもよい。また、5つ以上の溶血剤容器を試料供給部に接続してもよい。この際、各溶血剤容器に収容する溶血剤を、それぞれ予め所定の希釈倍率に希釈しておけば、各検出に用いる測定試料を調製する際に、溶血剤を所望の希釈倍率に希釈するための工程を別途設ける必要がない。
【0083】
また、上記実施形態では、溶血剤の一例として、標識物質を含まない溶血剤を示したが、第5〜第8の局面による発明はこれに限らず、溶血剤が標識物質を含んでいてもよい。
【0084】
また、上記実施形態では、第2光情報生成部の一例として、透過光情報としての吸光度を測定するHGB測定部を示したが、本発明はこれに限らず、散乱光情報を生成するHGB測定部であってもよい。この場合、データ処理ユニットのCPUは、HGB測定部により生成された散乱光情報に基づいてヘモグロビン濃度を取得する。
【0085】
また、上記実施形態では、溶血剤の一例として、アルキルトリメチルアンモニウム塩であって、アルキル基の炭素数が12以上18以下であるカチオン性界面活性剤(ラウリルトリメチルアンモニウムクロライド;34.1mM、ステアリルトリメチルアンモニウムクロライド;1.7mM)を含む溶血剤を示したが、本発明はこれに限らず、カチオン性界面活性剤(上記実施形態では、ラウリルトリメチルアンモニウムクロライドとステアリルトリメチルアンモニウムクロライドの合計)のWBC(分類用)測定試料における濃度が、0.62mM以上2.15mM以下であれば、上記以外の濃度のカチオン性界面活性剤を含む溶血剤であってもよい。なお、上記実施形態では、溶血剤を25倍希釈して測定試料を調製しているので、カチオン性界面活性剤のWBC(分類用)測定試料における濃度が0.62mMになるときのカチオン性界面活性剤の溶血剤における濃度は15.5mMであり、カチオン性界面活性剤のWBC(分類用)測定試料における濃度が2.15mMになるときのカチオン性界面活性剤の溶血剤における濃度は53.75mMである。また、上記の溶血剤に代えて、アルキル基の炭素数が8以上10以下であるカチオン性界面活性剤を用いれば、カチオン性界面活性剤のWBC(分類用)測定試料における濃度が2.15mM以上であっても測定可能である。
【0086】
ここで、本発明の一実施形態による血液分析装置において、溶血剤におけるカチオン性界面活性剤の濃度を変動させた場合の実験結果について説明する。実験では、溶血剤におけるカチオン性界面活性剤の濃度が微量ずつ異なる複数の実験結果を得たが、ここでは、代表して、カチオン性界面活性剤のWBC(分類用)測定試料における濃度が2.15mMである溶血剤を用いた場合、および、カチオン性界面活性剤のWBC(分類用)測定試料における濃度が0.62mMである溶血剤を用いた場合の2つの実験結果について説明する。
【0087】
図18および図20に示すように、スキャッタグラム上で、白血球をリンパ球と好塩基球との集団、単球および顆粒球(好中球と好酸球との集団)の3つに分類することが可能である。また、図19および図21に示すように、スキャッタグラム上で、好酸球と好酸球以外の集団とに分類することが可能である。また、これらの分類結果から白血球を、リンパ球と好塩基球との集団、単球、好中球および好酸球の4つに分類することが可能である。したがって、カチオン性界面活性剤のWBC(分類用)測定試料における濃度が0.62mM以上2.15mM以下の範囲においては、白血球を4分類することが可能であると考えられる。
【技術分野】
【0001】
本発明は、血液分析装置および血液分析方法に関する。
【背景技術】
【0002】
従来、白血球分類を行う血液分析装置が知られている。このような血液分析装置は、たとえば、特開2003−83960号公報および特開2005−257450号公報に開示されている。
【0003】
上記特開2003−83960号公報に記載の血液分析装置は、血液試料と試薬とから調製された測定試料中の白血球を検出する電気抵抗式検出部を備え、電気抵抗式検出部による検出結果に基づいて測定試料中の白血球を3つに分類するように構成されている。
【0004】
上記特開2005−257450号公報に記載の血液分析装置は、血液試料と試薬とから測定試料を調製する試料調製部と、前方散乱光、側方散乱光および蛍光を検出する光学系検出部とを備え、光学系検出部による検出結果に基づいて測定試料中の白血球を4つに分類するように構成されている。また、この光学系検出部では、蛍光標識された白血球の蛍光を検出している。
【0005】
しかしながら、上記特開2003−83960号公報の血液分析装置では、測定試料中の白血球を4つ以上に分類することができないという問題点がある。
【0006】
また、上記特開2005−257450号公報の血液分析装置では、血液試料中の白血球を4つに分類することが可能である一方、測定試料中の白血球に対して蛍光標識を行う必要があるので、標識物質を含む高価な試薬を用いる必要があるという不都合がある。このため、白血球を4つ以上に分類可能で、かつ、標識物質を含む試薬を用いる必要がない血液分析装置が望まれる。
【0007】
また、従来、白血球を分類し、ヘモグロビン濃度を取得する血液分析装置が知られている。このような血液分析装置は、たとえば、特開2006−292738号公報に開示されている。
【0008】
上記特開2006−292738号公報に記載の血液分析装置は、血液試料および白血球分類用試薬を含む測定試料を用いて、前方散乱光、側方散乱光および蛍光を測定し、測定試料中の白血球を4つに分類するように構成されている。また、この血液分析装置は、血液試料、および、白血球分類用試薬とは組成が異なる専用のヘモグロビン測定用試薬を含む測定試料を用いて、透過光を検出し、測定試料中のヘモグロビン濃度を取得するように構成されている。
【0009】
しかしながら、上記特開2006−292738号公報の血液分析装置では、白血球分類用試薬を用いて白血球を分類し、白血球分類用試薬とは組成が異なる専用のヘモグロビン測定用試薬を用いてヘモグロビン濃度を取得するので、白血球の分類およびヘモグロビン濃度の取得を行うために組成の異なる2種類の試薬を別々に開発する必要があり、その結果、試薬の価格が高騰し、ユーザに負担がかかるという問題点がある。
【発明の概要】
【0010】
この発明の第1の局面による血液分析装置は、血液試料および溶血剤を含む第1測定試料と、血液試料および溶血剤と同じ溶血剤を含む第2測定試料とを調製する試料調製部と、第1測定試料から、蛍光情報と、少なくとも2種類の散乱光情報とを生成する第1光情報生成部と、第2測定試料から、透過光情報または散乱光情報の少なくとも一方を生成する第2光情報生成部と、第1光情報生成部により生成された蛍光情報と2種類の散乱光情報とに基づいて、第1測定試料中の白血球を、少なくとも、単球と、好中球と、好酸球と、他の集団との4つに第1分類し、第2光情報生成部により生成された透過光情報または散乱光情報の少なくとも一方に基づいて、第2測定試料中のヘモグロビン濃度を取得する制御部とを備える。
【0011】
上記第1の局面による血液分析装置において、好ましくは、第2測定試料から、試料の電気情報を生成する電気情報生成部をさらに備え、制御部は、電気情報生成部により生成された電気情報に基づいて、第2測定試料中の白血球を少なくともリンパ球とリンパ球以外の集団とに第2分類するとともに、第1分類および第2分類の分類結果に基づいて、測定試料中の白血球を、少なくとも、リンパ球と、好塩基球と、単球と、好中球と、好酸球との5つに分類するように構成されている。
【0012】
この場合、好ましくは、試料調製部は、血液試料から第3測定試料をさらに調製し、電気情報生成部は、第3測定試料から、試料の電気情報を生成し、制御部は、電気情報生成部により第3測定試料から生成された電気情報に基づいて、第3測定試料中の赤血球数および血小板数を算出するように構成されている。
【0013】
上記第1の局面による血液分析装置において、好ましくは、第2測定試料における溶血剤の希釈倍率は、第1測定試料における溶血剤の希釈倍率と異なる。
【0014】
この場合、好ましくは、第2測定試料における溶血剤の希釈倍率は、第1測定試料における溶血剤の希釈倍率よりも小さい。
【0015】
上記第1の局面による血液分析装置において、好ましくは、試料調製部は、血液試料、所定の試薬容器に収容された溶血剤、および、所定量の希釈液を混合することにより第1測定試料を調製し、血液試料、所定の試薬容器に収容された溶血剤、および、所定量よりも少ない量の希釈液とを混合することにより第2測定試料を調製するように構成されている。
【0016】
この場合、好ましくは、試料調製部は、希釈液と血液試料とを混合した状態で、溶血剤を混合することにより第2測定試料を調製するように構成されている。
【0017】
上記第1の局面による血液分析装置において、好ましくは、試料調製部は、少なくとも血液試料、および、第1測定試料に用いられる溶血剤が収容された第1試薬容器とは異なる第2試薬容器に収容された溶血剤を混合することにより第2測定試料を調製するように構成されている。
【0018】
上記第1の局面による血液分析装置において、好ましくは、溶血剤は、カチオン性界面活性剤を含む。
【0019】
上記第1の局面による血液分析装置において、好ましくは、第1光情報生成部は、蛍光情報として、少なくとも、測定試料中の好酸球の自家蛍光の強度に応じた蛍光情報を生成するように構成されている。
【0020】
上記第1の局面による血液分析装置において、好ましくは、第1光情報生成部は、光源と、光源から測定試料に光が照射されることにより生じる蛍光を受光し、受光強度に応じた蛍光情報を生成する蛍光受光部と、光源から測定試料に光が照射されることにより生じる散乱光を受光し、受光強度に応じた散乱光情報を生成する散乱光受光部とを含む。
【0021】
上記第1光情報生成部が蛍光受光部と散乱光受光部とを含む構成において、好ましくは、散乱光受光部は、測定試料に光が照射されることにより光源から照射された光の進行方向に沿って生じる前方散乱光を受光し、受光強度に応じた前方散乱光情報を、散乱光情報のうちの第1情報として生成する第1受光部と、測定試料に光が照射されることにより光源から照射された光の進行方向に略垂直な方向に沿って生じる側方散乱光を受光し、受光強度に応じた側方散乱光情報を、散乱光情報のうちの第2情報として生成する第2受光部とを有する。
【0022】
この場合、好ましくは、制御部は、前方散乱光情報と蛍光情報とに基づいて、測定試料中の白血球を、少なくとも好酸球と好酸球以外の集団とに分類するように構成されている。
【0023】
上記第1光情報生成部が蛍光受光部と散乱光受光部とを含む構成において、好ましくは、光源は、350nm以上500nm以下の波長を有する光を照射するように構成されている。
【0024】
上記光源が所定範囲内の波長を有する光を照射する構成において、好ましくは、光源は、青紫色半導体レーザ素子を有する。
【0025】
この発明の第2の局面による血液分析方法は、血液試料および溶血剤を含む第1測定試料と、血液試料および溶血剤と同じ溶血剤を含む第2測定試料とを調製するステップと、第1測定試料から、蛍光情報と、少なくとも2種類の散乱光情報とを生成するステップと、第2測定試料から、透過光情報または散乱光情報の少なくとも一方を生成するステップと、第1測定試料から生成された蛍光情報と2種類の散乱光情報とに基づいて、第1測定試料中の白血球を、少なくとも、単球と、好中球と、好酸球と、他の集団との4つに分類するステップと、第2測定試料から生成された透過光情報または散乱光情報の少なくとも一方に基づいて、第2測定試料中のヘモグロビン濃度を取得するステップとを備える。
【図面の簡単な説明】
【0026】
【図1】本発明の一実施形態による血液分析装置の概略構成を示す正面図である。
【図2】図1に示した一実施形態による血液分析装置の構成を示すブロック図である。
【図3】図1に示した一実施形態による血液分析装置の測定ユニットを示す斜視図である。
【図4】図1に示した一実施形態による血液分析装置の測定ユニットの内部構造を示す斜視図である。
【図5】図1に示した一実施形態による血液分析装置の測定ユニットの内部構造を示す側面図である。
【図6】図1に示した一実施形態による血液分析装置の測定ユニットに設けられたフローセルの構成を模式的に示す斜視図である。
【図7】図1に示した一実施形態による血液分析装置の測定ユニットに設けられたWBC分類測定部の構成を示す概略図である。
【図8】図1に示した一実施形態による血液分析装置の測定ユニットに設けられたDC測定部の構成を模式的に示す斜視図である。
【図9】図1に示した一実施形態による血液分析装置の測定ユニットに設けられたHGB測定部の構成を模式的に示す斜視図である。
【図10】図1に示した一実施形態による血液分析装置に用いられる溶血剤の組成を示す図である。
【図11】図1に示した一実施形態による血液分析装置に用いられるマラリア検出用の染色液の組成を示す図である。
【図12】図1に示した一実施形態による血液分析装置における試料分析処理を示すフローチャートである。
【図13】図1に示した一実施形態による血液分析装置に用いられる第3測定試料および第2測定試料の作成工程を説明するための図である。
【図14】図1に示した一実施形態による血液分析装置において作成される白血球の粒度分布図である。
【図15】図1に示した一実施形態による血液分析装置において作成される白血球分類用のスキャッタグラムである。
【図16】図1に示した一実施形態による血液分析装置において作成される白血球分類用のスキャッタグラムである。
【図17】図1に示した一実施形態による血液分析装置において作成されるマラリア分類用のスキャッタグラムである。
【図18】図1に示した一実施形態による血液分析装置において、カチオン性界面活性剤のWBC(分類用)測定試料における濃度が2.15mMである溶血剤を用いた場合の実験結果を示した図である。
【図19】図1に示した一実施形態による血液分析装置において、カチオン性界面活性剤のWBC(分類用)測定試料における濃度が2.15mMである溶血剤を用いた場合の実験結果を示した図である。
【図20】図1に示した一実施形態による血液分析装置において、カチオン性界面活性剤のWBC(分類用)測定試料における濃度が0.62mMである溶血剤を用いた場合の実験結果を示した図である。
【図21】図1に示した一実施形態による血液分析装置において、カチオン性界面活性剤のWBC(分類用)測定試料における濃度が0.62mMである溶血剤を用いた場合の実験結果を示した図である。
【図22】図1に示した一実施形態による血液分析装置において、図10に示した溶血剤を用いた場合の実験結果を示した図である。
【図23】図1に示した一実施形態による血液分析装置において、図10に示した溶血剤を用いた場合の実験結果を示した図である。
【図24】複数の血液試料について、後述の実施形態に記載の方法(試薬は、後述の実施形態に記載の試薬と同様のものを使用した)により得られた測定結果と、同じ検体について、多項目自動血液分析装置XE−2100(シスメックス株式会社)により得られた測定結果との相関を示すヘモグロビンについての相関図である。
【図25】複数の血液試料について、後述の実施形態に記載の方法(試薬は、後述の実施形態に記載の試薬と同様のものを使用した)により得られた測定結果と、同じ検体について、多項目自動血液分析装置XE−2100(シスメックス株式会社)により得られた測定結果との相関を示すリンパ球と好塩基球との集団についての相関図である。
【図26】複数の血液試料について、後述の実施形態に記載の方法(試薬は、後述の実施形態に記載の試薬と同様のものを使用した)により得られた測定結果と、同じ検体について、多項目自動血液分析装置XE−2100(シスメックス株式会社)により得られた測定結果との相関を示す単球についての相関図である。
【図27】複数の血液試料について、後述の実施形態に記載の方法(試薬は、後述の実施形態に記載の試薬と同様のものを使用した)により得られた測定結果と、同じ検体について、多項目自動血液分析装置XE−2100(シスメックス株式会社)により得られた測定結果との相関を示す好中球についての相関図である。
【図28】複数の血液試料について、後述の実施形態に記載の方法(試薬は、後述の実施形態に記載の試薬と同様のものを使用した)により得られた測定結果と、同じ検体について、多項目自動血液分析装置XE−2100(シスメックス株式会社)により得られた測定結果との相関を示す好酸球についての相関図である。
【発明を実施するための形態】
【0027】
以下、本発明の実施形態を図面に基づいて説明する。
【0028】
まず、図1〜図11を参照して、本発明の一実施形態による血液分析装置1の構成について説明する。
【0029】
本実施形態による血液分析装置1は、図1に示すように、血液検査に使用される装置であり、測定ユニット2と、データ処理ユニット3とによって主として構成されている。また、血液分析装置1は、たとえば、病院または病理検査施設などの医療機関の施設内に設置されている。また、血液分析装置1では、測定ユニット2により血液試料中に含まれる成分について所定の測定を行い、この測定データをデータ処理ユニット3で受信して分析処理を行っている。そして、測定ユニット2とデータ処理ユニット3とは、互いにデータ通信可能なように、データ伝送ケーブル3aにより接続されている。なお、測定ユニット2とデータ処理ユニット3とは、データ伝送ケーブル3aにより直接接続される構成であってもよいし、たとえば、電話回線を使用した専用回線、LANまたはインターネットなどの通信ネットワークを介して接続されていてもよい。
【0030】
測定ユニット2は、図2に示すように、試料供給部4と、WBC分類測定部5と、DC測定部6と、HGB測定部7と、制御部8と、通信部9とを含んでいる。また、図3に示すように、測定ユニット2の正面右下部分には、血液試料を収容した採血管20をセット可能に構成された採血管セット部2aが設けられている。この採血管セット部2aは、その近傍に設けられたボタンスイッチ2bをユーザが押下することにより、手前方向に迫り出すように構成されている。ユーザは、採血管セット部2aが迫り出した状態で採血管20をセットすることが可能である。そして、採血管20をセットした後、ユーザが再度ボタンスイッチ2bを押下することにより、採血管セット部2aは測定ユニット2の内部に戻されるように構成されている。
【0031】
測定ユニット2の内部には、図4および図5に示すように、測定試料を吸引するピペット21、および、血液試料と試薬とを混合調製するためのチャンバ22、23(図5参照)などが設けられている。ピペット21は、上下方向に延びた管状に形成されており、その先端は鋭く尖っている。また、ピペット21は、図示しないシリンジポンプに連結されており、このシリンジポンプの動作によって液体を所定量だけ吸引するとともに、吐出することが可能なように構成されている。また、ピペット21は、移動機構に接続されており、上下方向および前後方向にそれぞれ移動可能に構成されている。また、ピペット21は、採血管20を密閉するゴム製のキャップ20aに、鋭利な先端を穿刺することにより、採血管20に収容された血液試料を吸引するように構成されている。また、ピペット21は、血液試料を吸引した後、移動機構により所定の位置まで移動され、チャンバ22および23内に血液試料を供給するように構成されている。
【0032】
試料供給部4は、チャンバ22および23、複数の電磁弁、ダイヤフラムポンプなどを有する流体ユニットである。チャンバ22は、赤血球、血小板の測定、およびヘモグロビン濃度の測定に用いられる測定試料を調製するために設けられている。また、チャンバ23は、白血球の測定に用いられる測定試料を調製するために設けられている。また、試料供給部4により構成される流体ユニットには、試薬容器が接続されている。具体的には、希釈液を収容するための希釈液容器24、溶血剤100を収容するための溶血剤容器25およびマラリア検出用の測定試料に用いられる染色液を収容するための染色液容器26が流体ユニットに接続されている。これにより、希釈液および溶血剤100をチャンバ22に供給することが可能であるとともに、希釈液、溶血剤100および染色液をチャンバ23に供給することが可能である。
【0033】
WBC分類測定部5は、光学式のフローサイトメータであり、半導体レーザ光を用いたフローサイトメトリー法により、白血球分類検出およびマラリア検出を行うために設けられている。また、WBC分類測定部5は、測定試料の液流を形成するフローセル51(図6参照)を有している。フローセル51は、透光性を有する石英、ガラス、合成樹脂などの材料によって管状に構成されており、その内部が測定試料およびシース液(希釈液)が通流する流路となっている。このフローセル51には、内部空間が他の部分よりも細く絞り込まれたオリフィス51aが設けられている。また、オリフィス51aの入口付近は二重管構造となっており、その内側管部分は試料ノズル51bとなっている。また、試料ノズル51bの外側の空間はシース液(希釈液)が通流する流路51cであり、シース液(希釈液)は、流路51cを通流し、オリフィス51aに導入される。このようにフローセル51に供給されたシース液(希釈液)は、試料ノズル51bから吐出された測定試料を取り囲むように流れる。そして、オリフィス51aによって測定試料の流れが細く絞り込まれ、測定試料に含まれる白血球、赤血球などの粒子がシース液(希釈液)に取り囲まれて1つずつオリフィス51aを通過する。
【0034】
また、WBC分類測定部5には、半導体レーザ光源52が、フローセル51のオリフィス51aへ向けてレーザ光を出射するように配置されている。この半導体レーザ光源52は、青紫色半導体レーザ素子52aを有し、波長が約405nmの青紫色レーザ光を出射することが可能なように構成されている。半導体レーザ光源52に青紫色半導体レーザ素子52aを設けることによって、容易に、短波長(約405nm)の光を測定試料に照射することが可能となる。また、半導体レーザ光源52とフローセル51との間には、複数のレンズからなる照射レンズ系53が配置されている。この照射レンズ系53によって、半導体レーザ光源52から出射された平行ビームがビームスポットに集束されるようになっている。また、半導体レーザ光源52から直線的に延びた光軸上には、フローセル51を挟んで照射レンズ系53に対向するように、ビームストッパ54aが設けられており、ビームストッパ54aは、半導体レーザ光源52からの直接光を遮光するように構成されている。
【0035】
また、ビームストッパ54aのさらに光軸下流側には、フォトダイオード54が配置されている。フォトダイオード54は、フローセル51を流れる測定試料により生じるレーザ光の散乱光を受光するように構成されている。具体的には、半導体レーザ光源52から直線的に延びた光軸に沿って進行する光のうち、半導体レーザ光源52の直接光はビームストッパ54aによって遮断されるので、フォトダイオード54は、概ね光軸方向に沿って進行する散乱光(以下、前方散乱光という)のみを受光するように構成されている。また、フォトダイオード54は、フローセル51から発せられた前方散乱光を光電変換し、これによって生じた電気信号(以下、前方散乱光信号という)をアンプ54bに伝達するように構成されている。そして、アンプ54bは、伝達された前方散乱光信号を増幅し、制御部8に出力するように構成されている。
【0036】
また、フローセル51の側方であって、半導体レーザ光源52からフォトダイオード54へ直線的に延びる光軸に対して直交する方向には、側方集光レンズ55が配置されており、この側方集光レンズ55は、フローセル51内を通過する血球にレーザ光を照射したときに発生する側方光(前記光軸に対して交差する方向へ出射される光)を集光するように構成されている。側方集光レンズ55の下流側にはダイクロイックミラー56が設けられており、ダイクロイックミラー56は、側方集光レンズ55から送られる信号光を散乱光成分と蛍光成分とに分けるように構成されている。ダイクロイックミラー56の側方(側方集光レンズ55とダイクロイックミラー56とを結ぶ光軸方向に交差する方向)には、側方散乱光受光用のフォトダイオード57が設けられており、ダイクロイックミラー56の光軸下流側には、光学フィルタ58aおよびアバランシェフォトダイオード58が設けられている。また、フォトダイオード57は、ダイクロイックミラー56で分けられた側方散乱光成分を光電変換し、これによって生じた電気信号(以下、側方散乱光信号という)をアンプ57aに伝達するように構成されている。そして、アンプ57aは、伝達された側方散乱光信号を増幅し、制御部8に出力するように構成されている。
【0037】
また、アバランシェフォトダイオード58は、光学フィルタ58aにより波長選択された後の側方蛍光成分を光電変換し、これによって生じた電気信号(側方蛍光信号)をアンプ58bに伝達するように構成されている。そして、アンプ58bは、伝達された側方蛍光信号を増幅し、制御部8に出力するように構成されている。
【0038】
DC測定部6は、シースフローDC検出法により、赤血球数(RBC)および血小板数(PLT)を測定することが可能なように構成されている。また、DC測定部6は、赤血球パルス波高値検出法により、ヘマトクリット値(HCT)を算出するための測定データも得ることが可能に構成されている。さらに、DC測定部6は、リンパ球比率を算出するための白血球数(WBC)検出にも用いられる。このようにDC測定部6を、赤血球数および血小板数の測定と、ヘマトクリット値(HCT)を算出するための測定データの取得と、リンパ球比率を算出するための白血球数(WBC)検出とに共通に用いることによって、これらの項目を測定するために別々の測定部を設ける必要がない。また、DC測定部6は、フローセルを有しており、このフローセルにチャンバ22から測定試料が移送されるようになっている。たとえば、赤血球数および血小板数の測定を行う場合には、図8に示すように、チャンバ22において血液試料と希釈液とが混合調製された測定試料が、シース液(希釈液)とともに試料供給部4からフローセルに移送される。そして、フローセル内では、測定試料がシース液(希釈液)によって取り囲まれた状態の液流が形成される。
【0039】
HGB測定部7は、メトヘモグロビン法により、血色素量(HGB)を測定するように構成されている。HGB測定部7は、図9に示すように、希釈試料を収容するセルを有しており、このセルにチャンバ22から測定試料が移送されるようになっている。そして、HGB測定部7は、波長が約555nmの光を照射する発光ダイオードを有しており、上記セル中の測定試料に発光ダイオードからの光を照射することによって、その吸光度を測定するように構成されている。なお、ヘモグロビンの測定を行う場合には、チャンバ22において、血液試料、希釈液および溶血剤100が混合され測定試料が調製される。
【0040】
制御部8は、CPU、ROM、RAMなどから構成されており、測定ユニット2の各部の動作制御を行うように構成されている。
【0041】
通信部9は、たとえば、RS−232Cインタフェース、USBインタフェース、Ethernet(登録商標)インタフェースであり、データ処理ユニット3との間でデータの送受信を行うことが可能なように構成されている。
【0042】
データ処理ユニット3は、図2に示すように、CPU31、ROM32、RAM33、ハードディスク34、通信インタフェース35、キーボードおよびマウスなどの入力部36、およびディスプレイ装置37を備えるコンピュータによって構成されている。データ処理ユニット3のハードディスク34には、オペレーティングシステムと、測定ユニット2から受信した測定データを分析処理するためのアプリケーションプログラムがインストールされている。
【0043】
ここで、本実施形態では、データ処理ユニット3のCPU31は、このアプリケーションプログラムを実行することにより、測定データを分析処理し、白血球数(WBC)、赤血球数(RBC)、血色素量(HGB)、ヘマトクリット値(HCT)、平均赤血球容積(MCV)、平均赤血球血色素量(MCH)、平均赤血球血色素濃度(MCHC)、血小板数(PLT)を算出するように構成されている。さらに、CPU31は、前方散乱光信号、側方散乱光信号、側方蛍光信号を用いてスキャッタグラムを作成して、白血球を好中球(Neut)、リンパ球、単球(Mono)、好酸球(EO)、好塩基球(BASO)の5つに分類するように構成されている。
【0044】
通信インタフェース35は、たとえば、RS−232Cインタフェース、USBインタフェース、Ethernet(登録商標)インタフェースであり、測定ユニット2との間でデータの送受信を行うことが可能に構成されている。
【0045】
また、本実施形態における溶血剤100は、図10に示すように、カチオン性界面活性剤(ラウリルトリメチルアンモニウムクロライド;34.1mM、ステアリルトリメチルアンモニウムクロライド;1.7mM)を含み、かつ、標識物質を含んでいない。標識物質とは、測定対象となる細胞に選択的に付与され、測定のための標識となる物質であり、たとえば、測定対象の細胞の核酸を染色する蛍光色素が該当する。また、この溶血剤100は、血液中のヘモグロビンをメトヘモグロビンへと転化する性質を有している。また、後述するように、各測定に用いられる各測定試料は、それぞれ、溶血剤100の希釈倍率、および、血液試料の希釈倍率が異なっている。このようにカチオン性界面活性剤を用いることによって、組成が異なる2種類以上の溶血剤を用いることなく希釈倍率を変えるだけで、測定試料中の白血球を4つに分類し、かつ、測定試料中のヘモグロビン濃度を取得することが可能である。また、染色液は、図11に示す化学式の構造を有する蛍光色素(たとえば、Invitrogen社のヘキスト34580)と、図11に示すノニオン界面活性剤群のうちの1つとを含有している。この蛍光色素は、半導体レーザ光源52aから出射される青紫色レーザ光(波長が約405nm)により励起可能である。
【0046】
次に、図12〜図17を参照して、本発明の一実施形態による血液分析装置1における試料分析処理について説明する。
【0047】
まず、血液分析装置1が起動されると、アプリケーションプログラムなどの初期化が行われた後、ステップS1において、データ処理ユニット3のCPU31により、ユーザからの測定開始指示があったか否かが判断され、指示があるまでこの判断が繰り返される。そして、測定開始指示があった場合には、ステップS2において、データ処理ユニット3から測定ユニット2に測定開始指示信号が送信される。
【0048】
そして、ステップS21において、測定ユニット2の制御部8により、測定開始指示信号が受信されたか否かが判断され、受信するまでこの判断が繰り返される。測定ユニット2が測定開始指示信号を受信すると、ステップS22において、ピペット21により、採血管セット部2aにセットされた採血管20から血液試料が吸引される。
【0049】
そして、ステップS23において、試料供給部4により、RBC/PLT測定試料(以下、第3測定試料という)が調製される。具体的には、図13に示すように、希釈液容器24から所定量(たとえば、2.0mL)の希釈液、および、ピペット21により採血管20から吸引された所定量(たとえば、6μL)の血液試料がチャンバ22に供給され、攪拌される。これにより、所定量(たとえば、2.0mL)の第3測定試料が調製される。その後、ステップS24において、チャンバ22内の第3測定試料の一部(たとえば、1mL)が、シース液(希釈液)とともにDC測定部6に移送されるとともに、DC測定部6により、第3測定試料のRBCおよびPLT検出が行われる。
【0050】
次に、ステップS25において、試料供給部4により、WBC(DC検出用)・HGB測定試料(以下、第2測定試料という)が調製される。具体的には、図13に示すように、所定量(たとえば、1mL)の第3測定試料が残存するチャンバ22に、溶血剤容器25から所定量(たとえば、0.5mL)の溶血剤100が供給され、攪拌される。すなわち、チャンバ22において血液試料と希釈液とが混合された後、溶血剤100が混合されて第2測定試料が調製される。これにより、溶血剤は希釈液により希釈された状態で血液試料に混合されるので、血液試料が所望の濃度よりも高い濃度の溶血剤と混合されるのを抑制することが可能である。このように溶血剤100が3倍に希釈(溶血剤/希釈液=1/2)され、血液試料が500倍に希釈された第2測定試料が調製される。また、これにより、赤血球が溶血されるとともに、ヘモグロビンがメトヘモグロビンへと転化される。また、第2測定試料における溶血剤100の希釈倍率(3倍)を、後述する第1測定試料における溶血剤100の希釈倍率(25倍)よりも小さくすることによって、測定試料中の赤血球を確実に溶血することができるので、精度よくヘモグロビン濃度を取得することが可能となる。その後、ステップS26において、チャンバ22内の第2測定試料がDC測定部6に移送されて、第2測定試料のWBC測定が行われる。また、ステップS27において、第2測定試料がHGB測定部7に移送されて、第2測定試料のHGB検出が行われる。
【0051】
そして、ステップS28において、試料供給部4により、WBC(分類用)測定試料(以下、第1測定試料という)が調製される。具体的には、上記した第2測定試料に含まれるのと同じ溶血剤100が25倍に希釈(溶血剤/希釈液=1/24)された所定量(たとえば、1mL)の希釈溶血剤、および、採血管20から吸引された所定量(たとえば、10μL)の血液試料がチャンバ23に供給され、攪拌される。これにより、血液試料が100倍に希釈された第1測定試料が調製される。また、これにより、溶血剤容器25に収容された共通の溶血剤100を用いて、第1測定試料および第2測定試料を調製することが可能となる。その後、ステップS29において、チャンバ23内の第1測定試料が、シース液(希釈液)とともにWBC分類測定部5に移送されるとともに、WBC分類測定部5により、第1測定試料のWBC検出が行われる。
【0052】
次に、ステップS30において、試料供給部4により、マラリア測定試料(以下、第4測定試料という)が調製される。具体的には、溶血剤100が9倍希釈(溶血剤/希釈液=1/8)された所定量(たとえば、1mL)の希釈溶血剤、採血管20から吸引された所定量(たとえば、10μL)の血液試料、および、染色液容器26から所定量(たとえば、10μL)の染色液がチャンバ23に供給され、攪拌される。これにより、血液試料が100倍に希釈された第4測定試料が調製される。その後、ステップS31において、チャンバ23内の第4測定試料が、シース液(希釈液)とともにWBC分類測定部5に移送されるとともに、WBC分類測定部5により、第4測定試料のマラリア検出が行われる。そして、ステップS32において、各検出部において測定された測定データが、測定ユニット2からデータ処理ユニット3に送信される。
【0053】
データ処理ユニット3では、ステップS3において、測定ユニット2が送信した測定データが受信されたか否かが判断され、受信するまでこの判断が繰り返される。そして、測定データを受信すると、ステップS4において、CPU31により、ステップS26で測定されたWBC検出による測定データに基づいて、白血球数(WBC)が算出される。また、ステップS5において、CPU31により、WBC検出による測定データに基づいて、図14に示すように、白血球の粒度分布図が作成され、白血球数(WBC)に対するリンパ球比率が算出される。なお、リンパ球は、粒度分布図において、左から1つ目の山(集団)として現れる。
【0054】
次に、ステップS6において、CPU31により、ステップS29で測定されたWBC分類検出による測定データに基づいて、白血球がリンパ球と好塩基球との集団、単球および顆粒球(好中球と好酸球との集団)の3つに分類される。具体的には、CPU31は、前方散乱光信号および側方散乱光信号を用いて、図15に示すように、スキャッタグラムを作成し、このスキャッタグラムから、リンパ球と好塩基球との集団、単球および顆粒球(好中球と好酸球との集団)のそれぞれの白血球数(WBC)に対する比率を算出する。ここで、図22には、実際に被験者から採取した血液試料を、本実施形態における溶血剤100(図10参照)を用いて測定し、その結果得られた前方散乱光信号および側方散乱光信号によるスキャッタグラムを示す。図22に示すように、実際の測定結果においても、スキャッタグラム上で、白血球をリンパ球と好塩基球との集団、単球および顆粒球(好中球と好酸球との集団)の3つに分類することが可能であることが分かる。
【0055】
そして、ステップS7において、CPU31により、WBC分類検出による測定データに基づいて、白血球が好酸球および好酸球以外の集団の2つに分類される。具体的には、CPU31は、前方散乱光信号および側方蛍光信号を用いて、図16に示すように、スキャッタグラムを作成し、このスキャッタグラムから、白血球数(WBC)に対する好酸球比率を算出する。この側方蛍光信号は、半導体レーザ光源52から出射された青紫色レーザ光(波長が約405nm)により励起された白血球の自家蛍光に基づくものであり、好酸球は、白血球の好酸球以外の集団よりも強い蛍光強度を有している。このように本実施形態では、標識物質を用いることなく、白血球を好酸球と好酸球以外の集団とに分類することが可能である。なお、CPU31は、側方散乱光信号および側方蛍光信号によるスキャッタグラムから、白血球数(WBC)に対する好酸球比率を算出することも可能である。ここで、図23には、実際に被験者から採取した血液試料を、本実施形態における溶血剤100(図10参照)を用いて測定し、その結果得られた前方散乱光信号および側方蛍光信号によるスキャッタグラムを示す。図23に示すように、実際の測定結果においても、スキャッタグラム上で、好酸球と好酸球以外の集団とに分類することが可能であることが分かる。
【0056】
その後、ステップS8において、CPU31により、ステップS6で算出された顆粒球(好中球と好酸球との集団)比率から、ステップS7で算出された好酸球比率を差し引くことによって、白血球数(WBC)に対する好中球比率が算出される。これにより、白血球がリンパ球と好塩基球との集団、単球、好中球および好酸球の4つに分類される。そして、ステップS9において、CPU31により、リンパ球と好塩基球との集団の比率から、ステップS5で算出されたリンパ球比率を差し引くことによって、白血球数(WBC)に対する好塩基球比率が算出される。これにより、白血球がリンパ球、好塩基球、単球、好中球および好酸球の5つに分類される。
【0057】
そして、ステップS10において、CPU31により、ステップS31で測定されたマラリア検出による測定データに基づいて、マラリア原虫感染赤血球がマラリア原虫感染赤血球以外の集団から分類される。具体的には、CPU31は、前方散乱光信号および側方蛍光信号を用いて、図17に示すように、スキャッタグラムを作成し、このスキャッタグラムから、マラリア原虫感染赤血球をマラリア原虫感染赤血球以外の集団から分類する。これにより、マラリア感染の有無を判断することが可能となる。
【0058】
次に、ステップS11において、CPU31により、ステップS24で測定されたRBC/PLT検出による測定データに基づいて、赤血球数(RBC)、血小板数(PLT)およびヘマトクリット値(HCT)が算出される。
【0059】
ここで、本実施形態では、ステップS12において、CPU31により、ステップS27で測定されたHGB検出による測定データに基づいて、血色素量(HGB)が算出される。すなわち、SLSヘモグロビン法を用いたHGB検出により得られた吸光度に基づいて、ヘモグロビン濃度が算出される。
【0060】
その後、ステップS13において、上記のように算出された赤血球数(RBC)、ヘマトクリット値(HCT)および血色素量(HGB)から、CPU31により、平均赤血球容積(MCV)、平均赤血球血色素量(MCH)および平均赤血球血色素濃度(MCHC)が算出される。各値の算出式をそれぞれ以下の式(1)〜(3)に示す。
【0061】
MCV=(HCT/RBC)×1000・・・・・(1)
上記式(1)において、MCVは平均赤血球容積(fL)、HCTはヘマトクリット値(%)、RBCは赤血球数(×104/μL)をそれぞれ表す。
【0062】
MCH=(HGB/RBC)×1000・・・・・(2)
上記式(2)において、MCHは平均赤血球血色素量(pg)、HGBは血色素量(g/dL)、RBCは赤血球数(×104/μL)をそれぞれ表す。
【0063】
MCHC=(HGB/HCT)×100・・・・・(3)
上記式(3)において、MCHCは平均赤血球血色素濃度(g/dL)、HGBは血色素量(g/dL)、HCTはヘマトクリット値(%)をそれぞれ表す。
【0064】
そして、ステップS14において、上記のように算出された、白血球数(WBC)、赤血球数(RBC)、血色素量(HGB)、ヘマトクリット値(HCT)、平均赤血球容積(MCV)、平均赤血球血色素量(MCH)、平均赤血球血色素濃度(MCHC)、血小板数(PLT)の算出結果がディスプレイ装置37に出力される。さらに、白血球数(WBC)に対する好中球比率、リンパ球比率、単球比率、好酸球比率および好塩基球比率がディスプレイ装置37に出力されるとともに、マラリア検出の結果も出力される。なお、白血球数(WBC)に対する各血球比率に加えて、白血球数(WBC)および各血球比率に基づいて算出された好中球数、リンパ球数、単球数、好酸球数および好塩基球数が出力される。
【0065】
その後、ステップS15において、ユーザからのシャットダウン指示の有無が判断され、指示がない場合には、ステップS1に移行される。シャットダウン指示があった場合には、血液分析装置1における試料分析処理のデータ処理ユニット3の動作が終了される。また、測定ユニット2側では、ステップS32で測定データをデータ処理ユニット3に送信した後、ステップS33において、ユーザからのシャットダウン指示があったか否かが判断され、指示がない場合には、ステップS21に移行される。シャットダウン指示があった場合には、血液分析装置1における試料分析処理の測定ユニット2の動作が終了される。
【0066】
本実施形態では、上記のように、血液試料と標識物質を含まない溶血剤100とから調製された測定試料から、側方蛍光信号、前方散乱光信号および側方散乱光信号を生成するWBC分類測定部5を設けることによって、測定試料に対して標識を行うことなく、測定試料中の好酸球の自家蛍光を利用して、側方蛍光信号、前方散乱光信号および側方散乱光信号を得ることができる。また、側方蛍光信号、前方散乱光信号および側方散乱光信号に基づいて、測定試料中の白血球を、単球、好中球、好酸球、および、リンパ球と好塩基球との集団の4つに分類するCPU31を設けることによって、標識物質を用いることなく白血球を4つに分類することができるので、溶血剤100に標識物質を含める必要がない。これにより、標識物質を含まない簡易な組成の溶血剤100を用いて測定試料中の白血球を4つに分類することができる。
【0067】
また、本実施形態では、シースフローDC検出法により血球測定を行うDC測定部6を設け、CPU31を、DC測定部6による測定データに基づいて、測定試料中の白血球をリンパ球とリンパ球以外の集団とに分類するとともに、この分類結果と側方蛍光信号、前方散乱光信号および側方散乱光信号とに基づく分類結果とから、白血球をリンパ球、好塩基球、単球、好中球および好酸球の5つに分類するように構成することによって、標識物質を含まない簡易な組成の溶血剤100を用いながら、測定試料中の白血球を5つに分類することができる。
【0068】
また、本実施形態による血液分析方法では、上記のように、標識物質を含まない測定試料から、側方蛍光信号、前方散乱光信号および側方散乱光信号を生成するステップを設けることによって、測定試料に対して標識を行うことなく、測定試料中の好酸球の自家蛍光を利用して、側方蛍光信号、前方散乱光信号および側方散乱光信号を得ることができる。また、側方蛍光信号、前方散乱光信号および側方散乱光信号に基づいて、測定試料中の白血球を、単球、好中球、好酸球、および、リンパ球と好塩基球との集団の4つに分類するステップを設けることによって、標識物質を用いることなく白血球を4つに分類することができるので、溶血剤100に標識物質を含める必要がない。これにより、標識物質を含まない簡易な組成の溶血剤100を用いて測定試料中の白血球を4つに分類することができる。
【0069】
また、本実施形態による溶血剤100を用いる血液分析方法に、標識物質を含まない測定試料から、側方蛍光信号、前方散乱光信号および側方散乱光信号を生成するステップを設けることによって、測定試料に対して標識を行うことなく、測定試料中の好酸球の自家蛍光を利用して、側方蛍光信号、前方散乱光信号および側方散乱光信号を得ることができる。また、当該溶血剤100を用いる血液分析方法に、側方蛍光信号、前方散乱光信号および側方散乱光信号に基づいて、測定試料中の白血球を、単球、好中球、好酸球、および、リンパ球と好塩基球との集団の4つに分類するステップを設けることによって、標識物質を用いることなく白血球を4つに分類することができるので、溶血剤100に標識物質を含める必要がない。このように、標識物質を含まない簡易な組成の溶血剤100を用いて、測定試料中の白血球を4つに分類することができる。
【0070】
また、本実施形態による標識物質を含まない溶血剤100を、上記のように、側方蛍光信号、前方散乱光信号および側方散乱光信号を用いて白血球を単球、好中球、好酸球、および、リンパ球と好塩基球との集団の4つに分類するために用いることによって、標識物質を用いることなく白血球を4つに分類することができるので、溶血剤100に標識物質を含める必要がない。すなわち、標識物質を含まない簡易な組成の溶血剤100を用いて、測定試料中の白血球を4つに分類することができる。
【0071】
また、本実施形態では、上記のように、WBC分類測定部5により血液試料および溶血剤100を含む第1測定試料から生成された側方蛍光信号、前方散乱光信号および側方散乱光信号に基づいて、第1測定試料中の白血球を、少なくとも、単球と、好中球と、好酸球と、他の集団との4つに分類し、HGB測定部7により血液試料および前記溶血剤100と同じ溶血剤100を含む第2測定試料から測定された吸光度に基づいて、第2測定試料中のヘモグロビン濃度を取得するCPU31とを設けることによって、白血球を4つに分類するための溶血剤とヘモグロビン濃度を取得するための溶血剤とを共通化することができるので、白血球分類およびヘモグロビン濃度取得を行うために組成の異なる2種類以上の溶血剤(試薬)を開発する必要がない。これにより、試薬の開発に起因するユーザへの負担を軽減しながら、測定試料中の白血球を4つに分類し、かつ、測定試料中のヘモグロビン濃度を取得することができる。
【0072】
また、本実施形態では、DC測定部6により得られた測定データに基づいて、第2測定試料中の白血球をリンパ球とリンパ球以外の集団とに分類するとともに、この分類結果と上記した白血球の4分類の分類結果とに基づいて、測定試料中の白血球を、少なくとも、リンパ球と、好塩基球と、単球と、好中球と、好酸球との5つに分類するようにCPU31を構成することによって、DC測定部6により、ヘモグロビン濃度を取得するために用いる測定試料と同じ第2測定試料を用いて、白血球をリンパ球とリンパ球以外の集団とに分類することができるので、組成の異なる測定試料を別途調製することなく、白血球を5つに分類することができる。
【0073】
また、本実施形態による血液分析方法では、上記のように、WBC分類測定部5により血液試料および溶血剤100を含む第1測定試料から生成された側方蛍光信号、前方散乱光信号および側方散乱光信号に基づいて、第1測定試料中の白血球を、少なくとも、単球と、好中球と、好酸球と、他の集団との4つに分類するステップと、HGB測定部7により血液試料および前記溶血剤100と同じ溶血剤100を含む第2測定試料から測定された吸光度に基づいて、第2測定試料中のヘモグロビン濃度を取得するステップとを設けることによって、白血球を4つに分類するための溶血剤とヘモグロビン濃度を取得するための溶血剤とを共通化することができるので、白血球分類およびヘモグロビン濃度取得を行うために組成の異なる2種類以上の溶血剤(試薬)を開発する必要がない。これにより、試薬の開発に起因するユーザへの負担を軽減しながら、測定試料中の白血球を4つに分類し、かつ、測定試料中のヘモグロビン濃度を取得することができる。
【0074】
また、本実施形態による溶血剤を、上記のように、WBC分類測定部5により血液試料および溶血剤100を含む第1測定試料から生成された側方蛍光信号、前方散乱光信号および側方散乱光信号に基づいて、第1測定試料中の白血球を、少なくとも、単球と、好中球と、好酸球と、他の集団との4つに分類するステップと、HGB測定部7により血液試料および前記溶血剤100と同じ溶血剤100を含む第2測定試料から測定された吸光度に基づいて、第2測定試料中のヘモグロビン濃度を取得するステップとを備える血液分析方法に用いることによって、白血球を4つに分類するための溶血剤とヘモグロビン濃度を取得するための溶血剤とを共通化することができるので、白血球分類およびヘモグロビン濃度取得を行うために組成の異なる2種類以上の溶血剤(試薬)を開発する必要がない。これにより、試薬の開発に起因するユーザへの負担を軽減しながら、測定試料中の白血球を4つに分類し、かつ、測定試料中のヘモグロビン濃度を取得することができる。
【0075】
また、本実施形態による溶血剤を、上記のように、カチオン性界面活性剤を含み、ヘモグロビン濃度を測定するために用いるとともに、白血球を少なくとも、リンパ球と、好塩基球と、単球と、好中球と、好酸球とに分類するために用いることによって、白血球を4つに分類するための溶血剤とヘモグロビン濃度を取得するための溶血剤とを共通化することができるので、白血球分類およびヘモグロビン濃度取得を行うために組成の異なる2種類以上の溶血剤(試薬)を開発する必要がない。これにより、試薬の開発に起因するユーザへの負担を軽減しながら、測定試料中の白血球を4つに分類し、かつ、測定試料中のヘモグロビン濃度を取得することができる。
【0076】
(実施例)
次に、図24〜図28を参照して、上記実施形態に記載の方法により得られた測定結果と、多項目自動血液分析装置XE−2100(シスメックス株式会社)により得られた測定結果との相関についての検証結果について説明する。上記実施形態に記載の方法による測定と多項目自動血液分析装置XE−2100による測定とは、複数の血液試料について、同じ検体について行った。なお、図24〜図28は、それぞれ、ヘモグロビン、リンパ球と好塩基球との集団、単球、好中球、および好酸球の測定結果の相関図を示している。また、図24〜図28では、それぞれ、縦軸に上記実施形態に記載の方法により得られた測定結果を、横軸に多項目自動血球分析装置XE−2100により得られた測定結果を示している。これらの図に示すように、相関係数rは、ヘモグロビンについては0.992、リンパ球と好塩基球との集団については0.968、単球については0.796、好中球については0.946、および、好酸球については0.892であり、いずれも高い相関を示す結果となった。
【0077】
なお、今回開示された実施形態は、全ての点で例示であって制限的なものではないと考えられるべきである。本発明の範囲は、上記した実施形態の説明ではなく特許請求の範囲によって示され、さらに特許請求の範囲と均等の意味および範囲内での全ての変更が含まれる。
【0078】
たとえば、上記実施形態では、WBC検出、HGB検出、WBC分類検出およびマラリア検出のために用いられる溶血剤を1つの溶血剤容器に収容する例を示したが、第1〜第4の局面による発明はこれに限らず、各検出用にそれぞれ別々の溶血剤を用意し、各溶血剤をそれぞれ別々の溶血剤容器に収容するようにしてもよい。この際、各検出に用いられる溶血剤は異なる種類の溶血剤であってもよい。また、各溶血剤容器に収容する溶血剤を、それぞれ予め所定の希釈倍率に希釈していてもよい。
【0079】
また、上記実施形態では、光源の一例として、青紫色半導体レーザ素子を有する半導体レーザ光源を示したが、本発明はこれに限らず、青色半導体レーザ素子またはアルゴンレーザ素子など、青紫色半導体レーザ素子以外のレーザ素子を有する光源であってもよい。
【0080】
また、上記実施形態では、光源の一例として、波長が約405nmの青紫色レーザ光を出射する半導体レーザ光源を示したが、第1〜第4の局面による発明はこれに限らず、350nm以上500nm以下の波長を有する光を出射する光源であれば、半導体レーザ光源以外の他の光源であってもよい。このように構成すれば、好酸球の自家蛍光に基づく蛍光情報を取得可能な短波長域の光を測定試料に照射することができる。
【0081】
また、上記実施形態では、試料分析処理において、早いものからRBC/PLT検出、WBC検出、HGB検出、WBC分類検出およびマラリア検出の順序で各検出処理を行う例を示したが、本発明はこれに限らず、試料分析処理において、上記以外の順序で各検出処理を行ってもよい。また、試料分析処理における、白血球分類処理、マラリア分類処理、赤血球数・血小板数算出処理、および、血色素量算出処理の順序も適宜変更可能である。
【0082】
また、上記実施形態では、WBC検出、HGB検出、WBC分類検出およびマラリア検出に共通に用いられる溶血剤を収容する1つの、試薬容器としての溶血剤容器を試料供給部に接続する例を示したが、第5〜第8の局面による発明はこれに限らず、各検出に用いる溶血剤をそれぞれ別々に収容するように4つの溶血剤容器を試料供給部に接続してもよいし、上記4つの検出のうち、いずれかに用いる溶血剤を共通の溶血剤容器に収容し、2つまたは3つの溶血剤容器を試料供給部に接続してもよい。また、5つ以上の溶血剤容器を試料供給部に接続してもよい。この際、各溶血剤容器に収容する溶血剤を、それぞれ予め所定の希釈倍率に希釈しておけば、各検出に用いる測定試料を調製する際に、溶血剤を所望の希釈倍率に希釈するための工程を別途設ける必要がない。
【0083】
また、上記実施形態では、溶血剤の一例として、標識物質を含まない溶血剤を示したが、第5〜第8の局面による発明はこれに限らず、溶血剤が標識物質を含んでいてもよい。
【0084】
また、上記実施形態では、第2光情報生成部の一例として、透過光情報としての吸光度を測定するHGB測定部を示したが、本発明はこれに限らず、散乱光情報を生成するHGB測定部であってもよい。この場合、データ処理ユニットのCPUは、HGB測定部により生成された散乱光情報に基づいてヘモグロビン濃度を取得する。
【0085】
また、上記実施形態では、溶血剤の一例として、アルキルトリメチルアンモニウム塩であって、アルキル基の炭素数が12以上18以下であるカチオン性界面活性剤(ラウリルトリメチルアンモニウムクロライド;34.1mM、ステアリルトリメチルアンモニウムクロライド;1.7mM)を含む溶血剤を示したが、本発明はこれに限らず、カチオン性界面活性剤(上記実施形態では、ラウリルトリメチルアンモニウムクロライドとステアリルトリメチルアンモニウムクロライドの合計)のWBC(分類用)測定試料における濃度が、0.62mM以上2.15mM以下であれば、上記以外の濃度のカチオン性界面活性剤を含む溶血剤であってもよい。なお、上記実施形態では、溶血剤を25倍希釈して測定試料を調製しているので、カチオン性界面活性剤のWBC(分類用)測定試料における濃度が0.62mMになるときのカチオン性界面活性剤の溶血剤における濃度は15.5mMであり、カチオン性界面活性剤のWBC(分類用)測定試料における濃度が2.15mMになるときのカチオン性界面活性剤の溶血剤における濃度は53.75mMである。また、上記の溶血剤に代えて、アルキル基の炭素数が8以上10以下であるカチオン性界面活性剤を用いれば、カチオン性界面活性剤のWBC(分類用)測定試料における濃度が2.15mM以上であっても測定可能である。
【0086】
ここで、本発明の一実施形態による血液分析装置において、溶血剤におけるカチオン性界面活性剤の濃度を変動させた場合の実験結果について説明する。実験では、溶血剤におけるカチオン性界面活性剤の濃度が微量ずつ異なる複数の実験結果を得たが、ここでは、代表して、カチオン性界面活性剤のWBC(分類用)測定試料における濃度が2.15mMである溶血剤を用いた場合、および、カチオン性界面活性剤のWBC(分類用)測定試料における濃度が0.62mMである溶血剤を用いた場合の2つの実験結果について説明する。
【0087】
図18および図20に示すように、スキャッタグラム上で、白血球をリンパ球と好塩基球との集団、単球および顆粒球(好中球と好酸球との集団)の3つに分類することが可能である。また、図19および図21に示すように、スキャッタグラム上で、好酸球と好酸球以外の集団とに分類することが可能である。また、これらの分類結果から白血球を、リンパ球と好塩基球との集団、単球、好中球および好酸球の4つに分類することが可能である。したがって、カチオン性界面活性剤のWBC(分類用)測定試料における濃度が0.62mM以上2.15mM以下の範囲においては、白血球を4分類することが可能であると考えられる。
【特許請求の範囲】
【請求項1】
血液試料および溶血剤を含む第1測定試料と、前記血液試料および前記溶血剤と同じ溶血剤を含む第2測定試料とを調製する試料調製部と、
前記第1測定試料から、蛍光情報と、少なくとも2種類の散乱光情報とを生成する第1光情報生成部と、
前記第2測定試料から、透過光情報または散乱光情報の少なくとも一方を生成する第2光情報生成部と、
前記第1光情報生成部により生成された前記蛍光情報と前記2種類の散乱光情報とに基づいて、前記第1測定試料中の白血球を、少なくとも、単球と、好中球と、好酸球と、他の集団との4つに第1分類し、前記第2光情報生成部により生成された前記透過光情報または前記散乱光情報の少なくとも一方に基づいて、前記第2測定試料中のヘモグロビン濃度を取得する制御部とを備える、血液分析装置。
【請求項2】
前記第2測定試料から、試料の電気情報を生成する電気情報生成部をさらに備え、
前記制御部は、前記電気情報生成部により生成された電気情報に基づいて、前記第2測定試料中の白血球を少なくともリンパ球とリンパ球以外の集団とに第2分類するとともに、前記第1分類および前記第2分類の分類結果に基づいて、測定試料中の白血球を、少なくとも、リンパ球と、好塩基球と、単球と、好中球と、好酸球との5つに分類するように構成されている、請求項1に記載の血液分析装置。
【請求項3】
前記試料調製部は、前記血液試料から第3測定試料をさらに調製し、
前記電気情報生成部は、前記第3測定試料から、試料の電気情報を生成し、
前記制御部は、前記電気情報生成部により前記第3測定試料から生成された電気情報に基づいて、前記第3測定試料中の赤血球数および血小板数を算出するように構成されている、請求項2に記載の血液分析装置。
【請求項4】
前記第2測定試料における前記溶血剤の希釈倍率は、前記第1測定試料における前記溶血剤の希釈倍率と異なる、請求項1〜3のいずれか1項に記載の血液分析装置。
【請求項5】
前記第2測定試料における前記溶血剤の希釈倍率は、前記第1測定試料における前記溶血剤の希釈倍率よりも小さい、請求項4に記載の血液分析装置。
【請求項6】
前記試料調製部は、前記血液試料、所定の試薬容器に収容された前記溶血剤、および、所定量の希釈液を混合することにより前記第1測定試料を調製し、前記血液試料、前記所定の試薬容器に収容された前記溶血剤、および、前記所定量よりも少ない量の前記希釈液とを混合することにより前記第2測定試料を調製するように構成されている、請求項1〜5のいずれか1項に記載の血液分析装置。
【請求項7】
前記試料調製部は、前記希釈液と前記血液試料とを混合した状態で、前記溶血剤を混合することにより前記第2測定試料を調製するように構成されている、請求項6に記載の血液分析装置。
【請求項8】
前記試料調製部は、少なくとも前記血液試料、および、前記第1測定試料に用いられる前記溶血剤が収容された第1試薬容器とは異なる第2試薬容器に収容された前記溶血剤を混合することにより前記第2測定試料を調製するように構成されている、請求項1〜7のいずれか1項に記載の血液分析装置。
【請求項9】
前記溶血剤は、カチオン性界面活性剤を含む、請求項1〜8のいずれか1項に記載の血液分析装置。
【請求項10】
前記第1光情報生成部は、前記蛍光情報として、少なくとも、前記測定試料中の好酸球の自家蛍光の強度に応じた蛍光情報を生成するように構成されている、請求項1〜9のいずれか1項に記載の血液分析装置。
【請求項11】
前記第1光情報生成部は、光源と、前記光源から前記測定試料に光が照射されることにより生じる蛍光を受光し、受光強度に応じた前記蛍光情報を生成する蛍光受光部と、前記光源から前記測定試料に光が照射されることにより生じる散乱光を受光し、受光強度に応じた前記散乱光情報を生成する散乱光受光部とを含む、請求項1〜10のいずれか1項に記載の血液分析装置。
【請求項12】
前記散乱光受光部は、前記測定試料に光が照射されることにより前記光源から照射された光の進行方向に沿って生じる前方散乱光を受光し、受光強度に応じた前方散乱光情報を、前記散乱光情報のうちの第1情報として生成する第1受光部と、前記測定試料に光が照射されることにより前記光源から照射された光の進行方向に略垂直な方向に沿って生じる側方散乱光を受光し、受光強度に応じた側方散乱光情報を、前記散乱光情報のうちの第2情報として生成する第2受光部とを有する、請求項11に記載の血液分析装置。
【請求項13】
前記制御部は、前記前方散乱光情報と前記蛍光情報とに基づいて、前記測定試料中の白血球を、少なくとも好酸球と好酸球以外の集団とに分類するように構成されている、請求項12に記載の血液分析装置。
【請求項14】
前記光源は、350nm以上500nm以下の波長を有する光を照射するように構成されている、請求項11〜13のいずれか1項に記載の血液分析装置。
【請求項15】
前記光源は、青紫色半導体レーザ素子を有する、請求項14に記載の血液分析装置。
【請求項16】
血液試料および溶血剤を含む第1測定試料と、前記血液試料および前記溶血剤と同じ溶血剤を含む第2測定試料とを調製するステップと、
前記第1測定試料から、蛍光情報と、少なくとも2種類の散乱光情報とを生成するステップと、
前記第2測定試料から、透過光情報または散乱光情報の少なくとも一方を生成するステップと、
前記第1測定試料から生成された前記蛍光情報と前記2種類の散乱光情報とに基づいて、前記第1測定試料中の白血球を、少なくとも、単球と、好中球と、好酸球と、他の集団との4つに分類するステップと、
前記第2測定試料から生成された前記透過光情報または前記散乱光情報の少なくとも一方に基づいて、前記第2測定試料中のヘモグロビン濃度を取得するステップとを備える、血液分析方法。
【請求項1】
血液試料および溶血剤を含む第1測定試料と、前記血液試料および前記溶血剤と同じ溶血剤を含む第2測定試料とを調製する試料調製部と、
前記第1測定試料から、蛍光情報と、少なくとも2種類の散乱光情報とを生成する第1光情報生成部と、
前記第2測定試料から、透過光情報または散乱光情報の少なくとも一方を生成する第2光情報生成部と、
前記第1光情報生成部により生成された前記蛍光情報と前記2種類の散乱光情報とに基づいて、前記第1測定試料中の白血球を、少なくとも、単球と、好中球と、好酸球と、他の集団との4つに第1分類し、前記第2光情報生成部により生成された前記透過光情報または前記散乱光情報の少なくとも一方に基づいて、前記第2測定試料中のヘモグロビン濃度を取得する制御部とを備える、血液分析装置。
【請求項2】
前記第2測定試料から、試料の電気情報を生成する電気情報生成部をさらに備え、
前記制御部は、前記電気情報生成部により生成された電気情報に基づいて、前記第2測定試料中の白血球を少なくともリンパ球とリンパ球以外の集団とに第2分類するとともに、前記第1分類および前記第2分類の分類結果に基づいて、測定試料中の白血球を、少なくとも、リンパ球と、好塩基球と、単球と、好中球と、好酸球との5つに分類するように構成されている、請求項1に記載の血液分析装置。
【請求項3】
前記試料調製部は、前記血液試料から第3測定試料をさらに調製し、
前記電気情報生成部は、前記第3測定試料から、試料の電気情報を生成し、
前記制御部は、前記電気情報生成部により前記第3測定試料から生成された電気情報に基づいて、前記第3測定試料中の赤血球数および血小板数を算出するように構成されている、請求項2に記載の血液分析装置。
【請求項4】
前記第2測定試料における前記溶血剤の希釈倍率は、前記第1測定試料における前記溶血剤の希釈倍率と異なる、請求項1〜3のいずれか1項に記載の血液分析装置。
【請求項5】
前記第2測定試料における前記溶血剤の希釈倍率は、前記第1測定試料における前記溶血剤の希釈倍率よりも小さい、請求項4に記載の血液分析装置。
【請求項6】
前記試料調製部は、前記血液試料、所定の試薬容器に収容された前記溶血剤、および、所定量の希釈液を混合することにより前記第1測定試料を調製し、前記血液試料、前記所定の試薬容器に収容された前記溶血剤、および、前記所定量よりも少ない量の前記希釈液とを混合することにより前記第2測定試料を調製するように構成されている、請求項1〜5のいずれか1項に記載の血液分析装置。
【請求項7】
前記試料調製部は、前記希釈液と前記血液試料とを混合した状態で、前記溶血剤を混合することにより前記第2測定試料を調製するように構成されている、請求項6に記載の血液分析装置。
【請求項8】
前記試料調製部は、少なくとも前記血液試料、および、前記第1測定試料に用いられる前記溶血剤が収容された第1試薬容器とは異なる第2試薬容器に収容された前記溶血剤を混合することにより前記第2測定試料を調製するように構成されている、請求項1〜7のいずれか1項に記載の血液分析装置。
【請求項9】
前記溶血剤は、カチオン性界面活性剤を含む、請求項1〜8のいずれか1項に記載の血液分析装置。
【請求項10】
前記第1光情報生成部は、前記蛍光情報として、少なくとも、前記測定試料中の好酸球の自家蛍光の強度に応じた蛍光情報を生成するように構成されている、請求項1〜9のいずれか1項に記載の血液分析装置。
【請求項11】
前記第1光情報生成部は、光源と、前記光源から前記測定試料に光が照射されることにより生じる蛍光を受光し、受光強度に応じた前記蛍光情報を生成する蛍光受光部と、前記光源から前記測定試料に光が照射されることにより生じる散乱光を受光し、受光強度に応じた前記散乱光情報を生成する散乱光受光部とを含む、請求項1〜10のいずれか1項に記載の血液分析装置。
【請求項12】
前記散乱光受光部は、前記測定試料に光が照射されることにより前記光源から照射された光の進行方向に沿って生じる前方散乱光を受光し、受光強度に応じた前方散乱光情報を、前記散乱光情報のうちの第1情報として生成する第1受光部と、前記測定試料に光が照射されることにより前記光源から照射された光の進行方向に略垂直な方向に沿って生じる側方散乱光を受光し、受光強度に応じた側方散乱光情報を、前記散乱光情報のうちの第2情報として生成する第2受光部とを有する、請求項11に記載の血液分析装置。
【請求項13】
前記制御部は、前記前方散乱光情報と前記蛍光情報とに基づいて、前記測定試料中の白血球を、少なくとも好酸球と好酸球以外の集団とに分類するように構成されている、請求項12に記載の血液分析装置。
【請求項14】
前記光源は、350nm以上500nm以下の波長を有する光を照射するように構成されている、請求項11〜13のいずれか1項に記載の血液分析装置。
【請求項15】
前記光源は、青紫色半導体レーザ素子を有する、請求項14に記載の血液分析装置。
【請求項16】
血液試料および溶血剤を含む第1測定試料と、前記血液試料および前記溶血剤と同じ溶血剤を含む第2測定試料とを調製するステップと、
前記第1測定試料から、蛍光情報と、少なくとも2種類の散乱光情報とを生成するステップと、
前記第2測定試料から、透過光情報または散乱光情報の少なくとも一方を生成するステップと、
前記第1測定試料から生成された前記蛍光情報と前記2種類の散乱光情報とに基づいて、前記第1測定試料中の白血球を、少なくとも、単球と、好中球と、好酸球と、他の集団との4つに分類するステップと、
前記第2測定試料から生成された前記透過光情報または前記散乱光情報の少なくとも一方に基づいて、前記第2測定試料中のヘモグロビン濃度を取得するステップとを備える、血液分析方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】


【公開番号】特開2012−168192(P2012−168192A)
【公開日】平成24年9月6日(2012.9.6)
【国際特許分類】
【出願番号】特願2012−97863(P2012−97863)
【出願日】平成24年4月23日(2012.4.23)
【分割の表示】特願2010−511052(P2010−511052)の分割
【原出願日】平成21年4月28日(2009.4.28)
【出願人】(390014960)シスメックス株式会社 (810)
【Fターム(参考)】
【公開日】平成24年9月6日(2012.9.6)
【国際特許分類】
【出願日】平成24年4月23日(2012.4.23)
【分割の表示】特願2010−511052(P2010−511052)の分割
【原出願日】平成21年4月28日(2009.4.28)
【出願人】(390014960)シスメックス株式会社 (810)
【Fターム(参考)】
[ Back to top ]

